Герпесвирус с измененным спектром мишеней, содержащий гибридный гликопротеин н - RU2732120C2
Код документа: RU2732120C2
Чертежи









Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области лечения заболеваний. В частности, настоящее изобретение относится к герпесвирусам с измененным спектром мишеней, содержащим гетерологичный полипептид, присоединенный к гликопротеину Н, причем мишенью указанного полипептида являются определенные клетки, в частности, клетки, пораженные заболеванием. Настоящее изобретение также относится к нуклеиновой кислоте, содержащей геном герпесвируса согласно настоящему изобретению, вектору, содержащему указанную нуклеиновую кислоту, и к клетке, содержащей указанную нуклеиновую кислоту или указанный вектор. Кроме того, настоящее изобретение относится к уничтожению клеток с помощью герпесвируса согласно настоящему изобретению и к способам культивирования указанного герпесвируса в условиях in vitro.
УРОВЕНЬ ТЕХНИКИ
Проблема неизлечимых и плохо излечиваемых заболеваний и патологий остается актуальной, несмотря на большое количество открытий, которые в последние десятилетия привели к появлению терапевтических средств и способов лечения и к улучшению здоровья и качества жизни людей. Особого внимания заслуживают различные виды рака, в частности, метастатические формы рака, которые лечат с применением химиотерапии и лучевой терапии или биологических лекарственных средств или их комбинаций с крайне ограниченным успехом.
В последние два десятилетия были осуществлены многочисленные попытки использовать вирусы простого герпеса (ВПГ) в качестве онколитических агентов (о-ВПГ) для лечения раковых заболеваний и метастазов. Примерами являются рекомбинантные ВПГ, несущие делеции некоторых вирусных генов с целью ослабления вирусов и придания некоторой степени специфичности по отношению к раку. Эти вирусы, примером которых является вирус под названием HSV1716, несут делецию одной или обеих копий гена γ134.5, продукт которого противодействует защитной реакции хозяина, запускающейся при активации PKR (протеинкиназы R).
ВПГ, несущие делецию гена γ134.5, приобретают частичную специфичность по отношению к раку благодаря тому, что нераковые клетки запускают врожденную реакцию против указанного ВПГ, препятствующую репликации вируса; и наоборот, некоторые раковые клетки характеризуются дефектами врожденной реакции и, таким образом, позволяют Δ γ134.5 ВПГ реплицироваться и, следовательно, уничтожать раковые клетки. Недостатком этих о-ВПГ является то, что раковые клетки являются разнородными, и Δ γ134.5 ВПГ может уничтожать лишь некоторую часть раковых клеток, дефектных по реакции PKR. По соображениям безопасности и с целью улучшения специфичности по отношению к раку в некоторых случаях Δ γ134.5 ВПГ модифицируют путем дополнительных делеций, примерами которых являются делеция гена UL 39, кодирующего большую субъединицу рибонуклеотидредуктазы, делеция ICP 47 и т.д. Эти дополнительные делеций приводят к дальнейшему ослаблению о-ВПГ.
Чтобы преодолеть ограниченный онколитический эффект, вызванный ослаблением, о-ВПГ, несущие делецию гена γ134.5 или комбинацию делеций, дополнительно модифицируют, придавая им способность кодировать хемокин или цитокин. Два соответствующих примера представляют собой T-VEC и М032. о-ВПГ, первоначально называвшийся Onco-Vex, а затем переименованный в T-VEC, кодирует ГМ-КСФ, способствующий рекрутингу и созреванию моноцитов и дендритных клеток и, таким образом, значительно усиливающий ответ пациента, подвергаемого лечению, на собственную опухоль. Данный эффект представляет собой усиление устранения опухоли иммунной системой пациента, подвергаемого лечению. В клиническом исследовании III фазы это позволило улучшить исход заболевания у пациентов с метастатической меланомой. Вторым примером является М032, Δ γ134.5 ВПГ, кодирующий последовательность ИЛ-12 за счет модификации. Согласно прогнозам, этот вирус должен способствовать Th1-ответу. Ведется поиск пациентов с глиобластомой для лечения с применением М032 в исследовании 1 фазы. Существует два основных ограничения ослабленных вирусов, (i) их в целом пониженная репликация, которая представляет собой препятствие как в условиях in vivo, так и для продукции достаточно большого количества вируса для получения эффективного инокулята; и (ii) их ограниченная специфичность по отношению к раку в связи с их способностью проникать в обычные клетки и поглощаться ими.
Ожидается, что эти два ограничения будут неблагоприятно влиять на клиническую эффективность лечения.
Один из подходов для преодоления этих ограничений представляет собой конструирование путем генной инженерии о-ВПГ, обладающих высокоспецифичным тропизмом по отношению к раковым клеткам и не ослабленных в других отношениях. Этот подход характеризуют как перенаправление тропизма ВПГ на рецепторы, специфические для рака. ВПГ проникает в клетку посредством слияния его оболочки с клеточными мембранами; указанные мембраны представляют собой плазматическую мембрану или мембрану, ограничивающую эндоцитозные везикулы. В последнем случае после присоединения вируса к поверхности клетки происходит поглощение вируса клеткой путем интернализации его в эндоцитозные везикулы, а затем путем слияния оболочки вириона с мембраной эндоцитозной везикулы. Оболочка вириона является наиболее внешней структурой частицы ВПГ; она состоит из мембраны, несущей ряд гликопротеинов, кодируемых вирусом, которые каскадно активируются, способствуя слиянию оболочки ВПГ с клеточными мембранами. Эти гликопротеины представляют собой gC и gB, опосредующие первое присоединение частицы ВПГ к гепарансульфату клеточной поверхности. После этого gD взаимодействует с по меньшей мере двумя независимыми альтернативными рецепторами клеточной поверхности под названиями нектин-1 и HVEM или HVEA. Сайты связывания нектина-1 или HVEM на gD отличаются друг от друга. Взаимодействие gD с одним из двух альтернативных рецепторов индуцирует конформационные изменения gD, которые, как считается, каскадно активируют следующие гликопротеины gH/gL (которые образуют гетеродимер) и gB. gB осуществляет слияние оболочки вириона с клеточной мембраной.
Введение в спектр мишеней ВПГ рецепторов, специфичных для рака, подразумевает генетические модификации gD посредством присоединения к нему гетерологичных последовательностей, кодирующих конкретный лиганд. После заражения рекомбинантным вирусом, кодирующим химерный гликопротеин gD-лиганд, образуются дочерние вирионы, оболочка которых содержит химерный гликопротеин gD-лиганд вместо gD дикого типа. Лиганд взаимодействует с молекулой, специфически экспрессируемой на выбранной раковой клетке или на клетках группы различных видов рака, и позволяет рекомбинантному о-ВПГ проникать в выбранную раковую клетку. Примеры лигандов, успешно применявшихся для изменения спектра мишеней ВПГ, представляют собой ИЛ-13α, uPaR, одноцепочечное антитело против HER2 и одноцепочечное антитело против EGFR.
В предыдущих исследованиях описано конструирование двух рекомбинантных вирусов под названием R-LM113 и P-LM249, в спектр мишеней которых включен рецептор рака HER2. Для получения высокой специфичности по отношению к раку устраняют взаимодействие gD с его природными рецепторами нектином-1 и HVEM путем делеций специфических фрагментов молекулы gD. R-LM113 несет делецию в последовательности зрелого gD, соответствующую АК 6-38. R-LM249 несет делецию в центральной области зрелого gD, соответствующую АК 61-218. У обоих вирусов удаленные последовательности заменили последовательностью, кодирующей одноцепочечное антитело (sc-Fv), происходящее от трастузумаба - моноклонального антитела против HER2.
Была предпринята попытка изменения спектра мишеней путем модификации других гликопротеинов, кроме gD, по отношению к gC. Встроенные лиганды представляли собой ЕРО и ИЛ-13. Вирус, несущий химерный белок gC-EPO, присоединялся к клеткам, экспрессирующим рецепторы ЕРО; однако это присоединение не приводило к проникновению и инфицированию клетки; вместо этого вирус разрушался, возможно, вследствие его поглощения и уничтожения в лизосомах; в итоге эта стратегия не привела к получению жизнеспособного вируса с измененным спектром мишеней. Химерный белок gC-HJI-13 присутствовал в вирусе, который нес вторую копию ИЛ-13 в гене gD. Данный вирус обладал измененным спектром мишеней. Поскольку все жизнеспособные ВПГ с измененным спектром мишеней несут в составе gD лиганд, обуславливающий изменение спектра мишеней, на основании этих исследований невозможно сделать вывод о том, участвовал ли gC-RJI-13 в появлении способности связываться с альфа-2-рецептором ИЛ-13.
Изменение спектра мишеней посредством генетической модификации gB ВПГ, согласно информации, известной авторам настоящего изобретения, никогда не было описано.
Изменение спектра мишеней посредством генетической модификации gH/gL или даже его попытки, согласно информации, известной авторам настоящего изобретения, никогда не было описано.
К настоящему изобретению имеют отношение предыдущие результаты, полученные в работе Cairns et al. (Journal of Virology, June 2003, Vol. 77, No. 12, p. 6731-6742), краткое содержание которых заключается в следующем. В попытке понять, какую роль играет gL в гетеродимере gH/gL, в ген gL герпесвируса под названием вирус болезни Ауески (PrV), герпесвируса свиньи с высокой гомологией по отношению к ВПГ человека, ввели делецию. ΔgL PrV был нежизнеспособным, поскольку он не мог инфицировать клетки и, следовательно, не мог реплицироваться. Последовательные слепые посевы этого вируса привели к получению спонтанного мутанта, названного PRV-ΔgLPass, содержавшего химерный гликопротеин, полученный из последовательности gD, присоединенной к N-концу gH. Практически аналогичный химерный белок впоследствии также был сконструирован на основе соответствующих генов ВПГ. Он несет последовательность, кодирующую сигнальный пептид gD и эктодомен зрелого gD (АК 1-308), присоединенные к N-концу зрелого gH. Примеры с частичной делецией gH не привели к получению функциональных молекул. Гликопротеин gD-gH, в котором эктодомен gD целиком присоединен к N-концу gH (называемого химерным белком 22 в работе Cairns et al, supra), входит в объем настоящего изобретения. Следует отметить, что у вируса дикого типа активация gH/gL, вызываемая gD, связанным с рецептором, обязательно происходит посредством межмолекулярной передачи сигнала. Авторы настоящего изобретения называют ее транс-передачей сигнала, в отличие от передачи сигнала, которая происходит в пределах одной молекулы, далее называемой цис-передачей сигнала. Неожиданное открытие авторов настоящего изобретения заключается в том, что активация gH может происходить по цис-механизму. Это происходит в случае конструктов R-VG803 и Р-VG809, в которых sc-Fv активирует gH-фрагмент в самом химерном белке. Химерный белок 22, описанный в работе Cairns et al., supra, использовали в комплементационных анализах. В частности, химерный белок 22 восстанавливал инфекцию gD-/- gH+/+-вируса или gH-/- gD+-вируса. Его не тестировали по отношению к комплементации вируса с двойной делецией gD-/- gH-/-. Существует два основных различия между предыдущими данными и настоящими результатами. Во-первых, в комплементационных анализах (Cairns et al, supra) gD дикого типа в gH-/- gD+-вирусе может активировать по транс-механизму фрагмент gH, который является частью химерного белка gD-gH. И наоборот, фрагмент gD, который является частью химерного белка, может активировать по транс-механизму gH дикого типа в gD-/- gH+-вирионах. В любом случае активация может иметь место только по транс-механизму, согласно заключению в Cairns et al, supra. Доказательства цис-активации химерного белка gD-gH не представлены, и специалисты считали ее невозможной. Во-вторых, независимо от механизма активации, в комплементарной системе активацию gH опосредовал gD, который содержит сайт связывания gH, а не гетерологичный лиганд. Эти результаты не позволяют установить или предположить, что гетерологичные последовательности (последовательности, не являющиеся последовательностью вируса), в настоящем документе называемые лигандом, можно внедрить в область N-конца gH и даже менее, так, чтобы гетерологичный лиганд, внедренный в область N-конца gH, мог придавать ВПГ тропизм к клеточным рецепторам, способным связывать рекомбинантный лиганд.
Авторы настоящего изобретения показали, что это действительно возможно и что gH можно модифицировать с целью изменения спектра мишеней герпесвируса.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В первом аспекте настоящее изобретение относится к рекомбинантному инфекционному герпесвирусу, содержащему гетерологичный полипептидный лиганд, присоединенный к N-концу зрелого гликопротеина Н (gH) или укороченного gH, или встроенный в gH.
Во втором аспекте настоящее изобретение относится к рекомбинантному инфекционному герпесвирусу согласно первому аспекту, предназначенному для применения при лечении заболеваний.
В третьем аспекте настоящее изобретение относится к нуклеиновой кислоте, содержащей геном рекомбинантного инфекционного герпесвируса согласно первому аспекту или по меньшей мере его гетерологичного полипептидного лиганда, присоединенного к N-концу зрелого gH или укороченного gH, или встроенного в gH.
В четвертом аспекте настоящее изобретение относится к вектору, содержащему нуклеиновую кислоту согласно третьему аспекту.
В пятом аспекте настоящее изобретение относится к клетке, содержащей рекомбинантный инфекционный герпесвирус согласно первому аспекту, нуклеиновую кислоту согласно третьему аспекту или вектор согласно четвертому аспекту.
В шестом аспекте настоящее изобретение относится к рекомбинантному инфекционному герпесвирусу согласно первому аспекту, предназначенному для медицинского применения.
В седьмом аспекте настоящее изобретение относится к способу уничтожения клетки с применением рекомбинантного инфекционного герпесвируса согласно первому аспекту.
В восьмом аспекте настоящее изобретение относится к способу культивирования рекомбинантного инфекционного герпесвируса согласно первому аспекту в клетках in vitro.
В предпочтительном варианте реализации настоящего изобретения рекомбинантный инфекционный герпесвирус содержит гликопротеин D (gD) с аминокислотной делецией, что приводит к потере способности герпесвируса использовать в качестве мишеней молекулы или их фрагменты, доступные на поверхности клетки и являющиеся мишенями немодифицированного gD. Кроме того или в качестве альтернативы, gD содержит гетерологичный полипептидный лиганд, присоединенный к N-концу зрелого gD или укороченного gD, или встроенный в gD.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1: Схемы геномов рекомбинантных вирусов R-VG803, R-VG811, R-VG809, R-VG805 и R-VG807. Геном ВПГ-1 представлена в виде линии, ограниченной внутренними повторами (IR). Последовательность ВАС, ограниченную Lox-P, вставили в межгенную область UL3-UL4. Красный флуоресцентный маркер m-Cherry вставили в межгенную область UL37 и UL38. R-VG803 несет инсерцию scFv-HER2, ограниченную линкерами Ser-Gly, между АК 23-24 gH. R-VG811 несет инсерцию scFv-HER2, ограниченную линкерами Ser-Gly, между АК 23-48 gH. R-VG809 в остальном идентичен R-VG803. Кроме того, он несет делецию АК 6-38 зрелого gD. R-VG805 в остальном идентичен R-VG809; кроме того, он несет инсерцию scFv-EGFR вместо АК 6-38 зрелого gD. R-VG807 в остальном идентичен R-VG809; кроме того, он несет инсерцию scFv-HER2 вместо АК 6-38 зрелого gD.
Фигура 2: R-VG803 и R-VG 809 экспрессируют химерный гликопротеин scFv-gH. Лизаты клеток Vero, инфицированных R-VG803, R-VG809 или R-LM5, подвергали элекстрофорезу в ПААГ. gH детектировали иммуноблоттингом. Цифры слева представляют положение миграции маркеров с молекулярной массой 130K и 95K.
Фигура 3: R-VG803 инфицирует клетки, экспрессирующие HER2 в качестве единственного рецептора (клетки J-HER2), а также клетки, положительные по естественным рецепторам gD, и следующие поколения вируса распространяются от клетки к клетке в клетках J-HER2. J-клетки не экспрессируют рецепторов ВПГ дикого типа. J-HER2, J-нектин-1, J-HVEM экспрессируют только указанные рецепторы. (А) Указанные клетки инфицировали R-VG803 (1 БОЕ/клетку согласно титру в клетках J-HER2) и отслеживали красную флуоресценцию посредством микроскопии. (В) Клетки J-HER2 инфицировали R-VG803 (0,01 БОЕ/клетку), поддерживали в среде, содержащей мАт 52S, и ежедневно отслеживали красную флуоресценцию. Увеличение размера бляшек указывало на распространение от клетки к клетке.
Фигура 4: Описание путей проникновения R-VG803 в клетки J-HER2 (А-В) и путей проникновения R-VG803 и P-VG809 в клетки SK-OV-3 (С). (А, В) Трастузумаб ингибирует инфекцию R-VG803 клеток J-HER2. Клетки J-HER2 инфицировали R-VG803 в присутствии трастузумаба (трастуз.) (28 мкг/мл) или контрольных IgG. Инфекцию отслеживали с помощью флуоресцентной микроскопии (А) или проточной цитометрии (В). (С) Влияние трастузумаба и мАт HD1 на инфекцию клеток SK-OV-3 вирусами R-VG803 или R-VG809. R-VG803 предварительно инкубировали с HD1 (конечная концентрация 1 мкг/мл), а затем использовали для инфицирования клеток SK-OV-3 в трех повторностях. В указанных случаях клетки предварительно обрабатывали трастузумабом (конечная концентрация 28 мкг/мл). Степень инфицирования количественно оценивали через 24 ч с помощью проточной цитометрии (BD Accuri С6) и выражали в процентах по отношению к клеткам, инфицированным необработанным вирусом. Каждое значение представляет собой среднее по трем повторностям.
Фигура 5: R-VG809 инфицирует клетки, экспрессирующие HER2 в качестве единственного рецептора (J-HER2, CHO-HER2), а также клетки SK-OV-3, и не инфицирует J-HVEM, J-нектин и клетки человека и животных, отрицательные по экспрессии HER2 и положительные по естественным рецепторам gD. Клетки инфицировали из расчета 3 БОЕ/клетку и отслеживали инфекцию через 24 часа.
Фигура 6: R-VG805 инфицирует клетки J-HER2, J-EGFR, CHO-EGFR, U251-EGFR-vIII и не инфицирует клетки J-нектин-1 и J-HVEM, а также клетки CHO-KI дикого типа, отрицательные по данным рецепторам.
Фигура 7: Инфекция вирусом R-VG811 клеток J-HER2, SK-OV-3, а также J-нектин-1 и J-HVEM (А) и определение степени вирусной инфекции (B-D). (A) R-VG811 инфицирует клетки J-HER2, SK-OV-3, а также J-нектин-1 и J-HVEM. (В) Сравнение количества инфицированных клеток после трансфекции ДНК-ВАС R-VG811 или R-VG803 в клетки J-HER2 или SK-OV-3. (C-D) Количественная оценка инфекции в клетках, трансфицированных DNA_BAC, с использованием обнаружения m-cherry.
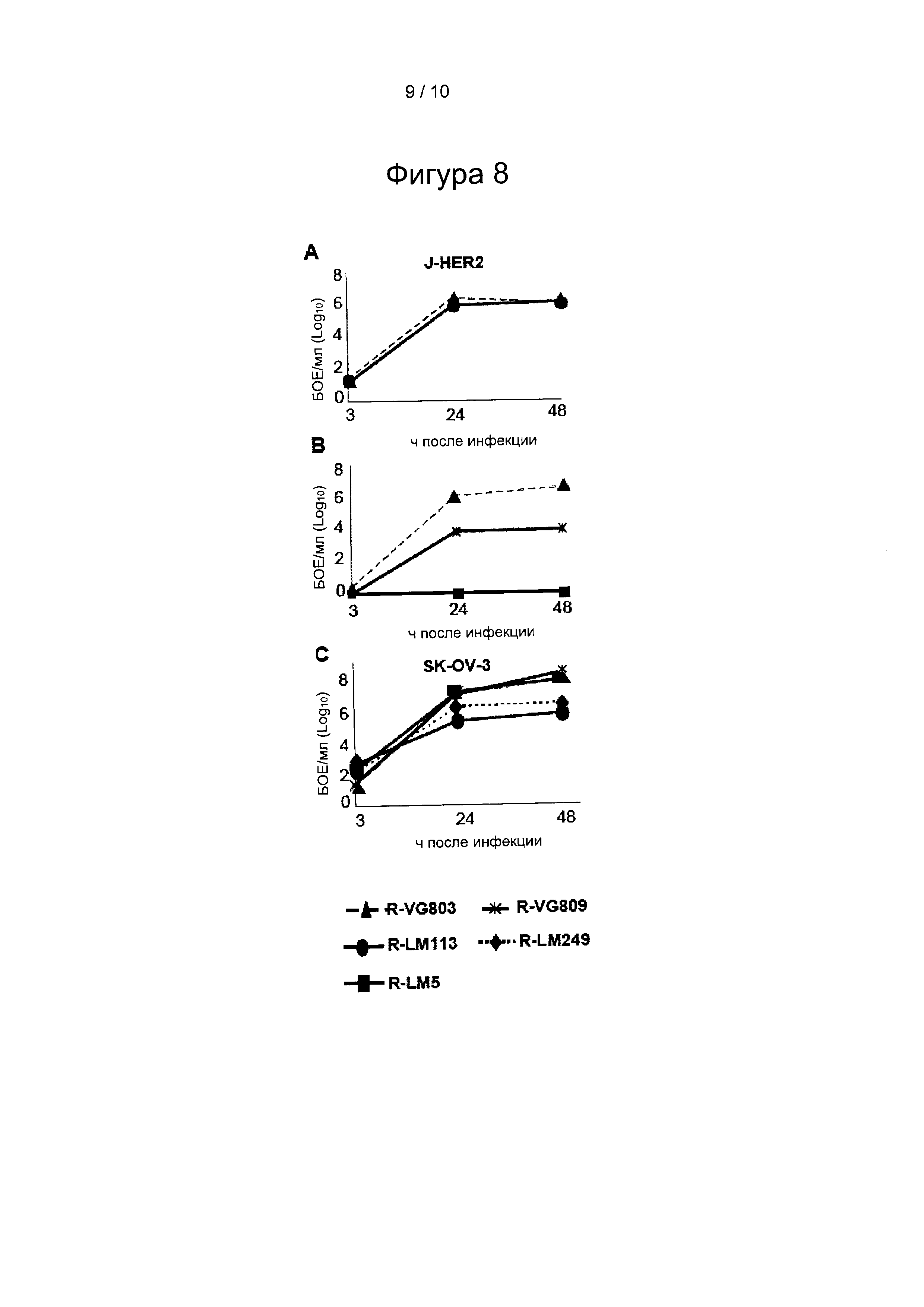
Фигура 8: Кривая репликации R-VG803 и P-VG809 по сравнению с R-LM113, R-LM249 и R-LM5 в клетках J-HER2 или SK-OV-3. (А) Кривые роста R-VG803 и R-LM113 в J-HER2, (В) кривые роста R-VG803, R-VG809 и R-LM5 в J-HER2. R-VG803, R-VG809, R-LM113, R-LM249 и R-LM5 в клетках SK-OV-3 (С). Клетки инфицировали из расчета 0,1 БОЕ/клетку (А, С) или 0,01 БОЕ/клетку (В) вируса, титрованного в клетках той же линии, собранного в указанные моменты времени. Потомство вируса титровали в клетках J-HER2 (А, В) или SK-OV-3 (С). Результаты представляют собой среднее значение по меньшей мере двух независимых экспериментов.
Фигура 9: Способность R-VG803 и P-VG809 к уничтожению клеток SK-OV-3 по сравнению с аналогичной способностью R-LM113, R-LM249 и R-LM5. Результаты показаны в виде жизнеспособности клеток SK-OV-3, инфицированных указанными вирусами из расчета 2 БОЕ/клетку согласно определению с использованием AlamarBlue, в трех повторных монослоях. Рисунок представляет собой среднее по трем повторностям.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Перед подробным описанием настоящего изобретения следует понимать, что настоящее изобретение не ограничивается конкретной методологией, протоколами и реагентами, описанными в настоящем документе, поскольку они могут изменяться. Кроме того, следует понимать, что терминология используется в настоящем документе лишь для целей описания конкретных вариантов воплощения и не должна рассматриваться в качестве ограничивающей рамки настоящего изобретения, которые должны ограничиваться только прилагаемой формулой изобретения. Если не указано иное, все технические и научные термины, использованные в настоящем документе, имеют значения, совпадающие с общепринятыми среди специалистов в данной области техники.
Предпочтительно термины, используемые в настоящем документе, соответствуют определениям, описанным в "A multilingual glossary of biotechnological terms: (IUPAC Recommendations)", Leuenberger, H.G.W, Nagel, B. and

Несколько документов упоминаются в тексте данного описания. Каждый из документов, упомянутых в настоящей заявке (включая все патенты, патентные заявки, патентные публикации, научные публикации, спецификации производителя, инструкции и т.д.) выше или ниже по тексту, полностью включен в настоящий документ посредством ссылки. Ничто в настоящем документе не следует интерпретировать в качестве признания того, что данное изобретение не может датировать данное описание более ранним числом в силу более раннего изобретения.
Ниже описаны элементы настоящего изобретения. Эти элементы перечислены с конкретными вариантами реализации, однако следует понимать, что их можно объединять любым образом и в любом количестве, создавая дополнительные варианты реализации. Не следует считать, что различные описанные примеры и предпочтительные варианты реализации ограничивают настоящее изобретение только явно описанными вариантами реализации. Следует понимать, что данное описание приведено для поддержки и охвата вариантов реализации, объединяющих явно описанные варианты реализации с любым количеством описанных и/или предпочтительных элементов. Кроме того, следует считать, что любые перестановки и комбинации всех элементов, описанных в настоящей заявке, включены в описание в настоящей заявке, если иное не следует из контекста.
Следует понимать, что в данном описании и последующей формуле изобретения слово "содержать» и его производные, например, "содержит" и "содержащий» подразумевают включение указанного элемента или этапа или группы элементов или этапов, а не исключение любого другого элемента или этапа или группы элементов или этапов, если контекст не требует иного. В настоящем описании и прилагаемой формуле изобретения формы единственного числа включают множественное число, если смысл описания не указывает на иное явным образом.
В первом аспекте настоящее изобретение относится к рекомбинантному инфекционному герпесвирусу, содержащему гетерологичный полипептидный лиганд, присоединенный к N-концу зрелого гликопротеина Н (gH) или укороченного gH, или встроенный в gH (также называемого в настоящем документе модифицированным gH).
Термин «рекомбинантный» герпесвирус в настоящем документе относится к герпесвирусу, генетически модифицированному с целью экспрессии гетерологичного белка. Способы создания рекомбинантных герпесвирусов хорошо известны в данной области техники, см., например, Sandri-Goldin et al., Alpha Herpesviruses: Molecular and Cellular Biology, Caister Academic Press, 2006.
Термин «инфекционный» герпесвирус в настоящем документе относится к герпесвирусу, способному проникать в клетку-мишень и продуцировать белки, кодируемые геномом вируса, включая гетерологичные белки, входящие в их число. В предпочтительном значении, герпесвирус также может продуцировать вирусы следующих поколений в клетке-мишени, в которую он проник.
Термин «герпесвирус» в настоящем документе относится к двуцепочечному ДНК-вирусу - члену семейства herpesviridae, которые вызывают скрытые или литические инфекции. Все герпесвирусы обладают общей структурой: все герпесвирусы содержат относительно крупные геномы на основе двуцепочечной линейной ДНК, кодирующие 100-200 генов, упакованные в икосаэдрическую белковую оболочку, называемую капсидом, который сам завернут в белковый слой, называемый тегументом, который содержит как вирусные белки, так и вирусные мРНК, и липидную двуслойную мембрану, называемую оболочкой. Всю эту частицу также называют вирионом.
Термин «гетерологичный» полипептид, используемый в настоящем документе по отношению к герпесвирусу, относится к полипептиду, который не является нативным для герпесвируса. Он по меньшей мере не является нативным для конкретного используемого штамма герпесвируса, а в предпочтительном значении также не является нативным для любых других герпесвирусов. Данный термин также не включает генетически модифицированные белки герпесвирусного происхождения, т.е. такие генетически модифицированные белки герпесвирусов не являются гетерологичными полипептидами в пределах указанного значения термина. В конкретном варианте реализации гетерологичный полипептидный лиганд не является гликопротеином D герпесвируса (gD) или его фрагментом, специфически связывающим клеточный лиганд gD.
Термин «гибридный» или «объединение» в настоящем документе относится к прямому или непрямому (посредством одного или более пептидных линкеров) связыванию двух различных полипептидов пептидными связями. В предпочтительном варианте реализации, относящемся к gH, гетерологичный полипептидный лиганд присоединен к N-концу зрелого gH или укороченного зрелого gH. В предпочтительном варианте реализации, относящемся к gD, гетерологичный полипептидный лиганд присоединен к N-концу зрелого gD или укороченного зрелого gD.
Длина пептидного линкера составляет от 1 до 30 аминокислот, предпочтительно от 5 до 15 аминокислот, более предпочтительно от 8 до 12 аминокислот, и он может состоять из любых аминокислот.Предпочтительно он содержит аминокислоту(ы) Gly и/или Ser, в более предпочтительном случае он содержит по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 аминокислот, выбранных из группы, состоящей из Gly и Ser. Наиболее предпочтительно он состоит из аминокислот Gly и/или Ser. Линкеры на основе Gly и Ser являются предпочтительными, поскольку они обеспечивают гибкость, хорошую растворимость и устойчивость к протеолизу.
Термин «зрелый» гликопротеин в настоящем документе относится к гликопротеину без N-концевого сигнального пептида. По отношению к gH он предпочтительно относится к gH без 1-18 аминокислот gH согласно SEQ ID NO: 1 или соответствующей области гомологичного gH. По отношению к gD он предпочтительно относится к gD без 1-25 аминокислот gD согласно SEQ ID NO: 4 или соответствующей области гомологичного gD.
Термин «укороченный» гликопротеин в настоящем документе относится к гликопротеину герпесвируса, предпочтительно к зрелому гликопротеину герпесвируса без N-концевого фрагмента. В конкретном варианте реализации gH укорочен (т.е. включительно) по любую из аминокислот 18-88 (т.е. 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40,41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87 или 88), в частности,
по 23, 24, 48, 50 или 88 аминокислоту gH согласно SEQ ID NO: 1 (укорачивание по 18 аминокислоту приводит к получению зрелого gH). В еще одном конкретном варианте реализации gD укорочен (т.е. включительно) по любую из аминокислот 25-64 (т.е. 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50,51, 52, 53, 54, 55, 56, 57, 58, 59, 60,61, 62, 63 или 64, в частности, до 64 аминокислоты gD согласно SEQ ID NO: 4 (укорачивание по 25 аминокислоту приводит к получению зрелого gD).
Термин «гликопротеин Н» или «gH» в настоящем документе относится к 110-кДа гликопротеину оболочки вириона, который играет роль в инфекционности герпесвируса. В частности, он образует гетеродимер с гликопротеином L герпесвируса. В настоящем документе он представлен gH ВПГ-1 согласно SEQ ID NO: 1 (предшественником gH или полноразмерным gH, который содержит сигнальную последовательность, зрелым gH без этой сигнальной последовательности, т.е. остатков 1-18 SEQ ID NO: 1). Вместе с тем, гомологи gH присутствуют во всех членах семейства герпесвирусов, и поэтому гомологичные последовательности могут отличаться друг от друга (предпочтительные гомологи см. также ниже). Таким образом, гомологи gH ВПГ-1 также входят в рамки изобретения. В предпочтительном варианте реализации такие гомологи gH ВПГ-1 содержат аминокислотную последовательность, по меньшей мере на 70%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичную последовательности согласно SEQ ID NO: 1 и сохраняют, предпочтительно в случае дикого типа (т.е. немодифицированном состоянии), способность к образованию гетеродимера с гликопротеином L герпесвируса. gH является консервативным по меньшей мере у герпесвирусов человека и обезьян. Известны кристаллические структуры внеклеточных фрагментов трех белков gH: один из них относится к gH альфа-герпесвируса ВПГ-2 (Chowdary et al., Nat Struct Mol Biol 2010 17:882-888), другой - к PrV свиньи (Backovic et al., PNAS 2012 107(52) 22635-22640), а также альфа-герпесвируса, и еще один - к вирусу Эпштейна-Барр (Matsuura et al., PNAS, 2010 107(52) 22641-22646), гамма-герпесвирусу. Они в значительной степени схожи, например, организация структурно аналогичных доменов присутствует во всех кристаллических структурах.
Термин «gD» или «гликопротеин D» относится к компоненту оболочки вириона герпесвируса, который играет важную роль в проникновении ВПГ в клетки. gD связывается с молекулами клетки, а именно HVEM и нектином-1 после первоначального взаимодействия гликопротеинов gC и gB герпесвируса с геперансульфатными протеогликанами. В настоящем документе он представлен gD ВПГ-1 согласно SEQ ID NO: 4 (предшественником gD или полноразмерным gD), который содержит сигнальную последовательность; зрелый gD не содержит этой сигнальной последовательности, т.е. остатков 1-25 SEQ ID NO: 4). Вместе с тем, гомологи gD (предпочтительные гомологи см. также ниже) присутствуют в других членах семейства герпесвирусов, и поэтому гомологичные последовательности могут отличаться друг от друга. Таким образом, гомологи gD ВПГ-1 также входят в рамки изобретения. В предпочтительном варианте реализации такие гомологи gD ВПГ-1 содержат аминокислотную последовательность, по меньшей мере на 70%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичную последовательности согласно SEQ ID NO: 4 и в случае дикого типа (т.е. Немодифицированном состоянии) сохраняют способность связывания с HVEM и нектином-1 или, в более общем случае, рецепторами клетки, что позволяет гомологу gD каскадно стимулировать слияние оболочки вируса с клеточными мембранами.
В предпочтительном варианте реализации герпесвирус выбран из группы, состоящей из вируса простого герпеса-1 (ВПГ-1), вируса простого герпеса-2 (ВПГ-2), вируса ветряной оспы (герпесвируса человека-3 (HHV-3)), альфа-герпесвируса болезни Ауески свиней (PRV), альфа-1-герпесвируса шимпанзе (ChHV), герпесвируса павианов-2 (HVP2), герпесвируса мартышковых-2 (CeHV2), герпесвируса макаковых-1 (MHV1), герпесвируса саймириевых-1 (HVS1), герпесвируса игрунковых-3 (CalHV3), герпесвируса саймириевых-2 (HVS2), герпесвируса крупного рогатого скота-1 (BoHV-1), герпесвируса крупного рогатого скота-5 (BoHV-5), герпесвируса лошадей-1 (EHV-1), герпесвируса лошадей-2 (EHV-2), герпесвируса лошадей-5 (EHV-5), герпесвируса собак-1 (CHV), герпесвируса кошек-1 (FHV-1), вируса энтерита уток (DEV), альфа-герпесвируса крыланов-1 (FBAHV1), герпесвируса крупного рогатого скота-2 (BoHV-2), герпесвируса заячьих-4 (LHV-4), герпесвируса лошадей-3 (EHV-3), герпесвируса лошадей-4 (EHV-4), герпесвируса лошадей-8 (EHV-8), герпесвируса лошадей-9 (EHV-9), герпесвируса мартышковых-9 (CeHV-9), герпесвируса свиных-1 (SuHV-1), вируса болезни Марека (MDV), вируса болезни Марека 2 серотипа (MDV2), герпесвируса соколиных 1 типа (FaHV-1), герпесвируса куриных-3 (GaHV-3), герпесвируса куриных-2 (GaHV-2), герпесвируса, ассоциированного с болезнью легких, глаз и трахеи (LETV), герпесвируса куриных-1 (GaHV-1), герпесвируса попугаеобразных-1 (PsHV-1), герпесвируса человека-8 (HHV-8), герпесвируса человека-4 (HHV-4), герпесвируса морских черепах-5 (ChHV5), герпесвируса коатовых-3 (AtHV3) или герпесвируса индеек-1 (MeHV-1). Все эти вирусы содержат по меньшей мере gH с четкой гомологией по отношению к gH ВПГ-1/-2. В более предпочтительном варианте реализации герпесвирус представляет собой ВПГ-1 или ВПГ-2.
Термин «встроенный» или «вставка/инсерция» в настоящем документе относится к включению одного полипептида в другой полипептид, при котором включенный полипептид связан с принимающим полипептидом пептидными связями прямым или непрямым образом через один или более пептидных линкеров, точнее, через N-концевой или С-концевой пептидный линкер по отношению к такой вставке. Хотя присоединение пептидного лиганда к зрелым gH/gD также может рассматриваться как инсерция в предшественник gH/gD согласно SEQ ID NO 1/4, соответственно, такая инсерция в настоящем документе называется N-концевым присоединением, поскольку вирион несет зрелый гликопротеин. Таким образом, термин «инсерция» предпочтительно относится к инсерции в зрелый гликопротеин, в частности, gH и gD.
В предпочтительном варианте реализации гетерологичный полипептидный лиганд встроен в N-концевую область gH, начиная с любой из аминокислот 19-23 (предпочтительно 19) и заканчивая любой из аминокислот 48-88 (предпочтительно 88), предпочтительно начиная с аминокислоты 19 и заканчивая аминокислотой 88, начиная с аминокислоты 61 и заканчивая аминокислотой 65, начиная с аминокислоты 69 и заканчивая аминокислотой 72 или начиная с аминокислоты 74 и заканчивая аминокислотой 80; или начиная с аминокислоты 116 и заканчивая аминокислотой 136 gH согласно SEQ ID NO: 1 или соответствующей области гомологичного gH. Считается, что диапазоны 61-65, 69-72 и 74-80 особенно полезны, поскольку они представляют собой области открытых петель домена H1A gH и поэтому представляют собой точки инсерции, позволяющие сохранить структурную целостность домена H1A gH. В более предпочтительном варианте реализации его вставляют в N-концевую область gH, начиная с аминокислоты 19 и заканчивая аминокислотой 50 gH согласно SEQ ID NO: 1 или соответствующей области гомологичного gH. В еще более предпочтительном варианте реализации его вставляют в N-концевую область gH, начиная с аминокислоты 19 и заканчивая аминокислотой 48 gH согласно SEQ ID NO: 1 или соответствующей области гомологичного gH. В еще одном более предпочтительном варианте реализации его вставляют в N-концевую область gH, начиная с аминокислоты 23 и заканчивая аминокислотой 48 gH согласно SEQ ID NO: 1 или соответствующей области гомологичного gH. Во всех указанных вариантах реализации аминокислоты, определяющие начало и конец области, входят в указанную область, т.е. инсерция может являться N-концевой или С-концевой по отношению к начальной или конечной аминокислоте. В конкретном случае N-концевой инсерции по отношению к 19 остатку SEQ ID NO: 1, инсерцию можно также рассматривать как присоединение к N-концу зрелого gH. Таким образом, для четкого различения терминов «инсерция» и «объединение» данный конкретный случай предпочтительно исключают из возможных инсерций и считают присоединением к N-концу зрелого gH согласно описанию.
Кроме того, во всех указанных вариантах реализации указанную область можно заменить инсерцией. В конкретном случае инсерции, заменяющей область, включающую 19 остаток SEQ ID NO: 1, инсерцию можно также рассматривать как присоединение к N-концу укороченного зрелого gH. Таким образом, для четкого различения терминов «инсерция» и «объединение» данный конкретный случай предпочтительно исключают из возможных инсерций и считают присоединением к N-концу укороченного зрелого gH согласно описанию.
В наиболее предпочтительном варианте реализации лиганд вставляют между аминокислотой 23 и аминокислотой 24 gH согласно SEQ ID NO: 1 или в соответствующую область (в данном случае соответствующую указанным аминокислотам 23 и 24) гомологичного gH.
В конкретном варианте реализации одна или более из аминокислот N-концевой области gH, указанных выше, удалены. В родственном варианте реализации gH укорочен, как указано выше.
Термин «соответствующая область гомологичного gH» относится к области gH, выравнивающейся с заданной областью gH ВПГ-1 (предпочтительно с областью инсерции, указанной выше) согласно SEQ ID NO: 1 с использованием алгоритма Смита-Уотермана и следующих параметров выравнивания: MATRIX (матрица): BLOSUM62, GAP OPEN (открытие разрыва): 10, GAP EXTEND (продолжение разрыва): 0,5. В случае, если только фрагмент или фрагменты заданной области gH ВПГ-1 выравнивается с последовательностью гомологичного gH с использованием вышеуказанного алгоритма и параметров, «соответствующая область гомологичного gH» относится к области, выравнивающейся с фрагментом(ами) заданной области gH ВПГ-1. Другими словами, в этом случае область гомологичного gH, в которую вставляют лиганд или которую заменяют лигандом, содержит только аминокислоты, выравнивающиеся с фрагментом(ами) заданной области gH ВПГ-1. Кроме того, в этом же случае, термин «соответствующая область гомологичного gH» может относиться к области, окруженной соответствующими фланкирующими последовательностями, причем соответствующие фланкирующие последовательности являются последовательностями гомологичного gH, выравнивающимися с использованием вышеуказанного алгоритма и параметров с последовательностями, фланкирующими вышеуказанную заданную область (предпочтительно область инсерции, описанную выше) gH ВПГ-1. Длина этих фланкирующих последовательностей gH ВПГ-1 составляет по меньшей мере 5, 6, 7, 8, 9, 10, 15, 20, 30, 40 или 50 аминокислот (фланкирующая последовательность на N-конце gH, т.е. с N-конца от любого из аминокислотных остатков 19-23 согласно SEQ ID NO: 1 может быть короче, т.е., в соответствии с указанием, но до 18, 19, 20, 21 или 22 аминокислотных остатков), и они выравниваются с последовательностью гомологичного gH с использованием вышеуказанного алгоритма и параметров.
Гомологичный gH предпочтительно представляет собой gH вируса простого герпеса-2 (ВПГ-2), вируса ветряной оспы (герпесвируса человека-3 HHV-3), альфа-герпесвируса болезни Ауески свиней (PRV), альфа-1-герпесвируса шимпанзе (ChHV), герпесвируса павианов-2 (HVP2), герпесвируса мартышковых-2 (CeHV2), герпесвируса макаковых-1 (MHV1), альфа-герпесвируса крыланов-1 (FBAHV1), герпесвируса саймириевых-1 (HVS1), герпесвируса игрунковых-3 (CalHV3), герпесвируса саймириевых-2 (HVS2), герпесвируса крупного рогатого скота-1 (BoHV-1), герпесвируса крупного рогатого скота-5 (BoHV-5), герпесвируса лошадей-1 (EHV-1), герпесвируса лошадей-2 (EHV-2), герпесвируса лошадей-5 (EHV-5), герпесвируса собак-1 (CHV), герпесвируса кошек-1 (FHV-1), герпесвируса мартышковых-9 (CeHV9), вируса энтерита уток (DEV, AnHV-1), герпесвируса крупного рогатого скота-2 (BoHV-2), герпесвируса заячьих-4 (LHV-4), герпесвируса лошадей-3 (EHV-3), герпесвируса лошадей-4 (EHV-4), герпесвируса лошадей-8 (EHV-8), герпесвируса лошадей-9 (EHV-9), вируса болезни Марека (MDV), вируса болезни Марека 2 серотипа (MDV2), герпесвируса куриных-3 (GaHV-З), герпесвируса куриных-2 (GaHV-2), герпесвируса, ассоциированного с болезнью легких, глаз и трахеи (LETV), герпесвируса куриных-1 (GaHV-1), герпесвируса попугаеобразных-1 (PsHV-1), герпесвируса человека-8 (HHV-8), герпесвируса человека-4 (HHV-4), герпесвируса соколиных 1 типа (FaHV-1), герпесвируса морских черепах-5 (ChHV5), герпесвируса коатовых-3 (AtHV3) или герпесвируса индеек-1 (MeHV-1). Последовательности gH этих герпесвирусов и ВПГ-1 высокконсервативны по сравнению с gH ВПГ-1. Более предпочтительно, гомологичный gH представляет собой gH вируса простого герпеса-2 (ВПГ-2), альфа-1-герпесвируса шимпанзе (ChHV), герпесвируса павианов-2 (HVP2), герпесвируса мартышковых-2 (CeHV2), герпесвируса макаковых-1 (MHV1), альфа-герпесвируса крыланов-1 (FBAHV1), герпесвируса крупного рогатого скота-2 (BoHV-2) или герпесвируса заячьих-4 (LHV-4). Наиболее предпочтительно, гомологичный gH представляет собой gH вируса простого герпеса-2 (ВПГ-2).
В еще одном варианте реализации гетерологичный полипептидный лиганд встроен в направлении N-конца по отношению к домену H1A gH. «Встроен в направлении N-конца » в этом смысле означает не «с N-концевой стороны H1A-домена в непосредственной близости от него», а «в любом месте с N-концевой стороны от Н1А-домена». Н1А-домен gH представляет собой субдомен H1-домена gH. Н1-домен располагается от 49 до 327 аминокислоты белка gH согласно SEQ ID NO: 1, а Н1А-домен располагается от 49 до 115 аминокислоты белка gH согласно SEQ ID NO: 1 (Chowdary et al., 2010). Многие белки gH не содержат Н1А-домена, что можно выявить путем выравнивания последовательностей с SEQ ID №: 1 или по структурному сходству в пределах H1-домена, как в случае gH вируса ветряной оспы (герпесвируса человека-3). Не каждый герпесвирус может содержать gH с областью, соответствующей 1-48 аминокислотам белка gH согласно SEQ ID NO: 1. Однако каждый зрелый gH содержит по меньшей мере несколько, например, 1, 2 или 3 аминокислоты за пределами N-конца H1A-домена. Один из примеров представляет собой ВЭБ, в котором только 1 остаток предшествует H1A-домену в составе зрелого пептида (считая, что H1A-домен начинается с первого остатка, видимого при рентгеноструктурном анализе, т.е., в случае ВЭБ, с положения 19 предшественника gH). В случае gH, в котором эта предшествующая область является очень короткой, например, длиной 10 аминокислот или менее, 5 аминокислот или менее, или 3 аминокислоты или менее, предполагается, что инсерция находится после (т.е. за пределами С-конца) этих остатков, и что при необходимости эти остатки дублируются за инсерцией, т.е. между инсерцией и Н1А-доменом.
В одном варианте реализации первого аспекта настоящего изобретения герпесвирус характеризуется пониженной вирулентностью по сравнению с вирулентностью вируса дикого типа или различной способностью к репликации в больных и не пораженных заболеванием клетках. Термин «вирулентность вируса дикого типа» относится к способности герпесвируса дикого типа (т.е. не рекомбинантного) инфицировать клетки, в частности, проникать в клетки. В конкретном варианте реализации пониженная вирулентность представляет собой пониженную или даже исключенную способность связываться с поверхностными рецепторами клетки-мишени, с которыми связывается вирус дикого типа. Такие поверхностные рецепторы клетки-мишени включают, например, HVEM (синонимы, используемые в данной области техники: HveA и TNFRSF14) и нектин-1 (синонимы, используемые в данной области техники: HveC и PVRL1), с которыми связывается gD, гепарансульфатные протеогликаны, с которыми связываются gB и gC, миелин-ассоциированный гликопротеин MAG, спаренный иммуногллобулин-подобный альфа-рецептор 2 типа (PILRalpha), DC-SIGN и тяжелую цепь-9 немышечного миозина MYH9/NMHC-IIA, с которой связывается gB, и интегрин ITGB3/αvβ3, с которым связывается gH-gL, интегрин альфа-V-бета-6 и интегрин альфа-V-бета-8, с которыми связывается gH (Gianni T, Salvioli S, Chesnokova LS, Hutt-Fletcher LM, Campadelli-Fiume G. PLoS Pathog. 2013; 9(12):e1003806). Снижения или исключения связывания можно достичь, например, путем удаления или модификации гликопротеинов вируса (например, gD, gB или gC) или их фрагментов, участвующих во взаимодействии с рецепторами поверхности клетки-мишени.
Термин «способность к репликации» относится к тому, сколько раз герпесвирус может копировать себя в инфицированной клетке за указанное время. Предпочтительно, если способность к репликации отличается в больных и не пораженных заболеванием клетках, она больше в больных клетках, чем в не пораженных заболеванием клетках (т.е. повышена для больных клеток), или ниже в клетках, не пораженных заболеванием, чем в больных клетках (т.е. понижена для клеток, не пораженных заболеванием).
В предпочтительном варианте реализации рекомбинантный инфекционный герпесвирус содержит модифицированный gD, обладающий пониженной способностью или не обладающий способностью связываться с клеточными лигандами gD, или не содержит gD.
В более предпочтительном варианте реализации герпесвирус содержит gD с аминокислотной делецией, начинающейся с любого из аминокислотных остатков 26-33 и заканчивающейся любым из аминокислотных остатков 31-63 (предпочтительно, начинающейся с 31 остатка и заканчивающейся 63 остатком), и/или начинающейся с любого из аминокислотных остатков 65-86 и заканчивающейся любым из аминокислотных остатков 235-243 (предпочтительно, начинающейся с 86 остатка и заканчивающейся 243 остатком) gD согласно SEQ ID NO: 4 или соответствующей области гомологичного gD. По отношению к зрелому gD, не содержащему N-концевого сигнального пептида длиной 25 аминокислот, это означает аминокислотную делецию, начинающуюся с любого из аминокислотных остатков 1-8 и заканчивающуюся любым из аминокислотных остатков 6-38 (предпочтительно, начинающуюся с 6 остатка и заканчивающуюся 38 остатком), и/или начинающуюся с любого из аминокислотных остатков 40-61 и заканчивающуюся любым из аминокислотных остатков 210-218 (предпочтительно, начинающуюся с 61 остатка и заканчивающуюся 218 остатком) зрелого gD, соответственно. При этом начальный и конечный остатки входят в состав делеций. Термин «соответствующая область гомологичного gD» относится к области gD, выравнивающейся с заданной областью gD ВПГ-1 (предпочтительно с делецией, описанной выше) согласно SEQ ID NO: 4 с использованием алгоритма Смита-Уотермана и следующих параметров выравнивания: MATRIX (матрица): BLOSUM62, GAP OPEN (открытие разрыва): 10, GAP EXTEND (продолжение разрыва): 0,5. В случае, если только фрагмент или фрагменты заданной области gD ВПГ-1 выравнивается с последовательностью гомологичного gD с использованием вышеуказанного алгоритма и параметров, «соответствующая область гомологичного gD» относится к области, выравнивающейся с фрагментом(ами) заданной области gD ВПГ-1. Другими словами, в этом случае делеция гомологичного gD содержит только аминокислоты, выравнивающиеся с фрагментом(ами) заданной области gD ВПГ-1. Кроме того, в этом же случае, термин «соответствующая область гомологичного gD» может относиться к области, окруженной соответствующими фланкирующими последовательностями, причем соответствующие фланкирующие последовательности являются последовательностями гомологичного gD, выравнивающимися с использованием вышеуказанного алгоритма и параметров с последовательностями, фланкирующими вышеуказанную заданную область (предпочтительно делецию, описанную выше) gD ВПГ-1. Длина этих фланкирующих последовательностей gD ВПГ-1 составляет по меньшей мере 5, 6, 7, 8, 9, 10, 15, 20, 30, 40 или 50 аминокислот (фланкирующая последовательность на N-конце gD, т.е. с N-конца от любого из аминокислотных остатков 26-33 согласно SEQ ID NO: 4 может быть короче, т.е., в соответствии с указанием, но до 25, 26, 27, 28, 29, 30, 31 или 32 аминокислотных остатков), и они выравниваются с последовательностью гомологичного gD с использованием вышеуказанного алгоритма и параметров. Гомологичный gD предпочтительно представляет собой gD ВПГ-2, gD альфа-1 герпесвируса шимпанзе (ChHV), gD герпесвируса макаковых-1 (MHV1), gD герпесвируса павианов-2 (HVP2), gD герпесвируса мартышковых-1 (CeHVl), gD герпесвируса мартышковых-2 (CeHV2), gD герпесвируса саймириевых-1 (HVS1), gD герпесвируса крупного рогатого скота-1 (BoHV-1), gD герпесвируса крупного рогатого скота-5 (BoHV-5), gD герпесвируса лошадей-1 (EHV-1), gD герпесвируса лошадей-3 (EHV-3), gD герпесвируса лошадей-4 (EHV-4), gD герпесвируса лошадей-8 (EHV-8), gD герпесвируса лошадей-9 (EHV-9), gD герпесвируса собак-1 (CHV), gD герпесвируса кошек-1 (FHV-1), gD вируса энтерита уток (DEV), gD герпесвируса лосей (ElkHV), gD герпесвируса северных оленей (RanHV), gD герпесвируса оленевых-1 (CerHV-1), герпесвируса заячьих-4 (LHV-4), герпесвируса оленевых-2 (CerHV-2), gD герпесвируса коз-1 (CapHV-1), gD герпесвируса азиатских буйволов-1 (BuHV1), gD альфа-герпесвируса крыланов-1 (FBAHV1), gD герпесвируса кенгуровых-1 (MaHV-1), герпесвируса соколиных-1 (FaHV-1), gD герпесвируса кенгуровых-1 (MaHV-2), gD вируса болезни Ауески свиней (PrV), герпесвируса тюленей-1 (PhHV-1), вируса болезни Марека (MDV), герпесвируса индеек (HVT), герпесвируса индеек-1 (MeHV-1), gD герпесвируса куриных-1 (GaHV-1), gD герпесвируса куриных-2 (GaHV-2) или gD герпесвируса грифов (VHV). Более предпочтительно, гомологичный gD представляет собой gD ВПГ-2, gD альфа-1-герпесвируса шимпанзе (ChHV), gD герпесвируса павианов-2 (HVP2), герпесвируса макаковых-1 (MHV1), gD герпесвируса мартышковых-1 (CeHV1), gD альфа-герпесвируса крыланов-1 (FBAHV1), gD герпесвируса мартышковых-2 (CeHV2), gD герпесвируса кенгуровых-1 (MaHV-2) или gD герпесвируса саймириевых-1 (HVS1). Наиболее предпочтительно, гомологичный gD представляет собой gD ВПГ-2.
В еще одном варианте реализации первого аспекта настоящего изобретения гетерологичный полипептидный лиганд присоединен к домену, функционально эквивалентному N-концу gD и присутствующему в белке, функция которого эквивалентна gD ВПГ, например, gp42 герпесвируса человека-4 (EBV), BZLF2 герпесвируса макаковых, ORF44 герпесвируса ингрунковых-3 или BZLF2 лимфотропного герпесвируса свиней-1.
Герпесвирус может также быть ослабленным, например, путем делеций или модификации вирусных генов γ134.5, UL39 и/или ICP47. Термин «ослабленный» относится к ослабленному или менее вирулентному герпесвирусу. Предпочтительно оно представляет собой условное ослабление, причем это ослабление влияет только на клетки, не пораженные заболеванием, не являющиеся мишенями герпесвируса после изменения спектра мишеней согласно настоящему изобретению. Таким образом, полная вирулентность герпесвируса проявляется только по отношению к больным клеткам (например, раковым клеткам), включенным в спектр мишеней герпесвируса. Условного ослабления можно достичь, например, путем замены области промотора гена γ134.5, UL39 или ICP47 промотором гена человека, экспрессируемого исключительно в раковых клетках (например, промотором сурвивина). Дальнейшие модификации с целью условного ослабления могут включать замену регуляторных областей, ответственных за транскрипцию генов IE, например, области промотора ICP-4, областями промоторов генов, экспрессируемых исключительно в больных, например, раковых клетках (например, промотора сурвивина). Эта модификация приведет к получению ВПГ, способного реплицироваться в заданных условиях, например, в раковых клетках, но не в обычных клетках. Дополнительная модификация вируса может включать инсерцию последовательности элементов, реагирующих на микроРНК (miR), которые в изобилии присутствуют в нормальных, но не опухолевых клетках, в 3'-нетранслируемую область важнейших генов ВПГ, например, ICP4. Это также приведет к получению вируса, некомпетентного по репликации лишь в нормальных клетках.
Термин «гены IE» относится к предранним генам, которые представляют собой гены, временно и быстро активирующиеся в ответ на клеточный раздражитель.
В еще одном варианте реализации первого аспекта настоящего изобретения герпесвирус содержит гетерологичный полипептидный лиганд, присоединенный к N-концу зрелого gD или укороченного gD, или встроенный в gD (также называемого в настоящем документе модифицированным gD). В предпочтительном варианте реализации гетерологичный полипептидный лиганд, встроенный в gD, встроен со стороны С-конца любой из аминокислот 26-243 gD в соответствии с SEQ ID NO: 4 (1-218 зрелого gD) или замещает аминокислотную последовательность, начинающуюся с любого из аминокислотных остатков 26-33 и заканчивающуюся любым из аминокислотных остатков 31-63 (предпочтительно, начинающуюся с 31 остатка и заканчивающуюся 63 остатком), и/или начинающуюся с любого из аминокислотных остатков 65-86 и заканчивающуюся любым из аминокислотных остатков 235-243 (предпочтительно, начинающуюся с 86 остатка и заканчивающуюся 243 остатком) gD согласно SEQ ID NO: 4 или соответствующей области гомологичного gD. Аналогично, термин «соответствующая область гомологичного gD» относится к области gD, выравнивающейся с заданной областью gD ВПГ-1 (предпочтительно с заменяемой аминокислотной последовательностью, описанной выше) согласно SEQ ID NO: 4 с использованием алгоритма Смита-Уотермана и следующих параметров выравнивания: MATRIX (матрица): BLOSUM62, GAP OPEN (открытие разрыва): 10, GAP EXTEND (продолжение разрыва): 0,5. В случае, если только фрагмент или фрагменты заданной области gD ВПГ-1 выравнивается с последовательностью гомологичного gD с использованием вышеуказанного алгоритма и параметров, «соответствующая область гомологичного gD» относится к области, выравнивающейся с фрагментом(ами) заданной области gD ВПГ-1. Другими словами, в этом случае заменяемая последовательность гомологичного gD содержит только аминокислоты, выравнивающиеся с фрагментом(ами) заданной области gD ВПГ-1. Кроме того, в этом же случае, термин «соответствующая область гомологичного gD» может относиться к области, окруженной соответствующими фланкирующими последовательностями, причем соответствующие фланкирующие последовательности являются последовательностями гомологичного gD, выравнивающимися с использованием вышеуказанного алгоритма и параметров с последовательностями, фланкирующими вышеуказанную заданную область (предпочтительно заменяемую аминокислотную последовательность, описанную выше) gD ВПГ-1. Длина этих фланкирующих последовательностей gD ВПГ-1 составляет по меньшей мере 5, 6, 7, 8, 9, 10, 15, 20, 30, 40 или 50 аминокислот (фланкирующая последовательность на N-конце gD, т.е. с N-конца от любого из аминокислотных остатков 26-33 согласно SEQ ID NO: 4 может быть короче, т.е., в соответствии с указанием, но до 25, 26, 27, 28, 29, 30, 31 или 32 аминокислотных остатков), и они выравниваются с последовательностью гомологичного gD с использованием вышеуказанного алгоритма и параметров. Гомологичный gD соответствует вышеприведенному описанию по отношению к делеций gD.
В предпочтительном варианте реализации первого аспекта настоящего изобретения гетерологичный полипептидный лиганд, объединенный с или встроенный в gH и/или gD, связывается с молекулой-мишенью или ее фрагментом, доступным на поверхности клетки. Предпочтительно, он специфически связывается с молекулой или ее фрагментом, доступным на поверхности клетки. Термин «специфически связывает» в настоящем документе относится к реакции связывания, которую можно использовать для определения наличия указанной молекулы в гетерогенной популяции белков и, в частности, клеток, например, в организме, предпочтительно, организме человека. Таким образом, указанный лиганд связывается с конкретной молекулой-мишенью и не связывается в значительной степени с другими молекулами, присутствующими на клетках, или другими молекулами, с которыми лиганд может контактировать в организме. Как правило, лиганд, «специфически связывающий» молекулу-мишень, характеризуется равновесной константой сродства с указанной молекулой-мишенью, превышающей приблизительно 105 (например, 106, 107, 108, 109, 1010, 1011 и 1012 или более) моль/л. В общем случае, гетерологичный полипептидный лиганд, объединенный с или встроенный в gH, может связываться с другой или той же молекулой или их фрагментами, доступными на поверхности клетки, по сравнению с полипептидным лигандом, объединенным с или встроенным в gD. Считается, что связывание с той же молекулой повышает степень связывания с одной молекулой, тогда как связывание с другими молекулами придает двойную специфичность и обеспечивает: 1) поддержание специфичности по отношению к клетке в случае, если одна из молекул более не присутствует на поверхности клетки, например, в случае мутировавших опухолевых клеток; 2) учет неоднородности опухоли: опухоли являются неоднородными и часто опухоль-специфическая молекула экспрессируется не во всех опухолевых клетках; таким образом, наличие двойной мишени позволяет вирусу проникать в клетки с помощью первого или второго рецепторов, связывающихся с этими мишенями, тем самым увеличивая количество опухолевых клеток, которые можно инфицировать.
В одном варианте реализации гетерологичный полипептидный лиганд выбран из группы, состоящей из антитела, производного антитела и имитатора антитела. Антитело, производное антитела или имитатор антитела могут являться моноспецифическими (т.е. специфическими по отношению только к одной молекуле-мишени или ее фрагменту, доступным на поверхности клетки) или полиспецифическими (т.е. специфическими по отношению к более чем одной молекуле-мишени или ее фрагменту, доступным на поверхности той же или другой клетки), например, биспецифическими или триспецифическими (см., например, Castoldi et al., Oncogene. 2013 Dec 12; 32(50):5593-601; Castoldi et al., Protein Eng Des Sel. 2012 Oct; 25(10):551-9). Одновременное адресное воздействие на более чем одну молекулу-мишень или их фрагменты, доступные на поверхности одной и той же клетки, увеличивает специфичность вируса. Одновременное адресное воздействие на более чем одну молекулу-мишень или их фрагменты, доступные на поверхности разных клеток, позволяет предусмотреть неоднородность опухоли, как описано выше.
Термин «производное антитела» в настоящем документе относится к молекуле, содержащей по меньшей мере один вариабельный домен антитела, но не обладающей структурой антитела в целом, например, IgA, IgD, IgE, IgG, IgM, IgY или IgW, хотя также способной связывать молекулу-мишень. Указанные производные могут представлять собой функциональные (т.е. связывающие мишень, в частности, специфически связывающие мишень) фрагменты антител, например, Fab, Fab2, scFv, Fv или их фрагменты, или другие производные или комбинации иммуноглобулинов, например, нанотела, диатела, миниантитела, однодоменные антитела верблюдовых, одиночные домены или Fab-фрагменты, домены вариабельной области тяжелых и легких цепей (например, Fd, VL, включая V-лямбда и V-каппа, VH, VHH) а также мини-домены, состоящие из двух бета-цепей иммуноглобулинового домена, соединенных по меньшей мере двумя структурными петлями, но не ограничиваются ими. Предпочтительно, производное антитела является одновалентным. Более предпочтительно, указанное производное представляет собой одноцепочечное антитело, наиболее предпочтительно содержащее структуру VL-пептидный линкер-VH или VH-пептидный линкер-VL.
Термин «имитатор антитела» в настоящем документе относится к органическим соединениям, которые способны специфически связывать антигены, как антитела, но структурно не родственны антителам. Они обычно представляют собой искусственные пептиды и белки с молярной массой от приблизительно 3 до 20 кДа. Неограничивающие примеры имитаторов антител представляют собой аффитела, аффины, аффимеры, аффитины, антикалины, авимеры, дарпины, финомеры, пептиды с доменом Кунитца, монотела, Z-домен белка А, кристаллин гамма-В, убиквитин, цистатин, Sac7D Sulfolobus acidocaldarius, липокалин, домен мембранных рецепторов, мотив анкиринового повтора, SH3-домен Fyn, домен Кунитца ингибиторов протеаз, 10-й домен III типа фибронектина, синтетические гетеродвухвалентные или гетерополивалентные лиганды (Josan et al., Bioconjug Chem. 2011 22(7): 1270-1278; Xu et al., PNAS 2012 109 (52) 21295-21300; Shallal et al., Bioconjug Chem. 2014 25(2) 393-405) или синтетические пептидные лиганды, например, из библиотеки (случайных) пептидов. Синтетические пептидные лиганды содержат аминокислотные последовательности неприродного происхождения, функция которых состоит в связывании с конкретной молекулой-мишенью. Пептидные лиганды в контексте настоящего изобретения обычно представляют собой ограниченные (т.е. содержат некоторый элемент структуры, например, аминокислоты, инициирующие β-изгиб или β-складчатый лист или, например, образуют циклы из-за наличия остатков Cys, связанных дисульфидными связями) или неограниченные (линейные) аминокислотные последовательности длиной менее приблизительно 50 аминокислотных остатков, и предпочтительно - менее приблизительно 40 аминокислотных остатков. Среди пептидных лигандов длиной менее приблизительно 40 аминокислотных остатков предпочтительными являются пептидные лиганды длиной от 10 до 30 аминокислотных остатков.
В одном варианте реализации клетка является клеткой, пораженной заболеванием. В частности, она может быть опухолевой клеткой, хронически инфицированной клеткой или стареющей клеткой.
В случае опухолевых клеток основным заболеванием является опухоль, предпочтительно выбранная из группы, состоящей из рака надпочечников, рака заднего прохода, рака желчных протоков, рака мочевого пузыря, рака костей, опухолей головного мозга/ЦНС, рака молочной железы, рака с неизвестной первичной локализацией, болезни Кастлемена, рака шейки матки, рака толстой кишки/прямой кишки, рака эндометрия, рака пищевода, семейства опухолей Юинга, рака глаз, рака желчного пузыря, карциноидных опухолей желудочно-кишечного тракта, стромальных опухолей желудочно-кишечного тракта (GIST), гестационной трофобластической болезни, болезни Ходжкина, саркомы Капоши, рака почки, рака гортани и гортаноглотки, лейкоза, рака печени, рака легких, лимфомы, лимфомы кожи, злокачественной мезотелиомы, множественной миеломы, миелодиспластического синдрома, рака полости и придаточных пазух носа, рака носоглотки, нейробластомы, неходжкинской лимфомы, рака полости рта и ротоглотки, остеосаркомы, рака яичников, рака поджелудочной железы, рака полового члена, опухолей гипофиза, рака предстательной железы, ретинобластомы, рабдомиосаркомы, рака слюнных желез, саркомы - рака мягких тканей у взрослых, рака кожи, рака тонкой кишки, рака желудка, рака яичка, рака тимуса, рака щитовидной железы, саркомы матки, рака влагалища, рака вульвы, макроглобулинемии Вальденстрема и опухоли Вильмса.
Предпочтительные опухолевые заболевания представляют собой HER-2-положительные виды рака (например, рак молочной железы, рак яичников, рак желудка, рак легких, рак головы и шеи, остеосаркому и мультиформную глиобластому), EGFR-положительные виды рака (например, рак головы и шеи, мультиформную глиобластому, немелкоклеточный рак легких, рак молочной железы, рак ободочной и прямой кишки и рак поджелудочной железы), EGFR-vIII положительные виды рака (например, мультиформную глиобластому), PSMA-положительные виды рака (например, рак предстательной железы), CD20+-положительные лимфомы и опухоли, связанные с ВЭБ.
В случае хронически инфицированной клетки основное заболевание представляет собой хроническое инфекционное заболевание, например, туберкулез, малярию,, хронический вирусный гепатит (ВГВ, вирус гепатита D и ВГС), синдром приобретенного иммунодефицита (СПИД, вызванный ВИЧ, вирусом иммунодефицита человека), или расстройства, связанные с ВЭБ: системные аутоиммунные заболевания (системную красную волчанку, ревматоидный артрит и синдром Шегрена) и рассеянный склероз (MS).
В случае стареющей клетки основным заболеванием является заболевание, ассоциированное со старением, например, (i) редкие генетические заболевания под названием прогероидные синдромы, характеризующиеся преждевременным старением: синдром Вернера (WS), синдром Блума (BS), синдром Ротмунда-Томсона (RTS), синдром Коккейна (CS), пигментная ксеродерма (ХР), трихотиодистрофия или синдром прогерии Хатчинсона-Гилфорда (HGPS) или (ii) распространенные возрастные расстройства: ожирение, диабет 2 типа, саркопения, артроз, идиопатический фиброз легких и хроническая обструктивная болезнь легких, катаракта, нейродегенеративные заболевания или расстройства, ассоциированные с лечением рака.
В одном варианте реализации, имеющем отношение к молекуле-мишени или ее фрагменте, доступным на поверхности клетки, молекула-мишень представляет собой белок, гликолипид или гликозид. Предпочтительно, указанный белок является клеточным рецептором. В случае опухолевой клетки предпочтительно, чтобы белок клеточной поверхности представлял собой антиген, ассоциированный с раком, например, HER2, EGFR, EGFRvIII, EGFR3 (ERBB3), MET, FAP, PSMA, CXCR4, ITGB3, СБА, CAIX, муцин, фолат-связывающий белок, GD2, VEGFR1, VEGFR2, CD20, CD30, CD33, CD52, CTLA4, CD55, αVβ3-интегрин, α5β1-интегрин, IGF1R, ЕРНА3, RANKL, TRAILR1, TRAILR2, IL13R-альфа, UPAR, танасцин, PD-1, PD-L1, опухоль-ассоциированный гликопротеин 72, ганглиозид GM2, А33, антиген Ley или MUC1. В случае стареющей клетки молекула-мишень представляет собой любой поверхностный белок, экспрессируемый в стареющей клетке, например CXCR2 или рецептор ИЛ-1.
В одном варианте реализации молекула-мишень или ее фрагмент, доступные на поверхности клетки, пораженной заболеванием, в естественных условиях недоступны на поверхности клетки, т.е. недоступны на поверхности клетки, не пораженной заболеванием (т.е. здоровой клетки) того же типа и/или ткани, и предпочтительно недоступны на поверхности любой другой клетки этого же организма. В родственном варианте реализации, имеющем отношение к хроническим инфекционным заболеваниям, молекула-мишень происходит из организма-возбудителя (например, вируса, бактерии или паразита), инфицировавшего клетку, и экспрессируется на поверхности инфицированной клетки (например, HBsAg ВГВ, gp120 ВИЧ, Е1 и Е2 ВГС, LMP1 и LMP2 ВЭБ). В еще одном варианте реализации гетерологичный полипептидный лиганд, объединенный с или встроенный в gD, может связываться с любой молекулой или ее фрагментом, доступными на поверхности клетки, но блокирует связывание с естественными рецепторами ВПГ. Как указано, в этом варианте реализации лиганд объединяют с или вставляют в gD с целью устранения способности gD связываться со своими природными рецепторами. Адресное воздействие на клетку-мишень осуществляется путем объединения с другим гликопротеином вируса, в частности, gH, или инсерции в него.
В еще одном варианте реализации гетерологичный полипептидный лиганд, объединенный с или встроенный в gH или gD, связывается с гетерологичной молекулой или ее фрагментом, доступным на поверхности клетки. Термин «гетерологичная молекула» в настоящем документе по отношению к клеткам относится к молекуле, которая не является нативной для клетки. В частности, она не продуцируется и/или не может продуцироваться в естественных условиях (т.е. без применения технологий рекомбинантных ДНК) в клетке. Предпочтительно, в случае полипептида, он не кодируется нативным (т.е. не подвергавшемся рекомбинантной модификации) геномом клетки. В данном варианте реализации клетку, являющуюся мишенью связывания gH или gD с гетерологичной молекулой или ее фрагментом, доступным на поверхности клетки, можно применять для выращивания, т.е. размножения вируса. Способ размножения является специфическим по отношению к данной клетке, и другие клетки (например, клетки пациента, подлежащего лечению с применением данного герпесвируса) не подвергаются адресному воздействию связывания gH или gD с гетерологичной молекулой или ее фрагментом.
В дополнительном варианте реализации первого аспекта настоящего изобретения рекомбинантный инфекционный герпесвирус содержит гетерологичный маркер с возможностью обнаружения, предпочтительно в составе экспрессионной кассеты. Термин «обнаруживаемый маркер/маркер с возможностью обнаружения» в настоящем документе относится к маркерам и меткам, широко используемым в данной области, например, ферментным маркерам, например, фосфатазам и пероксидазам, мембранным переносчикам, например, симпортеру NaI, радиоизотопным индикаторам для ПЭТ или SPEC или флуоресцентным маркерам. Флуоресцентные маркеры включают, например, GFP и варианты GFP, например, мутантные GFP, характеризующиеся различными спектрами флуоресценции, RFP (например, RFP mCherry) и варианты RFP, например, мутантные RFP, характеризующиеся различными спектрами флуоресценции, билирубин-индуцибельный флуоресцентный белок UnaG, dsRed, eqFP611, Dronpa, TagRFPs, KFP, EosFP, Dendra и IrisFP. Для визуализации опухоли особенно подходит мембранный переносчик - симпортер NaI.
Предпочтительно, маркер с возможностью обнаружения вставляют в область, не мешающую инфицированию клетки вирусом или размножению вируса в клетке или распространению вируса. В частности, эта область не мешает перекрыванию единиц транскрипции (смысловых или антисмысловых). Предпочтительно, маркер с возможностью обнаружения вставляют в межгенную последовательность генома герпесвируса, более предпочтительно - между UL37 и UL38, UL3 и UL4, или в межгенную последовательность US1 и US2.
В дополнительном варианте реализации первого аспекта рекомбинантный инфекционный герпесвирус содержит одну или более из экспрессионных кассет, экспрессирующих одно или более из следующих веществ
i) один или более из терапевтических белков, например, иммуномодуляторов с провоспалительной или противовоспалительной активностью (включая цитокины, предпочтительно цитокины, стимулирующие иммунный ответ, например, ГМ-КСФ или ИЛ-12), антител, их производных или имитаторов антител, например, антител, их производных или имитаторов антител против ингибиторов триггеров иммунного ответа (например, PDL1, PD1, CTLA4) или белков, способных изменять микроокружение очага заболевания (например, коллагеназы), в частности, микроокружение опухоли,
ii) один или более из гетерологичных или аутологичных антигенов, эпитопов/неоэпитопов или цепей эпитопов/неоэпитопов, или
iii) одного или более из ферментов, преобразующих пролекарства, например, валацикловир- и протеинкиназу цитомегаловируса человека, CYP2B1, цитозиндезаминазу, фосфорилазу пуриновых дезоксинуклеотидов, карбоксилэстеразу, ацетилхолинэстеразу, бутирилхолинэстеразу, параоксоназу, металлопротеиназы матрикса, щелочную фосфатазу, β-глюкуронидазу, валацикловиразу, плазмин, карбоксипептидазу G2, пенициллинамидазу, β-лактамазу или β-галактозидазу (примеры из статьи Yang et al., Acta Pharmaceutica Sinica В 2011 1(3)143-159)
В конкретном варианте реализации первого аспекта рекомбинантный инфекционный герпесвирус содержит модифицированный gH с аминокислотной последовательностью согласно SEQ ID NO: 2 (gH в виде конструкта R-VG803, R-VG805 и P-VG809 из раздела «Примеры»; scFv-HER2 между АК 23-24 gH дикого типа) или SEQ ID NO: 3 (gH в виде конструкта R-VG809 из раздела «Примеры»; scFv-HER2 между АК 24-47 gH дикого типа), оба белка без сигнальных последовательностей (остатков 1-18 SEQ ID NO: 2 и 3, соответственно), или его функциональный вариант с идентичностью последовательности по меньшей мере 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%, и, необязательно, модифицированный gD с аминокислотной последовательности согласно SEQ ID NO: 5 (gD в виде конструкта R-LM113 из раздела «Примеры»; scFv-HER2 замещает АК 31-63 gD дикого типа), SEQ ID NO: 6 (gD в виде конструкта R-LM249 из раздела «Примеры»; scFv-HER2 замещает АК 86-243 gD дикого типа), SEQ ID NO: 7 (gD в виде конструкта R-VG805 из раздела «Примеры»; scFv-EGFR замещает АК 31-63 gD дикого типа), SEQ ID NO: 8 (gD в виде конструкта R-VG807 из раздела «Примеры»; scFv-HER2 замещает АК 31-63 gD дикого типа) или SEQ ID NO: 9 (gD в виде конструкта R-VG809 из раздела «Примеры», делеция АК 31-63 gD дикого типа), все белки без сигнальной последовательности (остатки 1-25 SEQ ID NO 5-9), или его функциональный вариант с идентичностью последовательности по меньшей мере 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%. Термин «функциональный» в данном отношении, помимо gD согласно SEQ ID NO: 9, означает, что gH и/или gD могут опосредовать инфицирование клетки, несущей на своей поверхности HER2 и/или EGFR, соответственно. По отношению к gD согласно SEQ ID NO: 9 это означает, что gD с делецией и без инсерций не может опосредовать инфицирование любой клетки, в частности, за счет HVEM или нектина-1.
В еще одном конкретном варианте реализации первого аспекта рекомбинантный инфекционный герпесвирус содержит модифицированный gH с аминокислотной последовательностью согласно SEQ ID NO: 2 и 3, причем gH содержит любой гетерологичный пептидный лиганд, описанный выше, вместо scFv-HER2 (в частности, не scFv-HER2), или его функциональный вариант с идентичностью последовательности по меньшей мере 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%, и, необязательно, модифицированный gD с аминокислотной последовательности согласно любой из SEQ ID NO: 5-9, причем gD согласно SEQ ID NO: 5-9 содержит любой из гетерологичных пептидных лигандов, описанных выше, вместо лиганда, описанного в этих последовательностях (scFv-HER2 и scFv-EGFR, соответственно; «любой» означает, в частности, «не гетерологичный пептидный лиганд, приведенный в этих последовательностях»). Термин «функциональный» в данном отношении, помимо gD согласно SEQ ID NO: 9, означает, что gH и/или gD могут опосредовать инфицирование клетки, несущей на своей поверхности молекулу, с которой связывается гетерологичный пептидный лиганд, содержащийся в gH/gD. По отношению к gD согласно SEQ ID NO: 9 это означает, что gD с делецией и без инсерций не может опосредовать инфицирование любой клетки, в частности, за счет HVEM или нектина-1.
Во втором аспекте настоящее изобретение относится к рекомбинантному инфекционному герпесвирусу согласно первому аспекту, предназначенному для применения при лечении заболеваний.
В предпочтительном варианте реализации указанное заболевание представляет собой опухолевое заболевание, хроническое инфекционное заболевание или заболевание, ассоциированное со старением.
Опухолевое заболевание предпочтительно выбирают из группы, состоящей из рака надпочечников, рака заднего прохода, рака желчных протоков, рака мочевого пузыря, рака костей, опухолей головного мозга/ЦНС, рака молочной железы, рака с неизвестной первичной локализацией, болезни Кастлемена, рака шейки матки, рака толстой кишки/прямой кишки, рака эндометрия, рака пищевода, семейства опухолей Юинга, рака глаз, рака желчного пузыря, карциноидных опухолей желудочно-кишечного тракта, стромальных опухолей желудочно-кишечного тракта (GIST), гестационной трофобластической болезни, болезни Ходжкина, саркомы Капоши, рака почки, рака гортани и гортаноглотки, лейкоза, рака печени, рака легких, лимфомы, лимфомы кожи, злокачественной мезотелиомы, множественной миеломы, миелодиспластического синдрома, рака полости и придаточных пазух носа, рака носоглотки, нейробластомы, неходжкинской лимфомы, рака полости рта и ротоглотки, остеосаркомы, рака яичников, рака поджелудочной железы, рака полового члена, опухолей гипофиза, рака предстательной железы, ретинобластомы, рабдомиосаркомы, рака слюнных желез, саркомы - рака мягких тканей у взрослых, рака кожи, рака тонкой кишки, рака желудка, рака яичка, рака тимуса, рака щитовидной железы, саркомы матки, рака влагалища, рака вульвы, макроглобулинемии Вальденстрема и опухоли Вильмса.
Предпочтительные опухолевые заболевания представляют собой HER-2-положительные виды рака (например, рак молочной железы, рак яичников, рак желудка, рак легких, рак головы и шеи, остеосаркому и мультиформную глиобластому), EGFR-положительные виды рака (например, рак головы и шеи, мультиформную глиобластому, немелкоклеточный рак легких, рак молочной железы, рак ободочной и прямой кишки и рак поджелудочной железы), EGFR-vIII положительные виды рака (например, мультиформную глиобластому), PSMA-положительные виды рака (например, рак предстательной железы), CD20+-положительные лимфомы и опухоли, связанные с ВЭБ.
Хроническое инфекционное заболевание предпочтительно выбирают из группы, состоящей из туберкулеза, малярии, хронического вирусного гепатита (ВГВ, вируса гепатита D и ВГС), синдрома приобретенного иммунодефицита (СПИД, вызванного ВИЧ, вирусом иммунодефицита человека) и расстройств, связанных с ВЭБ, например, системных аутоиммунных заболеваний (системной красной волчанки, ревматоидного артрита и синдрома Шегрена) или рассеянного склероза (MS).
Заболевание, ассоциированное со старением, предпочтительно выбирают из группы, состоящей из (i) редких генетических заболеваний под названием прогероидные синдромы, характеризующихся преждевременным старением: синдрома Вернера (WS), синдрома Блума (BS), синдрома Ротмунда-Томсона (RTS), синдрома Коккейна (CS), пигментной ксеродермы (ХР), трихотиодистрофии или синдрома прогерии Хатчинсона-Гилфорда (HGPS) или (ii) распространенных возрастных расстройств: ожирения, диабета 2 типа, саркопении, артроза, идиопатического фиброза легких и хронической обструктивной болезни легких, катаракты, нейродегенеративных заболеваний или расстройств, ассоциированных с лечением рака.
В третьем аспекте настоящее изобретение относится к нуклеиновой кислоте, содержащей геном рекомбинантного инфекционного герпесвируса согласно первому аспекту или по меньшей мере его гетерологичного полипептидного лиганда, присоединенного к N-концу зрелого gH или укороченного gH, или встроенного в gH, а также, необязательно, его гетерологичного полипептидного лиганда, присоединенного к N-концу зрелого gD или укороченного gD, или встроенного в gD. Следует понимать, что нуклеиновая кислота, в частности, геном, предпочтительно кодирует модифицированный gH и, необязательно, модифицированный gD в виде не зрелых белков, а предшественников, содержащих сигнальные последовательности (остатки 1-18 SEQ ID NO: 1 и остатки 1-25 SEQ ID NO: 4). Типичными примерами являются gH и gD согласно SEQ ID NO: 2, 3 и 5-9.
В четвертом аспекте настоящее изобретение относится к вектору, содержащему нуклеиновую кислоту согласно третьему аспекту. Подходящие векторы известны в в данной области техники и включают, например, плазмиды, космиды, искусственные хромосомы (например, бактерий, дрожжей или человека), бактериофагов, вирусные векторы (например, ретровирусов, лентивирусов, аденовирусов, аденоассоциированных вирусов), в частности, бакуловирусный вектор, или вещества, полученные с помощь наноинженерии (например, ормосилы).
В одном варианте реализации вектор модифицируют, в частности, посредством делеций, инсерции и/или мутации одного или нескольких нуклеотидных остатков, ослабляя его вирулентность, предпочтительно в случае вирусного вектора, или придавая ему способность реплицироваться в заданных условиях в больных клетках, но не в клетках, не пораженных заболеванием. Например, замещение области промотора гена γ134.5 промотором гена человека, который экспрессируется исключительно в раковых клетках (например, промотором сурвивина), которая приводит к получению ослабленного фенотипа в не раковых клетках и не ослабленного фенотипа в раковых клетках, входит в настоящее изобретение. Дальнейшие модификации могут включать замену регуляторных областей, ответственных за транскрипцию генов IE, например, области промотора ICP-4, промоторами генов, экспрессируемых исключительно в раковых клетках (например, промотором сурвивина). Эта модификация позволяет получить ВПГ, способный реплицироваться в заданных условиях, т.е., в раковых клетках, но не в обычных клетках. Клетки культур для размножения следующих поколений вируса обеспечивают высокий уровень специфических белков, активирующих промотор, для высокого выхода вируса.
В пятом аспекте настоящее изобретение относится к клетке, содержащей рекомбинантный инфекционный герпесвирус согласно первому аспекту, нуклеиновую кислоту согласно третьему аспекту или вектор согласно четвертому аспекту. Предпочтительно, указанная клетка является клеткой культуры клеток. Подходящих культуры клеток и методики культивирования хорошо известны в данной области техники, например, см. Peterson et al., Comp Immunol Microbiol Infect Dis. 1988; 11(2):93-8.
В шестом аспекте настоящее изобретение относится к рекомбинантному инфекционному герпесвирусу согласно первому аспекту, предназначенному для применения в качестве медикамента.
В седьмом аспекте настоящее изобретение относится к способу уничтожения клетки с применением рекомбинантного инфекционного герпесвируса согласно первому аспекту. В одном варианте реализации возможно уничтожение клеток в культуре клеток, несущих молекулу-мишень на своей поверхности, например, для тестирования литической активности рекомбинантного инфекционного герпесвируса согласно первому аспекту. В еще одном варианте реализации клетка является больной клеткой, полученной от пациента, например, опухолевой клеткой от ракового пациента, и, необязательно размножающейся. Рекомбинантный инфекционный герпесвирус согласно первому аспекту инфицирует и, тем самым, уничтожает указанную клетку. Успешное уничтожение клеток, полученных от пациента, указывает на специфичность рекомбинантного инфекционного герпесвируса согласно первому аспекту к клеткам in vivo в организме пациента, т.е. на успешное терапевтическое применение. В дополнительном варианте реализации от того же пациента или субъекта, не страдающего данным заболеванием, можно получить клетки, не пораженные заболеванием, которым страдает пациент, и использовать их как контрольные клетки (клетки, не несущие молекулы-мишени на своей поверхности), в качестве показателя чувствительности клеток, не пораженных заболеванием, к инфекции рекомбинантным инфекционным герпесвирусом. В еще одном варианте реализации больные клетки, содержащиеся в популяции клеток (например, ткани, например, крови), содержащей клетки, не пораженные заболеванием, и больные клетки (например, раковые клетки, например, клетки лейкоза), уничтожают после выделения популяции клеток из организма пациента (например, лейкаферезом). Это необходимо для получения популяции клеток, не содержащей больных клеток, например, крови, не содержащей больных клеток, например, клеток лейкоза, в частности, для последующей трансплантации популяции клеток в организм пациента, предпочтительно того же пациента, из организма которого выделена популяция клеток. В случае, например, крови и лейкоза этот способ обеспечивает повторное вливание крови, не содержащей опухолевых клеток.
В предпочтительном варианте реализации способ согласно седьмому аспекту, включающий указанные варианты реализации, представляет собой способ in vitro.
В восьмом аспекте настоящее изобретение относится к способу культивирования рекомбинантного инфекционного герпесвируса согласно первому аспекту в клетках in vitro. Подходящие методики и условия для выращивания (культивирования) герпесвирусов в клетках хорошо известны в данной области техники, см., например, Peterson et al. (Comp Immunol Microbiol Infect Dis. 1988; 11(2):93-8). В конкретном варианте реализации рекомбинантный инфекционный герпесвирус согласно первому аспекту содержит модифицированные gH и gD, описанные выше. Предпочтительно, клетки, в которых выращивают герпесвирус, несут молекулу-мишень, с которой связывается (i) лиганд модифицированного gH или (ii) лиганд модифицированного gD. В случае (i) лиганд модифицированного gD связывает молекулу клетки, которая должна являться мишенью in vivo, предпочтительно больной клетки в организме пациента, а лиганд модифицированного gH связывает молекулу клетки, которая должна являться мишенью в культуре клеток; в случае (ii) лиганд модифицированного gH связывает молекулу клетки, которая должна являться мишенью in vivo, предпочтительно больной клетки в организме пациента, а лиганд модифицированного gD связывает молекулу в клетке, которая должна являться мишенью в культуре клеток.
***
Настоящее изобретение описано посредством следующих примеров, которые следует считать исключительно иллюстративными и не ограничивающими рамки настоящего изобретения. Следует отметить, что в примерах аминокислотные остатки, указанные по отношению к gH, относятся к белку-предшественнику согласно SEQ ID NO: 1, а аминокислотные остатки, указанные по отношению к gD, относятся к зрелому белку (SEQ ID NO: 4 без остатков 1-25).
ПРИМЕРЫ
Пример 1: Конструирование рекомбинантов ВПГ, экспрессирующих генетически модифицированные gH, несущие одноцепочечное антитело (scFv) против Her2 (scFv-HER2) с делецией в гене ВПГ или без нее, и несущие mCherry в качестве репортерного гена.
A) R-VG803: Инсерция scFv-HER2 между 23 и 24 АК gH ВПГ посредством рекомбинации ВПГ-ВАС и galK.
Авторы изобретения сконструировали R-VG801 путем инсерции последовательности, кодирующей scFv трастузумаба, между 23 и 24 АК gH. Исходный геном представлял собой pYEBac102, содержавший последовательности pBeloBAC, ограниченные LOX-P и встроенные между UL3 и UL4 генома ВПГ-1. Это конструирование было выполнено посредством рекомбинации galK. Вкратце, кассету GalK с плечами, гомологичными gH, амплифицировали с использованием праймеров gH6_galK_f ATGCGGTCCATGCCCAGGCCATCCAAAAACCATGGGTCTGTCTGCTCAGTCCTGTTGACAATTAATCATCGGCA (SEQ ID NO: 10) и gH5_galK_r TCGTGGGGGTTATTATTTTGGGCGTTGCGTGGGGTCAGGTCCACGACTGGTCAGCACTGTCCTGCTCCTT (SEQ ID NO: 11). Эту кассету вводили путем электропорации в бактерию SW102, несущую pYEBac102. Рекомбинантные клоны, несущие кассету galK, отбирали на чашках со средой М63 (15 мМ (NH4)2SO4, 100 мМ KH2PO4, 1,8 мкг FeSO4⋅7H2O, титрованной до рН 7) с добавлением 1 мг/л D-биотина, 0,2% галактозы, 45 мг/л L-лейцина, 1 мМ MgSO4⋅7H2O и 12 мкг/мл хлорамфеникола. Для исключения galK-ложноположительных колоний бактерий их также пересевали штрихом на чашки с агаром Мак-Конки с добавлением 1% галактозы и 12 мкг/мл хлорамфеникола и проверяли посредством ГЩР колоний с использованием праймеров galK_129_f ACAATCTCTGTTTGCCAACGCATTTGG (SEQ ID NO: 28) и galK_417_r CATTGCCGCTGATCACCATGTCCACGC (SEQ ID NO: 29). Далее кассету scFv трастузумаба, ограниченную линкерами Ser-Gly, описанными ниже, и плечами, гомологичными gH, амплифицировали в виде двух отдельных фрагментов, называемыми фрагментом №1 и фрагментом №2 из pSG-ScFvHER2-SG. pSG-ScFvHER2-SG содержит кассету scFv трастузумаба, ограниченную линкерами Ser-Gly (SEQ ID NO: 12). Фрагмент №1 амплифицировали с использованием праймеров gH23_8SG_scFv4D5_f TCGTGGGGGTTATTATTTTGGGCGTTGCGTGGGGTCAGGTCCACGACTGGCATAGTAGTGGCGGTGGCTCTGGATCCG (SEQ ID NO: 13) и scFv4D5_358_r GGAAACGGTTCGGATCAGCCATCGG (SEQ ID NO: 14), а также pSG-ScFvHER2 в качестве матрицы. Фрагмент №2 амплифицировали с использованием gH24_12SG_scFv4D5r ATGCGGTCCATGCCCAGGCCATCCAAAAACCATGGGTCTGTCTGCTCAGTACCGGATCCACCGGAACCAGAGCC (SEQ ID NO: 15) и scFv4D5_315_f GGAGATCAAATCGGATATGCCGATGG (SEQ ID NO: 16), а также pSG-ScFvHER2 в качестве матрицы. Фрагменты №1 и №2 отжигали и удлиняли с получением кассеты scFv-HER2, ограниченной линкерами Ser-Gly и плечами, гомологичными gH. Рекомбинантный геном несет scFv против HER2, ограниченный сверху линкером Ser-Gly с последовательностью HSSGGGSG (SEQ ID NO: 17), а снизу - линкером Ser-Gly с последовательностью SSGGGSGSGGSG (SEQ ID NO: 18). Линкер между VL и VH представляет собой SDMPMADPNR FRGKNLVFHS (SEQ ID NO: 19). Рекомбинатные клоны с вырезанной кассетой galK и инсерцией выбранной последовательности, подтвержденной по scFv-HER2 или mCherry, отбирали на чашках со средой М63 (см. выше) с добавлением 1 мг/л D-биотина, 0,2% дезокси-2-галактозы, 0,2% глицерина, 45 мг/л L-лейцина, 1 мМ MgSO4⋅7H2O и 12 мкг/мл хлорамфеникола. Бактериальные колонии также проверяли на предмет наличия выбранной последовательности с помощью ПЦР колоний.
Затем авторы изобретения вставили в межгенную область UL37-UL38 R-VG801 красный флуоресцирующий белок mCherry. Последовательность mCherry находится под управлением промотора ЦМВ. Во-первых, авторы изобретения вставили кассету galK, амплифицированную с использованием олигонуклеотидов UL37/38_galK_f CCGCAGGCGTTGCGAGTACCCCGCGTCTTCGCGGGGTGTTATACGGCCACCCTGTTGACAATTAATCATCGGCA (SEQ ID №: 20) и UL37/38_galK_r TCCGGACAATCCCCCGGGCCTGGGTCCGCGAACGGGATGCCGGGACTTAATCAGCACTGTCCTGCTCCTT (SEQ ID NO: 21). Затем авторы изобретения заменили последовательность galK кассетой промотор-mCherry, амплифицированной с использованием олигонуклеотидов UL37/38_CMV_mcherry_f CCGCAGGCGTTGCGAGTACCCCGCGTCTTCGCGGGGTGTTATACGGCCACCGATGTACGGGCCAGATATACG (SEQ ID NO: 22) и UL37/38_pA_mcherry_1958_r TCCGGACAATCCCCCGGGCCTGGGTCCGCGAACGGGATGCCGGGACTTAACCATAGAGCCCACCGCATCC (SEQ ID NO: 23).
b) Инсерция scFv-HER2 между 23 и 48 АК gH ВПГ (R-VG811). Во-первых, авторы изобретения сконструировали R-VG799 путем инсерции последовательности, кодирующей scFv трастузумаба, между 23 и 48 АК gH. Данная процедура была аналогична процедуре, описанной выше для конструирования scFv-HER2 в gH R-VG803, с двумя следующими отличиями. Во-первых, кассету galK амплифицировали с использованием праймеров gH29_galK_f CGCGGTGGTTTTTGGGGGTCGGGGGTGTTTGGCAGCCACAGACGCCCGGTCCTGTTGACAATTAATCATCGGCA (SEQ ID NO: 24) и gH5_galK_r TCGTGGGGGTTATTATTTTGGGCGTTGCGTGGGGTCAGGTCCACGACTGGTCAGCACTGTCCTGCTCCTT (SEQ ID NO: 25). Во-вторых, фрагмент №2 отличается от фрагмента №2, использованного для создания R-VG803, тем, что его амплифицировали посредством gH48_12SG_scFv4D5_r CCGCGCGGTGGTTTTTGGGGGTCGGGGGTGTTTGGCAGCCACAGACGCCCACCGGATCCACCGGAACCAGAGCC (SEQ ID №: 26) и scFv4D5_315_f GGAGATCAAATCGGATATGCCGATGG (SEQ ID NO: 27). Последовательность mCherry вставляли, как подробно описано при конструировании R-VG803.
С) R-VG809: Делеция АК 6-38 gD R-VG803.
R-VG809 идентичен R-VG803 и, кроме того, он несет делецию последовательности, соответствующей АК 6-38 gD. Исходный материал представлял собой геном ВАС R-VG803. Для получения делеций АК 6-38 gD кассету galK, ограниченную плечами, гомологичными gD, амплифицировали с использованием праймеров gD5_galK_f TTGTCGTCATAGTGGGCCTCCATGGGGTCCGCGGCAAATATGCCTTGGCGCCTGTTGACAATTAATCATCGGCA (SEQ ID №: 30) и gD39_galK_r ATCGGGAGGCTGGGGGGCTGGAACGGGTCCGGTAGGCCCGCCTGGATGTGTCAGACTGTCCTGCTCCTT (SEQ ID NO: 31). Затем авторы изобретения заменили последовательность galK синтетическим двуцепочечным олигонуклеотидом gD_aa5_39_f_r TTGTCGTCATAGTGGGCCTCCATGGGGTCCGCGGCAAATATGCCTTGGCGCACATCCAGGCGGGCCTACCGGACCCGTTCCAGCCCCCCAGCCTCCCGAT (SEQ ID NO: 32).
D) R-VG805: инсерция scFv-EGFR вместо АК 6-38 gD R-VG803.
Исходный материал для R-VG805 представлял собой геном ВАС R-VG803. Для получения делеций АК 6-38 gD кассету galK, ограниченную плечами, гомологичными gD, амплифицировали с использованием праймеров gD5_galK_f TTGTCGTCATAGTGGGCCTCCATGGGGTCCGCGGCAAATATGCCTTGGCGCCTGTTGACAATTAATCATCGGCA (SEQ ID №: 33) и gD39_galK_r ATCGGGAGGCTGGGGGGCTGGAACGGGTCCGGTAGGCCCGCCTGGATGTGTCAGCACTGTCCTGCTCCTT (SEQ ID NO: 34). Затем авторы изобретения заменили последовательность galK в ВАС VG804 кассетой scFv-EGFR, амплифицированной из pTNHaa-αEGFR (любезно предоставленного д-ром Стивом Расселом, клиника Майо, Рочестер) с использованием праймеров BAC_LM611_f TTGTCGTCATAGTGGGCCTCCATGGGGTCCGCGGCAAATATGCCTTGGCGGCCGAGGTGCAACTGCAGCAGTC (SEQ ID №: 35) и gD39_11SAG_EGFR_r ATCGGGAGGCTGGGGGGCTGGAACGGGTCCGGTAGGCCCGCCTGGATGTGACTTGCACTAGATGAAGCACTTCCTGCGGAAGATTTGATCTCGAGTTCTGTCCCCG (SEQ ID NO: 36). Линкер, находящийся ниже инсерции, обладал последовательностью SSAGSASSSAS (SEQ ID NO: 37); линкер выше инсерции отсутствовал. Линкер между VH и VL представлял собой GGGGSGGGGSGGGGS (SEQ ID NO: 38).
Е) R-VG807: инсерция scFv-HER2 вместо АК 6-38 gD R-VG803.
Исходный материал для R-VG807 представлял собой геном ВАС R-VG803. Для получения делеций АК 6-38 gD кассету galK, ограниченную плечами, гомологичными gD, амплифицировали с использованием праймеров gD5_galK_f TTGTCGTCATAGTGGGCCTCCATGGGGTCCGCGGCAAATATGCCTTGGCGCCTGTTGACAATTAATCATCGGCA (SEQ ID №: 39) и gD39_galK_r ATCGGGAGGCTGGGGGGCTGGAACGGGTCCGGTAGGCCCGCCTGGATGTGTCAGCACTGTCCTGCTCCTT (SEQ ID NO: 40). Затем авторы изобретения заменили последовательность galK кассетой scFv HER2, амплифицированной из pSG-ScFvHER2 с использованием праймеров gD5_scFvHER2_f TTGTCGTCATAGTGGGCCTCCATGGGGTCCGCGGCAAATATGCCTTGGCGTCCGATATCCAGATGACCCAGTCCC (SEQ ID NO: 41) и gD39_11SAG_HER2_r ATCGGGAGGCTGGGGGGCTGGAACGGGTCCGGTAGGCCCGCCTGGATGTGACTTGCACTAGATGAAGCACTTCCTGCGGAAGAGGAGACGGTGACTAGTGTTCCTTGACC (SEQ ID NO: 42). Линкер, находящийся ниже инсерции, обладал последовательностью SSAGSASSSAS (SEQ ID NO: 43); линкер выше инсерции отсутствовал. Линкер между VH и VL представлял собой SDMPMADPNR FRGKNLVFHS (SEQ ID NO: 44).
Для восстановления рекомбинантных вирусов 500 нг ДНК рекомбинантной ВАС трансфицировали в клетки SK-OV-3 с использованием липофектамина 2000 (Life Technologies). Рост вируса отслеживали по красной флуоресценции. Структуру рекомбинантов проверяли секвенированием ОРС gH и gD для R-VG809, R-VG805 и R-VG807. Рабочие растворы вируса получили и титровали на клетках SK-OV-3 или J-HER2.
Пример 2: Проверка инсерции scFv-HER2 в gH R-VG803.
Клетки Vero инфицировали R-VG803 (3 БОЕ/клетку), а также, для сравнения, R-LM5, и собирали через 72 ч после инфекции. Лизаты клеток подвергали электрофорезу в полиакриламидном геле, переносили на ПВДФ-мембраны и подвергали иммуноблоттингу с поликлональными антителами против gH. На фиг. 2 показано, что химерный scFv-HER2-gH R-VG803 мигрировал с более медленной электрофоретической подвижностью, чем gH дикого типа R-LM5, и кажущаяся Mr составляла 130 K.
Пример 3: Анализ инфицирования клеток J-HER2, экспрессирующих HER2 в качестве единственного рецептора, R-VG803, несущим scFv-HER2 в gH.
Ранее было показано, что инсерция scFv-HER2 в gD придает рекомбинантным вирусам R-LM113 и R-LM249 способность проникать в клетки посредством рецептора HER2. Для получения доказательств того, что инсерция scFV-HER2 в gH придает R-VG803 способность проникать в клетки посредством рецептора HER2, авторы изобретения использовали клетки, экспрессирующие HER2 в качестве единственного рецептора. Исходные J-клетки не экспрессировали рецептора gD, поэтому не могли активировать gD и не инфицировались ВПГ дикого типа. Клетки J-HER2 трансгенно экспрессировали HER2 в качестве единственного рецептора. В качестве контроля авторы изобретения включили клетки J-нектин и J-HVEM, трансгенно экспрессировавшие нектин-1 или HVEM в качестве рецепторов и инфицировавшиеся ВПГ дикого типа, и клетки человека и животных, экспрессировавшие ортологи HVEM/нектина-1 человеческого или животного происхождения, а именно кератиноциты НаСаТ, нейроны SK-N-SH, раковые клетки HeLa, MDA-MB-231, фибробласты человека HFF14, клетки хомяка BHK, а также клетки рака яичников SK-OV-3, экспрессировавшие HER2 и HVEM/нектин-1. Как показано на фиг. 3 A, R-VG803 инфицировал клетки J-HER2. Инфекция клеток J-нектин-1, J-HVEM и клеток человека и животных вирусом R-VG803 (фиг. 3А) не была неожиданной, поскольку R-VG803 кодировал gD дикого типа. Кроме того, авторы настоящего изобретения сообщили, что R-VG803 может распространяться от клетки к клетке в клетках J-HER2. Клетки инфицировали из расчета 0,01 БОЕ/клетку и отслеживали ежедневно. В 1 день инфекция поражала одиночные клетки. В следующие дни инфекция вовлекала кластеры клеток, постепенно увеличивавшиеся в размере (фиг. 3В).
Чтобы доказать, что проникновение R-VG803 в клетки J-HER2 происходит посредством HER2 в качестве клеточного рецептора и исследовать роль gD в пути проникновения R-VG803 в клетки SK-OV-3, авторы изобретения вначале подтвердили, что инфекция осуществлялась посредством рецептора HER2. Клетки J-HER2 инфицировали R-VG803 в присутствии трастузумаба - мАт против HER2, от которого происходил scFv-HER2. Трастузумаб блокировал инфекцию клеток J-HER2 вирусом R-VG803, согласно данным флуоресцентной микроскопии (фиг. 4А) и количественной оценки с помощью сортировщика клеток с возбуждением флуоресценции (FACS) (фиг. 4В). Это подтверждало вывод о том, что R-VG803 с измененным спектром мишеней использует HER2 в качестве точки проникновения в клетки J-HER2. Вывод о том, что R-VG803 может использовать HER2 в качестве рецептора, представляет собой доказательство возможности модификации тропизма ВПГ путем конструирования гетерологичного лиганда в составе gH. Кроме того, инфекция R-VG803 (ВПГ с измененным спектром мишеней gH) клеток J-HER2 может иметь место в клетках, не содержащих рецептора gD, т.е. в условиях, когда gD физически присутствует в вирионах R-VG803, но не действует, поскольку не может быть активирован своими родственными рецепторами и не может опосредовать активацию gH. Авторы настоящего изобретения сделали вывод, что инфекция R-VG803 не требует наличия gD с функциональными сайтами связывания рецепторов. Затем авторы изобретения проанализировали использование рецептора в клетках SK-OV-3, экспрессирующих оба набора рецепторов - HER2 и нектин-1/HVEM. Вопрос состоял в том, является ли предпочтительным использование одного рецептора перед другим, или каждый из них использовался попеременно. Клетки SK-OV-3 инфицировали R-VG803 в присутствии мАт против HER2 (трастузумаб) и/или мАт HD1. Контрольный вирус представлял собой R-LM5, несущий gD дикого типа и другие модификации генома, представленные в R-VG803, R-LM249 и P-LM113, а именно инсерцию последовательностей ВАС и маркера GFP. R-LM249 представлял собой ВПГ, в спектр мишеней которого включили HER2 посредством инсерции scFv-HER2 в область делеций АК 61-218 gD. R-LM113 представлял собой ВПГ, в спектр мишеней которого включили HER2 посредством инсерции scFv-HER2 в область делеций АК 6-38 зрелого gD. Кроме того, в исследование включили R-VG809 (см. Пример 4). На фиг. 4С показано, что мАт против HER2 или HD1 практически не ингибировали R-VG803 при использовании по отдельности, однако практически блокировали инфекцию при совместном применении. Таким образом, R-VG803 мог попеременно использовать HER2 или нектин-1/HVEM для инфицирования клеток SK-OV-3. Использование R-VG803 одной или других точек проникновения зависело от спектра рецепторов, присутствующих на клетках. Как и ожидалось, R-LM249 и R-LM113 с полностью измененным спектром рецепторов характеризовались НЕР2-зависимым путем проникновения. Инфекцию R-VG809 также ингибировал трастузумаб сам по себе или в комбинации с мАт HD1, что позволило сделать вывод, что в спектр мишеней этого рекомбината был включен HER2 за счет gH и исключен нектин-1/HVEM вследствие делеций АК 6-38 зрелого gD.
Пример 4: Генная инженерия рекомбинанта R-VG809, в спектр мишеней которого был включен HER2 посредством инсерции scFV-HER2 в gH и исключены рецепторы gD посредством делеций последовательности gD, кодирующей АК 6-38.
Авторы настоящего изобретения сконструировали рекомбинант, несущий scFv-HER2 в gH и делецию фрагментов сайтов связывания рецепторов в gD. Два основных рецептора gD представляют собой нектин-1 и HVEM. Сайт связывания HVEM в gD картируется в области АК 1-32. Сайт связывания нектина-1 в зрелом gD более широк и включает ядро с Ig-укладкой и фрагменты, расположенные между АК 35-38, 199-201, 214-217, 219-221. Авторы настоящего изобретения удалили из зрелого gD R-VG803 область АК 6-38, т.е. ту же область, которую ранее удаляли из R-LM113, ВПГ, в спектр мишеней которого включен HER2 путем инсерции scFv-HER2 между АК 5-39 зрелого gD. Делеция полностью удалила сайт связывания HVEM и некоторые остатки, участвующие во взаимодействии с нектином-1, включая ядро с Ig-укладкой и фрагменты, расположенные между АК 35-38, 199-201, 214-217, 219-221. Даже несмотря на удаление нескольких АК, вовлеченных во взаимодействие с нектином-1, продемонстрировано, что из спектра мишеней R-LM113 исключены нектин-1 и HVEM; из спектра мишеней рекомбинанта исключены как HVEM, так и нектин-1. Рекомбинантный вирус под названием R-VG809 не мог инфицировать не только клетки J-HVEM, но и клетки J-нектин-1, а также клетки человека НаСаТ, SK-N-SH, MDA-MB-231, HeLA, HFF14 и клетки хомяка ВНК. Он сохранял способность эффективно инфицировать клетки J-HER2 и SK-OV-3 (фиг. 5). Тропизм R-VG809 разительно отличался от тропизма R-VG803 (сравните фиг. 5 и фиг. 3А). Авторы настоящего изобретения сделали вывод о том, что инфекция R-VG809 посредством включения HER2 в спектр мишеней gH не требовала наличия сайтов связывания HVEM и нектина-1 в составе gD и, как следствие, рецептор-опосредованной активации gD. В общем, R-VG809 характеризовался полностью измененным тропизмом, в его спектр мишеней был включен рецептор HER2 за счет gH и исключены рецепторы gD. Путь его проникновения в клетки SK-OV-3 показан на фиг. 4. Можно видеть, что, в отличие от проникновения R-VG803, трастузумаб сам по себе ингибировал проникновение R-VG809 в клетки SK-OV-3, что указывало на то, что оно осуществлялось исключительно посредством рецептора HER2.
Пример 5: Генная инженерия рекомбинанта R-VG805, в спектр мишеней которого включен HER2 посредством инсерции scFV-HER2 в gH и EGFR посредством инсерции scFv-EGFR вместо области АК 6-38 зрелого gD. Двойное изменение спектра мишеней по отношению к двум различным выбранным рецепторам в комбинации с исключением рецепторов gD из спектра мишеней.
Авторы настоящего изобретения сконструировали рекомбинант ВПГ с одновременным включением в спектр мишеней HER2 посредством инсерции scFV-HER2 в gH и EGFR посредством инсерции scFv-EGFR вместо области АК 6-38 зрелого gD. Вкратце, R-VG803 модифицировали путем замены области эндогенных АК 6-38 зрелого gD на scFv против EGFR, в настоящем документе называемый scFv-EGFR. В спектр мишеней рекомбинатного вируса под названием R-VG805 был фактически включен HER2 посредством gH, исключены нектин-1 и HVEM из-за делеций области АК 6-38 зрелого gD и включен EGFR из-за инсерции scFv EGFR вместо АК 6-38 зрелого gD (фиг. 6). Авторы настоящего изобретения отметили, что инсерция scFV-EFGR также включала в спектр мишеней R-VG805 EGFR-vIII, вариант EGFR, несущий делецию (фиг. 6). Этот вариант EGFR интенсивно экспрессируется в глиобластоме человека. Эти результаты показали возможность разработки рекомбинанта ВПГ с двойным изменением спектра мишеней по отношению к двум различным выбранным рецепторам.
Пример 6: Генная инженерия рекомбинанта R-VG807, спектр мишеней которого дважды изменен путем включения HER2 посредством инсерции scFV-HER2 в gH и инсерции scFv-HER2 вместо области АК 6-38 зрелого gD. Двойное изменение спектра мишеней по отношению к одному и тому же рецептору в комбинации с исключением рецепторов gD из спектра мишеней.
Авторы настоящего изобретения сконструировали рекомбинант ВПГ с включением в спектр мишеней HER2 как посредством инсерции scFV-HER2 в gH, так и инсерции scFv-HER2 вместо области АК 6-38 зрелого gD. Вкратце, R-VG803 модифицировали путем замены области эндогенных АК 6-38 зрелого gD на scFv-HER2. В спектр мишеней рекомбинатного вируса под названием R-VG807 был дважды включен HER2 и исключены нектин-1 и HVEM из-за делеций области АК 6-38 зрелого gD.
Пример 7: Исследование сайта инсерции scFv-HER2 в gH. Удаление последовательности, кодирующей АК 24-47.
Авторы настоящего изобретения выполнили исследование, посвященное возможности сопряжения инсерции scFv-HER2 с делецией N-концевого фрагмента gH. Удаленный фрагмент представлял собой последовательность, кодирующую АК 24-47 gH. Эту последовательность заменили scFv-HER2. Полученный рекомбинант назвали R-VG811. На фиг. 7 показано, что R-VG811 инфицировал клетки J-HER2. Таким образом, инсерцию scFv-HER2 можно комбинировать с делецией в составе gH по меньшей мере до 48 АК. Это означает, что сайт инсерции может быть расположен за пределами С-конца 18 АК и N-конца любой АК между 19 и 48 АК. Atanasiu et al. (MBio. 2013 Feb 26; 4(2). pii: e00046-13. doi: 10.1128/mBio.00046-13) предполагали, что "gHΔ48/gL содержит промежуточную структуру на пути, ведущем к полной регуляторной активации, и что ключевым этапом пути объединения являлось преобразование gH/gL в активированное состояние за счет gD, связанного с рецептором; этот активированный gH/gL сходен с gHΔ48/gL". На основании результатов, полученных Atanasiu в анализе слияния клеток, а не проникновения вириона в клетку, специалист в данной области техники может сформулировать гипотезу о том, что делеция последовательности АК 24-47 в gH и ее замена scFv-HER2 может привести к получению вируса, в большей степени способного сливаться с мембраной клетки и тем самым способного к усиленной инфекции по сравнению с R-VG803. Авторы настоящего изобретения трансфицировали ДНК-ВАС R-VG811 и, для сравнения, R-VG803 в клетки SK-OV-3 и J-HER2, и определили степень инфекции/формирования вируса по количеству клеток, экспрессирующих маркер mCherry. На фиг. 7 B-D приведено сравнение количества инфицированных клеток после трансфекции ДНК R-VG811 или R-VG803 в клетки J-HER2 или SK-OV-3. Количественная оценка эксперимента показана на фиг. 7 C-D. В целом эффективность продукции инфекционных вирусов была ниже у R-VG811 по сравнению с R-VG803, что указывало, что делеция АК в области N-конца gH до 48 АК снижала инфекционную способность рекомбинантов. Таким образом, результаты, полученные Atanasiu et al., не позволяли прогнозировать поведение рекомбинантного ВПГ, несущего инсерцию scFv-HER2 вместо удаленных АК 24-47 (эндогенных последовательностей gH).
Пример 8: Способность рекомбинантов к репликации.
Авторы настоящего изобретения сравнили способность R-VG803 и R-VG809 к репликации с таковой у двух рекомбинантов - R-LM113 и R-LM249, в спектр мишеней которых был включен HER2 за счет инсерции scFv-HER2 в gD. Репликацию измеряли в клетках J-HER2, экспрессирующих HER2 в качестве рецептора, и в клетках SK-OV-3, экспрессирующих HER2 и нектин-1/HVEM в качестве рецепторов. Клетки инфицировали из расчета 0,1 БОЕ/клетку или 0,01 БОЕ/мл и собирали через 3, 24, 48 ч после инфекции. Результаты, приведенные на фиг. 8, показали, что R-VG803 и Р-VG809 реплицировались столь же эффективно, как R-LM113 или R-LM249, или даже более эффективно в клетках SK-OV-3.
Пример 9: Способность R-VG803 и R-VG809 уничтожать HER2-положительные раковые клетки.
С целью измерения способности R-VG803 или R-VG809 уничтожать клетки авторы изобретения выполнили анализ цитотоксичности с использованием AlamarBlue для HER2-положительных клеток SK-OV-3. ВПГ дикого типа R-LM5 и R-LM113 и Р-LM249 с измененным спектром мишеней включили для сравнения. На фиг. 9 показано, что цитотоксичность, вызванная R-VG803 и R-VG809, была очень сходна с цитотоксичностью, вызванной R-LM113 или R-LM249.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Alma Mater Studiorum Universita' di Bologna
<120> ГЕРПЕСВИРУС С ИЗМЕНЕННЫМ СПЕКТРОМ МИШЕНЕЙ, СОДЕРЖАЩИЙ ГИБРИДНЫЙ ГЛИКОПРОТЕИН H
<130> 854-7 PCT
<150> EP 15425012.0
<151> 11.02.2015
<160> 44
<170> Версия PatentIn 3.5
<210> 1
<211> 838
<212> БЕЛОК
<213> ВПГ-1
<400> 1
Met Gly Asn Gly Leu Trp Phe Val Gly Val Ile Ile Leu Gly Val Ala
1 5 10 15
Trp Gly Gln Val His Asp Trp Thr Glu Gln Thr Asp Pro Trp Phe Leu
20 25 30
Asp Gly Leu Gly Met Asp Arg Met Tyr Trp Arg Asp Thr Asn Thr Gly
35 40 45
Arg Leu Trp Leu Pro Asn Thr Pro Asp Pro Gln Lys Pro Pro Arg Gly
50 55 60
Phe Leu Ala Pro Pro Asp Glu Leu Asn Leu Thr Thr Ala Ser Leu Pro
65 70 75 80
Leu Leu Arg Trp Tyr Glu Glu Arg Phe Cys Phe Val Leu Val Thr Thr
85 90 95
Ala Glu Phe Pro Arg Asp Pro Gly Gln Leu Leu Tyr Ile Pro Lys Thr
100 105 110
Tyr Leu Leu Gly Arg Pro Pro Asn Ala Ser Leu Pro Ala Pro Thr Thr
115 120 125
Val Glu Pro Thr Ala Gln Pro Pro Pro Ser Val Ala Pro Leu Lys Gly
130 135 140
Leu Leu Tyr Asn Pro Val Ala Ser Val Leu Leu Arg Ser Arg Ala Trp
145 150 155 160
Val Thr Phe Ser Ala Val Pro Asp Pro Glu Ala Leu Thr Phe Pro Arg
165 170 175
Gly Asp Asn Val Ala Thr Ala Ser His Pro Ser Gly Pro Arg Asp Thr
180 185 190
Pro Pro Pro Arg Pro Pro Val Gly Ala Arg Arg His Pro Thr Thr Glu
195 200 205
Leu Asp Ile Thr His Leu His Asn Ala Ser Thr Thr Trp Leu Ala Thr
210 215 220
Arg Gly Leu Leu Arg Ser Pro Gly Arg Tyr Val Tyr Phe Ser Pro Ser
225 230 235 240
Ala Ser Thr Trp Pro Val Gly Ile Trp Thr Thr Gly Glu Leu Val Leu
245 250 255
Gly Cys Asp Ala Ala Leu Val Arg Ala Arg Tyr Gly Arg Glu Phe Met
260 265 270
Gly Leu Val Ile Ser Met His Asp Ser Pro Pro Val Glu Val Met Val
275 280 285
Val Pro Ala Gly Gln Thr Leu Asp Arg Val Gly Asp Pro Ala Asp Glu
290 295 300
Asn Pro Pro Gly Ala Leu Pro Gly Pro Pro Gly Gly Pro Arg Tyr Arg
305 310 315 320
Val Phe Val Leu Gly Ser Leu Thr Arg Ala Asp Asn Gly Ser Ala Leu
325 330 335
Asp Ala Leu Arg Arg Val Gly Gly Tyr Pro Glu Glu Gly Thr Asn Tyr
340 345 350
Ala Gln Phe Leu Ser Arg Ala Tyr Ala Glu Phe Phe Ser Gly Asp Ala
355 360 365
Gly Ala Glu Gln Gly Pro Arg Pro Pro Leu Phe Trp Arg Leu Thr Gly
370 375 380
Leu Leu Ala Thr Ser Gly Phe Ala Phe Val Asn Ala Ala His Ala Asn
385 390 395 400
Gly Ala Val Cys Leu Ser Asp Leu Leu Gly Phe Leu Ala His Ser Arg
405 410 415
Ala Leu Ala Gly Leu Ala Ala Arg Gly Ala Ala Gly Cys Ala Ala Asp
420 425 430
Ser Val Phe Phe Asn Val Ser Val Leu Asp Pro Thr Ala Arg Leu Gln
435 440 445
Leu Glu Ala Arg Leu Gln His Leu Val Ala Glu Ile Leu Glu Arg Glu
450 455 460
Gln Ser Leu Ala Leu His Ala Leu Gly Tyr Gln Leu Ala Phe Val Leu
465 470 475 480
Asp Ser Pro Ser Ala Tyr Asp Ala Val Ala Pro Ser Ala Ala His Leu
485 490 495
Ile Asp Ala Leu Tyr Ala Glu Phe Leu Gly Gly Arg Val Leu Thr Thr
500 505 510
Pro Val Val His Arg Ala Leu Phe Tyr Ala Ser Ala Val Leu Arg Gln
515 520 525
Pro Phe Leu Ala Gly Val Pro Ser Ala Val Gln Arg Glu Arg Ala Arg
530 535 540
Arg Ser Leu Leu Ile Ala Ser Ala Leu Cys Thr Ser Asp Val Ala Ala
545 550 555 560
Ala Thr Asn Ala Asp Leu Arg Thr Ala Leu Ala Arg Ala Asp His Gln
565 570 575
Lys Thr Leu Phe Trp Leu Pro Asp His Phe Ser Pro Cys Ala Ala Ser
580 585 590
Leu Arg Phe Asp Leu Asp Glu Ser Val Phe Ile Leu Asp Ala Leu Ala
595 600 605
Gln Ala Thr Arg Ser Glu Thr Pro Val Glu Val Leu Ala Gln Gln Thr
610 615 620
His Gly Leu Ala Ser Thr Leu Thr Arg Trp Ala His Tyr Asn Ala Leu
625 630 635 640
Ile Arg Ala Phe Val Pro Glu Ala Ser His Arg Cys Gly Gly Gln Ser
645 650 655
Ala Asn Val Glu Pro Arg Ile Leu Val Pro Ile Thr His Asn Ala Ser
660 665 670
Tyr Val Val Thr His Ser Pro Leu Pro Arg Gly Ile Gly Tyr Lys Leu
675 680 685
Thr Gly Val Asp Val Arg Arg Pro Leu Phe Leu Thr Tyr Leu Thr Ala
690 695 700
Thr Cys Glu Gly Ser Thr Arg Asp Ile Glu Ser Lys Arg Leu Val Arg
705 710 715 720
Thr Gln Asn Gln Arg Asp Leu Gly Leu Val Gly Ala Val Phe Met Arg
725 730 735
Tyr Thr Pro Ala Gly Glu Val Met Ser Val Leu Leu Val Asp Thr Asp
740 745 750
Asn Thr Gln Gln Gln Ile Ala Ala Gly Pro Thr Glu Gly Ala Pro Ser
755 760 765
Val Phe Ser Ser Asp Val Pro Ser Thr Ala Leu Leu Leu Phe Pro Asn
770 775 780
Gly Thr Val Ile His Leu Leu Ala Phe Asp Thr Gln Pro Val Ala Ala
785 790 795 800
Ile Ala Pro Gly Phe Leu Ala Ala Ser Ala Leu Gly Val Val Met Ile
805 810 815
Thr Ala Ala Leu Ala Gly Ile Leu Lys Val Leu Arg Thr Ser Val Pro
820 825 830
Phe Phe Trp Arg Arg Glu
835
<210> 2
<211> 1105
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> gH в составе конструктов R-VG803, R-VG805 и R-VG809
<400> 2
Met Gly Asn Gly Leu Trp Phe Val Gly Val Ile Ile Leu Gly Val Ala
1 5 10 15
Trp Gly Gln Val His Asp Trp His Ser Ser Gly Gly Gly Ser Gly Ser
20 25 30
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
35 40 45
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
50 55 60
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
65 70 75 80
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
85 90 95
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
100 105 110
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
115 120 125
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Ser Asp Met Pro Met
130 135 140
Ala Asp Pro Asn Arg Phe Arg Gly Lys Asn Leu Val Phe His Ser Glu
145 150 155 160
Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser
165 170 175
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr
180 185 190
Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala
195 200 205
Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys
210 215 220
Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu
225 230 235 240
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser
245 250 255
Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly
260 265 270
Thr Leu Val Thr Val Ser Ser Ser Gly Gly Gly Ser Gly Ser Gly Gly
275 280 285
Ser Gly Thr Glu Gln Thr Asp Pro Trp Phe Leu Asp Gly Leu Gly Met
290 295 300
Asp Arg Met Tyr Trp Arg Asp Thr Asn Thr Gly Arg Leu Trp Leu Pro
305 310 315 320
Asn Thr Pro Asp Pro Gln Lys Pro Pro Arg Gly Phe Leu Ala Pro Pro
325 330 335
Asp Glu Leu Asn Leu Thr Thr Ala Ser Leu Pro Leu Leu Arg Trp Tyr
340 345 350
Glu Glu Arg Phe Cys Phe Val Leu Val Thr Thr Ala Glu Phe Pro Arg
355 360 365
Asp Pro Gly Gln Leu Leu Tyr Ile Pro Lys Thr Tyr Leu Leu Gly Arg
370 375 380
Pro Pro Asn Ala Ser Leu Pro Ala Pro Thr Thr Val Glu Pro Thr Ala
385 390 395 400
Gln Pro Pro Pro Ser Val Ala Pro Leu Lys Gly Leu Leu Tyr Asn Pro
405 410 415
Val Ala Ser Val Leu Leu Arg Ser Arg Ala Trp Val Thr Phe Ser Ala
420 425 430
Val Pro Asp Pro Glu Ala Leu Thr Phe Pro Arg Gly Asp Asn Val Ala
435 440 445
Thr Ala Ser His Pro Ser Gly Pro Arg Asp Thr Pro Pro Pro Arg Pro
450 455 460
Pro Val Gly Ala Arg Arg His Pro Thr Thr Glu Leu Asp Ile Thr His
465 470 475 480
Leu His Asn Ala Ser Thr Thr Trp Leu Ala Thr Arg Gly Leu Leu Arg
485 490 495
Ser Pro Gly Arg Tyr Val Tyr Phe Ser Pro Ser Ala Ser Thr Trp Pro
500 505 510
Val Gly Ile Trp Thr Thr Gly Glu Leu Val Leu Gly Cys Asp Ala Ala
515 520 525
Leu Val Arg Ala Arg Tyr Gly Arg Glu Phe Met Gly Leu Val Ile Ser
530 535 540
Met His Asp Ser Pro Pro Val Glu Val Met Val Val Pro Ala Gly Gln
545 550 555 560
Thr Leu Asp Arg Val Gly Asp Pro Ala Asp Glu Asn Pro Pro Gly Ala
565 570 575
Leu Pro Gly Pro Pro Gly Gly Pro Arg Tyr Arg Val Phe Val Leu Gly
580 585 590
Ser Leu Thr Arg Ala Asp Asn Gly Ser Ala Leu Asp Ala Leu Arg Arg
595 600 605
Val Gly Gly Tyr Pro Glu Glu Gly Thr Asn Tyr Ala Gln Phe Leu Ser
610 615 620
Arg Ala Tyr Ala Glu Phe Phe Ser Gly Asp Ala Gly Ala Glu Gln Gly
625 630 635 640
Pro Arg Pro Pro Leu Phe Trp Arg Leu Thr Gly Leu Leu Ala Thr Ser
645 650 655
Gly Phe Ala Phe Val Asn Ala Ala His Ala Asn Gly Ala Val Cys Leu
660 665 670
Ser Asp Leu Leu Gly Phe Leu Ala His Ser Arg Ala Leu Ala Gly Leu
675 680 685
Ala Ala Arg Gly Ala Ala Gly Cys Ala Ala Asp Ser Val Phe Phe Asn
690 695 700
Val Ser Val Leu Asp Pro Thr Ala Arg Leu Gln Leu Glu Ala Arg Leu
705 710 715 720
Gln His Leu Val Ala Glu Ile Leu Glu Arg Glu Gln Ser Leu Ala Leu
725 730 735
His Ala Leu Gly Tyr Gln Leu Ala Phe Val Leu Asp Ser Pro Ser Ala
740 745 750
Tyr Asp Ala Val Ala Pro Ser Ala Ala His Leu Ile Asp Ala Leu Tyr
755 760 765
Ala Glu Phe Leu Gly Gly Arg Val Leu Thr Thr Pro Val Val His Arg
770 775 780
Ala Leu Phe Tyr Ala Ser Ala Val Leu Arg Gln Pro Phe Leu Ala Gly
785 790 795 800
Val Pro Ser Ala Val Gln Arg Glu Arg Ala Arg Arg Ser Leu Leu Ile
805 810 815
Ala Ser Ala Leu Cys Thr Ser Asp Val Ala Ala Ala Thr Asn Ala Asp
820 825 830
Leu Arg Thr Ala Leu Ala Arg Ala Asp His Gln Lys Thr Leu Phe Trp
835 840 845
Leu Pro Asp His Phe Ser Pro Cys Ala Ala Ser Leu Arg Phe Asp Leu
850 855 860
Asp Glu Ser Val Phe Ile Leu Asp Ala Leu Ala Gln Ala Thr Arg Ser
865 870 875 880
Glu Thr Pro Val Glu Val Leu Ala Gln Gln Thr His Gly Leu Ala Ser
885 890 895
Thr Leu Thr Arg Trp Ala His Tyr Asn Ala Leu Ile Arg Ala Phe Val
900 905 910
Pro Glu Ala Ser His Arg Cys Gly Gly Gln Ser Ala Asn Val Glu Pro
915 920 925
Arg Ile Leu Val Pro Ile Thr His Asn Ala Ser Tyr Val Val Thr His
930 935 940
Ser Pro Leu Pro Arg Gly Ile Gly Tyr Lys Leu Thr Gly Val Asp Val
945 950 955 960
Arg Arg Pro Leu Phe Leu Thr Tyr Leu Thr Ala Thr Cys Glu Gly Ser
965 970 975
Thr Arg Asp Ile Glu Ser Lys Arg Leu Val Arg Thr Gln Asn Gln Arg
980 985 990
Asp Leu Gly Leu Val Gly Ala Val Phe Met Arg Tyr Thr Pro Ala Gly
995 1000 1005
Glu Val Met Ser Val Leu Leu Val Asp Thr Asp Asn Thr Gln Gln
1010 1015 1020
Gln Ile Ala Ala Gly Pro Thr Glu Gly Ala Pro Ser Val Phe Ser
1025 1030 1035
Ser Asp Val Pro Ser Thr Ala Leu Leu Leu Phe Pro Asn Gly Thr
1040 1045 1050
Val Ile His Leu Leu Ala Phe Asp Thr Gln Pro Val Ala Ala Ile
1055 1060 1065
Ala Pro Gly Phe Leu Ala Ala Ser Ala Leu Gly Val Val Met Ile
1070 1075 1080
Thr Ala Ala Leu Ala Gly Ile Leu Lys Val Leu Arg Thr Ser Val
1085 1090 1095
Pro Phe Phe Trp Arg Arg Glu
1100 1105
<210> 3
<211> 1081
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> gH в составе конструкта R-VG811
<400> 3
Met Gly Asn Gly Leu Trp Phe Val Gly Val Ile Ile Leu Gly Val Ala
1 5 10 15
Trp Gly Gln Val His Asp Trp His Ser Ser Gly Gly Gly Ser Gly Ser
20 25 30
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
35 40 45
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
50 55 60
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
65 70 75 80
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
85 90 95
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
100 105 110
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
115 120 125
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Ser Asp Met Pro Met
130 135 140
Ala Asp Pro Asn Arg Phe Arg Gly Lys Asn Leu Val Phe His Ser Glu
145 150 155 160
Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser
165 170 175
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr
180 185 190
Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala
195 200 205
Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys
210 215 220
Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu
225 230 235 240
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser
245 250 255
Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly
260 265 270
Thr Leu Val Thr Val Ser Ser Ser Gly Gly Gly Ser Gly Ser Gly Gly
275 280 285
Ser Gly Gly Arg Leu Trp Leu Pro Asn Thr Pro Asp Pro Gln Lys Pro
290 295 300
Pro Arg Gly Phe Leu Ala Pro Pro Asp Glu Leu Asn Leu Thr Thr Ala
305 310 315 320
Ser Leu Pro Leu Leu Arg Trp Tyr Glu Glu Arg Phe Cys Phe Val Leu
325 330 335
Val Thr Thr Ala Glu Phe Pro Arg Asp Pro Gly Gln Leu Leu Tyr Ile
340 345 350
Pro Lys Thr Tyr Leu Leu Gly Arg Pro Pro Asn Ala Ser Leu Pro Ala
355 360 365
Pro Thr Thr Val Glu Pro Thr Ala Gln Pro Pro Pro Ser Val Ala Pro
370 375 380
Leu Lys Gly Leu Leu Tyr Asn Pro Val Ala Ser Val Leu Leu Arg Ser
385 390 395 400
Arg Ala Trp Val Thr Phe Ser Ala Val Pro Asp Pro Glu Ala Leu Thr
405 410 415
Phe Pro Arg Gly Asp Asn Val Ala Thr Ala Ser His Pro Ser Gly Pro
420 425 430
Arg Asp Thr Pro Pro Pro Arg Pro Pro Val Gly Ala Arg Arg His Pro
435 440 445
Thr Thr Glu Leu Asp Ile Thr His Leu His Asn Ala Ser Thr Thr Trp
450 455 460
Leu Ala Thr Arg Gly Leu Leu Arg Ser Pro Gly Arg Tyr Val Tyr Phe
465 470 475 480
Ser Pro Ser Ala Ser Thr Trp Pro Val Gly Ile Trp Thr Thr Gly Glu
485 490 495
Leu Val Leu Gly Cys Asp Ala Ala Leu Val Arg Ala Arg Tyr Gly Arg
500 505 510
Glu Phe Met Gly Leu Val Ile Ser Met His Asp Ser Pro Pro Val Glu
515 520 525
Val Met Val Val Pro Ala Gly Gln Thr Leu Asp Arg Val Gly Asp Pro
530 535 540
Ala Asp Glu Asn Pro Pro Gly Ala Leu Pro Gly Pro Pro Gly Gly Pro
545 550 555 560
Arg Tyr Arg Val Phe Val Leu Gly Ser Leu Thr Arg Ala Asp Asn Gly
565 570 575
Ser Ala Leu Asp Ala Leu Arg Arg Val Gly Gly Tyr Pro Glu Glu Gly
580 585 590
Thr Asn Tyr Ala Gln Phe Leu Ser Arg Ala Tyr Ala Glu Phe Phe Ser
595 600 605
Gly Asp Ala Gly Ala Glu Gln Gly Pro Arg Pro Pro Leu Phe Trp Arg
610 615 620
Leu Thr Gly Leu Leu Ala Thr Ser Gly Phe Ala Phe Val Asn Ala Ala
625 630 635 640
His Ala Asn Gly Ala Val Cys Leu Ser Asp Leu Leu Gly Phe Leu Ala
645 650 655
His Ser Arg Ala Leu Ala Gly Leu Ala Ala Arg Gly Ala Ala Gly Cys
660 665 670
Ala Ala Asp Ser Val Phe Phe Asn Val Ser Val Leu Asp Pro Thr Ala
675 680 685
Arg Leu Gln Leu Glu Ala Arg Leu Gln His Leu Val Ala Glu Ile Leu
690 695 700
Glu Arg Glu Gln Ser Leu Ala Leu His Ala Leu Gly Tyr Gln Leu Ala
705 710 715 720
Phe Val Leu Asp Ser Pro Ser Ala Tyr Asp Ala Val Ala Pro Ser Ala
725 730 735
Ala His Leu Ile Asp Ala Leu Tyr Ala Glu Phe Leu Gly Gly Arg Val
740 745 750
Leu Thr Thr Pro Val Val His Arg Ala Leu Phe Tyr Ala Ser Ala Val
755 760 765
Leu Arg Gln Pro Phe Leu Ala Gly Val Pro Ser Ala Val Gln Arg Glu
770 775 780
Arg Ala Arg Arg Ser Leu Leu Ile Ala Ser Ala Leu Cys Thr Ser Asp
785 790 795 800
Val Ala Ala Ala Thr Asn Ala Asp Leu Arg Thr Ala Leu Ala Arg Ala
805 810 815
Asp His Gln Lys Thr Leu Phe Trp Leu Pro Asp His Phe Ser Pro Cys
820 825 830
Ala Ala Ser Leu Arg Phe Asp Leu Asp Glu Ser Val Phe Ile Leu Asp
835 840 845
Ala Leu Ala Gln Ala Thr Arg Ser Glu Thr Pro Val Glu Val Leu Ala
850 855 860
Gln Gln Thr His Gly Leu Ala Ser Thr Leu Thr Arg Trp Ala His Tyr
865 870 875 880
Asn Ala Leu Ile Arg Ala Phe Val Pro Glu Ala Ser His Arg Cys Gly
885 890 895
Gly Gln Ser Ala Asn Val Glu Pro Arg Ile Leu Val Pro Ile Thr His
900 905 910
Asn Ala Ser Tyr Val Val Thr His Ser Pro Leu Pro Arg Gly Ile Gly
915 920 925
Tyr Lys Leu Thr Gly Val Asp Val Arg Arg Pro Leu Phe Leu Thr Tyr
930 935 940
Leu Thr Ala Thr Cys Glu Gly Ser Thr Arg Asp Ile Glu Ser Lys Arg
945 950 955 960
Leu Val Arg Thr Gln Asn Gln Arg Asp Leu Gly Leu Val Gly Ala Val
965 970 975
Phe Met Arg Tyr Thr Pro Ala Gly Glu Val Met Ser Val Leu Leu Val
980 985 990
Asp Thr Asp Asn Thr Gln Gln Gln Ile Ala Ala Gly Pro Thr Glu Gly
995 1000 1005
Ala Pro Ser Val Phe Ser Ser Asp Val Pro Ser Thr Ala Leu Leu
1010 1015 1020
Leu Phe Pro Asn Gly Thr Val Ile His Leu Leu Ala Phe Asp Thr
1025 1030 1035
Gln Pro Val Ala Ala Ile Ala Pro Gly Phe Leu Ala Ala Ser Ala
1040 1045 1050
Leu Gly Val Val Met Ile Thr Ala Ala Leu Ala Gly Ile Leu Lys
1055 1060 1065
Val Leu Arg Thr Ser Val Pro Phe Phe Trp Arg Arg Glu
1070 1075 1080
<210> 4
<211> 394
<212> БЕЛОК
<213> ВПГ-1
<400> 4
Met Gly Gly Ala Ala Ala Arg Leu Gly Ala Val Ile Leu Phe Val Val
1 5 10 15
Ile Val Gly Leu His Gly Val Arg Gly Lys Tyr Ala Leu Ala Asp Ala
20 25 30
Ser Leu Lys Met Ala Asp Pro Asn Arg Phe Arg Gly Lys Asp Leu Pro
35 40 45
Val Leu Asp Gln Leu Thr Asp Pro Pro Gly Val Arg Arg Val Tyr His
50 55 60
Ile Gln Ala Gly Leu Pro Asp Pro Phe Gln Pro Pro Ser Leu Pro Ile
65 70 75 80
Thr Val Tyr Tyr Ala Val Leu Glu Arg Ala Cys Arg Ser Val Leu Leu
85 90 95
Asn Ala Pro Ser Glu Ala Pro Gln Ile Val Arg Gly Ala Ser Glu Asp
100 105 110
Val Arg Lys Gln Pro Tyr Asn Leu Thr Ile Ala Trp Phe Arg Met Gly
115 120 125
Gly Asn Cys Ala Ile Pro Ile Thr Val Met Glu Tyr Thr Glu Cys Ser
130 135 140
Tyr Asn Lys Ser Leu Gly Ala Cys Pro Ile Arg Thr Gln Pro Arg Trp
145 150 155 160
Asn Tyr Tyr Asp Ser Phe Ser Ala Val Ser Glu Asp Asn Leu Gly Phe
165 170 175
Leu Met His Ala Pro Ala Phe Glu Thr Ala Gly Thr Tyr Leu Arg Leu
180 185 190
Val Lys Ile Asn Asp Trp Thr Glu Ile Thr Gln Phe Ile Leu Glu His
195 200 205
Arg Ala Lys Gly Ser Cys Lys Tyr Ala Leu Pro Leu Arg Ile Pro Pro
210 215 220
Ser Ala Cys Leu Ser Pro Gln Ala Tyr Gln Gln Gly Val Thr Val Asp
225 230 235 240
Ser Ile Gly Met Leu Pro Arg Phe Ile Pro Glu Asn Gln Arg Thr Val
245 250 255
Ala Val Tyr Ser Leu Lys Ile Ala Gly Trp His Gly Pro Lys Ala Pro
260 265 270
Tyr Thr Ser Thr Leu Leu Pro Pro Glu Leu Ser Glu Thr Pro Asn Ala
275 280 285
Thr Gln Pro Glu Leu Ala Pro Glu Asp Pro Glu Asp Ser Ala Leu Leu
290 295 300
Glu Asp Pro Val Gly Thr Val Ala Pro Gln Ile Pro Pro Asn Trp His
305 310 315 320
Ile Pro Ser Ile Gln Asp Ala Ala Thr Pro Tyr His Pro Pro Ala Thr
325 330 335
Pro Asn Asn Met Gly Leu Ile Ala Gly Ala Val Gly Gly Ser Leu Leu
340 345 350
Ala Ala Leu Val Ile Cys Gly Ile Val Tyr Trp Met Arg Arg Arg Thr
355 360 365
Gln Lys Ala Pro Lys Arg Ile Arg Leu Pro His Ile Arg Glu Asp Asp
370 375 380
Gln Pro Ser Ser His Gln Pro Leu Phe Tyr
385 390
<210> 5
<211> 621
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> gD в составе R-LM113
<400> 5
Met Gly Gly Ala Ala Ala Arg Leu Gly Ala Val Ile Leu Phe Val Val
1 5 10 15
Ile Val Gly Leu His Gly Val Arg Gly Lys Tyr Ala Leu Ala Glu Asn
20 25 30
Ser Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val
35 40 45
Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr
50 55 60
Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu
65 70 75 80
Ile Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser
85 90 95
Gly Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln
100 105 110
Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro
115 120 125
Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Ser Asp Met Pro
130 135 140
Met Ala Asp Pro Asn Arg Phe Arg Gly Lys Asn Leu Val Phe His Ser
145 150 155 160
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
165 170 175
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
180 185 190
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
195 200 205
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
210 215 220
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
225 230 235 240
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
245 250 255
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
260 265 270
Gly Thr Leu Val Thr Val Ser Ser Ser Gly Gly Gly Ser Gly Ser Gly
275 280 285
Gly Ser His Ile Gln Ala Gly Leu Pro Asp Pro Phe Gln Pro Pro Ser
290 295 300
Leu Pro Ile Thr Val Tyr Tyr Ala Val Leu Glu Arg Ala Cys Arg Ser
305 310 315 320
Val Leu Leu Asn Ala Pro Ser Glu Ala Pro Gln Ile Val Arg Gly Ala
325 330 335
Ser Glu Asp Val Arg Lys Gln Pro Tyr Asn Leu Thr Ile Ala Trp Phe
340 345 350
Arg Met Gly Gly Asn Cys Ala Ile Pro Ile Thr Val Met Glu Tyr Thr
355 360 365
Glu Cys Ser Tyr Asn Lys Ser Leu Gly Ala Cys Pro Ile Arg Thr Gln
370 375 380
Pro Arg Trp Asn Tyr Tyr Asp Ser Phe Ser Ala Val Ser Glu Asp Asn
385 390 395 400
Leu Gly Phe Leu Met His Ala Pro Ala Phe Glu Thr Ala Gly Thr Tyr
405 410 415
Leu Arg Leu Val Lys Ile Asn Asp Trp Thr Glu Ile Thr Gln Phe Ile
420 425 430
Leu Glu His Arg Ala Lys Gly Ser Cys Lys Tyr Ala Leu Pro Leu Arg
435 440 445
Ile Pro Pro Ser Ala Cys Leu Ser Pro Gln Ala Tyr Gln Gln Gly Val
450 455 460
Thr Val Asp Ser Ile Gly Met Leu Pro Arg Phe Ile Pro Glu Asn Gln
465 470 475 480
Arg Thr Val Ala Val Tyr Ser Leu Lys Ile Ala Gly Trp His Gly Pro
485 490 495
Lys Ala Pro Tyr Thr Ser Thr Leu Leu Pro Pro Glu Leu Ser Glu Thr
500 505 510
Pro Asn Ala Thr Gln Pro Glu Leu Ala Pro Glu Asp Pro Glu Asp Ser
515 520 525
Ala Leu Leu Glu Asp Pro Val Gly Thr Val Ala Pro Gln Ile Pro Pro
530 535 540
Asn Trp His Ile Pro Ser Ile Gln Asp Ala Ala Thr Pro Tyr His Pro
545 550 555 560
Pro Ala Thr Pro Asn Asn Met Gly Leu Ile Ala Gly Ala Val Gly Gly
565 570 575
Ser Leu Leu Ala Ala Leu Val Ile Cys Gly Ile Val Tyr Trp Met Arg
580 585 590
Arg Arg Thr Gln Lys Ala Pro Lys Arg Ile Arg Leu Pro His Ile Arg
595 600 605
Glu Asp Asp Gln Pro Ser Ser His Gln Pro Leu Phe Tyr
610 615 620
<210> 6
<211> 503
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> gD в составе R-LM249
<400> 6
Met Gly Gly Ala Ala Ala Arg Leu Gly Ala Val Ile Leu Phe Val Val
1 5 10 15
Ile Val Gly Leu His Gly Val Arg Gly Lys Tyr Ala Leu Ala Asp Ala
20 25 30
Ser Leu Lys Met Ala Asp Pro Asn Arg Phe Arg Gly Lys Asp Leu Pro
35 40 45
Val Leu Asp Gln Leu Thr Asp Pro Pro Gly Val Arg Arg Val Tyr His
50 55 60
Ile Gln Ala Gly Leu Pro Asp Pro Phe Gln Pro Pro Ser Leu Pro Ile
65 70 75 80
Thr Val Tyr Tyr Ala His Ser Ser Gly Gly Gly Ser Gly Ser Asp Ile
85 90 95
Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg
100 105 110
Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala Val Ala
115 120 125
Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ser
130 135 140
Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Arg
145 150 155 160
Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp
165 170 175
Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro Thr Phe
180 185 190
Gly Gln Gly Thr Lys Val Glu Ile Lys Ser Asp Met Pro Met Ala Asp
195 200 205
Pro Asn Arg Phe Arg Gly Lys Asn Leu Val Phe His Ser Glu Val Gln
210 215 220
Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg
225 230 235 240
Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr Ile His
245 250 255
Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile
260 265 270
Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys Gly Arg
275 280 285
Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met
290 295 300
Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Trp
305 310 315 320
Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu
325 330 335
Val Thr Val Ser Ser Ser Gly Gly Gly Ser Gly Ser Gly Gly Ser Gly
340 345 350
Met Leu Pro Arg Phe Ile Pro Glu Asn Gln Arg Thr Val Ala Val Tyr
355 360 365
Ser Leu Lys Ile Ala Gly Trp His Gly Pro Lys Ala Pro Tyr Thr Ser
370 375 380
Thr Leu Leu Pro Pro Glu Leu Ser Glu Thr Pro Asn Ala Thr Gln Pro
385 390 395 400
Glu Leu Ala Pro Glu Asp Pro Glu Asp Ser Ala Leu Leu Glu Asp Pro
405 410 415
Val Gly Thr Val Ala Pro Gln Ile Pro Pro Asn Trp His Ile Pro Ser
420 425 430
Ile Gln Asp Ala Ala Thr Pro Tyr His Pro Pro Ala Thr Pro Asn Asn
435 440 445
Met Gly Leu Ile Ala Gly Ala Val Gly Gly Ser Leu Leu Ala Ala Leu
450 455 460
Val Ile Cys Gly Ile Val Tyr Trp Met Arg Arg Arg Thr Gln Lys Ala
465 470 475 480
Pro Lys Arg Ile Arg Leu Pro His Ile Arg Glu Asp Asp Gln Pro Ser
485 490 495
Ser His Gln Pro Leu Phe Tyr
500
<210> 7
<211> 615
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> gD в составе R-VG805
<400> 7
Met Gly Gly Ala Ala Ala Arg Leu Gly Ala Val Ile Leu Phe Val Val
1 5 10 15
Ile Val Gly Leu His Gly Val Arg Gly Lys Tyr Ala Leu Ala Ala Glu
20 25 30
Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Lys Pro Gly Ala Ser
35 40 45
Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser His Trp
50 55 60
Met His Trp Val Lys Gln Arg Ala Gly Gln Gly Leu Glu Trp Ile Gly
65 70 75 80
Glu Phe Asn Pro Ser Asn Gly Arg Thr Asn Tyr Asn Glu Lys Phe Lys
85 90 95
Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr Met
100 105 110
Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys Ala
115 120 125
Ser Arg Asp Tyr Asp Tyr Asp Gly Arg Tyr Phe Asp Tyr Trp Gly Gln
130 135 140
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
145 150 155 160
Gly Ser Gly Gly Gly Gly Ser Asp Ile Glu Leu Thr Gln Ser Pro Ala
165 170 175
Ile Met Ser Ala Ser Pro Gly Glu Lys Val Thr Met Thr Cys Ser Ala
180 185 190
Ser Ser Ser Val Thr Tyr Met Tyr Trp Tyr Gln Gln Lys Pro Gly Ser
195 200 205
Ser Pro Arg Leu Leu Ile Tyr Asp Thr Ser Asn Leu Ala Ser Gly Val
210 215 220
Pro Val Arg Phe Ser Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr
225 230 235 240
Ile Ser Arg Met Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln
245 250 255
Trp Ser Ser His Ile Phe Thr Phe Gly Ser Gly Thr Glu Leu Glu Ile
260 265 270
Lys Ser Ser Ala Gly Ser Ala Ser Ser Ser Ala Ser His Ile Gln Ala
275 280 285
Gly Leu Pro Asp Pro Phe Gln Pro Pro Ser Leu Pro Ile Thr Val Tyr
290 295 300
Tyr Ala Val Leu Glu Arg Ala Cys Arg Ser Val Leu Leu Asn Ala Pro
305 310 315 320
Ser Glu Ala Pro Gln Ile Val Arg Gly Ala Ser Glu Asp Val Arg Lys
325 330 335
Gln Pro Tyr Asn Leu Thr Ile Ala Trp Phe Arg Met Gly Gly Asn Cys
340 345 350
Ala Ile Pro Ile Thr Val Met Glu Tyr Thr Glu Cys Ser Tyr Asn Lys
355 360 365
Ser Leu Gly Ala Cys Pro Ile Arg Thr Gln Pro Arg Trp Asn Tyr Tyr
370 375 380
Asp Ser Phe Ser Ala Val Ser Glu Asp Asn Leu Gly Phe Leu Met His
385 390 395 400
Ala Pro Ala Phe Glu Thr Ala Gly Thr Tyr Leu Arg Leu Val Lys Ile
405 410 415
Asn Asp Trp Thr Glu Ile Thr Gln Phe Ile Leu Glu His Arg Ala Lys
420 425 430
Gly Ser Cys Lys Tyr Ala Leu Pro Leu Arg Ile Pro Pro Ser Ala Cys
435 440 445
Leu Ser Pro Gln Ala Tyr Gln Gln Gly Val Thr Val Asp Ser Ile Gly
450 455 460
Met Leu Pro Arg Phe Ile Pro Glu Asn Gln Arg Thr Val Ala Val Tyr
465 470 475 480
Ser Leu Lys Ile Ala Gly Trp His Gly Pro Lys Ala Pro Tyr Thr Ser
485 490 495
Thr Leu Leu Pro Pro Glu Leu Ser Glu Thr Pro Asn Ala Thr Gln Pro
500 505 510
Glu Leu Ala Pro Glu Asp Pro Glu Asp Ser Ala Leu Leu Glu Asp Pro
515 520 525
Val Gly Thr Val Ala Pro Gln Ile Pro Pro Asn Trp His Ile Pro Ser
530 535 540
Ile Gln Asp Ala Ala Thr Pro Tyr His Pro Pro Ala Thr Pro Asn Asn
545 550 555 560
Met Gly Leu Ile Ala Gly Ala Val Gly Gly Ser Leu Leu Ala Ala Leu
565 570 575
Val Ile Cys Gly Ile Val Tyr Trp Met Arg Arg Arg Thr Gln Lys Ala
580 585 590
Pro Lys Arg Ile Arg Leu Pro His Ile Arg Glu Asp Asp Gln Pro Ser
595 600 605
Ser His Gln Pro Leu Phe Tyr
610 615
<210> 8
<211> 619
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> gD в составе R-VG807
<400> 8
Met Gly Gly Ala Ala Ala Arg Leu Gly Ala Val Ile Leu Phe Val Val
1 5 10 15
Ile Val Gly Leu His Gly Val Arg Gly Lys Tyr Ala Leu Ala Ser Asp
20 25 30
Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp
35 40 45
Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala Val
50 55 60
Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr
65 70 75 80
Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
85 90 95
Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
100 105 110
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro Thr
115 120 125
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Ser Asp Met Pro Met Ala
130 135 140
Asp Pro Asn Arg Phe Arg Gly Lys Asn Leu Val Phe His Ser Glu Val
145 150 155 160
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
165 170 175
Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr Ile
180 185 190
His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg
195 200 205
Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys Gly
210 215 220
Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln
225 230 235 240
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg
245 250 255
Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
260 265 270
Leu Val Thr Val Ser Ser Ser Ala Gly Ser Ala Ser Ser Ser Ala Ser
275 280 285
His Ile Gln Ala Gly Leu Pro Asp Pro Phe Gln Pro Pro Ser Leu Pro
290 295 300
Ile Thr Val Tyr Tyr Ala Val Leu Glu Arg Ala Cys Arg Ser Val Leu
305 310 315 320
Leu Asn Ala Pro Ser Glu Ala Pro Gln Ile Val Arg Gly Ala Ser Glu
325 330 335
Asp Val Arg Lys Gln Pro Tyr Asn Leu Thr Ile Ala Trp Phe Arg Met
340 345 350
Gly Gly Asn Cys Ala Ile Pro Ile Thr Val Met Glu Tyr Thr Glu Cys
355 360 365
Ser Tyr Asn Lys Ser Leu Gly Ala Cys Pro Ile Arg Thr Gln Pro Arg
370 375 380
Trp Asn Tyr Tyr Asp Ser Phe Ser Ala Val Ser Glu Asp Asn Leu Gly
385 390 395 400
Phe Leu Met His Ala Pro Ala Phe Glu Thr Ala Gly Thr Tyr Leu Arg
405 410 415
Leu Val Lys Ile Asn Asp Trp Thr Glu Ile Thr Gln Phe Ile Leu Glu
420 425 430
His Arg Ala Lys Gly Ser Cys Lys Tyr Ala Leu Pro Leu Arg Ile Pro
435 440 445
Pro Ser Ala Cys Leu Ser Pro Gln Ala Tyr Gln Gln Gly Val Thr Val
450 455 460
Asp Ser Ile Gly Met Leu Pro Arg Phe Ile Pro Glu Asn Gln Arg Thr
465 470 475 480
Val Ala Val Tyr Ser Leu Lys Ile Ala Gly Trp His Gly Pro Lys Ala
485 490 495
Pro Tyr Thr Ser Thr Leu Leu Pro Pro Glu Leu Ser Glu Thr Pro Asn
500 505 510
Ala Thr Gln Pro Glu Leu Ala Pro Glu Asp Pro Glu Asp Ser Ala Leu
515 520 525
Leu Glu Asp Pro Val Gly Thr Val Ala Pro Gln Ile Pro Pro Asn Trp
530 535 540
His Ile Pro Ser Ile Gln Asp Ala Ala Thr Pro Tyr His Pro Pro Ala
545 550 555 560
Thr Pro Asn Asn Met Gly Leu Ile Ala Gly Ala Val Gly Gly Ser Leu
565 570 575
Leu Ala Ala Leu Val Ile Cys Gly Ile Val Tyr Trp Met Arg Arg Arg
580 585 590
Thr Gln Lys Ala Pro Lys Arg Ile Arg Leu Pro His Ile Arg Glu Asp
595 600 605
Asp Gln Pro Ser Ser His Gln Pro Leu Phe Tyr
610 615
<210> 9
<211> 361
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> gD в составе R-VG809
<400> 9
Met Gly Gly Ala Ala Ala Arg Leu Gly Ala Val Ile Leu Phe Val Val
1 5 10 15
Ile Val Gly Leu His Gly Val Arg Gly Lys Tyr Ala Leu Ala His Ile
20 25 30
Gln Ala Gly Leu Pro Asp Pro Phe Gln Pro Pro Ser Leu Pro Ile Thr
35 40 45
Val Tyr Tyr Ala Val Leu Glu Arg Ala Cys Arg Ser Val Leu Leu Asn
50 55 60
Ala Pro Ser Glu Ala Pro Gln Ile Val Arg Gly Ala Ser Glu Asp Val
65 70 75 80
Arg Lys Gln Pro Tyr Asn Leu Thr Ile Ala Trp Phe Arg Met Gly Gly
85 90 95
Asn Cys Ala Ile Pro Ile Thr Val Met Glu Tyr Thr Glu Cys Ser Tyr
100 105 110
Asn Lys Ser Leu Gly Ala Cys Pro Ile Arg Thr Gln Pro Arg Trp Asn
115 120 125
Tyr Tyr Asp Ser Phe Ser Ala Val Ser Glu Asp Asn Leu Gly Phe Leu
130 135 140
Met His Ala Pro Ala Phe Glu Thr Ala Gly Thr Tyr Leu Arg Leu Val
145 150 155 160
Lys Ile Asn Asp Trp Thr Glu Ile Thr Gln Phe Ile Leu Glu His Arg
165 170 175
Ala Lys Gly Ser Cys Lys Tyr Ala Leu Pro Leu Arg Ile Pro Pro Ser
180 185 190
Ala Cys Leu Ser Pro Gln Ala Tyr Gln Gln Gly Val Thr Val Asp Ser
195 200 205
Ile Gly Met Leu Pro Arg Phe Ile Pro Glu Asn Gln Arg Thr Val Ala
210 215 220
Val Tyr Ser Leu Lys Ile Ala Gly Trp His Gly Pro Lys Ala Pro Tyr
225 230 235 240
Thr Ser Thr Leu Leu Pro Pro Glu Leu Ser Glu Thr Pro Asn Ala Thr
245 250 255
Gln Pro Glu Leu Ala Pro Glu Asp Pro Glu Asp Ser Ala Leu Leu Glu
260 265 270
Asp Pro Val Gly Thr Val Ala Pro Gln Ile Pro Pro Asn Trp His Ile
275 280 285
Pro Ser Ile Gln Asp Ala Ala Thr Pro Tyr His Pro Pro Ala Thr Pro
290 295 300
Asn Asn Met Gly Leu Ile Ala Gly Ala Val Gly Gly Ser Leu Leu Ala
305 310 315 320
Ala Leu Val Ile Cys Gly Ile Val Tyr Trp Met Arg Arg Arg Thr Gln
325 330 335
Lys Ala Pro Lys Arg Ile Arg Leu Pro His Ile Arg Glu Asp Asp Gln
340 345 350
Pro Ser Ser His Gln Pro Leu Phe Tyr
355 360
<210> 10
<211> 74
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер gH6_galK_f
<400> 10
atgcggtcca tgcccaggcc atccaaaaac catgggtctg tctgctcagt cctgttgaca 60
attaatcatc ggca 74
<210> 11
<211> 70
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер gH5_galK_r
<400> 11
tcgtgggggt tattattttg ggcgttgcgt ggggtcaggt ccacgactgg tcagcactgt 60
cctgctcctt 70
<210> 12
<211> 801
<212> ДНК
<213> Искусственная последовательность
<220>
<223> pSG-ScFvHER2-SG кассета scFv трастузумаба, ограниченная линкерами
Ser-Gly
<400> 12
catagtagtg gcggtggctc tggatccgat atccagatga cccagtcccc gagctccctg 60
tccgcctctg tgggcgatag ggtcaccatc acctgccgtg ccagtcagga tgtgaatact 120
gctgtagcct ggtatcaaca gaaaccagga aaagctccga agcttctgat ttactcggca 180
tccttcctct actctggagt cccttctcgc ttctctggta gccgttccgg gacggatttc 240
actctgacca tcagcagtct gcagccggaa gacttcgcaa cttattactg tcagcaacat 300
tatactactc ctcccacgtt cggacagggt accaaggtgg agatcaaatc ggatatgccg 360
atggctgatc cgaaccgttt ccgcggtaag aacctggttt ttcattctga ggttcagctg 420
gtggagtctg gcggtggcct ggtgcagcca gggggctcac tccgtttgtc ctgtgcagct 480
tctggcttca acattaaaga cacctatata cactgggtgc gtcaggcccc gggtaagggc 540
ctggaatggg ttgcaaggat ttatcctacg aatggttata ctagatatgc cgatagcgtc 600
aagggccgtt tcactataag cgcagacaca tccaaaaaca cagcctacct acaaatgaac 660
agcttaagag ctgaggacac tgccgtctat tattgtagcc gctggggagg ggacggcttc 720
tatgctatgg actactgggg tcaaggaaca ctagtcaccg tctcctcgag tggcggtggc 780
tctggttccg gtggatccgg t 801
<210> 13
<211> 78
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер gH23_8SG_scFv4D5_f
<400> 13
tcgtgggggt tattattttg ggcgttgcgt ggggtcaggt ccacgactgg catagtagtg 60
gcggtggctc tggatccg 78
<210> 14
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер scFv4D5_358_r
<400> 14
ggaaacggtt cggatcagcc atcgg 25
<210> 15
<211> 74
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер gH24_12SG_scFv4D5r
<400> 15
atgcggtcca tgcccaggcc atccaaaaac catgggtctg tctgctcagt accggatcca 60
ccggaaccag agcc 74
<210> 16
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер scFv4D5_315_f
<400> 16
ggagatcaaa tcggatatgc cgatgg 26
<210> 17
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкер
<400> 17
His Ser Ser Gly Gly Gly Ser Gly
1 5
<210> 18
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкер
<400> 18
Ser Ser Gly Gly Gly Ser Gly Ser Gly Gly Ser Gly
1 5 10
<210> 19
<211> 20
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкер
<400> 19
Ser Asp Met Pro Met Ala Asp Pro Asn Arg Phe Arg Gly Lys Asn Leu
1 5 10 15
Val Phe His Ser
20
<210> 20
<211> 74
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер UL37/38_galK_f
<400> 20
ccgcaggcgt tgcgagtacc ccgcgtcttc gcggggtgtt atacggccac cctgttgaca 60
attaatcatc ggca 74
<210> 21
<211> 70
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер UL37/38_galK_r
<400> 21
tccggacaat cccccgggcc tgggtccgcg aacgggatgc cgggacttaa tcagcactgt 60
cctgctcctt 70
<210> 22
<211> 72
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер UL37/38_CMV_mcherry_f
<400> 22
ccgcaggcgt tgcgagtacc ccgcgtcttc gcggggtgtt atacggccac cgatgtacgg 60
gccagatata cg 72
<210> 23
<211> 70
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер UL37/38_pA_mcherry_1958_r
<400> 23
tccggacaat cccccgggcc tgggtccgcg aacgggatgc cgggacttaa ccatagagcc 60
caccgcatcc 70
<210> 24
<211> 74
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер gH29_galK_f
<400> 24
cgcggtggtt tttgggggtc gggggtgttt ggcagccaca gacgcccggt cctgttgaca 60
attaatcatc ggca 74
<210> 25
<211> 70
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер gH5_galK_r
<400> 25
tcgtgggggt tattattttg ggcgttgcgt ggggtcaggt ccacgactgg tcagcactgt 60
cctgctcctt 70
<210> 26
<211> 74
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер gH48_12SG_scFv4D5_r
<400> 26
ccgcgcggtg gtttttgggg gtcgggggtg tttggcagcc acagacgccc accggatcca 60
ccggaaccag agcc 74
<210> 27
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер scFv4D5_315_f
<400> 27
ggagatcaaa tcggatatgc cgatgg 26
<210> 28
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер galK_129_f
<400> 28
acaatctctg tttgccaacg catttgg 27
<210> 29
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер galK_417_r
<400> 29
cattgccgct gatcaccatg tccacgc 27
<210> 30
<211> 74
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер gD5_galK_f
<400> 30
ttgtcgtcat agtgggcctc catggggtcc gcggcaaata tgccttggcg cctgttgaca 60
attaatcatc ggca 74
<210> 31
<211> 70
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер gD39_galK_r
<400> 31
atcgggaggc tggggggctg gaacgggtcc ggtaggcccg cctggatgtg tcagcactgt 60
cctgctcctt 70
<210> 32
<211> 100
<212> ДНК
<213> Искусственная последовательность
<220>
<223> олигонуклеотид gD_aa5_39_f_r
<400> 32
ttgtcgtcat agtgggcctc catggggtcc gcggcaaata tgccttggcg cacatccagg 60
cgggcctacc ggacccgttc cagcccccca gcctcccgat 100
<210> 33
<211> 74
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер gD5_galK_f
<400> 33
ttgtcgtcat agtgggcctc catggggtcc gcggcaaata tgccttggcg cctgttgaca 60
attaatcatc ggca 74
<210> 34
<211> 70
<212> ДНК
<213> Искусственная последовательность
<220>
<223> gD39_galK_r
<400> 34
atcgggaggc tggggggctg gaacgggtcc ggtaggcccg cctggatgtg tcagcactgt 60
cctgctcctt 70
<210> 35
<211> 73
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер BAC_LM611_f
<400> 35
ttgtcgtcat agtgggcctc catggggtcc gcggcaaata tgccttggcg gccgaggtgc 60
aactgcagca gtc 73
<210> 36
<211> 106
<212> ДНК
<213> Искусственная последовательность
<220>
<223> gD39_11SAG_EGFR_r
<400> 36
atcgggaggc tggggggctg gaacgggtcc ggtaggcccg cctggatgtg acttgcacta 60
gatgaagcac ttcctgcgga agatttgatc tcgagttctg tccccg 106
<210> 37
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкер
<400> 37
Ser Ser Ala Gly Ser Ala Ser Ser Ser Ala Ser
1 5 10
<210> 38
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкер
<400> 38
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 39
<211> 74
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер gD5_galK_f
<400> 39
ttgtcgtcat agtgggcctc catggggtcc gcggcaaata tgccttggcg cctgttgaca 60
attaatcatc ggca 74
<210> 40
<211> 70
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер gD39_galK_r
<400> 40
atcgggaggc tggggggctg gaacgggtcc ggtaggcccg cctggatgtg tcagcactgt 60
cctgctcctt 70
<210> 41
<211> 75
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер gD5_scFvHER2_f
<400> 41
ttgtcgtcat agtgggcctc catggggtcc gcggcaaata tgccttggcg tccgatatcc 60
agatgaccca gtccc 75
<210> 42
<211> 110
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер gD39_11SAG_HER2_r
<400> 42
atcgggaggc tggggggctg gaacgggtcc ggtaggcccg cctggatgtg acttgcacta 60
gatgaagcac ttcctgcgga agaggagacg gtgactagtg ttccttgacc 110
<210> 43
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкер
<400> 43
Ser Ser Ala Gly Ser Ala Ser Ser Ser Ala Ser
1 5 10
<210> 44
<211> 20
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкер
<400> 44
Ser Asp Met Pro Met Ala Asp Pro Asn Arg Phe Arg Gly Lys Asn Leu
1 5 10 15
Val Phe His Ser
20
<---
Реферат
Изобретение относится к области биотехнологии. Описана группа изобретений, включающая рекомбинантный инфекционный герпесвирус, нуклеиновую кислоту для получения вышеуказанного герпесвируса, нуклеиновую кислоту для получения зрелого гликопротеина H (gH) рекомбинантного инфекционного герпесвируса, вектор для получения рекомбинантного инфекционного герпесвируса, клетку для получения рекомбинантного инфекционного герпесвируса, способ уничтожения клетки с использованием рекомбинантного инфекционного герпесвируса и способ культивирования рекомбинантного инфекционного герпесвируса в клеткахВ одном из вариантов реализации герпесвирус содержит гетерологичный полипептидный лиганд, присоединенный к N-концу гликопротеина H (gH), у которого отсутствует N-концевая область до аминокислоты в положении 48 согласно SEQ ID NO: 1. Изобретение расширяет арсенал для получения рекомбинантных инфекционных герпесвирусов. 7 н. и 8 з.п. ф-лы, 9 ил., 9 пр.

Комментарии