Иммуногенная композиция, вызывающая иммунный ответ против парвовируса и цирковируса свиньи, вакцина против многосистемного синдрома истощения свиней (pmws) (варианты), набор для вакцинации и способ ее осуществления - RU2237492C2
Код документа: RU2237492C2
Чертежи


























Описание
Настоящее изобретение касается вакцины против синдрома МСИС (многосистемного синдрома истощения свиней, также именуемого многосистемным синдромом истощения после отлучения).
В нижеследующем тексте цитируются различные документы, в которых также цитируются или содержатся ссылки на различные документы. Это не означает, что любой из этих документов в самом деле представляет собой предшествующий уровень техники относительно настоящего изобретения. Все документы, цитируемые в настоящем изобретении, как и те, что процитированы или содержатся в качестве ссылок в этих документах, тем самым включаются в настоящее изобретение в виде ссылок.
PCV (от porcine circovirus, что значит цирковирус свиней) первоначально был обнаружен как нецитопатогенная примесь в линии почечных клеток свиней РК/15. Этот вирус был причислен к Circoviridae вместе с вирусом анемии цыплят (CAV, от chicken anaemia virus) и вирусом PBFDV (от psittacine beak and feather disease virus, вирус заболевания клюва и перьев попугаев). Это небольшой безоболочечный вирус (15-24 нм), общей характеристикой которого является геном в виде кольцевой однонитчатой ДНК размером от 1,76 до 2,31 кБ. Сначала полагали, что этот геном кодирует полипептид примерно в 30 кД (Todd et al., Arch. Virol. 1991, 117: 129-135). Однако в недавней работе показано, что транскрипция более сложная (Meehan et al., 1997, 78: 221-227). Более того, не обнаружено значительной гомологии в нуклеотидной последовательности или в общих антигенных детерминантах между тремя типами известных цирковирусов.
PCV из клеток РК/15 не считается патогенным. Его последовательность известна (Meehan et al., J.Gen. Virol. 1997, 78: 221-227). Лишь совсем недавно некоторые авторы стали полагать, что штаммы PCV могут быть патогенными в связи с синдромом МСИС (Gupi P.S. Nayar et al., Can. Vet. J. 1997, 38: 385-387 и Clark E.G., Proc. Am. Assoc. Swine Prac. 1997: 499-501). Nayar et al. обнаружили ДНК PCV у свиней с синдромом МСИС методом ПЦР.
Синдром МСИС, обнаруженный в Канаде, США и Франции, клинически характеризуется постепенной потерей веса и такими проявлениями, как тахипнея, диспнея и желтуха. С точки зрения патологии, его проявления включают лимфоцитическую и грануломатозную инфильтрацию, лимфаденопатию и, реже, гепатит и лимфоцитический и грануломатозный нефрит (Clark E.G., Proc. Am. Assoc. Swine Prac. 1997: 499-501; La Semaine



Подателям заявки удалось выделить новые штаммы PCV из образцов ткани легких и лимфатических узлов, полученных на фермах, расположенных в Канаде, США (Калифорния) и Франции (Бретань). Эти вирусы обнаружены в поврежденных тканях свиней с синдромом МСИС, но они отсутствовали у здоровых свиней.
Кроме того, податели заявки просеквенировали геномы 4 из этих штаммов, а именно штаммов, полученных из Канады и США, а также 2 штаммов из Франции. Штаммы проявляют очень сильную гомологию друг с другом на нуклеотидном уровне, превышающую 96%, и более слабую со штаммом РК/15, около 76%. Таким образом, новые штаммы можно рассматривать как представителей нового типа цирковируса свиней, который в дальнейшем именуется тип II, тогда как тип I представлен РК/15.
Очищенные препараты 5 штаммов были депонированы согласно Будапештскому Договору в ЕСАСС (Европейская коллекция клеточных культур, Центр прикладной микробиологии и иcследований, Porton Down, Salisbury, Wiltshire SP4 0JG, Великобритания) в четверг 2 октября 1997 года:
- за номером V97100219 (в дальнейшем именуется Imp. 1008PCV),
- за номером V97100218 (в дальнейшем именуется Imp. 1010PCV),
- за номером V97100217 (в дальнейшем именуется Imp. 999PCV), и в пятницу 16 января 1998 года:
- за номером V98011608 (в дальнейшем именуется Imp. 1011-48285),
- за номером V98011609 (в дальнейшем именуется Imp. 1011-48121).
Податели заявки в опытах по экспериментальному воспроизведению многосистемного синдрома истощения свиней наблюдали, что парвовирус свиней в сочетании с цирковирусом свиней может вызывать ухудшение заболевания.
Поэтому предметом настоящего изобретения является вакцинация свиней с помощью вакцины против цирковируса свиней, в частности типа I или II, предпочтительно типа II, в сочетании с вакциной против парвовируса свиней. При этом подразумевается вакцинация либо с помощью двухвалентной вакцины, либо применение одновременно вакцины против цирковируса свиней и вакцины против парвовируса свиней.
Контрольным штаммом парвовируса является штамм NADL-2, который можно получить из коллекции АТСС за номером VR-742. Вакцинация против парвовируса свиней хорошо известна специалистам в этой области, и вакцины против парвовируса свиней имеются в продаже. В качестве примера можно отметить Parvovax®(инактивированная вакцина против парвовируса свиней, которую поставляет MERIAL). Также, к примеру, смотрите Р.Vannier et A.Laval, Point Vet 1993, 25(151): 53-60; G.Florent et al., Proceedings of the Ninth Congress of Pig Veterinary Society, July 15-18, 1986, Barcelona, Spain. Что касается ДНК-вакцин, можно порекомендовать, к примеру, WO-A-9803658.
Предметом настоящего изобретения, следовательно, является антигенный препарат против синдрома МСИС, включающий по меньшей мере один антиген цирковируса свиней (предпочтительно цирковируса типа II) и по меньшей мере один антиген парвовируса свиней. В соответствии с изобретением, антиген цирковируса свиней (предпочтительно цирковируса типа II) и антиген парвовируса свиней выбирают, независимо друг от друга, из группы, состоящей из ослабленных цельных живых антигенов, инактивированных цельных антигенов, субъединичных антигенов, рекомбинантных живых векторов и ДНК-векторов. Подразумевается, что в эти комбинации согласно изобретению могут входить любые подходящие антигены или разновидности антигенных препаратов, и что вовсе не обязательно применять одинаковые разновидности для данной комбинации. Кроме того, антигенный препарат может содержать, как это обычно бывает, растворитель или наполнитель, приемлемый с ветеринарной точки зрения, а также, но необязательно, адъювант, приемлемый с ветеринарной точки зрения.
Предметом настоящего изобретения также является иммуногенная композиция или вакцина против синдрома МСИС, включающая эффективное количество антигенного препарата против цирковируса и парвовируса, как описано выше, в растворителе или наполнителе, приемлемом с ветеринарной точки зрения, а также, но необязательно, адъювант, приемлемый с ветеринарной точки зрения. Иммуногенная композиция вызывает иммунологическую реакцию, которая может иметь профилактическое действие, хотя и не обязательно. Соответственно, термин "иммуногенная композиция" включает "вакцинные композиции" (поскольку первый термин может означать профилактическую композицию).
Предметом изобретения также является иммунологический набор или набор для вакцинации, содержащий, в отдельных упаковках, антигенный препарат, иммуногенную композицию или вакцину против цирковируса свиней, и антигенный препарат, иммуногенную композицию или вакцину против парвовируса свиней. Этот набор может обладать различными характеристиками, изложенными выше в отношении антигенных препаратов, иммуногенных композиций и вакцин.
Предметом изобретения также является способ иммунизации или вакцинации против синдрома МСИС, включающий введение иммуногенной композиции или вакцины против цирковируса свиней и иммуногенной композиции или вакцины против парвовируса свиней, или введение двухвалентной иммуногенной композиции или вакцины, включающей, в одном и том же составе, антигенные препараты, специфичные для каждого вируса. В этом способе иммунизации или вакцинации применяются те же вакцины, что определены выше.
Предметом изобретения также является применение антигенного препарата или иммуногенной композиции или вакцины против парвовируса, в частности, как определено выше, для получения фармацевтической композиции, предназначенной для применения в плане профилактики синдрома МСИС, в сочетании с антигенным препаратом или иммуногенной композицией или вакциной против цирковируса свиней.
Для приготовления антигенных препаратов цирковирусы можно получить после культивирования в клетках, особенно в клеточных линиях, например, клетках РК/15. Супернатанты или экстракты культуры, необязательно очищенные стандартными методами, могут применяться в качестве антигенного препарата.
В плане ослабленных антигенных препаратов и ослабленных иммуногенных композиций или вакцин, ослабление может проводиться общепринятыми способами, например, культивированием в клетках, предпочтительно в клетках свиней, особенно клеточных линий, таких как РК/15 (например, 50-150 пересевов, предпочтительно порядка 100). Эти иммуногенные композиции и вакцины в общем случае включают растворитель или разбавитель, приемлемый с ветеринарной точки зрения, необязательно адъювант, приемлемый с ветеринарной точки зрения, а также, но необязательно стабилизатор для лиофилизации.
Эти антигенные препараты, иммуногенные композиции и вакцины, предпочтительно должны содержать от 103 до 107 TCID50 данного ослабленного вируса.
Они могут представлять собой антигенные препараты, иммуногенные композиции и вакцины на основе инактивированного цельного антигена. Инактивированные иммуногенные композиции и вакцины, кроме того включают растворитель или разбавитель, приемлемый с ветеринарной точи зрения, а также, но необязательно, адъювант, приемлемый с ветеринарной точи зрения.
Цирковирусы настоящего изобретения, с теми фракциями, которые могут в них присутствовать, инактивируют способами, известными специалистам в этой области. Инактивация предпочтительно проводится химическим путем, например, обработкой антигена химическим средством, таким как формальдегид (формалин), параформальдегид, β-пропиолактон или этиленимин или его производные. Предпочтительным способом инактивации в настоящем изобретении является обработка химическим агентом, в частности, этиленимином или β-пропиолактоном.
Предпочтительно, инактивированные антигенные препараты и инактивированные иммуногенные композиции и вакцины настоящего изобретения также могут содержать адъювант, предпочтительно введенный в виде эмульсии, например, вода-в-масле или масло-в-воде, согласно методам, хорошо известным специалистам в этой области. Адъювантный компонент может также происходить путем инкорпорации общепринятого адъювантного соединения в активный ингредиент.
В числе адъювантов, которые можно использовать, в качестве примера можно упомянуть гидроокись алюминия, сапонины (например, сапонин Quillaja или Quil A; смотри Vaccine Design, The Subunit and Adjuvant Approach, 1995, edited by Michael F. Powel and Mark J. Newman, Plenum Press, New York and London, p.210), Avridine®(Vaccine Design, p.148), DDA (диметилдиоктадециламмоний бромид, Vaccine Design, p.157), полифосфазен (Vaccine Design, p.204), или же эмульсии масло-в-воде на основе минерального масла, сквалена (например, эмульсия SPT, Vaccine Design, p.147), сквалена (например, MF59, Vaccine Design, p.183), или эмульсий вода-в-масле на основе метаболизируемого масла (предпочтительно согласно WO-A-9420071), а также эмульсий, описанных в US-A-5422109. Можно также выбрать комбинации адъювантов, например, Avridine® или DDA в сочетании с эмульсией.
Эти антигенные препараты, иммуногенные композиции и вакцины предпочтительно должны содержать от 105 до 108 ТСID50 данного инактивированного цельного вируса.
Адъюванты для живых вакцин, описанных выше, можно выбрать из числа тех, что приведены для инактивированных вакцин. Предпочтительны эмульсии. К тем, что указаны для инактивированных вакцин, можно добавить те, которые описаны в WO-A-9416681.
Что касается стабилизаторов для лиофилизации, то в качестве примера можно упомянуть SPGA (Bovarnik et al., J Bacteriol 59, 509, 950), такие углеводы, как сорбитол, маннитол, крахмал, сахароза, декстран или глюкоза, такие белки, как альбумин или казеин, производные этих соединений, или буферы типа фосфатов щелочноземельных металлов.
Антигенные препараты, иммуногенные композиции и вакцины согласно изобретению могут содержать один или несколько активных ингредиентов (антигенов) из одного или нескольких цирковирусов и/или парвовирусов настоящего изобретения.
Податели заявки, кроме того, получили геномы 4 изолятов цирковируса свиней типа II, которые обозначены как SEQ ID No. 1-4. Последовательность штамма РК/15 обозначена как SEQ ID No. 5. Разумеется, изобретение автоматически распространяется на эквивалентные последовательности, то есть последовательности, не изменяющие функциональность или штаммоспецифичность описанной последовательности или полипептидов, кодируемых этой последовательностью. Конечно, сюда относятся и последовательности, отличающиеся вследствие вырожденности кода.
Изобретение также распространяется на те эквивалентные последовательности, что способны гибридизироваться с указанной выше последовательностью в условиях высокой строгости или имеют высокую степень гомологии со штаммами изобретения.
Эти последовательности и их фрагменты можно с пользой применять для экспрессии полипептидов in vitro или in vivo с помощью соответствующих векторов.
В частности, в геномных последовательностях цирковирусов типа II были идентифицированы открытые рамки считывания (ORF 1-13), образующие фрагменты ДНК настоящего изобретения, которые можно применять для этой цели. Изобретение охватывает любые полипептиды, содержащие по меньшей мере одну из этих открытых рамок считывания (соответствующие аминокислотные последовательности). Предпочтительно, изобретение охватывает белки, в основном состоящие из ORF4, ORF7, ORF10 или ORF13.
Для экспрессии субъединиц in vitro в качестве средства экспрессии предпочтительно применяются Е.coli или бакуловирусы (US-A-4745051). Кодирующие последовательности или их фрагменты можно интегрировать в геном бакуловируса (например, бакуловируса Autographa californica, иначе Nuclear polyhedrosis virus, или AcNPV) и размножить этот бакуловирус в клетках насекомых, к примеру, Spodoptera frugiperda Sf9 (депозит CRL 1711 в АТТС). Субъединицы также можно продуцировать в таких эукариотических клетках, как дрожжи (например, Saccharomyces cerevisae), или клетках млекопитающих (например, СНО, ВНК).
Предметом изобретения также является применение в качестве субъединиц тех полипептидов, что продуцируются in vitro с помощью этих средств экспрессии, а затем, но необязательно, очищенных общепринятыми методами. Субъединичные иммуногенные композиции и вакцины содержат по меньшей мере один полипептид, полученный таким способом, или фрагмент, в растворителе или разбавителе, приемлемом с ветеринарной точки зрения, а также, но необязательно, адъювант, приемлемый с ветеринарной точки зрения.
Для экспрессии in vivo в целях получения иммуногенных композиций и вакцин, рекомбинантных живых или на основе ДНК, кодирующие последовательности или их фрагменты вставляют в соответствующий экспрессионный вектор в условиях, позволяющих экспрессию полипептида. В качестве живых векторов можно предпочтительно использовать живые вирусы, предпочтительно способные размножаться в свиньях, непатогенные для свиней (природно непатогенные или сделанные такими), согласно методам, хорошо известным специалистам в этой области. В частности, можно использовать герпесвирусы свиней типа вируса болезни Aujeszky, аденовирусы свиней, поксвирусы, особенно вирус коровьей оспы, вирусы оспы птиц, вирус оспы канареек, вирус оспы свиней. Также можно использовать в качестве векторов ДНК-векторы (WO-А-9011092, WO-A-9319813, WO-A-9421797, WO-A-9520660).
Предметом изобретения, следовательно, также являются векторы и иммуногенные композиции или вакцины, рекомбинантные живые или на основе ДНК (полинуклеотида), полученные таким способом, их получение и их применение, а также иммуногенные композиции и вакцины, дополнительно включающие растворитель или разбавитель, приемлемый с ветеринарной точки зрения.
По определению, иммуногенная композиция или вакцина на основе ДНК включает ДНК-вектор, являющийся кольцевой вакцинной плазмидой, суперскрученной или нет, или линейной молекулой ДНК, несущей и экспрессирующей in vivo нуклеотидную последовательность, кодирующую антигенный полипептид.
Иммуногенные композиции и вакцины, рекомбинантные и на основе ДНК, могут содержать адъювант.
В плане программ комбинированной иммунизации или вакцинации можно также комбинировать иммунизацию или вакцинацию против цирковируса свиней и парвовируса свиней с иммунизацией или вакцинацией против других патогенов свиней, в частности тех, что могут быть связаны с синдромом МСИС. Иммуногенная композиция или вакцина, согласно изобретению, следовательно, может содержать другую валентность, соответствующую другому патогену свиней, в число которых входят PRRS (репродуктивный и респираторный синдром свиней), и/или Мусорlasma hyopneumoniae, E.coli, и/или атрофический ринит, и/или вирус псевдобешенства (болезнь Aujeszky), и/или свиной грипп, и/или Actinobacillus pleuropneumoniae, и/или холера свиней и их комбинации. Предпочтительно, в программах иммунизации или вакцинации и в вакцинах согласно изобретению комбинируют иммунизацию или вакцинацию против цирковируса и парвовируса, а также против PRRS (WO-A-93/07898, WO-A-94/18311, FR-A-2709966; С. Charreyre et al., Proceedings of the 15th IPVS Congress, Birmingam, England, 5-9 July 1998, p.139) и/или Mycoplasma hyopneumoniae (EP-A-597852, EP-A-550477, EP-A-571648; О.Martion et al., p.157, 284, 285 и G.Reynaud et al., p.150 в указанных выше Proceedings of the 15th IPVS Congress) и/или гриппа свиней. Таким образом, можно использовать любые подходящие виды иммуногенных композиций или вакцин, в частности, любые коммерческие вакцины, комбинируя их с иммуногенной композицией или вакциной против цирковируса свиней и парвовируса свиней, описанной в настоящем изобретении.
Предметом настоящего изобретения, следовательно, также являются мультивалентные иммуногенные композиции и вакцины, мультивакцинные наборы, и способы комбинированной иммунизации или вакцинации, дающие возможность применять такие программы комбинированной иммунизации или вакцинации.
Далее изобретение и его воплощения будут раскрыты в неограничивающих примерах, со ссылками на соответствующие чертежи.
ПЕРЕЧЕНЬ ФИГУР
Фигура 1. Последовательность геномной ДНК штамма Imp.1011-48121.
Фигура 2. Последовательность геномной ДНК штамма Imp.1011-48285.
Фигура 3. Последовательность геномной ДНК штамма Imp.999.
Фигура 4. Последовательность геномной ДНК штамма Imp.1010.
Фигура 5. Сопоставление 4 последовательностей, соответствующих Фигурам 1-4, с последовательностью штамма РК/15 PCV.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID No. 1. Последовательность геномной ДНК штамма Imp.1011-48121.
SEQ ID No. 2. Последовательность геномной ДНК штамма Imp.1011-48285.
SEQ ID No. 3. Последовательность геномной ДНК штамма Imp.999.
SEQ ID No. 4. Последовательность геномной ДНК штамма Imp.1010.
SEQ ID No. 5. Последовательность геномной ДНК штамма РК/15.
ПРИМЕРЫ
Пример 1. Культурирование и выделение штаммов цирковируса свиней
Образцы тканей из легких и лимфатических узлов поросят собирали во Франции, Канаде и США. Эти поросята проявляли клинические симптомы, типичные для многосистемного синдрома истощения после отлучения. Для облегчения выделения вируса образцы тканей замораживали при -70°С сразу после аутопсии.
Для выделения вируса готовили суспензии, содержащие примерно 15% образца ткани, в минимальной среде, содержащей соли Эрла (ЕМЕМ, BioWhittaker UK Ltd., Wokingham, UK), пенициллин (100 Ед/мл) и стрептомицин (100 мкг/мл) (среда МЕМ-SA), путем растирания ткани стерильным песком с помощью стерильной ступки с пестиком. Этот протертый препарат затем суспендировали в MEM-SA, а затем центрифугировали 30 минут при 3000×g при +4°С и собирали супернатант.
Перед инокуляцией клеточных культур добавляли 100 мкл хлороформа к 2 мл каждого супернатанта и перемешивали непрерывно 10 минут при комнатной температуре. Эту смесь затем переносили в микроцентрифужную пробирку, центрифугировали 10 минут при 3000×g и собирали супернатант. Затем этот супернатант использовали в качестве инокулума в опытах по выделению вируса.
Во всех опытах по выделению вируса использовали культуры клеток РК/15, которые, как известно, не заражены цирковирусом свиней (PCV), пестивирусами, аденовирусами свиней и парвовирусами свиней (Allan G. et al., Pathogenesis of porcine circovirus experimental infections of colostrums-deprived piglets and examination of pig foetal material. Vet. Microbiol. 1995, 44: 49-64).
Выделение цирковирусов свиней проводили по следующей методике.
Монослои клеток РК/15 диссоциировали трипсинизацией (с помощью смеси трипсин-версен, версен = ЭДТА) конфлуэнтных культур и суспендировали в среде MEM-SA, содержащей 15% эмбриональной телячьей сыворотки, не зараженной пестивирусом (= среда MEM-G), до конечной концентрации примерно 400000 клеток/мл. Порции по 10 мл этой клеточной суспензии смешивали с 2 мл различных инокулумов, описанных выше, затем эти смеси разделяли по 6 мл в две колбы Falcon на 25 см2. Эти культуры инкубировали при 37°С в течение 18 часов в атмосфере, содержащей 10% СO2.
После инкубации культуральную среду полуконфлуэнтных монослоев обрабатывали 300 мМ D-глюкозамина (Сat. # G48175, Sigma-Aldrich Company Limited, Poole, UK) (Tischr I. et al., Arch. Virol., 1987, 96: 39-57) и продолжали инкубацию еще 48-72 часа при 37°С. После этой последней инкубации одну из двух колб Falcon каждого инокулума подвергали 3 циклам замораживания/оттаивания подряд. Клетки РК/15 в оставшейся колбе Falcon обрабатывали раствором трипсин-версена, ресуспендировали в 20 мл среды MEM-G и инокулировали в колбы Falcon на 75 см2 при концентрации 400000 клеток/мл, свежеинокулированные колбы сразу же "суперинфицировали" добавлением 5 мл соответствующего лизата, полученного после замораживания-оттаивания.
Пример 2. Подготовка образцов клеточной культуры для обнаружения цирковирусов свиней по иммунофлуоресценции и гибридизации in situ
Отбирали 5 мл "суперинфицированной" культуры и инокулировали в чашку Петри диаметром 55 мм, содержащую стерильное и обезжиренное покровное стекло. Культуры в колбах и на покровных стеклах инкубировали при 37° С и обрабатывали глюкозамином, как описано в Примере 1. Культуры на покровных стеклах вынимали через 24-48 часов после обработки глюкозамином и фиксировали либо ацетоном в течение 10 минут при комнатной температуре, либо 10% формальдегидом в буфере в течение 4 часов. После фиксации все покровные стекла хранили при -70°С на силикагеле до употребления в опытах по гибридизации in situ и иммуноцитохимии с меткой.
Пример 3. Обнаружение последовательностей PCV методом гибридизации in situ
Гибридизацию in situ проводили в фиксированных формальдегидом образцах тканей больных свиней, а также в препаратах клеточных культур, инокулированных для выделения вируса (см. Пример 2) и фиксированных на покровных стеклах.
Использовали полные геномные зонды, соответствующие цирковирусу свиней (PCV) PK/15 и вирусу инфекционной анемии цыплят (CAV). В качестве специфического источника ДНК вируса PCV использовали плазмиду pPCV1, содержащую репликативную форму генома PCV, клонированную в виде одной вставки в 1,7 тысяч пар оснований (т.п.о., или кБ) (Meehan В. et al. Sequence of porcine circovirus DNA: affinities with plant circoviruses, J.Gen. Virol. 1997, 78: 221-227). Аналогичную плазмиду pCAA1, содержащую репликативную форму цирковируса птиц CAV в 2,3 кБ, использовали в качестве отрицательного контроля. Соответствующие концентраты обоих плазмид в глицерине использовали для получения и очистки плазмид методом щелочного лизиса (Sambrook J. et al. Molecular Cloning: A Laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory, Cold Spring Harbor, New York, 1989), которые затем применяли в качестве матриц для приготовления зондов. Цирковирусные зонды, представляющие полные геномы PCV и CAV, получали из очищенных плазмид, описанных выше (по 1 мкг для каждого зонда), и гексануклеотидных случайных праймеров с помощью коммерческого набора для нерадиоактивного мечения ("DIG DNA labelling kit", Boehringer Mannheim, Lewes, UK) согласно рекомендациям поставщика.
Меченные дигоксигенином зонды суспендировали в 50-100 мкл стерильной воды перед употреблением для гибридизации in situ.
Образцы тканей больных свиней, залитые в парафин и фиксированные формальдегидом, а также препараты инфицированных клеточных культур, фиксированные формальдегидом, подготавливали для обнаружения нуклеиновых кислот PCV следующим образом.
Срезы толщиной 5 мкм нарезали из залитых парафином образцов тканей, удаляли парафин, а затем регидратировали в растворах спирта с последовательно снижающейся концентрацией. Тканевые срезы и клеточные культуры, фиксированные формальдегидом, инкубировали по 15 и по 5 минут, соответственно, при 37°С в 0,5% растворе протеиназы К в 0,05 М трис-НСl буфере, содержащем 5 мМ ЭДТА (рН 7,6). Затем препараты помещали в 1% раствор глицина в автоклавированной дистиллированной воде на 30 секунд, промывали дважды 0,01 М буфером PBS (фосфатный буфер в физрастворе) (рН 7,2), наконец, промывали в течение 5 минут в стерильной дистиллированной воде. Наконец, их высушивали на открытом воздухе и покрывали растворами зондов.
Каждый препарат ткани/зонда накрывали чистым и обезжиренным покровным стеклом и помещали на 10 минут в печь при 90°С, а затем помещали на кусок льда на 1 минуту, и наконец инкубировали 18 часов при 37°С. Препараты затем окунали в 2Х солевой буферный раствор цитрата натрия (SSC) (рН 7,0) для того, чтобы снять защитные покровные стекла, затем промывали дважды по 5 минут 2Х буфером SSC и наконец промывали дважды по 5 минут буфером PBS.
После этих промывок препараты погружали в раствор 0,1 М малеиновой кислоты, 0,15 М NaCl (рН 7,5) (малеиновый буфер) на 10 минут, а затем инкубировали в 1% растворе блокирующего реактива (Cat. # 1096176, Boehringer Mannheim UK, Lewis, East Sussex, UK) в малеиновом буфере 20 минут при 37°С.
Затем препараты инкубировали с моноклональным антителом против дигоксигенина (Boehringer Mannheim), разведенным 1:250 в блокирующем буфере, в течение 1 часа при 37°С, промывали PBS, а затем инкубировали с биотинилированным антителом против мышиного иммуноглобулина 10 минут при 37°С. Препараты промывали PBS и блокировали эндогенную пероксидазную активность обработкой 0,5% раствором перекиси водорода в PBS в течение 20 минут при комнатной температуре. Препараты опять промывали PBS и обрабатывали субстратом, 3-амино-9-диэтилкарбазолом (АВС) (Cambridge Bioscience, Cambridge, UK), который готовили непосредственно перед употреблением.
После последней промывки водопроводной водой препараты окрашивали гематоксилином, отмывали водопроводной водой и фиксировали на покровных стеклах для микроскопии с помощью фиксирующего раствора (GVA Mount, Cambridge Bioscience, Cambridge, UK). Экспериментальные контроли заключались в применении неродственного отрицательного зонда (CAV) и положительного зонда (PCV) для образцов, полученных из больных свиней и не болевших свиней.
Пример 4. Обнаружение PCV с помощью иммунофлуоресценции
Начальное скринирование всех препаратов клеточных культур, фиксированных ацетоном, проводили методом непрямой иммунофлуоресценции (НИФ), используя разведение 1:100 смешанной сыворотки взрослых свиней. Эта смешанная сыворотка содержит сыворотки 25 взрослых свиноматок из Северной Ирландии и, как известно, содержит антитела против целого ряда вирусов свиней, включая PCV: парвовируса свиней, аденовируса свиней и вируса PRRS. НИФ проводили, покрывая сывороткой (разведенной PBS) клеточные культуры в течение 1 часа при 37С, а затем промывали дважды PBS. После этого клеточные культуры окрашивали разведенным 1:80 в PBS кроличьим антителом против иммуноглобулина свиней, конъюгированного с флуоресцеин изотиоцианатом, в течение 1 часа, а затем промывали PBS и фиксировали в глицериновом буфере для микроскопии в ультрафиолетовом свете.
Пример 5. Результаты гибридизации in situ в тканях больных свиней
Гибридизация in situ с помощью геномного зонда PCV на препаратах тканей поросят с многосистемным истощением из Франции, Канады и Калифорнии, фиксированных формальдегидом, выявила присутствие нуклеиновых кислот PCV в поврежденных тканях в ряде исследованных тканей. Сигнала не наблюдалось, когда геномный зонд PCV применяли на тканях не болевших свиней, или когда применяли зонд CAV на тканях больных свиней. Присутствие нуклеиновых кислот PCV отмечалось в цитоплазме и ядрах многочисленных одноядерных клеток, инфильтрирующих поврежденные ткани легких у калифорнийских поросят. Присутствие нуклеиновых кислот PCV было также установлено в пневмоцитах, эпителиальных клетках бронхов и бронхиол, и в эндотелиальных клетках артериол, венул и лимфатических сосудов.
У больных французских свиней присутствие нуклеиновых кислот PCV обнаружено в цитоплазме многочисленных фолликулярных лимфоцитов и одноядерных клеток внутри синусов лимфатических узлов. Нуклеиновые кислоты PCV также обнаруживались в некоторых синцитиях. На основе этих результатов были взяты образцы легких у калифорнийских свиней, брыжеечных лимфатических узлов у французских свиней и органов канадских свиней в целях выделения новых штаммов цирковируса свиней.
Пример 6. Результаты клеточной культуры новых штаммов цирковируса свиней и обнаружение по иммунофлуоресценции
Не наблюдалось никаких цитопатических эффектов в клеточных культурах, инокулированных образцами, взятыми у французских поросят (штамм Imp. 1008), калифорнийских поросят (штамм Imp. 999) и канадских поросят (штамм Imp.1010), проявлявших клинические симптомы многосистемного синдрома истощения. Однако иммуномечение препаратов, полученных из инокулированных клеточных культур, фиксированных ацетоном и обработанных смешанной поликлональной сывороткой свиней, показало флуоресценцию в ядрах многочисленных клеток из культур, инокулированных образцами легких калифорнийских поросят (штамм Imp. 999), брыжеечных лимфатических узлов французских поросят (штамм Imp. 1008) и органов канадских поросят (штамм Imp. 1010).
Пример 7. Экстракция геномной ДНК цирковирусов свиней
Репликативные формы новых штаммов цирковируса свиней (PCV) получали из инфицированных культур клеток РК/15 (см. Пример 1) (10 колб Falcon на 75 см2), которые собирали после 72-76 часов инкубации и обрабатывали глюкозамином, как описано для клонирования репликативной формы CAV (Todd D. et al. Dot blot hybridization assay for chicken anaemia agent using a cloned DNA probe, J.Clin. Microbiol. 1991, 29: 933-939). Двунитевую ДНК этих репликативных форм экстрагировали модифицированным методом Хирта (Hirt, В. Selective extraction of polyoma virus DNA from infected cell cultures, J.Mol. Biol. 1967, 36: 365-369), как описано y Molitor (Molitor T.W. et al. Porcine parvovirus DNA: characterization of the genomic and replicative form DNA of two virus isolates. Virology, 1984, 137: 241-254.
Пример 8. Рестрикционная карта репликативной формы генома штамма Imp. 999 цирковируса свиней
ДНК (1-5 мкг), экстрагированную методом Хирта, обрабатывали нуклеазой S1 (Amersham) согласно рекомендациям поставщика, после чего расщепляли различными рестрикционными ферментами (Boehringer Mannheim, Lewis, East Sussex, UK) и продукты рестрикции разделяли методом электрофореза в 1,5% агарозном геле в присутствии этидийбромида, как описано у Todd et al. (Purification and biochemical characterization of chicken anemia agent. J.Gen. Virol. 1990, 71: 819-823). ДНК, экстрагированная из культур штамма Imp. 999, обладает уникальным сайтом EcoRI, двумя сайтами SacI и не обладает сайтом PstI. Тем самым этот рестрикционный профиль отличается от рестрикционного профиля PCV штамма РК/15 (Meehan В. et al. Sequence of porcine circovirus DNA; affinities with plant circoviruses, 1997, 78: 221-227), который, наоборот, обладает сайтом PstI и не обладает сайтом EcoRI.
Пример 9. Клонирование генома цирковируса свиней штамма Imp. 999
Рестрикционный фрагмент размером около 1,8 кБ, полученный при расщеплении двунитевой репликативной формы PCV штамма Imp. 999 рестрикционным ферментом EcoRI, выделяли после электрофореза в 1,5% агарозном геле (см. Пример 3) с помощью коммерческого набора фирмы Qiagen (QUIAEXII Gel Extraction Kit, Cat. # 20021, QIAGEN Ltd., Crawley, West Sussex, UK). Затем этот рестрикционный фрагмент EcoRI-EcoRI лигировали с вектором pGEM-7 (Promega, Medical Supply Company, Dublin, Ireland), который предварительно расщепляли тем же рестрикционным ферментом (EcoRI) и дефосфорилировали, согласно стандартным методам клонирования (Sambrook J. et al. Molecular Cloning: A Laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory, Cold Spring Harbor, New York, 1989). Полученные плазмиды вводили в штамм хозяина Escherichia coli JM109 (Stratagen, La Jolla, USA) путем трансформации стандартными методами. Рестрикционный фрагмент EcoRI-EcoRI штамма Imp. 999 также клонировали в сайт EcoRI вектора pBlueScript SK+ (Stratagen Inc., La Jolla, USA). Из клонов, полученных в каждом штамме хозяина, отбирали не менее 2 клонов, содержащих фрагменты ожидаемого размера. Полученные клоны затем культурировали и выделяли плазмиды, содержащие полный геном штамма Imp. 999, в небольшом объеме (2 мл) или в большом объеме (250 мл) стандартными методами получения и очистки плазмид.
Пример 10. Секвенирование геномной ДНК (двунитевой репликативной формы) PCV штамма Imp. 999
Нуклеотидную последовательность двух EcoRI-клонов Imp. 999 (клоны pGEM-7/2 и pGEM-7/8) определяли дидезоксинуклеотидным методом Сангера с помощью набора для секвенирования "AmpliTaq DNA polymerase FS" (Cat. # 402079 РЕ Applied Biosystems, Warrington, UK) и автоматического секвенатора АВ1373А фирмы Applied Biosystems согласно рекомендациям поставщика. Начальные реакции секвенирования проводили с помощью "прямого" и "обратного" универсальных праймеров М13. Последующие реакции секвенирования проводили методом "продвижения по ДНК". Олигонуклеотиды для этих последующих реакций секвенирования были синтезированы фирмой Life Technologies (Inchinnan Business Park, Paisley, UK).
Полученные последовательности собирали вместе и анализировали с помощью программы MacDNASIS версии 3.2 (Cat. # 22020101, Appligene, Durham, UK). Различные открытые рамки считывания анализировали с помощью алгоритма BLAST через сервер Национального Центра Биотехнологической Информации (NCBI, Bethesda, MD, USA).
Полная последовательность (фрагмент EcoRI-EcoRI) представлена в SEQ ID No. 3 (Фигура 3). Она представляет общую последовательность этого штамма, за начало которой было принято начало сайта EcoRI, то есть G в качестве первого нуклеотида.
Такая же процедура проводилась для получения последовательностей других 3 изолятов настоящего изобретения (см. SEQ ID No. 1, 2 и 4 и Фигуры 1, 2 и 4).
Размеры генома этих 4 штаммов составляют:
Imp. 1011-48121 1767 нуклеотидов
Imp. 1011-48285 1767 нуклеотидов
Imp. 999 1768 нуклеотидов
Imp. 1010 1768 нуклеотидов
Пример 11. Анализ последовательности PCV штамма Imp. 999
Когда последовательность штамма Imp. 999 проверили на гомологию к последовательностям, содержащимся в базе данных GenBank, была обнаружена только одна существенная гомология примерно в 76% (на уровне нуклеиновой кислоты) к последовательности штамма РК/15 (инвентарные номера Y09921 и U49186) (см. Фигуру 5).
На аминокислотном уровне проверка на гомологию продуктов трансляции в 6 фазах в базах данных (алгоритм BLAST X на сервере NABI) выявила гомологию в 94% к открытой рамке считывания, которая теоретически соответствует репликазе вируса BBTV, близкого цирковирусам растений (идентификационный номер 1841515 в GenBank), и кодируется последовательностью U49186 в базе данных GenBank.
Никакие другие последовательности, содержащиеся в базах данных, не проявляли существенной гомологии к последовательности, полученной из PCV штамма Imp. 999.
Анализ последовательностей, полученных из культур штамма Imp. 999, происходящих из поврежденных тканей калифорнийских поросят с клиническими симптомами многосистемного синдрома истощения, четко показывает, что этот изолят вируса является новым штаммом цирковируса свиней.
Пример 12. Сравнительный анализ последовательностей
Проводили сопоставление нуклеотидных последовательностей 4 новых штаммов PCV с последовательностью PCV РК/15 штамма (Фигура 5). Была составлена матрица гомологии между 4 новыми штаммами и штаммом РК/15 со следующими результатами:
1=Imp. 1011-48121
2=Imp. 1011-48285
3=Imp. 999
4=Imp. 1010
5=РК/15 (см. табл.1).

Гомология между двумя французскими штаммами Imp. 1011-48121 и Imp. 1011-48285 составляет более 99% (0,9977).
Гомология между двумя североамериканскими штаммами Imp. 999 и Imp. 1010 также составляет более 99% (0,9949). Гомология между французскими штаммами и североамериканскими штаммами слегка превышает 96%.
Гомология между всеми этими штаммами и РК/15 попадает между 75 и 76%.
Отсюда можно заключить, что штаммы настоящего изобретения представляют собой новый тип цирковируса свиней, отличный от типа, представленного штаммом РК/15. Этот новый тип, выделенный из свиней, проявляющих синдром МСИС, назван типом II цирковируса свиней, тогда как РК/15 представляет тип I. Штаммы, принадлежащие к типу II, проявляют заметную гомогенность по нуклеотидной последовательности, несмотря на то, что они выделены из регионов, географически сильно удаленных друг от друга.
Пример 13. Анализ белков, кодируемых геномом новых штаммов PCV
Нуклеотидная последовательность изолята Imp. 1010 была признана репрезентативной для остальных штаммов цирковируса, имеющих отношение к многосистемному синдрому истощения. Эту последовательность подробно анализировали с помощью алгоритма BLASTX (Altschul et al., J. Mol. Biol. 1990, 215: 403-410) и комбинации программ из набора MacVector 6.0 (Oxford Molecular Group, Oxford ОХ4 4GA, UK). В этой последовательности (кольцевом геноме) оказалось 13 открытых рамок считывания (ORF) размером более, чем 20 аминокислот. Эти 13 ORF приводятся в табл.2.

Положения начала и конца каждого ORF относятся к последовательности, представленной на Фигуре 4 (SEQ ID No. 4), из генома штамма 1010. Границы ORF 1-13 идентичны и для штамма 999. Они также идентичны для штаммов 1011-48121 и 1011-48285, за исключением ORF 3 и 13:
ORF3 1432-1539, смысловая, 108 нуклеотидов, 35 аминокислот
ORF13 314-1377, антисмысловая, 705 нуклеотидов, 35 аминокислот.
Четыре из этих 13 ORF имеют значительную гомологию с аналогичными ORF в геноме клонированного вируса PCV РК/15. Проанализировали каждую из открытых рамок считывания, присутствующих в геноме всех изолятов цирковируса, имеющих отношение к многосистемному синдрому истощения. Эти 4 ORF приводятся в табл.3.

Положения начала и конца каждого ORF относятся к последовательности, представленной на Фигуре 4 (SEQ ID No. 4). Размер ORF (в нуклеотидах) включает стоп-кодон.
Сравнение организации генома изолятов PCV Imp. 1010 и РК/15 позволило выявить 4 консервативные ORF в геноме этих двух вирусов. В табл.4 представлены их степени гомологии:

Наибольшая идентичность наблюдается между последовательностями ORF4 Imp. 1010 и ORF1 PK/15 (гомология 86%). Это и ожидалось, так как этот белок, вероятно, участвует в репликации вирусной ДНК и абсолютно необходим для размножения вируса (Meehan et al., J.Gen. Virol. 1997, 78: 221-227; Mankertz et al., J. Gen. Virol. 1998, 79: 381-384).
Идентичность последовательности между ORF13 Imp. 1010 и ORF2 PK/15 менее сильная (гомология 66,4%), однако каждая из них проявляет сильно консервативный N-концевой основный участок, идентичный N-концевому участку основного структурного белка цирковируса птиц CAV (Meehan et al., Arch. Virol. 1992, 124: 301-319). Кроме того, наблюдаются большие отличия между ORF7 Imp. 1010 и ORF3 PK/15 и между ORF10 Imp. 1010 ORF4 PK/15. В каждом случае имеется делеция С-концевого участка в ORF7 и ORF10 изолята Imp. 1010 при сравнении с ORF3 и ORF4 PCV штамма PK/15. Наибольшая гомология последовательности наблюдается на уровне N-концевых участков ORF7/ORF3 (гомология 61,5% в перекрывающемся участке) и ORF10/ORF4 (гомология 85% в перекрывающемся участке).
По-видимому, геном цирковируса свиней имеет весьма сложную организацию вследствие его чрезвычайной компактности. Основной структурный белок, вероятно, образуется посредством сплайсинга в нескольких рамках считывания, расположенных на одной и той же нити генома цирковируса свиней. Следовательно, можно полагать, что любая из открытых рамок считывания (от ORF1 до ORF13), описанных в таблице выше, может представлять собой весь или часть антигенного белка, кодируемого цирковирусом свиней типа II, и поэтому может служить в качестве антигена для специфического диагноза и/или вакцинации. Изобретение поэтому касается любого из белков, состоящих в основном из ORF4, ORF7, ORF10 или ORF13.
Пример 14. Инфекционная природа генома PCV, клонированного из новых штаммов
Плазмиду pGEM-7/8, содержащую полный геном (репликативную форму) изолята Imp. 999, вводили в клетки РК/15 путем трансфекции по методу, описанному Meehan В. et al. (characterization of viral DNAs from cells infected with chicken anemia agent: sequence analysis of the cloned replicative form and transfection capabilities of cloned genome fragments. Arch. Virol. 1992, 124: 301-319). Иммунофлуоресцентный анализ (см. Пример 4) первого пересева после трансфекции незараженных клеток РК/15 показал, что плазмида pGEM-7/8 способна индуцировать образование инфекционного вируса PCV. Наличие клона, содержащего инфекционный генетический материал PCV, позволяет проводить любые полезные изменения в геноме вируса с целью получения модифицированных вирусов PCV (либо ослабленных в свиньях, либо дефектных), которые можно использовать для продукции ослабленных или рекомбинантных вакцин, или для продукции антигена для диагностических наборов.
Пример 15. Продукция антигенов PCV в культуре in vitro
Культивирование незараженных клеток РК/15 и размножение вируса проводили теми же методами, что в Примере 1. Инфицированные клетки собирали после трипсинизации после 4 дней инкубации при 37°С и подсчитывали. При следующем пересеве их инокулировали из расчета 400000 инфицированных клеток на 1 мл.
Пример 16. Инактивация вирусных антигенов
По окончании культивирования вируса собирали инфицированные клетки и лизировали с помощью ультразвука (Branson Sonifier) или с помощью измельчителя типа ротор-статор (UltraTurrax, IKA). Эту суспензию затем центрифугировали 30 минут при 3700×g. Вирусную суспензию инактивировали 0,1% этиленимином в течение 18 часов при 37°С или 0,5% β-пропиолактоном в течение 24 часов при 28°С. Если титр вируса перед инактивацией недостаточен, вирусную суспензию концентрировали ультрафильтрацией с помощью мембраны, имеющей предел исключения 300 кД (Millipore PTMK300). Суспензию инактивированного вируса хранили при +5°С.
Пример 17. Приготовление вакцины в виде эмульсии на основе минерального масла
Вакцину готовили согласно следующей формуле:
- суспензия инактивированного цирковируса свиней 250 мл
- Montanide® ISA 70 (SEPPIC) 750 мл
Водную фазу и масляную фазу по отдельности стерилизовали фильтрованием. Эмульсию получали путем смешивания и гомогенизации ингредиентов с помощью турбинного эмульгатора Silverson.
Одна доза вакцины содержит около 107,5 ТСID50. Объем одной дозы вакцины составляет 0,5 мл для внутрикожного введения и 2 мл для внутримышечного введения.
Эта вакцина применяется в программе вакцинации против многосистемного синдрома истощения в сочетании с вакциной Parvovax®.
Пример 18. Приготовление вакцины в виде эмульсии на основе метаболизируемого масла
Вакцину готовили согласно следующей формуле:
- суспензия инактивированного цирковируса свиней 200 мл
- Dehymuls HRE 7 (Henkel) 60 мл
- Radia 7204 (Oleofina) 740 мл
Водную фазу и масляную фазу по отдельности стерилизовали фильтрованием.
Эмульсию получали путем смешивания и гомогенизации ингредиентов с помощью турбинного эмульгатора Silverson.
Одна доза вакцины содержит около 107, 5 ТСID50. Объем одной дозы вакцины составляет 2 мл для внутримышечного введения.
Эта вакцина применяется в программе вакцинации против многосистемного синдрома истощения в сочетании с вакциной Parvovax®.
Пример 19. Результаты непрямой иммунофлуоресценции в отношении штаммов вируса PCV из США и Франции и загрязнения в РК/15 с помощью гипериммунной сыворотки (PCV-T) и серии моноклональных антител F99, полученных из РК/15, и гипериммунной сыворотки, полученной из канадского штамма (PCV-C) (табл.5).

Пример 20. Экспериментальная выработка многосистемного синдрома истощения свиней - Протокол 1
Трехдневных гнотобиотических поросят, полученных кесаревым сечением и содержащихся в изоляторе, инокулировали раствором вируса PCV. Применялись вирусы PCV типа II, а именно - изолят Imp. 1010 и вирус, полученный из гомогенатов лимфатических узлов больных свиней.
Было образовано 5 групп. Всех поросят инокулировали в возрасте 3 дней, вводя ороназально 1,5 мл вирусного раствора согласно табл.6.

Результаты экспериментальной обработки
За время 5-недельного наблюдения у поросят не появилось клинических симптомов, кроме одного в группе В, проявлявшего существенное истощение. При аутопсии поросята в группах А, В и С проявляли гиперплазию лимфатических узлов (их размеры в 2-10 раз больше, чем у животных в группах D и Е), в частности, подчелюстных, бронхиальных, брыжеечных, подвздошных и бедренных узлов. Эта гиперплазия сопровождалась значительной экспансией корковых зон за счет инфильтрации моноцитов и макрофагов. Поросята в группах А, В и С также проявляли гиперплазию бронхиальной лимфоидной ткани.
В каждой из групп А, В и С было по одному поросенку с пневмонией.
У поросенка в группе В, проявлявшего существенное истощение, и у одного поросенка в группе А была язва желудка. Кроме того, у всех животных в группах А, В и С был миозит в мышечной стенке желудка и кишечника.
У большинства животных в группах А, В и С был миокардит, многоочаговый гепатит с инфильтрацией лимфоцитов, макрофагов и эозинофилов, а также интерстициальный нефрит коркового и мозгового слоя почек.
У одного поросенка в группе С была увеличена печень, имевшая рассеянные светлые очаги на поверхности.
Не наблюдалось никаких повреждений у поросят в группах D и Е.
Цирковирус выделяли из органов поросят в группах А, В и С.
Пример 21. Экспериментальное воспроизведение многосистемного синдрома истощения свиней - Протоколы 2 и 3
Обычных поросят, лишь изолированных от своих матерей с момента рождения, инокулировали вирусными растворами PCV типа II, парвовируса свиней или смесью из обоих вирусов.
В качестве вирусов PCV типа II использовали изоляты Imp. 1010 и Imp. 1011 (штамм 48121). В качестве вируса PPV использовали изолят канадского происхождения Imp. 1005. Последовательность этого вируса (секвенировано 1/3 генома) идентична последовательности других известных штаммов парвовируса свиней (штаммов NADL-2 и Kresse).
Применяли два экспериментальных протокола.
Протокол 2
Было образовано 3 группы из 3-дневных поросят. Всех поросят инокулировали, вводя ороназально 1 мл вирусного раствора согласно табл.7.

Результаты экспериментальной обработки
Группа А. 2 поросенка умерли через 21 день после инокуляции и 1 поросенок был забит гуманным образом через 24 дня после инокуляции.
Группа В. 1 поросенок умер через 23 дня после инокуляции и 1 поросенок был забит гуманным образом через 24 дня после инокуляции.
Аутопсия поросят, умерших после заражения, показала наличие существенных макроскопических повреждений: наличие жидкости в плевральной полости, легочная эдема, кровоизлияния в почках, беловатые повреждения в виде булавочной головки в почках, некроз печени. Эти повреждения идентичны тем, что наблюдаются при полевых случаях.
Аутопсия забитых поросят не показала наличия макроскопических повреждений.
Гистологическое исследование органов, взятых у поросят из групп А и В, умерших после заражения, а также забитых поросят из этих 2 групп, показало полную картину повреждений, типичную для многосистемного синдрома истощения свиней, которая наблюдается у животных в полевых условиях: некроз печени, некроз лимфатических узлов, очаговый некроз и сильные кровоизлияния в почках, наличие синцитиев в легких, сильный некроз гепатоцитов с ядерными включениями.
Следует отметить, что во всех этих повреждениях (умерших или забитых поросят) наблюдалось массивное количество антигена PCV, тогда как антиген PPV не был обнаружен в тех же повреждениях.
Не обнаружено никаких повреждений у контрольных поросят в группе С.
Протокол 3
Было образовано 4 группы из 4-недельных поросят. Всех поросят инокулировали, вводя ороназально 1 мл вирусного раствора согласно табл.8.
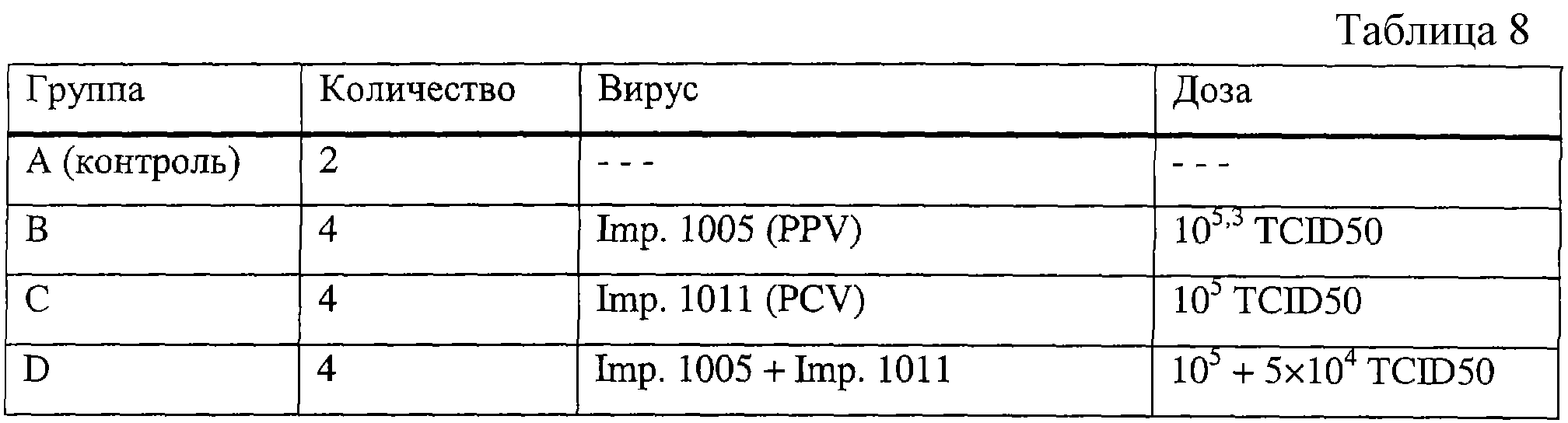
Результаты экспериментальной обработки
Одного контрольного поросенка и по 2 поросенка в каждой экспериментальной группе (В, С и D) забивали гуманным способом и подвергали аутопсии через 2 недели после инокуляции. Наблюдались значительные иммуногистологические повреждения у двух поросят в группе D (совместное заражение PCV + PPV). Следует отметить, что в этих повреждениях не обнаруживалось присутствие парвовируса свиней, хотя и наблюдалась сероконверсия к парвовирусу свиней у всех поросят в группе D.
Не наблюдалось никаких макроскопических или гистологических повреждений у контрольного поросенка и у поросят в остальных группах.
Следовательно, кажется вероятным, что комбинация PCV + PPV дает возможность воспроизводить гистологические повреждения, типичные для многосистемного синдрома истощения свиней. При этих двух экспериментальных протоколах отмечается, что инокуляция одним PCV, также как смесью PCV + PPV, ведет к более или менее полному воспроизведению многосистемного синдрома истощения свиней, однако в поврежденных тканях обнаруживается только цирковирус свиней. Напротив, экспериментальное заражение одним PPV (группа В протокола 3) не вызывает появления макроскопических или гистологических повреждений, однако в присутствии PCV повреждения появляются у 4-недельных поросят (группа D протокола 3).
Реферат
Изобретение относится к области вирусологии. Предложена иммуногенная композиция, вызывающая иммунный ответ против парвовируса и цирковируса свиньи. Композиция включает в себя по меньшей мере один антиген цирковируса свиньи и по меньшей мере один антиген парвовируса свиньи. Также предложена вакцина (варианты) против многосистемного синдрома истощения свиней (PMWS). Вакцина содержит меньшей мере один антиген цирковируса свиньи и по меньшей мере один антиген парвовируса свиньи. Кроме того, предложен набор для вакцинации и способ ее проведения против PMWS. Предложенная группа изобретений позволяет получать композиции и вакцины против PMWS и проводить эффективную вакцинацию свиней против данного заболевания. Изобретение может быть использовано в ветеринарии для вакцинации свиней против многосистемного синдрома истощения свиней. 6 н. и 36 з.п. ф-лы, 5 ил., 8 табл.

Комментарии