Вирус гриппа с и вакцина - RU2656186C2
Код документа: RU2656186C2
Чертежи

















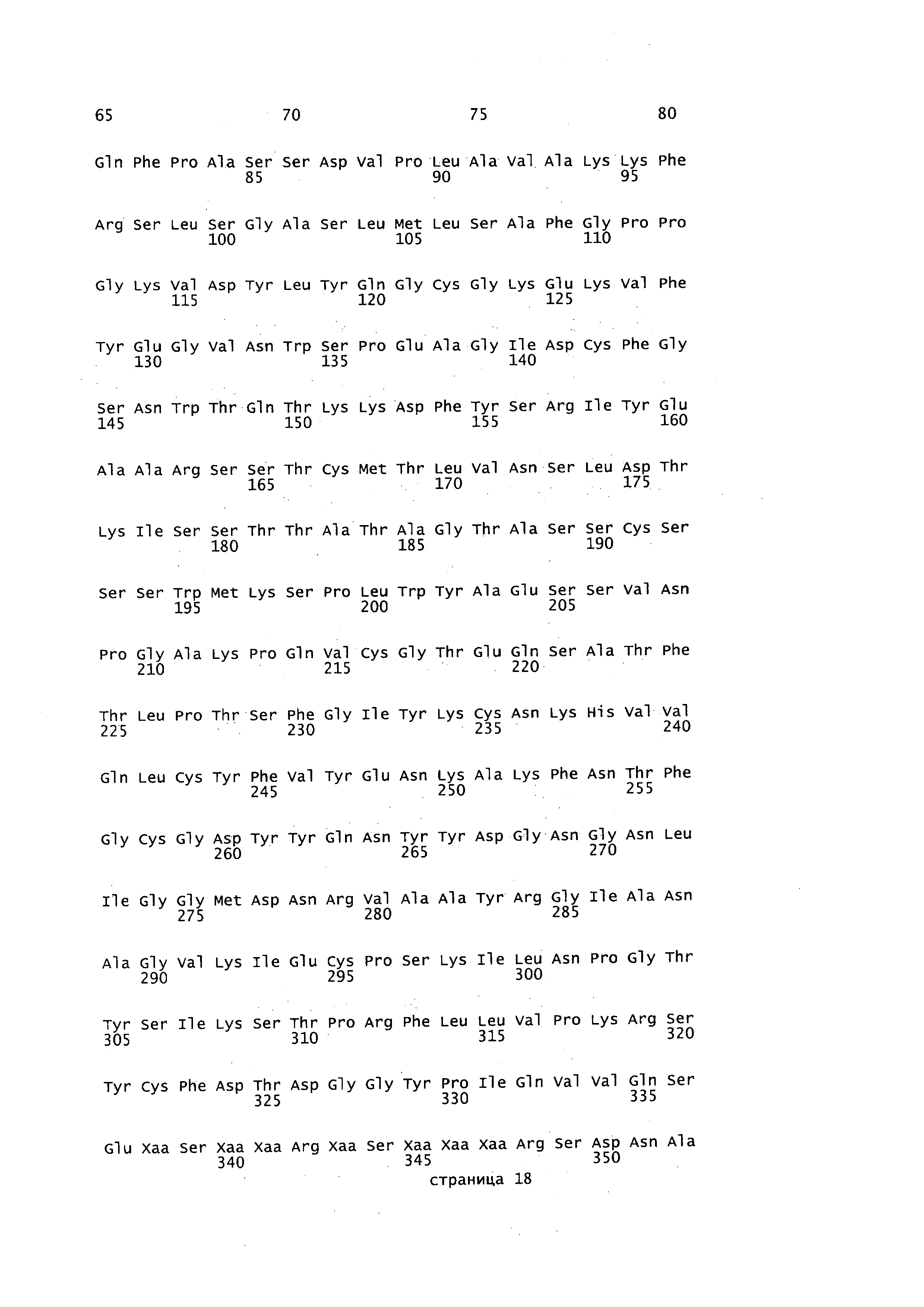






Описание
Ссылки на родственные заявки
Настоящая заявка претендует на приоритет от Патентной заявки США No. 13/385 004, поданной 27 января 2012 г., содержание которой включено сюда путем ссылки.
Уровень техники
Вирус гриппа С является распространенным патогеном у людей, так как большинство индивидуумов заражаются в детском возрасте. Вирус гриппа С вызывает легкое респираторное заболевание, подобное обычной простуде. Имеется одно сообщение о вирусе гриппа С, выделенном от свиней в Китае (Yuanji and Desselberger 1984, J. Gen. Virol. 65:1857-72). Кроме того, в этой работе показано, что свиные вирусы гриппа С могут заражать и передаваться между свиньями. В ряде других работ были определены антитела у свиней, которые реагируют с вирусом гриппа С, свидетельствуя о том, что либо свиньи являются резервуаром для гриппа С, либо люди очень часто передают этот вирус свиньям (Kimura et al. 1997, Virus Res. 48:71-9; Yamaoka et al. 1991, J Gen Virol. 72:711-714; Brown et al. 1995, Epidemiol. Infect. 114:511-20; Ohwada et al. 1987, Microbiol Immunol. 31:1173-80).
Сущность изобретения
Поскольку о вирусе гриппа С сообщалось только в одной работе, его редко находят у свиней. Вирус, который был выделен и охарактеризован, является уникальным вариантом вируса гриппа С.Общая степень гомологии этого вируса с известными вирусами гриппа С составляет лишь 65%, свидетельствуя, что это совершенно новая линия вируса, которая ранее не была описана и лишь отдаленно родственна описанным вирусам. Такой низкий уровень гомологии означает, что вакцины, полученные против типичных вирусов гриппа С человека, не смогут защитить от C/swine/Oklahoma/1334/2011. Тот факт, что "универсальный" набор праймеров для вируса гриппа С также не смог обнаружить этот вирус, тоже говорит о его новизне. Кроме того, обнаружение титров антител у людей и свиней, а также способность вируса к репликации у свиней и у хорьков означает, что этот вирус способен вызывать заболевание у свиней и человека. Мы показали, что можно получить вакцину, защищающую свиней от инфекции, а научная литература к тому же подтверждает, что эта вакцина может защитить людей.
В одном аспекте настоящего изобретения представлен новый вирус гриппа С, обладающий весьма слабой гомологией к ранее изученным вирусам гриппа С.Опыты по заражению показали, что этот вирус может инфицировать свиней и передаваться между ними. Кроме того, вирус гриппа С обычно рассматривается как патоген человека и проводились серологические исследования, в которых изучалась встречаемость антител против этого вируса и у свиней, и у людей. Примерно 10% свиней и 30% людей содержат антитела к этому вирусу. Дополнительные экспериментальные данные показали, что вирус может инфицировать хорьков (заменитель для исследования инфекций у человека) и передаваться между ними.
Во втором аспекте настоящего изобретения представлена вакцина к этому новому вирусу гриппа С.
В третьем аспекте настоящего изобретения представлен неполный геном этого нового вируса гриппа С.
В другом аспекте настоящего изобретения представлен способ обнаружения этого нового вируса гриппа С у животных.
Краткое описание фигур
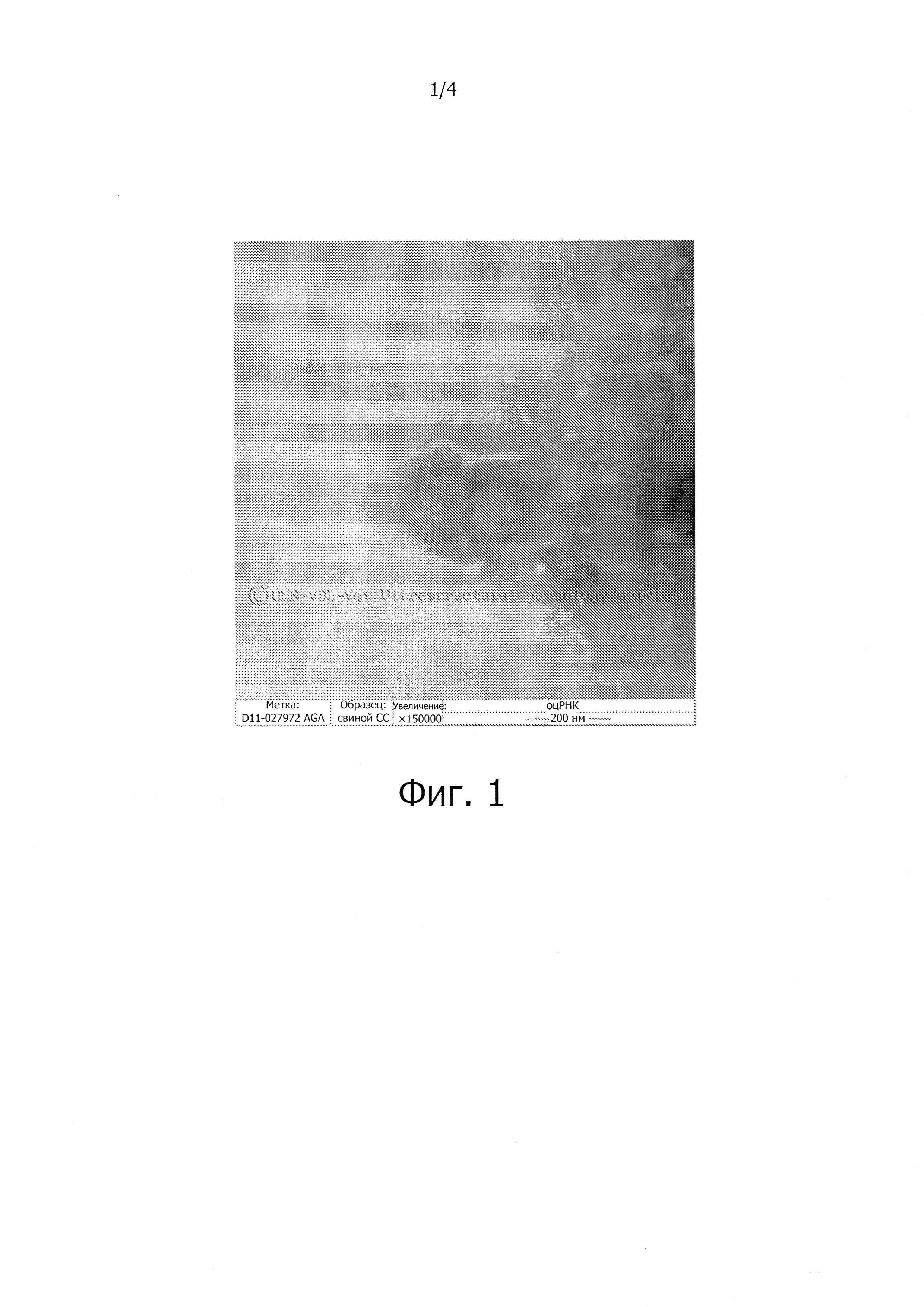
На фиг. 1 представлен электронно-микроскопический снимок нового вируса гриппа С по настоящему изобретению.
На фиг. 2 представлены HI-титры у вакцинированных и не вакцинированных свиней.
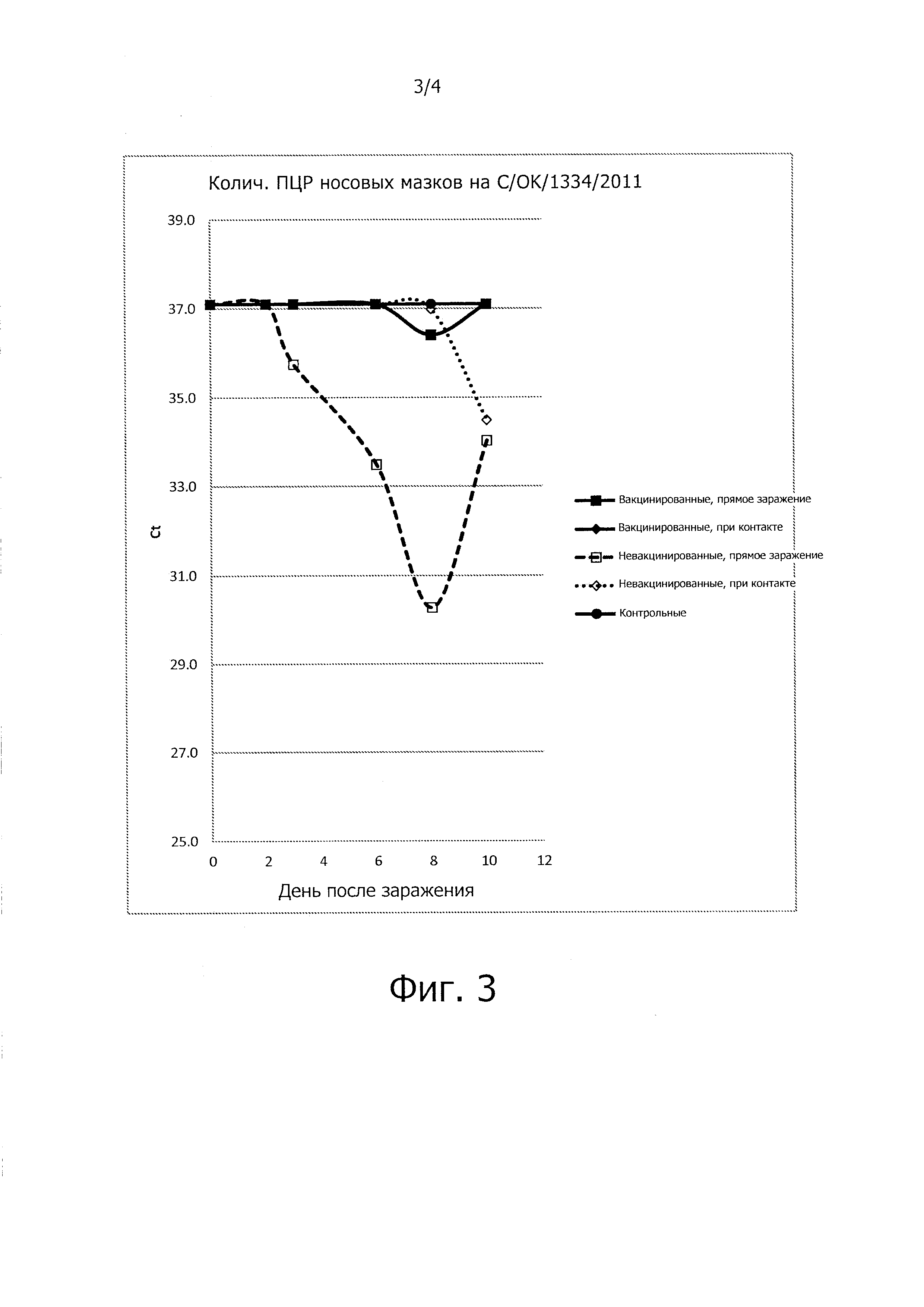
На фиг. 3 представлены пороговые значения ПЦР в режиме реального времени у вакцинированных и не вакцинированных свиней.
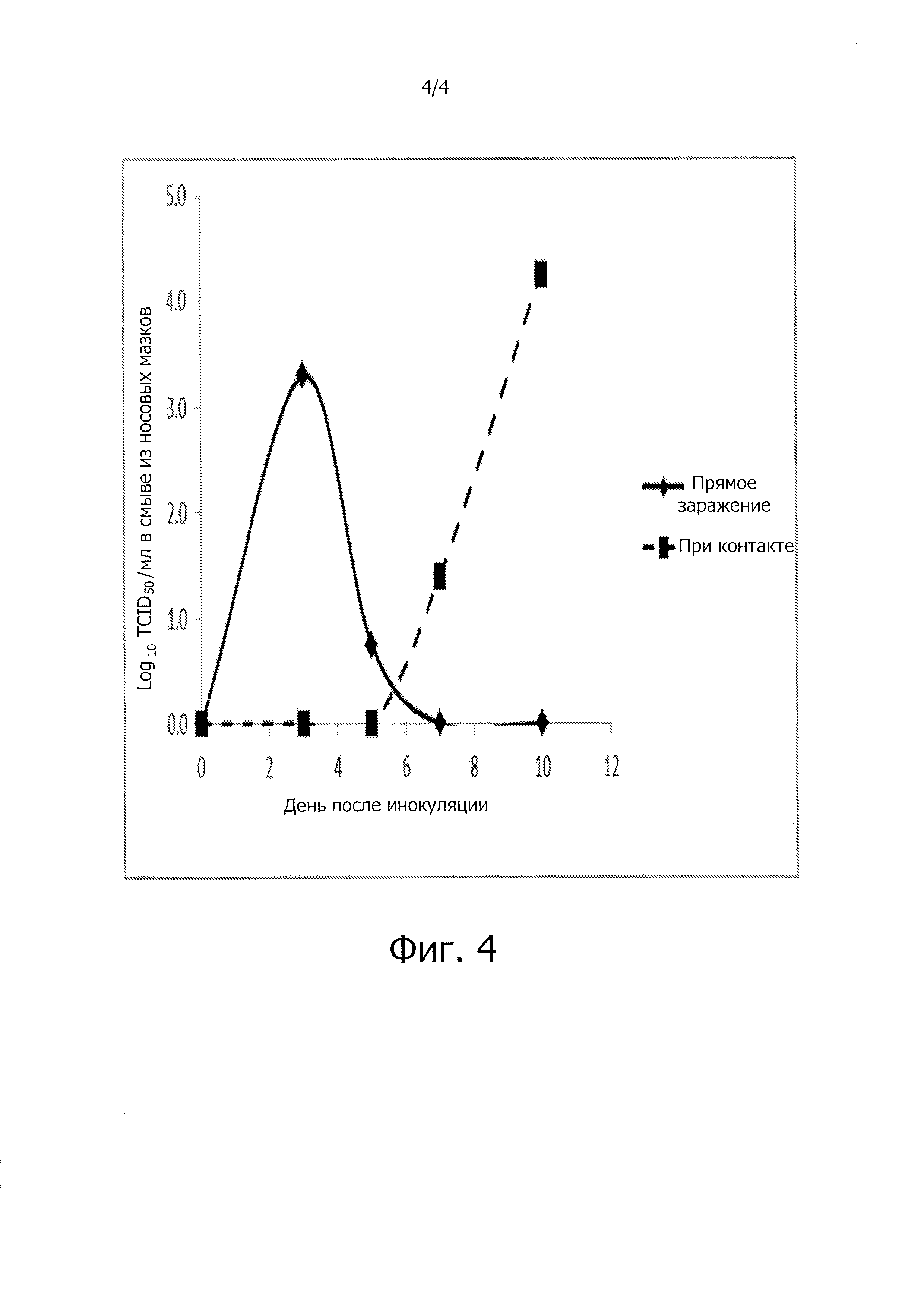
На фиг. 4 представлена инфицирующая доза культуры клеток при заражении хорьков вирусом настоящего изобретения.
Осуществление изобретения
Выделение вируса
Образцы, посланные в Newport Laboratories, представляли собой носовые мазки от свиней, проявляющих признаки заболевания, подобного гриппу. Образцы были отрицательны на грипп А по указанным ПЦР с обратной транскрипцией в реальном времени. Порцию образца наносили на конфлюентный монослой клеток яичек свиньи (ST) для того, чтобы прорастить присутствующие вирусы. Через 5 дней проявлялись цитопати-ческие эффекты, указывая на то, что в клетках ST растет вирус. Образцы супернатантов клеточных культур подвергали анализу на вирус гриппа А методом количественного ПЦР, и они были отрицательными. Супернатанты клеточных культур подвергали анализу на их способность вызывать гемагглютинацию эритроцитов индейки (методом гемагглютинации). Гемагглютинацию выполняли по следующей методике (эксперимент №1).
Эксперимент №1
1.0. Введение
Для количественного определения вируса гриппа свиней.
2.0. Материалы
- Резервуар
- 96-луночные микротитровальные планшеты с V-образным дном
- Многоканальная пипетка и наконечники (10-200 мкл)
- Пипетка на 100-1000 мкл
- Пипетка на 10-100 мкл
- Наконечники для пипеток
- Средства индивидуальной защиты (РРЕ: лабораторный халат, защитные очки, перчатки)
- Кабинет биологической безопасности/ламинар
- Крышки
- Таймер
- Пробирки на 50 мл Falcon
- Центрифуга
3.0. Реагенты/среды
- Эритроциты индейки (TRBC) от Lampire
- 1×DPBS
4.0. Составление сред
Раствор эритроцитов индейки (0,5%)
- TRBC поставляют в растворе Alsevers. Центрифугировать в конических пробирках на 50 мл при 2000 об/мин в течение 10 мин. Супернатант отсосать и отбросить.
- Промыть эритроциты добавлением порции 1×DPBS, равной исходному объему крови. Перевернуть и слега встряхнуть. Центрифугировать и отбросить супернатант. Повторить еще два раза. Хранить осажденные клетки при 4°С.
- Добавить 50 мл 1×DPBS в пробирку на 50 мл. Отобрать 250 мкл 1×DPBS. Добавить 250 мкл осажденных эритроцитов индейки. Осторожно перемешать. Требуется по 5 мл на планшет. Хранить разбавленные клетки при 4°С.
5.0. Процедура
Приготовление
- Обычно запускают по 8 образцов по горизонтали на 96-луночном планшете. Рассчитайте, сколько потребуется планшетов для тестирования образцов, и заполните соответствующий протокол.
- Альтернативная схема: можно запускать по 12 образцов по вертикали на 96-луночном планшете.
Процедура тестирования
- Заполнить все лунки планшетов по 50 мкл DPBS.
- Внести 50 мкл образца №1 в лунку A1, образца №2 в лунку В1 и т.д.
- При каждом комплекте планшетов запускать отрицательный контроль на последнем планшете (только DBPS).
- Проделать разведение в планшетах по 50 мкл, начиная с ряда 1 по ряд 12 (за исключением ряда отрицательного контроля), отбрасывая остальные 50 мкл.
- После разведения образцов заполнить все лунки по 50 мкл 0,5% TRBC (для перемешивания эритроцитов переворачивать пробирку, но не встряхивать). Осторожно постучать по планшетам, накрыть крышками и инкубировать при комнатной температуре вплоть до 2 ч.
- Альтернативная схема: для запуска 12 образцов по вертикали вносить 50 мкл образца №1 в лунку A1, образца №2 в лунку А2 и т.д.
- Проделать разведение в планшетах по 50 мкл, начиная со столбца А по столбец H (за исключением столбца отрицательного контроля), отбрасывая остальные 50 мкл.
- После разведения образцов заполнить все лунки по 50 мкл 0,5% TRBC (для перемешивания эритроцитов переворачивать пробирку, но не встряхивать). Осторожно постучать по планшетам, накрыть крышками и инкубировать при комнатной температуре вплоть до 2 ч.
6.0 Считывание
- Наклоните планшеты под углом 30-45° для проверки. При считывании за конечную точку принимается последняя не полностью прозрачная лунка. Проставить отметки в соответствующем протоколе.
- Записать титры НА в соответствующем протоколе.
- Ряд (или столбец) с отрицательным контролем должен быть полностью прозрачным, не проявляя никакой гемагглютинации.
Неидентифицированный вирус обладал способностью вызывать гемагглютинацию эритроцитов с титром 1280. Многие вирусы содержат ген, кодирующий белок гемагглютинин, который позволяет вирусу связываться с клетками, включая эритроциты. Вирусы гриппа обладают способностью вызывать гемагглютинацию эритроцитов.
Эксперимент №2
Колбу с клетками ST, инфицированными неизвестным вирусом, отсылали в лабораторию ветеринарной диагностики University of Minnesota для электронной микроскопии. Снимки вируса соответствовали семейству Orthomyxoviridae (фиг. 1). Это семейство состоит из вирусов гриппа А, В, С и вируса тогото.
Эксперимент №3
Проводили ПЦР с праймерами, составленными специально для обнаружения вирусов гриппа А, В или С (табл. 1). Все реакции ПЦР были отрицательными. Кроме того, проводили определение нейраминидазной активности с помощью субстрата нейраминидазы - метилумбеллиферил-N-ацетилнейраминовой кислоты. Вирус не обладал нейраминидазной активностью (а вирусы гриппа А и В содержат нейраминидазы). Затем проводили определение эстеразной активности с 4-нитрофенилацетатом (Sigma Aldrich N8130). Вирус обладал эстеразной активностью. Способность вызывать гемагглютинацию эритроцитов и наличие эстеразной активности характерны для вируса гриппа С и для некоторых представителей семейства Coronaviridae. Исходя из гемагглютинации, эстеразы и электронной микроскопии, вирус был предварительно идентифицирован как вирус гриппа С, несмотря на отрицательный результат ПЦР на вирусы гриппа С.

Эксперимент №4. Секвенирование генома
Вирус размножали в клеточной культуре, получая 200 мл урожая клеточной культуры с титром гемагглютинации (НА) 2560. Культуральную жидкость фильтровали через фильтр на 0,2 мкм, чтобы удалить остатки клеток. Затем жидкость центрифугировали при 110000×g в течение 3 ч для осаждения вируса. Затем вирус ресуспендировали в 1 мл физраствора с фосфатным буфером и расщепляли ДНКазой (New England Biolabs, M0303S) и РНКазой (New England Biolabs, M0243S) при 37°C в течение 1 ч. После этого раствор вируса осторожно наслаивали на 35 мл 25% раствора сахарозы и центрифугировали 3 часа при 110000×g для осаждения вируса. Из вирусного осадка экстрагировали РНК вируса с помощью набора Qiagen™ Viral RNA Mini Kit (Qiagen Inc., 27220 Turnberry Lane, Suite 200, Valencia, CA 91355) в соответствии с инструкциями производителя. Вкратце, вирусный осадок ресуспендировали в 700 мкл буфера AVL, содержащего РНК-носитель, и инкубировали 10 мин при комнатной температуре. Далее в образец добавляли 560 мкл этанола, а затем наносили на миниколонку QIAamp™ путем центрифугирования при 6000×g. Затем колонку промывали последовательно по 500 мкл каждого из буферов AW1 и AW2, сушили путем центрифугирования 2 мин при 14000×g, а затем элюировали 60 мкл воды. После этого проводили обратную транскрипцию кДНК из вирусной РНК с помощью набора Promega Reverse Transcription Kit (Promega Corp., 2800 Woods Hollow Rd., Madison WI 53711; www.promega.com) вместе с прилагаемыми произвольными праймерами. Система обратной транскрипции GoScript™ является удобным набором, который включает обратную транскриптазу и оптимизированный набор реагентов, предназначенных для эффективного синтеза первой нити кДНК, предназначенной для ПЦР-амплификации. Компоненты системы обратной транскрипции GoScript™ могут применяться для обратной транскрипции РНК матрицы, исходя из общей РНК, поли(А)+мРНК либо синтетического РНК-транскрипта.
После этого кДНК расщепляли в течение 1 ч при 37°С с помощью РНКазы H (New England Biolabs, M0297S), чтобы удалить РНК из гибрида РНК-кДНК. Одноцепочечную кДНК превращали в двухцепочечную с помощью фрагмента Кленова из ДНК-полимеразы (New England Biolabs, M0210S).
Двухцепочечную кДНК подвергали ультразвуковой обработке с помощью системы BioRuptor® Sonication System (Diagenode Inc. North America, 376 Lafayette Rd., Suite 102, Sparta, NJ 07871), чтобы фрагментировать вирусную кДНК. Затем фрагментированную кДНК использовали для конструирования библиотеки кДНК по методике из набора Life Technologies™ Ion Plus Fragment Library Kit (www.lifetechnologies.com), которая имеет следующий вид. Смешивали 50 мкл фрагментированной кДНК с 108 мкл воды, свободной от нуклеаз, 40 мкл 5 × буфера End Repair и 2 мкл фермента End Repair. Реакционную смесь инкубировали при комнатной температуре в течение 20 мин. После инкубации в образец добавляли 360 мкл шариков Agencourt® Ampure®, а затем помещали на качалку при 8-10 об/мин на 10 мин. Образец быстро центрифугировали и помещали на магнитный штатив DynaMag™-2. После осветления раствора супернатант извлекали и отбрасывали. Затем образец два раза промывали по следующей методике. В образец добавляли 500 мкл свежеприготовленного 70% этанола, не снимая его с магнита. Пробирку, содержащую образец, дважды прокручивали на магните, чтобы провернуть шарики. После осветления раствора удаляли этанол. Эту процедуру промывки повторяли еще раз. После второй промывки 70% этанолом и удаления супернатанта пробирку с образцом быстро центрифугировали и снова ставили на магнитный штатив. Отсасывали остаточный этанол и сушили образец при комнатной температуре примерно 5 мин. В кДНК добавляли 50 мкл 1×ΤΕ (10 мМ трис-HCl, 1 мМ EDTA, рН 8,0) и обрабатывали на вибромешалке, быстро центрифугировали и снова ставили на магнитный штатив. После осветления раствора супернатант, содержащий элюированную кДНК, переносили в новую пробирку LoBind™ Tube на 1,5 мл.
Смешивали 20 мкл лигазного 10 × буфера, 77 мкл свободной от нуклеаз воды, 50 мкл Adapters и 3 мкл ДНК-лигазы с 50 мкл кДНК. Смесь инкубировали при комнатной температуре в течение 30 мин. После осветления раствора супернатант извлекали и отбрасывали. Затем образец дважды промывали по следующей методике. В образец добавляли 500 мкл свежеприготовленного 70% этанола, не снимая его с магнита. Пробирку, содержащую образец, дважды прокручивали на магните, чтобы провернуть шарики. После осветления раствора удаляли этанол. Эту процедуру промывки повторяли еще раз. После второй промывки 70% этанолом и удаления супернатанта пробирку с образцом быстро центрифугировали и снова ставили на магнитный штатив. Отсасывали остаточный этанол и сушили образец при комнатной температуре примерно 5 мин. В кДНК добавляли 30 мкл 1×ΤΕ и обрабатывали на вибромешалке, быстро центрифугировали и снова ставили на магнитный штатив. После осветления раствора супернатант, содержащий элюированную кДНК, переносили в новую пробирку LoBind™ Tube на 1,5 мл.
Все 30 мкл кДНК наносили на 2% агарозный гель и подвергали гель-электрофорезу в течение 80 мин при 110V. После электрофореза образец разделялся по размерам на зоны по 180-210 пар оснований. Отобранную по размеру библиотеку кДНК подвергали очистке в геле с помощью набора QIAquick™ PCR Purification Kit (Qiagen Inc., 27220 Turnberry Lane, Suite 200, Valencia, CA 91355; www.qiagen.com), следуя инструкциям производителя. Вырезанный из геля фрагмент кДНК взвешивали и добавляли 3 объема буфера QG на 1 объем геля. Смесь инкубировали на качалке при комнатной температуре до тех пор, пока кусочек геля не растворится полностью. Как только кусочек геля полностью растворялся, раствор наносили на спин-колонку QIAquick™ (Qiagen Inc., 27220 Turnberry Lane, Suite 200, Valencia, CA 91355; www.qiagen.com) в прилагаемой пробирке для сбора на 2 мл и центрифугировали при максимальной скорости (примерно 16000×g) в течение 1 мин. Проточную жидкость отбрасывали, а колонку QIAquick™ вставляли обратно в ту же самую пробирку. Колонку, содержащую кДНК, промывали добавлением 750 мкл буфера РЕ на колонку и центрифугировали при максимальной скорости в течение 1 мин. Проточную жидкость отбрасывали, а колонку QIAquick™ вставляли обратно в ту же самую пробирку и центрифугировали 4 мин при максимальной скорости. QIAquick[trade] Затем колонку QIAquick™ вставляли в новую микроцентрифужную пробирку на 1,5 мл. На мембрану колонки QIAquick™ наносили 40 мкл буфера ЕВ и оставляли инкубироваться при комнатной температуре на несколько минут, после чего колонку центрифугировали в течение 1 мин, чтобы элюировать кДНК.
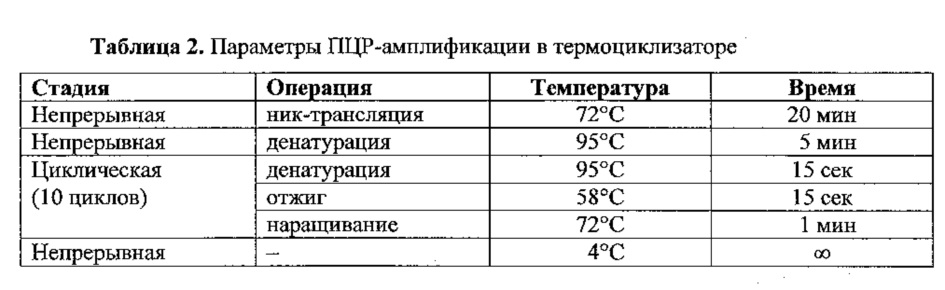
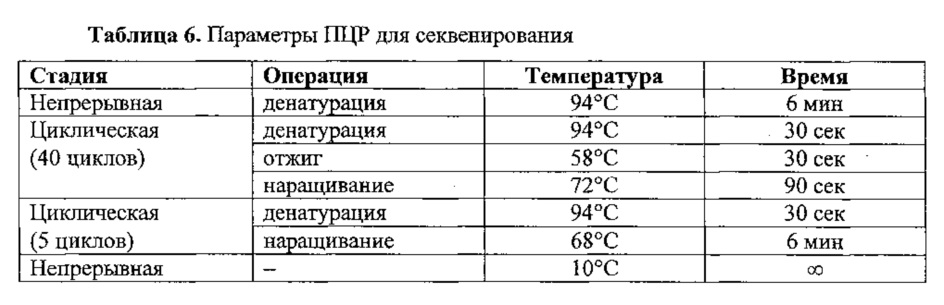
Элюированную отобранную по размерам библиотеку кДНК подвергали ник-трансляции и амплификации по методике из набора Life Technologies™ Ion Plus Fragment Library Kit (www.lifetechnologies.com). Смешивали 40 мкл отобранной по размеру кДНК с 200 мкл смеси Platinum™ PCR SuperMix High Fidelity и 10 мкл смеси праймеров Library Amplification Primer Mix. Порции по 125 мкл вносили в каждую из 2 пробирок для ПЦР и обрабатывали на амплификаторе (термоциклизаторе) в соответствии со следующими параметрами.
Образцы объединяли в новой микроцентрифужной пробирке на 1,5 мл и подвергали очистке путем добавления в образец 375 мкл шариков Agencourt Ampure® и инкубации его 10 мин при комнатной температуре на качалке. Образец быстро центрифугировали и помещали на магнитный штатив DynaMag™-2. После осветления раствора супернатант извлекали и отбрасывали. Затем образец дважды промывали по следующей методике. В образец добавляли 500 мкл свежеприготовленного 70% этанола, не снимая его с магнита. Пробирку, содержащую образец, дважды прокручивали на магните, чтобы провернуть шарики. После осветления раствора удаляли этанол. Эту процедуру промывки повторяли еще раз. После второй промывки 70% этанолом и удаления супернатанта пробирку с образцом быстро центрифугировали и снова ставили на магнитный штатив. Отсасывали остаточный этанол и сушили образец при комнатной температуре примерно 5 мин. Добавляли 50 мкл 1×ΤΕ в кДНК и обрабатывали на вибромешалке, быстро центрифугировали и снова ставили на магнитный штатив. После осветления раствора супернатант, содержащий элюированную кДНК, переносили в новую пробирку LoBind™ Tube на 1,5 мл.
Содержание кДНК количественно определяли с помощью набора Ion Library Quantitation Kit (www.lifetechnologies.com) по методике производителя. Готовили 5 последовательных 10-кратных разведений из контрольной библиотеки в Е. coli DH10B в соответствии со следующей таблицей.
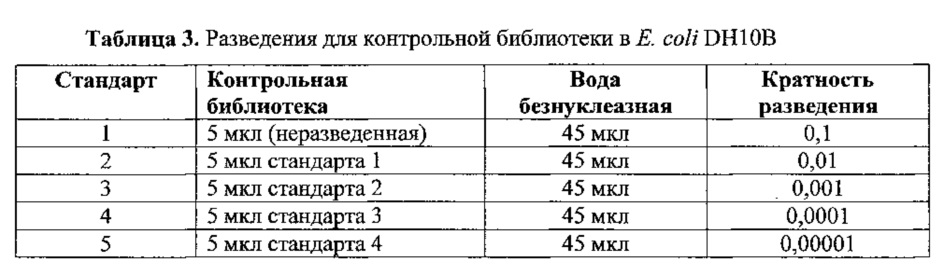
Сначала готовили разведение 1:20 библиотеки из образца в свободной от нуклеаз воде. После этого готовили серийные разведения 1:2000 и 1:20000, как описано в следующей таблице.

Поскольку каждую реакцию qПЦP готовили в трех повторах, то исходную смесь готовили смешиванием 250 мкл 2 × смеси Ion Library TaqMan® qPCR Mix 2X, 25 мкл 20 × смеси Ion Library TaqMan® Quantitation Assay 20X и 100 мкл свободной от нуклеазы воды на 1 реакцию qПЦP. Для каждой реакции в 1 лунку планшета для ПЦР пипеткой вносили по 15 мкл исходной смеси. В каждую лунку добавляли по 5 мкл разведенной контрольной библиотеки или библиотеки образца, соответственно. В качестве контроля без матрицы (NTC) использовали 5 мкл свободной от нуклеазы воды. Лунки запечатывали, быстро центрифугировали и подвергали ПЦР в реальном времени при следующих условиях.

Степень разведения матрицы рассчитывали по следующему уравнению: степень разведения матрицы = [(относительное количество при qПЦP) × (кратность разведения библиотеки образца)]/0,32.
Делали соответствующее разведение образца и готовили для секвенирования с помощью набора Ion Xpress™ Template Kit v2.0 (www.lifetechnologies.com). Вынимали из холодильника масло для эмульсии Emulsion Oil™ и перемешивали. Добавляли 9 мл масла Emulsion Oil™ в пробирку IKA® DT-20. Заполненную пробирку IKA® ставили на лед до употребления. Водную смесь для ПЦР получали смешиванием 582 мкл свободной от нуклеазы воды, 200 мкл 5 × смеси PCR Reagent Mix, 100 мкл 10 × смеси PCR Enzyme Mix, 100 мкл частиц Ion Sphere™ (обрабатывали на вибромешалке 1 мин перед добавлением) и 18 мкл разведенной библиотеки образца. Смесь обрабатывали на вибромешалке 5 сек и оставляли, а тем временем пробирку IKA® DT-20, содержащую масло Emulsion Oil, вставляли в устройство IKA® Ultra-Turrax® Tube Drive и фиксировали на месте. Удаляли наклейку на крышке пробирки IKA® DT-20, чтобы открылось отверстие для внесения образца. Нажимали на кнопку START на приборе IKA® Ultra-Turrax® и вносили весь объем водной смеси для ПЦР через отверстие в голубой крышке пробирки IKA® DT-20. После перемешивания 5 мин в устройстве ICA® Ultra-Turrax® Tube Drive эмульсию ставили на лед примерно на 5 мин. Для переноса эмульсии делали наконечник с широким отверстием, отрезая примерно 5 мм из наконечника пипетки. С помощью автопипетки Eppendorf® Repeater® Pipettor, снабженной наконечником с широким отверстием, набирали эмульсию и разливали по 100 мкл во все лунки 96-луночного планшета для ПЦР до тех пор, пока не заполнилось примерно 90 лунок. 96-луночный планшет закрывали и ставили в амплификатор с нижеследующими параметрами ПЦР.
После реакции ПЦР содержимое всех лунок, насколько возможно, с помощью многоканальной пипетки переносили в резервуар многоканальной пипетки. В каждую из шести микроцентрифркных пробирок на 1,5 мл вносили примерно 1,2 мл эмульсии. Все шесть микроцентрифужных пробирок центрифугировали 2 мин при 15500×g, чтобы собрать эмульсию. Во время центрифугирования готовили раствор Breaking Solution™ путем смешивания 2 мл Recovery Solution™ и 6 мл 1-бутанола. Затем Breaking Solution™ обрабатывали на вибромешалке примерно 1 мин до получения мелко-белого эмульгированного материала. После центрифугирования эмульсии из каждой пробирки удаляли прозрачную верхнюю фракцию масла. В каждую из 6 пробирок, содержащих белую эмульсию, вносили по 1 мл Breaking Solution™, обрабатывали на вибромешалке 30 сек и центрифугировали 2 мин при 15500×g. После центрифугирования из каждой пробирки удаляли верхнюю органическую фазу. В каждую пробирку с образцом вносили по 1 мл Recovery Solution™, обрабатывали на вибромешалке 30 сек, а затем центрифугировали 3 мин при 15500×g. Из каждой пробирки удаляли супернатант, пока не оставалось только примерно 100 мкл. Используя один и тот же наконечник пипетки, ресупендировали осадки во всех шести пробирках и переносили в новую микроцентрифужную пробирку на 1,5 мл. Три исходных пробирки промывали одной порцией 200 мкл раствора Recovery Solution™. После промывки третьей пробирки раствор переносили в пробирку, содержащую объединенные ресуспендированные осадки. Эту процедуру повторяли с остальными тремя пробирками.
В объединенную пробирку добавляли Recovery Solution™ до общего объема 1,5 мл. Затем пробирку обрабатывали на вибромешалке 30 сек и центрифугировали 3 мин при 15500×g. Супернатант удаляли, пока не оставалось только примерно 100 мкл. Оставшийся материал ресуспендировали и переносили в новую микроцентрифужную пробирку на 1,5 мл. В исходную пробирку добавляли 100 мкл раствора Wash Solution™ и промывали, а затем переносили в новую пробирку, содержащую образец. Образец дважды промывали добавлением 1 мл Wash Solution™, обрабатывали на вибромешалке 30 сек, а затем центрифугировали пробирку 3 мин при 15500×g. Супернатант удаляли, пока не оставалось только 100 мкл. Эту процедуру промывки повторяли еще раз.
Проводили обогащение матрицы с помощью частиц Ion Sphere™ по методике из набора Ion Xpress™ Template Kit v2.0 (www.lifetechnologies.com). Флакон, содержащий шарики Dynabeads® MyOne™ Streptavidin Cl, обрабатывали на вибромешалке. Переносили 10 мкл шариков MyOne™ в микроцентрифужную пробирку на 1,5 мл, промывали 70 мкл Wash Solution™, обрабатывали на вибромешалке и ставили на магнит на 2 мин. Затем отбрасывали супернатант. Шарики MyOne™ ресуспендировали в 10 мкл нового Wash Solution™ и затем переносили в пробирку с образцом, содержащую частицы Ion Sphere™ (ISPs). Для осуществления захвата в пробирку с образцом также добавляли 100 мкл буфера Annealing Buffer™, а затем ставили на качалку на 10 мин при комнатной температуре. Пробирку с образцом центрифугировали и ставили на магнит до тех пор, пока раствор не становился прозрачным. Супернатант переносили в пробирку с надписью "Unbound (несвязавшийся)". Шарики дважды промывали по 200 мкл Wash Solution™, перемешивали и снова ставили на магнит, после чего переносили супернатант в пробирку "Unbound". Готовили свежий раствор Melt-Off Solution™ смешиванием 200 мкл 1М NaOH, 16 мкл 10% раствора Tween® 20 в воде молекулярного уровня и 1,38 мл воды молекулярного уровня. Для элюирования частиц Ion Sphere™ из шариков Dynabeads® MyOne™ Streptavidin C1 в пробирку с образцом добавляли 400 мкл Melt-Off Solution™ и перемешивали, а затем ставили на качалку на 7 мин. После этого супернатант удаляли и помещали в пробирку с надписью "Enriched-1 (обогащенный-1)". Пробирку "Enriched-1" обрабатывали на вибромешалке и центрифугировали 4 мин при 15500×g. Затем удаляли весь супернатант, кроме 100 мкл. В пробирку "Enriched-1" затем добавляли 1 мл Wash Solution™, обрабатывали на вибромешалке и центрифугировали 4 мин при 15500×g. Опять удаляли весь супернатант, кроме 100 мкл. Оставшийся образец перемешивали и пробирку "Enriched-1" снова ставили на магнит. Через несколько минут супернатант удаляли и помещали в пробирку с надписью "Enriched-2 (обогащенный-2)".
Секвенирование ДНК проводили в соответствии с руководством для пользователей набора Ion Sequencing Kit v2.0 фирмы Life Technologies (www.lifetechnologies.com). 50 мкл образца из пробирки "Enriched-2" переносили в новую пробирку для ПЦР на 0,2 мл. Добавляли 5 мкл контрольных частиц Ion Sphere™ и 150 мкл буфера Annealing Buffer™, раствор перемешивали и центрифугировали 2 мин при 15500xg. Супернатант удаляли, пока не оставалось только 9 мкл. В образец добавляли 5 мкл праймера Sequencing Primer™ и ставили в амплификатор на один цикл из 2 мин при 95°С и 2 мин при 37°С. Затем образец вынимали из амплификатора, смешивали с 1 мкл полимеразы Sequencing Polymerase™ и инкубировали при комнатной температуре в течение 5 мин.
В это время вынимали из упаковки новый чип Ion Chip™ и помещали в адаптер для стаканов подвесного ротора центрифуги Ion™. С помощью пипетки с наконечником Rainin® SR-L200F вводили 50 мкл 100% изопропанола в большое отверстие чипа, а затем отсасывали из другого отверстия. Чип промывали два раза по 50 мкл буфера Annealing Buffer™, который вводили в большое отверстие чипа, а затем отсасывали из другого отверстия (порта).
На главном меню секвенатора PGM™ нажимали вкладку "Эксперимент". В ответ на запрос заменяли старый чип на новый. Для сканирования штрихкода чипа на упаковке использовали сканер штрихкода. После введения штрихкода нажимали кнопку "Chip Check (проверка чипа)". По завершении проверки чипа нажимали кнопку "Next (далее)", чтобы перейти к калибровке чипа. После калибровки чип вынимали, ставили обратно в адаптер для стаканов ротора центрифуги Ion™ и промывали 50 мкл буфера Annealing Buffer™, который вводили в большое отверстие чипа, а затем отсасывали из другого отверстия чипа. С помощью пипетки Rainin® Pipette-Lite® LTS-20 с наконечником Rainin® SR-L200F вводили 7 мкл образца в большое отверстие чипа. Затем удаляли жидкость, выходящую из другого отверстия чипа. Затем чип Ion Chip™ переносили в центрифугу и центрифугировали в течение 4 мин. С помощью нового наконечника Rainin® SR-L200F вводили остаток образца во входное отверстие чипа. Затем удаляли жидкость, выходящую из другого отверстия чипа, а чип снова центрифугировали в течение 4 мин. По завершении последнего центрифугирования нажимали кнопку "Next" на экране PGM, вставляли чип обратно в прибор Ion Torrent PGM™ и запускали секвенирование.
Сборку последовательности из просеквенированных кусков проводили с помощью программного обеспечения SeqmanNexGen® фирмы DNAStar (DNAStar Inc., 3801 Regent Street, Madison, WI 53705; www.dnastar.com), используя опцию сборки de novo. При сборке последовательности было установлено семь контигов, каждый из которых состоял из более чем 10000 кусков. Контиги были отделаны таким образом, чтобы они представляли полные открытые рамки считывания. Отформатированные последовательности и соответствующие белковые последовательности включены в настоящую заявку как SEQ ID NOs: 4-17. При анализе предполагаемых транслируемых открытых рамок считывания методом BLASTP проявлялась гомология к 7 сегментам от изолятов гриппа С человека, и указанный изолят был обозначен C/swine/Oklahoma/1334/2011. Ближайшие гомологи для каждого сегмента представлены ниже. Сегмент, отмеченный как кодирующий неструктурные белки (NS), подвергается транскрипции в мРНК и альтернативному сплайсингу с образованием двух различных белков (NS1 и NS2), как показано ниже в табл.7. Процент сходства означает степень сходства по каждому сегменту между выделенным вирусом гриппа С и его ближайшим гомологом в общедоступных базах указанных. Хотя сегмент РВ1 и проявлял умеренную гомологичность с РВ1 изолята C/Johannesburg/1/66 вируса гриппа С человека на уровне 85%, однако все другие сегменты проявляли меньшую гомологию к ранее секвенированными вирусам гриппа С, при этом степень сходства составляла 48-71%. В целом небольшое сходство C/swine/Oklahoma/1334/2011 с ранее секвенированными вирусами свидетельствует об уникальности этого вируса.

Серологические исследования для определения распространенности
После того как было установлено, что C/swine/Oklahoma/1334/2011 представляет собой новый вирус со слабой гомологией последовательности к вирусу гриппа С человека, проводили серологические исследования для определения зараженности у людей и у свиней. Примерно 200 случайных образцов сыворотки свиней из различных штатов были направлены в Newport Laboratories для анализа на антитела к C/swine/ Oklahoma/1334/2011 методом ингибирования гемагглютинации. Примерно 8% образцов оказались положительными при анализе методом HI с титрами от 10 до 160. Точно так же, сотрудники St Jude's Children's Hospital в Memphis, TN, проводили анализ методом HI банка сывороток человека, собранных от пожилых людей (в возрасте 65-95) из Канады. Примерно 28% образцов давали положительные титры HI от 10 до 80. В целом эти результаты свидетельствуют, что и люди, и свиньи зачастую подвергаются воздействию C/swine/Oklahoma/1334/2011. Эти результаты также свидетельствуют, что этот вирус способен заражать и людей, и свиней.
Эксперимент по вакцинации и заражению свиней
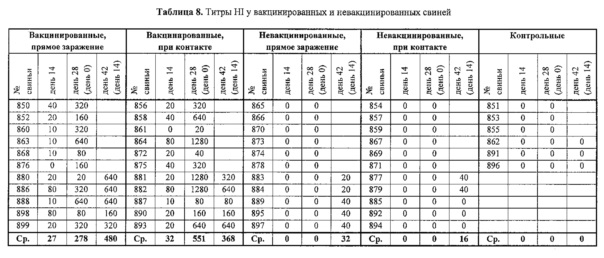
C/swine/Oklahoma/1334/2011 культивировали до высокого титра (НА=2560) и инактивировали бинарным этиленимином, а затем добавляли 10% Trigen (адъвант типа масло в воде), чтобы получить убитую вирусную вакцину. В день 0 и день 14 проводили вакцинацию 22 свиней, которые были серологически отрицательны по антителам к C/swine/Oklahoma/1334/2011, по 2 мл инактивированной вирусной вакцины при внутримышечном введении. В дни 0,14 и 28 брали образцы сыворотки и анализировали на титры HI. Также включали 28 свиней в качестве невакцинированных контролей. Вакцинированные свиньи подвергались сероконверсии на 28 день со средним титром HI=433. Невакцинированные свиньи были отрицательны при анализе HI. Результаты представлены в табл. 8 и на фиг. 3. Вакцинированные свиньи проявляли сильную сероконверсию. Как правило, для гриппа А титр HI>40 является защитным. Определение антител в сыворотке вакцинированных свиней до заражения свидетельствует о наличии защитных антител. Эти данные согласуются с результатами по заражению.
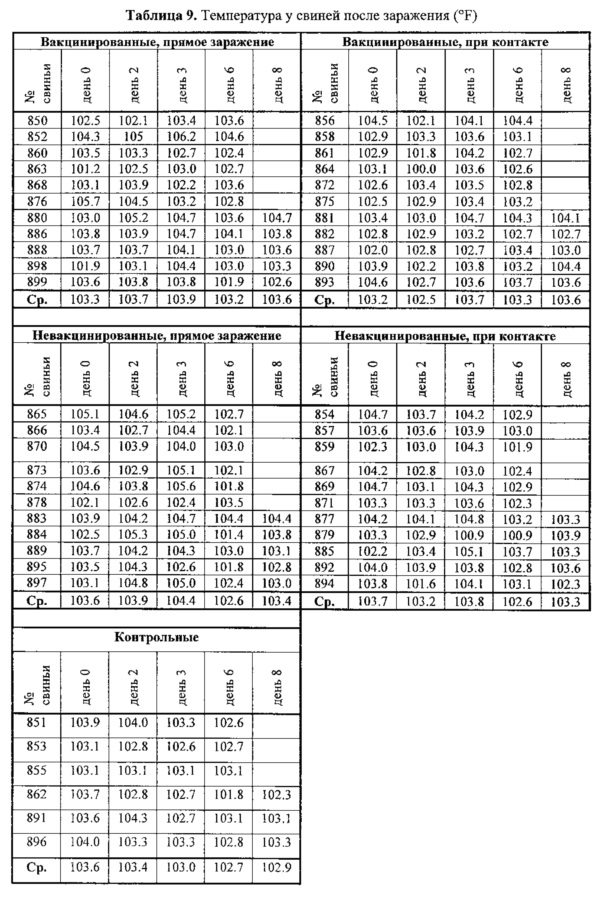
В день 28 проводили заражение 11 вакцинированных и 11 невакцинированных свиней интраназально по 2 мл 6,2 log10 TCID/мл C/swine/Oklahoma/1334/2011. В день 2 после заражения в помещение добавляли 11 вакцинированных и 11 невакцинированных свиней, которые служили в качестве группы заражения при контакте. Через каждый день измеряли температуру со дня заражения до 14 дней после заражения. Результаты представлены в табл. 9.
Никаких различий между опытными группами не наблюдалось, указывая на то, что вирус не вызывает лихорадки, как это обычно делают вирусы гриппа. Точно так же брали мазки из носа через каждый день со дня заражения до 14 дней после заражения.
Метод определения наличия вируса
Из мазков выделяли РНК и определяли наличие вируса гриппа С методом ПЦР с обратной транскрипцией в реальном времени (rt-RT-ПЦР), используя следующие праймеры и зонды, составленные на основе последовательности генома у C/swine/ Oklahoma/1334/2011. Нуклеотидные последовательности праймеров и зонда включены в настоящую заявку как SEQ ID NOs: 1-3, при этом прямой праймер = 5'-GCT GTT TGC AAG TTG ATG GG-3' (SEQ ID NO: 1); обратный праймер = 5'-TGA AAG CAG GTA ACT CCA AGG-3' (SEQ ID NO: 2); а зонд = меченный Cy5-5'-TTC AGG CAA GCA CCC GTA GGA TT-3'-(SEQ ID NO: 3)-IABkQ.
Результаты представлены в табл. 10 и на фиг. 3. "Ct" означает пороговый цикл. При ПЦР в реальном времени генетический материал (РНК или ДНК) копируется полимеразой при циклической обработке образца/фермента при различных температурах. При ПЦР в реальном времени используется флуоресцентный репортер, который связывается с образующимся ДНК-продуктом. По мере прогрессирования циклов и накопления ДНК-продукта вырабатывается все больше флуоресценции. В какой-то момент флуоресценция уже выявляется прибором для ПЦР. Определенный уровень обнаружения флуоресценции называется порогом. Количество циклов, необходимое для генерации флуоресценции выше порогового уровня, обозначается как Ct. Методом ПЦР в реальном времени можно определить количество РНК/ДНК в исходном образце с тем, что когда до ПЦР будет больше ДНК/РНК, то потребуется меньшее количество циклов/удвоений для генерации флуоресценции выше этого порога. Следовательно, меньшее значение Ct означает более высокий уровень ДНК/РНК в исходном образце.
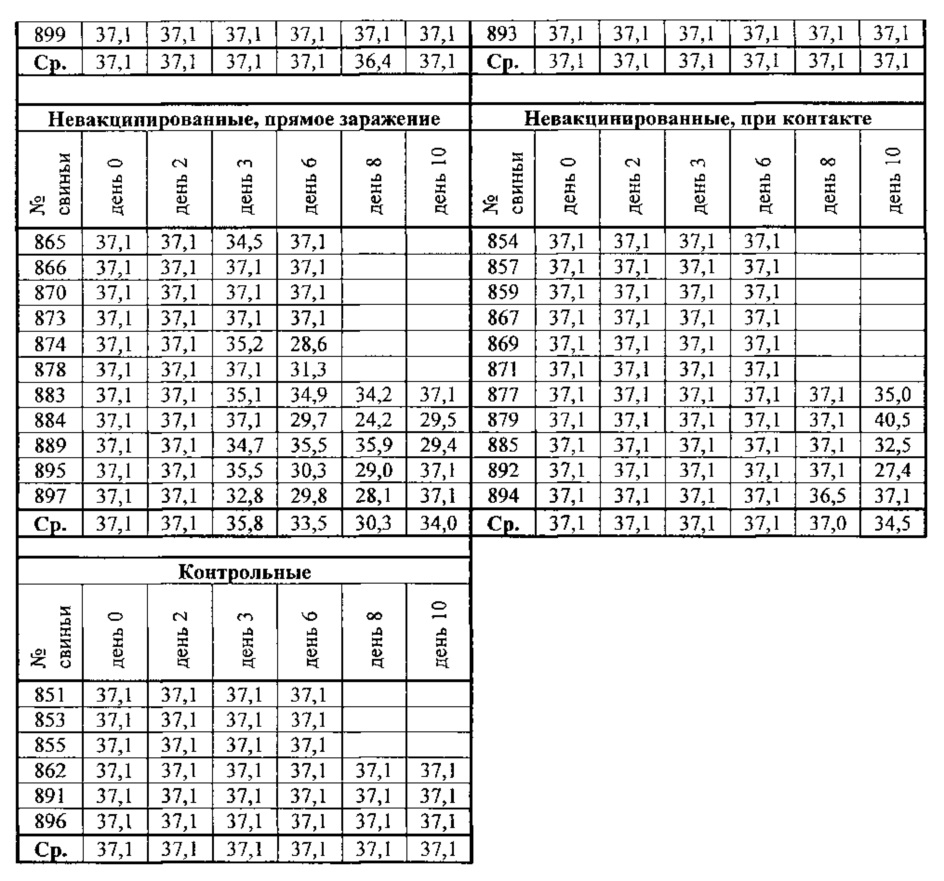
Значения Ct в вышеприведенной таблице представляют уровень РЫК в носовых мазках. 37,1 = отрицательный результат. Все значения меньше 37,1 являются положительными на РНК вируса (то есть на выделение вируса). Эти данные также представлены в виде графика на фиг. 3. У невакцинированной зараженной группы выделение вирусной РНК значительно отличается от вакцинированной. Мы проводили проверку этих указанных по критерию Стьюдента и оказалось, что выделение вируса у невакцинированной группы с прямым заражением было значительно выше, чем у других групп (р<0,001). Следовательно, вакцина защищает свиней. У вакцинированной группы вирус обнаруживался только у одной вакцинированной свиньи после заражения, прямого или при контакте. Напротив, невакцинированные свиньи начинали выделять вирус уже на 3-й день после заражения (прямое заражение) или на 6-й день после заражения (при контакте). Этот эксперимент показывает, что вирус способен инфицировать свиней и размножаться в них и выделяется в окружающую среду и при контакте между животными. Кроме того, свиньи, вакцинированные гомологичной вакциной, полностью защищены от заражения.
Заражение хорьков
Хорьков часто используют в качестве заменителя людей при исследовании гриппа, так как вирус гриппа человека обычно хорошо размножается у хорьков. Поскольку грипп С обычно считается патогеном человека, то использовали C/swine/Oklahoma/1334/2011 для заражения хорьков, чтобы проверить, является ли этот вирус вероятным патогеном человека. Трех хорьков заражали C/swine/Oklahoma/1334/2011 интраназально по 6,0 log10 полуинфекционной дозы культуры ткани на 1 мл (TCID50/мл). В 1-й день после заражения в клетку добавляли еще 3 хорьков, которые служили в качестве группы заражения при контакте. Кроме того, в отдельную клетку помещали еще 3 хорьков, которые служили в качестве группы аэрозольного заражения. Результаты представлены в табл. 11 и на фиг. 4.
Вирус выявляли в носовых мазках путем титрования клеток ST. Вирус выявлялся на 3-й день после заражения при интраназальном заражении животных и на 6-й день после контакта при контактном заражении хорьков. Вирус не обнаруживался у хорьков, подвергавшихся аэрозольному контакту. Эти данные показывают, что C/swine/Oklahoma/1334/2011 способен заражать хорьков как при прямом заражении, так и при контакте с зараженными животными. Однако вирус как будто не передается аэрозольным путем. Это свидетельствует о том, что C/swine/Oklahoma/1334/2011, вероятно, способен заражать и людей.
***
Если не определено иначе, все технические и научные термины, используемые здесь, имеют те же значения, которые обычно понимаются рядовыми специалистами в той области, к которой относится настоящее изобретение. Хотя при практическом применении или при тестировании настоящего изобретения могут применяться способы и материалы, аналогичные или эквивалентные описанным здесь, тем не менее, подходящие способы и материалы описаны ниже. Все публикации, патентные заявки, патенты и другие приведенные здесь ссылки включены путем ссылки во всей полноте в пределах, разрешенных соответствующим законодательством и нормативными актами. В случае противоречия должно возобладать настоящее описание, включая приведенные в нем определения.
Настоящее изобретение может быть воплощено и в других конкретных формах, не отходящих от его сущности или существенных признаков, поэтому желательно, чтобы настоящее воплощение рассматривалось во всех отношениях как иллюстративное, а не ограничительное, причем для выяснения объема настоящего изобретения следует обращаться к прилагаемой формуле изобретения, а не к вышеприведенному описанию.
Реферат
Представлены вакцина для защиты млекопитающих от заражения вирусом свиного гриппа С, вирус свиного гриппа С и способ определения наличия вируса свиного гриппа С. Охарактеризованная вакцина включает иммунологически эффективное количество инактивированного вируса свиного гриппа С. Вирус свиного гриппа С включает молекулу нуклеиновой кислоты, кодирующую восемь полипептидов свиного гриппа С PB1, PB2, P3, HE, NP, M, NS1 и NS2, имеющих аминокислотные последовательности, представленные в SEQ ID NO: 12, 11, 13, 14, 15, 16, 17 и 18. Способ определения наличия вируса свиного гриппа включает стадии: (a) амплификации одного или нескольких сегментов нуклеиновой кислоты из образца с помощью пары очищенных олигонуклеотидных праймеров, включающей прямой (SEQ ID NO:1) и обратный праймеры (SEQ ID NO:2), получая продукт амплификации; и (b) детектирования продукта амплификации, тем самым определяя наличие вируса свиного гриппа С в образце. Вирус гриппа С обладает слабой гомологией к ранее изученным вирусам гриппа С и может инфицировать свиней и передаваться между ними, а также может рассматриваться как патоген человека. 3 н. и 4 з.п. ф-лы, 4 ил., 11 табл.

Комментарии