Способ генерирования активных антител к антигену устойчивости, антитела, полученные этим способом, и их применения - RU2515904C2
Код документа: RU2515904C2
Чертежи




























Описание
Настоящее изобретение относится к новому подходу для создания исключительно моноклональных антител с терапевтической и/или диагностической целью. Более конкретно, задачей настоящего изобретения является создание антител, направленных против опухолевого антигена, отсутствующего на поверхности опухолевых клеток нативных опухолей и который может появиться после проведения противоопухолевого лечения этих нативных опухолей, антигена, который также возможно может быть вовлечен в устойчивость данных опухолей к этим противоопухолевым лечениям. Кроме того, данное изобретение включает такие антитела, а также применение этих антител в качестве лекарственного средства для профилактического и/или терапевтического лечения резистентных опухолей. И наконец, изобретение включает композиции, содержащие такие антитела, которые могут быть объединены с противораковыми агентами, и их применение для предупреждения и/или лечения некоторых типов рака.
Открытие антител и более конкретно разработка способов создания антител явились революцией в терапевтическом лечении или диагностике и, более конкретно, в относящейся к раку сфере. Действительно, впервые этот новый инструмент дал возможность осуществлять направленное лечение ввиду наличия распознавательной способности, присущей антителам. Одна из основных задач этих последних десятилетий состоит в разработке способов создания антител, независимо оттого, являются ли они в первой фазе поликлональными антителами, моноклональными антителами или даже фрагментами антител или аналогичными структурами.
На сегодняшний день специалистами в данной области техники разработаны несколько технологий, с помощью которых можно создавать антитела с терапевтической и/или диагностической целью.
Самые первые антитела представляют собой поликлональные антитела, т.е. гетерогенные популяции антител, содержащихся в сыворотках иммунизированных животных. Для их получения некоторых животных (мышей, крыс, кроликов, коз, …) иммунизируют путем инъекции заданного природного или синтетического антигена, в комбинации с одним или более адъювантами, такими как адъювант Фрейнда и гидроксид алюминия, направленными на стимуляцию и усиление иммунного ответа. Затем производят забор крови у животных и получают сыворотку или антисыворотку, содержащую как антитела, более или менее эффективно распознающие некоторые эпитопы данного антигена (поликлональные антитела), так и другие антитела животного. Очистку полученных антител выполняют, например аффинной хроматографией.
Первая разработка заключалась в создании моноклональных антител, которые могут быть получены из гибридом согласно методике, описанной KOHLER и MIELSTEIN (1975). Эта методика позволяет получить специфичные моноклональные антитела предетерминированного антигена и состоит в объединении клона лимфоцита В с миеломной (myelomatous) клеткой с получением клетки, называемой гибридомой. Эта гибридома характеризуется не только как иммортализованная, но также постоянно продуцирующая моноклональные и, следовательно, моноспецифичные антитела.
Также описаны другие методики, основанные на том же принципе, как например методика с использованием триомы или еще одна гибридомная методика, описанная KOZBOR и др. (1983).
Эти методики, первоначально примененные для создания мышиных антител, развивались, результатом чего стало создание гуманизированных или даже человеческих химерных антител. Все эти методики сегодня хорошо известны специалисту в данной области техники.
Человеческие антитела могут быть получены с использованием технологии генетически модифицированных мышей, так называемой "ксеномышиной" технологии, которая описана в патентах US 5814318 и US 5939598.
Кроме того, разработаны другие новые современные способы создания человеческих моноклональных антител и, более конкретно, фрагментов антител, как например методики, использующие банки или библиотеки фагов, как описано RIDDER и др. (1995), или так называемая технология "фагового дисплея", основанная на экстракции мРНК из директории (directory) человеческих клеток, происходящих из периферической крови, построении банка или библиотеки кДНК, содержащих последовательности вариабельных областей, и на вставке кДНК в фаги с целью продуцирования вариабельных областей антител в виде фрагментов, предпочтительно Fab-фрагментов.
Несмотря на то что эти способы различаются, все они имеют одну и ту же характерную особенность, т.е. иммунизацию известным антигеном или, в рамках объема библиотек или банков, скрининг этих банков с использованием того же известного и определенного антигена.
Настоящее изобретение отличается от этих способов тем, что известный и определенный антиген более не используется, а используется непосредственно вся опухоль или ее часть. Более конкретно, настоящее изобретение относится к непосредственному применению лизата, и/или суспензии, и/или измельченного клеточного гомогената опухоли. При лечении рака наблюдали в течение нескольких лет, что некоторое количество пациентов, которые характеризовались полным и удовлетворительным ответом после первого терапевтического лечения, имели тенденцию к развитию рецидива. В более конкретном случае известно, что опухоли способны модифицировать свой генотип и/или свой фенотип, чтобы быть устойчивыми к разным видам применяемого к ним лечения.
Это явление имеет место как для таких типов лечений, как лучевая терапия и химиотерапия, так и для лечений моноклональными антителами.
Исторически, первые химиотерапевтические соединения для лечения рака стали объектом клинических испытаний в 1940-х годах. Это были главным образом агенты с коротким временем полувыведения, такие как кортикостероиды, антифолаты или даже винкаалкалоиды. Однако, даже если была достигнута полная ремиссия, то она как правило продолжалась в течение не более чем одного года, и систематически наблюдали рецидив, ассоциированный с устойчивостью к химиотерапевтическому соединению, использованному для данного лечения (Lehnert М., Eur. J. Cancer, 1996, 32А: 912-920).
В ответ на это явление было предложено проводить так называемые "комбинированные" лечения с использованием различных противоопухолевых соединений. Путем одновременного или последовательного применения разных соединений действительно были получены более хорошие результаты В самом деле, в случае применения разных противоопухолевых соединений, каждое из которых обладает цитотоксической активностью, но разными механизмами действия, опухолевая клетка, устойчивая к соединению, может все еще быть чувствительной по меньшей мере к одному из других используемых соединений.
Однако, несмотря на использование разных противоопухолевых соединений или агентов, устойчивость опухолей остается главной проблемой в рамках химиотерапевтических лечений. Применение комбинаций влечет за собой задержку возникновения явления устойчивости, но не приводит к его исчезновению. Устойчивость к химиотерапевтическим средствам, как при начальном лечении, так и появляющаяся после рецидива вслед за благоприятным начальным ответом, имеется практически во всех случаях так называемых "излечимых" видов рака.
В качестве примера можно упомянуть заявки на патент WO 2005/077385, WO 2004/026293 или даже еще WO 2004/110497, где хорошо проиллюстрирован такой поиск новых способов контроля явления устойчивости, причем все эти заявки основаны на принципе дополнительного введения, как правило, новой химической молекулы.
Продемонстрированы другие механизмы приобретения устойчивости в опухоли, первоначально чувствительной к лечению. Согласно наиболее широко признанному предположению подразумевается, что это явление устойчивости могло бы происходить из-за накопления спонтанных и случайным образом возникающих соматических мутаций в генотипе опухолевой клетки (Cancer Chemotherapy and Biotherapy: Principles and practice, Chabner & Lango editors, 1996, chapter 1).
Другое известное и описанное явление устойчивости, называемое "MDR" (множественная лекарственная устойчивость (multidrug resistance); также полирезистентность; также резистентность ко многим лекарствам), основано на способности опухолевой клетки к выживанию при летальных концентрациях большого количества фармакологически, химически или даже структурно различающихся цитотоксических соединений. Клетки, проявляющие "MDR", обладают способностью к снижению накопления внутри клеток цитотоксических соединений в результате выведения указанных соединений транспортными белками. Эти белки, называемые "переносчики лекарственных средств, обеспечивающие множественную лекарственную устойчивость" (multi-drug transporters), являются мембранными белками, способными выводить широкий ряд токсичных молекул из клетки. Эти "переносчики лекарственных средств, обеспечивающие множественную лекарственную устойчивость" принадлежат "суперсемейству АТФ-связывающих кассетных (ABC; ATP-binding cassette)" транспортных белков, которые используют энергию гидролиза АТФ для своей активности. Показано, что за эту "MDR" ответственны несколько механизмов. Наиболее известным и наиболее документированным геном, наделенным такой устойчивостью, связанной с механизмом выведения (expulsion mechanism), зависящим от АТФ, является ген MDR1.
Одновременно с этим явлением устойчивости, индуцированным химиотерапевтическим лечением, также описана индуцированная устойчивость после лечения моноклональными антителами. Эта устойчивость может быть связана с типом хозяина, с фармакологическими соображениями или, кроме этого, она может быть присущей самой опухоли.
Раньше, при первоначальном использовании антител, относящихся к мышиным антителам, в результате получали антительный ответ против указанных мышиных антител, так называемый НАМА (человеческий антимышиный антительный (human anti-mouse antibody))-ответ. Эта форма устойчивости, имеющая отношение к хозяину, частично урегулирована тем, что мышиные антитела перестали применять, а стали использовать человеческие или гуманизированные антитела.
В разных тестах с использованием таких человеческих или гуманизированных антител продемонстрированы новые явления, в результате которых опухоль может быть устойчива к иммунологическим лечениям. В основе этих новых механизмов главным образом лежат мутации, индуцированные в опухоли, конститутивная активация рецепторов с последующим их расщеплением (или шеддингом) или даже потерей экспрессии целевого антигена.
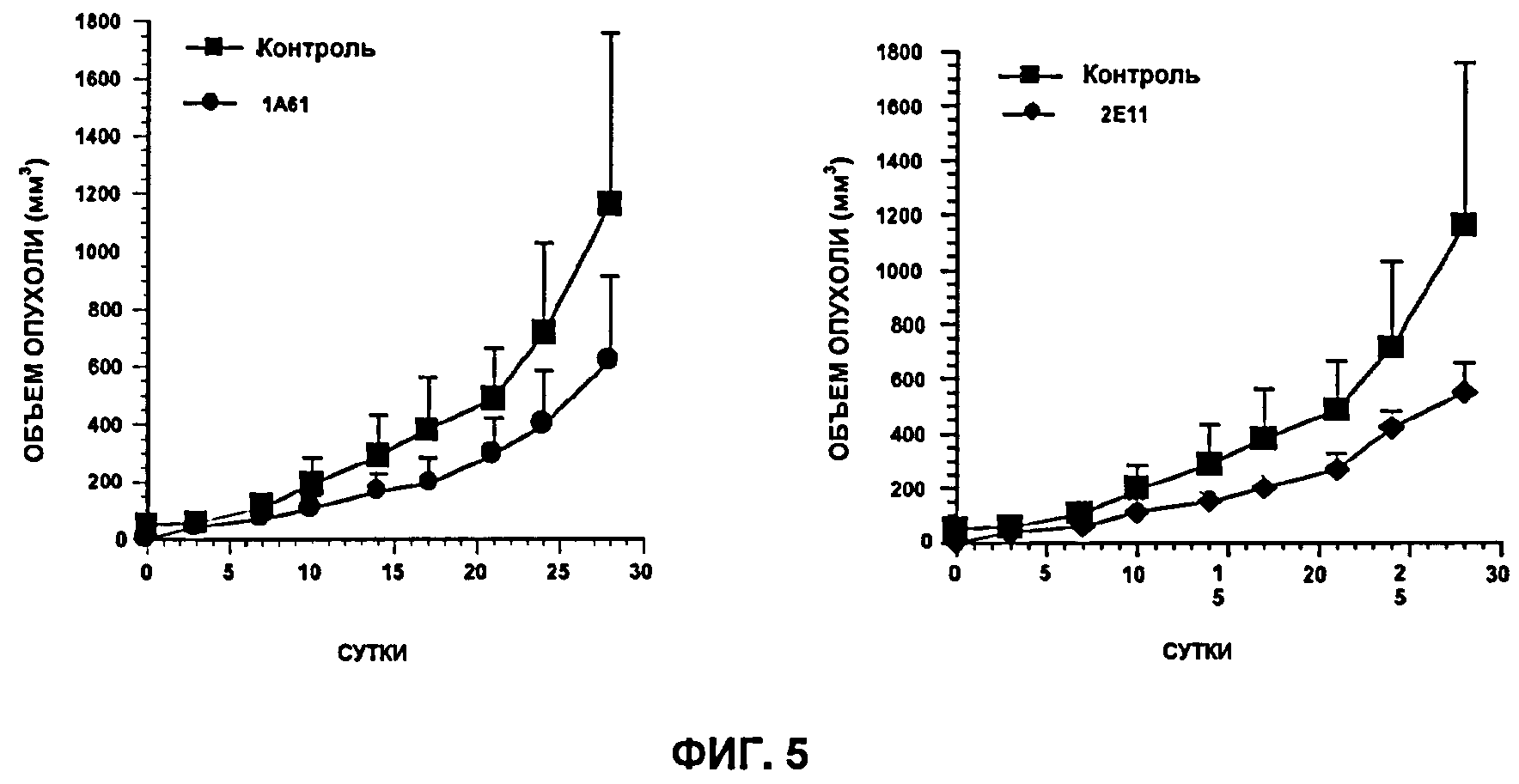
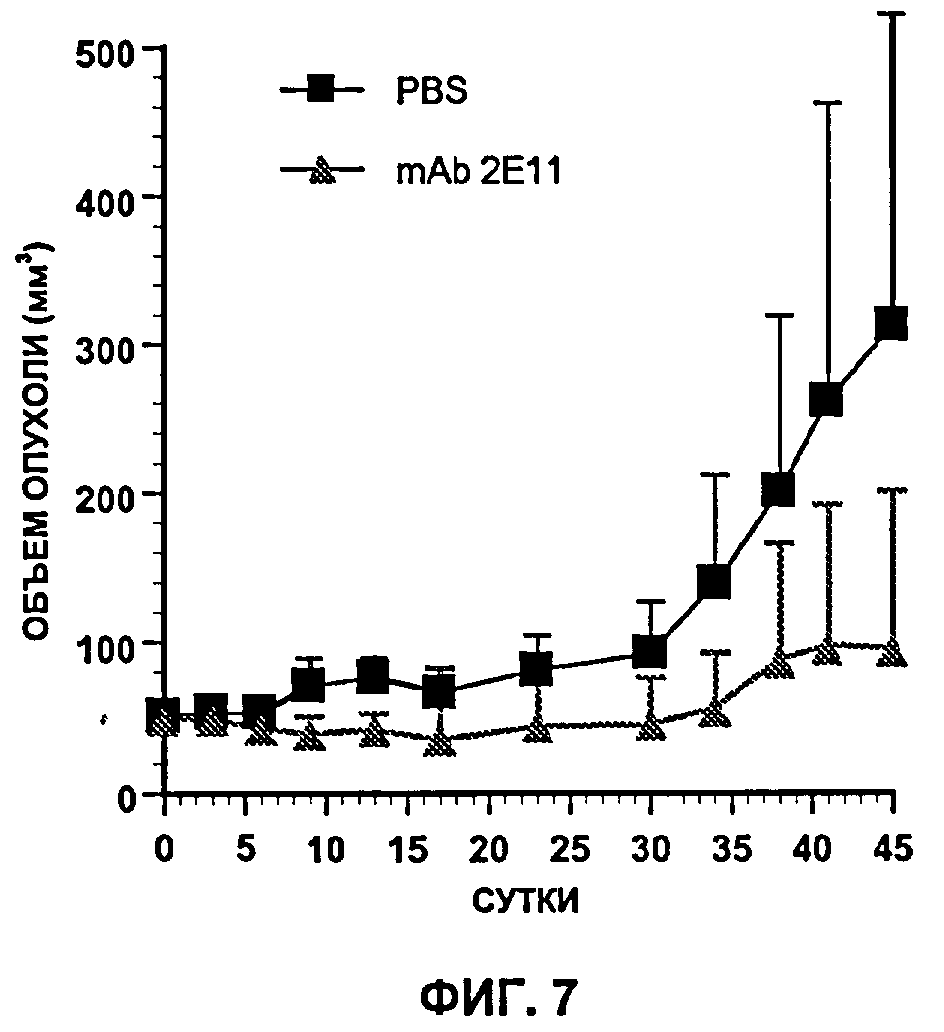
Как будет очевидно далее из Примера 1, исследования, проводимые заявителем, показывают, например, что при тройной терапии с использованием антител против IGF-1R (рецептора инсулиноподобного фактора роста 1 типа), EGFR (рецептора эпидермального фактора роста) и Her/2neu возможно достижение значительного снижения опухолевого роста А549-клеток у бестимусных голых мышей до полного исчезновения опухолей у 90% леченных животных. Несмотря на то что такая множественная терапия существенно более эффективна, чем монотерапия или битерапия, по-видимому опухоли, которые все-таки полностью регрессировали, постепенно появляются вновь, несмотря на продолжение лечения, т.е. они становятся устойчивыми к множественному лечению.
На основании этого наблюдения заявитель впервые предлагает непосредственное применение таких резистентных опухолей для создания антител, предпочтительно терапевтических и/или диагностических моноклональных антител, способных к распознаванию антигенов, экспрессия которых будет индуцирована на поверхности опухолевых клеток этой опухоли, устойчивой к противоопухолевому лечению, и которые не будут экспрессироваться на поверхности опухолевых клеток нативной (нелеченной) опухоли, эти антигены также могут быть вовлечены в устойчивость опухоли к противоопухолевому лечению.
Следовательно, согласно первому аспекту предметом настоящего изобретения является применение измельченного гомогената, и/или суспензии, и/или клеточного лизата из опухоли, устойчивой по меньшей мере к одному противоопухолевому соединению, для иммунизации и создания in vitro антитела или одного из его функциональных фрагментов, направленного против опухолевого антигена, экспрессируемого на поверхности опухолевых клеток указанной резистентной опухоли, при этом данный опухолевый антиген предпочтительно не экспрессируется на поверхности опухолевых клеток нативной опухоли, из которой происходит резистентная опухоль, и этот опухолевый антиген возможно вовлечен в устойчивость указанной опухоли к противоопухолевому соединению.
Под выражением "измельченный гомогенат" или "клеточный гомогенат" понимают смесь клеток и/или клеточных фрагментов, происходящих из опухолей (ксенотрансплантантов, ортотопических трансплантатов, сингенных трансплантатов, хирургических образцов от леченых пациентов, у которых имел место рецидив опухоли, или образцов из клеточных культур), полученную посредством механической диссоциации, например, с использованием ультразвуковой мельницы типа "Potter", мельницы типа Ultraturax® и т.д.
Под выражением "суспензия" или "клеточная суспензия" понимают суспензию клеток, полученных после культивирования in vitro с обработкой или без нее и отсоединенных от поддерживающей их среды с применением ферментативных растворов или неферментативных растворов для диссоциации.
Под выражением "лизат" или "клеточный лизат" понимают смесь клеток и/или клеточных фрагментов, происходящих из опухолей (ксенотрансплантантов, ортотопических трансплантатов, сингенных трансплантатов, хирургических образцов от леченных пациентов, у которых имел место рецидив опухоли, или образцов клеточных культур), полученную посредством ферментативного расщепления (enzymatic dissociation).
Под выражением "резистентная опухоль" понимают опухоль, которая не отвечает или больше не отвечает на применяемое(ые) лечение(я). Как описано выше, такая устойчивость может наблюдаться или после лечения с применением химиотерапии, лучевой терапии, гормонотерапии, или даже в результате конкретного использования антител, эти виды лечения могут применяться по отдельности, либо также в виде комбинации. У истоков такой способности к устойчивости могут стоять различные механизмы, как известные, так и не известные в настоящее время. И наконец, такая устойчивость может выражаться в потере или снижении эффекта первоначально примененного лечения.
Несомненно, известные и описанные явления "ускользания", представляют собой часть явления устойчивости, которое стремятся контролировать с использованием данного изобретения
Под нативной опухолью (или исходной опухолью) в данном описании понимают обозначение опухоли, из которой происходит резистентная опухоль, при этом данная нативная опухоль не подвергалась никакому противоопухолевому лечению в противоположность резистентной опухоли.
Опухолевый антиген понимается в данном описании как относящийся, в частности, к антигенам, экспрессируемым на поверхности опухолевых клеток, независимо от того, происходят ли они из нативной опухоли или из резистентной опухоли, причем этот опухолевый антиген не экспрессируется на поверхности здоровых клеток. В общем случае эти опухолевые антигены представляют собой природные макромолекулы (которые можно синтезировать), с которыми антитело может специфично связываться. Опухолевым антигеном может быть, в частности, полипептид, полисахарид, углевод, нуклеиновая кислота, липид, гаптен или любое другое соединение, естественно присутствующее на поверхности опухолевой клетки.
И наконец, выражения "антитело" или "иммуноглобулин" используются в данном описании взаимозаменяемо в их самом широком смысле и включают моноклональные антитела (например, целые или интактные моноклональные антитела), поликлональные антитела, поливалентные антитела, полиспецифичные антитела (например, биспецифичные антитела, при условии, что они демонстрируют желаемую биологическую активность). Химерные или гуманизированные антитела также подпадают под это обозначение.
Более конкретно, такая молекула представляет собой гликопротеин, содержащий по меньшей мере две тяжелых цепи (Н) и две легких цепи (L), соединенные вместе дисульфидными мостиками. Каждая тяжелая цепь состоит из вариабельной области (или домена) тяжелой цепи (HCVR или VH) и константной области тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов СН1, СН2 и СН3. Каждая легкая цепь состоит из вариабельной области легкой цепи (LCVR или VL) и константной области легкой цепи. Константная область тяжелой цепи содержит LC-домен VH- и VL-области могут быть подразделены на гипервариабельные участки, называемые CDR (определяющие комплементарность участки; "complementary determining regions"), чередующиеся с более консервативными областями, называемыми каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, располагающихся от N-концевой аминокислоты до C-концевой аминокислоты в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелых и легких цепей содержат связывающий домен, который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканями или факторами хозяина, включая разные клетки иммунной системы (например эффекторные клетки) и первый компонент (C1q) системы стандартного комплемента.
Они могут также включать в себя определенные фрагменты антител (экспрессия будет описана более подробно), демонстрирующие желаемую аффинность и специфичность в отношении источника или типа иммуноглобулина (IgG, IgE, IgM, IgA и т.д.).
Как правило, для получения моноклональных антител или их функциональных фрагментов, особенно мышиного происхождения, можно сделать ссылку на методики, описанные, в частности, в справочнике "Antibodies" (Hariow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor NY, pp.726, 1988), или на методики получения из гибридом, описанные Kohler и Milstein (Nature, 256: 495-497, 1975).
Среди антител, попытка создания которых решается настоящим изобретением, предпочтительны антитела, определенные выше, и так называемые "активные" антитела, т.е. обладающие противоопухолевой активностью, нацеленной на опухолевые клетки, устойчивые к терапии.
Среди антител, попытка создания которых решается настоящим изобретением, и в конкретном аспекте изобретения предпочтительны антитела, которые определены выше, и те, которые способны также к проявлению противоопухолевой активности, направленной против опухолевых клеток с агрессивным фенотипом, которые естественно (до лечения) экспрессируют антиген, против которого эти антитела направлены.
В первом воплощении применение по изобретению характеризуется тем, что указанную резистентную опухоль получают непосредственно путем биопсии и/или хирургии от пациента, который проходит или проходил терапевтическое лечение с использованием по меньшей мере указанного противоопухолевого соединения, способного индуцировать устойчивость, или устойчивость к которому данной опухоли установлена.
В этом воплощении адаптированное к каждому пациенту лечение можно рассматривать в том смысле, что в ответ на иммунизацию, осуществляемую с использованием всей резистентной опухоли или ее части, происходящей из реального пациента, вырабатываются антитела согласно изобретению. Таким образом, пациенту может быть предложена необходимая терапия ex vivo.
Во втором воплощении применение по изобретению характеризуется тем, что указанную резистентную опухоль индуцируют посредством трансплантации опухолевой линии и/или всей человеческой опухоли или ее части животному и затем посредством лечения этого животного путем введения, чаще всего посредством инъекции, по меньшей мере одного противоопухолевого соединения, устойчивость к которому желательно индуцировать или установить.
Более конкретно, по меньшей мере одно указанное противоопухолевое соединение выбрано из химиотерапевтических агентов, таких как химические молекулы, или даже из терапевтических антител, или даже из агентов лучевой терапии.
В общем случае во всем настоящем описании термины "противоопухолевый агент" или "противораковый терапевтический агент" предназначены для обозначения вещества, которое, когда его вводят пациенту, лечит рак или предотвращает развитие рака у пациента.
В качестве неограничивающего примера таких агентов могут быть упомянуты так называемые "цитотоксические" агенты, такие как "алкилирующие" агенты, антиметаболиты, противоопухолевые антибиотики, ингибиторы митоза, ингибиторы функционирования хроматина, антиангиогенезные агенты, антиэстрогены, антиандрогены или иммуномодуляторы.
Подобные агенты упоминаются, например, в справочнике ВИДАЛЬ 2006 года издания на странице, посвященной соединениям, относящимся к онкологии и гематологии, в графе "Цитотоксические средства"; эти цитотоксические соединения, упомянутые посредством ссылки в этом документе, упомянуты в данном описании как предпочтительные цитотоксические агенты.
Термин "алкилирующие агенты" относится к любому веществу, которое может образовывать ковалентную связь или алкилировать любую молекулу, предпочтительно нуклеиновую кислоту (например ДНК), в клетке. В качестве примеров таких алкилирующих агентов могут быть упомянуты азотистые аналоги иприта, такие как мехлоретамин, хлорамбуцил, мелфалан, хлоргидрат, пипоброман, преднимустин, фосфат динатрия или эстрамустин; оксазафосфорины, такие как циклофосфамид, альтретамин, трофосфамид, сульфофосфамид или ифосфамид; азиридины или этиленимины, такие как тиотепа, триэтиленамин или альтретамин; нитрозомочевины, такие как кармустин, стрептозоцин, фотемустин или ломустин, алкилсульфонаты, такие как бусульфан, треосульфан или импросульфан; триазены, такие как дакарбазин; или даже комплексы платины, такие как цисплатин, оксалиплатин или карбоплатин.
Термин "антиметаболиты" относится к веществам, которые блокируют рост и/или метаболизм клетки путем воздействия на некоторые виды активности, в особенности на синтез ДНК. Примерами антиметаболитов являются метотрексат, 5-фторурацил, флоксуридин, 5-фтордезоксиуридин, капецитабин, цитарабин, флударабин, цитозинарабинозид, 6-меркаптопурин (6-МР), 6-тиогуанин (6-TG), хлордезоксиаденозин, 5-азацитидин, гемцитабин, кладрибин, дезоксикоформицин и пентостатин.
Термин "противоопухолевые антибиотики" относится к соединениям, которые могут препятствовать синтезу или ингибировать синтез ДНК, РНК и/или белка. Примеры таких противоопухолевых антибиотиков включают доксорубицин, даунорубицин, идарубицин, валрубицин, митоксантрон, дактиномицин, митрамицин, пликамицин, митомицин С, блеомицин и прокарбазин.
"Ингибиторы митоза" препятствуют нормальному прохождению клеточного цикла и митоза. В общем случае, ингибиторы микротрубочек или "таксоиды", такие как паклитаксел и доцетаксел, способны ингибировать митоз. Также способны ингибировать митоз винкаалкалоиды, такие как винбластин, винкристин, виндезин и винорелбин.
Термин "ингибиторы функционирования хроматина" или "ингибиторы топоизомераз" относится к веществам, которые ингибируют нормальное функционирование моделирующих хроматин белков, таких как топоизомеразы I и II. Примеры таких ингибиторов включают, для топоизомеразы I, - камптотецин, а также его производные, такие как иринотекан или топотекан, и для топоизомеразы II, - этопозид, фосфат этипозида и тенипозид.
Термин "антиангиогенезные агенты" относится к любому лекарственному средству, соединению, веществу или агенту, которые ингибируют рост кровяных сосудов. Примеры антиангиогенезных агентов включают, без какого-либо ограничения, разоксин (razoxin), маримастат, батимастат, приномастат, таномастат, иломастат, CGS-27023A, галофугинон, COL-3, неовастат, BMS-275291, талидомид, CDC 501, DMXAA, L-651582, скваламин, эндостатин, SU5416, SU6668, альфа-интерферон, EMD121974, интерлейкин-12, IM862, ангиостатин и витаксин.
Термин "антиэстрогены" или "антиэстрогенные агенты" относится к любому веществу, которое ослабляет, антагонизирует или ингибирует действие эстрогенов. Примерами таких агентов являются тамоксифен, торемифен, ралоксифен, дролоксифен, иодоксифен (lodoxyfene), анастрозол, летрозол и эксеместан.
Термин "антиандрогены" или "антиандрогенные агенты" относится к любому веществу, которое ослабляет, антагонизирует или ингибирует действие андрогена. Примерами антиандрогенов являются флутамид, нилутамид, бикалутамид, спиронолактон, ципротерона ацетат, финастерид и цимитидин.
Иммуномодуляторами являются вещества, которые стимулируют иммунную систему. Примеры таких иммуномодуляторов включают интерферон, интерлейкины, такие как алдеслейкин, ОСТ-43, денилейкин дифлитокс или интерлейкин-2, факторы некроза опухолей, такие как тазонермин, или другие типы иммуномодуляторов, такие как лентинан, сизофиран, роквинимекс, пидотимод, пегадемаза, тимопентин, поли-I:C (полиинозиновая полицитидиловая кислота) или левамизол в комбинации с 5-фторурацилом.
Более подробную информацию специалист в данной области техники может найти в справочнике под редакцией Association Francaise des Enseignants de Chimie Therapeutique с названием "Traite de chimie therapeutique, Vol.6, Medicaments antitumoraux et perspectives dans le traitement des cancers, edition TEC & DOC, 2003".
В качестве противоопухолевых агентов также могут быть упомянуты агенты лучевой терапии, гормонотерапии или терапевтические агенты, направляемые небольшими молекулами, например ингибиторами тирозинкиназ. И наконец, согласно предпочтительному воплощению антитела представляют собой часть противоопухолевых агентов, которые могут быть использованы согласно изобретению. Более конкретно, в качестве неограничивающего примера можно упомянуть следующие антитела: антитела против EGFR, такие как цетуксимаб (С225 или эрбитакс), матузумаб, huR3, HuMax-EGFR или панитумаб; антитела против VEGF (сосудистый эндотелиальный фактор роста), такие как бевацизумаб (авастин) или 2С3; антитела против IGF-1R, такие как 7С10, h7C10, hEM164, АВХ-IGF-1R, Мао (моноклональное антитело (также mAb)) 39, 1Н7 или 4G11; антитела против HER2, такие как трастузумаб (герцептин) или пертузумаб, антитела против CD20 (лейкоцитарный антиген 20), такие как коммеритуксимаб (commentuximab), ибритумомаб или тоситумомаб; антитела против CD33, такие как гемтузумаб или линтузумаб; антитела против CD22, такие как эпратузумаб, антитела против CD52, такие как алемтузумаб; антитела против ЕрСАМ (молекула адгезии эпительальных клеток), такие как эдреколомаб, Ch 17-1А или IGN-101; антитела против СТР21 или 16, такие как Xactin; антитела против ДНК-Ag, такие как131I-Cotara TNT-1 (131I-котара - агент 1 терапии некроза опухолей); антитела против MUC1 (муцин-1), такие как пентумомаб или R1150; антитела против MUC18, такие как АВХ-МА1; антитела против GD3, такие как митумомаб; антитела против СЕА (карциноэмбриональный антиген), такие как CeaVac или лабетузумаб; антитела против СА125, такие как OvaRex; антитела против HLA (главный комплекс гистосовместимости)-DR, такие как аполизумаб; антитела против CTLA4 (цитотоксический Т-лимфоцитарный антиген 4), такие как MDX-010; антитела против PSMA (мембранный антиген предстательной железы), такие как MDX-070,111In и90Y-J591,177Lu J591, J591-DM1; антитела, направленные против антигена Льюиса (anti-Lewis Y antibodies), такие как IGN311; антиангиогенезные антитела, такие как AS1405 и90YmuBd; антитела против Trail-R1 (TNF-related apoptosis-induced ligand receptor 1; рецептор 1 родственного фактору некроза опухоли апоптозиндуцирующего лиганда), такие как TRAIL R1mAb или TRAIL R2mAb; или даже любое антитело, направленное против тирозинкиназного рецептора, отличного от упомянутых выше, или RON (recepteur d'origine nantais) рецептора, сМЕТ-рецептора, CXCR 2 (рецепторов хемокинов типа С-Х-С), CXCR4, рецепторов эфринового типа и т.д., подобно терапиям направленного действия с использованием небольших химических молекул, таких как ингибиторы тирозинкиназ.
Несомненно, этот список никоим образом не является ограничивающим, и его целью является просто упоминание об антителах, используемых или разработанных на сегодняшний день.
Согласно конкретному воплощению изобретения подразумевается, что указанная резистентная опухоль является устойчивой к различным видам лечения или противоопухолевым агентам, при этом последние могут иметь разнообразную природу.
Более конкретно, применение по изобретению характеризуется тем, что указанное по меньшей мере одно противоопухолевое соединение состоит по меньшей мере из двух, предпочтительно по меньшей мере из трех соединений различной природы, и/или имеющих разные механизмы действия, и/или направленных на разные белки.
Под разным механизмом действия понимают, например, то, что противоопухолевые агенты будут воздействовать на разные биологические функции клетки, такие как ангиогенез, синтез ДНК или даже митоз.
Более конкретно, направленное действие на разные белки относится к случаю, когда противоопухолевые агенты являются антителами, способными связываться с белками или рецепторами разной природы.
Совершенно очевидно, что можно рассматривать либо комбинирование только антител друг с другом или только химиотерапевтических агентов друг с другом, либо комбинирование обоих этих семейств соединений друг с другом или с лучевой терапией, гормонотерапевтическими лечениями или терапиями направленного действия, использующими небольшие химические молекулы, как описано выше.
Также предпочтительно, хотя необязательно, чтобы у всех противоопухолевых соединений был бы разный механизм действия или они бы действовали на разные мишени.
Согласно второму аспекту задачей настоящего изобретения является способ создания in vitro антитела или одного из его функциональных фрагментов, направленного против опухолевого антигена, экспрессируемого на поверхности опухоли, устойчивой по меньшей мере к одному противоопухолевому соединению, причем указанный опухолевый антиген предпочтительно не экспрессируется на поверхности опухолевых клеток соответствующей нативной (нелеченной) опухоли, и указанный опухолевый антиген возможно вовлечен в устойчивость указанной опухоли, устойчивой к противоопухолевому лечению, способ, включающий стадию, состоящую из иммунизации животных непосредственно измельченным гомогенатом, и/или суспензией, и/или клеточным лизатом из указанной резистентной опухоли, и стадию, состоящую из отбора антител, распознающих резистентную опухоль, а не нативную опухоль, из которой происходит резистентная опухоль.
Согласно конкретному аспекту этого способа по изобретению описан способ создания in vitro антитела или одного из его функциональных фрагментов, направленного против опухолевого антигена, экспрессируемого на поверхности резистентной опухоли, возможно вовлеченного в устойчивость указанной резистентной опухоли, включающий иммунизацию животных непосредственно измельченным гомогенатом, и/или суспензией, и/или клеточным лизатом из указанной опухоли, устойчивой по меньшей мере к одному противоопухолевому соединению (противоопухолевому соединению, устойчивость к которому данной опухоли была установлена или устойчивость к которому желательно индуцировать), либо после толеризации животных измельченным гомогенатом, и/или суспензией, и/или клеточным лизатом из нативной опухоли (опухоли, не подвергавшейся какому-либо лечению), либо без толеризации. Целью этой толеризации, которую проводят с использованием иммуносупрессивного агента типа циклофосфамида, является подавление иммунного ответа, направленного против всех поверхностных антигенов, присутствующих до проведения противоопухолевого лечения(ий), применяемого к животному или человеку с целью индукции устойчивости или в рамках терапии, касающейся людей. Таким образом, иммунный ответ после введения, особенно посредством инъекции, препаратов из резистентных опухолей будет сфокусирован на структурах поверхностей, индуцированных лечением и потенциально вовлеченных в установление устойчивости опухоли. Эффективность толеризации оценивают на основании последующего исчезновения сывороточного титра, устанавливаемого после иммунизации животных опухолевыми клетками из нативной опухоли.
Затем производят отбор образцов селезенок мышей, иммунизированных согласно вышеупомянутому способу, и производят слияние спленоцитов с миеломными клетками в соответствии со стандартным способом, известным специалисту в данной области техники.
Скрининг гибридом, полученных после этого клеточного слияния, будет проведен посредством "дифференциальной иммуногистохимии" на предметных стеклах, приготовленных заранее и несущих срезы (нелеченных) "нативных опухолей" или срезы резистентных опухолей (леченных как одним, так и многими противоопухолевыми агентами). С целью продуцирования антител и тестирования их на предмет их противоопухолевой активности будут отобраны, клонированы и заморожены только гибридомы, продуцирующие антитела, распознающие резистентную опухоль, но не нативные опухоли. Целиком этот способ будет схематически изображен впоследствии на Фиг.2 и 3. Следует отметить, что такой подход также может быть предложен для поиска и выявления внутриклеточных молекул, вовлеченных в устойчивость.
Определенные выше антитела по настоящему изобретению предпочтительно представляют собой специфичные, в особенности мышиные, химерные или гуманизированные моноклональные антитела, которые могут быть получены согласно стандартным способам, хорошо известным специалисту в данной области техники.
В общем случае для получения моноклональных антител или их функциональных фрагментов, особенно мышиного происхождения, можно сослаться на методики, описанные, в частности, в справочнике "Antibodies" (Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor NY, pp.726, 1988) или на методику получения из гибридом, описанную Kohler и Milstein (Nature, 256: 495-497, 1975).
В качестве антител по настоящему изобретению также включены химерные или гуманизированные антитела.
Химерное антитело предназначено для обозначения антитела, которое содержит природную вариабельную область (легкой цепи и тяжелой цепи), происходящую из антитела заданного вида, в ассоциации с константными областями легкой цепи и тяжелой цепи антитела, гетерологичного указанному заданному виду (мыши, лошади, кролики, собаки, коровы, курицы и т.д.).
Антитела или их фрагменты химерного типа по изобретению могут быть получены путем использования методик генетической рекомбинации. Например, химерное антитело может быть получено посредством клонирования рекомбинантной ДНК, включающей в себя промотор и последовательность, кодирующую вариабельную область не человеческого, особенно мышиного, моноклонального антитела по изобретению, и последовательность, кодирующую константную область человеческого антитела. Химерное антитело по изобретению, кодируемое таким рекомбинантным геном, будет представлять собой, например человеко-мышиную конструкцию, причем специфичность этого антитела будет определяться вариабельной областью, происходящей из мышиной ДНК, а его изотипы - константной областью, происходящей из человеческой ДНК. В отношении способов получения химерных антител можно сослаться, например на документ Verhoeyn и др. (BioEssays, 8: 74, 1988), Morrison и др. (Proc. Natl. Acad Sci. USA 82: 6851-6855, 1984) или патент США 4816567.
Гуманизированное антитело предназначено для обозначения антитела, которое содержит CDR-участки, происходящие из антитела не человеческого происхождения, причем другие части молекулы данного антитела происходят из одного (или более чем одного) человеческого антитела. К тому же, некоторые из остатков сегментов остова (skeleton) (называемых FR) могут быть заменены с целью сохранения аффинности связывания (Jones et al., Nature, 321: 522-525, 1986; Verhoeyen et al., Science, 239: 1534-1536, 1988, Riechmann et al., Nature, 332: 323-327, 1988).
Гуманизированные антитела по изобретению или их фрагменты могут быть получены с использованием методик, известных специалисту в данной области техники (таких как, например, описанные в документах Singer et al., J. Immun. 150: 2844-2857, 1992, Mountain et al., Biotechnol Genet. Eng Rev., 10. 1-142, 1992; или Bebbington et al., Bio/Technology, 10: 169-175, 1992).
Специалисту в данной области техники также известны и другие методики получения гуманизированных антител, такие как, например, методика "CDR-привития" ("CDR Grafting"), описанная PDL (Public Documentation License), являющаяся предметом изобретения патентов ЕР 0451261, ЕР 0682040, ЕР 0939127, ЕР 0566647 или еще US 5530101, US 6180370, US 5585089 и US 5693761. Также можно упомянуть патенты US 5639641 или еще US 6054297, US 5886152 и US 5877293.
Функциональный фрагмент антитела по изобретению предназначен, в частности, для обозначения такого фрагмента антитела, как фрагменты Fv, scFv (одноцепочечные Fv; sc от англ. simple chain), Fab, F(ab')2, Fab', scFv-Fc, или диатела либо любого фрагмента, продолжительность существования (lifetime) которого была бы увеличена посредством химической модификации, подобной добавлению поли(алкилен)гликоля, такого как полиэтиленгликоль (ПЭГ), в результате "ПЭГилирования", или посредством инкорпорирования в лизосомы. Указанный фрагмент обычно содержит по меньшей мере один из характерных CDR того антитела, из которого он происходит, и обычно способен к проявлению хоть частичной активности антитела, из которого он происходит.
Предпочтительно, указанные функциональные сегменты будут состоять из частичной последовательности или содержать частичную последовательность тяжелой или легкой вариабельной цепи антитела, из которого они происходят, причем указанная частичная последовательность по существу будет надлежащим образом сохранять ту же специфичность связывания, что и антитело, из которого она происходит, и достаточную аффинность, предпочтительно по меньшей мере эквивалентную 1/100, более предпочтительно по меньшей мере 1/10 от аффинности антитела, из которого она происходит.
Такой функциональный фрагмент будет включать как минимум 5 аминокислот, предпочтительно 10, 15, 25, 50 и 100 последовательных аминокислот из последовательности антитела, из которого он происходит.
Предпочтительно, эти функциональные фрагменты будут представлять собой фрагменты типа Fv, scFv, Fab, F(ab')2, F(ab'), scFv-Fc или диатела, которые обычно имеют ту же специфичность связывания, что и антитело, из которого они происходят. Согласно настоящему изобретению фрагменты антител по изобретению могут быть получены из антител так, как описано ранее, такими способами, как переваривание ферментами, такими как пепсин или папаин, и/или посредством расщепления дисульфидных мостиков в результате химического восстановления. По-другому, фрагменты антител по настоящему изобретению могут быть получены с применением методик генетической рекомбинации, также хорошо известных специалисту в данной области техники, или даже посредством пептидного синтеза, например с применением автоматических пептидных синтезаторов, как например, которые выпускаются Applied Biosystems, и т.д.
Более предпочтительно, изобретение включает антитела или их функциональные фрагменты по настоящему изобретению, особенно химерные или гуманизированные антитела, полученные посредством генетической рекомбинации или путем химического синтеза.
Согласно предпочтительному воплощению способа по изобретению указанную иммунизацию проводят посредством внутрибрюшинной, и/или подкожной, и/или внутривенной, и/или внутриселезеночной инъекции. Поскольку каждый способ иммунизации равноценен другому, выбор одного из них относительно другого делают в соответствии с используемыми животными и знаниями и опытом специалиста в данной области техники.
Более конкретно, согласно первому воплощению результирующую опухоль получают непосредственно путем биопсии и/или хирургии от пациента, который проходит или проходил терапевтическое лечение с использованием по меньшей мере одного противоопухолевого соединения, способного индуцировать устойчивость, или устойчивость к которому (данной опухоли) установлена.
Согласно второму воплощению резистентную опухоль индуцируют посредством трансплантации опухолевой линии и/или всей человеческой опухоли или ее части животному и затем посредством лечения этого животного путем введения инъекцией по меньшей мере одного противоопухолевого соединения, устойчивость к которому желательно индуцировать или установить.
Каким бы ни было описанное выше предпочтительное воплощение, способ по изобретению характеризуется тем, что указанное активное антитело или один из его функциональных фрагментов представляет собой моноклональное антитело.
Более конкретно, указанное моноклональное антитело или один из его функциональных фрагментов представляет собой иммуноглобулин, выбранный из группы, состоящей из IgG, IgA, IgM, IgD или IgE.
Еще более предпочтительно, когда указанное моноклональное антитело или один из его функциональных фрагментов представляет собой IgG изотипа гамма 1, гамма 2 или гамма 4.
Однако следует понимать, что согласно изобретению предпочтительны иммуноглобулины типов IgG1 и IgG2 ввиду их способности индуцировать эффекторные функции.
Как правило, специалисту в данной области будет очевидно, что эффекторные функции включают, в качестве неограничивающего примера, связывание с C1q, CDC (комплементзависимую цитотоксичность), связывание с рецептором Fc, ADCC (антителозависимую клеточную цитотоксичность) и фагоцитоз.
Более конкретно, предпочтительными эффекторными функциями по изобретению являются ADCC и CDC.
В общем случае функциональные фрагменты, к которым данное изобретение относится, выбраны из фрагментов Fv, Fab, (Fab')2, Fab', scFv, scFv-Fc и диател или любого фрагмента, продолжительность существования которого будет увеличена, подобно ПЭГилированным фрагментам.
В более конкретном, но ни в коей мере неограничивающем способе, способ по изобретению включает по меньшей мере следующие стадии:
i) непосредственную иммунизацию животных измельченным гомогенатом, и/или суспензией, и/или клеточным лизатом, происходящими из резистентной опухоли,
ii) слияние клеток селезенки животного, иммунизированного на стадии i), с миеломными клетками с получением гибридом и
iii) отбор посредством дифференциальной селекции (differential selection) гибридом, секретирующих антитела, специфично распознающие антигены, экспрессируемые на поверхности опухолевых клеток резистентной опухоли, и экспрессия которых индуцируется в результате противоопухолевого лечения.
Под "дифференциальной селекцией" понимают любой вид селекции, основанный на способах, посредством которых индуцированные антигены можно отличить по появлению устойчивости к лечению от антигенов, присутствующих на клетках до установления этой устойчивости.
В качестве неограничивающего примера методики, обеспечивающей такую "дифференциальную селекцию", можно упомянуть иммуногистохимию на замороженных срезах или включенных в парафин образцах либо подходы по типу "белковых массивов" или "генных массивов".
Более конкретно, использование так называемой методики "тканевого массива" является предпочтительным. Методика "тканевого массива" состоит в построении из блоков тканей, включенных в парафин или замороженных, новых блоков, содержащих от нескольких десятков до нескольких сотен сердцевин (cores) этих тканей, так, чтобы после разрезания этих блоков "тканевых массивов" имелась возможность изготовления предметных стекол микроскопа, содержащих от нескольких десятков до нескольких сотен срезов тканей.
Согласно предпочтительному воплощению способ по изобретению дополнительно включает перед стадией i), описанной выше, следующие стадии:
a) отбор животных и трансплантацию животным опухолевой линии и/или всей так называемой "нативной" опухоли или ее части,
b) лечение части этих подвергнутых трансплантации животных по меньшей мере одним противоопухолевым соединением,
c) извлечение целиком или частей так называемых "нативных" опухолей из нелеченных животных, подвергнутых трансплантации на стадии а),
d) извлечение целиком или частей резистентных опухолей из животных, леченных на стадии b),
e) подготовку средства для дифференциальной селекции антител из опухолей, полностью или частично извлеченных на стадиях с) и d), соответственно, и
f) подготовку измельченного гомогената и/или клеточного лизата из резистентных опухолей, полностью или частично извлеченных на стадии d).
Следует понимать, что в настоящем описании выражения "нативные опухоли" и "исходные опухоли" являются эквивалентными и будут использоваться независимо.
Согласно воплощению изобретения указанная опухолевая линия и/или так называемая "нативная" опухоль выбрана из группы опухолевых клеток (А549) из легких, и кроме того, но этим не ограничиваясь, из толстой кишки, предстательной железы, молочных желез, яичников или любой опухоли, устойчивости которых к лечению установлены.
В дополнение к этому, противоопухолевое соединение, используемое согласно изобретению, выбрано из химиотерапевтических агентов, агентов лучевой терапии, химических молекул или антител, причем все эти разные соединения определены выше в настоящем описании.
Согласно предпочтительному воплощению изобретения указанное по меньшей мере одно противоопухолевое соединение представляет собой моноклональное антитело, причем указанное моноклональное антитело даже более предпочтительно выбрано из группы антител или их функциональных фрагментов, направленных против рецепторов ростовых факторов, молекул, вовлеченных в ангиогенез, или даже хемокинов и интегринов, вовлеченных в явления клеточной миграции.
Под "ростовыми рецепторами" понимают любой трансмембранный белок, который после связывания лиганда(ов) или независимого изменения конформации лиганда либо гомо- или гетеродимеризации с другими мембранными белками будет опосредовать пролиферативный ответ. Под "молекулами, вовлеченными в ангиогенез", понимают любой мембранный рецептор, который после связывания лиганда(ов) или независимого изменения конформации лиганда либо гомо- или гетеродимеризации с другими мембранными белками будет вызывать образование сосудов.
Под "хемокинами и интегринами, вовлеченными в явления клеточной миграции" понимают любую растворимую молекулу, способную обладать активностью переваривания внеклеточного матрикса и/или хемоаттрактантной активностью.
Согласно другому воплощению изобретения способ характеризуется тем, что указанное по меньшей мере одно противоопухолевое соединение представляет собой комбинацию по меньшей мере двух, предпочтительно по меньшей мере трех противоопухолевых соединений различной природы, и/или характеризующихся различными механизмами действия, и/или направленных на разные белки.
Предпочтительно, указанная комбинация противоопухолевых соединений состоит из комбинации моноклональных антител или их функциональных фрагментов.
Еще более предпочтительно, указанная комбинация моноклональных антител или их функциональных фрагментов состоит из комбинации антител, выбранных из антител против IGF-1R, против EGFR, против Her/2neu, против VEGF, против VEGFR (рецептора VEGF), против CXCR, против смет, против RON, эфринового антитела и т.д.
Согласно воплощению, в качестве неограничивающего примера, способ по изобретению характеризуется тем, что указанная комбинация представляет собой комбинацию антитела против IGF-1R, антитела против EGFR и антитела против Her/2neu, причем указанные упомянутые антитела предпочтительно представляют собой моноклонапьные антитела 7С10, 225 и h4D5, соответственно.
Моноклональное антитело 7С10 представляет собой антитело, описанное в заявке на патент WO 03/059951, поданной заявителем 20 января 2003 года, и содержание которой включено в данное описание посредством ссылки.
Моноклональное антитело 225 представляет собой антитело, продуцируемое гибридомой, депонированной в АТСС под ссылочным номером НВ-8508.
Моноклональное антитело h4D5 представляет собой имеющийся в продаже герцептин, например в ICR (Institut Claudius Regaud).
Согласно другому предпочтительному воплощению способ по изобретению характеризуется тем, что указанную стадию iii) для проведения селекции гибридом, секретирующих антитела, которые не распознают антигены так называемой "нативной" опухолевой клетки, выполняют путем дифференциального скрининга между тканью нелеченной так называемой "нативной" опухоли и тканью резистентной опухоли и/или опухоли, которая сделана резистентной.
Под "дифференциальным скринингом" понимается скрининг, посредством которого индуцированные антигены можно отличить по появлению устойчивости к лечению от антигенов, присутствующих на клетках до установления этой устойчивости. Предпочтительно, когда дифференциальный скрининг проводят, применяя средство, полученное на стадии е), как описано выше.
И наконец, согласно последнему воплощению изобретения предпочтительно, что данный способ включает дополнительную стадию толеризации перед стадией i).
Под "толеризацией" понимается ослабление иммунного ответа, индуцированное посредством иммуносупрессивных соединений, таких как циклофосфамид. На практике указанная стадия толеризации может состоять из:
- введения, особенно путем инъекции, животным измельченного гомогената, и/или суспензии, и/или клеточного лизата, полученных из так называемых нативных опухолей, происходящих со стадии с), и
- обработки этих животных иммуносупрессором с целью элиминирования В-клеток, активированных инъекцией на описанной выше стадии, и тем самым ингибирования любого возможного ответа против указанной так называемой нативной опухоли.
Несомненно, любой похожий способ или практическая деятельность, с помощью чего может быть получен тот же самый результат, следует рассматривать эквивалентным и включенным в объем изобретения. Под "иммуносупрессором", понимают любое вещество, способное истощать (depleting) клеточные популяции иммунной системы. В качестве неограничивающего примера может быть упомянут циклофосфамид.
В другом аспекте настоящее изобретение относится к способу создания и отбора in vitro антитела или одного из его функциональных фрагментов, способного ингибировать устойчивость опухоли к противоопухолевому соединению, или к способу создания и отбора in vitro антитела или одного из его функциональных фрагментов, направленного против опухолевого антигена, экспрессируемого на поверхности опухоли, устойчивой по меньшей мере к одному противоопухолевому соединению, причем указанный опухолевый антиген вовлечен в устойчивость указанной опухоли к противоопухолевому соединению, способу, характеризующемуся тем, что он включает:
a) способ создания in vitro антитела или одного из его функциональных фрагментов по изобретению, причем указанное антитело направлено против указанного опухолевого антигена, специфично экспрессируемого на поверхности резистентной опухоли, указанный опухолевый антиген не экспрессируется на поверхности клеток нативной опухоли, из которой данная резистентная опухоль происходит;
b) приведение полученного на стадии а) антитела in vitro или in vivo в контакт с опухолью, устойчивой к противоопухолевому соединению, и
c) отбор указанного антитела, если продемонстрирован ингибирующий эффект этого антитела на устойчивость опухоли к противоопухолевому соединению.
Согласно другому воплощению может быть проведен тест in vitro или in vivo с целью определения того, вовлечен ли антиген, экспрессию которого индуцируют противоопухолевым лечением, в явление устойчивости или нет. Согласно предпочтительному воплощению такая стадия может состоять в тестировании in vitro или in vivo антитела, полученного в соответствии с изобретением, на резистентной опухоли и наблюдением того, развивается ли на резистентной опухоли ингибирующая устойчивость активность.
Еще один другой аспект настоящего изобретения относится к способу создания и отбора in vitro антитела или одного из его функциональных фрагментов, способного проявлять противоопухолевую активность, особенно путем ингибирования пролиферации опухолевых клеток, экспрессирующих антиген, против которого направлено указанное антитело, характеризующемуся тем, что способ включает:
а) способ создания in vitro антитела или одного из его функциональных фрагментов по изобретению, причем указанное антитело направлено против указанного опухолевого антигена, специфично экспрессируемого на поверхности резистентной опухоли, указанный опухолевый антиген не экспрессироуется на поверхности клеток нативной опухоли, из которой резистентная опухоль происходит;
b) приведение полученного на стадии а) антитела in vitro или in vivo в контакт с опухолью, клетки которой экспрессируют указанный опухолевый антиген, предпочтительно с указанной резистентной опухолью, использованной на стадии а), или с опухолью, имеющей агрессивный фенотип; и
c) отбор указанного антитела, если на этой опухоли продемонстрирован противоопухолевой эффект, в особенности ингибирование клеточной пролиферации этой опухоли.
На стадии b) способа, приведенного ранее, следует понимать, что опухоль, клетки которой экспрессируют указанный опухолевый антиген, не обязательно является опухолью, устойчивой к противоопухолевому соединению, использованному для создания указанного антитела. На стадии b) может быть использована любая опухоль, особенно с агрессивным фенотипом, опухолевые клетки которой экспрессируют опухолевый антиген, распознаваемый указанным антителом.
Кроме того, изобретение очевидно относится к применению описанного выше способа для создания терапевтических и/или диагностических моноклональных антител. Изобретение также охватывает частичное применение такого способа, который может быть разработан специалистом в данной области техники с целью удовлетворения конкретному критерию или, иначе, с целью совсем полного отличия от настоящего описания. Согласно третьему аспекту изобретения предложены моноклональное антитело или один из его функциональных фрагментов, полученное(ый) в результате применения описанного выше способа по изобретению.
Настоящее изобретение является передовым в том смысле, что на данный момент не описано ни одного антитела, обладающего такими свойствами, более того, полученного таким способом.
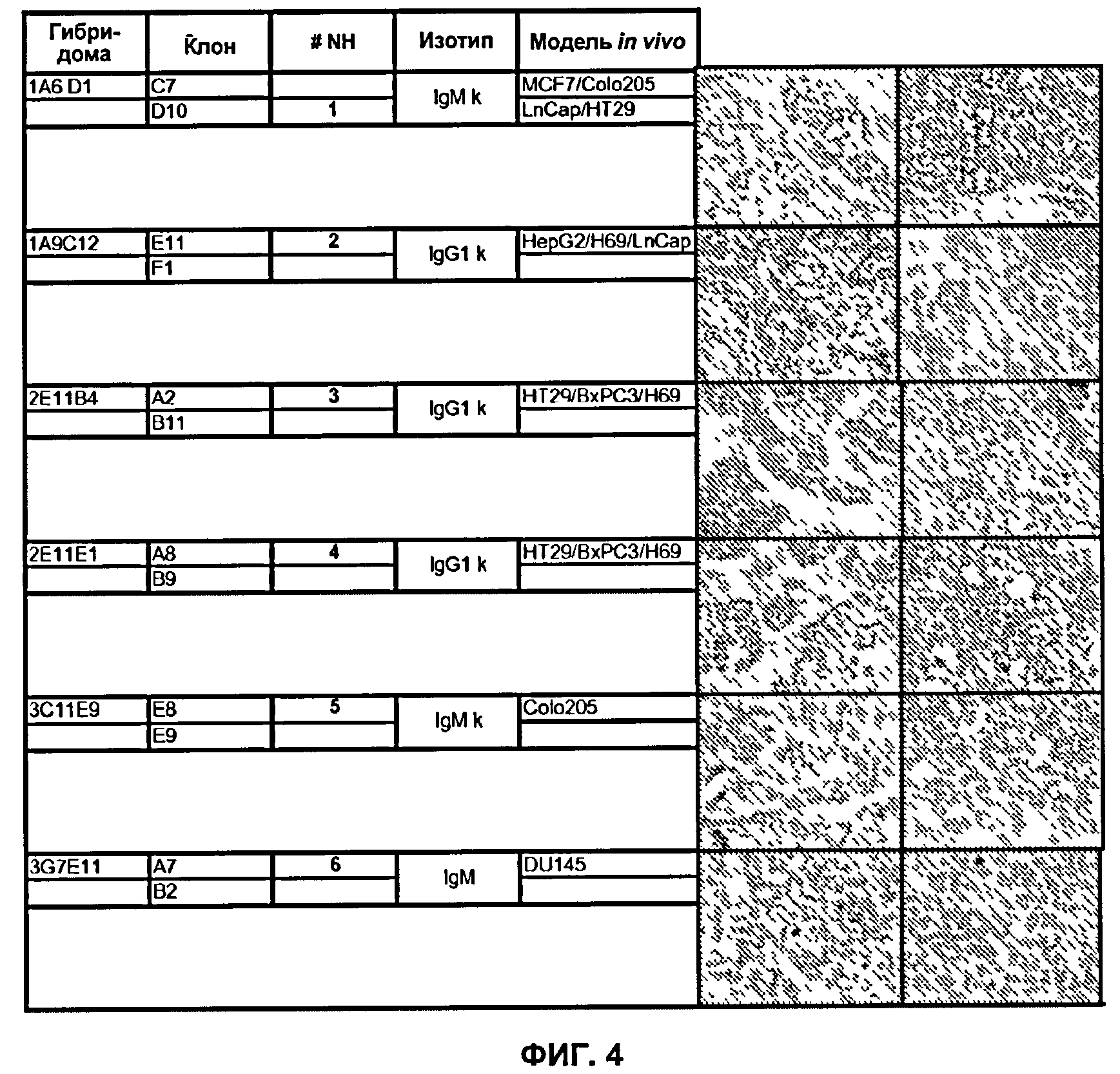
Предпочтительно, указанные функциональные фрагменты по настоящему изобретению будут выбраны из фрагментов Fv, scFv, Fab, (Fab')2, Fab', scFv-Fc или диател либо любого функционального фрагмента, продолжительность существования которого была бы увеличена посредством химической модификации, особенно в результате "ПЭГилирования", или посредством инкорпорирования в лизосому. Несомненно, этот список ни в коей мере не является ограничивающим, или любой другой тип фрагмента, известного специалисту в данной области техники, следует рассматривать как часть изобретения. В качестве иллюстративного примера изобретения далее описаны 5 антител, полученных путем применения данного способа по изобретению. Эти антитела, названные как 1А6, 1А9, 2Е11, 3С11 и 3G7, могут быть мышиными, химерными или гуманизированными.
Согласно первому воплощению настоящее изобретение относится к моноклональному антителу или одному из его функциональных фрагментов, характеризующимся тем, что он/оно содержит:
- легкую цепь, содержащую CDR-участки последовательностей SEQ ID No 1, 2 и 3, или для которых последовательности имеют по меньшей мере 80% идентичности после оптимального выравнивания с последовательностями SEQ ID No 1, 2 и 3; и
- тяжелую цепь, содержащую CDR-участки последовательностей SEQ ID No 4, 5 и 6, и для которых последовательности имеют по меньшей мере 80% идентичности после оптимального выравнивания с последовательностями SEQ ID No 4, 5 и 6.
В настоящем описании термины полипептиды, полипептидные последовательности, пептиды и белки, связанные с антителами или их последовательностями, взаимозаменяемы.
Здесь следует понимать, что изобретение не относится к антителам в их природной форме, т.е. они не берутся в их природном окружении, а существует возможность их выделения и получения посредством очистки из природных источников или также получения их с использованием генетической рекомбинации или с применением химического синтеза, и поэтому они могут включать неприродные аминокислоты, как будет описано ниже.
CDR-участок(ки) или CDRs предназначены для обозначения гипервариабельных участков тяжелых и легких цепей иммуноглобулинов, как определено Kabat и др. (Kabat et al., Sequences of proteins of immunological interest, 5th Ed, U.S. Department of Health and Human Services, NIH, 1991, и более поздние издания). Существуют 3 CDR тяжелых цепей и 3 CDR легких цепей. Термин CDR или CDRs используется в данном описании для обозначения, в зависимости от случая, одного из этих участков или нескольких либо даже всех этих участков, которые содержат большую часть аминокислотных остатков, ответственных за аффинное связывание антителом антигена или эпитопа, который оно распознает.
"Процент идентичности" между двумя последовательностями нуклеиновых кислот или аминокислот в контексте настоящего изобретения предназначен для обозначения процента нуклеотидов или идентичных аминокислотных остатков между обеими сравниваемыми последовательностями, полученного после наилучшего выравнивания (оптимального выравнивания), при том, что этот процент является чисто статистическим, и различия между обеими последовательностями распределены случайным образом и по всей их длине. Сравнение последовательностей двух нуклеиновых кислот или двух аминокислотных последовательностей традиционно проводят, сравнивая эти последовательности после выравнивания их оптимальным образом, при этом указанное сравнение может быть проведено посредством сравнения сегментов или с использованием "окна сравнения". Оптимальное выравнивание последовательностей для их сравнения может быть осуществлено также и вручную с применением алгоритма локальной гомологии Smith и Waterman (1981) (Ad. App. Math 2: 482), с применением алгоритма локальной гомологии Neddleman et Wunsch (1970) (J. Mol. Biol. 48:443), с применением аналогичного способа поиска Pearson и Lipman (1988) (Proc. Natl. Acad. Sci. USA 85: 2444), с применением пакетов компьютерных программ, использующих эти алгоритмы (GAP, BESTFIT, FASTA и TFASTA в пакете программ Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., Madison, WI, или даже с применением пакетов программ для такого сравнения BLAST N или BLAST Р).
Процент идентичности между двумя последовательностями нуклеиновых кислот или аминокислот определяют посредством сравнения этих двух последовательностей, выравненных оптимальным способом, при этом сравниваемая последовательность нуклеиновых кислот или аминокислот может содержать добавки или делеции относительно эталонной последовательности (reference sequence) для осуществления оптимального выравнивания между обеими последовательностями. Процент идентичности рассчитывают, определяя число идентичных положений, в которых нуклеотидный или аминокислотный остаток будет одинаковым в двух последовательностях, и производя деление этого числа идентичных положений на общее число положений в окне сравнения и производя умножение полученного результата на 100 для получения процента идентичности между обеими этими последовательностями.
Например, можно использовать программу BLAST "BLAST 2 sequences" (Tatusova et al, "Blast 2 sequences - a new tool for comparing protein and nucleotide sequences", FEMS Microbiol. Lett 174: 247-250), доступную на сайте http://www.ncbi.nlm.nih.gov/gorf/bl2.html, с параметрами, используемыми по умолчанию (в частности, что касается параметров "штраф на внесение делеции" ("gap open penalty"): 5, и "штраф на продолжение делеции" ("extension gap penalty": 2; при этом выбранной матрицей является, например, матрица "BLOSUM 62", предложенная этой программой), процент идентичности между обеими сравниваемыми последовательностями непосредственно вычисляется этой программой. Можно также использовать другие программы, такие как пакеты программного обеспечения "ALIGN" или "Megalign" (DNASTAR).
Среди аминокислотных последовательностей, имеющих по меньшей мере 80%, предпочтительно 85%, 90%, 95% и 98% идентичности с эталонной аминокислотной последовательностью, предпочтительны последовательности, имеющие относительно эталонной последовательности определенные модификации, в частности делецию, добавку или замену по меньшей мере одной аминокислоты, укорочение или вставку. В случае замены одной или более расположенных друг за другом или не расположенных друг за другом аминокислот предпочтительны замены, при которых заменяемые аминокислоты заменяются "эквивалентными" аминокислотами. Выражение "эквивалентные аминокислоты" в настоящем описании предложено для обозначения любой аминокислоты, которой можно заменить одну из аминокислот базисной структуры, однако, без существенного изменения биологических активностей соответствующих антител, которые будут определены впоследствии, особенно в примерах.
Эти эквивалентные аминокислоты можно определить, полагаясь либо на их структурную гомологию с аминокислотами, которых они заменяют, либо на результаты сравнительных тестов биологической активности между разными антителами, которые могут быть проведены.
В качестве неограничивающего примера в приведенной ниже Таблице 1 повторены возможности замен, которые могут быть проведены без большого влияния на биологическую активность соответствующего модифицированного антитела, обратные замены естественно могут рассматриваться в тех же самых условиях.
Предпочтительным является описанное выше антитело, получившее название 1А6 и содержащее последовательность тяжелой цепи, соответствующую последовательности SEQ ID No 7, и легкую цепь, содержащую последовательность SEQ ID No 8.
Более конкретно, настоящее изобретение также относится к мышиной гибридоме (1А6), способной секретировать антитело 1А6, которое описано выше. В настоящем описании независимо используется одна и та же кодировка, когда речь идет о мышиной гибридоме или также об антителе, продуцируемом той же гибридомой.
Такая мышиная гибридома представляет собой гибридому, депонированную в CNCM (Collection Nationale de Cultures de Microorganismes), Institut Pasteur, Pans (France) 31 мая 2006 года под №1-3612. Среди шести коротких CDR-последовательностей третий CDR тяжелой цепи (CDRH3) характеризуется большой степенью вариабельности (большое разнообразие по существу вследствие механизмов организации генов, приводящих к нему). Он может быть таким коротким, как 2 аминокислоты, тогда как самый больший известный размер равен 26. Функционально CDRH3 играет отдельную роль в определении специфичности антитела (Segal et al., PNAS, 71: 4298-4302, 1974; Amit et al., Science, 233: 747-753, 1986; Chothia et al, J Mol Biol, 196: 901-917, 1987, Chothia et al., Nature, 342: 877-883, 1989; Caton et al., J. Immunol, 144: 1965-1968, 1990, Sharon et al, PNAS, 87: 4814-4817, 1990, Sharon et al., J. Immunol, 144: 4863-4869, 1990, Kabat et al., J. Immunol, 147:1709-1719, 1991).
Известно, что только небольшой процент аминокислот CDRs вносит вклад в строение сайта связывания данного антитела, однако эти остатки должны поддерживаться в очень специфической пространственной конформации.
Согласно второму воплощению изобретение относится к моноклональному антителу или одному из его функциональных фрагментов, характеризующемуся тем, что оно/он содержит:
- легкую цепь, содержащую CDR-участки последовательностей SEQ ID No 9, 10 и 11, или для которых последовательности имеют по меньшей мере 80% идентичности после оптимального выравнивания с последовательностями SEQ ID No 9, 10 и 11; и
- тяжелую цепь, содержащую CDR-участки последовательностей SEQ ID No 12, 13 и 14, или для которых последовательности имеют по меньшей мере 80% идентичности после оптимального выравнивания с последовательностями SEQ ID No 12, 13 и 14.
Согласно другому воплощению указанное антитело по изобретению, получившее название 1А9, содержит последовательность тяжелой цепи, соответствующую последовательности SEQ ID No 15, и легкую цепь, содержащую последовательность SEQ ID No 16.
Согласно другому аспекту также заявлена мышиная гибридома (1А9), способная секретировать антитело, определенное выше.
И наконец, согласно предпочтительному воплощению изобретения включена мышиная гибридома 1А9, депонированная в CNCM (Collection Nationale de Cultures de Microorganismes), Institut Pasteur, Pans (France) 31 мая 2006 года под № I-3613.
Согласно третьему воплощению изобретение относится к моноклональному антителу или одному из его функциональных фрагментов, полученному согласно способу изобретения и содержащему:
- легкую цепь, содержащую CDR-участки с последовательностями SEQ ID No 17, 18 и 19, или для которых последовательности имеют по меньшей мере 80% идентичности после оптимального выравнивания с последовательностями SEQ No 17, 18 и 19, и
- тяжелую цепь, содержащую CDR-участки последовательностей SEQ ID No 20, 21 и 22, или для которых последовательности имеют по меньшей мере 80% идентичности после оптимального выравнивания с последовательностями SEQ ID No 20, 21 и 22.
Предпочтительно, указанное антитело по изобретению, получившее название 2Е11, содержит последовательность тяжелой цепи, содержащую последовательность SEQ ID No 23, и легкую цепь, содержащую последовательность SEQ ID No 24.
Согласно другому аспекту изобретение также включает мышиную гибридому 2Е11, способную секретировать антитело, описанное выше.
Более конкретно, указанная мышиная гибридома представляет собой гибридому, депонированную в CNCM (Collection Nationale de Cultures de Microorganismes), Institut Pasteur, Pans (France) 31 мая 2006 года под № I-3615.
Согласно четвертому воплощению изобретение относится к моноклонапьному антителу или одному из его функциональных фрагментов, полученному описанным выше способом и содержащему:
- легкую цепь, содержащую CDR-участки последовательностей SEQ ID No 25, 26 и 27, или для которых последовательности имеют по меньшей мере 80% идентичности после оптимального выравнивания с последовательностями SEQ ID No 25, 26 и 27; и
- тяжелую цепь, содержащую CDR-участки последовательностей SEQ ID No 28, 29 и 30, или для которых последовательности имеют по меньшей мере 80% идентичности после оптимального выравнивания с последовательностями SEQ ID No 28, 29 и 30.
Более конкретно, указанное антитело по изобретению, получившее название 3С11, содержит последовательность тяжелой цепи, содержащую последовательность SEQ ID No 31, и легкую цепь, содержащую последовательность SEQ ID No 32.
Согласно другому аспекту изобретение также относится к мышиной гибридоме 3С11, способной секретировать антитело, описанное выше.
Указанная гибридома предпочтительно представляет собой гибридому, депонированную в CNCM (Collection Nationale de Cultures de Microorganismes), Institut Pasteur, Pans (France) 31 мая 2006 года под № I-3614.
И наконец, согласно пятому воплощению изобретения последнее относится к моноклональному антителу или одному из его функциональных фрагментов, полученному в результате применения способа по настоящему изобретению и содержащему:
- легкую цепь, содержащую CDR-участки последовательностей SEQ ID No 33, 34 или 35, или для которых последовательности имеют по меньшей мере 80% идентичности после оптимального выравнивания с последовательностями SEQ ID No 33, 34 и 35; и
- тяжелую цепь, содержащую CDR-участки последовательностей SEQ ID No 36, 37 и 38, или для которых последовательности имеют по меньшей мере 80% идентичности после оптимального выравнивания с последовательностями SEQ ID No 36, 37 и 38.
Предпочтительно, указанное антитело, получившее название 3G7, содержит последовательность тяжелой цепи, содержащую последовательность SEQ ID No 39, и легкую цепь, содержащую последовательность SEQ ID No 40.
Согласно другому аспекту изобретения заявлена мышиная гибридома 3G7, способная секретировать антитело, описанное выше.
Указанная гибридома предпочтительно представляет собой гибридому, депонированную в 1а CNCM (Collection Nationale de Cultures de Microorganismes), Institut Pasteur, Pans (France) 31 мая 2006 года под № I-3616. Для ясности, она приведена в Таблице 2, ниже, в которой указано соответствие между антителами по изобретению и соответствующими аминокислотными последовательностями CDR указанных антител.
В Таблице 3, приведенной в данном описании ниже, в этом отношении показано соответствие между этими же антителами по изобретению и соответствующими аминокислотными последовательностями тяжелых и легких цепей указанных антител.
И наконец, в приведенной ниже Таблице 4 настоящего описания суммированы названия каждого антитела по изобретению с депозитными номерами в CNCM.
Несомненно, весь набор свойств или модификаций, описанных выше для антитела 1А6, применим к другим антителам по изобретению и более конкретно к антителам, идентифицированным как 1А9, 2Е11, 3С11 и 3G7.
Аналогично тому, как описано выше для любого антитела, полученного согласно способу по изобретению, также установлено, что весь набор желаемых характеристик, свойств или модификаций следует также рассматривать как применимый к антителам, идентифицированным в настоящей заявке.
Более конкретно, установлено, что любой функциональный фрагмент выбран из фрагментов Fv, scFv, Fab, (Fab')2, Fab', scFv-Fc и диател или любого фрагмента, продолжительность существования которого была бы увеличена, например ПЭГилированных фрагментов.
Предпочтительно, чтобы антитело по настоящему изобретению предпочтительно представляло собой антитело или один из его функциональных фрагментов, секретируемое(ый) одной из гидридом, описанных выше, т.е. гибридомами I-3612, I-3613, I-3614, I-3615 или I-3616.
Согласно следующему воплощению изобретения указанное антитело представляет собой химерное антитело и дополнительно содержит константные области легкой цепи и тяжелой цепи, происходящие из антитела гетерологичного мышам вида.
Предпочтительно, указанным гетерологичным видом является человеческий вид.
Еще более предпочтительно, что указанное химерное антитело или один из его функциональных фрагментов по изобретению характеризуется тем, что константные области легкой цепи и тяжелой цепи, происходящие из человеческого антитела, представляют собой области каппа и гамма 1, гамма 2 или гамма 4, соответственно.
И наконец, еще более предпочтительно, что указанное антитело представляет собой гуманизированное антитело и содержит легкую цепь и/или тяжелую цепь, при этом сегменты FR1-FR4 остова указанной легкой цепи и/или тяжелой цепи происходят из сегментов FR1-FR4 остова, соответственно, легкой цепи и/или тяжелой цепи человеческих антител.
Также в конкретном аспекте настоящее изобретение относится к химерному антителу или одному из его функциональных фрагментов по изобретению, характеризующемуся тем, что указанное антитело дополнительно содержит константные области легкой цепи и тяжелой цепи, происходящие из антитела гетерологичного мышам вида, в особенности человека, и предпочтительно, что константные области легкой цепи и тяжелой цепи, происходящие из человеческого антитела, представляют собой области каппа и гамма 1, гамма 2 или гамма 4, соответственно.
Согласно следующему аспекту изобретения описана выделенная нуклеиновая кислота, характеризующаяся тем, что она выбрана из следующих нуклеиновых кислот:
a) нуклеиновой кислоты, ДНК или РНК, кодирующей антитело или один из его функциональных фрагментов по изобретению;
b) нуклеиновой кислоты, комплементарной нуклеиновой кислоте, определенной в а);
c) нуклеиновой кислоты, состоящей по меньшей мере из 18 нуклеотидов, способных гибридизоваться в условиях жесткой строгости по меньшей мере с одним из CDR из последовательностей SEQ ID No 41-46, 49-54, 57-62, 65-70, 73-78 или с последовательностью, имеющей по меньшей мере 80% идентичности после оптимального выравнивания с последовательностями SEQ ID No 41-46, 49-54, 57-62, 65-70, 73-78; и
d) нуклеиновой кислоты, состоящей по меньшей мере из 18 нуклеотидов, способных гибридизоваться в условиях жесткой строгости по меньшей мере с одной из легких цепей из последовательностей SEQ ID No 48, 56, 64, 72 или 80 и/или одной из тяжелых цепей из последовательностей SEQ ID No 47, 55, 63, 71 или 79, или с последовательностью, имеющей по меньшей мере 80% идентичности после оптимального выравнивания с последовательностями SEQ ID No 47, 48, 55, 56, 63, 64, 71, 72, 79 или 80. Смысл терминов «нуклеиновая кислота», «нуклеиновая последовательность» или «нуклеиновокислотная последовательность», «полинуклеотид», «олигонуклеотид», «полинуклеотидная последовательность», «нуклеотидная последовательность», которые будут одинаково использованы в настоящем описании, состоит в указании на специфическое связывание нуклеотидов, либо модифицированных, либо нет, с помощью которых можно определить фрагмент или область нуклеиновой кислоты, которые либо включают неприродные нуклеотиды, либо нет, и которые могут соответствовать как двухцепочечной ДНК, так и одноцепочечной ДНК и продуктам транскрипции указанных ДНК.
Здесь также следует понимать, что настоящее изобретение не относится к нуклеотидным последовательностям в их естественном хромосомном окружении, т.е. в естественных условиях. Ими являются последовательности, которые выделены и/или очищены, т.е. отобранные как образцы прямо или опосредованно, например, путем копирования, при этом их окружение по меньшей мере частично модифицируется. Смысл состоит также в обозначении в данном описании выделенных нуклеиновых кислот, полученных посредством генетической рекомбинации при помощи клеток хозяина, например, или полученных химическим синтезом.
Нуклеиновые последовательности, имеющие процент идентичности по меньшей мере 80%, предпочтительно 85%, 90%, 95% и 98% после оптимального выравнивания с предпочтительной последовательностью, предназначены для обозначения нуклеиновых последовательностей, имеющих относительно эталонной нуклеиновой последовательности некоторые модификации, такие как в частности делеция, укорочение, вставка, химерное слияние и/или особенно замена типа точечной (point-like substitution). Ими являются предпочтительно последовательности, в которых закодированы те же последовательности аминокислот, что и у эталонной последовательности, причем это связано с вырожденностью генетического кода, или комплементарные последовательности, которые способны специфично гибридизоваться с предпочтительными эталонными последовательностями в условиях жесткой строгости, особенно как определено далее.
Гибридизация в условиях жесткой строгости означает, что условия температуры и ионной силы выбраны таким образом, что позволяют поддерживать гибридизацию между двумя комплементарными фрагментами ДНК. В качестве иллюстрации, условия жесткой строгости стадии гибридизации с целью определения полинуклеотидных фрагментов, описанных выше, предпочтительно являются следующими.
ДНК-ДНК или ДНК-РНК гибридизацию проводят в две стадии: (1) предгибридизация при 42°C в течение 3 часов в фосфатном буфере (20 мМ, рН 7.5), содержащем 5×SSC (1×SSC соответствует 0,15 М NaCl+0,015 М раствор цитрата натрия), 50% формамида, 7% додецилсуфата натрия (SDS), 10 × раствор Денхардта, 5% декстрансульфата и 1% ДНК из молоки лососевых; (2) реальная гибридизация в течение 20 часов при температуре, зависящей от размера зонда (т.е.: 42°C, для зонда размером >100 нуклеотидов) с последующими двумя 20-минутными промывками при 20°C в 2×SSC+2% SDS, 20-минутной промывкой при 20°C в 0,1×SSC+0,1% SDS. Последнюю промывку проводят в 0,1×SSC+0,1% SDS в течение 30 минут при 60°C для зонда размером >100 нуклеотидов. Условия гибридизации жесткой строгости, описанные выше для полинуклеотида определенного размера, могут быть адаптированы специалистом в данной области техники для олигонуклеотидов более крупного или более мелкого размера в соответствии с руководством Sambrook и др. (1989, Molecular cloning: a laboratory manual. 2nd Ed. Cold Spring Harbor).
Для внесения большей ясности, соответствие между антителами по изобретению, более конкретно последовательностями CDR, а также вариабельными цепями и их нуклеотидными последовательностями также изложены в Таблице 5, ниже.
Изобретение также относится к вектору, содержащему нуклеиновую кислоту по настоящему изобретению.
Изобретение особенно относится к клонированию и/или экспрессии векторов, содержащих нуклеотидную последовательность по изобретению.
Векторы по изобретению предпочтительно включают в себя элементы, позволяющие осуществлять экспрессию и/или секрецию нуклеотидных последовательностей в определенной клетке хозяина. Поэтому вектор должен включать в себя промотор, сигналы инициации и терминации трансляции, а также подходящие области для регуляции транскрипции. Он должен стабильно поддерживаться в клетке хозяина и возможно может иметь конкретные сигналы для специфической секреции транслируемого белка. Эти разные элементы выбираются и оптимизируются специалистом в данной области техники в зависимости от используемой клетки хозяина. С этой целью нуклеотидные последовательности по изобретению могут быть вставлены в самореплицирующиеся векторы в выбранном хозяине или представлять собой интегративные векторы выбранного хозяина.
Такие векторы получают способами, используемыми в настоящее время специалистом в данной области техники, и полученный клон может быть введен подходящему хозяину стандартными способами, такими как липофекция, электропорация, температурный шок или химические способы.
Векторами по изобретению, например, являются векторы плазмидного или вирусного происхождения. Они полезны для трансформации клеток хозяина с целью клонирования и экспрессии нуклеотидных последовательностей по изобретению.
Изобретение также включает клетки хозяина, трансформированные вектором или содержащие вектор по изобретению.
Клетка-хозяин может быть выбрана из прокариотической или эукариотической систем, например бактериальных клеток, но также клеток дрожжей или клеток животных, в частности клеток млекопитающих. Также можно использовать клетки насекомых или клетки растений.
Кроме того, изобретение относится к животным, за исключением людей, содержащим трансформированную клетку по изобретению.
В другом аспекте задачей изобретения является способ получения антитела или одного из его функциональных фрагментов по изобретению, характеризующийся тем, что он включает следующие стадии:
a) культивирование клетки хозяина по изобретению в среде и в подходящих условиях культивирования; и
b) выделение полученных таким образом указанных антител или одного из их функциональных фрагментов из культуральной среды или из указанных культивируемых клеток.
Трансформированные клетки по изобретению могут быть использованы в способах получения рекомбинантных полипептидов по изобретению. Сами способы получения полипептида по изобретению в рекомбинантной форме, характеризующиеся тем, что в них применяется вектор и/или клетка, трансформированная вектором по изобретению, включены в настоящее изобретение. Предпочтительно, клетку, трансформированную вектором по изобретению, культивируют в условиях, позволяющих экспрессироваться указанному полипептиду, и указанный рекомбинантный пептид выделяют.
Как установлено, клетка-хозяин может быть выбрана из прокариотической или эукариотической систем. В частности, можно идентифицировать нуклеотидные последовательности по изобретению, которые облегчают секрецию в такой прокариотической или эукариотической системе. Следовательно, вектор по изобретению, несущий такую последовательность, может быть предпочтительно использован для продуцирования рекомбинантных белков, предназначенных для секреции. Действительно, очистка этих представляющих интерес рекомбинантных белков, будет облегчена, поскольку они присутствуют в большей степени в супернатанте культуры клеток, чем внутри клеток хозяина.
Полипептиды по изобретению также могут быть получены путем химического синтеза. Такой способ получения также представляет собой задачу изобретения. Специалист в данной области техники осведомлен о способах химического синтеза, например о методиках, в которых применяют твердые фазы (см. особенно Steward et al, Solid phase peptides synthesis, Pierce Chem. Company, Rockford, 111, 2nd ed. (1984)), или о методиках, в которых используют частично твердые фазы, конденсацию фрагментов или синтез в обычном растворе. Полипептиды, полученные химическим синтезом и которые могут включать соответствующие неприродные аминокислоты, также включены в данное изобретение.
Антитела или один из их функциональных фрагментов, которые могут быть получены способом по изобретению, также включены в настоящее изобретение. Биспецифичные или бифункциональные антитела образуют второе поколение моноклональных антител, у которых в одной и той же молекуле объединены две разные вариабельные области (Hollinger and Bohlen, 1999, Cancer and metastasis rev. 18: 411-419). Их применимость была продемонстрирована как в области диагностики, так и в области терапии ввиду их способности к рекрутингу новых эффекторных функций или к направленной доставке к разным молекулам на поверхности опухолевых клеток. Эти антитела могут быть получены химическими способами (Glennie MJ et al., 1987, J. Immunol. 139, 2367-2375; Repp R. et al, 1995, J. Hemat. 377-382) или физическими (Staerz U D. and Bevan MJ., 1986, PNAS 83, 1453-1457; Suresh MR. et al, 1986, Method Enzymol., 121: 210-228), но также и предпочтительно с применением методик генетической инженерии, с помощью которых гетеродимеризация может быть форсирована и которые поэтому облегчают способ очистки искомого антитела (Merchand et al., 1998, Nature Biotech., 16: 677-681).
Эти биспецифичные антитела могут быть сконструированы в виде целых IgG, в виде биспецифичных Fab'2, в виде Fab'-ПЭГ или в виде диател или даже в виде биспецифичных scFv, а также в виде тетравалентного биспецифичного антитела или (антитела) с двумя сайтами связывания для каждого антигена-мишени (Park et al., 2000, Mol. Immunol., 37(18): 1123-30) или его фрагментов, как описано выше.
Кроме экономической выгоды от того, что получение и введение биспецифичного антитела является менее дорогостоящим, чем получение двух специфичных антител, применение таких биспецифичных антител имеет преимущество, заключающееся в снижении токсичности лечения. Действительно, применение биспецифичного антитела позволяет снизить общее количество циркулирующих антител и, следовательно, возможную токсичность.
В предпочтительном воплощении изобретения биспецифичное антитело представляет собой бивалентное или тетравалентное антитело.
На практике выгода от использования тетравалентного биспецифичного антитела состоит в том, что оно обладает большей авидностью по сравнению с бивалентным антителом ввиду наличия двух сайтов связывания для каждой мишени.
Аналогично, для выбора функциональных фрагментов антитела, описанного выше, указанную вторую структуру выбирают из фрагментов Fv, Fab, (Fab')2, Fab', Fab'-ПЭГ, scFv, scFv-Fc и диател или любой формы, продолжительность существования которой была бы увеличена.
В еще одном другом аспекте задачей изобретения является антитело или один из его функциональных фрагментов по изобретению в качестве лекарственного средства, предпочтительно гуманизированное антитело, которое определено ранее. В рамках настоящего описания под антителом понимают как антитело, полученное с применением определенного выше способа по изобретению, так и антитело, выбранное из идентифицированных и получивших названия антител 1А6, 1А9, 2Е11, 3С11 или также 3G7.
Изобретение также относится к фармацевтической композиции, содержащей в качестве активного ингредиента соединение, представляющее собой антитело или один из его функциональных фрагментов по изобретению, предпочтительно с добавленным фармацевтически приемлемым эксципиентом и/или носителем.
Более конкретно, изобретение охватывает композицию, содержащую в качестве активного ингредиента соединение, представляющее собой антитело, или один из его функциональных фрагментов, как, например, описанное выше или продуцируемое гибридомой I-3612, I-3613, I-3614, I-3615 или I-3616.
Согласно еще одному другому воплощению настоящее изобретение также относится к фармацевтической композиции, описанной выше, дополнительно содержащей в качестве комбинированного продукта для одновременного, раздельного применения или разнесенного во времени применения химиотерапевтический агент, агент лучевой терапии или антитело. Под "одновременным применением" понимают введение обоих соединений композиции по изобретению, содержащихся в разовой и одной и той же фармацевтической форме.
Под "раздельным применением" понимают введение в один и тот же момент времени обоих соединений композиции по изобретению, содержащихся в отдельных фармацевтических формах.
Под "разнесенным по времени применением" понимают последовательное введение обоих соединений композиции по изобретению, каждое из которых содержится в отдельной фармацевтической форме. Под химиотерапевтическим агентом понимают любое соединение, подпадающее под определение и список, показанный выше в настоящем описании и составляющий неотъемлемую часть изобретения.
В конкретном предпочтительном воплощении указанная композиция как комбинированный продукт по изобретению характеризуется тем, что указанный цитотоксический агент связан химической связью с указанным антителом для одновременного применения.
В конкретном предпочтительном воплощении указанная композиция по изобретению характеризуется тем, что указанный цитотоксический/цитостатический агент выбран из агентов, которые ингибируют или стабилизируют веретено, предпочтительно из винорелбина и/или винфлунина.
С целью облегчения образования связи между указанным цитотоксическим агентом и указанным антителом по изобретению между обоими связываемыми соединениями особенно могут быть введены спейсерные молекулы, такие как полиалкиленгликоли, как, например, полиэтиленгликоль, или даже аминокислоты, или в другом воплощении могут быть использованы активные производные указанных цитотоксических агентов, в которые введены функциональные группы, способные взаимодействовать с указанным антителом по изобретению. Эти методики сочетания хорошо известны специалисту в данной области техники и не будут раскрыты в настоящем описании.
Изобретение в другом аспекте относится к композиции, характеризующейся тем, что по меньшей мере одно из указанных антител или один из их функциональных фрагментов представляет собой конъюгат с клеточным токсином и/или радиоактивным элементом.
Предпочтительно, указанным токсином является токсин из энтеробактерий, особенно экзотоксин А из Pseudomonas.
Конъюгат токсина или радиоактивного элемента по меньшей мере с одним антителом или одним из его функциональных фрагментов по изобретению предназначен для обозначения любых средств, с помощью которых указанный токсин или указанный радиоактивный элемент могут быть связаны по меньшей мере с одним указанным антителом, особенно посредством образования ковалентной связи между обоими соединениями, с введением или без введения связывающей молекулы. Другая форма связывания может состоять в применении хелатного соединения с ионом (ion chelator), обеспечивающего нековалентное комплексообразование, такого как, например EDTA, DOTA или даже комплекс типа99mTc.
Также предпочтительно, чтобы указанное по меньшей мере одно антитело, участвующее в образовании указанного конъюгата по изобретению, было выбрано из его функциональных фрагментов, особенно фрагментов, отделенных от их Fc-компонента, таких как фрагменты scFv.
Настоящее изобретение дополнительно включает применение композиции по изобретению для изготовления лекарства.
Задачей настоящего изобретения также является применение антитела, которое описано выше или даже получено согласно способу по изобретению, также описанному выше, для приготовления лекарства, предназначенного для предупреждения или лечения рака.
Кроме того, задачей настоящего изобретения является применение антитела, которое описано выше или даже получено согласно способу по изобретению, и также описанному выше, для изготовления лекарства, предназначенного для ингибирования устойчивости опухоли к противоопухолевому лечению у пациента в рамках предупреждения и лечения рака у этого пациента.
Предпочтительно, указанный рак представляет собой рак устойчивого типа, выбранный из рака толстой кишки, предстательной железы, молочной железы, легкого, яичек или поджелудочной железы.
Согласно другому воплощению изобретения также заявлено применение антитела или одного из его функциональных фрагментов по изобретению для изготовления лекарства, предназначенного для специфично направленной доставки биологически активного соединения к резистентным опухолям и/или опухолям, обнаруженным на поздней стадии. Меченые антитела по изобретению или их функциональные фрагменты, например, включают так называемые иммуноконъюгированные антитела, которые могут быть, например, конъюгированы с такими ферментами, как пероксидаза, щелочная фосфатаза, α-D-галактозидаза, глюкозооксидаза, глюкоамилаза, карбоангидраза, ацетилхолинэстераза, лизоцим, малатдегидрогеназа или глюкозо-6-фосфатдегидрогеназа, или с такой молекулой, как биотин, дигоксигенин или 5-бромдезоксиуридин. С антителами или их функциональными фрагментами по изобретению также могут быть конъюгированы флуоресцентные маркеры, и они в особенности включают флюоресцеин и его производные, флюорохром, родамин и его производные, GFP (зеленый флюоресцентный белок), дансил, умбеллиферон и т.д. Такие конъюгаты с антителами по изобретению или их функциональные фрагменты могут быть получены способами, известными специалисту в данной области техники. Они (антитела) могут быть связаны с ферментами или флюоресцентными маркерами напрямую или через спейсерную группу или связывающую группу, такую как полиальдегид, например глутаровый альдегид, этилендиаминтетрауксусная кислота (EDTA), диэтилентриаминпентауксусная кислота (DPTA), или в присутствии агентов сочетания, таких как периодат и т.д. Конъюгаты, включающие в себя маркеры флюоресцеинового типа, могут быть получены в результате реакции с изотиоцианатом.
Другие конъюгаты также могут включать в себя хемилюминесцентные маркеры, такие как люминол и диоксетаны, биолюминесцентные маркеры, такие как люцифераза и люциферин, или даже радиоактивные маркеры.
Биологически активное соединение понимается для обозначения в данном описании любого соединения, способного к модулированию, особенно к ингибированию активности клеток, в частности их роста, их пролиферации, генной транскрипции или трансляции.
В настоящем описании фармацевтически приемлемый разбавитель понимается для обозначения соединения или комбинации соединений, входящих в фармацевтическую композицию, который не вызывает побочных реакций и который, например, может способствовать введению активного соединения(ий), может увеличивать продолжительность его существования и/или его эффективность в организме, может повышать его растворимость в растворе или даже может улучшать его сохранность. Эти фармацевтически приемлемые носители общеизвестны и будут адаптированы специалистами в данной области техники в зависимости от природы и способа введения выбранного активного соединения(ий).
Предпочтительно, эти соединения будут введены системно, в частности внутривенным путем, внутримышечным, интрадермальным, внутрибрюшинным или подкожным путем, или перорально. Более предпочтительно, композиция, содержащая антитела по изобретению, будет введена неоднократно, с разнесением по времени.
Способы их введения, лекарственные формы и оптимальные галеновы формы могут быть определены в соответствии с критериями, обычно принимаемыми в рассмотрение при установлении лечения, адаптированного к пациенту, как, например, возраст или масса тела пациента, тяжесть его/ее состояния, переносимость лечения и отмеченные побочные эффекты.
Другие признаки и преимущества изобретения будут очевидны из следующего описания в виде примеров и графических материалов, включая подписи, которые приведены далее.
И наконец, согласно последнему аспекту изобретения предложено применение способа по изобретению для идентификации новых терапевтических и/или диагностических внутри- или внеклеточных мишеней, вовлеченных в явление устойчивости.
И наконец, указанный способ идентификации новых терапевтических и/или диагностических внутри- или внеклеточных мишеней, вовлеченных в явление устойчивости, характеризуется тем, что он представляет собой применение описанного выше способа по изобретению с целью получения моноклонального антитела и последующей идентификации соединения, в частности белка, распознаваемого указанным моноклональным антителом.
Такая идентификация соединения, особенно белка, может быть проведена по любой методике, известной специалисту в данной области техники, такой как, например, иммунопреципитация и/или иммуноочистка клеточного лизата и идентификация белка с использованием методик вестерн-блоттинга в сочетании со стандартными протеомными методиками.
Подписи к графическим материалам и примеры, следующие далее, предназначены для иллюстрации изобретения без ограничения каким-либо образом его объема.
ПОДПИСИ К ГРАФИЧЕСКИМ МАТЕРИАЛАМ
Фиг.1: на Фиг.1 проиллюстрировано изменение во времени объема опухоли после проведения тройной терапии с использованием h4D5, 225 и 7С10 и показано появление устойчивости к такому лечению.
Фиг.2: на Фиг.2 проиллюстрирована, в первой иллюстративной форме, диаграмма, поясняющая воплощение изобретения.
1. Отбор образцов контрольных опухолей, деление на две части.
2. Толеризация мышей. Подготовка клеток для иммунизации: лизат, клеточная суспензия и т.д. Толеризация путем в/б (внутрибрюшинной) инъекции циклофосфамида или другого толеризующего агента.
3. Предметные стекла для IHC(иммуногистохимического)-скрининга. Замораживание или включение (в парафин) опухолей: подготовка предметных стекол для мечения = негативные контрольные предметные стекла.
4. Отбор образцов резистентных опухолей, деление на две части.
5. Подготовка клеток для иммунизации: лизат, клеточная суспензия и т.д.
6. Замораживание или включение (в парафин) опухолей: подготовка предметных стекол для мечения = тестируемые предметные стекла.
7. Отбор образцов контрольных опухолей.
8. Иммунизация мышей: подготовка клеток из контрольных опухолей.
9. Контрольные IHC-предметные стекла.
10. Толеризация путем инъекции(й) иммуносупрессивного агента.
11. Отбор образцов сывороток для контроля отсутствия ответа на нативные клетки.
12. Отбор образцов резистентных опухолей.
13. Иммунизация толеризованных мышей: подготовка клеток из резистентных опухолей.
14. Тестируемые IHC-предметные стекла.
15. Отбор образцов сывороток для IHC-мечения опухолей в сравнении с резистентными опухолями.
16. Селекция гибридом: отсутствие мечения на предметных стеклах с контрольными опухолями, позитивное мечение на резистентных опухолях (отсутствие мечения на стромальных клетках, мечение опухолевых клеток).
Фиг.3: на Фиг.3 также проиллюстрировано, но на этот раз в виде диаграммы, воплощение способа по изобретению.
Фиг.4: на Фиг.4 проиллюстрирован профиль антител по изобретению на предметных стеклах типа "тканевого массива", созданных из опухолей, которые использованы для толеризации и иммунизации.
Фиг.5: на Фиг.5 проиллюстрирована оценка противоопухолевой активности антител 1А6 и 2Е11 в модели ксенотрансплантанта толстой кишки НТ29.
Фиг.6: на Фиг.6 показаны соответствующие последовательности тяжелых и легких цепей антител 1А6, 1А9, 2Е11, 3С11 и 3G7. Соответствующие CDR выделены подчеркиванием и жирным шрифтом.
Фиг.7: на Фиг.7 проиллюстрирована оценка противоопухолевой активности антитела 2Е11 в модели ксенотрансплантанта поджелудочной железы ВхРС3.
Пример 1. Демонстрация устойчивости опухолевых клеток А549 к тройной терапии антителами против IGF-1R, EGFR и Her/2neu
Проводили трансплантацию А549-клеток мышам. После введения опухоли мышей подвергали лечению два раза в неделю смесью, содержащей по 300 мкг каждого из следующих антител, т.е.: h4D5 (герцептин, предоставленный ICR, Institut Claude Regaud, service pharmacie, 20-24, rue du Pont Saint-Pierre, 31052 Toulouse), 225 (ATCC № HB-8508) и 7С10.
He позже первой недели лечения у некоторых мышей можно наблюдать регрессию опухолевого роста до полного исчезновения опухоли. Лечение поддерживают несмотря на полную или частичную регрессию опухоли.
Впоследствии наблюдают повторное появление таких опухолей несмотря на непрерывность лечения, что показывает образование опухолей, устойчивых к тройной терапии.
На Фиг.1 приведена иллюстрация примера, в котором продемонстрирована опухолевая регрессия до 15-х суток и повторное появление опухолей, начиная с 15-х суток, что указывает на развитие устойчивости.
Пример 2. Создание активных моноклональных антител, направленных против антигена, вовлеченного в устойчивость к комбинированной терапии антителами против IGF-1R, EGFR и Her/2neu
Проводили трансплантацию А549-клеток двум партиям из 10 мышей. Первая партия получает каждые две недели инъекции PBS (забуференный фосфатом физиологический раствор). Вторую партию обрабатывают комбинацией антител (7С10, 225 и h4D5), направленных против рецепторов IGF-1R, EGFR и Her/2neu, соответственно. Эта комбинация антител вызывает опухолевую регрессию, приводящую к исчезновению этих опухолей у 60% леченных животных. Несмотря на такой радикальный эффект опухоли снова возникают у всех животных.
У животных, обработанных PBS, А549-опухоли извлекают, когда они достигают 100-200 мм3.
Каждую их этих опухолей делят на две части: одну замораживают при низких температурах с целью создания иммуногистохимических предметных стекол типа "тканевого массива", другую часть используют для толеризации BALB/c мышей. Эту толеризацию выполняют путем внутрибрюшинной инъекции измельченного гомогената клеток из опухоли с последующим введением циклофосфамида, и ее целью является полное искоренение ответа, направленного против нелеченных "исходных" А549-опухолей. Во время этого опухолевого рецидива также собирают опухоли, когда они достигают объема 100-200 мм3. Затем их делят на две равные части. Одна часть будет заморожена при низких температурах с целью создания иммуногистохимических предметных стекол типа "тканевого массива", как описано выше для контрольных опухолей с использованием PBS. Из второй части будет приготовлен измельченный гомогенат и использован для иммунизации мышей, толеризованных заблаговременно нелеченными А549-опухолями. Для всех этих мышей все 3 полученные внутрибрюшинные инъекции измельченных гомогенатов опухолей, устойчивых к тройной терапии, были усилены полным адъювантом Фрейнда для первой инъекции и неполным адъювантом Фрейнда для последующих инъекций.
Затем осуществляют слияние клеток и для полученных в результате этого слияния гибридом проводят скрининг с применением иммуногистохимического анализа на предметных стеклах типа "тканевого массива", приготовленных заблаговременно.
Гибридомы, секретирующие антитела, распознающие резистентные ткани и не распознающие ни опухоли из контрольной партии с PBS, ни нативную А549-клетку, которая была использована для создания опухоли in vivo, клонируют и замораживают. Затем антитела продуцируются в асцитическую жидкость, их очищают, повторно тестируют иммуногистохимически, после чего тестируют in vivo на клетках, экспрессирующих на поверхности структуру или антиген, распознаваемые антителами (эти клетки были отобраны заблаговременно с использованием FACSCAN-анализа неинвазивной панели опухолевых линий, имеющейся для каждого антитела).
На Фиг.4 показан профиль удерживаемых антител.
В приведенной ниже Таблице 6 в этом отношении сгруппированы клетки, распознаваемые этими антителами (Распознавание антител, выбранных по (данным) гистологии с использованием устройства FACSCAN, разных клеточных линий).
Пример 3. Оценка противоопухолевой активности антител, созданных согласно изобретению, (более конкретно 1А6 и 2Е11) в модели ксенотрансплантанта прямой кишки НТ29
5·106 клеток НТ29 трансплантируют мышам "Swiss-Nude". Через пять суток после трансплантации опухоли становятся измеримыми, и мышей разделяют на три партии по шесть мышей с опухолями однородного вида. Мышей подвергают лечению с использованием либо PBS (негативный контроль), либо 0,5 мг антитела 1А6 или 2Е11, три раза в неделю (инъекция первой дозы для презентации: 1 мг/мышь).
Контроль объема опухоли осуществляют два раза в неделю, принимая во внимание, что объем опухоли обычно подсчитывают согласно следующей формуле: (π/6)×(I)×(L)×(e), где I = измеренная ширина, L = измеренная длина и е = измеренная толщина.
Результаты проиллюстрированы на Фиг.5.
НТ29-клетки могут рассматриваться как клетки агрессивного фенотипа. Полученные результаты демонстрируют возможность использования антител непосредственно против антигенов опухолевых клеток, происходящих из опухоли, леченной противоопухолевой композицией (см. Пример 2) и к тому же устойчивой, в качестве противоопухолевого соединения для лечения опухолей с агрессивным фенотипом.
Результаты, полученные в этом эксперименте, подтверждают правильность данного оригинального подхода создания антител и концепции создания антител для терапевтической цели на основе индуцированной у мышей устойчивости. Этот способ можно применить к любой другой комбинации лекарственных средств, включая химиотерапевтические лекарственные средства либо по отдельности, либо в комбинации друг с другом или с антителами, или с ингибиторами тирозинкиназы, или с протеасомными ингибиторами, действуя таким же образом.
Пример 4. Оценка противоопухолевой активности антитела 2Е11, созданного согласно изобретению, в модели ксенотрансплантанта поджелудочной железы ВхРС3
10·106 клеток ВхРС3 трансплантируют бестимусным "голым" мышам. Через пять суток после трансплантации опухоли становятся измеримыми, и мышей разделяют на две партии по шесть мышей с опухолями однородного вида. Затем мышей подвергают лечению либо PBS (негативный контроль), либо антителом 2Е11 (1 мг/доза), два раза в неделю. Контроль объема опухоли осуществляют два раза в неделю.
Результаты проиллюстрированы на Фиг.7.
Результаты, полученные в этом эксперименте, обосновывают функциональную активность антитела 2Е11, а также концепцию создания антител для терапевтической цели на основе индуцированной у мышей устойчивости.
Реферат
Настоящее изобретение относится к области биотехнологии и медицины. Предложен способ создания антитела и его функциональных фрагментов, направленных против опухолевого антигена, экспрессируемого на поверхности опухоли, устойчивой по меньшей мере к одному противоопухолевому соединению, основанный на применении для иммунизации измельченного гомогената, и/или суспензии, и/или клеточного лизата, происходящих из такой опухоли. Также рассмотрено применение способа по изобретению для получения моноклональных антител и их функциональных фрагментов, моноклональные антитела, полученные этим способом, кодирующие их нуклеиновые кислоты, экспрессирующий вектор, клетка-хозяин и способ получения антитела с их использованием, а также гибридомы, способные секретировать эти антитела, применение антител и их функциональных фрагментов для изготовления лекарства, противоопухолевая композиция и ее применение в качестве лекарства. Данное изобретение может найти дальнейшее применение в терапии резистентных опухолей. 16 н. и 26 з.п. ф-лы, 7 ил., 4 пр., 6 табл.
Формула
i) непосредственную иммунизацию животных измельченным гомогенатом, и/или суспензией, и/или клеточным лизатом, происходящими из резистентной опухоли,
ii) слияние клеток селезёнки животного, иммунизированного на стадии i), с миеломными клетками с получением гибридом,
iii) выделение антител, секретированных гибридомами,
iv) отбор посредством дифференциальной селекции (differential selection) гибридом, секретирующих антитела, специфично распознающие антигены, экспрессируемые на поверхности опухолевых клеток резистентной опухоли, и экспрессия которых индуцируется в результате противоопухолевого лечения, где указанная резистентная опухоль получена способом, выбранным из следующих: а) биопсия и/или хирургия от пациента, который проходит или проходил терапевтическое лечение с использованием указанного по меньшей мере одного противоопухолевого соединения, способного индуцировать устойчивость опухоли, б) трансплантация опухолевой линии и/или всей человеческой опухоли или ее части животному и затем лечение этого животного путем введения по меньшей мере одного противоопухолевого соединения, устойчивость к которому желательно индуцировать, и
v) при необходимости получение функциональных фрагментов отобранных антител.
a) отбор и трансплантацию животным опухолевой линии и/или всей исходной опухоли или ее части,
b) лечение части этих подвергнутых трансплантации животных по меньшей мере одним противоопухолевым соединением,
c) извлечение целиком или частей исходных опухолей, происходящих из нелеченных животных, подвергнутых трансплантации на стадии a),
d) извлечение целиком или частей резистентных опухолей, происходящих из животных, леченных на стадии b),
е) подготовку средства для дифференциальной селекции антител из опухолей, полностью или частично извлеченных на стадиях с) и d) соответственно, и
f) подготовку измельченного гомогената и/или клеточного лизата из резистентных опухолей, полностью или частично извлеченных на стадии d).
- введения животным измельченного гомогената, и/или суспензии, и/или клеточного лизата, полученных из так называемых "нативных" опухолей, происходящих со стадии с), и
- обработки этих животных иммуносупрессором с целью удаления В-клеток, активированных в результате введения, проведенного на предшествующей стадии, и тем самым ингибирования любого возможного ответа против указанной так называемой нативной опухоли.
a) способ создания антитела или одного из его функциональных фрагментов по любому из пп.1-18, причем указанное антитело направлено против указанного опухолевого антигена, специфично экспрессируемого на поверхности резистентной опухоли, указанный опухолевый антиген не экспрессируется на поверхности клеток нативной опухоли, из которой данная резистентная опухоль происходит;
b) приведение полученного на стадии а) антитела в контакт с опухолью, устойчивой к противоопухолевому соединению; и
с) отбор указанного антитела, если продемонстрирован ингибирующий эффект этого антитела на устойчивость опухоли к противоопухолевому соединению.
(а) антитела, которое содержит:
- легкую цепь, содержащую CDR-участки (гипервариабельные участки) последовательностей SEQ ID No 1, 2 и 3; и
- тяжелую цепь, содержащую CDR-участки последовательностей SEQ ID No 4, 5 и 6;
(б) антитела, которое содержит:
- легкую цепь, содержащую CDR-участки последовательностей SEQ ID No 9, 10 и 11; и
- тяжелую цепь, содержащую CDR-участки последовательностей SEQ ID No 12, 13 и 14;
(в) антитела, которое содержит:
- легкую цепь, содержащую CDR-участки последовательностей SEQ ID No 17, 18 и 19; и
тяжелую цепь, содержащую CDR-участки последовательностей SEQ ID No 20, 21 и 22;
(г) антитела, которое содержит:
- легкую цепь, содержащую CDR-участки последовательностей SEQ ID No 25, 26 и 27; и
- тяжелую цепь, содержащую CDR-участки последовательностей SEQ ID No 28, 29 и 30;
(д) антитела, которое содержит:
- легкую цепь, содержащую CDR-участки последовательностей SEQ ID No 33, 34 и 35; и
- тяжелую цепь, содержащую CDR-участки последовательностей SEQ ID No 36, 37 и 38.
а) нуклеиновой кислоты, ДНК или РНК, кодирующей антитело или один из его функциональных фрагментов по п.25;
b) нуклеиновой кислоты, комплементарной нуклеиновой кислоте, определенной в а).
a) культивирование клетки по п.30 в среде и в подходящих условиях культивирования; и
b) выделение полученных таким образом указанных антител или одного из их функциональных фрагментов из культуральной среды или из указанных культивируемых клеток.

Комментарии