Pcv2b дивергентная вакцинная композиция и способы её применения - RU2662685C2
Код документа: RU2662685C2
Чертежи



































































Описание
Область техники, к которой относится изобретение
Представленное изобретение касается цирковируса свиней. Более конкретно, настоящее изобретение касается вакцинной композиции, включающей PCV2b дивергентный ORF2 антиген, и его применение в вакцине для защиты свиней против PCV2, включая высоковирулентный дивергентный штамм цирковируса свиней типа 2b (PCV2b) и мультисистемный синдром истощения после отъема (PMWS).
Предпосылки создания изобретения
Цирковирус свиней типа 2 (PCV2), член семейства Circoviridae, рода Circovirus, представляет собой небольшой круговой безоболочечный вирус, который впервые был открыт в 1998. PCV2 является одним из двух наиболее распространенных патогенов, встречающихся в свиноводстве, где другим является Mycoplasma hyopneumoniae (M. hyo). Свинья, инфицированная PCV2, демонстрирует синдром, который обычно называют как мультисистемный синдром истощения после отъема (PMWS). PMWS клинически характеризуется истощением, бледностью кожных покровов, худосочностью, респираторным дистрессом, диареей, иктеричностью и желтухой. В дополнение к PMWS, PCV2 связывают с несколькими другими заболеваниями, включая псевдобешенство, репродуктивный и респираторный синдром свиней (PRRS), энзоотическую пневмонию, болезнь Глассера, стрептококковый менингит, сальмонеллез, после отъемный колибактериоз, диетический гепатоз и гнойную бронхопневмонию. Различные клинические проявления инфекции PCV2 у свиней по всем возрастным группам стали известными как заболевания, связанные с цирковирусом свиней (PCVAD), и характеризуются слабостью и задержкой роста. PRRS вирус, вирус свиного гриппа (SIV), M. hyo и другие бактерии участвуют в качестве основных сопутствующих факторов в развитии PCVAD. PCVAD постоянно был угрозой для свиноводства во всем мире, что вызывало большие экономические потери.
Изоляты PCV2 в настоящее время подразделяются на три генотипа: PCV2a, PCV2b и PCV2c. PCV2 содержит две основных открытых рамки считывания (ORF), которые кодируют белок, связанный с репликацией (ORF1, 945 nt), и вирусный капсид (ORF2, 702 nt). PCV2 претерпел значительные генетические вариации в последние годы. По-новому эмергентный PCV2 мутант с дополнительным лизином (K) на С-конце ORF2-кодированного капсидного белка, который сравнивали с классическими PCV2a и PCV2b генотипами, был выделен в 2008 из образца сыворотки от абортированный свиньи (Guo et al., 2010, Virology Journal 7: 273). В данном по-новому эмергентном PCV2 мутанте одна базовая делеция в положении 1039 в геномной последовательности в результате приводила к мутации стоп-кодона (от UAA до AAG) в ORF2, что дает ORF2 ген 705 nt и новый стоп-кодон (Guo et al., 2011, Virology Journal 8: 291). Кроме того, Knell et al. ранее сообщали, что мутации могли происходить в ORF2 гене, поскольку делеция (Т) была найдена в положении 1042 в 1767 nt генома одного штамма (GenBank no. AY713470), что привело к удлинению на одну аминокислоту (лизин) на С-конце ORF2-кодированного капсидного белка (Knell et al., 2005, Veterinary Microbiology 109: 169-177). Olvera et al. также сообщали относительно удлинения на один лизиновый остаток на С-конце капсидного белка из-за мутации в стоп-кодоне ORF2 (Olvera et al., 2007, Virology 357: 175-185). Кроме того, штамм PCV2, называемый "JSTZ", с GenBank номером доступа No. JQ413808, был обнаружен и идентифицирован в образцах кала поросенка с тяжелой диареей в Китае, и его полный 1767 nt геном секвенировали (Li et al., 2012, Journal of Virology (jvi.asm.org), p. 4716). Филогенетический анализ на основе генома штамма PCV2 JSTZ и ORF других китайских штаммов PCV2 показали, что штамм PCV2 JSTZ принадлежал к новому генотипу в Китае (Li et al., 2012, выше).
Guo et al. оценивали относительную вирулентность мутантного штамма PCV2, названного PCV2b/rBDHor BDH (Gen Bank номер доступа №НМ038017), который был выделен в 2008 из образца от абортированной свиньи с PMWS и подтвердил большую вирулентность мутантного штамма PCV2 у поросят, чем у того, что связан с классическими PCV2a и PCV2b генотипами (Guo et al., 2012, PLoS ONE (plosone.org), Vol. 7, Issue 7, e41463, 1-10). Данный мутантный штамм PCV2 продемонстрировал более серьезные признаки сходные с PMWS, которые характеризуются слабостью, кашлем, одышкой, диареей, всколоченной шерстью покрытия и депрессией. Более того, патологические повреждения и виремии, а также, вирусные нагрузки в лимфатических узлах, миндалинах и селезенке, были значительно более тяжелыми для поросят, вызванные мутантным штаммом PCV2 по сравнению с теми, которые в группах, инфицированных классическим PCV2a и PCV2b. Кроме того, значительно более низкий средний дневной прирост массы был зафиксирован в группе, инфицированной мутантным штаммом PCV2, чем в группах, инфицированных преобладающими генотипами PCV2a и PCV2b (Guo et al., 2012, выше).
Два PCV2 штамма, US 22625-33 и US 22664-35, недавно были идентифицированы в случаях неудачи с предполагаемой вакциной у PMWS-пострадавших свиней в системе производства, расположенной в Соединенных Штатах (Xiao et al., 2012, Journal of Virology (jvi.asm.org), Vol. 86, No. 22, p. 12469). Полный геном данных двух штаммов США, как было обнаружено, был в составе 1767 nt, и размер его ORF2 гена составлял 705 nt, кодирующий ORF2 белок 234 аа, который был на одну аминокислоту длиннее, чем у общего PCV2. Филогенетический анализ с нуклеотидными последовательностями ORF2 классических PCV2a и PCV2b штаммов предположил, что как U.S. PCV2 штаммы US 22625-33, так и US 22664-35 тесно связаны с PCV2b. По сравнению с классическим PCV2b одна базовая делеция в пределах ORF2 гена в результате приводила к добавлению одной аминокислоты (лизина) в С-конец ORF2 белка. Кроме того, последовательность BLAST и сравнение показало, что оба штамма PCV2 США имели высокий уровень идентичности (99,9%) с PCV2 штаммом, BDH, обнаруженным в Китае, и, как сообщалось, имели повышенную вирулентность. Одна молчащая мутация (1677А→1677Т) в ORF1 была найдена между BDH двумя мутантными U.S. PCV2. В соответствии с новым определением PCV2 генотипа и номенклатурными критериями (Cortey, et al., 2011, Vet. Microbiol. 149:522-523; Segales, et al., 2008, Vet. Rec. 162: 867-868) все из данных новых мутантных PCV2 штаммов могли быть классифицированы как генотип PCV2b, на основании филогенетического анализа нуклеотидной последовательности гена ORF2 (Xiao et al., 2012, выше).
Ввиду сообщений о повышении вирулентности нового дивергента PCV2b, а также его присутствие в случаях неудачи с предполагаемой вакциной в Соединенных Штатах, что необходимо, является эффективной вакцина против данного нового PCV2b дивергента. Предпочтительно то, что данная вакцина будет совместима с другими антигенами свиней, такими как M. hyo и PRRS вирус.
Сущность изобретения
Представленное изобретение предусматривает вакцинную композицию для защиты свиней против PCV2, включая высоковирулентный дивергентный штамм цирковируса свиней типа 2b (PCV2b), где композиция включает PCV2b дивергентный ORF2 полипептид, где ORF2 полипептид содержит лейцин (L) в положении 89, треонин (Т) в положении 90 и аспарагин (N) в положении 134, в соответствии с нумерацией SEQ ID NO: 1. В одном варианте осуществления композиция также предусматривает гетерологическую защиту против классических штаммов PCV2a и PCV2b.
В одном варианте осуществления композиция находится в форме инактивированного, PCV2b дивергентного целого вируса, который содержит и/или экспрессирует PCV2b дивергентный ORF2 полипептид.
В другом варианте осуществления композиция находится в форме инактивированного химерного вируса, где химерный вирус содержит инактивированный рекомбинантный цирковирус свиней типа 1, который содержит и/или экспрессирует PCV2b дивергентный ORF2 полипептид.
В еще другом варианте осуществления композиция находится в форме выделенного рекомбинантного PCV2b дивергентного ORF2 полипептида. В одном варианте осуществления выделенный рекомбинантный PCV2b дивергентный ORF2 полипептид экспрессируется из вектора. В другом варианте осуществления вектор представляет собой бакуловирус или парапоксвирус. В следующем варианте осуществления вектор представляет собой живой или инактивированный вектор.
В одном варианте осуществления PCV2b дивергентный ORF2 полипептид, который включает лейцин (L) в положении 89, треонин (Т) в положении 90 и аспарагин (N) в положении 134, в соответствии с нумерацией SEQ ID NO: 1, дополнительно включает, по меньшей мере, один остаток, выбранный из группы, состоящей из: лизина (K) в остатке 59, лизина (K) в остатке 234, треонина (Т) в остатке 190, изолейцина (I) в остатке 53, аспарагина (N) в остатке 68, аргинина (R) или глицина (G) в остатке 169 и изолейцина (I) в остатке 215, в соответствии с нумерацией SEQ ID NO: 1.
В другом варианте осуществления PCV2b дивергентный ORF2 полипептид, который включает лейцин (L) в положении 89, треонин (Т) в положении 90 и аспарагин (N) в положении 134, в соответствии с нумерацией SEQ ID NO: 1, дополнительно включает лизин (K) в остатке 59 и лизин (K) в остатке 234, в соответствии с нумерацией SEQ ID NO: 1.
В следующем варианте осуществления PCV2b дивергентный ORF2 полипептид, который включает лейцин (L) в положении 89, треонин (Т) в положении 90, аспарагин (N) в положении 134, лизин (K) в остатке 59 и лизин (K) в остатке 234, в соответствии с нумерацией SEQ ID NO: 1, дополнительно включает треонин (Т) в остатке 190, изолейцин (I) в остатке 53, аспарагин (N) в остатке 68, аргинин (R) или глицин (G) в остатке 169 и изолейцин (I) в остатке 215, в соответствии с нумерацией SEQ ID NO: 1.
В одном варианте осуществления PCV2 дивергентный ORF2 полипептид представлен аминокислотной последовательностью SEQ ID NO: 1, или ее фрагментом.
В другом варианте осуществления композиция, которая включает PCV2 дивергентный ORF2 полипептид, дополнительно включает, по меньшей мере, один дополнительный свиной антиген. В одном варианте осуществления, по меньшей мере, один дополнительный антиген является защитным против заболевания у свиней, вызванного микроорганизмом.
В одном варианте осуществления микроорганизм включает бактерию, вирус, или простейшее. В другом варианте осуществления микроорганизм выбирают из, но не ограничиваются этим, следующего: вируса свиного репродуктивного и респираторного синдрома (PRRSV), свиного парвовируса (PPV), Haemophilusparasuis, Pasteurellamultocida, Streptococcumsuis, Staphylococcus hyicus, Actinobacillluspleuropneumoniae, Bordetellabronchiseptica, Salmonella choleraesuis, Salmonella enteritidis, Erysipelothrixrhusiopathiae, Mycoplamahyorhinis, Mycoplasma hyosynoviae, бактерий липтоспиры, Lawsoniaintracellularis, вируса свиного гриппа (SIV), антигена Escherichia coli, Brachyspirahyodysenteriae, свиного респираторного коронавируса, вируса эпизоотической диареи свиней (PED), ротавируса, вируса гепатита (TTV), свиного цитомегаловируса, свиных энтеровирусов, вируса энцефаломиокардита, патогена, вызывающего заболевание Ауески, классической свиной лихорадки (CSF) и патогена, вызывающий свиной трансмиссивный гастроэнтерит, или их комбинаций.
В некоторых вариантах осуществления композиция согласно представленному изобретению дополнительно включает адъювант. В одном варианте осуществления адъювант выбирают из, но не ограничиваются этим, адъюванта масло-в-воде, полимерного и водного адъюванта, адъюванта вода-в-масле, гидроксидалюминиевого адъюванта, адъюванта витамина E и/или их комбинаций. В другом варианте осуществления композиция согласно представленному изобретению дополнительно включает фармацевтически приемлемый носитель.
Представленное изобретение также предусматривает способ иммунизации свиньи против PCV2, включая дивергентный штамм PCV2b, где способ включает введение свинье композиции согласно представленному изобретению, как описано выше. Данная композиция для введения включает PCV2b дивергентный ORF2 полипептид, где ORF2 полипептид включает лейцин (L) в положении 89, треонин (Т) в положении 90 и аспарагин (N) в положении 134, в соответствии с нумерацией SEQ ID NO: 1. Как описано выше, данный PCV2b дивергентный ORF2 полипептид может дополнительно включать, по меньшей мере, один остаток, выбранный из следующих: лизина (K) в остатке 59, лизина (K) в остатке 234, треонина (Т) в остатке 190, изолейцина (I) в остатке 53, аспарагина (N) в остатке 68, аргинина (R) или глицина (G) в остатке 169 и изолейцин (I) в остатке 215, в соответствии с нумерацией SEQ ID NO: 1.
В одном варианте осуществления композиция для введения включает вирус, содержащий и/или экспрессирующий PCV2b дивергентный ORF2 полипептид. В другом варианте осуществления композиция для введения включает выделенный рекомбинантный PCV2b ORF2 полипептид.
В одном варианте осуществления способа согласно представленному изобретению композицию могут вводить внутримышечно, интрадермально, трансдермально, подкожно, интраназально или перорально, или другими способами, известными квалифицированному специалисту в данной области. В другом варианте осуществления композицию вводят одной дозой. В еще другом варианте осуществления композицию вводят двумя дозами.
В следующем варианте осуществления композицию вводят свиньям, имеющим материнские антитела против PCV2.
В одном варианте осуществления композицию вводят свиньям в возрасте 3 недель или старше.
Представленное изобретение, кроме того, предусматривает набор. Данный набор включает бутылочку, содержащую вакцинную композицию в соответствии с представленным изобретением для защиты свиней против высоковирулентного дивергентного штамма цирковируса свиней типа 2b (PCV2b). Данная вакцинная композиция включает PCV2b дивергентный ORF2 полипептид, где ORF2 полипептид включает лейцин (L) в положении 89, треонин (Т) в положении 90 и аспарагин (N) в положении 134, в соответствии с нумерацией SEQ ID NO: 1. Как описано выше, данный PCV2b дивергентный ORF2 полипептид может дополнительно включать, по меньшей мере, один остаток, выбранный из следующих: лизин (K) в остатке 59, лизин (K) в остатке 234, треонин (Т) в остатке 190, изолейцин (I) в остатке 53, аспарагин (N) в остатке 68, аргинин (R) или глицин (G) в остатке 169 и изолейцин (I) в остатке 215, в соответствии с нумерацией SEQ ID NO: 1.
В одном варианте осуществления набора вакцинная композиция находится в форме вируса, содержащего и/или экспрессирующего PCV2b дивергентный ORF2 полипептид. В другом варианте осуществления набора вакцинная композиция находится в форме выделенного рекомбинантного PCV2b дивергентного ORF2 полипептида.
В одном варианте осуществления набора вакцинная композиция в бутылочке обеспечивается как готовая к применению жидкая композиция. В другом варианте осуществления набора вакцинная композиция в бутылочке обеспечивается в лиофилизированной форме. В следующем варианте осуществления набор может включать разбавитель. В еще другом варианте осуществления набор может дополнительно включать руководство пользователя, которое содержит информацию о введении вакцинной композиции.
Краткое описание чертежей
Фигура 1 показывает выравнивания аминокислотных последовательностей между капсидной последовательностью PCV2b дивергентного штамма, названного "PCV2B-DIV-MUT", и тем, что из классического PCV2A штамма (названного ISU-40895) и классического PCV2b штамма (названного NMB).
Фигура 2 представляет собой график, показывающий геометрическое среднее, рассчитанное методом наименьших квадратов, копий ДНК на день обработки. *Все "0" были превращены в 1 с целью получения графических изображений.
Фигура 3 представляет собой график, показывающий геометрическое среднее, рассчитанное методом наименьших квадратов, фекальных выделений (ДНК копии) на день обработки после контрольного заражения. *Все "0" были превращены в 1 с целью получения графических изображений.
Фигура 4 представляет собой график, показывающий титры PCV2 ИФА S/P по методу наименших квадратов (НК) на день обработки и обработку.
Фигура 5 представляет собой график обратно преобразованного геометрического среднего, рассчитанного по методу наименьших квадратов, копий ДНК на день обработки.
Фигура 6 представляет собой график обратно преобразованного геометрического среднего, рассчитанного методом наименьших квадратов, фекальных выделений (ДНК копии) на день обработки после контрольного заражения.
Фигура 7 представляет собой график, показывающий титры PCV2 ИФА S/P по методу НК на день исследования
Краткое описание последовательностей
Как используется в данном документе, изоляты PCV2, представленные SEQ ID NO: с 1 до 57 и 66, представляют собой типовые примеры PCV2b дивергентных штаммов.
SEQ ID NO: 1 представляет собой аминокислотную последовательность, которая соответствует капсиду полной длины PCV2b дивергентного штамма, названного PCV2B-DIV-MUT в данном документе.
SEQ ID NO: 2 представляет собой нуклеотидную последовательность, кодирующую капсид полной длины PCV2b дивергентного штамма, названного PCV2B-DIV-MUT в данном документе.
SEQ ID NO: 3 представляет собой аминокислотную последовательность, которая соответствует капсиду полной длины PCV2 штамма: 798-1, с номером доступа GenBank №AB462384.
SEQ ID NO: 4 представляет собой нуклеотидную последовательность, кодирующую капсид полной длины PCV2 штамма: 798-1, с номером доступа GenBank №AB462384.
SEQ ID NO: 5 представляет собой аминокислотную последовательность, которая соответствует капсиду полной длины PCV2 штамма: FF, с номером доступа GenBank №DQ231516.
SEQ ID NO: 6 представляет собой нуклеотидную последовательность, кодирующую капсид полной длины PCV2 штамма: FF, с номером доступа GenBank №DQ231516.
SEQ ID NO: 7 представляет собой аминокислотную последовательность, которая соответствует капсиду полной длины PCV2 штамма: VC 2002-k2, с номером доступа GenBank №EF990645.
SEQ ID NO: 8 представляет собой нуклеотидную последовательность, кодирующую капсид полной длины PCV2 штамма: VC 2002-k2, с номером доступа GenBank №EF990645.
SEQ ID NO: 9 представляет собой аминокислотную последовательность, которая соответствует капсиду полной длины PCV2 изолята: GY09, с номером доступа GenBank №GQ845025.
SEQ ID NO: 10 представляет собой нуклеотидную последовательность, кодирующую капсид полной длины PCV2 штамма: GY09, с номером доступа GenBank №GQ845025.
SEQ ID NO: 11 представляет собой аминокислотную последовательность, которая соответствует капсиду полной длины PCV2 изолята: XS09, с номером доступа GenBank №GQ845028.
SEQ ID NO: 12 представляет собой нуклеотидную последовательность, кодирующую капсид полной длины PCV2 штамма: XS09, с номером доступа GenBank №GQ845028.
SEQ ID NO: 13 представляет собой аминокислотную последовательность, которая соответствует капсиду полной длины PCV2 изолята: SDld01, с номером доступа GenBank №HM535640.
SEQ ID NO: 14 представляет собой нуклеотидную последовательность, кодирующую капсид полной длины PCV2 изолята: SDld01, с номером доступа GenBank №HM535640.
SEQ ID NO: 15 представляет собой аминокислотную последовательность, которая соответствует капсиду полной длины PCV2 изолята: SDld02, с номером доступа GenBank №HM755880.
SEQ ID NO: 16 представляет собой нуклеотидную последовательность, кодирующую капсид полной длины PCV2 изолята: SDld02, с номером доступа GenBank №HM755880.
SEQ ID NO: 17 представляет собой аминокислотную последовательность, которая соответствует капсиду полной длины PCV2 изолята: НМ01, с номером доступа GenBank №HM755881.
SEQ ID NO: 18 представляет собой нуклеотидную последовательность, кодирующую капсид полной длины PCV2 изолята: НМ01, с номером доступа GenBank №HM755881.
SEQ ID NO: 19 представляет собой аминокислотную последовательность, которая соответствует капсиду полной длины PCV2 штамма: NIVS-1, с номером доступа GenBank №HQ378157.
SEQ ID NO: 20 представляет собой нуклеотидную последовательность, кодирующую капсид полной длины PCV2 штамма: NIVS-1, с номером доступа GenBank №HQ378157.
SEQ ID NO: 21 представляет собой аминокислотную последовательность, которая соответствует капсиду полной длины PCV2 изолята: С/2010-2*, с номером доступа GenBank №JF683394.
SEQ ID NO: 22 представляет собой нуклеотидную последовательность, кодирующую капсид полной длины PCV2 изолята: С/2010-2*, с номером доступа GenBank №JF683394.
SEQ ID NO: 23 представляет собой аминокислотную последовательность, которая соответствует капсиду полной длины PCV2 изолята: G/2009-2, с номером доступа GenBank №JF683408.
SEQ ID NO: 24 представляет собой нуклеотидную последовательность, кодирующую капсид полной длины PCV2 изолята: G/2009-2, с номером доступа GenBank №JF683408.
SEQ ID NO: 25 представляет собой аминокислотную последовательность, которая соответствует капсиду полной длины PCV2 изолята: I/2010, с номером доступа GenBank №JF927984.
SEQ ID NO: 26 представляет собой нуклеотидную последовательность, кодирующую капсид полной длины PCV2 изолята: I/2010, с номером доступа GenBank №JF927984.
SEQ ID NO: 27 представляет собой аминокислотную последовательность, которая соответствует капсиду полной длины PCV2 изолята: J/2010, с номером доступа GenBank №JF927985.
SEQ ID NO: 28 представляет собой нуклеотидную последовательность, кодирующую капсид полной длины PCV2 изолята: J/2010, с номером доступа GenBank №JF927985.
SEQ ID NO: 29 представляет собой аминокислотную последовательность, которая соответствует капсиду полной длины PCV2 изолята: К/2010, с номером доступа GenBank №JF927986.
SEQ ID NO: 30 представляет собой нуклеотидную последовательность, кодирующую капсид полной длины PCV2 изолята: К/2010, с номером доступа GenBank №JF927986.
SEQ ID NO: 31 представляет собой аминокислотную последовательность, которая соответствует капсиду полной длины PCV2 изолята: М/2010, с номером доступа GenBank №JF927988.
SEQ ID NO: 32 представляет собой нуклеотидную последовательность, кодирующую капсид полной длины PCV2 изолята: М/2010, с номером доступа GenBank №JF927988.
SEQ ID NO: 33 представляет собой аминокислотную последовательность, которая соответствует капсиду PCV2 изолята: WB/ROM89, с номером доступа GenBank №JN006445.
SEQ ID NO: 34 представляет собой нуклеотидную последовательность, кодирующую капсид PCV2 изолята: WB/ROM89, с номером доступа GenBank №JN006445.
SEQ ID NO: 35 представляет собой аминокислотную последовательность, которая соответствует капсиду полной длины PCV2 изолята: EU-RO-F4-3, с номером доступа GenBank №JN382188.
SEQ ID NO: 36 представляет собой нуклеотидную последовательность, кодирующую капсид полной длины PCV2 изолята: EU-RO-F4-3, с номером доступа GenBank №JN382188.
SEQ ID NO: 37 представляет собой аминокислотную последовательность, которая соответствует капсиду полной длины PCV2 изолята: HNing09, с номером доступа GenBank №JN411096.
SEQ ID NO: 38 представляет собой нуклеотидную последовательность, кодирующую капсид полной длины PCV2 изолята: HNing09, с номером доступа GenBank №JN411096.
SEQ ID NO: 39 представляет собой аминокислотную последовательность, которая соответствует капсиду полной длины PCV2 изолята: YWu09, с номером доступа GenBank №JN411099.
SEQ ID NO: 40 представляет собой нуклеотидную последовательность, кодирующую капсид полной длины PCV2 изолята: YWu09, с номером доступа GenBank №JN411099.
SEQ ID NO: 41 представляет собой аминокислотную последовательность, которая соответствует капсиду полной длины PCV2 изолята: CH-IVT4, с номером доступа GenBank №JX984586.
SEQ ID NO: 42 представляет собой нуклеотидную последовательность гена капсида полной длины PCV2 изолята: CH-IVT4, с номером доступа GenBank №JX984586.
SEQ ID NO: 43 представляет собой аминокислотную последовательность, которая соответствует капсиду полной длины PCV2 изолята: CH-IVT6, с номером доступа GenBank №JX984588.
SEQ ID NO: 44 представляет собой нуклеотидную последовательность гена капсида полной длины PCV2 изолята: CH-IVT6, с номером доступа GenBank №JX984588.
SEQ ID NO: 45 представляет собой аминокислотную последовательность, которая соответствует капсиду полной длины PCV2 изолята: CH-IVT7, с номером доступа GenBank №JX984589.
SEQ ID NO: 46 представляет собой нуклеотидную последовательность гена капсида полной длины PCV2 изолята: CH-IVT7, с номером доступа GenBank №JX984589.
SEQ ID NO: 47 представляет собой аминокислотную последовательность, которая соответствует капсиду полной длины PCV2 изолята, с номером доступа GenBank №JX984590.
SEQ ID NO: 48 представляет собой нуклеотидную последовательность гена капсида полной длины PCV2 изолята, с номером доступа GenBank №JX984590.
SEQ ID NO: 49 представляет собой аминокислотную последовательность, которая соответствует капсиду полной длины PCV2 изолята: CH-IVT9, с номером доступа GenBank №JX984591.
SEQ ID NO: 50 представляет собой нуклеотидную последовательность гена капсида полной длины PCV2 изолята: CH-IVT9, с номером доступа GenBank №JX984591.
SEQ ID NO: 51 представляет собой аминокислотную последовательность, которая соответствует капсиду полной длины PCV2 изолята: CH-IVT10, с номером доступа GenBank №JX984592.
SEQ ID NO: 52 представляет собой нуклеотидную последовательность гена капсида полной длины PCV2 изолята: CH-IVT10, с номером доступа GenBank №JX984592.
SEQ ID NO: 53 представляет собой аминокислотную последовательность, которая соответствует капсиду полной длины PCV2 изолята: CH-IVT11, с номером доступа GenBank №JX984593.
SEQ ID NO: 54 представляет собой нуклеотидную последовательность гена капсида полной длины PCV2 изолята: CH-IVT11, с номером доступа GenBank №JX984593.
SEQ ID NO: 55 представляет собой аминокислотную последовательность, которая соответствует капсиду полной длины PCV2 изолята: GDYX, с номером доступа GenBank №JX519293.
SEQ ID NO: 56 представляет собой нуклеотидную последовательность, кодирующую капсид полной длины PCV2 изолята: GDYX, с номером доступа GenBank №JX519293.
SEQ ID NO: 57 представляет собой полную геномную последовательность PCV2 изолята: GDYX, с номером доступа GenBank №JX519293.
SEQ ID NO: 58 представляет собой аминокислотную последовательность, которая соответствует капсиду полной длины классического PCV2a изолята: ISU-40895, с номером доступа GenBank №AF264042.
SEQ ID NO: 59 представляет собой нуклеотидную последовательность, кодирующую капсид полной длины PCV2a изолята: ISU-40895, с номером доступа GenBank №AF264042.
SEQ ID NO: 60 представляет собой аминокислотную последовательность, которая соответствует капсиду полной длины классического PCV2a изолята: Imp.1010-Stoon, с номером доступа GenBank №AF055392.
SEQ ID NO: 61 представляет собой нуклеотидную последовательность, кодирующую капсид полной длины классического PCV2a изолята: Imp.1010-Stoon, с номером доступа GenBank №AF055392.
SEQ ID NO: 62 представляет собой аминокислотную последовательность, которая соответствует капсиду полной длины классического PCV2a штамма: NMB, с номером доступа GenBank №GU799576.
SEQ ID NO: 63 представляет собой нуклеотидную последовательность, кодирующую капсид полной длины классического PCV2b изолята: NMB, с номером доступа GenBank №GU799576.
SEQ ID NO: 64 представляет собой аминокислотную последовательность, которая соответствует капсиду полной длины классического PCV2c штамма: DK1980PMWSfree, с номером доступа GenBank №EU148503.
SEQ ID NO: 65 представляет собой нуклеотидную последовательность, кодирующую капсид полной длины классического PCV2c штамма: DK1980PMWSfree, с номером доступа GenBank №EU148503.
SEQ ID NO: 66 представляет собой полную геномную последовательность PCV2 дивергента, названного "PCV2b-DIV-MUT".
Детальное описание изобретения
Как используется в описании и формуле изобретения, единственное число включает ссылки на множественное число, если контекст четко не указывает на иное. Например, термин "белковый антиген" включает множественность белковых антигенов, включая их смеси.
Как используется в данном документе, термин "содержащий" подразумевает, что композиции и способы включают перечисленные элементы, но не исключает других элементов.
Как используется в данном документе, термины "PCV2b дивергентный штамм", "PCV2b дивергент", "PCV2 мутант", "новый мутантный PCV2", "мутантный PCV2" и подобные относятся к высоковирулентному PCV2b штамму, который кодирует ORF2 капсидный полипептид, который включает лейцин (L) в положении 89, треонин (Т) в положении 90 и аспарагин (N) в положении 134, в соответствии с нумерацией SEQ ID NO: 1. Кодированный PCV2b дивергентный ORF2 полипептид может дополнительно включать, по меньшей мере, один остаток, выбранный из: лизина (K) в остатке 59, лизина (K) в остатке 234, треонина (Т) в остатке 190, изолейцина (I) в остатке 53, аспарагина (N) в остатке 68, аргинина (R) или глицина (G) в остатке 169 и изолейцина (I) в остатке 215 в соответствии с нумерацией SEQ ID NO: 1.
Как используется в данном документе, термин "PCV2b дивергентный ORF2 полипептид" предназначается для того, чтобы включать вирус, содержащий и/или экспрессирующий PCV2b дивергентный ORF2 полипептид, таким образом, что ORF2 полипептид представляет собой компонент самого вируса (например, белковая оболочка вируса). Вирус может представлять собой PCV, но не должен истолковываться, чтобы ограничиваться такими, и может включать другие вирусы. Данный термин также предназначен для того, чтобы включать выделенный рекомбинантный PCV2b дивергентный ORF2 полипептид.
Термин "антиген" касается соединения, композиции, или иммуногенного вещества которое может стимулировать продуцирование антительного или Т-клеточного ответа, или обоих, у животного, включая композиции, которые вводятся инъекционно или абсорбируются у животного. Иммунный ответ может быть сгенерирован к целой молекуле, или к части молекулы (например, эпитопу или гаптену). Термин "антиген" может включать целый вирус, полипептид, или его фрагмент.
Как используется в данном документе, термин "вакцинная композиция" включает, по меньшей мере, один антиген или иммуноген в фармацевтически приемлемом носителе, приемлемом для индуцирования иммунного ответа у хозяина. Вакцинные композиции могут вводить в дозах и способами, хорошо известными квалифицированному специалисту в области медицины и ветеринарии, принимая во внимание факторы, такие как возраст, пол, вес, вид и состояние животного-реципиента, и способ введения. Способ введения может быть чрескожным, посредством введения через слизистую оболочку (например, пероральный, назальный, анальный, вагинальный) или посредством парентерального способа (интрадермальный, трансдермальный, внутримышечный, подкожный, внутривенный или внутрибрюшинный). Вакцинные композиции могут вводиться самостоятельно, или могут совместно вводиться, или последовательно вводиться с другими лечениями или терапиями. Формы введения могут включать суспензии, сиропы или эликсиры и препараты для парентерального, подкожного, интрадермального, внутримышечного или внутривенного введения (например, инъекционного введения), такие как стерильные суспензии или эмульсии. Вакцинные композиции могут быть введены как спрей, или смешанные с едой и/или водой, или доставлены в смеси с приемлемым носителем, разбавителем или эксципиентом, таким как стерильная вода, физиологический солевой раствор, глюкоза, или аналогичные. Композиции могут содержать вспомогательные вещества, такие как увлажняющие или эмульгирующие агенты, рН буферные агенты, адъюванты, желирующие или повышающие вязкость добавки, консерванты, ароматические агенты, красители и тому подобные, в зависимости от способа введения и желаемого препарата. Стандартные фармацевтические тексты, такие как "Remington's Pharmaceutical Sciences" (1990), могут давать консультацию по получению подходящих препаратов, без излишних экспериментов.
Как определено в данном документе, "иммуногенная или иммунологическая композиция", касается смеси химически связанных веществ, которая содержит, по меньшей мере, один антиген, который вызывает иммунологический ответ у хозяина клеточного и/или антитело-опосредованого иммунного ответа к композиции или вакцине, вызывающей интерес.
Термин "иммунный ответ", как используется в данном документе, касается ответа, вызванного у животных. Иммунный ответ у животных может касаться клеточного иммунитета (CMI), гуморального иммунитета, или может включать оба. Представленное изобретение также предусматривает ограниченный ответ к части иммунной системы. Как правило, "иммунологический ответ" включает, но не ограничиваются этим, один или больше из следующих эффектов: продуцирование или активацию антител, В клетки, хелпер-Т-клетки, супрессор-Т клетки, и/или цитотоксические T клетки и/или yd-T клетки, специфически направленных на антиген или антигены, включенные в композицию или вакцину, представляющей интерес. Предпочтительно хозяин будет демонстрировать или терапевтический, или защитный иммунологический ответ, таким образом, что устойчивость к новой инфекции будет расширяться, и/или клиническая тяжесть заболевания будет снижаться. Такая защита будет продемонстрирована или путем уменьшения или отсутствия симптомов, которые обычно демонстрируются инфицированным хозяином, более быстрым временем восстановления, и/или сниженным титром вируса у инфицированного хозяина.
Как используется в данном документе, термин "иммуногенность" означает способность продуцировать иммунный ответ у хозяина-животного против антигена или антигенов. Данный иммунный ответ формирует основу защитного иммунитета, вызванного вакциной против конкретного возбудителя инфекции.
"Адъювант", как используется в данном документе, означает композицию, состоящую из одного или больше веществ, которые усиливают иммунный ответ к антигену(ам). Механизм, по которому действует адъювант, полностью не известен. Считается, что некоторые адъюванты усиливают иммунный ответ за счет медленного высвобождения антигена, тогда как другие адъюванты являются сильно иммуногенными сами по себе, и считается, что функционируют синергетически.
Как используется в данном документе, термин "мультвалентный" означает вакцину, содержащую больше, чем один антиген, или из одних и тех же микробиологических видов (например, различные изоляты Mycoplasma hyopneumoniae или PCV), из различных видов (например, изоляты как из Pasteurellahemolytica, так и Pasteurellamultocida), или вакцину, содержащую комбинацию антигенов из различных родов (например, вакцина, содержащая антигены из Pasteurellamultocida, Salmonella, Escherichia coli, Haemophilussomnus и Clostridium).
Термин "свинья" или "поросенок", как используется в данном документе, означает животное свиного происхождения, в то время как "свиноматка" касается самки свиньи репродуктивного возраста и способности. "Молодая свинья" представляет собой самку свиньи, которая никогда не была беременной.
Как используется в данном документе, термин "вирулентный" означает изолят, который сохраняет свою способность быть инфекционным у животного-хозяина и способен вызывать заболевание у животного-хозяина.
"Инактивированный вакцина" означает вакцинную композицию, содержащую возбудитель инфекции или патоген, который больше не способен к репликации или росту. Возбудитель может быть бактериальным, вирусным, протозойным или грибковым по происхождению. Инактивация может быть достигнута с помощью различных способов, включая замораживание-оттаивание, химическую обработку (например, обработку β-пропиолактоном (BPL) или формалином), обработку ультразвуком, излучением, теплом или какими-либо другими традиционными средствами, достаточными для предотвращения репликации или роста организма, сохраняя при этом его иммуногенность.
Термин "вариант", как используется в данном документе, касается полипептида или последовательности нуклеиновых кислот, кодирующих полипептид, который имеет одну или больше консервативных аминокислотных вариаций или других незначительных модификаций, таким образом, что соответствующий полипептид имеет практически эквивалентную функцию по сравнению с немутантным типом полипептида. Термин "вариант" также может касаться микроорганизма, содержащего полипептид или последовательность нуклеиновых кислот, имеющую также указанные вариации или модификации.
"Консервативная вариация" означает замену аминокислотного остатка другим биологически аналогичным остатком, или замену нуклеотида в последовательности нуклеиновой кислоты, таким образом, что кодированный аминокислотный остаток не изменится, или является другим биологически подобным остатком. Примеры консервативных вариаций включают замещение одного гидрофобного остатка, такого как изолейцин, валин, лейцин или метионин, на другой гидрофобный остаток, или замещение одного полярного остатка на другой, такое как замещение аргинина на лизин, глютаминовой кислоты на аспарагиновую кислоту, или глутамина на аспарагин и тому подобные. Термин "консервативная вариация" также включает замещенную аминокислоту вместо родительской аминокислоты, при условии, что антитела, индуцированные замещенным полипептидом также иммунореагируют с родительским (незамещенным) полипептидом.
Как используются в данном документе, термины "фармацевтически приемлемый носитель" и "фармацевтически приемлемый наполнитель" являются взаимозаменяемыми и касаются жидкого носителя, содержащего вакцинные антигены, который, может инъекционно вводится хозяину без побочных эффектов. Подходящие фармацевтически приемлемые носители, известные в данной области с уровня техники включают, но не ограничиваются этим, стерильную воду, солевой раствор, глюкозу, декстрозу, или буферные растворы. Носители могут включать вспомогательные вещества, включая, но не ограничиваются этим, разбавители, стабилизаторы (то есть сахара и аминокислоты), консерванты, увлажняющее агенты, эмульгирующие агенты, рН буферные агенты, добавки повышающие вязкость, окрашивающие добавки и тому подобные.
"Североамериканский PRRS вирус" означает какой-либо PRRS вирус, имеющий генетические характеристики, ассоциированные с изолятом североамериканского PRRS вируса, такие как, но не ограничиваются этим, PRRS вирус, который был впервые выделен в Соединенных Штатах приблизительно около 1990-х (смотри, например, Collins, J.E., et al., 1992, J. Vet. Diagn. Invest. 4: 117-126); изолят североамериканского PRRS вируса MN-1b (Kwang, J. et al., 1994, J. Vet. Diagn. Invest. 6: 293-296); Quebec LAF-exp91 штамм PRRS вируса (Mardassi, H. et al., 1995, Arch. Virol. 140: 1405-1418); и изолят североамериканского PRRS вируса VR 2385 (Meng, X.-J et al., 1994, J. Gen. Virol. 75: 1795-1801). Дополнительные примеры штаммов североамериканского PRRS вируса известны в данной области с уровня техники. Генетические характеристики относятся к подобности геномной нуклеотидной последовательности и подобности аминокислотной последовательность общедоступных штаммов североамериканского PRRS вируса. Китайские штаммы PRRS вирус, в целом фактически имеют подобность на приблизительно 80-93% нуклеотидной последовательности североамериканских штаммов.
"Европейский PRRS вирус" касается какого-либо штамма PRRS вируса, имеющего генетические характеристики, связанные с вирусом PRRS, который впервые был выделен в Европе около 1991 (смотри, например, Wensvoort, G., et al., 1991, Vet. Q. 13: 121-130). "Европейский PRRS вирус" также иногда называют в данной области как "Лелистад вирус". Дополнительные примеры штаммов европейского PRRS вируса известны в данной области с уровня техники.
Как используется в данном документе, генетически модифицированный вирус является "ослабленным" если он является менее вирулентным, чем его немодифицированный родительский штамм. Штамм является "менее вирулентным" если он показывает статистически значительное снижение одного или больше параметров, определяющих тяжесть заболевания. Такие параметры могут включать уровень виремии, лихорадку, тяжесть дыхательной недостаточности, тяжесть репродуктивных симптомов, или количество или тяжесть патологических поражений и т.д.
"Инфекционный клон" представляет собой изолированный или клонированный геном возбудителя заболевания (например, вирусы), которые могут быть конкретно и целенаправленно модифицированы в лаборатории и затем использованы для повторного создания живого генетически модифицированного организма. Живой генетически модифицированный вирус, полученный из инфекционного клона, может быть использован в живой вирусной вакцине. Альтернативно инактивированные вирусные вакцины могут быть получены путем обработки живого вируса, полученного из инфекционного клона с инактивирующими агентами, такими как формалин, бета-пропиолактон, бинарный этиленамин или гидрофобные растворители, кислоты и т.д., путем облучения ультрафиолетовым светом или рентгеновскими лучами, путем нагревания и т.д.
Представленное изобретение предусматривает вакцинную композицию для защиты свиней против PCV2, которая включает высоковирулентный дивергентный штамм цирковируса свиней типа 2b (PCV2b), где композиция включает PCV2b дивергентный ORF2 полипептид, где ORF2 полипептид содержит лейцин (L) в положении 89, треонин (Т) в положении 90 и аспарагин (N) в положении 134, в соответствии с нумерацией SEQ ID NO: 1. Как описано выше, данный PCV2b дивергентный ORF2 полипептид может дополнительно включать, по меньшей мере, один остаток, выбранный из следующих: лизина (K) в остатке 59, лизина (K) в остатке 234, треонина (Т) в остатке 190, изолейцина (I) в остатке 53, аспарагина (N) в остатке 68, аргинина (R) или глицина (G) в остатке 169 и изолейцина (I) в остатке 215, в соответствии с нумерацией SEQ ID NO: 1.
В одном варианте осуществления PCV2b дивергентный ORF2 полипептид который включает лейцин (L) в положении 89, треонин (Т) в положении 90 и аспарагин (N) в положении 134, в соответствии с нумерацией SEQ ID NO: 1, дополнительно включает лизин (K) в остатке 59 и лизин (K) в остатке 234, в соответствии с нумерацией SEQ ID NO: 1.
В следующем варианте осуществления PCV2b дивергентный ORF2 полипептид, который включает лейцин (L) в положении 89, треонин (Т) в положении 90, аспарагин (N) в положении 134, лизин (K) в остатке 59 и лизин (K) в остатке 234, в соответствии с нумерацией SEQ ID NO: 1, дополнительно включает треонин (Т) в остатке 190, изолейцин (I) в остатке 53, аспарагин (N) в остатке 68, аргинин (R) или глицин (G) в остатке 169 и изолейцин (I) в остатке 215, в соответствии с нумерацией SEQ ID NO: 1.
В одном варианте осуществления PCV2 дивергентный ORF2 полипептид представлен с помощью аминокислотной последовательности SEQ ID NO: 1 или ее фрагмента. Однако представленное изобретение не ограничивается данным вариантом осуществления. Например, в других вариантах осуществления PCV2 дивергентный ORF2 полипептид может быть выбран, но не ограничивается этим, из аминокислотной последовательности SEQ ID NO: 3 или ее фрагмента, аминокислотной последовательности SEQ ID NO: 5 или ее фрагмента, аминокислотной последовательности SEQ ID NO: 7 или ее фрагмента, аминокислотной последовательности SEQ ID NO: 9 или ее фрагмента, аминокислотной последовательности SEQ ID NO: 11 или ее фрагмента, аминокислотной последовательности SEQ ID NO: 13 или ее фрагмента, аминокислотной последовательности SEQ ID NO: 13 или ее фрагмента, аминокислотной последовательности SEQ ID NO: 15 или ее фрагмента, аминокислотной последовательности SEQ ID NO: 17 или ее фрагмента, аминокислотной последовательности SEQ ID NO: 19 или ее фрагмента, аминокислотной последовательности SEQ ID NO: 21 или ее фрагмента, аминокислотной последовательности SEQ ID NO: 23 или ее фрагмента, аминокислотной последовательности SEQ ID NO: 25 или ее фрагмента, аминокислотной последовательности SEQ ID NO: 27 или ее фрагмента, аминокислотной последовательности SEQ ID NO: 29 или ее фрагмента, аминокислотной последовательности SEQ ID NO: 31 или ее фрагмента, аминокислотной последовательности SEQ ID NO: 33 или ее фрагмента, аминокислотной последовательности SEQ ID NO: 35 или ее фрагмента, аминокислотной последовательности SEQ ID NO: 37 или ее фрагмента, аминокислотной последовательности SEQ ID NO: 39 или ее фрагмента, аминокислотной последовательности SEQ ID NO: 41 или ее фрагмента, аминокислотной последовательности SEQ ID NO: 43 или ее фрагмента, аминокислотной последовательности SEQ ID NO: 45 или ее фрагмента, аминокислотной последовательности SEQ ID NO: 47 или ее фрагмента, аминокислотной последовательности SEQ ID NO: 49 или ее фрагмента, аминокислотной последовательности SEQ ID NO: 51 или ее фрагмента, аминокислотной последовательности SEQ ID NO: 53 или ее фрагмента, или аминокислотной последовательности SEQ ID NO: 55 или ее фрагмента.
В одном варианте осуществления вакцинные композиции согласно представленному изобретению включают, по меньшей мере, один дополнительный антиген. В одном варианте осуществления, по меньшей мере, один дополнительный антиген защищает против заболевания у свиней, вызванного микроорганизмом.
В некоторых вариантах осуществления, по меньшей мере, один дополнительный антиген компонент защищает против заболевания у свиней, вызванного бактериями, вирусами или простейшими, которые, как известно, инфицируют свиней. Примеры таких микроорганизмов включают, но не ограничиваются этим, следующие: M. hyo, вирус свиного репродуктивного синдрома и вирус респираторного синдрома (PRRSV), свиной парвовирус (PPV), Haemophilusparasuis, Pasteurellamultocida, Streptococcumsuis, Staphylococcus hyicus, Actinobacillluspleuropneumoniae, Bordetellabronchiseptica, Salmonella choleraesuis, Salmonella enteritidis, Erysipelothrixrhusiopathiae, Mycoplamahyorhinis, Mycoplasma hyosynoviae, бактерии липтоспиры, Lawsoniaintracellularis, вирус свиного гриппа (SIV), антиген Escherichia coli, Brachyspirahyodysenteriae, свиной респираторный коронавирус, вирус эпизоотической диареи свиней (PED), свиной ротавирус (например, группы А, В и С), вирус гепатита (TTV), свиной цитомегаловирус, свиные энтеровирусы, вирус энцефаломиокардита, патоген, вызывающий заболевание Ауески, классическую свиную лихорадку (CSF) и патоген, вызывающий свиной трансмиссивный гастроэнтерит, или их комбинации.
В одном варианте осуществления, по меньшей мере, один дополнительный антиген представляет собой Mycoplasma hyopneumoniae (M. hyo). В другом варианте осуществления, по меньшей мере, один дополнительный антиген представляет собой PRRS вирус, такой как североамериканский штамм PRRS вируса, китайский штамм PRRS вируса, или европейский штамм PRRS вируса. Кроме того, ожидается, что, по меньшей мере, один дополнительный антиген может быть отличающимся изолятом PCV2, таким как классический PCV2a штамм, классический PCV2b штамм, или другие PCV2 генотипы.
В одном варианте осуществления композиция находится в форме инактивированного, PCV2b дивергентного целого вируса, который содержит и/или экспрессирует PCV2b дивергентный ORF2 полипептид.
В одном варианте осуществления ORF2 капсидный ген PCV2b дивергентного целого вируса соответствует SEQ ID NO: 2. В следующем варианте осуществления аминокислотная последовательность PCV2b дивергентного ORF2 полипептида, который экспрессируется с помощью PCV2b дивергентного целого вируса, соответствует SEQ ID NO: 1 или ее фрагменту. Однако представленное изобретение не ограничивается данными вариантами осуществления. Например, в некоторых вариантах осуществления PCV2b дивергентный ORF2 полипептид, экспрессированный PCV2b дивергентным целым вирусом, может быть выбранным из каких-либо следующих последовательностей или ее фрагментов: SEQ ID NO: 3, SEQ ID NO: 5 SEQ ID NO: 7, SEQ ID NO: 9, SEQ ID NO: 11, SEQ ID NO: 13, SEQ ID NO: 15, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 21, SEQ ID NO: 23, SEQ ID NO: 25, SEQ ID NO: 27, SEQ ID NO: 29, SEQ ID NO: 31, SEQ ID NO: 33, SEQ ID NO: 35, SEQ ID NO: 37, SEQ ID NO: 39, SEQ ID NO: 41, SEQ ID NO: 43, SEQ ID NO: 45, SEQ ID NO: 47, SEQ ID NO: 49, SEQ ID NO: 51, SEQ ID NO: 53, или SEQ ID NO: 55. Соответствующие последовательности ORF2 гена описаны в данном документе.
В другом варианте осуществления композиция находится в форме инактивированного химерного вируса, где химерный вирус содержит инактивированный рекомбинантный цирковирус свиней типа 1, который содержит и/или экспрессирует PCV2b дивергентный ORF2 полипептид (химерный PCV1-2b вирус). Химерные цирковирусы свиней и способы их получения описаны в WO 03/049703 А2 и также в патентах США №№7279166 и 7575752, которые включены в данный документ путем ссылки во всей их полноте.
В одном варианте осуществления ORF2 капсидный ген химерного PCV1-2 вируса соответствует SEQ ID NO: 2. В следующем варианте осуществления аминокислотная последовательность PCV2b дивергентного ORF2 полипептида, который экспрессируется химерным PCV1-2b вирусом, соответствует SEQ ID NO: 1 или ее фрагменту. Однако представленное изобретение не ограничивается данными вариантами осуществления. Например, в некоторых вариантах осуществления PCV2b дивергентный ORF2 полипептид, экспрессированный с помощью химерного PCV1-2b вируса, может быть выбран из каких-либо из следующих последовательностей или их фрагментов: SEQ ID NO: 3, SEQ ID NO: 5 SEQ ID NO: 7, SEQ ID NO: 9, SEQ ID NO: 11, SEQ ID NO: 13, SEQ ID NO: 15, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 21, SEQ ID NO: 23, SEQ ID NO: 25, SEQ ID NO: 27, SEQ ID NO: 29, SEQ ID NO: 31, SEQ ID NO: 33, SEQ ID NO: 35, SEQ ID NO: 37, SEQ ID NO: 39, SEQ ID NO: 41, SEQ ID NO: 43, SEQ ID NO: 45, SEQ ID NO: 47, SEQ ID NO: 49, SEQ ID NO: 51, SEQ ID NO: 53, или SEQ ID NO: 55.
В еще другом варианте осуществления композиция находится в форме выделенного рекомбинантного PCV2b дивергентного ORF2 полипептида. В одном варианте осуществления выделенный рекомбинантный PCV2b дивергентный ORF2 полипептид экспрессируется из вектора, такого как бакуловирус. Альтернативно другие известные векторы экспрессии могут быть использованы, такие как, включая, но не ограничиваются этим, парапокс-векторы. В одном варианте осуществления вектор может представлять собой живой или инактивированный вектор.
В следующем варианте осуществления рекомбинантно-экспрессированный PCV2b дивергентный ORF2 полипептид соответствует SEQ ID NO: 1 или ее фрагменту. Альтернативно в некоторых вариантах осуществления рекомбинантно-экспрессированный PCV2b дивергентный ORF2 полипептид может быть выбран из каких-либо из следующих последовательностей или ее фрагментов: SEQ ID NO: 3, SEQ ID NO: 5 SEQ ID NO: 7, SEQ ID NO: 9, SEQ ID NO: 11, SEQ ID NO: 13, SEQ ID NO: 15, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 21, SEQ ID NO: 23, SEQ ID NO: 25, SEQ ID NO: 27, SEQ ID NO: 29, SEQ ID NO: 31, SEQ ID NO: 33, SEQ ID NO: 35, SEQ ID NO: 37, SEQ ID NO: 39, SEQ ID NO: 41, SEQ ID NO: 43, SEQ ID NO: 45, SEQ ID NO: 47, SEQ ID NO: 49, SEQ ID NO: 51, SEQ ID NO: 53, или SEQ ID NO: 55.
В некоторых формах иммуногенные части PCV2 дивергентного ORF2 белка используют в качестве антигенного компонента в композиции. Например, усеченные и/или замещенные формы или фрагменты PCV2 дивергентного ORF2 белка могут быть использованы в композициях согласно представленному изобретению.
Квалифицированному специалисту в данной области будет понятно, что варианты PCV2b дивергентных ORF2 полипептидов могут быть использованы в композициях согласно представленному изобретению, при условии, что они по-прежнему сохраняют антигенные характеристики, которые делают его полезным в вакцинных композициях согласно настоящему изобретению. Предпочтительно PCV2b дивергентные варианты имеют, по меньшей мере, 80%, предпочтительно, по меньшей мере, 85%, более предпочтительно, по меньшей мере, 90%, еще более предпочтительно, по меньшей мере, 95% идентичность последовательности с полноразмерной геномной последовательностью PCV2 изолята, названного PCV2B-DIV-MUT. Антигенные характеристики иммунологической композиции, например, могут быть установлены с помощью эксперимента контрольного заражения, как это предусмотрено в примерах. Кроме того, антигенная характеристика модифицированного PCV2b дивергентного ORF2 антигена все еще сохраняется, когда модифицированный антиген дает, по меньшей мере, 70%, предпочтительно 80%, более предпочтительно 90% защитного иммунитета по сравнению с немутантным типом PCV2b дивергентного ORF2 белка, имеющего SEQ ID NO: 1.
Компонент PCV2b дивергентного ORF2 антигена обеспечивается в иммуногенной/вакцинной композиции уровне включения антигена, эффективном для индукцирования желаемого иммунного ответа, а именно снижения заболеваемости или уменьшения тяжести клинических признаков в результате инфекции с высоковирулентным штаммом PCV2b, примером которого является вирус, названный PCV2B-DIV-MUT в данном документе. В некоторых вариантах осуществления композиция также предусматривает гетерологическую защиту против классических штаммов PCV2a и PCV2b.
В одном варианте осуществления вакцинная композиция в соответствии с представленным изобретением находится в форме инактивированного рекомбинантного цирковируса свиней типа 1, который содержит и/или экспрессирует PCV2b дивергентный ORF2 полипептид (химерный PCV1-2bDIV вирус). Данный химерный вирус включают в композиции согласно изобретению на уровне, по меньшей мере, 1,0≤RP≤5,0, где RP является единицей относительной эффективности, которая определяется путем количественного анализа антигена с помощью ИФА (исследование эффективности in vitro) по сравнению с эталонной вакциной. В другом варианте осуществления химерный PCV1-2bDIV вирус включают в композиции согласно изобретению с конечной концентрацией от приблизительно 0,5% до приблизительно 5% из 20-кратного (20Х) концентрированного объема PCV1-2bDIV антигена.
В другом варианте осуществления вакцинная композиция в соответствии с представленным изобретением находится в форме инактивированного, PCV2b дивергентного целого вируса, который содержит и/или экспрессирует PCV2b дивергентный ORF2 полипептид. Данный вирус включают в композиции согласно изобретению на уровне, по меньшей мере, 1,0≤RP≤5,0, где RP является единицей относительной эффективности, которая определяется путем количественного анализа антигена с помощью ИФА (исследование эффективности in vitro) по сравнению с эталонной вакциной. В другом варианте осуществления инактивированный PCV2b дивергентный целый вирус включают в композиции согласно изобретению с конечной концентрацией от приблизительно 0,5% до приблизительно 5% из 20-кратного (20Х) концентрированного объема PCV2b дивергентного ORF2 антигена.
В еще другом варианте осуществления вакцинная композиция в соответствии с представленным изобретением находится в форме выделенного рекомбинантного PCV2b дивергентного ORF2 полипептида. PCV2b дивергентный ORF2 рекомбинантный белок может быть включен в композиции согласно изобретению на уровне, по меньшей мере, 0.2 мкг антигена/мл конечной иммуногенной/вакцинной композиции (мкг/мл). В следующем варианте осуществления уровень включения рекомбинантного PCV2b дивергентного ORF2 полипептида составляет от приблизительно 0,2 до приблизительно 400 мкг/мл. В еще другом варианте осуществления уровень включения рекомбинантного PCV2b дивергентного ORF2 полипептида составляет от приблизительно 0,3 до приблизительно 200 мкг/мл. В еще следующем варианте осуществления уровень включения рекомбинантного PCV2b дивергентного ORF2 полипептида составляет от приблизительно 0,35 до приблизительно 100 мкг/мл. В еще другом варианте осуществления уровень включения рекомбинантного PCV2b дивергентного ORF2 полипептида составляет от приблизительно 0,4 до приблизительно 50 мкг/мл.
В одном варианте осуществления вакцинная композиция согласно представленному изобретению включает комбинацию PCV2b дивергентного ORF2 полипептида, и, по меньшей мере, одного M. hyo растворимого антигена (например, два или больше). В одном варианте осуществления вакцинная композиция согласно изобретению включает PCV2b дивергентный ORF2 полипептид и один или больше из следующих M. hyo конкретных белковых антигенов: M. hyo белки с молекулярными массами приблизительно 46 кДа (р46), 64 кДа (р64) и 97кДа (р97). M. hyo белок приблизительно 64 кДа (р64) альтернативно может быть назван как р65 поверхностный антиген из M. hyo, описанный Kim et al. [Infect. Immun. 58(8): 2637-2643 (1990)], a также в патенте США №5788962. Futo et al. описали клонирование и характеристика поверхностного белка 46кДа M. hyo, который может быть использован в композициях согласно данному изобретению [J. Bact 177: 1915-1917 (1995)]. Zhang et al. описали и охарактеризовали р97 адгезиновый белок M. hyo [Infect. Immun. 63: 1013-1019, 1995]. Дополнительно, King et al. описали белок 124 кДа, названный Mhp1 из Р-5722 штамма M. hyo и представили данные, подтверждающие, что Mhp1 и р97 представляет собой один и тот же белок [Vaccine 15: 25-35 (1997)]. Such р97 белки могут быть использованы в композициях согласно данному изобретению. Вакцинные композиции согласно представленному изобретению могут включать, кроме того, M. hyo специфические белковые антигены, такие как, но не ограничиваются этим, белки приблизительно 41 кДа (р41), 42 кДа (р42), 89 кДа (р89) и 65 кДа (р65). См. Okada et al., 2000, J. Vet. Med. В 47: 527-533 and Kim et al., 1990, Infect. Immun. 58(8): 2637-2643. Кроме того, компонент M. hyo может включать M. hyo специфические белковые антигены приблизительно 102 кДа (р102) и 216 кДа (р216). См. патенты США №№6162435 и 7419806 Minion et al.
В другом варианте осуществления вакцинная композиция согласно представленному изобретению включает комбинацию PCV2b дивергентного ORF2 полипептида, по меньшей мере, одного M. hyo растворимого антигена (например, два или больше), а также антигена PRRS вируса. Приемлемые антигены PRRS вируса для использования в PCV2b дивергентных/М. hyo/PRRS композициях согласно представленному изобретению включают изоляты североамериканского PRRS вируса, штаммы китайского PRRS вируса и штаммы европейского PRRS вируса, а также генетически модифицированные версии таких изолятов/штаммов. В одном варианте осуществления компонент антигена PRRS вируса, применяемый в композициях в соответствии с представленным изобретением, представляет собой североамериканский PRRS вирус.
В некоторых вариантах осуществления компонент антигена PRRS вируса, применяемый в композициях согласно данному изобретению, представляет собой изолят североамериканского PRRS вируса, обозначенный как P129, или его живая, генетически модифицированная версия. Предпочтительно генетически модифицированный PRRS вирус не способен продуцировать патогенную инфекцию, при этом способен вызывать эффективный иммунозащитный ответ против инфицирования немутантным типом PRRS вируса.
Генетически модифицированный PRRS вирус для применения в композициях согласно изобретению может быть получен из инфекционного клона. Получение инфекционного клона кДНК изолята североамериканскогой PRRS вируса, обозначенного Р129, описывается в патенте США №6500662, который включен в данное описание полностью в качестве ссылки. Последовательность P129 кДНК раскрывается в Genbank под номером доступа №AF494042 и в патенте США №6500662.
В одном варианте осуществления PCV2b дивергентная/М. hyo комбинированная вакцина обеспечивается в виде разовой дозы вакцины в 1-ой бутылочке. В другом варианте осуществления PCV2b дивергентная/М. hyo/PRRS вирус комбинированная вакцина обеспечивается в виде разовой дозы вакцины в 2-х бутылочках. Например, в некоторых вариантах осуществления PCV2b дивергентная/М. hyo комбинация обеспечивается в виде стабильной жидкой композиции в первой бутылочке, и PRRS вирус обеспечивается в лиофилизированном состоянии во второй бутылочке. В некоторых вариантах осуществления дополнительные свиные антигены могут быть добавлены или в первую, или во вторую бутылочку.
В одном варианте осуществления PRRS вирусный компонент обеспечивается в виде лиофилизированного, генетически модифицированного живого вируса. Перед введением PCV2b дивергентная/М. hyo жидкая форма из первой бутылочки может быть использована, чтобы повторно гидратировать PRRS вирус во второй бутылочке, таким образом, что все три антигена могут быть введены животному одной дозой.
Вакцины согласно представленному изобретению могут быть сформулированы, следуя общепринятому порядку включения фармацевтически приемлемых носителей для животных, включая людей (если приемлемо), таких как стандартные буферы, стабилизаторы, разбавители, консерванты и/или солюбилизаторы, и могут быть сформулированы, чтобы способствовать пролонгированному высвобождению. Разбавители включают вода, солевой раствор, декстрозу, этанол, глицерин и тому подобные. Добавки для изотоничности включают среди других хлорид натрия, декстрозу, маннит, сорбит и лактозу. Стабилизаторы включают среди других альбумин. Другие приемлемые вакцинные носители и добавки, включая те, которые особенно полезны при формулировании модифицированных живых вакцин, известны или будут очевидны квалифицированному специалисту в данной области. Смотри, например, Remington's Pharmaceutical Science, 18th ed., 1990, Mack Publishing, которая включена в данный документ в виде ссылки.
Вакцины согласно представленному изобретению могут дополнительно включать один или больше дополнительных иммуномодулирующих компонентов, таких как, например, среди других адъювант или цитокин. Типы приемлемых адъювантов для применения в композициях согласно представленному изобретению включают следующие: адъювант масло-в-воде, полимерный и водный адъювант, адъювант вода-в-масле, адъювант гидроксид алюминия, адъювант витамин E и/или их комбинации. Некоторые конкретные примеры адъювантов включают, но не ограничиваются этим, полный адъювант Фрейнда, неполный адъювант Фрейнда, Corynebacterium parvum, бацилла Кальмета-Герена, гель гидроксида алюминия, глюкан, сульфат декстрана, оксид железа, альгинат натрия, бакто-адъювант, определенные синтетические полимеры, такие как полиаминокислоты и сополимеры аминокислот, блок-сополимер (CytRx, Atlanta, Ga.), QS-21 (Cambridge Biotech Inc., Cambridge Mass.), SAF-M (Chiron, Emeryville Calif.), адъювант AMPHIGEN®, сапонин, Quil А или другие фракции сапонина, монофосфориллипид А и Avridine липид-аминный адъювант (N,N-диоктадецил-N',N'-бис(2-гидроксиэтил)пропандиамин), "REGRESSIN" (Vetrepharm, Athens, Ga.), парафиновое масло, адъювантная система RIBI (Ribi Inc., Hamilton, Mont.), мурамилдипептид и тому подобные.
Неограничивающие примеры эмульсий масло-в-воде, используемых в вакцине согласно изобретению включают модифицированные SEAM62 и SEAM 1/2 препараты. Модифицированный SEAM62 представляет собой эмульсию масло-в-воде, содержащую 5% (об./об.) сквалена (Sigma), 1% (об./об.) SPAN® 85 детергента (ICI Surfactants), 0,7% (об./об.) TWEEN® 80 детергента (ICI Surfactants), 2,5% (об./об.) этанола, 200 мкг/мл Quil А, 100 мкг/мл холестерина и 0,5% (об./об.) лецитина. Модифицированные SEAM 1/2 представляет собой эмульсию масло-в-воде, содержащую 5% (об./об.) сквалена, 1% (об./об.) SPAN® 85 детергента, 0,7% (об./об.) детергента Tween 80, 2,5% (об./об.) этанола, 100 мкг/мл Quil А и 50 мкг/мл холестерина.
Другой пример адъюванта, используемого в композициях согласно изобретению, представляет собой SP-масло. Как используется в описании и формуле изобретения, термин "SP масло" обозначает масляную эмульсию, содержащую полиоксиэтилен-полиоксипропиленовый блок-сополимер, сквален, полиоксиэтиленсорбитана моноолеат и буферный солевой раствор. Полиоксиэтилен-полиоксипропиленовые блок-сополимеры представляют собой поверхностно-активные вещества, которые помогают суспендированию твердых и жидких компонентов. Данные поверхностно-активные вещества являются коммерчески доступными как полимеры под торговым названием Pluronic®. Предпочтительное поверхностно-активное вещество представляет собой полоксамер 401, который коммерчески доступный под торговым названием Pluronic® L-121. Как правило, SP-масляная эмульсия представляет собой иммуностимулирующую адъювантную смесь, которая будет содержать от приблизительно 1 до 3% об./об. блок-сополимера, от приблизительно 2 до 6% об./об. сквалена, более конкретно от приблизительно 3 до 6% сквалена и от приблизительно 0,1 до 0,5% об./об. полиоксиэтиленсорбитана моноолеат, где оставшуюся часть составляет буферный солевой раствор. В одном варианте осуществления SP-масляная эмульсия присутствует в конечной композиции композиция в об./об. количествах от приблизительно 1% до 25%, предпочтительно от приблизительно 2% до 15%, более предпочтительно от приблизительно 5% до 12% об./об.
Еще другой пример приемлемого адъюванта для применения в композициях согласно изобретению представляет собой адъювант AMPHIGEN™, который состоит из обезжиренного лецитина, растворенного в масле, как правило, светлом жидком парафине.
Другие примеры адъювантов, используемых в композициях согласно изобретению, представляют собой следующие запатентованные адъюванты: MicrosolDiluvac Forte® двойная эмульсионная адъювантная система, адъювант Emunade и адъювант Xsolve. Адъюванты как Emunade, так и Xsolve представляют собой эмульсии светлого минерального масла в воде, но Emunade также содержит гидроксид алюминия и d,l-α- токоферола ацетат является частью адъюванта XSolve. Еще одним примером приемлемого адъюванта для применения в композициях согласно изобретению является адъювант ImpranFLEX™ (адъювант вода-в-масле). Еще одним примером приемлемого адъюванта является адъювант на основе карбомера (Carbopol®). Предпочтительные адъюванты Carbopol® включают полимер Carbopol® 934 и полимер Carbopol® 941.
В одном варианте осуществления адъювант или адъювантную смесь добавляют в количестве от приблизительно 100 мкг до приблизительно 10 мг на дозу. В другом варианте осуществления адъювант/адъювантную смесь добавляют в количестве от приблизительно 200 мкг до приблизительно 5 мг на дозу. В еще другом варианте осуществления адъювант/адъювантную смесь добавляют в количестве от приблизительно 300 мкг до приблизительно 1 мг/дозу.
Адъювант или адъювантная смесь, как правило, присутствует в вакцинной композиции согласно изобретению в об./об. количествах от приблизительно 1% до 25%, предпочтительно от приблизительно 2% до 15%, более предпочтительно от приблизительно 5% до 12% об./об.
Другие "иммуномодуляторы", которые могут быть включены в вакцину, включают, например, один или больше интерлейкинов, интерферонов или других известных цитокинов. В одном варианте осуществления адъювант может быть производным циклодекстрина или полианионным полимером, таким как те, которые описаны в патентах США №№6165995 и 6610310 соответственно.
Представленное изобретение также предусматривает способ иммунизации свиньи против дивергентного штамма PCV2b, где способ включает введение свинье композиции в соответствии с представленным изобретением, как описано выше. Данная композиция для введения включает PCV2b дивергентный ORF2 полипептид, где ORF2 полипептид включает лейцин (L) в положении 89, треонин (Т) в положении 90 и аспарагин (N) в положении 134, в соответствии с нумерацией SEQ ID NO: 1. Как описано выше, данный PCV2b дивергентный ORF2 полипептид может дополнительно включать, по меньшей мере, один остаток, выбранный из следующих: лизина (K) в остатке 59, лизина (K) в остатке 234, треонина (Т) в остатке 190, изолейцина (I) в остатке 53, аспарагина (N) в остатке 68, аргинина (R) или глицина (G) в остатке 169 и изолейцина (I) в остатке 215, в соответствии с нумерацией SEQ ID NO: 1.
В одном варианте осуществления композиция для введения включает вирус, содержащий и/или экспрессирующий PCV2b дивергентный ORF2 полипептид. В другом варианте осуществления композиция для введения включает выделенный рекомбинантный PCV2b ORF2 полипептид.
В одном варианте осуществления способ согласно представленному изобретению, по которому композицию вводят внутримышечно, интрадермально, трансдермально, подкожно или перорально. В другом варианте осуществления композицию вводят одной дозой. В еще другом варианте осуществления композицию вводят двумя дозами.
В следующем варианте осуществления композицию вводят свиньям, которые имеют материнские антитела против PCV2.
В одном варианте осуществления композицию вводят свиньям в возрасте 3 недели или старше.
Вакцинные композиции в соответствии с представленным изобретением могут вводить в дозах и способами хорошо известными квалифицированному специалисту в области медицины и ветеринарии, принимая во внимание такие факторы, как возраст, пол, массу, вид и состояние животного-реципиента и способ введения. Способ введения может быть чрескожным, посредством введения через слизистую оболочку (например, пероральный, назальный, анальный, вагинальный) или парентеральным путем (интрадермальный, трансдермальный, внутримышечный, подкожный, внутривенный, или внутрибрюшинный). Вакцинные композиции в соответствии с представленным изобретением могут вводиться самостоятельно, или могут совместно вводиться или последовательно вводиться вместе с другими лечениями или терапиями. Формы введение могут включать суспензии, сиропы или эликсиры и препараты для парентерального, подкожного, интрадермального, внутримышечного или внутривенного введения (например, инъекционного введения), такие как стерильные суспензии или эмульсии. Вакцинные композиции в соответствии с представленным изобретением могут быть введены как спреи, или смешанными с едой и/или водой, или доставлены в смеси с приемлемым носителем, разбавителем или эксципиентом, таким как стерильная вода, физиологический солевой раствор, глюкоза и тому подобные. Композиции могут содержать вспомогательные вещества, такие как увлажняющие или эмульгирующие агенты, рН буферные агенты, адъюванты, гелеобразующие агенты или добавки повышающие вязкость, консерванты, ароматизирующие агенты, красители и тому подобные, в зависимости от способа введения и желаемого препарата.
Представленное изобретение, кроме того, предусматривает набор. Данный набор включает бутылочку, содержащую вакцинную композицию в соответствии с представленным изобретением для защиты свиней против высоковирулентного дивергентного штамма цирковируса свиней типа 2b (PCV2b). Данная вакцинная композиция включает PCV2b дивергентный ORF2 полипептид, где ORF2 полипептид включает лейцин (L) в положении 89, треонин (Т) в положении 90 и аспарагин (N) в положении 134, в соответствии с нумерацией SEQ ID NO: 1. Как описано выше, данный PCV2b дивергентный ORF2 полипептид может дополнительно включать, по меньшей мере, один остаток, выбранный из следующих: лизина (K) в остатке 59, лизина (K) в остатке 234, треонина (Т) в остатке 190, изолейцина (I) в остатке 53, аспарагина (N) в остатке 68, аргинина (R) или глицина (G) в остатке 169 и изолейцина (I) в остатке 215, в соответствии с нумерацией SEQ ID NO: 1.
В одном варианте осуществления набора вакцинная композиция находится в форме вируса, содержащего и/или экспрессирующего PCV2b дивергентный ORF2 полипептид. В другом варианте осуществления набора вакцинная композиция находится в форме выделенного рекомбинантного PCV2b дивергентного ORF2 полипептида.
В одном варианте осуществления набора согласно представленному изобретению вакцинная композиция в бутылочке обеспечивается как готовая к применению жидкая композиция. В другом варианте осуществления набора вакцинная композиция в бутылочке обеспечивается в лиофилизированной форме. В следующем варианте осуществления набор может включать разбавитель. В еще другом варианте осуществления набор может дополнительно включать руководство пользователя, которое содержит информацию касательно введения вакцинной композиции.
Другой аспект представленного изобретения предусматривает способы получения вакцинной композиции, которая находится в форме инактивированного химерного вируса, где химерный вирус включает инактивированный рекомбинантный цирковирус свиней типа 1, который экспрессирует PCV2b дивергентный ORF2 полипептид. Химерный цирковирус свиней и способы его получения описаны в WO 03/049703 А2 и также в патентах США №№7279166 и 7575752. Способы продуцирования химерного цирковируса свиней, включая инактивированный PCV1, который экспрессирует PCV2b дивергентный ORF2 полипептид описаны в примере 1 ниже. В одном варианте осуществления конечную композицию получают путем смешивания инактивированного cPCV1-2b вируса с приемлемым адъювантом и/или другим фармацевтически приемлемым носителем.
Следующий аспект представленного изобретения предусматривает способы получения вакцинной композиции, которая находится в форме инактивированного, PCV2b дивергентного целого вируса, который экспрессирует PCV2b дивергентный ORF2 полипептид. Такие способы описаны в примере 3 ниже. В одном варианте осуществления конечную композицию получают путем смешивания инактивированного PCV2B-DIV-MUT вируса с приемлемым адъювантом и/или другим фармацевтически приемлемым носителем.
Еще один аспект представленного изобретения предусматривает способы продуцирования рекомбинантного PCV2 дивергентного ORF2 белка, i) путем обеспечивания инфицирования чувствительных клеток в культуре рекомбинантным вирусным вектором, содержащим PCV2 дивергентный ORF2 кодирующий последовательности ДНК, где ORF2 белок экспрессируется рекомбинантным вирусным вектором, и ii) после этого выделение ORF2 белка в супернатанте. Как правило, высокие количества PCV2 дивергентного ORF2 белка может быть выделено в супернатант. Высокие количества PCV2 дивергентного ORF2 означает больше чем приблизительно 20 мкг/мл супернатанта, предпочтительно больше чем приблизительно 25 мкг/мл, еще более предпочтительно больше чем приблизительно 30 мкг/мл, еще более предпочтительно больше чем приблизительно 40 мкг/мл, еще более предпочтительно больше чем приблизительно 50 мкг/мл, еще более предпочтительно больше чем приблизительно 60 мкг/мл, еще более предпочтительно больше чем приблизительно 80 мкг/мл, еще более предпочтительно больше чем приблизительно 100 мкг/мл, еще более предпочтительно больше чем приблизительно 150 мкг/мл, наиболее предпочтительно больше чем приблизительно 190 мкг/мл.
Предпочтительные клеточные культуры имеют число клеток приблизительно 0,3-2,0×106 клеток/мл, более предпочтительно приблизительно 0,35-1,9×106 клеток/мл, еще более предпочтительно приблизительно 0,4-1,8×106 клеток/мл, еще более предпочтительно приблизительно 0,45-1,7×106 клеток/мл и наиболее предпочтительно приблизительно 0,5-1,5×106 клеток/мл. Предпочтительные клетки могут быть определены квалифицированным специалистом в данной области. Предпочтительные клетки представляют собой те, которые чувствительны к инфицированию соответствующим рекомбинантным вирусным вектором, содержащим PCV2 дивергентную ORF2 ДНК и экспрессирующий PCV2 дивергентный ORF2 белок. Предпочтительно клетки представляют собой клетки насекомого и более предпочтительно они включают клетки насекомого, продаваемые под торговым названием клетки насекомого Sf+ (Protein Sciences Corporation, Meriden, Conn.).
Соответствующие питательные среды также могут быть определены квалифицированным специалистом в данной области, где предпочтительными питательными средами являются не содержащие сыворотки среды клеток насекомых, такие как Excell 420 (JRH Biosciences, Inc., Lenexa, Kans.) и тому подобные. Предпочтительные вирусные векторы включают бакуловирус, такой как BaculoGold (BD Biosciences Pharmingen, San Diego, Calif.), в частности, если продуцирующие клетки являются клетками насекомых. Хотя система экспрессии бакуловируса является предпочтительной, квалифицированному специалисту в данной области следует понимать, что другие системы экспрессии будут работать для целей представленного изобретения, а именно экспрессии PCV2 дивергентного ORF2 в супернатанте клеточной культуры. Такие другие системы экспрессии могут требовать использования сигнальной последовательности для того, чтобы вызвать экспрессию ORF2 в средах. Однако, когда ORF2 продуцируется системой экспрессии бакуловируса, тогда, как правило, не требуется какой-либо сигнальной последовательности или дополнительной модификации для того, чтобы вызвать экспрессию ORF2 в средах. Считается, что данный белок независимо может образовывать вирусоподобные частицы (Journal of General Virology 2000, Vol. 81, pp. 2281-2287), и секретироваться в культуральном супернатанте. Рекомбинантный вирусный вектор, содержащий PCV2 дивергентные ORF2 ДНК последовательности, предпочтительно имеет множественность заражения (MOI) приблизительно 0,03-1,5, более предпочтительно приблизительно 0,05-1,3, еще более предпочтительно приблизительно 0,09-1,1 и наиболее предпочтительно приблизительно 0,1-1,0, когда для инфицирования используются чувствительные клетки. Предпочтительно MOI, как указано выше, касается одного мл культуральной жидкости клеток. Предпочтительно способ, описанный в данном документе включает инфицирование 0,35-1,9×106 клеток/мл, еще более предпочтительно приблизительно 0,4-1,8×106 клеток/мл, еще более предпочтительно приблизительно 0,45-1,7×106 клеток/мл и наиболее предпочтительно приблизительно 0,5-1,5×106 клеток/мл рекомбинантным вирусным вектором, содержащим PCV2 дивергентную ORF2 ДНК и экспрессирующим PCV2 дивергентный ORF белок, имеющий MOI (множественность заражения) приблизительно 0,03-1,5, более предпочтительно приблизительно 0,05-1,3, еще более предпочтительно приблизительно 0,09-1,1 и наиболее предпочтительно приблизительно 0,1-1,0.
Инфицированные клетки затем инкубируют в течение периода вплоть до десяти дней, более предпочтительно от приблизительно двух дней до приблизительно десяти дней, еще более предпочтительно от приблизительно четырех дней до приблизительно девяти дней и наиболее предпочтительно от приблизительно пяти дней до приблизительно восьми дней. Предпочтительные условия инкубирования включают температуру приблизительно 22-32°С, более предпочтительно приблизительно 24-30°С, еще более предпочтительно приблизительно 25-29°С, еще более предпочтительно приблизительно 26-28°С и наиболее предпочтительно приблизительно 27°С. Предпочтительно клетки Sf+ наблюдаются после инокуляции для характеристики изменений, вызванных бакуловирусом. Такое наблюдение может включать контролирование тенденций плотности клеток и снижение жизнеспособности в период после инфицирования. Пик вирусного титра, как правило, наблюдается через 3-5 дней после инфицирования, и пик высвобождения ORF2 из клеток в супернатанте, как правило, получают с 5 по 8 день, и/или когда жизнеспособность клеток снижается до меньше чем 10%.
Процесс выделение предпочтительно начинается с отделения клеточного дебриса от экспрессированного PCV2 дивергентного ORF2 полипептида в средах посредством стадии отделения. Предпочтительные стадии отделения включают фильтрацию, центрифугирование со скоростью вплоть до приблизительно 20000×g, непрерывное центрифугирование потока, хроматографическое разделение с использованием ионного обмена или гель-фильтрации, и традиционные способы иммуноаффинности. Данные способы известны квалифицированному специалисту в данной области (например, Harris and Angel (eds.), Protein purification methods--a practical approach, IRL press Oxford 1995). Предпочтительные способы фильтрации включают тупиковую микрофильтрацию и фильтрацию тангенциального потока (или поперечного потока), включая фильтрацию через полые волокна. Из них предпочтительной является тупиковая микрофильтрация. Предпочтительные размеры пор для тупиковой микрофильтрации составляют приблизительно 0,30-1,35 мкм, более предпочтительно приблизительно 0,35-1,25 мкм, еще более предпочтительно приблизительно 0,40-1,10 мкм и наиболее предпочтительно приблизительно 0,45-1,0 мкм.
Для выделения рекомбинантного PCV2 дивергентного ORF2 полипептида, который будут использовать в иммуногенной или иммунологической композиции, такой как вакцина, включение стадии инактивации является предпочтительным для того, чтобы инактивировать вирусный вектор. Предпочтительно данную инактивацию выполняют непосредственно перед или сразу после стадии фильтрации, где после стадии фильтрации является предпочтительным временем для инактивации. Какой-либо традиционный способ инактивации может быть использованы для целей представленного изобретения. Таким образом, инактивацию могут проводить с помощью химических и/или физических обработок. В предпочтительных формах определяется объем собранных жидкостей, и температуру доводят до приблизительно 32-42°С, более предпочтительно приблизительно 34-40°С и наиболее предпочтительно приблизительно 35-39°С. Предпочтительные способы инактивации включают добавление циклизованного бинарного этиленимина (BEI), предпочтительно в концентрации от приблизительно 1 до приблизительно 20 мМ, предпочтительно от приблизительно 2 до приблизительно 10 мМ, еще более предпочтительно от приблизительно 2 до приблизительно 8 мМ, еще более предпочтительно от приблизительно 3 до приблизительно 7 мМ, наиболее предпочтительно от приблизительно 5 мМ. Например инактивация включает добавление раствора 2-бромэтиленамина гидробромида, предпочтительно приблизительно 0,4 М, который был циклизован до 0,2 M бинарного этиленимина (BEI) в 0,3N NaOH, к жидкостям, чтобы получить конечную концентрацию приблизительно 5 мМ BEI. Предпочтительно такие жидкости затем непрерывно перемешивают в течение 72-96 часов, и инактивированные собираемые жидкости могут храниться в замороженном состоянии при -40°С или ниже, или приблизительно 1-7°С. После того как инактивация завершена, раствор тиосульфата натрия, предпочтительно 1,0 М, добавляют для нейтрализации какого-либо остаточного BEI. Предпочтительно тиосульфат натрия добавляют в эквивалентном количестве по сравнению с BEI, который добавляют перед инактивацией. Например, в случае когда BEI добавляют до конечной концентрации 5 мМ, 1,0 M раствор тиосульфата натрия добавляют для того, чтобы получить минимальную конечную концентрацию 5 мМ для нейтрализации какого-либо остаточного BEI.
Еще один аспект представленного изобретения касается способа получения композиции, содержащий PCV2 дивергентный ORF2 белок и инактивированный вирусный вектор. Данный способ включает стадии: i) клонирование амплифицированного PCV2 дивергентного ORF2 гена в вектор переноса; ii) трансфектирование части вектора переноса, содержащей рекомбинантный PCV2 дивергентный ORF2 ген в вирусе; iii) инфицирование клетки в средах с трансфектированным вирусным вектором; iv) инициирование трансфектированного вирусного вектора для экспрессии PCV2 дивергентного ORF2 рекомбинантного белка из PCV2 дивергентного ORF2 гена; v) отделение клеток от супернатанта; vi) выделение экспрессированного PCV2 дивергентного ORF2 белка из супернатанта; и vii) инактивирование рекомбинантного вирусного вектора. Предпочтительно рекомбинантный вирусный вектор представляет собой бакуловирус, содержащий ORF2 ДНК кодирующие последовательности, и клетки представляют собой клетки Sf+. Предпочтительные стадии отделения описаны выше, наиболее предпочтительно - это стадия фильтрации. Предпочтительные стадии инактивации описаны выше. Предпочтительно инактивацию выполняют при приблизительно 35-39°С и в присутствии от 2 до 8 мМ BEI, еще более предпочтительно в присутствии приблизительно 5 мМ BEI. Предпочтительно инактивацию выполняют в течение, по меньшей мере, 24 часов, еще более предпочтительно в течение 24-72 часов.
В соответствии со следующим аспектом способ получения композиции, содержащей PCV2 дивергентный ORF2 белок и инактивированный вирусный вектор, как описано выше, также включает стадию нейтрализации после стадии vii). Данная стадия viii) включает добавление эквивалентного количества агента, который нейтрализует агент инактивации в растворе. Предпочтительно, если агент инактивации представляет собой BEI, предпочтительным является добавление тиосульфата натрия в эквивалентном количестве. Таким образом, в соответствии с со следующим аспектом стадия viii) включает добавление раствора тиосульфата натрия до конечной концентрации от приблизительно 1 до приблизительно 20 мМ, предпочтительно от приблизительно 2 до приблизительно 10 мМ, еще более предпочтительно от приблизительно 2 до приблизительно 8 мМ, еще более предпочтительно от приблизительно 3 до приблизительно 7 мМ, наиболее предпочтительно от приблизительно 5 мМ, когда агентом инактивации является BEI.
В другом аспекте представленного изобретения предусматривается способ получения композиции, предпочтительно антигенной композиции, такой как, например, вакцина, для вызова иммунного ответа против PCV2 дивергентного штамма. Как правило, данный способ включает стадии трансфектирования конструкта в вирус, где конструкт содержит i) рекомбинантную ДНК из ORF2 PCV2 дивергентного штамма, ii) инфицирование клетки в питательных средах трансфектированным вирусом, iii) индуцирование вируса для экспрессии рекомбинантного белка из PCV2 дивергентного ORF2, iv) выделение экспрессированного ORF2 белка из супернатанта, v) и получение композиции путем смешивания выделенного белка с приемлемым адъювантом и/или другим фармацевтически приемлемым носителем.
Следующие примеры представляют предпочтительные материалы и процедуры в соответствии с представленным изобретением. Однако следует понимать, что данные примеры приведены только в качестве иллюстрации и ничто в них не должно рассматриваться как ограничение общего объема изобретения.
Пример 1: Способы продуцирования химерного цирковируса свиней (cPCV)1-2
cPCV1-2 конструируют путем клонирования иммуногенного капсидного гена патогенного дивергентного штамма цирковируса свиней типа 2b (названного "PCV2B-DIV-MUT") в геномном скелете непатогенного цирковируса свиней типа 1 (PCV1). Способ конструирования клона химерной ДНК описывается, например, в патенте США №7279166, который включен в данный документ в виде ссылки в полном своем объеме. Исходный инфекционный раствор химерного вируса используют для инфицирования клеток свиной почки (PK)-15, выращенных в минимально обогащенной среде (MEM), дополненной 0,05% лактальбумингидрозилата (LAH), 30 мкг/мл гентамицина сульфата и 5% фетальной телячьей сыворотки. Полученный в результате cPCV1-2 инфицированные PK-15 клетки дополнительно увеличивают в объеме путем серийного пассирования более четырех раз с использованием такой же питательной среды, за исключением с 2-3% фетальной телячьей сыворотки. Пятое пассирование замораживают, размораживают и фильтруют и полученные в результате лизаты используют для приготовления предварительного посевного материала и дальнейшего посевного материала.
Среда, которая используется для продуцирования вирусного посевного материала, является такой же, которую используют при получении вирусного исходного раствора. Для питательной среды, MEM, OptiMEM или эквивалент представляет собой базовую среду, которая может быть использована для посева клеточной линии PK-15 для выращивания. Питательная среда может быть дополнена вплоть до 10% сывороткой крупного рогатого скота, вплоть до 0,5% лактальбумингидрозилатом, вплоть до 0,5% бычьим сывороточным альбумином и вплоть до 30 мкг/мл гентамицином. Для среды распространения вируса используют MEM, OptiMEM или эквивалент. Среда распространения вируса может быть дополнена вплоть до 0,5% лактальбумингидрозилатом, вплоть до 2% сывороткой крупного рогатого скота, вплоть до 0,5% бычьим сывороточным альбумином и вплоть до 30 мкг/мл гентамицином. Вплоть до 5 г/л глюкозы и вплоть до 5 ммоль/л L-глутамина могут быть добавлены в питательную среду и/или среду распространения вируса по мере необходимости для поддержания клеток.
Исходный вакцинный вирус cPCV1-2 добавляют в клеточную суспензию PK-15 клеток и адсорбируют в течение вплоть до 3 часов. Посевной вирус разбавляют в базовой питательной среде, чтобы получить множественность заражения (MOI) от 0,1 до 0,2.
Культуры клеток PK-15 сначала инокулируют рабочим посевным вирусом во время посева клеток, или когда клетки достигают приблизительно 20%-50% конфлюентности. Данное исходное пассирование может быть названо как "Одностадийный способ инфицирования" для продуцирования исходного раствора антигена, или, кроме того, может использоваться для серийных пассирований. Для серийных пассирований, cPCV1-2 инфицированные клетки PK-15 дополнительно увеличивают в объеме вплоть до 7-го пассирования путем последовательных делений в соотношении 1:5-20 для размножения вируса. Культуральная среда, содержащая суспензию инфицированных клеток с предыдущего пассирования, может служить в качестве посевного материала для последующего пассирования. Инфицированные клетки cPCV1-2 инкубируют в течение от трех (3) до 14 дней для каждого пассирования при 36±2°С, когда клетки достигают ≥90% конфлюентности. Вирус cPCV1-2 вызывает наблюдаемые цитопатические изменения во время репликации вируса. В период сбора, наблюдается округления клеток и значительное количество флоатирующего дебриса. Кроме того, наблюдаются культуры, которые служат визуальным доказательством бактериальной или грибковой контаминации. Время инкубации между сборами для cPCV антигена приведены в таблице 1 ниже:

Культуральные жидкости cPCV1-2 собирают в стерильные емкости и отбирают образцы для микоплазменного загрязнения с использованием известных способов. Несколько сборов могут проводить из роллерного флакона, биореакторов и перфузионных емкостей.
Перед инактивацией собранного cPCV1-2 вируса одну или больше партий антигена могут концентрировать (например, вплоть до 60Х) с помощью ультрафильтрации. Концентраты могут промывать сбалансированным солевым раствором для снижения сывороточных белков.
Сейчас будет описан способ инактивации, ослабления или детоксификации вируса cPCV1-2. После концентрирования cPCV антигена β-пропиолактон (BPL) добавляют к объединенному cPCV1-2 вирусному материалу, чтобы получить приблизительную концентрацию 0,2% об./об. Объединенные вирусные жидкости затем перемешивают в течение минимум 15 минут и затем инактивирующие объемные антигенные жидкости переносят во вторую стерильную емкость. Перенесенные антигенные жидкости выдерживают при температуре 2-7°С при постоянном перемешивании в течение как минимум 24 часов. После как минимум 24 часов второе добавление 0,2% об./об. BPL добавляют к объединенной суспензии. Содержимое затем перемешивают, переносят в третью емкость и выдерживают при температуре 2-7°С при постоянном перемешивании в течение дополнительного времени не меньше чем 84 часов. Как правило, общее время инактивации составляет не меньше чем 108 часов и не больше чем 120 часов. Способ инактивации представлен в таблице 2 ниже.
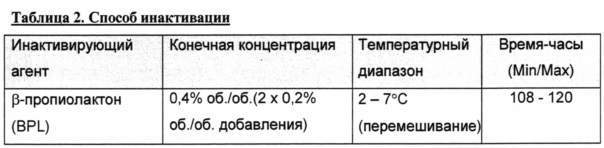
Инактивацию завершают путем добавления конечной концентрации не больше чем 0,1 М раствор тиосульфата натрия. рН исходного раствора инактивированного антигена регулируют до приблизительно 6,8, используя NaOH или HCl. После инактивации типичный образец берут из пула и исследуют касательно завершения инактивации. Инактивированный антигеный продут cPCV1-2 стандартизируют до соответствия целевого параметра больше чем 1,0 RP, как измерено с помощью эффективного ИФА. В одном варианте осуществления конечную композицию получают за счет смешивания инактивированного cPCV1-2b вируса с приемлемым адъювантом и/или другим фармацевтически приемлемым носителем.
Пример 2: Способы получения рекомбинантного PCV2b дивергентного капсидного белка
Получение субъединичной вакцины является результатом двухстадийного процесса: во-первых, продуцирование ORF2 субъединичного антигена в системе экспрессии бакуловируса, и, во-вторых, формулирование/изготовление конечного продукта. Для начальных стадий (конструирование рекомбинантного бакуловируса и продуцирование ORF2 антигена) основной используемый технологическиц процесс сейчас будет описан. Систему экспрессии бакуловируса используют для экспрессии ORF2 гена из PCV2b дивергентного штамма. Рекомбинантный бакуловирус, содержащий PCV2 ORF2 ген, формируется следующим образом: вирусный ДНК выделяют из PK-15 клеток, инфицированных дивергентным штаммом PCV2b, определенных в данном документе как "PCV2B-DIV-MUT". ORF2 ген из данного PCV2b дивергентного штамма ПЦР амплифицируют, чтобы содержать 5' последовательность Козака (ccgccatg) и 3' EcoR1 сайт (gaattc), и клонируют в pGEM-T-Easy вектор (Promega, Madison, Wis.). Затем его последовательно усекают и субклонируют в вектор переноса pVL1392 (BD Biosciences Pharmingen, San Diego, Calif.). pVL1392 плазмиду, содержащую PCV2b дивергентный ORF2 ген затем сотрансфектируют с BaculoGold®. (BD Biosciences Pharmingen) бакуловирусной ДНК в клетках насекомого Spodopterafrugiperda (Sf+) (Protein Sciences, Meriden, Conn.), чтобы генерировать рекомбинантный бакуловирус, содержащий PCV2b дивергентный ORF2 ген. Рекомбинантный бакуловирус, содержащий данный PCV2b дивергентный ORF2 ген, представляет собой очищенную бляшку, и исходный вакцинный вирус (MSV) распространяется на клеточную линию SF+, отбирали аликвоты и хранили при -70°С. MSV положительно идентифицируют как PCV2 ORF2 бакуловирус по ПЦР-ПДРФ с использованием конкретных праймеров бакуловируса. Клетки насекомых инфицировали PCV2 ORF2 бакуловирусом, чтобы сгенерировать MSV или рабочий посевной вирус, экспрессирующий PCV2 ORF2 антиген. Экспрессия ORF2 гена PCV2B-DIV-MUT подтверждается иммуноанализом с использованием гипериммунной сыворотки, которая возникает против PCV2B-DIV-MUT у кроликов, или моноклональными антителами, в косвенном анализе флуоресцентных антител. Альтернативно экспрессия ORF2 гена из PCV2B-DIV-MUT подтверждается иммуноанализом с использованием антитела, которое возникает против классического PCV2a или PCV2b с дивергентным штаммом PCV2b. Дополнительно, идентичность PCV2b дивергентного ORF2 бакуловируса подтверждается N-терминальным аминокислотным секвенированием. PCV2b дивергентный ORF2 бакуловирус MSV также исследуется на чистоту в соответствии с 9 C.F.R. 113.27 (с), 113.28 и 113.55.
Рекомбинантный вирусный вектор, содержащий PCV2 ORF2 ДНК последовательности, имеет предпочтительную множественность заражения (MOI) приблизительно 0,03-1,5, более предпочтительно приблизительно 0,05-1,3, еще более предпочтительно приблизительно 0,09-1,1 и наиболее предпочтительно приблизительно 0,1-1,0, когда для инфицирования использовали чувствительные клетки. Предпочтительно способ, описанный в данном документе, включает инфицирование 0,35-1,9×106 клеток/мл, еще более предпочтительно приблизительно 0,4-1,8×106 клеток/мл, еще более предпочтительно приблизительно 0,45-1,7×106 клеток/мл и наиболее предпочтительно приблизительно 0,5-1,5×106 клеток/мл рекомбинантным вирусным вектором, содержащим PCV2 ORF2 ДНК и экспрессирующим PCV2 ORF белок, имеющий MOI (множественность заражения) приблизительно 0,03-1,5, более предпочтительно приблизительно 0,05-1,3, еще более предпочтительно приблизительно 0,09-1,1 и наиболее предпочтительно приблизительно 0,1-1,0.
Инфицированные клетки затем инкубируют в течение периода вплоть до десяти дней, более предпочтительно от приблизительно двух дней до приблизительно десяти дней, еще более предпочтительно от приблизительно четырех дней до приблизительно девяти дней и наиболее предпочтительно от приблизительно пяти дней до приблизительно восьми дней. Предпочтительные условия инкубирования включают температуру приблизительно 22-32°С, более предпочтительно приблизительно 24-30°С, еще более предпочтительно приблизительно 25-29°С, еще более предпочтительно приблизительно 26-28°С и наиболее предпочтительно приблизительно 27°С. Предпочтительно клетки Sf+ наблюдаются после инокулирования касательно характерных изменений, вызванных бакуловирусом. Такие наблюдения могут включать контроль тенденции плотности клеток и снижение жизнеспособности в период после инфицирования. Пик вирусного титра, как правило, наблюдается через 3-5 дней после инфицирования, и пик высвобождения ORF2 из клеток в супернатант, как правило, получают на 5-8 день, и/или когда жизнеспособность клеток снижается до меньше чем 10%.
В одном варианте осуществления 1000 мл роллерную колбу засевают приблизительно 1,0×106 Sf+ клеток/мл в 300 мл среды Excell 420. Затем колбу инкубируют при 27°С и перемешивают на 100 об/мин. Затем колбу засевают PCV2b дивергентным ORF2/Bac (рекомбинантным бакуловирусом, содержащим PCV2b дивергентный ORF2 ген) посевным вирусом с 0,1 MOI после 24 часов инкубирования.
Затем колбу инкубируют при 27°С в течение всего 6 дней. После инкубирования содержимое колбы центрифугируют и собирают полученный в результате супернатанте, микрофильтруют через мембрану с размером пор 0,45-1,0 мкм и затем инактивируют. Супернатант инактивируют поднятием его температуры до 37±2°С и добавлением 10 мМ бинарного этиленимина (BEI) в супернатант. Затем супернатант непрерывно перемешивают в течение 48 часов. Добавляют 1,0 M раствор тиосульфата натрия для получения конечной минимальной концентрация 5 мМ, чтобы нейтрализовать какой-либо остаточный BEI. Затем количественно определяют количество ORF2 в нейтрализованном супернатанте, используя количественный аналитический способ ИФА, такой как тот, что описан в примере 1 патента США №7700285 Eichmeyer et al. Детектированное антитело представляет собой моноклональное антитело к PCV2b дивергентному ORF2 капсидному белку.
Представленное изобретение является масштабируемым от небольших масштабов продуцирования рекомбинантного PCV2b дивергентного ORF2 до крупномасштабного производства рекомбинантного PCV2b дивергентного ORF2.
Вторая фаза получения вакцины представляет собой формулирование/производство конечного продукта. Стратегия смешивания основывается на: а) фиксированное содержание антигена на дозу, и b) фиксированное количество, по меньшей мере, одного адъюванта. В одном варианте осуществления фармацевтическая форма конечного продукта является эквивалентной эмульсии масло-в-воде. Для того чтобы получить окончательную вакцину, адъювант добавляют к антигенной фракции и перемешивают до тех пор пока однородная эмульсия не будет получена. Доказывается удовлетворительная однородность. Для того чтобы гарантировать, что партия вакцины приведет к заявленной эффективности, ее относительную эффективность определяют с помощью анализа in vivo, который был валидирован. На основании проведенного анализа, исследование эффективности способно обнаруживать субэффективные партии.
Пример 3: Способы получения инактивированного PCV2b дивергентного полного вируса
Инфекционный исходный раствор PCV2b дивергентного вируса:PCV2B-DIV-MUT используют для инфицирования клеток свиной почки (РК)-15, выращенных в минимально обогащенной среде (MEM), дополненной 0,05% лактальбумингидрозилатом (LAH), 30 мкг/мл гентамицина сульфатом и 5% фетальной бычьей сывороткой. Полученный в результате PCV2B-DIV-MUT, инфицированный PK-15 клетками дополнительно увеличивают в объеме путем серийного пассирования более четырех раз, используя такую же питательную среду, за исключением 0,5-3% фетальной бычьей сыворотки. Пятое пассирование замораживают, размораживают и фильтруют и полученные в результате лизаты используют для приготовления предварительного посевного материала и дальнейшего посевного материала.
Среда, которая используется для продуцирования вирусного посевного материала, является такой же, которую используют при получении вирусного исходного раствора. Для питательной среды MEM OptiMEM или эквивалент представляет собой базовую среду, которая может быть использована для посева клеточной линии PK-15 для выращивания. Питательная среда может быть дополнена вплоть до 10% сывороткой крупного рогатого скота, вплоть до 0,5% лактальбумингидрозилатом, вплоть до 0,5% бычьим сывороточным альбумином и вплоть до 30 мкг/мл гентамицином. Для среды распространения вируса используют MEM, OptiMEM или эквивалент. Среда распространения вируса может быть дополнена вплоть до 0,5% лактальбумингидрозилатом, вплоть до 2% сывороткой крупного рогатого скота, вплоть до 0,5% бычьим сывороточным альбумином и вплоть до 30 мкг/мл гентамицином. Вплоть до 5 г/л глюкозы и вплоть до 5 ммоль/л L-глутамина могут быть добавлены в питательную среду и/или среду распространения вируса по мере необходимости для поддержания клеток.
Исходный вакцинный вирус PCV2B-DIV-MUT исходный вакцинный вирус добавляют в клеточную суспензию PK-15 клеток и адсорбируют в течение вплоть до 3 часов. Посевной вирус разбавляют в базовой питательной среде, чтобы получить множественность заражения (MOI) от 0,1 до 0,2.
Культуры клеток PK-15 сначала инокулируют рабочим посевным вирусом во время посева клеток или когда клетки достигают приблизительно 20%-50% конфлюентности. Данное исходное пассирование может быть названо как "Одностадийный способ инфицирования" для продуцирования исходного раствора антигена, или, кроме того, может использоваться для серийных пассирований. Для серийных пассирований инфицированные PCV2B-DIV-MUTPK-15 клетки дополнительно увеличивают в объеме вплоть до 7-го пассирования путем последовательных делений в соотношении 1:5-20 для размножения вируса. Культуральная среда, содержащая суспензию инфицированных клеток с предыдущего пассирования, может служить в качестве посевного материала для последующего пассирования. Инфицированные клетки PCV2B-DIV-MUT инкубируют в течение от трех (3) до 14 дней для каждого пассирования при 36±2°С, когда клетки достигают ≥90% конфлюентности. PCV2B-DIV-MUT вирус может вызывать наблюдаемые цитопатические изменения во время репликации вируса. В период сбора наблюдается округления клеток и значительное количество флоатирующего дебриса. Кроме того, наблюдаются культуры, которые служат визуальным доказательством бактериальной или грибковой контаминации. Время инкубации между сборами для PCV2B-DIV-MUT антигена являются такими же, как приведены в таблице 1 выше.
Культуральные жидкости PCV2B-DIV-MUT собирают в стерильные емкости и отбирают образцы для микоплазменного загрязнения с использованием известных способов. Несколько сборов могут проводить из роллерного флакона, биореакторов и перфузионных емкостей.
Перед инактивацией собранного PCV2B-DIV-MUT вируса одну или больше партий антигена могут концентрировать (например, вплоть до 60Х) с помощью ультрафильтрации. Концентраты могут промывать сбалансированным солевым раствором для снижения сывороточных белков.
Способ инактивации, ослабления или детоксификации PCV2B-DIV-MUT вируса является таким же, как тот, что описан в примере 1 и таблице 2 выше. Инактивацию завершают добавлением конечной концентрации не больше чем 0,1 M раствор тиосульфата натрия. рН исходного раствора инактивированного антигена регулируют до приблизительно 6,8, используя NaOH или HCl. После инактивации типовой образец берут из пула и исследуют для завершения инактивации. Инактивированный PCV2B-DIV-MUT антигенный продукт стандартизируют до соответствия целевого параметра больше чем 1,0 RP, как измерено с помощью эффективного ИФА. В одном варианте осуществления конечную композицию получают за счет смешивания инактивированного PCV2B-DIV-MUT вируса с приемлемым адъювантом и/или другим фармацевтически приемлемым носителем.
Пример 4: Обоснование PCV2b принципа исследования
Цель исследования состояла в том, чтобы оценить PCV2b дивергентную вакцину-кандидата для гомологичной и гетерологичной защиты. Дизайн исследования приведен в таблице 3. IVP для Т04, Т08 и Т12 состоял из убитого PCV2b-дивергентного вируса, адъювантного 10% SP-масло. IVP для Т02, Т06 и Т10 состоял из убитого химерного PCV1:2a вируса, адъювантного 10% SP-масло. IVP для Т03, Т07 та Т11 состоял из убитого химерного PCV1:2b вируса, адъювантного 10% SP-масло.

Свиньи в возрасте 3-4 недели были вакцинированы в день 0. Единичная доза 2 мл предназначенной вакцины вводили внутримышечно (в.м.) в правую сторону шеи. Единичный 3 мл стерильный шприц с 1'' или ¾'' иглой использовали для каждой свиньи. Детальные сведения о вакцинации были записаны. Свиней наблюдали в течение 1 часа (±30 минут) после каждой вакцинации касательно ненормальных клинических признаков, включая, но не ограничиваются этим: вялость, затрудненное дыхание, рвота и нарушение координации. Какие-либо наблюдаемые клинические признаки были зафиксированы в общей медицинской форме о состоянии здоровья. Ветеринар был уведомлен следить за двумя свиньями, у которых присутствовали признаки общего плохого состояния и ухудшение здоровья. Этих животных гуманно подвергли эвтаназии.
Контрольное заражение проводили на 21 день, когда свиньи достигли возраста приблизительно 6-7 недель. Каждую свинью инокулировали общим объемом 3 мл соответствующего вируса контрольного заражения, предварительно разбавленного до 4,8-5,8 log10 TCID50 /мл, где 1 мл вводили интраназально (и.н.) в каждую ноздрю и 1 мл вводили внутримышечно (в.м.). Резервированную аликвоту вирусов контрольного заражения титровали после контрольного заражения, чтобы подтвердить фактическую дозу контрольного заражения.
Индивидуальные образцы крови (5-10 мл) собирали в пробирки для отделения сыворотки (SST) в 1 день (перед вакцинацией) и 7, 14, 20/21, 28, 35 и 42 день. Образцы делили на аликвоты и хранили при ≤ -65°С и затем исследовали касательно титров на PCV2 антитела с использованием ИФА и PCV2 виремии с использованием кПЦР.
Индивидуальные фекальные мазки также были взяты от каждой свиньи перед контрольным заражением (день 20/21) и еженедельно после контрольного заражения. Индивидуальные стерильные полиэфирные тампоны были использованы для сбора фекальных мазков и помещены в пробирку, содержащую 3 мл стерильной PBS среды. Мазки взбалтывали в течение 5 секунд в среде перед тем, как отбросить. Образцы делили на аликвоты и хранили при ≤ -65°С. Образцы фекальных мазков исследовали на выделение вируса, используя стандартные методики количественной ПЦР.
Во время некропсии трахеобронхиальная секция, брыжейка и поверхностные паховые лимфатические узлы и ткани миндалин также были собраны в двух экземплярах для каждой свиньи, индивидуально идентифицированы и фиксированы в 10% буферном формалине. Один набор был архивирован, тогда как другой был представлен для стандартного патоморфологического исследования на лимфоидное истощение (PCVAD) и гистиоцитарную замену. Вывод был записан как Да (+) или Нет (-). Считалось, что свинья имеет лимфоидное истощение или гистиоцитарную замену, если одна или несколько тканей были оценены "+". Кроме того, ткани также исследовали на PCV2 антиген с помощью IHC. Результаты регистрировали как 0 (отсутствие окрашивания) и 1-3 (разные уровни окрашивания). Балл 0 рассматривался как PCV2 IHC (-), и балл от 1 или выше рассматривался как PCV2 IHC (+). Свинья считалась IHC (+), если одна или больше тканей были IHC (+).
Первичные результаты представляли собой гомологичную и гетерологичные защиту кандидатной вакцины по сравнению с плацебо. Первичная переменная представляла собой виремии, и вторичные переменные представляли собой фекальные выделения и гистологические поражения.
Результаты показали, что перед контрольным заражением свиньи оставались отрицательными по PCV2 виремии и фекальным выделениям, как показано в таблицах 4 и 5. В течение всего исследования, однако все свиньи во всех группах лечения стали положительными в какой-то момент для PCV2, как определено с помощью количественной ПЦР касательно PCV2 виремии (таблица 4) и PCV2 фекальных выделений (таблица 5).
таблицах 4 и 5. В течение всего исследования, однако все свиньи во всех группах лечения стали положительными в какой-то момент для PCV2, как определено с помощью количественной ПЦР касательно PCV2 виремии (таблица 4) и PCV2 фекальных выделений (таблица 5).



Перед контрольным заражением титры, как измерено с помощью PCV2 ИФА, показали, что по методу наименьших квадратов (НК) титры всех лечебных групп были отрицательными на PCV2 антитела (Таблица 6). Считалось, что титры PCV2 ИФА антител >0,5 являются положительными на PCV2 антитела.

Обработка экспериментальной PCV2b дивергентной вакциной (Т04, Т08 и Т12) численно уменьшила PCV2 виремии (таблица 4) и фекальное выделение (таблица 5). Кроме того, это привело к уменьшению гистопатологичных поражений в большинстве точек времени по сравнению с плацебо, как продемонстрировано с помощью иммуногистохимической (IHC) оценки (таблица 7) и оценки лимфоидного истощения (таблица 8). После контрольного заражения наблюдался умеренный анамнестический ответ в титрах PCV2 ИФА антитела во всех группах контрольного заражения (таблица 6), потенциально предполагая, что доза вакцины антигена нуждалась в дальнейшей оптимизации. Несмотря на то что статистические сравнения были сделаны в этом исследовании, очевидно, что обработка PCV2b дивергентной вакциной обеспечивала защиту против PCV2a, PCV2b и PCV2b-Дивергентных штаммов контрольного заражения.
При оценке эффективности PCV2 вакцины, многими рассматривается, что виремия и лимфоидное истощение являются ключевыми параметрами для измерения. В данном исследовании важно отметить, что PCV2b дивергентная вакцина исполняла роль защиты численно лучше против PCV2b дивергентного контрольного заражения, чем это делали PCV2a или PCV2b вакцины.
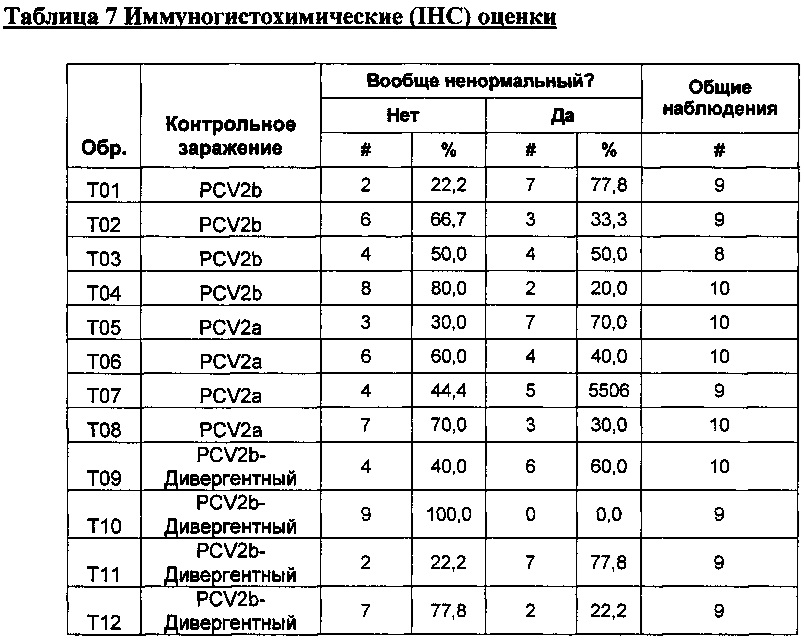

Пример 5: Модель оптимизации исследования PCV2b контрольного заражения
Цель данного исследования состояла в том, чтобы оценить титрования материала PCV2b контрольного заражения и пути введения. Кроме того, предварительная оценка нового препарата PCV2b дивергентного контрольного заражения была проведена вместе с текущими валидированными моделями PCV2a и PCV2b контрольного заражения. Схема дизайна исследования показана в таблице 9.


Кроссбред свиньи возрастом приблизительно 6 недель в день 0 с низким антителом отрицательной сыворотки к PCV2 и не содержащий PCV2 виремии были помещены в назначенные загоны/комнаты в BSL-2 приспособлении с отдельными воздушными промежутками. Было 4 загона в каждой из трех комнат с 12 свиньями на загон. Свиньи оставались в присвоенных загонах на протяжении всего исследования. Свиньи имели неограниченный доступ к воде и немедикаментозный соответствующий возрасту полный рацион на протяжении всего исследования. Всем свиньям давалась возможность акклиматизироваться в течение как минимум трех дней.
Контрольное заражение проводили в день 0, когда возраст свиней составляет приблизительно 6 недель. Каждую свинью инокулировали общим количеством 3 мл соответствующего вируса контрольного заражения, предварительно разбавляли до 4,0-6,0±0,5 log10 TCID50 /мл, 2 мл вводили интраназально (и.н.) в каждую ноздрю и 1 мл внутримышечно (в.м.) или 3 мл в.м. в зависимости от группы обработки. Резервированную аликвоту вирусов контрольного заражения титровали после контрольного заражения, чтобы подтвердить фактическую дозу контрольного заражения.
Индивидуальные образцы крови (5-10 мл) собирали в пробирки для отделения сыворотки (SST) в день -21, день -1 (перед вакцинацией) и 7, 14 и 21 день. Образцы делили на аликвоты и хранили при ≤ -65°С. Сыворотку с дней -21, -1, 7, 14 и 21 исследовали касательно титров на PCV2 антитела с использованием ИФА и PCV2 виремии с использованием кПЦР.
Индивидуальные фекальные мазки также были взяты от каждой свиньи перед контрольным заражением (день-1) и еженедельного после контрольного заражения. Индивидуальные стерильные полиэфирные тампоны были использованы для сбора фекальных мазков и помещены в пробирку, содержащую 3 мл стерильной PBS среды. Мазки взбалтывали в течение 5 секунд в среде перед тем, как отбросить. Образцы делили на аликвоты и хранили при ≤ -65°С. Образцы фекальных мазков исследовали на выделение вируса, используя стандартные методики количественной ПЦР.
Во время некропсии трахеобронхиальная секция, брыжейка и поверхностные паховые лимфатические узлы и ткани миндалин также были собраны в двух экземплярах для каждой свиньи, индивидуально идентифицированы и фиксированы в 10% буферном формалине. Один набор был представлен для стандартного гистопатологического исследования на лимфоидное истощение (PCVAD) и гистиоцитарную замену. Вывод был записан как Да (+) или Нет (-). Считалось, что свинья имеет лимфоидное истощение или гистиоцитарную замену, если одна или несколько тканей были оценены "+". Кроме того, ткани также исследовали на PCV2 антиген с помощью IHC. Результаты регистрировали как О (отсутствие окрашивания) и 1-3 (разные уровни окрашивания). Балл 0 рассматривался как PCV2 IHC (-), и балл от 1 или выше рассматривался как PCV2 IHC (+). Свинья считалась IHC (+), если одна или больше тканей были IHC (+).
Из-за фактической сложности PCV эпидемиологии и чувствительности PCV2 кПЦР, вполне возможно, что некоторые свиньи могут стать виремичными перед контрольным заражением. Свиньи, которых исследовали перед контрольным заражением, могут быть удалены из исследования и могут быть исключены при анализе данных на основе выбора клинического спонсора.
Первичные результаты представляли собой PCV2b дивергентный изолят контрольного заражения, которое исследовали по сравнению с валидированными моделями для PCV2a и PCV2b.
Результаты
Животные, которым вводили PCV2b дивергентный изолят контрольного заражения, имели увеличение в титрах антител перед контрольным заражением до конца исследования по всем группам обработки. Группы неразбавленного контрольного заражения с последующей группой Т12 (разбавление 1:5, вводили и.н.) имели пик виремии через 14 дней после контрольного заражения с более чем 4 миллионами и 1 миллионом ДНК копии/мл соответственно. Пик PCV2 выделений в неразбавленном материале контрольного заражения составлял 754,114 ДНК копии/мл. Неразбавленная в.м./и.н. и только 1:5 и.н. в результате приводила к наибольшему количеству животных положительных касательно гистологических отклонений от нормы и PCV2 колонизации.
На основе данных, собранных из данного исследования оптимизации PCV2b контрольного заражения (данные не показаны), путь контрольного заражения и дозу изменялась на 3 мл интраназально. Изменение пути контрольного заражения и дозы, как полагают, уменьшает вероятность побочных эффектов, которые, как считается, являются вызванными внутримышечным введением и повышают общее принятие контрольного заражения.
Пример 6: Оценка двух кандидатов в вакцины против PCV2b контрольного заражения
Цель исследования состояла в том, чтобы оценить химерную PCV2b вакцину и PCV2b дивергентную вакцину, каждая представлена с низкой и высокой антигенной дозой, против PCV2b контрольное заражение. Дизайн исследования приведен в таблице 10. Плацебо (T01) представляло собой 10% SP-масло. IVP были следующими: Т02, убитая PCV1:PCV2b капсидная химера с низкой дозой (низкий cPCV2b), адъювантная 10% SP-масло; Т03, убитая PCV1:PCV2b капсидная химера с высокой дозой (высокий cPCV2b), адъювантная 10% SP-масло; Т04, убитая PCV2b-дивергентная вакцина с низкой дозой (низкий PCV2b DIV), адъювантная 10% SP-масло; Т05, убитая PCV2b-дивергентная вакцина с высокой дозой (высокий PCV2b DIV), адъювантная 10% SP-масло. Вакцины были получены с использованием 20× концентрированного антигена и затем сформулированы в вакцину с: 0,69% введенного антигена = низкая доза или 3,00% введенного антигена = высокая доза.
Свиньи в возрасте ~3 недель были вакцинированы в день 0. Администратор лечения вводил единичную дозу 2 мл предназначенной вакцины внутримышечно (в.м.) в правую сторону шеи. Единичный 3 мл стерильный шприц с 1'' или ¾'' иглой использовали для каждой свиньи. Детальные сведения о вакцинации были записаны. Свиней наблюдали в течение 1 часа (±30 минут) после каждой вакцинации касательно ненормальных клинических признаков, включая, но не ограничиваются этим: вялость, затрудненное дыхание, рвота и нарушение координации. Какие-либо наблюдаемые клинические признаки были зафиксированы в общей медицинской форме о состоянии здоровья. Ветеринар был уведомлен следить за свиньей(ями) с каким-либо из признаков, описанных выше.
Контрольное заражение проводили на 21 день, когда свиньи достигли возраста приблизительно 6 недель. Каждую свинью инокулировали общим объемом 3 мл интраназально (и.н.) культуры вирулентного PCV2b штамма, предварительно разбавленного до 4,8-5,8 log10 TCID50 /мл. Резервированную аликвоту вирусов контрольного заражения титровали после контрольного заражения, чтобы подтвердить фактическую дозу контрольного заражения.
Индивидуальные образцы крови (5-10 мл) собирали в пробирки для отделения сыворотки (SST) в 1 день - (перед вакцинацией) и 7, 14, 20/21, 28, 35 и 42 день. Образцы делили на аликвоты и хранили при ≤ -65°С. Позже их исследовали касательно титров на PCV2 антитела с использованием ИФА и PCV2 виремии с использованием кПЦР.
Индивидуальные фекальные мазки также были взяты от каждой свиньи перед контрольным заражением (день 20/21) и еженедельно после контрольного заражения. Индивидуальные стерильные полиэфирные тампоны были использованы для сбора фекальных мазков и помещены в пробирку, содержащую 3 мл стерильной PBS среды. Мазки взбалтывали в течение 5 секунд в среде перед тем, как отбросить. Образцы делили на аликвоты и хранили при ≤ -65°С. Образцы фекальных мазков исследовали на выделение вируса, используя стандартные методики количественной ПЦР.
Во время некропсии трахеобронхиальная секция, брыжейка и поверхностные паховые лимфатические узлы и ткани миндалин также были собраны в двух экземплярах для каждой свиньи, индивидуально идентифицированы и фиксированы в 10% буферном формалине. Один набор был архивирован, тогда как другой был представлен для стандартного гистопатологического исследования на лимфоидное истощение (PCVAD) и гистиоцитарную замену. Вывод был записан как Да (+) или Нет (-). Считалось, что свинья имеет лимфоидное истощение или гистиоцитарную замену, если одна или несколько тканей были оценены "+". Кроме того, ткани также исследовали на PCV2 антиген с помощью IHC. Результаты регистрировали как 0 (отсутствие окрашивания) и 1-3 (разные уровни окрашивания). Балл 0 рассматривался как PCV2 IHC (-), и балл от 1 или выше рассматривался как PCV2 IHC (+). Свинья считалась IHC (+), если одна или больше тканей были IHC (+).
Первичные результаты представляли собой защиту одной из четырех кандидатных вакцин против PCV2b контрольного заражения, по сравнению с плацебо. Первичная переменная представляла собой виремию, и вторичные переменные представляли собой фекальные выделения и гистологические поражения.
Результаты
PCV2 Виремии
Сыворотку собирали еженедельно и анализировали касательно PCV2 виремии с использованием количественной ПЦР. Геометрическое среднее, рассчитанное методом наименьших квадратов, для каждого дня исследования проиллюстрированы на фигуре 2. Все свиньи оставались отрицательными касательно PCV2 виремии перед контрольным заражением, как продемонстрировано в таблице 11 ниже.

PCV2 Виремии (ДНК копии) путем обработки и контрольного заражения описаны ниже в таблице 12. Все группы обработки значительно отличались от Т01 группы после контрольного заражения на 35-й и 44-й день (Р<0,0001).
Процент животных, которые были еще положительными на протяжении всего хода исследования, перечислен ниже (таблица 12). Группа плацебо имела значительно более высокое число животных, которые были еще положительными по сравнению с вакцинированными группами (Р<0,0124).
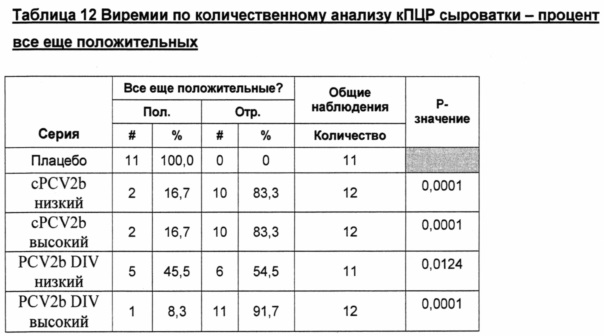
Фекальные выделения PCV2
Геометрическое среднее, рассчитанное методом наименьших квадратов, фекальных выделений на день исследования проиллюстрировано на фигуре 3. PCV2 фекальные выделения (ДНК копии) путем обработки и контрольного заражения описаны ниже в таблице 13. Все группы обработки значительно отличались от Т01 группы после контрольного заражения на 35-й и 44-й день (Р<0,0001).
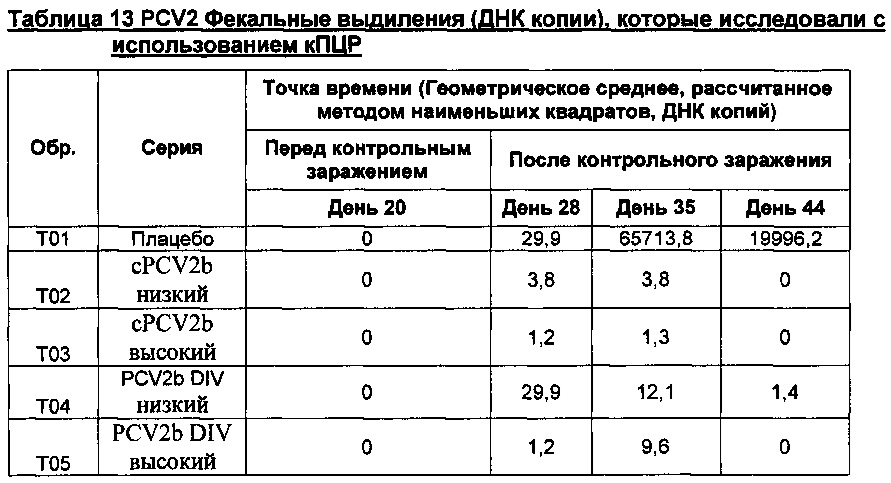
Процент животных, которые были еще положительными по выделениям на протяжении всего хода исследования, перечислен ниже (таблица 14). Группа плацебо имела значительно более высокое число животных, которые были еще положительными по сравнению с вакцинированными группами (Р<0,0124).
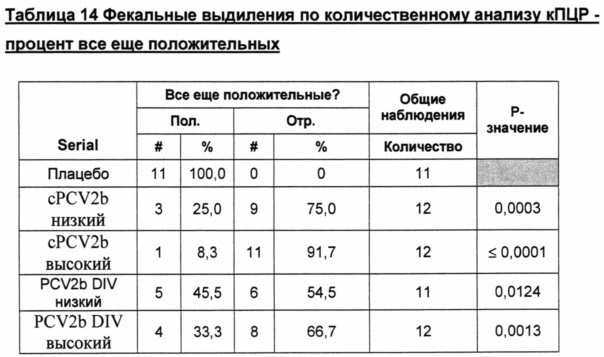
Ответ сывороточных антител
Средние титры PCV2 антител каждого лечения на день исследования проиллюстрированы на фигуре 4. Все свиньи были PCV2 серонегативными перед вакцинацией. Свиньи в группе плацебо оставались серонегативными перед контрольным заражением.
Титры PCV2 ИФА антител приведены в таблице 15 ниже. Все титры>0,5, как считается, являются положительными на PCV2 антитело. Свиньи во всех вакцинных группах показали значительное увеличение (Р≤0,0895) титра PCV2 антител на 28-44-й день после вакцинации по сравнению с плацебо, что указывает на активный иммунный ответ на PCV2 после вакцинации. Кроме того, Т03 и Т05 также имели значительно более высокие титры на 20-й день после вакцинации (Р≤0,0684 и Р≤0,0738 соответственно).

Гистопатология: Лимфоидное истощение (LD) и инфицирование вирусом в лимфоидных тканях (IНС)
Процентные оценки PCV2 не соответствующей норме гистопатологии (данные не показаны) не продемонстрировали существенную разницу между плацебо и вакцинированными группами при рассмотрении на лимфоидные поражения и на присутствие PCV2 антигенов.
Данные этого исследования показали, что все свиньи в исследовании вплоть до контрольного заражения на 21-й день оставались свободными от PCV2 инфекции о чем свидетельствует 1) отсутствие детектируемой PCV2 ДНК в сыворотке, собранной с недельными интервалами с момента вакцинации до времени контрольного заражения и 2) отсутствие серологических доказательств среди T01 группы о том, что было какое-либо непреднамеренное воздействие PCV2 перед контрольным заражением. Все вакцины значительно защищали вакцинированных животных от виремии после контрольного заражения. Кроме того, все вакцины значительно уменьшали фекальные выделения с PCV2 после контрольного заражения у вакцинированных животных. Свиньи во всех вакцинных группах показали значительное увеличение (Р≤0,0895) титра PCV2 антител на 28-44-й день после вакцинирования по сравнению с плацебо, что указывает на активный иммунный ответ к PCV2 после вакцинирования. Наблюдалось численное уменьшение колонизации (IHC) во всех вакцинированных группах по сравнению с контрольной, но это не было статистически значимым. Отсутствие существенных различий между группами может быть из-за слабого контрольного заражения, проводимого в контрольной группе.
Пример 7: Оценка двух кандидатов в вакцины против PCV2b-дивергентного контрольного заражения
Цель исследования состояла в том, чтобы оценить защиту химерной PCV2b вакцины и PCV2b дивергентной вакцины, каждая из которых представлена в низкой и высокой антигенной дозе, а также PCV2a капсид экспрессированный в бакуловирусе, против PCV2b дивергентного контрольного заражения. Дизайн исследования приведен в таблице 16. Плацебо (Т01) представляло собой 10% SP-масло. IVP были следующими: Т02, убитая PCV1:PCV2b капсидная химера с низкой дозой (низкий cPCV2b), адъювантная 10% SP-масло; Т03, убитая PCV1:PCV2b капсидная химера с высокой дозой (высокий cPCV2b), адъювантная 10% SP-масло; Т04, убитая PCV2b-дивергентная вакцина с низкой дозой (низкий PCV2b DIV), адъювантная 10% SP-масло; Т05, убитая PCV2b-дивергентная вакцина с высокой дозой (высокий PCV2b DIV), адъювантная 10% SP-масло; Т06, убитый бакуловирус, экспрессирующий PCV2a капсид, в адъюванте на основе воды (продукт сравнения). Т02-Т05 вакцины были получены с использованием 20-кратного концентрированного антигена и затем сформулированы в вакцину с: 0,69% введенного антигена = низкая доза или 3,00% введенного антигена = высокая доза.

Свиньи в возрасте ~3 недель (в возрасте 21±8 дней) были вакцинированы в день 0. Администратор лечения вводил единичную дозу 2 мл (Т01-Т05) или 1 мл (Т06) предназначенной вакцины внутримышечно (IM) в правую сторону шеи. Единичный 3 мл стерильный шприц с 1'' или ¾'' иглой использовали для каждой свиньи. Детальные сведения о вакцинации были записаны. Свиней наблюдали в течение 1 часа (±30 минут) после каждой вакцинации касательно ненормальных клинических признаков, включая, но не ограничиваются этим: вялость, затрудненное дыхание, рвота и нарушение координации. Какие-либо наблюдаемые клинические признаки были зафиксированы в общей медицинской форме о состоянии здоровья. Ветеринар был уведомлен следить за свиньей(ями) с каким-либо из признаков, описанных выше.
Контрольное заражение проводили на 21 день, когда свиньи достигли возраста приблизительно 6 недель. Каждую свинью инокулировали общим объемом 3 мл интраназально (и.н.) культуры вирулентного PCV2b-дивергентного штамма, предварительно разбавленного до 4,8-5,8 log10 TCID50 /мл. Резервированную аликвоту вирусов контрольного заражения титровали после контрольного заражения, чтобы подтвердить фактическую дозу контрольного заражения.
Индивидуальные образцы крови (5-10 мл) собирали в пробирки для отделения сыворотки (SST) в 1 день - (перед вакцинацией) и 7, 14, 20/21, 28, 35 и 42 день. Образцы делили на аликвоты и хранили при ≤-65°С. Позже их исследовали касательно титров на PCV2 антитела с использованием ИФА и PCV2 виремии с использованием кПЦР.
Индивидуальные фекальные мазки также были взяты от каждой свиньи перед контрольным заражением (день 20/21) и еженедельно после контрольного заражения. Индивидуальные стерильные полиэфирные тампоны были использованы для сбора фекальных мазков и помещены в пробирку, содержащую 3 мл стерильной PBS среды. Мазки взбалтывали в течение 5 секунд в среде перед тем, как отбросить. Образцы делили на аликвоты и хранили при ≤-65°С. Образцы фекальных мазков исследовали на выделение вируса, используя стандартные методики количественной ПЦР.
Во время некропсии трахеобронхиальная секция, брыжейка и поверхностные паховые лимфатические узлы и ткани миндалин также были собраны в двух экземплярах для каждой свиньи, индивидуально идентифицированы и фиксированы в 10% буферном формалине. Один набор был архивирован, тогда как другой был представлен для стандартного гистопатологического исследования на лимфоидное истощение (PCVAD) и гистиоцитарную замену. Вывод был записан как Да (+) или Нет (-). Считалось, что свинья имеет лимфоидное истощение или гистиоцитарную замену, если одна или несколько тканей были оценены "+". Кроме того, ткани также исследовали на PCV2 антиген с помощью IHC. Результаты регистрировали как 0 (отсутствие окрашивания) и 1-3 (разные уровни окрашивания). Балл 0 рассматривался как PCV2 IHC (-), и балл от 1 или выше рассматривался как PCV2 IHC (+). Свинья считалась IHC (+), если одна или больше тканей были IHC (+).
Первичные результаты представляли собой защиту одной из четырех кандидатных вакцин и бакуловирусной вакцины против PCV2b-дивергентного контрольного заражения, по сравнению с плацебо. Первичная переменная представляла собой виремию, и вторичные переменные представляли собой фекальные выделения и гистологические поражения.
PCV2 Виремии
Сыворотку собирали еженедельно и анализировали касательно PCV2 виремии с использованием количественной ПЦР. Геометрическое среднее, рассчитанное методом наименьших квадратов, для каждого дня исследования проиллюстрированы на фигуре 5. Все свиньи, за исключением одного животного как в Т04, так и Т05 группах оставались отрицательными для PCV2 виремии перед контрольным заражением, как продемонстрировано в таблице 17 ниже.

Процент животных, которые были еще положительными на протяжении всего хода исследования, перечислен ниже (таблица 18). Группа плацебо имела значительно более высокое число животных, которые были еще положительными по сравнению с вакцинированными группами (Р<0,0046).
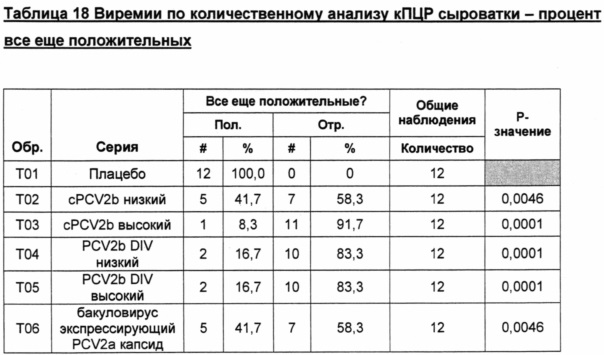
Фекальные выделения PCV2
Геометрическое среднее, рассчитанное методом наименьших квадратов, фекальных выделений на день исследования проиллюстрированы на фигуре 6. PCV2 фекальные выделения (ДНК копии) путем обработки и контрольного заражения описаны ниже в таблице 19. Одно животное в Т04 группе было с выделением за день перед контрольным заражением. Все вакцинные группы были с выделением значительно более низкого (Р≤0,0001) числа PCV2 ДНК копий, как рассчитано по методу наименьших квадратов, чем в группе плацебо на 35-й и 43-й день после контрольного заражения. Кроме того, в Т03, Т05 и Т06 группах также было отмечено выделения значительно более низкого числа ДНК копий, как рассчитано по методу наименьших квадратов, (Р≤0,0830) на 28-й день исследования.
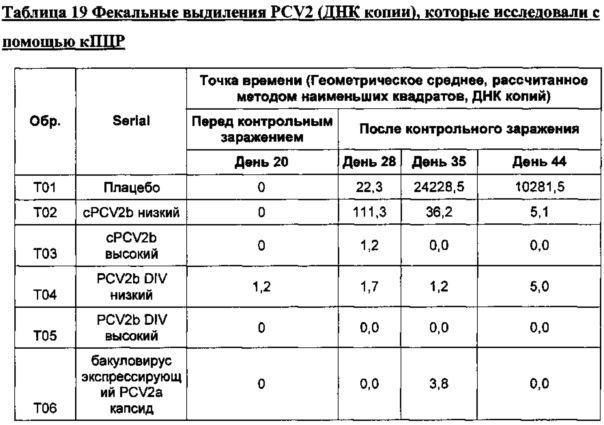
Процент животных, которые были еще положительными по выделениям на протяжении всего хода исследования, перечислен ниже (таблица 20). После контрольного заражения по сравнению с группой плацебо группы Т03-Т06 имели значительное снижение (Р≤0,0028) процента свиней, выделяющих PCV2 ДНК, детектируемую в ПЦР.

Ответ сывороточных антител
По отношению к титрам антител PCV2, результаты показали, что обработки PCV2b дивергентной вакциной (Т04; Т05) имели более сильный серологический ответ по сравнению с другими обработками перед контрольным заражением на 21-й день исследования, как оценено по ИФА (таблица 21; фигура 7). После контрольного заражения, однако, PCV2b дивергентные обработки не давали такого сильного ответа как другие обработки (фигура 7). Один из возможных выводов заключается в том, что животное уже имело конкретный сильный ответ анти-PCV2b дивергентного антитела и было в состоянии очень быстро нейтрализовать и устранить вирус контрольного заражения. Это переводится на сниженный антительный ответ после контрольного заражения, по сравнению с гетерологичной вакциной. Тогда как серология не является тем же самым, что и эффективность, было продемонстрировано, что снижение титра антител у свиней, получающих эффективную вакцину, показывает защиту (Thacker et al., 2013, Proc AASV, 217).

Гистопатология: Лимфоидное истощение (LD) и инфицирование вирусом в лимфоидных тканях (IHC)
Во время некропсии, по сравнению с группою плацебо, все вакцинные группы имели значительно меньший процесс животных с микроскопическими лимфоидными поражениями (LD) и колонизацией PCV2 антигена (IHC), Р≤0,0995.
Данные PCV2 IHC приведены в таблице 22 ниже.

Данные касательно PCV2 лимфоидного истощения (LD) приведены в таблице 23 ниже.

Данные этого исследования показали, что все группы обработки по титрам PCV2 согласно методу наименьших квадратов были серонегативными перед вакцинированием. Свиньи в группе плацебо оставались серонегативными до контрольного заражения. Одно животное в обеих Т04 и Т05 группами были виремичными за день до контрольного заражения. Животное в группе Т04 также было с выделением, однако меньше чем 10% животных стали виремичными перед контрольным заражением, и исследование считалось действительным. После контрольного заражения по сравнению с группой плацебо все вакцинированные группы имели значительное снижение процента свиней с виремией. После контрольного заражения по сравнению с группой плацебо группы Т03-Т06 имели значительное снижение процента свиней с детектируемой по ПЦР PCV2 ДНК в выделениях. При некропсии по сравнению с группой плацебо все вакцинированные группы имели значительно меньший процент животных с микроскопическими лимфоидными поражениями (LD) и колонизацией PCV2 антигена. Исследование продемонстрировало, что cPCV1-2b, PCV2b дивергентные и бакуловирус, экспрессирующая PCV2a, капсидные вакцины перекрестно защищают против PCV2b дивергентного штамма контрольного заражения.
Следует понимать, что приведенные выше примеры представлены только в качестве иллюстрации и ничто в них не должно рассматриваться как ограничение касательно общего объема настоящего изобретения.
Реферат
Изобретения относятся к области биотехнологии и касаются вакцинной композиции, способа иммунизации при использовании указанной композиции и набора для осуществления такого способа. Представленная вакцинная композиция содержит эффективное количество ORF2 полипептида высоковирулентного дивергентного штамма цирковируса свиней типа 2b (PCV2b), кодированного геномной последовательностью, которая имеет, по меньшей мере, 95% идентичность последовательности с SEQ ID NO: 66, где кодированный ORF2 полипептид содержит лейцин (L) в положении 89, треонин (Т) в положении 90 и аспарагин (N) в положении 134 в соответствии с нумерацией SEQ ID NO: 1; и эмульсионный адъювант масло-в-воде. Изобретения могут быть использованы для обеспечения защиты свиней от цирковируса свиней типа 2 (PCV2), включая защиту от PCV2b. 3 н. и 14 з.п. ф-лы, 7 ил., 23 табл., 7 пр.
Формула
Документы, цитированные в отчёте о поиске
Способы и композиции для иммунизации свиней против свиного цирковируса
Вакцина против рсv-2

Комментарии