Новые штаммы вируса ветряной оспы и противовирусная вакцина против ветряной оспы и опоясывающего лишая, в которой применяются такие штаммы - RU2580003C2
Код документа: RU2580003C2
Чертежи









































Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к новым штаммам вируса Varicella zoster (VZV) и противовирусной вакцине против ветряной оспы и опоясывающего лишая, в которой применяются такие штаммы. Более конкретно, настоящее изобретение относится к геномной ДНК штамма VZV MAV/06, выделенного у пациента в Корее и аттенуированного, соответствующей открытой рамке считывания (в дальнейшем называемой ORF), белку, кодируемому геномной ДНК штамма VZV MAV/06 и соответствующей ORF, и вакцинной композиции, содержащий указанный белок в качестве активного компонента.
Уровень техники
Вирус Varicella zoster (в дальнейшем называемый VZV) относится к семейству Herpes viridae и является причиной болезни с двумя различными симптомами (ветряная оспа и опоясывающий лишай (или опоясывающий герпес)).
Что касается штамма VZV, выделенного из клинических проб, первоначально представили полную нуклеотидную последовательность штамма Dumas (Davison, A.J. and Scott, J.E., 1986). Кроме того, полные завершенные нуклеотидные последовательности 23 штаммов VZV, включая парентеральный штамм Oka и три вакцинных вирусных штамма, полученных из парентерального штамма Oka (штамм vOka, штамм Varivax и штамм Varilrix), были введены в базу данных NCBI GenBank на настоящий момент.
В настоящее время исследование определенной области для аттенуирования вакцинного штамма может быть проведено путем сравнительного анализа всех нуклеотидных последовательностей в вакцинном вирусном штамме и клиническом вирусном штамме (Argaw et al., 2000; Gomi et al., 2002; Tillieux et al., 2008; Yamanish, 2008).
Между тем, "Suduvax" главным образом производился корпорацией Green Cross в виде аттенуированной вакцины против ветряной оспы с 1994 года. Вирусный штамм MAV/06, используемый для производства Suduvax, был получен при выделении вируса Varicella zoster из везикул пациента возрастом 33 месяца из Кореи, заразившегося ветряной оспой в 1989 году, и первоначально выделенный VZV культивировали в человеческих эмбриональных клетках легкого, при этом было подтверждено, при проверке различных свойств вируса Varicella zoster, что культивируемый VZV был новым VZV (Park et al., Propagation of Varicella-Zoster Virus isolated in Korea, J. Kor. Soc. Virol. 21, 1-9, 1991).
Suduvax выпускался на рынок Кореи с 1994 года и присутствовал на мировом рынке с 1998 года. Впрочем, даже при том, что эффективность и безопасность Suduvax были доказаны на рынке, молекулярные биологические характеристики, способные описать механизм эффективного действия и аттенуирования вакцины, еще не были представлены.
Молекулярные биологические особенности особенно важны для повышения точности контроля качества и проверки качества для гарантии эффективности, безопасности и гомогенности аттенуированной вакцины и должны быть непременно исследованы.
Описание
Техническая задача
Для решения данной задачи авторы настоящего изобретения выяснили геномную последовательность нового штамма VZV MAV/06, выделенного у пациента из Кореи, и провели молекулярный биологический анализ, включающий анализ ORF и филогенетический анализ выделенного штамма VZV MAV/06, осуществив, таким образом, настоящее изобретение.
Цель настоящего изобретения заключается в предоставлении геномной ДНК штамма VZV MAV/06.
Другая цель настоящего изобретения заключается в предоставлении открытой рамки считывания (ORF) геномной ДНК штамма VZV MAV/06.
Еще одна цель настоящего изобретения состоит в предоставлении белка, кодируемого ORF геномной ДНК штамма VZV MAV/06.
Еще одна цель настоящего изобретения состоит в предоставлении рекомбинантного вектора экспрессии, включающего геномную ДНК штамма VZV MAV/06 или соответствующую ORF.
Еще одна цель настоящего изобретения заключается в предоставлении трансформанта, включающего геномную ДНК штамма VZV MAV/06 или соответствующую ORF.
Еще одна цель настоящего изобретения состоит в предоставлении способа получения белка, кодируемого геномной ДНК штамма VZV MAV/06 или соответствующей ORF.
Еще одна цель настоящего изобретения заключается в предоставлении вакцинной композиции, содержащей белок штамма VZV MAV/06 в качестве активного компонента.
Техническое решение
Для достижения указанных целей в настоящем изобретении предложена геномная ДНК штамма VZV MAV/06 и соответствующая ORF.
Далее настоящее изобретение описывается подробно.
Используемый в настоящей заявке термин "открытая рамка считывания" или "ORF", который является последовательностью оснований ДНК, означает последовательность оснований ДНК, транслируемую в аминокислотную последовательность, означает последовательность оснований от кодона инициации трансляции (например, ATG) до терминирующего кодона (например, TGA, ТАА и TAG).
В одном общем аспекте настоящего изобретения предложена геномная ДНК VZV штамма MAV/06, имеющая последовательность оснований SEQ ID NO. 1.
В другом общем аспекте настоящего изобретения предложена ORF геномной ДНК штамма VZV MAV/06. Более конкретно, ORF может быть выбрана из ORF0, имеющей последовательность оснований SEQ ID NO. 2, ORF17, имеющей последовательность оснований SEQ ID NO. 3, ORF29, имеющей последовательность оснований SEQ ID NO. 4, ORF56, имеющей последовательность оснований SEQ ID NO. 5, и ORF60, имеющей последовательность оснований SEQ ID NO. 6.
В другом общем аспекте настоящего изобретения предложен белок, кодируемый геномной ДНК штамма VZV MAV/06 или соответствующей ORF. Более конкретно, в настоящем изобретении предложен белок, кодируемый геномной ДНК штамма VZV MAV/06, имеющей последовательность оснований SEQ ID NO. 1, или ORF, выбранной из ORF0, имеющей последовательность оснований SEQ ID NO. 2, ORF17, имеющей последовательность оснований SEQ ID NO. 3, ORF29, имеющей последовательность оснований SEQ ID NO. 4, ORF56, имеющей последовательность оснований SEQ ID NO. 5, и ORF60, имеющей последовательность оснований SEQ ID NO. 6.
В другом общем аспекте настоящего изобретения предложен рекомбинантный вектор экспрессии, включающий геномную ДНК штамма VZV MAV/06 или соответствующую ORF. Более конкретно, в настоящем изобретении предложен рекомбинантный вектор экспрессии, включающий геномную ДНК штамма VZV MAV/06, имеющую последовательность оснований SEQ ID NO. 1, или ORF, выбранную из ORF0, имеющей последовательность оснований SEQ ID NO. 2, ORF17, имеющей последовательность оснований SEQ ID NO.3, ORF29, имеющей последовательность оснований SEQ ID NO. 4, ORF56, имеющей последовательность оснований SEQ ID NO. 5, и ORF60, имеющей последовательность оснований SEQ ID NO. 6.
Используемый в настоящей заявке термин "рекомбинантный вектор", который является вектором экспрессии, способным экспрессировать целевой белок в подходящей клетке-хозяине, означает генетическую конструкцию, содержащую существенный регуляторный элемент, с которым генетическая вставка функционально связана, чтобы она могла экспрессироваться. Используемый в настоящей заявке термин "функционально связанный" означает, что последовательность, регулирующая экспрессию нуклеиновой кислоты, и последовательность нуклеиновой кислоты, кодирующая целевой белок, функционально связаны друг с другом для выполнения общих функций. Функциональное связывание с рекомбинантным вектором может быть выполнено с использованием генно-инженерных технологий, известных в области техники, к которой относится настоящее изобретение, при этом сайт-специфичное расщепление и связывание ДНК могут быть легко выполнены при использовании фермента, широко известного в области техники, к которой относится настоящее изобретение.
Подходящий вектор экспрессии, пригодный к применению в настоящем изобретении, может включать в себя сигнальную последовательность для мембранного таргетинга или секреции в дополнение к элементам регуляции экспрессии, таким как промотор, инициирующий кодон, терминирующий кодон, сигнал полиаденилирования и энхансер. Инициирующий кодон и терминирующий кодон можно в целом считать частью нуклеотидной последовательности, кодирующей иммуногенный целевой белок, которые должны быть функциональными в особи, которой генетическая конструкция была введена, и должны находиться в рамке считывания вместе с кодирующей последовательностью. Промотор может быть вообще конститутивным или индуцируемым. Пример промотора, доступного в прокариотических клетках, может включать lac, tac, Т3 и Т7 промоторы, но не ограничивается ими. Пример промотора, доступного в эукариотических клетках, может включать промотор β-актина, человеческий промотор гемоглобина, человеческий промотор мышечного креатина и человеческий промотор металлотионеина, а также промотор вируса обезьян 40 (SV40), промотор вируса опухоли молочной железы мышей (MMTV), промотор вируса иммунодефицита человека (ВИЧ), такой как промотор длинного терминального повтора (LTR) ВИЧ, промотор вируса Молони, промотор цитомегаловируса (CMV), промотор вируса Эпштейна-Барр (EBV) и промотор вируса саркомы Рауса (RSV), но не ограничивается ими. Вектор экспрессии может включать селективный маркер для отбора клеток-хозяев, содержащих вектор. Селективный маркер служит для отбора клеток, трансформированных вектором, и в качестве селективного маркера могут использоваться маркеры, придающие отбираемые фенотипы, такие как устойчивость к лекарственному средству, потребность в питательных веществах, устойчивость к цитотоксическому средству или экспрессия поверхностных белков. Поскольку в среде, обработанной селективным агентом, выживают только клетки, экспрессирующие селективный маркер, трансформированные клетки могут быть отобраны. Кроме того, в случае реплицирующегося вектора экспрессии, вектор экспрессии может включать сайт начала репликации, который представляет собой определенную последовательность нуклеиновых кислот, которая инициирует репликацию. В качестве рекомбинантного вектора экспрессии может использоваться вектор, имеющий различные формы, такой как плазмида, вирус, космида и т.п. Тип рекомбинантного вектора специально не ограничен при условии, что вектор может служить для экспрессии целевого гена в различных клетках-хозяевах, таких как прокариотические клетки и эукариотические клетки, и продукции целевого белка, но при этом вектор, способный к продукции чужеродного белка, имеющего форму, подобную форме такого белка в естественном состоянии, в большом масштабе, и имеющий промотор, обладающий высокой активностью и потенциалом экспрессии, может быть предпочтительным.
Для экспрессии белка штамма VZV MAV/06, кодируемого любой из последовательностей оснований, выбранных из SEQ ID NO. 1-6 согласно настоящему изобретению, могут применяться различные комбинации организма-хозяина/вектора экспрессии. В качестве вектора экспрессии, подходящего для эукариотических клеток, может использоваться последовательность регуляции экспрессии, полученная из SV40, вируса папилломы быков, аденовируса, аденоассоциированного вируса, цитомегаловируса и ретровируса, и т.п., однако настоящее изобретение не ограничивается этим. Вектор экспрессии, пригодный в бактериальных клетках-хозяевах, может включать бактериальную плазмиду, полученную из Escherichia coli, такую как векторы рЕТ, pRSET, pBluescript, pGEX2T, pUC, col E1, pCR1, pBR322, pMB9 и их производные, плазмиды, имеющие более широкий диапазон организмов-хозяев, такие как RP4, ДНК фага, представленную различными производными фага лямбда, такими как λgt10, λgt11, NM989, и другие ДНК фаги, такие как М13, одноцепочечный нитчатый ДНК фаг, или подобные. Вектор экспрессии, доступный в клетках дрожжей, может быть 2-мкм плазмидой и ее производным. Вектором, пригодным для клеток насекомых, может быть pVL941.
Рекомбинантный вектор может быть введен в клетку-хозяина с получением трансформанта. В данном случае, подходящие клетки-хозяева могут быть прокариотическими клетками, такими как Escherichia coli, Bacillus subtilis, Streptomyces sp., Pseudomonas sp., Proteus mirabilis или Staphylococcus sp. Кроме того, подходящие клетки-хозяева могут быть грибами, такими как Aspergillus sp., дрожжами, такими как Pichia pastoris, Saccharomyces cerevisiae, Schizosaccharomyces sp. и Neurospora crassa, эукариотическими клетками, такими как низшие эукариотические клетки, высшие эукариотические клетки, например клетки насекомых или подобные.
Клетка-хозяин предпочтительно может быть получена из растений и/или млекопитающих. В особенности могут использоваться клетки почки обезьяны 7 (COS7), клетки NSO, SP2/0, клетки яичников китайского хомячка (СНО), W138, клетки почки новорожденного хомяка (BHK), клетки Мадин-Дарби почек собак (MDCK), линии клеток миеломы, клетки HuT 78, клетки HEK293 и т.п., но настоящее изобретение не ограничивается ими. В частности, могут быть предпочтительными клетки СНО.
Используемый в настоящей заявке термин "трансформация в клетки-хозяева" может включать в себя любой метод введения нуклеиновых кислот в организмы, клетки, ткани или органы, который может быть выполнен при выборе стандартных методик, подходящих для клетки-хозяина, как известно в уровне техники. Указанные методы могут включать метод электропорации, метод слияния протопластов, метод осаждения фосфатом кальция (CaPO4), метод осаждения хлоридом кальция (CaCl2), метод перемешивания с использованием волокна карбида кремния, метод агробактериально-опосредованной трансформации, а также трансформацию с использованием ПЭГ, декстран-сульфата или липофектамина и трансформацию, опосредованную высыханием/ингибированием, но не ограничиваются ими.
Трансформированные клетки-хозяева, в которых экспрессируется рекомбинантный вектор, культивируют в питательной среде таким образом, чтобы белок штамма VZV MAV/06, кодируемый любой последовательностью, выбранной из последовательностей оснований SEQ ID NO. 1-6 согласно настоящему изобретению, мог продуцироваться в большом масштабе. В данном случае обычная питательная среда и условия культивирования могут быть надлежащим образом подобраны в соответствии с клеткой-хозяином. Условия, такие как температуру, pH питательной среды, время культивирования и т.п., можно соответственным образом регулировать по росту клеток во время культивирования клеток и массовой продукции белка. Белок штамма VZV MAV/06, кодируемый любой из последовательностей, выбранных из последовательностей оснований SEQ ID NO. 1-6, рекомбинантно продуцированный, как описано выше, может быть выделен из лизатов среды или клеток и отделен и очищен с помощью стандартной методики биохимического разделения (Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd Ed., Cold Spring Harbor Laboratory Press (1989); Deuscher, M., Guide to Protein Purification Methods Enzyraology, Vol.182. Academic Press, Inc., San Diego, CA (1990)). В качестве метода разделения может использоваться электрофорез, центрифугирование, гель-фильтрация, осаждение, диализ, хроматография (ионообменная хроматография, аффинная хроматография, иммуносорбционная хроматография, эксклюзионная хроматография), изоэлектрическое фокусирование, а также различные модификации и комбинации указанных методов, но настоящее изобретение не ограничивается ими.
В другом общем аспекте настоящего изобретения предложена вакцинная композиция, содержащая белок штамма VZV MAV/06, кодируемый любой последовательностью, выбранной из последовательностей оснований SEQ ID NO. 1-6, в качестве активного компонента. В этом случае вакцинная композиция может дополнительно содержать фармацевтически приемлемый адъювант или вспомогательное вещество. Любой адъювант может использоваться при условии, что он способствует формированию антитела в момент введения адъюванта в тело, чтобы таким образом осуществить цели настоящего изобретения. В частности, предпочтительно может использоваться по меньшей мере одно, выбранное из соли алюминия (Al(O)3 или AlPO4), сквален, сорбитан, полисорбат 80, CpG, липосома, холестерин, монофосфориллипид (MPL) А и глюкопиранозиллипид A (GLA), но настоящее изобретение не ограничивается ими.
Полезные эффекты
Согласно настоящему изобретению, полную геномную последовательность вируса Varicella zoster (VZV) штамма MAV/06, выделенного у пациента в Корее, проанализировали и сравнили с последовательностями оснований 23 штаммов вируса VZV, таких, что может быть подтвержден полиморфизм длины генома между разновидностями вследствие деформации многократно повторяющихся последовательностей и сайта начала репликации. Кроме того, вся последовательность вируса штамма VZV MAV/06 может способствовать пониманию молекулярных особенностей аттенуированных вакцинных вирусных штаммов VZV посредством биоинформационного исследования, сравнительного геномного исследования и т.п.
Описание чертежей
На фиг. 1 показана карта ORF штамма VZV MAV/06 (в дальнейшем обозначаемого ′Suduvax′ на чертежах) согласно настоящему изобретению;
на фиг. 2 показана филогенетическая схема 24 штаммов вируса VZV, основанная на полных нуклеотидных последовательностях;
на фиг. 3 показана филогенетическая схема 24 штаммов вируса VZV, основанная на не кодирующих нуклеотидных последовательностях;
на фиг. 4 показана характеристическая филогенетическая схема вакцинных вирусных штаммов, основанная на 12 различиях ORF между вакцинными вирусными штаммами и клиническими вирусными штаммами;
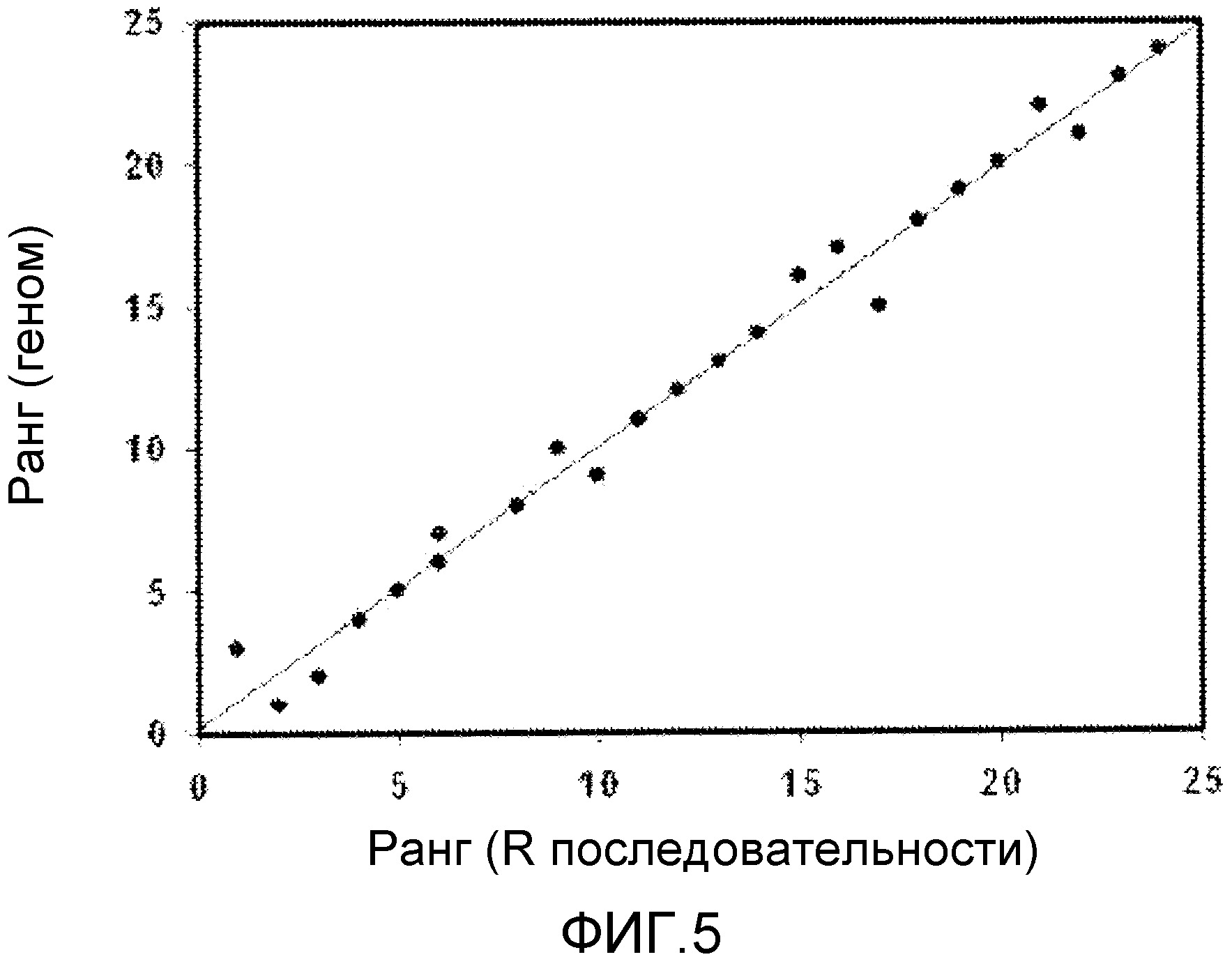
на фиг. 5 показана корреляция между длинами геномов и многократно повторяющимися последовательностями штаммов вируса VZV;
на фиг. 6 показаны мутанты между ORF0 штамма VZV MAV/06 согласно настоящему изобретению и вакцинными вирусными штаммами Oka;
на фиг. 7 показана область делеции 3 пн в ORF17 штамма VZV MAV/06 согласно настоящему изобретению;
на фиг. 8 показана область делеции 3 пн в ORF56 штамма VZV MAV/06 согласно настоящему изобретению;
на фиг. 9 показана область делеции 15 пн в ORF29 штамма VZV MAV/06 согласно настоящему изобретению; и
на фиг. 10 показана область вставки 3 пн в ORF60 штамма VZV MAV/06 согласно настоящему изобретению.
Наилучший вариант осуществления
Далее настоящее изобретение будет описано подробно с обращением к примерам и сопровождающим фигурам. Впрочем, примеры и фигуры настоящего изобретения были раскрыты в иллюстративных целях, при этом объем настоящего изобретения не ограничивается этим.
[Пример 1] Вирус и секвенирование ДНК
Вирусный штамм MAV/06 был получен при выделении вируса Varicella zoster от везикул пациента из Кореи возрастом 33 месяца, зараженного ветряной оспой в 1989 году, и первичном культивировании выделенного VZV в человеческих эмбриональных клетках легкого (Hwang, K.K., Park, S.Y., Kim, S.J., Ryu, Y.W., & Kim, K.H., Restriction Fragment Length Polymorphism Analysis of Varicella-Zoster Virus isolated in Korea. J. Kor. Soc. Virol. 21, 201-210, 1991).
Выращенный вирусный штамм MAV/06 55 раз субкультивировали в эмбриональных диплоидных клетках легкого человека и морской свинки при 34-36°C и по чувствительности клеток и с помощью тестов термочувствительности подтверждали, что субкультивированный вирусный штамм MAV/06 был аттенуирован (Hwang et al., Marker test for attenuation of varicella-zoster viruses isolated in Korea). Аттенуированный вирусный штамм назвали "MAV/06" и использовали для получения Suduvax.
Аттенуированный вирусный штамм MAV/06 последовательно субкультивировали в человеческих эмбриональных диплоидных клетках легкого, чтобы получить исходный вирусный инокулят, и подготовленный исходный вирусный инокулят последовательно субкультивировали для получения рабочего вирусного инокулята.
Кроме того, "Suduvax", который является конечной вакциной, производили, используя рабочий вирусный инокулят, субкультивированный 5 раз, и анализ последовательности выполняли при использовании конечной вакцины.
ДНК выделяли из вирусного посевного материала штамма MAV/06 при концентрации 5,5 мкг/100 мкл с использованием набора QIAamp DNA mini kit (Macrogen). Последовательность ДНК определяли с помощью стандартной системы Genome Sequencer FLX производства Roche Diagnostics.
Было получено 23722 фрагмента последовательности со средней длиной ~400 пн, и полученные фрагменты последовательности собирали и изучали с использованием программы Consed (http://bozeman.mbt.washington.edu/consed/consed.html). Среднее качество фрагментов последовательности составляло 99,99%. В общей сложности 99,38% из 124759 последовательностей совпадали с полученной консенсусной последовательностью, при этом разрешение составило 83 скана на нуклеотид. Их выравнивали с двумя референсными вирусными штаммами Dumas (NC_001348) и Varilrix (DQ008354) и пропуски между контигами заполняли при помощи ПЦР секвенирования, используя праймеры, полученные из смежных контигов.
Полученная полная геномная последовательность вирусного штамма MAV/06 была зарегистрирована в базе данных NCBI Genbank (9 августа 2011 года) и представлена SEQ ID NO. 1. Как показано в SEQ ID NO. 1, было подтверждено, что геном вирусного штамма MAV/06 имеет длину 124 759 пн.
[Пример 2] Анализ открытых рамок считывания
Местоположение открытых рамок считывания (ORF) вирусного штамма MAV/06 в полной последовательности генома определяли с помощью поиска в BLAST по двум референсным вирусным штаммам Dumas (NC_001348) и Varilrix (DQ008354). Можно было подтвердить, что полученные данные включали первое и последнее нуклеотидные положения каждой ORF в геноме вирусного штамма MAV/06 и направление ORF.
Информацию ORF проверяли с помощью программ поиска ORF, таких как CLC Sequence Viewer (version 6.1, http://www.cicbio.com/index.php) и ORF Finder, предоставленной NCBI. В том случае, если результаты поиска в BLAST не совпадали с результатами, полученными программами поиска ORF, нуклеотидные последовательности соответствующих ORF проверяли с помощью BioEdit Sequence Alignment Editor (Department of Microbiology, North Carolina State University, version 5.0.9, http://www/mbio.ncsu.edu/BioEdit/bioedit.html) и редактировали вручную, определяя, таким образом, положения терминирующих и инициирующих кодонов. Наконец, все локализованные ORF подтверждали при идентификации транслированных аминокислотных последовательностей.
Результаты вышеуказанного анализа представлены в следующих пунктах (1)-(4).
(1) Структура генома вирусного штамма MAV/06 и картирование ORF
Структура генома вирусного штамма MAV/06 являлась типичной структурой штамма вируса VZV тем, что геном можно было разделить на 6 областей, то есть TRL, UL, IRL, IRS, US и TRS, при этом длины областей составляли 88 пн, 104799 пн, 88 пн, 7267 пн, 5232 пн и 7276 пн соответственно.
G+C содержание генома вирусного штамма MAV/06 составляло приблизительно 46,1%, при этом полная длина генома была очень близка длинам генома 24 штаммов вируса VZV. Штаммы вируса VZV, проанализированные в настоящем изобретении, а также их регистрационные номера GenBank, длины геномов и G+C содержание показаны в следующей таблице 1:

Вирусный штамм MAV/06 включал 74 ORF. Было подтверждено, что из них 64 ORF были UL генами и 4 ORF были US генами.
3 гена (ORF 62-64) в IRS многократно присутствовали в обратном направлении в TRS (ORF 69-71), при этом из 74 ORF70 ORF присутствовали в прямом направлении, 34 ORF присутствовали в обратном направлении. Кроме того, направления ORF у штаммов VZV 100% консервативны. Карта ORF вирусного штамма MAV/06 (обозначенного "Suduvax" на всех чертежах) показана на фиг. 1.
(2) Филогенетический анализ вирусного штамма MAV/06
На основе полных нуклеотидных последовательностей вирусных штаммов в таблице 1 филогенетические схемы были построены с использованием метода соединения соседних пар.
Нуклеотидную последовательность ORF вирусного штамма MAV/06 многократно выравнивали с нуклеотидными последовательностями и аминокислотами 24 штаммов VZV таблицы 1, зарегистрированных в базе данных NCBI GenBank, при помощи ClustalW (ver. 2.0.1), с последующим ручным редактированием.
Полученные выходные файлы использовали для построения филогенетических схем, используя Dnadist и другие программы, включенные в пакет программ Phylip package (version 3.69, http://evolution.genetics.washington.edu/phylip.html). Матрицу дистанций получали с помощью двухпараметрического метода Кимуры. Групповой анализ выполняли с помощью метода соединения соседей (NJ) и метода максимальной вероятности (ML) и полученные файлы схем просматривали с использованием программы Treeview (version 1.6.6). Значимость филогенетических схем проверяли с помощью бутстрэп-анализа. Филогенетические схемы строили на основе 1000 реплик, сгенерированных программой Seqboot, и консенсусное древо идентифицировали с помощью программы Consense.
Филогенетическую схему строили с помощью метода максимальной вероятности (ML) на основе полных нуклеотидных последовательностей. В результате вирусные штаммы (vOka, Varilrix и Varivax), включая вирусный штамм MAV/06, которые были вирусными штаммами 4 живых аттенуированных вирусных вакцин, формировали кластер, и вирусный штамм M2DR и 8 вирусных штаммов формировали кластер, смежный первому кластеру, как показано на фиг. 2. Кроме того, вирусный штамм СА123 независимо формировал третий кластер, вирусные штаммы 11, 22, 03-500 и HJ0 формировали четвертый кластер, и остальные клинические вирусные штаммы формировали другой кластер.
В результате при построении филогенетического древа с использованием метода максимальной вероятности (ML) на основе не кодирующих нуклеотидных последовательностей вирусный штамм MAV/06, выделенный у пациента в Корее, и вирусный штамм Oka, выделенный у пациента в Японии, формировали уникальный кластер (японско-корейский (J-K) кластер), как показано на фиг. 3. Вирусный штамм pOka расположился между 4 вакцинными вирусными штаммами (vOka, Varilrix, Varivax и MAV/06) и 19 клиническими вирусными штаммами на филогенетической схеме для 24 вирусных штаммов VZV, созданной на основе полных нуклеотидных последовательностей и общих аминокислотных последовательностей, но расположился между вакцинными вирусными штаммами на филогенетической схеме для 24 вирусных штаммов VZV, созданной на основе не кодирующих нуклеотидных последовательностей. То есть другими словами, было подтверждено, что 4 вакцинных вирусных штамма (vOka, Varilrix, Varivax и MAV/06) формировали субклад в японско-корейском (J-K) кластере на филогенетическом древе для 24 вирусных штаммов VZV, созданном на основе полных нуклеотидных последовательностей и общих аминокислотных последовательностей, но не формировали субклад на филогенетическом древе для 24 вирусных штаммов VZV, созданном на основе не кодирующих нуклеотидных последовательностей.
Чтобы подтвердить главный ORF для дифференцирования вакцинных вирусных штаммов и клинических вирусных штаммов друг от друга, построили 74 филогенетических древа в соответствии с ORF. Из них специфичные вакцинным вирусным штаммам филогенетические схемы были подтверждены в 12 ORF, как показано на фиг. 4. В качестве ORF, пригодных для получения филогенетической схемы, специфичной вакцинному вирусному штамму, рассматриваются ORF 0, 1, 6, 18, 31, 35, 39, 59, 62, 64, 69 и 71.
(3) Многократно повторяющиеся последовательности и анализ полиморфизма длины генома
Длины ORF вирусных штаммов VZV практически не изменялись. Можно было подтвердить, что среди 74 ORF вирусных штаммов VZV не было почти никакого различия по длине ORF63 между вирусными штаммами VZV. Как показано в следующей таблице 2, можно подтвердить, что полиморфизм длины 3 ORF (ORFs 11, 14 и 22) между штаммами был относительно высоким из-за длин многократно повторяющихся последовательностей.

Таким образом, R1 был помещен в ORF11 и сформирован при комбинировании различных последовательностей 18-пн элемента (консенсус: GGACGCGATCGACGACGA) и 15-пн элемента (консенсус: GGGAGAGGCGGAGGA). Поскольку 15-пн элемент в ORF11 дополнительно повторялся в вирусном штамме MAV/06, его длина отличалась от длины вакцинного вирусного штамма Oka.
Кроме того, R2 был помещен в ORF 14 и сформирован из различных 42-пн элементов (консенсус: ACCTCGGCCGCTT/aCCCGAAAG/taCCCGATCCCGCCGTCGCGCCC, в данном случае строчная буква указывает малое отклонение суммы), и их часть (32-пн элемент) была также включена в R2. В вирусном штамме MAV/06 42-пн элемент в ORF11 повторялся 7 раз, как в вакцинном вирусном штамме Oka.
Далее, R3 был помещен в центр 3-конца ORF22, при этом 9-пн элемент многократно реплицировался. Консенсусной последовательностью 9-пн элемента являлась последовательность GC/tCCGC/tG/cCA/g (в данном случае строчная буква указывает малое отклонение суммы). Количество повторов (n) сильно отличалось между штаммами. В вирусном штамме 03-500 количество повторов составило 73, а в вирусном штамме vOka количество повторов составило 3. В вирусном штамме MAV/06 количество повторов 9-пн элемента составило 11, но в вирусных штаммах Varilrix и Varivax количество повторов составляло 8.
Кроме того, R4 и R5 являлись не кодирующими областями. R4 был сформирован из 27-пн элемента (консенсус: CCCCGCCGATGGGGAGGGGGCGCGGTA), и его часть (11-пн элемент) также была включена в R4. R4 (R4a) был помещен между ORF 62 и 63 в IRS, а комплементарный ему R4b был помещен между ORF 70 и 71 в TRS. Длина R4a была такой же, как у R4b, однако в случае вирусного штамма HJ0 длины R4a и R4b были различными. Поскольку в R4b вирусного штамма HJ0 27-пн элемент дополнительно повторялся 4 раза, длина R4b была больше, чем у R4a, на 108 пн. В случае вирусных штаммов Varilrix и Varivax, 27-пн элемент дополнительно повторялся 5 раз. В вирусном штамме MAV/06 27-пн элемент дополнительно повторялся 3 раза.
R5 был расположен между ORF 60 и 61 и сформирован из 88-пн элемента, включающего 24-пн элемент. Два указанных элемента отличались от других повторяющихся последовательностей. Присутствовали два типа повторяющихся последовательностей. Вирусный штамм MAV/06 включал два 88-пн элемента и один 24-пн элемент, как и большинство вирусных штаммов, а вирусные штаммы vOka и pOka включали три 88-пн элемента и два 24-пн элемента.
При сравнении длин геномных последовательностей 24 вирусных штаммов VZV с длинами повторяющихся последовательностей было подтверждено, что полиморфизм длин геномов вирусных штаммов VZV был обусловлен длиной повторяющейся последовательности. Вирусный штамм ВС включает наиболее длинную повторяющуюся последовательность как наиболее протяженный геном, но вирусный штамм MAV/06 включает вторую наиболее короткую повторяющуюся последовательность как самый короткий геном. Длина (700 пн) между наиболее протяженным геномом и наиболее коротким геномом была подобна разности (724 пн) между наиболее длинной повторяющейся последовательностью и наиболее короткой повторяющейся последовательностью. Если повторяющаяся последовательность была удалена из генома, длина генома уменьшалась вместе с изменением коэффициента вариации (CV). При удалении повторяющейся последовательности из полного генома было удалено 0,000129, при этом вычисленный CV составил 0,00179.
Фактически, как показано на фиг. 5, когда порядок длины генома был установлен как порядок длины повторяющихся последовательностей, коэффициент корреляции (r2) составлял 0,9854, и была установлена почти линейная зависимость между длинами геномов вирусных штаммов VZV и повторяющихся последовательностей.
(4) Начало репликации
Последовательность начала репликации (ORI) вирусных штаммов VZV была расположена между ORF 62 и 63. Длина последовательности ORI в 36 вирусных штаммах составляла 80 пн, а в вирусном штамме HJ0 длина последовательности ORI составляла 108 пн, так как количество повторов динуклеотидов ТА и GA в конфигурации последовательности ORI отличались друг от друга.
Как показано в следующей таблице 3, последовательность ORI в вирусном штамме MAV/06 была расположена между 110080-м и 110183-м положениями генома, и в нее были включены 15 тандемных повторов GA и 11 тандемных повторов ТА.


Количества тандемных повторов в 110235 положениях генома были различными, но в вакцинном вирусном штамме Oka и вирусном штамме MAV/06, как правило, А был заменен G в тандемных повторах GA в одном положении из нуклеотидных положений, соответствующих 110235 положениям в вирусном штамме Dumas, который является референсным вирусным штаммом. Последовательность ORI была точно комплементарно дуплицирована между ORF 70 и 71 за исключением вирусных штаммов HJ0 и Varilrix: (TA)3 (GA)2 был удален в вирусном штамме HJ0, и один тандемный повтор GA был удален в вирусном штамме Varilrix.
(5) Анализ свойств ORF вирусного штамма MAV/06
Длина ORF0 вирусного штамма MAV/06 была увеличена вследствие мутации. TGA (388-390-е нуклеотидное положение), который является терминирующим кодоном, был мутирован на CGA, кодирующий аргинин (Agr). TGA, оцениваемый как терминирующий кодон, был найден в нижней концевой области, перекрывающейся с ORF1. Увеличенная ORF0 кодировала новый белок, содержащий 221 аминокислотный остаток. Такая же мутация была подтверждена в других подобных вакцинных вирусных штаммах vOka, Varilrix и Varivax (фиг. 6).
Из всех клинических вирусных штаммов, вирусный штамм pOka включал ORF0, кодирующую 129 аминокислот и имеющую длину 390 пн.
По сравнению с вирусным штаммом Dumas, который является референсным вирусным штаммом, так как ТСТ в 658-660 положении и ТСА в 367-369 положении были удалены из ORF17 (SEQ ID NO. 3) и ORF56 (SEQ ID NO. 5) вирусного штамма MAV/06 соответственно, длины ORF17 и ORF56 уменьшились на 3 пн (фиг. 7 и 8). Все вышеуказанные делеции вызвали делецию аминокислотного остатка серина (S). С другой стороны, в ORF60 (SEQ ID NO. 6) вирусного штамма MAV/06 три нуклеотида (ATG) были вставлены в 28 положение (фиг. 10). Примечательно, что одна вставка и две делеции были обнаружены во всех вакцинных вирусных штаммах Oka, включая вирусный штамм pOka.
Кроме того, в вирусе штамма MAV/06, а также в вакцинных вирусных штаммах Oka длина ORF29 (SEQ ID NO. 4) была меньше, чем у ORF29 в штамме Dumas и большинстве клинических вирусных штаммов, на 15 пн (AACATTTCAGGGTCA). Штамм Dumas, который являлся референсным вирусным штаммом, а также большинство клинических вирусных штаммов непрерывно и повторно включали 15-пн последовательность. В M2DR, СА123 и 8 клинических вирусных штаммах длина ORF60 была такой же, как у ORF60 в вакцинном вирусном штамме Oka и вирусном штамме MAV/06 (фиг. 9).
[Предварительное описание к списку последовательностей]
SEQ ID NO. 1 - последовательность геномной ДНК штамма VZV MAV/06.
SEQ ID NO. 2 - ORF0 геномной ДНК штамма VZV MAV/06.
SEQ ID NO. 3 - ORF17 геномной ДНК штамма VZV MAV/06.
SEQ ID NO. 4 - ORF29 геномной ДНК штамма VZV MAV/06.
SEQ ID NO. 5 - ORF56 геномной ДНК штамма VZV MAV/06.
SEQ ID NO. 6 - ORF60 геномной ДНК штамма VZV MAV/06.
Реферат
Изобретение относится к области биотехнологии и вирусологии. Описан новый штамм вируса ветряной оспы (VZV). Раскрыты геномная ДНК VZV штамма MAV/06, выделенного у пациента в Корее, его открытые рамки считывания (ORF) и белки, кодируемые геномной ДНК VZV штамма MAV/06 и соответствующей ORF. Также описана вакцинная композиция, которая содержит указанный белок в качестве активного компонента. Предложенная группа изобретений может быть использована в медицине. 7 н. и 4 з.п. ф-лы, 10 ил., 3 табл., 2 пр.
Формула
Документы, цитированные в отчёте о поиске
Стабилизированная вакцинная композиция для стимулирования иммунного ответа и способ ее получения

Комментарии