Стабильное получение лентивирусных векторов - RU2577979C2
Код документа: RU2577979C2
Чертежи













Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к получению лентивирусных векторов (LV) для генной терапии. Более конкретно, изобретение относится к стабильным линиям пакующих лентивирусы клеток и способам получения линий пакующих клеток с использованием гибридного бакуло-аденоассоциированного вирусного (AAV) вектора для стабильной интеграции структурных и регуляторных лентивирусных белков.
Уровень техники
После самого первого клинического испытания LV фазы I против СПИДа в 2001 контролирующими органами были рассмотрены результаты 38 испытаний фазы I-II и два испытания фазы II-III, в которых использовали основанные на ВИЧ LV в качестве носителей для доставки генов; три из них еще находятся на рассмотрении. Наибольшее количество испытаний включают моногенные расстройства, некоторые из которых встречаются с высокой частотой, такие как анемия Кули или большая β-талассемия (4 испытания). Далее следуют злокачественные опухоли и инфекционные болезни, главным образом инфекция ВИЧ-1. Обычно количество пациентов, набираемых для испытаний, ограничено в фазе I/II, но не ограничено в фазе III. Таким образом, существует неотложная необходимость в стабильных линиях пакующих клеток для 2-ого (основанного на LTR) и 3-его (основанного на SIN) поколения LV, чтобы обеспечить неотложную потребность в крупномасштабном получении LV для испытаний фазы III, которые, как следует надеяться, могут быть осуществлены в будущем в большом количестве. Получение LV, основанное на временных протоколах, в действительности, является непригодным для широкого применения с точки зрения безопасности, затрат и воспроизводимости.
Возрастающее количество доказательств свидетельствуют о том, что LV, совсем недавно разработанные вирусные интегрирующиеся векторы для генной терапии, широко применимы для трансдукции либо окончательно дифференцированных, либо делящихся клеток, идеальны для поддержания долговременной экспрессии трансгена и более безопасны, чем предполагали вначале. Опыт, накопленный при использовании гамма-ретровирусных векторов (γ-RV) на основе вируса лейкоза мышей Молони (MoMLV) в последние два десятилетия, привел к быстрому прогрессу в создании LV-систем доставки, разработка которых началась в связи с необходимостью преодолеть неспособность ретровируса трансдуцировать неделящиеся клетки. В частности, создание самоинактивируемых (SIN) векторов для переноса делает более вероятными планы широкого применения LV в клинических испытаниях на человеке [1], при условии расширения и оптимизации такого эффективного способа производства. Однако в отличие от γRV, который может быть продуцирован несколькими коммерчески доступными линиями пакующих клеток человека и мыши, LV в настоящее время получают не только со степенью чистоты для исследований, но также со степенью чистоты, соответствующей стандарту GMP, почти исключительно в результате временной трансфекции. Такая методика является дорогостоящей, ее трудно стандартизовать и масштабировать, и она требует многочисленных подтверждающих тестов в ходе выполнения. Кроме того, риск появления компетентных по репликации лентивирусов (RCL), вероятно возникающих в результате рекомбинации между вирусными последовательностями в пакующей конструкции и конструкции вектора для переноса, является редким, но более вероятным событием в ходе временной продукции, чем в ходе стабильной продукции.
Разработка стабильной линии пакующих клеток для LV, эквивалентной линии пакующих ретровирусы клеток, оказалась более медленной и более трудной, так как, в отличие от гамма-ретровируса, экспрессия лентивирусных белков, таких как env, протеаза и некоторые вспомогательные белки, является токсичной для клеток человека. Чтобы преодолеть такую проблему, вспомогательные гены, присутствующие в наиболее ранних вариантах пакующих клеток, затем в последних поколениях были удалены. Основанные на SIV- и ВИЧ линии пакующих LV клеток первого поколения получали из прикрепляющихся клеток либо Vero обезьян, либо COS, HeLa и 293 человека [2-5], сконструированных с использованием лентивирусных геномов, несущих несколько важных модификаций, таких как удаление сигнала упаковки. Ген gp120 env и большинство вспомогательных генов, фактически сохранялись. Получаемый титр LV был очень низким [2-5], и что более важно, возможное применение таких векторов неизбежно ограничено T-клетками CD4+ для способов направленной против СПИДа генной терапии. Позже gp120 env заменили гликопротеидом, полученным из вируса везикулярного стоматита (VSV-G) и все вспомогательные гены были удалены, поскольку, как было доказано, они являются необязательными для эффективной продукции LV. Чтобы предотвратить токсичность, также описанную для VSV-G, его экспрессию при определенных условиях индуцировали, используя множество различных систем, таких как Tet, экдизон, Rev и сочетание Tet и кумата [20]. Подобным образом, чтобы снизить токсический эффект вирусной протеазы во время клональной селекции, описана экспрессия гена gag-pol, обусловленная Tet и сочетанием лекарственных средств доксициклина и кумата [7]. Во всех таких системах гены gag-pol, rev и env были интегрированы посредством временной трансфекции плазмидной ДНК с последующим отбором с использованием лекарственных средств и клонированием клеток.
Одной важной проблемой при использовании действительно стабильной линии пакующих клеток является выбор наилучших носителей для доставки вирусных генов. Большинство исследователей интегрировали гены gag-pol, rev и env посредством временной трансфекции плазмидной ДНК с последующим отбором с использованием лекарственных средств и клонированием клеток [7-10]. Известно, что такая методика страдает таким недостатком, что с течением времени возникает сайленсинг генов и утрата генов [11], что также может ставить под угрозу долговременную стабильность пакующего клона.
Альтернативные носители для доставки генов раскрыты в частности в случае линии пакующих клеток STAR [12] и в случае недавно разработанной линии пакующих клеток GPRG-TL-20 [6], в которых гены gag, pol и rev были интегрированы в клетки HEK293T с помощью MLV-челночных векторов. Две копии регистрируемого гена gag-pol были стабильно интегрированы в STAR, тогда для GPRG-TL-20 [6] подобная информация отсутствует. В отличие от STAR, где осуществляли трансфекцию гена env, в GPRG-TL-20 все сохраняемые вирусные гены были введены посредством SIN-MLV.
Существует несколько систем, которые обеспечивают стабильную интеграцию чужеродного генома в клетки-хозяева. Palombo с соавторами, 1998 [13], описывают гибридный бакуловирусный-AAV-вектор для специфичной интеграции в клетки-хозяева. Такой вектор, по-видимому, является очень эффективным, если он содержит ген rep в том же гибридном бакуловирусном-AVV-векторе. В указанной публикации нет упоминания о конструкции согласно настоящему изобретению, не говоря уже о предложении использовать систему такого вида для продуцирования LV.
На протяжении последних почти двух десятилетий было предпринято несколько попыток создания стабильных линий клеток, пакующих LV. Несмотря на различные раскрытые методики на сегодняшний день ни одна из таких линий пакующих клеток еще не используется в клинических испытаниях и не вышла на рынок. Поэтому существует необходимость в новых системах для крупномасштабного получения LV, которые являются эффективными с точки зрения производительности и являются безопасными, рентабельными и воспроизводимыми.
Сущность изобретения
Настоящее изобретение относится к области получения LV. Проходит несколько клинических испытаний генной терапии с использованием LV в качестве носителей для доставки генов. Во всех таких испытаниях получение LV еще основано на временных протоколах.
Настоящее изобретение относится к новой методике создания основанной на ВИЧ-1 линии пакующих клеток. Такая методика основана на применении гибридного вектора, содержащего бакуловирусный остов, включающий в себя кассету интеграции, фланкированную ITR AAV, так называемой гибридной системы бакуло-AAV, в сочетании с плазмидой, кодирующей белок rep. Такая система позволяет получать стабильную интеграцию структурных белков ВИЧ-1 gag/pol и rev. Система согласно настоящему изобретению включает в себя a) гибридный вектор бакуло-AAV, отличающийся тем, что он содержит две кассеты экспрессии, одна из которых кодирует лентивирусные гены gag и pol, а другая кодирует лентивирусный rev и маркер селекции, и b) плазмиду, кодирующую белок rep. Предложенная система представляет собой новый и обладающий преимуществами путь доставки структурных и регуляторных белков ВИЧ-1, чтобы стабильно и эффективно сконструировать клетки-хозяева с такими лентивирусными белками. Используя такую систему, получили первый промежуточный продукт, содержащий только структурные и регуляторные белки ВИЧ-1 gag/pol и rev, применимый в качестве исходной точки для получения линий пакующих клеток 2-ого и 3-его поколения, содержащих, соответственно, регуляторный белок (tat) и представляющий интерес белок оболочки или только белок оболочки, а также линий клеток-продуцентов, также содержащих вектор для переноса.
Первый промежуточный продукт несет две копии рекомбинантной пакующейся конструкции бакуло-AAV, экспрессирующей гены ВИЧ-1 gag-pol и rev в трехцистронной конфигурации. Такой промежуточный продукт был назван PK-7 и упоминается как PK-7 в примерах. Геномной интеграции пакующегося вектора бакуло-AAV способствовала временная экспрессия белка AAV rep78, который, как известно, необходим для ITR-опосредованной интеграции вектора AAV [14]. Показано, что такой первый промежуточный продукт обладает неожиданной генетической стабильностью в течение 1 года культивирования, что свидетельствует о непрерывной продукции функционального LV после временной трансфекции оставшихся генетических элементов. Кроме того, в таких клетках не наблюдали явления сайленсинга. Кроме того, благодаря точному картированию сайта интеграции двух тандемно интегрированных пакующих векторов AAV в некодирующей межгенной транскрипционно активной области, авторы получили аргумент в пользу безопасности и против возможной активации опасных генов, мРНК которых может быть включена в LV и в конечном итоге в клетки-хозяева, являющиеся мишенями.
Из первого промежуточного продукта могут быть получены стабильные линии пакующих клеток 2-ого и 3-его поколения. В частности, согласно настоящему изобретению линия пакующих клеток 3-его поколения может быть получена в результате стабильной интеграции в первый промежуточный PK-7 представляющего интерес белка оболочки, такого как ретровирусные env MLV 4070, env RD114 или env GALV или их производные. Стабильную интеграцию можно получить, используя доставку SIN-LV, но можно использовать и другие носители для доставки генов. Авторы изобретения получили соответствующую линию пакующих клеток, называемую в примере PK-7-RD, посредством интеграции химерного белка оболочки RD114-TR, который содержит внеклеточный и трансмембранный домены оболочки, полученные из эндогенного ретровируса кошачьих, и цитоплазматический хвост env MLV 4070 [15]. Интеграцию химерного белка оболочки RD114-TR получали с использованием доставки SIN-LV.
Чтобы получить линии клеток-продуцентов 2-ого и 3-его поколения SIN-Tat, SIN-Env и вектор переноса или только SIN-Env и вектор переноса, соответственно, интегрировали в результате последовательной доставки. В принципе, интеграция одного вектора за один раз, хотя требует много времени, но снижает риск гомологичной рекомбинации и тем самым образование RCL.
Разработанная пакующая система на основе применения гибридного вектора бакуло-AAV для стабильной экспрессии лентивирусных gag-pol и rev была названа «MolPack», поэтому линия клеток-продуцентов 2-ого поколения, разработанная с использованием такой системы и содержащая RD114-TR и tat в качестве белка оболочки и регуляторного белка, соответственно, и вектор переноса, кодирующий Chim3 в качестве терапевтического гена, названа в примерах RD2-MolPack-Chim3.
Примечательно, что титр LV, полученный из клонов RD2-MolPack-Chim3, был более чем на 2-log выше, чем титр LV, полученных из контрольных клеток HEK293T, что свидетельствует о том, что RD2-MolPack-Chim3 образует более функциональные LV по сравнению с эквивалентными LV, получаемыми с использованием временного протокола, при наличии дополнительного преимущества продуцирования стабильной линией клеток-продуцентов, которая является экономически эффективной и безопасной.
Основные положения изобретения
Согласно первому аспекту изобретения предлагается система для стабильной экспрессии лентивирусных структурных и регуляторных белков, состоящая из:
i) гибридного вектора, содержащего бакуловирусный остов, который содержит кассету интеграции, фланкированную ITR AAV, включающую в себя две кассеты экспрессии, при этом первая кассета экспрессии кодирует лентивирусные гены gag и pol, а вторая кассета экспрессии кодирует лентивирусный rev и селектируемый маркер, и
ii) экспрессирующей плазмиды, содержащей открытую рамку считывания (ORF) Rep AAV под контролем промотора.
Предпочтительно две кассеты экспрессии гибридного вектора находятся в ориентации хвост-к-хвосту, и каждая кассета управляется конститутивным промотором и поли-A, предпочтительно промотор выбран из CMV, CMV IE, PGK, SV40, eF1α SFFV и RSV, более предпочтительно промотором является промотор CMV IE.
Согласно предпочтительному аспекту изобретения селектируемый маркер выбран из гена резистентности к гигромицину, канамицину, неомицину или зеомицину, более предпочтительно селектируемым маркером является ген резистентности к гигромицину.
Предпочтительно селектируемый маркер клонируют ниже участка внутренней посадки рибосомы (IRES).
Предпочтительно белок rep AAV выбран из rep78 или rep68. Более предпочтительно белком rep является rep78.
Согласно другому аспекту изобретения предлагается полустабильная линия пакующих лентивирусы клеток, состоящая из клеток, стабильно экспрессирующих лентивирусные gag pol и rev, отличающаяся тем, что такие клетки содержат стабильно интегрированную в их геном, по меньшей мере, одну копию кассеты интеграции, фланкированную ITR AAV, включающую в себя две кассеты экспрессии, при этом первая кассета экспрессии кодирует лентивирусные гены gag и pol, а вторая кассета экспрессии кодирует лентивирусный rev и селектируемый маркер.
Предпочтительно клеткой является линия клеток человека, предпочтительно выбранная из HEK293, HEK293-T, HEK293-SF, TE671, HT1080 или HeLa, более предпочтительно линией клеток является HEK293-T.
Предпочтительно две кассеты экспрессии находятся в ориентации хвост-к-хвосту, и каждая кассета управляется конститутивным промотором и поли-A; предпочтительно промотор выбран из CMV, CMV IE, PGK, SV40, eF1α, SFFV и RSV, более предпочтительно конститутивным промотором является промотор CMV IE.
Согласно предпочтительному аспекту изобретения селектируемый маркер выбран из гена резистентности к гигромицину, канамицину, неомицину, зеомицину; более предпочтительно селектируемым маркером является ген резистентности к гигромицину. Более предпочтительно селектируемый маркер клонируют ниже IRES.
Предпочтительно белок rep AAV выбран из rep78 или rep68. Более предпочтительно белком rep является rep78.
Согласно другому аспекту изобретения предлагается способ получения стабильной линии клеток, пакующих лентивирусы, включающий в себя:
i) получение гибридного вектора (A), содержащего бакуловирусный остов, содержащий кассету интеграции, фланкированную ITR AAV, включающую в себя две кассеты экспрессии, при этом первая кассета экспрессии кодирует лентивирусные гены gag и pol, а вторая кассета экспрессии кодирует лентивирусный rev и селектируемый маркер; и
ii) получение экспрессирующей плазмиды (B), содержащей ORF rep AAV под контролем промотора;
iii) трансфекцию клеток экспрессирующей плазмидой B и затем инфекцию клетки гибридным вектором A;
iv) культивирование клеток в присутствии антибиотика для селекции;
v) получение клеток, стабильно экспрессирующих белки sing gag, pol и rev;
vi) интеграцию гена env в таких клетках;
vii) культивирование клеток, чтобы получить линию клеток, стабильно экспрессирующих белки gag, pol, rev и env.
Согласно другому аспекту изобретения предлагается способ получения стабильной линии клеток, пакующих лентивирусы, включающий в себя:
i) получение гибридного вектора (A), содержащего бакуловирусный остов, содержащий кассету интеграции, фланкированную ITR AAV, включающую в себя две экспрессирующих кассеты, при этом первая кассета экспрессии кодирует лентивирусные гены gag и pol, а вторая кассета экспрессии кодирует лентивирусный rev и селектируемый маркер; и
ii) получение экспрессирующей плазмиды (B), содержащей ORF rep AAV под контролем промотора;
iii) трансфекцию клетки экспрессирующей плазмидой B и затем инфекцию клетки гибридным вектором A;
iv) культивирование клеток в присутствии антибиотика для селекции;
v) получение клеток, стабильно экспрессирующих белки gag, pol и rev;
vi) интеграцию лентивирусного гена tat в таких клетках;
vii) культивирование клеток для получения линии клеток, стабильно экспрессирующих белки gag, pol, rev и tat;
viii) интеграцию гена env в таких клетках;
ix) культивирование клеток для получения линии клеток, стабильно экспрессирующих белки gag, pol, rev, tat и env.
Предпочтительно две кассеты экспрессии гибридного вектора находятся в ориентации хвост-к-хвосту, и каждая кассета экспрессии управляется конститутивным промотором и поли-A; предпочтительно промотор выбран из CMV, CMV IE, PGK, SV40, eF1α, SFFV и RSV, более предпочтительно конститутивным промотором является промотор CMV IE.
Предпочтительно геном tat является tat ВИЧ-1.
Согласно предпочтительному аспекту изобретения селектируемый маркер выбран из гена резистентности к гигромицину, канамицину, неомицину, зеомицину; предпочтительно селектируемым маркером является ген резистентности к гигромицину, более предпочтительно селектируемый маркер клонируют ниже IRES.
Предпочтительно ген env интегрируют в клетки-хозяева с использованием вектора AAV, ретровирусного вектора, стабильной интеграции плазмиды или гомологичной рекомбинации. Согласно более предпочтительному аспекту ген env интегрируют, используя лентивирусный SIN-вектор.
Предпочтительно ген env выбран из env MLV 4070, env D114, химерного белка оболочки RD114-TR, химерного белка оболочки RD114pro, бакуловирусного env GP64 или env GALV или их производных; более предпочтительно геном env является ген, кодирующий химерный белок оболочки RD114-TR.
В предпочтительном варианте предлагается лентивирусный SIN-вектор, содержащий кассету экспрессии, содержащую от 5'- к 3'-концу промотор CMV, интрон β-глобина, содержащий элемент RRE в своей последовательности, и ORF RD114-TR для стабильной интеграции химерного белка оболочки RD114-TR.
Предпочтительно белок rep AAV выбран из rep78 или rep68. Более предпочтительно белком rep является rep78.
Согласно другому аспекту изобретения предлагается стабильная линия клеток, пакующих лентивирусы, содержащая стабильно интегрированные в их геном:
i) по меньшей мере, одну копию кассеты интеграции, фланкированную ITR AAV, включающую в себя две кассеты экспрессии, при этом первая кассета экспрессии кодирует лентивирусные гены gag и pol, а вторая кассета экспрессии кодирует лентивирусный rev и селектируемый маркер;
ii) по меньшей мере, одну копию env.
Согласно тому же аспекту изобретения указанная выше стабильная линия пакующих лентивирусы клеток дополнительно содержит, по меньшей мере, одну копию гена HIV-1-tat, стабильно интегрированную в их геном.
Предпочтительно клеткой является линия клеток человека, предпочтительно линия клеток выбрана из HEK293, HEK293-SF, HEK293-T, TE671, HT1080 или HeLa, более предпочтительно линией клеток является HEK293-T.
Предпочтительно две кассеты экспрессии в кассете интеграции находятся в ориентации хвост-к-хвосту, и каждая кассета управляется конститутивным промотором и поли-A; предпочтительно промотор выбран из CMV, CMV IE, PGK, SV40, eF1α, SFFV и RSV, более предпочтительно конститутивным промотором является промотор CMV IE.
Согласно предпочтительному аспекту изобретения селектируемый маркер выбран из гена резистентности к гигромицину, канамицину, неомицину, зеомицину; предпочтительно селектируемым маркером является гигромицин, более предпочтительно селектируемый маркер клонируют ниже IRES.
Предпочтительно ген env интегрируют в клетки-хозяева, используя вектор AAV, ретровирусный вектор, стабильную интеграцию плазмиды или гомологичную рекомбинацию. Согласно более предпочтительному аспекту ген env интегрируют, используя лентивирусный SIN-вектор.
Предпочтительно ген env выбран из env MLV 4070, env RD114, химерного белка оболочки RD114-TR, химерного белка оболочки RD114-pro, бакуловирусного env GP64 или env GALV или их производных, более предпочтительно геном env является ген, кодирующий химерный белок оболочки RD114-TR.
Согласно другому аспекту предлагается способ получения лентивирусных векторов, включающий в себя:
i) культивирование стабильной линии пакующих лентивирусы клеток, содержащих стабильно интегрированную в их геном, по меньшей мере, одну копию кассеты интеграции, фланкированной ITR AAV, включающую в себя две кассеты экспрессии, при этом первая кассета экспрессии кодирует лентивирусные гены gag и pol, а вторая кассета экспрессии кодирует лентивирусный rev и селектируемый маркер; и, по меньшей мере, одну копию env;
ii) встраивание в стабильную линию пакующих клеток вектора переноса.
Предпочтительно две кассеты экспрессии находятся в ориентации хвост-к-хвосту, и каждая кассета экспрессии управляется конститутивным промотором и поли-A; предпочтительно промотор выбран из CMV, CMV IE, PGK, SV40, eF1α, SFFV и RSV, более предпочтительно конститутивным промотором является промотор CMV IE.
Предпочтительно селектируемый маркер выбран из гена резистентности к гигромицину, канамицину, неомицину, зеомицину; более предпочтительно селектируемым маркером является ген резистентности к гигромицину. Более предпочтительно селектируемый маркер клонируют ниже IRES.
Предпочтительно ген env выбран из env VSV-G, env MLV 4070, env RD114, химерного белка оболочки RD114-TR, химерного белка оболочки RD114pro, бакуловирусного env GP64 или env GALV или их производных, более предпочтительно геном env является ген, кодирующий RD114-TR.
Согласно другому аспекту настоящего изобретения предлагается линия клеток-продуцентов, содержащих стабильно интегрированные в их геном:
i) по меньшей мере, одну копию кассеты интеграции, фланкированную ITR AAV, включающую в себя две кассеты экспрессии, при этом первая кассета экспрессии кодирует лентивирусные гены gag и pol, а вторая кассета экспрессии кодирует лентивирусный rev и селектируемый маркер;
ii) по меньшей мере, одну копию гена env;
iii) вектор переноса.
Согласно тому же аспекту изобретения указанная выше стабильная линия пакующих лентивирусы клеток дополнительно содержит лентивирусный ген tat, стабильно интегрированный в их геном.
Предпочтительно клеткой является линия клеток человека, предпочтительно выбранная из HEK293, HEK293-T, TE671, HEK293-SF, TE671, HT1080 или HeLa, более предпочтительно линией клеток является HEK293-T.
Предпочтительно две кассеты экспрессии в кассете интеграции находятся в ориентации хвост-к-хвосту, и каждая кассета управляется конститутивным промотором и поли-A; предпочтительно промотор выбран из CMV, CMV IE, PGK, SV40, eF1α, SFFV и RSV, предпочтительным конститутивным промотором является промотор CMV IE.
Согласно предпочтительному аспекту изобретения селектируемый маркер выбран из гена резистентности к гигромицину, канамицину, неомицину, зеомицину; более предпочтительно селектируемым маркером является гигромицин, более предпочтительно селектируемый маркер клонируют ниже IRES.
Предпочтительно ген env интегрируют в клетки-хозяева, используя вектор AAV, ретровирусный вектор, стабильную интеграцию плазмиды или гомологичную рекомбинацию. Согласно более предпочтительному аспекту ген env интегрируют, используя лентивирусный SIN-вектор.
Предпочтительно ген env выбран из env MLV 4070, env RD114, химерного белка оболочки RD114-TR, химерного белка оболочки RD114-pro, бакуловирусного env GP64 или env GALV или их производных, более предпочтительно геном env является ген, кодирующий химерный белок оболочки RD114-TR.
Согласно другому аспекту предлагается способ получения лентивирусных векторов, включающий в себя культивирование линии клеток-продуцентов, содержащих стабильно интегрированных в геном:
i) по меньшей мере, одну копию кассеты интеграции, фланкированную ITR AAV, включающую в себя две кассеты экспрессии, при этом первая кассета экспрессии кодирует лентивирусные гены gag и pol, а вторая кассета экспрессии кодирует лентивирусный rev и селектируемый маркер;
ii) по меньшей мере, одну копию env;
iii) по меньшей мере, одну копию вектора переноса, кодирующего представляющие интерес ген.
Предпочтительно две кассеты экспрессии находятся в ориентации хвост-к-хвосту, и каждая кассета экспрессии управляется конститутивным промотором и поли-A; предпочтительно промотор выбран из CMV, CMV IE, PGK, SV40, eF1α, SFFV и RSV, более предпочтительно конститутивным промотором является промотор CMV IE.
Предпочтительно селектируемый маркер выбран из гена резистентности к гигромицину, канамицину, неомицину, зеомицину; более предпочтительное селектируемым маркером является ген резистентности к гигромицину. Более предпочтительно селектируемый маркер клонируют ниже IRES.
Предпочтительно ген env выбран из env VSV-G, env MLV 4070, env RD114, химерного белка оболочки RD114-TR, химерного белка оболочки RD114pro, бакуловирусного env GP64 или env GALV или их производных, более предпочтительно геном env является ген, кодирующий RD114-TR.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Подробное описание предпочтительных признаков и вариантов осуществления изобретения будет приведено с использованием неограничивающих примеров.
Изобретение может быть применено на практике специалистом в данной области, который будет использовать, если не указано иное, обычные методики химии, молекулярной биологии, микробиологии, рекомбинантной ДНК и иммунологии. Все указанные методики раскрыты и подробно описаны в общедоступной литературе. См., например, J. Sambrook, E. F. Fritsch, andT. Maniatis, 1989, Molecular Cloning: A Laboratory Manual, Second Edition, Books 1-3, Cold Spring Harbor Laboratory Press; Ausubel, F.M. et al. (1995 and periodic supplements; Current Protocols in Molecular Biology, ch. 9, 13, and 16, John Wiley & Sons, New York, N.Y.); Current Protocols in Immunology, ch. 12, John Wiley & Sons, New York, N.Y.); B. Roe, J. Crabtree, and A. Kahn, 1996, DNA Isolation and Sequencing: Essential Techniques, John Wiley & Sons; J. M. Polak and James O'D. McGee, 1990, In Situ Hybridization: Principles and Practice; Oxford University Press; M. J. Gait (Editor), 1984, Oligonucleotide Synthesis: A Practical Approach, Irl Press; and, D. M. J. Lilley and J. E. Dahlberg, 1992, Methods of Enzymology: DNA Structure Part A: Synthesis and Physical Analysis of DNA Methods in Enzymology, Academic Press. Все указанные публикации включены в виде ссылки.
Гибридная бакуло-AAV-система
Настоящее изобретение относится к новой методике создания основанной на ВИЧ-1 линии пакующих клеток. Оптимизация системы продуцирования LV является одной из важнейших проблем, которую необходимо решить для разработки генной терапии на основе LV-методики. Несмотря на растущее количество клинических испытаний, в которых используют такую методику, LV в таких испытаниях все еще получают, используя протоколы временной трансфекции. Таким образом, получение LV все еще является очень дорогостоящим и неподходящим для большего количества пациентов. По этой причине было предпринято множество попыток разработать стабильные линии пакующих клеток для LV. Одной из важных проблем при разработке стабильной линии пакующих лентивирусы клеток является выбор правильного носителя для конструирования клеток-хозяев. Во многих случаях клетки-хозяева конструировали, используя плазмиды, но в таких случаях также наблюдали нестабильность генома и явление сайленсинга генов. В двух других случаях использовали ретровирусные векторы, чтобы стабильно интегрировать гены gag/pol и rev. Ни одну из разработанных до настоящего времени стабильных линий пакующих клеток не использовали в клинических испытаниях.
Методика согласно настоящему изобретению основана на использовании системы стабильной экспрессии лентивирусных структурных и регуляторных белков, состоящей из гибридного вектора, содержащего бакуловирусный остов, который содержит кассету интеграции, фланкированную ITR AAV, включающую в себя две кассеты экспрессии, при этом первая кассета экспрессии кодирует лентивирусные гены gag и pol, а вторая кассета экспрессии кодирует лентивирусный rev и селектируемый маркер; вместе с экспрессирующей плазмидой, содержащей ORF rep AAV под контролем промотора. Присутствие бакуловирусного остова позволяет хозяину принимать большую и сложную кассету интеграции, содержащую две кассеты экспрессии, кодирующие несколько разных белков. Полученный пакующий вектор бакуло-AAV позволяет конструировать клетки-хозяева с белками gag, pol и rev, которые необходимы для стабильной и эффективной продукции LV посредством только одного события инфекции.
Геномную интеграцию пакующего вектора бакуло-AAV получали в результате временной экспрессии белка rep AAV. Такая система позволила осуществлять интеграцию векторов AAV в некодирующую межгенную транскрипционно активную область, тем самым исключая активацию опасных генов, мРНК которых может быть включена в LV и в конечном итоге в клетки-хозяева, являющиеся мишенями.
Предложенная система представляет собой новый и обладающий преимуществами путь доставки структурных белков ВИЧ-1, чтобы стабильно и эффективно конструировать клетки-хозяина со структурными и регуляторными лентивирусными белками. В предпочтительном варианте две кассеты экспрессии, включенные в пакующую конструкцию бакуло-AAV, находятся в ориентации хвост-к-хвосту, и каждая кассета экспрессии управляется конститутивным промотором и поли-A, предпочтительно промотор выбран из CMV, CMV IE, PGK, SV40, eF1α, SFFV и RSV, более предпочтительно промотором является промотор CMV IE. Согласно предпочтительному аспекту изобретения селектируемый маркер, включенный в пакующий AAV-вектор, выбран из гена резистентности к гигромицину, канамицину, неомицину, зеомицину; предпочтительно маркером является ген резистентности к гигромицину; более предпочтительно селектируемый маркер клонирован ниже IRES.
Геномную интеграцию пакующего вектора бакуло-AAV получали в результате временной экспрессии белка rep AAV для ITR-опосредованной интеграции AAV-вектора. В предпочтительном варианте белок rep выбран из rep78 и rep68, более предпочтительно белком является rep78.
С использованием указанной системы можно получать клетки, сконструированные для стабильной экспрессии белков ВИЧ-1 gag/pol и rev, которые авторы изобретения назвали полустабильной линией пакующих клеток. В частности, в настоящем изобретении раскрыты и заявлены такие сконструированные клетки и их применение для получения линий пакующих клеток 2-ого и 3-его поколения, содержащих структурные и регуляторные белки и представляющий интерес белок оболочки, и линии клеток-продуцентов, также содержащих вектор переноса, а также способ получения стабильных линий пакующих клеток.
Полустабильная линия пакующих клеток
Полустабильная линия пакующих клеток согласно настоящему изобретению состоит из клеток-хозяев, несущих, по меньшей мере, одну копию рекомбинантной пакующей конструкции бакуло-AAV, экспрессирующей гены ВИЧ-1 gag-pol и rev. Геномную интеграцию пакующего вектора бакуло-AAV получили в результате временной экспрессии белка rep AAV, чтобы получить ITR-опосредованную интеграцию AAV-вектора. Предпочтительно две кассеты экспрессии находятся в ориентации хвост-к-хвосту, и каждая кассета экспрессии управляется конститутивным промотором и поли-A, предпочтительно промотор выбран из CMV, CMV IE, PGK, SV40, eF1α, SFFV и RSV. Более предпочтительно конститутивным промотором является промотор CMV IE.
Согласно предпочтительному аспекту изобретения селектируемый маркер выбран из гена резистентности к гигромицину, канамицину, неомицину, зеомицину; предпочтительно селектируемым маркером является ген резистентности к гигромицину, более предпочтительно селектируемый маркер клонируют ниже IRES.
Предпочтительно белок rep AAV выбран из rep78 и rep68. Более предпочтительно белком rep является rep78. Линии клеток-хозяев, которые могут быть сконструированы для получения полустабильной линии пакующих клеток, представляют собой линии клеток, выбранные из HEK293, HEK293-T, HEK293-SF, TE671, HT1080 или HeLa, более предпочтительно линией клеток является HEK293-T.
Такая полустабильная линия пакующих клеток подходит для получения большого разнообразия LV с разными env и разными векторами для переноса в полустабильной системе продуцирования. Поэтому она дает большое преимущество с точки зрения более эффективной продукции лентивирусных векторов, так как позволяет снизить затраты, она не требует использования плазмидной ДНК со степенью чистоты, соответствующей стандарту GMP, кодирующей gag-pol и rev, и при этом снижен риск образования RCL на фоне событий рекомбинации между плазмидами в ходе временной трансфекции.
Показано, что полустабильная линия пакующих клеток согласно настоящему изобретению обладает неожиданной генетической стабильностью в течение 1 года культивирования, что свидетельствует о непрерывной продукции функционального LV после временной трансфекции оставшихся генетических элементов. Кроме того, по сути, не наблюдается явление сайленсинга, и титр и инфекционность лентивирусных частиц, получаемых с использованием такого промежуточного продукта, сохраняются неизменными спустя 1 год. Такие данные были подтверждены как в присутствии, так и в отсутствие давления отбора. Следует отметить, что сопоставимые данные в отношении стабильности интеграции кассеты, опосредованной ITR AAV, в литературе отсутствуют. Единственная соответствующая информация относится к тому, что полученная из костного мозга человека линия подобных фибробластам клеток (клетки Раддла Детройт 6), инфицированных AAV дикого типа серотипа 2 (AVV-2), сохраняла вирусные последовательности в латентном состоянии в течение, по меньшей мере, 47 и 118 пассажей [16, 17]. Как показано в примерах, полустабильная линия пакующих клеток согласно настоящему изобретению сохранялась в течение, по меньшей мере, 102 пассажей.
Стабильная линия пакующих клеток
Настоящее изобретение относится к способу получения стабильной линии пакующих лентивирусы клеток. Такой способ основан на применении пакующей конструкции бакуло-AAV для стабильной интеграции, по меньшей мере, одной копии кассеты интеграции, содержащей две кассеты экспрессии, одна из которых кодирует лентивирусные гены gag и pol, а вторая кодирует лентивирусный rev и селектируемый маркер. Стабильную интеграцию такой кассеты получают в результате коэкспрессии белка rep, который обеспечивает возможность ITR-опосредованной стабильной интеграции в клетку-хозяина. Затем сконструированные таким образом клетки-хозяева культивируют в присутствии антибиотика и затем клонируют. Полученная полустабильная линия пакующих клеток является исходной точкой для создания линии пакующих лентивирусы клеток 2-ого и 3-его поколения. В частности, стабильную линию пакующих клеток 3-его поколения получают дополнительной интеграцией требуемого белка env. Стабильную линию пакующих клеток 2-ого поколения получают, сначала интегрируя белок Tat ВИЧ-1 и затем требуемый белок оболочки.
Белок оболочки и tat ВИЧ-1 могут быть стабильно интегрированы в клетки-хозяева с использованием вектора AAV, ретровирусного вектора, стабильной интеграции плазмиды или гомологичной рекомбинации. Предпочтительно белки оболочки и tat ВИЧ-1 интегрируют в клетку-хозяина, используя вектор ВИЧ-SIN. Можно использовать несколько видов белка оболочки, таких как env MLV 4070, env RD114, химерный белок оболочки RD114-TR, химерный белок оболочки RD114-pro, бакуловирусный env GP64 или env GALV или их производные. Более предпочтительно геном env является ген, кодирующий химерный белок оболочки RD114-TR.
Чтобы получить стабильную интеграцию белка оболочки RD114-TR, сначала разрабатывали SIN-конструкцию, содержащую BamHI-BamHI-фрагмент, полученный из плазмиды pCMV-RD114-TR, несущей ORF RD114-TR под контролем промотора CMV. Такая конструкция не образовывала белка RD114-TR. Неожиданным открытием при конструировании LV SIN-RD114-TR было установление того, что интрон β-глобина должен быть обязательно включен между промотором CMV и ORF RD114-TR. В общем, большинство кассет экспрессии клеточных и вирусных генов, ограниченных контекстом SIN-LV, лишены интронных элементов из-за риска сплайсинга между SD вектора SA интрона и последующего вырезания промотора, имеющегося в кассете экспрессии. Чтобы обойти такую опасность, создали новый SIN-LV, несущий два элемента RRE, один в канонической конфигурации SIN-LV между последовательностями SD и SA и один в интроне β-глобина.
На основании полученных данных было выдвинуто предположение, что неожиданное требование присутствия интрона β-глобина для осуществления продуцирования RD114-TR, может отражать наличие нестабильности или негативных последовательностей в ORF RD114-TR или во фрагменте длиной 328 п.н., охватывающих область от стоп-кодона RD114-TR до 3'-сайта рестрикции ферментом BamHI, присутствующем в конструкции SIN-RD114-TR. В анализе последовательностей с помощью GeneOptimizer®, осуществляемом в GENEART AG (Regensburg, Germany), определили, что неточно используемые кодоны были распространены на протяжении всего гена D114-TR и фрагмента длиной 328 п.е., давая авторам основание для такого предположения. Кроме того, анализ оптимизации кодонов показал, что индекс адаптации кодонов (CAI) повышался с 0,65 до 0,98 (при этом CAI, равный 1 является оптимальным). Следовательно, в принципе, альтернативным и более простым способом интеграции RD114-TR в RD-MolPack с использованием либо основанных на MLV, либо основанных на ВИЧ SIN-векторов может быть применение перекодированного RD114-TR. Получали и тестировали такие конструкции, содержащие оптимизированные по кодонам последовательности. С другой стороны, было обнаружено, что оптимизация кодонов обеспечивает возможность трансляции белка предшественника (PR) RD114-TR даже в отсутствие интрона β-глобина, но неожиданно высокий уровень PR не процессировался надлежащим образом фурином на субъединицы SU и TM. Таким образом, RD114-TR был успешно интегрирован в линию пакующих клеток с использованием основанного на ВИЧ SIN-вектора, содержащего интрон β-глобина в конструкции между промотором CMV и ORF RD114-TR. В предпочтительном варианте предлагается SIN-LV, содержащий кассету экспрессии, включающую в себя от 5'- к 3'-концу промотор CMV, интрон β-глобина, содержащий элемент RRE в своей последовательности, и ORF RD114-TR.
Настоящее изобретение относится к способу получения LV, включающему в себя:
i) культивирование стабильной линии пакующих клеток, которая описана выше;
ii) встраивание в полустабильную линию пакующих клеток вектора переноса.
Получение LV, используемых в настоящее время в клинических испытаниях, все еще основано на временной трансфекции всех требуемых белков. Напротив, способы и линии пакующих клеток согласно настоящему изобретению обеспечивают возможность стабильной продукции. В частности, гибридная система экспрессии бакуло-AAV, используемая в способе согласно настоящему изобретению, успешно обеспечивает стабильное и безопасное введение структурных (gag/pol) и регуляторных (rev) белков ВИЧ-1 только в ходе одного раунда трансфекции/инфекции и клонирования. Промежуточный продукт, полученный с использованием такой системы экспрессии, является стабильным, не проявляет явления сайленсинга и позволяет разрабатывать линии пакующих клеток 2-ого и 3-его поколения, которые являются очень важными средствами для разработки быстрых и эффективных протоколов получения LV. Стабильные линии пакующих клеток согласно настоящему изобретению можно применять для экономичного и безопасного получения. Действительно, полное отсутствие трансфекции позволяет снизить затраты и снижает вероятность событий рекомбинации, потенциально приводящей к образованию RCL. Кроме того, было обнаружено, что стабильные линии пакующих клеток, получаемые способом согласно изобретению, способны продуцировать LV с титром, по меньшей мере, сравнимым или даже более высоким, чем титр LV, продуцируемых при использовании временных протоколов.
Линия клеток-продуцентов
Линия клеток-продуцентов может быть получена в результате стабильной интеграции вектора переноса, кодирующего представляющий интерес ген (GOI), в стабильную линию пакующих клеток, которая описана выше. Настоящее изобретение, кроме того, относится к способу получения LV, включающему в себя культивирование такой линии клеток-продуцентов.
Примечательно, что средний титр и инфекционность LV, продуцируемых стабильной линией пакующих клеток 2-ого поколения, называемых в примере клонами RD2-MolPack-Chim3, более чем на 2 log выше, чем в случае LV, продуцируемых контрольными клетками HEK293T, что свидетельствует о том, что RD2-MolPack-Chim3 генерирует более функциональные LV по сравнению с эквивалентными LV, продуцируемыми при использовании временного протокола. Интерес представляет клон RD2-MolPack-Chim3.14, который спонтанно растет в суспензии и продуцирует LV с титром 1,0×106 те/мл на клетках SupT1 и 0,5×106 те/мл в HSC CD34+.
Описание чертежей
Фигура 1. Схемы разработки RD-MolPack. (a) Схематичное представление ДНК-плазмид, используемых в данном исследовании. pPolh, промотор полиэдрина; attB1, присоединение B1; ITR, инвертированный концевой повтор; CMV, промотор цитомегаловируса; In, интрон; RRE, элемент ответа на rev; A, поли-A-последовательность; IRES, участок внутренней посадки рибосомы; SD, донор сплайсинга; SA, акцептор сплайсинга; ψ, сигнал упаковки; WPRE, элемент посттраскрипционной регуляции вируса гепатита сурков; cPPT, центральный полипуриновый тракт; hPGK, промотор фосфоглицераткиназы человека. (b) Графическое изображение Rep78-опосредованной геномной интеграции вектора AAV-GPR. Rep 78 AAV стимулирует эксцизию ITR-фланкированной кассеты AAV-GPR и способствует ее интеграции в хромосомы человека. (c) Схема методики разработки стабильных линий пакующих клеток RD-MolPack либо 2-ого, либо 3-его поколения.
Фигура 2. Характеристика клонов PK. (a) Саузерн-блот-анализ интеграции вектора AAV-GPR. Чтобы установить количество копий и целостность кассеты, геномную ДНК (10 мкг), полученную из клонов PK, расщепляли двумя разными ферментами рестрикции, BamHI и SnaBI, соответственно. (b) Вестерн-блот-анализ вирусных белков, продуцируемых с кассеты GPR. Левая панель, клеточные экстракты (50 мкг/дорожку), полученные из клонов PK, гибридизовали с антисывороткой человека против ВИЧ-1, узнающей белки ВИЧ-1. Затем мембрану гибридизовали со специфичными анти-rev-Ат. Правая панель, 30 нг p24gag-эквивалента вирусоподобных частиц (VLP), полученных из клонов PK, обрабатывали идентично обработке клеточных экстрактов. (c) Схематичное картирование интеграции GPR-кассеты способом ОЛ-ПЦР (опосредованной лигированием ПЦР), которое выявляет точку разрыва ДНК в длинном плече хромосомы 2 в положении 2q32.1. (d) Совместная локализация кассеты AAV-GPR и гена Hox4 человека в хромосоме 2. Гибридизацию in situ метафазных хромосом PK-7 осуществляли, используя gag-специфичный (красный) и Hox4-специфичный (зеленый) зонды, соответственно, (e) Схематичное представление перестройки двух интегрированных кассет GPR в клоне PK-7 и их ориентация хвост-к-хвосту.
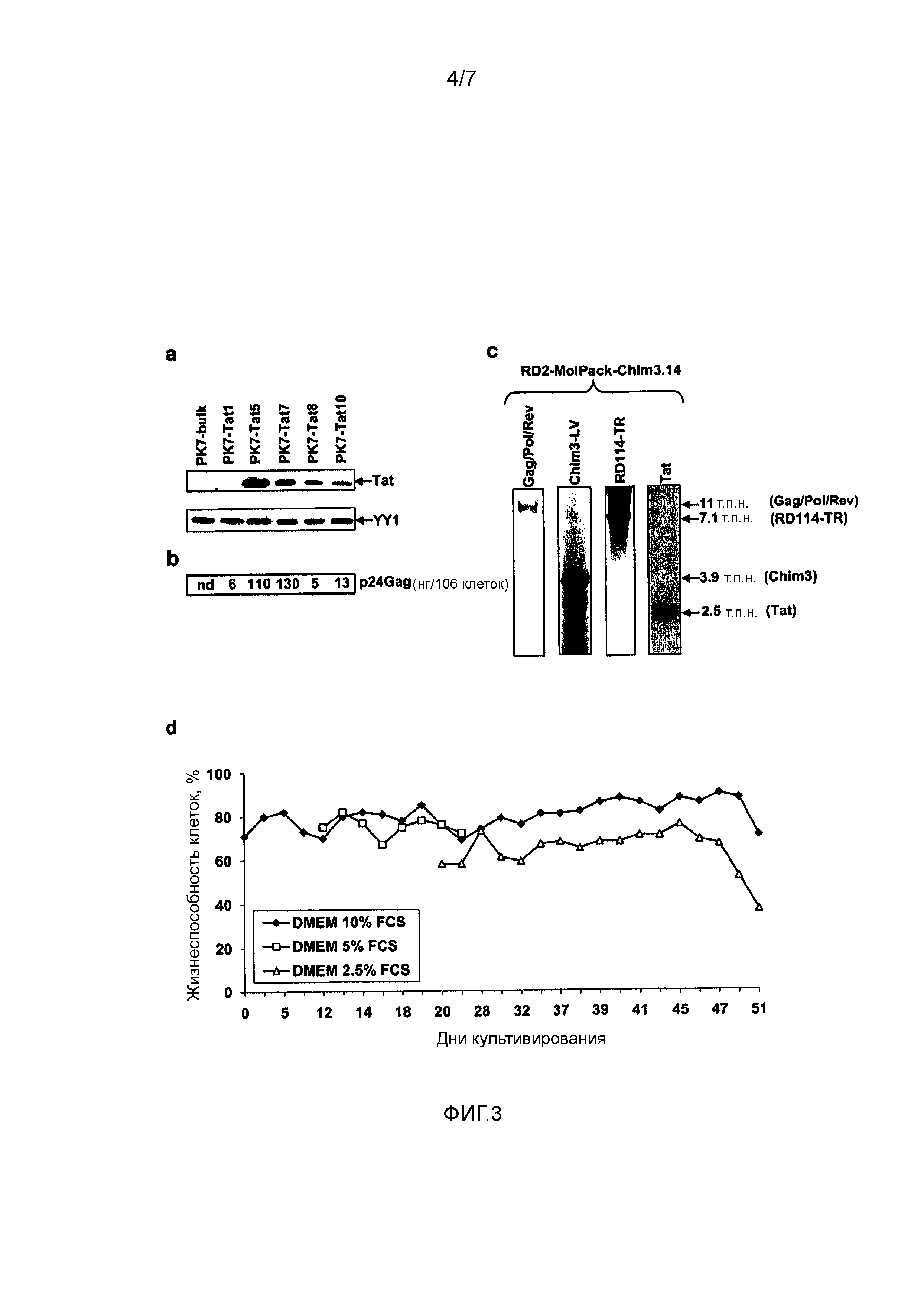
Фигура 3. Экспрессия Tat в клонах PK-7-Tat. (a) Вестерн-блот-анализ ядерных экстрактов (50 мкг/дорожку), полученных из общей популяции клеток PK-7-Tat и пяти производных клонов. Мембрану гибридизовали со специфичным анти-tat-Ат и после очистки от связанных антител с анти-YY1-Ат, которое выявляет фактор конститутивной ядерной транскрипции YY1 в качестве внутреннего контроля. (b) Продукцию p24 gag, выраженную в расчете на клетку, в отобранных клонах измеряли с использованием ELISA. (c) Саузерн-блот-анализ геномной ДНК RD2-MolPack-Chim3.14 в отношении целостности векторов SIN-LV-Tat, SIN-LV-RD114-TR и LTR-LV-Chim3. Количество копий вектора для трех векторов, рассчитанное с использованием ПЦР TaqMan, указано в скобках. (d) График жизнеспособности клеток среди клеток RD2-MolPack-Chim3.14, культивируемых при разном процентном содержании FCS, которое указано в пояснении к графику, почти в течение двух месяцев.
Фигура 4. Анализ экспрессии белка оболочки RD114-TR. (a) Вестерн-блот-анализ для выявления экспрессии RD114-TR с разных конструкций. Клетки PK-7 временно трансфицировали (TF) плазмидой CMV-RD114-TR (дорожка 1) и соответствующий экстракт целых клеток использовали в качестве позитивного контроля. SIN-RD114-TR (дорожки 2 и 3), pIRES-RD114-TR-WT и pIRES-RD114-TR-оптимизированную по кодонам (CO) (дорожки 4 и 5), SIN-RD114-TR-IN (дорожки 6 и 7), SIN-RD114-TR-IN-RRE (дорожки 8 и 9), SIN-RD114-WT-TR-IN-RRE и SIN-RD114-TR-CO-IN-RRE (дорожки 12 и 13) либо трансфицировали (TF) в клетки PK-7, либо упаковывали в виде вектора переноса в VSV-G-псевдотипированный LV, созданный в результате стандартной тройной трансфекции HEK293T. Затем LV, содержащий SIN-RD114-TR, использовали для спинокуляции клеток PK-7 (TD). Дорожки 1-9, 12 и 13 соответствуют клеточным экстрактам (50 мкг/дорожку); дорожки 10 и 11 соответствуют LV (30 нг p24gag-эквивалента/дорожку). Фильтры исследовали, используя в качестве зонда анти-RD114-TR-антитело, которое узнает предшественник (PR) и трансмембранную (TM), но не поверхностную (SU) субъединицу химерного белка оболочки. Полоса TM* соответствует более короткой трансмембранной субъединице, получаемой после зависимого от вирусной протеазы расщепления. (b) Вестерн-блот-анализ оболочки RD114-TR в трех клонах PK-7-Tat7-RD. Левая панель, клеточные экстракты (40 мкг/дорожки) исследовали с использованием в качестве зонда анти-RD114-TR-антитела. После очистки от антитела мембраны гибридизовали с анти-p24gag-антителами, чтобы оценить относительную долю RD114-TR в уровне p24gag. Правая панель, 30 нг p24gag-эквивалента LV, полученного из клонов PK-7-Tat-RD, обрабатывали подобно клеточным экстрактам. Указанные в скобках числа означают копии интегрированного вектора SIN-RD114-TR-IN-RRE. (c) Вестерн-блот-анализ белка оболочки RD114-TR в трех клонах PK-7-RD. Правая панель, клеточные экстракты (40 мкг/дорожку) исследовали, используя в качестве зонда анти-RD114-TR-антитело. После очистки от антител мембрану гибридизовали с анти-p24gag-антителом. Правая панель, 30 нг p24gag-эквивалента LV, полученных из клонов PK-7-RD, обрабатывали подобно клеточным экстрактам. Числа в скобках указывают копии интегрированного вектора SIN-RD114-TR-IN-RRE. (d) Вестерн-блот-анализ белка оболочки RD114-TR в трех субклонах PK-7-RD26. Левая панель, клеточные экстракты (40 мкг/дорожку) исследовали, используя в качестве зонда анти-RD114-TR-антитело. После очистки от антитела мембрану гибридизовали с анти-p24gag-антителом. Правая панель, 30 нг p24gag-эквивалента LV, полученных из субклонов PK-7-RD26, обрабатывали подобно клеточным экстрактам. Числа в скобках указывают копии интегрированного вектора SIN-RD114-TR-IN-RRE на левой панели и титр LV, образованных в субклонах после трансфекции вектора переноса SIN-GFP на правой панели.
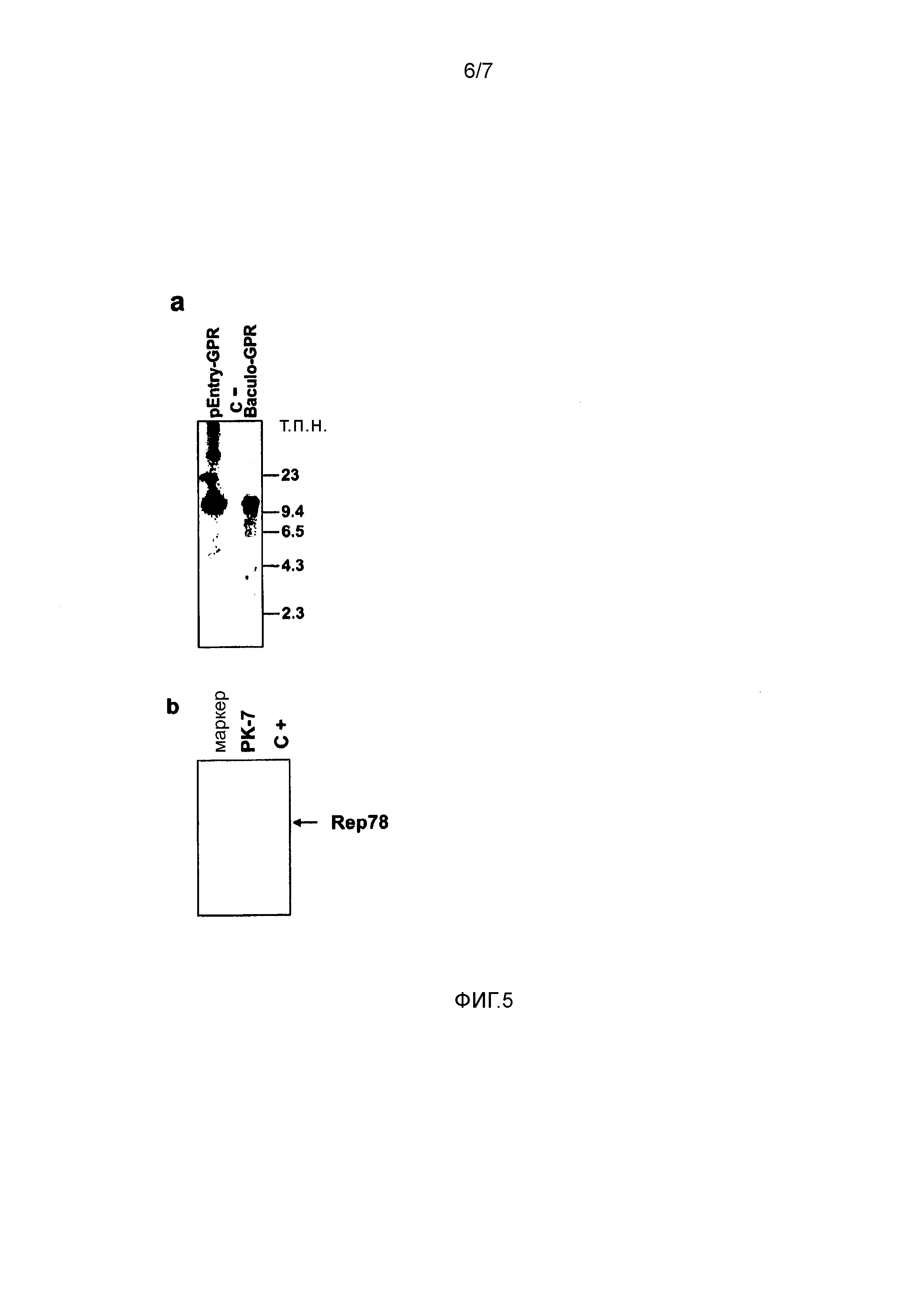
Фигура 5. Анализ геномной ДНК бакуло-AAV-GPR DNA и предполагаемой интеграции остаточной ДНК Rep78. (a) Саузерн-блот-анализ рекомбинантной ДНК бакуловируса-AAV. ДНК экстрагировали из бакуловирусных частиц, расщепленных в течение ночи ферментом рестрикции MluI, и после блоттинга исследовали с использованием специфичного для кассеты GPR зонда длиной 11 т.п.н.. Пустую плазмиду GPR (1 пг) и пустую бакуловирусную ДНК (100 нг) загружали в качестве позитивного и негативного контроля, соответственно. (b) Выявление предполагаемой интеграции остаточной плазмидной ДНК rep78 в клетки PK-7. Специфичную для Rep78 ПЦР осуществляли, используя геномную ДНК PK-7 в качестве матрицы образца и плазмиду CMV-Rep78 (1 пг) в качестве позитивного контроля.
Фигура 6. Транскрипция векторов SIN-RD114-TR и SIN-RD114-TR-IN. Нозерн-блот-анализ экспрессии РНК RD114-TR после трансфекции векторов SIN-RD114-TR в клетки HEK293T в присутствии (дорожки 2 и 4) или в отсутствие (дорожки 1 и 3) дополнительной плазмиды Rev (2,5 мкг). Через сорок восемь часов после котрансфекции суммарную РНК (5 мкг) экстрагировали из клеток HEK293T и гибридизовали со специфичным зондом RD114-TR. FL, полная длина; Exp. FL, ожидаемая полная длина вектора SIN-RD114-TR-IN, который, как ожидается, на 800 п.н. длиннее, чем SIN-RD114-TR за счет присутствия интрона β-глобина. Фрагмент RD114-TR длиной 550 п.н. использовали в качестве специфичного зонда.
Примеры
Пример I: Общие способы
Плазмиды
Гены ВИЧ-1 дикого типа gag, pol и rev вырезали при расщеплении MluI/NarI и MluI/NotI из плазмид pCG719-pKLgagpol (далее называемой CMV-GPR для простоты) (фигура 1a, схема 13) и pCG720-pKrev (CMV-Rev) (фигура 1a, схема 9), соответственно [27]. Вирусные гены встраивали в челночный вектор Gateway® pENTR™4 (Invitrogen, Co., Carlsbad, CA) в двух отдельных кассетах экспрессии, расположенных в ориентации хвост-к-хвосту, при этом каждая кассета управляется промотором CMV IE и несет поли-A-последовательность. Первая кассета экспрессирует гены gag и pol, тогда как вторая кассета экспрессирует ген rev и селектируемый маркерный ген резистентности к гигромицину (hygro); hygro клонировали ниже IRES, чтобы обеспечить возможность бицистронной трансляции. Две единицы экспрессии вводили в сайт XbaI рекомбинантной плазмиды pSUB201, несущей инфекционный геном AAV [18]. Затем полученную кассету 5'ITR-CMV-GagPol-polyA-polyA-hygro-IRES-rev-CMV-ITR3' вырезали и встраивали в челночный вектор Gateway® pENTR™4. Рекомбинантный гибридный пакующий вектор бакуло-AAV (бакуло-AAV-GPR) (фигура 1a, схема 1) получали с помощью сайт-специфичной системы рекомбинации бактериофага лямбда между исходным челночным вектором pENTRTM4, содержащим две кассеты, и линейной ДНК BaculoDirect (системы бакуловирусной экспрессии BaculoDirectTM, Invitrogen, Co.). При этом в ходе гомологичной рекомбинации ген полиэдрина бакуловирусной ДНК заменяли двойной кассетой GPR. Экспрессирующую плазмиду pABCMV-rep78 (CMV-AAV-rep78) получали клонированием ORF AAV-rep78 под контролем промотора CMV IE экспрессирующего вектора pABS.43, как описано Recchia с соавторами, 2004 [19] (фигура 1a, схема 8). Плазмида pMD.G (CMV-VSV-G) [20] кодирует гликопротеид оболочки вируса везикулярного стоматита (VSV-G) (фигура 1a, схема 10). Вектор переноса 3-его поколения, pCCLsin.PPT.hPGK.eGFP.WPRE.Amp (SIN-eGFP) [21] экспрессирует ген eGFP под контролем конститутивного промотора hPGK (фигура 1a, схема 6). Вектор переноса PΔN-Chim3 2-ого поколения, экспрессирующий трансген Chim3 против ВИЧ-1, описан Porcellini с соавторами, 2009 и 2010 [23, 24] (фигура 1a, схема 7). Векторы SIN-RD114-TR (фигура 1a, схемы 3-5) конструировали, следуя разным методикам, с использованием ORF RD114-TR, вырезанной из плазмиды pCMV-RD114-TR (CMV-RD114-TR) (фигура 1a, схема 11), которая кодирует химерный белок оболочки RD114-TR, состоящий из внеклеточного и трансмембранного доменов белка оболочки RD114 эндогенного ретровируса кошачьих и цитоплазматического хвоста (TR) A-MLVenv 4070A [22]. Коротко, каждую из кассет CMV-RD114-TR, CMV-RD114-TR-IN и CMV-RD114-TR-IN-RRE клонировали в сайте MluI вектора SIN-polyWluI, модифицированного варианта вектора SIN-eGFP, в котором кассету hPGK-eGFP удаляли и заменяли EcoRV-MluI-SmaI-MluI-NotI-SacI-BglII-BamHI-SalI-полилинкером. Конструкции SIN-RD114-TR-IN и RD114-TR-IN-RRE (фигура 1a, схемы 4 и 5, соответственно) содержат интрон β-глобина кролика, присутствующий в векторе CMV-RD114-TR (фигура 1a, схема 11). В SIN-RD114-TR-IN-RRE, элемент RRE длиной 230 п.н., амплифицированный в ПЦР, как описано в разделе «ПЦР-анализ», интегрировали в сайт ScaI интронного элемента β-глобина. Пакующая конструкция pCMV-ΔR8.74 (CMV-GPRT) 2-ого поколения (фигура 1a, схема 12) кодирует гены ВИЧ-1 gag, pol, rev и tat [25]. Вектор SIN-Tat (фигура 1a, схема 2) конструировали, встраивая ген tat, полученный из плазмиды CMV-GPRT (фигура 1a, схема 12), в сайт EcoRI pIRESpuro3 (Clontech Laboratories Inc., a TakaraBio Company, Mountain View, CA) и затем клонируя бицистронную кассету CMV-Tat-IRES-puro в MluI вектора SIN-poly/MluI.
Клетки
Клетки насекомых Spodoptera frugiperda (Sf9) (Invitrogen, Co.) выращивали в суспензии в среде TC-100 (Invitrogen, Co.) с добавлением 10% FCS (EuroClone Ltd., UK) и сочетания пенициллина-стрептомицина и глутамина (PSG) при 27°C в отсутствие CO2. Клетки эмбриональной почки человека 293T (HEK293T) и производные от них клоны (PK-7 и производные PK-7) размножали в модифицированной Дульбекко среде Игла (DMEM) с добавлением 10% FCS и PSG. T-клетки CEM A3.01 и SupT1 выращивали в RPMI 1640 с добавлением 10% FCS и PSG. Гемопоэтические стволовые клетки (HSC) CD34+ и неонатальные лейкоциты очищали из пуповинной крови (UCB) центрифугированием в градиенте плотности фикола-гипака (Lymphoprep, Nycomed Pharma AS, Oslo, Norway). После разделения в градиенте HSC CD34+ выделяли из собранного кольца мононуклеарных клеток UCB в результате позитивной селекции с использованием набора микрошариков CD34 и колонок для сепаратора MiniMACS (Miltenyi Biotec, Sunnyvale, CA). Чистоту клеток CD34+ (>92%) устанавливали в анализе FACS (FACSCalibur BD Bioscience, San Jose, CA) и с помощью компьютерной программы FlowJo (Tree Star, Inc., Ashland, OR), используя анти-CD34-PE-Ат (BD PharmingenTM, San Diego, CA). Клетки CD34+ предварительно стимулировали в течение 24 часов в среде Дульбекко, модифицированной по способу Искова (IMDM), с 20% сыворотки, содержащей фактор стволовых клеток человека (h-SCF) 100 нг/мл (R&D Systems, Minneapolis, MN), h-Flt3L 100 нг/мл (Peprotech, Rocky Hill, NJ), h-IL-6 20 нг/мл (R&D Systems) и тромбопоэтин человека (h-Tpo) 20 нг/мл (Peprotech) и поддерживали в такой среде во время трансдукции. Неонатальные лейкоциты стимулировали в течение 48 часов растворимым антителом против CD3 человека (30 нг/мл) (Orthoclone OKT3, Janssen-Cilag, UK) и рекомбинантным IL-2 человека (rhIL-2) 50 единиц/мл (Chiron, Emeryville, CA) в RPMI и затем хранили в RPMI с добавлением 10% FCS, PSG и rhIL-2.
Клон RD2-MolPack-Chim3.14 адаптировали для роста в среде Дульбекко (DMEM), содержащей 2,5% FCS, следующим образом: клетки выращивали во встряхиваемых флаконах объемом 125 мл на ротационном встряхивателе при 120 об./мин, 37°C в увлажненной воздушной атмосфере с 5% CO2 до достижения плотности 1,5×106 клеток/мл. Жизнеспособность поддерживали >70%, клетки делили по 0,5×106клеток/мл, и среду меняли ежедневно. На ходе нескольких пассажей количество FCS снижали с 10% до 5% до 2,5%; каждую смену сыворотки осуществляли, по меньшей мере, через два пересева культуры.
Получение бакловирусов и инфекция бакуло-GPR клеток HEK293T
Бакуловирус, несущий рекомбинантный гибридный ДНК-геном бакуло-AAV-GPR, получали, следуя способу BaculoDirect, с использованием адаптированной для бакуловирусной ДНК системы Gateway® (Invitrogen, Co.). Титр рекомбинантного бакуловируса оценивали в анализе бляшек, и титр соответствовал 1×1011 БОЕ/мл после трех пассажей для амплификации вирусов в клетках Sf9. Клон PK-7 получали трансфекцией 1,5×106клеток HEK293T с использованием 4 мкг экспрессирующей плазмиды AAV-rep78 и через 24 часа инфицировали рекомбинантным бакуло-AAV-GPR при MOI 1000. Клетки поддерживали без гигромицина в течение 4 дней и затем высевали 5×105 клеток на 22 чашки диаметром 10 см в присутствии гигромицина (100 мкг/мл) в серийно разведенных концентрациях. 22 чашки подвергали скринингу в ELISA отношении продуцирования p24gag. Только в одной чашке, в которой высевали 3,7×104 клеток/чашку, высвобождалось достаточное количество p24gag в надосадок. Чашка содержала 40 колоний, которые все собирали и подвергали скринингу. Три из них, которые были оценены позитивно в отношении продукции p24gag, характеризовали дополнительно.
Получение и титрование LV
Псевдотипированные LV, продуцируемые в клетках HEK293T, получали в результате временной котрансфекции следующих плазмид: пакующих конструкций CMV-GPR (3-его поколения) [или CMV-GPRT (2-ого поколения)], конструкций оболочки VSV-G или RD114-TR и векторов переноса SIN-eGFP [26] 3-го поколения или PΔN-Chim3 [23] 2-ого поколения или PΔN-eGFP. Соотношение конструкций пакующей:оболочки:вектора переноса составляло 6,5:3,5:10 мкг ДНК, если не указано иное. LV из клона PK-7 создавали в результате котрансфекции env-экспрессирующей плазмиды и вектора переноса, тогда как LV, продуцируемые клонами PK-7-RD и PK-7-Tat7-RD, получали только трансфекцией соответствующего вектора переноса. Временные трансфекции осуществляли либо стандартным основанным на Ca++-фосфате способом, либо с помощью системы Fugene6TM, следуя инструкции производителя (Roche Diagnostics Corporation, Indianapolis, IN), получая сходные результаты. Надосадки собирали через 48 часов после трансфекции и фильтровали через фильтр 0,45 мкм. Титр вычисляли на SupT1, CEM A3.01, первичных активированных мононуклеарных клетках периферической крови (PBMC) и полученных из пуповинной крови HSC CD34+, в зависимости от типа экспериментов. Коротко, SupT1 и активированные первичные мононуклеарные клетки трансдуцировали, используя два цикла спинокуляции (1,240 g в течение 1 часа) в присутствии полибрена (8 мкг/мл) (Sigma-Aldrich, St Louis, MO), разделенных фазой покоя в течение ночи; HSC CD34+ трансдуцировали в течение 24 часов на планшетах, покрытых ретронектином (Takara Bio, Otsu, Japan) без полибрена. Эффективность трансдукции контролировали на основании проточно-цитометрического анализа (FACS Calibur BD Bioscience, San Jose, CA) экспрессии eGFP (SIN-eGFP) или экспрессии ΔLNFGR (PΔN- Chim3), как описано Porcellini с соавторами, 2009 и 2010 [23,24], используя компьютерную программу FlowJo (Tree Star, Inc., Ashland, OR). Использовали только значения трансдукции в диапазоне от 5 до 20% позитивных клеток для расчета титра каждого препарата LV согласно следующей формуле: те = [количество клеток × (%GFP/100)]/добавленный объем (в мл).
Протокол скрининга клонов на основе титров
Чтобы ускорить отбор авторы изобретения провели скрининг всех производных субклонов PK-7, подсчитывая титр LV в их надосадках. Авторы проводили основанную на Ca++-фосфате котрансфекцию одной или двух плазмид в небольшом масштабе, чтобы создать LV, эффективность которых затем определяли на клетках SupT1 с использованием протокола трансдукции в небольшом масштабе. Коротко, 6×104 производных от PK-7 клеток/лунку высевали в 48-луночный планшет и через 24 часа котрансфицировали остальными плазмидами, необходимыми для получения функциональных LV. Через сорок восемь часов после трансфекции 200 мкл надосадков культуры использовали для трансдукции 3×104 клеток SupT1/лунку, которые высевали в концентрации 7,5×104/мл. Оценку порога титра устанавливали на уровне ≥1×102 те/мл.
Нозерн- и Саузерн-блот-анализы
Нозерн-блот-анализ. Суммарную РНК экстрагировали реагентом тризолом (Life TechnologiesTM Inc., Gaithersburg, MD), следуя инструкциям производителя. Пять мкг/образец разгоняли в 0,8% агарозном геле с формальдегидом, переносили на мембрану Hybond-N с помощью капиллярного переноса и наконец анализировали, используя32P-меченый RD114-TR-зонд длиной 550 п.н., в концентрации, соответствующей 1×106 распадов в минуту/мл, в буфере для гибридизации PerfectHyb PLUS (Sigma Chemical Corp., St. Louis, MO). После тщательной промывки мембраны экспонировали с рентгеновскими пленками при -70°C.
Саузерн-блот-анализ. Геномную ДНК (гДНК) выделяли, используя набор QIAamp Mini (QIAGEN GmbH, Germany) согласно инструкциям производителя. Бакуловирусную ДНК экстрагировали из вирусных частиц, используя микронабор для получения ДНК QIAamp (QIAGEN). После расщепления в течение ночи указанными ферментами рестрикции 10 мкг гДНК разгоняли в 0,8% агарозном геле, посредством капиллярного Саузерн-блоттинга переносили на нейлоновые мембраны (Duralon, Stratagene, TX, USA) и затем гибридизовали со случайно праймированной меченой32P (1×106 распадов в минуту/мл) либо CMV 600 п.н., либо GPR-кассетой 11 т.п.н., специфичным для tat 250 п.н., Chim3600 п.н. и RD114-TR 500 п.н. зондом в буфере для гибридизации PerfectHyb PLUS. После тщательных промывок мембраны экспонировали с рентгеновскими пленками при -70°C или визуализировали с использованием Phosphorimager (Molecular Dynamics, Sunnyvale, CA).
Аналитический ПЦР-анализ
Ампликон RRE длиной 230 п.н. получали, используя 1 нг вектора SIN-eGFP в качестве ДНК-матрицы и набор праймеров: RRE-прямой: 5'-AGT ACT GGA GCT TTG TTC CTT GGG-3'; RRE-обратный: 5'-AGT ACT AAA TCC CCA GGA GCT G-3' в следующих условиях ПЦР: 98°C в течение 7 минут, 30 циклов при 94°C в течение 30 секунд, 50°C в течение 30 секунд и 72°C в течение 30 секунд.
ПЦР-анализ для скрининга интеграции остаточной плазмиды AAV-Rep78 в клетки PK-7 осуществляли на 300 нг геномной гДНК, используя набор праймеров: AAV-Rep78 прямой: 5'-CGG GCT GCT GGC CCA CCA GG-3'; AAV-Rep78 обратный: 5'-ATG CCG GGG TTT TAC GAG ATT GTG-3' и следующие условия ПЦР: 98°C в течение 7 минут, 30 циклов 94°C в течение 30 секунд, 66°C в течение 30 секунд и 72°C в течение 1,5 минут.
Чтобы установить ориентацию двух кассет GPR, осуществляли ПЦР-амплификацию на 300 нг гДНК, используя набор праймеров: rev прямой: 5'-CTT GAG GAG GTC TTC GTC GC-3'; бета-глобин обратный: 5'-CCC TGT TAC TTC TCC CCT TCC-3'; rev прямой гнездовой: 5'-TGT CTC CGC TTC TTC CTG CC-3'; бета-глобин гнездовой обратный: 5'-TTA ACC ATA GAA AAG AAG GGG-3' и следующие условия: 94°C в течение 2 минут, 35 циклов при 94°C в течение 30 секунд, 52°C в течение 30 секунд и 72°C в течение 1,5 минут.
ELISA p24gag
Физическую продукцию LV измеряли в надосадках культуры с использованием набора для ELISA антигена p24 ВИЧ-1 Alliance (Perkin Elmer Life and Analytical Sciences, Inc. Waltham, MA), следуя инструкциям производителя, полагая, что 1 пг p24gag соответствует 1×104 физических частиц.
Вестерн-блот-анализ
Экстракты целых клеток и ядер, полученные из клеток PK-7, и вирусные белки, полученные из изолированных бесклеточных VLP или LV, готовили как описано ранее [23, 24]. Белки фракционировали по размеру в SDS-ПААГ, и посредством электроблоттинга переносили на нитроцеллюлозные мембраны Hybond ECL (GE Healthcare, Life Sciences, UK Ltd, UK). Мембраны блокировали в 5% растворе обезжиренного сухого молока и затем инкубировали с соответствующими первыми Ат. Антисыворотку против ВИЧ-1, полученную от пациента со СПИДом, использовали в разведении 1:2000; антисыворотку кролика против RD114-TR [22], узнающую два 15-мерных пептида (аминокислоты 95-109, QNRRGLDLLTAEQGG, и аминокислоты 65-79, SGIVRNKIRTLQEEL) в эктодомене белка в разведении 1:500; моноклональные Ат против rev ВИЧ-1 (Rev-6, sc-69730) и аффинно очищенные кроличьи поликлональные антитела против YY1 (C-20, sc-281) (S. Cruz Biotechnology, Inc., S. Cruz, CA) и мышиные антитела против p24gag (Acris Antibodies, Germany) в разведении 1:200, 1:1000 и 1:500, соответственно. Связывание Ат визуализировали, используя систему усиленной хемилюминесценции ECL (ECL, Amersham), следуя инструкциям производителя.
Определение количества копий вектора (VCN) с использованием ПЦР TaqMan в реальном времени.
Количество копий интегрированного вектора (VCN) устанавливали посредством количественной TaqMan-ПЦР, используя прибор ABI Prism 7,900 FAST (Applied Biosystems, Foster City, CA), и анализировали с использованием компьютерной программы SDS 2.3 (Applied Biosystems). Использовали следующие условия ПЦР: 2 минуты при 50°C и 5 минут при 95°C, с последующими 40 циклами 15 секунд при 95°C и 15 секунд при 60°C, с повышением температуры на 0,1°C/цикл в случае последовательности мишени GAG. гДНК амплифицировали, используя следующие праймеры и зонды:
Опосредованная лигированием (ОЛ) ПЦР
Геномную ДНК экстрагировали из клеток PK-7, используя набор QIAamp DNA Mini (QIAGEN), согласно инструкциям производителя и расщепляли BglII и BamHI при 37°C в течение ночи. Лигирование адаптерного олигонуклеотидного линкера длиной 76 п.н., совместимого с липкими концами 5'-GATC-3', осуществляли в стандартных условиях. ОЛ-ПЦР осуществляли, используя следующую пару гнездовых праймеров: ITR прямой: 16s: 5'-GTA GCA TGG CGG GTT AAT CA-3', и 17s/длинный гнездовой: 5'-TTA ACT ACA AGG AAC CCC TAG TGA TGG-3'; обратные линкерные праймеры: линкер-1: 5'-GTA ATA CGA CTC ACT ATA GGG C-3' и линкер-2 гнездовой: 5'-AGG GCT CCG CTT AAG GGA C-3'. Линкерные последовательности соответствовали 5' GAT CGT CCC TTA AGC GGA GCC CTA TAG TGA GTC GTA TTA CCA GGG AAT TCG CCT CGG GAT ATC ACT CAG CAT AAT G-3'. Осуществляли два раунда ОЛ-ПЦР, используя ДНК-полимеразу AmpliTaq Gold (Applied Biosystems), каждый из которых включал в себя 30 циклов (95°C в течение 30 секунд, 52°C в течение 30 секунд, 72°C в течение 2 минут). ПЦР-ампликоны клонировали, используя набор для клонирования TOPO® (Invitrogen, Co.), и колонии плазмид, несущих вставки длиной примерно 100-200 п.н., отбирали для секвенирования. Гомологию последовательностей выявляли при поиске с использованием алгоритма BLAST, NCBI.
Флуоресцентная гибридизация in situ (FISH)
Метафазные хромосомы получали обработкой клеток PK-7 колхицином (10 мкг/мл) (Sigma № C9754) в течение 2 часов при 37°C. После промывки фосфатно-солевым буфером (PBS) клетки выдерживали в гипотоническом растворе (75 мМ KCl) в течение 6 минут при комнатной температуре (КТ), фиксировали 4 промывками в метаноле/уксусной кислоте (3:1) и затем распределяли на чистом предметном стекле. Цитогенетические образцы денатурировали в 70% растворе формамида в течение 2 минут при 72°C, обезвоживали последовательными промывками холодным 70%, 85% и 95% этанолом и затем сушили на воздухе. Специфичные зонды получали следующим образом: плазмидную ДНК длиной 13 т.п.н., содержащую кассету GPR, метили, используя набор для мечения случайно праймированной ДНК (Roche Applied Science, Indianapolis, IN) SpectrumOrangeTM-dUTP (Vysis, Inc., Downers Grove, IL), тогда как контрольную космидную ДНК длиной 30 т.п.н., содержащую ген hox4 человека, метили, используя набор для мечения нуклеиновых кислот FISHSBrigtTM (Kreatech Biotechnology, Amsterdam, The Netherlands). Гибридизацию осуществляли в результате инкубации 5 нг/мкл каждого зонда в 250 мкл 50% формамида, 2× SSC и 10% сульфата декстрана и 50 нг/мкл ДНК C0T-1 человека (Invitrogen) в буфере для гибридизации. Образцы покрывали денатурированными зондами на 10 минут при 75°C, накрывали парафильмом M и инкубировали в течение ночи при 37°C во влажной камере. Образцы промывали один раз в 0,4×SSC, pH=7, при 72°C в течение 2 минут, один раз в 4×SSC, pH=7, содержащем 0,0025% Твин-20, в течение 30 секунд при комнатной температуре и два раза в PBS 1 в течение 1 минуты при комнатной температуре. Предметные стекла контрастно красили, используя 0,02 мкг/мкл 49,6-диамидино-2-фенилиндола (DAPI) (Sigma). Визуализацию и фотографические изображения получали с помощью прямого микроскопа Nikon 80i (Nikon Instruments S.p.A., Италия), используя фильтрованное освещение для зеленого (ФИТЦ) и оранжевого спектра (спектральный оранжевый). Изображения обрабатывали, используя компьютерную программу Genikon (Nikon).
Пример II: Создание первого промежуточного клона PK-7
Чтобы получить линию пакующих клеток RD-MolPack для непрерывной продукции LV либо 2-ого, либо 3-его поколения, получали несколько производных от HEK293T промежуточных клонов. Первый клон был назван PK-7 и был получен в результате стабильной интеграция генов ВИЧ-1 gag, pol и rev с помощью рекомбинантного гибридного вектора бакуло-AAV (rhBaculo-AAV-GPR) (фигура 1a, схема 1). В такой системе доставки использована активность интегразы белка AAV-rep78, осуществляемой временно, чтобы вырезать и интегрировать фланкированные ITR AAV кассеты интеграции в хромосомы человека (фигура 1b). Вектор rh-baculo-AAV создавали в результате гомологичной рекомбинации между линейной ДНК BaculoDirect и исходной плазмидой Gateway® pENTRTM4, содержащей ITR-фланкированные кассеты GPR (фигура 1a, схема 1). После 3 циклов (p3) амплификации рекомбинантного бакуловируса в клетках насекомых Sf9 проверяли титр и возможные события рекомбинации гибридной ДНК бакуло-AAV в анализе бляшек и в Сайзерн-блот-анализе вирусной геномной ДНК, соответственно. Титр в p3 соответствовал 6×1010 БОЕ/мл, и Саузерн-блот-анализ выявил одну отчетливую полосу, доказывающую отсутствие событий рекомбинации в ходе процесса амплификации вируса (фигура 5).
Затем тщательно определяли дозу и время трансфекции плазмидой AAV-Rep78 и инфекции rh-baculo-AAV и условия клонирования инфицированных клеток HEK293T (фигура 1c). Действительно, выяснилось, что выбор таких экспериментальных условий является важным. Таким образом, после тестирования широкого диапазона условий в конце концов было установлено, что одна доза плазмидной ДНК AAV-rep78, трансфицированной за 24 часа до инфекции rh-baculo-AAV при MOI 1000, соответствовала наилучшему дизайну эксперимента. Кроме того, обнаружено, что посев всего 5×105 клеток, которые распределяли на 22 чашках Петри диаметром 90 мм, при этом посев на каждую чашку осуществляли в разных концентрациях, и добавление гигромицина в концентрации 100 мкг/мл через 4 дня после посева обеспечивали наилучшие условия для сбора наибольшего количества клонов клеток. Только три из 360 подсчитанных клонов, PK-7, PK-17 и PK-18, экспрессировали p24gag выше установленного порога 100 пг/мл. Саузерн-блот-анализ клонов показал, что каждый клон содержит две копии правильного по размеру вектора (фигура 2a). Чтобы исключить возможную интеграцию остаточной плазмидной ДНК AAV-rep78, осуществляли rep78-специфичную ПЦР на гДНК PK-7, которая не выявила позитивного сигнала (фигура 5b). Картину экспрессии белков ВИЧ-1, полученной с кассеты GPR, контролировали, используя Вестерн-блот трех клонов PK и соответствующих им вирусоподобных частиц (VLP), высвобождаемых в среду. Все вирусные белки были правильны образом процессированы, имели правильный размер и присутствовали в правильном относительном соотношении (фигура 2b). Будущий рабочий клон PK отбирали, вычисляя на клетках SupT1 эффективность LV, продуцируемых тремя клонами после котрансфекции плазмидой VSV-G и вектором переноса SIN-eGFP 3-его поколения (таблица 1). Следует отметить, что хотя титр контрольных LV в HEK293T, полученный в результате временной трансфекции, был в 5 раз более высоким, чем в случае LV PK-7 и PK-18, их инфекционность была почти идентичной инфекционности LV PK, что свидетельствует о том, что клоны PK образуют LV, которые с точки зрения «качества» сравнимы с LV, полученными обычными способами (таблица 1). Хотя эффективность LV PK-7 и PK-18 была сходной, клон PK-7 был отобран для дальнейших генетических операций, поскольку его морфология, рост, жизнеспособность и оцененные значения продукции p24gag были лучше, чем указанные параметры в случае клона PK-18 (таблица 1).
Затем интеграцию ITR-фланкированной кассеты GPR подробно характеризовали в клоне PK-7, используя количественную ОЛ-ПЦР, ПЦР TaqMan (фигура 2c) и методику FISH (фигура 2d). Чтобы точно картировать участок интеграции, осуществляли исследования с использованием ОЛ-ПЦР, которые привлекли внимание к точке разрыва в хромосоме 2, 2q32.1 (фигура 2c). Полученный результат был подтвержден при использовании гибридизации in situ со специфичным GPR-зондом, которая выявила одно пятно на хромосоме 2 на основании дины плеча и положения центромеры (фигура 2d). Чтобы подтвердить определение такого положения, использовали зонд HOX4, который, как известно, картирован в хромосоме 2q31.2. Так как клетки HEK293T являются триплоидными, HOX4 правильным образом выявляли во всех трех хромосомах 2 (фигура 2d). Наконец с использованием количественной TaqMan-ПЦР подтвердили, что были интегрированы две копии, и с помощью гнездовой ПЦР с праймерами соответствующего дизайна (фигура 2e) подтвердили, что две копии были в тандемной ориентации хвост-к-хвосту. Ориентация хвост-к-хвосту является природной конфигурацией, также наблюдаемой в случае интеграции AAV дикого типа и большинства конкатемеров вектора rAAV в геном клетки-хозяина [17]. Анализ последовательности ампликона, охватывающего соединение хвост-к-голове, выявил, что фрагмент длиной 910 п.н., содержащий 303 п.н. 3'-CMV-промотора первой кассеты вместе с обоими ITR первой и второй кассет и полным 5'-CMV-промотором второй кассеты были утрачены (фигура 2e, красный прямоугольник). Большинство событий векторно-клеточной рекомбинации фактически происходит в последовательностях ITR вектора. Такая перегруппировка вызывала в клетках PK-7 утрату транскрипции гена gag-pol второй кассеты и вероятно утрату транскрипции генов rev и hygro первой кассеты. Однако заслуживает внимания, что область длиной 285 п.н. слева от делетированного промотора CMV (фигура 2e, серый треугольник в центре схемы) еще содержит TATA-бокс, который может быть достаточным для управления транскрипцией генов rev и hygro. В заключение необходимо отметить, что PK-7 содержит две интегрированные кассеты, которые вместе транскрибируют один ген gag-pol и один или два гена rev и hygro.
Чтобы продемонстрировать стабильность клона PK-7 в течение времени, клетки культивировали в присутствии или отсутствие гигромицина в течение 350 дней, что соответствует примерно 420 удвоениям клеток, и измеряли продукцию p24gag в расчете на клетку (таблица 2). Средняя продукция в присутствии гигромицина соответствует 15,34±8,47 SD нг p24gag/1×106 клеток, тогда как в отсутствие антибиотика составляет 6,70±3,51 SD нг p24gag/1×106 клеток (таблица 2).
Такое различие вероятно возникает в связи с тем фактом, что под давлением лекарственного средства гигромицина сохраняется «включенное» состояние транскрипции гена резистентности hygro и тем самым также и хроматина. Это может благоприятствовать более высокой транскрипции генов gag-pol. Чтобы оценить, были ли VLP, образованные клоном PK-7, функциональными даже после нескольких сотен удвоений, клетки PK-7 котрансфицировали в p60 и p102 конструкцией VSV-G оболочки и вектором переноса SIN-eGFP и вычисляли эффективность LV на клетках SupT1. Удивительно, что титр и инфекционность LV, продуцируемых как в присутствии, так и в отсутствие лекарственного средства для селекции, еще сохранялись на нормальном уровне после такого продолжительного периода времени (таблица 1). Полученные данные показывают отсутствие генетической нестабильности кассеты GPR, независимо от присутствия или отсутствия давления лекарственного средства и позволили авторам избежать применения гигромицина при дальнейшей характеристике. Сопоставимые данные в отношении стабильности интеграции кассеты, опосредованной ITR AAV, в литературе отсутствуют. Единственная соответствующая информация относится к тому, что полученная из костного мозга человека линия подобных фибробластам клеток (клетки Раддла Детройт 6), инфицированных AAV дикого типа серотипа 2 (AVV-2), сохраняли вирусные последовательности в латентном состоянии в течение, по меньшей мере, 47 пассажей и 118 пассажей [16,17]3. В частности, клетки PK-7 выживали в течение, по меньшей мере, 102 пассажей.
Пример III: Разработка второго промежуточного клона PK-7-Tat7 для RD2-MolPack 2-ого поколения
Следующая стадия к разработке RD-MolPack 2-ого поколения (фигура 1c) заключалась в стабильной интеграции регуляторного фактора Tat ВИЧ-1 в клетки PK-7 с помощью доставки SIN-LV (фигура 1, схема 2). Клетки трансдуцировали в результате двух циклов спинокуляции и затем клонировали, используя лимитирующее разведение после селекции на пуромицине. 11 растущих клонов собирали и после первого скрининга на основе продуцирования p24gag оценивали экспрессию Tat с помощью Вестерн-блота с использованием ядерных экстрактов, полученных из пяти клонов, в которых наблюдали значения >5 нг p24gag/1×106 клеток. Только в клонах PK-7-Tat5 и PK-7-Tat7 наблюдали высокий уровень tat (фигура 3a) и p24gag (фигура 3b). Поэтому только такие два клона были подвергнуты дальнейшей характеристике, и с помощью TaqMan-ПЦР было установлено, что PK-7-Tat5 содержит 12, и PK-7-Tat7 содержит шесть копий гена tat; также измеряли эффективность LV при котрансфекции плазмидой для оболочки VSV-G и вектором переноса 2-ого поколения PΔN-eGFP. Хотя титр в случае обоих клонов был на 2 log ниже, эффективность была только на 1 log ниже, чем в случае контрольных клеток (таблица 3). На этом основании PK-7-Tat7 отобрали в качестве промежуточного клона для последующей интеграции RD114-TR оболочки.
Пример IV: Конструирование вектора SIN-RD114-TR-IN-RRE
Первая из многочисленных попыток добавления RD114-TR оболочки в клоны PK-7 и PK-7-Tat7 посредством доставки SIN-LV заключалась в конструировании вектора SIN-RD114-TR (фигура 1a, схема 3). С этой целью кассету PGK-eGFP вектора SIN-eGFP (фигура 1a, схема 6) заменяли кассетой CMV-RD114-TR, которая не содержала интрона β-глобина, присутствующего в исходной плазмиде CMV-RD114-TR (фигура 1a, схема 12). Интрон β-глобина сначала исключали из конструкции из-за множества возможных событий сплайсинга, запускаемых сильным донором сплайсинга (SD), расположенным выше сигнала упаковки вектора SIN, не только с акцептором сплайсинга (SA), расположенным выше элемента cPPT, но также с SA интрона β-глобина. Действительно, в последнем случае, сплайсинг может удалять промотор CMV из геномной РНК вектора (фигура 1, схема 6). Неожиданно такой SIN-вектор и все промежуточные плазмиды с такой же конфигурацией кассеты экспрессии не продуцировали белок RD114-TR. Действительно, когда клеточные экстракты, полученные из клеток, трансфицированных (TF) или трансдуцированных (TD) SIN-RD114-TR, анализировали с использованием Вестерн-блота, уровень белка RD114-TR был нерегистрируемым по сравнению с уровнем, получаемым в случае контрольной плазмиды CMV-RD114-TR (фигура 4a, дорожки 1-3). Нозерн-блот-анализ показал, что SIN-RD114-TR-специфичные транскрипты, образованные после трансфекции плазмиды в клетки PK-7, соответствовали полноразмерным (FL) и сплайсированным один раз транскриптам, но не соответствовали внутренней кассете CMV-RD114-TR, что свидетельствует о возможной необходимости интрона β-глобина для эффективного накопления транскриптов RD114-TR (фигура 6, дорожки 1 и 2).
На основании полученных данных было выдвинуто предположение о том, что неожиданная потребность в присутствии интрона β-глобина для осуществления продуцирования RD114-TR, может отражать наличие нестабильности или негативных последовательностей в ORF RD114-TR. В анализе последовательностей с помощью GeneOptimizer®, осуществляемом в GENEART AG (Regensburg, Germany), определили, что неточно используемые кодоны были распространены на протяжении всего гена D114-TR, что давало авторам основание для такого предположения. Кроме того, анализ оптимизации кодонов показал, что индекс адаптации кодонов (CAI) повышался с 0,65 до 0,98 (при этом CAI, равный 1, является оптимальным). Поэтому, чтобы избежать необходимости включения интрона β-глобина в конструкцию вектора, полную ORF RD114-TR ORF подвергали оптимизации кодонов, воспользовавшись услугами GENEART AG. Было обнаружено, что оптимизация кодонов обеспечивала трансляцию PR RD114-TR даже в отсутствие интрона β-глобина, но неожиданно имел место высокий уровень белка-предшественника (PR), который не процессировался фурином на соответствующие субъединицы SU и TM (фигура 4a, дорожки 7). Была исключена возможность того, что накопление большого количества непроцессированного PR является вторичным по отношению к избытку субстрата, так как не было подтверждено протеолитическое расщепление даже после трансфекции очень небольшого количества плазмидной ДНК (10 пг ДНК/106 клеток). Таким образом, был сделан вывод, что одна или несколько молчащих мутаций могли модифицировать скорость транскрипции/трансляции белка, тем самым мешая его правильному фолдингу и вероятно доступности для зависимого от фурина расщепления.
Таким образом, были созданы два других вектора экспрессирующих RD114-TR WT, содержащий интрон β-глобина, последовательность SIN-RD114-TR-IN и SIN-RD114-TR-IN-RRE (фигура 1a, схема 4 и 5, соответственно); в последней был встроен дополнительный RRE в интрон β-глобина, чтобы защитить его от сплайсинга. Вектор SIN-RD114-TR-IN продуцировал большое количество белка после трансфекции (фигура 4a, дорожка 6), но белок отсутствовал в трансдуцированных SIN-RD114-TR-IN клетках (фигура 4a, дорожка 7). Полученные данные были подтверждены Нозерн-блот-анализом, в котором не выявлялась полноразмерная геномная РНК, которая, как ожидалось, мигрирует медленнее, чем SIN-RD114-TR, вследствие присутствия интрона β-глобина длиной 800 п.н. (фигура 6, дорожки 3 и 4, ожидаемый FL, полноразмерный). Напротив, большое количество сплайсированной РНК получали при действии SD и SA β-интрона (фигура 6, дорожки 3 и 4).
Неожиданно было обнаружено, что RRE в векторе SIN-RD114-TR-IN-RRE необходим и достаточен для обеспечения экспрессии оболочки как в трансфицированных, так и в трансдуцированных клетках PK-7 (фигура 4a, дорожки 8 и 9) и в соответствующих VLP (фигура 4a, дорожки 10 и 11). RD114-TR, включенный в VLP, нормально процессировался, при это наблюдали высокий уровень трансмембранных субъединиц TM и TM*; последняя образовывалась в результате расщепления субъединицы TM вирусной протеазой, как показано Sandrin с соавторами, 2004 [22]. Субъединицу D114-T SU, которая должна мигрировать совместно с молекулой PR, не выявляла специфичное анти-RD114-TR-антитело, которое использовали авторы. Затем авторы создали вектор SIN-RD114-TR-CO-IN-RRE и провели тестирование в отношении продукции и процессинга белка. Кроме того, белок, продуцируемый с такого вектора, нормальным образом не продуцировался и не процессировался (фигура 4a, дорожка 13). Полученный результат приводит к выводу о том, что единственной имеющейся конструкцией для правильной продукции RD114-TR является SIN-RD114-TR-IN-RRE.
Пример V: Разработка клона PK-7-Tat7-RD19 для получения RD2-MolPack и клона PK-7-RD32 для получения RD3-MolPack
На основании результатов, представленных до настоящего времени, оболочку RD114-TR стабильно интегрировали в оба клона PK-7-Tat7 и PK-7 посредством доставки VSV-G-псевдотипированного LV SIN-RD114-TR-IN-RRE. Клетки PK-7-Tat7 подвергали спинокуляции и клонировали способом лимитирующего разведения. Затем девять клонов подвергали скринингу, вычисляя титр LV, продуцируемых после трансдукции вектора переноса 2-ого поколения PΔN-eGFP (таблица 4); уровень RD114-TR контролировали, используя Вестерн-блот, и количество интегрированных копий с использованием ПЦР TaqMan только в таких клонах, в которых наблюдали титр >1×105 те/мл, то есть в клонах PK-7-Tat7-RD3, PK-7-Tat7-RD12 и PK-7-Tat7-RD19 (фигура 4b). Клон PK-7-Tat7-RD19 выбрали потому, что продуцирует самый высокий титр и большое количество RD114-TR по отношению к количеству интегрированных копий LV SIN-RD114-TR-IN-RRE (фигура 4b, числа в скобках).
Затем такие же протоколы трансдукции, отбора, клонирования и скрининга, адаптированные для создания клонов PK-7-Tat7-RD, также использовали для интеграции RD114-TR в клетки PK-7 (таблица 5). Выбранные клетки PK-7-RD-26, PK-7-RD-28 и PK-7-RD-32 тестировали с использованием Вестерн-блота и методики ПЦР TaqMan (фигура 4c). Выбор пал на клон PK-7-RD26 потому что, несмотря на тот факт, что он продуцирует LV с низким титром, он продуцирует наиболее высокий уровень p24gag по сравнению с другими выбранными клонами и даже по сравнению с родительским клоном PK-7 (таблица 5).
Интересно, что уровень субъединицы TM RD114-TR был эквивалентным в клонах PK-7-RD28 и PK-7-RD32 вопреки заметному различию в количестве копий RD114-TR между двумя клонами (фигура 4c, числа в скобках), что свидетельствует о том, что часть векторов SIN-RD114-TR-IN-RRE должны быть не функциональной в клоне PK-7-RD32. Таким образом, чтобы объединить высокий уровень продукции p24gag и вероятно более высокий уровень белка RD114-TR в клоне PK-7-RD26, осуществили два других цикла интеграции SIN-RD114-TR-IN-RRE, отбора и клонирования, получив в результате первого цикла субклон PK-7-RD26.72 и в результате второго цикла субклон RD26.72.10, и повысив количество копий RD114-TR с 2 до 11 и затем до 22, и титр с 7,0×102 до 1,1×104 и в конце концов до 2,7×105, соответственно (фигура 4d, числа в скобках).
Пример VI: разработка стабильной линии клеток-продуцентов RD-MolPack-Chim3 2-ого поколения
Чтобы получить конечные пакующие клетки RD-MolPack 2-ого поколения, в клетки PK-7-Tat7-RD19 интегрировали вектор переноса PΔN-Chim3 (Фигура 1a, схема 7), терапевтический ген Chim3 в котором был подробно охарактеризован в контексте генной терапии, направленной против ВИЧ/СПИДа [23, 24]. После осуществления стандартизованного протокола скрининга были выбраны три клона, PK-7-Tat7-RD19-Chim3.2, PK-7-Tat7-RD19-Chim3.3 и PK-7-Tat7-RD19-Chim3.14 (таблица 6), для дальнейшей характеристики.
Был отобран клон PK-7-Tat7-RD19-Chim3.14 (далее RD2-MolPack-Chim3.14) поскольку он спонтанно растет в суспензии. Было подтверждено, что клон живет в культуре почти два месяца, образуя 3те/клетку/сутки, когда титр определяли на клетках SupT1. Кроме того, клетки RD2- MolPack-Chim3.14 могли нормально жить в среде DMEM, содержащей 5% FCS, в то время как их жизнеспособность снижалась, когда их адаптировали к росту в среде DMEM, содержащей 2,5% FCS (фигура 3d). Параметры роста клеток важны для возможного крупномасштабного культивирования в биореакторе. Также было подтверждено, что несмотря на большое количество копий интегрированного Chim3-LV, не наблюдали перестроек вирусных генов при Саузерн-блот-анализе, что доказывает генетическую стабильность интегрированных векторов (фигура 3c). Поразительно, что титр LV, продуцируемых клоном RD2-MolPack-Chim3.14 выше, чем титр LV, продуцируемых во временно трансфицированных контрольных клетках PK-7 и HEK293T остальными плазмидами в случае расчета титра либо на клетках SupT1, либо на клетках CD34+ (таблица 6).
Ссылки
1. Schambach, A., and Baum, C. (2008). Clinical application of lentiviral vectors - concepts and practice. Curr Gene Ther 8: 474-482.
2. Carroll, R., Lin, J. T., Dacquel, E. J., Mosca, J. D., Burke, D. S., and St Louis, D. C. (1994). A human immunodeficiency virus type 1 (HlV-l)-based retroviral vector system utilizing stable HIV-1 packaging cell lines. J Virol 68: 6047-6051.
3. Yu, H., Rabson, A. B., Kaul, M., Ron, Y., and Dougherty, J. P. (1996). Inducible human immunodeficiency virus type 1 packaging cell lines. J Virol 70: 4530-4537.
4. Poeschla, E., Corbeau, P., and Wong-Staal, F. (1996). Development of HIV vectors for anti-HIV 10 gene therapy. Proc Natl Acad Sci USA 93: 11395-11399.
5. Corbeau, P., Kraus, G., and Wong-Staal, F. (1996). Efficient gene transfer by a human immunodeficiency virus type 1 (HlV-l)-derived vector utilizing a stable HIV packaging cell line. Proc Natl Acad Sci U S A 93: 14070-14075.
6. Throm, R. E., et al. (2009). Efficient construction of producer cell lines for a SIN lentiviral 15 vector for SCID-X1 gene therapy by concatemeric array transfection. Blood 113: 5104-5110.
7. Broussau, S., et al. (2008). Inducible packaging cells for large-scale production of lentiviral vectors in serum-free suspension culture. Mol Ther 16: 500-507.
8. Srinivasakumar, N., Chazal, N., Helga-Maria, C., Prasad, S., Hammarskjold, M. L., and Rekosh, D. (1997). The effect of viral regulatory protein expression on gene delivery by human immunodeficiency virus type 1 vectors produced in stable packaging cell lines. J Virol 71: 5841-5848.
9. Kaul, M., Yu, H., Ron, Y., and Dougherty, J. P. (1998). Regulated lentiviral packaging cell line devoid of most viral cis-acting sequences. Virology 249:167-174.
10. Cockrell, A. S., Ma, H., Fu, K., McCown, T. J., and Kafri, T. (2006). A trans-lentiviral packaging cell line for high-titer conditional self-inactivating HIV-1 vectors. Mol Ther 14: 276-284.
11. Bestor, T. H. (2000). Gene silencing as a threat to the success of gene therapy. J Clin Invest 105: 409-411.
12. Ikeda, Y., Takeuchi, Y., Martin, F., Cosset, F. L., Mitrophanous, K., and Collins, M. (2003). Continuous high-titer HIV-1 vector production. Nat Biotechnol 21: 569-572.
13. Palombo, F., Monciotti, A., Recchia, A., Cortese, R., Ciliberto, G., and La Monica, N. (1998). 30 Site-specific integration in mammalian cells mediated by a new hybrid baculovirus-adeno-associated virus vector. J. Virol. 72: 5025-5034.
14. Smith, R. H. (2008). Adeno-associated virus integration: virus versus vector. Gene Ther 15: 817-822.
15. Sandrin, V., et al. (2002). Lentiviral vectors pseudotyped with a modified RD114 envelope 35 glycoprotein show increased stability in sera and augmented transduction of primary lymphocytes and CD34+ cells derived from human and nonhuman primates. Blood 100: 823-832.
16. Berns, K. I., and Linden, R. M. (1975). The cryptic lyfe style of adeno-associated virus. Bioessays 17: 237-245.
17. Cheung, A. K., Hoggan, M. D., Hauswirth, W. W., and Berns, K. I. (1980). Integration of the adeno-associated virus genome into cellular DNA in latently infected human Detroit 6 cells. J Virol 33:739-748.
18. Samulski, R. J., Chang, L. S., and Shenk, T. (1987). A recombinant plasmid from which an infectious adeno-associated virus genome can be excised in vitro and its use to study viral replication. J Virol 61: 3096-3101.
19. Recchia, A., Perani, L., Sartori, D., Olgiati, C., and Mavilio, F. (2004). Site-specific integration of 10 functional transgenes into the human genome by adeno/AAV hybrid vectors. Mol Ther 10: 660-670.
20. Zufferey, R., Nagy, D., Mandel, R. J., Naldini, L., and Trono, D. (1997). Multiply attenuated lentiviral vector achieves efficient gene delivery in vivo. Nat Biotechnol 15: 871-875.
21. Follenzi, A., Ailles, L. E., Bakovic, S., Geuna, M., and Naldini, L. (2000). Gene transfer by lentiviral vectors is limited by nuclear translocation and rescued by HIV-1 pol sequences. Nat Genet 25:217-222.
22. Sandrin, V., Muriaux, D., Darlix, J. L., and Cosset, F. L. (2004). Intracellular trafficking of Gag and Env proteins and their interactions modulate pseudotyping of retroviruses. J Virol 78: 7153-7164.
23. Porcellini, S., et al. (2009). The F12-Vif derivative Chim3 inhibits HIV-1 replication in CD4+ T lymphocytes and CD34+-derived macrophages by blocking HIV-1 DNA integration. Blood 113: 3443-20 3452.
24. Porcellini, S., Gubinelli, F., Alberici, L., Piovani, B. M., Rizzardi, G. P., and Bovolenta, C. (2010). Chim3 confers survival advantage to CD4+ T cells upon HIV-1 infection by preventing HIV-1 DNA integration and HIV-l-induced G2 cell-cycle delay. Blood 115: 4021-4029.
25. Zufferey, R., Nagy, D., Mandel, R. J., Naldini, L., and Trono, D. (1997). Multiply attenuated 25 lentiviral vector achieves efficient gene delivery in vivo. Nat Biotechnol 15: 871-875.
26. Di Nunzio, F., Piovani, B., Cosset, F. L., Mavilio, F., and Stornaiuolo, A. (2007). Transduction of human hematopoietic stem cells by lentiviral vectors pseudotyped with the RD114-TR chimeric envelope glycoprotein. Hum Gene Ther 18: 811-820.
27. Dull, T., Zufferey, R.,Kelly, M., Mandel, R. J., Nguyen, M., Trono, D., Naldini, L. A third- 30 generation lentivirus vector with a conditional packaging system. J Virol, 1998; 72: 8463-71.
Реферат
Изобретения касаются способов получения стабильной линии пакующих лентивирусы клеток (варианты), стабильной линии пакующих лентивирусы клеток, способа получения лентивирусных векторов, линии клеток-продуцентов и способа производства лентивирусных векторов. Представленные изобретения созданы с применением гибридной системы бакуло-AAV для стабильной экспрессии структурных и регуляторных лентивирусных белков. Такая система содержит бакуловирусный остов, содержащий кассету интеграции, фланкированную ITR AAV, в сочетании с плазмидой, кодирующей белок rep. Представленная система позволяет осуществлять стабильную интеграцию структурных и регуляторных белков ВИЧ-1 gag/pol и rev и получать первый промежуточный продукт, содержащий только структурные и регуляторные белки ВИЧ gag/pol и rev, используемый в качестве исходной точки для получения стабильных линий пакующих клеток, а также линий клеток-продуцентов. Изобретения могут быть использованы в генной терапии. 6 н. и 24 з.п. ф-лы, 6 ил., 6 табл., 6 пр.
Формула
i) получение гибридного вектора (А), содержащего бакуловирусный остов, содержащий кассету интеграции, фланкированную ITR AAV, включающую две кассеты экспрессии, при этом первая кассета экспрессии кодирует лентивирусные гены gag и pol, а вторая кассета экспрессии кодирует лентивирусный rev и селектируемый маркер; и
ii) получение экспрессирующей плазмиды (В), содержащей открытую рамку считывания rep AAV под контролем промотора;
iii) трансфекцию клеток экспрессирующей плазмидой В и затем инфекцию клеток гибридным вектором А;
iv) культивирование клеток в присутствии антибиотика для селекции;
v) получение клеток, стабильно экспрессирующих белки gag, pol и rev;
vi) интеграцию гена env в клетки;
vii) культивирование клеток для получения клеточной линии, стабильно экспрессирующей белки gag, pol rev и env.
i) получение гибридного вектора (А), содержащего бакуловирусный остов, содержащий кассету интеграции, фланкированную инвертированными концевыми повторами (ITR) аденоассоциированного вируса (AAV), содержащую две кассеты экспрессии, при этом первая кассета экспрессии кодирует лентивирусные гены gag и pol, а вторая кассета экспрессии кодирует лентивирусный rev и селектируемый маркер; и
ii) получение экспрессирующей плазмиды (В), содержащей ORF rep AAV под контролем промотора;
iii) трансфекцию клеток экспрессирующей плазмидой В и затем инфекцию клеток гибридным вектором А;
iv) культивирование клеток в присутствии антибиотика для селекции;
v) получение клеток, стабильно экспрессирующих белки gag, pol и rev;
vi) интеграцию лентивирусного гена tat в такие клетки;
vii) культивирование клеток для получения клеточной линии, стабильно экспрессирующей белки gag, pol, rev и tat.
viii) интеграцию гена env в такие клетки;
ix) культивирование клеток для получения клеточной линии, стабильно экспрессирующей белки gag, pol, rev, tat и env.
i) по меньшей мере, одну копию кассеты интеграции, фланкированную ITR AAV, содержащую две кассеты экспрессии, при этом первая кассета экспрессии кодирует лентивирусные гены gag и pol, а вторая кассета экспрессии кодирует лентивирусный rev и селектируемый маркер;
ii) по меньшей мере, одну копию гена env.
i) культивирование стабильной линии пакующих лентивирусы клеток по любому из пп. 13-20;
ii) встраивание в стабильную линию пакующих клеток вектора переноса.
i) по меньшей мере, одну копию кассеты интеграции, фланкированную ITR AAV, содержащую две кассеты экспрессии, при этом первая кассета экспрессии кодирует лентивирусные гены gag и pol, а вторая кассета экспрессии кодирует лентивирусный rev и селектируемый маркер;
ii) по меньшей мере, одну копию env;
iii) вектор переноса.
i) культивирование линии клеток-продуцентов по любому из пп. 22-29.

Комментарии