Рекомбинантный непатогенный mdv-вектор, обеспечивающий полиспецифический иммунитет - RU2593950C2
Код документа: RU2593950C2
Чертежи









Описание
Настоящее изобретение относится к области ветеринарных вакцин, в частности, к ветеринарным вакцинам для домашних птиц на основе вирусных векторов, основанных на рекомбинантных непатогенных вирусах болезни Марека.
Вирусы болезни Марека (MDV) образуют семейство Alphaherpesvirideae, инфицирующее виды птиц. Их вирион заключен в оболочку и имеет размер приблизительно 160 нм. Внутри капсида содержится большой геном, состоящий из линейной двухцепочечной ДНК.
MDV серотипа 1 (MDV1), также известный как герпесвирус куриных 2, является патогенным для куриц и распространен по всему миру. Он является канцерогенным и вызывает лимфомы и паралич. Аттенуированные штаммы MDV1 применяли в качестве вакцины, например, вакцины Rispens (штамм CVI-988) (Kreager, 1998, Poultry Sci., vol. 77, p. 1213).
MDV серотипа 2 (MDV2), также известный как герпесвирус куриных 3, является сильно аттенуированным к практически непатогенному MDV куриц (Petherbridge et al., 2009, J. Virol. Meth., vol. 158, p. 11), который повсеместно применяют в качестве вакцины против MDV1. Хорошо известная вакцина MDV2 представляет собой Nobilis™ Marexine SB1 (MSD Animal Health).
MDV серотипа 3, также известный как герпесвирус индюков 1 (HVT). Он был описан в 1970-х годах как вирус герпеса, заражающий индюков (Witter et al., 1970, Am. J. Vet. Res., vol. 31, p. 525) и непатогенный для куриц. Штаммы HVT, такие как PB1 или FC-126, повсеместно применяют для вакцинации против MDV1. Альтернативно, когда необходима защита от высоковирулентного MDV1, HVT применяют в сочетании с вакцинным штаммом MDV2, например, с SB1 от Nobilis™ Marexine CA126+SB 1 (MSD Animal Health), или с вакцинным штаммом MDV1, таким как Rispens от Nobilis™ RISMAVAC+CA126 (MSD Animal Health).
Непатогенные вирусы болезни Марека (npMDV) MDV2 и HVT реплицируются в лимфоцитах периферической крови птиц (PBL), и, таким образом, представляют собой системные вирусы, вызывающие продолжительный иммунный ответ, который в основном затрагивает клеточную, а не на гуморальную иммунную систему.
Вакцины npMDV можно применять для куриц с раннего возраста, что возможно благодаря их безопасным непатогенным свойствам, а также относительной нечувствительности к материнским антителам (MDA) против MDV2 или HVT; MDA у цыплят представляют собой антитела, полученные из яиц от матерей, которых планово вакцинируют против типичных патогенов домашних птиц. Таким образом, вакцины npMDV можно вводить птенцам через сутки после их вылупления из яйца (первые сутки) или даже до вылупления, внутри яйца. Последний подход, который называют 'вакцинация in ovo', представляет собой форму пренатальной вакцинации, которую обычно применяют на 18-е сутки эмбрионального развития (ED), приблизительно за 3 суток до вылупления.
Гетерологичный ген, который экспрессируется в живом рекомбинантном векторе, как правило, кодирует белок (или его важную часть), который представляет собой основной защитный иммуноген микроорганизма, против которого проводят вакцинацию; поскольку этот белок или пептид содержит иммунодоминантный эпитоп(ы) такого микроорганизма, он может стимулировать иммунную систему хозяина к выработке нейтрализующих антител и/или клеточного иммунитета, который очищает микроорганизм от вакцинированного животного.
Помимо непосредственного применения в качестве вакцины, HVT также применяют в качестве вакцины на основе вирусного вектора для экспрессии и доставки различных иммуногенных белков домашним птицам, см. WO 87/04463. В векторах HVT экспрессировали несколько генов, кодирующих антигены из патогенов домашних птиц, такие как из: вируса болезни Ньюкасла (NDV) (Sondermeijer et al., 1993, Vaccine, vol. 11, p. 349-358), и вируса инфекционного бурсита (IBDV) (Darteil et al., 1995, Virology, vol. 211, p. 481-490). Также показано, что экспрессия паразитического антигена (Cronenberg et al., 1999, Acta Virol., vol. 43, p. 192-197) и цитокина может влиять на иммунный ответ куриц (WO 2009/156367; Tarpey et al., 2007, Vaccine, vol. 25, p. 8529-8535).
Введение векторной вакцины HVT домашним птицам вызывает иммунный ответ против экспрессирующегося гетерологичного гена, а также против HVT, что предоставляет защиту от MDV. Это применяют в ряде коммерческих векторных вакцин HVT, например: ген белка NDV F: Innovax™-ND (MSD Animal Health) и Vectormune™ HVT-NDV (Ceva); или ген VP2 IBDV: Vaxxitek™ HVT+IBD (Merial; прежнее название: Gallivac™ HVT-IBD) и Vectormune™ HVT-IBD (Ceva);
Геномная нуклеотидная последовательность HVT доступна, например, в Genbank™ под номер AF291866 (штамм FC-126). Описаны несколько способов встраивания гетерологичных нуклеиновых кислот в HVT, такие как посредством применения гомологичной рекомбинации (Sondermeijer et al., выше), космидная регенерация (US 5961982) или бакмид (бактериальные искусственные хромосомы) (Baigent et al., 2006, J. of Gen. Virol., vol. 87, p. 769-776).
Изучены многие генетические сайты для встраивания гетерологичной генетической конструкции в геном HVT, и известны несколько подходящих, не относящихся к незаменимым, локусов, например, в уникальном коротком регионе геноме HVT (EP 431668); или в уникальном длинном регионе HVT (EP 794257).
Для стимулирования экспрессии гетерологичного гена в экспрессирующих кассетах для HVT применяли различные промоторы, такие как: промотор PRV gpX (WO 87/04463); промотор вируса саркомы Рауса LTR, промотор ранних генов SV40 и промотор предранних генов цитомегаловируса человека (hCMV IE1) (EP 719,864); или промотор гена бета-актина курицы (EP 1298139).
Аналогично, геномные нуклеотидные последовательности штаммов MDV2 доступны в Genbank™: HQ840738 (SB1) и AB049735 (HPRS24). Геномная организация MDV2 очень сходна с геномной организацией HVT, в частности, в отношении наличия региона Us, идентичного региону HVT (Kingham et al., 2001, J. of Gen. Virol., vol. 82, p. 1 123; Spatz & Schat, 201 1, Virus genes, vol. 42, p. 331). Описаны клонирование и трансфекция вируса MDV2 (Petherbridge et al., выше).
Для конструирования рекомбинантных векторов гетерологичная конструкция, которая подлежит встраиванию в векторный геном, как правило, представляет собой молекулу нуклеиновой кислоты, содержащую, по меньшей мере, один (гетерологичный) ген или кодирующую область, которая должна быть способна к кодированию (по меньшей мере иммуногенная часть) антигенного белка.
Также конструкция может содержать промоторную последовательность для стимулирования экспрессии гетерологичного гена.
В последнем случае конструкцию часто называют "экспрессирующей кассетой".
Окончательный эффект встраивания экспрессирующей кассеты в векторный геном может различаться, поскольку этот геном может стать больше или меньше по размеру или сохранить прежний размер в зависимости от того, подвергается ли геном вставке, замене или удалению генетического материала. Также может различаться местоположение встроенного материала: он может помещаться внутри кодирующей или некодирующей области генома; и может помещаться внутри или между генами вектора или регуляторными участками. Эти альтернативные варианты определяют итоговую композицию экспрессирующей кассеты и ее воздействие на вектор и в конечном счете на животное, подлежащее вакцинации.
Вне зависимости от конкретной композиции конструкции, предпочтительная экспрессирующая кассета должна позволять живому рекомбинантному вирусному вектору преодолевать ряд биологических воздействий на его стабильность и эффективность: во-первых, на способность к размножению после встраивания гетерологичного материала. Это указывает на то, что рекомбинантный вирус является жизнеспособным, несмотря на встраивание в геном. Во-вторых, способность к репликации in vitro в клеточной линии хозяина в течение многих циклов с сохранением репликации и экспрессии гетерологичной вставки. Это указывает на то, что рекомбинант не был аттенуирован в результате встраивания, и вставка стабильно воспроизводится и экспрессируется. В-третьих, репликация и экспрессия in vivo. Это указывает на то, что рекомбинантный вирус может преодолевать сильное давление отбора в живом животном, такое как возникающее вследствие активации его иммунной системы. В таких условиях утрата экспрессии чужеродного гена благоприятствует более быстрой репликации в животном; такие "ускользнувшие" мутанты приобрели мутации или крупные делеции в чужеродном гене или его регуляторной области и имеют преимущество по сравнению с интактными вирусными векторами. Наконец, что наиболее важно, репликация вектора и экспрессия гетерологичного гена в животном должна обеспечивать иммунный ответ, достаточно эффективный для того, чтобы вакцинированное животное было защищено от инфекции и/или заболевание, которые в противном случае вызывались бы микроорганизмами, которые являются донорами гетерологичной вставки, экспрессирующейся в векторе.
Таким образом, полученный рекомбинантный вектор должен предоставлять стабильную интеграцию экспрессирующей кассеты в его геном; хорошую репликацию полученного рекомбинантного вектора, как in vitro, так и in vivo; и эффективную экспрессию гетерологичного гена(ов) in vivo, предпочтительно на высоком уровне и устойчивую во времени, для обеспечения и поддержания защитного иммунного ответа.
Такое сочетание свойств позволяет проводить значительное количество циклов репликации in vitro, необходимых для крупномасштабного производства, а также для продолжительной экспрессии и представления иммунной системе хозяина встроенного чужеродного гена, когда векторная вакцина реплицируется в вакцинированном животном. Кроме того, такая стабильность репликации и экспрессии необходима для того, чтобы векторная вакцина соответствовала очень высоким стандартам безопасности и биологической стабильности, которые требуются от рекомбинантного вируса, подлежащего применению в данной области в качестве коммерческого продукта после получения лицензии на продажу от органов государственной власти.
Болезнь Ньюкасла и инфекционный бурсит представляют собой важные заболевания домашних птиц, встречающиеся по всему миру, и могут приводить к тяжелым негативным последствиям в птицеводстве, касающимся благополучия животных и минимизации затрат (см.: Disease of poultry, 12th ed., 2008, Y. Saif ed., Iowa State Univ. press, ISBN-10: 0813807182).
Вирусы болезни Ньюкасла относятся к отряду Mononegavirales, в частности, к семейству Paramyxoviridae, и разделяются на различные патотипы в зависимости от их вирулентности; непатогенный лентогенный тип NDV почти не вызывает симптомов у домашних птиц. Напротив, мезогенный (обладающий средней патогенностью) и велогенный (обладающий высокой патогенностью) штаммы NDV вызывают серьезное заболевание и смертность и, таким образом, являются причиной заболеваний, подлежащих регистрации во многих странах. Симптомы заболевания включают нарушения дыхательной и нервной систем, среди которых наиболее заметными являются затрудненное дыхание и искривление шеи.
В птицеводстве защиту от инфекций и/или заболеваний, вызываемых патогенными штаммами NDV, обеспечивают посредством плановой вакцинации домашних птиц, как правило, на первые сутки после вылупления, живыми лентогенными штаммами NDV, такими как Nobilis™ ND Clone 30 (MSD Animal Health).
NDV содержит несегментированный отрицательно-полярный одноцепочечный РНК-геном, имеющий длину приблизительно 15 т.п.н., и содержит шесть генов, в том числе ген гликопротеина F, иммунодоминантного белка. Белок F участвует в прикреплении NDV к клетке-хозяину и внедрении в нее и может представлять собой основу эффективного иммунного ответа против NDV. Он экспрессируется как нативный белок F, который внеклеточно расщепляется пептидазами на F1 и F2. Расщепление облегчается благодаря аминокислотной последовательности из определенных основных аминокислот, которая находится в сайте расщепления F1/F2, и это обуславливает вирулентность штаммов NDV.
Вирус инфекционного бурсита (IBDV), также известный как вирус болезни Гамборо, является причинной развития инфекционного бурсита и относится к семейству Birnaviridae. Вирусы этого семейства содержат геном, состоящий из двух сегментов (A и B) двухцепочечной РНК. Крупный сегмент A кодирует полипротеин массой 110 кДа, который затем расщепляется посредством аутопротеолиза с образованием зрелых вирусных белков VP2, VP3 и VP4. Из них белки VP2 и VP3 представляют собой структурные белки капсида вириона, а VP2 представляет собой главный защитный иммуноген.
В случае IBDV существуют два серотипа, серотипы 1 и 2. Эти серотипы можно различать посредством реакции нейтрализации вирусов (VN). Показано, что вируса серотипа 1 являются патогенными для куриц, в то время как IBDV серотипа 2 вызывают только подострое заболевание у индеек.
Традиционно к вирусам IBDV серотипа 1 относили только один тип, который известен как "классический" вирус IBD. Недавно появился так называемый "вариантный" штамм IBDV; классический и вариантный штаммы можно идентифицировать и различать посредством реакции нейтрализации вируса с применением панели моноклональных антител или с применением ПЦР в реальном времени; это описано в Wu et al. (2007, Avian Disesases, vol. 51, p. 515-526). Хорошо известные классические штаммы IBDV представляют собой: D78, Faragher 52/70 и STC.
IBDV представляет собой острую высококонтагиозную вирусную инфекцию лимфоидной ткани куриц, которая в первую очередь поражает важнейший иммунный орган птиц: фабрициеву сумку. Заболеваемость в восприимчивых стаях является высокой и приводит к быстрой потере массы тела и от умеренной до высокой смертности. Птенцы, которые восстанавливаются после заболевания, могут приобретать иммунодеифицит вследствие разрушения (участков) фабрициевой сумки. В результате они являются чувствительными к вторичным инфекциям.
В данной области вирулентность циркулирующего вируса IBDV дикого типа постепенно повышается от вирулентных до очень вирулентных штаммов. Это может вызывать необходимость адаптации применяемых вакцин.
Плановую вакцинацию против IBD проводят у цыплят как можно более раннего возраста с применением живых вакцин IBDV, однако это способ можно применять только после того, как уровень MDA против IBDV достиг достаточного уровня, что, как правило, происходит от 7 до 30 суток после вылупления, как правило, от 15 до 20 суток.
Многие живые или инактивированные вакцины IBDV являются коммерчески доступными, например, живая вакцина, такая как Nobilis™ Gumboro D78 (MSD Animal Health).
Общепринятый подход для достижения экономической эффективности заключается в разработке вакцин, которые содержат комбинации антигенов. Таким образом, один сеанс вакцинации позволяет одновременно иммунизировать птиц против ряда заболеваний. Это помогает не только сохранить время и сократить затраты, но и уменьшает у подвергающихся вакцинации животных дискомфорт и стресс, которые в противном случае наблюдались бы вследствие повторных сеансов вакцинации. Самая высокая эффективности в связи с этим достигается в случае вакцинаций, которые проводят не посредством массовых способов, таких как опрыскивание спреем или добавление вакцины в питьевую воду, а посредством индивидуальных инъекций. Примером такого способа является вакцинация куриц-несушек и маточных куриц инактивированной субъединичной вакциной. Этот способ в настоящее время привел к появлению комбинированных вакцин, содержащих до 7 различных антигенов; например, Nobilis™ Cor4+IB+ND+EDS (MSD Animal Health).
Поскольку вакцины, основанные на рекомбинантном npMDV в качестве вирусного вектора, также требуют введения посредством индивидуальной инъекции, применение комбинаций в этом случае является предпочтительным. Возможность получения одновременной защиты от нескольких различных заболеваний (в дополнение к защите от MDV благодаря вектору NPMDV) является огромным преимуществом. Таким образом, многие группы исследовали комбинированную экспрессию и доставку более чем одного гетерологичного антигена посредством вакцинации вектором npMDV.
Самый простой подход заключался в комбинировании известных рекомбинантных векторных вакцин npMDV, каждая из которых содержит одну гетерологичную вставку. Однако ранее было показано, что этот подход не является эффективным, поэтому в информации о продукте в случае рекомбинантных вакцин HVT содержится рекомендация не комбинировать их с другими (чистыми) рекомбинантами HVT.
Возможно, вследствие отбора в организме вакцинированного животного один из рекомбинантных штаммов npMDV был способен приобретать преимущество по сравнению с другим. В результате только один рекомбинантный штамм оказывался способен к эффективной репликации, и иммунная защита вырабатывалась только против одного из существующих патогенов.
Альтернативный подход заключался в конструировании вектора npMDV, который содержит множество гетерологичных вставок в одном рекомбинантном геноме. Этот подход изучали после того, как были получены первые рекомбинантные конструкты npMDV (WO 87/044630), и было описано несколько мультивалентных комбинаций вставок в HVT, например: в WO 93/25665, "двухвалентные вакцины" из Примера 11, конструкты HVT-007, HVT-048 и HVT-096; аналогично, в WO 96/05291, "двухвалентные вакцины" из Примеров 11-14, и даже "тривалентные вакцины" из Примеров 16-17. То же самое относится и к рекомбинантам HVT, как описано в EP 719864.
Хотя большинство этих конструктов пока находятся на стадии разработки, некоторые из описанных векторов с множественными вставками уже были изолированы; некоторые прошли тестирования на курицах SPF (свободных от специфической патогенной микрофлоры).
Однако для большинства этих мультивалентных экспрессирующих конструкций не было опубликовано никаких результатов, касающихся изучения генетической стабильности этих конструктов или динамики экспрессии гетерологичных вставок in vitro или in vivo.
Фактически, из всех известных на сегодня публикаций единственный рекомбинант npMDV с множественными вставками, который был тщательно изучен и характеризуется подтвержденной безопасностью, стабильностью и эффективностью в качестве вакцины, представляет собой конструкт, содержащий гены gD и gl вируса инфекционного ларинготрахеита (ILTV), который коммерчески доступен под названием Innovax™-ILT (MSD Animal Health).
Однако даже в этом случае гетерологичные вставки предоставляют только мононвалентную защиту от одного патогена домашних птиц, а именно ILTV. Это связано с тем, что гены ILTV gD/gl в природе перекрываются и для предоставления достаточной иммунизации против ILTV должны экспрессироваться комбинированно. Таким образом, применение множественных вставок не является необходимым для расширения диапазона иммунизации.
Таким образом, до сегодняшнего дня, несмотря на огромные потенциальные преимущества и множество предпринятых попыток, не известно публикаций, описывающих безопасную, стабильную и эффективную рекомбинантную векторную вакцину npMDV, которая обеспечивала бы экспрессию более чем одного гетерологичного гена, каждый из которых был бы получен от разных микроорганизмов, и таким образом позволяла бы получить мультивалентный иммунный ответ (в дополнение к защите от MDV) посредством вакцинации единой рекомбинантной векторной вакциной npMDV.
Целью настоящего изобретения является выполнение данной необходимости и предоставление первой безопасной и стабильной рекомбинантной векторной вакцины npMDV, которая обеспечивает эффективную иммунизацию домашних птиц против более чем одного патогена домашних птиц (в дополнение к защите от MDV).
Неожиданно было обнаружено, что эту задачу выполняет рекомбинантный npMDV по изобретению, который предоставляет экспрессию гетерологичных иммунопротекторных антигенов из более чем одного патогена домашних птиц.
Таким образом, изобретение относится к рекомбинантному непатогенному вирусу болезни Марека (npMDV), содержащему гетерологичную молекулу нуклеиновой кислоты, который характеризуется тем, что указанная гетерологичная молекула нуклеиновой кислоты содержит в направлении от 5′-конца к 3′-концу в следующем порядке:
a. коровый промотор предраннего гена 1 цитомегаловируса человека (hCMV-IE1),
b. ген белка слияния (F) вируса болезни Ньюкасла (NDV),
c. терминатор транскрипции,
d. коровый промотор гена бета-актина курицы,
e. ген вирусного белка 2 (VP2) вируса инфекционного бурсита классического типа (IBDV).
Задача вызывала некоторые затруднений, как обнаружили авторы изобретения в ходе экспериментов, поскольку многие рекомбинантные npMDV, описанные на современном уровне техники для бивалентных и тривалентных конструктов, экспрессирующих, помимо прочего, ген белка F NDV или ген VP2 IBDV, имели серьезные недостатки; они либо вовсе не были способны к репликации, либо могли реплицироваться только в течение ограниченного количества циклов, либо не демонстрировали экспрессии гетерологичных вставок in vitro, и только некоторые из них были эффективны in vivo или предоставляли достаточную иммунную защиту. Генетическая стабильность в большинстве случаев была невысокой. Таким образом, большинство из них были неподходящими для получения эффективных вакцин, основанных на рекомбинантных npMDV.
Аналогично, рекомбинантный npMDV, полученный на основе комбинации известных экспрессирующих кассет с генами белка F или VP2, также был неэффективным; он не давал потомства и не демонстрировал экспрессию, или экспрессия быстро прекращалась вследствие нестабильности, что приводило к появлению "ускользнувших" мутантов (см. Пример 1 и фиг. 1).
Для преодоления этих проблем было необходимо делать неочевидный выборы и проводить отбор и модификации, выходящие за рамки рутинной практики, с целью получения рекомбинантного npMDV для экспрессии как белка F NDV, так и белка VP2 IBDV, который демонстрирует желаемую генетическую стабильность, способность к репликации вирусного вектора и стабильную экспрессию гетерологичных генов.
Авторы изобретения обнаружили, что применение слишком сильных промоторов вызывает нестабильность мультивалентной экспрессирующей кассеты полученного вектора npMDV, в то время как слишком слабые промоторы не способны обеспечивать достаточную экспрессию и иммунную защиту. Не связываясь с конкретной теорией, авторы изобретения полагают, что основные признаки, позволяющие рекомбинантому npMDV проявлять эффективность, превышающую эффективность известных векторов, включают: отбор специфичных промоторов в сочетании модификациями, внесенными в эти промоторы для регуляции их силы, а также определенный порядок расположения гетерологичных генов, экспрессирующихся этими промоторами, в экспрессирующей кассете. Эта сложная и специфическая комбинация признаков позволяет получить рекомбинантный npMDV, содержащий мультивалентную экспрессирующую кассету с оптимальным балансом стабильности, способности к репликации и уровня экспрессии, благодаря чему этот рекомбинантный npMDV может преодолевать все биологические препятствия in vitro и in vivo и при этом оставаться эффективным для иммунизации животного.
В данном изобретении "рекомбинант" представляет собой молекулу нуклеиновой кислоты или микроорганизм, генетический материал которого был модифицирован с получением генетической конструкции, которую он исходно не содержал.
В данном изобретении "npMDV" представляет собой вирус из семейства вирусов MDV, который не обладает или обладает невысокой патогенностью для домашних птиц. Предпочтительно npMDV представляют собой природные вирусы или вирусы, аттенуированные посредством пассирования, например, для применения в качестве вакцин. В более предпочтительном варианте осуществления npMDV представляют собой вирусы MDV2 или HVT. В зависимости от цели предпочтительным может быть любой из этих вирусов, поскольку они обладают разными преимуществами: MDV2 в природе распространяется более активно, чем HVT, поэтому, когда необходимо быстрое распространение рекомбинантного npMDV по изобретению, предпочтительным родительским вирусом является MDV2, более предпочтительно штамм SB1. С другой стороны, когда наиболее важна безопасность рекомбинантного npMDV по изобретению, предпочтительным родительским вирусом является HVT, более предпочтительно штаммы PB1 или FC-126.
Даже в более предпочтительном варианте осуществления применяют комбинацию рекомбинантного npMDV по изобретению, в которой родительские вирусы для рекомбинантного вектора относятся к разным типам, например, MDV2 и HVT. Преимущество этого варианта осуществления заключается в возможности значительного увеличения количества иммуногенных белков, присутствующих и экспрессирующихся в животном. Каждый вектор может содержать ряд гетерологичных генов, количество которых не должно превышать определенного максимума, по достижении которого ухудшается стабильность, репликация вируса и экспрессия. Таким образом, комбинация векторов может предоставлять больше гетерологичных генов, чем вектор одного типа. Такая комбинация векторов различных типов, таким образом, позволяет преодолевать проблему, наблюдающуюся на известном уровне техники, при которой введение более чем одного вектора одного типа приводит к тому, что преимущество получает один из них, в результате чего иммунизация достигается только в отношении антигенов одного из векторов. Благодаря комбинированию векторов npMDV по изобретению, относящихся к различным типам, такому как комбинирование основанных на MDV2 и HVT векторов, ни один из векторов не получает преимущества по сравнению с другими векторами.
Как применяют в настоящем документе, термин "содержащий" (а также его вариации, такие как "содержит", "содержат" и "содержал") относится ко всем элементам во всех возможных комбинациях, применяемых для изобретения, которые охвачены или включены в раздел текста, абзац, пункт формулы изобретения и т.д., в которых применяется такой термин, даже если такие элементы или комбинации не перечисляются открытым текстом; и не подразумевает исключения любого из таких элементов или комбинаций.
Таким образом, любой такой раздел текста, абзац, пункт формулы изобретения и т.д. может, таким образом, также относиться к одному или нескольким вариантам осуществления, где термин "содержащий" (или его варианты) заменен на такие термины как "состоит из", "состоящий из" или "состоит в основном из".
Ген является "гетерологичным" по отношению к npMDV, в котором он содержится, если этот ген не присутствовал в родительском npMDV, который использовали для получения рекомбинантного вектора npMDV по изобретению.
Термин "ген" применяют для обозначения нуклеиновой кислоты, способной кодировать белок. Ген по изобретению предпочтительно кодирует полный белок, но также может кодировать участок белка, например, кодировать только зрелую форму белка, т.е. белок без "лидерной последовательности", "трансмембранной последовательности" или "сигнальной последовательности". Ген может даже кодировать определенный участок белка, такой как участок, содержащий иммунопротективный эпитоп.
В этом отношении "белок" по изобретению представляет собой молекулярную цепь аминокислот. Белок может быть нативным или зрелым белком, белком-предшественником или пропротеином или функциональным фрагментом белка. В числе прочего, пептиды, олигопептиды и полипептиды также включены в определение белка.
По изобретению, "содержащий гетерологичную молекулу нуклеиновой кислоты" относится к вставке гетерологичной молекулы нуклеиновой кислоты в геном npMDV. Встраивание можно вводить посредством любого доступного способа при условии, что полученный рекомбинантный npMDV способен демонстрировать желаемую безопасность, стабильность и эффективную экспрессию антигенов.
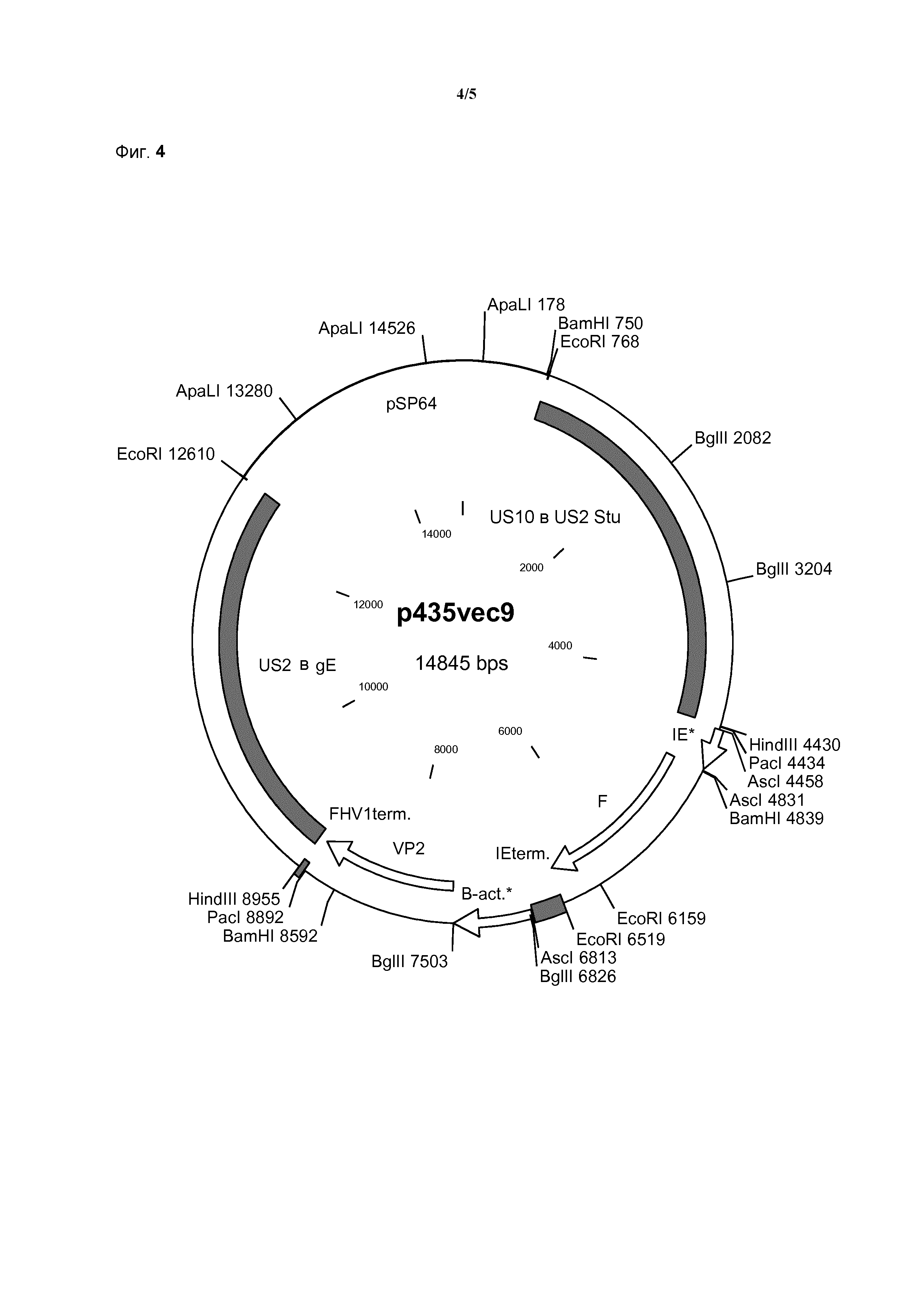
Предпочтительные способы введения вставки представляют собой космидную регенерацию, например, как описано в WO 93/25665, или способ с применением бакмид, как описано в EP 996738. Эти способы обязательно включают применение набора крупных перекрывающихся субгеномных фрагментов генома npMDV для реконструкции полного генома npMDV при трансфекции в клетки-хозяева. Поскольку одна из космид содержит экспрессирующую кассету, она стабильно встраивается в геном (впоследствии рекомбинантного) npMDV.
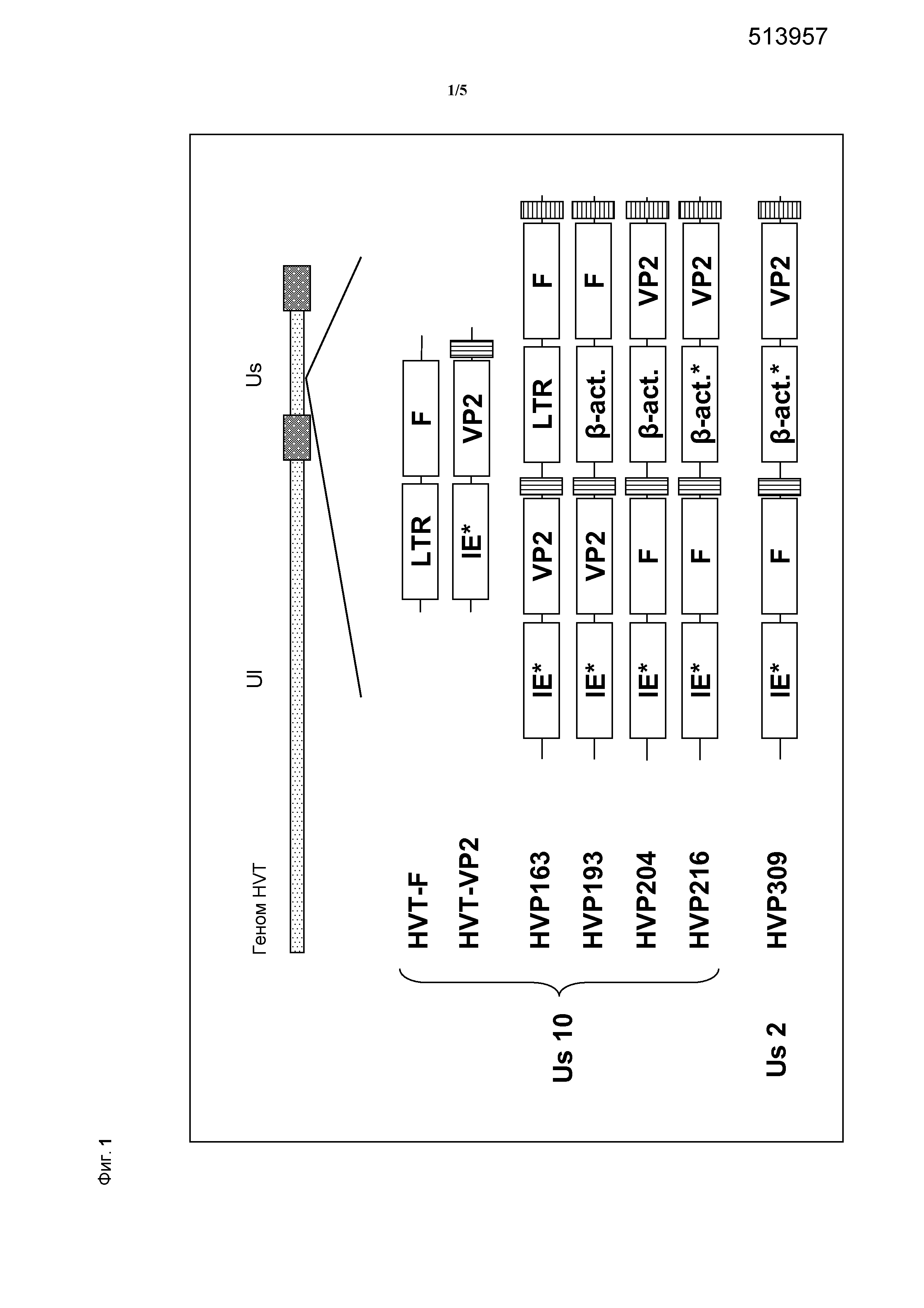
Схема трансфекции нуклеиновой кислоты по изобретению в геном HVT посредством космидной регенерации показана на фиг. 3.
Термин "в направлении от 5′-конца к 3′-концу", также известный как "в нижележащем направлении", хорошо известен в данной области.
Вместе с термином "в следующем порядке" он указывает на порядок, в котором перечисленные элементы должны располагаться относительно друг друга, и, в отношении ген-экспрессирующих механизмов клетка-хозяина, на порядок, в котором рекомбинантный npMDV по изобретению реплицируется и экспрессируется. Как должно быть ясно специалистам в данной области, этот порядок относится той цепи ДНК двухцепочечного ДНК-генома npMDV, которая является "кодирующей цепью", и относится к закодированной молекуле мРНК, которая находится в "нетранскрибируемой" ориентации.
Однако, не отрицая смысл предыдущего абзаца: в комплементарной цепи двойной спирали ДНК, которая является "матричной" цепью, относительный порядок перечисленных элементов остается таким же, но ориентация цепи ДНК меняется на 3′-5′.
Дополнительно, как должно быть ясно специалистам в данной области, поскольку экспрессирующая кассета представляет собой изолированный экспрессирующий модуль, ориентация всей экспрессирующей кассеты по изобретению относительно генома npMDV не является критичной. Это означает, что молекулу нуклеиновой кислоты в целом можно встраивать в геном npMDV в любой из двух ориентаций. Например, когда молекулу нуклеиновой кислоты по изобретению встраивают в регион Us генома npMDV, она может быть ориентирована как считывающаяся по направлению к TR или как считаывающаяся по направлению к IR. На фиг. 1 в связи с этим представлена только одна из двух возможных ориентаций.
"Промотор" по изобретению представляет собой функциональный участок генома организма, который направляет транскрипцию нижележащей кодирующей области. Промотор, таким образом, представляет собой участок нуклеиновой кислоты, как правило, ДНК, который расположен выше открытой рамки считывания, как правило, гена.
Промотор инициирует синтез мРНК гена или кодирующей области, которую он контролирует, начиная с "сайта начала транскрипции" (TSS). Полученная мРНК, в свою очередь, транслируется в белок, начиная со стартового кодона гена, который представляет собой первую последовательность ATG в открытой рамке считывания (первая последовательность AUG в мРНК). Как правило, TSS находится в области 30-40 нуклеотидов выше стартового кодона. TSS можно идентифицировать посредством секвенирования 5'-конца мРНК гена, например, посредством RACE.
В основном промоторы находятся в пределах 1000 нуклеотидов выше нуклеотида A стартового кодона, который, как правило, обозначают как A+1, и большинство промоторов находятся между -500 и A+1.
Как правило, промоторы содержат ряд распознаваемых регуляторных областей, таких как энхансерный участок, который участвует в регуляции времени, продолжительности, условий и уровня транскрипции. Центральный участок промотора участвует в связывании факторов транскрипции и направлении РНК-полимеразы. Он, как правило, содержит ряд консервативных последовательностей, таких как TATA-бокс, CAAT-бокс и GC-бокс.
Название промотора, как правило, основано на названии гена, экспрессию которого он контролирует. Например, термин "промотор гена hCMV-IE1" относится к промотору, который в природе контролирует экспрессию гена IE1 hCMV и находится непосредственно выше этого гена. Поскольку ген IE1 является хорошо изученным и хорошо распознаваемым генов, а также поскольку были секвенированы геномы многих вирусов Herpesvirideae (целиком или частично), такой промотор можно легко идентифицировать посредством известных способов. Например, промотор можно отбирать посредством простого субклонирования участка между двумя соседними генами, например, от поли-A-последовательности лежащего выше гена до TSS лежащего ниже гена. Затем промотор идентифицируют посредством применения стандартных тестов: экспрессия маркерного гена субклонированными небольшими или крупными участками предполагаемого промотора.
Таким образом, промотор гена "hCMV-IE1" хорошо известен в данной области, и его можно легко получать из ряда коммерческих источников, таких как поставщики коммерческих плазмид для клонирования и экспрессии. Ген IE1 также называют главным геном IE. Как правило, этот промотор гена hCMV-IE1 имеет длину приблизительно 1,5 т.п.н. и состоит из энхансера, промотора и интрона, где активность промотора затрагивает интрон. Детальное исследование энхансер-промоторного участка hCMV-IE1 описано в Koedood et al. (1995, J. of Virol., vol. 69, p. 2194-2207). Промотор гена hCMV-IE1 можно, например, получать из плазмиды pl17, как описано в Cox et al. (2002, Scand. J. Immunol., vol. 55, p. 14-23), или из экспрессирующих векторов млекопитающих, таких как pCMV (Clontech) или pCMV-MCS (Stratagene; номер доступа в Genbank™ AF369966). Альтернативно, промотор можно получать из генома вируса hCMV вирус, из региона, предшествующего гену IE1, с применением обычных способов молекулярной биологии.
Для данного изобретения известный промотор гена hCMV-IE1 оказался неэффективным, поскольку он не обладал желаемой силой и стабильностью в векторе npMDV и в экспрессирующей кассете, в составе которой экспрессировался другой гетерологичный ген. Неожиданно было показано, что посредством применения определенного центрального участка промотора гена hCMV-IE1, "корового" промотора (элемент a.), были получены желаемые характеристики. В конкретном варианте осуществления длина этого корового промотора составляет всего приблизительно 361 п.н., и он представлен в SEQ ID NO:1.
Однако для корового промотора гена hCMV-IE1 известны многие варианты, демонстрирующие высокое сходство; например, поиск в NCBI′s Genbank™ с применением выравнивания Blast с SEQ ID NO:1 в качестве запроса выдает около 60 сходных промоторных последовательностей, идентичность которых находится в пределах 95%. Эти гомологи и варианты промотора hCMV-IE1 в равной степени пригодны в изобретении с учетом применения такого же корового участка этого промотора.
Таким образом, в предпочтительном варианте осуществления коровый промотор гена hCMV-IE1 по изобретению представляет собой молекулу нуклеиновой кислоты длиной приблизительно 361 пар оснований, содержащую нуклеотидную последовательность, по меньшей мере, на 95% идентичную полноразмерной нуклеотидной последовательности в SEQ ID NO:1. Более предпочтительна идентичность нуклеотидной последовательности, составляющая, по меньшей мере, 96, 97, 98, 99 или даже 100%, в указанном порядке предпочтительности.
Как известно специалистам в данной области, могут возникать некоторые вариации длины корового промотора гена hCMV-IE1, а также других элементов, которые составляют гетерологичную молекулу нуклеиновой кислоты, встроенную в рекомбинантный npMDV по изобретению. Это может происходить вследствие различий в конкретных условиях, при которых проводят клонирование и конструирование; например, вследствие применения различных участков распознавания рестрикционных ферментов, праймеров для ПЦР или различных условий для модификации концов молекул, подвергающихся клонированию. Таким образом, могут возникать некоторые вариации длины составных элементов.
Таким образом, по изобретению "приблизительно 361" представляет собой: 361±25%, предпочтительно ±20, 15, 12, 10, 8, 6, 5, 4, 3, 2, 1 или даже 0%, в указанном порядке предпочтительности.
Это, однако, верно при условии, что такие изменения длины не влияют на стабильность и эффективность полной встроенной гетерологичной молекулы нуклеиновой кислоты, и в таком случае изменения длины являются несущественными и должны рассматривать как часть изобретения.
Промотор для экспрессии гетерологичного гена в (вирусном) векторе должен быть способен эффективно контролировать транскрипцию нижележащей кодирующей области. Эту способность, как правило, обозначают как свойство промотора быть "функционально связанным" с геном или: ген находится "под контролем" промотора. Это, как правило, означает, что в составе экспрессирующей кассеты промотор и ген связаны с одной и той же ДНК, находятся в эффективной близости и не содержат сигналов или последовательностей между ними, которые бы мешали эффективной транскрипции и трансляции.
Таким образом, в предпочтительном варианте осуществления коровый промотор гена hCMV-IE1 по изобретению является "функционально связанным" с нижележащим геном белка F NDV.
"Ген белка F NDV" по изобретению (элемент b.) кодирует слитый белок вируса NDV. Такие гены хорошо известны, и их последовательности широко доступны на современном уровне техники благодаря ряду общедоступных плазмидных конструкций. Альтернативно, их можно получать из изолированного природного NDV с применением общеизвестных способов работы с РНК-вирусами. Вирус NDV можно легко идентифицировать с применением серологии или молекулярной биологии.
Ген белка F, применяемый по изобретению, был получен из NDV Clone 30, обычного лентогенного вакцинного штамма NDV; последовательность гена представлена в SEQ ID NO:2. Для изобретения можно применять также гомологи и варианты гена белка F, полученные из лентогенных, мезогенных или велогенных NDV, поскольку последовательность гена белка F является в этих разных патогенах NDV высоко консервативной.
Таким образом, ген белка F NDV по изобретению предпочтительно представляет собой молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, по меньшей мере, на 90% идентичную полноразмерной нуклеотидной последовательности, представленной в SEQ ID NO:2. Более предпочтительна идентичность нуклеотидной последовательности, составляющая, по меньшей мере, 92, 94, 95, 96, 97, 98, 99 или даже 100%, в указанном порядке предпочтительности.
Альтернативно, для дополнительного повышения иммунной эффективности гетерологичного белка, экспрессирующегося с молекулой нуклеиновой кислоты по изобретению, гетерологичный ген можно подвергать оптимизации кодонов. Способ оптимизации кодонов хорошо известен в данной области и включает адаптацию нуклеотидной последовательности, кодирующей белок, с тем, чтобы она кодировала те же аминокислоты, что и исходная кодирующая последовательность, только с другими нуклеотидами; т.е. мутации должны быть "молчащими". Этот способ может повышать уровень экспрессии кодирующей последовательности в биологических условиях, отличных от природных условий для экспрессирующегося гена.
Авторы изобретения показали, что для достижения желаемой стабильности репликации и эффективности экспрессии необходимо специально разделять транскрипцию двух гетерологичных генов в молекуле нуклеиновой кислоты по изобретению, таким образом, получая две отдельных мРНК. Таким образом, необходимо введение терминатора транскрипции между двумя кодирующими областями, ниже гена белка F NDV и выше корового промотора Ch β-актина.
"Терминатор транскрипции" (элемент c.) представляет собой регуляторный участок нуклеиновой кислоты, который вызывает терминацию транскрипции кодирующей последовательности ДНК РНК-полимеразой.
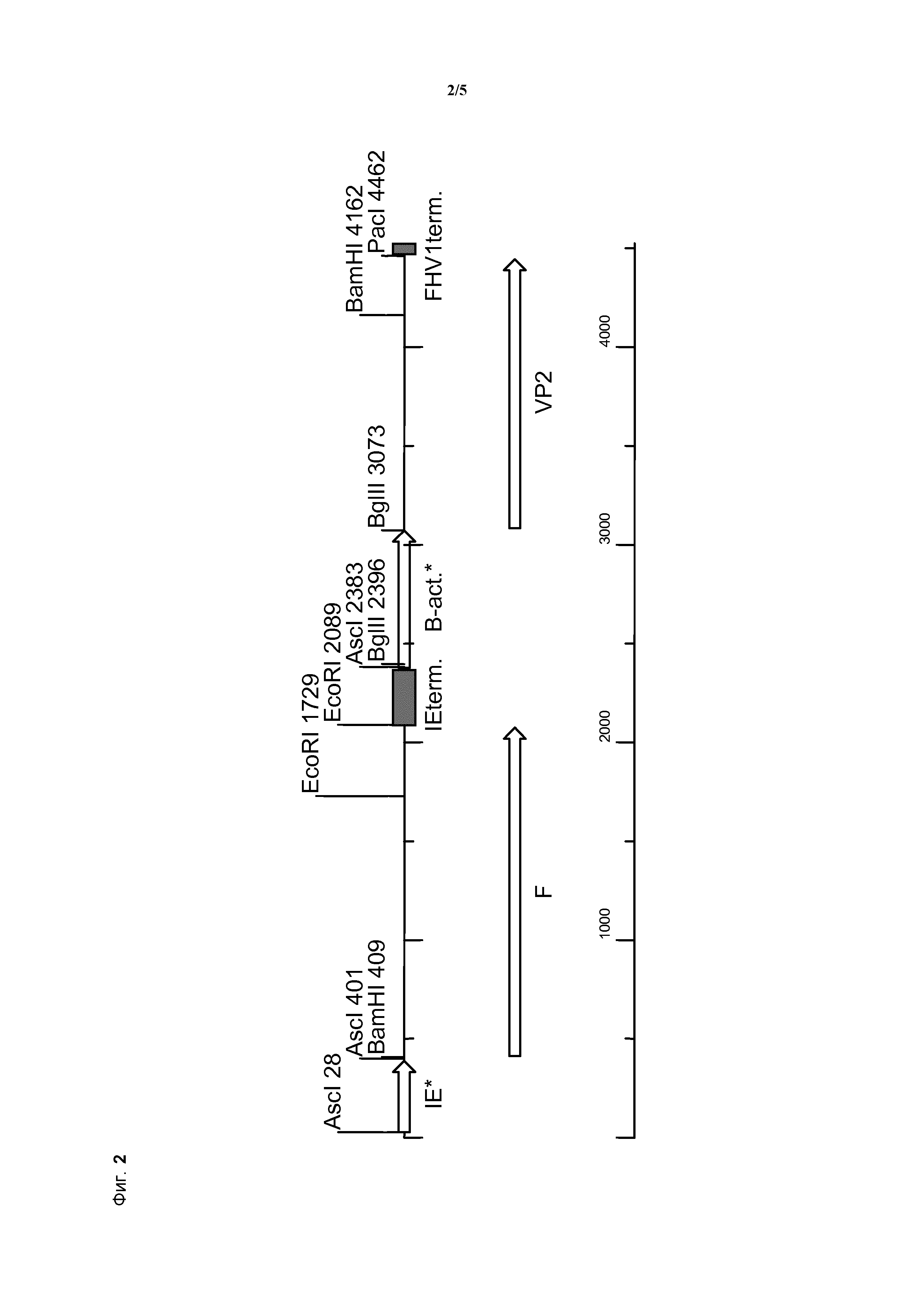
Как правило, "внутренняя терминация" вызывается структурой "стебель-петля" в синтезируемой мРНК, которая состоит из G-C-богатой последовательности и U-богатой последовательности. Большинство генов содержат терминатор транскрипции на конце кодирующей последовательности, и в рамках изобретения тип применяемого терминатора не важен, если достигается эффективная терминация транскрипции лежащего выше гена белка F и предотвращается "сквозная" транскрипция по направлению к кодирующей области VP2. Пример подходящего терминатора транскрипции, который можно использовать по изобретению, представляет собой терминатор транскрипции гена hCMV-IE1, представленный в SEQ ID NO: 3.
"Промотор гена бета-актина курицы" (промотор гена Ch β-актина) хорошо известен на современном уровне техники, и этот промотор применяют во многих плазмидах и коммерческих экспрессирующих векторах. Впервые он был описан Kost et al. (1983, Nucl. Acids Res., vol. 11, p. 8287-8301), см. номер доступа Genbank: X00182. Затем были получены многочисленные варианты, такие как гибридный промотор (Tsukamoto et al., 2002, J. of Virol., vol. 76, p. 5637-5645). В EP 351585 авторы изобретения модифицировали промотор гена Ch β-актина с получением промотора, эффективность которого была в 10 раз выше, посредством замены акцепторного сайта сплайсинга: исходный акцепторный сайт сплайсинга, который находится в позиции -7 промотора гена Ch β-актина, был заменен на акцепторный сайт сплайсинга из третьего интрона гена глобина кролика; полученный модифицированный промотор гена Ch β-актина представлен под номером доступа Genbank E03011 и входит в состав плазмиды, представленной под номером доступа Genbank AJ575208.
Для настоящего изобретения тестировали этот модифицированный промотор гена Ch β-актина, однако он оказался неэффективным; требовалась значительная дополнительная модификация для предоставления желаемого соотношения силы и стабильности для применения в составе мультивалентного экспрессирующего вектора npMDV. Этого удалось достичь посредством удаления большой части интрона этого промотора гена Ch β-актина. Полученный модифицированный промотор, содержащий только коровый участок этого промотора, представляет собой коровый промотор гена Ch β-актина (элемент d.), который составляет приблизительно 696 п.н. в длину и представлен в SEQ ID NO: 4.
Однако, аналогично ситуации с модифицированным коровым промотором гена hCMV-IE1, описанным выше, известны многочисленные очень сходные версии корового промотора гена Ch β-актина. Такие гомологи и варианты корового промотора гена Ch β-актина в равной степени пригодны для применения по изобретению, если применяются одинаковые коровые участки этого промотора.
Таким образом, в предпочтительном варианте осуществления коровый промотор гена Ch β-актина по изобретению представляет собой молекулу нуклеиновой кислоты длиной приблизительно 696 пар оснований, содержащую нуклеотидную последовательность, по меньшей мере, на 95% идентичную полноразмерной нуклеотидной последовательности, представленной в SEQ ID NO: 4. Более предпочтительна идентичность нуклеотидной последовательности, составляющая, по меньшей мере, 96, 97, 98, 99 или даже 100%, в указанном порядке предпочтительности.
Как указано выше, различия в длине не влияют на стабильность и эффективность полной молекулы нуклеиновой кислоты по изобретению и рассматриваются как часть изобретения. Таким образом, по изобретению "приблизительно 696" представляет собой: 696±25%, предпочтительно ±20, 15, 12, 10, 8, 6, 5, 4, 3, 2, 1 или даже 0%, в указанном порядке предпочтительности.
Коровый промотор гена Ch β-актина по изобретению должен быть "функционально связанным" с нижележащим геном VP2 IBDV классического типа.
"Ген VP2 IBDV классического типа" по изобретению (элемент e.) кодирует белок VP2 белок вируса IBDV классического типа. Такие гены хорошо известны, и их последовательности доступны на современном уровне техники, см., например, номера доступа Genbank: D00869 (F52/70), D00499 (STC) или AF499929 (D78).
Альтернативно, указанный ген можно получать из генома классического природного изолированного IBDV с применением способов манипуляции с бирнавирусами. IBDV классического типа можно легко идентифицировать с применением серологии или молекулярной биологии.
Ген VP2, применяемый по изобретению, был получен из штамма классического IBDV Faragher 52/70; последовательность гена представлена в SEQ ID NO:5. Гомологи и варианты гена VP2 в равной степени пригодны для применения по изобретению, если они относятся к классическому серотипу.
Поскольку нуклеотидные последовательности таких генов белка VP2 обычно идентичны более чем на 90%, классический ген VP2 IBDV по изобретению предпочтительно представляет собой молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, по меньшей мере, на 90% идентичную полноразмерной нуклеотидной последовательности, представленной в SEQ ID NO:5. Более предпочтительной является идентичной нуклеотидной последовательностей, составляющая, по меньшей мере, 92, 94, 95, 96, 97, 98, 99 или даже 100%, в указанном порядке предпочтительности.
Рекомбинантный npMDV по изобретению можно получать посредством общепринятых способов, в основном посредством амплификации в культурах in vitro эмбриональных клеток курицы, как правило, эмбриональных фибробластов курицы (CEF). Их можно получать посредством трипсинизации эмбрионов курицы. CEF высевают на чашку Петри с формированием монослоев и инфицируют npMDV. Этот способ можно расширять до индустриального производства.
Как правило, инфицированные клетки-хозяева собирают в интактной форме для получения рекомбинантного npMDV в связанной с клетками форме. Эти клетки помещают в подходящий носитель для стабилизации при хранении и замораживании. Затем инфицированные клетки, как правило, помещают в стеклянные ампулы, которые закрывают, замораживают и хранят в жидком азоте. В таком виде их можно доставлять пользователям по всему миру в рамках так называемой системы "холодильной цепи".
В ситуациях, когда систему "холодильной цепи" невозможно реализовать, а npMDV по изобретению представляет собой рекомбинантный HVT, альтернативный способ заключается в применении лиофилизации. В этом способе применяется благоприятное свойство HVT, которое заключается в том, что его можно изолировать из его клетки-хозяина, например, посредством разрушения клеточной взвеси ультразвуком, поместить в стабилизатор и лиофилизировать для стабильного хранения.
В предпочтительном варианте осуществления рекомбинантного npMDV по изобретению в экспрессирующей кассете содержится дополнительный генетический элемент: дополнительный терминатор транскрипции (элемент f.) находится ниже классического гена VP2 IBDV в нуклеиновой кислоте по изобретению. Он служит для обеспечения терминации транскрипции гена VP2, независимой от композиции участка генома npMDV, который фланкирует 3′-конец экспрессирующей кассеты.
Терминатор транскрипции, находящийся ниже VP2 (элемент f.) может отличаться или не отличаться от терминатора, находящегося ниже гена белка F (элемент a), при условии, что обеспечивается должная терминация транскрипции и не ухудшается стабильность и экспрессия.
В дополнительном предпочтительном варианте осуществления терминатор транскрипции на 3′-конце классического гена VP2 IBDV в составе нуклеиновой кислоты по изобретению (элемент f.) получен из вируса герпеса 1 кошек (FHV1), из участка соединения FHV1 Us/TR, находящегося ниже FHV1 Us9. Он представлен, например, под номером доступа Genbank: D421 13, а последовательность, применяемая для одного из вариантов осуществления изобретения, представлена в SEQ ID NO: 6.
В предпочтительном варианте осуществления рекомбинантный npMDV по изобретению содержит нуклеотидную последовательность, представленную в SEQ ID NO: 7 и на фиг. 2.
Следует отметить, что последовательность, представленная в SEQ ID NO:7, представляет собой настоящую нуклеотидную последовательность, которую определяли для экспрессирующей кассеты из рекомбинантного конструкта npMDV HVP309, амплифицированного для 6 пассажей культуры клеток из бляшки, отобранной после трансфекции.
Таким образом, в дополнительном аспекте изобретение относится к молекуле нуклеиновой кислоты для применения в получении рекомбинантного npMDV по изобретению, где указанная молекула нуклеиновой кислоты содержит в направлении от 5′-конца к 3′-концу в указанном порядке:
a. коровый промотор hCMV-IE1,
b. ген белка F NDV,
c. терминатор транскрипции,
d. коровый промотор гена бета-актина курицы,
e. ген VP2 IBDV классического типа,
f. терминатор транскрипции.
Молекула нуклеиновой кислоты по изобретению представляет собой экспрессирующую кассету по изобретению.
В предпочтительном варианте осуществления молекула нуклеиновой кислоты по изобретению имеет нуклеотидную последовательность, представленную в SEQ ID NO: 7.
Получение, конструирование и сборку рекомбинантного npMDV, молекулы нуклеиновой кислоты и рекомбинантной молекулы ДНК по изобретению можно проводить посредством хорошо известных способов молекулярной биологии, которые включают клонирование, трансфекцию, рекомбинацию, отбор и амплификацию.
Эти и другие способы молекулярной биологии очень подробно описаны в стандартных руководствах, таких как Sambrook & Russell: "Molecular cloning: a laboratory manual" (2001, Cold Spring Harbour Laboratory Press; ISBN: 0879695773); Ausubel et al., in: Current Protocols in Molecular Biology (J. Wiley and Sons Inc, NY, 2003, ISBN: 047150338X); C. Dieffenbach & G. Dveksler: "PCR primers: a laboratory manual" (CSHL Press, ISBN 0879696540); и "PCR protocols", J. Bartlett and D. Stirling (Humana press, ISBN: 0896036421).
Для удобного конструирования молекулы нуклеиновой кислоты по изобретению и для ее применения с целью получения рекомбинантного npMDV по изобретению указанная нуклеиновая кислота может входить в состав более крупной молекулы нуклеиновой кислоты.
Таким образом, в дополнительном аспекте изобретение относится к рекомбинантной молекуле ДНК, содержащей молекулу нуклеиновой кислоты по изобретению.
Предпочтительно такая рекомбинантная молекула ДНК по изобретению представляет собой обычную клонирующую плазмиду, например, такую как полученная из pBR322 или pUC. Эти плазмиды являются коммерчески доступными.
Когда рекомбинантную молекулу ДНК по изобретению готовят для применения в трансфекции, ее обычно обозначают как "трансфер-вектор", "челночный вектор" или "донорная плазмида". В этой ситуации молекула нуклеиновой кислоты по изобретению может быть с обеих сторон фланкирована последовательностями, полученным из генома npMDV. Они позволяют проводить гомологичную рекомбинацию и помещать вставку (в желаемой ориентации) в нужный участок вставки в геноме npMDV.
Альтернативно, рекомбинантная молекула ДНК по изобретению может представлять собой космиду для применения в космидной регенерации.
Как правило, трансфер-вектор, который применяют для трансфекции, сам не интегрируется в геном живого рекомбинантного микроорганизма-носителя; он только облегчает интеграцию экспрессирующей кассеты, которую он содержит.
Пример рекомбинантной молекулы ДНК по изобретению, применяемой в качестве трансфер-вектора по изобретению, представляет собой плазмиду p435vec9, представленную на фиг. 4.
Рекомбинантный npMDV по изобретению содержит молекулу нуклеиновой кислоты по изобретению в уникальном генетическом сайте встраивания. Для npMDV известны многочисленные сайты встраивания, и теоретически все они являются пригодными для использования по изобретению, если встроенная мультивалентная экспрессирующая кассета способна продемонстрировать стабильность и эффективность. Для практических целей предпочтительно применение определенных сайтов, например, в связи с доступностью определенных инструментов молекулярной биологии для конструкции и анализа. В связи с этим в настоящем изобретении предпочтительно применение генетического сайта встраивания, находящегося в области Us генома npMDV.
Таким образом, в предпочтительном варианте осуществления рекомбинантного npMDV по изобретению гетерологичную молекулу нуклеиновой кислоты встраивают в геном рекомбинантного npMDV в области Us.
Особенно стабильные и эффективные рекомбинантные npMDV по изобретению можно получать посредством применения уникального генетического сайта встраивания по изобретению, гена Us2 или гена Us10 генома npMDV.
Таким образом, в предпочтительном варианте осуществления рекомбинантного npMDV по изобретению гетерологичную молекулу нуклеиновой кислоты встраивают в геном рекомбинантного npMDV в области гена Us2 или гена Us10.
Согласно изобретению, термины "в области гена Us2" и "в области гена Us10" указывают на то, что вставка встроена в участок генома npMDV, содержащий ген Us2 или Us10; это может относиться к промотору или к кодирующей области любого из этих генов. Кроме того, нетто-эффект встраивания может выражаться во вставке, делеции или нейтральной замене, как описано. Ожидаемое следствие такого встраивания заключается в том, что нормальная кодирующая функция гена Us2 или Us10 в полученном рекомбинантном npMDV нарушается.
Рекомбинантный npMDV по изобретению представляет собой живой рекомбинантный микроорганизм-носитель, или "векторный" вирус, который успешно применяют для вакцинации домашних птиц. При таком способе применения он является безопасным, поскольку не вызывает негативных реакций от вакцинации, таких как какие-либо признаки заболевания или инфекции или ухудшение роста или развития вакцинированного животного, даже при применении в очень раннем возрасте. Кроме того, рекомбинантный npMDV проявляет стабильную репликацию как в культуре клеток (in vitro), так и в организме животного (in vivo). Также рекомбинантный npMDV демонстрирует интенсивную и стабильную экспрессию (как in vitro, так и in vivo) двух гетерологичных генов, входящих в его состав: гена белка F NDV и гена VP2 классического IBDV. Наконец, благодаря репликации и экспрессии в организме животного он обеспечивает эффективное представление экспрессирующегося гетерологичного гена иммунной системе животного. Это вызывает эффективный иммунный ответ, который защищает вакцинированное животное против инфекции и/или заболевания, вызванного NDV и IBDV. Кроме того, рекомбинантный npMDV обеспечивает иммунную защиту от MDV.
Свойство "стабильности" по изобретению означает, что генетическая конструкция рекомбинантного npMDV по изобретению не проявляет значительных изменений в последовательных циклах репликации вируса; на практике это означало бы утрату экспрессии одного или обоих встроенных гетерологичных генов. Проконтролировать это можно, например, посредством общепринятых способов, например, посредством последовательного пассирования рекомбинантного npMDV по изобретению в клеточной культуре и последующего пассирования в организме животного. Повторно изолированный вирус затем помещают на чашки для культивирования клеток, покрывают агаром и инкубируют до появления заметных бляшек; все это проводят посредством общепринятых способов. Затем бляшки окрашивают с применением подходящих составов антител для экспрессии белка F или VP2 в анализе иммунофлуоресценции (IFA). Записывают количество бляшек, которые больше не экспрессируют один или оба белка, причем анализу, например, посредством УФ-микроскопии следует подвергать, по меньшей мере, 100 отдельных бляшек.
Строгий тест стабильности включает проведение 15 последовательных пассажей культуры ткани и последующее вакцинирование животных для оценки оставшейся способности к экспрессии.
Как должно быть ясно специалистам в данной области, при таких условиях интенсивного пассирования нельзя гарантировать абсолютную (100%) стабильность, поскольку всегда может проявиться некоторое количество природных мутаций. Это не является признаком значительной нестабильности; фактически рекомбинантный векторный вирус, демонстрирующий генетическую стабильность выше 95%, теоретически является подходящим для получения вакцины и применения для животных, хотя в данном случае демонстрирует гораздо более высокая стабильность.
Неожиданно было показано, что рекомбинантные npMDV по изобретению в строгом тесте стабильности, описанном выше, сохраняли стабильную экспрессию обоих гетерологичных генов в более чем 95% повторно изолированных бляшках. Фактически в нескольких тестах только очень небольшой процент бляшек (от 0% до 0,3%) не экспрессировали один из гетерологичных генов (Пример 5). Кроме того, когда эти пассированные рекомбинантные npMDV тестировали на животных, они по-прежнему были способны обеспечивать эффективную иммунную защиту против инфекции как NDV, так и IBDV (Примеры 6 и 7).
Это является значительным достижением по сравнению с результатами, известными на современном уровне техники для рекомбинантных npMDV и неэффективных рекомбинантов, полученных и проанализированных в ходе экспериментов по изобретению (см. Пример 1). Такие неэффективные рекомбинантные npMDV после трансфекции обычно не образовывали бляшек, способных к амплификации в течение нескольких циклов, или демонстрировали только очень слабый уровень экспрессии гетерологичного белка, или утрачивали экспрессию через несколько циклов амплификации. Некоторые конструкции были способны к амплификации для тестирования на животных, однако не предоставляли иммунный ответ, поскольку большинство таких рекомбинантных npMDV после повторной изоляции утрачивали способность к экспрессии (одного из) гетерологичных генов.
Таким образом, в предпочтительном варианте осуществления рекомбинантный npMDV по изобретению характеризуется тем, что более 95% указанных рекомбинантных вирусов поддерживают экспрессию обоих гетерологичных белков после 15 последовательных пассажей в клеточной культуре.
В дополнительных предпочтительных вариантах осуществления более 96, 97, 98, 99, 99,5, 99,7, или 100% рекомбинантных вирусов поддерживают экспрессию обоих гетерологичных белков, в указанном порядке предпочтительности.
Посредством способов трансфекции, таких как космидная регенерация, как описано выше и рассмотрено в примерах далее в настоящем документе, молекулу нуклеиновой кислоты и/или рекомбинантную молекулу ДНК по изобретению можно использовать для получения рекомбинантного npMDV по изобретению, содержащего молекулу нуклеиновой кислоты по изобретению, стабильно интегрированную с уникальным генетическим сайтом встраивания геноме.
Таким образом, дополнительный аспект изобретения относится к способу получения рекомбинантного npMDV по изобретению, где указанный способ включает встраивание молекулы нуклеиновой кислоты по изобретению в уникальный генетический сайт встраивания в геноме npMDV.
Встраивание молекулы нуклеиновой кислоты по изобретению в геном npMDV с получением рекомбинантного npMDV по изобретению можно легко проводить посредством применения рекомбинантной молекулы ДНК по изобретению в качестве трансфер-вектора.
Хотя непосредственное встраивание полноразмерной молекулы нуклеиновой кислоты по изобретению в геном npMDV представляет собой предпочтительный способ получения рекомбинантного npMDV по изобретению, известны и другие способы получения такого рекомбинантного npMDV. Например, способ встраивания частей молекулы нуклеиновой кислоты по изобретению в npMDV посредством одного или нескольких циклов трансфекции. Эти части можно конструировать с тем, чтобы при их объединении полная вставка формировала целую экспрессирующую кассету по изобретению, например, посредством применения перекрывающихся участков для управления порядком и ориентацией отдельных частей.
Как описано, npMDV обычно амплифицируют в культурах эмбриональных клеток, и полученную вакцину npMDV можно поставлять в виде бесклеточного состава или (в случае применения HVT в качестве родительского вируса) хранить в лиофилизированной форме. Однако предпочтительно вакцину npMDV поставляют в клеточно-фиксированном составе, содержащем отобранные клетки CEF, инфицированные npMDV.
Аналогично, молекулы нуклеиновой кислоты и рекомбинантной ДНК по изобретению, представленные, например, в форме плазмид, обычно амплифицируют посредством встраивания их в бактериальные клетки, которые обеспечивают репликацию и амплификацию; космиды можно амплифицировать с применением фагов лямбда. Например, часто применяют специальные лабораторные штаммы бактерий Escherichia coli, доступные у коммерческих поставщиков. Для удобства их можно приобретать в форме компетентных клеток, готовых к встраиванию ДНК посредством общепринятых способов, таких как электропорация или тепловой шок.
Таким образом, в дополнительном аспекте изобретение относится к клетке-хозяину, содержащей рекомбинантный npMDV, молекулу нуклеиновой кислоты или рекомбинантную молекулу ДНК по изобретению.
"Клетка-хозяин" по изобретению предпочтительно представляет собой бактериальную клетку E.coli для применения с молекулой нуклеиновой кислоты или рекомбинантной ДНК по изобретению. Кроме того, клетка-хозяин по изобретению предпочтительно представляет собой CEF для применения с рекомбинантным npMDV по изобретению.
Как описано, эффективное применение рекомбинантного npMDV по изобретению представляет собой применение в составе вакцины для домашних птиц.
Таким образом, в дополнительном аспекте изобретение относится к вакцине для домашних птиц, содержащей рекомбинантный npMDV или клетку-хозяина по изобретению и фармацевтически приемлемый носитель.
"Вакцина" известна как композиция, содержащая иммунологически активное соединение в фармацевтически приемлемом носителе. "Иммунологически активное соединение", или "антиген" представляет собой молекулу, которая распознается иммунной системой организма-мишени и индуцирует иммунный ответ. Ответ может возникать со стороны врожденной или приобретенной иммунной системы и может быть клеточным или гуморальным.
Вакцина индуцирует иммунный ответ, который помогает предотвратить, улучшить, облегчить тяжесть или вылечить заболевание или нарушение, возникающее в результате инфицирования микроорганизмом. Защита достигается в результате введения, по меньшей мере, одного антигена, полученного из микроорганизма. Это приводит к тому, что животное-мишень демонстрирует снижение числа или интенсивности клинических проявлений, вызванных микроорганизмом. Такой эффект может быть результатом сокращения инвазии, колонизации или скорости распространения инфекции, вызванной микроорганизмом, что приводит к снижению числа или тяжести патологических изменений или эффектов, вызванных микроорганизмом или ответом на него организма-мишени.
Термин "домашние птицы" по изобретению относится к любым видам птиц, восприимчивых к вакцинации npMDV; предпочтительные виды-мишени включают курицу, индейку и утку; курицы являются самыми предпочтительными видами.
Птицы-мишени могут быть несушками, производителями, представителями комбинированных пород или представителями родительских линий любых из таких пород.
Возраст, масса тела, пол, иммунный статус и другие характеристики домашних птиц, подлежащих вакцинации, не очень важны, хотя ясно, что предпочтительно проводить вакцинацию здоровых птиц-мишеней и вакцинировать их как можно раньше для предотвращения (последствий) любых полевых инфекций.
Вакцину по изобретению предпочтительно применяют в клеточно-фиксированной форме, где клетки-хозяева, которые инфицируют таким рекомбинантным npMDV, вводят животному-мишени.
"Фармацевтически приемлемый носитель" предназначен для облегчения стабилизации и доставки вакцины без возникновения (тяжелых) неблагоприятных воздействий на здоровье животного-мишени, которому доставляют вакцину. Такой носитель может, например, представлять собой стерильную воду или стерильный физиологический раствор. В более сложном варианте носитель может, например, представлять собой буфер, который может содержать дополнительные добавки, такие как стабилизаторы или консерваторы. Детали и примеры описаны, например, в хорошо известных руководствах, таких как: "Remington: the science and practice of pharmacy" (2000, Lippincott, USA, ISBN: 683306472), и: "Veterinary vaccinology" (P. Pastoret et al. ed., 1997, Elsevier, Amsterdam, ISBN 0444819681).
Согласно настоящему изобретению, если вакцина представлена в клеточно-фиксированной форме, то носитель предпочтительно представляет собой смесь среды для культивирования с сывороткой (приблизительно 10%) и DMSO (приблизительно 6%). Сыворотка может представлять собой любую сыворотку, обычно применяемую для культивирования клеток, такую как эмбриональная телячья сыворотка или сыворотка новорожденных телят.
Вакцину по изобретению получают из живого рекомбинантного npMDV по изобретению посредством способов, описанных в настоящем документе, которые известны специалистам в данной области. Например, рекомбинантный npMDV по изобретению получают посредством трансфекции и рекомбинации, а желаемый рекомбинантный npMDV отбирают, как описано в настоящем документе. Затем рекомбинантные векторные вирусы npMDV получают в промышленных масштабах в меньших или больших объемах. Хотя возможно также получение в организме животных-хозяев, предпочтительной является пролиферация в культурах in vitro, например, в CEF. Из таких культур собирают суспензию, содержащую вирус, либо в виде цельных клеток, либо в виде сониката, после чего из этой суспензии получают вакцину и упаковывают конечный продукт. Поле проведения исчерпывающего тестирования на качество, количество и стерильность такие вакцины выпускают в продажу.
Общие способы и факторы, относящиеся к получению вакцин, хорошо известны в данной области и описаны, например, в правительственных постановлениях (Pharmacopoeia) и в руководствах, таких как: "Veterinary vaccinology" и: "Remington" (см. выше).
Вакцину по изобретению теоретически можно доставлять домашним птицам посредством различных способов и в различные моменты их жизни, с учетом того, что введенный рекомбинантный npMDV обеспечивает наличие защитной инфекции.
Однако, поскольку инфицирование MDV, NDV или IBDV можно проводить в очень раннем возрасте, предпочтительно применять вакцину по изобретению как можно раньше. Вакцину по изобретению предпочтительно применяют в первые сутки после вылупления ("сутки 1") или in ovo, например, на 18-е сутки ED. Подходящее оборудование для автоматизированного введения вакцины в яйца в промышленном масштабе является коммерчески доступным. Такой способ предоставляет защиту с самого раннего возможного возраста при минимизации затрат на оплату труда.
Таким образом, в предпочтительном варианте осуществления вакцину по изобретению доставляют in ovo.
Известны различные способы инокуляции in ovo, такие как введение в желточный мешок, эмбрион или аллантоисную полость; эти способы при необходимости можно оптимизировать. Предпочтительно инокуляцию in ovo проводят таким образом, чтобы игла касалась эмбриона.
Альтернативно, для некоторых молодых птиц можно применять парентеральную инокуляцию. При этом предпочтительно применяют внутримышечное или подкожное введение.
Составы вакцины по изобретению, подходящие для инъекции, представляют собой, например, суспензию, раствор, взвесь или эмульсию.
В зависимости способа введения вакцины по изобретению может возникать необходимость в адаптации вакцинной композиции. Это находится в пределах компетентности специалистов и, как правило, подразумевает корректировку эффективности или безопасности вакцины. Этого можно достигать посредством адаптации дозы, качества, частоты или способа введения вакцины, посредством применения вакцины в другой форме или другом составе или посредством адаптации других составляющих вакцины (например, стабилизатора или адъюванта).
Например, для пригодности к введению in ovo вакцинная композиция должна обладать очень мягким действием, чтобы не снижать вылупляемость цыплят. Однако даже при этом может наблюдаться некоторое снижение вылупляемости цыплят, возникающее, например, в результате механических повреждений эмбриона вследствие инокуляции, инфекции и т.д.
В дополнение к генетической стабильности, которую обеспечивает молекула нуклеиновой кислоты по изобретению, безопасность вакцины по изобретению обеспечивается благодаря применению в качестве родительского вируса для рекомбинантного npMDV по изобретению вакцинного штамма npMDV с установленной безопасностью, например, вакцинных штаммов HVT PB1 или FC-126. Альтернативно вакцинного штамма MDV2 SB1. Все они, как правило, доступны (FC-126 из ATCC: VR # 584-C; и PB1 и SB1 выпускаются в MSD Animal Health) и известны как подходящие для инокуляции молодых птиц или эмбрионов. Включение гетерологичной нуклеиновой кислоты не повышает вирулентность или патогенность родительского npMDV (наоборот), и не следует ожидать реверсии к вирулентности, поскольку npMDV в естественных условиях является непатогенным.
Точное количество рекомбинантного npMDV по изобретению на одну дозу вакцины, доставляемую животному, не является критичным, как это было бы в случае инактивированной вакцины; поскольку рекомбинантный npMDV является живым, он реплицируется самостоятельно и, таким образом, умножает свое количество в организме животного-мишени до уровня виремии, который является биологически устойчивым. Теоретически доза вакцины должна быть только достаточной для инициации продуктивной инфекции. Более высокая доза инокулята не сокращает время, которое требуется для достижения оптимальной виремии. Таким образом, очень высокие дозы не являются эффективными, поскольку виремия не может превысить уровень естественного равновесия, и, кроме того, очень высокая доза инокулята непривлекательная с точки зрения экономических причин.
Предпочтительная доза инокулята составляет, таким образом, от 1×10^2 до 1×10^6 бляшкообразующих единиц (БОЕ) векторного вируса npMDV на дозу на животное, более предпочтительно от 1×10^2 до 1×10^5 БОЕ/дозу, даже более предпочтительно от 1×10^3 до 1×10^4 БОЕ/дозу; наиболее предпочтительно от 1500 и 5000 БОЕ/дозу. Когда вакцина по изобретению является клеточно-фиксированной, эти количества рекомбинантного npMDV содержатся в инфицированных клетках-хозяевах. В этом случае одна доза на животное содержит от 100 до 10000 инфицированных клеток-хозяев, предпочтительно 100-5000 инфицированных клеток на дозу, более предпочтительно 200-2000 инфицированных клеток на дозу.
Способы подсчета вирусных частиц рекомбинантного npMDV по изобретению хорошо известны.
Определение иммунологически эффективного количества вакцины по изобретению находится в пределах компетентности специалистов и проводится, например, посредством анализа иммунного ответа после вакцинации или после введения инфекции, например, посредством повторной изоляции патогена, или посредством анализа клинических признаков заболевания или серологических показателей у животного-мишени и сравнения их с признаками, наблюдающимися у животных, вакцинированных имитацией вакцины.
Схема дозирования для применения вакцины по изобретению для организма-мишени может представлять собой схему с однократными или многократными дозами, которые можно доставлять одновременно или последовательно способом, соответствующим составу вакцины и в таком количестве, какое является иммунологически эффективным.
Вакцину по изобретению можно использовать для профилактического и/или терапевтического лечения и, таким образом, препятствовать установлению и/или прогрессии инфекции или клинических симптомов заболевания.
Вакцину по изобретению можно эффективно применять для примирующей вакцинации, после чего можно амплифицировать ее посредством вторичной вакцинации, например, той же самой вакциной или классической инактивированной и содержащей адъюванты вирусной вакцины.
Протокол введения вакцины по изобретению предпочтительно встроен в известные схемы вакцинации для других вакцин.
Предпочтительно вакцину по изобретению применяют однократно, либо на первые сутки после вылупления, либо in ovo на 18-е сутки ED.
Объем на дозу на животное рекомбинантного npMDV по изобретению можно оптимизировать в соответствии с выбранным способом применения: инокуляцию in ovo, как правило, проводят с применением объема от 0,05 до 0,5 мл/яйцо, а парентеральную инъекцию, как правило, проводят с применением объема от 0,1 до 1 мл/птицу.
Оптимизация объема дозы вакцины находится в пределах компетентности специалистов в данной области.
Не требует доказательств тот факт, что добавление других соединений, таких как стабилизаторы, носители, разбавители, эмульсии и т.п., в вакцины по изобретению также находятся в пределах объема изобретения. Такие добавки описаны в хорошо известных руководствах, таких как: "Remington" и "Veterinary Vaccinology" (см. выше).
При правильной оптимизации состава, дозы и способа применения, как описано выше, вакцина по изобретению может защищать домашних птиц от MDV, NDV и IBDV посредством однократной инокуляции в очень раннем возрасте. Поскольку npMDV обеспечивает персистентную инфекцию, полученная защита характеризуется очень высокой продолжительность иммунности, которая сохраняется до начала яйцекладки, до возраста приблизительно 20-25 недель. Эффективность защиты можно оценивать различными способами, такими как клинические анализы, серология, (гисто-)патология и т.д.
Вакцин по изобретению является эффективной "маркерной вакциной" для NDV и IBDV, поскольку иммунитет, который она предоставляет, направлен только против одного белка из этих вирусов. Это позволяет проводить "дифференциацию инфицированных и вакцинированных животных" в рамках так называемой стратегии DIVA. Ее можно осуществлять посредством серологического анализа, такого как ELISA или анализ иммунофлуоресценций.
Помимо мультивалентной иммунной защиты, которую предоставляет вакцина по изобретению (против NDV и IBDV; и в дополнение к защите против MDV), эффективным является получение дополнительных комбинаций посредством добавления дополнительных антигенных составов для усиления имеющейся иммунной защиты или для расширения ее до других патогенов. Теоретически это могут быть живые или убитые микроорганизмы или субъединичный антиген, при условии, что не понижают безопасность, стабильность и эффективность вакцины по изобретению.
Таким образом, в предпочтительном варианте осуществления вакцина по изобретению содержит, по меньшей мере, один дополнительный иммуноактивный компонент.
Такой "дополнительный иммуноактивный компонент(ы)" может представлять собой антиген, иммуноукрепляющее соединение, цитокин и/или вакцину. Это предоставляет преимущества в отношении стоимости, эффективности и благополучия животных. Альтернативно к вакцине можно добавлять вакцину по изобретению.
В более предпочтительном варианте осуществления, по меньшей мере, один дополнительный иммуноактивный компонент представляет собой микроорганизм, патогенный для домашних птиц; микроорганизм может представлять собой рекомбинантный организм, например, экспрессирующий иммунозащитный белок. Альтернативно, по меньшей мере, один дополнительный иммуноактивный компонент представляет собой (субъединичный) антиген, полученный из микроорганизма, патогенного для домашних птиц. Его можно получать посредством любого подходящего способа, например, посредством получения из экстракта или гомогената микроорганизмов или в качестве продукта рекомбинантно-экспрессированной нуклеиновой кислоты, где указанная нуклеиновая кислота получена из участка, кодирующего антигенный белок из микроорганизма, патогенного для домашних птиц.
Дополнительные микроорганизмы предпочтительно выбирают из следующих групп, и/или дополнительный антиген предпочтительно получают из микроорганизмов, выбранных из следующих групп, состоящих из:
- вирусы: вирус инфекционного бронхита, NDV, аденовирус, вирус синдрома снижения несучести, IBDV, вирус анемии куриц, вирус энцефаломиелита птиц, вирус оспы птиц, вирус ринотрахеита индеек, вирус чумы уток (вирус энтерита уток), вирус оспы голубей, MDV, вирус лейкоза птиц, ILTV, пневмовирус птиц и реовирус;
- бактерии: Escherichia coli, Salmonella sp., Ornitobacterium rhinotracheale, Haemophilis paragallinarum, Pasteurella multocida, Erysipelothrix rhusiopathiae, Erysipelas sp., Mycoplasma sp. и Clostridium sp.;
- паразиты: Eimeria sp.; и
- грибы: например, Aspergillus sp.
В более предпочтительных вариантах осуществления вакцины по изобретению дополнительный иммуноактивный компонент выбирают из групп MDV, NDV и IBDV или любого их сочетания. Такой дополнительный компонент предназначен для улучшения и расширения предоставляемой иммуногенности. Это является предпочтительным в тех случаях или географических регионах, в которых преобладают высоковирулентные полевые штаммы MDV, NDV или IBDV.
В связи с этим известна комбинация npMDV с MDV1, MDV2 или HVT; согласно изобретению, MDV штамма Rispens (MDV1), штамма SB1 (MDV2) или штаммов FC-126 или PB1 (HVT) является предпочтительным дополниительным иммуноактивным компонентом.
Для усиления ответа против NDV рекомбинантный npMDV по изобретению можно комбинировать с вакцинным штаммом NDV, таким как мягкий живой вакцинный штамм NDV C2.
Аналогично, для усиления ответа против IBDV рекомбинантный npMDV по изобретению можно комбинировать с мягким живым вакцинным штаммом IBDV, таким как D78, PBG98, Cu-1, ST-12 или 89-03.
Как ясно специалистам в данной области, эти "комбинации" также включают схемы вакцинации, где рекомбинантный npMDV по изобретению и дополнительный иммуноактивный компонент применяют не одновременно; например, рекомбинантный npMDV можно вводить in ovo, а штаммы NDV C2 и/или IBDV 89-03 можно вводить на первые сутки.
Таким образом, в более предпочтительном варианте осуществления вакцина по изобретению содержит, по меньшей мере, один дополнительный иммуноактивный компонент, где, по меньшей мере, один дополнительный иммуноактивный компонент представляет собой микроорганизм, выбранный из группы, состоящей из вакцинного штамма: MDV, NDV и IBDV или любого их сочетания.
Более предпочтительно дополнительный иммуноактивный компонент выбран из группы, состоящей из: MDV Rispens, MDV SB1, NDV C2, IBDV D78 и IBDV 89-03.
Комбинированную вакцину можно получать рядом способов: посредством комбинирования препаратов вирусов или клеток-хозяев или их смесей; все они включены в настоящее изобретение. В предпочтительном варианте осуществления компоненты такой комбинированной вакцины удобно получать раздельно и затем комбинировать и помещать в один контейнер для вакцины.
Посредством способов, приведенных выше и описанных в примерах далее в настоящем документе, можно получать вакцину по изобретению.
Таким образом, дополнительный аспект изобретения относится к способу получения вакцины по изобретению, где указанный способ включает стадии:
- инфицирования клеток-хозяев рекомбинантным npMDV по изобретению,
- отбора инфицированных клеток-хозяев и
- смешивания отобранных инфицированных клеток-хозяев с фармацевтически приемлемым носителем.
Подходящие клетки-хозяева и фармацевтически приемлемые носители по изобретению описаны выше. Кроме того, подходящие способы инфицирования, культивирования и отбора хорошо известны в данной области и описаны и приведены в примерах в настоящем документе.
Как подробно описано выше, рекомбинантный npMDV по изобретению можно эффективно применять в вакцине для домашних птиц с получением безопасной, стабильной и эффективной вакцины против MDV, NDV и IBDV, которую можно вводить домашним птицам в очень раннем возрасте.
Таким образом, дополнительный аспект изобретения относится к рекомбинантному npMDV по изобретению для применения в вакцине для домашних птиц.
Различные аспекты и варианты осуществления "применения в вакцине" описаны выше и включают применение свободного или клеточно-фиксированного вируса в различных вакцинных композициях для инокуляции домашних птиц.
Таким образом, различные аспекты и варианты осуществления изобретения можно эффективно применять для получения безопасной, стабильной и эффективной вакцины для домашних птиц.
Таким образом, в дополнительном аспекте изобретение относится к применению рекомбинантного npMDV, молекулы нуклеиновой кислоты, рекомбинантной молекулы ДНК или клетки-хозяина по изобретению или любого их сочетания для получения вакцины для домашних птиц.
Как описано выше и указано в примерах далее в настоящем документе, вакцину по изобретению можно эффективно применять для предоставления безопасной и эффективной иммунной защиты домашних птиц от ряда заболеваний посредством однократной инокуляции в очень раннем возрасте.
Таким образом, в дополнительном аспекте изобретение относится к способу вакцинации домашних птиц, включающей этап инокуляции указанных домашних птиц вакциной по изобретению.
Детали инокуляции домашних птиц вакциной по изобретению описаны выше; в частности, инокуляция посредством внутримышечного или подкожного введения цыплятам возраста 1 сутки и инокуляция in ovo эмбрионам возраста 18 суток.
Изобретение далее описано со ссылкой на следующие не ограничивающие примеры.
Примеры
1. Тестирование различных экспрессирующих кассет:
(см. фиг. 1, где представлено графическое изображение описанных конструктов, и табл. 1, где представлен обзор результатов)
1.1. HVT-F и HVT-VP2:
Два рекомбинантных HVT были сконструированы с экспрессирующими кассетами для одного гена; содержащими либо ген белка F NDV Clone 30, либо ген VP2 из штамма классического IBDV Faragher 52/70. В них применяли разные промоторы: промотор LTR вируса саркомы Рауса для гена белка F и коровый промотор гена hCMV-IE1 для гена белка VP2. Обе экспрессирующие кассеты встраивали (посредством гомологичной рекомбинации in vitro) в ген Us10 генома HVT родительского штамма PB1. Рекомбинант HVT-F является тем же, который применяют в коммерческой вакцине Innovax™ ND.
Оба рекомбинанта оказались эффективными в отношении стабильности, виремии и экспрессии.
Когда эти два рекомбинантных HVT объединяли в одной инокуляции, повторная изоляция из вакцинированных куриц через 4 недели показала, что только один из двух HVT можно было повторно изолировать в значительном количестве, при незначительных количествах другого. Взаимное исключение не всегда давало одинаковые результаты: иногда выживал HVT-F, а иногда HVT-VP2.
Виремию in vivo определяли как процент лимфоцитов периферической крови (PBL), инфицированных (рекомбинантным) HVT, в образцах крови, полученных от инокулированных цыплят через две или три недели после инокуляции.
Защиту in vivo определяли следующим образом: защиту NDV измеряли посредством подсчета цыплят после введения им летальной дозы вирулентного вируса NDV. Защиту IBDV измеряли посредством гистологического анализа лимфопении в фабрициевой сумке; система оценок была основана на баллах от 5 для полной лимфопении (отсутствие защиты) до 0 для полной защиты (отсутствие лимфопении).
1.2. HVP163:
Рекомбинантный HVT под названием HVP163, содержащий экспрессирующую кассету в Us10 штамма PB1 HVT, которая представляет собой комбинацию двух кассет в рекомбинантах HVT-F и HVT-VP2: секция IE/VP2 промотор+ген находится выше секции LTR/F. Ниже гена белка F встраивали терминатор транскрипции, который получали из участка соединения Us/TRs в FHV1; VP2 уже имел терминатор гена hCMV-IE1.
Этот рекомбинант проявлял низкую эффективность; экспрессии гена белка F не наблюдалось.
1.3. HVP193:
В экспрессирующей кассете для HVP193 промотор LTR был заменен на более сильный промотор: химерный промотор гена бета-актина курицы, элемент длиной 1,34 т.п.н., полученный по номеру доступа Genbank: AJ575208, посредством расщепления рестрикционными ферментами Ncol - EcoRI.
Хотя экспрессия гетерологичных белков VP2 и F была ясно детектируемой, репликация in vivo была слабой по сравнению с родительским штаммом PB1.
Это также отражалось в результатах провокационного теста с HVP193 (описанным в разделе про HVP204 ниже), в котором из вакцинированных HVP193 цыплят только 17% были защищены от летальной провокационной инфекции NDV.
1.4. HVP204:
Рекомбинант HVT HVP204 содержал два дополнительных изменения по сравнению с HVP193: был изменен относительный порядок генов белка VP2 и белка F, а также промоторов, контролирующих эти гены. В полученной экспрессирующей кассете ген белка F находился выше гена VP2, и ген белка F контролировался коровым промотором гена hCMV-IE1; лежащий ниже ген VP2 контролировался (химерным) промотором гена бета-актина. Окрашивание IFA со специфичными антителами VP2- и F-белков подтверждало функциональную экспрессию обоих генов в инфицированных монослоях CEF. Уровни виремии тестировали на PBL вакцинированных куриц на 15-е или 22-е сутки p.i. результаты указывали на то, что репликация in vivo HVP204 значительно повысилась по сравнению с HVP193, однако не достигла уровня виремии вируса дикого типа.
Тестировали защитную способность in vivo с применением двух отдельных изолятов HVP204 против летального провокационного инфицирования NDV или тяжелого провокационного инфицирования IBDV через три недели после инокуляции в возрасте одних суток.
Защита от NDV, предоставляемая HVP204, составляла 47%; защита от IBDV была почти полной с патологическими изменениями на уровне от 0 до 0,5.
Однако генетическая стабильность рекомбинанта HVP205 HVT была недостаточной, поскольку до 26% рекомбинантов утрачивали способность к экспрессии одного или двух гетерологичных генов после 10-го пассажа клеточной культуры.
1.5. HVP216:
Неожиданно было выявлено, что значительная адаптация к промотору Ch бета-актина предоставляла рекомбинантные HVT, обладающие желаемой генетической стабильностью при сохранении (и даже улучшении) других свойств репликации и экспрессии. Адаптация, внесенная в химерный промотор гена β-актина курицы, как применяли с HVP193 и HVP204, представляла собой делецию большого участка интрона, который в указанном промоторе гена Ch β-актина расположен выше старт-кодона. Это можно легко осуществлять посредством расщепления рестрикционными ферментами Eco47lll и Nael. Это приводило к делеции в интроне промотора участка в 675 п.н., представленного нуклеотидами 807-1483 из фрагмента Ncol-EcoRI, который расположен в области нуклеотидов 394-1734 (все в отношении плазмиды, представленной по номеру доступа Genbank: AJ575208). Полученную коровую версию промотора гена β-актина использовали для замены длинной версии в экспрессирующей кассете HVP204, в локусе Us10 родительского штамма PB1.
Полученный рекомбинантный HVP216 обладал желаемой генетической стабильностью и очень хорошими репликативными и экспрессирующими свойствами: окрашивание IFA с VP2- и F-специфичными антителами подтверждало функциональную экспрессию обоих генов вируса HVP216, который подвергали пассированию более 10 раз в клеточных культурах CEF.
Иммунную защиту, предоставляемую HVP216, тестировали в сериях экспериментов: провокационный тест IBDV с применением MDA + вакцинация цыплят на 1-е сутки (sc) и провокационный тест на 21-е сутки. Значения лимфопении указывали на то, что PB1 не предоставлял защиты (балл 4,5), однако очень хорошую защиту от IBDV предоставляли: HVT-VP2: 1,0; HVP204: 0; HVP216: 0 и 0,5 (два параллельных изолята).
Провокационный тест с применением NDV проводили через 3 или 4 недели после вакцинации цыплят SPF: PB1 предоставлял незначительную защиту, однако HVP216 предоставлял защиту до 90% цыплят через 4 недели после вакцинации.
1.6. HVP309:
Рекомбинанты HVP309 HVT отличаются от рекомбинантов HVP216 тем, что для встраивания экспрессирующей кассеты HVP216 применяли другой сайт встраивания: ген Us2 родительского вирусного штамма HVT FC-126, причем рекомбинант получали посредством космидной регенерации. Полученный рекомбинант HVP309 демонстрировал очень хорошие результаты в тестах на репликацию, экспрессию, генетическую стабильность и эффективность вакцинации (см. примеры ниже), как и HVP216.
2. Трансфекция посредством космидной регенерации
Общие способы трансфекции, рекомбинации, отбора и амплификации были по существу такими аналогичными описанным в Sondermeijer et al., 1993 (выше) и EP 431,668.
Космидную регенерацию для HVP309 проводили по существу способом, описанным в WO 93/25665 (например, фиг. 8 по указанной ссылке). Для обеспечения встраивания в регион Us генома FC-126 HVT указанный регион, входящий в космиду номер 378-50 в WO 93/25665, был получен из трех более мелких плазмид: pSY640 и 556-60,6 и одной трансферной плазмиды (p435vec9), перекрывающейся с двумя другими и содержащей экспрессирующую кассету в локусе гена Us2.
Субгеномный клон pSY640 получали из космиды 378-50, которая содержала крупный (29,6 т.п.н.) фрагмент BamHI-A генома HVT FC-126, кодирующий все Us и большинство фланкирующих IRs и Trs. Это осуществляли посредством замены во вставке 378-50 участка распознавания рестрикционного фермента StuI в Us2 на сайт HindIII. Расщепление HindII разрезает этот участок генома HVT примерно надвое; для pSY640 использовали участок Us от 1 до 13,7 т.п.н., который расположен между IRs и (исходным) сайтом StuI в Us2. Этот участок генома HVT субклонировали в векторе pSP64 (Promega).
Субгеномный клон p556-60,6 состоит из большей части другого участка вставки 378-50: региона, который расположен приблизительно от 16,4 т.п.н. в BamHI-A (в Us6 = gD) до TRs. Этот участок субклонировали в плазмиду pBR322.
Средняя часть фрагмента BamHI-A 378-50, где расположен Us 2, не входит в pSY640 и p556-60,6 и содержится в трансферной плазмиде p435vec9 наряду с некоторыми дополнительными участками из Us, располагаясь между Us10 и Us8 (gE) таким образом, что она перекрывается с pSY640 и p556-60,6, и содержит экспрессирующую кассету IE/F-βAct/VP2 (как описано в SEQ ID NO: 7) в локусе гена Us2. Полученная плазмида, названная p435vec9, представлена на фиг. 4.
Набор из семи линейных конструктов: 4 космиды и 3 плазмиды целиком трансфицировали в CEF посредством стандартного способа трансфекции с применением CaCl2; вкратце: только что полученные CEF высевали на 10 см планшеты для культивирования и инкубировали при 38°C в присутствии 5% CО2. Для каждого планшета смешивали общее количество 1 мкг ДНК космид и плазмид и добавляли 150 мМ CaCl2 по каплям, пока не возникала угроза осаждения. Эту смесь добавляли к клеточной суспензии CEF на планшетах для культивирования и инкубировали в течение 12 часов. Удаляли супернатант, добавляли поверхностный слой 15% глицерина и оставляли клетки на 1 минуту. Затем слой удаляли, промывали PBS, добавляли свежую среду для культивирования и инкубировали клетки в течение 5 суток. Затем клетки собирали посредством трипсинизации, клетки из отдельных планшетов высевали на свежие монослои клеток CEF во флаконах T175 для культивирования и икубировали в течение 2 суток. Культуры клеток во флаконах T175 подвергали трипсинизации, промывали, повторно высевали в свежую среду без дополнительных CEF и инкубировали в течение еще 3 суток. Затем амплифицированные трансфицированные клетки собирали посредством трипсинизации и в разведениях от 10^-2 до 10^-4 высевали на 10 см планшеты с монослоями CEF и инкубировали. После инкубирования, которое проводили до тех, пока не становились видны бляшки (приблизительно 3 суток p.i.), планшеты покрывали агаром, выделяли ряд отдельных бляшек HVP309 и амплифицировали их на CEF.
3. Проверка встраивания
Для подтверждения того, что встраивание экспрессирующей кассеты в рекомбинант HVT HVP309 прошло правильно и полностью, проводили ряд проверок: ряд отдельных бляшек вируса HVP309 выделяли и амплифицировали в клеточной культуре. Затем эти бляшки использовали для проведения саузерн-блоттинга с применением стандартных способов; вкратце: в гель вносили продукты расщепления EcoRI геномной ДНК, изолированной из родительского HVT FC-126 или рекомбинантного HVP309. Их переносили на нитроцеллюлозу и инкубировали с фрагментами экспрессирующей кассеты, помеченной 32P. Авторадиограмма показала наличие нескольких специфичных полосок: одной полоски длиной 7,3 т.п.н. из FC-126 и двух полосок из HVP309, длиной 5,4 и 6,1 т.п.н., см. фиг. 5. Это указывало на то, что в HVP309 встроилась полная экспрессирующая кассета длиной приблизительно 4,2 т.п.н. Поскольку зонд содержал участки фланкирующего региона вставки, это также указывало на то, что встраивание произошло в нужном генетическом локусе.
Для подтверждения того, что 5′- и 3'-концы экспрессирующей кассеты в HVP309 остались интактными, проводили ПЦР-секвенирование. Лежащую выше фланкирующую область Us2 и промотор 5′-hCMV-IE1 детектировали с применением праймеров для ПЦР:
309F1: 5′-TCACACTAGTTGGGTTTATC-3′ (SEQ ID NO: 8)
309R1: 5′-ACGTAGATGTACTGCCAAGTAG-3′ (SEQ ID NO: 9)
Аналогично, 3'-конец гена VP2 и терминатор транскрипции FHV1 с лежащей ниже фланкирующей областью Us2 детектировали с применением праймеров для ПЦР:
309F10: 5′-CCGGGCTATAAGGAGGTAAG-3′ (SEQ ID NO: 10)
309R10: 5′-GTACGCGTCCGGGTATACAC-3′ (SEQ ID NO: 1 1).
Амплификацию посредством ПЦР проводили с применением геномной ДНК HVP309, и в обеих реакциях ПЦР были амплифицированы ожидаемые фрагменты длиной приблизительно в 0,6 т.п.н. ПЦР проводили согласно рекомендациям производителя; вкратце: с применением Taq™ 2x Master Mix от VWR International, с программой: 30 с 95°C с последующими 30 циклами: 15 с 95°C, 30 с 55°C и 45 с 72°C. В конце реакции 5 мин 72°C, после чего образцы хранили при 20°C до проведения анализа.
Ампликоны очищали от агарозного геля с применением набора Qiaquick™ от Qiagen Inc.
Секвенирующую ПЦР проводили с описанными выше праймерами с применением набора Big Dye™ Terminator v.1.1 Cycle Sequencing от Applied Biosystems. Программа секвенирующей ПЦР была следующей: 10 с 94°C с последующими 25 циклами: 5 с 50°C и 2 мин 60°C. Образцы хранили при 20°C до проведения анализа. Невключившиеся нуклеотиды удаляли с применением набора Dye Ex™ от Qiagen, а секвенирование проводили с применением Genetic Analyzer™ 3500 и соответствующего программного обеспечения от Applied Biosystems. Последовательности выравнивали относительно референсной последовательности с применением программного обеспечения Sequencher™ v. 4.10.1 от Gene Codes Corporation.
Результаты секвенирования указывали на то, что 5′- и 3'-концы экспрессирующей кассеты, встроенной в HVP309, были правильными и полными, как и предполагалось, а сайт встраивания, как и предполагалось, находился в гене Us2.
4. Проверка экспрессии посредством IFA
IFA для проверки экспрессии F и VP2 в рекомбинантах HVP30 проводили согласно стандартным способам, вкратце: CEF получали посредством стандартного способа (трипсинизация 10 ED SPF куриных эмбрионов) и помещали в стандартную среду для культивирования, содержащую 2% FCS и антибиотики. В каждую лунку 96-луночного планшета помещали стандартную среду и амплифицировали изолят HVP309 с применением разведений 1:5. Затем добавляли клетки CEF клетки в количестве 1×10^5/лунку и планшеты инкубировали в течение 3 суток при 38°C в присутствии 5% CО2.
Супернатант удаляли и фиксировали клеточный монослой 80% этанолом при -20°C в течение, по меньшей мере, 5 минут. Если планшеты не хранили при -20°C, их промывали 3× фосфатным буфером. Затем лунки инкубировали с антителами, либо поликлональными против NDV или -IBDV, либо моноклональными против белка F или белка VP2, в зависимости от доступности. Антитела использовали при подходящем предварительном разведении в стандартном буфере для инкубации (фосфатный буфер с Tween 20 и BSA). Планшеты инкубировали в течение приблизительно 1 ч при 37°C, промывали 3 раза и инкубировали с подходящим конъюгированным с FITC вторым антителом, разведенным в буфере для инкубации, например, IgG-FITC козы против мыши (Sigma, F-0257) в разведении 1:50. Эта смесь также содержала краситель голубой Эванса для контр-окрашивания клеток. После инкубации в течение 1 ч при 37°C планшеты промывали 3 раза, и лунки покрывали глицерином и хранили при 4°C до проведения анализа на УФ-микроскопе.
Изоляты из HVP309 демонстрировали экспрессию белков F и VP2, начиная с первых бляшек после трансфекции и заканчивая бляшками, полученными после тестирования стабильности посредством пассирования клеток.
5. Проверка генетической стабильности после 16-серийного пассирования клеточной культуры
Пассирование культуры клеток и амплификацию проводили посредством последовательных пассажей в первичных CEF. В кратком изложении: первичные CEF высевали в роллер-флаконы в стандартную среду для культивирования, содержащую 5% FBS + антибиотики, культивировали в течение 18-24 часов с формированием монослоев, инфицировали и инкубировали. Инфицированные клетки собирали с применением трипсина, когда CPE достигал приблизительно 20-50% (как правило, через 18-25 часов инкубирования). Отобранные инфицированные клетки CEF клетки затем применяли для инфицирования свежих клеток и т.д.
Для определения генетической стабильности изолятов HVP309 их подвергали серийным пассажам клеточной культуры вплоть до 16-го пассажа (p16) и затем тестировали на экспрессию белков F и VP2 посредством IFA. Проводили два эксперимента по одинаковой схеме: в планшеты 60 мм высевали вторичные CEF, и приблизительно через 20 ч после высевания (когда клетки CEF достигают 80-90% конфлюентности) планшеты инфицировали изолятом p16 HVP309. По меньшей мере, 10 планшетов применяли для окрашивания белка F и 10 для окрашивания белка VP2; каждый планшет содержал приблизительно 10 бляшек. Два планшета оставляли неинфицированными.
После инфицирования планшеты инкубировали в течение 5 суток. Затем в каждом планшете подсчитывали общее количество бляшек с применением световой микроскопии. Затем планшеты фиксировали и окрашивали посредством IFA специфичными к белку F или белку VP2 моноклональными антителами и специфичными к мыши конъюгатами антитело-FITC. Все бляшки на всех планшетах анализировали, сначала посредством светопольной микроскопии, а затем посредством эпифлуоресцентной микроскопии, на флуоресценцию и, таким образом, на экспрессию белка F или белка VP2.
Результаты: Эксперимент 1: 344 бляшек анализировали посредством светопольной микроскопии. Из 180 бляшек, окрашенных на экспрессию VP2, и из 164 бляшек, окрашенных на экспрессию белка F, все бляшки продемонстрировали специфичную флуоресценцию, что указывало на гетерологичную экспрессию гена при p16.
Эксперимент 2: Из 306 бляшек, окрашенных на экспрессию VP2, все показали положительный результат; из 326 бляшек, окрашенных на экспрессию белка F, одна бляшка (0,3%) не продемонстрировала экспрессию.
В обоих экспериментах неинфицированные планшеты не демонстрировали специфичной флуоресценции на экспрессию белка F или белка VP2.
В заключение: после проведения 16 серийных пассажей клеточной культуры уровень отсутствия экспрессии одного из встроенных гетерологичных генов HVP309 составлял 0% или 0,3%. Это указывает на очень высокую генетическую стабильность HVP309.
6. Провокационный тест вакцинации с применением HVP309 против IBDV
HVP309, пассированные до P16, тестировали в провокационном тесте вакцинации для оценки оставшейся способности к предоставлению эффективной иммунной защиты против IBDV и NDV (см. Пример 7).
Схема эксперимента
Биологические материалы, использованные в тесте: HVP309 при p16; Vaxxitek™ HVT+IBD; и штамм HVT FC-126
Животные: SPF курицы породы белый леггорн, на 18 ED. Цыплятам надевали крылометки при вылуплении и ежедневно делали наблюдения, отмечая симптомы, поведение или нежелательные реакции, не связанные с экспериментов. Их помещали в изоляторы и содержали согласно стандартным способам.
Вакцинация: инокуляция in ovo на 18 ED, с применением трех вакцин; введение дозы 0,1 мл в хориоаллантоис с применением иглы 22G 1,25′′. Вакцину подвергали обратному титрованию и вводили дозы вакцины с приблизительно 2000 БОЕ/дозу.
Провокационный тест: цыплят подвергали провокационному тесту с применением штамма классического IBDV STC через 2 или 3 недели после вакцинации, используя приблизительно 10^2,5 EID50 на цыпленка в объеме 60 мкл посредством индивидуальных закапываний в глаза.
Наблюдения: соответствующие группы цыплят тестировали через 4 суток после проведения провокационного теста на макроскопические повреждения фабрициевой сумки и на гистологию фабрициевой сумки (лимфопения и повреждения) через 10 суток после проведения провокационного теста.
Анализ данных: эксперименты считали достоверными, если у цыплят, не повергавшихся провокационному тесу, не развивалось заболевание, в то время как у более 70% цыплят, вакцинированных FC 126 в провокационном тесте, развивалось тяжелое заболевание.
Оценка:
- положительные птицы (на вирус, применяемый в провокационном тесте): определяли по значительности повреждений фабрициевой сумки: птиц считали положительными, если у них наблюдались любые повреждения фабрициевой сумки, такие как: (околосумочный) отек, макроскопическое кровотечение, исчерченность фабрициевой сумки или изменение цвета фабрициевой сумки (на желтый/кремовый цвет).
- защита (от инфекции, применяемой в провокационном тесте): птиц считали защищенными, если значения лимфопении составляли <3, и незащищенными, если эти значения составляли 3-5 по шкале 0-5.
Результаты и заключения
Цыплята, вакцинированные in ovo HVT-векторными IBDV вакцинами Vaxxitek™ HVT+IBD или HVP309, были хорошо защищены от тяжелой провокационной инфекции IBDV, как через 2 недели, так и через 3 недели после вакцинации. Подробные результаты приведены в табл. 2.
6.3. Заключения
Вакцинация рекомбинантом HVP309 HVT, даже после 16 серийных пассажей клеток, предоставляла очень эффективную иммунную защиту от тяжелой провокационной инфекции IBDV, поскольку, по меньшей мере, 95% животных-мишеней были защищены.

Провокацинный тест вакцинации с применением HVP309 против NDV
В экспериментах на животных, сходных с экспериментами из Примера 6, измеряли способность p12 и p16 HVP309 к защите от NDV измеряли. Также в этом эксперименте сравнивали вакцинацию in ovo (18 и 19 ED) с вакцинацией в возрасте 1 суток.
7.1. Схема эксперимента
Биологические материалы, использованные в тесте: HVP309 при p12 и p16; Vaxxitek™ HVT-IBD; и Innovax™- ND;
Плацебо: Разбавитель Марека.
Животные: SPF курицы породы белый леггорн, на 18 или 19 ED и в возрасте 1 суток. Цыплятам надевали крылометки при вылуплении и ежедневно делали наблюдения, отмечая симптомы, поведение или нежелательные реакции, не связанные с экспериментом. Их помещали в изоляторы класса BSL2 и содержали согласно стандартным способам.
Вакцинация: проводили инокуляцию in ovo на 18 или 19 ED с применением одной из использованных в тесте вакцин; вводили дозу 0,1 мл в хориоаллантоис с применением иглы 22G 1,25′′. Вакцинацию в первые сутки проводили посредством подкожного введения дозы 0,2 мл. Вакцину подвергали обратному титрованию и вводили дозы с приблизительно 1300 БОЕ/дозу.
Провокационный тест: Во время проведения провокационного теста вакцинированных и контрольных животных объединяли в клетках. Всем цыплятам вводили штамм NDV Texas GB (велогенный) через четыре недели после вакцинации, с приблизительно 10 EID50 на цыпленка в объеме 200 мкл, который вводили индивидуально посредством внутримышечной инъекции в грудную мышцу.
Наблюдения: соответствующие группы цыплят тестировали через 14 суток после проведения провокационного теста на клинические признаки ND.
Анализ данных: эксперимент считали достоверным, поскольку более 90% цыплят, вакцинированных плацебо, демонстрировали клинические признаки ND.
Оценка: Птиц считали положительными на NDV, если наблюдались любые клинические признаки NDV, такие как любые неврологические нарушения или смерть.
7.2. Результаты
Как p12, так и p16 HVP309 обладали способностью защищать цыплят от тяжелой провокационной инфекции NDV. Это было показано как при проведении вакцинации in ovo, так и при проведении вакцинации подкожным способом. Только в случае Innovax™ ND наблюдался эффект возраста, в котором применяли вакцинацию in ovo: 18 или 19 ED.
7.3. Заключение
Вакцинация HVP309 предоставляла эффективную иммунную защиту против тяжелой провокационной инфекции NDV. p12 и p16 HVP309 показали одинаково хорошие результаты. Вакцинация посредством введения in ovo и вакцинация посредством подкожного введения в возрасте 1 суток предоставляла одинаково хорошие результаты.

Тестирование генетической стабильности in vivo
В ходе экспериментов по разработке продукта рекомбинантный непатогенный конструкт вируса болезни Марека HVP309 по изобретению подвергали повторным обратным пассажам в организме животных для тестирования стабильности и безопасности in vivo в организме животных-мишеней. Для оценки безопасности куриц, инокулированных пассированным рекомбинантным вирусом, их тестировали на любые признаки реверсии или повышения вирулентности при проведении последовательных пассажей от животного к животному. Для оценки генетической стабильности вирус на последнем пассаже сравнивали с исходным инокулятом до проведения первого пассажа в организме животного. Все эксперименты проводили согласно международным рекомендациям, короткое описание которых приведено ниже.
8.1. Пассирование на животных
Отбирали одну бляшку изолята HVP309 (названую B1) и амплифицировали с получением препарата исходного вакцинного вируса (MSV) посредством определенного количества пассажей амплификации с применением первичных CEF в роллер-флаконах. Полученный MSV титровали и использовали для инокуляции SPF цыплят породы белый леггорн возраста 1 сутки с применением приблизительно 50 000 БОЕ на дозу 0,2 мл посредством подкожного введения. Цыплята были здоровые, их случайным образом распределяли по группам и содержали в изолированных условиях; применяли подходящие невакцинированные контроли. Птиц содержали в течение 14 суток и тщательно обследовали на любые признаки заболеваний или других нежелательных реакций. Через 14 суток после инокуляции получали индивидуальные образцы крови (3-5 мл) и выделяли лейкоциты. Их объединяли в одну группу и применяли для титрования бляшек и для дальнейших пассажей на животных; лейкоциты инокулировали новым группам цыплят возраста 1 сутки в дозе 0,2 мл посредством подкожного введения, и этих цыплят наблюдали в течение 14 суток. Процедуру повторяли еще 3 раза, пока MSV не проходил 5 последовательных пассажей на животных (MSV-AP5).
8.2. Общие результаты пассирования
Рекомбинантный вирус можно было получать после каждого пассажа на животных, на что указывали результаты промежуточных бляшек после каждого пассажа. Кроме того, не было показано никаких изменений вирулентности, на что указывали результаты макроскопического и микроскопического гистологического анализа тканей инокулированных и неинокулированных птиц после каждого пассажа.
8.3. Генетическая стабильность
Генетическую стабильность рекомбинантного вируса HVP309B1 подтверждали посредством изолирования и сравнения вирусной ДНК из образцов MSV и MSV-AP в отношении встроенной экспрессирующей кассеты и фланкирующих областей сайта встраивания в вирусном геноме HVT.
Вирусную геномную ДНК выделяли из CE, инокулированнных либо MSV, либо лейкоцитами, содержащими MSV-AP5, полученный от цыплят после последнего пассажа на животных. ДНК выделяли с применением стандартных наборов и способов и использовали в ряде ПЦР (с применением праймеров к подходящим участкам и стандартных параметров реакции) для амплификации экспрессирующей кассеты и фланкирующих областей сайта встраивания. Это позволяло получать набор перекрывающихся фрагментов длиной приблизительно 600 п.н., которые в общей сложности составляли участок длиной 5,5 т.п.н., расположенный в нужной области: 4,5 т.п.н. встроенной экспрессирующей кассеты и приблизительно 500 п.н. каждой из фланкирующих областей. Секвенирование ДНК проводили с применением автоматического оборудования для циклического секвернирования (Applied Biosystems), и полученные последовательности объединяли, выравнивали и анализировали с применением программного обеспечения Sequencher® (Gene Codes Corp.). Некоторые неясности в объединенных последовательностях разрешали посредством включения дополнительных фрагментов ПЦР. Итоговую консенсусную последовательность получали для вирусной ДНК MSV и MSV-AP5, где итоговая избыточность секвенирования составляла 4-5x на нуклеотид.
Консенсусные последовательности вставки и фланкирующих областей вируса HVP309B1 в MSV и в MSV-AP5 были идентичными.
Такое абсолютное сохранение генетической стабильности, даже после проведения 5 последовательных пассажей на животных, соответствует фенотипической стабильности, установленной ранее в других экспериментах (см. Пример 5) и указывает на очень высокую стабильность рекомбинантного вирусного конструкта HVP309.
Пояснения к фигурам
Фиг. 1:
Графическое изображение различных молекул нуклеиновой кислоты по изобретению (экспрессирующие кассеты), использованных в тесте. Ul и Us: соответственно, уникальные длинные и уникальные короткие участки генома HVT; Us2 и Us10: генетические сайты встраивания в генах HVT Us2 или Us10; LTR: промотор длинного концевого повтора вируса саркомы Рауса; F: ген гликопротеина слияния NDV Clone 30; IE: коровый промотор предраннего гена 1 цитомегаловируса человека; IE*: указывает на применением "корового" промотора; VP2: ген вирусного белка 2 вируса инфекционного бурсита классического типа; маленький прямоугольник: терминатор транскрипции - вертикальные полоски: терминатор гена hCMV-IE1; - горизонтальные полоски: терминатор места соединения US/TRs вируса герпеса 1; β-акт.: коровый промотор гена бета-актина курицы, содержащий модифицированный акцепторный сайт сплайсинга; β-акт.*: указывает на применением корового промотора.
NB: Элементы на фиг. 1 представлены не в масштабе. Кроме того, ориентация экспрессирующей кассеты относительно генома HVT может быть обратной.
Фиг. 2:
Графическое изображение одного из вариантов осуществления молекулы нуклеиновой кислоты по изобретению. Соответствует 4,5 т.п.н. молекулы, представленной в SEQ ID NO: 7. Названия и обозначения по существу аналогичны представленным на фиг. 1.
Фиг. 3:
Графическое изображение способа трансфекции посредством космидной регенерации, который применяли для получения рекомбинанта npMDV HVP309.
Обращенный вниз треугольник указывает на генетический сайт встраивания; для HVP309 он представляет собой Us2.
Фиг. 4:
Графическое изображение варианта осуществления рекомбинантной молекулы ДНК по изобретению; в этом случае: трансфер-вектор p435vec9, который использовали для трансфекции посредством космидной регенерации с получением HVP309.
Названия и обозначения по существу аналогичны представленным на фиг. 1 и 2.
Фиг. 5:
Изображение авторадиограммы саузерн-блоттинга, описанного в Примере 3. Полосы: M: маркерная полоса с размером полосок в т.п.н., указанным слева от изображения; Полоса 1: вирусная ДНК FC-126, расщепленная EcoRI; Полоса 2: вирусная ДНК HVP309, расщепленная EcoRI. Использованный зонд представлял собой инсерционный вектор p435-47, помеченный 32P. Черные треугольники указывают на полученные полосы: полоса 1: 7,3 т.п.н.; полоса 2: 6,1 и 5,4 т.п.н.
Реферат
Настоящие изобретения относятся к области ветеринарных вакцин, в частности к области векторных вакцин для домашних птиц, основанных на рекомбинантном непатогенном вирусе болезни Марека (npMDV). Также изобретения относятся к способам и применениям, включающим рекомбинантный npMDV, экспрессирующей кассете, инфицированной клетке-хозяине и вакцине. Рекомбинантный npMDV содержит гетерологичную молекулу нуклеиновой кислоты, где указанная молекула нуклеиновой кислоты содержит в направлении от 5′-конца к 3′-концу в следующем порядке:a. коровый промотор предраннего гена 1 цитомегаловируса человека (hCMV-IE1), где указанный промотор представлен в SEQ ID NO: 1,b. ген белка слияния (F) вируса болезни Ньюкасла (NDV),c. терминатор транскрипции,d. коровый промотор гена бета-актина курицы, где указанный промотор представлен в SEQ ID NO: 4, иe. ген вирусного белка 2 (VP2) вирус инфекционного бурсита (IBDV) классического типа.Вакцину, основанную на этом рекомбинантном npMDV, можно применять для индуцирования у домашних птиц защитного иммунного ответа не только против болезни Марека, но и против болезни Ньюкасла и инфекционного бурсита. 9 н. и 2 з.п. ф-лы, 5 ил., 3 табл., 8 пр.
Формула
a. коровый промотор предраннего гена 1 цитомегаловируса человека (hCMV-IE1), где указанный промотор представлен в SEQ ID NO: 1,
b. ген белка слияния (F) вируса болезни Ньюкасла (NDV),
c. терминатор транскрипции,
d. коровый промотор гена бета-актина курицы, где указанный промотор представлен в SEQ ID NO: 4,
e. ген вирусного белка 2 (VP2) вирус инфекционного бурсита (IBDV) классического типа.
a. коровый промотор hCMV-IE1, где указанный промотор представлен в SEQ ID NO: 1,
b. ген белка F NDV,
c. терминатор транскрипции,
d. коровый промотор гена бета-актина курицы, где указанный промотор представлен в SEQ ID NO: 4,
e. ген VP2 IBDV классического типа,
f. терминатор транскрипции.
указанный способ включает встраивание молекулы нуклеиновой кислоты по п. 2 в уникальный сайт встраивания в геноме npMDV.
- инфицирования клеток-хозяев рекомбинантным npMDV по любому из пп. 1 или 4,
- отбора клеток-хозяев и
- смешивания отобранных инфицированных клеток-хозяев с фармацевтически приемлемым носителем.

Комментарии