Рекомбинантные вакцины против вируса " синего языка ", их применение - RU2575599C2
Код документа: RU2575599C2
Чертежи




























Описание
Перекрестные ссылки на родственные заявки
Данная заявка заявляет преимущество предварительной заявки США порядковый №61/313,164, поданной 12 марта 2010, и предварительной заявки США порядковый №61/366,363 поданной 21 июля 2010.
Область техники, к которой относится изобретение
Настоящее изобретение имеет отношение к композициям, предназначенным для борьбы с инфекцией вирусом «синего языка» (BTV) у животных. Настоящее изобретение предоставляет фармацевтические композиции, содержащие антиген BTV, способы вакцинации против BTV и наборы, для применения с такими способами и композициями.
Известный уровень техники
«Синий язык» (ВТ) представляет собой передающееся членистоногими инфекционное вирусное заболевание жвачных животных. Крупный рогатый скот и козы могут быть легко инфицированы вирусом «синего языка» (BTV), являющимся причиной болезни, однако при этом отсутствует обширное сосудистое повреждение, и, следовательно, у этих видов в большинстве случаев не наблюдаются выраженные клинические симптомы. В противоположность этому, заболевание у овец характеризуется катаральным воспалением слизистых оболочек рта, носа и переднего отдела желудка, а также воспалением венчика копыт и основы кожи копыт.Происходит отделение (экскориация) эпителия и в конечном итоге некроз слизистой оболочки щеки; опухший и воспаленный язык и рот могут принять синюю окраску, из-за которой болезнь получила свое название (Spreull 1905). Процент смертности среди овец оценивается на уровне 1-30%.
BTV представляет собой прототип вируса рода Orbivirus (семейство Reoviridae) и состоит, по меньшей мере, из 24 различных серотипов (Wilson and Mecham 2000). Различные штаммы BTV выявлены по всей территории тропических и умеренных зон по всему миру. Инфекция BTV встречается до 45° с.ш. в Европе, до 50° с.ш. в Азии и Северной Америке и до 35° на юг. BTV не передается между жвачными животными, следовательно распространение BTV зависит от присутствия членистоногих переносчиков вида coides sp. (мокрецы), причем разных видов-переносчиков в различных регионах мира. Последние данные подтверждают, что дрейф генов и эффект основателя способствует разнообразию отдельных генных сегментов полевых штаммов BTV (Bonneau, Mullens et al. 2001).
Инфекция BTV у жвачных животных является транзиторной (кратковременной), тогда как инфекция, переносимая насекомыми рода Culicoides, является персистирующей. Продолжительность вирусемии (наличия вируса в крови) зависит от вида животного и штамма BTV. Сообщалось, что вирусемия у овец может быть очень кратковременной и может длиться до 41 дня у особей, инфицированных BTV, до 42 дней у коз и до 100 дней у крупного рогатого скота. Так как инфицирование крупного рогатого скота вирусом BTV часто приводит к затянувшейся, но не постоянной вирусемии, крупный рогатый скот служит источником, из которого переносчик рода Culicoides может получить вирус и затем передать его другим жвачным животным (Anderson, Stott et al. 1985; MacLachlan 1994; MacLachlan and Pearson 2004). Экология многих видов переносчиков рода Culicoides плохо изучена, места их размножения в основном неохарактеризованы, и неизвестна скорость их распространения. Основным переносчиком BTV в Северной Америке является Culicoides sonorensis. Самки насекомых Culicoides становятся постоянно инфицированными вирусом BTV и могут передавать вирус после внешнего инкубационного периода, длящегося до 14 дней (Mullens, Tabachnick et al. 1995). BTV, перезимовавший в температурных зонах, может передаваться вертикально у инфицированных насекомых-переносчиков, хотя последние данные указывают, что наблюдается пониженная экспрессия генов внешнего капсида во время персистирующей инфекции BTV на личиночных стадиях насекомых-переносчиков (White, Wilson et al. 2005).
Вирионы BTV имеют диаметр ~69 нм вместе с двойной оболочкой (капсид), который иногда окружен липопротеиновой "псевдо-оболочкой", возникающей из клеточных мембран инфицированных клеток. Геном BTV включает 10 различных сегментов двухцепочечной РНК, которые совместно кодируют семь структурных (с VP1 по VP7) и четыре неструктурных (NS1, NS2, NS3 и NS3a) белка (Roy 1996). Девять из геномных сегментов являются моноцистронными, в то время как сегмент 10 кодирует и NS3 и NS3A с помощью второго инициирующего кодона, находящегося внутри рамки считывания. Икосаэдрическая частица вириона содержит геномную РНК, заключенную в белковый капсид с двухслойной оболочкой (Verwoerd, Els et al. 1972). Сердцевина икосаэдра состоит из двух основных (VP3 и VP7) и трех минорных (VP1, VP4, VP6) белков и окружена внешней капсидной оболочкой, состоящей из VP2 и VP5, которые соответственно кодируются геномными сегментами 2 и 5 (Roy 1996). VP2 является ответственным за связывание и вход BTV в клетки, нейтрализацию, серотип-специфичность и гемагглютинацию. Мультимерные формы VP2 (димеры и тримеры) занимают значительную часть поверхности каркаса VP5 на внешней поверхности вирусных частиц (Hassan and Roy 1999). VP2 варьирует больше всего среди 24 BTV серотипов, при этом уровни анти-VP2 антител коррелируют с нейтрализацией вируса in vitro и in vivo (Huismans and Erasmus 1981). VP5 также заметно варьирует между разными серотипами и штаммами BTV (de Mattos, de Mattos et al. 1994; DeMaula, Bonneau et al. 2000), и, хотя до настоящего времени VP5-специфичные нейтрализующие MAb's не установлены, данные наводят на мысль, что этот белок играет роль в нейтрализации и установлении серотипа посредством его конформационного влияния на VP2 (Huismans and Erasmus 1981; Roy, Urakawa et al. 1990; DeMaula et al., 2000). Очищенный VP2, иммуноабсорбированный с сывороткой против сердцевины BTV для удаления следового количества VP7, обеспечивает защиту от инфекции овец тем же самым BTV серотипом (Huismans, van der Walt et al. 1987). Недавние результаты показывают, что VP2 и NS1 экспрессируют эпитопы, распознаваемые цитотоксическими Т-лимфоцитами (CTL) (Andrew, Whiteley et al. 1995), в то время как маловероятно, что VP7 и VP5 имеют CTL эпитопы. На настоящий момент VP3, VP4, VP6, NS2 и NS3 не стимулировали CTL ответ у овец (Lobato, Coupar et al. 1997).
Lobato и Coupar (Lobato, Coupar et al. 1997) разработали векторы экспрессии на основе вируса осповакцины, содержащие различные вставки, соответствующие нуклеотидным последовательностям, кодирующим структурные белки VP2, VP5 и VP7 вируса BTV для исследований как in vivo так и in vitro. Эти экспрессионные векторы были введены кроликам и овцам для оценки иммунного ответа с помощью ELISA и титра нейтрализующих антител, и была проверена эффективность защиты конструктов VP2 и VP5 у овец. Экспрессированные вирусом осповакцины VP2, VP5 и VP2+VP5 проявили защитные свойств, причем наиболее воспроизводимый защитный эффект наблюдался у животных, иммунизированных и VP2 и VP5, однако защита даже с помощью этого конструкта была изменчива и не вполне эффективна. Были предприняты попытки разработать составы рекомбинантных BTV-вакцин, например, в опубликованной патентной заявке США 2007/280960. Другие авторы описали BTV-иммунологические композиции, содержащие различные BTV-антигены, вырабатываемые, например, бакуловирусом (см., например, патенты США №5,833,995 и 5,690,938).
Таким образом, полезно было бы предоставить усовершенствованные иммуногенные композиции и вакцины против BTV и способы изготовления и применения таких композиций, включая композиции, которые предназначаются для разных способов диагностики, анализов и наборов.
В последнее время исследуется возможность использования растений в качестве источников для получения таких терапевтических средств, как вакцины, антитела и биофармацевтические препараты. Однако, получение вакцин, антител, белков и биофармацевтических препаратов из растений далеко от корректного процесса, при этом существуют многочисленные затруднения, с которыми обычно связано получение таких вакцин. Ограничения, связанные с успешным получением растительных вакцин, включают низкий выход биопродукта или экспрессированного антигена (Chargelegue et al., Trends in Plant Science 2001, 6, 495-496), нестабильность белка, несоответствие качества продукта (Schillberg et al., Vaccine 2005, 23, 1764-1769) и недостаточную способность получать вирусоподобные продукты предполагаемого размера и иммуногенности (Arntzen et al., Vaccine 2005, 23, 1753-1756). Как возможные стратегии для решения этих проблем рассматриваются оптимизация кодонов, тщательные подходы к получению и очистке растительных продуктов, использование частей растений, таких как хлоропласта, для увеличения усвоения сырья и усовершенствованный подбор внутриклеточных мишеней (Koprowski, Vaccine 2005, 23, 1757-1763).
Принимая во внимание восприимчивость животных к BTV, способ предотвращения инфицирования BTV и защиты животных имеет существенное значение. Таким образом, существует необходимость в эффективной вакцине против BTV.
Раскрытие изобретения
Предоставляются композиции, содержащие антигенный BTV-полипептид и его фрагменты и варианты. Антигены BTV и их фрагменты и варианты обладают иммуногенными и защитными свойствами. BTV антигены могут быть получены в растении или водоросли.
Антигенные полипептиды и их фрагменты и варианты могут заключаться в состав вакцин и/или фармацевтических композиций. Такие вакцины можно использовать для вакцинирования животного и обеспечения защиты, по меньшей мере, от одного штамма BTV.
Способы изобретения включают способы получения антигенных полипептидов в растении или водоросли. Способы также включают способы применения, включающие введение животному эффективного количества антигенного полипептида или его фрагмента или варианта с целью получения защитного иммуногенного ответа. После получения в растении или водоросли, антигенный полипептид может быть частично или практически очищенным для использования в качестве вакцины.
Краткое описание чертежей
Следующее подробное описание, представленное как пример, не предназначается для ограничения изобретения только до конкретных описанных вариантов осуществления и может быть лучше понято в совокупности с прилагаемыми чертежами, на которых:
Фигура 1 представляет таблицу, суммирующую SEQ ID NO, соответствующие последовательностям ДНК и белков.
Фигура 2 представляет плазмиду pCG102, кодирующую BTV1 VP5 (SEQ ID NO:10), использованную в качестве положительного контроля при скрининге.
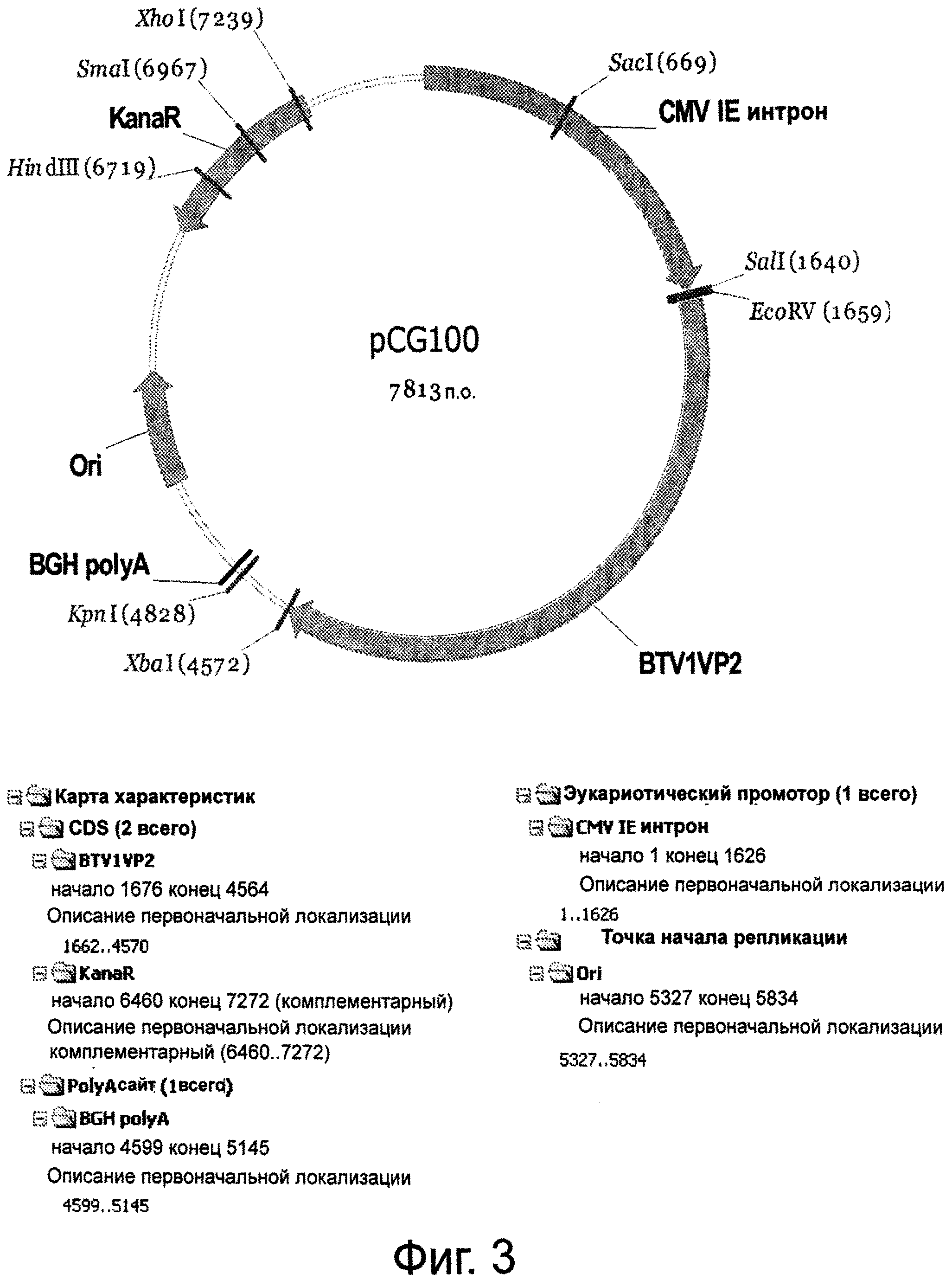
Фигура 3 представляет плазмиду pCG100, кодирующую BTV1 VP2 (SEQ ID NO:4), использованную в качестве положительного контроля при скрининге.
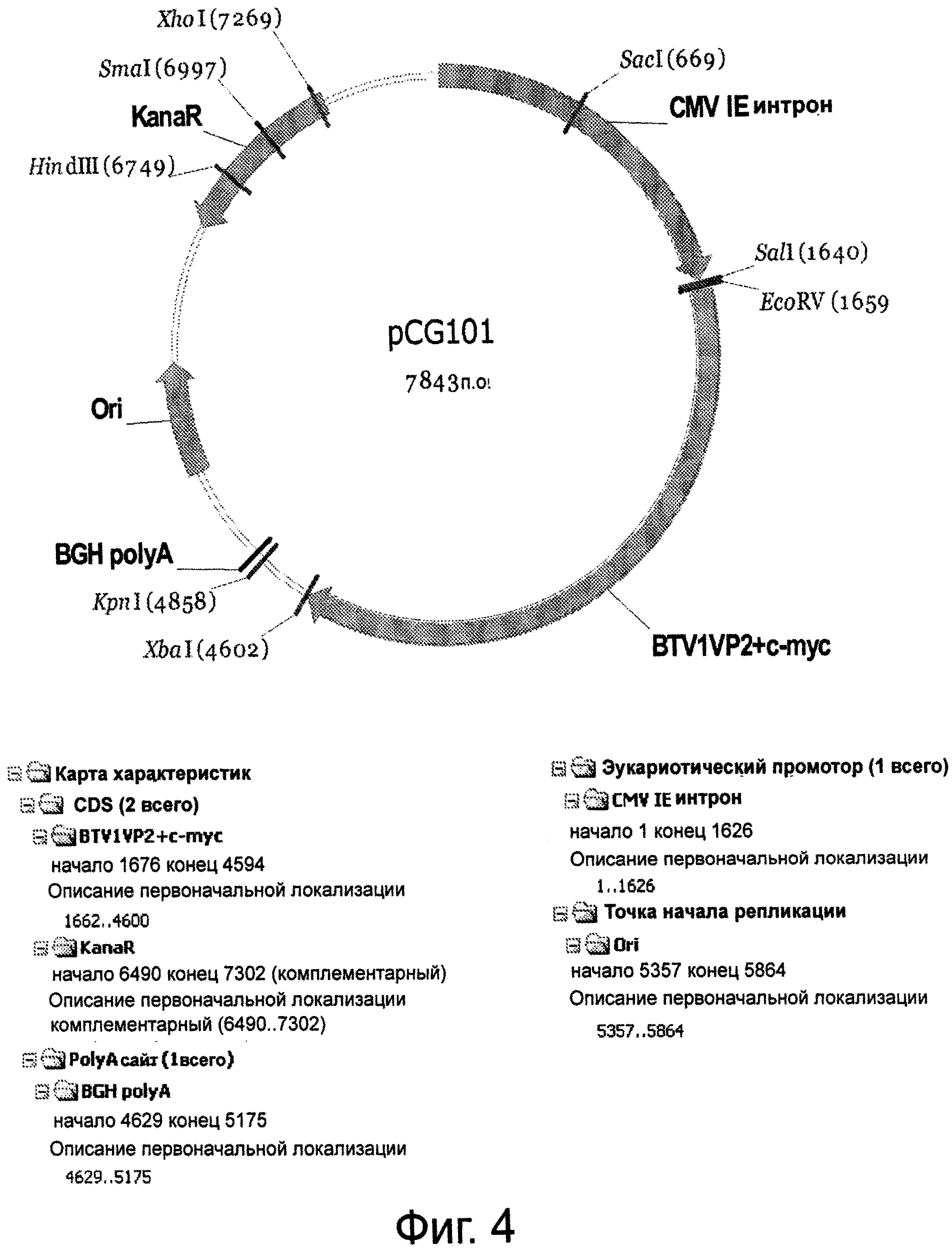
Фигура 4 представляет плазмиду pCG101, кодирующую BTV1 VP2-с-тус (SEQ ID NO:6), использованную в качестве положительного контроля при скрининге.
Фигура 5 демонстрирует Вестерн-блот лизатов клеток линии СНО, показывающий, что антитело AHSV VP5 10АЕ12 селективно обнаруживает белок BTV1 VP5 экспрессированный pCG102 (SEQ ID NO:10).
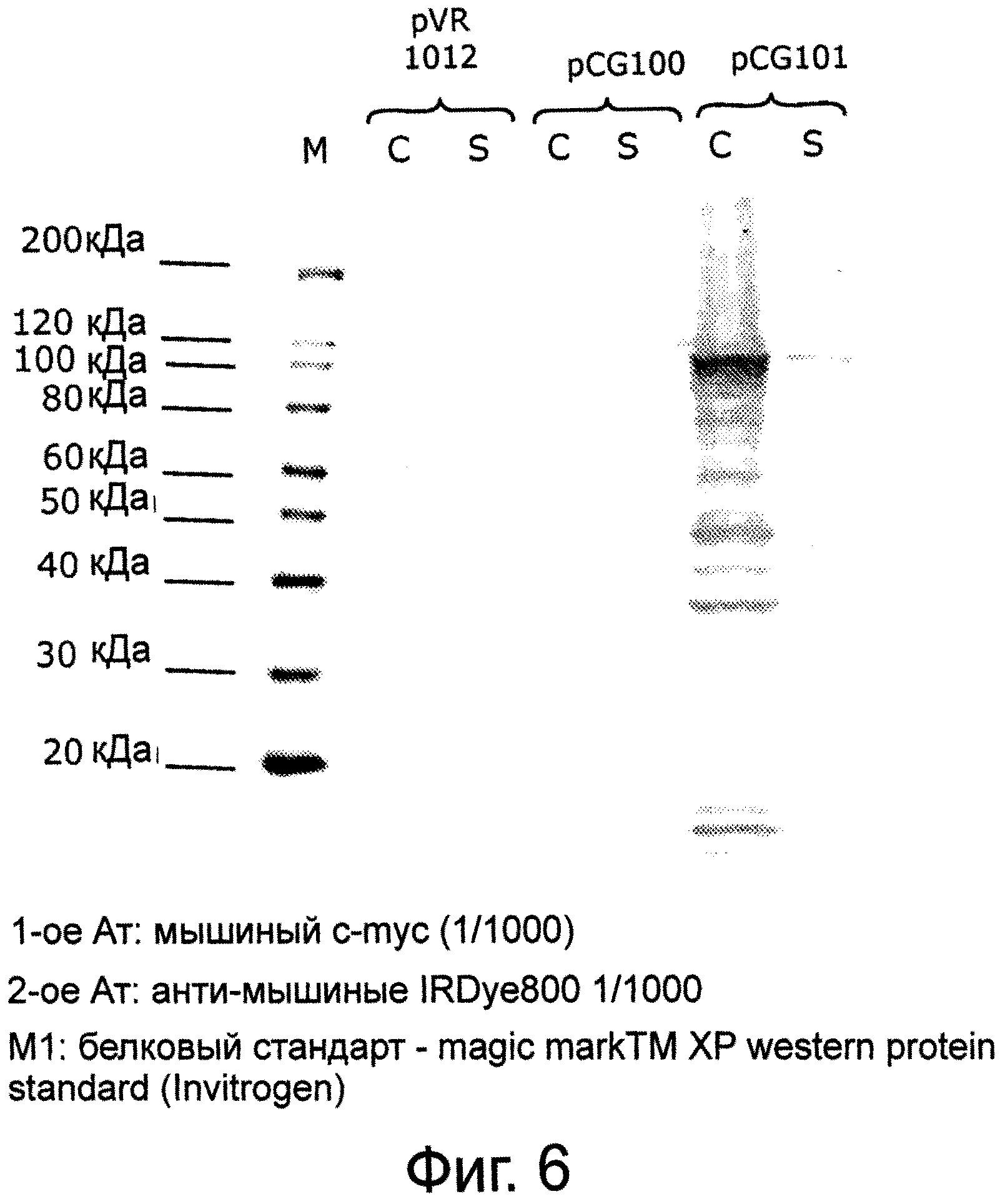
Фигура 6 представляет Вестерн-блот лизатов клеток линии СНО, показывающий, что мышиные анти-с-Myc антитела селективно обнаруживают с-Myc-меченый белок VP2 BTV1 экспрессированный pCG101 (SEQ ID NO:6), но не обнаруживает немеченый белок BTV1 VP2 экспрессированный pCG100 (SEQ ID NO:4).
Фигуры 7а и 7b представляют Вестерн-блоты лизатов клеток линии СНО, которые были трансфицированы указанными конструктами. И L167 и L168 поликлональные BTV1 VP2 антитела селективно обнаруживали белок VP2 (SEQ ID NO:4), экспрессированный в клетках, трансфицированных pCG100.
Фигура 8 показывает выравнивание последовательностей полинуклеотидов, кодирующих BTV VP2, и процент идентичности последовательностей.
Фигура 9 показывает выравнивание последовательностей полинуклеотидов, кодирующих BTV VP5, и процент идентичности последовательностей.
Фигура 10 показывает идентичность и расположение оптимизированных для ряски BTV1 антигенов для 4 экспрессирующих конструкций.
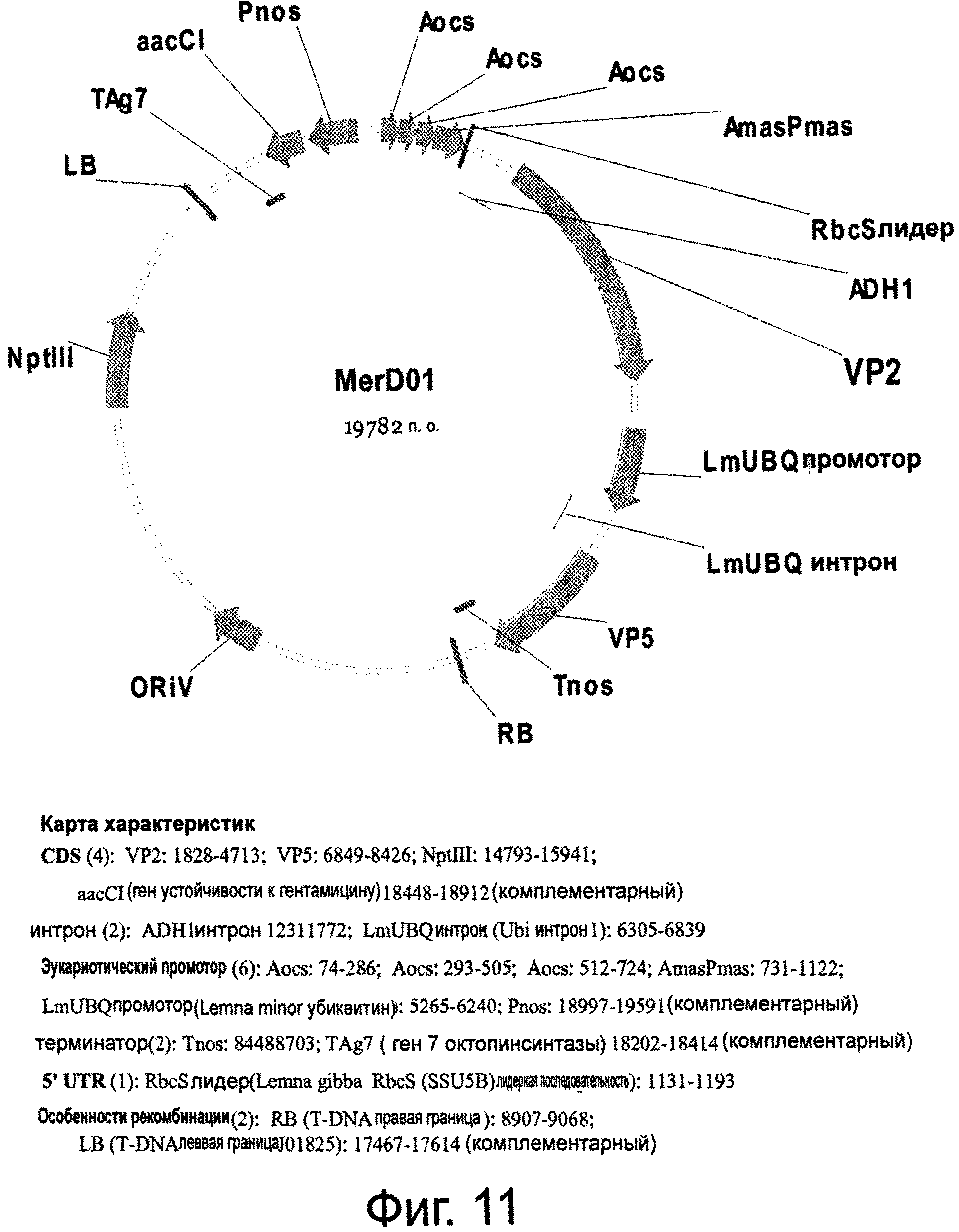
Фигура 11 показывает плазмиду pMerD01, содержащую локализованные в цитоплазме VP2 и VP5, расположенные последовательно.
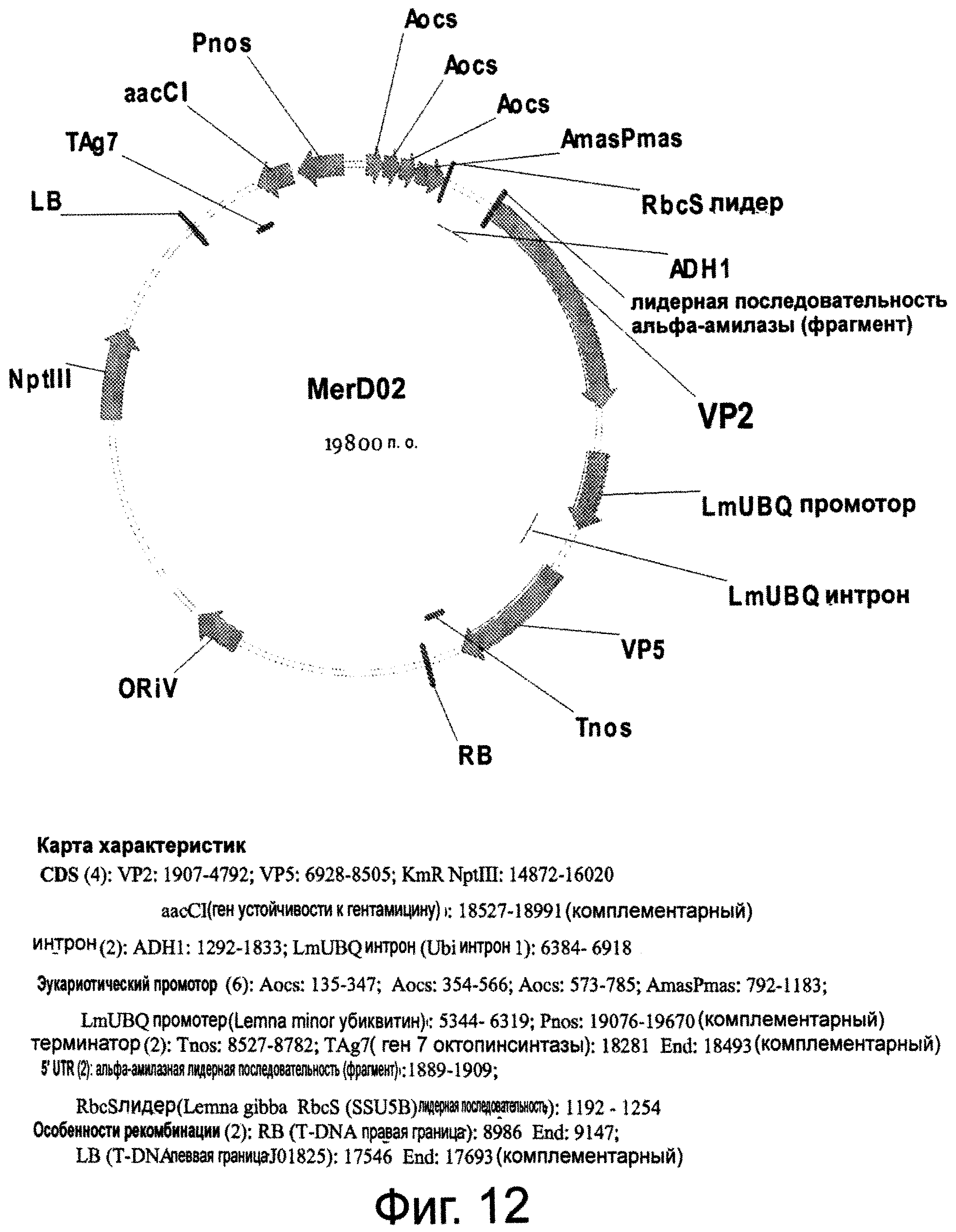
Фигура 12 представляет плазмиду MerD02, содержащую цитоплазматически локализованный VP2 с оптимизированным 5'UTR и VP5, расположенные последовательно.
Фигура 13 представляет плазмиду MerD03, содержащую только локализующийся в цитоплазме VP2 отдельно.
Фигура 14 представляет плазмиду MerD04, содержащую только локализующийся в цитоплазме VP2 с оптимизированным 5'UTR.
Фигура 15 показывает характерные Вестерн-блоты лизатов из ряски, экспрессирующей различные MerD конструкции, полученные при использовании VP2 антител.
Фигура 16 показывает характерные Вестерн-блоты лизатов из ряски, экспрессирующей MerD01 конструкцию, полученные при использовании VP2 и VP5 антител.
Фигура 17 показывает VP2 Вестерн-блоты лизатов из ряски, экспрессирующей MerD01, MerD02, MerD03 и Mer04.
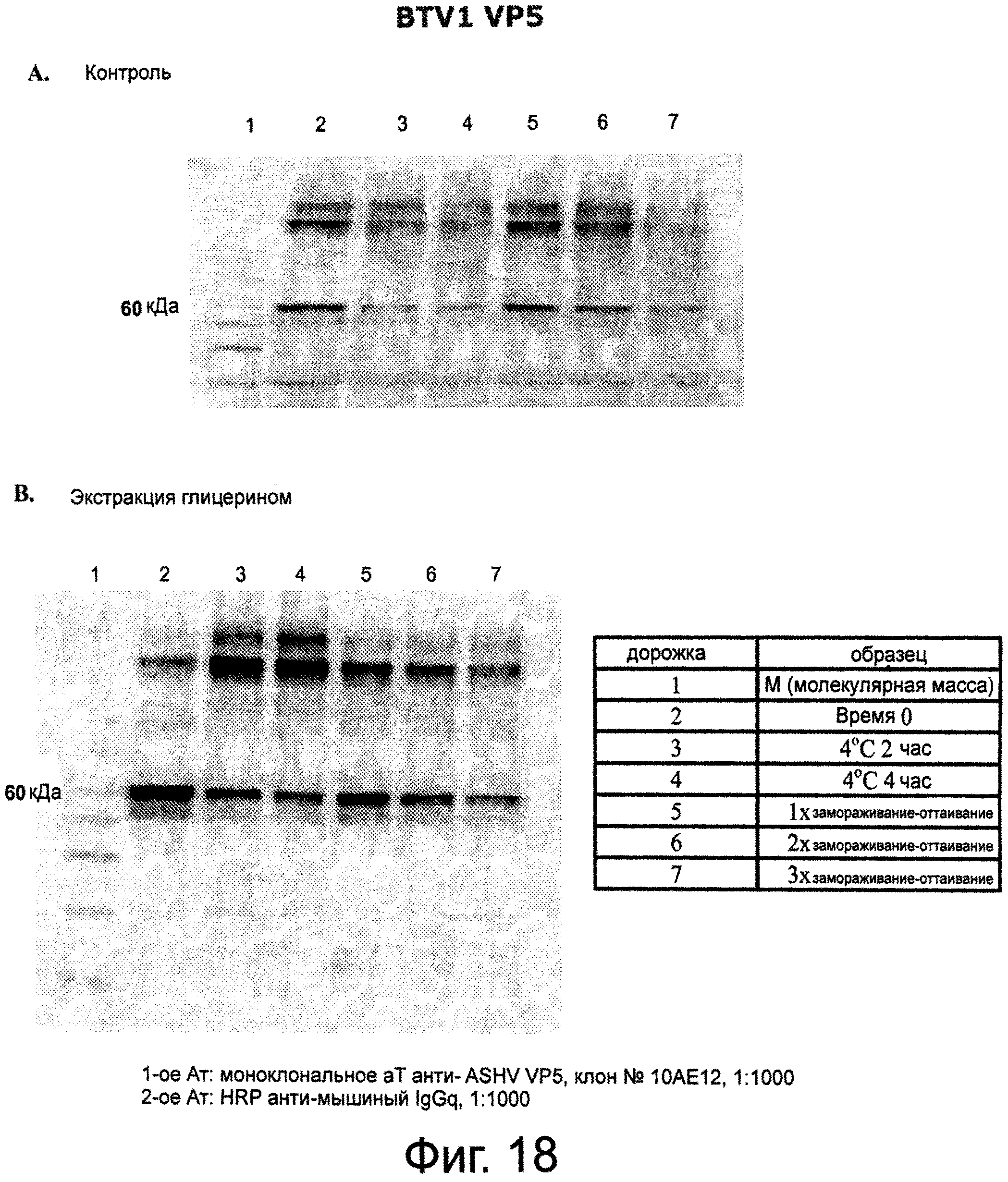
Фигура 18 представляет Вестерн-блот лизатов из ряски, экспрессирующей MerD01 и MerD02, полученные с использованием VP5 моноклональных антител клона #10АЕ12
Фигура 19 показывает характерное изображение денситометрического анализа VP2 при помощи Agilent 2100 Bioanalyzer.
Фигура 20 показывает средний размер местных реакций в месте инъекции.
Фигура 21 показывает ректальную температуру после первой вакцинации BTV.
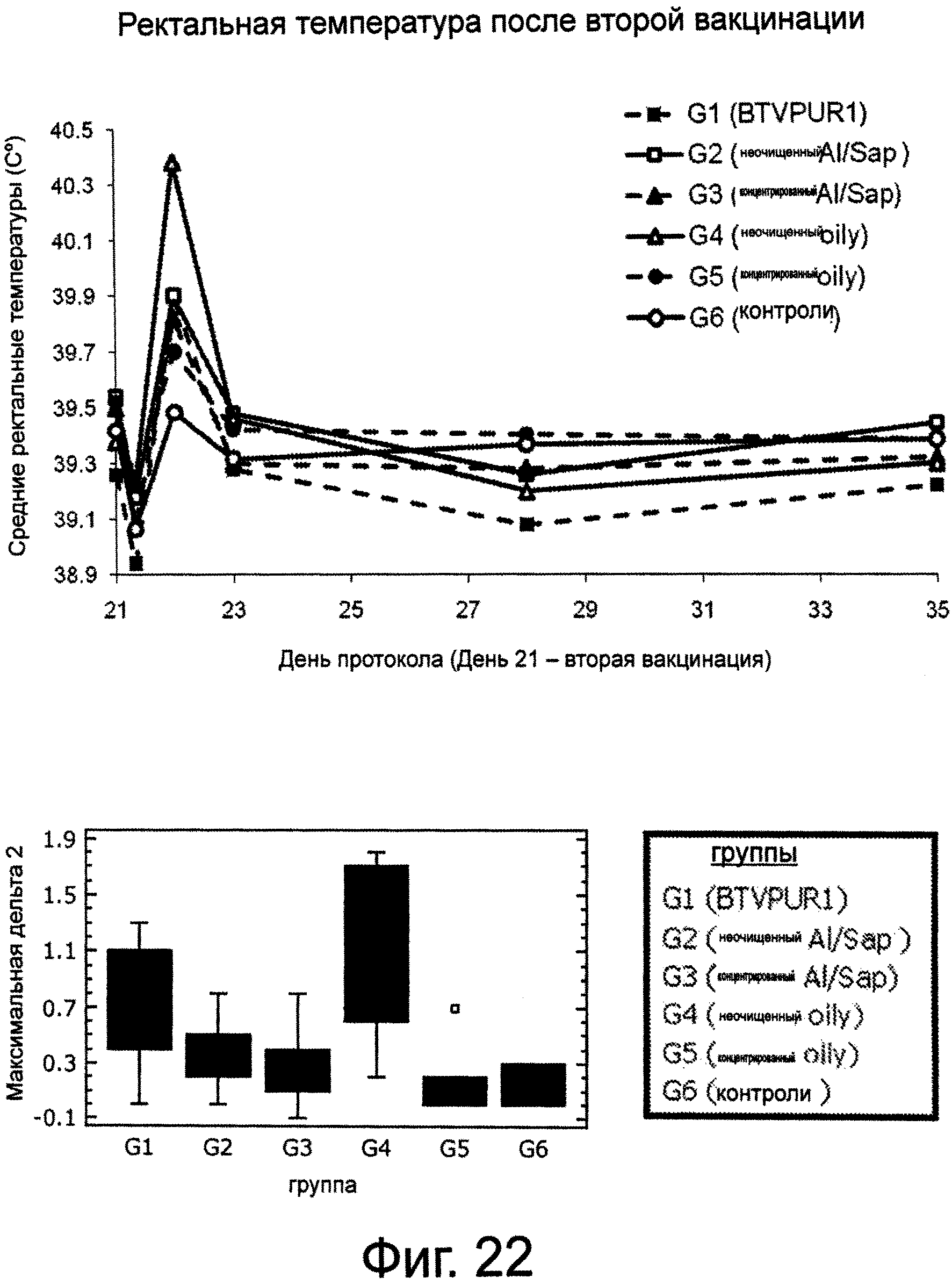
Фигура 22 показывает ректальную температуру после второй вакцинации BTV.
Фигура 23 показывает ректальную температуру после контрольного заражения BTV.
Фигура 24 показывает клинические признаки после контрольного заражения BTV.
Фигура 25 показывает титр BTV1 антител при нейтрализации сывороткой.
Фигура 26 показывает средний титр вирусемии, измеренный с помощью qRT-PCR в каждой лечебной группе.
Фигура 27 показывает выравнивание белковой последовательности BTV1 VP2 и процент идентичности последовательностей.
Фигура 28 показывает выравнивание белковых последовательностей семи последовательностей BTV1 VP5 и одной BTV2 VP5 и процент идентичности последовательностей.
Подробное описание изобретения
Предоставляются композиции, содержащие BTV-полипептид, антиген и его фрагменты и варианты, вызывающие иммуногенный ответ у животного. Антигенные полипептиды или их фрагменты или варианты получают в растении или водорослях. Антигенные полипептиды или их фрагменты или варианты могут быть включены в состав вакцин или фармацевтических композиций и могут использоваться для того, чтобы вызвать или стимулировать защитный ответ у животного. В одном варианте осуществления полипептидный антиген представляет собой BTV VP2 или BTV VP5 полипептид или его активный фрагмент или вариант.
Показано, что антигенные полипептиды изобретения могут быть полноразмерными полипептидами или их активными фрагментами или вариантами. Под термином "активные фрагменты" или "активные варианты" имеется в виду, что фрагменты или варианты сохраняют антигенную природу полипептида. Таким образом, настоящее изобретение включает любой полипептид, антиген, эпитоп или иммуноген BTV, вызывающий иммуногенный ответ у животного. Полипептид, антиген, эпитоп или иммуноген BTV может быть любым полипептидом, антигеном, эпитопом или иммуногеном BTV, таким как, но не ограничиваясь этим, белок, пептид или его фрагмент или вариант, вызывающий, индуцирующий или стимулирующий ответ у животного, такого как овца, корова или коза.
Настоящее изобретение имеет отношение к вакцинам для овец, коров или коз или композициям, которые могут содержать эффективное количество рекомбинантного BTV-антигена и приемлемый фармацевтически или с точки зрения ветеринарии носитель, эксципиент, адъювант или разбавитель.
В некоторых вариантах осуществления вакцины дополнительно содержат адъюванты, например, эмульсии масло-в-воде (O/W), описанные в патенте США 7371395.
В следующих вариантах осуществления адъюванты включают EMULSIGEN®, гидроксид алюминия и сапонин, CpG или их комбинации.
В некоторых вариантах осуществления реакция у животного представляет собой защитный иммунный ответ.
Под термином "животное" имеются в виду млекопитающие, птицы и т.п. Животное или хозяин включает млекопитающих и человека. Животное может быть выбрано из группы, состоящей из представителей семейств лошадиных (например, лошади), псовых (например, собаки, волки, лисы, койоты, шакалы), кошачьих (например, львы, тигры, домашние кошки, дикие кошки и другие виды кошачьих, включая гепардов и рысей), овечьих (например, овца), бычьих (например, рогатый скот), свиньих (например, свиньи), козлиных (например, козы), птичьих (например, курица, утка, гусь, индюк, перепел, фазан, попугай, зяблик, ястреб, ворон, страус, эму и казуар), приматов (например, полуобезьяны, долгопяты, обезьяны, гиббоны, человекообразные обезьяны) и рыб. Термин "животное" также включает отдельное животное на всех стадиях развития, включая эмбриональную и зародышевую стадии.
Термин "растение" при использовании в описании включает и двудольные и однодольные растения. Двудольные растения включают, но не ограничиваются этим, "растения из семейства бобовых, такие как горох, люцерна и соя, морковь, сельдерей, помидор, картофель, табак, перец, масличный рапс, свекла, капуста, цветная капуста, брокколи, салат-латук, арахис и т.п. Однодольные растения включают, но не ограничиваются этим, зерновые культуры, такие как пшеница, ячмень, сорго и просо, рожь, тритикале, кукуруза, рис и овес, сахарный тростник, ряску, злаковые травы и т.п. Термин "растение" также относится к нецветковым растениям, включая, но не ограничиваясь этим, папоротники, хвощи, плауны, лишайники, печеночники, антоцеровые, водоросли. Термин "водоросли" и "водоросль" при использовании в описании включает любой штамм водорослей, способный продуцировать полипептид или его фрагмент или вариант.Водоросли могут включать красные, коричневые и зеленые водоросли, гаметофиты и тому подобное. Водоросли могут быть микроводорослями. Микроводоросли могут быть Thraustochytriaceae, например, Schizochytrium, Thraustochytrium, Labyrinthuloides и Japonochytrium.
В случае, когда не объясняется иначе, все технические и научные термины, использованные в описании, имеют то же самое значение, которое обычно понятно среднему специалисту в области техники, к которой относится это раскрытие. Термины в единственном числе включают объекты во множественном числе, если контекст явно не диктует иначе. Подобным образом, слово "или" предназначается для включения "и", если контекст явно не указывает иначе.
Следует отметить, что в этом раскрытии и в частности в пунктах формулы изобретения и/или параграфах, такие термины как "содержит", "содержащий" и тому подобные могут иметь значение, придаваемое им в законе США о патентах; например, они могут означать "включает", "включенный", "включающий" и тому подобное; и что термины, такие как "состоящий в основном из" и "состоит в основном из" имеют значение, данное им в законе США о патентах, например, они допускают включение элементов, которые непосредственно в них не указаны, но исключают элементы, которые найдены в известном уровне техники или затрагивают основную или новую характеристику изобретения.
Антигенные полипептиды изобретения способны защищать от BTV. То есть они способны стимулировать иммунный ответ у животного. Под "антигеном" или "иммуногеном" имеется в виду субстанция (вещество), которая вызывает специфическую иммунную реакцию у животного-хозяина. Антиген может являться целым организмом, убитым, ослабленным или живым; субъединицей или частью организма; рекомбинантным вектором, содержащим вставку с иммуногенными свойствами; частью или фрагментом ДНК, способным вызвать иммунный ответ после презентирования животному-хозяину; полипептидом, эпитопом, гаптеном или любой их комбинацией. Альтернативно, иммуноген или антиген может содержать токсин или антитоксин.
Термин "иммуногенный белок, полипептид или пептид" при использовании в описании включает полипептиды, являющиеся иммунологически активными в том смысле, что сразу после введения хозяину они способны вызвать иммунный ответ гуморального или клеточного типа, направленный против белка. Предпочтительно белковый фрагмент является таким, что он в основном обладает той же самой иммунологической активностью, как полный белок. Таким образом, белковый фрагмент согласно изобретению содержит или состоит в основном из или состоит, по меньшей мере, из одного эпитопа или антигенной детерминанты. "Иммуногенный" белок или полипептид при использовании в описании включает полную последовательность белка, его аналоги или его иммуногенные фрагменты. Под "иммуногенным фрагментом" имеется в виду фрагмент белка, включающий один или более эпитопов, и таким образом вызывающий иммунологический ответ, описанный выше. Такие фрагменты можно установить с помощью ряда методов картирования эпитопов, хорошо известных в данной области техники. См., например, Epitope Mapping Protocols in Methods in Molecular Biology, Vol.66 (Glenn E. Morris, Ed., 1996). Например, линейные эпитопы могут быть определены с помощью, например, одновременного синтеза большого количества пептидов на твердых подложках, данные пептиды соответствуют частям белковой молекулы, и проведения реакции пептидов с антителами в то время как пептиды являются все еще прикрепленными к подложкам. Такие методы известны в данной области техники и описаны, например, в патенте США №4,708,871; Geysen et al., 1984; Geysen et al., 1986. Подобным образом, конформационные эпитопы легко установить путем определения пространственной конформации аминокислот, например, с помощью рентгеноструктурного анализа и 2-мерного ядерного магнитного резонанса. См., например, Epitope Mapping Protocols, выше.
Как было сказано выше, изобретение включает активные фрагменты и варианты антигенного полипептида. Таким образом, термин "иммуногенный белок, полипептид или пептид" дополнительно охватывает последовательности с делециями, вставками и заменами, при условии, что полипептид действует и вызывает иммунологический ответ, как определено в описании. Термин "консервативное изменение" обозначает замену остатка аминокислоты другим биологически подобным остатком, или такую замену нуклеотида в нуклеиновокислотной последовательности, что кодируемый аминокислотный остаток не изменяется или заменяется на биологически сходный остаток. В этом отношении, особенно предпочтительными заменами являются в большинстве "случаев консервативные по природе, т.е. те замены, которые происходят внутри семейства аминокислот. Например, аминокислоты делятся на четыре семейства: (1) кислые - аспартат и глутамат; (2) основные - лизин, аргинин, гистидин; (3) неполярные - аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан; и (4) незаряженные полярные - глицин, аспарагин, глутамин, цистеин, серии, треонин, тирозин. Фенилаланин, триптофан и тирозин иногда относят к ароматическим аминокислотам. Примеры консервативных изменений включают замену одного гидрофобного остатка, такого как изолейцин, валин, лейцин и метионин на другой гидрофобный остаток, или замену одного полярного остатка на другой полярный остаток, например, замену аргинина на лизин, глутаминовой кислоты на аспарагиновую кислоту или глутамина на аспарагин и тому подобное; или сходную консервативную замену аминокислоты структурно родственной аминокислотой, не оказывающей большого влияния на биологическую активность. Белки, имеющие в основном ту же самую аминокислотную последовательность, как исходная молекула, однако имеющие незначительные аминокислотные замены, не влияющие существенно на иммуногенность белка попадают, следовательно, под определение исходного полипептида. Сюда включаются все полипептиды, полученные в результате этих модификаций. Термин "консервативное изменение" также включает использование замещенной аминокислоты вместо незамещенной исходной аминокислоты, при условии, что антитела индуцированные к замещенному полипептиду, также вступают в иммунореакцию с незамещенным полипептидом.
Термин "эпитоп" относится к месту (сайту) на антигене или гаптене, на который реагируют специфические В-клетки и/или Т-клетки. Этот термин также используется взаимозаменяемым образом с термином "антигенная детерминанта" или "сайт антигенной детерминанты". Антитела, распознающие один и тот же эпитоп, могут быть установлены с помощью простого иммуноанализа, показывающего способность одного антитела препятствовать связыванию другого антитела с антигеном-мишенью.
"Иммунологический ответ" на композицию или вакцину - это развитие у хозяина клеточного и/или опосредованного антителами иммунного ответа на интересующую композицию или вакцину. В большинстве случаев "иммунологический ответ" включает, но не ограничивается этим, один или более из следующих эффектов: выработку антител, В-клеток, хелперных Т-клеток и/или цитотоксических Т-клеток, специфически направленных на антиген или антигены, включенные в интересующую композицию или вакцину. Предпочтительно, что хозяин будет демонстрировать или терапевтический или защитный иммунологический ответ, так что устойчивость к новой инфекции будет увеличиваться и/или снижаться клиническая тяжесть болезни. Такую защиту можно обнаружить по уменьшению или отсутствию симптомов, обычно наблюдаемых у инфицированного хозяина, более быстрому времени восстановления и/или более низкому титру вируса у инфицированного хозяина.
Синтетические антигены также включаются в определение, например, полиэпитопы, фланкирующие эпитопы и другие рекомбинантные или полученные синтетическим путем антигены. См., например, Bergmaim et al., 1993; Bergmaim et al., 1996; Suhrbier, 1997; Gardner et al., 1998. Иммуногенные фрагменты для целей настоящего изобретения в большинстве случаев будут включать, по меньшей мере, около 3 аминокислот, по меньшей мере, около 5 аминокислот, по меньшей мере, около 10-15 аминокислот или около 15-25 аминокислот или более аминокислот молекулы. Не существует критического верхнего предела для длины фрагмента, который может содержать почти полную длину белковой последовательности, или даже гибридный белок, содержащий по меньшей мере один эпитоп белка.
Соответственно, минимальная структура полинуклеотида, экспрессирующего эпитоп, - это структура, которая содержит или состоит в основном из или состоит из нуклеотидов, кодирующих эпитоп или антигенную детерминанту BTV полипептида. Полинуклеотид, кодирующий фрагмент BTV полипептида, может содержать или состоять в основном из или состоять минимум из 15 нуклеотидов, примерно 30-45 нуклеотидов, примерно 45-75 или по меньшей мере 57, 87 или 150 последовательных или соседних нуклеотидов последовательности, кодирующей полипептид. При использовании изобретения на практике можно применять такие методы определения эпитопов, как создание перекрывающихся пептидных библиотек (Hemmer et al., 1998), систему Pepscan (Geysen et al., 1984; Geysen et al., 1985; Van der Zee R. et al., 1989; Geysen, 1990; Multipin. RTM. Peptide Synthesis Kits de Chiron) и алгоритмы (De Groot et al., 1999;
PCT/US2004/022605).
Термин "нуклеиновая кислота" или "полинуклеотид" относится к РНК или ДНК, являющейся линейной или разветвленной, одноцепочечной или двухцепочечной, или ее гибриду. Термин также включает гибриды РНК/ДНК. Ниже перечислены неограничивающие примеры полинуклеотид ов: ген или генный фрагмент, экзоны, интроны, мРНК, тРНК, рРНК, рибозимы, кДНК, рекомбинантные полинуклеотиды, разветвленные полинуклеотиды, плазмиды, векторы, изолированная ДНК любой последовательности, изолированная РНК любой последовательности, нуклеиновокислотные пробы и праймеры. Полинуклеотид может включать модифицированные нуклеотиды, такие как метилированные нуклеотиды и аналоги нуклеотидов, урацил, другие сахара и связывающие группы, такие как фторрибоза и тиолат, и ветви нуклеотидов. Последовательность нуклеотидов может быть дополнительно модифицирована после полимеризации, например, путем конъюгирования с меченым компонентом. Другими типами модификаций, включенными в это определение, являются кэпы, замещение одного или более природных нуклеотидов аналогом и введение его посредством присоединения полинуклеотида к белкам, металлические ионы, меченые компоненты, другие полинуклеотиды или твердая подложка. Полинуклеотиды могут быть получены путем химического синтеза или получены от микроорганизма.
Термин "ген" используется широко для упоминания любого сегмента полинуклеотида, имеющего отношение к биологической функции. Таким образом, гены включают интроны и экзоны, как и в геномной последовательности, или только кодирующие последовательности как в кДНК и/или регуляторные последовательности, необходимые для их экспрессии. Например, ген также относится к нуклеиновокислотному фрагменту, экспрессирующему мРНК или функциональную РНК, или кодирующему специфический белок, и включающему регуляторные последовательности.
Кроме того, изобретение включает комплементарную цепочку к полинуклеотиду, кодирующему BTV-антиген, эпитоп или иммуноген. Комплементарная цепочка может быть полимерной и любой длины, а также может содержать дезоксирибонуклеотиды, рибонуклеотиды и аналоги в любой комбинации.
Термины "белок", "пептид", "полипептид" и "полипептидный фрагмент" используются в описании взаимозаменяемо для упоминания полимеров любой длины, состоящих из аминокислотных остатков. Полимер может быть линейным или разветвленным, он может содержать модифицированные аминокислоты или аналоги аминокислот, причем он может прерываться химическими группами (фрагментами), отличными от аминокислот. Эти термины также включают аминокислотный полимер, модифицированный естественным путем или посредством вмешательства; например, образованием дисульфидной связи, гликозилированием, липидизацией, ацетилированием, фосфорилированием или путем любой другой манипуляции или модификации, такой как соединение с меченым или биоактивным компонентом.
"Изолированный" биологический компонент (такой как нуклеиновая кислота или белок или органелла) относится к компоненту, который практически отделен или очищен от других биологических компонентов в клетке организма, где компонент встречается в естественных условиях, например, других хромосомных и экстра-хромосомных ДНК и РНК, белков и органелл. "Изолированные" нуклеиновые кислоты и белки включают нуклеиновые кислоты и белки, очищенные с помощью стандартных методов. Термин также включает нуклеиновые кислоты и белки, полученные с помощью рекомбинантных методов, а также химического синтеза.
Использование в описании термина "очищенный" не подразумевает абсолютной чистоты; скорее термин используется как относительный. Таким образом, например, очищенный полипептидный препарат - это препарат, более богатый полипетидом по сравнению с его содержанием в естественной среде. То есть полипептид является отделенным от клеточных компонентов. Под термином "практически очищенный" подразумевается, что полипептид представляет собой несколько вариантов осуществления, когда удалено по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%, или по меньшей мере 98%, или более клеточных компонентов или материалов. Подобным образом, полипептид может быть частично очищенным. Под термином "частично очищенный" имеется в виду, что удалено менее, чем 60% клеточных компонентов или материалов. То же самое применимо к полинуклеотидам. Раскрытые в описании полипептиды могут быть очищены с помощью любых известных в данной области техники способов.
Как было указано выше, антигенные полипептиды или их фрагменты или варианты представляют собой антигенные полипептиды BTV, которые получены в растении или водоросли. Фрагменты и варианты раскрытых полинуклеотидов и полипептидов, кодируемых ими, также рассматриваются настоящим изобретением. Под "фрагментом" имеется в виду часть полинуклеотида или часть антигенной аминокислотной последовательности, кодированной им. Фрагменты полинуклеотида могут кодировать белковые фрагменты, сохраняющие биологическую активность природного белка и, следовательно, обладают иммуногенной активностью, как отмечается в других местах в описании. Фрагменты полипептидной последовательности сохраняют способность вызывать защитный иммунный ответ у животного.
"Варианты" означают в значительной степени похожие последовательности. Относительно полинуклеотидов, вариант содержит выпадение (делецию) и/или вставку одного или более нуклеотидов в одном или более участках внутри природного полинуклеотида и/или замену одного или более нуклеотидов на одном или более участках в природном полинуклеотиде. При использовании в описании "природный" полинуклеотид или полипептид включает существующую в природе нукдеотидную последовательность или аминокислотную последовательность, соответственно. Варианты отдельного, полинуклеотида изобретения (т.е. исходного полинуклеотида) также можно оценить путем сравнения процента идентичности последовательности между полипептидом, который кодируется вариантом полинуклеотида, и полипептидом, кодируемым исходным полинуклеотидом. "Вариант" белка означает белок, полученный из природного белка при удалении или добавлении одной или более аминокислот в одном или более участках в природном белке и/или заменой одной или более аминокислот на одном или более участках природного белка. Варианты белков, рассматриваемые настоящим изобретением, являются биологически активными, то есть способными вызвать иммунный ответ.
В одном аспекте настоящее изобретение предоставляет BTV-полипептиды, полученные от животных семейств овечьих, бычьих или козлиных. В другом аспекте настоящее изобретение предоставляет полипептид, имеющий последовательность, представленную в SEQ ID NO:4, 6, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25, и его вариант или фрагмент.
Боле того, гомологи BTV-полипептидов, полученных от животных семейств овечьих, бычьих или козлиных, рассматриваются в рамках настоящего изобретения. При использовании в описании термин "гомологи" включает ортологи, аналоги и паралоги. Термин "аналоги" относится к двум полинуклеотидам или полипептидам, имеющим одинаковую или сходную функцию, но которые обнаружены отдельно в неродственных организмах. Термин "ортологи" относится к двум полинуклеотидам или полипептидам от разных видов, но которые развились от общего предкового гена при видообразовании. Как правило, ортологи кодируют полипептиды, имеющие одинаковые или сходные функции. Термин "паралоги" относится к двум полинуклеотидам или полипептидам, полученным в результате удвоения в геноме. Обычно паралоги имеют разные функции, однако эти функции могут быть родственными. Аналоги, ортологи и паралоги BTV-полипептида дикого типа могут отличаться от BTV-полипептида дикого типа посттрансляционными модификациями, различиями в аминокислотных последовательностях или и тем и другим. В частности, гомологи изобретения в большинстве случаев будут демонстрировать, по меньшей мере, 80-85%, 85-90%, 90-95% или 95%, 96%, 97%, 98%, 99% идентичности последовательности со всеми или частью полипептидными или полинуклеотидными последовательностями BTV дикого типа, и будут демонстрировать сходную функцию. Варианты включают аллельные варианты. Термин "аллельный вариант" относится к полинуклеотиду или полипептиду, содержащему полиморфизмы, которые приводят к изменениям в аминокислотных последовательностях белка и которые существуют внутри природной популяции (например, виды или разновидности вирусов). Такие природные аллельные изменения могут приводить к 1-5% изменению в полинуклеотиде или полипептиде. Аллельные варианты могут быть установлены с помощью секвенирования (установления последовательности) интересующей нуклеиновокислотной последовательности у нескольких различных видов, которое может быть легко выполнено с помощью гибридизационных зондов для установления одинаковых генетических локусов в этих видах. Все и любые подобные нуклеиновокислотные изменения и полученные в результате аминокислотные полиморфизмы или изменения, являющиеся результатом природного аллельного изменения и неизменяющие функциональную активность представляющего интерес гена, включаются в рамки изобретения.
При использовании в описании термин "производное" или "вариант" относится к полипептиду или нуклеиновой кислоте, кодирующей полипептид, который имеет одно или более консервативных аминокислотных изменений или другие незначительные изменения, например, (1) соответствующий полипептид имеет в основном эквивалентную функцию по сравнению с полипептидом дикого типа или (2) антитело, индуцированное к полипептиду, является иммунореактивным в отношении полипептида дикого типа. Эти варианты или производные включают полипептиды, имеющие незначительные модификации первичных аминокислотных последовательностей BTV-полипептида, что может давать в результате пептиды, обладающие по существу равноценной активностью по сравнению с соответствующим немодифицированным полипептидом. Такие модификации могут быть преднамеренными, как например, полученные с помощью сайт-направленного мутагенеза, или могут быть спонтанными. Термин "вариант" дополнительно включает делеции, вставки и замены в последовательности, если полипептид функционирует и вызывает иммунологический ответ, как описано здесь.
Термин "консервативное изменение" означает замену аминокислотного остатка другим биологически сходным остатком, или замену нуклеотида в нуклеиновокислотной последовательности, при которой кодируемый аминокислотный остаток не изменяется или является другим биологически сходным остатком. В этом отношении особенно предпочтительными заменами будут консервативные по природе замены, как описано выше.
Полинуклеотиды раскрытия включают последовательности, которые вследствие вырожденности генетического кода являются вырожденными, например, у них оптимизирована частота использования кодона для конкретного хозяина. При использовании в описании термин "оптимизированный" относится к полинуклеотиду, созданному генно-инженерными методами для увеличения его экспрессии в данных видах. Для предоставления оптимизированных полинуклеотидов, кодирующих BTV-полипептиды, ДНК последовательность гена BTV-белка может быть модифицирована для того, чтобы 1) включать кодоны предпочитаемые высокоэкспрессированными генами в конкретных видах; 2) включать содержание А+Т или G+C в составе нуклеиновых оснований соответствующее содержанию, обнаруженному в указанных видах; 3) создать инициирующую последовательность указанных видов; или 4) устранить последовательности, которые вызывают дестабилизацию, ненадлежащее полиаденилирование, деградацию и терминацию РНК, или которые образуют вторичную структуру типа «шпилек» или сайты сплайсинга РНК. Повышенная экспрессия BTV белка в указанных видах может быть достигнута при использовании частоты распределения используемых кодонов у эукариот и прокариот или в конкретных видах. Термин частота предпочтительно используемого кодона относится к предпочтению, которое проявляет отдельная клетка-хозяин при использовании нуклеотидных кодонов для определения заданной аминокислоты. Существует 20 природных аминокислот, большинство из которых определяется более чем одним кодоном. Следовательно, все вырожденные нуклеотидные последовательности включаются в раскрытие, если аминокислотная последовательность BTV полипептида, кодированного нуклеотидной последовательностью, является функционально неизменившейся.
Идентичность между двумя аминокислотными последовательностями может быть установлена с помощью обеспечиваемого NCBI (Национальным центром биотехнологической информации) попарного анализа blast и матрицы blosum62 с использованием стандартных параметров (см., например BLAST или BLASTX алгоритм, доступный на сервере "National Center for Biotechnology Information" (NCBI, Bethesda, Md., США), а также в работе Altschul et al.; таким образом данный документ упоминает о применении алгоритма или BLAST или BLASTX и матрицы BLOSUM62 под термином "blasts").
"Идентичность" в отношении последовательностей может относиться к числу положений с идентичными нуклеотидами или аминокислотами, деленному на число нуклеотидов или аминокислот в более короткой из двух последовательностей, при этом выравнивание двух последовательностей может определяться в соответствии с алгоритмом Вилбура и Липмана (Wilbur and Lipman), например, используя размер окна 20 нуклеотидов, длину слова из 4 нуклеотидов, штраф за пропуск в последовательности 4, и компьютеризированный анализ и интерпретацию данных о последовательности, включая выравнивание, можно удобно осуществить с помощью коммерчески доступных программ (например, Intelligenetics™ Suite, hitelligenetics Inc. CA). В том случае, когда РНК-последовательности называются подобными или имеют степень идентичности последовательностей или гомологию с ДНК-последовательностями, тимидин (Т) в ДНК-последовательности считается равным урацилу (U) в РНК-последовательности. Таким образом, РНК-последовательности находятся в рамках изобретения и могут быть получены из ДНК-последовательности, тимидин (Т) в ДНК-последовательности считается равным урацилу (U) РНК-последовательностей.
Идентичность или подобие двух аминокислотных последовательностей или идентичность между двумя нуклеотидными последовательностями может быть определена с помощью комплекта программного обеспечения Vector NTI (Invitrogen, 1600 Faraday Ave., Carlsbad, CA).
Следующие документы предоставляют алгоритмы для сравнения относительной идентичности или гомологии последовательностей, и дополнительно или альтернативно в отношении вышеизложенного, методы, представленные в этих ссылках, могут использоваться для определения процента гомологии или идентичности: Needleman SB and Wunsch CD; Smith TF and Waterman MS; Smith TF, Waterman MS and Sadler JR; Feng DF and Dolittle RF; Higgins DG and Sharp PM; Thompson JD, Higgins DG and Gibson TJ; and, Devereux J, Haeberlie P and Smithies О. И, не прибегая к чрезмерному экспериментированию, специалист в данной области может принять во внимание многие другие программы или ссылки для определения процента гомологии.
Реакции гибридизации могут проводиться в условиях разной "жесткости." Условия, повышающие жесткость реакции гибридизации, хорошо известны. См., например, "Molecular Cloning: A Laboratory Manual", второе издание (Sambrook et al., 1989).
Кроме того, изобретение включает BTV-полинуклеотиды, входящие в состав молекулы-вектора или вектора экспрессии, и функционально связанные с промоторным элементом и необязательно с энхансером.
"Вектор" относится к рекомбинантной ДНК или РНК плазмиде или вирусу, содержащему гетерологичный полинуклеотид, который следует доставить в клетку-мишень или in vitro или in vivo. Гетерологичный полинуклеотид может содержать представляющую интерес последовательность в целях предотвращения или лечения, и может необязательно быть в форме кассеты экспрессии. При использовании в описании вектор может и не быть способным к репликации в конечной клетке-мишени или субъекте. Термин включает клонирующие векторы и вирусные векторы.
Термин "рекомбинантный" означает полинуклеотид полусинтетического или синтетического происхождения, который или не встречается в природе или является связанным с другим полинуклеотидом в конфигурации, не обнаруженной в природе.
"Гетерологичный" означает полученный из организма, генетически отличного от остальной части организма, с которой сравнивается. Например, полинуклеотид с помощью методов генной инженерии может быть помещен в плазмиду или вектор, полученный из другого источника, при этом полинуклеотид является гетерологичным полинуклеотидом. Промотор, удаленный из его природной кодирующей последовательности и функционально связанный с кодирующей последовательностью отличной от природной последовательности, является гетерологичным промотором.
Настоящее изобретение имеет отношение к вакцинам для овец, коров и коз или фармацевтичесим или иммунологическим композициям, которые могут содержать эффективное количество рекомбинантных BTV-антигенов и фармацевтически или с точки зрения ветеринарии приемлемый носитель, эксципиент или разбавитель.
Предмет изобретения, описанный здесь, отчасти имеет отношение к композициям и способам, связанным с полученным в экспрессирующей системе растения или водоросли BTV-антигеном, который был высокоиммуногенным и способным защищать животных от заражения штаммами BTV.
Композиции
Настоящее изобретение имеет отношение к BTV-вакцине или композиции, которая может содержать эффективное количество рекомбинантного BTV-антигена и фармацевтически или с точки зрения ветеринарии приемлемый носитель, эксципиент или разбавитель. В одном варианте осуществления рекомбинантный BTV-антиген экспрессируется в растении или водоросли.
В одном варианте осуществления предмет изобретения, раскрытый в описании, имеет отношение к композиции, содержащей BTV-антиген, продуцируемый экспрессирующей системой ряски, и растительный материал из ряски, включая род Lemna, и фармацевтически или с точки зрения ветеринарии приемлемый носитель, эксципиент или разбавитель.
В одном варианте осуществления рекомбинантный BTV-антиген экспрессируется в водоросли. В еще одном варианте осуществления водоросли выбирают из Schizochytrium. В одном варианте осуществления рекомбинантный BTV-антиген может быть экспрессирован в системе экспрессии белка Schizochytrium, как описано, например, в патенте США №7,001,772 и опубликованной патентной заявке США №2008/0022422.
В одном варианте осуществления предмет изобретения, раскрытый в описании, имеет отношение к белку, произведенному экспрессирующей системой растения или водоросли, содержащему BTV-антиген и материал из растения или водоросли.
В одном варианте осуществления предмет изобретения, раскрытый в описании, имеет отношение к вакцине или композиции, содержащей BTV-антиген, произведенный экспрессирующей системой ряски, и растительный материал из ряски.
В одном варианте осуществления предмет изобретения, раскрытый в описании, имеет отношение к стабильно трансформированному растению или растительной культуре, экспрессирующей BTV-антиген, причем растение или растительная культура представляет собой ряску.
Настоящее изобретение включает любой BTV полипептид, антиген, эпитоп или иммуноген, вызывающий иммуногенный ответ у животного, такого как овца, корова или коза. BTV полипептид, антиген, эпитоп или иммуноген может быть любым BTV полипептидом, антигеном, эпитопом или иммуногеном, таким как, но не ограничиваясь этим, белок, пептид или его фрагмент, который вызывает, индуцирует или стимулирует ответ у животного, такого как овца, корова или коза.
В некотором варианте осуществления BTV иммунологическая композиция или вакцина является рекомбинантной иммунологической композицией или вакциной, при этом композиция или вакцина содержит рекомбинантный вектор и приемлемый фармацевтически или с точки зрения ветеринарии эксципиент, носитель или разбавитель; рекомбинантный вектор представляет собой растительный вектор экспрессии, который может содержать полинуклеотид, кодирующий полипептид, антиген, эпитоп или иммуноген. BTV полипептид, антиген, эпитоп или иммуноген может быть VP1, VP2, VP3, VP4, VP5, NS1, VP7, NS2, VP6, NS3, NS3a или любым их фрагментом.
В другом варианте осуществления BTV полипептид, антиген, эпитоп или иммуноген может быть получен от овцы, коровы или козы, инфицированной штаммом BTV. В одном варианте осуществления BTV антиген, эпитоп или иммуноген представляет собой РНК полимеразу (VP1), внешний капсидный белок (VP2, VP5), внутренний капсидный белок (VP3), кэпирующий фермент (VP4), белок, формирующий трубочки (NS1), белок внешней поверхности сердцевины (VP7), матриксный белок (NS2), хеликазу (VP6) и гликопротеины (NS3 и NS3a).
В некотором варианте осуществления, в котором BTV иммунологическая композиция или вакцина является рекомбинантной иммунологической композицией или вакциной, композиция или вакцина содержит рекомбинантный вектор и приемлемый фармацевтически или приемлемый с точки зрения ветеринарии эксципиент, носитель или разбавитель; рекомбинантный вектор является растительным вектором экспрессии, который может содержать полинуклеотид, кодирующий полипептид, антиген, эпитоп или иммуноген BTV. Полипептид, антиген, эпитоп или иммуноген BTV может быть BTV полипептидом внешнего капсида (VP2, VP5), белком сердцевины или суб-сердцевины капсида (V1, VP3, или VP4) или другими полипептидами, такими как NS1, NS2, NS3, VP6 или VP7.
В одном варианте осуществления BTV антиген, эпитоп или иммуноген является VP2 или VP5. В другом варианте осуществления VP2 может быть модифицирован таким образом, что в случае эксспресии в ряске, локализуется в цитоплазме. В другом варианте осуществления VP2 может иметь 5'UTR, оптимизированную для экспрессии в ряске.
В следующем варианте осуществления BTV-антиген может быть получен из BTV1. В одном варианте осуществления BTV1 последовательности являются оптимизированными для экспрессии в ряске.
В другом варианте осуществления BTV антиген может быть VP2 или VP5. В следующем варианте осуществления BTV антиген может быть VP2 или VP5 BTV серотипа 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или 24. В другом варианте осуществления VP2 или VP5 выделяется из французского изолята.
Настоящее изобретение имеет отношение к BTV композиции или вакцине, которая может содержать эффективное количество рекомбинантного BTV антигена и фармацевтически или с точки зрения ветеринарии приемлемый носитель, эксципиент, адъювант или разбавитель. В одном варианте осуществления BTV антиген может быть VP2 или VP5 BTV.
В другом варианте осуществления рекомбинантный BTV антиген экспрессируется в растении или водоросли. В еще одном варианте осуществления растение представляет собой ряску, включая растения рода Lemna. В еще одном варианте осуществления растение представляет собой Lemna minor (ряска малая). В одном варианте осуществления рекомбинантный BTV антиген может экспрессироваться в запатентованной системе экспрессии белка Lemna minor, преимущественно Biolex's LEX systemSM.
В другом варианте осуществления фармацевтически или с точки зрения ветеринарии приемлемый носитель, эксципиент, адъювант, или разбавитель может быть эмульсией вода-в-масле. В следующем варианте осуществления эмульсия вода-в-масле может быть тройной эмульсией вода/масло/вода (W/O/W). В еще одном варианте осуществления адъюванты включают EMULSIGEN®, гидроксид алюминия и сапонин, CpG, или их комбинации.
Изобретение дополнительно включает BTV полинуклеотиды, входящие в состав молекулы-вектора или вектора экспрессии, функционально связанные с промоторным элементом и необязательно с энхансером.
В одном аспекте настоящее изобретение предоставляет BTV полипептиды, имеющие последовательность, представленную в SEQ ID NO:4, 6, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25, и их вариант или фрагмент.
В другом аспекте настоящее изобретение предоставляет полипептид, имеющий по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, 96%, 97%, 98% или 99% идентичность последовательности с антигенным полипептидом изобретения, в частности с полипептидами, имеющими последовательность, указанную в SEQ ID NO:4, 6, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25.
В следующем аспекте настоящее изобретение предоставляет фрагменты и варианты BTV-полипептидов, представленных выше (SEQ ID NO:4, 6, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25), которые могут быть легко получены специалистом в данной области техники с помощью хорошо известных методов молекулярной биологии.
Варианты представляют собой гомологичные полипептиды, имеющие идентичность аминокислотной последовательности, по меньшей мере, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% с аминокислотными последовательностями, указанными в SEQ ID NO:4, 6, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25.
Иммуногенный фрагмент BTV-полипептида включает, по меньшей мере, 8, 10, 15 или 20 последовательных аминокислот, по меньшей мере, 21 аминокислоту, по меньшей мере, 23 аминокислоты, по меньшей мере, 25 аминокислот или, по меньшей мере, 30 аминокислот BTV-полипептида, имеющего последовательность, указанную в SEQ ID NO:4, 6, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25, или его варианты. В другом варианте осуществления фрагмент BTV полипептида включает специфический антигенный эпитоп, обнаруженный в полном BTV-полипептиде.
В другом аспекте настоящее изобретение предоставляет полинуклеотид, кодирующий BTV-полипептид, такой как полинуклеотид, кодирующий полипептид, имеющий последовательность, указанную в SEQ ID NO:4, 6, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25. В следующем аспекте настоящее изобретение предоставляет полинуклеотид, кодирующий полипептид, имеющий, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, 96%, 97%, 98% или 99% идентичность последовательности с полипептидом, имеющим последовательность, указанную в SEQ ID NO:4, 6, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25, или консервативный вариант, аллельный вариант, гомолог или иммуногенный фрагмент, содержащий, по меньшей мере, восемь или, по меньшей мере, десять последовательных аминокислот одного из этих полипептидов или комбинацию этих полипептидов.
В другом аспекте настоящее изобретение предоставляет полинуклеотид, имеющий нуклеотидную последовательность, указанную в SEQ ID NO:1, 2, 3, 5, 6, 7, 8 или 9, или его вариант.В еще одном аспекте настоящее изобретение предоставляет полинуклеотид, имеющий по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 95%, 96%, 97%, 98% или 99% идентичность последовательности с одним из полинуклеотидов, имеющих последовательность, указанную в SEQ ID NO:1, 2, 3, 5, 6, 7, 8, или 9, или его вариант.
Полинуклеотиды изобретения могут содержать дополнительные последовательности, такие как дополнительные кодирующие последовательности, в той же самой единице транскрипции, контролирующие элементы, такие как промоторы, сайты связывания рибосом, 5'UTR, 3'UTR, терминаторы транскрипции, сайты полиаденилирования, дополнительные единицы транскрипции под контролем того же самого или другого промотора, последовательности разрешающие клонирование, экспрессию, гомологичную рекомбинацию и трансформацию клетки-хозяина, и любые подобные конструкции, необходимые для обеспечения вариантов осуществления этого изобретения.
Элементы, необходимые для экспрессии BTV полипептида, антигена, эпитопа или иммуногена, предпочтительно присутствуют в векторе изобретения. Минимально он включает, состоит в основном из или состоит из инициаторного (стартового) кодона (ATG), стоп-кодона и промотора, а также необязательно последовательности полиаденилирования для некоторых векторов, таких как плазмида и некоторые вирусные векторы, например, вирусные векторы, отличные от поксвирусов. Если полинуклеотид кодирует фрагмент полипротеина, например BTV пептид, то, предпочтительно, в векторе ATG размещают на 5' конце рамки считывания, а стоп-кодон располагают на 3'. Также могут присутствовать другие элементы для контролирования экспрессии, такие как энхансерные последовательности, стабилизирующие последовательности, такие как интронные и сигнальные последовательности, обеспечивающие секрецию белка.
Настоящее изобретение также имеет отношение к препаратам, содержащим векторы, такие как векторы экспрессии, например, терапевтическим композициям. Препараты могут содержать один или более векторов, например, векторы экспрессии, такие как векторы экспрессии in vivo, содержащие и экспрессирующие один или более BTV полипептидов, антигенов, эпитопов или иммуногенов. В одном варианте осуществления вектор содержит и экспрессирует полинуклеотид, который содержит, в основном состоит из или состоит из полинуклеотида, кодирующего (и предпочтительно экспрессирующего) BTV антиген, эпитоп или иммуноген в фармацевтически или с точки зрения ветеринарии приемлемом носителе, эксципиенте или разбавителе. Таким образом, согласно некоторому варианту осуществления изобретения, другой вектор или векторы в препарате содержит, в основном состоит из или состоит из полинуклеотида, который кодирует, а при соответствующих условиях данный вектор экспрессирует один или более других белков BTV полипептида, антигена, эпитопа или иммуногена, или его фрагмент.
В соответствии с другим вариантом осуществления вектор или векторы в препарате содержит или в основном состоит из или состоит из полинуклеотида(ов), кодирующего один или более белков или фрагмент(ы) его BTV-полипептида, антигена, эпитопа или иммуногена, причем вектор или векторы экспрессируют полинуклеотид(ы). В другом варианте осуществления препарат содержит один, два или более векторов, содержащих полинуклеотиды, кодирующие и экспрессирующие, предпочтительно in vivo, BTV полипептид, антиген, гибридный белок или его эпитоп. Кроме того, изобретение имеет отношение к смесям векторов, которые содержат полинуклеотиды, кодирующие и экспрессирующие различные BTV полипептиды, антигены, эпитопы или иммуногены, например, BTV полипептид, антиген, эпитоп или иммуноген от разных видов животных таких как, но, не ограничиваясь этим, овца, корова или коза.
Согласно следующему варианту осуществления изобретения вектор экспрессии представляет собой плазмидный вектор или ДНК-плазмидный вектор, в частности in vivo вектор экспрессии. В конкретном, неограниченном примере, плазмида pVR. 1020 или 1012 (VICAL Inc.; Luke et al., 1997; Hartikka et al., 1996, см., например, патенты США №5,846,946 и 6,451,769) может использоваться в качестве вектора для введения полинуклеотидной последовательности. Плазмида pVR.1020 получена из pVR-1012 и содержит человеческую tPA сигнальную последовательность. В одном варианте осуществления человеческая tPA сигнальная последовательность имеет в составе аминокислоты от М(1) до S(23) последовательности, имеющей номер доступа в Genbank HUMTPA14. В другом отдельном, неограничивающем примере, плазмида, используемая в качестве вектора для введения полинуклеотидной последовательности, может содержать сигнальную пептидную последовательность лошадиного IGF1 от аминокислоты М(24) до аминокислоты А(48) последовательности, имеющей номер доступа в Genbank U28070. Дополнительную информацию о ДНК плазмидах, которую можно обсуждать или применять на практике, можно найти, например, в патентах США №6,852,705; 6,818,628; 6,586,412; 6,576,243; 6,558,674; 6,464,984; 6,451,770; 6,376,473 и 6,221,362.
Термин плазмида распространяется на любую единицу транскрипции ДНК, содержащую полинуклеотид согласно изобретению и элементы, необходимые для его экспрессии in vivo в клетке или клетках желательного хозяина или мишени; и в этом отношении, следует отметить, что суперспиральная (сверхскрученная) или несуперспиральная кольцевая плазмида, также как и линейная форма, включаются в рамки изобретения.
Каждая плазмида содержит или состоит в основном из, в дополнение к полинуклеотиду, кодирующему BTV антиген, эпитоп или иммуноген, необязательно соединенный с гетерологичной пептидной последовательностью, вариант, аналог или фрагмент, функционально связанный с промотором или находящийся под контролем промотора или зависящий от промотора. В большинстве случаев выгодно использовать сильный промотор, эффективный в эукариотических клетках. Сильный промотор может быть, но, не ограничиваясь этим, немедленно-ранним промотором цитомегаловируса (CMV-IE) человеческого или мышиного происхождения, или необязательно может иметь другое происхождение, например от крысы или морской свинки, Super promoter (Ni, M. et al., Plant J. 7, 661-676, 1995.). CMV-IE промотор может содержать действительную промоторную часть, которая может быть или может не быть связана с энхансерной частью. Можно сделать ссылки на ЕР-А-260 148, ЕР-А-323 597, патенты США №5,168,062, 5,385,839 и 4,968,615, а также на заявку РСТ № WO 87/03905. CMV-IE промотор предпочтительно является человеческим CMV-IE (Boshart et al., 1985) или мышиным CMV-IE.
В более общих терминах, промотор имеет вирусное, растительное или клеточное происхождение. Сильный вирусный промотор, отличный от CMV-IE, который может успешно использоваться на практике изобретения, представляет собой ранний/поздний промотор вируса SV40 или LTR промотор вируса саркомы Рауса. Сильный клеточный промотор, который может успешно использоваться на практике изобретения, является промотором гена клеточного скелета, таким как, например, десминовый промотор (Kwissa et al., 2000) или актиновый промотор (Miyazaki et al., 1989).
Можно использовать любые из конститутивных, регулируемых или стимул-зависимых промоторов. Например, конститутивные промоторы могут включать промотор маннопинсинтазы из Agrobacterium tumefaciens. Альтернативно, может быть удобно использовать промоторы гена теплового шока, промоторы гена, индуцируемого засухой, индуцируемые патогеном промоторы, индуцируемые ранением, и промоторы, индуцируемые светом/темнотой. Может быть удобно использовать промоторы, которые контролируются регуляторами роста растений, такими как абсцизовая кислота, ауксины, цитокины и гибберелиновая кислота. Также могут быть выбраны промоторы, обеспечивающие ткане-специфическую экспрессию (например, специфические промоторы корня, листа и цветка).
Плазмиды могут содержать другие элементы, контролирующие экспрессию. В частности, полезно включать стабилизирующую последовательность(и), например, интронную последовательность(и), например, интрон алкогольдегидрогеназы кукурузы (Callis et al. Genes & Dev.1(10): 1183-1200, Dec. 1987), первый интрон hCMV-IE (PCT заявка № WO 1989/0103 6), интрон II гена β-глобина кролика (van Ooyen et al., 1979). В другом варианте осуществления плазмиды могут содержать 3'UTR. 3'UTR может быть, но не ограничивается этим, нопалинсинтазой (Nos) 3' UTR agrobacterium (Nopaline synthase: transcript mapping and DNA sequence. Depicker, A. et al. J. Mol. Appl. Genet., 1982; Bevan, NAR, 1984, 12(22): 8711-8721).
Что касается сигнала полиаденилирования (полиА) для плазмид и вирусных векторов, кроме проксвирусов, можно использовать сигнал поли(А) гена бычьего гормона роста (bGH) (см. США 5,122,458) или сигнал поли(А) гена кроличьего β-глобина или сигнал поли(А) SV40 вируса.
"Клетка-хозяин" означает прокариотическую или эукариотическую клетку, которая генетически изменена или способна генетически изменяться при введении экзогенного полинуклеотида, такого как рекомбинантная плазмида или вектор. При упоминании генетически измененных клеток термин относится и к исходно измененной клетке и к ее потомству.
В одном варианте осуществления рекомбинантный BTV антиген экспрессируется в трансгенном растении или водоросли. В другом варианте осуществления трансгенное растение представляет собой растение рода Lemna. В следующем варианте осуществления трансгенное растение представляет собой Lemna minor (ряска малая). В другом варианте осуществления рекомбинантный BTV антиген может быть экспрессирован в системе экспрессии белка Lemna minor (ряска малая), Biolex's LEX systemSM. Подробности системы экспрессии белка в Lemna minor (ряска малая) можно найти, например, в патентах США №6,815,184, 7,022,309, 7,160,717, 7,176,024, 6,040,498 и 7,161,064. В следующем варианте осуществления трансгенная водоросль представляет собой Schizochytrium. Подробности системы экспрессии белка в водоросли можно найти например, в США 7,001,772, США 2008/0022422. BTV антиген в вариантах осуществления может быть любым полипептидом, раскрытым в описании, или полипептидом, кодируемым любым полинуклеотидом, раскрытым в описании.
Способы экспрессирования BTV-полипептидов в ряске или микроводоросли
Таким образом, в некоторых вариантах осуществления изобретения антигенные BTV полипептиды или их фрагменты или варианты, экспрессируются в ряске или микроводоросли. Эти способы включают использование кассет экспрессии, которые вводятся в ряску или микроводоросль с помощью любого подходящего метода трансформации, известного в данной области техники. Полинуклеотиды в этих кассетах экспрессии могут быть модифицированы для обеспечения повышенной экспрессии антигенного BTV полипептида или его фрагмента или варианта в ряске или микроводоросли, как указано далее.
Кассеты для экспрессии в ряске или микроводоросли антигенных BTV полипептидов
Трансгенную ряску или микроводоросль, экспрессирующую BTV полипептид или его фрагмент или вариант, получают посредством трансформации ряски или микроводоросли с помощью кассеты экспрессии, содержащей полинуклеотид, кодирующий антигенный BTV полипептид или его фрагмент или вариант. Таким образом, полинуклеотид, кодирующий представляющий интерес BTV полипептид или его фрагмент или вариант, встраивается в кассету экспрессии и вводится в растение ряску или культуру микроводоросли с помощью любого подходящего способа трансформации, известного в данной области техники.
В некоторых вариантах осуществления ряска или микроводоросль, трансформированная кассетой экспрессии, содержащей полинуклеотид, кодирующий представляющий интерес BTV полипептид или его фрагмент или вариант, также может быть трансфомирована кассетой экспрессии, которая обеспечивает экспрессию другого гетерологичного, представляющего интерес полипептида, например, другого BTV полипептида, его фрагмента или варианта. Кассета экспрессии, обеспечивающая экспрессию другого гетерологичного полипептида, представляющего интерес, может быть предоставлена на том же самом полинукдеотиде (например, на том же самом векторе трансформации) для введения в ряску или микроводоросль, или на другом полинуклеотиде (например, на другом векторе трансформации) для введения в ряску или микроводоросль в то же самое время или разное время, с помощью одних и тех же или разных методов введения, например, с помощью одних и тех же или разных методов трансформации.
Кассеты экспрессии, предназначенные для применения при трансформации ряски или микроводоросли, содержат контролирующие экспрессию элементы, включающие, по меньшей мере, участок инициации транскрипции (например, промотор), функционально связанный с представляющим интерес полинуклеотидом, т.е., полинуклеотидом, кодирующим BTV полипептид, его фрагмент или вариант."Функционально связанный" при использовании в описании в применении к нуклеотидным последовательностям имеет отношение к нескольким нуклеотидным последовательностям, которые находятся в функциональной зависимости друг от друга. Как правило, функционально связанные ДНК последовательности являются смежными и в необходимых случаях соединяют два участка, кодирующих белок, в рамке считывания. Такая кассета экспрессии предоставляется вместе с множеством сайтов рестрикции для введения полинуклеотида или полинуклеотидов, представляющих интерес (например, одного нужного полинуклеотида, двух нужных полинуклеотидов и т.д.), для того, чтобы находиться под транскрипционной регуляцией промотора и других элементов, контролирующих экспрессию. В отдельных вариантах осуществления изобретения полинуклеотид, предназначенный для переноса (трансфекции), содержит две или более кассет экспрессии, каждая из которых содержит, по меньшей мере, один интересующий полинуклеотид.
Под "элементом, контролирующим экспрессию," имеется в виду регуляторный участок ДНК, обычно содержащий ТАТА-бокс, способный направлять РНК полимеразу II, или в некоторых вариантах осуществления, РНК полимеразу III, чтобы инициировать синтез РНК в соответствующем участке инициации транскрипции для определенной кодирующей последовательности. Элемент, контролирующий экспрессию, может дополнительно содержать другие последовательности распознавания (сайты узнавания) в большинстве случаев расположенные «выше» или в направлении 5' относительно ТАТА-бокса, которые оказывают влияние (например, увеличивают) частоту инициации транскрипции. Более того, элемент, контролирующий экспрессию, может дополнительно содержать последовательности, в большинстве случаев расположенные «ниже» или в направлении 3' относительно ТАТА-бокса, которые оказывают влияние (например, увеличивают) частоту инициации транскрипции.
Участок инициации транскрипции (например, промотор) может быть «родным» или гомологичным или чужеродным или гетерологичным для ряски или микроводоросли-хозяина, или может быть природной последовательностью или синтетической последовательностью. Под чужеродным подразумевается, что участок инициации транскрипции не обнаружен в ряске дикого типа или микроводоросли-хозяине, в которую вводится участок инициации транскрипции. Под "функциональным промотором" имеется в виду промотор, который будучи функционально связанным с последовательностью, кодирующей представляющий интерес BTV полипептид или его фрагмент или вариант, способен управлять экспрессией (т.е., транскрипцией и трансляцией) закодированного полипептида, фрагмента или варианта. Промоторы можно выбрать, исходя из желаемого результата. Таким образом, кассеты экспрессии изобретения могут содержать конститутивные, индуцибельные, предпочтительные для определенной ткани или другие промоторы для экспрессии в ряске.
Любой подходящий промотор, известный в данной области техники, может использоваться в кассетах экспрессии согласно настоящему изобретению, включая промоторы бактерий, дрожжей, грибов, насекомых, млекопитающих и растений. Например, могут использоваться растительные промоторы, включая промоторы ряски или микроводоросли. Примеры промоторов включают, но не ограничиваются этим, промотор 35S вируса мозаики цветной капусты, промоторы опинсинтетазы (например, nos, mas, ocs и т.д.), промотор убиквитина, актиновый промотор, промотор маленькой субъединицы рибулозодифосфат-карбоксилазы (RubP) и промотор алкогольдегидрогеназы. Промотор маленькой субъединицы RubP карбоксилазы ряски известен в данной области техники (Silverthome et al. (1990) Plant Mol. Biol. 15:49). Другие промоторы вирусов, инфицирующих растения или микроводоросли, также являются пригодными, включая, но не ограничиваясь этим, промоторы, выделенные из вируса мозаики колоказии, вируса хлореллы (например, промотор аденинметилтрансферазы вируса хлореллы; Mitra et al. (1994) Plant Mol. Biol. 26:85), вирус бронзовости томата, вирус погремковости табака, вирус некроза табака, вирус кольцевой пятнистости табака, вирус кольцевой пятнистости томата, вирус мозаики огурца, вирус карликовости арахиса, вирус мозаики люцерны, палочковидный баднавирус сахарного тростника и тому подобное.
Элементы, контролирующие экспрессию, включая промоторы, можно выбрать для получения необходимого уровня регуляции. Например, в некоторых случаях полезно использовать промотор, обеспечивающий конститутивную экспрессию (например, промотор маннопинсинтазы от Agrobacterium tumefaciens). Альтернативно, в других ситуациях может быть полезно использование промоторов, которые активируются в ответ на специфические стимулы окружающей среды (например, промоторы гена теплового шока, промоторы, индуцируемые засухой, промоторы, индуцируемые патогенном, промоторы, индуцируемые ранением, и промоторы, индуцируемые светом/темнотой), или регуляторов роста растений (например, промоторы от генов, индуцируемых абсцизовой кислотой, ауксинами, цитокинами и гибберелиновой кислотой). В качестве дополнительной альтернативы, могут быть выбраны промоторы, обеспечивающие ткане-специфическую экспрессию (например, специфические промоторы корня, листа и цветка).
Общая сила определенного промотора может находиться под влиянием комбинации и пространственной организации цис-действующих нуклеотидных последовательностей, таких как вышерасположенные активирующие последовательности. Например, активирующие нуклеотидные последовательности, полученные от гена октопинсинтазы Agrobacterium tumefaciens, могут увеличить транскрипцию с промотора маннопинсинтазы Agrobacterium tumefaciens (см. патент США 5,955,646). В настоящем изобретении кассета экспрессии может содержать активирующую нуклеотидную последовательность, вставленную «выше» промоторной последовательности, чтобы увеличить экспрессию антигенного BTV полипептида, представляющего интерес, или его фрагмента или варианта. В одном варианте осуществления кассета экспрессии включает три вышерасположенные активирующие последовательности, полученные от гена октопинсинтазы Agrobacterium tumefaciens, функционально связанные с промотором, полученным от гена маннопинсинтазы Agrobacterium tumefaciens (см. патент США 5,955,646).
Таким образом, кассета экспрессии включает в 5'-3' направлении транскрипции контролирующий экспрессию элемент, включающий участок инициации транскрипции и трансляции, полинуклеотид, кодирующий антигенный BTV полипептид, представляющий интерес, (или его фрагмент или вариант) и участок терминации транскрипции и трансляции, функциональный в растениях. Любая подходящая терминирующая последовательность (стоп-кодон), известная в данной области техники, может использоваться в соответствии с настоящим изобретением. Участок терминации может быть «родным» (нативным) с участком инициации транскрипции, может быть «родным» с интересующей кодирующей последовательностью или может быть получен из другого источника. Подходящие участки терминации доступны от Ti-плазмиды A. tumefaciens, такие как участки терминации октапинсинтетазы и нопалинсинтетазы. См. также Guerineau et al. (1991) Mol. Gen. Genet. 262:141; Proudfbot (1991) Cell 64:671; Sanfacon et al. (1991) Genes Dev. 5:141; Mogen et al. (1990) Plant Cell 2:1261; Munroe et al. (1990) Gene 91:151; Ballast al. (1989) Nucleic Acids Res. 17:7891; и Joshi et al. (1987) Nucleic Acids Res. 15:9627. Дополнительными примерами терминирующих последовательностей (стоп-кодонов) являются терминирующая последовательность маленькой субъединицы RubP карбоксилазы гороха и терминирующая последовательность 35S вируса мозаики цветной капусты.
В большинстве случае кассета экспрессии будет содержать селектируемый маркерный ген, предназначенный для отбора трансформированных клеток или тканей ряски. Селектируемые маркерные гены включают гены, кодирующие устойчивость к антибиотикам, такие как те, которые кодируют неомицинфосфотрансферазу II (NEO) и гидромицинфосфотрансферазу (НРТ), а также гены, обеспечивающие устойчивость к гербицидным соединениям. Как правило, гены устойчивости к гербицидам кодируют модифицированный белок-мишень, нечувствительный к гербициду, или фермент, который разлагает или нейтрализует гербицид в растении, до того как он начнет действовать. Смоти DeBlock et al. (1987) EMBO J. 6:2513; DeBlock et al. (1989) Plant Physiol. 91:691; Fromm et al. (1990) BioTechnology 8:833; Gordon-Kamm et al. (1990) Plant Cell 2:603. Например, устойчивость к гербицидам глифосату или сульфонилмочевине получают, используя гены, кодирующие мутантные ферменты-мишени, 5-энолпирувилшикимат-3-фосфатсинтазу (EPSPS) и ацетолактатсинтазу (ALS). Устойчивость к глюфосинату аммония, бромоксинилу и 2,4-дихлорофеноксиацетату (2,4-D) получают, используя бактериальные гены, кодирующие фосфинотрицин ацетилтрансферазу, нитрилазу или 2,4-дихлорфеноксиацетат монооксигеназу, которые детоксифицируют соответствующие гербициды.
Для целей настоящего изобретения селектируемые маркерные гены включают, но не ограничиваются этим, гены, кодирующие неомицинфосфотрансферазу II (Fraley et al. (1986) CRC Critical Reviews in Plant Science 4:1); цианамидгидратазу (Maier-Greiner et al. (1991) Proc. Natl. Acad. Sci. USA 88:4250); аспартаткиназу; дигидродипиколинат синтазу (Perl et al. (1993) BioTechnology 11:715); ген bar (Toki et al. (1992) Plant Physiol. 100:1503; Meagher et al. (1996) Crop Sci. 36:1367); триптофандекарбоксилазу (Goddijn et al. (1993) Plant Mol. Biol. 22:907); неомицинфосфотрансферазу (NEO; Southern et al. (1982) J. Mol. Appl. Gen. 1:327); гидромицинфосфотрансферазу (НРТ или HYG; Shimizu etal. (1986) Mol. Cell. Biol. 6:1074); дигидрофолатредуктазу (DHFR; Kwok et al. (1986) Proc. Natl. Acad. Sci. USA 83:4552); фосфинотрицин ацетилтрансферазу (DeBlock et al. (1987) EMBO J. 6:2513); дегалогеназу 2,2-дихлорпропионовой кислоты (Buchanan-Wollatron et al. (1989) J. Cell. Biochem. 13D:330); синтазу ацетогидроксикислот (патент США №4,761,373 по Anderson et al.; Haughn et al. (1988) Mol. Gen. Genet. 221:266); 5-енолпирувил-шикимат-фосфат синтазу (aroA; Comai et al. (1985) Nature 317:741); галоарилнитрилазу (WO 87/04181 to Stalker et al.); ацетил-коэнзим А карбоксилазу (Parker et al. (1990) Plant Physiol. 92:1220); дигидроптероат синтазу (sull; Guermeau etal. (1990) Plant Mol. Biol. 15:127); и полипептид 32 кДа фотосиситемы II (psbA; Hirschberg et al. (1983) Science 222:1346 (1983).
Кроме того, включаются гены, кодирующие устойчивость к гентамицину (например, aacC1, Wohlleben et al. (1989) Mol. Gen. Genet. 217:202-208); хлорамфениколу (Herrera-Estrella et al. (1983) EMBO J. 2:987); метотрексату (Herrera-Estrella et al. (1983) Nature 303:209; Meijer et al. (1991) Plant Mol. Biol. 16:807); гидромицину (Waldron et al. (1985) Plant Mol. Biol. 5:103; Zhijian et al. (1995) Plant Science 108:219; Meijer et al. (1991) Plant Mol. Bio. 16:807); стрептомицину (Jones et al. (1987) Mol. Gen. Genet. 210:86); спекгиномицину (Bretagne-Sagnard et al. (1996) Transgenic Res. 5:131); блеомицину (Hille et al. (1986) Plant Mol. Biol. 7:171); сульфонамиду (Guerineau et al. (1990) Plant Mol. Bio. 15:127); бромоксинилу (Stalker et al. (1988) Sciencee 242:419); 2,4-D (Streber et al. (1989) BioTechnology 7:811); фосфинотрицину (DeBlock et al. (1987) EMBO J. 6:2513); стрептомицину (Bretagne-Sagnard and Chupeau, Transgenic Research 5:131).
-Ген bar придает устойчивость к гербицидам глюфосинатного типа, таким как фосфинотрицин (РРТ) или биалафос, и т.п. Как отмечалось ранее, другие селектируемые маркеры, которые могут использоваться в векторных конструкциях включают, но не ограничиваются этим, ген pat для устойчивости к биалафосу и фосфинотрицину, ген ALS для устойчивости к имидазолинону, ген НРН или HYG для устойчивости к гидромицину, ген EPSP синтазы для устойчивости к глифосату, ген Hm1 для устойчивости к Нс-токсину и другие селективные агенты, обычно используемые и известные среднему специалисту в данной области техники. См. Yarranton (1992) Curr. Opin. Biotech. 3:506; Chistopherson et al. (1992) Proc. Natl. Acad. Sci. USA 89:6314; Yao et al. (1992) Cell 71:63; Reznikoff(1992) Mol. Microbiol. 6:2419; Barkley et al. (1980) The Орегон 177-220; Ни et al. (1987) Cell 48:555; Brown et al. (1987) Cell 49:603; Figge et al. (1988) Cell 52:713; Deuschle et al. (1989) Proc. Natl. Acad. Sci. USA 86:5400; Fuerst et al. (1989) Proc. Natl. Acad. Sci. USA 86:2549; Deuschle et al. (1990) Science 248:480; Labow et al. (1990) Mol. Cell. Biol. 10:3343; Zambretti et al. (1992) Proc. Natl. Acad. Sci. USA 89:3952; Bairn et al. (1991) Proc. Natl. Acad. Sci. USA 88:5072; Wyborski et al. (1991) Nuc. Acids Res. 19:4647; Hillenand-Wissman (1989) Topics in Mol. AndStruc. Biol. 10:143; Degenkolb et al. (1991) Antimicrob. Agents Chemother. 35:1591; Kleinschnidt et al. (1988) Biochemistry 27:1094; Gatz et al. (1992) Plant J. 2:397; Gossen et al. (1992) Proc. Natl. Acad. Sci. USA 89:5547; Oliva et al. (1992) Antimicrob. Agents Chemother. 36:913; Hiavka et al. (1985) Handbook of Experimental Pharmacology 78; и Gill et al. (1988) Nature 334:721. Подобные раскрытия включаются в описание путем отсылки.
Приведенный выше перечень селектируемых маркерных генов не является ограничивающим. Любой селектируемый маркерный ген может использоваться в настоящем изобретении.
Модификация нукпеотидных последовательностей для усиления экспрессии в растении или микроводоросли-хозяине
В случаях, когда BTV полипептид или его фрагмент или вариант экспрессируется в ряске или микроводоросли, экспрессированная полинуклеотидная последовательность, кодирующая BTV полипептид или его фрагмент или вариант, может быть модифицирована для увеличения его экспрессии в ряске или микроводоросли, соответственно. Одной такой модификацией является синтез полинуклеотида с использованием предпочтительных для растений кодонов, в частности, кодонов, предпочтительных для ряски, или использованием, кодонов, предпочтительных для микроводоросли, таких как Schizochytrium-предпочтительные кодоны. Методы синтеза нуклеотидных последовательностей с помощью предпочтительных для растений кодонов доступны в данной области техники. См., например, патенты США №5,380,831 и 5,436,391; ЕР 0359472; ЕР 0385962; WO 91/16432; Perlak et al. (1991) Proc. Natl. Acad. Sci. USA 15:3324; larmacome et al. (1997) Plant Mol. Biol. 34:485; and Murray et al. (1989) Nucleic Acids. Res. 17:477. Синтез может осуществляться с помощью любого метода, известного специалисту в данной области техники. Предпочтительные кодоны могут быть определены на основании самой высокой частоты белков, экспрессированных в ряске или микроводоросли. Например, частота использования кодона для Lemna minor показана в Таблице А, частота использования кодона для Schizochytrium показана в Таблице В.
В целях настоящего изобретения "предпочтительные для ряски кодоны" относится к кодонам, имеющим частоту использования кодона в ряске больше чем 17%. "Lemna-предпочтительные кодоны" при использовании в описании относится к кодонам, имеющим частоту использования кодона в роде Lemna больше, чем 17%. "Lemna minor-предпочтительные кодоны" при использовании в описании относится к кодонам, имеющим частоту использования кодона в Lemna minor больше, чем 17%, при этом частоту использования кодона в Lemna minor получают из базы данных об использовании кодонов (GenBank Release 160.0, June 15, 2007). "Кодоны, предпочтительные для микроводоросли" относится к кодонам, имеющим частоту использования кодона в микроводоросли больше чем 17%. "Кодоны, предпочтительные для микроводоросли " при использовании в описании относится к кодонам, имеющим частоту использования кодона в семействе Thraustochytriaceae болше, чем 17%. "Schizochytrium-предпочтительные кодоны" при использовании в описании относится к кодонам, имеющим частоту использования кодона в schizochytrium больше, чем 17%, при этом частоту использования кодона в schizochytrium получают из базы данных об использовании кодонов.
Кроме того, признается, что весь или любая часть полинуклеотида, кодирующего интересующий BTV полипептид или его фрагмент или вариант может быть оптимизированной или синтетической. Другими словами, также могут использоваться полностью оптимизированные или частично оптимизированные последовательности. Например, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 87%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% кодонов могут быть кодонами, предпочтительными для ряски или кодонами предпочтительными для микроводоросли. В одном варианте осуществления от 90 до 96% кодонов являются кодонами, предпочтительными для ряски или предпочтительными для микроводоросли. Кодирующая последовательность полинуклеотидной последовательности, кодирующей интересующий BTV полипептид или его фрагмент или вариант, может содержать кодоны, используемые с частотой, по меньшей мере, 17% в Lemna gibba или, по меньшей мере, 17% в Lemna minor. В одном варианте осуществления BTV полипептид представляет собой VP2 или VP5 полипептид, например, VP2 полипептид, представленный SEQ ID NO:4, или VP5 полипептид, представленный SEQ ID NO:10, а кассета экспрессии содержит оптимизированную кодирующую последовательность для этого VP2 полипептида, при этом кодирующая последовательность включает предпочтительные для ряски кодоны, например, Lemna minor-предпочтительные или Lemna gibba-предпочтительные кодоны. В одном таком варианте осуществления кассета экспрессии включает SEQ ID NO:3, которая содержит Lemna ттиог-предпочтительные кодоны, кодирующие VP2 полипептид, представленный SEQ ID NO:4. В другом таком варианте осуществления кассета экспрессии включает SEQ ID NO:9, которая содержит Lemna minor-предпочтительные кодоны, кодирующие VP5 полипептид, представленный SEQ ID NO:10.
Также могут быть сделаны другие модификации полинуклеотида, кодирующего представляющий интерес BTV полипептид или его фрагмент или вариант, для увеличения его экспрессии в ряске или микроводоросли. Эти модификации включают, но не ограничиваются этим, устранение последовательностей, кодирующих ложные сигналы полиаденилирования, сигналов экзон-интронных сайтов сплайсинга, транспозон-подобных повторов и других подобных, хорошо охарактеризованных последовательностей, которые могут быть вредными для экспрессии генов. Содержание в последовательности G-C может быть отрегулировано до уровней средних для ряски, как определено расчетом в соответствии с известными генами, экспрессированными в этом растении. При наличии возможности полинуклеотид, кодирующий гетерологичный полипептид, представляющий интерес, может быть модифицирован с целью избежать образования шпилечных вторичных мРНК структур.
Существуют известные различия между оптимальными контекстными нуклеотидными последовательностями инициации трансляции для кодонов, инициирующих трансляцию, у животных, растений и водорослей. "Контекстная нуклеотидная последовательность инициации трансляции" при использовании в описании относится к идентичности трех нуклеотидов, расположенных непосредственно рядом с ко доном инициации трансляции в направлении 5'. "Ко дон инициации трансляции" относится к кодону, который инициирует трансляцию мРНК, транскрибируемой (считываемой) с интересующей нуклеотидной последовательности. Состав этих контексных нуклеотидных последовательностей инициации трансляции может влиять на эффективность инициации трансляции. См., например, Lukaszewicz et al. (2000) Plant Science 154:89-98; and Joshi et al. (1997); Plant Mol. Biol. 35:993-1001. В настоящем изобретении контекстная нуклеотидная последовательность инициации трансляции для кодона, инициирующего трансляцию полинуклеотида, кодирующего антигенный интересующий BTV полипептид или его фрагмент или вариант, может быть модифицирована с целью увеличения экспрессии в ряске. В одном варианте осуществления нуклеотидная последовательность модифицирована так, что три нуклеотида непосредственно перед (выше) кодоном инициации трансляции представляют собой "АСС." Во втором варианте осуществления эти нуклеотиды представляют собой "АСА."
Экспрессия BTV-полипептида в ряске или водоросли также может быть увеличена при использовании 5' лидерных последовательностей. Такие лидерные последовательности могут служить для увеличения трансляции. Трансляционные лидерные последовательности известны в данной области техники и включают но не ограничиваются этим, лидерные последовательности пикорнавирусов, например, EMCV лидерная последовательность (5' некодирующая область энцефаломиокардита; EIroy-Stein et al. (1989) Proc. Natl. Acad. Sci USA 86:6126); лидерные последовательности потивирусов, например, TEV лидерная последовательность (вирус гравировки табака; Allison et al. (1986) Virology 154:9); белок связывания тяжелой цепи человеческого иммуноглобина (BiP; Macajak and Samow (1991) Nature 353:90); нетранслируемую лидерную последовательность мРНК белковой оболочки вируса мозаики люцерны (AMV РНК 4; Jobling and Gehrke (1987) Nature 325:622); лидерную последовательность вируса мозаики табака (TMV; Gallic (1989) Molecular Biology of RNA, 23:56); лидерную последовательность вируса гравировки картофеля (Tomashevskaya et al. (1993) J. Gen. Virol. 74:2717-2724); Fed-1 5' нетранслируемый участок (Dickey (1992) EMBO J. 11:2311-2317); RbcS 5' нетранслируемый участок (Silverthome et al. (1990) J. Plant. Mol. Biol. 15:49-58); и лидерную последовательность вируса хлоротической крапчатости кукурузы (MCMV; Lommel et al. (1991) Virology 81:382). См. также, Della-Cioppa et al. (1987) Plant Physiology 84:965. Также было показано, что лидерная последовательность, содержащая растительную интронную последовательность, включая интронную последовательность из гена алкогольдегидрогеназы 1 (ADH1) кукурузы, гена каталазы касторовых бобов или гена РАТ1 пути триптофана из Arabidopsis, увеличивает эффективность трансляции у растений (Callis et al. (1987) Genes Dev. 1:1183-1200; Mascarenhas et al. (1990) Plant Mol. Biol. 15:913-920).
В некоторых вариантах осуществления настоящего изобретения нуклеотидная последовательность, соответствующая нуклеотидам 1222-1775 гена алкогольдегидрогеназы 1 кукурузы (ADH1; GenBank номер доступа Х04049), вставляется «выше» полинуклеотида, кодирующего нужный BTV полипептид или его фрагмент или вариант, для увеличения эффективности его трансляции. В другом варианте осуществления кассета экспрессии содержит лидерную последовательность от гена маленькой субъединицы рибулозо-бис-фосфат-карбоксилазы 5 В Lemna gibba (RbcS лидерная последовательность; см. Buzby et al. (1990) Plant Cell 2:805-814).
Признано, что любые усиливающие экспрессию модификации нуклеотидной последовательности, описанные выше, могут использоваться в настоящем изобретении, включая любую отдельную модификацию, или любую возможную комбинацию модификаций. Фраза "модифицированный для увеличения экспрессии" в ряске при использовании в описании относится к полинуклеотидной последовательности, содержащей любую одну или любую комбинацию этих модификаций.
Трансформированные растения ряски и культуры узелков ряски или трансформированные микроводоросли
Настоящее изобретение предоставляет трансформированные растения ряски, экспрессирующие представляющий интерес BTV полипептид или его фрагмент или вариант.Термин "ряска" относится к членам семейства Lemnaceae. В настоящее время это семейство подразделяется на пять родов и 38 видов ряски, как перечислено далее: род Lemna (L. aequinoctialis, L. disperma, L. ecuadoriensis, L. gibba, L. japonica, L. minor, L. miniscula, L. obscura, L. perpusilla, L. tenera, L. trisuica, L. turionifera, L. valdiviana); род Spirodela {S. intermedia, S. polyrrhiza, S. punctatd); род Wolffia (Wa. angusta, Wa. arrhiza, Wa. australina, Wa. borealis, Wa. brasiliensis, Wa. columbiana, Wa. elongata, Wa. globosa, Wa. microscopica, Wa. neglectd); род Wolfiella (Wl. caudata, Wl. denticulata, Wl. gladiata, Wl. hyalina, Wl. lingulata, Wl. repunda, Wl. rotunda, и Wl. neotropicd) и род Landoltia (L. punctatd). Любые другие роды и виды Lemnaceae, если они существуют, являются также аспектами настоящего изобретения. Виды Lemna можно классифицировать, используя таксономическую схему, описанную Landolt (1986) Biosystematic Investigation on the Family of Duckweeds: The family of Lemnaceae-A Monograph Study (Geobatanischen Institut ETH, Stiftung Rubel, Zurich).
При использовании в описании "растение" включает целые растения, органы растений (например, фронды (листецы, листовидные стебли), стебли, корни и т.д.), семена, растительные клетки и их потомство. Должно быть понятно, что части трансгенных растений включаются в рамки изобретения, например, клетки растения, протопласты растения, культуры клеток тканей растений, из которых растение может регенерировать, ткани, каллюс растений, зародыши, а также, цветки, семяпочки, плоды, листья, корни, корневые кончики, узелки и тому подобное, возникшее в трансгенных растениях или их потомстве, предварительно трансформированном полинуклеотидом, представляющим интерес, и следовательно, состоящее, по меньшей мере, отчасти, из трансгенных клеток. При использовании в описании термин "растительная клетка" включает клетки семян, завязей, семяпочек, меристематических участков, каллюсную ткань, листву, листья, корни, узелки, побеги, пыльники и пыльцу.
При использовании в описании "узелок ряски" означает ткань ряски, содержащую клетки ряски, при этом, по меньшей мере, около 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% клеток являются дифференцированными клетками. При использовании в описании "дифференцированная клетка" означает клетку, по меньшей мере, с одним фенотипическим признаком (например, характерной клеточной морфологией или экспрессией маркерной нуклеиновой кислоты или белка), который отличает ее от недифференцированных клеток или от клеток, обнаруженных в других типах тканей. Дифференцированные клетки культуры узелков ряски, описанные здесь, образуют гладкую «черепитчатую» поверхность из клеток, соединяющихся смежными клеточными стенками, с узелками, которые начинают превращаться в листовой примордий, разбросанный по всей ткани. На поверхности ткани узелковой культуры имеются эпидермальные клетки, соединенные друг с другом через плазмодесмы.
Характер роста ряски является идеальным для методов культивирования. Растение быстро размножается путем вегетативного отпочковывания новых фрондов (листецов), похоже на бесполое размножение у дрожжей, только в макроскопическом виде. Это размножение происходит путем вегетативного почкования от меристематических клеток. Меристематическая область небольшая и находится на вентральной поверхности «листеца». Меристематические клетки находятся в двух «карманах», по одному на каждой стороне средней жилки «листеца». Кроме того, небольшой участок средней жилки является местом, из которого возникает корень и появляется стебель, который соединяет каждый листец с его материнским листецом. Меристематический карман защищен «лоскутом» ткани. Альтернативно листецы дают почки из этих карманов. Время удвоения варьирует между видами и составляет меньше, чем 20-24 час (Landolt (1957) Ber. Schweiz. Bot. Ges. 67:271; Chang et al. (1977) Bull. Inst. Chem. Acad. Sin. 24:19; Datko and Mudd (1970) Plant Physiol. 65:16; Venkataraman et al. (1970) Z Pflanzenphysiol. 62: 316). Интенсивное культивирование ряски дает в результате самые высокие уровни накопления биомассы за единицу времени (Landolt and Kandeler (1987) The Family of Lemnaceae-A Monographic Study Vol.2: Phytochemistry, Physiology, Application, Bibliography (Veroffentlichungen des Geobotanischen Institutes ETH, Stiftung Rubel, Zurich)), при накоплении сухого веса в пределах 6-15% сырого веса (Tillberg et al. (1979) Physiol. Plant. 46:5; Landolt (1957) Ber. Schweiz. Bot. Ges. 67:271; Stomp, unpublished data). Как сообщалось, содержание белка в целом ряде видов ряски, выращенных при различных условиях, находится в пределах от 15-45% сухого веса (Chang et al. (1977) Bull. Inst. Chem. Acad. Sin. 24:19; Chang and Chui (1978) Z Pflanzenphysiol. 89:91; Porath et al. (1979) Aquatic Botany 7:272; Appenroth et al. (1982) Biochem. Physiol. Pflanz. 177:251). На примере этих значений, можно сказать, что уровень получения белка на литр среды в ряске составляет тот же порядок величины, как при использовании генных экспрессирующих систем дрожжей.
Настоящее изобретение также обеспечивает трансформированные растения микроводорослей, экспрессирующих представляющий интерес BTV полипептид или его фрагмент или вариант. Термин "микроводоросль" или "микроводоросли" относится к членам семейства Thraustochytriaceae. Это семейство в настоящее время подразделяется на четыре рода: Schizochytrium, Thraustochytrium, Labyrinthuloides и Japonochytrium.
Трансформированные растения ряски или микроводоросли изобретения можно получить путем введения экспрессирующей конструкции, включающей полинуклеотид, кодирующий BTV полипептид или его фрагмент или вариант, в растение ряски или микроводоросль.
Термин "введение" в контексте полинуклеотида, например, экспрессирующей конструкции, включающей полинуклеотид, кодирующий BTV полипептид, или его фрагмент или вариант, означает предоставление (передачу) растению ряски или микроводоросли полинуклеотида таким образом, что полинуклеотид получает доступ во внутреннее пространство клетки растения ряски или микроводоросли. В том случае, когда вводится более чем один полинуклеотид, эти полинуклеотиды могут быть собраны как части одной нуклеотидной конструкции, или как отдельные нуклеотидные конструкции, и могут располагаться на тех же самых или разных трансформирующих векторах. Соответственно, эти полинуклеотиды могут быть введены в интересующую клетку-хозяина ряски или микроводоросли во время однократного случая трансформации, во время отдельных случаев трансформации или, например, как часть протокола размножения. Композиции и способы изобретения не зависят от определенного метода введения одного или более полинуклеотидов в растение ряски или микроводоросли, за исключением того, что полинуклеотид(ы) получает доступ во внутреннее пространство, по меньшей мере, одной клетки растения ряски или микроводоросли. Способы введения полинуклеотидов в растения или водоросли известны в данной области техники, включая, но не ограничиваясь этим, методы временной трансформации, методы стабильной трансформации и методы, опосредованные вирусом.
"Временная трансформация" в контексте полинуклеотида, такого как полинуклеотид кодирующий BTV полипептид или его фрагмент или вариант, означает, что полинуклеотид вводится в растение ряски или микроводоросль и не объединяется с геномом растения ряски или микроводоросли.
"Стабильное введение" или "стабильно введенный" в контексте полинуклеотида (такого как полинуклеотид, кодирующий BTV полипептид или его фрагмент или вариант), введенного в растение ряски или микроводоросли, означает, что введенный полинуклеотид является стабильно включенным в геном ряски или микроводоросли, и таким образом растение ряски или микроводоросль является стабильно трансформированным данным полинуклеотидом.
"Стабильная трансформация" или "стабильно трансформированные" означает, что полинуклеотид, например, полинуклеотид, кодирующий BTV полипептид или его фрагмент или вариант, введенный в растение ряски или микроводоросли, включается (интегрирует) в геном растения или водоросли и способен наследоваться потомством, конкретнее, потомками многих последующих поколений. В некоторых вариантах осуществления последующие поколения включают потомков, полученных вегетативно (т.е. бесполым размножением), например, с помощью клонального размножения. В других вариантах осуществления последующие поколения включают потомство, полученное путем полового размножения.
Экспрессирующая конструкция, содержащая полинуклеотд, кодирующий BTV полипептид или его фрагмент или вариант, может быть введена в растение ряски или микроводоросль, представляющую интерес, с помощью любого протокола трансформации, известного квалифицированным специалистам в данной области техники. Подходящие методы введения нуклеотидной последовательности в растение ряски или растительные клетки или узелки или микроводоросль включают микроинъекцию (Crossway et al. (1986) Biotechniques 4:320-334), электропорацию (Riggs et al. (1986) Proc. Natl. Acad. Sci. USA 83:5602-5606), трансформацию опосредованную Agrobacterium (патенты США №5,563,055 и 5,981,840, оба включаются в описание путем отсылки), прямой перенос генов (Paszkowski et al. (1984) EMBO J. 3:2717-2722), бомбардировку микрочастицами или баллистический метод (см., например, патенты США №4,945,050; 5,879,918; 5,886,244; и 5,932,782 (каждый из которых включается в описание путем отсылки); и Tomes et al. (1995) "Direct DNA Transfer into Intact Plant Cells via Microprojectile Bombardment," in Plant Cell, Tissue, and Organ Culture: Fundamental Methods, ed. Gamborg and Phillips (Springer-Verlag, Berlin); McCabe et al. (1988) Biotechnology 6:923-926). Трансформированные клетки могут выращиваться в растениях в соответствии с общепринятыми способами.
Как упоминалось выше, стабильно трансформированную ряску или микроводоросль можно получить с помощью любого метода переноса генов, известного в данной области техники, например, одним из методов переноса генов, раскрытых в патенте США №6,040,498 или патентных опубликованных заявках №2003/0115640, 2003/0033630 или 2002/0088027. Растение ряски или культуры узелков или микроводорослей могут быть эффективно трансформированы кассетой экспрессии, содержащей описанную здесь нуклеиновокислотную последовательность, с помощью любого из целого ряда методов, включая генный перенос, опосредованный Agrobacterium, баллистический метод или электропорацию. Используемым Agrobacterium может быть Agrobacterium tumefaciens или Agrobacterium rhizogenes. Стабильные трансформанты ряски или микроводоросли можно выделить (изолировать) путем совместной трансформации клеток ряски или микроводоросли представляющей интерес нуклеиновокислотной последовательностью и геном, дающим устойчивость к селективному агенту, а затем культивирования трансформированных клеток в среде, содержащей селективный агент. См., например, патент США №6,040,498, содержание которого полностью включено в описание путем отсылки.
Стабильно трансформированные растения ряски или микроводоросли, использованные в этих методах, должны проявлять нормальную морфологию и быть способными к половому размножению и/или способными размножаться вегетативно (т.е., вегетативным размножением), например, с помощью клонального размножения. Предпочтительно трансформированные растения ряски или микроводоросли настоящего изобретения содержат единственную копию перенесенной нуклеиновой кислоты, содержащей полинуклеотид, кодирующий BTV полипептид или его фрагмент или вариант, при этом перенесенная нуклеиновая кислота не имеет значительных перестановок. Общепризнано, что трансформированные растения ряски или микроводоросли изобретения могут содержать перенесенные нуклеиновые кислоты, присутствующие в незначительном количестве копий (т.е., не более чем двенадцать копий, не более чем восемь копий, не более чем пять копий, альтернативно, не более чем три копии, и как дополнительный вариант, меньше чем три копии нуклеиновой кислоты на трансформированную клетку).
Трансформированные растения или микроводоросли, экспрессирующие BTV полипептид или его фрагмент или вариант, можно культивировать при подходящих условиях с целью экспрессии антигенного BTV полипептида или его фрагмента или варианта. Затем BTV полипептид или его фрагмент или вариант можно извлечь из растения ряски или микроводоросли, культуральной среды или растения ряски или микроводоросли и культуральной среды, и при желании, очистить, используя любой обычный метод извлечения и очистки, известный в данной области техники, как описано в других местах. Затем антигенный BTV полипептид или его фрагмент или вариант может быть включен в состав вакцины с целью терапевтического применения, как описано в другом месте в описании.
Способы получения BTV полипептида
Как полностью описано здесь, в некотором варианте осуществления способ получения BTV полипептида включает: (а) культивирование в среде для культивирования растения ряски или клубенька ряски, при этом растение ряски или клубенек ряски является стабильно трансформированным с целью экспрессии полипептида, при этом полипептид экспрессируется за счет нуклеотидной последовательности, содержащей кодирующую последовательность для указанного полипептида; и (b) сбор антигенного полипептида из указанного растения ряски или узелка ряски. Термин «сбор» включает, но не ограничивается этим, извлечение из культуральной среды или очистку.
После получения рекомбинантного полипептида в ряске или микроводоросли для очистки белка может использоваться любой метод, доступный в данной области техники. Различные стадии включают освобождение белка от небелкового или растительного материала или материала микроводоросли, затем очистку интересующего белка от других белков. Первоначальные стадии процесса очистки включают центрифугирование, фильтрование или их комбинацию. Белки, секретированные во внеклеточном пространстве тканей, можно получить, путем извлечения с помощью вакуума или центрифугирования. Минимальная обработка также может предполагать приготовление сырых продуктов. Другие методы включают вымачивание (мацерацию) и экстракциюи дают возможность прямого использования экстракта.
В методах очистки интересующего белка могут использоваться различия в размере белка, физико-химических свойствах и аффинности связывания. Такие методы включают хроматографию, включая прокаинамид-аффинную, эксклюзионную, высокоэффективную жидкостную, обратно-фазовую и анионообменную хроматографию, аффинные метки, фильтрацию и т.д. В частности, для очистки экспрессированного белка может использоваться аффинная хроматография с использованием иммобилизованных ионов Ni. См., Favacho et al. (2006) Protein expression and purification 46:196-203. Смотри также, Zhou et al. (2007) The Protein J 26:29-37; Wang et al. (2006) Vaccine 15:2176-2185; и WO/2009/076778. В процессе очистки могут использоваться защитные средства (средства) предохранения, такие как осмотические вещества, антиоксиданты, фенольные ингибиторы окисления, ингибиторы протеазы и т.п.
Способы применения
В одном варианте осуществления предмет изобретения, раскрытый в описании, имеет отношение к способу вакцинирования овец, коров и коз, включающему введение овцам, коровам и козам эффективного количества вакцины, которое может включать эффективное количество рекомбинантного BTV полипептида или антигена и фармацевтически или с точки зрения ветеринарии приемлемый носитель, эксципиент, адъювант или разбавитель.
В одном варианте осуществления настоящего изобретения способ включает одно введение вакцинной композиции, заключенной в состав вместе с эмульсией или классической кристаллической солью согласно изобретению. В некотором варианте осуществления предмет изобретения, раскрытый в описании, имеет отношение к способу вакцинирования овец, коров и коз, включающему введение овцам, коровам и козам BTV полипептида или антигена, полученного в растении или водоросли, и растительного материала из рода Lemna или материала микроводоросли от schizochytrium.
В некотором варианте осуществления предмет изобретения, раскрытый в описании, имеет отношение к способу стимуляции иммунного ответа, включающему введение овцам, коровам и козам вакцины, содержащей BTV полипептид или антиген, экспрессированный в растении или водоросли, при котором вызывается иммунный ответ.
В некотором варианте осуществления предмет изобретения, раскрытый в описании, имеет отношение к способу получения стабильно трансформированного растения ряски, включающему, (а) введение в растение генетической конструкции, содержащей ген антигена BTV; и (b) культивирование растения. Способы трансформации ряски доступны в данной области техники.
В некотором варианте осуществления предмет изобретения, раскрытый в описании, имеет отношение к способу получения вакцины или композиции, содержащей изолированный BTV антиген, произведенный системой экспрессии ряски или микроводоросли и необязательно объединенный с фармацевтически или с точки зрения ветеринарии приемлемым носителем, эксципиентом, адъювантом или разбавителем.
В некотором варианте осуществления предмет изобретения, раскрытый в описании, имеет отношение к способу получения вакцины или композиции, содержащей сочетание BTV антигена, произведенного системой экспрессии Lemna, и растительного материала из рода Lemna и необязательно фармацевтически приемлемого или приемлемого с точки зрения ветеринарии носителя, эксципиента, адъюванта или разбавителя.
В другом варианте осуществления предмет изобретения, раскрытый в описании, имеет отношение к способу получения вакцины или композиции, содержащей сочетание BTV антигена, произведенного системой экспрессии Schizochytrium, и материала Schizochytrium и необязательно фармацевтически приемлемого или приемлемого с точки зрения ветеринарии носителя, эксципиента, адъюванта или разбавителя.
Введение может быть подкожным или внутримышечным. Введение может осуществляться с помощью безыгольного приспособления (например, Pigjet или Bioject).
В одном варианте осуществления изобретения может использоваться режим прайм-буст, который состоит, по меньшей мере, из одного первичного введения и, по меньшей мере, одного бустерного введения (вторичного, повторного введения) при использовании, по меньшей мере, одного общего полипептида, антигена, эпитопа или иммуногена. В большинстве случаев иммунологическая композиция или вакцина, используемая при первичном введении, отличается по своему характеру от той, которая применяется как бустер (вторичное введение антигена). Однако, следует отметить, что одна и та же композиция может быть использована для первичного введения и как буст (вторичное введение) Это протокол введения называется "прайм-буст".
Прайм-буст согласно настоящему изобретению может включать рекомбинантный вирусный вектор, используемый для экспрессирования BTV кодирующей последовательности или ее фрагментов. Конкретно, вирусный вектор может экспрессировать BTV ген или его фрагмент, кодирующий антигенный полипептид. Предполагаемый в описании вирусный вектор включает, но не ограничивается этим, поксвирус [например, вирус осповакцины или ослабленный вирус осповакцины, вирус рода авипокс или ослабленный вирус рода авипокс (например, оспы канареек, оспы кур, оспы диких голубей, оспы одомашненных голубей, ALVAC, TROVAC; см., например, США 5,505,941, США 5,494,8070), вирус оспы енотов, вирус оспы свиней и т.д.], аденовирус (например, человеческий аденовирус, собачий аденовирус), герпесвирус (например, собачий герпесвирус, герпесвирус индюшек, вирус болезни Марека, вирус инфекционного лагинготрахеита (ILTV), герпесвирус кошачьих, бычий герпесвирус, свиной герпесвирус), бакуловирус, ретровирус и т.д. В другом варианте осуществления авипокс-экспрессирующий вектор может быть вектором на основе вируса оспы канареек, таким как ALVAC. В еще одном варианте осуществления авипокс-экспрессирующий вектор может быть вектором на основе вируса оспы кур, таким как TROVAC. BTV антиген изобретения, который должен экспрессироваться, вставляется под контролем специфического промотора поксвируса, например, промотора энтомопоксвируса Amsacta moorei 42К. (Barcena, Lorenzo et al. 2000), промотора вируса осповакцины 7,5 кДа (Cochran et al., 1985), промотора вируса осповакцины I3L (Riviere et al., 1992), промотора вируса осповакцины НА (Shida, 1986), промотора вируса коровьей оспы ATI (Funahashi et al., 1988), промотора вируса осповакцины Н6 (Taylor et al., 1988b; Guo et al., 1989; Perkus et al., 1989), в числе прочих. В другом варианте осуществления авипокс вектор экспрессии может быть вектором на основе вируса оспы канареек, таким как, ALVAC. BTV полипептид, антиген, эпитоп или иммуноген может быть BTV VP2 или VP5 BTV. Вирусный вектор может быть VCP2289. который кодирует BTV кодон-оптимизированный синтетический VP2 и VP5 (см. США 2007/0280960).
В другом аспекте прайм-буст протокола изобретения, композицию, содержащую BTV-антиген изобретения, вводят после введения вакцины или композиции, содержащей рекомбинантный вирусный вектор, который содержит и экспрессирует BTV антиген in vivo, или инактивированной вирусной вакцины или композиции, содержащей BTV антиген, или вакцины или композиции с плазмидной ДНК, которая содержит или экспрессирует BTV антиген. Аналогично, прайм-буст протокол может включать введение вакцины или композиции, включающей рекомбинантный вирусный вектор, который содержит и экспрессирует BTV антиген in vivo, или инактивированной вирусной вакцины или композиции, содержащей BTV антиген, или вакцины или композиции с плазмидной ДНК, которая содержит или экспрессирует BTV антиген, за которым следует введение композиции, содержащей BTV антиген изобретения. Дополнительно следует отметить, что и первичное и вторичное введение может включать композицию, содержащую BTV антиген изобретения.
Прайм-буст протокол включает, по меньшей мере, одно первичное введение и, по меньшей мере, одно бустерное введение, с использованием, по меньшей мере, одного общего полипептида и/или его вариантов или фрагментов. Вакцина, использованная в первичном введении может сличаться по природе от вакцины, используемой в качестве более поздней бустерной вакцины. Первичное введение может включать одно или более введений. Подобным образом, бустерное введение может включать одно или более введений.
Объем дозы композиций, предназначенных для целевых видов животных, являющихся млекопитающими, например, объем дозы композиций, предназначенных для овец, коров и коз, на основе вирусных векторов, например, композиций на основе вирусного вектора за исключением вектора поксвируса, в большинстве случаев составляет примерно от 0,1 до 5,0 мл, примерно от 0,1 до 3,0 мл, и примерно от 0,5 мл до 2,5 мл.
Эффективность вакцин может быть проверена примерно через 2-4 недели после последней иммунизации посредством заражения животных, таких как овца, корова или коза, вирулентным штаммом BTV, таким как штаммы BTV-1/2/3/4/8/9/16 или 17. Например, штамм BTV может представлять собой серотип 17, который первоначально был выделен из крови овцы, от Tulare County, CA (see Bonneau, DeMaula et al. 2002; DeMaula, Leutenegger et al. 2002). Штамм BTV также может быть серотипом 8, для которого в настоящее время доступна инактивированная вакцина от Merial Limited.
Другие штаммы могут включать BTV1 (изолят из Франции), BTV1 (изолят из Австралии), BTV1 (изолят из Южной Африки), BTV2 (изолят из США), ВТУЗ (изолят из Южной Африки), BTV4-9, BTV10 (изолят из США), BTV11 (изолят из США), BTV12, BTV13 (изолят из США), BTV14-17, BTV17 (изолят из США), BTV18, BTV19, BTV20 (изолят из Австралии), BTV21-24 или корсиканский BTV.
Для заражения при тестировании эффективности вакцины могут использоваться и гомологичные и гетерологичные штаммы. Животное может быть заражено внутрикожно, подкожно, распылением, через нос, внутриокулярно, внутритрахеально и/или перорально.
Коровы и козы в отношении BTV оцениваются по распространенному повреждению сосудов. А овец в отношении BTV оценивают по катаральному воспалению слизистой оболочки рта, носа и переднего отдела желудка, воспалению венчика копыт и основы кожи копыт, отделению эпителия, некрозу слизистой оболочки щек и опухшему/воспаленному/синему языку и рту. Мазки для выделения вируса можно взять у всех животных после заражения. Присутствие или отсутствие вирусных антигенов в перечисленных выше тканях можно оценить с помощью полимеразной цепной реакции с обратной транскриптазой в реальном времени (qRRT-PCR). Образцы крови можно собрать до и после заражения и исследовать на присутствие анти-BTV специфических антител.
Прайм-буст введения предпочтительно могут проводиться с интервалом от 2 до 6 недель, например, с интервалом около 3 недель. Согласно одному варианту осуществления также предусматриваются полугодовые или ежегодные бустерные введения, предпочтительно с использованием вакцины на основе вирусного вектора. Предпочтительно во время первого введения животные находятся в возрасте, по меньшей мере, от 6 до 8 недель.
Композиции, включающие рекомбинантные антигенные полипептиды изобретения и применяемые в прайм-буст протоколах, содержатся в фармацевтически или с точки зрения ветеринарии приемлемом носителе, разбавителе, адъюванте или эксципиенте. Протоколы изобретения защищают животное от овечьего, бычьего и козьего BTV и/или предотвращают развитие болезни у инфицированного животного.
Предпочтительно разные введения выполняют с интервалом от 1 до 6 недель, а конкретнее около 3 недель. Согласно предпочтительному способу также предусматривается ежегодная бустер-инъекция, предпочтительно с использованием иммунологической композиции вакцины на основе вирусного вектора. Предпочтительно во время первого введения животные являются, по меньшей мере, суточными.
Специалисту в данной области техники должно быть понятно, что раскрытие предоставляется в описании как пример, однако настоящее изобретение не ограничивается этим. Из раскрытия в описании и знаний в данной области техники квалифицированный специалист может определить число введений, способ введения и дозы, которые следует использовать для каждого протокола введения, без проведения дополнительных экспериментов.
Настоящее изобретение предполагает, по меньшей мере, одно введение животному эффективного количества терапевтической композиции, изготовленной согласно изобретению. Животное может быть самцом, самкой, беременной самкой и новорожденным. Это введение может осуществляться разными путями включая, но не ограничиваясь этим, внутримышечную (IM), внутрикожную (ID) или подкожную (SC) инъекцию, или с помощью интраназального или пероарального введения. Терапевтическая композиция согласно изобретению также может быть введена с помощью безыгольных устройств (например, с помощью Pigjet, Dermojet, Biojector, Avijet (Merial, GA, США), приспособлений Vetjet или Vitajet (Bioject, Oregon, США). Другим подходом к введению плазмидных композиций является применение электропорации (см., например, Tollefsen et al., 2002; Tollefsen et al., 2003; Babiuk et al., 2002; PCT №заявки WO 99/01158). В другом варианте осуществления терапевтическая композиция доставляется животному с помощью генной пушки или бомбардировки золотыми частицами.
В одном варианте осуществления изобретение обеспечивает введение терапевтически эффективного количества композиции для доставки и экспрессии BTV антигена или эпитопа в клетках-мишенях. Определение терапевтически эффективного количества является обычной экспериментальной работой для среднего специалиста в данной области техники. В одном варианте осуществления композиция содержит вектор экспрессии, включающий полинуклеотид, который экспрессирует BTV антиген или эпитоп, и приемлемый фармацевтически или приемлемый с точки зрения ветеринарии носитель, разбавитель или эксципиент. В другом варианте осуществления фармацевтически или с точки зрения ветеринарии приемлемый носитель, разбавитель или эксципиент способствует трансфекции или другим методам переноса полинуклеотидов животному-хозяину и/или улучшает сохранение вектора или белка у хозяина.
В одном варианте осуществления предмет изобретения, раскрытый в описании, предоставляет способ различения инфицированных и вакцинированных животных (DIVA).
В настоящее время существует несколько доступных BTV вакцин. Merial предлагает инактивированные BTV1 и BTV8 вакцины. Intervet предлагает инактивированные BTV8 вакцины. Pfizer предлагает инактивированные BTV1, BTV4 и BTV8 вакцины. Способ нахождения различия между BTV-вакцинированными и BTV-инфицированными животными недавно был описан (Anderson, J et al, J. Virol. Methods, 1993; Silvia С. Barros et al., Veterinary-Microbiology, 2009).
В описании раскрывается, что применение вакцины или композиции настоящего изобретения делает возможным обнаружение BTV-инфекции у животного. В описании раскрывается, что применение вакцины или композиции настоящего изобретения дает возможность обнаружения инфекции у животных путем различения между инфицированными и вакцинированными животными (DIVA). Разработаны диагностические тесты на основе неструктурных белков, такие как непрямой NS3-ELISA и конкурентный ELISA с использованием моноклонального антитела против NS1. Однако, в том случае, когда вакцины недостаточно очищены, инактивированные вакцины все еще могут индуцировать низкие уровни антител к неструктурным белкам. Это ограничение будет преодолеваться настоящим изобретением, вызывающим экспрессию только белков внешней капсиды VP2 и VP5.
Готовое изделие
В некотором варианте осуществления предмет изобретения, раскрытый в описании, имеет отношение к набору для осуществления способа стимулирования или индуцирования иммунного ответа, который может включать любую одну из рекомбинантных BTV иммунологических композиций или вакцин или инактивированные BTV иммунологические композиции или вакцины, рекомбинантные BTV вирусные композиции или вакцины и инструкции для осуществления способа.
Другим вариантом осуществления изобретения является набор для осуществления способа индуцирования иммунологического или защитного ответа против BTV у животного, включающий композицию или вакцину, содержащую BTV антиген изобретения, и рекомбинантную BTV вирусную иммунологическую композицию или вакцину и инструкции для осуществления способа доставки в эффективном количестве для стимулирования иммунного ответа у животного.
Другим вариантом осуществления изобретения является набор для осуществления способа индуцирования иммунологического или защитного ответа против BTV у животного, включающий композицию или вакцину, содержащую BTV антиген изобретения, и инактивированную BTV иммунологическую композицию или вакцину и инструкции для осуществления способа доставки в эффективном количестве для стимулирования иммунного ответа у животного.
Следующий аспект настоящего изобретения имеет отношение к набору для прайм-буст вакцинации согласно настоящему изобретению, как описано выше. Набор может содержать, по меньшей мере, два флакона: первый флакон, содержащий вакцину или композицию для первичной вакцинации согласно настоящему изобретению, и второй флакон, содержащий вакцину или композицию для буст-вакцинации согласно настоящему изобретению. Набор может предпочтительно содержать дополнительный первый или второй сосуды для дополнительных первых вакцинаций или дополнительных буст-вакцинаций.
В изобретение включаются следующие варианты осуществления. В некотором варианте осуществления раскрывается композиция, содержащая BTV антиген или его фрагмент или вариант и фармацевтически приемлемый или приемлемый с точки зрения ветеринарии носитель, эксципиент или разбавитель. В другом варианте осуществления раскрывается композиция, описанная выше, в которой BTV антиген или его фрагмент или вариант включает иммуногенный фрагмент, содержащий, по меньшей мере, 15 аминокислот BTV-антигена овцы, коровы или козы. В следующем варианте осуществления раскрываются вышеуказанные композиции, в которых BTV антиген или его фрагмент или вариант получают в ряске или микроводоросли. В некотором варианте осуществления раскрываются вышеуказанные композиции, в которых BTV антиген или его фрагмент или вариант является частично очищенным. В некотором варианте осуществления раскрываются вышеуказанные композиции, в которых BTV антиген или его фрагмент или вариант является практически очищенным. В некотором варианте осуществления раскрываются вышеуказанные композиции, в которых BTV антиген или его фрагмент или вариант является BTV1-полипептидом. В некотором варианте осуществления раскрываются вышеуказанные композиции, в которых BTV1 полипептид является VP2 или VP5 полипептидом. В некотором варианте осуществления раскрываются вышеупомянутые композиции, в которых BTV антиген или его фрагмент или вариант имеет, по меньшей мере, 80%-ную идентичность последовательности с последовательностью, указанной в SEQ ID NO:4, 6, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25. В одном варианте осуществления раскрываются вышеупомянутые композиции, в которых BTV антиген кодируется полинуклеотидом, имеющим, по меньшей мере, 70%-ную идентичность последовательности с последовательностью, указанной в SEQ ID NO:1, 2, 3, 5, 7, 8 или 9.
В одном варианте осуществления раскрываются вышеуказанные композиции, в которых фармацевтически или с точки зрения ветеринарии приемлемый носитель, эксципиент, адъювант или разбавитель является эмульсией вода-в-масле или эмульсией масло-в-воде. В другом варианте осуществления раскрывается способ вакцинирования животного, чувствительного к овечьему, бычьему или козьему BTV, включающий введение указанных выше композиций животному. В некотором варианте осуществления раскрывается способ вакцинирования животного, чувствительного к овечьему, бычьему или козьему BTV, включающий режим прайм-буст. В одном варианте осуществления раскрывается практически очищенный антигенный полипептид, экспрессированный в ряске или микроводоросли, при этом полипептид содержит аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с полипептидом, имеющим последовательность, указанную в SEQ ID NO:4, 6, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25. В любом варианте осуществления животное является предпочтительно овцой, коровой или козой. В одном варианте осуществления раскрывается способ диагнострования BTV-инфекции у животного. В следующем варианте осуществления раскрывается набор для прайм-буст вакцинации, включающий, по меньшей мере, два флакона, при этом первый флакон содержит композицию настоящего изобретения, а второй флакон содержит состав для бустерной вакцинации, содержащий композицию, включающую рекомбинантный вирусный вектор, или композицию, включающую инактивированную вирусную композицию, или ДНК плазмидную композицию, которая содержит или экспрессирует BTV антиген.
Фармацевтически или с точки зрения ветеринарии приемлемые носители, разбавители, адъюванты или эксципиенты хорошо известны специалисту в данной области техники. Например, фармацевтически или с точки зрения ветеринарии приемлемый носитель, разбавитель, адъювант, или эксципиент может быть 0,9% NaCl (например, физиологическим) раствором или фосфатным буфером. Другой фармацевтически или с точки зрения ветеринарии приемлемый носитель, разбавитель, адъювант, или эксципиент, который может использоваться в способах данного изобретения, включает, но не ораничиваются этим, поли-(L-глутамат) или поливинилпирролидон. Фармацевтически или с точки зрения ветеринарии приемлемый носитель, разбавитель, адъювант или эксципиент может быть любым соединением или комбинацией соединений, способствующим введению вектора (или белка, экспрессируемого вектором изобретения in vitro); предпочтительно, носитель, разбавитель, адъювант или эксципиент может способствовать трансфекции и/или улучшать сохранность вектора (или белка). Дозировки и объемы доз обсуждаются в общем описании и также могут быть определены специалистом в данной области в результате прочтения раскрытия в сочетании со знаниями в данной области техники, без проведения дополнительных экспериментов.
Катионные липиды, содержащие соль четвертичного аммония, которые предпочтительно, но не обязательно, являются пригодными для плазмид, предпочтительно представляют собой липиды, имеющие следующую формулу:
в которой R1 является насыщенным или ненасыщенным алифатическим радикалом с неразветвленной цепью, имеющим от 12 до 18 атомов глерода, R2 является другим алифатическим радикалом, содержащим 2 или 3 атома углерода, и Х является аминной или гидроксильной группой, например, DMRIE. В другом варианте осуществления катионный липид может быть связан с нейтральным липидом, например, DOPE.
Среди катионных липидов предпочтение отдается DMRIE (N-(2-гидроксиэтил)-N,N-диметил-2,3-бис(тетрадецилокси)-1-пропанаммоний; WO 96/34109), предпочтительно связанному с нейтральным липидом, предпочтительно DOPE (диолеоил-фосфатидил-этаноламин; Behr, 1994), с образованием DMRIE-DOPE.
Предпочтительно смесь плазмиды с адъювантом приготавливают непосредственно перед и преимущественно одновременно с введением препарата или незадолго до введения препарата; например, незадолго до или перед введением изготавливают смесь плазмида-адъювант, при этом предпочтительно выдержать смесь в течение времени, достаточного для образования комплекса, например, примерно от 10 до 60 минут до введения, например, приблизительно 30 минут до введения.
В случае присутствия DOPE, молярное отношение DMRIE:DOPE составляет предпочтительно примерно от 95: до 5, примерно от 5: до 95, более предпочтительно около 1: около 1, например, 1:1.
Весовое соотношение между плазмидой и адъювантом DMRIE или DMRIE-DOPE может составлять около 50: около 1 и около 1: около 10, например, около 10: около 1 и около 1: около 5, и около 1: около 1 и около 1: около 2, например, 1:1 и 1:2.
В другом варианте осуществления фармацевтически или с точки зрения ветеринарии приемлемый носитель, эксципиент, разбавитель или адъювант может быть эмульсией вода-в-масле. Примеры подходящих эмульсий вода-в-масле включают вакцинные эмульсии на масляной основе вода-в-масле, которые являются стабильными и жидкими при 4°С и содержат от 6 до 50 об./об.% антиген-содержащей водной фазы, предпочтительно от 12 до 25 об./об.%, от 50 до 94 об./об.% масляной фазы, содержащей целиком или отчасти неметаболизируемое масло (например, минеральное масло, такое как парафиновое масло) и/или метаболизируемое масло (например, растительное масло, или жирная кислота, многоатомный спирт или спиртовые эфиры), от 0,2 до 20 p/v% поверхностно-активных веществ, предпочтительно от 3 до 8 p/v%, которые полностью или частично находятся в смеси любых сложных эфиров полиглицерина, указанные сложные эфиры полиглицерина представляют собой предпочтительно полиглицерин (поли)рицинолеаты, или полиоксиэтилен рициновые масла или еще гидрогенезированные полиоксиэтилен рициновые масла. Примеры поверхностно-активных веществ, которые могут использоваться в эмульсии вода-в-масле, включают этоксилированные сложные эфиры сорбитана (например, полиоксиэтилен (20) сорбитан моноолеат (Твин 80®), доступный от компании AppliChem, Inc., Cheshire, CT) и сложные эфиры сорбитана (например, сорбитан моноолеат (SPAN 80®), доступный от компании Sigma Aldrich, St. Louis, МО). В дополнение к этому, в отношении эмульсии вода-в-масле, также см. патент США №6,919,084, например. Пример 8. В некоторых вариантах осуществления водная фаза, содержащая антиген, включает солевой раствор, содержащий один или более буферных веществ. Примером подходящего буферного раствора является фосфатно-буферный раствор. В одном варианте осуществления эмульсия вода-в-масле может быть тройной эмульсией вода/масло/вода (W/O/W) (патент США №6,358,500). Примеры других подходящих эмульсий описаны в патенте США №7,371,395.
Иммунологические композиции и вакцины согласно изобретению могут содержать или в основном состоять из одного или более фармацевтически или с точки зрения ветеринарии приемлемого носителя, эксципиента, разбавителя или адъюванта. Для осуществления на практике настоящего изобретения подходящими носителями или адъювантами являются (1) полимеры акриловой и метакриловой кислоты, полимеры малеинового ангидрида и производного алкенила, (2) иммуностимулирующие последовательности (ISS), такие как олигодезоксирибонуклеотидные последовательности, содержащие один или более неметилированных мотивов CpG (Klinman et al., 1996; WO 98/16247), (3) эмульсии масло-в-воде, такие как эмульсия SPT, описанная на странице 147 работы "Vaccine Design, The Subunit and Адъювант Approach" published by M.Powell, M.Newman, Plenum Press 1995, и эмульсия MF59, описанная на странице 183 той же публикации, (4) катионные липиды, содержащие соль четвертичного аммония, например, DDA (5) цитокины, (6) гидроксид алюминия или фосфат алюминия, (7) сапонин или (8) другие адъюванты, обсуждаемые в любом документе, цитируемом и включенном путем отсылки в настоящую заявку, или (9) любые их комбинации или смеси.
Эмульсия масло в воде (3), особенно пригодная для вирусных векторов, может быть приготовлена на основе: легкого жидкого парафина (типа, предусмотренного Европейской фармакопеей), изопреноидного масла, такого как сквалан, сквален; масла, образующегося при олигомеризации алкенов, например, изобутена или децена; сложных эфиров кислот или спиртов с линейной алкильной группой, таких как растительные масла, этилолеат, пропиленгликоль, ди(каприлат/капрат), глицерил три(каприлат/капрат) и пропиленгликольдиолеат; сложных эфиров кислот или жирных спиртов с разветвленной цепью, в частности, сложных эфиров изостеариновой кислоты.
Для образования эмульсии масло используется в комбинации с эмульгаторами. Эмульгаторами могут служить неионные поверхностно-активные вещества, такие как: сложные эфиры, с одной стороны, сорбитана, маннида (например, ангидроманнитололеата), глицерина, полиглицерина или пропиленгликоля и, с другой стороны, олеиновой, изостеариновой, рицинолевой или гидроксистеариновой кислот, причем указанные сложные эфиры необязательно являются этоксилированными, или блок-сополимеры полиоксипропилен-полиоксиэтилен, в частности, плюроник, например, L121.
Из вспомогательных полимеров типа (1) предпочтение отдается сшитым полимерам акриловой или метакриловой кислоты, в частности, сшитым полиалкениловым эфирам Сахаров или многоатомных спиртов. Эти соединения известны под названием карбомеры (Pharmeuropa, vol.8, no. 2, June 1996). Специалист в данной области техники также может обратиться к патенту США №2909462, в котором описаны такие акриловые полимеры, сшитые полигидроксилированным соединением, содержащим, по меньшей мере, три гидроксильных группы, предпочтительно, не более восьми таких групп, при этом атомы водорода, по меньшей мере, в трех гидроксильных группах замещены алифатическими ненасыщенными радикалами, содержащими, по меньшей мере, два атома углерода. Предпочтительными радикалами являются радикалы, содержащие от 2 до 4 атомов углерода, например, винилы, аллилы и другие ненасыщенные группы этиленового ряда. Ненасыщенные радикалы также могут содержать другие заместители, такие как метил. Особенно подходящими являются продукты, продаваемые под названием Carbopol (BF Goodrich, Огайо, США). Они сшиты, в частности, аллильным производным сахарозы или аллилпентаэритритолом. Из них, в частности, можно упомянуть Carbopol 974P, 934Р и 971Р.
Из сополимеров малеинового ангидрида и производного алкенила предпочтение отдается EMA (Monsanto), которые являются линейными или сшитыми сополимерами малеинового ангидрида и этилена, например, сшитые дивиниловым эфиром. Можно также сослаться на J. Fields et al., 1960.
Что касается структуры, полимеры акриловой или метакриловой кислоты и EMA образованы преимущественно структурными единицами, имеющими следующую формулу:
где:
- R1 и R2, одинаковые или разные, представляют собой Н или СНЗ
- х=0 или 1, предпочтительно х=1
- y=1 или 2, при этом х+y=2.
Для ЕМА х=0 и y=2, а для карбомеров х=у=1.
Эти полимеры являются растворимыми в воде или физиологическом солевом растворе (20 г/л NaCl), при этом значение рН может быть отрегулировано до значения 7,3-7,4, например, содой (NaOH), для получения раствора адъюванта, в который могут быть введены вектор(ы) экспрессии. Концентрация полимера в окончательной иммунологической композиции или вакцине может колебаться в пределах примерно от 0,01 до 1,5% вес./об., примерно от 0,05 до 1% вес./об. и примерно от 0,1 до 0,4% вес./об.
В составе иммунологической композиции или вакцины цитокин или цитокины (5) могут находиться в виде белка или могут экспрессироваться у хозяина вместе с иммугеном или иммуногенами или их эпитопом(ами). Предпочтение отдается коэкспрессии цитокина или цитокинов или посредством того же вектора, который экспрессирует иммуноген или иммуногены или его эпитоп(ы), или посредством собственного отдельного вектора.
Изобретение включает получение таких комбинированных композиций; например, путем примешивания активных компонентов, предпочтительно вместе с адъювантом, носителем, цитокином и/или разбавителем.
Цитокины, которые могут использоваться в настоящем изобретении, включают, но не ограничиваются этим, гранулоцитарный колониестимулирующий фактор (G-CSF), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), интерферон α (IFNα), интерферон β (IFNβ), интерферон γ (IFNγ), интерлейкин-1α (1L-1α), интерлейкин-1β (IL-1β), интерлейкин-2 (IL-2), интерлейкин-3 (IL-3), интерлейкин-4 (IL-4), интерлейкин-5 (IL-5), интерлейкин-6 (IL-6), интерлейкин-7 (IL-7), интерлейкин-8 (IL-8), интерлейкин-9 (IL-9), интерлейкин-10 (IL-10), интерлейкин-11 (IL-11), интерлейкин-12 (IL-12), фактор некроза опухолей α (TNFα), фактор некроза опухолей β (TNFβ) и трансформирующий фактор роста β (TGFβ). Понятно, что цитокины могут быть введены совместно и/или последовательно с иммунологической композицией или вакциной настоящего изобретения. Таким образом, например, вакцина настоящего изобретения также может содержать молекулу экзогенной нуклеиновой кислоты, т vivo экспрессирующей подходящий цитокин, например, цитокин, подходящий для данного хозяина, которого нужно вакцинировать, или у которого нужно вызвать иммунологический ответ (например, коровий цитокин для препаратов, предназначенных для введения коровам).
Предпочтительно иммунологическая композиция и/или вакцина согласно изобретению включает или в основном содержит или включает эффективное количество, для индуцирования терапевтического ответа, одного или более полипептидов, как описано здесь; при этом эффективное количество можно определить из данного описания, учитывая включенные в описание документы и знания в данной области техники без проведения дополнительных экспериментов.
В случае иммунологической композиции и/или вакцины на основе экспрессированных полипептидов доза может содержать примерно от 1 мкг до 2000 мкг, предпочтительно примерно от 50 мкг до 1000 мкг и более предпочтительно примерно от 100 мкг до 500 мкг BTV антигена, эпитопа или иммуногена. Объем дозы может составлять примерно от 0,1 до 10 мл, предпочтительно примерно от 0,2 до 5 мл.
Теперь изобретение будет дополнительно описано с помощью следующих неограничивающих примеров.
Примеры
Создание ДНК-вставок, плазмид и рекомбинантных вирусных или растительных векторов осуществляли с помощью стандартных методов молекулярной биологии, описанных J. Sambrook et al. (Molecular Cloning: A Laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory, Cold Spring Harbor, New York, 1989).
Пример 1. Создание плазмиды pCG102. экспрессирующей VP5 BTVL плазмиды pCG100. экспрессирующей VP2 BTV1. и плазмиды pCG101. экспрессирующей BTV1 VP2+с-Myc
Цель этих эксперментов - получить плазмидные конструкции на основе pVR1012, содержащие ген VP2 или VP5 от BTV серотипа 1, и подтвердить экспрессию в трансфицированных клетках линии СНО. Подробности о pVR1012 можно найти, например, в VICAL Inc.; Luke et al., 1997; Hartikka et al., 1996; патентах США №5846946 и 6451769. Эти эксперименты были разработаны для получения подходящих контролей с целью оптимизировать обнаружение/количественное определение экспрессированных в ряске BTV антигенов.
BTV1 VP2 ORF, оптимизированная для экспрессии у млекопитающих (SEQ ID NO:2), BTV1 VP2, оптимизированный для экспрессии у млекопитающих, содержащий с-myc tag (SEQ Ю NO:5), и BTV1 VP5 ORF, оптимизированная для экспрессии у млекопитающих (SEQ ID NO:8), были клонированы в плазмиду pVR1012 с использованием сайтов EcoRV и XbaI и вектора и вставки, для получения pCG100, pCG101 и pCG102, соответственно. Экспрессию in vitro белка VP2 BTV1 (SEQ ID NO:4) и белка VP5 BTV1 (SEQ ID NO:10) определяли после временной трансфекции клеток линии СНО-F1, используя Lipofectamine 2000 (Invitrogen, Carlsbad CA). При достижении конфлюэнтности 90% клетки линии СНО-K1 в плоских чашках диаметром 6 см трансфицировали 5 мкг плазмиды и 10 мкл Lipofectamine, согласно инструкциям производителя. После трансфекции клетки культивировали в среде МЕМ-глютамакс (Invitrogen, Carlsbad CA), содержащей 1% SVF в течение 24 часов. Культуральные супернатанты собирали и концентрировали в 50 раз осаждением белков при помощи ТСА. Клетки промывали PBS, собирали соскабливанием и лизировали с использованием Laemmli SDS-PAGE загрузочного буфера. Выработку и секрецию рекомбинантного белка анализировали, проводя SDS-PAGE и вестерн-блоттинг полных клеточных экстрактов и концентрированных (50х) культуральных супернатантов или с кроличьими поликлональными антителами против VP2 белка (GENOVAC, Freiburg, Германия) или моноклональными антителами против VP5 белка (10АЕ12, Ingenasa, Испания).
Эпитоп моноклонального антитела, использованного для анализа экспрессии (антитело AHSV 10АЕ12 предоставлено Ingenasa, Испания), был локализован в пределах аминокислот от 85 до 92 белка VP5 - высококонсервативной области среди разных орбивирусов, таких как вирус африканской болезни лошадей (AHSV), вирус «синего языка» (BTV) и вирус эпизоотической геморрагической болезни (EHDV) (Martinez-Torrecuadrada et al. Virology, 257, 449-459; 1999). Эти результаты картирования эпитопа указывали на то, что моноклональное антитело можно использовать как группоспецифический реагент, и наши результаты свидетельствовали, что это наблюдение было правильным. Вторичным антителом было анти-мышиное IRDye800 в разведении 1/10000.
Как показано на Фиг.5, BTV1 VP5 специфически обнаруживается с помощью AHSV 10АЕ12 антитела в рСС102-трансфицированной фракции клеток СНО, но не в супернатанте. Фигуры 7 и 8 показывают результаты вестерн-блоттинга для Pab L167 и Pab L 168 на VP2 от разных BTV серотипов. Распределение дорожек 1) маркер, 2) pVR.1012, 3) pCG100 (VP2 BTV1), 4) pIV001 (VP2 BTV2), 5) pIV002 (VP2 BTV4), 6) pKMR003 (VP2 BTV8), 7) pCG030 (VP2 BTV9) и 8) pIV003 (VP2 BTV16).
Пример 2. Создание BTV векторов экспрессии и трансформация растений
Оптимизированные для ряски VP2 BTV (SEQ ID NO:3) и VP5 BTV (SEQ ID NO:9) гены из патогенного BTV1 изолята были экспрессированы с помощью Biolex's LEX system™, запатентованной белковой системаы Lemna minor. Как показано на Фигурах 10, 11, 12, 13 и 14, было создано несколько вариантов, включая векторы, экспрессирующие и VP2 и VP5 (MerD01 & MerD02), и векторы, экспрессирующие только VP2 (MerD03 & MerD04).
Для скрининга были созданы трансгенные линии (Таблица 2). После получения трансгенных линий, их отобрали в отношении экспрессии BTV в среде и ткани. Коротко, растения выращивали в течение двух недель в небольших сосудах и собирали полученную среду и ткань для исследования. Для анализа тканей замороженные ткани гомогенизировали, центрифугировали и отбирали супернатант для исследования.
Готовили экстракт из сырой (необработанной) ткани из линии, содержащей BTV антигены. Все стадии проводили при 4°С. Сто грамм замороженной биомассы (растительный материал, собранный из среды) смешивали с 200 мл буфера для экстракции (50 мМ NaPO4; 0,3M NaCl, 10 мМ EDTA, рН 7,4) и затем гомогенизировали в гомогенизаторе Уоринга (20 секунд на полной скорости 4 раза и 10-20-секундным охлаждением между ними). Гомогенат центрифугировали при 10,000×g в течение 30 мин при 4°С, очищали фильтрованием через целлюлозно-ацетатный фильтр (0,22 мкм). Полученный гомогенат хранили при 4°С или на льду во время непосредственного тестирования. Оставшийся гомогенат замораживали в аликвотах при -80°С для дальнейших исследований. Общий растворимый белок (TSP) определяли по методу Брэдфорд с использованием бычьего сывороточного альбумина в качестве стандарта.
Четыре линии ряски, экспрессирующие ВТ VI, были отобраны для увеличения масштаба после первоначального этапа скрининга. Были выбраны линии, экспрессирующие VP2 на наиболее высоком уровне, так как считается, что VP2 белок/антиген значительно способствует защитному иммунному действию композиций вакцин, содержащих указанный белок/антиген. Линии ряски, экспрессирующие оптимизированный VP2 на наиболее высоком уровне, что было определено с помощью вестерн-блоттинга для BTV, выращивали в сосудах большого размера, чтобы обеспечить биомассу для использования при изучении характеристик и исследовании на животных.
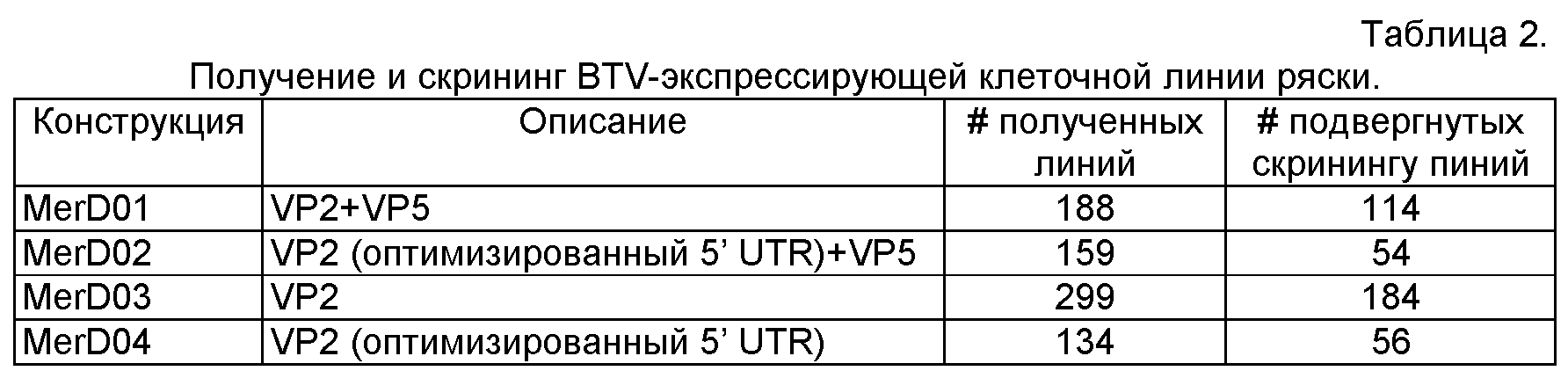
Для определения молекулярной массы (М) экспрессированных в ряске BTV-антигенов использовали вестерн-блоттинг. Смотри также опубликованную патентную заявку США 2004/261148 на предмет подробного описания получения рекомбинантно экспрессированных полипептидов/антигенов из ряски. Коротко, 100 мг замороженной растительной ткани гомогенизировали в 1 мл буфера для экстракции (в соотношении 1:10, вес./об.), центрифугировали и отбирали супернатант для исследования. Буфер для экстракции содержал 50 мМ NaPO4, 0,3M NaCl, 10 мМ EDTA, рН 7,4. 1,0% Твин 80, 10% глицерин и 1,0% Твин 80/10% Глицериновые буферы получали добавлением соответствующих количеств Твина 80 и/или глицерина к стандартному буферу для экстракции. Экстрагированные образцы примешивали к SDS буферу непосредственно после экстракции и затем инкубировали на льду в течение 2 часов, затем SDS буфер, 4 часа инкубации на льду с последующим SDS буфером, 1х, 2х и 3х замерзание-оттаивание с последующим SDS буфером. Затем образцы разделяли на 4-20% трис-глициновых гелях при восстанавливающих условиях.
Было установлено, что к буферу для экстракции следует добавлять 10% глицерин при кожчественном анализе белка VP5. Исходя из данных, была возможна агрегация VP5 белка, а количественная оценка с помощью вестерн-блотинга вероятно занижала количество VP5 белка, присутствующего в образце (т.е. поскольку белок не очень хорошо разделяется на геле, оставшиеся агрегаты не обнаруживаются). В вестерн-блоттинге для обнаружения экспрессии VP5 использовали УР5-моноклональные антитела, клона #10АЕ12. Результаты Вестерн-анализа показаны на Фигуре 18.
VP2 антиген был количественно определен с помощью денситометрии с использованием окрашивания SDS/PAGE кумасси (Таблица 3) и Agilent 2100 Bioanalyzer (Таблица 4). В случае кумасси-денситометрии плотность полос УР2-антигена на стандартном окрашенном кумасси SDS/PAGE геле сравнивали с BSA-стандартом (бычий сывороточный альбумин). Результатом сравнительной денситометрии была концентрация белка VP2. Результаты количественной SDS/кумасси денситометрии показаны в Таблице 3.
В дополнение к денситометрическому анализу с использованием окрашивания SDS-PAGE кумасси, VP2 BTV был определен количественно с помощью прибора Agilent 2100 Bioanalyzer. Этот прибор представляет собой систему на основе чипов, созданную для измерения размера и количественного определения белков. Измерение сопровождалось сравнением MW и интенсивности полосы со стандартным белковым маркером, предоставленным производителем. Результаты показаны в Таблице 4.
Исходя из этих результатов, все четыре линии ряски экспрессируют антиген VP2 BTV1 на уровне около или выше 50 мкг/мл мишень.
Пример 3. Вакцинация овец
Вакцины/композиции, предназначенные для тестирования, показаны в Таблице 5 ниже.
В эксперименте с вакцинацией (на День 0) использовали тридцать одну овцу, самок и самцов в возрасте от 4 до 6 месяцев. На День 2 всех овец (31) взвешивали по отдельности, затем случайным образом разбили на 5 групп по 5 овец в группе (группы с G1 по G5) и одну груупу из 6 овец (G6). На День 0 и День 21 животные из группы G1 получили одну дозу (1 мл) коммерческой вакцины BTVPUR AlSap1, эти животные служили положительным контролем. Каждое животное из групп G2, G3, G4 и G5 получило одну дозу объемом 1,2 мл BTV-композиции из ряски, как описано в Таблице 6. Животные из группы G6 оставались необработанными и служили в качестве отрицательного контроля. Инъекции вакцины делали подкожно в правую боковую поверхность грудной клетки около колена в День 0 и левую боковую поверхность грудной клетки на День 21.
Пример 4. Титрование антител с помощью нейтрализации сывороткой
На День 29 до начала исследования все овцы были отрицательными в отношении BTV, исходя из титрования с помощью ELISA, и, таким образом, были включены в исследование. Их отрицательный серологический статус был подтвержден на День 0 до вакцинации с помощью SN-теста (нейтрализации сывороткой). Средние значения титров антител (SN-тест) для каждой лечебной группы на протяжении всего исследования показаны на Фигуре 25.
Исследования крови проводились после измерения ректальной температуры. На День 0 (до первой иммунизации). День 21 (до второй вакцинации). День 35, День 42 (до контрольного заражения) и День 56 у всех животных из яремной вены отбирали образцы крови в сухую пробирку. Образцы крови центрифугировали для сбора сыворотки. Сыворотку разделяли на два образца, а затем инактивировали нагреванием (30 минут при 56°С), и тестировали в трехкратных разведениях, начиная от 1/3, в титрационных микропланшетах. Сто микролитров разбавленной сыворотки инкубировали 1 час при 37°С вместе с 50 микролитрами суспензии вирусов данного BTV серотипа (BTV1), содержащей приблизительно 25 TCID50 вирусов на лунку. Затем к смеси добавили пятьдесят микролитров суспензии клеток VERO, содержащей 500000 клеток на мл, и планшеты инкубировали при 37°С в течение 7 дней. Снятие показаний было основано на цитопатическом действии. Сывороточные титры, выраженные в log10 (PD 50%) были вычислены методом регрессии после тригонометрического преобразования. Титр, составлявший более чем 0,48, считался положительным.
Как показано на фиг.25, все титры антител были значительно выше контрольного до и после заражения.
Пример 5. Проверка эффективности BTV вакцин, полученных в ряске, с помощью RT-PCR
На День 42 (до заражения), День 47, День 49, День 51, День 54 и День D56 у всех овец были взяты образцы крови с помощью пункции из яремной вены. Для того, чтобы обнаружить и количественно определить РНК вируса «синего языка» в крови, было проведено qRT-PCR исследование этих образцов. После выделения РНК с помощью коммерческого набора, сначала РНК денатурировали с помощью термической обработки. Затем одну аликвоту (в двух повторноетях) инкубировали с зондом TaqMan MGB, BTV специфическими праймерами и реагентом, по инструкции для амплификации (Invitrogen Super Script III Platinum One Step Kit). BTV-специфические праймеры были созданы для гибридизации последовательности нуклеиновой кислоты внутри консервативных участков BTV, консервативных среди всех известных BTV-серотипов. Сигнал флуоресцеции пропорционален количеству синтезированной ДНК. Количественное определение нуклеиновых кислот BTV в образцах было выполнено путем сравнения со стандартизованными образцами РНК. Количество РНК было выражено в Log10 числа РНК копий на мл крови.
Результаты qRT-PCR представлены на Фигуре 26 и в Таблице 7 ниже. Было подтверждено, что все овцы были отрицательными в отношении вирусной РНК BTV до заражения (День 42). В G6 (контрольная группа) все овцы были положительными во все дни исследования после контрольной иммунизации. Титры индивидуальной вирусемии были высокими на протяжении всего периода после заражения, находясь в пределах от 6,60 до 8,59 log 10 РНК копий/мл. В противоположность этому, у всех вакцинированных животных наблюдалась отрицательная вирусемия на всем протяжении периода после заражения. Таким образом, наблюдалось предотвращение вирусемии у 100% животных в каждой вакцинированной группе. Общая кинетика вирусемии была значительно уменьшена в каждой вакцинированной группе по сравнению с контрольной группой (р=0,003).
Пример 6. Клинические признаки полученных BTV-вакцин
Чтобы приучить животных к манипуляциям, ректальную температуру измеряли у всех животных в День-2 и День-1 (не для исследования). Ширину местных реакций в месте инъекции (в см) и в некотором количестве участков измеряли с помощью штангенциркуля. Клинические признаки регистрировали в следующие дни: День 0 (до первой иммунизации), День 0 (16 часов), День 1, День 2, День 7, Ддень 14, День 21 (перед второй вакцинацией) и День 21 (16 часов), День 22, День 23, День 28, День 35.
В день 42 замороженный штамм для контрольного заражения (BTV1) размораживали путем частичного погружения в теплую воду, а затем держали на дробленом льду. Всем овцам ввели по 3 мл штамма для контрольного заражения внутрикожно в нескольких местах в паховой области. Перед любыми другими манипуляциями проводилось измерение ректальной температуры. Ректальную температуру у всех животных измеряли в день 42 перед началом тестирования, затем ежедневно со Дня 47 до Дня 56. Результаты представлены на Фигурах 21, 22 и 23. Как показано на Фиг.23, со Дня 47 и далее средняя ректальная температура в контрольной группе (G6) значительно увеличивалась, в среднем на +0,9°С между Днем 42 (заражение) и Днем 48. В противоположность этому, средняя ректальная температура во всех вакцинированных группах не увеличивалась и оставалась относительно стабильной на всем протяжении периода исследования. Статистическое сравнение показало, что в каждой вакцинированной группе наблюдался значительно более низкий уровень максимальной гипертермии, чем в контрольной группе G6 (р<0,001).
Со Дня 47 по День 56 проводилась ежедневное клиническое обследование всех животных. Клинические признаки включали: гиперемия ушей, глаз, ноздрей, губ, опухание ушей, глаз, морды, ноздрей, губ, слюноотделение, хромота, кашель/затруднение дыхания, диарея, выделения из носа/образование корки, петехия (точечные кровоизлияния), покраснение кожи (эритема) и вес. Общее состояние и поведение животных оценивали при помощи качественной шкалы оценки - балл 0 соответствовал "хорошему состоянию", что означало, что животное было полностью здоровым, подвижным и внимательным. Балл 1 соответствовал "апатии", что означало, что животное остается в отдалении от остальных и передвигается медленно. Балл 2 соответствовал "депрессии" что означало, что животное лежит на некотором расстоянии, сохраняя внимание. Балл 3 соответствовал "прострации", что означало, что животное находится в лежачем положении и мерзнет (дрожит). Нормальный вес был указан как 0, 1 - худое животное и 2 - упадок сил. Балл гипертермии вычисляли для каждого животного каждый день после контрольного заражения. Балл гипертермии вычисляли, как описано далее: Рект. Темп.≤40.0°С=балл 0; 40.0°С<Рект. Темп.<41.0°С=балл 1; 41.0°С<Рект. Темп.<42.0°С=балл 2; Рект. Темп.≥42.0°С=балл 4. Ежедневный клинический балл вычислялся путем сложения балла гипертермии, балла общего состояния, балла состояния организма, числа наблюдаемых специфических клинических признаков (+1 очко на наблюдаемый клинический признак) и числа непредвиденных признаков, оцениваемых как связанные с заражением (+1 очко на зарегистрированный признак). Для каждого животного вычисляли Общий клинический счет (GCS), суммируя индивидуальные ежедневные клинические баллы в течение периода после контрольного заражения (День 47-День 56). Средний ежедневный клинический счет показан на Фигуре 24. Результаты показали, что на День 48, средний ежедневный клинический балл в G6 (контрольная группа) достигал максимума и оставался высоким (между 5,8 и 6,5 баллов) до Дня 51. GCS в этой группе находился в пределах от 20 до 53 баллов. Однако, в вакцинированных группах, средний ежедневный клинический счет оставался очень низким (<1 очка) на протяжении всего исследования, а индивидуальный GCS был равен 0 для половины животных или никогда не превышал 5. Статистическое сравнение GCS показало значимое различие между каждой вакцинированной группой и контрольной группой (р<0,01).
Оценка эффективности BTV-композиций/вакцин из ряски показала, что наблюдалась сильная защита от заражения BTV у 100% вакцинированных животных и полное предотвращение вирусемии после заражения у всех вакцинированных животных. Проведенная оценка клинических признаков показала отсутствие после вакцинации общих реакций, связанных с обработкой, удовлетворительную местную безопасность после первой и второй инъекций и удовлетворительный иммунный ответ.
Пример 7. Экспрессия ВТУ-антигенов в Schizochytrium
Кодон-оптимизированные BTV VP2 и VP5 гены заклонированы в вектор экспрессии рАВ0018 (АТСС номер депозита РТА9616). Специфическая нуклеиновокислотная последовательность BTV гена оптимизирована для экспрессии в Schizochytrium sp. Дополнительно, экспрессионный вектор содержит кассету селективного маркера, придающего устойчивсоть Schizochytrium трансформантам, промотор от нативного гена Schizochytrium для управления экспрессией трансгена и терминатор.
Schizochytrium sp.(АТСС 20888) используется как хозяин для трансформации экспрессионным вектором, содержащим BTV ген, методом электропорации. Криостоки трансгенных штаммов Schizochytrium выращивают в М50-20 (описано в США 2008/0022422) до конфлюэнтности. Выращенные культуры Schizochytrium переносят в 50 мл конические пробирки и центрифугируют при 3000g в течение 15 минут или 100,000g в течение 1 часа. Полученный осадок и растворимую фракцию используют для анализа экспрессии и при исследовании заражения на животных.
Итак, имея подробно описанные предпочтительные варианты осуществления настоящего изобретения, следует понимать, что изобретение, определенное вышеприведенными параграфами, не ограничивается конкретными деталями, установленными в вышеприведенном описании, поскольку возможны многие его явные варианты без отступления от существа и объема настоящего изобретения.
Все документы, цитированные или упомянутые в списке процитированных документов, и все документы, цитированные или упомянутые в описании ("документы, цитируемые здесь"), и все документы, процитированные или упомянутые в документах, цитируемых здесь, вместе с любыми инструкциями прозводителя, описаниями, спецификациями продукта и описаниями продукта в отношении любых продуктов, упомянутых в описании или в любом документе, включенном в описание путем отсылки, этим включаются в описание путем отсылки, и могут использоваться при осуществлении изобретения на практике.
Ссылки
Anderson, G. A., J. L. Stott, et al. (1985). "Subclinical and clinical bluetongue disease in cattle: clinical, pathological and pathogenic considerations." Prog Clin Biol Res 178: 103-7.
Anderson, J., Mertens, P.P., Hemiman, K.A., 1993. A competitive ELISA for the detection of anti-tubule antibodies using monoclonal antibody against bluetongue virus non-structural protein NS1. J. Virol. Methods 43, 167-175.
Andreansky, S.S., B.He, et al. (1996). "The application of genetically engineered herpes simplex viruses to the treatment of experimental brain tumors." Proc Natl Acad Sci USA 93(21): 11313-8.
Andrew, M., P.Whiteley, et al. (1995). "Antigen specificity of the ovine cytotoxic Т lymphocyte response to bluetongue virus." Vet Immunol Immunopathol 47(3-4): 311-22.
Antoine, G., F. Scheiflinger, et al. (1998). "The complete genomic sequence of the modified vaccinia Ankara strain: comparison with other orthopoxviruses." Virology 244(2): 365-96.
Ballay, A., M. Levrero, et al. (1985). "In vitro and in vivo synthesis of the hepatitis В virus surface antigen and of the receptor for polymerized human serum albumin from recombinant human adenoviruses." Embo J 4 (13B): 3861-5.
Barcena, J., M.M.Lorenzo, et al. (2000). "Sequence and analysis of a swinepox virus homologue of the vaccinia virus major envelope protein P37 (F13L)." J Gen Virol 81 (Pt 4): 1073-85.
Bernard, K.A., B.A.Israel, et al. (1997). "Sequence and cognitive analyses of two virulence-associated markers of bluetongue virus serotype 17." Intervirology 40(4): 226-31.
Bonneau, K.R., С.D.DeMaula, et al. (2002). "Duration of вирусемии infectious to Culicoides sonorensis in bluetongue virus-infected cattle and sheep." Vet Microbiol 88(2): 115-25.
Bonneau, K.R., B.A.Mullens, et al. (2001). "Occurrence of genetic drift and founder effect during quasispecies evolution of the VP2 and NS3/NS3A genes of bluetongue virus upon passage between sheep, cattle, and Culicoides sonorensis." J Virol 75(17): 8298-305.
Bonneau, K.R., N.Zhang, et al. (1999). "Sequence comparison of the L2 and S 10 genes of bluetongue viruses from the United States and the People's Republic of China." Virus Res 61(2): 153-60.
Boshart, M., F.Weber, et al. (1985). "A very strong enhancer is located upstream of an immediate early gene of human cytomegalovirus." Cell 41(2): 521-30.
Bradel-Tretheway, B.G., Z.Zhen, et al. (2003). "Effects of codon-optimization on protein expression by the human herpesvirus 6 and 7 U51 open reading frame." J Virol Methods 111(2): 145-56.
Carroll, M.W, W.W.Overwijk, et al. (1997). "Highly attenuated modified vaccinia virus Ankara (MVA) as an effective recombinant vector: a murine tumor model." Vaccine 15(4): 387-94.
Cochran, M.A., C.Puckett, et al. (1985). "hi vitro mutagenesis of the promoter region for a vaccinia virus gene: evidence for tandem early and late regulatory signals." J Virol 54(1): 30-7.
Cowley, J.A. and B.M.German (1989). "Cross-neutralization of genetic reassortants of bluetongue virus serotypes 20 and 21." Vet Microbiol 19(1): 37-51.
De Groot, A.S. and F.G.Rothman (1999). "In silico predictions; in vivo veritas." Nat Biotechnol 17(6): 533-4.
de Mattos, C.A., C.C.de Mattos, et al. (1994). "Heterogeneity of the L2 gene of field isolates of bluetongue virus serotype 17 from the San Joaquin Valley of California." Virus Res 31(1): 67-87.
DeMaula, C.D., K.R.Bonneau, et al. (2000). "Changes in the outer capsid proteins of bluetongue virus serotype ten that abrogate neutralization by monoclonal antibodies." Virus Res 67(1): 59-66.
DeMaula, C.D., H.W.Heidner, et al. (1993). "Neutralization determinants of United States bluetongue virus serotype ten." Virology 195(1): 292-6.
DeMaula, C.D., C.M.Leutenegger, et al. (2002). "The role of endothelial cell-derived inflammatory and vasoactive mediators in the pathogenesis of bluetongue." Virology 296(2): 330-7.
Disbrow, G. L., I. Sunitha, et al. (2003). "Codon optimization of the HPV-16 E5 gene enhances protein expression." Virology 311(1): 105-14.
Felgner, J.H., R.Kumar, et al. (1994). "Enhanced gene delivery and mechanism studies with a novel series ofcationic lipid formulations." J Biol Chem 269(4): 2550-61.
Frolov, I., T. A. Hoffman, et al. (1996). "Alphavirus-based expression vectors: strategies and applications." Proc Natl Acad Sci USA 93(21): 11371-7.
Funahashi, S., T. Sato, et al. (1988). "Cloning and characterization of the gene encoding the major protein of the A-type inclusion body ofcowpox virus." J Gen Virol 69 (Pt 1): 35-47.
Geysen, H.M. (1990). "Molecular technology: peptide epitope mapping and the pin technology." Southeast Asian J Trop Med Public Health 21(4): 523-33.
Geysen, H.M., S.J.Barteling, et al. (1985). "Small peptides induce antibodies with a sequence and structural requirement for binding antigen comparable to antibodies raised against the native protein." Proc Natl Acad Sci U S A 82(1); 178-82.
Geysen, H.M., R.H.Meloen, et al. (1984). "Use of peptide synthesis to probe viral antigens for epitopes to a resolution of a single amino acid." Proc Natl Acad Sci U S A 81(13): 3998-4002.
Ghiasi, H., A. Fukusho, et al. (1987). "Identification and characterization of conserved and variable regions in the neutralization VP2 gene ofbluetongue virus." Virology 160(1): 100-9.
Graham, F. L. (1990). "Adenoviruses as expression vectors and recombinant vaccines." Trends Biotechnol 8(4): 85-7.
Guo, P.X., S.Goebel, et al. (1989). "Expression in recombinant vaccinia virus of the equine herpesvirus 1 gene encoding glycoprotein gpl3 and protection of immunized animals." J Virol 63(10): 4189-98.
Hartikka, J., M.Sawdey, et al. (1996). "An improved plasmid DNA expression vector for direct injection into skeletal muscle." Hum Gene Ther 7(10): 1205-17.
Hassan, S.S. and P.Roy (1999). "Expression and functional characterization ofbluetongue virus VP2 protein: role in cell entry." J Virol 73(12): 9832-42.
Heidner, H.W., P.V.Rossitto, et al. (1990). "Identification of four distinct neutralizing epitopes on bluetongue virus serotype 10 using neutralizing monoclonal antibodies and neutralization-escape варианты." Virology 176(2): 658-61.
Hemmer, В., С.Pinilla, et al. (1998). "The use of soluble synthetic peptide combinatorial libraries to determine antigen recognition of Т cells." J Pept Res 52(5): 338-45.
Huang, I.J., G.Y.Hwang, et al. (1995). "Sequence analyses and antigenic epitope mapping of the putative RNA-directed RNA polymerase of five U.S. bluetongue viruses." Virology 214(1): 280-8.
Huismans, H. and B.J.Erasmus (1981). "Identification of the serotype-specific and group-specific antigens ofbluetongue virus." Onderstepoort J Vet Res 48(2): 51-8.
Huismans, H., N.T. van der Walt, et al. (1987). "Isolation of a capsid protein ofbluetongue virus that induces a protective immune response in sheep." Virology 157(1): 172-9.
Jewell, J.E. and J.O.Mecham (1994). "Identification of an amino acid on VP2 that affects neutralization ofbluetongue virus serotype 10." Virus Res 33(2): 139-44.
Ju, Q., D. Edelstein, et al. (1998). "Transduction of non-dividing adult human pancreatic beta cells by an integrating lentiviral vector." Diabetologia 41(6): 736-9.
Kim, С.H., Y.Oh, et al. (1997). "Codon optimization for high-level expression of human erythropoietin (EPO) in mammalian cells." Gene 199(1-2): 293-301.
Klinman, D. M., A. K. Yi, et al. (1996). "CpG motifs present in bacteria DNA rapidly induce lymphocytes to secrete interleukin 6, interleukin 12, and interferon gamma." Proc Natl Acad Sci 1LSA 93(7): 2879-83.
Kwissa, M., K. van Kampen, et al. (2000). "Efficient vaccination by intradermal или intramuscular inoculation of plasmid DNA expressing hepatitis В surface antigen under desmin promoter/enhancer control." Vaccine 18(22): 2337-44.
Laval, F., R. Paillot, et al. (2002). "Quantitative analysis of the antigen-specific IFNgamma+ Т cell-mediated immune response in conventional outbred pigs: kinetics and duration of the DNA-induced IFNgamma+CD8+Т cell response." Vet Immunol Immunopathol 90(3-4): 191-201.
Lobato, Z. I., B. E. Coupar, et al. (1997). "Antibody responses and protective immunity to recombinant vaccinia virus-expressed bluetongue virus antigens." Vet Immunol Immunopathol 59(3-4): 293-309.
Luckow, V. A. and M. D. Summers (1988). "Signals important for high-level expression of foreign genes in Autographa califomica nuclear polyhedrosis virus expression vectors." Virology 167(1): 56-71.
MacLachlan, N. J. (1994). "The pathogenesis and immunology of bluetongue virus infection of жвачные животные." Comp Immunol Microbiol Infect Pis 17(3-4): 197-206.
MacLachlan, N.J. and J.E.Pearson (2004). Bluetongue: Prodeedings of the Third International Symposium. Bluetongue: Prodeedings of the Third International Symposium. N.J.MacLachlan and J.E.Pearson, Vet Italiana. 40: 1-730.
Marshall, E., L.B.Woolford, et al. (1997). "Continuous infusion ofmacrophage inflammatory protein MIP-1 alpha enhances leucocyte recovery and haemopoietic progenitor cell mobilization after cyclophosphamide." Br J Cancer 75(12): 1715-20.
Martinez-Torrecuadrada, J.L., J.P.Langeveld, et al. (1999). "Antigenic profile of African horse sickness virus serotype 4 VP5 and identification of a neutralizing epitope shared with bluetongue virus and epizootic hemorrhagic disease virus." Virology 257(2): 449-59.
McClements, W.L., M.E.Armstrong, et al. (1996). "Immunization with DNA vaccines encoding glycoprotein D или glycoprotein B, alone или in combination, induces protective immunity in animal models of herpes simplex virus-2 disease." Proc Natl Acad Sci USA 93(21): 11414-20.
Mecham, J.O., V.С.Dean, et al. (1986). "Correlation of serotype specificity and protein structure of the five U.S. serotypes of bluetongue virus." J Gen Virol 67 (Pt 12): 2617-24.
Mecham, J.O. and D.J.Johnson (2005). "Persistence of bluetongue virus serotype 2 (BTV-2) in the southeast United States." Virus Res 113(2): 116-22.
Miyazaki, J., S. Takaki, et al. (1989). "Expression vector system based on the chicken beta-actin promoter directs efficient production ofinterleukin-5." Gene 79(2): 269-77.
Moss, B. (1996). "Genetically engineered poxviruses for recombinant gene expression, vaccination, and safety." Proc Natl Acad Sci USA 93(21): 11341-8.
Mullens, B.A., W.J.Tabachnick, et al. (1995). "Effects of temperature on virogenesis of bluetongue virus serotype 11 in Culicoides variipennis sonorensis." Med Vet Entomol 9(1): 71-6.
Paoletti, E. (1996). "Applications of pox vims vectors to vaccination: an update." Proc Natl Acad Sci USA 93(21): 11349-53.
Pearson, W.R. and D.J.Lipman (1988). "Improved tools for biological sequence comparison." Proc Natl Acad Sci USA 85(8): 2444-8.
Pennock, G.D., C.Shoemaker, et al. (1984). "Strong and regulated expression of Escherichia coli beta-galactosidase in insect cells with a baculovirus vector." Mol Cell Biol 4(3): 399-406.
Perkus, M.E., K.Limbach, et al. (1989). "Cloning and expression of foreign genes in vaccinia virus, using a host range selection system." J Virol 63(9): 3829-36.
Powell, M.F. and M.J.Newman (1995). Vaccine Design, The Subunit and Adjuvant Approach. A Compendium of Vaccine Adjuvants and Excipients. F.Vogel and M.Powell. New York, Plenum Press. 6: 147, 183.
Prevec, L., M.Schneider, et al. (1989). "Use of human adenovirus-based vectors for antigen expression in animals." J Gen Virol 70 (Pt 2): 429-34.
Pritchard, L.I. and A.R.Gould (1995). "Phylogenetic comparison of the serotype-specific VP2 protein of bluetongue and related orbiviruses." Virus Res 39(2-3): 207-20.
Regelson, W., S.Kuhar, et al. (1960). "Synthetic polyelectrolytes as tumour inhibitors." Nature 186:778-80.
Riviere, M., J. Tartaglia, et al. (1992). "Protection of mice and swine from pseudorabies virus conferred by vaccinia virus-based recombinants." J Virol 66(6): 3424-34.
Robertson, E. S., T.Ooka, et al. (1996). "Epstein-Barr virus vectors for gene delivery to В lymphocytes." Proc Natl Acad Sci U S A 93(21): 11334-40.
Robinson, H.L. and С.A.Torres (1997). "DNA vaccines." Semin Immunol 9(5): 271-83.
Roizman, В. (1996). "The function of herpes simplex virus genes: a primer for genetic engineering of novel vectors." Proc Natl Acad Sci USA 93(21): 11307-12.
Rossitto, P.V. and N.J.MacLachlan (1992). "Neutralizing epitopes of the serotypes of bluetongue virus present in the United States." J Gen Virol 73 (Pt 8): 1947-52.
Roy, P. (1992). "Bluetongue virus proteins." J Gen Virol 73 (Pt 12): 3051-64.
Roy, P. (1996). "Orbivirus structure and assembly." Virology 216(1): 1-11.
Roy, P. (1996). Orbiviruses and their replication. Fields Virology. B.N.Fields, D.M.Knipe, P.M.Howley. Philadelphia, PA, Lippincott-Raven: 1709-1734.
Roy, P., T.Urakawa, et al. (1990). "Recombinant virus vaccine for bluetongue disease in sheep." JVirol 64(5): 1998-2003.
Sambrook, J. and D.W.Russell (2001). Molecular Cloning: a laboratory manual / Joseph Sambrook. David W.Russell. Cold Spring Harbor, N.Y., Cold Spring Harbor Laboratory Press. Schneider, K., F.Puehler, et al. (2000). "cDNA cloning of biologically active chicken interleukin-18." J Interferon Cvtokine Res 20(10): 879-83.
Shida, H. (1986). "Nucleotide sequence of the vaccinia virus hemagglutinin gene." Virology 150(2): 451-62.
Smith, G.E., M.D.Summers, et al. (1983). "Production of human beta interferon in insect cells infected with a baculovirus expression vector." Mol Cell Biol 3(12); 2156-65.
Snedecor, G.W. & COCHRAN, W.G. (1971) Transformation de proportions en Arcsinus. In Methodes Statistiques. 6th edn. Eds H. Boelle, E. Camhaji. Association de Coordination Technique Agricole. pp 366-367
Spreull, J. (1905). "Malarial catarrhal fever (bluetongue) of sheep in South Africa." J. Comp. Path.. Ther. 18: 321-337.
Stickl, H. and V.Hochstein-Mintzel (1971). "[Intracutaneous smallpox vaccination with a weak pathogenic vaccinia virus ("MVA virus")]." Munch Med Wochenschr 113(35): 1149-53.
Stittelaar, K.J., L.S.Wyatt, et al. (2000). "Protective immunity in macaques vaccinated with a modified vaccinia virus Ankara-based measles virus vaccine in the presence of passively acquired antibodies." J Virol 74(9): 4236-43.
Sutter, G. and B. Moss (1992). "Nonreplicating vaccinia vector efficiently expresses recombinant genes." Proc Natl Acad Sci USA 89 (22). 10847-51.
Sutter, G., L.S.Wyatt, et al. (1994). "A recombinant vector derived from the host range-restricted and highly attenuated MVA strain of vaccinia virus stimulates protective immunity in mice to BTV или FMDV virus." Vaccine 12(11): 1032-40.
Tang, D.C., M.DeVit, et al. (1992). "Genetic immunization is a simple method for eliciting an immune response." Nature 356(6365): 152-4.
Taylor, J., R. Weinberg, et al. (1988). "Protective immunity against avia BTV или FMDV induced by a fowlpox virus recombinant." Vaccine 6(6): 504-8.
Thompson, J.D., D.G.Higgins, et al. (1994). "CLUSTAL W: improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice." Nucleic Acids Res 22(22): 4673-80.
Ulmer, J.В., J.J.Donnelly, et al. (1993). "Heterologous protection against BTV или FMDV by injection of DNA encoding a viral protein." Science 259(5102): 1745-9.
Van der Zee, R., W.Van Eden, et al. (1989). "Efficient mapping and characterization of a T cell epitope by the simultaneous synthesis of multiple peptides." Bur J Immunol 19(1): 43-7.
van Ooyen, A., J. van den Berg. et al. (1979). "Comparison of total sequence of a cloned rabbit beta-globin gene and its flanking regions with a homologous mouse sequence." Science 206(4416): 337-44.
Verwoerd, D.W., H.J.Els, et al. (1972). "Structure of the bluetongue vims capsid." J Virol 10(4): 783-94.
Vialard, J., M.Lalumiere, et al. (1990). "Synthesis of the membrane fusion and hemagglutinin proteins of measles virus, using a novel baculovirus vector containing the beta-galactosidase gene." J Virol 64(1): 37-50.
Wang, L.F., D.H.Du Plessis, et al. (1995). "Use of a gene-targeted phage display random epitope library to map an antigenic determinant on the bluetongue virus outer capsid protein VP5." J Immunol Methods 178(1): 1-12.
White, D.M., W.C.Wilson, et al. (2005). "Studies on overwintering of bluetongue viruses in insects." J Gen Virol 86 (Pt 2): 453-62.
Wilson, W.C. and J.O.Mecham (2000). "Molecular Evolution of Orbiviruses." Proc USAHA 104: 169-180.
Xin, K.Q., K.Hamajima, et al. (1999). "IL-15 expression plasmid enhances cell-mediated immunity induced by an HIV-1 DNA vaccine." Vaccine 17(7-8): 858-66.
Реферат
Изобретение относится к области биохимии, в частности к композиции для противодействия, предотвращения или защиты животного от инфекции вируса синего языка BTV, где композиция содержит эффективное количество антигена BTV VP2 и антигена BTV VP5, и где антигены экспрессируются в растении ряски. Также раскрыты стабильно трансформированное растение ряски для экспрессии антигена BTV, входящего в состав указанной композиции, и плазмида, предназначенная для трансформации указанного растения и для продукции антигена BTV, входящего в состав указанной композиции. Раскрыт способ вакцинирования хозяина, чувствительного к BTV, и способ получения антигена BTV. Изобретение позволяет защищать животных от инфекции вируса синего языка BTV. 5 н. и 15 з.п. ф-лы, 28 ил., 7 табл., 7 пр.
Формула
где композиция содержит эффективное количество антигена BTV, где антиген выбран из группы, включающей BTV VP2, который имеет, по меньшей мере, 80% идентичность последовательности с полипептидом, имеющим последовательность, указанную в SEQ ID NO:4 или 6 или комбинацию BTV VP2, который имеет, по меньшей мере, 80% идентичность последовательности с полипептидом, имеющим последовательность, указанную в SEQ ID NO:4 или 6 и BTV VP5, который имеет, по меньшей мере, 80% идентичность последовательности с полипептидом, имеющим последовательность, указанную в SEQ ID NO:10, и где антиген BTV экспрессируется в растении ряски.

Комментарии