Вакцина широкого спектра действия против реовируса птиц - RU2701808C2
Код документа: RU2701808C2
Чертежи





Описание
Настоящее изобретение относится к области ветеринарных вакцин, в частности, к вакцинам для домашней птицы, предназначенным для уменьшения инфицирования птичьим реовирусом. Также изобретение относится к способам получения указанной вакцины и к медицинским применениям таких вакцин.
Реовирусы птиц таксономически относятся к видам ортореовируса птиц, который входит в род Orthoreovirus из семейства Reoviridae. Вирусная частица не имеет оболочки, но окружена двухслойным белковым капсидом. Этот капсид содержит геном двухцепочечной РНК, который состоит из 10 сегментов. Геномные сегменты могут быть сгруппированы по трем классам в зависимости от размеров: большой (L), средний (М) и малый (S); вирусные белки, кодируемые этими сегментами, обозначаются с указанием на эти сегменты, соответственно, как лямбда (λ), мю (μ) или сигма (σ). Обзор структуры птичьего реовируса выполнен авторами Benavente and Martinez-Costas (Virus Res., 2007, стр. 105-119).
Реовирусы птиц являются опасными возбудителями тяжелых заболеваний у птиц и наносят значительный экономический ущерб коммерческой деятельности птицеводческих хозяйств; в основном птичьи реовирусы инфицируют кур, но могут вызывать болезни индеек и других видов птиц. Тяжелые болезни и даже гибель наблюдается в основном у молодых птиц, поскольку возрастная сопротивляемость к симптомам и инфекции реовируса птиц развивается у птиц в возрасте приблизительно от 4 недель. Симптомы включают, среди прочего, кишечные и респираторные заболевания, миокардит и гепатит. Наиболее характерным симптомом является вирусный артрит, в результате которого развивается тендовагинит (или реовирусный артрит) суставов и сухожилий. Возникающая при этом хромота затрудняет доступ к кормушкам. С другой стороны, вирусное кишечное заболевание приводит к мальабсорбции, препятствующей эффективному перевариванию корма. Оба заболевания представляют собой серьезную проблему для быстро растущих пород с повышенной массой тела, таких, как бройлеры (птица мясного типа). Также, в сочетании с некоторыми другими возбудителями вирусных и бактериальных кишечных заболеваний, реовирус птиц относится к факторам так называемого "синдрома задержки роста и малорослости".
Все эти симптомы приводят к страданиям животных и к экономическим потерям, которые обусловлены снижением убойной массы и убытками из-за плохого качества тушек.
Основным способом борьбы с реовирусной инфекцией птиц является вакцинация, например, непосредственная вакцинация цыплят в очень раннем возрасте, или вакцинация племенных птиц (кур-несушек, которые производят оплодотворенные яйца для выведения потомства) перед периодом яйцекладки, в целях снижения передачи инфекции в яйца и опосредованной защиты цыплят через полученные от матери антитела.
Реовирус птиц можно культивировать in vitro и успешно размножать, например, на первичных клетках печени куриного эмбриона. Репликация вызывает типичный цитопатический эффект (CPE) с появлением крупноклеточного синцития.
Вакцины против реовируса птиц обычно представляют собой вакцины из целого вируса, которые относятся к живым аттенуированным вакцинам или вакцинам инактивированного типа. Примерами коммерческих вакцин против реовируса птиц (все из перечисленных от компании MSD АH, Нидерланды) являются: живые вакцины: Nobilis® Reo 1133 или Nobilis® Reo 2177, или инактивированные-адъювантные вакцины, такие как Nobilis® Reo INAC (содержащие штаммы 1733 и 2408). Происхождение вакцинного штамма S1133 относится к началу 1980-х годов (Van der Heide et al., 1983, Avian Dis., том 27, стр. 698-706), но он до сих пор используется и в настоящее время.
Согласно рекомендованной стандартной схеме вакцинации, племенную птицу вакцинируют против реовируса птиц по меньшей мере два раза: первичную (примирующую) вакцинацию проводят путем введения живой вакцины в очень раннем возрасте, и повторную (бустерную) вакцинацию проводят путем введения инактивированной вакцины через несколько недель. В зависимости от тяжести давления полевой инфекции можно вводить другой бустер через несколько недель, и обычно дополнительную бустерную вакцинацию племенной птицы проводят приблизительно в возрасте 16-18 недель, то есть за 4-6 недель до начала яйцекладки. На практике давление полевой инфекции реовируса птиц не всегда является высоким, поэтому многие птицеводы считают достаточным проведение единственной вакцинации цыплят или племенных кур. Однако в случае вспышки вирулентной инфекции реовируса птиц куриный молодняк может не получить достаточную защиту от полевой инфекции.
Формирование иммунной защиты от реовируса птиц обусловлено эффективным гуморальным иммунным ответом против некоторых структурных белков вируса. Вместе с тем, основными вирусными иммуногенами являются внешние капсидные белки сигма-B и сигма-C. Белок сигма-B (или σВ) является основным капсидным белком, и белок сигма-C (σC) представляет собой минорный белок наружного капсида. Белок сигма-C служит для прикрепления вирусной частицы к клетке-хозяину. Он кодируется 3'-областью геномного сегмента S1 и имеет размер приблизительно 326 аминокислот. Было обнаружено, что антигенная вариабельность белка сигма-C значительно выше, чем у белка сигма-B (см. WO 2009/093251 и Meanger et al., 1995, Avian Pathol., том 24, стр. 121-134).
В теоретическом аспекте в отношении вакцин против реовируса птиц существует общее мнение, что эффективная вакцинация против реовируса птиц может осуществляться только с помощью гомологичной вакцины, то есть, против вирусов той же серотипической группы, что и вакцинный антиген (Wood et al., 1986, Comp. Pathol., том 86, стр. 125-129). Поэтому на протяжении многих лет вакцины против реовируса птиц были основаны на антигенах из разных отдельных серотипических групп. Стандартные программы вакцинации были направлены против серотипа реовируса, который присутствовал в местном поголовье; в этом случае надежный иммунитет обеспечивался с помощью повторных вакцинаций.
Если в регионе был распространен более чем один серотип реовируса птиц, можно было поочередно применять эти вакцины для примирующей и бустерной вакцинации, например, проводить примирующую вакцинацию "классическим" вакцинным штаммом реовируса птиц, таким как S1133, 1733, 2177 или 2408, и после этого применять бустерную вакцину, например, против штамма ERS. На протяжении многих лет указанные штаммы были основными видами реовируса птиц, превалирующими в качестве полевой инфекции.
Поскольку реовирус птиц является РНК-вирусом, в его геноме могут возникать мутации. На практике это приводит к случайному возникновению в конкретном регионе новых вариантов, которые могут быть обладать большей или меньшей вирулентностью. Вместе с тем, проблемой в этом отношении является трудность эффективной дифференциации птичьих реовирусов, поскольку серологические тесты могут показывать вариабельные результаты. Поэтому обычно штаммы реовируса птиц идентифицируют с помощью реакции нейтрализации вируса с использованием поликлональных сывороток в анализе бляшкообразования, или путем определения характера специфичного связывания с использованием панели моноклональных антител, см. свойства штамма 2177 (ЕР 687.728) и штамма ERS (ЕР 1.024.189).
С другой стороны, штаммы реовируса птиц можно охарактеризовать по основным клиническим симптомам, которые вызваны этим вирусом, таким как тендовагинит, мальабсорбция или неврологические симптомы (например, штамм ERS индуцирует неврологические симптомы, как описано в ЕР 1.551.961). Тем не менее, по причине гетерогенной патогенности, достоверность такой характеристики не является полной.
В последнее время классификацию реовирусов птиц проводят на основе молекулярной диагностики, путем сравнения последовательностей аминокислот или нуклеотидов этих вирусов. Было установлено, что особенно полезным в этом отношении является сравнение аминокислотной последовательности белка сигма-C, поскольку он проявляет наибольшую вариабельность среди белков реовируса птиц, а именно, аминокислотная последовательность этого белка только на 35% идентична последовательности наименее родственных птичьих изолятов (J.M. Day, 2009, Inf. Gen. & Evolution, том 9, стр. 390-400).
Некоторые ученые описывают классификацию изолятов реовирусов птиц по филогенетическому анализу, исходя из идентичности аминокислотной последовательности их белков сигма-C. Поскольку в общедоступных базах данных появляется все больше и больше последовательностей белков сигма-C из изолятов реовируса птиц, стало возможным проведение более сложных анализов. Например, в публикации Канта и др. (Kant et al., 2003, Vet. Res., Т. 34, стр. 203-212) описано разделение реовирусов птиц на 5 основных генотипических групп. Не выявлено какой-либо корреляции между серотипическими и генотипическими группами, или между генотипом и характеристиками болезни: все виды ассоциированных с птичьим реовирусом заболеваний могут возникать в результате заражения птичьим реовирусом, относящимся к любой из генотипических групп.
Другой принцип классификации с использованием других параметров описан в других филогенетических исследованиях, основанных на анализе белка сигма-C: авторы Liu et al. (2003, Virology, том 314, стр. 336-349) выделяют 6 линий происхождения, а в публикации Liblin et al. (2011, Vaccine, том 29, стр. 8683-8688) выделены 4 генотипические группы.
Более серьезную научную поддержку получила система, описанная Кантом и др. (с выделением 5генотипическихгрупп). Согласно этой классификации, все "классические" вакцинные штаммы реовируса птиц соответствуют генотипу группы 1 по Канту, тогда как штамм ERS относится к генотипу группы 5 по Канту.
Вакцинация против различных генотипических групп была изучена авторами Lublin et al. (см. выше). В соответствии с общей точкой зрения, что вакцины против реовируса птиц создают в основном равномерную защиту, вышеупомянутые авторы выявили, что вакцина, которая эффективна против всех разных генотипов реовируса птиц, должна содержать антигенный материал от каждой из этих генотипических групп.
В последние годы наблюдается всплеск числа прорывных инфекций реовируса птиц. Приблизительно с 2009 по 2013 год произошло несколько вспышек реовируса птиц в Европе и США, в результате чего в куриных поголовьях были выявлены симптомы тяжелой реовирусной инфекции с тендовагинитом, мальабсорбцией и даже смертностью, несмотря на то, что куры были должным образом вакцинированы коммерческими вакцинами против реовируса птиц. Это свидетельствует о развитии новых вирулентных штаммов реовируса птиц, и о том, что вакцины классического типа и ERS-типа не всегда могут создать эффективную защиту.
Исследователи Troxler et al. (2013, Vet. Record, том 172, стр. 556) проанализировали ряд вспышек в 2011-2012 годах в двух регионах Франции. Исходя из описанного Kant et al. (см. выше) разделения штаммов реовируса птиц на 5 генотипических групп путем сравнения аминокислотной последовательности белка сигма-C, Troxler и др. классифицировали выделенные при упомянутых вспышках во Франции штаммы, как генотипический подкласс 1-й группы по Канту.
Поскольку существующие вакцины оказались неэффективными против этих недавно возникших прорывных штаммов, Troxler et al. повторили рекомендацию Lublin et al. о необходимости создания вакцины широкого действия с перекрестной защитой, включающей все генотипические группы реовируса птиц.
Следовательно, в области птицеводства существует острая необходимость в наличии вакцины против реовируса птиц, которая обладает широким защитным действием и также эффективностью против недавно возникших вирулентных прорывных штаммов.
Таким образом, задачей настоящего изобретения является преодоление недостатков предшествующего уровня и удовлетворение упомянутой потребности в данной области путем получения вакцины, которая сможет уменьшить инфекции, обусловленные широким спектром реовирусов птиц, включающих, среди прочего, недавно возникшие вирулентные прорывные штаммы реовируса птиц.
Неожиданно было обнаружено, что эту задачу можно выполнить, и следовательно, преодолеть недостатки предшествующего уровня техники путем создания вакцины для снижения инфицирования птичьим реовирусом, при этом такая вакцина будет содержать антигенный материал реовируса птиц, который получен только от двух из пяти генотипических групп реовируса птиц, подразделяемых на основе сравнения аминокислотной последовательности вирусного белка сигма-C.
Была найдена такая вакцина, обеспечивающая защиту широкого спектра действия, которая после всего лишь однократной вакцинации почти полностью снижает репликацию недавно возникших прорывных изолятов реовируса птиц.
Авторы проанализировали около 150 образцов от вспышек реовируса птиц в ряде стран, происходивших между 1993 и 2013 годами. Интересно отметить, что при сравнении аминокислотных последовательностей белка сигма-C этих вирусов, выделенные в последнее время реовирусы птиц относились ко всем группам генотипов, что подробно описано ниже. Это также согласуется с выводами Troxler et al., и показывает, что недавние вспышки реовируса птиц не вызваны каким-либо конкретным генотипом реовируса птиц. Скорее всего, можно предположить, что происходит общее изменение свойств вируса, и это делает существующие вакцины менее эффективными. Следовательно, существует необходимость в обновлении вакцин против реовируса птиц, и необходимо, чтобы обновленные вакцины создавали защиту от всех существующих генотипов вируса.
Для осуществления настоящего изобретения были выделены штаммы реовируса птиц и разделены на 5 генотипических групп, согласно изобретению, исходя из аминокислотной последовательности белка сигма-C. Это эффективная методика разделения всех известных штаммов, которая также позволяет классифицировать недавно возникшие прорывные штаммы. Также было установлено, что такое деление на 5 генотипических групп близко совпадает с делением по генотипу, описанным Kant et al. (см. выше).
Авторы изобретения неожиданно обнаружили, что вакцина на основе конкретной комбинации антигенного материала от двух генотипических групп реовируса птиц, а именно, генотипических групп 1 и 4, обладает защитным действием широкого спектра. В отличие от этого, подобная вакцина, содержащая антигенный материал реовируса птиц от генотипических групп 1 и 5, не обеспечивает такую широкую защиту.
Такая новая вакцина создает у целевых видов птиц защиту широкого спектра против репликации реовируса птиц, поскольку эта вакцина способна почти полностью уменьшить репликацию реовируса птиц в организме-мишени. Это относится как к реовирусу птиц из той же генотипической группы, что и содержащийся в вакцине антигенный материал (гомологичный реовирус птиц), и к реовирусу птиц из генотипической группы, которая отличается от содержащегося в вакцине антигенного материала (т.е. гетерологичного реовируса птиц). Такой эффект от вакцины достигается уже после однократной вакцинации, и вакцина была эффективной даже против недавно возникших прорывных вирулентных штаммов реовируса птиц.
Таким образом, эта новая вакцина широкого спектра действия против реовируса птиц снижает вызванную птичьим реовирусом заболеваемость у вакцинированных животных. Дополнительно, она уменьшает распространение вируса путем уменьшения вирусной нагрузки.
Это стало неожиданностью и прямо противоречило общему мнению в данной области на момент изобретения. Широко распространенное убеждение состояло в том, что вакцина против реовируса птиц является полностью эффективной только против гомологичных вирусов и не может обеспечить эффективную гетерологичную защиту в отношении других генотипических групп, и, чтобы такая вакцинация была эффективной, по стандарту потребуется по меньшей мере два введения. В действительности это было подтверждено авторами Lublin et al. (см. выше), которые протестировали вакцину широкого спектра против реовируса птиц, основанную на антигенном материале от представителей каждой из описанных генотипических групп.
Таким образом, следуя упомянутой рекомендации в этой области, для разработки эффективной вакцины с широким спектром защиты от недавно возникших прорывных штаммов реовируса птиц потребуется включать в вакцину антигенный материал реовирусов птиц из всех описанных генотипических групп.
Неизвестно, почему конкретная комбинация антигенного материала реовируса птиц из генотипических групп 1 и 4 способна обеспечить такую эффективность вакцины широкого спектра действия. Авторы изобретения, вне зависимости от какой-либо теории или модели, которые могли бы объяснить эти наблюдения, предполагают, что эта конкретная комбинация антигенного материала от реовируса птиц из генотипических групп 1 и 4 должна представлять иммунной системе целевых видов птиц комбинацию антигенов, которые запускают иммунный ответ, представляющий собой перекрестную защиту от широкого спектра специфичных антигенов, которые представляют реовирусы птиц разных генотипических групп.
Таким образом, в одном аспекте изобретение относится к вакцине для уменьшения инфицирования птичьим реовирусом, и указанная вакцина содержит антигенный материал реовируса птиц, который получен из реовирусов птиц от более чем одной генотипической группы, и фармацевтически приемлемый носитель, при этом антигенный материал реовируса птиц состоит из антигенного материала, полученного из реовирусов птиц от каждой из двух генотипических групп: генотипической группы 1 и генотипической группы 4.
Специалисту в данной области будет очевидно, что такая вакцина широкого спектра действия, которая может быть создана только на основе ограниченного количества антигенов, обеспечивает некоторые явные преимущества перед более распространенной комбинированной вакциной, содержащей антигены от всех генотипических групп. Эти преимущества заключаются в основном в значительной экономии, которая может быть достигнута таким образом в отношении затрат труда и капитала, за счет повышения эффективности и простоты производства, хранения и контроля качества.
Термин "вакцина" является общепринятым и относится к композиции, которая имеет характерный лечебный эффект и содержит иммунологически активный компонент и фармацевтически приемлемый носитель. "Иммунологически активный компонент" представляет собой антигенную молекулу (комбинацию антигенных молекул), которая распознается иммунной системой организма-мишени, после чего иммунная система индуцирует защитный иммунный ответ. Реакция может быть индуцирована врожденной и/или приобретенной иммунной системой организма-мишени, и может представлять собой реакцию клеточного и/или гуморального типа.
Для вакцины согласно изобретению иммунный ответ, индуцированный у вакцинированного животного-мишени, обладает эффектом "снижения инфицирования птичьим реовирусом". Это относится к снижению уровня или распространенности инфекции, например, путем снижения вирусной нагрузки или сокращения продолжительности репликации вируса в организме животного-хозяина.
Указанный эффект достигается за счет предотвращения или уменьшения возникновения или распространения продуктивной инфекции реовируса птиц в органах-мишенях, таких как сухожилия или кишечник. В свою очередь, это приводит к уменьшению у животного-мишени количества, интенсивности или тяжести поражений и клинических симптомов, которые могут быть вызваны вирусной инфекцией. Такая вакцина общепринято называется вакциной "против" реовируса птиц или "птичьей реовирусной вакциной".
Определение эффективности вакцины по изобретению в отношении снижения инфицирования птичьим реовирусом входит в компетенцию рядового специалиста в данной области и может быть сделано, например, путем мониторинга иммунологического ответа после вакцинации или после контрольного заражения, например, путем мониторинга целевых признаков заболевания, клинических показателей, серологических параметров, или путем повторного выделения возбудителя и сравнения этих результатов с реакцией на контрольное заражение, наблюдаемой у ложно вакцинированных животных.
Различные варианты осуществления, предпочтения и примеры вакцины по изобретению описаны ниже.
"Реовирус птиц" хорошо известен в данной области и представляет собой вирус, принадлежащий к виду птичьих ортореовирусов. Эти вирусы и вызванные ими заболевания описаны, например, в общеизвестных справочниках, например, "The Merck Veterenary Handbook" (10-е изд, 2010, C.M. Kanh edt., ISBN: 091191093X) и "Deseases of Poultry" (12-е изд, 2008, Н.М. Saif edt., ISBN-10: 0813807182).
Реовирус птиц проявляет отличительные признаки членов своей таксономической группы, такие как морфологические, геномные и биохимические свойства, а также биологические свойства, такие как физиологические иммунологические характеристики или патологические функции. Как известно специалистам в данной области, классификация микроорганизмов основана на сочетании таких свойств. Таким образом, изобретение также включает реовирусы птиц, совокупность которых каким-либо образом подразделена, например, на подвид, штамм, изолят, генотип, вариант, подтип или подгруппу и тому подобное.
Специалисту в данной области будет очевидно, что несмотря на современное деление всех реовирусов птиц по изобретению на конкретные виды или рода, это деление является таксономической классификацией, которая может меняться с течением времени, по мере того, как в результате нового понимания проблемы появится новая классификация с отнесением реовируса птиц в новую или другую таксономическую группу. Тем не менее, поскольку при этом изменяется не сам микроорганизм или его антигенный репертуар, а только его научное название или классификация, такие переклассифицированные микроорганизмы остаются в объеме настоящего изобретения.
Термин "содержащий" (а также его вариации, такие как "содержать" и "содержит"), используемые в изобретении, относится ко всем элементам и в любой возможной комбинации, допустимой в данном изобретении, которые охвачены или включены в раздел, параграф, пункт формулы изобретения и т.п. настоящего документа, в котором используется этот термин, даже если такие элементы или комбинации не приведены явным образом и не относятся к исключению из любого такого элемента (элементов) или их комбинации. Следовательно, любой такой раздел, параграф, пункт формулы изобретения и т.п. настоящего документа также может относиться к одному варианту или нескольким вариантам осуществления, в котором термин "содержащий" (или его вариации) заменяется такими терминами, как "состоит из", "состоящий из" или "по существу состоящий из".
"Антигенный материал" по изобретению может представлять собой в принципе материал любого типа, полученный из реовируса птиц по изобретению, при условии, что он может индуцировать защитный иммунный ответ (или сам по себе, или совместно с адъювантом). Таким образом, антигенный материал должен иметь такой размер, структуру, форму или качество, чтобы иммунный ответ, который индуцируется этим материалом у вакцинированных целевых видов птиц, имел достаточную силу, способную уменьшить вызванную птичьим реовирусом инфекцию.
Антигенный материал по изобретению может представлять собой репликативный реовирус птиц (т.е. "живой" реовирус птиц), инактивированный ("убитый") реовирус птиц или часть реовируса птиц, например, его субъдиницу, экстракт, фракцию, гомогенат или взвесь, полученную ультразвуковым воздействием.
В случае, если антигенный материал по изобретению представляет собой часть реовируса птиц, этот материал может представлять собой белок, липопротеин, гликопротеин, молекулу нуклеиновой кислоты или комбинацию одного или нескольких из вышеперечисленного. Антигенный материал может иметь биологическое или синтетическое происхождение, и также может быть получен напрямую или опосредованно из реовируса птиц по изобретению.
Термин "белок" в настоящем изобретении относится к молекулярной цепи аминокислот. Белок не имеет конкретных показателей длины, структуры или формы, и может, при необходимости, подвергаться модификации in vivo или in vitro, такой как гликозилирование, амидирование, карбоксилирование, фосфорилирование, пэгилирование или изменения в пространственной укладке. Белок может представлять собой нативный или зрелый белок, белок-предшественник или про-белок или часть белка. Белок может иметь биологическое или синтетическое происхождение. Среди прочего, в это определение белка включены полипептиды и пептиды.
Согласно изобретению, антигенный материал "получен из" реовируса птиц по изобретению, если он каким-либо образом происходит из реовируса птиц или из его части. Может быть приемлемым, чтобы антигенный материал, полученный для осуществления изобретения, содержался в носителе, таком как буфер, и предпочтительно находился в жидкой форме, что позволяет использовать или проводить манипуляции с антигенным материалом для осуществления изобретения. Специалист в данной области способен выбирать и использовать подходящий для этой цели носитель.
В качестве примера, способами для получения антигенного материала по изобретению из реовируса птиц может быть пролиферация реовируса птиц по изобретению в подходящей клетке-хозяине, после чего вирус может быть собран и выделен стандартными способами, хорошо известными в данной области. Полученный репликативный вирус может быть использован с клеткой-хозяином или с ее частями, или без клетки-хозяина.
Реовирус птиц по изобретению также может быть получен в инактивированной форме, путем обработки репликативного реовируса птиц любым подходящим способом, например, с помощью нагревания, облучения или обработки химическими веществами, такими как формалин, бета-пропиолактон, бинарный этиленимин или бета-этаноламин.
Дополнительно, антигенный материал, полученный из реовируса птиц по изобретению, может представлять собой часть реовируса птиц, такую как субъединица, экстракт, фракция, гомогенат или взвесь, полученную ультразвуковым воздействием. Такой материал может быть получен с помощью стандартных технологий, хорошо известных в данной области, и может начинаться с реплицирующихся или инактивированных вирусов. Используемый вирус может быть получен из вирусной культуры, например, из клеточного дебриса, культурального супернатанта или цельной культуры.
Антигенный материал по изобретению также может быть получен путем экспрессии гена реовируса птиц в клетках экспрессионной системы рекомбинантной ДНК: эти клетки, супернатант или цельная культура могут быть собраны и очищены, например, центрифугированием или фильтрацией, при необходимости с последующим концентрированием. В качестве альтернативы, если экспрессированный белок остается в клетках системы экспрессии, эти клетки могут быть собраны, и белок может быть получен в виде субъединиц, экстракта, фракции, гомогената или взвеси этих клеток, полученной ультразвуковым воздействием. Все эти способы хорошо известны в данной области. Удобными системами экспрессии являются системы бактериального происхождения, дрожжи, насекомые, растения или млекопитающие, например, кишечная палочка, Escherichia coli, Bacillus subtilis, Lactobacillus sp., или Caulobacter crescentus; Sacharomyces cereviseae, Pichia pastoris; клетки насекомого/бакуловирус, дрозофилы, растение табак, или клетки Hela или клетки СНО.
Необходимые способы и материалы для получения антигенного материала реовируса птиц для осуществления настоящего изобретения представляют собой стандартные способы в вирусологии, биохимии и молекулярной биологии, хорошо известные специалистам в данных областях. Например, молекулярно-биологические способы и материалы для получения вирусной РНК из реовируса птиц по изобретению в целях подготовки кДНК и ее обработки для экспрессии хорошо известны в данной области и подробно описаны, например, в общеизвестных справочниках, таких как: Current Protocols in Molecular Biology, John Wiley & Sons, N.Y. (1989); Basic Methods in Molecular Biology, Elsevier Science Publishing Co., Inc., N.Y. (1986), и Sambrook & Russell, 2001, 3-е издание 'Molecular cloning: a laboratory manual', New York, USA: Cold Spring Harbour Laboratory Press.
"Генотипическая группа" в отношении реовируса птиц по изобретению относится к количеству изолятов реовируса птиц, которые могут быть сгруппированы вместе, исходя из результатов выравнивания аминокислотных последовательностей их белка сигма-C, как описано в настоящем изобретении. Члены такой группы связаны наличием одинакового определенного минимального уровня идентичности аминокислотных последовательностей для белка сигма-C. Таким образом, были определены 5 генотипических групп реовируса птиц.
Упомянутое сравнение идентичности аминокислотной последовательности представляет собой хорошо известный способ определения эволюционных связей или "филогении" между белками. Это можно выразить в процентах аминокислот, которые идентичны при сравнении соответствующих положений в разных аминокислотных последовательностях, в отношении длины выровненного белка по количеству аминокислот. NB: идентичность не следует путать со сходством последовательностей, когда учитываются также аминокислоты, которые похожи, но имеют отличия.
Упомянутое выравнивание предпочтительно выполняют с помощью компьютерной программы для автоматизированного (множественного) попарного выравнивания.
С целью определения генотипической группы реовируса птиц по изобретению был проведен достоверный анализ с помощью компьютерной программы: "BLAST 2 Sequences", доступный на сайте NCBI (с выбором "bl2seq" и подпрограммы "blastP", которую можно найти по адресу: http://blast.ncbi.nlm.nih.gov/Blast.cgi), используя ее настройки параметров по умолчанию. Программа оптимизирует методику выравнивания двух последовательностей и отображает область наложения, количество и процент идентичных совпадений между аминокислотами.
Выровненная аминокислотная последовательность по изобретению состоит из аминокислот 1-277 из белка сигма-C, где метионин из старт-кодона считается аминокислотой под номером 1.
Перечень оценок выравнивания последовательностей из реовирусов птиц разных генотипических групп представлены в таблицах, которые вошли в настоящее изобретение.
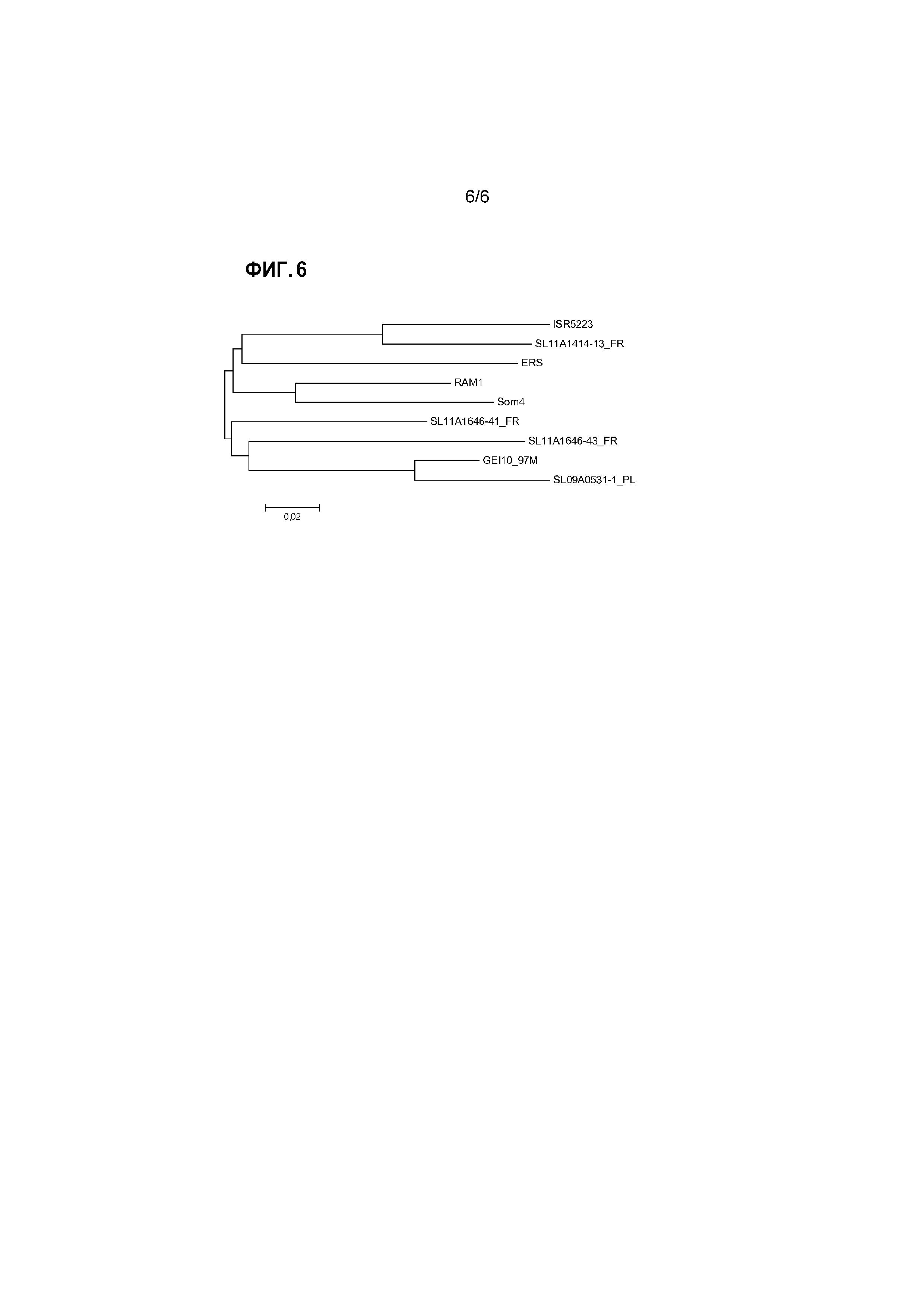
Для представления эволюционных взаимоотношений в пределах генотипических групп и между группами можно представить результаты выравнивания в виде филогенетического дерева. Для этого также можно использовать компьютерную программу, например, программу PHYLIP (например, доступную на сайте: www.phylogeny.fr), или программу MEGA (Tamura et al., 2013, Mol. Biol. and Evol., том 30, стр. 2725-2729; самая последняя версия MEGA6). Изображения, представляющие такие филогенетические деревья генотипических групп реовирусов птиц, проанализированных в изобретении, представлены на прилагаемых к настоящему документу чертежах.
В общедоступных базах данных, таких как GenBank или EMBL, в настоящее время доступны более 200 аминокислотных последовательностей белков сигма-C, из широкого спектра изолятов реовирусов птиц. Это позволило провести сравнительные выравнивания и классификацию известных штаммов реовируса птиц на генотипические группы согласно изобретению.
В дополнение к этому большому объему информации об известных последовательностях, авторы настоящего изобретения сделали доступными данные об аминокислотных последовательностях белков сигма-C, полученных из ряда штаммов, вызвавших вспышки последнего времени. Подробное описание приведено ниже в разделе примеров. Коротко, для амплификации какого-либо вируса образец ткани гомогенизировали и культивировали. Вирусную РНК экстрагировали, и с помощью специфичных праймеров сигма-C (Liu et al., см. выше) по методике полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) амплифицировали сегмент генома реовируса птиц, кодирующего белок сигма-C. Все манипуляции проводили с использованием стандартных методик. Затем определяли последовательность нуклеиновой кислоты этой кДНК и выполняли трансляцию этой последовательности ДНК в предполагаемую аминокислотную последовательность. После этого проводили сравнение с другими последовательностями сигма-C для определения генотипической группы очагового изолята. Как описано выше, среди очаговых изолятов были выявлены представители всех 5 генотипических групп.
Аминокислотная последовательность белка сигма-С из ряда репрезентативных прорывных изолятов от всех пяти генотипических групп представлена в прилагаемом списке последовательностей.
По этим анализам было установлено, что реовирус птиц по изобретению классифицируется как принадлежащий к генотипической группе 1, при этом указанный реовирус птиц в репликативной форме содержит генетическую информацию по кодированию белка сигма-C, который имеет аминокислотную последовательностью с идентичностью по меньшей мере 57% по отношению к аминокислотной последовательности SEQ ID NO: 1 (аминокислотная последовательность белка сигма-C изолята реовируса птиц SL11A0823-2 BE).
Аналогично, реовирус птиц по изобретению классифицируется как принадлежащий к генотипической группе 4, поскольку этот реовирус птиц в репликативной форме содержит генетическую информацию по кодированию белка сигма-C, который имеет аминокислотную последовательность, по меньшей мере на 66% идентичную аминокислотной последовательности SEQ ID NO: 4 (аминокислотная последовательность изолята № SL11A0823-1 ВЕ).
Понятие "в репликативной форме" используется для обозначения реовируса птиц, который способен к репликации, т.е., обозначает репликативный, не инактивированный или "живой" вирус. Таким образом, в вакцине по изобретению используется антигенный материал, полученный из реовируса птиц, который в какой-либо момент времени находился в репликативной форме, и, соответственно, содержал генетическую информацию, кодирующую белок сигма-C с заданным уровнем идентичности. Тем не менее, это не означает, что сам по себе антигенный материал должен сохранять содержание этой генетической информации, как есть или в интактном виде.
Термин "фармацевтически приемлемый носитель" относится к вспомогательному веществу для приготовления, хранения или введения иммуно-активного соединения вакцины, которое не вызывает (тяжелых) неблагоприятных явлений для здоровья животного-мишени, которому вводят эту вакцину. Такой носитель может представлять собой, например, стерильную воду, или физиологический солевой раствор или фосфатно-буферный раствор. В более сложной форме носитель может представлять собой, например, буфер, который может содержать дополнительные добавки, такие как стабилизаторы или консерванты. Подробности и примеры описаны, например, в общеизвестных справочниках, таких как "Remington: the science and practice of pharmacy" (2000, Lippincot, USA, ISBN: 683306472) и "Veterinary vaccinology" (P. Pastoret et al. ed., 1997, Elsevier, Amsterdam, ISBN 0444819681).
Таким образом, для получения вакцины по изобретению можно использовать реовирусы птиц, принадлежащие к генотипическим группам 1 или 4. Такие реовирусы птиц подробно описаны в разделе примеров настоящего изобретения, они хорошо известны в данной области и могут быть легко получены специалистом в данной области.
Например, можно использовать реовирусы птиц из общедоступных коллекций образцов реовирусов птиц; можно предварительно классифицировать эти образцы как принадлежащие к генотипическим группам 1 или 4, или их можно легко классифицировать согласно настоящему изобретению. Такие образцы доступны в различных университетах и научно-исследовательских институтах, изучающих проблемы птицеводства, а также в институтах - депозитариях, таких, как АТСС (Manassas, VA, США), CNCM (Институт Пастера, Париж, Франция) или ЕСАСС (Портон Даун, Великобритания).
В качестве альтернативы, реовирусы птиц генотипических групп 1 и 4 могут быть получены из полевых образцов от кур с клиническими признаками реовирусной инфекции, такими как вирусный артрит или мальабсорбция. Образцы могут быть получены из органов инфицированных птиц, например, из сухожилий, скакательных суставов, печени, селезенки или кишечника, например, из тощей кишки. Вирус может быть культивирован in vitro и может быть идентифицирован как реовирус птиц, например, по характерному для него CPE в клеточной культуре, или с помощью специфичных к реовирусу птиц антител. Также вирусную РНК можно анализировать с помощью ОТ-ПЦР, с использованием праймеров, описанных в литературе или в настоящем изобретении. С помощью последующего компьютерного анализа аминокислотной последовательности белка сигма-C можно установить генотипическую группу образца.
Используя указанные способы, авторы выделили и проанализировали большое количество изолятов реовирусов птиц. Вакцина по изобретению была получена из двух из упомянутых изолятов, выделенных из реовирусов птиц, которые вызвали прорывные инфекции в различных птицеводческих хозяйствах в Бельгии в 2011 году, наименования изолятов: SL11A0823-2BE и SL11A0823-1BE. Они были классифицированы, соответственно, как принадлежащие к генотипическим группам 1 и 4 согласно изобретению. Последовательности аминокислот белка сигма-C этих изолятов представляют собой SEQ ID NO: 1 и 4, соответственно.
Вакцины были получены с помощью стандартных методик. Коротко: вирус амплифицировали из полевого образца и трижды клонировали способом бляшкообразования. Затем вирус культивировали на клетках Vero, инактивировали с помощью формалина и концентрировали, после чего готовили композицию вирусного антигенного материала в виде эмульсии вода-в-масле с легким минеральным маслом и эмульгаторами.
Единичную дозу вакцины вводили однократно курам-несушкам - SPF (не имеющим специфической патогенной микрофлоры) в разных группах эксперимента, путем внутримышечного введения. Оплодотворенные яйца от этих вакцинированных кур собирали, начиная через 5 недель после вакцинации. Цыплят выводили в инкубаторе, и вылупившееся потомство подвергалось заражению путем инокуляции репликативного реовируса птиц из разных генотипических групп. Эффективность вакцинации для потомства определяли путем выявления вирусного заражения в образцах крови, взятых в течение 3 дней после заражения инокуляцией.
Результаты вакцинации подробно описаны в разделе примеров. Эффективная защита широкого спектра наблюдалось только при использовании вакцины, содержащей антигены реовирусов птиц из генотипических групп 1 и 4: у цыплят после заражения различными гомологичными или гетерологичными инокуляциями практически было невозможно выделить ни один заражающий вирус.
В противоположность этому, цыплята из группы, получавшей вакцину, содержащую антигенный материал только из единственного изолята реовируса птиц, были защищены только от гомологичного заражающего штамма; во всех образцах в контрольной невакцинированной группе был выявлен положительный ответ на заражающий вирус. При этом комбинированная вакцина с антигеном реовирусов птиц из генотипических групп 1 и 5 давала защиту только от заражения вирусом генотипической группы 1 или 2, и такой же результат был показан с поливалентной вакциной генотипической группы 1.
В предпочтительном варианте осуществления реовирус птиц, принадлежащий к генотипической группе 1 в соответствии с изобретением (в репликативной форме), содержит генетическую информацию по кодированию белка сигма-C с аминокислотной последовательностью, которая по меньшей мере на 58% идентична аминокислотной последовательности SEQ ID NO: 1. Более предпочтительный показатель идентичности составляет 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или даже 100% идентичности по отношению к аминокислотной последовательности SEQ ID NO: 1, в указанном порядке предпочтения.
В предпочтительном варианте осуществления реовирус птиц, принадлежащий к генотипической группе 4 в соответствии с изобретением (в репликативной форме), содержит генетическую информацию по кодированию белка сигма-C, имеющего аминокислотную последовательность, которая по меньшей мере на 67% идентична аминокислотной последовательности SEQ ID NO: 1. Более предпочтительный показатель идентичности составляет 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или даже 100% идентичности по отношению к аминокислотной последовательности SEQ ID NO: 4, в указанном порядке предпочтения.
В одном варианте осуществления вакцины по изобретению антигенный материал реовируса птиц состоит из антигенного материала, полученного из двух типов реовируса птиц: к первому типу относится реовирус птиц, который в репликативной форме содержит генетическую информацию по кодированию белка сигма-C с аминокислотной последовательностью, которая по меньшей мере на 57% идентична аминокислотной последовательности SEQ ID NO: 1, а ко второму типу относится реовирус птиц, который в репликативной форме содержит генетическую информацию по кодированию белка сигма-C с аминокислотной последовательностью, которая по меньшей мере на 66% идентична аминокислотной последовательности SEQ ID NO: 4.
В настоящем изобретении обозначения "первый тип" и "второй тип" используются исключительно для удобства, а не для обозначения какого-либо числового порядка или зависимости.
В предпочтительном варианте осуществления первый тип реовируса птиц (в репликативной форме) содержит генетическую информацию по кодированию белка сигма-C с аминокислотной последовательностью, которая по меньшей мере на 58% идентична аминокислотной последовательности SEQ ID NO: 1. Более предпочтительный показатель идентичности составляет 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или даже 100% идентичности по отношению к аминокислотной последовательности SEQ ID NO: 1, в указанном порядке предпочтения.
В предпочтительном варианте осуществления второй тип реовируса птиц (в репликативной форме) содержит генетическую информацию по кодированию белка сигма-C с аминокислотной последовательностью, которая по меньшей мере на 67% идентична аминокислотной последовательности SEQ ID NO: 4. Более предпочтительный показатель идентичности составляет 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или даже 100% идентичности по отношению к аминокислотной последовательности SEQ ID NO: 4, в указанном порядке предпочтения.
Выполняя анализ выявленных в последнее время прорывных штаммов реовируса птиц, авторы изобретения обнаружили, что большинство изолятов, которые относятся к генотипической группе 1 (согласно изобретению), фактически образуют генотипическую подгруппу, имеющую явные отличия от штаммов классического вакцинного типа, которые также относятся к генотипической группе 1. Это также согласуется с выводами Troxler et al. (см. выше). Таким образом, авторы изобретения считают, что генотипическая группа классических вакцинных штаммов реовируса птиц относится к генотипической подгруппе 1А, и генотипическая группа прорывных изолятов из этого раздела относится к генотипической подгруппе 1B.
Таким образом, в варианте осуществления вакцины по изобретению антигенный материал, полученный из реовируса птиц из генотипической группы 1, представляет собой материал, полученный из реовируса птиц из генотипической подгруппы 1B.
Реовирус птиц по изобретению классифицируется как принадлежащий к генотипической подгруппе 1B, если этот реовирус птиц в репликативной форме содержит генетическую информацию по кодированию белка сигма-C с аминокислотной последовательностью, которая по меньшей мере на 78% идентична аминокислотной последовательности SEQ ID NO: 1.
В дополнительном варианте осуществления реовирус птиц (в репликативной форме), принадлежащий к генотипической подгруппе 1В в соответствии с настоящим изобретением, содержит генетическую информацию по кодированию белка сигма-C с аминокислотной последовательностью, которая по меньшей мере на 79% идентична аминокислотной последовательности SEQ ID NO: 1. Более предпочтительный показатель идентичности составляет 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или даже 100% идентичности по отношению к аминокислотной последовательности SEQ ID NO: 1, в указанном порядке предпочтения.
Для надлежащего описания свойств других генотипических групп реовирусов птиц, которые используются в изобретении, также можно определять степень идентичности аминокислотной последовательности их белка сигма-C по отношению к эталонной аминокислотной последовательности:
Реовирус птиц классифицируется, согласно изобретению, как принадлежащий к генотипической подгруппе 1А, если этот реовирус птиц в репликативной форме содержит генетическую информацию по кодированию белка сигма-C, имеющий аминокислотную последовательность, которая по меньшей мере на 79% идентична аминокислотной последовательности, представленной в GenBank под номером доступа AAB61607 (реовирус птиц, штамм 1733). Более предпочтительный показатель идентичности составляет 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или даже 100% идентичности по отношению к аминокислотной последовательности, представленной в GenBank под номером AAB61607, в указанном порядке предпочтения.
Реовирус птиц классифицируется, согласно изобретению, как принадлежащий у генотипической группе, если этот реовирус птиц в репликативной форме содержит генетическую информацию по кодированию белка сигма-C, имеющего аминокислотную последовательность, которая по меньшей мере на 58% идентична аминокислотной последовательности SEQ ID NO: 2 (аминокислотная последовательность белка сигма-C изолята реовируса птиц SL11A0294-12 FR). Более предпочтительный показатель идентичности составляет 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или даже 100% идентичности по отношению к аминокислотной последовательности SEQ ID NO: 2, в указанном порядке предпочтения.
Реовирус птиц классифицируется, согласно изобретению, как принадлежащий к генотипической группе 3, если этот реовирус птиц в репликативной форме содержит генетическую информацию по кодированию белка сигма-C, имеющего аминокислотную последовательность, которая по меньшей мере на 57% идентична аминокислотной последовательности SEQ ID NO: 3 (аминокислотная последовательность белка сигма-C изолята реовируса птиц SL10A1581-32 ES). Более предпочтительный показатель идентичности составляет 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или даже 100% идентичности по отношению к аминокислотной последовательности SEQ ID NO: 3, в указанном порядке предпочтения.
Реовирус птиц классифицируется, согласно изобретению, как принадлежащий к генотипической группе 5, если этот реовирус птиц в репликативной форме содержит генетическую информацию по кодированию белка сигма-C, имеющего аминокислотную последовательность, которая по меньшей мере на 65% идентична аминокислотной последовательности SEQ ID NO: 5 (аминокислотная последовательность белка сигма-C реовируса птиц, штамма ERS). Более предпочтительный показатель идентичности составляет 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или даже 100% идентичности по отношению к аминокислотной последовательности SEQ ID NO: 5, в указанном порядке предпочтения.
В одном варианте осуществления антигенный материал по изобретению, который получен из реовируса птиц, представляет собой репликативный реовирус птиц, инактивированный реовирус птиц или часть реовируса птиц, такую как субъединица, экстракт, фракция, гомогенат или полученная ультразвуком взвесь реовируса птиц. Более предпочтительным является инактивированный реовирус птиц.
Если антигенный материал представляет собой инактивированный реовирус птиц или часть реовируса птиц, то антигенный материал должен содержать (все) компоненты реовируса птиц, которые вовлечены в иммунный ответ.
Количество антигенного материала реовируса птиц, которое содержится в вакцине по изобретению, при том, что этот антигенный материал представляет собой инактивированный реовирус птиц или часть реовируса птиц, составляет приблизительно от 1 приблизительно до 1000 мкг на дозу для животного. Предпочтительное количество антигенного материала птичьего реовирус составляет приблизительно от 10 приблизительно до 500, более предпочтительно, от 10 до 250 мкг/на дозу и от 25 до 100 мкг/на дозу.
Для осуществления изобретения предпочтительное количество антигенного материала реовируса птиц на ветеринарную дозу может относиться к количеству антигенного материала от каждой из двух генотипических групп 1 и 4 по отдельности, или к количеству материала от вместе взятых указанных групп. Также, количество антигенного материала на ветеринарную дозу из одной генотипической группы не обязательно равно количеству антигенного материала из другой генотипической группы. Такой последний вариант осуществления позволяет дополнительно оптимизировать эффективность вакцины по изобретению, за счет подбора количества антигена в абсолютном и в относительном выражении.
Если антигенный материал, полученный из реовируса птиц по изобретению, представлен в виде инактивированного реовируса птиц или является частью реовируса птиц, то количество такого материала на ветеринарную дозу может быть выражено относительно количества репликативного вируса, который был использован для инактивации или экстракции, фракционирования, гомогенизации и т.д... В качестве альтернативы, количество такого материала на ветеринарную дозу может быть выражено в биохимических терминах, например, как количество белка, или в произвольных единицах иммуноферментного анализа ELISA, по отношению к известному стандарту. Все это хорошо известно специалистам в этой области.
Если антигенный материал, полученный из реовируса птиц по изобретению, представлен в виде репликативного реовируса птиц, то количество вируса на одну ветеринарную дозу вакцины по изобретению не является настолько же важным показателем, как в случае, если вакцина создана на основе инактивированного реовируса птиц или его субъединицы. Это отличие обусловлено тем, что репликативный реовирус птиц будет размножаться в птичьем организме-мишени до уровня виремии, который является биологически устойчивым. Тем не менее, для эффективности "получения" "живой" вакцины необходимо вводить минимальную дозу. В этой связи существуют различные способы количественного определения репликативного реовируса птиц. Удобным способом считается подсчет фактически жизнеспособных вирусных частиц, например, в экспериментах с титрованием тканевых культур, или в анализе бляшкообразования на восприимчивом клеточном слое. Количество реовируса птиц по изобретению может быть выражено как число единиц дозы, инфицирующей 50% клеток культуры ткани (TCID50), или число бляшкообразующих единиц (БОЕ). Также, количество, составляющее эффективную инфицирующую дозу, зависит от жизнеспособности и репликативной силы конкретного реовируса, который используется для осуществления изобретения.
Если антигенный материал, полученный из реовируса птиц по изобретению, представлен в виде репликативного реовируса птиц, то предпочтительное количество репликативного реовируса птиц для вакцины по изобретению составляет приблизительно от 10 приблизительно до 1×107 TCID50 реовируса птиц на ветеринарную дозу, более предпочтительное количество находится в диапазоне от 1×102 до 1×106, в диапазоне от 1×102 до 1×105, в диапазоне от 1×102 до 1×104, и даже в диапазоне от 500 до 5000 TCID50/на дозу, в указанном порядке предпочтения.
Вакцины по изобретению можно вводить в объеме, который является приемлемым для животного-мишени, и может составлять, например, приблизительно от 0,1 приблизительно до 10 мл. Предпочтительный объем одной дозы составляет приблизительно от 0,2 приблизительно до 3 мл.
В одном варианте осуществления вакцина согласно изобретению дополнительно содержит стабилизатор. Стабилизатор может служить для защиты склонных к разрушению компонентов и/или для повышения срока хранения вакцины. Обычно такими стабилизаторами являются крупные молекулы с высокой молекулярной массой, такие как липиды, углеводы или белки, например, сухое молоко, желатин, сывороточный альбумин, сорбит, сахароза, трегалоза, спермидин, нитрозамины, декстран или поливинилпирролидон, и буферы, такие как фосфаты щелочных металлов.
Предпочтительно, стабилизатор не содержит соединений животного происхождения или подобных соединений. Химическое определение стабилизатора описано в опубликованной заявке WO 2006/094974.
Также в вакцину можно добавлять консерванты, такие как тиомерсал, мертиолат, фенольные соединения и/или гентамицин.
Общепринятые способы и методики создания вакцин хорошо известны в данной области и описаны, например, в государственных нормативных документах, таких как Фармакопеи, и в хорошо известных справочниках, таких как "Remington" и "Veterinary vaccinology" (см. выше).
Животными, для которых предназначена вакцина по изобретению, являются птицы, восприимчивые к реовирусной инфекции. Предпочтительными целевыми видами птиц являются виды, имеющие отношение к человеку или к области ветеринарии, например, курица, индейка, утка, гусь, куропатка, павлин, перепел, голубь, фазан, цесарка, зяблик, ворона, длиннохвостый попугай, попугай, ара, какаду, зяблик, сокол, ястреб, эму, казуар или страус.
Предпочтительными являются целевые виды птиц, выбранные из группы, состоящей из кур, индеек, уток и гусей. Более предпочтительным видом являются куры, поскольку для этого целевого вида птиц наиболее заметны экономические последствия инфицирования птичьим реовирусом и заболеваний.
Согласно изобретению, птица может относиться к любому типу, породе или сорту, таким как несушки, племенные птицы, бройлеры, комбинированные породы или родительские линии любой из таких пород. Предпочтительными типами являются бройлер, племенная птица и несушка. Наиболее предпочтительными являются племенные куры, поскольку вакцинация этого типа птиц создает защиту для их потомства, которое является наиболее восприимчивым к реовирусной инфекции.
Для осуществления изобретения необязательно, чтобы виды птиц, которые являются мишенью для вакцинации, представляли собой те же самые виды, что и виды птиц, от которых был выделен реовирус птиц, который в свою очередь использовали для получения антигенного материала для вакцины по изобретению.
В предпочтительном варианте осуществления для вакцины по изобретению используется реовирус птиц, который был выделен из курицы.
Вакцина по изобретению может служить для эффективной примирующей вакцинации, после которой затем можно усиливать эффект с помощью бустерной вакцинации.
Животное-мишень для вакцинации в соответствии с изобретением в принципе может быть здоровым или больным, и может иметь положительный или отрицательный ответ на наличие реовируса птиц или антител против реовируса птиц. Также животное-мишень может быть в любом возрасте, в котором оно восприимчиво к вакцинации. Вместе с тем, очевидно, что преимущество будет иметь вакцинация здоровых, неинфицированных животных, и как можно более раннее проведение вакцинации для предотвращения любой полевой инфекции.
Таким образом, вакцину по изобретению можно применять или в качестве профилактического или в качестве терапевтического лечения, или как оба вида лечения, поскольку эта вакцина препятствует и возникновению и прогрессированию инфекции, вызванной птичьим реовирусом.
В этой связи, еще один полезный эффект от уменьшения вирусной нагрузки посредством вакцины по изобретению представляет собой предотвращение или уменьшение выделения вируса и, следовательно, распространения вируса, как по вертикали в виде передачи потомству, так и по горизонтали внутри поголовья или популяции, и в пределах географической зоны. Следовательно, применение вакцины по изобретению приводит к уменьшению распространенности реовируса птиц.
Таким образом, дополнительными аспектами настоящего изобретения являются:
- применение вакцины по изобретению для снижения уровня распространенности реовируса птиц в популяции или в географической зоне, и
- вакцина по изобретению для снижения распространенности реовируса птиц в популяции или в географической зоне.
Схема введения вакцины по изобретению в организм целевых птиц может представлять собой введение единственной дозы или нескольких доз, которые можно вводить одновременно, совместно или последовательно, и таким способом, который соответствует предполагаемой дозировке и рецептуре, и в таком количестве, которое будет иммунологически эффективным.
Схема введения вакцины по изобретению в идеале интегрирована в существующие графики вакцинации другими вакцинами, которые могут быть необходимыми у целевых птиц, для уменьшения стресса у птиц и снижения трудовых затрат.
Вакцину против реовируса птиц согласно изобретению в принципе можно вводить в организм целевых птиц с помощью разных способов применения и в разные точки времени их жизни, при условии, что вводимая вакцина способна создавать эффективный иммунный ответ.
В одном варианте осуществления вакцину по изобретению вводят цыплятам в день вылупления из яйца или вскоре после него, то есть, в возрасте 1-3 дней. В качестве альтернативы, вакцину по изобретению вводят в яйцо, незадолго до вылупления, для кур это примерно 18-й день эмбрионального развития.
Вакцину по изобретению предпочтительно вводят в организм целевых птиц не менее чем за 4 недели до предполагаемого начала яйцекладки.
Таким образом, потомство может быть эффективно защищено полученными от матери антителами и/или снижается или предотвращается инфицирование путем вертикальной передачи вируса.
Предпочтительные способы введения вакцины по изобретению целевым птицам представляют собой парентеральное введение путем инъекции, например, внутримышечной или подкожной инъекции, введение суспензии в каплях, например, в виде спрея, глазных капель или перорально-назальным путем, или введение через пищеварительный тракт.
Предпочтительным способом является применение путем внутримышечной или подкожной инъекции: предпочтительной является внутримышечная инъекция в бедро или грудную мышцу или подкожная инъекция в область шеи. Это относится в равной степени к применению антигенного материала реовируса птиц по изобретению в виде репликативного вируса, инактивированного вируса или субъединицы.
Следует понимать, что оптимальный путь введения будет зависеть от конкретной композиции используемой вакцины и от конкретных характеристик целевой птицы.
Дальнейшая оптимизация вакцины по изобретению входит в компетенцию специалиста в данной области. Обычно такая оптимизация включает точную настройку эффективности вакцины таким образом, чтобы она обеспечивала достаточную иммунную защиту. Настройку можно выполнять путем подгонки дозы вакцины, или путем использования другой лекарственной формы или рецептуры вакцины, или путем подгонки других компонентов вакцины (например, стабилизатора или адъюванта), или с помощью другого способа введения.
Вакцина может дополнительно содержать другие соединения, такие как адъювант, дополнительный антиген, цитокин и т.д. В качестве альтернативы, вакцина по изобретению может иметь преимущество при комбинировании с фармацевтическим компонентом, например, с антибиотиком, гормоном, противовоспалительным или противопаразитарным лекарственным средством.
В одном варианте осуществления вакцина согласно изобретению содержит адъювант.
Это относится, в частности, к варианту, когда антигенный материал получен из реовируса птиц по изобретению в виде инактивированного вируса, или является частью реовируса птиц по изобретению. Поскольку такие антигенные материалы являются нерепликативными формами, для них обычно необходима дополнительная иммуностимуляция, чтобы такая вакцина могла вызывать эффект широкого спектра.
"Адъювант" представляет собой хорошо известный ингредиент вакцины, который обычно представляет собой вещество, стимулирующее иммунный ответ организма-мишени неспецифическим образом. Множество различных адъювантов известны в данной области. Примерами адъювантов являются полный и неполный адъювант Фрейнда, витамин Е, композиции алюминия, такие как фосфат алюминия или гидроксид алюминия, неионные блок-сополимеры и полиамины, такие как декстрансульфат, Карбопол®, пиран, сапонин, такой как Квил A (Quil A®) или Q-VAC®. Сапониновые и вакцинные компоненты могут быть объединены в препарате ISCOM® (ЕР 109942, ЕР 180564, ЕР 242380).
Дополнительно, в качестве адъюванта часто используются пептиды, такие как мурамилдипептиды, диметилглицин, тафцин, и масляные эмульсии, в которых используется минеральное масло, например, Bayol™ или Markol™, Montanide™ или легкое минеральное (парафиновое) масло, или используется неминеральное масло, такое как сквален и сквалан, или растительные масла, например, этилолеат. Преимущество может давать использование комбинированных продуктов, таких как ISA™ от компании Seppic™ или DiluvacForte™. Эмульсия может быть представлять собой эмульсию типа вода-в-масле (В/М), масло-в-воде (М/В), вода-в-масле-в-воде (В/М/В) или двойную масляную эмульсию (ДМЭ) и т.д.
В предпочтительном варианте осуществления вакцина согласно изобретению содержит эмульсию типа вода-в-масле.
Такая эмульсия создает эффект депо у вакцинированного животного, поскольку происходит медленное высвобождение антигена и тем самым достигается пролонгированная стимуляция иммунной системы организма-мишени.
В предпочтительном варианте осуществления масляная фаза эмульсии вода-в-масле содержит минеральное масло или этилолеат.
В одном варианте осуществления вакцины по изобретению антигенный материал представляет собой инактивированный реовирус птиц в рецептуре в виде эмульсии вода-в-масле, при этом масляная фаза эмульсии вода-в-масле содержит минеральное масло или этилолеат.
Следует понимать, что другие способы добавления к вакцине по изобретению адъювантов, соединений носителей или разбавителей, эмульгаторов или стабилизаторов также входят в объем настоящего изобретения.
В одном варианте осуществления вакцина по изобретению дополнительно содержит олигонуклеотид, который представляет собой иммуностимулирующий неметилированный CpG-содержащий олигонуклеотид (INO). Предпочтительным INO является агонист птичьего Toll-подобного рецептора (TLR) 21, например, описанный в патенте WO 2012/089800 (семейство Х4), в патенте WO 2012/160183 (семейство X43) или в патенте WO 2012/160184 (семейство Х23).
Вакцину по изобретению предпочтительно можно объединять с дополнительным антигенным материалом в комбинированной вакцине. Вместе с тем, дополнительный антигенный материал, полученный из реовируса птиц, не является обязательным.
Таким образом, в одном варианте осуществления вакцины по изобретению эта вакцина содержит дополнительный антигенный материал, который получен из патогенного для птиц микроорганизма, а не из реовируса птиц.
"Дополнительный антигенный материал" сам по себе может быть в репликативной или инактивированной форме или в виде субъединицы, и может быть с адъювантом или без адъюванта. Дополнительный антигенный материал получают из дополнительного микроорганизма, который является патогенным для целевой птицы. Такой материал может, например, содержать природную или синтетическую молекулу, например, белок, углевод, липополисахарид, нуклеиновую кислоту, кодирующую белковый антиген. Также клетка-хозяин, содержащая такую нуклеиновую кислоту, или живой рекомбинантный микроорганизм-носитель, содержащий такую нуклеиновую кислоту, могут представлять собой способы доставки нуклеиновой кислоты или дополнительного антигенного материала в организм целевой птицы. В качестве альтернативы, дополнительный антигенный материал может содержать инактивированный микроорганизм, такой как паразит, бактерия или вирус.
В качестве альтернативы, вакцина по изобретению сама по себе может быть добавлена в вакцину.
Полезный эффект комбинированной вакцины по изобретению состоит в том, что эта вакцина не только вызывает иммунный ответ против реовируса птиц, но и против других патогенов целевой птицы, при этом для вакцинации требуется только единственная обработка целевого животного. Таким образом уменьшается дискомфорт для целевого животного, а также затраты времени и трудовые затраты.
"Микроорганизм, патогенный для птицы" по изобретению хорошо известен в данной области. В этой связи, дополнительный антигенный материал может быть получен в принципе от любых вирусов (кроме реовируса птиц), бактерий, паразитов, грибков, риккетсий, простейших и/или от паразита, который является патогенным для птиц и который также является мишенью для вакцины, предназначенной для уменьшения вызванной птичьим реовирусом инфекции, в соответствии с настоящим изобретением.
В предпочтительном варианте осуществления патогенный для птиц вирус выбран из следующих вирусов: вирус инфекционного бронхита, вирус ньюкаслской болезни, аденовирус птиц, птичий астровирус, птичий парамиксовирус, вирус синдрома снижения яйценоскости, птичий аденовирус, вирус ифекционного бурсита (IBDV), вирус анемии кур, вирус птичьего энцефаломиелита, вирус птичьей оспы, вирус ринотрахеита индеек, вирус чумы уток, вирус вирусного гепатита уток, вирус оспы голубей, вирус болезни Марека, вирус птичьего лейкоза, вирус инфекционного ларинготрахеита, птичий метапневмовирус, вирус птичьего гриппа и гусиный парвовирус.
В предпочтительном варианте осуществления патогенная для птиц бактерия выбрана из следующих родов бактерий: Escherichia, Salmonella, Ornithobacterium, Haemophilus, Pasteurella, Bordetella, Erysipelothrix, Mycoplasma, Campylobacter, Borrelia, Enterococcus, Avibacterium, Riemerella, Listeria, Shigella, Streptococcus, Staphylococcus, Mycobacterium, Chlamydia и Clostridium.
В предпочтительном варианте осуществления паразит, патогенный для птиц, выбран из паразитов родов Eimeria и Cryptosporidium.
В предпочтительном варианте осуществления грибок, патогенный для птиц, выбран из родов грибов Aspergillus и Candida.
Еще в одном аспекте изобретение относится к способам получения вакцины согласно изобретению.
Результатом упомянутых способов является доступность вакцины по изобретению, достижение полезного эффекта вакцины, который состоит в уменьшении инфицирования птиц птичьим реовирусом, как описано выше.
"Приготовление" вакцины по изобретению осуществляют способами, хорошо известными специалисту в данной области. Такие способы производства, в общем, содержат этапы, смешивания и создания рецептуры антигенного материала, полученного из реовируса птиц по изобретению, вместе с фармацевтически приемлемыми наполнителями, с последующей равномерной расфасовкой в емкости подходящего размера. Различные этапы производства необходимо контролировать с помощью соответствующих тестов, например, с помощью иммунологических анализов качества и определения количества антигенов, микробиологических анализов на стерильность и отсутствие посторонних веществ, и на конечном этапе, с помощью экспериментов in vitro или in vivo для определения эффективности и безопасности вакцины. Все эти тесты хорошо известны специалисту в данной области и прописаны в руководствах и в государственных нормативных документах, таких как Фармакопеи.
Вакцина по изобретению может быть приготовлена в форме, подходящей для введения целевым птицам, соответствующей желательному пути введения и обладающей желательным эффектом.
Предпочтительно, вакцину по изобретению получают в виде инъекционной жидкости, такой как суспензия, раствор, дисперсия или эмульсия. Обычно такие вакцины готовят стерильными.
В одном варианте осуществления вакцину по изобретению получают из антигенного материала реовируса птиц, который был инактивирован. Такую инактивированную вакцину против реовируса птиц теперь можно изготовить в целях изобретения с помощью общеизвестных способов.
Таким образом, в дополнительном аспекте настоящее изобретение относится к способу получения вакцины согласно изобретению, и указанный способ содержит этап инактивации реовируса птиц от каждой из двух генотипических групп: генотипической группы 1 и генотипической группы 4.
Репликацию реовируса птиц в соответствии с изобретением можно выполнять разными способами, например, с помощью животного-хозяина, и собирать вирус из крови и/или органов. Вместе с тем, предпочтительным способом является система культивирования in vitro с использованием клеток-хозяев, восприимчивых к реовирусу птиц. Такая система культивирования легче поддается контролю и регуляции, чем производство in vivo, и выход вируса может быть оптимизирован. Обычно в системе культивирования in vitro используется емкость для культивирования и определенная (полуопределенная) культуральная среда. Клетки-хозяева могут быть получены из животного, то есть первичные клетки, или можно использовать бессмертные клетки, например, из устойчивой клеточной линии. В небольших масштабах, культуральный сосуд может представлять собой плоскодонную колбу или роллерный флакон; для культивирования в больших масштабах культуральным сосудом может быть ферментер, в котором существует возможность контроля и регуляции, при необходимости, ряда важных параметров культуры, и такой ферментер даже может быть автоматизированным. Технологии, материалы и оборудование для культуральной системы любого масштаба in vitro по изобретению хорошо известны и доступны от многих коммерческих поставщиков, работающих в сфере естественных наук.
В одном варианте осуществления способ получения по изобретению содержит следующие этапы:
а. размножение реовируса птиц в клеточной культуре in vitro,
b. сбор и инактивация указанного реовируса птиц, и
c. смешивание инактивированного реовируса птиц с фармацевтически приемлемым носителем.
Еще в одном варианте осуществления способ получения по изобретению содержит этап смешивания с адъювантом антигенного материала реовируса птиц, описанного в изобретении.
В других аспектах настоящее изобретение относится к различным видам медицинского применения вакцины по изобретению или антигенного материала реовируса птиц, описанного в изобретении. Эти материалы и способы в результате приводят к полезному эффекту снижения инфицирования птичьим реовирусом птиц, как описано выше.
Таким образом, в следующих аспектах настоящее изобретение относится к следующему:
- к композиции, содержащей антигенный материал реовируса птиц, который состоит из антигенного материала, полученного из реовирусов птиц от каждой из двух генотипических групп: генотипической группы 1 и генотипической группы 4, для использования в качестве вакцины для снижения инфицирования птиц птичьим реовирусом.
- к использованию антигенного материала реовируса птиц, состоящего из антигенного материала, полученного из реовирусов птиц от каждой из двух генотипических групп: генотипической группы 1 и генотипической группы 4, для изготовления вакцины, предназначенной для снижения инфицирования птиц птичьим реовирусом.
- к вакцине по изобретению для использования с целью снижения инфицирования птиц птичьим реовирусом.
- к применению вакцины по изобретению, или вакцины, которую можно получить способом по изобретению, для снижения инфицирования птиц птичьим реовирусом.
- к способу снижения инфицирования птиц птичьим реовирусом, и указанный способ содержит введение птице вакцины по изобретению, или вакцины, которую можно получить способом по изобретению.
Далее изобретение дополнительно описано с помощью следующих примеров, не ограничивающих объем изобретения.
Примеры
1. Выделение реовируса птиц и подготовка образцов
Реовирус птиц выделяли из куриных органов путем культивирования тканевых гомогенатов на клетках печени куриного эмбриона (CEL). Коротко, из (потенциально) зараженных кур получали ткани, такие как сухожилия, печень, тощую кишку и кровь. Кровь центрифугировали и собирали сыворотку. Образцы тканей иссекали. Эти образцы помещали в пробирку объемом 6 мл, содержащую около 0,5 мл стеклянных шариков диаметром около 1 мм, и 1 мл фосфатно-солевого буферного раствора (ФБР), в котором содержался коктейль из антибиотиков и противогрибковых соединений. Образцы гомогенизировали путем взбалтывания в течение 20 минут на шаровой мельнице Mixer Mill ball mill (Retsch), с последующим центрифугированием для удаления осадка. Супернатант собирали и хранили в замороженном виде при -70 °С для последующего использования.
Первичные клетки CEL получали свежими перед использованием, в соответствии со стандартным протоколом. Коротко: для получения ткани SPF печени использовали 14-16-дневных куриных эмбрионов. Печени дважды промывали в ФБР для удаления крови, после чего инкубировали с перемешиванием в растворе трипсина/ФБР при 37 °С в течение 15 минут. Трипсин нейтрализовали фетальной телячьей сывороткой (FCS) и обработанную трипсином смесь центрифугировали в течение 10 минут при 600 x g. Осадок ресуспендировали в стандартной ростовой среде (содержащей коктейль из антибиотиков и 5% фетальной телячьей сыворотки (FCS)). Выполняли однократную фильтрацию для удаления сгустков, и затем подсчитывали клетки CEL и использовали их как есть.
Клетки CEL высевали в количестве 1,5×106 клеток/мл в 5 мл ростовой среды (5% FCS) в культуральные флаконы Т25 и инкубировали в течение ночи в инкубаторе в увлажненной среде при температуре 37 °С и 5% CО2, для достижения устойчивого монослоя. На следующий день культуральную среду заменяли средой, содержащей 2% FCS, и во флаконы инокулировали образец вируса в виде 50 мкл сыворотки или тканевого супернатанта. После этого флаконы инкубировали в течение 4-7 дней.
После первого цикла инкубации на слое клеток CEL часто появлялись дефекты от дебриса, поэтому не было видно какого-либо заметного цитопатического эффекта (CPE), поэтому обычно проводили второй пассаж: свежие клетки CEL были приготовлены, высеяны и инкубированы в виде монослоя, и затем в них инокулировали 50 мкл культурального супернатанта из первого пассажа. Такую культуру инкубировали в течение 4-х дней, после чего во флаконе можно было отчетливо наблюдать специфический CPE реовируса птиц (клетки CEL казались потемневшими и зернистыми, с полупрозрачными бластоподобными везикулами). Во флаконах с CPE-отрицательным результатом можно выполнять третий пассаж. В конце собирали супернатант от культуры из 2-го или 3-го пассажа и хранили в замороженном состоянии (-70 °C) для последующего использования.
Изоляты получали наименования и были пронумерованы, при этом буквы SL означают "служебная лаборатория", следующие две цифры обозначают год выделения, номер изолята в хронологическом порядке и 2-буквенный код страны, в которой получен донорский материал, используемый для выделения.
Выделенные образцы вируса можно использовать непосредственно для выделения РНК, анализа ОТ-ПЦР и анализа последовательности. Изоляты, которые были использованы в экспериментах на животных, подвергались дальнейшей обработке: образцы, используемые для экспериментального заражения, подвергались амплификации непосредственно из амплифицированного изолята третьего цикла, в целях получения более высоких титров и увеличения объемов путем пролиферации клеток CEL из эмбриональных фибробластов (CEF) в культуральных сосудах с последовательно возрастающим объемом, например, во флаконах Т75 (15 мл культуры) или Т175 (25 мл культуры), в плоскодонных флаконах для клеточных культур Cellstar™ (Greiner Bio-One) или в роллерных флаконах объемом 490 см2 (150 мл культуры) (Corning, Fischer Scientific). Все манипуляции проводили в стандартной культуральной среде и в стандартных условиях культивирования. Таким образом, экспериментальное заражение было проведено с использованием:
- SL11A823-2 ВЕ (генотипическая группа 1): 7,95 Log10 TCID50/мл
- SL11A294-12 FR (генотипическая группа 2): 6,32 Log10 TCID50/мл
- SL10A1581-32 ES (генотипическая группа 3): 5,95 Log10 TCID50/мл
- SL11A823-1 ВЕ (генотипическая группа 4): 7,70 Log10 TCID50/мл
Образцы прорывных изолятов реовируса птиц, которые были использованы для получения вакцин, вначале трижды клонировали способом бляшкообразования, как описано ниже, и затем проводили амплификацию подобными способами.
2. Подтверждение вирулентности вирусных изолятов у целевых животных
В соответствии с теориями Коха, патогенность и повторное выделение птичьих реовирусных изолятов были продемонстрированы с помощью экспериментального заражения кур. Были использованы цыплята в возрасте 1 день, которые происходили от кур, свободных от специфичных патогенов (SPF), или от кур, вакцинированных против реовируса. Тесты с полученными от вакцинированных кур цыплятами, которые имели положительную реакцию на материнские антитела (MDA+) против классических штаммов реовируса, служили для подтверждения возможности вакцинации в отношении прорыва этих вирусных изолятов. Вирусы, используемые для экспериментального заражения, представляли собой изоляты SL11A823-1BE, SL11A823-2BE, SL11A0294-12 FR и SL10A1581-32 ES, которые были выделены и амплифицированы, как описано выше. Заражение проводилось перорально, чтобы имитировать естественный путь передачи инфекции, или, в качестве альтернативы, внутримышечным путем, который оказался наиболее эффективным способом экспериментального заражения.
2.1. Схема эксперимента
Цыплята SPF 200-дневного возраста обоих полов были помечены с помощью меток на крыльях и помещены в отдельные изоляторы с отрицательным давлением, по 20 цыплят на группу. Использовали цыплят - несушек породы белый леггорн. Корм и вода были доступны без ограничений. Цыплята с очевидными признаками ослабленности или мелкие птенцы не были включены в эксперимент. Дополнительно, у 10 цыплят из одного выводка брали кровь, чтобы получить образцы сыворотки для тестирования статуса антител.
Заражение инокуляцией проводили в первый день размещения, и всего было использовано 10 изоляторов для размещения разных групп: 2 изолятора для каждой из инокуляций изолятом реовируса птиц, при этом в одном изоляторе группа цыплят подвергалась пероральному заражению, а в другом изоляторе группа цыплят была заражена внутримышечно. В качестве положительного контроля был добавлен один изолятор, в котором цыплята получали контрольную инокуляцию вакцинного штамма 1133 живого ослабленного реовируса, внутримышечным путем. Также, еще в одном изоляторе находилась группа отрицательного контроля, которая подвергалась ложному заражению.
Все инокуляции проводили в дозе 0,1 мл на цыпленка и составляли 4,5 Log10 TCID50/на цыпленка, как при пероральном, так и при внутримышечном заражении. Готовили свежие разведения вируса-инокулята в пределах 1 часа перед введением, и сохраняли их на льду до момента применения. Оставшийся инокулят использовали для обратного титрования, которое проводилось для подтверждения дозы введенного инокулята.
Квалифицированный персонал проводил ежедневное наблюдение всех цыплят в ходе всего эксперимента с целью выявления клинических признаков болезни или других нарушений. Животные с признаками боли или дискомфорта подвергались эвтаназии и патологоанатомическому исследованию.
Отобранные цыплята были взяты для забора проб на 3 и на 10 день после заражения, и от них получали образцы крови и тканей. Из крови получали сыворотку, половину которой использовали для повторного выделения вируса, а другую половину использовали для определения антител. Были использованы различные ткани (сухожилия, печень и тощая кишка) для гомогенизации и повторного выделения вируса.
2.2. Результаты экспериментов для подтверждения вирулентности
У цыплят из группы отрицательного контроля, или в любом из их образцов, а также в сыворотке, полученной в день 0 от цыплят одного выводка, не было выявлено каких-либо признаков болезни или инфекции, которые могли иметь отношение к эксперименту. Также, как и предполагалось, в группе положительного контроля, зараженной вакцинным штаммом 1133 реовируса птиц, выявлены вирус-положительные ткани (сухожилие, печень) и сыворотка (на 10 день после заражения), таким образом, эксперимент был достоверным.
Обратное титрование образцов инокуляции показало, что доза инокуляции составляла ± 0,2 Log10 TCID50 от заданной дозы 4,5 Log 10 TCID50/на цыпленка.
2.2.1. Общие наблюдения:
- Повторное выделение вируса из крови было положительным только на 3 день после инокуляции (п/и), а не на 10 день п/и.
- При определении сывороточной реакции подтвержден отрицательный ответ на 3 день или на 10 день п/и для полевых изолятов, и только в случае инокуляции изолята штамма 1133 был выявлен положительный ответ антител против реовируса на 10 день п/и. По-видимому, в этот период титры антител еще не были достаточно высокими, чтобы их можно было обнаружить с помощью серийного анализа на антитела против реовируса птиц (IDEXX REO антитела в анализе ELISA).
- При внутримышечной инокуляции выявлено гораздо больше образцов с положительным ответом на повторное выделение вируса, чем при пероральной инокуляции, для всех протестированных вирусных изолятов, и на 3 день п/и, и на 10 день п/и.
- Все полевые изоляты были вирулентными как при пероральном, так и при внутримышечном введении. Выявленные клинические признаки представляли собой депрессию и замедление роста, хромоту в той конечности, куда вводили инокулят, или полную неподвижность. Также часто наблюдалось кишечное воспаление и некроз печени. Периодически у подопытных животных даже наблюдались случаи смертности: для изолята SL11A823-2 BE (генотипическая группа 1) при пероральном введении, и для изолята SL10A1581-32 ES (генотипическая группа 3) при внутримышечном введении.
- При заражении штаммом 1133 было обнаружено преимущественное поражение сухожилий. Полевые изоляты в самых высоких количествах повторно выделялись из печени или тощей кишки; в целом, самые высокие показатели повторного выделения для каждого из изолятов из тощей кишки были достигнуты на 7 день после инокуляции.
3. Выделение, амплификации и ДНК-секвенирование нуклеиновых кислот
Культуральный супернатант от 2-го или 3-го пассажа изолятов использовали для выделения общей вирусной РНК реовируса птиц. Эту РНК использовали для получения и амплификации кДНК, которую затем можно было использовать для определения последовательности ДНК. Для всех манипуляций применялись стандартные способы и условия, с использованием коммерческих наборов и автоматизированного лабораторного оборудования.
Коротко: выделение вирусной РНК выполняли из образцов культуральных супернатантов объемом 200 мкл с помощью устройства MagNA Pure™ 96 (Roche). Это оборудование позволяет лизировать образец и выделить нуклеиновую кислоту с помощью магнитных шариков. Затем элюированную нуклеиновую кислоту использовали для получения первой нити кДНК с помощью обратной транскрипции, используя набор для синтеза первой цепи SuperScript™ III (Invitrogen), в соответствии с инструкцией изготовителя.
Используемые праймеры, специфичные для гена сигма-С реовируса птиц, представляли собой:
REO FW1: 5'- AGTATTTGTGAGTACGATTG - 3' (SEQ ID NO: 19)
REO REV5: 5'- GGCGCCACACCTTAGGT - 3' (SEQ ID NO: 20)
Известно, что праймер REO FW1 присоединяется слева от гена сигма-C в направлении 5' (приблизительная локализация геномного сегмента S1 реовируса птиц - нуклеотиды 533-552), и праймер REO REV5 присоединяется на 3'-конце гена сигма-C (приблизительная локализация S1 сегмента - нуклеотиды 1621-1605), и это является причиной невозможности определения предпоследних нуклеотидов, расположенных в направлении 3' от гена сигма-C. Праймер REO FW1 использовался для синтеза первой цепи, и оба праймера, FW1 и REV5, использовались для ПЦР-реакций амплификации и секвенирования. Эти праймеры могут быть использованы для образцов реовируса птиц из всех генотипических групп, тем не менее, обратный праймер иногда не проявлял достаточной эффективности, поэтому для некоторых образцов реовируса птиц были сконструированы и использованы дополнительные праймеры, для дополнительной амплификации вирусной нуклеиновой кислоты.
После синтеза кДНК образцы амплифицировали с помощью ПЦР, с праймерами FW1 и REV5 в конечной концентрации 0,4 мкМ в образцах 50 мкл с 2 мкл образца кДНК, с использованием высокоточной ДНК-полимеразы и мастер-смеси Phusion™ (Thermo Scientific). Применяли следующие условия ПЦР: 60 секунд 98 °С; 35 циклов: 10 секунд 98 °С, 30 секунд 58 °C; и 30 секунд 72 °С; затем 10 минут при 72 °С.
Синтез кДНК подтверждали с помощью электрофореза в 1% агарозном геле (Hispanagar), содержащем бромид этидия, и путем сравнения с маркерной полосой 200-10000 п.н. Smartladder™ (Eurogentec). Рутинным способом были получены гелевые полоски приблизительно 1,1 т.п.н., что было показателем успешной амплификации гена сигма-С реовируса птиц.
Образцы ПЦР с положительным результатом по полоске 1088 п.н. подвергали очистке с использованием набора для ПЦР-очистки QIAquick™ (Qiagen). Затем измеряли концентрацию ДНК с помощью спектрофотометра NanoDrop™ (Thermo Scientific). Обычно вирусную кДНК получали в концентрации от 10 до 40 нг/мкл.
Определение последовательности ДНК проводили с использованием оборудования для секвенирования в режиме автоматизированных циклов и данные считывания последовательности были собраны, выровнены и проанализированы с помощью компьютерного программного обеспечения, все в соответствии с инструкциями изготовителя. Коротко: первый цикл ПЦР-секвенирования проводили с вирусной кДНК в количестве от 20 до 70 нг (обычно 1 или 2 мкл очищенного ПЦР-амплифицированного образца вирусной кДНК) и 0,5 мкМ праймера FW1 или REV5 в 20 мкл на реакцию, с помощью набора для завершения цикла секвенирования Big Dye™ (Applied Biosystems). Использовали следующую программу ПЦР-секвенирования: 25 циклов: 10 секунд 96 °C, 5 секунд 50 °С и 2 минуты 60 °С. В дальнейшем образцы сохраняли при 15 °С до анализа.
Затем образцы ПЦР-секвенирования очищали с использованием набора для центрифугирования Dye Ex™ (Qiagen) в соответствии с инструкциями изготовителя, и образцы хранили при 4 °С до начала запуска секвенирования.
Секвенирование ДНК проводили с помощью капиллярного электрофореза с использованием анализатора ABI 3500 Genetic Analyzer™ и соответствующего программного обеспечения (Applied Biosystems). Полученные данные о последовательности затем анализировали с помощью программного обеспечения V.54 Sequencher™ (Gene Codes Corp.).
Некоторые неясности в собранных последовательностях можно устранить путем использования дополнительных праймеров с гибридизацией во внутренние области гена сигма-C, чтобы при считывании получить дополнительные перекрывающиеся данные.
4. Выравнивания последовательностей и филогения
Были проанализированы последовательности аминокислот белка сигма-C реовируса птиц, как в секвенированных полевых изолятах, как описано выше, так и из общедоступных баз данных. Для сбора результатов и определения филогении аминокислотные последовательности были выровнены с использованием комбинации программ, таких как программа SIAS (http://imed.med.ucm.es Tools/sias.html) для множественного попарного выравнивания, и программа MEGA6 (см. выше). Выравнивание подтверждали с помощью выравнивания один к одному в программе BLASTP (см. выше), и оценки согласно этой программе были решающими для определения генотипической группы вирусной последовательности.
В некоторых из прорывных изолятов реовируса птиц было невозможно с уверенностью определить последние приблизительно 30 нуклеиновых кислот 3'-области гена, кодирующего белок сигма-C, так как эти основания расположены непосредственно ниже после ПЦР-праймера. Также, для некоторых последовательностей из общедоступных баз данных отсутствует информация о С-конце белка сигма-C. Таким образом, чтобы оптимизировать наложение выравниваний, аминокислотную последовательность С-конца белка сигма-C не использовали в этих анализах. Вместе с тем, это не влияет на точность определения группы, как было также отмечено Kant et al. (см. выше): надежное определение генотипической группы может быть обеспечено даже с использованием неполной аминокислотной последовательности белка сигма-C. Аналогичным образом, случайная неясность в последовательности не препятствует анализу.
Выравнивание выполняли с использованием аминокислот 1-277 из белка сигма-C, по возможности; последовательности, которые были намного короче, не были включены в анализ. Вместе с тем, последовательности немного короче, такие как ISR-5223, были включены в анализ, так как это является ссылкой на предшествующий уровень техники в отношении определения типа генотипической группы.
Оценку выравнивания округляли до целых чисел, в соответствии с результатами оценки, как это предусмотрено программой BLAST. Вместе с тем, это означает, что эти цифры с точностью до 0,49%, относящиеся к длине в 277 аминокислот, соответствуют 2 аминокислотам.
Таблицы с описанием разных проанализированных последовательностей и их разделение на группы приведены в разделе таблиц ниже. Графическое представление филогении пяти генотипических групп представлено на чертежах. Из многочисленных протестированных полевых образцов в таблицах приведены только избранные данные о соответствующих и репрезентативных образцах: в таблице 1 описаны наиболее соответствующие из этих полевых образцов. Был проведен дальнейший отбор для образцов, полная аминокислотная последовательность которых представлена в прилагаемом списке последовательностей, см. таблицу 2. В таблице 3 перечислены наиболее подходящие из общедоступных последовательностей, с соответствующими номерами доступа в базе данных, а также их предварительное разделение на генотипические группы.
В таблице 4 представлены, в нескольких разделах, результаты попарного множественного выравнивания аминокислотных последовательностей белка сигма-C реовируса птиц для разных генотипических групп; выравнивание аминокислотной последовательности эталонного штамма генотипической группы было проведено по отношению к перечисленным последовательностям. Результаты выражены в процентах идентичности аминокислот и представлены для репрезентативных членов генотипической группы (подгруппы), а также для эталонных штаммов других генотипических групп. Из данных этих выравниваний были выведены точки разделения, которые служат для характеристики разных генотипических групп, согласно изобретению.
5. Клонирование полевых изолятов способом бляшкообразования
Для двух из прорывных штаммов реовируса птиц было проведено клонирование способом бляшкообразования для получения клонально чистого вирусного изолята в целях проведения исследований по вакцинации. Это были изоляты SL11A823-1BE и SL11A823-2BE, принадлежащие к генотипическим группам 4 и 1, соответственно. Для этого использовали стандартное клонирование вирусных бляшек на CEL-клетках в чашках для тканевой культуры под агаром. Коротко: готовили разведения из двух изолятов вируса, до концентрации 1×10-8. После этого чашки диаметром 6 см с культурами изолята инокулировали 1 мл CEL-клеток в концентрации 5×106 клеток/мл, 1 мл вирусного разведения и 3 мл стандартной среды для роста с FCS и антибиотиками. Чашки инкубировали в течение ночи. На следующий день супернатант удаляли и монослой два раза промывали ФБР. Затем в чашки добавляли 5 мл слой агарозы, 1:1 смесь: бактоагар 2,25% раствор в дистиллированной воде при 49 °С, и 2 × культуральную среду при 37 °С. Чашки инкубировали в течение 4-х дней и окрашивали нейтральным красным: в каждую чашку добавляли 2 мл раствора нейтрального красного 0,04% об/об в ФБР. Инкубировали в течение 6 часов, после чего вирусные бляшки становились заметными.
Для каждого вирусного изолята отбирали несколько отдельных бляшек из чашек с четко отделенными бляшками при высоких разведениях. Бляшки переносили в 0,5 мл ФБР. Затем каждый изолят бляшки подвергался одному циклу амплификации на клетках CEL в культуральном флаконе T25.
Клонирование способом бляшкообразования повторяли в течение еще двух циклов с использованием 0,1 мл амплификата бляшки из предыдущего цикла. В общей сложности проводили три цикла клонирования бляшек; в анализ всегда были включены чашки и флаконы для отрицательного контроля.
После третьего цикла клонирования способом бляшкообразования изоляты реовируса птиц подвергали амплификации на первичных клетках-фибробластах куриных эмбрионов (CEF) в больших флаконах для культивирования тканей; CEF-клетки получали по существу таким же образом, как и CEL-клетки, за исключением того, что для трипсинизации использовали целые эмбрионы. После амплификации были получены большие объемы стокового вируса с высокой степенью титрования для дальнейшего использования; титры 7-8 Log10 TCID50/мл могут быть получены рутинным способом.
6. Получение вакцины
Изоляты реовируса птиц после клонирования бляшкообразованием были дополнительно амплифицированы для производства экспериментальных вакцин. Для этой цели вирусы размножали на клетках Vero, культуральные супернатанты собирали, инактивировали формальдегидом, и инактивированный вирусный антиген был использован для эмульгирования с адъювантом - минеральным маслом в вакцинную эмульсию вода-в-масле. Коротко: суспензию клеток Vero в концентрации 1×105 клеток/мл высевали в роллерные флаконы объемом 1750 см2 в стандартной среде для роста с 5% FCS и антибиотиками. В роллерные флаконы инокулировали 1 мл амплифицированных клонированных бляшкообразованием изолятов реовируса птиц SL11A823-1BE или SL11A823-2BE, и инкубировали при 37 °С с вращением.
Через 5-6 дней был выявлен 100% СРЕ, и культуральный супернатант собирали. В культуральный супернатант добавляли разведенный формалин до конечной концентрации 0,2% об/об. Эту смесь оставляли для инактивации на 48 часов при температуре 37 °С, с перемешиванием со скоростью 200 оборотов в минуту.
После инактивации антигены реовируса птиц подвергали концентрированию примерно в 20 раз путем ультрафильтрации. В лабораторном масштабе это выполняли с помощью центробежного фильтра Centriprep™ (Millipore) с отсечной мембраной 10 кД: образцы 15 мл в объеме центрифугировали в течение 40 минут при 3000 g при 20 °C. Концентрированный вирусный антиген хранили в холодильнике при температуре 2-8 °С до дальнейшего использования.
Адъювантная вакцина была изготовлена путем объединения антигенных материалов реовируса птиц с масляной фазой. Водная фаза была подготовлена путем смешивания асептической воды для инъекций с концентрированным вирусным антигеном. Масляная фаза содержала жидкий парафин в качестве минерального масла и эмульгаторы, которые (в лабораторном масштабе) были гомогенизированы с маслом с использованием устройства Ultra Turrax™ (IKA). После этого масляную фазу стерилизовали фильтрованием через 0,2 мкм нейлоновый фильтр Ultipor™ (Pall). Затем масляную и водную фазы эмульгировали с использованием Ultra Turrax, циклами по несколько минут, чтобы избежать нагрева смеси выше 40 °C. Затем проверяли гомогенность с помощью световой микроскопии. Это повторяли до достижения размера всех водных пузырьков не менее 3 мкм.
Затем готовую вакцину разливали в маркированные стерильные флаконы в асептических условиях, флаконы закрывали нитрил-резиновыми пробками и герметизировали кодированной алюминиевой крышкой. Конечный вакцинный продукт хранится в холодильнике до использования.
Таким образом, были получены вакцины против реовируса птиц в соответствии с изобретением. Для получения дозы вакцины 0,5 мл на курицу была сделана вакцина, содержащая (на конечный объем эмульгированной вакцины) вирусный антиген SL11A823-1BE (при 8,32 Log10 TCID50/мл) в концентрации 1% об/об на 1 мл, и 2% об/об SL11A823-2BE (в 6,45 log 10 TCID 50/мл). Контрольные вакцины или не содержали вирусный антиген, или содержали только один из этих двух вирусных антигенов.
Были подготовлены сходные вакцины, служившие в качестве сравнительных примеров, которые содержали другие антигены реовируса птиц: или "классические" вакцинные штаммы 1733 и 2408, в качестве мультимерной вакцины единственной генотипической группы, или комбинацию штаммов 1733 2408 и ERS, содержащих антигены из генотипической группы 1 (в двукратном количестве) и генотипической группы 5. Количество антигена, используемого для этих сравнительных вакцин, было таким же, как в современных коммерческих вакцинах, и это количество измерялось в произвольных единицах ELISA по известному стандартному образцу.
7. Эксперименты с вакцинацией и заражением
Вакцины вода-в-масле, полученные, как описано выше, были использованы в экспериментах на животных с вакцинации и заражением. В серии экспериментов цыплят-несушек прививали вакциной по изобретению, которая была сделана на основе антигенного материала реовируса птиц из генотипических групп 1 и 4, тогда как их потомство подвергали заражению инокуляцией тяжелой инфекции, которая вызвана птичьим реовирусом из разных генотипических групп. Целью эксперимента была демонстрация защитных свойств широкого спектра действия и перекрестно-защитные свойства таких вакцин в ответ на заражение гомологичным и гетерологичным вирусом.
7.1. Схема эксперимента
7.1.1. Вакцинация производителей
Нормальные здоровые SPF-куры - несушки были разделены на 8 групп по 12 кур в каждой группе. Использовали кур-несушек породы белый леггорн в возрасте примерно 32 недель, и к каждой группе из 12 кур был добавлен один петух.
Куры были вакцинированы единственной дозой (0,5 мл) вакцины вода-в-масле, как описано выше, внутримышечно в правую грудную мышцу. Петухи не подвергались вакцинации, в целях предоставления образцов сыворотки отрицательного контроля. Через пять недель после вакцинации ежедневно собирали яйца для последующих экспериментов с заражением потомства инокуляцией. Яйца хранили при 4 °С до использования.
Все куры были размещены в птичнике с воздушными фильтрами (Hepa) на входящих и выводящих воздуховодах. Стандартный куриный корм и водопроводная вода были доступны без ограничений.
Куры были разделены на группы с начала эксперимента, при этом в каждую группу кур-несушек был введен один петух. Куры имели индивидуальные метки на крыльях или свифт-метки.
В целях акклиматизации все куры были размещены за одну неделю до вакцинации, и ежедневно наблюдались в ходе эксперимента квалифицированным персоналом для выявления клинических признаков заболевания или других нарушений.
Схема вакцинации кур-производителей:
Группа 1: вакцина: антиген SL11 A823-1ВЕ
Группа 2: вакцина: антиген SL11A823-2BE антиген
Группа 3: вакцина: антиген SL11A823-1ВЕ и антиген SL11A823-2BE
Группа 4: ложная вакцина (не содержащая антиген реовируса птиц)
Группа 5: "классическая" вакцина против реовируса птиц: антигены штаммов 1733 и 2408 (вакцина сходна с коммерческой вакциной Nobilis® Reo INAC).
Группа 6: "классическая" вакцина против реовируса птиц (антигены штаммов 1733 и 2408) с антигеном штамма ERS
Петухи: без вакцинации
7.1.2. Заражение потомства инокуляцией
Этот эксперимент предназначен для тестирования защиты потомства от вакцинированных родителей, на способность потомства переносить тяжелую инфекцию, вызванную птичьим реовирусом, даже в случае, если инфицирующий вирус относится к другой генотипической группе, отличной от группы вакцинного вируса. Исходя из масштаба и размера, эту задачу выполняли в двух последовательных экспериментах. Вначале анализировали заражение инокуляцией с введением изолятов SL11A294-12 FR (генотипическая группа 2) и SL10A1581-32 ES (генотипическая группа 3), а через две недели на новом потомстве от одних и тех же родителей проводили последующие серии заражений с введением изолятов SL11A823-1 ВE (генотипическая группа 4) и SL11A823-2 BE (генотипическая группа 1).
В этих обоих экспериментах яйца, собранные в эксперименте с вакцинацией кур-производителей, инкубировали по группам, в зависимости от групп введения у кур-производителей, в стандартных инкубаторах для выведения цыплят, до момента вылупления на 21 день. Суточные цыплята (смешанного пола) были собраны и получали метки на крыльях. Заметно слабые или мелкие птенцы не были включены в эксперимент. У 10 цыплят от каждой группы кур-производителей брали кровь для получения образцов сыворотки в целях анализа исходного MDA-статуса цыплят. Затем цыплят разделяли на группы путем размещения в отдельных изоляторах с отрицательным давлением, таким образом, чтобы для каждой группы цыплят от группы кур-производителей в зависимости от введения был один изолятор, содержащий от 24 до 30 цыплят. Корма и вода были доступны без ограничений.
Заражение инокуляцией проводили в день размещения: для каждого изолятора использовали один тип инфицирующего вируса, в результате чего половина цыплят была инфицирована пероральным путем, а другая половина цыплят была инфицирована внутримышечным путем. У цыплят брали кровь для забора образцов на 3 или на 10 дней после инокуляции.
Доза инокуляции при заражении составляла 0,1 мл, в количестве 4,5 log 10 TCID50/на цыпленка, для каждого из четырех проанализированных инфицирующих вирусов, и эту дозу вводили внутримышечно (в/м). Готовили свежие разведения вируса-инокулята в пределах 1 часа перед введением, и сохраняли их на льду до момента введения. Оставшийся инокулят использовали для обратного титрования, которое проводилось для подтверждения дозы введенного инокулята.
Квалифицированный персонал проводил ежедневное наблюдение всех цыплят в ходе всего эксперимента с целью выявления клинических признаков болезни или других нарушений. Животные с признаками боли или дискомфорта подвергались эвтаназии и патологоанатомическому исследованию.
7.2. Анализы образцов
От кур-производителей образцы крови брали через 2 и 4 недели после вакцинации, а также за 1 неделю перед вакцинацией (день 0). Образцы крови от потомства забирали в начале эксперимента и на 3 или 10 день после инокуляции.
Образцы крови доставлялись в лабораторию при температуре окружающей среды. После свертывания крови при комнатной температуре собирали сыворотку. Для анализов у потомства половину сыворотки хранили при -70 °C для изоляции вируса. Остальные пробы сыворотки инактивировали нагреванием в течение 30 минут при 56 °С, а затем хранили при -20 °С до использования.
Обнаружение антител против реовируса птиц в сыворотке крови проводили с использованием антител IDEXX REO Elisa, в соответствии с инструкциями изготовителя.
Достоверность экспериментов определяли на основании отсутствия у кур-производителей антител против реовируса птиц в образцах, полученных в день 0, и в образцах отрицательного контроля.
У потомства от вакцинированных кур-несушек выявлен MDA+ ответ против реовируса птиц, в зависимости от лечения кур-производителей.
Сыворотку для повторного выделения вируса получали после свертывания образца крови, и замораживали ее -70 °С без дополнительной обработки. При анализе этих образцов CEL-клетки высевали в 6- луночные планшеты для тканевых культур, по 2 мл на лунку с концентрацией 1×106 клеток/мл, в стандартной культуральной среде с 5% FCS и антибиотиками. Проводили инкубацию в течение ночи до образования монослоя. На следующий день культуральный супернатант удаляли и заменяли на 4 мл стандартной среды без FCS. В лунки инокулировали 40 мкл тестируемой сыворотки и инкубировали в течение 5 дней. Затем 100 мкл супернатанта из лунки высевали в лунки нового 6-луночного планшета с CEL-клеточным монослоем, и инкубировали дополнительно в течение 5 дней. После этого специфический CPE реовируса птиц оценивали с помощью световой микроскопии. Поскольку отрицательные образцы оставались отрицательными даже после третьего пассажа, в качестве стандарта применяли два пассажа.
7.3. Результаты экспериментов с вакцинацией и заражением
7.3.1. Контроль
Поскольку оценки во всех положительных и отрицательных контрольных образцах соответствовали предположениям, эксперимент считается достоверным.
7.3.2. Способ оценки результатов
Для оценки результатов экспериментов по вакцинации кур-производителей и заражения потомства провели анализы и сравнения множества образцов, собранных в ходе эксперимента. Сыворотка была получена и проанализирована на наличие антител и повторное выделение вируса. В отношении серологических данных было выявлено, что период измерения от 3 до 10 дня не является достаточно продолжительным для получения четких положительных результатов. Положительный ответ в отношении повторного выделения вируса из сыворотки является показателем активной виремии реовируса птиц, и было установлено, что повторное выделение вируса из сыворотки, собранной в течение 3 дней после внутримышечной инокуляции, дает четкую картину эффекта различных экспериментальных введений. Таким образом, можно определять, какая вакцинация кур-производителей может уменьшить инфицирование птичьим реовирусом при вирусном заражении потомства.
В группе введения, получившей внутримышечное заражение, сыворотку собирали на 3 день после инокуляции, и сыворотка от 5 цыплят (в одной группе только 4) из каждой группы подходила для повторного выделения вируса. В качестве порогового значения, учитывалось, что в группах с 3 или больше животными с положительным ответом на повторное выделение вируса в сыворотке, взятой на на 3 день п/и, не было показано снижение инфицирования при заражении вирусом; положительный ответ у 2 животных считался сомнительным результатом; и ноль или 1 положительный ответ рассматривались как показатель снижения инфицирования. Результаты приведены в таблице 5, где показано наличие (ДА) или отсутствие (НЕТ) снижения инфицирования у потомства при введении штамма реовируса птиц, при том, что такое снижение было индуцировано разными вакцинациями кур-производителей. В скобках указано основание для такого вывода, то есть общее количество протестированных цыплят, у которых образец сыворотки, взятой на 3 день после инокуляции, был положительным на реовирус птиц, что установлено по обнаружению CPE после двух пассажей на CEL-клетках.
7.3.3. Обсуждение результатов
Как представлено в таблице 5, у всех цыплят, происходящих от ложно вакцинированных родителей (вакцинация тестируемой группы 4), можно повторно выделить реовирус птиц из сыворотки, взятой на 3-й день после инокуляции, и это наблюдается для всех введенных инфицирующих вирусов. Это свидетельствует о том, что инфицирующий вирус беспрепятственно реплицируется у цыплят, и, следовательно, о том, что эти цыплята не имели защитных факторов, которые им передали (ложно вакцинированные) родители. Клинические признаки были не слишком очевидны, так как используемые в этом эксперименте куры относились к несушкам, которые менее чувствительны, чем куры более тяжелого типа, такие как бройлеры. Тем не менее, наблюдались явные различия в эффективности вакцинации.
Куры-производители в тестируемой группе 5 получали одну вакцинацию введением вакцины, содержащей антигенный материал из двух штаммов "классического" реовируса птиц: штаммов 1733 и 2408, чтобы имитировать вакцину обширной генотипической группы 1. Эта вакцина индуцировала у потомства значительное снижение инфицирования при заражении птичьим реовирусом, принадлежащим к генотипическим группам 1 или 2, согласно изобретению. Вместе с тем, не выявлено какого-либо снижения инфицирования, индуцированного против инфицирующего реовируса птиц из генотипических групп 3 или 4.
Примечательно, что куры-производители в тестируемой группе 6 не передавали своему потомству защиту, которая была шире, чем любая защита, которая уже была достигнута с антигенным материалом генотипической группы 1, используемым для вакцинации тестируемой группы 5. Это происходит несмотря на то, что вакцина, используемая для группы 6, имела дополнительный антигенный материал реовируса птиц из штамма ERS (ERS принадлежит к генотипической группе 5, согласно изобретению). Таким образом, показано, что, по-видимому, не происходит автоматического расширения защитного действия, обусловленного применением вакцин, содержащих антигенный материал реовируса птиц от более чем одной генотипической группы.
Вакцины, используемые для тестирования групп 1 или 2, содержали антигенный материал реовируса птиц или из генотипической группы 1 или из группы 4, соответственно. Родители этих тестируемых групп обеспечивали полную защиту своего потомства от репликации инфицирующего реовируса птиц, который относился к тому же генотипу, что и вакцинный штамм. Однако не наблюдалось индукции защиты широкого спектра или гетерологичной защиты, поскольку эти вакцины не уменьшают инфицирование птичьим реовирусом из генотипической группы, которая отличается от их собственной генотипической группы.
Тем не менее, было к удивлению обнаружено, что сильный синергический эффект возникает при комбинации антигенного материала реовируса птиц из генотипических групп 1 и 4: родители, получавшие в тестируемой группе 3 вакцину, которая представляла собой комбинацию антигенного материала из генотипических групп 1 и 4 реовируса птиц (согласно изобретению), действительно обеспечивали для своего потомства защиту широкого спектра действия. У цыплят от таких кур-производителей было можно значительно уменьшить инфицирование всеми проанализированными штаммами реовируса птиц при вирусном заражении, как гомологичными, так и гетерологичными по отношении к применяемой к вакцине, и после однократной вакцинации.
Таблицы
Таблица 1: Перечень полевых прорывных изолятов реовируса птиц, упоминаемых в разделе примеров
Таблица 2: Описание последовательностей, представленных в перечне последовательностей
Таблица 3: Список реовирусов птиц предшествующего уровня техники, указанных в примерах
Таблица 4: Попарные множественные выравнивания последовательностей аминокислот белка сигма-С реовируса птиц.
Таблица 5: Результаты вакцинации - эксперименты с заражением
н.в.=не выполнялось
ПЕРЕВОД ЧЕРТЕЖЕЙ
Фигуры 1-6:
Показаны филогенетические деревья выравнивания аминокислотных последовательностей белков сигма-С от репрезентативных реовирусов птиц, анализ и сравнение которых приведены в разделе примеров, для всех генотипических групп и подгрупп указанных вирусов. Филогенетические деревья были созданы с помощью программы MEGA6, при этом вначале вычисляли оценки попарного выравнивания, а затем создавали изображения некорневых деревьев способом объединения соседей (Saitou N. & Nei M., 1987, Mol. Biol. and Evol., том 4, стр. 406-425). На масштабной линейке показано относительное генетическое расстояние.
Фигура 1: Генотипическая подгруппа 1 A
Фигура 2: Генотипическая подгруппа 1 B
Фигура 3: Генотипическая группа 2
Фигура 4: Генотипическая группа 3
Фигура 5: Генотипическая группа 4
Фигура 6: Генотипическая группа 5
Реферат
Изобретение относится к области биотехнологии. Изобретение представляет собой вакцину широкого спектра действия против реовируса птиц, которая эффективна у целевых птиц для снижения инфицирования реовирусом птиц. Вакцина содержит антигенный материал, полученный из реовируса птиц двух генотипических групп: 1 и 4, согласно изобретению. Эта вакцина эффективна против всех реовирусов птиц, гомологичных или гетерологичных по отношению к вакцине, включая вирулентные прорывные штаммы последнего времени. 7 н. и 2 з.п. ф-лы, 6 ил., 5 табл.

Комментарии