Средство для профилактики вирусных инфекций - RU2682320C1
Код документа: RU2682320C1
Описание
Изобретение относится к медицине и ветеринарии, а более конкретно - к фармакологии, и может использоваться для профилактики вирусных инфекций, вызванных РНК-содержащими вирусами, имеющими липидную оболочку, в частности, гриппа, трансмиссивного гастроэнтерита свиней и других вирусных инфекций. Изобретение расширяет арсенал средств заявленного назначения.
Наиболее распространенными вирусными инфекциями у людей являются грипп и простуда. Каждый год приблизительно 10-20% населения земного шара заболевают гриппом, а простуда - наиболее часто возникающая инфекция у людей.
Существует множество неспецифических препаратов для профилактики вирусных инфекций, например, гриппферон, арбидол, ацикловир. Наряду с широко применяемыми неспецифическими профилактическими препаратами разрабатываются и новые - на основе растений (патенты РФ №2505306, 2393871), мицелия грибов (патент РФ №2522880), дипептида (патент РФ №2429875) и пр.
В частности, известно средство для профилактики вирусных инфекций, (см. патент РФ №2505306 по кл. МПК А61К 36/185, опубл. 27.01.2014), содержащее водный экстракт листьев и ветвей растений рода Ribes. Средство предназначено для использования при вирусных инфекциях, включая простуду с первичной инфекцией, вызываемой риновирусами, аденовирусами и/или коронавирусами, грипп, вирусную инфекцию, вызванную ретровирусами.
Поскольку средство представляет собой растительный экстракт, то оно является многокомпонентной системой, которая может проявлять не только положительные действия на вирусы, но и изменять резистентность организма человека и животных.
Другую группу профилактических препаратов составляют специфические средства (вакцины).
Общим свойством всех существующих вакцин является то, что они действуют в отношении конкретного серотипа возбудителя и его антигенного состава.
В частности, известно средство для профилактики вирусных инфекций на основе холодоадаптированного штамма вируса гриппа А/Краснодар/101/59/35 (H2N2) (см. Патент РФ №2354695 по кл. МПК C12N 7/00, опубл. 10.05.2009), содержащее данный штамм в десятикратном разведении, 1% раствор глютамата хитозония и 0,9% раствор хлорида натрия.
Однако, средство действует только в отношении определенного вида вируса (H2N2). Причем, действие данной живой вакцины направлено не на сам вирус, а на усиление иммунного ответа организма.
Наиболее близким к заявляемому является средство для профилактики вирусных инфекций, в частности трансмиссивного гастроэнтерита свиней (см. патент РФ №2463073 по кл. МПК А61К 39/225 опубл. 10.10.2012), содержащее вирусный материал из штамма «ВН-96» вируса трансмиссивного гастроэнтерита свиней в титре 7,0-7,2 lg ТЦД50/мл и физиологический раствор в определенных процентных соотношениях.
Однако, данное средство направлено на профилактику трансмиссивного гастроэнтерита только определенного серотипа возбудителя и неэффективно при иммунодефицитных состояниях животных.
Таким образом, приведенные аналоги не решают проблему внутриклеточного подавления вируса, они только способствуют коррекции иммунитета. Создание противовирусных средств является далеко не решенной задачей. Поэтому поиск новых средств защиты от вирусных инфекций весьма актуален.
Технической проблемой заявляемого изобретения является расширение спектра противовирусных профилактических препаратов и формирование новых подходов к проблеме профилактики вирусных заболеваний человека, особенно гриппа, за счет внутриклеточного подавления вируса.
Достигаемый при этом технический результат заключается в создании простого и недорогого средства для профилактики вирусных заболеваний человека и животных, вызываемых РНК-содержащими вирусами с липидной оболочкой, позволяющего быстро и с минимальными затратами (путем однократного или двукратного введения) проводить профилактику вирусных заболеваний независимо от серотипов вируса (разновидности возбудителя) и его антигенного состава за счет активизации завершенного фагоцитоза вирусов без повышения титра специфических вируснейтрализующих антител.
Для достижения заявляемого результата предложено средство для профилактики вирусных инфекций, содержащее вирусный материал из РНК-содержащих вирусов, имеющих липидную оболочку, и стабилизированный коллоидный селен.
Соотношение весовых частей вирусного материала к стабилизированному коллоидному селену составляет 1:1.
Вирусный материал из РНК-содержащих вирусов имеет титры 6,0-8,0 lg ТЦД50/мл.
Для получения коллоидного селена с размерами частиц от 10 до 15 нм коллоидный селен стабилизируют полиэтиленгликолем, а коллоидного селена с размерами частиц от 20 до 40 нм - цистеином.
Стабилизированный коллоидный селен имеет концентрацию 6,0-6,2%.
В известных авторам источниках патентной и научно-технической документации не описано средства для профилактики вирусных инфекций на основе вирусного материала и стабилизированного коллоидного селена, взятых в равных частях, позволяющего проводить профилактику вирусных заболеваний независимо от разновидности возбудителя и его антигенного состава за счет активизации завершенного фагоцитоза и, как следствие, внутриклеточного подавления вируса.
По мнению авторов, селен с размерами частиц 10-40 нм способен поглощаться фагоцитирующими клетками. Коллоидные частицы селена защищают липидную оболочку вируса от воздействия ферментов клеток макроорганизма. Фагоцит захватывает образованные комплексы селен-вирус и подвергает их «перевариванию» благодаря создавшемуся объему для захвата (фагоцитирования) частиц вирусов, ставших соизмеримыми с бактериями. Это позволяет доставить все структурные элементы вируса (липиды, белки, РНК) в фагоцитирующие клетки, что способствует полному иммунному ответу и развитию «памяти» фагоцитов для дальнейшей защиты макроорганизма от вирусных инфекций.
Известно, что селен - это естественный метаболит (см., например, http://ru.wikipedia.org/wiki; http://www.zdorove-plus.ru/page315.html; http://www.eliform.com/minersl-selenium.html), участвующий в биохимических процессах организма. Как естественный метаболит он не накапливается в клетках, а используется как активизатор обменных процессов в фагоцитах.
Именно коллоидный селен с размерами частиц 10-40 нм в комплексе с вирусными частицами является уникальным стимулятором иммунной защиты макроорганизма на уровне специфического завершенного фагоцитоза.
Таким образом, авторами впервые установлено неочевидное свойство, заключающееся в участии фагоцитов в иммунной защите от вирусных инфекций. Заявляемое изобретение основано на новом механизме иммунной защиты, обусловленном участием фагоцитов в иммунном процессе при вирусных инфекциях, отсутствием увеличения количества антител к возбудителям и наличием «памяти» в фагоцитирующих клетках. То есть защита есть, а антител нет или они образуются в минимальных количествах.
Сказанное позволяет сделать вывод о наличии в заявляемом решении критерия «изобретательский уровень».
Коллоидный селен представляет собой наноразмерные частички селена в растворе (см, например, http://testvich.ru/entsiklopediya/kolloidnyiy-selen-zoloto). Коллоидный селен получают восстановлением разбавленных водных растворов растворимого селена оксидом серы (IV), гидразингидратом, декстрозой, трихлоридом титана или пропусканием электрическою тока через раствор селенистой кислоты (анод - платиновый, катод - покрыт селеном), а также другими способами. Цвет коллоидного селена зависит от условий осаждения и изменяется от фиолетового до красного; плотность такая же, как и порошкообразного селена (см., например, http://ibrain.kz/himiya-svoystva-elementov/selen).
Хорошо известно (см., например, http://texnosila.narod.ru/Foton/nanoteh/Exampl KOAKR3.html), что коллоидные растворы обладают нестабильными свойствами. Нестабильные свойства определяются многими факторами - температурой, плотностью раствора, материалом, количеством и размером частиц, наличием таких внешних воздействий, как вибрация основания, присутствие электромагнитных полей, излучений. Все эти факторы существенно влияют на равновесное состояние коллоидной среды.
В заявляемом изобретении использовали в качестве стабилизирующих факторов добавление к коллоидному раствору селена либо полиэтиленгликоля (при размере частиц селена в растворе 10-15 нм) либо цистеина (при размере частиц селена 20-40 нм), либо белка сыворотки молока (при размере частиц 100 нм и выше). При этом, выбор того или иного стабилизатора был осуществлен экспериментальным путем, зависел от технологии приготовления препарата.
Вирусный материал был получен при культивировании штаммов: вируса трансмиссивного гастроэнтерита и гриппа.
Штамм вируса трансмиссивного гастроэнтерита «ВН-96» - депонирован во Всероссийском государственном научно-исследовательском институте контроля, стандартизации и сертификации ветеринарных препаратов и кормов (ВГНКИ) (справка о депонировании №1103/19 от 27 мая 2009). Выделен в 1988 году из вакцинного штамма «РИМС» на перевиваемой культуре СПЭВ (крупнобляшечный вариант), авирулентный для свиней, титр вируса 7,0 lg ТЦД50/мл.
Штамм вируса гриппа А/Краснодар/101/3 5/59 (H2N2) зарегистрирован в коллекции депозитария НИИ вирусологии им. Д.И. Ивановского (№2439 от 09.06.2008). Предназначен в качестве штамма-донора аттенуации для получения реассортантных живых гриппозных вакцин (см. патент РФ №2354695). Штамм получен методом серийных пассажей в куриных эмбрионах и культуре клеток MDCK при пониженной температуре с последующим 3-х кратным клонированием методом бляшек в культуре клеток MDCK, что обеспечивает генетическую гомогенность штамма.
Средство для профилактики вирусных инфекций представляет собой раствор красно-коричневого цвета, без запаха.
Для получения вирусного материала берут исходный штамм вируса (в частности, штамм вируса трансмиссивного гастроэнтерита «ВН-96», штамм вируса гриппа А/Краснодар/101/35/59 (H2N2), с определенным титром и доводят его до титра 6,0-8,0 lg ТЦД50/мл.
При этом, для профилактики гриппа предпочтителен вирусный материал с титром 8,0 lg ТЦД50/мл, профилактики трансмиссивного гастроэнтерита - с титром 7,0 lg ТЦД50/мл.
Вирусный материал хранят при температуре минус 18-20°С.
Изобретение иллюстрируется следующими примерами.
Пример №1. Пример приготовления коллоидного селена с размером частиц 10-15 нм.
Берут 100 мг селенита натрия, содержащего 40 мг селена и растворяют его в 10 мл дистиллированной воды.
Берут 0,52 г солянокислого гидрозина и растворяют в 5 мл дистиллированной воды.
В коническую колбу вносят 10 мл селенита натрия и сразу же приливают 5 мл гидрозина.
Раствор перемешивают на магнитной мешалке при 450 об/мин без нагревания до появления интенсивного окрашивания кирпично-красного цвета (выпадение в осадок аморфного селена) в течение 10 минут.
В колбу приливают 10 мл полиэтиленгликоля (ПЭГ-200) и смесь нагревают до 150°С при интенсивном перемешивании до полного испарения воды (наблюдается прекращение кипения).
После испарения воды на колбу ставят дефлегматор и поднимают температуру до 220°С на 15-30 минут. Смесь охлаждают до комнатной температуры.
Центрифугируют при 4200 об/мин в течение 20 минут.
Надосадок ставят на диализ против фосфатносолевого буфера рН 7,2.
Полученную смесь концентрируют на роторном испарителе с вакуумом при 70°С и скорости вращения 50 об./мин. (25 мл смеси концентрируют до 15 мл). Затем к полученному осадку добавляют физиологический раствор до получения концентрации коллоидного селена 0,062 мг/мл (6,2%).
Размер частиц селена, определенный с использованием электронного микроскопа LIBRA 120 (Carl Zeiss, Германия), составил 10-15 нм.
Пример №2. Пример приготовления коллоидного селена с размером частиц 20-40 нм.
К раствору 0,01М L - цистеина при постоянном перемешивании при комнатной температуре добавляют по каплям раствор 0,001М селенистой кислоты (H2SeO3) в отношении объемов 1:1.
Затем к полученному осадку добавляют физиологический раствор до получения концентрации коллоидного селена 0,061 мг/мл (6,1%).
Размер частиц селена, определенный с использованием электронного микроскопа LIBRA 120 (Carl Zeiss, Германия), составил 20-40 нм.
Пример №3. Пример приготовления коллоидного селена с размером частиц 100-140 нм. Этот коллоидный селен был использован в дальнейших экспериментах также для получения профилактического средства для доказательства эффективности достигаемого результата.
К 2 мл дистиллированной воды добавляют 0,5 мл 1М раствора солянокислого гидразина и 0,125 мл 1М селенита натрия (бурно развивается желто-оранжевая окраска). В течение 30 секунд данный раствор вносят в белок сыворотки молока.
Смесь перемешивают в течение 1 часа. После появления оранжевого окрашивания реакцию останавливают 1М раствором гидроксида натрия доведением РН до 7,62. Полученный раствор диализуют против 0,01 М фосфатно-солевого буфера, затем смесь концентрируют.
К полученному осадку добавляют физиологический раствор до получения концентрации коллоидного селена 0,060 мг/мл (6,0%).
Размер частиц селена, определенный с использованием электронного микроскопа LIBRA 120 (Carl Zeiss, Германия), составил 100-140 нм.
Полученная в примерах 1-3 концентрация коллоидного селена (6,0-6,2%) обеспечивает стабильное состояние субстанции селена с размерами частиц 10-140 нм. Экспериментально было показано, что концентрация селена менее 6,0% и более 6,2% приводит к нарушению требуемых размеров частиц селена или коагуляции селена.
Пример №4
Средство для профилактики вирусных инфекций готовят следующим образом.
Берут 1 мл вирусного материала из штамма «ВН-96» вируса трансмиссивного гастроэнтерита свиней в титре 7,0 lg ТЦД50/мл, добавляют к нему 1 мл стабилизированного коллоидного селена с размером частиц 20-40 нм, полученную смесь перемешивают.
Готовое средство для профилактики вирусных инфекций представляет собой жидкость красно-коричневого цвета.
Аналогично описанному в примере 4 готовят вирусный материал из штаммов вируса гриппа А/Краснодар/101/35/59 (H2N2).
Пример №5.
Обоснование профилактических свойств заявляемого препарата против гриппа.
В эксперименте было использовано 70 белых мышей, распределенных по 7 группам (по 10 голов в каждой), из которых 2 были контрольными и 5 - опытными группами.
В первой контрольной группе мышей ничем не иммунизировали.
Во второй контрольной группе мышей иммунизировали подкожно препаратом, содержащим 0,1 мл физиологического раствора и 0,1 мл штамма вируса гриппа А/Краснодар/101/35/59 (H2N2) - с титром 8,0 lg ТЦД50/мл. Препарат вводили дважды с интервалом 14 дней.
Во всех опытных группах препарат вводили также подкожно дважды с интервалом между введениями 14 дней.
При этом, в первой опытной группе мышей иммунизировали препаратом, содержащим 0,1 мл коллоидного селена с размером частиц 10-15 нм, стабилизированного полиэтиленгликолем (ПЭГ), и 0,1 мл вирусного материала из штамма вируса гриппа А/Краснодар/101/35/59 (H2N2) - с титром 8,0 lg ТЦД50/мл.
Во второй опытной группе мышей иммунизировали препаратом, содержащим 0,1 мл стабилизированного цистеином коллоидного селена с размером частиц 20-40 нм и 0,1 мл вирусного материала из штамма вируса гриппа А/Краснодар/101/35/59 (H2N2) - с титром 8,0 lg ТЦД50/мл.
В третьей опытной группе мышей иммунизировали препаратом, содержащим 0,1 мл стабилизированного белком сыворотки молока коллоидного селена с размером частиц 100-140 нм и 0,1 мл вирусного материала из штамма вируса гриппа А/Краснодар/101/35/59 (H2N2) - с титром 8,0 lg ТЦД50/мл.
В четвертой и пятой опытных группах мышей иммунизировали препаратом, содержащим 0,1 мл стабилизированного цистеином коллоидного селена с размером частиц 20-40 нм и 0,1 мл вирусного материала из штамма вируса гриппа А/Краснодар/101/35/59 (H2N2) - с титром 7,0 lg ТЦД50/мл (четвертая группа) и с титром 6,0 lg ТЦД50/мл (пятая группа).
Через 28 дней после первого введения препарата все группы мышей были инфицированы интраназально вирулентным штаммом А/Брисбейн/59/07 (H1N1) в дозе 2,0 lg ТЦД50/0,05 мл.
Через 72 часа после инфицирования вирулентным штаммом мыши были умерщвлены с соблюдением этических принципов обращения с лабораторными животными. У мышей были извлечены легкие и из легких была приготовлена 10% суспензия в ступках с тертым стеклом. 10-кратные разведения данной суспензии были внесены в куриные 9-дневные эмбрионы.
Через 48 часов инкубации инфицированных куриных эмбрионов при 37°С в термостате, эмбрионы помещались в холодильник при 4°С на 18-24 часа.
Затем эмбрионы вскрывались, отсасывалась аллантоисная жидкость и определялся титр вирусов в легких у каждой из групп мышей с помощью реакции гемагглютинации. Результаты представлены в таблице 1.
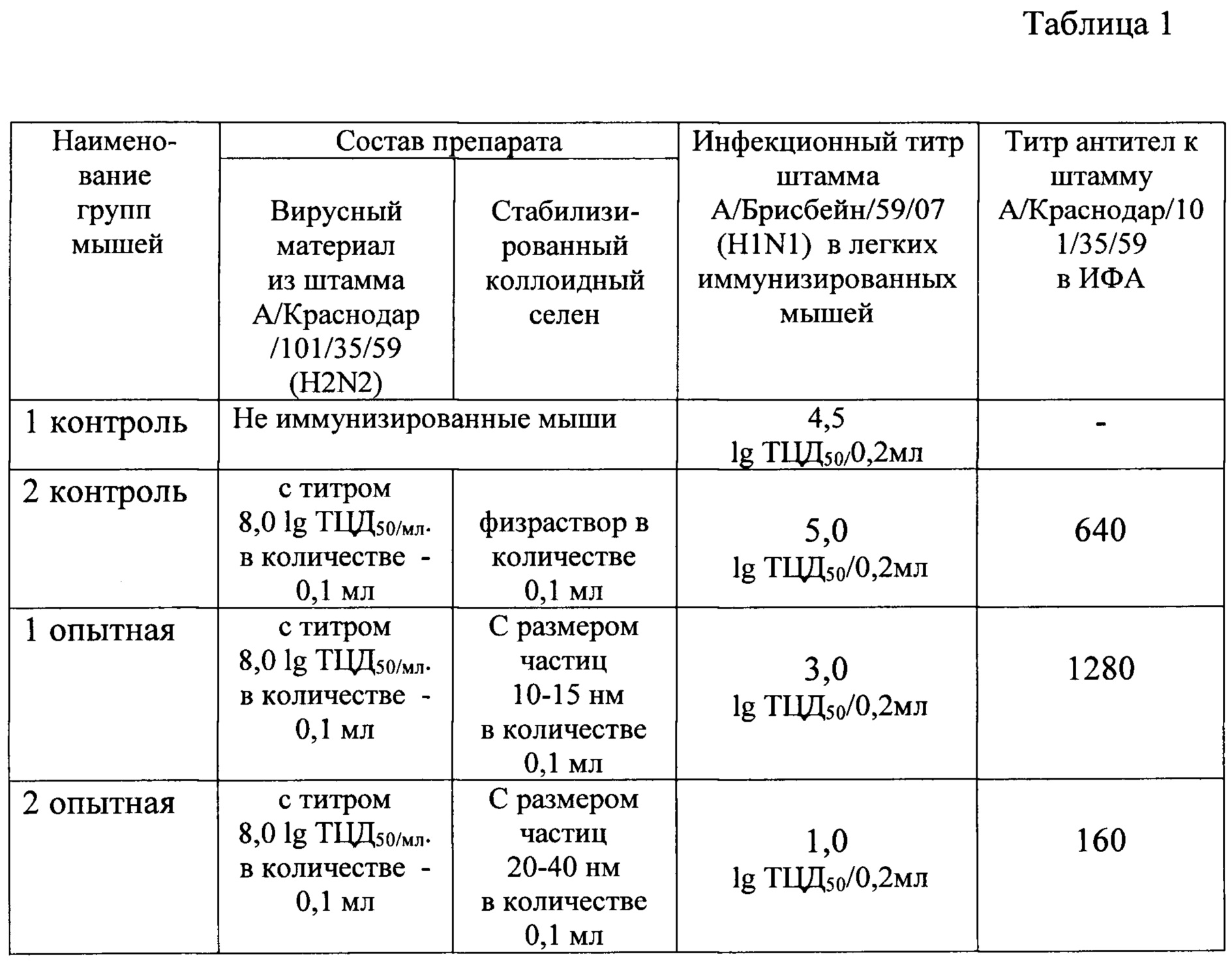
Из таблицы 1 следует, что титр вирулентного штамма А/Брисбейн/59/07 (H1N1) в легких неиммунных мышей (контроль 1) равнялся 4,5 lg ТЦД50/0,2 мл.
Титр вирулентного штамма А/Брисбейн/59/07 (H1N1) в легких мышей, иммунизированных подкожно дозой штамма вируса гриппа А/Краснодар/101/35/59 (H2N2) с титром 8,0 lg ТЦД50/мл ненамного отличался от титра в первом контроле - 5 lg ТЦД50/0,2 мл.
Однако, наблюдалось заметное снижение титра вирулентного штамма А/Брисбейн/59/07 (H1N1) в легких мышей, иммунизированных подкожно той же дозой штамма А/Краснодар/101/35/59 (H2N2) в комбинации с коллоидным селеном. При этом, при иммунизации препаратом с размером частиц 10-15 нм титр составил 3 lg ТЦД50/0,2 мл, а при иммунизации препаратом с размером частиц 20-40 нм наблюдалось тысячекратное снижение титра.
Не наблюдалось снижения инфекционного титра вирулентного штамма А/Брисбейн/59/07 (H1N1) в легких мышей, иммунизированных подкожно препаратом с размером частиц стабилизированного коллоидного селена 100 нм - 140 нм.
Исследования по использованию вирусного материала из штамма А/Краснодар/101/35/59 (H2N2) с титрами 7,0 lg ТЦД50/мл и 6,0 lg ТЦД50/мл в сочетании со стабилизированным коллоидным селеном с размерами частиц 20-40 нм показали (см. таблицу 1), что препарат с таким содержанием компонентов не дает значительного повышения титров специфических вируснейтрализующих антител (титр равен 80), но обеспечивает эффективную защиту от заражения.
Представленные в примере №5 результаты исследований по определению эффективности защиты при заражении мышей вирулентным штаммом гриппа доказывают, что наилучшая эффективность защиты обеспечивается при введении препарата, содержащего стабилизированный коллоидный селен с размерами частиц 20-40 нм и вирусный материал с титром 6,0-8,0 lg ТЦЦ50/мл.
Дальнейшие исследования по обоснованию эффективной защиты от трансмиссивного гастроэнтерита проводили с использованием препарата, содержащего стабилизированный коллоидный селен с размерами частиц 20-40 нм и вирусный материал против вируса трансмиссивного гастроэнтерита - с титром 8,0 lg ТЦД50/мл.
Поскольку в примере 5 (см. таблицу 1) было показано, что эффективность защиты при гриппе коррелирует с пониженным, а не с повышенным содержанием специфических вируснейтрализующих антител к вирусу гриппа, то оценку эффективности защиты против трансмиссивного гастроэнтерита осуществляли по наличию специфических вируснейтрализующих антител к вирусу трансмиссивного гастроэнтерита на лабораторных животных, соответственно - на мышах и морских свинках, а не путем прямого заражения.
Пример №6.
Обоснование профилактических свойств заявляемого препарата против трансмиссивного гастроэнтерита.
Для доказательства эффективности защиты было сформировано 3 группы морских свинок: по 5 животных в каждой группе.
Одна группа животных была контрольной, им вводили только физиологический раствор в дозе 0,5 мл.
Первой опытной группе животных вводили вирусный материал из штамма вируса трансмиссивного гастроэнтерита «ВН-96» с титром 7,0 lg ТЦД50/мл в сочетании с физиологическим раствором (0,25 мл вирусного материала и 0,25 мл физиологического раствора).
Второй опытной группе вводили вирусный материал из штамма вируса трансмиссивного гастроэнтерита «ВН-96»с титром 7,0 lg ТЦД50/мл мл в сочетании со стабилизированным коллоидным селеном (0,25 мл вирусного материала и 0,25 мл коллоидного селена) с размером частиц 20-40 нм, взятые в соотношении 1:1.
Через 28 дней после введения препаратов определяли титр специфических вируснейтрализующих антител в реакции нейтрализации. Результат представлен в таблице №2.
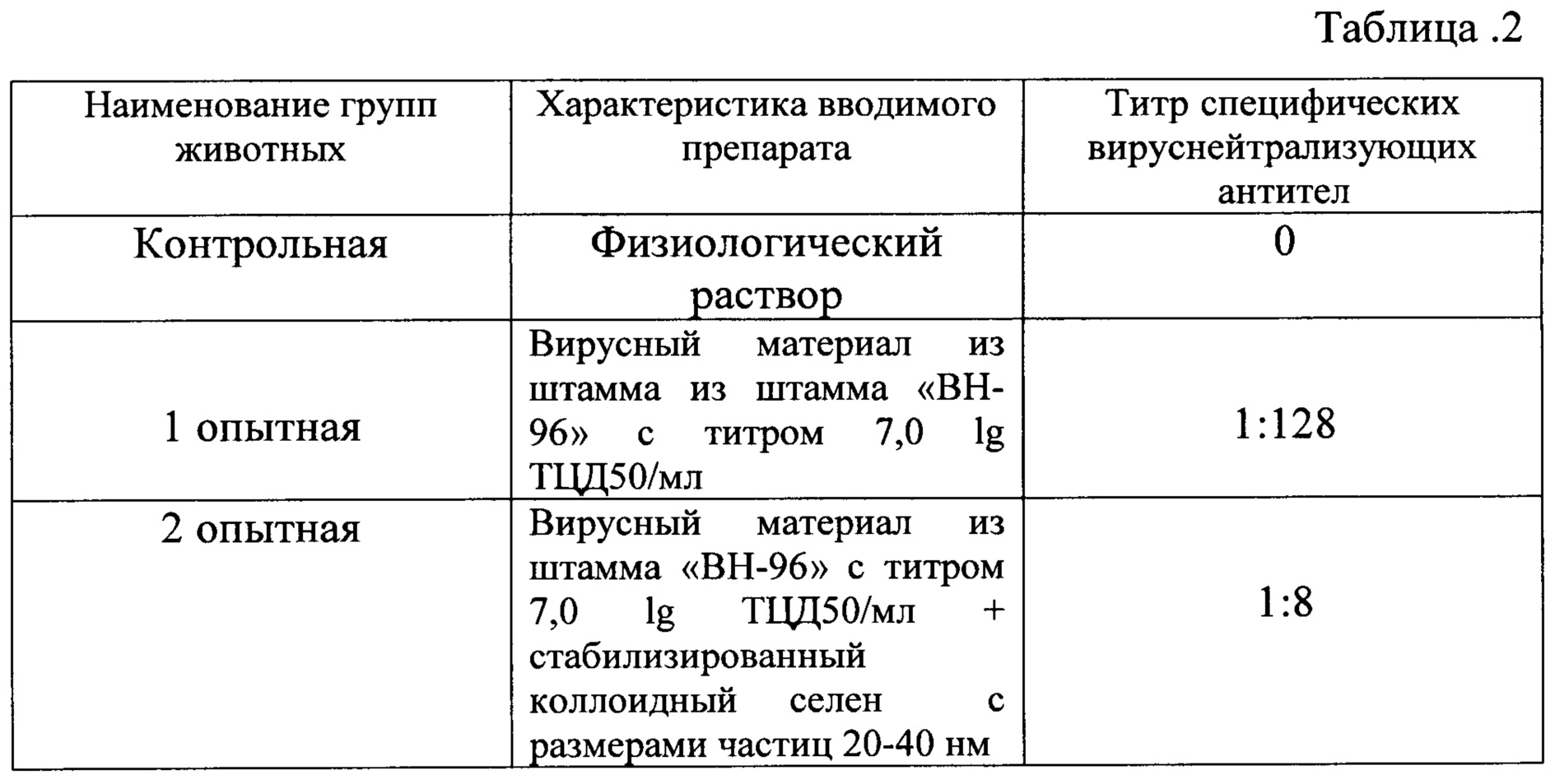
Из таблицы 2 следует, что введение препарата, содержащего вирусный материал из штамма «ВН-96» с титром 7,0 lg ТЦД50/мл в сочетании со стабилизированным коллоидным селеном с размерами частиц 20-40 нм обеспечивает снижение титра специфических вируснейтрализующих антител с 1:128 до 1:8, т.е. в 16 раз.
Таким образом, заявляемое средство для профилактики вирусных заболеваний человека и животных, вызываемых РНК-содержащими вирусами с липидной оболочкой, позволяет быстро и с минимальными затратами (путем однократного или двукратного введения) проводить профилактику вирусных заболеваний независимо от серотипов вируса (разновидности возбудителя) и его антигенного состава за счет активизации завершенного фагоцитоза вирусов без повышения титра специфических вируснейтрализующих антител.
Заявляемое средство расширяет спектр противовирусных профилактических препаратов и позволяет решить проблему профилактики вирусных заболеваний человека, особенно гриппа, за счет внутриклеточного подавления вируса.
Реферат
Изобретение относится к медицине и ветеринарии, в частности к средству для профилактики вирусных инфекций, содержащему вирусный материал из РНК-содержащих вирусов, имеющих липидную оболочку. Осуществление изобретения позволяет расширить арсенал противовирусных профилактических препаратов. 6 з.п. ф-лы, 2 табл., 6 пр.

Комментарии