Аттенуированные вирусы с минус-цепью с измененной антагонистической в отношении интерферона активностью для применения в качестве вакцин и фармацевтических веществ - RU2236252C2
Код документа: RU2236252C2
Чертежи

Описание
Исследование, отраженное в данной заявке, поддерживалось, частично, грантом от Национального Института здравоохранения, и правительство может иметь определенные права в отношении данного изобретения.
Данная заявка является частичным продолжением заявки с регистрационным номером 60/117 683, поданной 29 января 1999 года; заявки с регистрационным номером 60/108 832, поданной 18 ноября 1998 года, и заявки с регистрационным номером 60/089 103, поданной 12 июня 1998 года, каждая из которых включена здесь в качестве ссылки в полном виде.
1. ВВЕДЕНИЕ
Данное изобретение относится в общем к аттенуированным РНК-вирусам с минус-цепью, имеющим нарушенную способность противодействовать клеточному интерферон-(ИФН)-ответу, и применению таких аттенуированных вирусов в вакцинных и фармацевтических композициях. Данное изобретение относится также к развитию и использованию ИФН-недостаточных систем для отбора, идентификации и размножения таких аттенуированных вирусов.
В конкретном варианте, данное изобретение относится к аттенуированным вирусам гриппа, имеющим модификации, относящиеся к гену NS1, которые уменьшают способность продукта гена NS1 противодействовать клеточному ИФН-ответу. Эти мутантные вирусы реплицируются in vivo, но демонстрируют уменьшенную патогенность и, следовательно, хорошо пригодны для применения в живых вирусных вакцинах и фармацевтических композициях.
2. ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
2.1 ВИРУС ГРИППА
Семейства вирусов, содержащие оболочку и одноцепочечную РНК негативного (негативно-смыслового) генома, классифицируются на группы, имеющие несегментированные геномы (Paramyxoviridae, Rhabdoviridae, Filoviridae и вирус болезни Borna), или группы, имеющие сегментированные геномы (Orthomyxoviridae, Bunyaviridae и Arenaviridae). Семейство Orthomyxoviridae, описанное подробно ниже и используемое здесь в примерах, включает в себя вирусы гриппа, вирусы типов А, В и С, а также вирусы Thogoto и Dhori и вирус инфекционной анемии лосося.
Вирионы гриппа состоят из внутреннего рибонуклеопротеинового кора (спирального нуклеокапсида), содержащего геном в виде одноцепочечной РНК, и наружной липопротеиновой оболочки, выстланной внутри белком матрикса (M1). Сегментированный геном вируса гриппа А состоит из 8 молекул (семь для гриппа С) линейных, имеющих отрицательную полярность, одноцепочечных РНК, которые кодируют десять полипептидов, в том числе: белки РНК-зависимой РНК-полимеразы (РВ2, РВ1 и РА) и нуклеопротеин (NP), которые образуют нуклеокапсид; белки мембраны матрикса (M1, M2); два поверхностных гликопротеина, которые выступают из липидсодержащей оболочки: гемагглютинин (НА) и нейраминидазу (NA); неструктурный белок (NS1) и белок ядерного транспорта (NEP). Транскрипция и репликация этого генома имеет место в ядре, а сборка происходит через почкование на плазматической мембране. Эти вирусы могут рекомбинировать гены во время смешанных инфекций.
Вирусы гриппа адсорбируются через НА к сиалилолигосахаридам в гликопротеинах и гликолипидах клеточной мембраны. После эндоцитоза вириона в молекуле НА происходит конформационное изменение в клеточной эндосоме, которое облегчает слияние мембран, запуская декапсидацию вируса. Нуклеокапсид мигрирует в ядро, где транскрибируется вирусная мРНК. Вирусная мРНК транскрибируется по уникальному механизму, в котором вирусная эндонуклеаза отщепляет кэпированный 5'-конец от клеточных гетерологичных мРНК, который затем служит в качестве праймеров для транскрипции вирусных РНК-матриц вирусной транскриптазой. Транскрипты терминируются в сайтах, расположенных на расстоянии 15-22 оснований от концов их матриц, где олиго(U)-последовательности действуют в качестве сигналов для присоединения поли(А)-трактов. Из полученных таким образом восьми вирусных РНК-молекул шесть являются моноцистронными матрицами, которые транслируются непосредственно в белки, представляющие НА, NA, NP и белки вирусной полимеразы, РВ2, РВ1 и РА. Два других транскрипта подвергаются сплайсингу, причем каждый дает две мРНК, которые транслируются в различных рамках считывания с образованием M1, M2, NS1 и NEP. Другими словами, восемь вирусных сегментов РНК кодируют десять белков: девять структурных и один неструктурный. Гены вируса гриппа и их белковые продукты суммированы в таблице 1.
Геном вируса гриппа А содержит восемь сегментов одноцепочечной РНК отрицательной полярности, кодирующих один неструктурный и девять структурных белков. Неструктурный белок NS1 находится в избытке в инфицированных вирусом гриппа клетках, но не детектировался в вирионах. NS1 является фосфопротеином, обнаруживаемым в ядре в начале инфекции, а также в цитоплазме на более поздних стадиях вирусного цикла (King et al., 1975, Virology 64: 378). Исследования с чувствительными к температуре (ts) мутантами гриппа, несущими повреждения в гене NS, предполагают, что белок NS1 является транскрипционным и посттранскрипционным регулятором механизмов, при помощи которых этот вирус способен ингибировать экспрессию генов клетки-хозяина и стимулировать синтез вирусных белков. Подобно многим другим белкам, которые регулируют посттранскрипционные процессы, белок NS1 взаимодействует со специфическими последовательностями и структурами РНК. Сообщалось, что белок NS1 связывается с различными типами РНК, в том числе: vPHK, поли-А, snPHK U6, 5'-нетранслируемым районом как вирусных мРНК, так и dsPHK (Qiu et al., 1995, RNA 1: 304; Qiu et al., 1994, J.Virol. 68: 2425; Hatada Fukuda 1992, J.Gen. Virol. 73:3325-9. Экспрессия белка NS1 из кДНК в трансфицированных клетках была связана с несколькими эффектами: ингибированием ядерно-цитоплазматического транспорта мРНК, ингибированием сплайсинга пре-мРНК, ингибированием полиаденилирования мРНК хозяина и стимуляцией трансляции вирусной мРНК (Fortes et al., 1994, EMBO J. 13: 704; Enami, et al., 1994, J. Virol. 68: 1432; de la Luna, et al., 1995, J. Virol. 69:2427; Lu, et al., 1994, Genes Dev. 8: 1817; Park, et al., 1995, J. Biol. Chem. 270, 28433; Nemeroff et al., 1998, Mol. Cell. 1: 1991; Chen, et al., 1994, EMBO J. 18: 2273-83).
2.2 АТТЕНУИРОВАННЫЕ ВИРУСЫ
Инактивированные вирусные вакцины получают “уничтожением” вирусного патогена, например, нагреванием или обработкой формалином, так чтобы он не был способен к репликации. Инактивированные вакцины имеют ограниченную применимость, так как они не обеспечивают долгосрочного иммунитета и, следовательно, дают ограниченную защиту. Альтернативный подход к получению вирусных вакцин включает в себя применение аттенуированных живых вирусных вакцин.
Аттенуированные вирусы способны к репликации, но не являются патогенными и, следовательно, обеспечивают долгосрочный иммунитет и дают большую защиту. Однако общепринятые способы получения аттенуированных вирусов включают в себя случайное выделение мутантов с измененным спектром литического действия (круга хозяев), многие из которых является чувствительными к температуре; например, вирус пассируют через неприродных хозяев и отбирают потомство вирусов, которое является иммуногенным, но еще не патогенным.
Общепринятым субстратом для выделения и выращивания вирусов гриппа для целей получения вакцин являются яйца кур с развивающимися эмбрионами. Вирусы гриппа обычно выращивают в течение 2-4 дней при 37°С в 10-11-дневных яйцах. Хотя большая часть первичных изолятов вирусов гриппа А и В человека растет лучше в амниотическом мешке эмбрионов, после 2-3 пассажей вирусы становятся адаптированными к росту в клетках аллантоисной полости, которая доступна снаружи яйца (Murphy B.R. and R.G.Webster, 1996. Orthomyxoviruses, p.1397-1445. In Fields Virology, Lippincott-Raven P.A.).
Технология рекомбинантных ДНК и способы генной инженерии, теоретически, могли бы предоставить превосходный подход к получению аттенуированного вируса, так как могли бы быть целенаправленно сконструированы специфические мутации в вирусном геноме. Однако генетические изменения, требующиеся для аттенуации вирусов, не являются известными или предсказуемыми. Обычно, попытки использования технологии рекомбинантных ДНК к конструированию вирусных вакцин были в основном направлены на получение субъединичных вакцин, которые содержат только белковые субъединицы патогена, участвующие в иммунном ответе, экспрессируемые в рекомбинантных вирусных векторах, таких как вирус коровьей оспы или бакуловирус. Не так давно, способы рекомбинантных ДНК были использованы в попытке получить делеционные мутанты герпесвируса или полиовирусы, которые имитируют аттенуированные вирусы, обнаруживаемые в природе, или известные мутанты с измененным спектром литического действия (т.е. мутанты, расширяющие круг хозяев). До 1990 года РНК-вирусы с минус-цепью не поддавались сайт-специфическим манипуляциям вообще и, следовательно, не могли быть генетически сконструированными.
Аттенуированные живые вирусы гриппа, полученные до сих пор, не могут быть способными к супрессии интерферонового ответа в хозяине, в котором они реплицируются. Таким образом, хотя эти вирусы являются выгодными, поскольку они являются иммуногенными, но не патогенными, их трудно размножать в общепринятых субстратах для целей приготовления вакцин. Кроме того, аттенуированные вирусы могут обладать свойствами вирулентности, которые являются такими слабыми, что не позволят хозяину обеспечить иммунный ответ, достаточный для удовлетворения последующих заражений.
3. СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к аттенуированным РНК-вирусам с минус-цепью, имеющим ослабленную способность противодействовать клеточному ИФН-ответу, и применению таких вирусов в вакцинных и фармацевтических композициях. Эти мутантные вирусы с нарушенной антагонистической в отношении ИФН активностью являются аттенуированными - они являются инфекционными, могут реплицироваться in vivo с обеспечением субклинических уровней инфекции и не являются патогенными. Таким образом, они являются идеальными кандидатами для живых вирусных вакцин. Кроме того, аттенуированные вирусы могут индуцировать сильный ИФН-ответ, который имеет другие биологические последствия in vivo, обеспечивая защиту против последующих инфекционных заболеваний, и/или индуцируя противоопухолевые ответные реакции. Таким образом, аттенуированные вирусы могут быть использованы фармацевтически, для предупреждения или лечения других инфекционных заболеваний, рака у индивидуумов с высоким риском в отношении рака и/или заболеваний, излечиваемых посредством ИФН.
РНК-вирусы с минус-цепью, используемые в соответствии с данным изобретением, включают в себя как сегментированные, так и несегментированные вирусы; предпочтительные варианты включают в себя, но не ограничиваются ими, вирус гриппа, респираторно-синцитиальный вирус (RSV), вирус ньюкаслской болезни (NDV), вирус везикулярного стоматита (VSV) и вирус парагриппа (PIV). Вирусы, используемые в данном изобретении, могут быть выбраны из природно встречающихся штаммов, вариантов или мутантов; мутагенизированных вирусов (например, генерируемых экспонированием мутагенами, повторяемыми пассированиями и/или перепрививками в непермиссивных хозяевах); вирусных рекомбинантов (реассортантов) (в случае сегментированных вирусных геномов) и/или генетически сконструированных вирусов (например, с использованием способов "обратной генетики"), имеющих желательный фенотип, т.е. нарушенную способность противодействовать клеточному ИФН-ответу. Мутант или генетически сконструированный вирус может быть выбран на основе различающегося роста в ИФН-недостаточных системах в сравнении с ИФН-компетентными системами. Например, могут быть выбраны вирусы, которые растут в ИФН-недостаточной системе, но не в ИФН-компетентной системе (или растут хуже в ИФН-компетентной системе).
Аттенуированный вирус, выбранный таким образом, может быть сам использован в качестве активного ингредиента в вакцинных или фармацевтических композициях. Альтернативно, аттенуированный вирус может быть использован в качестве вектора или "каркаса" рекомбинантно полученных вакцин. Для этой цели, способ "обратной генетики" может быть использован для конструирования мутаций или введения чужеродных эпитопов в аттенуированный вирус, который может служить в качестве "родительского" штамма. Таким путем, могут быть сконструированы вакцины для иммунизации против вариантов штаммов или, альтернативно, против полностью отличающихся инфекционных агентов или антигенов заболеваний. Например, может быть сконструирован аттенуированный вирус для экспрессии нейтрализующих эпитопов других предварительно выбранных штаммов. Альтернативно, эпитопы вирусов, иных, чем РНК-вирусы с минус-цепью, могут быть встроены в этот аттенуированный мутантный вирус (например, gp160, gp120 или gp41 ВИЧ). Альтернативно, в этот вирус могут быть встроены эпитопы невирусных инфекционных патогенов (например, паразитов, бактерий, гибков). Еще в одной альтернативе, могут быть приготовлены противораковые вакцины, например, встраиванием опухолевых антигенов в аттенуированный вирусный каркас.
В конкретном варианте, включающем в себя РНК-вирусы с сегментированными геномами, способы реаранжировки (вирусной рекомбинации) могут быть использованы для переноса аттенуированного фенотипа из родительского сегментированного РНК-вирусного штамма (природного мутанта, мутагенизированного вируса или генетически сконструированного вируса) в отличающийся вирусный штамм (вирус дикого типа, природный мутант, мутагенизированный вирус или генетически сконструированный вирус).
Аттенуированные вирусы, индуцирующие сильные ИФН-ответы в хозяевах, могут быть также использованы в фармацевтических композициях для профилактики или лечения других вирусных инфекций или излечиваемых ИФН заболеваний, таких как рак. В этом отношении тропизм аттенуированного вируса может быть изменен для нацеливания вируса на желательные, являющиеся мишенями орган, ткань или клетки in vivo или ex vivo. С использованием этого подхода ИФН-ответ может быть индуцирован локально, в сайте-мишени, что позволяет таким образом избежать или минимизировать побочные эффекты системного введения ИФН. Для этой цели аттенуированный вирус может быть сконструирован для экспрессии лиганда, специфического для рецептора этих являющихся мишенями органа, ткани или клетки.
Данное изобретение основано, частично, на открытии заявителей, что NS1 вируса гриппа дикого типа действует в качестве антагониста ИФН в том смысле, что NS1 ингибирует опосредованный ИФН ответ инфицированных вирусом клеток-хозяев. Было обнаружено, что вирусные мутанты, недостаточные по активности NS1, являются сильнодействующими индукторами клеточного ИФН-ответа и демонстрируют аттенуированный фенотип in vivo; т.е. эти мутантные вирусы реплицируются in vivo, но имеют пониженные патогенные эффекты. Не желая связывать себя с какой-либо теорией или с каким-либо объяснением, как действует данное изобретение, авторы изобретения считают, что аттенуированные признаки вирусов данного изобретения предположительно обусловлены их способностью индуцировать сильный клеточный ИФН-ответ и их ослабленной способностью противодействовать ИФН-ответу хозяина. Однако эти полезные признаки аттенуированных вирусов данного изобретения не могут приписываться только действиям на клеточный опосредованный интерфероном ответ. В самом деле, изменения в других активностях, ассоциированных с NS1, могут вносить вклад в желательный аттенуированный фенотип.
Показано, что мутантные вирусы гриппа с ослабленной антагонистической активностью в отношении ИФН реплицируются in vivo, давая титры, которые являются достаточными для индукции иммунологических ответов и ответов цитокинов. Например, вакцинация аттенуированным вирусом гриппа уменьшала вирусный титр в животных, которых затем заражали вирусом гриппа дикого типа. Аттенуированные вирусы гриппа продемонстрировали также антивирусную и противоопухолевую активность. Предварительное инфицирование аттенуированным вирусом гриппа ингибировала репликацию других штаммов вируса гриппа дикого типа и других вирусов (таких как вирус Sendai), суперинфицированных в яйцах с развивающимися эмбрионами. Инокуляция аттенуированного вируса гриппа в животных, инъецированных опухолевыми клетками, уменьшала число образованных очагов патологии. Поскольку известно, что вирус гриппа индуцирует CTL-ответ (ответ цитотоксических Т-лимфоцитов), аттенуированный вирус является очень привлекательным кандидатом для противораковых вакцин.
Мутации, которые уменьшают, но не уничтожают полностью антагонистическую в отношении ИФН активность вируса, являются предпочтительными для вакцинных композиций - такие вирусы могут быть выбраны для выращивания как в общепринятых, так и в нестандартных субстратах, и для получения промежуточной вирулентности. В частности, авторы изобретения показали, что мутант с укороченным на С-конце NS1 реплицируется до высоких титров в ИФН-недостаточных субстратах, таких как 6- и 7-дневные развивающиеся куриные эмбрионы, а также в аллантоисной мембране 10-дневных развивающихся куриных с эмбрионов, общепринятом субстрате для вируса гриппа, который не допускает роста мутантов вируса гриппа, в которых делетирован весь ген NS1 (называемых здесь также "нокаут"-мутантами). Однако репликация мутанта с укороченным на С-конце NS1 является сниженной в яйцах с 12-дневными развивающимися эмбрионами. Этот подход впервые позволяет генерирование и идентификацию живых аттенуированных вирусов с минус-цепью, которые имеют измененную, но не устраненную антагонистическую в отношении ИФН активность и которые способны расти в субстратах, пригодных для получения вакцин. Этот подход обеспечивает также впервые эффективную систему отбора/идентификации для вируса гриппа или других вирусов, содержащих мутации, которые придают им измененную, но не устраненную, антагонистическую в отношении интерферона активность.
Данное изобретение относится также к применению ИФН-недостаточных систем для размножения аттенуированных вирусов, которые не могут быть выращены в общепринятых системах, используемых в настоящее время для получения вакцин. Термин "ИФН-недостаточные системы" в применении здесь относится к ситемам, таким как, например, клетки, клеточные линии и животные, такие как мыши, куры, индейки, кролики, крысы и т.д., которые не продуцируют ИФН или продуцируют низкие уровни ИФН, не отвечают или отвечают менее эффективно на ИФН и/или являются недостаточными в активности антивирусных генов, индуцируемых интерфероном. Для этой цели авторы изобретения идентифицировали или сконструировали ряд ИФН-недостаточных систем, которые могут быть использованы, в том числе, но не только, яйца с развивающимися эмбрионами на ранней стадии, ИФН-недостаточные клеточные линии (такие как клетки VERO или генетически сконструированные клеточные линии, такие как STAT1-нокауты). Альтернативно, яйца с развивающимися эмбрионами или клеточные линии могут быть предварительно обработаны соединениями, которые ингибируют ИФН-систему (в том числе лекарственными средствами, антителами, антисмысловыми нуклеиновыми кислотами, рибозимами и т.д.). Еще один вариант включает в себя применение яиц, недостаточных по ИФН-системе, например, яиц, продуцируемых STAT1-негативными птицами, в частности, домашней птицей, включая, но не ограничиваясь трансгенными курами, утками или индейками.
4. ОПИСАНИЕ ФИГУР
Фиг.1. Вирус delNS1 ингибирует репликацию вируса гриппа А дикого типа в яйцах. Яйца с десятидневными развивающимися куриными эмбрионами инокулировали указанными БОЕ вируса delNS1. Спустя восемь часов эти яйца инфицировали 103 БОЕ вируса WSN. После двух дней инкубации при 37°С аллантоисную жидкость собирали и титры вируса WSN определяли методом бляшек в клетках MDBK. Результаты представляют среднее для двух яиц.
Фиг.2. Индукция антивирусного ответа в яйцах с развивающимися эмбрионами вирусом delNS1. Яйца с десятидневными развивающимися эмбрионами инокулировали ЗФР (необработанные) или 2×104 БОЕ вируса delNS1 (delNS1-обработанные). Спустя восемь часов эти яйца инфицировали теперь 103 БОЕ вируса гриппа A/WSN/33 (H1N1), вируса гриппа A/PR8/34 (H+N1), вируса гриппа А/Х-31 (H3N2), вируса гриппа B/Lee/40 или вируса Sendai. После двух дней инкубации аллантоисную жидкость собирали и титры вирусов определяли при помощи метода гемагглютинации. Результаты являются средними величинами для двух яиц.
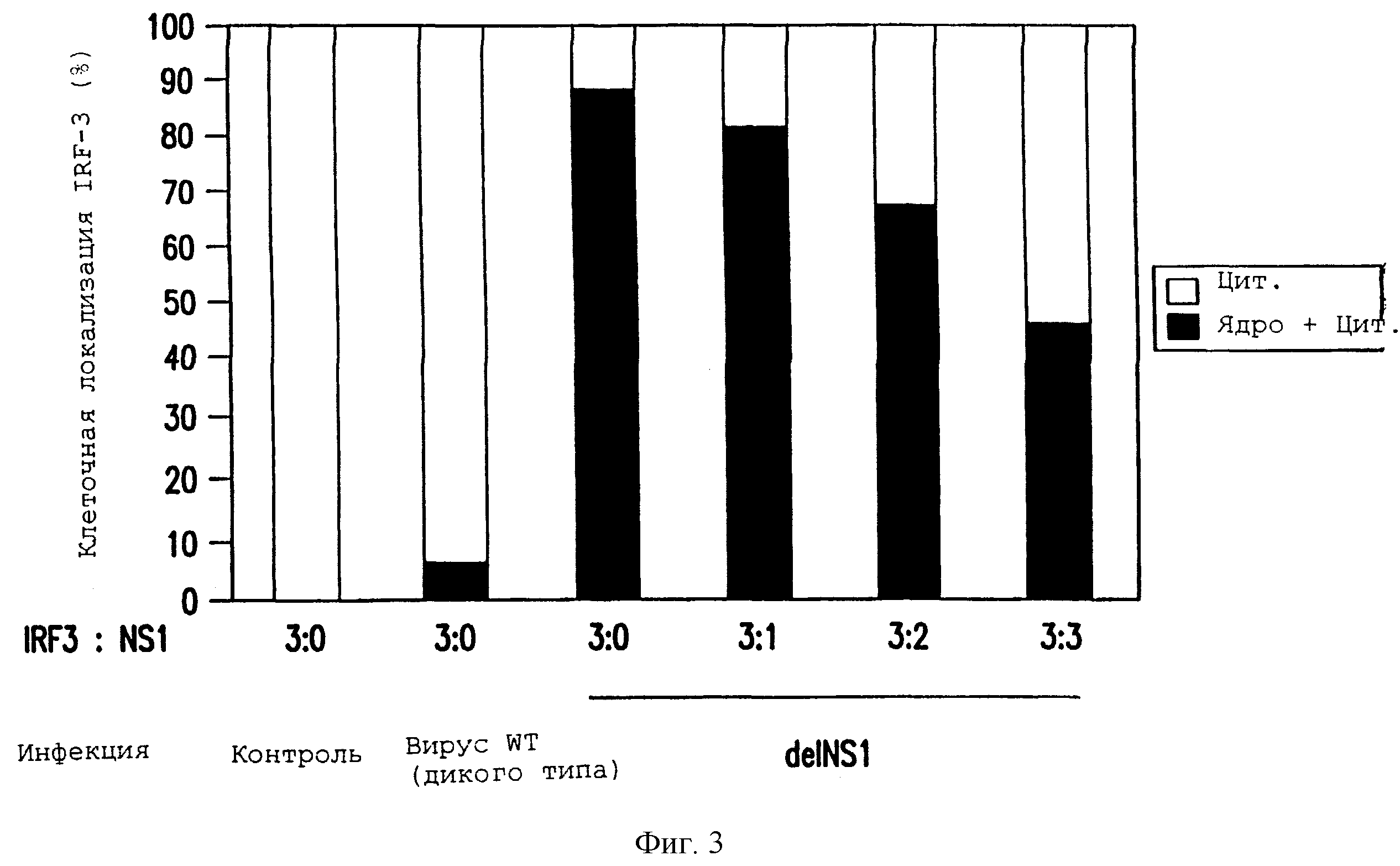
Фиг.3. Клетки CV1 трансфицировали плазмидой, экспрессирующей IRF-3, слитый с зеленым флуоресцентным белком (GFP). Это делает возможным определение локализации IFR-3 в клетках при помощи флуоресцентной микроскопии. В некоторых случаях, экспрессирующую NS1 плазмиду котрансфицировали с экспрессирующей IRF-3 плазмидой в указанных соотношениях. Спустя 24 ч после трансфекции клетки инфицировали при высокой множественности заражения (МЗ) PR8 (WT) или вирусом delNS1, как указано. Спустя 10 ч после инфицирования клетки анализировали флуоресцентной микроскопией в отношении локализации IRF-3-GFP. Показан процент клеток, обнаруживших исключительно цитоплазматическую локализацию (Цит) и как цитоплазматическую, так и ядерную локализации IRF-3 (Ядро+Цит).
5. ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение относится к генерированию, селекции и идентификации аттенуированных РНК-вирусов с минус-цепью, которые имеют ухудшенную способность противодействовать клеточному ИФН-ответу, и применению таких вирусов в вакцинных и фармацевтических композициях.
Эти вирусы могут иметь сегментированный или несегментированный геномы и могут быть выбраны из природно встречающихся штаммов, вариантов или мутантов; мутагенизированных вирусов (например, посредством УФ-облучения, действия мутагенов и/или пассирования); вирусных рекомбинантов (реассортантов) (для вирусов с сегментированными геномами); и/или генетически сконструированных вирусов. Например, мутантные вирусы могут быть получены природной изменчивостью, экспонированием УФ-излучению, экспонированию химическим мутагенам, пассированием в непермиссивных хозяевах, реаранжировкой (рекомбинацией) (т.е. совместным инфицированием аттенуированного сегментированного вируса с другим штаммом, имеющим желательные антигены), и/или генетической инженерией (например, с использованием "обратной генетики"). Вирусы, отобранные для использования в данном изобретении, имеют дефектную антагонистическую в отношении ИФН активность и являются аттенуированными; т.е. они являются инфекционными и могут реплицироваться in vivo, но дают только низкие титры, приводящие к субклиническим уровням инфекции, которые не являются патогенными. Такие аттенуированные вирусы являются идеальными кандидатами для живых вакцин.
В предпочтительном варианте, аттенуированные вирусы, выбранные для применения в данном изобретении, должны быть способны к индукции сильного ИФН-ответа в хозяине - признака, который способствует генерированию сильной иммунной реакции при использовании в качестве вакцины и который имеет другие биологические последствия, что делает эти вирусы применимыми в качестве фармацевтических агентов для предупреждения и/или лечения других вирусных инфекций или опухолеобразования в индивидуумах с высоким риском или других заболеваний, которые могут лечиться интерфероном.
Данное изобретение основано, частично, на ряде открытий и наблюдений, сделанных заявителями при работе с мутантами вируса гриппа. Однако, эти принципы могут быть аналогично применены и экстраполированы к другим сегментированным и несегементированным РНК-вирусам с минус-цепью, в том числе, но не ограничиваясь, к парамиксовирусам (вирусу Sendai, вирусу парагриппа, вирусу эпидемического паротита, вирусу Ньюкаслской болезни), морбилливирусу (вирусу кори, вирусу чумы собачьих и вирусу чумы крупного рогатого скота); пневмовирусу (респираторно-синцитиальному вирусу и бычьему респираторному вирусу) и рабдовирусу (вирусу везикулярного стоматита и вирусу бешенства).
Во-первых, ИФН-ответ является важным для вирусной инфекции in vivo. Авторы изобретения обнаружили, что рост вируса гриппа дикого типа A/WSN/33 в ИФН-недостаточных мышах (мышах STAT1-/-) приводил к пан-органной инфекции (инфекции всех органов); т.е. вирусная инфекция не ограничивалась легкимми, как это имеет место у мышей дикого типа, которые генерируют ИФН-ответ (статья Garcia-Sastre, et al., 1998, J.Virol. 72:8550, включенная здесь в качестве полной ссылки). Во-вторых, авторы изобретения установили, что мутант вируса гриппа с делецией всего гена NS1 (т.е. с NS1-"нокаутом") не мог расти до высоких титров в ИФН-компетентных клетках-хозяевах и мог размножаться только в ИФН-недостаточных хозяевах. Вирус с нокаутом NS1 продемонстировал аттенуированный фенотип (т.е. он был летальным в ИФН-недостаточных мышах STAT-/-, но не в мышах дикого типа), и было обнаружено, что он является сильным индуктором ИФН-ответов в клетках-хозяевах (статья Garcia-Sastre, et al., 1998, J.Virology 252: 324-330, включенная здесь в качестве полной ссылки). Предынкубация с мутантным вирусом с NS1-нокаутом снижала титры вируса гриппа дикого типа и других вирусов (например, вируса Sendai), суперинфицированных в яйцах с развивающимися эмбрионами. В другом эксперименте, инфекция мутантным вирусом гриппа с NS1-нокаутом уменьшала образование очагов заболевания в животных, инокулированных опухолевыми клетками. Таким образом, вирус гриппа с NS1-нокаутом демонстрировал представляющие интерес биологические свойства. Однако, мутантные вирусы с NS1-нокаутом не могли бы размножаться в общепринятых системах для получения вакцин. Для преодоления этой проблемы авторы изобретения использовали и разработали ИФН-недостаточные системы, которые позволяют получать разумные выходы аттенуированного вируса.
Кроме того, авторы изобретения сконструировали делеционные мутанты NS1, которые не делегируют полный ген. Неожиданным образом было обнаружено, что эти NS1-мутанты проявляют "промежуточный" фенотип - этот вирус может быть выращен в общепринятых хозяевах для размножения вируса гриппа (хотя рост его происходит лучше в ИФН-недостаточных системах, которые дают более высокие титры). Наиболее важным является то, что эти делеционные мутанты являются аттенуированными in vivo и индуцируют сильный ИФН-ответ. Вакцинация мутантами с укороченным NS1 приводила к низким титрам вируса в животных, зараженных затем вирусом дикого типа, и давала защиту против заболевания.
Данное изобретение относится также к субстратам, предназначенным для выделения, идентификации и роста вирусов для целей получения вакцин. В частности, описаны интерферон-недостаточные субстраты для эффективного выращивания мутантов вируса гриппа. В соответствии с данным изобретением, интерферон-недостаточным субстратом является субстрат, который является дефектным в его способности продуцировать или отвечать на интерферон. Субстрат данного изобретения может быть использован для роста любого числа вирусов, которые могут требовать интерферон-недостаточной среды выращивания. Такие вирусы могут включать в себя, при этом не ограничиваясь ими, парамиксовирусы (вирус Sendai, вирус парагриппа, вирус эпидемического паротита, вирус Ньюкаслской болезни), морбилливирус (вирус кори, вирус чумы собачьих и вирус чумы крупного рогатого скота); пневмовирус (респираторно-синцитиальный вирус и бычий респираторный вирус) и рабдовирус (вирус везикулярного стоматита и вирус бешенства).
Данное изобретение относится также к применению аттенуированного вируса данного изобретения в вакцинах и фармацевтических препаратах для человека и животных. В частности, аттенуированные вирусы могут быть использованы в качестве вакцин против широкого круга вирусов и/или антигенов, в том числе, но не только, антигенов вариантов штамма, отличающихся вирусов или других инфекционных патогенов (например, бактерий, паразитов, грибков), или опухолеспецифических антигенов. В другом варианте, аттенуированные вирусы, которые ингибируют репликацию вирусов и образование опухолей, могут быть использованы для профилактики или лечения инфекции (вирусных или невирусных патогенов) или образования опухоли или лечения заболеваний, для которых ИФН является терапевтически эффективным агентом. Многие способы могут быть использованы для введения живых аттенуированных вирусных препаратов человеку или животному для индукции иммунного или подходящего медиируемого цитокинами ответа. Они включают в себя, но не ограничиваются ими, интраназальный, внутритрахеальный, пероральный, интрадермальный, внутримышечный, внутрибрюшинный, внутривенный и подкожный пути. В предпочтительном варианте, аттенуированные вирусы данного изобретения готовят для интраназальной доставки.
5.1 ПОЛУЧЕНИЕ МУТАНТОВ С ИЗМЕНЕННОЙ АНТАГОНИСТИЧЕСКОЙ В ОТНОШЕНИИ ИФН АКТИВНОСТЬЮ
Любой мутантный вирус или штамм, который имеет уменьшенную антагонистическую в отношении ИФН активность, может быть выбран и использован в соответствии с данным изобретением. В одном варианте, могут быть выбраны природно встречающиеся мутанты или варианты или спонтанные мутанты, которые имеют ухудшенную способность противодействовать клеточному ИФН-ответу. В другом варианте, мутантные вирусы могут быть получены экспонированием вируса мутагенами, таким как ультрафиолетовое излучение или химические мутагены, или множественными пассированиями и/или перепрививанием в непермиссивных хозяевах. Скрининг в дифференциальной системе роста может быть использован для селекции на мутанты, имеющие ухудшенную антагонистическую в отношении ИФН функцию. Для вирусов с сегментированными геномами, этот аттенуированный фенотип может быть перенесен другому штамму, имеющему желательный антиген для рекомбинации (т.е. посредством совместного инфицирования аттенуированного вируса и этого желательного штамма и отбора на вирусные рекомбинанты, проявляющие оба фенотипа).
В другом варианте, могут быть введены мутации в РНК-вирус с минус-цепью, такой как вирус гриппа, RSV, NDV, VSV и PIV, с использованием подходов "обратной генетики". Таким путем природные или иные мутации, которые придают аттенуированный фенотип, могут быть введены в вакцинные штаммы. Например, могут быть сконструированы делеции, инсерции или замены кодирующего региона гена, ответственного за антагонистическую в отношении ИФН активность (такого как NS1 вируса гриппа). Делеции, замены или вставки в некодирующей области гена, ответственного за антагонистическую в отношении ИФН активность, также обсуждаются. Для этой цели могут быть сконструированы мутации в сигналах, ответственных за транскрипцию, репликацию, полиаденилирование и/или упаковку гена, ответственного за антагонистическую в отношении ИФН активность. Например, в вирусе гриппа такие модификации могут включать в себя, но не ограничиваются ими: замену некодирующих регионов гена вируса гриппа А некодирующими регионами гена вируса гриппа В (Muster, et al., 1991, Proc. Natl. Acad. Sci. USA, 88: 5177), замены пар оснований в некодирующих регионах гена вируса гриппа (Fodor, et al., 1998, J.Virol. 72: 6283), мутации в районе промотора гена вируса гриппа (Piccone, et al., 1993, Virus Res. 28: 99; Li, et al., 1992, J.Virol. 66: 4331), замены и делеции в сегменте остатков уридина на 5'-конце гена вируса гриппа, влияющего на полиаденилирование (Luo, et al., 1991, J.Virol. 65: 2861; Li, et al., J. Virol. 1994, 68(2): 1245-9). Такие мутации, например, в отношении промотора, могли бы отрицательно регулировать экспрессию гена, ответственного за антагонистическую в отношении ИФН активность. Мутации в вирусных генах, которые могут регулировать экспрессию гена, ответственного за ИФН-антагонистическую активность, находятся также в объеме вирусов, которые могут быть использованы в соответствии с данным изобретением.
Данное изобретение относится также к мутациям в сегементе гена NS1, которые не приводят к измененной ИФН-антагонистической активности или ИФН-индуцирующему фенотипу, а скорее приводят к измененным вирусным функциям и аттенуированному фенотипу, например, измененному ингибированию ядерного экспорта поли(А)-содержащей мРНК, измененному ингибированию сплайсинга пре-мРНК, измененному ингибированию активации PKR путем связывания dsPHK, измененному влиянию на трансляцию вирусной РНК и измененному ингибированию полиаденилирования мРНК хозяина (например, см. Krug in Textbook of Influenza, Nicholson et al., Ed. 1998, 82-92, и цитированные в этой статье ссылки).
Способ обратной генетики включает в себя получение синтетических рекомбинантных вирусных РНК, которые содержат некодирующие районы вирусной РНК с минус-цепью, которые являются существенными для узнавания вирусными полимеразами и для упаковки сигналов, необходимых для генерирования зрелого вириона. Эти рекомбинантные РНК синтезируют из рекомбинантной ДНК-матрицы и воспроизводят in vitro с очищенным вирусным полимеразным комплексом с получением рекомбинантных рибонуклеопротеинов (РНП), которые могут быть использованы для трансфекции клеток. Более эффективная трансфекция достигается, если белки вирусной полимеразы присутствуют во время транскрипции синтетических РНК либо in vitro, либо in vivo. Синтетические рекомбинантные РНП могут быть спасены введением в инфекционные вирусные частицы. Вышеупомянутые способы описаны в патенте США №5166057, выданном 24 ноября 1992 года; в патенте США №5854037, выданном 29 декабря 1998 года; в Европейской патентной публикации ЕР 0702085А1, опубликованной 20 февраля 1996 года; в патентной заявке США с регистрационным номером 09/152845; в Международных патентных публикациях РСТ WO 97/12032, опубликованной 3 апреля 1997 года; WO 96/34625, опубликованной 7 ноября 1996 года; в Европейской патентной публикации ЕР-А780475; WO 99/02657, опубликованной 21 января 1999 года; WO 98/53078, опубликованной 26 ноября 1998 года; WO 98/02530, опубликованной 22 января 1998 года; WO 99/15672, опубликованной 1 апреля 1999 года; WO 98/13501, опубликованной 2 апреля 1998 года; WO 97/06270, опубликованной 20 февраля 1997 года, и ЕРО 780 47SA1, опубликованной 25 июня 1997 года, каждая из которых включена здесь в виде полной ссылки.
Аттенуированные вирусы, генерируемые подходом обратной генетики, могут быть использованы в вакцинных и фармацевтических композициях, описанных здесь. Способы обратной генетики могут быть использованы для конструирования дополнительных мутаций для других вирусных генов, важных для получения вакцин - т.е. эпитопы ценных вариантов вакцинных штаммов могут быть введены генной инженерией в аттенуированный вирус. Альтернативно, полностью чужеродные эпитопы, в том числе антигены, полученные из других вирусных или невирусных патогенов, могут быть введены генной инженерией в аттенуированный штамм. Например, в аттенуированный штамм могут быть введены генной инженерией антигены неродственных вирусов, таких как ВИЧ (gp160, gp120, gp41), антигены паразитов (например, малярии), бактериальные или грибковые антигены или опухолевые антигены. Альтернативно, эпитопы, изменяющие тропизм вируса in vivo, могут быть введены генной инженерией в химерные аттенуированные вирусы данного изобретения.
В альтернативном варианте, комбинация способов обратной генетики и способов реаранжировки (вирусной рекомбинации) могут быть использованы для конструирования аттенуированных вирусов, имеющих желательные эпитопы в сегментированных РНК-вирусах. Например, аттенуированный вирус (полученный естественным отбором, посредством мутагенеза или при помощи способов обратной генетики) и штамм, несущий желательный вакцинный эпитоп (полученный естественным отбором, посредством мутагенеза или при помощи способов обратной генетики), могут быть коинфицированы в хозяев, которые разрешают рекомбинацию сегментированных геномов. Рекомбинантные вирусы, которые проявляют как аттенуированный фенотип, так и желательный эпитоп, могут быть затем отобраны.
В другом варианте, вирус, который должен быть мутирован, является ДНК-вирусом (например, вирусом коровьей оспы, аденовирусом, бакуловирусом) или плюс-цепью РНК-вируса (например, полиовируса). В таких случаях, могут быть использованы способы рекомбинантных ДНК, которые хорошо известны в данной области (например, см. патент США №4769330, выданный Paoletti, патент США №4215051, выданный Smith, каждый из которых включен здесь в качестве ссылки в полном виде).
Любой вирус может быть сконструирован в соответствии с данным изобретением, в том числе вирусы семейств, представленных в таблице 2.
Используемые аббревиатуры: ds = двухцепочечная; ss = одноцепочечная; заключенные в оболочку = обладающие наружным липидным бислоем, образованным из мембраны клетки-хозяина; позитивный смысловой геном = для РНК-вирусов, геномы, которые составлены из нуклеотидых последовательностей, которые непосредственно транслируются на рибосомах, = для ДНК-вирусов, геномы, которые составлены из нуклеотидных последовательностей, которые являются теми же самыми, что и мРНК; негативный смысловой геном = геномы, которые составлены из нуклеотидных последовательностей, комплементарных позитивной-смысловой цепи.
В предпочтительных вариантах, данное изобретение относится к генетически сконструированным вирусам гриппа, содержащим делеции и/или усечения продукта гена NS1. NS1-мутанты вирусов гриппа А и В являются особенно предпочтительными. В одном подходе, части аминоконцевого района продукта гена NS1 являются сохраненными, тогда как части С-концевого района продукта гена NS1 делетированы. Специфические желательные мутации могут быть сконструированы посредством вставки, делеции или мутации нуклеиновой кислоты в подходящем кодоне. В частности, укороченные NS1-белки имеют 1-60 аминокислот, 1-70 аминокислот, 1-80 аминокислот, 1-90 аминокислот (N-концевой аминокислотой является аминокислота 1), и предпочтительно 90 аминокислот; 1-100 аминокислот и предпочтительно 99 аминокислот; 1-120 аминокислот; или 1-130 аминокислот и предпочтительно 124 аминокислоты продукта гена NS1 дикого типа.
Данное изобретение относится также к любому сконструированному с использованием генной инженерии вирусу гриппа, в котором продукт гена NS1 был модифицирован укорачиванием или модификацией белка NS1, которая придает мутантным вирусам следующие фенотипы: способность этих вирусов расти до высоких титров в нестандартных субстратах, таких как 6-7-дневные куриные яйца, или способность этих вирусов индуцировать ответную реакцию хозяина в виде интерферонов. В случае вирусов гриппа А, они включают в себя, но не ограничиваются ими, вирусы, имеющие укороченные NS1.
Данное изобретение включает в себя применение природно встречающихся мутантов вирусов гриппа А или В, имеющих аттенуированный фенотип, а также штаммов вируса гриппа, сконструированных для содержания таких мутаций, ответственных за аттенуированный фенотип. В случае вирусов гриппа А, они включают в себя, но не ограничиваются ими: вирусы, имеющие NS1 из 124 аминокислот (Norton et al., 1987, Virology 156: 204-213, включенный здесь в качестве ссылки во всей своей полноте). В случае вирусов гриппа В, они включают в себя, но не ограничиваются ими: вирусы, имеющие укороченный мутантный NS1, содержащий 127 аминокислот, полученных из N-конца (В/201) (Norton et al., 1987, Virology 156: 204-213, включенный здесь в качестве ссылки во всей своей полноте), и вирусы, имеющие укороченный мутантный NS1, содержащий 90 аминокислот, полученных из N-конца (B/AWBY-234) (Tobita et al., 1990, Virology 174: 314-19, включенный здесь в качестве полной ссылки). Данное изобретение включает в себя применение природно встречающихся мутантов, аналогичных NS1/38, NS1/80, NS1/124 (Egorov, et al., 1998, J.Virol. 72 (8): 6437-41), а также природно встречающихся мутантов, A/Turkey/ORE/71, В/201 или B/AWBY-234.
Аттенуированный вирус гриппа может быть дополнительно сконструирован для экспрессии антигенов других вакцинных штаммов (например, с использованием обратной генетики или рекомбинации (реаранжировки)). Альтернативно, аттенуированные вирусы гриппа могут быть сконструированы с использованием обратной генетики или рекомбинации с генетически сконструированными вирусами, для экспрессии полностью чужеродных эпитопов, например, антигенов других инфекционных патогенов, опухолевых антигенов или нацеливающих антигенов. Поскольку РНК-сегмент NS является самым коротким среди восьми сегментов вирусных РНК, возможно, что РНК NS будет выдерживать более длинные вставки гетерологичных последовательностей, чем другие вирусные гены. Кроме того, РНК-сегмент NS регулирует синтез высоких уровней белка в инфицированных клетках, что позволяет предположить, что он мог бы быть идеальным сегментом для инсерций чужеродных антигенов. Однако, в соответствии с данным изобретением, любой из восьми сегментов вирусов гриппа может быть использован для встраивания гетерологичных последовательностей. Например, если желательно представление (презентация) поверхностного антигена, могут быть использованы сегменты, кодирующие структурные белки, например, НА или NA.
5.2 СИСТЕМЫ СЕЛЕКЦИИ НА ОСНОВЕ РЕСТРИКЦИИ ХОЗЯИНА
Данное изобретение включает в себя способы селекции вирусов, которые имеют желательный фенотип, т.е. вирусов, которые имеют низкую ИФН-антагонистическую активность или не имеют ИФН-антагонистической активности, полученных из природных вариантов, спонтанных вариантов (т.е. вариантов, которые эволюционировали во время развития вирусов), мутагенизированных природных вариантов, рекомбинантных вирусов (образованных рекомбинацией между вирусами) и/или генетически сконструированных вирусов. Такие вирусы могут быть лучше всего подвергнуты скринингу в анализах различающегося роста, в которых сравнивают рост в ИФН-недостаточных и ИФН-компетентных системах-хозяевах. Вирусы, которые демонстрируют лучший рост в ИФН-недостаточных системах в сравнении с ИФН-компетентными системами, отбирают; предпочтительно отбирают вирусы, которые растут до титров, по меньшей мере на один log более высоких в ИФН-недостаточных системах в сравнении с ИФН-компетентной системой.
Альтернативно, вирусы могут быть подвергнуты скринингу с использованием тест-систем ИФН, например, транскрипции, на основе тест-систем, в которых экспрессия репортерного гена регулируется ИФН-чувствительным промотором. Экспрессия репортерного гена в инфицированных клетках в сравнении с неинфицированными клетками может измеряться для идентификации вирусов, которые эффективно индуцируют ИФН-ответ, но которые неспособны противодействовать ИФН-ответу. Однако, в предпочтительном варианте для отбора вирусов, имеющих желательный фенотип, используют тесты дифференциального (различающегося) роста, так как используемая система-хозяин (ИФН-компетентная в сравнении с ИФН-недостаточной) накладывет соответствующее давление на отбор.
Например, рост вируса (измеряемый титром) может быть сравнен в различных клетках, клеточных линиях или модельных системах животных, которые экспрессируют ИФН и компоненты ИФН-ответа, в сравнении с клетками, клеточными линиями или модельными системами животных, недостаточных в отношении ИФН или компонентов ИФН-ответа. Для этой цели можно сравнивать рост вируса в клеточных линиях клеток VERO (которые являются ИФН-недостаточными) с ростом вируса в клетках MDCK (которые являются ИФН-компетентными). Альтернативно, ИФН-недостаточные клеточные линии могут быть произведены и получены из животных, выведенных или полученных с использованием генной инженерии для того, чтобы они были недостаточными по ИФН-системе (например, мутант мышей STAT1-/-). Может быть измерен рост вируса в таких клеточных линиях, в сравнении с ИФН-компетентными клетками, полученными, например, из животных дикого типа (например, мышей дикого типа). Еще в одном варианте, клеточные линии, которые являются ИФН-компетентными и о которых известно, что они поддерживают рост вируса дикого типа, могут быть сконструированы таким образом, что они будут ИФН-недостаточными (например, посредством нокаута STAT1, IRF3, PKR и т.д.). Могут быть использованы способы, которые хорошо известны в данной области для размножения вирусов в клеточных линиях (см., например, рабочие примеры infra). Можно сравнивать рост вируса в стандартной ИФН-компетентной клеточной линии и рост вируса в ИФН-недостаточной генетически сконструированной клеточной линии.
Могут быть также использованы системы животных. Например, для гриппа, рост в молодых, ИФН-недостаточных яйцах с развивающимися эмбрионами, например, приблизительно 6-8-дневных, может сравниваться с ростом в ИФН-компетентных яйцах "большего возраста", например, приблизительно 10-12-дневных. Для этой цели, могут быть использованы способы, хорошо известные в данной области для инфицирования и размножения в яйцах (например, см. рабочие примеры infra). Альтернативно, рост в ИФН-недостаточных мышах STAT1-/- может сравниваться с ростом в ИФН-компетентных мышах дикого типа. Еще в одном альтернативном варианте, рост в ИФН-недостаточных яйцах с развивающимися эмбрионами, продуцируемыми, например, STAT1-/- трансгенной домашней птицей, можно сравнивать с ростом в ИФН-компетентных яйцах, продуцируемых домашней птицей дикого типа.
Однако, для целей скрининга, могут использоваться временно ИФН-недостаточные системы вместо генетически сконструированных систем. Например, система-хозяин может быть обработана соединениями, которые ингибируют продуцирование ИФН или компонентов ИФН-ответа (например, лекарственными средствами, антителами против ИФН, антителами против рецептора ИФН, ингибиторами PKR, антисмысловыми молекулами и рибозимами и т.д.). Рост вируса можно сравнивать в ИФН-компетентных необработанных контролях против ИФН-недостаточных обработанных систем. Например, яйца с развивающимися эмбрионами "большего возраста", которые являются ИФН-компетентными, могут быть предобработаны такими лекарственными средствами перед инфицированием подлежащим скринингу вирусом. Рост сравнивают с ростом, достигаемым в необработанных контрольных яйцах с развивающимися эмбрионами того же самого возраста.
Способы скрининга данного изобретения обеспечивают простой и легкий скрининг для идентификации мутантных вирусов с устраненной ИФН-антагонистической активностью по неспособности мутантного вируса расти в средах с ИФН-ответом (ИФН-компетентных средах), в сравнении со способностью этого мутантного вируса расти в ИФН-недостаточных средах. Способы скрининга данного изобретения могут быть также использованы для идентификации мутантных вирусов с измененной, но не с устраненной ИФН-антагонистической активностью путем измерения способности мутантного вируса расти как в среде с ИФН-ответом, например, в яйцах с 10-дневными развивающимися эмбрионами или клетках MDCK, так и в ИФН-недостаточных средах, например, в яйцах с 6-7-дневными развивающимися эмбрионами или клетках Vero. Например, вирусы гриппа, обнаруживающие по меньшей мере на один log более низкие титры в 10-дневных яйцах против 6-7-дневных яиц, будут считаться вирусами, ухудшенными в их способности ингибировать ИФН-ответ. В другом примере, вирусы гриппа, обнаруживающие по меньшей мере на один log более низкий титр в 12-дневных яйцах (которые устанавливают высокий ИФН-ответ) против 10-дневных яиц (которые устанавливают умеренный ИФН-ответ), считаются частично ухудшенными в их способности противодействовать ИФН-ответу и рассматриваются в качестве привлекательных вакцинных кандидатов.
Способы отбора данного изобретения включают в себя также идентификацию мутантных вирусов, которые индуцируют ИФН-ответы. В соответствии со способами отбора данного изобретения, индукция ИФН-ответов может быть измерена определением уровней экспрессии ИФН или экспрессии генов-мишеней или репортерных генов, индуцированных ИФН, после инфицирования мутантным вирусом или активацией трансактиваторами, участвующими в экспрессии ИФН и/или ИФН-ответной реакции.
Еще в одном варианте систем селекции данного изобретения индукция ИФН-ответов может быть определена измерением фосфорилированного состояния компонентов пути ИФН после инфекции испытуемым мутантным вирусом, например, состояния компонента IRF-3, который фосфорилируется в ответ на двухцепочечную РНК. В ответ на ИФН типа I, киназа Jakl и киназа TyK2, субъединицы рецептора ИФН, STAT1 и STAT2, быстро фосфорилируются по тирозину. Таким образом, чтобы определить, индуцирует ли мутантный вирус ИФН-ответы, клетки, такие как клетки 293, инфицируют испытуемым мутантным вирусом и после инфицирования эти клетки лизируют.
Компоненты пути ИФН, такие как киназа Jakl и киназа TyK2, осаждают иммунопреципитацией из лизатов инфицированных клеток с использованием специфических поликлональных сывороток или антител и тирозин-фосфорилированное состояние киназы определяют иммуноблоттингом с антителом против фосфотирозина (например, см. Krishnan et al., 1997, Eur. J.Biochem. 247: 298-305). Состояние повышенного фосфорилирования любого из компонентов ИФН-пути после инфекции мутантным вирусом указывало бы на индукцию ИФН-ответов мутантным вирусом.
Еще в одном варианте, системы селекции данного изобретения включают в себя измерение способности связывать специфические последовательности ДНК или транслокации факторов транскрипции, индуцируемой в ответ на вирусную инфекцию, например, IRF3, STAT1, STAT2 и т.д. В частности, STAT1 и STAT2 фосфорилируются и транслоцируются из цитоплазмы в ядро в ответ на ИФН типа I. Способность связывать специфические последовательности ДНК или транслокация факторов транскрипции могут быть измерены способами, хорошо известными специалистам в данной области, например, тестами смещения электромобильности в геле, окрашиванием клеток и т.д.
Еще в одном варианте систем селекции данного изобретения, индукция ИФН-ответов может быть определена измерением ИФН-зависимой активации транскрипции после инфекции испытуемым мутантным вирусом. В этом варианте, экспрессия генов, о которых известно, что они индуцируются ИФН, например, Mx, PKR, 2-5-олигоаденилатсинтетазы, главного комплекса гистосовместимости (МНС) класса I и т.д., может анализироваться способами, известными специалистам с квалификацией в данной области (например, нозерн-блоттингом, вестерн-блоттингом, ПЦР и т.д.). Альтернативно, тест-клетки, такие как клетки почек эмбриона человека или клетки остеогенной саркомы человека, конструируют с использованием генной инженерии для временной (преходящей) или конститутивной экспрессии репортерных генов, таких как репортерный ген люциферазы или репортерный ген хлорамфениколтрансферазы (CAT), под контролем элемента стимулируемого интерфероном ответа, такого как ИФН-стимулируемый промотор гена ISG-54K (Bluyssen et al., 1994, Eur. J.Biochem. 220: 395-402). Клетки инфицируют испытуемым мутантным вирусом и уровень экспрессии репортерного гена сравнивают с уровнем в неинфицированных клетках или клетках, инфицированных вирусом дикого типа. Увеличение уровня экспрессии репортерного гена после инфекции испытуемым вирусом указывало бы, что испытуемый мутантный вирус индуцирует ИФН-ответ.
В другом варианте, системы селекции данного изобретения включают в себя измерение индукции ИФН путем определения, способен ли экстракт из клеток или яйца, инфицированных испытуемым мутантным вирусом, придавать защитную активность против вирусной инфекции. Более конкретно, группы куриных яиц с 10-дневными развивающимися эмбрионами инфицируют испытуемым мутантным вирусом или вирусом дикого типа. Приблизительно через 15-20 ч после инфекции аллантоисную жидкость собирают и тестируют на активность ИФН путем определения наивысшего разведения с защитной активностью против VSV-инфекции в клетках культуры ткани, таких как клетки CEF.
5.3 РАЗМНОЖЕНИЕ ВИРУСА В ИНТЕРФЕРОН-НЕДОСТАТОЧНЫХ
СУБСТРАТАХ ДЛЯ ВЫРАЩИВАНИЯ
Данное изобретение включает в себя также способы и ИФН-недостаточные субстраты для выращивания и выделения природно встречающихся или полученных генной инженерией мутантных вирусов, имеющих измененную ИФН-антагонистическую активность. ИФН-недостаточные субстраты, которые могут быть использованы для поддержания роста аттенуированных мутантных вирусов, включают в себя, но не ограничиваются ими, природно встречающиеся клетки, клеточные линии, животных или яйца с развивающимися эмбрионами; рекомбинантные клетки или клеточные линии, которые сконструированы таким образом, чтобы они были ИФН-недостаточными, например, ИФН-недостаточные клеточные линии, полученные из мышей с STAT1-нокаутом или других подобным образом полученных трансгенных животных; яйца с развивающимися эмбрионами, полученные из ИФН-недостаточных птиц, в частности, домашней птицы (например, кур, уток, индеек), в том числе стад птиц, которых разводили, чтобы они были ИФН-недостаточными, или трансгенных птиц (например, со STAT1-нокаутами). Альтернативно, эта система-хозяин, например, клетки, клеточные линии, яйца или животные, могут быть получены с использованием генной инженерии для экспрессии трансгенов, кодирующих ингибиторы ИФН-системы, например, доминантно-негативные мутанты, такие как STAT1, не имеющий ДНК-связывающего домена, антисмысловая РНК, рибозимы, ингибиторы образования ИФН, ингибиторы передачи сигнала ИФН и/или ингибиторы антивирусных генов, индуцируемых ИФН. Должно быть понятно, что животные, которых разводили или получали генной инженерией для того, чтобы они были ИФН-недостаточными, будут иметь в некоторой степени ослабленный иммунитет и должны содержаться в контролируемой, не допускающей заболеваний среде. Таким образом, должны быть приняты меры (в том числе применение добавляемых в рацион антибиотиков) для ограничения риска экспонирования инфекционным агентам трансгенных ИФН-недостаточных животных, таких как поголовья (стада) разводимых кур, уток, индеек и т.д. Альтернативно, эта система-хозяин, например, клетки, клеточные линии, яйца или животные, могут быть обработаны соединением, которое ингибирует образование ИФН и/или путь ИФН, например, лекарственными средствами, антителами, антисмысловыми молекулами, молекулами рибозимов, нацеленными на ген STAT1, и/или антивирусные гены, индуцированные ИФН.
Согласно данному изобретению, незрелые куриные яйца с развивающимися эмбрионами представляют собой яйца, которые, как само собой разумеется, являются яйцами до 10-дневного возраста, но еще не 10-дневными, предпочтительно шестидевятидневные; и яйца, которые искусственно имитируют незрелые яйца до возраста 10 дней, но еще не 10-дневные, в результате изменений условий роста, например, изменениями температур инкубации; обработкой лекарственными средствами или любым другим изменением, которое приводит к получению яиц с замедленным развитием, так что система ИФН яйца не развивается полностью в сравнении с 10-12-дневными яйцами.
5.3.1 ПРИРОДНЫЕ ИФН-НЕДОСТАТОЧНЫЕ СУБСТРАТЫ
В одном варианте, данное изобретение относится к выращиванию природно встречающихся и полученных генной инженерией мутантных вирусов в нестандартных субстратах, таких как незрелые яйца с развивающимися эмбрионами, которые еще не развили ИФН-систему. Незрелые яйца с развивающимися эмбрионами обычно не применяют для выращивания вируса вследствие их ослабленного состояния и меньшего аллантоисного объема. Данное изобретение включают в себя выращивание мутантных вирусов в яйцах с развивающимися эмбрионами с возрастом менее 10 дней; предпочтительно выращивание мутированного вируса в яйцах с 8-дневными развивающимися эмбрионами и наиболее предпочтительно в 6-8-дневных яйцах.
Данное изобретение включает в себя также способы выращивания и выделения мутированных вирусов, имеющих измененную ИФН-антагонистическую активность, в клетках и клеточных линиях, которые природно не имеют ИФН-пути или имеют недостаточный ИФН-путь или имеет недостаточность в системе ИФН, например, низкие уровни экспрессии ИФН, в сравнении с клетками дикого типа. В конкретном предпочтительном варианте, данное изобретение относится к способам выращивания мутированных вирусов, имеющих измененную антагонистическую в отношении ИФН активность, в клетках Vero.
5.3.2 ПОЛУЧЕННЫЕ ГЕННОЙ ИНЖЕНЕРИЕЙ ИФН-НЕДОСТАТОЧНЫЕ СУБСТРАТЫ
Данное изобретение относится к способам выращивания и выделения мутированных вирусов, имеющих измененную антагонистическую в отношении ИФН активность, в полученном генной инженерией ИФН-недостаточном субстрате. Данное изобретение включает в себя трансгенных птиц, в которых ген, существенный для ИФН-системы, является мутированным, например, STAT1, которые могли бы откладывать яйца, которые являются ИФН-недостаточными. Кроме того, данное изобретение включает в себя трансгенных птиц, которые экспрессируют доминантно-негативные факторы транскрипции, например, STAT1, не имеющий ДНК-связывающего домена, рибозимы, антисмысловые РНК, ингибиторы продуцирования ИФН, ингибиторы антивирусных генов, индуцируемых в ответ на ИФН. Выгодность использования яиц от ИФН-недостаточной птицы заключается в том, что обычные яйца 10-дневного возраста могут быть использованы для выращивания вируса, так как они являются более стабильными и имеют больший объем вследствие их большего размера. Еще в одном варианте, могут быть получены генной инженерией клеточные линии, которые являются ИФН-недостаточными. Данное изобретение включает в себя клеточные линии, в которых ген, существенный для синтеза ИФН, пути ИФН и/или антивирусного гена (генов), индуцированных ИФН, являются мутированными, например, STAT1.
Данное изобретение обеспечивает рекомбинантные клеточные линии или животных, в частности, птиц, в которых один или несколько генов, существенных для пути ИФН, например, рецептора интерферона, STAT1 и т.д., были разрушены, т.е. являются "нокаутированными"; рекомбинантное животное может быть любым животным, но в предпочтительном варианте оно является птицей, например, цыпленком, индейкой, взрослой курицей, уткой и т.д. (см., например, Sang, 1994, Trends Biotechnol. 12: 415; Perry, et al., 1993, Transgenic Res. 2: 125; Stern, C.D., 1996, Curr Top Microbiol Immunol 212: 195-206 и Shuman, 1997, Experientia 47: 897 в отношении обзоров, касающихся получения птичьих трансгенных животных, каждый их которых включен здесь в качестве сссылки во всей полноте). Такие клеточная линия или животное могут быть получены любым способом, известным в данной области для разрушения гена на хромосоме клетки или животного. Такие способы включают в себя, но не ограничиваются ими, микроинъекцию пронуклеуса (Норре & Wagner, 1989, патент США №4873191); опосредованный ретровирусом перенос гена в клетки зародышевой линии (Van der Putten et al., 1985, Proc. Natl. Acad. Sci. USA 82: 6148-6152); направленную доставку генов в эмбриональных стволовых клетках (Thompson et al., 1989, Cell 56: 313); электропорацию эмбрионов (Lo, 1983, Mol. Cell. Biol. 3: 1803) и опосредованный сперматозоидами перенос генов (Lavitrano et al., 1989, Cell 57: 717) и т.д. В отношении обзора таких способов см. Gordon, 1989, Transgenic Animals, Intl. Rev. Cytol. 115: 171, включенный здесь в качестве ссылки во всей полноте.
В частности, животное с нокаутом STAT1 может быть получено стимуляцией гомологичной рекомбинации между геном STAT1 в его хромосоме и экзогенным геном STAT1, который был сделан биологически неактивным (предпочтительно встраиванием гетерологичной последовательности, например, гена устойчивости к антибиотику). Способы гомологичной рекомбинации для разрушения генов в геноме мышей описаны, например, Capecchi (1989, Science 244: 1288) и Mansour et al. (1988, Nature 336: 348).
Вкратце, весь геномный клон STAT1 или его часть выделяют из геномной ДНК из того же самого вида, к которому относятся клетка или животное с нокаутом гена. Геномный клон STAT1 может быть выделен любым способом, известным в данной области для выделения геномных клонов (например, зондированием геномной библиотеки зондом, произведенным из последовательности STAT1, таким как последовательности, представленные в работах Meraz et al., 1996, Cell 84: 431; Durbin et al., 1996, Cell 84: 443 и цитированных в ней ссылках). После выделения геномного клона весь этот клон или его часть вводят в рекомбинантный вектор. Предпочтительно, часть этого клона, вводимая в вектор, содержит по меньшей мере часть экзона гена STAT1, т.е. содержит кодирующую белок STAT1 последовательность. Затем последовательность, не гомологичную этой последовательности STAT1, предпочтительно маркер позитивного отбора, такой как ген, кодирующий устойчивость к антибиотику, вводят в экзон гена STAT1. Предпочтительно, этот селектируемый маркер функционально (оперативно) связан с промотором, более предпочтительно с конститутивным промотором. Негомологичную последовательность вводят в любом месте в кодирующей последовательности STAT1, в котором она будет нарушать активность STAT1, например, в положении, в котором, как было продемонстрировано, точковые мутации или иные мутации инактивируют функцию белка STAT1. Например, но не в качестве органичения, негомологичная последовательность может быть встроена в кодирующую последовательность для части белка STAT1, содержащую весь киназный домен или его часть (например, нуклеотидную последовательность, кодирующую по меньшей мере 50, 100, 150, 200 или 250 аминокислот киназного домена).
Позитивный селектируемый маркер представляет собой предпочтительно ген устойчивости к неомицину (ген nео) или ген устойчивости к гигромицину (ген hygro). Промотор может быть любым промотором, известным в данной области; например, этот промотор может быть промотором фосфоглицераткиназы (PGK) (Adra et al., 1987, Gene 60: 65-74), промотором PolII (Soriano et al., 1991, Cell 64: 693-701) или промотором МС1, который является синтетическим промотором, сконструированным для экспрессии стволовых клеток, происходящих из эмбриона (Thomas & Capecchi, 1987, Cell 51: 503-512). Применение селектируемого маркера, такого как ген устойчивости к антибиотику, делает возможным отбор клеток, которые включили нацеливающий вектор (например, экспрессия продукта гена nео придает устойчивость к G418, а экспрессия продукта гена hygro придает устойчивость к гигромицину).
В предпочтительном варианте, негативный селектируемый маркер для стадии "противоотбора" (негативного отбора) на гомологичную (в противоположность негомологичной) рекомбинацию вектора встраивают вне вставки геномного клона STAT1. Например, таким негативным селектируемым маркером является ген тимидинкиназы HSV (HSV-tk), экспрессия которого делает клетки чувствительными к ганцикловиру. Предпочтительно, негативный селектируемый маркер находится под контролем промотора, такого как, но не ограничиваясь ими, промотор PGK, промотор PolII или промотор МС1.
Когда имеет место гомологичная рекомбинация, части вектора, которые являются гомологичными гену STAT1, а также негомологичная вставка в последовательностях гена STAT1 включаются в ген STAT1 в хромосоме, а оставшаяся часть вектора теряется. Таким образом, поскольку негативный селектируемый маркер находится вне региона гомологии с геном STAT1, клетки, в которых произошла гомологичная рекомбинация (или их потомство), не будут содержать негативного селектируемого маркера. Например, если негативным селектируемым маркером является ген HSV-tk, клетки, в которых произошла гомологичная рекомбинация, не будут экспрессировать тимидинкиназу и будут выдерживать воздействие ганцикловиром. Эта процедура позволяет отбирать клетки, в которых произошла гомологичная комбинация, в сравнении с негомологичной рекомбинацией, в которой, по-видимому, негативный селектируемый маркер также встраивается в геном вместе с последовательностями STAT1 и позитивным селектируемым маркером. Таким образом, клетки, в которых произошла негомологичная рекомбинация, наиболее вероятно, экспрессируют тимидинкиназу и являются чувствительными к ганцикловиру.
После приготовления нацеливающего вектора его линеаризуют рестриктазой, для которой в этом нацеливающем векторе имеется уникальный сайт, и этот линеаризованный вектор вводят в полученные из эмбриона стволовые клетки (ES) (Gossler et al., 1986, Proc. Natl. Acad. Sci. USA 83: 9065-9069) любым способом, известным в данной области, например, электропорацией. Если нацеливающий вектор содержит позитивный селектируемый маркер и негативный противоселектируемый маркер, клетки ES, в которых произошла гомологичная рекомбинация, могут быть отобраны инкубированием в селективных средах. Например, если селектируемыми маркерами являются ген устойчивости neo и ген HSV-tk, на клетки воздействуют G418 (например, приблизительно 300 мкг/мл) и ганцикловиром (например, приблизительно 2 мкМ).
Любой способ, известный в данной области для генотипирования, например, но не только, блоттинг по Саузерну или полимеразная цепная реакция, может быть использован для подтверждения, что нарушенные последовательности STAT1 гомологично рекомбинировались в ген STAT1 в геноме клеток ES. Поскольку рестрикционная карта геномного клона STAT1 известна и последовательность нуклеотидов кодирующей последовательности STAT1 известна (см. Meraz et al., 1996, Cell 84: 431; Durbin et al., 1996, Cell 84: 443-450 и все цитированные в них ссылки), может быть определен размер конкретного фрагмента рестрикции или продукта ПЦР-амплификации, генерируемых из ДНК как из нарушенных, так и из ненарушенных аллелей. Таким образом, посредством анализа на рестрикционный фрагмент или ПЦР-продукт, размер которого различается между нарушенным и ненарушенным геном STAT1, можно определить, произошла ли гомологичная рекомбинация, разрушающая ген STAT1.
Клетки ES с нарушенным локусом STAT1 могут быть затем введены в бластоцисты микроинъекцией и затем эти бластоцисты могут быть имплантированы в матки псевдобеременных мышей при помощи рутинных способов. Животные, которые развиваются из имплантированных бластоцист, являются химерными в отношении нарушенного аллеля. Химерные самцы могут быть скрещены с самками, и это скрещивание может быть построено таким образом, что перенос аллеля в клетки зародышевой линии связан с переносом определенной окраски шерстного покрова. Передача аллеля в гаплоидные клетки может быть подтверждена блоттингом по Саузерну или ПЦР-анализом, как описано выше, геномной ДНК, выделенной из проб ткани.
5.3.3 ВРЕМЕННЫЕ ИФН-НЕДОСТАТОЧНЫЕ СУБСТРАТЫ
Клетки, клеточные линии, животные или яйца могут быть предобработаны соединениями, которые ингибируют ИФН-систему. Согласно данному изобретению, соединения, которые ингибируют синтез ИФН или активность или экспрессию компонентов ИФН-системы, могут быть использованы для предварительной обработки хозяев, например, соединения, которые ингибируют синтез ИФН, активность ИФН, рецептор ИФН, другие мишени в пути трансдукции сигнала ИФН, или соединения, которые ингибируют активность антивирусных генов, индуцируемых ИФН. Примеры соединений, которые могут быть использованы в соответствии с данным изобретением, включают в себя, но не ограничиваются ими, молекулы нуклеиновых кислот, антитела, пептиды, антагонисты рецептора ИФН, ингибиторы пути STAT1, ингибиторы PKR и т.д. В соответствии с данным изобретением, молекулы нуклеиновых кислот включают в себя антисмысловые молекулы, рибозимы и молекулы с тройной спиралью, которые действуют на гены, кодирующие существенные компоненты ИФН-системы, например, STAT1. Эти молекулы нуклеиновых кислот включают в себя также нуклеотиды, кодирующие доминантно-негативные мутанты компонентов ИФН-системы; например, перед инфицированием вирусным мутантом клетки могут быть трансфицированы ДНК, кодирующей укороченный, некомпетентный в передаче сигнала мутант рецептора ИФН.
Доминантно-негативные мутанты, которые могут быть использованы в соответствии с данным изобретением для ингибирования ИФН-пути, включают в себя дефектные по киназе версии факторов транскрипции Jakl, TyK2 или STAT1 (см., например, Krishnan et al., 1997, Eur. J.Biochem. 247: 298-305).
5.4. ВАКЦИННЫЕ КОМПОЗИЦИИ
Данное изобретение включает в себя вакцинные композиции, содержащие аттенуированные РНК-вирусы с минус-цепью, имеющие ослабленную способность противодействовать клеточному ИФН-ответу, и подходящий наполнитель. Вирус, используемый в вакцинной композиции, может быть выбран из природно встречающихся мутантов или вариантов, мутагенизированных вирусов или генетически сконструированных вирусов. Аттенуированные штаммы сегментированных РНК-вирусов могут быть также получены посредством способов рекомбинации или с использованием комбинации методов обратной генетики и способов рекомбинации. Природно встречающиеся варианты включают в себя вирусы, выделенные из природы, а также спонтанные встречающиеся варианты, генерируемые во время размножения вирусов, имеющие нарушенную способность противодействовать клеточному ИФН-ответу. Этот аттенуированный вирус может сам быть использован в качестве активного ингредиента в вакцинной композиции. Альтернативно, аттенуированный вирус может быть использован в качестве вектора или "каркаса" полученных рекомбинантным способом вакцин. Для этой цели, рекомбинантные способы, такие как обратная генетика (или, для сегментированных вирусов, комбинации обратной генетики и способов рекомбинации) могут быть использованы для конструирования мутаций или введения чужеродных антигенов в аттенуированный вирус, используемый в вакцинной композиции. Таким путем могут быть сконструированы вакцины для иммунизации против вариантов штаммов или, альтернативно, против совершенно отличающихся агентов или антигенов заболевания.
В сущности, любая последовательность гетерологичного гена может быть введена генной инженерией в вирусы данного изобретения для использования в вакцинах. Предпочтительно, эпитопы, которые индуцируют защитную иммунную реакцию на любой из множества патогенов, или антигены, которые связывают нейтрализующие антитела, могут быть экспрессированы этими вирусами или в виде части этих вирусов. Например, последовательности гетерологичных генов, которые могут быть встроены в вирусы данного изобретения для использования в вакцинах, включают в себя, но не ограничиваются ими, эпитопы вируса иммунодефицита человека (ВИЧ), такие как gp120; поверхностный антиген вируса гепатита В (НВsАg); гликопротеины вируса герпеса (например, gD, gE); VP1 полиовируса; антигенные детерминанты невирусных патогенов, таких как бактерии и паразиты, среди прочих. В другом варианте, могут экспрессироваться все гены иммуноглобулинов или их части. Например, вариабельные области антиидиотипических иммуноглобулинов, которые имитируют такие эпитопы, могут быть встроены в вирусы данного изобретения. Еще в одном варианте, могут быть экспрессированы ассоциированные с опухолями антигены.
Может быть приготовлена либо живая рекомбинантная вирусная вакцина, либо инактивированная рекомбинантная вирусная вакцина. Живая вакцина может быть предпочтительной, так как размножение в хозяине приводит к пролонгированному стимулу того же типа и диапазона, которые встречаются в природных инфекциях, и, следовательно, придают существенный, долгосрочный иммунитет. Получение таких живых рекомбинантных вирусных вакцинных композиций может выполняться с использованием общепринятых способов, включающих в себя размножение вируса в культуре клеток или в аллантоисе куриного эмбриона с последующей очисткой.
Вакцинные композиции могут включать в себя генетически сконструированные РНК-вирусы с минус-цепью, которые имеют мутации в гене NS1 или аналогичном гене, в том числе, но не ограничивающиеся ими, мутанты гриппа с укороченным NS1, описанные в рабочих примерах infra. Они могут быть также приготовлены с использованием природных вариантов, таких как природный вариант A/turkey/Ore/71 вируса гриппа А или В/201 и B/AWBY-234, которые являются природными вариантами гриппа В. При приготовлении в виде живой вирусной вакцины следует использовать диапазон от около 104 БОЕ до около 5×106 БОЕ на дозу.
Многие способы могут быть использованы для введения вакцинных композиций, описанных выше, они включают в себя, но не ограничиваются ими, интраназальный, внутритрахеальный, пероральный, интрадермальный, внутримышечный, внутрибрюшинный, внутривенный и подкожный пути введения. Может быть предпочтительным введение вирусной вакцинной композиции через природный путь инфицирования патогена, для которого предназначена данная вакцина, или через природный путь инфицирования родительского аттенуированного вируса. При использовании живой вирусной вакцины гриппа, она может быть предпочтительно введена через природный путь инфекции вируса гриппа. Способность вируса гриппа индуцировать сильную секреторную и клеточную иммунную ответную реакцию, может быть выгодно использована. Например, инфекция дыхательных путей вирусами гриппа может индуцировать сильный секреторный иммунный ответ, например, в мочеполовой системе, с сопутствующей защитой против конкретного вызывающего данное заболевание агента.
Вакцина данного изобретения, содержащая 104-5× 106 БОЕ мутантных вирусов с измененной ИФН-антагонистической активностью, могла бы вводиться один раз. Альтернативно, вакцина данного изобретения, содержащая 104-5×106 БОЕ мутантных вирусов с измененной ИФН-антагонистической активностью, могла бы вводиться два или три раза с интервалом 2-6 месяцев между дозами. Альтернативно, вакцина данного изобретения, содержащая 104-5×106 БОЕ мутантных вирусов с измененной ИФН-антагонистической активностью, могла бы вводиться так часто, как это необходимо для животного, предпочтительно млекопитающего и более предпочтительно человека.
5.5 ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ
Данное изобретение включает в себя фармацевтические композиции, содержащие мутантные вирусы с измененной ИФН-антагонистической активностью, для применения в качестве антивирусных агентов или противоопухолевых агентов или агентов против ИФН-чувствительных заболеваний. Эти фармацевтические композиции применимы в качестве антивирусных профилактических веществ и могут вводиться индивидууму с риском получения инфекции, или, как ожидается, с риском экспонирования вирусу. Например, в случае, когда ребенок приходит домой из школы, где он общался с несколькими одноклассниками, имеющими грипп, родитель мог бы сам ввести антивирусную фармацевтическую композицию этому ребенку и другим членам семьи для предупреждения вирусной инфекции и последующей болезни. Люди, путешествующие в разных частях света, где преобладает определенное инфекционное заболевание (например, вирус гепатита А, малярия и т.д.), могли бы также вводить такую композицию.
Альтернативно, эти фармацевтические композиции могут быть использованы для лечения опухолей или предупреждения образования опухолей, например, у пациентов, которые имеют рак, или у пациентов, которые имеют высокий риск развития неоплазм или рака. Например, пациентам с раком можно вводить эту композицию для предотвращения дальнейшего онкогенеза. Альтернативно, композиции могут вводиться субъектам, которые соприкасаются с канцерогенами или в отношении которых ожидается, что они могут быть подвергнуты воздействию канцерогенов; индивидуумам, принимающим участие в очистке окружающей среды, которые могут быть подвергнуты воздействию загрязнителями среды (например, асбесту). Альтернативно, композиция может быть введена индивидуумам, которые подвергаются радиации, перед воздействием и после воздействия облучения (например, пациентам, подвергающимся высокой радиации, или пациентам, которые должны принимать канцерогенные лекарственные средства).
Применение аттенуированных вирусов данного изобретения в качестве противоопухолевых агентов основано на открытии авторов изобретения, что аттенуированный мутант вируса гриппа, содержащий делецию в его гене антагониста ИФН, способен уменьшать образование опухолей у мышей. Противоопухолевые свойства аттенуированных вирусов данного изобретения могут быть по меньшей мере частично связаны с их способностью индуцировать ИФН и ИФН-ответы. Альтернативно, противоопухолевые свойства аттенуированных вирусов данного изобретения могут быть связаны с их способностью специфически расти в опухолевых клетках и убивать опухолевые клетки, многие из которых, как известно, являются недостаточными в отношении ИФН-системы. Независимо от молекулярного механизма (механизмов), ответственных за эти противоопухолевые свойства, аттенуированные вирусы данного изобретения могут быть использованы для лечения опухолей или для предупреждения образования опухолей.
Кроме того, данное изобретение включает в себя мутантные вирусы с измененным ИФН-антагонистическим фенотипом, которые нацелены на специфические органы, ткани и/или клетки в теле для локальной индукции терапевтических или профилактических эффектов. Одним из преимуществ такого подхода является то, что ИФН-индуцирующие вирусы данного изобретения нацелены на специфические сайты, например, местоположения опухоли, для индукции ИФН предпочтительнее сайтспецифическим образом, чем для системной индукции ИФН, которая может иметь токсические эффекты.
Мутантные ИФН-индуцирующие вирусы данного изобретения могут быть сконструированы с использованием описанных здесь способов для экспрессии белков или пептидов, которые могли бы нацеливать эти вирусы на конкретный сайт. В предпочтительном варианте, ИФН-индуцирующие вирусы могли бы быть нацелены на сайты опухоли. В таком варианте, мутантные вирусы могут быть сконструированы для экспрессии антигенсвязывающего центра антитела, который узнается опухолеспецифическим антигеном, что приводит к нацеливанию ИФН-индуцирующего вируса на опухоль. Еще в одном варианте, в котором опухоль-мишень экспрессирует рецептор гормона, такая как опухоли молочной железы или яичника, которые экспрессируют рецепторы эстрогена, ИФН-индуцирующий вирус может быть сконструирован для экспрессии соответствующего гормона. Еще в одном варианте, в котором опухоль-мишень экспрессирует рецептор для фактора роста, например, VEGF, EGF или PDGF, может быть сконструирован ИФН-индуцирующий вирус для экспрессии подходящего фактора роста или его части (частей). Таким образом, в соответствии с данным изобретением, могут быть сконструированы ИФН-индуцирующие вирусы для экспрессии любого генного продукта-мишени, в том числе пептидов, белков, таких как ферменты, гормоны, факторы роста, антигены или антитела, функцией которых будет нацеливание вируса на участок (сайт), в котором требуется антивирусная, антибактериальная, антимикробная или противораковая активность.
Способы введения включают в себя, но не ограничиваются ими, интрадермальный, внутримышечный, внутрибрюшинный, внутривенный, подкожный, интраназальный, эпидуральный и пероральный пути введения. Фармацевтические композиции данного изобретения могут вводиться любым пригодным путем, например, инфузией или болюс-инъекцией, поглощением через эпителиальные и кожно-слизистые выстилки (например, слизистую оболочку полости рта, ректальную и кишечную слизистую оболочку и т.д.) и могут вводиться вместе с другими биологически активными агентами. Введение может быть системным или локальным. Кроме того, в предпочтительном варианте может быть желательным введение фармацевтических композиций данного изобретения в легкие любым пригодным для этого путем. Может быть использовано также легочное введение, например, с использованием ингалятора или распылителя и композиции с образующим аэрозоль агентом.
В конкретном варианте, может быть желательным введение фармацевтических композиций данного изобретения локально к зоне, нуждающейся в лечении; это может быть достигнуто, например, местным нанесением, например, вместе с раневой повязкой после хирургии, посредством инъекции, при помощи катетера, с использованием суппозитория или с использованием имплантата, причем указанный имплантат является пористым, непористым или студенистым материалом, в том числе мембранами, такими как сиаластические мембраны, или волокнами. В одном варианте, введение может быть прямой инъекцией в месте (или в бывшем месте) злокачественной опухоли или неопластической или пре-неопластической ткани.
Еще в одном варианте, эта фармацевтическая композиция может быть доставлена в системе регулируемого высвобождения. В одном варианте, может быть использован насос (см. Langer, supra; Sefton, 1987, CRC Crit. Ref. Biomed. Eng. 14: 201; Buchwald et al., 1980, Surgery 88: 507; Saudek et al., 1989, N.Engl. J.Med. 321: 574). В другом варианте, могут быть использованы полимерные материалы (см. Medical Applications of Controlled Release, Langer and Wise (eds.), CRC Pres., Boca Raton, Florida (1974); Controlled Drug Bioavailability, Drug Product Design and Performance, Smolen and Ball (eds.), Wiley, New York (1984); Ranger & Peppas, 1983, J.Macromol. Sci. Rev. Macromol. Chem. 23: 61; см. также Levy et al., 1985, Science 228: 190; During et al., 1989, Ann. Neurol. 25: 351 (1989); Howard et al., 1989, J.Neurosurg. 71: 105). Еще в одном варианте, система регулируемого высвобождения может быть помещена вблизи от мишени для композиции, а именно, легкого, что требует только части системной дозы (см., например, Goodson, 1984, in Medical Applications of Controlled Release, supra, vol. 2, pp.115-138). Другие системы регулируемого высвобождения обсуждаются в обзоре Langer (1990, Science 249: 1527-1533).
Фармацевтические композиции данного изобретения содержат терапевтически эффективное количество аттенуированного вируса и фармацевтически приемлемый носитель. В конкретном варианте, термин "фармацевтически приемлемый" обозначает одобренный органом контроля Федерального правительства или Правительства штата или занесенный в Фармакопею США или другие признанные фармакопеи для применения в животных и, более конкретно, в человеке. Термин "носитель" относится к разбавителю, адъюванту, наполнителю или носителю, с которыми вводят фармацевтическую композицию. Солевые растворы и водные растворы декстрозы и глицерина могут быть также использованы в качестве жидких носителей, в частности, для инъекционных растворов. Подходящие фармацевтические наполнители включают в себя крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, высушенное сепарированное молоко, глицерин, пропиленгликоль, воду, этанол и т.п. Эти композиции могут иметь форму растворов, суспензий, эмульсии, таблеток, пилюль, капсул, порошков, композиций длительного высвобождения и т.п. Эти композиции могут быть приготовлены в виде суппозитория. Пероральная композиция может включать в себя стандартные носители, такие как имеющие фармацевтическую чистоту маннит, лактоза, крахмал, стеарат магния, натрий-сахарин, целлюлоза, карбонат магния и т.д. Примеры пригодных фармацевтических носителей описаны в "Remington's Pharmaceutical Sciences", by E.W.Martin. Такие композиции будут содержать терапевтически эффективное количество терапевтического вещества, предпочтительно в очищенной форме, вместе с подходящим количеством носителя, так чтобы обеспечить форму для правильного введения пациенту. Форма композиции должна подходить для способа введения.
Количество фармацевтической композиции данного изобретения, которое будет эффективным в лечении конкретного нарушения или состояния, будет зависеть от характера нарушения или состояния и может быть определено стандартными клиническими способами. Кроме того, могут быть необязательно использованы тесты in vitro для облегчения определения оптимальных диапазонов доз. Точная доза для использования в композиции будет также зависеть от способа введения и серьезности заболевания или нарушения и должна быть определена в соответствии с оценкой лечащего врача и из обстоятельств каждого пациента. Однако, подходящие диапазоны доз для введения составляют обычно около 104-5×106 БОЕ и дозы могут вводиться один раз или несколько раз с необходимыми интервалами. Фармацевтические композиции данного изобретения, содержащие 104-5×106 БОЕ мутантных вирусов с измененной ИФН-антагонистической активностью, могут вводиться интраназально, внутритрахеально, внутримышечно или подкожно. Эффективные дозы могут быть экстраполированы из кривых доза-ответ, полученных из тест-систем in vitro или модельных систем животных.
6. ПРИМЕР: ГЕНЕРИРОВАНИЕ И ХАРАКТЕРИСТИКА МУТАНТОВ С УКОРОЧЕННЫМ MS1 ВИРУСА ГРИППА А
6.1 МАТЕРИАЛЫ И СПОСОБЫ
Вирус гриппа A/PR/8/34 (PR8) размножали в яйцах с 10-дневными развивающимися эмбрионами при 37°С. Вирус гриппа А 25А-1, рекомбинантный вирус, содержащий NS-сегмент из адаптированного к холоду штамма А/Ленинград/134/47/57, а остальные гены из вируса PR8 (Egorov et al., 1994, Vopr. Virusol. 39: 201-205; Shaw et al., 1996, in Option of the control of influenza III, eds. Brown, Hampson Webster (Elsevier Scienxe) pp.433-436), выращивали в клетках Vero при 34°С. Вирус 25А-1 является чувствительным к температуре в клетках млекопитающего и его использовали в качестве хелперного вируса для спасения трансфектантного вируса NS1/99. Клетки Vero и клетки MDCK, поддерживаемые в минимальной основной среде (MEM), содержащей 1 мкг/мл трипсина (Difco Laboratories, Detroit, Michigan), использовали для выращивания вируса гриппа. Клетки Vero использовали также для отбора, очистки методом бляшек и титрования вируса NS1/99. Клетки MDCK поддерживали в DMEM (минимальной основной среде Дульбекко), содержащей 10% инактивированную нагреванием фетальную телячью сыворотку. Клетки Vero выращивали в среде AIM-V (Life Technologies, Grand Island, NY).
Плазмиду pT3NS1/99, которая содержит усеченную на С-конце форму NS1 из 99 аминокислот, получали следующим образом. Сначала pPUC19-T3/NS PR8, содержащую полный ген NS вируса PR8, фланкированный промотором РНК-полимеразы Т3 и сайтом рестрикции BpuAI, амплифицировали с использованием обратной ПЦР (Ochman et al., 1988, Genetics 120: 621-623) с применением подходящих праймеров. Полученную таким образом кДНК, содержащую усеченный ген NS1, фосфорилировали, обрабатывали фрагментом Кленова, самолигировали и размножали в штамме TG1 Е. coli. Конструкция, полученная после очистки, была названа pT3NS1/99 и ее подтверждали секвенированием. Плазмиды для экспрессии белков NP, PB1, РВ2 и РА вируса PR8 (pHMG-NP, pHMG-PB1, pHMG-PB2 и pHMG-PA) описаны ранее (Pleschka et al., 1996, J.Virol. 70: 4188-4192). pPOLI-NS-RB получали замещением открытой рамки считывания CAT pPOLI-CAT-RT (Pleschka et al., 1996, J. Virol. 70: 4188-4192) продуктом RT-PCR (ПЦР с обратной транскриптазой), полученным из кодирующего района гена NS вируса (WSN) гриппа A/WSN/33. Эта плазмида экспрессирует NS-специфический сегмент вирусной РНК вируса WSN под контролем промотора укороченной полимеразы I человека.
Получение вируса NS1/99 проводили посредством трансфекции рибонуклеопротеина (РНП) (Luytjes et al., 1989, Cell 59: 1107-1113). РНП получали посредством транскрипции РНК-полимеразой Т3 из pT3NS1/99, линеаризованной BpuAI, в присутствии очищенного нуклеопротеина и полимеразы вируса гриппа 25А-1 (Enami, et al., 1991, J.Virol. 65: 2711-2713). РНП-комплексы трансфицировали в клетки Vero, которые предварительно инфицировали вирусом 25А-1. Трансфицированные клетки инкубировали в течение 18 ч при 37°С и супернатант пассировали дважды в клетках Vero при 40°С и очищали методом бляшек три раза в клетках Vero, покрытых агаровым покрытием, при 37°С. Выделенный вирус NS1/99 анализировали RT-PCR (ОТ-ПЦР) с использованием специфических праймеров. Трансфектантный вирус дикого типа получали следующим образом: клетки Vero в чашках 35 мм трансфицировали плазмидами pHMG-NP, pHMG-PB1, pHMG-PB2, pHMG-PA и pPOLI-NS-RB, как описано ранее (Pleschka et al., 1996, J.Virol. 70: 4188-4192). Через 2 дня после трансфекции клетки инфицировали 5×104 БОЕ вируса delNS1 и инкубировали еще два дня при 37°С. Клеточный супернатант пассировали один раз в клетках MDCK и дважды в яйцах с развивающимися эмбрионами. Трансфектантные вирусы клонировали лимитирующим разведением в яйцах. Геномную РНК из очищенного трансфектантного вируса NS1/99 анализировали при помощи электрофореза в полиакриламидном геле, как описано ранее (Zheng et al., 1996, Virology 217: 242-251). Экспрессию укороченного белка NS1 вирусом NS1/99 подтверждали иммунопреципитацией экстрактов меченых инфицированных клеток с использованием кроличьих поликлональных антисывороток против NS1.
Аллантоисную полость куриных яиц с развивающимися эмбрионами в возрасте 6, 10 и 14 дней инокулировали приблизительно 103 БОЕ вирусов PR8, NS1/99 или delNS1 (в котором был делетирован весь ген NS1), инкубировали при 37°С в течение двух дней и вирусы, присутствующие в аллантоисной жидкости, титровали с использованием метода гемагглютинации (НА).
Группам из 5 мышей BALB/c (Taconic Farms) инокулировали интраназально 5×106 БОЕ, 1,5×105 БОЕ или 5×105 БОЕ вируса A/PR/8/34 (PR8) дикого типа или вируса NS1/99. Инокуляции проводили под анестезией с использованием 50 мкл MEM, содержащей подходящее число бляшкообразующих единиц соответствующего вируса. Животных подвергали ежедневному мониторингу и умерщвляли, когда наблюдали in extremis (предсмертное состояние). В следующем эксперименте всех выживших мышей заражали спустя четыре недели дозой 100 LD50вируса PR8 дикого типа. Все процедуры соответствовали руководящим указаниям Национального института здравоохранения (NIH) по уходу и использованию лабораторных животных.
6.2 РЕЗУЛЬТАТЫ: АТТЕНУАЦИЯ ВИРУСОВ ГРИППА А ПОСРЕДСТВОМ ДЕЛЕЦИЙ NS1
Заявители показали ранее, что вирус гриппа А, в котором делетирован ген NS1 (вирус delNS1), способен расти до титров приблизительно 107 БОЕ/мл в клетках, недостаточных по продуцированию интерферона (ИФН) типа I, таких как клетки Vero. Однако этот вирус является ухудшенным в его способности реплицироваться и вызывает заболевание в мышах (Garcia-Sastre et al., 1998, Virology 252: 324). В противоположность этому, вирус delNS1 был способен расти в мышах STAT1-/- и вызывать их гибель. Эти результаты показали, что белок NS1 вируса гриппа является фактором вирулентности, участвующим в ингибировании антивирусных ответов хозяина, опосредованных ИФН типа I. Следующие эксперименты проводили для определения, можно ли генерировать вирусы гриппа со свойствами вирулентности, промежуточными между вирусом дикого типа и вирусом delNS1, делетированием частей гена NS1 и могут ли некоторые из этих вирусов иметь оптимальные характеристики для использования их в качестве живых аттенуированных вакцин против вирусов гриппа, т.е. иметь стабильность и подходящий баланс между аттенуацией, иммуногенностыо и ростом в субстратах, пригодных для получения вакцин, таких как куриные яйца с развивающимися эмбрионами.
Для испытания этой гипотезы, генерировали вирус гриппа A/PR/8/34 (PR8), в котором ген NS1 был модифицирован таким образом, чтобы направлять экспрессию укороченного белка NS1, содержащего только 99 аминокислот на амино-конце всего белка NS1 дикого типа из 230 аминокислот. Этот вирус (NS1/99) получали трансфекцией РНП синтетически сконструированного гена NS с использованием хелперного вируса 25А-1, как описано ранее (Garcia-Sastre et al., 1998, Virology 252: 324). Анализ экспрессии NS1 в инфицированных вирусом клетках выявил укороченный характер белка NS1 вируса NS1-99.
Анализировали способность вирусов delNS1, NS1-99 и вируса PR8 дикого типа расти в куриных яйцах с развивающимися эмбрионами. Обоснование этого эксперимента исходит из того факта, что способность яиц с развивающимися эмбрионами синтезировать ИФН типа I и отвечать на него под действием подходящего стимула является зависимой от возраста. Действительно, как индуцируемость ИФН, так и реагирование на ИФН начинаются в возрасте приблизительно 10 дней и затем экспоненциально увеличиваются с возрастом (Sekellick et al., 1990, In Vitro Cell. Dev. Biol. 26: 997; Sekellick and Marcus, 1985 J.Interferon Res. 5: 657). Таким образом, применение яиц разного возраста представляет уникальную систему для испытания способности различных вирусов ингибировать ИФН-ответы. Яйца в возрасте 6, 10 и 14 дней инокулировали приблизительно 103 БОЕ вирусов PR8, NS1-99 или delNS1, инкубировали при 37°С в течение 2 дней и вирусы, присутствующие в аллантоисной жидкости, титровали с использованием метода гемагглютинации (НА). Как показано в таблице 3, в то время как вирус дикого типа рос до одинаковых НА-титров в яйцах с развивающимися эмбрионами 6-, 10- и 14-дневного возраста, delNS1 реплицировался только до детектируемого НА-титра в 6-дневных яйцах. В противоположность этому, вирус NS1-99 обнаружил промежуточное поведение между вирусом delNS1 и вирусом дикого типа и был способен расти до титров, меньших, чем титры вируса дикого типа в 10-дневных яйцах, но не в 14-дневных яйцах.
Затем на мышах определяли характеристики аттенуации вируса NS1-99. Для этой цели группы из 5 мышей BALB/c инфицировали интраназально 5×106 БОЕ, 1,5× 105 БОЕ или 1,5×103 БОЕ вируса дикого типа PR8 или вируса NS1-99. Затем мышей подвергали мониторингу в течение 3 недель на выживание. Результаты приведены в таблице 4. Вирус NS1-99 имел LD50 по меньшей мере на три log более высокую, чем LD50вируса дикого типа.
7. ПРИМЕР: ГЕНЕРИРОВАНИЕ И ХАРАКТЕРИСТИКА МУТАНТОВ С УКОРОЧЕННЫМ NS1 В ВИРУСЕ ГРИППА В
7.1 МАТЕРИАЛЫ И СПОСОБЫ
Экспериментальные подробности сходны с подробностями в разделе 6.1. Два мутантных вируса гриппа В, В/610В5В/201 (В/201) и B/AWBY-234, длиной 127 аминокислот и 90 аминокислот (укороченные на С-конце белки NS1), соответственно (Norton et al., 1987, Virology 156: 204; Tobita et al., 1990, Virology 174: 314), получали из экспериментов с коинфицированием в культуре ткани с использованием вирусов B/Yamagata/1/73 (B-Yam) и A/Aichi/2/68 в присутствии антитела против вируса A(H3N2). Рост этих мутантных вирусов гриппа в яйцах с развивающимися эмбрионами разного возраста сравнивали с ростом родительского вируса B/Yam, который обладает белком NS1 дикого типа из 281 аминокислоты. Яйца в возрасте 6, 10 и 14 дней инокулировали приблизительно 103БОЕ вирусов B-Yam, B/201 или B/AWBY-234, инкубировали при 35°С в течение 2 дней и вирусы, присутствующие в аллантоисной жидкости, титровали с использованием НА-теста.
Далее, характеристики аттенуации вирусов B/201 и B/AWBY-234 определяли в мышах. Группы из 3 мышей BALB/c инфицировали интраназально 3×105 БОЕ вируса дикого типа B/YAM или мутантных вирусов B/201 и B/AWBY/234 и способность этих вирусов реплицироваться определяли измерением вирусных титров в легких в день 3 после инфекции, так как вирус дикого типа B/YAM не индуцировал видимых признаков заболевания в мышах.
7.2 РЕЗУЛЬТАТЫ
Результаты роста мутантных вирусов и вируса дикого типа гриппа В в куриных яйцах с развивающимися эмбрионами, показанные в таблице 5, демонстрируют, что, как и в случае вирусов гриппа А, карбокси-концевое усечение NS1 вируса гриппа В является ответственным за более низкий выход репликации в куриных яйцах с развивающимися эмбрионами большего возраста, которые устанавливают эффективный ИФН-ответ. Это открытие показывает, что NS1 вируса гриппа В также участвует в ингибировании ИФН-ответов в хозяине и что делеции на гене NS1 вируса гриппа В приводят к аттенуированному фенотипу.
Результаты из экспериментов по репликации в мышах приведены в таблице 6. Титры вирусов В/201 и B/AWBY-234 были приблизительно на 3 log более низкими, чем титры B/Yam, указывая на то, что усечения карбокси-концевого домена NS1 вируса гриппа В являются ответственными за аттенуированный фенотип в мышах.
8. ЗАЩИТА ПРОТИВ ИНФЕКЦИИ ВИРУСА ГРИППА ДИКОГО ТИПА В МЫШАХ, ИММУНИЗИРОВАННЫХ ВИРУСАМИ ГРИППА А И В, СОДЕРЖАЩИМИ ДЕЛЕЦИИ В ИХ БЕЛКАХ NS1
Для определения, были ли мыши, иммунизированные аттенуированными вирусами гриппа А и В, содержащими укороченные белки NS1, защищены против заражения соответствующими им вирусами дикого типа, проводили следующий эксперимент. Мышей BALB/c иммунизировали интраназально вирусом A/NS1-99, а спустя три недели их инфицировали 100 LD50 вируса гриппа дикого типа A/PR/8/34. Иммунизированные животные были защищены от летального исхода, тогда как контрольные неиммунизированные мыши погибали после заражения (см. таблицу 7). Во втором эксперименте, мышей BALB/c иммунизировали интраназально вирусами гриппа В/201 или B/AWBY-234, экспрессируюшими укороченные белки NS1. Спустя три недели этих мышей заражали 3х105 БОЕ вируса дикого типа B/Yam/1/73. Поскольку этот штамм вируса гриппа В не индуцирует симптомы заболевания у мышей, степень защиты определяли измерением вирусных титров в легких в день 3 после заражения. В то время как неиммунизированные контрольные животные имели титры около 104 БОЕ/легкое, в легких иммунизированных животных не были обнаружены вирусы (см. таблицу 8). Эти открытия предполагают, что вирус гриппа А, а также вирус гриппа В, содержащие модифицированные гены NS1, способны индуцировать иммунный ответ в мышах, который является полностью защитным против последующего заражения вирусом дикого типа.
9. ПРИМЕР: ИНДУКЦИЯ ИНТЕРФЕРОНА ТИПА I В ЯЙЦАХ С РАЗВИВАЮЩИМИСЯ ЭМБРИОНАМИ, ИНФИЦИРОВАННЫХ ВИРУСОМ delNS1
Затем определяли способность вируса delNS1, вируса гриппа А, не имеющего гена NS1, индуцировать секрецию ИФН типа I в куриных яйцах с развивающимися эмбрионами. Для этой цели группы из двух куриных яиц с развивающимися 10-дневными эмбрионами инфицировали 5×103 БОЕ вирусов delNS1 или PR8 дикого типа. После восемнадцати часов постынкубации при 37°С аллантоисную жидкость собирали и диализовали против кислого рН в течение ночи для инактивации инфекционных вирусов. После обработки кислым рН пробы диализовали против ЗФР и их испытывали на активность ИФН определением наивысшего разведения с защитной активностью против инфекции VSV (приблизительно 200 БОЕ) в клетках CEF. Результаты, приведенные в таблице 9, показывают, что в отсутствие NS1 вирусы гриппа А являются более сильными индукторами ИФН.
10. ПРИМЕР: АНТИВИРУСНАЯ АКТИВНОСТЬ ВИРУСА delNS1
Элиминация гена-антагониста (NS1) ИФН из вируса гриппа А может приводить к получению вируса со способностью индуцировать высокие уровни ИФН. Если это имеет место, то вирус delNS1 будет "мешать" репликации ИФН-чувствительных вирусов. Для испытания этой возможности авторы изобретения исследовали способность вируса delNS1 ингибировать репликацию вируса гриппа A/WSN/33, обычно используемого лабораторного штамма вируса гриппа, в яйцах. Как можно видеть на фиг.1, обработка всего лишь 2 БОЕ вируса delNS1 была способна уменьшать конечные титры вируса WSN в аллантоисной жидкости на один log. Кроме того, обработка 2×104 БОЕ вируса delNS1 приводила к практически полному подавлению репликации WSN в яйцах. Вирус delNS1 был также способен препятствовать репликации в яйцах других штаммов вируса гриппа A (H1N1 и H3N2), вируса гриппа В и отличающегося вируса, такого как вирус Sendai (фиг.2).
Воодушевленные этими результатами, авторы изобретения определили затем способность вируса delNS1 противодействовать репликации вируса гриппа дикого типа в мышах. Хотя обработка ИФН типа I в культуре ткани предотвращает репликацию вируса гриппа A in vitro, обработка мышей ИФН не была способна ингибировать репликацию вирусов гриппа (Haller, 1981, Current Top Microbiol Immunol 92: 25-52). Это является верным для большинства инбредных штаммов мышей, за исключением мышей A2G. Мыши A2G, а также значительная часть диких мышей (приблизительно 75%) содержат по меньшей мере один интактный аллель М×1, тогда как большинство лабораторных животных являются М×1-/- (Haller, 1986, Current Top Microbiol Immunol 127: 331-337). Белок Mx1, который является гомологом белка М× А человека (Aebi, 1989, Mol. Cell. Biol. 11: 5062), является сильным ингибитором репликации вируса гриппа (Haller, 1980, Nature 283: 660). Этот белок не экспрессируется конститутивно, но его экспрессия транскрипционно индуцируется ИФН типа I. Таким образом, мыши A2G могут быть использованы для испытания способности ИФН-индукторов стимулировать антивирусный ответ против вирусов гриппа A (Haller, 1981, Current Top Microbiol Immunol 92: 25-52).
Авторы изобретения инфицировали интраназально восемь 4-недельных мышей A2G 5×106 БОЕ высокопатогенного вирусного изолята гриппа A/PR/8/34 (Haller, 1981, Current Top Microbiol Immunol 92: 25-52). Половина мышей получала интраназальную обработку 5×106 БОЕ delNS1 при -24 часах относительно инфицирования PR8. Остальных четырех мышей обрабатывали ЗФР. Проводили мониторинг изменений веса и выживания. Эти результаты показывают, что обработка delNS1 была способна защищать мышей A2G против индуцированных вирусом гриппа смерти и потери веса. Та же самая обработка не была эффективной в мышах М×1-/-, что указывало на то, что механизм защиты от вируса был опосредован М×1, т.е. ИФН.
11. ПРИМЕР: ПРОТИВООПУХОЛЕВЫЕ СВОЙСТВА ВИРУСА delNS1 В МЫШАХ
При условии, что ИФН типа I и/или индукторы ИФН типа I, как было показано, обладают противоопухолевыми активностями (Belardelli and Gresser, 1996, Immunology Today 17: 369-372; Qin et al., 1998, Proc. Natl. Acad. Sci. 95: 14411-14416), возможным является то, что обработка опухолей вирусом delNS1 сможет медиировать регресс (обратное развитие) опухолей. Альтернативно, вирус delNS1 может иметь онколитические свойства, т.е. он может быть способным специфически расти в опухолевых клетках и убивать опухолевые клетки, многие из которых, как известно, являются недостаточными в отношении ИФН-системы. Для испытания противоопухолевой активности вируса delNS1 проводили следующий эксперимент с использованием линии мышиной карциномы CT26. WT в мышиной модели опухоли для легочного метастазирования (Restifo et а1., 1998, Virology, 249: 89-97). 5×105 клеток CT26. WT инъецировали внутривенно в двенадцать 6-недельных мышей BALB/c. Половину этих мышей обрабатывали интраназально 106БОЕ вируса delNS1 каждые 24 ч при днях 1, 2 и 3 после инокуляции. Спустя двенадцать дней после инъекции опухоли мышей умерщвляли и подсчитывали число легочных метастазов. Как показано в таблице 10, обработка delNS1 опосредовала значимый регресс метастазов в легких мышей.
12. ПРИМЕР: БЕЛОК NS1 ИНГИБИРУЕТ ТРАНСЛОКАЦИЮ IRF-3 ВО ВРЕМЯ ИНФЕКЦИИ ВИРУСА ГРИППА
Результаты, описанные здесь, предполагают, что белок NS1 вируса гриппа является ответственным за ингибирование ответа ИФН типа I против этого вируса и что мутации/делеции в этом белке приводят к аттенуированным вирусам вследствие усиленного ИФН-ответа по время инфекции. Известно, что синтез ИФН типа I во время вирусной инфекции может запускаться двухцепочечной РНК (dsPHK). IRF-3 является фактором транскрипции, который обычно обнаруживается в неактивной форме в цитоплазме клеток млекопитающих. Двухцепочечная РНК индуцирует фосфорилирование (активацию) фактора транскрипции IRF-3, приводя к его транслокации в ядро, где он индуцирует транскрипцию специфических генов, кодирующих ИФН типа I (Weaver et al., 1998, Mol. Cell. Biol. 18: 1359). Для определения, действует ли NS1 вируса гриппа на IRF-3, локализацию IRF-3 в клетках CV1, инфицированных PR8 дикого типа или вирусом гриппа A delNS1, подвергали мониторингу. Фиг. 3 показывает, что транслокация IRF-3 является минимальной в PR8-инфицированных клетках (в менее чем 10% клеток). В противоположность этому, приблизительно 90% deINS1-инфицированных клеток обнаружили ядерную локализацию IRF-3. Поразительным образом, можно было частично ингибировать транслокацию IRF-3 в delNS1-инфицированных клетках экспрессией NS1 из плазмиды в трансположении. Эти результаты показывают, что белок NS1 вируса гриппа А способен ингибировать транслокацию IRF-3 в инфицированных вирусом клетках. Вероятно, NS1 вируса гриппа предотвращает опосредованную delNS1 активацию IRF-3 связыванием dsPHK, генерируемой во время вирусной инфекции, приводя таким образом к ингибированию синтеза ИФН.
Данное изобретение не должно ограничиваться в его объеме описанными характерными вариантами, которые приведены в качестве отдельных иллюстраций индивидуальных аспектов данного изобретения, и любые конструкции или вирусы, которые являются функционально эквивалентными, находятся также в объеме данного изобретения. Действительно, разнообразные модификации данного изобретения, кроме представленных и описанных здесь, будут очевидными для специалистов в данной области из приведенного выше описания и сопутствующих чертежей. Имеется в виду, что такие модификации находятся в объеме прилагаемой формулы изобретения.
Здесь цитируются многочисленные ссылки, описания которых включены в качестве полных ссылок










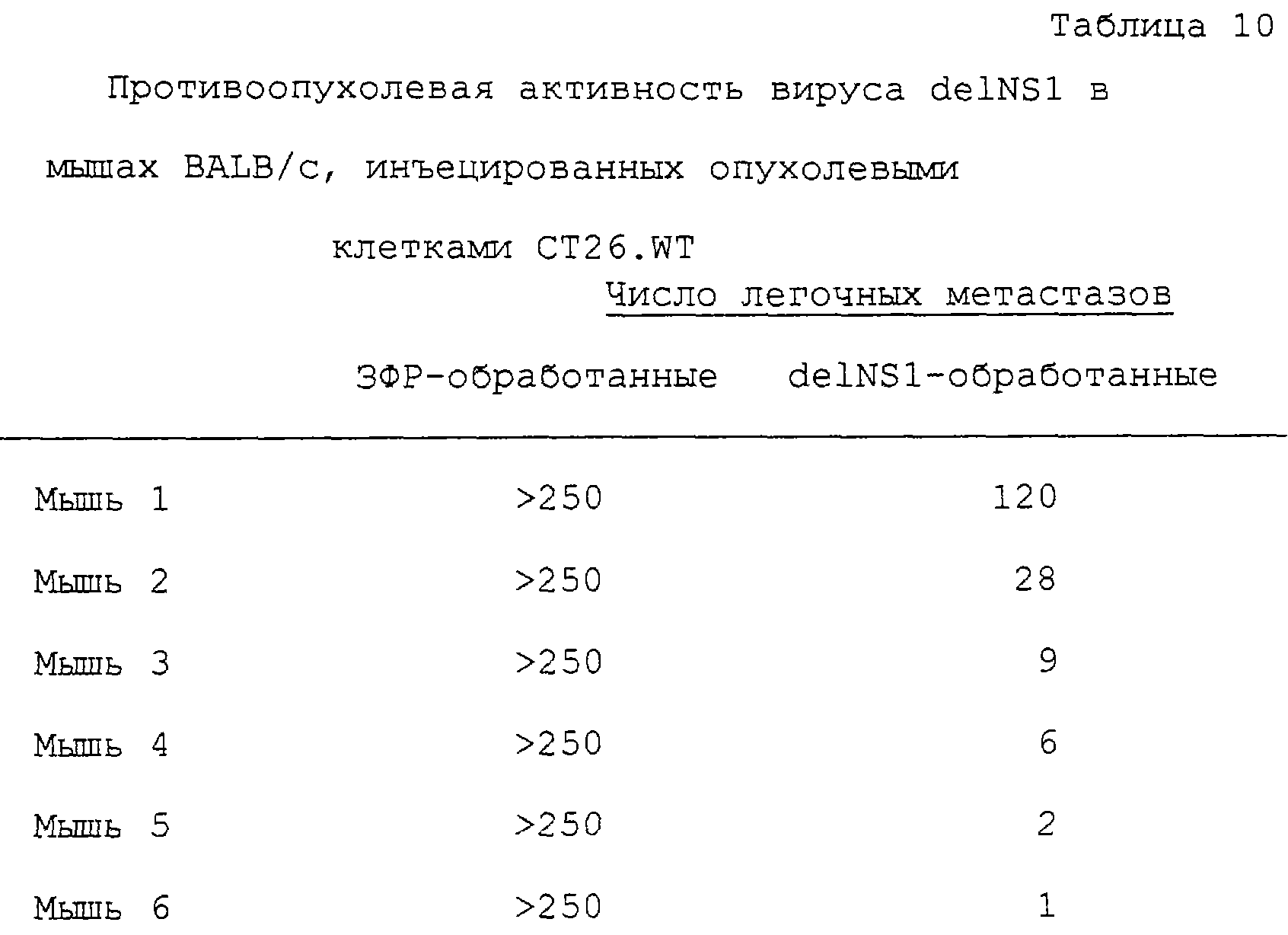
Реферат
Данное изобретение относится в общем к аттенуированным РНК-вирусам с минус-цепью, имеющим нарушенную способность противодействовать клеточному интерферон-(ИФН)-ответу, и применению таких аттенуированных вирусов в вакцинных и фармацевтических композициях, также к развитию и применению ИФН-недостаточных систем для отбора таких аттенуированных вирусов. В частности, данное изобретение относится к аттенуированным вирусам гриппа, имеющим модификации, относящиеся к гену NS1, которые уменьшают или устраняют способность продукта гена NS1 противодействовать клеточному ИФН-ответу. Эти мутантные вирусы реплицируются in vivo, но демонстрируют уменьшенную патогенность и, следовательно, хорошо пригодны для применения в живых вирусных вакцинах и фармацевтических композициях. Преимущество изобретения заключается в разработке препаратов на основе аттенуированных вирусов, позволяющих обеспечить иммунный ответ, достаточный для удовлетворения последующих заражений. 23 н. и 27 з.п. ф-лы, 10 табл., 3 ил.
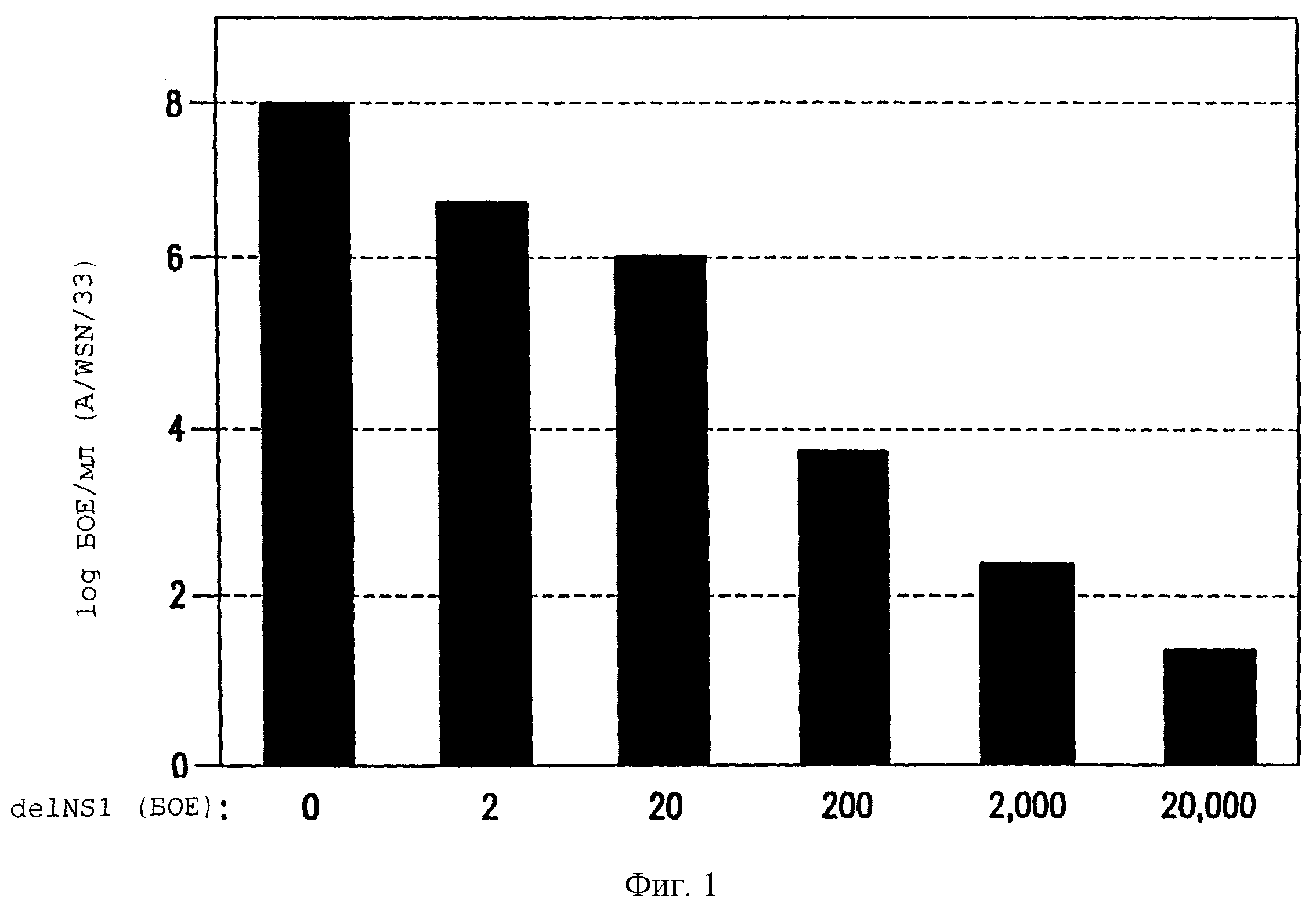

Комментарии