Способ репликации вируса в птичьих эмбриональных стволовых клетках - RU2457253C2
Код документа: RU2457253C2
Чертежи






















Описание
Область техники
Настоящее изобретение относится к созданию и производству противовирусных вакцин. В частности, изобретение относится к области промышленного производства вирусных векторов и противовирусных вакцин, в особенности, к применению клеток птиц, предпочтительно к линии куриных эмбриональных стволовых клеток, для производства вирусных векторов и противовирусных вакцин. Изобретение особенно полезно для промышленного производства противовирусных вакцин с целью защиты людей и животных от заражения вирусом.
Предшествующий уровень техники
Массовая вакцинация могла бы быть самым простым и наиболее эффективным подходом в контроле вирусных пандемий, таких как пандемические и межпандемические вспышки гриппа, а также способом предупреждения угрозы биотерроризма, такой как недавние террористические акты, включающие распространение сибирской язвы в США. Однако для многих противовирусных вакцин, таких как вакцины против гриппа и оспы, которые в настоящее время производят в аллантоисной системе, наиболее вероятно, что имеющийся в настоящее время объем производственных мощностей производящих вакцины предприятий не достаточен для покрытия нужд, которые могут возникнуть в случае пандемий или атаки биотеррористов.
С непредсказуемыми интервалами и в дополнении к сезонным умеренным эпидемиям гриппа, которые вызываются антигенной изменчивостью или рекомбинациями, возникают антигенные изменчивости с появлением полностью новых подтипов вирусов гриппа, против которых не существует иммунитета в человеческой популяции. Они вызывают глобальные пандемии, которые быстро распространяются по всему миру. Три таких пандемии произошли в прошлом веке (1918, 1957, 1968). Наиболее суровая была в 1918, в ходе которой заразилось приблизительно 50% мировой популяции, примерно 25% от всех клинических заболеваний; общая смертность оценивалась между 20-40 миллионами, особенно поражая людей, находившихся в расцвете сил. Эта пандемия затормозила рост популяции в течение следующих 10 лет. Последняя вспышка с высокой смертностью и высоким пандемическим потенциалом случилась в 1997 г., когда в Гонгконге появился новый вирус гриппа (H5N1), убивший треть пораженных пациентов, в основном молодых взрослых людей. К счастью, вирус не был способен распространяться от человека к человеку, и существовала возможность быстро остановить вспышку. Похожий вирус был изолирован в Гонгконге в 2003 г. Предсказывается, что в США возникновение новой пандемии приведет к 18-42 миллионам амбулаторных обследований, к 314,000-734,000 госпитализаций и к 89,000-207,000 смертей, учитывая, что следующая пандемия будет столь же значительной, как пандемии 1957 или 1968 г., но не такой как пандемия 1918 г. (Meltzer MI, Cox NJ and Fukuda К. The economic impact of pandemic influenza in the United States: priorities for intervention. Emerging Infectious Diseases 1999; 5:659-671). Если оценить это предсказываемое воздействие по отношению к всемирной популяции, то можно сделать макрооценку всемирного воздействия следующей пандемии, которая по расчетам будет составлять 1-2 биллиона случаев гриппа, 5.3-12.3 миллионов заболеваний в тяжелой форме и 1.5-3.5 смертей. Помимо потенциальных пандемий, ежегодные эпидемии гриппа, вызываемые вариантами, возникающими в результате дрейфа генов вариантов вируса А и В, заражают примерно 10-20% населения каждый сезон и приводят к лихорадочным заболеваниям, госпитализациям и смертям. Непрямые статистические методы, применяемые для оценок общей тяжести гриппа, включают различные статистические модели, по которым можно рассчитать сезонное увеличение заболеваемости и смертности в течение эпидемических периодов гриппа (Simonsen L., Clarke MJ, Williamson GD, Stroup DF, Arden NH, Schonberger LB. The impact of influenza epidemics on mortality: introducing a seventy index. Am J. Public Health 1997; 87:1944-1950). Оцененный по этой методике сезон гриппа в США в настоящее время связан, в среднем, с 25-50 миллионами случаев заболевания гриппом, 150,000 госпитализаций и 20,000-40,000 смертей. Учитывая, что возраст специфического риска заболеваемости гриппом сходен с возрастом, показанным в США, ежегодная средняя всемирная тяжесть межпандемического гриппа, может быть порядка примерно 1 биллиона случаев заболевания гриппом, примерно 3-5 миллионов случаев тяжелых заболеваний и 250,000-500,000 смертей (см. WHO report, Geneva, April 2003: State of the art of new vaccines Research & Development - Initiative for Vaccine Research).
Доступные в настоящее время противогриппозные вакцины эффективны для предотвращения межпандемических, связанных с гриппом заболеваний и высокоэффективны в смысле предупреждения госпитализации и смерти. Несмотря на эти успехи в развитых и развивающихся странах, этот результат до сих пор не был достигнут ни в одной из «групп населения повышенного риска», что частично связано с относительно высокой ценой вакцины и необходимостью ежегодной ревакцинации. Тем не менее, совсем недавно по всему миру началось увеличение применения вакцины против гриппа, количество которой достигло примерно 235 миллионов доз в 2003 г., но до сих пор существует значительный разрыв между потребностью в вакцине и современным объемом производства вакцины. Так, по оценкам Всемирной Организации Здравоохранения (ВОЗ) существует примерно 1.2 биллиона людей с «высоким риском» тяжелых последствий гриппа (пожилые люди в возрасте примерно 65 лет, дошкольники, дети школьного возраста, взрослые с хроническими проблемами со здоровьем, здоровый медицинский персонал, …).
Применяемая в настоящее время система производства лицензионной вакцины против гриппа на основе яиц, несмотря на то, что она была испытана на протяжении более чем 50 лет, имеет некоторые ограничения, включая:
- растянутый, громоздкий и дорогостоящий производственный способ, требующий контроля поставок и качества огромного количества яиц для каждой индивидуальной компании-производителя. Эта применяемая в настоящее время система производства не побуждает новые фармацевтические компании включаться в бизнес по производству культивируемых в яйцах вакцин, так как потенциальный размер прибыли очень низок;
- необходимость выбирать, какой штамм вируса будет в вакцине, по меньшей мере, за 6 месяцев до начала сезона гриппа. Это принимаемое заранее решение, касающееся того, какой штамм необходимо включить в вакцину против гриппа, не всегда бывает правильным, и для производства вакцины требуется длительное время, что делает невозможным провести коррекцию после того, как способ уже запущен;
- необходимость в производстве достаточного количества вакцины против гриппа каждый год все время сталкивается с увеличивающимися потребностями в вакцине (примерно 250 миллионов доз в индустриальных странах в 2004 г., примерно 100 миллионов доз только в США). Последний раз недостаток в вакцине против гриппа в США зимой 2004-2005 гг. был связан с инфицированностью расположенной в Великобритании фабрики по производству аллантоисных противогриппозных вакцин, производитель предавал большое значение этой проблеме. К тому же, возможности производства вакцины против гриппа во всем мире не достаточны для того, чтобы удовлетворить часть всемирной популяции «высокого риска». В действительности, сомнительно, что всемирная инфраструктура способна справиться с регулярными поставками и распространением вакцин против пандемии гриппа;
- потребность в сотнях миллионов оплодотворенных куриных яиц для производства вакцины, что связано с риском недостаточного снабжения яйцами в случае эпидемических инфекций в стаях куриц-доноров;
- необходимость в случаях живого ослабленного вируса гриппа применять дорогостоящие специфические свободные от патогенов (SPF) куриных яиц;
- затраты на инфляцию, связанные с применением бычьей сыворотки, получаемой из стран, свободных от BSE (губчатой энцефалопатии крупного рогатого скота);
- аллергическая реакция некоторых индивидуумов на компоненты куриных яиц;
- невозможность применения яиц для размножения вирусов, высоковирулентных и летальных для кур.
Дополнительно технология производства вакцин в настоящее время приводит к выпуску узкого спектра вакцин, и, следовательно, мало вероятно, что имеющаяся в запасе вакцина способна полностью защитить от нового пандемического штамма вируса гриппа.
Альтернативно угроза биотерроризма, ставшая главной заботой для многих правительств западных стран в последние годы, особенно после последних террористических актов с применением сибирской язвы. Правительство Соединенных Штатов предприняло соответствующие меры для быстрого обнаружения, защиты и реагирования на биологические атаки путем осуществления «Акта готовности и ответа на биотерроризм» (Bioterrorism Preparedness and Response Act) в 2002 г. Биологическое оружие действительно сравнительно доступно и применяется биотеррористическими организациями как дешевый и эффективный способ угрозы и запугивания население и правительства. В частности, в последние годы участились случаи применения вируса оспы в качестве биологического оружия, и некоторые страны разрабатывают чрезвычайные планы, предусматривающие подобный риск.
Считается, что оспа, вслед за чумой, сибирской язвой и ботулизмом имеет наибольший потенциал для того, чтобы произвести невосстановимые потери в случае намеренного рассеяния. В 1980 г. было объявлено, что оспа искоренена, и с этого момента все страны мира остановили свои программы вакцинации против оспы. Это привело к постоянному снижению иммунитета к заражению вирусом у населения, что сделало вирус оспы еще более опасным средством в случае биотерроризма. Центр контроля заболеваний США (The US Center for Disease Control (CDC)) классифицировал оспу как биотеррористический фактор класса А, т.е. поместил ее среди наиболее опасных микроорганизмов, которые легко распространяются и обладают высоким коэффициентом смертности.
Быстрая массовая вакцинация могла бы быть идеальным подходом контроля при вспышке оспы. Правительство Соединенных Штатов взяло на себя инициативу обеспечить дополнительный запас вакцины, вакцинировать военных и основных медицинских работников и создать программу разработки надежной вакцины, которая подходила бы любому жителю, независимо от состояния его здоровья. Правительства других стран следят за успехами в США и оценивают свою собственную готовность к критической ситуации.
В недавнем прошлом правительства как приобретали, так и производили свои собственные штаммы первого поколения в государственных лабораториях или объявляли коммерческие тендеры. Было показано, что вакцины первого поколения, получаемые прямо от животных, были эффективными; однако, они часто содержали примеси и бактерии, которые значительно увеличивали шанс отрицательных реакций и осложнений, особенной у людей с ослабленным иммунитетом. С момента уничтожения оспы ограниченное число фармацевтических компаний были способны быстро включиться в производство вакцины против оспы. Из этой группы еще меньшее число фармацевтических компаний были способны производить вакцины второго поколения, применяя штаммы коровьей оспы Dryvax® и Lister-Elstree в подходящих клеточных культурах, в соответствии со стандартами производства. Однако, как и в случае с вакцинами первого поколения, эти вакцины также не подходили для людей с ослабленным иммунитетом. Массовая вакцинация вакцинами первого и второго поколений могла приводить к осложнениям, способными убить одного из миллиона человек и привести к серьезным заболеваниям в 10 из миллиона случаев. Поэтому в нескольких фармацевтических компаниях была разработана надежная вакцина третьего поколения. Вакцины третьего поколения были основаны на штамме модифицированного осповакцинного вируса Анкара (Modified Vaccinia Ankara (MVA)), применяемого во время кампании по искоренению оспы в Германии 1970-х гг. В ходе клинических испытаний введение MVA примерно 150,000 человек, включая тех, которые как считалось, рискуют при стандартной вакцинации против оспы, не сопровождалось значительными побочными эффектами.
Все эти вакцины против оспы производили на первичных фибробластах эмбрионов кур, изолированных из куриных эмбрионов. Эти способы производства связаны с несколькими серьезными ограничениями, включая:
- растянутый, громоздкий и затратный производственный способ, требующий контроля поставок и качества огромного количества яиц или СЕF для каждой индивидуальной компании, поставляющей продукцию.
- необходимость во многих случаях применять дорогостоящие специфические свободные от патогенов (SPF) куриные эмбрионы;
- риски недостаточного снабжения яйцами в случае эпидемических инфекций в стаях куриц-доноров;
- затраты на инфляцию, связанные с применением бычьей сыворотки, получаемой из свободных от BSE стран;
- аллергическую реакцию некоторых индивидуумов на яйца;
- невозможность применения яиц для размножения высоковирулентных и летальных для кур вирусов.
Поскольку способ производства, основанный на применении яиц и CEF, остается надежным способом, эффективная система производства, основанная на клетках, представляла бы значительное усовершенствование в предоставлении быстрого, дешевого и менее громоздкого способа культивирования вирусов. К тому же, в случае пандемии гриппа основанный на клеточной культуре производственный способ предоставляет дополнительные преимущества:
- производство вакцины против гриппа можно начать немедленно после того, как пандемический штамм будет идентифицирован, изолирован и распространен;
- нет необходимости дожидаться развития так называемой выборки сильного роста High Growth Reassortants (реассортативных вирусов, адаптированных к росту с высоким выходом в куриных яйцах с зародышами), необходимой для производства в яйцах;
- готовность первой партии вакцины приблизительно через 9 недель после получения штамма, вместо 6-9 месяцев в способе с использованием яиц;
- применение способа на основе клеточной культуры позволяет производить штаммы, которые не могут быть адекватно выращены в яйцах (например, Avian Hong Kong Flu в 1997);
- не существует проблемы нехватки яиц во время пандемии.
К тому же, применение клеточных линий для производства противовирусных вакцин, вместо способов, основанных на применении яиц или CEF, будет иметь следующие дополнительные преимущества, связанные с безопасностью вакцины: в рецептуре вакцины нет антибиотиков; не нужны токсические консерванты (такие как тиомерсал); сниженные уровни эндотоксинов, нет проблемы аллергии к яйцам; рост в среде, свободной от белков и сыворотки (нет случайных факторов/BSE); высокая чистота препарата противовирусной вакцины.
Следовательно, существует насущная необходимость в усовершенствовании имеющихся в настоящее время технологий производства противовирусной вакцины, основанных на применении яиц или куриных эмбриональных фибробластов. Разработка способов, применяющих клеточные культуры в производстве противовирусных вакцин, в качестве альтернативы системам продуцирования, основанным на применении яиц или CEF, представляет собой, вероятно, наиболее быстрый и многообещающий путь для преодоления имеющихся в настоящее время узких мест и ограничений, накладываемых временем. К тому же, технология производства с применением клеточных культур усовершенствует возможность наращивания мощностей при производстве вакцины перед лицом пандемии или террористической атаки.
На основании этих специальных требований заявитель может использовать в своих интересах специальные знания в области биологии птиц и птичьих эмбриональных стволовых клеток (ES) для того, чтобы предпринять разработку новых стабильных птичьих клеточных линий, способных к эффективной репликации вакцин, применимых для лечения людей и в ветеринарии, и вакцин на стадии разработки, таких, которые будут удовлетворять промышленным, регулятивным и медицинским спецификациям. Применяя патентование (см. WO 03/076601 и WO 05/007840), заявитель, таким образом, создал серию хорошо охарактеризованных и документально подтвержденных клеточных линий (клетки ЕВх®), которые были произведены из куриных ES-клеток без генетических и химических этапов или этапа вирусной иммортализации. ЕВх®-клетки были созданы с применением полностью документально подтвержденного двухстадийного способа, и принимая во внимание регулятивные требования:
Стадия 1: Выделение, культивирование in vitro и рост куриных ES-клеток
Эмбриональные стволовые клетки являются уникальными по следующим критериям: (i) они способны к неограниченному самообновлению in vitro как недифференцированные клетки; (ii) они обладают неограниченной регенерационной способностью; (iii) они поддерживают постоянный хромосомный набор; (iv) они экспрессируют высокий уровень теломеразы и специфических маркеров клеточной поверхности. Несмотря на многочисленные попытки, ES-клетки были успешно выделены только из очень ограниченного числа видов (мыши, человека, обезьян). Заявитель проанализировал значительный объем информации за последние годы по возможностям выделения и создания ES-клеток из различных видов птиц. В результате таких интенсивных исследований появилась возможность успешно выделить и охарактеризовать куриные ES-клетки [Pain et al. 1999. Cell Tissues Organs 165:212-219]. Заявитель затем разработал патентованный метод, позволяющий эффективно культивировать in vitro и выращивать в крупных масштабах куриные ES-клетки без индукции дифференциации.
Стадия 2: Получение ЕВх® клеток
Затем заявитель создал патентованный метод получения из куриных ES-клеток устойчивой прикрепленной к субстрату клеточной линии и клеточных линий в виде суспензии. Способ включает постепенное удаление сыворотки, фидерных клеток и факторов роста из клеточной культуральной среды и адаптацию клеток к культуре в виде суспензии. Эти полученные из эмбриональных куриные клеточные линии поддерживают большинство из желаемых признаков ES-клеток (например, неограниченную пролиферацию, экспрессию специфических ES-маркеров, таких как теломераза, стабильность кариотипа), но, дополнительно, они демонстрируют новые «удобные для промышленности» ("industrial-friendly") черты (рост в виде суспензии в свободной от сыворотки среде).
Основываясь на их привлекательных биологических свойствах, заявитель выбрал некоторые куриные клеточные линии ЕВх® для дальнейшей разработки, такие как прикрепленные к подложке клеточные линии ЕВ45 (также называемые S86N45 в патентах WO 03/076601 и WO 051007840), из которых была произведена суспензионная клеточная линия ЕВ14. Более предпочтительные куриные ЕВх®-клетки изобретения выбирали из клеточных линий ЕВ45 и ЕВ 14. В более предпочтительном воплощении куриной клеточной линией ЕВх® была линия ЕВ14 или ее субклон ЕВ14-074. Для простоты линии ЕВ14 и ЕВ14-074 в этом документе будут называться ЕВ14. Клетки ЕВ45 и ЕВ14 демонстрируют фенотип эмбриональных стволовых клеток (например, высокое ядерно-цитоплазматическое отношение) в долгосрочной культуре (>150 пассажей). Клетки ЕВ45 и ЕВ14 - это маленькие клетки с большим ядром и ядрышками, у них наблюдаются короткие псевдоподии, вытягивающиеся из плазматической мембраны (Фигура 1). Клетки ЕВ45 и ЕВ14 метаболически высокоактивны и характеризуются цитоплазмой, богатой рибосомами и митохондриями. Генетический анализ клеток ЕВ45 и ЕВ14 показал, что они мужского пола, диплоидные и генетически стабильные при размножении (Фигура 2). Клетки ЕВ45 и ЕВ14 экспрессируют щелочную фосфатазу, специфические для стволовых клеток маркеры клеточной поверхности, такие как ЕМЕА-1 и SSEA-1 (Фигура 5) и специфический для ES-клеток ген ENS1 (Фигура 4). Особенно важно то, что клетки ЕВ45 и ЕВ14 экспрессируют также высокий уровень теломеразной энзиматической активности, которая стабильно поддерживается от пассажа к пассажу (Фигура 3). Теломераза представляет собой ключевой фермент в том смысле, что она способствует постоянному клеточному росту и хромосомной стабильности. Анализ на онкогенность, проводимый в течение трех недель и 2.5 месяцев в модели с новорожденными крысами с подавленным иммунитетом, показал, что in vivo ЕВ14 клетки не являются онкогенными. Клетки ЕВ45 и ЕВ14 характеризуются очень коротким временем размножения, около 16 часов при 39°С (температура тела у кур) и около 20 часов при 37°С.Следовательно, эти клеточные линии обладают уникальными свойствами, делающими их более эффективными, безопасными и рентабельными клеточными субстратами для промышленного производства противовирусных вакцин, таких как вакцины против гриппа и оспы.
ЕВх®-клетки, и, в особенности, клетки ЕВ14 изобретения могут иметь высокую ценность для производства вакцины против гриппа и оспы, а также других основных противовирусных вакцин для людей и животных (см. Таблицу), которые в настоящее время производят с помощью яиц с зародышами или с помощью первичных куриных фибробластов, таких как вакцина против кори, эпидемического паротита, желтой лихорадки, или проходящие клиническое испытание поксвирусы, применяемые против инфекционных заболеваний, таких как HIV или опухоли. Полученные к настоящему времени данные уже показали возможности клеточной линии ЕВх®, и, в особенности, ее возможности для репликации некоторых рекомбинантных вирусов и вирусов дикого типа. Например, в предварительных экспериментах было установлено, что ЕВх®-клетки способствуют репликации вируса гриппа (см. приоритетный французский документ, заявка на патент FR 0503583, зарегистрированная 11 апреля 2005, пример 3, страницы от 30 до 41) и модифицированного осповакцинного вируса Анкара (Modified Vaccinia vims Ankara (MVA)) (см. WO 05/007840).

Перечисленные выше уникальные свойства клеток ЕВх®, и, в особенности, клеток ЕВ14, предполагают создание специфического способа для производства противовирусных вакцин в клетках ЕВх®. Действительно, без того чтобы быть связанным теорией, высокий метаболический уровень клеток ЕВх® требует, чтобы клеточная культуральная среда предоставляла достаточно энергии клеткам с целью обеспечения клеточного роста и репликации вирусов. Целью настоящего изобретения было обеспечение новаторского и эффективного производственного способа, в основе которого лежит применение птичьих эмбриональных стволовых клеток ЕВх®, в особенности, клеток ЕВ14, для промышленного производства противовирусных вакцин, которые до настоящего времени производили в яйцах и в СЕF.
Осуществление изобретения
Настоящее изобретение обеспечивает способ репликации вируса в стволовых клетках эмбрионов птиц ЕВх®, более предпочтительно, в клетках ЕВ14, включающий стадии:
- инфицирования культуры клеток ЕВх интересующим вирусом; предпочтительно, культивируя указанные клетки ЕВх в среде, свободной от сыворотки животных;
- культивирования инфицированных ЕВх клеток с целью репликации указанного вируса;
- получения вируса в супернатанте клеточной культуры и/или внутри указанных клеток.
Согласно предпочтительному воплощению указанный способ включает стадии:
a) пролиферации указанных клеток ЕВх®, более предпочтительно, клеток ЕВ14, во флаконе для культивирования, в суспензии, в свободной от сыворотки среде №1;
b) инфицирования указанных клеток выбранным вирусом при условии, что плотность клеток равна, по меньшей мере, 1.5 миллионам клеток/мл;
c) добавления к клеточной культуре свободной от сыворотки среды №2 незадолго до инфицирования, одновременно с инфицированием или сразу после инфицирования;
d) дальнейшее культивирование указанных инфицированных клеток с целью создания возможности для репликацию вируса; и
е) необязательно, сбора указанного вируса.
Термин «вирус» в том виде, в каком он был применен в этом документе, включает не только вирусы, существующие в природе, но также и ослабленные вирусы, реассортативные вирусы, вакцинные штаммы, а также рекомбинантные вирусы и вирусные векторы, и так далее. Вирусы изобретения предпочтительно выбирали из группы, состоявшей из аденовирусов, гепаднавирусов, вирусов герпеса, ортомиксовирусов, паповавирусов, парамиксовирусов, пикорнавирусов, поксвирусов, реовирусов и ретровирусов.
В предпочтительном воплощении вирусы, родственные вирусные векторы, вирусные частицы и противовирусные вакцины относились к семейству поксвирусов, и более предпочтительно, к хордопоксвиридае (chordopoxviridae). В одном из воплощений вирус или родственные вирусные векторы, вирусные частицы и противовирусные вакцины были авипоксвирусами, которые выбирали из вируса оспы домашней птицы, вируса оспы канареек (например, ALVAC), вируса оспы юнко, вируса оспы майны, вируса оспы голубей, вируса оспы попугаев, вируса оспы перепелов, вируса оспы воробьев, вируса оспы скворцов, вируса оспы индеек. Согласно еще одному предпочтительному воплощению, вирус - это вирус осповакцины, который выбирали из штамма вируса осповакцины Lister-Elstree, модифицированного вируса осповакцины, такого как модифицированный осповакцинный вирус Анкара (MVA), который может быть получен из АТСС (АТСС Number VR-1508), NYVAC (Tartaglia et al., 1992 Virology 188:217-232), LC16m8 (Sugimoto et Yamanouchi 1994 Vaccine 12:675-681), CVI78 (Kempe et al., 1968 Pediatrics 42: 980-985) и других рекомбинантных или нерекомбинантных вирусов осповакцины.
В еще одном предпочтительном воплощении вирусы, родственные вирусные векторы, вирусные частицы и противовирусные вакцины относились к семейству ортомиксовирусов, в частности к вирусу гриппа. Вирус гриппа выбирали из группы, состоявшей из вируса гриппа человека, вируса гриппа птиц, вируса гриппа лошадей, вируса гриппа свиней, вируса гриппа кошек. Вирус гриппа предпочтительно выбирали из штаммов А, В и С. Среди штаммов А, можно перечислить вирусы с различными подтипами гемагглютинина и нейраминидазы, такие как, без ограничения, H1N1, H2N2, H3N2, H4N2, H4N6, H5N1, H5N2, H7N7 и H9N2. Среди штаммов H1N1 можно перечислить A/Porto Rico/8/34, A/New Caledonial20/99, A/Beijing/262/95, A/Johannesburg/282/96, A/Texas/36/91, A/Singapore. Среди штаммов H3N2 можно перечислить A/Panama/2007/99, A/Moscow/10/99, A/Johannesburg/33/94. Среди штаммов В можно перечислить, без ограничения, B/Porto Rico/8/34, B/Johannesburg/5/99, B/Vienna/1/99, B/Ann Arbor/1/86, B/Memphis/1/93, B/HarbinR/94, N/Shandong/7/97, B/Hong Kong/330/01, B/Yamanashi/166/98. Вирус гриппа изобретения выбирали из вируса дикого типа, из изолята первичного вируса, полученного от инфицированных людей, рекомбинантного вируса, ослабленного вируса, чувствительного к температуре вируса, адаптированного к низким температурам вируса, реассортативного вируса, т.е. вируса, полученного обратным генно-инженерным способом.
Когда вирус изобретения представляет собой вирус гриппа, способ изобретения включает дополнительную стадию внесения протеолитического фермента в культуральную среду в условиях, способствующих размножению вируса. Протеолитический фермент выбирали из группы, состоявшей из трипсина, химотрипсина, термолизина, пепсина, панкреатина, папаина, проназы, субтилизина А, эластазы, фурина и карбоксипептидазы. Согласно предпочтительному воплощению ферментом был трипсин. Конечная концентрация трипсина в клеточной культуральной среде была равна величине примерно от 0.5 до 1 мг/мл, вплоть до 25 мг/мл. Более предпочтительно конечная концентрация трипсина в клеточной культуральной среде была равна величине от 0.01 до 10 usp/мл (usp - это фармакопейная единица, принятая в США), предпочтительно, примерно от 0.05 до 2 usp/мл, более предпочтительно, примерно от 0.3 до 1 usp/мл. Предпочтительно протеолитическим ферментом был рекомбинантный белок, полученный в прокариотическом хозяине.
В еще одном предпочтительном воплощении вирусы, родственные вирусные векторы, вирусные частицы и противовирусные вакцины относились к семейству парамиксовирусов, в особенности к вирусу кори, вирусу ньюкаслской болезни, вирусу эпидемического паротита и вирусам краснухи.
В еще одном предпочтительном воплощении вирусы, родственные вирусные векторы, вирусные частицы и противовирусные вакцины относились к семейству бирнавирусов, в особенности к вирусу инфекционного бурсита.
Рекомбинантные вирусы включали, но не ограничивались вирусными векторами, включающими гетерологичные гены. В некоторых воплощениях функцию (функции) хелпера для репликации вирусов обеспечивали клетки-хозяева ЕВх®, вирус-хелпер или плазмида-хелпер. Типичные представители векторов включают, но не ограничиваются теми, которые могут инфицировать клетки птиц или млекопитающих.
Термин «птичий» в том виде, в каком он был применен в этом документе, имеет отношение к любому виду, подвиду или расе организма таксономического класса «ava», таким как, но не ограниченным такими организмами, как курицы, индейки, утки, гуси, перепелки, фазаны, попугаи, зяблики, соколы, вороны, страусы, эму и казуары. Термин включает различные породы Gallus gallus или куриц (например, White Leghom, Brown Leghom, Barred-Rock, Sussex, New Hampshire, Rhode Island, Australorp, Minorca, Amrox, California Gray, Italian Partidge-colored), а также породы индеек, фазанов, перепелок, уток, страусов и других обычно разводимых домашних птиц. В предпочтительном воплощении клетка птицы настоящего изобретения были куриной клеткой.
Сосуд для культивации изобретения более предпочтительно выбирали из непрерывно перемешиваемого резервуара-биореактора, биореактора Wave™, биореактора Bello™, флакона с перемешиванием, колбы и специализированного устройства по производству клеток. Обычно клетки наращивали в крупном масштабе из ампулы главного или рабочего банка клеток с помощью Т-образных колб или вращающихся флаконов различного размера и, предпочтительно, в конечном счете, с помощью биореакторов. Затем полученную клеточную суспензию обычно подкармливали в биореакторе для выращивания посевного материала (обычно в объеме 20-30 л) для дальнейшего выращивания, и в некоторых воплощениях, в биореакторах с большей производительностью (обычно в объеме 150-180 л). Отношение объема второго (большего) биореактора к объему биореактора для выращивания посевного материала зависел от степени, до которой размножали клеточную линию в первом биореакторе, но обычно оно было равно от 3:1 до 10:1, например, в интервале примерно (6-8):1. Согласно предпочтительному воплощению культивационный сосуд был резервуаром-биореактором с непрерывным перемешиванием, что позволяло контролировать температуру, аэрацию, рН и другие контролируемые условия, и который был оборудован:
- подходящими входными отверстиями для внесения клеток, стерильного кислорода, различных сред для культивирования и т.д.;
- выходными отверстиями для извлечения клеток и среды; и
- устройством для перемешивания культуральной среды в биореакторе.
Согласно настоящему изобретению "свободная от сыворотки среда" (SFM) означает клеточную культуральную среду, готовую к применению, что означает, что она не требует добавления сыворотки для того, чтобы дать клеткам возможность выживать и расти. Эта среда необязательно химически определена и может содержать гидролизаты разного происхождения, например из растений. Предпочтительно, указанная SFM была квалифицирована как "неживотного происхождения", что означает, что она не содержала компонентов, происходящих от животных или человека (статус FAO: "свободна от животного происхождения"), В SFM нативные белки сыворотки были заменены рекомбинантными белками. Альтернативно согласно изобретению среда SFM не содержала белков (среда PF: "среда, свободная от белков") и/или была определена химически (среда CDM: "химически определенная среда"). Среда SFM обладала несколькими преимуществами: (i) прежде всего такая среда обладает регулируемой совместимостью (действительно, нет риска получить примесь случайных веществ, таких как BSE, вирусы); (ii) оптимизация способа очистки; (iii) лучшая воспроизводимость способа, в результате того, что состав среды лучше определен. Примерами доступных коммерческих сред SFM являются: VP SFM (InVitrogen Ссылка 11681-020, каталог 2003 г.), Opti Pro (InVitrogen Ссылка 12309-019, каталог 2003 г.), Episerf (InVitrogen Ссылка 10732-022, каталог 2003 г.), Pro 293 S-CDM (Cambrex ссылка 12765Q, каталог 2003 г.), LC17 (Cambrex Ссылка BESP302Q), Pro CHO 5-CDM (Cambrex ссылка 12-766Q, каталог 2003 г.), HyQ SFM4CHO (Hyclone Ссылка SH30515-02), HyQ SFM4CHO-Utility (Hyclone Ссылка SH30516.02), HyQ PF293 (Hyclone ссылка SH30356.02), HyQ PF Vero (Hyclone Ссылка SH30352.02), среда для клеток Ex 293 (JRH Biosciences ссылка 14570-1000M), среда для клеток Ex, свободная от белков, 325 PF CHO (JRH Biosciences ссылка 14335-1000М), среда для клеток Ex VPRO (JRH Biosciences ссылка 14560-1000М), свободная от сыворотки среда для клеток Ех 302 (JRH Biosciences ссылка 14312-1000M), среда для клеток Ех 65319 (JRH Biosciences), среда для Ех клеток 65421 (JRH Biosciences), среда для Ех клеток 65625 (JRH Biosciences), среда для Ех клеток 65626 (JRH Biosciences), среда для Ех клеток 65627 (JRH Biosciences), среда для Ех клеток 65628 (JRH Biosciences), среда для Ех клеток 65629 (JRH Biosciences), среда для генной терапии 3 (свободная от компонентов животного происхождения) (SIGMA-Aldrich, ссылка G-9916) (в дальнейшем в этом документе называемая средой G9916).
Согласно первому предпочтительному воплощению среда, свободная от сыворотки №1, и среда, свободная от сыворотки №2, - это одна и та же среда.
Согласно второму предпочтительному воплощению среда, свободная от сыворотки №1, и среда, свободная от сыворотки №2, имеют разный состав. Например, среда, свободная от сыворотки №1, - это Excell 65319 (AFC Biosciences) и среда Opti Pro (In Vitrogen Ссылка 12309-019, каталог 2003 г.) может быть средой, свободной от сыворотки №2.
Согласно предпочтительному воплощению среда, свободная от сыворотки №1, - это среда для Ех клеток 65319 (JRH Biosciences). Согласно второму предпочтительному воплощению среда, свободная от сыворотки №1, - это среда для Ех клеток 65421 (JRH Biosciences).
Согласно предпочтительному воплощению среда, свободная от сыворотки №2, - это среда для Ех клеток 65319 (JRH Biosciences). Согласно второму предпочтительному воплощению среда, свободная от сыворотки №2, - это среда G9916 (SIGMA-Aldrich).
Способ изобретения охватывает удаление всей или части свободной от сыворотки среды №1 с последующим ее замещением свободной от сыворотки средой №2. Однако удобнее удалить значительную порцию (например, до примерно 50%) свободной от сыворотки среды №1 и затем пополнить ее свободной от сыворотки средой №2, наряду с этим все еще удаляя среду №1, например, через центробежный фильтр. Согласно предпочтительному воплощению свободную от сыворотки среду №2 добавляли непосредственно в свободную от сыворотки среду №1 без удаления части свободной от сыворотки среды №1. От примерно 0.25 до 10 объемов свободной от сыворотки среды №2 добавляли к 1 объему свободной от сыворотки среды №1.
В предпочтительном воплощении от примерно 0.5 до 8 объемов свободной от сыворотки среды №2 добавляли к 1 объему свободной от сыворотки среды №1. В более предпочтительном воплощении от примерно 3 до 6 объемов свободной от сыворотки среды №2 добавляли к 1 объему свободной от сыворотки среды №1.
Свободная от сыворотки среда №1 и/или свободная от сыворотки среда №2 была/были дополнены, по меньшей мере, одним ингредиентом, который выбирали из группы, состоявшей из аминокислот, липидов, жирных кислот, холестерина, углеводов, гидролизатов белков неживотного происхождения и их смесей.
Альтернативно способ изобретения - это способ с периодической подпиткой, который включал дополнительную стадию подпитки клеток, по меньшей мере, одним ингредиентом, который выбирали из группы, состоявшей из аминокислот, липидов, углеводов, гидролизатов белков неживотного происхождения, сурфактантов и их смесей. Согласно первому предпочтительному воплощению подкормку осуществляли на стадиях от а) до d), альтернативно, только во время стадий от b) до d), или альтернативно, только во время стадии d). Подкормку могли осуществлять либо на ежедневной основе, либо на непрерывной основе. Если подкормку проводили с перерывами, то подкормка могла осуществляться один раз в день, более одного раза в день или менее одного раза в день.
Среда SFM изобретения включала несколько ингредиентов, включая аминокислоты, витамины, органические и неорганические соли, источники углеводов, каждый ингредиент присутствовал в количестве, обеспечивающем культивирование клеток in vitro. Однако с целью усовершенствовать рост клеток или вирусную продуктивность к среде SFM добавляли дополнительные ингредиенты.
Аминокислоты, добавляемые к клеточной культуре, можно выбрать исходя из анализа потребления аминокислот клетками в культуре. Согласно предпочтительному воплощению аминокислоты, добавляемые к клеточной культуре, выбирали из группы состоявшей из аспарагина и глутамина или их смеси. В более предпочтительном воплощении добавляли глутамин и подкормку глутамином проводили в течение стадий от а) до d) для поддержания концентрации глутамина в среде от примерно 0.5 мМ до примерно 5 мМ, предпочтительно от примерно 1 мМ до примерно 3 мМ и наиболее предпочтительно примерно 2 мМ. В предпочтительном воплощении подкормку глутамином проводили на непрерывной основе.
Согласно предпочтительному воплощению углеводы, добавляемые к среде, выбирали из группы, состоявшей из D-глюкозы, D-сахарозы и D-галактозы или их смеси. Согласно более предпочтительному воплощению добавляемым углеводом была D-глюкоза.
Подкормку D-глюкозой проводили в течение стадий от а) до d), более предпочтительно от b) до d) для поддержания концентрации D-глюкозы в среде от примерно 0.5 г/л от примерно 25 г/л, предпочтительно от примерно 1 г/л от примерно 10 г/л D-глюкозы и предпочтительно примерно от 2 до 3 г/л D-глюкозы. В предпочтительном воплощении подкормку D-глюкозой проводили на непрерывной основе.
Согласно предпочтительному воплощению липиды выбирали из группы состоявшей из холестерина, стероидов и жирных кислот, таких как пальмитиновая кислота, пальмитолеиновая кислота, стеариновая кислота, олеиновая кислота, линолевая кислота, линоленовая кислота и их производные или их смеси. Более предпочтительно добавленные жирные кислоты были из SIGMA-ALDRICH (Ссылка F7050) и примерно 0.35 ul/мл раствора жирных кислот добавляли в культуральную жидкость.
Согласно предпочтительному воплощению белковые гидролизаты неживотного происхождения выбирали из группы, включавшей бактериальный триптон, дрожжевой триптон, гидролизаты растений, такие как гидролизаты сои, или их смеси. В предпочтительном воплощении белковым гидролизатом неживотного происхождения был Yeastolate.
Термин "гидролизат" включает результат энзиматического расщепления соевого пептона или дрожжевого экстракта. Гидролизат может быть получен из многочисленных препаратов соевых пептонов или дрожжевых экстрактов, соответственно, которые затем могут быть энзиматически расщеплены (например, папаином), и/или получен путем автолиза, термолиза и/или плазмолиза. Гидролизаты могут быть получены из коммерческих источников, таких как Yeastolate, Hy-Soy, Hy-Yeast 412 и Hi-Yeast 444, из таких источников как JRH BioSciences (Lenaxa, KA), Quest International (Norwich, N.Y.), OrganoTechnie S.A. (France) или Deutsche Hefewerke GmbH (Germany). Источники дрожжевых экстрактов также раскрыты в патенте WO 98/15614. Источники дрожжевых экстрактов и соевых гидролизатов также раскрыты в патенте WO 00/03000. Гидролизаты, применяемые в средах изобретения, предпочтительно, очищали из грубой фракции, так как примеси, которые могут влиять на эффективность культивирования, предпочтительно исключали в ходе этой очистки, таким образом, усовершенствуя консистенцию гидролизата. Очистка может быть проведена с помощью ультрафильтрации или хроматографии на Sephadex (например, на Sephadex G25 или Sephadex G10 или аналогичных носителях), ионно-обменной хроматографии, аффинной хроматографии, хроматографии с исключающим размером или хроматографии с "обратной фазой". Предпочтительно очистку проводили с помощью ультрафильтрации, применяя фильтр, осекающий молекулы в 10 kDa. Эти способы известны в этой области техники. С помощью этих способов можно выбрать фракции, содержащие соевые или дрожжевые гидролизаты с определенным молекулярным весом. Предпочтительно средние молекулярные веса соевых или дрожжевых гидролизатов, предпочтительно примерно от 220 до 375 дальтон.
Предпочтительно Yeastolate присутствовал в клеточной культуральной среде. Yeastolate 50X (примерно 200 г/л) приобретенный, например, в JRH-BIOSCIENCES (Ссылка 58902) присутствовал в клеточной культуральной среде в конечной концентрации примерно от 0.1Х до 2Х, предпочтительно примерно от 0.5Х примерно до IX в культуральную среду. Соевый гидролизат может также быть добавлен к клеточной культуральной среде. Соевый гидролизат 50X приобретенный, например, в JRH-BIOSCIENCES (Ссылка 58903100М) добавляли в конечной концентрации примерно от 0.1Х до 2Х, предпочтительно примерно IX в культуральную среду. Альтернативно смесь соевого гидролизата и дрожжевого гидролизата может быть добавлена в клеточную культуральную среду, как описано в патенте US 2004/0077086.
Среда может содержать дополнительные вещества, такие как буферные вещества, такие как бикарбонат натрия, стабилизаторы окисления, стабилизаторы, препятствующие механическому напряжению или ингибиторы протеаз. Если требуется, неионные сурфактанты, такие как полипропиленгликоль (PLURONIC F-61, PLURONIC F-68, SYNPERONIC F-68, PLURONIC F-71 или PLURONIC F-108), могут быть добавлены к среде в качестве противопенного вещества. Эти факторы обычно применяют для защиты клеток от негативных эффектов аэрации, так, без добавления сурфактанта, поднимающиеся и лопающиеся пузырьки воздуха могут привести к повреждению тех клеток, которые расположены на поверхности этих воздушных пузырьков ("барботаж"). Количество неионного сурфактанта находилось предпочтительно между примерно 0.05 и примерно 10 г/л, обычно между примерно 0.1 и примерно 5 г/л. Согласно другому воплощению изобретения концентрация сурфактанта в клеточной культуральной среде может быть снижена для увеличения размера клеточных комочков.
Согласно одному воплощению изобретения внесение свободной от сыворотки среды №2 к культуре клеток проводили после инфицирования на стадии b), предпочтительно между примерно от 0.5 до 4 часов после стадии b) и более предпочтительно примерно через 1 час после стадии b). Согласно другому воплощению изобретения внесение свободной от сыворотки среды №2 к культуре клеток проводили после инфицирования на стадии b), предпочтительно между примерно от 0.5 до 4 часов после стадии b) и более предпочтительно примерно за 1 час до стадии b). Согласно другому воплощению изобретения добавление свободной от сыворотки среды №2 к культуре клеток проводили одновременно с инфицированием на стадии b.
Инфицирование вирусом на стадии b) проводили при m.o.i. (множественность инфицирования) (multiplicity of infection) примерно от 10 до 10-6, предпочтительно примерно от 10-2 до 10-5 и более предпочтительно примерно 10-4. Специалист в этой области техники может определить оптимальную m.o.i. в соответствии с типом вируса.
На стадии с) инфицированные клетки предпочтительно культивировали в течение, по меньшей мере, 24-х часов, по меньшей мере, 48-ми часов, по меньшей мере, 72-х часов, по меньшей мере, 96-ти часов, по меньшей мере, 120-ти часов, по меньшей мере, 144-х часов. Если вирус был поксвирусом, инфицированные клетки культивировали, по меньшей мере, 144 часа.
В способе изобретения на стадии а) клетки культивировали как периодическую культуру клеток, выращиваемую в замкнутом объеме, многократную культуру клеток, выращиваемую в замкнутом объеме, подпитываемую культуру или перфузируемую культуру. Более предпочтительно на стадии а) клетки культивировали как подпитываемую культуру. Инфицирование на стадии b) проводили тогда, когда плотность клеток была равна, по меньшей мере, примерно 4 миллионам, предпочтительно 6 миллионам клеток/мл, более предпочтительно 8 миллионам клеток/мл при способе культивирования в замкнутом объеме или при способе с подпиткой. Если применяли способ с перфузируемой культурой, то инфицирование на стадии b) проводили тогда, когда плотность клеток была равна, по меньшей мере, примерно 8 миллионам клеток/мл, предпочтительно примерно от 9 до 10 миллионов клеток/мл или даже выше.
рН свободной от сыворотки культуральной среды на стадиях а), b), с) и d) предпочтительно контролировали с помощью биореактора. рН должен быть в интервале от 6.5 до 7.8, предпочтительно примерно от 6.8 до 7.5 и более предпочтительно примерно 7.2.
В способе изобретения стадия d) продолжалась в течение от 2 до 10 дней перед сбором клеток. Согласно предпочтительному воплощению стадия d) длится в течение от 3 до 7 дней перед сбором клеток.
Культивирование клеток осуществляли при температуре от 32 до 39°С в зависимости от типа вируса. Для производства вируса гриппа инфицирование культуры клеток проводили предпочтительно при 33°С.
Клетки ЕВх® обладают способностью расти в виде суспензионной культуры с клетками, слипшимися в неплотные агрегаты, состоящие от из нескольких клеток до более чем сотни (сотен) клеток. Не будучи связанными теорией, размер агрегатов может варьировать в зависимости от состава клеточной среды. Например, на размер агрегатов может влиять присутствие сурфактанта, такого как полипропиленгликоль (PLURONIC F-61, PLURONIC F-68, SYNPERONIC F-68, PLURONIC F-71 или PLURONIC F-108), и перемешивание. Заявитель теперь обнаружил, что выход вируса может быть увеличен, если позволить ЕВх® клеткам изобретения агрегировать друг с другом с образованием комочков, по меньшей мере, на стадии а) способа. В ходе увеличения количества клеток от количества клеток от количества, находившегося в ампуле главного и рабочего банка клеток, через Т-колбы или вращающиеся флаконы различного размера до биореактора, суспензию клеток обычно пассировали в сосуд большего размера, либо путем разведения в свежей среде, либо с помощью центрифугирования с последующим ресуспендированием осадка клеток в свежей среде. Заявитель обнаружил, что при пассировании клеток рекомендуется сохранять в культуре большие комочки клеток. Для того, чтобы это выполнить, лучше не разбивать комочки клеток с целью улучшения репликации вируса в клетках ЕВх®. Например, в ходе начальных фаз культивирования на стадии а) в Т-колбах или во вращающихся флаконах рекомендуется разводить культуру клеток для пассирования клеток в сосуд (сосуды) большего объема, и не рекомендуется ни центрифугировать, ни разбивать комочки клеток пипетированием или перемешиванием. Однако очень большие комки могут быть субоптимальными для высокой продукции вирусов. Следовательно, специалист в этой области техники должен определить, может ли частичное разрушение комочков с помощью пипетирования или перемешивания в ходе начальных клеточных пассажей на стадии а) улучшить выход вируса. Согласно предпочтительному воплощению поксвирусы, и предпочтительно, MVA, ALVAC и вирусы домашней птицы были получены с помощью способа изобретения, включающего стадию а) размножающихся слипшихся ЕВх® клеток в виде рыхлых агрегатов, состоящих из от нескольких клеток до более чем, по меньшей мере, одна сотня клеток, по меньшей мере, две сотни клеток, по меньшей мере, пять сотен клеток, по меньшей мере, тысяча клеток.
Настоящее изобретение также подходит для клеток других типов, применяемых для размножения вирусов, таких как без ограничений, куриные эмбриональные фибробласты (CEF), VERO клетки, РеrС6, MDCK и те, что способны расти в суспензии в виде клеточных комочков.
Изобретение также имеет отношение к вирусу, который может быть получен с помощью способа изобретения.
Настоящее изобретение также имеет отношение к вакцинам, содержащим вирус изобретения. Способ производства вирусной вакцины включает способ репликации вируса согласно изобретению, где стадию е) получения вируса, включающую, по меньшей мере, одну стадию выбирали из фильтрования, концентрирования, замораживания и стабилизации с помощью добавления стабилизирующих веществ.
Получение вируса проводили согласно способам, хорошо известным специалистам в этой области техники. Согласно предпочтительному воплощению стадия получения указанного вируса включает сбор клеточного супернатанта, полученного в результате центрифугирования культуры клеток, концентрированно, замораживание и стабилизацию вирусного препарата с помощью добавления стабилизирующих веществ (например, для вируса гриппа см. работу Furminger, In Nicholson, Webster и Hay (Eds) Textbook of influenza, chapter 24 pp324-332).
Способ производства вирусной вакцины согласно изобретению может также включать дополнительную стадию инактивации полученного вируса. Инактивацию предпочтительно проводили с помощью обработки формальдегидом, бета-пропиолактоном, эфиром, эфиром и детергентом (например, таким как Tween 80™), цитилтриметиламмония бромид (СТАВ) и Triton N102, дезоксихолатом натрия и три(N-бутил)фосфатом.
Согласно другому воплощению изобретение также имеет отношение к способу получения вирусных антигенов из вирусов, получаемых по способу изобретения, указанный способ состоит из следующих дополнительных стадий:
a) необязательно, инкубирование супернатанта клеточной культуры, включающего полный вирус, с рестриктазой дезоксирибонуклеиновой кислоты, предпочтительно с ДНКазами (см. ЕС 3.1.21 и ЕС 3.1.22 по классификации ферментов) и нуклеазами (см. ЕС 3.1.30 и ЕС 3.1.31 по классификации ферментов). Предпочтительно ферментом, расщепляющим ДНК, была бензоназа (Benzon nuclease) или ДНКаза 1;
b) присоединение катионного детергента. Примеры катионного детергента: без ограничений, соль цитилтриметиламмония, такая как СТАВ, соль миристилтриметиламмония, липофектин, DOTMA и Tween;
с) выделение антигенов. Последняя стадия может быть осуществлена с помощью центрифугирования или ультрафильтрации.
Вирус в вакцине может находиться либо в виде интактных вирусных частиц или в виде дезинтегрированных вирусных частиц. Согласно одному воплощению вакцина была убитой или инактивированной вакциной. Согласно другому воплощению вакцина была живой ослабленной вакциной, где указанные вакцины, в основном, включали супернатант культуры клеток ЕВх, получаемый по способу изобретения, предпочтительно без сыворотки, необязательно отфильтрованный и/или сконцентрированный, и включающий указанный вирус. Согласно третьему воплощению вакцины, включающие вирусные антигены, которые могут быть получены из вируса, получали согласно способу изобретения.
Изобретение также имеет отношение к обеспечению вакцины, включающей инфицированную клеточную линию ЕВх®, предпочтительно ЕВ14, которая может быть получена с помощью способа изобретения, и где инфицированную клеточную линию ЕВх®, предпочтительно ЕВ14, собирали на стадии d).
Вакцина изобретения может включать вирус изобретения в сочетании с фармацевтически приемлемыми веществами, усиливающими иммунный ответ. Неограничивающие примеры веществ, усиливающих иммунный ответ, включают неполный адъювант Фрейнда, сапонин, соли гидроксида алюминия, лизолецитин, плутоновые полиолы, полианионы, пептиды, бациллы Кальметта и Герена (БЦЖ) (bacilli Calmette-Guerin (BCG)) и Corynebacterium parvum. Примером синтетического адъюванта был QS-21. Для усиления иммунного ответа вакцины могут быть дополнительно применены иммунно-стимулирующие белки (интерлейкины 111, 112, IL3, IL4, IL12, IL13, гранулоцит-макрофаг-колониестимулирующий фактор, …).
Вакцина изобретения была предпочтительно в виде жидкости, замороженного препарата, обезвоженного и замороженного препарата, необязательно адаптированного к интраназальному способу введения.
Вакцину изобретения предпочтительно применяли для профилактического и/или терапевтического лечения человека, зараженного вирусом, которую выбирали из вирусов оспа и гриппа, кори, эпидемического паротита и краснухи. Рекомбинантная вирусная вакцина изобретения может также быть применена для профилактического и/или терапевтического лечения хронических заболеваний, таких как рак, или инфекционных заболеваний, такие как AIDS.
Клеточные линии ЕВх® изобретения были полезны для создания и производства реассортативных вирусов. Вирусы с сегментированным геномом, такие как вирусы гриппа, может быть реассортативным вирусом. При одновременном инфицировании клеток ЕВх® изобретения, по меньшей мере, двумя разными штаммами вирусов гриппа, смесь сегментированных геномов из двух разных штаммов присутствует в одной и той же клетке-хозяине. Теоретически в ходе сборки вируса могут образовываться все сочетания геномных сегментов. Таким образом, с помощью селекции или элиминирования могут быть выделены специфические реассортативные вирусы с антителом, например вирус с желаемыми свойствами (см. Kilnourne E.D. в Plotkin S.A. and Mortimer E.A. Eds, Vaccines, 1994).
ЕВх® клеточные линии изобретения были также полезны для создания и производства вируса гриппа с помощью обратных генно-инженерных методов (см. Enami, Proc. Natl. Acad. Sri. USA 87:3802-3805 (1990); Enami et Palese, J.Virol. 65:2511-2513 (1991); Luytjes, Cell 59:1107-1113 (1989)).
Изобретение также имеет отношение к диагностическим композициям, содержавшим вирусы изобретения или их компоненты.
Приведенные ниже примеры объясняют изобретение более подробно. Следующие методики и примеры приведены для того, чтобы дать возможность специалистам в этой области техники более ясно понять и осуществить на практике настоящее изобретение. Настоящее изобретение, однако, не ограничено в объеме приведенных в качестве примеров воплощений, которые должны рассматриваться как иллюстрации только отдельных аспектов изобретения, и функционально эквивалентные способы находятся в рамках объема изобретения. Действительно, различные модификации изобретения дополнительно к тем, что были описаны в этом документе, будут ясны специалистам в этой области техники из вышеизложенного описания и сопроводительных чертежей. Надо понимать, что такие модификации попадают в объем прилагаемой формулы изобретения. Остальное будет описано в подписях к приведенным ниже фигурам.
ФИГУРЫ
ФИГУРА 1: Трансмиссионный электронно-микроскопический анализ ЕВ14 клеток
Клетки ЕВ14 демонстрировали типичную морфологию эмбриональных стволовых клеток (например, высокое ядерно-цитоплазматическое отношение), напоминавшую по фенотипу эмбриональные стволовые клетки мышей (mES). Клетки ЕВ14 - это маленькие круглые клетки с большим ядром и ядрышками, с короткими псевдоподиями, вытягивающимися из плазматической мембраны. Они метаболически высокоактивны и характеризуются цитоплазмой, богатой рибосомами и митохондриями. Клеточная морфология клеток ЕВ14 отличается от клеточной морфологии куриных эмбриональных фибробластов (CEF).
ФИГУРА 2: Анализ по определению кариотипа ЕВ14 клеток на пассажах 105 и 118
Анализ клеток ЕВ14, культивируемых в свободной от сыворотки среде до тех пор, пока пассажи 105 и 118 не подтвердили диплоидную природу этих клеток, где присутствовали 18 макрохромосом и 30 микрохромосом (верхняя часть фигуры). Этот результат находился в полном соответствии с числом хромосом, ожидаемым для куриных клеток (нижняя часть фигуры).
ФИГУРА 3: Экспрессия теломеразы в ЕВ14 клетках
Экспрессия теломеразы в ЕВ14 клетках, культивируемых в свободной от сыворотки среде, была исследована на разных пассажах при помощи набора Рош для определения теломераз (Roche telomerase detection kit) (Telomerase OCR ELISA). В клетках ЕВ14 была обнаружена высокая экспрессия теломеразы. Высокий уровень экспрессии теломеразы поддерживается от пассажа к пассажу, как показано на пассаже 89, на пассаже 160 (который соответствует ЕВ14 клеткам из главного банка клеток (Master Cell Bank), и на пассаже 179 (который соответствует концу производственных пассажей). Клеточная линия собак MDCK была применена в качестве негативного контроля и не экспрессировала теломеразу. Подобное отсутствие экспрессии теломеразы было обнаружено для CEFs клеток (данные не приведены).
ФИГУРА 4: Ген ENS1 экспрессируется в ЕВ14 клетках
Ген ENS1 был описан как ген, специфически экспрессируемый в куриных клетках ES (Acloque & al., Mech Dev. 103, р 79-91, 2001). Его экспрессия в клетках ЕВ14 была измерена с помощью RT-PCR. Птичьи эмбриональные стволовые клетки (клетки ES) собирали на стадии откладки яиц, и была обнаружена сильная экспрессия гена ENS1 в клетках ЕВ14 на различных пассажах (Р21, Р159, Р160), тогда как птичья клеточная линия DF1 (US 5,672,485) и куриные эмбриональные фибробласты (CEFs) не экспрессировали этот ген. Анализ гена «домашнего хозяйства» GAPDH проводили параллельно на тех же образцах для контроля на присутствие RNA (нижняя часть фигуры).
ФИГУРА 5: Экспрессия маркеров, специфичных для клеток ES в клеточной линии ЕВ14 (левая часть фигуры) и в клеточной линии DF1 (правая часть фигуры)
Клетки ЕВ14 экспрессировали гены ЕМЕА1 и SSEA1, тогда как клетки DF1 не экспрессировали эти гены. Ген паксиллина - это повсеместно распространенный ген, применяемый в качестве контроля. Клетки ЕВ14 не экспрессировали клеточные маркеры TROMA-1, McIM, TRA-1-60 и SSEA3.
ФИГУРА 6: Экспрессия рецепторов клеточной поверхности SA 2-3 и SAa2-6 в клеточных линиях ЕВ14 и MDCK
Клетки инкубировали с меченными дигоксигенином пектинами: агглютинин пектина Sambuca nigra специфически связывается с Sia2-6Gal, тогда как агглютинин лектина Maackia amwensis специфически связывается с Sia2-3Gal. Лектины, связавшиеся с клетками, выявляли с помощью FITC-меченных антител к дигоксигенину способом, известным специалисту в этой области техники. FITC-меченные клетки подсчитывали с помощью флуоресцентного сортировщика клеток (FAGS). Как было описано, молекулы SAa2-3 и SAa2-6 представляют собой рецепторы вирусов гриппа птиц и человека, соответственно.
ФИГУРЫ 7А и 7В: Кинетика роста ЕВ14 клеток в 3L-биореакторе с подпиткой
Фигура 7А. Биомассе, полученной из клеток ЕВ14, позволяли накапливаться при 37°С в среде клеточного роста, дополненной 0.5Х Yeastolate, до тех пор, пока плотность клеток не достигала величины равной 5-6·106 клеток/мл. Затем смесь была разведена в 2.9 раз, и за кинетикой роста клеток следили в течение 10 дней. Плотность клеток равная 13-ти миллионам клеток/мл была достигнута на 5 день.
Фигура 7В. Гибкость индекса разведения для кинетики клеточного роста ЕВ-14 клеток в 3L-биореакторе с подпиткой: Вслед за посевом клеток с коэффициентом разведения, равным 1/10 (0.23 л с плотностью 0.4·106 клеток/мл в 2.1 л конечного объема), биомассе, полученной из клеток ЕВ14, позволяли накапливаться в среде роста Excell 65319 (AFC) при 37°С в течение 11 дней. Концентрации L-глутамина (2 мМ) и D-(+)-глюкозы (2 г/л) ежедневно подводили, как это делают в способе с подпиткой, и были установлены следующие параметры биореактора: скорость вращения: 80 rpm, рO2: 50%, рН: 7,20.
ФИГУРА 8: Влияние среды продуцирования клеток и размера комочков на размножение вируса MVA-GFP в инфицированных ЕВ14 клетках: экспрессия GFP
Клеткам ЕВ14 было позволено образовать маленькие (левая часть фигуры) или большие (правая часть фигуры) комочки в перемешиваемых сосудах-резервуарах Т175 при размножении клеток в среде для роста клеток SFM (SAFC: Excell 65319). Комочки затем инфицировали вирусом MVA-GFP в количестве 10-2 ТСID50/клетку, и смесь разводили в нескольких средах для продукции клеток SFM (Optipro, Excell 65319, Excell 65629). В течение 7 дней вирус размножали при 37°С, изображение UV-экспонированных инфицированных клеток получали ежедневно. Контроль: Optipro (INVITROGEN) применяли как среду для клеточного роста и клеточной продукции.
ФИГУРА 9: Влияние среды продуцирования клеток и размера комочков на размножение вируса MVA-GFP в инфицированных ЕВ14 клетках: титрование инфекционности вируса
Клеткам ЕВ14 было позволено образовать маленькие (левая часть фигуры) или большие (правая часть фигуры) комочки в перемешиваемых сосудах-резервуарах при размножении клеток в среде для роста клеток (SAFC Excell 65319). Затем комочки были инфицированы вирусом MVA-GFP в количестве 10-2 ТСID50/клетку, и смесь разводили в нескольких средах для продукции клеток (Optipro, Excell 65319, Excell 65421, Excell 65625, Excell 65626, Excell 65627, Excell 65628, Excell 65629, G9916). В течение 7 дней вирус размножали при 37°С, образцы собирали ежедневно и титрование TCID50 проводили до конца кинетических измерений.
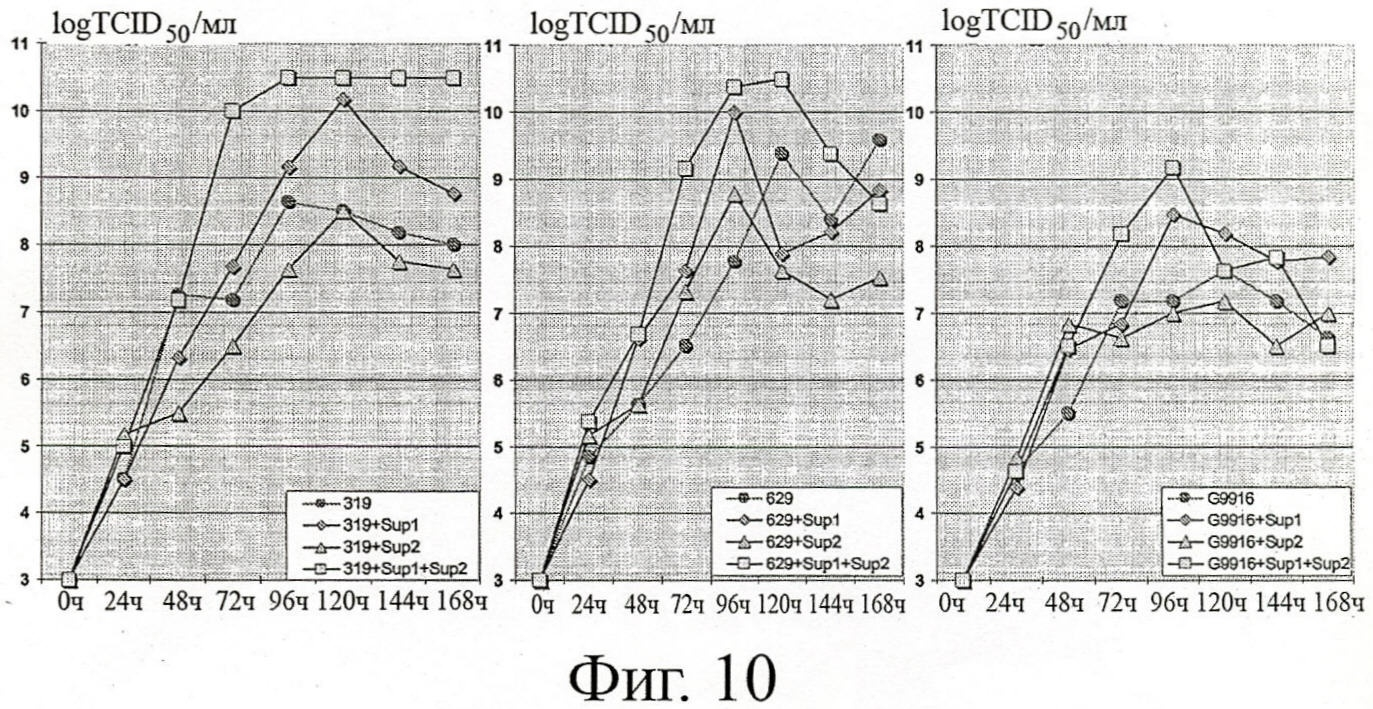
ФИГУРА 10: Влияние среды продуцирования клеток и дополнений на размножение вируса MVA-GFP в инфицированных ЕВ14 клетках
Клеткам ЕВ14 было позволено образовать маленькие комочки в перемешиваемых сосудах-резервуарах Т175 при размножении клеток в среде для роста клеток (SAFC Excell 65319). Клетки были инфицированы вирусом MVA-GFP в количестве 10-2 ТСID50/клетку, и смесь разводили в нескольких средах для продукции клеток (от левой до правой части фигуры: среда Excell 65319, Excell 65629 или G9916), дополненных или не дополненных 1X Yeastolate (дополнение 1) и/или 1X жирной кислотой (дополнение 2). В течение 7 дней вирус размножали при 37°С, образцы собирали ежедневно и титрование ТСID50 проводили до конца кинетических измерений.
ФИГУРА 11: Экспрессия GFP в клетках ЕВ-14, инфицированных вирусом MVA-GFP в 3L-биореакторе с подпиткой
Биомассе, полученной из клеток ЕВ14, позволяли накапливаться в ходе фазы пролиферации в среде роста Excell 65319. Затем клетки были инфицированы вирусом MVA-GFP в количестве 10-2 ТСID50/клетку, и смесь разводили в среде для продукции клеток G9916. Изображения (увеличение Х5 или Х10) UV-экспонированных инфицированных при 37°С клеток получали ежедневно (PI: после инфицирования (Post-Infection)).
ФИГУРА 12: Титрование инфекционности вируса гриппа MVA-GFP, полученного в клетках ЕВ14 в 3L-биореакторе с подпиткой
Биомассе, полученной из клеток ЕВ14, позволяли накапливаться в ходе фазы пролиферации в среде роста Excell 65319. Затем клетки были инфицированы вирусом MVA-GFP в количестве 10-2 ТСID50/клетку, и смесь разводили в среде Excell 65319 дополненной 1х Yeastolate. В течение 9 дней периода размножения вируса при 37°С собирали ежедневно образцы, проводили TCID50 титрование до конца кинетических измерений и сравнивали с титрами, полученными для СЕF клеток.
ФИГУРА 13: Анализ электронных микрофотографий вируса MVA-GFP, продуцированного в клетках ЕВ14
Клетки ЕВ14 были инфицированы вирусом MVA-GFP в количестве 10-2ТСID50/клетку и были собраны на 18 ч, 48 ч и 72 ч после инфицирования. Тонкие срезы фиксированных и залитых образцов были проанализированы с помощью электронной микроскопии (Dr. D.Spehner, IGBMC, Strasbourg).
ФИГУРА 14: Титрование инфекционности вируса множественных штаммов гриппа человека, продуцированного в клетках ЕВ14
Клетки ЕВ14 были инфицированы в перемешиваемых сосудах-резервуарах Т175 в количестве 10-2 ТСID50/клетку различными штаммами вирусов гриппа человека A/H3N2, A/H1N1 и В, в присутствии рекомбинантного трипсина, в концентрации 0.75 USP/мл. Образцы собирали каждые 24 ч и титр TCID50 анализировали до конца кинетических измерений путем титрования MDCK клеток в отсутствии бычьей сыворотки (левая часть фигуры). Некоторые инфицированные клетки ЕВ14 были параллельно проанализированы с помощью электронной микроскопии для обнаружения формирования частиц вируса гриппа (правая часть фигуры; Dr. D.Spehner, IGBMC, Strasbourg).
ФИГУРЫ 15А и 15В: Продуктивная репликация множественных штаммов вируса гриппа в ЕВ14 клетках
Фигура 15А - Вестерн-блотт анализ гемагглютинина (НА) в клетках ЕВ14, инфицированных различными штаммами вируса гриппа.
Клетки ЕВ14 культивировали в свободной от сыворотки среде в Т175 флаконах в шейкере и инфицировали указанными вирусами с множественностью инфекции, равной 10-4, в присутствии 0.75 USP/мл рекомбинантного трипсина. 4 мкл супернатанта клеточной культуры собирали ежедневно и анализировали методом SDS-электрофореза в 10%-ном полиакриламидном геле (ПААГ) и методом вестерн-блоттинга. Белки переносили методом электроблоттинга на поливинилидендифторидные мембраны и нерасщепленные (НАО) или пост-расщепленные частицы НА (НА1 и НА2) и обнаруживали с помощью инкубации со специфическими поликлональными овечьими антителами к НА. Антитела к IgG овцы, конъюгированные с пероксидазой, были применены для иммуноокрашивания. Для каждого штамма вирусов сравнивали накопление НА от 72 до 168 ч в постинфекционном периоде с увеличением количеств стандартных полученных из яиц НА реагентов.
Фигура 15В - SRID-анализ уровней продукции НА, полученного в клетках ЕВ14, для различных вирусов гриппа
Клетки ЕВ14 инфицировали в перемешиваемых сосудах-резервуарах Т175 в количестве 10-2 ТСID50/клетку различными штаммами вирусов гриппа человека A/H3N2, A/H1N1 и В, в присутствии рекомбинантного трипсина, в концентрации 0.75 USP/мл. Образцы собирали каждые 24 ч и до конца кинетических измерений проводили одномерный радиальный иммунодиффузионный анализ (SRID). Для каждого штамма вируса расчет аккумуляции НА проводили по кривой зависимости эффекта от дозы хорошо определенных соответствующих стандартных реагентов.
ФИГУРЫ 16А и 16В: Продукция штамма вируса гриппа A/H3N2 в ЕВ14 клетках в 3L-биореакторах
Фигура 16А - Кинетика роста клеток ЕВ14, инфицированных штаммом вируса гриппа A/H3N2/NewYork/55/2005
Биомассе, полученной из клеток ЕВ14, позволяли накапливаться при 37°С в ходе фазы пролиферации в среде роста клеток. Затем клетки были инфицированы вирусом A/H3N2/New York/55/2005 в количестве 10-2 ТСID50/клетку, смесь разводили в среде продукции Excell 65629 (среда Е), дополненной трипсином в концентрации 0.3 USP/мл, и температуру понижали до 33°С. В течение 10 дней периода размножения вируса при 37°С собирали ежедневно образцы и помещали для хранения при -80°С. Левая часть фигуры: плотность клеток (×106 клеток/мл), правая часть фигуры: общее число клеток (желтые ромбы, ×10' клеток) и жизнеспособность (красные кружки, %).
Фигура 16В - Анализ НА с помощью вестерн-блоттинга и SRID-анализа
Образцы, отобранные из 3L-биореактора в течение 7 дней постинфекционного периода, были проанализированы для обнаружения и количественной оценки продуцированного НА со специфическими поликлональными овечьими антителами к НА. Левая часть фигуры: вестерн-блотт анализ 4 мкл вирусного супернатанта был подвергнут иммуноокрашиванию антителами овцы к НА вместе с антителами к IgG овцы, конъюгированными с пероксидазой. Сравнивали накопление НА с увеличением количеств стандартных полученных из яиц реагентов. НАО: нерасщепленная субъединица НА, НА1 и НА2: расщепленные субъединицы НА. Правая часть фигуры: количественное определение методом SRID 10 мкл вирусного супернатанта. Расчет содержания НА проводили по кривой зависимости эффекта от дозы тех же стандартных реагентов.
ФИГУРЫ 17А и 17В: Продукция штамма вируса гриппа В в ЕВ14 клетках в 3L-биореакторе
Фигура 17А - Кинетика роста ЕВ14 клеток, инфицированных штаммом вируса гриппа B/Johannesburg/5/99
Клеткам ЕВ14 позволяли накапливаться при 37°С в ходе фазы пролиферации в среде роста клеток. Затем клетки были инфицированы вирусом гриппа B/Johannesburg/5/99 в количестве 10-2 ТСID50/клетку, смесь разводили в среде продукции SAFC Excell 65629 (среда Е), дополненной трипсином в концентрации 0.3 USP/мл, и температуру понижали до 33°С. В течение 10 дней периода размножения вируса при 37°С ежедневно собирали образцы и помещали для хранения при -80°С. Левая часть фигуры: плотность клеток (×106 клеток/мл), правая часть фигуры: общее число клеток (желтые ромбы, ×10' клеток) и жизнеспособность (красные кружки, %).
Фигура 17В - Вестерн-блотт анализ НА вируса гриппа B/Johannesburg/5/99, продуцированного в ЕВ14 клетках
Образцы, отобранные в течение 7 дней постинфекционного периода, были проанализированы для обнаружения продуцированного НА со специфическими поликлональными овечьими антителами к НА. 4 нл вирусного супернатанта использовали для проведения вестерн-блотт анализа, захваченные антигенами антитела иммуноокрашивали антителами к IgG овцы, конъюгированными с пероксидазой. Сравнивали накопление НА с увеличивающимися количествами полученных из яиц стандартов-антигенов. НАО: нерасщепленная субъединица НА, НА1 и НА2: расщепленные субъединицы НА.
ФИГУРЫ 18А и 18В: Продукция штаммов вируса гриппа A/H1N1 в ЕВ14 клетках в 30L-биореакторе
Фигура 18А - Кинетика роста ЕВ14 клеток, инфицированных штаммом вируса гриппа AT/H1N1/NewCaledonia/20/99
Клеткам ЕВ14 позволяли накапливаться при 37°С в ходе фазы пролиферации в среде роста клеток. Затем клетки были инфицированы вирусом гриппа A/H1N1/NewCaledonia/20/99 в количестве 10-2 ТСID50/клетку, смесь разводили в среде продукции SAFC Excell 65629 (среда Е), дополненной трипсином в концентрации 0.3 USP/мл, и температуру понижали до 33°С. В течение 8 дней периода размножения вируса собирали ежедневно образцы и помещали для хранения при
-80°С. Левая часть фигуры: плотность клеток (×106 клеток/мл), правая часть фигуры: общее число клеток (желтые ромбы, ×10' клеток) и жизнеспособность (красные кружки, %).
Фигура 18В - Анализ гемагглютинина в образцах вируса гриппа A1H1N1/NewCaledonia/20/99, полученных в ЕВ14-клетках
Образцы, собранные в течение 7 дней постинфекционного периода, были проанализированы для обнаружения и количественной оценки продуцированного НА со специфическими поликлональными овечьими антителами к НА. Левая часть фигуры: вестерн-блотт анализ 4 мкл вирусного супернатанта, в котором связанные с антигенами антитела были подвергнуты иммуноокрашиванию овечьими антителами к НА вместе с антителами к IgG овцы, конъюгированных с пероксидазой. Сравнивали накопление НА с увеличивающимся количеством стандартных полученных из яиц реагентов. НАО: нерасщепленная субъединица НА, НА1 и НА2: расщепленные субъединицы НА. Правая часть фигуры: количественное определение методом SRID 10 мкл вирусного супернатанта. Расчет содержания НА проводили по кривой зависимости эффекта от дозы тех же стандартных реагентов.
ПРИМЕРЫ
ПРИМЕР 1: Способ получения линии клеток ЕВх®
Способ получения линий птичьих эмбриональных стволовых клеток ЕВх® ранее был описан в патентах WO 03/076601 и WO 05/007840. Коротко этот способ получения линий клеток ЕВх® включает следующие стадии:
a) выделение, культивирование и рост птичьих клеток, предпочтительно птичьих эмбриональных стволовых клеток, в полной культуральной среде, содержавшей все факторы, обеспечивающие возможность для их роста, и в присутствии фидерного слоя из мышиных фибробластов, предпочтительно инактивированных, и дополненной сывороткой животного происхождения;
b) пассирование путем модифицирования культуральной среды так, чтобы получить постепенное или полное изъятие указанных факторов, указанной сыворотки и указанного фидерного слоя;
c) создание прикрепленных и неприкрепленных клеточных линий, способных к пролиферации в базальной среде в отсутствии экзогенных факторов роста, инактивированного фидерного слоя и низкого уровня сыворотки или без сыворотки.
В этом случае базальная среда стадии с) еще включала низкий уровень сыворотки (например, примерно 2% или меньше), указанный способ может необязательно включать на дополнительной стадии d) изменение базальной среды, больше не содержащей ни экзогенного фактора роста, ни инактивированного фидерного слоя, но содержащей низкий уровень сыворотки, со средой культивирования, которую выбирали из:
- базальной среды, дополненной сывороткой (i) и разведенной свободной от сыворотки средой, затем культивирование путем последовательных пассажей указанных птичьих клеток в базальной среде (i), в которой пропорцию свободной от сыворотки среды постепенно увеличивали до полного удаления указанной базальной среды, не содержащей ни экзогенного фактора роста, ни инактивированного фидерного слоя, ни сыворотки;
- свободной от сыворотки среды, дополненной сывороткой (ii), затем культивирование путем последовательных пассажей указанных птичьих клеток в указанной среде (ii), в которой пропорция сыворотки постепенно уменьшалась до получения свободной от сыворотки среды;
- свободной от сыворотки среды (iii), затем культивирование указанных птичьих клеток в среде (iii); затем поддержание в свободной от сыворотки среде указанных птичьих клеток, адаптированных к изменениям среды.
Термин «фактор, обеспечивающий возможность для их роста» в том виде, в котором он применен в этом документе, означает фактор роста, необходимый для выживания и роста птичьих клеток в культуре. Согласно изобретению факторы роста включают трофические факторы и цитокины. Трофические факторы - это, в основном, SCF, IGF-1 и bFGF. Цитокины - это, в основном, те цитокины, которые действуют через рецептор, который связан с белком gp130, таким как LIF, интерлекин 11, интерлекин 6, рецептор интерлекина 6, CNTF, онкостатин и кардиотропин.
Птичьи клетки стадии а) - это клетки, которые выбирали среди птичьих эмбриональных клеток, более предпочтительно среди птичьих эмбриональных стволовых клеток и среди зародышевых птичьих клеток. В предпочтительном воплощении клетки были тотипотентными или плюрипотентными птичьими эмбриональными стволовыми клетками, выделенными из популяции остановленной стадии диссоциации Х бластодермальных клеток, полученных из эмбрионов птиц, более предпочтительно из эмбрионов курицы (см. классификацию EYAL-GILADI: EYAL-GILADI и KOCHAN, 1976, «From cleavage to primitive streack formation: a complementary normal table and a new look at the first stages of the development in the chick». "General Morphology" Dev. Biol. 49:321-337). Эти птичьи эмбриональные стволовые клетки характеризуются медленным временем удвоения в культуре, которое находится между от 48 до 72 часов при 39°С.
Модификация культуральной среды стадии b) способа создания линий клеток ЕВх®, которая заключается в постепенном или полном удалении факторов роста, сыворотки и/или фидерного слоя, может быть проведена одновременно, последовательно или отдельно. Последовательность действий при истощении культуральной среды может быть на выбор следующей:
фидерный слой/сыворотка/факторы роста;
фидерный слой/факторы роста/сыворотка;
сыворотка/факторы роста/фидерный слой;
сыворотка/фидерный слой/факторы роста;
факторы роста/сыворотка/фидерный слой;
факторы роста/фидерный слой/сыворотка.
В предпочтительном воплощении последовательность действий при истощении культуральной среды была такой: факторы роста/фидерный слой/сыворотка.
Этот способ позволял проводить отбор клеточных клонов, адаптированных к этим новым, все более и более жестким условиям культивирования, до тех пор, пока не будут получены стабильные линии, которые способны расти в истощенной по сыворотке среде или среде, полностью свободной от сыворотки. Созданные линии ЕВх® предпочтительно представляют собой не прикрепленные стволовые клетки, растущие в виде суспензии в среде, свободной от экзогенных факторов роста и сыворотки, и без фидерных клеток.
Под «полной культуральной средой» следует понимать базальную среду, дополненную факторами роста и сывороткой животного происхождения. Пример полной культуральной среды описан в работе Pain et al. (1996, Development 122:2339-2348), в патентах ЕР 787,180 и US 6,114,168, US 5,340,740, US 6,656,479 и US 5,830,510. Согласно изобретению "базальная среда" означает среду с классическим для питательной среды составом, которая сама по себе предоставляет, по меньшей мере, возможность для выживания клеток, и что даже лучше, предоставляет возможность для клеточного роста. Примерами базальной среды были среда SFM, такая как была описана выше, или такая среда, как ВМЕ (базальная среда Игла), MEM (минимальная среда Игла), среда 199, DMEM (среда Игла в модификации Дальбеко), GMEM (среда Игла в модификации Glasgow), DMEM-HamF12, Ham-F12 и Ham-F10, среда Дальбеко в модификации Iscove, среда MacCoy 5A, RPMI 1640. Базальная среда включала неорганические соли (например: СаСl2, KСl, NaCl, NaНСО3, NaH2PO4, MgSO4, …), аминокислоты, витамины (тиамин, рибофлавин, фолевую кислоту, D-Ca пантотенат, …) и другие компоненты, такие как глюкоза, бета-меркаптоэтанол, пируват натрия.
Существует возможность схематически различить два семейства факторов роста: цитокины и трофические факторы. Цитокины представляют собой, в основном, те цитокины, которые действуют через рецептор, который связан с белком gp130. Таким образом, LIF, интерлекин 11, интерлекин 6, рецептор интерлекина 6, CNTF, онкостатин и кардиотропин обладают сходным механизмом действия с усилением на уровне рецептора в специфической цепи и комбинацией последнего с белком gp130 в мономерной или иногда в гетеродимерной форме. Трофические факторы представляют собой, в основном, SCF, IGF-1 и bFGF. Более предпочтительно полная среда включает базальную среду, инсулиновый фактор роста 1 (IGF-1), цилиарный нейротрофический фактор (CNTF), интерлекин 6 (IL-6), рецептор интерлекина 6 (IL-6R), фактор стволовых клеток (SCF), основной фактор роста фибробластов (bFGF), необязательно, интерлекин 11 (IL-11) и сыворотку животного происхождения. Клетки птиц, предпочтительно птичьи эмбриональные клетки стадии а), культивировали в течение нескольких пассажей в полной среде. Среда была дополнена, по меньшей мере, одним фактором роста, который выбирали из следующей группы: LIF, IGF-1, CNTF, IL-6, IL-6R, SCF, bFGF, IL-11, онкостатина, кардиотропин. Согласно преимущественному воплощению полная культуральная среда - это базальная среда, дополненная IGF-1 и CNTF. Согласно другому преимущественному воплощению полная культуральная среда - это базальная среда, дополненная IGF-1, CNTF, IL-6, IL-6R, SCF, bFGF, необязательно IL-11. Концентрация факторов роста IGF-1, CNTF, IL-6, IL-6R, SCF, bFGF, необязательно IL-11, в базальной среде составляла примерно от 0.01 до 10 нг/мл, предпочтительно от 0.1 до 5 нг/мл и более предпочтительно примерно 1 нг/мл.
После примерно от 3 до 10 пассажей полную среду истощали по факторам роста (стадия 15b). Предпочтительно для каждого фактора роста истощение проводили прямо в одну стадию, от одного пассажа к другому. Альтернативно истощение по фактору роста проводили с помощью постепенного снижения концентрации фактора роста в полной среде. В более предпочтительном воплощении истощение по фактору роста проводили одновременно, по меньшей мере, для двух факторов роста. В предпочтительном воплощении, в котором полная культуральная среда была базальной средой, дополненной IGF-1 и CNTF, истощение по фактору роста проводили с помощью удаления в один прием. В другом предпочтительном воплощении, в котором полная культуральная среда была базальной средой, дополненной IGF-1, CNTF, IL-6, IL-6R, SCF, bFGF, необязательно IL-11, истощение по фактору роста проводили с помощью в два приема: во-первых, SCF, IL6, IL6R, bFGF, необязательно IL11, прямо удаляли из полной среды; птичьи клетки затем поддерживали в культуре в течение, по меньшей мере, одного пассажа в полной среде, содержавшей IGF1 и CNTF, необязательно IL-11, и дополненной сывороткой животного происхождения. Во-вторых, IGF1 и CNTF, необязательно IL-11 прямо удаляли из культуральной среды, которая в итоге и составляла базальную среду, только дополненную сывороткой. Обычно среда полностью освобождалась от факторов роста за период примерно от 20 до 30 пассажей.
В предпочтительном воплощении удаление фидерных клеток проводили после удаления факторов роста. Удаление фидерных клеток проводили постепенно в течение нескольких пассажей. Затем птичьи клетки сеяли во флаконы при более низкой концентрации, чем на стадии а), примерно от около 4×104 клеток/см2 до 5×104клеток/см2. Птичьи клетки сеяли во флаконы в концентрации примерно 4.2×104клеток/см2. Постепенно концентрацию фидерных клеток во флаконах снижали. Практически такая же концентрация фидерных клеток была применена на пассажах от 2-го до 4-го, затем более низкая концентрация фидерных клеток была применена для дополнительных пассажей от 2-го до 4-го и так далее. Затем флакон засевали примерно 4.2×104 фидерных клеток/см2, затем примерно 2.2×104 фидерных клеток/см2, затем примерно 1.8×104 фидерных клеток/см2, затем примерно 1.4×104 фидерных клеток/см2, затем примерно 1.1×104 фидерных клеток/см2, затем примерно 0.9×104 фидерных клеток/см2, затем примерно 0.5×104 фидерных клеток/см2. Затем флакон засевали примерно от 6.5×104 птичьих клеток/см2 до 7.5×104 птичьих клеток/см2 и без фидерных клеток. Согласно теории птичьи клетки не бывают хорошей формы после понижения концентрации фидерных клеток во флаконе, поэтому птичьи клетки культивировали в течение дополнительных пассажей с той же концентрацией фидерных клеток до того момента, когда осуществляли удаление фидерных клеток.
В другом предпочтительном воплощении удаление сыворотки проводили после удаления фактора роста и фидерных клеток. Базальная среда была заменена средой, которую выбирали из:
- Базальная среда (i), дополненная сывороткой и разведенная новой свободной от сыворотки средой (ii). Затем птичьи клетки культивировали в несколько последовательных пассажей в среде (i), в которой пропорция свободной от сыворотки среды постепенно увеличивалась вплоть до полного удаления базальной среды, дополненной сывороткой (постепенное разведение).
- Новая свободная от сыворотки среда (ii), дополненная сывороткой. Птичьи клетки культивировали через последовательные пассажи в среде (ii), к которой пропорция сыворотки последовательно снижалась с целью получить свободную от сыворотки среду (последовательное истощение).
- Новая свободная от сыворотки среда (ii), не дополненная сывороткой. Затем птичьи клетки были прямо помещены в свободную от сыворотки среду (ii) (прямое истощение).
В предпочтительном воплощении истощение по сыворотке проводили с помощью последовательного истощения.
Фидерные клетки - это клетки животных, которые предпочтительно были инактивированы с помощью облучения или химической обработки митомицином. Фидер может быть генетически модифицирован для экспрессии факторов роста, таких как SCF. Предпочтительно, фидерные клетки являются линиями клеток фибробластов мышей, таких как STO (American Type Culture Collection ATCC N°CRL-1503).
Этот способ приводит к созданию полученных из птичьих эмбрионов клеточных линий, называемых ЕВх®, которые поддерживаются в культуре in vitro в течение значительного периода времени. Благоприятно то, что клетки ЕВх®, полученные на стадии с) способны к росту в течение, по меньшей мере, 50 дней, 100 дней, 150 дней, 300 дней или предпочтительно, по меньшей мере, 600 дней. 600 дней не составляет лимит по времени, так как полученные клетки ЕВх® были все еще живы после значительно более продолжительных временных периодов. Например, главный банк клеток ЕВ14 был получен на пассаже Р160, а конец банка продуцирования клеток ЕВ14 был получен на пассаже Р184, и клетки ЕВ14 все еще были способны размножаться. Следовательно, эти линии считаются способными к неограниченному росту в базальной среде культивирования, свободной от экзогенных факторов роста, сыворотки и/или инактивированного фидерного слоя. Под выражением "линия" следует понимать любую популяцию клеток, способную к неограниченному размножению в культуре in vitro, сохраняя при этом в большей или меньшей степени те же морфологические или фенотипические характеристики. Конечно, вышеупомянутый способ дает возможность получить клеточные клоны, произведенные из клеток созданных линий. Эти клоны представляют собой клетки, которые генетически идентичны клетке, из которой они были выведены с помощью деления.
Созданные клеточные линии и клетки, выведенные из них (стадия с) или d)), предпочтительно, представляли собой линии птичьих эмбриональных стволовых клеток, более точно, эти клетки представляли собой плюрипотентные птичьи эмбриональные стволовые клетки. Птичьи эмбриональные стволовые клетки ЕВх®, полученные способом изобретения, представляли собой маленькие, круглые, имеющие индивидуальные черты клетки со временем удвоения при 39°С, равным примерно 24 часам или менее. Клетки, которые можно получить с помощью способа изобретения, были, по меньшей мере, на пассаже р60, по меньшей мере, на пассаже р70, по меньшей мере, на пассаже р80, по меньшей мере, на пассаже р90, по меньшей мере, на пассаже р100, по меньшей мере, на пассаже р110, по меньшей мере, на пассаже р120, по меньшей мере, на пассаже р130, по меньшей мере, на пассаже Р150, по меньшей мере, на пассаже Р160, по меньшей мере, на пассаже Р170, по меньшей мере, на пассаже Р180 или позднее. Птичьи эмбриональные стволовые клетки согласно изобретению обладали, по меньшей мере, одной из следующих характеристик:
- высокое ядерно-цитоплазматическое отношение,
- эндогенная активность щелочной фосфатазы,
- эндогенная активность теломеразы,
- способность реагировать со специфическими антителами к SSEA-1 (TEC01), SSEA-3 и ЕМА-1,
- они экспрессировали ген ENS1.
Время удвоения короче, чем время удвоения птичьих клеток стадии а) способа изобретения (от 48 до 72 часов при 39°С), примерно 24 часа или меньше в тех же условиях культивирования.
Эти линии клеток ЕВх® способны к неограниченному размножению в базальной среде, в особенности в такой среде, как SAFC Excell media, DMEM, GMEM, HamF12 или в среде МсСоу, дополненной различными добавками, обычно применяемыми специалистами в этой области техники. Среди добавок могут быть приведены заменимые аминокислоты, витамины и пируват натрия, жирные кислоты, дрожжевой и соевый гидролизаты. Тем не менее, эти клетки способны размножаться в базальной среде без глутамина. Эти клеточные линии и клетки, выведенные из них, характеризовались тем, что росли либо как прикрепленные клетки, либо в виде суспензии клеток.
Предпочтительно клетки ЕВх® изобретения, предпочтительно клетки ЕВ14, имеют все вышеуказанные характеристики и применяются для продуцирования биопрепаратов, таких как вирусные вакцины и рекомбинантные пептиды и протеины (например, антитела, …).
ПРИМЕР 2: ХАРАКТЕРИСТИКА КЛЕТОК ЕВ14
2.1 - Кариотип клеток ЕВ14
Анализ кариотипа клеток ЕВ14 проводили в Pr. Michel Franck Laboratory, Unit de zootechnie, ethnologic et economie rurale, Ecole Nationale Veerinaire, 1 avenue Bourgelat, 69280 Marcy I'Etoile, France.
Анализ кариотипа клеток ЕВ14 проводили на двух различных пассажах (пассаж 105 и 118) с помощью стандартных способов, хорошо известных специалисту в этой области техники. Как и ожидалось, у клеток ЕВ14 на пассаже 105 и 118 был обнаружен диплоидный кариотип (Фигура 2):
Пассаж 105: модальное число хромосом =78 (среднее значение: 78.41 - стандартное отклонение: 4.951 в 53 исследованных метафаз)
Пассаж 118: модальное число хромосом =79 (среднее значение: 79.68 - стандартное отклонение: 3.733 в 50 исследованных метафаз).
Геном кур включает два типа пар хромосом: макро- и микрохромосомы. Анализ пассажа 115 показал, что модальное число макрохромосом было равно 18 со средним значением равным 17.82 и стандартным отклонением равным 0.833, а модальное число микрохромосом было равно 60 со средним значением равным 60.6 и стандартным отклонением равным 4.7. Анализ пассажа 118 показал, что модальное число макрохромосом было равно 18 со средним значением равным 18.24 и стандартным отклонением равным 0.797, а модальное число микрохромосом было равно 60 со средним значением равным 61.44 и стандартным отклонением равным 3.688. Не было значительных расхождений в распределении хромосом между двумя исследованными пассажами.
У линии клеток ЕВ 14 был обнаружен нормальный мужской (ZZ) диплоидный кариотип на пассажах 105 и 118, который демонстрировал хромосомную стабильность клеток ЕВ14.
2.2 - Анализ на онкогенность клеток ЕВ14 в модели иммуносупрессивных новорожденных крыс
Онкогенность клеток ЕВ14 на пассаже 127 определяли в модели иммуносупрессивных новорожденных крыс (Sanofi-Aventis, France) (WHO технический отчет №878 (1998). Клетки Hela применяли в качестве позитивного контроля. Десяти иммуносупрессивным новорожденным крысам вкалывали подкожно 10 миллионов клеток ЕВ14 и дополнительным десяти иммуносупрессивным новорожденным крысам вкалывали подкожно 10 миллионов клеток Hela. Все животные получали по 0.1 мл крысиных антител к тимоцитам на 0, +2, +7 и +14 дни. Животных регулярно осматривали в течение трех недель для обнаружения узелковых утолщений на месте инъекции. Через три недели животных забивали и проводили исследование с целью обнаружения разрастания клеток в месте инъекции и в других органах. В месте инъекции клеток ЕВ14 или в отдаленных органах не было обнаружено ни узелков, ни опухолей. Клетки ЕВ14 не были онкогенными в модели иммуносупрессивных новорожденных крыс.
2.3 - Клетки ЕВ14 экспрессируют рецепторы птичьего и человеческого вируса гриппа
Обнаружение рецепторов к птичьему (Sia 2-3Gal) и человеческому (Sia 2-6Gal) вирусу гриппа на клетках ЕВ14 проводили методом флуоресцентного анализа с помощью клеточного сортера, применяя меченные дигоксигенином лектины (Boehringer):
- Агглютинин лектина Sambuca nigra (SNA) специфически связывается с Sia 2-6Gal;
- Агглютинин лектина Maackia amurensis (MAA) специфически связывается с Sia 2-Gal.
Линии клеток ЕВ14 и MDCK промывали в 10 мМ HEPES, 150 мМ Nad pH 7.5 и ресуспендировали в том же буфере до конечной концентрации 5×106. Клетки инкубировали 30 мин на льду, затем дополнительно в течение от 15 до 30 минут в присутствии SNA или MAA. Клетки, обработанные пектином, промывали в 10 мМ HEPES, 150 мМ NaCl, pH 7.5, перед инкубацией на льду в течение от 15 до 30 минут с FITC-меченными антителами к дигоксигенину. Затем клетки промывали в 0.9%-ном NaCl и анализировали по методу FACS.
Клетки ЕВ 14 экспрессируют рецепторы клеточной поверхности, включающие олигосахариды с остатками Sia 2-6Gal и Siaa 2-3Gal (Фигура 6).
ПРИМЕР 3: ПРОДУКЦИЯ MVA В КЛЕТКАХ ЕВ14
3.1 - Материалы и методы
Применяли рекомбинантный вирус MVA, кодирующий ген зеленого флуоресцирующего белка. Титрование инфекционности вирусов MVA-GFP проводили на клетках DF-1. Кратко, клетки сеяли в плоскодонные луночные планшеты до плотности 15×103 клеток/лунку в среде DMEM (Biowhittaker), дополненную 5%-ной эмбриональной телячьей сывороткой (FCS) (SAFC) и 2 мМ L-глутамином (Biowhittaker). Двадцатью четырьмя часами позже клетки инфицировали последовательно десятикратно разведенными в DMEM образцами и инкубировали в течение одной недели при 37°С, 5% СO2 во влажной атмосфере. Инфекционность вируса была измерена с помощью микроскопических наблюдений глобального цитопатического эффекта (СРЕ) и UV-облученных инфицированных клеток. Затем титры TCID50 были рассчитаны методом Reed и Muench (1938, A simple method of estimating fifty percent endpoints. Am. J. Hyg. 27, 493-97).
3.2 - Инфицирование в тканевых культуральных флаконах
3.2.1 - Материалы
Сосуд: F175 флакон (Starstedt, Ссылка. 831812502)
Орбитальная мешалка: IKA KS260 или эквивалент
Ультразвуковой дезинтегратор: IKA U50 (выполняется с помощью наконечника US50-3)
Среда: Excell 65319 (SAFC-JRH) с 2.5 мМ глутамином (Cambrex Ссылка. ВЕ17605Е);
3.2.2 - Методы
Стадия 1: Получение клеток ЕВ14
Клетки должны быть приготовлены за 2 недели до начала эксперимента по инфицированию.
День 0: Клетки ЕВ14 сеяли во флаконы F175 в количестве 0.4×106 клеток/мл в 25 мл среды Excell 65319 с 2.5 мМ глутамином [первый посев после разрушения комочков]. Клетки инкубировали при 37°С, 7,5%-ном CO2, влажной атмосфере, при перемешивании (60 rpm).
День 1: Добавляли 25 мл среды Excell 65319 с 2.5 мМ глутамином.
День 2: Добавляли 50 мл среды Excell 65319 с 2.5 мМ глутамином.
День 3: Клетки подсчитывали. Аликвоту клеток ЕВ14 сеяли в новые флаконы F175 в количестве 0.4×106 клеток/мл в 25 мл среды Excell 65319 с 2.5 мМ глутамином. Это разведение +1.
День 4: Добавляли 25 мл среды Excell 65319 с 2.5 мМ глутамином.
День 5: Добавляли 50 мл среды Excell 65319 с 2.5 мМ глутамином.
День 6: Клетки подсчитывали. Аликвоту клеток ЕВ 14 сеяли в новые флаконы F175 в количестве 0.4×106 клеток/мл в 25 мл среды Excell 65319 с 2.5 мМ глутамином. Это разведение +2.
Затем амплификацию клеток продолжали таким способом, вплоть до разведения, включающего предпочтительно от +3 до +7, более предпочтительно от +3 до +5. Затем нужно переходить к стадии 2 инфицирования клеток.
Для получения культуры клеток, содержавшей клетки ЕВх® в виде больших комочков (называемой в дальнейшем в этом документе: условия "больших комочков"), где клетки пассируются путем разведения в сосуде (сосудах) большего размера, клетки ЕВх® не центрифугировали, и комочки клеток не разбивали пилотированием и перемешиванием. Напротив, для получения культуры клеток без значительной доли клеток ЕВх® в виде комочков комочки разбивали пипетированием и перемешиванием при пассировании клеток (называемой в дальнейшем в этом документе: условия без "комочков").
Стадия 2: Инфицирование клеток ЕВ14 MVA-GFP (зеленый флуоресцирующий белок)
День 1: Клетки ЕВ14 сеяли во флаконы F175 в количестве 0.4х106 клеток/мл в 40 мл среды JRH Excell 65319 с 2.5 мМ глутамином. Клетки инкубировали при 37°С, 7,5%, СO2, влажной атмосфере, при перемешивании (60 rpm).
Дни 2 и 3: Клетки подсчитывали.
День 4: Клетки подсчитывали. Когда клеточная плотность во флаконе достигала величины примерно 0.4×106 клеток/мл, клетки ЕВ14 инфицировали с MOI равной 0.01 ТСID50/клетку с 1 мл смеси вирусной инфекции на флакон. Смеси вирусной инфекции подготавливали непосредственно перед применением путем разведения вируса в Excell 65319 с 2.5 мМ глутамином. Каждый инокулят озвучивали 30 сек (амплитуда 100% и непрерывный цикл) на льду в 15 мл пробирке Falcon™. Инокулят нагревали при комнатной температуре перед перемешиванием с клеточной культурой. После инокуляции инфицированную культуральную среду инкубировали 1 ч при 37°С. Затем во флакон добавляли 60 мл свежей среды Excell 65319, дополненной 2.5 мМ глутамином, 0.5x Yeastolate и 0.35 мл/л жирными кислотами. Инфицированную культуральную среду дополнительно инкубировали при 37°С в течение, по меньшей мере, 144 ч (nb: пик продукции вируса находился между pi+72 ч и pi+120 ч).
Образцы культуры клеток (1 мл) отбирали каждые 24 ч и хранили замороженными при -80°С. Перед отбором образцов культуру клеток гомогенизировали с помощью мягкого пипетирования. Титрование вируса для каждого отобранного образца проводили в конце эксперимента, применяя метод расчета величины ТСID50/мл, предложенный Reed и Мuench (1938).
3.3 - Инфицирование в спиннере
3.3.1 - Материалы
3.3.2 - Метод
Стадия 1: Получение клеток ЕВ14
Клетки должны быть получены за 2 недели до начала эксперимента по инфицированию
День 0: Клетки ЕВ14 сеяли во флаконы F175 в количестве 0.4×106 клеток/мл в 25 мл среды Excell 65319 с 2.5 мМ глутамином [первый посев после разрушения комочков].
Клетки инкубировали при 37°С, 7,5%-ном СO2, влажной атмосфере, при перемешивании (60 rpm).
День 1: Добавляли 25 мл среды Excell 65319 с 2.5 мМ глутамином.
День 2: Добавляли 50 мл среды Excell 65319 с 2.5 мМ глутамином.
День 3: Клетки подсчитывали. Аликвоту клеток ЕВ14 сеяли в новые флаконы F175 в количестве 0.4×106 клеток/мл в 25 мл среды Excell 65319 с 2.5 мМ глутамином. Это разведение +1.
День 4: Добавляли 25 мл среды Excell 65319 с 2.5 мМ глутамином.
День 5: Добавляли 50 мл среды Excell 65319 с 2.5 мМ глутамином.
День 6: Клетки подсчитывали. Аликвоту клеток ЕВ14 сеяли в новые флаконы F175 в количестве 0.4×106 клеток/мл в 25 мл среды Excell 65319 с 2.5 мМ глутамином. Это разведение +2.
Затем амплификацию клеток продолжали таким способом вплоть до разведения, включающего предпочтительно от +3 до +7, более предпочтительно от +3 до +5. Затем следует переходить к стадии 2 инфицирования клеток.
Для получения культуры клеток, содержащей клетки ЕВх®® в виде больших комочков (называемой в дальнейшем в этом документе: "большие комочки"), где клетки пассируют путем разведения в сосуде (сосудах) большего размера, клетки ЕВх® не центрифугировали, и комочки не разбивали пипетированием и перемешиванием. Напротив, для получения культуры клеток без значительной доли клеток ЕВх® в виде комочков комочки разбивали пипетированием и перемешиванием при пассировании клеток (называемой в дальнейшем в этом документе: «без комочков").
Стадия 2: Инфицирование клеток ЕВ14 MVA-GFP
День 1: Клетки ЕВ14 сажали в 500 мл (или 1,000 мл) флакон с постоянным перемешиванием в количестве 0.4×106 клеток/мл в 150 мл (300 мл) среды JRH Excell 65319 с 2.5 мМ глутамином. Клетки инкубировали при 37°С, 7,5%, CO2, влажной атмосфере, при перемешивании (60 rpm).
Дни 2 и 3: Клетки подсчитывали.
День 4: Клетки подсчитывали. Когда клеточная плотность в спиннере достигала величины примерно 0.4×106 клеток/мл, клетки ЕВ14 инфицировали с MOI равной 0.01 ТСID50/клетку с 1 мл смеси вирусной инфекции на флакон с постоянным перемешиванием. Смеси вирусной инфекции подготавливали непосредственно перед применением путем разведения вируса в Excell 65319 с 2.5 мМ глутамином. Каждый инокулят озвучивали в течение 30 сек (амплитуда 100% и непрерывный цикл) на льду в 15 мл пробирке Falcon. Инокулят нагревали при комнатной температуре перед перемешиванием с клеточной культурой. После инокуляции инфицированную культуральную среду инкубировали 1 ч при 37°С. Затем к 500 мл (или 1000 мл) флакону с постоянным перемешиванием добавляли 60 мл свежей среды Excell 65319, дополненной 2.5 мМ глутамином, 0.5x Yeastolate и 0.35 мл/л жирными кислотами. Инфицированную культуральную среду дополнительно инкубировали при 37°С в течение, по меньшей мере, 144 ч (nb: пик продукции вируса находился между pi+72 ч и pi+120 ч).
Образцы культуры клеток (1 мл) отбирали каждые 24 ч и хранили замороженными при -80°С. Перед отбором образцов культуру клеток гомогенизировали с помощью мягкого пипетирования. Титрование вируса для каждого отобранного образца проводили в конце эксперимента, применяя метод расчета величины ТСID50/мл, предложенный Reed и Muench (1938)*. *Reed L & Muench H (1938) A simple method of estimating fifty percent endpoints. Am. J. Hyg. 27, 493-97.
3.4 - Инфицирование в 3L перемешиваемом резервуаре-биореакторе
3.4.1 - Метод
Оттаивание клеток
Пробирки с замороженными клетками хранили в жидком азоте при -196°С; каждая криопробирка содержала 20×106 клеток. Криопробирку размораживали непосредственно в предварительно нагретой до 37°С водяной бане, для того чтобы быстро разморозить замороженную пробирку. Клеточную суспензию переносили с помощью пипетки в 50 мл стерильную пробирку РР с 30 мл предварительно нагретой культуральной средой. Суспензию клеток центрифугировали 5 мин при 300±20 g, при комнатной температуре, супернатант отбрасывали, осадок ресуспендировали в 15 мл свежей культуральной среды и мягко гомогенизировали. Клеточную суспензию помещали во флакон Т75 cm2 и инкубировали при 37±С в атмосфере 7.5%-ного СO2 на орбитальной мешалке при 50 rpm. После 24 часов и 48 часов культивирования 15 мл предварительно нагретой культуральной среды добавляли к культуре клеток. После 72 часов культивирования отбирали образец (после гомогенизации основной массы) и проводили подсчет клеток: ожидали ≥40×106 клеток. Затем проводили первую амплификацию.
Первая амплификация клеток: центрифугирование, разъединение и разведение
Суспендированные клетки собирали из флакона (флаконов) в 50 мл стерильную (стерильные) РР пробирку (пробирки). После 5 мин центрифугирования при 300±20 g, при комнатной температуре, супернатант отбрасывали и к осадку (осадкам) добавляли 10 мл предварительно нагретой свежей культуральной среды. Комочки клеток мягко разъединяли с помощью пипетки на 10 мл, и, если это было необходимо, клеточные суспензии объединяли в одной 50 мл стерильной пробирке РР. Объем культуры доводили до 20 мл предварительно нагретой свежей культуральной средой, если это было необходимо. Подсчет клеток проводили с помощью окрашивания триптофановым синим для определения плотности клеток и жизнеспособности клеток (жизнеспособность клеток была обычно равна примерно 80%). Клетки в количестве 0.4×10 клеток сеяли в 40 мл предварительно нагретой культуральной среды в 1 флакон Т175 cm2. Клеточную культуру инкубировали при 37°С в атмосфере 7.5%-ного СO2 на орбитальной мешалке при 50 rpm. В день 2 к культуре клеток добавляли 60 мл предварительно нагретой культуральной среды. В день 3 проводили разведение клеток.
Разведение от +1 до +5 (без центрифугирования, без разъединения, только разведение).
Образец был отобран из флакона Т175 (после мягкого перемешивания) для проведения подсчета клеток, которое проводили с помощью окрашивания триптофановым синим для определения плотности клеток. Образец был отобран из флакона Т175 (после мягкого перемешивания) с целью посеять клетки в количестве 0.4×106 клеток в 1 флакон Т175 cm2 в предварительно нагретой культуральной среды в суммарном объеме 25 мл. Это разведение +1.
В день 1 добавляли 50 мл предварительно нагретой культуральной среды. В день 2 проводили разведение +2, применяя тот же способ, какой был применен для разведения +1 (см. выше). Амплификацию клеток проводили таким же способом вплоть до разведения от +3 до +5. Инокулят для 3L-биореактора может быть приготовлен из разведения от +3 вплоть до разведения +5. Два флакона Т175 были подготовлены в качестве инокулята.
Посев клеток в 3L перемешиваемый резервуар-биореактор
Посев - День 0
Подготовили инокулят (в биореактор необходимо инокулировать 320×106 клеток). Объединили 2 флакона Т175. Образец отбирали после мягкого перемешивания (комочки клеток не должны быть разрушены) для проведения подсчета клеток с помощью окрашивания триптофановым синим для определения плотности клеток. Приготовили 150 мл клеточной смеси с целью получить концентрацию клеток, равную 0.4×106 клеток мл-1, в 800 мл конечного объема культуры в биореакторе.
Перед посевом клеток доводили значение рН в сосуде до 7.2 (поскольку рН будет падать из-за поверхностного поступления СO2). рO2 доводили до 50% насыщения О2 (регулятор массового расхода был выставлен на 100%, что соответствовало максимальной скорости тока газа из барботажного устройства равной до 50 мл×мин-1). В начале способа рН поддерживался с помощью СO2, поступающего через поверхность, позднее, его контролировали путем добавления 7.5%-ного NaHCO3. Поверхностную аэрацию начинали воздухом со скоростью тока 0.3 мл×мин-1.
Завершение культивирования / Питательная добавка (День 1, День 2)
Подсчет клеток проводили с помощью общепринятых методов. Метаболиты, такие как глутамат, глутамин, лактат и глюкоза, анализировали на протяжении всего времени культивирования с помощью компьютерной программы BioProfile Basic. Концентрацию метаболитов регулировали, если в этом была необходимость. Например, глутамин доводили до концентрации 2 мМ.
Инфицирование MVA-GFP (День 3)
После 3-х дней культивирования клеточная плотность должна быть выше 3×106клеток×мл-1. Если требуемая плотность клеток была достигнута (от 3 до 5×106 клеток×мл-1), проводили инфицирование вирусом при MOI равном 10-2 ТСIF50/клетку. Штамм вируса размораживали на льду. Инфекционную смесь готовили в 50 мл стерильной пробирке РР с 10 мл среды для продукции. Смесь озвучивали в течение 30 сек на льду (амплитуда 100% и постоянный цикл). Инфекционную смесь инокулировали в биореактор. После 1 часа вирусной адсорбции конечную продукционную среду добавляли в сосуд. 1.5 л продукционной среды Excell 65319 в 1.5 л дополняли Yeastolate и жирными кислотами до конечной концентрации 0.5Х и 0.35 мл/л, соответственно (конечный объем: 2,3 л).
Продолжение продуцирования / Питательная добавка (День 4. День 5. День 6. День 7. День 8. День 9. День 10)
Пика продуцирования вируса MVA достигали от 72 до 120 ч после инфицирования. Каждый день образец, примерно в 15 мл, отбирали из биореактора для проведения подсчета клеток, анализа морфологии клеток и наблюдения СРЕ. Метаболиты, такие как глутамат, глутамин, лактат и глюкоза анализировали на протяжении всего времени культивирования с помощью компьютерной программы BioProfile Basic. Концентрацию метаболитов регулировали, если в этом была необходимость. Например, концентрацию глутамина доводили до 2 мМ, если в этом была необходимость. Концентрации глюкозы доводили до 2 г×л-1, если в этом была необходимость.
Анализы
Титрование вирусом проводили в конце эксперимента, применяя все отобранные образцы.
3.5 - Результаты
3.5.1 - Кинетика роста клеток ЕВ14 в подпитываемом 3L-биореакторе
Клетки ЕВ14 обычным образом культивировали в биореакторе с перемешиваемым резервуаром. Биомассе, полученной из клеток ЕВ14, позволили накапливаться при 37°С в среде для роста клеток до тех пор, пока плотность клеток достигла величины равной примерно 5-6×106 клеток/мл. Затем смесь разводили примерно в 3 раза, и в течение 10 дней следили за кинетикой роста клеток. В таких условиях плотность, равную от 12 до 16 миллионов клеток/мл, обычно достигали от примерно 5 до 8 дня (Фигура 7А). Коэффициент деления клеток ЕВ14 может быть увеличен. Фигура 7В показывает кинетику роста клеток ЕВ14, разведенных в 10 раз.
3.5.2 - Пластичность клеток ЕВ-14: очистка бляшек вируса MVA-GFP на прикрепленных клетках
Клетки ЕВ14 растили в суспензионной культуре. Однако клетки ЕВ14 обладали способностью расти прикрепленными к флакону или чашке. Эта особенность позволили заявителям провести очистку бляшек MVA-GFP на прикрепленных клетках ЕВ14. Для того чтобы это сделать, десятикратные последовательные разведения вируса MVA-GFP были инокулированы к прикрепленным клеткам ЕВ-14, посеянным в 6-луночные планшеты за 24 часа до в клеточной плотности примерно 7×104 клеток/см2. После вирусной адсорбции на клетки наслаивали смесь 1.2%-ной LMP агарозы / 2.5%-ного FCS DMEM и инкубировали при 37°С в течение нескольких дней. Лунки были в конце окрашены нейтральным красным. Затем рассчитывали титр бляшкообразующей единицы при разведении, обеспечивающем получение изолированных бляшек.
3.5.3 - Влияние продукционной среды и размера комочков па размножение вируса MVA-GFP в инфицированных клетках ЕВ14
Клеткам ЕВ14 было позволено сформировать маленькие или большие комочки в перемешиваемых Т175 резервуарах-флаконах в ходе размножения клеток в среде клеточного роста (Excell 65319). Затем клетки были инфицированы вирусом MVA-GFP в количестве 10-2 ТСID50/клеток, и смесь была разведена в другой продукционной среде (Optipro, Excell 319, Excell 421, Excell 625, Excell 626, Excell 627, Excell 628, Excell 629, G9916).
Присутствие больших комочков клеток ЕВ14 улучшает инфицирование вирусом и размножение вируса (Фигура 8), что приводит к более высоким вирусным титрам (Фигура 9). Внесение дополнительных веществ, таких как yeastolate (дополнительное вещество 1) и жирные кислоты (дополнительное вещество 2), в вирусную продукционную среду дополнительно улучшает титры вируса MVA. Как показано на Фигуре 10, когда только один yeastolate IX (дополнительное вещество 1) добавляли в среду, увеличивался выход вирусного MVA-GFP, и даже наблюдался синергический эффект при добавлении yeastolate (дополнительного вещества 1) и жирных кислот (дополнительного вещества 2) в среду роста клеток. Действительно, одни жирные кислоты IX не увеличивали вирусных титров.
3.5.4 - Продукция вируса MVA в 3L-биореакторе
Биомассе, полученной из клеток ЕВ14, позволяли накапливаться в ходе фазы пролиферации в среде роста Excell 65319. Затем клетки были инфицированы вирусом MVA-GFP в количестве 10-2 ТСID50/клетку, и смесь разводили в среде для продукции клеток Excell 65319. После добавления среды Excell 65319 плотность клеток падала (День 3), а на День 5 клеточная плотность инфицированных клеток увеличивалась и достигала величины 4 миллиона клеток/мл. Тот факт, что никакого центрифугирования при амплификации клеток не проводили, позволял получить в культуре комочки большого размера от 2-го до 4-го дня после инфицирования (Фигура 11). В таких условиях продукция MVA-GFP была высокой. Так как на День 6 постинфекционного периода титр MVA-GFP был равен примерно 108.32 ТСID50/мл (концентрация клеток примерно 1.49×106 клеток/мл), что соответствует ТСID50/клетку =414 (коэффициент амплификации 41,000) (Фигура 12). Оказалось, что если клетки ЕВ14 были амплифицированы без разрушения комочков (например, с помощью разведения), то получали более высокий вирусный титр в 3L-биореакторе, по сравнению с титром, полученным в отсутствии больших комочков в клеточной культуре (коэффициент амплификации - примерно 1900 и ТСID50/клетку =19).
3.5.5 - Нормальная ультраструктура инфицированных MVA клеток ЕВ14
Клетки ЕВ14, инфицированные вирусом MVA, анализировали с помощью электронного микроскопа (Drs. Daniele Spehner & Robert Drillien, IGBMC, Strasbourg France). Созревание вируса MVA, продуцированного в клетках ЕВ14, было нормальным и похожим на созревание вируса, наблюдаемое в первичных куриных эмбриональных фибробластах.
ПРИМЕР 4: ПРОДУЦИРОВАНИЕ ВИРУСА ГРИППА В КЛЕТКАХ ЕВ14
4.1 - Материалы и Методы
4.1.1 - Исследование инвазионной способности вируса гриппа (TCID50)
Титрование инфекционности вирусов гриппа проводили на клетках MDCK. Кратко клетки сеяли в плоскодонные 96-луночные планшеты до плотности 3×103клеток/лунку в среде UltraMDCK, дополненной 2.5 мМ L-глутамином. Двадцатью четырьмя часами позже клетки были инфицированы последовательно десятикратно разведенными в среде UltraMDCK образцами, содержавшими 6 мкг×мл-1 трипсина-ЭДТА, и инкубированы в течение одной недели при 33°С, 5% СО2, во влажной атмосфере. Репликацию вируса затем тестировали с помощью определения НА, применяя куриные эритроциты, и титры TCID50 рассчитывали методом Reed и Muench (1938)*.
* Reed L, Muench H, 1938. A simple method of estimating fifty percent endpoints. Am. J. Hyg. 5 27,493-97.
4.1.2 - Исследование методом одномерной радиальной иммунодиффузии (SRID)
Концентрацию гемагглютинина в образцах, полученных из клеток ЕВ14, инфицированных вирусом гриппа, определяли методом, описанным Wood and colleagues*. Коротко, стеклянные пластинки покрывали агарозным гелем, содержавшим антитела к вирусу гриппа (рекомендуемые концентрации были обеспечены с помощью NIBSC). После того, как гель был получен, 10 мкл опытных и контрольных образцов в подходящем разведении были загружены в пробитые лунки Ø3 мм. После 18-24 ч инкубации во влажной камере при комнатной температуре пластинки замачивали в 0.9%-ном NaCl и промывали в дистиллированной воде. Затем гель запрессовывали и высушивали. Пластины красили раствором Coomassie Brillant Blue в течение 15 мин и дважды отмывали от краски в смеси метанола и уксусной кислоты до тех пор, пока хорошо различимые окрашенные зоны не становились видимыми. После высушивания пластинок диаметр окрашенной зоны, окружающей антигенные лунки, измеряли в двух направлениях под прямым углом друг к другу. Строили кривые зависимости доза - эффект для разведений антигена против поверхности и рассчитывали результаты стандартными методами по тангенсу угла наклона кривых. "Wood JM. Et al. "An improved single-radial-immunodiffusion technique for the assay of influenza haemagglutinin antigen: application for potency determinations of inactivated whole virus and subunit vaccines". J Biol Stand. 1977; 5(3):237-47).
4.1.3 - Анализ белка гемагглютинина вируса гриппа методом вестерн-блоттинга
SDS-PAGE проводили, как описано по методу Laemmli UK (1970, Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 259:680-685) в 10%-ном полиакриамидном геле. Денатурированные белки (1%-ный SDS, 70 мМ β-меркаптоэтанол) переносили на поливинилидендифторидную мембрану (hybond Р, Amersham) методом полусухого блоттинга (Kyhse-Andersen J (1984) Электроблоттинг множественных гелей: простой прибор без резервуара для буфера для быстрого переноса белков из полиакриамидного геля на нитроцеллюлозу. J Biochem Biophys Methods 10:203-209). Блоты блокировали в течение 1 часа при комнатной температуре смесью, состоявшей из 5% жира сухого молока в среде TBST, дополненной 1%-ной FCS (SAFC). Затем блоты инкубировали в течение ночи в блокирующем растворе, дополненном специфическими поликлональными овечьими антителами к НА (1:500 (NIBSC). Блоты промывали 6 раз средой TBST и инкубировали в блокирующем растворе в течение 1 ч при комнатной температуре с hrp-конъюгированными кроличьими поликлональными антителами к IgG овцы (1:5000 (Rockland). После шести промываний с TBST окончательно выявляли комплекс белок-конъюгат, применяя хемилюминесцентный метод (ECL kit, Amersham) и пленки (Hypefilm, Amersham).
4.2 - Инфицирование клеток ЕВ14 вирусом гриппа в 3L-биореакторе
4.2.1 - Материалы и оборудование
Материалы для оттаивания клеток
флаконы 175 cm2 (Sarstedt, Cat# 831813502)
культуральная среда (свободная от сыворотки среда)
200 мМ L-глутамин (Biowhittaker, Cat# BE17-605E)
Орбитальная мешалка IKA KS260 (Fisher Bioblock, Cat# F35044)
Материал для клеточной амплификации
флаконы 175 cm2 (Sarstedt, Cat# 831813502)
культуральная среда (свободная от сыворотки среда): Excell
65319 (JRH, Cat# 65319-1000M1687), дополненная 2.5 мМ глутамином
200 мМ L-глутамин (Biowhittaker, Cat# BE17-605E)
Раствор Yeastolate UF 50X (JRH, Cat# 58902-100M)
D (+) глюкоза (45%) (Sigma, Cat# 68769)
Материал для продуцирования
Продукционная среда (свободная от сыворотки среда): Excell 65629
(JRH, Cat# 65629), дополненная 2.5 мМ глутамином
Раствор Yeastolate UF 50X (JRH, Cat# 58902-100M)
200 мМ L-глутамин (Biowhittaker, Cat# BE17-605E)
D (+) глюкоза (45%) (Sigma, Cat# 68769)
Трипсин (Trypzean 1 X, Sigma, Cat# T3449)
7.5%-ный раствор бикарбоната натрия (Sigma, Cat# 205-633-8)
Штамм вируса гриппа (замороженный при -80°С)
4.2.2 - Метод
Размораживание клеток
Криопробирки с клетками хранили в жидком азоте при -196°С; каждая криопробирка содержала 20×106 клеток. Криопробирку размораживали непосредственно в предварительно нагретой до 37°С водяной бане. Клеточную суспензию переносили в 50 мл стерильную пробирку РР с 30 мл предварительно нагретой культуральной средой. После центрифугирования (5 мин при 300±20 g, при комнатной температуре) к осадку добавляли 15 мл свежей культуральной среды и мягко гомогенизировали. В образце подсчитывали клетки с помощью окрашивания триптофановым синим. Получили ≥20×106клеток и их жизнеспособность была >70%, что гарантировало получение хорошей культуры. Клеточную суспензию помещали во флакон Т75 cm2 и инкубировали при 37°С в атмосфере 7.5%-ного СO2 на орбитальной мешалке при 50 rpm. После 24 часов и 48 часов культивирования 15 мл предварительно нагретой культуральной среды добавляли к культуре клеток. После 72 часов культивирования отбирали образец (после гомогенизирования основной массы) и проводили подсчет клеток: ожидали от 20 до 30×106 клеток. Затем проводили первую амплификацию.
Первая амплификация клеток: центрифугирование, разделение и разведение
Суспендированные клетки собирали из флакона (флаконов) в 50 мл стерильную (стерильные) пробирку (пробирки) РР и центрифугировали 5 мин при 300±20 g при комнатной температуре. К осадку (осадкам) добавляли 10 мл предварительно нагретой свежей культуральной среды. Комочки клеток мягко разъединяли, клеточные суспензии объединяли; объем культуры доводили до 40 мл предварительно нагретой свежей культуральной средой. Клетки в количестве 0.25×106 клеток/мл поместили в 40 мл предварительно нагретой среды в 1 флакон Т175 cm2 и инкубировали при 37°С в атмосфере 7.5%-ного CO2 на орбитальной мешалке при 50 rpm. В день 2 к культуре клеток добавляли 60 мл предварительно нагретой культуральной среды. В день 3 проводили второй круг амплификации.
Посев клеток в 3L перемешиваемый резервуар-биореактор
Посев - День 0
Подготовили инокулят (в 3L-биореактор необходимо инокулировать 320×106клеток). Объединяли 2 флакона Т175. Образец отбирали после мягкого перемешивания (комочки клеток не должны быть разрушены) для проведения подсчета клеток с помощью окрашивания триптофановым синим для определения плотности клеток. Приготовили 150 мл клеточной смеси с целью получить концентрацию клеток, равную 0.4×106 клеток мл-1, в 800 мл конечного объема культуры в биореакторе.
Перед посевом клеток доводили значение рН в сосуде до 7.2 (поскольку рН будет падать из-за поверхностного поступления CO2). pO2 доводили до 50% насыщения O2 (регулятор массового расхода был выставлен на 100%, что соответствовало максимальной скорости тока газа из барботажного устройства равной до 50 мл×мин-1). В начале способа рН поддерживался с помощью СО2, поступающего через поверхность, позднее его контролировали путем добавления 7.5%-ного NaHCO3. Поверхностную аэрацию начинали воздухом со скоростью тока 0.3 мл×мин-1.
Завершение культивирования / Питательная добавка (День 1, День 2)
Подсчет клеток проводили с помощью общепринятых способов. Метаболиты, такие как глутамат, глутамин, лактат и глюкоза, анализировали на протяжении всего времени культивирования с помощью компьютерной программы BioProfile Basic. Концентрацию метаболитов регулировали, если в этом была необходимость. Например, концентрацию глутамина доводили до 2 мМ.
Инфицирование - День 3
После 3-х дней культивирования, клеточная плотность должна быть выше 4-5×106клеток×мл-1. Если требуемая плотность клеток была достигнута, проводили инфицирование вирусом при MOI равном 10-4. Температуру сосуда приводили к 33°С.
Штамм вируса размораживали на льду. Инфекционную смесь готовили в 10 мл среды для продукции. После инокуляции инфекционной среды в биореактор проводили адсорбцию вируса в течение 1 часа. Готовили конечную продукционную среду: в 1.5 л продукционной среды добавляли трипсин, так чтобы его конечная концентрация в сосуде была примерно 0.3 U×мл-1 (в целом получилось 2.3 л) и добавляли 0.5Х Yeastolate. Затем добавляли предварительно нагретую конечную продукционную среду.
Продолжение продукции / Питательная добавка (День 4. День 5. День 6. День 7. День 8. День 9. День 10)
Каждый день образец приблизительно в 15 мл отбирали из биореактора для проведения подсчета клеток, анализа морфологии клеток и наблюдения СРЕ. Метаболиты, такие как глутамат, глутамин, лактат и глюкоза, анализировали на протяжении всего времени культивирования с помощью компьютерной программы BioProfile Basic. Концентрацию метаболитов регулировали, если в этом была необходимость. Например, концентрацию глутамина доводили до 2 мМ, если в этом была необходимость. Концентрацию глюкозы доводили до 2 г×л-1, если в этом была необходимость.
Анализы
Титрование вирусом, определения гемагглютинина (HAU) и количественные определения НА-антигена (вестерн-блоттинг, SRID) проводили в конце эксперимента, применяя все отобранные образцы.
4.3 - Результаты
Заявители показали, что клетки ЕВ14 являются надежным и эффективным клеточным субстратом для репликации различных штаммов вирусов гриппа А и В. Продуцирование вируса гриппа может быть проведено в различных сосудах, таких как флаконы и спинеры (данные не показаны) и биореакторы. Заявителями был разработан воспроизводимый и эффективный способ продуцирования вируса гриппа с подпиткой в 3L- и 30L-перемешиваемых резервуарах биореакторах. Продуктивность, равная примерно 25 мг/л гемагглютинина, обычно достигалась во флаконах, и продуктивность, равная примерно 35 мг/л гемагглютинина, обычно достигалась во флаконах со штаммами А и В вируса гриппа.
Реферат
Настоящее изобретение относится к области биотехнологии и касается способа репликации вируса в птичьих эмбриональных стволовых клетках. Представленный способ включает выделение, культивирование и размножение птичьих эмбриональных стволовых клеток в полной культуральной среде, включающей все факторы, необходимые для их роста в присутствии инактивированного фидерного слоя и дополненной животной сывороткой; удаление факторов роста, сыворотки и фидерного слоя; получение неадгезивных эмбриональных стволовых клеток; пролиферацию полученных клеток в суспензии в виде клеточных комочков; инфицирование указанных клеток выбранным вирусом; добавление к клеточной культуре второй свободной от сыворотки среды; дальнейшее культивирование инфицированных клеток для репликации вируса и сбор указанного вируса. Представленное изобретение может быть использовано при получении вакцин и, в частности, позволяет производить штаммы вирусов, которые не могут быть адекватно выращены в яйцах. 37 з.п. ф-лы, 23 ил., 1 табл., 4 пр.
Формула
i) выделение, культивирование и размножение птичьих эмбриональных стволовых клеток в полной культуральной среде, включающей все факторы, необходимые для их роста в присутствии инактивированного фидерного слоя, и дополненной животной сывороткой;
ii) модификация культуральной среды путем удаления упомянутых факторов, упомянутой сыворотки и упомянутого фидерного слоя в течение нескольких клеточных пассажей;
iii) определение клонов клеток, способных пролиферировать в базальной среде в отсутствии экзогенных факторов роста, инактивированного фидерного слоя и 2 или менее процентов сыворотки или в отсутствии сыворотки вообще для получения неадгезивных эмбриональных стволовых клеток;
причем упомянутый способ включает стадии:
a) пролиферации полученных клеток в сосудах для культивирования в суспензии в виде клеточных комочков в первой свободной от сыворотки среде, позволяющей клеткам агрегировать друг с другом для формирования скоплений в ходе, по крайней мере, этой стадии;
b) инфицирования указанных клеток выбранным вирусом при плотности клеток, по меньшей мере, примерно 1,5 миллиона клеток/мл;
c) добавления к клеточной культуре второй свободной от сыворотки среды незадолго до инфицирования, одновременно с инфицированием или сразу после инфицирования; и
d) дальнейшего культивирования указанных инфицированных клеток для репликации вируса; и
e) сбора указанного вируса.

Комментарии