Новые вакцинные составы, включающие сапонинсодержащие адъюванты - RU2555342C2
Код документа: RU2555342C2
Чертежи







Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к эмульсиям масло-в-воде, их применению в качестве адъювантов и к фармацевтическим, иммунологическим или вакцинным композициям, которые содержат данные эмульсии.
Включение ссылкой
Настоящей заявкой заявляется приоритет предварительной патентной заявки США №61/241171 от 10 сентября 2009 года, и дополнительно дается ссылка на следующие патентные заявки: патентная заявка США №12/027776 от 7 февраля 2008 года, патентная заявка США №10/899181 от 26 июля 2004 года, теперь является выданным патентом США 7371395, и предварительная патентная заявка США №60/490345 от 24 июля 2003 года. Вышеупомянутые заявки и все документы, процитированные в них или в ходе их рассмотрения («документы, процитированные в заявке») и все документы или ссылки в документах, процитированных в заявке, и все документы, процитированные или упоминаемые в данном документе («документы, процитированные в данном документе»), и все документы, процитированные или упомянутые в документах, процитированных в данном документе, вместе с какими-либо инструкциями производителя, описаниями, техническими описаниями изделия и технологическими картами для любых продуктов, упомянутых в данном документе, или в любом документе, включенном ссылкой в данный документ, настоящим включены в данный документ ссылкой, и могут быть использованы при практическом осуществлении изобретения.
Предшествующий уровень техники
Применение адъювантов в вакцинах хорошо известно. Адъювант представляет собой соединение, которое при объединении с вакцинным антигеном повышает иммунный ответ на вакцинный антиген по сравнению с ответом, индуцированным вакцинным антигеном отдельно. Среди стратегий, которые стимулируют иммуногенность антигена, есть те, в которых придают вакцинным антигенам дисперсную форму, те, в которых вакцинные антигены полимеризуют или эмульгируют, есть способы инкапсуляции вакцинных антигенов, есть пути улучшения ответа собственных цитокинов хозяина, и есть способы, которые направляют вакцинные антигены к антиген-презентирующим клеткам (Nossal, 1999, In: Fundamental Immunology. Paul (Ed.), Lippincott-Raven Publishers, Philadelphia, Pa.; Vogel and Powell, 1995, In: Vaccine Design. The Subunit and Adjuvant Approach. Powell and Newman (Eds.), Plenum Press, NY, N.Y. p.141). Так как адъюванты играют существенную роль в улучшении иммуногенности вакцинных антигенов, то применение адъювантов в составе вакцин является по существу повсеместным (Nossal, 1999, выше; Vogel and Powell, 1995, выше; см. также заявку РСТ WO 97/18837, раскрытие которой включено в данный документ ссылкой). Подходящие адъюванты, хорошо известные в данной области, различаются по своей природе. Они могут, например, состоять из нерастворимых в воде неорганических солей, липосом, мицелл или эмульсий, как например, адъювант Фрейнда. Другие адъюванты можно найти в публикации Vogel and Powell, 1995, упомянутой выше. Хотя не существует единого механизма действия адъювантов, существенной характеристикой является их способность значительно повышать иммунный ответ на вакцинный антиген по сравнению с ответом, индуцированным вакцинным антигеном отдельно (Nossal, 1999, выше; Vogel and Powell, 1995, выше). В связи с этим, некоторые адъюванты являются более эффективными по части усиления гуморального иммунного ответа; другие адъюванты более эффективны в увеличении клеточно-опосредованного иммунного ответа (Vogel and Powell, 1995, выше); и еще другая группа адъювантов увеличивает оба типа иммунного ответа против вакцинных антигенов, гуморальный и клеточно-опосредованный (Vogel and Powell, 1995, выше).
Как правило, эмульсии, используемые в вакцинном составе, включают смесь масла, водного раствора и поверхностно-активных веществ. Некоторые эмульсии включают липофильное поверхностно-активное вещество, такое как «SPAN 80®» и гидрофильное поверхностно-активное вещество, такое как «TWEEN 80®».
Однако могут наблюдаться проблемы стабильности с эмульсиями, используемыми в качестве вакцинных адъювантов, в частности, во время хранения и транспортировки. Это в особенности верно, когда эти композиции содержат концентрированные иммуногены, особенно неочищенные концентрированные иммуногены. Как правило, это происходит с адъювантами, используемыми в инактивированных (убитых) вакцинах. Данная проблема еще более значима для мультивалентных вакцинных композиций, поскольку иммуногены сильнее сконцентрированы в том же объеме разбавителя.
Другая проблема, касающаяся адъюванта, связана с риском побочных эффектов, таких как токсичность или локальное воспаление в месте инъекции. Например, после инъекции может возникнуть локальный воспалительный ответ и/или гранулема. С целью ограничения таких побочных реакций, количество поверхностно-активных веществ и других компонентов в эмульсии может быть уменьшено; однако это уменьшение в результате может привести к снижению стабильности вакцинной композиции. Таким образом, существует необходимость получения новых адъювантов и вакцинных композиций, содержащих такие адъюванты, с повышенной безопасностью и стабильностью.
Сущность изобретения
В первом воплощении, в настоящем изобретении предлагается новая эмульсия масло-в-воде (М/В) с повышенной стабильностью в присутствии бактериальных или вирусных суспензий, особенно концентрированных и не очищенных или слабо очищенных.
Другое воплощение настоящего изобретения обеспечивает стабильную, безопасную и легко вводимую, в частности, инъецируемую, М/В эмульсию в качестве носителя для доставки фармацевтической композиции, включающей, по меньшей мере, один активный ингредиент, который, более конкретно, может представлять собой иммуноген.
Еще одно воплощение настоящего изобретения обеспечивает стабильную, безопасную и инъецируемую М/В эмульсию, действующую в качестве адъюванта для повышения иммунного ответа, индуцированного иммуногеном. Конкретно, в настоящем изобретении предлагается новый адъювант, который при использовании в вакцинной композиции, содержащей иммуноген, повышает клеточный иммунный ответ вакцинированного на иммуноген, гуморальный иммунный ответ или, предпочтительно, повышает оба иммунных ответа.
Еще в одном воплощении настоящего изобретения предлагается стабильная, безопасная и иммуногенная композиция или вакцина, включающая М/В эмульсию.
В следующем воплощении настоящего изобретения предлагается способ получения вакцинной композиции с использованием адъюванта по настоящему изобретению; полученная вакцинная композиция; и способы ее применения.
Еще в одном воплощении настоящего изобретения предлагается набор реагентов, включающий один или несколько флаконов. В одном воплощении, набор реагентов включает один флакон, содержащий адъювант по настоящему изобретению и иммуноген или другой фармацевтический продукт. Еще в одном воплощении, набор реагентов включает иммуноген или другой фармацевтический продукт в первом флаконе, и адъювант, полученный согласно настоящему изобретению, во втором флаконе, при этом адъювант разработан так, чтобы перед применением его необходимо было смешивать с иммуногеном или другим вакцинным продуктом.
В одном воплощении, в настоящем изобретении предлагается инъецируемая эмульсия масло-в-воде (М/В), включающая:
(1) водный раствор, включающий иммуноген;
(2) водный раствор, включающий гидрофильное ионное поверхностно-активное вещество, такое как сапонин
(3) необязательный водный раствор, включающий гидроксид алюминия;
(4) минеральное масло;
(5) неионное липофильное поверхностно-активное вещество;
(6) неионное гидрофильное поверхностно-активное вещество с низким значением ГЛБ, которое включает этоксилированные диэфиры сорбита и жирных кислот (как правило, имеющие значение от 11 до 13).
В другом воплощении, в настоящем изобретении предлагается инъецируемая эмульсия масло-в-воде (М/В), включающая:
(1) водный раствор, включающий иммуноген;
(2) водный раствор, включающий гидрофильное ионное поверхностно-активное вещество, такое как сапонин
(3) минеральное масло;
(4) неионное липофильное поверхностно-активное вещество;
(5) неионное гидрофильное поверхностно-активное вещество с низким значением ГЛБ, которое включает этоксилированные диэфиры сорбита и жирных кислот (как правило, имеющие значение от 11 до 13).
В другом воплощении, в настоящем изобретении предлагается инъецируемая эмульсия масло-в-воде (М/В), включающая:
(1) водный раствор, включающий иммуноген;
(2) водный раствор, включающий гидрофильное ионное поверхностно-активное вещество, такое как сапонин
(3) необязательный водный раствор, включающий гидроксид алюминия;
(4) неионное гидрофильное поверхностно-активное вещество с высоким значением гидрофильно-липофильного баланса (ГЛБ) более чем 13 и менее чем 40, конкретно, с ГЛБ>13,5, и предпочтительно с ГЛБ>14;
(5) минеральное масло;
(6) неионное липофильное поверхностно-активное вещество;
(7) неионное гидрофильное поверхностно-активное вещество с низким значением ГЛБ (значение ГЛБ от около 9 до около 13).
В другом воплощении, в настоящем изобретении предлагается инъецируемая эмульсия масло-в-воде (М/В), включающая:
(1) водный раствор, включающий иммуноген;
(2) водный раствор, включающий гидрофильное ионное поверхностно-активное вещество, такое как сапонин
(3) неионное гидрофильное поверхностно-активное вещество с высоким значением гидрофильно-липофильного баланса (ГЛБ) более чем 13 и менее чем 40, конкретно, с ГЛБ≥13,5, и предпочтительно с ГЛБ≥14;
(4) минеральное масло;
(5) неионное липофильное поверхностно-активное вещество;
(6) неионное гидрофильное поверхностно-активное вещество с низким значением ГЛБ (значение ГЛБ от около 9 до около 13).
Еще в одном воплощении, в настоящем изобретении предлагается вакцинная композиция, включающая новую эмульсию, содержащую, по меньшей мере, один иммуноген, подходящий для вызова иммунологического ответа у вакцинированного. В изобретении дополнительно предлагаются такие композиции, где эмульсия действует в качестве адъюванта для усиления иммунного ответа, индуцированного иммуногеном, конкретно, для усиления клеточного ответа, гуморального ответа или, предпочтительно, обоих ответов.
В другом воплощении настоящего изобретения предлагается способ получения вакцинной композиции, где иммуноген смешивают с адъювантом согласно настоящему изобретению, особенно, иммуноген в сухой форме, который может быть получен путем лиофилизации или путем стеклования, или иммуноген в водном растворе, особенно, где указанная сухая форма или указанный водный раствор дополнительно включают ионное поверхностно-активное вещество, например, сапонин и необязательно дополнительно включают гидроксид алюминия. Иммуноген может быть выбран из группы, состоящей из инактивированных патогенов, ослабленных патогенов, субъединиц антигенов, очищенных антигенов, неочищенных антигенов или антигенов, полученных рекомбинантно с использованием бактериальных клеток, дрожжевых, растительных, клеток насекомых или животных клеток, экспрессирующих векторы, включающие плазмиды, и т.п. Антигены могут быть очищены с помощью способов, хорошо известных в данной области, включающих в частности ультрафильтрацию, ультрацентрифугирование, эксклюзионную гель-фильтрацию, ион-обменную хроматографию и очистку с ПЭГ. Патоген может иметь бактериальное, вирусное происхождение, может происходить из простейших или может иметь грибное происхождение, или в состав иммуногена может входить антитоксин.
В другом воплощении в настоящем изобретении предлагается способ индукции иммунного ответа у вакцинированного против патогена, причем способ включает введение вакцинируемому вакцинной композиции по настоящему изобретению.
В другом воплощении, в настоящем изобретении предлагаются наборы реагентов, включающие один флакон, содержащий очищенные иммуногены и эмульсию по настоящему изобретению. В одном воплощении, иммуногены, содержащиеся в одном флаконе, включают очищенные антигены вируса ящура.
В другом воплощении, в настоящем изобретении предлагаются наборы реагентов, включающие, по меньшей мере, два флакона, где первый флакон содержит иммуноген, особенно иммуноген в сухой форме или в растворе или в водной среде, особенно где указанная сухая форма или указанный водный раствор дополнительно включают ионное поверхностно-активное вещество, преимущественно сапонин, и необязательно дополнительно включают гидроксид алюминия, а второй флакон содержит адъювант или эмульсию согласно настоящему изобретению. Применение наборов реагентов, которые включают, по меньшей мере, два флакона, особенно эффективно в случаях, где комбинация дискретных компонентов (т.е. смешивание в одном флаконе содержимого, по меньшей мере, двух флаконов) будет приводить в результате к получению состава вакцины с уменьшенной стабильностью.
Следует отметить, что в данном раскрытии и особенно в формуле изобретения термины, такие как «содержит», «содержащий» и т.п. могут иметь значение, которое придается термину в патентном законе США, например, они могут означать «включает», «включенный», «включающий» и т.п.; и что термины, такие как «состоящий преимущественно» и «состоит преимущественно» имеют значение, предписанное им в патентном законе США, например, они позволяют элементам не явным образом упоминаться, но исключать элементы, которые обнаружены в предшествующем уровне техники или которые влияют на основную или новую характеристику изобретения.
Эти и другие воплощения описаны в следующем подробном описании или очевидны из него и охвачены им.
Краткое описание чертежей
Полное и достаточное раскрытие настоящего изобретения, включающее лучший способ его осуществления, более конкретно изложено для специалистов в данной области в оставшейся части описания изобретения, включая ссылку на прилагаемые чертежи, где:
На фиг.1 представлены графики определения температуры обращения фаз, ТОФ (англ. Phase Inversion Temperature, PIT) (измеренной посредством проводимости) для вакцинных составов испытаний 1 и 2 в дни 7, 22, 121, и 330 (одногодичное исследование стабильности). Определение ТОФ является одной мерой стабильности вакцинного состава.
На фиг.2 представлены графики определения ТОФ для вакцинных составов испытаний 3 и 4 в различные дни после получения (одногодичное исследование стабильности).
На фиг.3 представлены графики определения ТОФ для вакцинных составов испытаний 5 и 6 в различные дни после получения (одногодичное исследование стабильности).
На фиг.4 представлены графики определения ТОФ для вакцинных составов испытаний 7 и 8 в различные дни после получения (одногодичное исследование стабильности).
На фиг.5 представлен график определения ТОФ для вакцинных составов испытания 9 в различные дни после получения (одногодичное исследование стабильности).
На фиг.6 представлены графики определения ТОФ для вакцинных составов (испытаний 1-9), полученных согласно настоящему изобретению, и сохраняемых в течение 36 месяцев.
На фиг.7 представлен график, который выявляет временную зависимость изменений ректальной температуры свиней, подвергнутых обработке согласно материалам и методам, раскрытым в примере 6.
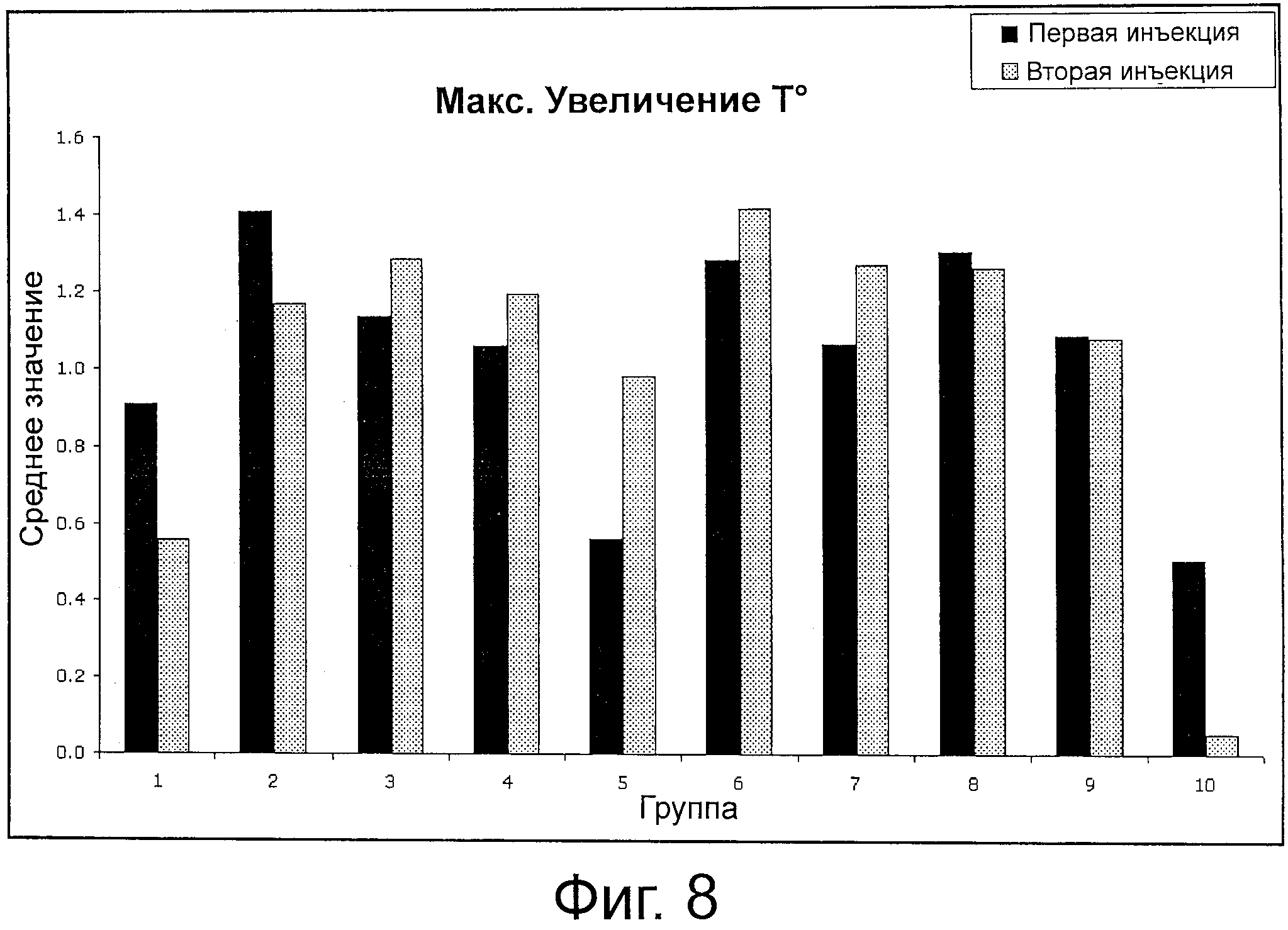
На фиг.8 представлен график, который выявляет максимальное изменение температуры, наблюдаемое для свиней, подвергнутых обработке согласно материалам и методам, раскрытым в примере 6.
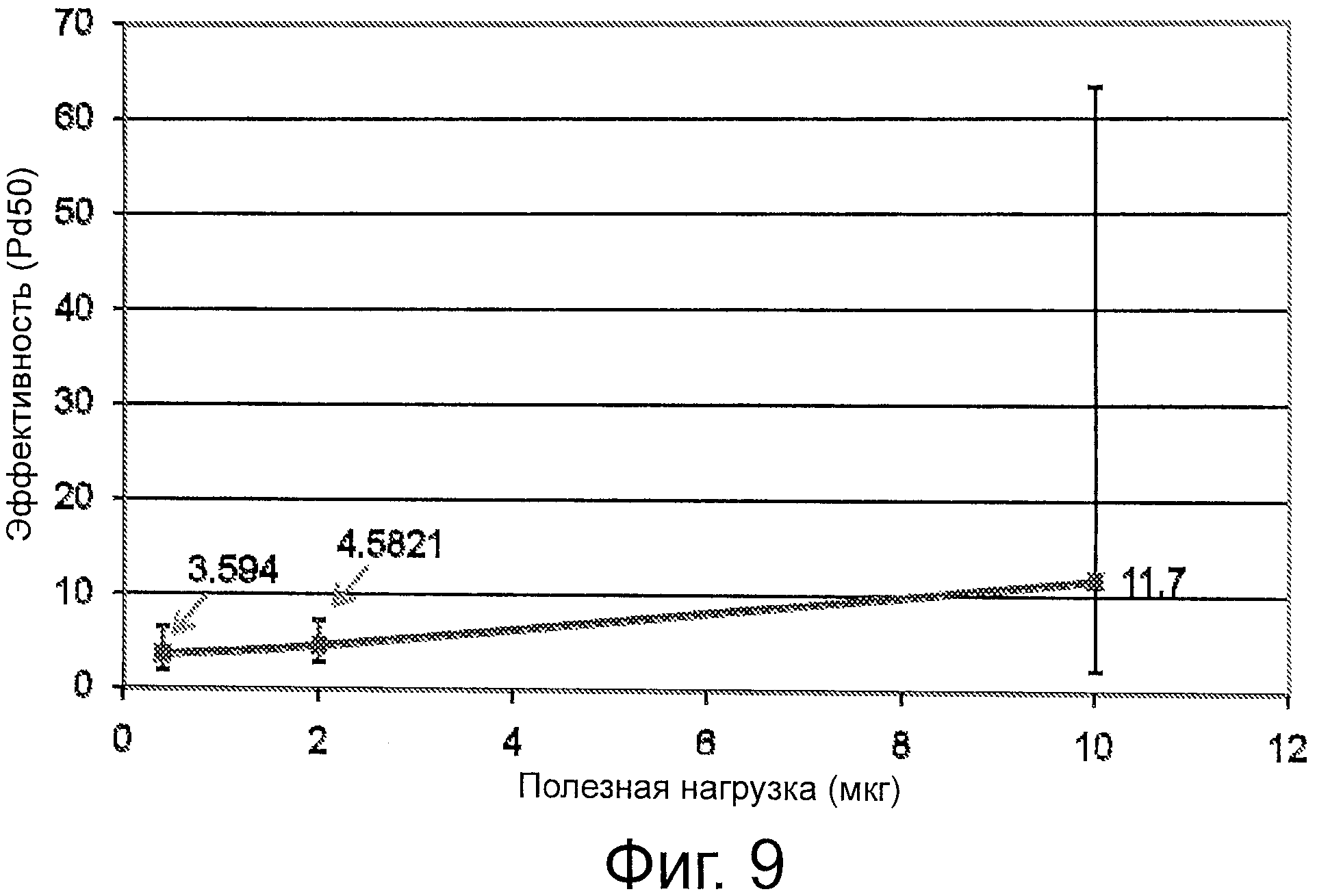
На фиг.9 представлен график, который демонстрирует эффективность вакцины (PD50) относительно полезной нагрузки (мкг) для свиней, подвергнутых обработке согласно материалам и методам, которые раскрыты в примере 7.
Подробное описание изобретения
Другие задачи, особенности и аспекты настоящего изобретения будут раскрыты или станут очевидны из следующего подробного описания изобретения. Специалисту в данной области следует понимать, что настоящее обсуждение представляет собой только описание типичных воплощений и не предназначено для ограничения более широких аспектов настоящего изобретения, которые будут воплощены в примерном исполнении. Фактически, специалисту в данной области будет очевидно, что в настоящем изобретении могут быть произведены различные модификации и вариации, не отходя при этом от объема притязаний и сущности изобретения. Например, признаки, проиллюстрированные или описанные как часть одного воплощения, могут использоваться в другом воплощении с получением еще одного воплощения. Подразумевается, что настоящее изобретение охватывает такие модификации и вариации, попадающие в рамки приложенной формулы изобретения и ее эквивалентов. Содержание публикаций, опубликованных патентов и патентов, цитированных в настоящей заявке, настоящим включено с помощью ссылки в полном объеме.
Для удобства здесь собраны определенные термины, применяемые в Описании изобретения, в примерах и в приложенной Формуле изобретения.
При использовании в данном документе, термин «животное» включает всех позвоночных, включающих человека. Он также включает индивидуальное животное во всех стадиях развития, включая стадии эмбриона и плода. Конкретно, термин «позвоночное животное» включает в частности людей, представителей семейства собачьих (например, собаки), кошачьих (например, кошки); лошадиных (например, лошади), жвачных парнокопытных (например, коровы, крупный рогатый скот), свиней (например, свиньи), а также птиц. При использовании в данном документе, термин «корова» или «крупный рогатый скот» используется, как правило, для обозначения животного с происхождением из семейства жвачных парнокопытных любого возраста. Взаимозаменяемые термины включают «бык», «теленок», «вол», «буйвол», «телка», «корова» и тому подобные. Взаимозаменяемые термины включают «поросенок», «свиноматка» и тому подобные. Термин «птичий» при использовании в данном документе относится к любым видам или подвидам таксономической группы птичьих, таких как в частности, курица (племенные птицы, бройлеры и несушки), индейка, утка, гусь, перепел, фазан, попугай, зяблик, ястреб, ворона и бескилевые, включающие страуса, эму и казуара. Термин «свинья» или «поросенок» обозначает животного свиного происхождения, в то время как «свиноматка» обозначает самку с репродуктивными возрастом и способностью.
При использовании в данном документе, термин «вирулентный» обозначает изолят, который сохраняет свою способность инфицировать животное-хозяина.
При использовании в данном документе, термин «инактивированная вакцина» обозначает вакцинную композицию, содержащую инфекционный организм или патоген, который более не способен к репликации или росту. Патоген может иметь бактериальное, вирусное происхождение, может происходить из простейших или может иметь грибное происхождение. Инактивация может осуществляться с помощью разнообразных способов, включающих замораживание-оттаивание, химическую обработку (например, обработку формалином), обработку ультразвуком, облучение, нагревание или другой подходящий способ, достаточный для предотвращения репликации или роста организма, с сохранением при этом его иммуногенности.
При использовании в данном документе, термин «иммуногенность» обозначает способность продуцировать иммунный ответ у животного-хозяина против антигена или антигенов. Иммунный ответ образует основание защитного иммунитета, вызываемого вакциной против специфического инфекционного организма.
При использовании в данном документе, термин «иммунный ответ» обозначает ответ, вызываемый у животного. Иммунный ответ может обозначать клеточный иммунитет (англ. cellular immunity, CMI); гуморальный иммунитет или может включать в себя и то и другое. Настоящее изобретение также предполагает ответ, ограниченный частью иммунной системы. Например, вакцинная композиция по настоящему изобретению может специфично индуцировать усиленный ответ гамма-интерферона.
При использовании в данном документе, термин «антиген» или «иммуноген» обозначает вещество, которое индуцирует специфический иммунный ответ у животного-хозяина. Антиген может включать цельный организм, убитый, ослабленный или живой; субъединицу или часть организма; рекомбинантный вектор, содержащий вставку с иммуногенными свойствами; часть или фрагмент ДНК, способной индуцировать иммунный ответ при презентировании животному-хозяину; белок, полипептид, пептид, эпитоп, гаптен или любую их комбинацию. В ином случае, иммуноген или антиген могут содержать токсин или антитоксин.
При использовании в настоящем документе, термин «мультивалентная» обозначает вакцину, содержащую более одного антигена либо из одного вида (т.е. различные изоляты серотипов вируса ящура), из различных видов (т.е. изоляты как из Pasteurella hemolytica, так и из Pasteurella multocida), или вакцину, содержащую комбинацию антигенов из различных родов (например, вакцина, включающая антигены из Pasteurella multocida, Salmonella, Escherichia coli, Haemophilus somnus и Clostridium).
При использовании в данном документе, термин «адъювант» обозначает вещество, добавляемое к вакцине для усиления иммуногенности вакцины. Механизм того, как функционирует антиген, до конца не ясен. Считается, что некоторые адъюванты усиливают иммунный ответ путем медленного высвобождения антигена, в то время как другие адъюванты сами по себе являются сильно иммуногенными и считается, что они функционируют синергично. Известные вакцинные адъюванты включают в частности масляные и водные эмульсии (например, полный адъювант Фрейнда и неполный адъювант Фрейнда), Corynebacterium parvum, бациллу Кальмета-Герена, гидроксид алюминия, глюкан, декстран сульфат, оксид железа, альгинат натрия, бакто-адъювант, определенные синтетические полимеры, такие как полиаминокислоты и сополимеры аминокислот, сапонин, «REGRESSIN» (Vetrepharm, Athens, Ga.), «AVRIDINE» (N,N-диоктадецил-N',N'-бис(2-гидроксиэтил)-пропандиамин), парафиновое масло, мурамил-дипептид и т.п.
При использовании в данном документе, термин «эмульсия» обозначает комбинацию, по меньшей мере, двух веществ, где первое вещество диспергируется во втором веществе, в котором первое вещество не растворимо. Один пример эмульсии по настоящему изобретению представляет собой масляную фазу, диспергированную в водной фазе.
При использовании в данном документе, термин «неполная эмульсия» обозначает композицию, к которой должен быть добавлен, по меньшей мере, один дополнительный компонент для получения «полной эмульсии». При использовании в данном документе, термин «полная эмульсия» может рассматриваться как эквивалент «готовой к применению» иммунологической композиции по настоящему изобретению. Примером полной эмульсии является иммунологическая композиция в соответствии с настоящим изобретением, которая готова к введению животному в соответствии со способами по настоящему изобретению.
При использовании в настоящем документе, термины «фармацевтически приемлемый носитель» и «фармацевтически приемлемое средство переноса» взаимозаменяемы и обозначают жидкое средство переноса для содержания вакцинных антигенов, которые могут инъецироваться организму-хозяину без побочных эффектов. Подходящие фармацевтически приемлемые носители, известные в данной области, включают в частности стерильную воду, солевой раствор, глюкозу, декстрозу или буферные растворы. Носители могут включать вспомогательные агенты, включающие в частности разбавители, стабилизаторы (т.е., сахара и аминокислоты), консерванты, увлажнители, эмульгаторы, рН-буферные агенты, добавки усиления вязкости, красители и т.д.
При использовании в данном документе, термин «вакцинная композиция» включает, по меньшей мере, один антиген или иммуноген в фармацевтически приемлемом носителе, используемый для индукции иммунного ответа у организма-хозяина. Вакцинные композиции могут быть введены в дозировках и методами, хорошо известными специалистам в области медицины или ветеринарии, принимая во внимание такие факторы, как возраст, пол, масса, вид и состояние животного-реципиента, а также путь введения. Путь введения может быть чрескожным введением через слизистую оболочку (например, пероральное, назальное, ректальное, вагинальное), или может быть ведением через парентеральный путь (внутрикожное, внутримышечное, подкожное, внутривенное или внутрибрюшинное введение). Вакцинные композиции могут вводиться отдельно или могут вводиться совместно или последовательно с другими обработками или терапиями. Формы введения могут включать суспензии, сиропы или эликсиры, и препараты для парентерального, подкожного, внутрикожного, внутримышечного или внутривенного введения (например, введения с помощью инъекций), такие как стерильные суспензии или эмульсии. Вакцинные композиции могут вводиться в виде спрея или могут смешиваться с пищей и/или водой, или могут доставляться в виде предварительной смеси с использованием подходящего носителя, разбавителя или наполнителя, такого как стерильная вода, физиологический солевой раствор, глюкоза и т.д. Композиции могут содержать вспомогательные вещества, такие как увлажнители или эмульгаторы, корректирующие рН буферные агенты, адъюванты, добавки, усиливающие гелеобразование или вязкость, консерванты, ароматизаторы, красители и т.п., в зависимости от требуемых путей введения и приготовления. Стандартные фармацевтические тексты, такие как «Remington's Pharmaceutical Sciences», 1990, могут быть использованы для консультации при приготовлении подходящих препаратов, без проведения излишних экспериментов.
При использовании в данном документе термин «очищенный» не требует абсолютной чистоты; скорее он подразумевается как относительный термин. Таким образом, например, очищенный иммуногенный препарат, такой как белок или инактивированный вирус, является препаратом, в котором иммуноген находится в более обогащенном состоянии, чем иммуноген в его естественной среде. Иммуногенный препарат в данном документе часто обозначается как «очищенный», если иммуноген составляет, по меньшей мере, 60%, по меньшей мере, 70%, по меньшей мере, 80%, по меньшей мере, 90%, по меньшей мере, 95%, или, по меньшей мере, 98% от общего содержания иммуногена в препарате. «Сырой препарат», который соответствует самой низкой степени очистки, может содержать настолько мало, как менее чем 60%, менее чем 20%, менее чем 10%, менее чем 5%, или менее чем 1% иммуногенных компонентов.
Подразумевается, что при использовании в данном документе, термин «высокоочищенный» предполагает «высокую степень чистоты» относительно термина «среднеочищенный». Эта «более высокая степень чистоты» может включать, но никоим образом не ограничивать, уменьшенное процентное содержание примесей в иммунологическом препарате, который является «высокоочищенным» по сравнению с иммунологическим препаратом, который является «среднеочищенным». Как обсуждается в данном документе, «высокоочищенные» иммунологические препараты будут содержать от самого низкого до не детектируемого процентного содержания примесей, которые могут вызывать: снижение целевого иммунного ответа, усиление нецелевого иммунного ответа (например, реакцию гиперчувствительности), или уменьшение стабильности состава. Аналогично, иммунологический препарат, который является «среднеочищенным», содержит относительно сниженное процентное содержание примесей по сравнению с иммунологическим препаратом, который является «минимально очищенным», который также содержит сниженное процентное содержание примесей по сравнению с препаратом, обозначенным как «сырой препарат».
Примеси в иммунологическом препарате могут включать, но никоим образом не ограничиваются этим, вещества, которые вносят отрицательный вклад в иммунологическую композицию по настоящему изобретению. Одним из нескольких примеров примесей, которые вносят отрицательный вклад, является примесь, которая снижает способность иммунологической композиции по настоящему изобретению вызывать иммунный ответ у животных.
С помощью различных методов можно достичь различных уровней чистоты (например, «высокой чистоты», «средней чистоты», и т.п.). Например, комбинация хроматографии и гель-фильтрации может приводить в результате к получению «высокоочищенных» или «среднеочищенных» иммунологических препаратов. Различия источника/типа иммуногенов, а также небольшие вариации в процедурах очистки могут значительно повлиять на конечную степень чистоты иммуногена. Как правило, при использовании в данном документе, иммунологические препараты, содержащие примеси от самого низкого процента до самого высокого, будут описаны как 1) «высокоочищенные», 2) «среднеочищенные», 3) «минимально очищенные», 4) «сырой препарат», соответственно. «Высокоочищенный» препарат будет иметь самый низкий уровень всех типов примесей. «Среднеочищенный» препарат будет, соответственно, иметь относительно низкий уровень большинства типов примесей, но может иметь одну примесь, которая будут более высоко представлена, по сравнению с ее уровнем, который можно наблюдать в «высокоочищенном» препарате. В ином случае, «минимально очищенный препарат» будет иметь относительно низкий уровень некоторых типов примесей, но может иметь более одного типа примесей, которые будут более высоко представлены, по сравнению с их уровнем в «среднеочищенном» препарате. Как и следовало ожидать, «сырой препарат» имеет наиболее высокий уровень всех типов примесей по сравнению с другими типами препаратов, обсуждаемыми в данном документе.
В настоящем изобретении предлагается новая эмульсия масло-в-воде (М/В), включающая:
(1) водный раствор, включающий вакцинный антиген или иммуноген, способный индуцировать иммунный ответ у хозяина;
(2) водный раствор, включающий ионное поверхностно активное вещество;
(3) неионное гидрофильное поверхностно активное вещество;
(4) минеральное масло;
В одном воплощении, новая эмульсия масло-в-воде (М/В) включает:
(1) водный раствор, включающий вакцинный антиген или иммуноген, способный индуцировать иммунный ответ у хозяина;
(2) водный раствор, включающий ионное поверхностно активное вещество, такое как сапонин;
(3) неионное гидрофильное поверхностно активное вещество со значением гидрофильно-липофильного баланса (ГЛБ) более чем 13 и менее чем 40 (ГЛБ≥13, конкретно, с ГЛБ≥13,5, и предпочтительно с ГЛБ≥14);
(4) минеральное масло;
(5) неионное липофильное поверхностно активное вещество;
(6) неионное гидрофильное поверхностно активное вещество с низким значением ГЛБ (значение ГЛБ от 9 до 13).
В другом воплощении, в настоящем изобретении предлагается новая эмульсия масло-в-воде (М/В), включающая:
(1) водный раствор, включающий вакцинный антиген или иммуноген, способный индуцировать иммунный ответ у хозяина;
(2) водный раствор, включающий ионное поверхностно активное вещество, такое как сапонин
(3) необязательный водный раствор, включающий гидроксид алюминия;
(4) неионное гидрофильное поверхностно активное вещество со значением гидрофильно-липофильного баланса (ГЛБ) более чем 13 и менее чем 40 (ГЛБ≥13, конкретно, с ГЛБ≥13,5, и предпочтительно с ГЛБ≥14);
(5) минеральное масло;
(6) неионное липофильное поверхностно активное вещество; и
(7) неионное гидрофильное поверхностно-активное вещество с низким значением ГЛБ (значение ГЛБ от 9 до 13).
Некоторые эмульсии, полученные согласно настоящему изобретению, основаны на комбинации, по меньшей мере, четырех (4) поверхностно-активных веществ, и возможно использование одного или нескольких поверхностно-активных веществ, принадлежащих к каждой группе. Три (3) из этих групп включают неионные поверхностно-активные вещества и одна (1) из этих групп включает ионные поверхностно-активные вещества, например, сапонины.
В одном из некоторых воплощений, концентрация ионного поверхностно-активного вещества (2) в эмульсии (в настоящем описании это означает конечную эмульсию, включающую все ингредиенты, если иное не указано) составляет от около 0,01% до около 10%>.
В одном из воплощений, концентрация неионного поверхностно-активного вещества (7) в эмульсии (в настоящем описании это означает конечную эмульсию, включающую все ингредиенты, если иное не указано) составляет от 1% до 8%, конкретно, от 1,5% до 6%, предпочтительно, от 2% до 5%, более предпочтительно, от 2,5% до 4%, выраженных в виде процентного отношения массы к объему эмульсии (мас./об.).
Эта группа поверхностно-активных веществ включает неионные гидрофильные поверхностно-активные вещества, имеющие низкое значение ГЛБ (значение ГЛБ от 9 до 13). Данная группа включает в частности этоксилированный моноэфир сорбита и жирной кислоты (конкретно, 5 этоксигрупп) (например, этоксилированный сорбитан моноолеат, такой как «TWEEN 81®», диэфиры этоксилированной жирной кислоты и сорбитана, этоксилированные триэфиры сорбита и жирной кислоты (конкретно, 20 этоксигрупп) (например, этоксилированный сорбитан триолеат, такой как «TWEEN 85®»), этоксилированный сорбитан тристеарат, такой как «TWEEN 65®», этоксилированные жирные спирты (конкретно, 5-10 этоксигрупп) (например, «BRIJ 76®», «BRIJ 56®», «BRIJ 96®»), этоксилированные жирные кислоты (конкретно, 5-10 этоксигрупп) (например, «Simulsol 2599®», «MYRJ 45®»), этоксилированное касторовое масло (конкретно, 25-35 этоксигрупп) (например, «ARLATONE 650®», «ARLATONE G®»), и их комбинации.
Предпочтительными являются этоксилированные диэфиры сорбита и жирной кислоты и этоксилированные триэфиры сорбита и жирной кислоты, а также комбинации этих двух видов. Жирную кислоту предпочтительно выбирают из группы, состоящей из олеата, пальмитата, стеарата, изостеарата, лаурината и их комбинации. Предпочтительные этоксилированные триэфиры сорбита и жирной кислоты включают этоксилированный сорбитан триолеат, такой как «TWEEN 85®»), или этоксилированный сорбитан тристеарат, такой как «TWEEN 65®».
В одном из некоторых воплощений концентрация неионного гидрофильного поверхностно-активного вещества (4) как правило составляет от 0,1% до 1,5%, конкретно от 0,2% до 1,4%, предпочтительно, от 0,3% до 1,3%, более предпочтительно, от 0,4% до 1,2%, и выражена в виде процентного отношения массы к объему эмульсии (мас./об.).
Эта вторая группа поверхностно-активных веществ включает неионные гидрофильные поверхностно-активные вещества, имеющие значение гидрофильно-липофильного баланса (ГЛБ) (ГЛБ≥13, конкретно ГЛБ≥13,5, и предпочтительно, ГЛБ≥14). Данная группа включает этоксилированные моноэфиры сорбита и жирной кислоты (конкретно, 20 этоксигрупп) (например, этоксилированный сорбитанмонолауринат, такой как «TWEEN 20®», этоксилированный сорбитанмонопальмитат, такой как «TWEEN 40®», этоксилированный сорбитанмоностеарат, такой как «TWEEN 60®», этоксилированный сорбитанмоноолеат, такой как «TWEEN 80®», этоксилированные жирные спирты (конкретно, 15-30 этоксигрупп) (например, «BRIJ 78®», «BRIJ 98®», «BRIJ 721®»), этоксилированные жирные кислоты (конкретно, 15-30 этоксигрупп) (например, «MYRJ 49®», «MYRJ 51®», «MYRJ 52®», «MYRJ 53®»), неионные блок-сополимеры (например, сополимер полиоксиэтилена/полиоксипроиплена (РОЕ-РОР), такой как «LUTROL F127®», «LUTROL F68®»), и их комбинации.
Для неионных блок-сополимеров процентное содержание может быть ниже и в частности составляет от 0,1% до 0,5%, более конкретно, от 0,2% до 0,4% (отношения массы по объему эмульсии (мас./об.)).
Предпочтительные поверхностно-активные вещества (4) включают этоксилированные моноэфиры сорбита и жирной кислоты, такие как описанные выше.
В одном из некоторых воплощений концентрация неионного липофильного поверхностно-активного вещества (6) составляет от 0,1% до 2,5%, конкретно от 0,2% до 2%, предпочтительно, от 0,2% до 1,5%, более предпочтительно, от 0,2% до 1,2%, и выражена в процентном отношении массы к объему эмульсии (мас./об.).
Данная группа поверхностно-активных веществ включает эфиры сорбита и жирной кислоты (например, сорбитанмонолауринат, типа «SPAN 20®», сорбитанмонопальмитат, такой как «SPAN 40®», сорбитанмоностеарат, такой как «SPAN 60®», сорбитантристеарат, такой как «SPAN 65®», сорбитанмоноолеат, типа «SPAN 80®», сорбитантриолеат, типа «SPAN 85®», сорбитанмоноизостеарат, такой как «ARLACEL 987®», сорбитанизостеарат, такой как «CRILL 6®»), эфиры маннита и жирной кислоты например, «MONTANIDE 80®», маннит моноолеат (такой как «ARLACEL А®»), маннит диолеат, маннит триолеат.маннит тетраолеат), этоксилированные эфиры жирной кислоты и маннита (2, 3 или 4 этоксигруппы) (например, «MONTANIDE 888®», «MONTANIDE 103®», этокслированный маннит моноолеат, этоксилированный маннит диолеат, этоксилированный маннит триолеат, этоксилированный маннит тетраолеат), и их комбинации.
Жирную кислоту предпочтительно выбирают из группы, состоящей из олеата, пальмитата, стеарата, изостеарата, лаурината и их комбинации.
Предпочтительные поверхностно-активные вещества (6) включают эфиры сорбита и жирной кислоты, в частности, описанные выше или их комбинации.
Поверхностно-активные вещества по изобретению могут содержать жирные кислоты животного или растительного происхождения. Изменение одного происхождения на другое (например, животный «TWEEN 80®» на растительный «TWEEN 80®») может осуществляться с незначительной регуляцией состава эмульсии.
Эмульсия согласно изобретению может иметь общую концентрацию поверхностно-активных веществ, выраженную отношением массы к объему эмульсии, и составляющую от 1,2% до 10%, конкретно от 2% до 8%, предпочтительно от 3% до 7%, более предпочтительно, от 4% до 6%.
Как правило, эмульсия согласно изобретению может иметь температуру обращения фаз (ТОФ), которая ≥33°С, конкретно, колеблется от 33°С до 65°С, более конкретно, от 36°С до 60°С, предпочтительно, от 37°С до 55°С, и более предпочтительно, от 38°С до 50°С.
ТОФ представляет собой температуру, при которой эмульсия вода-в-масле изменяется на эмульсию масло-в-воде или дефазируется (разрушается эмульсия и разделение 2 фаз). Значение ТОФ может быть измерено различными способами, как например, с помощью визуального проявления (например, см. пример 2) или с помощью проводимости. Эмульсию помещают при температуре ниже ТОФ эмульсии, например, около 25°С в водяную баню. Температуру поступательно увеличивают. Наблюдают изменение визуального аспекта эмульсии по сравнению с контрольной эмульсией, а именно изменение текучести, вязкости, разделения на две фазы, изменение поверхностного аспекта благодаря миграции масляной фазы на поверхность. Температура, для которой наблюдают изменение визуального аспекта, представляет собой значение ТОФ эмульсии. В ином случае, ТОФ определяют с помощью быстрого перехода от значения проводимости около 5-8 миллисименс/сантиметр (мС/см) (эмульсия масло-вводе) до значения около 0 мС/см (эмульсия вода-в-масле), измеренного с помощью зонда, помещенного в эмульсию около ее поверхности. Температура, для которой наблюдают обращение, является значением ТОФ эмульсии. Специалист в данной области способен без дополнительных экспериментов определить комбинации поверхностно-активных веществ и масла, включая их соответствующие концентрации, с целью получения эмульсий согласно изобретению и. конкретно, эмульсий, имеющих значение ТОФ в интервалах, определенных выше.
Как правило, эмульсии по изобретению могут содержать концентрацию масла, выраженную отношением объема к объему эмульсии, от 3% до 55% масла, конкретно, от 5% до 50% масла, предпочтительно, от 10% до 40% масла и, более предпочтительно, от 20% до 40% масла. По определению, интервалы значений в настоящем описании всегда включают ограничение интервала, если не указано иное.
Используемое масло может быть минеральным маслом, включающим, в частности, парафиновое масло, такое как изопарафиновое масло и/или нафтеновое масло, сквалан, пристан, полиизобутеновое масло, гидрогенизированное полиизобутеновое масло, полидеценовое масло, полиизопреновое масло, полиизопропенвое масло и т.п.Одно предпочтительное минеральное масло, используемое в настоящем изобретении, может включать масло, включающее линейную или разветвленную углеродную цепь, содержащую атомы углерода в количестве более чем 15, предпочтительно от 15 до 32, свободное от ароматических соединений. Такие масла могут, например, представлять собой масла, продаваемые под марками «MARCOL 52®» или «MARCOL 82®» (производство Esso, Франция) или «DRAKEOL 6VR®» или «DRAKEOL 5®» «DRAKEOL 7®» (производство Penreco, США), «CLEAROL®» (производство Sonnebom, США), «Paraffin Oil Codex AAB2®» (производство Aiglon, Франция), «BLANDOL» (производство Sonnebom, США), «ONDINA 915» (производство Shell, Великобритания).
Масло также может представлять собой смесь масел, включающую, по меньшей мере, два масла, выбранных из масел, описанных в данном документе, и смесь в любой пропорции. Смесь масел также может включать, по меньшей мере, одно масло, выбранное из масел, описанных выше, и, по меньшей мере, одно растительное масло, и это растительное масло составляет от около 0,1% до около 33% масляной фазы, предпочтительно, от около 10% до около 25% об./об. Эти растительные масла представляют собой ненасыщенные масла, богатые олеиновой кислотой, которые являются биодеградируемыми и, предпочтительно, жидкими при температуре хранения (около +4°С) или, по меньшей мере, возможно получение эмульсий, которые являются жидкими при данной температуре. Например, растительное масло может представлять собой арахисовое масло, ореховое масло, подсолнечное масло, сафлоровое масло, соевое масло, онагровое масло и т.п.
В одном из некоторых воплощений, гидрофильные поверхностно-активные вещества (4) и (7) предпочтительно включают поверхностно-активные вещества, содержащие в молекулах одинаковый гидрофильный компонент. Например, применение включает этоксилированные эфиры сорбита и жирной кислоты для каждого из гидрофильных поверхностно-активных веществ (4) и (7). Например, если в качестве неионного гидрофильного поверхностно-активного вещества выбирают «TWEEN 85®», имеющий низкое значение ГЛБ, то неионное гидрофильное поверхностно-активное вещество, имеющее высокое значение ГЛБ, будет предпочтительно содержать гидрофильный компонент, состоящий из этоксилированного сорбитана, такого как «TWEEN 80®».
Как правило, настоящим изобретением предусмотрено применение водного раствора, включающего подходящий для применения в ветеринарии или фармацевтически приемлемый носитель, наполнитель или разбавитель, включающие в частности, стерильную воду, физиологический раствор, глюкозу, буфер и т.п. Носитель, наполнитель или разбавитель также могут включать полиолы, глюциды или буферные агенты для стабилизации рН. Носитель, наполнитель или разбавитель могут, например, также включать аминокислоты, пептиды, антиоксиданты, бактерицидные или бактериостатические соединения. Водный раствор добавляют к маслу и поверхностно-активным веществам в таком количестве, чтобы получить 100% объема эмульсии согласно изобретению.
Гидрофильно-липофильный баланс (ГЛБ) эмульсии дает возможность оценки гидрофильного или липофильного фактора поверхностно-активного вещества. ГЛБ амфифильной молекулы, как правило, рассчитывают следующим образом:
ГЛБ может иметь значение в интервале от 0 (для наиболее липофильной молекулы) до 20 (для наиболее гидрофильной молекулы). Согласно химическому составу поверхностно-активного вещества (важно, например, добавление этоксигрупп или алкеноксидов), эта оценка может изменяться и интервал значений ГЛБ может увеличиваться (например, «LUTROL F68®» имеет ГЛБ 29). При использовании смеси поверхностно-активных веществ, ГЛБ смеси представляет собой добавление ГЛБ каждого поверхностно-активного вещества, сбалансированное с помощью их массового соотношения:
ГЛБ=(ГЛБ поверхностно-активного вещества Х × массу поверхностно-активного вещества X)+(ГЛБ поверхностно-активного вещества Y × массу поверхностно-активного вещества Y)/(масса поверхностно-активного вещества Х + масса поверхностно-активного вещества Y)
В одном воплощении эмульсии, полученной согласно настоящему изобретению, конечное значение ГЛБ эмульсии составляет от около 9 до около 12, предпочтительно, от около 9,5 до около 11,5 и, более предпочтительно, от около 10 до около 11,5.
Настоящим изобретением предусмотрена эмульсия, включающая парафиновое масло (конкретно, в концентрации от около 10% до около 40% и, предпочтительно, от около 20% до около 40%), выраженной в виде отношения объема к объему эмульсии (об./об.)); моноэфиры сорбита и жирной кислоты (в качестве неионного липофильного поверхностно-активного вещества), этоксилированный триэфир сорбита и жирной кислоты (в качестве неионного гидрофильного поверхностно-активного вещества, имеющего низкое значение ГЛБ); и этоксилированный моноэфир сорбита и жирной кислоты (в качестве неионного гидрофильного поверхностно-активного вещества с высоким значением ГЛБ). В частности, моноэфир сорбита и жирной кислоты представляет собой сорбитанмоноолеат (конкретно, в концентрации от 0,2% до 1,5%, предпочтительно, от 0,2% до 1,2%, выраженной в виде отношения массы к объему эмульсии (мас./об.)), этоксилированный триэфир сорбита и жирной кислоты представляет собой этоксилированный сорбитантриолеат (конкретно, в концентрации от 2% до 5%, предпочтительно, от 2,5% до 4% мас./об.)) и этоксилированный моноэфир сорбита и жирной кислоты представляет собой этоксилированный сорбитанмоноолеат (конкретно, в концентрации от 0,3% до 1,3%, предпочтительно, от 0,4% до 1,2% мас./об.). Например, эмульсия включает парафиновое масло в концентрации около 29,3% отношения объема к объему эмульсии, сорбитанмоноолеат в концентрации 0,6% отношения массы к объему эмульсии, этоксилированный сорбитантриолеат в концентрации 3,4% отношения массы к объему эмульсии, и этоксилированный сорбитанмоноолеат в концентрации 0,75% отношения массы к объему эмульсии.
Во втором воплощении согласно настоящему изобретению, эмульсия включает парафиновое масло (конкретно, в концентрации от 10% до 40%, предпочтительно, от 20% до 40% об./об.), моноэфиры сорбита и жирной кислоты (в качестве неионного липофильного поверхностно-активного вещества), этоксилированный триэфир сорбита и жирной кислоты (в качестве неионного гидрофильного поверхностно-активного вещества, имеющего низкое значение ГЛБ) и неионный блок-сополимер (в качестве неионного гидрофильного поверхностно-активного вещества, имеющего высокое значение ГЛБ). В частности, моноэфир сорбита и жирной кислоты представляет собой сорбитанмоноолеат (конкретно, в концентрации от 0,2% до 1,5%, предпочтительно, от 0,2% до 1,2%, мас./об.), этоксилированный триэфир сорбита и жирной кислоты представляет собой этоксилированный сорбитантриолеат (конкретно, в концентрации от 2% до 5%, предпочтительно, от 2,5% до 4% мас./об.)), а нионный блок-сополимер представляет собой полимер полиоксиэтилен/полиоксипропилен РОЕ-РОР) (конкретно в концентрации от 0,1% до 0,5%, предпочтительно, от 0,2% до 0,4% мас./об.). Например, эмульсия включает парафиновое масло в концентрации около 29,3% об./об., сорбитанмоноолеат в концентрации 0,6% мас./об., этоксилированный сорбитантриолеат в концентрации 3,4% мас./об., и этоксилированный сорбитанмоноолеат в концентрации 0,25% мас./об.
В конкретном воплощении, в изобретении предлагается инъецируемая эмульсия масло-в-воде (М/В), включающая:
(1) водный раствор, включающий активный ингредиент, такой как лекарственное средство или иммуноген, предпочтительно, иммуноген;
(2) водный раствор, включающий сапонин
(3) минеральное масло;
(4) неионное липофильное поверхностно активное вещество;
(5) неионное гидрофильное поверхностно активное вещество с низким значением ГЛБ, которое включает этоксилированный диэфир сорбита и жирной кислоты (которое может иметь значение от 11 до 13).
В другом конкретном воплощении, в изобретении предлагается инъецируемая эмульсия масло-в-воде (М/В), включающая:
(1) водный раствор, включающий активный ингредиент, такой как лекарственное средство или иммуноген, предпочтительно, иммуноген;
(2) водный раствор, включающий сапонин
(3) водный раствор, включающий гидроксид алюминия;
(4) минеральное масло;
(5) неионное липофильное поверхностно-активное вещество;
(6) неионное гидрофильное поверхностно-активное вещество с низким значением ГЛБ, которое включает этоксилированный диэфир сорбита и жирной кислоты (которое может иметь значение от 11 до 13).
Эмульсия согласно данному воплощению включает этоксилированные эфиры сорбита и жирной кислоты, которые могут содержать до 20 этоксигрупп. Жирные кислоты могут быть животного или растительного происхождения и могут быть выбраны из группы, состоящей из олеата, пальмитата, стеарата, изостеарата, лаурината и их комбинации. В одном воплощении, этоксилированная жирная кислота предпочтительно представляет собой олеат. Другие ингредиенты, а также основные свойства эмульсии, такие как ТОФ, могут иметь одинаковые характеристики в отличие от других, описанных выше.
Предпочтительно, если поверхностно-активное вещество (6) включает этоксилированный диэфир сорбита и жирной кислоты, такой как этоксилированный сорбитандиолеат, этоксилированный сорбитандистеарат и этоксилированный сорбитандиизостеарат, этоксилированный сорбитандипальмитат, этоксилированный сорбитандилауринат и их комбинации.
Необязательно к эмульсии могут быть добавлены другие соединения в качестве ко-адъювантов, включающие в частности, алюминиевые квасцы; CpG-олигонуклеотиды (ODN), конкретно, ODN 2006, 2007, 2059, или 2135 (Pontarollo R.A. et al. Vet. Immunol. Immunopath, 2002, 84: 43-59; Wemette CM. et al., Vet. Immunol. Immunopath, 2002, 84: 223-236; Mutwiri G. et al., Vet. Immunol. Immunopath, 2003, 91: 89-103); полиА-полиУ ("Vaccine Design The Subunit and Adjuvant Approach", edited by Michael F.Powell and Mark J.Newman, Pharmaceutical Biotechnology, 6: 03); диметилдиоктадециламмоний бромид (DDA) ("Vaccine Design: The Subunit and Adjuvant Approach", edited by Michael F.Powell and Mark J.Newman, Pharmaceutical Biotechnology, volume 6: 157), N,N-диоктадецил-N',N'-бис(2-гидроксиэтил)пропандиамин (такой как AVRIDINE®) (там же, р.148), карбомер, хитозан (см. например, Пат.США №5980912).
В настоящем изобретении также предлагается способ получения вакцинной композиции или иммунологической композиции, включающей, по меньшей мере, одну антигенную или иммуногенную композицию и адъювант или эмульсии, полученные согласно настоящему изобретению. Антигенная или иммуногенная композиция может быть включена в процессе образования эмульсии или, в альтернативном воплощении, антигенная или иммуногенная композиция, предпочтительно дополнительно включающая сапонин и необязательно дополнительно включающая гидроксид алюминия, может быть добавлена к эмульсии позже, например, непосредственно перед применением.
Полное количество используемого водного раствора может присутствовать с начала получения эмульсии. Или это может быть только часть водного раствора, используемого для образования эмульсии, а оставшееся количество водного раствора добавляют после включения иммуногена. Иммуноген или антиген могут быть представлены в сухом виде или могут присутствовать в некоторых других подходящих формах, например в твердой, которую затем смешивают с эмульсией, или, в ином случае, антиген может быть представлен в растворе, конкретно, в водном растворе, и этот раствор смешивают с эмульсией.
Поверхностно-активные вещества добавляют либо к маслу, либо к водному раствору согласно их растворимости. Например, неионные липофильные поверхностно-активные вещества добавляют к маслу согласно изобретению, в то время как неионные гидрофильные поверхностно-активные вещества, имеющие высокое значение ГЛБ, добавляют к водному раствору.
Эмульгирование могут проводить согласно подходящим методам, известным специалисту в данной области. Например, в одном воплощении настоящего изобретения, эмульсию можно получать при температуре ниже ТОФ эмульсии, конкретно, при комнатной температуре, например, при около 25°С. Водную фазу и масляную фазу смешивают вместе механическим перемешиванием, например, с помощью турбины, оборудованной ротором-статором, способным создавать высокое усилие сдвига. Предпочтительно, перемешивание начинают при низкой скорости вращения и медленно увеличивают вместе с поступательным добавлением, как правило, водного раствора к маслу. Предпочтительно, водный раствор поступательно добавляют к маслу. Отношение масла/водного раствора может быть отрегулировано для получения эмульсии вода-в-масле (В/М), например, в концентрации от около 40% до около 55% масла (об./об.). Когда перемешивание прекращают, эмульсия поступательно изменяется на эмульсию М/В (обращение фаз). После обращения и в случае необходимости, эмульсию разводят путем добавления водного раствора с получением целевой концентрации масла в конечной эмульсии. Эмульсию можно хранить при температуре около 5°С.
В другом воплощении, эмульсию можно получать при температуре выше, чем ТОФ эмульсии. В первой стадии, водную фазу и масляную фазу смешивают вместе при температуре выше, чем ТОФ эмульсии. Предпочтительно, водный раствор поступательно добавляют к маслу. Отношение масла/водного раствора может быть урегулировано для получения эмульсии вода-в-масле (В/М), например, в концентрации от около 40% до около 55% масла (об./об.). Эмульгирование может быть осуществлено с помощью перемешивания с использованием небольшого усилия сдвига или при его отсутствии, например, с помощью статического миксера или с помощью гребного винта или с помощью турбины с очень низкой скоростью вращения. Полученная эмульсия представляет собой эмульсию вода-в-масле (В/М). Во второй стадии, эмульсию поступательно охлаждают до температуры ниже ТОФ. Во время этой стадии, эмульсия изменяется на эмульсию М/В (обращение фаз). После обращения и в случае необходимости, эмульсию разводят путем добавления водного раствора с получением целевой концентрации масла в конечной эмульсии. Эмульсию можно хранить при температуре около 5°С.
Размер капель эмульсии может составлять от около 100 нм до около 500 нм. Эмульсию можно применять, например, в качестве адъюванта для включения в состав вакцинной композиции или фармацевтической композиции. Эмульсию также можно применять в качестве растворителя для растворения сухого продукта, особенно сухого продукта, содержащего например, ослабленные микроорганизмы или живые рекомбинантные векторы.
В конкретном воплощении первичную эмульсию получают с использованием лишь части водного раствора. Эта первичная эмульсия может быть разведена путем добавления суспензии активного ингредиента, такого как лекарственное средство или иммуноген, предпочтительно, иммуноген, с получением конечной композиции. В ином случае, первичную эмульсию можно разводить с использованием водного раствора и применять для растворения высушенного продукта, такого как сухой продукт.
Иммуноген или антиген, подходящий для использования в настоящем изобретении, может быть выбран из группы, состоящей из инактивированных патогенов, ослабленных патогенов, иммуногенных субъединиц (например, белков, полипептидов, пептидов, эпитопов, гаптенов), или рекомбинантных экспрессирующих векторов, включающих плазмиды, содержащие иммуногенные вставки. В одном воплощении настоящего изобретения, иммуноген представляет собой инактивированный или убитый микроорганизм. В другом воплощении изобретения вакцинная композиция включает иммуноген, выбранный из группы птичьих патогенов, включающих в частности Salmonella typhimurium. Salmonella enteritidis, вирус инфекционного бронхита (IBV), вирус ньюкаслской болезни (NDV), синдром снижения несучести (EDS), или вирус инфекционного бурсита IBDV), птичий вирус гриппа и т.п., а также из их комбинации.
В ином случае вакцинная композиция включает иммуноген, выбранный из кошачьего патогена, такого как в частности кошачий вирус герпеса (FHV), кошачий калицивирус (FCV), кошачий вирус лейкоза (FeLV), кошачий вирус иммунодефицита (FIV), вирус бешенства и т.д., и из их комбинации.
Еще в одном воплощении, вакцинная композиция по настоящему изобретению включает иммуноген, выбранный из собачьих патогенов, включающих, в частности вирус бешенства, вирус герпеса собак (CHV), парвовирус собак (CPV), коронавирус собак, Leptospira canicola, Leptospira icterohaemorragiae, Leptospira grippotyphosa, Borrelia burgdorferi, Bordetella bronchiseptica и т.д., и их комбинации.
Еще в одном воплощении изобретения, композиция включает иммуноген, выбранный из лошадиных патогенов, таких как вирус герпеса лошадей (типа 1 или типа 4), вирус гриппа лошадей, столбняка, вирус Западного Нила, и т.д. или их комбинации.
Еще в одном воплощении изобретения, композиция включает иммуноген, выбранный из бычьих патогенов, таких как вирус ящура (FMDV), вирус бешенства, бычий ротавирус, бычий вирус парагриппа типа 3 (bPIV-3), бычий коронавирус, бычий вирус диарреи (BVDV), бычий респираторно-синцитиальный вирус (BRSV), бычий вирус инфекционного ринотрахеита (IBR), Escherichia coli, Pasteurella multocida, Pasteurella haemolytica и т.д., и их комбинации.
Еще в одном воплощении настоящего изобретения, иммуноген выбирают из свиных патогенов, таких как в частности вирус свиного гриппа (SIV), свиной цирковирус типа 2 (PCV-2), свиной вирус репродуктивно-респираторного синдрома (PRRS), вирус псевдобешенства (PRV), свиной парвовирус (PPV), FMDV, Mycoplasma hyopneumoniae, Erysipelothrix rhusiopathiae, Pasteurella multocida, Bordetella bronchiseptica, Escherichia coli и т.д., и их комбинаций.
В другом воплощении изобретения предлагаются вакцинные композиции, включающие, по меньшей мере, один иммуноген и эмульсию в фармацевтически приемлемом носителе. Иммуногены, включающие вирусы, бактерии, грибы и т.д., могут быть получены с помощью методов культивирования in vitro с использованием подходящей культуральной среды или линий клеток-хозяев и с использованием подходящих способов, хорошо известных специалисту в данной области. Например, PRRS можно культивировать в подходящей клеточной линии, такой как клеточная линия МА-104 (см. среди прочих Пат. США №5587164; 5866401; 5840563; 6251404). Аналогично, PCV-2 можно культивировать с использованием клеточной линии РК-15 (см. Пат. США №6391314); SIV можно культивировать на яйцах (Пат. США №6048537); и Mycoplasma hyopneumoniae можно культивировать в подходящей культуральной среде (Пат. США №5968525;US 5338543; Ross R.F. et al. Am. J.Vet.Res., 1984, 45: 1899-1905).
С целью получения инактивированной иммунологической или вакцинной композиции, патоген предпочтительно инактивируют после культивирования и необязательно подвергают очистке средствами химической обработки с использованием, например, формалина или формальдегида, бета-пропиолактона, этиленимина, бинарный этиленимин (BEI), и/или посредством физической обработки (например, тепловой или ультразвуковой). Способы инактивации хорошо известны специалистам в данной области. Например, вирус FMD может быть инактивирован с помощью этиленимина (Cunliffe, HR, Applied Microbiology, 1973, p.747-750) или с помощью высокого давления (Ishimaru et al, Vaccine 22 (2004) 2334-2339), вирус PRRS может быть инактивирован с помощью бета-пропиолактона (Plana-Duran et al. Vet. Microbiol, 1997, 55: 361-370) или с помощью BEI-обработки (Пат. США №5587164); инактивация вируса PCV-2 может осуществляться с использованием обработки этиленимином или с помощью обработки бета-пропиолактоном (Пат. США №6391314); свиной вирус гриппа может быть инактивирован с использованием детергента типа Тритона или с помощью обработки формальдегидом (Пат. США №6048537); бактерии Mycoplasma hyopneumoniae могут быть инактивированы с помощью обработки формальдегидом (Ross R.F. выше), с помощью этиленимина или с помощью BEI-обработки (см. WO 91/18627).
Инактивированный патоген может быть сконцентрирован с помощью подходящих методов концентрирования, конкретно, с помощью ультрафильтрации, и/или может быть очищен с помощью подходящих способов очистки, конкретно, с использованием методов хроматографии, включающих в частности гель-фильтрацию, ультрацентрифугирование в градиенте сахарозы или селективное осаждение, конкретно, в присутствии полиэтиленгликоля (ПЭГ).
Иммуноген, применяемый в вакцинных композициях согласно настоящему изобретению, также включает экспрессирующие векторы. Такие векторы включают в частности in vivo рекомбинантные экспрессирующие векторы, такие как полинуклеотидный вектор или плазмида (ЕР-А2-1001025; Chaudhuri P, Res. Vet. Sci. 2001, 70: 255-6), вирусные векторы, такие как в частности аденовирусные векторы, векторы на основе вирусов оспы, таких как вирус оспы птиц (Пат. США №5174993; 5505941; и 5766599), или векторы на основе поксвируса канареек (Пат. США №5756103) или бактериальные векторы (Escherichia coli или виды Salmonella).
Настоящее изобретение также охватывает состав мультивалентных иммунологических композиций или комбинацию вакцинных композиций. Например, антигены, применяемые в комбинации с бычьим бактерином, полученном согласно настоящему изобретению, включают в частности Mycoplasma bovis, Pasteurella sp., особенно, Р.multocida и Р.haemolytica, Haemophilus sp., особенно H.somnus, Clostridium sp., Salmonella, Corynebacterium, Streptococcus, Staphylococcus, Moraxella, E.coli и т.д..
В настоящем изобретении дополнительно предлагаются способы индукции иммунного ответа у организма-хозяина, например, у животного, причем способы включают введение организму-хозяину иммунологической композиции или вакцинной композиции согласно изобретению. Вызванные таким образом иммунные ответы в частности представляют собой антительный и/или клеточный иммунный ответ, а конкретнее, ответ гамма-интерферона.
Конкретно, в настоящем изобретении предлагаются способы иммунизации против или профилактики или уменьшения симптомов, вызванных инфекцией животного патогенным организмом (например, инфекцией с помощью вируса, бактерий, грибов или простейших паразитов). Способ по настоящему изобретению применяется для позвоночных животных, включающих в частности людей, семейство собачьих (например, собак), кошачьих (например, кошек); лошадиных (например, лошадей), семейство полорогих (например, крупный рогатый скот) и свиней (например, свиней), а также для птиц, включающих в частности кур, индеек, гусей, перепелов, фазанов, попугаев, зябликов, ястребов, ворон и бескилевых (страусов, эму и казуаров и т.д.).
В конкретном аспекте изобретения, эти способы состоят из вакцинации беременных самок перед родами путем введения вакцинной композиции, полученной по изобретению. Эти способы дополнительно включают индукцию защитных антител, вызванную протоколом вакцинации, и перенос этих защитных антител от вакцинированных беременных самок к их потомству. Перенос таких материнских антител впоследствии защищает потомство от заболевания.
Дозировка вакцинной композиции, полученной согласно настоящему изобретению, будет зависеть от вида, породы, возраста, размера, истории вакцинации и состояния здоровья животного, подвергаемого вакцинации. Другие факторы типа концентрации антигена, дополнительных компонентов вакцин, и пути введения (т.е., подкожное, внутрикожное, пероральное, внутримышечное или внутривенное введение) также будут способствовать эффективному дозированию. Дозировка вакцины для введения легко определяется на основе концентрации антигена вакцины, пути введения, возраста и состояния животного, подвергаемого вакцинации. Каждая партия антигенов может быть индивидуально откалибрована. В ином случае, систематические испытания иммуногенности различных дозировок, а также исследования LD50 и другие процедуры скрининга можно применять для определения эффективной дозировки вакцинной композиции по настоящему изобретению без проведения излишних экспериментов. Из представленных ниже примеров легко понять, какая должна быть приблизительная дозировка и какой приблизительно объем будет соответствовать вакцинной композиции, описанной в настоящем документе. Критический фактор заключается в том, что дозировка обеспечивает, по меньшей мере, частичный защитный эффект против природной инфекции, что становится очевидным в виду снижения смертности и заболеваемости в результате этой природной инфекции. Аналогично подходящий объем легко оценивается специалистом в данной области. Например, у птиц объем дозы может составлять от около 0,1 мл до около 0,5 мл и предпочтительно от около 0,3 мл до около 0,5 мл. Для животных семейств кошачьих, собачьих и лошадиных объем дозы может составлять от около 0,2 мл до около 3 мл, предпочтительно, от около 0,3 мл до около 2 мл и более, предпочтительно, от около 0,5 мл до около 1 мл. Для животных семейств полорогих и свиней объем дозы может составлять от около 0,2 мл до около 5 мл, предпочтительно, от около 0,3 мл до около 3 мл и более, предпочтительно, от около 0,5 мл до около 2 мл.
Повторные вакцинации могут осуществляться предпочтительно с интервалом периодичности для усиления исходного иммунного ответа, или когда истек продолжительный период времени после последней дозы. В одном воплощении настоящего изобретения, вакцинную композицию вводят в виде парентеральной инъекции (т.е., подкожно, внутрикожно или внутримышечно). Композиция может вводиться в виде однократной дозы или, в альтернативных воплощениях, может вводиться в виде повторяющихся доз от около двух до около пяти, которые вводят с интервалом от около двух до около шести недель, предпочтительно, от около двух до около пяти недель. Однако специалисту в данной области понятно, что количество доз и временные интервалы между вакцинациями зависят от ряда факторов, включающих в частности возраст вакцинируемого животного; состояние животного; путь иммунизации; количество антигена, доступного на одну дозу; и т.п. Для исходной вакцинации, период, как правило, будет продолжительнее, чем неделя и предпочтительно составит от около двух до около пяти недель. Для ранее вакцинированных животных, вторичная вакцинация перед беременностью или во время нее может осуществляться с интервалом около года.
Настоящим изобретением также предусмотрено введение вакцинной композиции с использованием безыгольного инъектора, такого как «Pigjet®», «Avijet®», «Dermojet®» или «Biojector®» (Bioject, Орегон, США). Специалист в данной области способен подобрать спецификации инжектора согласно факторам, таким как вид животного, подвергаемого вакцинации; возраст и масса животного и т.п., без проведения излишних экспериментов.
В одном воплощении настоящего изобретения способ включает однократное введение состава вакцинной композиции с эмульсией согласно изобретению. Например, в одном воплощении, вакцинная композиция представляет собой композицию инактивированного вируса FMD, в то время как в альтернативном воплощении предлагается вакцина, включающая композицию инактивированного вируса PCV2. Другие иммунологические композиции или вакцины, подходящие для применения в режиме с однократной дозой включают в частности инактивированные бактерии Mycoplasma hyopneumoniae, PRRS и SIV.
Изобретение дополнительно относится к способам лечения организма-хозяина, например, животного, причем способ включает введение организму-хозяину фармацевтической композиции, полученной по изобретению и включающей, по меньшей мере, один иммуноген, выбранный из группы, состоящей из белков или пептидов, инактивированного или ослабленного вируса, антител, аллергенов, CpG ODN, факторов роста, цитокинов или антибиотиков и, конкретно, CpG ODN или цитокинов. Эти фармацевтические композиции можно применять для улучшения показателей роста у животного, такого как курица, свинья, корова или крупный рогатый скот.
Настоящее изобретение дополнительно относится к набору реагентов, включающему один флакон, содержащий ингредиент, такой как очищенный иммуноген, объединенный с эмульсией, полученной согласно настоящему изобретению. Набор реагентов может альтернативно включать первый флакон, содержащий ингредиент, такой как иммуногенная или фармацевтическая композиция, объединенная с сапонином и гидроксидом алюминия, и второй флакон, содержащий эмульсию, полученную согласно настоящему изобретению. Иммуноген может быть представлен в сухой форме, в высушенной форме или в виде водного раствора, описанного в данном документе.
Далее изобретение будет описано с помощью представленных ниже частных примеров.
Пример 1 Способ получения эмульсии
Эмульсию получают методом инверсии. В первой стадии, водную фазу и масляную фазу смешивают вместе при +40°С. Во второй стадии, эмульсию поступательно охлаждают до температуры ниже ТОФ при +5°С с целью получения эмульсии М/В. После обращения фаз, конечную эмульсию (т.е. вакцинный состав) смешивают и затем хранят при +5°С (суммировано в таблице 1).
Сорбитанмоноолеат (SPAN 80®) и Сорбитантриолеат (20 ОЕ) (TWEEN 85®), вводили в масляную фазу. Сорбитанмоноолеат (20 ОЕ) (TWEEN 80®) не способен смешиваться с парафиновым маслом. 20% (мас./об.) раствор TWEEN 80® получали в том же буфере, что и вакцину, например, в динатрийфосфатном и монокалийортофосфатном 0,02М изотоническом буфере (рН 7,8). Когда перемешивание прекращали, то эмульсия превращалась в эмульсию масло-в-воде. Эмульсию помещали в холодную камеру при 5°С в течение, по меньшей мере, 4 часов. На этой стадии эмульсия представляла собой первичную эмульсию, содержащую 50% масляной фазы.
Вторая стадия: Водную фазу #2 получали с использованием 120 мл динатрийфосфатного и монокалийортофосфатного 0,02М изотонического буфера рН 7,8 с иммуногенами (инактивированный FMDV, иммуноген Mycoplasma hyopneumoniae, или иммуноген PCV-2, описанные ниже), сапонином и гидроксидом алюминия. Первичную эмульсию, полученную в первой стадии, охлаждали до около 5°С, разводили путем добавления половины объема водной фазы #2 при той же температуре и смешивали путем перемешивания с использованием магнитной мешалки в течение 1 минуты. Конечная концентрация поверхностно-активного вещества в эмульсии TSAP составила 4,75% (мас./об.).
В основном, компоненты вакцинных составов, раскрытых в данном документе, добавляли в следующем порядке: 1) среда 102 при 5°С, 2) сапонин, 3) гидроксид алюминия, 4) антигены, и 5) неполная эмульсия (т.е. комбинация масляной фазы вместе с водной фазой #1). Полученные согласно настоящему документу TSAP-вакцины стабильны вплоть до 36 месяцев при 5°С.
С использованием такого же способа получения можно получить другие эмульсии, как описано в профетических примерах ниже:
Эмульсия TSAP-2
Эмульсия TSAP-2 представляет собой эмульсию М/В, содержащую 33% масляной фазы. Масляная фаза (120 мл) содержит «MARCOL 82®» 88% об./об., «SPAN 80®» 1,8% мас./об. и «TWEEN 85®» 10,2% мас./об. Водная фаза #1 (120 мл) сдержит динатрийфосфатный и монокалийортофосфатный 0,02М изотонический буфер (рН 7,8) 97,75% об./об., и «LUTROL F127®» 0,75% мас./об. Водная фаза #2 (120 мл) состоит из динатрийфосфатного и монокалийортофосфатного 0,02М изотонического буфера (рН 7,8), сапонина, гидроксида алюминия и необязательно содержит иммуногены. Конечная концентрация поверхностно-активного вещества в эмульсии TSAP-2 составила 4,25% мас./об.
Эмульсия TSAP-3
Эмульсия TSAP-3 представляет собой эмульсию М/В, содержащую 50% масляной фазы. Масляная фаза (160 мл) содержит «MARCOL 82®» 92% об./об., «SPAN 85®» 1,8% мас./об. и «BRIJ 96®» 6,2% мас./об. Водная фаза #1 (160 мл) сдержит динатрийфосфатный и монокалийортофосфатный 0,02М изотонический буфер (рН 7,8) 98.5% об./об., и «LUTROL F127®» 0,5% мас./об., сапонин, гидроксид алюминия и необязательно содержит иммуногены. Конечная концентрация поверхностно-активного вещества в эмульсии TSAP-3 составила 4,25% мас./об.
Эмульсия TSAP-4
Эмульсия TSAP-4 представляет собой эмульсию М/В, содержащую 10% масляной фазы. Масляная фаза (120 мл) содержит «MARCOL 82®» 60% об./об., «SPAN 40®» 17,2% мас./об. и «ARLATONE 650®» 22,8% мас./об. Водная фаза #1 (120 мл) сдержит динатрийфосфатный и монокалийортофосфатный 0,02М изотонический буфер (рН 7,8) 97,5% об./об., и TWEEN 20® 2,5% мас./об. Водную фазу #2 получали с использованием динатрийфосфатного и монокалийортофосфатного 0,02М изотонического буфера рН 7,8, сапонина, гидроксида алюминия и необязательно содержит иммуногены. 100 мл первичной эмульсии разводили с помощью 400 мл водной фазы #2 с получением эмульсии TSAP-3. Конечная концентрация поверхностно-активного вещества в эмульсии TSAP-4 составила 4,25% мас./об.
Пример 2
Определение температуры обращения фаз (ТОФ) эмульсии
10 мл эмульсии TSAP помещали в стеклянную пробирку на водяную баню при температуре около 25°С. Эмульсия TSAP представляла собой белую гомогенную эмульсию. Температуру в водяной бане поступательно увеличивали. Изменения в состоянии эмульсии наблюдали визуально (эмульсия разделялась на две фазы благодаря миграции желто-коричневой масляной фазы к поверхности). Данное изменение является характерным признаком разрушения эмульсии. Температура, при которой наблюдают данное изменение, представляет собой значение ТОФ эмульсии. Для эмульсии TSAP, ТОФ колеблется в интервале около 36°С-46°С. На Фиг. 1-5 представлены графики определения ТОФ для вакцинных составов, полученных по настоящему изобретению (одногодичное исследование стабильности). На Фиг. 6 представлены графики определения ТОФ для вакцинных составов, полученных по настоящему изобретению, которые хранили в течение 36 месяцев (3-годичное исследование стабильности).
Пример 3
Исследование #1: Стабильность вакцинных составов, полученных согласно примеру 1
В данной таблице представлена стабильность (т.е. время в месяцах, в течение которого составы остаются в виде эмульсий масло-в-воде) вакцинных составов, полученных согласно способу, описанному в примере 1. Составы состоят из указанных составляющих ингредиентов (см. составы 1-13), и антигены, используемые для каждого из этих составов, включают изоляты инактивированного вируса FMD, которые, как предполагается, являются средне или высокоочищенными.
Как указано в таблице 2, присутствие гидроксида алюминия обеспечивает повышенную стабильность вакцины, особенно при использовании наиболее высокой концентрации антигена (сравните повышенную стабильность составов 9, 11, и 13 с относительно пониженной стабильностью через 12 месяцев составов 3, 5 и 7). В среднем присутствие гидроксида алюминия в составах с более высоким содержанием антигена (т.е. составы 9, 11, и 13) повышает стабильность эмульсии масло/вода в течение от около 3-6 месяцев (т.е. стабильность эмульсии масло/вода, наблюдаемая для составов 3, 5, и 7) до около двенадцати (12) месяцев (т.е. стабильность эмульсии масло/вода, наблюдаемая для составов 9, 11), или даже до около двадцати четырех (24) месяцев (т.е.стабильность эмульсии масло/вода, наблюдаемая для состава 13).
Пример 4
Исследование #2: Стабильность вакцинных составов, полученных согласно примеру 1
Вакцинные составы получали, как описано в примере 1 и согласно количеству компонентов, указанному в таблице 3. Как описано ранее, порядок добавления компонентов был следующим: 1) среда 102, 2) сапонин, 3) гидроксид алюминия, 4) очищенные антигены, и 5) неполная эмульсия (ссылка на пример 1, где неполную эмульсию определяют в виде масляной фазы вместе с водной фазой #1). Очищенные антигены представляли собой антигены FMDV, 01 Campos, A24 Cmzeiro, и С3 Indaial. Общий объем доводили с помощью Среды 102 (M102, состав указан ниже).
Стабильность вакцины определяли согласно таблицы 5.
Для каждого вакцинного состава температуру обращения фаз (ТОФ) определяли, как описано в примере 2. Количество добавляемого антигена указано с помощью «гемагглютининовых единиц» (UH) на дозу вакцины. В таблице 6 суммированы данные о ТОФ и выявлено, что ТОФ, как правило, остается стабильной до 36 месяцев. На Фиг. 6 представлены графики определения ТОФ с помощью проводимости для вакцинных составов испытаний 1-10 (данные суммированы в таблице 6). Повышение ТОФ, которое наблюдали с использованием составов, содержащих адъювант сапонин (т.е. испытания 3, 4, 6, 7, 9, и 10), само по себе представляет собой улучшение в отношении стабильности по соавнению с составами, не содержащими адъювант сапонин (т.е. испытания 2, 5, и 8).
Распределение размера частиц (таблица 7) эмульсий, где размер находится в интервале, представленном в критерии исследования, для периода времени около 36 месяцев.
Пример 5
Серологические результаты после введения многократных доз вакцины против вируса ящура (FMD) с адъювантом в виде эмульсии TSAP. Исследование на крупном рогатом скоте.
Материалы и методы: отбирали 90 представителей крупного рогатого скота, в возрасте от 12 до 14 месяцев, не вакцинированных ранее и не содержащих антител к FMD (Foot-and-Mouth Disease), распределяли случайным образом на 10 групп по 9 животных для вакцинации. Животных вакцинировали с помощью указанных вакцинных составов (9807-9814) в день 1. Каждый из составов, перечисленных в таблицах 8, 9, 10, и 11, получали согласно примеру 1, и составы включали все компоненты, приведенные в примере 1, с количествами сапонина и гидроксида алюминия, варьирующимися согласно следующим концентрациям: количество сапонина составляло или 0, 0,7, 1,3, или 2,7 мг/дозу, а количество гидроксида алюминия «Algel» составляло или 0% или 0,37%. Восемь (8) групп вакцинировали с помощью внутримышечного пути введения (группа IM) и две (2) группы вакцинировали с помощью подкожного пути введения (группа SC). Каждое животное группы IM ревакцинировали с помощью соответствующей вакцины в день 56 с помощью внутримышечного пути введения и в день 84 с помощью подкожного пути введения. Каждое животное группы SC ревакцинировали с помощью соответствующей вакцины в дни 56 и 84 с помощью подкожного пути введения. В таблице 8 суммированы данные о стабильности вакцинных составов.
После первой вакцинации внутримышечным введением не было никаких повреждений. Имелись некоторые очаги повреждения после второй вакцинации с помощью внутримышечного пути введения, но все эти очаги повреждений исчезали через 28 дней после второй вакцинации внутримышечным введением. В таблице 9 суммированы данные о безопасности вакцинных составов, указанные с помощью измерений массы тела животного, проведенных в определенные дни.
Результаты: В таблице 10 суммированы серологические данные, собранные во время экспериментальных испытаний. 01 Campos, A24 Cruzeiro, и С3 Indaial представляют собой три независимых серотипа вируса FMD, и присутствие антител O1, A24, и С3 является положительным индикатором того, что вакцинный состав вызывает иммунный ответ у вакцинированных. «G1» указывает на то, что вакцинный состав вводили внутримышечно, а «G2» указывает на то, что вакцинный состав вводили подкожно. Для настоящего изобретения, особенно для антигенов вируса FMD имеет место строгая прямая корреляция между титром антител (т.е. между сывороточным уровнем 01 Campos, A24 Cruzeiro, и С3 Indaial) и числом эквивалентной защиты популяции (англ. Equivalent Population Protection, EPP). Проще говоря, когда титры антител высокие, то вакцинированные животные соответственно хорошо защищены от вирусной инфекции.
Неожиданно обнаружили, что присутствие гидроксида алюминия связано со значительными различиями иммунного ответа, который зависит от пути введения. В присутствии гидроксида алюминия, как в составах 9812G1 и 9812G2, наблюдается значительное усиление иммунного ответа у вакцинированного, которое измерено с помощью титров антител, при введении вакцинного состава подкожно. Не наблюдается аналогичного значительного различия в эффективности, связанного с путем введения, для соответствующих вакцинных составов, которые не содержат гидроксид алюминия, а именно 9811G1 и 9811G2.
Причина данного усиления иммунного ответа вследствие присутствия гидроксида алюминия вместе с использованием подкожного пути введения, в настоящее время неизвестна, но эффективное воплощение настоящего изобретения включает в частности вариацию пути введения вакцины в зависимости от данных текущей и будущей эффективности (например, титра антител).
По сравнению с контрольными вакцинными составами без адъюванта в виде сапонина (т.е. 9807 и 9808), вакцинные составы с адъювантом сапонином вызывают у исследуемых животных более быстрый иммунный ответ на все три антигена вируса FMD, выявленный по более высокому титру антител для составов с адъювантом сапонином в день 21. Все вместе эти данные указывают на то, что настоящее изобретение обеспечивает улучшенную стабильность и дает возможность более быстрого иммунного ответа по сравнению с составами без адъюванта в виде сапонина.
Пример 6
Серологические результаты после введения двух доз вакцины против вируса ящура (FMD) с адъювантом в виде эмульсии TSAP - Исследование на свиньях.
Материалы и методы: отбирали 57 свиней, не вакцинированных ранее и не содержащих антител к FMD, распределяли случайным образом на 9 групп по 6 животных для вакцинации и 1 группу из трех животных не для вакцинации (невакцинированные животные). Животных вакцинировали указанными вакцинными составами (A-I) в день 1.
Каждый из составов, перечисленных в таблице 11, получали согласно примеру 1, и составы включали все компоненты, приведенные в примере 1, с сапонином и гидроксидом алюминия в количествах, варьирующихся согласно следующим концентрациям:
количество сапонина составляло или 0, 0,7, 1,3, или 2,7 мг/дозу, а количество гидроксида алюминия «Algel» составляло или 0% или 0,37%. Безопасность вакцинного состава оценивали посредством измерения нескольких параметров, включающих ректальную температуру и визуальные признаки реакции животных на вакцинацию.
Результаты: Все вакцинные составы, которые содержали антиген (составы B-I, описанные в таблице 11), индуцировали у тестируемых животных антительный ответ, который был значительно сильнее, чем ответ, индуцируемый контролем без антигена (состав I, описанный в таблице 11). Составы, которые содержали сапонин, индуцировали относительно более сильный антительный ответ по сравнению с составами, которые не содержали сапонин. В таблице 12 суммированы данные относительно титров антител и пересчитаны количества антигена, сапонина и гидроксида алюминия для каждого состава. Конкретно, данные относительно титров антител выявляют, что присутствие в вакцинных составах сапонина в количествах от около 0,7 мг/дозу до около 2,7 мг/дозу усиливает антительный ответ относительно вакцинных составов, которые не содержат сапонин.
Пример 7
Определение защитной дозы 50% (PD50) на основе трех экспериментальных FMD-вакцин для свиней
Краткое описание. Целью исследования было тестирование эффективности по отношению к вирулентному стимулу FMD у свиней на основе 3 экспериментальных вакцинных составов FMD согласно настоящему изобретению. Четыре вакцины (А, В, С, и D) получали соответственно без Антигена (А), и с варьирующимися дозами инактивированного очищенного антигена FMD 01 Manisa (вакцины В, С и D) с включенным в состав адъювантом согласно настоящему изобретению. Вакцины были представлены в виде 30 мл флаконов, заполненных до 25 мл, с дозами по 2 мл. Стимулирующим штаммом был FMD 01 Manisa, 449402 4D:911, 20-07-1994 (который был исходно выделен в виде 01 Manisa Turkey 1/78), и титр во вторичных клетках почки свиньи составил 7,67 log10 TCID50/мл. Разбавителем для стимулирующего штамма была среда Hanks MEM, содержащая 2% фетальную бычью сыворотку (FBS) и стандартные антибиотики.
Процедура. В данном исследовании использовали свиней без FMDV и не вакцинированных ранее против FMD. Каждую из 47 свиней в возрасте 10 недель (плюс или минус 1 неделя) подвергали акклиматизации в течение, по меньшей мере, 24 часов перед экспериментальными процедурами. Свиней размещали по 2-3 животных на помещение и кормили стандартным гранулированным кормом и поили водой без ограничений. В День 1 (D1) свиней (независимо от пола) распределяли на 15 групп по три животных и еще одна группа из двух животных. Каждую группу помещали в одно конкретное помещение, и в каждом помещении животные были индивидуально разделены с помощью деревянных щитов (1,5 м) для защиты от столкновений до завершения исследования.
В момент времени DO, животных вакцинировали внутримышечно за ухом с левой стороны индивидуальным шприцом, согласно таблицам 13 и 14. Перед вакцинацией флаконы с вакциной мягко переворачивали около 10 раз для гарантии получения гомогенной суспензии.
Проверочное заражение. В момент времени D28, вирус FMD типа О разводили с получением 100000 TCID50 на 1 мл (концентрированный вирус разводили в 2,67 log10 или в 468 раз). В тот же день всех животных анестезировали путем введения стресснила (STRESSNIL) (1 мл/20 кг) и кетамина (2 мл/20 кг) внутримышечным введением и заражали 10000 TCID50 вируса в объеме до 0,1 мл внутрикожным введением в утолщение пятки внешнего копытца левой задней ноги. Общее состояние животных контролировали ежедневно с момента D0 до D28. Отмечали любые клинические наблюдения и обработки. После проверочного заражения за животными наблюдали ежедневно в течение 7 дней (D29-D35). Наблюдения осуществляли в таком же порядке, начиная с помещений с животными, вакцинированными наибольшими дозами, и далее наблюдая за животными, вакцинированными самыми низкими дозами, и заканчивая контролями (группа А). Общее состояние контролировали ежедневно, обращая особое внимание на признаки FMD на рыле и ногах. Забор крови проводили у каждого животного перед вакцинацией (в момент D1 или D0), D14, и D28 перед проверочным заражением и в конце исследования. Образцы инактивировали нагреванием (56°С в течение 30 минут) и определяли титр антител к FMDV типа О во всех сыворотках с помощью теста VN (MERIAL R&D, Leiystad).
В момент D36 (конец периода наблюдения), животных умерщвляли (4-6 мл на 50 кг IV Т61) и тщательно проверяли на предмет признаков FMDV. Любые очаги повреждений, наблюдаемые в группах, вакцинированных полной дозой вакцины (группы B1, C1 или D1), собирали и замораживали при -70°С для дальнейшего типирования вируса. Присутствие очагов повреждений на рыле, во рту и/или ногах (за исключением основного копытца инокулированной ноги) рассматривали как проявление FMD. Тест считали достоверным, поскольку он удовлетворял критериям, согласно которым две контрольные свиньи должны демонстрировать клинические признаки FMD. PD50 каждой вакцины рассчитывали с помощью метода Спирмен-Карбер (Spearman Karber).
Результаты. Эффективность в зависимости от полезной нагрузки представлена на фиг.9, и данные соответствующих исследований суммированы в числовом виде в таблицах 15 и 16 ниже.
Реферат
Настоящее изобретение раскрывает стабильную вакцинную композицию, включающую по меньшей мере один иммуноген, выбранный из инактивированного цирковируса свиней типа 2 (PCV-2), вируса ящура (FMDV) и бактерий; сапонин, гидроксид алюминия, неионные поверхностно-активные вещества с конечным ГЛБ эмульсии от около 9 до около 12. Изобретение сохраняет стабильность в течение коммерчески полезного периода времени. 10 з.п. ф-лы, 9 ил., 16 табл., 7 пр.
Формула
(i) водный раствор, содержащий по меньшей мере один иммуноген, выбранный из инактивированного цирковируса свиней типа 2 (PCV-2), вируса ящура (FMDV), и бактерий;
(ii) водный раствор, содержащий сапонин в количестве от около 0,7 мг/дозу до около 1,3 мг/дозу;
(iii) водный раствор, содержащий гидроксид алюминия в количестве от около 0.37% мас./об. до около 0,42% мас./об. эмульсии;
(iv) минеральное масло в количестве от 20% до 40% эмульсии;
(v) неионное липофильное поверхностно-активное вещество в количестве от 0.1% мас./об. до около 2,5% мас./об. эмульсии;
(vi) неионное гидрофильное поверхностно-активное вещество в количестве от 0.1% мас./об. до около 1,5% мас./об. эмульсии, имеющее значение гидрофильно-липофильного баланса (ГЛБ) между 13 и 40, выбранное из этоксилированных моноэфиров жирной кислоты и сорбитана, этоксилированные жирные кислоты и их комбинации; и
(vii) неионное гидрофильное поверхностно-активное вещество в количестве от около 1% мас./об. до около 8% мас./об. эмульсии, имеющее низкое значение гидрофильно-липофильного баланса (ГЛБ) между 9 и 13, выбранное из этоксилированных моноэфиров жирной кислоты и сорбитана, диэфиры этоксилированные жирной кислоты и сорбитана, моноэфиры этоксилированные жирной кислоты и сорбитана, этоксилированные жирные кислоты, этоксилированное касторовое масло и их комбинации; и
где конечное ГЛБ эмульсии составляет от около 9 до около 12.
где композиция остается О/W эмульсией в течение по меньшей мере около 36 месяцев.

Комментарии