Вакцина собак против бешенства (варианты), способвакцинации (варианты), набор для вакцинации (варианты) - RU2319504C2
Код документа: RU2319504C2
Чертежи


Описание
Настоящее изобретение относится к формуле вакцины для вакцинации собак против большого числа инфекционных патологий, в частности респираторных патологий и патологий пищеварения. Оно также относится к соответствующей методике вакцинации.
Инфекционные патологии собак крайне разнообразны и зачастую с трудом поддаются контролю в силу обстоятельств, имеющих место на конкретной территории.
Уже существует ряд вакцин, в частности, против болезни Каре (вирус CDV), парвовироза (вирус CPV), коронавироза (вирус CCV), респираторного комплекса или собачьего кашля (вирус Р12) и бешенства (рабдовирус). Эти вакцины являются, в целом, живыми вакцинами ослабленных штаммов. Таков, в частности, случай вакцин болезней Каре, вакцин против собачьих аденовирозов, вакцин против парвовироза и вакцин против коронавируса собак.
В некоторых случаях предлагались также инактивированные вакцины, например, в отношении бешенства и коронавироза.
Эти разнообразные вакцины продаются как по отдельности, т.е. в виде одновалентных вакцин, так и в виде ассоциированных вакцин, т.е. поливалентных.
Поливалентные ассоциации, разработанные до настоящего времени, всегда вызывали проблемы совместимости валентностей и стабильности. Так, необходимо одновременно обеспечить совместимость различных валентностей вакцины, как в плане различных используемых антигенов, так и в плане самих составов, в частности, если используют одновременно инактивированные вакцины и живые вакцины. Также возникает проблема хранения таких комбинированных вакцин и их безвредности, в частности, в присутствии добавок. Эти вакцины являются, в целом, достаточно дорогими.
Степень защиты и длительность этой защиты могут, кроме этого, быть очень разными, и на них влияют местные особенности. Это особенно справедливо в отношении вакцинации щенков, у которых антитела материнского происхождения противостоят иммунизации инактивированными вакцинами и даже живыми вакцинами.
Таким образом, желательно усовершенствовать подход к вакцинации псовых, и в частности собак, учитывая требования экономии, не позволяющие использовать дорогостоящие вакцины или сложные способы.
Исследования по вакцинации против болезни Каре очищенными препаратами антигенов сплавления F и эквивалентов гемагглютинина Н в полной добавке Фройнда показали, что антиген F может представлять интерес в качестве иммуногена для защиты против вируса CDV (Е.Norrby и др., J. Of Virol. Mai 1986: 536-541) в субъединичной вакцине.
Другая статья (Р. De Vries и др., J. Gen. Virol. 1988, 69: 2071-2083) показывает, что протеины F и НА вируса CDV могут представлять интерес для вакцинации по технологии иммуностимулирующих комплексов (ISKOMS).
Мыши, иммунизированные рекомбинантной вакциной, содержащей ген протеина F вируса CDV, проявляли устойчивость к этому вирусу.
Эти результаты являются, однако, лабораторными, которые трудно интерпретировать, особенно в условиях конкретной местности.
В отношении парвовирозов исследования субъединичных вакцин, содержащих мажорный протеин капсида VP2 вируса CPV, полученного генной рекомбинацией в бакуловирусе, позволили показать, что у иммунизированных таким образом собак вырабатывалась защита против вируса CPV.
В отношении собачьих герпесвирусов CHV были проведены исследования по использованию гликопротеинов в качестве составляющих субъединичных вакцин. Эти исследования показали наличие индукции перекрестных ответов с другими герпесвирусами, такими как FHV, но не позволили сделать вывод о возможности получения защитных вакцин.
В отношении болезни Лима, OspA и OspB в сочетании друг с другом устанавливают защиту у мыши и у собаки, а OspA в отдельности - у мыши, хомяка и собаки.
В заявках WO-A-90 11092, WO-A-93 19183, WO-A-94 21797 и WO-A-95 20660 описано использование недавно разработанной технологии полинуклеотидных вакцин. Известно, что в этих вакцинах используют плазмиду, способную осуществлять в клетках хозяина экспрессию встроенного в плазмиду антигена. Были предложены все пути введения (внутрибрюшинный, внутривенный, внутримышечный, чрескожный, внутрикожный, через слизистую и т.д.). Также могут быть использованы различные средства вакцинации, такие как ДНК, помещенная на поверхность частиц золота и распыляемая таким образом, чтобы она проникала в кожу животного (Tang и др., Nature 356, 152-154, 1992), и жидкоструйные впрыскиватели, позволяющие осуществить трансфекцию одновременно в кожу, в мышцы, в жировые ткани и в ткани молочной железы (Furth и др., Analytical Biochemistry, 205, 365-368, 1992).
В полинуклеотидных вакцинах могут быть использованы как неодетые ДНК, так и ДНК в составе, например, липосом или катионных липидов.
В практике прошлого не отмечено никаких результатов в плане установления у собак защиты методом полинуклеотидной вакцинации против этих болезней. Еще меньше известно о собачих коронавирусах CCV и агентах, вызывающих респираторный комплекс.
В отношении бешенства было показано наличие защиты у мышей после обработки полинуклеотидной вакциной, несущей ген протеина G под контролем раннего промотора вируса SV 40 (Xiang и др., Virology 199, 1994: 132-140); сходный результат был получен и с промотором IE вируса CMV.
Задачей изобретения является разработка формулы поливалентной вакцины для вакцинации собак против определенного числа патогенных агентов.
Другой целью изобретения является разработка такой формулы вакцины, сочетающей различные валентности при сохранении всех требуемых критериев совместимости и стабильности валентностей.
Другой целью изобретения является разработка такой формулы вакцины, позволяющей использовать различные валентности в одном и том же носителе.
Другой целью изобретения является разработка такой формулы вакцины, которая была бы проста в применении и не являлась бы дорогостоящей.
Еще одной целью изобретения является разработка методики вакцинации, которая позволила бы существенно повысить эффективность вакцины по изобретению или сильно сократить необходимое количество вакцины и которая являлась бы безвредной.
Таким образом, объектом настоящего изобретения является формула вакцины против патологий псовых, включающая по меньшей мере две валентности вакцины, каждая из которых включает в себя плазмиду, содержащую (и обеспечивающую его экспрессию in vivo в клетках хозяина из семейства псовых) ген одной валентности собачьего патогена, а именно, валентность вируса болезни Каре CDV и валентность собачьего парвовируса CPV, а плазмиды содержат, для каждой валентности, один или несколько генов, выбранных из группы, представленной НА и F для вируса болезни Каре и геном VP2 для собачего парвовируса.
Предпочтительно для валентности болезни Каре одна или несколько плазмид содержат гены НА и F, встроенные в одну плазмиду или в разные плазмиды.
Поливалентная вакцина по изобретению может также включать в себя валентность собачьего коронавируса CCV с одной или несколькими плазмидами, содержащими один или несколько генов, выбранных из группы генов S и М, предпочтительно ген S или S и М. В этом случае также гены могут быть встроены в разные плазмиды или собраны в одной плазмиде так, чтобы была возможна их экспрессия. Двух- или трехвалентная вакцина по изобретению может также включать в себя, кроме этого, одну эффективную валентность для предупреждения респираторного комплекса, а именно валентность Р12, включающую одну или несколько плазмид, содержащих по меньшей мере один из генов НА и F. Предпочтительно, используют одновременно оба гена НА и F.
Другие валентности, представляющие интерес для настоящего изобретения, могут, таким образом, быть введены в состав вакцин по изобретению; в частности, это может быть одна или несколько валентностей, выбранных из группы, представленной герпесвирозом CHV, болезнью Лима и бешенством, при этом плазмиды содержат для каждой валентности, один или несколько генов, выбранных из группы, представленной генами gB, gD для вируса CHV, генами OspA, OspB и р100 для В. Burgdorferi (болезнь Лима) и геном G для бешенства.
Предпочтительно в отношении герпесвироза сочетают в двух разных плазмидах или в одной плазмиде оба гена gB и gD. В отношении болезни Лима предпочтение отдают гену OspA.
Предпочтительно вакцина по изобретению, включающая в себя валентность болезни Каре и парвовироза, включает в качестве другой валентности валентность коронавироза или, менее предпочтительно, валентность респираторного комплекса, или обе эти валентности, при этом само собой разумеется, что любая комбинация, включающая в себя одну, несколько или все из таких валентностей как коронавироз, респираторный комплекс, герпесвироз, болезнь Лима и бешенство, может сочетаться с обеими валентностями - болезни Каре и парвовироза.
Предпочтительно формула вакцины по изобретению находится в составе носителя, подходящего для введения, желательно, внутримышечным путем; объем дозы составляет при этом от 0,1 до 5 мл, предпочтительно от 0,5 до 2 мл.
Доза составляет обычно от 10 нг до 1 мг, предпочтительно от 100 нг до 500 мкг, еще лучше - от 1 мкг до 250 мкг на каждый тип плазмиды.
Используют предпочтительно неодетые плазмиды, просто помещенные в вакцинирующий носитель, которым является обычно физиологический раствор (0,9% NaCl), ультрачистая вода, буфер ТЕ и т.п. Можно, разумеется, использовать все описанные в практике формы полинуклеотидных вакцин.
Каждая плазмида содержит промотор, способный обеспечивать экспрессию зависящего от него гена в клетках хозяина. Им обычно является сильный эукариотический промотор, в частности, ранний протомотор цитомегаловируса CMV-IE, происходящий от человека или мыши, или, возможно, от другого животного, такого как крыса, свинья, морская свинка.
В общем, промотор может иметь как вирусное, так и клеточное происхождение. В качестве вирусного промотора, кроме CMV-IE, можно назвать ранний или поздний промотор вируса SV40 или промотор LTR вируса Саркомы Руса. Это также может быть промотор вируса, от которого получен ген, например собственный промотор данного гена.
В качестве клеточного промотора можно назвать промотор гена цитоскелета, например промотор десмина (Bolmont и др., Journal of Submicroscopic Cytology and Pathology, 1990, 22, 117-122; и ZHENLIN и др., Gene, 1989, 78, 243-254) или промотор актина.
Если одна плазмида содержит несколько генов, они могут находиться в одной единице транскрипции или в двух разных единицах транскрипции.
Комбинация различных валентностей вакцины по изобретению может быть получена, предпочтительно, смешиванием полинуклеотидных плазмид, обеспечивающих экспрессию одного или нескольких антигенов каждой валентности, но также можно осуществить экспрессию антигенов нескольких валентностей через одну и ту же плазмиду.
Также объектом настоящего изобретения является методика вакцинации собак, включающая введение эффективной дозы формулы вакцины, как она описана выше. Эта методика вакцинации включает введение одной или нескольких формул вакцины, причем эти дозы могут быть введены последовательно через короткие промежутки времени и/или последовательно через большие промежутки времени.
Формулы вакцины по изобретению могут быть введены, в рамках этой методики вакцинации, различными путями введения, используемыми в практике при полинуклеотидной вакцинации, и с использованием известной техники введения, при этом предпочтение отдают внутримышечному введению.
Эффективность взаимодействия антигенов с иммунной системой находится в зависимости от тканей. В частности, слизистые оболочки дыхательных путей служат барьером на пути патогенов и связаны с лимфоидными тканями, обеспечивающими местный иммунитет. Введение вакцины через контакт со слизистыми, в частности слизистыми ротовой полости, глотки и бронхиальной области, представляет большой интерес для вакцинации против респираторных патологий и патологий пищеварения.
Таким образом, путь введения через слизистые составляет часть способа введения по изобретению, причем используют, в частности, распыление, или спрэй, или воду для питья.
При этом могут применяться формулы вакцины и методики вакцинации по изобретению.
Еще одним объектом изобретения являются формулы одновалентной вакцины, включающие одну или несколько плазмид, кодирующих один или несколько генов одного из вышеназванных вирусов, причем эти гены соответствуют перечисленным выше. За исключением их одновалентного характера, эти формулы могут обладать вышеуказанными характеристиками в отношении выбора генов, их комбинаций, состава плазмид, объемов доз, доз и т.п.
Формулы одновалентной вакцины могут быть использованы (i) для получения формулы поливалентной вакцины, как она описана выше, (ii) в индивидуальном порядке против конкретной патологии, (iii) в сочетании с вакциной другого типа (цельной живой или инактивированной, рекомбинантной, субъединичной) против другой патологии или (iv) в качестве вторичной вакцины для введения после вакцины, описанной ниже.
Действительно, еще одним объектом настоящего изобретения является использование одной или нескольких плазмид по изобретению для получения собачьей вакцины, предназначенной для вакцинации животных, первично вакцинированных при помощи первой, обычной, вакцины (одновалентной или поливалентной), из таких, которые использовались в практике прошлого, выбранной, в частности, из группы, представленной цельной живой вакциной, цельной инактивированной вакциной, субъединичной вакциной, рекомбинантной вакциной, причем эта первая вакцина несет (т.е. содержит или обеспечивает их экспрессию) один или несколько антигенов, кодируемых одной или несколькими используемыми плазмидами, или антигенов, обеспечивающих перекрестную защиту.
Представляет интерес тот факт, что полинуклеотидная вакцина оказывает сильное действие в качестве вторичной вакцины, проявляющееся в усилении иммунного ответа и в установлении длительного иммунитета.
В целом, вакцины для первичной вакцинации могут быть выбраны из числа вакцин, предлагаемых к продаже различными производителями ветеринарных вакцин.
Еще одним объектом изобретения является методика вакцинации, заключающаяся в том, что проводят первичную вакцинацию, как она описана выше, и вторичную вакцинацию формулой вакцины по изобретению.
Согласно предпочтительной форме осуществления способа по изобретению сначала животному вводят эффективную дозу вакцины классического типа, в частности инактивированной, живой, ослабленной или рекомбинантной, или субъеденичной вакцины, таким образом, чтобы обеспечить первичную вакцинацию и через 2-6 недель вводят поливалентную или одновалентную вакцину по изобретению.
Объектом настоящего изобретения является также набор для вакцинации, в который входят вакцина для первичной вакцинации, как она описана выше, и, в качестве вторичной вакцины, формула вакцины по изобретению. Изобретение также относится к формуле вакцины по изобретению с приложенной к ней инструкцией, в которой указывается на использование этой формулы в качестве вторичной вакцины после первичной вакцинации, как она описана выше.
Изобретение также относится к методике получения формул вакцин, а именно получения валентностей и их смесей, как следует из данного описания.
Далее следует детальное описание изобретения с помощью способов осуществления изобретения с опорой на рисунки приложения.
Список фигур.
Фигура № 1: Плазмида pVR1012
Фигура № 2: Плазмида рАВ044
Фигура № 3: Плазмида рАВ036
Фигура № 4: Плазмида рАВ024
Фигура № 5: Плазмида рАВ021
Фигура № 6: Плазмида рАВ022
Фигура № 7: Плазмида рАВ037
Фигура № 8: Плазмида рАВ038
Фигура № 9: Плазмида рАВ017
Фигура № 10: Плазмида рАВ041
Список последовательностей SEQ ID №.
SEQ ID № 1: Олигонуклеотид AB017
SEQ ID № 2: Олигонуклеотид АВ018
SEQ ID № 3: Олигонуклеотид АВ085
SEQ ID № 4: Олигонуклеотид АВ086
SEQ ID № 5: Олигонуклеотид АВ053
SEQ ID № 6: Олигонуклеотид AB054
SEQ ID № 7: Олигонуклеотид АВ045
SEQ ID № 8: Олигонуклеотид AB048
SEQ ID № 9: Олигонуклеотид АВ049
SEQ ID № 10: Олигонуклеотид АВ050
SEQ ID № 11: Олигонуклеотид АВ087
SEQ ID № 12: Олигонуклеотид АВ088
SEQ ID № 13: Олигонуклеотид АВ089
SEQ ID № 14: Олигонуклеотид АВ090
SEQ ID № 15: Олигонуклеотид АВ038
SEQ ID № 16: Олигонуклеотид АВ039
SEQ ID № 17: Олигонуклеотид АВ011
SEQ ID № 18: Олигонуклеотид АВ012
ПРИМЕРЫ
Пример 1. Культура вирусов
Вирусы культивируют на соответствующей системе клеток до проявления цитопатического эффекта. Системы клеток, используемые для каждого вируса, хорошо известны специалистам. В общих словах, клетки, чувствительные к используемому вирусу, культивируемые в минимальной необходимой среде Игла (среда MEM) или в другой подходящей среде, заражают штаммом исследуемого вируса, используя множественность заражения 1. Инфицированные клетки инкубируют при 37°С в течение времени, необходимого для проявления полного цитопатического эффекта (в среднем, 36 часов).
Пример 2. Культура бактерий
Штаммы Borrelia burgdorferi культивируют в соответствующих средах в известных условиях. Эти условия и среды описаны, в частности, A.Barbour (J. Biol. Med. 1984. 57. 71-75). Экстракцию бактериальной ДНК проводили в условиях, описанных W.Simpson и др. (Infect. Immun. 1990. 58. 847-853). Технологии, описанные J.Sambrook и др. (Molecular Cloning: A Laboratory Manual. 2-е Изд. Cold Spring Harbor Laboratory. Cold Spring Harbor. New York. 1989), также могут быть использованы при этом.
Пример 3. Экстракция геномных вирусных ДНК
После культивирования собирают разрушенные клетки и их плавающие на поверхности обломки, а вирусную суспензию центрифугируют при 1000 g и при +4°С в течение 10 минут, чтобы удалить обломки клеток. Затем осаждают вирионы ультрацентрифугированием при 400000 g и при +4°С в течение 1 часа. Осадок собирают в минимальном объеме буфера (Tris 10 мМ, EDTA 1 мМ). Эту концентрированную вирусную суспензию обрабатывают протеиназой К (100 мкг/мл конечн.) в присутствии натрийдодецилсульфата (SDS) (0,5% конечн.) в течение 2 часов при 37°С. Затем вирусную ДНК экстрагируют при помощи смеси фенол/хлороформ, потом преципитируют 2 объемами абсолютного этанола. По прошествии ночи при -20°С ДНК центрифугируют при 10000 g и при +4°С в течение 15 минут. Осадок ДНК высушивают, затем собирают в минимальном объеме стерильной ультрачистой воды. После этого она может быть расщеплена ферментами рестрикции.
Пример 4. Изолирование геномных вирусных РНК
РНК-содержащие вирусы очищали по известным специалистам технологиям. РНК генома каждого вируса изолировали, используя технологию экстракции "тиоцианат гуанидия/фенолхлороформ", описанную Р.Chomczynski и N.Sacchi (Anal. Biochem. 1987. 162. 156-159).
Пример 5. Технологии молекулярной биологии
Все плазмидные конструкции были получены с использованием стандартных технологий молекулярной биологии, описанных Sambrook J. И др. (Molecular Cloning: A Laboratory Manual, 2-е Изд. Cold Spring Harbor Laboratory. Cold Spring Harbor. New York. 1989). Все рестрикционные фрагменты, используемые в настоящем изобретении, были изолированы с использованием набора "Geneclean" (BIO 101 INC. La Jolla, CA).
Пример 6. Технология RT-PCR
Специфические олигонуклеотиды (несущие на 5'-концах сайты рестрикции для облегчения клонирования расширенных фрагментов) были синтезированы таким образом, что они полностью закрывают кодирующие участки генов, которые должны быть расширены (см. Специфические примеры). Реакция обратной транскрипции (RT) и расширение в цепи полимеразой (PCR) были осуществлены по стандартным технологиям (Sambrook и др. 1989). Каждая реакция RT-PCR была проведена с парой специфических амплимеров с использованием в качестве матрицы экстрагированной геномной вирусной РНК. Расширенную комплементарную ДНК экстрагировали фенолом/хлороформом/изоамиловым спиртом (25:24:1) перед расщеплением рестрикционными ферментами.
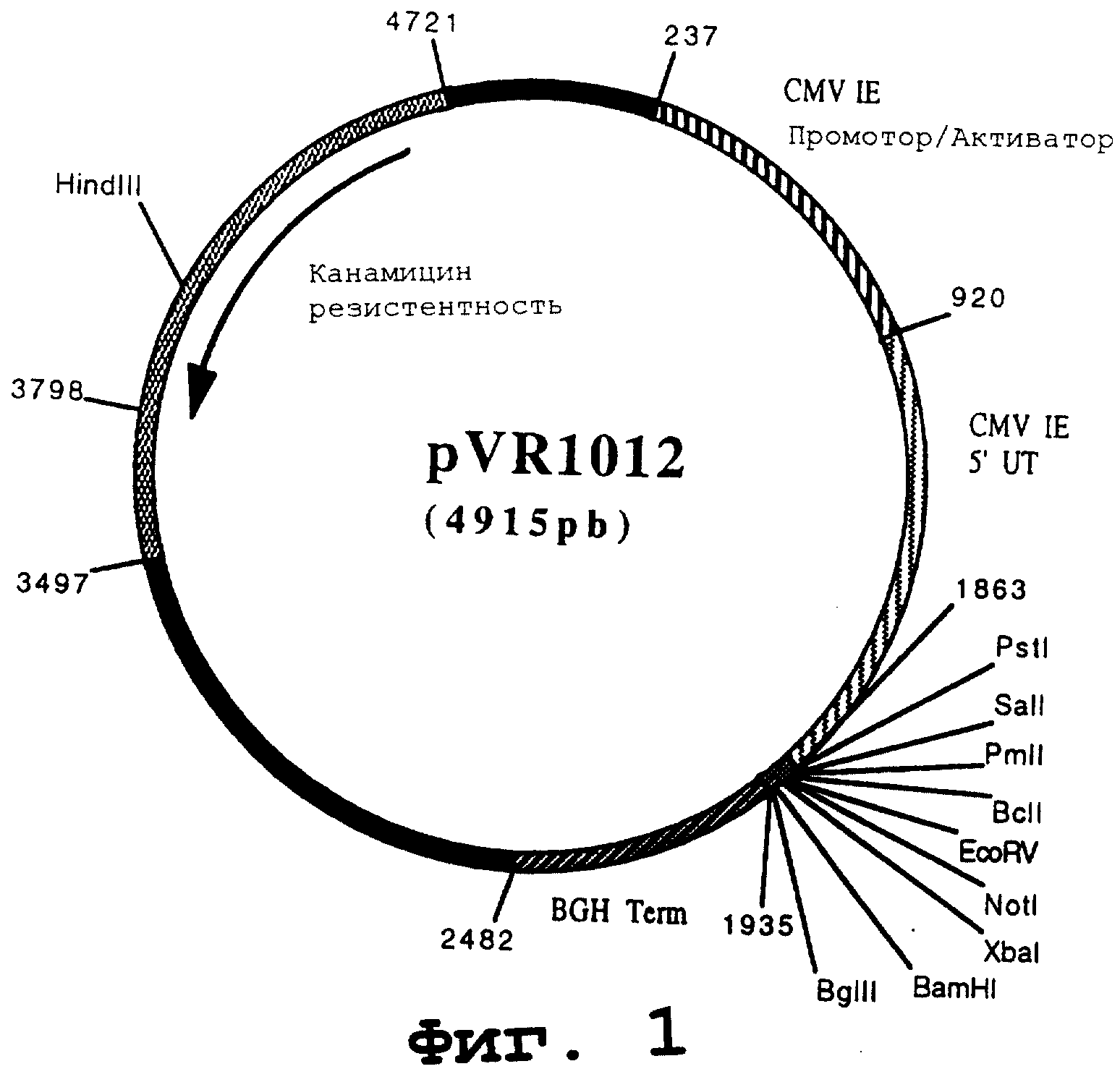
Пример 7. Плазмида pVR1012
Плазмида pVR1012 (фигура №1) была получена при Vical Ink., San Diego, CA, USA. Ее конструкция была описана J.Hartikka и др. (Human Gene Therapy. 1996. 7. 1205-1217).
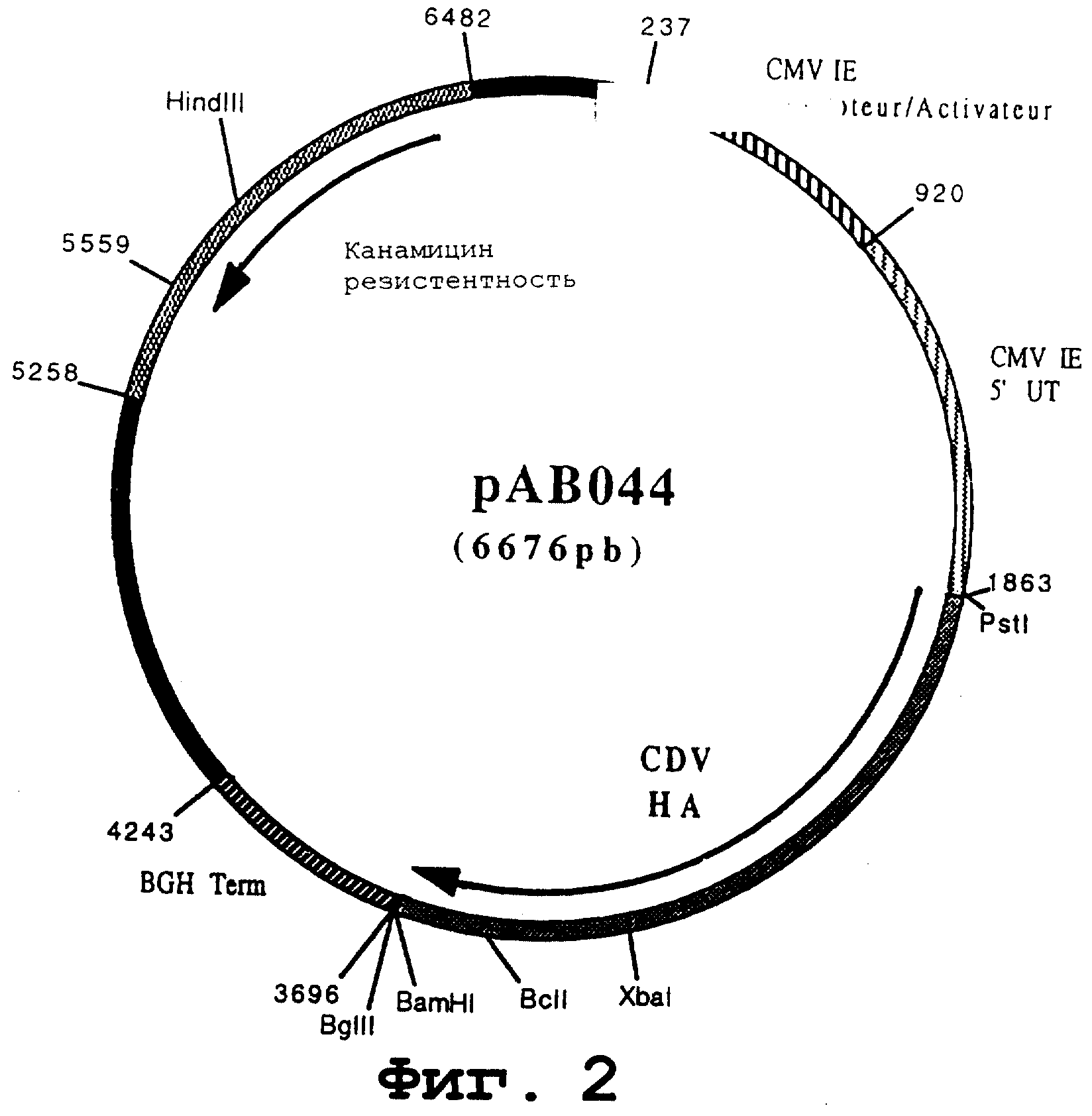
Пример 8. Конструирование плазмиды рАВ044 (ген CDV НА)
По технологии из примера 6 провели реакцию RT-PCR с РНК генома вируса болезни Каре (CDV) (штамм Onderstepoort) (М.Sidhu и др. Virology. 1993. 193. 66-72), полученной по технологии из примера 4, и следующими олигонуклеотидами:
АВ017 (35 mer) (SEQ ID №1)
5'AAAACTGCAGAATGCTCCCCTACCAAGACAAGGTG3'
AB018 (37 mer) (SEQ ID №2)
5'CGCGGATCCTTAACGGTTACATGAGAATCTTATACGG3'
чтобы изолировать ген, кодирующий гликопротеин НА вируса CDV, в форме фрагмента Pstl-BamHI. После очистки продукт RT-PCR (1835 pb) расщепили с помощью PstI и BamHI, чтобы изолировать фрагмент Pstl-BamHI (1817 pb). Этот фрагмент сшили с вектором pVR1012 (пример 7), предварительно расщепленным с помощью PstI и BamHI, и получили плазмиду рАВ044 (6676 pb) (Фигура №2).
Пример 9. Конструирование плазмиды рАВ036 (ген CDV F)
По технологии из примера 6 провели реакцию RT-PCR с РНК генома вируса болезни Каре (CDV) (штамм Onderstepoort) (R.Driellen № доступа последовательности в Genebank=X65509), полученной по технологии из примера 4, и следующими олигонуклеотидами:
АВ085 (40 mer) (SEQ ID №3)
5'ATAAGAAGCGGCCGCACATGCACAAGGGAATCCCCAAAAG3'
AB086 (32 mer) (SEQ ID №4)
5'CGCGGATCCACTTCAGTGTGATCTCACATAGG3'
чтобы изолировать ген, кодирующий гликопротеин F вируса CDV, в форме фрагмента NotI-BamHI. После очистки продукт RT-PCR (2018 pb) расщепили с помощью NotI и BamHI, чтобы изолировать фрагмент NotI-BamHI (2000 pb). Этот фрагмент сшили с вектором pVR1012 (пример 7), предварительно расщепленным с помощью NotI и BamHI, и получили плазмиду рАВ036 (6893 pb) (Фигура № 3).
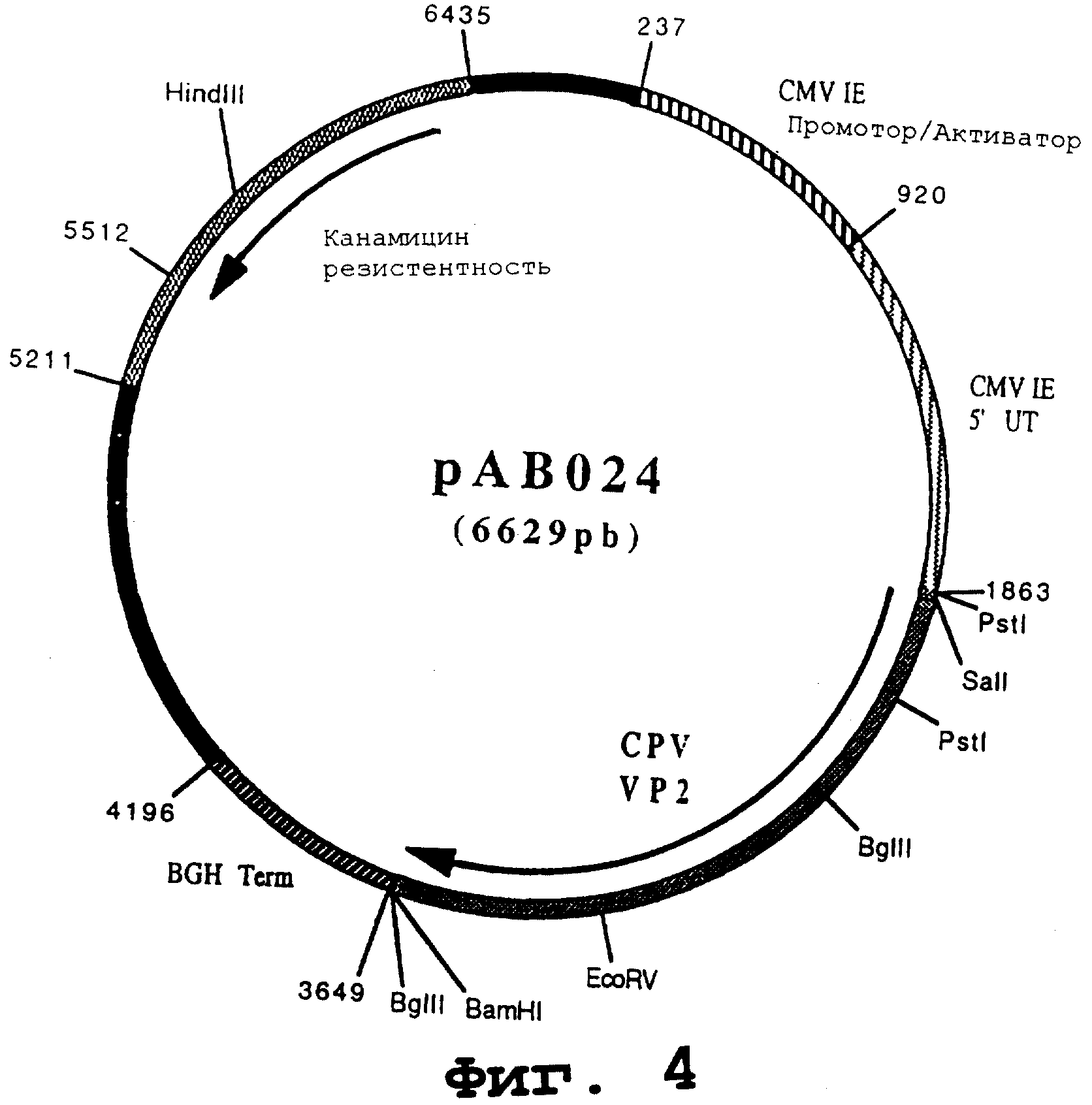
Пример 10. Конструирование плазмиды рАВ024 (ген собачьего парвовируса VP2)
Провели реакцию PCR с ДНК генома собачьего парвовируса (CPV) (штамм CPV-b) (С.Parrish № доступа последовательности в Genebank=M19296), полученной по технологии из примера 3, и следующими олигонуклеотидами:
АВ053 (33 mer) (SEQ ID №5)
5'ACGCGTCGACATGAGTGATGGAGCAGTTCAACC3'
AB054 (33 mer) (SEQ ID №6)
5'CGCGGATCCTTAATATAATTTTCTAGGTGCTAG3'
чтобы изолировать ген, кодирующий протеин капсида VP2 (CPV VP2), в форме фрагмента SalI-BamHI. После очистки продукт RT-PCR (1773 pb) расщепили с помощью Sail и BamHI, чтобы изолировать фрагмент SaII-BamHI (1760 pb). Этот фрагмент сшили с вектором pVR1012 (пример 7), предварительно расщепленным с помощью SalI и BamHI, и получили плазмиду рАВ024 (6629 pb) (Фигура № 4).
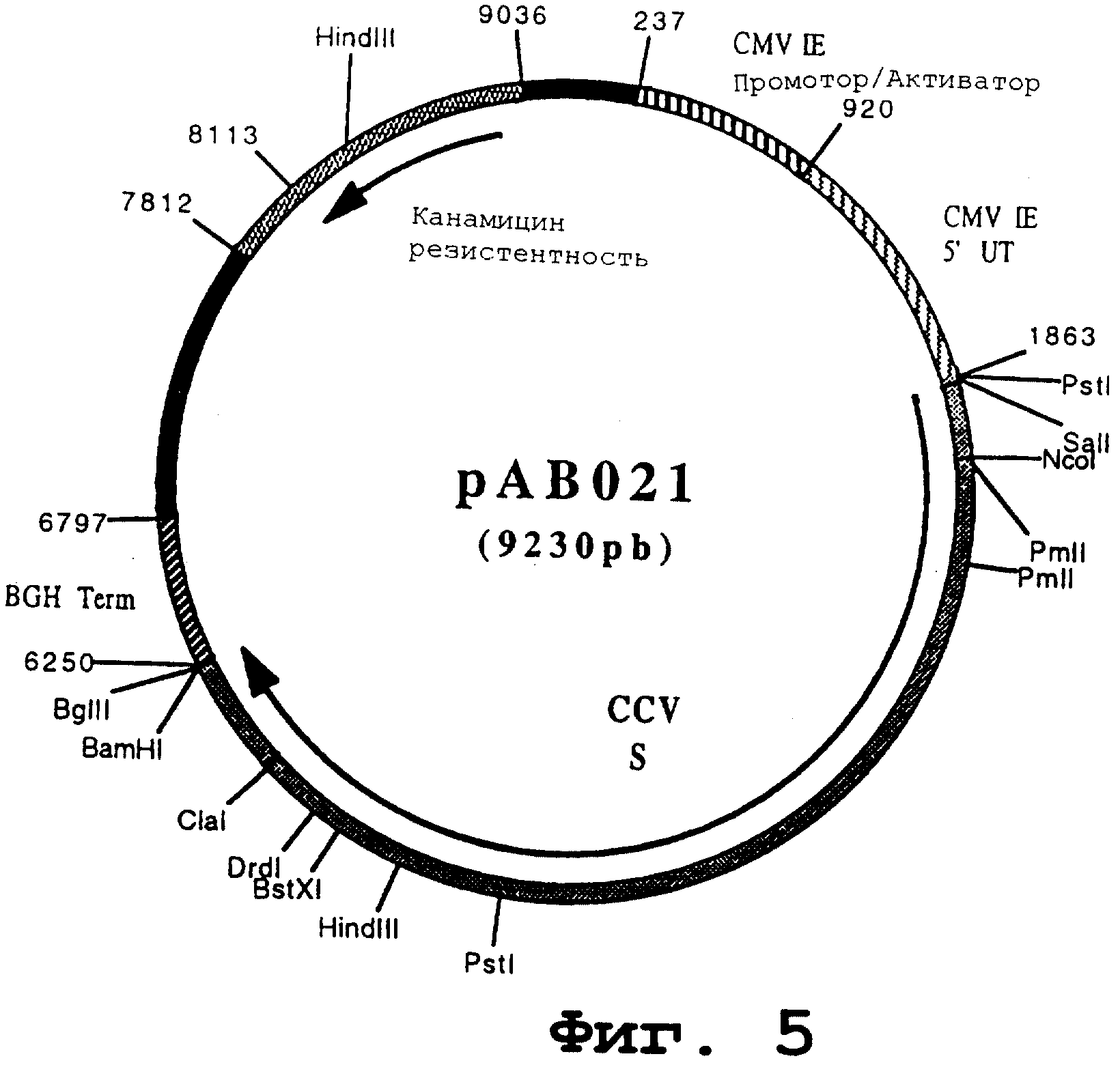
Пример 11. Конструирование плазмиды рАВ021 (ген CCV S)
По технологии из примера 6 провели реакцию RT-PCR с РНК генома собачьего коронавируса (CCV) (В.Horshburgh и др. J. Gen. Virol. 1992.73. 2849-2862), полученной по технологии из примера 4, и следующими олигонуклеотидами:
АВ045 (32 mer) (SEQ ID №7)
5'ACGCGTCGACATGATTGTGCTTACATTGTGCC3'
AB048 (35 mer) (SEQ ID №8)
5'CGCGGATCCTCAGTGAACATGAACТТТТТCAATAG3'
чтобы расширить фрагмент (4374 pb), содержащий ген, кодирующий гликопротеин S вируса CCV, в форме фрагмента SalI-BamHI. После очистки продукт RT-PCR расщепили с помощью SalI и BamHI, чтобы изолировать фрагмент SalI-BamHI (4361 pb). Этот фрагмент сшили с вектором pVR1012 (пример 7), предварительно расщепленным с помощью SalI и BamHI, и получили плазмиду рАВ021 (9230 pb) (Фигура № 5).
Пример 12. Конструирование плазмиды рАВ022 (ген CCV М)
По технологии из примера 6 провели реакцию RT-PCR с РНК генома собачьего коронавируса CCV (В.Horshburgh и др. J. Gen. Virol. 1992. 73. 2849-2862), полученной по технологии из примера 4, и следующими олигонуклеотидами:
АВ049 (34 mer) (SEQ ID №9)
5'AAAACTGCAGAAATGAAGAAAATTTTGTTTTTAC3'
AB050 (33 mer) (SEQ ID №10)
5'CGCGGATCCTTATACCATATGTAATAATTTTTC3'
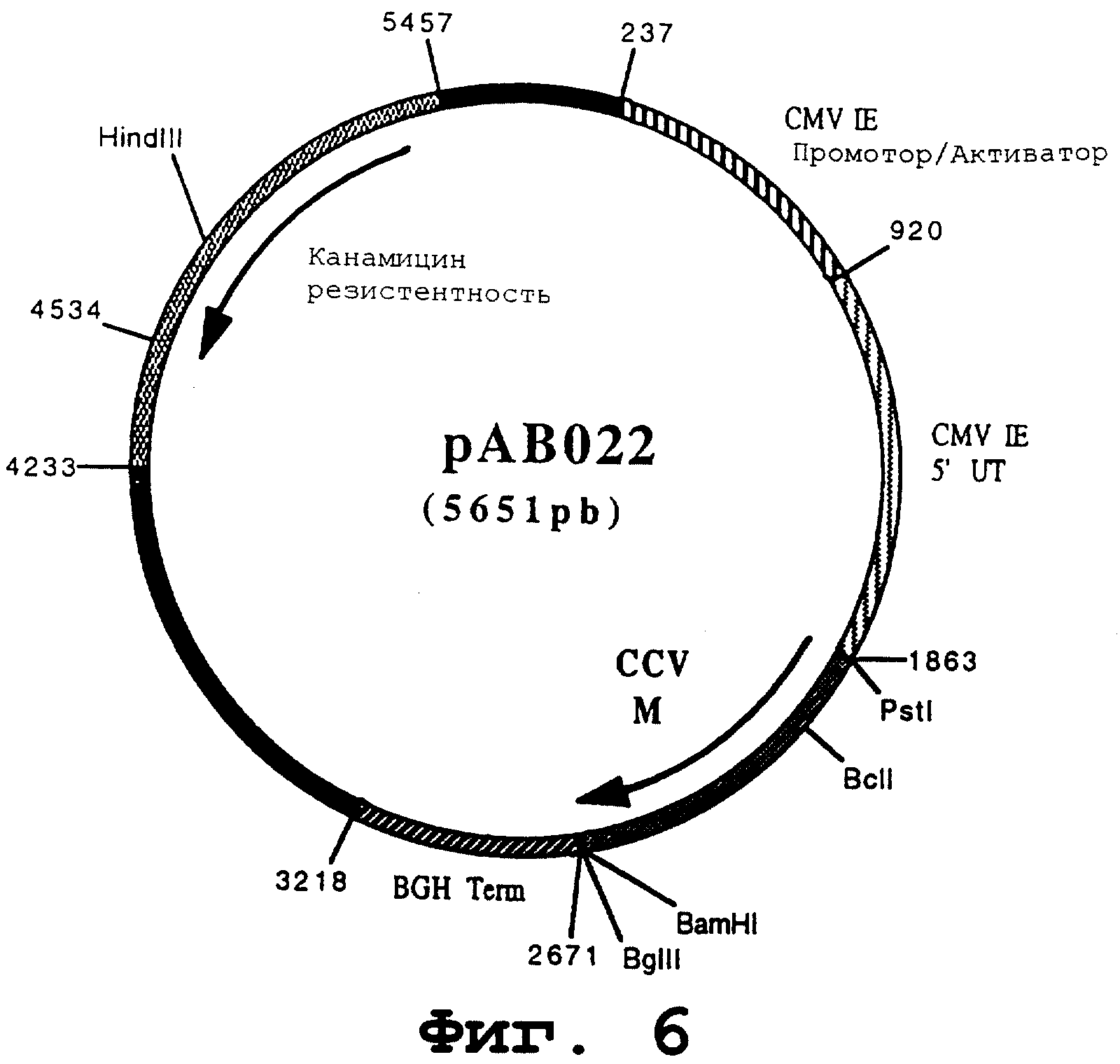
чтобы изолировать ген, кодирующий гликопротеин М (CCV М), в форме фрагмента PstI-BamHI. После очистки продукт RT-PCR (809 pb) расщепили с помощью PstI и BamHI, чтобы изолировать фрагмент PstI-BamHI (792 pb). Этот фрагмент сшили с вектором pVR1012 (пример 7), предварительно расщепленным с помощью PstI и BamHI, и получили плазмиду рАВ022 (5651 pb) (Фигура № 6).
Пример 13. Конструирование плазмиды рАВ037 (ген CHV gB)
Провели реакцию PCR с ДНК генома собачьего герпесвируса (CHV0 (штамм Carmichael) (K.Limbach и др. J. Gen. Virol 1994. 75. 2029-2039), полученной по технологии из примера 3, и следующими олигонуклеотидами:
АВ087 (34 mer) (SEQ ID № 11)
5'AAAACTGCAGAAGTATGTTTTCATTGTATCTATA3'
AB088 (34 mer) (SEQ ID № 12)
5'CTAGTCTAGATTATTAAACTTTACTTTCATTTTC3'
чтобы изолировать ген, кодирующий гликопротеин gB вируса CHV, в форме фрагмента PstI-XbaI. После очистки продукт RT-PCR (2667 pb) расщепили с помощью PstI и XbaI, чтобы изолировать фрагмент PstI-XbaI (2648 pb). Этот фрагмент сшили с вектором pVR1012 (пример 7), предварительно расщепленным с помощью PstI и Xbal, и получили плазмиду рАВ037 (7523 pb) (Фигура № 7).
Пример 14. Конструирование плазмиды рАВ036 (ген CHV gD)
Провели реакцию PCR с ДНК генома собачьего герпесвируса (CHV) (штамм Carmichael) (K.Limbach и др. J. Gen. Virol 1994. 75. 2029-2039), полученной по технологии из примера 3, и следующими олигонуклеотидами:
АВ089 (34 mer) (SEQ ID №13)
5'AAAACTGCAGAAAATGATTAAACTTCTATTTATC3'
АВ090 (35 mer) (SEQ ID №14)
5'ATAAGAATGCGGCCGCAAAGGCTAAACATTTGTTG3'
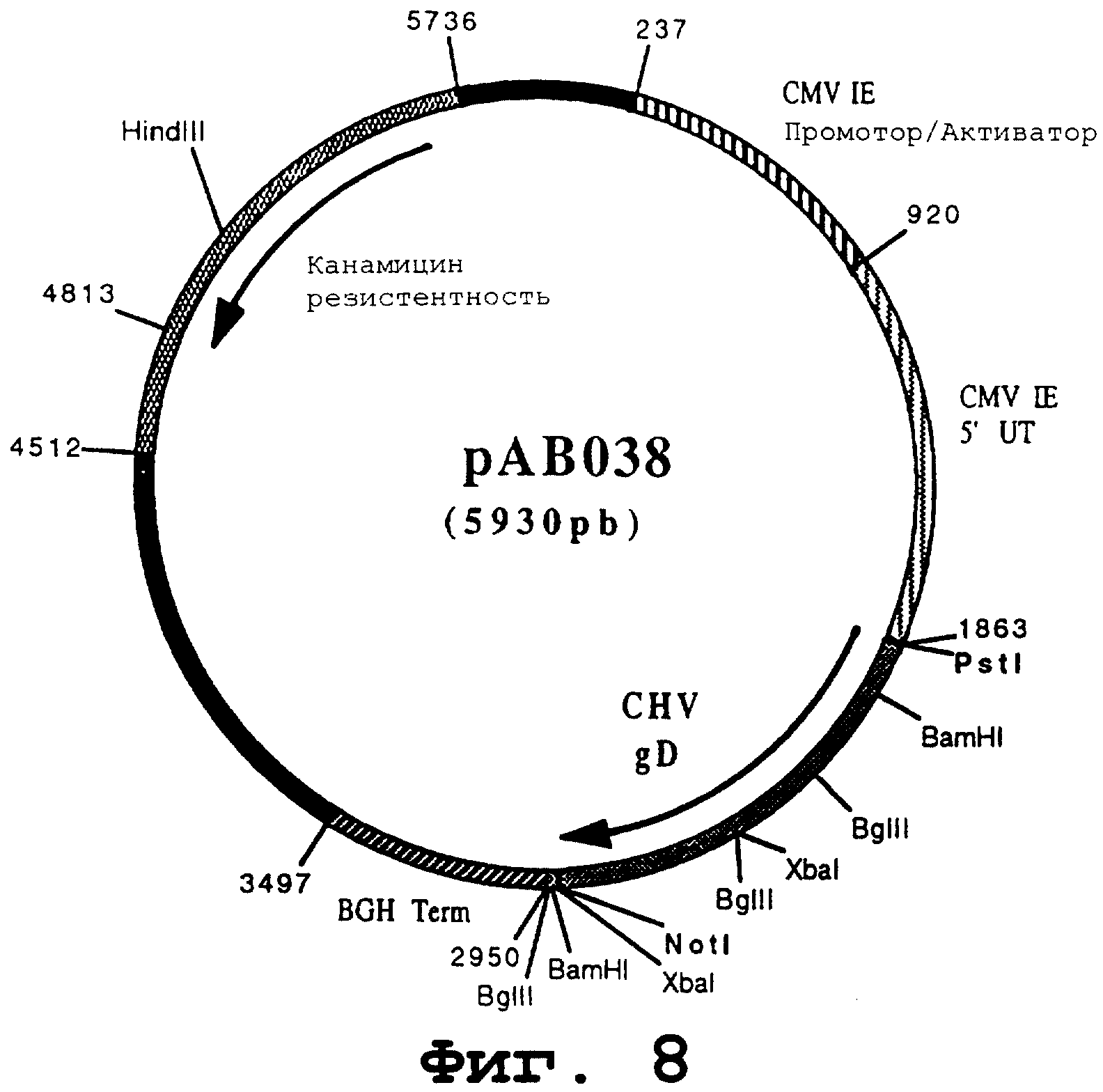
чтобы изолировать ген, кодирующий гликопротеин gB вируса CHV, в форме фрагмента PstI-NotI. После очистки продукт PCR (1072 pb) расщепили с помощью PstI и NotI, чтобы изолировать фрагмент PstI-NotI (1049 pb). Этот фрагмент сшили с вектором pVR1012 (пример 7), предварительно расщепленным с помощью PstI и NotI, и получили плазмиду рАВ038 (5930 pb) (фигура №8).
Пример 15. Конструирование плазмиды рАВ017 (ген Borrelia burgdorferi ospA)
Провели реакцию PCR с ДНК генома Borrelia burgdorferi (штамм В31) (S.Bergstrom и др. Mol. Microbiol. 1989. 3. 479-486), полученной по технологии из примера 2, и следующими олигонуклеотидами:
АВ038 (37 mer) (SEQ ID №15)
5'ACGCGTCGACTATGAAAAAATATTTATTGGGAATAGG3'
AB039 (34 mer) (SEQ ID №16)
5'CGCGGATCCCTTATTTTAAAGCGTTTTTAATTTC3'
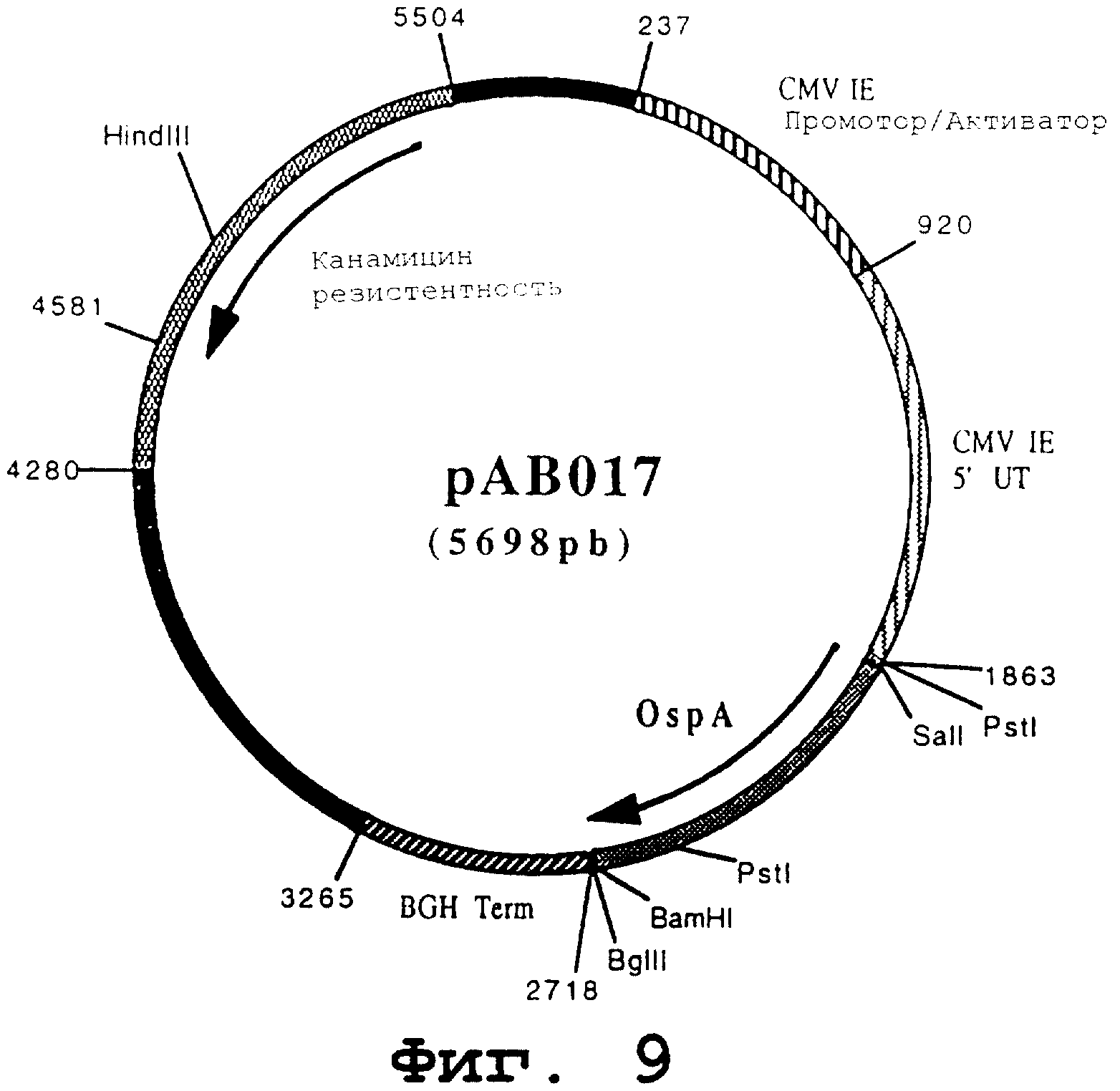
чтобы изолировать ген, кодирующий мембранный протеин OspA, в форме фрагмента SalI-BamHI. После очистки продукт PCR (842 pb) расщепили с помощью SalI и BamHI, чтобы изолировать фрагмент SalI-BamHI. Этот фрагмент сшили с вектором pVR1012 (пример 7), предварительно расщепленным с помощью SalI и BamHI, и получили плазмиду рАВ017 (5698 pb) (Фигура № 9).
Пример 16. Конструирование плазмиды рАВ041 (ген G вируса бешенства)
По технологии из примера 6 провели реакцию RT-PCR с РНК генома вируса бешенства (штамм ERA) (A.Anilionis и др. Nature. 1981. 294. 275-278), полученной по технологии из примера 4, и следующими олигонуклеотидами:
АВ011 (33 mer) (SEQ ID № 17)
5'AAAACTGCAGAGATGGTTCCTCAGGCTCTCCTG3'
AB012 (34 mer) (SEQ ID №18)
5'CGCGGATCCTCACAGTCTGGTCTCACCCCCACTC3'
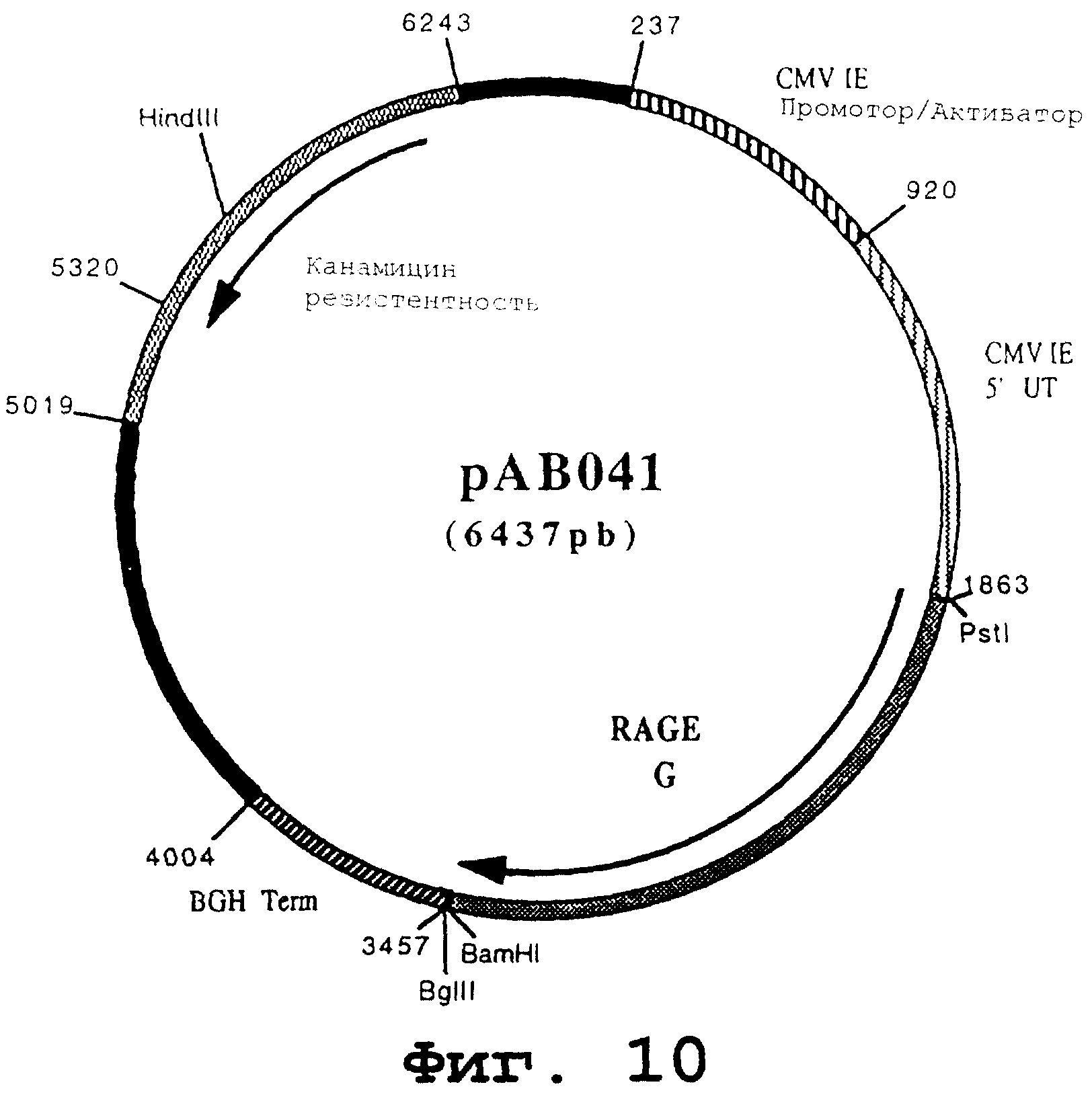
чтобы расширить фрагмент (1589 pb), содержащий ген, кодирующий гликопротеин G вируса бешенства. После очистки продукт RT-PCR расщепили с помощью PstI и BamHI, чтобы получить фрагмент PstI-BamHI (1578 pb). Этот фрагмент сшили с вектором pVR1012 (пример 7), предварительно расщепленным с помощью PstI и BamHI, и получили плазмиду рАВ041 (6437 pb) (Фигура № 10).
Пример 17. Получение и очистка плазмид
Для получения плазмид, предназначенных для вакцинации животных, можно использовать любую технологию, позволяющую получить суспензию очищенных плазмид, по большей части в сверхскрученной форме. Такие технологии хорошо известны специалистам. Можно назвать, в частности, технику щелочного лизиса с последующим двукратным ультрацентрифугированием в градиенте хлорида цезия и в присутствии бромида этидия, как описано J.Sambrook и др. (Molecular Cloning: A Laboratory Manual. 2-е изд. Cold Spring Harbor Laboratory. Cold Spring Harbor. New York. 1989). Можно также обратиться к материалам заявок РСТ WO 95/21250 и РСТ WO 96/02658, в которых описаны методики получения в промышленном масштабе плазмид для вакцинации. Для получения вакцин (см. Пример 17), готовят суспензию очищенных плазмид таким образом, чтобы получить высококонцентрированные растворы (>2 мг/мл), пригодные для хранения. Для этого готовят суспензию плазмид или в ультрачистой воде, или в буфере ТЕ (Tris-HCl 10 мМ; EDTA 1 мМ, рН 8,0).
Пример 18. Получение ассоциированных вакцин
Различные плазмиды, необходимые для получения ассоциированной вакцины, смешивают в их концентрированных растворах (пример 16). Смеси готовят таким образом, чтобы конечная концентрация каждой плазмиды соответствовала эффективной дозе каждой плазмиды. В качестве растворов для доводки конечной концентрации вакцины можно использовать раствор 0,9% NaCl или буфер PBS.
Особые составы, такие как липосомы, катионные липиды, могут также быть использованы для получения вакцин.
Пример 19. Вакцинация собак
Собак вакцинируют дозами 10 мкг, 50 мкг или 250 мкг на каждый тип плазмиды.
Инъекции можно проводить с помощью иглы внутримышечно. В этом случае вакцинные дозы вводят в объемах 1 или 2 мл. Инъекции можно проводить с помощью иглы внутрикожно. В этом случае вакцинные дозы вводят в общем объеме 1 мл, вводимом в 10 точках по 0,1 мл или в 20 точках по 0,05 мл. Перед внутрикожным введением выбривают кожу (обычно бок грудной клетки) или их проводят на уровне относительно безволосых анатомических областей, таких как, например, внутренняя поверхность бедра. Также можно использовать жидкоструйный инъекционный аппарат для внутрикожных инъекций.
Реферат
Изобретение относится к области вирусологии и биотехнологии. Вакцина против бешенства собак содержит плазмиду, содержащую нуклеиновую кислоту, кодирующую белок G вируса бешенства. Вакцина обеспечивает полную защиту против бешенства в течение одного года после единственного введения этой вакцины. Предложены также способ вакцинации с помощью такой вакцины и набор, ее включающий. Изобретение может быть использовано в ветеринарии. 6 н.п. и 18 з.п. ф-лы, 10 ил.

Комментарии