Последовательности пептидов и пептидные композиции - RU2466737C2
Код документа: RU2466737C2
Чертежи




















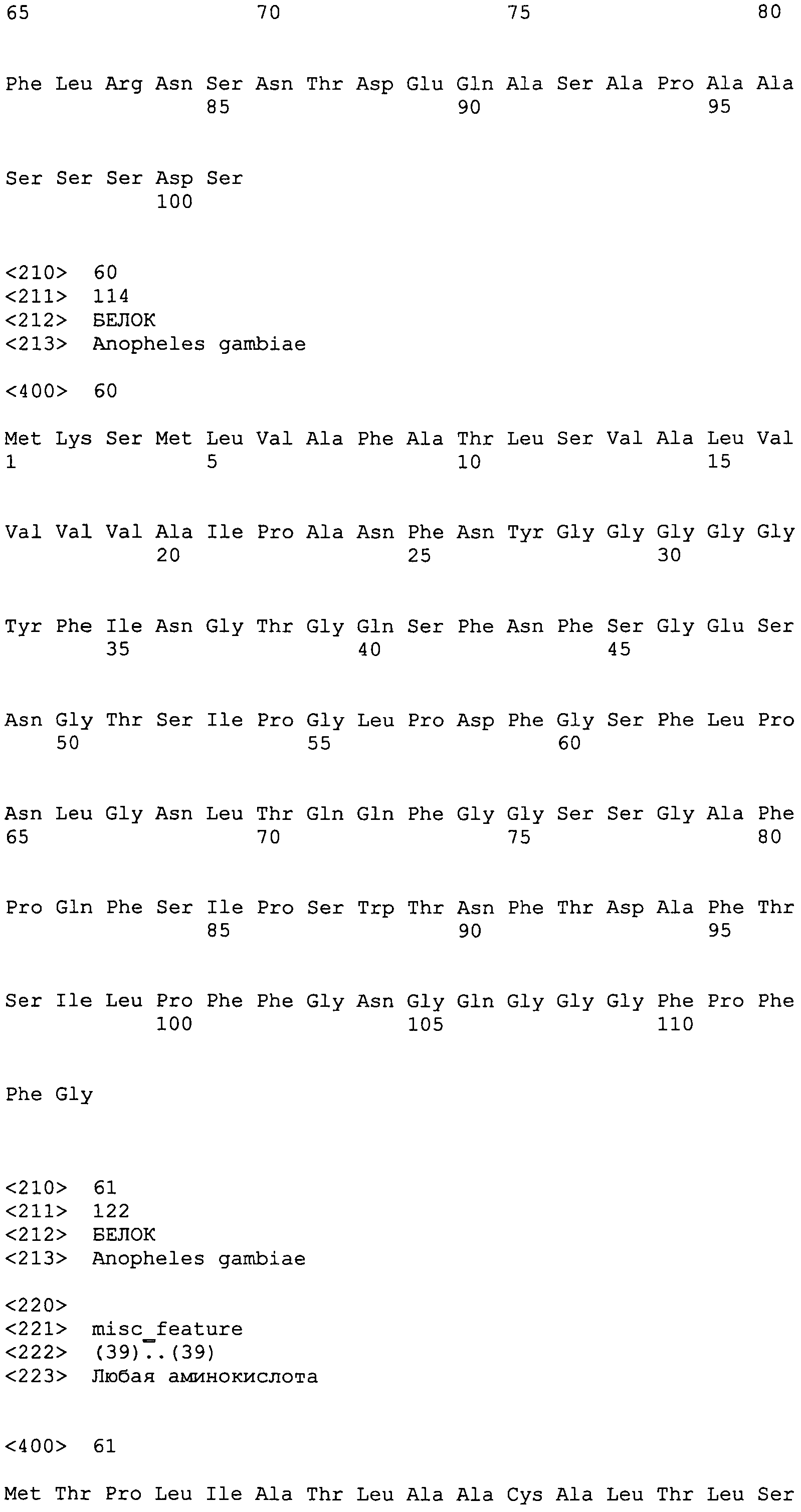

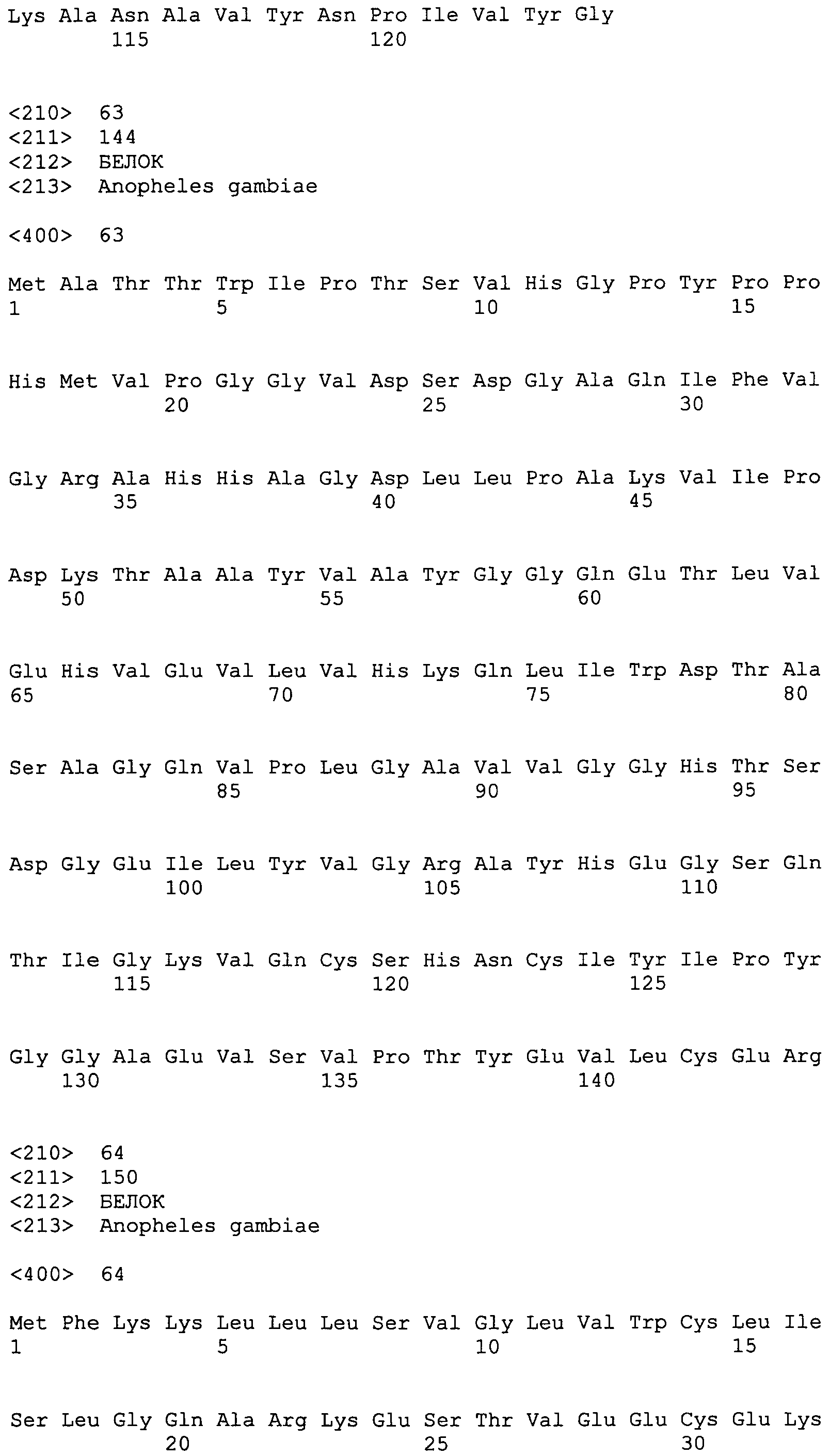











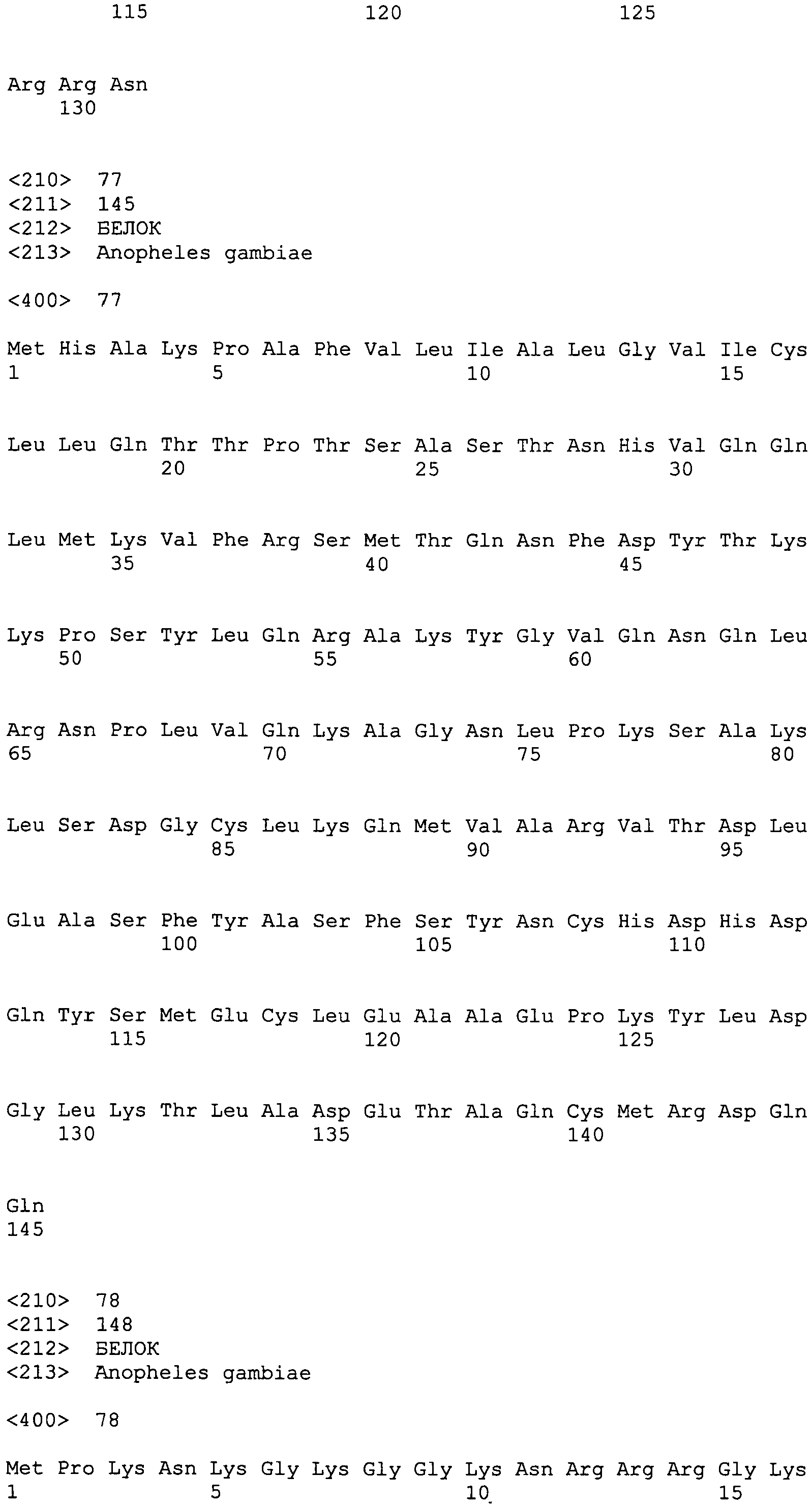

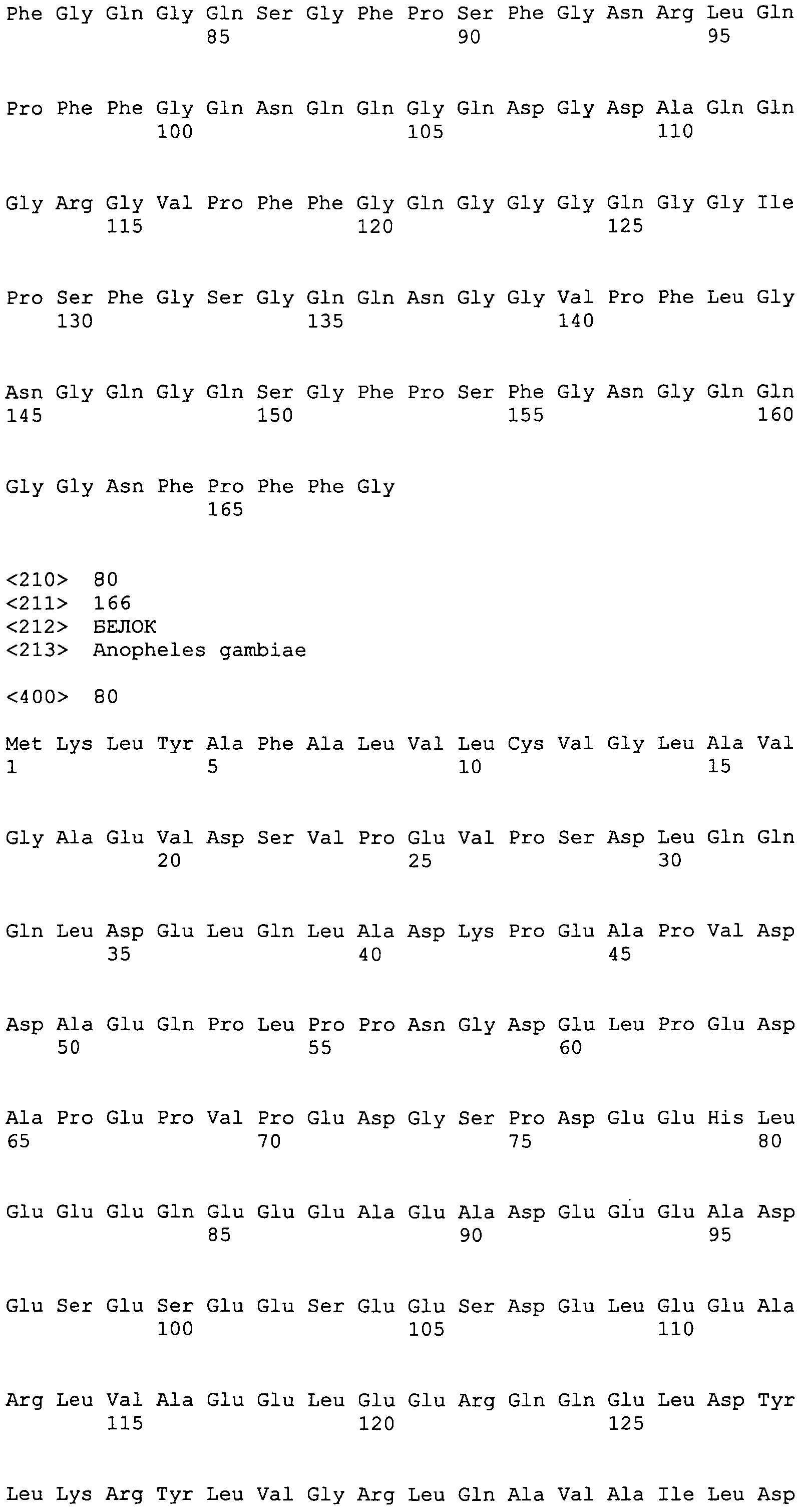
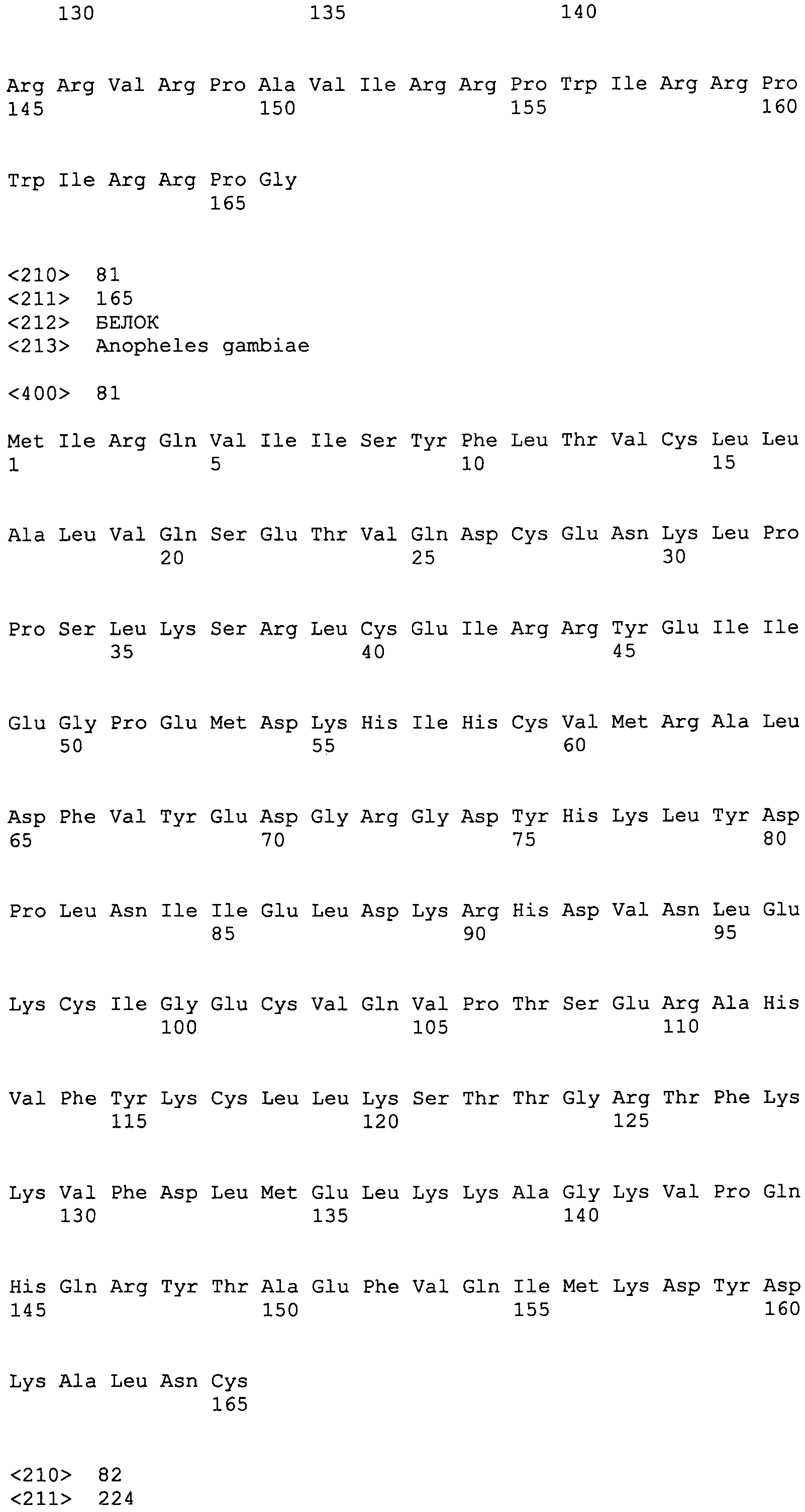

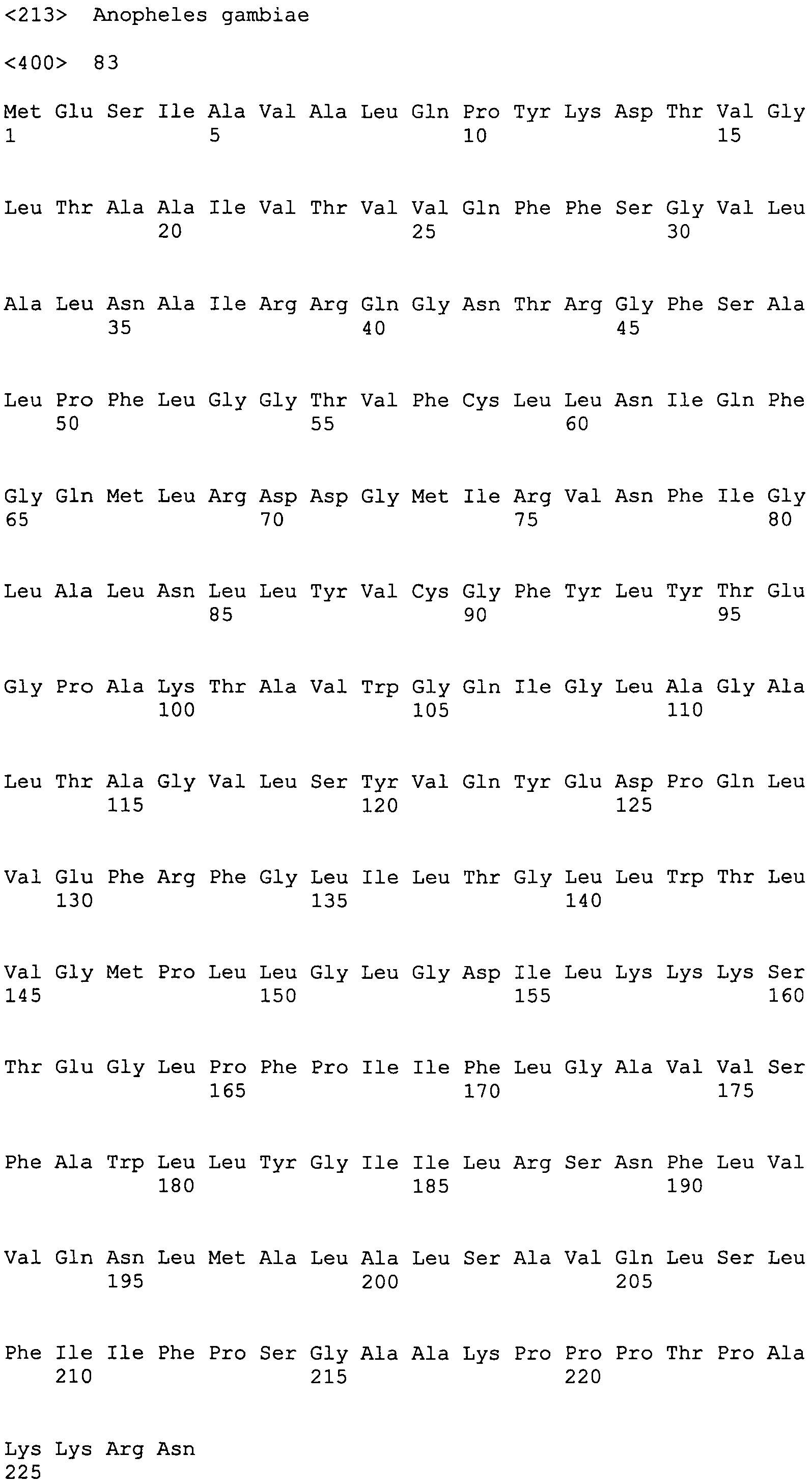
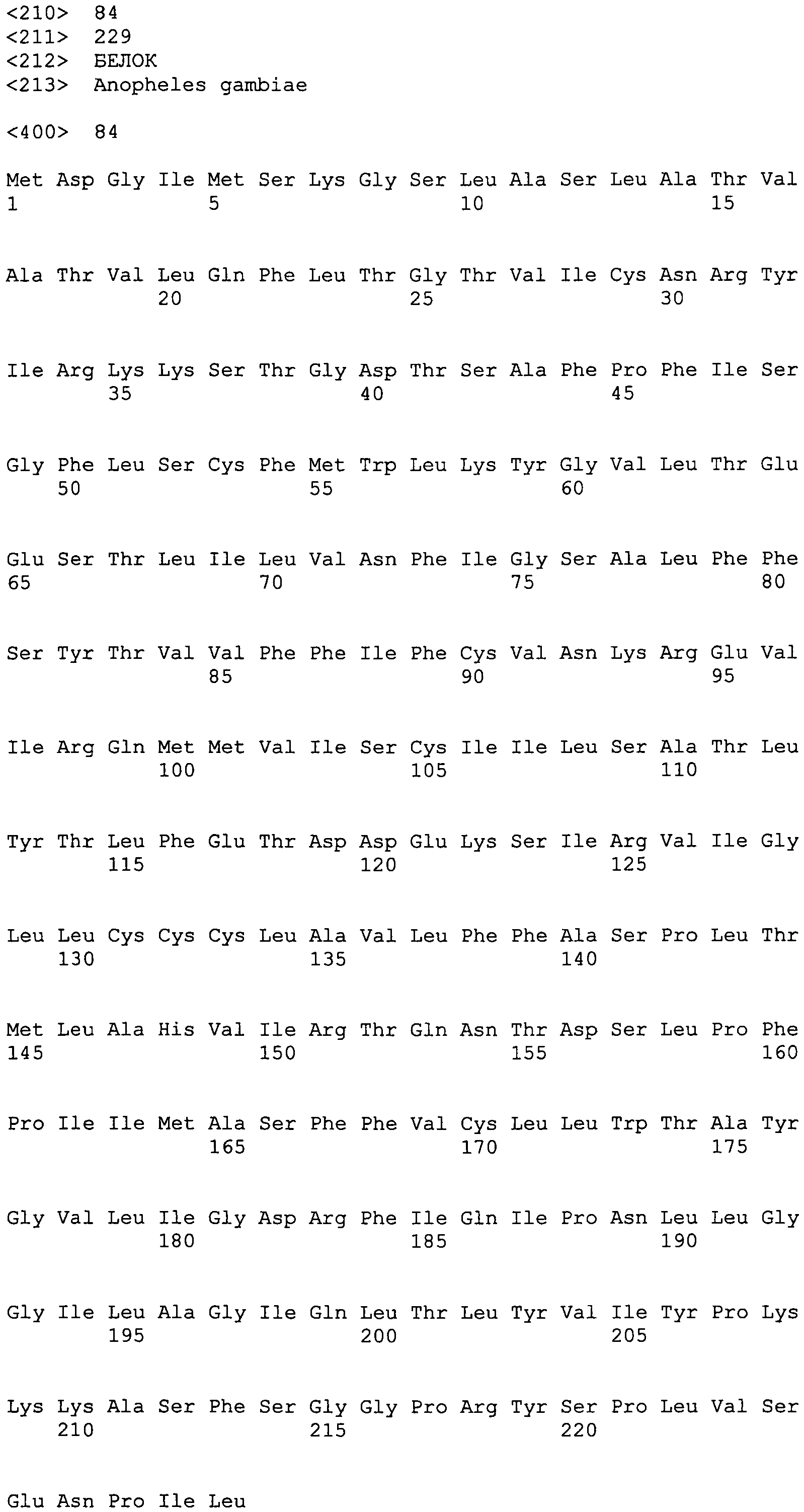
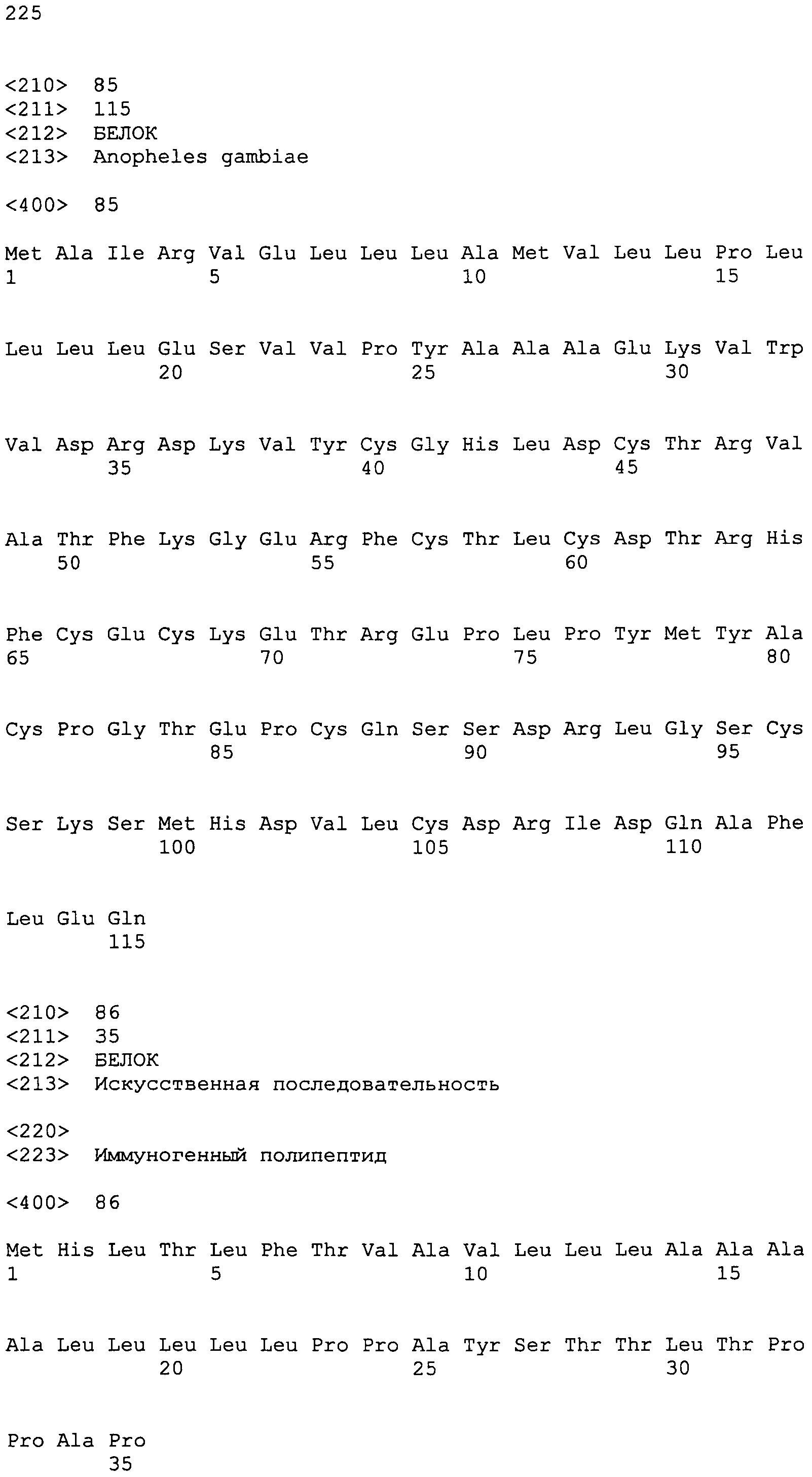








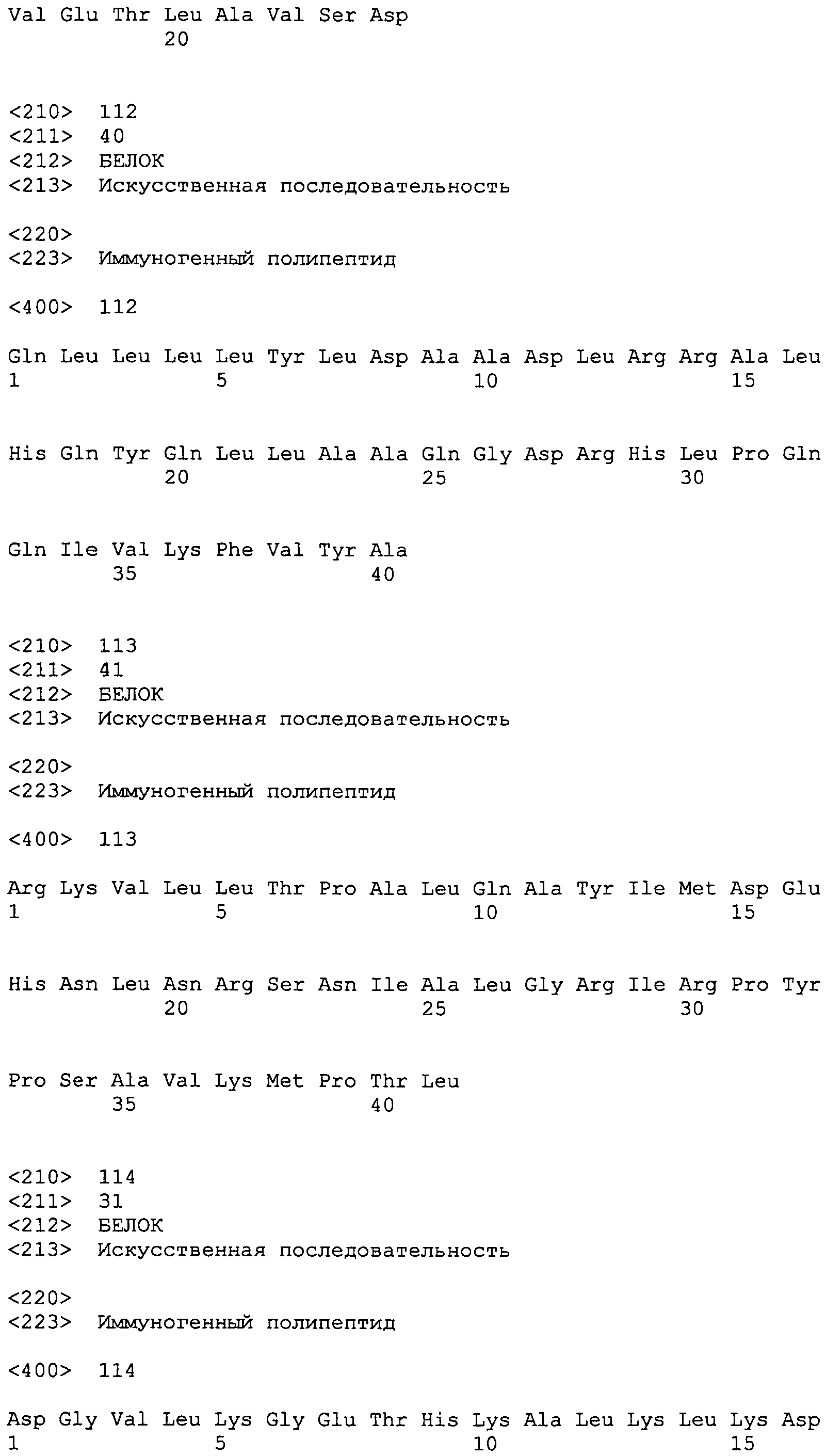





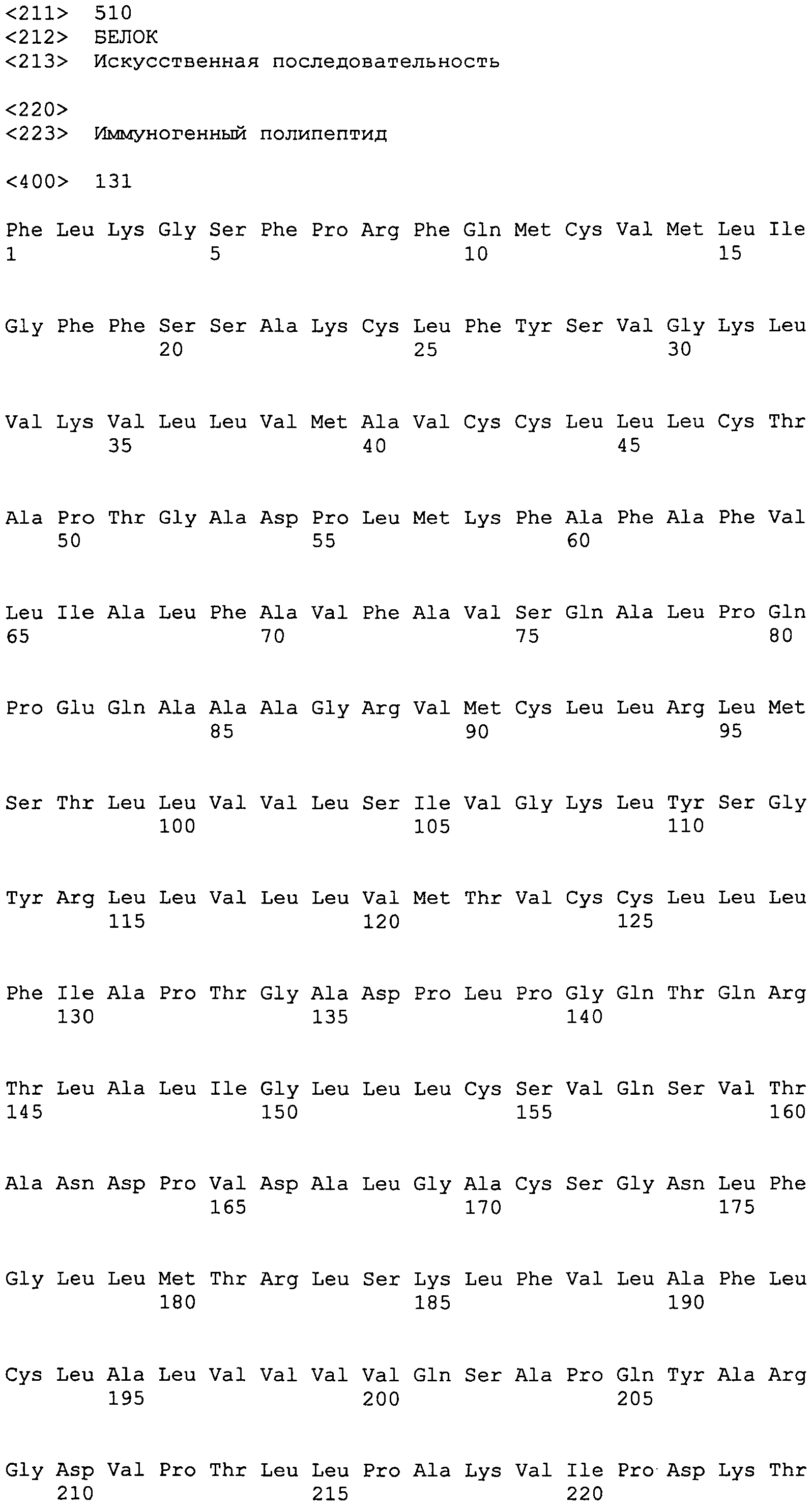
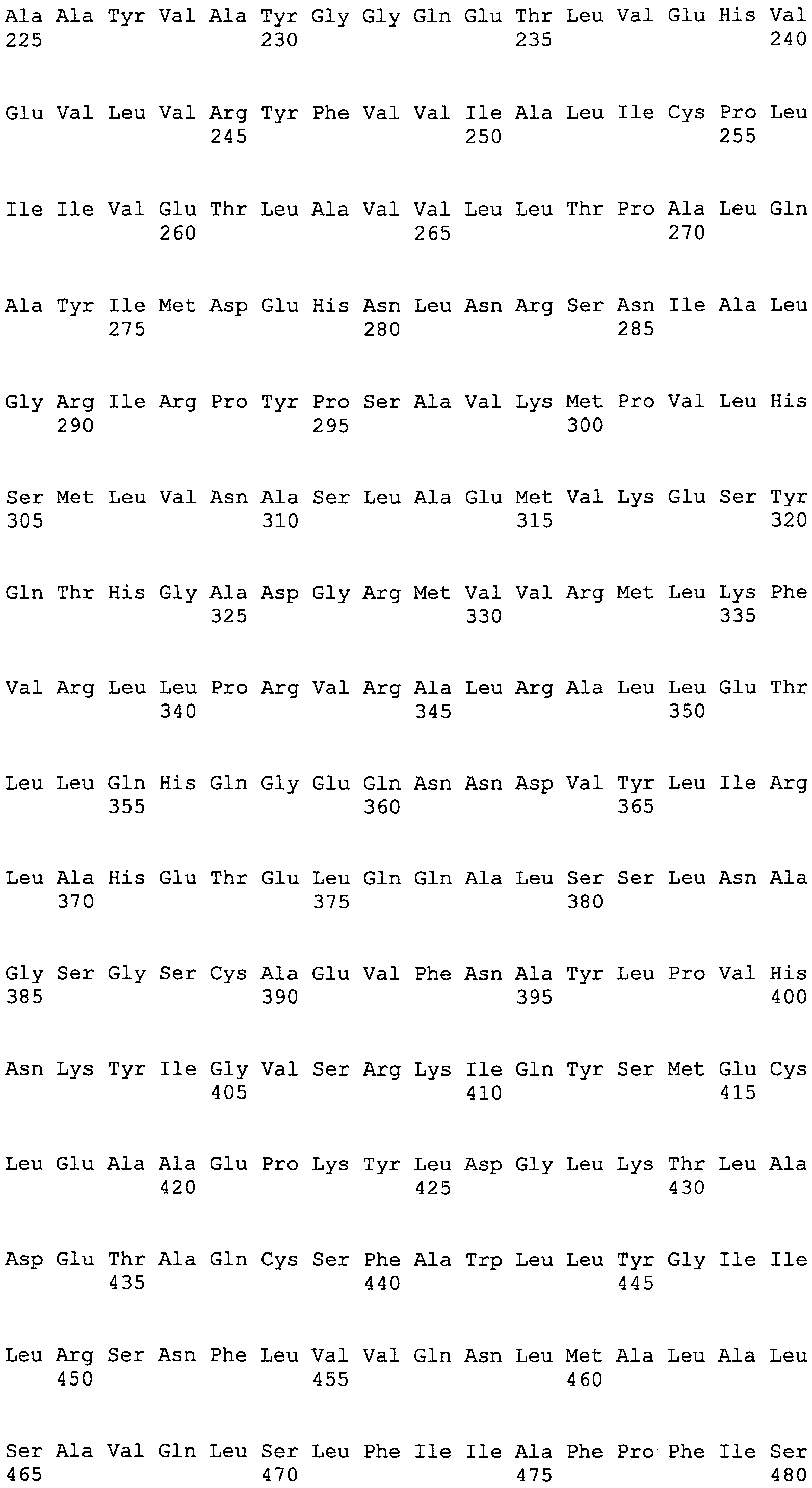
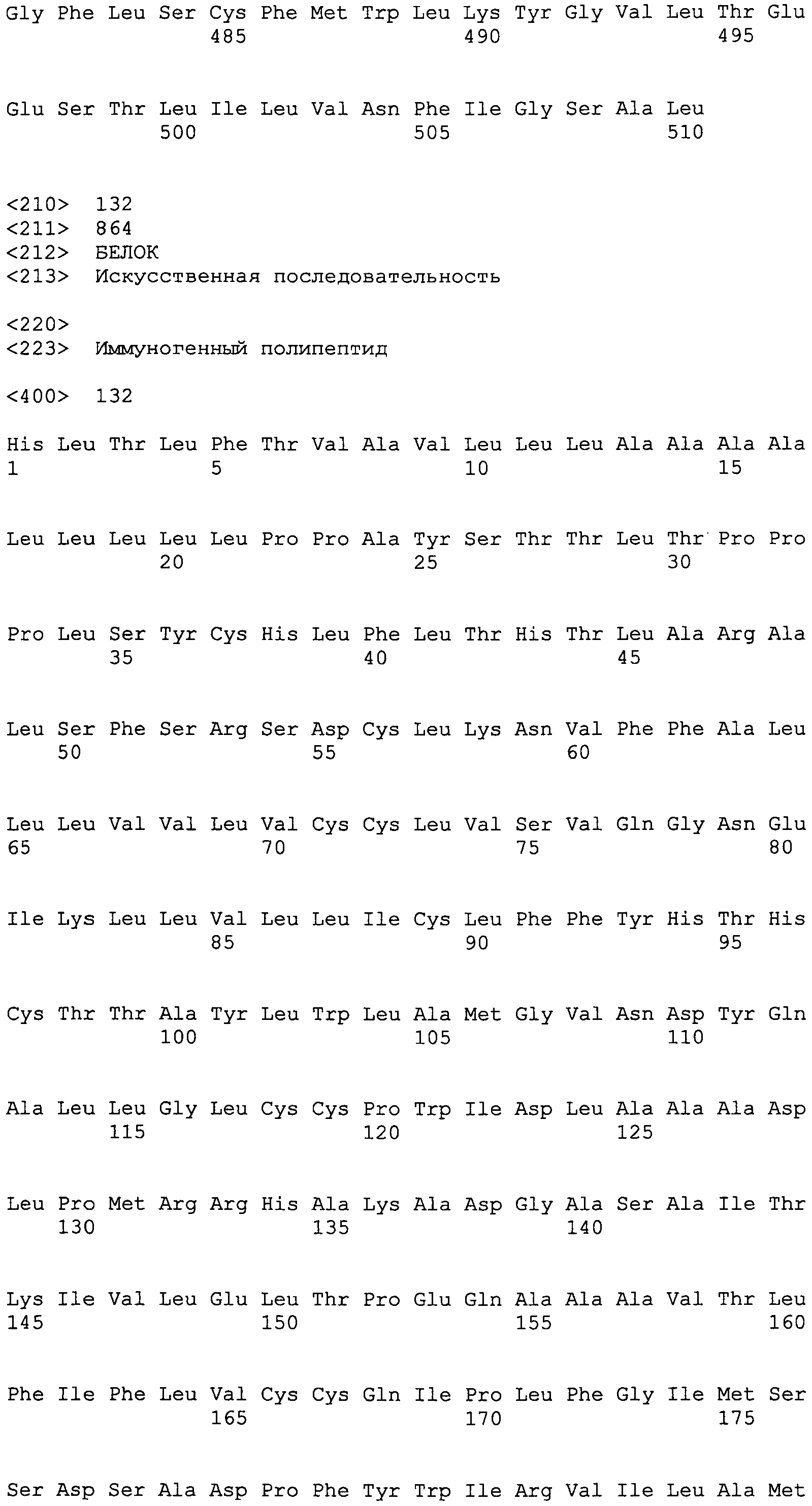


Описание
Настоящее изобретение относится к последовательностям пептидов, композициям, содержащим последовательности пептидов, в частности вакцинам против распространяемых членистоногими болезней, включающим указанные последовательности и композиции, и применениям последовательностей. Настоящее изобретение имеет, в частности, отношение к вакцинам, которые защищают от любой одной или нескольких распространяемых комарами болезней, в том числе, одного или нескольких малярийных штаммов.
Защита от болезни важна для выживания всех животных, и используемым для этой цели защитным механизмом является иммунная система животного. Поэтому понимание иммунной системы является ключом к осознанию разработки новых или более современных лечений одинаково для людей и животных.
Механизм функционирования иммунной системы исследовался на протяжении многих лет. Система состоит из ряда типов клеток и множества молекул, что делает ее чрезвычайно сложной. Даже после многих лет исследования весь объем компонентов иммунной системы и их взаимодействие друг с другом поняты не полностью.
Много лет назад признавалось, что субъект, выздоровевший от конкретной болезни, может приобрести в будущем некоторый иммунитет к этой болезни, но не к болезни, которой субъект еще не заболел. В то время этот фундаментальный аспект иммунной системы интерпретировали, считая, что иммунная система приобретает что-то вроде «памяти» в отношении некоторых патогенов после подвергания воздействию таких патогенов, при этом память является специфической для конкретной болезни.
Мало-помалу стало известно, что подвергание воздействию менее опасных вариантов патогена может вызвать защиту от более опасных вариантов (например, подвергание воздействию вируса осповакцины - защитить от вируса натуральной оспы или подвергание воздействию инактивированной сибиреязвенной бациллы - защитить от живой сибиреязвенной бациллы). Так возникла идея вакцинации против болезни.
В настоящее время известно, что иммунная система имеет по меньшей мере две части: врожденный иммунитет и приобретенный иммунитет. Врожденный иммунитет является полностью функциональным до проникновения патогена в систему, в то время как приобретенный иммунитет включается после проникновения патогена в систему. Она затем проявляет специфичную для патогена атаку. Врожденная иммунная система включает ряд компонентов, в том числе фагоциты, такие как макрофаги, которые (в соответствии с названием) «пожирают» или поглощают чужеродные тела, такие как патогены.
Обычно, но не исключительно, настоящее изобретение имеет отношение к приобретенной иммунной системе, и, кроме особо оговоренных случаев, «иммунная система» в контексте настоящего изобретения относится к приобретенной иммунной системе.
Для более полного понимания того, каким образом функционирует иммунная система, должна быть подвергнута тщательному рассмотрению роль ее отдельных компонентов. В отношении приобретенной иммунной системы хорошо известно, что иммунитет к патогенам обеспечивается действием лимфоцитов, которые являются типом самых распространенных клеток в иммунной системе. Существует два типа лимфоцитов: В-лимфоциты и Т-лимфоциты. Их обычно называют В-клетками и Т-клетками соответственно.
В-клетки обладают способностью к преобразованию в плазматические клетки, которые продуцируют антитела. Антитела являются очень важными компонентами иммунной системы животных. Они продуцируются в ответ на некую отличительную часть инвазивного патогена (антиген патогена - при этом антигены определяют здесь как любое чужеродное вещество, распознаваемое иммунной системой) и являются, как правило, специфичными для этого патогена. Однако если два патогена являются очень схожими или по меньшей мере содержат одинаковый антиген, антитела, продуцированные против одного патогена, могут, тем не менее, быть эффективными против другого патогена (они могут давать «перекрестную реакцию»). Это объясняет, почему вакцинация вирусом осповакцины может защитить от вируса натуральной оспы. Важно понимать, что антитела «распознают» только небольшую часть антигенной молекулы патогена, а не весь патоген. Эти части называют эпитопами.
Т-клетки не обладают антителами или не продуцируют их. Вместо этого они распознают фрагменты (т.е. эпитопы) чужеродного антитела, образующие комплекс с главным комплексом гистосовместимости (MCH) (или в случае людей главным комплексом гистосовместимости человека (HLA)), через посредство специализированного рецептора, известного как TCR (рецептор Т-клеток). Сами Т-клетки делятся на субпопуляции, которые обладают или регуляторной функцией, или эффекторной функцией. Клетки-эффекторы связаны с «осуществлением» удаления чужеродных веществ. Например, цитотоксические Т-клетки (CTL) являются клетками-эффекторами, которые способны к уничтожению инфицированных клеток, а также других нежелательных разновидностей, таких как опухолевые клетки. С другой стороны, регуляторные Т-клетки играют роль в оказании помощи эффекторным Т- и В-клеткам стать более эффективными. Вследствие этой функции эти регуляторные Т-клетки часто называют Т-клетками-«хелперами». Полагают, что другие регуляторные Т-клетки, называемые Т-клетками-«супрессорами», подавляют иммунные ответы, но они менее хорошо изучены. Регуляторные Т-клетки могут также взаимодействовать с компонентами врожденной иммунной системы для усиления их активности.
У нормального здорового индивидуума лимфоциты в иммунной системе остаются в неактивном состоянии «покоя» до вызова иммунного ответа. При необходимости иммунного ответа лимфоциты становятся активированными, подвергаются пролиферации и начинают выполнять отведенные им функции. Например, любая покоящаяся Т-клетка, представляющая на своей поверхности TCR, который распознает эпитоп инвазивного патогена, образующий комплекс с молекулой МНС, активируется, подвергается пролиферации (это называют «размножением клона»), и получаемое в результате потомство начинает активно выполнять отведенные им эффекторные функции, требуемые для борьбы с инвазивными организмами.
После завершения иммунного ответа (т.е. удаления патогенов и/или инфицированных клеток) лимфоциты снова возвращаются к состоянию покоя. Однако это состояние покоя не эквивалентно исходному неактивному состоянию покоя. Активированные, но покоящиеся лимфоциты могут быть быстро подвергнуты рекрутингу и стимуляции для пролиферации в ответ на инфицирование тем же самым, или близко родственным, патогеном впоследствии.
Эта способность активированных покоящихся лимфоцитов к созданию более быстрого и более сильного ответа после второго столкновения с инвазивным патогеном эффективно снабжает «памятью» иммунную систему. Эксплуатация памяти иммунной системы является основой для всех долговременных иммунопрофилактических лекарственных средств (например, вакцин) и остается целью разработки многих долговременных иммунопрофилактических лекарственных средств.
Для выполнения клетками своих функций внутри сложных систем животного на поверхности клеток должны быть «рецепторы». Эти рецепторы способны к «распознанию» специфических веществ, которые контролируют различные весьма важные процессы, такие как активация, пролиферация и адгезия к другим клеткам или веществам. Например, в случае иммунной системы рецепторы на Т- и В-клетках позволяют им не только распознавать антиген, но также взаимодействовать друг с другом и, следовательно, регулировать свои активности. Без этих рецепторов клетки утратили бы весьма важное средство связи и не были бы способны к эффективному согласованному действию, которое является весьма важным для иммунной системы многоклеточного организма.
Для того чтобы иммунная система была способна к специфическому распознанию широкого ряда патогенов, присутствующих в окружающей среде, и началу действий в отношении такого ряда, в ней были созданы два типа в высокой степени вариабельных рецепторов антигенов на лимфоцитах: антитела в В-клетках и рецепторы Т-клеток, или TCR, в Т-клетках.
Для способствования в распознавании широкого ряда инвазивных агентов иммунной системой в организме существует огромное множество различных рецепторов возможных антигенов. В действительности у индивидуума существует приблизительно 1012 различных В-клеток и рецепторов Т-клеток. Каждая отдельная В-клетка имеет только один тип рецептора, и значит, для начала действий в отношении конкретного патогена должна быть отобрана В-клетка, имеющая «максимально соответствующий» рецептор для антигена этого патогена. Этот процесс называют «отбором клона». Теоретически может отвечать только один клон (моноклональный ответ), или несколько клонов (олигоклональный ответ), или множество клонов (поликлональный ответ) в зависимости от числа антигенов/эпитопов, экспонированных патогеном, и специфичности различных отобранных В-клеток в отношении этих антигенов/эпитопов.
Между типами антигенов, которые могут быть распознаны В-клетками и Т-клетками, существует основное различие. Насколько известно, только рецепторы на поверхности В-лимфоцитов (т.е. антитела) способны к прямому распознаванию антигенов, таких как белки вирусов и бактерий или чужеродные молекулы, растворенные в жидкости организма. Антитела могут также продуцироваться в растворимой форме В-клетками, когда они активируются и преобразуются в плазматические клетки. Антитела также называют иммуноглобулинами (сокращенно Ig). С другой стороны, рецепторы Т-клеток распознают только короткие пептиды, также известные как Т-клеточные эпитопы, на поверхности клеток организма. Эти Т-клеточные эпитопы создаются при деградации больших белков, которые являются или внутренними (т.е. встречающими в природе белками организма), или не внутренними (т.е. происходящими из чужеродных организмов, инфицирующих организм). Только эпитопы, происходящие из чужеродных белков, т.е. антигены, обычно способны к вызову иммунного ответа в организме. После создания эти эпитопы связываются со специальным типом молекулы, МНС (главным комплексом гистосовместимости), и получаемый в результате комплекс затем презентируется на поверхности клетки для связывания с рецептором Т-клеток.
Должно быть понятно, что из-за деструктивной природы иммунного ответа он должен быть направлен только против чужеродных патогенов, а не против собственных клеток или белков организма. Таким образом, иммунной системе необходимо проводить различие между «внутренними» и «не внутренними» белками или клетками. Было сделано предположение, что, хотя действующие против внутренних белков или клеток клоны лимфоцитов продуцируются, они подвергаются делеции до того, как может возникнуть какой-либо ответ. Этот процесс называют «делецией клона». Также было сделано предположение, что любые действующие против внутренних белков или клеток лимфоциты могут сохраняться, но только в «выключенном» состоянии. Этот механизм называют «клональной толерантностью». Какой бы не рассматривался процесс, остается неясным точный, лежащий в основе механизм, который позволяет лимфоидным тканям, таким как вилочковая железа, идентифицировать отдельные клоны Т-клеток, действующие против внутренних белков или клеток, из пула Т-лимфоцитов, действующих только против не внутренних белков или клеток.
На протяжении многих лет было известно, что главный комплекс гистосовместимости (МНС) играет ключевую роль в иммунной системе животных. Молекулы МНС способствуют распознаванию антигенов Т-клетками, как уже обсуждалось выше. Существует три основных типа молекул МНС, класса I, класса II и класса III. Молекулы МНС класса I и класса II являются гликопротеинами, которые присутствуют на поверхности клетки, в то время как молекулы МНС класса III обычно являются растворимыми молекулами, присутствующими внутри клетки. Существует большое число различных типов молекул МНС. Например, у людей (у которых MHC называют HLA, главным комплексом гистосовместимости человека) существует несколько сотен различных аллелей генов, кодирующих молекулы МНС, что означает, что в популяции людей существует множество различных типов HLA. МНС различных видов обычно присваивают различные условные обозначения, так МНС мыши называют Н-2, крысы - RT1, а кролика - RLA. Различные области генов, кодирующие различные молекулы МНС у индивидуума, обычно называют в индивидуальном порядке, например HLA-A, HLA-C и т.п. у людей.
Молекула МНС является крайне важной молекулой иммунной системы, поскольку она является именно той молекулой, которая осуществляет презентацию эпитопов антигенов иммунной системе. Например, если Т-клетка должна отвечать на конкретный патоген, патоген должен обладать по меньшей мере одним антигеном (например, белком), который имеет по меньшей мере один эпитоп (например, пептидный участок белка), который может связываться с молекулой МНС на поверхности клетки и, следовательно, взаимодействовать с Т-клеткой, которая связывается с комплексом МНС-пептид. Следовательно, иммунный ответ зависит от способности МНС связываться с эпитопом. В отсутствие эпитопа, с которым будет связываться МНС, или в отсутствие Т-клетки, с которой будет связываться комплекс МНС-пептид, иммунный ответ возникать не будет.
Что касается «внутренних» белков, один из нескольких эпитопов, однако, может быть способен к связыванию с молекулой МНС и, следовательно, к возможному вызову иммунного ответа. В этих случаях должен быть предусмотрен специфический «сигнал» для делеции или «выключения» клонов лимфоцитов, действующих против внутренних белков.
Несмотря на растущую сумму знаний о работе иммунной системы позвоночных вакцины против многих болезней остаются труднодостижимыми. Некоторые патогены (например, ВИЧ и вирус гриппа) подвергаются быстрому мутированию, так что эпитопы, которые могут быть пригодными мишенями для создания вакцины против одного штамма, не пригодны после возникновения мутации, поскольку эпитоп в новом штамме изменился. Были тщательно исследованы другие патогены, такие как плазмодий (патоген, ответственный за малярию), но мишени на патогене, которые можно использовать для разработки вакцины, оказалось трудно идентифицировать или просто не обеспечивали эффективную вакцину in vivo.
Патогены, прогресс в исследовании которых особенно необходим, являются патогенами, которые распространяются членистоногими и вызывают так называемые «распространяемые членистоногими болезни». Такие болезни являются основной причиной смерти по всему миру и включают, в числе других, малярию и лихорадку денге - некоторые из наиболее значительных средств уничтожения популяции на сегодняшний день, в частности, в более бедных областях мира. Примеры включают, но без ограничения, болезни, перечисленные ниже в таблице 1.
Ранее попытки обеспечить вакцины против распространяемых членистоногими болезней включали идентификацию существующих штаммов патогенов и затем получение вакцины, специфичной в отношении этого патогена. Как правило, вакцины основывались на В-клеточном ответе (образовании антител) (и изредка на Т-клеточном ответе), при этом антитело реагировало с поверхностными антигенами конкретного штамма патогена, против которого оно разрабатывалось. Как правило, включающие антигены поверхностные белки меняются от одного вызывающего болезнь штамма к последующему штамму и полностью отличны для различных патогенов. Результатом этого является то, что обычные вакцины обычно защищают только от одного конкретного патогена или штамма патогена (если они вообще эффективны) и не будут защищать от других штаммов или нового штамма, который является следствием мутации. Поэтому особая вакцина требуется для защиты от каждой болезни и часто от различных и/или новых штаммов, вызывающих одну и ту же болезнь.
На протяжении некоторого периода времени известно, что иммунизация против слюны членистоногих или против антигенов, экспрессируемых в кишке членистоногих, может защитить индивидуума от инфицирования. Статьи, в которых это обсуждается, включают выделенные ниже статьи.
R.G. Titus et al. “The immunomodulatory factors of arthropod saliva and the potential for these factors to serve as vaccine targets to prevent pathogen transmission”, Parasite Immunology, 2006, 28, 131-141. В статье приводится обзор известных иммуномодуляторов в слюнных железах членистоногих. Иммуномодулирующие факторы могут усилить передачу патогена членистоногими. Слюна переносчика инфекции содержит большое число веществ, активности которых включают способность к ингибированию гемостаза, сужения кровеносных сосудов и развития воспаления и иммунного ответа. У комаров существует несколько ингибиторов Т-клеток. Если слюна членистоногих усиливает инфицирование патогенами, которые передают членистоногие, должен быть возможен контроль передачи патогена с помощью вакцинации хозяина против молекулы (молекул) в слюне, которые усиливают инфицирование, блокируя, тем самым, усиливающие эффекты слюны и, следовательно, предотвращая укоренение инфекции - патогена у хозяина. Был клонирован ген максадилана или МАХ, который кодирует сильный вазодилататор в слюне песчаного москита, и были исследованы активности белкового продукта гена. Эффекты МАХ песчаного москита проявляются через первичные воздействия на фагоциты, и это приводит к последующим иммуномодулирующим/ингибиторным эффектам на Т-клеточные ответы. Мышей вакцинировали против МАХ путем инъецирования МАХ в полном адъюванте Фрейнда, а затем МАХ в неполном адъюванте Фрейнда и затем бустер-инъецирования растворимого МАХ до достижения титра антител против МАХ в крови между 1/10000 и 1/20000. Вакцинированные мыши были явно защищены от инфекции.
G.A.T. Targett, “Parasites, arthropod vectors, and immune responses”, Parasite Immunology, 2006, 28, 117-119. В этой статье демонстрируется, что отсасывание крови комарами вызывает иммунные реакции на слюну насекомых. Они включают как реакции гиперчувствительности, так и образование антител против комаров. Определение образований этих антител может иметь эпидемиологическое значения для контролирования популяций переносчиков инфекции, а применение таких образований - для оценки эффективности стратегий вмешательства. Получение вакцин, которые бы уменьшали отсасывание крови, развитие и/или выживание являющихся членистоногими переносчиков инфекции или эктопаразитов, является привлекательной, хотя и амбициозной идеей. Одной важной целью является контролирование самих членистоногих-эктопаразитов, в то время как второй целью является использование вакцины против членистоногих в качестве средства для нанесения ущерба паразитам, которых членистоногое распространяет или внутри самого себя, или когда происходит передача являющемуся позвоночным хозяину.
M.M.A. Whitten et al., “Mosquito midguts and malaria: cell biology, compartmentalization and immunology”, Parasite Immunology, 2006, 28, 121-130. Средняя кишка комара представляет собой одну из самых трудных сред для выживания и развития плазмодия. Во время их попыток преодолеть эпителий средней кишки по пути в слюнные железы подвижные оокинеты быстро выявляются и метятся распознающими факторами комаров и делаются мишенью для разрушения рядом иммунных ответов, которые осуществляют рекрутинг вызывающих гибель факторов как из средней кишки, так и из других тканей в окружающей брюшной полости. Точное взаимодействие этих факторов и паразита является в высокой степени специфическим для вида и штамма, как и выбор времени и пути инвазии паразита. Средняя кишка образует физический барьер, отделяющий и защищающий ткани гемоцеля от пищеварительных ферментов и инфекционных агентов. Она состоит из одного слоя поляризованных эпителиальных клеток, при этом на одном из двух полюсов обнаруживаются различные морфологические адаптации для увеличения площади поверхности, вовлеченной в обмен молекул. Отличная микроворсинчатая апикальная поверхность экспонирована в просвет кишечника, и ее основной ролью является секреция пищеварительных ферментов и абсорбция питательных веществ. Структурные изменения, инициируемые отсасыванием крови, включают образование плотного неклеточного, хитинового перитрофического матричного материала (РМ), который секретируется эпителием средней кишки и который подвергается полимеризации под действием расщепленной пищи в виде крови. РМ окружает комок крови и образует барьер для паразитов и попыток бактерий пройти через эпителий средней кишки.
P.F. Billingsley et al. “Immune interactions between mosquitoes and their hosts”, Parasite Immunology, 2006, 28, 143-153. Антитела, направленные на среднюю кишку комаров, также важны при разработке вакцин против комаров. Секреция слюны комаром во время отсасывания крови важна для успешного определения местонахождения кровеносных сосудов хозяина и воздействия на гемостатические и иммунные реакции хозяина. Методы иммуноблоттинга использовались для характеристики распознавания антигенов слюны антителами против комаров хозяина. Во время отсасывания крови комар заглатывает иммунные факторы хозяина как растворимые, так и клеточные, которые остаются активными в средней кишке. В противоположность антигенам слюны, хозяин обычно не будет подвергаться воздействию антигенов из внутренних органов комара, что наводит на мысль об использовании этих «скрытых» антигенов в качестве мишеней для создания вакцины. Наилучшим источником скрытых антигенов является средняя кишка, поскольку после отсасывания крови в ней содержится пища в виде крови с составляющими ее иммунными эффекторными молекулами и клетками. Средние кишки и препараты всего тела Ae. aegypti индуцировали высокие титры антител у мышей, и была установлена связь увеличенной гибели комаров, которые питались их кровью, с антителом, которое связывается с микроворсинками средней кишки. Образования IgG индуцировали у мышей, которым инъецировали библиотеку кДНК средней кишки An. Gambiae, и высокие титры антител получали после бустер-иммунизации белками средней кишки. Для комаров, кормящихся кровью этих мышей, демонстрировались воспроизводимые снижения выживания и фертильности, но, что интересно, клеточные, а не гуморальные ответы, по-видимому, были ответственны за москитоцидные эффекты. Эти исследования столкнулись с проблемами. Даже в пределах экспериментов нестабильность может быть высокой, и трудно достичь воспроизводимости эффекта. Иммунизация сложной смесью или белковых экстрактов средней кишки, или библиотекой кДНК средней кишки означала, что протективные, являющиеся мишенями антигены не были идентифицированы.
Однако несмотря на эту сумму знаний все еще не разработана эффективная вакцина против распространяемых членистоногими болезней, в которой используется этот механизм действия. Дальнейшей значительной проблемой, связанной с существующими вакцинами против распространяемых членистоногими болезней, основывающимися или на В-клеточных, или Т-клеточных ответах, является то, что каждая из них защищает только от одного патогена или самое большое от одного существующего штамма патогена и не обеспечивает защиту от возможных будущих патогенов или от множества патогенов. Существует отчаянная необходимость в вакцине, защищающей от множества распространяемых членистоногими болезней, включающего средства крупномасштабного уничтожения, такие как малярия и лихорадка денге.
В настоящее время авторы настоящего изобретения смогли идентифицировать последовательности специфических иммуногенных пептидов, присутствующие в белках слюны членистоногих, которые могут обеспечить защиту от всех распространяемых членистоногими патогенов, и разработали вакцины против болезней, которые они вызывают, используя идентифицированные последовательности. Таким образом, авторы настоящего изобретения разработали пептиды, применимые в вакцинах, индуцирующих иммунный ответ и, в частности, быстрый вторичный иммунный ответ против распространяемых членистоногими болезней.
Соответственно, целью настоящего изобретения является разрешение проблем, связанных с известным уровнем техники, представленным выше. Дальнейшей целью настоящего изобретения является обеспечение полипептидной композиции, которая способна индуцировать у позвоночных иммунный ответ (например, клеточный ответ, включающий Т-клеточный ответ и/или В-клеточный ответ) против множества распространяемых членистоногими болезней, т.е. болезней, вызываемых множеством патогенов или штаммов патогенов. Дальнейшей целью настоящего изобретения является обеспечение вакцины против распространяемых членистоногими болезней, используя полипептидные композиции настоящего изобретения.
Соответственно, настоящим изобретением обеспечивается полипептидная композиция, включающая один или несколько полипептидов, которые являются иммуногенными у позвоночного, так что они вызывают у позвоночного продукцию клеток иммунной системы (или активируют продукцию таких клеток), способных к распознаванию по меньшей мере одного эпитопа в белковой фракции слюны членистоногих, причем белковая фракция слюны членистоногих имеет массу, составляющую 40 кДа или меньше, а полипептиды независимо выбирают из:
(а) последовательностей полипептидов SEQ ID NO:1-44 или имеющих 7 аминокислот или более подпоследовательностей из этих последовательностей:
SEQ ID NO:1 HLTLFTVAVLLLAAAALLLLLPPAYSTTLTPP
SEQ ID NO:2 PLSYCHLFLTHTLARALSFSRSDCL
SEQ ID NO:3 KNVFFALLLVVLVCCLVSVQGNEI
SEQ ID NO:4 KLLVLLICLFFYHTHCTTAYLWLAMGV
SEQ ID NO:5 FLKGSFPRFQMCVMLIGFFSSAKCL
SEQ ID NO:6 NDYQALLGLCCPWIDLAAADLPMRRHAKA
SEQ ID NO:7 FYSVGKLVKVLLVMAVCCLLLCTAPTGADPL
SEQ ID NO:8 MKFAFAFVLIALFAVFAVSQALPQPEQAAA
SEQ ID NO:9 DGASAITKIVLELTPEQAAAV
SEQ ID NO:10 TLFIFLVCCQIPLFGIMSSDSADPFYWIRVILA
SEQ ID NO:11 GRVMCLLRLMSTLLVVLSIVGK
SEQ ID NO:12 LYSGYRLLVLLVMTVCCLLLFIAPTGADPLPGQTQRTL
SEQ ID NO:13 MYCVIKGKTGGYCNSEGLCTCRAEDLHFLLKPIINKD
SEQ ID NO:14 NAEDPRTELIGCGSVLFHLAANRLSLQLEEFAVCKR
SEQ ID NO:15 ALIGLLLCSVQSVTANDPVDALGACSGNLFGLLMTRL
SEQ ID NO:16 SKLFVLAFLCLALVVVVQSAPQYARGDVPT
SEQ ID NO:17 SMLVAFATLSVALVVVVAIPANFNYGGGGGYFINGTGQ
SEQ ID NO:18 IYEKLPAYLSEVSARVNVLQVSLQHDLPNLQ
SEQ ID NO:19 EMKLAKVALVTISLWFMAWTPYLVINFTGI
SEQ ID NO:20 LLPAKVIPDKTAAYVAYGGQETLVEHVEVLV
SEQ ID NO:21 FYTCFLGTSSLAGFKNAVDYDELLKAG
SEQ ID NO:22 VLEVLGFVEDNGELVFQELLGVLKMVDPDGD
SEQ ID NO:23 KLTPTVVVVLLCLTFVADALTIQELRAQIAQQRIQQRYGVTVATT
SEQ ID NO:24 SLSDYGLIELKEHCLECCQKDTEADSKLKVYPAAVLEV
SEQ ID NO:25 TYICFILHGVSEIIPQQQKKTMKFLLLVASVLCLVLI
SEQ ID NO:26 RYFVVIALICPLIIVETLAV
SEQ ID NO:27 LLLYLDAADLRRALHQYQLLAAQGDRHLPQQIVKFV
SEQ ID NO:28 VLLTPALQAYIMDEHNLNRSNIALGRIRPYPSAVKMP
SEQ ID NO:29 VLKGETHKALKLKDGGHYLVEFKSIYM
SEQ ID NO:30 VLHSMLVNASLAEMVKESYQTHGADGRMVVRMLKFVRLLP
SEQ ID NO:31 RVRALRALLETLLQHQGEQNNDVYLIRLAHET
SEQ ID NO:32 ELQQALSSLNAGSGSCAEVFNAYLPVHNKYIGVSRKI
SEQ ID NO:33 KFYRLISTLLVVVVIAPRHQCSPFFFQYNRPYL
SEQ ID NO:34 NYVPDVSALEQDIIEVDPETKEMLKHLDFNNIVVQL
SEQ ID NO:35 QYSMECLEAAEPKYLDGLKTLADETAQC
SEQ ID NO:36 EYAQVTKMLGNGRLEAMCFDGVKRLCHIRGKL
SEQ ID NO:37 KLFLTLLSTLSVAMVFALPAHHHSRG
SEQ ID NO:38 ELEEARLVAEELEERQQELDYLKRYLVGRLQAV
SEQ ID NO:39 SYFLTVCLLALVQSETVQD
SEQ ID NO:40 AMTNANLVGLTISLAYAIFFLLYTPPTGRSS
SEQ ID NO:41 SFAWLLYGIILRSNFLVVQNLMALALSAVQLSLFII
SEQ ID NO:42 AFPFISGFLSCFMWLKYGVLTEESTLILVNFIGSAL
SEQ ID NO:43 GLLCCCLAVLFFASPLTMLAHVIR
SEQ ID NO:44 LLLAMVLLPLLLLESVVPYAAAEKVW
(b) последовательностей, ограниченных следующими аминокислотными остатками белка слюны членистоногих или имеющих 7 аминокислот или более подпоследовательностей из этих последовательностей:
остатками 2-33 >gi|18389913|gb|AAL68793.1|AF457563_1 гипотетического белка 16 [Anopheles gambiae]
остатками 2-26 >gi|18389909|gb|AAL68791.1|AF457561_1 гипотетического белка 14 [Anopheles gambiae]
остатками 2-25 >gi|18389907|gb|AAL68790.1|AF457560_1 гипотетического белка 13 [Anopheles gambiae]
остатками 10-36 >gi|18389903|gb|AAL68788.1|AF457558_1 гипотетического белка 11 [Anopheles gambiae]
остатками 2-26 >gi|62546227|gb|AAX86005.1|hyp3.5-предшественника [Anopheles gambiae]
остатками 14-42 gi|18389899|gb|AAL68786.1|AF457556_1 7-подобного белка слюнных желез [Anopheles gambiae]
остатками 3-33 >gi|18389911|gb|AAL68792.1|AF457562_1 гипотетического белка 15 [Anopheles gambiae]
остатками 1-30 >gi|62546225|gb|AAX86004.1|hyp6.3- предшественника [Anopheles gambiae]
остатками 34-54 >gi|62546225|gb|AAX86004.1|hyp6.3- предшественника [Anopheles gambiae]
остатками 38-70 >gi|17026153|emb|CAD12038.1|Sec61-белка [Anopheles gambiae]
остатками 2-23 >gi|62546223|gb|AAX86003.1|hyp6.2- предшественника [Anopheles gambiae]
остатками 17-54 >gi|18389915|gb|AAL68794.1|AF457564_1 гипотетического белка 17 [Anopheles gambiae]
остатками 57-93 >gi|87080391|gb|ABD18596.1|дефенсина [Anopheles gambiae]
остатками 22-57 >gi|18389901|gb|AAL68787.1|AF457557_1 гипотетического белка 10 [Anopheles gambiae]
остатками 7-43 >gi|18389905|gb|AAL68789.1|AF457559_1 гипотетического белка 12 [Anopheles gambiae]
остатками 3-32 >gi|4127344|emb|CAA76832.1|cE5-белка [Anopheles gambiae]
остатками 3-40 >gi|4210617|emb|CAA10259.1|SG2-белка [Anopheles gambiae]
остатками 91-121 >gi|4127309|emb|CAA76820.1|гипотетического белка [Anopheles gambiae]
остатками 65-94 >gi|4375824|emb|CAA76825.1|опсина [Anopheles gambiae]
остатками 41-71 >gi|62546233|gb|AAX86008.1|неизвестного белка [Anopheles gambiae]
остатками 117-143 >gi|3378531|emb|CAA03872.1|D7r2-белка [Anopheles gambiae]
остатками 63-93 >gi|3378529|emb|CAA03871.1|D7r3-белка [Anopheles gambiae]
остатками 23-67 >gi|18389893|gb|AAL68783.1|AF457553_1 муциноподобного белка [Anopheles gambiae]
остатками 43-80 >gi|18389881|gb|AAL68777.1|AF457547_1 селенопротеина [Anopheles gambiae]
остатками 6-42 >gi|18389879|gb|AAL68776.1|AF457546_1 белка с М.м. 30 кДа [Anopheles gambiae]
остатками 4-23 >gi|18378603|gb|AAL68639.1|AF458073_1 D7-родственного белка 5 [Anopheles gambiae]
остатками 20-55 >gi|18389897|gb|AAL68785.1|AF457555_1 1-подобного белка 4 слюнных желез [Anopheles gambiae]
остатками 59-95 >gi|18389883|gb|AAL68778.1|AF457548_1 антигена - 5-родственного белка 1 [Anopheles gambiae]
остатками 158-184 >gi|83016748|dbj|BAE53441.1|DsRed [синтетической конструкции]
остатками 37-76 >gi|18389895|gb|AAL68784.1|AF457554_1 1-подобного белка 3 слюнных желез [Anopheles gambiae]
остатками 191-222 >gi|18389895|gb|AAL68784.1|AF457554_1 1-подобного белка 3 слюнных желез [Anopheles gambiae]
остатками 113-149 >gi|18389891|gb|AAL68782.1|AF457552_1 длинной формы D7-белка [Anopheles gambiae]
остатками 1-37 >emb|CAC35527.1|gSG9-белка [Anopheles gambiae]
остатками 81-120 >sp|Q9U9L1|RS17_ANOGA белка S17 40S-субъединицы рибосомы
остатками 111-142 >emb|CAC35523.1|gSG7 белка [Anopheles gambiae]
остатками 32-67 >gb|AAD47075.1|AF164151_1 фактора 4С (1А) инициации трансляции [Anopheles gambiae]
остатками 1-29 >emb|CAC35519.1|gSG2-подобного белка [Anopheles gambiae]
остатками 106-142 >emb|CAC35451.1|гипотетического белка [Anopheles gambiae]
остатками 6-28 >emb|CAC35524.1|D7r4-белка [Anopheles gambiae]
остатками 70-104 >ref|XP_001230998.1|ENSANGP00000014906 [Anopheles gambiae штамм PEST]
остатками 174-213 >ref|XP_316361.2|ENSANGP00000012984 [Anopheles gambiae штамм PEST]
остатками 41-80 >ref|XP_314140.3|ENSANGP00000015780 [Anopheles gambiae штамм PEST]
остатками 126-153 >ref|XP_314140.3|ENSANGP00000015780 [Anopheles gambiae штамм PEST]
остатками 5-34 >emb|CAC35522.1|gSG6-белка [Anopheles gambiae]
(c) и из последовательностей полипептидов, которые гомологичны на 85% или более одной или нескольким последовательностям (а) или (b) и содержатся в одной или нескольких следующих базах данных: GeneBank, Банке данных по структуре белка (PDB), SwissProt, Информационном белковом ресурсе (PIR), Фонде по исследованию белков (PRF) или трансляциях кодирующих последовательностей (CDS) из этих баз данных.
CDS является сокращением для «кодирующей последовательности», т.е. области нуклеотидов, которая соответствует последовательности аминокислот в предсказанном белке. CDS включает инициирующий кодон и стоп-кодон, следовательно, кодирующие последовательности начинаются с «ATG» и заканчиваются стоп-кодоном. Неэкспрессируемые последовательности, включающие 5'-UTR, 3'-UTR, интроны или основания, не экспрессируемые вследствие сдвига рамки считывания, не включены в CDS. Обратите внимание, что CDS не соответствует фактически существующей последовательности мРНК. В результате, трансляцией CDS является белок, который мог бы быть получен, если бы были транслированы все кодоны между инициирующим кодоном и стоп-кодоном.
PDB означает Банк данных по структуре белка. Эта база данных (http://www.rcsb.org/pdb/home/home.do) поддерживается Коллаборацией по изучению структурной биоинформатики (RCSB), не извлекающий прибыль консорциум, специализирующийся на улучшении понимания функционирования биологических систем через изучение трехмерной структуры биологических макромолекул.
Информационный белковый ресурс (PIR) (http://pir.georgetown.edu/) является интегральным общим биоинформационным ресурсом, созданным в 1984 Национальным фондом биомедицинских исследований (NBRF) в качестве ресурса, помогающего исследователям идентифицировать и интерпретировать информацию о последовательности белка (Wu C.H., Yeh L.S., Huang G., Arminski L., Castro-Alvear J., Chen Y., Hu Z., Kourtesis P., Ledley R.S., Suzek B.E., Garrett L., Vinayaka C.R., Zhang J., Backer W.C. (2003) “The Protein Information Resource”, Nucleic Acids Res. 31(1): 345-7).
PRF является оперативной базой данных, поддерживаемой Фондом по исследованию белков (PRF) (http://www.prf.or.jp/en/index.shtml). База данных содержит информацию, относящуюся к аминокислотам, пептидам и белкам, собранную из научных журналов, данные по последовательностям пептидов и белков, данные по синтетическим соединениям и молекулярным аспектам белков.
GenBank является базой данных по последовательностям генов NIH (http://www.ncbi.nlm.nih.gov/), снабженной комментариями коллекцией всех общедоступных последовательностей ДНК. Новая версия создается каждые два месяца. GenBank является частью Международной коллаборации по созданию базы данных, касающихся нуклеотидных последовательностей, которая состоит из Банка данных по ДНК Японии (DDBJ), Европейской лаборатории молекулярной биологии (EMBL) и GenBank при Национальном центре биотехнологической информации.
Swissprot (также называемая UniProtKB/Swiss-Prot) является курируемой базой данных по последовательностям белков (http://expasy.org/sprot), поддерживаемой Институтом биоинформатики Швейцарии (SIB). База данных стремится предоставить на высоком уровне комментарии (такие, как описание функции белка, его доменная структура, посттрансляционные модификации, варианты и т.п.), обеспечить дублирование на минимальном уровне и интеграцию с другими базами данных на высоком уровне.
Эти базы данных обновляются еженедельно или ежемесячно, и указанные выше последовательности распространяются на последовательности в базах данных в момент подачи этой заявки. При отыскании в базах данных последовательностей, имеющих требуемую степень гомологии, можно использовать любой способ, в зависимости от критериев соответствия. Однако предпочтительно может быть использована программа BLASTP [BLAST и являющиеся ее производными программы (например, BLASTP) являются бесплатным программным обеспечением].
В другом варианте осуществления вместо упоминаемой выше в части (с) гомологии на 85% (или дополнительно к ней) также включены последовательности полипептидов в составе указанных выше баз данных, которые имеют по крайней 85% аминокислот, являющихся общими (на основании как идентичности аминокислот, так и положения в последовательности) с аминокислотами части последовательности в (а) или (b), длина которой составляет 8 аминокислот или более и предпочтительно от 8 аминокислот вплоть до одной трети длины последовательности в (а) или (b). Другими словами, для последовательности в (а) или (b), длина которой составляет 30 аминокислот, также включена последовательность базы данных, если она разделяет 85% или более своих аминокислот с любой частью последовательности в (а) или (b), имеющей длину 8 аминокислот или больше, предпочтительно 8-10 аминокислот. Аналогично, если длина последовательности в (а) или (b) составляет 60 аминокислот, также включена последовательность базы данных, если она разделяет 85% или более своих аминокислот с любой частью последовательности в (а) или (b), имеющей длину 8 аминокислот или больше, предпочтительно 8-20 аминокислот. Соответствие аминокислот необязательно является последовательным. Например, в случае последовательности длиной 20 аминокислот в (а) или (b), если соответствующая последовательность базы данных разделяет 17 или более аминокислот в соответствующих положениях, ее включают, даже если не все эти положения являются последовательными.
Как правило, полипептиды в композиции не являются полноразмерными (или целыми) белками слюны членистоногих. Под полноразмерными (или целыми) подразумевается, что полипептиды действительно содержат все аминокислотные остатки, присутствующие в любом из встречающихся в природе белков слюны членистоногих.
Таким образом, полипептидом является полипептид, который может включать любую из указанных выше последовательностей целиком (или может включать части любой из указанных выше последовательностей длиной по меньшей мере 7 или более остатков). Полипептид должен быть также иммуногенным у позвоночного. Обычно эта иммуногенность такова, что полипептиды вызывают у позвоночного продукцию клеток иммунной системы, способных к распознанию по меньшей мере одного эпитопа в белковой фракции слюны членистоногих. Следовательно, если полипептид индуцирует Т-клеточный или В-клеточный ответ, он является иммуногенным у позвоночного. В альтернативном случае полипептид может быть эпитопом Т-лимфоцита-хелпера (Th) или может быть эпитопом В-лимфоцита.
Один способ определения того, обладает ли полипептид иммуногенностью, представлен ниже в эксперименте 2. Однако настоящее изобретение не ограничивается такими способами, и квалифицированный специалист может выбрать любой известный способ определения иммуногенности, по желанию.
Особенно предпочтительно, когда полипептиды полипептидной композиции независимо выбирают из SEQ ID NO:1-6, 20, 28, 30-32 и 35 или имеющих 7 аминокислот или более подпоследовательностей из этих последовательностей или последовательностей полипептидов, которые гомологичны на 85% или более одной из этих последовательностей и содержатся в одной или нескольких следующих базах данных: GeneBank, Банке данных по структуре белка (PDB), SwissProt, Информационном белковом ресурсе (PIR), Фонде по исследованию белков (PRF) или трансляциях кодирующих последовательностей (CDS) из этих баз данных.
Обычно, но не исключительно, полипептидная композиция настоящего изобретения включает 2 или более полипептидов, предпочтительно от 2 до 10 полипептидов или более предпочтительно 2-6 полипептидов. Однако композиция может включать один полипептид и дополнительные не являющиеся полипептидами компоненты, если желательно.
Как правило, в полипептидной композиции в соответствии с настоящим изобретением белковая фракция слюны членистоногих имеет массу, составляющую 40 кДа или меньше, 30 кДа или меньше или более предпочтительно 20 кДа или меньше. Фракция может также иметь массу, составляющую 20-40 кДа, 20-30 кДа или 10-20 кДа.
В другом варианте осуществления настоящего изобретения полипептидная композиция настоящего изобретения включает SEQ ID NO:131 или включает одну или несколько подпоследовательностей SEQ ID NO:131, имеющих 7 аминокислот или более, или включает последовательности полипептидов, которые гомологичны на 85% или более одной из этих последовательностей и содержатся в одной или нескольких следующих базах данных: GeneBank, Банке данных по структуре белка (PDB), SwissProt, Информационном белковом ресурсе (PIR), Фонде по исследованию белков (PRF) или трансляциях кодирующих последовательностей (CDS) из этих баз данных.
SEQ ID NO:131
FLKGSFPRFQMCVMLIGFFSSAKCLFYSVGKLVKVLLVMAVCCLLLCTAPTGADPLMKFAFAFVLIALFAVFAVSQALPQPEQAAAGRVMCLLRLMSTLLVVLSIVGKLYSGYRLLVLLVMTVCCLLLFIAPTGADPLPGQTQRTLALIGLLLCSVQSVTANDPVDALGACSGNLFGLLMTRLSKLFVLAFLCLALVVVVQSAPQYARGDVPTLLPAKVIPDKTAAYVAYGGQETLVEHVEVLVRYFVVIALICPLIIVETLAVVLLTPALQAYIMDEHNLNRSNIALGRIRPYPSAVKMPVLHSMLVNASLAEMVKESYQTHGADGRMVVRMLKFVRLLPRVRALRALLETLLQHQGEQNNDVYLIRLAHETELQQALSSLNAGSGSCAEVFNAYLPVHNKYIGVSRKIQYSMECLEAAEPKYLDGLKTLADETAQCSFAWLLYGIILRSNFLVVQNLMALALSAVQLSLFIIAFPFISGFLSCFMWLKYGVLTEESTLILVNFIGSAL
В другом варианте осуществления настоящего изобретения полипептидная композиция настоящего изобретения включает одну или несколько последовательностей, выбираемых из SEQ ID NO:1-4, 6, 9, 10, 13, 14, 17-19, 21-25, 27, 29, 33, 34, 36-40, 43 и 44, или включает одну или несколько имеющих 7 аминокислот или более аминокислот подпоследовательностей этих последовательностей или включает последовательности полипептидов, которые гомологичны на 85% или более одной из этих последовательностей и содержатся в одной или нескольких следующих базах данных: GeneBank, Банке данных по структуре белка (PDB), SwissProt, Информационном белковом ресурсе (PIR), Фонде по исследованию белков (PRF) или трансляциях кодирующих последовательностей (CDS) из этих баз данных.
В дальнейшем варианте осуществления полипептидная композиция настоящего изобретения включает SEQ ID NO:132 или включает одну или несколько подпоследовательностей SEQ ID NO:132, имеющих 7 аминокислот или более, или включает последовательности полипептидов, которые гомологичны на 85% или более одной из этих последовательностей и содержатся в одной или нескольких следующих базах данных: GeneBank, Банке данных по структуре белка (PDB), SwissProt, Информационном белковом ресурсе (PIR), Фонде по исследованию белков (PRF) или трансляциях кодирующих последовательностей (CDS) из этих баз данных.
SEQ ID NO:132
HLTLFTVAVLLLAAAALLLLLPPAYSTTLTPPPLSYCHLFLTHTLARALSFSRSDCLKNVFFALLLVVLVCCLVSVQGNEIKLLVLLICLFFYHTHCTTAYLWLAMGVNDYQALLGLCCPWIDLAAADLPMRRHAKADGASAITKIVLELTPEQAAAVTLFIFLVCCQIPLFGIMSSDSADPFYWIRVILAMYCVIKGKTGGYCNSEGLCTCRAEDLHFLLKPIINKDNAEDPRTELIGCGSVLFHLAANRLSLQLEEFAVCKRSMLVAFATLSVALVVVVAIPANFNYGGGGGYFINGTGQIYEKLPAYLSEVSARVNVLQVSLQHDLPNLQEMKLAKVALVTISLWFMAWTPYLVINFTGIFYTCFLGTSSLAGFKNAVDYDELLKAGVLEVLGFVEDNGELVFQELLGVLKMVDPDGDKLTPTVVVVLLCLTFVADALTIQELRAQIAQQRIQQRYGVTVATTSLSDYGLIELKEHCLECCQKDTEADSKLKVYPAAVLEVTYICFILHGVSEIIPQQQKKTMKFLLLVASVLCLVLILLLYLDAADLRRALHQYQLLAAQGDRHLPQQIVKFVVLKGETHKALKLKDGGHYLVEFKSIYMKFYRLISTLLVVVVIAPRHQCSPFFFQYNRPYLNYVPDVSALEQDIIEVDPETKEMLKHLDFNNIVVQLEYAQVTKMLGNGRLEAMCFDGVKRLCHIRGKLKLFLTLLSTLSVAMVFALPAHHHSRGELEEARLVAEELEERQQELDYLKRYLVGRLQAVSYFLTVCLLALVQSETVQDAMTNANLVGLTISLAYAIFFLLYTPPTGRSSGLLCCCLAVLFFASPLTMLAHVIRLLLAMVLLPLLLLESVVPYAAAEKVW
Во все еще дальнейшем варианте осуществления полипептидная композиция настоящего изобретения включает SEQ ID NO:133 или включает одну или несколько подпоследовательностей SEQ ID NO:133, имеющих 7 аминокислот или более, или включает последовательности полипептидов, которые гомологичны на 85% или более одной из этих последовательностей и содержатся в одной или нескольких следующих базах данных: GeneBank, Банке данных по структуре белка (PDB), SwissProt, Информационном белковом ресурсе (PIR), Фонде по исследованию белков (PRF) или трансляциях кодирующих последовательностей (CDS) из этих баз данных.
SEQ ID NO:133
HLTLFTVAVLLLAAAALLLLLPPAYSTTLTPPPLSYCHLFLTHTLARALSFSRSDCLKNVFFALLLVVLVCCLVSVQGNEIKLLVLLICLFFYHTHCTTAYLWLAMGVFLKGSFPRFQMCVMLIGFFSSAKCLNDYQALLGLCCPWIDLAAADLPMRRHAKA
Во все еще дальнейшем варианте осуществления полипептидная композиция настоящего изобретения включает SEQ ID NO:134 или включает одну или несколько подпоследовательностей SEQ ID NO:134, имеющих 7 аминокислот или более, или включает последовательности полипептидов, которые гомологичны на 85% или более одной из этих последовательностей и содержатся в одной или нескольких следующих базах данных: GeneBank, Банке данных по структуре белка (PDB), SwissProt, Информационном белковом ресурсе (PIR), Фонде по исследованию белков (PRF) или трансляциях кодирующих последовательностей (CDS) из этих баз данных.
SEQ ID NO:134
LLPAKVIPDKTAAYVAYGGQETLVEHVEVLVVLLTPALQAYIMDEHNLNRSNIALGRIRPYPSAVKMPVLHSMLVNASLAEMVKESYQTHGADGRMVVRMLKFVRLLPRVRALRALLETLLQHQGEQNNDVYLIRLAHETELQQALSSLNAGSGSCAEVFNAYLPVHNKYIGVSRKIQYSMECLEAAEPKYLDGLKTLADETAQC
Важно, что во всех вариантах осуществления настоящего изобретения может использоваться, или отдельно, или в комбинации, любая комбинация перечисленных последовательностей. Особенно предпочтительными полипептидами являются полипептиды, имеющие последовательности SEQ ID NO:1-6, и/или последовательности, имеющие последовательности SEQ ID NO:20, 28, 30-32 и 35. Особенно предпочтительно, когда присутствует любая одна или несколько этих последовательностей, и особенно предпочтительно, когда присутствуют все из SEQ ID NO:1-6 и/или все из SEQ ID NO:20, 28, 30-32 и 35.
Авторы настоящего изобретения установили, что указанные выше последовательности включают эпитоп или множество эпитопов, которые могут предоставить защиту от распространяемых членистоногими болезней для широкого ряда позвоночных в популяции. Укусы членистоногих вызывают у хозяина иммунный ответ на компоненты слюны, который характеризуется фенотипом Th2 (т.е. ингибированием продукции IFN-γ и активацией продукции IL-4) (Mbow et al., 1998). Установлено, что этот иммунный ответ, вместе с антигемостатическим эффектом многих из этих молекул слюны, способствует передаче паразитов и усиливает ее в общем (Dhar and Kumar, 2003) и, в частности, содействует инфицированию Leishmania (Kamhawi et al., 2000). Установлено, что, напротив, усиление клеточного иммунного ответа, характеризующегося увеличенной продукцией IFN-γ и IL-12, оба из которых являются цитокинами типа Th1, в месте инфицирования (т.е. в месте укуса) вызывает защиту от инфицирования Leishmania major при укусе инфицированными песчаными москитами (Kamhawi et al., 2000).
Без ограничения какой-либо теорией полагают, что иммунизация белками слюны, приводящая к активации ответа типа Th1, будет приводить к быстрому распознаванию антигенов слюны в месте укуса клетками иммунной системы (такими, как активированные цитотоксические Т-клетки (CTL) и Т-клетки-хелперы типа 1) и продукции IFN-γ. Этот цитокин (1) стимулирует большую продукцию IFN-γ как Т-, так и NK-клетками, (2) усиливает бактерицидную активность макрофагов, (3) индуцирует переключение изотипа на IgG2a и увеличенную продукцию IgG2a В-клетками и (4) продукцию множества цитокинов (например, TNF-α, интерлейкина (IL)-12 и IL-18), которые совместно запускают каскад иммунных реакций, которые приводят к гибели внутриклеточных паразитов. Ниже представлены ссылки, в которых это детализируется.
Mbow M.L., Bleyenberg J.A., Hall L.R. & Titus R.G. 1998. Phlebotomus papatasi sandfly salivary gland lysate down-regulates a Th1, but up-regulates a Th2, response in mice infected with Leishmania major, J. Immunol., 161; 5571-5577.
Dhar R., Kumar N. 2003. Role of mosquito salivary glands. Cur. Sci., 85, 1308-1313.
Kamhawi S., Belkaid Y., Modi G., Rowton E., Sacks D., 2000. Protection against cutaneous leishmaniasis resulting from bites of uninfected sand flies. Science 290, 1351-1354.
Malaguarnera L., Musumeci S. 2002. The immune response to Plasmodium falciparum malaria, Lancet Infect. Dis. Aug; 2(8): 472-8.
Как обсуждалось выше, указанные выше последовательности были идентифицированы после анализа последовательностей слюны Anopheles gambiae. Для квалифицированного специалиста будет очевидно, что настоящее изобретение распространяется не только на эти последовательности и их эпитопы, но также на большие последовательности в белках слюны членистоногих, содержащих эти последовательности, и на последовательности, которые гомологичны этим последовательностям, а значит, обладают иммуногенной активностью. Таким образом, в объеме настоящего изобретения также находятся последовательности, гомологичные в некоторой степени консенсусным последовательностям. Такая гомология допускает замену, например, вплоть до 3 аминокислот в 8-мерном эпитопе (гомология на 62,5%) или в 9-мерном, 10-мерном или 11-мерном эпитопе. Предпочтительно, когда не более 10 таких замен идентифицируются в последовательности настоящего изобретения, соответствующей полноразмерным последовательностям SEQ ID NO:1-44 (гомология на 66,6% для 30-мера). Предпочтительно такие замены являются консервативными заменами в соответствии с известными схемами замен.
Настоящим изобретением также обеспечивается полипептид, содержащий одну или более последовательностей, определяемых следующими последовательностями SEQ ID NO:1-44 или ограниченных следующими аминокислотными остатками белка слюны членистоногих, или содержащих одну или более имеющих 7 аминокислот или более подпоследовательностей из этих последовательностей, или содержащий последовательности полипептидов, которые гомологичны на 85% или более одной из этих последовательностей и содержатся в одной или нескольких следующих базах данных: GeneBank, Банке данных по структуре белка (PDB), SwissProt, Информационном белковом ресурсе (PIR), Фонде по исследованию белков (PRF) или трансляциях кодирующих последовательностей (CDS) из этих баз данных.
SEQ ID NO:1 HLTLFTVAVLLLAAAALLLLLPPAYSTTLTPP
SEQ ID NO:2 PLSYCHLFLTHTLARALSFSRSDCL
SEQ ID NO:3 KNVFFALLLVVLVCCLVSVQGNEI
SEQ ID NO:4 KLLVLLICLFFYHTHCTTAYLWLAMGV
SEQ ID NO:5 FLKGSFPRFQMCVMLIGFFSSAKCL
SEQ ID NO:6 NDYQALLGLCCPWIDLAAADLPMRRHAKA
SEQ ID NO:7 FYSVGKLVKVLLVMAVCCLLLCTAPTGADPL
SEQ ID NO:8 MKFAFAFVLIALFAVFAVSQALPQPEQAAA
SEQ ID NO:9 DGASAITKIVLELTPEQAAAV
SEQ ID NO:10 TLFIFLVCCQIPLFGIMSSDSADPFYWIRVILA
SEQ ID NO:11 GRVMCLLRLMSTLLVVLSIVGK
SEQ ID NO:12 LYSGYRLLVLLVMTVCCLLLFIAPTGADPLPGQTQRTL
SEQ ID NO:13 MYCVIKGKTGGYCNSEGLCTCRAEDLHFLLKPIINKD
SEQ ID NO:14 NAEDPRTELIGCGSVLFHLAANRLSLQLEEFAVCKR
SEQ ID NO:15 ALIGLLLCSVQSVTANDPVDALGACSGNLFGLLMTRL
SEQ ID NO:16 SKLFVLAFLCLALVVVVQSAPQYARGDVPT
SEQ ID NO:17 SMLVAFATLSVALVVVVAIPANFNYGGGGGYFINGTGQ
SEQ ID NO:18 IYEKLPAYLSEVSARVNVLQVSLQHDLPNLQ
SEQ ID NO:19 EMKLAKVALVTISLWFMAWTPYLVINFTGI
SEQ ID NO:20 LLPAKVIPDKTAAYVAYGGQETLVEHVEVLV
SEQ ID NO:21 FYTCFLGTSSLAGFKNAVDYDELLKAG
SEQ ID NO:22 VLEVLGFVEDNGELVFQELLGVLKMVDPDGD
SEQ ID NO:23 KLTPTVVVVLLCLTFVADALTIQELRAQIAQQRIQQRYGVTVATT
SEQ ID NO:24 SLSDYGLIELKEHCLECCQKDTEADSKLKVYPAAVLEV
SEQ ID NO:25 TYICFILHGVSEIIPQQQKKTMKFLLLVASVLCLVLI
SEQ ID NO:26 RYFVVIALICPLIIVETLAV
SEQ ID NO:27 LLLYLDAADLRRALHQYQLLAAQGDRHLPQQIVKFV
SEQ ID NO:28 VLLTPALQAYIMDEHNLNRSNIALGRIRPYPSAVKMP
SEQ ID NO:29 VLKGETHKALKLKDGGHYLVEFKSIYM
SEQ ID NO:30 VLHSMLVNASLAEMVKESYQTHGADGRMVVRMLKFVRLLP
SEQ ID NO:31 RVRALRALLETLLQHQGEQNNDVYLIRLAHET
SEQ ID NO:32 ELQQALSSLNAGSGSCAEVFNAYLPVHNKYIGVSRKI
SEQ ID NO:33 KFYRLISTLLVVVVIAPRHQCSPFFFQYNRPYL
SEQ ID NO:34 NYVPDVSALEQDIIEVDPETKEMLKHLDFNNIVVQL
SEQ ID NO:35 QYSMECLEAAEPKYLDGLKTLADETAQC
SEQ ID NO:36 EYAQVTKMLGNGRLEAMCFDGVKRLCHIRGKL
SEQ ID NO:37 KLFLTLLSTLSVAMVFALPAHHHSRG
SEQ ID NO:38 ELEEARLVAEELEERQQELDYLKRYLVGRLQAV
SEQ ID NO:39 SYFLTVCLLALVQSETVQD
SEQ ID NO:40 AMTNANLVGLTISLAYAIFFLLYTPPTGRSS
SEQ ID NO:41 SFAWLLYGIILRSNFLVVQNLMALALSAVQLSLFII
SEQ ID NO:42 AFPFISGFLSCFMWLKYGVLTEESTLILVNFIGSAL
SEQ ID NO:43 GLLCCCLAVLFFASPLTMLAHVIR
SEQ ID NO:44 LLLAMVLLPLLLLESVVPYAAAEKVW
остатками 2-33 >gi|18389913|gb|AAL68793.1|AF457563_1 гипотетического белка 16 [Anopheles gambiae]
остатками 2-26 >gi|18389909|gb|AAL68791.1|AF457561_1 гипотетического белка 14 [Anopheles gambiae]
остатками 2-25 >gi|18389907|gb|AAL68790.1|AF457560_1 гипотетического белка 13 [Anopheles gambiae]
остатками 10-36 >gi|18389903|gb|AAL68788.1|AF457558_1 гипотетического белка 11 [Anopheles gambiae]
остатками 2-26 >gi|62546227|gb|AAX86005.1|hyp3.5- предшественника [Anopheles gambiae]
остатками 14-42 gi|18389899|gb|AAL68786.1|AF457556_1 7-подобного белка слюнных желез [Anopheles gambiae]
остатками 3-33 >gi|18389911|gb|AAL68792.1|AF457562_1 гипотетического белка 15 [Anopheles gambiae]
остатками 1-30 >gi|62546225|gb|AAX86004.1|hyp6.3- предшественника [Anopheles gambiae]
остатками 34-54 >gi|62546225|gb|AAX86004.1|hyp6.3- предшественника [Anopheles gambiae]
остатками 38-70 >gi|17026153|emb|CAD12038.1|Sec61-белка [Anopheles gambiae]
остатками 2-23 >gi|62546223|gb|AAX86003.1|hyp6.2- предшественника [Anopheles gambiae]
остатками 17-54 >gi|18389915|gb|AAL68794.1|AF457564_1 гипотетического белка 17 [Anopheles gambiae]
остатками 57-93 >gi|87080391|gb|ABD18596.1|дефенсина [Anopheles gambiae]
остатками 22-57 >gi|18389901|gb|AAL68787.1|AF457557_1 гипотетического белка 10 [Anopheles gambiae]
остатками 7-43 >gi|18389905|gb|AAL68789.1|AF457559_1 гипотетического белка 12 [Anopheles gambiae]
остатками 3-32 >gi|4127344|emb|CAA76832.1|cE5-белка [Anopheles gambiae]
остатками 3-40 >gi|4210617|emb|CAA10259.1|SG2-белка [Anopheles gambiae]
остатками 91-121 >gi|4127309|emb|CAA76820.1|гипотетического белка [Anopheles gambiae]
остатками 65-94 >gi|4375824|emb|CAA76825.1|опсина [Anopheles gambiae]
остатками 41-71 >gi|62546233|gb|AAX86008.1|неизвестного белка [Anopheles gambiae]
остатками 117-143 >gi|3378531|emb|CAA03872.1|D7r2-белка [Anopheles gambiae]
остатками 63-93 >gi|3378529|emb|CAA03871.1|D7r3-белка [Anopheles gambiae]
остатками 23-67 >gi|18389893|gb|AAL68783.1|AF457553_1 муциноподобного белка [Anopheles gambiae]
остатками 43-80 >gi|18389881|gb|AAL68777.1|AF457547_1 селенопротеина [Anopheles gambiae]
остатками 6-42 >gi|18389879|gb|AAL68776.1|AF457546_1 белка с М.м. 30 кДа [Anopheles gambiae]
остатками 4-23 >gi|18378603|gb|AAL68639.1|AF458073_1 D7-родственного белка 5 [Anopheles gambiae]
остатками 20-55 >gi|18389897|gb|AAL68785.1|AF457555_1 1-подобного белка 4 слюнных желез [Anopheles gambiae]
остатками 59-95 >gi|18389883|gb|AAL68778.1|AF457548_1 антигена - 5-родственного белка 1 [Anopheles gambiae]
остатками 158-184 >gi|83016748|dbj|BAE53441.1|DsRed [синтетической конструкции]
остатками 37-76 >gi|18389895|gb|AAL68784.1|AF457554_1 1-подобного белка 3 слюнных желез [Anopheles gambiae]
остатками 191-222 >gi|18389895|gb|AAL68784.1|AF457554_1 1-подобного белка 3 слюнных желез [Anopheles gambiae]
остатками 113-149 >gi|18389891|gb|AAL68782.1|AF457552_1 длинной формы D7-белка [Anopheles gambiae]
остатками 3-35 >gi|13537676|emb|CAC35527.1|gSG9-белка [Anopheles gambiae]
остатками 83-118 >sp|Q9U9L1|RS17_ANOGA белка S17 40S-субъединицы рибосомы и gb|AAD47077.1|AF164153_1 рибосомного белка S17 [Anopheles gambiae]
остатками 113-140 >emb|CAC35523.1|gSG7-белка [Anopheles gambiae]
остатками 34-65 >gb|AAD47075.1|AF164151_1 фактора 4С (1А) инициации трансляции [Anopheles gambiae]
остатками 2-27 >emb|CAC35519.1|gSG2-подобного белка [Anopheles gambiae]
остатками 108-140 >emb|CAC35451.1|гипотетического белка [Anopheles gambiae] и >gb|EAU75730.1|ENSANGP00000031975 [Anopheles gambiae штамм PEST]
остатками 8-26 >emb|CAC35524.1|D7r4-белка [Anopheles gambiae] и >gb|AAK84945.1|D7-родственного белка 4 [Anopheles gambiae]
остатками 72-102 >ref|XP_001230998.1|ENSANGP00000014906 [Anopheles gambiae штамм PEST] и gb|EAU76798.1|ENSANGP00000014906 [Anopheles gambiae штамм PEST]
остатками 176-211 >ref|XP_316361.2|ENSANGP00000012984 [Anopheles gambiae штамм PEST] и >gb|EAA10852.2|ENSANGP00000012984 [Anopheles gambiae штамм PEST]
остатками 43-78 >ref|XP_314140.3|ENSANGP00000015780 [Anopheles gambiae штамм PEST] и gb|EAA09398.3|ENSANGP00000015780 [Anopheles gambiae штамм PEST]
остатками 128-151 >ref|XP_314140.3|ENSANGP00000015780 [Anopheles gambiae штамм PEST] и gb|EAA09398.3|ENSANGP00000015780 [Anopheles gambiae штамм PEST]
остатками 7-32 >emb|CAC35522.1|gSG6-белка [Anopheles gambiae]
Предпочтительно, полипептид не является полноразмерным белком слюны членистоногих.
Упоминаемая в настоящем изобретении нумерация последовательности определяется в соответствии с общепризнанными принципами. Следовательно, нумерация начинается с 1 от установленного кодона инициации трансляции (ATG). Он соответствует метионину (М), для сегмента генома, кодирующего представляющий интерес белок. Другими словами, она начинается с 1 в соответствии с метионином, обнаруженным в качестве первой аминокислоты в представляющей интерес последовательности белка, используемой и определяемой базами данных, в которых отражены последовательности (т.е. GenBank, SwissProt и т.п.).
Подробнее настоящее изобретение будет описано в качестве примера только со ссылкой на следующие фигуры, на которых:
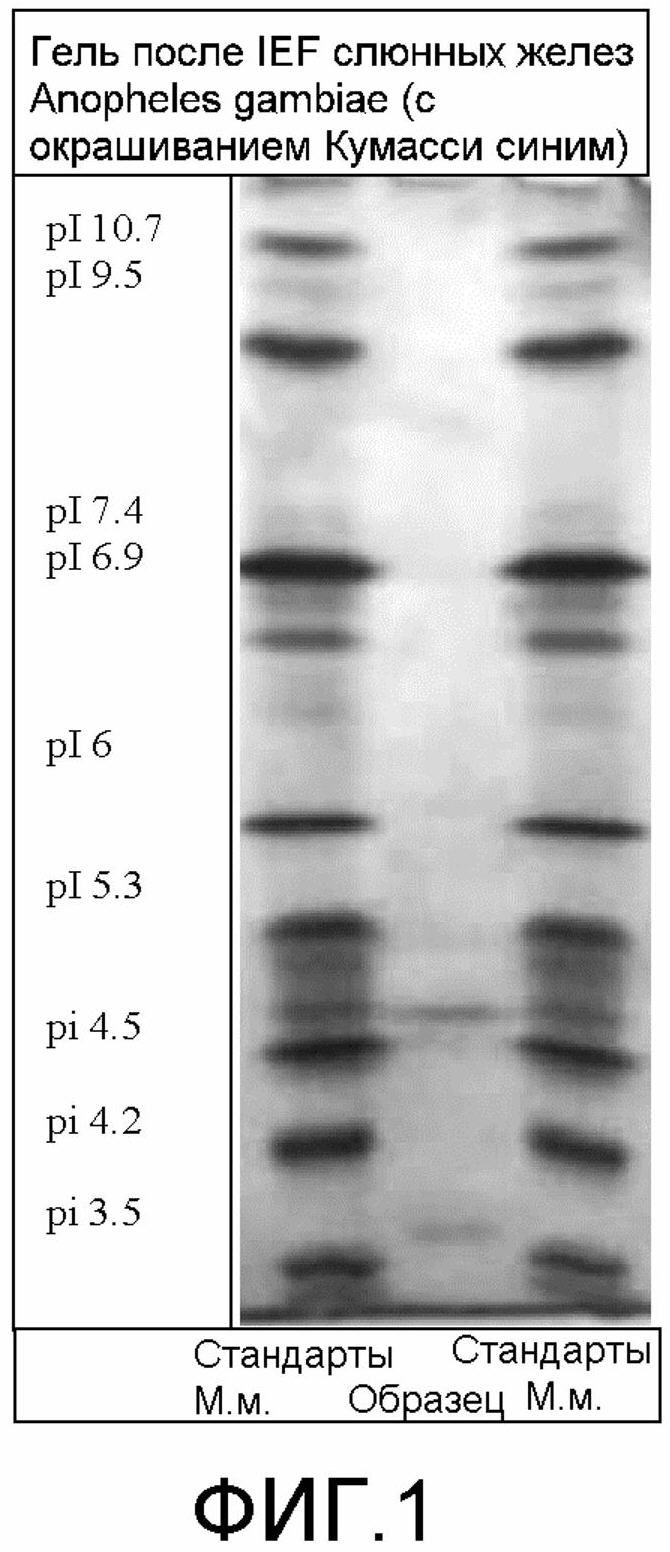
на фиг.1 и 9 демонстрируются гели после изоэлектрического фокусирования (IEF) слюнных желез Anopheles gambiae (с окрашиванием Кумасси синим), полученные в соответствии с протоколами, представленными в примерах;
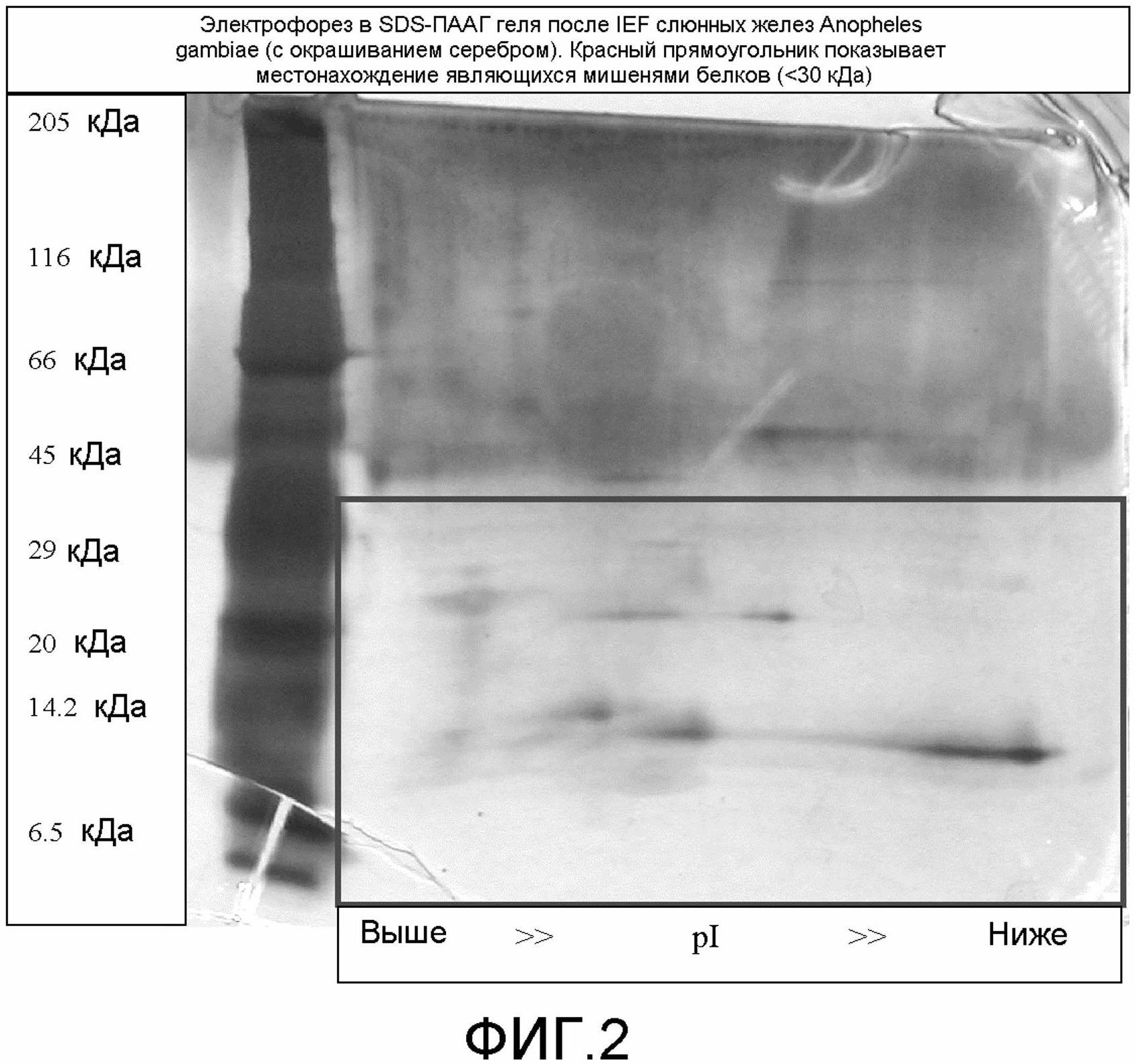
на фиг.2 демонстрируется электрофорез в SDS-ПААГ IEF-геля фиг.1 (с окрашиванием серебром) - красный прямоугольник показывает местонахождение одного из являющихся мишенями белков (<30 кДа);
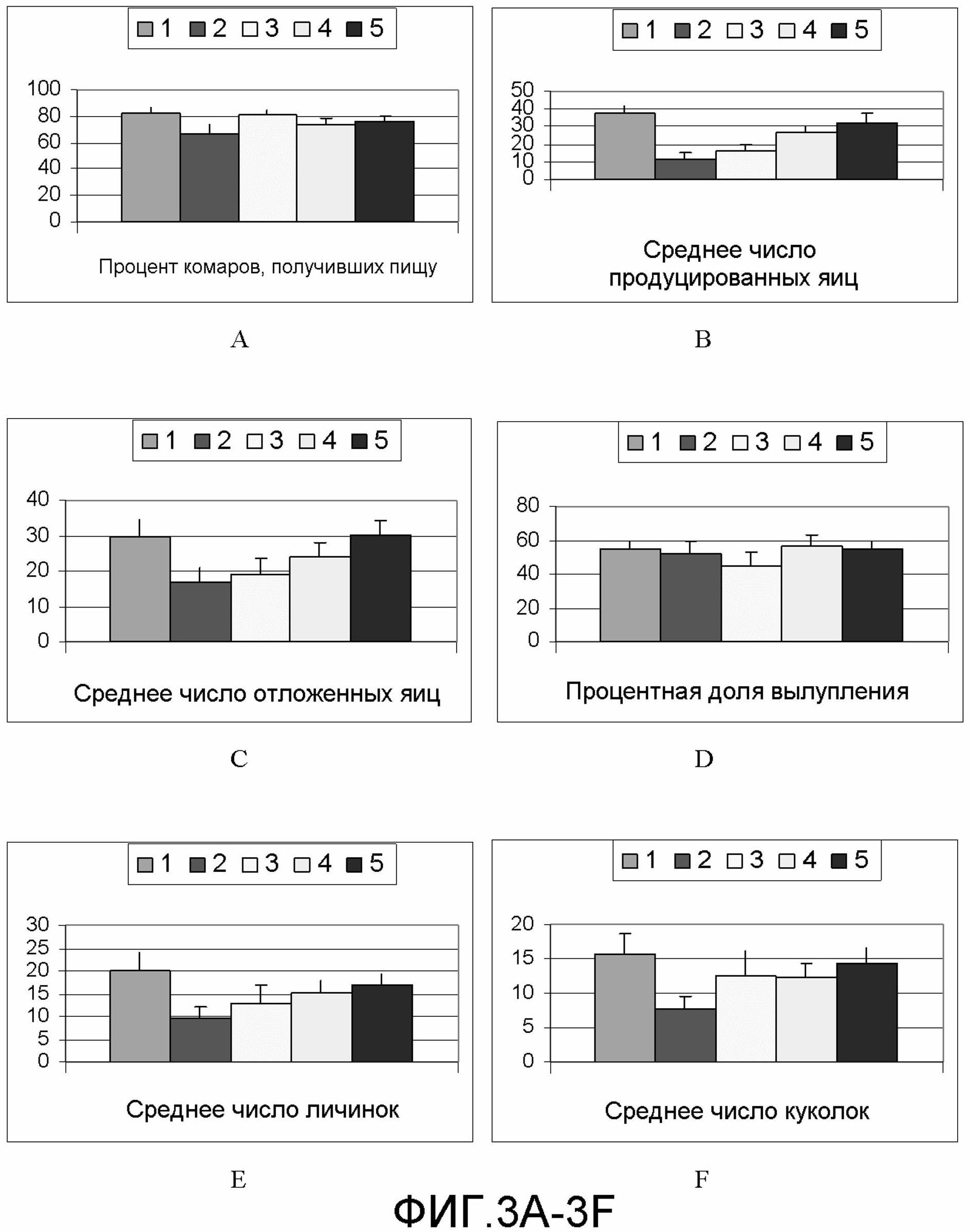
на фиг.3А-3I демонстрируются следующие данные по эффекту вакцины на фертильность комаров:
3A: Процент комаров, получивших пищу
3B: Среднее число продуцированных яиц
3C: Среднее число отложенных яиц
3D: Процентная доля вылупления
3E: Среднее число личинок
3F: Среднее число куколок
3G: Процент окукливания
3H: Процент вылета
3I: Среднее число взрослых комаров
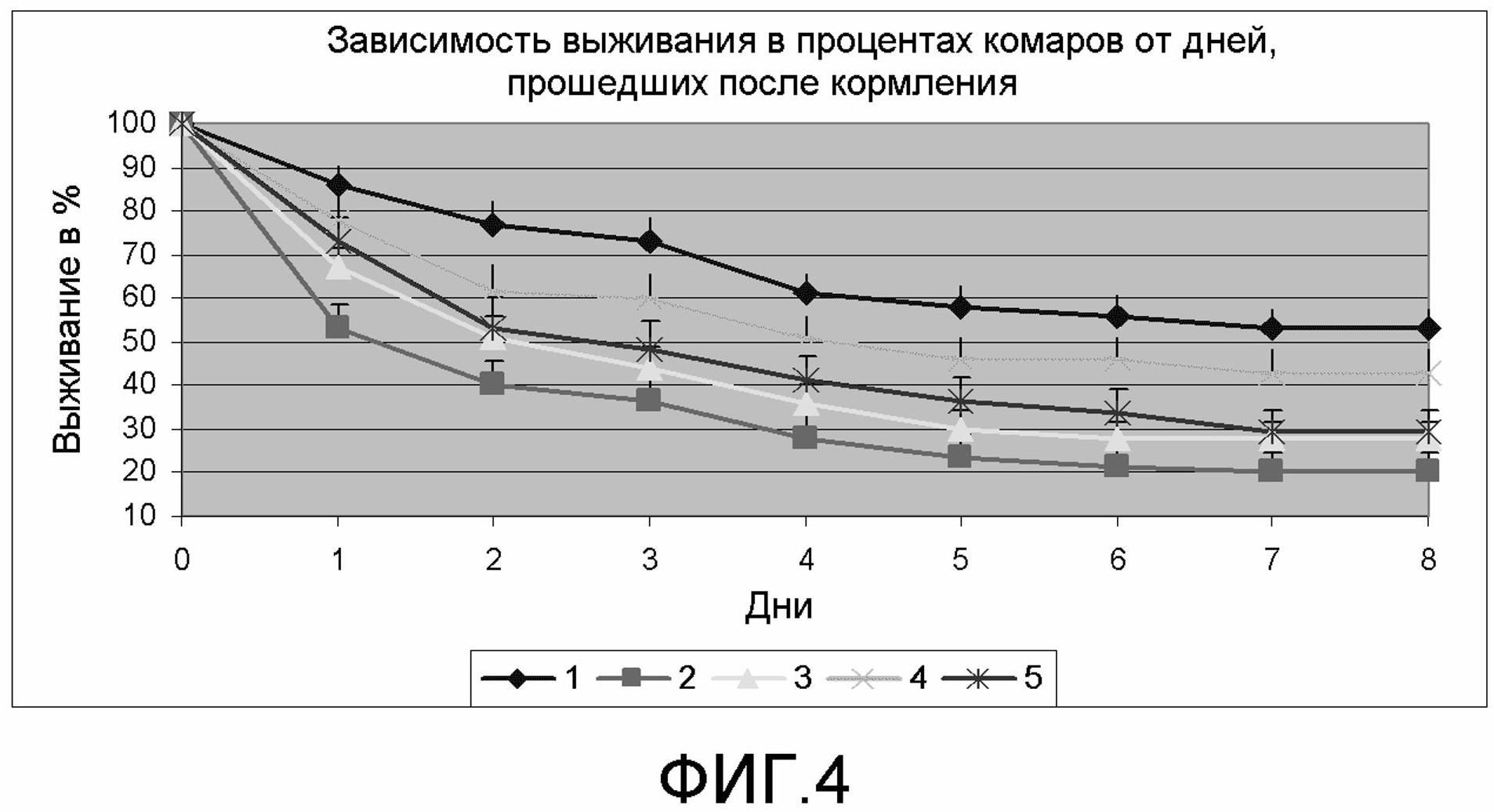
На фиг.4 демонстрируются данные по выживанию в процентах комаров после кормления кровью иммунизированных мышей.
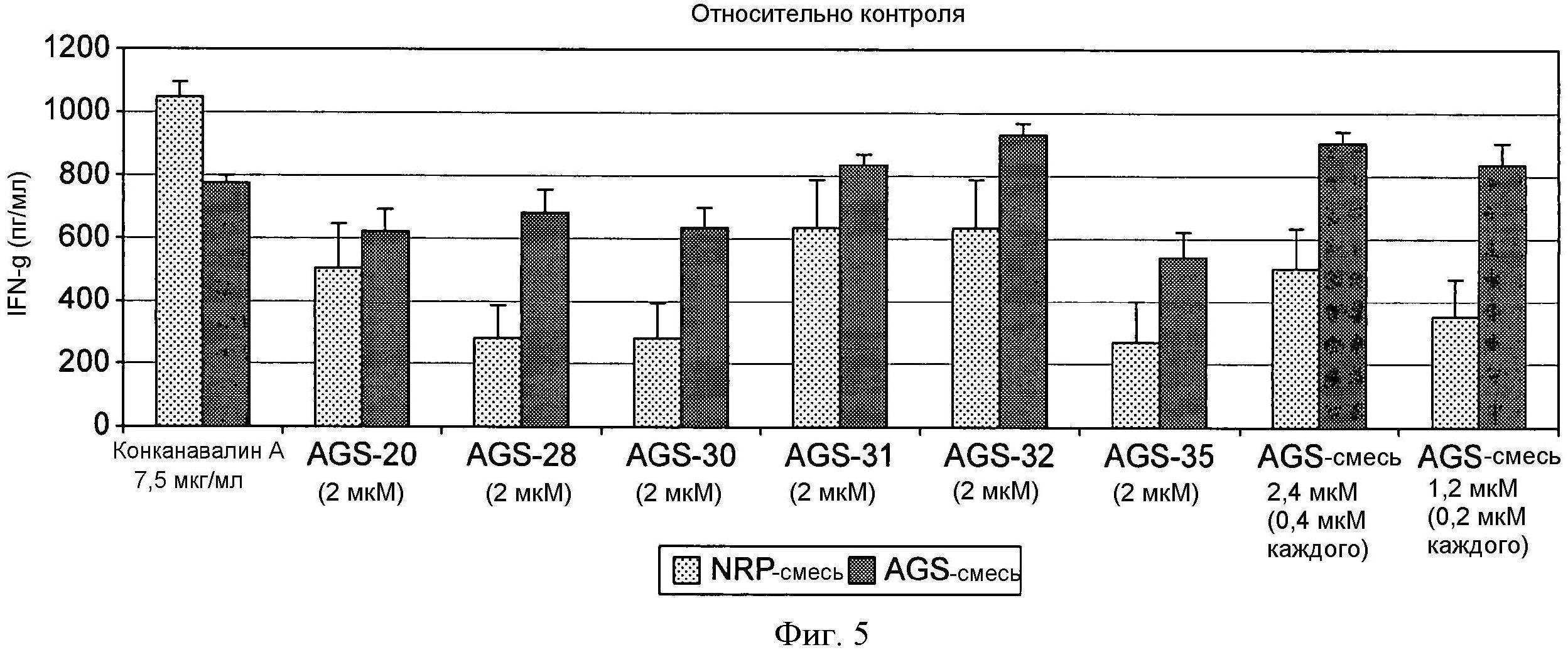
На фиг.5 демонстрируется продукция IFN-гамма после 96-часовой стимуляции in vitro антигенами в эксперименте 3.
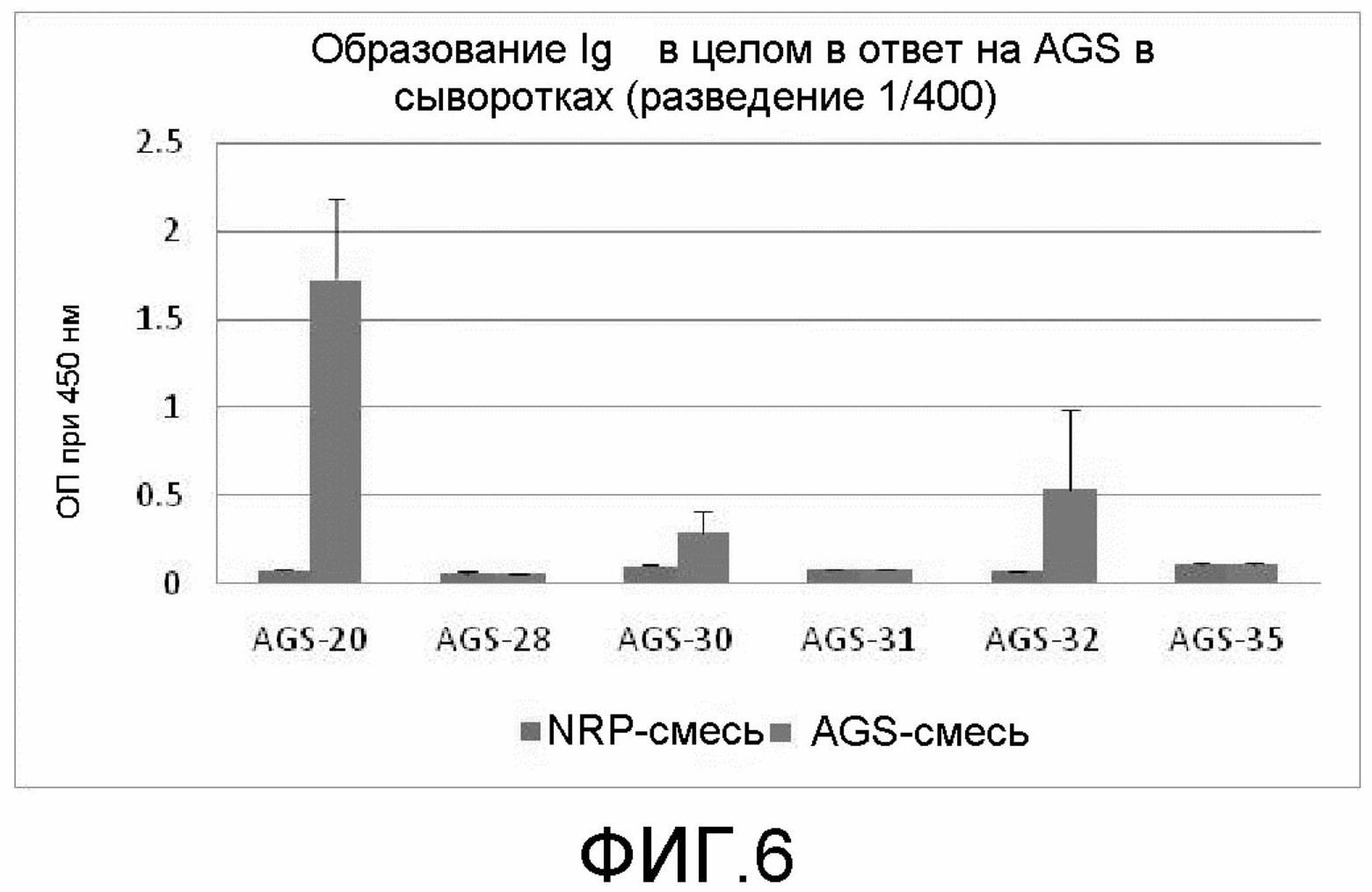
На фиг.6 демонстрируется образование Ig в целом в сыворотках на антигены в соответствии с экспериментом 3.
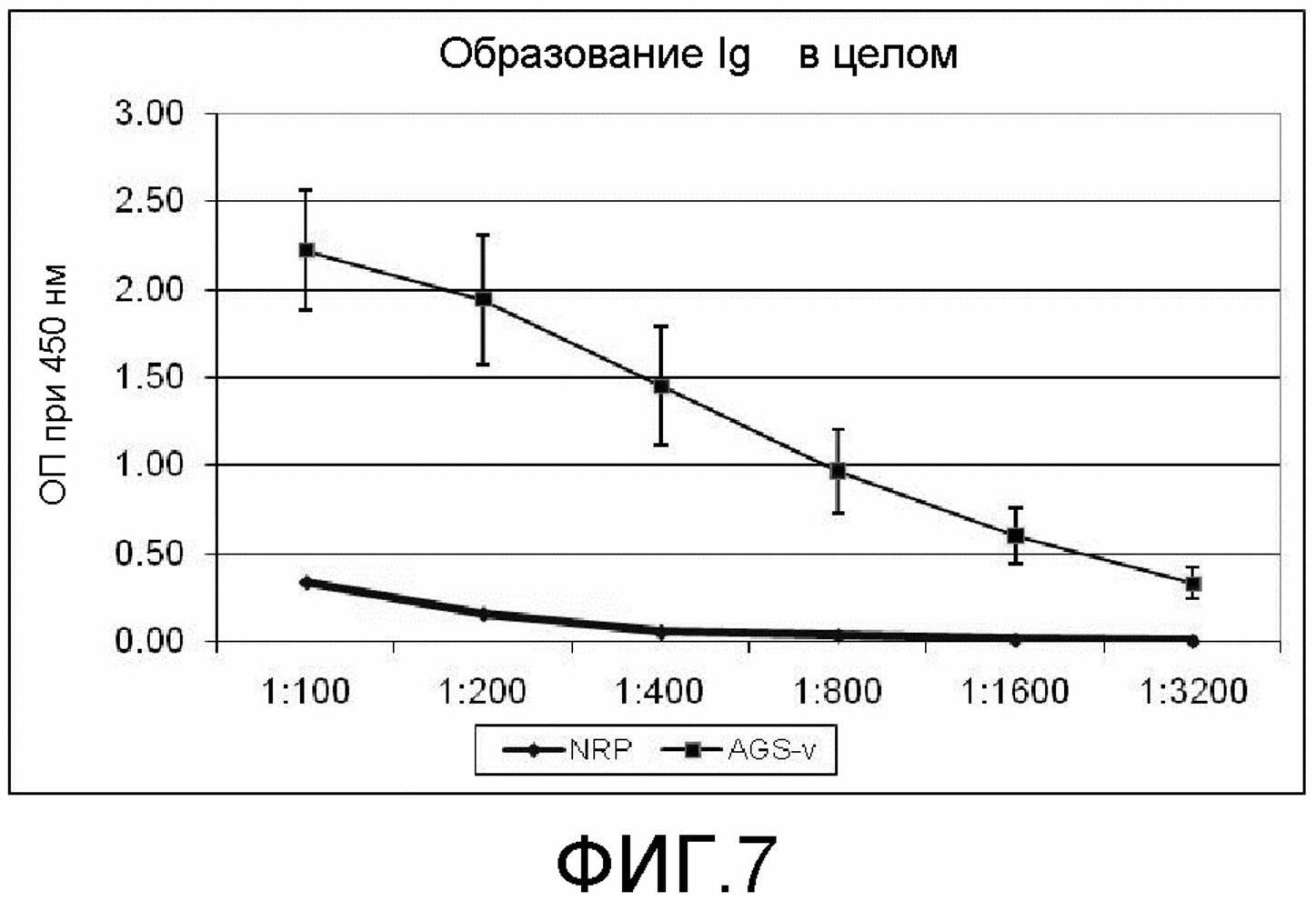
На фиг.7 демонстрируется образование Ig в целом в сыворотках на AGS-смесь в день 21 в соответствии с экспериментом 4.
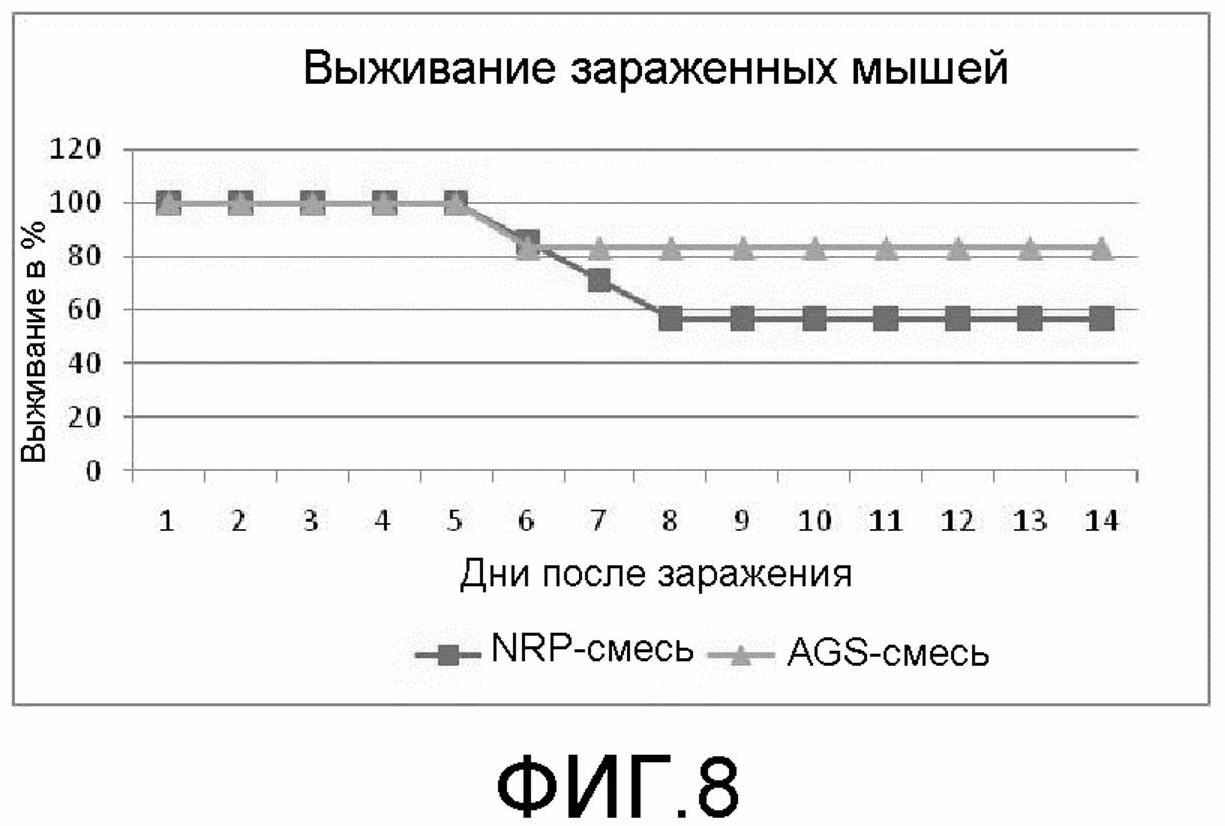
На фиг.8 демонстрируется подвергнутая иммунизации AGS-смесью группа в эксперименте 4, демонстрирующая увеличенную степень выживания по сравнению с комарами в контрольной группе, подвергнутой иммунизации NRP-смесью.
Описанные выше полипептиды обычно включают один или более (предпочтительно два или более) эпитопов. Предпочтительно эти эпитопы являются Т-клеточными эпитопами, такими как эпитопы цитотоксических Т-лимфоцитов (CTL), но также могут содержать В-клеточные эпитопы. Как правило, полипептид является иммуногенным относительно белка слюны членистоногих и предпочтительно относительно множества таких белков. В контексте настоящего изобретения предполагается, что полипептид, иммуногенный относительно белка слюны членистоногих, означает полипептид, который является частью белка слюны членистоногих и индуцирует ответ иммунной системы. Один способ определения того, обладает ли полипептид такой иммуногенностью, представлен ниже в эксперименте 2. Однако настоящее изобретение не ограничивается такими способами, и квалифицированный специалист может выбрать любой известный способ определения иммуногенности, при желании.
В настоящем изобретении полипептидная композиция включает одну или несколько определенных выше последовательностей. Как правило, две, три, четыре, пять или более таких последовательностей могут присутствовать в полипептидной композиции, если желательно. Чем больше таких эпитопов присутствует, тем больше ширина защиты, предоставляемая в популяции являющихся людьми и/или животными индивидуумов с различными HLA или MHC. Это особенно верно, если включенные эпитопы происходят из слюны множества различных членистоногих или разделяются белками слюны различных видов членистоногих и могут, следовательно, обеспечить защиту от болезней, вызываемых множеством различных членистоногих. Как правило, полипептидная композиция включает 10 полипептидов или меньше, предпочтительно 6 полипептидов или меньше и обычно 2-10 полипептидов и более предпочтительно 2-6 полипептидов.
Полипептидная композиция в соответствии с настоящим изобретением может также содержать одну или несколько дополнительных последовательностей, которые не являются эпитопами, если желательно. Как правило, дополнительные последовательности происходят из одного или нескольких белков слюны членистоногих, предпочтительно выбирают из последовательностей SEQ ID NO:45-85 или их подпоследовательностей. Эти последовательности могут находиться между двумя или более последовательностями (эпитопами), описанными выше, или могут находиться на одном или обоих концах полипептида. Присутствие таких дополнительных последовательностей не должно влиять на функционирование полипептида при условии, если полипептид в целом не становится слишком большим, вносящим помехи в презентацию эпитопов в иммунной системе позвоночного.
В наиболее предпочтительных вариантах осуществления дополнительными последовательностями из вышеупомянутых белков являются последовательности, которые являются следующими последовательностями (или находятся внутри них):
SEQ ID NO:45 - >gi|18389913|gb|AAL68793.1|AF457563_1 гипотетический белок 16 [Anopheles gambiae]
MHLTLFTVAVLLLAAAALLLLLPPAYSTTLTPPAPPRLSHLGITIGRI
SEQ ID NO:46 - >gi|18389909|gb|AAL68791.1|AF457561_1 гипотетический белок 14 [Anopheles gambiae]
MPLSYCHLFLTHTLARALSFSRSDCLKFSEKRLLFSGSKTFPTTLL
SEQ ID NO:47 - >gi|18389907|gb|AAL68790.1|AF457560_1 гипотетический белок 13 [Anopheles gambiae]
MKNVFFALLLVVLVCCLVSVQGNEIIQNVVKRSIPLRQLILQHNALDDSNSDSGSQ
SEQ ID NO:48 - >gi|18389903|gb|AAL68788.1|AF457558_1 гипотетический белок 11 [Anopheles gambiae]
MCIFFQAGIKLLVLLICLFFYHTHCTTAYLWLAMGVEAKSIKARGTAHSKSRTSTN
SEQ ID NO:49 - >gi|62546227|gb|AAX86005.1|hyp3.5- предшественник [Anopheles gambiae]
MFLKGSFPRFQMCVMLIGFFSSAKCLMCFADWEGMLLMTMEVFDFQLIVFTPVLKRS
SEQ ID NO:50 - >gi|18389899|gb|AAL68786.1|AF457556_1 7-подобный белок слюнных желез [Anopheles gambiae]
MAGESQKNARSKQNDYQALLGLCCPWIDLAAADLPMRRHAKAREAINFLLQAHEAGPNEEPSLPA
SEQ ID NO:51 - >gi|18389911|gb|AAL68792.1|AF457562_1 гипотетический белок 15 [Anopheles gambiae]
MKFYSVGKLVKVLLVMAVCCLLLCTAPTGADPLPGRDRNTIANKSKDKKASAPKHSLGTGARMALTGGGVLGGVLTNM
SEQ ID NO:52 - >gi|62546225|gb|AAX86004.1|hyp6.3- предшественник [Anopheles gambiae]
MKFAFAFVLIALFAVFAVSQALPQPEQAAASSNDGASAITKIVLELTPEQAAAVQKMGGRGFWPIMMKSVKKIMAIGCDLIDC
SEQ ID NO:53 - >gi|17026153|emb|CAD12038.1|Sec61-белок [Anopheles gambiae]
MGIKFLEIIKPFCGILPEIAKPERKIQFREKVLWTAITLFIFLVCCQIPLFGIMSSDSADPFYWIRVILASNRGTLM
SEQ ID NO:54 - >gi|62546223|gb|AAX86003.1|hyp6.2- предшественник [Anopheles gambiae]
MGRVMCLLRLMSTLLVVLSIVGKKTNAAPQVTEAPGNVGSTYSPMADIGRLATGATKLFGQFWNTGTRFGTELSRRTFDFLRVKK
SEQ ID NO:55 - >gi|18389915|gb|AAL68794.1|AF457564_1 гипотетический белок 17 [Anopheles gambiae]
MAGDIQLFSTRETTMKLYSGYRLLVLLVMTVCCLLLFIAPTGADPLPGQTQRTLGYRGNDKRATPPMHSLGSGARMAMTGGGILGGIFSAL
SEQ ID NO:56 - >gi|87080391|gb|ABD18596.1|дефенсин [Anopheles gambiae]
MDQCSVPRLCIIIMKSFIAAAVIALICAIAVSGTTVTLQSTCKLFTADVVSSITCKMYCVIKGKTGGYCNSEGLCTCRAEDLHFLLKPIINKD
SEQ ID NO:57 - >gi|18389901|gb|AAL68787.1|AF457557_1 гипотетический белок 10 [Anopheles gambiae]
MRFLSVLTVGLLVWVGVFATVNAEDPRTELIGCGSVLFHLAANRLSLQLEEFAVCKRSNPGYDCSDSIHRAISDLQQGLFDLNHCTKDIR
SEQ ID NO:58 - >gi|18389905|gb|AAL68789.1|AF457559_1 гипотетический белок 12 [Anopheles gambiae]
MRFCCVALIGLLLCSVQSVTANDPVDALGACSGNLFGLLMTRLQQMVEDFTACRQEATANDPQHDRSDSIQRAKVDLQQQLVNYSYCTKNIQ
SEQ ID NO:59 - >gi|4127344|emb|CAA76832.1|cE5-белок [Anopheles gambiae]
MASKLFVLAFLCLALVVVVQSAPQYARGDVPTYDEEDFDEESLKPHSSSPSDDGEEEFDPSLLEEHADAPTARDPGRNPEFLRNSNTDEQASAPAASSSDS
SEQ ID NO:60 - >gi|4210617|emb|CAA10259.1|SG2-белок [Anopheles gambiae]
MKSMLVAFATLSVALVVVVAIPANFNYGGGGGYFINGTGQSFNFSGESNGTSIPGLPDFGSFLPNLGNLTQQFGGSSGAFPQFSIPSWTNFTDAFTSILPFFGNGQGGGFPFFG
SEQ ID NO:61 - >gi|4127309|emb|CAA76820.1|гипотетический белок [Anopheles gambiae]
MTPLIATLAACALTLSIVHSRGLPESSDKLEACGQHYGXLLKASTTWNEKECNGSTKLAACVVSEHEQAYRELKQRCQEAHDERTAKVNAIYEKLPAYLSEVSARVNVLQVSLQHDLPNLQE
SEQ ID NO:62 - >gi|4375824|emb|CAA76825.1|опсин [Anopheles gambiae]
PDVAEPLVHHHLRHLRVLAAAADHHLLVHLHPEGCVRSREEHARAGQEGNVASLRTQEAQNTSTEMKLAKVALVTISLWFMAWTPYLVINFTGIFKAAPISPLATIRGSLFAKANAVYNPIVYG
SEQ ID NO:63 - >gi|62546233|gb|AAX86008.1|неизвестный белок [Anopheles gambiae]
MATTWIPTSVHGPYPPHMVPGGVDSDGAQIFVGRAHHAGDLLPAKVIPDKTAAYVAYGGQETLVEHVEVLVHKQLIWDTASAGQVPLGAVVGGHTSDGEILYVGRAYHEGSQTIGKVQCSHNCIYIPYGGAEVSVPTYEVLCER
SEQ ID NO:64 - >gi|3378531|emb|CAA03872.1|D7r2-белок [Anopheles gambiae]
MFKKLLLSVGLVWCLISLGQARKESTVEECEKNIGDSLKDRVCELRQYTPVSSDDMDKHMQCVLEVVGFVDGNGEVKESVLLELLQRVDSGVNHAANMKKCVTEASTSGSDKKANTFYTCFLGTSSLAGFKNAVDYDELLKAGKMQTSDP
SEQ ID NO:65 - >gi|3378529|emb|CAA03871.1|D7r3-белок [Anopheles gambiae]
MFGKLLPCAILLWCLFSLGQARQEETVEECERNIPASLKERVCELRQYTPVQGKDMDSHMQCVLEVLGFVEDNGELVFQELLGVLKMVDPDGDHAGSMKKCNGEAEKVDTSSKANTFYTCFLGTSSAQAFKYAVDYVXAXRAGKLDMGTTFNAGQV
SEQ ID NO:66 - >gi|18389893|gb|AAL68783.1|AF457553_1 муциноподобный белок [Anopheles gambiae]
AGGFSLFEALKQTTTRGEMFRRKLTPTVVVVLLCLTFVADALTIQELRAQIAQQRIQQRYGVTVATTSAATTTAATTSAATTSEATTTAAASTTQASDSDNTTTTAEATTTTEAQTTSSSDNSTTTEAAATTTAASETTADSSSTGTTSVEAGLRAQYRDQVRQQAIERALARAAAFG
SEQ ID NO:67 - >gi|18389881|gb|AAL68777.1|AF457547_1 селенопротеин [Anopheles gambiae]
MRLFAITCLLFSIVTVIGAEFSAEDCRELGLIKSQLFCSACSSLSDYGLIELKEHCLECCQKDTEADSKLKVYPAAVLEVCTCKFGAYPQIQAFIKSDRPAKFPNLTIKYVRGLDPIVKLMDEQGTVKETLSINKWNTDTVQEFFETRLAKVEDDDYIKTNRV
SEQ ID NO:68 - >gi|18389879|gb|AAL68776.1|AF457546_1 белок с М.м. 30 кДа [Anopheles gambiae]
MAGAITYICFILHGVSEIIPQQQKKTMKFLLLVASVLCLVLIVSARPADDTSDQESSTELSDDAGAEEGAEDAGSDAEADAGAADGEEGATDTESGAEGDDSEMDSAMKEGEEGAGSDDAVSGADDETEESKDDAEEDSEEGGEEGGDSASGGEGGEKESPRNTYRQVHKLLKKIMKVDTKD
SEQ ID NO:69 - >gi|18378603|gb|AAL68639.1|AF458073_1 D7-родственный белок 5 [Anopheles gambiae]
MEWRYFVVIALICPLIIVETLAVSDCVRHVSESARNTVCDVRQYRVTKGVEADRYVQCFMTALGFADESGSIQRSNVLTALDAVETHDGVYTDAVDVCLSKAKKLPGTERSGYFFSCMLRTESALNFRDAVELQELRVASKWPEGERFDRSKVQQMMRELNSQLRC
SEQ ID NO:70 - >gi|18389897|gb|AAL68785.1|AF457555_1 1-подобный белок 4 слюнных желез [Anopheles gambiae]
GREAIETMRTEQRNHRQQLLLLYLDAADLRRALHQYQLLAAQGDRHLPQQIVKFVYAAPRHENRRLENLLDLVRQLPARQDQRTLYQLLQPEIMKRPAQNQSTLAMLTALEMGQVVEGNGELKKQQDAMYQLVLKRWMFLCLAGQYREIVQFATKHPRLFE
SEQ ID NO:71 - >gi|18389883|gb|AAL68778.1|AF457548_1 антиген - 5-родственный белок 1 [Anopheles gambiae]
MAIWIVCATLLLAVLSVVSVGGQYCSSDLCPRGGPHVGCNPPSSSGGPTCQGKQKARKVLLTPALQAYIMDEHNLNRSNIALGRIRPYPSAVKMPTLTWDPELASLADANARSCNYGHDRCRATKKFPYAGQNIAITQFFGYRFTEKDLIHKFVSSWWSEYLDARPEHVRKYPSSYSG
SEQ ID NO:72 - >gi|83016748|dbj|BAE53441.1|DsRed [синтетическая конструкция]
MKLASSENVITEFMRFKVRMEGTVNGHEFEIEGEGEGRPYEGHNTVKLKVTKGGPLPFAWDILSPQFQYGSKVYVKHPADIPDYKKLSFPEGFKWERVMNFEDGGVATVTQDSSLQDGCFIYKVKFIGVNFPSDGPVMQKKTMGWEASTERLYPRDGVLKGETHKALKLKDGGHYLVEFKSIYMAKKPVQLPGYYYVDAKLDITSHNEDYTIVEQYERTEGRHHLFLRSRAPPPPPLT
SEQ ID NO:73 - >gi|18389895|gb|AAL68784.1|AF457554_1 1-подобный белок 3 слюнных желез [Anopheles gambiae]
MAGQRHLIEQAWQYGAQLQHELMLTSMESDRVQRALVLHSMLVNASLAEMVKESYQTHGADGRMVVRMLKFVRLLPGADERVAVYKQLAELLKSNGQDGRFPAVIFSTDVRQLEDRYKPDHAQYEGKVVERWLAELQAGTFHEVVEFARDYPEYFARVEEPLYETLKQQWSAEGLDRMVSFPNALPVGVQRVRALRALLETLLQHQGEQNNDVYLIRLAHETGRVEATVGQADAAVRQALDDVKKLFEQFKYQRGFPDYEALYKLFKGL
SEQ ID NO:74 - >gi|18389891|gb|AAL68782.1|AF457552_1 длинная форма D7-белка [Anopheles gambiae]
MIVPRVLLFILLELFVQATQAFKALDPEEAWYVYERCHEDHLPSGPNRETYLKTWKFWKLEPNDAVTHCYVKCTLAGLQMYDEKTNTFKPETVPVQHEAYKSFTEVESSKVNELQQALSSLNAGSGSCAEVFNAYLPVHNKYIGVSRKIYHGTVDSVAKIYEAKPEIKKQEESFFAYCAKKALGANGKEGYKKIRDYELADSAEFRNAMDCVFRGFRYMDDSGLKVDEVVRDFNLINKSDLEPEVRSVLASCTGTHAYDYYSCLLNSSVKEDFRNAFYFHELRSANYGYLAMGKVYEGPEKVKEELKKLNY
SEQ ID NO:75 - >emb|CAC35527.1|gSG9-белок [Anopheles gambiae]
MCKFYRLISTLLVVVVIAPRHQCSPFFFQYNRPYLSQPSSQLASTAANVVQRSNVTVALGNRINTDTALDDYGTRV
SEQ ID NO:76 - >sp|Q9U9L1|RS17_ANOGA белок S17 40S-субъединицы рибосомы
MGRVRTKTIKKASKVIIEKYYTRLTMDFDTNKRIVEEVAIIPTKPLRNKIAGFVTHLMKRLRHSQVRGISIKLQEEERERRDNYVPDVSALEQDIIEVDPETKEMLKHLDFNNIVVQLTNPTAPGYSNRRN
SEQ ID NO:77 - >emb|CAC35523.1|gSG7-белок [Anopheles gambiae]
MHAKPAFVLIALGVICLLQTTPTSASTNHVQQLMKVFRSMTQNFDYTKKPSYLQRAKYGVQNQLRNPLVQKAGNLPKSAKLSDGCLKQMVARVTDLEASFYASFSYNCHDHDQYSMECLEAAEPKYLDGLKTLADETAQCMRDQQ
SEQ ID NO:78 - >gb|AAD47075.1|AF164151_1 фактор 4С (1А) инициации трансляции [Anopheles gambiae]
MPKNKGKGGKNRRRGKNENESEKRELIFKEDEQEYAQVTKMLGNGRLEAMCFDGVKRLCHIRGKLRKKVWINQGDIILIGLRDYQDSKADVILKYTPDEARNLKTYGEFPESVRINETVTFVENDMDDDIEFGDDYSSSEEGDAIDAI
SEQ ID NO:79 - >emb|CAC35519.1|gSG2-подобный белок [Anopheles gambiae]
MKLFLTLLSTLSVAMVFALPAHHHSRGGDGSSANSTGNSDNNSAGVPDFGFNSQSNVPGFGNGQQPGQQQQGQQGQGFPFFGQGQSGFPSFGNRLQPFFGQNQQGQDGDAQQGRGVPFFGQGGGQGGIPSFGSGQQNGGVPFLGNGQGQSGFPSFGNGQQGGNFPFFG
SEQ ID NO:80 - >emb|CAC35451.1|гипотетический белок [Anopheles gambiae]
MKLYAFALVLCVGLAVGAEVDSVPEVPSDLQQQLDELQLADKPEAPVDDAEQPLPPNGDELPEDAPEPVPEDGSPDEEHLEEEQEEEAEADEEEADESESEESEESDELEEARLVAEELEERQQELDYLKRYLVGRLQAVAILDRRVRPAVIRRPWIRRPWIRRPG
SEQ ID NO:81 - >emb|CAC35524.1|D7r4-белок [Anopheles gambiae]
MIRQVIISYFLTVCLLALVQSETVQDCENKLPPSLKSRLCEIRRYEIIEGPEMDKHIHCVMRALDFVYEDGRGDYHKLYDPLNIIELDKRHDVNLEKCIGECVQVPTSERAHVFYKCLLKSTTGRTFKKVFDLMELKKAGKVPQHQRYTAEFVQIMKDYDKALNC
SEQ ID NO:82 - >ref|XP_001230998.1|ENSANGP00000014906 [Anopheles gambiae штамм PEST]
MEAISEALQPYKEQVGMAAGILTVGQMFSGCFVCNDIRKKGTTDGFSAMPFVGGCGLTVLFLQHGMLMNDSAMTNANLVGLTISLAYAIFFLLYTPPTGRSSYWRQVGGTALFTITLLGYVKVENPSVVEDRFGMIITVLMLALIGQPLFGLPDIIRRKSTEGLPFAMILSGTIVGLSWLLYGVILNNVFVVCQNLAAVTLSGIQLALFAIYPSKAAPPSKKRE
SEQ ID NO:83 - >ref|XP_316361.2|ENSANGP00000012984 [Anopheles gambiae штамм PEST]
MESIAVALQPYKDTVGLTAAIVTVVQFFSGVLALNAIRRQGNTRGFSALPFLGGTVFCLLNIQFGQMLRDDGMIRVNFIGLALNLLYVCGFYLYTEGPAKTAVWGQIGLAGALTAGVLSYVQYEDPQLVEFRFGLILTGLLWTLVGMPLLGLGDILKKKSTEGLPFPIIFLGAVVSFAWLLYGIILRSNFLVVQNLMALALSAVQLSLFIIFPSGAAKPPPTPAKKRN
SEQ ID NO:84 - >ref|XP_314140.3|ENSANGP00000015780 [Anopheles gambiae штамм PEST]
MDGIMSKGSLASLATVATVLQFLTGTVICNRYIRKKSTGDTSAFPFISGFLSCFMWLKYGVLTEESTLILVNFIGSALFFSYTVVFFIFCVNKREVIRQMMVISCIILSATLYTLFETDDEKSIRVIGLLCCCLAVLFFASPLTMLAHVIRTQNTDSLPFPIIMASFFVCLLWTAYGVLIGDRFIQIPNLLGGILAGIQLTLYVIYPKKKASFSGGPRYSPLVSENPIL
SEQ ID NO:85 - >emb|CAC35522.1|gSG6-белок [Anopheles gambiae]
MAIRVELLLAMVLLPLLLLESVVPYAAAEKVWVDRDKVYCGHLDCTRVATFKGERFCTLCDTRHFCECKETREPLPYMYACPGTEPCQSSDRLGSCSKSMHDVLCDRIDQAFLEQ
Пептиды настоящего изобретения, такие как пептиды с SEQ ID NO:1-44 и пептиды внутри SEQ ID NO:131-134, описанные выше, предпочтительно включают одну или более дополнительных аминокислот на одном или обоих своих концах для содействия их переработки в вакцины. Как правило, эти дополнительные аминокислоты являются аминокислотами, примыкающими к каждому из концов SEQ ID NO:1-44, как продемонстрировано выше в больших белках SEQ ID NO:45-86 (эти большие белки содержат последовательности SEQ ID NO:1-44). Предпочтительно число дополнительных аминокислот на каждом конце составляет 1-5, более предпочтительно 1-3 и наиболее предпочтительно 2 на каждом конце. В каждом из этих случаев, если на конце последовательностей SEQ ID NO:1-44 находится менее двух дополнительных аминокислот, дополнительные аминокислоты включают не больше остающейся аминокислоты (аминокислот) на этом конце. Особенно предпочтительными последовательностями этого типа, соответствующими SEQ ID NO:1-44, являются следующие последовательности:
SEQ ID NO:86 MHLTLFTVAVLLLAAAALLLLLPPAYSTTLTPPAP
SEQ ID NO:87 MPLSYCHLFLTHTLARALSFSRSDCLKF
SEQ ID NO:88 MKNVFFALLLVVLVCCLVSVQGNEIIQ
SEQ ID NO:89 GIKLLVLLICLFFYHTHCTTAYLWLAMGVEA
SEQ ID NO:90 MFLKGSFPRFQMCVMLIGFFSSAKCLMC
SEQ ID NO:91 KQNDYQALLGLCCPWIDLAAADLPMRRHAKARE
SEQ ID NO:92 MKFYSVGKLVKVLLVMAVCCLLLCTAPTGADPLPG
SEQ ID NO:93 MKFAFAFVLIALFAVFAVSQALPQPEQAAASS
SEQ ID NO:94 SNDGASAITKIVLELTPEQAAAVQK
SEQ ID NO:95 AITLFIFLVCCQIPLFGIMSSDSADPFYWIRVILASN
SEQ ID NO:96 MGRVMCLLRLMSTLLVVLSIVGKKT
SEQ ID NO:97 MKLYSGYRLLVLLVMTVCCLLLFIAPTGADPLPGQTQRTLGY
SEQ ID NO:98 CKMYCVIKGKTGGYCNSEGLCTCRAEDLHFLLKPIINKD
SEQ ID NO:99 TVNAEDPRTELIGCGSVLFHLAANRLSLQLEEFAVCKRSN
SEQ ID NO:100 CVALIGLLLCSVQSVTANDPVDALGACSGNLFGLLMTRLQQ
SEQ ID NO:101 MASKLFVLAFLCLALVVVVQSAPQYARGDVPTYD
SEQ ID NO:102 MKSMLVAFATLSVALVVVVAIPANFNYGGGGGYFINGTGQSF
SEQ ID NO:103 NAIYEKLPAYLSEVSARVNVLQVSLQHDLPNLQE
SEQ ID NO:104 STEMKLAKVALVTISLWFMAWTPYLVINFTGIFK
SEQ ID NO:105 GDLLPAKVIPDKTAAYVAYGGQETLVEHVEVLVHK
SEQ ID NO:106 NTFYTCFLGTSSLAGFKNAVDYDELLKAGKM
SEQ ID NO:107 QCVLEVLGFVEDNGELVFQELLGVLKMVDPDGDHA
SEQ ID NO:108 RRKLTPTVVVVLLCLTFVADALTIQELRAQIAQQRIQQRYGVTVATTSA
SEQ ID NO:109 CSSLSDYGLIELKEHCLECCQKDTEADSKLKVYPAAVLEVCT
SEQ ID NO:110 AITYICFILHGVSEIIPQQQKKTMKFLLLVASVLCLVLIVS
SEQ ID NO:111 EWRYFVVIALICPLIIVETLAVSD
SEQ ID NO:112 QLLLLYLDAADLRRALHQYQLLAAQGDRHLPQQIVKFVYA
SEQ ID NO:113 RKVLLTPALQAYIMDEHNLNRSNIALGRIRPYPSAVKMPTL
SEQ ID NO:114 DGVLKGETHKALKLKDGGHYLVEFKSIYMAK
SEQ ID NO:115 ALVLHSMLVNASLAEMVKESYQTHGADGRMVVRMLKFVRLLPGA
SEQ ID NO:116 VQRVRALRALLETLLQHQGEQNNDVYLIRLAHETGR
SEQ ID NO:117 VNELQQALSSLNAGSGSCAEVFNAYLPVHNKYIGVSRKIYH
SEQ ID NO:118 MCKFYRLISTLLVVVVIAPRHQCSPFFFQYNRPYLSQ
SEQ ID NO:119 RDNYVPDVSALEQDIIEVDPETKEMLKHLDFNNIVVQLTN
SEQ ID NO:120 HDQYSMECLEAAEPKYLDGLKTLADETAQCMR
SEQ ID NO:121 EQEYAQVTKMLGNGRLEAMCFDGVKRLCHIRGKLRK
SEQ ID NO:122 MKLFLTLLSTLSVAMVFALPAHHHSRGGD
SEQ ID NO:123 SDELEEARLVAEELEERQQELDYLKRYLVGRLQAVAI
SEQ ID NO:124 IISYFLTVCLLALVQSETVQDCE
SEQ ID NO:125 DSAMTNANLVGLTISLAYAIFFLLYTPPTGRSSYW
SEQ ID NO:126 VVSFAWLLYGIILRSNFLVVQNLMALALSAVQLSLFIIFP
SEQ ID NO:127 TSAFPFISGFLSCFMWLKYGVLTEESTLILVNFIGSALFF
SEQ ID NO:128 VIGLLCCCLAVLFFASPLTMLAHVIRTQ
SEQ ID NO:129 VELLLAMVLLPLLLLESVVPYAAAEKVWVD
Такие особенно предпочтительные пептиды также включают следующие остатки:
остатки 1-35 >gi|18389913|gb|AAL68793.1|AF457563_1 гипотетического белка 16 [Anopheles gambiae]
остатки 1-28 >gi|18389909|gb|AAL68791.1|AF457561_1 гипотетического белка 14 [Anopheles gambiae]
остатки 1-27 >gi|18389907|gb|AAL68790.1|AF457560_1 гипотетического белка 13 [Anopheles gambiae]
остатки 8-38 >gi|18389903|gb|AAL68788.1|AF457558_1 гипотетического белка 11 [Anopheles gambiae]
остатки 1-28 >gi|62546227|gb|AAX86005.1|hyp3.5-предшественника [Anopheles gambiae]
остатки 12-44 gi|18389899|gb|AAL68786.1|AF457556_1 7-подобного белка слюнных желез [Anopheles gambiae]
остатки 1-35 >gi|18389911|gb|AAL68792.1|AF457562_1 гипотетического белка 15 [Anopheles gambiae]
остатки 1-32 >gi|62546225|gb|AAX86004.1|hyp6.3-предшественника [Anopheles gambiae]
остатки 32-56 >gi|62546225|gb|AAX86004.1|hyp6.3- предшественника [Anopheles gambiae]
остатки 36-72 >gi|17026153|emb|CAD12038.1|Sec61-белка [Anopheles gambiae]
остатки 1-25 >gi|62546223|gb|AAX86003.1|hyp6.2-предшественника [Anopheles gambiae]
остатки 15-56 >gi|18389915|gb|AAL68794.1|AF457564_1 гипотетического белка 17 [Anopheles gambiae]
остатки 55-93 >gi|87080391|gb|ABD18596.1|дефенсина [Anopheles gambiae]
остатки 20-59 >gi|18389901|gb|AAL68787.1|AF457557_1 гипотетического белка 10 [Anopheles gambiae]
остатки 5-45 >gi|18389905|gb|AAL68789.1|AF457559_1 гипотетического белка 12 [Anopheles gambiae]
остатки 1-34 >gi|4127344|emb|CAA76832.1|cE5-белка [Anopheles gambiae]
остатки 1-42 >gi|4210617|emb|CAA10259.1|SG2-белка [Anopheles gambiae]
остатки 89-122 >gi|4127309|emb|CAA76820.1|гипотетического белка [Anopheles gambiae]
остатки 63-96 >gi|4375824|emb|CAA76825.1|опсина [Anopheles gambiae]
остатки 39-73 >gi|62546233|gb|AAX86008.1|неизвестного белка [Anopheles gambiae]
остатки 115-145 >gi|3378531|emb|CAA03872.1|D7r2-белка [Anopheles gambiae]
остатки 61-95 >gi|3378529|emb|CAA03871.1|D7r3-белка [Anopheles gambiae]
остатки 21-69 >gi|18389893|gb|AAL68783.1|AF457553_1 муциноподобного белка [Anopheles gambiae]
остатки 41-82 >gi|18389881|gb|AAL68777.1|AF457547_1 селенопротеина [Anopheles gambiae]
остатки 4-44 >gi|18389879|gb|AAL68776.1|AF457546_1 белка с М.м. 30 кДа [Anopheles gambiae]
остатки 2-25 >gi|18378603|gb|AAL68639.1|AF458073_1 D7-родственного белка 5 [Anopheles gambiae]
остатки 18-57 >gi|18389897|gb|AAL68785.1|AF457555_1 1-подобного белка 4 слюнных желез [Anopheles gambiae]
остатки 57-97 >gi|18389883|gb|AAL68778.1|AF457548_1 антигена - 5-родственного белка 1 [Anopheles gambiae]
остатки 156-186 >gi|83016748|dbj|BAE53441.1|DsRed [синтетической конструкции]
остатки 35-78 >gi|18389895|gb|AAL68784.1|AF457554_1 1-подобного белка 3 слюнных желез [Anopheles gambiae]
остатки 189-224 >gi|18389895|gb|AAL68784.1|AF457554_1 1-подобного белка 3 слюнных желез [Anopheles gambiae]
остатки 111-151 >gi|18389891|gb|AAL68782.1|AF457552_1 длинной формы D7-белка [Anopheles gambiae]
остатки 1-37 >emb|CAC35527.1|gSG9-белка [Anopheles gambiae]
остатки 81-120 >sp|Q9U9L1|RS17_ANOGA белка S17 40S-субъединицы рибосомы
остатки 111-142 >emb|CAC35523.1|gSG7-белка [Anopheles gambiae]
остатки 32-67 >gb|AAD47075.1|AF164151_1 фактора 4С (1А) инициации трансляции [Anopheles gambiae]
остатки 1-29 >emb|CAC35519.1|gSG2-подобного белка [Anopheles gambiae]
остатки 106-142 >emb|CAC35451.1|гипотетического белка [Anopheles gambiae]
остатки 6-28 >emb|CAC35524.1|D7r4-белка [Anopheles gambiae]
остатки 70-104 >ref|XP_001230998.1|ENSANGP00000014906 [Anopheles gambiae штамм PEST]
остатки 174-213 >ref|XP_316361.2|ENSANGP00000012984 [Anopheles gambiae штамм PEST]
остатки 41-80 >ref|XP_314140.3|ENSANGP00000015780 [Anopheles gambiae штамм PEST]
остатки 126-153 >ref|XP_314140.3|ENSANGP00000015780 [Anopheles gambiae штамм PEST]
остатки 5-34 >emb|CAC35522.1|gSG6 белка [Anopheles gambiae]
В альтернативных вариантах осуществления настоящего изобретения оно направлено на композиции, содержащие полипептиды, которые гомологичны описанным выше последовательностям, в частности пептиды, которые гомологичны любой из SEQ ID NO:1-134. Гомология, упоминаемая выше в отношении этих последовательностей, составляет предпочтительно 60%, 75%, 80%, 85%, 90%, 95% или по существу 100%.
Гомологию в процентах первой последовательности полипептида ко второй последовательности полипептида, упоминаемую в контексте настоящего изобретения, определяют как число аминокислотных остатков во второй последовательности, которые соответствуют как по положению, так и по тождеству аминокислотным остаткам в первой последовательности, поделенное на общее число аминокислотных остатков во втором полипептиде (и первый, и второй полипептиды должны иметь одинаковое число аминокислотных остатков) и умноженное на 100. В настоящем изобретении предпочтительно, когда гомология полипептида определенным выше последовательностям составляет 75% или более, 80% или более, 85% или более, 90% или более, 95% или более или 100% (или по существу 100%).
В настоящем изобретении распространяемая членистоногими болезнь особенно не ограничивается, и полипептиды могут быть иммуногенными в отношении любой известной распространяемой членистоногими болезни и/или выведенными из нее. Примеры болезней, патогенов и переносчиков инфекций, охватываемых настоящим изобретением, приведены выше в таблице 1. Однако предпочтительно релевантной болезнью является малярия (включающая любой малярийный штамм), вызываемая любым из штаммов плазмодий.
Конкретными последовательностями, гомологичными любой из SEQ ID NO:1-134, определенных выше, являются предпочтительно последовательности в соответствующих положениях в известных белках членистоногих, которые можно найти в базе данных по белкам общего пользования NCBI, доступ к которой в сети можно получить по следующему URL-адресу: http://www.ncbi.nlm.nih.gov/entrez/query/static/help/helpdoc.html#Protein. Список обычно представлен в форме |номер версии (gi номер)|идентификатор базы данных (например, gb для GenBank)|входящий номер в NCBI|необязательная дополнительная информация (например, входящий номер нуклеотидной последовательности, из которой выведена последовательность белка). Белковая база данных содержит данные о последовательностях, выведенных из транслируемых кодирующих областей последовательностей ДНК в GenBank, EMBL и DDBJ, а также последовательности белков, представленные в Информационном белковом ресурсе (PIR), SwissProt, Фонде по исследованию белков (PRF) и Банке данных по структуре белка (PDB) (последовательности из разгаданных структур).
Эпитопы внутри определенных выше последовательностей особо не ограничиваются при условии, что они содержат 7 аминокислот или более. Предпочтительно эпитопы имеют по меньшей мере длину, которая является подходящей для наименьших иммуногенных эпитопов, таких как эпитопы CTL, Т-хелперов и В-клеток в конкретном виде позвоночного, таком как человек. Как правило, эпитопы содержат 8, 9, 10 или 11 аминокислотных остатков, но могут содержать больше аминокислотных остатков, если желательно.
Хотя полипептид может включать больше аминокислот, как правило, он содержит 100 аминокислот или меньше, предпочтительно между 7 и 100 аминокислотами и более предпочтительно 8-75 аминокислот. Размер не должен быть столь большим, что пригодные эпитопы страдают от конкуренции с непротективными эпитопами в иммунной системе (по этой причине полноразмерные белки не включаются), также размер не должен быть столь малым, что только очень узкий диапазон защиты обеспечивается. Более предпочтительными диапазонами являются 15-75 аминокислот, 20-55 аминокислот и 23-50 аминокислот. Особенно предпочтительно, когда полипептид состоит (или по существу состоит) из последовательности, выбираемой из определенных выше последовательностей.
Помимо описанных выше полипептидов настоящим изобретением также обеспечиваются полиэпитопные иммуногенные полипептиды, содержащие два или более полипептидов настоящего изобретения или в виде многократно разветвленных полипептидов, или соединенных в цепь последовательностей. Размер этих полиэпитопных полипептидов не ограничивается и может составлять, например, вплоть до 1400, или вплоть до 900, или вплоть до 550 аминокислот. Таким образом, они распространяются не только на очерченные выше полипептиды, но также на большие полипептиды при условии, если эти большие полипептиды включают две или более единиц, при этом каждая единица состоит из полипептида настоящего изобретения. Следовательно, настоящим изобретением охватывается полипептид, имеющий 100 повторяющихся 7-мерных единиц в соответствии с настоящим изобретением, как и полипептид, имеющий, скажем, 52 единицы одного 8-мерного эпитопа и 23 единицы второго 10-мерного эпитопа. Полипептиды этого типа не будут страдать проблемами, связанными с конкуренцией с полипептидами схожей длины, которые включают только один или два эпитопа. Во избежание сомнений полиэпитопный полипептид может включать множество копий одного и того же эпитопа, или одиночные копии множества различных эпитопов, или множество копий 2 или более эпитопов. Особенно предпочтительно, когда полиэпитопный полипептид содержит две или более последовательностей, указанных выше в SEQ ID NO:1-44 (и особенно последовательностей в SEQ ID NO:1-6, 7, 8, 11, 12, 15, 16, 20, 26, 28, 30-32, 35, 41 и 42) или в SEQ ID NO:86-134.
Как уже упоминалось, настоящим изобретением обеспечивается полипептидная композиция, включающая один или несколько, предпочтительно два или более различных полипептидов, определенных выше. Таким образом, полипептидная композиция может включать любое число полипептидов настоящего изобретения вместе в одной и той же последовательности, смеси или композиции. Присутствие вместе множества полипептидов полезно, поскольку каждый из них может индуцировать свой собственный иммунный ответ, расширяя протективный эффект композиции. Особенно предпочтительно, когда композиция содержит две или более (или все) последовательностей SEQ ID NO:1-44 (и особенно последовательностей в SEQ ID NO:1-6, 7, 8, 11, 12, 15, 16, 20, 26, 28, 30-32, 35, 41 и 42) и/или два или более эпитопов внутри SEQ ID NO:86-134. В композиции каждая последовательность и/или эпитоп может присутствовать или в виде отдельного пептида, или в виде ряда более больших пептидов, включающих несколько соединенных в цепь эпитопов и/или последовательностей (например, три последовательности, соединенные в цепь одного более большого пептида, и другие 4 последовательности, соединенные в цепь другого более большого пептида, и т.п.).
Настоящим изобретением также обеспечивается полипептидная конструкция, которая включает определенный выше полипептид и носитель. Конструкцию можно создать объединением одного или нескольких эпитопов и/или полипептидов, определенных выше, с носителем. Носителем может быть молекула, такая как адъювант и/или наполнитель. В этом контексте объединение означает или смешивание вместе, или связывание вместе (например, через ковалентную связь).
Настоящим изобретением, кроме того, обеспечивается определенный выше полипептид для применения в медицине. Также обеспечивается лекарственное средство или вакцинная композиция против распространяемых членистоногими болезней, включающая определенный выше полипептид и один или несколько подходящих наполнителей и/или адъювантов или определенную выше полипептидную конструкцию и необязательно один или несколько подходящих наполнителей и/или адъювантов (если являющаяся носителем часть конструкции сама является наполнителем или адъювантом, дополнительный наполнитель или адъювант может быть не нужен). Наполнитель или адъювант особенно не ограничиваются, и может использоваться любой наполнитель или адъювант, используемый в лекарственных средствах и вакцинах. Лекарственное средство или вакцинную композицию можно создать в соответствии с любым известным способом, соответствующим образом адаптированным к настоящему изобретению, например смешиванием полипептида настоящего изобретения с подходящим наполнителем.
Настоящим изобретением также обеспечивается способ получения определенного выше полипептида. Способ особенно не ограничивается и, как правило, включает соединение двух или более эпитопов с образованием полипептида. Полипептид можно, однако, синтезировать путем прямого химического синтеза (например, включением одной аминокислоты единовременно до образования полноразмерного полипептида) или рекомбинантными способами. Такие общие способы хорошо известны квалифицированному специалисту и могут быть адаптированы к настоящему изобретению, при желании. В некоторых случаях полипептид настоящего изобретения может включать дополнительные аминокислотные последовательности на одном или обоих концах для содействия в синтезе полипептида. Предпочтительно длина этих дополнительных последовательностей составляет 1-5 аминокислот. Обычно включают 2 аминокислоты. Примеры таких последовательностей предоставлены как SEQ ID NO:86-129, описанные выше.
Все еще далее настоящим изобретением обеспечивается применение определенных выше полипептида или композиции для производства лекарственного средства или вакцины, эффективных для лечения или профилактики распространяемой членистоногими болезни. Также обеспечивается способ лечения или профилактики распространяемой членистоногими болезни, включающий введение позвоночному определенных выше полипептида, композиции, лекарственного средства или вакцины. Способ введения особенно не ограничивается и может включать подкожное, внутримышечное, внутривенное, внутрикожное или интраназальное введение, или пероральное введение (например, в форме таблетки или жидкого препарата), или введение в форме суппозитория, если желательно. Форма препаратов для таких введений особенно не ограничивается, и могут использоваться известные формы с соответствующими модификациями, которые будут очевидны квалифицированному специалисту. Доза особенно не ограничивается и может находиться в диапазоне от 1 пг до 100 г, предпочтительно от 1 нг до 100 г полипептида для каждого индивидуума, в зависимости от размера, веса и вида вовлеченного индивидуума.
Настоящее изобретение применимо к любому позвоночному, поскольку иммунные системы позвоночных функционируют соответствующим образом. Как правило, упоминаемым в контексте настоящего изобретения позвоночным является млекопитающее, птица, пресмыкающееся или рыба. Особенно предпочтительно, когда позвоночным является человек, домашнее животное (такое, как собака или кошка), сельскохозяйственное животное (такое, как свинья или лошадь), крупный рогатый скот (например, коровы и быки) или птица (например, домашняя птица, сельскохозяйственная птица или птица бойцовой породы). Если позвоночным является птица, она предпочтительно является курицей, индюшкой, уткой или гусем.
Примеры человеческих MHC (HLA), которые могут связываться с конкретным Т-клеточным эпитопом в настоящем изобретении, включают следующие MHC (HLA):
HLA-A
A*010101, A*010102, A*010103, A*0102, A*0103, A*0104N, A*0106, A*0107, A*0108, A*0109, A*0110, A*02010101, A*02010102L, A*020102, A*020103, A*020104, A*020105, A*020106, A*020107, A*020108, A*020109, A*020110, A*020111, A*0202, A*020301, A*020302, A*0204, A*0205, A*020601, A*020602, A*020603, A*0207, A*0208, A*0209, A*0210, A*0211, A*0212, A*0213, A*0214, A*0215N, A*0216, A*021701, A*021702, A*0218, A*0219, A*022001, A*022002, A*0221, A*0222, A*0224, A*0225, A*0226, A*0227, A*0228, A*0229, A*0230, A*0231, A*0232N, A*0233, A*0234, A*023501, A*023502, A*0236, A*0237, A*0238, A*0239, A*0240, A*0241, A*0242, A*0243N, A*0244, A*0245, A*0246, A*0247, A*0248, A*0249, A*0250, A*0251, A*0252, A*0253N, A*0254, A*0255, A*0256, A*0257, A*0258, A*0259, A*0260, A*0261, A*0262, A*0263, A*0264, A*0265, A*0266, A*0267, A*0268, A*0269, A*0270, A*0271, A*0272, A*0273, A*03010101, A*03010102N, A*03010103, A*030102, A*030103, A*0302, A*0303N, A*0304, A*0305, A*0306, A*0307, A*0308, A*0309, A*0310, A*0311N, A*0312, A*0313, A*0314, A*110101, A*110102, A*1102, A*1103, A*1104, A*1105, A*1106, A*1107, A*1108, A*1109, A*1110, A*1111, A*1112, A*1113, A*1114, A*1115, A*1116, A*1117, A*1118, A*1119, A*2301, A*2302, A*2303, A*2304, A*2305, A*2306, A*2307N, A*2308N, A*2309, A*2310, A*2311N, A*2312, A*24020101, A*24020102L, A*240202, A*240203, A*240204, A*240205, A*240206, A*240301, A*240302, A*2404, A*2405, A*2406, A*2407, A*2408, A*2409N, A*2410, A*2411N, A*2413, A*2414, A*2415, A*2417, A*2418, A*2419, A*2420, A*2421, A*2422, A*2423, A*2424, A*2425, A*2426, A*2427, A*2428, A*2429, A*2430, A*2431, A*2432, A*2433, A*2434, A*2435, A*2436N, A*2437, A*2438, A*2439, A*2440N, A*2441, A*2442, A*2443, A*2444, A*2445N, A*2446, A*250101, A*250102, A*2502, A*2503, A*2504, A*2601, A*2602, A*2603, A*2604, A*2605, A*2606, A*260701, A*260702, A*2608, A*2609, A*2610, A*2611N, A*2612, A*2613, A*2614, A*2615, A*2616, A*2617, A*2618, A*2619, A*2620, A*2621, A*2622, A*2623, A*29010101, A*29010102N, A*290201, A*290202, A*290203, A*2903, A*2904, A*2905, A*2906, A*2907, A*2908N, A*2909, A*2910, A*2911, A*300101, A*300102, A*300201, A*300202, A*3003, A*3004, A*3006, A*3007, A*3008, A*3009, A*3010, A*3011, A*3012, A*310102, A*3102, A*3103, A*3104, A*3105, A*3106, A*3107, A*3108, A*3109, A*3110, A*3201, A*3202, A*3203, A*3204, A*3205, A*3206, A*3207, A*3208, A*3301, A*330301, A*330302, A*3304, A*3305, A*3306, A*3307, A*3401, A*3402, A*3403, A*3404, A*3405, A*3406, A*3601, A*3602, A*3603, A*3604, A*4301, A*6601, A*6602, A*6603, A*6604, A*680101, A*680102, A*680103, A*6802, A*680301, A*680302, A*6804, A*6805, A*6806, A*6807, A*6808, A*6809, A*6810, A*6811N, A*6812, A*6813, A*6814, A*6815, A*6816, A*6817, A*6818N, A*6819, A*6820, A*6821, A*6822, A*6823, A*6824, A*6825, A*6826, A*6827, A*6901, A*7401, A*7402, A*7403, A*7404, A*7405, A*7406, A*7407, A*7408, A*7409, A*7410, A*8001.
HLA-B
B*070201, B*070202, B*070203, B*070204, B*0703, B*0704, B*0705, B*0706, B*0707, B*0708, B*0709, B*0710, B*0711, B*0712, B*0713, B*0714, B*0715, B*0716, B*0717, B*0718, B*0719, B*0720, B*0721, B*0722, B*0723, B*0724, B*0725, B*0726, B*0727, B*0728, B*0729, B*0730, B*0731, B*0732, B*0733, B*0734, B*0735, B*0736, B*0737, B*0738, B*0801, B*0802, B*0803, B*0804, B*0805, B*0806, B*0807, B*0808N, B*0809, B*0810, B*0811, B*0812, B*0813, B*0814, B*0815, B*0816, B*0817, B*0818, B*0819N, B*0820, B*0821, B*0822, B*1301, B*1302, B*1303, B*1304, B*1306, B*1307N, B*1308, B*1309, B*1310, B*1311, B*1312, B*1313, B*1401, B*1402, B*1403, B*1404, B*1405, B*140601, B*140602, B*15010101, B*15010102N, B*150102, B*150103, B*150104, B*150105, B*1502, B*1503, B*1504, B*1505, B*1506, B*1507, B*1508, B*1509, B*1510, B*151101, B*151102, B*1512, B*1513, B*1514, B*1515, B*1516, B*15170101, B*15170102, B*1518, B*1519, B*1520, B*1521, B*1523, B*1524, B*1525, B*1526N, B*1527, B*1528, B*1529, B*1530, B*1531, B*1532, B*1533, B*1534, B*1535, B*1536, B*1537, B*1538, B*1539, B*1540, B*1542, B*1543, B*1544, B*1545, B*1546, B*1547, B*1548, B*1549, B*1550, B*1551, B*1552, B*1553, B*1554, B*1555, B*1556, B*1557, B*1558, B*1560, B*1561, B*1562, B*1563, B*1564, B*1565, B*1566, B*1567, B*1568, B*1569, B*1570, B*1571, B*1572, B*1573, B*1574, B*1575, B*1576, B*1577, B*1578, B*1579N, B*1580, B*1581, B*1582, B*1583, B*1584, B*1585, B*1586, B*1587, B*1588, B*1589, B*1590, B*1591, B*1592, B*1593, B*1594N, B*180101, B*180102, B*1802, B*1803, B*1804, B*1805, B*1806, B*1807, B*1808, B*1809, B*1810, B*1811, B*1812, B*1813, B*1814, B*1815, B*1817N, B*1818, B*1819, B*1820, B*2701, B*2702, B*2703, B*2704, B*270502, B*270503, B*270504, B*270505, B*270506, B*270507, B*2706, B*2707, B*2708, B*2709, B*2710, B*2711, B*2712, B*2713, B*2714, B*2715, B*2716, B*2717, B*2718, B*2719, B*2720, B*2721, B*2723, B*2724, B*2725, B*2726, B*350101, B*350102, B*3502, B*3503, B*3504, B*3505, B*3506, B*3507, B*3508, B*350901, B*350902, B*3510, B*3511, B*3512, B*3513, B*351401, B*351402, B*3515, B*3516, B*3517, B*3518, B*3519, B*3520, B*3521, B*3522, B*3523, B*3524, B*3525, B*3526, B*3527, B*3528, B*3529, B*3530, B*3531, B*3532, B*3533, B*3534, B*3535, B*3536, B*3537, B*3538, B*3539, B*3540N, B*3541, B*3542, B*3543, B*3544, B*3545, B*3546, B*3547, B*3548, B*3549, B*3550, B*3551, B*3552, B*3553N, B*3701, B*3702, B*3703N, B*3704, B*3705, B*3706, B*3707, B*3801, B*380201, B*380202, B*3803, B*3804, B*3805, B*3806, B*3807, B*3808, B*3809, B*3810, B*390101, B*390103, B*390104, B*390201, B*390202, B*3903, B*3904, B*3905, B*390601, B*390602, B*3907, B*3908, B*3909, B*3910, B*3911, B*3912, B*3913, B*3914, B*3915, B*3916, B*3917, B*3918, B*3919, B*3920, B*3922, B*3923, B*3924, B*3925N, B*3926, B*3927, B*3928, B*3929, B*3930, B*3931, B*3932, B*400101, B*400102, B*400103, B*400104, B*400105, B*400201, B*400202, B*4003, B*4004, B*4005, B*40060101, B*40060102, B*4007, B*4008, B*4009, B*4010, B*4011, B*4012, B*4013, B*401401, B*401402, B*401403, B*4015, B*4016, B*4018, B*4019, B*4020, B*4021, B*4022N, B*4023, B*4024, B*4025, B*4026, B*4027, B*4028, B*4029, B*4030, B*4031, B*4032, B*4033, B*4034, B*4035, B*4036, B*4037, B*4038, B*4039, B*4040, B*4042, B*4043, B*4044, B*4045, B*4046, B*4047, B*4048, B*4049, B*4050, B*4051, B*4052, B*4053, B*4054, B*4055, B*4056, B*4057, B*4101, B*4102, B*4103, B*4104, B*4105, B*4106, B*4201, B*4202, B*4204, B*420501, B*420502, B*4206, B*44020101, B*44020102S, B*440202, B*440203, B*440301, B*440302, B*4404, B*4405, B*4406, B*4407, B*4408, B*4409, B*4410, B*4411, B*4412, B*4413, B*4414, B*4415, B*4416, B*4417, B*4418, B*4419N, B*4420, B*4421, B*4422, B*4423N, B*4424, B*4425, B*4426, B*4427, B*4428, B*4429, B*4430, B*4431, B*4432, B*4433, B*4434, B*4435, B*4436, B*4437, B*4438, B*4439, B*4440, B*4501, B*4502, B*4503, B*4504, B*4505, B*4506, B*4507, B*4601, B*4602, B*4603, B*4604, B*47010101, B*47010102, B*4702, B*4703, B*4704, B*4705, B*4801, B*4802, B*4803, B*4804, B*4805, B*4806, B*4807, B*4808, B*4809, B*4810, B*4901, B*4902, B*4903, B*5001, B*5002, B*5004, B*510101, B*510102, B*510103, B*510104, B*510105, B*510201, B*510202, B*5103, B*5104, B*5105, B*5106, B*5107, B*5108, B*5109, B*5110, B*5111N, B*5112, B*511301, B*511302, B*5114, B*5115, B*5116, B*5117, B*5118, B*5119, B*5120, B*5121, B*5122, B*5123, B*5124, B*5126, B*5127N, B*5128, B*5129, B*5130, B*5131, B*5132, B*5133, B*5134, B*5135, B*5136, B*520101, B*520102, B*520103, B*520104, B*5202, B*5203, B*5204, B*5205, B*5206, B*530101, B*530102, B*5302, B*5303, B*5304, B*5305, B*5306, B*5307, B*5308, B*5309, B*5401, B*5402, B*5501, B*5502, B*5503, B*5504, B*5505, B*5507, B*5508, B*5509, B*5510, B*5511, B*5512, B*5513, B*5514, B*5515, B*5516, B*5601, B*5602, B*5603, B*5604, B*560501, B*560502, B*5606, B*5607, B*5608, B*5609, B*5610, B*5611, B*5612, B*5613, B*5614, B*570101, B*570102, B*5702, B*570301, B*570302, B*5704, B*5705, B*5706, B*5707, B*5708, B*5709, B*5801, B*5802, B*5804, B*5805, B*5806, B*5807, B*5808, B*5809, B*5810N, B*5901, B*670101, B*670102, B*6702, B*7301, B*7801, B*780201, B*780202, B*7803, B*7804, B*7805, B*8101, B*8102, B*8201, B*8202, B*8301.
HLA-C
Cw*010201, Cw*010202, Cw*0103, Cw*0104, Cw*0105, Cw*0106, Cw*0107, Cw*0108, Cw*0109, Cw*0110, Cw*020201, Cw*020202, Cw*020203, Cw*020204, Cw*020205, Cw*0203, Cw*0204, Cw*0205, Cw*0206, Cw*0207, Cw*0208, Cw*0209, Cw*030201, Cw*030202, Cw*030301, Cw*030302, Cw*030303, Cw*030304, Cw*030401, Cw*030402, Cw*030403, Cw*0305, Cw*0306, Cw*0307, Cw*0308, Cw*0309, Cw*0310, Cw*0311, Cw*0312, Cw*0313, Cw*0314, Cw*0315, Cw*0316, Cw*0317, Cw*0318, Cw*04010101, Cw*04010102, Cw*040102, Cw*0403, Cw*040401, Cw*040402, Cw*0405, Cw*0406, Cw*0407, Cw*0408, Cw*0409N, Cw*0410, Cw*0411, Cw*0412, Cw*0413, Cw*0414, Cw*0415, Cw*050101, Cw*050102, Cw*0502, Cw*0503, Cw*0504, Cw*0505, Cw*0506, Cw*0507N, Cw*0508, Cw*0509, Cw*0510, Cw*0602, Cw*0603, Cw*0604, Cw*0605, Cw*0606, Cw*0607, Cw*0608, Cw*0609, Cw*0610, Cw*0611, Cw*070101, Cw*070102, Cw*070103, Cw*07020101, Cw*07020102, Cw*07020103, Cw*0703, Cw*070401, Cw*070402, Cw*0705, Cw*0706, Cw*0707, Cw*0708, Cw*0709, Cw*0710, Cw*0711, Cw*0712, Cw*0713, Cw*0714, Cw*0715, Cw*0716, Cw*0717, Cw*0718, Cw*0719, Cw*0720, Cw*0721, Cw*0722, Cw*0723, Cw*0724, Cw*0725, Cw*0726, Cw*0727, Cw*0728, Cw*0729, Cw*080101, Cw*080102, Cw*0802, Cw*0803, Cw*0804, Cw*0805, Cw*0806, Cw*0807, Cw*0808, Cw*0809, Cw*0810, Cw*0811, Cw*0812, Cw*120201, Cw*120202, Cw*120203, Cw*120301, Cw*120302, Cw*120303, Cw*120401, Cw*120402, Cw*1205, Cw*1206, Cw*1207, Cw*1208, Cw*1209, Cw*1210, Cw*1211, Cw*1212, Cw*1213, Cw*1214, Cw*1215, Cw*140201, Cw*140202, Cw*140203, Cw*1403, Cw*1404, Cw*1405, Cw*150201, Cw*150202, Cw*1503, Cw*1504, Cw*150501, Cw*150502, Cw*150503, Cw*150504, Cw*1506, Cw*1507, Cw*1508, Cw*1509, Cw*1510, Cw*1511, Cw*1512, Cw*1601, Cw*1602, Cw*160401, Cw*1606, Cw*1701, Cw*1702, Cw*1703, Cw*1801, Cw*1802.
HLA-E
E*0101, E*010301, E*010302, E*010303, E*0104.
HLA-F
F*010101, F*010102.
HLA-G
G*010101, G*010102, G*010103, G*010104, G*010105, G*010106, G*010107, G*010108, G*0102, G*0103, G*010401, G*010402, G*010403, G*0105N, G*0106.
HLA-DRA
DRA*0101, DRA*010201, DRA*010202.
HLA-DRB1
DRB1*010101, DRB1*010102, DRB1*010103, DRB1*010201, DRB1*010202, DRB1*010203, DRB1*010204, DRB1*0103, DRB1*0104, DRB1*0105, DRB1*0106, DRB1*0107, DRB1*0108, DRB1*0109, DRB1*0110, DRB1*0111, DRB1*030101, DRB1*030102, DRB1*030201, DRB1*030202, DRB1*0303, DRB1*0304, DRB1*030501, DRB1*030502, DRB1*0306, DRB1*0307, DRB1*0308, DRB1*0309, DRB1*0310, DRB1*0311, DRB1*0312, DRB1*0313, DRB1*0314, DRB1*0315, DRB1*0316, DRB1*0317, DRB1*0318, DRB1*0319, DRB1*0320, DRB1*0321, DRB1*0322, DRB1*0323, DRB1*0324, DRB1*0325, DRB1*0326, DRB1*0327, DRB1*0328, DRB1*040101, DRB1*040102, DRB1*0402, DRB1*040301, DRB1*040302, DRB1*0404, DRB1*040501, DRB1*040502, DRB1*040503, DRB1*040504, DRB1*0406, DRB1*040701, DRB1*040702, DRB1*040703, DRB1*0408, DRB1*0409, DRB1*0410, DRB1*0411, DRB1*0412, DRB1*0413, DRB1*0414, DRB1*0415, DRB1*0416, DRB1*0417, DRB1*0418, DRB1*0419, DRB1*0420, DRB1*0421, DRB1*0422, DRB1*0423, DRB1*0424, DRB1*0425, DRB1*0426, DRB1*0427, DRB1*0428, DRB1*0429, DRB1*0430, DRB1*0431, DRB1*0432, DRB1*0433, DRB1*0434, DRB1*0435, DRB1*0436, DRB1*0437, DRB1*0438, DRB1*0439, DRB1*0440, DRB1*0441, DRB1*0442, DRB1*0443, DRB1*0444, DRB1*0445, DRB1*0446, DRB1*0447, DRB1*0448, DRB1*0449, DRB1*0450, DRB1*070101, DRB1*070102, DRB1*0703, DRB1*0704, DRB1*0705, DRB1*0706, DRB1*0707, DRB1*0708, DRB1*080101, DRB1*080102, DRB1*080201, DRB1*080202, DRB1*080203, DRB1*080302, DRB1*080401, DRB1*080402, DRB1*080403, DRB1*080404, DRB1*0805, DRB1*0806, DRB1*0807, DRB1*0808, DRB1*0809, DRB1*0810, DRB1*0811, DRB1*0812, DRB1*0813, DRB1*0814, DRB1*0815, DRB1*0816, DRB1*0817, DRB1*0818, DRB1*0819, DRB1*0820, DRB1*0821, DRB1*0822, DRB1*0823, DRB1*0824, DRB1*0825, DRB1*0826, DRB1*0827, DRB1*0828, DRB1*0829, DRB1*090102, DRB1*090103, DRB1*0902, DRB1*0903, DRB1*100101, DRB1*100102, DRB1*110101, DRB1*110102, DRB1*110103, DRB1*110104, DRB1*110105, DRB1*1102, DRB1*1103, DRB1*110401, DRB1*110402, DRB1*1105, DRB1*110601, DRB1*110602, DRB1*1107, DRB1*110801, DRB1*110802, DRB1*1109, DRB1*1110, DRB1*1111, DRB1*111201, DRB1*111202, DRB1*1113, DRB1*1114, DRB1*1115, DRB1*1116, DRB1*1117, DRB1*1118, DRB1*1119, DRB1*1120, DRB1*1121, DRB1*1122, DRB1*1123, DRB1*1124, DRB1*1125, DRB1*1126, DRB1*112701, DRB1*112702, DRB1*1128, DRB1*1129, DRB1*1130, DRB1*1131, DRB1*1132, DRB1*1133, DRB1*1134, DRB1*1135, DRB1*1136, DRB1*1137, DRB1*1138, DRB1*1139, DRB1*1140, DRB1*1141, DRB1*1142, DRB1*1143, DRB1*1144, DRB1*1145, DRB1*1146, DRB1*1147, DRB1*1148, DRB1*1149, DRB1*1150, DRB1*1151, DRB1*1152, DRB1*1153, DRB1*1154, DRB1*120101, DRB1*120102, DRB1*120201, DRB1*120202, DRB1*120302, DRB1*1204, DRB1*1205, DRB1*1206, DRB1*1207, DRB1*1208, DRB1*1209, DRB1*1210, DRB1*130101, DRB1*130102, DRB1*130103, DRB1*130201, DRB1*130202, DRB1*130301, DRB1*130302, DRB1*1304, DRB1*1305, DRB1*1306, DRB1*130701, DRB1*130702, DRB1*1308, DRB1*1309, DRB1*1310, DRB1*1311, DRB1*1312, DRB1*1313, DRB1*131401, DRB1*131402, DRB1*1315, DRB1*1316, DRB1*1317, DRB1*1318, DRB1*1319, DRB1*1320, DRB1*1321, DRB1*1322, DRB1*1323, DRB1*1324, DRB1*1325, DRB1*1326, DRB1*1327, DRB1*1328, DRB1*1329, DRB1*1330, DRB1*1331, DRB1*1332, DRB1*1333, DRB1*1334, DRB1*1335, DRB1*1336, DRB1*1337, DRB1*1338, DRB1*1339, DRB1*1340, DRB1*1341, DRB1*1342, DRB1*1343, DRB1*1344, DRB1*1345, DRB1*1346, DRB1*1347, DRB1*1348, DRB1*1349, DRB1*1350, DRB1*1351, DRB1*1352, DRB1*1353, DRB1*1354, DRB1*1355, DRB1*1356, DRB1*1357, DRB1*1358, DRB1*1359, DRB1*1360, DRB1*1361, DRB1*1362, DRB1*1363, DRB1*1364, DRB1*1365, DRB1*140101, DRB1*140102, DRB1*1402, DRB1*140301, DRB1*140302, DRB1*1404, DRB1*140501, DRB1*140502, DRB1*1406, DRB1*140701, DRB1*140702, DRB1*1408, DRB1*1409, DRB1*1410, DRB1*1411, DRB1*1412, DRB1*1413, DRB1*1414, DRB1*1415, DRB1*1416, DRB1*1417, DRB1*1418, DRB1*1419, DRB1*1420, DRB1*1421, DRB1*1422, DRB1*1423, DRB1*1424, DRB1*1425, DRB1*1426, DRB1*1427, DRB1*1428, DRB1*1429, DRB1*1430, DRB1*1431, DRB1*1432, DRB1*1433, DRB1*1434, DRB1*1435, DRB1*1436, DRB1*1437, DRB1*1438, DRB1*1439, DRB1*1440, DRB1*1441, DRB1*1442, DRB1*1443, DRB1*1444, DRB1*1445, DRB1*1446, DRB1*1447, DRB1*1448, DRB1*150101, DRB1*150102, DRB1*150103, DRB1*150104, DRB1*150105, DRB1*150201, DRB1*150202, DRB1*150203, DRB1*1503, DRB1*1504, DRB1*1505, DRB1*1506, DRB1*1507, DRB1*1508, DRB1*1509, DRB1*1510, DRB1*1511, DRB1*1512, DRB1*1513, DRB1*1514, DRB1*1515, DRB1*1516, DRB1*160101, DRB1*160102, DRB1*160201, DRB1*160202, DRB1*1603, DRB1*1604, DRB1*160501, DRB1*160502, DRB1*1607, DRB1*1608.
HLA-DRB2-9
DRB2*0101, DRB3*010101, DRB3*01010201, DRB3*01010202, DRB3*010103, DRB3*010104, DRB3*0102, DRB3*0103, DRB3*0104, DRB3*0105, DRB3*0106, DRB3*0107, DRB3*0108, DRB3*0109, DRB3*0110, DRB3*0111, DRB3*0201, DRB3*020201, DRB3*020202, DRB3*020203, DRB3*020204, DRB3*0203, DRB3*0204, DRB3*0205, DRB3*0206, DRB3*0207, DRB3*0208, DRB3*0209, DRB3*0210, DRB3*0211, DRB3*0212, DRB3*0213, DRB3*0214, DRB3*0215, DRB3*0216, DRB3*0217, DRB3*0218, DRB3*0219, DRB3*030101, DRB3*030102, DRB3*0302, DRB3*0303, DRB4*01010101, DRB4*0102, DRB4*01030101, DRB4*01030102N, DRB4*010302, DRB4*010303, DRB4*010304, DRB4*0104, DRB4*0105, DRB4*0106, DRB4*0107, DRB4*0201N, DRB4*0301N, DRB5*010101, DRB5*010102, DRB5*0102, DRB5*0103, DRB5*0104, DRB5*0105, DRB5*0106, DRB5*0107, DRB5*0108N, DRB5*0109, DRB5*0110N, DRB5*0111, DRB5*0112, DRB5*0113, DRB5*0202, DRB5*0203, DRB5*0204, DRB5*0205, DRB6*0101, DRB6*0201, DRB6*0202, DRB7*010101, DRB7*010102, DRB8*0101, DRB9*0101.
HLA-DQA1
DQA1*010101, DQA1*010102, DQA1*010201, DQA1*010202, DQA1*0103, DQA1*010401, DQA1*010402, DQA1*0105, DQA1*0106, DQA1*0107, DQA1*0201, DQA1*030101, DQA1*0302, DQA1*0303, DQA1*040101, DQA1*040102, DQA1*0402, DQA1*0403N, DQA1*0404, DQA1*050101, DQA1*050102, DQA1*0502, DQA1*0503, DQA1*0504, DQA1*0505, DQA1*060101, DQA1*060102, DQA1*0602.
HLA-DQB1
DQB1*020101, DQB1*020102, DQB1*0202, DQB1*0203, DQB1*030101, DQB1*030102, DQB1*030201, DQB1*030202, DQB1*030302, DQB1*030303, DQB1*0304, DQB1*030501, DQB1*030502, DQB1*030503, DQB1*0306, DQB1*0307, DQB1*0308, DQB1*0309, DQB1*0310, DQB1*0311, DQB1*0312, DQB1*0313, DQB1*0401, DQB1*0402, DQB1*050101, DQB1*050102, DQB1*050201, DQB1*050202, DQB1*050301, DQB1*050302, DQB1*0504, DQB1*060101, DQB1*060102, DQB1*060103, DQB1*0602, DQB1*0603, DQB1*060401, DQB1*060402, DQB1*060501, DQB1*060502, DQB1*0606, DQB1*0607, DQB1*0608, DQB1*0609, DQB1*0610, DQB1*061101, DQB1*061102, DQB1*0612, DQB1*0613, DQB1*0614, DQB1*0615, DQB1*0616, DQB1*0617, DQB1*0618, DQB1*0619, DQB1*0620, DQB1*0621, DQB1*0622, DQB1*0623.
HLA-DPA1
DPA1*010301, DPA1*010302, DPA1*010303, DPA1*0104, DPA1*0105, DPA1*0106, DPA1*0107, DPA1*0108, DPA1*020101, DPA1*020102, DPA1*020103, DPA1*020104, DPA1*020105, DPA1*020106, DPA1*020201, DPA1*020202, DPA1*020203, DPA1*0203, DPA1*0301, DPA1*0302, DPA1*0303, DPA1*0401.
HLA-DPB1
DPB1*010101, DPB1*010102, DPB1*010103, DPB1*0102, DPB1*020102, DPB1*020103, DPB1*020104, DPB1*020105, DPB1*020106, DPB1*0202, DPB1*0203, DPB1*030101, DPB1*030102, DPB1*0302, DPB1*040101, DPB1*040102, DPB1*0402, DPB1*0501, DPB1*0601, DPB1*0801, DPB1*0901, DPB1*1001, DPB1*110101, DPB1*110102, DPB1*1301, DPB1*1401, DPB1*1501, DPB1*1601, DPB1*1701, DPB1*1801, DPB1*1901, DPB1*200101, DPB1*200102, DPB1*2101, DPB1*2201, DPB1*2301, DPB1*2401, DPB1*2501, DPB1*260101, DPB1*260102, DPB1*2701, DPB1*2801, DPB1*2901, DPB1*3001, DPB1*3101, DPB1*3201, DPB1*3301, DPB1*3401, DPB1*3501, DPB1*3601, DPB1*3701, DPB1*3801, DPB1*3901, DPB1*4001, DPB1*4101, DPB1*4401, DPB1*4501, DPB1*4601, DPB1*4701, DPB1*4801, DPB1*4901, DPB1*5001, DPB1*5101, DPB1*5201, DPB1*5301, DPB1*5401, DPB1*5501, DPB1*5601, DPB1*5701, DPB1*5801, DPB1*5901, DPB1*6001, DPB1*6101N, DPB1*6201, DPB1*6301, DPB1*6401N, DPB1*6501, DPB1*6601, DPB1*6701, DPB1*6801, DPB1*6901, DPB1*7001, DPB1*7101, DPB1*7201, DPB1*7301, DPB1*7401, DPB1*7501, DPB1*7601, DPB1*7701, DPB1*7801, DPB1*7901, DPB1*8001, DPB1*8101, DPB1*8201, DPB1*8301, DPB1*8401, DPB1*8501, DPB1*8601, DPB1*8701, DPB1*8801, DPB1*8901, DPB1*9001, DPB1*9101, DPB1*9201, DPB1*9301, DPB1*9401, DPB1*9501, DPB1*9601, DPB1*9701, DPB1*9801, DPB1*9901.
HLA-DMA
DMA*0101, DMA*0102, DMA*0103, DMA*0104.
HLA-DMB
DMB*0101, DMB*0102, DMB*0103, DMB*0104, DMB*0105, DMB*0106.
HLA-DOA
DOA*010101, DOA*01010201, DOA*01010202, DOA*01010203, DOA*010103, DOA*01010401, DOA*01010402, DOA*010105.
HLA-DOB
DOB*01010101, DOB*01010102, DOB*010102, DOB*010201, DOB*010202, DOB*0103, DOB*01040101, DOB*01040102.
MHC класса I
H-2Db, H-2Dd, H-2Dk, H-2Dq, H-2Kb, H-2Kd, H-2Kk, H-2Ld, H-2M3, H-2Ad, H-2Ag7, H-2Ak, H2-Ab, H-2Ed, H-2Ek, H-2Bxk, H-2F, H-2I, H-2P, H-2R, H-2S, H-2Sxd, H-2T4, H-2U.
MHC класса II
I-Ab, I-Ad, I-Ag7, I-Ak, I-Ap, I-Aq, I-Ar, I-As, I-Au, I-Av, I-Ea, I-Eb, I-Ed, I-Ek, I-Es, I-Eu, H-2Q, H-2Qa-2, H-2Qa-2a, Qa-1a, Qa-1b.
Настоящее изобретение не ограничивается такими молекулами MHC и HLA и может быть адаптировано к вновь открываемым молекулам, если желательно, просто путем создания способности веществ, таких как пептиды, к реагированию с этими молекулами. Это можно без труда успешно выполнить, используя известные методы, которые являются общепринятыми в данной области техники. Особенно предпочтительные для использования с настоящим изобретением аллели HLA включают следующие аллели:
HLA класса I
HLA класса II
Наиболее предпочтительными аллелями в соответствии с настоящим изобретением являются следующие аллели:
HLA-A*0201, HLA-A*0206, HLA-A*0301, HLA-A*1101, HLA-A*2402, HLA-A*3401, HLA-B*0702, HLA-B*0801, HLA-B*1301, HLA-B*27, HLA-B*4002, HLA-B*5101, HLA-Cw*03, HLA-cW*07
HLA-DRB1*0301, HLA-DRB1*0401, HLA-DRB1*0701, HLA-DRB1*1501, HLA-DRB1*1104, HLA-DRB1*1101, HLA-DRB4*0101
HLA-DQA1*01, HLA-DQA1*02, HLA-DQA1*05
HLA-DQB1*03, HLA-DQB1*04, HLA-DQB1*05, HLA-DQB1*06
HLA-DPA1*01, HLA-DPA1*02
HLA-DPB1*02, HLA-DPB1*04
Настоящее изобретение теперь будет описано только в качестве примера, со ссылкой на следующие конкретные варианты осуществления.
ПРИМЕРЫ
Приготовление белковых фракций слюны членистоногих
Для определения эффекта конкретных последовательностей настоящего изобретения их иммуногенность можно проверить на фоне различных белковых фракций слюны членистоногих. Те последовательности, которые вызывают у позвоночного продукцию клеток иммунной системы, которые распознают по меньшей мере один эпитоп в конкретных белковых фракциях слюны членистоногих, применимы в вакцинах настоящего изобретения.
Белковые фракции слюны легко выделить, используя стандартные лабораторные методы, хорошо известные квалифицированному специалисту. Можно использовать любые белковые фракции слюны членистоногих, поскольку авторы настоящего изобретения установили, что в действительности важна масса белковой фракции. В частности, применимы фракции с массой, составляющей 40 кДа или меньше, 30 кДа или меньше, предпочтительно 20-40 кДа и более предпочтительно 20 кДа или меньше.
Следующий протокол предоставлен для приведения примера белковой фракции, на фоне которой можно проверить последовательности-кандидаты. В нем используется слюна от комаров Anopheles gambiae, хотя может использоваться слюна любого членистоногого.
Пары слюнных желез Anopheles gambiae иссекали из колоний самок комаров. Пятнадцать пар слюнных желез собирали в 20 мкл PBS и лизировали добавлением 5 мкл буфера для образца, используемого для проведения электрофореза в SDS-ПААГ, содержащего 0,25% 2-β-меркаптоэтанола. После встряхивания и кипячения в течение 5 мин белковую смесь вносили в 4-20%-градиентный Tris-глициновый гель Novex (Invitrogen). Затем гель окрашивали серебром и фотографировали (смотри фиг.9).
Пунктирные стрелки указывают положения точек отсечки для отбора фракций пар слюнных желез, которые можно использовать для иммунизации и исследования (т.е. <20 кДа, 20-40 кДа, 40-80 кДа и >80 кДа). Сплошная стрелка указывает положение точки отсечки для отбора фракций пар слюнных желез, составляющих <30 кДа и >30 кДа.
Идентификация образцов белков-кандидатов из слюны комаров
Используя подход, схожий с приведенным в качестве примера протоколом, очерченным выше, для исследования было приготовлено несколько образцов белков слюны.
Слюнные железы иссекали из самок комаров Anopheles gambiae и хранили в PBS при -70°С до использования.
Для анализа в геле слюнные железы лизировали замораживанием-оттаиванием, добавляли буфер для образца (pH 3-10), используемого для проведения IEF, Novex® (Invitrogen), и результирующий материал анализировали в геле для IEF Novex® (Invitrogen). Затем гель фиксировали с использованием 12% трихлоруксусной кислоты, отмывали три раза водой и окрашивали Кумасси синим. Получаемый в результате гель продемонстрирован на фиг.1.
После окрашивания и удаления красителя IEF-гель инкубировали в 20% этаноле в течение 10 минут и полоску геля, содержащую линию с белками слюнных желез, вырезали. Эту полоску геля уравновешивали в течение 5 мин в 2× буфере для образца, используемого для проведения электрофореза в SDS-ПААГ, содержащем 20% этанола, дважды ополаскивали в буфере для образца, используемого для проведения электрофореза в SDS-ПААГ, и вносили в одну лунку 4-20%-градиентного Tris-глицинового геля Novex® (Invitrogen). Получаемый в результате гель продемонстрирован на фиг.2.
Наконец, гель, содержащий разделенные белки слюнных желез, окрашивали, используя краситель Proteosilver (Sigma), в соответствии с инструкциями производителя.
Для анализа были определены четыре группы белков из геля (названные соединениями 1, 2, 3 и 4):
Соединение 1: белковая фракция слюнных желез с массой <20 кДа
Соединение 2: белковая фракция слюнных желез с массой 20 кДа < Х < 40 кДа
Соединение 3: белковая фракция слюнных желез с массой 40 кДа < Х < 80 кДа
Соединение 4: белковая фракция слюнных желез с массой >80 кДа
ЭКСПЕРИМЕНТ 1
Цели:
(А) Установить эффективность кандидатов в защите животных от заражения при укусе инфицированных комаров (т.е. Anopheles gambiae, инфицированных Plasmodium yoelii nigeriensis).
(В) Установить уровень перекрестной реактивности ответа против комаров, индуцированного кандидатами, для совокупности различных видов комаров (например, Anopheles gambiae и Anopheles stephensi).
(С) Установить эффективность кандидатов в предотвращении инфицирования комаров (Anopheles gambiae и Anopheles stephensi) агентами Plasmodium yoelii nigeriensis после укусов иммунизированных и инфицированных мышей.
Соединения-кандидаты
Выбранными соединениями были определенные выше соединения:
Соединение 1: белковая фракция слюнных желез с массой <20 кДа
Соединение 2: белковая фракция слюнных желез с массой 20 кДа < Х < 40 кДа
Соединение 3: белковая фракция слюнных желез с массой 40 кДа < Х < 80 кДа
Соединение 4: белковая фракция слюнных желез с массой >80 кДа
Штамм и число вовлеченных животных
Использовали мышей CD1. Использовали пять экспериментальных групп (1, 2, 3, 4 и 5), при этом группа 1 представляла собой отрицательную контрольную группу, а группы 2-5 - испытуемые группы, при этом в каждой группе содержалось 9 животных.
Экспериментальный протокол
День 1: 4 группы (группы 2, 3, 4 и 5) из 9 мышей CD1 каждая (N=4×9=36) иммунизировали подкожным введением доз соединений-кандидатов на вакцину (группу 2 - соединением 1, группу 3 - соединением 2 и т.д.).
День 14: Всех мышей подвергали бустер-иммунизации с использованием тех же доз соединений-кандидатов на вакцину (группу 2 - соединением 1, группу 3 - соединением 2 и т.д.).
День 21: У всех животных брали образцы крови. Образцы хранили замороженными (-20°С) до сбора. Каждую группу делили на дальнейшие подгруппы: А - 5 животных, В - 4 животных.
Подгруппа А
День 28: Всех животных в подгруппах А заражали через укусы 5-9 инфицированных комаров (т.е. Anopheles gambiae, инфицированных Plasmodium yoelii nigeriensis) в брюшной области. Всех животных сохраняли до первого установления наличия паразитемии или в течение максимум 6 недель после заражения инфицированными комарами. Всех животных убивали при обескровливании, и образцы сыворотки хранили замороженными (-20°С) до сбора.
Подгруппа В
День 28: Всех животных в подгруппах В использовали для кормления (в брюшной области) следующего числа неинфицированных комаров:
5-10 Anopheles gambiae и 5-10 Anopheles stephensi
Всех этих комаров исследовали на:
1. Выживание в течение 8-дневного периода.
2. Число отложенных яиц.
3. Число продуцированных яиц.
4. Число взрослых комаров (F), полученных из отложенных яиц.
День 32: Всех животных в подгруппах В инфицировали Plasmodium yoelii nigeriensis путем прямого внутривенного введения паразитов.
День 32: После идентификации активной малярийной инфекции у всех (или по меньшей мере 75%) животных в группе В всех инфицированных животных использовали для кормления (в брюшной области) большого числа (>10 для каждой мыши) как неинфицированных Anopheles gambiae, так и неинфицированных Anopheles stephensi.
Всех этих комаров исследовали на:
1. Выживание в течение 8-дневного периода.
2. Число комаров с малярийными паразитами в их слюнных железах среди тех, кто пережил требуемый инкубационный период (17 дней).
3. Число отложенных яиц.
4. Число продуцированных яиц.
5. Число взрослых комаров (F1), полученных из отложенных яиц.
После кормления комаров всех животных убивали при обескровливании и образцы сыворотки хранили замороженными (-20°С) до сбора.
Любое количество экспериментального соединения, остающееся в конце исследования, хранили замороженным (-20°С) до сбора.
Результаты
Графические представления результатов экспериментов демонстрируются на фиг.3А-3I и 4. В первом наборе фигур (фигуры 3Х) демонстрируются следующие данные по эффекту вакцины на фертильность комаров, для каждой из групп 1-5:
3A: Процент комаров, получивших пищу.
3B: Среднее число продуцированных яиц.
3C: Среднее число отложенных яиц.
3D: Процентная доля вылупления.
3E: Среднее число личинок.
3F: Среднее число куколок.
3G: Процент окукливания.
3H: Процент вылета.
3I: Среднее число взрослых комаров.
Числовые данные, поддерживающие каждое из этих графических представлений А-I, размещены соответственно (колонка А для Фиг.3А и т.д.) в таблице 2 ниже.
Данные, представленные в таблицах 3А-3I ниже, показывают р-величины, полученные с использованием непараметрического статистического анализа Манна-Уитни указанных выше данных.
На фиг.4 демонстрируется выживание в процентах комаров в каждой из пяти групп в течение периода времени, составляющего 8 дней. Число комаров в каждой группе в день 0 было следующим:
Данные, имеющие отношение к графическому представлению на фиг.4, представлены в таблице 4 ниже.
Данные, представленные в таблице 5(i)-5(viii) ниже, показывают р-величины, полученные с использованием непараметрического статистического анализа Манна-Уитни указанных выше данных.
ЭКСПЕРИМЕНТ 2: Индукция продукции цитокинов путем иммунизации являющимися полипептидами антигенами
Пептиды и рекомбинантные белки
Самую эффективную в эксперименте 1 фракцию исследовали далее для идентификации полипептидов, которые могут использоваться в вакцинах. Эффективность пептидов настоящего изобретения определяли, используя следующий протокол.
Иммунизации
Все исследуемые полипептиды (препараты антигенов) синтезируют с помощью химической технологии с использованием Fmoc-защитных групп.
Мышей C57BL/6 возрастом от шести до десяти недель иммунизируют подкожным введением дозы препарата антигенов в объеме 200 мкл на одну мышь. В испытуемой группе каждая доза препарата антигенов содержит эквимолярную смесь пептидов (10 нмоль каждого), приготовленную в адъюванте (Sigma) в соответствии с инструкциями производителя. В контрольной группе каждая доза препарата антигена содержит равную дозу нерелевантного полипептида, приготовленного в IFA (Sigma) в соответствии с инструкциями производителя (препарата NRP).
В день 15 после иммунизации все животные получают бустер-иммунизацию, используя такие же дозы и путь введения, как и первоначальные дозы и путь введения.
Наконец, в день 20 всех животных сортируют и собирают их селезенки и сыворотки.
ELISA цитокинов
Селезенки мышей, относящихся к одной и той же экспериментальной группе, объединяют, осторожно подвергают сепарации в сеточном фильтре для клеток и эритроциты удаляют обработкой буфером для лизиса эритроцитов (девять частей 0,16 M NH4Cl и одна часть 0,17 M Tris, pH 7,2). Суспензию спленоцитов от каждой экспериментальной группы засевают в 96-луночные планшеты в четырех повторах при плотности 4 × 106 клеток/лунку в среду IMDM (Invitrogen), дополненную 0,02 мМ β-меркаптоэтанолом (Sigma), 50 МЕ/50 мг/мл пенициллина/стрептомицина (Sigma) и 10% FCS (Sigma) и содержащую каждый из исследуемых антигенов - полипептидов (2 мкМ). Через 3 дня инкубации при 37°С супернатант собирают и анализируют на IFN-γ и IL-4 с помощью сэндвич-ELISA для цитокинов в соответствии с протоколом производителя (Pharmingen). Нижние пределы обнаружения для этого анализа составляют 9,77 пг/мл для IL-4 и 39,06 пг/мл для IFN-γ.
Специфичный для IgG2a ELISA
96-луночные планшеты для микротитрования, используемые для ELISA (Becton-Dickinson), покрывают 2 мМ каждого экспериментального полипептида в PBS. После инкубации в течение ночи при 4°С планшеты дважды промывают в PBST (PBS, содержащем 0,5% Tween-20) и лунки блокируют 1% фракции V BSA в PBST. После инкубации в течение 1 ч планшеты трижды промывают в PBST и в лунки добавляют ряд разведений испытуемых и контрольной сывороток в PBST. После инкубации в течение 2 ч планшеты шесть раз промывают в PBST и во все лунки добавляют первичные сыворотки против Ig2a мыши. После инкубации в течение 1 ч планшеты шесть раз промывают в PBST и во все лунки добавляют сыворотки против первичных сывороток против Ig2a мыши. После инкубации в течение 1 ч планшеты семь раз промывают в PBST и во все лунки добавляют субстрат ТМВ. После инкубации в течение 20-30 минут реакции останавливают добавлением HCl и считывают оптическую плотность при 450 нм.
Статистический анализ
Статистически значимые различия в продукции IFN-γ в ответ на различные антигены между испытуемой и контрольной группами устанавливают благодаря непараметрическому анализу Манна-Уитни образцов. Различия считаются статистически значимыми, если р-величина ниже 0,05.
ЭКСПЕРИМЕНТ 3 - Оценка иммунного ответа на различные полипептиды
Были исследованы следующие полипептиды: SEQ ID NO:20, SEQ ID NO:28, SEQ ID NO:30, SEQ ID NO:31, SEQ ID NO:32 и SEQ ID NO:35. Эти пептиды смешивали вместе с образованием вакцины-кандидата для проверки (называемой AGS-смесью пептидов).
Тип и степень иммунного ответа, индуцированного путем вакцинации этими пептидами, оценивали в соответствии с представленным ниже протоколом:
День 1: Иммунизировать 2 группы из 4 мышей CD1 каждая следующими вводимыми подкожно дозами продуктов-кандидатов на вакцину:
- Смеси нерелевантных пептидов (NRP) (10 нмоль каждого) + ISA-51
- AGS-смеси пептидов (10 нмоль каждого) + ISA-51
День 15: Осуществить бустер-иммунизацию всех животных теми же дозами продуктов-кандидатов на вакцину.
День 21: В заключение обескровить всех животных. Собрать по отдельности селезенки и проверить на продукцию IFN-гамма в ответ на:
- Отдельные пептиды AGS (2 мкМ каждого)
- AGS-смесь (0,5 мкМ и 2 мкМ каждого)
- Конканавалин А
- Контроль
После дня 21: Проверить все сыворотки на способность вступать в реакции с пептидами AGS.
Результаты
Продукция IFN-гамма после 96-часовой стимуляции in vitro антигенами показана на диаграмме на фиг.5.
Продукция IFN-гамма в ответ на SEQ ID NO:28, SEQ ID NO:30 и SEQ ID NO:35, а также препарат AGS-смеси являются статистически значимыми (p<0,05).
SEQ ID NO:20, SEQ ID NO:31 и SEQ ID NO:32 индуцируют ответ большей степени у животных, иммунизированных AGS-смесью, но они также, по-видимому, являются стимулирующими, неспецифическим образом, спленоциты у мышей, иммунизированных NRP-смесью.
Образование Ig в целом в сыворотке в ответ на антигены показано на диаграмме на фиг.6. Образования Ig в целом в ответ на SEQ ID NO:20 и SEQ ID NO:30 являются статистически значимыми (p<0,05).
ЭКСПЕРИМЕНТ 4 - Исследование заражения после иммунизации AGS-смесью пептидов
Для проверки способности препарата AGS-смеси предоставлять защиту от природной малярийной инфекции мышей CD1 подвергали иммунизации и заражению в соответствии с приведенным ниже протоколом:
День 0: Взять образцы крови у всех животных. Сохранять образцы для дальнейшего анализа.
День 1: Иммунизировать 2 (две) группы из 8 мышей CD1 каждая подкожным введением следующих доз продуктов-кандидатов на вакцину:
- Смеси нерелевантных пептидов (NRP) (10 нмоль каждого) + ISA-51
- AGS-смеси пептидов (10 нмоль каждого) + ISA-51
День 7: Взять образцы крови у всех животных. Сохранять образцы для дальнейшего анализа.
День 14: Осуществить бустер-иммунизацию животных теми же дозами продуктов-кандидатов на вакцину.
День 21: Взять образцы крови у всех животных. Сохранять образцы для дальнейшего анализа.
День 28: Всех животных заражают через укусы 8 инфицированных комаров (т.е. Anopheles gambiae, инфицированных Plasmodium yoelii nigeriensis) в брюшной области. Всех животных сохраняют до первого установления наличия паразитемии или в течение максимум 6 недель после заражения инфицированными комарами.
День 70 (максимум): В заключение обескровить всех животных.
Результаты
Образование Ig в целом в сыворотках в ответ на AGS-смесь показано на графике фиг.7.
У одного животного в группе, иммунизированной AGS-смесью, продемонстрировано значительно меньшее образование Ig в целом, чем у остальных животных в этой группе (<50% среднего образования Ig в целом в группе, иммунизированной AGS-смесью).
В день заражения одно животное в группе, иммунизированной NRP-смесью, и два животных в группе, иммунизированной AGS-смесью, нельзя было заразить из-за нехватки инфицированных комаров.
Среди подвергнутых заражению животных животные в группе, иммунизированной AGS-смесью, продемонстрировали большую степень выживания, чем животные в контрольной группе, иммунизированной NRP-смесью (смотри фиг.8). Одним животным, которое умерло в иммунизированной AGS-смесью группе, было тем же животным, у которого не развился сильный гуморальный иммунный ответ на препарат AGS.
Реферат
Группа изобретений относится к полипептидной композиции, содержащей один или несколько полипептидов, которые являются иммуногенными у позвоночного, так что они вызывают у позвоночного продукцию клеток иммунной системы, способных к распознаванию по меньшей мере одного эпитопа в белковой фракции слюны членистоногих, причем белковая фракция слюны членистоногих имеет массу, составляющую 20 кДа или меньше, а полипептиды независимо выбирают из последовательностей полипептидов SEQ ID NO:1-44 или имеющих 7 аминокислот или более подпоследовательностей, способам ее получения, применению для получения лекарственного средства. Группа изобретений эффективна при лечении и профилактике распространяемой членистоногими болезни. 9 н. и 35 з.п. ф-лы, 10 ил., 21 табл., 4 пр.
Формула
полипептидных последовательностей SEQ ID NO:1-28, 33-39 и 44 или подпоследовательностей этих последовательностей, имеющих 7 аминокислот или более:
SEQ ID NO:1 HLTLFTVAVLLLAAAALLLLLPPAYSTTLTPP
SEQ ID NO:2 PLSYCHLFLTHTLARALSFSRSDCL
SEQ ID NO:3 KNVFFALLLWLVCCLVSVQGNEI
SEQ ID NO:4 KLLVLLICLFFYHTHCTTAYLWLAMGV
SEQ ID NO:5 FLKGSFPRFQMCVMLIGFFSSAKCL
SEQ ID NO:6 NDYQALLGLCCPWIDLAAADLPMRRHAKA
SEQ ID NO:7 FYSVGKLVKVLLVMAVCCLLLCTAPTGADPL
SEQ ID NO:8 MKFAFAFVLIALFAVFAVSQALPQPEQAAA
SEQ ID NO:9 DGASAITKIVLELTPEQAAAV
SEQ ID NO:10 TLFIFLVCCQIPLFGIMSSDSADPFYWIRVILA
SEQ ID NO:11 GRVMCLLRLMSTLLWLSIVGK
SEQ ID NO:12 LYSGYRLLVLLVMTVCCLLLFIAPTGADPLPGQTQRTL
SEQ ID NO:13 MYCVIKGKTGGYCNSEGLCTCRAEDLHFLLKPIINKD
SEQ ID NO:14 NAEDPRTELIGCGSVLFHLAANRLSLQLEEFAVCKR
SEQ ID NO:15 ALIGLLLCSVQSVTANDPVDALGACSGNLFGLLMTRL
SEQ ID NO:16 SKLFVLAFLCLALWWQSAPQYARGDVPT
SEQ ID NO:17 SMLVAFATLSVALWWAIPANFNYGGGGGYFINGTGQ
SEQ ID NO:18 IYEKLPAYLSEVSARVNVLQVSLQHDLPNLQ
SEQ ID NO:19 EMKLAKVALVTISLWFMAWTPYLVINFTGI
SEQ ID NO:20 LLPAKVIPDKTAAYVAYGGQETLVEHVEVLV
SEQ ID NO:21 FYTCFLGTSSLAGFKNAVDYDELLKAG
SEQ ID NO:22 VLEVLGFVEDNGELVFQELLGVLKMVDPDGD
SEQ ID NO:23 KLTPTWWLLCLTFVADALTIQELRAQIAQQRIQQRYGVTVATT
SEQ ID NO:24 SLSDYGLIELKEHCLECCQKDTEADSKLKVYPAAVLEV
SEQ ID NO:25 TYICFILHGVSEIIPQQQKKTMKFLLLVASVLCLVLI
SEQ ID NO:26 RYFWIALICPLIIVETLAV
SEQ ID NO:27 LLLYLDAADLRRALHQYQLLAAQGDRHLPQQIVKFV
SEQ ID NO:28 VLLTPALQAYIMDEHNLNRSNIALGRIRPYPSAVKMP
SEQ ID NO:33 KFYRLISTLLWWIAPRHQCSPFFFQYNRPYL
SEQ ID NO:34 NYVPDVSALEQDIIEVDPETKEMLKHLDFNNIWQL
SEQ ID NO:35 QYSMECLEAAEPKYLDGLKTLADETAQC
SEQ ID NO:36 EYAQVTKMLGNGRLEAMCFDGVKRLCHIRGKL
SEQ ID NO:37 KLFLTLLSTLSVAMVFALPAHHHSRG
SEQ ID NO:38 ELEEARLVAEELEERQQELDYLKRYLVGRLQAV
SEQ ID NO:39 SYFLTVCLLALVQSETVQD
SEQ ID NO:44 LLLAMVLLPLLLLESWPYAAAEKVW.
дополнительно содержит одну или несколько последовательностей, независимо выбранных из:
полипептидных последовательностей SEQ ID NO:29-32 или 40-43 или подпоследовательностей этих последовательностей, имеющих 7 аминокислот или более:
SEQ ID NO:29 VLKGETHKALKLKDGGHYLVEFKSIYM
SEQ ID NO:30 VLHSMLVNASLAEMVKESYQTHGADGRMWRMLKFVRLLP
SEQ ID NO:31 RVRALRALLETLLQHQGEQNNDVYLIRLAHET
SEQ ID NO:32 ELQQALSSLNAGSGSCAEVFNAYLPVHNKYIGVSRKI
SEQ ID NO:40 AMTNANLVGLTISLAYAIFFLLYTPPTGRSS
SEQ ID NO:41 SFAWLLYGIILRSNFLWQNLMALALSAVQLSLFII
SEQ ID NO:42 AFPFISGFLSCFMWLKYGVLTEESTLILVNFIGSAL
SEQ ID NO:43 GLLCCCLAVLFFASPLTMLAHVIR.

Комментарии