Способ производства комбинированной вакцины - RU2264226C2
Код документа: RU2264226C2
Чертежи





Описание
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
Техническая область
Настоящее изобретение относится к способу производства комбинированной вакцины, способной одновременно предотвращать различные заболевания детей раннего возраста, такие как дифтерия, столбняк, коклюш, гепатит В и другие заболевания, которые следует предотвращать у детей раннего возраста.
Основа создания изобретения
Комбинированная вакцина относится к вакцине, изготовленной посредством сочетания защитных антигенов для каждого заболевания по отношению к различным другим инфекционным заболеваниям, или к вакцине, изготовленной посредством комбинирования различных родственных антигенов для предотвращения одного инфекционного заболевания.
В качестве примера указанных вакцин первого названного типа может служить вакцина DTP, способная усиливать иммунитет по отношению к дифтерии, столбняку и коклюшу, вакцина MMR, способная усиливать иммунитет по отношению к кори, эпидемическому паротиту, краснухе и т.п. Перечисленные вакцины используются уже в течение почти 20 лет. В качестве примера указанных вакцин второго названного типа может служить пневмококковая вакцина, изготовленная посредством комбинирования 14 или 23 пневмококковых полисахаридов, способная усиливать иммунитет по отношению к пневмонии, и менингококковая вакцина, изготовленная посредством комбинирования 4 менингококковых полисахаридов, способная усиливать иммунитет для защиты от менингита, и т.п. Данные вакцины используются в течение нескольких лет.
Указанные вакцины используются в течение многих лет, поскольку их разработка широко признана вследствие их высоких иммуногенных эффектов и меньшего количества побочных эффектов по отношению к каждому инфекционному заболеванию, а также в силу их хорошей адаптации для защиты от различных заболеваний. Создатели вакцин в настоящее время разрабатывают новые комбинированные вакцины различных типов для указанных выше целей. В качестве указанных выше комбинированных вакцин существует вакцина (международная публикация №WO 99/13906), изготовленная посредством комбинирования вакцины DTP, бактериальной энцефаломенингитной вакцины (вакцины Hib), инактивироаанной полиомиелитной вакцины и вакцины против гепатита В. Определенная комбинированная вакцина разрабатывается посредством комбинирования пневмококковых и менингококковых полисахаридов, конъюгированных с белком. Скоро будет разработана комбинированная закцина, способная защищать от кишечной инфекции, вызываемой бактерией холеры, от брюшного тифа, дизентерии и диареи.
Комбинированная вакцина, изготовленная посредством комбинирования каждого антигена для предотвращения различных других инфекционных заболеваний, имеет то преимущество, что количество вакцинаций сокращается, а источник вакцины является простым, что снижает его стоимость. Согласно схеме вакцинации детей раннего возраста, рекомендованной Ассоциацией педиатров (1997 г.), дети раннего возраста вакцинируются много раз в течение 1 года после рождения, и инъекция вакцины иногда накладывается на различные вакцины из-за болезни или соображений удобства. Следовательно, важно прививать детей раннего возраста на основе правильной методики, что обеспечивает удобства как для персонала, осуществляющего вакцинацию, так и для вакцинируемых пациентов. В частности, в качестве стандартизированной схемы вакцинации рекомендуется вакцинации против DTP и гепатита 3 в виде трех первичных иммунизации в течение первого года жизни детей и повторных иммунизации. Кроме того, поскольку рекомендованные схемы идентичны, может иметь место проблема перекрывающихся иммунизации.
Авторы настоящего изобретения осуществили исследования с целью создания определенных удобств для вакцинации как для персонала, осуществляющего вакцинацию, так и для вакцинируемых пациентов, посредством разработки комбинированной вакцины против DTP и гепатита В и стабилизации источника вакцины, что создает благоприятные условия вакцинации для большего количества людей.
Поскольку изучение комбинированной вакцины направлено, главным образом, на комбинирование каждого антигена-компонента вакцинных продуктов, которые обеспечивают иммунитет и стабильность, разработка способа комбинирования является важной для минимизации вариаций ответа и иммунитета, наблюдающихся в результате взаимодействия между каждым защитным антигеном и адсорбентом, является важной для данного исследования. По окончании разработки были изучены гомогенность и стабильность изобретенных комбинированных вакцинных композиций. В настоящем изобретении было выполнено исследование на основе вакцины DTP и вакцины против гепатита В, иммуногенность и стабильность которых доказаны.
В качестве способа комбинирования каждой компонентной вакцины существует способ (международные публикации №№WO 99/13906 и WO 00/7623) простого объединения продуктов каждой компонентной вакцины, способ (международная публикация №WO 99/13906) одновременного введения при осуществлении вакцинации, с использованием специально сконструированного контейнера, и способ изготовления комбинированной вакцины путем смешивания каждого компонента вакцины и ингредиентов в одну композицию. Что касается снабжения вакцинами, использование комбинированной вакцины, изготовленной первыми двумя способами, является аналогичным использованию каждой моновалентной вакцины в отдельности; в обращении с такими вакцинами требуется больше внимания по сравнению с любой моновалентной вакциной, поэтому в использовании этого типа комбинированной вакцины преимуществ нет. Кроме того, невозможно выполнить исследование, касающееся вариаций иммунитета и наблюдения побочных эффектов. Следовательно, для изучения комбинированной вакцины предпочтительно, чтобы каждый компонент вакцины смешивался в одну композицию в качестве одного продукта.
Целью настоящего исследования является разработка способа производства комбинированной вакцины, способной предотвращать различные заболевания детей раннего возраста, включая дифтерию, столбняк, коклюш и гепатит В, которые должны быть предотвращены у детей раннего возраста.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Соответственно, целью настоящего исследования является разработка способа производства комбинированной вакцины для одновременной профилактики различных заболеваний детей раннего возраста, таких как дифтерия, столбняк, коклюш и гепатит В, которые должны быть предотвращены у детей раннего возраста.
Для того, чтобы достигнуть указанной выше цели, разработан способ производства комбинированной вакцины, включающий в себя следующие стадии:
стадию адсорбции, при которой каждый защитный антиген, соответственно, относящийся к тому или иному заболеванию, независимо адсорбируется на адсорбенте; и
стадию комбинирования, при которой все указанные выше защитные антигены, адсорбированные на адсорбенте, смешиваются.
Разработан также способ, при котором защитный антиген представляет собой антиген, выбранный из группы, состоящей из антигена дифтерии, антигена столбняка, антигена коклюша, антигена гепатита В, или двух или более их комбинаций.
Разработан также способ, при котором адсорбент представляет собой гель гидроксида алюминия.
Также с целью достижения указанной выше цели разработана комбинированная вакцина, которая изготавливается в соответствии с любым из указанных выше способов.
Более конкретно, настоящее изобретение относится к способу производства комбинированной вакцины, который включает в себя стадии независимой адсорбции каждого защитного антигена на адсорбенте - геле гидроксида алюминия, относящегося к различным заболеваниям, таким как дифтерия, столбняк, коклюш и гепатит В, которые должны быть предотвращены у детей раннего возраста, и объединения каждого защитного антигена, адсорбированного на адсорбенте, после адсорбции.
Антигены согласно изобретению не ограничиваются упомянутыми заболеваниями и применимы к различным антигенам, экспрессируемым при различных заболеваниях.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Настоящее изобретение будет более понятно с помощью прилагаемых чертежей, которые приводятся только с целью иллюстрации и, таким образом, не ограничивают настоящее изобретение:
Фиг.1 представляет собой график, иллюстрирующий степень адсорбции каждого составляющего антигена в зависимости от концентрации адсорбента. Дифтерийный анатоксин, столбнячный анатоксин и поверхностный антиген вируса гепатита В представляют собой компоненты дифтерийного антигена, столбнячного антигена и антигена гепатита В, а коклюшный анатоксин и коклюшный антиген FHA (коклюшная частица волокнистого агглютинина крови) представляют собой компоненты очищенного коклюшного антигена;
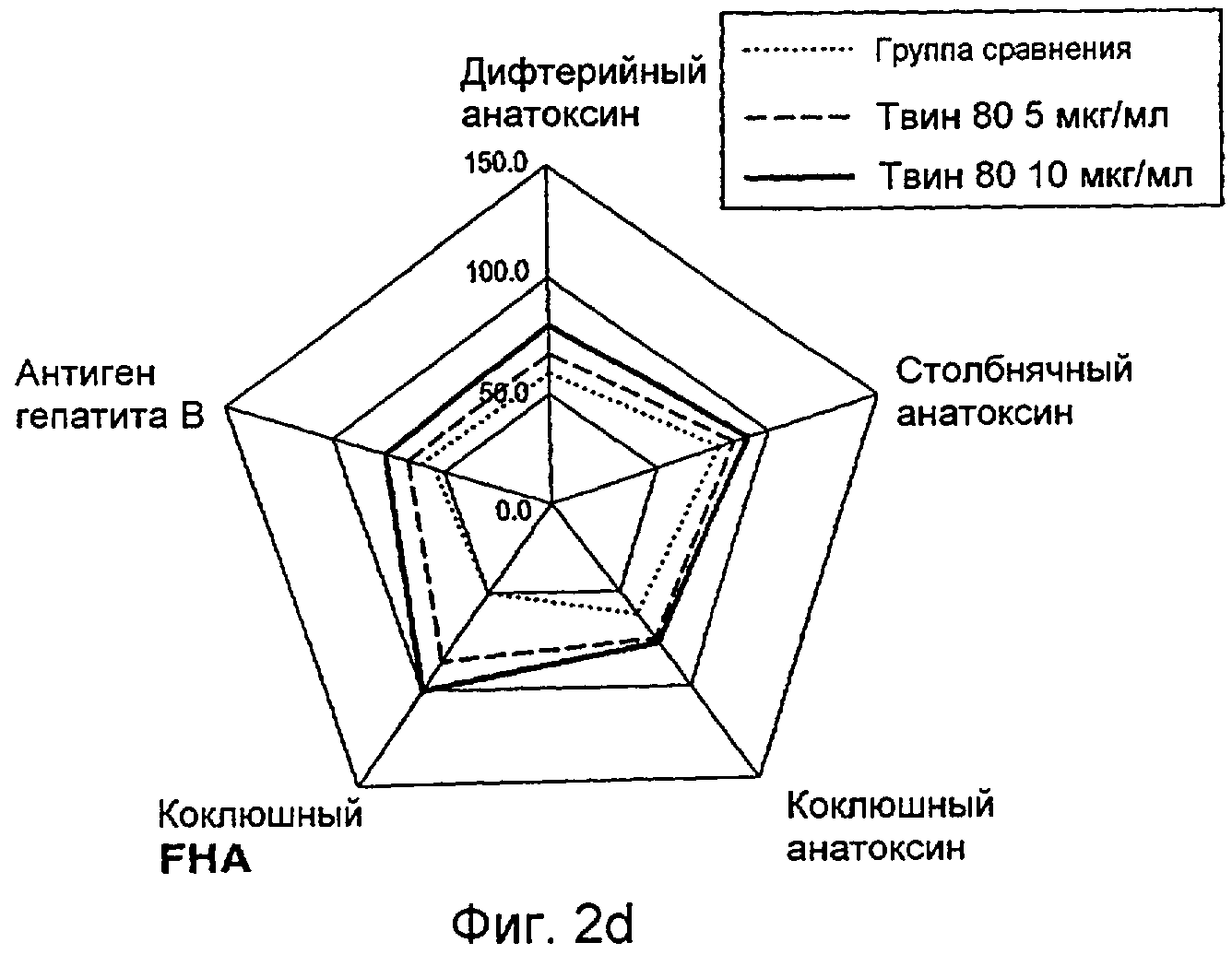
Фиг.2a-2d представляют собой схемы, иллюстрирующие антигенность и иммунитет в зависимости от способа адсорбции, где образец 1 представляет собой образец, в который добавлен излишек геля гидроксида алюминия по окончании объединения всех компонентов вакцины, а образец 2 представляет собой образец, в который указанный адсорбент в той же концентрации предварительно добавлен до окончания объединения; фиг.2а и 2b представляют собой схемы, иллюстрирующие относительную антигенность образцов 1 и 2, соответственно, а фиг.2с и 2d представляют собой схемы, иллюстрирующие относительный уровень образования антител против каждого антигена образцов 1 и 2, соответственно.
Фиг.3 представляет собой схему, иллюстрирующую уровень образования антител против каждого антигена в сыворотке, полученной от обезьян, которым вводили комбинированную вакцину, изготовленную согласно настоящему изобретению, или одновременно каждый вакцинный продукт DTP или вакцину против гепатита В, на основе данных отбора образцов крови от каждой обезьяны. В группе 1 вводили одновременно вакцину DTP и вакцину против гепатита В, а в группе 2 вводили комбинированную вакцину.
СПОСОБ ОСУЩЕСТВЛЕНИЯ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
В качестве способа производства комбинированной вакцины, содержащей каждый вакцинный компонент в виде одного продукта, описанный выше способ разделили на две стадии: способ для стадии объединения антигенов, которые образуют каждый вакцинный компонент, и осуществления адсорбции с использованием адсорбента, и способ для стадии объединения предварительно адсорбированных антигенов, в том случае, когда адсорбент используется в качестве компонента в указанном способе. Однако в случае, когда каждый составляющий антиген сначала смешивают, способность к адсорбции по отношению к адсорбенту каждого антигена может уменьшаться из-за взаимодействия между антигенами и ингредиентами в растворе. Кроме того, адсорбция между адсорбентом и составляющим антигеном оптимизируется каждый раз при независимых условиях. Если указанные выше процессы адсорбции осуществляются одновременно, степень адсорбции может уменьшиться в силу различий условий адсорбции для каждого составляющего антигена. Поскольку внутренние взаимоотношения между степенью адсорбции с учетом адсорбента для составляющего антигена и иммуногенностью вакцины обратно пропорциональны, иммуногенность комбинированной вакцины, которую производят в одновременном процессе, может снизиться по сравнению с иммуногенностью каждой моновалентной вакцины.
Таким образом, авторы настоящего изобретения сделали вывод о том, что правильнее производить комбинированную вакцину посредством изготовления массы раствора каждого составляющего антигена, независимо выполняя адсорбцию каждого антигена, и объединения адсорбированных антигенов.
Кроме того, в случае, когда каждый составляющий антиген объединяют в каждом типе адсорбции, конечная концентрация каждого составляющего антигена в комбинированной вакцине должна быть такой же, как концентрация составляющего антигена в каждой стандартной моновалентной вакцине, для сравнения иммуногенности и свойств вакцинных антигенов в вакцинных продуктах. Таким образом, для производства комбинированной вакцины адсорбируют более концентрированный, чем в моновалентной вакцине, составляющий антиген, а затем объединяют. Вакцину DTP производят на основе адсорбции, с использованием антигена, который сконцентрирован в 1,5-2 раза, а вакцину против гепатита В производят с использованием антигена, который сконцентрирован в 2-3 раза. Конечная концентрация каждого составляющего антигена комбинированной вакцины согласно изобретению совпадает с концентрацией каждой моновалентной вакцины благодаря подбору соотношения каждого антигена при объединении.
Согласно настоящему изобретению заявители осуществили исследования различных комбинаций для разработки комбинированной вакцины. В данном случае конечное содержание каждого иммунного компонента в вакцинном продукте является таким же, как в моновалентной вакцине. Кроме того, производят мониторинг изменения степени адсорбции каждого антигена посредством контроля содержания адсорбента и других компонентов. Каждым образцом, в котором выявляли наименьшие изменения в степени адсорбции, иммунизировали малых животных, чтобы сравнить уровень образования антител. Посредством обзора результатов по образованию антител у малых животных был выбран наиболее правильный способ объединения.
Помимо этого, в результате указанного обзора, с учетом адсорбентов современной коммерческой вакцины DTP и вакцины против гепатита В, использовали главным образом гель гидроксида алюминия и гель фосфата алюминия. Известно, что адсорбция белка на каждом алюминиевом геле вызывается поверхностным электрическим зарядом каждого белка и составляющего геля. Известно также, что гель гидроксида алюминия имеет положительный поверхностный электрический заряд при физиологических значениях рН, а гель фосфата алюминия имеет отрицательный поверхностный электрический заряд ("Vaccine Design - The subunit and adjuvant approach", изд. M.F. Powell & M.J. Newman, 1995, стр.229-239).
В случае, когда используются одновременно оба указанных выше типа алюминиевых гелей, наблюдается некоторое взаимодействие, в результате которого размер частиц в растворе может увеличиваться, а способность адсорбировать белок может уменьшиться. Кроме того, поверхностный электрический заряд каждого составляющего антигена вакцины против гепатита В и комбинированной вакцины представляет собой в основном отрицательный поверхностный электрический заряд при физиологических значениях рН. Таким образом, наиболее благоприятным в качестве адсорбента является гель гидроксида алюминия.
В обычной практике компонент адсорбента, такой как гель гидроксида алюминия и гель фосфата алюминия, использовали совместно (международная публикация №WO 93/24148), но по указанной выше причине авторы настоящего изобретения пришли к заключению, что абсорбент комбинированной вакцины должен иметь тот же тип соли, и что гель гидроксида алюминия, который используется в качестве адсорбента, представляет собой важный фактор для получения определенного соотношения адсорбции каждого составляющего антигена.
Очевидно, однако, что под адсорбентом в настоящем изобретении подразумевается не только гель гидроксида алюминия, но также и его эквиваленты.
Кроме того, в комбинированной вакцине, изготовленной согласно изобретению, другие составляющие компоненты, за исключением антигена гепатита В, включают в себя белки в качестве главного компонента, в то время как в случае вакцины против гепатита В антиген существует главным образом в виде частиц, которые включают в себя фосфолипидный слой. Таким образом, предпочтительно, чтобы при производстве вакцины против гепатита В для комбинированной вакцины согласно изобретению, с целью уменьшения определенного препятствования со стороны других антигенов с точки зрения фосфолипидного компонента антигена вакцины против гепатита В, который включает в себя фосфолипидный слой, добавляют нейтральное поверхностно-активное вещество, такое как Полисорбат 20 (Тайн 20), Полисорбат 80 (Твин 80) и Тритон Х-100.
Поскольку титр вакцины против гепатита В имеет тенденцию к уменьшению в случае, если количество нейтрального поверхностно-активного вещества велико, предпочтительно, чтобы нейтральное поверхностно-активное вещество добавляли в массовом отношении менее 50% по отношению к количеству белка поверхностного антигена вакцины против гепатита В, однако верхний предел данным числом не ограничивается.
В настоящем изобретении в качестве дифтерийного антигена получают и культивируют в соответствующей культуральной среде Corynebacterium diphtheria, PW №8. Предпочтительным является дифтерийный анатоксин, который получают обезвреживанием дифтерийного токсина, который очищают обычным способом. Количество антигена предпочтительно составляет 10-25 Lf, на основе педиатрической дозы. В качестве столбнячного антигена культивируют в соответствующей культуральной среде в анаэробных условиях Clostridium tetanii. Harvard. Подходящим является столбнячный анатоксин, который получают путем обезвреживания столбнячного токсина, очищенного обычным способом. Количество антигена предпочтительно составляет 1-5 Lf, на основе педиатрической дозы. Кроме того, коклюшный антиген культивируют в соответствующей культуральной среде с использованием Bordetella pertussis, Tohama фаза I, и множество видов антигенного белка, включая коклюшный анатоксин, выделяют обычным способом из культуральной надосадочной жидкости и обезвреживают. Очищенные коклюшные антигены или цельноклеточный коклюшный антиген являются подходящими. В этом случае разработан способ производства комбинированной вакцины, при котором, в случае множества видов антигенов, общее количество антигенов составляет менее 20 мкгPN, на основе педиатрической дозы, а в случае цельноклеточного коклюшного антигена количество антигена предпочтительно составляет менее 20 OE, на основе педиатрической дозы. Настоящее изобретение относится также к способу производства комбинированной вакцины, при котором очищенные множественные антигенные белки включают в себя обезвреженный коклюшный анатоксин и волокнистый гемагглютининовый (FHA) антиген.
Предпочтительно, настоящее изобретение относится к способу производства комбинированной вакцины, при котором количество рекомбинантного поверхностного антигена вируса гепатита В, который получают способом генной инженерии как антиген гепатита В, составляет 5-10 мкг, на основе педиатрической дозы. Более предпочтительно, настоящее изобретение относится к способу производства комбинированной вакцины, при котором поверхностный антиген гепатита В адсорбируют на адсорбенте путем смешивания при перемешивании при 2-8°С в течение 3-20 часов. Для того, чтобы найти оптимальное содержание адсорбента для производства комбинированной вакцины, соотношение адсорбции для каждого антигенного компонента было проанализировано для каждой концентрации адсорбента. В результате, когда конечная концентрация ионов алюминия ниже 0,5 мг/мл в то время, когда окончательное объединение завершено, соотношение адсорбции для каждого антигена было относительно снижено (как показано на фиг 1). Кроме того, было оговорено, что концентрация ионов алюминия будет ниже 1,25 мг/мл в геле алюминия, который используется для вакцины путем регулирования (ВОЗ, "Requirements for diphtheria, tetanus, pertussis and combined vaccines", в серии технических докладов №800, 1990, стр.87-179). Таким образом, при использовании геля гидроксида алюминия конечная концентрация ионов алюминия предпочтительно заключена в пределах 0,5-1/25 мг/мл, и, более предпочтительно, в пределах 0,7 мг/мл.
Кроме того, для того, чтобы предотвратить возможность уменьшения степени абсорбции каждого составляющего антигена из-за сил отталкивания, возникающих между составляющими антигенами, даже после завершения объединения каждого компонента, антигенность и уровень образования антител каждого составляющего антигена перерассчитывают в относительные процентные доли, чтобы сравнить указанные величины двух образцов между собой: образца, с которым предварительно объединен другой компонент, кроме геля гидроксида алюминия, а затем дополнительно добавлен излишек геля гидроксида алюминия, и образца, в который адсорбент в той же концентрации предварительно добавлен до завершения объединения.
Изменение антигенности и уровня образования антител уменьшается, когда добавляют излишек геля гидроксида алюминия, даже после завершения объединения каждого компонента (как показано на фиг.2).
Кроме того, в случае образца, в который добавляли Полисорбат 80 (Твин 80), антигенность и титр, что касается гепатита В, сохранялись (как показано на фиг.2). Ожидается, что сходный результат можно получить, даже когда используются нейтральные поверхностно-активные вещества, такие как Полисорбат 20 и Тритон Х-100, в подходящей концентрации. Как показано на фиг.2, образец 1 и образец 2 были изготовлены, соответственно, путем дополнительного добавления избытка геля гидроксида алюминия после завершения объединения каждого компонента и путем предварительного добавления адсорбента в той же концентрации до завершения объединения.
Предпочтительно, настоящее изобретение относится к способу производства комбинированной вакцины, в которой концентрация ионов алюминия в геле гидроксида алюминия заключена в пределах 0,5-1,25 мг/мл. Более предпочтительно, настоящее изобретение относится к способу производства комбинированной вакцины, который включает в себя стадию добавления избытка адсорбента в таких пределах, которые не превышают пределы концентрации ионов алюминия 0,5-1,25 мг/мл после того, как защитные антигены, адсорбированные на адсорбенте, объединены. В предпочтительном варианте осуществления настоящего изобретения возможно поддерживать адсорбцию, присущую каждому составляющему антигену в комбинированной вакцине, и повышать иммунитет.
В Корее и нескольких других странах в качестве коклюшного антигена обычно используют очищенный коклюшный антиген. В то же время, некоторые страны Америки и страны третьего мира используют цельноклеточный коклюшный антиген, который обезврежен. Следовательно, в настоящем изобретении пределы применения комбинированной вакцины расширяются вследствие изучения комбинированного способа с использованием цельноклеточного коклюшного антигена. В данном случае объединение осуществлялось тем же способом, который применялся при использовании упомянутого очищенного коклюшного антигена, в результате чего получали образец, способный поддерживать иммунитет каждого компонента (как показано в таблице 1).
В случае вакцины DTP, которая включает в себя цельноклеточный коклюшный антиген, в качестве адсорбента обычно используют гель фосфата алюминия. Однако для того, чтобы производить комбинированную вакцину к антигену гепатита В, вакцину DTP изготавливали с использованием геля гидроксида алюминия. В данном случае иммунитет к коклюшу снижался, но когда дополнительно добавляли избыток геля гидроксида алюминия после завершения объединения каждого компонента вакцины (образец А), становилось возможным поддерживать желательный иммунитет. В качестве стандарта, образец В изготавливали с предварительным добавлением адсорбента в той же концентрации, до завершения объединения.
Безопасность и эффективность комбинированной вакцины, изготовленной согласно настоящему изобретению, подтверждали на основе следующих методик. Во-первых, грызунам вводили избыточную дозу комбинированной вакцины, и в результате биопсии никаких повреждений не наблюдалось (результаты не представлены). Кроме того, определяли уровень антител против каждого антигена в группе (группа 2), в которой комбинированную вакцину вводили обезьянам, и в группе (группа 1), в которой одновременно звонили вакцину DTP и вакцину против гепатита В. С помощью t-критерия по отношению к количеству антител между двумя группами, при сравнении результата в группе 2 с результатом в группе 1, определили, что комбинированная вакцина показала равную или более высокую иммуногенность против каждого антигена по сравнению с группой, получавшей каждую из вакцин одновременно (как показано на фиг.3. Статистические результаты не представлены).
В заключение, в настоящем изобретении разработан способ объединения, при котором взаимодействие между различными иммунными компонентами сведены к минимуму, а каждый из иммуногенных эффектов при этом не уменьшается. Если классифицировать каждый иммунный компонент, который использовался для комбинированной вакцины, по физическим и химическим свойствам, иммуногенные компоненты можно разделить на белковый антиген (дифтерийный антиген, столбнячный антиген, очищенный коклюшный антиген), антиген, состоящий из белка и фосфолипидного слоя (антиген гепатита В), и антиген, состоящий из убитой интактной клетки (цельноклеточный коклюшный антиген), и т.п. Следовательно, можно прогнозировать, что комбинацию с другим антигеном моновалентной вакцины можно осуществлять на основе физических и химических свойств компонентов. Комбинация с дополнительной вакциной может быть возможна по отношению к заболеваниям (гемофильный грипп, полиомиелит), которые необходимо предотвращать у детей раннего возраста, с помощью комбинированных вакцин, изготовленных согласно настоящему изобретению.
Период вакцинации организма комбинированным вакцинным агентом согласно изобретению может представлять собой предыдущие периоды вакцинации вакциной DTP или вакциной против гепатита В. В том случае, когда в организме матери имеется антиген гепатита В, предпочтительно производить вакцинацию трижды, на втором, четвертом и шестом месяцах. В том случае, когда в организме матери нет гепатита В, подходящим периодом для вакцинации является однократная вакцинация после рождения, а затем осуществляют дополнительную вакцинацию с использованием комбинированной вакцины. Что касается должной вакцинации детей раннего возраста, то ее можно осуществлять способом внутримышечной или подкожной инъекции. Доза антигена дифтерии, столбняка, коклюша и гепатита В, соответственно, в комбинированной вакцине согласно изобретению та же, что и доза антигена каждой моновалентной вакцины для детей раннего возраста.
Пример 1
Производство антигена гепатита В
Интенсивно культивируют дрожжевые клетки, которые способны экспрессировать поверхностный антиген гепатита В с использованием методики генной инженерии. 1 кг осадка дрожжевых клеток, который получают путем центрифугирования, разбавляют в соотношении 1:2 буферным раствором (0,5 М NaCl, 10 мМ EDTA, 0,01% тимерозал, 0,1 М фосфат, рН 7,0). Разбавленный раствор протекает через ролл со стеклянными бусами (или Dynomil), в результате чего клеточные стенки разрушаются и т.д. В полученный раствор добавляют нейтральное поверхностно-активное вещество (группы Твина или группы Тритона) до 0,5% и гомогенно смешивают путем перемешивания при 4°С. К полученному раствору добавляют гидроксид натрия до получения рН 11, а затем смешивают путем взбалтывания при 4°С в течение 5 часов. К полученному раствору добавляют разбавленную хлористоводородную кислоту до получения рН 4. Осадок удаляют путем центрифугирования при 6000 об./мин в течение 15 мин, с использованием центрифуги (ROTOR: JA-14, Beckman Inc., USA), и получают верхнюю часть раствора, содержащую поверхностный антиген гепатита В. рН верхней части раствора доводят до 7, а затем добавляют диоксид кремния и перемешивают при 4-25°С в течение 3-16 часов, в результате чего поверхностный антиген гепатита В адсорбируется на диоксиде кремния. Гель диоксида кремния, который предпочтительно используют в настоящем изобретении, представляет собой Aerosil 380 (Degussa, USA), который включает в себя чистый гидратированный диоксид кремния или безводный диоксид кремния, имеющий истинную площадь поверхности 100-500 мм2/г. Для того, чтобы удалить примеси из диоксида кремния, на котором адсорбируют поверхностный антиген гепатита В, полученный раствор промывают два раза с использованием буферного раствора фосфата натрия - хлорида натрия с рН 7. Промытый диоксид кремния контактирует с буферным раствором карбоната натрия с рН 9,6 в течение приблизительно 2 часов, в результате чего происходит десорбция поверхностного антигена. Отделенный таким способом поверхностный антиген имеет чистоту белка в растворе свыше 90%. Полученный раствор пропускают через DEAE-сефарозу (PHARMACIA, Швеция), уравновешенную указанным раствором натриевого буфера, в результате чего специфичным образом закрепляется поверхностный антиген и удаляются вещества, отделенные на колонке с использованием указанного буферного раствора. Примеси, слабо закрепленные в колонке, элюируют с использованием буферного раствора, содержащего хлорид натрия в концентрации 0,05-0,1 М. После этого поверхностный антиген гепатита В элюируют с использованием указанного буферного раствора, содержащего хлорид натрия в концентрации 0,2 М. Элюированный таким способом раствор концентрируют с использованием ультрафильтрационной мембраны, которая способна отделять вещество с молекулярной массой свыше 100000, а осадок отделяют центрифугированием и удаляют, и верхнюю часть раствора собирают и осуществляют гель-хроматографию (Сефароза CL-4B, Швеция) собранной верхней части раствора. Фракции, которые содержат подтвержденный электрофорезом частый поверхностный антиген, используют в качестве антигена гепатита В. Кроме того, для того, чтобы уменьшить взаимодействие с каждым поверхностным антигеном гепатита, добавляют Твин 80 до концентрации 0, 5, 10 мкг на 1 мл, а затем наблюдают эффект Твина 80 (как показано на фиг.2).
Пример 2
Производство дифтерийного анатоксина
Corynebacterium diphtheria PW №8 культивируют при 35°С в течение 24 часов в питательной агаровой культуральной среде (DIFCO, USA) и получают субкультуры два раза. Одну из колоний культивируют при 35°С в течение 24 часов в 2 мл экстракта мозговой-сердечной культуральной среды (DIFCO, USA), и 1,2 мл из нее инокулируют в модифицированную культуральную среду Мюллера (см. Stainer, et al., Canadian J. Microbiol., 14:155, 1968) объемом 300 мл и культивируют при 35°С в течение 36 часов. После культивирования клетки удаляют из культурального раствора, а раствор токсина собирают и добавляют в него сульфат аммония при 4°С. Конечную концентрацию доводят до 25% (масс./об.), а рН доводят до 8,0. Культуральный раствор с доведенными рН и концентрацией соли помещают на колонку с фенил-сефарозой, которую предварительно уравновешивают раствором 10 мМ трис-буфера, рН 8,0, содержащего сульфат аммония 25% (масс./об.). Буферный раствор представляет собой тот же раствор, который используется для уравновешивания колонки, а затем через колонку пропускают раствор 10 мМ трис-буфера (рН 8,0), содержащий сульфат аммония 15% (масс./об.) для удаления примесей. Токсин элюируют раствором 10 мМ трис-буфера (рН 8,0), который не содержит соль. Элюированный раствор дифтерийного токсина собирают и подвергают диализу против 10 мМ раствора фосфатного буфера (рН 7,4), содержащего хлорид натрия в концентрации 150 мМ. По окончании процесса диализа добавляют формалин так, чтобы конечная концентрация составила 0,05% (масс./об.), и в полученном растворе происходит реакция при 37°С в течение 1 часа, и добавляют лизин до конечной концентрации 0,05 М, а затем полученный раствор обезвреживают при 37°С в течение 4 недель.
Раствор анатоксина подвергают диализу против раствора 10 мМ фосфатного буфера (рН 7,4), содержащего хлорид натрия, для полного удаления формалина, и добавляют тимерозал до конечной концентрации 0,01% (масс./об.). Полученный раствор используют в качестве раствора дифтерийного анатоксина.
Пример 3
Производство столбнячного анатоксина
Clostridium tetanii (штамм Harvard) культивировали способом расплавленного агара со стерилизованной печеночно-желчной агаровой средой (DIFCO, USA). Несколько колоний из указанной выше культуры инокулируют в мозговую-сердечную инфузионную культуральную среду (DIFCO, USA), содержащую 0/3% (масс./об.). дрожжевого экстракта (DIFCO, USA), объемом 2 мл, имеющую пониженный уровень кислорода/ и культивируют при 35°С в течение 24 часов в анаэробных условиях. Затем культуральный раствор инокулируют в мозговую-сердечную инфузионную культуральную среду (DIFCO, USA) объемом 500 мл, содержащую 0,3% (масс./об.). дрожжевого экстракта (DIFCO, USA), и культивируют при 35°С в течение 7 дней в анаэробных условиях. После культивирования клетки удаляют из культурального раствора, раствор токсина собирают и добавляют сульфат аммония при 4°С до конечной концентрации 60% (масс./об.), и перемешивают в течение более 24 часов, а затем полностью смешивают до получения осадка путем центрифугирования. Осадок растворяют в малом количестве дистиллированной воды и удаляют нерастворившийся материал. Полученный раствор помещают в колонку сефагрилл S-100, которую предварительно уравновешивают раствором 10 мМ фосфатного буфера (рН 8,0), содержащего 0,5 М хлорида натрия. Тот же буферный раствор используют для элюирования отделенного токсина. Раствор столбнячного токсина собирают и подвергают диализу против раствора 10 мМ фосфатного буфера (рН 7,4), содержащего хлорид натрия в концентрации 150 мМ. После диализа добавляют формалин так, чтобы конечная концентрация составила 0,025% (масс./об.), и в полученном растворе происходит реакция при 37°С в течение 1 часа. После этого добавляют лизин и гидрокарбонат натрия до конечной концентрации 0,05 мМ и 0,04 М, соответственно, а затем полученный раствор созревает при 37°С в течение 4 недель, и его обезвреживают. После обезвреживания раствор анатоксина подвергают диализу против раствора 10 мМ фосфатного буфера (рН 7,4), содержащего хлорид натрия в концентрации 150 мМ, и формалин полностью удаляют. Добавляют тимерозал до конечной концентрации 0,01% (масс./об.) и используют в качестве раствора столбнячного анатоксина.
Пример 4
Производство очищенного коклюшного антигенного белка
Bordetella pertussis, Tohama фаза I, культивируют в агаровой культуральной среде Bodet-Gengo (DIFCO, USA), содержащей 15% крови кролика, при 35°С в течение 72 часов, и производят два пассажа. Несколько колоний инокулируют в 50 мл культуральной среды stanor-sholte и культивируют при 35°С в течение 48 часов. Культивированный таким способом раствор повторно инокулируют в 500 мл измененной культуральной среды stanor-sholte (см. Imazumi et al., INFECT. - IMMUN., 1983, vol. 41, стр.1138) и культивируют при 35°С в течение 36 часов. К культуральному раствору добавляют 10% водный раствор тимерозала до конечной концентрации 0,01%, предотвращая, таким образом, рост бактерий коклюша, а затем клетки удаляют путем центрифугирования. К полученному раствору добавляют три объема дистиллированной воды и тщательно смешивают. Имеющуюся на данный момент величину рН снижают до 6,0 с помощью 1 н серной кислоты. Полученный раствор помещают в колонку с СМ-сефарозой, которую предварительно уравновешивают 10 мМ буферным раствором фосфата натрия с рН 6,0. Тот же буферный раствор, который использовали для уравновешивания колонки, пропускают через колонку для удаления веществ, которые не закрепились в колонке, а примеси, которые слабо закрепились в колонке, удаляют с использованием того же буферного раствора, который использовали для уравновешивания колонки, содержащего 100 мМ хлорида натрия. Когда примеси более не элюируются из колонки, связанные материалы элюируют с помощью линейного градиента, образованного раствором для уравновешивания колонки, содержащим 100 мМ хлорида натрия и 600 мМ хлорида натрия, который имеет тот же объем, таким образом, что фракция, содержащая коклюшный антигенный белок, такой как коклюшный токсин и FHA (волокнистый гемагглютинин), отделяется. Фракцию антигена разбавляют 10 мМ буферным раствором фосфата натрия (рН 8,0) двойного объема до получения рН 8,0. Полученный раствор помещают в колонку с гидроксиапатитом, которую предварительно уравновешивают 10 мМ буферным раствором фосфата натрия с рН 8,0. Тот же буферный раствор, который использовали для уравновешивания колонки, содержащий 100 мМ хлорида натрия, пропускают через колонку для удаления веществ, которые не закрепились в колонке. 80 мМ буферный раствор фосфата натрия с рН 8,0, содержащий 100 мМ хлорида натрия, пропускают с той же скоростью, что и скорость поступления пропускаемого раствора, для отделения фракции коклюшного токсина. После отделения коклюшного токсина 250 мМ буферного раствора фосфата натрия с рН 8,0, содержащего 100 мМ хлорида натрия, пропускают с той же скоростью, что и скорость поступления пропускаемого раствора, для отделения фракции FHA (волокнистого гемагглютинина). Отделенный коклюшный токсин и FHA (волокнистый гемагглютинин) подвергают диализу против 10 мМ буферного раствора фосфата натрия (рН 7,4), содержащего 0,15% хлорида натрия, при 4°С. К диализированному раствору образца коклюшного токсина добавляют глицерин и глутаровый альдегид до конечной концентрации 50% (масс./об.) и 0,05% (масс./об.) и обезвреживают при 37°С в течение 4 часов. Добавляют аспартат натрия до конечной концентрации 0,025 М, для завершения, таким образом, процесса обезвреживания. К диализированному раствору образца FHA (волокнистого гемагглютинина) добавляют глицерин и формалин до конечной концентрации 50% (масс./об.) и 0/025% (масс./об.) и обезвреживают при 37°С в течение 24 часов. Добавляют лизин до конечной концентрации 0,025 М, для завершения, таким образом, процесса обезвреживания. Каждый раствор образца подвергают диализу против 10 мМ буферного раствора фосфата натрия (рН 7,4), содержащего 0,15% хлорида натрия, при комнатной температуре. Добавляют тимерозал до конечной концентрации 0,01% (масс./об.). После этого обезвреженные раствор образца коклюшного токсина и раствор образца FNA (волокнистого гемагглютинина) смешивают в соотношении 1:4 и используют в качестве коклюшного антигенного белка.
Пример 5
Производство цельноклеточного коклюшного антигена
Bordetella pertussis, Tohama фаза I, культивируют в агаровой культуральной среде Bodet-Gengo (DIFCO, USA), содержащей 15% крови кролика, при 35°С в течение 72 часов, и производят два пассажа. Некоторое количество колоний инокулируют в 50 мл культуральной среды Stanor-sholte и культивируют при 35°С в течение 48 часов. Полученный раствор повторно инокулируют в 500 мл измененной культуральной среды Stanor-sholte (см. Imazumi et al., INFECT. - IMMUN., 1983, vol.41, стр.1138) и культивируют при 35°С в течение 36 часов. К культуральному раствору добавляет 10% водный раствор тимерозала до конечной концентрации 0,01%, предотвращая, таким образом, рост бактерий коклюша, и клетки собирают путем центрифугирования. Собранный соматический раствор подвергают диализу против 10 мМ буферного раствора фосфата натрия (рН 7,4), содержащего 0,15% хлорида натрия, при 4°С. К диализированному раствору коклюшных бактерий добавляют формалин до конечной концентрации 0,025% (масс./об.) и обезвреживают при 37°С в течение 4 недель. Добавляют лизин до конечной концентрации 0,025 М, для завершения, таким образом, процесса обезвреживания. Раствор образца подвергают диализу против 10 мМ буферного раствора фосфата натрия (рН 7,4), содержащего 0,15% хлорида натрия, и добавляют тимерозал до конечной концентрации 0,01% (масс./об.) и используют в качестве цельноклеточного коклюшного антигена.
Пример 6
Производство комбинированной вакцины, содержащей очищенный коклюшный антиген
Стадия 1. Производство вакцины против гепатита В
Вакцину против гепатита В производят с использованием поверхностного антигена гепатита В, полученного в примере 1. Раствор гидроксида алюминия получают, добавляя гель гидроксида алюминия к раствору фосфатного буфера. Полученный раствор медленно перемешивают и упомянутый выше раствор антигена добавляют по каплям и смешивают путем медленного перемешивания при 4°С в течение 15 часов, получая, таким образом, вакцину против гепатита В. В это время количество гепатитного поверхностного антигена составляет 60 мкг/мл, что в три раза превышает концентрацию обычного поверхностного антигена гепатита В. В первом образце количество ионов алюминия в геле гидроксида алюминия составляет 0,9 мг/мл. Во втором образце количество ионов алюминия в геле гидроксида алюминия составляет 1,5 мг/мл (как показано на фиг.2).
Стадия 2. Производство комбинированной вакцины DTP
Комбинированную вакцину DTP производят с использованием каждого антигена, полученного во втором, третьем и четвертом примерах. Раствор гидроксида алюминия получают, добавляя гель гидроксида алюминия к раствору фосфатного буфера обычным способом. По мере медленного взбалтывания полученного раствора к нему добавляют по каплям раствор каждого антигена и смешивают путем медленного перемешивания, обеспечивая, таким образом, однородную адсорбцию, получая в результате комбинированную вакцину DTP. В это время количество каждого антигена в 1/5 раза превышает концентрацию каждого составляющего антигена в обычной вакцине DTP. Количество ионов алюминия в геле гидроксида алюминия составляет 0,3 мг/мл.
Стадия 3. Производство комбинированной вакцины против DTP-гепатита В
Вакцину DTP и вакцину против гепатита В, полученные на стадиях 1 и 2, медленно смешивают в объемном соотношении 2:1. В случае первого образца добавляют избыток геля гидроксида алюминия таким образом, что количество ионов алюминия в геле гидроксида алюминия составляет в конечном итоге 0,7 мг/мл, и непрерывно смешивают путем взбалтывания при 25°С в течение 1 часа, в результате чего получают стабильную комбинированную вакцину, которая не взаимодействует с остальными компонентами. В случае второго образца избыток геля гидроксида алюминия не добавляют и непрерывно смешивают путем перемешивания при 25°С в течение 1 часа, в результате чего получают комбинированную вакцину. Количество ионов алюминия в геле гидроксида алюминия в комбинированных вакцинах первого и второго образцов составляет 0,7 мг/мл. Для проверки титра антител, в 1 мл композиции комбинированной вакцины было представлено 20 мкг поверхностного антигена гепатита В, 25 Lf дифтерийного анатоксина, 3 Lf столбнячного анатоксина, 2,5 мкгPN коклюшного анатоксина и 10 мкгPN коклюшного антигена FHA (волокнистого гемагглютинина) (как показано на фиг.2).
Пример 7
Производство комбинированной вакцины, содержащей цельноклеточный коклюшный антиген
Стадия 1. Производство вакцины против гепатита В
Вакцину против гепатита В производят с использованием поверхностного антигена гепатита В, полученного в примере 1. Гель гидроксида алюминия добавляют к раствору фосфатного буфера, получая в результате раствор гидроксида алюминия. По мере медленного перемешивания раствора упомянутый выше раствор антигена добавляют по каплям и полностью смешивают при 4°С в течение 15 часов, получая, таким образом, вакцину против гепатита В. В это время количество поверхностного антигена гепатита В составляет 60 мкг/мл, что в три раза превышает концентрацию обычного поверхностного антигена гепатита В. В случае первого образца количество ионов алюминия в геле гидроксида алюминия составляет 0,9 мг/мл. В случае второго образца количество ионов алюминия в геле гидроксида алюминия составляет 1,5 мг/мл (как показано на фиг.2).
Стадия 2. Производство комбинированной вакцины DTP
Комбинированную вакцину DTP производят с использованием каждого антигена, полученного в примерах 2, 3 и 5. Раствор гидроксида алюминия получают путем добавления геля гидроксида алюминия к раствору фосфатного буфера обычным способом. По мере медленного перемешивания полученного раствора к нему добавляют по каплям раствор упомянутого выше антигена и полностью смешивают. Посредством однородной адсорбции получают в результате комбинированную вакцину DTP. В это время количество каждого антигена в 1,5 раза превышает концентрацию каждого составляющего антигена в обычной вакцине DTP. Количество ионов алюминия в геле гидроксида алюминия составляет 0,3 мг/мл.
Стадия 3. Производство комбинированной вакцины против DTP-гепатита В
Вакцину DTP и вакцину против гепатита В, полученные на стадиях 1 и 2, медленно смешивают в объемном соотношении 2:1. В случае первого образца добавляют избыток геля гидроксида алюминия таким образом, что количество ионов алюминия в геле гидроксида алюминия составляет в конечном итоге 0,7 мг/мл, и полученный раствор непрерывно смешивают при 25°С в течение 1 часа, в результате чего получают стабильную комбинированную вакцину, которая не взаимодействует с остальными компонентами. В случае второго образца избыток геля гидроксида алюминия не добавляют и раствор непрерывно смешивают при 25°С в течение 1 часа, в результате чего получают комбинированную вакцину. Количество ионов алюминия в геле гидроксида алюминия в комбинированных вакцинах первого и второго образца составляет 0,7 мг/мл. Для проверки титра антител в 1 мл композиции комбинированной вакцины было представлено 20 мкг поверхностного антигена гепатита В, 50 Lf дифтерийного анатоксина, 10 Lf столбнячного анатоксина и 20 OE цельноклеточного коклюшного антигена (как показано на фиг.2).
Пример 8. Тест на антигенность комбинированной вакцины
Тест на антигенность комбинированной вакцины, полученной в примерах 6 и 7, осуществляют посредством ферментного иммунного анализа (EIA) с использованием моноклонального антитела и поликлонального антитела путем сравнения со стандартом каждого антигена, с учетом содержания каждого антигена.
Кроме того, антиген, адсорбированный на соли алюминия, удаляют центрифугированием для определения степени адсорбции каждого антигена, и количество отделенного антигена измеряют, используя верхнюю часть раствора.
Среднее значение каждого результата представлено на фиг.1 и 2, где показана относительная антигенность каждого антигена.
Пример 9. Тест на образование антител при использовании комбинированной вакцины
Тест на образование антител против поверхностного антигена гепатита В
Комбинированную вакцину и вакцину против гепатита В, полученные в примерах 6 и 7, инокулируют мышам ICR, 16 из которых составляют группу 1, и отбирают образцы крови у мышей ICR спустя 18 дней. От крови отделяют сыворотку. Уровень антител против поверхностного антигена гепатита В получают на основе единицы МЕ/мл, с помощью EIA (ферментного иммунного анализа), и рассчитывают как геометрическое среднее титра антител. Титр комбинированной вакцины рассчитывают по отношению к вакцине против гепатита В.
Фиг.2с и 2d показывают относительный титр антител комбинированной вакцины по отношению к каждому антигену, а таблица 1 показывает величины каждого титра.
Тест на образование антител против дифтерийного антигена
Комбинированную вакцину и вакцину DTP, полученные в примерах 6 и 7, инокулируют мышам ICR, 16 из которых составляют группу 1. Отбирают образцы крови у мышей CIR спустя 28 дней. От крови отделяют сыворотку. Уровень антител в сыворотке против дифтерийного антигена определяют с помощью EIA (ферментного иммунного анализа), на основе единицы ME/мл, и рассчитывают как геометрическое среднее титра антител. После этого определяют титр комбинированной вакцины по сравнению с вакциной DTP.
Фиг.2с и 2d показывают относительный титр антител комбинированной вакцины по отношению к каждому антигену, а таблица 1 показывает величины каждого титра.
Тест на образование антител против столбнячного антигена
Комбинированную вакцину и вакцину DTP, полученные в примерах 6 и 7, инокулируют мышам ICR, 16 из которых составляют группу 1. Отбирают образцы крови у мышей ICR спустя 28 дней. От крови отделяют сыворотку. Уровень антител в сыворотке против столбнячного антигена определяют с помощью EIA (ферментного иммунного анализа), на основе единицы МЕ/мл, и рассчитывают как геометрическое среднее титра антител. После этого определяют титр комбинированной вакцины по сравнению с вакциной DTP.
Фиг.2с и 2d показывают относительный титр антител комбинированной вакцины по отношению к каждому антигену, а таблица 1 показывает величины каждого титра.
Тест на образование антител против коклюшного антигена
Комбинированную вакцину и вакцину DTP, полученные в примерах 6 и 7, инокулируют мышам ICR, 16 из которых составляют группу 1. Отбирают образцы крови у мышей ICR спустя 28 дней. От крови отделяют сыворотку. Уровень антител в сыворотке против коклюшного антигена определяют с помощью EIA (ферментного иммунного анализа), на основе единицы МЕ/мл, и рассчитывают как геометрическое среднее титра антител. После этого определяют титр комбинированной вакцины по сравнению с вакциной DTP.
Фиг.2с и 2d показывают относительный титр антител комбинированной вакцины по отношению к каждому антигену, а таблица 1 показывает величины каждого титра.
Пример 10
Тест на сравнительную эффективность на обезьянах
Тест осуществляют для подтверждения иммуногенности для приматов комбинированной вакцины и сравнения с обычной моновалентной вакциной. Одновременно комбинированной вакциной, полученной в примере 6, вакцинировали шесть обезьян (группа 2); группа состояла из равного количества самцов и самок обезьян, и каждым компонентом вакцины вакцинировали 6 обезьян (группа 1); группа состояла из равного количества самцов и самок обезьян. Теми же продуктами повторно вакцинировали каждую группу на 30-й и 60-й дни. Образцы крови отбирали у каждого экспериментального животного на 1-й, 29-й, 58-й и 86-й дни от даты первоначальной вакцинации, и титр антител против каждого заболевания определяли с помощью методики ELISA, адаптированной для крови сыворотки обезьян.
На Фиг.3 показано геометрическое среднее титра антител против каждого антигена в каждой группе.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Настоящее изобретение относится к способу производства комбинированной вакцины для одновременной профилактики различных заболеваний, таких как дифтерия, столбняк, коклюш, гепатит В и т.п., которые следует предотвращать у детей раннего возраста. С помощью настоящего изобретения возможна одновременная профилактика заболеваний, таких как дифтерия, столбняк, коклюш, гепатит В, которые следует предотвращать у детей раннего возраста, с использованием комбинированной вакцины согласно изобретению.
Поскольку настоящее изобретение можно осуществлять в нескольких вариантах, без отступления от его идеи или главных характеристик, следует также понимать, что описанные выше варианты осуществления никоим образом не ограничены деталями предшествующего описания, если не указано иное, и должны быть истолкованы широко в пределах идеи и объема, определяемых прилагаемой формулой изобретения, и следовательно, все изменения и модификации, которые подпадают под требования и границы формулы изобретения, или эквиваленты указанных требований и границ, заключены в прилагаемой формуле изобретения.
Реферат
Изобретение относится к области медицины и касается способа производства комбинированной вакцины, включающий антигены дифтерии, столбняка, коклюша и гепатита В. Сущность изобретения включает стадии независимой адсорбции каждого защитного антигена на адсорбенте-геле гидроксида алюминия к различным антигенам: дифтерии, столбняка, коклюша и гепатита В и последующем смешивании адсорбированных антигенов. Преимущество изобретения заключается в создании способа, позволяющего более точно оценивать и предотвращать побочный эффект. 2 н. и 9 з.п. ф-лы, 3 ил., 1 табл.

Формула
Документы, цитированные в отчёте о поиске
Комбинированная вакцина для иммунопрофилактики вирусного гепатита в, столбняка, дифтерии и коклюша

Комментарии