Способы и продукты для получения и доставки нуклеиновых кислот - RU2714404C2
Код документа: RU2714404C2
Чертежи









Описание
ЗАЯВЛЕНИЕ ПРИОРИТЕТА
Настоящая заявка заявляет приоритет по предварительной заявке США № 61/934397, поданной 31 января 2014 г., предварительной заявке США № 62/038608, поданной 18 августа 2014 г. и предварительной заявке США № 62/069667, поданной 28 октября 2014 г., полное содержание которых тем самым включено в данный документ посредством ссылки в полном объеме.
Настоящая заявка относится к заявке США № 13/465490, поданной 7 мая 2012 г., международной заявке № PCT/US2012/067966, поданной 5 декабря 2012 г., заявке США № 13/931251, поданной 28 июня 2013 г., и международной заявке № PCT/US2013/068118, поданной 1 ноября 2013 г., полное содержание которых тем самым включено в данный документ посредством ссылки в полном объеме.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение, в частности, относится к способам, композициям и продуктам для получения и доставки нуклеиновых кислот в клетки, ткани, органы и организм пациентов, способам экспрессии белков в клетках, тканях, органах и в организме пациентов, и клеткам, терапевтическим и косметическим средствам, полученным с использованием этих способов, композиций и продуктов.
ОПИСАНИЕ ТЕКСТОВОГО ФАЙЛА, ПРЕДСТАВЛЕННОГО В ЭЛЕКТРОННОМ ВИДЕ
Содержание текстового файла, представленного в электронном виде вместе с данной заявкой, включено в данный документ посредством ссылки в полном объеме: Копия перечня последовательностей в машиночитаемом формате (название файла: FAB-008PC SequenceListing.txt; дата записи: 30 января 2015 г.; размер файла: 929 КБ).
УРОВЕНЬ ТЕХНИКИ
Терапевтические средства на основе синтетических РНК и нуклеиновых кислот
Рибонуклеиновая кислота (РНК) повсеместно распространена как в прокариотических, так и в эукариотических клетках, где она в виде матричной РНК кодирует генетическую информацию, в виде транспортной РНК связывает и транспортирует аминокислоты, в виде рибосомальной РНК собирает аминокислоты в белки и выполняет многочисленные другие функции, включающие регуляцию генной экспрессии в виде микроРНК и длинной некодирующей РНК. РНК можно получать синтетически методами, включающими прямой химический синтез, и транскрипцией in vitro, и она может вводиться пациентам с целью терапевтического применения. Однако, ранее описанные молекулы синтетических РНК являются нестабильными и запускают в клетках человека сильный врожденный иммунный ответ. В дополнение к этому, ранее не были описаны способы эффективной невирусной доставки нуклеиновых кислот в организм пациентов, органы, ткани и клетки in vivo. Множество недостатков существующих технологий применения синтетических РНК и способов доставки нуклеиновых кислот делают их неприемлемыми для терапевтического или косметического применения.
Виды терапии на основе клеток и репрограммирования клеток
Клетки могут репрограммироваться воздействием на них специфических внеклеточных стимулов и/или эктопической экспрессией специфических белков, микроРНК и т.д. Хотя ранее было описано несколько способов репрограммирования, большинство из них основываются на эктотопической экспрессии, требующей введения экзогеной ДНК, которая может нести риски возникновения мутаций. Сообщалось о не использующих ДНК способах репрограммирования, основанных на прямой доставке репрограммирующих белков. Однако, эти способы также являются неэффективными и ненадежными в отношении коммерческого применения. В дополнение к этому были описаны способы репрограммирования на основе РНК (см., например, Angel. MIT Thesis. 2008. 1-56; Angel et al. PLoS ONE. 2010. 5,107; Warren et al. Cell Stem Cell. 2010. 7,618-630; Angel. MIT Thesis. 2011. 1-89 и Lee et al. Cell. 2012. 151,547-558; содержание которых тем самым включено в данный документ посредством ссылки). Однако, существующие способы репрограммирования на основе РНК являются медленными, ненадежными и неэффективными при осуществлении на зрелых клетках, требуют множество трансфекций (приводящих к значительным затратам и возможности возникновения ошибки), могут репрограммировать только ограниченное количество типов клеток, могут репрограммировать клетки только по отношению к ограниченному количеству типов клеток, требуют использования иммуносуппрессантов и требуют использования множества компонентов, полученных из организма человека, включая полученный из крови САЧ и фидерные фибробласты человека. Множество недостатков описанных ранее способов репрограммирования на основе РНК делают их неприменимыми для применения in vivo.
Редактирование генов
Несколько встречающихся в природе белков содержат ДНК-связывающие домены, которые могут распознавать специфические последовательности ДНК, к примеру, цинковые пальцы (ZF) и подобные активаторам транскрипции эффекторы (TALE). Гибридные белки, содержащие один или более из этих ДНК-связывающих доменов и домена расщепления эндонуклеазы FokI, могут использоваться для создания двухцепочечного разрыва в требуемом участке ДНК в клетке (см., например, опубликованную патентную заявку США № US 2012/0064620, опубликованная патентная заявка США № US 2011/0239315, патентная заявка США № 8470973, опубликованная патентная заявка США № US 2013/0217119, патентная заявка США № 8420782, опубликованная патентная заявка США № US 2011/0301073, опубликованная патентная заявка США № US 2011/0145940, патентная заявка США № 8450471, патентная заявка США № 8440431, патентная заявка США № 8440432, опубликованная патентная заявка США № 2013/0122581, содержание которых тем самым включено в данный документ посредством ссылки). Однако, существующие способы редактирования генов клеток являются неэффективными и несут риск неконтролированного мутагенеза, что делает их неприемлемыми как для исследования, так и для терапевтического применения. Ранее не были изучены способы редактирования генов соматических клеток без использования ДНК и не существует способов одновременного или последовательного редактирования генов и репрограммирования соматических клеток. В дополнение к этому, ранее не были изучены способы прямого редактирования генов клеток в организме пациентов (т.е.in vivo), и разработка таких способов ограничена отсутствием приемлемых мишеней, неэффективной доставкой, неэффективной экспрессией редактирующего гены белка/белков, неэффективным редактированием генов экспрессированным редактирующим гены белком/белками, в частности из-за слабого связывания ДНК-связывающих доменов, чрезмерные нецелевые эффекты, в частности из-за неуправляемой димеризации домена расщепления FokI и слабой специфичности ДНК-связывающих доменов и другими факторами. Наконец, ранее не было изучено применение редактирования генов при противобактериальном, противовирусном и противораковом видах лечения.
Соответственно, остается потребность в усовершенствовании способов и композиций для получения и доставки нуклеиновых кислот в клетки, ткани, органы и организм пациентов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящем изобретении, в частности, представлены композиции, способы, изделия и устройства для доставки нуклеиновых кислот в клетки, ткани, органы и организмы пациентов, способы индуцирования клеток для экспрессии белков, способы, изделия и устройства для получения этих композиций, способов, изделий и устройств, и композиции и изделия, включающие клетки, организмы, косметические и терапевтические средства, полученные с использованием этих композиций, способов, изделий и устройств. В отличии от ранее сообщавшихся способов, в некоторых вариантах реализации по данному изобретению не проводится воздействие на клетки экзогенной ДНК или аллогенных или полученных из организма животных материалов, что делает продукты, полученные в соответствии со способами по данному изобретению, пригодными для терапевтических и косметических применений.
В некоторых аспектах изобретения предложено способ экспрессии белка в популяции клеток пациента, включающий внедрение РНК в популяцию клеток, причем РНК, содержащая один или более неканонических нуклеотидов, не индуцирует значительный клеточный иммунный ответ и практически не снижает экспрессию белков. В некоторых вариантах реализации изобретения по меньшей мере 50%, или по меньшей мере 75%, или по меньшей мере 90% неканонических нуклеотидов выбирают из одного или более из 5-гидроксицитидина, 5-гидроксиметилцитидина, 5-карбоксицитидина, 5-формилцитидина, 5-гидроксиуридина, 5-гидроксиметилуридина, 5-карбоксиуридина и 5-формилуридина, или в некоторых вариантах реализации изобретения выбирают из одного или более из 5-гидроксиметилцитидина, 5-карбоксицитидина и 5-формилцитидина. Дополнительные варианты реализации изобретения относятся к дополнительным элементам РНК, например, 5ʹ-кэп структура, 3ʹ-поли(A) хвост и 5ʹ-НТО и/или 3ʹ-НТО, которые необязательно содержат одну или более из консенсусной последовательности Козак, последовательности, которая увеличивает стабильность РНК in vivo (таким образом как, в качестве иллюстрации, 5ʹ-НТО альфа-глобина или бета-глобина).
В некоторых аспектах изобретения предложены пластыри для доставки нуклеиновых кислот. В одном аспекте изобретения предложены устройства для доставки нуклеиновых кислот с использованием электростатических полей. Другие аспекты изобретения принадлежат к способам и композициям для доставки нуклеиновых кислот в кожу. Дополнительные аспекты изобретения принадлежат к способам и композициям для экспрессии белков в коже.
В одном аспекте в изобретении представлены способы и композиции для лечения заболеваний и патологических состояний у людей, включающие, но не ограниченные, профилактическим лечением, лечением редких заболеваний, включающими, но не ограниченными, дерматологическими редкими заболеваниями, и лечением для применения в медицинской дерматологии и эстетической медицине. В другом аспекте в изобретении предложены косметические средства, содержащие нуклеиновые кислоты. Дополнительные аспекты изобретения относятся к способам и композициям для изменения пигментации, к примеру, для лечения нарушений пигментации. Дополнительные аспекты изобретения относятся к способам и композициям для усиления заживления, включая, но не ограничиваясь, заживлением в результате нанесения раны или хирургического вмешательства. Другие аспекты изобретения относятся к нуклеиновым кислотам, содержащим один или более неканонических нуклеотидов. В одном аспекте в изобретении представлены нуклеиновые кислоты, содержащие, к примеру, один или более из 5-гидроксицитидина, 5-гидроксиметилцитидина, 5-карбоксицитидина, 5-формилцитидина, 5-гидроксиуридина, 5-гидроксиметилуридина, 5-карбоксиуридина и 5-формилуридина, или в некоторых вариантах реализации изобретения выбирают из одного или более из 5-гидроксиметилцитидина, 5-карбоксицитидина и/или 5-формилцитидина.
Композиции по данному изобретению могут изменять, модифицировать и/или заменять внешний вид представителя системы покровов тела субъекта, такого как, но не ограничиваясь, кожа, волосы и ногти. Такое изменение, модификация и/или замена могут проходить в контексте способов лечения и/или терапевтических применений, как описано в данном документе, включая, в качестве неограничивающего примера, дерматологические способы лечения и процедуры с применением косметических средств.
В некоторых аспектах изобретения представлены молекулы синтетических РНК с низкой токсичностью и высокой эффективностью трансляции. В одном аспекте изобретения предложена среда для культивирования клеток для высокоэффективной трансфекции in vivo, репрограммирования и редактирования генов клеток. Другие аспекты принадлежат к способам получения молекул синтетических РНК, кодирующих репрограммирующие белки. Дополнительные аспекты принадлежат к способам получения молекул синтетических РНК, кодирующих редактирующие гены белки.
В одном аспекте в изобретении представлены высокоэффективные редактирующие гены белки, содержащие сконструированные домены расщепления нуклеаз. В другом аспекте в изобретении представлены высокоточные редактирующие гены белки, содержащие сконструированные домены расщепления нуклеаз. Другие аспекте изобретения относятся к высокоэффективным редактирующим гены белкам, содержащим сконструированные ДНК-связывающие домены. Дополнительные аспекты изобретения принадлежат к высокоточным редактирующим гены белкам, содержащим сконструированные ДНК-связывающие домены. Дополнительные аспекты изобретения относятся к редактирующим гены белкам, содержащим сконструированные повторы последовательностей. Некоторые аспекты изобретения относятся к способам изменения последовательности ДНК клетки трансфицированием клетки или индуцированием клетки для экспрессии редактирующего гены белка. Другие аспекты изобретения относятся к способам изменения последовательности ДНК клетки, которая представлена в культуре in vitro. Дополнительные аспекты изобретения относятся к способам изменения последовательности ДНК клетки, которая представлена in vivo.
В некоторых аспектах в изобретении предложены способы лечения рака, включающие введение пациенту терапевтически эффективного количества редактирующего гены белка или нуклеиновой кислоты, кодирующей редактирующий гены белок. В одном аспекте изобретения редактирующий гены белок способен изменять последовательность ДНК гена, связанного с возникновением рака. В другом аспекте изобретения ген, связанный с возникновением рака, представляет собой ген BIRC5. Другие аспекты изобретения относятся к терапевтическим средствам, содержащим нуклеиновые кислоты и/или клетки, и способам использования терапевтических средств, содержащих нуклеиновые кислоты и/или клетки, для лечения, к примеру, диабета 1 типа, сердечно-сосудистого заболевания, включающего ишемическую и дилатационную кардиомиопатию, макулярной дегенерации, болезни Паркинсона, муковисцидоза, серповидноклеточной анемии, талассемии, анемии Фанкони, тяжелого комбинированного иммунодефицита, наследственной сенсорной нейропатии, пигментной ксеродермы, болезни Хантингтона, мышечной дистрофии, латерального амиотрофического склероза, болезни Альцгеймера, рака и инфекционных заболеваний, включающих гепатит и ВИЧ/СПИД. В некоторых аспектах изобретения нуклеиновые кислоты содержат синтетическую РНК. В других аспектах изобретения нуклеиновые кислоты доставляются в клетки с использованием вируса. В некоторых аспектах изобретения вирус представляет собой репликационно-компетентный вирус. В других аспектах изобретения вирус представляет собой репликационно-некомпетентный вирус.
Подробности изобретения изложены ниже в прилагаемом описании. Хотя при практической реализации или тестировании настоящего изобретение могут быть использованы способы и материалы, аналогичные или эквивалентные тем, которые описаны в данном документе, сейчас будут описываться иллюстративные способы и материалы. Другие признаки, цели и преимущества изобретения будут очевидны из описания и из формулы изобретения. В описании и прилагаемой формуле изобретения формы единственного числа включают также множественное число, если из контекста явно не следует иное. Если не указано иное, все технические и научные термины, используемые в данном документе, имеют то же значение, что обычно понимается средним специалистом в данной области техники, к которой относится это изобретение.
ПОДРОБНОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На ФИГ. 1 изображена РНК, кодирующая белок эластин человека и содержащая аденозин, 50% гуанозина, 50% 7-дезазагуанозина, 60% уридина, 40% 5-метилуридина и 5-метилцитидина, проанализированная в агарозном геле при денатурации формальдегидом.
На ФИГ. 2 изображены первичные дермальные фибробласты взрослого человека, трансфицированые РНК из ФИГ. 1.
На ФИГ. 3 изображены результаты иммуногистохимического анализа первичных дермальных фибробластов взрослого человека из ФИГ. 2 с использованием антител, таргетирующих белок эластин человека.
На ФИГ. 4 изображены первичные дермальные фибробласты человека, трансфицированные синтетической РНК, содержащей цитидин, 5-метилцитидин (5mC), 5-гидроксиметилцитидин (5hmC), 5-карбоксицитидин (5cC) или 5-формилцитидин (5fC) и кодирующие белок Oct4. Через 24 часа после трансфекции клетки фиксировали и окрашивали на наличие белка Oct4.
На ФИГ. 5 изображены первичные дермальные фибробласты человека, трансфицированные синтетической РНК, содержащей 5-гидроксиметилцитидин и кодирующей зеленый флуоресцентный белок (GFP). Через 24 часа после трансфекции получали изображения клеток.
На ФИГ. 6 изображен участок вентральной части предплечья субъекта здорового мужчины возрастом 33 года, которому применяли синтетическую РНК, содержащую 5-гидроксиметилцитидин (5hmC) и кодирующую GFP. Стрелки указывают флуоресцирующие клетки.
На ФИГ. 7 изображен участок вентральной части предплечья пациента здорового мужчины возрастом 33 года, которому применяли синтетическую РНК, содержащую 5-гидроксиметилцитидин (5hmC) и кодирующую GFP. На верхнем изображении показано необработанную область того же предплечья, тогда как на нижних изображениях показаны два поля с обработанной областью. На нижних изображениях четко видны флюоресцирующие клетки (указанные стрелками).
На ФИГ. 8 изображены первичные дермальные фибробласты человека, трансфицированные синтетической РНК, содержащей 5-метилуридин и 5-гидроксиметилцитидин и кодирующей указанный белок. Через 48 часов после трансфекции клетки фиксировали и окрашивали с использованием антител, таргетирующих указанный белок.
На ФИГ. 9 изображены первичные дермальные фибробласты человека, трансфицированные синтетической РНК, содержащей 5-метилуридин и 5-гидроксиметилцитидин и кодирующей тирозиназу человека. Через 24 часа после трансфекции клетки фиксировали и окрашивали с использованием антитела, таргетирующего тирозиназу человека.
На ФИГ. 10 изображены первичные эпидермальные меланоциты человека.
На ФИГ. 11 изображены первичные дермальные фибробласты человека, трансфицированные синтетической РНК, содержащей 5-гидроксиметилцитидин и кодирующей указанные белки.
На ФИГ. 12 изображены первичные дермальные фибробласты человека, ежедневно трансфицированные синтетической РНК, содержащей 5-гидроксиметилцитидин и кодирующей тирозиназу человека. Над каждым образцом показано количество трансфекций. Через 48 часа после последней трансфекции получали изображения клеток.
На ФИГ. 13 изображены первичные дермальные фибробласты человека, ежедневно трансфицированные синтетической РНК, содержащей указанные нуклеотиды и кодирующей тирозиназу человека. Через 48 часа после трансфекции получали изображения клеток.
На ФИГ. 14 изображена экспрессия IFNB1 и продукция пигмента в первичных дермальных фибробластах человека, трансфицированных синтетической РНК, содержащей указанные нуклеотиды и кодирующей тирозиназу человека. Значения нормализованы по отношению к образцу, трансфицированному синтетической РНК, содержащей только канонические нуклеотиды (A,G,U,C). В качестве контроля нагрузки использовали GAPDH. Прямоугольники, изображающие величину ошибки, показывают среднеквадратическую ошибку (n=2).
На ФИГ. 15 изображена экспрессия указанных генов, измеренных как указано для ФИГ. 14.
На ФИГ. 16 изображен участок вентральной части предплечья субъекта здорового мужчины возрастом 33 года, которому применяли синтетическую РНК, содержащую 5-метилуридин и 5-гидроксиметилцитидин и кодирующую тирозиназу человека (верхнее изображение), и веснушка на вентральной части предплечья того же субъекта (нижнее изображение). Для обоих изображений использовано одинаковое увеличение.
На ФИГ. 17 изображены первичные дермальные фибробласты человека, трансфицированные синтетической РНК, содержащей 5-гидроксиметилцитидин и кодирующей коллаген I (A1) (+ COL1 РНК). Между 24 и 72 часами после трансфекции клетки фиксировали и окрашивали с использованием антитела, таргетирующего коллаген I. Для каждого объекта из: трансфицированных клеток и нетрансфицированных клеток (Отр.) показаны два репрезентативных поля. Стрелками указаны внеклеточные отложения коллагена I.
На ФИГ. 18 изображены первичные дермальные фибробласты человека, трансфицированные синтетической РНК, содержащей 5-гидроксиметилцитидин и кодирующей коллаген VII (A1) (+ COL7 РНК). Между 24 и 72 часами после трансфекции клетки фиксировали и окрашивали с использованием антитела, таргетирующего коллаген I. Для каждого объекта из: трансфицированных клеток и нетрансфицированных клеток (Отр.) показано репрезентативное поле.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
Термином «молекула» обозначается химическое соединение (молекула, ион, комплекс и т.д.).
Термином «молекула РНК» обозначается молекула, которая содержит РНК.
Термином «молекула синтетической РНК» обозначается молекула РНК, которая продуцируется вне клетки или которая продуцируется внутри клетки с использованием биоинженерии, в качестве неограничивающего примера, молекула РНК, которая продуцируется в реакции транскрипции in vitro, молекула РНК, которая продуцируется прямым химическим синтезом, или молекула РНК, которая продуцируется в сконструированной методами генетической инженерии клетке E.coli.
Термином «трансфекция» обозначается приведение клетки в контакт с молекулой, причем молекула интернализируется клеткой.
Термином «при трансфекции» обозначается действие, происходящее во время или после трансфекции.
Термином «реагент для трансфекции» обозначается вещество или смесь веществ, которые ассоциируются с молекулами и облегчают доставку молекулы и/или интернализацию молекулы клеткой, в качестве неограничивающего примера, катионный липид, заряженный полимер или проникающий в клетки пептид.
Термином «трансфекция, обусловленная применением реагента» обозначается трансфекция с использованием реагента для трансфекции.
Термином «среда для культивирования клеток» обозначается среда, которая может использоваться для культивирования клеток, в качестве неограничивающего примера, модифицированная по Дульбекко среда Игла (DMEM) или DMEM+10% фетальной бычьей сыворотки (ФБС), независимо от того используется ли среда in vitro или in vivo.
Термином «среда для комплексообразования» обозначается среда, к которой добавляется реагент для трансфекции и подлежащая трансфекции молекула и в которой реагент для трансфекции ассоциирует с подлежащей трансфекции молекулой.
Термином «среда для трансфекции» обозначается среда, которая может использоваться для трансфекции, в качестве неограничивающего примера, модифицированная по Дульбекко среда Игла (DMEM), DMEM/F12, солевой раствор или вода, независимо от того используется ли среда in vitro или in vivo.
Термином «рекомбинантный белок» обозначается белок или пептид, который не продуцируется в организме животных или людей. Неограничивающие примеры включают трансферрин человека, который продуцируется в бактериях, фибронектин человека, который продуцируется in vitro в культуре клеток мыши, и сывороточный альбумин человека, который продуцируется в растении риса.
Термином «липидный переносчик» обозначается вещество, которое может увеличивать растворимость липидной или липидорастворимой молекулы в водном растворе, в качестве неограничивающего примера, сывороточный альбумин человека или метил-бета-циклодекстрин.
Термином «белок Oct4» обозначается белок, который кодируется геном POU5F1, или его природный или сконструированный вариант, представитель семейства, ортолог, фрагмент или гибридная конструкция, в качестве неограничивающего примера, белок Oct4 человека (SEQ ID №: 8), белок Oct4 мыши, белок Oct1, белок, кодированный псевдогеном 2 POU5F1, ДНК-связывающий домен белка Oct4 или гибридный белок Oct4-GFP. В некоторых вариантах реализации изобретения белок Oct4 содержит аминокислотную последовательность, которая обладает по меньшей мере 70% идентичности с SEQ ID №: 8, или в других вариантах реализации изобретения по меньшей мере 75%, 80%, 85%, 90% или 95% идентичности с SEQ ID №: 8. В некоторых вариантах реализации изобретения белок Oct4 содержит аминокислотную последовательность, содержащую от 1 до 20 аминокислотных инсерций, делеций или замен (в совокупности) в отношении SEQ ID №: 8. Или в других вариантах реализации изобретения белок Oct4 содержит аминокислотную последовательность, содержащую от 1 до 15 или от 1 до 10 аминокислотных инсерций, делеций или замен (в совокупности) в отношении SEQ ID №: 8.
Термином «белок Sox2» обозначается белок, который кодируется геном SOX2, или его природный или сконструированный вариант, представитель семейства, ортолог, фрагмент или гибридная конструкция, в качестве неограничивающего примера, белок Sox2 человека (SEQ ID №: 9), белок Sox2 мыши, ДНК-связывающий домен белка Sox2 или гибридный белок Sox2-GFP. В некоторых вариантах реализации изобретения белок Sox2 содержит аминокислотную последовательность, которая обладает по меньшей мере 70% идентичности с SEQ ID №: 9, или в других вариантах реализации изобретения по меньшей мере 75%, 80%, 85%, 90% или 95% идентичности с SEQ ID №: 9. В некоторых вариантах реализации изобретения белок Sox2 содержит аминокислотную последовательность, содержащую от 1 до 20 аминокислотных инсерций, делеций или замен (в совокупности) в отношении SEQ ID №: 9. Или в других вариантах реализации изобретения белок Sox2 содержит аминокислотную последовательность, содержащую от 1 до 15 или от 1 до 10 аминокислотных инсерций, делеций или замен (в совокупности) в отношении SEQ ID №: 9.
Термином «белок Klf4» обозначается белок, который кодируется геном KLF4, или его природный или сконструированный вариант, представитель семейства, ортолог, фрагмент или гибридная конструкция, в качестве неограничивающего примера, белок Klf4 человека (SEQ ID №: 10), белок Klf4 мыши, ДНК-связывающий домен белка Klf4 или гибридный белок Klf4-GFP. В некоторых вариантах реализации изобретения белок Klf4 содержит аминокислотную последовательность, которая обладает по меньшей мере 70% идентичности с SEQ ID №: 10, или в других вариантах реализации изобретения по меньшей мере 75%, 80%, 85%, 90% или 95% идентичности с SEQ ID №: 10. В некоторых вариантах реализации изобретения белок Klf4 содержит аминокислотную последовательность, содержащую от 1 до 20 аминокислотных инсерций, делеций или замен (в совокупности) в отношении SEQ ID №: 10. Или в других вариантах реализации изобретения белок Klf4 содержит аминокислотную последовательность, содержащую от 1 до 15 или от 1 до 10 аминокислотных инсерций, делеций или замен (в совокупности) в отношении SEQ ID №: 10.
Термином «белок c-Myc» обозначается белок, который кодируется геном MYC, или его природный или сконструированный вариант, представитель семейства, ортолог, фрагмент или гибридная конструкция, в качестве неограничивающего примера, белок c-Myc человека (SEQ ID №: 11), белок c-Myc мыши, белок l-Myc, белок c-Myc (T58A), ДНК-связывающий домен белка c-Myc или гибридный белок c-Myc-GFP. В некоторых вариантах реализации изобретения белок c-Myc содержит аминокислотную последовательность, которая обладает по меньшей мере 70% идентичности с SEQ ID №: 11, или в других вариантах реализации изобретения по меньшей мере 75%, 80%, 85%, 90% или 95% идентичности с SEQ ID №: 11. В некоторых вариантах реализации изобретения белок c-Myc содержит аминокислоты, содержащие от 1 до 20 аминокислотных инсерций, делеций или замен (в совокупности) в отношении SEQ ID №: 11. Или в других вариантах реализации изобретения белок c-Myc содержит аминокислотную последовательность, содержащую от 1 до 15 или от 1 до 10 аминокислотных инсерций, делеций или замен (в совокупности) в отношении SEQ ID №: 11.
Термином «репрограммирование» обозначается воздействие, вызывающее изменение фенотипа клетки, в качестве неограничивающего примера, вызывающее дифференцировку предшественника β-клеток в зрелую β-клетку, вызывающее дифференцировку фибробласта в плюрипотентную стволовую клетку, вызывающее трансдифференцировку кератиноцита в стволовой кардиомицит, вызывающее удлинение теломер клетки или вызывающее рост аксона нейрона.
Термином «репрограммирующий фактор» обозначается молекула, которая если клетка контактирует с молекулой и/или клетка экспрессирует молекулу, может самостоятельно или в комбинации с другой молекулой, вызывать репрограммирование, в качестве неограничивающего примера, белка Oct4.
Термином «фидер» обозначается клетка, которая может использоваться для кондиционирования среды или для поддержания иным образом роста других клеток в культуре.
Термином «кондиционирование» обозначается приведение в контакт одного или более фидеров со средой.
Термином «жирная кислота» обозначается молекула, которая содержит алифатическую цепь из по меньшей мере двух атомов углерода, в качестве неограничивающего примера, линолевая кислота, α-линоленовая кислота, октановая кислота, лейкотриен, простагландин, холестерин, глюкокортикоид, резолвин, протектин, тромбоксан, липоксин, марезин, сфинголипид, триптофан, N-ацетилтриптофан или их соль, метиловый эфир или производное.
Термином «короткоцепочечная жирная кислота» обозначается жирная кислота, которая содержит алифатическую цепь размером между двумя и 30 атомами углерода.
Термином «альбумин» обозначается белок, который хорошо растворяется в воде, в качестве неограничивающего примера, сывороточный альбумин человека.
Термином «ассоциированная молекула» обозначается молекула, которая нековалентно связана с другой молекулой.
Термином «компонент ассоциированной молекулы альбумина» обозначается одна или более молекул, которые связаны с полипептидом альбумина, в качестве неограничивающего примера, липиды, гормоны, холестерин, ионы кальция и т.п., которые связываются с полипептидом альбумина.
Термином «обработанный альбумин» обозначается альбумин, который обрабатывается для уменьшения, удаления, замены или инактивации иным образом компонента ассоциированной молекулы альбумина, в качестве неограничивающего примера, сывороточный альбумин человека, который инкубируется при повышенной температуре, сывороточный альбумин человека, который приводится в контакт с октаноатом натрия, или сывороточный альбумин человека, который приводится в контакт с пористым материалом.
Термином «ионообменная смола» обозначается материал, который при приведении в контакт с содержащим ионы раствором может замещать один или более из ионов одним или более другими ионами, в качестве неограничивающего примера, материал, который может замещать один или более ионов кальция одним или более ионами натрия.
Термином «половая клетка» обозначается сперматозоид или яйцеклетка.
Термином «плюрипотентная стволовая клетка» обозначается клетка, которая in vivo может дифференцироваться в клетки всех трех зародышевых листков (эндодерма, мезодерма и эктодерма).
Термином «соматическая клетка» обозначается клетка, которая не является плюрипотентной стволовой клеткой или половой клеткой, в качестве неограничивающего примера, клетка кожи.
Термином «инсулинпродуцирующая клетка, реагирующая на изменение уровня глюкозы» обозначается клетка, которая при воздействии определенной концентрации глюкозы может продуцировать и/или секретировать количество инсулина, которое отличается от (в меньшую или в большую сторону) количества инсулина, которое продуцирует и/или секретирует клетка, когда клетка подвергается воздействию другой концентрации глюкозы, в качестве неограничивающего примера, β-клетка.
Термином «гемопоэтическая клетка» обозначается клетка крови или клетка, которая может дифференцировать в клетку крови, в качестве неограничивающего примера, гемопоэтическая стволовая клетка или белая клетка крови.
Термином «кардиомицит» обозначается клетка сердца или клетка, которая может дифференцировать в клетку сердца, в качестве неограничивающего примера, стволовой кардиомицит или кардиомицит.
Термином «ретинальная клетка» обозначается клетка сетчатки или клетка, которая может дифференцировать в клетку сетчатки, в качестве неограничивающего примера, ретинальная пигментированная эпителиальная клетка.
Термином «клетка кожи» обозначается клетка, которая обычно обнаруживается в коже, в качестве неограничивающего примера, фибробласт, кератиноцит, меланоцит, адипоцит, мезенхимальная стволовая клетка, адипозная стволовая клетка или клетка крови.
Термином «агонист передачи сигнала Wnt» обозначается молекула, которая может выполнять одну или более биологических функций одного или более представителей семейства белков Wnt, в качестве неограничивающего примера, Wnt1, Wnt2, Wnt3, Wnt3a или 2-амино-4-[3,4-(метилендиокси)бензиламино]-6-(3-метоксифенил)пиримидин.
Термином «агонист передачи сигнала ИЛ-6» обозначается молекула, которая может выполнять одну или более биологических функций белка ИЛ-6, в качестве неограничивающего примера, белка ИЛ-6 или рецептора ИЛ-6 (также известного как растворимый рецептор ИЛ-6, IL-6R, IL-6R альфа и т.п.).
Термином «агонист передачи сигнала ТФР-β» обозначается молекула, которая может выполнять одну или более биологических функций одного или более представителей суперсемейства белков ТФР-β, в качестве неограничивающего примера, ТФР-β1, ТФР-β3, активин A, BMP-4 или белок Nodal.
Термином «иммуносуппрессант» обозначается вещество, которое может суппрессировать один или более аспектов иммунной системы и которое обычно отсутствует в организме млекопитающего, в качестве неограничивающего примера, B18R или дексаметазон.
Термином «одноцепочечный разрыв» обозначается участок одноцепочечной или двухцепочечной ДНК, в котором одна или более ковалентных связей, связывающих нуклеотиды, разрушены на одной из одной или двух цепей.
Термином «двухцепочечный разрыв» обозначается участок двухцепочечной ДНК, в котором одна или более ковалентных связей, связывающих нуклеотиды, разрушены на каждой из двух цепей.
Термином «нуклеотид» обозначается нуклеотид или его фрагмент или производное, в качестве неограничивающего примера, нуклеотидное основание, нуклеозид, нуклеотидтрифосфат и т.п.
Термином «нуклеозид» обозначается нуклеотид или его фрагмент или производное, в качестве неограничивающего примера, нуклеотидное основание, нуклеозид, нуклеотидтрифосфат и т.п.
Термином «редактирование генов» обозначается изменение последовательности ДНК клетки, в качестве неограничивающего примера, трансфицированием клетки белком, который вызывает образование в ДНК клетки мутации.
Термином «редактирующий гены белок» обозначается белок, который может самостоятельно или в комбинации с одной или более других молекул, изменять последовательность ДНК клетки, в качестве неограничивающего примера, нуклеаза, подобная активатору транскрипции эффекторная нуклеаза (TALEN), цинк-пальцевая нуклеаза, мегануклеаза, никаза, белок, ассоциированный с короткими палиндромными повторами, регулярно расположенными группами (CRISPR) или их природный или сконструированный вариант, представитель семейства, ортолог, фрагмент или гибридная конструкция.
Термином «матрица для репарации» обозначается нуклеиновая кислота, содержащая участок с по меньшей мере около 70% гомологии с последовательностью, которая находится в пределах 10 т.п.н. сайта-мишени редактирующего гены белка.
Термином «повтор последовательности» обозначается аминокислотная последовательность, которая присутствует в белке в более чем одной копии, составляющая до по меньшей мере около 10% гомологии, в качестве неограничивающего примера, мономерный повтор подобного активатору транскрипции эффектора.
Термином «ДНК-связывающий домен» обозначается участок молекулы, которая способна связываться с молекулой ДНК, в качестве неограничивающего примера, белковый домен, содержащий один или более цинковых пальцев, белковый домен, содержащий один или более повторов последовательностей подобного активатору транскрипции эффектора (TAL), или связывающий карман малой молекулы, который способен связывать молекулу ДНК.
Термином «сайт связывания» обозначается последовательность нуклеиновой кислоты, которая способна распознаваться редактирующим гены белком, ДНК-связывающим белок, ДНК-связывающим доменом или их биологически активным фрагментом или вариантом, или последовательностью нуклеиновой кислоты, к которой редактирующий гены белок, ДНК-связывающий белок, ДНК-связывающий домен или их биологически активный фрагмент или вариант обладает высокой аффинностью, в качестве неограничивающего примера, последовательность ДНК размером около 20 пар оснований в экзоне 1 гена BIRC5 человека.
Термином «мишень» обозначается нуклеиновая кислота, которая содержит сайт связывания.
Другие определения изложены в заявке США № 13/465490, предварительной заявке США № 61/664494, предварительной заявке США № 61/721302, международной заявке № PCT/US12/67966, предварительной заявке США № 61/785404, предварительной заявке США № 61/842874, международной заявке № PCT/US13/68118, предварительной заявке США № 61/934397, заявке США № 14/296220, предварительной заявке США № 62/038608 и предварительной заявке США № 62/069667, содержание которых тем самым включено в данный документ посредством ссылки в полном объеме.
Гликация и гликозилирование представляют собой процессы, посредством которых одна или более молекул сахаридов связываются с белком. В настоящее время установлено, что изменение количества или локализации сайтов гликации или гликозилирования может увеличить или уменьшить стабильность белка. Поэтому некоторые варианты реализации изобретения относятся к белку с одним или более сайтами гликации или гликозилирования. В одном варианте реализации изобретения белок сконструирован таким образом, чтобы содержать больше сайтов гликации или гликозилирования, чем природный вариант белка. В другом варианте реализации изобретения белок сконструирован таким образом, чтобы содержать меньше сайтов гликации или гликозилирования, чем природный вариант белка. В еще одном варианте реализации изобретения белок имеет увеличенную стабильность. В еще одном варианте реализации изобретения белок имеет уменьшенную стабильность.
Дополнительно было обнаружено, что при определенных обстоятельствах, включающих присутствие одного или более стероидов и/или одного или более антиоксидантов в среде для трансфекции может увеличить эффективность трансфекции in vivo, эффективность репрограммирования in vivo и эффективность редактирования генов in vivo. Поэтому некоторые варианты реализации изобретения относятся к приведению клетки или организма пациента в контакт с глюкокортикоидом, таким как гидрокортизон, преднизон, преднизолон, метилпреднизолон, дексаметазон или бетаметазон. Другие варианты реализации изобретения относятся к способу индуцирования клетки для экспрессии представляющего интерес белка приведением клетки в контакт со средой, содержащей стероид, и приведение клетки в контакт с одной или более молекул нуклеиновых кислот. В одном варианте реализации изобретения молекула нуклеиновой кислоты содержит синтетическую РНК. В другом варианте реализации изобретения стероид представляет собой гидрокортизон. В еще одном варианте реализации изобретения гидрокортизон присутствует в среде в концентрации между около 0,1 мкМ и около 10 мкМ, или около 1 мкМ. Другие варианты реализации изобретения относятся к способу индуцирования клетки in vivo для экспрессии представляющего интерес белка приведением в клетки контакт со средой, содержащей антиоксидант, и приведением клетки в контакт с одной или более молекул нуклеиновых кислот. В одном варианте реализации изобретения антиоксидант представляет собой аскорбиновую кислоту или 2-фосфат аскорбиновой кислоты. В другом варианте реализации изобретения аскорбиновая кислота или 2-фосфат аскорбиновой кислоты присутствует в среде в концентрации между около 0,5 мг/л и около 500 мг/л, включая около 50 мг/л. Другие варианты реализации изобретения относятся к способу репрограммирования и/или редактирования генов клетки in vivo приведением клетки в контакт со средой, содержащей стероид и/или антиоксидант, и приведением клетки в контакт с одной или более молекул нуклеиновых кислот, причем одна или более молекул нуклеиновых кислот кодируют один или более репрограммирующих или редактирующих гены белков. В некоторых вариантах реализации изобретения клетка присутствует в организме, а стероид и/или антиоксидант доставляются в организм.
Сообщалось, что при определенных обстоятельствах добавление трансферрина в среду для комплексообразования увеличивает эффективность трансфекции плазмид. В настоящее время установлено, что добавление трансферрина в среду для комплексообразования также может увеличить эффективность трансфекции in vivo молекулами синтетических РНК. Поэтому некоторые варианты реализации изобретения относятся к способу индуцирования клетки in vivo для экспрессии представляющего интерес белка добавлением в содержащий трансферрин раствор одной или более молекул синтетических РНК и реагента для трансфекции. В одном варианте реализации изобретения трансферрин присутствует в растворе в концентрации между около 1 мг/л и около 100 мг/л, такой как 5 мг/л. В другом варианте реализации изобретения трансферрин является рекомбинантным.
Клетки, ткани, органы и организмы, включающие, но не ограниченные, человеческими, обладают несколькими свойствами, которые могут ингибировать или предотвращать доставку нуклеиновых кислот, включая, к примеру, роговой слой, который может служить барьером для чужеродных организмов и нуклеиновых кислот. Таким образом, эти свойства могут ингибировать воздействие терапевтических и косметических средств, содержащих нуклеиновой кислоты. В настоящее время установлено, что многие из этих свойств можно обойти или преодолеть использованием пластыря, содержащего эластичную мембрану и множество игл, и такой пластырь может служить как эффективное и безопасное изделие для доставки нуклеиновых кислот. Поэтому некоторые варианты реализации изобретения относятся к пластырю для доставки нуклеиновых кислот. В одном варианте реализации изобретения пластырь для доставки нуклеиновых кислот содержит эластичную мембрану. В другом варианте реализации изобретения пластырь для доставки нуклеиновых кислот содержит множество игл. В еще одном варианте реализации изобретения множество игл присоединены к эластичной мембране. В некоторых вариантах реализации изобретения пластырь содержит нуклеиновую кислоту. В одном варианте реализации изобретения нуклеиновая кислота находится в растворе. В одном варианте реализации изобретения множество игл включает одну или более игл, имеющих просвет. В другом варианте реализации изобретения пластырь дополнительно содержит вторую эластичную мембрану. В еще одном варианте реализации изобретения эластичная мембрана и вторая эластичная мембрана расположены с образованием полости. В дополнительном варианте реализации изобретения полость содержит нуклеиновую кислоту. В другом дополнительном варианте реализации изобретения мембрана содержит одно или более отверстий, через которые может проходить нуклеиновая кислота. В другом дополнительном варианте реализации изобретения одно или более отверстий и одна или более игл, имеющих просвет, расположены чтобы допускать прохождение раствора, содержащего нуклеиновую кислоту, через по меньшей мере одно из одного или более отверстий и через по меньшей мере одну из одной или более игл, имеющих просвет. В некоторых вариантах реализации изобретения пластырь выполнен с возможностью доставки раствора в кожу. В одном варианте реализации изобретения раствор содержит нуклеиновую кислоту. В другом варианте реализации изобретения раствор содержит носитель. В еще одном варианте реализации изобретения носитель представляет собой липид или липидоид. В другом дополнительном варианте реализации изобретения носитель представляет реагент для трансфекции на основе липида.
Клеточная мембрана может служить защитным барьером для чужеродных нуклеиновых кислот. В настоящее время установлено, что сочетание пластыря по данному изобретению с электрическим полем может увеличивать эффективность доставки нуклеиновых кислот. Поэтому некоторые варианты реализации изобретения относятся к пластырю для доставки нуклеиновых кислот, содержащему множество игл, причем по меньшей мере две иглы образуют часть высоковольтного контура. В одном варианте реализации изобретения высоковольтный контур генерирует напряжение более чем около 10 В. В другом варианте реализации изобретения высоковольтный контур генерирует напряжение более чем около 20 В. В еще одном варианте реализации изобретения между двумя иглами создается электрическое поле. В дополнительном варианте реализации изобретения величина электрического поля составляет по меньшей мере около 100 В/см. В другом дополнительном варианте реализации изобретения величина электрического поля составляет по меньшей мере около 200 В/см. В некоторых вариантах реализации изобретения пластырь выполнен с возможностью доставки нуклеиновой кислоты в эпидермис. В других вариантах реализации изобретения пластырь выполнен с возможностью доставки нуклеиновой кислоты в дерму. В еще одних вариантах реализации изобретения пластырь выполнен с возможностью доставки нуклеиновой кислоты в субдермальную ткань. В еще одних вариантах реализации изобретения пластырь выполнен с возможностью доставки нуклеиновой кислоты в мышцу. Некоторые варианты реализации изобретения относятся к пластырю для доставки нуклеиновых кислот, содержащему множество электродов. В одном варианте реализации изобретения множество электродов присоединено к эластичной мембране. Другие варианты реализации изобретения относятся к пластырю для доставки нуклеиновых кислот, содержащему жесткую структуру. В одном варианте реализации изобретения множество электродов присоединены к жесткой структуре.
Другие варианты реализации изобретения относятся к способу доставки нуклеиновой кислоты в клетку in vivo, включающему нанесение нуклеиновой кислоты на ткань, содержащую клетки in vivo. В одном варианте реализации изобретения способ дополнительно включает наложение нестационарного электрического поля вблизи клетки. В другом варианте реализации изобретения способ приводит к интернализации клеткой нуклеиновой кислоты in vivo. В еще одном варианте реализации изобретения нуклеиновая кислота содержит синтетическую РНК. В дополнительном варианте реализации изобретения способ дополнительно приводит к интернализации клеткой терапевтически или косметически эффективного количества нуклеиновой кислоты. В одном варианте реализации изобретения клетка представляет собой клетку кожи. В другом варианте реализации изобретения клетка представляет собой мышечную клетку. В еще одном варианте реализации изобретения клетка представляет собой дермальный фибробласт. В дополнительном варианте реализации изобретения клетка представляет собой кератиноцит. В другом дополнительном варианте реализации изобретения клетка представляет собой миобласт. В некоторых вариантах реализации изобретения нуклеиновая кислота содержит представляющий интерес белок. В одном варианте реализации изобретения представляющий интерес белок является флуоресцентным белком. В другом варианте реализации изобретения представляющий интерес белок является белком внеклеточного матрикса. В еще одном варианте реализации изобретения представляющий интерес белок является представителем из группы: эластина, коллагена, ламинина, фибронектина, витронектина, лизилоксидазы, эластинсвязывающего белка, фактора роста, фактора роста фибробластов, трансформирующего фактора роста бета, колониестимулирующего фактора гранулоцитов, матриксной металлопротеазы, актина, фибриллина, ассоциированного с микрофибриллами гликопротеина, подобного лизилоксидазе белка, фактора роста тромбоцитов, липазы, разобщающего белка, термогенина и белка, вовлеченного в продукцию пигмента. В некоторых вариантах реализации изобретения способ дополнительно включает доставку нуклеиновой кислоты в эпидермис. В других вариантах реализации изобретения способ дополнительно включает доставку нуклеиновой кислоты в дерму. В других вариантах реализации изобретения способ дополнительно включает доставку нуклеиновой кислоты ниже дермы. В одном варианте реализации изобретения доставка осуществляется инъекцией. В другом варианте реализации изобретения доставка осуществляется инъекцией с использованием микроигольчатой матрицы. В еще одном варианте реализации изобретения доставка осуществляется местным введением. В дополнительном варианте реализации изобретения доставка включает разрушение или удаление части ткани. В дополнительном варианте реализации изобретения доставка включает разрушение или удаление части рогового слоя. В некоторых вариантах реализации изобретения нуклеиновая кислота находится в растворе. В одном варианте реализации изобретения раствор содержит фактор роста. В другом варианте реализации изобретения фактор роста является представителем из группы: фактора роста фибробластов и трансформирующего фактора роста. В еще одном варианте реализации изобретения фактор роста является представителем из группы: основного фактора роста фибробластов и трансформирующего фактора роста бета. В других вариантах реализации изобретения раствор содержит холестерин.
В другом варианте реализации изобретения способ дополнительно включает приведение клетки в контакт с одной или более молекул нуклеиновых кислот. В еще одном варианте реализации изобретения по меньшей мере одна из одной или более молекул нуклеиновых кислот кодирует представляющий интерес белок. В дополнительном варианте реализации изобретения способ приводит к экспрессии клеткой представляющего интерес белка. В другом дополнительном варианте реализации изобретения способ приводит к экспрессии клеткой терапевтически или косметически эффективного количества представляющего интерес белка.
В другом варианте реализации изобретения клетка приводится в контакт с молекулой нуклеиновой кислоты. В еще одном варианте реализации изобретения способ приводит к интернализации клеткой молекулы нуклеиновой кислоты. В дополнительном варианте реализации изобретения способ приводит к интернализации клеткой терапевтически или косметически эффективного количества молекулы нуклеиновой кислоты. В одном варианте реализации изобретения нуклеиновая кислота кодирует представляющий интерес белок. В одном варианте реализации изобретения молекула нуклеиновой кислоты содержит представителя из группы: молекулы дцДНК, молекулы оцДНК, молекулы дцРНК, молекулы оцРНК, плазмиды, олигонуклеотида, молекулы синтетической РНК, молекулы миРНК, молекулы мРНК и молекулы киРНК.
Синтетическая РНК, содержащая только канонические нуклеотиды, может связываться с рецепторами паттерна распознавания, может распознаваться с патоген-ассоциированным молекулярным паттерном и может запускать сильный иммунный ответ в клетках, который может приводить к блокированию трансляции, секреции воспалительных цитокинов и гибели клеток. В настоящее время установлено, что синтетическая РНК, содержащая определенные неканонические нуклеотиды, может избегать выявления врожденной иммунной системой и с высокой эффективностью может транслироваться в белок. Дополнительно установлено, что синтетическая РНК, содержащая по меньшей мере одного представителя из группы: 5-гидроксицитидина, 5-гидроксиметилцитидина, 5-карбоксицитидина, 5-формилцитидина, 5-гидроксиуридина, 5-гидроксиметилуридина, 5-карбоксиуридина и 5-формилуридина может избегать выявления врожденной иммунной системой и с высокой эффективностью может транслироваться в белок. Поэтому некоторые варианты реализации изобретения относятся к способу индуцирования клетки для экспрессии представляющего интерес белка, включающему приведение клетки в контакт с синтетической РНК. Другие варианты реализации изобретения относятся к способу трансфицирования клетки синтетической РНК, включающему приведение клетки в контакт с раствором, содержащим одну или более молекул синтетических РНК. Другие варианты реализации изобретения относятся к способу лечения пациента, включающему введение пациенту синтетической РНК. В одном варианте реализации изобретения синтетическая РНК содержит по меньшей мере одного представителя из группы: 5-гидроксицитидина, 5-гидроксиметилцитидина, 5-карбоксицитидина, 5-формилцитидина, 5-гидроксиуридина, 5-гидроксиметилуридина, 5-карбоксиуридина и 5-формилуридина. В другом варианте реализации изобретения синтетическая РНК кодирует представляющий интерес белок. Типичные РНК могут содержать комбинации и уровни содержания неканонических и неканонических нуклеотидов, как описано в другом месте данного документа, включая отношение к экспрессии любого представляющего интерес белка, описанного в данном документе. В еще одном варианте реализации изобретения способ приводит к экспрессии представляющего интерес белка. В дополнительном варианте реализации изобретения способ приводит к экспрессии представляющего интерес белка в коже пациента.
В настоящее время дополнительно установлено, что приведение клетки в контакт со стероидом может подавлять врожденный иммунный ответ к чужеродным нуклеиновым кислотам и может увеличивать эффективность доставки и трансляции нуклеиновых кислот. Поэтому некоторые варианты реализации изобретения относятся к приведению клетки в контакт со стероидом. Другие варианты реализации изобретения относятся к введению стероида пациенту. В одном варианте реализации изобретения стероид представляет собой гидрокортизон. В другом варианте реализации изобретения стероид представляет собой дексаметазон. Другие варианты реализации изобретения относятся к введению пациенту представителя из группы: антибиотиков, противогрибковых средств и ингибиторов РНКаз.
Другие варианты реализации изобретения относятся к способу доставки в клетку нуклеиновой кислоты in vivo. Другие варианты реализации изобретения относятся к способу индуцирования клетки in vivo для экспрессии представляющего интерес белка. Другие варианты реализации изобретения относятся к способу лечения пациента. В одном варианте реализации изобретения способ включает разрушение рогового слоя. В другом варианте реализации изобретения способ включает приведение клетки в контакт с нуклеиновой кислотой. В еще одном варианте реализации изобретения способ приводит к интернализации клеткой нуклеиновой кислоты. В дополнительном варианте реализации изобретения способ приводит к экспрессии клеткой представляющего интерес белка. В другом дополнительном варианте реализации изобретения способ приводит к экспрессии в организме пациента представляющего интерес белка. В другом дополнительном варианте реализации изобретения способ приводит к облегчению одного или более симптомов пациента. В другом дополнительном варианте реализации изобретения пациент нуждается в представляющем интерес белке. В другом дополнительном варианте реализации изобретения у пациента наблюдается недостаток представляющего интерес белка.
Другие варианты реализации изобретения относятся к способу лечения пациента, включающему доставку композиции в организм пациента. В одном варианте реализации изобретения композиция содержит альбумин, который обработан ионообменной смолой или активированным углем. В другом варианте реализации изобретения способ включает одну или более молекул нуклеиновых кислот. В еще одном варианте реализации изобретения по меньшей мере одна из одной или более молекул нуклеиновых кислот кодирует представляющий интерес белок. В одном варианте реализации изобретения способ приводит к экспрессии белка в коже пациента. В другом варианте реализации изобретения способ приводит к экспрессии терапевтически или косметически эффективного количества представляющего интерес белка в организме пациента. В еще одном варианте реализации изобретения способ включает введение стероида. В дополнительном варианте реализации изобретения стероид является представителем из группы: гидрокортизона и дексаметазона.
Некоторые варианты реализации изобретения относятся к молекуле синтетической РНК. В одном варианте реализации изобретения молекула синтетической РНК кодирует представляющий интерес белок. В другом варианте реализации изобретения молекула синтетической РНК содержит по меньшей мере одного представителя из группы: 5-гидроксицитидина, 5-гидроксиметилцитидина, 5-карбоксицитидина, 5-формилцитидина, 5-гидроксиуридина, 5-гидроксиметилуридина, 5-карбоксиуридина и 5-формилуридина. Другие варианты реализации изобретения относятся к косметической композиции. В одном варианте реализации изобретения косметическая композиция содержит альбумин. В другом варианте реализации изобретения альбумин обрабатывается ионообменной смолой или активированным углем. В еще одном варианте реализации изобретения косметическая композиция содержит молекулу нуклеиновой кислоты. В дополнительном варианте реализации изобретения косметическая композиция содержит как молекулу альбумина, так и нуклеиновой кислоты. Другие варианты реализации изобретения относятся к изделию для косметического лечения, содержащему косметическую композицию, помещенную в устройство, выполненное с возможностью доставки в организм пациента композиции. Другие варианты реализации изобретения относятся к устройству, выполненному с возможностью доставки косметической композиции в организм пациента. В одном варианте реализации изобретения молекула нуклеиновой кислоты кодирует представителя из группы: эластина, коллагена, тирозиназы, рецептора меланокортина 1 и гиалуронансинтазы.
Некоторые белки обладают длительными периодами полувыведения и могут сохранять присутствие в тканях в течение нескольких часов, суток, недель, месяцев и лет. В настоящее время установлено, что некоторые способы лечения пациента могут приводить к накоплению одного или более белков, включая, к примеру, один или более полезных белков. Поэтому некоторые варианты реализации изобретения относятся к способу лечения пациента, включающему доставку в организм пациента сериями доз нуклеиновой кислоты, кодирующей один или более белков. В одном варианте реализации изобретения нуклеиновая кислота содержит синтетическую РНК. В другом варианте реализации изобретения первая доза дается в первой временной точке. В еще одном варианте реализации изобретения вторая доза дается во второй временной точке. В дополнительном варианте реализации изобретения количество по меньшей мере одного из одного или более белков, вводимое пациенту во второй временной точке, больше количества указанного белка в первой временной точке. В дополнительном варианте реализации изобретения способ приводит к накоплению указанного белка в организме пациента.
Другие варианты реализации изобретения относятся к терапевтической композиции, содержащей молекулу нуклеиновой кислоты, кодирующую один или более белков, причем по меньшей мере один из одного или более белков представляет собой белок внеклеточного матрикса. Другие варианты реализации изобретения относятся к косметической композиции, содержащей молекулу нуклеиновой кислоты, кодирующую один или более белков, причем по меньшей мере один из одного или более белков представляет собой белок внеклеточного матрикса.
Нарушения пигментации могут приводить к появлению у пациента тяжелых симптомов. В настоящее время установлено, что нарушения пигментации можно лечить доставкой в организм пациента нуклеиновой кислоты, кодирующей тирозиназу. Поэтому некоторые варианты реализации изобретения относятся к способу лечения нарушения пигментации. Другие варианты реализации изобретения относятся к способу изменения у пациента пигментации. В одном варианте реализации изобретения способ включает доставку в организм пациента нуклеиновой кислоты, кодирующей тирозиназу. Другие варианты реализации изобретения относятся к косметической композиции, содержащей нуклеиновую кислоту, кодирующую тирозиназу. Другие варианты реализации изобретения относятся к терапевтической композиции, содержащей нуклеиновую кислоту, кодирующую тирозиназу. Другие варианты реализации изобретения относятся к способу увеличения поглощения ультрафиолетового света кожей пациента. В одном варианте реализации изобретения способ включает доставку в организм пациента нуклеиновой кислоты, кодирующей тирозиназу. В другом варианте реализации изобретения способ приводит к увеличению поглощения ультрафиолетового света кожей пациента. Другие варианты реализации изобретения относятся к способу уменьшения фотоповреждения кожи человека под воздействием ультрафиолетового света. В одном варианте реализации изобретения способ приводит к снижению фотоповреждения кожи человека под воздействием ультрафиолетового света. Другие варианты реализации изобретения относятся к способу лечения пигментной ксеродермы. В одном варианте реализации изобретения способ включает доставку в организм пациента нуклеиновой кислоты, кодирующей тирозиназу. Другие варианты реализации изобретения относятся к способу лечения буллезного эпидермолиза. В одном варианте реализации изобретения способ включает доставку в организм пациента нуклеиновой кислоты, кодирующей коллаген VII типа. В другом варианте реализации изобретения способ включает доставку в организм пациента нуклеиновой кислоты, кодирующей рецептор меланокортина 1. Другие варианты реализации изобретения относятся к способу лечения ксероза. В одном варианте реализации изобретения способ включает доставку в организм пациента нуклеиновой кислоты, кодирующей гиалуронансинтазу. В другом варианте реализации изобретения у пациента диагностирован атопический дерматит. В еще одном варианте реализации изобретения у пациента диагностирован ихтиоз. Некоторые варианты реализации изобретения относятся к способу лечения косметического патологического состояния. Другие варианты реализации изобретения относятся к способу индуцирования заживления тканей. В одном варианте реализации изобретения способ включает доставку в организм пациента нуклеиновой кислоты, кодирующей гиалуронансинтазу. В другом варианте реализации изобретения косметическое патологическое состояние является представителем из группы: морщин, обвисшей кожи, тонкой кожи, обесцвечивания и сухости кожи. В еще одном варианте реализации изобретения пациенту проведено хирургическое вмешательство по лечению катаракты. В некоторых вариантах реализации изобретения нуклеиновая кислота представляет собой синтетическую РНК. В других вариантах реализации изобретения способ приводит к облегчению одного или более симптомов пациента. Другие варианты реализации изобретения относятся к способу лечения показания доставкой в клетку или организм пациента нуклеиновой кислоты, кодирующей белок или пептид. Другие варианты реализации изобретения относятся к композиции, содержащей нуклеиновую кислоту, кодирующую белок или пептид. Показания, которые могут проходить лечение с использованием способов и композиций по данному изобретению и белки и пептиды, которые могут кодироваться композициями по данному изобретению, изложены в табл. 1, даются в качестве примера и не являются ограничивающими. В одном варианте реализации изобретения показание выбирается из табл. 1. В другом варианте реализации изобретения белок или пептид выбирается из табл. 1. В еще одном варианте реализации изобретения показание и белок или пептид выбираются из одного и того же ряда табл. 1. В дополнительном варианте реализации изобретения представляющий интерес белок является представителем из группы: UCP1, UCP2 и UCP3. Другие варианты реализации изобретения относятся к способам индуцирования клетки для экспрессии множества представляющих интерес белков. В одном варианте реализации изобретения представляющие интерес белки включают по меньшей мере два представителя из группы: липазы, UCP1, UCP2 и UCP3. В другом варианте реализации изобретения представляющие интерес белки включают липазу и представителя из группы: UCP1, UCP2 и UCP3. В другом варианте реализации изобретения белок представляет собой редактирующий гены белок. В еще одном варианте реализации изобретения редактирующий гены белок таргетирует ген, который по меньшей мере частично отвечает за фенотип заболевания. В еще одном варианте реализации изобретения редактирующий гены белок таргетирует ген, который кодирует белок, выбранный из табл. 1. В еще одном варианте реализации изобретения редактирующий гены белок корректирует или удаляет, самостоятельно или в комбинации с одной или более молекулами или редактирующими гены белками, мутацию, которая по меньшей мере частично отвечает за фенотип заболевания.
Таблица 1
Иллюстративные показания
Дополнительные иллюстративные цели настоящего изобретения включают косметические цели, перечисленные в табл. 6 международной патентной публикации № WO 2013/151671, содержание которой тем самым включено в данный документ посредством ссылки в полном объеме.
Дополнительно настоящие композиции и способы могут использоваться для изменения биологического и/или физиологического процесса, к примеру, уменьшения обвисания кожи, увеличения толщины кожи, увеличения объема кожи, уменьшения количества морщин, длины морщин и/или глубины морщин, увеличения тургора, плотности, тонуса и/или эластичности кожи, увеличения гидратации кожи и способности удерживать влагу, приток воды и осмотический баланс, увеличения уровня липидов кожи; увеличения полипептидов внеклеточного матрикса и/или адгезии и коммуникации; увеличение в коже образования; использования и сохранения энергии; улучшения использования кислорода; улучшения иммунной защиты клеток кожи, ответа на стресс от теплового шока, антиокислительной защитной способности в отношении нейтрализации свободных радикалов и/или защиты от токсинов; улучшения защиты и восстановления от ультрафиолетовых лучей; улучшения коммуникации клеток кожи и иннервации клеток кожи; улучшения коадгезии/адгезии клеток; улучшения минерального кальциевого метаболизма и другого минерального метаболизма; улучшения скорости обновления клеточной популяции и улучшения циркадных ритмов клеток.
Дополнительно в некоторых вариантах реализации изобретения настоящие композиции могут использоваться для лечения заболевания, нарушения и/или патологического состояния и/или могут изменять, модифицировать или заменять внешний вид представителя покровной системы субъекта, страдающего от заболевания, нарушения и/или патологического состояния такого как, но не ограничиваясь ими, обыкновенные угри, солнечные акне, шаровидные угри, косметические угри, молниеносные угри, келоидный фолликулит затылка, механические акне, вызванные медикаментами угри, милиарные некротические акне, некротические акне, розовые угри, актинический кератоз, обыкновенные угри, солнечные акне, шаровидные угри, косметические угри, молниеносные угри, келоидный фолликулит затылка, механические акне, вызванные медикаментами угри, милиарные некротические акне, некротические акне, розовые угри, острая крапивница, аллергический контактный дерматит, гнездная алопеция, ангиоэдема, эпидермофития стопы, атопический дерматит, аутоэкзематизация, акне новорожденных, облысение, бластомикоз, черные точки на лице, родинки и другие проблемы пигментации кожи, чирьи, синяки, укусы и ужаления насекомых, ожоги, целлюлит, укусы клещей, хлоракне, холинэргическая или стрессогенная крапивница, хроническая крапивница, крапивница простудного типа, сливающийся папулезный папилломатоз, кожные наросты, цисты, перхоть, герпетиформный дерматит, дерматографизм, дисгидротическая экзема, опрелость, сухая кожа, дисгидроз, эктодермальная дисплазия, такая как гипогидротическая эктодермальная дисплазия и X-сцепленная гипогидротическая эктодермальная дисплазия, экзема, бородавчатая эпидермодисплазия, узловатая эритема, экскориированные угри, индуцированный физическими упражнениями анафилактический фолликулит, избыточного жира кожи, фолликулит, веснушки, обморожение, грибковые поражения ногтей, густота волос, скорость роста волос, вызванные соединениями галогенов акне, выпадение волос, тепловая сыпь, гематома, инфекции простого герпеса (например, негенитального), гнойный гидраденит, сыпь, гипергидроз, гиперпигментация, гипогидротическая эктодермальная дисплазия, гипопигментация, импетиго, вросшие волосы, крапивница горячечного типа, вросший ноготь пальца стопы, младенческие акне или неонатальные акне, кожный зуд, ирритантный контактный дерматит, паховая эпидермофития, келоид, волосяной кератоз, плоский лишай, склерозирующий лишай, милиарная диссеминированная волчанка лица, мелазма, бородавки, контагиозный моллюск, скорость роста ногтей, здоровье ногтей, нейродерматит, монетовидная экзема, профессиональное акне, масляные угри, онихомикоз, механическая крапивница, пилонидальная киста, розовый лишай, разноцветный лишай, высыпания от сумаха ядоносного, помадные угри, псевдофолликулит зоны роста бороды или келоидный фолликулит затылка, псориаз, псориатический артрит, компрессионная крапивница или вызванная давлением замедленная крапивница, колотые раны, такие как порезы и соскобы, сыпь, редкая крапивница или крапивница водяночного типа, ринопластия, дерматомикоз, розовые угри, синдром Ротмунда-Томсона, обвисание кожи, струпья, рубцы, себорея, себорейный дерматит, опоясывающий герпес, рак кожи, мягкая бородавка, крапивница типа солнечного ожога, укус пауков, растяжки, солнечные ожоги, смолистые угри, тропические угри, утончение кожи, молочница, разноцветный лишай, транзиторный акантолитический дерматоз, колпак магната или милиарные некротические акне, неравномерный тонус кожи, варикозное расширение вен, венозная экзема, вибрационная ангиоэдема, витилиго, наросты, болезнь Вебера-Крисчена, морщины, X-сцепленная гипогидротическая эктодермальная дисплазия, ксеротическая экзема, дрожжевая инфекция и общие признаки старения.
В некоторых вариантах реализации изобретения представлены способы лечения сухой кожи настоящими композициями. В некоторых вариантах реализации изобретения профилаггрин (белок, который превращается в филаггрин) является представляющим интерес белком (например, при лечении обыкновенного ихтиоза).
В некоторых вариантах реализации изобретения представлены способы лечения любого из различных типов псориаза (например, бляшковидного псориаза, каплевидного псориаза, пустулезного псориаза, псориаза складок и эритродермического псориаза). В различных вариантах реализации изобретения представляющий интерес белок является любым из продуктов генов, вызывающих восприимчивость к псориазу от 1 до 9 (PSORSl - PSORS9).
Различные варианты реализации изобретения относятся к лечению экземы (например, атопического дерматита, монетовидной экземы, дисгидротической экземы, себорейного дерматита, ирритантного контактного дерматита, аллергического контактного дерматита, дисгидроза, венозной экземы, герпетиформного дерматита, нейродерматита, аутоэкзематизации и ксеротической экземы и, необязательно, может таргетироваться один или более из: филаггрина; трех генетических вариантов, подобного ovo белка 1 (OVOL1), подобного актину белка 9 (ACTL9) и представителя семейства кинезинов 3 A (KIF3A), ассоциированных с экземой, и генов нейротрофического фактора головного мозга (BDNF) и тахикинина, предшественника 1 (TAC1).
Сыпь или крапивница, включая, но не ограничиваясь, острой крапивницей, хронической крапивницей и ангиоэдемой, механической крапивницей, компрессионной или вызванной давлением замедленной крапивницей, холинэргической или стрессогенной крапивницей, крапивницей простудного типа, крапивницей горячечного типа, крапивницей типа солнечного ожога, редкой крапивницей или крапивницей водяночного типа, вибрационной крапивницей, индуцированной физическими упражнениями анафилаксией и дерматографизмом, могут проходить лечение настоящими композициями, к примеру, таргетированием PLCG-2.
Различные варианты реализации изобретения относятся к лечению розовых угрей, которые включают, но не ограничиваются, эритематотелеангиэктатической розацеа, папуло-пустолезными розовыми угрями, фиматозной розацеа и окулярной розацеа. Необязательно, антимикробный пептид кателицидин (CAMP) и/или родственная калликреину пептидаза 5 (также известная как триптический фермент рогового слоя (SCTE)) являются представляющими интерес белками.
В некоторых вариантах реализации изобретения представлены способы лечения акне настоящими композициями. К примеру, акне может включать, но не ограничиваться, угревидной сыпью, солнечными акне, шаровидными угрями, косметическими угрями, молниеносными угрями, келоидным фолликулитом затылка, механическими акне, вызванные медикаментами угрями, милиарными некротическими акне, некротическими акне, розовыми угрями, акне новорожденных, черными точками на лице, хлоракне, экскориированными угрями, вызванными соединениями галогенов акне, младенческими акне или неонатальными акне, милиарной диссеминированной волчанкой лица, профессиональными акне, масляными акне, помадными акне, смолистыми акне, тропическими акне, колпаком магната или милиарными некротическими акне, псевдофолликулитом зоны роста бороды или келоидным фолликулитом затылка и гнойным гидраденитом. В этих вариантах реализации изобретения представляющий интерес белок может быть одной или более матриксными металлопротеиназами (ММP), например, матриксной металлопротеиназой-1 (ММP-1 или интерстициальной коллагеназой), матриксной металлопротеиназой-9 (ММP-9) и матриксной металлопротеиназой-13 (ММP-13).
В дополнительных вариантах реализации изобретения витилиго проходит лечение настоящими композициями, например, при этом таргетируется ген, который входит в семейство NLR, содержащий пириновый домен 1 гена (NALP1).
В некоторых вариантах реализации изобретения настоящие композиции находят применение для лечения гипогидротической эктодермальной дисплазии (HED), например, посредством гена эктодисплазина A (EDA), рецептора (EDAR) и ассоциированного с рецептором домена смерти (EDARADD).
В некоторых вариантах реализации изобретения настоящие композиции находят применение для лечения облысения или утончения волос (например, облысения по мужскому типу или андрогенной алопеции (AGA)) и, необязательно, один или более из следующих может быть представляющим интерес белком: андрогенный рецептор (AR), рецептор эктодисплазина A2 (EDA2R) и рецептор 6 лизофосфатидиловой кислоты (P2RY5).
Настоящие композиции также находят применение в способах лечения шрамов и растяжек (стрии), например, посредством коллагена, рибосомальной киназы s6, секретированного фосфопротеина 1 (также известного как остеопонтин) или трансформирующего фактора роста бета 3.
Бородавчатая эпидермодисплазия (также известная как эпидермодисплазия Лютца-Левандовского), редкое аутосомальное рецессивное генетическое наследственное нарушение кожи, также может проходить лечение композициями по данному изобретению, например, таргетированием генов подобного трансмембранному каналу белка 6 (EVER1) или подобного трансмембранному каналу белка 8 (EVER2).
В некоторых вариантах реализации изобретения обвисание, утончение или веснушчатость кожи может проходить лечение настоящей композицией, например, таргетированием одного или более представляющих интерес белков, таких как коллаген, эластин, фактор роста фибробластов 7, ингибиторы металлопептидаз TIMP, матриксных металлопептидаз, супероксиддисмутаза и другие белки внеклеточного матрикса и протеогликаны.
Дополнительные варианты реализации изобретения применяются при загорании кожи, такие как, меланоцитстимулирующий гормон и/или проопиомеланокортин.
В некоторых вариантах реализации изобретения настоящие композиции могут применяться для лечения ран. В некоторых вариантах реализации изобретения способы лечения ран настоящими композициями включают дополнительные этапы, к примеру, очищение раневого ложе для облегчения заживления ран и затягивания, включая, но не ограничиваясь: хирургической обработкой, первичной хирургической обработкой (хирургическое удаление из раны мертвых или инфицированных тканей), необязательно, включающей химические агенты для хирургической обработки, такие как ферменты, для удаления некротических тканей; перевязки ран для обеспечения раны влагой, сохранения теплого окружения и содействия репарации и заживления тканей (например, перевязка ран, включающая гидрогели (например, AQUASORB®; DUODERM®), гидроколлоиды (например, AQUACEL®; COMFEEL®), пены (например, LYOFOAM®; SPYROSORB®) и альгинаты (например, ALGISITE®; CURASORB®); введение факторов роста для стимулирования деления и пролиферации клеток и для содействия заживления ран, например, бекаплермина, и (iv) покрытие раны мягкой тканью, кожным трансплантатом может быть необходимым для получения покрытия чистых незаживших ран (например, аутологические кожные трансплантаты, кадаверические кожные трансплантаты, биоинженерные заменители кожи (например, APLIGRAF®; DERMAGRAFT®)).
В различных вариантах реализации изобретения разнообразные раковые заболевания проходят лечение настоящими композициями (например, колоректальный рак, рак желчного пузыря, рак легких, рак поджелудочной железы и рак желудка). В некоторых вариантах реализации изобретения рак кожи проходит лечение настоящими композициями. Например, базально-клеточный рак (БКР), плоскоклеточный рак (ПКР) и меланома. В некоторых вариантах реализации изобретения в настоящих композициях используют адъювант для полной круговой периферической и глубокой краевой оценки, хирургия Моса, радиационного воздействия (например, внешней лучевой радиотерапии или брахитерапии), химиотерапии (включающей, но без ограничения местную химиотерапию, например, с использованием имихимода или 5-фторурацила) и криотерапии. Настоящие композиции также находят применение при лечении различных стадий раковых заболеваний, включая раковые заболевания кожи (например, базально-клеточный рак (БКР), плоскоклеточный рак (ПКР) и меланому), такие как стадия по системе TNM Американского объединенного комитета по раку (AJCC) (например, одна или более из TX, T0, Tis, T1, T1a, T1b, T2, T2A, T2B,T3, T3a, T3b, T4, T4a, T4b, NX, N0, N1, N2, N3, M0, M1a, M1b, M1c) и/или системы определения стадий (например, стадия 0, стадия IA, стадия IB, стадия IIA, стадия IIB, стадия IIC, стадия IIIA, стадия IIIB, стадия IIIC, стадия IV).
В различных вариантах реализации изобретения одно или более редких заболеваний проходят лечение настоящими композициями, включая, в качестве иллюстрации, эритропоэтическую протопорфирию, болезнь Хейли-Хейли, буллезный эпидермолиз (БЭ), пигментную ксеродерму, синдром Элерса-Данлоса, синдром вялой кожи, недостаточность белка C и белка S, синдром Альпорта, полосатую ладонно-подошвенную кератодермию, летальный акантолитический БЭ, эластическую псевдоксантому (ЭПК), обыкновенный ихтиоз, обыкновенную пузырчатку и синдром базально-клеточного невуса.
При определенных обстоятельствах может требоваться замещение компонентов, полученных из животных, полученными не из животных и/или рекомбинантными компонентами, в частности потому что полученные не из животных и/или рекомбинантные компоненты могут получаться с большей степенью стабильности, чем полученные из животных компоненты, и в частности потому что полученные не из животных и/или рекомбинантные компоненты несут меньший риск контаминации токсическими и/или патогенными субстанциями, чем полученные из животных компоненты. Поэтому некоторые варианты реализации изобретения относятся к белку, который является полученным не из животных и/или рекомбинантным. Другие варианты реализации изобретения относятся к среде, в которой некоторые или все компоненты среды являются полученными не из животных и/или рекомбинантными.
Другие варианты реализации изобретения относятся к способу трансфекции клетки in vivo. В одном варианте реализации изобретения клетка трансфицируется in vivo одной или более нуклеиновыми кислотами и трансфекция проводится с использованием реагента для трансфекции, такого как реагент для трансфекции на основе липидов. В одном варианте реализации изобретения одна или более нуклеиновых кислот содержат по меньшей мере одну молекулу РНК. В другом варианте реализации изобретения клетка трансфицируется одной или более нуклеиновыми кислотами, и одна или более нуклеиновых кислот кодируют по меньшей мере одного из: p53, TERT, цитокина, секретированного белка, мембраносвязанного белка, фермента, редактирующего гены белка, модифицирующего хроматин белка, ДНК-связывающего белка, фактора транскрипции, гистондеацитилазы, патоген-ассоциированного молекулярного паттерна и опухоль-ассоциированного антигена или их биологически активного фрагмента, аналога, варианта или представителя семейства. В другом варианте реализации изобретения клетка трансфицируется повторно, в том числе по меньшей мере около 2 раз в течение около 10 последовательных суток, или по меньшей мере около 3 раз в течение около 7 последовательных суток, или по меньшей мере около 4 раз в течение около 6 последовательных суток.
Репрограммирование может проводиться трансфицированием клеток одной или более нуклеиновыми кислотами, кодирующими один или более репрограммирующих факторов. Примеры репрограммирующих факторов включают, но не ограничиваются: белком Oct4, белком Sox2, белком Klf4, белком c-Myc, белком l-Myc, белком TERT, белком Nanog, белком Lin28, белком Utf1, белком Aicda, микроРНК miR200, микроРНК miR302, микроРНК miR367, микроРНК miR369 и их биологическими активными фрагментами, аналогами, вариантами и представителями семейств. Поэтому некоторые варианты реализации изобретения относятся к способу репрограммирования клетки in vivo. В одном варианте реализации изобретения клетка репрограммируется in vivo трансфицированием клетки одной или более нуклеиновыми кислотами, кодирующими один или более репрограммирующих факторов. В одном варианте реализации изобретения одна или более нуклеиновых кислот содержат молекулу РНК, которая кодирует белок Oct4. В другом варианте реализации изобретения одна или более нуклеиновых кислот также содержат одну или более молекул РНК, которые кодируют белок Sox2, белок Klf4 и белок c-Myc. В еще одном варианте реализации изобретения одна или более нуклеиновых кислот также содержат молекулу РНК, которая кодирует белок Lin28. В одном варианте реализации изобретения клетка представляет собой клетку кожи человека и клетка кожи человека репрограммируется в плюрипотентную стволовую клетку. В другом варианте реализации изобретения клетка представляет собой клетку кожи человека и клетка кожи человека репрограммируется в инсулинпродуцирующую клетку, реагирующую на изменение уровня глюкозы. Примеры других клеток, которые могут репрограммироваться, и других клеток, по отношению к которым клетка может репрограммироваться, включают, но не ограничиваются: клетками кожи, плюрипотентными стволовыми клетками, мезенхимальными стволовыми клетками, β-клетками, ретинальными пигментированными эпителиальными клетками, гемопоэтическими клетками, кардиомицитами, эпителиальными клетками дыхательных путей, нейральными стволовыми клетками, нейронами, глиальными клетками, клетками костей, клетками крови и стволовыми клетками дентальной пульпы. В одном варианте реализации изобретения клетка приводится в контакт со средой, которая поддерживает репрограммированную клетку. В одном варианте реализации изобретения среда также поддерживает клетку.
Важно отметить, что сообщалось о том, что инфицирование клеток кожи вирусами, кодирующими Oct4, Sox2, Klf4 и c-Myc, в сочетании с культивирование клеток в среде, которая поддерживает рост кардиомицитов, вызывает репрограммирование клеток кожи в кардиомициты без начального репрограммирования клеток кожи в плюрипотентные стволовые клетки (см. Efs et al Nat Cell Biol. 2011;13:215-22, содержание которых тем самым включено в данный документ посредством ссылки). При определенных обстоятельствах может быть желательным прямое репрограммирование (репрограммирование одной соматической клетки в другую соматическую клетку без начального репрограммирования соматической клетки в плюрипотентную стволовую клетку, также известное как «трансдифференцировка»), в частности потому что культивирование плюрипотентных стволовых клеток может быть затратным по времени и дорогим, дополнительная работа, заключающаяся в оценке и определении характеристик стабильной линии плюрипотентных стволовых клеток, может нести повышенный риск контаминации, а дополнительный период времени пребывания в культуре, связанный с начальным получением плюрипотентных стволовых клеток, может нести повышенный риск геномной нестабильности и образования мутаций, включающих точечные мутации, вариации числа копий и кариотипические аномалии. Поэтому некоторые варианты реализации изобретения относятся к способу репрограммирования соматической клетки in vivo, причем клетка репрограммируется в соматическую клетку и, при этом не получается требующая определения характеристик линия плюрипотентных стволовых клеток.
Дополнительно установлено, что при определенных обстоятельствах, может потребоваться меньшее общее количество трансфекций для репрограммирования клетки в соответствии со способами по данному изобретению, чем в соответствии с другими методами. Поэтому некоторые варианты реализации изобретения относятся к способу репрограммирования клетки in vivo, причем между около 1 и около 12 трансфекций проводятся в течение около 20 последовательных суток, или между около 4 и около 10 трансфекций проводятся в течение около 15 последовательных суток, или между около 4 и около 8 трансфекций проводятся в течение около 10 последовательных суток. Понятно, что когда клетка приводится в контакт со средой, содержащей молекулы нуклеиновых кислот, клетка вероятно может приводится в контакт и/или интернализировать более одной молекулы кислоты нуклеиновой кислоты одновременно или в разные моменты времени. Поэтому клетка может приводится в контакт с нуклеиновой кислотой более одного раза, например повторно, даже если клетка приводится в контакт со средой, содержащей нуклеиновые кислоты, один раз.
Следует отметить, что нуклеиновые кислоты могут содержать один или более неканонических, или «модифицированных», остатков (например, остатка, отличающегося от аденина, гуанина, тимина, урацила и цитозина или стандартного нуклеозида, нуклеотида, дезоксинуклеозида или их дезоксинуклеозидных производных). Следует отдельно отметить, что псевдоуридин-5'-трифосфат может быть заменен уридин-5'-трифосфатом реакцией транскрипции in vitro с получением синтетической РНК, причем до 100% остатков уридина синтетической РНК может замещаться псевдоуридиновыми остатками. Транскрипция in vitro может приводить к получению РНК с остаточной иммуногенностью даже если псевдоуридин и 5-метилцитидин, соответственно, полностью замещены на уридин и цитидин (см., например, Angel. Reprogramming Human Somatic Cells to Pluripotency Using RNA [Doctoral Thesis]. Cambridge, MA: MIT; 2011, содержание которой тем самым включено в данный документ посредством ссылки). По этой причине обычной практикой является добавление иммуносупрессанта в среду для трансфекции при трансфицировании клеток РНК. При определенных обстоятельствах может быть нежелательным добавление иммуносупрессанта в среду для трансфекции, в частности потому что наиболее часто используемый с этой целью рекомбинантный иммуносупрессант, B18R, может быть дорогим и сложным для производства. В настоящее время установлено, что клетки могут трансфицироваться и/или репрограммироваться in vivo в соответствии со способами по данному изобретению без использования B18R или любого другого иммуносупрессанта. Дополнительно установлено, что репрограммирование клеток in vivo в соответствии со способами по данному изобретению без использования иммуносупрессантов может быть быстрым, эффективным и надежным. Поэтому некоторые варианты реализации изобретения относятся к способу трансфицирования клетки in vivo, причем среда для трансфекции не содержит иммуносупрессанта. Другие варианты реализации изобретения относятся к способу репрограммирования клетки in vivo, причем среда для трансфекции не содержит иммуносупрессанта. При определенных обстоятельствах, к примеру при использовании высокой плотности клеток, может быть целесообразным добавлять иммуносупрессант в среду для трансфекции. Поэтому некоторые варианты реализации изобретения относятся к способу трансфицирования клетки in vivo, причем среда для трансфекции содержит иммуносупрессант. Другие варианты реализации изобретения относятся к способу репрограммирования клетки in vivo, причем среда для трансфекции содержит иммуносупрессант. В одном варианте реализации изобретения иммуносупрессант представляет собой B18R или его биологически активный фрагмент, аналог, вариант или представитель семейства или дексаметазон или его производное. В одном варианте реализации изобретения среда для трансфекции не содержит иммуносупрессант, а доза нуклеиновой кислоты выбирается такой, что предотвращает избыточную токсичность. В другом варианте реализации изобретения доза нуклеиновой кислоты составляет менее около 1 мг/см2 ткани или менее около 1 мг/100000 клеток или менее около 10 мг/кг.
Репрограммированные клетки, полученные в соответствии с некоторыми вариантами реализации изобретения по данному изобретению, подходят для терапевтических и/или косметических применений, поскольку они не содержат последовательности экзогенных ДНК и они не подвергаются воздействию продуктов, полученных из организма животных или человека, которые могут иметь неопределенный состав и которые могут содержать токсические и/или патогенные контаминанты. Кроме того, высокая скорость осуществления, эффективность и надежность некоторых вариантов реализации по данному изобретению могут снижать риск возникновения и накопления мутаций и других хромосомных аномалий. Таким образом, некоторые варианты реализации изобретения могут использоваться для создания клеток, которые имеют профиль безопасности, достаточный для использования для терапевтических и/или косметических применений. К примеру, репрограммирование клеток с использованием РНК и среды по данному изобретению, при котором среда не содержит компонентов, полученных из организма животных или человека, может приводить к получению клеток, которые не подвергались воздействию аллогенного материала. Поэтому некоторые варианты реализации изобретения относятся к репрограммированной клетке, которая обладает требуемым профилем безопасности. В одном варианте реализации изобретения репрограммированная клетка обладает нормальным кариотипом. В другом варианте реализации изобретения репрограммированная клетка обладает меньше чем около 5 вариациями числа копий (CNV) относительно генома пациента, такими как меньше чем около 3 вариациями числа копий относительно генома пациента или отсутствием вариаций числа копий относительно генома пациента. В еще одном варианте реализации изобретения репрограммированная клетка имеет нормальный кариотип и менее чем около 100 однонуклеотидных вариантов в кодирующих участках относительно генома пациента, или менее чем около 50 однонуклеотидных вариантов в кодирующих участках относительно генома пациента, или менее чем около 10 однонуклеотидных вариантов в кодирующих участках относительно генома пациента.
Эндотоксины и нуклеазы могут совместно очищаться и/или оказываться ассоциированными с другими белками, такими как сывороточный альбумин. Рекомбинантные белки, в частности, часто могут содержать высокие уровни ассоциированных эндотоксинов и нуклеаз, в частности из-за лизиса клеток, который может происходить во время их получения. Эндотоксины и нуклеазы могут быть снижены, удалены, замещены или иным образом инактивироваться множеством способов по данному изобретению, включающими, к примеру, ацетилирование, добавление стабилизатора, такого как октаноат натрия, с последующей обработкой нагреванием, добавление в раствор альбумина и/или среду ингибиторов нуклеаз, кристаллизацию, приведение в контакт с одной или более ионообменных смол, приведение в контакт с активированным углем, препаративный электрофорез или аффинную хроматографию. В настоящее время установлено, что частичное или полное снижение, удаление, замещение или иным образом инактивирование эндотоксинов и/или нуклеаз из среды и/или из одного или более компонентов среды может увеличивать эффективность, с которой клетки могут быть трансфицированы и репрограммированы. Поэтому некоторые варианты реализации изобретения относятся к способу трансфицирования клетки in vivo одной или более нуклеиновыми кислотами, причем среда для трансфекции обрабатывается для частичного или полного снижения, удаления, замещения или иным образом инактивирования одного или более эндотоксинов и/или нуклеаз. Другие варианты реализации изобретения относятся к среде, которая вызывает минимальную деградацию нуклеиновых кислот. В одном варианте реализации изобретения среда содержит менее чем около 1 ЕЭ/мл, или менее чем около 0,1 ЕЭ/мл, или менее около 0,01 ЕЭ/мл.
При определенных обстоятельствах липидные носители на основе белков, такие как сывороточный альбумин, могут замещаться липидными носителями не на основе белков, такими как метил-бета-циклодектрин. Среда по данному изобретению также может использоваться без липидного носителя, к примеру, если трансфекция выполняется с использованием способа, который может не требовать или для которого не является целесообразным наличие липидного носителя, к примеру, с использованием одного или более реагентов для трансфекции на основе липидов, реагентов для трансфекции на основе полимеров или реагентов для трансфекции на основе пептидов или с использованием электропорации. Множество ассоциированных с белками молекул, такие как ионы металлов, могут быть очень токсическими для клеток in vivo. Эта токсичность может вызывать снижение жизнеспособности, а также возникновение мутаций. Таким образом некоторые варианты реализации изобретения имеют дополнительное преимущество получения клеток, которые свободны от токсических молекул.
Количество ассоциированного молекулярного компонента белка может измеряться суспендированием белка в растворе и измерением проводимости раствора. Поэтому некоторые варианты реализации изобретения относятся к среде, которая содержит белок, причем около 10% раствор белка в воде имеет проводимость менее чем около 500 мкОм/см. В одном варианте реализации изобретения раствор имеет проводимость менее чем около 50 мкОм/см. В другом варианте реализации изобретения менее чем около 0,65% сухой массы белка содержит липиды и/или менее около 0,35% сухой массы белка содержит свободные жирные кислоты.
Количество нуклеиновой кислоты, доставляемой в клетки in vivo, может быть увеличено для увеличения требуемого эффекта нуклеиновой кислоты. Однако, увеличение количества доставляемой in vivo нуклеиновой кислоты в клетки сверх определенного значения может вызвать уменьшение жизнеспособности клеток, в частности из-за токсичности реагента для трансфекции. В настоящее время установлено, что если нуклеиновая кислота доставляется в популяцию клеток in vivo вфиксированный объем (к примеру, клетки в участке ткани), то количество нуклеиновой кислоты, доставленной в каждую клетку, может зависеть от общего количества нуклеиновой кислоты, доставленной в популяцию клеток и в скопление клеток с более высокой плотностью клеток, приводя к получению меньшего количества нуклеиновой кислоты, доставляемого в каждую клетку. В некоторых вариантах реализации изобретения клетка трансфицируется in vivo одной или более нуклеиновыми кислотами более одного раза. В определенных условиях, к примеру если клетки являются пролиферирующими, плотность клеток может изменяться от одной трансфекции к следующей. Поэтому некоторые варианты реализации изобретения относятся к способу трансфицирования клетки in vivo нуклеиновой кислотой, причем клетка трансфицируется более одного раза и при этом количество нуклеиновой кислоты, доставляемое в клетку, отличается для двух трансфекций. В одном варианте реализации изобретения клетка пролиферирует между двумя трансфекциями, а количество нуклеиновой кислоты, доставляемое в клетку, больше для второй из двух трансфекций чем для первой из двух трансфекций. В другом варианте реализации изобретения клетка трансфицируется более двух раз и количество нуклеиновой кислоты, доставляемое в клетку, больше для второй из трех трансфекций чем для первой из трех одинаковых трансфекций, а количество нуклеиновой кислоты, доставляемое в клетку, больше для третьей из трех одинаковых трансфекций чем для второй из трех одинаковых трансфекций. В еще одном варианте реализации изобретения клетка трансфицируется более одного раза, а максимальное количество нуклеиновой кислоты, доставляемое в клетку во время каждой трансфекции, является достаточно низким, что обеспечивает по меньшей мере около 80% жизнеспособности для по меньшей мере двух последовательных трансфекциях.
В настоящее время установлено, что модулирование количества нуклеиновой кислоты, доставляемого в популяцию пролиферирующих клеток in vivo сериями трансфекций, может приводить как к увеличенному воздействию нуклеиновой кислоты так и к увеличенной жизнеспособности клеток. Дополнительно установлено, что при определенных обстоятельствах, если клетки приводятся в контакт in vivo с одной или более нуклеиновых кислот, кодирующих один или более репрограммирующих факторов, сериями трансфекций, то для по меньшей мере части из серии трансфекций эффективность репрограммирования может быть увеличена, когда количество нуклеиновой кислоты, доставленное в последующих трансфекциях, является большим чем количество нуклеиновой кислоты, доставленное в предыдущих трансфекциях. Поэтому некоторые варианты реализации изобретения относятся к способу репрограммирования клетки in vivo, в котором одна или более нуклеиновых кислот повторно доставляются в клетку сериями трансфекций, а количество нуклеиновой кислоты, доставляемое в клетку является большим для по меньшей мере одной последующей трансфекции чем для по меньшей мере одной предыдущей трансфекции. В одном варианте реализации изобретения клетка трансфицируется между около 2 и около 10 раз, или между около 3 и около 8 раз, или между около 4 и около 6 раз. В другом варианте реализации изобретения одна или более нуклеиновых кислот включают по меньшей мере одну молекулу РНК, клетка трансфицируется между около 2 и около 10 раз, а количество нуклеиновой кислоты, доставляемое в клетку в каждой трансфекции является одинаковым или большим чем количество нуклеиновой кислоты, доставляемой в клетку в самой последней предыдущей трансфекции. В еще одном варианте реализации изобретения количество нуклеиновой кислоты, доставляемое в клетку в первой трансфекции составляет между около 20 нг/см2 и около 250 нг/см2, или между 100 нг/см2 и 600 нг/см2. В еще одном варианте реализации изобретения клетка трансфицируется около 5 раз с интервалами между около 12 и около 48 часами, а количество нуклеиновой кислоты, доставляемое в клетку составляет около 25 нг/см2 для перовой трансфекции, около 50 нг/см2 для второй трансфекции, около 100 нг/см2 для третьей трансфекции, около 200 нг/см2 для четвертой трансфекции и около 400 нг/см2 для пятой трансфекции. В еще одном варианте реализации изобретения клетка дополнительно трансфицируется по меньшей мере один раз после пятой трансфекции, а количество нуклеиновой кислоты, доставляемое в клетку составляет около 400 нг/см2.
Некоторые варианты реализации изобретения относятся к способу трансфицирования клетки in vivo нуклеиновой кислотой, причем количество нуклеиновой кислоты определяется измерением плотности клеток, а выбор количества нуклеиновой кислоты для трансфицирования основывается на измерении плотности клеток. В одном варианте реализации изобретения плотность клеток измеряется оптическими средствами. В другом варианте реализации изобретения клетка трансфицируется повторно, плотность клеток увеличивается между двумя трансфекциями, а количество трансфицированной нуклеиновой кислоты больше для второй из двух трансфекций чем для первой из двух трансфекций.
В настоящее время установлено, что при определенных обстоятельствах, эффективность трансфекции in vivo и жизнеспособность клеток, контактировавших со средой по данному изобретению, могут быть улучшены кондиционированием среды. Поэтому некоторые варианты реализации изобретения относятся к способу кондиционирования среды. Другие варианты реализации изобретения относятся к среде, которая является кондиционированной. В одном варианте реализации изобретения фидеры представляют собой фибробласты, а среда кондиционируется в течение приблизительно 24 часов. Другие варианты реализации изобретения относятся к способу трансфицирования клетки in vivo, причем среда для трансфекции является кондиционированной. Другие варианты реализации изобретения относятся к способу репрограммирования и/или редактирования генов клетки in vivo, причем среда является кондиционированной. В одном варианте реализации изобретения фидеры являются митотически инактивированными, к примеру, воздействием химического вещества, такого как митомитоцин-C, или воздействием гамма-радиации. В некоторых вариантах реализации изобретения может быть целесообразным применение только аутологических материалов, в частности, к примеру и не желая связи с какой-либо теорией, для избегания риска передачи заболевание от фидеров к клетке или пациенту. Поэтому некоторые варианты реализации изобретения относятся к способу трансфицирования клетки in vivo, причем среда для трансфекции является кондиционированной и при этом фидеры получают из организма того же индивида, что и клетка, подвергаемая трансфицированию. Другие варианты реализации изобретения относятся к способу репрограммирования и/или редактирования генов клетки in vivo, причем среда является кондиционированной и при этом фидеры получают из организма того же индивида, что и клетка, подвергаемая репрограммированию и/или редактированию генов.
В среду кондиционированием могут добавляться несколько молекул. Поэтому некоторые варианты реализации изобретения относятся к среде, которая обогащается одной или более молекулами, которые присутствуют в кондиционированной среде. В одном варианте реализации изобретения среда обогащается Wnt1, Wnt2, Wnt3, Wnt3a или их биологически активным фрагментом, аналогом, вариантом, агонистом или представителем семейства. В другом варианте реализации изобретения среда обогащается ТФР-β или его биологически активным фрагментом, аналогом, вариантом, агонистом или представителем семейства. В еще одном варианте реализации изобретения клетка репрограммируется in vivo в соответствии со способом по данному изобретению, в котором среда не обогащена ТФР-β в течение между около 1 и около 5 суток, и потом обогащается ТФР-β в течение по меньшей мере около 2 суток. В еще одном варианте реализации изобретения среда обогащается ИЛ-6, IL-6R или их биологически активным фрагментом, аналогом, вариантом, агонистом или представителем семейства. В еще одном варианте реализации изобретения среда обогащается сфинголипидом или жирной кислотой. В другом варианте реализации изобретения сфинголипид представляет собой лизофосфатидиловую кислоту, лизосфингомиелин, сфингозин-1-фосфат или их биологически активный аналог, вариант или производное.
В дополнение к митотически инактивированным клеткам, в определенных условиях, изменять экспрессию генов клеток может облучение, что приводит к продукции клетками меньшего количества некоторых белков и большего количества некоторых других белков чем необлученные клетки, к примеру, представителей семейства Wnt белков. В дополнение к этому некоторые представители семейства Wnt белков могут способствовать росту и трансформации клеток. В настоящее время установлено, что при определенных обстоятельствах эффективность репрограммирования может быть существенно увеличена приведением клетки в контакт со средой in vivo, которая кондиционирована с использованием облученных фидеров вместо обработанных митомицином-C фидеров. Дополнительно установлено, что увеличение эффективности репрограммирования наблюдалось при использовании облученных фидеров, вызванное в частности белками Wnt, которые секретируются фидерами. Поэтому некоторые варианты реализации изобретения относятся к способу репрограммирования клетки in vivo, в котором клетка приводится в контакт с Wnt1, Wnt2, Wnt3, Wnt3a или их биологически активным фрагментом, аналогом, вариантом, представителем семейства или агонистом, включая агонисты последующих мишеней белков Wnt и/или агенты, которые имитируют один или более биологических эффектов белков Wnt, к примеру, 2-амино-4-[3,4-(метилендиокси)бензиламино]-6-(3-метоксифенил)пиримидин.
Из-за низкой эффективности многих способов репрограммирования на основе использования ДНК, эти способы может быть сложно или невозможно использовать с клетками, полученными из взятых у пациентов образцов, которые могут содержать только малое количество клеток. В противоположность этому высокая эффективность в некоторых вариантах реализации по данному изобретению может допускать надежное репрограммирование малого количества клеток, включая одиночные клетки. Некоторые варианты реализации изобретения относятся к способу репрограммирования малого количества клеток. Другие варианты реализации изобретения относятся к способу репрограммирования единственной клетки. В одном варианте реализации изобретения клетка приводится в контакт с одним или более ферментами. В другом варианте реализации изобретения фермент представляет собой коллагеназу. В еще одном варианте реализации изобретения коллагеназа является свободной от компонентов организма животных. В одном варианте реализации коллагеназа присутствует в концентрации между около 0,1 мг/мл и около 10 мг/мл, или между около 0,5 мг/мл и около 5 мг/мл. В другом варианте реализации изобретения клетка представляет собой клетку крови. В еще одном варианте реализации изобретения клетка приводится в контакт со средой, содержащей один или более белков, которые получены из крови пациента. В другом варианте реализации изобретения клетка приводится в контакт со средой, содержащей: DMEM/F12+2 мM L-аланил-L-глутамина+между около 5% и около 25% полученной из организма пациента сыворотки, или между около 10% и около 20% полученной из организма пациента сыворотки, или около 20% полученной из организма пациента сыворотки.
В настоящее время установлено, что при определенных обстоятельствах трансфицирование клеток in vivo смесью РНК, кодирующих Oct4, Sox2, Klf4 и c-Myc, с использованием среды по данному изобретению, может вызывать увеличение скорости пролиферации клеток. Если количество РНК, доставляемое в клетки является слишком низким для обеспечения того, чтобы трансфицировались все клетки, то только часть клеток может показать увеличенную скорость пролиферации. При определенных обстоятельствах, таких как создание персонализированных терапевтических средств, может требоваться увеличение скорости пролиферации клеток, в частности потому что благодаря этому можно уменьшить период времени, необходимый для создания терапевтического средства, и таким образом можно уменьшить стоимость терапевтического средства. Поэтому некоторые варианты реализации изобретения относятся к способу трансфицирования клетки in vivo смесью РНК, кодирующих Oct4, Sox2, Klf4 и c-Myc. В одном варианте реализации изобретения клетка проявляет увеличенную скорость пролиферации. В другом варианте реализации изобретения клетка репрограммируется.
Множество заболеваний ассоциированы с одной или более мутаций. Мутации могут корректироваться приведением клетки в контакт с нуклеиновой кислотой, кодирующей белок, который самостоятельно или в комбинации с другими молекулами, корректирует мутации (пример редактирования генов). Примеры таких белков включают: цинк-пальцевые нуклеазы и TALEN. Поэтому некоторые варианты реализации изобретения относятся к способу трансфицирования клетки in vivo нуклеиновой кислотой, причем нуклеиновая кислота кодирует белок, который самостоятельно или в комбинации с другими молекулами, создает в молекуле ДНК одноцепочечный или двухцепочечный разрыв. В одном варианте реализации изобретения белок представляет собой цинк-пальцевую нуклеазу или TALEN. В другом варианте реализации изобретения нуклеиновая кислота представляет собой молекулу РНК. В еще одном варианте реализации изобретения одноцепочечный или двухцепочечный разрыв находится в пределах около 5000000 оснований сайта инициации транскрипции гена, выбранного из группы: CCR5, CXCR4, GAD1, GAD2, CFTR, HBA1, HBA2, HBB, HBD, FANCA, XPA, XPB, XPC, ERCC2, POLH, HTT, DMD, SOD1, APOE, PRNP, BRCA1 и BRCA2 или их аналога, варианта или представителя семейства. В еще одном варианте реализации изобретения клетка трансфицируется нуклеиновой кислотой, которая действует как матрица для репарации, вызывая образование инсерции последовательности ДНК в области одноцепочечного или двухцепочечного разрыва или иным образом вызывая изменение в последовательности ДНК в участке одноцепочечного или двухцепочечного разрыва. В еще одном варианте реализации изобретения клетка репрограммируется и, впоследствии, в клетке редактируются гены. В еще одном варианте реализации изобретения в клетке редактируются гены и, впоследствии, клетка репрограммируется. В еще одном варианте реализации изобретения редактирование генов и репрограммирование выполняется в пределах около 7 суток относительно друг друга. В еще одном варианте реализации изобретения редактирование генов и репрограммирование происходит одновременно или в один и тот же день. В еще одном варианте реализации изобретения клетка представляет собой клетку кожи, причем в клетке кожи редактируются гены для разрушения гена CCR5, клетка кожи репрограммируется в гемопоэтическую стволовую клетку, таким образом получается терапевтическое средство против ВИЧ/СПИДа и терапевтическое средство используется для лечения пациента с ВИЧ/СПИДом. В еще одном варианте реализации изобретения клетку кожи получают у того же пациента, для лечения которого применяется терапевтическое средство.
Гены, которые могут редактироваться в соответствии со способами по данному изобретению для получения терапевтических средств по данному изобретению, включают гены, которые могут редактироваться для восстановления нормальной функции, а также гены, которые могут редактироваться для снижения или ликвидации функции. Такие гены включают, но не ограничиваются геном бета-глобина (HBB), мутации в котором могут вызывать серповидноклеточную анемию (SCD) и β-талассемию, геном рака молочной железы с ранним проявлением 1 (BRCA1) и геном рака молочной железы с ранним проявлением 2 (BRCA2), мутации в которых могут увеличивать чувствительность к раку молочной железы, геном хемокинового рецептора C-C 5 типа (CCR5) и геном хемокинового рецептора C-X-C 4 типа (CXCR4), мутации в которых могут придавать устойчивость к инфекции ВИЧ, геном трансмебранного регулятора проводимости при муковисцидозе (CFTR), мутации в котором могут вызывать муковисцидоз, геном дистрофина (DMD), мутации в котором могут вызывать мышечную дистрофию, включая мышечную дистрофию Дюшенна и мышечную дистрофию Беккера, геном глутаматдекарбоксилазы 1 и геном глутаматдекарбоксилазы 2 (GAD1, GAD2), мутации в которых могут предотвращать аутоиммунное разрушение β-клеток, генами гемоглобина-альфа 1, гемоглобина-альфа 2 и гемоглобина-дельта (HBA1, HBA2 и HBD), мутации в которых могут вызывать талассемию, геном Хантингтона (HTT), мутации в котором могут вызывать болезнь Хантингтона, геном супероксиддисмутазы 1 (SOD1), мутации в котором могут вызывать латеральный амиотрофический склероз (ALS), генами XPA, XPB, XPC, XPD (ERCC6) и полимеразы (ДНК-направляемой) эта (POLH), мутации в которых могут вызывать пигментную ксеродерму, богатым лектинами повтором киназы 2 (LRRK2), мутации в котором могут вызывать болезнь Паркинсона и анемию Фанкони, комплементирующими группами A, B, C, D1, D2, E, F, G, I, J, L, M, N, P (FANCA, FANCB, FANCC, FANCD1, FANCD2, FANCE, FANCF, FANCG, FANCI, FANCJ, FANCL, FANCM, FANCN, FANCP) и гомологом C RAD51 (S. cerevisiae) (RAD51C), мутации в которых могут вызывать анемию Фанкони.
Некоторые варианты реализации изобретения относятся к терапевтической композиции, содержащей нуклеиновую кислоту. В одном варианте реализации изобретения нуклеиновая кислота кодирует один или более редактирующих гены белков. Другие варианты реализации изобретения относятся к терапевтическому средству, содержащему одну или более клеток, которые трансфицированы, репрограммированы и/или с редактированием генов in vivo в соответствии со способами по данному изобретению. В одном варианте реализации изобретения клетка трансфицируется, репрограммируется и/или у нее редактируются гены, и/или трансфицированная/с репрограммированными генами клетка вводится пациенту. В другом варианте реализации изобретения клетка отбирается у того же пациента, которому вводится трансфицированная, репрограммированная и/или с редактированными генами клетка. Примеры заболеваний, которые могут проходить лечение терапевтическими средствами по данному изобретению включают, но не ограничиваются, болезнью Альцгеймера, повреждением спинного мозга, латеральным амиотрофическим склерозом, муковисцидозом, сердечно-сосудистым заболеванием, включающим ишемическую и дилатационную кардиомиопатию, макулярной дегенерацией, болезнью Паркинсона, болезнью Хантингтона, диабетом, серповидноклеточной анемией, талассемией, анемией Фанкони, пигментной ксеродермой, мышечной дистрофией, тяжелым комбинированным иммунодефицитом, наследственной сенсорной невропатией, раком и ВИЧ/СПИДом. В некоторых вариантах реализации изобретения терапевтическое средство содержит косметическое средство. В одном варианте реализации изобретения клетка отбирается у пациента, клетка репрограммируется и размножается до большого количества адипозных клеток для получения косметического средства и косметическое средство вводится пациенту. В другом варианте реализации изобретения косметическое средство применяется для восстановления тканей.
Несмотря на то, что в данном документе предложены подробные примеры для получения специфических типов клеток и для получения терапевтических средств, содержащих специфические типы клеток, понятно, что способы по данному изобретению могут использоваться для получения многих других типов клеток и для получения терапевтических средств, содержащих один или более из многих других типов клеток, к примеру, репрограммированием клетки в соответствии со способами по данному изобретению и культивированием клеток в условиях, которые имитируют один или более аспектов развития, обеспечивая условия, которые напоминают условия, имеющиеся в клеточном микроокружении в процессе развития.
Некоторые варианты реализации изобретения относятся к библиотеке клеток с разнообразными типами лейкоцитарных антигенов человека (HLA) (HLA-согласованные библиотеки). HLA-согласованные библиотеки могут быть полезными, в частности потому что они могут обеспечить быструю продукцию и/или распределение терапевтических средств без необходимости ожидания пациентом терапевтического средства, которое нужно получать из клеток пациента. Такая библиотека может быть особенно полезной для получения косметических средств и для лечения сердечно-сосудистого заболевания и заболеваний крови и/или иммунной системы, при которых пациенты могут получить выгоду от немедленной доступности терапевтического или косметического средства.
Некоторые неканонические нуклеотиды, при внедрении в молекулы синтетических РНК, могут снижать токсичность молекул синтетических РНК, в частности препятствуя связыванию белков, которые выявляют экзогенные нуклеиновые кислоты, к примеру, белковая киназа R, Rig-1 и семейство белков олигоаденилатсинтазы. Неканонические нуклеотиды, которые, как сообщалось, снижают токсичность молекул синтетических РНК при внедрении в них, включают: псевдоуридин, 5-метилуридин, 2-тиоуридин, 5-метилцитидин, N6-метиладенозин и их некоторые комбинации. Однако химические свойства неканонических нуклеотидов, которые могут обеспечить им возможность снизить токсичность молекул синтетических РНК in vivo до настоящего момента остаются неизвестными. Кроме того, внедрение большого количества из большинства неканонических нуклеотидов, к примеру, 5-метилуридина, 2-тиоуридина, 5-метилцитидина и N6-метиладенозина, может снижать эффективность, с которой молекулы синтетических РНК могут транслироваться в белок, ограничивая полезность молекул синтетических РНК, содержащих эти нуклеотиды в применениях, требующих экспрессии белков. В дополнение к этому, в то время как псевдоуридин в молекулах синтетических РНК может быть полностью заменен на уридин без снижения эффективности, с которой молекулы синтетических РНК могут транслироваться в белок, при определенных обстоятельствах, к примеру, при проведении частых повторных трансфекций, молекулы синтетических РНК, содержащие только аденозин, гуанозин, цитидин и псевдоуридин могут проявлять избыточную токсичность.
В настоящее время установлено, что молекулы синтетических РНК, содержащие один или более неканонических нуклеотидов, которые содержат одно или более замещений в положениях 2C и/или 4C и/или 5C в случая пиримидина или положениях 6C и/или 7N и/или 8C в случае пурина, могут быть менее токсическими чем молекулы синтетических РНК, содержащие только канонические нуклеотиды, в частности из-за способности заместителей в этих положениях препятствовать распознаванию молекул синтетических РНК белками, которые выявляют экзогенные нуклеиновые кислоты, и кроме того, такие заместители в этих положениях могут обладать минимальным влиянием на эффективность, с которой молекулы синтетических РНК могут транслироваться в белок, в частности из-за отсутствия взаимодействия заместителей в этих положениях при взаимодействиях спаривания оснований и стекинга оснований.
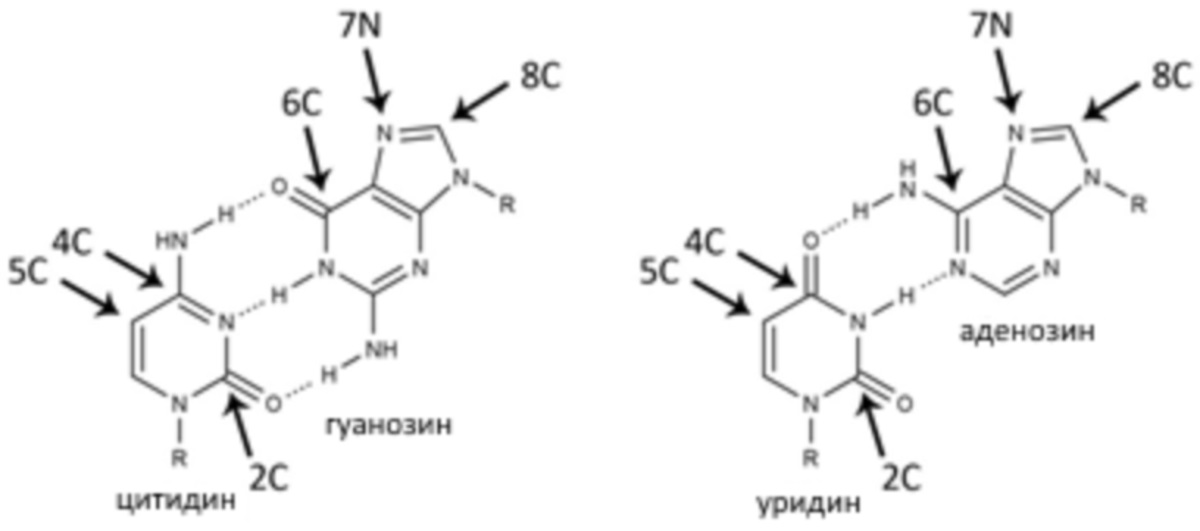
Примеры неканонических нуклеотидов, которые включают один или более заместителей в положениях 2C и/или 4C и/или 5C в случае пиримидина или положениях 6C и/или 7N и/или 8C в случае пурина включают, но не ограничиваются ими: 2-тиоуридин, 5-азауридин, псевдоуридин, 4-тиоуридин, 5-метилуридин, 5-аминоуридин, 5-гидроксиуридин, 5-метил-5-азауридин, 5-амино-5-азауридин, 5-гидрокси-5-азауридин, 5-метилпсевдоуридин, 5-аминопсевдоуридин, 5-гидроксипсевдоуридин, 4-тио-5-азауридин, 4-тиопсевдоуридин, 4-тио-5-метилуридин, 4-тио-5-аминоуридин, 4-тио-5-гидроксиуридин, 4-тио-5-метил-5-азауридин, 4-тио-5-амино-5-азауридин, 4-тио-5-гидрокси-5-азауридин, 4-тио-5-метилпсевдоуридин, 4-тио-5-аминопсевдоуридин, 4-тио-5-гидроксипсевдоуридин, 2-тиоцитидин, 5-азацитидин, псевдоцитидин, N4-метилцитидин, N4-аминоцитидин, N4-гидроксицитидин, 5-метилцитидин, 5-аминоцитидин, 5-гидроксицитидин, 5-метил-5-азацитидин, 5-амино-5-азацитидин, 5-гидрокси-5-азацитидин, 5-метилпсевдоизоцитидин, 5-аминопсевдоизоцитидин, 5-гидроксипсевдоизоцитидин, N4-метил-5-азацитидин, N4-метилпсевдоизоцитидин, 2-тио-5-азацитидин, 2-тиопсевдоизоцитидин, 2-тио-N4-метилцитидин, 2-тио-N4-аминоцитидин, 2-тио-N4-гидроксицитидин, 2-тио-5-метилцитидин, 2-тио-5-аминоцитидин, 2-тио-5-гидроксицитидин, 2-тио-5-метил-5-азацитидин, 2-тио-5-амино-5-азацитидин, 2-тио-5-гидрокси-5-азацитидин, 2-тио-5-метилпсевдоизоцитидин, 2-тио-5-аминопсевдоизоцитидин, 2-тио-5-гидроксипсевдоизоцитидин, 2-тио-N4-метил-5-азацитидин, 2-тио-N4-метилпсевдоизоцитидин, N4-метил-5-метилцитидин, N4-метил-5-аминоцитидин, N4-метил-5-гидроксицитидин, N4-метил-5-метил-5-азацитидин, N4-метил-5-амино-5-азацитидин, N4-метил-5-гидрокси-5-азацитидин, N4-метил-5-метилпсевдоизоцитидин, N4-метил-5-аминопсевдоизоцитидин, N4-метил-5-гидроксипсевдоизоцитидин, N4-амино-5-азацитидин, N4-аминопсевдоизоцитидин, N4-амино-5-метилцитидин, N4-амино-5-аминоцитидин, N4-амино-5-гидроксицитидин, N4-амино-5-метил-5-азацитидин, N4-амино-5-амино-5-азацитидин, N4-амино-5-гидрокси-5-азацитидин, N4-амино-5-метилпсевдоизоцитидин, N4-амино-5-аминопсевдоизоцитидин, N4-амино-5-гидроксипсевдоизоцитидин, N4-гидрокси-5-азацитидин, N4-гидроксипсевдоизоцитидин, N4-гидрокси-5-метилцитидин, N4-гидрокси-5-аминоцитидин, N4-гидрокси-5-гидроксицитидин, N4-гидрокси-5-метил-5-азацитидин, N4-гидрокси-5-амино-5-азацитидин, N4-гидрокси-5-гидрокси-5-азацитидин, N4-гидрокси-5-метилпсевдоизоцитидин, N4-гидрокси-5-аминопсевдоизоцитидин, N4-гидрокси-5-гидроксипсевдоизоцитидин, 2-тио-N4-метил-5-метилцитидин, 2-тио-N4-метил-5-аминоцитидин, 2-тио-N4-метил-5-гидроксицитидин, 2-тио-N4-метил-5-метил-5-азацитидин, 2-тио-N4-метил-5-амино-5-азацитидин, 2-тио-N4-метил-5-гидрокси-5-азацитидин, 2-тио-N4-метил-5-метилпсевдоизоцитидин, 2-тио-N4-метил-5-аминопсевдоизоцитидин, 2-тио-N4-метил-5-гидроксипсевдоизоцитидин, 2-тио-N4-амино-5-азацитидин, 2-тио-N4-аминопсевдоизоцитидин, 2-тио-N4-амино-5-метилцитидин, 2-тио-N4-амино-5-аминоцитидин, 2-тио-N4-амино-5-гидроксицитидин, 2-тио-N4-амино-5-метил-5-азацитидин, 2-тио-N4-амино-5-амино-5-азацитидин, 2-тио-N4-амино-5-гидрокси-5-азацитидин, 2-тио-N4-амино-5-метилпсевдоизоцитидин, 2-тио-N4-амино-5-аминопсевдоизоцитидин, 2-тио-N4-амино-5-гидроксипсевдоизоцитидин, 2-тио-N4-гидрокси-5-азацитидин, 2-тио-N4-гидроксипсевдоизоцитидин, 2-тио-N4-гидрокси-5-метилцитидин, N4-гидрокси-5-аминоцитидин, 2-тио-N4-гидрокси-5-гидроксицитидин, 2-тио-N4-гидрокси-5-метил-5-азацитидин, 2-тио-N4-гидрокси-5-амино-5-азацитидин, 2-тио-N4-гидрокси-5-гидрокси-5-азацитидин, 2-тио-N4-гидрокси-5-метилпсевдоизоцитидин, 2-тио-N4-гидрокси-5-аминопсевдоизоцитидин, 2-тио-N4-гидрокси-5-гидроксипсевдоизоцитидин, N6-метиладенозин, N6-аминоаденозин, N6-гидроксиаденозин, 7-дезазааденозин, 8-азааденозин, N6-метил-7-дезазааденозин, N6-метил-8-азааденозин, 7-дезаза-8-азааденозин, N6-метил-7-дезаза-8-азааденозин, N6-амино-7-дезазааденозин, N6-амино-8-азааденозин, N6-амино-7-дезаза-8-азааденозин, N6-гидроксиаденозин, N6-гидрокси-7-дезазааденозин, N6-гидрокси-8-азааденозин, N6-гидрокси-7-дезаза-8-азааденозин, 6-тиогуанозин, 7-дезазагуанозин, 8-азагуанозин, 6-тио-7-дезазагуанозин, 6-тио-8-азагуанозин, 7-дезаза-8-азагуанозин и 6-тио-7-дезаза-8-азагуанозин. Следует отметить, что существуют альтернативные схемы присвоения названий некоторых неканонических нуклеотидов. К примеру, при определенных обстоятельствах, 5-метилпсевдоуридин может называться «3-метилпсевдоуридин» или «N3-метилпсевдоуридин» или «1-метилпсевдоуридин» или «N1-метилпсевдоуридин».
Нуклеотиды, которые содержат приставку «амино» могут относится к любому нуклеотиду который содержит атом азота, связанный с атомом в указанном положении нуклеотида, к примеру, 5-аминоцитидин может относится к 5-аминоцитидину, 5-метиламиноцитидину и 5-нитроцитидину. Сходным образом нуклеотиды, которые содержат приставку «метил» могут относится к любому нуклеотиду, который содержит атом углерода, связанный с атомом в указанном положении нуклеотида, к примеру, 5-метилцитидин может относится к 5-метилцитидину, 5-этилцитидину и 5-гидроксиметилцитидину, нуклеотиды, которые содержат приставку «тио» могут относится к любому нуклеотиду, который содержит атом серы, связанный с атомом в данном положении нуклеотида, а нуклеотиды, которые содержат приставку «гидрокси» могут относится к любому нуклеотиду, который содержит атом кислорода, связанный с атомом в данном положении нуклеотида, к примеру, 5-гидроксиуридин может относится к 5-гидроксиуридину и уридину с метильной группой, связанной с атомом кислорода, причем атом кислорода связан с атомом в положении 5C уридина.
Поэтому некоторые варианты реализации изобретения относятся к молекуле синтетической РНК, причем молекула синтетической РНК содержит один или более нуклеотидов, которые включают один или более заместителей в положениях 2C и/или 4C и/или 5C в случае пиримидина или положениях 6C и/или 7N и/или 8C в случае пурина. Другие варианты реализации изобретения относятся к терапевтическому средству, причем терапевтическое средство содержит одну или более молекул синтетических РНК и при этом одна или более молекул синтетической РНК содержит один или более нуклеотидов, которые включают один или более заместителей в положениях 2C и/или 4C и/или 5C в случае пиримидина или положениях 6C и/или 7N и/или 8C в случае пурина. В одном варианте реализации изобретения терапевтическое средство содержит реагент для трансфекции. В другом варианте реализации изобретения реагент для трансфекции содержит катионный липид, липосому или мицеллу. В другом варианте реализации изобретения липосома или мицелла содержит фолат и терапевтическую композицию, обладающую противораковой активностью. В другом варианте реализации изобретения один или более нуклеотидов включают по меньшей мере одного из псевдоуридина, 2-тиоуридина, 4-тиоуридина, 5-азауридина, 5-гидроксиуридина, 5-метилуридина, 5-аминоуридина, 2-тиопсевдоуридина, 4-тиопсевдоуридина, 5-гидроксипсевдоуридина, 5-метилпсевдоуридина, 5-аминопсевдоуридина, псевдоизоцитидина, N4-метилцитидина, 2-тиоцитидина, 5-азацитидина, 5-гидроксицитидина, 5-аминоцитидина, 5-метилцитидина, N4-метилпсевдоизоцитидина, 2-тиопсевдоизоцитидина, 5-гидроксипсевдоизоцитидина, 5-аминопсевдоизоцитидина, 5-метилпсевдоизоцитидина, 7-дезазааденозина, 7-дезазагуанозина, 6-тиогуанозина и 6-тио-7-дезазагуанозина. В другом варианте реализации изобретения один или более нуклеотидов включают по меньшей мере одного из псевдоуридина, 2-тиоуридина, 4-тиоуридина, 5-азауридина, 5-гидроксиуридина, 5-метилуридина, 5-аминоуридина, 2-тиопсевдоуридина, 4-тиопсевдоуридина, 5-гидроксипсевдоуридина, 5-метилпсевдоуридина и 5-аминопсевдоуридина и по меньшей мере одного из псевдоизоцитидина, N4-метилцитидина, 2-тиоцитидина, 5-азацитидина, 5-гидроксицитидина, 5-аминоцитидина, 5-метилцитидина, N4-метилпсевдоизоцитидина, 2-тиопсевдоизоцитидина, 5-гидроксипсевдоизоцитидина, 5-аминопсевдоизоцитидина и 5-метилпсевдоизоцитидина. В другом варианте реализации изобретения один или более нуклеотидов включают по меньшей мере одного из псевдоуридина, 2-тиоуридина, 4-тиоуридина, 5-азауридина, 5-гидроксиуридина, 5-метилуридина, 5-аминоуридина, 2-тиопсевдоуридина, 4-тиопсевдоуридина, 5-гидроксипсевдоуридина и 5-метилпсевдоуридина, 5-аминопсевдоуридина и по меньшей мере одного из псевдоизоцитидина, N4-метилцитидина, 2-тиоцитидина, 5-азацитидина, 5-гидроксицитидина, 5-аминоцитидина, 5-метилцитидина, N4-метилпсевдоизоцитидина, 2-тиопсевдоизоцитидина, 5-гидроксипсевдоизоцитидина, 5-аминопсевдоизоцитидина и 5-метилпсевдоизоцитидина и по меньшей мере одного из 7-дезазагуанозина, 6-тиогуанозина и 6-тио-7-дезазагуанозина. В еще одном варианте реализации изобретения один или более нуклеотидов включают: 5-метилцитидин и 7-дезазагуанозин. В другом варианте реализации изобретения один или более нуклеотидов также включают псевдоуридин или 4-тиоуридин, или 5-метилуридин, или 5-аминоуридин, или 4-тиопсевдоуридин, или 5-метилпсевдоуридин, или 5-аминопсевдоуридин. В другом варианте реализации изобретения один или более нуклеотидов также включают 7-дезазааденозин. В другом варианте реализации изобретения один или более нуклеотидов включают: псевдоизоцитидин и 7-дезазагуанозин и 4-тиоуридин. В еще одном варианте реализации изобретения один или более нуклеотидов включают: псевдоизоцитидин или 7-дезазагуанозин и псевдоуридин. В другом варианте реализации изобретения один или более нуклеотидов включают: 5-метилуридин и 5-метилцитидин и 7-дезазагуанозин. В дополнительном варианте реализации изобретения один или более нуклеотидов включают: псевдоуридин или 5-метилпсевдоуридин и 5-метилцитидин и 7-дезазагуанозин. В другом варианте реализации изобретения один или более нуклеотидов включают: псевдоизоцитидин и 7-дезазагуанозин и псевдоуридин. В одном варианте реализации изобретения молекула синтетической РНК присутствует in vivo.
Некоторые неканонические нуклеотиды могут внедряться РНК-полимеразами, которые обычно используются для транскрипции in vitro, в молекулы синтетических РНК более эффективно чем другие неканонические нуклеотиды, в частности из-за склонности этих определенных неканонических нуклеотидов участвовать в стандартных взаимодействиях спаривания оснований и взаимодействиях стекинга оснований и взаимодействовать с РНК-полимеразой сходным образом, которым соответствующий канонический нуклеотид взаимодействует с РНК-полимеразой. В результате определенные смеси нуклеотидов, содержащие один или более неканонических нуклеотидов, могут быть полезными, в частности потому что реакции транскрипции in vitro, содержащие эти смеси нуклеотидов, могут давать большое количество синтетической РНК. Поэтому некоторые варианты реализации изобретения относятся к смеси нуклеотидов, содержащей один или более нуклеотидов, которые включают один или более заместителей в положениях 2C и/или 4C и/или 5C в случае пиримидина или положениях 6C и/или 7N и/или 8C в случае пурина. Смеси нуклеотидов включают, но не ограничиваются (числа у каждого предыдущего нуклеотида указывают типичную долю неканонического нуклеотидтрифосфата в реакции транскрипции in vitro, к примеру, 0,2 псевдоизоцитидина относится к реакции, содержащей аденозин-5'-трифосфат, гуанозин-5'-трифосфат, уридин-5'-трифосфат, цитидин-5'-трифосфат и псевдоизоцитидин-5'-трифосфат, причем псевдоизоцитидин-5'-трифосфат присутствует в реакции в количестве приблизительно равном 0,2 от общего количества псевдоизоцитидин-5'-трифосфата+цитидин-5'-трифосфата, которые присутствуют в реакции с количествами, измеренными или на основе молярного или массового соотношения, и при этом более чем одно предшествующее нуклеозиду число указывает диапазон типичных долей): 1,0 псевдоуридина, 0,1-0,8 2-тиоуридина, 0,1-0,8 5-метилуридина, 0,2-1,0 5-гидроксиуридина, 0,1-1,0 5-аминоуридина, 0,1-1,0 4-тиоуридина, 0,1-1,0 2-тиопсевдоуридина, 0,1-1,0 4-тиопсевдоуридина, 0,1-1,0 5-гидроксипсевдоуридина, 0,2-1 5-метилпсевдоуридина, 0,1-1,0 5-аминопсевдоуридина, 0,2-1,0 2-тиоцитидина, 0,1-0,8 псевдоизоцитидина, 0,2-1,0 5-метилцитидина, 0,2-1,0 5-гидроксицитидина, 0,1-1,0 5-аминоцитидина, 0,2-1,0 N4-метилцитидина, 0,2-1,0 5-метилпсевдоизоцитидина, 0,2-1,0 5-гидроксипсевдоизоцитидина, 0,2-1,0 5-аминопсевдоизоцитидина, 0,2-1,0 N4-метилпсевдоизоцитидина, 0,2-1,0 2-тиопсевдоизоцитидина, 0,2-1,0 7-дезазагуанозина, 0,2-1,0 6-тиогуанозина, 0,2-1,0 6-тио-7-дезазагуанозина, 0,2-1,0 8-азагуанозина, 0,2-1,0 7-дезаза-8-азагуанозина, 0,2-1,0 6-тио-8-азагуанозина, 0,1-0,5 7-дезазааденозина и 0,1-0,5 N6-метиладенозина.
В различных вариантах реализации изобретения композиции синтетических РНК или композиции синтетических полинуклеотидов (например, которые можно готовить транскрипцией in vitro) состоят практически или целиком из канонических нуклеотидов в положениях, содержащих в генетическом коде аденин или «A». Термин «практически» в этом контексте относится к по меньшей мере 90%. В этих вариантах реализации изобретения композиция синтетических РНК или композиция синтетических полинуклеотидов может дополнительно содержать (например, состоять из) 7-дезазагуанозин в генетическом коде в положениях «G», а также соответствующий канонический нуклеотид «G», и канонический и неканонический нуклеотид в положениях G могут содержаться в диапазоне от 5:1 до 1:5 или в некоторых вариантах реализации изобретения в диапазоне от 2:1 до 1:2. В этих вариантах реализации изобретения композиция синтетических РНК или композиция синтетических полинуклеотидов может дополнительно содержать (например, состоять из) один или более (например, двух, трех или четырех) из 5-гидроксиметилцитидина, 5-гидроксицитидина, 5-карбоксицитидина и 5-формилцитидина в генетическом коде в положениях «C», а также канонический нуклеотид «C», и канонический и неканонический нуклеотид в положениях C могут содержаться в диапазоне от 5:1 до 1:5 или в некоторых вариантах реализации изобретения в диапазоне от 2:1 до 1:2. В некоторых вариантах реализации изобретения уровни неканонического нуклеотида в положениях «C» описаны в предшествующем параграфе. В этих вариантах реализации изобретения композиция синтетических РНК или композиция синтетических полинуклеотидов может дополнительно содержать (например, состоять из) один или более (например, двух, трех или четырех) из 5-гидроксиметилуридина, 5-гидроксиуридина, 5-карбоксиуридина и 5-формилуридина в генетическом коде в положениях «U», а также канонический нуклеотид «U», и канонический и неканонический нуклеотид в положениях «U» могут содержаться в диапазоне от 5:1 до 1:5 или в некоторых вариантах реализации изобретения в диапазоне от 2:1 до 1:2. В некоторых вариантах реализации изобретения уровни неканонического нуклеотида в положениях «U» описаны в предшествующем параграфе.
В настоящее время установлено, что комбинирование некоторых неканонических нуклеотидов может быть полезным в частности потому тому что вклад неканонических нуклеотидов в снижение токсичности молекул синтетических РНК может быть аддитивным. Поэтому некоторые варианты реализации изобретения относятся к смеси нуклеотидов, причем смесь нуклеотидов содержит более одного из неканонических нуклеотидов, перечисленных выше, к примеру, смесь нуклеотидов содержит как псевдоуридин так и 7-дезазагуанозин или смесь нуклеотидов содержит как N4-метилцитидин так и 7-дезазагуанозин и т.д. В одном варианте реализации изобретения смесь нуклеотидов содержит более одного из неканонических нуклеотидов, перечисленных выше, и каждый из неканонических нуклеотидов присутствует в смеси нуклеотидов в долях, описанных выше, к примеру, смесь нуклеотидов содержит 0,1-0,8 псевдоуридина и 0,2-1,0 7-дезазагуанозина или смесь нуклеотидов содержит 0,2-1,0 N4-метилцитидина и 0,2-1,0 7-дезазагуанозина и т.д.
При определенных обстоятельствах, к примеру если нет необходимости или желательно максимизировать выход реакции транскрипции in vitro могут использоваться доли нуклеотидов отличающиеся от данных выше. Типичные доли и диапазоны долей, перечисленные выше, относятся к растворам нуклеотидтрифосфатов обычной чистоты (более 90% чистоты). Большие доли этих и других нуклеотидов могут применяться с использованием растворов нуклеотидтрифосфатов большей чистоты, к примеру, большей чем около 95% чистоты или большей чем около 98% чистоты или большей чем около 99% чистоты или большей чем около 99,5% чистоты, которая может достигаться, к примеру, очищением раствора нуклеотидтрифосфата с использованием существующих технологий химической очистки, таких как жидкостная хроматография высокого давления (ВЭЖХ) или другими способами. В одном варианте реализации изобретения нуклеотиды с множеством изомеров очищаются для обогащения требуемого изомера.
Другие варианты реализации изобретения относятся к способу индуцирования клетки in vivo для экспрессии представляющего интерес белка приведением клетки в контакт с молекулой синтетической РНК, которая содержит один или более неканонических нуклеотидов, которые включают один или более заместителей в положениях 2C и/или 4C и/или 5C в случае пиримидина или положениях 6C и/или 7N и/или 8C в случае пурина. Другие варианты реализации изобретения относятся к способу трансфицирования, репрограммирования и/или редактирования генов в клетке in vivo приведением клетки в контакт с молекулой синтетической РНК, которая содержит один или более неканонических нуклеотидов, которые включают один или более заместителей в положениях 2C и/или 4C и/или 5C в случае пиримидина или положениях 6C и/или 7N и/или 8C в случае пурина. В одном варианте реализации изобретения молекула синтетической РНК продуцируется транскрипцией in vivo. В одном варианте реализации изобретения молекула синтетической РНК кодирует один или более репрограммирующих факторов. В другом варианте реализации изобретения один или более репрограммирующих факторов включают белок Oct4. В другом варианте реализации изобретения клетка также приводится в контакт с молекулой синтетической РНК, которая кодирует белок Sox2. В еще одном варианте реализации изобретения клетка также приводится в контакт с молекулой синтетической РНК, которая кодирует белок Klf4. В еще одном варианте реализации изобретения клетка также приводится в контакт с молекулой синтетической РНК, которая кодирует белок c-Myc. В еще одном варианте реализации изобретения клетка также приводится в контакт с молекулой синтетической РНК, которая кодирует белок Lin28.
Ферменты, такие как РНК-полимераза T7, преимущественно может внедрять канонические нуклеотиды в реакции транскрипции in vitro, содержащей как канонические так и неканонические нуклеотиды. В результате реакция транскрипции in vitro, содержащая определенную долю неканонического нуклеотида, может давать РНК, содержащую разную чаще более низкую долю неканонического нуклеотида, чем доля в которой неканонический нуклеотид присутствовал в реакции. Поэтому в некоторых вариантах реализации изобретения ссылки на доли внедрения нуклеотидов (к примеру, «молекула синтетической РНК, содержащие 50% псевдоуридина» или «0,1-0,8 псевдоуридина») могут относится как к молекулам РНК, содержащим установленную долю нуклеотида, так и к молекулам РНК, синтезированным в реакции, содержащей установленную долю нуклеотида (или производного нуклеотида, к примеру, нуклеотидтрифосфата), даже несмотря на что такая реакции может давать РНК, содержащую другую долю нуклеотида чем доля, в которой неканонический нуклеотид присутствовал в реакции.
Разные нуклеотидные последовательности могут кодировать такой же белок использованием альтернативных кодонов. Поэтому в некоторых вариантах реализации изобретения ссылки на доли внедрения нуклеотидов могут относится как к молекулам РНК, содержащим установленную долю нуклеотида, так и к молекулам РНК, кодирующим тот же белок, что и другая молекула РНК, причем другая молекула РНК содержит установленную долю нуклеотида.
Некоторые варианты реализации изобретения относятся к набору, содержащему один или более материалов, необходимых для практической реализации настоящего изобретения. В одном варианте реализации изобретения набор содержит одну или более молекул синтетических РНК. В одном варианте реализации изобретения набор содержит одну или более молекул синтетических РНК, которые кодируют один или более репрограммирующих факторов и/или редактирующих гены белков. В другом варианте реализации изобретения одна или более молекул синтетических РНК содержат один или более неканонических нуклеотидов, которые включают один или более заместителей в положениях 2C и/или 4C и/или 5C в случае пиримидина или положениях 6C и/или 7N и/или 8C в случае пурина. В другом варианте реализации изобретения набор содержит один или более из: среды для трансфекции, реагент для трансфекции, среды для комплексообразования и матриксный раствор. В одном варианте реализации изобретения матриксный раствор содержит фибронектин и/или витронектин или рекомбинантный фибронектин и/или рекомбинантный витронектин. В одном варианте реализации изобретения один или более из компонентов набора присутствуют в виде множества аликвот. В одном варианте реализации изобретения набор содержит аликвоты комплексов нуклеиновая кислота-реагент для трансфекции. В другом варианте реализации изобретения набор содержит аликвоты комплексов нуклеиновая кислота-реагент для трансфекции, которые предоставляются в твердой форме, к примеру, в виде замороженных или лиофилизированных гранул. В еще одном варианте реализации изобретения набор содержит аликвоты среды, причем каждая аликвота содержит комплексы реагент для трансфекции-нуклеиновая кислота, которые стабилизированы или химической обработкой или замораживание.
Трансфекция в общем и репрограммирование в частности могут быть сложными и времязатратными методиками, которые могут быть повторяющимися и подверженными ошибке. Однако эти методики часто выполняются вручную из-за отсутствия автоматизированного оборудования для трансфекции. Поэтому некоторые варианты реализации изобретения относятся к системе, которая может трансфицировать, репрограммировать и/или редактировать гены в клетках in vivo автоматизированным или полуавтоматическим способом.
В настоящее время установлено, что представители неканонических нуклеотидов из механизма деметилирования 5-метилцитидина при внедрении в синтетическую РНК, могут увеличивать эффективность, с которой синтетическая РНК может транслироваться в белок in vivo, и может уменьшать токсичность синтетической РНК in vivo. Эти неканонические нуклеотиды включают, к примеру: 5-метилцитидин, 5-гидроксиметилцитидин, 5-формилцитидин и 5-карбоксицитидин (также называемый «цитидин-5-карбоновая кислота»). Поэтому некоторые варианты реализации изобретения относятся к нуклеиновой кислоте. В некоторых вариантах реализации изобретения нуклеиновая кислота присутствует in vivo. В одном варианте реализации изобретения нуклеиновая кислота представляет собой молекулу синтетической РНК. В другом варианте реализации изобретения нуклеиновая кислота содержит один или более неканонических нуклеотидов. В одном варианте реализации изобретения нуклеиновая кислота содержит один или более представителей неканонических нуклеотидов механизма деметилирования 5-метилцитидина. В другом варианте реализации изобретения нуклеиновая кислота содержит по меньшей мере одного из: 5-метилцитидина, 5-гидроксиметилцитидина, 5-формилцитидина и 5-карбоксицитидина или их производного. В дополнительном варианте реализации изобретения нуклеиновая кислота содержит по меньшей мере одного из: псевдоуридина, 5-метилпсевдоуридина, 5-гидроксиуридина, 5-метилуридина, 5-метилцитидина, 5-гидроксиметилцитидина, N4-метилцитидина, N4-ацетилцитидина и 7-дезазагуанозина или их производного.
Механизм деметилирования 5-метилцитидина

Некоторые варианты реализации изобретения относятся к белку. Некоторые варианты реализации изобретения относятся к нуклеиновой кислоте, кодирующей белок. В одном варианте реализации изобретения белок является представляющим интерес белком. В другом варианте реализации изобретения белок выбирается из репрограммирующего белка или редактирующего гены белка. В одном варианте реализации изобретения нуклеиновая кислота представляет собой плазмиду. В другом варианте реализации изобретения нуклеиновая кислота присутствует в вирусе или вирусном векторе. В дополнительном варианте реализации изобретения вирус или вирусный вектор является репликационно некомпетентным. В дополнительном варианте реализации изобретения вирус или вирусный вектор является репликационно компетентным. В одном варианте реализации изобретения вирус или вирусный вектор включает по меньшей мере одного из: аденовируса, ретровируса, лентивируса, вируса герпеса, аденоассоциированного вируса или их природного или сконструированного варианта, и сконструированного вируса.
В настоящее время установлено, что некоторые комбинации неканонических нуклеотидов могут быть особенно эффективными для увеличения эффективности, с которой синтетическая РНК может транслироваться в белок in vivo, и уменьшения токсичности синтетической РНК in vivo, к примеру, комбинации: 5-метилуридина и 5-метилцитидина, 5-гидроксиуридина и 5-метилцитидина, 5-гидроксиуридина и 5-гидроксиметилцитидина, 5-метилуридина и 7-дезаазагуанозина, 5-метилцитидина и 7-дезаазагуанозина, 5-метилуридина, 5-метилцитидина и 7-дезаазагуанозина и 5-метилуридина, 5-гидроксиметилцитидина и 7-дезаазагуанозина. Поэтому некоторые варианты реализации изобретения относятся к нуклеиновой кислоте, содержащей по меньшей мере двоих из: 5-метилуридина, 5-метилцитидина, 5-гидроксиметилцитидина и 7-дезазагуанозина или их одно или более производных. Некоторые варианты реализации изобретения относятся к нуклеиновой кислоте, содержащей по меньшей мере троих из: 5-метилуридина, 5-метилцитидина, 5-гидроксиметилцитидина и 7-дезазагуанозина или их одно или более производных. Другие варианты реализации изобретения относятся к нуклеиновой кислоте, содержащей все из: 5-метилуридина, 5-метилцитидина, 5-гидроксиметилцитидина и 7-дезазагуанозина или их одно или более производных. В одном варианте реализации изобретения нуклеиновая кислота содержит один или более остатков 5-метилуридина, один или более остатков 5-метилцитидина и один или более остатков 7-дезазагуанозина или один или более остатков 5-метилуридина, один или более остатков 5-гидроксиметилцитидина и один или более остатков 7-дезазагуанозина.
Дополнительно установлено, что молекулы синтетической РНК, содержащие определенные доли определенных неканонических нуклеотидов и их комбинаций, могут проявлять особенно высокую эффективность трансляции и низкую токсичность in vivo. Поэтому некоторые варианты реализации изобретения относятся к нуклеиновой кислоте, содержащей по меньшей мере один из: одного или более остатков уридина, одного или более остатков цитидина и одного или более остатков гуанозина, и содержащей один или более неканонических нуклеотидов. В одном варианте реализации изобретения между около 20% и около 80% остатков уридина являются остатками 5-метилуридина. В другом варианте реализации изобретения между около 30% и около 50% остатков уридина являются остатками 5-метилуридина. В дополнительном варианте реализации изобретения около 40% остатков уридина являются остатками 5-метилуридина. В одном варианте реализации изобретения между около 60% и около 80% остатков цитидина являются остатками 5-метилцитидина. В другом варианте реализации изобретения между около 80% и около 100% остатков цитидина являются остатками 5-метилцитидина. В дополнительном варианте реализации изобретения около 100% остатков цитидина являются остатками 5-метилцитидина. В дополнительном варианте реализации изобретения между около 20% и около 100% остатков цитидина являются остатками 5-гидроксиметилцитидина. В одном варианте реализации изобретения между около 20% и около 80% остатков гуанозина являются остатками 7-дезазагуанозина. В другом варианте реализации изобретения между около 40% и около 60% остатков гуанозина являются остатками 7-дезазагуанозина. В дополнительном варианте реализации изобретения около 50% остатков гуанозина являются остатками 7-дезазагуанозина. В одном варианте реализации изобретения между около 20% и около 80% или между около 30% и около 60% или около 40% остатков цитидина являются остатками N4-метилцитидина и/или N4-ацетилцитидина. В другом варианте реализации изобретения каждый остаток цитидина представляет собой остаток 5-метилцитидина. В дополнительном варианте реализации изобретения около 100% остатков цитидина являются остатками 5-метилцитидина и/или остатками 5-гидроксиметилцитидина и/или остатками N4-метилцитидина и/или остатками N4-ацетилцитидина и/или их одним или более производных. В дополнительном варианте реализации изобретения около 40% остатков уридина являются остатками 5-метилуридина, между около 20% и около 100% остатков цитидина являются остатками N4-метилцитидина и/или N4-ацетилцитидина и около 50% остатков гуанозина являются остатками 7-дезазагуанозина. В одном варианте реализации изобретения около 40% остатков уридина являются остатками 5-метилуридина, а около 100% остатков цитидина являются остатками 5-метилцитидина. В другом варианте реализации изобретения около 40% остатков уридина являются остатками 5-метилуридина, а около 50% остатков гуанозина являются остатками 7-дезазагуанозина. В дополнительном варианте реализации изобретения около 100% остатков цитидина являются остатками 5-метилцитидина, а около 50% остатков гуанозина являются остатками 7-дезазагуанозина. В дополнительном варианте реализации изобретения около 100% остатков уридина являются остатками 5-гидроксиуридина. В одном варианте реализации изобретения около 40% остатков уридина являются остатками 5-метилуридина и около 100% остатков цитидина являются остатками 5-метилцитидина и около 50% остатков гуанозина являются остатками 7-дезазагуанозина. В другом варианте реализации изобретения около 40% остатков уридина являются остатками 5-метилуридина и между около 20% и около 100% остатков цитидина являются остатками 5-гидроксиметилцитидина и около 50% остатков гуанозина являются остатками 7-дезазагуанозина. В некоторых вариантах реализации изобретения менее чем около 100% остатков цитидина являются остатками 5-метилцитидина. В других вариантах реализации изобретения менее чем около 100% остатков цитидина являются остатками 5-гидроксиметилцитидина. В одном варианте реализации изобретения каждый остаток уридина в молекуле синтетической РНК представляет собой остаток псевдоуридина или остаток 5-метилпсевдоуридина. В другом варианте реализации изобретения около 100% остатков уридина являются остатками псевдоуридина и/или 5-метилпсевдоуридина. В дополнительном варианте реализации изобретения около 100% остатков уридина являются остатками псевдоуридина и/или остатками 5-метилпсевдоуридина и около 100% остатков цитидина являются остатками 5-метилцитидина и около 50% остатков гуанозина являются остатками 7-дезазагуанозина.
Другие неканонические нуклеотиды, которые могут использоваться вместо или в комбинации с 5-метилуридином, включают, но не ограничиваются: псевдоуридином, 5-гидроксиуридином и 5-метилпсевдоуридином (иначе называемым «1-метилпсевдоуридин», иначе называемым «N1-метилпсевдоуридин» или его одним или более производными. Другие неканонические нуклеотиды, которые могут использоваться вместо или в комбинации с 5-метилцитидином и/или 5-гидроксиметилцитидином, включают, но не ограничиваются: псевдоизоцитидином, 5-метилпсевдоизоцитидином, 5-гидроксиметилцитидином, 5-формилцитидином, 5-карбоксицитидином, N4-метилцитидином, N4-ацетилцитидином или их одним или более производных. В некоторых вариантах реализации изобретения, к примеру, при проведении единственной трансфекции, инъекции или доставки или если клетки, ткань, орган или организм пациента, подвергающиеся трансфекции, инъекции или доставки не являются особенно чувствительными к ассоциированной с трансфекцией токсичностью или передачей сигнала врожденной иммунной системе, доли неканонических нуклеотидов могут быть уменьшены. Уменьшение доли неканонических нуклеотидов может быть выгодным, в частности, потому что уменьшение доли неканонических нуклеотидов может снижать стоимость нуклеиновой кислоты. При определенных обстоятельствах, к примеру, если требуется минимальная иммуногенность нуклеиновой кислоты, то доли неканонических нуклеотидов могут быть увеличены.
Ферменты, такие как РНК-полимераза T7, преимущественно могут внедрять канонические нуклеотиды в реакции транскрипции in vitro, содержащей как канонические так и неканонические нуклеотиды. В результате реакция транскрипции in vitro, содержащая определенную долю неканонического нуклеотида, может давать РНК, содержащую разную чаще более низкую долю неканонического нуклеотида, чем доля в которой неканонический нуклеотид присутствовал в реакции. Поэтому в некоторых вариантах реализации изобретения ссылки на доли внедрения нуклеотидов (к примеру, «50% 5-метилуридина») могут относится как к нуклеиновым кислотам, содержащим установленную долю нуклеотида, так и к нуклеиновым кислотам, синтезированным в реакции, содержащей установленную долю нуклеотида (или производного нуклеотида, к примеру, нуклеотидтрифосфата), даже несмотря на что такая реакции может давать нуклеиновую кислоту, содержащую другую долю нуклеотида чем доля, в которой неканонический нуклеотид присутствовал в реакции. В дополнение к этому разные нуклеотидные последовательности могут кодировать такой же белок использованием альтернативных кодонов. Поэтому в некоторых вариантах реализации изобретения ссылки на доли внедрения нуклеотидов могут относится как к нуклеиновым кислотам, содержащим установленную долю нуклеотида, так и к нуклеиновым кислотам, кодирующим тот же белок, что и другая нуклеиновая кислота, причем другая нуклеиновая кислота содержит установленную долю нуклеотида.
Последовательность ДНК клетки может изменяться приведением клетки в контакт с редактирующим гены белком или индуцированием клетки для экспрессии редактирующего гены белка. Однако, ранее описанные редактирующие гены белки обладают недостатком из-за низкой эффективности связывания и избыточной нецелевой активности, которые могут вводить нежелательные мутации в ДНК клетки, что сильно ограничивает их использование in vivo, к примеру для терапевтических и косметических применений, в которых введение нежелательных мутаций в клетки пациента может привести к развитию рака. В настоящее время установлено, что редактирующие гены белки, которые содержат домен расщепления эндонуклеазы StsI (SEQ ID №: 1) может проявлять значительно более низкую нецелевую активность in vivo чем ранее описанные редактирующие гены белки, в то же время сохраняя высокий уровень целевой активности in vivo. В отношении других новосконструированных белков также установлено, что они могут проявлять высокую целевую активность in vivo, низкую нецелевой активность in vivo, могут иметь малый размер, растворимость и другие требуемые свойства, когда они используются как нуклеазный домен редактирующиго гены белка: StsI-HA (SEQ ID №: 2), StsI-HA2 (SEQ ID №: 3), StsI-UHA (SEQ ID №: 4), StsI-UHA2 (SEQ ID №: 5), StsI-HF (SEQ ID №: 6) и StsI-UHF (SEQ ID №: 7). StsI-HA, StsI-HA2 (высокая активность), StsI-UHA и StsI-UHA2 (очень высокая активность) могут проявлять более высокую целевую активность in vivo чем дикий тип StsI и дикий тип FokI, в частности благодаря специфическим аминокислотным заместителям в N-концевом участке в положениях 34 и 61, тогда как StsI-HF (высокая точность) и StsI-UHF (очень высокая точность) могут проявлять более низкую нецелевую активность in vivo чемдикий тип StsI и дикий тип FokI, в частности благодаря специфическим аминокислотным заместителям в C-концевом участке в положениях 141 и 152.
Поэтому некоторые варианты реализации изобретения относятся к белку. В некоторых вариантах реализации изобретения белок присутствует in vivo. В других вариантах реализации изобретения белок содержит нуклеазный домен. В одном варианте реализации изобретения нуклеазный домен содержит один или более из: домена расщепления эндонуклеазы FokI (SEQ ID №: 53), домена расщепления эндонуклеазы StsI (SEQ ID №: 1), StsI-HA (SEQ ID №: 2), StsI-HA2 (SEQ ID №: 3), StsI-UHA (SEQ ID №: 4), StsI-UHA2 (SEQ ID №: 5), StsI-HF (SEQ ID №: 6) и StsI-UHF (SEQ ID №: 7) или их биологически активный фрагмент или вариант.
Установлено также, что сконструированные редактирующие гены белки, которые содержат ДНК-связывающие домены, содержащие некоторые новые повторы последовательностей, могут проявлять более низкую нецелевую активность in vivo чем ранее описанные редактирующие гены белки, в то же время сохраняя высокий уровень целевой активности in vivo. Некоторые из этих сконструированных редактирующих гены белков могут обеспечивать несколько преимуществ по сравнению с ранее описанными редактирующими гены белками, включающими, к примеру, увеличенную гибкость линкерного участка, соединяющего повторы последовательностей, которые могут приводить к увеличенной эффективности связывания. Поэтому некоторые варианты реализации изобретения относятся к белку, содержащему множество повторов последовательностей. В одном варианте реализации изобретения по меньшей мере один из повторов последовательностей содержит аминокислотную последовательность: GabG, где каждый «a» и «b» представляет любую аминокислоту. В одном варианте реализации изобретения белок представляет собой редактирующий гены белок. В другом варианте реализации изобретения один или более повторов последовательностей присутствуют в ДНК-связывающем домене. В дополнительном варианте реализации изобретения «a» и «b» каждый независимо выбирают из группы: H и G. В дополнительном варианте реализации изобретения «a» и «b», соответственно, представляют собой H и G. В одном варианте реализации изобретения аминокислотная последовательность представлена в около 5 аминокислотах C-конца повтора последовательности. В другом варианте реализации изобретения аминокислотная последовательность представлена на C-конце повтора последовательности. В некоторых вариантах реализации изобретения один или более G в аминокислотной последовательности GabG заменен одной или более аминокислотами, отличающимися от G, к примеру A, H или GG. В одном варианте реализации изобретения повтор последовательности имеет длину между около 32 и около 40 аминокислотами или между около 33 и около 39 аминокислотами, или между около 34 и 38 аминокислотами, или между около 35 и около 37 аминокислотами, или около 36 аминокислотами, или более чем около 32 аминокислоты, или более чем около 33 аминокислот, или более чем около 34 аминокислоты, или более чем около 35 аминокислот. Другие варианты реализации изобретения относятся к белку, содержащему один или более подобных активатору транскрипции эффекторных доменов. В одном варианте реализации изобретения по меньшей мере один из подобных активатору транскрипции эффекторных доменов содержит повтор последовательности. Другие варианты реализации изобретения относятся к белку, содержащему множество повторов последовательностей, созданных вставкой одной или более аминокислот между по меньшей мере двумя повторами последовательностей подобного активатору транскрипции эффекторного домена. В одном варианте реализации изобретения одна или более аминокислот вставлены на расстоянии около 1 или около 2 или около 3 или около 4 или около 5 аминокислот от C-конца по меньшей мере одного повтора последовательности. Другое варианты реализации изобретения относятся к белку, содержащему множество повторов последовательностей, причем приблизительно каждый второй повтор последовательности имеет отличающуюся длину от длины повтора последовательности непосредственно предшествующего или последующего за данным повтором последовательности. В одном варианте реализации изобретения каждый второй повтор последовательности составляет в длину около 36 аминокислот. В другом варианте реализации изобретения каждый второй повтор последовательности составляет в длину около 36 аминокислот. Другие варианты реализации изобретения относятся к белку, содержащему множество повторов последовательностей, причем множество повторов последовательностей содержит по меньшей мере два повтора последовательностей, каждый составляет в длину по меньшей мере 36 аминокислот, и при этом по меньшей мере два из повторов последовательностей, которые составляют в длину по меньшей мере 36 аминокислот, разделены по меньшей мере одним повтором последовательностей, который составляет в длину менее 36 аминокислот. Некоторые варианты реализации изобретения относятся к белку, который содержит одну или более последовательностей, выбранных из, к примеру, SEQ ID №: 54, SEQ ID №: 55, SEQ ID №: 56, SEQ ID №: 57, SEQ ID №: 58, SEQ ID №: 59 и SEQ ID №: 60.
Другие варианты реализации изобретения относятся к белку, который содержит ДНК-связывающий домен. В некоторых вариантах реализации изобретения ДНК-связывающий домен содержит множество повторов последовательностей. В одном варианте реализации изобретения множество повторов последовательностей обеспечивают возможность высокоспецифичного распознавания сайта связывания молекулы ДНК-мишени. В другом варианте реализации изобретения по меньшей мере двое из повторов последовательностей имеют по меньшей мере около 50%, или около 60%, или около 70%, или около 80%, или около 90%, или около 95%, или около 98% или около 99% гомологии друг к другу. В дополнительном варианте реализации изобретения по меньшей мере один из повторов последовательностей содержит один или более участков способных связываться с сайтом связывания в молекуле ДНК-мишени. В дополнительном варианте реализации изобретения сайт связывания содержит определенную последовательность в длину между около 1 и около 5 оснований. В одном варианте реализации изобретения ДНК-связывающий домен содержит цинковый палец. В другом варианте реализации изобретения ДНК-связывающий домен содержит подобный активатору транскрипции эффектор (TALE). В дополнительном варианте реализации изобретения множество повторов последовательностей включают один повтор последовательности, имеющий по меньшей мере около 50%, или около 60%, или около 70%, или около 80%, или около 90%, или около 95%, или около 98% или около 99% гомологии с TALE. В дополнительном варианте реализации изобретения редактирующий гены белок содержит белок, ассоциированный с короткими палиндромными повторами, регулярно расположенными группами (CRISPR). В одном варианте реализации изобретения редактирующий гены белок содержит последовательность внутриядерной локализации. В другом варианте реализации изобретения последовательность внутриядерной локализации содержит аминокислотную последовательность: PKKKRKV. В одном варианте реализации изобретения редактирующий гены белок содержит последовательность внутримитохондриальной локализации. В другом варианте реализации изобретения последовательность внутримитохондриальной локализации содержит аминокислотную последовательность: LGRVIPRKIASRASLM. В одном варианте реализации изобретения редактирующий гены белок содержит линкер. В другом варианте реализации изобретения линкер соединяет ДНК-связывающий домен с нуклеазным доменом. В дополнительно варианте реализации изобретения линкер составляет в длину между около 1 и около 10 аминокислот. В некоторых вариантах реализации изобретения линкер составляет в длину около 1, около 2, или около 3, или около 4, или около 5, или около 6, или около 7, или около 8, или около 9, или около 10 аминокислот. В одном варианте реализации изобретения редактирующий гены белок способен создавать одноцепочечный или двухцепочечный разрыв в молекуле ДНК-мишени.
Некоторые варианты реализации изобретения относятся к способу модификации генома клетки in vivo, причем способ содержит введение в клетку in vivo молекулы нуклеиновой кислоты, кодирующей не встречающийся в природе гибридный белок, содержащий искусственный домен повтора подобного активатору транскрипции эффектора (TAL), содержащий один или более единиц повтора в длину 36 аминокислот, и эндонуклеазный домен, причем домен повтора сконструирован для распознавания предварительно заданной нуклеотидной последовательности и при этом гибридный белок распознает предварительно заданную нуклеотидную последовательность. В одном варианте реализации изобретения клетка представляет собой эукариотическую клетку. В другом варианте реализации изобретения клетка представляет собой клетку животного. В дополнительном варианте реализации изобретения клетка представляет собой клетку млекопитающего. В другом дополнительном варианте реализации изобретения клетка представляет собой клетку человека. В одном варианте реализации изобретения клетка представляет собой клетку растения. В другом варианте реализации изобретения клетка представляет собой прокариотическую клетку. В некоторых вариантах реализации изобретения гибридный белок вводит в нуклеиновую кислоту клетки эндонуклеотическое расщепление, посредством чего модифицируется геном клетки.
Некоторые варианты реализации изобретения относятся к композиции для изменения последовательности ДНК клетки in vivo,содержащей нуклеиновую кислоту, причем нуклеиновая кислота кодирует редактирующий гены белок. Другие варианты реализации изобретения относятся к композиции для изменения последовательности ДНК клетки in vivo,содержащей смесь нуклеиновых кислот, причем смесь нуклеиновых кислот содержит: первую нуклеиновую кислоту, которая кодирует первый редактирующий гены белок, и вторую нуклеиновую кислоту, которая кодирует второй кодирующий гены белок. В одном варианте реализации изобретения сайт связывания первого редактирующего гены белка и сайт связывания второго редактирующего гены белка присутствуют в одной и той же молекуле ДНК-мишени. В другом варианте реализации изобретения сайт связывания первого редактирующего гены белка и сайт связывания второго редактирующего гены белка разделены менее чем около 50 основаниями, или менее чем около 40 основаниями, или менее чем около 30 основаниями, или менее чем около 20 основаниями, или менее чем около 10 основаниями, или между около 10 основаниями и около 25 основаниями, или около 15 основаниями. В одном варианте реализации изобретения нуклеазный домен первого редактирующего гены белка и нуклеазный домен второго редактирующего гены белка способны образовывать димер. В другом варианте реализации изобретения димер способен создавать одноцепочечный или двухцепочечный разрыв в молекуле ДНК-мишени.
Некоторые варианты реализации изобретения относятся к терапевтической композиции. Другие варианты реализации изобретения относятся к косметической композиции. В некоторых вариантах реализации композиция содержит матрицу для репарации. В дополнительном варианте реализации изобретения матрица для репарации представляет собой молекулу одноцепочечной ДНК или молекулу двухцепочечной ДНК.
Другие варианты реализации изобретения относятся к промышленному препарату для синтеза белка или нуклеиновой кислоты, кодирующей белок. В одном варианте реализации изобретения препарат представляет собой нуклеиновую кислоту. В другом варианте реализации изобретения белок содержит ДНК-связывающий домен. В дополнительном варианте реализации изобретения нуклеиновая кислота содержит нуклеотидную последовательность, кодирующую ДНК-связывающий домен. В одном варианте реализации изобретения белок содержит нуклеазный домен. В другом варианте реализации изобретения нуклеиновая кислота содержит нуклеотидную последовательность, кодирующую нуклеазный домен. В одном варианте реализации изобретения белок содержит множество повторов последовательностей. В другом варианте реализации изобретения нуклеиновая кислота кодирует множество повторов последовательностей. В дополнительном варианте реализации изобретения нуклеазный домен выбирается из: FokI, StsI, StsI-HA, StsI-HA2, StsI-UHA, StsI-UHA2, StsI-HF и StsI-UHF или их природный или сконструированный вариант или биологически активный фрагмент. В одном варианте реализации изобретения нуклеиновая кислота содержит промотор РНК-полимеразы. В другом варианте реализации изобретения промотор РНК-полимеразы представляет собой промотор T7 или промотор SP6. В дополнительном варианте реализации изобретения нуклеиновая кислота содержит вирусный промотор. В одном варианте реализации изобретения нуклеиновая кислота содержит нетранслируемый участок. В другом варианте реализации изобретения нуклеиновая кислота представляет матрицу для транскрипции in vitro.
Некоторые варианты реализации изобретения относятся к способу индуцирования клетки in vivo для экспрессии белка. Другие аспекты изобретения относятся к способу изменения последовательности ДНК клетки in vivo, включающий трансфицирование клетки in vivo редактирующим гены белком или индуцированием клетки для экспрессии редактирующего гены белка in vivo. Другие варианты реализации изобретения относятся к способу снижения в клетке экспрессии представляющего интерес белка in vivo. В одном варианте реализации изобретения клетка индуцируется для экспрессии редактирующего гены белка, причем редактирующий гены белок способен создавать одноцепочечный или двухцепочечный разрыв в молекуле ДНК-мишени. В другом варианте реализации изобретения одноцепочечный или двухцепочечный разрыв приводит к инактивации гена. Другие варианты реализации изобретения относятся к способу получения неактивной, со сниженной активностью или доминантно отрицательной формы белка in vivo. В одном варианте реализации изобретения белок представляет собой сурвивин. Другие варианты реализации изобретения относятся к способу репарации одной или более мутаций в клетке in vivo. В одном варианте реализации изобретения клетка приводится в контакт с матрицей для репарации. В другом варианте реализации изобретения матрица для репарации представляет собой молекулу ДНК. В дополнительном варианте реализации изобретения матрица для репарации не содержит сайт связывания редактирующего гены белка. В дополнительном варианте реализации изобретения матрица для репарации кодирует аминокислотную последовательность, которая кодируется последовательностью ДНК, которая содержит сайт связывания редактирующего гены белка.
Другие варианты реализации изобретения относятся к способу лечения пациента, включающему введение пациенту терапевтически или косметически эффективного количества белка или нуклеиновой кислоты, кодирующей белок. В одном варианте реализации изобретения лечение приводит к облегчению одного или более симптомов пациента. Некоторые варианты реализации изобретения относятся к способу лечения пациента, включающему: a. индуцирование клетки для экспрессии представляющего интерес белка трансфицированием клетки in vivo нуклеиновой кислотой, кодирующей представляющий интерес белок, и/или b. репрограммирование клетки in vivo. В одном варианте реализации изобретения клетка репрограммируется в менее дифференцированное состояние. В другом варианте реализации изобретения клетка репрограммируется трансфицированием клетки одной или более молекулами синтетической РНК, кодирующими один или более репрограммирующих белков. В дополнительном варианте реализации изобретения клетка представляет является дифференцированной. В дополнительном варианте реализации изобретения клетка дифференцируется в одну из: клетки кожи, инсулинпродуцирующей клетки, реагирующей на изменение уровня глюкозы, гемопоэтической клетки, кардиомицита, ретинальной клетки, клетки почек, клетки нервной системы, клетки желудка, жировой клетки, клетки костей, мышечной клетки, ооцита и сперматозоида. Другие варианты реализации изобретения относятся к способу лечения пациента, включающему: a. индуцирование клетки для экспрессии редактирующего гены белка трансфицированием клетки in vivo нуклеиновой кислотой, кодирующей редактирующий гены белок, и/или b. репрограммирование клетки in vivo.
Другие варианты реализации изобретения относятся к среде для комплексообразования. В одном варианте реализации изобретения среда для комплексообразования имеет значение pH больше чем около 7, или больше чем около 7,2, или больше чем около 7,4, или больше чем около 7,6, или больше чем около 7,8, или больше чем около 8,0, или больше чем около 8,2, или больше чем около 8,4, или больше чем около 8,6, или больше чем около 8,8, или больше чем около 9,0. В другом варианте реализации изобретения среда для комплексообразования содержит трансферрин. В дополнительном варианте реализации изобретения среда для комплексообразования содержит DMEM. В дополнительном варианте реализации изобретения среда для комплексообразования содержит DMEM/F12. Другие варианты реализации изобретения относятся к способу образования комплексов нуклеиновая кислота-реагент для трансфекции. В одном варианте реализации изобретения реагент для трансфекции инкубируется со средой для комплексообразования. В другом варианте реализации изобретения инкубация проходит перед этапом смешивания. В дополнительном варианте реализации изобретения этап инкубации длится между около 5 секунд и около 5 минут, или между около 10 секунд и около 2 минут, или между около 15 секунд и около 1 минутой, или между около 30 секунд и около 45 секунд. В одном варианте реализации изобретения реагент для трансфекции выбирается из табл. 2. В другом варианте реализации изобретения реагент для трансфекции представляет собой липид или липидоид. В дополнительном варианте реализации изобретения реагент для трансфекции содержит катион. В другом дополнительном варианте реализации изобретения катион представляет собой многовалентный катион. В другом дополнительном варианте реализации изобретения реагент для трансфекции представляет собой N1-[2-((1S)-1-[(3-аминопропил)амино]-4-[ди(3-аминопропил)амино]бутилкарбоксамидо)этил]-3,4-ди[олеилокси]-бензамид (иначе именуемый MVL5) или его производное.
Некоторые варианты реализации изобретения относятся к способу индуцирования клетки для экспрессии белка приведением клетки в контакт с нуклеиновой кислотой in vivo. В одном варианте реализации изобретения клетка представляет собой клетку млекопитающего. В другом варианте реализации изобретения клетка представляет собой клетку человека или клетку грызуна. Другие варианты реализации изобретения относятся к клетке, полученной с использованием одного или более способов по данному изобретению. В одном варианте реализации изобретения клетка присутствует в организме пациента. В другом варианте реализации изобретения клетка выделяется из организма пациента. Другие варианты реализации изобретения относятся к библиотеке для скрининга, содержащей клетку, полученную с использованием одного или более способов по данному изобретению. В одном варианте реализации изобретения библиотека для скрининга применяется для по меньшей мере одного из: скрининга токсичности, включающего: скрининг кардиотоксичности, скрининг нейротоксичности и скрининг гепатотоксичности, скрининга эффективности, высокопроизводительного скрининга, многопараметрического скрининга и других видов скрининга.
Другие варианты реализации изобретения относятся к набору, содержащему нуклеиновую кислоту. В одном варианте реализации изобретения набор содержит реагент для доставки (иначе именуемый «реагент для трансфекции»). В другом варианте реализации изобретения набор представляет собой набор для репрограммирования. В дополнительном варианте реализации изобретения набор представляет собой набор для редактирования генов. Другие варианты реализации изобретения относятся к набору для получения нуклеиновых кислот. В одном варианте реализации изобретения набор содержит по меньшей мере двоих из: псевдоуридинтрифосфата, 5-метилуридинтрифосфата, 5-метилцитидинтрифосфата, 5-гидроксиметилцитидинтрифосфата, N4-метилцитидинтрифосфата, N4-ацетилцитидинтрифосфата и 7-дезазагуанозинтрифосфата или их одного или более производных. Другие варианты реализации изобретения относятся к терапевтической или косметической композиции, содержащей нуклеиновую кислоту. В одном варианте реализации изобретения терапевтическая или косметическая композиция представляет собой фармацевтическую композицию. В другом варианте реализации изобретения фармацевтическая композиция приготовлена в виде лекарственной формы. В дополнительном варианте реализации изобретения лекарственная форма содержит водную суспензию липосом. Примерные компоненты липосом изложены в табл. 2, даются в качестве примера и не являются ограничивающими. В одном варианте реализации изобретения липосомы включают одну или более цепей полиэтиленгликоля (ПЭГ). В другом варианте реализации изобретения клетка ПЭГ представляет собой ПЭГ2000. В дополнительном варианте реализации изобретения липосомы включают 1,2-дистеароил-sn-глицеро-3-фосфороэтаноламин (DSPE) или его производное. В одном варианте реализации изобретения терапевтическое средство содержит один или более лигандов. В другом варианте реализации изобретения терапевтическое средство содержит по меньшей мере один из: андрогена, CD30 (TNFRSF8), проникающего в клетки пептида, CXCR, эстрогена, эпидермального факторов роста, EGFR, HER2, фолата, инсулина, инсулинподобного фактора роста-I, интерлейкина-13, интегрина, прогестерона, стромального фактора-1, тромбина, витамина D и трансферрина или их биологически активного фрагмента или варианта. Другие варианты реализации изобретения относятся к терапевтическому или косметическому средству, содержащему клетку, полученную с использованием одного или более способов по данному изобретению. В одном варианте реализации изобретения терапевтическое средство вводится пациенту для лечения одного из: диабета 1 типа, сердечно-сосудистого заболевания, включающего ишемическую и дилатационную кардиомиопатию, макулярной дегенерации, болезни Паркинсона, муковисцидоза, серповидноклеточной анемии, талассемии, анемии Фанкони, тяжелого комбинированного иммунодефицита, наследственной сенсорной нейропатии, пигментной ксеродермы, болезни Хантингтона, мышечной дистрофии, латерального амиотрофического склероза, болезни Альцгеймера, рака и инфекционных заболеваний, включающих: гепатит и ВИЧ/СПИД.
Таблица 2
Типичные биосовместимые липиды
В некоторых вариантах реализации настоящее изобретение относится к одной или более методик введения, описанных в патентах США № 5711964; 5891468; 6316260; 6413544; 6770291 и 7390780, полное содержание которых тем самым включено в данный документ посредством ссылки в полном объеме.
Некоторые варианты реализации изобретения относятся к нуклеиновой кислоте, содержащей 5'-кэп структуру, выбранную из кэпа 0, кэпа 1, кэпа 2 и кэпа 3 или их производных. В одном варианте реализации изобретения нуклеиновая кислота содержит одну или более НТО. В другом варианте реализации изобретения одна или более НТО увеличивают стабильность нуклеиновой кислоты. В дополнительном варианте реализации изобретения одна или более НТО содержит 5'-НТО альфа-глобина или бета-глобина. В дополнительном варианте реализации изобретения одна или более НТО содержит 3'-НТО альфа-глобина или бета-глобина. В дополнительном варианте реализации изобретения молекула синтетической РНК содержит 5'-НТО альфа-глобина или бета-глобина и 3'-НТО альфа-глобина или бета-глобина. В одном варианте реализации изобретения 5'-НТО содержит последовательность Козак, которая практически сходна с консенсусной последовательностью Козак. В другом варианте реализации изобретения нуклеиновая кислота содержит 3'-поли(A) хвост. В дополнительном варианте реализации изобретения 3'-поли(A) хвост составляет в длину между около 20 нт и около 250 нт или между около 120 нт и около 150 нт. В дополнительном варианте реализации изобретения 3'-поли(A) хвост составляет в длину около 20 нт, или около 30 нт, или около 40 нт, или около 50 нт, или около 60 нт, или около 70 нт, или около 80 нт, или около 90 нт, или около 100 нт, или около 110 нт, или около 120 нт, или около 130 нт, или около 140 нт, или около 150 нт, или около 160 нт, или около 170 нт, или около 180 нт, или около 190 нт, или около 200 нт, или около 210 нт, или около 220 нт, или около 230 нт, или около 240 нт, или около 250 нт.
Другие варианты реализации изобретения относятся к способу репрограммирования клетки in vivo. В одном варианте реализации изобретения клетка репрограммируется приведением клетки в контакт с одной или более нуклеиновыми кислотами. В одном варианте реализации изобретения клетка приводится в контакт с множеством нуклеиновых кислот, кодирующих по меньшей мере один из: белка Oct4, белка Sox2, белка Klf4, белка c-Myc, белка Lin28 или их биологически активного фрагмента, варианта или производного. В другом варианте реализации изобретения клетка приводится в контакт с множеством нуклеиновых кислот, кодирующих множество из белков включающих: белок Oct4, белок Sox2, белок Klf4 и белок c-Myc или их один или более биологически активных фрагментов, вариантов или производных. Другие варианты реализации изобретения относятся к способу редактирования генов клетки in vivo. В одном варианте реализации изобретения в клетке редактируются гены приведением клетки в контакт с одной или более нуклеиновыми кислотами.
Нуклеиновые кислоты, включающие липосомальные лекарственные формы, содержащие нуклеиновые кислоты, при доставке in vivo могут накапливаться в печени и/или селезенке. В настоящее время установлено, что нуклеиновые кислоты, кодирующие белки могут модулировать экспрессию белков в печени и селезенке и что нуклеиновые кислоты, используемые таким образом, могут составлять сильные терапевтические средства для лечения заболеваний печени и селезенки. Некоторые варианты реализации изобретения относятся к способу лечения заболевания печени и/или селезенки доставкой в организм пациента нуклеиновой кислоты, кодирующей представляющий интерес белок. Другие варианты реализации изобретения относятся к терапевтической композиции, содержащей нуклеиновую кислоту, кодирующую представляющий интерес белок, для лечения заболевания печени и/или селезенки. Заболевания и патологические состояния печени и/или селезенки, которые могут проходить лечение включают, но не ограничиваются: гепатитом, индуцированным алкоголем заболеванием печени, индуцированным лекарствами заболеванием печени, вирусной инфекцией Эпштейна-Барр, аденовирусной инфекцией, цитомегаловирусной инфекцией, токсоплазмозом, пятнистой лихорадкой Скалистых гор, неалкогольной жировой дистрофией печени, хемохроматозом, болезнью Вильсона, болезнью Жильбера и раком печени и/или селезенки.
Некоторые варианты реализации изобретения относятся к способу индуцирования клетки in vivo для экспрессии представляющего интерес белка, включающему приведение клетки in vivo в контакт с раствором, содержащим альбумин, который обработан ионообменной смолой или активированным углем, и одной или более молекулами нуклеиновых кислот, причем по меньшей мере одна из одной или более молекул нуклеиновых кислот кодирует представляющий интерес белок. В одном варианте реализации изобретения способ приводит к экспрессии клеткой представляющего интерес белка. В другом варианте реализации изобретения одна или более молекул нуклеиновых кислот содержит молекулу синтетической РНК. В одном варианте реализации изобретения клетка представляет собой клетку кожи. В другом варианте реализации изобретения клетка представляет собой мышечную клетку. В еще одном варианте реализации изобретения клетка представляет собой дермальный фибробласт. В еще одном варианте реализации изобретения клетка представляет собой миобласт. В одном варианте реализации изобретения представляющий интерес белок является белком внеклеточного матрикса. В другом варианте реализации изобретения представляющий интерес белок выбирается из: эластина, коллагена, ламинина, фибронектина, витронектина, лизилоксидазы, эластинсвязывающего белка, фактора роста, фактора роста фибробластов, трансформирующего фактора роста бета, колониестимулирующего фактора гранулоцитов, матриксной металлопротеазы, актина, фибриллина, ассоциированного с микрофибриллами гликопротеина, подобного лизилоксидазе белка и фактора роста тромбоцитов. В одном варианте реализации изобретения раствор доставляется в дерму. В другом варианте реализации изобретения доставка осуществляется инъекцией. В еще одном варианте реализации изобретения доставка осуществляется инъекцией с использованием микроигольчатой матрицы. В одном варианте реализации изобретения раствор дополнительно содержит фактор роста. В другом варианте реализации изобретения фактор роста выбирается из: фактора роста фибробластов и трансформирующего фактора роста бета. В еще одном варианте реализации изобретения раствор дополнительно содержит холестерин.
Другие варианты реализации изобретения относятся к способу индуцирования клетки in vivo для экспрессии представляющего интерес белка, включающему приведение клетки in vivo в контакт с раствором, содержащим холестерин и одну или более молекул нуклеиновых кислот, причем по меньшей мере одна из одной или более молекул нуклеиновых кислот кодирует представляющий интерес белок. В одном варианте реализации изобретения способ приводит к экспрессии клеткой представляющего интерес белка. Другие варианты реализации изобретения относятся к способу трансфицирования клетки in vivo молекулой нуклеиновой кислоты, включающему приведение в контакт клетки in vivo с раствором, содержащим альбумин, который обработан ионообменной смолой или активированным углем, и молекулой нуклеиновой кислоты. В одном варианте реализации изобретения способ приводит к тому, что клетка трансфицируется молекулой нуклеиновой кислоты. В другом варианте реализации изобретения молекула нуклеиновой кислоты является одной из: молекулы дцДНК, молекулы оцДНК, молекулы дцРНК, молекулы оцРНК, плазмиды, олигонуклеотида, молекулы синтетической РНК, молекулы миРНК, молекулы мРНК, молекулы киРНК. Другие варианты реализации изобретения относятся к способу лечения пациента, включающему доставку в организм пациента композиции, содержащей альбумин, который обработан ионообменной смолой или активированным углем, и одну или более молекул нуклеиновых кислот, причем по меньшей мере одна из одной или более молекул нуклеиновых кислот кодирует представляющий интерес белок. В одном варианте реализации изобретения способ приводит к экспрессии в организме пациента представляющего интерес белка. В другом варианте реализации изобретения способ приводит к экспрессии представляющего интерес белка в дерме пациента.
Некоторые варианты реализации изобретения относятся к косметической композиции, содержащей альбумин, который обработан ионообменной смолой или активированным углем, и молекулу нуклеиновой кислоты. Другие варианты реализации изобретения относятся к препарату для косметического лечения. В одном варианте реализации изобретения препарат для косметического лечения содержит устройство, выполненное с возможностью доставки композиции в организм пациента. В другом варианте реализации изобретения молекула нуклеиновой кислоты кодирует белок эластин или белок коллаген. Другие варианты реализации изобретения относятся к раствору для трансфекции клетки in vivo, содержащему холестерин или аналог холестерина и одну или более молекул нуклеиновых кислот. В одном варианте реализации изобретения холестерин или аналог холестерина ковалентно связывается с по меньшей мере одной из одной или более молекул нуклеиновых кислот. В другом варианте реализации изобретения аналог холестерина представляет собой оксистерол. В еще одном варианте реализации изобретения аналог холестерина включает один или более из: заместителя A-кольца, заместителя B-кольца, заместителя D-кольца, заместителя боковой цепи, холестаноевой кислоты, холестеноевой кислоты, полиненасыщенного фрагмента, дейтерированного фрагмента, фторированного фрагмента, сульфонированного фрагмента, фосфорилированного фрагмента и флуоресцентного фрагмента. В еще одном варианте реализации изобретения способ включает лечение пациента одним или более из: кожного наполнителя, нейротоксина (в качестве иллюстрации ингибиторы натриевых каналов (например, тетродоксин), ингибиторы калиевых каналов (например, тетраэтиламмоний), ингибиторы хлоридных каналов (например, хлоротоксин и кураре), ингибиторы кальциевых каналов (например, конотоксин), ингибиторы высвобождения синаптических везикул (например, ботулотоксин и столбнячный токсин) и ингибитор гематоэнцефалического барьера (например, алюминий и ртуть)) и лечение с индукцией репарации.
Например, ботулотоксин A типа утвержден Управлением по контролю пищевых продуктов и лекарственных средств США (FDA) для лечения эссенциального блефароспазма, косоглазия и гемифациального спазма у пациентов возрастом старше двенадцати лет, шейной дистонии, морщин межбровной линии (лица) и лечения гипергидроза, а ботулотоксин B типа утвержден для лечения шейной дистонии. Настоящие композиции при лечении этих заболеваний могут комбинироваться с этими токсинами.
Дополнительно комбинации любого из вышеупомянутых токсинов могут использоваться в комбинации с настоящими композициями для различных косметических процедур, включающих без ограничения, лицевые морщины, гиперкинетичекие линии кожи, межбровные линии, гусиные лапки, морщины марионетки, кожные нарушения, носогубные складки, блефароспазм, косоглазие, гемифациальные спазмы и расстройства потоотделения. Альтернативно, настоящие композиции могут применяться для таких косметических процедур в виде монотерапии.
Некоторые варианты реализации изобретения относятся комбинационной терапии, включающей одно или более терапевтических или косметических композиций по настоящему изобретению, и одной или более вспомогательных терапий или косметических процедур. В некоторых вариантах реализации изобретения одна или более терапевтических или косметических композиций по настоящему изобретению, вводятся субъекту, который проходит лечение одной или более вспомогательных терапий или косметических процедур. Примерные вспомогательные терапии или косметические процедуры изложены в табл. 3 и табл. 5 предварительной заявки США № 61/721302, содержание которой тем самым включено в данный документ посредством ссылки, дано в качестве примера и не является ограничивающим.
Таблица 3
Типичная вспомогательная терапия
Фармацевтические препараты могут дополнительно содержать реагенты для доставки (иначе именуемые «реагенты для трансфекции») и/или вспомогательные вещества. Фармацевтически приемлемые реагенты для доставки, вспомогательные вещества и способы их приготовления и применения, включающие способы получения и введения фармацевтических препаратов в организм пациентов (иначе именуемых «субъекты») хорошо известны в данной области и изложены в многочисленных публикациях, включающих, к примеру, патентную заявку США № US 2008/0213377, полный объем которой включен в данный документ посредством ссылки.
К примеру, данные композиции могут существовать в виде фармацевтически приемлемых солей. Такие соли включают перечисленные, к примеру, в J. Pharma. Sci. 66, 2-19 (1977) и The Handbook of Pharmaceutical Salts; Properties, Selection, and Use. P. H. Stahl и C. G. Wermuth (eds.), Verlag, Zurich (Switzerland) 2002, которые тем самым включены в данный документ в полном объеме посредством ссылки. Неограничивающие примеры фармацевтически приемлемых солей включают: сульфат, цитрат, ацетат, оксалат, хлорид, бромид, йодид, нитрат, бисульфат, фосфат, кислый фосфат, изоникотинат, лактат, салицилат, кислый цитрат, тартрат, олеат, таннат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкуронат, сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат, камфорсульфонат, памоат, фенилацетат, трифторацетат, акрилат, хлорбензоат, динитробензоат, гидроксибензоат, метоксибензоат, метилбензоат, o-ацетоксибензоат, нафталин-2-бензоат, изобутират, фенилбутират, α-гидроксибутират, бутин-1,4-дикарбоксилат, гексин-1,4-дикарбоксилат, капрат, каприлат, циннамат, гликолят, гептаноат, гиппурат, малат, гидроксималеат, малонат, манделат, мезилат, никотинат, фталат, терефталат, пропиолат, пропионат, фенилпрорионат, себацинат, суберат, п-бромбензолсульфонат, хлорбензолсульфонат, этилсульфонат, 2-гидроксиэтилсульфонат, метилсульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат, нафталин-1,5-сульфонат, ксилолсульфонат, соли тартратов, гидроксидов щелочных металлов, таких как натрий, калий и литий; гидроксидов щелочноземельных металлов, таких как кальций и магний; гидроксидов других металлов, таких как алюминий и цинк; аммония и органических аминов, таких как незамещенные или гидроксизамещенные моно-, ди- или триалкиламины, дициклогексиламин; трибутиламин; пиридин; N-метил, N-этиламин; диэтиламин; триэтиламин; моно-, бис- или трис-(2-OH-низшие алкиламины), такие как моно-, бис- или трис-(2-гидроксиэтил)амин, 2-гидрокси-трет-бутиламин или трис-(гидроксиметил)метиламин, N,N-ди-низшие алкил-N-(гидроксилнизший алкил)-амины, такие как N,N-диметил-N-(2-гидроксиэтил)амин или три-(2-гидроксиэтил)амин; N-метил-D-глюкамин; и аминокислоты, такие как аргинин, лизин и тому подобные.
Настоящие фармацевтические композиции могут содержать вспомогательные вещества, включающие жидкости, такие как вода и масла, включая масла из нефти, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и тому подобное. Фармацевтические вспомогательные вещества могут быть, к примеру, солевым раствором, аравийской камедью, крахмальной пастой, тальком, кератином, коллоидным силикагелем, мочевиной и тому подобным. В дополнение к этому, могут использоваться вспомогательные, стабилизирующие, загущающие, смазывающие и окрашивающие агенты. В одном варианте реализации изобретения фармацевтически приемлемые вспомогательные вещества при введении субъекту являются стерильными. Подходящие фармацевтические вспомогательные вещества также включают крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, моностерат глицерина, тальк, хлорид натрия, сухое обезжиренное молоко, глицерин, пропиленгликоль, воду, этанол и тому подобные. Любые агенты, описанные в данном документе, если требуется, могут также содержать меньшие количества увлажняющих или эмульгирующих агентов или pH-буферизующих агентов.
В различных вариантах осуществления композиции, описанные в данном документе, могут вводиться в эффективной дозе, к примеру, от около 1 мг/кг до около 100 мг/кг, от около 2,5 мг/кг до около 50 мг/кг или от около 5 мг/кг до около 25 мг/кг. Точное определение того, что может считаться эффективной дозой, может основываться на факторах, индивидуальных для каждого пациента, включая их рост, возраст и тип заболевания. Дозировки легко могут быть установлены средними специалистами в данной области из этого описания и уровня знаний в данной области. К примеру, дозы могут определяться по ссылке Physiciansʹ Desk Reference, 66th Edition, PDR Network; 2012 Edition (27 декабря 2011 г.), содержание которой включено в полном объеме посредством ссылки.
Активные композиции по данному изобретению могут включать классические фармацевтические препараты. Введение этих композиций в соответствии с данным изобретением может происходить посредством любого обычного пути при условии, что целевая ткань доступна посредством этого пути. Он включает оральное, назальное или буккальное введение. Альтернативно, введение может происходить внутрикожной, подкожной, внутримышечной, внутрибрюшинной или внутривенной инъекцией, или прямой инъекцией в раковую ткань. Агенты, описанные в данном документе, также могут вводиться катетерными системами. Такие композиции обычно могут вводиться как фармацевтически приемлемые композиции, как описано в данном документе.
После приготовления лекарственной формы растворы могут вводиться способом, согласованным с дозированной лекарственной формой и в таком количестве, которое является терапевтически эффективным. Лекарственные формы могут легко вводится разнообразными дозированными лекарственными формами, такими как инъекционные растворы, капсулы с замедленным высвобождением лекарственного вещества и тому подобными. Для парентерального введения водным раствором, к примеру, раствор как правило содержит надлежаще забуференный и жидкий растворитель, сначала доведенный до изотонического, к примеру, достаточным количеством солевого раствора или глюкозы. К примеру, такие водные растворы могут использоваться для внутривенного, внутримышечного, подкожного и внутрибрюшинного введения. Предпочтительно применяется стерильная водная среда, как известно специалистам в данной области, особенно в свете настоящего описания.
Типичные субъекты или пациенты относятся к любому позвоночному, включающему без ограничения людей и других приматов (например, шимпанзе и другие виды высших обезьян и макак), сельскохозяйственных животных (например, крупный рогатый скот, овцы, свиньи, козы и кони), домашних животных (например, собак и кошек), лабораторных животных (например, грызуны, такие как мыши, крысы и морские свинки) и птиц (например, домашние, дикие и промысловые, такие как куры, индейки и другие куриные, утки, гуси и тому подобные). В некоторых вариантах реализации изобретения субъект представляет собой млекопитающее. В некоторых вариантах реализации изобретения субъект представляет собой человека.
Введение композиций, описанных в данном документе может происходить, к примеру, инъекцией, местным введением, офтальмологическим введением интраназальным введением. Инъекция может включать инъекции такие как, но не ограниченные внутрикожной, подкожной и внутримышечной. В некоторых вариантах реализации изобретения инъекция может быть связана с применением электрической силы (например, электропорация, включая использование устройств, которые находят применение в электрохимиотерапии (например, CLINIPORATOR, IGEA Srl, г.Капри [MO], Италия)). Местное введение может проводиться, но не ограничено использованием крема, лосьона, мази, геля, спрея и тому подобным. Местное введение может дополнительно включать использование усилителя проникновения, такого как, но не ограниченного поверхностно-активными веществами, жирными кислотами, солями желчных кислот, хелатирующими агентами, нехелатирующими поверхностно-активными веществами, полиоксиэтилен-9-лауриловым эфиром, полиоксиэтилен-20-цетиловым эфиром, жирными кислотами и/или солями в комбинации с желчными кислотами и/или солями, натриевой солью в комбинации с лауриловой кислотой, каприновой кислотой и UDCA и тому подобным. Местное введение также может включать использование ароматизатора, красителя, солнцезащитного, антибактериального средства и/или увлажнителя. Композиции, описанные в данном документе, могут вводиться по меньшей мере в одно место, такое как, но не ограниченное, лбом, скальпом, волосяными фолликулами, волосами, верхними веками, нижними веками, бровями, ресницами, нижними глазничными областями, окологлазничными областями, виском, носом, переносицей, щеками, языком, носогубными складками, губами, околочелюстными областями, линией челюсти, ушами, шеей, грудью, предплечьем, плечом, ладонью, рукой, пальцем, ногтями, спиной, животом, боками, ягодицами, бедром, голенью, стопой, пальцем стопы и тому подобным.
Последовательности
Это изобретение дополнительно проиллюстрировано следующими неограничивающими примерами.
ПРИМЕРЫ
Пример 1. Синтез РНК.
РНК, кодирующие зеленый флуоресцентный белок или белки человека эластин, тирозиназу, рецептор меланокортина 1, гиалуронансинтазу 1, гиалуронансинтазу 2, гиалуронансинтазу 3, коллаген типа III a1, коллаген типа VII a1, интерлейкин 10, гликопротеиновый лиганд-1 P-селектина, альфа-(1,3)-фукозилтрансферазу Oct4, Sox2, Klf4, c-Myc-2 (T58A) и Lin28 или TALEN-таргетируемые гены человека XPA, CCR5, TERT, MYC и BIRC5, и содержащие различные комбинации канонических и неканонических нуклеотидов, синтезировали на ДНК-матрицах с использованием набора для синтеза РНК с высоким выходом T7 и набора с системой кэппирования осповакцины с 2'-O-метилтрансферазой кэппирования мРНК (все из New England Biolabs Inc.), в соответствии с инструкциями производителя и ранее описанными изобретениями данных изобретателей (заявка США № 13/465490 (сейчас патент США № 8497124), международная заявка № PCT/US12/67966, заявка США № 13/931251 и международная заявка № PCT/US13/68118, содержание всех из которых тем самым включено в полном объеме посредством ссылки) (табл. 4). Потом РНК разбавляли водой без нуклеазной активности до концентрации между 100 нг/мкл и 1000 нг/мкл. Для некоторых экспериментов добавляли ингибитор РНКазы (Superase⋅In, Life Technologies Corporation) в концентрации 1 мкл/100 мкг РНК. Растворы РНК хранили при 4 C. Для экспериментов по репрограммированию РНК, кодирующие Oct4, Sox2, Klf4, c-Myc-2 (T58A) и Lin28, смешивали в молярном соотношении 3:1:1:1:1.
Таблица 4
Синтез РНК
«A» относится к аденозин-5'-трифосфату, «G» относится к гуанозин-5'-трифосфату, «U» относится к уридин-5'-трифосфату, «C» относится к цитидин-5'-трифосфату, «5mC» относится к 5-метилцитидин-5'-трифосфату, «5hmC» относится к 5-гидроксиметилцитидин-5'-трифосфату, «5cC» относится к 5-карбоксицитидин-5'-трифосфату, «5fC» относится к 5-формилцитидин-5'-трифосфату, «psU» относится к 5-псевдоуридин-5'-трифосфату, «5mU» относится к 5-метилуридин-5'-трифосфату, «5hU» относится к 5'-трифосфату уридина с метильной группой, связанной с атомом кислорода в положении 5C уридина, и «7dG» относится к 7-дезазагуанозин-5'-трифосфату.
Пример 2. Трансфекция клеток синтетической РНК.
Для трансфекции в 6-луночных планшетах сначала отдельно разводили 2 мкг РНК и 6 мкл реагента для трансфекции (Lipofectamine RNAiMAX, Life Technologies Corporation) в среде для комплексообразования (Opti-MEM, Life Technologies Corporation, или DMEM/F12+10 мкг/мл инсулина+5,5 мкг/мл трансферрина+6,7 нг/мл селенита натрия+2 мкг/мл этаноламина) до общего объема 60 мкл каждого разведения. Потом разведенную РНК и реагент для трансфекции смешивали и инкубировали в течение 15 мин при комнатной температуре в соответствии с инструкциями производителя реагента для трансфекции. Потом добавляли комплексы к клеткам в культуре. К каждой лунке 6-луночного планшета, которая уже содержала 2 мл среды для трансфекции на лунку, добавляли между 12 мкл и 240 мкл комплексов. Планшеты осторожно встряхивали для распределения комплексов по всей лунке. Перед заменой среды свежей средой для трансфекции (2 мл/лунку) клетки инкубировали с комплексами от 4 часов до в течение ночи. Объемы масштабировали для трансфекции в 24-луночных и 96-луночных планшетах. Альтернативно, между 0,5 мкг и 5 мкг РНК и между 2-3 мкл реагента для трансфекции (Lipofectamine 2000, Life Technologies Corporation) на мкг РНК сначала отдельно разводили в среде для комплексообразования (Opti-MEM, Life Technologies Corporation, или DMEM/F12+10 мкг/мл инсулина+5,5 мкг/мл трансферрина+6,7 нг/мл селенита натрия+2 мкг/мл этаноламина) до общего объема между 5 мкл и 100 мкл каждого разведения. Потом разведенную РНК и реагент для трансфекции смешивали и инкубировали в течение 10 мин при комнатной температуре. Потом добавляли комплексы к клеткам в культуре. К каждой лунке 6-луночного планшета, которая уже содержала 2 мл среды для трансфекции на лунку, добавляли между 10 мкл и 200 мкл комплексов. В некоторых экспериментах вместо среды для трансфекции использовали DMEM+10% ФБС или DMEM+50% ФБС. Планшеты осторожно встряхивали для распределения комплексов по всей лунке. Клетки инкубировали с комплексами от 4 часов до в течение ночи. В некоторых экспериментах среды заменяли свежей средой для трансфекции (2 мл/лунку) через 4 ч или 24 ч после трансфекции.
Пример 3. Токсичность и трансляция белков на синтетических РНК, содержащих неканонические нуклеотиды.
Первичные фибробласты человека трансфицировали в соответствии с Примером 2, с использованием РНК, синтезированной в соответствии с Примером 1. Через 20-24 часа после трансфекции клетки фиксировали и окрашивали с использованием антитела против Oct4. Относительную токсичность РНК определяли оцениванием плотности клеток во время фиксации.
Пример 4. Состав среды для трансфекции.
Среду для культивирования клеток разрабатывали для обеспечения эффективной трансфекции клеток нуклеиновыми кислотами и эффективного репрограммирования («среда для трансфекции»):
DMEM/F12+15 мM ГЭПЭС+2 мM L-аланил-L-глутамина+10 мкг/мл инсулина+5,5 мкг/мл трансферрина+6,7 нг/мл селенита натрия+2 мкг/мл этаноламина+50 мкг/мл гидрата сесквимагниевой соли 2-фосфата L-аскорбиновой кислоты+4 мкг/мл холестерина+1 мкM гидрокортизона+25 мкг/мл полиоксиэтиленсорбитана моноолеата+2 мкг/мл D-альфа-токоферола ацетата+20 нг/мл бФРФ+5 мг/мл обработанного сывороточного альбумина человека.
Вариант этой среды разрабатывали для обеспечения устойчивого долговременного культивирования различных типов клеток, включая плюрипотентные стволовые клетки («среда для поддержания»):
DMEM/F12+2 мM L-аланил-L-глутамина+10 мкг/мл инсулина+5,5 мкг/мл трансферрина+6,7 нг/мл селенита натрия+2 мкг/мл этаноламина+50 мкг/мл гидрата сесквимагниевой соли 2-фосфата L-аскорбиновой кислоты+20 нг/мл бФРФ+2 нг/мл ТФР-β1.
Среду для трансфекции, в которой обработанный сывороточный альбумин человека обрабатывали добавлением 32 мM октаноата натрия с последующим нагреванием при 60 C в течение 4 ч, с последующей обработкой ионообменной смолой (AG501-X8(D), Bio-Rad Laboratories Inc.) в течение 6 ч при комнатной температуре, с последующей обработкой покрытым декстраном активированным углем (C6241, Sigma-Aldrich Co. LLC.) в течение ночи при комнатной температуре с последующим центрифугированием, фильтрованием, доведением до 10% раствора водой без нуклеазной активности, с последующим добавлением других компонентов среды, применяли как среду для трансфекции во всех примерах, описанных в данном документе, если не указано иное. Для экспериментов по репрограммированию, если не указано иное, клетки наносили или на непокрытые планшеты в DMEM+10%-20% сыворотки или на покрытые фибронектином и витронектином планшеты в среде для трансфекции. Среду для трансфекции, если не указано иное, не кондиционировали. Понятно, что состав среды для трансфекции может корректироваться для соответствия требованиям специфических типов клеток, подлежащих культивированию. Далее понятно, что обработанный сывороточный альбумин человека может заменяться другим обработанным альбумином, к примеру, обработанным бычьим сывороточным альбумином, без отрицательного влияния на показатели среды. Далее понятно, что вместо или в дополнение к L-аланил-L-глутамату могут использоваться другие источники глутамина, к примеру, L-глутамин, что вместо или в дополнение к ГЭПЭС могут использоваться другие буферные системы, к примеру, фосфатная, бикарбонатная и т.п., что вместо или в дополнение к селениту натрия селен может обеспечиваться другими формами, к примеру, селенистой кислотой, что вместо или в дополнение к гидрату сесквимагниевой соли 2-фосфата L-аскорбиновой кислоты и/или D-альфа-токоферола ацетату могут использоваться другие антиоксиданты, к примеру, L-аскорбиновая кислота, что вместо или в дополнение к полиоксиэтиленсорбитана моноолеату могут использоваться другие поверхностно-активные вещества, к примеру, Плюроник F-68 и/или Плюроник F-127, что вместо или в дополнение к DMEM/F12 могут использоваться другие основные среды, к примеру, MEM, DMEM и т.п., и что компоненты культуральной среды могут варьировать с течением времени, к примеру, использованием среды без ТФР-β от 0 суток до 5 суток, а потом использованием среды, содержащей 2 нг/мл ТФР-β после 5 суток без отрицательного влияния на показатели среды. Далее понятно, что в соответствующих концентрациях без отрицательного влияния на показатели среды могут добавляться другие ингредиенты, к примеру, жирные кислоты, лизофосфатидиловая кислота, лизосфингомиелин, сфингозин-1-фосфат, другие сфинголипиды, ингибиторы ROCK, включающие Y-27632 и тиазовивин, представители семейства белков ТФР-β/NODAL, ИЛ-6, представители семейства белков Wnt и т.д., и что в соответствующих концентрациях в среду могут добавляться ингредиенты, которые как известно способствуют или ингибируют рост специфических типов клеток, и/или агонисты и/или антагонисты белков или другие молекулы, которые как известно способствуют или ингибируют рост специфических типов клеток, если они используются с такими типами клеток без отрицательного влияния на показатели среды, к примеру, сфингозин-1-фосфат и плюрипотентные стволовые клетки. Настоящее изобретение одинаковым образом относится к ингредиентам, которые добавляются в виде очищенных соединений, к ингредиентам, которые добавляются в виде частей смесей определенного состава, к ингредиентам, которые добавляются в виде частей сложных смесей или смесей неопределенного состава, к примеру, масла животного или растительного происхождения, и к ингредиентам, которые добавляются при биологических процессах, к примеру, при кондиционировании. Концентрации компонентов могут варьировать от перечисленных величин в пределах диапазонов, которые будут очевидны специалистам в данной области, без отрицательного влияния на показатели среды. Вариант среды без компонентов животного происхождения получали путем использования рекомбинантных вариантов всех белковых ингредиентов, и вариантов неживотного происхождения всех других компонентов, включающих полусинтетический холестерин растительного происхождения (Avanti Polar Lipids Inc.).
Пример 5. Состав среды для трансфекции.
Среду для культивирования клеток разрабатывали для поддержания эффективной трансфекции, репрограммирования и редактирования генов в клетках:
DMEM/F12+10 мкг/мл инсулина+5,5 мкг/мл трансферрина+6,7 нг/мл селенита натрия+20 нг/мл бФРФ+5 мг/мл обработанного сывороточного альбумина человека.
Варианты этой среды также разрабатывали для обеспечения улучшенных показателей при использовании со специфическими реагентами для трансфекции, специфическими нуклеиновыми кислотами и специфическими типами клеток: DMEM/F12+10 мкг/мл инсулина+5,5 мкг/мл трансферрина+6,7 нг/мл селенита натрия+4,5 мкг/мл холестерина+20 нг/мл бФРФ+5 мг/мл обработанного сывороточного альбумина человека, DMEM/F12+10 мг/мл инсулина+5,5 мкг/мл трансферрина+6,7 нг/мл селенита натрия+1 мкM гидрокортизона+20 нг/мл бФРФ+5 мг/мл обработанного сывороточного альбумина человека, и DMEM/F12+10 мкг/мл инсулина+5,5 мкг/мл трансферрина+6,7 нг/мл селенита натрия+4,5 мкг/мл холестерина+1 мкM гидрокортизона+20 нг/мл бФРФ+5 обработанного сывороточного альбумина человека.
Примеры дополнительных компонентов, которые в некоторых экспериментах добавляли к среде для культивирования клеток (перечисленные с примерными концентрациями), включают: 15 мM ГЭПЭС, 2 мM L-аланил-L-глутамина, 2 мкг/мл этаноламина, 10 мкг/мл жирных кислот, 10 мкг/мл жирных кислот печени трески (метиловые сложные эфиры), 25 мкг/мл полиоксиэтиленсорбитана моноолеата, 2 мкг/мл D-альфа-токоферола ацетата, 1-50 мкг/мл гидрата сесквимагниевой соли 2-фосфата L-аскорбиновой кислоты, 200 нг/мл B18R и 0,1% Плюроника F-68.
Для некоторых экспериментов, в которых среда кондиционировалась, использовали следующий вариант:
DMEM/F12+15 мM ГЭПЭС+2 мM L-аланил-L-глутамина+10 мкг/мл инсулина+5,5 мкг/мл трансферрина+6,7 нг/мл селенита натрия+2 мкг/мл этаноламина+4,5 мкг/мл холестерина+10 мкг/мл жирных кислот печени трески (метиловые сложные эфиры)+25 мкг/мл полиоксиэтиленсорбитана моноолеата+2 мкг/мл D-альфа-токоферола ацетата+1 мкг/мл гидрата сесквимагниевой соли 2-фосфата L-аскорбиновой кислоты+0,1% Плюроника F-68+20 нг/мл бФРФ+5 мг/мл обработанного сывороточного альбумина человека.
Для некоторых экспериментов, в которых среда не кондиционировалась, использовали следующий вариант.
DMEM/F12+15 мM ГЭПЭС+2 мM L-аланил-L-глутамина+10 мкг/мл инсулина+5,5 мкг/мл трансферрина+6,7 нг/мл селенита натрия+2 мкг/мл этаноламина+4,5 мкг/мл холестерина+1 мкM гидрокортизона+0-25 мкг/мл полиоксиэтиленсорбитана моноолеата+2 мкг/мл D-альфа-токоферола ацетата+50 мкг/мл гидрата сесквимагниевой соли 2-фосфата L-аскорбиновой кислоты+20 нг/мл бФРФ+5 мг/мл обработанного сывороточного альбумина человека.
Для получения этих вариантов обработанный сывороточный альбумин человека обрабатывали добавлением 32 мM октаноата натрия с последующим нагреванием при 60 C в течение 4 ч, с последующей обработкой ионообменной смолой (AG501-X8(D)) в течение 6 ч при комнатной температуре, с последующей обработкой покрытым декстраном активированным углем (C6241, Sigma-Aldrich Co. LLC.) в течение ночи при комнатной температуре с последующим центрифугированием, фильтрованием, доведением до 10% раствора водой без нуклеазной активности, с последующим добавлением других компонентов среды. Для некоторых экспериментов, в которых кондиционировалась среда, среду кондиционировали в течение 24 ч на облученных фидерах неонатальных фибробластов человека. Клетки, если не указано иное, наносили на покрытые фибронектином планшеты или покрытые фибронектином и витронектином планшеты.
Состав среды может корректироваться для соответствия требованиям специфических типов клеток, подлежащих культивированию. Кроме того, при определенных обстоятельствах обработанный сывороточный альбумин человека может заменяться другим обработанным альбумином, к примеру, обработанным бычьим альбумином, вместо или в дополнение к L-аланил-L-глутамату могут использоваться другие источники глутамина, к примеру, L-глутамин, вместо или в дополнение к ГЭПЭС могут использоваться другие буферные системы, к примеру, фосфатная, бикарбонатная и т.п., вместо или в дополнение к селениту натрия селен может обеспечиваться другими формами, к примеру, селенистой кислотой, вместо или в дополнение к гидрату сесквимагниевой соли 2-фосфата L-аскорбиновой кислоты и/или D-альфа-токоферола ацетату могут использоваться другие антиоксиданты, к примеру, L-аскорбиновая кислота, вместо или в дополнение к полиоксиэтиленсорбитана моноолеату и/или Плюронику F-68 могут использоваться другие поверхностно-активные вещества, к примеру, Плюроник F-127, вместо или в дополнение к DMEM/F12 могут использоваться другие основные среды, к примеру, MEM, DMEM и т.п., и компоненты культуральной среды могут варьировать с течением времени, к примеру, использованием среды без ТФР-β от 0 суток до 5 суток, а потом использованием среды, содержащей 2 нг/мл ТФР-β после 5 суток. При определенных обстоятельствах в соответствующих концентрациях могут добавляться другие ингредиенты, к примеру, жирные кислоты, лизофосфатидиловая кислота, лизосфингомиелин, сфингозин-1-фосфат, другие сфинголипиды, представители семейства белков ТФР-β/NODAL, ИЛ-6, представители семейства белков Wnt и т.д., и в среду в соответствующих концентрациях могут добавляться ингредиенты, которые как известно способствуют или ингибируют рост специфических типов клеток, и/или агонисты и/или антагонисты белков или других молекул, которые как известно способствуют или ингибируют рост специфических типов клеток, если они используются с такими типами клеток, к примеру, сфингозин-1-фосфат и плюрипотентные стволовые клетки. Ингредиенты могут принимать вид очищенных соединений, частей смесей определенного состава, частей сложных смесей или смесей неопределенного состава, к примеру, масел животного или растительного происхождения, и могут добавляться при биологических процессах, к примеру, при кондиционировании. Концентрации компонентов могут варьировать от перечисленных величин в пределах диапазонов, которые будут очевидны специалистам в данной области.
Пример 6. Трансфекция клеток синтетической РНК.
Для трансфекции в 6-луночных планшетах сначала отдельно разводили 2 мкг РНК и 6 мкл реагента для трансфекции (Lipofectamine™ RNAiMAX, Life Technologies Corporation) в среде для комплексообразования (Opti-MEM®, Life Technologies Corporation) до общего объема 60 мкл каждого разведения. Потом разведенную РНК и реагент для трансфекции смешивали и инкубировали в течение 15 мин при комнатной температуре в соответствии с инструкциями производителя реагента для трансфекции. Потом добавляли комплексы к клеткам в культуре. К каждой лунке 6-луночного планшета, которая уже содержала 2 мл среды для трансфекции на лунку, добавляли между 30 мкл и 240 мкл комплексов. Потом планшеты осторожно встряхивали для распределения комплексов по всей лунке. Перед заменой среды свежей средой для трансфекции (2 мл/лунку) клетки инкубировали с комплексами от 2 часов до в течение ночи. Объемы масштабировали для трансфекции в 24-луночных и 96-луночных планшетах. Через 20-24 часа после трансфекции клетки фиксировали и окрашивали с использованием антитела против Oct4. Для определения относительной токсичности РНК ядра окрашивали и подсчитывали.
Пример 7. Анализ способности препаратов обработанного сывороточного альбумина человека обеспечивать трансфекцию нуклеиновых кислот и РНК-репрограммирование.
Первичные неонатальные фибробласты человека культивировали в среде без или с 5 мг/мл САЧ. Скринингу подвергали фракцию Коэна V (A6784, Sigma-Aldrich Co. LLC.) и четыре разных рекомбинантых препаратов САЧ (A6608, A7736, A9731 и A9986, все получены из Sigma-Aldrich Co. LLC.). В соответствии с Примером 2 клетки трансфицировали РНК, синтезированной в соответствии с Примером 1. В то время как нетрансфицированные клетки хорошо росли в среде, содержавшей любые из препаратов САЧ, в трансфицированных лунках каждый из препаратов САЧ вызывал появление сильно отличавшихся морфологий клеток и плотностей клеток и ни в одной не произошло морфологических изменений, указывавших на прохождение репрограммирования.
Пример 8. Получение обработанного октаноатом сывороточного альбумина человека.
С 22 мМ хлорида натрия и 16 мМ октаноата натрия (Sigma-Aldrich Co. LLC) предварительно инкубировали 10% раствор САЧ и перед приготовлением полной среды инкубировали при 37 C в течение 3 часов.
Пример 9. Обработка сывороточного альбумина человека с использованием ионообменной хроматографии.
Растворением 2 г САЧ в 10 мл воды без нуклеазной активности при осторожном перемешивании при комнатной температуре готовили 20% раствор рекомбинантного САЧ, продуцированного в Pichia pastoris (A7736, Sigma-Aldrich Co. LLC.). Потом раствор САЧ деионизировали сначала добавлением 1 г деионизирующей смолы в смешанном слое (AG 501-X8(D), Bio-Rad Laboratories Inc.) и покачиванием в течение 1 ч при комнатной температуре. Потом раствор САЧ декантировали в пробирке, содержавшей 5 г свежей смолы и качали в течение 4 ч при комнатной температуре. Наконец, деионизированный раствор САЧ декантировали, доводили до 10% содержания общего белка водой без нуклеазной активности, стерилизовали фильтрованием с использованием мембранного фильтра из ПЭС с размером пор 0,2 мкм и хранили при 4 C.
Пример 10. Анализ эффективности трансфекции и жизнеспособности клеток, культивированных в среде, содержащей обработанный октаноатом сывороточный альбумин человека.
Первичные неонатальные фибробласты человека культивировали в среде, содержавшей рекомбинантный САЧ, обработанный в соответствии с Примером 8 и/или Примером 9, или содержавшей обработанный полученный из крови САЧ (Bio-Pure HSA, Biological Industries). Клетки, начиная с 0 суток, в соответствии с Примером 2 ежедневно трансфицировали РНК, синтезированной в соответствии с Примером 1. Фотографии делали на 3 сутки. В лунках, содержавших октаноат, наблюдали несколько небольших областей с клетками, претерпевшими морфологические изменения, напоминавшие мезенхимально-эпителиальный переход, что указывает на увеличенную эффективность трансфекции. В образцах, содержавших обработанный полученный из крови САЧ, наблюдали много больших областей с морфологическими изменениями, напоминавшими мезенхимально-эпителиальный переход. В обоих случаях морфологические изменения были свойственны репрограммированию.
Пример 11. Репрограмирование фибробластов человека с использованием среды, содержащей обработанный октаноатом сывороточный альбумин человека.
Первичные неонатальные фибробласты человека наносили на 6-луночные планшеты при плотности 5000 клеток/лунку в среде для фибробластов (DMEM+10% фетальной бычьей сыворотки). Через 6 часов среду заменяли средой для трансфекции, содержавшей обработанный октаноатом САЧ. Клетки, начиная с 0 суток, в соответствии с Примером 2 ежедневно трансфицировали РНК, синтезированной в соответствии с Примером 1. На 5 сутки лунка содержала несколько областей с клетками, проявившими соответствующую репрограммированию морфологию. Этот эксперимент не включал использование фидеров или иммуносупрессантов.
Пример 12. Анализ эффективности трансфекции и жизнеспособности клеток, культивированных в среде, содержащей обработанный ионообменной смолой сывороточный альбумин человека.
Первичные неонатальные фибробласты человека, начиная с 0 суток, в соответствии с Примером 2 трансфицировали РНК, синтезированной в соответствии с Примером 1. Фотографии делали на 2 сутки. Клетки в лунке, содержавшей необработанный САЧ, проявили низкую жизнеспособность по сравнению с лункой, содержавшей обработанный полученный из крови САЧ или обработанный ионообменной смолой рекомбинантный САЧ.
Пример 13. Репрограмирование фибробластов человека с использованием обработанного ионообменной смолой сывороточного альбумина человека.
Первичные неонатальные фибробласты человека наносили на 6-луночные планшеты на фидеры при плотности 10000 клеток/лунку в среде для фибробластов (DMEM+10% фетальной бычьей сыворотки). Клетки, начиная с 0 суток, в соответствии с Примером 2 ежедневно трансфицировали РНК, синтезированной в соответствии с Примером 1. На 4 сутки выполняли пересев с индексом разведения 1:20. Фотографии делали на 10 сутки. Лунка содержала много областей с клетками, проявившими соответствующую репрограммированию морфологию. В лунках, подвергшихся воздействию среды для культивирования клеток, содержавшей необработанный САЧ, не наблюдалось колоний.
Пример 14. Репрограмирование фибробластов человека без использования фидеров или иммуносупрессантов.
Первичные фибробласты человека наносили на 6-луночные планшеты при плотности 20000 клеток/лунку в среде для фибробластов (DMEM+10% фетальной бычьей сыворотки). Через 6 часов среду заменяли средой для трансфекции, содержавшей обработанный САЧ и не содержавшей иммуносупрессанты, и клетки в соответствии с Примером 2 ежедневно трансфицировали РНК, синтезированной в соответствии с Примером 1, за исключением того, что доза РНК была снижена до 1 мкг/лунку и всего было выполнено 5 трансфекций. Фотографии делали на 7 сутки. Уже на 5 сутки стали видны небольшие колонии клеток, проявившие соответствующую репрограммированию морфологию. На 7 сутки среду заменяли DMEM/F12+20% раствор для замещения сыворотки Knockout™ (Life Technologies Corporation)+1X раствор с незаменимыми аминокислотами+2 мM L-глутамина, кондиционированную на облученных эмбриональных фибробластах мыши в течение 24 часов и потом добавляли 20 нг/мл бФРФ и 10 мкM Y-27632. Уже на 8 сутки стали видны большие колонии с репрограммированной морфологией. Колонии собирали на 10 сутки и наносили на лунки, покрытые экстрактом базальных мембран (Cultrex® Human BME Pathclear®, Trevigen Inc.). Клетки быстро росли и для получения линий пересевались. Полученные линии положительно окрашивались на маркеры плюрипотентных стволовых клеток Oct4 и SSEA4. Весь протокол повторяли и получали сходные результаты.
Пример 15. Эффективная быстрая деривация и репрограммирование клеток из ткани биоптата кожи человека.
Биопсию на всю толщину проводили дермальным пробойником на здоровом добровольце возрастом 31 год в соответствии с утвержденным протоколом. Вкратце, область кожи на левой верхней части руки анестезировали местным введением 2,5% лидокаина. Поле дезинфицировали 70% изопропанолом и выполняли дермальную биопсию на всю толщину с использованием пробойника диаметром 1,5 мм. Ткань промывали фосфатно-солевым буферным раствором (PBS), помещали в пробирку на 1,5 мл, содержавшую 250 мкл TrypLE™ Select CTS™ (Life Technologies Corporation), и инкубировали при 37 C в течение 30 мин. Потом ткань переносили в пробирку на 1,5 мл, содержавшую 250 мкл DMEM/F12-CTS™ (Life Technologies Corporation)+5 мг/мл коллагеназы и инкубировали при 37 C в течение 2 ч. Используя пинцет удаляли эпидермис и ткань диссоциировали механическим способом. Клетки дважды промывали DMEM/F12-CTS™ и наносили в покрытые фибронектином лунки 24-луночных и 96-луночных планшетов. У того же добровольца проводили флеботомию и в пробирки Vacutainer® SST™ (Becton, Dickinson and Company) собирали венозную кровь. Сыворотку выделяли в соответствии с протоколом производителя. Изогенную среду для нанесения готовили смешиванием DMEM/F12-CTS™+2 мM L-аланил-L-глутамина (Sigma-Aldrich Co. LLC.)+20% сыворотки человека. Клетки из образца дермальной ткани наносили или в среде для трансфекции или в изогенной среде для нанесения. Через 2 часа лунки промывали и среду заменяли средой для трансфекции. На 2 сутки присоединялось и начинало размножаться множество клеток с морфологией фибробластов. Клетки, начиная с 2 суток, в соответствии с Примером 2 трансфицировали РНК, синтезированной в соответствии с Примером 1, с использованием всех объемов, масштабированных для соответствия меньшим лункам. На 5 сутки наблюдали области с клетками с соответствующей репрограммированию морфологией.
Пример 16. Репрограмирование фибробластов человека с использованием синтетической РНК, содержавшей неканонические нуклеотиды.
Первичные фибробласты человека наносили в 6-луночные планшеты, покрытые рекомбинантным фибронектином человека и рекомбинантным витронектином человека (каждый разведен в DMEM/F12 до концентрации 1 мкг/мл, 1 мл/лунку, с инкубированием при комнатной температуре в течение 1 ч), при плотности 20000 клеток/лунку в среде для трансфекции. На следующие сутки клетки как в Примере 2 трансфицировали РНК, синтезированной в соответствии с Примером 1, за исключением того, что доза РНК составляла 0,5 мкг/лунку в 1 сутки, 0,5 мкг/лунку на 2 сутки и 2 мкг/лунку на 3 сутки. Фотографии делали на 4 сутки. На 4 сутки были видны небольшие колонии клеток, проявившие соответствующую репрограммированию морфологию.
Пример 17. Репрограмирование фибробластов человека с некондиционированной средой для трансфекции.
Первичные фибробласты человека наносили в 6-луночные планшеты, покрытые рекомбинантным фибронектином человека и рекомбинантным витронектином человека (каждый разведен в DMEM/F12 до концентрации 1 мкг/мл, 1 мл/лунку, с инкубированием при комнатной температуре в течение 1 ч), при плотности 20000 клеток/лунку в среде для трансфекции. На следующие сутки клетки как в Примере 2 трансфицировали РНК, синтезированной в соответствии с Примером 1, за исключением того, что доза РНК составляла 0,5 мкг/лунку в 1 сутки, 0,5 мкг/лунку на 2 сутки, 2 мкг/лунку на 3 сутки, 2 мкг/лунку на 4 сутки и 4 мкг/лунку на 5 сутки. Уже на 5 сутки стали видны небольшие колонии клеток, проявившие соответствующую репрограммированию морфологию. На 7 сутки среду заменяли DMEM/F12+20% раствор для замещения сыворотки Knockout™ (Life Technologies Corporation)+1X раствор с незаменимыми аминокислотами+2 мM L-глутамина, кондиционированную на облученных эмбриональных фибробластах мыши в течение 24 часов и потом добавляли 20 нг/мл бФРФ и 10 мкM Y-27632. Уже на 8 сутки стали видны большие колонии с репрограммированной морфологией. Колонии собирали на 10 сутки и наносили на лунки, покрытые экстрактом базальных мембран (Cultrex® Human BME Pathclear®, Trevigen Inc.). Клетки быстро росли и для получения линий пересевались.
Пример 18. Репрограмирование фибробластов человека с использованием синтетической РНК, содержащей неканонические нуклеотиды.
Первичные неонатальные фибробласты человека наносили в 6-луночные планшеты, покрытые рекомбинантным фибронектином человека и рекомбинантным витронектином человека (каждый разведен в DMEM/F12 до концентрации 1 мкг/мл, 1 мл/лунку, с инкубированием при комнатной температуре в течение 1 ч), при плотности 10000 клеток/лунку в среде для трансфекции. На следующие сутки клетки как в Примере 2 трансфицировали с использованием РНК, содержавшей A, 0,5 7dG, 0,5 5mU и 5mC, и дозой РНК 0,5 мкг/лунку в 1 сутки, 0,5 мкг/лунку на 2 сутки, 2 мкг/лунку на 3 сутки, 2 мкг/лунку на 4 сутки и 4 мкг/лунку на 5 сутки. Уже на 5 сутки стали видны небольшие колонии клеток, проявившие соответствующую репрограммированию морфологию. На 6 сутки среду заменяли средой для поддержания. Клетки окрашивали с использованием антитела против Oct4. По всей лунки были видны Oct4-положительные колонии клеток, проявившие соответствующую репрограммированию морфологию.
Пример 19. Репрограммирование первичных фибробластов взрослого человека с использованием синтетической РНК без применения фидеров, пересевов, иммуносупрессантов и кондиционирования.
Лунки 6-луночного планшета покрывали смесью рекомбинантного фибронектина человека и рекомбинантного витронектина человека (1 мкг/мл в DMEM/F12, 1 мл/лунку) в течение 1 ч при комнатной температуре. Первичные фибробласты взрослого человека наносили на покрытые лунки в среде для трансфекции при плотности 10000 клеток/лунку. Клетки поддерживали при 37 C, 5% CO2 и 5% O2. Начиная со следующих суток, в соответствии с Примером 2 ежедневно в течение 5 суток клетки трансфицировали РНК, синтезированной в соответствии с Примером 1. Общее количество РНК, трансфицированное каждые из 5 суток, составляло 0,5 мкг, 0,5 мкг, 2 мкг, 2 мкг и 4 мкг, соответственно. Начиная с четвертой трансфекции, среду заменяли дважды в сутки. На сутки следующие за последней трансфекцией среду заменяли средой для трансфекции с добавкой 10 мкМ Y-27632. Альтернативно, общее количество РНК, трансфицированное каждые сутки составляло 0,25 мкг, 0, 0,5 мкг, 0,5 мкг и 0,5 мкг, соответственно, или 0,25 мкг, 0, 0,25 мкг, 0,25 мкг, 0,25 мкг и 0,25 мкг, соответственно. В некоторых экспериментах во время проведения трансфекции среда для трансфекции заменялась только раз в сутки. На 4 сутки в каждой трансфицированной лунке были видны компактные колонии клеток с репрограммированной морфологией.
Пример 20. Эффективная быстрая деривация и репрограммирование клеток из ткани биоптата кожи взрослого человека.
Биопсию на всю толщину проводили дермальным пробойником на здоровом добровольце возрастом 31 год в соответствии с утвержденным протоколом. Вкратце, область кожи на левой верхней части руки анестезировали местным введением 2,5% лидокаина. Поле дезинфицировали 70% изопропанолом и выполняли дермальную биопсию на всю толщину с использованием пробойника диаметром 1,5 мм. Ткань промывали фосфатно-солевым буферным раствором (PBS), помещали в пробирку на 1,5 мл, содержавшую 250 мкл TrypLE Select CTS (Life Technologies Corporation), и инкубировали при 37 C в течение 30 мин. Потом ткань переносили в пробирку на 1,5 мл, содержавшую 250 мкл DMEM/F12-CTS (Life Technologies Corporation)+5 мг/мл коллагеназы и инкубировали при 37 C в течение 2 ч. Используя пинцет удаляли эпидермис и ткань диссоциировали механическим способом. Клетки дважды промывали DMEM/F12-CTS. У того же добровольца проводили флеботомию и в пробирки Vacutainer SST (Becton, Dickinson and Company) собирали венозную кровь. Сыворотку выделяли в соответствии с инструкциями производителя. Изогенную среду для нанесения готовили смешиванием DMEM/F12-CTS+2 мM L-аланил-L-глутамина (Sigma-Aldrich Co. LLC.)+20% сыворотка человека. Клетки из образца дермальной ткани наносили на покрытую фибронектином лунку 6-луночного планшета в изогенной среде для нанесения. На 2 сутки присоединялось и начинало размножаться множество клеток с морфологией фибробластов. Клетки размножали и замораживали в устройстве Synth-a-Freeze (Life Technologies Corporation).
Клетки пересевали в 6-луночные планшеты при плотности 5000 клеток/лунку. На следующие сутки среду заменяли средой для трансфекции и клетки трансфицировали как в Примере 2 с использованием РНК, содержавшей A, 0,5 7dG, 0,4 5mU и 5mC, и дозой РНК 0,5 мкг/лунку в 1 сутки, 0,5 мкг/лунку на 2 сутки, 2 мкг/лунку на 3 сутки, 2 мкг/лунку на 4 сутки и 2 мкг/лунку на 5 сутки. Некоторые лунки получали дополнительные трансфекции по 2 мкг/лунку на 6 сутки и 7 сутки. В дополнение к этому, некоторые лунки получали 2 нг/мл ТФР-β1, начиная с 4 суток. На 6 сутки среду заменяли средой для поддержания. Между 5 сутками и 10 сутками стали видны колонии клеток, проявившие соответствующую репрограммированию морфологию. Колония быстро росли и многие проявили морфологию, сходную с такой у колоний эмбриональнальных стволовых клеток. Колонии собирали и переносили в лунки, покрытые рекомбинантным фибронектином человека и рекомбинантным витронектином человека (каждый разведен в DMEM/F12 до концентрации 1 мкг/мл, 1 мл/лунку, с инкубированием при комнатной температуре в течение 1 ч). Клетки быстро росли и для получения линий пересевались.
Пример 21. Высокоэффективное редактирование генов повторными трансфекциями с помощью RiboSlice.
Первичные фибробласты человека наносили как в Примере 19. На следующие сутки клетки как в Примере 2 трансфицировали РНК, синтезированной в соответствии с Примером 1. На следующие сутки клетки в одной из лунок трансфицировали второй раз. Через двое суток после второй трансфекции эффективность редактирования генов измеряли с использованием анализа с мутациеспецифическими нуклеазами.
Пример 22. Трансфекция клеток синтетической РНК, содержащей неканонические нуклеотиды, и ДНК, кодирующей матрицу для репарации.
Для трансфекции в 6-луночных планшетах сначала отдельно разводили 1 мкг РНК, кодировавшей редактирующие гены белки, таргетирующие экзон 16 гена APP человека, 1 мкг одноцепочечной ДНК-матрицы для репарации, содержавшей сайт рестрикции PstI, который отсутствовал в клетках-мишенях, и 6 мкл реагента для трансфекции (Lipofectamine RNAiMAX, Life Technologies Corporation) в среде для комплексообразования (Opti-MEM, Life Technologies Corporation) до общего объема 120 мкл. Потом разведенную РНК, матрицу для репарации и реагент для трансфекции смешивали и инкубировали в течение 15 мин при комнатной температуре в соответствии с инструкциями производителя реагента для трансфекции. Комплексы добавляли к клеткам в культуре. К каждой лунке 6-луночного планшета, которая уже содержала 2 мл среды для трансфекции на лунку, добавляли приблизительно 120 мкл комплексов. Планшеты осторожно встряхивали для распределения комплексов по всей лунке. Перед заменой среды свежей средой для трансфекции (2 мл/лунку) клетки инкубировали с комплексами от 4 часов до в течение ночи. На следующие сутки среду заменяли на DMEM+10% ФБС. Через двое суток после трансфекции выделяли и очищали геномную ДНК. Участок внутри гена APP амплифицировали методом ПЦР, а амплифицированный продукт расщепляли PstI и анализировали методом гель-электрофореза.
Пример 23. Исследование безопасности RiboSlice in vivo.
40 самкам мышей NCr nu/nu подкожно инъецировали 5×106 опухолевых клеток MDA-MB-231 в 50% Matrigel (BD Biosciences). Объем инъекции клеток составлял 0,2 мл/мышь. В начале исследования возраст мыши составлял от 8 до 12 недель. Когда опухоли достигали среднего размера 100-150 мм3, проводился подбор пар, животных разделяли на 4 группы из 10 животных в каждой и начиналось лечение. Массу тела измеряли каждые сутки в течение первых 5 суток, а потом дважды в неделю до конца исследования. Лечение заключалось в применении RiboSlice BIRC5-1.2, образовавшего комплекс с носителем (Lipofectamine 2000, Life Technologies Corporation). Для приготовления для каждой группы раствора дозирования пипеткой переносили 308 мкл буферного раствора для комплексообразования (Opti-MEM, Life Technologies Corporation) в каждую из двух стерильных пробирок на 1,5 мл без РНКазной активности. В одну из двух пробирок добавляли 22 мкл RiboSlice BIRC5-1.2 (500 нг/мл) и содержимое пробирки перемешивали пипетированием. Во вторую пробирку добавляли 22 мкл плацебо. Содержимое второй пробирки перемешивали, потом переносили в первую пробирку и пипетированием смешивали с содержимым первой пробирки для образования комплексов. Комплексы инкубировали при комнатной температуре в течение 10 минут. Во время инкубации наполняли шприцы. Животным внутривенно или внутрь опухолей инъецировали общую дозу 1 мкг РНК/животное в общем объеме 60 мкл/животное. Всего провели 5 обработок с введением инъекций каждый второй день. Дозы не корректировали на массу тела. За животными наблюдали 17 суток. Не наблюдалось статистически значимого снижения средней массы тела, что продемонстрировало безопасность редактирующей гены РНК RiboSlice in vivo.
Пример 24. Скрининг реагентов для доставки нуклеиновых кислот в клетки.
Реагенты для доставки, включавшие полиэтиленимин (ПЭИ), различные коммерческие реагенты для трансфекции на основе липидов, реагенты для трансфекции на основе пептидов (N-TER, Sigma-Aldrich Co. LLC.) и несколько реагентов для доставки на основе липидов и на основе стеролов подвергали скринингу на эффективность трансфекции и токсичность in vitro. Проводили образование комплексов реагентов для доставки с RiboSlice BIRC5-1.2 и комплексы доставляли в клетки HeLa в культуре. Токсичность оценивали путем анализа плотности клеток после 24 ч после трансфекции. Эффективность трансфекции оценивали посредством анализа морфологических изменений. Испытанные реагенты проявляли широкий диапазон токсичности и эффективности трансфекции. Реагенты, содержавшие большую пропорцию сложноэфирных связей проявили более низкую токсичность, чем реагенты содержавшие меньшую пропорцию сложноэфирных связей или не содержавших сложноэфирных связей.
Пример 25. Высококонцентрированный липосомальный препарат RiboSlice.
Высококонцентрированный липосомальный препарат RiboSlice получали смешиванием 1 мкг РНК в растворе 500 нг/мл с 3 мкл среды для комплексообразования (Opti-MEM, Life Technologies Corporation) и 2,5 мкл реагента для трансфекции (Lipofectamine 2000, Life Technologies Corporation) на мкг РНК с 2,5 мкл среды для комплексообразования. Потом разведенную РНК и реагент для трансфекции смешивали и инкубировали в течение 10 мин при комнатной температуре для образования высококонцентрированного липосомального препарата RiboSlice. Альтернативно, использовался реагент для трансфекции, содержавший DOSPA или DOSPER.
Пример 26. Исследование эффективности RiboSlice in vivo - модель подкожной глиомы.
40 самкам мышей NCr nu/nu подкожно инъецировали 1×107 опухолевых клеток U-251. Объем инъекции клеток составлял 0,2 мл/мышь. В начале исследования возраст мыши составлял от 8 до 12 недель. Когда опухоли достигали среднего размера 35-50 мм3, проводился подбор пар, животных разделяли на 4 группы из 10 животных в каждой и начиналось лечение. Массу тела измеряли каждые сутки в течение первых 5 суток, а потом дважды в неделю до конца исследования. Дважды в неделю проводили измерения штангенциркулем и рассчитывали размер опухолей. Лечение заключалось в применении RiboSlice BIRC5-2.1, образовавшего комплекс с носителем (Lipofectamine 2000, Life Technologies Corporation). Для получения раствора дозирования пипеткой переносили 294 мкл буферного раствора для комплексообразования (Opti-MEM, Life Technologies Corporation) в пробирку, содержавшую 196 мкл RiboSlice BIRC5-1.2 (500 нг/мкл), и содержимое пробирки перемешивали пипетированием. В пробирку, содержавшую 245 мкл носителя, пипеткой переносили 245 мкл буферного раствора для комплексообразования. Содержимое второй пробирки перемешивали, потом переносили в первую пробирку и пипетированием смешивали с содержимым первой пробирки для образования комплексов. Комплексы инкубировали при комнатной температуре в течение 10 минут. Во время инкубации наполняли шприцы. Животным внутрь опухолей инъецировали общую дозу 2 мкг или 5 мкг РНК/животное в общем объеме 20 мкл или 50 мкл/животное. Всего провели 5 обработок с введением инъекций каждый второй день. Дозы не корректировали на массу тела. За животными наблюдали 25 суток.
Пример 27. Липосомальный состав и инкапсулирование нуклеиновых кислот.
Липосомы получают с использованием следующего состава: 3,2 мг/мл N-(карбонилэтоксиполиэтиленгликоль 2000)-1,2-дистеароил-sn-глицеро-3-фосфоэтаноламина (MPEG2000-DSPE), 9,6 мг/мл полностью гидрогенизированного фосфатидилхолина, 3,2 мг/мл холестерина, 2 мг/мл сульфата аммония и гистидина в качестве буферного вещества. pH контролируется с использованием гидроксида натрия, а изотоничность поддерживается с использованием сахарозы. Для образования липосом липиды смешивают с органическим растворителем, высушивают, гидратируют с перемешиванием и формируют экструзией через поликарбонатный фильтр со средним размером пор 800 нм. Нуклеиновые кислоты инкапсулируют соединением 10 мкг липосомального состава на 1 мкг нуклеиновой кислоты и инкубированием при комнатной температуре в течение 5 минут.
Пример 28. Липосомальный состав, таргетирующий фолат.
Липосомы готовили в соответствии с Примером 62, за исключением того, что к липидной смеси добавляли 0,27 мг/мл 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-N-[фолат(полиэтиленгликоль)-5000] (FA-MPEG5000-DSPE).
Пример 29. Терапия, включающая липосомальную кодирующую белок РНК.
Липосомы с инкапсулированной синтетической РНК, кодирующей лечебный белок, синтезированной в соответствии с Примером 1, получают в соответствии с Примером 27 или Примером 28. Липосомы вводят инъекцией или внутривенной инфузией.
Пример 30. Создание ivT-РНК матрицы эластина.
Общую РНК извлекали из неонатальных дермальных фибробластов человека с использованием мининабора RNeasy (QIAGEN GmbH) в соответствии с инструкциями производителя. кДНК, кодировавшую эластин человека, получали с использованием обратной транскриптазы MonsterScript™ (Epicentre Biotechnologies) и праймера: AAAAAAACCGGT TCATTTTCTCTTCCGGCCAC. Матрицу для транскрипции in vitro (ivT) получали из кДНК методом ПЦР-амплификации кодирующей эластин последовательности (CDS) с использованием праймеров: F: AAAAAAGCTAGCATGGCGGGTCTGACG и R: AAAAAAACCGGTTCATTTTCTCTTCCGGCCAC. Потом ПЦР-продукт очищали с использованием электрофореза в агарозном геле и набора для гель-экстракции QIAquick (QIAGEN GmbH) и клонировали в векторе, содержавшем 5ʹ- и 3ʹ-нетранслируемые области бета-глобина человека (HBB) и сильную последовательность Козак. Перед синтезом РНК вектор амплифицировали, очищали и линеаризировали.
Пример 31. Синтез РНК эластина.
РНК, кодировавшую эластин человека, синтезировали с использованием ДНК-матрицы из Примера 30 и набора для синтеза РНК с высоким выходом T7 (New England Biolabs Inc.) в соответствии с инструкциями производителя (табл. 4). Образцы РНК анализировали методом электрофореза в агарозном геле для оценки качества РНК (ФИГ. 1). Потом РНК разбавляли до 200 нг/мл и добавляли ингибитор РНКазы (Superase⋅In™, Life Technologies Corporation) в концентрации 1 мкл/200 мкг РНК. Раствор РНК хранили при 4 C.
Пример 32. Получение обработанного октаноатом сывороточного альбумина человека.
С 16 мМ октаноата натрия (Sigma-Aldrich Co. LLC) предварительно инкубировали 10% раствор САЧ и перед приготовлением полной среды инкубировали при 37 C в течение 3 часов.
Пример 33. Состав для доставки нуклеиновых кислот in vivo.
Состав для доставки нуклеиновых кислот in vivo готовят соединением РНК, синтезированной в соответствии с Примером 31, и сывороточного альбумина человека, обработанного в соответствии с Примерами 8, 9 и/или 32, в подходящем буферном растворе (например, воде, DMEM/F12, среде для комплексообразования, Opti-MEM и т.п.).
Пример 34. Увеличение продукции эластина в коже трансдермальной инъекцией обработанного альбумина и РНК, кодирующей эластин, через шприц.
Составом из примера 33 наполняют инсулиновый шприц с иглой 28 калибра и длиной 0,5 дюйма и доставляют его в дерму пациента через эпидермис. При необходимости вводят дополнительные дозы.
Пример 35. Увеличение продукции эластина в коже трансдермальной инъекцией обработанного альбумина и РНК, кодирующей эластин, через моторизированную микроигольчатую матрицу.
Составом из примера 33 наполняют камеру моторизированной микроигольчатой матрицы, настроенной на глубину проникновения приблизительно 0,1 мм. Микроигольчатая матрица доставляет состав в дерму пациента через эпидермис.
Пример 36. Увеличение продукции коллагена в коже трансдермальной инъекцией обработанного альбумина и РНК, кодирующей коллаген.
Состав из примера 33 получают с использованием РНК, кодирующей коллаген человека I типа и/или III типа. Состав доставляют как в Примере 34 или 35.
Пример 37. Увеличение продукции актина в скелетной мышце внутримышечной инъекцией обработанного альбумина и РНК, кодирующей актин.
Состав из примера 33 получают с использованием РНК, кодирующей скелетный актин альфа. Составы доставляют в организм пациента через внутримышечную инъекцию.
Пример 38. Лечение для заживления ран.
Состав из примера 33 получают с использованием РНК, кодирующей основный фактор роста фибробластов. Состав доставляют как в Примере 34 или 35.
Пример 39. Противорубцовое лечение.
Состав из примера 33 получают с использованием РНК, кодирующей коллагеназу. Состав доставляют как в Примере 34 или 35.
Пример 40. Создание ivT-РНК матрицы тирозиназы.
Общую РНК извлекали из эпидермальных меланоцитов человека с использованием мининабора RNeasy (QIAGEN GmbH) в соответствии с инструкциями производителя. кДНК, кодировавшую тирозиназу человека, получали с использованием обратной транскриптазы MonsterScript™ (Epicentre Biotechnologies). Матрицу для транскрипции in vitro (ivT) получали из кДНК методом ПЦР-амплификации кодирующей тирозиназу последовательности (CDS). Потом ПЦР-продукт очищали с использованием электрофореза в агарозном геле и набора для гель-экстракции QIAquick (QIAGEN GmbH) и клонировали в векторе, содержавшем 5ʹ- и 3ʹ-нетранслируемые области бета-глобина человека (HBB) и сильную последовательность Козак. Перед синтезом РНК вектор амплифицировали, очищали и линеаризировали.
Пример 41. Синтез РНК тирозиназы.
РНК, кодировавшую тирозиназу человека, синтезировали в соответствии с Примером 1 с использованием ДНК-матрицы из Примера 40 и набора для синтеза РНК с высоким выходом T7 (New England Biolabs Inc.) в соответствии с инструкциями производителя (табл. 4). Образцы РНК анализировали методом электрофореза в агарозном геле для оценки качества РНК. Потом РНК разбавляли до 1 мкг/мкл. Раствор РНК хранили при 4 C.
Пример 42. Получение обработанного октаноатом сывороточного альбумина человека.
С 16 мМ октаноата натрия (Sigma-Aldrich Co. LLC) предварительно инкубировали 10% раствор САЧ и перед приготовлением полной среды инкубировали при 37 C в течение 3 часов.
Пример 43. Увеличение продукции меланина в коже трансдермальной инъекцией РНК, кодирующей тирозиназу, через шприц.
РНК из Примера 41 наполняли шприц и доставляли в дерму вентральной части предплечья здорового пациента-мужчины возрастом 33 года в течение приблизительно 30 секунд.
Пример 44. Увеличение продукции меланина в коже комбинированной доставкой РНК, кодирующей тирозиназу, и электропорацией.
Область кожи, обработанная в Примере 43, подвергалась воздействию электрических импульсов между 10 В и 155 В и между приблизительно 10 миллисекундами и приблизительно 1 секундой с использованием двухэлектродной матрицы электрически подключенной к конденсатору. Пациент сообщал об ощущении покалывания на всех напряжениях и глубинах проникновения. Через 24-48 часов обработанная область стала темнее (см. ФИГ. 16). Эксперименты повторяли несколько раз со сходным результатом.
Пример 45. Увеличение продукции меланина в коже местным или внутрикожным введением РНК, кодирующей тирозиназу.
РНК из Примера 41 или липосомы из Примера 29 наносили непосредственно на кожу с или без разрушения рогового слоя или инъецировали внутрикожно с использованием дозы один микрограмм или меньше на квадратный сантиметр. Необязательно накладывали электрическое поле как в Примере 44 или использовали пластырь с контактной поверхностью для усиления доставки РНК.
Пример 46. Увеличение продукции эластина в коже трансдермальной доставкой РНК, кодирующей эластин.
РНК, кодировавшую эластин, готовили в соответствии с Примером 1. РНК доставляют как в Примерах 43, 44 или 45.
Пример 47. Увеличение продукции коллагена в коже трансдермальной доставкой РНК, кодирующей коллаген.
РНК, кодировавшую коллаген, готовили в соответствии с Примером 1. РНК доставляют как в Примерах 43, 44 или 45.
Пример 48. Терапия анемии, включающая доставку РНК, кодирующую эритропоэтин или дарбэпоэтин.
РНК, кодировавшую дарбэпоэтин альфа, готовили в соответствии с Примером 1. РНК доставляют как в Примерах 43, 44 или 45.
Пример 49. Увеличение продукции актина в скелетной мышце внутримышечной доставкой РНК, кодирующей актин.
РНК, кодирующую актин, готовят в соответствии с Примером 1. РНК доставляют в организм пациента через внутримышечную инъекцию с и без применения электрического поля как в Примерах 43, 44 или 45.
Пример 50. Лечение для заживления ран.
РНК, кодирующую основный фактор роста фибробластов, готовят в соответствии с Примером 1. РНК доставляют как в Примерах 43, 44 или 45.
Пример 51. Противорубцовое лечение.
РНК, кодирующую коллагеназу, готовят в соответствии с Примером 1. РНК доставляют как в Примерах 43, 44 или 45.
Пример 52. Получение ботулотоксина.
РНК, кодирующую ботулотоксин, готовят в соответствии с Примером 1. РНК доставляют как в Примерах 43, 44 или 45.
Пример 53. Увеличение клетками кожи продукции коллагена трансфекцией РНК, кодирующей коллаген I.
РНК, содержавшую кодирующую последовательность гена COL1A1 человека, синтезировали в соответствии с Примером 1. Первичные дермальные фибробласты человека наносили в лунки 24-луночного планшета и трансфицировали в соответствии с Примером 2. Между 24 и 72 часами после трансфекции клетки фиксировали и окрашивали с использованием антитела, таргетирующего коллаген I. В трансфицированных лунках было видно много внеклеточных отложений коллагена (ФИГ. 17).
Пример 54. Увеличение клетками кожи продукции коллагена трансфекцией РНК, кодирующей коллаген VII.
РНК, содержавшую кодирующую последовательность гена COL7 человека, синтезировали в соответствии с Примером 1. Первичные дермальные фибробласты человека наносили в лунки 24-луночного планшета и трансфицировали в соответствии с Примером 2. Между 24 и 72 часами после трансфекции клетки фиксировали и окрашивали с использованием антитела, таргетирующего коллаген VII. Трансфицированные клетки проявили высокие уровни коллагена VII по сравнению с нетрансфицированным контролем (ФИГ. 18).
Пример 55. Увеличение продукции коллагена в коже трансдермальной инъекцией РНК, кодирующей коллаген I или коллаген VII, через шприц.
РНК, содержавшую кодирующую последовательность гена COL1A1 человека или гена COL7 человека, синтезировали в соответствии с Примером 1. РНК наполняют шприц и доставляют в дерму пациента в течение приблизительно 30 секунд или как в Примерах 43, 44 или 45.
Пример 56. Увеличение продукции коллагена в коже комбинированной доставкой РНК, кодирующей коллаген I или коллаген VII, и электропорацией.
Область кожи, обработанная в Примере 55, подвергается воздействию электрических импульсов между 10 В и 155 В и между приблизительно 50 миллисекундами и приблизительно 1 секундой с использованием мультиэлектродной матрицы электрически подключенной к источнику питания.
ЭКВИВАЛЕНТЫ
Специалисты в данной области поймут или способны установить с использованием только лишь обычного проведения экспериментов многочисленные эквиваленты специальным вариантам реализации изобретения, описанные исключительно в данном документе. Подразумевается, что такие эквиваленты должны охватываться объемом следующей формулы изобретения.
ВКЛЮЧЕНИЕ ПУТЕМ ССЫЛКИ
Все патенты и публикации, на которые ссылаются в данном документе, тем самым включены посредством ссылки в полном объеме.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Angel, Matthew
Rohde, Christopher
<120> СПОСОБЫ И ПРОДУКТЫ ДЛЯ ПОЛУЧЕНИЯ И ДОСТАВКИ НУКЛЕИНОВЫХ КИСЛОТ
<130> FAB-008PC
<150> US 61/934397
<151> 2014-01-31
<150> US 62/038608
<151> 2014-08-18
<150> US 62/069667
<151> 2014-10-28
<160> 144
<170> PatentIn версии 3.5
<210> 1
<211> 195
<212> ПРТ
<213> Homo sapiens
<400> 1
Val Leu Glu Lys Ser Asp Ile Glu Lys Phe Lys Asn Gln Leu Arg Thr
1 5 10 15
Glu Leu Thr Asn Ile Asp His Ser Tyr Leu Lys Gly Ile Asp Ile Ala
20 25 30
Ser Lys Lys Lys Thr Ser Asn Val Glu Asn Thr Glu Phe Glu Ala Ile
35 40 45
Ser Thr Lys Ile Phe Thr Asp Glu Leu Gly Phe Ser Gly Lys His Leu
50 55 60
Gly Gly Ser Asn Lys Pro Asp Gly Leu Leu Trp Asp Asp Asp Cys Ala
65 70 75 80
Ile Ile Leu Asp Ser Lys Ala Tyr Ser Glu Gly Phe Pro Leu Thr Ala
85 90 95
Ser His Thr Asp Ala Met Gly Arg Tyr Leu Arg Gln Phe Thr Glu Arg
100 105 110
Lys Glu Glu Ile Lys Pro Thr Trp Trp Asp Ile Ala Pro Glu His Leu
115 120 125
Asp Asn Thr Tyr Phe Ala Tyr Val Ser Gly Ser Phe Ser Gly Asn Tyr
130 135 140
Lys Glu Gln Leu Gln Lys Phe Arg Gln Asp Thr Asn His Leu Gly Gly
145 150 155 160
Ala Leu Glu Phe Val Lys Leu Leu Leu Leu Ala Asn Asn Tyr Lys Thr
165 170 175
Gln Lys Met Ser Lys Lys Glu Val Lys Lys Ser Ile Leu Asp Tyr Asn
180 185 190
Ile Ser Tyr
195
<210> 2
<211> 195
<212> ПРТ
<213> Homo sapiens
<400> 2
Val Leu Glu Lys Ser Asp Ile Glu Lys Phe Lys Asn Gln Leu Arg Thr
1 5 10 15
Glu Leu Thr Asn Ile Asp His Ser Tyr Leu Lys Gly Ile Asp Ile Ala
20 25 30
Ser Lys Lys Lys Thr Ser Asn Val Glu Asn Thr Glu Phe Glu Ala Ile
35 40 45
Ser Thr Lys Ile Phe Thr Asp Glu Leu Gly Phe Ser Gly Glu His Leu
50 55 60
Gly Gly Ser Asn Lys Pro Asp Gly Leu Leu Trp Asp Asp Asp Cys Ala
65 70 75 80
Ile Ile Leu Asp Ser Lys Ala Tyr Ser Glu Gly Phe Pro Leu Thr Ala
85 90 95
Ser His Thr Asp Ala Met Gly Arg Tyr Leu Arg Gln Phe Thr Glu Arg
100 105 110
Lys Glu Glu Ile Lys Pro Thr Trp Trp Asp Ile Ala Pro Glu His Leu
115 120 125
Asp Asn Thr Tyr Phe Ala Tyr Val Ser Gly Ser Phe Ser Gly Asn Tyr
130 135 140
Lys Glu Gln Leu Gln Lys Phe Arg Gln Asp Thr Asn His Leu Gly Gly
145 150 155 160
Ala Leu Glu Phe Val Lys Leu Leu Leu Leu Ala Asn Asn Tyr Lys Thr
165 170 175
Gln Lys Met Ser Lys Lys Glu Val Lys Lys Ser Ile Leu Asp Tyr Asn
180 185 190
Ile Ser Tyr
195
<210> 3
<211> 195
<212> ПРТ
<213> Homo sapiens
<400> 3
Val Leu Glu Lys Ser Asp Ile Glu Lys Phe Lys Asn Gln Leu Arg Thr
1 5 10 15
Glu Leu Thr Asn Ile Asp His Ser Tyr Leu Lys Gly Ile Asp Ile Ala
20 25 30
Ser Lys Pro Lys Thr Ser Asn Val Glu Asn Thr Glu Phe Glu Ala Ile
35 40 45
Ser Thr Lys Ile Phe Thr Asp Glu Leu Gly Phe Ser Gly Lys His Leu
50 55 60
Gly Gly Ser Asn Lys Pro Asp Gly Leu Leu Trp Asp Asp Asp Cys Ala
65 70 75 80
Ile Ile Leu Asp Ser Lys Ala Tyr Ser Glu Gly Phe Pro Leu Thr Ala
85 90 95
Ser His Thr Asp Ala Met Gly Arg Tyr Leu Arg Gln Phe Thr Glu Arg
100 105 110
Lys Glu Glu Ile Lys Pro Thr Trp Trp Asp Ile Ala Pro Glu His Leu
115 120 125
Asp Asn Thr Tyr Phe Ala Tyr Val Ser Gly Ser Phe Ser Gly Asn Tyr
130 135 140
Lys Glu Gln Leu Gln Lys Phe Arg Gln Asp Thr Asn His Leu Gly Gly
145 150 155 160
Ala Leu Glu Phe Val Lys Leu Leu Leu Leu Ala Asn Asn Tyr Lys Thr
165 170 175
Gln Lys Met Ser Lys Lys Glu Val Lys Lys Ser Ile Leu Asp Tyr Asn
180 185 190
Ile Ser Tyr
195
<210> 4
<211> 195
<212> ПРТ
<213> Homo sapiens
<400> 4
Val Leu Glu Lys Ser Asp Ile Glu Lys Phe Lys Asn Gln Leu Arg Thr
1 5 10 15
Glu Leu Thr Asn Ile Asp His Ser Tyr Leu Lys Gly Ile Asp Ile Ala
20 25 30
Ser Lys Pro Lys Thr Ser Asn Val Glu Asn Thr Glu Phe Glu Ala Ile
35 40 45
Ser Thr Lys Ile Phe Thr Asp Glu Leu Gly Phe Ser Gly Glu His Leu
50 55 60
Gly Gly Ser Asn Lys Pro Asp Gly Leu Leu Trp Asp Asp Asp Cys Ala
65 70 75 80
Ile Ile Leu Asp Ser Lys Ala Tyr Ser Glu Gly Phe Pro Leu Thr Ala
85 90 95
Ser His Thr Asp Ala Met Gly Arg Tyr Leu Arg Gln Phe Thr Glu Arg
100 105 110
Lys Glu Glu Ile Lys Pro Thr Trp Trp Asp Ile Ala Pro Glu His Leu
115 120 125
Asp Asn Thr Tyr Phe Ala Tyr Val Ser Gly Ser Phe Ser Gly Asn Tyr
130 135 140
Lys Glu Gln Leu Gln Lys Phe Arg Gln Asp Thr Asn His Leu Gly Gly
145 150 155 160
Ala Leu Glu Phe Val Lys Leu Leu Leu Leu Ala Asn Asn Tyr Lys Thr
165 170 175
Gln Lys Met Ser Lys Lys Glu Val Lys Lys Ser Ile Leu Asp Tyr Asn
180 185 190
Ile Ser Tyr
195
<210> 5
<211> 191
<212> ПРТ
<213> Homo sapiens
<400> 5
Val Leu Glu Lys Ser Asp Ile Glu Lys Phe Lys Asn Gln Leu Arg Thr
1 5 10 15
Glu Leu Thr Asn Ile Asp His Ser Tyr Leu Lys Gly Ile Asp Ile Ala
20 25 30
Ser Lys Pro Val Glu Asn Thr Glu Phe Glu Ala Ile Ser Thr Lys Ile
35 40 45
Phe Thr Asp Glu Leu Gly Phe Ser Gly Glu His Leu Gly Gly Ser Asn
50 55 60
Lys Pro Asp Gly Leu Leu Trp Asp Asp Asp Cys Ala Ile Ile Leu Asp
65 70 75 80
Ser Lys Ala Tyr Ser Glu Gly Phe Pro Leu Thr Ala Ser His Thr Asp
85 90 95
Ala Met Gly Arg Tyr Leu Arg Gln Phe Thr Glu Arg Lys Glu Glu Ile
100 105 110
Lys Pro Thr Trp Trp Asp Ile Ala Pro Glu His Leu Asp Asn Thr Tyr
115 120 125
Phe Ala Tyr Val Ser Gly Ser Phe Ser Gly Asn Tyr Lys Glu Gln Leu
130 135 140
Gln Lys Phe Arg Gln Asp Thr Asn His Leu Gly Gly Ala Leu Glu Phe
145 150 155 160
Val Lys Leu Leu Leu Leu Ala Asn Asn Tyr Lys Thr Gln Lys Met Ser
165 170 175
Lys Lys Glu Val Lys Lys Ser Ile Leu Asp Tyr Asn Ile Ser Tyr
180 185 190
<210> 6
<211> 195
<212> ПРТ
<213> Homo sapiens
<400> 6
Val Leu Glu Lys Ser Asp Ile Glu Lys Phe Lys Asn Gln Leu Arg Thr
1 5 10 15
Glu Leu Thr Asn Ile Asp His Ser Tyr Leu Lys Gly Ile Asp Ile Ala
20 25 30
Ser Lys Lys Lys Thr Ser Asn Val Glu Asn Thr Glu Phe Glu Ala Ile
35 40 45
Ser Thr Lys Ile Phe Thr Asp Glu Leu Gly Phe Ser Gly Lys His Leu
50 55 60
Gly Gly Ser Asn Lys Pro Asp Gly Leu Leu Trp Asp Asp Asp Cys Ala
65 70 75 80
Ile Ile Leu Asp Ser Lys Ala Tyr Ser Glu Gly Phe Pro Leu Thr Ala
85 90 95
Ser His Thr Asp Ala Met Gly Arg Tyr Leu Arg Gln Phe Thr Glu Arg
100 105 110
Lys Glu Glu Ile Lys Pro Thr Trp Trp Asp Ile Ala Pro Glu His Leu
115 120 125
Asp Asn Thr Tyr Phe Ala Tyr Val Ser Gly Ser Phe Ser Gly Asp Tyr
130 135 140
Lys Glu Gln Leu Gln Lys Phe Arg Gln Asp Thr Asn His Leu Gly Gly
145 150 155 160
Ala Leu Glu Phe Val Lys Leu Leu Leu Leu Ala Asn Asn Tyr Lys Thr
165 170 175
Gln Lys Met Ser Lys Lys Glu Val Lys Lys Ser Ile Leu Asp Tyr Asn
180 185 190
Ile Ser Tyr
195
<210> 7
<211> 195
<212> ПРТ
<213> Homo sapiens
<400> 7
Val Leu Glu Lys Ser Asp Ile Glu Lys Phe Lys Asn Gln Leu Arg Thr
1 5 10 15
Glu Leu Thr Asn Ile Asp His Ser Tyr Leu Lys Gly Ile Asp Ile Ala
20 25 30
Ser Lys Lys Lys Thr Ser Asn Val Glu Asn Thr Glu Phe Glu Ala Ile
35 40 45
Ser Thr Lys Ile Phe Thr Asp Glu Leu Gly Phe Ser Gly Lys His Leu
50 55 60
Gly Gly Ser Asn Lys Pro Asp Gly Leu Leu Trp Asp Asp Asp Cys Ala
65 70 75 80
Ile Ile Leu Asp Ser Lys Ala Tyr Ser Glu Gly Phe Pro Leu Thr Ala
85 90 95
Ser His Thr Asp Ala Met Gly Arg Tyr Leu Arg Gln Phe Thr Glu Arg
100 105 110
Lys Glu Glu Ile Lys Pro Thr Trp Trp Asp Ile Ala Pro Glu His Leu
115 120 125
Asp Asn Thr Tyr Phe Ala Tyr Val Ser Gly Ser Phe Ser Gly Asp Tyr
130 135 140
Lys Glu Gln Leu Gln Lys Phe Arg Gln Asn Thr Asn His Leu Gly Gly
145 150 155 160
Ala Leu Glu Phe Val Lys Leu Leu Leu Leu Ala Asn Asn Tyr Lys Thr
165 170 175
Gln Lys Met Ser Lys Lys Glu Val Lys Lys Ser Ile Leu Asp Tyr Asn
180 185 190
Ile Ser Tyr
195
<210> 8
<211> 360
<212> ПРТ
<213> Homo sapiens
<400> 8
Met Ala Gly His Leu Ala Ser Asp Phe Ala Phe Ser Pro Pro Pro Gly
1 5 10 15
Gly Gly Gly Asp Gly Pro Gly Gly Pro Glu Pro Gly Trp Val Asp Pro
20 25 30
Arg Thr Trp Leu Ser Phe Gln Gly Pro Pro Gly Gly Pro Gly Ile Gly
35 40 45
Pro Gly Val Gly Pro Gly Ser Glu Val Trp Gly Ile Pro Pro Cys Pro
50 55 60
Pro Pro Tyr Glu Phe Cys Gly Gly Met Ala Tyr Cys Gly Pro Gln Val
65 70 75 80
Gly Val Gly Leu Val Pro Gln Gly Gly Leu Glu Thr Ser Gln Pro Glu
85 90 95
Gly Glu Ala Gly Val Gly Val Glu Ser Asn Ser Asp Gly Ala Ser Pro
100 105 110
Glu Pro Cys Thr Val Thr Pro Gly Ala Val Lys Leu Glu Lys Glu Lys
115 120 125
Leu Glu Gln Asn Pro Glu Glu Ser Gln Asp Ile Lys Ala Leu Gln Lys
130 135 140
Glu Leu Glu Gln Phe Ala Lys Leu Leu Lys Gln Lys Arg Ile Thr Leu
145 150 155 160
Gly Tyr Thr Gln Ala Asp Val Gly Leu Thr Leu Gly Val Leu Phe Gly
165 170 175
Lys Val Phe Ser Gln Thr Thr Ile Cys Arg Phe Glu Ala Leu Gln Leu
180 185 190
Ser Phe Lys Asn Met Cys Lys Leu Arg Pro Leu Leu Gln Lys Trp Val
195 200 205
Glu Glu Ala Asp Asn Asn Glu Asn Leu Gln Glu Ile Cys Lys Ala Glu
210 215 220
Thr Leu Val Gln Ala Arg Lys Arg Lys Arg Thr Ser Ile Glu Asn Arg
225 230 235 240
Val Arg Gly Asn Leu Glu Asn Leu Phe Leu Gln Cys Pro Lys Pro Thr
245 250 255
Leu Gln Gln Ile Ser His Ile Ala Gln Gln Leu Gly Leu Glu Lys Asp
260 265 270
Val Val Arg Val Trp Phe Cys Asn Arg Arg Gln Lys Gly Lys Arg Ser
275 280 285
Ser Ser Asp Tyr Ala Gln Arg Glu Asp Phe Glu Ala Ala Gly Ser Pro
290 295 300
Phe Ser Gly Gly Pro Val Ser Phe Pro Leu Ala Pro Gly Pro His Phe
305 310 315 320
Gly Thr Pro Gly Tyr Gly Ser Pro His Phe Thr Ala Leu Tyr Ser Ser
325 330 335
Val Pro Phe Pro Glu Gly Glu Ala Phe Pro Pro Val Ser Val Thr Thr
340 345 350
Leu Gly Ser Pro Met His Ser Asn
355 360
<210> 9
<211> 317
<212> ПРТ
<213> Homo sapiens
<400> 9
Met Tyr Asn Met Met Glu Thr Glu Leu Lys Pro Pro Gly Pro Gln Gln
1 5 10 15
Thr Ser Gly Gly Gly Gly Gly Asn Ser Thr Ala Ala Ala Ala Gly Gly
20 25 30
Asn Gln Lys Asn Ser Pro Asp Arg Val Lys Arg Pro Met Asn Ala Phe
35 40 45
Met Val Trp Ser Arg Gly Gln Arg Arg Lys Met Ala Gln Glu Asn Pro
50 55 60
Lys Met His Asn Ser Glu Ile Ser Lys Arg Leu Gly Ala Glu Trp Lys
65 70 75 80
Leu Leu Ser Glu Thr Glu Lys Arg Pro Phe Ile Asp Glu Ala Lys Arg
85 90 95
Leu Arg Ala Leu His Met Lys Glu His Pro Asp Tyr Lys Tyr Arg Pro
100 105 110
Arg Arg Lys Thr Lys Thr Leu Met Lys Lys Asp Lys Tyr Thr Leu Pro
115 120 125
Gly Gly Leu Leu Ala Pro Gly Gly Asn Ser Met Ala Ser Gly Val Gly
130 135 140
Val Gly Ala Gly Leu Gly Ala Gly Val Asn Gln Arg Met Asp Ser Tyr
145 150 155 160
Ala His Met Asn Gly Trp Ser Asn Gly Ser Tyr Ser Met Met Gln Asp
165 170 175
Gln Leu Gly Tyr Pro Gln His Pro Gly Leu Asn Ala His Gly Ala Ala
180 185 190
Gln Met Gln Pro Met His Arg Tyr Asp Val Ser Ala Leu Gln Tyr Asn
195 200 205
Ser Met Thr Ser Ser Gln Thr Tyr Met Asn Gly Ser Pro Thr Tyr Ser
210 215 220
Met Ser Tyr Ser Gln Gln Gly Thr Pro Gly Met Ala Leu Gly Ser Met
225 230 235 240
Gly Ser Val Val Lys Ser Glu Ala Ser Ser Ser Pro Pro Val Val Thr
245 250 255
Ser Ser Ser His Ser Arg Ala Pro Cys Gln Ala Gly Asp Leu Arg Asp
260 265 270
Met Ile Ser Met Tyr Leu Pro Gly Ala Glu Val Pro Glu Pro Ala Ala
275 280 285
Pro Ser Arg Leu His Met Ser Gln His Tyr Gln Ser Gly Pro Val Pro
290 295 300
Gly Thr Ala Ile Asn Gly Thr Leu Pro Leu Ser His Met
305 310 315
<210> 10
<211> 479
<212> ПРТ
<213> Homo sapiens
<400> 10
Met Arg Gln Pro Pro Gly Glu Ser Asp Met Ala Val Ser Asp Ala Leu
1 5 10 15
Leu Pro Ser Phe Ser Thr Phe Ala Ser Gly Pro Ala Gly Arg Glu Lys
20 25 30
Thr Leu Arg Gln Ala Gly Ala Pro Asn Asn Arg Trp Arg Glu Glu Leu
35 40 45
Ser His Met Lys Arg Leu Pro Pro Val Leu Pro Gly Arg Pro Tyr Asp
50 55 60
Leu Ala Ala Ala Thr Val Ala Thr Asp Leu Glu Ser Gly Gly Ala Gly
65 70 75 80
Ala Ala Cys Gly Gly Ser Asn Leu Ala Pro Leu Pro Arg Arg Glu Thr
85 90 95
Glu Glu Phe Asn Asp Leu Leu Asp Leu Asp Phe Ile Leu Ser Asn Ser
100 105 110
Leu Thr His Pro Pro Glu Ser Val Ala Ala Thr Val Ser Ser Ser Ala
115 120 125
Ser Ala Ser Ser Ser Ser Ser Pro Ser Ser Ser Gly Pro Ala Ser Ala
130 135 140
Pro Ser Thr Cys Ser Phe Thr Tyr Pro Ile Arg Ala Gly Asn Asp Pro
145 150 155 160
Gly Val Ala Pro Gly Gly Thr Gly Gly Gly Leu Leu Tyr Gly Arg Glu
165 170 175
Ser Ala Pro Pro Pro Thr Ala Pro Phe Asn Leu Ala Asp Ile Asn Asp
180 185 190
Val Ser Pro Ser Gly Gly Phe Val Ala Glu Leu Leu Arg Pro Glu Leu
195 200 205
Asp Pro Val Tyr Ile Pro Pro Gln Gln Pro Gln Pro Pro Gly Gly Gly
210 215 220
Leu Met Gly Lys Phe Val Leu Lys Ala Ser Leu Ser Ala Pro Gly Ser
225 230 235 240
Glu Tyr Gly Ser Pro Ser Val Ile Ser Val Ser Lys Gly Ser Pro Asp
245 250 255
Gly Ser His Pro Val Val Val Ala Pro Tyr Asn Gly Gly Pro Pro Arg
260 265 270
Thr Cys Pro Lys Ile Lys Gln Glu Ala Val Ser Ser Cys Thr His Leu
275 280 285
Gly Ala Gly Pro Pro Leu Ser Asn Gly His Arg Pro Ala Ala His Asp
290 295 300
Phe Pro Leu Gly Arg Gln Leu Pro Ser Arg Thr Thr Pro Thr Leu Gly
305 310 315 320
Leu Glu Glu Val Leu Ser Ser Arg Asp Cys His Pro Ala Leu Pro Leu
325 330 335
Pro Pro Gly Phe His Pro His Pro Gly Pro Asn Tyr Pro Ser Phe Leu
340 345 350
Pro Asp Gln Met Gln Pro Gln Val Pro Pro Leu His Tyr Gln Glu Leu
355 360 365
Met Pro Pro Gly Ser Cys Met Pro Glu Glu Pro Lys Pro Lys Arg Gly
370 375 380
Arg Arg Ser Trp Pro Arg Lys Arg Thr Ala Thr His Thr Cys Asp Tyr
385 390 395 400
Ala Gly Cys Gly Lys Thr Tyr Thr Lys Ser Ser His Leu Lys Ala His
405 410 415
Leu Arg Thr His Thr Gly Glu Lys Pro Tyr His Cys Asp Trp Asp Gly
420 425 430
Cys Gly Trp Lys Phe Ala Arg Ser Asp Glu Leu Thr Arg His Tyr Arg
435 440 445
Lys His Thr Gly His Arg Pro Phe Gln Cys Gln Lys Cys Asp Arg Ala
450 455 460
Phe Ser Arg Ser Asp His Leu Ala Leu His Met Lys Arg His Phe
465 470 475
<210> 11
<211> 454
<212> ПРТ
<213> Homo sapiens
<400> 11
Met Asp Phe Phe Arg Val Val Glu Asn Gln Gln Pro Pro Ala Thr Met
1 5 10 15
Pro Leu Asn Val Ser Phe Thr Asn Arg Asn Tyr Asp Leu Asp Tyr Asp
20 25 30
Ser Val Gln Pro Tyr Phe Tyr Cys Asp Glu Glu Glu Asn Phe Tyr Gln
35 40 45
Gln Gln Gln Gln Ser Glu Leu Gln Pro Pro Ala Pro Ser Glu Asp Ile
50 55 60
Trp Lys Lys Phe Glu Leu Leu Pro Thr Pro Pro Leu Ser Pro Ser Arg
65 70 75 80
Arg Ser Gly Leu Cys Ser Pro Ser Tyr Val Ala Val Thr Pro Phe Ser
85 90 95
Leu Arg Gly Asp Asn Asp Gly Gly Gly Gly Ser Phe Ser Thr Ala Asp
100 105 110
Gln Leu Glu Met Val Thr Glu Leu Leu Gly Gly Asp Met Val Asn Gln
115 120 125
Ser Phe Ile Cys Asp Pro Asp Asp Glu Thr Phe Ile Lys Asn Ile Ile
130 135 140
Ile Gln Asp Cys Met Trp Ser Gly Phe Ser Ala Ala Ala Lys Leu Val
145 150 155 160
Ser Glu Lys Leu Ala Ser Tyr Gln Ala Ala Arg Lys Asp Ser Gly Ser
165 170 175
Pro Asn Pro Ala Arg Gly His Ser Val Cys Ser Thr Ser Ser Leu Tyr
180 185 190
Leu Gln Asp Leu Ser Ala Ala Ala Ser Glu Cys Ile Asp Pro Ser Val
195 200 205
Val Phe Pro Tyr Pro Leu Asn Asp Ser Ser Ser Pro Lys Ser Cys Ala
210 215 220
Ser Gln Asp Ser Ser Ala Phe Ser Pro Ser Ser Asp Ser Leu Leu Ser
225 230 235 240
Ser Thr Glu Ser Ser Pro Gln Gly Ser Pro Glu Pro Leu Val Leu His
245 250 255
Glu Glu Thr Pro Pro Thr Thr Ser Ser Asp Ser Glu Glu Glu Gln Glu
260 265 270
Asp Glu Glu Glu Ile Asp Val Val Ser Val Glu Lys Arg Gln Ala Pro
275 280 285
Gly Lys Arg Ser Glu Ser Gly Ser Pro Ser Ala Gly Gly His Ser Lys
290 295 300
Pro Pro His Ser Pro Leu Val Leu Lys Arg Cys His Val Ser Thr His
305 310 315 320
Gln His Asn Tyr Ala Ala Pro Pro Ser Thr Arg Lys Asp Tyr Pro Ala
325 330 335
Ala Lys Arg Val Lys Leu Asp Ser Val Arg Val Leu Arg Gln Ile Ser
340 345 350
Asn Asn Arg Lys Cys Thr Ser Pro Arg Ser Ser Asp Thr Glu Glu Asn
355 360 365
Val Lys Arg Arg Thr His Asn Val Leu Glu Arg Gln Arg Arg Asn Glu
370 375 380
Leu Lys Arg Ser Phe Phe Ala Leu Arg Asp Gln Ile Pro Glu Leu Glu
385 390 395 400
Asn Asn Glu Lys Ala Pro Lys Val Val Ile Leu Lys Lys Ala Thr Ala
405 410 415
Tyr Ile Leu Ser Val Gln Ala Glu Glu Gln Lys Leu Ile Ser Glu Glu
420 425 430
Asp Leu Leu Arg Lys Arg Arg Glu Gln Leu Lys His Lys Leu Glu Gln
435 440 445
Leu Arg Asn Ser Cys Ala
450
<210> 12
<211> 191
<212> ДНК
<213> Homo sapiens
<400> 12
ttgaatcgcg ggacccgttg gcagaggtgg cggcggcggc atgggtgccc cgacgttgcc 60
ccctgcctgg cagccctttc tcaaggacca ccgcatctct acattcaaga actggccctt 120
cttggagggc tgcgcctgca ccccggagcg ggtgagactg cccggcctcc tggggtcccc 180
cacgcccgcc t 191
<210> 13
<211> 190
<212> ДНК
<213> Homo sapiens
<400> 13
ggctgccacg tccactcacg agctgtgctg tcccttgcag atggccgagg ctggcttcat 60
ccactgcccc actgagaacg agccagactt ggcccagtgt ttcttctgct tcaaggagct 120
ggaaggctgg gagccagatg acgaccccat gtaagtcttc tctggccagc ctcgatgggc 180
tttgttttga 190
<210> 14
<211> 198
<212> ДНК
<213> Homo sapiens
<400> 14
cccttcagct gcctttccgc tgttgttttg atttttctag agaggaacat aaaaagcatt 60
cgtccggttg cgctttcctt tctgtcaaga agcagtttga agaattaacc cttggtgaat 120
ttttgaaact ggacagagaa agagccaaga acaaaattgt atgtattggg aataagaact 180
gctcaaaccc tgttcaat 198
<210> 15
<211> 170
<212> ДНК
<213> Homo sapiens
<400> 15
gctctggttt cagtgtcatg tgtctattct ttatttccag gcaaaggaaa ccaacaataa 60
gaagaaagaa tttgaggaaa ctgcggagaa agtgcgccgt gccatcgagc agctggctgc 120
catggattga ggcctctggc cggagctgcc tggtcccaga gtggctgcac 170
<210> 16
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 16
ttgccccctg cctggcagcc 20
<210> 17
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 17
ttcttgaatg tagagatgcg 20
<210> 18
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 18
tgggtgcccc gacgttgccc 20
<210> 19
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 19
tgcggtggtc cttgagaaag 20
<210> 20
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 20
tcaaggacca ccgcatctct 20
<210> 21
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 21
tgcaggcgca gccctccaag 20
<210> 22
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 22
tggccgaggc tggcttcatc 20
<210> 23
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 23
tgggccaagt ctggctcgtt 20
<210> 24
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 24
ttggcccagt gtttcttctg 20
<210> 25
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 25
tcgtcatctg gctcccagcc 20
<210> 26
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 26
tgcgctttcc tttctgtcaa 20
<210> 27
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 27
tcaaaaattc accaagggtt 20
<210> 28
<211> 297
<212> ПРТ
<213> Homo sapiens
<400> 28
Met Glu Asp Tyr Thr Lys Ile Glu Lys Ile Gly Glu Gly Thr Tyr Gly
1 5 10 15
Val Val Tyr Lys Gly Arg His Lys Thr Thr Gly Gln Val Val Ala Met
20 25 30
Lys Lys Ile Arg Leu Glu Ser Glu Glu Glu Gly Val Pro Ser Thr Ala
35 40 45
Ile Arg Glu Ile Ser Leu Leu Lys Glu Leu Arg His Pro Asn Ile Val
50 55 60
Ser Leu Gln Asp Val Leu Met Gln Asp Ser Arg Leu Tyr Leu Ile Phe
65 70 75 80
Glu Phe Leu Ser Met Asp Leu Lys Lys Tyr Leu Asp Ser Ile Pro Pro
85 90 95
Gly Gln Tyr Met Asp Ser Ser Leu Val Lys Ser Tyr Leu Tyr Gln Ile
100 105 110
Leu Gln Gly Ile Val Phe Cys His Ser Arg Arg Val Leu His Arg Asp
115 120 125
Leu Lys Pro Gln Asn Leu Leu Ile Asp Asp Lys Gly Thr Ile Lys Leu
130 135 140
Ala Asp Phe Gly Leu Ala Arg Ala Phe Gly Ile Pro Ile Arg Val Tyr
145 150 155 160
Thr His Glu Val Val Thr Leu Trp Tyr Arg Ser Pro Glu Val Leu Leu
165 170 175
Gly Ser Ala Arg Tyr Ser Thr Pro Val Asp Ile Trp Ser Ile Gly Thr
180 185 190
Ile Phe Ala Glu Leu Ala Thr Lys Lys Pro Leu Phe His Gly Asp Ser
195 200 205
Glu Ile Asp Gln Leu Phe Arg Ile Phe Arg Ala Leu Gly Thr Pro Asn
210 215 220
Asn Glu Val Trp Pro Glu Val Glu Ser Leu Gln Asp Tyr Lys Asn Thr
225 230 235 240
Phe Pro Lys Trp Lys Pro Gly Ser Leu Ala Ser His Val Lys Asn Leu
245 250 255
Asp Glu Asn Gly Leu Asp Leu Leu Ser Lys Met Leu Ile Tyr Asp Pro
260 265 270
Ala Lys Arg Ile Ser Gly Lys Met Ala Leu Asn His Pro Tyr Phe Asn
275 280 285
Asp Leu Asp Asn Gln Ile Lys Lys Met
290 295
<210> 29
<211> 298
<212> ПРТ
<213> Homo sapiens
<400> 29
Met Glu Asn Phe Gln Lys Val Glu Lys Ile Gly Glu Gly Thr Tyr Gly
1 5 10 15
Val Val Tyr Lys Ala Arg Asn Lys Leu Thr Gly Glu Val Val Ala Leu
20 25 30
Lys Lys Ile Arg Leu Asp Thr Glu Thr Glu Gly Val Pro Ser Thr Ala
35 40 45
Ile Arg Glu Ile Ser Leu Leu Lys Glu Leu Asn His Pro Asn Ile Val
50 55 60
Lys Leu Leu Asp Val Ile His Thr Glu Asn Lys Leu Tyr Leu Val Phe
65 70 75 80
Glu Phe Leu His Gln Asp Leu Lys Lys Phe Met Asp Ala Ser Ala Leu
85 90 95
Thr Gly Ile Pro Leu Pro Leu Ile Lys Ser Tyr Leu Phe Gln Leu Leu
100 105 110
Gln Gly Leu Ala Phe Cys His Ser His Arg Val Leu His Arg Asp Leu
115 120 125
Lys Pro Gln Asn Leu Leu Ile Asn Thr Glu Gly Ala Ile Lys Leu Ala
130 135 140
Asp Phe Gly Leu Ala Arg Ala Phe Gly Val Pro Val Arg Thr Tyr Thr
145 150 155 160
His Glu Val Val Thr Leu Trp Tyr Arg Ala Pro Glu Ile Leu Leu Gly
165 170 175
Cys Lys Tyr Tyr Ser Thr Ala Val Asp Ile Trp Ser Leu Gly Cys Ile
180 185 190
Phe Ala Glu Met Val Thr Arg Arg Ala Leu Phe Pro Gly Asp Ser Glu
195 200 205
Ile Asp Gln Leu Phe Arg Ile Phe Arg Thr Leu Gly Thr Pro Asp Glu
210 215 220
Val Val Trp Pro Gly Val Thr Ser Met Pro Asp Tyr Lys Pro Ser Phe
225 230 235 240
Pro Lys Trp Ala Arg Gln Asp Phe Ser Lys Val Val Pro Pro Leu Asp
245 250 255
Glu Asp Gly Arg Ser Leu Leu Ser Gln Met Leu His Tyr Asp Pro Asn
260 265 270
Lys Arg Ile Ser Ala Lys Ala Ala Leu Ala His Pro Phe Phe Gln Asp
275 280 285
Val Thr Lys Pro Val Pro His Leu Arg Leu
290 295
<210> 30
<211> 305
<212> ПРТ
<213> Homo sapiens
<400> 30
Met Asp Met Phe Gln Lys Val Glu Lys Ile Gly Glu Gly Thr Tyr Gly
1 5 10 15
Val Val Tyr Lys Ala Lys Asn Arg Glu Thr Gly Gln Leu Val Ala Leu
20 25 30
Lys Lys Ile Arg Leu Asp Leu Glu Met Glu Gly Val Pro Ser Thr Ala
35 40 45
Ile Arg Glu Ile Ser Leu Leu Lys Glu Leu Lys His Pro Asn Ile Val
50 55 60
Arg Leu Leu Asp Val Val His Asn Glu Arg Lys Leu Tyr Leu Val Phe
65 70 75 80
Glu Phe Leu Ser Gln Asp Leu Lys Lys Tyr Met Asp Ser Thr Pro Gly
85 90 95
Ser Glu Leu Pro Leu His Leu Ile Lys Ser Tyr Leu Phe Gln Leu Leu
100 105 110
Gln Gly Val Ser Phe Cys His Ser His Arg Val Ile His Arg Asp Leu
115 120 125
Lys Pro Gln Asn Leu Leu Ile Asn Glu Leu Gly Ala Ile Lys Leu Ala
130 135 140
Asp Phe Gly Leu Ala Arg Ala Phe Gly Val Pro Leu Arg Thr Tyr Thr
145 150 155 160
His Glu Val Val Thr Leu Trp Tyr Arg Ala Pro Glu Ile Leu Leu Gly
165 170 175
Ser Lys Phe Tyr Thr Thr Ala Val Asp Ile Trp Ser Ile Gly Cys Ile
180 185 190
Phe Ala Glu Met Val Thr Arg Lys Ala Leu Phe Pro Gly Asp Ser Glu
195 200 205
Ile Asp Gln Leu Phe Arg Ile Phe Arg Met Leu Gly Thr Pro Ser Glu
210 215 220
Asp Thr Trp Pro Gly Val Thr Gln Leu Pro Asp Tyr Lys Gly Ser Phe
225 230 235 240
Pro Lys Trp Thr Arg Lys Gly Leu Glu Glu Ile Val Pro Asn Leu Glu
245 250 255
Pro Glu Gly Arg Asp Leu Leu Met Gln Leu Leu Gln Tyr Asp Pro Ser
260 265 270
Gln Arg Ile Thr Ala Lys Thr Ala Leu Ala His Pro Tyr Phe Ser Ser
275 280 285
Pro Glu Pro Ser Pro Ala Ala Arg Gln Tyr Val Leu Gln Arg Phe Arg
290 295 300
His
305
<210> 31
<211> 303
<212> ПРТ
<213> Homo sapiens
<400> 31
Met Ala Thr Ser Arg Tyr Glu Pro Val Ala Glu Ile Gly Val Gly Ala
1 5 10 15
Tyr Gly Thr Val Tyr Lys Ala Arg Asp Pro His Ser Gly His Phe Val
20 25 30
Ala Leu Lys Ser Val Arg Val Pro Asn Gly Gly Gly Gly Gly Gly Gly
35 40 45
Leu Pro Ile Ser Thr Val Arg Glu Val Ala Leu Leu Arg Arg Leu Glu
50 55 60
Ala Phe Glu His Pro Asn Val Val Arg Leu Met Asp Val Cys Ala Thr
65 70 75 80
Ser Arg Thr Asp Arg Glu Ile Lys Val Thr Leu Val Phe Glu His Val
85 90 95
Asp Gln Asp Leu Arg Thr Tyr Leu Asp Lys Ala Pro Pro Pro Gly Leu
100 105 110
Pro Ala Glu Thr Ile Lys Asp Leu Met Arg Gln Phe Leu Arg Gly Leu
115 120 125
Asp Phe Leu His Ala Asn Cys Ile Val His Arg Asp Leu Lys Pro Glu
130 135 140
Asn Ile Leu Val Thr Ser Gly Gly Thr Val Lys Leu Ala Asp Phe Gly
145 150 155 160
Leu Ala Arg Ile Tyr Ser Tyr Gln Met Ala Leu Thr Pro Val Val Val
165 170 175
Thr Leu Trp Tyr Arg Ala Pro Glu Val Leu Leu Gln Ser Thr Tyr Ala
180 185 190
Thr Pro Val Asp Met Trp Ser Val Gly Cys Ile Phe Ala Glu Met Phe
195 200 205
Arg Arg Lys Pro Leu Phe Cys Gly Asn Ser Glu Ala Asp Gln Leu Gly
210 215 220
Lys Ile Phe Asp Leu Ile Gly Leu Pro Pro Glu Asp Asp Trp Pro Arg
225 230 235 240
Asp Val Ser Leu Pro Arg Gly Ala Phe Pro Pro Arg Gly Pro Arg Pro
245 250 255
Val Gln Ser Val Val Pro Glu Met Glu Glu Ser Gly Ala Gln Leu Leu
260 265 270
Leu Glu Met Leu Thr Phe Asn Pro His Lys Arg Ile Ser Ala Phe Arg
275 280 285
Ala Leu Gln His Ser Tyr Leu His Lys Asp Glu Gly Asn Pro Glu
290 295 300
<210> 32
<211> 292
<212> ПРТ
<213> Homo sapiens
<400> 32
Met Gln Lys Tyr Glu Lys Leu Glu Lys Ile Gly Glu Gly Thr Tyr Gly
1 5 10 15
Thr Val Phe Lys Ala Lys Asn Arg Glu Thr His Glu Ile Val Ala Leu
20 25 30
Lys Arg Val Arg Leu Asp Asp Asp Asp Glu Gly Val Pro Ser Ser Ala
35 40 45
Leu Arg Glu Ile Cys Leu Leu Lys Glu Leu Lys His Lys Asn Ile Val
50 55 60
Arg Leu His Asp Val Leu His Ser Asp Lys Lys Leu Thr Leu Val Phe
65 70 75 80
Glu Phe Cys Asp Gln Asp Leu Lys Lys Tyr Phe Asp Ser Cys Asn Gly
85 90 95
Asp Leu Asp Pro Glu Ile Val Lys Ser Phe Leu Phe Gln Leu Leu Lys
100 105 110
Gly Leu Gly Phe Cys His Ser Arg Asn Val Leu His Arg Asp Leu Lys
115 120 125
Pro Gln Asn Leu Leu Ile Asn Arg Asn Gly Glu Leu Lys Leu Ala Asp
130 135 140
Phe Gly Leu Ala Arg Ala Phe Gly Ile Pro Val Arg Cys Tyr Ser Ala
145 150 155 160
Glu Val Val Thr Leu Trp Tyr Arg Pro Pro Asp Val Leu Phe Gly Ala
165 170 175
Lys Leu Tyr Ser Thr Ser Ile Asp Met Trp Ser Ala Gly Cys Ile Phe
180 185 190
Ala Glu Leu Ala Asn Ala Gly Arg Pro Leu Phe Pro Gly Asn Asp Val
195 200 205
Asp Asp Gln Leu Lys Arg Ile Phe Arg Leu Leu Gly Thr Pro Thr Glu
210 215 220
Glu Gln Trp Pro Ser Met Thr Lys Leu Pro Asp Tyr Lys Pro Tyr Pro
225 230 235 240
Met Tyr Pro Ala Thr Thr Ser Leu Val Asn Val Val Pro Lys Leu Asn
245 250 255
Ala Thr Gly Arg Asp Leu Leu Gln Asn Leu Leu Lys Cys Asn Pro Val
260 265 270
Gln Arg Ile Ser Ala Glu Glu Ala Leu Gln His Pro Tyr Phe Ser Asp
275 280 285
Phe Cys Pro Pro
290
<210> 33
<211> 326
<212> ПРТ
<213> Homo sapiens
<400> 33
Met Glu Lys Asp Gly Leu Cys Arg Ala Asp Gln Gln Tyr Glu Cys Val
1 5 10 15
Ala Glu Ile Gly Glu Gly Ala Tyr Gly Lys Val Phe Lys Ala Arg Asp
20 25 30
Leu Lys Asn Gly Gly Arg Phe Val Ala Leu Lys Arg Val Arg Val Gln
35 40 45
Thr Gly Glu Glu Gly Met Pro Leu Ser Thr Ile Arg Glu Val Ala Val
50 55 60
Leu Arg His Leu Glu Thr Phe Glu His Pro Asn Val Val Arg Leu Phe
65 70 75 80
Asp Val Cys Thr Val Ser Arg Thr Asp Arg Glu Thr Lys Leu Thr Leu
85 90 95
Val Phe Glu His Val Asp Gln Asp Leu Thr Thr Tyr Leu Asp Lys Val
100 105 110
Pro Glu Pro Gly Val Pro Thr Glu Thr Ile Lys Asp Met Met Phe Gln
115 120 125
Leu Leu Arg Gly Leu Asp Phe Leu His Ser His Arg Val Val His Arg
130 135 140
Asp Leu Lys Pro Gln Asn Ile Leu Val Thr Ser Ser Gly Gln Ile Lys
145 150 155 160
Leu Ala Asp Phe Gly Leu Ala Arg Ile Tyr Ser Phe Gln Met Ala Leu
165 170 175
Thr Ser Val Val Val Thr Leu Trp Tyr Arg Ala Pro Glu Val Leu Leu
180 185 190
Gln Ser Ser Tyr Ala Thr Pro Val Asp Leu Trp Ser Val Gly Cys Ile
195 200 205
Phe Ala Glu Met Phe Arg Arg Lys Pro Leu Phe Arg Gly Ser Ser Asp
210 215 220
Val Asp Gln Leu Gly Lys Ile Leu Asp Val Ile Gly Leu Pro Gly Glu
225 230 235 240
Glu Asp Trp Pro Arg Asp Val Ala Leu Pro Arg Gln Ala Phe His Ser
245 250 255
Lys Ser Ala Gln Pro Ile Glu Lys Phe Val Thr Asp Ile Asp Glu Leu
260 265 270
Gly Lys Asp Leu Leu Leu Lys Cys Leu Thr Phe Asn Pro Ala Lys Arg
275 280 285
Ile Ser Ala Tyr Ser Ala Leu Ser His Pro Tyr Phe Gln Asp Leu Glu
290 295 300
Arg Cys Lys Glu Asn Leu Asp Ser His Leu Pro Pro Ser Gln Asn Thr
305 310 315 320
Ser Glu Leu Asn Thr Ala
325
<210> 34
<211> 142
<212> ПРТ
<213> Homo sapiens
<400> 34
Met Gly Ala Pro Thr Leu Pro Pro Ala Trp Gln Pro Phe Leu Lys Asp
1 5 10 15
His Arg Ile Ser Thr Phe Lys Asn Trp Pro Phe Leu Glu Gly Cys Ala
20 25 30
Cys Thr Pro Glu Arg Met Ala Glu Ala Gly Phe Ile His Cys Pro Thr
35 40 45
Glu Asn Glu Pro Asp Leu Ala Gln Cys Phe Phe Cys Phe Lys Glu Leu
50 55 60
Glu Gly Trp Glu Pro Asp Asp Asp Pro Ile Glu Glu His Lys Lys His
65 70 75 80
Ser Ser Gly Cys Ala Phe Leu Ser Val Lys Lys Gln Phe Glu Glu Leu
85 90 95
Thr Leu Gly Glu Phe Leu Lys Leu Asp Arg Glu Arg Ala Lys Asn Lys
100 105 110
Ile Ala Lys Glu Thr Asn Asn Lys Lys Lys Glu Phe Glu Glu Thr Ala
115 120 125
Glu Lys Val Arg Arg Ala Ile Glu Gln Leu Ala Ala Met Asp
130 135 140
<210> 35
<211> 826
<212> ПРТ
<213> Homo sapiens
<400> 35
Met Glu Gly Ala Gly Gly Ala Asn Asp Lys Lys Lys Ile Ser Ser Glu
1 5 10 15
Arg Arg Lys Glu Lys Ser Arg Asp Ala Ala Arg Ser Arg Arg Ser Lys
20 25 30
Glu Ser Glu Val Phe Tyr Glu Leu Ala His Gln Leu Pro Leu Pro His
35 40 45
Asn Val Ser Ser His Leu Asp Lys Ala Ser Val Met Arg Leu Thr Ile
50 55 60
Ser Tyr Leu Arg Val Arg Lys Leu Leu Asp Ala Gly Asp Leu Asp Ile
65 70 75 80
Glu Asp Asp Met Lys Ala Gln Met Asn Cys Phe Tyr Leu Lys Ala Leu
85 90 95
Asp Gly Phe Val Met Val Leu Thr Asp Asp Gly Asp Met Ile Tyr Ile
100 105 110
Ser Asp Asn Val Asn Lys Tyr Met Gly Leu Thr Gln Phe Glu Leu Thr
115 120 125
Gly His Ser Val Phe Asp Phe Thr His Pro Cys Asp His Glu Glu Met
130 135 140
Arg Glu Met Leu Thr His Arg Asn Gly Leu Val Lys Lys Gly Lys Glu
145 150 155 160
Gln Asn Thr Gln Arg Ser Phe Phe Leu Arg Met Lys Cys Thr Leu Thr
165 170 175
Ser Arg Gly Arg Thr Met Asn Ile Lys Ser Ala Thr Trp Lys Val Leu
180 185 190
His Cys Thr Gly His Ile His Val Tyr Asp Thr Asn Ser Asn Gln Pro
195 200 205
Gln Cys Gly Tyr Lys Lys Pro Pro Met Thr Cys Leu Val Leu Ile Cys
210 215 220
Glu Pro Ile Pro His Pro Ser Asn Ile Glu Ile Pro Leu Asp Ser Lys
225 230 235 240
Thr Phe Leu Ser Arg His Ser Leu Asp Met Lys Phe Ser Tyr Cys Asp
245 250 255
Glu Arg Ile Thr Glu Leu Met Gly Tyr Glu Pro Glu Glu Leu Leu Gly
260 265 270
Arg Ser Ile Tyr Glu Tyr Tyr His Ala Leu Asp Ser Asp His Leu Thr
275 280 285
Lys Thr His His Asp Met Phe Thr Lys Gly Gln Val Thr Thr Gly Gln
290 295 300
Tyr Arg Met Leu Ala Lys Arg Gly Gly Tyr Val Trp Val Glu Thr Gln
305 310 315 320
Ala Thr Val Ile Tyr Asn Thr Lys Asn Ser Gln Pro Gln Cys Ile Val
325 330 335
Cys Val Asn Tyr Val Val Ser Gly Ile Ile Gln His Asp Leu Ile Phe
340 345 350
Ser Leu Gln Gln Thr Glu Cys Val Leu Lys Pro Val Glu Ser Ser Asp
355 360 365
Met Lys Met Thr Gln Leu Phe Thr Lys Val Glu Ser Glu Asp Thr Ser
370 375 380
Ser Leu Phe Asp Lys Leu Lys Lys Glu Pro Asp Ala Leu Thr Leu Leu
385 390 395 400
Ala Pro Ala Ala Gly Asp Thr Ile Ile Ser Leu Asp Phe Gly Ser Asn
405 410 415
Asp Thr Glu Thr Asp Asp Gln Gln Leu Glu Glu Val Pro Leu Tyr Asn
420 425 430
Asp Val Met Leu Pro Ser Pro Asn Glu Lys Leu Gln Asn Ile Asn Leu
435 440 445
Ala Met Ser Pro Leu Pro Thr Ala Glu Thr Pro Lys Pro Leu Arg Ser
450 455 460
Ser Ala Asp Pro Ala Leu Asn Gln Glu Val Ala Leu Lys Leu Glu Pro
465 470 475 480
Asn Pro Glu Ser Leu Glu Leu Ser Phe Thr Met Pro Gln Ile Gln Asp
485 490 495
Gln Thr Pro Ser Pro Ser Asp Gly Ser Thr Arg Gln Ser Ser Pro Glu
500 505 510
Pro Asn Ser Pro Ser Glu Tyr Cys Phe Tyr Val Asp Ser Asp Met Val
515 520 525
Asn Glu Phe Lys Leu Glu Leu Val Glu Lys Leu Phe Ala Glu Asp Thr
530 535 540
Glu Ala Lys Asn Pro Phe Ser Thr Gln Asp Thr Asp Leu Asp Leu Glu
545 550 555 560
Met Leu Ala Pro Tyr Ile Pro Met Asp Asp Asp Phe Gln Leu Arg Ser
565 570 575
Phe Asp Gln Leu Ser Pro Leu Glu Ser Ser Ser Ala Ser Pro Glu Ser
580 585 590
Ala Ser Pro Gln Ser Thr Val Thr Val Phe Gln Gln Thr Gln Ile Gln
595 600 605
Glu Pro Thr Ala Asn Ala Thr Thr Thr Thr Ala Thr Thr Asp Glu Leu
610 615 620
Lys Thr Val Thr Lys Asp Arg Met Glu Asp Ile Lys Ile Leu Ile Ala
625 630 635 640
Ser Pro Ser Pro Thr His Ile His Lys Glu Thr Thr Ser Ala Thr Ser
645 650 655
Ser Pro Tyr Arg Asp Thr Gln Ser Arg Thr Ala Ser Pro Asn Arg Ala
660 665 670
Gly Lys Gly Val Ile Glu Gln Thr Glu Lys Ser His Pro Arg Ser Pro
675 680 685
Asn Val Leu Ser Val Ala Leu Ser Gln Arg Thr Thr Val Pro Glu Glu
690 695 700
Glu Leu Asn Pro Lys Ile Leu Ala Leu Gln Asn Ala Gln Arg Lys Arg
705 710 715 720
Lys Met Glu His Asp Gly Ser Leu Phe Gln Ala Val Gly Ile Gly Thr
725 730 735
Leu Leu Gln Gln Pro Asp Asp His Ala Ala Thr Thr Ser Leu Ser Trp
740 745 750
Lys Arg Val Lys Gly Cys Lys Ser Ser Glu Gln Asn Gly Met Glu Gln
755 760 765
Lys Thr Ile Ile Leu Ile Pro Ser Asp Leu Ala Cys Arg Leu Leu Gly
770 775 780
Gln Ser Met Asp Glu Ser Gly Leu Pro Gln Leu Thr Ser Tyr Asp Cys
785 790 795 800
Glu Val Asn Ala Pro Ile Gln Gly Ser Arg Asn Leu Leu Gln Gly Glu
805 810 815
Glu Leu Leu Arg Ala Leu Asp Gln Val Asn
820 825
<210> 36
<211> 449
<212> ПРТ
<213> Homo sapiens
<400> 36
Met Gly Arg Val Gly Gly Met Ala Gln Pro Met Gly Arg Ala Gly Ala
1 5 10 15
Pro Lys Pro Met Gly Arg Ala Gly Ser Ala Arg Arg Gly Arg Phe Lys
20 25 30
Gly Cys Trp Ser Glu Gly Ser Pro Val His Pro Val Pro Ala Val Leu
35 40 45
Ser Trp Leu Leu Ala Leu Leu Arg Cys Ala Ser Thr Met Leu Ser Leu
50 55 60
Arg Val Pro Leu Ala Pro Ile Thr Asp Pro Gln Gln Leu Gln Leu Ser
65 70 75 80
Pro Leu Lys Gly Leu Ser Leu Val Asp Lys Glu Asn Thr Pro Pro Ala
85 90 95
Leu Ser Gly Thr Arg Val Leu Ala Ser Lys Thr Ala Arg Arg Ile Phe
100 105 110
Gln Glu Pro Thr Glu Pro Lys Thr Lys Ala Ala Ala Pro Gly Val Glu
115 120 125
Asp Glu Pro Leu Leu Arg Glu Asn Pro Arg Arg Phe Val Ile Phe Pro
130 135 140
Ile Glu Tyr His Asp Ile Trp Gln Met Tyr Lys Lys Ala Glu Ala Ser
145 150 155 160
Phe Trp Thr Ala Glu Glu Val Asp Leu Ser Lys Asp Ile Gln His Trp
165 170 175
Glu Ser Leu Lys Pro Glu Glu Arg Tyr Phe Ile Ser His Val Leu Ala
180 185 190
Phe Phe Ala Ala Ser Asp Gly Ile Val Asn Glu Asn Leu Val Glu Arg
195 200 205
Phe Ser Gln Glu Val Gln Ile Thr Glu Ala Arg Cys Phe Tyr Gly Phe
210 215 220
Gln Ile Ala Met Glu Asn Ile His Ser Glu Met Tyr Ser Leu Leu Ile
225 230 235 240
Asp Thr Tyr Ile Lys Asp Pro Lys Glu Arg Glu Phe Leu Phe Asn Ala
245 250 255
Ile Glu Thr Met Pro Cys Val Lys Lys Lys Ala Asp Trp Ala Leu Arg
260 265 270
Trp Ile Gly Asp Lys Glu Ala Thr Tyr Gly Glu Arg Val Val Ala Phe
275 280 285
Ala Ala Val Glu Gly Ile Phe Phe Ser Gly Ser Phe Ala Ser Ile Phe
290 295 300
Trp Leu Lys Lys Arg Gly Leu Met Pro Gly Leu Thr Phe Ser Asn Glu
305 310 315 320
Leu Ile Ser Arg Asp Glu Gly Leu His Cys Asp Phe Ala Cys Leu Met
325 330 335
Phe Lys His Leu Val His Lys Pro Ser Glu Glu Arg Val Arg Glu Ile
340 345 350
Ile Ile Asn Ala Val Arg Ile Glu Gln Glu Phe Leu Thr Glu Ala Leu
355 360 365
Pro Val Lys Leu Ile Gly Met Asn Cys Thr Leu Met Lys Gln Tyr Ile
370 375 380
Glu Phe Val Ala Asp Arg Leu Met Leu Glu Leu Gly Phe Ser Lys Val
385 390 395 400
Phe Arg Val Glu Asn Pro Phe Asp Phe Met Glu Asn Ile Ser Leu Glu
405 410 415
Gly Lys Thr Asn Phe Phe Glu Lys Arg Val Gly Glu Tyr Gln Arg Met
420 425 430
Gly Val Met Ser Ser Pro Thr Glu Asn Ser Phe Thr Leu Asp Ala Asp
435 440 445
Phe
<210> 37
<211> 188
<212> ПРТ
<213> Homo sapiens
<400> 37
Met Thr Glu Tyr Lys Leu Val Val Val Gly Ala Gly Gly Val Gly Lys
1 5 10 15
Ser Ala Leu Thr Ile Gln Leu Ile Gln Asn His Phe Val Asp Glu Tyr
20 25 30
Asp Pro Thr Ile Glu Asp Ser Tyr Arg Lys Gln Val Val Ile Asp Gly
35 40 45
Glu Thr Cys Leu Leu Asp Ile Leu Asp Thr Ala Gly Gln Glu Glu Tyr
50 55 60
Ser Ala Met Arg Asp Gln Tyr Met Arg Thr Gly Glu Gly Phe Leu Cys
65 70 75 80
Val Phe Ala Ile Asn Asn Thr Lys Ser Phe Glu Asp Ile His His Tyr
85 90 95
Arg Glu Gln Ile Lys Arg Val Lys Asp Ser Glu Asp Val Pro Met Val
100 105 110
Leu Val Gly Asn Lys Cys Asp Leu Pro Ser Arg Thr Val Asp Thr Lys
115 120 125
Gln Ala Gln Asp Leu Ala Arg Ser Tyr Gly Ile Pro Phe Ile Glu Thr
130 135 140
Ser Ala Lys Thr Arg Gln Gly Val Asp Asp Ala Phe Tyr Thr Leu Val
145 150 155 160
Arg Glu Ile Arg Lys His Lys Glu Lys Met Ser Lys Asp Gly Lys Lys
165 170 175
Lys Lys Lys Lys Ser Lys Thr Lys Cys Val Ile Met
180 185
<210> 38
<211> 1210
<212> ПРТ
<213> Homo sapiens
<400> 38
Met Arg Pro Ser Gly Thr Ala Gly Ala Ala Leu Leu Ala Leu Leu Ala
1 5 10 15
Ala Leu Cys Pro Ala Ser Arg Ala Leu Glu Glu Lys Lys Val Cys Gln
20 25 30
Gly Thr Ser Asn Lys Leu Thr Gln Leu Gly Thr Phe Glu Asp His Phe
35 40 45
Leu Ser Leu Gln Arg Met Phe Asn Asn Cys Glu Val Val Leu Gly Asn
50 55 60
Leu Glu Ile Thr Tyr Val Gln Arg Asn Tyr Asp Leu Ser Phe Leu Lys
65 70 75 80
Thr Ile Gln Glu Val Ala Gly Tyr Val Leu Ile Ala Leu Asn Thr Val
85 90 95
Glu Arg Ile Pro Leu Glu Asn Leu Gln Ile Ile Arg Gly Asn Met Tyr
100 105 110
Tyr Glu Asn Ser Tyr Ala Leu Ala Val Leu Ser Asn Tyr Asp Ala Asn
115 120 125
Lys Thr Gly Leu Lys Glu Leu Pro Met Arg Asn Leu Gln Glu Ile Leu
130 135 140
His Gly Ala Val Arg Phe Ser Asn Asn Pro Ala Leu Cys Asn Val Glu
145 150 155 160
Ser Ile Gln Trp Arg Asp Ile Val Ser Ser Asp Phe Leu Ser Asn Met
165 170 175
Ser Met Asp Phe Gln Asn His Leu Gly Ser Cys Gln Lys Cys Asp Pro
180 185 190
Ser Cys Pro Asn Gly Ser Cys Trp Gly Ala Gly Glu Glu Asn Cys Gln
195 200 205
Lys Leu Thr Lys Ile Ile Cys Ala Gln Gln Cys Ser Gly Arg Cys Arg
210 215 220
Gly Lys Ser Pro Ser Asp Cys Cys His Asn Gln Cys Ala Ala Gly Cys
225 230 235 240
Thr Gly Pro Arg Glu Ser Asp Cys Leu Val Cys Arg Lys Phe Arg Asp
245 250 255
Glu Ala Thr Cys Lys Asp Thr Cys Pro Pro Leu Met Leu Tyr Asn Pro
260 265 270
Thr Thr Tyr Gln Met Asp Val Asn Pro Glu Gly Lys Tyr Ser Phe Gly
275 280 285
Ala Thr Cys Val Lys Lys Cys Pro Arg Asn Tyr Val Val Thr Asp His
290 295 300
Gly Ser Cys Val Arg Ala Cys Gly Ala Asp Ser Tyr Glu Met Glu Glu
305 310 315 320
Asp Gly Val Arg Lys Cys Lys Lys Cys Glu Gly Pro Cys Arg Lys Val
325 330 335
Cys Asn Gly Ile Gly Ile Gly Glu Phe Lys Asp Ser Leu Ser Ile Asn
340 345 350
Ala Thr Asn Ile Lys His Phe Lys Asn Cys Thr Ser Ile Ser Gly Asp
355 360 365
Leu His Ile Leu Pro Val Ala Phe Arg Gly Asp Ser Phe Thr His Thr
370 375 380
Pro Pro Leu Asp Pro Gln Glu Leu Asp Ile Leu Lys Thr Val Lys Glu
385 390 395 400
Ile Thr Gly Phe Leu Leu Ile Gln Ala Trp Pro Glu Asn Arg Thr Asp
405 410 415
Leu His Ala Phe Glu Asn Leu Glu Ile Ile Arg Gly Arg Thr Lys Gln
420 425 430
His Gly Gln Phe Ser Leu Ala Val Val Ser Leu Asn Ile Thr Ser Leu
435 440 445
Gly Leu Arg Ser Leu Lys Glu Ile Ser Asp Gly Asp Val Ile Ile Ser
450 455 460
Gly Asn Lys Asn Leu Cys Tyr Ala Asn Thr Ile Asn Trp Lys Lys Leu
465 470 475 480
Phe Gly Thr Ser Gly Gln Lys Thr Lys Ile Ile Ser Asn Arg Gly Glu
485 490 495
Asn Ser Cys Lys Ala Thr Gly Gln Val Cys His Ala Leu Cys Ser Pro
500 505 510
Glu Gly Cys Trp Gly Pro Glu Pro Arg Asp Cys Val Ser Cys Arg Asn
515 520 525
Val Ser Arg Gly Arg Glu Cys Val Asp Lys Cys Asn Leu Leu Glu Gly
530 535 540
Glu Pro Arg Glu Phe Val Glu Asn Ser Glu Cys Ile Gln Cys His Pro
545 550 555 560
Glu Cys Leu Pro Gln Ala Met Asn Ile Thr Cys Thr Gly Arg Gly Pro
565 570 575
Asp Asn Cys Ile Gln Cys Ala His Tyr Ile Asp Gly Pro His Cys Val
580 585 590
Lys Thr Cys Pro Ala Gly Val Met Gly Glu Asn Asn Thr Leu Val Trp
595 600 605
Lys Tyr Ala Asp Ala Gly His Val Cys His Leu Cys His Pro Asn Cys
610 615 620
Thr Tyr Gly Cys Thr Gly Pro Gly Leu Glu Gly Cys Pro Thr Asn Gly
625 630 635 640
Pro Lys Ile Pro Ser Ile Ala Thr Gly Met Val Gly Ala Leu Leu Leu
645 650 655
Leu Leu Val Val Ala Leu Gly Ile Gly Leu Phe Met Arg Arg Arg His
660 665 670
Ile Val Arg Lys Arg Thr Leu Arg Arg Leu Leu Gln Glu Arg Glu Leu
675 680 685
Val Glu Pro Leu Thr Pro Ser Gly Glu Ala Pro Asn Gln Ala Leu Leu
690 695 700
Arg Ile Leu Lys Glu Thr Glu Phe Lys Lys Ile Lys Val Leu Gly Ser
705 710 715 720
Gly Ala Phe Gly Thr Val Tyr Lys Gly Leu Trp Ile Pro Glu Gly Glu
725 730 735
Lys Val Lys Ile Pro Val Ala Ile Lys Glu Leu Arg Glu Ala Thr Ser
740 745 750
Pro Lys Ala Asn Lys Glu Ile Leu Asp Glu Ala Tyr Val Met Ala Ser
755 760 765
Val Asp Asn Pro His Val Cys Arg Leu Leu Gly Ile Cys Leu Thr Ser
770 775 780
Thr Val Gln Leu Ile Thr Gln Leu Met Pro Phe Gly Cys Leu Leu Asp
785 790 795 800
Tyr Val Arg Glu His Lys Asp Asn Ile Gly Ser Gln Tyr Leu Leu Asn
805 810 815
Trp Cys Val Gln Ile Ala Lys Gly Met Asn Tyr Leu Glu Asp Arg Arg
820 825 830
Leu Val His Arg Asp Leu Ala Ala Arg Asn Val Leu Val Lys Thr Pro
835 840 845
Gln His Val Lys Ile Thr Asp Phe Gly Leu Ala Lys Leu Leu Gly Ala
850 855 860
Glu Glu Lys Glu Tyr His Ala Glu Gly Gly Lys Val Pro Ile Lys Trp
865 870 875 880
Met Ala Leu Glu Ser Ile Leu His Arg Ile Tyr Thr His Gln Ser Asp
885 890 895
Val Trp Ser Tyr Gly Val Thr Val Trp Glu Leu Met Thr Phe Gly Ser
900 905 910
Lys Pro Tyr Asp Gly Ile Pro Ala Ser Glu Ile Ser Ser Ile Leu Glu
915 920 925
Lys Gly Glu Arg Leu Pro Gln Pro Pro Ile Cys Thr Ile Asp Val Tyr
930 935 940
Met Ile Met Val Lys Cys Trp Met Ile Asp Ala Asp Ser Arg Pro Lys
945 950 955 960
Phe Arg Glu Leu Ile Ile Glu Phe Ser Lys Met Ala Arg Asp Pro Gln
965 970 975
Arg Tyr Leu Val Ile Gln Gly Asp Glu Arg Met His Leu Pro Ser Pro
980 985 990
Thr Asp Ser Asn Phe Tyr Arg Ala Leu Met Asp Glu Glu Asp Met Asp
995 1000 1005
Asp Val Val Asp Ala Asp Glu Tyr Leu Ile Pro Gln Gln Gly Phe
1010 1015 1020
Phe Ser Ser Pro Ser Thr Ser Arg Thr Pro Leu Leu Ser Ser Leu
1025 1030 1035
Ser Ala Thr Ser Asn Asn Ser Thr Val Ala Cys Ile Asp Arg Asn
1040 1045 1050
Gly Leu Gln Ser Cys Pro Ile Lys Glu Asp Ser Phe Leu Gln Arg
1055 1060 1065
Tyr Ser Ser Asp Pro Thr Gly Ala Leu Thr Glu Asp Ser Ile Asp
1070 1075 1080
Asp Thr Phe Leu Pro Val Pro Glu Tyr Ile Asn Gln Ser Val Pro
1085 1090 1095
Lys Arg Pro Ala Gly Ser Val Gln Asn Pro Val Tyr His Asn Gln
1100 1105 1110
Pro Leu Asn Pro Ala Pro Ser Arg Asp Pro His Tyr Gln Asp Pro
1115 1120 1125
His Ser Thr Ala Val Gly Asn Pro Glu Tyr Leu Asn Thr Val Gln
1130 1135 1140
Pro Thr Cys Val Asn Ser Thr Phe Asp Ser Pro Ala His Trp Ala
1145 1150 1155
Gln Lys Gly Ser His Gln Ile Ser Leu Asp Asn Pro Asp Tyr Gln
1160 1165 1170
Gln Asp Phe Phe Pro Lys Glu Ala Lys Pro Asn Gly Ile Phe Lys
1175 1180 1185
Gly Ser Thr Ala Glu Asn Ala Glu Tyr Leu Arg Val Ala Pro Gln
1190 1195 1200
Ser Ser Glu Phe Ile Gly Ala
1205 1210
<210> 39
<211> 454
<212> ПРТ
<213> Homo sapiens
<400> 39
Met Asp Phe Phe Arg Val Val Glu Asn Gln Gln Pro Pro Ala Thr Met
1 5 10 15
Pro Leu Asn Val Ser Phe Thr Asn Arg Asn Tyr Asp Leu Asp Tyr Asp
20 25 30
Ser Val Gln Pro Tyr Phe Tyr Cys Asp Glu Glu Glu Asn Phe Tyr Gln
35 40 45
Gln Gln Gln Gln Ser Glu Leu Gln Pro Pro Ala Pro Ser Glu Asp Ile
50 55 60
Trp Lys Lys Phe Glu Leu Leu Pro Thr Pro Pro Leu Ser Pro Ser Arg
65 70 75 80
Arg Ser Gly Leu Cys Ser Pro Ser Tyr Val Ala Val Thr Pro Phe Ser
85 90 95
Leu Arg Gly Asp Asn Asp Gly Gly Gly Gly Ser Phe Ser Thr Ala Asp
100 105 110
Gln Leu Glu Met Val Thr Glu Leu Leu Gly Gly Asp Met Val Asn Gln
115 120 125
Ser Phe Ile Cys Asp Pro Asp Asp Glu Thr Phe Ile Lys Asn Ile Ile
130 135 140
Ile Gln Asp Cys Met Trp Ser Gly Phe Ser Ala Ala Ala Lys Leu Val
145 150 155 160
Ser Glu Lys Leu Ala Ser Tyr Gln Ala Ala Arg Lys Asp Ser Gly Ser
165 170 175
Pro Asn Pro Ala Arg Gly His Ser Val Cys Ser Thr Ser Ser Leu Tyr
180 185 190
Leu Gln Asp Leu Ser Ala Ala Ala Ser Glu Cys Ile Asp Pro Ser Val
195 200 205
Val Phe Pro Tyr Pro Leu Asn Asp Ser Ser Ser Pro Lys Ser Cys Ala
210 215 220
Ser Gln Asp Ser Ser Ala Phe Ser Pro Ser Ser Asp Ser Leu Leu Ser
225 230 235 240
Ser Thr Glu Ser Ser Pro Gln Gly Ser Pro Glu Pro Leu Val Leu His
245 250 255
Glu Glu Thr Pro Pro Thr Thr Ser Ser Asp Ser Glu Glu Glu Gln Glu
260 265 270
Asp Glu Glu Glu Ile Asp Val Val Ser Val Glu Lys Arg Gln Ala Pro
275 280 285
Gly Lys Arg Ser Glu Ser Gly Ser Pro Ser Ala Gly Gly His Ser Lys
290 295 300
Pro Pro His Ser Pro Leu Val Leu Lys Arg Cys His Val Ser Thr His
305 310 315 320
Gln His Asn Tyr Ala Ala Pro Pro Ser Thr Arg Lys Asp Tyr Pro Ala
325 330 335
Ala Lys Arg Val Lys Leu Asp Ser Val Arg Val Leu Arg Gln Ile Ser
340 345 350
Asn Asn Arg Lys Cys Thr Ser Pro Arg Ser Ser Asp Thr Glu Glu Asn
355 360 365
Val Lys Arg Arg Thr His Asn Val Leu Glu Arg Gln Arg Arg Asn Glu
370 375 380
Leu Lys Arg Ser Phe Phe Ala Leu Arg Asp Gln Ile Pro Glu Leu Glu
385 390 395 400
Asn Asn Glu Lys Ala Pro Lys Val Val Ile Leu Lys Lys Ala Thr Ala
405 410 415
Tyr Ile Leu Ser Val Gln Ala Glu Glu Gln Lys Leu Ile Ser Glu Glu
420 425 430
Asp Leu Leu Arg Lys Arg Arg Glu Gln Leu Lys His Lys Leu Glu Gln
435 440 445
Leu Arg Asn Ser Cys Ala
450
<210> 40
<211> 889
<212> ПРТ
<213> Homo sapiens
<400> 40
Met Glu Glu Gly Ala Pro Arg Gln Pro Gly Pro Ser Gln Trp Pro Pro
1 5 10 15
Glu Asp Glu Lys Glu Val Ile Arg Arg Ala Ile Gln Lys Glu Leu Lys
20 25 30
Ile Lys Glu Gly Val Glu Asn Leu Arg Arg Val Ala Thr Asp Arg Arg
35 40 45
His Leu Gly His Val Gln Gln Leu Leu Arg Ser Ser Asn Arg Arg Leu
50 55 60
Glu Gln Leu His Gly Glu Leu Arg Glu Leu His Ala Arg Ile Leu Leu
65 70 75 80
Pro Gly Pro Gly Pro Gly Pro Ala Glu Pro Val Ala Ser Gly Pro Arg
85 90 95
Pro Trp Ala Glu Gln Leu Arg Ala Arg His Leu Glu Ala Leu Arg Arg
100 105 110
Gln Leu His Val Glu Leu Lys Val Lys Gln Gly Ala Glu Asn Met Thr
115 120 125
His Thr Cys Ala Ser Gly Thr Pro Lys Glu Arg Lys Leu Leu Ala Ala
130 135 140
Ala Gln Gln Met Leu Arg Asp Ser Gln Leu Lys Val Ala Leu Leu Arg
145 150 155 160
Met Lys Ile Ser Ser Leu Glu Ala Ser Gly Ser Pro Glu Pro Gly Pro
165 170 175
Glu Leu Leu Ala Glu Glu Leu Gln His Arg Leu His Val Glu Ala Ala
180 185 190
Val Ala Glu Gly Ala Lys Asn Val Val Lys Leu Leu Ser Ser Arg Arg
195 200 205
Thr Gln Asp Arg Lys Ala Leu Ala Glu Ala Gln Ala Gln Leu Gln Glu
210 215 220
Ser Ser Gln Lys Leu Asp Leu Leu Arg Leu Ala Leu Glu Gln Leu Leu
225 230 235 240
Glu Gln Leu Pro Pro Ala His Pro Leu Arg Ser Arg Val Thr Arg Glu
245 250 255
Leu Arg Ala Ala Val Pro Gly Tyr Pro Gln Pro Ser Gly Thr Pro Val
260 265 270
Lys Pro Thr Ala Leu Thr Gly Thr Leu Gln Val Arg Leu Leu Gly Cys
275 280 285
Glu Gln Leu Leu Thr Ala Val Pro Gly Arg Ser Pro Ala Ala Ala Leu
290 295 300
Ala Ser Ser Pro Ser Glu Gly Trp Leu Arg Thr Lys Ala Lys His Gln
305 310 315 320
Arg Gly Arg Gly Glu Leu Ala Ser Glu Val Leu Ala Val Leu Lys Val
325 330 335
Asp Asn Arg Val Val Gly Gln Thr Gly Trp Gly Gln Val Ala Glu Gln
340 345 350
Ser Trp Asp Gln Thr Phe Val Ile Pro Leu Glu Arg Ala Arg Glu Leu
355 360 365
Glu Ile Gly Val His Trp Arg Asp Trp Arg Gln Leu Cys Gly Val Ala
370 375 380
Phe Leu Arg Leu Glu Asp Phe Leu Asp Asn Ala Cys His Gln Leu Ser
385 390 395 400
Leu Ser Leu Val Pro Gln Gly Leu Leu Phe Ala Gln Val Thr Phe Cys
405 410 415
Asp Pro Val Ile Glu Arg Arg Pro Arg Leu Gln Arg Gln Glu Arg Ile
420 425 430
Phe Ser Lys Arg Arg Gly Gln Asp Phe Leu Arg Ala Ser Gln Met Asn
435 440 445
Leu Gly Met Ala Ala Trp Gly Arg Leu Val Met Asn Leu Leu Pro Pro
450 455 460
Cys Ser Ser Pro Ser Thr Ile Ser Pro Pro Lys Gly Cys Pro Arg Thr
465 470 475 480
Pro Thr Thr Leu Arg Glu Ala Ser Asp Pro Ala Thr Pro Ser Asn Phe
485 490 495
Leu Pro Lys Lys Thr Pro Leu Gly Glu Glu Met Thr Pro Pro Pro Lys
500 505 510
Pro Pro Arg Leu Tyr Leu Pro Gln Glu Pro Thr Ser Glu Glu Thr Pro
515 520 525
Arg Thr Lys Arg Pro His Met Glu Pro Arg Thr Arg Arg Gly Pro Ser
530 535 540
Pro Pro Ala Ser Pro Thr Arg Lys Pro Pro Arg Leu Gln Asp Phe Arg
545 550 555 560
Cys Leu Ala Val Leu Gly Arg Gly His Phe Gly Lys Val Leu Leu Val
565 570 575
Gln Phe Lys Gly Thr Gly Lys Tyr Tyr Ala Ile Lys Ala Leu Lys Lys
580 585 590
Gln Glu Val Leu Ser Arg Asp Glu Ile Glu Ser Leu Tyr Cys Glu Lys
595 600 605
Arg Ile Leu Glu Ala Val Gly Cys Thr Gly His Pro Phe Leu Leu Ser
610 615 620
Leu Leu Ala Cys Phe Gln Thr Ser Ser His Ala Cys Phe Val Thr Glu
625 630 635 640
Phe Val Pro Gly Gly Asp Leu Met Met Gln Ile His Glu Asp Val Phe
645 650 655
Pro Glu Pro Gln Ala Arg Phe Tyr Val Ala Cys Val Val Leu Gly Leu
660 665 670
Gln Phe Leu His Glu Lys Lys Ile Ile Tyr Arg Asp Leu Lys Leu Asp
675 680 685
Asn Leu Leu Leu Asp Ala Gln Gly Phe Leu Lys Ile Ala Asp Phe Gly
690 695 700
Leu Cys Lys Glu Gly Ile Gly Phe Gly Asp Arg Thr Ser Thr Phe Cys
705 710 715 720
Gly Thr Pro Glu Phe Leu Ala Pro Glu Val Leu Thr Gln Glu Ala Tyr
725 730 735
Thr Arg Ala Val Asp Trp Trp Gly Leu Gly Val Leu Leu Tyr Glu Met
740 745 750
Leu Val Gly Glu Cys Pro Phe Pro Gly Asp Thr Glu Glu Glu Val Phe
755 760 765
Asp Cys Ile Val Asn Met Asp Ala Pro Tyr Pro Gly Phe Leu Ser Val
770 775 780
Gln Gly Leu Glu Phe Ile Gln Lys Leu Leu Gln Lys Cys Pro Glu Lys
785 790 795 800
Arg Leu Gly Ala Gly Glu Gln Asp Ala Glu Glu Ile Lys Val Gln Pro
805 810 815
Phe Phe Arg Thr Thr Asn Trp Gln Ala Leu Leu Ala Arg Thr Ile Gln
820 825 830
Pro Pro Phe Val Pro Thr Leu Cys Gly Pro Ala Asp Leu Arg Tyr Phe
835 840 845
Glu Gly Glu Phe Thr Gly Leu Pro Pro Ala Leu Thr Pro Pro Ala Pro
850 855 860
His Ser Leu Leu Thr Ala Arg Gln Gln Ala Ala Phe Arg Asp Phe Asp
865 870 875 880
Phe Val Ser Glu Arg Phe Leu Glu Pro
885
<210> 41
<211> 1056
<212> ПРТ
<213> Homo sapiens
<400> 41
Met Ala Ser Gln Pro Asn Ser Ser Ala Lys Lys Lys Glu Glu Lys Gly
1 5 10 15
Lys Asn Ile Gln Val Val Val Arg Cys Arg Pro Phe Asn Leu Ala Glu
20 25 30
Arg Lys Ala Ser Ala His Ser Ile Val Glu Cys Asp Pro Val Arg Lys
35 40 45
Glu Val Ser Val Arg Thr Gly Gly Leu Ala Asp Lys Ser Ser Arg Lys
50 55 60
Thr Tyr Thr Phe Asp Met Val Phe Gly Ala Ser Thr Lys Gln Ile Asp
65 70 75 80
Val Tyr Arg Ser Val Val Cys Pro Ile Leu Asp Glu Val Ile Met Gly
85 90 95
Tyr Asn Cys Thr Ile Phe Ala Tyr Gly Gln Thr Gly Thr Gly Lys Thr
100 105 110
Phe Thr Met Glu Gly Glu Arg Ser Pro Asn Glu Glu Tyr Thr Trp Glu
115 120 125
Glu Asp Pro Leu Ala Gly Ile Ile Pro Arg Thr Leu His Gln Ile Phe
130 135 140
Glu Lys Leu Thr Asp Asn Gly Thr Glu Phe Ser Val Lys Val Ser Leu
145 150 155 160
Leu Glu Ile Tyr Asn Glu Glu Leu Phe Asp Leu Leu Asn Pro Ser Ser
165 170 175
Asp Val Ser Glu Arg Leu Gln Met Phe Asp Asp Pro Arg Asn Lys Arg
180 185 190
Gly Val Ile Ile Lys Gly Leu Glu Glu Ile Thr Val His Asn Lys Asp
195 200 205
Glu Val Tyr Gln Ile Leu Glu Lys Gly Ala Ala Lys Arg Thr Thr Ala
210 215 220
Ala Thr Leu Met Asn Ala Tyr Ser Ser Arg Ser His Ser Val Phe Ser
225 230 235 240
Val Thr Ile His Met Lys Glu Thr Thr Ile Asp Gly Glu Glu Leu Val
245 250 255
Lys Ile Gly Lys Leu Asn Leu Val Asp Leu Ala Gly Ser Glu Asn Ile
260 265 270
Gly Arg Ser Gly Ala Val Asp Lys Arg Ala Arg Glu Ala Gly Asn Ile
275 280 285
Asn Gln Ser Leu Leu Thr Leu Gly Arg Val Ile Thr Ala Leu Val Glu
290 295 300
Arg Thr Pro His Val Pro Tyr Arg Glu Ser Lys Leu Thr Arg Ile Leu
305 310 315 320
Gln Asp Ser Leu Gly Gly Arg Thr Arg Thr Ser Ile Ile Ala Thr Ile
325 330 335
Ser Pro Ala Ser Leu Asn Leu Glu Glu Thr Leu Ser Thr Leu Glu Tyr
340 345 350
Ala His Arg Ala Lys Asn Ile Leu Asn Lys Pro Glu Val Asn Gln Lys
355 360 365
Leu Thr Lys Lys Ala Leu Ile Lys Glu Tyr Thr Glu Glu Ile Glu Arg
370 375 380
Leu Lys Arg Asp Leu Ala Ala Ala Arg Glu Lys Asn Gly Val Tyr Ile
385 390 395 400
Ser Glu Glu Asn Phe Arg Val Met Ser Gly Lys Leu Thr Val Gln Glu
405 410 415
Glu Gln Ile Val Glu Leu Ile Glu Lys Ile Gly Ala Val Glu Glu Glu
420 425 430
Leu Asn Arg Val Thr Glu Leu Phe Met Asp Asn Lys Asn Glu Leu Asp
435 440 445
Gln Cys Lys Ser Asp Leu Gln Asn Lys Thr Gln Glu Leu Glu Thr Thr
450 455 460
Gln Lys His Leu Gln Glu Thr Lys Leu Gln Leu Val Lys Glu Glu Tyr
465 470 475 480
Ile Thr Ser Ala Leu Glu Ser Thr Glu Glu Lys Leu His Asp Ala Ala
485 490 495
Ser Lys Leu Leu Asn Thr Val Glu Glu Thr Thr Lys Asp Val Ser Gly
500 505 510
Leu His Ser Lys Leu Asp Arg Lys Lys Ala Val Asp Gln His Asn Ala
515 520 525
Glu Ala Gln Asp Ile Phe Gly Lys Asn Leu Asn Ser Leu Phe Asn Asn
530 535 540
Met Glu Glu Leu Ile Lys Asp Gly Ser Ser Lys Gln Lys Ala Met Leu
545 550 555 560
Glu Val His Lys Thr Leu Phe Gly Asn Leu Leu Ser Ser Ser Val Ser
565 570 575
Ala Leu Asp Thr Ile Thr Thr Val Ala Leu Gly Ser Leu Thr Ser Ile
580 585 590
Pro Glu Asn Val Ser Thr His Val Ser Gln Ile Phe Asn Met Ile Leu
595 600 605
Lys Glu Gln Ser Leu Ala Ala Glu Ser Lys Thr Val Leu Gln Glu Leu
610 615 620
Ile Asn Val Leu Lys Thr Asp Leu Leu Ser Ser Leu Glu Met Ile Leu
625 630 635 640
Ser Pro Thr Val Val Ser Ile Leu Lys Ile Asn Ser Gln Leu Lys His
645 650 655
Ile Phe Lys Thr Ser Leu Thr Val Ala Asp Lys Ile Glu Asp Gln Lys
660 665 670
Lys Glu Leu Asp Gly Phe Leu Ser Ile Leu Cys Asn Asn Leu His Glu
675 680 685
Leu Gln Glu Asn Thr Ile Cys Ser Leu Val Glu Ser Gln Lys Gln Cys
690 695 700
Gly Asn Leu Thr Glu Asp Leu Lys Thr Ile Lys Gln Thr His Ser Gln
705 710 715 720
Glu Leu Cys Lys Leu Met Asn Leu Trp Thr Glu Arg Phe Cys Ala Leu
725 730 735
Glu Glu Lys Cys Glu Asn Ile Gln Lys Pro Leu Ser Ser Val Gln Glu
740 745 750
Asn Ile Gln Gln Lys Ser Lys Asp Ile Val Asn Lys Met Thr Phe His
755 760 765
Ser Gln Lys Phe Cys Ala Asp Ser Asp Gly Phe Ser Gln Glu Leu Arg
770 775 780
Asn Phe Asn Gln Glu Gly Thr Lys Leu Val Glu Glu Ser Val Lys His
785 790 795 800
Ser Asp Lys Leu Asn Gly Asn Leu Glu Lys Ile Ser Gln Glu Thr Glu
805 810 815
Gln Arg Cys Glu Ser Leu Asn Thr Arg Thr Val Tyr Phe Ser Glu Gln
820 825 830
Trp Val Ser Ser Leu Asn Glu Arg Glu Gln Glu Leu His Asn Leu Leu
835 840 845
Glu Val Val Ser Gln Cys Cys Glu Ala Ser Ser Ser Asp Ile Thr Glu
850 855 860
Lys Ser Asp Gly Arg Lys Ala Ala His Glu Lys Gln His Asn Ile Phe
865 870 875 880
Leu Asp Gln Met Thr Ile Asp Glu Asp Lys Leu Ile Ala Gln Asn Leu
885 890 895
Glu Leu Asn Glu Thr Ile Lys Ile Gly Leu Thr Lys Leu Asn Cys Phe
900 905 910
Leu Glu Gln Asp Leu Lys Leu Asp Ile Pro Thr Gly Thr Thr Pro Gln
915 920 925
Arg Lys Ser Tyr Leu Tyr Pro Ser Thr Leu Val Arg Thr Glu Pro Arg
930 935 940
Glu His Leu Leu Asp Gln Leu Lys Arg Lys Gln Pro Glu Leu Leu Met
945 950 955 960
Met Leu Asn Cys Ser Glu Asn Asn Lys Glu Glu Thr Ile Pro Asp Val
965 970 975
Asp Val Glu Glu Ala Val Leu Gly Gln Tyr Thr Glu Glu Pro Leu Ser
980 985 990
Gln Glu Pro Ser Val Asp Ala Gly Val Asp Cys Ser Ser Ile Gly Gly
995 1000 1005
Val Pro Phe Phe Gln His Lys Lys Ser His Gly Lys Asp Lys Glu
1010 1015 1020
Asn Arg Gly Ile Asn Thr Leu Glu Arg Ser Lys Val Glu Glu Thr
1025 1030 1035
Thr Glu His Leu Val Thr Lys Ser Arg Leu Pro Leu Arg Ala Gln
1040 1045 1050
Ile Asn Leu
1055
<210> 42
<211> 2825
<212> ПРТ
<213> Homo sapiens
<400> 42
Met Tyr Ala Ser Leu Gly Ser Gly Pro Val Ala Pro Leu Pro Ala Ser
1 5 10 15
Val Pro Pro Ser Val Leu Gly Ser Trp Ser Thr Gly Gly Ser Arg Ser
20 25 30
Cys Val Arg Gln Glu Thr Lys Ser Pro Gly Gly Ala Arg Thr Ser Gly
35 40 45
His Trp Ala Ser Val Trp Gln Glu Val Leu Lys Gln Leu Gln Gly Ser
50 55 60
Ile Glu Asp Glu Ala Met Ala Ser Ser Gly Gln Ile Asp Leu Leu Glu
65 70 75 80
Arg Leu Lys Glu Leu Asn Leu Asp Ser Ser Asn Phe Pro Gly Val Lys
85 90 95
Leu Arg Ser Lys Met Ser Leu Arg Ser Tyr Gly Ser Arg Glu Gly Ser
100 105 110
Val Ser Ser Arg Ser Gly Glu Cys Ser Pro Val Pro Met Gly Ser Phe
115 120 125
Pro Arg Arg Gly Phe Val Asn Gly Ser Arg Glu Ser Thr Gly Tyr Leu
130 135 140
Glu Glu Leu Glu Lys Glu Arg Ser Leu Leu Leu Ala Asp Leu Asp Lys
145 150 155 160
Glu Glu Lys Glu Lys Asp Trp Tyr Tyr Ala Gln Leu Gln Asn Leu Thr
165 170 175
Lys Arg Ile Asp Ser Leu Pro Leu Thr Glu Asn Phe Ser Leu Gln Thr
180 185 190
Asp Met Thr Arg Arg Gln Leu Glu Tyr Glu Ala Arg Gln Ile Arg Val
195 200 205
Ala Met Glu Glu Gln Leu Gly Thr Cys Gln Asp Met Glu Lys Arg Ala
210 215 220
Gln Arg Ser Ser Gln Asn Lys His Glu Thr Gly Ser His Asp Ala Glu
225 230 235 240
Arg Gln Asn Glu Gly Gln Gly Val Gly Glu Ile Asn Met Ala Thr Ser
245 250 255
Gly Asn Gly Gln Gly Ser Thr Thr Arg Met Asp His Glu Thr Ala Ser
260 265 270
Val Leu Ser Ser Ser Ser Thr His Ser Ala Pro Arg Arg Leu Thr Ser
275 280 285
His Leu Gly Thr Lys Val Glu Met Val Tyr Ser Leu Leu Ser Met Leu
290 295 300
Gly Thr His Asp Lys Asp Asp Met Ser Arg Thr Leu Leu Ala Met Ser
305 310 315 320
Ser Ser Gln Asp Ser Cys Ile Ser Met Arg Gln Ser Gly Cys Leu Pro
325 330 335
Leu Leu Ile Gln Leu Leu His Gly Asn Asp Lys Asp Ser Val Leu Leu
340 345 350
Gly Asn Ser Arg Gly Ser Lys Glu Ala Arg Ala Arg Ala Ser Ala Ala
355 360 365
Leu His Asn Ile Ile His Ser Gln Pro Asp Asp Lys Arg Gly Arg Arg
370 375 380
Glu Ile Arg Val Leu His Leu Leu Glu Gln Ile Arg Ala Tyr Cys Glu
385 390 395 400
Thr Cys Trp Glu Trp Gln Glu Ala His Glu Pro Gly Met Asp Gln Asp
405 410 415
Lys Asn Pro Met Pro Ala Pro Val Glu His Gln Ile Cys Pro Ala Val
420 425 430
Cys Val Leu Met Lys Leu Ser Phe Asp Glu Glu His Arg His Ala Met
435 440 445
Asn Glu Leu Gly Gly Leu Gln Ala Ile Ala Glu Leu Leu Gln Val Asp
450 455 460
Cys Glu Met Tyr Gly Leu Thr Asn Asp His Tyr Ser Ile Thr Leu Arg
465 470 475 480
Arg Tyr Ala Gly Met Ala Leu Thr Asn Leu Thr Phe Gly Asp Val Ala
485 490 495
Asn Lys Ala Thr Leu Cys Ser Met Lys Gly Cys Met Arg Ala Leu Val
500 505 510
Ala Gln Leu Lys Ser Glu Ser Glu Asp Leu Gln Gln Val Ile Ala Ser
515 520 525
Val Leu Arg Asn Leu Ser Trp Arg Ala Asp Val Asn Ser Lys Lys Thr
530 535 540
Leu Arg Glu Val Gly Ser Val Lys Ala Leu Met Glu Cys Ala Leu Glu
545 550 555 560
Val Lys Lys Glu Ser Thr Leu Lys Ser Val Leu Ser Ala Leu Trp Asn
565 570 575
Leu Ser Ala His Cys Thr Glu Asn Lys Ala Asp Ile Cys Ala Val Asp
580 585 590
Gly Ala Leu Ala Phe Leu Val Gly Thr Leu Thr Tyr Arg Ser Gln Thr
595 600 605
Asn Thr Leu Ala Ile Ile Glu Ser Gly Gly Gly Ile Leu Arg Asn Val
610 615 620
Ser Ser Leu Ile Ala Thr Asn Glu Asp His Arg Gln Ile Leu Arg Glu
625 630 635 640
Asn Asn Cys Leu Gln Thr Leu Leu Gln His Leu Lys Ser His Ser Leu
645 650 655
Thr Ile Val Ser Asn Ala Cys Gly Thr Leu Trp Asn Leu Ser Ala Arg
660 665 670
Asn Pro Lys Asp Gln Glu Ala Leu Trp Asp Met Gly Ala Val Ser Met
675 680 685
Leu Lys Asn Leu Ile His Ser Lys His Lys Met Ile Ala Met Gly Ser
690 695 700
Ala Ala Ala Leu Arg Asn Leu Met Ala Asn Arg Pro Ala Lys Tyr Lys
705 710 715 720
Asp Ala Asn Ile Met Ser Pro Gly Ser Ser Leu Pro Ser Leu His Val
725 730 735
Arg Lys Gln Lys Ala Leu Glu Ala Glu Leu Asp Ala Gln His Leu Ser
740 745 750
Glu Thr Phe Asp Asn Ile Asp Asn Leu Ser Pro Lys Ala Ser His Arg
755 760 765
Ser Lys Gln Arg His Lys Gln Ser Leu Tyr Gly Asp Tyr Val Phe Asp
770 775 780
Thr Asn Arg His Asp Asp Asn Arg Ser Asp Asn Phe Asn Thr Gly Asn
785 790 795 800
Met Thr Val Leu Ser Pro Tyr Leu Asn Thr Thr Val Leu Pro Ser Ser
805 810 815
Ser Ser Ser Arg Gly Ser Leu Asp Ser Ser Arg Ser Glu Lys Asp Arg
820 825 830
Ser Leu Glu Arg Glu Arg Gly Ile Gly Leu Gly Asn Tyr His Pro Ala
835 840 845
Thr Glu Asn Pro Gly Thr Ser Ser Lys Arg Gly Leu Gln Ile Ser Thr
850 855 860
Thr Ala Ala Gln Ile Ala Lys Val Met Glu Glu Val Ser Ala Ile His
865 870 875 880
Thr Ser Gln Glu Asp Arg Ser Ser Gly Ser Thr Thr Glu Leu His Cys
885 890 895
Val Thr Asp Glu Arg Asn Ala Leu Arg Arg Ser Ser Ala Ala His Thr
900 905 910
His Ser Asn Thr Tyr Asn Phe Thr Lys Ser Glu Asn Ser Asn Arg Thr
915 920 925
Cys Ser Met Pro Tyr Ala Lys Leu Glu Tyr Lys Arg Ser Ser Asn Asp
930 935 940
Ser Leu Asn Ser Val Ser Ser Ser Asp Gly Tyr Gly Lys Arg Gly Gln
945 950 955 960
Met Lys Pro Ser Ile Glu Ser Tyr Ser Glu Asp Asp Glu Ser Lys Phe
965 970 975
Cys Ser Tyr Gly Gln Tyr Pro Ala Asp Leu Ala His Lys Ile His Ser
980 985 990
Ala Asn His Met Asp Asp Asn Asp Gly Glu Leu Asp Thr Pro Ile Asn
995 1000 1005
Tyr Ser Leu Lys Tyr Ser Asp Glu Gln Leu Asn Ser Gly Arg Gln
1010 1015 1020
Ser Pro Ser Gln Asn Glu Arg Trp Ala Arg Pro Lys His Ile Ile
1025 1030 1035
Glu Asp Glu Ile Lys Gln Ser Glu Gln Arg Gln Ser Arg Asn Gln
1040 1045 1050
Ser Thr Thr Tyr Pro Val Tyr Thr Glu Ser Thr Asp Asp Lys His
1055 1060 1065
Leu Lys Phe Gln Pro His Phe Gly Gln Gln Glu Cys Val Ser Pro
1070 1075 1080
Tyr Arg Ser Arg Gly Ala Asn Gly Ser Glu Thr Asn Arg Val Gly
1085 1090 1095
Ser Asn His Gly Ile Asn Gln Asn Val Ser Gln Ser Leu Cys Gln
1100 1105 1110
Glu Asp Asp Tyr Glu Asp Asp Lys Pro Thr Asn Tyr Ser Glu Arg
1115 1120 1125
Tyr Ser Glu Glu Glu Gln His Glu Glu Glu Glu Arg Pro Thr Asn
1130 1135 1140
Tyr Ser Ile Lys Tyr Asn Glu Glu Lys Arg His Val Asp Gln Pro
1145 1150 1155
Ile Asp Tyr Ser Leu Lys Tyr Ala Thr Asp Ile Pro Ser Ser Gln
1160 1165 1170
Lys Gln Ser Phe Ser Phe Ser Lys Ser Ser Ser Gly Gln Ser Ser
1175 1180 1185
Lys Thr Glu His Met Ser Ser Ser Ser Glu Asn Thr Ser Thr Pro
1190 1195 1200
Ser Ser Asn Ala Lys Arg Gln Asn Gln Leu His Pro Ser Ser Ala
1205 1210 1215
Gln Ser Arg Ser Gly Gln Pro Gln Lys Ala Ala Thr Cys Lys Val
1220 1225 1230
Ser Ser Ile Asn Gln Glu Thr Ile Gln Thr Tyr Cys Val Glu Asp
1235 1240 1245
Thr Pro Ile Cys Phe Ser Arg Cys Ser Ser Leu Ser Ser Leu Ser
1250 1255 1260
Ser Ala Glu Asp Glu Ile Gly Cys Asn Gln Thr Thr Gln Glu Ala
1265 1270 1275
Asp Ser Ala Asn Thr Leu Gln Ile Ala Glu Ile Lys Glu Lys Ile
1280 1285 1290
Gly Thr Arg Ser Ala Glu Asp Pro Val Ser Glu Val Pro Ala Val
1295 1300 1305
Ser Gln His Pro Arg Thr Lys Ser Ser Arg Leu Gln Gly Ser Ser
1310 1315 1320
Leu Ser Ser Glu Ser Ala Arg His Lys Ala Val Glu Phe Ser Ser
1325 1330 1335
Gly Ala Lys Ser Pro Ser Lys Ser Gly Ala Gln Thr Pro Lys Ser
1340 1345 1350
Pro Pro Glu His Tyr Val Gln Glu Thr Pro Leu Met Phe Ser Arg
1355 1360 1365
Cys Thr Ser Val Ser Ser Leu Asp Ser Phe Glu Ser Arg Ser Ile
1370 1375 1380
Ala Ser Ser Val Gln Ser Glu Pro Cys Ser Gly Met Val Ser Gly
1385 1390 1395
Ile Ile Ser Pro Ser Asp Leu Pro Asp Ser Pro Gly Gln Thr Met
1400 1405 1410
Pro Pro Ser Arg Ser Lys Thr Pro Pro Pro Pro Pro Gln Thr Ala
1415 1420 1425
Gln Thr Lys Arg Glu Val Pro Lys Asn Lys Ala Pro Thr Ala Glu
1430 1435 1440
Lys Arg Glu Ser Gly Pro Lys Gln Ala Ala Val Asn Ala Ala Val
1445 1450 1455
Gln Arg Val Gln Val Leu Pro Asp Ala Asp Thr Leu Leu His Phe
1460 1465 1470
Ala Thr Glu Ser Thr Pro Asp Gly Phe Ser Cys Ser Ser Ser Leu
1475 1480 1485
Ser Ala Leu Ser Leu Asp Glu Pro Phe Ile Gln Lys Asp Val Glu
1490 1495 1500
Leu Arg Ile Met Pro Pro Val Gln Glu Asn Asp Asn Gly Asn Glu
1505 1510 1515
Thr Glu Ser Glu Gln Pro Lys Glu Ser Asn Glu Asn Gln Glu Lys
1520 1525 1530
Glu Ala Glu Lys Thr Ile Asp Ser Glu Lys Asp Leu Leu Asp Asp
1535 1540 1545
Ser Asp Asp Asp Asp Ile Glu Ile Leu Glu Glu Cys Ile Ile Ser
1550 1555 1560
Ala Met Pro Thr Lys Ser Ser Arg Lys Ala Lys Lys Pro Ala Gln
1565 1570 1575
Thr Ala Ser Lys Leu Pro Pro Pro Val Ala Arg Lys Pro Ser Gln
1580 1585 1590
Leu Pro Val Tyr Lys Leu Leu Pro Ser Gln Asn Arg Leu Gln Pro
1595 1600 1605
Gln Lys His Val Ser Phe Thr Pro Gly Asp Asp Met Pro Arg Val
1610 1615 1620
Tyr Cys Val Glu Gly Thr Pro Ile Asn Phe Ser Thr Ala Thr Ser
1625 1630 1635
Leu Ser Asp Leu Thr Ile Glu Ser Pro Pro Asn Glu Leu Ala Ala
1640 1645 1650
Gly Glu Gly Val Arg Gly Gly Ala Gln Ser Gly Glu Phe Glu Lys
1655 1660 1665
Arg Asp Thr Ile Pro Thr Glu Gly Arg Ser Thr Asp Glu Ala Gln
1670 1675 1680
Gly Gly Lys Thr Ser Ser Val Thr Ile Pro Glu Leu Asp Asp Asn
1685 1690 1695
Lys Ala Glu Glu Gly Asp Ile Leu Ala Glu Cys Ile Asn Ser Ala
1700 1705 1710
Met Pro Lys Gly Lys Ser His Lys Pro Phe Arg Val Lys Lys Ile
1715 1720 1725
Met Asp Gln Val Gln Gln Ala Ser Ala Ser Ser Ser Ala Pro Asn
1730 1735 1740
Lys Asn Gln Leu Asp Gly Lys Lys Lys Lys Pro Thr Ser Pro Val
1745 1750 1755
Lys Pro Ile Pro Gln Asn Thr Glu Tyr Arg Thr Arg Val Arg Lys
1760 1765 1770
Asn Ala Asp Ser Lys Asn Asn Leu Asn Ala Glu Arg Val Phe Ser
1775 1780 1785
Asp Asn Lys Asp Ser Lys Lys Gln Asn Leu Lys Asn Asn Ser Lys
1790 1795 1800
Val Phe Asn Asp Lys Leu Pro Asn Asn Glu Asp Arg Val Arg Gly
1805 1810 1815
Ser Phe Ala Phe Asp Ser Pro His His Tyr Thr Pro Ile Glu Gly
1820 1825 1830
Thr Pro Tyr Cys Phe Ser Arg Asn Asp Ser Leu Ser Ser Leu Asp
1835 1840 1845
Phe Asp Asp Asp Asp Val Asp Leu Ser Arg Glu Lys Ala Glu Leu
1850 1855 1860
Arg Lys Ala Lys Glu Asn Lys Glu Ser Glu Ala Lys Val Thr Ser
1865 1870 1875
His Thr Glu Leu Thr Ser Asn Gln Gln Ser Ala Asn Lys Thr Gln
1880 1885 1890
Ala Ile Ala Lys Gln Pro Ile Asn Arg Gly Gln Pro Lys Pro Ile
1895 1900 1905
Leu Gln Lys Gln Ser Thr Phe Pro Gln Ser Ser Lys Asp Ile Pro
1910 1915 1920
Asp Arg Gly Ala Ala Thr Asp Glu Lys Leu Gln Asn Phe Ala Ile
1925 1930 1935
Glu Asn Thr Pro Val Cys Phe Ser His Asn Ser Ser Leu Ser Ser
1940 1945 1950
Leu Ser Asp Ile Asp Gln Glu Asn Asn Asn Lys Glu Asn Glu Pro
1955 1960 1965
Ile Lys Glu Thr Glu Pro Pro Asp Ser Gln Gly Glu Pro Ser Lys
1970 1975 1980
Pro Gln Ala Ser Gly Tyr Ala Pro Lys Ser Phe His Val Glu Asp
1985 1990 1995
Thr Pro Val Cys Phe Ser Arg Asn Ser Ser Leu Ser Ser Leu Ser
2000 2005 2010
Ile Asp Ser Glu Asp Asp Leu Leu Gln Glu Cys Ile Ser Ser Ala
2015 2020 2025
Met Pro Lys Lys Lys Lys Pro Ser Arg Leu Lys Gly Asp Asn Glu
2030 2035 2040
Lys His Ser Pro Arg Asn Met Gly Gly Ile Leu Gly Glu Asp Leu
2045 2050 2055
Thr Leu Asp Leu Lys Asp Ile Gln Arg Pro Asp Ser Glu His Gly
2060 2065 2070
Leu Ser Pro Asp Ser Glu Asn Phe Asp Trp Lys Ala Ile Gln Glu
2075 2080 2085
Gly Ala Asn Ser Ile Val Ser Ser Leu His Gln Ala Ala Ala Ala
2090 2095 2100
Ala Cys Leu Ser Arg Gln Ala Ser Ser Asp Ser Asp Ser Ile Leu
2105 2110 2115
Ser Leu Lys Ser Gly Ile Ser Leu Gly Ser Pro Phe His Leu Thr
2120 2125 2130
Pro Asp Gln Glu Glu Lys Pro Phe Thr Ser Asn Lys Gly Pro Arg
2135 2140 2145
Ile Leu Lys Pro Gly Glu Lys Ser Thr Leu Glu Thr Lys Lys Ile
2150 2155 2160
Glu Ser Glu Ser Lys Gly Ile Lys Gly Gly Lys Lys Val Tyr Lys
2165 2170 2175
Ser Leu Ile Thr Gly Lys Val Arg Ser Asn Ser Glu Ile Ser Gly
2180 2185 2190
Gln Met Lys Gln Pro Leu Gln Ala Asn Met Pro Ser Ile Ser Arg
2195 2200 2205
Gly Arg Thr Met Ile His Ile Pro Gly Val Arg Asn Ser Ser Ser
2210 2215 2220
Ser Thr Ser Pro Val Ser Lys Lys Gly Pro Pro Leu Lys Thr Pro
2225 2230 2235
Ala Ser Lys Ser Pro Ser Glu Gly Gln Thr Ala Thr Thr Ser Pro
2240 2245 2250
Arg Gly Ala Lys Pro Ser Val Lys Ser Glu Leu Ser Pro Val Ala
2255 2260 2265
Arg Gln Thr Ser Gln Ile Gly Gly Ser Ser Lys Ala Pro Ser Arg
2270 2275 2280
Ser Gly Ser Arg Asp Ser Thr Pro Ser Arg Pro Ala Gln Gln Pro
2285 2290 2295
Leu Ser Arg Pro Ile Gln Ser Pro Gly Arg Asn Ser Ile Ser Pro
2300 2305 2310
Gly Arg Asn Gly Ile Ser Pro Pro Asn Lys Leu Ser Gln Leu Pro
2315 2320 2325
Arg Thr Ser Ser Pro Ser Thr Ala Ser Thr Lys Ser Ser Gly Ser
2330 2335 2340
Gly Lys Met Ser Tyr Thr Ser Pro Gly Arg Gln Met Ser Gln Gln
2345 2350 2355
Asn Leu Thr Lys Gln Thr Gly Leu Ser Lys Asn Ala Ser Ser Ile
2360 2365 2370
Pro Arg Ser Glu Ser Ala Ser Lys Gly Leu Asn Gln Met Asn Asn
2375 2380 2385
Gly Asn Gly Ala Asn Lys Lys Val Glu Leu Ser Arg Met Ser Ser
2390 2395 2400
Thr Lys Ser Ser Gly Ser Glu Ser Asp Arg Ser Glu Arg Pro Val
2405 2410 2415
Leu Val Arg Gln Ser Thr Phe Ile Lys Glu Ala Pro Ser Pro Thr
2420 2425 2430
Leu Arg Arg Lys Leu Glu Glu Ser Ala Ser Phe Glu Ser Leu Ser
2435 2440 2445
Pro Ser Ser Arg Pro Ala Ser Pro Thr Arg Ser Gln Ala Gln Thr
2450 2455 2460
Pro Val Leu Ser Pro Ser Leu Pro Asp Met Ser Leu Ser Thr His
2465 2470 2475
Ser Ser Val Gln Ala Gly Gly Trp Arg Lys Leu Pro Pro Asn Leu
2480 2485 2490
Ser Pro Thr Ile Glu Tyr Asn Asp Gly Arg Pro Ala Lys Arg His
2495 2500 2505
Asp Ile Ala Arg Ser His Ser Glu Ser Pro Ser Arg Leu Pro Ile
2510 2515 2520
Asn Arg Ser Gly Thr Trp Lys Arg Glu His Ser Lys His Ser Ser
2525 2530 2535
Ser Leu Pro Arg Val Ser Thr Trp Arg Arg Thr Gly Ser Ser Ser
2540 2545 2550
Ser Ile Leu Ser Ala Ser Ser Glu Ser Ser Glu Lys Ala Lys Ser
2555 2560 2565
Glu Asp Glu Lys His Val Asn Ser Ile Ser Gly Thr Lys Gln Ser
2570 2575 2580
Lys Glu Asn Gln Val Ser Ala Lys Gly Thr Trp Arg Lys Ile Lys
2585 2590 2595
Glu Asn Glu Phe Ser Pro Thr Asn Ser Thr Ser Gln Thr Val Ser
2600 2605 2610
Ser Gly Ala Thr Asn Gly Ala Glu Ser Lys Thr Leu Ile Tyr Gln
2615 2620 2625
Met Ala Pro Ala Val Ser Lys Thr Glu Asp Val Trp Val Arg Ile
2630 2635 2640
Glu Asp Cys Pro Ile Asn Asn Pro Arg Ser Gly Arg Ser Pro Thr
2645 2650 2655
Gly Asn Thr Pro Pro Val Ile Asp Ser Val Ser Glu Lys Ala Asn
2660 2665 2670
Pro Asn Ile Lys Asp Ser Lys Asp Asn Gln Ala Lys Gln Asn Val
2675 2680 2685
Gly Asn Gly Ser Val Pro Met Arg Thr Val Gly Leu Glu Asn Arg
2690 2695 2700
Leu Asn Ser Phe Ile Gln Val Asp Ala Pro Asp Gln Lys Gly Thr
2705 2710 2715
Glu Ile Lys Pro Gly Gln Asn Asn Pro Val Pro Val Ser Glu Thr
2720 2725 2730
Asn Glu Ser Ser Ile Val Glu Arg Thr Pro Phe Ser Ser Ser Ser
2735 2740 2745
Ser Ser Lys His Ser Ser Pro Ser Gly Thr Val Ala Ala Arg Val
2750 2755 2760
Thr Pro Phe Asn Tyr Asn Pro Ser Pro Arg Lys Ser Ser Ala Asp
2765 2770 2775
Ser Thr Ser Ala Arg Pro Ser Gln Ile Pro Thr Pro Val Asn Asn
2780 2785 2790
Asn Thr Lys Lys Arg Asp Ser Lys Thr Asp Ser Thr Glu Ser Ser
2795 2800 2805
Gly Thr Gln Ser Pro Lys Arg His Ser Gly Ser Tyr Leu Val Thr
2810 2815 2820
Ser Val
2825
<210> 43
<211> 1863
<212> ПРТ
<213> Homo sapiens
<400> 43
Met Asp Leu Ser Ala Leu Arg Val Glu Glu Val Gln Asn Val Ile Asn
1 5 10 15
Ala Met Gln Lys Ile Leu Glu Cys Pro Ile Cys Leu Glu Leu Ile Lys
20 25 30
Glu Pro Val Ser Thr Lys Cys Asp His Ile Phe Cys Lys Phe Cys Met
35 40 45
Leu Lys Leu Leu Asn Gln Lys Lys Gly Pro Ser Gln Cys Pro Leu Cys
50 55 60
Lys Asn Asp Ile Thr Lys Arg Ser Leu Gln Glu Ser Thr Arg Phe Ser
65 70 75 80
Gln Leu Val Glu Glu Leu Leu Lys Ile Ile Cys Ala Phe Gln Leu Asp
85 90 95
Thr Gly Leu Glu Tyr Ala Asn Ser Tyr Asn Phe Ala Lys Lys Glu Asn
100 105 110
Asn Ser Pro Glu His Leu Lys Asp Glu Val Ser Ile Ile Gln Ser Met
115 120 125
Gly Tyr Arg Asn Arg Ala Lys Arg Leu Leu Gln Ser Glu Pro Glu Asn
130 135 140
Pro Ser Leu Gln Glu Thr Ser Leu Ser Val Gln Leu Ser Asn Leu Gly
145 150 155 160
Thr Val Arg Thr Leu Arg Thr Lys Gln Arg Ile Gln Pro Gln Lys Thr
165 170 175
Ser Val Tyr Ile Glu Leu Gly Ser Asp Ser Ser Glu Asp Thr Val Asn
180 185 190
Lys Ala Thr Tyr Cys Ser Val Gly Asp Gln Glu Leu Leu Gln Ile Thr
195 200 205
Pro Gln Gly Thr Arg Asp Glu Ile Ser Leu Asp Ser Ala Lys Lys Ala
210 215 220
Ala Cys Glu Phe Ser Glu Thr Asp Val Thr Asn Thr Glu His His Gln
225 230 235 240
Pro Ser Asn Asn Asp Leu Asn Thr Thr Glu Lys Arg Ala Ala Glu Arg
245 250 255
His Pro Glu Lys Tyr Gln Gly Ser Ser Val Ser Asn Leu His Val Glu
260 265 270
Pro Cys Gly Thr Asn Thr His Ala Ser Ser Leu Gln His Glu Asn Ser
275 280 285
Ser Leu Leu Leu Thr Lys Asp Arg Met Asn Val Glu Lys Ala Glu Phe
290 295 300
Cys Asn Lys Ser Lys Gln Pro Gly Leu Ala Arg Ser Gln His Asn Arg
305 310 315 320
Trp Ala Gly Ser Lys Glu Thr Cys Asn Asp Arg Arg Thr Pro Ser Thr
325 330 335
Glu Lys Lys Val Asp Leu Asn Ala Asp Pro Leu Cys Glu Arg Lys Glu
340 345 350
Trp Asn Lys Gln Lys Leu Pro Cys Ser Glu Asn Pro Arg Asp Thr Glu
355 360 365
Asp Val Pro Trp Ile Thr Leu Asn Ser Ser Ile Gln Lys Val Asn Glu
370 375 380
Trp Phe Ser Arg Ser Asp Glu Leu Leu Gly Ser Asp Asp Ser His Asp
385 390 395 400
Gly Glu Ser Glu Ser Asn Ala Lys Val Ala Asp Val Leu Asp Val Leu
405 410 415
Asn Glu Val Asp Glu Tyr Ser Gly Ser Ser Glu Lys Ile Asp Leu Leu
420 425 430
Ala Ser Asp Pro His Glu Ala Leu Ile Cys Lys Ser Glu Arg Val His
435 440 445
Ser Lys Ser Val Glu Ser Asn Ile Glu Asp Lys Ile Phe Gly Lys Thr
450 455 460
Tyr Arg Lys Lys Ala Ser Leu Pro Asn Leu Ser His Val Thr Glu Asn
465 470 475 480
Leu Ile Ile Gly Ala Phe Val Thr Glu Pro Gln Ile Ile Gln Glu Arg
485 490 495
Pro Leu Thr Asn Lys Leu Lys Arg Lys Arg Arg Pro Thr Ser Gly Leu
500 505 510
His Pro Glu Asp Phe Ile Lys Lys Ala Asp Leu Ala Val Gln Lys Thr
515 520 525
Pro Glu Met Ile Asn Gln Gly Thr Asn Gln Thr Glu Gln Asn Gly Gln
530 535 540
Val Met Asn Ile Thr Asn Ser Gly His Glu Asn Lys Thr Lys Gly Asp
545 550 555 560
Ser Ile Gln Asn Glu Lys Asn Pro Asn Pro Ile Glu Ser Leu Glu Lys
565 570 575
Glu Ser Ala Phe Lys Thr Lys Ala Glu Pro Ile Ser Ser Ser Ile Ser
580 585 590
Asn Met Glu Leu Glu Leu Asn Ile His Asn Ser Lys Ala Pro Lys Lys
595 600 605
Asn Arg Leu Arg Arg Lys Ser Ser Thr Arg His Ile His Ala Leu Glu
610 615 620
Leu Val Val Ser Arg Asn Leu Ser Pro Pro Asn Cys Thr Glu Leu Gln
625 630 635 640
Ile Asp Ser Cys Ser Ser Ser Glu Glu Ile Lys Lys Lys Lys Tyr Asn
645 650 655
Gln Met Pro Val Arg His Ser Arg Asn Leu Gln Leu Met Glu Gly Lys
660 665 670
Glu Pro Ala Thr Gly Ala Lys Lys Ser Asn Lys Pro Asn Glu Gln Thr
675 680 685
Ser Lys Arg His Asp Ser Asp Thr Phe Pro Glu Leu Lys Leu Thr Asn
690 695 700
Ala Pro Gly Ser Phe Thr Lys Cys Ser Asn Thr Ser Glu Leu Lys Glu
705 710 715 720
Phe Val Asn Pro Ser Leu Pro Arg Glu Glu Lys Glu Glu Lys Leu Glu
725 730 735
Thr Val Lys Val Ser Asn Asn Ala Glu Asp Pro Lys Asp Leu Met Leu
740 745 750
Ser Gly Glu Arg Val Leu Gln Thr Glu Arg Ser Val Glu Ser Ser Ser
755 760 765
Ile Ser Leu Val Pro Gly Thr Asp Tyr Gly Thr Gln Glu Ser Ile Ser
770 775 780
Leu Leu Glu Val Ser Thr Leu Gly Lys Ala Lys Thr Glu Pro Asn Lys
785 790 795 800
Cys Val Ser Gln Cys Ala Ala Phe Glu Asn Pro Lys Gly Leu Ile His
805 810 815
Gly Cys Ser Lys Asp Asn Arg Asn Asp Thr Glu Gly Phe Lys Tyr Pro
820 825 830
Leu Gly His Glu Val Asn His Ser Arg Glu Thr Ser Ile Glu Met Glu
835 840 845
Glu Ser Glu Leu Asp Ala Gln Tyr Leu Gln Asn Thr Phe Lys Val Ser
850 855 860
Lys Arg Gln Ser Phe Ala Pro Phe Ser Asn Pro Gly Asn Ala Glu Glu
865 870 875 880
Glu Cys Ala Thr Phe Ser Ala His Ser Gly Ser Leu Lys Lys Gln Ser
885 890 895
Pro Lys Val Thr Phe Glu Cys Glu Gln Lys Glu Glu Asn Gln Gly Lys
900 905 910
Asn Glu Ser Asn Ile Lys Pro Val Gln Thr Val Asn Ile Thr Ala Gly
915 920 925
Phe Pro Val Val Gly Gln Lys Asp Lys Pro Val Asp Asn Ala Lys Cys
930 935 940
Ser Ile Lys Gly Gly Ser Arg Phe Cys Leu Ser Ser Gln Phe Arg Gly
945 950 955 960
Asn Glu Thr Gly Leu Ile Thr Pro Asn Lys His Gly Leu Leu Gln Asn
965 970 975
Pro Tyr Arg Ile Pro Pro Leu Phe Pro Ile Lys Ser Phe Val Lys Thr
980 985 990
Lys Cys Lys Lys Asn Leu Leu Glu Glu Asn Phe Glu Glu His Ser Met
995 1000 1005
Ser Pro Glu Arg Glu Met Gly Asn Glu Asn Ile Pro Ser Thr Val
1010 1015 1020
Ser Thr Ile Ser Arg Asn Asn Ile Arg Glu Asn Val Phe Lys Glu
1025 1030 1035
Ala Ser Ser Ser Asn Ile Asn Glu Val Gly Ser Ser Thr Asn Glu
1040 1045 1050
Val Gly Ser Ser Ile Asn Glu Ile Gly Ser Ser Asp Glu Asn Ile
1055 1060 1065
Gln Ala Glu Leu Gly Arg Asn Arg Gly Pro Lys Leu Asn Ala Met
1070 1075 1080
Leu Arg Leu Gly Val Leu Gln Pro Glu Val Tyr Lys Gln Ser Leu
1085 1090 1095
Pro Gly Ser Asn Cys Lys His Pro Glu Ile Lys Lys Gln Glu Tyr
1100 1105 1110
Glu Glu Val Val Gln Thr Val Asn Thr Asp Phe Ser Pro Tyr Leu
1115 1120 1125
Ile Ser Asp Asn Leu Glu Gln Pro Met Gly Ser Ser His Ala Ser
1130 1135 1140
Gln Val Cys Ser Glu Thr Pro Asp Asp Leu Leu Asp Asp Gly Glu
1145 1150 1155
Ile Lys Glu Asp Thr Ser Phe Ala Glu Asn Asp Ile Lys Glu Ser
1160 1165 1170
Ser Ala Val Phe Ser Lys Ser Val Gln Lys Gly Glu Leu Ser Arg
1175 1180 1185
Ser Pro Ser Pro Phe Thr His Thr His Leu Ala Gln Gly Tyr Arg
1190 1195 1200
Arg Gly Ala Lys Lys Leu Glu Ser Ser Glu Glu Asn Leu Ser Ser
1205 1210 1215
Glu Asp Glu Glu Leu Pro Cys Phe Gln His Leu Leu Phe Gly Lys
1220 1225 1230
Val Asn Asn Ile Pro Ser Gln Ser Thr Arg His Ser Thr Val Ala
1235 1240 1245
Thr Glu Cys Leu Ser Lys Asn Thr Glu Glu Asn Leu Leu Ser Leu
1250 1255 1260
Lys Asn Ser Leu Asn Asp Cys Ser Asn Gln Val Ile Leu Ala Lys
1265 1270 1275
Ala Ser Gln Glu His His Leu Ser Glu Glu Thr Lys Cys Ser Ala
1280 1285 1290
Ser Leu Phe Ser Ser Gln Cys Ser Glu Leu Glu Asp Leu Thr Ala
1295 1300 1305
Asn Thr Asn Thr Gln Asp Pro Phe Leu Ile Gly Ser Ser Lys Gln
1310 1315 1320
Met Arg His Gln Ser Glu Ser Gln Gly Val Gly Leu Ser Asp Lys
1325 1330 1335
Glu Leu Val Ser Asp Asp Glu Glu Arg Gly Thr Gly Leu Glu Glu
1340 1345 1350
Asn Asn Gln Glu Glu Gln Ser Met Asp Ser Asn Leu Gly Glu Ala
1355 1360 1365
Ala Ser Gly Cys Glu Ser Glu Thr Ser Val Ser Glu Asp Cys Ser
1370 1375 1380
Gly Leu Ser Ser Gln Ser Asp Ile Leu Thr Thr Gln Gln Arg Asp
1385 1390 1395
Thr Met Gln His Asn Leu Ile Lys Leu Gln Gln Glu Met Ala Glu
1400 1405 1410
Leu Glu Ala Val Leu Glu Gln His Gly Ser Gln Pro Ser Asn Ser
1415 1420 1425
Tyr Pro Ser Ile Ile Ser Asp Ser Ser Ala Leu Glu Asp Leu Arg
1430 1435 1440
Asn Pro Glu Gln Ser Thr Ser Glu Lys Ala Val Leu Thr Ser Gln
1445 1450 1455
Lys Ser Ser Glu Tyr Pro Ile Ser Gln Asn Pro Glu Gly Leu Ser
1460 1465 1470
Ala Asp Lys Phe Glu Val Ser Ala Asp Ser Ser Thr Ser Lys Asn
1475 1480 1485
Lys Glu Pro Gly Val Glu Arg Ser Ser Pro Ser Lys Cys Pro Ser
1490 1495 1500
Leu Asp Asp Arg Trp Tyr Met His Ser Cys Ser Gly Ser Leu Gln
1505 1510 1515
Asn Arg Asn Tyr Pro Ser Gln Glu Glu Leu Ile Lys Val Val Asp
1520 1525 1530
Val Glu Glu Gln Gln Leu Glu Glu Ser Gly Pro His Asp Leu Thr
1535 1540 1545
Glu Thr Ser Tyr Leu Pro Arg Gln Asp Leu Glu Gly Thr Pro Tyr
1550 1555 1560
Leu Glu Ser Gly Ile Ser Leu Phe Ser Asp Asp Pro Glu Ser Asp
1565 1570 1575
Pro Ser Glu Asp Arg Ala Pro Glu Ser Ala Arg Val Gly Asn Ile
1580 1585 1590
Pro Ser Ser Thr Ser Ala Leu Lys Val Pro Gln Leu Lys Val Ala
1595 1600 1605
Glu Ser Ala Gln Ser Pro Ala Ala Ala His Thr Thr Asp Thr Ala
1610 1615 1620
Gly Tyr Asn Ala Met Glu Glu Ser Val Ser Arg Glu Lys Pro Glu
1625 1630 1635
Leu Thr Ala Ser Thr Glu Arg Val Asn Lys Arg Met Ser Met Val
1640 1645 1650
Val Ser Gly Leu Thr Pro Glu Glu Phe Met Leu Val Tyr Lys Phe
1655 1660 1665
Ala Arg Lys His His Ile Thr Leu Thr Asn Leu Ile Thr Glu Glu
1670 1675 1680
Thr Thr His Val Val Met Lys Thr Asp Ala Glu Phe Val Cys Glu
1685 1690 1695
Arg Thr Leu Lys Tyr Phe Leu Gly Ile Ala Gly Gly Lys Trp Val
1700 1705 1710
Val Ser Tyr Phe Trp Val Thr Gln Ser Ile Lys Glu Arg Lys Met
1715 1720 1725
Leu Asn Glu His Asp Phe Glu Val Arg Gly Asp Val Val Asn Gly
1730 1735 1740
Arg Asn His Gln Gly Pro Lys Arg Ala Arg Glu Ser Gln Asp Arg
1745 1750 1755
Lys Ile Phe Arg Gly Leu Glu Ile Cys Cys Tyr Gly Pro Phe Thr
1760 1765 1770
Asn Met Pro Thr Asp Gln Leu Glu Trp Met Val Gln Leu Cys Gly
1775 1780 1785
Ala Ser Val Val Lys Glu Leu Ser Ser Phe Thr Leu Gly Thr Gly
1790 1795 1800
Val His Pro Ile Val Val Val Gln Pro Asp Ala Trp Thr Glu Asp
1805 1810 1815
Asn Gly Phe His Ala Ile Gly Gln Met Cys Glu Ala Pro Val Val
1820 1825 1830
Thr Arg Glu Trp Val Leu Asp Ser Val Ala Leu Tyr Gln Cys Gln
1835 1840 1845
Glu Leu Asp Thr Tyr Leu Ile Pro Gln Ile Pro His Ser His Tyr
1850 1855 1860
<210> 44
<211> 3418
<212> ПРТ
<213> Homo sapiens
<400> 44
Met Pro Ile Gly Ser Lys Glu Arg Pro Thr Phe Phe Glu Ile Phe Lys
1 5 10 15
Thr Arg Cys Asn Lys Ala Asp Leu Gly Pro Ile Ser Leu Asn Trp Phe
20 25 30
Glu Glu Leu Ser Ser Glu Ala Pro Pro Tyr Asn Ser Glu Pro Ala Glu
35 40 45
Glu Ser Glu His Lys Asn Asn Asn Tyr Glu Pro Asn Leu Phe Lys Thr
50 55 60
Pro Gln Arg Lys Pro Ser Tyr Asn Gln Leu Ala Ser Thr Pro Ile Ile
65 70 75 80
Phe Lys Glu Gln Gly Leu Thr Leu Pro Leu Tyr Gln Ser Pro Val Lys
85 90 95
Glu Leu Asp Lys Phe Lys Leu Asp Leu Gly Arg Asn Val Pro Asn Ser
100 105 110
Arg His Lys Ser Leu Arg Thr Val Lys Thr Lys Met Asp Gln Ala Asp
115 120 125
Asp Val Ser Cys Pro Leu Leu Asn Ser Cys Leu Ser Glu Ser Pro Val
130 135 140
Val Leu Gln Cys Thr His Val Thr Pro Gln Arg Asp Lys Ser Val Val
145 150 155 160
Cys Gly Ser Leu Phe His Thr Pro Lys Phe Val Lys Gly Arg Gln Thr
165 170 175
Pro Lys His Ile Ser Glu Ser Leu Gly Ala Glu Val Asp Pro Asp Met
180 185 190
Ser Trp Ser Ser Ser Leu Ala Thr Pro Pro Thr Leu Ser Ser Thr Val
195 200 205
Leu Ile Val Arg Asn Glu Glu Ala Ser Glu Thr Val Phe Pro His Asp
210 215 220
Thr Thr Ala Asn Val Lys Ser Tyr Phe Ser Asn His Asp Glu Ser Leu
225 230 235 240
Lys Lys Asn Asp Arg Phe Ile Ala Ser Val Thr Asp Ser Glu Asn Thr
245 250 255
Asn Gln Arg Glu Ala Ala Ser His Gly Phe Gly Lys Thr Ser Gly Asn
260 265 270
Ser Phe Lys Val Asn Ser Cys Lys Asp His Ile Gly Lys Ser Met Pro
275 280 285
Asn Val Leu Glu Asp Glu Val Tyr Glu Thr Val Val Asp Thr Ser Glu
290 295 300
Glu Asp Ser Phe Ser Leu Cys Phe Ser Lys Cys Arg Thr Lys Asn Leu
305 310 315 320
Gln Lys Val Arg Thr Ser Lys Thr Arg Lys Lys Ile Phe His Glu Ala
325 330 335
Asn Ala Asp Glu Cys Glu Lys Ser Lys Asn Gln Val Lys Glu Lys Tyr
340 345 350
Ser Phe Val Ser Glu Val Glu Pro Asn Asp Thr Asp Pro Leu Asp Ser
355 360 365
Asn Val Ala Asn Gln Lys Pro Phe Glu Ser Gly Ser Asp Lys Ile Ser
370 375 380
Lys Glu Val Val Pro Ser Leu Ala Cys Glu Trp Ser Gln Leu Thr Leu
385 390 395 400
Ser Gly Leu Asn Gly Ala Gln Met Glu Lys Ile Pro Leu Leu His Ile
405 410 415
Ser Ser Cys Asp Gln Asn Ile Ser Glu Lys Asp Leu Leu Asp Thr Glu
420 425 430
Asn Lys Arg Lys Lys Asp Phe Leu Thr Ser Glu Asn Ser Leu Pro Arg
435 440 445
Ile Ser Ser Leu Pro Lys Ser Glu Lys Pro Leu Asn Glu Glu Thr Val
450 455 460
Val Asn Lys Arg Asp Glu Glu Gln His Leu Glu Ser His Thr Asp Cys
465 470 475 480
Ile Leu Ala Val Lys Gln Ala Ile Ser Gly Thr Ser Pro Val Ala Ser
485 490 495
Ser Phe Gln Gly Ile Lys Lys Ser Ile Phe Arg Ile Arg Glu Ser Pro
500 505 510
Lys Glu Thr Phe Asn Ala Ser Phe Ser Gly His Met Thr Asp Pro Asn
515 520 525
Phe Lys Lys Glu Thr Glu Ala Ser Glu Ser Gly Leu Glu Ile His Thr
530 535 540
Val Cys Ser Gln Lys Glu Asp Ser Leu Cys Pro Asn Leu Ile Asp Asn
545 550 555 560
Gly Ser Trp Pro Ala Thr Thr Thr Gln Asn Ser Val Ala Leu Lys Asn
565 570 575
Ala Gly Leu Ile Ser Thr Leu Lys Lys Lys Thr Asn Lys Phe Ile Tyr
580 585 590
Ala Ile His Asp Glu Thr Ser Tyr Lys Gly Lys Lys Ile Pro Lys Asp
595 600 605
Gln Lys Ser Glu Leu Ile Asn Cys Ser Ala Gln Phe Glu Ala Asn Ala
610 615 620
Phe Glu Ala Pro Leu Thr Phe Ala Asn Ala Asp Ser Gly Leu Leu His
625 630 635 640
Ser Ser Val Lys Arg Ser Cys Ser Gln Asn Asp Ser Glu Glu Pro Thr
645 650 655
Leu Ser Leu Thr Ser Ser Phe Gly Thr Ile Leu Arg Lys Cys Ser Arg
660 665 670
Asn Glu Thr Cys Ser Asn Asn Thr Val Ile Ser Gln Asp Leu Asp Tyr
675 680 685
Lys Glu Ala Lys Cys Asn Lys Glu Lys Leu Gln Leu Phe Ile Thr Pro
690 695 700
Glu Ala Asp Ser Leu Ser Cys Leu Gln Glu Gly Gln Cys Glu Asn Asp
705 710 715 720
Pro Lys Ser Lys Lys Val Ser Asp Ile Lys Glu Glu Val Leu Ala Ala
725 730 735
Ala Cys His Pro Val Gln His Ser Lys Val Glu Tyr Ser Asp Thr Asp
740 745 750
Phe Gln Ser Gln Lys Ser Leu Leu Tyr Asp His Glu Asn Ala Ser Thr
755 760 765
Leu Ile Leu Thr Pro Thr Ser Lys Asp Val Leu Ser Asn Leu Val Met
770 775 780
Ile Ser Arg Gly Lys Glu Ser Tyr Lys Met Ser Asp Lys Leu Lys Gly
785 790 795 800
Asn Asn Tyr Glu Ser Asp Val Glu Leu Thr Lys Asn Ile Pro Met Glu
805 810 815
Lys Asn Gln Asp Val Cys Ala Leu Asn Glu Asn Tyr Lys Asn Val Glu
820 825 830
Leu Leu Pro Pro Glu Lys Tyr Met Arg Val Ala Ser Pro Ser Arg Lys
835 840 845
Val Gln Phe Asn Gln Asn Thr Asn Leu Arg Val Ile Gln Lys Asn Gln
850 855 860
Glu Glu Thr Thr Ser Ile Ser Lys Ile Thr Val Asn Pro Asp Ser Glu
865 870 875 880
Glu Leu Phe Ser Asp Asn Glu Asn Asn Phe Val Phe Gln Val Ala Asn
885 890 895
Glu Arg Asn Asn Leu Ala Leu Gly Asn Thr Lys Glu Leu His Glu Thr
900 905 910
Asp Leu Thr Cys Val Asn Glu Pro Ile Phe Lys Asn Ser Thr Met Val
915 920 925
Leu Tyr Gly Asp Thr Gly Asp Lys Gln Ala Thr Gln Val Ser Ile Lys
930 935 940
Lys Asp Leu Val Tyr Val Leu Ala Glu Glu Asn Lys Asn Ser Val Lys
945 950 955 960
Gln His Ile Lys Met Thr Leu Gly Gln Asp Leu Lys Ser Asp Ile Ser
965 970 975
Leu Asn Ile Asp Lys Ile Pro Glu Lys Asn Asn Asp Tyr Met Asn Lys
980 985 990
Trp Ala Gly Leu Leu Gly Pro Ile Ser Asn His Ser Phe Gly Gly Ser
995 1000 1005
Phe Arg Thr Ala Ser Asn Lys Glu Ile Lys Leu Ser Glu His Asn
1010 1015 1020
Ile Lys Lys Ser Lys Met Phe Phe Lys Asp Ile Glu Glu Gln Tyr
1025 1030 1035
Pro Thr Ser Leu Ala Cys Val Glu Ile Val Asn Thr Leu Ala Leu
1040 1045 1050
Asp Asn Gln Lys Lys Leu Ser Lys Pro Gln Ser Ile Asn Thr Val
1055 1060 1065
Ser Ala His Leu Gln Ser Ser Val Val Val Ser Asp Cys Lys Asn
1070 1075 1080
Ser His Ile Thr Pro Gln Met Leu Phe Ser Lys Gln Asp Phe Asn
1085 1090 1095
Ser Asn His Asn Leu Thr Pro Ser Gln Lys Ala Glu Ile Thr Glu
1100 1105 1110
Leu Ser Thr Ile Leu Glu Glu Ser Gly Ser Gln Phe Glu Phe Thr
1115 1120 1125
Gln Phe Arg Lys Pro Ser Tyr Ile Leu Gln Lys Ser Thr Phe Glu
1130 1135 1140
Val Pro Glu Asn Gln Met Thr Ile Leu Lys Thr Thr Ser Glu Glu
1145 1150 1155
Cys Arg Asp Ala Asp Leu His Val Ile Met Asn Ala Pro Ser Ile
1160 1165 1170
Gly Gln Val Asp Ser Ser Lys Gln Phe Glu Gly Thr Val Glu Ile
1175 1180 1185
Lys Arg Lys Phe Ala Gly Leu Leu Lys Asn Asp Cys Asn Lys Ser
1190 1195 1200
Ala Ser Gly Tyr Leu Thr Asp Glu Asn Glu Val Gly Phe Arg Gly
1205 1210 1215
Phe Tyr Ser Ala His Gly Thr Lys Leu Asn Val Ser Thr Glu Ala
1220 1225 1230
Leu Gln Lys Ala Val Lys Leu Phe Ser Asp Ile Glu Asn Ile Ser
1235 1240 1245
Glu Glu Thr Ser Ala Glu Val His Pro Ile Ser Leu Ser Ser Ser
1250 1255 1260
Lys Cys His Asp Ser Val Val Ser Met Phe Lys Ile Glu Asn His
1265 1270 1275
Asn Asp Lys Thr Val Ser Glu Lys Asn Asn Lys Cys Gln Leu Ile
1280 1285 1290
Leu Gln Asn Asn Ile Glu Met Thr Thr Gly Thr Phe Val Glu Glu
1295 1300 1305
Ile Thr Glu Asn Tyr Lys Arg Asn Thr Glu Asn Glu Asp Asn Lys
1310 1315 1320
Tyr Thr Ala Ala Ser Arg Asn Ser His Asn Leu Glu Phe Asp Gly
1325 1330 1335
Ser Asp Ser Ser Lys Asn Asp Thr Val Cys Ile His Lys Asp Glu
1340 1345 1350
Thr Asp Leu Leu Phe Thr Asp Gln His Asn Ile Cys Leu Lys Leu
1355 1360 1365
Ser Gly Gln Phe Met Lys Glu Gly Asn Thr Gln Ile Lys Glu Asp
1370 1375 1380
Leu Ser Asp Leu Thr Phe Leu Glu Val Ala Lys Ala Gln Glu Ala
1385 1390 1395
Cys His Gly Asn Thr Ser Asn Lys Glu Gln Leu Thr Ala Thr Lys
1400 1405 1410
Thr Glu Gln Asn Ile Lys Asp Phe Glu Thr Ser Asp Thr Phe Phe
1415 1420 1425
Gln Thr Ala Ser Gly Lys Asn Ile Ser Val Ala Lys Glu Ser Phe
1430 1435 1440
Asn Lys Ile Val Asn Phe Phe Asp Gln Lys Pro Glu Glu Leu His
1445 1450 1455
Asn Phe Ser Leu Asn Ser Glu Leu His Ser Asp Ile Arg Lys Asn
1460 1465 1470
Lys Met Asp Ile Leu Ser Tyr Glu Glu Thr Asp Ile Val Lys His
1475 1480 1485
Lys Ile Leu Lys Glu Ser Val Pro Val Gly Thr Gly Asn Gln Leu
1490 1495 1500
Val Thr Phe Gln Gly Gln Pro Glu Arg Asp Glu Lys Ile Lys Glu
1505 1510 1515
Pro Thr Leu Leu Gly Phe His Thr Ala Ser Gly Lys Lys Val Lys
1520 1525 1530
Ile Ala Lys Glu Ser Leu Asp Lys Val Lys Asn Leu Phe Asp Glu
1535 1540 1545
Lys Glu Gln Gly Thr Ser Glu Ile Thr Ser Phe Ser His Gln Trp
1550 1555 1560
Ala Lys Thr Leu Lys Tyr Arg Glu Ala Cys Lys Asp Leu Glu Leu
1565 1570 1575
Ala Cys Glu Thr Ile Glu Ile Thr Ala Ala Pro Lys Cys Lys Glu
1580 1585 1590
Met Gln Asn Ser Leu Asn Asn Asp Lys Asn Leu Val Ser Ile Glu
1595 1600 1605
Thr Val Val Pro Pro Lys Leu Leu Ser Asp Asn Leu Cys Arg Gln
1610 1615 1620
Thr Glu Asn Leu Lys Thr Ser Lys Ser Ile Phe Leu Lys Val Lys
1625 1630 1635
Val His Glu Asn Val Glu Lys Glu Thr Ala Lys Ser Pro Ala Thr
1640 1645 1650
Cys Tyr Thr Asn Gln Ser Pro Tyr Ser Val Ile Glu Asn Ser Ala
1655 1660 1665
Leu Ala Phe Tyr Thr Ser Cys Ser Arg Lys Thr Ser Val Ser Gln
1670 1675 1680
Thr Ser Leu Leu Glu Ala Lys Lys Trp Leu Arg Glu Gly Ile Phe
1685 1690 1695
Asp Gly Gln Pro Glu Arg Ile Asn Thr Ala Asp Tyr Val Gly Asn
1700 1705 1710
Tyr Leu Tyr Glu Asn Asn Ser Asn Ser Thr Ile Ala Glu Asn Asp
1715 1720 1725
Lys Asn His Leu Ser Glu Lys Gln Asp Thr Tyr Leu Ser Asn Ser
1730 1735 1740
Ser Met Ser Asn Ser Tyr Ser Tyr His Ser Asp Glu Val Tyr Asn
1745 1750 1755
Asp Ser Gly Tyr Leu Ser Lys Asn Lys Leu Asp Ser Gly Ile Glu
1760 1765 1770
Pro Val Leu Lys Asn Val Glu Asp Gln Lys Asn Thr Ser Phe Ser
1775 1780 1785
Lys Val Ile Ser Asn Val Lys Asp Ala Asn Ala Tyr Pro Gln Thr
1790 1795 1800
Val Asn Glu Asp Ile Cys Val Glu Glu Leu Val Thr Ser Ser Ser
1805 1810 1815
Pro Cys Lys Asn Lys Asn Ala Ala Ile Lys Leu Ser Ile Ser Asn
1820 1825 1830
Ser Asn Asn Phe Glu Val Gly Pro Pro Ala Phe Arg Ile Ala Ser
1835 1840 1845
Gly Lys Ile Val Cys Val Ser His Glu Thr Ile Lys Lys Val Lys
1850 1855 1860
Asp Ile Phe Thr Asp Ser Phe Ser Lys Val Ile Lys Glu Asn Asn
1865 1870 1875
Glu Asn Lys Ser Lys Ile Cys Gln Thr Lys Ile Met Ala Gly Cys
1880 1885 1890
Tyr Glu Ala Leu Asp Asp Ser Glu Asp Ile Leu His Asn Ser Leu
1895 1900 1905
Asp Asn Asp Glu Cys Ser Thr His Ser His Lys Val Phe Ala Asp
1910 1915 1920
Ile Gln Ser Glu Glu Ile Leu Gln His Asn Gln Asn Met Ser Gly
1925 1930 1935
Leu Glu Lys Val Ser Lys Ile Ser Pro Cys Asp Val Ser Leu Glu
1940 1945 1950
Thr Ser Asp Ile Cys Lys Cys Ser Ile Gly Lys Leu His Lys Ser
1955 1960 1965
Val Ser Ser Ala Asn Thr Cys Gly Ile Phe Ser Thr Ala Ser Gly
1970 1975 1980
Lys Ser Val Gln Val Ser Asp Ala Ser Leu Gln Asn Ala Arg Gln
1985 1990 1995
Val Phe Ser Glu Ile Glu Asp Ser Thr Lys Gln Val Phe Ser Lys
2000 2005 2010
Val Leu Phe Lys Ser Asn Glu His Ser Asp Gln Leu Thr Arg Glu
2015 2020 2025
Glu Asn Thr Ala Ile Arg Thr Pro Glu His Leu Ile Ser Gln Lys
2030 2035 2040
Gly Phe Ser Tyr Asn Val Val Asn Ser Ser Ala Phe Ser Gly Phe
2045 2050 2055
Ser Thr Ala Ser Gly Lys Gln Val Ser Ile Leu Glu Ser Ser Leu
2060 2065 2070
His Lys Val Lys Gly Val Leu Glu Glu Phe Asp Leu Ile Arg Thr
2075 2080 2085
Glu His Ser Leu His Tyr Ser Pro Thr Ser Arg Gln Asn Val Ser
2090 2095 2100
Lys Ile Leu Pro Arg Val Asp Lys Arg Asn Pro Glu His Cys Val
2105 2110 2115
Asn Ser Glu Met Glu Lys Thr Cys Ser Lys Glu Phe Lys Leu Ser
2120 2125 2130
Asn Asn Leu Asn Val Glu Gly Gly Ser Ser Glu Asn Asn His Ser
2135 2140 2145
Ile Lys Val Ser Pro Tyr Leu Ser Gln Phe Gln Gln Asp Lys Gln
2150 2155 2160
Gln Leu Val Leu Gly Thr Lys Val Ser Leu Val Glu Asn Ile His
2165 2170 2175
Val Leu Gly Lys Glu Gln Ala Ser Pro Lys Asn Val Lys Met Glu
2180 2185 2190
Ile Gly Lys Thr Glu Thr Phe Ser Asp Val Pro Val Lys Thr Asn
2195 2200 2205
Ile Glu Val Cys Ser Thr Tyr Ser Lys Asp Ser Glu Asn Tyr Phe
2210 2215 2220
Glu Thr Glu Ala Val Glu Ile Ala Lys Ala Phe Met Glu Asp Asp
2225 2230 2235
Glu Leu Thr Asp Ser Lys Leu Pro Ser His Ala Thr His Ser Leu
2240 2245 2250
Phe Thr Cys Pro Glu Asn Glu Glu Met Val Leu Ser Asn Ser Arg
2255 2260 2265
Ile Gly Lys Arg Arg Gly Glu Pro Leu Ile Leu Val Gly Glu Pro
2270 2275 2280
Ser Ile Lys Arg Asn Leu Leu Asn Glu Phe Asp Arg Ile Ile Glu
2285 2290 2295
Asn Gln Glu Lys Ser Leu Lys Ala Ser Lys Ser Thr Pro Asp Gly
2300 2305 2310
Thr Ile Lys Asp Arg Arg Leu Phe Met His His Val Ser Leu Glu
2315 2320 2325
Pro Ile Thr Cys Val Pro Phe Arg Thr Thr Lys Glu Arg Gln Glu
2330 2335 2340
Ile Gln Asn Pro Asn Phe Thr Ala Pro Gly Gln Glu Phe Leu Ser
2345 2350 2355
Lys Ser His Leu Tyr Glu His Leu Thr Leu Glu Lys Ser Ser Ser
2360 2365 2370
Asn Leu Ala Val Ser Gly His Pro Phe Tyr Gln Val Ser Ala Thr
2375 2380 2385
Arg Asn Glu Lys Met Arg His Leu Ile Thr Thr Gly Arg Pro Thr
2390 2395 2400
Lys Val Phe Val Pro Pro Phe Lys Thr Lys Ser His Phe His Arg
2405 2410 2415
Val Glu Gln Cys Val Arg Asn Ile Asn Leu Glu Glu Asn Arg Gln
2420 2425 2430
Lys Gln Asn Ile Asp Gly His Gly Ser Asp Asp Ser Lys Asn Lys
2435 2440 2445
Ile Asn Asp Asn Glu Ile His Gln Phe Asn Lys Asn Asn Ser Asn
2450 2455 2460
Gln Ala Ala Ala Val Thr Phe Thr Lys Cys Glu Glu Glu Pro Leu
2465 2470 2475
Asp Leu Ile Thr Ser Leu Gln Asn Ala Arg Asp Ile Gln Asp Met
2480 2485 2490
Arg Ile Lys Lys Lys Gln Arg Gln Arg Val Phe Pro Gln Pro Gly
2495 2500 2505
Ser Leu Tyr Leu Ala Lys Thr Ser Thr Leu Pro Arg Ile Ser Leu
2510 2515 2520
Lys Ala Ala Val Gly Gly Gln Val Pro Ser Ala Cys Ser His Lys
2525 2530 2535
Gln Leu Tyr Thr Tyr Gly Val Ser Lys His Cys Ile Lys Ile Asn
2540 2545 2550
Ser Lys Asn Ala Glu Ser Phe Gln Phe His Thr Glu Asp Tyr Phe
2555 2560 2565
Gly Lys Glu Ser Leu Trp Thr Gly Lys Gly Ile Gln Leu Ala Asp
2570 2575 2580
Gly Gly Trp Leu Ile Pro Ser Asn Asp Gly Lys Ala Gly Lys Glu
2585 2590 2595
Glu Phe Tyr Arg Ala Leu Cys Asp Thr Pro Gly Val Asp Pro Lys
2600 2605 2610
Leu Ile Ser Arg Ile Trp Val Tyr Asn His Tyr Arg Trp Ile Ile
2615 2620 2625
Trp Lys Leu Ala Ala Met Glu Cys Ala Phe Pro Lys Glu Phe Ala
2630 2635 2640
Asn Arg Cys Leu Ser Pro Glu Arg Val Leu Leu Gln Leu Lys Tyr
2645 2650 2655
Arg Tyr Asp Thr Glu Ile Asp Arg Ser Arg Arg Ser Ala Ile Lys
2660 2665 2670
Lys Ile Met Glu Arg Asp Asp Thr Ala Ala Lys Thr Leu Val Leu
2675 2680 2685
Cys Val Ser Asp Ile Ile Ser Leu Ser Ala Asn Ile Ser Glu Thr
2690 2695 2700
Ser Ser Asn Lys Thr Ser Ser Ala Asp Thr Gln Lys Val Ala Ile
2705 2710 2715
Ile Glu Leu Thr Asp Gly Trp Tyr Ala Val Lys Ala Gln Leu Asp
2720 2725 2730
Pro Pro Leu Leu Ala Val Leu Lys Asn Gly Arg Leu Thr Val Gly
2735 2740 2745
Gln Lys Ile Ile Leu His Gly Ala Glu Leu Val Gly Ser Pro Asp
2750 2755 2760
Ala Cys Thr Pro Leu Glu Ala Pro Glu Ser Leu Met Leu Lys Ile
2765 2770 2775
Ser Ala Asn Ser Thr Arg Pro Ala Arg Trp Tyr Thr Lys Leu Gly
2780 2785 2790
Phe Phe Pro Asp Pro Arg Pro Phe Pro Leu Pro Leu Ser Ser Leu
2795 2800 2805
Phe Ser Asp Gly Gly Asn Val Gly Cys Val Asp Val Ile Ile Gln
2810 2815 2820
Arg Ala Tyr Pro Ile Gln Trp Met Glu Lys Thr Ser Ser Gly Leu
2825 2830 2835
Tyr Ile Phe Arg Asn Glu Arg Glu Glu Glu Lys Glu Ala Ala Lys
2840 2845 2850
Tyr Val Glu Ala Gln Gln Lys Arg Leu Glu Ala Leu Phe Thr Lys
2855 2860 2865
Ile Gln Glu Glu Phe Glu Glu His Glu Glu Asn Thr Thr Lys Pro
2870 2875 2880
Tyr Leu Pro Ser Arg Ala Leu Thr Arg Gln Gln Val Arg Ala Leu
2885 2890 2895
Gln Asp Gly Ala Glu Leu Tyr Glu Ala Val Lys Asn Ala Ala Asp
2900 2905 2910
Pro Ala Tyr Leu Glu Gly Tyr Phe Ser Glu Glu Gln Leu Arg Ala
2915 2920 2925
Leu Asn Asn His Arg Gln Met Leu Asn Asp Lys Lys Gln Ala Gln
2930 2935 2940
Ile Gln Leu Glu Ile Arg Lys Ala Met Glu Ser Ala Glu Gln Lys
2945 2950 2955
Glu Gln Gly Leu Ser Arg Asp Val Thr Thr Val Trp Lys Leu Arg
2960 2965 2970
Ile Val Ser Tyr Ser Lys Lys Glu Lys Asp Ser Val Ile Leu Ser
2975 2980 2985
Ile Trp Arg Pro Ser Ser Asp Leu Tyr Ser Leu Leu Thr Glu Gly
2990 2995 3000
Lys Arg Tyr Arg Ile Tyr His Leu Ala Thr Ser Lys Ser Lys Ser
3005 3010 3015
Lys Ser Glu Arg Ala Asn Ile Gln Leu Ala Ala Thr Lys Lys Thr
3020 3025 3030
Gln Tyr Gln Gln Leu Pro Val Ser Asp Glu Ile Leu Phe Gln Ile
3035 3040 3045
Tyr Gln Pro Arg Glu Pro Leu His Phe Ser Lys Phe Leu Asp Pro
3050 3055 3060
Asp Phe Gln Pro Ser Cys Ser Glu Val Asp Leu Ile Gly Phe Val
3065 3070 3075
Val Ser Val Val Lys Lys Thr Gly Leu Ala Pro Phe Val Tyr Leu
3080 3085 3090
Ser Asp Glu Cys Tyr Asn Leu Leu Ala Ile Lys Phe Trp Ile Asp
3095 3100 3105
Leu Asn Glu Asp Ile Ile Lys Pro His Met Leu Ile Ala Ala Ser
3110 3115 3120
Asn Leu Gln Trp Arg Pro Glu Ser Lys Ser Gly Leu Leu Thr Leu
3125 3130 3135
Phe Ala Gly Asp Phe Ser Val Phe Ser Ala Ser Pro Lys Glu Gly
3140 3145 3150
His Phe Gln Glu Thr Phe Asn Lys Met Lys Asn Thr Val Glu Asn
3155 3160 3165
Ile Asp Ile Leu Cys Asn Glu Ala Glu Asn Lys Leu Met His Ile
3170 3175 3180
Leu His Ala Asn Asp Pro Lys Trp Ser Thr Pro Thr Lys Asp Cys
3185 3190 3195
Thr Ser Gly Pro Tyr Thr Ala Gln Ile Ile Pro Gly Thr Gly Asn
3200 3205 3210
Lys Leu Leu Met Ser Ser Pro Asn Cys Glu Ile Tyr Tyr Gln Ser
3215 3220 3225
Pro Leu Ser Leu Cys Met Ala Lys Arg Lys Ser Val Ser Thr Pro
3230 3235 3240
Val Ser Ala Gln Met Thr Ser Lys Ser Cys Lys Gly Glu Lys Glu
3245 3250 3255
Ile Asp Asp Gln Lys Asn Cys Lys Lys Arg Arg Ala Leu Asp Phe
3260 3265 3270
Leu Ser Arg Leu Pro Leu Pro Pro Pro Val Ser Pro Ile Cys Thr
3275 3280 3285
Phe Val Ser Pro Ala Ala Gln Lys Ala Phe Gln Pro Pro Arg Ser
3290 3295 3300
Cys Gly Thr Lys Tyr Glu Thr Pro Ile Lys Lys Lys Glu Leu Asn
3305 3310 3315
Ser Pro Gln Met Thr Pro Phe Lys Lys Phe Asn Glu Ile Ser Leu
3320 3325 3330
Leu Glu Ser Asn Ser Ile Ala Asp Glu Glu Leu Ala Leu Ile Asn
3335 3340 3345
Thr Gln Ala Leu Leu Ser Gly Ser Thr Gly Glu Lys Gln Phe Ile
3350 3355 3360
Ser Val Ser Glu Ser Thr Arg Thr Ala Pro Thr Ser Ser Glu Asp
3365 3370 3375
Tyr Leu Arg Leu Lys Arg Arg Cys Thr Thr Ser Leu Ile Lys Glu
3380 3385 3390
Gln Glu Ser Ser Gln Ala Ser Thr Glu Glu Cys Glu Lys Asn Lys
3395 3400 3405
Gln Asp Thr Ile Thr Thr Lys Lys Tyr Ile
3410 3415
<210> 45
<211> 393
<212> ПРТ
<213> Homo sapiens
<400> 45
Met Glu Glu Pro Gln Ser Asp Pro Ser Val Glu Pro Pro Leu Ser Gln
1 5 10 15
Glu Thr Phe Ser Asp Leu Trp Lys Leu Leu Pro Glu Asn Asn Val Leu
20 25 30
Ser Pro Leu Pro Ser Gln Ala Met Asp Asp Leu Met Leu Ser Pro Asp
35 40 45
Asp Ile Glu Gln Trp Phe Thr Glu Asp Pro Gly Pro Asp Glu Ala Pro
50 55 60
Arg Met Pro Glu Ala Ala Pro Pro Val Ala Pro Ala Pro Ala Ala Pro
65 70 75 80
Thr Pro Ala Ala Pro Ala Pro Ala Pro Ser Trp Pro Leu Ser Ser Ser
85 90 95
Val Pro Ser Gln Lys Thr Tyr Gln Gly Ser Tyr Gly Phe Arg Leu Gly
100 105 110
Phe Leu His Ser Gly Thr Ala Lys Ser Val Thr Cys Thr Tyr Ser Pro
115 120 125
Ala Leu Asn Lys Met Phe Cys Gln Leu Ala Lys Thr Cys Pro Val Gln
130 135 140
Leu Trp Val Asp Ser Thr Pro Pro Pro Gly Thr Arg Val Arg Ala Met
145 150 155 160
Ala Ile Tyr Lys Gln Ser Gln His Met Thr Glu Val Val Arg Arg Cys
165 170 175
Pro His His Glu Arg Cys Ser Asp Ser Asp Gly Leu Ala Pro Pro Gln
180 185 190
His Leu Ile Arg Val Glu Gly Asn Leu Arg Val Glu Tyr Leu Asp Asp
195 200 205
Arg Asn Thr Phe Arg His Ser Val Val Val Pro Tyr Glu Pro Pro Glu
210 215 220
Val Gly Ser Asp Cys Thr Thr Ile His Tyr Asn Tyr Met Cys Asn Ser
225 230 235 240
Ser Cys Met Gly Gly Met Asn Arg Arg Pro Ile Leu Thr Ile Ile Thr
245 250 255
Leu Glu Asp Ser Ser Gly Asn Leu Leu Gly Arg Asn Ser Phe Glu Val
260 265 270
Arg Val Cys Ala Cys Pro Gly Arg Asp Arg Arg Thr Glu Glu Glu Asn
275 280 285
Leu Arg Lys Lys Gly Glu Pro His His Glu Leu Pro Pro Gly Ser Thr
290 295 300
Lys Arg Ala Leu Pro Asn Asn Thr Ser Ser Ser Pro Gln Pro Lys Lys
305 310 315 320
Lys Pro Leu Asp Gly Glu Tyr Phe Thr Leu Gln Ile Arg Gly Arg Glu
325 330 335
Arg Phe Glu Met Phe Arg Glu Leu Asn Glu Ala Leu Glu Leu Lys Asp
340 345 350
Ala Gln Ala Gly Lys Glu Pro Gly Gly Ser Arg Ala His Ser Ser His
355 360 365
Leu Lys Ser Lys Lys Gly Gln Ser Thr Ser Arg His Lys Lys Leu Met
370 375 380
Phe Lys Thr Glu Gly Pro Asp Ser Asp
385 390
<210> 46
<211> 770
<212> ПРТ
<213> Homo sapiens
<400> 46
Met Leu Pro Gly Leu Ala Leu Leu Leu Leu Ala Ala Trp Thr Ala Arg
1 5 10 15
Ala Leu Glu Val Pro Thr Asp Gly Asn Ala Gly Leu Leu Ala Glu Pro
20 25 30
Gln Ile Ala Met Phe Cys Gly Arg Leu Asn Met His Met Asn Val Gln
35 40 45
Asn Gly Lys Trp Asp Ser Asp Pro Ser Gly Thr Lys Thr Cys Ile Asp
50 55 60
Thr Lys Glu Gly Ile Leu Gln Tyr Cys Gln Glu Val Tyr Pro Glu Leu
65 70 75 80
Gln Ile Thr Asn Val Val Glu Ala Asn Gln Pro Val Thr Ile Gln Asn
85 90 95
Trp Cys Lys Arg Gly Arg Lys Gln Cys Lys Thr His Pro His Phe Val
100 105 110
Ile Pro Tyr Arg Cys Leu Val Gly Glu Phe Val Ser Asp Ala Leu Leu
115 120 125
Val Pro Asp Lys Cys Lys Phe Leu His Gln Glu Arg Met Asp Val Cys
130 135 140
Glu Thr His Leu His Trp His Thr Val Ala Lys Glu Thr Cys Ser Glu
145 150 155 160
Lys Ser Thr Asn Leu His Asp Tyr Gly Met Leu Leu Pro Cys Gly Ile
165 170 175
Asp Lys Phe Arg Gly Val Glu Phe Val Cys Cys Pro Leu Ala Glu Glu
180 185 190
Ser Asp Asn Val Asp Ser Ala Asp Ala Glu Glu Asp Asp Ser Asp Val
195 200 205
Trp Trp Gly Gly Ala Asp Thr Asp Tyr Ala Asp Gly Ser Glu Asp Lys
210 215 220
Val Val Glu Val Ala Glu Glu Glu Glu Val Ala Glu Val Glu Glu Glu
225 230 235 240
Glu Ala Asp Asp Asp Glu Asp Asp Glu Asp Gly Asp Glu Val Glu Glu
245 250 255
Glu Ala Glu Glu Pro Tyr Glu Glu Ala Thr Glu Arg Thr Thr Ser Ile
260 265 270
Ala Thr Thr Thr Thr Thr Thr Thr Glu Ser Val Glu Glu Val Val Arg
275 280 285
Glu Val Cys Ser Glu Gln Ala Glu Thr Gly Pro Cys Arg Ala Met Ile
290 295 300
Ser Arg Trp Tyr Phe Asp Val Thr Glu Gly Lys Cys Ala Pro Phe Phe
305 310 315 320
Tyr Gly Gly Cys Gly Gly Asn Arg Asn Asn Phe Asp Thr Glu Glu Tyr
325 330 335
Cys Met Ala Val Cys Gly Ser Ala Met Ser Gln Ser Leu Leu Lys Thr
340 345 350
Thr Gln Glu Pro Leu Ala Arg Asp Pro Val Lys Leu Pro Thr Thr Ala
355 360 365
Ala Ser Thr Pro Asp Ala Val Asp Lys Tyr Leu Glu Thr Pro Gly Asp
370 375 380
Glu Asn Glu His Ala His Phe Gln Lys Ala Lys Glu Arg Leu Glu Ala
385 390 395 400
Lys His Arg Glu Arg Met Ser Gln Val Met Arg Glu Trp Glu Glu Ala
405 410 415
Glu Arg Gln Ala Lys Asn Leu Pro Lys Ala Asp Lys Lys Ala Val Ile
420 425 430
Gln His Phe Gln Glu Lys Val Glu Ser Leu Glu Gln Glu Ala Ala Asn
435 440 445
Glu Arg Gln Gln Leu Val Glu Thr His Met Ala Arg Val Glu Ala Met
450 455 460
Leu Asn Asp Arg Arg Arg Leu Ala Leu Glu Asn Tyr Ile Thr Ala Leu
465 470 475 480
Gln Ala Val Pro Pro Arg Pro Arg His Val Phe Asn Met Leu Lys Lys
485 490 495
Tyr Val Arg Ala Glu Gln Lys Asp Arg Gln His Thr Leu Lys His Phe
500 505 510
Glu His Val Arg Met Val Asp Pro Lys Lys Ala Ala Gln Ile Arg Ser
515 520 525
Gln Val Met Thr His Leu Arg Val Ile Tyr Glu Arg Met Asn Gln Ser
530 535 540
Leu Ser Leu Leu Tyr Asn Val Pro Ala Val Ala Glu Glu Ile Gln Asp
545 550 555 560
Glu Val Asp Glu Leu Leu Gln Lys Glu Gln Asn Tyr Ser Asp Asp Val
565 570 575
Leu Ala Asn Met Ile Ser Glu Pro Arg Ile Ser Tyr Gly Asn Asp Ala
580 585 590
Leu Met Pro Ser Leu Thr Glu Thr Lys Thr Thr Val Glu Leu Leu Pro
595 600 605
Val Asn Gly Glu Phe Ser Leu Asp Asp Leu Gln Pro Trp His Ser Phe
610 615 620
Gly Ala Asp Ser Val Pro Ala Asn Thr Glu Asn Glu Val Glu Pro Val
625 630 635 640
Asp Ala Arg Pro Ala Ala Asp Arg Gly Leu Thr Thr Arg Pro Gly Ser
645 650 655
Gly Leu Thr Asn Ile Lys Thr Glu Glu Ile Ser Glu Val Lys Met Asp
660 665 670
Ala Glu Phe Arg His Asp Ser Gly Tyr Glu Val His His Gln Lys Leu
675 680 685
Val Phe Phe Ala Glu Asp Val Gly Ser Asn Lys Gly Ala Ile Ile Gly
690 695 700
Leu Met Val Gly Gly Val Val Ile Ala Thr Val Ile Val Ile Thr Leu
705 710 715 720
Val Met Leu Lys Lys Lys Gln Tyr Thr Ser Ile His His Gly Val Val
725 730 735
Glu Val Asp Ala Ala Val Thr Pro Glu Glu Arg His Leu Ser Lys Met
740 745 750
Gln Gln Asn Gly Tyr Glu Asn Pro Thr Tyr Lys Phe Phe Glu Gln Met
755 760 765
Gln Asn
770
<210> 47
<211> 3144
<212> ПРТ
<213> Homo sapiens
<400> 47
Met Ala Thr Leu Glu Lys Leu Met Lys Ala Phe Glu Ser Leu Lys Ser
1 5 10 15
Phe Gln Gln Gln Gln Gln Gln Gln Gln Gln Gln Gln Gln Gln Gln Gln
20 25 30
Gln Gln Gln Gln Gln Gln Gln Gln Pro Pro Pro Pro Pro Pro Pro Pro
35 40 45
Pro Pro Pro Gln Leu Pro Gln Pro Pro Pro Gln Ala Gln Pro Leu Leu
50 55 60
Pro Gln Pro Gln Pro Pro Pro Pro Pro Pro Pro Pro Pro Pro Gly Pro
65 70 75 80
Ala Val Ala Glu Glu Pro Leu His Arg Pro Lys Lys Glu Leu Ser Ala
85 90 95
Thr Lys Lys Asp Arg Val Asn His Cys Leu Thr Ile Cys Glu Asn Ile
100 105 110
Val Ala Gln Ser Val Arg Asn Ser Pro Glu Phe Gln Lys Leu Leu Gly
115 120 125
Ile Ala Met Glu Leu Phe Leu Leu Cys Ser Asp Asp Ala Glu Ser Asp
130 135 140
Val Arg Met Val Ala Asp Glu Cys Leu Asn Lys Val Ile Lys Ala Leu
145 150 155 160
Met Asp Ser Asn Leu Pro Arg Leu Gln Leu Glu Leu Tyr Lys Glu Ile
165 170 175
Lys Lys Asn Gly Ala Pro Arg Ser Leu Arg Ala Ala Leu Trp Arg Phe
180 185 190
Ala Glu Leu Ala His Leu Val Arg Pro Gln Lys Cys Arg Pro Tyr Leu
195 200 205
Val Asn Leu Leu Pro Cys Leu Thr Arg Thr Ser Lys Arg Pro Glu Glu
210 215 220
Ser Val Gln Glu Thr Leu Ala Ala Ala Val Pro Lys Ile Met Ala Ser
225 230 235 240
Phe Gly Asn Phe Ala Asn Asp Asn Glu Ile Lys Val Leu Leu Lys Ala
245 250 255
Phe Ile Ala Asn Leu Lys Ser Ser Ser Pro Thr Ile Arg Arg Thr Ala
260 265 270
Ala Gly Ser Ala Val Ser Ile Cys Gln His Ser Arg Arg Thr Gln Tyr
275 280 285
Phe Tyr Ser Trp Leu Leu Asn Val Leu Leu Gly Leu Leu Val Pro Val
290 295 300
Glu Asp Glu His Ser Thr Leu Leu Ile Leu Gly Val Leu Leu Thr Leu
305 310 315 320
Arg Tyr Leu Val Pro Leu Leu Gln Gln Gln Val Lys Asp Thr Ser Leu
325 330 335
Lys Gly Ser Phe Gly Val Thr Arg Lys Glu Met Glu Val Ser Pro Ser
340 345 350
Ala Glu Gln Leu Val Gln Val Tyr Glu Leu Thr Leu His His Thr Gln
355 360 365
His Gln Asp His Asn Val Val Thr Gly Ala Leu Glu Leu Leu Gln Gln
370 375 380
Leu Phe Arg Thr Pro Pro Pro Glu Leu Leu Gln Thr Leu Thr Ala Val
385 390 395 400
Gly Gly Ile Gly Gln Leu Thr Ala Ala Lys Glu Glu Ser Gly Gly Arg
405 410 415
Ser Arg Ser Gly Ser Ile Val Glu Leu Ile Ala Gly Gly Gly Ser Ser
420 425 430
Cys Ser Pro Val Leu Ser Arg Lys Gln Lys Gly Lys Val Leu Leu Gly
435 440 445
Glu Glu Glu Ala Leu Glu Asp Asp Ser Glu Ser Arg Ser Asp Val Ser
450 455 460
Ser Ser Ala Leu Thr Ala Ser Val Lys Asp Glu Ile Ser Gly Glu Leu
465 470 475 480
Ala Ala Ser Ser Gly Val Ser Thr Pro Gly Ser Ala Gly His Asp Ile
485 490 495
Ile Thr Glu Gln Pro Arg Ser Gln His Thr Leu Gln Ala Asp Ser Val
500 505 510
Asp Leu Ala Ser Cys Asp Leu Thr Ser Ser Ala Thr Asp Gly Asp Glu
515 520 525
Glu Asp Ile Leu Ser His Ser Ser Ser Gln Val Ser Ala Val Pro Ser
530 535 540
Asp Pro Ala Met Asp Leu Asn Asp Gly Thr Gln Ala Ser Ser Pro Ile
545 550 555 560
Ser Asp Ser Ser Gln Thr Thr Thr Glu Gly Pro Asp Ser Ala Val Thr
565 570 575
Pro Ser Asp Ser Ser Glu Ile Val Leu Asp Gly Thr Asp Asn Gln Tyr
580 585 590
Leu Gly Leu Gln Ile Gly Gln Pro Gln Asp Glu Asp Glu Glu Ala Thr
595 600 605
Gly Ile Leu Pro Asp Glu Ala Ser Glu Ala Phe Arg Asn Ser Ser Met
610 615 620
Ala Leu Gln Gln Ala His Leu Leu Lys Asn Met Ser His Cys Arg Gln
625 630 635 640
Pro Ser Asp Ser Ser Val Asp Lys Phe Val Leu Arg Asp Glu Ala Thr
645 650 655
Glu Pro Gly Asp Gln Glu Asn Lys Pro Cys Arg Ile Lys Gly Asp Ile
660 665 670
Gly Gln Ser Thr Asp Asp Asp Ser Ala Pro Leu Val His Cys Val Arg
675 680 685
Leu Leu Ser Ala Ser Phe Leu Leu Thr Gly Gly Lys Asn Val Leu Val
690 695 700
Pro Asp Arg Asp Val Arg Val Ser Val Lys Ala Leu Ala Leu Ser Cys
705 710 715 720
Val Gly Ala Ala Val Ala Leu His Pro Glu Ser Phe Phe Ser Lys Leu
725 730 735
Tyr Lys Val Pro Leu Asp Thr Thr Glu Tyr Pro Glu Glu Gln Tyr Val
740 745 750
Ser Asp Ile Leu Asn Tyr Ile Asp His Gly Asp Pro Gln Val Arg Gly
755 760 765
Ala Thr Ala Ile Leu Cys Gly Thr Leu Ile Cys Ser Ile Leu Ser Arg
770 775 780
Ser Arg Phe His Val Gly Asp Trp Met Gly Thr Ile Arg Thr Leu Thr
785 790 795 800
Gly Asn Thr Phe Ser Leu Ala Asp Cys Ile Pro Leu Leu Arg Lys Thr
805 810 815
Leu Lys Asp Glu Ser Ser Val Thr Cys Lys Leu Ala Cys Thr Ala Val
820 825 830
Arg Asn Cys Val Met Ser Leu Cys Ser Ser Ser Tyr Ser Glu Leu Gly
835 840 845
Leu Gln Leu Ile Ile Asp Val Leu Thr Leu Arg Asn Ser Ser Tyr Trp
850 855 860
Leu Val Arg Thr Glu Leu Leu Glu Thr Leu Ala Glu Ile Asp Phe Arg
865 870 875 880
Leu Val Ser Phe Leu Glu Ala Lys Ala Glu Asn Leu His Arg Gly Ala
885 890 895
His His Tyr Thr Gly Leu Leu Lys Leu Gln Glu Arg Val Leu Asn Asn
900 905 910
Val Val Ile His Leu Leu Gly Asp Glu Asp Pro Arg Val Arg His Val
915 920 925
Ala Ala Ala Ser Leu Ile Arg Leu Val Pro Lys Leu Phe Tyr Lys Cys
930 935 940
Asp Gln Gly Gln Ala Asp Pro Val Val Ala Val Ala Arg Asp Gln Ser
945 950 955 960
Ser Val Tyr Leu Lys Leu Leu Met His Glu Thr Gln Pro Pro Ser His
965 970 975
Phe Ser Val Ser Thr Ile Thr Arg Ile Tyr Arg Gly Tyr Asn Leu Leu
980 985 990
Pro Ser Ile Thr Asp Val Thr Met Glu Asn Asn Leu Ser Arg Val Ile
995 1000 1005
Ala Ala Val Ser His Glu Leu Ile Thr Ser Thr Thr Arg Ala Leu
1010 1015 1020
Thr Phe Gly Cys Cys Glu Ala Leu Cys Leu Leu Ser Thr Ala Phe
1025 1030 1035
Pro Val Cys Ile Trp Ser Leu Gly Trp His Cys Gly Val Pro Pro
1040 1045 1050
Leu Ser Ala Ser Asp Glu Ser Arg Lys Ser Cys Thr Val Gly Met
1055 1060 1065
Ala Thr Met Ile Leu Thr Leu Leu Ser Ser Ala Trp Phe Pro Leu
1070 1075 1080
Asp Leu Ser Ala His Gln Asp Ala Leu Ile Leu Ala Gly Asn Leu
1085 1090 1095
Leu Ala Ala Ser Ala Pro Lys Ser Leu Arg Ser Ser Trp Ala Ser
1100 1105 1110
Glu Glu Glu Ala Asn Pro Ala Ala Thr Lys Gln Glu Glu Val Trp
1115 1120 1125
Pro Ala Leu Gly Asp Arg Ala Leu Val Pro Met Val Glu Gln Leu
1130 1135 1140
Phe Ser His Leu Leu Lys Val Ile Asn Ile Cys Ala His Val Leu
1145 1150 1155
Asp Asp Val Ala Pro Gly Pro Ala Ile Lys Ala Ala Leu Pro Ser
1160 1165 1170
Leu Thr Asn Pro Pro Ser Leu Ser Pro Ile Arg Arg Lys Gly Lys
1175 1180 1185
Glu Lys Glu Pro Gly Glu Gln Ala Ser Val Pro Leu Ser Pro Lys
1190 1195 1200
Lys Gly Ser Glu Ala Ser Ala Ala Ser Arg Gln Ser Asp Thr Ser
1205 1210 1215
Gly Pro Val Thr Thr Ser Lys Ser Ser Ser Leu Gly Ser Phe Tyr
1220 1225 1230
His Leu Pro Ser Tyr Leu Lys Leu His Asp Val Leu Lys Ala Thr
1235 1240 1245
His Ala Asn Tyr Lys Val Thr Leu Asp Leu Gln Asn Ser Thr Glu
1250 1255 1260
Lys Phe Gly Gly Phe Leu Arg Ser Ala Leu Asp Val Leu Ser Gln
1265 1270 1275
Ile Leu Glu Leu Ala Thr Leu Gln Asp Ile Gly Lys Cys Val Glu
1280 1285 1290
Glu Ile Leu Gly Tyr Leu Lys Ser Cys Phe Ser Arg Glu Pro Met
1295 1300 1305
Met Ala Thr Val Cys Val Gln Gln Leu Leu Lys Thr Leu Phe Gly
1310 1315 1320
Thr Asn Leu Ala Ser Gln Phe Asp Gly Leu Ser Ser Asn Pro Ser
1325 1330 1335
Lys Ser Gln Gly Arg Ala Gln Arg Leu Gly Ser Ser Ser Val Arg
1340 1345 1350
Pro Gly Leu Tyr His Tyr Cys Phe Met Ala Pro Tyr Thr His Phe
1355 1360 1365
Thr Gln Ala Leu Ala Asp Ala Ser Leu Arg Asn Met Val Gln Ala
1370 1375 1380
Glu Gln Glu Asn Asp Thr Ser Gly Trp Phe Asp Val Leu Gln Lys
1385 1390 1395
Val Ser Thr Gln Leu Lys Thr Asn Leu Thr Ser Val Thr Lys Asn
1400 1405 1410
Arg Ala Asp Lys Asn Ala Ile His Asn His Ile Arg Leu Phe Glu
1415 1420 1425
Pro Leu Val Ile Lys Ala Leu Lys Gln Tyr Thr Thr Thr Thr Cys
1430 1435 1440
Val Gln Leu Gln Lys Gln Val Leu Asp Leu Leu Ala Gln Leu Val
1445 1450 1455
Gln Leu Arg Val Asn Tyr Cys Leu Leu Asp Ser Asp Gln Val Phe
1460 1465 1470
Ile Gly Phe Val Leu Lys Gln Phe Glu Tyr Ile Glu Val Gly Gln
1475 1480 1485
Phe Arg Glu Ser Glu Ala Ile Ile Pro Asn Ile Phe Phe Phe Leu
1490 1495 1500
Val Leu Leu Ser Tyr Glu Arg Tyr His Ser Lys Gln Ile Ile Gly
1505 1510 1515
Ile Pro Lys Ile Ile Gln Leu Cys Asp Gly Ile Met Ala Ser Gly
1520 1525 1530
Arg Lys Ala Val Thr His Ala Ile Pro Ala Leu Gln Pro Ile Val
1535 1540 1545
His Asp Leu Phe Val Leu Arg Gly Thr Asn Lys Ala Asp Ala Gly
1550 1555 1560
Lys Glu Leu Glu Thr Gln Lys Glu Val Val Val Ser Met Leu Leu
1565 1570 1575
Arg Leu Ile Gln Tyr His Gln Val Leu Glu Met Phe Ile Leu Val
1580 1585 1590
Leu Gln Gln Cys His Lys Glu Asn Glu Asp Lys Trp Lys Arg Leu
1595 1600 1605
Ser Arg Gln Ile Ala Asp Ile Ile Leu Pro Met Leu Ala Lys Gln
1610 1615 1620
Gln Met His Ile Asp Ser His Glu Ala Leu Gly Val Leu Asn Thr
1625 1630 1635
Leu Phe Glu Ile Leu Ala Pro Ser Ser Leu Arg Pro Val Asp Met
1640 1645 1650
Leu Leu Arg Ser Met Phe Val Thr Pro Asn Thr Met Ala Ser Val
1655 1660 1665
Ser Thr Val Gln Leu Trp Ile Ser Gly Ile Leu Ala Ile Leu Arg
1670 1675 1680
Val Leu Ile Ser Gln Ser Thr Glu Asp Ile Val Leu Ser Arg Ile
1685 1690 1695
Gln Glu Leu Ser Phe Ser Pro Tyr Leu Ile Ser Cys Thr Val Ile
1700 1705 1710
Asn Arg Leu Arg Asp Gly Asp Ser Thr Ser Thr Leu Glu Glu His
1715 1720 1725
Ser Glu Gly Lys Gln Ile Lys Asn Leu Pro Glu Glu Thr Phe Ser
1730 1735 1740
Arg Phe Leu Leu Gln Leu Val Gly Ile Leu Leu Glu Asp Ile Val
1745 1750 1755
Thr Lys Gln Leu Lys Val Glu Met Ser Glu Gln Gln His Thr Phe
1760 1765 1770
Tyr Cys Gln Glu Leu Gly Thr Leu Leu Met Cys Leu Ile His Ile
1775 1780 1785
Phe Lys Ser Gly Met Phe Arg Arg Ile Thr Ala Ala Ala Thr Arg
1790 1795 1800
Leu Phe Arg Ser Asp Gly Cys Gly Gly Ser Phe Tyr Thr Leu Asp
1805 1810 1815
Ser Leu Asn Leu Arg Ala Arg Ser Met Ile Thr Thr His Pro Ala
1820 1825 1830
Leu Val Leu Leu Trp Cys Gln Ile Leu Leu Leu Val Asn His Thr
1835 1840 1845
Asp Tyr Arg Trp Trp Ala Glu Val Gln Gln Thr Pro Lys Arg His
1850 1855 1860
Ser Leu Ser Ser Thr Lys Leu Leu Ser Pro Gln Met Ser Gly Glu
1865 1870 1875
Glu Glu Asp Ser Asp Leu Ala Ala Lys Leu Gly Met Cys Asn Arg
1880 1885 1890
Glu Ile Val Arg Arg Gly Ala Leu Ile Leu Phe Cys Asp Tyr Val
1895 1900 1905
Cys Gln Asn Leu His Asp Ser Glu His Leu Thr Trp Leu Ile Val
1910 1915 1920
Asn His Ile Gln Asp Leu Ile Ser Leu Ser His Glu Pro Pro Val
1925 1930 1935
Gln Asp Phe Ile Ser Ala Val His Arg Asn Ser Ala Ala Ser Gly
1940 1945 1950
Leu Phe Ile Gln Ala Ile Gln Ser Arg Cys Glu Asn Leu Ser Thr
1955 1960 1965
Pro Thr Met Leu Lys Lys Thr Leu Gln Cys Leu Glu Gly Ile His
1970 1975 1980
Leu Ser Gln Ser Gly Ala Val Leu Thr Leu Tyr Val Asp Arg Leu
1985 1990 1995
Leu Cys Thr Pro Phe Arg Val Leu Ala Arg Met Val Asp Ile Leu
2000 2005 2010
Ala Cys Arg Arg Val Glu Met Leu Leu Ala Ala Asn Leu Gln Ser
2015 2020 2025
Ser Met Ala Gln Leu Pro Met Glu Glu Leu Asn Arg Ile Gln Glu
2030 2035 2040
Tyr Leu Gln Ser Ser Gly Leu Ala Gln Arg His Gln Arg Leu Tyr
2045 2050 2055
Ser Leu Leu Asp Arg Phe Arg Leu Ser Thr Met Gln Asp Ser Leu
2060 2065 2070
Ser Pro Ser Pro Pro Val Ser Ser His Pro Leu Asp Gly Asp Gly
2075 2080 2085
His Val Ser Leu Glu Thr Val Ser Pro Asp Lys Asp Trp Tyr Val
2090 2095 2100
His Leu Val Lys Ser Gln Cys Trp Thr Arg Ser Asp Ser Ala Leu
2105 2110 2115
Leu Glu Gly Ala Glu Leu Val Asn Arg Ile Pro Ala Glu Asp Met
2120 2125 2130
Asn Ala Phe Met Met Asn Ser Glu Phe Asn Leu Ser Leu Leu Ala
2135 2140 2145
Pro Cys Leu Ser Leu Gly Met Ser Glu Ile Ser Gly Gly Gln Lys
2150 2155 2160
Ser Ala Leu Phe Glu Ala Ala Arg Glu Val Thr Leu Ala Arg Val
2165 2170 2175
Ser Gly Thr Val Gln Gln Leu Pro Ala Val His His Val Phe Gln
2180 2185 2190
Pro Glu Leu Pro Ala Glu Pro Ala Ala Tyr Trp Ser Lys Leu Asn
2195 2200 2205
Asp Leu Phe Gly Asp Ala Ala Leu Tyr Gln Ser Leu Pro Thr Leu
2210 2215 2220
Ala Arg Ala Leu Ala Gln Tyr Leu Val Val Val Ser Lys Leu Pro
2225 2230 2235
Ser His Leu His Leu Pro Pro Glu Lys Glu Lys Asp Ile Val Lys
2240 2245 2250
Phe Val Val Ala Thr Leu Glu Ala Leu Ser Trp His Leu Ile His
2255 2260 2265
Glu Gln Ile Pro Leu Ser Leu Asp Leu Gln Ala Gly Leu Asp Cys
2270 2275 2280
Cys Cys Leu Ala Leu Gln Leu Pro Gly Leu Trp Ser Val Val Ser
2285 2290 2295
Ser Thr Glu Phe Val Thr His Ala Cys Ser Leu Ile Tyr Cys Val
2300 2305 2310
His Phe Ile Leu Glu Ala Val Ala Val Gln Pro Gly Glu Gln Leu
2315 2320 2325
Leu Ser Pro Glu Arg Arg Thr Asn Thr Pro Lys Ala Ile Ser Glu
2330 2335 2340
Glu Glu Glu Glu Val Asp Pro Asn Thr Gln Asn Pro Lys Tyr Ile
2345 2350 2355
Thr Ala Ala Cys Glu Met Val Ala Glu Met Val Glu Ser Leu Gln
2360 2365 2370
Ser Val Leu Ala Leu Gly His Lys Arg Asn Ser Gly Val Pro Ala
2375 2380 2385
Phe Leu Thr Pro Leu Leu Arg Asn Ile Ile Ile Ser Leu Ala Arg
2390 2395 2400
Leu Pro Leu Val Asn Ser Tyr Thr Arg Val Pro Pro Leu Val Trp
2405 2410 2415
Lys Leu Gly Trp Ser Pro Lys Pro Gly Gly Asp Phe Gly Thr Ala
2420 2425 2430
Phe Pro Glu Ile Pro Val Glu Phe Leu Gln Glu Lys Glu Val Phe
2435 2440 2445
Lys Glu Phe Ile Tyr Arg Ile Asn Thr Leu Gly Trp Thr Ser Arg
2450 2455 2460
Thr Gln Phe Glu Glu Thr Trp Ala Thr Leu Leu Gly Val Leu Val
2465 2470 2475
Thr Gln Pro Leu Val Met Glu Gln Glu Glu Ser Pro Pro Glu Glu
2480 2485 2490
Asp Thr Glu Arg Thr Gln Ile Asn Val Leu Ala Val Gln Ala Ile
2495 2500 2505
Thr Ser Leu Val Leu Ser Ala Met Thr Val Pro Val Ala Gly Asn
2510 2515 2520
Pro Ala Val Ser Cys Leu Glu Gln Gln Pro Arg Asn Lys Pro Leu
2525 2530 2535
Lys Ala Leu Asp Thr Arg Phe Gly Arg Lys Leu Ser Ile Ile Arg
2540 2545 2550
Gly Ile Val Glu Gln Glu Ile Gln Ala Met Val Ser Lys Arg Glu
2555 2560 2565
Asn Ile Ala Thr His His Leu Tyr Gln Ala Trp Asp Pro Val Pro
2570 2575 2580
Ser Leu Ser Pro Ala Thr Thr Gly Ala Leu Ile Ser His Glu Lys
2585 2590 2595
Leu Leu Leu Gln Ile Asn Pro Glu Arg Glu Leu Gly Ser Met Ser
2600 2605 2610
Tyr Lys Leu Gly Gln Val Ser Ile His Ser Val Trp Leu Gly Asn
2615 2620 2625
Ser Ile Thr Pro Leu Arg Glu Glu Glu Trp Asp Glu Glu Glu Glu
2630 2635 2640
Glu Glu Ala Asp Ala Pro Ala Pro Ser Ser Pro Pro Thr Ser Pro
2645 2650 2655
Val Asn Ser Arg Lys His Arg Ala Gly Val Asp Ile His Ser Cys
2660 2665 2670
Ser Gln Phe Leu Leu Glu Leu Tyr Ser Arg Trp Ile Leu Pro Ser
2675 2680 2685
Ser Ser Ala Arg Arg Thr Pro Ala Ile Leu Ile Ser Glu Val Val
2690 2695 2700
Arg Ser Leu Leu Val Val Ser Asp Leu Phe Thr Glu Arg Asn Gln
2705 2710 2715
Phe Glu Leu Met Tyr Val Thr Leu Thr Glu Leu Arg Arg Val His
2720 2725 2730
Pro Ser Glu Asp Glu Ile Leu Ala Gln Tyr Leu Val Pro Ala Thr
2735 2740 2745
Cys Lys Ala Ala Ala Val Leu Gly Met Asp Lys Ala Val Ala Glu
2750 2755 2760
Pro Val Ser Arg Leu Leu Glu Ser Thr Leu Arg Ser Ser His Leu
2765 2770 2775
Pro Ser Arg Val Gly Ala Leu His Gly Val Leu Tyr Val Leu Glu
2780 2785 2790
Cys Asp Leu Leu Asp Asp Thr Ala Lys Gln Leu Ile Pro Val Ile
2795 2800 2805
Ser Asp Tyr Leu Leu Ser Asn Leu Lys Gly Ile Ala His Cys Val
2810 2815 2820
Asn Ile His Ser Gln Gln His Val Leu Val Met Cys Ala Thr Ala
2825 2830 2835
Phe Tyr Leu Ile Glu Asn Tyr Pro Leu Asp Val Gly Pro Glu Phe
2840 2845 2850
Ser Ala Ser Ile Ile Gln Met Cys Gly Val Met Leu Ser Gly Ser
2855 2860 2865
Glu Glu Ser Thr Pro Ser Ile Ile Tyr His Cys Ala Leu Arg Gly
2870 2875 2880
Leu Glu Arg Leu Leu Leu Ser Glu Gln Leu Ser Arg Leu Asp Ala
2885 2890 2895
Glu Ser Leu Val Lys Leu Ser Val Asp Arg Val Asn Val His Ser
2900 2905 2910
Pro His Arg Ala Met Ala Ala Leu Gly Leu Met Leu Thr Cys Met
2915 2920 2925
Tyr Thr Gly Lys Glu Lys Val Ser Pro Gly Arg Thr Ser Asp Pro
2930 2935 2940
Asn Pro Ala Ala Pro Asp Ser Glu Ser Val Ile Val Ala Met Glu
2945 2950 2955
Arg Val Ser Val Leu Phe Asp Arg Ile Arg Lys Gly Phe Pro Cys
2960 2965 2970
Glu Ala Arg Val Val Ala Arg Ile Leu Pro Gln Phe Leu Asp Asp
2975 2980 2985
Phe Phe Pro Pro Gln Asp Ile Met Asn Lys Val Ile Gly Glu Phe
2990 2995 3000
Leu Ser Asn Gln Gln Pro Tyr Pro Gln Phe Met Ala Thr Val Val
3005 3010 3015
Tyr Lys Val Phe Gln Thr Leu His Ser Thr Gly Gln Ser Ser Met
3020 3025 3030
Val Arg Asp Trp Val Met Leu Ser Leu Ser Asn Phe Thr Gln Arg
3035 3040 3045
Ala Pro Val Ala Met Ala Thr Trp Ser Leu Ser Cys Phe Phe Val
3050 3055 3060
Ser Ala Ser Thr Ser Pro Trp Val Ala Ala Ile Leu Pro His Val
3065 3070 3075
Ile Ser Arg Met Gly Lys Leu Glu Gln Val Asp Val Asn Leu Phe
3080 3085 3090
Cys Leu Val Ala Thr Asp Phe Tyr Arg His Gln Ile Glu Glu Glu
3095 3100 3105
Leu Asp Arg Arg Ala Phe Gln Ser Val Leu Glu Val Val Ala Ala
3110 3115 3120
Pro Gly Ser Pro Tyr His Arg Leu Leu Thr Cys Leu Arg Asn Val
3125 3130 3135
His Lys Val Thr Thr Cys
3140
<210> 48
<211> 89
<212> ПРТ
<213> Homo sapiens
<400> 48
Met Gly Ile Leu Lys Leu Gln Val Phe Leu Ile Val Leu Ser Val Ala
1 5 10 15
Leu Asn His Leu Lys Ala Thr Pro Ile Glu Ser His Gln Val Glu Lys
20 25 30
Arg Lys Cys Asn Thr Ala Thr Cys Ala Thr Gln Arg Leu Ala Asn Phe
35 40 45
Leu Val His Ser Ser Asn Asn Phe Gly Ala Ile Leu Ser Ser Thr Asn
50 55 60
Val Gly Ser Asn Thr Tyr Gly Lys Arg Asn Ala Val Glu Val Leu Lys
65 70 75 80
Arg Glu Pro Leu Asn Tyr Leu Pro Leu
85
<210> 49
<211> 776
<212> ПРТ
<213> Homo sapiens
<400> 49
Met Ala Glu Pro Arg Gln Glu Phe Glu Val Met Glu Asp His Ala Gly
1 5 10 15
Thr Tyr Gly Leu Gly Asp Arg Lys Asp Gln Gly Gly Tyr Thr Met His
20 25 30
Gln Asp Gln Glu Gly Asp Thr Asp Ala Gly Leu Lys Glu Ser Pro Leu
35 40 45
Gln Thr Pro Thr Glu Asp Gly Ser Glu Glu Pro Gly Ser Glu Thr Ser
50 55 60
Asp Ala Lys Ser Thr Pro Thr Ala Glu Asp Val Thr Ala Pro Leu Val
65 70 75 80
Asp Glu Gly Ala Pro Gly Lys Gln Ala Ala Ala Gln Pro His Thr Glu
85 90 95
Ile Pro Glu Gly Thr Thr Ala Glu Glu Ala Gly Ile Gly Asp Thr Pro
100 105 110
Ser Leu Glu Asp Glu Ala Ala Gly His Val Thr Gln Glu Pro Glu Ser
115 120 125
Gly Lys Val Val Gln Glu Gly Phe Leu Arg Glu Pro Gly Pro Pro Gly
130 135 140
Leu Ser His Gln Leu Met Ser Gly Met Pro Gly Ala Pro Leu Leu Pro
145 150 155 160
Glu Gly Pro Arg Glu Ala Thr Arg Gln Pro Ser Gly Thr Gly Pro Glu
165 170 175
Asp Thr Glu Gly Gly Arg His Ala Pro Glu Leu Leu Lys His Gln Leu
180 185 190
Leu Gly Asp Leu His Gln Glu Gly Pro Pro Leu Lys Gly Ala Gly Gly
195 200 205
Lys Glu Arg Pro Gly Ser Lys Glu Glu Val Asp Glu Asp Arg Asp Val
210 215 220
Asp Glu Ser Ser Pro Gln Asp Ser Pro Pro Ser Lys Ala Ser Pro Ala
225 230 235 240
Gln Asp Gly Arg Pro Pro Gln Thr Ala Ala Arg Glu Ala Thr Ser Ile
245 250 255
Pro Gly Phe Pro Ala Glu Gly Ala Ile Pro Leu Pro Val Asp Phe Leu
260 265 270
Ser Lys Val Ser Thr Glu Ile Pro Ala Ser Glu Pro Asp Gly Pro Ser
275 280 285
Val Gly Arg Ala Lys Gly Gln Asp Ala Pro Leu Glu Phe Thr Phe His
290 295 300
Val Glu Ile Thr Pro Asn Val Gln Lys Glu Gln Ala His Ser Glu Glu
305 310 315 320
His Leu Gly Arg Ala Ala Phe Pro Gly Ala Pro Gly Glu Gly Pro Glu
325 330 335
Ala Arg Gly Pro Ser Leu Gly Glu Asp Thr Lys Glu Ala Asp Leu Pro
340 345 350
Glu Pro Ser Glu Lys Gln Pro Ala Ala Ala Pro Arg Gly Lys Pro Val
355 360 365
Ser Arg Val Pro Gln Leu Lys Ala Arg Met Val Ser Lys Ser Lys Asp
370 375 380
Gly Thr Gly Ser Asp Asp Lys Lys Ala Lys Thr Ser Thr Arg Ser Ser
385 390 395 400
Ala Lys Thr Leu Lys Asn Arg Pro Cys Leu Ser Pro Lys His Pro Thr
405 410 415
Pro Gly Ser Ser Asp Pro Leu Ile Gln Pro Ser Ser Pro Ala Val Cys
420 425 430
Pro Glu Pro Pro Ser Ser Pro Lys Tyr Val Ser Ser Val Thr Ser Arg
435 440 445
Thr Gly Ser Ser Gly Ala Lys Glu Met Lys Leu Lys Gly Ala Asp Gly
450 455 460
Lys Thr Lys Ile Ala Thr Pro Arg Gly Ala Ala Pro Pro Gly Gln Lys
465 470 475 480
Gly Gln Ala Asn Ala Thr Arg Ile Pro Ala Lys Thr Pro Pro Ala Pro
485 490 495
Lys Thr Pro Pro Ser Ser Ala Thr Lys Gln Val Gln Arg Arg Pro Pro
500 505 510
Pro Ala Gly Pro Arg Ser Glu Arg Gly Glu Pro Pro Lys Ser Gly Asp
515 520 525
Arg Ser Gly Tyr Ser Ser Pro Gly Ser Pro Gly Thr Pro Gly Ser Arg
530 535 540
Ser Arg Thr Pro Ser Leu Pro Thr Pro Pro Thr Arg Glu Pro Lys Lys
545 550 555 560
Val Ala Val Val Arg Thr Pro Pro Lys Ser Pro Ser Ser Ala Lys Ser
565 570 575
Arg Leu Gln Thr Ala Pro Val Pro Met Pro Asp Leu Lys Asn Val Lys
580 585 590
Ser Lys Ile Gly Ser Thr Glu Asn Leu Lys His Gln Pro Gly Gly Gly
595 600 605
Lys Val Gln Ile Ile Asn Lys Lys Leu Asp Leu Ser Asn Val Gln Ser
610 615 620
Lys Cys Gly Ser Lys Asp Asn Ile Lys His Val Pro Gly Gly Gly Ser
625 630 635 640
Val Gln Ile Val Tyr Lys Pro Val Asp Leu Ser Lys Val Thr Ser Lys
645 650 655
Cys Gly Ser Leu Gly Asn Ile His His Lys Pro Gly Gly Gly Gln Val
660 665 670
Glu Val Lys Ser Glu Lys Leu Asp Phe Lys Asp Arg Val Gln Ser Lys
675 680 685
Ile Gly Ser Leu Asp Asn Ile Thr His Val Pro Gly Gly Gly Asn Lys
690 695 700
Lys Ile Glu Thr His Lys Leu Thr Phe Arg Glu Asn Ala Lys Ala Lys
705 710 715 720
Thr Asp His Gly Ala Glu Ile Val Tyr Lys Ser Pro Val Val Ser Gly
725 730 735
Asp Thr Ser Pro Arg His Leu Ser Asn Val Ser Ser Thr Gly Ser Ile
740 745 750
Asp Met Val Asp Ser Pro Gln Leu Ala Thr Leu Ala Asp Glu Val Ser
755 760 765
Ala Ser Leu Ala Lys Gln Gly Leu
770 775
<210> 50
<211> 253
<212> ПРТ
<213> Homo sapiens
<400> 50
Met Ala Asn Leu Gly Cys Trp Met Leu Val Leu Phe Val Ala Thr Trp
1 5 10 15
Ser Asp Leu Gly Leu Cys Lys Lys Arg Pro Lys Pro Gly Gly Trp Asn
20 25 30
Thr Gly Gly Ser Arg Tyr Pro Gly Gln Gly Ser Pro Gly Gly Asn Arg
35 40 45
Tyr Pro Pro Gln Gly Gly Gly Gly Trp Gly Gln Pro His Gly Gly Gly
50 55 60
Trp Gly Gln Pro His Gly Gly Gly Trp Gly Gln Pro His Gly Gly Gly
65 70 75 80
Trp Gly Gln Pro His Gly Gly Gly Trp Gly Gln Gly Gly Gly Thr His
85 90 95
Ser Gln Trp Asn Lys Pro Ser Lys Pro Lys Thr Asn Met Lys His Met
100 105 110
Ala Gly Ala Ala Ala Ala Gly Ala Val Val Gly Gly Leu Gly Gly Tyr
115 120 125
Met Leu Gly Ser Ala Met Ser Arg Pro Ile Ile His Phe Gly Ser Asp
130 135 140
Tyr Glu Asp Arg Tyr Tyr Arg Glu Asn Met His Arg Tyr Pro Asn Gln
145 150 155 160
Val Tyr Tyr Arg Pro Met Asp Glu Tyr Ser Asn Gln Asn Asn Phe Val
165 170 175
His Asp Cys Val Asn Ile Thr Ile Lys Gln His Thr Val Thr Thr Thr
180 185 190
Thr Lys Gly Glu Asn Phe Thr Glu Thr Asp Val Lys Met Met Glu Arg
195 200 205
Val Val Glu Gln Met Cys Ile Thr Gln Tyr Glu Arg Glu Ser Gln Ala
210 215 220
Tyr Tyr Gln Arg Gly Ser Ser Met Val Leu Phe Ser Ser Pro Pro Val
225 230 235 240
Ile Leu Leu Ile Ser Phe Leu Ile Phe Leu Ile Val Gly
245 250
<210> 51
<211> 140
<212> ПРТ
<213> Homo sapiens
<400> 51
Met Asp Val Phe Met Lys Gly Leu Ser Lys Ala Lys Glu Gly Val Val
1 5 10 15
Ala Ala Ala Glu Lys Thr Lys Gln Gly Val Ala Glu Ala Ala Gly Lys
20 25 30
Thr Lys Glu Gly Val Leu Tyr Val Gly Ser Lys Thr Lys Glu Gly Val
35 40 45
Val His Gly Val Ala Thr Val Ala Glu Lys Thr Lys Glu Gln Val Thr
50 55 60
Asn Val Gly Gly Ala Val Val Thr Gly Val Thr Ala Val Ala Gln Lys
65 70 75 80
Thr Val Glu Gly Ala Gly Ser Ile Ala Ala Ala Thr Gly Phe Val Lys
85 90 95
Lys Asp Gln Leu Gly Lys Asn Glu Glu Gly Ala Pro Gln Glu Gly Ile
100 105 110
Leu Glu Asp Met Pro Val Asp Pro Asp Asn Glu Ala Tyr Glu Met Pro
115 120 125
Ser Glu Glu Gly Tyr Gln Asp Tyr Glu Pro Glu Ala
130 135 140
<210> 52
<211> 140
<212> ПРТ
<213> Homo sapiens
<400> 52
Met Asp Val Phe Met Lys Gly Leu Ser Lys Ala Lys Glu Gly Val Val
1 5 10 15
Ala Ala Ala Glu Lys Thr Lys Gln Gly Val Ala Glu Ala Ala Gly Lys
20 25 30
Thr Lys Glu Gly Val Leu Tyr Val Gly Ser Lys Thr Lys Glu Gly Val
35 40 45
Val His Gly Val Ala Thr Val Ala Glu Lys Thr Lys Glu Gln Val Thr
50 55 60
Asn Val Gly Gly Ala Val Val Thr Gly Val Thr Ala Val Ala Gln Lys
65 70 75 80
Thr Val Glu Gly Ala Gly Ser Ile Ala Ala Ala Thr Gly Phe Val Lys
85 90 95
Lys Asp Gln Leu Gly Lys Asn Glu Glu Gly Ala Pro Gln Glu Gly Ile
100 105 110
Leu Glu Asp Met Pro Val Asp Pro Asp Asn Glu Ala Tyr Glu Met Pro
115 120 125
Ser Glu Glu Gly Tyr Gln Asp Tyr Glu Pro Glu Ala
130 135 140
<210> 53
<211> 196
<212> ПРТ
<213> Homo sapiens
<400> 53
Gln Leu Val Lys Ser Glu Leu Glu Glu Lys Lys Ser Glu Leu Arg His
1 5 10 15
Lys Leu Lys Tyr Val Pro His Glu Tyr Ile Glu Leu Ile Glu Ile Ala
20 25 30
Arg Asn Ser Thr Gln Asp Arg Ile Leu Glu Met Lys Val Met Glu Phe
35 40 45
Phe Met Lys Val Tyr Gly Tyr Arg Gly Lys His Leu Gly Gly Ser Arg
50 55 60
Lys Pro Asp Gly Ala Ile Tyr Thr Val Gly Ser Pro Ile Asp Tyr Gly
65 70 75 80
Val Ile Val Asp Thr Lys Ala Tyr Ser Gly Gly Tyr Asn Leu Pro Ile
85 90 95
Gly Gln Ala Asp Glu Met Gln Arg Tyr Val Glu Glu Asn Gln Thr Arg
100 105 110
Asn Lys His Ile Asn Pro Asn Glu Trp Trp Lys Val Tyr Pro Ser Ser
115 120 125
Val Thr Glu Phe Lys Phe Leu Phe Val Ser Gly His Phe Lys Gly Asn
130 135 140
Tyr Lys Ala Gln Leu Thr Arg Leu Asn His Ile Thr Asn Cys Asn Gly
145 150 155 160
Ala Val Leu Ser Val Glu Glu Leu Leu Ile Gly Gly Glu Met Ile Lys
165 170 175
Ala Gly Thr Leu Thr Leu Glu Glu Val Arg Arg Lys Phe Asn Asn Gly
180 185 190
Glu Ile Asn Phe
195
<210> 54
<211> 36
<212> ПРТ
<213> Homo sapiens
<220>
<221> misc_feature
<222> (12)..(13)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<400> 54
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys
1 5 10 15
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
20 25 30
His Gly Gly Gly
35
<210> 55
<211> 36
<212> ПРТ
<213> Homo sapiens
<220>
<221> misc_feature
<222> (12)..(13)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<400> 55
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys
1 5 10 15
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
20 25 30
Gly His Gly Gly
35
<210> 56
<211> 36
<212> ПРТ
<213> Homo sapiens
<220>
<221> misc_feature
<222> (12)..(13)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<400> 56
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys
1 5 10 15
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
20 25 30
His Gly Ser Gly
35
<210> 57
<211> 1089
<212> ПРТ
<213> Homo sapiens
<220>
<221> misc_feature
<222> (188)..(189)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (224)..(225)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (258)..(259)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (294)..(295)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (328)..(329)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (364)..(365)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (398)..(399)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (434)..(435)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (468)..(469)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (504)..(505)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (538)..(539)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (574)..(575)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (608)..(609)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (644)..(645)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (678)..(679)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (714)..(715)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (748)..(749)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (784)..(785)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (818)..(819)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<400> 57
Met Asp Tyr Lys Asp His Asp Gly Asp Tyr Lys Asp His Asp Ile Asp
1 5 10 15
Tyr Lys Asp Asp Asp Asp Lys Met Ala Pro Lys Lys Lys Arg Lys Val
20 25 30
Gly Ile His Gly Val Pro Ala Ala Val Asp Leu Arg Thr Leu Gly Tyr
35 40 45
Ser Gln Gln Gln Gln Glu Lys Ile Lys Pro Lys Val Arg Ser Thr Val
50 55 60
Ala Gln His His Glu Ala Leu Val Gly His Gly Phe Thr His Ala His
65 70 75 80
Ile Val Ala Leu Ser Gln His Pro Ala Ala Leu Gly Thr Val Ala Val
85 90 95
Lys Tyr Gln Asp Met Ile Ala Ala Leu Pro Glu Ala Thr His Glu Ala
100 105 110
Ile Val Gly Val Gly Lys Gln Trp Ser Gly Ala Arg Ala Leu Glu Ala
115 120 125
Leu Leu Thr Val Ala Gly Glu Leu Arg Gly Pro Pro Leu Gln Leu Asp
130 135 140
Thr Gly Gln Leu Leu Lys Ile Ala Lys Arg Gly Gly Val Thr Ala Val
145 150 155 160
Glu Ala Val His Ala Trp Arg Asn Ala Leu Thr Gly Ala Pro Leu Asn
165 170 175
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys
180 185 190
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
195 200 205
Gly His Gly Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa
210 215 220
Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
225 230 235 240
Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala
245 250 255
Ser Xaa Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
260 265 270
Pro Val Leu Cys Gln Ala Gly His Gly Gly Leu Thr Pro Glu Gln Val
275 280 285
Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val
290 295 300
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu
305 310 315 320
Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys Gln Ala Leu Glu
325 330 335
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala Gly His Gly Gly
340 345 350
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys
355 360 365
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
370 375 380
His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly
385 390 395 400
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
405 410 415
Gln Ala Gly His Gly Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala
420 425 430
Ser Xaa Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
435 440 445
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala
450 455 460
Ile Ala Ser Xaa Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
465 470 475 480
Leu Leu Pro Val Leu Cys Gln Ala Gly His Gly Gly Leu Thr Pro Glu
485 490 495
Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys Gln Ala Leu Glu
500 505 510
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
515 520 525
Pro Glu Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys Gln Ala
530 535 540
Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala Gly His
545 550 555 560
Gly Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly
565 570 575
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
580 585 590
Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa
595 600 605
Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
610 615 620
Leu Cys Gln Ala Gly His Gly Gly Leu Thr Pro Glu Gln Val Val Ala
625 630 635 640
Ile Ala Ser Xaa Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
645 650 655
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val
660 665 670
Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val
675 680 685
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala Gly His Gly Gly Leu Thr
690 695 700
Pro Glu Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys Gln Ala
705 710 715 720
Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly
725 730 735
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys
740 745 750
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
755 760 765
Gly His Gly Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa
770 775 780
Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
785 790 795 800
Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala
805 810 815
Ser Xaa Xaa Gly Gly Arg Pro Ala Leu Glu Ser Ile Val Ala Gln Leu
820 825 830
Ser Arg Pro Asp Pro Ala Leu Ala Ala Leu Thr Asn Asp His Leu Val
835 840 845
Ala Leu Ala Cys Leu Gly Gly Arg Pro Ala Leu Asp Ala Val Lys Lys
850 855 860
Gly Leu Pro His Ala Pro Ala Leu Ile Lys Arg Thr Asn Arg Arg Ile
865 870 875 880
Pro Glu Arg Thr Ser His Arg Val Ala Gly Ser Gln Leu Val Lys Ser
885 890 895
Glu Leu Glu Glu Lys Lys Ser Glu Leu Arg His Lys Leu Lys Tyr Val
900 905 910
Pro His Glu Tyr Ile Glu Leu Ile Glu Ile Ala Arg Asn Ser Thr Gln
915 920 925
Asp Arg Ile Leu Glu Met Lys Val Met Glu Phe Phe Met Lys Val Tyr
930 935 940
Gly Tyr Arg Gly Lys His Leu Gly Gly Ser Arg Lys Pro Asp Gly Ala
945 950 955 960
Ile Tyr Thr Val Gly Ser Pro Ile Asp Tyr Gly Val Ile Val Asp Thr
965 970 975
Lys Ala Tyr Ser Gly Gly Tyr Asn Leu Pro Ile Gly Gln Ala Asp Glu
980 985 990
Met Gln Arg Tyr Val Glu Glu Asn Gln Thr Arg Asn Lys His Ile Asn
995 1000 1005
Pro Asn Glu Trp Trp Lys Val Tyr Pro Ser Ser Val Thr Glu Phe
1010 1015 1020
Lys Phe Leu Phe Val Ser Gly His Phe Lys Gly Asn Tyr Lys Ala
1025 1030 1035
Gln Leu Thr Arg Leu Asn His Ile Thr Asn Cys Asn Gly Ala Val
1040 1045 1050
Leu Ser Val Glu Glu Leu Leu Ile Gly Gly Glu Met Ile Lys Ala
1055 1060 1065
Gly Thr Leu Thr Leu Glu Glu Val Arg Arg Lys Phe Asn Asn Gly
1070 1075 1080
Glu Ile Asn Phe Arg Ser
1085
<210> 58
<211> 1107
<212> ПРТ
<213> Homo sapiens
<220>
<221> misc_feature
<222> (188)..(189)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (224)..(225)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (260)..(261)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (296)..(297)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (332)..(333)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (368)..(369)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (404)..(405)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (440)..(441)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (476)..(477)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (512)..(513)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (548)..(549)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (584)..(585)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (620)..(621)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (656)..(657)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (692)..(693)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (728)..(729)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (764)..(765)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (800)..(801)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (836)..(837)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<400> 58
Met Asp Tyr Lys Asp His Asp Gly Asp Tyr Lys Asp His Asp Ile Asp
1 5 10 15
Tyr Lys Asp Asp Asp Asp Lys Met Ala Pro Lys Lys Lys Arg Lys Val
20 25 30
Gly Ile His Gly Val Pro Ala Ala Val Asp Leu Arg Thr Leu Gly Tyr
35 40 45
Ser Gln Gln Gln Gln Glu Lys Ile Lys Pro Lys Val Arg Ser Thr Val
50 55 60
Ala Gln His His Glu Ala Leu Val Gly His Gly Phe Thr His Ala His
65 70 75 80
Ile Val Ala Leu Ser Gln His Pro Ala Ala Leu Gly Thr Val Ala Val
85 90 95
Lys Tyr Gln Asp Met Ile Ala Ala Leu Pro Glu Ala Thr His Glu Ala
100 105 110
Ile Val Gly Val Gly Lys Gln Trp Ser Gly Ala Arg Ala Leu Glu Ala
115 120 125
Leu Leu Thr Val Ala Gly Glu Leu Arg Gly Pro Pro Leu Gln Leu Asp
130 135 140
Thr Gly Gln Leu Leu Lys Ile Ala Lys Arg Gly Gly Val Thr Ala Val
145 150 155 160
Glu Ala Val His Ala Trp Arg Asn Ala Leu Thr Gly Ala Pro Leu Asn
165 170 175
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys
180 185 190
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
195 200 205
Gly His Gly Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa
210 215 220
Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
225 230 235 240
Leu Cys Gln Ala Gly His Gly Gly Leu Thr Pro Glu Gln Val Val Ala
245 250 255
Ile Ala Ser Xaa Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
260 265 270
Leu Leu Pro Val Leu Cys Gln Ala Gly His Gly Gly Leu Thr Pro Glu
275 280 285
Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys Gln Ala Leu Glu
290 295 300
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala Gly His Gly Gly
305 310 315 320
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys
325 330 335
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
340 345 350
Gly His Gly Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa
355 360 365
Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
370 375 380
Leu Cys Gln Ala Gly His Gly Gly Leu Thr Pro Glu Gln Val Val Ala
385 390 395 400
Ile Ala Ser Xaa Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
405 410 415
Leu Leu Pro Val Leu Cys Gln Ala Gly His Gly Gly Leu Thr Pro Glu
420 425 430
Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys Gln Ala Leu Glu
435 440 445
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala Gly His Gly Gly
450 455 460
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys
465 470 475 480
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
485 490 495
Gly His Gly Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa
500 505 510
Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
515 520 525
Leu Cys Gln Ala Gly His Gly Gly Leu Thr Pro Glu Gln Val Val Ala
530 535 540
Ile Ala Ser Xaa Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
545 550 555 560
Leu Leu Pro Val Leu Cys Gln Ala Gly His Gly Gly Leu Thr Pro Glu
565 570 575
Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys Gln Ala Leu Glu
580 585 590
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala Gly His Gly Gly
595 600 605
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys
610 615 620
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
625 630 635 640
Gly His Gly Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa
645 650 655
Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
660 665 670
Leu Cys Gln Ala Gly His Gly Gly Leu Thr Pro Glu Gln Val Val Ala
675 680 685
Ile Ala Ser Xaa Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
690 695 700
Leu Leu Pro Val Leu Cys Gln Ala Gly His Gly Gly Leu Thr Pro Glu
705 710 715 720
Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys Gln Ala Leu Glu
725 730 735
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala Gly His Gly Gly
740 745 750
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys
755 760 765
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
770 775 780
Gly His Gly Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa
785 790 795 800
Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
805 810 815
Leu Cys Gln Ala Gly His Gly Gly Leu Thr Pro Glu Gln Val Val Ala
820 825 830
Ile Ala Ser Xaa Xaa Gly Gly Arg Pro Ala Leu Glu Ser Ile Val Ala
835 840 845
Gln Leu Ser Arg Pro Asp Pro Ala Leu Ala Ala Leu Thr Asn Asp His
850 855 860
Leu Val Ala Leu Ala Cys Leu Gly Gly Arg Pro Ala Leu Asp Ala Val
865 870 875 880
Lys Lys Gly Leu Pro His Ala Pro Ala Leu Ile Lys Arg Thr Asn Arg
885 890 895
Arg Ile Pro Glu Arg Thr Ser His Arg Val Ala Gly Ser Gln Leu Val
900 905 910
Lys Ser Glu Leu Glu Glu Lys Lys Ser Glu Leu Arg His Lys Leu Lys
915 920 925
Tyr Val Pro His Glu Tyr Ile Glu Leu Ile Glu Ile Ala Arg Asn Ser
930 935 940
Thr Gln Asp Arg Ile Leu Glu Met Lys Val Met Glu Phe Phe Met Lys
945 950 955 960
Val Tyr Gly Tyr Arg Gly Lys His Leu Gly Gly Ser Arg Lys Pro Asp
965 970 975
Gly Ala Ile Tyr Thr Val Gly Ser Pro Ile Asp Tyr Gly Val Ile Val
980 985 990
Asp Thr Lys Ala Tyr Ser Gly Gly Tyr Asn Leu Pro Ile Gly Gln Ala
995 1000 1005
Asp Glu Met Gln Arg Tyr Val Glu Glu Asn Gln Thr Arg Asn Lys
1010 1015 1020
His Ile Asn Pro Asn Glu Trp Trp Lys Val Tyr Pro Ser Ser Val
1025 1030 1035
Thr Glu Phe Lys Phe Leu Phe Val Ser Gly His Phe Lys Gly Asn
1040 1045 1050
Tyr Lys Ala Gln Leu Thr Arg Leu Asn His Ile Thr Asn Cys Asn
1055 1060 1065
Gly Ala Val Leu Ser Val Glu Glu Leu Leu Ile Gly Gly Glu Met
1070 1075 1080
Ile Lys Ala Gly Thr Leu Thr Leu Glu Glu Val Arg Arg Lys Phe
1085 1090 1095
Asn Asn Gly Glu Ile Asn Phe Arg Ser
1100 1105
<210> 59
<211> 1086
<212> ПРТ
<213> Homo sapiens
<220>
<221> misc_feature
<222> (188)..(189)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (224)..(225)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (258)..(259)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (294)..(295)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (328)..(329)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (364)..(365)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (398)..(399)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (434)..(435)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (468)..(469)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (504)..(505)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (538)..(539)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (574)..(575)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (608)..(609)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (644)..(645)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (678)..(679)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (714)..(715)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (748)..(749)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (784)..(785)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (818)..(819)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<400> 59
Met Asp Tyr Lys Asp His Asp Gly Asp Tyr Lys Asp His Asp Ile Asp
1 5 10 15
Tyr Lys Asp Asp Asp Asp Lys Met Ala Pro Lys Lys Lys Arg Lys Val
20 25 30
Gly Ile His Gly Val Pro Ala Ala Val Asp Leu Arg Thr Leu Gly Tyr
35 40 45
Ser Gln Gln Gln Gln Glu Lys Ile Lys Pro Lys Val Arg Ser Thr Val
50 55 60
Ala Gln His His Glu Ala Leu Val Gly His Gly Phe Thr His Ala His
65 70 75 80
Ile Val Ala Leu Ser Gln His Pro Ala Ala Leu Gly Thr Val Ala Val
85 90 95
Lys Tyr Gln Asp Met Ile Ala Ala Leu Pro Glu Ala Thr His Glu Ala
100 105 110
Ile Val Gly Val Gly Lys Gln Trp Ser Gly Ala Arg Ala Leu Glu Ala
115 120 125
Leu Leu Thr Val Ala Gly Glu Leu Arg Gly Pro Pro Leu Gln Leu Asp
130 135 140
Thr Gly Gln Leu Leu Lys Ile Ala Lys Arg Gly Gly Val Thr Ala Val
145 150 155 160
Glu Ala Val His Ala Trp Arg Asn Ala Leu Thr Gly Ala Pro Leu Asn
165 170 175
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys
180 185 190
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
195 200 205
Gly His Gly Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa
210 215 220
Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
225 230 235 240
Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala
245 250 255
Ser Xaa Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
260 265 270
Pro Val Leu Cys Gln Ala Gly His Gly Gly Leu Thr Pro Glu Gln Val
275 280 285
Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val
290 295 300
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu
305 310 315 320
Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys Gln Ala Leu Glu
325 330 335
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala Gly His Gly Gly
340 345 350
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys
355 360 365
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
370 375 380
His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly
385 390 395 400
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
405 410 415
Gln Ala Gly His Gly Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala
420 425 430
Ser Xaa Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
435 440 445
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala
450 455 460
Ile Ala Ser Xaa Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
465 470 475 480
Leu Leu Pro Val Leu Cys Gln Ala Gly His Gly Gly Leu Thr Pro Glu
485 490 495
Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys Gln Ala Leu Glu
500 505 510
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
515 520 525
Pro Glu Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys Gln Ala
530 535 540
Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala Gly His
545 550 555 560
Gly Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly
565 570 575
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
580 585 590
Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa
595 600 605
Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
610 615 620
Leu Cys Gln Ala Gly His Gly Gly Leu Thr Pro Glu Gln Val Val Ala
625 630 635 640
Ile Ala Ser Xaa Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
645 650 655
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val
660 665 670
Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val
675 680 685
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala Gly His Gly Gly Leu Thr
690 695 700
Pro Glu Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys Gln Ala
705 710 715 720
Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly
725 730 735
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys
740 745 750
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
755 760 765
Gly His Gly Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa
770 775 780
Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
785 790 795 800
Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala
805 810 815
Ser Xaa Xaa Gly Gly Arg Pro Ala Leu Glu Ser Ile Val Ala Gln Leu
820 825 830
Ser Arg Pro Asp Pro Ala Leu Ala Ala Leu Thr Asn Asp His Leu Val
835 840 845
Ala Leu Ala Cys Leu Gly Gly Arg Pro Ala Leu Asp Ala Val Lys Lys
850 855 860
Gly Leu Pro His Ala Pro Ala Leu Ile Lys Arg Thr Asn Arg Arg Ile
865 870 875 880
Pro Glu Arg Thr Ser His Arg Val Ala Gly Ser Val Leu Glu Lys Ser
885 890 895
Asp Ile Glu Lys Phe Lys Asn Gln Leu Arg Thr Glu Leu Thr Asn Ile
900 905 910
Asp His Ser Tyr Leu Lys Gly Ile Asp Ile Ala Ser Lys Lys Lys Thr
915 920 925
Ser Asn Val Glu Asn Thr Glu Phe Glu Ala Ile Ser Thr Lys Ile Phe
930 935 940
Thr Asp Glu Leu Gly Phe Ser Gly Lys His Leu Gly Gly Ser Asn Lys
945 950 955 960
Pro Asp Gly Leu Leu Trp Asp Asp Asp Cys Ala Ile Ile Leu Asp Ser
965 970 975
Lys Ala Tyr Ser Glu Gly Phe Pro Leu Thr Ala Ser His Thr Asp Ala
980 985 990
Met Gly Arg Tyr Leu Arg Gln Phe Thr Glu Arg Lys Glu Glu Ile Lys
995 1000 1005
Pro Thr Trp Trp Asp Ile Ala Pro Glu His Leu Asp Asn Thr Tyr
1010 1015 1020
Phe Ala Tyr Val Ser Gly Ser Phe Ser Gly Asn Tyr Lys Glu Gln
1025 1030 1035
Leu Gln Lys Phe Arg Gln Asp Thr Asn His Leu Gly Gly Ala Leu
1040 1045 1050
Glu Phe Val Lys Leu Leu Leu Leu Ala Asn Asn Tyr Lys Thr Gln
1055 1060 1065
Lys Met Ser Lys Lys Glu Val Lys Lys Ser Ile Leu Asp Tyr Asn
1070 1075 1080
Ile Ser Tyr
1085
<210> 60
<211> 1104
<212> ПРТ
<213> Homo sapiens
<220>
<221> misc_feature
<222> (188)..(189)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (224)..(225)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (260)..(261)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (296)..(297)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (332)..(333)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (368)..(369)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (404)..(405)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (440)..(441)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (476)..(477)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (512)..(513)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (548)..(549)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (584)..(585)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (620)..(621)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (656)..(657)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (692)..(693)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (728)..(729)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (764)..(765)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (800)..(801)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (836)..(837)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<400> 60
Met Asp Tyr Lys Asp His Asp Gly Asp Tyr Lys Asp His Asp Ile Asp
1 5 10 15
Tyr Lys Asp Asp Asp Asp Lys Met Ala Pro Lys Lys Lys Arg Lys Val
20 25 30
Gly Ile His Gly Val Pro Ala Ala Val Asp Leu Arg Thr Leu Gly Tyr
35 40 45
Ser Gln Gln Gln Gln Glu Lys Ile Lys Pro Lys Val Arg Ser Thr Val
50 55 60
Ala Gln His His Glu Ala Leu Val Gly His Gly Phe Thr His Ala His
65 70 75 80
Ile Val Ala Leu Ser Gln His Pro Ala Ala Leu Gly Thr Val Ala Val
85 90 95
Lys Tyr Gln Asp Met Ile Ala Ala Leu Pro Glu Ala Thr His Glu Ala
100 105 110
Ile Val Gly Val Gly Lys Gln Trp Ser Gly Ala Arg Ala Leu Glu Ala
115 120 125
Leu Leu Thr Val Ala Gly Glu Leu Arg Gly Pro Pro Leu Gln Leu Asp
130 135 140
Thr Gly Gln Leu Leu Lys Ile Ala Lys Arg Gly Gly Val Thr Ala Val
145 150 155 160
Glu Ala Val His Ala Trp Arg Asn Ala Leu Thr Gly Ala Pro Leu Asn
165 170 175
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys
180 185 190
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
195 200 205
Gly His Gly Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa
210 215 220
Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
225 230 235 240
Leu Cys Gln Ala Gly His Gly Gly Leu Thr Pro Glu Gln Val Val Ala
245 250 255
Ile Ala Ser Xaa Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
260 265 270
Leu Leu Pro Val Leu Cys Gln Ala Gly His Gly Gly Leu Thr Pro Glu
275 280 285
Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys Gln Ala Leu Glu
290 295 300
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala Gly His Gly Gly
305 310 315 320
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys
325 330 335
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
340 345 350
Gly His Gly Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa
355 360 365
Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
370 375 380
Leu Cys Gln Ala Gly His Gly Gly Leu Thr Pro Glu Gln Val Val Ala
385 390 395 400
Ile Ala Ser Xaa Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
405 410 415
Leu Leu Pro Val Leu Cys Gln Ala Gly His Gly Gly Leu Thr Pro Glu
420 425 430
Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys Gln Ala Leu Glu
435 440 445
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala Gly His Gly Gly
450 455 460
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys
465 470 475 480
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
485 490 495
Gly His Gly Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa
500 505 510
Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
515 520 525
Leu Cys Gln Ala Gly His Gly Gly Leu Thr Pro Glu Gln Val Val Ala
530 535 540
Ile Ala Ser Xaa Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
545 550 555 560
Leu Leu Pro Val Leu Cys Gln Ala Gly His Gly Gly Leu Thr Pro Glu
565 570 575
Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys Gln Ala Leu Glu
580 585 590
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala Gly His Gly Gly
595 600 605
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys
610 615 620
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
625 630 635 640
Gly His Gly Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa
645 650 655
Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
660 665 670
Leu Cys Gln Ala Gly His Gly Gly Leu Thr Pro Glu Gln Val Val Ala
675 680 685
Ile Ala Ser Xaa Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
690 695 700
Leu Leu Pro Val Leu Cys Gln Ala Gly His Gly Gly Leu Thr Pro Glu
705 710 715 720
Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys Gln Ala Leu Glu
725 730 735
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala Gly His Gly Gly
740 745 750
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys
755 760 765
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
770 775 780
Gly His Gly Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa
785 790 795 800
Xaa Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
805 810 815
Leu Cys Gln Ala Gly His Gly Gly Leu Thr Pro Glu Gln Val Val Ala
820 825 830
Ile Ala Ser Xaa Xaa Gly Gly Arg Pro Ala Leu Glu Ser Ile Val Ala
835 840 845
Gln Leu Ser Arg Pro Asp Pro Ala Leu Ala Ala Leu Thr Asn Asp His
850 855 860
Leu Val Ala Leu Ala Cys Leu Gly Gly Arg Pro Ala Leu Asp Ala Val
865 870 875 880
Lys Lys Gly Leu Pro His Ala Pro Ala Leu Ile Lys Arg Thr Asn Arg
885 890 895
Arg Ile Pro Glu Arg Thr Ser His Arg Val Ala Gly Ser Val Leu Glu
900 905 910
Lys Ser Asp Ile Glu Lys Phe Lys Asn Gln Leu Arg Thr Glu Leu Thr
915 920 925
Asn Ile Asp His Ser Tyr Leu Lys Gly Ile Asp Ile Ala Ser Lys Lys
930 935 940
Lys Thr Ser Asn Val Glu Asn Thr Glu Phe Glu Ala Ile Ser Thr Lys
945 950 955 960
Ile Phe Thr Asp Glu Leu Gly Phe Ser Gly Lys His Leu Gly Gly Ser
965 970 975
Asn Lys Pro Asp Gly Leu Leu Trp Asp Asp Asp Cys Ala Ile Ile Leu
980 985 990
Asp Ser Lys Ala Tyr Ser Glu Gly Phe Pro Leu Thr Ala Ser His Thr
995 1000 1005
Asp Ala Met Gly Arg Tyr Leu Arg Gln Phe Thr Glu Arg Lys Glu
1010 1015 1020
Glu Ile Lys Pro Thr Trp Trp Asp Ile Ala Pro Glu His Leu Asp
1025 1030 1035
Asn Thr Tyr Phe Ala Tyr Val Ser Gly Ser Phe Ser Gly Asn Tyr
1040 1045 1050
Lys Glu Gln Leu Gln Lys Phe Arg Gln Asp Thr Asn His Leu Gly
1055 1060 1065
Gly Ala Leu Glu Phe Val Lys Leu Leu Leu Leu Ala Asn Asn Tyr
1070 1075 1080
Lys Thr Gln Lys Met Ser Lys Lys Glu Val Lys Lys Ser Ile Leu
1085 1090 1095
Asp Tyr Asn Ile Ser Tyr
1100
<210> 61
<211> 1464
<212> ПРТ
<213> Homo sapiens
<400> 61
Met Phe Ser Phe Val Asp Leu Arg Leu Leu Leu Leu Leu Ala Ala Thr
1 5 10 15
Ala Leu Leu Thr His Gly Gln Glu Glu Gly Gln Val Glu Gly Gln Asp
20 25 30
Glu Asp Ile Pro Pro Ile Thr Cys Val Gln Asn Gly Leu Arg Tyr His
35 40 45
Asp Arg Asp Val Trp Lys Pro Glu Pro Cys Arg Ile Cys Val Cys Asp
50 55 60
Asn Gly Lys Val Leu Cys Asp Asp Val Ile Cys Asp Glu Thr Lys Asn
65 70 75 80
Cys Pro Gly Ala Glu Val Pro Glu Gly Glu Cys Cys Pro Val Cys Pro
85 90 95
Asp Gly Ser Glu Ser Pro Thr Asp Gln Glu Thr Thr Gly Val Glu Gly
100 105 110
Pro Lys Gly Asp Thr Gly Pro Arg Gly Pro Arg Gly Pro Ala Gly Pro
115 120 125
Pro Gly Arg Asp Gly Ile Pro Gly Gln Pro Gly Leu Pro Gly Pro Pro
130 135 140
Gly Pro Pro Gly Pro Pro Gly Pro Pro Gly Leu Gly Gly Asn Phe Ala
145 150 155 160
Pro Gln Leu Ser Tyr Gly Tyr Asp Glu Lys Ser Thr Gly Gly Ile Ser
165 170 175
Val Pro Gly Pro Met Gly Pro Ser Gly Pro Arg Gly Leu Pro Gly Pro
180 185 190
Pro Gly Ala Pro Gly Pro Gln Gly Phe Gln Gly Pro Pro Gly Glu Pro
195 200 205
Gly Glu Pro Gly Ala Ser Gly Pro Met Gly Pro Arg Gly Pro Pro Gly
210 215 220
Pro Pro Gly Lys Asn Gly Asp Asp Gly Glu Ala Gly Lys Pro Gly Arg
225 230 235 240
Pro Gly Glu Arg Gly Pro Pro Gly Pro Gln Gly Ala Arg Gly Leu Pro
245 250 255
Gly Thr Ala Gly Leu Pro Gly Met Lys Gly His Arg Gly Phe Ser Gly
260 265 270
Leu Asp Gly Ala Lys Gly Asp Ala Gly Pro Ala Gly Pro Lys Gly Glu
275 280 285
Pro Gly Ser Pro Gly Glu Asn Gly Ala Pro Gly Gln Met Gly Pro Arg
290 295 300
Gly Leu Pro Gly Glu Arg Gly Arg Pro Gly Ala Pro Gly Pro Ala Gly
305 310 315 320
Ala Arg Gly Asn Asp Gly Ala Thr Gly Ala Ala Gly Pro Pro Gly Pro
325 330 335
Thr Gly Pro Ala Gly Pro Pro Gly Phe Pro Gly Ala Val Gly Ala Lys
340 345 350
Gly Glu Ala Gly Pro Gln Gly Pro Arg Gly Ser Glu Gly Pro Gln Gly
355 360 365
Val Arg Gly Glu Pro Gly Pro Pro Gly Pro Ala Gly Ala Ala Gly Pro
370 375 380
Ala Gly Asn Pro Gly Ala Asp Gly Gln Pro Gly Ala Lys Gly Ala Asn
385 390 395 400
Gly Ala Pro Gly Ile Ala Gly Ala Pro Gly Phe Pro Gly Ala Arg Gly
405 410 415
Pro Ser Gly Pro Gln Gly Pro Gly Gly Pro Pro Gly Pro Lys Gly Asn
420 425 430
Ser Gly Glu Pro Gly Ala Pro Gly Ser Lys Gly Asp Thr Gly Ala Lys
435 440 445
Gly Glu Pro Gly Pro Val Gly Val Gln Gly Pro Pro Gly Pro Ala Gly
450 455 460
Glu Glu Gly Lys Arg Gly Ala Arg Gly Glu Pro Gly Pro Thr Gly Leu
465 470 475 480
Pro Gly Pro Pro Gly Glu Arg Gly Gly Pro Gly Ser Arg Gly Phe Pro
485 490 495
Gly Ala Asp Gly Val Ala Gly Pro Lys Gly Pro Ala Gly Glu Arg Gly
500 505 510
Ser Pro Gly Pro Ala Gly Pro Lys Gly Ser Pro Gly Glu Ala Gly Arg
515 520 525
Pro Gly Glu Ala Gly Leu Pro Gly Ala Lys Gly Leu Thr Gly Ser Pro
530 535 540
Gly Ser Pro Gly Pro Asp Gly Lys Thr Gly Pro Pro Gly Pro Ala Gly
545 550 555 560
Gln Asp Gly Arg Pro Gly Pro Pro Gly Pro Pro Gly Ala Arg Gly Gln
565 570 575
Ala Gly Val Met Gly Phe Pro Gly Pro Lys Gly Ala Ala Gly Glu Pro
580 585 590
Gly Lys Ala Gly Glu Arg Gly Val Pro Gly Pro Pro Gly Ala Val Gly
595 600 605
Pro Ala Gly Lys Asp Gly Glu Ala Gly Ala Gln Gly Pro Pro Gly Pro
610 615 620
Ala Gly Pro Ala Gly Glu Arg Gly Glu Gln Gly Pro Ala Gly Ser Pro
625 630 635 640
Gly Phe Gln Gly Leu Pro Gly Pro Ala Gly Pro Pro Gly Glu Ala Gly
645 650 655
Lys Pro Gly Glu Gln Gly Val Pro Gly Asp Leu Gly Ala Pro Gly Pro
660 665 670
Ser Gly Ala Arg Gly Glu Arg Gly Phe Pro Gly Glu Arg Gly Val Gln
675 680 685
Gly Pro Pro Gly Pro Ala Gly Pro Arg Gly Ala Asn Gly Ala Pro Gly
690 695 700
Asn Asp Gly Ala Lys Gly Asp Ala Gly Ala Pro Gly Ala Pro Gly Ser
705 710 715 720
Gln Gly Ala Pro Gly Leu Gln Gly Met Pro Gly Glu Arg Gly Ala Ala
725 730 735
Gly Leu Pro Gly Pro Lys Gly Asp Arg Gly Asp Ala Gly Pro Lys Gly
740 745 750
Ala Asp Gly Ser Pro Gly Lys Asp Gly Val Arg Gly Leu Thr Gly Pro
755 760 765
Ile Gly Pro Pro Gly Pro Ala Gly Ala Pro Gly Asp Lys Gly Glu Ser
770 775 780
Gly Pro Ser Gly Pro Ala Gly Pro Thr Gly Ala Arg Gly Ala Pro Gly
785 790 795 800
Asp Arg Gly Glu Pro Gly Pro Pro Gly Pro Ala Gly Phe Ala Gly Pro
805 810 815
Pro Gly Ala Asp Gly Gln Pro Gly Ala Lys Gly Glu Pro Gly Asp Ala
820 825 830
Gly Ala Lys Gly Asp Ala Gly Pro Pro Gly Pro Ala Gly Pro Ala Gly
835 840 845
Pro Pro Gly Pro Ile Gly Asn Val Gly Ala Pro Gly Ala Lys Gly Ala
850 855 860
Arg Gly Ser Ala Gly Pro Pro Gly Ala Thr Gly Phe Pro Gly Ala Ala
865 870 875 880
Gly Arg Val Gly Pro Pro Gly Pro Ser Gly Asn Ala Gly Pro Pro Gly
885 890 895
Pro Pro Gly Pro Ala Gly Lys Glu Gly Gly Lys Gly Pro Arg Gly Glu
900 905 910
Thr Gly Pro Ala Gly Arg Pro Gly Glu Val Gly Pro Pro Gly Pro Pro
915 920 925
Gly Pro Ala Gly Glu Lys Gly Ser Pro Gly Ala Asp Gly Pro Ala Gly
930 935 940
Ala Pro Gly Thr Pro Gly Pro Gln Gly Ile Ala Gly Gln Arg Gly Val
945 950 955 960
Val Gly Leu Pro Gly Gln Arg Gly Glu Arg Gly Phe Pro Gly Leu Pro
965 970 975
Gly Pro Ser Gly Glu Pro Gly Lys Gln Gly Pro Ser Gly Ala Ser Gly
980 985 990
Glu Arg Gly Pro Pro Gly Pro Met Gly Pro Pro Gly Leu Ala Gly Pro
995 1000 1005
Pro Gly Glu Ser Gly Arg Glu Gly Ala Pro Gly Ala Glu Gly Ser
1010 1015 1020
Pro Gly Arg Asp Gly Ser Pro Gly Ala Lys Gly Asp Arg Gly Glu
1025 1030 1035
Thr Gly Pro Ala Gly Pro Pro Gly Ala Pro Gly Ala Pro Gly Ala
1040 1045 1050
Pro Gly Pro Val Gly Pro Ala Gly Lys Ser Gly Asp Arg Gly Glu
1055 1060 1065
Thr Gly Pro Ala Gly Pro Ala Gly Pro Val Gly Pro Val Gly Ala
1070 1075 1080
Arg Gly Pro Ala Gly Pro Gln Gly Pro Arg Gly Asp Lys Gly Glu
1085 1090 1095
Thr Gly Glu Gln Gly Asp Arg Gly Ile Lys Gly His Arg Gly Phe
1100 1105 1110
Ser Gly Leu Gln Gly Pro Pro Gly Pro Pro Gly Ser Pro Gly Glu
1115 1120 1125
Gln Gly Pro Ser Gly Ala Ser Gly Pro Ala Gly Pro Arg Gly Pro
1130 1135 1140
Pro Gly Ser Ala Gly Ala Pro Gly Lys Asp Gly Leu Asn Gly Leu
1145 1150 1155
Pro Gly Pro Ile Gly Pro Pro Gly Pro Arg Gly Arg Thr Gly Asp
1160 1165 1170
Ala Gly Pro Val Gly Pro Pro Gly Pro Pro Gly Pro Pro Gly Pro
1175 1180 1185
Pro Gly Pro Pro Ser Ala Gly Phe Asp Phe Ser Phe Leu Pro Gln
1190 1195 1200
Pro Pro Gln Glu Lys Ala His Asp Gly Gly Arg Tyr Tyr Arg Ala
1205 1210 1215
Asp Asp Ala Asn Val Val Arg Asp Arg Asp Leu Glu Val Asp Thr
1220 1225 1230
Thr Leu Lys Ser Leu Ser Gln Gln Ile Glu Asn Ile Arg Ser Pro
1235 1240 1245
Glu Gly Ser Arg Lys Asn Pro Ala Arg Thr Cys Arg Asp Leu Lys
1250 1255 1260
Met Cys His Ser Asp Trp Lys Ser Gly Glu Tyr Trp Ile Asp Pro
1265 1270 1275
Asn Gln Gly Cys Asn Leu Asp Ala Ile Lys Val Phe Cys Asn Met
1280 1285 1290
Glu Thr Gly Glu Thr Cys Val Tyr Pro Thr Gln Pro Ser Val Ala
1295 1300 1305
Gln Lys Asn Trp Tyr Ile Ser Lys Asn Pro Lys Asp Lys Arg His
1310 1315 1320
Val Trp Phe Gly Glu Ser Met Thr Asp Gly Phe Gln Phe Glu Tyr
1325 1330 1335
Gly Gly Gln Gly Ser Asp Pro Ala Asp Val Ala Ile Gln Leu Thr
1340 1345 1350
Phe Leu Arg Leu Met Ser Thr Glu Ala Ser Gln Asn Ile Thr Tyr
1355 1360 1365
His Cys Lys Asn Ser Val Ala Tyr Met Asp Gln Gln Thr Gly Asn
1370 1375 1380
Leu Lys Lys Ala Leu Leu Leu Gln Gly Ser Asn Glu Ile Glu Ile
1385 1390 1395
Arg Ala Glu Gly Asn Ser Arg Phe Thr Tyr Ser Val Thr Val Asp
1400 1405 1410
Gly Cys Thr Ser His Thr Gly Ala Trp Gly Lys Thr Val Ile Glu
1415 1420 1425
Tyr Lys Thr Thr Lys Thr Ser Arg Leu Pro Ile Ile Asp Val Ala
1430 1435 1440
Pro Leu Asp Val Gly Ala Pro Asp Gln Glu Phe Gly Phe Asp Val
1445 1450 1455
Gly Pro Val Cys Phe Leu
1460
<210> 62
<211> 1366
<212> ПРТ
<213> Homo sapiens
<400> 62
Met Leu Ser Phe Val Asp Thr Arg Thr Leu Leu Leu Leu Ala Val Thr
1 5 10 15
Leu Cys Leu Ala Thr Cys Gln Ser Leu Gln Glu Glu Thr Val Arg Lys
20 25 30
Gly Pro Ala Gly Asp Arg Gly Pro Arg Gly Glu Arg Gly Pro Pro Gly
35 40 45
Pro Pro Gly Arg Asp Gly Glu Asp Gly Pro Thr Gly Pro Pro Gly Pro
50 55 60
Pro Gly Pro Pro Gly Pro Pro Gly Leu Gly Gly Asn Phe Ala Ala Gln
65 70 75 80
Tyr Asp Gly Lys Gly Val Gly Leu Gly Pro Gly Pro Met Gly Leu Met
85 90 95
Gly Pro Arg Gly Pro Pro Gly Ala Ala Gly Ala Pro Gly Pro Gln Gly
100 105 110
Phe Gln Gly Pro Ala Gly Glu Pro Gly Glu Pro Gly Gln Thr Gly Pro
115 120 125
Ala Gly Ala Arg Gly Pro Ala Gly Pro Pro Gly Lys Ala Gly Glu Asp
130 135 140
Gly His Pro Gly Lys Pro Gly Arg Pro Gly Glu Arg Gly Val Val Gly
145 150 155 160
Pro Gln Gly Ala Arg Gly Phe Pro Gly Thr Pro Gly Leu Pro Gly Phe
165 170 175
Lys Gly Ile Arg Gly His Asn Gly Leu Asp Gly Leu Lys Gly Gln Pro
180 185 190
Gly Ala Pro Gly Val Lys Gly Glu Pro Gly Ala Pro Gly Glu Asn Gly
195 200 205
Thr Pro Gly Gln Thr Gly Ala Arg Gly Leu Pro Gly Glu Arg Gly Arg
210 215 220
Val Gly Ala Pro Gly Pro Ala Gly Ala Arg Gly Ser Asp Gly Ser Val
225 230 235 240
Gly Pro Val Gly Pro Ala Gly Pro Ile Gly Ser Ala Gly Pro Pro Gly
245 250 255
Phe Pro Gly Ala Pro Gly Pro Lys Gly Glu Ile Gly Ala Val Gly Asn
260 265 270
Ala Gly Pro Ala Gly Pro Ala Gly Pro Arg Gly Glu Val Gly Leu Pro
275 280 285
Gly Leu Ser Gly Pro Val Gly Pro Pro Gly Asn Pro Gly Ala Asn Gly
290 295 300
Leu Thr Gly Ala Lys Gly Ala Ala Gly Leu Pro Gly Val Ala Gly Ala
305 310 315 320
Pro Gly Leu Pro Gly Pro Arg Gly Ile Pro Gly Pro Val Gly Ala Ala
325 330 335
Gly Ala Thr Gly Ala Arg Gly Leu Val Gly Glu Pro Gly Pro Ala Gly
340 345 350
Ser Lys Gly Glu Ser Gly Asn Lys Gly Glu Pro Gly Ser Ala Gly Pro
355 360 365
Gln Gly Pro Pro Gly Pro Ser Gly Glu Glu Gly Lys Arg Gly Pro Asn
370 375 380
Gly Glu Ala Gly Ser Ala Gly Pro Pro Gly Pro Pro Gly Leu Arg Gly
385 390 395 400
Ser Pro Gly Ser Arg Gly Leu Pro Gly Ala Asp Gly Arg Ala Gly Val
405 410 415
Met Gly Pro Pro Gly Ser Arg Gly Ala Ser Gly Pro Ala Gly Val Arg
420 425 430
Gly Pro Asn Gly Asp Ala Gly Arg Pro Gly Glu Pro Gly Leu Met Gly
435 440 445
Pro Arg Gly Leu Pro Gly Ser Pro Gly Asn Ile Gly Pro Ala Gly Lys
450 455 460
Glu Gly Pro Val Gly Leu Pro Gly Ile Asp Gly Arg Pro Gly Pro Ile
465 470 475 480
Gly Pro Ala Gly Ala Arg Gly Glu Pro Gly Asn Ile Gly Phe Pro Gly
485 490 495
Pro Lys Gly Pro Thr Gly Asp Pro Gly Lys Asn Gly Asp Lys Gly His
500 505 510
Ala Gly Leu Ala Gly Ala Arg Gly Ala Pro Gly Pro Asp Gly Asn Asn
515 520 525
Gly Ala Gln Gly Pro Pro Gly Pro Gln Gly Val Gln Gly Gly Lys Gly
530 535 540
Glu Gln Gly Pro Pro Gly Pro Pro Gly Phe Gln Gly Leu Pro Gly Pro
545 550 555 560
Ser Gly Pro Ala Gly Glu Val Gly Lys Pro Gly Glu Arg Gly Leu His
565 570 575
Gly Glu Phe Gly Leu Pro Gly Pro Ala Gly Pro Arg Gly Glu Arg Gly
580 585 590
Pro Pro Gly Glu Ser Gly Ala Ala Gly Pro Thr Gly Pro Ile Gly Ser
595 600 605
Arg Gly Pro Ser Gly Pro Pro Gly Pro Asp Gly Asn Lys Gly Glu Pro
610 615 620
Gly Val Val Gly Ala Val Gly Thr Ala Gly Pro Ser Gly Pro Ser Gly
625 630 635 640
Leu Pro Gly Glu Arg Gly Ala Ala Gly Ile Pro Gly Gly Lys Gly Glu
645 650 655
Lys Gly Glu Pro Gly Leu Arg Gly Glu Ile Gly Asn Pro Gly Arg Asp
660 665 670
Gly Ala Arg Gly Ala Pro Gly Ala Val Gly Ala Pro Gly Pro Ala Gly
675 680 685
Ala Thr Gly Asp Arg Gly Glu Ala Gly Ala Ala Gly Pro Ala Gly Pro
690 695 700
Ala Gly Pro Arg Gly Ser Pro Gly Glu Arg Gly Glu Val Gly Pro Ala
705 710 715 720
Gly Pro Asn Gly Phe Ala Gly Pro Ala Gly Ala Ala Gly Gln Pro Gly
725 730 735
Ala Lys Gly Glu Arg Gly Ala Lys Gly Pro Lys Gly Glu Asn Gly Val
740 745 750
Val Gly Pro Thr Gly Pro Val Gly Ala Ala Gly Pro Ala Gly Pro Asn
755 760 765
Gly Pro Pro Gly Pro Ala Gly Ser Arg Gly Asp Gly Gly Pro Pro Gly
770 775 780
Met Thr Gly Phe Pro Gly Ala Ala Gly Arg Thr Gly Pro Pro Gly Pro
785 790 795 800
Ser Gly Ile Ser Gly Pro Pro Gly Pro Pro Gly Pro Ala Gly Lys Glu
805 810 815
Gly Leu Arg Gly Pro Arg Gly Asp Gln Gly Pro Val Gly Arg Thr Gly
820 825 830
Glu Val Gly Ala Val Gly Pro Pro Gly Phe Ala Gly Glu Lys Gly Pro
835 840 845
Ser Gly Glu Ala Gly Thr Ala Gly Pro Pro Gly Thr Pro Gly Pro Gln
850 855 860
Gly Leu Leu Gly Ala Pro Gly Ile Leu Gly Leu Pro Gly Ser Arg Gly
865 870 875 880
Glu Arg Gly Leu Pro Gly Val Ala Gly Ala Val Gly Glu Pro Gly Pro
885 890 895
Leu Gly Ile Ala Gly Pro Pro Gly Ala Arg Gly Pro Pro Gly Ala Val
900 905 910
Gly Ser Pro Gly Val Asn Gly Ala Pro Gly Glu Ala Gly Arg Asp Gly
915 920 925
Asn Pro Gly Asn Asp Gly Pro Pro Gly Arg Asp Gly Gln Pro Gly His
930 935 940
Lys Gly Glu Arg Gly Tyr Pro Gly Asn Ile Gly Pro Val Gly Ala Ala
945 950 955 960
Gly Ala Pro Gly Pro His Gly Pro Val Gly Pro Ala Gly Lys His Gly
965 970 975
Asn Arg Gly Glu Thr Gly Pro Ser Gly Pro Val Gly Pro Ala Gly Ala
980 985 990
Val Gly Pro Arg Gly Pro Ser Gly Pro Gln Gly Ile Arg Gly Asp Lys
995 1000 1005
Gly Glu Pro Gly Glu Lys Gly Pro Arg Gly Leu Pro Gly Leu Lys
1010 1015 1020
Gly His Asn Gly Leu Gln Gly Leu Pro Gly Ile Ala Gly His His
1025 1030 1035
Gly Asp Gln Gly Ala Pro Gly Ser Val Gly Pro Ala Gly Pro Arg
1040 1045 1050
Gly Pro Ala Gly Pro Ser Gly Pro Ala Gly Lys Asp Gly Arg Thr
1055 1060 1065
Gly His Pro Gly Thr Val Gly Pro Ala Gly Ile Arg Gly Pro Gln
1070 1075 1080
Gly His Gln Gly Pro Ala Gly Pro Pro Gly Pro Pro Gly Pro Pro
1085 1090 1095
Gly Pro Pro Gly Val Ser Gly Gly Gly Tyr Asp Phe Gly Tyr Asp
1100 1105 1110
Gly Asp Phe Tyr Arg Ala Asp Gln Pro Arg Ser Ala Pro Ser Leu
1115 1120 1125
Arg Pro Lys Asp Tyr Glu Val Asp Ala Thr Leu Lys Ser Leu Asn
1130 1135 1140
Asn Gln Ile Glu Thr Leu Leu Thr Pro Glu Gly Ser Arg Lys Asn
1145 1150 1155
Pro Ala Arg Thr Cys Arg Asp Leu Arg Leu Ser His Pro Glu Trp
1160 1165 1170
Ser Ser Gly Tyr Tyr Trp Ile Asp Pro Asn Gln Gly Cys Thr Met
1175 1180 1185
Asp Ala Ile Lys Val Tyr Cys Asp Phe Ser Thr Gly Glu Thr Cys
1190 1195 1200
Ile Arg Ala Gln Pro Glu Asn Ile Pro Ala Lys Asn Trp Tyr Arg
1205 1210 1215
Ser Ser Lys Asp Lys Lys His Val Trp Leu Gly Glu Thr Ile Asn
1220 1225 1230
Ala Gly Ser Gln Phe Glu Tyr Asn Val Glu Gly Val Thr Ser Lys
1235 1240 1245
Glu Met Ala Thr Gln Leu Ala Phe Met Arg Leu Leu Ala Asn Tyr
1250 1255 1260
Ala Ser Gln Asn Ile Thr Tyr His Cys Lys Asn Ser Ile Ala Tyr
1265 1270 1275
Met Asp Glu Glu Thr Gly Asn Leu Lys Lys Ala Val Ile Leu Gln
1280 1285 1290
Gly Ser Asn Asp Val Glu Leu Val Ala Glu Gly Asn Ser Arg Phe
1295 1300 1305
Thr Tyr Thr Val Leu Val Asp Gly Cys Ser Lys Lys Thr Asn Glu
1310 1315 1320
Trp Gly Lys Thr Ile Ile Glu Tyr Lys Thr Asn Lys Pro Ser Arg
1325 1330 1335
Leu Pro Phe Leu Asp Ile Ala Pro Leu Asp Ile Gly Gly Ala Asp
1340 1345 1350
Gln Glu Phe Phe Val Asp Ile Gly Pro Val Cys Phe Lys
1355 1360 1365
<210> 63
<211> 1487
<212> ПРТ
<213> Homo sapiens
<400> 63
Met Ile Arg Leu Gly Ala Pro Gln Thr Leu Val Leu Leu Thr Leu Leu
1 5 10 15
Val Ala Ala Val Leu Arg Cys Gln Gly Gln Asp Val Gln Glu Ala Gly
20 25 30
Ser Cys Val Gln Asp Gly Gln Arg Tyr Asn Asp Lys Asp Val Trp Lys
35 40 45
Pro Glu Pro Cys Arg Ile Cys Val Cys Asp Thr Gly Thr Val Leu Cys
50 55 60
Asp Asp Ile Ile Cys Glu Asp Val Lys Asp Cys Leu Ser Pro Glu Ile
65 70 75 80
Pro Phe Gly Glu Cys Cys Pro Ile Cys Pro Thr Asp Leu Ala Thr Ala
85 90 95
Ser Gly Gln Pro Gly Pro Lys Gly Gln Lys Gly Glu Pro Gly Asp Ile
100 105 110
Lys Asp Ile Val Gly Pro Lys Gly Pro Pro Gly Pro Gln Gly Pro Ala
115 120 125
Gly Glu Gln Gly Pro Arg Gly Asp Arg Gly Asp Lys Gly Glu Lys Gly
130 135 140
Ala Pro Gly Pro Arg Gly Arg Asp Gly Glu Pro Gly Thr Pro Gly Asn
145 150 155 160
Pro Gly Pro Pro Gly Pro Pro Gly Pro Pro Gly Pro Pro Gly Leu Gly
165 170 175
Gly Asn Phe Ala Ala Gln Met Ala Gly Gly Phe Asp Glu Lys Ala Gly
180 185 190
Gly Ala Gln Leu Gly Val Met Gln Gly Pro Met Gly Pro Met Gly Pro
195 200 205
Arg Gly Pro Pro Gly Pro Ala Gly Ala Pro Gly Pro Gln Gly Phe Gln
210 215 220
Gly Asn Pro Gly Glu Pro Gly Glu Pro Gly Val Ser Gly Pro Met Gly
225 230 235 240
Pro Arg Gly Pro Pro Gly Pro Pro Gly Lys Pro Gly Asp Asp Gly Glu
245 250 255
Ala Gly Lys Pro Gly Lys Ala Gly Glu Arg Gly Pro Pro Gly Pro Gln
260 265 270
Gly Ala Arg Gly Phe Pro Gly Thr Pro Gly Leu Pro Gly Val Lys Gly
275 280 285
His Arg Gly Tyr Pro Gly Leu Asp Gly Ala Lys Gly Glu Ala Gly Ala
290 295 300
Pro Gly Val Lys Gly Glu Ser Gly Ser Pro Gly Glu Asn Gly Ser Pro
305 310 315 320
Gly Pro Met Gly Pro Arg Gly Leu Pro Gly Glu Arg Gly Arg Thr Gly
325 330 335
Pro Ala Gly Ala Ala Gly Ala Arg Gly Asn Asp Gly Gln Pro Gly Pro
340 345 350
Ala Gly Pro Pro Gly Pro Val Gly Pro Ala Gly Gly Pro Gly Phe Pro
355 360 365
Gly Ala Pro Gly Ala Lys Gly Glu Ala Gly Pro Thr Gly Ala Arg Gly
370 375 380
Pro Glu Gly Ala Gln Gly Pro Arg Gly Glu Pro Gly Thr Pro Gly Ser
385 390 395 400
Pro Gly Pro Ala Gly Ala Ser Gly Asn Pro Gly Thr Asp Gly Ile Pro
405 410 415
Gly Ala Lys Gly Ser Ala Gly Ala Pro Gly Ile Ala Gly Ala Pro Gly
420 425 430
Phe Pro Gly Pro Arg Gly Pro Pro Gly Pro Gln Gly Ala Thr Gly Pro
435 440 445
Leu Gly Pro Lys Gly Gln Thr Gly Glu Pro Gly Ile Ala Gly Phe Lys
450 455 460
Gly Glu Gln Gly Pro Lys Gly Glu Pro Gly Pro Ala Gly Pro Gln Gly
465 470 475 480
Ala Pro Gly Pro Ala Gly Glu Glu Gly Lys Arg Gly Ala Arg Gly Glu
485 490 495
Pro Gly Gly Val Gly Pro Ile Gly Pro Pro Gly Glu Arg Gly Ala Pro
500 505 510
Gly Asn Arg Gly Phe Pro Gly Gln Asp Gly Leu Ala Gly Pro Lys Gly
515 520 525
Ala Pro Gly Glu Arg Gly Pro Ser Gly Leu Ala Gly Pro Lys Gly Ala
530 535 540
Asn Gly Asp Pro Gly Arg Pro Gly Glu Pro Gly Leu Pro Gly Ala Arg
545 550 555 560
Gly Leu Thr Gly Arg Pro Gly Asp Ala Gly Pro Gln Gly Lys Val Gly
565 570 575
Pro Ser Gly Ala Pro Gly Glu Asp Gly Arg Pro Gly Pro Pro Gly Pro
580 585 590
Gln Gly Ala Arg Gly Gln Pro Gly Val Met Gly Phe Pro Gly Pro Lys
595 600 605
Gly Ala Asn Gly Glu Pro Gly Lys Ala Gly Glu Lys Gly Leu Pro Gly
610 615 620
Ala Pro Gly Leu Arg Gly Leu Pro Gly Lys Asp Gly Glu Thr Gly Ala
625 630 635 640
Ala Gly Pro Pro Gly Pro Ala Gly Pro Ala Gly Glu Arg Gly Glu Gln
645 650 655
Gly Ala Pro Gly Pro Ser Gly Phe Gln Gly Leu Pro Gly Pro Pro Gly
660 665 670
Pro Pro Gly Glu Gly Gly Lys Pro Gly Asp Gln Gly Val Pro Gly Glu
675 680 685
Ala Gly Ala Pro Gly Leu Val Gly Pro Arg Gly Glu Arg Gly Phe Pro
690 695 700
Gly Glu Arg Gly Ser Pro Gly Ala Gln Gly Leu Gln Gly Pro Arg Gly
705 710 715 720
Leu Pro Gly Thr Pro Gly Thr Asp Gly Pro Lys Gly Ala Ser Gly Pro
725 730 735
Ala Gly Pro Pro Gly Ala Gln Gly Pro Pro Gly Leu Gln Gly Met Pro
740 745 750
Gly Glu Arg Gly Ala Ala Gly Ile Ala Gly Pro Lys Gly Asp Arg Gly
755 760 765
Asp Val Gly Glu Lys Gly Pro Glu Gly Ala Pro Gly Lys Asp Gly Gly
770 775 780
Arg Gly Leu Thr Gly Pro Ile Gly Pro Pro Gly Pro Ala Gly Ala Asn
785 790 795 800
Gly Glu Lys Gly Glu Val Gly Pro Pro Gly Pro Ala Gly Ser Ala Gly
805 810 815
Ala Arg Gly Ala Pro Gly Glu Arg Gly Glu Thr Gly Pro Pro Gly Pro
820 825 830
Ala Gly Phe Ala Gly Pro Pro Gly Ala Asp Gly Gln Pro Gly Ala Lys
835 840 845
Gly Glu Gln Gly Glu Ala Gly Gln Lys Gly Asp Ala Gly Ala Pro Gly
850 855 860
Pro Gln Gly Pro Ser Gly Ala Pro Gly Pro Gln Gly Pro Thr Gly Val
865 870 875 880
Thr Gly Pro Lys Gly Ala Arg Gly Ala Gln Gly Pro Pro Gly Ala Thr
885 890 895
Gly Phe Pro Gly Ala Ala Gly Arg Val Gly Pro Pro Gly Ser Asn Gly
900 905 910
Asn Pro Gly Pro Pro Gly Pro Pro Gly Pro Ser Gly Lys Asp Gly Pro
915 920 925
Lys Gly Ala Arg Gly Asp Ser Gly Pro Pro Gly Arg Ala Gly Glu Pro
930 935 940
Gly Leu Gln Gly Pro Ala Gly Pro Pro Gly Glu Lys Gly Glu Pro Gly
945 950 955 960
Asp Asp Gly Pro Ser Gly Ala Glu Gly Pro Pro Gly Pro Gln Gly Leu
965 970 975
Ala Gly Gln Arg Gly Ile Val Gly Leu Pro Gly Gln Arg Gly Glu Arg
980 985 990
Gly Phe Pro Gly Leu Pro Gly Pro Ser Gly Glu Pro Gly Lys Gln Gly
995 1000 1005
Ala Pro Gly Ala Ser Gly Asp Arg Gly Pro Pro Gly Pro Val Gly
1010 1015 1020
Pro Pro Gly Leu Thr Gly Pro Ala Gly Glu Pro Gly Arg Glu Gly
1025 1030 1035
Ser Pro Gly Ala Asp Gly Pro Pro Gly Arg Asp Gly Ala Ala Gly
1040 1045 1050
Val Lys Gly Asp Arg Gly Glu Thr Gly Ala Val Gly Ala Pro Gly
1055 1060 1065
Ala Pro Gly Pro Pro Gly Ser Pro Gly Pro Ala Gly Pro Thr Gly
1070 1075 1080
Lys Gln Gly Asp Arg Gly Glu Ala Gly Ala Gln Gly Pro Met Gly
1085 1090 1095
Pro Ser Gly Pro Ala Gly Ala Arg Gly Ile Gln Gly Pro Gln Gly
1100 1105 1110
Pro Arg Gly Asp Lys Gly Glu Ala Gly Glu Pro Gly Glu Arg Gly
1115 1120 1125
Leu Lys Gly His Arg Gly Phe Thr Gly Leu Gln Gly Leu Pro Gly
1130 1135 1140
Pro Pro Gly Pro Ser Gly Asp Gln Gly Ala Ser Gly Pro Ala Gly
1145 1150 1155
Pro Ser Gly Pro Arg Gly Pro Pro Gly Pro Val Gly Pro Ser Gly
1160 1165 1170
Lys Asp Gly Ala Asn Gly Ile Pro Gly Pro Ile Gly Pro Pro Gly
1175 1180 1185
Pro Arg Gly Arg Ser Gly Glu Thr Gly Pro Ala Gly Pro Pro Gly
1190 1195 1200
Asn Pro Gly Pro Pro Gly Pro Pro Gly Pro Pro Gly Pro Gly Ile
1205 1210 1215
Asp Met Ser Ala Phe Ala Gly Leu Gly Pro Arg Glu Lys Gly Pro
1220 1225 1230
Asp Pro Leu Gln Tyr Met Arg Ala Asp Gln Ala Ala Gly Gly Leu
1235 1240 1245
Arg Gln His Asp Ala Glu Val Asp Ala Thr Leu Lys Ser Leu Asn
1250 1255 1260
Asn Gln Ile Glu Ser Ile Arg Ser Pro Glu Gly Ser Arg Lys Asn
1265 1270 1275
Pro Ala Arg Thr Cys Arg Asp Leu Lys Leu Cys His Pro Glu Trp
1280 1285 1290
Lys Ser Gly Asp Tyr Trp Ile Asp Pro Asn Gln Gly Cys Thr Leu
1295 1300 1305
Asp Ala Met Lys Val Phe Cys Asn Met Glu Thr Gly Glu Thr Cys
1310 1315 1320
Val Tyr Pro Asn Pro Ala Asn Val Pro Lys Lys Asn Trp Trp Ser
1325 1330 1335
Ser Lys Ser Lys Glu Lys Lys His Ile Trp Phe Gly Glu Thr Ile
1340 1345 1350
Asn Gly Gly Phe His Phe Ser Tyr Gly Asp Asp Asn Leu Ala Pro
1355 1360 1365
Asn Thr Ala Asn Val Gln Met Thr Phe Leu Arg Leu Leu Ser Thr
1370 1375 1380
Glu Gly Ser Gln Asn Ile Thr Tyr His Cys Lys Asn Ser Ile Ala
1385 1390 1395
Tyr Leu Asp Glu Ala Ala Gly Asn Leu Lys Lys Ala Leu Leu Ile
1400 1405 1410
Gln Gly Ser Asn Asp Val Glu Ile Arg Ala Glu Gly Asn Ser Arg
1415 1420 1425
Phe Thr Tyr Thr Ala Leu Lys Asp Gly Cys Thr Lys His Thr Gly
1430 1435 1440
Lys Trp Gly Lys Thr Val Ile Glu Tyr Arg Ser Gln Lys Thr Ser
1445 1450 1455
Arg Leu Pro Ile Ile Asp Ile Ala Pro Met Asp Ile Gly Gly Pro
1460 1465 1470
Glu Gln Glu Phe Gly Val Asp Ile Gly Pro Val Cys Phe Leu
1475 1480 1485
<210> 64
<211> 1418
<212> ПРТ
<213> Homo sapiens
<400> 64
Met Ile Arg Leu Gly Ala Pro Gln Thr Leu Val Leu Leu Thr Leu Leu
1 5 10 15
Val Ala Ala Val Leu Arg Cys Gln Gly Gln Asp Val Arg Gln Pro Gly
20 25 30
Pro Lys Gly Gln Lys Gly Glu Pro Gly Asp Ile Lys Asp Ile Val Gly
35 40 45
Pro Lys Gly Pro Pro Gly Pro Gln Gly Pro Ala Gly Glu Gln Gly Pro
50 55 60
Arg Gly Asp Arg Gly Asp Lys Gly Glu Lys Gly Ala Pro Gly Pro Arg
65 70 75 80
Gly Arg Asp Gly Glu Pro Gly Thr Pro Gly Asn Pro Gly Pro Pro Gly
85 90 95
Pro Pro Gly Pro Pro Gly Pro Pro Gly Leu Gly Gly Asn Phe Ala Ala
100 105 110
Gln Met Ala Gly Gly Phe Asp Glu Lys Ala Gly Gly Ala Gln Leu Gly
115 120 125
Val Met Gln Gly Pro Met Gly Pro Met Gly Pro Arg Gly Pro Pro Gly
130 135 140
Pro Ala Gly Ala Pro Gly Pro Gln Gly Phe Gln Gly Asn Pro Gly Glu
145 150 155 160
Pro Gly Glu Pro Gly Val Ser Gly Pro Met Gly Pro Arg Gly Pro Pro
165 170 175
Gly Pro Pro Gly Lys Pro Gly Asp Asp Gly Glu Ala Gly Lys Pro Gly
180 185 190
Lys Ala Gly Glu Arg Gly Pro Pro Gly Pro Gln Gly Ala Arg Gly Phe
195 200 205
Pro Gly Thr Pro Gly Leu Pro Gly Val Lys Gly His Arg Gly Tyr Pro
210 215 220
Gly Leu Asp Gly Ala Lys Gly Glu Ala Gly Ala Pro Gly Val Lys Gly
225 230 235 240
Glu Ser Gly Ser Pro Gly Glu Asn Gly Ser Pro Gly Pro Met Gly Pro
245 250 255
Arg Gly Leu Pro Gly Glu Arg Gly Arg Thr Gly Pro Ala Gly Ala Ala
260 265 270
Gly Ala Arg Gly Asn Asp Gly Gln Pro Gly Pro Ala Gly Pro Pro Gly
275 280 285
Pro Val Gly Pro Ala Gly Gly Pro Gly Phe Pro Gly Ala Pro Gly Ala
290 295 300
Lys Gly Glu Ala Gly Pro Thr Gly Ala Arg Gly Pro Glu Gly Ala Gln
305 310 315 320
Gly Pro Arg Gly Glu Pro Gly Thr Pro Gly Ser Pro Gly Pro Ala Gly
325 330 335
Ala Ser Gly Asn Pro Gly Thr Asp Gly Ile Pro Gly Ala Lys Gly Ser
340 345 350
Ala Gly Ala Pro Gly Ile Ala Gly Ala Pro Gly Phe Pro Gly Pro Arg
355 360 365
Gly Pro Pro Gly Pro Gln Gly Ala Thr Gly Pro Leu Gly Pro Lys Gly
370 375 380
Gln Thr Gly Glu Pro Gly Ile Ala Gly Phe Lys Gly Glu Gln Gly Pro
385 390 395 400
Lys Gly Glu Pro Gly Pro Ala Gly Pro Gln Gly Ala Pro Gly Pro Ala
405 410 415
Gly Glu Glu Gly Lys Arg Gly Ala Arg Gly Glu Pro Gly Gly Val Gly
420 425 430
Pro Ile Gly Pro Pro Gly Glu Arg Gly Ala Pro Gly Asn Arg Gly Phe
435 440 445
Pro Gly Gln Asp Gly Leu Ala Gly Pro Lys Gly Ala Pro Gly Glu Arg
450 455 460
Gly Pro Ser Gly Leu Ala Gly Pro Lys Gly Ala Asn Gly Asp Pro Gly
465 470 475 480
Arg Pro Gly Glu Pro Gly Leu Pro Gly Ala Arg Gly Leu Thr Gly Arg
485 490 495
Pro Gly Asp Ala Gly Pro Gln Gly Lys Val Gly Pro Ser Gly Ala Pro
500 505 510
Gly Glu Asp Gly Arg Pro Gly Pro Pro Gly Pro Gln Gly Ala Arg Gly
515 520 525
Gln Pro Gly Val Met Gly Phe Pro Gly Pro Lys Gly Ala Asn Gly Glu
530 535 540
Pro Gly Lys Ala Gly Glu Lys Gly Leu Pro Gly Ala Pro Gly Leu Arg
545 550 555 560
Gly Leu Pro Gly Lys Asp Gly Glu Thr Gly Ala Ala Gly Pro Pro Gly
565 570 575
Pro Ala Gly Pro Ala Gly Glu Arg Gly Glu Gln Gly Ala Pro Gly Pro
580 585 590
Ser Gly Phe Gln Gly Leu Pro Gly Pro Pro Gly Pro Pro Gly Glu Gly
595 600 605
Gly Lys Pro Gly Asp Gln Gly Val Pro Gly Glu Ala Gly Ala Pro Gly
610 615 620
Leu Val Gly Pro Arg Gly Glu Arg Gly Phe Pro Gly Glu Arg Gly Ser
625 630 635 640
Pro Gly Ala Gln Gly Leu Gln Gly Pro Arg Gly Leu Pro Gly Thr Pro
645 650 655
Gly Thr Asp Gly Pro Lys Gly Ala Ser Gly Pro Ala Gly Pro Pro Gly
660 665 670
Ala Gln Gly Pro Pro Gly Leu Gln Gly Met Pro Gly Glu Arg Gly Ala
675 680 685
Ala Gly Ile Ala Gly Pro Lys Gly Asp Arg Gly Asp Val Gly Glu Lys
690 695 700
Gly Pro Glu Gly Ala Pro Gly Lys Asp Gly Gly Arg Gly Leu Thr Gly
705 710 715 720
Pro Ile Gly Pro Pro Gly Pro Ala Gly Ala Asn Gly Glu Lys Gly Glu
725 730 735
Val Gly Pro Pro Gly Pro Ala Gly Ser Ala Gly Ala Arg Gly Ala Pro
740 745 750
Gly Glu Arg Gly Glu Thr Gly Pro Pro Gly Pro Ala Gly Phe Ala Gly
755 760 765
Pro Pro Gly Ala Asp Gly Gln Pro Gly Ala Lys Gly Glu Gln Gly Glu
770 775 780
Ala Gly Gln Lys Gly Asp Ala Gly Ala Pro Gly Pro Gln Gly Pro Ser
785 790 795 800
Gly Ala Pro Gly Pro Gln Gly Pro Thr Gly Val Thr Gly Pro Lys Gly
805 810 815
Ala Arg Gly Ala Gln Gly Pro Pro Gly Ala Thr Gly Phe Pro Gly Ala
820 825 830
Ala Gly Arg Val Gly Pro Pro Gly Ser Asn Gly Asn Pro Gly Pro Pro
835 840 845
Gly Pro Pro Gly Pro Ser Gly Lys Asp Gly Pro Lys Gly Ala Arg Gly
850 855 860
Asp Ser Gly Pro Pro Gly Arg Ala Gly Glu Pro Gly Leu Gln Gly Pro
865 870 875 880
Ala Gly Pro Pro Gly Glu Lys Gly Glu Pro Gly Asp Asp Gly Pro Ser
885 890 895
Gly Ala Glu Gly Pro Pro Gly Pro Gln Gly Leu Ala Gly Gln Arg Gly
900 905 910
Ile Val Gly Leu Pro Gly Gln Arg Gly Glu Arg Gly Phe Pro Gly Leu
915 920 925
Pro Gly Pro Ser Gly Glu Pro Gly Lys Gln Gly Ala Pro Gly Ala Ser
930 935 940
Gly Asp Arg Gly Pro Pro Gly Pro Val Gly Pro Pro Gly Leu Thr Gly
945 950 955 960
Pro Ala Gly Glu Pro Gly Arg Glu Gly Ser Pro Gly Ala Asp Gly Pro
965 970 975
Pro Gly Arg Asp Gly Ala Ala Gly Val Lys Gly Asp Arg Gly Glu Thr
980 985 990
Gly Ala Val Gly Ala Pro Gly Ala Pro Gly Pro Pro Gly Ser Pro Gly
995 1000 1005
Pro Ala Gly Pro Thr Gly Lys Gln Gly Asp Arg Gly Glu Ala Gly
1010 1015 1020
Ala Gln Gly Pro Met Gly Pro Ser Gly Pro Ala Gly Ala Arg Gly
1025 1030 1035
Ile Gln Gly Pro Gln Gly Pro Arg Gly Asp Lys Gly Glu Ala Gly
1040 1045 1050
Glu Pro Gly Glu Arg Gly Leu Lys Gly His Arg Gly Phe Thr Gly
1055 1060 1065
Leu Gln Gly Leu Pro Gly Pro Pro Gly Pro Ser Gly Asp Gln Gly
1070 1075 1080
Ala Ser Gly Pro Ala Gly Pro Ser Gly Pro Arg Gly Pro Pro Gly
1085 1090 1095
Pro Val Gly Pro Ser Gly Lys Asp Gly Ala Asn Gly Ile Pro Gly
1100 1105 1110
Pro Ile Gly Pro Pro Gly Pro Arg Gly Arg Ser Gly Glu Thr Gly
1115 1120 1125
Pro Ala Gly Pro Pro Gly Asn Pro Gly Pro Pro Gly Pro Pro Gly
1130 1135 1140
Pro Pro Gly Pro Gly Ile Asp Met Ser Ala Phe Ala Gly Leu Gly
1145 1150 1155
Pro Arg Glu Lys Gly Pro Asp Pro Leu Gln Tyr Met Arg Ala Asp
1160 1165 1170
Gln Ala Ala Gly Gly Leu Arg Gln His Asp Ala Glu Val Asp Ala
1175 1180 1185
Thr Leu Lys Ser Leu Asn Asn Gln Ile Glu Ser Ile Arg Ser Pro
1190 1195 1200
Glu Gly Ser Arg Lys Asn Pro Ala Arg Thr Cys Arg Asp Leu Lys
1205 1210 1215
Leu Cys His Pro Glu Trp Lys Ser Gly Asp Tyr Trp Ile Asp Pro
1220 1225 1230
Asn Gln Gly Cys Thr Leu Asp Ala Met Lys Val Phe Cys Asn Met
1235 1240 1245
Glu Thr Gly Glu Thr Cys Val Tyr Pro Asn Pro Ala Asn Val Pro
1250 1255 1260
Lys Lys Asn Trp Trp Ser Ser Lys Ser Lys Glu Lys Lys His Ile
1265 1270 1275
Trp Phe Gly Glu Thr Ile Asn Gly Gly Phe His Phe Ser Tyr Gly
1280 1285 1290
Asp Asp Asn Leu Ala Pro Asn Thr Ala Asn Val Gln Met Thr Phe
1295 1300 1305
Leu Arg Leu Leu Ser Thr Glu Gly Ser Gln Asn Ile Thr Tyr His
1310 1315 1320
Cys Lys Asn Ser Ile Ala Tyr Leu Asp Glu Ala Ala Gly Asn Leu
1325 1330 1335
Lys Lys Ala Leu Leu Ile Gln Gly Ser Asn Asp Val Glu Ile Arg
1340 1345 1350
Ala Glu Gly Asn Ser Arg Phe Thr Tyr Thr Ala Leu Lys Asp Gly
1355 1360 1365
Cys Thr Lys His Thr Gly Lys Trp Gly Lys Thr Val Ile Glu Tyr
1370 1375 1380
Arg Ser Gln Lys Thr Ser Arg Leu Pro Ile Ile Asp Ile Ala Pro
1385 1390 1395
Met Asp Ile Gly Gly Pro Glu Gln Glu Phe Gly Val Asp Ile Gly
1400 1405 1410
Pro Val Cys Phe Leu
1415
<210> 65
<211> 1466
<212> ПРТ
<213> Homo sapiens
<400> 65
Met Met Ser Phe Val Gln Lys Gly Ser Trp Leu Leu Leu Ala Leu Leu
1 5 10 15
His Pro Thr Ile Ile Leu Ala Gln Gln Glu Ala Val Glu Gly Gly Cys
20 25 30
Ser His Leu Gly Gln Ser Tyr Ala Asp Arg Asp Val Trp Lys Pro Glu
35 40 45
Pro Cys Gln Ile Cys Val Cys Asp Ser Gly Ser Val Leu Cys Asp Asp
50 55 60
Ile Ile Cys Asp Asp Gln Glu Leu Asp Cys Pro Asn Pro Glu Ile Pro
65 70 75 80
Phe Gly Glu Cys Cys Ala Val Cys Pro Gln Pro Pro Thr Ala Pro Thr
85 90 95
Arg Pro Pro Asn Gly Gln Gly Pro Gln Gly Pro Lys Gly Asp Pro Gly
100 105 110
Pro Pro Gly Ile Pro Gly Arg Asn Gly Asp Pro Gly Ile Pro Gly Gln
115 120 125
Pro Gly Ser Pro Gly Ser Pro Gly Pro Pro Gly Ile Cys Glu Ser Cys
130 135 140
Pro Thr Gly Pro Gln Asn Tyr Ser Pro Gln Tyr Asp Ser Tyr Asp Val
145 150 155 160
Lys Ser Gly Val Ala Val Gly Gly Leu Ala Gly Tyr Pro Gly Pro Ala
165 170 175
Gly Pro Pro Gly Pro Pro Gly Pro Pro Gly Thr Ser Gly His Pro Gly
180 185 190
Ser Pro Gly Ser Pro Gly Tyr Gln Gly Pro Pro Gly Glu Pro Gly Gln
195 200 205
Ala Gly Pro Ser Gly Pro Pro Gly Pro Pro Gly Ala Ile Gly Pro Ser
210 215 220
Gly Pro Ala Gly Lys Asp Gly Glu Ser Gly Arg Pro Gly Arg Pro Gly
225 230 235 240
Glu Arg Gly Leu Pro Gly Pro Pro Gly Ile Lys Gly Pro Ala Gly Ile
245 250 255
Pro Gly Phe Pro Gly Met Lys Gly His Arg Gly Phe Asp Gly Arg Asn
260 265 270
Gly Glu Lys Gly Glu Thr Gly Ala Pro Gly Leu Lys Gly Glu Asn Gly
275 280 285
Leu Pro Gly Glu Asn Gly Ala Pro Gly Pro Met Gly Pro Arg Gly Ala
290 295 300
Pro Gly Glu Arg Gly Arg Pro Gly Leu Pro Gly Ala Ala Gly Ala Arg
305 310 315 320
Gly Asn Asp Gly Ala Arg Gly Ser Asp Gly Gln Pro Gly Pro Pro Gly
325 330 335
Pro Pro Gly Thr Ala Gly Phe Pro Gly Ser Pro Gly Ala Lys Gly Glu
340 345 350
Val Gly Pro Ala Gly Ser Pro Gly Ser Asn Gly Ala Pro Gly Gln Arg
355 360 365
Gly Glu Pro Gly Pro Gln Gly His Ala Gly Ala Gln Gly Pro Pro Gly
370 375 380
Pro Pro Gly Ile Asn Gly Ser Pro Gly Gly Lys Gly Glu Met Gly Pro
385 390 395 400
Ala Gly Ile Pro Gly Ala Pro Gly Leu Met Gly Ala Arg Gly Pro Pro
405 410 415
Gly Pro Ala Gly Ala Asn Gly Ala Pro Gly Leu Arg Gly Gly Ala Gly
420 425 430
Glu Pro Gly Lys Asn Gly Ala Lys Gly Glu Pro Gly Pro Arg Gly Glu
435 440 445
Arg Gly Glu Ala Gly Ile Pro Gly Val Pro Gly Ala Lys Gly Glu Asp
450 455 460
Gly Lys Asp Gly Ser Pro Gly Glu Pro Gly Ala Asn Gly Leu Pro Gly
465 470 475 480
Ala Ala Gly Glu Arg Gly Ala Pro Gly Phe Arg Gly Pro Ala Gly Pro
485 490 495
Asn Gly Ile Pro Gly Glu Lys Gly Pro Ala Gly Glu Arg Gly Ala Pro
500 505 510
Gly Pro Ala Gly Pro Arg Gly Ala Ala Gly Glu Pro Gly Arg Asp Gly
515 520 525
Val Pro Gly Gly Pro Gly Met Arg Gly Met Pro Gly Ser Pro Gly Gly
530 535 540
Pro Gly Ser Asp Gly Lys Pro Gly Pro Pro Gly Ser Gln Gly Glu Ser
545 550 555 560
Gly Arg Pro Gly Pro Pro Gly Pro Ser Gly Pro Arg Gly Gln Pro Gly
565 570 575
Val Met Gly Phe Pro Gly Pro Lys Gly Asn Asp Gly Ala Pro Gly Lys
580 585 590
Asn Gly Glu Arg Gly Gly Pro Gly Gly Pro Gly Pro Gln Gly Pro Pro
595 600 605
Gly Lys Asn Gly Glu Thr Gly Pro Gln Gly Pro Pro Gly Pro Thr Gly
610 615 620
Pro Gly Gly Asp Lys Gly Asp Thr Gly Pro Pro Gly Pro Gln Gly Leu
625 630 635 640
Gln Gly Leu Pro Gly Thr Gly Gly Pro Pro Gly Glu Asn Gly Lys Pro
645 650 655
Gly Glu Pro Gly Pro Lys Gly Asp Ala Gly Ala Pro Gly Ala Pro Gly
660 665 670
Gly Lys Gly Asp Ala Gly Ala Pro Gly Glu Arg Gly Pro Pro Gly Leu
675 680 685
Ala Gly Ala Pro Gly Leu Arg Gly Gly Ala Gly Pro Pro Gly Pro Glu
690 695 700
Gly Gly Lys Gly Ala Ala Gly Pro Pro Gly Pro Pro Gly Ala Ala Gly
705 710 715 720
Thr Pro Gly Leu Gln Gly Met Pro Gly Glu Arg Gly Gly Leu Gly Ser
725 730 735
Pro Gly Pro Lys Gly Asp Lys Gly Glu Pro Gly Gly Pro Gly Ala Asp
740 745 750
Gly Val Pro Gly Lys Asp Gly Pro Arg Gly Pro Thr Gly Pro Ile Gly
755 760 765
Pro Pro Gly Pro Ala Gly Gln Pro Gly Asp Lys Gly Glu Gly Gly Ala
770 775 780
Pro Gly Leu Pro Gly Ile Ala Gly Pro Arg Gly Ser Pro Gly Glu Arg
785 790 795 800
Gly Glu Thr Gly Pro Pro Gly Pro Ala Gly Phe Pro Gly Ala Pro Gly
805 810 815
Gln Asn Gly Glu Pro Gly Gly Lys Gly Glu Arg Gly Ala Pro Gly Glu
820 825 830
Lys Gly Glu Gly Gly Pro Pro Gly Val Ala Gly Pro Pro Gly Gly Ser
835 840 845
Gly Pro Ala Gly Pro Pro Gly Pro Gln Gly Val Lys Gly Glu Arg Gly
850 855 860
Ser Pro Gly Gly Pro Gly Ala Ala Gly Phe Pro Gly Ala Arg Gly Leu
865 870 875 880
Pro Gly Pro Pro Gly Ser Asn Gly Asn Pro Gly Pro Pro Gly Pro Ser
885 890 895
Gly Ser Pro Gly Lys Asp Gly Pro Pro Gly Pro Ala Gly Asn Thr Gly
900 905 910
Ala Pro Gly Ser Pro Gly Val Ser Gly Pro Lys Gly Asp Ala Gly Gln
915 920 925
Pro Gly Glu Lys Gly Ser Pro Gly Ala Gln Gly Pro Pro Gly Ala Pro
930 935 940
Gly Pro Leu Gly Ile Ala Gly Ile Thr Gly Ala Arg Gly Leu Ala Gly
945 950 955 960
Pro Pro Gly Met Pro Gly Pro Arg Gly Ser Pro Gly Pro Gln Gly Val
965 970 975
Lys Gly Glu Ser Gly Lys Pro Gly Ala Asn Gly Leu Ser Gly Glu Arg
980 985 990
Gly Pro Pro Gly Pro Gln Gly Leu Pro Gly Leu Ala Gly Thr Ala Gly
995 1000 1005
Glu Pro Gly Arg Asp Gly Asn Pro Gly Ser Asp Gly Leu Pro Gly
1010 1015 1020
Arg Asp Gly Ser Pro Gly Gly Lys Gly Asp Arg Gly Glu Asn Gly
1025 1030 1035
Ser Pro Gly Ala Pro Gly Ala Pro Gly His Pro Gly Pro Pro Gly
1040 1045 1050
Pro Val Gly Pro Ala Gly Lys Ser Gly Asp Arg Gly Glu Ser Gly
1055 1060 1065
Pro Ala Gly Pro Ala Gly Ala Pro Gly Pro Ala Gly Ser Arg Gly
1070 1075 1080
Ala Pro Gly Pro Gln Gly Pro Arg Gly Asp Lys Gly Glu Thr Gly
1085 1090 1095
Glu Arg Gly Ala Ala Gly Ile Lys Gly His Arg Gly Phe Pro Gly
1100 1105 1110
Asn Pro Gly Ala Pro Gly Ser Pro Gly Pro Ala Gly Gln Gln Gly
1115 1120 1125
Ala Ile Gly Ser Pro Gly Pro Ala Gly Pro Arg Gly Pro Val Gly
1130 1135 1140
Pro Ser Gly Pro Pro Gly Lys Asp Gly Thr Ser Gly His Pro Gly
1145 1150 1155
Pro Ile Gly Pro Pro Gly Pro Arg Gly Asn Arg Gly Glu Arg Gly
1160 1165 1170
Ser Glu Gly Ser Pro Gly His Pro Gly Gln Pro Gly Pro Pro Gly
1175 1180 1185
Pro Pro Gly Ala Pro Gly Pro Cys Cys Gly Gly Val Gly Ala Ala
1190 1195 1200
Ala Ile Ala Gly Ile Gly Gly Glu Lys Ala Gly Gly Phe Ala Pro
1205 1210 1215
Tyr Tyr Gly Asp Glu Pro Met Asp Phe Lys Ile Asn Thr Asp Glu
1220 1225 1230
Ile Met Thr Ser Leu Lys Ser Val Asn Gly Gln Ile Glu Ser Leu
1235 1240 1245
Ile Ser Pro Asp Gly Ser Arg Lys Asn Pro Ala Arg Asn Cys Arg
1250 1255 1260
Asp Leu Lys Phe Cys His Pro Glu Leu Lys Ser Gly Glu Tyr Trp
1265 1270 1275
Val Asp Pro Asn Gln Gly Cys Lys Leu Asp Ala Ile Lys Val Phe
1280 1285 1290
Cys Asn Met Glu Thr Gly Glu Thr Cys Ile Ser Ala Asn Pro Leu
1295 1300 1305
Asn Val Pro Arg Lys His Trp Trp Thr Asp Ser Ser Ala Glu Lys
1310 1315 1320
Lys His Val Trp Phe Gly Glu Ser Met Asp Gly Gly Phe Gln Phe
1325 1330 1335
Ser Tyr Gly Asn Pro Glu Leu Pro Glu Asp Val Leu Asp Val Gln
1340 1345 1350
Leu Ala Phe Leu Arg Leu Leu Ser Ser Arg Ala Ser Gln Asn Ile
1355 1360 1365
Thr Tyr His Cys Lys Asn Ser Ile Ala Tyr Met Asp Gln Ala Ser
1370 1375 1380
Gly Asn Val Lys Lys Ala Leu Lys Leu Met Gly Ser Asn Glu Gly
1385 1390 1395
Glu Phe Lys Ala Glu Gly Asn Ser Lys Phe Thr Tyr Thr Val Leu
1400 1405 1410
Glu Asp Gly Cys Thr Lys His Thr Gly Glu Trp Ser Lys Thr Val
1415 1420 1425
Phe Glu Tyr Arg Thr Arg Lys Ala Val Arg Leu Pro Ile Val Asp
1430 1435 1440
Ile Ala Pro Tyr Asp Ile Gly Gly Pro Asp Gln Glu Phe Gly Val
1445 1450 1455
Asp Val Gly Pro Val Cys Phe Leu
1460 1465
<210> 66
<211> 1669
<212> ПРТ
<213> Homo sapiens
<400> 66
Met Gly Pro Arg Leu Ser Val Trp Leu Leu Leu Leu Pro Ala Ala Leu
1 5 10 15
Leu Leu His Glu Glu His Ser Arg Ala Ala Ala Lys Gly Gly Cys Ala
20 25 30
Gly Ser Gly Cys Gly Lys Cys Asp Cys His Gly Val Lys Gly Gln Lys
35 40 45
Gly Glu Arg Gly Leu Pro Gly Leu Gln Gly Val Ile Gly Phe Pro Gly
50 55 60
Met Gln Gly Pro Glu Gly Pro Gln Gly Pro Pro Gly Gln Lys Gly Asp
65 70 75 80
Thr Gly Glu Pro Gly Leu Pro Gly Thr Lys Gly Thr Arg Gly Pro Pro
85 90 95
Gly Ala Ser Gly Tyr Pro Gly Asn Pro Gly Leu Pro Gly Ile Pro Gly
100 105 110
Gln Asp Gly Pro Pro Gly Pro Pro Gly Ile Pro Gly Cys Asn Gly Thr
115 120 125
Lys Gly Glu Arg Gly Pro Leu Gly Pro Pro Gly Leu Pro Gly Phe Ala
130 135 140
Gly Asn Pro Gly Pro Pro Gly Leu Pro Gly Met Lys Gly Asp Pro Gly
145 150 155 160
Glu Ile Leu Gly His Val Pro Gly Met Leu Leu Lys Gly Glu Arg Gly
165 170 175
Phe Pro Gly Ile Pro Gly Thr Pro Gly Pro Pro Gly Leu Pro Gly Leu
180 185 190
Gln Gly Pro Val Gly Pro Pro Gly Phe Thr Gly Pro Pro Gly Pro Pro
195 200 205
Gly Pro Pro Gly Pro Pro Gly Glu Lys Gly Gln Met Gly Leu Ser Phe
210 215 220
Gln Gly Pro Lys Gly Asp Lys Gly Asp Gln Gly Val Ser Gly Pro Pro
225 230 235 240
Gly Val Pro Gly Gln Ala Gln Val Gln Glu Lys Gly Asp Phe Ala Thr
245 250 255
Lys Gly Glu Lys Gly Gln Lys Gly Glu Pro Gly Phe Gln Gly Met Pro
260 265 270
Gly Val Gly Glu Lys Gly Glu Pro Gly Lys Pro Gly Pro Arg Gly Lys
275 280 285
Pro Gly Lys Asp Gly Asp Lys Gly Glu Lys Gly Ser Pro Gly Phe Pro
290 295 300
Gly Glu Pro Gly Tyr Pro Gly Leu Ile Gly Arg Gln Gly Pro Gln Gly
305 310 315 320
Glu Lys Gly Glu Ala Gly Pro Pro Gly Pro Pro Gly Ile Val Ile Gly
325 330 335
Thr Gly Pro Leu Gly Glu Lys Gly Glu Arg Gly Tyr Pro Gly Thr Pro
340 345 350
Gly Pro Arg Gly Glu Pro Gly Pro Lys Gly Phe Pro Gly Leu Pro Gly
355 360 365
Gln Pro Gly Pro Pro Gly Leu Pro Val Pro Gly Gln Ala Gly Ala Pro
370 375 380
Gly Phe Pro Gly Glu Arg Gly Glu Lys Gly Asp Arg Gly Phe Pro Gly
385 390 395 400
Thr Ser Leu Pro Gly Pro Ser Gly Arg Asp Gly Leu Pro Gly Pro Pro
405 410 415
Gly Ser Pro Gly Pro Pro Gly Gln Pro Gly Tyr Thr Asn Gly Ile Val
420 425 430
Glu Cys Gln Pro Gly Pro Pro Gly Asp Gln Gly Pro Pro Gly Ile Pro
435 440 445
Gly Gln Pro Gly Phe Ile Gly Glu Ile Gly Glu Lys Gly Gln Lys Gly
450 455 460
Glu Ser Cys Leu Ile Cys Asp Ile Asp Gly Tyr Arg Gly Pro Pro Gly
465 470 475 480
Pro Gln Gly Pro Pro Gly Glu Ile Gly Phe Pro Gly Gln Pro Gly Ala
485 490 495
Lys Gly Asp Arg Gly Leu Pro Gly Arg Asp Gly Val Ala Gly Val Pro
500 505 510
Gly Pro Gln Gly Thr Pro Gly Leu Ile Gly Gln Pro Gly Ala Lys Gly
515 520 525
Glu Pro Gly Glu Phe Tyr Phe Asp Leu Arg Leu Lys Gly Asp Lys Gly
530 535 540
Asp Pro Gly Phe Pro Gly Gln Pro Gly Met Thr Gly Arg Ala Gly Ser
545 550 555 560
Pro Gly Arg Asp Gly His Pro Gly Leu Pro Gly Pro Lys Gly Ser Pro
565 570 575
Gly Ser Val Gly Leu Lys Gly Glu Arg Gly Pro Pro Gly Gly Val Gly
580 585 590
Phe Pro Gly Ser Arg Gly Asp Thr Gly Pro Pro Gly Pro Pro Gly Tyr
595 600 605
Gly Pro Ala Gly Pro Ile Gly Asp Lys Gly Gln Ala Gly Phe Pro Gly
610 615 620
Gly Pro Gly Ser Pro Gly Leu Pro Gly Pro Lys Gly Glu Pro Gly Lys
625 630 635 640
Ile Val Pro Leu Pro Gly Pro Pro Gly Ala Glu Gly Leu Pro Gly Ser
645 650 655
Pro Gly Phe Pro Gly Pro Gln Gly Asp Arg Gly Phe Pro Gly Thr Pro
660 665 670
Gly Arg Pro Gly Leu Pro Gly Glu Lys Gly Ala Val Gly Gln Pro Gly
675 680 685
Ile Gly Phe Pro Gly Pro Pro Gly Pro Lys Gly Val Asp Gly Leu Pro
690 695 700
Gly Asp Met Gly Pro Pro Gly Thr Pro Gly Arg Pro Gly Phe Asn Gly
705 710 715 720
Leu Pro Gly Asn Pro Gly Val Gln Gly Gln Lys Gly Glu Pro Gly Val
725 730 735
Gly Leu Pro Gly Leu Lys Gly Leu Pro Gly Leu Pro Gly Ile Pro Gly
740 745 750
Thr Pro Gly Glu Lys Gly Ser Ile Gly Val Pro Gly Val Pro Gly Glu
755 760 765
His Gly Ala Ile Gly Pro Pro Gly Leu Gln Gly Ile Arg Gly Glu Pro
770 775 780
Gly Pro Pro Gly Leu Pro Gly Ser Val Gly Ser Pro Gly Val Pro Gly
785 790 795 800
Ile Gly Pro Pro Gly Ala Arg Gly Pro Pro Gly Gly Gln Gly Pro Pro
805 810 815
Gly Leu Ser Gly Pro Pro Gly Ile Lys Gly Glu Lys Gly Phe Pro Gly
820 825 830
Phe Pro Gly Leu Asp Met Pro Gly Pro Lys Gly Asp Lys Gly Ala Gln
835 840 845
Gly Leu Pro Gly Ile Thr Gly Gln Ser Gly Leu Pro Gly Leu Pro Gly
850 855 860
Gln Gln Gly Ala Pro Gly Ile Pro Gly Phe Pro Gly Ser Lys Gly Glu
865 870 875 880
Met Gly Val Met Gly Thr Pro Gly Gln Pro Gly Ser Pro Gly Pro Val
885 890 895
Gly Ala Pro Gly Leu Pro Gly Glu Lys Gly Asp His Gly Phe Pro Gly
900 905 910
Ser Ser Gly Pro Arg Gly Asp Pro Gly Leu Lys Gly Asp Lys Gly Asp
915 920 925
Val Gly Leu Pro Gly Lys Pro Gly Ser Met Asp Lys Val Asp Met Gly
930 935 940
Ser Met Lys Gly Gln Lys Gly Asp Gln Gly Glu Lys Gly Gln Ile Gly
945 950 955 960
Pro Ile Gly Glu Lys Gly Ser Arg Gly Asp Pro Gly Thr Pro Gly Val
965 970 975
Pro Gly Lys Asp Gly Gln Ala Gly Gln Pro Gly Gln Pro Gly Pro Lys
980 985 990
Gly Asp Pro Gly Ile Ser Gly Thr Pro Gly Ala Pro Gly Leu Pro Gly
995 1000 1005
Pro Lys Gly Ser Val Gly Gly Met Gly Leu Pro Gly Thr Pro Gly
1010 1015 1020
Glu Lys Gly Val Pro Gly Ile Pro Gly Pro Gln Gly Ser Pro Gly
1025 1030 1035
Leu Pro Gly Asp Lys Gly Ala Lys Gly Glu Lys Gly Gln Ala Gly
1040 1045 1050
Pro Pro Gly Ile Gly Ile Pro Gly Leu Arg Gly Glu Lys Gly Asp
1055 1060 1065
Gln Gly Ile Ala Gly Phe Pro Gly Ser Pro Gly Glu Lys Gly Glu
1070 1075 1080
Lys Gly Ser Ile Gly Ile Pro Gly Met Pro Gly Ser Pro Gly Leu
1085 1090 1095
Lys Gly Ser Pro Gly Ser Val Gly Tyr Pro Gly Ser Pro Gly Leu
1100 1105 1110
Pro Gly Glu Lys Gly Asp Lys Gly Leu Pro Gly Leu Asp Gly Ile
1115 1120 1125
Pro Gly Val Lys Gly Glu Ala Gly Leu Pro Gly Thr Pro Gly Pro
1130 1135 1140
Thr Gly Pro Ala Gly Gln Lys Gly Glu Pro Gly Ser Asp Gly Ile
1145 1150 1155
Pro Gly Ser Ala Gly Glu Lys Gly Glu Pro Gly Leu Pro Gly Arg
1160 1165 1170
Gly Phe Pro Gly Phe Pro Gly Ala Lys Gly Asp Lys Gly Ser Lys
1175 1180 1185
Gly Glu Val Gly Phe Pro Gly Leu Ala Gly Ser Pro Gly Ile Pro
1190 1195 1200
Gly Ser Lys Gly Glu Gln Gly Phe Met Gly Pro Pro Gly Pro Gln
1205 1210 1215
Gly Gln Pro Gly Leu Pro Gly Ser Pro Gly His Ala Thr Glu Gly
1220 1225 1230
Pro Lys Gly Asp Arg Gly Pro Gln Gly Gln Pro Gly Leu Pro Gly
1235 1240 1245
Leu Pro Gly Pro Met Gly Pro Pro Gly Leu Pro Gly Ile Asp Gly
1250 1255 1260
Val Lys Gly Asp Lys Gly Asn Pro Gly Trp Pro Gly Ala Pro Gly
1265 1270 1275
Val Pro Gly Pro Lys Gly Asp Pro Gly Phe Gln Gly Met Pro Gly
1280 1285 1290
Ile Gly Gly Ser Pro Gly Ile Thr Gly Ser Lys Gly Asp Met Gly
1295 1300 1305
Pro Pro Gly Val Pro Gly Phe Gln Gly Pro Lys Gly Leu Pro Gly
1310 1315 1320
Leu Gln Gly Ile Lys Gly Asp Gln Gly Asp Gln Gly Val Pro Gly
1325 1330 1335
Ala Lys Gly Leu Pro Gly Pro Pro Gly Pro Pro Gly Pro Tyr Asp
1340 1345 1350
Ile Ile Lys Gly Glu Pro Gly Leu Pro Gly Pro Glu Gly Pro Pro
1355 1360 1365
Gly Leu Lys Gly Leu Gln Gly Leu Pro Gly Pro Lys Gly Gln Gln
1370 1375 1380
Gly Val Thr Gly Leu Val Gly Ile Pro Gly Pro Pro Gly Ile Pro
1385 1390 1395
Gly Phe Asp Gly Ala Pro Gly Gln Lys Gly Glu Met Gly Pro Ala
1400 1405 1410
Gly Pro Thr Gly Pro Arg Gly Phe Pro Gly Pro Pro Gly Pro Asp
1415 1420 1425
Gly Leu Pro Gly Ser Met Gly Pro Pro Gly Thr Pro Ser Val Asp
1430 1435 1440
His Gly Phe Leu Val Thr Arg His Ser Gln Thr Ile Asp Asp Pro
1445 1450 1455
Gln Cys Pro Ser Gly Thr Lys Ile Leu Tyr His Gly Tyr Ser Leu
1460 1465 1470
Leu Tyr Val Gln Gly Asn Glu Arg Ala His Gly Gln Asp Leu Gly
1475 1480 1485
Thr Ala Gly Ser Cys Leu Arg Lys Phe Ser Thr Met Pro Phe Leu
1490 1495 1500
Phe Cys Asn Ile Asn Asn Val Cys Asn Phe Ala Ser Arg Asn Asp
1505 1510 1515
Tyr Ser Tyr Trp Leu Ser Thr Pro Glu Pro Met Pro Met Ser Met
1520 1525 1530
Ala Pro Ile Thr Gly Glu Asn Ile Arg Pro Phe Ile Ser Arg Cys
1535 1540 1545
Ala Val Cys Glu Ala Pro Ala Met Val Met Ala Val His Ser Gln
1550 1555 1560
Thr Ile Gln Ile Pro Pro Cys Pro Ser Gly Trp Ser Ser Leu Trp
1565 1570 1575
Ile Gly Tyr Ser Phe Val Met His Thr Ser Ala Gly Ala Glu Gly
1580 1585 1590
Ser Gly Gln Ala Leu Ala Ser Pro Gly Ser Cys Leu Glu Glu Phe
1595 1600 1605
Arg Ser Ala Pro Phe Ile Glu Cys His Gly Arg Gly Thr Cys Asn
1610 1615 1620
Tyr Tyr Ala Asn Ala Tyr Ser Phe Trp Leu Ala Thr Ile Glu Arg
1625 1630 1635
Ser Glu Met Phe Lys Lys Pro Thr Pro Ser Thr Leu Lys Ala Gly
1640 1645 1650
Glu Leu Arg Thr His Val Ser Arg Cys Gln Val Cys Met Arg Arg
1655 1660 1665
Thr
<210> 67
<211> 1712
<212> ПРТ
<213> Homo sapiens
<400> 67
Met Gly Arg Asp Gln Arg Ala Val Ala Gly Pro Ala Leu Arg Arg Trp
1 5 10 15
Leu Leu Leu Gly Thr Val Thr Val Gly Phe Leu Ala Gln Ser Val Leu
20 25 30
Ala Gly Val Lys Lys Phe Asp Val Pro Cys Gly Gly Arg Asp Cys Ser
35 40 45
Gly Gly Cys Gln Cys Tyr Pro Glu Lys Gly Gly Arg Gly Gln Pro Gly
50 55 60
Pro Val Gly Pro Gln Gly Tyr Asn Gly Pro Pro Gly Leu Gln Gly Phe
65 70 75 80
Pro Gly Leu Gln Gly Arg Lys Gly Asp Lys Gly Glu Arg Gly Ala Pro
85 90 95
Gly Val Thr Gly Pro Lys Gly Asp Val Gly Ala Arg Gly Val Ser Gly
100 105 110
Phe Pro Gly Ala Asp Gly Ile Pro Gly His Pro Gly Gln Gly Gly Pro
115 120 125
Arg Gly Arg Pro Gly Tyr Asp Gly Cys Asn Gly Thr Gln Gly Asp Ser
130 135 140
Gly Pro Gln Gly Pro Pro Gly Ser Glu Gly Phe Thr Gly Pro Pro Gly
145 150 155 160
Pro Gln Gly Pro Lys Gly Gln Lys Gly Glu Pro Tyr Ala Leu Pro Lys
165 170 175
Glu Glu Arg Asp Arg Tyr Arg Gly Glu Pro Gly Glu Pro Gly Leu Val
180 185 190
Gly Phe Gln Gly Pro Pro Gly Arg Pro Gly His Val Gly Gln Met Gly
195 200 205
Pro Val Gly Ala Pro Gly Arg Pro Gly Pro Pro Gly Pro Pro Gly Pro
210 215 220
Lys Gly Gln Gln Gly Asn Arg Gly Leu Gly Phe Tyr Gly Val Lys Gly
225 230 235 240
Glu Lys Gly Asp Val Gly Gln Pro Gly Pro Asn Gly Ile Pro Ser Asp
245 250 255
Thr Leu His Pro Ile Ile Ala Pro Thr Gly Val Thr Phe His Pro Asp
260 265 270
Gln Tyr Lys Gly Glu Lys Gly Ser Glu Gly Glu Pro Gly Ile Arg Gly
275 280 285
Ile Ser Leu Lys Gly Glu Glu Gly Ile Met Gly Phe Pro Gly Leu Arg
290 295 300
Gly Tyr Pro Gly Leu Ser Gly Glu Lys Gly Ser Pro Gly Gln Lys Gly
305 310 315 320
Ser Arg Gly Leu Asp Gly Tyr Gln Gly Pro Asp Gly Pro Arg Gly Pro
325 330 335
Lys Gly Glu Ala Gly Asp Pro Gly Pro Pro Gly Leu Pro Ala Tyr Ser
340 345 350
Pro His Pro Ser Leu Ala Lys Gly Ala Arg Gly Asp Pro Gly Phe Pro
355 360 365
Gly Ala Gln Gly Glu Pro Gly Ser Gln Gly Glu Pro Gly Asp Pro Gly
370 375 380
Leu Pro Gly Pro Pro Gly Leu Ser Ile Gly Asp Gly Asp Gln Arg Arg
385 390 395 400
Gly Leu Pro Gly Glu Met Gly Pro Lys Gly Phe Ile Gly Asp Pro Gly
405 410 415
Ile Pro Ala Leu Tyr Gly Gly Pro Pro Gly Pro Asp Gly Lys Arg Gly
420 425 430
Pro Pro Gly Pro Pro Gly Leu Pro Gly Pro Pro Gly Pro Asp Gly Phe
435 440 445
Leu Phe Gly Leu Lys Gly Ala Lys Gly Arg Ala Gly Phe Pro Gly Leu
450 455 460
Pro Gly Ser Pro Gly Ala Arg Gly Pro Lys Gly Trp Lys Gly Asp Ala
465 470 475 480
Gly Glu Cys Arg Cys Thr Glu Gly Asp Glu Ala Ile Lys Gly Leu Pro
485 490 495
Gly Leu Pro Gly Pro Lys Gly Phe Ala Gly Ile Asn Gly Glu Pro Gly
500 505 510
Arg Lys Gly Asp Arg Gly Asp Pro Gly Gln His Gly Leu Pro Gly Phe
515 520 525
Pro Gly Leu Lys Gly Val Pro Gly Asn Ile Gly Ala Pro Gly Pro Lys
530 535 540
Gly Ala Lys Gly Asp Ser Arg Thr Ile Thr Thr Lys Gly Glu Arg Gly
545 550 555 560
Gln Pro Gly Val Pro Gly Val Pro Gly Met Lys Gly Asp Asp Gly Ser
565 570 575
Pro Gly Arg Asp Gly Leu Asp Gly Phe Pro Gly Leu Pro Gly Pro Pro
580 585 590
Gly Asp Gly Ile Lys Gly Pro Pro Gly Asp Pro Gly Tyr Pro Gly Ile
595 600 605
Pro Gly Thr Lys Gly Thr Pro Gly Glu Met Gly Pro Pro Gly Leu Gly
610 615 620
Leu Pro Gly Leu Lys Gly Gln Arg Gly Phe Pro Gly Asp Ala Gly Leu
625 630 635 640
Pro Gly Pro Pro Gly Phe Leu Gly Pro Pro Gly Pro Ala Gly Thr Pro
645 650 655
Gly Gln Ile Asp Cys Asp Thr Asp Val Lys Arg Ala Val Gly Gly Asp
660 665 670
Arg Gln Glu Ala Ile Gln Pro Gly Cys Ile Gly Gly Pro Lys Gly Leu
675 680 685
Pro Gly Leu Pro Gly Pro Pro Gly Pro Thr Gly Ala Lys Gly Leu Arg
690 695 700
Gly Ile Pro Gly Phe Ala Gly Ala Asp Gly Gly Pro Gly Pro Arg Gly
705 710 715 720
Leu Pro Gly Asp Ala Gly Arg Glu Gly Phe Pro Gly Pro Pro Gly Phe
725 730 735
Ile Gly Pro Arg Gly Ser Lys Gly Ala Val Gly Leu Pro Gly Pro Asp
740 745 750
Gly Ser Pro Gly Pro Ile Gly Leu Pro Gly Pro Asp Gly Pro Pro Gly
755 760 765
Glu Arg Gly Leu Pro Gly Glu Val Leu Gly Ala Gln Pro Gly Pro Arg
770 775 780
Gly Asp Ala Gly Val Pro Gly Gln Pro Gly Leu Lys Gly Leu Pro Gly
785 790 795 800
Asp Arg Gly Pro Pro Gly Phe Arg Gly Ser Gln Gly Met Pro Gly Met
805 810 815
Pro Gly Leu Lys Gly Gln Pro Gly Leu Pro Gly Pro Ser Gly Gln Pro
820 825 830
Gly Leu Tyr Gly Pro Pro Gly Leu His Gly Phe Pro Gly Ala Pro Gly
835 840 845
Gln Glu Gly Pro Leu Gly Leu Pro Gly Ile Pro Gly Arg Glu Gly Leu
850 855 860
Pro Gly Asp Arg Gly Asp Pro Gly Asp Thr Gly Ala Pro Gly Pro Val
865 870 875 880
Gly Met Lys Gly Leu Ser Gly Asp Arg Gly Asp Ala Gly Phe Thr Gly
885 890 895
Glu Gln Gly His Pro Gly Ser Pro Gly Phe Lys Gly Ile Asp Gly Met
900 905 910
Pro Gly Thr Pro Gly Leu Lys Gly Asp Arg Gly Ser Pro Gly Met Asp
915 920 925
Gly Phe Gln Gly Met Pro Gly Leu Lys Gly Arg Pro Gly Phe Pro Gly
930 935 940
Ser Lys Gly Glu Ala Gly Phe Phe Gly Ile Pro Gly Leu Lys Gly Leu
945 950 955 960
Ala Gly Glu Pro Gly Phe Lys Gly Ser Arg Gly Asp Pro Gly Pro Pro
965 970 975
Gly Pro Pro Pro Val Ile Leu Pro Gly Met Lys Asp Ile Lys Gly Glu
980 985 990
Lys Gly Asp Glu Gly Pro Met Gly Leu Lys Gly Tyr Leu Gly Ala Lys
995 1000 1005
Gly Ile Gln Gly Met Pro Gly Ile Pro Gly Leu Ser Gly Ile Pro
1010 1015 1020
Gly Leu Pro Gly Arg Pro Gly His Ile Lys Gly Val Lys Gly Asp
1025 1030 1035
Ile Gly Val Pro Gly Ile Pro Gly Leu Pro Gly Phe Pro Gly Val
1040 1045 1050
Ala Gly Pro Pro Gly Ile Thr Gly Phe Pro Gly Phe Ile Gly Ser
1055 1060 1065
Arg Gly Asp Lys Gly Ala Pro Gly Arg Ala Gly Leu Tyr Gly Glu
1070 1075 1080
Ile Gly Ala Thr Gly Asp Phe Gly Asp Ile Gly Asp Thr Ile Asn
1085 1090 1095
Leu Pro Gly Arg Pro Gly Leu Lys Gly Glu Arg Gly Thr Thr Gly
1100 1105 1110
Ile Pro Gly Leu Lys Gly Phe Phe Gly Glu Lys Gly Thr Glu Gly
1115 1120 1125
Asp Ile Gly Phe Pro Gly Ile Thr Gly Val Thr Gly Val Gln Gly
1130 1135 1140
Pro Pro Gly Leu Lys Gly Gln Thr Gly Phe Pro Gly Leu Thr Gly
1145 1150 1155
Pro Pro Gly Ser Gln Gly Glu Leu Gly Arg Ile Gly Leu Pro Gly
1160 1165 1170
Gly Lys Gly Asp Asp Gly Trp Pro Gly Ala Pro Gly Leu Pro Gly
1175 1180 1185
Phe Pro Gly Leu Arg Gly Ile Arg Gly Leu His Gly Leu Pro Gly
1190 1195 1200
Thr Lys Gly Phe Pro Gly Ser Pro Gly Ser Asp Ile His Gly Asp
1205 1210 1215
Pro Gly Phe Pro Gly Pro Pro Gly Glu Arg Gly Asp Pro Gly Glu
1220 1225 1230
Ala Asn Thr Leu Pro Gly Pro Val Gly Val Pro Gly Gln Lys Gly
1235 1240 1245
Asp Gln Gly Ala Pro Gly Glu Arg Gly Pro Pro Gly Ser Pro Gly
1250 1255 1260
Leu Gln Gly Phe Pro Gly Ile Thr Pro Pro Ser Asn Ile Ser Gly
1265 1270 1275
Ala Pro Gly Asp Lys Gly Ala Pro Gly Ile Phe Gly Leu Lys Gly
1280 1285 1290
Tyr Arg Gly Pro Pro Gly Pro Pro Gly Ser Ala Ala Leu Pro Gly
1295 1300 1305
Ser Lys Gly Asp Thr Gly Asn Pro Gly Ala Pro Gly Thr Pro Gly
1310 1315 1320
Thr Lys Gly Trp Ala Gly Asp Ser Gly Pro Gln Gly Arg Pro Gly
1325 1330 1335
Val Phe Gly Leu Pro Gly Glu Lys Gly Pro Arg Gly Glu Gln Gly
1340 1345 1350
Phe Met Gly Asn Thr Gly Pro Thr Gly Ala Val Gly Asp Arg Gly
1355 1360 1365
Pro Lys Gly Pro Lys Gly Asp Pro Gly Phe Pro Gly Ala Pro Gly
1370 1375 1380
Thr Val Gly Ala Pro Gly Ile Ala Gly Ile Pro Gln Lys Ile Ala
1385 1390 1395
Val Gln Pro Gly Thr Val Gly Pro Gln Gly Arg Arg Gly Pro Pro
1400 1405 1410
Gly Ala Pro Gly Glu Met Gly Pro Gln Gly Pro Pro Gly Glu Pro
1415 1420 1425
Gly Phe Arg Gly Ala Pro Gly Lys Ala Gly Pro Gln Gly Arg Gly
1430 1435 1440
Gly Val Ser Ala Val Pro Gly Phe Arg Gly Asp Glu Gly Pro Ile
1445 1450 1455
Gly His Gln Gly Pro Ile Gly Gln Glu Gly Ala Pro Gly Arg Pro
1460 1465 1470
Gly Ser Pro Gly Leu Pro Gly Met Pro Gly Arg Ser Val Ser Ile
1475 1480 1485
Gly Tyr Leu Leu Val Lys His Ser Gln Thr Asp Gln Glu Pro Met
1490 1495 1500
Cys Pro Val Gly Met Asn Lys Leu Trp Ser Gly Tyr Ser Leu Leu
1505 1510 1515
Tyr Phe Glu Gly Gln Glu Lys Ala His Asn Gln Asp Leu Gly Leu
1520 1525 1530
Ala Gly Ser Cys Leu Ala Arg Phe Ser Thr Met Pro Phe Leu Tyr
1535 1540 1545
Cys Asn Pro Gly Asp Val Cys Tyr Tyr Ala Ser Arg Asn Asp Lys
1550 1555 1560
Ser Tyr Trp Leu Ser Thr Thr Ala Pro Leu Pro Met Met Pro Val
1565 1570 1575
Ala Glu Asp Glu Ile Lys Pro Tyr Ile Ser Arg Cys Ser Val Cys
1580 1585 1590
Glu Ala Pro Ala Ile Ala Ile Ala Val His Ser Gln Asp Val Ser
1595 1600 1605
Ile Pro His Cys Pro Ala Gly Trp Arg Ser Leu Trp Ile Gly Tyr
1610 1615 1620
Ser Phe Leu Met His Thr Ala Ala Gly Asp Glu Gly Gly Gly Gln
1625 1630 1635
Ser Leu Val Ser Pro Gly Ser Cys Leu Glu Asp Phe Arg Ala Thr
1640 1645 1650
Pro Phe Ile Glu Cys Asn Gly Gly Arg Gly Thr Cys His Tyr Tyr
1655 1660 1665
Ala Asn Lys Tyr Ser Phe Trp Leu Thr Thr Ile Pro Glu Gln Ser
1670 1675 1680
Phe Gln Gly Ser Pro Ser Ala Asp Thr Leu Lys Ala Gly Leu Ile
1685 1690 1695
Arg Thr His Ile Ser Arg Cys Gln Val Cys Met Lys Asn Leu
1700 1705 1710
<210> 68
<211> 1670
<212> ПРТ
<213> Homo sapiens
<400> 68
Met Ser Ala Arg Thr Ala Pro Arg Pro Gln Val Leu Leu Leu Pro Leu
1 5 10 15
Leu Leu Val Leu Leu Ala Ala Ala Pro Ala Ala Ser Lys Gly Cys Val
20 25 30
Cys Lys Asp Lys Gly Gln Cys Phe Cys Asp Gly Ala Lys Gly Glu Lys
35 40 45
Gly Glu Lys Gly Phe Pro Gly Pro Pro Gly Ser Pro Gly Gln Lys Gly
50 55 60
Phe Thr Gly Pro Glu Gly Leu Pro Gly Pro Gln Gly Pro Lys Gly Phe
65 70 75 80
Pro Gly Leu Pro Gly Leu Thr Gly Ser Lys Gly Val Arg Gly Ile Ser
85 90 95
Gly Leu Pro Gly Phe Ser Gly Ser Pro Gly Leu Pro Gly Thr Pro Gly
100 105 110
Asn Thr Gly Pro Tyr Gly Leu Val Gly Val Pro Gly Cys Ser Gly Ser
115 120 125
Lys Gly Glu Gln Gly Phe Pro Gly Leu Pro Gly Thr Leu Gly Tyr Pro
130 135 140
Gly Ile Pro Gly Ala Ala Gly Leu Lys Gly Gln Lys Gly Ala Pro Ala
145 150 155 160
Lys Glu Glu Asp Ile Glu Leu Asp Ala Lys Gly Asp Pro Gly Leu Pro
165 170 175
Gly Ala Pro Gly Pro Gln Gly Leu Pro Gly Pro Pro Gly Phe Pro Gly
180 185 190
Pro Val Gly Pro Pro Gly Pro Pro Gly Phe Phe Gly Phe Pro Gly Ala
195 200 205
Met Gly Pro Arg Gly Pro Lys Gly His Met Gly Glu Arg Val Ile Gly
210 215 220
His Lys Gly Glu Arg Gly Val Lys Gly Leu Thr Gly Pro Pro Gly Pro
225 230 235 240
Pro Gly Thr Val Ile Val Thr Leu Thr Gly Pro Asp Asn Arg Thr Asp
245 250 255
Leu Lys Gly Glu Lys Gly Asp Lys Gly Ala Met Gly Glu Pro Gly Pro
260 265 270
Pro Gly Pro Ser Gly Leu Pro Gly Glu Ser Tyr Gly Ser Glu Lys Gly
275 280 285
Ala Pro Gly Asp Pro Gly Leu Gln Gly Lys Pro Gly Lys Asp Gly Val
290 295 300
Pro Gly Phe Pro Gly Ser Glu Gly Val Lys Gly Asn Arg Gly Phe Pro
305 310 315 320
Gly Leu Met Gly Glu Asp Gly Ile Lys Gly Gln Lys Gly Asp Ile Gly
325 330 335
Pro Pro Gly Phe Arg Gly Pro Thr Glu Tyr Tyr Asp Thr Tyr Gln Glu
340 345 350
Lys Gly Asp Glu Gly Thr Pro Gly Pro Pro Gly Pro Arg Gly Ala Arg
355 360 365
Gly Pro Gln Gly Pro Ser Gly Pro Pro Gly Val Pro Gly Ser Pro Gly
370 375 380
Ser Ser Arg Pro Gly Leu Arg Gly Ala Pro Gly Trp Pro Gly Leu Lys
385 390 395 400
Gly Ser Lys Gly Glu Arg Gly Arg Pro Gly Lys Asp Ala Met Gly Thr
405 410 415
Pro Gly Ser Pro Gly Cys Ala Gly Ser Pro Gly Leu Pro Gly Ser Pro
420 425 430
Gly Pro Pro Gly Pro Pro Gly Asp Ile Val Phe Arg Lys Gly Pro Pro
435 440 445
Gly Asp His Gly Leu Pro Gly Tyr Leu Gly Ser Pro Gly Ile Pro Gly
450 455 460
Val Asp Gly Pro Lys Gly Glu Pro Gly Leu Leu Cys Thr Gln Cys Pro
465 470 475 480
Tyr Ile Pro Gly Pro Pro Gly Leu Pro Gly Leu Pro Gly Leu His Gly
485 490 495
Val Lys Gly Ile Pro Gly Arg Gln Gly Ala Ala Gly Leu Lys Gly Ser
500 505 510
Pro Gly Ser Pro Gly Asn Thr Gly Leu Pro Gly Phe Pro Gly Phe Pro
515 520 525
Gly Ala Gln Gly Asp Pro Gly Leu Lys Gly Glu Lys Gly Glu Thr Leu
530 535 540
Gln Pro Glu Gly Gln Val Gly Val Pro Gly Asp Pro Gly Leu Arg Gly
545 550 555 560
Gln Pro Gly Arg Lys Gly Leu Asp Gly Ile Pro Gly Thr Pro Gly Val
565 570 575
Lys Gly Leu Pro Gly Pro Lys Gly Glu Leu Ala Leu Ser Gly Glu Lys
580 585 590
Gly Asp Gln Gly Pro Pro Gly Asp Pro Gly Ser Pro Gly Ser Pro Gly
595 600 605
Pro Ala Gly Pro Ala Gly Pro Pro Gly Tyr Gly Pro Gln Gly Glu Pro
610 615 620
Gly Leu Gln Gly Thr Gln Gly Val Pro Gly Ala Pro Gly Pro Pro Gly
625 630 635 640
Glu Ala Gly Pro Arg Gly Glu Leu Ser Val Ser Thr Pro Val Pro Gly
645 650 655
Pro Pro Gly Pro Pro Gly Pro Pro Gly His Pro Gly Pro Gln Gly Pro
660 665 670
Pro Gly Ile Pro Gly Ser Leu Gly Lys Cys Gly Asp Pro Gly Leu Pro
675 680 685
Gly Pro Asp Gly Glu Pro Gly Ile Pro Gly Ile Gly Phe Pro Gly Pro
690 695 700
Pro Gly Pro Lys Gly Asp Gln Gly Phe Pro Gly Thr Lys Gly Ser Leu
705 710 715 720
Gly Cys Pro Gly Lys Met Gly Glu Pro Gly Leu Pro Gly Lys Pro Gly
725 730 735
Leu Pro Gly Ala Lys Gly Glu Pro Ala Val Ala Met Pro Gly Gly Pro
740 745 750
Gly Thr Pro Gly Phe Pro Gly Glu Arg Gly Asn Ser Gly Glu His Gly
755 760 765
Glu Ile Gly Leu Pro Gly Leu Pro Gly Leu Pro Gly Thr Pro Gly Asn
770 775 780
Glu Gly Leu Asp Gly Pro Arg Gly Asp Pro Gly Gln Pro Gly Pro Pro
785 790 795 800
Gly Glu Gln Gly Pro Pro Gly Arg Cys Ile Glu Gly Pro Arg Gly Ala
805 810 815
Gln Gly Leu Pro Gly Leu Asn Gly Leu Lys Gly Gln Gln Gly Arg Arg
820 825 830
Gly Lys Thr Gly Pro Lys Gly Asp Pro Gly Ile Pro Gly Leu Asp Arg
835 840 845
Ser Gly Phe Pro Gly Glu Thr Gly Ser Pro Gly Ile Pro Gly His Gln
850 855 860
Gly Glu Met Gly Pro Leu Gly Gln Arg Gly Tyr Pro Gly Asn Pro Gly
865 870 875 880
Ile Leu Gly Pro Pro Gly Glu Asp Gly Val Ile Gly Met Met Gly Phe
885 890 895
Pro Gly Ala Ile Gly Pro Pro Gly Pro Pro Gly Asn Pro Gly Thr Pro
900 905 910
Gly Gln Arg Gly Ser Pro Gly Ile Pro Gly Val Lys Gly Gln Arg Gly
915 920 925
Thr Pro Gly Ala Lys Gly Glu Gln Gly Asp Lys Gly Asn Pro Gly Pro
930 935 940
Ser Glu Ile Ser His Val Ile Gly Asp Lys Gly Glu Pro Gly Leu Lys
945 950 955 960
Gly Phe Ala Gly Asn Pro Gly Glu Lys Gly Asn Arg Gly Val Pro Gly
965 970 975
Met Pro Gly Leu Lys Gly Leu Lys Gly Leu Pro Gly Pro Ala Gly Pro
980 985 990
Pro Gly Pro Arg Gly Asp Leu Gly Ser Thr Gly Asn Pro Gly Glu Pro
995 1000 1005
Gly Leu Arg Gly Ile Pro Gly Ser Met Gly Asn Met Gly Met Pro
1010 1015 1020
Gly Ser Lys Gly Lys Arg Gly Thr Leu Gly Phe Pro Gly Arg Ala
1025 1030 1035
Gly Arg Pro Gly Leu Pro Gly Ile His Gly Leu Gln Gly Asp Lys
1040 1045 1050
Gly Glu Pro Gly Tyr Ser Glu Gly Thr Arg Pro Gly Pro Pro Gly
1055 1060 1065
Pro Thr Gly Asp Pro Gly Leu Pro Gly Asp Met Gly Lys Lys Gly
1070 1075 1080
Glu Met Gly Gln Pro Gly Pro Pro Gly His Leu Gly Pro Ala Gly
1085 1090 1095
Pro Glu Gly Ala Pro Gly Ser Pro Gly Ser Pro Gly Leu Pro Gly
1100 1105 1110
Lys Pro Gly Pro His Gly Asp Leu Gly Phe Lys Gly Ile Lys Gly
1115 1120 1125
Leu Leu Gly Pro Pro Gly Ile Arg Gly Pro Pro Gly Leu Pro Gly
1130 1135 1140
Phe Pro Gly Ser Pro Gly Pro Met Gly Ile Arg Gly Asp Gln Gly
1145 1150 1155
Arg Asp Gly Ile Pro Gly Pro Ala Gly Glu Lys Gly Glu Thr Gly
1160 1165 1170
Leu Leu Arg Ala Pro Pro Gly Pro Arg Gly Asn Pro Gly Ala Gln
1175 1180 1185
Gly Ala Lys Gly Asp Arg Gly Ala Pro Gly Phe Pro Gly Leu Pro
1190 1195 1200
Gly Arg Lys Gly Ala Met Gly Asp Ala Gly Pro Arg Gly Pro Thr
1205 1210 1215
Gly Ile Glu Gly Phe Pro Gly Pro Pro Gly Leu Pro Gly Ala Ile
1220 1225 1230
Ile Pro Gly Gln Thr Gly Asn Arg Gly Pro Pro Gly Ser Arg Gly
1235 1240 1245
Ser Pro Gly Ala Pro Gly Pro Pro Gly Pro Pro Gly Ser His Val
1250 1255 1260
Ile Gly Ile Lys Gly Asp Lys Gly Ser Met Gly His Pro Gly Pro
1265 1270 1275
Lys Gly Pro Pro Gly Thr Ala Gly Asp Met Gly Pro Pro Gly Arg
1280 1285 1290
Leu Gly Ala Pro Gly Thr Pro Gly Leu Pro Gly Pro Arg Gly Asp
1295 1300 1305
Pro Gly Phe Gln Gly Phe Pro Gly Val Lys Gly Glu Lys Gly Asn
1310 1315 1320
Pro Gly Phe Leu Gly Ser Ile Gly Pro Pro Gly Pro Ile Gly Pro
1325 1330 1335
Lys Gly Pro Pro Gly Val Arg Gly Asp Pro Gly Thr Leu Lys Ile
1340 1345 1350
Ile Ser Leu Pro Gly Ser Pro Gly Pro Pro Gly Thr Pro Gly Glu
1355 1360 1365
Pro Gly Met Gln Gly Glu Pro Gly Pro Pro Gly Pro Pro Gly Asn
1370 1375 1380
Leu Gly Pro Cys Gly Pro Arg Gly Lys Pro Gly Lys Asp Gly Lys
1385 1390 1395
Pro Gly Thr Pro Gly Pro Ala Gly Glu Lys Gly Asn Lys Gly Ser
1400 1405 1410
Lys Gly Glu Pro Gly Pro Ala Gly Ser Asp Gly Leu Pro Gly Leu
1415 1420 1425
Lys Gly Lys Arg Gly Asp Ser Gly Ser Pro Ala Thr Trp Thr Thr
1430 1435 1440
Arg Gly Phe Val Phe Thr Arg His Ser Gln Thr Thr Ala Ile Pro
1445 1450 1455
Ser Cys Pro Glu Gly Thr Val Pro Leu Tyr Ser Gly Phe Ser Phe
1460 1465 1470
Leu Phe Val Gln Gly Asn Gln Arg Ala His Gly Gln Asp Leu Gly
1475 1480 1485
Thr Leu Gly Ser Cys Leu Gln Arg Phe Thr Thr Met Pro Phe Leu
1490 1495 1500
Phe Cys Asn Val Asn Asp Val Cys Asn Phe Ala Ser Arg Asn Asp
1505 1510 1515
Tyr Ser Tyr Trp Leu Ser Thr Pro Ala Leu Met Pro Met Asn Met
1520 1525 1530
Ala Pro Ile Thr Gly Arg Ala Leu Glu Pro Tyr Ile Ser Arg Cys
1535 1540 1545
Thr Val Cys Glu Gly Pro Ala Ile Ala Ile Ala Val His Ser Gln
1550 1555 1560
Thr Thr Asp Ile Pro Pro Cys Pro His Gly Trp Ile Ser Leu Trp
1565 1570 1575
Lys Gly Phe Ser Phe Ile Met Phe Thr Ser Ala Gly Ser Glu Gly
1580 1585 1590
Thr Gly Gln Ala Leu Ala Ser Pro Gly Ser Cys Leu Glu Glu Phe
1595 1600 1605
Arg Ala Ser Pro Phe Leu Glu Cys His Gly Arg Gly Thr Cys Asn
1610 1615 1620
Tyr Tyr Ser Asn Ser Tyr Ser Phe Trp Leu Ala Ser Leu Asn Pro
1625 1630 1635
Glu Arg Met Phe Arg Lys Pro Ile Pro Ser Thr Val Lys Ala Gly
1640 1645 1650
Glu Leu Glu Lys Ile Ile Ser Arg Cys Gln Val Cys Met Lys Lys
1655 1660 1665
Arg His
1670
<210> 69
<211> 1690
<212> ПРТ
<213> Homo sapiens
<400> 69
Met Trp Ser Leu His Ile Val Leu Met Arg Cys Ser Phe Arg Leu Thr
1 5 10 15
Lys Ser Leu Ala Thr Gly Pro Trp Ser Leu Ile Leu Ile Leu Phe Ser
20 25 30
Val Gln Tyr Val Tyr Gly Ser Gly Lys Lys Tyr Ile Gly Pro Cys Gly
35 40 45
Gly Arg Asp Cys Ser Val Cys His Cys Val Pro Glu Lys Gly Ser Arg
50 55 60
Gly Pro Pro Gly Pro Pro Gly Pro Gln Gly Pro Ile Gly Pro Leu Gly
65 70 75 80
Ala Pro Gly Pro Ile Gly Leu Ser Gly Glu Lys Gly Met Arg Gly Asp
85 90 95
Arg Gly Pro Pro Gly Ala Ala Gly Asp Lys Gly Asp Lys Gly Pro Thr
100 105 110
Gly Val Pro Gly Phe Pro Gly Leu Asp Gly Ile Pro Gly His Pro Gly
115 120 125
Pro Pro Gly Pro Arg Gly Lys Pro Gly Met Ser Gly His Asn Gly Ser
130 135 140
Arg Gly Asp Pro Gly Phe Pro Gly Gly Arg Gly Ala Leu Gly Pro Gly
145 150 155 160
Gly Pro Leu Gly His Pro Gly Glu Lys Gly Glu Lys Gly Asn Ser Val
165 170 175
Phe Ile Leu Gly Ala Val Lys Gly Ile Gln Gly Asp Arg Gly Asp Pro
180 185 190
Gly Leu Pro Gly Leu Pro Gly Ser Trp Gly Ala Gly Gly Pro Ala Gly
195 200 205
Pro Thr Gly Tyr Pro Gly Glu Pro Gly Leu Val Gly Pro Pro Gly Gln
210 215 220
Pro Gly Arg Pro Gly Leu Lys Gly Asn Pro Gly Val Gly Val Lys Gly
225 230 235 240
Gln Met Gly Asp Pro Gly Glu Val Gly Gln Gln Gly Ser Pro Gly Pro
245 250 255
Thr Leu Leu Val Glu Pro Pro Asp Phe Cys Leu Tyr Lys Gly Glu Lys
260 265 270
Gly Ile Lys Gly Ile Pro Gly Met Val Gly Leu Pro Gly Pro Pro Gly
275 280 285
Arg Lys Gly Glu Ser Gly Ile Gly Ala Lys Gly Glu Lys Gly Ile Pro
290 295 300
Gly Phe Pro Gly Pro Arg Gly Asp Pro Gly Ser Tyr Gly Ser Pro Gly
305 310 315 320
Phe Pro Gly Leu Lys Gly Glu Leu Gly Leu Val Gly Asp Pro Gly Leu
325 330 335
Phe Gly Leu Ile Gly Pro Lys Gly Asp Pro Gly Asn Arg Gly His Pro
340 345 350
Gly Pro Pro Gly Val Leu Val Thr Pro Pro Leu Pro Leu Lys Gly Pro
355 360 365
Pro Gly Asp Pro Gly Phe Pro Gly Arg Tyr Gly Glu Thr Gly Asp Val
370 375 380
Gly Pro Pro Gly Pro Pro Gly Leu Leu Gly Arg Pro Gly Glu Ala Cys
385 390 395 400
Ala Gly Met Ile Gly Pro Pro Gly Pro Gln Gly Phe Pro Gly Leu Pro
405 410 415
Gly Leu Pro Gly Glu Ala Gly Ile Pro Gly Arg Pro Asp Ser Ala Pro
420 425 430
Gly Lys Pro Gly Lys Pro Gly Ser Pro Gly Leu Pro Gly Ala Pro Gly
435 440 445
Leu Gln Gly Leu Pro Gly Ser Ser Val Ile Tyr Cys Ser Val Gly Asn
450 455 460
Pro Gly Pro Gln Gly Ile Lys Gly Lys Val Gly Pro Pro Gly Gly Arg
465 470 475 480
Gly Pro Lys Gly Glu Lys Gly Asn Glu Gly Leu Cys Ala Cys Glu Pro
485 490 495
Gly Pro Met Gly Pro Pro Gly Pro Pro Gly Leu Pro Gly Arg Gln Gly
500 505 510
Ser Lys Gly Asp Leu Gly Leu Pro Gly Trp Leu Gly Thr Lys Gly Asp
515 520 525
Pro Gly Pro Pro Gly Ala Glu Gly Pro Pro Gly Leu Pro Gly Lys His
530 535 540
Gly Ala Ser Gly Pro Pro Gly Asn Lys Gly Ala Lys Gly Asp Met Val
545 550 555 560
Val Ser Arg Val Lys Gly His Lys Gly Glu Arg Gly Pro Asp Gly Pro
565 570 575
Pro Gly Phe Pro Gly Gln Pro Gly Ser His Gly Arg Asp Gly His Ala
580 585 590
Gly Glu Lys Gly Asp Pro Gly Pro Pro Gly Asp His Glu Asp Ala Thr
595 600 605
Pro Gly Gly Lys Gly Phe Pro Gly Pro Leu Gly Pro Pro Gly Lys Ala
610 615 620
Gly Pro Val Gly Pro Pro Gly Leu Gly Phe Pro Gly Pro Pro Gly Glu
625 630 635 640
Arg Gly His Pro Gly Val Pro Gly His Pro Gly Val Arg Gly Pro Asp
645 650 655
Gly Leu Lys Gly Gln Lys Gly Asp Thr Ile Ser Cys Asn Val Thr Tyr
660 665 670
Pro Gly Arg His Gly Pro Pro Gly Phe Asp Gly Pro Pro Gly Pro Lys
675 680 685
Gly Phe Pro Gly Pro Gln Gly Ala Pro Gly Leu Ser Gly Ser Asp Gly
690 695 700
His Lys Gly Arg Pro Gly Thr Pro Gly Thr Ala Glu Ile Pro Gly Pro
705 710 715 720
Pro Gly Phe Arg Gly Asp Met Gly Asp Pro Gly Phe Gly Gly Glu Lys
725 730 735
Gly Ser Ser Pro Val Gly Pro Pro Gly Pro Pro Gly Ser Pro Gly Val
740 745 750
Asn Gly Gln Lys Gly Ile Pro Gly Asp Pro Ala Phe Gly His Leu Gly
755 760 765
Pro Pro Gly Lys Arg Gly Leu Ser Gly Val Pro Gly Ile Lys Gly Pro
770 775 780
Arg Gly Asp Pro Gly Cys Pro Gly Ala Glu Gly Pro Ala Gly Ile Pro
785 790 795 800
Gly Phe Leu Gly Leu Lys Gly Pro Lys Gly Arg Glu Gly His Ala Gly
805 810 815
Phe Pro Gly Val Pro Gly Pro Pro Gly His Ser Cys Glu Arg Gly Ala
820 825 830
Pro Gly Ile Pro Gly Gln Pro Gly Leu Pro Gly Tyr Pro Gly Ser Pro
835 840 845
Gly Ala Pro Gly Gly Lys Gly Gln Pro Gly Asp Val Gly Pro Pro Gly
850 855 860
Pro Ala Gly Met Lys Gly Leu Pro Gly Leu Pro Gly Arg Pro Gly Ala
865 870 875 880
His Gly Pro Pro Gly Leu Pro Gly Ile Pro Gly Pro Phe Gly Asp Asp
885 890 895
Gly Leu Pro Gly Pro Pro Gly Pro Lys Gly Pro Arg Gly Leu Pro Gly
900 905 910
Phe Pro Gly Phe Pro Gly Glu Arg Gly Lys Pro Gly Ala Glu Gly Cys
915 920 925
Pro Gly Ala Lys Gly Glu Pro Gly Glu Lys Gly Met Ser Gly Leu Pro
930 935 940
Gly Asp Arg Gly Leu Arg Gly Ala Lys Gly Ala Ile Gly Pro Pro Gly
945 950 955 960
Asp Glu Gly Glu Met Ala Ile Ile Ser Gln Lys Gly Thr Pro Gly Glu
965 970 975
Pro Gly Pro Pro Gly Asp Asp Gly Phe Pro Gly Glu Arg Gly Asp Lys
980 985 990
Gly Thr Pro Gly Met Gln Gly Arg Arg Gly Glu Pro Gly Arg Tyr Gly
995 1000 1005
Pro Pro Gly Phe His Arg Gly Glu Pro Gly Glu Lys Gly Gln Pro
1010 1015 1020
Gly Pro Pro Gly Pro Pro Gly Pro Pro Gly Ser Thr Gly Leu Arg
1025 1030 1035
Gly Phe Ile Gly Phe Pro Gly Leu Pro Gly Asp Gln Gly Glu Pro
1040 1045 1050
Gly Ser Pro Gly Pro Pro Gly Phe Ser Gly Ile Asp Gly Ala Arg
1055 1060 1065
Gly Pro Lys Gly Asn Lys Gly Asp Pro Ala Ser His Phe Gly Pro
1070 1075 1080
Pro Gly Pro Lys Gly Glu Pro Gly Ser Pro Gly Cys Pro Gly His
1085 1090 1095
Phe Gly Ala Ser Gly Glu Gln Gly Leu Pro Gly Ile Gln Gly Pro
1100 1105 1110
Arg Gly Ser Pro Gly Arg Pro Gly Pro Pro Gly Ser Ser Gly Pro
1115 1120 1125
Pro Gly Cys Pro Gly Asp His Gly Met Pro Gly Leu Arg Gly Gln
1130 1135 1140
Pro Gly Glu Met Gly Asp Pro Gly Pro Arg Gly Leu Gln Gly Asp
1145 1150 1155
Pro Gly Ile Pro Gly Pro Pro Gly Ile Lys Gly Pro Ser Gly Ser
1160 1165 1170
Pro Gly Leu Asn Gly Leu His Gly Leu Lys Gly Gln Lys Gly Thr
1175 1180 1185
Lys Gly Ala Ser Gly Leu His Asp Val Gly Pro Pro Gly Pro Val
1190 1195 1200
Gly Ile Pro Gly Leu Lys Gly Glu Arg Gly Asp Pro Gly Ser Pro
1205 1210 1215
Gly Ile Ser Pro Pro Gly Pro Arg Gly Lys Lys Gly Pro Pro Gly
1220 1225 1230
Pro Pro Gly Ser Ser Gly Pro Pro Gly Pro Ala Gly Ala Thr Gly
1235 1240 1245
Arg Ala Pro Lys Asp Ile Pro Asp Pro Gly Pro Pro Gly Asp Gln
1250 1255 1260
Gly Pro Pro Gly Pro Asp Gly Pro Arg Gly Ala Pro Gly Pro Pro
1265 1270 1275
Gly Leu Pro Gly Ser Val Asp Leu Leu Arg Gly Glu Pro Gly Asp
1280 1285 1290
Cys Gly Leu Pro Gly Pro Pro Gly Pro Pro Gly Pro Pro Gly Pro
1295 1300 1305
Pro Gly Tyr Lys Gly Phe Pro Gly Cys Asp Gly Lys Asp Gly Gln
1310 1315 1320
Lys Gly Pro Val Gly Phe Pro Gly Pro Gln Gly Pro His Gly Phe
1325 1330 1335
Pro Gly Pro Pro Gly Glu Lys Gly Leu Pro Gly Pro Pro Gly Arg
1340 1345 1350
Lys Gly Pro Thr Gly Leu Pro Gly Pro Arg Gly Glu Pro Gly Pro
1355 1360 1365
Pro Ala Asp Val Asp Asp Cys Pro Arg Ile Pro Gly Leu Pro Gly
1370 1375 1380
Ala Pro Gly Met Arg Gly Pro Glu Gly Ala Met Gly Leu Pro Gly
1385 1390 1395
Met Arg Gly Pro Ser Gly Pro Gly Cys Lys Gly Glu Pro Gly Leu
1400 1405 1410
Asp Gly Arg Arg Gly Val Asp Gly Val Pro Gly Ser Pro Gly Pro
1415 1420 1425
Pro Gly Arg Lys Gly Asp Thr Gly Glu Asp Gly Tyr Pro Gly Gly
1430 1435 1440
Pro Gly Pro Pro Gly Pro Ile Gly Asp Pro Gly Pro Lys Gly Phe
1445 1450 1455
Gly Pro Gly Tyr Leu Gly Gly Phe Leu Leu Val Leu His Ser Gln
1460 1465 1470
Thr Asp Gln Glu Pro Thr Cys Pro Leu Gly Met Pro Arg Leu Trp
1475 1480 1485
Thr Gly Tyr Ser Leu Leu Tyr Leu Glu Gly Gln Glu Lys Ala His
1490 1495 1500
Asn Gln Asp Leu Gly Leu Ala Gly Ser Cys Leu Pro Val Phe Ser
1505 1510 1515
Thr Leu Pro Phe Ala Tyr Cys Asn Ile His Gln Val Cys His Tyr
1520 1525 1530
Ala Gln Arg Asn Asp Arg Ser Tyr Trp Leu Ala Ser Ala Ala Pro
1535 1540 1545
Leu Pro Met Met Pro Leu Ser Glu Glu Ala Ile Arg Pro Tyr Val
1550 1555 1560
Ser Arg Cys Ala Val Cys Glu Ala Pro Ala Gln Ala Val Ala Val
1565 1570 1575
His Ser Gln Asp Gln Ser Ile Pro Pro Cys Pro Gln Thr Trp Arg
1580 1585 1590
Ser Leu Trp Ile Gly Tyr Ser Phe Leu Met His Thr Gly Ala Gly
1595 1600 1605
Asp Gln Gly Gly Gly Gln Ala Leu Met Ser Pro Gly Ser Cys Leu
1610 1615 1620
Glu Asp Phe Arg Ala Ala Pro Phe Leu Glu Cys Gln Gly Arg Gln
1625 1630 1635
Gly Thr Cys His Phe Phe Ala Asn Lys Tyr Ser Phe Trp Leu Thr
1640 1645 1650
Thr Val Lys Ala Asp Leu Gln Phe Ser Ser Ala Pro Ala Pro Asp
1655 1660 1665
Thr Leu Lys Glu Ser Gln Ala Gln Arg Gln Lys Ile Ser Arg Cys
1670 1675 1680
Gln Val Cys Val Lys Tyr Ser
1685 1690
<210> 70
<211> 1685
<212> ПРТ
<213> Homo sapiens
<400> 70
Met Lys Leu Arg Gly Val Ser Leu Ala Ala Gly Leu Phe Leu Leu Ala
1 5 10 15
Leu Ser Leu Trp Gly Gln Pro Ala Glu Ala Ala Ala Cys Tyr Gly Cys
20 25 30
Ser Pro Gly Ser Lys Cys Asp Cys Ser Gly Ile Lys Gly Glu Lys Gly
35 40 45
Glu Arg Gly Phe Pro Gly Leu Glu Gly His Pro Gly Leu Pro Gly Phe
50 55 60
Pro Gly Pro Glu Gly Pro Pro Gly Pro Arg Gly Gln Lys Gly Asp Asp
65 70 75 80
Gly Ile Pro Gly Pro Pro Gly Pro Lys Gly Ile Arg Gly Pro Pro Gly
85 90 95
Leu Pro Gly Phe Pro Gly Thr Pro Gly Leu Pro Gly Met Pro Gly His
100 105 110
Asp Gly Ala Pro Gly Pro Gln Gly Ile Pro Gly Cys Asn Gly Thr Lys
115 120 125
Gly Glu Arg Gly Phe Pro Gly Ser Pro Gly Phe Pro Gly Leu Gln Gly
130 135 140
Pro Pro Gly Pro Pro Gly Ile Pro Gly Met Lys Gly Glu Pro Gly Ser
145 150 155 160
Ile Ile Met Ser Ser Leu Pro Gly Pro Lys Gly Asn Pro Gly Tyr Pro
165 170 175
Gly Pro Pro Gly Ile Gln Gly Leu Pro Gly Pro Thr Gly Ile Pro Gly
180 185 190
Pro Ile Gly Pro Pro Gly Pro Pro Gly Leu Met Gly Pro Pro Gly Pro
195 200 205
Pro Gly Leu Pro Gly Pro Lys Gly Asn Met Gly Leu Asn Phe Gln Gly
210 215 220
Pro Lys Gly Glu Lys Gly Glu Gln Gly Leu Gln Gly Pro Pro Gly Pro
225 230 235 240
Pro Gly Gln Ile Ser Glu Gln Lys Arg Pro Ile Asp Val Glu Phe Gln
245 250 255
Lys Gly Asp Gln Gly Leu Pro Gly Asp Arg Gly Pro Pro Gly Pro Pro
260 265 270
Gly Ile Arg Gly Pro Pro Gly Pro Pro Gly Gly Glu Lys Gly Glu Lys
275 280 285
Gly Glu Gln Gly Glu Pro Gly Lys Arg Gly Lys Pro Gly Lys Asp Gly
290 295 300
Glu Asn Gly Gln Pro Gly Ile Pro Gly Leu Pro Gly Asp Pro Gly Tyr
305 310 315 320
Pro Gly Glu Pro Gly Arg Asp Gly Glu Lys Gly Gln Lys Gly Asp Thr
325 330 335
Gly Pro Pro Gly Pro Pro Gly Leu Val Ile Pro Arg Pro Gly Thr Gly
340 345 350
Ile Thr Ile Gly Glu Lys Gly Asn Ile Gly Leu Pro Gly Leu Pro Gly
355 360 365
Glu Lys Gly Glu Arg Gly Phe Pro Gly Ile Gln Gly Pro Pro Gly Leu
370 375 380
Pro Gly Pro Pro Gly Ala Ala Val Met Gly Pro Pro Gly Pro Pro Gly
385 390 395 400
Phe Pro Gly Glu Arg Gly Gln Lys Gly Asp Glu Gly Pro Pro Gly Ile
405 410 415
Ser Ile Pro Gly Pro Pro Gly Leu Asp Gly Gln Pro Gly Ala Pro Gly
420 425 430
Leu Pro Gly Pro Pro Gly Pro Ala Gly Pro His Ile Pro Pro Ser Asp
435 440 445
Glu Ile Cys Glu Pro Gly Pro Pro Gly Pro Pro Gly Ser Pro Gly Asp
450 455 460
Lys Gly Leu Gln Gly Glu Gln Gly Val Lys Gly Asp Lys Gly Asp Thr
465 470 475 480
Cys Phe Asn Cys Ile Gly Thr Gly Ile Ser Gly Pro Pro Gly Gln Pro
485 490 495
Gly Leu Pro Gly Leu Pro Gly Pro Pro Gly Ser Leu Gly Phe Pro Gly
500 505 510
Gln Lys Gly Glu Lys Gly Gln Ala Gly Ala Thr Gly Pro Lys Gly Leu
515 520 525
Pro Gly Ile Pro Gly Ala Pro Gly Ala Pro Gly Phe Pro Gly Ser Lys
530 535 540
Gly Glu Pro Gly Asp Ile Leu Thr Phe Pro Gly Met Lys Gly Asp Lys
545 550 555 560
Gly Glu Leu Gly Ser Pro Gly Ala Pro Gly Leu Pro Gly Leu Pro Gly
565 570 575
Thr Pro Gly Gln Asp Gly Leu Pro Gly Leu Pro Gly Pro Lys Gly Glu
580 585 590
Pro Gly Gly Ile Thr Phe Lys Gly Glu Arg Gly Pro Pro Gly Asn Pro
595 600 605
Gly Leu Pro Gly Leu Pro Gly Asn Ile Gly Pro Met Gly Pro Pro Gly
610 615 620
Phe Gly Pro Pro Gly Pro Val Gly Glu Lys Gly Ile Gln Gly Val Ala
625 630 635 640
Gly Asn Pro Gly Gln Pro Gly Ile Pro Gly Pro Lys Gly Asp Pro Gly
645 650 655
Gln Thr Ile Thr Gln Pro Gly Lys Pro Gly Leu Pro Gly Asn Pro Gly
660 665 670
Arg Asp Gly Asp Val Gly Leu Pro Gly Asp Pro Gly Leu Pro Gly Gln
675 680 685
Pro Gly Leu Pro Gly Ile Pro Gly Ser Lys Gly Glu Pro Gly Ile Pro
690 695 700
Gly Ile Gly Leu Pro Gly Pro Pro Gly Pro Lys Gly Phe Pro Gly Ile
705 710 715 720
Pro Gly Pro Pro Gly Ala Pro Gly Thr Pro Gly Arg Ile Gly Leu Glu
725 730 735
Gly Pro Pro Gly Pro Pro Gly Phe Pro Gly Pro Lys Gly Glu Pro Gly
740 745 750
Phe Ala Leu Pro Gly Pro Pro Gly Pro Pro Gly Leu Pro Gly Phe Lys
755 760 765
Gly Ala Leu Gly Pro Lys Gly Asp Arg Gly Phe Pro Gly Pro Pro Gly
770 775 780
Pro Pro Gly Arg Thr Gly Leu Asp Gly Leu Pro Gly Pro Lys Gly Asp
785 790 795 800
Val Gly Pro Asn Gly Gln Pro Gly Pro Met Gly Pro Pro Gly Leu Pro
805 810 815
Gly Ile Gly Val Gln Gly Pro Pro Gly Pro Pro Gly Ile Pro Gly Pro
820 825 830
Ile Gly Gln Pro Gly Leu His Gly Ile Pro Gly Glu Lys Gly Asp Pro
835 840 845
Gly Pro Pro Gly Leu Asp Val Pro Gly Pro Pro Gly Glu Arg Gly Ser
850 855 860
Pro Gly Ile Pro Gly Ala Pro Gly Pro Ile Gly Pro Pro Gly Ser Pro
865 870 875 880
Gly Leu Pro Gly Lys Ala Gly Ala Ser Gly Phe Pro Gly Thr Lys Gly
885 890 895
Glu Met Gly Met Met Gly Pro Pro Gly Pro Pro Gly Pro Leu Gly Ile
900 905 910
Pro Gly Arg Ser Gly Val Pro Gly Leu Lys Gly Asp Asp Gly Leu Gln
915 920 925
Gly Gln Pro Gly Leu Pro Gly Pro Thr Gly Glu Lys Gly Ser Lys Gly
930 935 940
Glu Pro Gly Leu Pro Gly Pro Pro Gly Pro Met Asp Pro Asn Leu Leu
945 950 955 960
Gly Ser Lys Gly Glu Lys Gly Glu Pro Gly Leu Pro Gly Ile Pro Gly
965 970 975
Val Ser Gly Pro Lys Gly Tyr Gln Gly Leu Pro Gly Asp Pro Gly Gln
980 985 990
Pro Gly Leu Ser Gly Gln Pro Gly Leu Pro Gly Pro Pro Gly Pro Lys
995 1000 1005
Gly Asn Pro Gly Leu Pro Gly Gln Pro Gly Leu Ile Gly Pro Pro
1010 1015 1020
Gly Leu Lys Gly Thr Ile Gly Asp Met Gly Phe Pro Gly Pro Gln
1025 1030 1035
Gly Val Glu Gly Pro Pro Gly Pro Ser Gly Val Pro Gly Gln Pro
1040 1045 1050
Gly Ser Pro Gly Leu Pro Gly Gln Lys Gly Asp Lys Gly Asp Pro
1055 1060 1065
Gly Ile Ser Ser Ile Gly Leu Pro Gly Leu Pro Gly Pro Lys Gly
1070 1075 1080
Glu Pro Gly Leu Pro Gly Tyr Pro Gly Asn Pro Gly Ile Lys Gly
1085 1090 1095
Ser Val Gly Asp Pro Gly Leu Pro Gly Leu Pro Gly Thr Pro Gly
1100 1105 1110
Ala Lys Gly Gln Pro Gly Leu Pro Gly Phe Pro Gly Thr Pro Gly
1115 1120 1125
Pro Pro Gly Pro Lys Gly Ile Ser Gly Pro Pro Gly Asn Pro Gly
1130 1135 1140
Leu Pro Gly Glu Pro Gly Pro Val Gly Gly Gly Gly His Pro Gly
1145 1150 1155
Gln Pro Gly Pro Pro Gly Glu Lys Gly Lys Pro Gly Gln Asp Gly
1160 1165 1170
Ile Pro Gly Pro Ala Gly Gln Lys Gly Glu Pro Gly Gln Pro Gly
1175 1180 1185
Phe Gly Asn Pro Gly Pro Pro Gly Leu Pro Gly Leu Ser Gly Gln
1190 1195 1200
Lys Gly Asp Gly Gly Leu Pro Gly Ile Pro Gly Asn Pro Gly Leu
1205 1210 1215
Pro Gly Pro Lys Gly Glu Pro Gly Phe His Gly Phe Pro Gly Val
1220 1225 1230
Gln Gly Pro Pro Gly Pro Pro Gly Ser Pro Gly Pro Ala Leu Glu
1235 1240 1245
Gly Pro Lys Gly Asn Pro Gly Pro Gln Gly Pro Pro Gly Arg Pro
1250 1255 1260
Gly Leu Pro Gly Pro Glu Gly Pro Pro Gly Leu Pro Gly Asn Gly
1265 1270 1275
Gly Ile Lys Gly Glu Lys Gly Asn Pro Gly Gln Pro Gly Leu Pro
1280 1285 1290
Gly Leu Pro Gly Leu Lys Gly Asp Gln Gly Pro Pro Gly Leu Gln
1295 1300 1305
Gly Asn Pro Gly Arg Pro Gly Leu Asn Gly Met Lys Gly Asp Pro
1310 1315 1320
Gly Leu Pro Gly Val Pro Gly Phe Pro Gly Met Lys Gly Pro Ser
1325 1330 1335
Gly Val Pro Gly Ser Ala Gly Pro Glu Gly Glu Pro Gly Leu Ile
1340 1345 1350
Gly Pro Pro Gly Pro Pro Gly Leu Pro Gly Pro Ser Gly Gln Ser
1355 1360 1365
Ile Ile Ile Lys Gly Asp Ala Gly Pro Pro Gly Ile Pro Gly Gln
1370 1375 1380
Pro Gly Leu Lys Gly Leu Pro Gly Pro Gln Gly Pro Gln Gly Leu
1385 1390 1395
Pro Gly Pro Thr Gly Pro Pro Gly Asp Pro Gly Arg Asn Gly Leu
1400 1405 1410
Pro Gly Phe Asp Gly Ala Gly Gly Arg Lys Gly Asp Pro Gly Leu
1415 1420 1425
Pro Gly Gln Pro Gly Thr Arg Gly Leu Asp Gly Pro Pro Gly Pro
1430 1435 1440
Asp Gly Leu Gln Gly Pro Pro Gly Pro Pro Gly Thr Ser Ser Val
1445 1450 1455
Ala His Gly Phe Leu Ile Thr Arg His Ser Gln Thr Thr Asp Ala
1460 1465 1470
Pro Gln Cys Pro Gln Gly Thr Leu Gln Val Tyr Glu Gly Phe Ser
1475 1480 1485
Leu Leu Tyr Val Gln Gly Asn Lys Arg Ala His Gly Gln Asp Leu
1490 1495 1500
Gly Thr Ala Gly Ser Cys Leu Arg Arg Phe Ser Thr Met Pro Phe
1505 1510 1515
Met Phe Cys Asn Ile Asn Asn Val Cys Asn Phe Ala Ser Arg Asn
1520 1525 1530
Asp Tyr Ser Tyr Trp Leu Ser Thr Pro Glu Pro Met Pro Met Ser
1535 1540 1545
Met Gln Pro Leu Lys Gly Gln Ser Ile Gln Pro Phe Ile Ser Arg
1550 1555 1560
Cys Ala Val Cys Glu Ala Pro Ala Val Val Ile Ala Val His Ser
1565 1570 1575
Gln Thr Ile Gln Ile Pro His Cys Pro Gln Gly Trp Asp Ser Leu
1580 1585 1590
Trp Ile Gly Tyr Ser Phe Met Met His Thr Ser Ala Gly Ala Glu
1595 1600 1605
Gly Ser Gly Gln Ala Leu Ala Ser Pro Gly Ser Cys Leu Glu Glu
1610 1615 1620
Phe Arg Ser Ala Pro Phe Ile Glu Cys His Gly Arg Gly Thr Cys
1625 1630 1635
Asn Tyr Tyr Ala Asn Ser Tyr Ser Phe Trp Leu Ala Thr Val Asp
1640 1645 1650
Val Ser Asp Met Phe Ser Lys Pro Gln Ser Glu Thr Leu Lys Ala
1655 1660 1665
Gly Asp Leu Arg Thr Arg Ile Ser Arg Cys Gln Val Cys Met Lys
1670 1675 1680
Arg Thr
1685
<210> 71
<211> 1691
<212> ПРТ
<213> Homo sapiens
<400> 71
Met Leu Ile Asn Lys Leu Trp Leu Leu Leu Val Thr Leu Cys Leu Thr
1 5 10 15
Glu Glu Leu Ala Ala Ala Gly Glu Lys Ser Tyr Gly Lys Pro Cys Gly
20 25 30
Gly Gln Asp Cys Ser Gly Ser Cys Gln Cys Phe Pro Glu Lys Gly Ala
35 40 45
Arg Gly Arg Pro Gly Pro Ile Gly Ile Gln Gly Pro Thr Gly Pro Gln
50 55 60
Gly Phe Thr Gly Ser Thr Gly Leu Ser Gly Leu Lys Gly Glu Arg Gly
65 70 75 80
Phe Pro Gly Leu Leu Gly Pro Tyr Gly Pro Lys Gly Asp Lys Gly Pro
85 90 95
Met Gly Val Pro Gly Phe Leu Gly Ile Asn Gly Ile Pro Gly His Pro
100 105 110
Gly Gln Pro Gly Pro Arg Gly Pro Pro Gly Leu Asp Gly Cys Asn Gly
115 120 125
Thr Gln Gly Ala Val Gly Phe Pro Gly Pro Asp Gly Tyr Pro Gly Leu
130 135 140
Leu Gly Pro Pro Gly Leu Pro Gly Gln Lys Gly Ser Lys Gly Asp Pro
145 150 155 160
Val Leu Ala Pro Gly Ser Phe Lys Gly Met Lys Gly Asp Pro Gly Leu
165 170 175
Pro Gly Leu Asp Gly Ile Thr Gly Pro Gln Gly Ala Pro Gly Phe Pro
180 185 190
Gly Ala Val Gly Pro Ala Gly Pro Pro Gly Leu Gln Gly Pro Pro Gly
195 200 205
Pro Pro Gly Pro Leu Gly Pro Asp Gly Asn Met Gly Leu Gly Phe Gln
210 215 220
Gly Glu Lys Gly Val Lys Gly Asp Val Gly Leu Pro Gly Pro Ala Gly
225 230 235 240
Pro Pro Pro Ser Thr Gly Glu Leu Glu Phe Met Gly Phe Pro Lys Gly
245 250 255
Lys Lys Gly Ser Lys Gly Glu Pro Gly Pro Lys Gly Phe Pro Gly Ile
260 265 270
Ser Gly Pro Pro Gly Phe Pro Gly Leu Gly Thr Thr Gly Glu Lys Gly
275 280 285
Glu Lys Gly Glu Lys Gly Ile Pro Gly Leu Pro Gly Pro Arg Gly Pro
290 295 300
Met Gly Ser Glu Gly Val Gln Gly Pro Pro Gly Gln Gln Gly Lys Lys
305 310 315 320
Gly Thr Leu Gly Phe Pro Gly Leu Asn Gly Phe Gln Gly Ile Glu Gly
325 330 335
Gln Lys Gly Asp Ile Gly Leu Pro Gly Pro Asp Val Phe Ile Asp Ile
340 345 350
Asp Gly Ala Val Ile Ser Gly Asn Pro Gly Asp Pro Gly Val Pro Gly
355 360 365
Leu Pro Gly Leu Lys Gly Asp Glu Gly Ile Gln Gly Leu Arg Gly Pro
370 375 380
Ser Gly Val Pro Gly Leu Pro Ala Leu Ser Gly Val Pro Gly Ala Leu
385 390 395 400
Gly Pro Gln Gly Phe Pro Gly Leu Lys Gly Asp Gln Gly Asn Pro Gly
405 410 415
Arg Thr Thr Ile Gly Ala Ala Gly Leu Pro Gly Arg Asp Gly Leu Pro
420 425 430
Gly Pro Pro Gly Pro Pro Gly Pro Pro Ser Pro Glu Phe Glu Thr Glu
435 440 445
Thr Leu His Asn Lys Glu Ser Gly Phe Pro Gly Leu Arg Gly Glu Gln
450 455 460
Gly Pro Lys Gly Asn Leu Gly Leu Lys Gly Ile Lys Gly Asp Ser Gly
465 470 475 480
Phe Cys Ala Cys Asp Gly Gly Val Pro Asn Thr Gly Pro Pro Gly Glu
485 490 495
Pro Gly Pro Pro Gly Pro Trp Gly Leu Ile Gly Leu Pro Gly Leu Lys
500 505 510
Gly Ala Arg Gly Asp Arg Gly Ser Gly Gly Ala Gln Gly Pro Ala Gly
515 520 525
Ala Pro Gly Leu Val Gly Pro Leu Gly Pro Ser Gly Pro Lys Gly Lys
530 535 540
Lys Gly Glu Pro Ile Leu Ser Thr Ile Gln Gly Met Pro Gly Asp Arg
545 550 555 560
Gly Asp Ser Gly Ser Gln Gly Phe Arg Gly Val Ile Gly Glu Pro Gly
565 570 575
Lys Asp Gly Val Pro Gly Leu Pro Gly Leu Pro Gly Leu Pro Gly Asp
580 585 590
Gly Gly Gln Gly Phe Pro Gly Glu Lys Gly Leu Pro Gly Leu Pro Gly
595 600 605
Glu Lys Gly His Pro Gly Pro Pro Gly Leu Pro Gly Asn Gly Leu Pro
610 615 620
Gly Leu Pro Gly Pro Arg Gly Leu Pro Gly Asp Lys Gly Lys Asp Gly
625 630 635 640
Leu Pro Gly Gln Gln Gly Leu Pro Gly Ser Lys Gly Ile Thr Leu Pro
645 650 655
Cys Ile Ile Pro Gly Ser Tyr Gly Pro Ser Gly Phe Pro Gly Thr Pro
660 665 670
Gly Phe Pro Gly Pro Lys Gly Ser Arg Gly Leu Pro Gly Thr Pro Gly
675 680 685
Gln Pro Gly Ser Ser Gly Ser Lys Gly Glu Pro Gly Ser Pro Gly Leu
690 695 700
Val His Leu Pro Glu Leu Pro Gly Phe Pro Gly Pro Arg Gly Glu Lys
705 710 715 720
Gly Leu Pro Gly Phe Pro Gly Leu Pro Gly Lys Asp Gly Leu Pro Gly
725 730 735
Met Ile Gly Ser Pro Gly Leu Pro Gly Ser Lys Gly Ala Thr Gly Asp
740 745 750
Ile Phe Gly Ala Glu Asn Gly Ala Pro Gly Glu Gln Gly Leu Gln Gly
755 760 765
Leu Thr Gly His Lys Gly Phe Leu Gly Asp Ser Gly Leu Pro Gly Leu
770 775 780
Lys Gly Val His Gly Lys Pro Gly Leu Leu Gly Pro Lys Gly Glu Arg
785 790 795 800
Gly Ser Pro Gly Thr Pro Gly Gln Val Gly Gln Pro Gly Thr Pro Gly
805 810 815
Ser Ser Gly Pro Tyr Gly Ile Lys Gly Lys Ser Gly Leu Pro Gly Ala
820 825 830
Pro Gly Phe Pro Gly Ile Ser Gly His Pro Gly Lys Lys Gly Thr Arg
835 840 845
Gly Lys Lys Gly Pro Pro Gly Ser Ile Val Lys Lys Gly Leu Pro Gly
850 855 860
Leu Lys Gly Leu Pro Gly Asn Pro Gly Leu Val Gly Leu Lys Gly Ser
865 870 875 880
Pro Gly Ser Pro Gly Val Ala Gly Leu Pro Ala Leu Ser Gly Pro Lys
885 890 895
Gly Glu Lys Gly Ser Val Gly Phe Val Gly Phe Pro Gly Ile Pro Gly
900 905 910
Leu Pro Gly Ile Pro Gly Thr Arg Gly Leu Lys Gly Ile Pro Gly Ser
915 920 925
Thr Gly Lys Met Gly Pro Ser Gly Arg Ala Gly Thr Pro Gly Glu Lys
930 935 940
Gly Asp Arg Gly Asn Pro Gly Pro Val Gly Ile Pro Ser Pro Arg Arg
945 950 955 960
Pro Met Ser Asn Leu Trp Leu Lys Gly Asp Lys Gly Ser Gln Gly Ser
965 970 975
Ala Gly Ser Asn Gly Phe Pro Gly Pro Arg Gly Asp Lys Gly Glu Ala
980 985 990
Gly Arg Pro Gly Pro Pro Gly Leu Pro Gly Ala Pro Gly Leu Pro Gly
995 1000 1005
Ile Ile Lys Gly Val Ser Gly Lys Pro Gly Pro Pro Gly Phe Met
1010 1015 1020
Gly Ile Arg Gly Leu Pro Gly Leu Lys Gly Ser Ser Gly Ile Thr
1025 1030 1035
Gly Phe Pro Gly Met Pro Gly Glu Ser Gly Ser Gln Gly Ile Arg
1040 1045 1050
Gly Ser Pro Gly Leu Pro Gly Ala Ser Gly Leu Pro Gly Leu Lys
1055 1060 1065
Gly Asp Asn Gly Gln Thr Val Glu Ile Ser Gly Ser Pro Gly Pro
1070 1075 1080
Lys Gly Gln Pro Gly Glu Ser Gly Phe Lys Gly Thr Lys Gly Arg
1085 1090 1095
Asp Gly Leu Ile Gly Asn Ile Gly Phe Pro Gly Asn Lys Gly Glu
1100 1105 1110
Asp Gly Lys Val Gly Val Ser Gly Asp Val Gly Leu Pro Gly Ala
1115 1120 1125
Pro Gly Phe Pro Gly Val Ala Gly Met Arg Gly Glu Pro Gly Leu
1130 1135 1140
Pro Gly Ser Ser Gly His Gln Gly Ala Ile Gly Pro Leu Gly Ser
1145 1150 1155
Pro Gly Leu Ile Gly Pro Lys Gly Phe Pro Gly Phe Pro Gly Leu
1160 1165 1170
His Gly Leu Asn Gly Leu Pro Gly Thr Lys Gly Thr His Gly Thr
1175 1180 1185
Pro Gly Pro Ser Ile Thr Gly Val Pro Gly Pro Ala Gly Leu Pro
1190 1195 1200
Gly Pro Lys Gly Glu Lys Gly Tyr Pro Gly Ile Gly Ile Gly Ala
1205 1210 1215
Pro Gly Lys Pro Gly Leu Arg Gly Gln Lys Gly Asp Arg Gly Phe
1220 1225 1230
Pro Gly Leu Gln Gly Pro Ala Gly Leu Pro Gly Ala Pro Gly Ile
1235 1240 1245
Ser Leu Pro Ser Leu Ile Ala Gly Gln Pro Gly Asp Pro Gly Arg
1250 1255 1260
Pro Gly Leu Asp Gly Glu Arg Gly Arg Pro Gly Pro Ala Gly Pro
1265 1270 1275
Pro Gly Pro Pro Gly Pro Ser Ser Asn Gln Gly Asp Thr Gly Asp
1280 1285 1290
Pro Gly Phe Pro Gly Ile Pro Gly Pro Lys Gly Pro Lys Gly Asp
1295 1300 1305
Gln Gly Ile Pro Gly Phe Ser Gly Leu Pro Gly Glu Leu Gly Leu
1310 1315 1320
Lys Gly Met Arg Gly Glu Pro Gly Phe Met Gly Thr Pro Gly Lys
1325 1330 1335
Val Gly Pro Pro Gly Asp Pro Gly Phe Pro Gly Met Lys Gly Lys
1340 1345 1350
Ala Gly Pro Arg Gly Ser Ser Gly Leu Gln Gly Asp Pro Gly Gln
1355 1360 1365
Thr Pro Thr Ala Glu Ala Val Gln Val Pro Pro Gly Pro Leu Gly
1370 1375 1380
Leu Pro Gly Ile Asp Gly Ile Pro Gly Leu Thr Gly Asp Pro Gly
1385 1390 1395
Ala Gln Gly Pro Val Gly Leu Gln Gly Ser Lys Gly Leu Pro Gly
1400 1405 1410
Ile Pro Gly Lys Asp Gly Pro Ser Gly Leu Pro Gly Pro Pro Gly
1415 1420 1425
Ala Leu Gly Asp Pro Gly Leu Pro Gly Leu Gln Gly Pro Pro Gly
1430 1435 1440
Phe Glu Gly Ala Pro Gly Gln Gln Gly Pro Phe Gly Met Pro Gly
1445 1450 1455
Met Pro Gly Gln Ser Met Arg Val Gly Tyr Thr Leu Val Lys His
1460 1465 1470
Ser Gln Ser Glu Gln Val Pro Pro Cys Pro Ile Gly Met Ser Gln
1475 1480 1485
Leu Trp Val Gly Tyr Ser Leu Leu Phe Val Glu Gly Gln Glu Lys
1490 1495 1500
Ala His Asn Gln Asp Leu Gly Phe Ala Gly Ser Cys Leu Pro Arg
1505 1510 1515
Phe Ser Thr Met Pro Phe Ile Tyr Cys Asn Ile Asn Glu Val Cys
1520 1525 1530
His Tyr Ala Arg Arg Asn Asp Lys Ser Tyr Trp Leu Ser Thr Thr
1535 1540 1545
Ala Pro Ile Pro Met Met Pro Val Ser Gln Thr Gln Ile Pro Gln
1550 1555 1560
Tyr Ile Ser Arg Cys Ser Val Cys Glu Ala Pro Ser Gln Ala Ile
1565 1570 1575
Ala Val His Ser Gln Asp Ile Thr Ile Pro Gln Cys Pro Leu Gly
1580 1585 1590
Trp Arg Ser Leu Trp Ile Gly Tyr Ser Phe Leu Met His Thr Ala
1595 1600 1605
Ala Gly Ala Glu Gly Gly Gly Gln Ser Leu Val Ser Pro Gly Ser
1610 1615 1620
Cys Leu Glu Asp Phe Arg Ala Thr Pro Phe Ile Glu Cys Ser Gly
1625 1630 1635
Ala Arg Gly Thr Cys His Tyr Phe Ala Asn Lys Tyr Ser Phe Trp
1640 1645 1650
Leu Thr Thr Val Glu Glu Arg Gln Gln Phe Gly Glu Leu Pro Val
1655 1660 1665
Ser Glu Thr Leu Lys Ala Gly Gln Leu His Thr Arg Val Ser Arg
1670 1675 1680
Cys Gln Val Cys Met Lys Ser Leu
1685 1690
<210> 72
<211> 1838
<212> ПРТ
<213> Homo sapiens
<400> 72
Met Asp Val His Thr Arg Trp Lys Ala Arg Ser Ala Leu Arg Pro Gly
1 5 10 15
Ala Pro Leu Leu Pro Pro Leu Leu Leu Leu Leu Leu Trp Ala Pro Pro
20 25 30
Pro Ser Arg Ala Ala Gln Pro Ala Asp Leu Leu Lys Val Leu Asp Phe
35 40 45
His Asn Leu Pro Asp Gly Ile Thr Lys Thr Thr Gly Phe Cys Ala Thr
50 55 60
Arg Arg Ser Ser Lys Gly Pro Asp Val Ala Tyr Arg Val Thr Lys Asp
65 70 75 80
Ala Gln Leu Ser Ala Pro Thr Lys Gln Leu Tyr Pro Ala Ser Ala Phe
85 90 95
Pro Glu Asp Phe Ser Ile Leu Thr Thr Val Lys Ala Lys Lys Gly Ser
100 105 110
Gln Ala Phe Leu Val Ser Ile Tyr Asn Glu Gln Gly Ile Gln Gln Ile
115 120 125
Gly Leu Glu Leu Gly Arg Ser Pro Val Phe Leu Tyr Glu Asp His Thr
130 135 140
Gly Lys Pro Gly Pro Glu Asp Tyr Pro Leu Phe Arg Gly Ile Asn Leu
145 150 155 160
Ser Asp Gly Lys Trp His Arg Ile Ala Leu Ser Val His Lys Lys Asn
165 170 175
Val Thr Leu Ile Leu Asp Cys Lys Lys Lys Thr Thr Lys Phe Leu Asp
180 185 190
Arg Ser Asp His Pro Met Ile Asp Ile Asn Gly Ile Ile Val Phe Gly
195 200 205
Thr Arg Ile Leu Asp Glu Glu Val Phe Glu Gly Asp Ile Gln Gln Leu
210 215 220
Leu Phe Val Ser Asp His Arg Ala Ala Tyr Asp Tyr Cys Glu His Tyr
225 230 235 240
Ser Pro Asp Cys Asp Thr Ala Val Pro Asp Thr Pro Gln Ser Gln Asp
245 250 255
Pro Asn Pro Asp Glu Tyr Tyr Thr Glu Gly Asp Gly Glu Gly Glu Thr
260 265 270
Tyr Tyr Tyr Glu Tyr Pro Tyr Tyr Glu Asp Pro Glu Asp Leu Gly Lys
275 280 285
Glu Pro Thr Pro Ser Lys Lys Pro Val Glu Ala Ala Lys Glu Thr Thr
290 295 300
Glu Val Pro Glu Glu Leu Thr Pro Thr Pro Thr Glu Ala Ala Pro Met
305 310 315 320
Pro Glu Thr Ser Glu Gly Ala Gly Lys Glu Glu Asp Val Gly Ile Gly
325 330 335
Asp Tyr Asp Tyr Val Pro Ser Glu Asp Tyr Tyr Thr Pro Ser Pro Tyr
340 345 350
Asp Asp Leu Thr Tyr Gly Glu Gly Glu Glu Asn Pro Asp Gln Pro Thr
355 360 365
Asp Pro Gly Ala Gly Ala Glu Ile Pro Thr Ser Thr Ala Asp Thr Ser
370 375 380
Asn Ser Ser Asn Pro Ala Pro Pro Pro Gly Glu Gly Ala Asp Asp Leu
385 390 395 400
Glu Gly Glu Phe Thr Glu Glu Thr Ile Arg Asn Leu Asp Glu Asn Tyr
405 410 415
Tyr Asp Pro Tyr Tyr Asp Pro Thr Ser Ser Pro Ser Glu Ile Gly Pro
420 425 430
Gly Met Pro Ala Asn Gln Asp Thr Ile Tyr Glu Gly Ile Gly Gly Pro
435 440 445
Arg Gly Glu Lys Gly Gln Lys Gly Glu Pro Ala Ile Ile Glu Pro Gly
450 455 460
Met Leu Ile Glu Gly Pro Pro Gly Pro Glu Gly Pro Ala Gly Leu Pro
465 470 475 480
Gly Pro Pro Gly Thr Met Gly Pro Thr Gly Gln Val Gly Asp Pro Gly
485 490 495
Glu Arg Gly Pro Pro Gly Arg Pro Gly Leu Pro Gly Ala Asp Gly Leu
500 505 510
Pro Gly Pro Pro Gly Thr Met Leu Met Leu Pro Phe Arg Phe Gly Gly
515 520 525
Gly Gly Asp Ala Gly Ser Lys Gly Pro Met Val Ser Ala Gln Glu Ser
530 535 540
Gln Ala Gln Ala Ile Leu Gln Gln Ala Arg Leu Ala Leu Arg Gly Pro
545 550 555 560
Ala Gly Pro Met Gly Leu Thr Gly Arg Pro Gly Pro Val Gly Pro Pro
565 570 575
Gly Ser Gly Gly Leu Lys Gly Glu Pro Gly Asp Val Gly Pro Gln Gly
580 585 590
Pro Arg Gly Val Gln Gly Pro Pro Gly Pro Ala Gly Lys Pro Gly Arg
595 600 605
Arg Gly Arg Ala Gly Ser Asp Gly Ala Arg Gly Met Pro Gly Gln Thr
610 615 620
Gly Pro Lys Gly Asp Arg Gly Phe Asp Gly Leu Ala Gly Leu Pro Gly
625 630 635 640
Glu Lys Gly His Arg Gly Asp Pro Gly Pro Ser Gly Pro Pro Gly Pro
645 650 655
Pro Gly Asp Asp Gly Glu Arg Gly Asp Asp Gly Glu Val Gly Pro Arg
660 665 670
Gly Leu Pro Gly Glu Pro Gly Pro Arg Gly Leu Leu Gly Pro Lys Gly
675 680 685
Pro Pro Gly Pro Pro Gly Pro Pro Gly Val Thr Gly Met Asp Gly Gln
690 695 700
Pro Gly Pro Lys Gly Asn Val Gly Pro Gln Gly Glu Pro Gly Pro Pro
705 710 715 720
Gly Gln Gln Gly Asn Pro Gly Ala Gln Gly Leu Pro Gly Pro Gln Gly
725 730 735
Ala Ile Gly Pro Pro Gly Glu Lys Gly Pro Leu Gly Lys Pro Gly Leu
740 745 750
Pro Gly Met Pro Gly Ala Asp Gly Pro Pro Gly His Pro Gly Lys Glu
755 760 765
Gly Pro Pro Gly Glu Lys Gly Gly Gln Gly Pro Pro Gly Pro Gln Gly
770 775 780
Pro Ile Gly Tyr Pro Gly Pro Arg Gly Val Lys Gly Ala Asp Gly Ile
785 790 795 800
Arg Gly Leu Lys Gly Thr Lys Gly Glu Lys Gly Glu Asp Gly Phe Pro
805 810 815
Gly Phe Lys Gly Asp Met Gly Ile Lys Gly Asp Arg Gly Glu Ile Gly
820 825 830
Pro Pro Gly Pro Arg Gly Glu Asp Gly Pro Glu Gly Pro Lys Gly Arg
835 840 845
Gly Gly Pro Asn Gly Asp Pro Gly Pro Leu Gly Pro Pro Gly Glu Lys
850 855 860
Gly Lys Leu Gly Val Pro Gly Leu Pro Gly Tyr Pro Gly Arg Gln Gly
865 870 875 880
Pro Lys Gly Ser Ile Gly Phe Pro Gly Phe Pro Gly Ala Asn Gly Glu
885 890 895
Lys Gly Gly Arg Gly Thr Pro Gly Lys Pro Gly Pro Arg Gly Gln Arg
900 905 910
Gly Pro Thr Gly Pro Arg Gly Glu Arg Gly Pro Arg Gly Ile Thr Gly
915 920 925
Lys Pro Gly Pro Lys Gly Asn Ser Gly Gly Asp Gly Pro Ala Gly Pro
930 935 940
Pro Gly Glu Arg Gly Pro Asn Gly Pro Gln Gly Pro Thr Gly Phe Pro
945 950 955 960
Gly Pro Lys Gly Pro Pro Gly Pro Pro Gly Lys Asp Gly Leu Pro Gly
965 970 975
His Pro Gly Gln Arg Gly Glu Thr Gly Phe Gln Gly Lys Thr Gly Pro
980 985 990
Pro Gly Pro Pro Gly Val Val Gly Pro Gln Gly Pro Thr Gly Glu Thr
995 1000 1005
Gly Pro Met Gly Glu Arg Gly His Pro Gly Pro Pro Gly Pro Pro
1010 1015 1020
Gly Glu Gln Gly Leu Pro Gly Leu Ala Gly Lys Glu Gly Thr Lys
1025 1030 1035
Gly Asp Pro Gly Pro Ala Gly Leu Pro Gly Lys Asp Gly Pro Pro
1040 1045 1050
Gly Leu Arg Gly Phe Pro Gly Asp Arg Gly Leu Pro Gly Pro Val
1055 1060 1065
Gly Ala Leu Gly Leu Lys Gly Asn Glu Gly Pro Pro Gly Pro Pro
1070 1075 1080
Gly Pro Ala Gly Ser Pro Gly Glu Arg Gly Pro Ala Gly Ala Ala
1085 1090 1095
Gly Pro Ile Gly Ile Pro Gly Arg Pro Gly Pro Gln Gly Pro Pro
1100 1105 1110
Gly Pro Ala Gly Glu Lys Gly Ala Pro Gly Glu Lys Gly Pro Gln
1115 1120 1125
Gly Pro Ala Gly Arg Asp Gly Leu Gln Gly Pro Val Gly Leu Pro
1130 1135 1140
Gly Pro Ala Gly Pro Val Gly Pro Pro Gly Glu Asp Gly Asp Lys
1145 1150 1155
Gly Glu Ile Gly Glu Pro Gly Gln Lys Gly Ser Lys Gly Asp Lys
1160 1165 1170
Gly Glu Gln Gly Pro Pro Gly Pro Thr Gly Pro Gln Gly Pro Ile
1175 1180 1185
Gly Gln Pro Gly Pro Ser Gly Ala Asp Gly Glu Pro Gly Pro Arg
1190 1195 1200
Gly Gln Gln Gly Leu Phe Gly Gln Lys Gly Asp Glu Gly Pro Arg
1205 1210 1215
Gly Phe Pro Gly Pro Pro Gly Pro Val Gly Leu Gln Gly Leu Pro
1220 1225 1230
Gly Pro Pro Gly Glu Lys Gly Glu Thr Gly Asp Val Gly Gln Met
1235 1240 1245
Gly Pro Pro Gly Pro Pro Gly Pro Arg Gly Pro Ser Gly Ala Pro
1250 1255 1260
Gly Ala Asp Gly Pro Gln Gly Pro Pro Gly Gly Ile Gly Asn Pro
1265 1270 1275
Gly Ala Val Gly Glu Lys Gly Glu Pro Gly Glu Ala Gly Glu Pro
1280 1285 1290
Gly Leu Pro Gly Glu Gly Gly Pro Pro Gly Pro Lys Gly Glu Arg
1295 1300 1305
Gly Glu Lys Gly Glu Ser Gly Pro Ser Gly Ala Ala Gly Pro Pro
1310 1315 1320
Gly Pro Lys Gly Pro Pro Gly Asp Asp Gly Pro Lys Gly Ser Pro
1325 1330 1335
Gly Pro Val Gly Phe Pro Gly Asp Pro Gly Pro Pro Gly Glu Pro
1340 1345 1350
Gly Pro Ala Gly Gln Asp Gly Pro Pro Gly Asp Lys Gly Asp Asp
1355 1360 1365
Gly Glu Pro Gly Gln Thr Gly Ser Pro Gly Pro Thr Gly Glu Pro
1370 1375 1380
Gly Pro Ser Gly Pro Pro Gly Lys Arg Gly Pro Pro Gly Pro Ala
1385 1390 1395
Gly Pro Glu Gly Arg Gln Gly Glu Lys Gly Ala Lys Gly Glu Ala
1400 1405 1410
Gly Leu Glu Gly Pro Pro Gly Lys Thr Gly Pro Ile Gly Pro Gln
1415 1420 1425
Gly Ala Pro Gly Lys Pro Gly Pro Asp Gly Leu Arg Gly Ile Pro
1430 1435 1440
Gly Pro Val Gly Glu Gln Gly Leu Pro Gly Ser Pro Gly Pro Asp
1445 1450 1455
Gly Pro Pro Gly Pro Met Gly Pro Pro Gly Leu Pro Gly Leu Lys
1460 1465 1470
Gly Asp Ser Gly Pro Lys Gly Glu Lys Gly His Pro Gly Leu Ile
1475 1480 1485
Gly Leu Ile Gly Pro Pro Gly Glu Gln Gly Glu Lys Gly Asp Arg
1490 1495 1500
Gly Leu Pro Gly Pro Gln Gly Ser Ser Gly Pro Lys Gly Glu Gln
1505 1510 1515
Gly Ile Thr Gly Pro Ser Gly Pro Ile Gly Pro Pro Gly Pro Pro
1520 1525 1530
Gly Leu Pro Gly Pro Pro Gly Pro Lys Gly Ala Lys Gly Ser Ser
1535 1540 1545
Gly Pro Thr Gly Pro Lys Gly Glu Ala Gly His Pro Gly Pro Pro
1550 1555 1560
Gly Pro Pro Gly Pro Pro Gly Glu Val Ile Gln Pro Leu Pro Ile
1565 1570 1575
Gln Ala Ser Arg Thr Arg Arg Asn Ile Asp Ala Ser Gln Leu Leu
1580 1585 1590
Asp Asp Gly Asn Gly Glu Asn Tyr Val Asp Tyr Ala Asp Gly Met
1595 1600 1605
Glu Glu Ile Phe Gly Ser Leu Asn Ser Leu Lys Leu Glu Ile Glu
1610 1615 1620
Gln Met Lys Arg Pro Leu Gly Thr Gln Gln Asn Pro Ala Arg Thr
1625 1630 1635
Cys Lys Asp Leu Gln Leu Cys His Pro Asp Phe Pro Asp Gly Glu
1640 1645 1650
Tyr Trp Val Asp Pro Asn Gln Gly Cys Ser Arg Asp Ser Phe Lys
1655 1660 1665
Val Tyr Cys Asn Phe Thr Ala Gly Gly Ser Thr Cys Val Phe Pro
1670 1675 1680
Asp Lys Lys Ser Glu Gly Ala Arg Ile Thr Ser Trp Pro Lys Glu
1685 1690 1695
Asn Pro Gly Ser Trp Phe Ser Glu Phe Lys Arg Gly Lys Leu Leu
1700 1705 1710
Ser Tyr Val Asp Ala Glu Gly Asn Pro Val Gly Val Val Gln Met
1715 1720 1725
Thr Phe Leu Arg Leu Leu Ser Ala Ser Ala His Gln Asn Val Thr
1730 1735 1740
Tyr His Cys Tyr Gln Ser Val Ala Trp Gln Asp Ala Ala Thr Gly
1745 1750 1755
Ser Tyr Asp Lys Ala Leu Arg Phe Leu Gly Ser Asn Asp Glu Glu
1760 1765 1770
Met Ser Tyr Asp Asn Asn Pro Tyr Ile Arg Ala Leu Val Asp Gly
1775 1780 1785
Cys Ala Thr Lys Lys Gly Tyr Gln Lys Thr Val Leu Glu Ile Asp
1790 1795 1800
Thr Pro Lys Val Glu Gln Val Pro Ile Val Asp Ile Met Phe Asn
1805 1810 1815
Asp Phe Gly Glu Ala Ser Gln Lys Phe Gly Phe Glu Val Gly Pro
1820 1825 1830
Ala Cys Phe Met Gly
1835
<210> 73
<211> 1499
<212> ПРТ
<213> Homo sapiens
<400> 73
Met Met Ala Asn Trp Ala Glu Ala Arg Pro Leu Leu Ile Leu Ile Val
1 5 10 15
Leu Leu Gly Gln Phe Val Ser Ile Lys Ala Gln Glu Glu Asp Glu Asp
20 25 30
Glu Gly Tyr Gly Glu Glu Ile Ala Cys Thr Gln Asn Gly Gln Met Tyr
35 40 45
Leu Asn Arg Asp Ile Trp Lys Pro Ala Pro Cys Gln Ile Cys Val Cys
50 55 60
Asp Asn Gly Ala Ile Leu Cys Asp Lys Ile Glu Cys Gln Asp Val Leu
65 70 75 80
Asp Cys Ala Asp Pro Val Thr Pro Pro Gly Glu Cys Cys Pro Val Cys
85 90 95
Ser Gln Thr Pro Gly Gly Gly Asn Thr Asn Phe Gly Arg Gly Arg Lys
100 105 110
Gly Gln Lys Gly Glu Pro Gly Leu Val Pro Val Val Thr Gly Ile Arg
115 120 125
Gly Arg Pro Gly Pro Ala Gly Pro Pro Gly Ser Gln Gly Pro Arg Gly
130 135 140
Glu Arg Gly Pro Lys Gly Arg Pro Gly Pro Arg Gly Pro Gln Gly Ile
145 150 155 160
Asp Gly Glu Pro Gly Val Pro Gly Gln Pro Gly Ala Pro Gly Pro Pro
165 170 175
Gly His Pro Ser His Pro Gly Pro Asp Gly Leu Ser Arg Pro Phe Ser
180 185 190
Ala Gln Met Ala Gly Leu Asp Glu Lys Ser Gly Leu Gly Ser Gln Val
195 200 205
Gly Leu Met Pro Gly Ser Val Gly Pro Val Gly Pro Arg Gly Pro Gln
210 215 220
Gly Leu Gln Gly Gln Gln Gly Gly Ala Gly Pro Thr Gly Pro Pro Gly
225 230 235 240
Glu Pro Gly Asp Pro Gly Pro Met Gly Pro Ile Gly Ser Arg Gly Pro
245 250 255
Glu Gly Pro Pro Gly Lys Pro Gly Glu Asp Gly Glu Pro Gly Arg Asn
260 265 270
Gly Asn Pro Gly Glu Val Gly Phe Ala Gly Ser Pro Gly Ala Arg Gly
275 280 285
Phe Pro Gly Ala Pro Gly Leu Pro Gly Leu Lys Gly His Arg Gly His
290 295 300
Lys Gly Leu Glu Gly Pro Lys Gly Glu Val Gly Ala Pro Gly Ser Lys
305 310 315 320
Gly Glu Ala Gly Pro Thr Gly Pro Met Gly Ala Met Gly Pro Leu Gly
325 330 335
Pro Arg Gly Met Pro Gly Glu Arg Gly Arg Leu Gly Pro Gln Gly Ala
340 345 350
Pro Gly Gln Arg Gly Ala His Gly Met Pro Gly Lys Pro Gly Pro Met
355 360 365
Gly Pro Leu Gly Ile Pro Gly Ser Ser Gly Phe Pro Gly Asn Pro Gly
370 375 380
Met Lys Gly Glu Ala Gly Pro Thr Gly Ala Arg Gly Pro Glu Gly Pro
385 390 395 400
Gln Gly Gln Arg Gly Glu Thr Gly Pro Pro Gly Pro Val Gly Ser Pro
405 410 415
Gly Leu Pro Gly Ala Ile Gly Thr Asp Gly Thr Pro Gly Ala Lys Gly
420 425 430
Pro Thr Gly Ser Pro Gly Thr Ser Gly Pro Pro Gly Ser Ala Gly Pro
435 440 445
Pro Gly Ser Pro Gly Pro Gln Gly Ser Thr Gly Pro Gln Gly Ile Arg
450 455 460
Gly Gln Pro Gly Asp Pro Gly Val Pro Gly Phe Lys Gly Glu Ala Gly
465 470 475 480
Pro Lys Gly Glu Pro Gly Pro His Gly Ile Gln Gly Pro Ile Gly Pro
485 490 495
Pro Gly Glu Glu Gly Lys Arg Gly Pro Arg Gly Asp Pro Gly Thr Val
500 505 510
Gly Pro Pro Gly Pro Val Gly Glu Arg Gly Ala Pro Gly Asn Arg Gly
515 520 525
Phe Pro Gly Ser Asp Gly Leu Pro Gly Pro Lys Gly Ala Gln Gly Glu
530 535 540
Arg Gly Pro Val Gly Ser Ser Gly Pro Lys Gly Ser Gln Gly Asp Pro
545 550 555 560
Gly Arg Pro Gly Glu Pro Gly Leu Pro Gly Ala Arg Gly Leu Thr Gly
565 570 575
Asn Pro Gly Val Gln Gly Pro Glu Gly Lys Leu Gly Pro Leu Gly Ala
580 585 590
Pro Gly Glu Asp Gly Arg Pro Gly Pro Pro Gly Ser Ile Gly Ile Arg
595 600 605
Gly Gln Pro Gly Ser Met Gly Leu Pro Gly Pro Lys Gly Ser Ser Gly
610 615 620
Asp Pro Gly Lys Pro Gly Glu Ala Gly Asn Ala Gly Val Pro Gly Gln
625 630 635 640
Arg Gly Ala Pro Gly Lys Asp Gly Glu Val Gly Pro Ser Gly Pro Val
645 650 655
Gly Pro Pro Gly Leu Ala Gly Glu Arg Gly Glu Gln Gly Pro Pro Gly
660 665 670
Pro Thr Gly Phe Gln Gly Leu Pro Gly Pro Pro Gly Pro Pro Gly Glu
675 680 685
Gly Gly Lys Pro Gly Asp Gln Gly Val Pro Gly Asp Pro Gly Ala Val
690 695 700
Gly Pro Leu Gly Pro Arg Gly Glu Arg Gly Asn Pro Gly Glu Arg Gly
705 710 715 720
Glu Pro Gly Ile Thr Gly Leu Pro Gly Glu Lys Gly Met Ala Gly Gly
725 730 735
His Gly Pro Asp Gly Pro Lys Gly Ser Pro Gly Pro Ser Gly Thr Pro
740 745 750
Gly Asp Thr Gly Pro Pro Gly Leu Gln Gly Met Pro Gly Glu Arg Gly
755 760 765
Ile Ala Gly Thr Pro Gly Pro Lys Gly Asp Arg Gly Gly Ile Gly Glu
770 775 780
Lys Gly Ala Glu Gly Thr Ala Gly Asn Asp Gly Ala Arg Gly Leu Pro
785 790 795 800
Gly Pro Leu Gly Pro Pro Gly Pro Ala Gly Pro Thr Gly Glu Lys Gly
805 810 815
Glu Pro Gly Pro Arg Gly Leu Val Gly Pro Pro Gly Ser Arg Gly Asn
820 825 830
Pro Gly Ser Arg Gly Glu Asn Gly Pro Thr Gly Ala Val Gly Phe Ala
835 840 845
Gly Pro Gln Gly Pro Asp Gly Gln Pro Gly Val Lys Gly Glu Pro Gly
850 855 860
Glu Pro Gly Gln Lys Gly Asp Ala Gly Ser Pro Gly Pro Gln Gly Leu
865 870 875 880
Ala Gly Ser Pro Gly Pro His Gly Pro Asn Gly Val Pro Gly Leu Lys
885 890 895
Gly Gly Arg Gly Thr Gln Gly Pro Pro Gly Ala Thr Gly Phe Pro Gly
900 905 910
Ser Ala Gly Arg Val Gly Pro Pro Gly Pro Ala Gly Ala Pro Gly Pro
915 920 925
Ala Gly Pro Leu Gly Glu Pro Gly Lys Glu Gly Pro Pro Gly Leu Arg
930 935 940
Gly Asp Pro Gly Ser His Gly Arg Val Gly Asp Arg Gly Pro Ala Gly
945 950 955 960
Pro Pro Gly Gly Pro Gly Asp Lys Gly Asp Pro Gly Glu Asp Gly Gln
965 970 975
Pro Gly Pro Asp Gly Pro Pro Gly Pro Ala Gly Thr Thr Gly Gln Arg
980 985 990
Gly Ile Val Gly Met Pro Gly Gln Arg Gly Glu Arg Gly Met Pro Gly
995 1000 1005
Leu Pro Gly Pro Ala Gly Thr Pro Gly Lys Val Gly Pro Thr Gly
1010 1015 1020
Ala Thr Gly Asp Lys Gly Pro Pro Gly Pro Val Gly Pro Pro Gly
1025 1030 1035
Ser Asn Gly Pro Val Gly Glu Pro Gly Pro Glu Gly Pro Ala Gly
1040 1045 1050
Asn Asp Gly Thr Pro Gly Arg Asp Gly Ala Val Gly Glu Arg Gly
1055 1060 1065
Asp Arg Gly Asp Pro Gly Pro Ala Gly Leu Pro Gly Ser Gln Gly
1070 1075 1080
Ala Pro Gly Thr Pro Gly Pro Val Gly Ala Pro Gly Asp Ala Gly
1085 1090 1095
Gln Arg Gly Asp Pro Gly Ser Arg Gly Pro Ile Gly Pro Pro Gly
1100 1105 1110
Arg Ala Gly Lys Arg Gly Leu Pro Gly Pro Gln Gly Pro Arg Gly
1115 1120 1125
Asp Lys Gly Asp His Gly Asp Arg Gly Asp Arg Gly Gln Lys Gly
1130 1135 1140
His Arg Gly Phe Thr Gly Leu Gln Gly Leu Pro Gly Pro Pro Gly
1145 1150 1155
Pro Asn Gly Glu Gln Gly Ser Ala Gly Ile Pro Gly Pro Phe Gly
1160 1165 1170
Pro Arg Gly Pro Pro Gly Pro Val Gly Pro Ser Gly Lys Glu Gly
1175 1180 1185
Asn Pro Gly Pro Leu Gly Pro Ile Gly Pro Pro Gly Val Arg Gly
1190 1195 1200
Ser Val Gly Glu Ala Gly Pro Glu Gly Pro Pro Gly Glu Pro Gly
1205 1210 1215
Pro Pro Gly Pro Pro Gly Pro Pro Gly His Leu Thr Ala Ala Leu
1220 1225 1230
Gly Asp Ile Met Gly His Tyr Asp Glu Ser Met Pro Asp Pro Leu
1235 1240 1245
Pro Glu Phe Thr Glu Asp Gln Ala Ala Pro Asp Asp Lys Asn Lys
1250 1255 1260
Thr Asp Pro Gly Val His Ala Thr Leu Lys Ser Leu Ser Ser Gln
1265 1270 1275
Ile Glu Thr Met Arg Ser Pro Asp Gly Ser Lys Lys His Pro Ala
1280 1285 1290
Arg Thr Cys Asp Asp Leu Lys Leu Cys His Ser Ala Lys Gln Ser
1295 1300 1305
Gly Glu Tyr Trp Ile Asp Pro Asn Gln Gly Ser Val Glu Asp Ala
1310 1315 1320
Ile Lys Val Tyr Cys Asn Met Glu Thr Gly Glu Thr Cys Ile Ser
1325 1330 1335
Ala Asn Pro Ser Ser Val Pro Arg Lys Thr Trp Trp Ala Ser Lys
1340 1345 1350
Ser Pro Asp Asn Lys Pro Val Trp Tyr Gly Leu Asp Met Asn Arg
1355 1360 1365
Gly Ser Gln Phe Ala Tyr Gly Asp His Gln Ser Pro Asn Thr Ala
1370 1375 1380
Ile Thr Gln Met Thr Phe Leu Arg Leu Leu Ser Lys Glu Ala Ser
1385 1390 1395
Gln Asn Ile Thr Tyr Ile Cys Lys Asn Ser Val Gly Tyr Met Asp
1400 1405 1410
Asp Gln Ala Lys Asn Leu Lys Lys Ala Val Val Leu Lys Gly Ala
1415 1420 1425
Asn Asp Leu Asp Ile Lys Ala Glu Gly Asn Ile Arg Phe Arg Tyr
1430 1435 1440
Ile Val Leu Gln Asp Thr Cys Ser Lys Arg Asn Gly Asn Val Gly
1445 1450 1455
Lys Thr Val Phe Glu Tyr Arg Thr Gln Asn Val Ala Arg Leu Pro
1460 1465 1470
Ile Ile Asp Leu Ala Pro Val Asp Val Gly Gly Thr Asp Gln Glu
1475 1480 1485
Phe Gly Val Glu Ile Gly Pro Val Cys Phe Val
1490 1495
<210> 74
<211> 1745
<212> ПРТ
<213> Homo sapiens
<400> 74
Met Gly Asn Arg Arg Asp Leu Gly Gln Pro Arg Ala Gly Leu Cys Leu
1 5 10 15
Leu Leu Ala Ala Leu Gln Leu Leu Pro Gly Thr Gln Ala Asp Pro Val
20 25 30
Asp Val Leu Lys Ala Leu Gly Val Gln Gly Gly Gln Ala Gly Val Pro
35 40 45
Glu Gly Pro Gly Phe Cys Pro Gln Arg Thr Pro Glu Gly Asp Arg Ala
50 55 60
Phe Arg Ile Gly Gln Ala Ser Thr Leu Gly Ile Pro Thr Trp Glu Leu
65 70 75 80
Phe Pro Glu Gly His Phe Pro Glu Asn Phe Ser Leu Leu Ile Thr Leu
85 90 95
Arg Gly Gln Pro Ala Asn Gln Ser Val Leu Leu Ser Ile Tyr Asp Glu
100 105 110
Arg Gly Ala Arg Gln Leu Gly Leu Ala Leu Gly Pro Ala Leu Gly Leu
115 120 125
Leu Gly Asp Pro Phe Arg Pro Leu Pro Gln Gln Val Asn Leu Thr Asp
130 135 140
Gly Arg Trp His Arg Val Ala Val Ser Ile Asp Gly Glu Met Val Thr
145 150 155 160
Leu Val Ala Asp Cys Glu Ala Gln Pro Pro Val Leu Gly His Gly Pro
165 170 175
Arg Phe Ile Ser Ile Ala Gly Leu Thr Val Leu Gly Thr Gln Asp Leu
180 185 190
Gly Glu Lys Thr Phe Glu Gly Asp Ile Gln Glu Leu Leu Ile Ser Pro
195 200 205
Asp Pro Gln Ala Ala Phe Gln Ala Cys Glu Arg Tyr Leu Pro Asp Cys
210 215 220
Asp Asn Leu Ala Pro Ala Ala Thr Val Ala Pro Gln Gly Glu Pro Glu
225 230 235 240
Thr Pro Arg Pro Arg Arg Lys Gly Lys Gly Lys Gly Arg Lys Lys Gly
245 250 255
Arg Gly Arg Lys Gly Lys Gly Arg Lys Lys Asn Lys Glu Ile Trp Thr
260 265 270
Ser Ser Pro Pro Pro Asp Ser Ala Glu Asn Gln Thr Ser Thr Asp Ile
275 280 285
Pro Lys Thr Glu Thr Pro Ala Pro Asn Leu Pro Pro Thr Pro Thr Pro
290 295 300
Leu Val Val Thr Ser Thr Val Thr Thr Gly Leu Asn Ala Thr Ile Leu
305 310 315 320
Glu Arg Ser Leu Asp Pro Asp Ser Gly Thr Glu Leu Gly Thr Leu Glu
325 330 335
Thr Lys Ala Ala Arg Glu Asp Glu Glu Gly Asp Asp Ser Thr Met Gly
340 345 350
Pro Asp Phe Arg Ala Ala Glu Tyr Pro Ser Arg Thr Gln Phe Gln Ile
355 360 365
Phe Pro Gly Ala Gly Glu Lys Gly Ala Lys Gly Glu Pro Ala Val Ile
370 375 380
Glu Lys Gly Gln Gln Phe Glu Gly Pro Pro Gly Ala Pro Gly Pro Gln
385 390 395 400
Gly Val Val Gly Pro Ser Gly Pro Pro Gly Pro Pro Gly Phe Pro Gly
405 410 415
Asp Pro Gly Pro Pro Gly Pro Ala Gly Leu Pro Gly Ile Pro Gly Ile
420 425 430
Asp Gly Ile Arg Gly Pro Pro Gly Thr Val Ile Met Met Pro Phe Gln
435 440 445
Phe Ala Gly Gly Ser Phe Lys Gly Pro Pro Val Ser Phe Gln Gln Ala
450 455 460
Gln Ala Gln Ala Val Leu Gln Gln Thr Gln Leu Ser Met Lys Gly Pro
465 470 475 480
Pro Gly Pro Val Gly Leu Thr Gly Arg Pro Gly Pro Val Gly Leu Pro
485 490 495
Gly His Pro Gly Leu Lys Gly Glu Glu Gly Ala Glu Gly Pro Gln Gly
500 505 510
Pro Arg Gly Leu Gln Gly Pro His Gly Pro Pro Gly Arg Val Gly Lys
515 520 525
Met Gly Arg Pro Gly Ala Asp Gly Ala Arg Gly Leu Pro Gly Asp Thr
530 535 540
Gly Pro Lys Gly Asp Arg Gly Phe Asp Gly Leu Pro Gly Leu Pro Gly
545 550 555 560
Glu Lys Gly Gln Arg Gly Asp Phe Gly His Val Gly Gln Pro Gly Pro
565 570 575
Pro Gly Glu Asp Gly Glu Arg Gly Ala Glu Gly Pro Pro Gly Pro Thr
580 585 590
Gly Gln Ala Gly Glu Pro Gly Pro Arg Gly Leu Leu Gly Pro Arg Gly
595 600 605
Ser Pro Gly Pro Thr Gly Arg Pro Gly Val Thr Gly Ile Asp Gly Ala
610 615 620
Pro Gly Ala Lys Gly Asn Val Gly Pro Pro Gly Glu Pro Gly Pro Pro
625 630 635 640
Gly Gln Gln Gly Asn His Gly Ser Gln Gly Leu Pro Gly Pro Gln Gly
645 650 655
Leu Ile Gly Thr Pro Gly Glu Lys Gly Pro Pro Gly Asn Pro Gly Ile
660 665 670
Pro Gly Leu Pro Gly Ser Asp Gly Pro Leu Gly His Pro Gly His Glu
675 680 685
Gly Pro Thr Gly Glu Lys Gly Ala Gln Gly Pro Pro Gly Ser Ala Gly
690 695 700
Pro Pro Gly Tyr Pro Gly Pro Arg Gly Val Lys Gly Thr Ser Gly Asn
705 710 715 720
Arg Gly Leu Gln Gly Glu Lys Gly Glu Lys Gly Glu Asp Gly Phe Pro
725 730 735
Gly Phe Lys Gly Asp Val Gly Leu Lys Gly Asp Gln Gly Lys Pro Gly
740 745 750
Ala Pro Gly Pro Arg Gly Glu Asp Gly Pro Glu Gly Pro Lys Gly Gln
755 760 765
Ala Gly Gln Ala Gly Glu Glu Gly Pro Pro Gly Ser Ala Gly Glu Lys
770 775 780
Gly Lys Leu Gly Val Pro Gly Leu Pro Gly Tyr Pro Gly Arg Pro Gly
785 790 795 800
Pro Lys Gly Ser Ile Gly Phe Pro Gly Pro Leu Gly Pro Ile Gly Glu
805 810 815
Lys Gly Lys Ser Gly Lys Thr Gly Gln Pro Gly Leu Glu Gly Glu Arg
820 825 830
Gly Pro Pro Gly Ser Arg Gly Glu Arg Gly Gln Pro Gly Ala Thr Gly
835 840 845
Gln Pro Gly Pro Lys Gly Asp Val Gly Gln Asp Gly Ala Pro Gly Ile
850 855 860
Pro Gly Glu Lys Gly Leu Pro Gly Leu Gln Gly Pro Pro Gly Phe Pro
865 870 875 880
Gly Pro Lys Gly Pro Pro Gly His Gln Gly Lys Asp Gly Arg Pro Gly
885 890 895
His Pro Gly Gln Arg Gly Glu Leu Gly Phe Gln Gly Gln Thr Gly Pro
900 905 910
Pro Gly Pro Ala Gly Val Leu Gly Pro Gln Gly Lys Thr Gly Glu Val
915 920 925
Gly Pro Leu Gly Glu Arg Gly Pro Pro Gly Pro Pro Gly Pro Pro Gly
930 935 940
Glu Gln Gly Leu Pro Gly Leu Glu Gly Arg Glu Gly Ala Lys Gly Glu
945 950 955 960
Leu Gly Pro Pro Gly Pro Leu Gly Lys Glu Gly Pro Ala Gly Leu Arg
965 970 975
Gly Phe Pro Gly Pro Lys Gly Gly Pro Gly Asp Pro Gly Pro Thr Gly
980 985 990
Leu Lys Gly Asp Lys Gly Pro Pro Gly Pro Val Gly Ala Asn Gly Ser
995 1000 1005
Pro Gly Glu Arg Gly Pro Leu Gly Pro Ala Gly Gly Ile Gly Leu
1010 1015 1020
Pro Gly Gln Ser Gly Ser Glu Gly Pro Val Gly Pro Ala Gly Lys
1025 1030 1035
Lys Gly Ser Arg Gly Glu Arg Gly Pro Pro Gly Pro Thr Gly Lys
1040 1045 1050
Asp Gly Ile Pro Gly Pro Leu Gly Pro Leu Gly Pro Pro Gly Ala
1055 1060 1065
Ala Gly Pro Ser Gly Glu Glu Gly Asp Lys Gly Asp Val Gly Ala
1070 1075 1080
Pro Gly His Lys Gly Ser Lys Gly Asp Lys Gly Asp Ala Gly Pro
1085 1090 1095
Pro Gly Gln Pro Gly Ile Arg Gly Pro Ala Gly His Pro Gly Pro
1100 1105 1110
Pro Gly Ala Asp Gly Ala Gln Gly Arg Arg Gly Pro Pro Gly Leu
1115 1120 1125
Phe Gly Gln Lys Gly Asp Asp Gly Val Arg Gly Phe Val Gly Val
1130 1135 1140
Ile Gly Pro Pro Gly Leu Gln Gly Leu Pro Gly Pro Pro Gly Glu
1145 1150 1155
Lys Gly Glu Val Gly Asp Val Gly Ser Met Gly Pro His Gly Ala
1160 1165 1170
Pro Gly Pro Arg Gly Pro Gln Gly Pro Thr Gly Ser Glu Gly Thr
1175 1180 1185
Pro Gly Leu Pro Gly Gly Val Gly Gln Pro Gly Ala Val Gly Glu
1190 1195 1200
Lys Gly Glu Arg Gly Asp Ala Gly Asp Pro Gly Pro Pro Gly Ala
1205 1210 1215
Pro Gly Ile Pro Gly Pro Lys Gly Asp Ile Gly Glu Lys Gly Asp
1220 1225 1230
Ser Gly Pro Ser Gly Ala Ala Gly Pro Pro Gly Lys Lys Gly Pro
1235 1240 1245
Pro Gly Glu Asp Gly Ala Lys Gly Ser Val Gly Pro Thr Gly Leu
1250 1255 1260
Pro Gly Asp Leu Gly Pro Pro Gly Asp Pro Gly Val Ser Gly Ile
1265 1270 1275
Asp Gly Ser Pro Gly Glu Lys Gly Asp Pro Gly Asp Val Gly Gly
1280 1285 1290
Pro Gly Pro Pro Gly Ala Ser Gly Glu Pro Gly Ala Pro Gly Pro
1295 1300 1305
Pro Gly Lys Arg Gly Pro Ser Gly His Met Gly Arg Glu Gly Arg
1310 1315 1320
Glu Gly Glu Lys Gly Ala Lys Gly Glu Pro Gly Pro Asp Gly Pro
1325 1330 1335
Pro Gly Arg Thr Gly Pro Met Gly Ala Arg Gly Pro Pro Gly Arg
1340 1345 1350
Val Gly Pro Glu Gly Leu Arg Gly Ile Pro Gly Pro Val Gly Glu
1355 1360 1365
Pro Gly Leu Leu Gly Ala Pro Gly Gln Met Gly Pro Pro Gly Pro
1370 1375 1380
Leu Gly Pro Ser Gly Leu Pro Gly Leu Lys Gly Asp Thr Gly Pro
1385 1390 1395
Lys Gly Glu Lys Gly His Ile Gly Leu Ile Gly Leu Ile Gly Pro
1400 1405 1410
Pro Gly Glu Ala Gly Glu Lys Gly Asp Gln Gly Leu Pro Gly Val
1415 1420 1425
Gln Gly Pro Pro Gly Pro Lys Gly Asp Pro Gly Pro Pro Gly Pro
1430 1435 1440
Ile Gly Ser Leu Gly His Pro Gly Pro Pro Gly Val Ala Gly Pro
1445 1450 1455
Leu Gly Gln Lys Gly Ser Lys Gly Ser Pro Gly Ser Met Gly Pro
1460 1465 1470
Arg Gly Asp Thr Gly Pro Ala Gly Pro Pro Gly Pro Pro Gly Ala
1475 1480 1485
Pro Ala Glu Leu His Gly Leu Arg Arg Arg Arg Arg Phe Val Pro
1490 1495 1500
Val Pro Leu Pro Val Val Glu Gly Gly Leu Glu Glu Val Leu Ala
1505 1510 1515
Ser Leu Thr Ser Leu Ser Leu Glu Leu Glu Gln Leu Arg Arg Pro
1520 1525 1530
Pro Gly Thr Ala Glu Arg Pro Gly Leu Val Cys His Glu Leu His
1535 1540 1545
Arg Asn His Pro His Leu Pro Asp Gly Glu Tyr Trp Ile Asp Pro
1550 1555 1560
Asn Gln Gly Cys Ala Arg Asp Ser Phe Arg Val Phe Cys Asn Phe
1565 1570 1575
Thr Ala Gly Gly Glu Thr Cys Leu Tyr Pro Asp Lys Lys Phe Glu
1580 1585 1590
Ile Val Lys Leu Ala Ser Trp Ser Lys Glu Lys Pro Gly Gly Trp
1595 1600 1605
Tyr Ser Thr Phe Arg Arg Gly Lys Lys Phe Ser Tyr Val Asp Ala
1610 1615 1620
Asp Gly Ser Pro Val Asn Val Val Gln Leu Asn Phe Leu Lys Leu
1625 1630 1635
Leu Ser Ala Thr Ala Arg Gln Asn Phe Thr Tyr Ser Cys Gln Asn
1640 1645 1650
Ala Ala Ala Trp Leu Asp Glu Ala Thr Gly Asp Tyr Ser His Ser
1655 1660 1665
Ala Arg Phe Leu Gly Thr Asn Gly Glu Glu Leu Ser Phe Asn Gln
1670 1675 1680
Thr Thr Ala Ala Thr Val Ser Val Pro Gln Asp Gly Cys Arg Leu
1685 1690 1695
Arg Lys Gly Gln Thr Lys Thr Leu Phe Glu Phe Ser Ser Ser Arg
1700 1705 1710
Ala Gly Phe Leu Pro Leu Trp Asp Val Ala Ala Thr Asp Phe Gly
1715 1720 1725
Gln Thr Asn Gln Lys Phe Gly Phe Glu Leu Gly Pro Val Cys Phe
1730 1735 1740
Ser Ser
1745
<210> 75
<211> 1028
<212> ПРТ
<213> Homo sapiens
<400> 75
Met Arg Ala Ala Arg Ala Leu Leu Pro Leu Leu Leu Gln Ala Cys Trp
1 5 10 15
Thr Ala Ala Gln Asp Glu Pro Glu Thr Pro Arg Ala Val Ala Phe Gln
20 25 30
Asp Cys Pro Val Asp Leu Phe Phe Val Leu Asp Thr Ser Glu Ser Val
35 40 45
Ala Leu Arg Leu Lys Pro Tyr Gly Ala Leu Val Asp Lys Val Lys Ser
50 55 60
Phe Thr Lys Arg Phe Ile Asp Asn Leu Arg Asp Arg Tyr Tyr Arg Cys
65 70 75 80
Asp Arg Asn Leu Val Trp Asn Ala Gly Ala Leu His Tyr Ser Asp Glu
85 90 95
Val Glu Ile Ile Gln Gly Leu Thr Arg Met Pro Gly Gly Arg Asp Ala
100 105 110
Leu Lys Ser Ser Val Asp Ala Val Lys Tyr Phe Gly Lys Gly Thr Tyr
115 120 125
Thr Asp Cys Ala Ile Lys Lys Gly Leu Glu Gln Leu Leu Val Gly Gly
130 135 140
Ser His Leu Lys Glu Asn Lys Tyr Leu Ile Val Val Thr Asp Gly His
145 150 155 160
Pro Leu Glu Gly Tyr Lys Glu Pro Cys Gly Gly Leu Glu Asp Ala Val
165 170 175
Asn Glu Ala Lys His Leu Gly Val Lys Val Phe Ser Val Ala Ile Thr
180 185 190
Pro Asp His Leu Glu Pro Arg Leu Ser Ile Ile Ala Thr Asp His Thr
195 200 205
Tyr Arg Arg Asn Phe Thr Ala Ala Asp Trp Gly Gln Ser Arg Asp Ala
210 215 220
Glu Glu Ala Ile Ser Gln Thr Ile Asp Thr Ile Val Asp Met Ile Lys
225 230 235 240
Asn Asn Val Glu Gln Val Cys Cys Ser Phe Glu Cys Gln Pro Ala Arg
245 250 255
Gly Pro Pro Gly Leu Arg Gly Asp Pro Gly Phe Glu Gly Glu Arg Gly
260 265 270
Lys Pro Gly Leu Pro Gly Glu Lys Gly Glu Ala Gly Asp Pro Gly Arg
275 280 285
Pro Gly Asp Leu Gly Pro Val Gly Tyr Gln Gly Met Lys Gly Glu Lys
290 295 300
Gly Ser Arg Gly Glu Lys Gly Ser Arg Gly Pro Lys Gly Tyr Lys Gly
305 310 315 320
Glu Lys Gly Lys Arg Gly Ile Asp Gly Val Asp Gly Val Lys Gly Glu
325 330 335
Met Gly Tyr Pro Gly Leu Pro Gly Cys Lys Gly Ser Pro Gly Phe Asp
340 345 350
Gly Ile Gln Gly Pro Pro Gly Pro Lys Gly Asp Pro Gly Ala Phe Gly
355 360 365
Leu Lys Gly Glu Lys Gly Glu Pro Gly Ala Asp Gly Glu Ala Gly Arg
370 375 380
Pro Gly Ser Ser Gly Pro Ser Gly Asp Glu Gly Gln Pro Gly Glu Pro
385 390 395 400
Gly Pro Pro Gly Glu Lys Gly Glu Ala Gly Asp Glu Gly Asn Pro Gly
405 410 415
Pro Asp Gly Ala Pro Gly Glu Arg Gly Gly Pro Gly Glu Arg Gly Pro
420 425 430
Arg Gly Thr Pro Gly Thr Arg Gly Pro Arg Gly Asp Pro Gly Glu Ala
435 440 445
Gly Pro Gln Gly Asp Gln Gly Arg Glu Gly Pro Val Gly Val Pro Gly
450 455 460
Asp Pro Gly Glu Ala Gly Pro Ile Gly Pro Lys Gly Tyr Arg Gly Asp
465 470 475 480
Glu Gly Pro Pro Gly Ser Glu Gly Ala Arg Gly Ala Pro Gly Pro Ala
485 490 495
Gly Pro Pro Gly Asp Pro Gly Leu Met Gly Glu Arg Gly Glu Asp Gly
500 505 510
Pro Ala Gly Asn Gly Thr Glu Gly Phe Pro Gly Phe Pro Gly Tyr Pro
515 520 525
Gly Asn Arg Gly Ala Pro Gly Ile Asn Gly Thr Lys Gly Tyr Pro Gly
530 535 540
Leu Lys Gly Asp Glu Gly Glu Ala Gly Asp Pro Gly Asp Asp Asn Asn
545 550 555 560
Asp Ile Ala Pro Arg Gly Val Lys Gly Ala Lys Gly Tyr Arg Gly Pro
565 570 575
Glu Gly Pro Gln Gly Pro Pro Gly His Gln Gly Pro Pro Gly Pro Asp
580 585 590
Glu Cys Glu Ile Leu Asp Ile Ile Met Lys Met Cys Ser Cys Cys Glu
595 600 605
Cys Lys Cys Gly Pro Ile Asp Leu Leu Phe Val Leu Asp Ser Ser Glu
610 615 620
Ser Ile Gly Leu Gln Asn Phe Glu Ile Ala Lys Asp Phe Val Val Lys
625 630 635 640
Val Ile Asp Arg Leu Ser Arg Asp Glu Leu Val Lys Phe Glu Pro Gly
645 650 655
Gln Ser Tyr Ala Gly Val Val Gln Tyr Ser His Ser Gln Met Gln Glu
660 665 670
His Val Ser Leu Arg Ser Pro Ser Ile Arg Asn Val Gln Glu Leu Lys
675 680 685
Glu Ala Ile Lys Ser Leu Gln Trp Met Ala Gly Gly Thr Phe Thr Gly
690 695 700
Glu Ala Leu Gln Tyr Thr Arg Asp Gln Leu Leu Pro Pro Ser Pro Asn
705 710 715 720
Asn Arg Ile Ala Leu Val Ile Thr Asp Gly Arg Ser Asp Thr Gln Arg
725 730 735
Asp Thr Thr Pro Leu Asn Val Leu Cys Ser Pro Gly Ile Gln Val Val
740 745 750
Ser Val Gly Ile Lys Asp Val Phe Asp Phe Ile Pro Gly Ser Asp Gln
755 760 765
Leu Asn Val Ile Ser Cys Gln Gly Leu Ala Pro Ser Gln Gly Arg Pro
770 775 780
Gly Leu Ser Leu Val Lys Glu Asn Tyr Ala Glu Leu Leu Glu Asp Ala
785 790 795 800
Phe Leu Lys Asn Val Thr Ala Gln Ile Cys Ile Asp Lys Lys Cys Pro
805 810 815
Asp Tyr Thr Cys Pro Ile Thr Phe Ser Ser Pro Ala Asp Ile Thr Ile
820 825 830
Leu Leu Asp Gly Ser Ala Ser Val Gly Ser His Asn Phe Asp Thr Thr
835 840 845
Lys Arg Phe Ala Lys Arg Leu Ala Glu Arg Phe Leu Thr Ala Gly Arg
850 855 860
Thr Asp Pro Ala His Asp Val Arg Val Ala Val Val Gln Tyr Ser Gly
865 870 875 880
Thr Gly Gln Gln Arg Pro Glu Arg Ala Ser Leu Gln Phe Leu Gln Asn
885 890 895
Tyr Thr Ala Leu Ala Ser Ala Val Asp Ala Met Asp Phe Ile Asn Asp
900 905 910
Ala Thr Asp Val Asn Asp Ala Leu Gly Tyr Val Thr Arg Phe Tyr Arg
915 920 925
Glu Ala Ser Ser Gly Ala Ala Lys Lys Arg Leu Leu Leu Phe Ser Asp
930 935 940
Gly Asn Ser Gln Gly Ala Thr Pro Ala Ala Ile Glu Lys Ala Val Gln
945 950 955 960
Glu Ala Gln Arg Ala Gly Ile Glu Ile Phe Val Val Val Val Gly Arg
965 970 975
Gln Val Asn Glu Pro His Ile Arg Val Leu Val Thr Gly Lys Thr Ala
980 985 990
Glu Tyr Asp Val Ala Tyr Gly Glu Ser His Leu Phe Arg Val Pro Ser
995 1000 1005
Tyr Gln Ala Leu Leu Arg Gly Val Phe His Gln Thr Val Ser Arg
1010 1015 1020
Lys Val Ala Leu Gly
1025
<210> 76
<211> 1019
<212> ПРТ
<213> Homo sapiens
<400> 76
Met Leu Gln Gly Thr Cys Ser Val Leu Leu Leu Trp Gly Ile Leu Gly
1 5 10 15
Ala Ile Gln Ala Gln Gln Gln Glu Val Ile Ser Pro Asp Thr Thr Glu
20 25 30
Arg Asn Asn Asn Cys Pro Glu Lys Thr Asp Cys Pro Ile His Val Tyr
35 40 45
Phe Val Leu Asp Thr Ser Glu Ser Val Thr Met Gln Ser Pro Thr Asp
50 55 60
Ile Leu Leu Phe His Met Lys Gln Phe Val Pro Gln Phe Ile Ser Gln
65 70 75 80
Leu Gln Asn Glu Phe Tyr Leu Asp Gln Val Ala Leu Ser Trp Arg Tyr
85 90 95
Gly Gly Leu His Phe Ser Asp Gln Val Glu Val Phe Ser Pro Pro Gly
100 105 110
Ser Asp Arg Ala Ser Phe Ile Lys Asn Leu Gln Gly Ile Ser Ser Phe
115 120 125
Arg Arg Gly Thr Phe Thr Asp Cys Ala Leu Ala Asn Met Thr Glu Gln
130 135 140
Ile Arg Gln Asp Arg Ser Lys Gly Thr Val His Phe Ala Val Val Ile
145 150 155 160
Thr Asp Gly His Val Thr Gly Ser Pro Cys Gly Gly Ile Lys Leu Gln
165 170 175
Ala Glu Arg Ala Arg Glu Glu Gly Ile Arg Leu Phe Ala Val Ala Pro
180 185 190
Asn Gln Asn Leu Lys Glu Gln Gly Leu Arg Asp Ile Ala Ser Thr Pro
195 200 205
His Glu Leu Tyr Arg Asn Asp Tyr Ala Thr Met Leu Pro Asp Ser Thr
210 215 220
Glu Ile Asp Gln Asp Thr Ile Asn Arg Ile Ile Lys Val Met Lys His
225 230 235 240
Glu Ala Tyr Gly Glu Cys Tyr Lys Val Ser Cys Leu Glu Ile Pro Gly
245 250 255
Pro Ser Gly Pro Lys Gly Tyr Arg Gly Gln Lys Gly Ala Lys Gly Asn
260 265 270
Met Gly Glu Pro Gly Glu Pro Gly Gln Lys Gly Arg Gln Gly Asp Pro
275 280 285
Gly Ile Glu Gly Pro Ile Gly Phe Pro Gly Pro Lys Gly Val Pro Gly
290 295 300
Phe Lys Gly Glu Lys Gly Glu Phe Gly Ala Asp Gly Arg Lys Gly Ala
305 310 315 320
Pro Gly Leu Ala Gly Lys Asn Gly Thr Asp Gly Gln Lys Gly Lys Leu
325 330 335
Gly Arg Ile Gly Pro Pro Gly Cys Lys Gly Asp Pro Gly Asn Arg Gly
340 345 350
Pro Asp Gly Tyr Pro Gly Glu Ala Gly Ser Pro Gly Glu Arg Gly Asp
355 360 365
Gln Gly Gly Lys Gly Asp Pro Gly Arg Pro Gly Arg Arg Gly Pro Pro
370 375 380
Gly Glu Ile Gly Ala Lys Gly Ser Lys Gly Tyr Gln Gly Asn Ser Gly
385 390 395 400
Ala Pro Gly Ser Pro Gly Val Lys Gly Ala Lys Gly Gly Pro Gly Pro
405 410 415
Arg Gly Pro Lys Gly Glu Pro Gly Arg Arg Gly Asp Pro Gly Thr Lys
420 425 430
Gly Ser Pro Gly Ser Asp Gly Pro Lys Gly Glu Lys Gly Asp Pro Gly
435 440 445
Pro Glu Gly Pro Arg Gly Leu Ala Gly Glu Val Gly Asn Lys Gly Ala
450 455 460
Lys Gly Asp Arg Gly Leu Pro Gly Pro Arg Gly Pro Gln Gly Ala Leu
465 470 475 480
Gly Glu Pro Gly Lys Gln Gly Ser Arg Gly Asp Pro Gly Asp Ala Gly
485 490 495
Pro Arg Gly Asp Ser Gly Gln Pro Gly Pro Lys Gly Asp Pro Gly Arg
500 505 510
Pro Gly Phe Ser Tyr Pro Gly Pro Arg Gly Ala Pro Gly Glu Lys Gly
515 520 525
Glu Pro Gly Pro Arg Gly Pro Glu Gly Gly Arg Gly Asp Phe Gly Leu
530 535 540
Lys Gly Glu Pro Gly Arg Lys Gly Glu Lys Gly Glu Pro Ala Asp Pro
545 550 555 560
Gly Pro Pro Gly Glu Pro Gly Pro Arg Gly Pro Arg Gly Val Pro Gly
565 570 575
Pro Glu Gly Glu Pro Gly Pro Pro Gly Asp Pro Gly Leu Thr Glu Cys
580 585 590
Asp Val Met Thr Tyr Val Arg Glu Thr Cys Gly Cys Cys Asp Cys Glu
595 600 605
Lys Arg Cys Gly Ala Leu Asp Val Val Phe Val Ile Asp Ser Ser Glu
610 615 620
Ser Ile Gly Tyr Thr Asn Phe Thr Leu Glu Lys Asn Phe Val Ile Asn
625 630 635 640
Val Val Asn Arg Leu Gly Ala Ile Ala Lys Asp Pro Lys Ser Glu Thr
645 650 655
Gly Thr Arg Val Gly Val Val Gln Tyr Ser His Glu Gly Thr Phe Glu
660 665 670
Ala Ile Gln Leu Asp Asp Glu Arg Ile Asp Ser Leu Ser Ser Phe Lys
675 680 685
Glu Ala Val Lys Asn Leu Glu Trp Ile Ala Gly Gly Thr Trp Thr Pro
690 695 700
Ser Ala Leu Lys Phe Ala Tyr Asp Arg Leu Ile Lys Glu Ser Arg Arg
705 710 715 720
Gln Lys Thr Arg Val Phe Ala Val Val Ile Thr Asp Gly Arg His Asp
725 730 735
Pro Arg Asp Asp Asp Leu Asn Leu Arg Ala Leu Cys Asp Arg Asp Val
740 745 750
Thr Val Thr Ala Ile Gly Ile Gly Asp Met Phe His Glu Lys His Glu
755 760 765
Ser Glu Asn Leu Tyr Ser Ile Ala Cys Asp Lys Pro Gln Gln Val Arg
770 775 780
Asn Met Thr Leu Phe Ser Asp Leu Val Ala Glu Lys Phe Ile Asp Asp
785 790 795 800
Met Glu Asp Val Leu Cys Pro Asp Pro Gln Ile Val Cys Pro Asp Leu
805 810 815
Pro Cys Gln Thr Glu Leu Ser Val Ala Gln Cys Thr Gln Arg Pro Val
820 825 830
Asp Ile Val Phe Leu Leu Asp Gly Ser Glu Arg Leu Gly Glu Gln Asn
835 840 845
Phe His Lys Ala Arg Arg Phe Val Glu Gln Val Ala Arg Arg Leu Thr
850 855 860
Leu Ala Arg Arg Asp Asp Asp Pro Leu Asn Ala Arg Val Ala Leu Leu
865 870 875 880
Gln Phe Gly Gly Pro Gly Glu Gln Gln Val Ala Phe Pro Leu Ser His
885 890 895
Asn Leu Thr Ala Ile His Glu Ala Leu Glu Thr Thr Gln Tyr Leu Asn
900 905 910
Ser Phe Ser His Val Gly Ala Gly Val Val His Ala Ile Asn Ala Ile
915 920 925
Val Arg Ser Pro Arg Gly Gly Ala Arg Arg His Ala Glu Leu Ser Phe
930 935 940
Val Phe Leu Thr Asp Gly Val Thr Gly Asn Asp Ser Leu His Glu Ser
945 950 955 960
Ala His Ser Met Arg Lys Gln Asn Val Val Pro Thr Val Leu Ala Leu
965 970 975
Gly Ser Asp Val Asp Met Asp Val Leu Thr Thr Leu Ser Leu Gly Asp
980 985 990
Arg Ala Ala Val Phe His Glu Lys Asp Tyr Asp Ser Leu Ala Gln Pro
995 1000 1005
Gly Phe Phe Asp Arg Phe Ile Arg Trp Ile Cys
1010 1015
<210> 77
<211> 3177
<212> ПРТ
<213> Homo sapiens
<400> 77
Met Arg Lys His Arg His Leu Pro Leu Val Ala Val Phe Cys Leu Phe
1 5 10 15
Leu Ser Gly Phe Pro Thr Thr His Ala Gln Gln Gln Gln Ala Asp Val
20 25 30
Lys Asn Gly Ala Ala Ala Asp Ile Ile Phe Leu Val Asp Ser Ser Trp
35 40 45
Thr Ile Gly Glu Glu His Phe Gln Leu Val Arg Glu Phe Leu Tyr Asp
50 55 60
Val Val Lys Ser Leu Ala Val Gly Glu Asn Asp Phe His Phe Ala Leu
65 70 75 80
Val Gln Phe Asn Gly Asn Pro His Thr Glu Phe Leu Leu Asn Thr Tyr
85 90 95
Arg Thr Lys Gln Glu Val Leu Ser His Ile Ser Asn Met Ser Tyr Ile
100 105 110
Gly Gly Thr Asn Gln Thr Gly Lys Gly Leu Glu Tyr Ile Met Gln Ser
115 120 125
His Leu Thr Lys Ala Ala Gly Ser Arg Ala Gly Asp Gly Val Pro Gln
130 135 140
Val Ile Val Val Leu Thr Asp Gly His Ser Lys Asp Gly Leu Ala Leu
145 150 155 160
Pro Ser Ala Glu Leu Lys Ser Ala Asp Val Asn Val Phe Ala Ile Gly
165 170 175
Val Glu Asp Ala Asp Glu Gly Ala Leu Lys Glu Ile Ala Ser Glu Pro
180 185 190
Leu Asn Met His Met Phe Asn Leu Glu Asn Phe Thr Ser Leu His Asp
195 200 205
Ile Val Gly Asn Leu Val Ser Cys Val His Ser Ser Val Ser Pro Glu
210 215 220
Arg Ala Gly Asp Thr Glu Thr Leu Lys Asp Ile Thr Ala Gln Asp Ser
225 230 235 240
Ala Asp Ile Ile Phe Leu Ile Asp Gly Ser Asn Asn Thr Gly Ser Val
245 250 255
Asn Phe Ala Val Ile Leu Asp Phe Leu Val Asn Leu Leu Glu Lys Leu
260 265 270
Pro Ile Gly Thr Gln Gln Ile Arg Val Gly Val Val Gln Phe Ser Asp
275 280 285
Glu Pro Arg Thr Met Phe Ser Leu Asp Thr Tyr Ser Thr Lys Ala Gln
290 295 300
Val Leu Gly Ala Val Lys Ala Leu Gly Phe Ala Gly Gly Glu Leu Ala
305 310 315 320
Asn Ile Gly Leu Ala Leu Asp Phe Val Val Glu Asn His Phe Thr Arg
325 330 335
Ala Gly Gly Ser Arg Val Glu Glu Gly Val Pro Gln Val Leu Val Leu
340 345 350
Ile Ser Ala Gly Pro Ser Ser Asp Glu Ile Arg Tyr Gly Val Val Ala
355 360 365
Leu Lys Gln Ala Ser Val Phe Ser Phe Gly Leu Gly Ala Gln Ala Ala
370 375 380
Ser Arg Ala Glu Leu Gln His Ile Ala Thr Asp Asp Asn Leu Val Phe
385 390 395 400
Thr Val Pro Glu Phe Arg Ser Phe Gly Asp Leu Gln Glu Lys Leu Leu
405 410 415
Pro Tyr Ile Val Gly Val Ala Gln Arg His Ile Val Leu Lys Pro Pro
420 425 430
Thr Ile Val Thr Gln Val Ile Glu Val Asn Lys Arg Asp Ile Val Phe
435 440 445
Leu Val Asp Gly Ser Ser Ala Leu Gly Leu Ala Asn Phe Asn Ala Ile
450 455 460
Arg Asp Phe Ile Ala Lys Val Ile Gln Arg Leu Glu Ile Gly Gln Asp
465 470 475 480
Leu Ile Gln Val Ala Val Ala Gln Tyr Ala Asp Thr Val Arg Pro Glu
485 490 495
Phe Tyr Phe Asn Thr His Pro Thr Lys Arg Glu Val Ile Thr Ala Val
500 505 510
Arg Lys Met Lys Pro Leu Asp Gly Ser Ala Leu Tyr Thr Gly Ser Ala
515 520 525
Leu Asp Phe Val Arg Asn Asn Leu Phe Thr Ser Ser Ala Gly Tyr Arg
530 535 540
Ala Ala Glu Gly Ile Pro Lys Leu Leu Val Leu Ile Thr Gly Gly Lys
545 550 555 560
Ser Leu Asp Glu Ile Ser Gln Pro Ala Gln Glu Leu Lys Arg Ser Ser
565 570 575
Ile Met Ala Phe Ala Ile Gly Asn Lys Gly Ala Asp Gln Ala Glu Leu
580 585 590
Glu Glu Ile Ala Phe Asp Ser Ser Leu Val Phe Ile Pro Ala Glu Phe
595 600 605
Arg Ala Ala Pro Leu Gln Gly Met Leu Pro Gly Leu Leu Ala Pro Leu
610 615 620
Arg Thr Leu Ser Gly Thr Pro Glu Val His Ser Asn Lys Arg Asp Ile
625 630 635 640
Ile Phe Leu Leu Asp Gly Ser Ala Asn Val Gly Lys Thr Asn Phe Pro
645 650 655
Tyr Val Arg Asp Phe Val Met Asn Leu Val Asn Ser Leu Asp Ile Gly
660 665 670
Asn Asp Asn Ile Arg Val Gly Leu Val Gln Phe Ser Asp Thr Pro Val
675 680 685
Thr Glu Phe Ser Leu Asn Thr Tyr Gln Thr Lys Ser Asp Ile Leu Gly
690 695 700
His Leu Arg Gln Leu Gln Leu Gln Gly Gly Ser Gly Leu Asn Thr Gly
705 710 715 720
Ser Ala Leu Ser Tyr Val Tyr Ala Asn His Phe Thr Glu Ala Gly Gly
725 730 735
Ser Arg Ile Arg Glu His Val Pro Gln Leu Leu Leu Leu Leu Thr Ala
740 745 750
Gly Gln Ser Glu Asp Ser Tyr Leu Gln Ala Ala Asn Ala Leu Thr Arg
755 760 765
Ala Gly Ile Leu Thr Phe Cys Val Gly Ala Ser Gln Ala Asn Lys Ala
770 775 780
Glu Leu Glu Gln Ile Ala Phe Asn Pro Ser Leu Val Tyr Leu Met Asp
785 790 795 800
Asp Phe Ser Ser Leu Pro Ala Leu Pro Gln Gln Leu Ile Gln Pro Leu
805 810 815
Thr Thr Tyr Val Ser Gly Gly Val Glu Glu Val Pro Leu Ala Gln Pro
820 825 830
Glu Ser Lys Arg Asp Ile Leu Phe Leu Phe Asp Gly Ser Ala Asn Leu
835 840 845
Val Gly Gln Phe Pro Val Val Arg Asp Phe Leu Tyr Lys Ile Ile Asp
850 855 860
Glu Leu Asn Val Lys Pro Glu Gly Thr Arg Ile Ala Val Ala Gln Tyr
865 870 875 880
Ser Asp Asp Val Lys Val Glu Ser Arg Phe Asp Glu His Gln Ser Lys
885 890 895
Pro Glu Ile Leu Asn Leu Val Lys Arg Met Lys Ile Lys Thr Gly Lys
900 905 910
Ala Leu Asn Leu Gly Tyr Ala Leu Asp Tyr Ala Gln Arg Tyr Ile Phe
915 920 925
Val Lys Ser Ala Gly Ser Arg Ile Glu Asp Gly Val Leu Gln Phe Leu
930 935 940
Val Leu Leu Val Ala Gly Arg Ser Ser Asp Arg Val Asp Gly Pro Ala
945 950 955 960
Ser Asn Leu Lys Gln Ser Gly Val Val Pro Phe Ile Phe Gln Ala Lys
965 970 975
Asn Ala Asp Pro Ala Glu Leu Glu Gln Ile Val Leu Ser Pro Ala Phe
980 985 990
Ile Leu Ala Ala Glu Ser Leu Pro Lys Ile Gly Asp Leu His Pro Gln
995 1000 1005
Ile Val Asn Leu Leu Lys Ser Val His Asn Gly Ala Pro Ala Pro
1010 1015 1020
Val Ser Gly Glu Lys Asp Val Val Phe Leu Leu Asp Gly Ser Glu
1025 1030 1035
Gly Val Arg Ser Gly Phe Pro Leu Leu Lys Glu Phe Val Gln Arg
1040 1045 1050
Val Val Glu Ser Leu Asp Val Gly Gln Asp Arg Val Arg Val Ala
1055 1060 1065
Val Val Gln Tyr Ser Asp Arg Thr Arg Pro Glu Phe Tyr Leu Asn
1070 1075 1080
Ser Tyr Met Asn Lys Gln Asp Val Val Asn Ala Val Arg Gln Leu
1085 1090 1095
Thr Leu Leu Gly Gly Pro Thr Pro Asn Thr Gly Ala Ala Leu Glu
1100 1105 1110
Phe Val Leu Arg Asn Ile Leu Val Ser Ser Ala Gly Ser Arg Ile
1115 1120 1125
Thr Glu Gly Val Pro Gln Leu Leu Ile Val Leu Thr Ala Asp Arg
1130 1135 1140
Ser Gly Asp Asp Val Arg Asn Pro Ser Val Val Val Lys Arg Gly
1145 1150 1155
Gly Ala Val Pro Ile Gly Ile Gly Ile Gly Asn Ala Asp Ile Thr
1160 1165 1170
Glu Met Gln Thr Ile Ser Phe Ile Pro Asp Phe Ala Val Ala Ile
1175 1180 1185
Pro Thr Phe Arg Gln Leu Gly Thr Val Gln Gln Val Ile Ser Glu
1190 1195 1200
Arg Val Thr Gln Leu Thr Arg Glu Glu Leu Ser Arg Leu Gln Pro
1205 1210 1215
Val Leu Gln Pro Leu Pro Ser Pro Gly Val Gly Gly Lys Arg Asp
1220 1225 1230
Val Val Phe Leu Ile Asp Gly Ser Gln Ser Ala Gly Pro Glu Phe
1235 1240 1245
Gln Tyr Val Arg Thr Leu Ile Glu Arg Leu Val Asp Tyr Leu Asp
1250 1255 1260
Val Gly Phe Asp Thr Thr Arg Val Ala Val Ile Gln Phe Ser Asp
1265 1270 1275
Asp Pro Lys Val Glu Phe Leu Leu Asn Ala His Ser Ser Lys Asp
1280 1285 1290
Glu Val Gln Asn Ala Val Gln Arg Leu Arg Pro Lys Gly Gly Arg
1295 1300 1305
Gln Ile Asn Val Gly Asn Ala Leu Glu Tyr Val Ser Arg Asn Ile
1310 1315 1320
Phe Lys Arg Pro Leu Gly Ser Arg Ile Glu Glu Gly Val Pro Gln
1325 1330 1335
Phe Leu Val Leu Ile Ser Ser Gly Lys Ser Asp Asp Glu Val Asp
1340 1345 1350
Asp Pro Ala Val Glu Leu Lys Gln Phe Gly Val Ala Pro Phe Thr
1355 1360 1365
Ile Ala Arg Asn Ala Asp Gln Glu Glu Leu Val Lys Ile Ser Leu
1370 1375 1380
Ser Pro Glu Tyr Val Phe Ser Val Ser Thr Phe Arg Glu Leu Pro
1385 1390 1395
Ser Leu Glu Gln Lys Leu Leu Thr Pro Ile Thr Thr Leu Thr Ser
1400 1405 1410
Glu Gln Ile Gln Lys Leu Leu Ala Ser Thr Arg Tyr Pro Pro Pro
1415 1420 1425
Ala Val Glu Ser Asp Ala Ala Asp Ile Val Phe Leu Ile Asp Ser
1430 1435 1440
Ser Glu Gly Val Arg Pro Asp Gly Phe Ala His Ile Arg Asp Phe
1445 1450 1455
Val Ser Arg Ile Val Arg Arg Leu Asn Ile Gly Pro Ser Lys Val
1460 1465 1470
Arg Val Gly Val Val Gln Phe Ser Asn Asp Val Phe Pro Glu Phe
1475 1480 1485
Tyr Leu Lys Thr Tyr Arg Ser Gln Ala Pro Val Leu Asp Ala Ile
1490 1495 1500
Arg Arg Leu Arg Leu Arg Gly Gly Ser Pro Leu Asn Thr Gly Lys
1505 1510 1515
Ala Leu Glu Phe Val Ala Arg Asn Leu Phe Val Lys Ser Ala Gly
1520 1525 1530
Ser Arg Ile Glu Asp Gly Val Pro Gln His Leu Val Leu Val Leu
1535 1540 1545
Gly Gly Lys Ser Gln Asp Asp Val Ser Arg Phe Ala Gln Val Ile
1550 1555 1560
Arg Ser Ser Gly Ile Val Ser Leu Gly Val Gly Asp Arg Asn Ile
1565 1570 1575
Asp Arg Thr Glu Leu Gln Thr Ile Thr Asn Asp Pro Arg Leu Val
1580 1585 1590
Phe Thr Val Arg Glu Phe Arg Glu Leu Pro Asn Ile Glu Glu Arg
1595 1600 1605
Ile Met Asn Ser Phe Gly Pro Ser Ala Ala Thr Pro Ala Pro Pro
1610 1615 1620
Gly Val Asp Thr Pro Pro Pro Ser Arg Pro Glu Lys Lys Lys Ala
1625 1630 1635
Asp Ile Val Phe Leu Leu Asp Gly Ser Ile Asn Phe Arg Arg Asp
1640 1645 1650
Ser Phe Gln Glu Val Leu Arg Phe Val Ser Glu Ile Val Asp Thr
1655 1660 1665
Val Tyr Glu Asp Gly Asp Ser Ile Gln Val Gly Leu Val Gln Tyr
1670 1675 1680
Asn Ser Asp Pro Thr Asp Glu Phe Phe Leu Lys Asp Phe Ser Thr
1685 1690 1695
Lys Arg Gln Ile Ile Asp Ala Ile Asn Lys Val Val Tyr Lys Gly
1700 1705 1710
Gly Arg His Ala Asn Thr Lys Val Gly Leu Glu His Leu Arg Val
1715 1720 1725
Asn His Phe Val Pro Glu Ala Gly Ser Arg Leu Asp Gln Arg Val
1730 1735 1740
Pro Gln Ile Ala Phe Val Ile Thr Gly Gly Lys Ser Val Glu Asp
1745 1750 1755
Ala Gln Asp Val Ser Leu Ala Leu Thr Gln Arg Gly Val Lys Val
1760 1765 1770
Phe Ala Val Gly Val Arg Asn Ile Asp Ser Glu Glu Val Gly Lys
1775 1780 1785
Ile Ala Ser Asn Ser Ala Thr Ala Phe Arg Val Gly Asn Val Gln
1790 1795 1800
Glu Leu Ser Glu Leu Ser Glu Gln Val Leu Glu Thr Leu His Asp
1805 1810 1815
Ala Met His Glu Thr Leu Cys Pro Gly Val Thr Asp Ala Ala Lys
1820 1825 1830
Ala Cys Asn Leu Asp Val Ile Leu Gly Phe Asp Gly Ser Arg Asp
1835 1840 1845
Gln Asn Val Phe Val Ala Gln Lys Gly Phe Glu Ser Lys Val Asp
1850 1855 1860
Ala Ile Leu Asn Arg Ile Ser Gln Met His Arg Val Ser Cys Ser
1865 1870 1875
Gly Gly Arg Ser Pro Thr Val Arg Val Ser Val Val Ala Asn Thr
1880 1885 1890
Pro Ser Gly Pro Val Glu Ala Phe Asp Phe Asp Glu Tyr Gln Pro
1895 1900 1905
Glu Met Leu Glu Lys Phe Arg Asn Met Arg Ser Gln His Pro Tyr
1910 1915 1920
Val Leu Thr Glu Asp Thr Leu Lys Val Tyr Leu Asn Lys Phe Arg
1925 1930 1935
Gln Ser Ser Pro Asp Ser Val Lys Val Val Ile His Phe Thr Asp
1940 1945 1950
Gly Ala Asp Gly Asp Leu Ala Asp Leu His Arg Ala Ser Glu Asn
1955 1960 1965
Leu Arg Gln Glu Gly Val Arg Ala Leu Ile Leu Val Gly Leu Glu
1970 1975 1980
Arg Val Val Asn Leu Glu Arg Leu Met His Leu Glu Phe Gly Arg
1985 1990 1995
Gly Phe Met Tyr Asp Arg Pro Leu Arg Leu Asn Leu Leu Asp Leu
2000 2005 2010
Asp Tyr Glu Leu Ala Glu Gln Leu Asp Asn Ile Ala Glu Lys Ala
2015 2020 2025
Cys Cys Gly Val Pro Cys Lys Cys Ser Gly Gln Arg Gly Asp Arg
2030 2035 2040
Gly Pro Ile Gly Ser Ile Gly Pro Lys Gly Ile Pro Gly Glu Asp
2045 2050 2055
Gly Tyr Arg Gly Tyr Pro Gly Asp Glu Gly Gly Pro Gly Glu Arg
2060 2065 2070
Gly Pro Pro Gly Val Asn Gly Thr Gln Gly Phe Gln Gly Cys Pro
2075 2080 2085
Gly Gln Arg Gly Val Lys Gly Ser Arg Gly Phe Pro Gly Glu Lys
2090 2095 2100
Gly Glu Val Gly Glu Ile Gly Leu Asp Gly Leu Asp Gly Glu Asp
2105 2110 2115
Gly Asp Lys Gly Leu Pro Gly Ser Ser Gly Glu Lys Gly Asn Pro
2120 2125 2130
Gly Arg Arg Gly Asp Lys Gly Pro Arg Gly Glu Lys Gly Glu Arg
2135 2140 2145
Gly Asp Val Gly Ile Arg Gly Asp Pro Gly Asn Pro Gly Gln Asp
2150 2155 2160
Ser Gln Glu Arg Gly Pro Lys Gly Glu Thr Gly Asp Leu Gly Pro
2165 2170 2175
Met Gly Val Pro Gly Arg Asp Gly Val Pro Gly Gly Pro Gly Glu
2180 2185 2190
Thr Gly Lys Asn Gly Gly Phe Gly Arg Arg Gly Pro Pro Gly Ala
2195 2200 2205
Lys Gly Asn Lys Gly Gly Pro Gly Gln Pro Gly Phe Glu Gly Glu
2210 2215 2220
Gln Gly Thr Arg Gly Ala Gln Gly Pro Ala Gly Pro Ala Gly Pro
2225 2230 2235
Pro Gly Leu Ile Gly Glu Gln Gly Ile Ser Gly Pro Arg Gly Ser
2240 2245 2250
Gly Gly Ala Ala Gly Ala Pro Gly Glu Arg Gly Arg Thr Gly Pro
2255 2260 2265
Leu Gly Arg Lys Gly Glu Pro Gly Glu Pro Gly Pro Lys Gly Gly
2270 2275 2280
Ile Gly Asn Arg Gly Pro Arg Gly Glu Thr Gly Asp Asp Gly Arg
2285 2290 2295
Asp Gly Val Gly Ser Glu Gly Arg Arg Gly Lys Lys Gly Glu Arg
2300 2305 2310
Gly Phe Pro Gly Tyr Pro Gly Pro Lys Gly Asn Pro Gly Glu Pro
2315 2320 2325
Gly Leu Asn Gly Thr Thr Gly Pro Lys Gly Ile Arg Gly Arg Arg
2330 2335 2340
Gly Asn Ser Gly Pro Pro Gly Ile Val Gly Gln Lys Gly Asp Pro
2345 2350 2355
Gly Tyr Pro Gly Pro Ala Gly Pro Lys Gly Asn Arg Gly Asp Ser
2360 2365 2370
Ile Asp Gln Cys Ala Leu Ile Gln Ser Ile Lys Asp Lys Cys Pro
2375 2380 2385
Cys Cys Tyr Gly Pro Leu Glu Cys Pro Val Phe Pro Thr Glu Leu
2390 2395 2400
Ala Phe Ala Leu Asp Thr Ser Glu Gly Val Asn Gln Asp Thr Phe
2405 2410 2415
Gly Arg Met Arg Asp Val Val Leu Ser Ile Val Asn Asp Leu Thr
2420 2425 2430
Ile Ala Glu Ser Asn Cys Pro Arg Gly Ala Arg Val Ala Val Val
2435 2440 2445
Thr Tyr Asn Asn Glu Val Thr Thr Glu Ile Arg Phe Ala Asp Ser
2450 2455 2460
Lys Arg Lys Ser Val Leu Leu Asp Lys Ile Lys Asn Leu Gln Val
2465 2470 2475
Ala Leu Thr Ser Lys Gln Gln Ser Leu Glu Thr Ala Met Ser Phe
2480 2485 2490
Val Ala Arg Asn Thr Phe Lys Arg Val Arg Asn Gly Phe Leu Met
2495 2500 2505
Arg Lys Val Ala Val Phe Phe Ser Asn Thr Pro Thr Arg Ala Ser
2510 2515 2520
Pro Gln Leu Arg Glu Ala Val Leu Lys Leu Ser Asp Ala Gly Ile
2525 2530 2535
Thr Pro Leu Phe Leu Thr Arg Gln Glu Asp Arg Gln Leu Ile Asn
2540 2545 2550
Ala Leu Gln Ile Asn Asn Thr Ala Val Gly His Ala Leu Val Leu
2555 2560 2565
Pro Ala Gly Arg Asp Leu Thr Asp Phe Leu Glu Asn Val Leu Thr
2570 2575 2580
Cys His Val Cys Leu Asp Ile Cys Asn Ile Asp Pro Ser Cys Gly
2585 2590 2595
Phe Gly Ser Trp Arg Pro Ser Phe Arg Asp Arg Arg Ala Ala Gly
2600 2605 2610
Ser Asp Val Asp Ile Asp Met Ala Phe Ile Leu Asp Ser Ala Glu
2615 2620 2625
Thr Thr Thr Leu Phe Gln Phe Asn Glu Met Lys Lys Tyr Ile Ala
2630 2635 2640
Tyr Leu Val Arg Gln Leu Asp Met Ser Pro Asp Pro Lys Ala Ser
2645 2650 2655
Gln His Phe Ala Arg Val Ala Val Val Gln His Ala Pro Ser Glu
2660 2665 2670
Ser Val Asp Asn Ala Ser Met Pro Pro Val Lys Val Glu Phe Ser
2675 2680 2685
Leu Thr Asp Tyr Gly Ser Lys Glu Lys Leu Val Asp Phe Leu Ser
2690 2695 2700
Arg Gly Met Thr Gln Leu Gln Gly Thr Arg Ala Leu Gly Ser Ala
2705 2710 2715
Ile Glu Tyr Thr Ile Glu Asn Val Phe Glu Ser Ala Pro Asn Pro
2720 2725 2730
Arg Asp Leu Lys Ile Val Val Leu Met Leu Thr Gly Glu Val Pro
2735 2740 2745
Glu Gln Gln Leu Glu Glu Ala Gln Arg Val Ile Leu Gln Ala Lys
2750 2755 2760
Cys Lys Gly Tyr Phe Phe Val Val Leu Gly Ile Gly Arg Lys Val
2765 2770 2775
Asn Ile Lys Glu Val Tyr Thr Phe Ala Ser Glu Pro Asn Asp Val
2780 2785 2790
Phe Phe Lys Leu Val Asp Lys Ser Thr Glu Leu Asn Glu Glu Pro
2795 2800 2805
Leu Met Arg Phe Gly Arg Leu Leu Pro Ser Phe Val Ser Ser Glu
2810 2815 2820
Asn Ala Phe Tyr Leu Ser Pro Asp Ile Arg Lys Gln Cys Asp Trp
2825 2830 2835
Phe Gln Gly Asp Gln Pro Thr Lys Asn Leu Val Lys Phe Gly His
2840 2845 2850
Lys Gln Val Asn Val Pro Asn Asn Val Thr Ser Ser Pro Thr Ser
2855 2860 2865
Asn Pro Val Thr Thr Thr Lys Pro Val Thr Thr Thr Lys Pro Val
2870 2875 2880
Thr Thr Thr Thr Lys Pro Val Thr Thr Thr Thr Lys Pro Val Thr
2885 2890 2895
Ile Ile Asn Gln Pro Ser Val Lys Pro Ala Ala Ala Lys Pro Ala
2900 2905 2910
Pro Ala Lys Pro Val Ala Ala Lys Pro Val Ala Thr Lys Met Ala
2915 2920 2925
Thr Val Arg Pro Pro Val Ala Val Lys Pro Ala Thr Ala Ala Lys
2930 2935 2940
Pro Val Ala Ala Lys Pro Ala Ala Val Arg Pro Pro Ala Ala Ala
2945 2950 2955
Ala Ala Lys Pro Val Ala Thr Lys Pro Glu Val Pro Arg Pro Gln
2960 2965 2970
Ala Ala Lys Pro Ala Ala Thr Lys Pro Ala Thr Thr Lys Pro Met
2975 2980 2985
Val Lys Met Ser Arg Glu Val Gln Val Phe Glu Ile Thr Glu Asn
2990 2995 3000
Ser Ala Lys Leu His Trp Glu Arg Ala Glu Pro Pro Gly Pro Tyr
3005 3010 3015
Phe Tyr Asp Leu Thr Val Thr Ser Ala His Asp Gln Ser Leu Val
3020 3025 3030
Leu Lys Gln Asn Leu Thr Val Thr Asp Arg Val Ile Gly Gly Leu
3035 3040 3045
Leu Ala Gly Gln Thr Tyr His Val Ala Val Val Cys Tyr Leu Arg
3050 3055 3060
Ser Gln Val Arg Ala Thr Tyr His Gly Ser Phe Ser Thr Lys Lys
3065 3070 3075
Ser Gln Pro Pro Pro Pro Gln Pro Ala Arg Ser Ala Ser Ser Ser
3080 3085 3090
Thr Ile Asn Leu Met Val Ser Thr Glu Pro Leu Ala Leu Thr Glu
3095 3100 3105
Thr Asp Ile Cys Lys Leu Pro Lys Asp Glu Gly Thr Cys Arg Asp
3110 3115 3120
Phe Ile Leu Lys Trp Tyr Tyr Asp Pro Asn Thr Lys Ser Cys Ala
3125 3130 3135
Arg Phe Trp Tyr Gly Gly Cys Gly Gly Asn Glu Asn Lys Phe Gly
3140 3145 3150
Ser Gln Lys Glu Cys Glu Lys Val Cys Ala Pro Val Leu Ala Lys
3155 3160 3165
Pro Gly Val Ile Ser Val Met Gly Thr
3170 3175
<210> 78
<211> 2944
<212> ПРТ
<213> Homo sapiens
<400> 78
Met Thr Leu Arg Leu Leu Val Ala Ala Leu Cys Ala Gly Ile Leu Ala
1 5 10 15
Glu Ala Pro Arg Val Arg Ala Gln His Arg Glu Arg Val Thr Cys Thr
20 25 30
Arg Leu Tyr Ala Ala Asp Ile Val Phe Leu Leu Asp Gly Ser Ser Ser
35 40 45
Ile Gly Arg Ser Asn Phe Arg Glu Val Arg Ser Phe Leu Glu Gly Leu
50 55 60
Val Leu Pro Phe Ser Gly Ala Ala Ser Ala Gln Gly Val Arg Phe Ala
65 70 75 80
Thr Val Gln Tyr Ser Asp Asp Pro Arg Thr Glu Phe Gly Leu Asp Ala
85 90 95
Leu Gly Ser Gly Gly Asp Val Ile Arg Ala Ile Arg Glu Leu Ser Tyr
100 105 110
Lys Gly Gly Asn Thr Arg Thr Gly Ala Ala Ile Leu His Val Ala Asp
115 120 125
His Val Phe Leu Pro Gln Leu Ala Arg Pro Gly Val Pro Lys Val Cys
130 135 140
Ile Leu Ile Thr Asp Gly Lys Ser Gln Asp Leu Val Asp Thr Ala Ala
145 150 155 160
Gln Arg Leu Lys Gly Gln Gly Val Lys Leu Phe Ala Val Gly Ile Lys
165 170 175
Asn Ala Asp Pro Glu Glu Leu Lys Arg Val Ala Ser Gln Pro Thr Ser
180 185 190
Asp Phe Phe Phe Phe Val Asn Asp Phe Ser Ile Leu Arg Thr Leu Leu
195 200 205
Pro Leu Val Ser Arg Arg Val Cys Thr Thr Ala Gly Gly Val Pro Val
210 215 220
Thr Arg Pro Pro Asp Asp Ser Thr Ser Ala Pro Arg Asp Leu Val Leu
225 230 235 240
Ser Glu Pro Ser Ser Gln Ser Leu Arg Val Gln Trp Thr Ala Ala Ser
245 250 255
Gly Pro Val Thr Gly Tyr Lys Val Gln Tyr Thr Pro Leu Thr Gly Leu
260 265 270
Gly Gln Pro Leu Pro Ser Glu Arg Gln Glu Val Asn Val Pro Ala Gly
275 280 285
Glu Thr Ser Val Arg Leu Arg Gly Leu Arg Pro Leu Thr Glu Tyr Gln
290 295 300
Val Thr Val Ile Ala Leu Tyr Ala Asn Ser Ile Gly Glu Ala Val Ser
305 310 315 320
Gly Thr Ala Arg Thr Thr Ala Leu Glu Gly Pro Glu Leu Thr Ile Gln
325 330 335
Asn Thr Thr Ala His Ser Leu Leu Val Ala Trp Arg Ser Val Pro Gly
340 345 350
Ala Thr Gly Tyr Arg Val Thr Trp Arg Val Leu Ser Gly Gly Pro Thr
355 360 365
Gln Gln Gln Glu Leu Gly Pro Gly Gln Gly Ser Val Leu Leu Arg Asp
370 375 380
Leu Glu Pro Gly Thr Asp Tyr Glu Val Thr Val Ser Thr Leu Phe Gly
385 390 395 400
Arg Ser Val Gly Pro Ala Thr Ser Leu Met Ala Arg Thr Asp Ala Ser
405 410 415
Val Glu Gln Thr Leu Arg Pro Val Ile Leu Gly Pro Thr Ser Ile Leu
420 425 430
Leu Ser Trp Asn Leu Val Pro Glu Ala Arg Gly Tyr Arg Leu Glu Trp
435 440 445
Arg Arg Glu Thr Gly Leu Glu Pro Pro Gln Lys Val Val Leu Pro Ser
450 455 460
Asp Val Thr Arg Tyr Gln Leu Asp Gly Leu Gln Pro Gly Thr Glu Tyr
465 470 475 480
Arg Leu Thr Leu Tyr Thr Leu Leu Glu Gly His Glu Val Ala Thr Pro
485 490 495
Ala Thr Val Val Pro Thr Gly Pro Glu Leu Pro Val Ser Pro Val Thr
500 505 510
Asp Leu Gln Ala Thr Glu Leu Pro Gly Gln Arg Val Arg Val Ser Trp
515 520 525
Ser Pro Val Pro Gly Ala Thr Gln Tyr Arg Ile Ile Val Arg Ser Thr
530 535 540
Gln Gly Val Glu Arg Thr Leu Val Leu Pro Gly Ser Gln Thr Ala Phe
545 550 555 560
Asp Leu Asp Asp Val Gln Ala Gly Leu Ser Tyr Thr Val Arg Val Ser
565 570 575
Ala Arg Val Gly Pro Arg Glu Gly Ser Ala Ser Val Leu Thr Val Arg
580 585 590
Arg Glu Pro Glu Thr Pro Leu Ala Val Pro Gly Leu Arg Val Val Val
595 600 605
Ser Asp Ala Thr Arg Val Arg Val Ala Trp Gly Pro Val Pro Gly Ala
610 615 620
Ser Gly Phe Arg Ile Ser Trp Ser Thr Gly Ser Gly Pro Glu Ser Ser
625 630 635 640
Gln Thr Leu Pro Pro Asp Ser Thr Ala Thr Asp Ile Thr Gly Leu Gln
645 650 655
Pro Gly Thr Thr Tyr Gln Val Ala Val Ser Val Leu Arg Gly Arg Glu
660 665 670
Glu Gly Pro Ala Ala Val Ile Val Ala Arg Thr Asp Pro Leu Gly Pro
675 680 685
Val Arg Thr Val His Val Thr Gln Ala Ser Ser Ser Ser Val Thr Ile
690 695 700
Thr Trp Thr Arg Val Pro Gly Ala Thr Gly Tyr Arg Val Ser Trp His
705 710 715 720
Ser Ala His Gly Pro Glu Lys Ser Gln Leu Val Ser Gly Glu Ala Thr
725 730 735
Val Ala Glu Leu Asp Gly Leu Glu Pro Asp Thr Glu Tyr Thr Val His
740 745 750
Val Arg Ala His Val Ala Gly Val Asp Gly Pro Pro Ala Ser Val Val
755 760 765
Val Arg Thr Ala Pro Glu Pro Val Gly Arg Val Ser Arg Leu Gln Ile
770 775 780
Leu Asn Ala Ser Ser Asp Val Leu Arg Ile Thr Trp Val Gly Val Thr
785 790 795 800
Gly Ala Thr Ala Tyr Arg Leu Ala Trp Gly Arg Ser Glu Gly Gly Pro
805 810 815
Met Arg His Gln Ile Leu Pro Gly Asn Thr Asp Ser Ala Glu Ile Arg
820 825 830
Gly Leu Glu Gly Gly Val Ser Tyr Ser Val Arg Val Thr Ala Leu Val
835 840 845
Gly Asp Arg Glu Gly Thr Pro Val Ser Ile Val Val Thr Thr Pro Pro
850 855 860
Glu Ala Pro Pro Ala Leu Gly Thr Leu His Val Val Gln Arg Gly Glu
865 870 875 880
His Ser Leu Arg Leu Arg Trp Glu Pro Val Pro Arg Ala Gln Gly Phe
885 890 895
Leu Leu His Trp Gln Pro Glu Gly Gly Gln Glu Gln Ser Arg Val Leu
900 905 910
Gly Pro Glu Leu Ser Ser Tyr His Leu Asp Gly Leu Glu Pro Ala Thr
915 920 925
Gln Tyr Arg Val Arg Leu Ser Val Leu Gly Pro Ala Gly Glu Gly Pro
930 935 940
Ser Ala Glu Val Thr Ala Arg Thr Glu Ser Pro Arg Val Pro Ser Ile
945 950 955 960
Glu Leu Arg Val Val Asp Thr Ser Ile Asp Ser Val Thr Leu Ala Trp
965 970 975
Thr Pro Val Ser Arg Ala Ser Ser Tyr Ile Leu Ser Trp Arg Pro Leu
980 985 990
Arg Gly Pro Gly Gln Glu Val Pro Gly Ser Pro Gln Thr Leu Pro Gly
995 1000 1005
Ile Ser Ser Ser Gln Arg Val Thr Gly Leu Glu Pro Gly Val Ser
1010 1015 1020
Tyr Ile Phe Ser Leu Thr Pro Val Leu Asp Gly Val Arg Gly Pro
1025 1030 1035
Glu Ala Ser Val Thr Gln Thr Pro Val Cys Pro Arg Gly Leu Ala
1040 1045 1050
Asp Val Val Phe Leu Pro His Ala Thr Gln Asp Asn Ala His Arg
1055 1060 1065
Ala Glu Ala Thr Arg Arg Val Leu Glu Arg Leu Val Leu Ala Leu
1070 1075 1080
Gly Pro Leu Gly Pro Gln Ala Val Gln Val Gly Leu Leu Ser Tyr
1085 1090 1095
Ser His Arg Pro Ser Pro Leu Phe Pro Leu Asn Gly Ser His Asp
1100 1105 1110
Leu Gly Ile Ile Leu Gln Arg Ile Arg Asp Met Pro Tyr Met Asp
1115 1120 1125
Pro Ser Gly Asn Asn Leu Gly Thr Ala Val Val Thr Ala His Arg
1130 1135 1140
Tyr Met Leu Ala Pro Asp Ala Pro Gly Arg Arg Gln His Val Pro
1145 1150 1155
Gly Val Met Val Leu Leu Val Asp Glu Pro Leu Arg Gly Asp Ile
1160 1165 1170
Phe Ser Pro Ile Arg Glu Ala Gln Ala Ser Gly Leu Asn Val Val
1175 1180 1185
Met Leu Gly Met Ala Gly Ala Asp Pro Glu Gln Leu Arg Arg Leu
1190 1195 1200
Ala Pro Gly Met Asp Ser Val Gln Thr Phe Phe Ala Val Asp Asp
1205 1210 1215
Gly Pro Ser Leu Asp Gln Ala Val Ser Gly Leu Ala Thr Ala Leu
1220 1225 1230
Cys Gln Ala Ser Phe Thr Thr Gln Pro Arg Pro Glu Pro Cys Pro
1235 1240 1245
Val Tyr Cys Pro Lys Gly Gln Lys Gly Glu Pro Gly Glu Met Gly
1250 1255 1260
Leu Arg Gly Gln Val Gly Pro Pro Gly Asp Pro Gly Leu Pro Gly
1265 1270 1275
Arg Thr Gly Ala Pro Gly Pro Gln Gly Pro Pro Gly Ser Ala Thr
1280 1285 1290
Ala Lys Gly Glu Arg Gly Phe Pro Gly Ala Asp Gly Arg Pro Gly
1295 1300 1305
Ser Pro Gly Arg Ala Gly Asn Pro Gly Thr Pro Gly Ala Pro Gly
1310 1315 1320
Leu Lys Gly Ser Pro Gly Leu Pro Gly Pro Arg Gly Asp Pro Gly
1325 1330 1335
Glu Arg Gly Pro Arg Gly Pro Lys Gly Glu Pro Gly Ala Pro Gly
1340 1345 1350
Gln Val Ile Gly Gly Glu Gly Pro Gly Leu Pro Gly Arg Lys Gly
1355 1360 1365
Asp Pro Gly Pro Ser Gly Pro Pro Gly Pro Arg Gly Pro Leu Gly
1370 1375 1380
Asp Pro Gly Pro Arg Gly Pro Pro Gly Leu Pro Gly Thr Ala Met
1385 1390 1395
Lys Gly Asp Lys Gly Asp Arg Gly Glu Arg Gly Pro Pro Gly Pro
1400 1405 1410
Gly Glu Gly Gly Ile Ala Pro Gly Glu Pro Gly Leu Pro Gly Leu
1415 1420 1425
Pro Gly Ser Pro Gly Pro Gln Gly Pro Val Gly Pro Pro Gly Lys
1430 1435 1440
Lys Gly Glu Lys Gly Asp Ser Glu Asp Gly Ala Pro Gly Leu Pro
1445 1450 1455
Gly Gln Pro Gly Ser Pro Gly Glu Gln Gly Pro Arg Gly Pro Pro
1460 1465 1470
Gly Ala Ile Gly Pro Lys Gly Asp Arg Gly Phe Pro Gly Pro Leu
1475 1480 1485
Gly Glu Ala Gly Glu Lys Gly Glu Arg Gly Pro Pro Gly Pro Ala
1490 1495 1500
Gly Ser Arg Gly Leu Pro Gly Val Ala Gly Arg Pro Gly Ala Lys
1505 1510 1515
Gly Pro Glu Gly Pro Pro Gly Pro Thr Gly Arg Gln Gly Glu Lys
1520 1525 1530
Gly Glu Pro Gly Arg Pro Gly Asp Pro Ala Val Val Gly Pro Ala
1535 1540 1545
Val Ala Gly Pro Lys Gly Glu Lys Gly Asp Val Gly Pro Ala Gly
1550 1555 1560
Pro Arg Gly Ala Thr Gly Val Gln Gly Glu Arg Gly Pro Pro Gly
1565 1570 1575
Leu Val Leu Pro Gly Asp Pro Gly Pro Lys Gly Asp Pro Gly Asp
1580 1585 1590
Arg Gly Pro Ile Gly Leu Thr Gly Arg Ala Gly Pro Pro Gly Asp
1595 1600 1605
Ser Gly Pro Pro Gly Glu Lys Gly Asp Pro Gly Arg Pro Gly Pro
1610 1615 1620
Pro Gly Pro Val Gly Pro Arg Gly Arg Asp Gly Glu Val Gly Glu
1625 1630 1635
Lys Gly Asp Glu Gly Pro Pro Gly Asp Pro Gly Leu Pro Gly Lys
1640 1645 1650
Ala Gly Glu Arg Gly Leu Arg Gly Ala Pro Gly Val Arg Gly Pro
1655 1660 1665
Val Gly Glu Lys Gly Asp Gln Gly Asp Pro Gly Glu Asp Gly Arg
1670 1675 1680
Asn Gly Ser Pro Gly Ser Ser Gly Pro Lys Gly Asp Arg Gly Glu
1685 1690 1695
Pro Gly Pro Pro Gly Pro Pro Gly Arg Leu Val Asp Thr Gly Pro
1700 1705 1710
Gly Ala Arg Glu Lys Gly Glu Pro Gly Asp Arg Gly Gln Glu Gly
1715 1720 1725
Pro Arg Gly Pro Lys Gly Asp Pro Gly Leu Pro Gly Ala Pro Gly
1730 1735 1740
Glu Arg Gly Ile Glu Gly Phe Arg Gly Pro Pro Gly Pro Gln Gly
1745 1750 1755
Asp Pro Gly Val Arg Gly Pro Ala Gly Glu Lys Gly Asp Arg Gly
1760 1765 1770
Pro Pro Gly Leu Asp Gly Arg Ser Gly Leu Asp Gly Lys Pro Gly
1775 1780 1785
Ala Ala Gly Pro Ser Gly Pro Asn Gly Ala Ala Gly Lys Ala Gly
1790 1795 1800
Asp Pro Gly Arg Asp Gly Leu Pro Gly Leu Arg Gly Glu Gln Gly
1805 1810 1815
Leu Pro Gly Pro Ser Gly Pro Pro Gly Leu Pro Gly Lys Pro Gly
1820 1825 1830
Glu Asp Gly Lys Pro Gly Leu Asn Gly Lys Asn Gly Glu Pro Gly
1835 1840 1845
Asp Pro Gly Glu Asp Gly Arg Lys Gly Glu Lys Gly Asp Ser Gly
1850 1855 1860
Ala Ser Gly Arg Glu Gly Arg Asp Gly Pro Lys Gly Glu Arg Gly
1865 1870 1875
Ala Pro Gly Ile Leu Gly Pro Gln Gly Pro Pro Gly Leu Pro Gly
1880 1885 1890
Pro Val Gly Pro Pro Gly Gln Gly Phe Pro Gly Val Pro Gly Gly
1895 1900 1905
Thr Gly Pro Lys Gly Asp Arg Gly Glu Thr Gly Ser Lys Gly Glu
1910 1915 1920
Gln Gly Leu Pro Gly Glu Arg Gly Leu Arg Gly Glu Pro Gly Ser
1925 1930 1935
Val Pro Asn Val Asp Arg Leu Leu Glu Thr Ala Gly Ile Lys Ala
1940 1945 1950
Ser Ala Leu Arg Glu Ile Val Glu Thr Trp Asp Glu Ser Ser Gly
1955 1960 1965
Ser Phe Leu Pro Val Pro Glu Arg Arg Arg Gly Pro Lys Gly Asp
1970 1975 1980
Ser Gly Glu Gln Gly Pro Pro Gly Lys Glu Gly Pro Ile Gly Phe
1985 1990 1995
Pro Gly Glu Arg Gly Leu Lys Gly Asp Arg Gly Asp Pro Gly Pro
2000 2005 2010
Gln Gly Pro Pro Gly Leu Ala Leu Gly Glu Arg Gly Pro Pro Gly
2015 2020 2025
Pro Ser Gly Leu Ala Gly Glu Pro Gly Lys Pro Gly Ile Pro Gly
2030 2035 2040
Leu Pro Gly Arg Ala Gly Gly Val Gly Glu Ala Gly Arg Pro Gly
2045 2050 2055
Glu Arg Gly Glu Arg Gly Glu Lys Gly Glu Arg Gly Glu Gln Gly
2060 2065 2070
Arg Asp Gly Pro Pro Gly Leu Pro Gly Thr Pro Gly Pro Pro Gly
2075 2080 2085
Pro Pro Gly Pro Lys Val Ser Val Asp Glu Pro Gly Pro Gly Leu
2090 2095 2100
Ser Gly Glu Gln Gly Pro Pro Gly Leu Lys Gly Ala Lys Gly Glu
2105 2110 2115
Pro Gly Ser Asn Gly Asp Gln Gly Pro Lys Gly Asp Arg Gly Val
2120 2125 2130
Pro Gly Ile Lys Gly Asp Arg Gly Glu Pro Gly Pro Arg Gly Gln
2135 2140 2145
Asp Gly Asn Pro Gly Leu Pro Gly Glu Arg Gly Met Ala Gly Pro
2150 2155 2160
Glu Gly Lys Pro Gly Leu Gln Gly Pro Arg Gly Pro Pro Gly Pro
2165 2170 2175
Val Gly Gly His Gly Asp Pro Gly Pro Pro Gly Ala Pro Gly Leu
2180 2185 2190
Ala Gly Pro Ala Gly Pro Gln Gly Pro Ser Gly Leu Lys Gly Glu
2195 2200 2205
Pro Gly Glu Thr Gly Pro Pro Gly Arg Gly Leu Thr Gly Pro Thr
2210 2215 2220
Gly Ala Val Gly Leu Pro Gly Pro Pro Gly Pro Ser Gly Leu Val
2225 2230 2235
Gly Pro Gln Gly Ser Pro Gly Leu Pro Gly Gln Val Gly Glu Thr
2240 2245 2250
Gly Lys Pro Gly Ala Pro Gly Arg Asp Gly Ala Ser Gly Lys Asp
2255 2260 2265
Gly Asp Arg Gly Ser Pro Gly Val Pro Gly Ser Pro Gly Leu Pro
2270 2275 2280
Gly Pro Val Gly Pro Lys Gly Glu Pro Gly Pro Thr Gly Ala Pro
2285 2290 2295
Gly Gln Ala Val Val Gly Leu Pro Gly Ala Lys Gly Glu Lys Gly
2300 2305 2310
Ala Pro Gly Gly Leu Ala Gly Asp Leu Val Gly Glu Pro Gly Ala
2315 2320 2325
Lys Gly Asp Arg Gly Leu Pro Gly Pro Arg Gly Glu Lys Gly Glu
2330 2335 2340
Ala Gly Arg Ala Gly Glu Pro Gly Asp Pro Gly Glu Asp Gly Gln
2345 2350 2355
Lys Gly Ala Pro Gly Pro Lys Gly Phe Lys Gly Asp Pro Gly Val
2360 2365 2370
Gly Val Pro Gly Ser Pro Gly Pro Pro Gly Pro Pro Gly Val Lys
2375 2380 2385
Gly Asp Leu Gly Leu Pro Gly Leu Pro Gly Ala Pro Gly Val Val
2390 2395 2400
Gly Phe Pro Gly Gln Thr Gly Pro Arg Gly Glu Met Gly Gln Pro
2405 2410 2415
Gly Pro Ser Gly Glu Arg Gly Leu Ala Gly Pro Pro Gly Arg Glu
2420 2425 2430
Gly Ile Pro Gly Pro Leu Gly Pro Pro Gly Pro Pro Gly Ser Val
2435 2440 2445
Gly Pro Pro Gly Ala Ser Gly Leu Lys Gly Asp Lys Gly Asp Pro
2450 2455 2460
Gly Val Gly Leu Pro Gly Pro Arg Gly Glu Arg Gly Glu Pro Gly
2465 2470 2475
Ile Arg Gly Glu Asp Gly Arg Pro Gly Gln Glu Gly Pro Arg Gly
2480 2485 2490
Leu Thr Gly Pro Pro Gly Ser Arg Gly Glu Arg Gly Glu Lys Gly
2495 2500 2505
Asp Val Gly Ser Ala Gly Leu Lys Gly Asp Lys Gly Asp Ser Ala
2510 2515 2520
Val Ile Leu Gly Pro Pro Gly Pro Arg Gly Ala Lys Gly Asp Met
2525 2530 2535
Gly Glu Arg Gly Pro Arg Gly Leu Asp Gly Asp Lys Gly Pro Arg
2540 2545 2550
Gly Asp Asn Gly Asp Pro Gly Asp Lys Gly Ser Lys Gly Glu Pro
2555 2560 2565
Gly Asp Lys Gly Ser Ala Gly Leu Pro Gly Leu Arg Gly Leu Leu
2570 2575 2580
Gly Pro Gln Gly Gln Pro Gly Ala Ala Gly Ile Pro Gly Asp Pro
2585 2590 2595
Gly Ser Pro Gly Lys Asp Gly Val Pro Gly Ile Arg Gly Glu Lys
2600 2605 2610
Gly Asp Val Gly Phe Met Gly Pro Arg Gly Leu Lys Gly Glu Arg
2615 2620 2625
Gly Val Lys Gly Ala Cys Gly Leu Asp Gly Glu Lys Gly Asp Lys
2630 2635 2640
Gly Glu Ala Gly Pro Pro Gly Arg Pro Gly Leu Ala Gly His Lys
2645 2650 2655
Gly Glu Met Gly Glu Pro Gly Val Pro Gly Gln Ser Gly Ala Pro
2660 2665 2670
Gly Lys Glu Gly Leu Ile Gly Pro Lys Gly Asp Arg Gly Phe Asp
2675 2680 2685
Gly Gln Pro Gly Pro Lys Gly Asp Gln Gly Glu Lys Gly Glu Arg
2690 2695 2700
Gly Thr Pro Gly Ile Gly Gly Phe Pro Gly Pro Ser Gly Asn Asp
2705 2710 2715
Gly Ser Ala Gly Pro Pro Gly Pro Pro Gly Ser Val Gly Pro Arg
2720 2725 2730
Gly Pro Glu Gly Leu Gln Gly Gln Lys Gly Glu Arg Gly Pro Pro
2735 2740 2745
Gly Glu Arg Val Val Gly Ala Pro Gly Val Pro Gly Ala Pro Gly
2750 2755 2760
Glu Arg Gly Glu Gln Gly Arg Pro Gly Pro Ala Gly Pro Arg Gly
2765 2770 2775
Glu Lys Gly Glu Ala Ala Leu Thr Glu Asp Asp Ile Arg Gly Phe
2780 2785 2790
Val Arg Gln Glu Met Ser Gln His Cys Ala Cys Gln Gly Gln Phe
2795 2800 2805
Ile Ala Ser Gly Ser Arg Pro Leu Pro Ser Tyr Ala Ala Asp Thr
2810 2815 2820
Ala Gly Ser Gln Leu His Ala Val Pro Val Leu Arg Val Ser His
2825 2830 2835
Ala Glu Glu Glu Glu Arg Val Pro Pro Glu Asp Asp Glu Tyr Ser
2840 2845 2850
Glu Tyr Ser Glu Tyr Ser Val Glu Glu Tyr Gln Asp Pro Glu Ala
2855 2860 2865
Pro Trp Asp Ser Asp Asp Pro Cys Ser Leu Pro Leu Asp Glu Gly
2870 2875 2880
Ser Cys Thr Ala Tyr Thr Leu Arg Trp Tyr His Arg Ala Val Thr
2885 2890 2895
Gly Ser Thr Glu Ala Cys His Pro Phe Val Tyr Gly Gly Cys Gly
2900 2905 2910
Gly Asn Ala Asn Arg Phe Gly Thr Arg Glu Ala Cys Glu Arg Arg
2915 2920 2925
Cys Pro Pro Arg Val Val Gln Ser Gln Gly Thr Gly Thr Ala Gln
2930 2935 2940
Asp
<210> 79
<211> 724
<212> ПРТ
<213> Homo sapiens
<400> 79
Met Ala Gly Leu Thr Ala Ala Ala Pro Arg Pro Gly Val Leu Leu Leu
1 5 10 15
Leu Leu Ser Ile Leu His Pro Ser Arg Pro Gly Gly Val Pro Gly Ala
20 25 30
Ile Pro Gly Gly Val Pro Gly Gly Val Phe Tyr Pro Gly Ala Gly Leu
35 40 45
Gly Ala Leu Gly Gly Gly Ala Leu Gly Pro Gly Gly Lys Pro Leu Lys
50 55 60
Pro Val Pro Gly Gly Leu Ala Gly Ala Gly Leu Gly Ala Gly Leu Gly
65 70 75 80
Ala Phe Pro Ala Val Thr Phe Pro Gly Ala Leu Val Pro Gly Gly Val
85 90 95
Ala Asp Ala Ala Ala Ala Tyr Lys Ala Ala Lys Ala Gly Ala Gly Leu
100 105 110
Gly Gly Val Pro Gly Val Gly Gly Leu Gly Val Ser Ala Gly Ala Val
115 120 125
Val Pro Gln Pro Gly Ala Gly Val Lys Pro Gly Lys Val Pro Gly Val
130 135 140
Gly Leu Pro Gly Val Tyr Pro Gly Gly Val Leu Pro Gly Ala Arg Phe
145 150 155 160
Pro Gly Val Gly Val Leu Pro Gly Val Pro Thr Gly Ala Gly Val Lys
165 170 175
Pro Lys Ala Pro Gly Val Gly Gly Ala Phe Ala Gly Ile Pro Gly Val
180 185 190
Gly Pro Phe Gly Gly Pro Gln Pro Gly Val Pro Leu Gly Tyr Pro Ile
195 200 205
Lys Ala Pro Lys Leu Pro Gly Gly Tyr Gly Leu Pro Tyr Thr Thr Gly
210 215 220
Lys Leu Pro Tyr Gly Tyr Gly Pro Gly Gly Val Ala Gly Ala Ala Gly
225 230 235 240
Lys Ala Gly Tyr Pro Thr Gly Thr Gly Val Gly Pro Gln Ala Ala Ala
245 250 255
Ala Ala Ala Ala Lys Ala Ala Ala Lys Phe Gly Ala Gly Ala Ala Gly
260 265 270
Val Leu Pro Gly Val Gly Gly Ala Gly Val Pro Gly Val Pro Gly Ala
275 280 285
Ile Pro Gly Ile Gly Gly Ile Ala Gly Val Gly Thr Pro Ala Ala Ala
290 295 300
Ala Ala Ala Ala Ala Ala Ala Lys Ala Ala Lys Tyr Gly Ala Ala Ala
305 310 315 320
Gly Leu Val Pro Gly Gly Pro Gly Phe Gly Pro Gly Val Val Gly Val
325 330 335
Pro Gly Ala Gly Val Pro Gly Val Gly Val Pro Gly Ala Gly Ile Pro
340 345 350
Val Val Pro Gly Ala Gly Ile Pro Gly Ala Ala Val Pro Gly Val Val
355 360 365
Ser Pro Glu Ala Ala Ala Lys Ala Ala Ala Lys Ala Ala Lys Tyr Gly
370 375 380
Ala Arg Pro Gly Val Gly Val Gly Gly Ile Pro Thr Tyr Gly Val Gly
385 390 395 400
Ala Gly Gly Phe Pro Gly Phe Gly Val Gly Val Gly Gly Ile Pro Gly
405 410 415
Val Ala Gly Val Pro Gly Val Gly Gly Val Pro Gly Val Gly Gly Val
420 425 430
Pro Gly Val Gly Ile Ser Pro Glu Ala Gln Ala Ala Ala Ala Ala Lys
435 440 445
Ala Ala Lys Tyr Gly Val Gly Thr Pro Ala Ala Ala Ala Ala Lys Ala
450 455 460
Ala Ala Lys Ala Ala Gln Phe Gly Leu Val Pro Gly Val Gly Val Ala
465 470 475 480
Pro Gly Val Gly Val Ala Pro Gly Val Gly Val Ala Pro Gly Val Gly
485 490 495
Leu Ala Pro Gly Val Gly Val Ala Pro Gly Val Gly Val Ala Pro Gly
500 505 510
Val Gly Val Ala Pro Gly Ile Gly Pro Gly Gly Val Ala Ala Ala Ala
515 520 525
Lys Ser Ala Ala Lys Val Ala Ala Lys Ala Gln Leu Arg Ala Ala Ala
530 535 540
Gly Leu Gly Ala Gly Ile Pro Gly Leu Gly Val Gly Val Gly Val Pro
545 550 555 560
Gly Leu Gly Val Gly Ala Gly Val Pro Gly Leu Gly Val Gly Ala Gly
565 570 575
Val Pro Gly Phe Gly Ala Val Pro Gly Ala Leu Ala Ala Ala Lys Ala
580 585 590
Ala Lys Tyr Gly Ala Ala Val Pro Gly Val Leu Gly Gly Leu Gly Ala
595 600 605
Leu Gly Gly Val Gly Ile Pro Gly Gly Val Val Gly Ala Gly Pro Ala
610 615 620
Ala Ala Ala Ala Ala Ala Lys Ala Ala Ala Lys Ala Ala Gln Phe Gly
625 630 635 640
Leu Val Gly Ala Ala Gly Leu Gly Gly Leu Gly Val Gly Gly Leu Gly
645 650 655
Val Pro Gly Val Gly Gly Leu Gly Gly Ile Pro Pro Ala Ala Ala Ala
660 665 670
Lys Ala Ala Lys Tyr Gly Ala Ala Gly Leu Gly Gly Val Leu Gly Gly
675 680 685
Ala Gly Gln Phe Pro Leu Gly Gly Val Ala Ala Arg Pro Gly Phe Gly
690 695 700
Leu Ser Pro Ile Phe Pro Gly Gly Ala Cys Leu Gly Lys Ala Cys Gly
705 710 715 720
Arg Lys Arg Lys
<210> 80
<211> 677
<212> ПРТ
<213> Homo sapiens
<400> 80
Met Ala Gly Leu Thr Ala Ala Ala Pro Arg Pro Gly Val Leu Leu Leu
1 5 10 15
Leu Leu Ser Ile Leu His Pro Ser Arg Pro Gly Gly Val Pro Gly Ala
20 25 30
Ile Pro Gly Gly Val Pro Gly Gly Val Phe Tyr Pro Ala Leu Gly Pro
35 40 45
Gly Gly Lys Pro Leu Lys Pro Val Pro Gly Gly Leu Ala Gly Ala Gly
50 55 60
Leu Gly Ala Gly Leu Gly Ala Phe Pro Ala Val Thr Phe Pro Gly Ala
65 70 75 80
Leu Val Pro Gly Gly Val Ala Asp Ala Ala Ala Ala Tyr Lys Ala Ala
85 90 95
Lys Ala Gly Ala Gly Leu Gly Gly Val Pro Gly Val Gly Gly Leu Gly
100 105 110
Val Ser Ala Gly Ala Val Val Pro Gln Pro Gly Ala Gly Val Lys Pro
115 120 125
Gly Lys Val Pro Gly Val Gly Leu Pro Gly Val Tyr Pro Gly Gly Val
130 135 140
Leu Pro Gly Ala Arg Phe Pro Gly Val Gly Val Leu Pro Gly Val Pro
145 150 155 160
Thr Gly Ala Gly Val Lys Pro Lys Ala Pro Gly Val Gly Gly Ala Phe
165 170 175
Ala Gly Ile Pro Gly Val Gly Pro Phe Gly Gly Pro Gln Pro Gly Val
180 185 190
Pro Leu Gly Tyr Pro Ile Lys Ala Pro Lys Leu Pro Gly Gly Tyr Gly
195 200 205
Leu Pro Tyr Thr Thr Gly Lys Leu Pro Tyr Gly Tyr Gly Pro Gly Gly
210 215 220
Val Ala Gly Ala Ala Gly Lys Ala Gly Tyr Pro Thr Gly Thr Gly Val
225 230 235 240
Gly Pro Gln Ala Ala Ala Ala Ala Ala Ala Lys Ala Ala Ala Lys Phe
245 250 255
Gly Ala Gly Ala Ala Gly Val Leu Pro Gly Val Gly Gly Ala Gly Val
260 265 270
Pro Gly Val Pro Gly Ala Ile Pro Gly Ile Gly Gly Ile Ala Gly Val
275 280 285
Gly Thr Pro Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala Lys Ala Ala
290 295 300
Lys Tyr Gly Ala Ala Ala Gly Leu Val Pro Gly Gly Pro Gly Phe Gly
305 310 315 320
Pro Gly Val Val Gly Val Pro Gly Ala Gly Val Pro Gly Val Gly Val
325 330 335
Pro Gly Ala Gly Ile Pro Val Val Pro Gly Ala Gly Ile Pro Gly Ala
340 345 350
Ala Val Pro Gly Val Val Ser Pro Glu Ala Ala Ala Lys Ala Ala Ala
355 360 365
Lys Ala Ala Lys Tyr Gly Ala Arg Pro Gly Val Gly Val Gly Gly Ile
370 375 380
Pro Thr Tyr Gly Val Gly Ala Gly Gly Phe Pro Gly Phe Gly Val Gly
385 390 395 400
Val Gly Gly Ile Pro Gly Val Ala Gly Val Pro Gly Val Gly Gly Val
405 410 415
Pro Gly Val Gly Gly Val Pro Gly Val Gly Ile Ser Pro Glu Ala Gln
420 425 430
Ala Ala Ala Ala Ala Lys Ala Ala Lys Tyr Gly Leu Val Pro Gly Val
435 440 445
Gly Val Ala Pro Gly Val Gly Val Ala Pro Gly Val Gly Val Ala Pro
450 455 460
Gly Val Gly Leu Ala Pro Gly Val Gly Val Ala Pro Gly Val Gly Val
465 470 475 480
Ala Pro Gly Val Gly Val Ala Pro Gly Ile Gly Pro Gly Gly Val Ala
485 490 495
Ala Ala Ala Lys Ser Ala Ala Lys Val Ala Ala Lys Ala Gln Leu Arg
500 505 510
Ala Ala Ala Gly Leu Gly Ala Gly Ile Pro Gly Leu Gly Val Gly Val
515 520 525
Gly Val Pro Gly Leu Gly Val Gly Ala Gly Val Pro Gly Leu Gly Val
530 535 540
Gly Ala Gly Val Pro Gly Phe Gly Ala Val Pro Gly Ala Leu Ala Ala
545 550 555 560
Ala Lys Ala Ala Lys Tyr Gly Ala Ala Val Pro Gly Val Leu Gly Gly
565 570 575
Leu Gly Ala Leu Gly Gly Val Gly Ile Pro Gly Gly Val Val Gly Ala
580 585 590
Gly Pro Ala Ala Ala Ala Ala Ala Ala Lys Ala Ala Ala Lys Ala Ala
595 600 605
Gln Phe Gly Leu Val Gly Ala Ala Gly Leu Gly Gly Leu Gly Val Gly
610 615 620
Gly Leu Gly Val Pro Gly Val Gly Gly Leu Gly Gly Ile Pro Pro Ala
625 630 635 640
Ala Ala Ala Lys Ala Ala Lys Tyr Gly Val Ala Ala Arg Pro Gly Phe
645 650 655
Gly Leu Ser Pro Ile Phe Pro Gly Gly Ala Cys Leu Gly Lys Ala Cys
660 665 670
Gly Arg Lys Arg Lys
675
<210> 81
<211> 692
<212> ПРТ
<213> Homo sapiens
<400> 81
Met Ala Gly Leu Thr Ala Ala Ala Pro Arg Pro Gly Val Leu Leu Leu
1 5 10 15
Leu Leu Ser Ile Leu His Pro Ser Arg Pro Gly Gly Val Pro Gly Ala
20 25 30
Ile Pro Gly Gly Val Pro Gly Gly Val Phe Tyr Pro Gly Ala Gly Leu
35 40 45
Gly Ala Leu Gly Gly Gly Ala Leu Gly Pro Gly Gly Lys Pro Leu Lys
50 55 60
Pro Val Pro Gly Gly Leu Ala Gly Ala Gly Leu Gly Ala Gly Leu Gly
65 70 75 80
Ala Phe Pro Ala Val Thr Phe Pro Gly Ala Leu Val Pro Gly Gly Val
85 90 95
Ala Asp Ala Ala Ala Ala Tyr Lys Ala Ala Lys Ala Gly Ala Gly Leu
100 105 110
Gly Gly Val Pro Gly Val Gly Gly Leu Gly Val Ser Ala Ala Pro Ser
115 120 125
Val Pro Gly Ala Val Val Pro Gln Pro Gly Ala Gly Val Lys Pro Gly
130 135 140
Lys Val Pro Gly Val Gly Leu Pro Gly Val Tyr Pro Gly Gly Val Leu
145 150 155 160
Pro Gly Ala Arg Phe Pro Gly Val Gly Val Leu Pro Gly Val Pro Thr
165 170 175
Gly Ala Gly Val Lys Pro Lys Ala Pro Gly Val Gly Gly Ala Phe Ala
180 185 190
Gly Ile Pro Gly Val Gly Pro Phe Gly Gly Pro Gln Pro Gly Val Pro
195 200 205
Leu Gly Tyr Pro Ile Lys Ala Pro Lys Leu Pro Gly Gly Tyr Gly Leu
210 215 220
Pro Tyr Thr Thr Gly Lys Leu Pro Tyr Gly Tyr Gly Pro Gly Gly Val
225 230 235 240
Ala Gly Ala Ala Gly Lys Ala Gly Tyr Pro Thr Gly Thr Gly Val Gly
245 250 255
Pro Gln Ala Ala Ala Ala Ala Ala Ala Lys Ala Ala Ala Lys Phe Gly
260 265 270
Ala Gly Ala Ala Gly Val Leu Pro Gly Val Gly Gly Ala Gly Val Pro
275 280 285
Gly Val Pro Gly Ala Ile Pro Gly Ile Gly Gly Ile Ala Gly Val Gly
290 295 300
Thr Pro Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala Lys Ala Ala Lys
305 310 315 320
Tyr Gly Ala Ala Ala Gly Leu Val Pro Gly Gly Pro Gly Phe Gly Pro
325 330 335
Gly Val Val Gly Val Pro Gly Ala Gly Val Pro Gly Val Gly Val Pro
340 345 350
Gly Ala Gly Ile Pro Val Val Pro Gly Ala Gly Ile Pro Gly Ala Ala
355 360 365
Val Pro Gly Val Val Ser Pro Glu Ala Ala Ala Lys Ala Ala Ala Lys
370 375 380
Ala Ala Lys Tyr Gly Ala Arg Pro Gly Val Gly Val Gly Gly Ile Pro
385 390 395 400
Thr Tyr Gly Val Gly Ala Gly Gly Phe Pro Gly Phe Gly Val Gly Val
405 410 415
Gly Gly Ile Pro Gly Val Ala Gly Val Pro Gly Val Gly Gly Val Pro
420 425 430
Gly Val Gly Gly Val Pro Gly Val Gly Ile Ser Pro Glu Ala Gln Ala
435 440 445
Ala Ala Ala Ala Lys Ala Ala Lys Tyr Gly Leu Val Pro Gly Val Gly
450 455 460
Val Ala Pro Gly Val Gly Val Ala Pro Gly Val Gly Val Ala Pro Gly
465 470 475 480
Val Gly Leu Ala Pro Gly Val Gly Val Ala Pro Gly Val Gly Val Ala
485 490 495
Pro Gly Val Gly Val Ala Pro Gly Ile Gly Pro Gly Gly Val Ala Ala
500 505 510
Ala Ala Lys Ser Ala Ala Lys Val Ala Ala Lys Ala Gln Leu Arg Ala
515 520 525
Ala Ala Gly Leu Gly Ala Gly Ile Pro Gly Leu Gly Val Gly Val Gly
530 535 540
Val Pro Gly Leu Gly Val Gly Ala Gly Val Pro Gly Leu Gly Val Gly
545 550 555 560
Ala Gly Val Pro Gly Phe Gly Ala Val Pro Gly Ala Leu Ala Ala Ala
565 570 575
Lys Ala Ala Lys Tyr Gly Ala Ala Val Pro Gly Val Leu Gly Gly Leu
580 585 590
Gly Ala Leu Gly Gly Val Gly Ile Pro Gly Gly Val Val Gly Ala Gly
595 600 605
Pro Ala Ala Ala Ala Ala Ala Ala Lys Ala Ala Ala Lys Ala Ala Gln
610 615 620
Phe Gly Leu Val Gly Ala Ala Gly Leu Gly Gly Leu Gly Val Gly Gly
625 630 635 640
Leu Gly Val Pro Gly Val Gly Gly Leu Gly Gly Ile Pro Pro Ala Ala
645 650 655
Ala Ala Lys Ala Ala Lys Tyr Gly Val Ala Ala Arg Pro Gly Phe Gly
660 665 670
Leu Ser Pro Ile Phe Pro Gly Gly Ala Cys Leu Gly Lys Ala Cys Gly
675 680 685
Arg Lys Arg Lys
690
<210> 82
<211> 711
<212> ПРТ
<213> Homo sapiens
<400> 82
Met Ala Gly Leu Thr Ala Ala Ala Pro Arg Pro Gly Val Leu Leu Leu
1 5 10 15
Leu Leu Ser Ile Leu His Pro Ser Arg Pro Gly Gly Val Pro Gly Ala
20 25 30
Ile Pro Gly Gly Val Pro Gly Gly Val Phe Tyr Pro Gly Ala Gly Leu
35 40 45
Gly Ala Leu Gly Gly Gly Ala Leu Gly Pro Gly Gly Lys Pro Leu Lys
50 55 60
Pro Val Pro Gly Gly Leu Ala Gly Ala Gly Leu Gly Ala Gly Leu Gly
65 70 75 80
Ala Phe Pro Ala Val Thr Phe Pro Gly Ala Leu Val Pro Gly Gly Val
85 90 95
Ala Asp Ala Ala Ala Ala Tyr Lys Ala Ala Lys Ala Gly Ala Gly Leu
100 105 110
Gly Gly Val Pro Gly Val Gly Gly Leu Gly Val Ser Ala Ala Pro Ser
115 120 125
Val Pro Gly Ala Val Val Pro Gln Pro Gly Ala Gly Val Lys Pro Gly
130 135 140
Lys Val Pro Gly Val Gly Leu Pro Gly Val Tyr Pro Gly Gly Val Leu
145 150 155 160
Pro Gly Ala Arg Phe Pro Gly Val Gly Val Leu Pro Gly Val Pro Thr
165 170 175
Gly Ala Gly Val Lys Pro Lys Ala Pro Gly Val Gly Gly Ala Phe Ala
180 185 190
Gly Ile Pro Gly Val Gly Pro Phe Gly Gly Pro Gln Pro Gly Val Pro
195 200 205
Leu Gly Tyr Pro Ile Lys Ala Pro Lys Leu Pro Gly Gly Tyr Gly Leu
210 215 220
Pro Tyr Thr Thr Gly Lys Leu Pro Tyr Gly Tyr Gly Pro Gly Gly Val
225 230 235 240
Ala Gly Ala Ala Gly Lys Ala Gly Tyr Pro Thr Gly Thr Gly Val Gly
245 250 255
Pro Gln Ala Ala Ala Ala Ala Ala Ala Lys Ala Ala Ala Lys Phe Gly
260 265 270
Ala Gly Ala Ala Gly Val Leu Pro Gly Val Gly Gly Ala Gly Val Pro
275 280 285
Gly Val Pro Gly Ala Ile Pro Gly Ile Gly Gly Ile Ala Gly Val Gly
290 295 300
Thr Pro Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala Lys Ala Ala Lys
305 310 315 320
Tyr Gly Ala Ala Ala Gly Leu Val Pro Gly Gly Pro Gly Phe Gly Pro
325 330 335
Gly Val Val Gly Val Pro Gly Ala Gly Val Pro Gly Val Gly Val Pro
340 345 350
Gly Ala Gly Ile Pro Val Val Pro Gly Ala Gly Ile Pro Gly Ala Ala
355 360 365
Val Pro Gly Val Val Ser Pro Glu Ala Ala Ala Lys Ala Ala Ala Lys
370 375 380
Ala Ala Lys Tyr Gly Ala Arg Pro Gly Val Gly Val Gly Gly Ile Pro
385 390 395 400
Thr Tyr Gly Val Gly Ala Gly Gly Phe Pro Gly Phe Gly Val Gly Val
405 410 415
Gly Gly Ile Pro Gly Val Ala Gly Val Pro Gly Val Gly Gly Val Pro
420 425 430
Gly Val Gly Gly Val Pro Gly Val Gly Ile Ser Pro Glu Ala Gln Ala
435 440 445
Ala Ala Ala Ala Lys Ala Ala Lys Tyr Gly Val Gly Thr Pro Ala Ala
450 455 460
Ala Ala Ala Lys Ala Ala Ala Lys Ala Ala Gln Phe Gly Leu Val Pro
465 470 475 480
Gly Val Gly Val Ala Pro Gly Val Gly Val Ala Pro Gly Val Gly Val
485 490 495
Ala Pro Gly Val Gly Leu Ala Pro Gly Val Gly Val Ala Pro Gly Val
500 505 510
Gly Val Ala Pro Gly Val Gly Val Ala Pro Gly Ile Gly Pro Gly Gly
515 520 525
Val Ala Ala Ala Ala Lys Ser Ala Ala Lys Val Ala Ala Lys Ala Gln
530 535 540
Leu Arg Ala Ala Ala Gly Leu Gly Ala Gly Ile Pro Gly Leu Gly Val
545 550 555 560
Gly Val Gly Val Pro Gly Leu Gly Val Gly Ala Gly Val Pro Gly Leu
565 570 575
Gly Val Gly Ala Gly Val Pro Gly Phe Gly Ala Val Pro Gly Ala Leu
580 585 590
Ala Ala Ala Lys Ala Ala Lys Tyr Gly Ala Ala Val Pro Gly Val Leu
595 600 605
Gly Gly Leu Gly Ala Leu Gly Gly Val Gly Ile Pro Gly Gly Val Val
610 615 620
Gly Ala Gly Pro Ala Ala Ala Ala Ala Ala Ala Lys Ala Ala Ala Lys
625 630 635 640
Ala Ala Gln Phe Gly Leu Val Gly Ala Ala Gly Leu Gly Gly Leu Gly
645 650 655
Val Gly Gly Leu Gly Val Pro Gly Val Gly Gly Leu Gly Gly Ile Pro
660 665 670
Pro Ala Ala Ala Ala Lys Ala Ala Lys Tyr Gly Val Ala Ala Arg Pro
675 680 685
Gly Phe Gly Leu Ser Pro Ile Phe Pro Gly Gly Ala Cys Leu Gly Lys
690 695 700
Ala Cys Gly Arg Lys Arg Lys
705 710
<210> 83
<211> 705
<212> ПРТ
<213> Homo sapiens
<400> 83
Met Ala Gly Leu Thr Ala Ala Ala Pro Arg Pro Gly Val Leu Leu Leu
1 5 10 15
Leu Leu Ser Ile Leu His Pro Ser Arg Pro Gly Gly Val Pro Gly Ala
20 25 30
Ile Pro Gly Gly Val Pro Gly Gly Val Phe Tyr Pro Gly Ala Gly Leu
35 40 45
Gly Ala Leu Gly Gly Gly Ala Leu Gly Pro Gly Gly Lys Pro Leu Lys
50 55 60
Pro Val Pro Gly Gly Leu Ala Gly Ala Gly Leu Gly Ala Gly Leu Gly
65 70 75 80
Ala Phe Pro Ala Val Thr Phe Pro Gly Ala Leu Val Pro Gly Gly Val
85 90 95
Ala Asp Ala Ala Ala Ala Tyr Lys Ala Ala Lys Ala Gly Ala Gly Leu
100 105 110
Gly Gly Val Pro Gly Val Gly Gly Leu Gly Val Ser Ala Gly Ala Val
115 120 125
Val Pro Gln Pro Gly Ala Gly Val Lys Pro Gly Lys Val Pro Gly Val
130 135 140
Gly Leu Pro Gly Val Tyr Pro Gly Gly Val Leu Pro Gly Ala Arg Phe
145 150 155 160
Pro Gly Val Gly Val Leu Pro Gly Val Pro Thr Gly Ala Gly Val Lys
165 170 175
Pro Lys Ala Pro Gly Val Gly Gly Ala Phe Ala Gly Ile Pro Gly Val
180 185 190
Gly Pro Phe Gly Gly Pro Gln Pro Gly Val Pro Leu Gly Tyr Pro Ile
195 200 205
Lys Ala Pro Lys Leu Pro Gly Gly Tyr Gly Leu Pro Tyr Thr Thr Gly
210 215 220
Lys Leu Pro Tyr Gly Tyr Gly Pro Gly Gly Val Ala Gly Ala Ala Gly
225 230 235 240
Lys Ala Gly Tyr Pro Thr Gly Thr Gly Val Gly Pro Gln Ala Ala Ala
245 250 255
Ala Ala Ala Ala Lys Ala Ala Ala Lys Phe Gly Ala Gly Ala Ala Gly
260 265 270
Val Leu Pro Gly Val Gly Gly Ala Gly Val Pro Gly Val Pro Gly Ala
275 280 285
Ile Pro Gly Ile Gly Gly Ile Ala Gly Val Gly Thr Pro Ala Ala Ala
290 295 300
Ala Ala Ala Ala Ala Ala Ala Lys Ala Ala Lys Tyr Gly Ala Ala Ala
305 310 315 320
Gly Leu Val Pro Gly Gly Pro Gly Phe Gly Pro Gly Val Val Gly Val
325 330 335
Pro Gly Ala Gly Val Pro Gly Val Gly Val Pro Gly Ala Gly Ile Pro
340 345 350
Val Val Pro Gly Ala Gly Ile Pro Gly Ala Ala Val Pro Gly Val Val
355 360 365
Ser Pro Glu Ala Ala Ala Lys Ala Ala Ala Lys Ala Ala Lys Tyr Gly
370 375 380
Ala Arg Pro Gly Val Gly Val Gly Gly Ile Pro Thr Tyr Gly Val Gly
385 390 395 400
Ala Gly Gly Phe Pro Gly Phe Gly Val Gly Val Gly Gly Ile Pro Gly
405 410 415
Val Ala Gly Val Pro Gly Val Gly Gly Val Pro Gly Val Gly Gly Val
420 425 430
Pro Gly Val Gly Ile Ser Pro Glu Ala Gln Ala Ala Ala Ala Ala Lys
435 440 445
Ala Ala Lys Tyr Gly Leu Val Pro Gly Val Gly Val Ala Pro Gly Val
450 455 460
Gly Val Ala Pro Gly Val Gly Val Ala Pro Gly Val Gly Leu Ala Pro
465 470 475 480
Gly Val Gly Val Ala Pro Gly Val Gly Val Ala Pro Gly Val Gly Val
485 490 495
Ala Pro Gly Ile Gly Pro Gly Gly Val Ala Ala Ala Ala Lys Ser Ala
500 505 510
Ala Lys Val Ala Ala Lys Ala Gln Leu Arg Ala Ala Ala Gly Leu Gly
515 520 525
Ala Gly Ile Pro Gly Leu Gly Val Gly Val Gly Val Pro Gly Leu Gly
530 535 540
Val Gly Ala Gly Val Pro Gly Leu Gly Val Gly Ala Gly Val Pro Gly
545 550 555 560
Phe Gly Ala Val Pro Gly Ala Leu Ala Ala Ala Lys Ala Ala Lys Tyr
565 570 575
Gly Ala Ala Val Pro Gly Val Leu Gly Gly Leu Gly Ala Leu Gly Gly
580 585 590
Val Gly Ile Pro Gly Gly Val Val Gly Ala Gly Pro Ala Ala Ala Ala
595 600 605
Ala Ala Ala Lys Ala Ala Ala Lys Ala Ala Gln Phe Gly Leu Val Gly
610 615 620
Ala Ala Gly Leu Gly Gly Leu Gly Val Gly Gly Leu Gly Val Pro Gly
625 630 635 640
Val Gly Gly Leu Gly Gly Ile Pro Pro Ala Ala Ala Ala Lys Ala Ala
645 650 655
Lys Tyr Gly Ala Ala Gly Leu Gly Gly Val Leu Gly Gly Ala Gly Gln
660 665 670
Phe Pro Leu Gly Gly Val Ala Ala Arg Pro Gly Phe Gly Leu Ser Pro
675 680 685
Ile Phe Pro Gly Gly Ala Cys Leu Gly Lys Ala Cys Gly Arg Lys Arg
690 695 700
Lys
705
<210> 84
<211> 706
<212> ПРТ
<213> Homo sapiens
<400> 84
Met Ala Gly Leu Thr Ala Ala Ala Pro Arg Pro Gly Val Leu Leu Leu
1 5 10 15
Leu Leu Ser Ile Leu His Pro Ser Arg Pro Gly Gly Val Pro Gly Ala
20 25 30
Ile Pro Gly Gly Val Pro Gly Gly Val Phe Tyr Pro Gly Ala Gly Leu
35 40 45
Gly Ala Leu Gly Gly Gly Ala Leu Gly Pro Gly Gly Lys Pro Leu Lys
50 55 60
Pro Val Pro Gly Gly Leu Ala Gly Ala Gly Leu Gly Ala Gly Leu Gly
65 70 75 80
Ala Phe Pro Ala Val Thr Phe Pro Gly Ala Leu Val Pro Gly Gly Val
85 90 95
Ala Asp Ala Ala Ala Ala Tyr Lys Ala Ala Lys Ala Gly Ala Gly Leu
100 105 110
Gly Gly Val Pro Gly Val Gly Gly Leu Gly Val Ser Ala Gly Ala Val
115 120 125
Val Pro Gln Pro Gly Ala Gly Val Lys Pro Gly Lys Val Pro Gly Val
130 135 140
Gly Leu Pro Gly Val Tyr Pro Gly Gly Val Leu Pro Gly Ala Arg Phe
145 150 155 160
Pro Gly Val Gly Val Leu Pro Gly Val Pro Thr Gly Ala Gly Val Lys
165 170 175
Pro Lys Ala Pro Gly Val Gly Gly Ala Phe Ala Gly Ile Pro Gly Val
180 185 190
Gly Pro Phe Gly Gly Pro Gln Pro Gly Val Pro Leu Gly Tyr Pro Ile
195 200 205
Lys Ala Pro Lys Leu Pro Gly Gly Tyr Gly Leu Pro Tyr Thr Thr Gly
210 215 220
Lys Leu Pro Tyr Gly Tyr Gly Pro Gly Gly Val Ala Gly Ala Ala Gly
225 230 235 240
Lys Ala Gly Tyr Pro Thr Gly Thr Gly Val Gly Pro Gln Ala Ala Ala
245 250 255
Ala Ala Ala Ala Lys Ala Ala Ala Lys Phe Gly Ala Gly Ala Ala Gly
260 265 270
Val Leu Pro Gly Val Gly Gly Ala Gly Val Pro Gly Val Pro Gly Ala
275 280 285
Ile Pro Gly Ile Gly Gly Ile Ala Gly Val Gly Thr Pro Ala Ala Ala
290 295 300
Ala Ala Ala Ala Ala Ala Ala Lys Ala Ala Lys Tyr Gly Ala Ala Ala
305 310 315 320
Gly Leu Val Pro Gly Gly Pro Gly Phe Gly Pro Gly Val Val Gly Val
325 330 335
Pro Gly Ala Gly Val Pro Gly Val Gly Val Pro Gly Ala Gly Ile Pro
340 345 350
Val Val Pro Gly Ala Gly Ile Pro Gly Ala Ala Val Pro Gly Val Val
355 360 365
Ser Pro Glu Ala Ala Ala Lys Ala Ala Ala Lys Ala Ala Lys Tyr Gly
370 375 380
Ala Arg Pro Gly Val Gly Val Gly Gly Ile Pro Thr Tyr Gly Val Gly
385 390 395 400
Ala Gly Gly Phe Pro Gly Phe Gly Val Gly Val Gly Gly Ile Pro Gly
405 410 415
Val Ala Gly Val Pro Gly Val Gly Gly Val Pro Gly Val Gly Gly Val
420 425 430
Pro Gly Val Gly Ile Ser Pro Glu Ala Gln Ala Ala Ala Ala Ala Lys
435 440 445
Ala Ala Lys Tyr Gly Val Gly Thr Pro Ala Ala Ala Ala Ala Lys Ala
450 455 460
Ala Ala Lys Ala Ala Gln Phe Gly Leu Val Pro Gly Val Gly Val Ala
465 470 475 480
Pro Gly Val Gly Val Ala Pro Gly Val Gly Val Ala Pro Gly Val Gly
485 490 495
Leu Ala Pro Gly Val Gly Val Ala Pro Gly Val Gly Val Ala Pro Gly
500 505 510
Val Gly Val Ala Pro Gly Ile Gly Pro Gly Gly Val Ala Ala Ala Ala
515 520 525
Lys Ser Ala Ala Lys Val Ala Ala Lys Ala Gln Leu Arg Ala Ala Ala
530 535 540
Gly Leu Gly Ala Gly Ile Pro Gly Leu Gly Val Gly Val Gly Val Pro
545 550 555 560
Gly Leu Gly Val Gly Ala Gly Val Pro Gly Leu Gly Val Gly Ala Gly
565 570 575
Val Pro Gly Phe Gly Ala Val Pro Gly Ala Leu Ala Ala Ala Lys Ala
580 585 590
Ala Lys Tyr Gly Ala Ala Val Pro Gly Val Leu Gly Gly Leu Gly Ala
595 600 605
Leu Gly Gly Val Gly Ile Pro Gly Gly Val Val Gly Ala Gly Pro Ala
610 615 620
Ala Ala Ala Ala Ala Ala Lys Ala Ala Ala Lys Ala Ala Gln Phe Gly
625 630 635 640
Leu Val Gly Ala Ala Gly Leu Gly Gly Leu Gly Val Gly Gly Leu Gly
645 650 655
Val Pro Gly Val Gly Gly Leu Gly Gly Ile Pro Pro Ala Ala Ala Ala
660 665 670
Lys Ala Ala Lys Tyr Gly Val Ala Ala Arg Pro Gly Phe Gly Leu Ser
675 680 685
Pro Ile Phe Pro Gly Gly Ala Cys Leu Gly Lys Ala Cys Gly Arg Lys
690 695 700
Arg Lys
705
<210> 85
<211> 643
<212> ПРТ
<213> Homo sapiens
<400> 85
Met Ala Gly Leu Thr Ala Ala Ala Pro Arg Pro Gly Val Leu Leu Leu
1 5 10 15
Leu Leu Ser Ile Leu His Pro Ser Arg Pro Gly Gly Val Pro Gly Ala
20 25 30
Ile Pro Gly Gly Val Pro Gly Gly Val Phe Tyr Pro Gly Ala Gly Leu
35 40 45
Gly Ala Leu Gly Gly Gly Ala Leu Gly Pro Gly Gly Lys Pro Leu Lys
50 55 60
Pro Gly Leu Gly Ala Phe Pro Ala Val Thr Phe Pro Gly Ala Leu Val
65 70 75 80
Pro Gly Gly Val Ala Asp Ala Ala Ala Ala Tyr Lys Ala Ala Lys Ala
85 90 95
Gly Ala Gly Leu Gly Gly Val Pro Gly Val Gly Gly Leu Gly Val Ser
100 105 110
Ala Gly Ala Val Val Pro Gln Pro Gly Ala Gly Val Lys Pro Gly Lys
115 120 125
Val Pro Gly Val Gly Leu Pro Gly Val Tyr Pro Gly Gly Val Leu Pro
130 135 140
Gly Ala Arg Phe Pro Gly Val Gly Val Leu Pro Gly Val Pro Thr Gly
145 150 155 160
Ala Gly Val Lys Pro Lys Ala Pro Gly Val Gly Pro Phe Gly Gly Pro
165 170 175
Gln Pro Gly Val Pro Leu Gly Tyr Pro Ile Lys Ala Pro Lys Leu Pro
180 185 190
Gly Tyr Gly Pro Gly Gly Val Ala Gly Ala Ala Gly Lys Ala Gly Tyr
195 200 205
Pro Thr Gly Thr Gly Val Gly Pro Gln Ala Ala Ala Ala Ala Ala Ala
210 215 220
Lys Ala Ala Ala Lys Phe Gly Ala Gly Ala Ala Gly Val Leu Pro Gly
225 230 235 240
Val Gly Gly Ala Gly Val Pro Gly Val Pro Gly Ala Ile Pro Gly Ile
245 250 255
Gly Gly Ile Ala Gly Val Gly Thr Pro Ala Ala Ala Ala Ala Ala Ala
260 265 270
Ala Ala Ala Lys Ala Ala Lys Tyr Gly Ala Ala Ala Gly Leu Val Pro
275 280 285
Gly Gly Pro Gly Phe Gly Pro Gly Val Val Gly Val Pro Gly Ala Gly
290 295 300
Val Pro Gly Val Gly Val Pro Gly Ala Gly Ile Pro Val Val Pro Gly
305 310 315 320
Ala Gly Ile Pro Gly Ala Ala Val Pro Gly Val Val Ser Pro Glu Ala
325 330 335
Ala Ala Lys Ala Ala Ala Lys Ala Ala Lys Tyr Gly Ala Arg Pro Gly
340 345 350
Val Gly Val Gly Gly Ile Pro Thr Tyr Gly Val Gly Ala Gly Gly Phe
355 360 365
Pro Gly Phe Gly Val Gly Val Gly Ala Glu Ala Gln Ala Ala Ala Ala
370 375 380
Ala Lys Ala Ala Lys Tyr Gly Leu Val Pro Gly Val Gly Val Ala Pro
385 390 395 400
Gly Val Gly Val Ala Pro Gly Val Gly Val Ala Pro Gly Val Gly Leu
405 410 415
Ala Pro Gly Val Gly Val Ala Pro Gly Val Gly Val Ala Pro Gly Val
420 425 430
Gly Val Ala Pro Gly Ile Gly Pro Gly Gly Val Ala Ala Ala Ala Lys
435 440 445
Ser Ala Ala Lys Val Ala Ala Lys Ala Gln Leu Arg Ala Ala Ala Gly
450 455 460
Leu Gly Ala Gly Ile Pro Gly Leu Gly Val Gly Val Gly Val Pro Gly
465 470 475 480
Leu Gly Val Gly Ala Gly Val Pro Gly Leu Gly Val Gly Ala Gly Val
485 490 495
Pro Gly Phe Gly Ala Val Pro Gly Ala Leu Ala Ala Ala Lys Ala Ala
500 505 510
Lys Tyr Gly Ala Ala Val Pro Gly Val Leu Gly Gly Leu Gly Ala Leu
515 520 525
Gly Gly Val Gly Ile Pro Gly Gly Val Val Gly Ala Gly Pro Ala Ala
530 535 540
Ala Ala Ala Ala Ala Lys Ala Ala Ala Lys Ala Ala Gln Phe Gly Leu
545 550 555 560
Val Gly Ala Ala Gly Leu Gly Gly Leu Gly Val Gly Gly Leu Gly Val
565 570 575
Pro Gly Val Gly Gly Leu Gly Gly Ile Pro Pro Ala Ala Ala Ala Lys
580 585 590
Ala Ala Lys Tyr Gly Ala Ala Gly Leu Gly Gly Val Leu Gly Gly Ala
595 600 605
Gly Gln Phe Pro Leu Gly Gly Val Ala Ala Arg Pro Gly Phe Gly Leu
610 615 620
Ser Pro Ile Phe Pro Gly Gly Ala Cys Leu Gly Lys Ala Cys Gly Arg
625 630 635 640
Lys Arg Lys
<210> 86
<211> 700
<212> ПРТ
<213> Homo sapiens
<400> 86
Met Ala Gly Leu Thr Ala Ala Ala Pro Arg Pro Gly Val Leu Leu Leu
1 5 10 15
Leu Leu Ser Ile Leu His Pro Ser Arg Pro Gly Gly Val Pro Gly Ala
20 25 30
Ile Pro Gly Gly Val Pro Gly Gly Val Phe Tyr Pro Ala Leu Gly Pro
35 40 45
Gly Gly Lys Pro Leu Lys Pro Val Pro Gly Gly Leu Ala Gly Ala Gly
50 55 60
Leu Gly Ala Gly Leu Gly Ala Phe Pro Ala Val Thr Phe Pro Gly Ala
65 70 75 80
Leu Val Pro Gly Gly Val Ala Asp Ala Ala Ala Ala Tyr Lys Ala Ala
85 90 95
Lys Ala Gly Ala Gly Leu Gly Gly Val Pro Gly Val Gly Gly Leu Gly
100 105 110
Val Ser Ala Ala Pro Ser Val Pro Gly Ala Val Val Pro Gln Pro Gly
115 120 125
Ala Gly Val Lys Pro Gly Lys Val Pro Gly Val Gly Leu Pro Gly Val
130 135 140
Tyr Pro Gly Gly Val Leu Pro Gly Ala Arg Phe Pro Gly Val Gly Val
145 150 155 160
Leu Pro Gly Val Pro Thr Gly Ala Gly Val Lys Pro Lys Ala Pro Gly
165 170 175
Val Gly Gly Ala Phe Ala Gly Ile Pro Gly Val Gly Pro Phe Gly Gly
180 185 190
Pro Gln Pro Gly Val Pro Leu Gly Tyr Pro Ile Lys Ala Pro Lys Leu
195 200 205
Pro Gly Gly Tyr Gly Leu Pro Tyr Thr Thr Gly Lys Leu Pro Tyr Gly
210 215 220
Tyr Gly Pro Gly Gly Val Ala Gly Ala Ala Gly Lys Ala Gly Tyr Pro
225 230 235 240
Thr Gly Thr Gly Val Gly Pro Gln Ala Ala Ala Ala Ala Ala Ala Lys
245 250 255
Ala Ala Ala Lys Phe Gly Ala Gly Ala Ala Gly Val Leu Pro Gly Val
260 265 270
Gly Gly Ala Gly Val Pro Gly Val Pro Gly Ala Ile Pro Gly Ile Gly
275 280 285
Gly Ile Ala Gly Val Gly Thr Pro Ala Ala Ala Ala Ala Ala Ala Ala
290 295 300
Ala Ala Lys Ala Ala Lys Tyr Gly Ala Ala Ala Gly Leu Val Pro Gly
305 310 315 320
Gly Pro Gly Phe Gly Pro Gly Val Val Gly Val Pro Gly Ala Gly Val
325 330 335
Pro Gly Val Gly Val Pro Gly Ala Gly Ile Pro Val Val Pro Gly Ala
340 345 350
Gly Ile Pro Gly Ala Ala Val Pro Gly Val Val Ser Pro Glu Ala Ala
355 360 365
Ala Lys Ala Ala Ala Lys Ala Ala Lys Tyr Gly Ala Arg Pro Gly Val
370 375 380
Gly Val Gly Gly Ile Pro Thr Tyr Gly Val Gly Ala Gly Gly Phe Pro
385 390 395 400
Gly Phe Gly Val Gly Val Gly Gly Ile Pro Gly Val Ala Gly Val Pro
405 410 415
Gly Val Gly Gly Val Pro Gly Val Gly Gly Val Pro Gly Val Gly Ile
420 425 430
Ser Pro Glu Ala Gln Ala Ala Ala Ala Ala Lys Ala Ala Lys Tyr Gly
435 440 445
Leu Val Pro Gly Val Gly Val Ala Pro Gly Val Gly Val Ala Pro Gly
450 455 460
Val Gly Val Ala Pro Gly Val Gly Leu Ala Pro Gly Val Gly Val Ala
465 470 475 480
Pro Gly Val Gly Val Ala Pro Gly Val Gly Val Ala Pro Gly Ile Gly
485 490 495
Pro Gly Gly Val Ala Ala Ala Ala Lys Ser Ala Ala Lys Val Ala Ala
500 505 510
Lys Ala Gln Leu Arg Ala Ala Ala Gly Leu Gly Ala Gly Ile Pro Gly
515 520 525
Leu Gly Val Gly Val Gly Val Pro Gly Leu Gly Val Gly Ala Gly Val
530 535 540
Pro Gly Leu Gly Val Gly Ala Gly Val Pro Gly Phe Gly Ala Val Pro
545 550 555 560
Gly Ala Leu Ala Ala Ala Lys Ala Ala Lys Tyr Gly Ala Ala Val Pro
565 570 575
Gly Val Leu Gly Gly Leu Gly Ala Leu Gly Gly Val Gly Ile Pro Gly
580 585 590
Gly Val Val Gly Ala Gly Pro Ala Ala Ala Ala Ala Ala Ala Lys Ala
595 600 605
Ala Ala Lys Ala Ala Gln Phe Gly Leu Val Gly Ala Ala Gly Leu Gly
610 615 620
Gly Leu Gly Val Gly Gly Leu Gly Val Pro Gly Val Gly Gly Leu Gly
625 630 635 640
Gly Ile Pro Pro Ala Ala Ala Ala Lys Ala Ala Lys Tyr Gly Ala Ala
645 650 655
Gly Leu Gly Gly Val Leu Gly Gly Ala Gly Gln Phe Pro Leu Gly Gly
660 665 670
Val Ala Ala Arg Pro Gly Phe Gly Leu Ser Pro Ile Phe Pro Gly Gly
675 680 685
Ala Cys Leu Gly Lys Ala Cys Gly Arg Lys Arg Lys
690 695 700
<210> 87
<211> 730
<212> ПРТ
<213> Homo sapiens
<400> 87
Met Ala Gly Leu Thr Ala Ala Ala Pro Arg Pro Gly Val Leu Leu Leu
1 5 10 15
Leu Leu Ser Ile Leu His Pro Ser Arg Pro Gly Gly Val Pro Gly Ala
20 25 30
Ile Pro Gly Gly Val Pro Gly Gly Val Phe Tyr Pro Gly Ala Gly Leu
35 40 45
Gly Ala Leu Gly Gly Gly Ala Leu Gly Pro Gly Gly Lys Pro Leu Lys
50 55 60
Pro Val Pro Gly Gly Leu Ala Gly Ala Gly Leu Gly Ala Gly Leu Gly
65 70 75 80
Ala Phe Pro Ala Val Thr Phe Pro Gly Ala Leu Val Pro Gly Gly Val
85 90 95
Ala Asp Ala Ala Ala Ala Tyr Lys Ala Ala Lys Ala Gly Ala Gly Leu
100 105 110
Gly Gly Val Pro Gly Val Gly Gly Leu Gly Val Ser Ala Gly Ala Val
115 120 125
Val Pro Gln Pro Gly Ala Gly Val Lys Pro Gly Lys Val Pro Gly Val
130 135 140
Gly Leu Pro Gly Val Tyr Pro Gly Gly Val Leu Pro Gly Ala Arg Phe
145 150 155 160
Pro Gly Val Gly Val Leu Pro Gly Val Pro Thr Gly Ala Gly Val Lys
165 170 175
Pro Lys Ala Pro Gly Val Gly Gly Ala Phe Ala Gly Ile Pro Gly Val
180 185 190
Gly Pro Phe Gly Gly Pro Gln Pro Gly Val Pro Leu Gly Tyr Pro Ile
195 200 205
Lys Ala Pro Lys Leu Pro Gly Gly Tyr Gly Leu Pro Tyr Thr Thr Gly
210 215 220
Lys Leu Pro Tyr Gly Tyr Gly Pro Gly Gly Val Ala Gly Ala Ala Gly
225 230 235 240
Lys Ala Gly Tyr Pro Thr Gly Thr Gly Val Gly Pro Gln Ala Ala Ala
245 250 255
Ala Ala Ala Ala Lys Ala Ala Ala Lys Phe Gly Ala Gly Ala Ala Gly
260 265 270
Val Leu Pro Gly Val Gly Gly Ala Gly Val Pro Gly Val Pro Gly Ala
275 280 285
Ile Pro Gly Ile Gly Gly Ile Ala Gly Val Gly Thr Pro Ala Ala Ala
290 295 300
Ala Ala Ala Ala Ala Ala Ala Lys Ala Ala Lys Tyr Gly Ala Ala Ala
305 310 315 320
Gly Leu Val Pro Gly Gly Pro Gly Phe Gly Pro Gly Val Val Gly Val
325 330 335
Pro Gly Ala Gly Val Pro Gly Val Gly Val Pro Gly Ala Gly Ile Pro
340 345 350
Val Val Pro Gly Ala Gly Ile Pro Gly Ala Ala Val Pro Gly Val Val
355 360 365
Ser Pro Glu Ala Ala Ala Lys Ala Ala Ala Lys Ala Ala Lys Tyr Gly
370 375 380
Ala Arg Pro Gly Val Gly Val Gly Gly Ile Pro Thr Tyr Gly Val Gly
385 390 395 400
Ala Gly Gly Phe Pro Gly Phe Gly Val Gly Val Gly Gly Ile Pro Gly
405 410 415
Val Ala Gly Val Pro Gly Val Gly Gly Val Pro Gly Val Gly Gly Val
420 425 430
Pro Gly Val Gly Ile Ser Pro Glu Ala Gln Ala Ala Ala Ala Ala Lys
435 440 445
Ala Ala Lys Tyr Gly Val Gly Thr Pro Ala Ala Ala Ala Ala Lys Ala
450 455 460
Ala Ala Lys Ala Ala Gln Phe Ala Leu Leu Asn Leu Ala Gly Leu Val
465 470 475 480
Pro Gly Val Gly Val Ala Pro Gly Val Gly Val Ala Pro Gly Val Gly
485 490 495
Val Ala Pro Gly Val Gly Leu Ala Pro Gly Val Gly Val Ala Pro Gly
500 505 510
Val Gly Val Ala Pro Gly Val Gly Val Ala Pro Gly Ile Gly Pro Gly
515 520 525
Gly Val Ala Ala Ala Ala Lys Ser Ala Ala Lys Val Ala Ala Lys Ala
530 535 540
Gln Leu Arg Ala Ala Ala Gly Leu Gly Ala Gly Ile Pro Gly Leu Gly
545 550 555 560
Val Gly Val Gly Val Pro Gly Leu Gly Val Gly Ala Gly Val Pro Gly
565 570 575
Leu Gly Val Gly Ala Gly Val Pro Gly Phe Gly Ala Val Pro Gly Ala
580 585 590
Leu Ala Ala Ala Lys Ala Ala Lys Tyr Gly Ala Ala Val Pro Gly Val
595 600 605
Leu Gly Gly Leu Gly Ala Leu Gly Gly Val Gly Ile Pro Gly Gly Val
610 615 620
Val Gly Ala Gly Pro Ala Ala Ala Ala Ala Ala Ala Lys Ala Ala Ala
625 630 635 640
Lys Ala Ala Gln Phe Gly Leu Val Gly Ala Ala Gly Leu Gly Gly Leu
645 650 655
Gly Val Gly Gly Leu Gly Val Pro Gly Val Gly Gly Leu Gly Gly Ile
660 665 670
Pro Pro Ala Ala Ala Ala Lys Ala Ala Lys Tyr Gly Ala Ala Gly Leu
675 680 685
Gly Gly Val Leu Gly Gly Ala Gly Gln Phe Pro Leu Gly Gly Val Ala
690 695 700
Ala Arg Pro Gly Phe Gly Leu Ser Pro Ile Phe Pro Gly Gly Ala Cys
705 710 715 720
Leu Gly Lys Ala Cys Gly Arg Lys Arg Lys
725 730
<210> 88
<211> 658
<212> ПРТ
<213> Homo sapiens
<400> 88
Met Ala Gly Leu Thr Ala Ala Ala Pro Arg Pro Gly Val Leu Leu Leu
1 5 10 15
Leu Leu Ser Ile Leu His Pro Ser Arg Pro Gly Gly Val Pro Gly Ala
20 25 30
Ile Pro Gly Gly Val Pro Gly Gly Val Phe Tyr Pro Gly Ala Gly Leu
35 40 45
Gly Ala Leu Gly Gly Gly Ala Leu Gly Pro Gly Gly Lys Pro Leu Lys
50 55 60
Pro Val Pro Gly Gly Leu Ala Gly Ala Gly Leu Gly Ala Gly Leu Gly
65 70 75 80
Ala Phe Pro Ala Val Thr Phe Pro Gly Ala Leu Val Pro Gly Gly Val
85 90 95
Ala Asp Ala Ala Ala Ala Tyr Lys Ala Ala Lys Ala Gly Ala Gly Leu
100 105 110
Gly Gly Val Pro Gly Val Gly Gly Leu Gly Val Ser Ala Gly Ala Val
115 120 125
Val Pro Gln Pro Gly Ala Gly Val Lys Pro Gly Lys Val Pro Gly Val
130 135 140
Gly Leu Pro Gly Val Tyr Pro Gly Gly Val Leu Pro Gly Ala Arg Phe
145 150 155 160
Pro Gly Val Gly Val Leu Pro Gly Val Pro Thr Gly Ala Gly Val Lys
165 170 175
Pro Lys Ala Pro Gly Val Gly Gly Ala Phe Ala Gly Ile Pro Gly Val
180 185 190
Gly Pro Phe Gly Gly Pro Gln Pro Gly Val Pro Leu Gly Tyr Pro Ile
195 200 205
Lys Ala Pro Lys Leu Pro Gly Tyr Gly Pro Gly Gly Val Ala Gly Ala
210 215 220
Ala Gly Lys Ala Gly Tyr Pro Thr Gly Thr Gly Val Gly Pro Gln Ala
225 230 235 240
Ala Ala Ala Ala Ala Ala Lys Ala Ala Ala Lys Phe Gly Ala Gly Ala
245 250 255
Ala Gly Val Leu Pro Gly Val Gly Gly Ala Gly Val Pro Gly Val Pro
260 265 270
Gly Ala Ile Pro Gly Ile Gly Gly Ile Ala Gly Val Gly Thr Pro Ala
275 280 285
Ala Ala Ala Ala Ala Ala Ala Ala Ala Lys Ala Ala Lys Tyr Gly Ala
290 295 300
Ala Ala Gly Leu Val Pro Gly Gly Pro Gly Phe Gly Pro Gly Val Val
305 310 315 320
Gly Val Pro Gly Ala Gly Val Pro Gly Val Gly Val Pro Gly Ala Gly
325 330 335
Ile Pro Val Val Pro Gly Ala Gly Ile Pro Gly Ala Ala Val Pro Gly
340 345 350
Val Val Ser Pro Glu Ala Ala Ala Lys Ala Ala Ala Lys Ala Ala Lys
355 360 365
Tyr Gly Ala Arg Pro Gly Val Gly Val Gly Gly Ile Pro Thr Tyr Gly
370 375 380
Val Gly Ala Gly Gly Phe Pro Gly Phe Gly Val Gly Val Gly Gly Ile
385 390 395 400
Pro Gly Val Ala Gly Val Pro Gly Val Gly Gly Val Pro Gly Val Gly
405 410 415
Gly Val Pro Gly Val Gly Ile Ser Pro Glu Ala Gln Ala Ala Ala Ala
420 425 430
Ala Lys Ala Ala Lys Tyr Gly Leu Val Pro Gly Val Gly Val Ala Pro
435 440 445
Gly Val Gly Val Ala Pro Gly Val Gly Val Ala Pro Gly Val Gly Leu
450 455 460
Ala Pro Gly Val Gly Val Ala Pro Gly Val Gly Val Ala Pro Gly Val
465 470 475 480
Gly Val Ala Pro Gly Ile Gly Pro Gly Gly Val Ala Gly Ala Ala Ala
485 490 495
Gly Leu Gly Ala Gly Ile Pro Gly Leu Gly Val Gly Val Gly Val Pro
500 505 510
Gly Leu Gly Val Gly Ala Gly Val Pro Gly Leu Gly Val Gly Ala Gly
515 520 525
Val Pro Gly Phe Gly Ala Val Pro Gly Ala Leu Ala Ala Ala Lys Ala
530 535 540
Ala Lys Tyr Gly Ala Ala Val Pro Gly Val Leu Gly Gly Leu Gly Ala
545 550 555 560
Leu Gly Gly Val Gly Ile Pro Gly Gly Val Val Gly Ala Gly Pro Ala
565 570 575
Ala Ala Ala Ala Ala Ala Lys Ala Ala Ala Lys Ala Ala Gln Phe Gly
580 585 590
Leu Val Gly Ala Ala Gly Leu Gly Gly Leu Gly Val Gly Gly Leu Gly
595 600 605
Val Pro Gly Val Gly Gly Leu Gly Gly Ile Pro Pro Ala Ala Ala Ala
610 615 620
Lys Ala Ala Lys Tyr Gly Val Ala Ala Arg Pro Gly Phe Gly Leu Ser
625 630 635 640
Pro Ile Phe Pro Gly Gly Ala Cys Leu Gly Lys Ala Cys Gly Arg Lys
645 650 655
Arg Lys
<210> 89
<211> 714
<212> ПРТ
<213> Homo sapiens
<400> 89
Met Ala Gly Leu Thr Ala Ala Ala Pro Arg Pro Gly Val Leu Leu Leu
1 5 10 15
Leu Leu Ser Ile Leu His Pro Ser Arg Pro Gly Gly Val Pro Gly Ala
20 25 30
Ile Pro Gly Gly Val Pro Gly Gly Val Phe Tyr Pro Ala Leu Gly Pro
35 40 45
Gly Gly Lys Pro Leu Lys Pro Val Pro Gly Gly Leu Ala Gly Ala Gly
50 55 60
Leu Gly Ala Gly Leu Gly Ala Phe Pro Ala Val Thr Phe Pro Gly Ala
65 70 75 80
Leu Val Pro Gly Gly Val Ala Asp Ala Ala Ala Ala Tyr Lys Ala Ala
85 90 95
Lys Ala Gly Ala Gly Leu Gly Gly Val Pro Gly Val Gly Gly Leu Gly
100 105 110
Val Ser Ala Gly Ala Val Val Pro Gln Pro Gly Ala Gly Val Lys Pro
115 120 125
Gly Lys Val Pro Gly Val Gly Leu Pro Gly Val Tyr Pro Gly Gly Val
130 135 140
Leu Pro Gly Ala Arg Phe Pro Gly Val Gly Val Leu Pro Gly Val Pro
145 150 155 160
Thr Gly Ala Gly Val Lys Pro Lys Ala Pro Gly Val Gly Gly Ala Phe
165 170 175
Ala Gly Ile Pro Gly Val Gly Pro Phe Gly Gly Pro Gln Pro Gly Val
180 185 190
Pro Leu Gly Tyr Pro Ile Lys Ala Pro Lys Leu Pro Gly Gly Tyr Gly
195 200 205
Leu Pro Tyr Thr Thr Gly Lys Leu Pro Tyr Gly Tyr Gly Pro Gly Gly
210 215 220
Val Ala Gly Ala Ala Gly Lys Ala Gly Tyr Pro Thr Gly Thr Gly Val
225 230 235 240
Gly Pro Gln Ala Ala Ala Ala Ala Ala Ala Lys Ala Ala Ala Lys Phe
245 250 255
Gly Ala Gly Ala Ala Gly Val Leu Pro Gly Val Gly Gly Ala Gly Val
260 265 270
Pro Gly Val Pro Gly Ala Ile Pro Gly Ile Gly Gly Ile Ala Gly Val
275 280 285
Gly Thr Pro Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala Lys Ala Ala
290 295 300
Lys Tyr Gly Ala Ala Ala Gly Leu Val Pro Gly Gly Pro Gly Phe Gly
305 310 315 320
Pro Gly Val Val Gly Val Pro Gly Ala Gly Val Pro Gly Val Gly Val
325 330 335
Pro Gly Ala Gly Ile Pro Val Val Pro Gly Ala Gly Ile Pro Gly Ala
340 345 350
Ala Val Pro Gly Val Val Ser Pro Glu Ala Ala Ala Lys Ala Ala Ala
355 360 365
Lys Ala Ala Lys Tyr Gly Ala Arg Pro Gly Val Gly Val Gly Gly Ile
370 375 380
Pro Thr Tyr Gly Val Gly Ala Gly Gly Phe Pro Gly Phe Gly Val Gly
385 390 395 400
Val Gly Gly Ile Pro Gly Val Ala Gly Val Pro Gly Val Gly Gly Val
405 410 415
Pro Gly Val Gly Gly Val Pro Gly Val Gly Ile Ser Pro Glu Ala Gln
420 425 430
Ala Ala Ala Ala Ala Lys Ala Ala Lys Tyr Gly Val Gly Thr Pro Ala
435 440 445
Ala Ala Ala Ala Lys Ala Ala Ala Lys Ala Ala Gln Phe Gly Leu Val
450 455 460
Pro Gly Val Gly Val Ala Pro Gly Val Gly Val Ala Pro Gly Val Gly
465 470 475 480
Val Ala Pro Gly Val Gly Leu Ala Pro Gly Val Gly Val Ala Pro Gly
485 490 495
Val Gly Val Ala Pro Gly Val Gly Val Ala Pro Gly Ile Gly Pro Gly
500 505 510
Gly Val Ala Ala Ala Ala Lys Ser Ala Ala Lys Val Ala Ala Lys Ala
515 520 525
Gln Leu Arg Ala Ala Ala Gly Leu Gly Ala Gly Ile Pro Gly Leu Gly
530 535 540
Val Gly Val Gly Val Pro Gly Leu Gly Val Gly Ala Gly Val Pro Gly
545 550 555 560
Leu Gly Val Gly Ala Gly Val Pro Gly Phe Gly Ala Val Pro Gly Ala
565 570 575
Leu Ala Ala Ala Lys Ala Ala Lys Tyr Gly Ala Ala Val Pro Gly Val
580 585 590
Leu Gly Gly Leu Gly Ala Leu Gly Gly Val Gly Ile Pro Gly Gly Val
595 600 605
Val Gly Ala Gly Pro Ala Ala Ala Ala Ala Ala Ala Lys Ala Ala Ala
610 615 620
Lys Ala Ala Gln Phe Gly Leu Val Gly Ala Ala Gly Leu Gly Gly Leu
625 630 635 640
Gly Val Gly Gly Leu Gly Val Pro Gly Val Gly Gly Leu Gly Gly Ile
645 650 655
Pro Pro Ala Ala Ala Ala Lys Ala Ala Lys Tyr Gly Ala Ala Gly Leu
660 665 670
Gly Gly Val Leu Gly Gly Ala Gly Gln Phe Pro Leu Gly Gly Val Ala
675 680 685
Ala Arg Pro Gly Phe Gly Leu Ser Pro Ile Phe Pro Gly Gly Ala Cys
690 695 700
Leu Gly Lys Ala Cys Gly Arg Lys Arg Lys
705 710
<210> 90
<211> 617
<212> ПРТ
<213> Homo sapiens
<400> 90
Met Ala Gly Leu Thr Ala Ala Ala Pro Arg Pro Gly Val Leu Leu Leu
1 5 10 15
Leu Leu Ser Ile Leu His Pro Ser Arg Pro Gly Gly Val Pro Gly Ala
20 25 30
Ile Pro Gly Gly Val Pro Gly Gly Val Phe Tyr Pro Ala Leu Gly Pro
35 40 45
Gly Gly Lys Pro Leu Lys Pro Val Pro Gly Gly Leu Ala Gly Ala Gly
50 55 60
Leu Gly Ala Gly Leu Gly Ala Phe Pro Ala Val Thr Phe Pro Gly Ala
65 70 75 80
Leu Val Pro Gly Gly Val Ala Asp Ala Ala Ala Ala Tyr Lys Ala Ala
85 90 95
Lys Ala Gly Ala Gly Leu Gly Gly Val Pro Gly Val Gly Gly Leu Gly
100 105 110
Val Ser Ala Gly Ala Val Val Pro Gln Pro Gly Ala Gly Val Lys Pro
115 120 125
Gly Lys Val Pro Gly Val Gly Leu Pro Gly Val Tyr Pro Gly Gly Val
130 135 140
Leu Pro Gly Val Gly Pro Phe Gly Gly Pro Gln Pro Gly Val Pro Leu
145 150 155 160
Gly Tyr Pro Ile Lys Ala Pro Lys Leu Pro Gly Gly Tyr Gly Leu Pro
165 170 175
Tyr Thr Thr Gly Lys Leu Pro Tyr Gly Tyr Gly Pro Gly Gly Val Ala
180 185 190
Gly Ala Ala Gly Lys Ala Gly Tyr Pro Thr Gly Thr Gly Val Gly Pro
195 200 205
Gln Ala Ala Ala Ala Ala Ala Ala Lys Ala Ala Ala Lys Phe Gly Ala
210 215 220
Gly Ala Ala Gly Val Leu Pro Gly Val Gly Gly Ala Gly Val Pro Gly
225 230 235 240
Val Pro Gly Ala Ile Pro Gly Ile Gly Gly Ile Ala Gly Val Gly Thr
245 250 255
Pro Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala Lys Ala Ala Lys Tyr
260 265 270
Gly Ala Ala Ala Gly Leu Val Pro Gly Gly Pro Gly Phe Gly Pro Gly
275 280 285
Val Val Gly Val Pro Gly Ala Gly Val Pro Gly Val Gly Val Pro Gly
290 295 300
Ala Gly Ile Pro Val Val Pro Gly Ala Gly Ile Pro Gly Ala Ala Val
305 310 315 320
Pro Gly Val Val Ser Pro Glu Ala Ala Ala Lys Ala Ala Ala Lys Ala
325 330 335
Ala Lys Tyr Gly Ala Arg Pro Gly Val Gly Val Gly Gly Ile Pro Thr
340 345 350
Tyr Gly Val Gly Ala Gly Gly Phe Pro Gly Phe Gly Val Gly Val Gly
355 360 365
Ala Glu Ala Gln Ala Ala Ala Ala Ala Lys Ala Ala Lys Tyr Gly Leu
370 375 380
Val Pro Gly Val Gly Val Ala Pro Gly Val Gly Val Ala Pro Gly Val
385 390 395 400
Gly Val Ala Pro Gly Val Gly Leu Ala Pro Gly Val Gly Val Ala Pro
405 410 415
Gly Val Gly Val Ala Pro Gly Val Gly Val Ala Pro Gly Ile Gly Pro
420 425 430
Gly Gly Val Ala Ala Ala Ala Lys Ser Ala Ala Lys Val Ala Ala Lys
435 440 445
Ala Gln Leu Arg Ala Ala Ala Gly Leu Gly Ala Gly Ile Pro Gly Leu
450 455 460
Gly Val Gly Val Gly Val Pro Gly Leu Gly Val Gly Ala Gly Val Pro
465 470 475 480
Gly Leu Gly Val Gly Ala Gly Val Pro Gly Phe Gly Ala Val Pro Gly
485 490 495
Ala Leu Ala Ala Ala Lys Ala Ala Lys Tyr Gly Ala Ala Val Pro Gly
500 505 510
Val Leu Gly Gly Leu Gly Ala Leu Gly Gly Val Gly Ile Pro Gly Gly
515 520 525
Val Val Gly Ala Gly Pro Ala Ala Ala Ala Ala Ala Ala Lys Ala Ala
530 535 540
Ala Lys Ala Ala Gln Phe Gly Leu Val Gly Ala Ala Gly Leu Gly Gly
545 550 555 560
Leu Gly Val Gly Gly Leu Gly Val Pro Gly Val Gly Gly Leu Gly Gly
565 570 575
Ile Pro Pro Ala Ala Ala Ala Lys Ala Ala Lys Tyr Gly Val Ala Ala
580 585 590
Arg Pro Gly Phe Gly Leu Ser Pro Ile Phe Pro Gly Gly Ala Cys Leu
595 600 605
Gly Lys Ala Cys Gly Arg Lys Arg Lys
610 615
<210> 91
<211> 786
<212> ПРТ
<213> Homo sapiens
<400> 91
Met Ala Gly Leu Thr Ala Ala Ala Pro Arg Pro Gly Val Leu Leu Leu
1 5 10 15
Leu Leu Ser Ile Leu His Pro Ser Arg Pro Gly Gly Val Pro Gly Ala
20 25 30
Ile Pro Gly Gly Val Pro Gly Gly Val Phe Tyr Pro Gly Ala Gly Leu
35 40 45
Gly Ala Leu Gly Gly Gly Ala Leu Gly Pro Gly Gly Lys Pro Leu Lys
50 55 60
Pro Val Pro Gly Gly Leu Ala Gly Ala Gly Leu Gly Ala Gly Leu Gly
65 70 75 80
Ala Phe Pro Ala Val Thr Phe Pro Gly Ala Leu Val Pro Gly Gly Val
85 90 95
Ala Asp Ala Ala Ala Ala Tyr Lys Ala Ala Lys Ala Gly Ala Gly Leu
100 105 110
Gly Gly Val Pro Gly Val Gly Gly Leu Gly Val Ser Ala Gly Ala Val
115 120 125
Val Pro Gln Pro Gly Ala Gly Val Lys Pro Gly Lys Val Pro Gly Val
130 135 140
Gly Leu Pro Gly Val Tyr Pro Gly Gly Val Leu Pro Gly Ala Arg Phe
145 150 155 160
Pro Gly Val Gly Val Leu Pro Gly Val Pro Thr Gly Ala Gly Val Lys
165 170 175
Pro Lys Ala Pro Gly Val Gly Gly Ala Phe Ala Gly Ile Pro Gly Val
180 185 190
Gly Pro Phe Gly Gly Pro Gln Pro Gly Val Pro Leu Gly Tyr Pro Ile
195 200 205
Lys Ala Pro Lys Leu Pro Gly Gly Tyr Gly Leu Pro Tyr Thr Thr Gly
210 215 220
Lys Leu Pro Tyr Gly Tyr Gly Pro Gly Gly Val Ala Gly Ala Ala Gly
225 230 235 240
Lys Ala Gly Tyr Pro Thr Gly Thr Gly Val Gly Pro Gln Ala Ala Ala
245 250 255
Ala Ala Ala Ala Lys Ala Ala Ala Lys Phe Gly Ala Gly Ala Ala Gly
260 265 270
Val Leu Pro Gly Val Gly Gly Ala Gly Val Pro Gly Val Pro Gly Ala
275 280 285
Ile Pro Gly Ile Gly Gly Ile Ala Gly Val Gly Thr Pro Ala Ala Ala
290 295 300
Ala Ala Ala Ala Ala Ala Ala Lys Ala Ala Lys Tyr Gly Ala Ala Ala
305 310 315 320
Gly Leu Val Pro Gly Gly Pro Gly Phe Gly Pro Gly Val Val Gly Val
325 330 335
Pro Gly Ala Gly Val Pro Gly Val Gly Val Pro Gly Ala Gly Ile Pro
340 345 350
Val Val Pro Gly Ala Gly Ile Pro Gly Ala Ala Val Pro Gly Val Val
355 360 365
Ser Pro Glu Ala Ala Ala Lys Ala Ala Ala Lys Ala Ala Lys Tyr Gly
370 375 380
Ala Arg Pro Gly Val Gly Val Gly Gly Ile Pro Thr Tyr Gly Val Gly
385 390 395 400
Ala Gly Gly Phe Pro Gly Phe Gly Val Gly Val Gly Gly Ile Pro Gly
405 410 415
Val Ala Gly Val Pro Gly Val Gly Gly Val Pro Gly Val Gly Gly Val
420 425 430
Pro Gly Val Gly Ile Ser Pro Glu Ala Gln Ala Ala Ala Ala Ala Lys
435 440 445
Ala Ala Lys Tyr Gly Ala Ala Gly Ala Gly Val Leu Gly Gly Leu Val
450 455 460
Pro Gly Ala Pro Gly Ala Val Pro Gly Val Pro Gly Thr Gly Gly Val
465 470 475 480
Pro Gly Val Gly Thr Pro Ala Ala Ala Ala Ala Lys Ala Ala Ala Lys
485 490 495
Ala Ala Gln Phe Gly Leu Val Pro Gly Val Gly Val Ala Pro Gly Val
500 505 510
Gly Val Ala Pro Gly Val Gly Val Ala Pro Gly Val Gly Leu Ala Pro
515 520 525
Gly Val Gly Val Ala Pro Gly Val Gly Val Ala Pro Gly Val Gly Val
530 535 540
Ala Pro Gly Ile Gly Pro Gly Gly Val Ala Ala Ala Ala Lys Ser Ala
545 550 555 560
Ala Lys Val Ala Ala Lys Ala Gln Leu Arg Ala Ala Ala Gly Leu Gly
565 570 575
Ala Gly Ile Pro Gly Leu Gly Val Gly Val Gly Val Pro Gly Leu Gly
580 585 590
Val Gly Ala Gly Val Pro Gly Leu Gly Val Gly Ala Gly Val Pro Gly
595 600 605
Phe Gly Ala Gly Ala Asp Glu Gly Val Arg Arg Ser Leu Ser Pro Glu
610 615 620
Leu Arg Glu Gly Asp Pro Ser Ser Ser Gln His Leu Pro Ser Thr Pro
625 630 635 640
Ser Ser Pro Arg Val Pro Gly Ala Leu Ala Ala Ala Lys Ala Ala Lys
645 650 655
Tyr Gly Ala Ala Val Pro Gly Val Leu Gly Gly Leu Gly Ala Leu Gly
660 665 670
Gly Val Gly Ile Pro Gly Gly Val Val Gly Ala Gly Pro Ala Ala Ala
675 680 685
Ala Ala Ala Ala Lys Ala Ala Ala Lys Ala Ala Gln Phe Gly Leu Val
690 695 700
Gly Ala Ala Gly Leu Gly Gly Leu Gly Val Gly Gly Leu Gly Val Pro
705 710 715 720
Gly Val Gly Gly Leu Gly Gly Ile Pro Pro Ala Ala Ala Ala Lys Ala
725 730 735
Ala Lys Tyr Gly Ala Ala Gly Leu Gly Gly Val Leu Gly Gly Ala Gly
740 745 750
Gln Phe Pro Leu Gly Gly Val Ala Ala Arg Pro Gly Phe Gly Leu Ser
755 760 765
Pro Ile Phe Pro Gly Gly Ala Cys Leu Gly Lys Ala Cys Gly Arg Lys
770 775 780
Arg Lys
785
<210> 92
<211> 417
<212> ПРТ
<213> Homo sapiens
<400> 92
Met Arg Phe Ala Trp Thr Val Leu Leu Leu Gly Pro Leu Gln Leu Cys
1 5 10 15
Ala Leu Val His Cys Ala Pro Pro Ala Ala Gly Gln Gln Gln Pro Pro
20 25 30
Arg Glu Pro Pro Ala Ala Pro Gly Ala Trp Arg Gln Gln Ile Gln Trp
35 40 45
Glu Asn Asn Gly Gln Val Phe Ser Leu Leu Ser Leu Gly Ser Gln Tyr
50 55 60
Gln Pro Gln Arg Arg Arg Asp Pro Gly Ala Ala Val Pro Gly Ala Ala
65 70 75 80
Asn Ala Ser Ala Gln Gln Pro Arg Thr Pro Ile Leu Leu Ile Arg Asp
85 90 95
Asn Arg Thr Ala Ala Ala Arg Thr Arg Thr Ala Gly Ser Ser Gly Val
100 105 110
Thr Ala Gly Arg Pro Arg Pro Thr Ala Arg His Trp Phe Gln Ala Gly
115 120 125
Tyr Ser Thr Ser Arg Ala Arg Glu Ala Gly Ala Ser Arg Ala Glu Asn
130 135 140
Gln Thr Ala Pro Gly Glu Val Pro Ala Leu Ser Asn Leu Arg Pro Pro
145 150 155 160
Ser Arg Val Asp Gly Met Val Gly Asp Asp Pro Tyr Asn Pro Tyr Lys
165 170 175
Tyr Ser Asp Asp Asn Pro Tyr Tyr Asn Tyr Tyr Asp Thr Tyr Glu Arg
180 185 190
Pro Arg Pro Gly Gly Arg Tyr Arg Pro Gly Tyr Gly Thr Gly Tyr Phe
195 200 205
Gln Tyr Gly Leu Pro Asp Leu Val Ala Asp Pro Tyr Tyr Ile Gln Ala
210 215 220
Ser Thr Tyr Val Gln Lys Met Ser Met Tyr Asn Leu Arg Cys Ala Ala
225 230 235 240
Glu Glu Asn Cys Leu Ala Ser Thr Ala Tyr Arg Ala Asp Val Arg Asp
245 250 255
Tyr Asp His Arg Val Leu Leu Arg Phe Pro Gln Arg Val Lys Asn Gln
260 265 270
Gly Thr Ser Asp Phe Leu Pro Ser Arg Pro Arg Tyr Ser Trp Glu Trp
275 280 285
His Ser Cys His Gln His Tyr His Ser Met Asp Glu Phe Ser His Tyr
290 295 300
Asp Leu Leu Asp Ala Asn Thr Gln Arg Arg Val Ala Glu Gly His Lys
305 310 315 320
Ala Ser Phe Cys Leu Glu Asp Thr Ser Cys Asp Tyr Gly Tyr His Arg
325 330 335
Arg Phe Ala Cys Thr Ala His Thr Gln Gly Leu Ser Pro Gly Cys Tyr
340 345 350
Asp Thr Tyr Gly Ala Asp Ile Asp Cys Gln Trp Ile Asp Ile Thr Asp
355 360 365
Val Lys Pro Gly Asn Tyr Ile Leu Lys Val Ser Val Asn Pro Ser Tyr
370 375 380
Leu Val Pro Glu Ser Asp Tyr Thr Asn Asn Val Val Arg Cys Asp Ile
385 390 395 400
Arg Tyr Thr Gly His His Ala Tyr Ala Ser Gly Cys Thr Ile Ser Pro
405 410 415
Tyr
<210> 93
<211> 187
<212> ПРТ
<213> Homo sapiens
<400> 93
Met Ser Met Tyr Asn Leu Arg Cys Ala Ala Glu Glu Asn Cys Leu Ala
1 5 10 15
Ser Thr Ala Tyr Arg Ala Asp Val Arg Asp Tyr Asp His Arg Val Leu
20 25 30
Leu Arg Phe Pro Gln Arg Val Lys Asn Gln Gly Thr Ser Asp Phe Leu
35 40 45
Pro Ser Arg Pro Arg Tyr Ser Trp Glu Trp His Ser Cys His Gln His
50 55 60
Tyr His Ser Met Asp Glu Phe Ser His Tyr Asp Leu Leu Asp Ala Asn
65 70 75 80
Thr Gln Arg Arg Val Ala Glu Gly His Lys Ala Ser Phe Cys Leu Glu
85 90 95
Asp Thr Ser Cys Asp Tyr Gly Tyr His Arg Arg Phe Ala Cys Thr Ala
100 105 110
His Thr Gln Gly Leu Ser Pro Gly Cys Tyr Asp Thr Tyr Gly Ala Asp
115 120 125
Ile Asp Cys Gln Trp Ile Asp Ile Thr Asp Val Lys Pro Gly Asn Tyr
130 135 140
Ile Leu Lys Val Ser Val Asn Pro Ser Tyr Leu Val Pro Glu Ser Asp
145 150 155 160
Tyr Thr Asn Asn Val Val Arg Cys Asp Ile Arg Tyr Thr Gly His His
165 170 175
Ala Tyr Ala Ser Gly Cys Thr Ile Ser Pro Tyr
180 185
<210> 94
<211> 1132
<212> ПРТ
<213> Homo sapiens
<400> 94
Met Pro Arg Ala Pro Arg Cys Arg Ala Val Arg Ser Leu Leu Arg Ser
1 5 10 15
His Tyr Arg Glu Val Leu Pro Leu Ala Thr Phe Val Arg Arg Leu Gly
20 25 30
Pro Gln Gly Trp Arg Leu Val Gln Arg Gly Asp Pro Ala Ala Phe Arg
35 40 45
Ala Leu Val Ala Gln Cys Leu Val Cys Val Pro Trp Asp Ala Arg Pro
50 55 60
Pro Pro Ala Ala Pro Ser Phe Arg Gln Val Ser Cys Leu Lys Glu Leu
65 70 75 80
Val Ala Arg Val Leu Gln Arg Leu Cys Glu Arg Gly Ala Lys Asn Val
85 90 95
Leu Ala Phe Gly Phe Ala Leu Leu Asp Gly Ala Arg Gly Gly Pro Pro
100 105 110
Glu Ala Phe Thr Thr Ser Val Arg Ser Tyr Leu Pro Asn Thr Val Thr
115 120 125
Asp Ala Leu Arg Gly Ser Gly Ala Trp Gly Leu Leu Leu Arg Arg Val
130 135 140
Gly Asp Asp Val Leu Val His Leu Leu Ala Arg Cys Ala Leu Phe Val
145 150 155 160
Leu Val Ala Pro Ser Cys Ala Tyr Gln Val Cys Gly Pro Pro Leu Tyr
165 170 175
Gln Leu Gly Ala Ala Thr Gln Ala Arg Pro Pro Pro His Ala Ser Gly
180 185 190
Pro Arg Arg Arg Leu Gly Cys Glu Arg Ala Trp Asn His Ser Val Arg
195 200 205
Glu Ala Gly Val Pro Leu Gly Leu Pro Ala Pro Gly Ala Arg Arg Arg
210 215 220
Gly Gly Ser Ala Ser Arg Ser Leu Pro Leu Pro Lys Arg Pro Arg Arg
225 230 235 240
Gly Ala Ala Pro Glu Pro Glu Arg Thr Pro Val Gly Gln Gly Ser Trp
245 250 255
Ala His Pro Gly Arg Thr Arg Gly Pro Ser Asp Arg Gly Phe Cys Val
260 265 270
Val Ser Pro Ala Arg Pro Ala Glu Glu Ala Thr Ser Leu Glu Gly Ala
275 280 285
Leu Ser Gly Thr Arg His Ser His Pro Ser Val Gly Arg Gln His His
290 295 300
Ala Gly Pro Pro Ser Thr Ser Arg Pro Pro Arg Pro Trp Asp Thr Pro
305 310 315 320
Cys Pro Pro Val Tyr Ala Glu Thr Lys His Phe Leu Tyr Ser Ser Gly
325 330 335
Asp Lys Glu Gln Leu Arg Pro Ser Phe Leu Leu Ser Ser Leu Arg Pro
340 345 350
Ser Leu Thr Gly Ala Arg Arg Leu Val Glu Thr Ile Phe Leu Gly Ser
355 360 365
Arg Pro Trp Met Pro Gly Thr Pro Arg Arg Leu Pro Arg Leu Pro Gln
370 375 380
Arg Tyr Trp Gln Met Arg Pro Leu Phe Leu Glu Leu Leu Gly Asn His
385 390 395 400
Ala Gln Cys Pro Tyr Gly Val Leu Leu Lys Thr His Cys Pro Leu Arg
405 410 415
Ala Ala Val Thr Pro Ala Ala Gly Val Cys Ala Arg Glu Lys Pro Gln
420 425 430
Gly Ser Val Ala Ala Pro Glu Glu Glu Asp Thr Asp Pro Arg Arg Leu
435 440 445
Val Gln Leu Leu Arg Gln His Ser Ser Pro Trp Gln Val Tyr Gly Phe
450 455 460
Val Arg Ala Cys Leu Arg Arg Leu Val Pro Pro Gly Leu Trp Gly Ser
465 470 475 480
Arg His Asn Glu Arg Arg Phe Leu Arg Asn Thr Lys Lys Phe Ile Ser
485 490 495
Leu Gly Lys His Ala Lys Leu Ser Leu Gln Glu Leu Thr Trp Lys Met
500 505 510
Ser Val Arg Asp Cys Ala Trp Leu Arg Arg Ser Pro Gly Val Gly Cys
515 520 525
Val Pro Ala Ala Glu His Arg Leu Arg Glu Glu Ile Leu Ala Lys Phe
530 535 540
Leu His Trp Leu Met Ser Val Tyr Val Val Glu Leu Leu Arg Ser Phe
545 550 555 560
Phe Tyr Val Thr Glu Thr Thr Phe Gln Lys Asn Arg Leu Phe Phe Tyr
565 570 575
Arg Lys Ser Val Trp Ser Lys Leu Gln Ser Ile Gly Ile Arg Gln His
580 585 590
Leu Lys Arg Val Gln Leu Arg Glu Leu Ser Glu Ala Glu Val Arg Gln
595 600 605
His Arg Glu Ala Arg Pro Ala Leu Leu Thr Ser Arg Leu Arg Phe Ile
610 615 620
Pro Lys Pro Asp Gly Leu Arg Pro Ile Val Asn Met Asp Tyr Val Val
625 630 635 640
Gly Ala Arg Thr Phe Arg Arg Glu Lys Arg Ala Glu Arg Leu Thr Ser
645 650 655
Arg Val Lys Ala Leu Phe Ser Val Leu Asn Tyr Glu Arg Ala Arg Arg
660 665 670
Pro Gly Leu Leu Gly Ala Ser Val Leu Gly Leu Asp Asp Ile His Arg
675 680 685
Ala Trp Arg Thr Phe Val Leu Arg Val Arg Ala Gln Asp Pro Pro Pro
690 695 700
Glu Leu Tyr Phe Val Lys Val Asp Val Thr Gly Ala Tyr Asp Thr Ile
705 710 715 720
Pro Gln Asp Arg Leu Thr Glu Val Ile Ala Ser Ile Ile Lys Pro Gln
725 730 735
Asn Thr Tyr Cys Val Arg Arg Tyr Ala Val Val Gln Lys Ala Ala His
740 745 750
Gly His Val Arg Lys Ala Phe Lys Ser His Val Ser Thr Leu Thr Asp
755 760 765
Leu Gln Pro Tyr Met Arg Gln Phe Val Ala His Leu Gln Glu Thr Ser
770 775 780
Pro Leu Arg Asp Ala Val Val Ile Glu Gln Ser Ser Ser Leu Asn Glu
785 790 795 800
Ala Ser Ser Gly Leu Phe Asp Val Phe Leu Arg Phe Met Cys His His
805 810 815
Ala Val Arg Ile Arg Gly Lys Ser Tyr Val Gln Cys Gln Gly Ile Pro
820 825 830
Gln Gly Ser Ile Leu Ser Thr Leu Leu Cys Ser Leu Cys Tyr Gly Asp
835 840 845
Met Glu Asn Lys Leu Phe Ala Gly Ile Arg Arg Asp Gly Leu Leu Leu
850 855 860
Arg Leu Val Asp Asp Phe Leu Leu Val Thr Pro His Leu Thr His Ala
865 870 875 880
Lys Thr Phe Leu Arg Thr Leu Val Arg Gly Val Pro Glu Tyr Gly Cys
885 890 895
Val Val Asn Leu Arg Lys Thr Val Val Asn Phe Pro Val Glu Asp Glu
900 905 910
Ala Leu Gly Gly Thr Ala Phe Val Gln Met Pro Ala His Gly Leu Phe
915 920 925
Pro Trp Cys Gly Leu Leu Leu Asp Thr Arg Thr Leu Glu Val Gln Ser
930 935 940
Asp Tyr Ser Ser Tyr Ala Arg Thr Ser Ile Arg Ala Ser Leu Thr Phe
945 950 955 960
Asn Arg Gly Phe Lys Ala Gly Arg Asn Met Arg Arg Lys Leu Phe Gly
965 970 975
Val Leu Arg Leu Lys Cys His Ser Leu Phe Leu Asp Leu Gln Val Asn
980 985 990
Ser Leu Gln Thr Val Cys Thr Asn Ile Tyr Lys Ile Leu Leu Leu Gln
995 1000 1005
Ala Tyr Arg Phe His Ala Cys Val Leu Gln Leu Pro Phe His Gln
1010 1015 1020
Gln Val Trp Lys Asn Pro Thr Phe Phe Leu Arg Val Ile Ser Asp
1025 1030 1035
Thr Ala Ser Leu Cys Tyr Ser Ile Leu Lys Ala Lys Asn Ala Gly
1040 1045 1050
Met Ser Leu Gly Ala Lys Gly Ala Ala Gly Pro Leu Pro Ser Glu
1055 1060 1065
Ala Val Gln Trp Leu Cys His Gln Ala Phe Leu Leu Lys Leu Thr
1070 1075 1080
Arg His Arg Val Thr Tyr Val Pro Leu Leu Gly Ser Leu Arg Thr
1085 1090 1095
Ala Gln Thr Gln Leu Ser Arg Lys Leu Pro Gly Thr Thr Leu Thr
1100 1105 1110
Ala Leu Glu Ala Ala Ala Asn Pro Ala Leu Pro Ser Asp Phe Lys
1115 1120 1125
Thr Ile Leu Asp
1130
<210> 95
<211> 1069
<212> ПРТ
<213> Homo sapiens
<400> 95
Met Pro Arg Ala Pro Arg Cys Arg Ala Val Arg Ser Leu Leu Arg Ser
1 5 10 15
His Tyr Arg Glu Val Leu Pro Leu Ala Thr Phe Val Arg Arg Leu Gly
20 25 30
Pro Gln Gly Trp Arg Leu Val Gln Arg Gly Asp Pro Ala Ala Phe Arg
35 40 45
Ala Leu Val Ala Gln Cys Leu Val Cys Val Pro Trp Asp Ala Arg Pro
50 55 60
Pro Pro Ala Ala Pro Ser Phe Arg Gln Val Ser Cys Leu Lys Glu Leu
65 70 75 80
Val Ala Arg Val Leu Gln Arg Leu Cys Glu Arg Gly Ala Lys Asn Val
85 90 95
Leu Ala Phe Gly Phe Ala Leu Leu Asp Gly Ala Arg Gly Gly Pro Pro
100 105 110
Glu Ala Phe Thr Thr Ser Val Arg Ser Tyr Leu Pro Asn Thr Val Thr
115 120 125
Asp Ala Leu Arg Gly Ser Gly Ala Trp Gly Leu Leu Leu Arg Arg Val
130 135 140
Gly Asp Asp Val Leu Val His Leu Leu Ala Arg Cys Ala Leu Phe Val
145 150 155 160
Leu Val Ala Pro Ser Cys Ala Tyr Gln Val Cys Gly Pro Pro Leu Tyr
165 170 175
Gln Leu Gly Ala Ala Thr Gln Ala Arg Pro Pro Pro His Ala Ser Gly
180 185 190
Pro Arg Arg Arg Leu Gly Cys Glu Arg Ala Trp Asn His Ser Val Arg
195 200 205
Glu Ala Gly Val Pro Leu Gly Leu Pro Ala Pro Gly Ala Arg Arg Arg
210 215 220
Gly Gly Ser Ala Ser Arg Ser Leu Pro Leu Pro Lys Arg Pro Arg Arg
225 230 235 240
Gly Ala Ala Pro Glu Pro Glu Arg Thr Pro Val Gly Gln Gly Ser Trp
245 250 255
Ala His Pro Gly Arg Thr Arg Gly Pro Ser Asp Arg Gly Phe Cys Val
260 265 270
Val Ser Pro Ala Arg Pro Ala Glu Glu Ala Thr Ser Leu Glu Gly Ala
275 280 285
Leu Ser Gly Thr Arg His Ser His Pro Ser Val Gly Arg Gln His His
290 295 300
Ala Gly Pro Pro Ser Thr Ser Arg Pro Pro Arg Pro Trp Asp Thr Pro
305 310 315 320
Cys Pro Pro Val Tyr Ala Glu Thr Lys His Phe Leu Tyr Ser Ser Gly
325 330 335
Asp Lys Glu Gln Leu Arg Pro Ser Phe Leu Leu Ser Ser Leu Arg Pro
340 345 350
Ser Leu Thr Gly Ala Arg Arg Leu Val Glu Thr Ile Phe Leu Gly Ser
355 360 365
Arg Pro Trp Met Pro Gly Thr Pro Arg Arg Leu Pro Arg Leu Pro Gln
370 375 380
Arg Tyr Trp Gln Met Arg Pro Leu Phe Leu Glu Leu Leu Gly Asn His
385 390 395 400
Ala Gln Cys Pro Tyr Gly Val Leu Leu Lys Thr His Cys Pro Leu Arg
405 410 415
Ala Ala Val Thr Pro Ala Ala Gly Val Cys Ala Arg Glu Lys Pro Gln
420 425 430
Gly Ser Val Ala Ala Pro Glu Glu Glu Asp Thr Asp Pro Arg Arg Leu
435 440 445
Val Gln Leu Leu Arg Gln His Ser Ser Pro Trp Gln Val Tyr Gly Phe
450 455 460
Val Arg Ala Cys Leu Arg Arg Leu Val Pro Pro Gly Leu Trp Gly Ser
465 470 475 480
Arg His Asn Glu Arg Arg Phe Leu Arg Asn Thr Lys Lys Phe Ile Ser
485 490 495
Leu Gly Lys His Ala Lys Leu Ser Leu Gln Glu Leu Thr Trp Lys Met
500 505 510
Ser Val Arg Asp Cys Ala Trp Leu Arg Arg Ser Pro Gly Val Gly Cys
515 520 525
Val Pro Ala Ala Glu His Arg Leu Arg Glu Glu Ile Leu Ala Lys Phe
530 535 540
Leu His Trp Leu Met Ser Val Tyr Val Val Glu Leu Leu Arg Ser Phe
545 550 555 560
Phe Tyr Val Thr Glu Thr Thr Phe Gln Lys Asn Arg Leu Phe Phe Tyr
565 570 575
Arg Lys Ser Val Trp Ser Lys Leu Gln Ser Ile Gly Ile Arg Gln His
580 585 590
Leu Lys Arg Val Gln Leu Arg Glu Leu Ser Glu Ala Glu Val Arg Gln
595 600 605
His Arg Glu Ala Arg Pro Ala Leu Leu Thr Ser Arg Leu Arg Phe Ile
610 615 620
Pro Lys Pro Asp Gly Leu Arg Pro Ile Val Asn Met Asp Tyr Val Val
625 630 635 640
Gly Ala Arg Thr Phe Arg Arg Glu Lys Arg Ala Glu Arg Leu Thr Ser
645 650 655
Arg Val Lys Ala Leu Phe Ser Val Leu Asn Tyr Glu Arg Ala Arg Arg
660 665 670
Pro Gly Leu Leu Gly Ala Ser Val Leu Gly Leu Asp Asp Ile His Arg
675 680 685
Ala Trp Arg Thr Phe Val Leu Arg Val Arg Ala Gln Asp Pro Pro Pro
690 695 700
Glu Leu Tyr Phe Val Lys Val Asp Val Thr Gly Ala Tyr Asp Thr Ile
705 710 715 720
Pro Gln Asp Arg Leu Thr Glu Val Ile Ala Ser Ile Ile Lys Pro Gln
725 730 735
Asn Thr Tyr Cys Val Arg Arg Tyr Ala Val Val Gln Lys Ala Ala His
740 745 750
Gly His Val Arg Lys Ala Phe Lys Ser His Val Ser Thr Leu Thr Asp
755 760 765
Leu Gln Pro Tyr Met Arg Gln Phe Val Ala His Leu Gln Glu Thr Ser
770 775 780
Pro Leu Arg Asp Ala Val Val Ile Glu Gln Ser Ser Ser Leu Asn Glu
785 790 795 800
Ala Ser Ser Gly Leu Phe Asp Val Phe Leu Arg Phe Met Cys His His
805 810 815
Ala Val Arg Ile Arg Gly Lys Ser Tyr Val Gln Cys Gln Gly Ile Pro
820 825 830
Gln Gly Ser Ile Leu Ser Thr Leu Leu Cys Ser Leu Cys Tyr Gly Asp
835 840 845
Met Glu Asn Lys Leu Phe Ala Gly Ile Arg Arg Asp Gly Leu Leu Leu
850 855 860
Arg Leu Val Asp Asp Phe Leu Leu Val Thr Pro His Leu Thr His Ala
865 870 875 880
Lys Thr Phe Leu Ser Tyr Ala Arg Thr Ser Ile Arg Ala Ser Leu Thr
885 890 895
Phe Asn Arg Gly Phe Lys Ala Gly Arg Asn Met Arg Arg Lys Leu Phe
900 905 910
Gly Val Leu Arg Leu Lys Cys His Ser Leu Phe Leu Asp Leu Gln Val
915 920 925
Asn Ser Leu Gln Thr Val Cys Thr Asn Ile Tyr Lys Ile Leu Leu Leu
930 935 940
Gln Ala Tyr Arg Phe His Ala Cys Val Leu Gln Leu Pro Phe His Gln
945 950 955 960
Gln Val Trp Lys Asn Pro Thr Phe Phe Leu Arg Val Ile Ser Asp Thr
965 970 975
Ala Ser Leu Cys Tyr Ser Ile Leu Lys Ala Lys Asn Ala Gly Met Ser
980 985 990
Leu Gly Ala Lys Gly Ala Ala Gly Pro Leu Pro Ser Glu Ala Val Gln
995 1000 1005
Trp Leu Cys His Gln Ala Phe Leu Leu Lys Leu Thr Arg His Arg
1010 1015 1020
Val Thr Tyr Val Pro Leu Leu Gly Ser Leu Arg Thr Ala Gln Thr
1025 1030 1035
Gln Leu Ser Arg Lys Leu Pro Gly Thr Thr Leu Thr Ala Leu Glu
1040 1045 1050
Ala Ala Ala Asn Pro Ala Leu Pro Ser Asp Phe Lys Thr Ile Leu
1055 1060 1065
Asp
<210> 96
<211> 2477
<212> ПРТ
<213> Homo sapiens
<400> 96
Met Leu Arg Gly Pro Gly Pro Gly Leu Leu Leu Leu Ala Val Gln Cys
1 5 10 15
Leu Gly Thr Ala Val Pro Ser Thr Gly Ala Ser Lys Ser Lys Arg Gln
20 25 30
Ala Gln Gln Met Val Gln Pro Gln Ser Pro Val Ala Val Ser Gln Ser
35 40 45
Lys Pro Gly Cys Tyr Asp Asn Gly Lys His Tyr Gln Ile Asn Gln Gln
50 55 60
Trp Glu Arg Thr Tyr Leu Gly Asn Ala Leu Val Cys Thr Cys Tyr Gly
65 70 75 80
Gly Ser Arg Gly Phe Asn Cys Glu Ser Lys Pro Glu Ala Glu Glu Thr
85 90 95
Cys Phe Asp Lys Tyr Thr Gly Asn Thr Tyr Arg Val Gly Asp Thr Tyr
100 105 110
Glu Arg Pro Lys Asp Ser Met Ile Trp Asp Cys Thr Cys Ile Gly Ala
115 120 125
Gly Arg Gly Arg Ile Ser Cys Thr Ile Ala Asn Arg Cys His Glu Gly
130 135 140
Gly Gln Ser Tyr Lys Ile Gly Asp Thr Trp Arg Arg Pro His Glu Thr
145 150 155 160
Gly Gly Tyr Met Leu Glu Cys Val Cys Leu Gly Asn Gly Lys Gly Glu
165 170 175
Trp Thr Cys Lys Pro Ile Ala Glu Lys Cys Phe Asp His Ala Ala Gly
180 185 190
Thr Ser Tyr Val Val Gly Glu Thr Trp Glu Lys Pro Tyr Gln Gly Trp
195 200 205
Met Met Val Asp Cys Thr Cys Leu Gly Glu Gly Ser Gly Arg Ile Thr
210 215 220
Cys Thr Ser Arg Asn Arg Cys Asn Asp Gln Asp Thr Arg Thr Ser Tyr
225 230 235 240
Arg Ile Gly Asp Thr Trp Ser Lys Lys Asp Asn Arg Gly Asn Leu Leu
245 250 255
Gln Cys Ile Cys Thr Gly Asn Gly Arg Gly Glu Trp Lys Cys Glu Arg
260 265 270
His Thr Ser Val Gln Thr Thr Ser Ser Gly Ser Gly Pro Phe Thr Asp
275 280 285
Val Arg Ala Ala Val Tyr Gln Pro Gln Pro His Pro Gln Pro Pro Pro
290 295 300
Tyr Gly His Cys Val Thr Asp Ser Gly Val Val Tyr Ser Val Gly Met
305 310 315 320
Gln Trp Leu Lys Thr Gln Gly Asn Lys Gln Met Leu Cys Thr Cys Leu
325 330 335
Gly Asn Gly Val Ser Cys Gln Glu Thr Ala Val Thr Gln Thr Tyr Gly
340 345 350
Gly Asn Ser Asn Gly Glu Pro Cys Val Leu Pro Phe Thr Tyr Asn Gly
355 360 365
Arg Thr Phe Tyr Ser Cys Thr Thr Glu Gly Arg Gln Asp Gly His Leu
370 375 380
Trp Cys Ser Thr Thr Ser Asn Tyr Glu Gln Asp Gln Lys Tyr Ser Phe
385 390 395 400
Cys Thr Asp His Thr Val Leu Val Gln Thr Arg Gly Gly Asn Ser Asn
405 410 415
Gly Ala Leu Cys His Phe Pro Phe Leu Tyr Asn Asn His Asn Tyr Thr
420 425 430
Asp Cys Thr Ser Glu Gly Arg Arg Asp Asn Met Lys Trp Cys Gly Thr
435 440 445
Thr Gln Asn Tyr Asp Ala Asp Gln Lys Phe Gly Phe Cys Pro Met Ala
450 455 460
Ala His Glu Glu Ile Cys Thr Thr Asn Glu Gly Val Met Tyr Arg Ile
465 470 475 480
Gly Asp Gln Trp Asp Lys Gln His Asp Met Gly His Met Met Arg Cys
485 490 495
Thr Cys Val Gly Asn Gly Arg Gly Glu Trp Thr Cys Ile Ala Tyr Ser
500 505 510
Gln Leu Arg Asp Gln Cys Ile Val Asp Asp Ile Thr Tyr Asn Val Asn
515 520 525
Asp Thr Phe His Lys Arg His Glu Glu Gly His Met Leu Asn Cys Thr
530 535 540
Cys Phe Gly Gln Gly Arg Gly Arg Trp Lys Cys Asp Pro Val Asp Gln
545 550 555 560
Cys Gln Asp Ser Glu Thr Gly Thr Phe Tyr Gln Ile Gly Asp Ser Trp
565 570 575
Glu Lys Tyr Val His Gly Val Arg Tyr Gln Cys Tyr Cys Tyr Gly Arg
580 585 590
Gly Ile Gly Glu Trp His Cys Gln Pro Leu Gln Thr Tyr Pro Ser Ser
595 600 605
Ser Gly Pro Val Glu Val Phe Ile Thr Glu Thr Pro Ser Gln Pro Asn
610 615 620
Ser His Pro Ile Gln Trp Asn Ala Pro Gln Pro Ser His Ile Ser Lys
625 630 635 640
Tyr Ile Leu Arg Trp Arg Pro Lys Asn Ser Val Gly Arg Trp Lys Glu
645 650 655
Ala Thr Ile Pro Gly His Leu Asn Ser Tyr Thr Ile Lys Gly Leu Lys
660 665 670
Pro Gly Val Val Tyr Glu Gly Gln Leu Ile Ser Ile Gln Gln Tyr Gly
675 680 685
His Gln Glu Val Thr Arg Phe Asp Phe Thr Thr Thr Ser Thr Ser Thr
690 695 700
Pro Val Thr Ser Asn Thr Val Thr Gly Glu Thr Thr Pro Phe Ser Pro
705 710 715 720
Leu Val Ala Thr Ser Glu Ser Val Thr Glu Ile Thr Ala Ser Ser Phe
725 730 735
Val Val Ser Trp Val Ser Ala Ser Asp Thr Val Ser Gly Phe Arg Val
740 745 750
Glu Tyr Glu Leu Ser Glu Glu Gly Asp Glu Pro Gln Tyr Leu Asp Leu
755 760 765
Pro Ser Thr Ala Thr Ser Val Asn Ile Pro Asp Leu Leu Pro Gly Arg
770 775 780
Lys Tyr Ile Val Asn Val Tyr Gln Ile Ser Glu Asp Gly Glu Gln Ser
785 790 795 800
Leu Ile Leu Ser Thr Ser Gln Thr Thr Ala Pro Asp Ala Pro Pro Asp
805 810 815
Pro Thr Val Asp Gln Val Asp Asp Thr Ser Ile Val Val Arg Trp Ser
820 825 830
Arg Pro Gln Ala Pro Ile Thr Gly Tyr Arg Ile Val Tyr Ser Pro Ser
835 840 845
Val Glu Gly Ser Ser Thr Glu Leu Asn Leu Pro Glu Thr Ala Asn Ser
850 855 860
Val Thr Leu Ser Asp Leu Gln Pro Gly Val Gln Tyr Asn Ile Thr Ile
865 870 875 880
Tyr Ala Val Glu Glu Asn Gln Glu Ser Thr Pro Val Val Ile Gln Gln
885 890 895
Glu Thr Thr Gly Thr Pro Arg Ser Asp Thr Val Pro Ser Pro Arg Asp
900 905 910
Leu Gln Phe Val Glu Val Thr Asp Val Lys Val Thr Ile Met Trp Thr
915 920 925
Pro Pro Glu Ser Ala Val Thr Gly Tyr Arg Val Asp Val Ile Pro Val
930 935 940
Asn Leu Pro Gly Glu His Gly Gln Arg Leu Pro Ile Ser Arg Asn Thr
945 950 955 960
Phe Ala Glu Val Thr Gly Leu Ser Pro Gly Val Thr Tyr Tyr Phe Lys
965 970 975
Val Phe Ala Val Ser His Gly Arg Glu Ser Lys Pro Leu Thr Ala Gln
980 985 990
Gln Thr Thr Lys Leu Asp Ala Pro Thr Asn Leu Gln Phe Val Asn Glu
995 1000 1005
Thr Asp Ser Thr Val Leu Val Arg Trp Thr Pro Pro Arg Ala Gln
1010 1015 1020
Ile Thr Gly Tyr Arg Leu Thr Val Gly Leu Thr Arg Arg Gly Gln
1025 1030 1035
Pro Arg Gln Tyr Asn Val Gly Pro Ser Val Ser Lys Tyr Pro Leu
1040 1045 1050
Arg Asn Leu Gln Pro Ala Ser Glu Tyr Thr Val Ser Leu Val Ala
1055 1060 1065
Ile Lys Gly Asn Gln Glu Ser Pro Lys Ala Thr Gly Val Phe Thr
1070 1075 1080
Thr Leu Gln Pro Gly Ser Ser Ile Pro Pro Tyr Asn Thr Glu Val
1085 1090 1095
Thr Glu Thr Thr Ile Val Ile Thr Trp Thr Pro Ala Pro Arg Ile
1100 1105 1110
Gly Phe Lys Leu Gly Val Arg Pro Ser Gln Gly Gly Glu Ala Pro
1115 1120 1125
Arg Glu Val Thr Ser Asp Ser Gly Ser Ile Val Val Ser Gly Leu
1130 1135 1140
Thr Pro Gly Val Glu Tyr Val Tyr Thr Ile Gln Val Leu Arg Asp
1145 1150 1155
Gly Gln Glu Arg Asp Ala Pro Ile Val Asn Lys Val Val Thr Pro
1160 1165 1170
Leu Ser Pro Pro Thr Asn Leu His Leu Glu Ala Asn Pro Asp Thr
1175 1180 1185
Gly Val Leu Thr Val Ser Trp Glu Arg Ser Thr Thr Pro Asp Ile
1190 1195 1200
Thr Gly Tyr Arg Ile Thr Thr Thr Pro Thr Asn Gly Gln Gln Gly
1205 1210 1215
Asn Ser Leu Glu Glu Val Val His Ala Asp Gln Ser Ser Cys Thr
1220 1225 1230
Phe Asp Asn Leu Ser Pro Gly Leu Glu Tyr Asn Val Ser Val Tyr
1235 1240 1245
Thr Val Lys Asp Asp Lys Glu Ser Val Pro Ile Ser Asp Thr Ile
1250 1255 1260
Ile Pro Glu Val Pro Gln Leu Thr Asp Leu Ser Phe Val Asp Ile
1265 1270 1275
Thr Asp Ser Ser Ile Gly Leu Arg Trp Thr Pro Leu Asn Ser Ser
1280 1285 1290
Thr Ile Ile Gly Tyr Arg Ile Thr Val Val Ala Ala Gly Glu Gly
1295 1300 1305
Ile Pro Ile Phe Glu Asp Phe Val Asp Ser Ser Val Gly Tyr Tyr
1310 1315 1320
Thr Val Thr Gly Leu Glu Pro Gly Ile Asp Tyr Asp Ile Ser Val
1325 1330 1335
Ile Thr Leu Ile Asn Gly Gly Glu Ser Ala Pro Thr Thr Leu Thr
1340 1345 1350
Gln Gln Thr Ala Val Pro Pro Pro Thr Asp Leu Arg Phe Thr Asn
1355 1360 1365
Ile Gly Pro Asp Thr Met Arg Val Thr Trp Ala Pro Pro Pro Ser
1370 1375 1380
Ile Asp Leu Thr Asn Phe Leu Val Arg Tyr Ser Pro Val Lys Asn
1385 1390 1395
Glu Glu Asp Val Ala Glu Leu Ser Ile Ser Pro Ser Asp Asn Ala
1400 1405 1410
Val Val Leu Thr Asn Leu Leu Pro Gly Thr Glu Tyr Val Val Ser
1415 1420 1425
Val Ser Ser Val Tyr Glu Gln His Glu Ser Thr Pro Leu Arg Gly
1430 1435 1440
Arg Gln Lys Thr Gly Leu Asp Ser Pro Thr Gly Ile Asp Phe Ser
1445 1450 1455
Asp Ile Thr Ala Asn Ser Phe Thr Val His Trp Ile Ala Pro Arg
1460 1465 1470
Ala Thr Ile Thr Gly Tyr Arg Ile Arg His His Pro Glu His Phe
1475 1480 1485
Ser Gly Arg Pro Arg Glu Asp Arg Val Pro His Ser Arg Asn Ser
1490 1495 1500
Ile Thr Leu Thr Asn Leu Thr Pro Gly Thr Glu Tyr Val Val Ser
1505 1510 1515
Ile Val Ala Leu Asn Gly Arg Glu Glu Ser Pro Leu Leu Ile Gly
1520 1525 1530
Gln Gln Ser Thr Val Ser Asp Val Pro Arg Asp Leu Glu Val Val
1535 1540 1545
Ala Ala Thr Pro Thr Ser Leu Leu Ile Ser Trp Asp Ala Pro Ala
1550 1555 1560
Val Thr Val Arg Tyr Tyr Arg Ile Thr Tyr Gly Glu Thr Gly Gly
1565 1570 1575
Asn Ser Pro Val Gln Glu Phe Thr Val Pro Gly Ser Lys Ser Thr
1580 1585 1590
Ala Thr Ile Ser Gly Leu Lys Pro Gly Val Asp Tyr Thr Ile Thr
1595 1600 1605
Val Tyr Ala Val Thr Gly Arg Gly Asp Ser Pro Ala Ser Ser Lys
1610 1615 1620
Pro Ile Ser Ile Asn Tyr Arg Thr Glu Ile Asp Lys Pro Ser Gln
1625 1630 1635
Met Gln Val Thr Asp Val Gln Asp Asn Ser Ile Ser Val Lys Trp
1640 1645 1650
Leu Pro Ser Ser Ser Pro Val Thr Gly Tyr Arg Val Thr Thr Thr
1655 1660 1665
Pro Lys Asn Gly Pro Gly Pro Thr Lys Thr Lys Thr Ala Gly Pro
1670 1675 1680
Asp Gln Thr Glu Met Thr Ile Glu Gly Leu Gln Pro Thr Val Glu
1685 1690 1695
Tyr Val Val Ser Val Tyr Ala Gln Asn Pro Ser Gly Glu Ser Gln
1700 1705 1710
Pro Leu Val Gln Thr Ala Val Thr Asn Ile Asp Arg Pro Lys Gly
1715 1720 1725
Leu Ala Phe Thr Asp Val Asp Val Asp Ser Ile Lys Ile Ala Trp
1730 1735 1740
Glu Ser Pro Gln Gly Gln Val Ser Arg Tyr Arg Val Thr Tyr Ser
1745 1750 1755
Ser Pro Glu Asp Gly Ile His Glu Leu Phe Pro Ala Pro Asp Gly
1760 1765 1770
Glu Glu Asp Thr Ala Glu Leu Gln Gly Leu Arg Pro Gly Ser Glu
1775 1780 1785
Tyr Thr Val Ser Val Val Ala Leu His Asp Asp Met Glu Ser Gln
1790 1795 1800
Pro Leu Ile Gly Thr Gln Ser Thr Ala Ile Pro Ala Pro Thr Asp
1805 1810 1815
Leu Lys Phe Thr Gln Val Thr Pro Thr Ser Leu Ser Ala Gln Trp
1820 1825 1830
Thr Pro Pro Asn Val Gln Leu Thr Gly Tyr Arg Val Arg Val Thr
1835 1840 1845
Pro Lys Glu Lys Thr Gly Pro Met Lys Glu Ile Asn Leu Ala Pro
1850 1855 1860
Asp Ser Ser Ser Val Val Val Ser Gly Leu Met Val Ala Thr Lys
1865 1870 1875
Tyr Glu Val Ser Val Tyr Ala Leu Lys Asp Thr Leu Thr Ser Arg
1880 1885 1890
Pro Ala Gln Gly Val Val Thr Thr Leu Glu Asn Val Ser Pro Pro
1895 1900 1905
Arg Arg Ala Arg Val Thr Asp Ala Thr Glu Thr Thr Ile Thr Ile
1910 1915 1920
Ser Trp Arg Thr Lys Thr Glu Thr Ile Thr Gly Phe Gln Val Asp
1925 1930 1935
Ala Val Pro Ala Asn Gly Gln Thr Pro Ile Gln Arg Thr Ile Lys
1940 1945 1950
Pro Asp Val Arg Ser Tyr Thr Ile Thr Gly Leu Gln Pro Gly Thr
1955 1960 1965
Asp Tyr Lys Ile Tyr Leu Tyr Thr Leu Asn Asp Asn Ala Arg Ser
1970 1975 1980
Ser Pro Val Val Ile Asp Ala Ser Thr Ala Ile Asp Ala Pro Ser
1985 1990 1995
Asn Leu Arg Phe Leu Ala Thr Thr Pro Asn Ser Leu Leu Val Ser
2000 2005 2010
Trp Gln Pro Pro Arg Ala Arg Ile Thr Gly Tyr Ile Ile Lys Tyr
2015 2020 2025
Glu Lys Pro Gly Ser Pro Pro Arg Glu Val Val Pro Arg Pro Arg
2030 2035 2040
Pro Gly Val Thr Glu Ala Thr Ile Thr Gly Leu Glu Pro Gly Thr
2045 2050 2055
Glu Tyr Thr Ile Tyr Val Ile Ala Leu Lys Asn Asn Gln Lys Ser
2060 2065 2070
Glu Pro Leu Ile Gly Arg Lys Lys Thr Asp Glu Leu Pro Gln Leu
2075 2080 2085
Val Thr Leu Pro His Pro Asn Leu His Gly Pro Glu Ile Leu Asp
2090 2095 2100
Val Pro Ser Thr Val Gln Lys Thr Pro Phe Val Thr His Pro Gly
2105 2110 2115
Tyr Asp Thr Gly Asn Gly Ile Gln Leu Pro Gly Thr Ser Gly Gln
2120 2125 2130
Gln Pro Ser Val Gly Gln Gln Met Ile Phe Glu Glu His Gly Phe
2135 2140 2145
Arg Arg Thr Thr Pro Pro Thr Thr Ala Thr Pro Ile Arg His Arg
2150 2155 2160
Pro Arg Pro Tyr Pro Pro Asn Val Gly Glu Glu Ile Gln Ile Gly
2165 2170 2175
His Ile Pro Arg Glu Asp Val Asp Tyr His Leu Tyr Pro His Gly
2180 2185 2190
Pro Gly Leu Asn Pro Asn Ala Ser Thr Gly Gln Glu Ala Leu Ser
2195 2200 2205
Gln Thr Thr Ile Ser Trp Ala Pro Phe Gln Asp Thr Ser Glu Tyr
2210 2215 2220
Ile Ile Ser Cys His Pro Val Gly Thr Asp Glu Glu Pro Leu Gln
2225 2230 2235
Phe Arg Val Pro Gly Thr Ser Thr Ser Ala Thr Leu Thr Gly Leu
2240 2245 2250
Thr Arg Gly Ala Thr Tyr Asn Ile Ile Val Glu Ala Leu Lys Asp
2255 2260 2265
Gln Gln Arg His Lys Val Arg Glu Glu Val Val Thr Val Gly Asn
2270 2275 2280
Ser Val Asn Glu Gly Leu Asn Gln Pro Thr Asp Asp Ser Cys Phe
2285 2290 2295
Asp Pro Tyr Thr Val Ser His Tyr Ala Val Gly Asp Glu Trp Glu
2300 2305 2310
Arg Met Ser Glu Ser Gly Phe Lys Leu Leu Cys Gln Cys Leu Gly
2315 2320 2325
Phe Gly Ser Gly His Phe Arg Cys Asp Ser Ser Arg Trp Cys His
2330 2335 2340
Asp Asn Gly Val Asn Tyr Lys Ile Gly Glu Lys Trp Asp Arg Gln
2345 2350 2355
Gly Glu Asn Gly Gln Met Met Ser Cys Thr Cys Leu Gly Asn Gly
2360 2365 2370
Lys Gly Glu Phe Lys Cys Asp Pro His Glu Ala Thr Cys Tyr Asp
2375 2380 2385
Asp Gly Lys Thr Tyr His Val Gly Glu Gln Trp Gln Lys Glu Tyr
2390 2395 2400
Leu Gly Ala Ile Cys Ser Cys Thr Cys Phe Gly Gly Gln Arg Gly
2405 2410 2415
Trp Arg Cys Asp Asn Cys Arg Arg Pro Gly Gly Glu Pro Ser Pro
2420 2425 2430
Glu Gly Thr Thr Gly Gln Ser Tyr Asn Gln Tyr Ser Gln Arg Tyr
2435 2440 2445
His Gln Arg Thr Asn Thr Asn Val Asn Cys Pro Ile Glu Cys Phe
2450 2455 2460
Met Pro Leu Asp Val Gln Ala Asp Arg Glu Asp Ser Arg Glu
2465 2470 2475
<210> 97
<211> 2355
<212> ПРТ
<213> Homo sapiens
<400> 97
Met Leu Arg Gly Pro Gly Pro Gly Leu Leu Leu Leu Ala Val Gln Cys
1 5 10 15
Leu Gly Thr Ala Val Pro Ser Thr Gly Ala Ser Lys Ser Lys Arg Gln
20 25 30
Ala Gln Gln Met Val Gln Pro Gln Ser Pro Val Ala Val Ser Gln Ser
35 40 45
Lys Pro Gly Cys Tyr Asp Asn Gly Lys His Tyr Gln Ile Asn Gln Gln
50 55 60
Trp Glu Arg Thr Tyr Leu Gly Asn Ala Leu Val Cys Thr Cys Tyr Gly
65 70 75 80
Gly Ser Arg Gly Phe Asn Cys Glu Ser Lys Pro Glu Ala Glu Glu Thr
85 90 95
Cys Phe Asp Lys Tyr Thr Gly Asn Thr Tyr Arg Val Gly Asp Thr Tyr
100 105 110
Glu Arg Pro Lys Asp Ser Met Ile Trp Asp Cys Thr Cys Ile Gly Ala
115 120 125
Gly Arg Gly Arg Ile Ser Cys Thr Ile Ala Asn Arg Cys His Glu Gly
130 135 140
Gly Gln Ser Tyr Lys Ile Gly Asp Thr Trp Arg Arg Pro His Glu Thr
145 150 155 160
Gly Gly Tyr Met Leu Glu Cys Val Cys Leu Gly Asn Gly Lys Gly Glu
165 170 175
Trp Thr Cys Lys Pro Ile Ala Glu Lys Cys Phe Asp His Ala Ala Gly
180 185 190
Thr Ser Tyr Val Val Gly Glu Thr Trp Glu Lys Pro Tyr Gln Gly Trp
195 200 205
Met Met Val Asp Cys Thr Cys Leu Gly Glu Gly Ser Gly Arg Ile Thr
210 215 220
Cys Thr Ser Arg Asn Arg Cys Asn Asp Gln Asp Thr Arg Thr Ser Tyr
225 230 235 240
Arg Ile Gly Asp Thr Trp Ser Lys Lys Asp Asn Arg Gly Asn Leu Leu
245 250 255
Gln Cys Ile Cys Thr Gly Asn Gly Arg Gly Glu Trp Lys Cys Glu Arg
260 265 270
His Thr Ser Val Gln Thr Thr Ser Ser Gly Ser Gly Pro Phe Thr Asp
275 280 285
Val Arg Ala Ala Val Tyr Gln Pro Gln Pro His Pro Gln Pro Pro Pro
290 295 300
Tyr Gly His Cys Val Thr Asp Ser Gly Val Val Tyr Ser Val Gly Met
305 310 315 320
Gln Trp Leu Lys Thr Gln Gly Asn Lys Gln Met Leu Cys Thr Cys Leu
325 330 335
Gly Asn Gly Val Ser Cys Gln Glu Thr Ala Val Thr Gln Thr Tyr Gly
340 345 350
Gly Asn Ser Asn Gly Glu Pro Cys Val Leu Pro Phe Thr Tyr Asn Gly
355 360 365
Arg Thr Phe Tyr Ser Cys Thr Thr Glu Gly Arg Gln Asp Gly His Leu
370 375 380
Trp Cys Ser Thr Thr Ser Asn Tyr Glu Gln Asp Gln Lys Tyr Ser Phe
385 390 395 400
Cys Thr Asp His Thr Val Leu Val Gln Thr Arg Gly Gly Asn Ser Asn
405 410 415
Gly Ala Leu Cys His Phe Pro Phe Leu Tyr Asn Asn His Asn Tyr Thr
420 425 430
Asp Cys Thr Ser Glu Gly Arg Arg Asp Asn Met Lys Trp Cys Gly Thr
435 440 445
Thr Gln Asn Tyr Asp Ala Asp Gln Lys Phe Gly Phe Cys Pro Met Ala
450 455 460
Ala His Glu Glu Ile Cys Thr Thr Asn Glu Gly Val Met Tyr Arg Ile
465 470 475 480
Gly Asp Gln Trp Asp Lys Gln His Asp Met Gly His Met Met Arg Cys
485 490 495
Thr Cys Val Gly Asn Gly Arg Gly Glu Trp Thr Cys Ile Ala Tyr Ser
500 505 510
Gln Leu Arg Asp Gln Cys Ile Val Asp Asp Ile Thr Tyr Asn Val Asn
515 520 525
Asp Thr Phe His Lys Arg His Glu Glu Gly His Met Leu Asn Cys Thr
530 535 540
Cys Phe Gly Gln Gly Arg Gly Arg Trp Lys Cys Asp Pro Val Asp Gln
545 550 555 560
Cys Gln Asp Ser Glu Thr Gly Thr Phe Tyr Gln Ile Gly Asp Ser Trp
565 570 575
Glu Lys Tyr Val His Gly Val Arg Tyr Gln Cys Tyr Cys Tyr Gly Arg
580 585 590
Gly Ile Gly Glu Trp His Cys Gln Pro Leu Gln Thr Tyr Pro Ser Ser
595 600 605
Ser Gly Pro Val Glu Val Phe Ile Thr Glu Thr Pro Ser Gln Pro Asn
610 615 620
Ser His Pro Ile Gln Trp Asn Ala Pro Gln Pro Ser His Ile Ser Lys
625 630 635 640
Tyr Ile Leu Arg Trp Arg Pro Lys Asn Ser Val Gly Arg Trp Lys Glu
645 650 655
Ala Thr Ile Pro Gly His Leu Asn Ser Tyr Thr Ile Lys Gly Leu Lys
660 665 670
Pro Gly Val Val Tyr Glu Gly Gln Leu Ile Ser Ile Gln Gln Tyr Gly
675 680 685
His Gln Glu Val Thr Arg Phe Asp Phe Thr Thr Thr Ser Thr Ser Thr
690 695 700
Pro Val Thr Ser Asn Thr Val Thr Gly Glu Thr Thr Pro Phe Ser Pro
705 710 715 720
Leu Val Ala Thr Ser Glu Ser Val Thr Glu Ile Thr Ala Ser Ser Phe
725 730 735
Val Val Ser Trp Val Ser Ala Ser Asp Thr Val Ser Gly Phe Arg Val
740 745 750
Glu Tyr Glu Leu Ser Glu Glu Gly Asp Glu Pro Gln Tyr Leu Asp Leu
755 760 765
Pro Ser Thr Ala Thr Ser Val Asn Ile Pro Asp Leu Leu Pro Gly Arg
770 775 780
Lys Tyr Ile Val Asn Val Tyr Gln Ile Ser Glu Asp Gly Glu Gln Ser
785 790 795 800
Leu Ile Leu Ser Thr Ser Gln Thr Thr Ala Pro Asp Ala Pro Pro Asp
805 810 815
Pro Thr Val Asp Gln Val Asp Asp Thr Ser Ile Val Val Arg Trp Ser
820 825 830
Arg Pro Gln Ala Pro Ile Thr Gly Tyr Arg Ile Val Tyr Ser Pro Ser
835 840 845
Val Glu Gly Ser Ser Thr Glu Leu Asn Leu Pro Glu Thr Ala Asn Ser
850 855 860
Val Thr Leu Ser Asp Leu Gln Pro Gly Val Gln Tyr Asn Ile Thr Ile
865 870 875 880
Tyr Ala Val Glu Glu Asn Gln Glu Ser Thr Pro Val Val Ile Gln Gln
885 890 895
Glu Thr Thr Gly Thr Pro Arg Ser Asp Thr Val Pro Ser Pro Arg Asp
900 905 910
Leu Gln Phe Val Glu Val Thr Asp Val Lys Val Thr Ile Met Trp Thr
915 920 925
Pro Pro Glu Ser Ala Val Thr Gly Tyr Arg Val Asp Val Ile Pro Val
930 935 940
Asn Leu Pro Gly Glu His Gly Gln Arg Leu Pro Ile Ser Arg Asn Thr
945 950 955 960
Phe Ala Glu Val Thr Gly Leu Ser Pro Gly Val Thr Tyr Tyr Phe Lys
965 970 975
Val Phe Ala Val Ser His Gly Arg Glu Ser Lys Pro Leu Thr Ala Gln
980 985 990
Gln Thr Thr Lys Leu Asp Ala Pro Thr Asn Leu Gln Phe Val Asn Glu
995 1000 1005
Thr Asp Ser Thr Val Leu Val Arg Trp Thr Pro Pro Arg Ala Gln
1010 1015 1020
Ile Thr Gly Tyr Arg Leu Thr Val Gly Leu Thr Arg Arg Gly Gln
1025 1030 1035
Pro Arg Gln Tyr Asn Val Gly Pro Ser Val Ser Lys Tyr Pro Leu
1040 1045 1050
Arg Asn Leu Gln Pro Ala Ser Glu Tyr Thr Val Ser Leu Val Ala
1055 1060 1065
Ile Lys Gly Asn Gln Glu Ser Pro Lys Ala Thr Gly Val Phe Thr
1070 1075 1080
Thr Leu Gln Pro Gly Ser Ser Ile Pro Pro Tyr Asn Thr Glu Val
1085 1090 1095
Thr Glu Thr Thr Ile Val Ile Thr Trp Thr Pro Ala Pro Arg Ile
1100 1105 1110
Gly Phe Lys Leu Gly Val Arg Pro Ser Gln Gly Gly Glu Ala Pro
1115 1120 1125
Arg Glu Val Thr Ser Asp Ser Gly Ser Ile Val Val Ser Gly Leu
1130 1135 1140
Thr Pro Gly Val Glu Tyr Val Tyr Thr Ile Gln Val Leu Arg Asp
1145 1150 1155
Gly Gln Glu Arg Asp Ala Pro Ile Val Asn Lys Val Val Thr Pro
1160 1165 1170
Leu Ser Pro Pro Thr Asn Leu His Leu Glu Ala Asn Pro Asp Thr
1175 1180 1185
Gly Val Leu Thr Val Ser Trp Glu Arg Ser Thr Thr Pro Asp Ile
1190 1195 1200
Thr Gly Tyr Arg Ile Thr Thr Thr Pro Thr Asn Gly Gln Gln Gly
1205 1210 1215
Asn Ser Leu Glu Glu Val Val His Ala Asp Gln Ser Ser Cys Thr
1220 1225 1230
Phe Asp Asn Leu Ser Pro Gly Leu Glu Tyr Asn Val Ser Val Tyr
1235 1240 1245
Thr Val Lys Asp Asp Lys Glu Ser Val Pro Ile Ser Asp Thr Ile
1250 1255 1260
Ile Pro Ala Val Pro Pro Pro Thr Asp Leu Arg Phe Thr Asn Ile
1265 1270 1275
Gly Pro Asp Thr Met Arg Val Thr Trp Ala Pro Pro Pro Ser Ile
1280 1285 1290
Asp Leu Thr Asn Phe Leu Val Arg Tyr Ser Pro Val Lys Asn Glu
1295 1300 1305
Glu Asp Val Ala Glu Leu Ser Ile Ser Pro Ser Asp Asn Ala Val
1310 1315 1320
Val Leu Thr Asn Leu Leu Pro Gly Thr Glu Tyr Val Val Ser Val
1325 1330 1335
Ser Ser Val Tyr Glu Gln His Glu Ser Thr Pro Leu Arg Gly Arg
1340 1345 1350
Gln Lys Thr Gly Leu Asp Ser Pro Thr Gly Ile Asp Phe Ser Asp
1355 1360 1365
Ile Thr Ala Asn Ser Phe Thr Val His Trp Ile Ala Pro Arg Ala
1370 1375 1380
Thr Ile Thr Gly Tyr Arg Ile Arg His His Pro Glu His Phe Ser
1385 1390 1395
Gly Arg Pro Arg Glu Asp Arg Val Pro His Ser Arg Asn Ser Ile
1400 1405 1410
Thr Leu Thr Asn Leu Thr Pro Gly Thr Glu Tyr Val Val Ser Ile
1415 1420 1425
Val Ala Leu Asn Gly Arg Glu Glu Ser Pro Leu Leu Ile Gly Gln
1430 1435 1440
Gln Ser Thr Val Ser Asp Val Pro Arg Asp Leu Glu Val Val Ala
1445 1450 1455
Ala Thr Pro Thr Ser Leu Leu Ile Ser Trp Asp Ala Pro Ala Val
1460 1465 1470
Thr Val Arg Tyr Tyr Arg Ile Thr Tyr Gly Glu Thr Gly Gly Asn
1475 1480 1485
Ser Pro Val Gln Glu Phe Thr Val Pro Gly Ser Lys Ser Thr Ala
1490 1495 1500
Thr Ile Ser Gly Leu Lys Pro Gly Val Asp Tyr Thr Ile Thr Val
1505 1510 1515
Tyr Ala Val Thr Gly Arg Gly Asp Ser Pro Ala Ser Ser Lys Pro
1520 1525 1530
Ile Ser Ile Asn Tyr Arg Thr Glu Ile Asp Lys Pro Ser Gln Met
1535 1540 1545
Gln Val Thr Asp Val Gln Asp Asn Ser Ile Ser Val Lys Trp Leu
1550 1555 1560
Pro Ser Ser Ser Pro Val Thr Gly Tyr Arg Val Thr Thr Thr Pro
1565 1570 1575
Lys Asn Gly Pro Gly Pro Thr Lys Thr Lys Thr Ala Gly Pro Asp
1580 1585 1590
Gln Thr Glu Met Thr Ile Glu Gly Leu Gln Pro Thr Val Glu Tyr
1595 1600 1605
Val Val Ser Val Tyr Ala Gln Asn Pro Ser Gly Glu Ser Gln Pro
1610 1615 1620
Leu Val Gln Thr Ala Val Thr Asn Ile Asp Arg Pro Lys Gly Leu
1625 1630 1635
Ala Phe Thr Asp Val Asp Val Asp Ser Ile Lys Ile Ala Trp Glu
1640 1645 1650
Ser Pro Gln Gly Gln Val Ser Arg Tyr Arg Val Thr Tyr Ser Ser
1655 1660 1665
Pro Glu Asp Gly Ile His Glu Leu Phe Pro Ala Pro Asp Gly Glu
1670 1675 1680
Glu Asp Thr Ala Glu Leu Gln Gly Leu Arg Pro Gly Ser Glu Tyr
1685 1690 1695
Thr Val Ser Val Val Ala Leu His Asp Asp Met Glu Ser Gln Pro
1700 1705 1710
Leu Ile Gly Thr Gln Ser Thr Ala Ile Pro Ala Pro Thr Asp Leu
1715 1720 1725
Lys Phe Thr Gln Val Thr Pro Thr Ser Leu Ser Ala Gln Trp Thr
1730 1735 1740
Pro Pro Asn Val Gln Leu Thr Gly Tyr Arg Val Arg Val Thr Pro
1745 1750 1755
Lys Glu Lys Thr Gly Pro Met Lys Glu Ile Asn Leu Ala Pro Asp
1760 1765 1770
Ser Ser Ser Val Val Val Ser Gly Leu Met Val Ala Thr Lys Tyr
1775 1780 1785
Glu Val Ser Val Tyr Ala Leu Lys Asp Thr Leu Thr Ser Arg Pro
1790 1795 1800
Ala Gln Gly Val Val Thr Thr Leu Glu Asn Val Ser Pro Pro Arg
1805 1810 1815
Arg Ala Arg Val Thr Asp Ala Thr Glu Thr Thr Ile Thr Ile Ser
1820 1825 1830
Trp Arg Thr Lys Thr Glu Thr Ile Thr Gly Phe Gln Val Asp Ala
1835 1840 1845
Val Pro Ala Asn Gly Gln Thr Pro Ile Gln Arg Thr Ile Lys Pro
1850 1855 1860
Asp Val Arg Ser Tyr Thr Ile Thr Gly Leu Gln Pro Gly Thr Asp
1865 1870 1875
Tyr Lys Ile Tyr Leu Tyr Thr Leu Asn Asp Asn Ala Arg Ser Ser
1880 1885 1890
Pro Val Val Ile Asp Ala Ser Thr Ala Ile Asp Ala Pro Ser Asn
1895 1900 1905
Leu Arg Phe Leu Ala Thr Thr Pro Asn Ser Leu Leu Val Ser Trp
1910 1915 1920
Gln Pro Pro Arg Ala Arg Ile Thr Gly Tyr Ile Ile Lys Tyr Glu
1925 1930 1935
Lys Pro Gly Ser Pro Pro Arg Glu Val Val Pro Arg Pro Arg Pro
1940 1945 1950
Gly Val Thr Glu Ala Thr Ile Thr Gly Leu Glu Pro Gly Thr Glu
1955 1960 1965
Tyr Thr Ile Tyr Val Ile Ala Leu Lys Asn Asn Gln Lys Ser Glu
1970 1975 1980
Pro Leu Ile Gly Arg Lys Lys Thr Asp Glu Leu Pro Gln Leu Val
1985 1990 1995
Thr Leu Pro His Pro Asn Leu His Gly Pro Glu Ile Leu Asp Val
2000 2005 2010
Pro Ser Thr Val Gln Lys Thr Pro Phe Val Thr His Pro Gly Tyr
2015 2020 2025
Asp Thr Gly Asn Gly Ile Gln Leu Pro Gly Thr Ser Gly Gln Gln
2030 2035 2040
Pro Ser Val Gly Gln Gln Met Ile Phe Glu Glu His Gly Phe Arg
2045 2050 2055
Arg Thr Thr Pro Pro Thr Thr Ala Thr Pro Ile Arg His Arg Pro
2060 2065 2070
Arg Pro Tyr Pro Pro Asn Val Gly Gln Glu Ala Leu Ser Gln Thr
2075 2080 2085
Thr Ile Ser Trp Ala Pro Phe Gln Asp Thr Ser Glu Tyr Ile Ile
2090 2095 2100
Ser Cys His Pro Val Gly Thr Asp Glu Glu Pro Leu Gln Phe Arg
2105 2110 2115
Val Pro Gly Thr Ser Thr Ser Ala Thr Leu Thr Gly Leu Thr Arg
2120 2125 2130
Gly Ala Thr Tyr Asn Ile Ile Val Glu Ala Leu Lys Asp Gln Gln
2135 2140 2145
Arg His Lys Val Arg Glu Glu Val Val Thr Val Gly Asn Ser Val
2150 2155 2160
Asn Glu Gly Leu Asn Gln Pro Thr Asp Asp Ser Cys Phe Asp Pro
2165 2170 2175
Tyr Thr Val Ser His Tyr Ala Val Gly Asp Glu Trp Glu Arg Met
2180 2185 2190
Ser Glu Ser Gly Phe Lys Leu Leu Cys Gln Cys Leu Gly Phe Gly
2195 2200 2205
Ser Gly His Phe Arg Cys Asp Ser Ser Arg Trp Cys His Asp Asn
2210 2215 2220
Gly Val Asn Tyr Lys Ile Gly Glu Lys Trp Asp Arg Gln Gly Glu
2225 2230 2235
Asn Gly Gln Met Met Ser Cys Thr Cys Leu Gly Asn Gly Lys Gly
2240 2245 2250
Glu Phe Lys Cys Asp Pro His Glu Ala Thr Cys Tyr Asp Asp Gly
2255 2260 2265
Lys Thr Tyr His Val Gly Glu Gln Trp Gln Lys Glu Tyr Leu Gly
2270 2275 2280
Ala Ile Cys Ser Cys Thr Cys Phe Gly Gly Gln Arg Gly Trp Arg
2285 2290 2295
Cys Asp Asn Cys Arg Arg Pro Gly Gly Glu Pro Ser Pro Glu Gly
2300 2305 2310
Thr Thr Gly Gln Ser Tyr Asn Gln Tyr Ser Gln Arg Tyr His Gln
2315 2320 2325
Arg Thr Asn Thr Asn Val Asn Cys Pro Ile Glu Cys Phe Met Pro
2330 2335 2340
Leu Asp Val Gln Ala Asp Arg Glu Asp Ser Arg Glu
2345 2350 2355
<210> 98
<211> 2330
<212> ПРТ
<213> Homo sapiens
<400> 98
Met Leu Arg Gly Pro Gly Pro Gly Leu Leu Leu Leu Ala Val Gln Cys
1 5 10 15
Leu Gly Thr Ala Val Pro Ser Thr Gly Ala Ser Lys Ser Lys Arg Gln
20 25 30
Ala Gln Gln Met Val Gln Pro Gln Ser Pro Val Ala Val Ser Gln Ser
35 40 45
Lys Pro Gly Cys Tyr Asp Asn Gly Lys His Tyr Gln Ile Asn Gln Gln
50 55 60
Trp Glu Arg Thr Tyr Leu Gly Asn Ala Leu Val Cys Thr Cys Tyr Gly
65 70 75 80
Gly Ser Arg Gly Phe Asn Cys Glu Ser Lys Pro Glu Ala Glu Glu Thr
85 90 95
Cys Phe Asp Lys Tyr Thr Gly Asn Thr Tyr Arg Val Gly Asp Thr Tyr
100 105 110
Glu Arg Pro Lys Asp Ser Met Ile Trp Asp Cys Thr Cys Ile Gly Ala
115 120 125
Gly Arg Gly Arg Ile Ser Cys Thr Ile Ala Asn Arg Cys His Glu Gly
130 135 140
Gly Gln Ser Tyr Lys Ile Gly Asp Thr Trp Arg Arg Pro His Glu Thr
145 150 155 160
Gly Gly Tyr Met Leu Glu Cys Val Cys Leu Gly Asn Gly Lys Gly Glu
165 170 175
Trp Thr Cys Lys Pro Ile Ala Glu Lys Cys Phe Asp His Ala Ala Gly
180 185 190
Thr Ser Tyr Val Val Gly Glu Thr Trp Glu Lys Pro Tyr Gln Gly Trp
195 200 205
Met Met Val Asp Cys Thr Cys Leu Gly Glu Gly Ser Gly Arg Ile Thr
210 215 220
Cys Thr Ser Arg Asn Arg Cys Asn Asp Gln Asp Thr Arg Thr Ser Tyr
225 230 235 240
Arg Ile Gly Asp Thr Trp Ser Lys Lys Asp Asn Arg Gly Asn Leu Leu
245 250 255
Gln Cys Ile Cys Thr Gly Asn Gly Arg Gly Glu Trp Lys Cys Glu Arg
260 265 270
His Thr Ser Val Gln Thr Thr Ser Ser Gly Ser Gly Pro Phe Thr Asp
275 280 285
Val Arg Ala Ala Val Tyr Gln Pro Gln Pro His Pro Gln Pro Pro Pro
290 295 300
Tyr Gly His Cys Val Thr Asp Ser Gly Val Val Tyr Ser Val Gly Met
305 310 315 320
Gln Trp Leu Lys Thr Gln Gly Asn Lys Gln Met Leu Cys Thr Cys Leu
325 330 335
Gly Asn Gly Val Ser Cys Gln Glu Thr Ala Val Thr Gln Thr Tyr Gly
340 345 350
Gly Asn Ser Asn Gly Glu Pro Cys Val Leu Pro Phe Thr Tyr Asn Gly
355 360 365
Arg Thr Phe Tyr Ser Cys Thr Thr Glu Gly Arg Gln Asp Gly His Leu
370 375 380
Trp Cys Ser Thr Thr Ser Asn Tyr Glu Gln Asp Gln Lys Tyr Ser Phe
385 390 395 400
Cys Thr Asp His Thr Val Leu Val Gln Thr Arg Gly Gly Asn Ser Asn
405 410 415
Gly Ala Leu Cys His Phe Pro Phe Leu Tyr Asn Asn His Asn Tyr Thr
420 425 430
Asp Cys Thr Ser Glu Gly Arg Arg Asp Asn Met Lys Trp Cys Gly Thr
435 440 445
Thr Gln Asn Tyr Asp Ala Asp Gln Lys Phe Gly Phe Cys Pro Met Ala
450 455 460
Ala His Glu Glu Ile Cys Thr Thr Asn Glu Gly Val Met Tyr Arg Ile
465 470 475 480
Gly Asp Gln Trp Asp Lys Gln His Asp Met Gly His Met Met Arg Cys
485 490 495
Thr Cys Val Gly Asn Gly Arg Gly Glu Trp Thr Cys Ile Ala Tyr Ser
500 505 510
Gln Leu Arg Asp Gln Cys Ile Val Asp Asp Ile Thr Tyr Asn Val Asn
515 520 525
Asp Thr Phe His Lys Arg His Glu Glu Gly His Met Leu Asn Cys Thr
530 535 540
Cys Phe Gly Gln Gly Arg Gly Arg Trp Lys Cys Asp Pro Val Asp Gln
545 550 555 560
Cys Gln Asp Ser Glu Thr Gly Thr Phe Tyr Gln Ile Gly Asp Ser Trp
565 570 575
Glu Lys Tyr Val His Gly Val Arg Tyr Gln Cys Tyr Cys Tyr Gly Arg
580 585 590
Gly Ile Gly Glu Trp His Cys Gln Pro Leu Gln Thr Tyr Pro Ser Ser
595 600 605
Ser Gly Pro Val Glu Val Phe Ile Thr Glu Thr Pro Ser Gln Pro Asn
610 615 620
Ser His Pro Ile Gln Trp Asn Ala Pro Gln Pro Ser His Ile Ser Lys
625 630 635 640
Tyr Ile Leu Arg Trp Arg Pro Lys Asn Ser Val Gly Arg Trp Lys Glu
645 650 655
Ala Thr Ile Pro Gly His Leu Asn Ser Tyr Thr Ile Lys Gly Leu Lys
660 665 670
Pro Gly Val Val Tyr Glu Gly Gln Leu Ile Ser Ile Gln Gln Tyr Gly
675 680 685
His Gln Glu Val Thr Arg Phe Asp Phe Thr Thr Thr Ser Thr Ser Thr
690 695 700
Pro Val Thr Ser Asn Thr Val Thr Gly Glu Thr Thr Pro Phe Ser Pro
705 710 715 720
Leu Val Ala Thr Ser Glu Ser Val Thr Glu Ile Thr Ala Ser Ser Phe
725 730 735
Val Val Ser Trp Val Ser Ala Ser Asp Thr Val Ser Gly Phe Arg Val
740 745 750
Glu Tyr Glu Leu Ser Glu Glu Gly Asp Glu Pro Gln Tyr Leu Asp Leu
755 760 765
Pro Ser Thr Ala Thr Ser Val Asn Ile Pro Asp Leu Leu Pro Gly Arg
770 775 780
Lys Tyr Ile Val Asn Val Tyr Gln Ile Ser Glu Asp Gly Glu Gln Ser
785 790 795 800
Leu Ile Leu Ser Thr Ser Gln Thr Thr Ala Pro Asp Ala Pro Pro Asp
805 810 815
Pro Thr Val Asp Gln Val Asp Asp Thr Ser Ile Val Val Arg Trp Ser
820 825 830
Arg Pro Gln Ala Pro Ile Thr Gly Tyr Arg Ile Val Tyr Ser Pro Ser
835 840 845
Val Glu Gly Ser Ser Thr Glu Leu Asn Leu Pro Glu Thr Ala Asn Ser
850 855 860
Val Thr Leu Ser Asp Leu Gln Pro Gly Val Gln Tyr Asn Ile Thr Ile
865 870 875 880
Tyr Ala Val Glu Glu Asn Gln Glu Ser Thr Pro Val Val Ile Gln Gln
885 890 895
Glu Thr Thr Gly Thr Pro Arg Ser Asp Thr Val Pro Ser Pro Arg Asp
900 905 910
Leu Gln Phe Val Glu Val Thr Asp Val Lys Val Thr Ile Met Trp Thr
915 920 925
Pro Pro Glu Ser Ala Val Thr Gly Tyr Arg Val Asp Val Ile Pro Val
930 935 940
Asn Leu Pro Gly Glu His Gly Gln Arg Leu Pro Ile Ser Arg Asn Thr
945 950 955 960
Phe Ala Glu Val Thr Gly Leu Ser Pro Gly Val Thr Tyr Tyr Phe Lys
965 970 975
Val Phe Ala Val Ser His Gly Arg Glu Ser Lys Pro Leu Thr Ala Gln
980 985 990
Gln Thr Thr Lys Leu Asp Ala Pro Thr Asn Leu Gln Phe Val Asn Glu
995 1000 1005
Thr Asp Ser Thr Val Leu Val Arg Trp Thr Pro Pro Arg Ala Gln
1010 1015 1020
Ile Thr Gly Tyr Arg Leu Thr Val Gly Leu Thr Arg Arg Gly Gln
1025 1030 1035
Pro Arg Gln Tyr Asn Val Gly Pro Ser Val Ser Lys Tyr Pro Leu
1040 1045 1050
Arg Asn Leu Gln Pro Ala Ser Glu Tyr Thr Val Ser Leu Val Ala
1055 1060 1065
Ile Lys Gly Asn Gln Glu Ser Pro Lys Ala Thr Gly Val Phe Thr
1070 1075 1080
Thr Leu Gln Pro Gly Ser Ser Ile Pro Pro Tyr Asn Thr Glu Val
1085 1090 1095
Thr Glu Thr Thr Ile Val Ile Thr Trp Thr Pro Ala Pro Arg Ile
1100 1105 1110
Gly Phe Lys Leu Gly Val Arg Pro Ser Gln Gly Gly Glu Ala Pro
1115 1120 1125
Arg Glu Val Thr Ser Asp Ser Gly Ser Ile Val Val Ser Gly Leu
1130 1135 1140
Thr Pro Gly Val Glu Tyr Val Tyr Thr Ile Gln Val Leu Arg Asp
1145 1150 1155
Gly Gln Glu Arg Asp Ala Pro Ile Val Asn Lys Val Val Thr Pro
1160 1165 1170
Leu Ser Pro Pro Thr Asn Leu His Leu Glu Ala Asn Pro Asp Thr
1175 1180 1185
Gly Val Leu Thr Val Ser Trp Glu Arg Ser Thr Thr Pro Asp Ile
1190 1195 1200
Thr Gly Tyr Arg Ile Thr Thr Thr Pro Thr Asn Gly Gln Gln Gly
1205 1210 1215
Asn Ser Leu Glu Glu Val Val His Ala Asp Gln Ser Ser Cys Thr
1220 1225 1230
Phe Asp Asn Leu Ser Pro Gly Leu Glu Tyr Asn Val Ser Val Tyr
1235 1240 1245
Thr Val Lys Asp Asp Lys Glu Ser Val Pro Ile Ser Asp Thr Ile
1250 1255 1260
Ile Pro Ala Val Pro Pro Pro Thr Asp Leu Arg Phe Thr Asn Ile
1265 1270 1275
Gly Pro Asp Thr Met Arg Val Thr Trp Ala Pro Pro Pro Ser Ile
1280 1285 1290
Asp Leu Thr Asn Phe Leu Val Arg Tyr Ser Pro Val Lys Asn Glu
1295 1300 1305
Glu Asp Val Ala Glu Leu Ser Ile Ser Pro Ser Asp Asn Ala Val
1310 1315 1320
Val Leu Thr Asn Leu Leu Pro Gly Thr Glu Tyr Val Val Ser Val
1325 1330 1335
Ser Ser Val Tyr Glu Gln His Glu Ser Thr Pro Leu Arg Gly Arg
1340 1345 1350
Gln Lys Thr Gly Leu Asp Ser Pro Thr Gly Ile Asp Phe Ser Asp
1355 1360 1365
Ile Thr Ala Asn Ser Phe Thr Val His Trp Ile Ala Pro Arg Ala
1370 1375 1380
Thr Ile Thr Gly Tyr Arg Ile Arg His His Pro Glu His Phe Ser
1385 1390 1395
Gly Arg Pro Arg Glu Asp Arg Val Pro His Ser Arg Asn Ser Ile
1400 1405 1410
Thr Leu Thr Asn Leu Thr Pro Gly Thr Glu Tyr Val Val Ser Ile
1415 1420 1425
Val Ala Leu Asn Gly Arg Glu Glu Ser Pro Leu Leu Ile Gly Gln
1430 1435 1440
Gln Ser Thr Val Ser Asp Val Pro Arg Asp Leu Glu Val Val Ala
1445 1450 1455
Ala Thr Pro Thr Ser Leu Leu Ile Ser Trp Asp Ala Pro Ala Val
1460 1465 1470
Thr Val Arg Tyr Tyr Arg Ile Thr Tyr Gly Glu Thr Gly Gly Asn
1475 1480 1485
Ser Pro Val Gln Glu Phe Thr Val Pro Gly Ser Lys Ser Thr Ala
1490 1495 1500
Thr Ile Ser Gly Leu Lys Pro Gly Val Asp Tyr Thr Ile Thr Val
1505 1510 1515
Tyr Ala Val Thr Gly Arg Gly Asp Ser Pro Ala Ser Ser Lys Pro
1520 1525 1530
Ile Ser Ile Asn Tyr Arg Thr Glu Ile Asp Lys Pro Ser Gln Met
1535 1540 1545
Gln Val Thr Asp Val Gln Asp Asn Ser Ile Ser Val Lys Trp Leu
1550 1555 1560
Pro Ser Ser Ser Pro Val Thr Gly Tyr Arg Val Thr Thr Thr Pro
1565 1570 1575
Lys Asn Gly Pro Gly Pro Thr Lys Thr Lys Thr Ala Gly Pro Asp
1580 1585 1590
Gln Thr Glu Met Thr Ile Glu Gly Leu Gln Pro Thr Val Glu Tyr
1595 1600 1605
Val Val Ser Val Tyr Ala Gln Asn Pro Ser Gly Glu Ser Gln Pro
1610 1615 1620
Leu Val Gln Thr Ala Val Thr Asn Ile Asp Arg Pro Lys Gly Leu
1625 1630 1635
Ala Phe Thr Asp Val Asp Val Asp Ser Ile Lys Ile Ala Trp Glu
1640 1645 1650
Ser Pro Gln Gly Gln Val Ser Arg Tyr Arg Val Thr Tyr Ser Ser
1655 1660 1665
Pro Glu Asp Gly Ile His Glu Leu Phe Pro Ala Pro Asp Gly Glu
1670 1675 1680
Glu Asp Thr Ala Glu Leu Gln Gly Leu Arg Pro Gly Ser Glu Tyr
1685 1690 1695
Thr Val Ser Val Val Ala Leu His Asp Asp Met Glu Ser Gln Pro
1700 1705 1710
Leu Ile Gly Thr Gln Ser Thr Ala Ile Pro Ala Pro Thr Asp Leu
1715 1720 1725
Lys Phe Thr Gln Val Thr Pro Thr Ser Leu Ser Ala Gln Trp Thr
1730 1735 1740
Pro Pro Asn Val Gln Leu Thr Gly Tyr Arg Val Arg Val Thr Pro
1745 1750 1755
Lys Glu Lys Thr Gly Pro Met Lys Glu Ile Asn Leu Ala Pro Asp
1760 1765 1770
Ser Ser Ser Val Val Val Ser Gly Leu Met Val Ala Thr Lys Tyr
1775 1780 1785
Glu Val Ser Val Tyr Ala Leu Lys Asp Thr Leu Thr Ser Arg Pro
1790 1795 1800
Ala Gln Gly Val Val Thr Thr Leu Glu Asn Val Ser Pro Pro Arg
1805 1810 1815
Arg Ala Arg Val Thr Asp Ala Thr Glu Thr Thr Ile Thr Ile Ser
1820 1825 1830
Trp Arg Thr Lys Thr Glu Thr Ile Thr Gly Phe Gln Val Asp Ala
1835 1840 1845
Val Pro Ala Asn Gly Gln Thr Pro Ile Gln Arg Thr Ile Lys Pro
1850 1855 1860
Asp Val Arg Ser Tyr Thr Ile Thr Gly Leu Gln Pro Gly Thr Asp
1865 1870 1875
Tyr Lys Ile Tyr Leu Tyr Thr Leu Asn Asp Asn Ala Arg Ser Ser
1880 1885 1890
Pro Val Val Ile Asp Ala Ser Thr Ala Ile Asp Ala Pro Ser Asn
1895 1900 1905
Leu Arg Phe Leu Ala Thr Thr Pro Asn Ser Leu Leu Val Ser Trp
1910 1915 1920
Gln Pro Pro Arg Ala Arg Ile Thr Gly Tyr Ile Ile Lys Tyr Glu
1925 1930 1935
Lys Pro Gly Ser Pro Pro Arg Glu Val Val Pro Arg Pro Arg Pro
1940 1945 1950
Gly Val Thr Glu Ala Thr Ile Thr Gly Leu Glu Pro Gly Thr Glu
1955 1960 1965
Tyr Thr Ile Tyr Val Ile Ala Leu Lys Asn Asn Gln Lys Ser Glu
1970 1975 1980
Pro Leu Ile Gly Arg Lys Lys Thr Val Gln Lys Thr Pro Phe Val
1985 1990 1995
Thr His Pro Gly Tyr Asp Thr Gly Asn Gly Ile Gln Leu Pro Gly
2000 2005 2010
Thr Ser Gly Gln Gln Pro Ser Val Gly Gln Gln Met Ile Phe Glu
2015 2020 2025
Glu His Gly Phe Arg Arg Thr Thr Pro Pro Thr Thr Ala Thr Pro
2030 2035 2040
Ile Arg His Arg Pro Arg Pro Tyr Pro Pro Asn Val Gly Gln Glu
2045 2050 2055
Ala Leu Ser Gln Thr Thr Ile Ser Trp Ala Pro Phe Gln Asp Thr
2060 2065 2070
Ser Glu Tyr Ile Ile Ser Cys His Pro Val Gly Thr Asp Glu Glu
2075 2080 2085
Pro Leu Gln Phe Arg Val Pro Gly Thr Ser Thr Ser Ala Thr Leu
2090 2095 2100
Thr Gly Leu Thr Arg Gly Ala Thr Tyr Asn Ile Ile Val Glu Ala
2105 2110 2115
Leu Lys Asp Gln Gln Arg His Lys Val Arg Glu Glu Val Val Thr
2120 2125 2130
Val Gly Asn Ser Val Asn Glu Gly Leu Asn Gln Pro Thr Asp Asp
2135 2140 2145
Ser Cys Phe Asp Pro Tyr Thr Val Ser His Tyr Ala Val Gly Asp
2150 2155 2160
Glu Trp Glu Arg Met Ser Glu Ser Gly Phe Lys Leu Leu Cys Gln
2165 2170 2175
Cys Leu Gly Phe Gly Ser Gly His Phe Arg Cys Asp Ser Ser Arg
2180 2185 2190
Trp Cys His Asp Asn Gly Val Asn Tyr Lys Ile Gly Glu Lys Trp
2195 2200 2205
Asp Arg Gln Gly Glu Asn Gly Gln Met Met Ser Cys Thr Cys Leu
2210 2215 2220
Gly Asn Gly Lys Gly Glu Phe Lys Cys Asp Pro His Glu Ala Thr
2225 2230 2235
Cys Tyr Asp Asp Gly Lys Thr Tyr His Val Gly Glu Gln Trp Gln
2240 2245 2250
Lys Glu Tyr Leu Gly Ala Ile Cys Ser Cys Thr Cys Phe Gly Gly
2255 2260 2265
Gln Arg Gly Trp Arg Cys Asp Asn Cys Arg Arg Pro Gly Gly Glu
2270 2275 2280
Pro Ser Pro Glu Gly Thr Thr Gly Gln Ser Tyr Asn Gln Tyr Ser
2285 2290 2295
Gln Arg Tyr His Gln Arg Thr Asn Thr Asn Val Asn Cys Pro Ile
2300 2305 2310
Glu Cys Phe Met Pro Leu Asp Val Gln Ala Asp Arg Glu Asp Ser
2315 2320 2325
Arg Glu
2330
<210> 99
<211> 2296
<212> ПРТ
<213> Homo sapiens
<400> 99
Met Leu Arg Gly Pro Gly Pro Gly Leu Leu Leu Leu Ala Val Gln Cys
1 5 10 15
Leu Gly Thr Ala Val Pro Ser Thr Gly Ala Ser Lys Ser Lys Arg Gln
20 25 30
Ala Gln Gln Met Val Gln Pro Gln Ser Pro Val Ala Val Ser Gln Ser
35 40 45
Lys Pro Gly Cys Tyr Asp Asn Gly Lys His Tyr Gln Ile Asn Gln Gln
50 55 60
Trp Glu Arg Thr Tyr Leu Gly Asn Ala Leu Val Cys Thr Cys Tyr Gly
65 70 75 80
Gly Ser Arg Gly Phe Asn Cys Glu Ser Lys Pro Glu Ala Glu Glu Thr
85 90 95
Cys Phe Asp Lys Tyr Thr Gly Asn Thr Tyr Arg Val Gly Asp Thr Tyr
100 105 110
Glu Arg Pro Lys Asp Ser Met Ile Trp Asp Cys Thr Cys Ile Gly Ala
115 120 125
Gly Arg Gly Arg Ile Ser Cys Thr Ile Ala Asn Arg Cys His Glu Gly
130 135 140
Gly Gln Ser Tyr Lys Ile Gly Asp Thr Trp Arg Arg Pro His Glu Thr
145 150 155 160
Gly Gly Tyr Met Leu Glu Cys Val Cys Leu Gly Asn Gly Lys Gly Glu
165 170 175
Trp Thr Cys Lys Pro Ile Ala Glu Lys Cys Phe Asp His Ala Ala Gly
180 185 190
Thr Ser Tyr Val Val Gly Glu Thr Trp Glu Lys Pro Tyr Gln Gly Trp
195 200 205
Met Met Val Asp Cys Thr Cys Leu Gly Glu Gly Ser Gly Arg Ile Thr
210 215 220
Cys Thr Ser Arg Asn Arg Cys Asn Asp Gln Asp Thr Arg Thr Ser Tyr
225 230 235 240
Arg Ile Gly Asp Thr Trp Ser Lys Lys Asp Asn Arg Gly Asn Leu Leu
245 250 255
Gln Cys Ile Cys Thr Gly Asn Gly Arg Gly Glu Trp Lys Cys Glu Arg
260 265 270
His Thr Ser Val Gln Thr Thr Ser Ser Gly Ser Gly Pro Phe Thr Asp
275 280 285
Val Arg Ala Ala Val Tyr Gln Pro Gln Pro His Pro Gln Pro Pro Pro
290 295 300
Tyr Gly His Cys Val Thr Asp Ser Gly Val Val Tyr Ser Val Gly Met
305 310 315 320
Gln Trp Leu Lys Thr Gln Gly Asn Lys Gln Met Leu Cys Thr Cys Leu
325 330 335
Gly Asn Gly Val Ser Cys Gln Glu Thr Ala Val Thr Gln Thr Tyr Gly
340 345 350
Gly Asn Ser Asn Gly Glu Pro Cys Val Leu Pro Phe Thr Tyr Asn Gly
355 360 365
Arg Thr Phe Tyr Ser Cys Thr Thr Glu Gly Arg Gln Asp Gly His Leu
370 375 380
Trp Cys Ser Thr Thr Ser Asn Tyr Glu Gln Asp Gln Lys Tyr Ser Phe
385 390 395 400
Cys Thr Asp His Thr Val Leu Val Gln Thr Arg Gly Gly Asn Ser Asn
405 410 415
Gly Ala Leu Cys His Phe Pro Phe Leu Tyr Asn Asn His Asn Tyr Thr
420 425 430
Asp Cys Thr Ser Glu Gly Arg Arg Asp Asn Met Lys Trp Cys Gly Thr
435 440 445
Thr Gln Asn Tyr Asp Ala Asp Gln Lys Phe Gly Phe Cys Pro Met Ala
450 455 460
Ala His Glu Glu Ile Cys Thr Thr Asn Glu Gly Val Met Tyr Arg Ile
465 470 475 480
Gly Asp Gln Trp Asp Lys Gln His Asp Met Gly His Met Met Arg Cys
485 490 495
Thr Cys Val Gly Asn Gly Arg Gly Glu Trp Thr Cys Ile Ala Tyr Ser
500 505 510
Gln Leu Arg Asp Gln Cys Ile Val Asp Asp Ile Thr Tyr Asn Val Asn
515 520 525
Asp Thr Phe His Lys Arg His Glu Glu Gly His Met Leu Asn Cys Thr
530 535 540
Cys Phe Gly Gln Gly Arg Gly Arg Trp Lys Cys Asp Pro Val Asp Gln
545 550 555 560
Cys Gln Asp Ser Glu Thr Gly Thr Phe Tyr Gln Ile Gly Asp Ser Trp
565 570 575
Glu Lys Tyr Val His Gly Val Arg Tyr Gln Cys Tyr Cys Tyr Gly Arg
580 585 590
Gly Ile Gly Glu Trp His Cys Gln Pro Leu Gln Thr Tyr Pro Ser Ser
595 600 605
Ser Gly Pro Val Glu Val Phe Ile Thr Glu Thr Pro Ser Gln Pro Asn
610 615 620
Ser His Pro Ile Gln Trp Asn Ala Pro Gln Pro Ser His Ile Ser Lys
625 630 635 640
Tyr Ile Leu Arg Trp Arg Pro Lys Asn Ser Val Gly Arg Trp Lys Glu
645 650 655
Ala Thr Ile Pro Gly His Leu Asn Ser Tyr Thr Ile Lys Gly Leu Lys
660 665 670
Pro Gly Val Val Tyr Glu Gly Gln Leu Ile Ser Ile Gln Gln Tyr Gly
675 680 685
His Gln Glu Val Thr Arg Phe Asp Phe Thr Thr Thr Ser Thr Ser Thr
690 695 700
Pro Val Thr Ser Asn Thr Val Thr Gly Glu Thr Thr Pro Phe Ser Pro
705 710 715 720
Leu Val Ala Thr Ser Glu Ser Val Thr Glu Ile Thr Ala Ser Ser Phe
725 730 735
Val Val Ser Trp Val Ser Ala Ser Asp Thr Val Ser Gly Phe Arg Val
740 745 750
Glu Tyr Glu Leu Ser Glu Glu Gly Asp Glu Pro Gln Tyr Leu Asp Leu
755 760 765
Pro Ser Thr Ala Thr Ser Val Asn Ile Pro Asp Leu Leu Pro Gly Arg
770 775 780
Lys Tyr Ile Val Asn Val Tyr Gln Ile Ser Glu Asp Gly Glu Gln Ser
785 790 795 800
Leu Ile Leu Ser Thr Ser Gln Thr Thr Ala Pro Asp Ala Pro Pro Asp
805 810 815
Pro Thr Val Asp Gln Val Asp Asp Thr Ser Ile Val Val Arg Trp Ser
820 825 830
Arg Pro Gln Ala Pro Ile Thr Gly Tyr Arg Ile Val Tyr Ser Pro Ser
835 840 845
Val Glu Gly Ser Ser Thr Glu Leu Asn Leu Pro Glu Thr Ala Asn Ser
850 855 860
Val Thr Leu Ser Asp Leu Gln Pro Gly Val Gln Tyr Asn Ile Thr Ile
865 870 875 880
Tyr Ala Val Glu Glu Asn Gln Glu Ser Thr Pro Val Val Ile Gln Gln
885 890 895
Glu Thr Thr Gly Thr Pro Arg Ser Asp Thr Val Pro Ser Pro Arg Asp
900 905 910
Leu Gln Phe Val Glu Val Thr Asp Val Lys Val Thr Ile Met Trp Thr
915 920 925
Pro Pro Glu Ser Ala Val Thr Gly Tyr Arg Val Asp Val Ile Pro Val
930 935 940
Asn Leu Pro Gly Glu His Gly Gln Arg Leu Pro Ile Ser Arg Asn Thr
945 950 955 960
Phe Ala Glu Val Thr Gly Leu Ser Pro Gly Val Thr Tyr Tyr Phe Lys
965 970 975
Val Phe Ala Val Ser His Gly Arg Glu Ser Lys Pro Leu Thr Ala Gln
980 985 990
Gln Thr Thr Lys Leu Asp Ala Pro Thr Asn Leu Gln Phe Val Asn Glu
995 1000 1005
Thr Asp Ser Thr Val Leu Val Arg Trp Thr Pro Pro Arg Ala Gln
1010 1015 1020
Ile Thr Gly Tyr Arg Leu Thr Val Gly Leu Thr Arg Arg Gly Gln
1025 1030 1035
Pro Arg Gln Tyr Asn Val Gly Pro Ser Val Ser Lys Tyr Pro Leu
1040 1045 1050
Arg Asn Leu Gln Pro Ala Ser Glu Tyr Thr Val Ser Leu Val Ala
1055 1060 1065
Ile Lys Gly Asn Gln Glu Ser Pro Lys Ala Thr Gly Val Phe Thr
1070 1075 1080
Thr Leu Gln Pro Gly Ser Ser Ile Pro Pro Tyr Asn Thr Glu Val
1085 1090 1095
Thr Glu Thr Thr Ile Val Ile Thr Trp Thr Pro Ala Pro Arg Ile
1100 1105 1110
Gly Phe Lys Leu Gly Val Arg Pro Ser Gln Gly Gly Glu Ala Pro
1115 1120 1125
Arg Glu Val Thr Ser Asp Ser Gly Ser Ile Val Val Ser Gly Leu
1130 1135 1140
Thr Pro Gly Val Glu Tyr Val Tyr Thr Ile Gln Val Leu Arg Asp
1145 1150 1155
Gly Gln Glu Arg Asp Ala Pro Ile Val Asn Lys Val Val Thr Pro
1160 1165 1170
Leu Ser Pro Pro Thr Asn Leu His Leu Glu Ala Asn Pro Asp Thr
1175 1180 1185
Gly Val Leu Thr Val Ser Trp Glu Arg Ser Thr Thr Pro Asp Ile
1190 1195 1200
Thr Gly Tyr Arg Ile Thr Thr Thr Pro Thr Asn Gly Gln Gln Gly
1205 1210 1215
Asn Ser Leu Glu Glu Val Val His Ala Asp Gln Ser Ser Cys Thr
1220 1225 1230
Phe Asp Asn Leu Ser Pro Gly Leu Glu Tyr Asn Val Ser Val Tyr
1235 1240 1245
Thr Val Lys Asp Asp Lys Glu Ser Val Pro Ile Ser Asp Thr Ile
1250 1255 1260
Ile Pro Ala Val Pro Pro Pro Thr Asp Leu Arg Phe Thr Asn Ile
1265 1270 1275
Gly Pro Asp Thr Met Arg Val Thr Trp Ala Pro Pro Pro Ser Ile
1280 1285 1290
Asp Leu Thr Asn Phe Leu Val Arg Tyr Ser Pro Val Lys Asn Glu
1295 1300 1305
Glu Asp Val Ala Glu Leu Ser Ile Ser Pro Ser Asp Asn Ala Val
1310 1315 1320
Val Leu Thr Asn Leu Leu Pro Gly Thr Glu Tyr Val Val Ser Val
1325 1330 1335
Ser Ser Val Tyr Glu Gln His Glu Ser Thr Pro Leu Arg Gly Arg
1340 1345 1350
Gln Lys Thr Gly Leu Asp Ser Pro Thr Gly Ile Asp Phe Ser Asp
1355 1360 1365
Ile Thr Ala Asn Ser Phe Thr Val His Trp Ile Ala Pro Arg Ala
1370 1375 1380
Thr Ile Thr Gly Tyr Arg Ile Arg His His Pro Glu His Phe Ser
1385 1390 1395
Gly Arg Pro Arg Glu Asp Arg Val Pro His Ser Arg Asn Ser Ile
1400 1405 1410
Thr Leu Thr Asn Leu Thr Pro Gly Thr Glu Tyr Val Val Ser Ile
1415 1420 1425
Val Ala Leu Asn Gly Arg Glu Glu Ser Pro Leu Leu Ile Gly Gln
1430 1435 1440
Gln Ser Thr Val Ser Asp Val Pro Arg Asp Leu Glu Val Val Ala
1445 1450 1455
Ala Thr Pro Thr Ser Leu Leu Ile Ser Trp Asp Ala Pro Ala Val
1460 1465 1470
Thr Val Arg Tyr Tyr Arg Ile Thr Tyr Gly Glu Thr Gly Gly Asn
1475 1480 1485
Ser Pro Val Gln Glu Phe Thr Val Pro Gly Ser Lys Ser Thr Ala
1490 1495 1500
Thr Ile Ser Gly Leu Lys Pro Gly Val Asp Tyr Thr Ile Thr Val
1505 1510 1515
Tyr Ala Val Thr Gly Arg Gly Asp Ser Pro Ala Ser Ser Lys Pro
1520 1525 1530
Ile Ser Ile Asn Tyr Arg Thr Glu Ile Asp Lys Pro Ser Gln Met
1535 1540 1545
Gln Val Thr Asp Val Gln Asp Asn Ser Ile Ser Val Lys Trp Leu
1550 1555 1560
Pro Ser Ser Ser Pro Val Thr Gly Tyr Arg Val Thr Thr Thr Pro
1565 1570 1575
Lys Asn Gly Pro Gly Pro Thr Lys Thr Lys Thr Ala Gly Pro Asp
1580 1585 1590
Gln Thr Glu Met Thr Ile Glu Gly Leu Gln Pro Thr Val Glu Tyr
1595 1600 1605
Val Val Ser Val Tyr Ala Gln Asn Pro Ser Gly Glu Ser Gln Pro
1610 1615 1620
Leu Val Gln Thr Ala Val Thr Thr Ile Pro Ala Pro Thr Asp Leu
1625 1630 1635
Lys Phe Thr Gln Val Thr Pro Thr Ser Leu Ser Ala Gln Trp Thr
1640 1645 1650
Pro Pro Asn Val Gln Leu Thr Gly Tyr Arg Val Arg Val Thr Pro
1655 1660 1665
Lys Glu Lys Thr Gly Pro Met Lys Glu Ile Asn Leu Ala Pro Asp
1670 1675 1680
Ser Ser Ser Val Val Val Ser Gly Leu Met Val Ala Thr Lys Tyr
1685 1690 1695
Glu Val Ser Val Tyr Ala Leu Lys Asp Thr Leu Thr Ser Arg Pro
1700 1705 1710
Ala Gln Gly Val Val Thr Thr Leu Glu Asn Val Ser Pro Pro Arg
1715 1720 1725
Arg Ala Arg Val Thr Asp Ala Thr Glu Thr Thr Ile Thr Ile Ser
1730 1735 1740
Trp Arg Thr Lys Thr Glu Thr Ile Thr Gly Phe Gln Val Asp Ala
1745 1750 1755
Val Pro Ala Asn Gly Gln Thr Pro Ile Gln Arg Thr Ile Lys Pro
1760 1765 1770
Asp Val Arg Ser Tyr Thr Ile Thr Gly Leu Gln Pro Gly Thr Asp
1775 1780 1785
Tyr Lys Ile Tyr Leu Tyr Thr Leu Asn Asp Asn Ala Arg Ser Ser
1790 1795 1800
Pro Val Val Ile Asp Ala Ser Thr Ala Ile Asp Ala Pro Ser Asn
1805 1810 1815
Leu Arg Phe Leu Ala Thr Thr Pro Asn Ser Leu Leu Val Ser Trp
1820 1825 1830
Gln Pro Pro Arg Ala Arg Ile Thr Gly Tyr Ile Ile Lys Tyr Glu
1835 1840 1845
Lys Pro Gly Ser Pro Pro Arg Glu Val Val Pro Arg Pro Arg Pro
1850 1855 1860
Gly Val Thr Glu Ala Thr Ile Thr Gly Leu Glu Pro Gly Thr Glu
1865 1870 1875
Tyr Thr Ile Tyr Val Ile Ala Leu Lys Asn Asn Gln Lys Ser Glu
1880 1885 1890
Pro Leu Ile Gly Arg Lys Lys Thr Asp Glu Leu Pro Gln Leu Val
1895 1900 1905
Thr Leu Pro His Pro Asn Leu His Gly Pro Glu Ile Leu Asp Val
1910 1915 1920
Pro Ser Thr Val Gln Lys Thr Pro Phe Val Thr His Pro Gly Tyr
1925 1930 1935
Asp Thr Gly Asn Gly Ile Gln Leu Pro Gly Thr Ser Gly Gln Gln
1940 1945 1950
Pro Ser Val Gly Gln Gln Met Ile Phe Glu Glu His Gly Phe Arg
1955 1960 1965
Arg Thr Thr Pro Pro Thr Thr Ala Thr Pro Ile Arg His Arg Pro
1970 1975 1980
Arg Pro Tyr Pro Pro Asn Val Gly Glu Glu Ile Gln Ile Gly His
1985 1990 1995
Ile Pro Arg Glu Asp Val Asp Tyr His Leu Tyr Pro His Gly Pro
2000 2005 2010
Gly Leu Asn Pro Asn Ala Ser Thr Gly Gln Glu Ala Leu Ser Gln
2015 2020 2025
Thr Thr Ile Ser Trp Ala Pro Phe Gln Asp Thr Ser Glu Tyr Ile
2030 2035 2040
Ile Ser Cys His Pro Val Gly Thr Asp Glu Glu Pro Leu Gln Phe
2045 2050 2055
Arg Val Pro Gly Thr Ser Thr Ser Ala Thr Leu Thr Gly Leu Thr
2060 2065 2070
Arg Gly Ala Thr Tyr Asn Ile Ile Val Glu Ala Leu Lys Asp Gln
2075 2080 2085
Gln Arg His Lys Val Arg Glu Glu Val Val Thr Val Gly Asn Ser
2090 2095 2100
Val Asn Glu Gly Leu Asn Gln Pro Thr Asp Asp Ser Cys Phe Asp
2105 2110 2115
Pro Tyr Thr Val Ser His Tyr Ala Val Gly Asp Glu Trp Glu Arg
2120 2125 2130
Met Ser Glu Ser Gly Phe Lys Leu Leu Cys Gln Cys Leu Gly Phe
2135 2140 2145
Gly Ser Gly His Phe Arg Cys Asp Ser Ser Arg Trp Cys His Asp
2150 2155 2160
Asn Gly Val Asn Tyr Lys Ile Gly Glu Lys Trp Asp Arg Gln Gly
2165 2170 2175
Glu Asn Gly Gln Met Met Ser Cys Thr Cys Leu Gly Asn Gly Lys
2180 2185 2190
Gly Glu Phe Lys Cys Asp Pro His Glu Ala Thr Cys Tyr Asp Asp
2195 2200 2205
Gly Lys Thr Tyr His Val Gly Glu Gln Trp Gln Lys Glu Tyr Leu
2210 2215 2220
Gly Ala Ile Cys Ser Cys Thr Cys Phe Gly Gly Gln Arg Gly Trp
2225 2230 2235
Arg Cys Asp Asn Cys Arg Arg Pro Gly Gly Glu Pro Ser Pro Glu
2240 2245 2250
Gly Thr Thr Gly Gln Ser Tyr Asn Gln Tyr Ser Gln Arg Tyr His
2255 2260 2265
Gln Arg Thr Asn Thr Asn Val Asn Cys Pro Ile Glu Cys Phe Met
2270 2275 2280
Pro Leu Asp Val Gln Ala Asp Arg Glu Asp Ser Arg Glu
2285 2290 2295
<210> 100
<211> 2176
<212> ПРТ
<213> Homo sapiens
<400> 100
Met Leu Arg Gly Pro Gly Pro Gly Leu Leu Leu Leu Ala Val Gln Cys
1 5 10 15
Leu Gly Thr Ala Val Pro Ser Thr Gly Ala Ser Lys Ser Lys Arg Gln
20 25 30
Ala Gln Gln Met Val Gln Pro Gln Ser Pro Val Ala Val Ser Gln Ser
35 40 45
Lys Pro Gly Cys Tyr Asp Asn Gly Lys His Tyr Gln Ile Asn Gln Gln
50 55 60
Trp Glu Arg Thr Tyr Leu Gly Asn Ala Leu Val Cys Thr Cys Tyr Gly
65 70 75 80
Gly Ser Arg Gly Phe Asn Cys Glu Ser Lys Pro Glu Ala Glu Glu Thr
85 90 95
Cys Phe Asp Lys Tyr Thr Gly Asn Thr Tyr Arg Val Gly Asp Thr Tyr
100 105 110
Glu Arg Pro Lys Asp Ser Met Ile Trp Asp Cys Thr Cys Ile Gly Ala
115 120 125
Gly Arg Gly Arg Ile Ser Cys Thr Ile Ala Asn Arg Cys His Glu Gly
130 135 140
Gly Gln Ser Tyr Lys Ile Gly Asp Thr Trp Arg Arg Pro His Glu Thr
145 150 155 160
Gly Gly Tyr Met Leu Glu Cys Val Cys Leu Gly Asn Gly Lys Gly Glu
165 170 175
Trp Thr Cys Lys Pro Ile Ala Glu Lys Cys Phe Asp His Ala Ala Gly
180 185 190
Thr Ser Tyr Val Val Gly Glu Thr Trp Glu Lys Pro Tyr Gln Gly Trp
195 200 205
Met Met Val Asp Cys Thr Cys Leu Gly Glu Gly Ser Gly Arg Ile Thr
210 215 220
Cys Thr Ser Arg Asn Arg Cys Asn Asp Gln Asp Thr Arg Thr Ser Tyr
225 230 235 240
Arg Ile Gly Asp Thr Trp Ser Lys Lys Asp Asn Arg Gly Asn Leu Leu
245 250 255
Gln Cys Ile Cys Thr Gly Asn Gly Arg Gly Glu Trp Lys Cys Glu Arg
260 265 270
His Thr Ser Val Gln Thr Thr Ser Ser Gly Ser Gly Pro Phe Thr Asp
275 280 285
Val Arg Ala Ala Val Tyr Gln Pro Gln Pro His Pro Gln Pro Pro Pro
290 295 300
Tyr Gly His Cys Val Thr Asp Ser Gly Val Val Tyr Ser Val Gly Met
305 310 315 320
Gln Trp Leu Lys Thr Gln Gly Asn Lys Gln Met Leu Cys Thr Cys Leu
325 330 335
Gly Asn Gly Val Ser Cys Gln Glu Thr Ala Val Thr Gln Thr Tyr Gly
340 345 350
Gly Asn Ser Asn Gly Glu Pro Cys Val Leu Pro Phe Thr Tyr Asn Gly
355 360 365
Arg Thr Phe Tyr Ser Cys Thr Thr Glu Gly Arg Gln Asp Gly His Leu
370 375 380
Trp Cys Ser Thr Thr Ser Asn Tyr Glu Gln Asp Gln Lys Tyr Ser Phe
385 390 395 400
Cys Thr Asp His Thr Val Leu Val Gln Thr Arg Gly Gly Asn Ser Asn
405 410 415
Gly Ala Leu Cys His Phe Pro Phe Leu Tyr Asn Asn His Asn Tyr Thr
420 425 430
Asp Cys Thr Ser Glu Gly Arg Arg Asp Asn Met Lys Trp Cys Gly Thr
435 440 445
Thr Gln Asn Tyr Asp Ala Asp Gln Lys Phe Gly Phe Cys Pro Met Ala
450 455 460
Ala His Glu Glu Ile Cys Thr Thr Asn Glu Gly Val Met Tyr Arg Ile
465 470 475 480
Gly Asp Gln Trp Asp Lys Gln His Asp Met Gly His Met Met Arg Cys
485 490 495
Thr Cys Val Gly Asn Gly Arg Gly Glu Trp Thr Cys Ile Ala Tyr Ser
500 505 510
Gln Leu Arg Asp Gln Cys Ile Val Asp Asp Ile Thr Tyr Asn Val Asn
515 520 525
Asp Thr Phe His Lys Arg His Glu Glu Gly His Met Leu Asn Cys Thr
530 535 540
Cys Phe Gly Gln Gly Arg Gly Arg Trp Lys Cys Asp Pro Val Asp Gln
545 550 555 560
Cys Gln Asp Ser Glu Thr Gly Thr Phe Tyr Gln Ile Gly Asp Ser Trp
565 570 575
Glu Lys Tyr Val His Gly Val Arg Tyr Gln Cys Tyr Cys Tyr Gly Arg
580 585 590
Gly Ile Gly Glu Trp His Cys Gln Pro Leu Gln Thr Tyr Pro Ser Ser
595 600 605
Ser Gly Pro Val Glu Val Phe Ile Thr Glu Thr Pro Ser Gln Pro Asn
610 615 620
Ser His Pro Ile Gln Trp Asn Ala Pro Gln Pro Ser His Ile Ser Lys
625 630 635 640
Tyr Ile Leu Arg Trp Arg Pro Lys Asn Ser Val Gly Arg Trp Lys Glu
645 650 655
Ala Thr Ile Pro Gly His Leu Asn Ser Tyr Thr Ile Lys Gly Leu Lys
660 665 670
Pro Gly Val Val Tyr Glu Gly Gln Leu Ile Ser Ile Gln Gln Tyr Gly
675 680 685
His Gln Glu Val Thr Arg Phe Asp Phe Thr Thr Thr Ser Thr Ser Thr
690 695 700
Pro Val Thr Ser Asn Thr Val Thr Gly Glu Thr Thr Pro Phe Ser Pro
705 710 715 720
Leu Val Ala Thr Ser Glu Ser Val Thr Glu Ile Thr Ala Ser Ser Phe
725 730 735
Val Val Ser Trp Val Ser Ala Ser Asp Thr Val Ser Gly Phe Arg Val
740 745 750
Glu Tyr Glu Leu Ser Glu Glu Gly Asp Glu Pro Gln Tyr Leu Asp Leu
755 760 765
Pro Ser Thr Ala Thr Ser Val Asn Ile Pro Asp Leu Leu Pro Gly Arg
770 775 780
Lys Tyr Ile Val Asn Val Tyr Gln Ile Ser Glu Asp Gly Glu Gln Ser
785 790 795 800
Leu Ile Leu Ser Thr Ser Gln Thr Thr Ala Pro Asp Ala Pro Pro Asp
805 810 815
Pro Thr Val Asp Gln Val Asp Asp Thr Ser Ile Val Val Arg Trp Ser
820 825 830
Arg Pro Gln Ala Pro Ile Thr Gly Tyr Arg Ile Val Tyr Ser Pro Ser
835 840 845
Val Glu Gly Ser Ser Thr Glu Leu Asn Leu Pro Glu Thr Ala Asn Ser
850 855 860
Val Thr Leu Ser Asp Leu Gln Pro Gly Val Gln Tyr Asn Ile Thr Ile
865 870 875 880
Tyr Ala Val Glu Glu Asn Gln Glu Ser Thr Pro Val Val Ile Gln Gln
885 890 895
Glu Thr Thr Gly Thr Pro Arg Ser Asp Thr Val Pro Ser Pro Arg Asp
900 905 910
Leu Gln Phe Val Glu Val Thr Asp Val Lys Val Thr Ile Met Trp Thr
915 920 925
Pro Pro Glu Ser Ala Val Thr Gly Tyr Arg Val Asp Val Ile Pro Val
930 935 940
Asn Leu Pro Gly Glu His Gly Gln Arg Leu Pro Ile Ser Arg Asn Thr
945 950 955 960
Phe Ala Glu Val Thr Gly Leu Ser Pro Gly Val Thr Tyr Tyr Phe Lys
965 970 975
Val Phe Ala Val Ser His Gly Arg Glu Ser Lys Pro Leu Thr Ala Gln
980 985 990
Gln Thr Thr Lys Leu Asp Ala Pro Thr Asn Leu Gln Phe Val Asn Glu
995 1000 1005
Thr Asp Ser Thr Val Leu Val Arg Trp Thr Pro Pro Arg Ala Gln
1010 1015 1020
Ile Thr Gly Tyr Arg Leu Thr Val Gly Leu Thr Arg Arg Gly Gln
1025 1030 1035
Pro Arg Gln Tyr Asn Val Gly Pro Ser Val Ser Lys Tyr Pro Leu
1040 1045 1050
Arg Asn Leu Gln Pro Ala Ser Glu Tyr Thr Val Ser Leu Val Ala
1055 1060 1065
Ile Lys Gly Asn Gln Glu Ser Pro Lys Ala Thr Gly Val Phe Thr
1070 1075 1080
Thr Leu Gln Pro Gly Ser Ser Ile Pro Pro Tyr Asn Thr Glu Val
1085 1090 1095
Thr Glu Thr Thr Ile Val Ile Thr Trp Thr Pro Ala Pro Arg Ile
1100 1105 1110
Gly Phe Lys Leu Gly Val Arg Pro Ser Gln Gly Gly Glu Ala Pro
1115 1120 1125
Arg Glu Val Thr Ser Asp Ser Gly Ser Ile Val Val Ser Gly Leu
1130 1135 1140
Thr Pro Gly Val Glu Tyr Val Tyr Thr Ile Gln Val Leu Arg Asp
1145 1150 1155
Gly Gln Glu Arg Asp Ala Pro Ile Val Asn Lys Val Val Thr Pro
1160 1165 1170
Leu Ser Pro Pro Thr Asn Leu His Leu Glu Ala Asn Pro Asp Thr
1175 1180 1185
Gly Val Leu Thr Val Ser Trp Glu Arg Ser Thr Thr Pro Asp Ile
1190 1195 1200
Thr Gly Tyr Arg Ile Thr Thr Thr Pro Thr Asn Gly Gln Gln Gly
1205 1210 1215
Asn Ser Leu Glu Glu Val Val His Ala Asp Gln Ser Ser Cys Thr
1220 1225 1230
Phe Asp Asn Leu Ser Pro Gly Leu Glu Tyr Asn Val Ser Val Tyr
1235 1240 1245
Thr Val Lys Asp Asp Lys Glu Ser Val Pro Ile Ser Asp Thr Ile
1250 1255 1260
Ile Pro Ala Val Pro Pro Pro Thr Asp Leu Arg Phe Thr Asn Ile
1265 1270 1275
Gly Pro Asp Thr Met Arg Val Thr Trp Ala Pro Pro Pro Ser Ile
1280 1285 1290
Asp Leu Thr Asn Phe Leu Val Arg Tyr Ser Pro Val Lys Asn Glu
1295 1300 1305
Glu Asp Val Ala Glu Leu Ser Ile Ser Pro Ser Asp Asn Ala Val
1310 1315 1320
Val Leu Thr Asn Leu Leu Pro Gly Thr Glu Tyr Val Val Ser Val
1325 1330 1335
Ser Ser Val Tyr Glu Gln His Glu Ser Thr Pro Leu Arg Gly Arg
1340 1345 1350
Gln Lys Thr Gly Leu Asp Ser Pro Thr Gly Ile Asp Phe Ser Asp
1355 1360 1365
Ile Thr Ala Asn Ser Phe Thr Val His Trp Ile Ala Pro Arg Ala
1370 1375 1380
Thr Ile Thr Gly Tyr Arg Ile Arg His His Pro Glu His Phe Ser
1385 1390 1395
Gly Arg Pro Arg Glu Asp Arg Val Pro His Ser Arg Asn Ser Ile
1400 1405 1410
Thr Leu Thr Asn Leu Thr Pro Gly Thr Glu Tyr Val Val Ser Ile
1415 1420 1425
Val Ala Leu Asn Gly Arg Glu Glu Ser Pro Leu Leu Ile Gly Gln
1430 1435 1440
Gln Ser Thr Val Ser Asp Val Pro Arg Asp Leu Glu Val Val Ala
1445 1450 1455
Ala Thr Pro Thr Ser Leu Leu Ile Ser Trp Asp Ala Pro Ala Val
1460 1465 1470
Thr Val Arg Tyr Tyr Arg Ile Thr Tyr Gly Glu Thr Gly Gly Asn
1475 1480 1485
Ser Pro Val Gln Glu Phe Thr Val Pro Gly Ser Lys Ser Thr Ala
1490 1495 1500
Thr Ile Ser Gly Leu Lys Pro Gly Val Asp Tyr Thr Ile Thr Val
1505 1510 1515
Tyr Ala Val Thr Gly Arg Gly Asp Ser Pro Ala Ser Ser Lys Pro
1520 1525 1530
Ile Ser Ile Asn Tyr Arg Thr Glu Ile Asp Lys Pro Ser Gln Met
1535 1540 1545
Gln Val Thr Asp Val Gln Asp Asn Ser Ile Ser Val Lys Trp Leu
1550 1555 1560
Pro Ser Ser Ser Pro Val Thr Gly Tyr Arg Val Thr Thr Thr Pro
1565 1570 1575
Lys Asn Gly Pro Gly Pro Thr Lys Thr Lys Thr Ala Gly Pro Asp
1580 1585 1590
Gln Thr Glu Met Thr Ile Glu Gly Leu Gln Pro Thr Val Glu Tyr
1595 1600 1605
Val Val Ser Val Tyr Ala Gln Asn Pro Ser Gly Glu Ser Gln Pro
1610 1615 1620
Leu Val Gln Thr Ala Val Thr Thr Ile Pro Ala Pro Thr Asp Leu
1625 1630 1635
Lys Phe Thr Gln Val Thr Pro Thr Ser Leu Ser Ala Gln Trp Thr
1640 1645 1650
Pro Pro Asn Val Gln Leu Thr Gly Tyr Arg Val Arg Val Thr Pro
1655 1660 1665
Lys Glu Lys Thr Gly Pro Met Lys Glu Ile Asn Leu Ala Pro Asp
1670 1675 1680
Ser Ser Ser Val Val Val Ser Gly Leu Met Val Ala Thr Lys Tyr
1685 1690 1695
Glu Val Ser Val Tyr Ala Leu Lys Asp Thr Leu Thr Ser Arg Pro
1700 1705 1710
Ala Gln Gly Val Val Thr Thr Leu Glu Asn Val Ser Pro Pro Arg
1715 1720 1725
Arg Ala Arg Val Thr Asp Ala Thr Glu Thr Thr Ile Thr Ile Ser
1730 1735 1740
Trp Arg Thr Lys Thr Glu Thr Ile Thr Gly Phe Gln Val Asp Ala
1745 1750 1755
Val Pro Ala Asn Gly Gln Thr Pro Ile Gln Arg Thr Ile Lys Pro
1760 1765 1770
Asp Val Arg Ser Tyr Thr Ile Thr Gly Leu Gln Pro Gly Thr Asp
1775 1780 1785
Tyr Lys Ile Tyr Leu Tyr Thr Leu Asn Asp Asn Ala Arg Ser Ser
1790 1795 1800
Pro Val Val Ile Asp Ala Ser Thr Ala Ile Asp Ala Pro Ser Asn
1805 1810 1815
Leu Arg Phe Leu Ala Thr Thr Pro Asn Ser Leu Leu Val Ser Trp
1820 1825 1830
Gln Pro Pro Arg Ala Arg Ile Thr Gly Tyr Ile Ile Lys Tyr Glu
1835 1840 1845
Lys Pro Gly Ser Pro Pro Arg Glu Val Val Pro Arg Pro Arg Pro
1850 1855 1860
Gly Val Thr Glu Ala Thr Ile Thr Gly Leu Glu Pro Gly Thr Glu
1865 1870 1875
Tyr Thr Ile Tyr Val Ile Ala Leu Lys Asn Asn Gln Lys Ser Glu
1880 1885 1890
Pro Leu Ile Gly Arg Lys Lys Thr Gly Gln Glu Ala Leu Ser Gln
1895 1900 1905
Thr Thr Ile Ser Trp Ala Pro Phe Gln Asp Thr Ser Glu Tyr Ile
1910 1915 1920
Ile Ser Cys His Pro Val Gly Thr Asp Glu Glu Pro Leu Gln Phe
1925 1930 1935
Arg Val Pro Gly Thr Ser Thr Ser Ala Thr Leu Thr Gly Leu Thr
1940 1945 1950
Arg Gly Ala Thr Tyr Asn Ile Ile Val Glu Ala Leu Lys Asp Gln
1955 1960 1965
Gln Arg His Lys Val Arg Glu Glu Val Val Thr Val Gly Asn Ser
1970 1975 1980
Val Asn Glu Gly Leu Asn Gln Pro Thr Asp Asp Ser Cys Phe Asp
1985 1990 1995
Pro Tyr Thr Val Ser His Tyr Ala Val Gly Asp Glu Trp Glu Arg
2000 2005 2010
Met Ser Glu Ser Gly Phe Lys Leu Leu Cys Gln Cys Leu Gly Phe
2015 2020 2025
Gly Ser Gly His Phe Arg Cys Asp Ser Ser Arg Trp Cys His Asp
2030 2035 2040
Asn Gly Val Asn Tyr Lys Ile Gly Glu Lys Trp Asp Arg Gln Gly
2045 2050 2055
Glu Asn Gly Gln Met Met Ser Cys Thr Cys Leu Gly Asn Gly Lys
2060 2065 2070
Gly Glu Phe Lys Cys Asp Pro His Glu Ala Thr Cys Tyr Asp Asp
2075 2080 2085
Gly Lys Thr Tyr His Val Gly Glu Gln Trp Gln Lys Glu Tyr Leu
2090 2095 2100
Gly Ala Ile Cys Ser Cys Thr Cys Phe Gly Gly Gln Arg Gly Trp
2105 2110 2115
Arg Cys Asp Asn Cys Arg Arg Pro Gly Gly Glu Pro Ser Pro Glu
2120 2125 2130
Gly Thr Thr Gly Gln Ser Tyr Asn Gln Tyr Ser Gln Arg Tyr His
2135 2140 2145
Gln Arg Thr Asn Thr Asn Val Asn Cys Pro Ile Glu Cys Phe Met
2150 2155 2160
Pro Leu Asp Val Gln Ala Asp Arg Glu Asp Ser Arg Glu
2165 2170 2175
<210> 101
<211> 657
<212> ПРТ
<213> Homo sapiens
<400> 101
Met Leu Arg Gly Pro Gly Pro Gly Leu Leu Leu Leu Ala Val Gln Cys
1 5 10 15
Leu Gly Thr Ala Val Pro Ser Thr Gly Ala Ser Lys Ser Lys Arg Gln
20 25 30
Ala Gln Gln Met Val Gln Pro Gln Ser Pro Val Ala Val Ser Gln Ser
35 40 45
Lys Pro Gly Cys Tyr Asp Asn Gly Lys His Tyr Gln Ile Asn Gln Gln
50 55 60
Trp Glu Arg Thr Tyr Leu Gly Asn Ala Leu Val Cys Thr Cys Tyr Gly
65 70 75 80
Gly Ser Arg Gly Phe Asn Cys Glu Ser Lys Pro Glu Ala Glu Glu Thr
85 90 95
Cys Phe Asp Lys Tyr Thr Gly Asn Thr Tyr Arg Val Gly Asp Thr Tyr
100 105 110
Glu Arg Pro Lys Asp Ser Met Ile Trp Asp Cys Thr Cys Ile Gly Ala
115 120 125
Gly Arg Gly Arg Ile Ser Cys Thr Ile Ala Asn Arg Cys His Glu Gly
130 135 140
Gly Gln Ser Tyr Lys Ile Gly Asp Thr Trp Arg Arg Pro His Glu Thr
145 150 155 160
Gly Gly Tyr Met Leu Glu Cys Val Cys Leu Gly Asn Gly Lys Gly Glu
165 170 175
Trp Thr Cys Lys Pro Ile Ala Glu Lys Cys Phe Asp His Ala Ala Gly
180 185 190
Thr Ser Tyr Val Val Gly Glu Thr Trp Glu Lys Pro Tyr Gln Gly Trp
195 200 205
Met Met Val Asp Cys Thr Cys Leu Gly Glu Gly Ser Gly Arg Ile Thr
210 215 220
Cys Thr Ser Arg Asn Arg Cys Asn Asp Gln Asp Thr Arg Thr Ser Tyr
225 230 235 240
Arg Ile Gly Asp Thr Trp Ser Lys Lys Asp Asn Arg Gly Asn Leu Leu
245 250 255
Gln Cys Ile Cys Thr Gly Asn Gly Arg Gly Glu Trp Lys Cys Glu Arg
260 265 270
His Thr Ser Val Gln Thr Thr Ser Ser Gly Ser Gly Pro Phe Thr Asp
275 280 285
Val Arg Ala Ala Val Tyr Gln Pro Gln Pro His Pro Gln Pro Pro Pro
290 295 300
Tyr Gly His Cys Val Thr Asp Ser Gly Val Val Tyr Ser Val Gly Met
305 310 315 320
Gln Trp Leu Lys Thr Gln Gly Asn Lys Gln Met Leu Cys Thr Cys Leu
325 330 335
Gly Asn Gly Val Ser Cys Gln Glu Thr Ala Val Thr Gln Thr Tyr Gly
340 345 350
Gly Asn Ser Asn Gly Glu Pro Cys Val Leu Pro Phe Thr Tyr Asn Gly
355 360 365
Arg Thr Phe Tyr Ser Cys Thr Thr Glu Gly Arg Gln Asp Gly His Leu
370 375 380
Trp Cys Ser Thr Thr Ser Asn Tyr Glu Gln Asp Gln Lys Tyr Ser Phe
385 390 395 400
Cys Thr Asp His Thr Val Leu Val Gln Thr Arg Gly Gly Asn Ser Asn
405 410 415
Gly Ala Leu Cys His Phe Pro Phe Leu Tyr Asn Asn His Asn Tyr Thr
420 425 430
Asp Cys Thr Ser Glu Gly Arg Arg Asp Asn Met Lys Trp Cys Gly Thr
435 440 445
Thr Gln Asn Tyr Asp Ala Asp Gln Lys Phe Gly Phe Cys Pro Met Ala
450 455 460
Ala His Glu Glu Ile Cys Thr Thr Asn Glu Gly Val Met Tyr Arg Ile
465 470 475 480
Gly Asp Gln Trp Asp Lys Gln His Asp Met Gly His Met Met Arg Cys
485 490 495
Thr Cys Val Gly Asn Gly Arg Gly Glu Trp Thr Cys Ile Ala Tyr Ser
500 505 510
Gln Leu Arg Asp Gln Cys Ile Val Asp Asp Ile Thr Tyr Asn Val Asn
515 520 525
Asp Thr Phe His Lys Arg His Glu Glu Gly His Met Leu Asn Cys Thr
530 535 540
Cys Phe Gly Gln Gly Arg Gly Arg Trp Lys Cys Asp Pro Val Asp Gln
545 550 555 560
Cys Gln Asp Ser Glu Thr Gly Thr Phe Tyr Gln Ile Gly Asp Ser Trp
565 570 575
Glu Lys Tyr Val His Gly Val Arg Tyr Gln Cys Tyr Cys Tyr Gly Arg
580 585 590
Gly Ile Gly Glu Trp His Cys Gln Pro Leu Gln Thr Tyr Pro Ser Ser
595 600 605
Ser Gly Pro Val Glu Val Phe Ile Thr Glu Thr Pro Ser Gln Pro Asn
610 615 620
Ser His Pro Ile Gln Trp Asn Ala Pro Gln Pro Ser His Ile Ser Lys
625 630 635 640
Tyr Ile Leu Arg Trp Arg Pro Val Ser Ile Pro Pro Arg Asn Leu Gly
645 650 655
Tyr
<210> 102
<211> 478
<212> ПРТ
<213> Homo sapiens
<400> 102
Met Ala Pro Leu Arg Pro Leu Leu Ile Leu Ala Leu Leu Ala Trp Val
1 5 10 15
Ala Leu Ala Asp Gln Glu Ser Cys Lys Gly Arg Cys Thr Glu Gly Phe
20 25 30
Asn Val Asp Lys Lys Cys Gln Cys Asp Glu Leu Cys Ser Tyr Tyr Gln
35 40 45
Ser Cys Cys Thr Asp Tyr Thr Ala Glu Cys Lys Pro Gln Val Thr Arg
50 55 60
Gly Asp Val Phe Thr Met Pro Glu Asp Glu Tyr Thr Val Tyr Asp Asp
65 70 75 80
Gly Glu Glu Lys Asn Asn Ala Thr Val His Glu Gln Val Gly Gly Pro
85 90 95
Ser Leu Thr Ser Asp Leu Gln Ala Gln Ser Lys Gly Asn Pro Glu Gln
100 105 110
Thr Pro Val Leu Lys Pro Glu Glu Glu Ala Pro Ala Pro Glu Val Gly
115 120 125
Ala Ser Lys Pro Glu Gly Ile Asp Ser Arg Pro Glu Thr Leu His Pro
130 135 140
Gly Arg Pro Gln Pro Pro Ala Glu Glu Glu Leu Cys Ser Gly Lys Pro
145 150 155 160
Phe Asp Ala Phe Thr Asp Leu Lys Asn Gly Ser Leu Phe Ala Phe Arg
165 170 175
Gly Gln Tyr Cys Tyr Glu Leu Asp Glu Lys Ala Val Arg Pro Gly Tyr
180 185 190
Pro Lys Leu Ile Arg Asp Val Trp Gly Ile Glu Gly Pro Ile Asp Ala
195 200 205
Ala Phe Thr Arg Ile Asn Cys Gln Gly Lys Thr Tyr Leu Phe Lys Gly
210 215 220
Ser Gln Tyr Trp Arg Phe Glu Asp Gly Val Leu Asp Pro Asp Tyr Pro
225 230 235 240
Arg Asn Ile Ser Asp Gly Phe Asp Gly Ile Pro Asp Asn Val Asp Ala
245 250 255
Ala Leu Ala Leu Pro Ala His Ser Tyr Ser Gly Arg Glu Arg Val Tyr
260 265 270
Phe Phe Lys Gly Lys Gln Tyr Trp Glu Tyr Gln Phe Gln His Gln Pro
275 280 285
Ser Gln Glu Glu Cys Glu Gly Ser Ser Leu Ser Ala Val Phe Glu His
290 295 300
Phe Ala Met Met Gln Arg Asp Ser Trp Glu Asp Ile Phe Glu Leu Leu
305 310 315 320
Phe Trp Gly Arg Thr Ser Ala Gly Thr Arg Gln Pro Gln Phe Ile Ser
325 330 335
Arg Asp Trp His Gly Val Pro Gly Gln Val Asp Ala Ala Met Ala Gly
340 345 350
Arg Ile Tyr Ile Ser Gly Met Ala Pro Arg Pro Ser Leu Ala Lys Lys
355 360 365
Gln Arg Phe Arg His Arg Asn Arg Lys Gly Tyr Arg Ser Gln Arg Gly
370 375 380
His Ser Arg Gly Arg Asn Gln Asn Ser Arg Arg Pro Ser Arg Ala Thr
385 390 395 400
Trp Leu Ser Leu Phe Ser Ser Glu Glu Ser Asn Leu Gly Ala Asn Asn
405 410 415
Tyr Asp Asp Tyr Arg Met Asp Trp Leu Val Pro Ala Thr Cys Glu Pro
420 425 430
Ile Gln Ser Val Phe Phe Phe Ser Gly Asp Lys Tyr Tyr Arg Val Asn
435 440 445
Leu Arg Thr Arg Arg Val Asp Thr Val Asp Pro Pro Tyr Pro Arg Ser
450 455 460
Ile Ala Gln Tyr Trp Leu Gly Cys Pro Ala Pro Gly His Leu
465 470 475
<210> 103
<211> 1247
<212> ПРТ
<213> Homo sapiens
<400> 103
Met Leu Ala Ser Ser Ser Arg Ile Arg Ala Ala Trp Thr Arg Ala Leu
1 5 10 15
Leu Leu Pro Leu Leu Leu Ala Gly Pro Val Gly Cys Leu Ser Arg Gln
20 25 30
Glu Leu Phe Pro Phe Gly Pro Gly Gln Gly Asp Leu Glu Leu Glu Asp
35 40 45
Gly Asp Asp Phe Val Ser Pro Ala Leu Glu Leu Ser Gly Ala Leu Arg
50 55 60
Phe Tyr Asp Arg Ser Asp Ile Asp Ala Val Tyr Val Thr Thr Asn Gly
65 70 75 80
Ile Ile Ala Thr Ser Glu Pro Pro Ala Lys Glu Ser His Pro Gly Leu
85 90 95
Phe Pro Pro Thr Phe Gly Ala Val Ala Pro Phe Leu Ala Asp Leu Asp
100 105 110
Thr Thr Asp Gly Leu Gly Lys Val Tyr Tyr Arg Glu Asp Leu Ser Pro
115 120 125
Ser Ile Thr Gln Arg Ala Ala Glu Cys Val His Arg Gly Phe Pro Glu
130 135 140
Ile Ser Phe Gln Pro Ser Ser Ala Val Val Val Thr Trp Glu Ser Val
145 150 155 160
Ala Pro Tyr Gln Gly Pro Ser Arg Asp Pro Asp Gln Lys Gly Lys Arg
165 170 175
Asn Thr Phe Gln Ala Val Leu Ala Ser Ser Asp Ser Ser Ser Tyr Ala
180 185 190
Ile Phe Leu Tyr Pro Glu Asp Gly Leu Gln Phe His Thr Thr Phe Ser
195 200 205
Lys Lys Glu Asn Asn Gln Val Pro Ala Val Val Ala Phe Ser Gln Gly
210 215 220
Ser Val Gly Phe Leu Trp Lys Ser Asn Gly Ala Tyr Asn Ile Phe Ala
225 230 235 240
Asn Asp Arg Glu Ser Val Glu Asn Leu Ala Lys Ser Ser Asn Ser Gly
245 250 255
Gln Gln Gly Val Trp Val Phe Glu Ile Gly Ser Pro Ala Thr Thr Asn
260 265 270
Gly Val Val Pro Ala Asp Val Ile Leu Gly Thr Glu Asp Gly Ala Glu
275 280 285
Tyr Asp Asp Glu Asp Glu Asp Tyr Asp Leu Ala Thr Thr Arg Leu Gly
290 295 300
Leu Glu Asp Val Gly Thr Thr Pro Phe Ser Tyr Lys Ala Leu Arg Arg
305 310 315 320
Gly Gly Ala Asp Thr Tyr Ser Val Pro Ser Val Leu Ser Pro Arg Arg
325 330 335
Ala Ala Thr Glu Arg Pro Leu Gly Pro Pro Thr Glu Arg Thr Arg Ser
340 345 350
Phe Gln Leu Ala Val Glu Thr Phe His Gln Gln His Pro Gln Val Ile
355 360 365
Asp Val Asp Glu Val Glu Glu Thr Gly Val Val Phe Ser Tyr Asn Thr
370 375 380
Asp Ser Arg Gln Thr Cys Ala Asn Asn Arg His Gln Cys Ser Val His
385 390 395 400
Ala Glu Cys Arg Asp Tyr Ala Thr Gly Phe Cys Cys Ser Cys Val Ala
405 410 415
Gly Tyr Thr Gly Asn Gly Arg Gln Cys Val Ala Glu Gly Ser Pro Gln
420 425 430
Arg Val Asn Gly Lys Val Lys Gly Arg Ile Phe Val Gly Ser Ser Gln
435 440 445
Val Pro Ile Val Phe Glu Asn Thr Asp Leu His Ser Tyr Val Val Met
450 455 460
Asn His Gly Arg Ser Tyr Thr Ala Ile Ser Thr Ile Pro Glu Thr Val
465 470 475 480
Gly Tyr Ser Leu Leu Pro Leu Ala Pro Val Gly Gly Ile Ile Gly Trp
485 490 495
Met Phe Ala Val Glu Gln Asp Gly Phe Lys Asn Gly Phe Ser Ile Thr
500 505 510
Gly Gly Glu Phe Thr Arg Gln Ala Glu Val Thr Phe Val Gly His Pro
515 520 525
Gly Asn Leu Val Ile Lys Gln Arg Phe Ser Gly Ile Asp Glu His Gly
530 535 540
His Leu Thr Ile Asp Thr Glu Leu Glu Gly Arg Val Pro Gln Ile Pro
545 550 555 560
Phe Gly Ser Ser Val His Ile Glu Pro Tyr Thr Glu Leu Tyr His Tyr
565 570 575
Ser Thr Ser Val Ile Thr Ser Ser Ser Thr Arg Glu Tyr Thr Val Thr
580 585 590
Glu Pro Glu Arg Asp Gly Ala Ser Pro Ser Arg Ile Tyr Thr Tyr Gln
595 600 605
Trp Arg Gln Thr Ile Thr Phe Gln Glu Cys Val His Asp Asp Ser Arg
610 615 620
Pro Ala Leu Pro Ser Thr Gln Gln Leu Ser Val Asp Ser Val Phe Val
625 630 635 640
Leu Tyr Asn Gln Glu Glu Lys Ile Leu Arg Tyr Ala Leu Ser Asn Ser
645 650 655
Ile Gly Pro Val Arg Glu Gly Ser Pro Asp Ala Leu Gln Asn Pro Cys
660 665 670
Tyr Ile Gly Thr His Gly Cys Asp Thr Asn Ala Ala Cys Arg Pro Gly
675 680 685
Pro Arg Thr Gln Phe Thr Cys Glu Cys Ser Ile Gly Phe Arg Gly Asp
690 695 700
Gly Arg Thr Cys Tyr Asp Ile Asp Glu Cys Ser Glu Gln Pro Ser Val
705 710 715 720
Cys Gly Ser His Thr Ile Cys Asn Asn His Pro Gly Thr Phe Arg Cys
725 730 735
Glu Cys Val Glu Gly Tyr Gln Phe Ser Asp Glu Gly Thr Cys Val Ala
740 745 750
Val Val Asp Gln Arg Pro Ile Asn Tyr Cys Glu Thr Gly Leu His Asn
755 760 765
Cys Asp Ile Pro Gln Arg Ala Gln Cys Ile Tyr Thr Gly Gly Ser Ser
770 775 780
Tyr Thr Cys Ser Cys Leu Pro Gly Phe Ser Gly Asp Gly Gln Ala Cys
785 790 795 800
Gln Asp Val Asp Glu Cys Gln Pro Ser Arg Cys His Pro Asp Ala Phe
805 810 815
Cys Tyr Asn Thr Pro Gly Ser Phe Thr Cys Gln Cys Lys Pro Gly Tyr
820 825 830
Gln Gly Asp Gly Phe Arg Cys Val Pro Gly Glu Val Glu Lys Thr Arg
835 840 845
Cys Gln His Glu Arg Glu His Ile Leu Gly Ala Ala Gly Ala Thr Asp
850 855 860
Pro Gln Arg Pro Ile Pro Pro Gly Leu Phe Val Pro Glu Cys Asp Ala
865 870 875 880
His Gly His Tyr Ala Pro Thr Gln Cys His Gly Ser Thr Gly Tyr Cys
885 890 895
Trp Cys Val Asp Arg Asp Gly Arg Glu Val Glu Gly Thr Arg Thr Arg
900 905 910
Pro Gly Met Thr Pro Pro Cys Leu Ser Thr Val Ala Pro Pro Ile His
915 920 925
Gln Gly Pro Ala Val Pro Thr Ala Val Ile Pro Leu Pro Pro Gly Thr
930 935 940
His Leu Leu Phe Ala Gln Thr Gly Lys Ile Glu Arg Leu Pro Leu Glu
945 950 955 960
Gly Asn Thr Met Arg Lys Thr Glu Ala Lys Ala Phe Leu His Val Pro
965 970 975
Ala Lys Val Ile Ile Gly Leu Ala Phe Asp Cys Val Asp Lys Met Val
980 985 990
Tyr Trp Thr Asp Ile Thr Glu Pro Ser Ile Gly Arg Ala Ser Leu His
995 1000 1005
Gly Gly Glu Pro Thr Thr Ile Ile Arg Gln Asp Leu Gly Ser Pro
1010 1015 1020
Glu Gly Ile Ala Val Asp His Leu Gly Arg Asn Ile Phe Trp Thr
1025 1030 1035
Asp Ser Asn Leu Asp Arg Ile Glu Val Ala Lys Leu Asp Gly Thr
1040 1045 1050
Gln Arg Arg Val Leu Phe Glu Thr Asp Leu Val Asn Pro Arg Gly
1055 1060 1065
Ile Val Thr Asp Ser Val Arg Gly Asn Leu Tyr Trp Thr Asp Trp
1070 1075 1080
Asn Arg Asp Asn Pro Lys Ile Glu Thr Ser Tyr Met Asp Gly Thr
1085 1090 1095
Asn Arg Arg Ile Leu Val Gln Asp Asp Leu Gly Leu Pro Asn Gly
1100 1105 1110
Leu Thr Phe Asp Ala Phe Ser Ser Gln Leu Cys Trp Val Asp Ala
1115 1120 1125
Gly Thr Asn Arg Ala Glu Cys Leu Asn Pro Ser Gln Pro Ser Arg
1130 1135 1140
Arg Lys Ala Leu Glu Gly Leu Gln Tyr Pro Phe Ala Val Thr Ser
1145 1150 1155
Tyr Gly Lys Asn Leu Tyr Phe Thr Asp Trp Lys Met Asn Ser Val
1160 1165 1170
Val Ala Leu Asp Leu Ala Ile Ser Lys Glu Thr Asp Ala Phe Gln
1175 1180 1185
Pro His Lys Gln Thr Arg Leu Tyr Gly Ile Thr Thr Ala Leu Ser
1190 1195 1200
Gln Cys Pro Gln Gly His Asn Tyr Cys Ser Val Asn Asn Gly Gly
1205 1210 1215
Cys Thr His Leu Cys Leu Ala Thr Pro Gly Ser Arg Thr Cys Arg
1220 1225 1230
Cys Pro Asp Asn Thr Leu Gly Val Asp Cys Ile Glu Gln Lys
1235 1240 1245
<210> 104
<211> 3075
<212> ПРТ
<213> Homo sapiens
<400> 104
Met Arg Gly Gly Val Leu Leu Val Leu Leu Leu Cys Val Ala Ala Gln
1 5 10 15
Cys Arg Gln Arg Gly Leu Phe Pro Ala Ile Leu Asn Leu Ala Ser Asn
20 25 30
Ala His Ile Ser Thr Asn Ala Thr Cys Gly Glu Lys Gly Pro Glu Met
35 40 45
Phe Cys Lys Leu Val Glu His Val Pro Gly Arg Pro Val Arg Asn Pro
50 55 60
Gln Cys Arg Ile Cys Asp Gly Asn Ser Ala Asn Pro Arg Glu Arg His
65 70 75 80
Pro Ile Ser His Ala Ile Asp Gly Thr Asn Asn Trp Trp Gln Ser Pro
85 90 95
Ser Ile Gln Asn Gly Arg Glu Tyr His Trp Val Thr Ile Thr Leu Asp
100 105 110
Leu Arg Gln Val Phe Gln Val Ala Tyr Val Ile Ile Lys Ala Ala Asn
115 120 125
Ala Pro Arg Pro Gly Asn Trp Ile Leu Glu Arg Ser Leu Asp Gly Thr
130 135 140
Thr Phe Ser Pro Trp Gln Tyr Tyr Ala Val Ser Asp Ser Glu Cys Leu
145 150 155 160
Ser Arg Tyr Asn Ile Thr Pro Arg Arg Gly Pro Pro Thr Tyr Arg Ala
165 170 175
Asp Asp Glu Val Ile Cys Thr Ser Tyr Tyr Ser Arg Leu Val Pro Leu
180 185 190
Glu His Gly Glu Ile His Thr Ser Leu Ile Asn Gly Arg Pro Ser Ala
195 200 205
Asp Asp Leu Ser Pro Lys Leu Leu Glu Phe Thr Ser Ala Arg Tyr Ile
210 215 220
Arg Leu Arg Leu Gln Arg Ile Arg Thr Leu Asn Ala Asp Leu Met Thr
225 230 235 240
Leu Ser His Arg Glu Pro Lys Glu Leu Asp Pro Ile Val Thr Arg Arg
245 250 255
Tyr Tyr Tyr Ser Ile Lys Asp Ile Ser Val Gly Gly Met Cys Ile Cys
260 265 270
Tyr Gly His Ala Ser Ser Cys Pro Trp Asp Glu Thr Thr Lys Lys Leu
275 280 285
Gln Cys Gln Cys Glu His Asn Thr Cys Gly Glu Ser Cys Asn Arg Cys
290 295 300
Cys Pro Gly Tyr His Gln Gln Pro Trp Arg Pro Gly Thr Val Ser Ser
305 310 315 320
Gly Asn Thr Cys Glu Ala Cys Asn Cys His Asn Lys Ala Lys Asp Cys
325 330 335
Tyr Tyr Asp Glu Ser Val Ala Lys Gln Lys Lys Ser Leu Asn Thr Ala
340 345 350
Gly Gln Phe Arg Gly Gly Gly Val Cys Ile Asn Cys Leu Gln Asn Thr
355 360 365
Met Gly Ile Asn Cys Glu Thr Cys Ile Asp Gly Tyr Tyr Arg Pro His
370 375 380
Lys Val Ser Pro Tyr Glu Asp Glu Pro Cys Arg Pro Cys Asn Cys Asp
385 390 395 400
Pro Val Gly Ser Leu Ser Ser Val Cys Ile Lys Asp Asp Leu His Ser
405 410 415
Asp Leu His Asn Gly Lys Gln Pro Gly Gln Cys Pro Cys Lys Glu Gly
420 425 430
Tyr Thr Gly Glu Lys Cys Asp Arg Cys Gln Leu Gly Tyr Lys Asp Tyr
435 440 445
Pro Thr Cys Val Ser Cys Gly Cys Asn Pro Val Gly Ser Ala Ser Asp
450 455 460
Glu Pro Cys Thr Gly Pro Cys Val Cys Lys Glu Asn Val Glu Gly Lys
465 470 475 480
Ala Cys Asp Arg Cys Lys Pro Gly Phe Tyr Asn Leu Lys Glu Lys Asn
485 490 495
Pro Arg Gly Cys Ser Glu Cys Phe Cys Phe Gly Val Ser Asp Val Cys
500 505 510
Ser Ser Leu Ser Trp Pro Val Gly Gln Val Asn Ser Met Ser Gly Trp
515 520 525
Leu Val Thr Asp Leu Ile Ser Pro Arg Lys Ile Pro Ser Gln Gln Asp
530 535 540
Ala Leu Gly Gly Arg His Gln Val Ser Ile Asn Asn Thr Ala Val Met
545 550 555 560
Gln Arg Leu Ala Pro Lys Tyr Tyr Trp Ala Ala Pro Glu Ala Tyr Leu
565 570 575
Gly Asn Lys Leu Thr Ala Phe Gly Gly Phe Leu Lys Tyr Thr Val Ser
580 585 590
Tyr Asp Ile Pro Val Glu Thr Val Asp Ser Asn Leu Met Ser His Ala
595 600 605
Asp Val Ile Ile Lys Gly Asn Gly Leu Thr Leu Ser Thr Gln Ala Glu
610 615 620
Gly Leu Ser Leu Gln Pro Tyr Glu Glu Tyr Leu Asn Val Val Arg Leu
625 630 635 640
Val Pro Glu Asn Phe Gln Asp Phe His Ser Lys Arg Gln Ile Asp Arg
645 650 655
Asp Gln Leu Met Thr Val Leu Ala Asn Val Thr His Leu Leu Ile Arg
660 665 670
Ala Asn Tyr Asn Ser Ala Lys Met Ala Leu Tyr Arg Leu Glu Ser Val
675 680 685
Ser Leu Asp Ile Ala Ser Ser Asn Ala Ile Asp Leu Val Val Ala Ala
690 695 700
Asp Val Glu His Cys Glu Cys Pro Gln Gly Tyr Thr Gly Thr Ser Cys
705 710 715 720
Glu Ser Cys Leu Ser Gly Tyr Tyr Arg Val Asp Gly Ile Leu Phe Gly
725 730 735
Gly Ile Cys Gln Pro Cys Glu Cys His Gly His Ala Ala Glu Cys Asn
740 745 750
Val His Gly Val Cys Ile Ala Cys Ala His Asn Thr Thr Gly Val His
755 760 765
Cys Glu Gln Cys Leu Pro Gly Phe Tyr Gly Glu Pro Ser Arg Gly Thr
770 775 780
Pro Gly Asp Cys Gln Pro Cys Ala Cys Pro Leu Thr Ile Ala Ser Asn
785 790 795 800
Asn Phe Ser Pro Thr Cys His Leu Asn Asp Gly Asp Glu Val Val Cys
805 810 815
Asp Trp Cys Ala Pro Gly Tyr Ser Gly Ala Trp Cys Glu Arg Cys Ala
820 825 830
Asp Gly Tyr Tyr Gly Asn Pro Thr Val Pro Gly Glu Ser Cys Val Pro
835 840 845
Cys Asp Cys Ser Gly Asn Val Asp Pro Ser Glu Ala Gly His Cys Asp
850 855 860
Ser Val Thr Gly Glu Cys Leu Lys Cys Leu Gly Asn Thr Asp Gly Ala
865 870 875 880
His Cys Glu Arg Cys Ala Asp Gly Phe Tyr Gly Asp Ala Val Thr Ala
885 890 895
Lys Asn Cys Arg Ala Cys Glu Cys His Val Lys Gly Ser His Ser Ala
900 905 910
Val Cys His Leu Glu Thr Gly Leu Cys Asp Cys Lys Pro Asn Val Thr
915 920 925
Gly Gln Gln Cys Asp Gln Cys Leu His Gly Tyr Tyr Gly Leu Asp Ser
930 935 940
Gly His Gly Cys Arg Pro Cys Asn Cys Ser Val Ala Gly Ser Val Ser
945 950 955 960
Asp Gly Cys Thr Asp Glu Gly Gln Cys His Cys Val Pro Gly Val Ala
965 970 975
Gly Lys Arg Cys Asp Arg Cys Ala His Gly Phe Tyr Ala Tyr Gln Asp
980 985 990
Gly Ser Cys Thr Pro Cys Asp Cys Pro His Thr Gln Asn Thr Cys Asp
995 1000 1005
Pro Glu Thr Gly Glu Cys Val Cys Pro Pro His Thr Gln Gly Val
1010 1015 1020
Lys Cys Glu Glu Cys Glu Asp Gly His Trp Gly Tyr Asp Ala Glu
1025 1030 1035
Val Gly Cys Gln Ala Cys Asn Cys Ser Leu Val Gly Ser Thr His
1040 1045 1050
His Arg Cys Asp Val Val Thr Gly His Cys Gln Cys Lys Ser Lys
1055 1060 1065
Phe Gly Gly Arg Ala Cys Asp Gln Cys Ser Leu Gly Tyr Arg Asp
1070 1075 1080
Phe Pro Asp Cys Val Pro Cys Asp Cys Asp Leu Arg Gly Thr Ser
1085 1090 1095
Gly Asp Ala Cys Asn Leu Glu Gln Gly Leu Cys Gly Cys Val Glu
1100 1105 1110
Glu Thr Gly Ala Cys Pro Cys Lys Glu Asn Val Phe Gly Pro Gln
1115 1120 1125
Cys Asn Glu Cys Arg Glu Gly Thr Phe Ala Leu Arg Ala Asp Asn
1130 1135 1140
Pro Leu Gly Cys Ser Pro Cys Phe Cys Ser Gly Leu Ser His Leu
1145 1150 1155
Cys Ser Glu Leu Glu Asp Tyr Val Arg Thr Pro Val Thr Leu Gly
1160 1165 1170
Ser Asp Gln Pro Leu Leu Arg Val Val Ser Gln Ser Asn Leu Arg
1175 1180 1185
Gly Thr Thr Glu Gly Val Tyr Tyr Gln Ala Pro Asp Phe Leu Leu
1190 1195 1200
Asp Ala Ala Thr Val Arg Gln His Ile Arg Ala Glu Pro Phe Tyr
1205 1210 1215
Trp Arg Leu Pro Gln Gln Phe Gln Gly Asp Gln Leu Met Ala Tyr
1220 1225 1230
Gly Gly Lys Leu Lys Tyr Ser Val Ala Phe Tyr Ser Leu Asp Gly
1235 1240 1245
Val Gly Thr Ser Asn Phe Glu Pro Gln Val Leu Ile Lys Gly Gly
1250 1255 1260
Arg Ile Arg Lys Gln Val Ile Tyr Met Asp Ala Pro Ala Pro Glu
1265 1270 1275
Asn Gly Val Arg Gln Glu Gln Glu Val Ala Met Arg Glu Asn Phe
1280 1285 1290
Trp Lys Tyr Phe Asn Ser Val Ser Glu Lys Pro Val Thr Arg Glu
1295 1300 1305
Asp Phe Met Ser Val Leu Ser Asp Ile Glu Tyr Ile Leu Ile Lys
1310 1315 1320
Ala Ser Tyr Gly Gln Gly Leu Gln Gln Ser Arg Ile Ser Asp Ile
1325 1330 1335
Ser Met Glu Val Gly Arg Lys Ala Glu Lys Leu His Pro Glu Glu
1340 1345 1350
Glu Val Ala Ser Leu Leu Glu Asn Cys Val Cys Pro Pro Gly Thr
1355 1360 1365
Val Gly Phe Ser Cys Gln Asp Cys Ala Pro Gly Tyr His Arg Gly
1370 1375 1380
Lys Leu Pro Ala Gly Ser Asp Arg Gly Pro Arg Pro Leu Val Ala
1385 1390 1395
Pro Cys Val Pro Cys Ser Cys Asn Asn His Ser Asp Thr Cys Asp
1400 1405 1410
Pro Asn Thr Gly Lys Cys Leu Asn Cys Gly Asp Asn Thr Ala Gly
1415 1420 1425
Asp His Cys Asp Val Cys Thr Ser Gly Tyr Tyr Gly Lys Val Thr
1430 1435 1440
Gly Ser Ala Ser Asp Cys Ala Leu Cys Ala Cys Pro His Ser Pro
1445 1450 1455
Pro Ala Ser Phe Ser Pro Thr Cys Val Leu Glu Gly Asp His Asp
1460 1465 1470
Phe Arg Cys Asp Ala Cys Leu Leu Gly Tyr Glu Gly Lys His Cys
1475 1480 1485
Glu Arg Cys Ser Ser Ser Tyr Tyr Gly Asn Pro Gln Thr Pro Gly
1490 1495 1500
Gly Ser Cys Gln Lys Cys Asp Cys Asn Pro His Gly Ser Val His
1505 1510 1515
Gly Asp Cys Asp Arg Thr Ser Gly Gln Cys Val Cys Arg Leu Gly
1520 1525 1530
Ala Ser Gly Leu Arg Cys Asp Glu Cys Glu Pro Arg His Ile Leu
1535 1540 1545
Met Glu Thr Asp Cys Val Ser Cys Asp Asp Glu Cys Val Gly Val
1550 1555 1560
Leu Leu Asn Asp Leu Asp Glu Ile Gly Asp Ala Val Leu Ser Leu
1565 1570 1575
Asn Leu Thr Gly Ile Ile Pro Val Pro Tyr Gly Ile Leu Ser Asn
1580 1585 1590
Leu Glu Asn Thr Thr Lys Tyr Leu Gln Glu Ser Leu Leu Lys Glu
1595 1600 1605
Asn Met Gln Lys Asp Leu Gly Lys Ile Lys Leu Glu Gly Val Ala
1610 1615 1620
Glu Glu Thr Asp Asn Leu Gln Lys Lys Leu Thr Arg Met Leu Ala
1625 1630 1635
Ser Thr Gln Lys Val Asn Arg Ala Thr Glu Arg Ile Phe Lys Glu
1640 1645 1650
Ser Gln Asp Leu Ala Ile Ala Ile Glu Arg Leu Gln Met Ser Ile
1655 1660 1665
Thr Glu Ile Met Glu Lys Thr Thr Leu Asn Gln Thr Leu Asp Glu
1670 1675 1680
Asp Phe Leu Leu Pro Asn Ser Thr Leu Gln Asn Met Gln Gln Asn
1685 1690 1695
Gly Thr Ser Leu Leu Glu Ile Met Gln Ile Arg Asp Phe Thr Gln
1700 1705 1710
Leu His Gln Asn Ala Thr Leu Glu Leu Lys Ala Ala Glu Asp Leu
1715 1720 1725
Leu Ser Gln Ile Gln Glu Asn Tyr Gln Lys Pro Leu Glu Glu Leu
1730 1735 1740
Glu Val Leu Lys Glu Ala Ala Ser His Val Leu Ser Lys His Asn
1745 1750 1755
Asn Glu Leu Lys Ala Ala Glu Ala Leu Val Arg Glu Ala Glu Ala
1760 1765 1770
Lys Met Gln Glu Ser Asn His Leu Leu Leu Met Val Asn Ala Asn
1775 1780 1785
Leu Arg Glu Phe Ser Asp Lys Lys Leu His Val Gln Glu Glu Gln
1790 1795 1800
Asn Leu Thr Ser Glu Leu Ile Val Gln Gly Arg Gly Leu Ile Asp
1805 1810 1815
Ala Ala Ala Ala Gln Thr Asp Ala Val Gln Asp Ala Leu Glu His
1820 1825 1830
Leu Glu Asp His Gln Asp Lys Leu Leu Leu Trp Ser Ala Lys Ile
1835 1840 1845
Arg His His Ile Asp Asp Leu Val Met His Met Ser Gln Arg Asn
1850 1855 1860
Ala Val Asp Leu Val Tyr Arg Ala Glu Asp His Ala Ala Glu Phe
1865 1870 1875
Gln Arg Leu Ala Asp Val Leu Tyr Ser Gly Leu Glu Asn Ile Arg
1880 1885 1890
Asn Val Ser Leu Asn Ala Thr Ser Ala Ala Tyr Val His Tyr Asn
1895 1900 1905
Ile Gln Ser Leu Ile Glu Glu Ser Glu Glu Leu Ala Arg Asp Ala
1910 1915 1920
His Arg Thr Val Thr Glu Thr Ser Leu Leu Ser Glu Ser Leu Val
1925 1930 1935
Ser Asn Gly Lys Ala Ala Val Gln Arg Ser Ser Arg Phe Leu Lys
1940 1945 1950
Glu Gly Asn Asn Leu Ser Arg Lys Leu Pro Gly Ile Ala Leu Glu
1955 1960 1965
Leu Ser Glu Leu Arg Asn Lys Thr Asn Arg Phe Gln Glu Asn Ala
1970 1975 1980
Val Glu Ile Thr Arg Gln Thr Asn Glu Ser Leu Leu Ile Leu Arg
1985 1990 1995
Ala Ile Pro Lys Gly Ile Arg Asp Lys Gly Ala Lys Thr Lys Glu
2000 2005 2010
Leu Ala Thr Ser Ala Ser Gln Ser Ala Val Ser Thr Leu Arg Asp
2015 2020 2025
Val Ala Gly Leu Ser Gln Glu Leu Leu Asn Thr Ser Ala Ser Leu
2030 2035 2040
Ser Arg Val Asn Thr Thr Leu Arg Glu Thr His Gln Leu Leu Gln
2045 2050 2055
Asp Ser Thr Met Ala Thr Leu Leu Ala Gly Arg Lys Val Lys Asp
2060 2065 2070
Val Glu Ile Gln Ala Asn Leu Leu Phe Asp Arg Leu Lys Pro Leu
2075 2080 2085
Lys Met Leu Glu Glu Asn Leu Ser Arg Asn Leu Ser Glu Ile Lys
2090 2095 2100
Leu Leu Ile Ser Gln Ala Arg Lys Gln Ala Ala Ser Ile Lys Val
2105 2110 2115
Ala Val Ser Ala Asp Arg Asp Cys Ile Arg Ala Tyr Gln Pro Gln
2120 2125 2130
Ile Ser Ser Thr Asn Tyr Asn Thr Leu Thr Leu Asn Val Lys Thr
2135 2140 2145
Gln Glu Pro Asp Asn Leu Leu Phe Tyr Leu Gly Ser Ser Thr Ala
2150 2155 2160
Ser Asp Phe Leu Ala Val Glu Met Arg Arg Gly Arg Val Ala Phe
2165 2170 2175
Leu Trp Asp Leu Gly Ser Gly Ser Thr Arg Leu Glu Phe Pro Asp
2180 2185 2190
Phe Pro Ile Asp Asp Asn Arg Trp His Ser Ile His Val Ala Arg
2195 2200 2205
Phe Gly Asn Ile Gly Ser Leu Ser Val Lys Glu Met Ser Ser Asn
2210 2215 2220
Gln Lys Ser Pro Thr Lys Thr Ser Lys Ser Pro Gly Thr Ala Asn
2225 2230 2235
Val Leu Asp Val Asn Asn Ser Thr Leu Met Phe Val Gly Gly Leu
2240 2245 2250
Gly Gly Gln Ile Lys Lys Ser Pro Ala Val Lys Val Thr His Phe
2255 2260 2265
Lys Gly Cys Leu Gly Glu Ala Phe Leu Asn Gly Lys Ser Ile Gly
2270 2275 2280
Leu Trp Asn Tyr Ile Glu Arg Glu Gly Lys Cys Arg Gly Cys Phe
2285 2290 2295
Gly Ser Ser Gln Asn Glu Asp Pro Ser Phe His Phe Asp Gly Ser
2300 2305 2310
Gly Tyr Ser Val Val Glu Lys Ser Leu Pro Ala Thr Val Thr Gln
2315 2320 2325
Ile Ile Met Leu Phe Asn Thr Phe Ser Pro Asn Gly Leu Leu Leu
2330 2335 2340
Tyr Leu Gly Ser Tyr Gly Thr Lys Asp Phe Leu Ser Ile Glu Leu
2345 2350 2355
Phe Arg Gly Arg Val Lys Val Met Thr Asp Leu Gly Ser Gly Pro
2360 2365 2370
Ile Thr Leu Leu Thr Asp Arg Arg Tyr Asn Asn Gly Thr Trp Tyr
2375 2380 2385
Lys Ile Ala Phe Gln Arg Asn Arg Lys Gln Gly Val Leu Ala Val
2390 2395 2400
Ile Asp Ala Tyr Asn Thr Ser Asn Lys Glu Thr Lys Gln Gly Glu
2405 2410 2415
Thr Pro Gly Ala Ser Ser Asp Leu Asn Arg Leu Asp Lys Asp Pro
2420 2425 2430
Ile Tyr Val Gly Gly Leu Pro Arg Ser Arg Val Val Arg Arg Gly
2435 2440 2445
Val Thr Thr Lys Ser Phe Val Gly Cys Ile Lys Asn Leu Glu Ile
2450 2455 2460
Ser Arg Ser Thr Phe Asp Leu Leu Arg Asn Ser Tyr Gly Val Arg
2465 2470 2475
Lys Gly Cys Leu Leu Glu Pro Ile Arg Ser Val Ser Phe Leu Lys
2480 2485 2490
Gly Gly Tyr Ile Glu Leu Pro Pro Lys Ser Leu Ser Pro Glu Ser
2495 2500 2505
Glu Trp Leu Val Thr Phe Ala Thr Thr Asn Ser Ser Gly Ile Ile
2510 2515 2520
Leu Ala Ala Leu Gly Gly Asp Val Glu Lys Arg Gly Asp Arg Glu
2525 2530 2535
Glu Ala His Val Pro Phe Phe Ser Val Met Leu Ile Gly Gly Asn
2540 2545 2550
Ile Glu Val His Val Asn Pro Gly Asp Gly Thr Gly Leu Arg Lys
2555 2560 2565
Ala Leu Leu His Ala Pro Thr Gly Thr Cys Ser Asp Gly Gln Ala
2570 2575 2580
His Ser Ile Ser Leu Val Arg Asn Arg Arg Ile Ile Thr Val Gln
2585 2590 2595
Leu Asp Glu Asn Asn Pro Val Glu Met Lys Leu Gly Thr Leu Val
2600 2605 2610
Glu Ser Arg Thr Ile Asn Val Ser Asn Leu Tyr Val Gly Gly Ile
2615 2620 2625
Pro Glu Gly Glu Gly Thr Ser Leu Leu Thr Met Arg Arg Ser Phe
2630 2635 2640
His Gly Cys Ile Lys Asn Leu Ile Phe Asn Leu Glu Leu Leu Asp
2645 2650 2655
Phe Asn Ser Ala Val Gly His Glu Gln Val Asp Leu Asp Thr Cys
2660 2665 2670
Trp Leu Ser Glu Arg Pro Lys Leu Ala Pro Asp Ala Glu Asp Ser
2675 2680 2685
Lys Leu Leu Pro Glu Pro Arg Ala Phe Pro Glu Gln Cys Val Val
2690 2695 2700
Asp Ala Ala Leu Glu Tyr Val Pro Gly Ala His Gln Phe Gly Leu
2705 2710 2715
Thr Gln Asn Ser His Phe Ile Leu Pro Phe Asn Gln Ser Ala Val
2720 2725 2730
Arg Lys Lys Leu Ser Val Glu Leu Ser Ile Arg Thr Phe Ala Ser
2735 2740 2745
Ser Gly Leu Ile Tyr Tyr Met Ala His Gln Asn Gln Ala Asp Tyr
2750 2755 2760
Ala Val Leu Gln Leu His Gly Gly Arg Leu His Phe Met Phe Asp
2765 2770 2775
Leu Gly Lys Gly Arg Thr Lys Val Ser His Pro Ala Leu Leu Ser
2780 2785 2790
Asp Gly Lys Trp His Thr Val Lys Thr Asp Tyr Val Lys Arg Lys
2795 2800 2805
Gly Phe Ile Thr Val Asp Gly Arg Glu Ser Pro Met Val Thr Val
2810 2815 2820
Val Gly Asp Gly Thr Met Leu Asp Val Glu Gly Leu Phe Tyr Leu
2825 2830 2835
Gly Gly Leu Pro Ser Gln Tyr Gln Ala Arg Lys Ile Gly Asn Ile
2840 2845 2850
Thr His Ser Ile Pro Ala Cys Ile Gly Asp Val Thr Val Asn Ser
2855 2860 2865
Lys Gln Leu Asp Lys Asp Ser Pro Val Ser Ala Phe Thr Val Asn
2870 2875 2880
Arg Cys Tyr Ala Val Ala Gln Glu Gly Thr Tyr Phe Asp Gly Ser
2885 2890 2895
Gly Tyr Ala Ala Leu Val Lys Glu Gly Tyr Lys Val Gln Ser Asp
2900 2905 2910
Val Asn Ile Thr Leu Glu Phe Arg Thr Ser Ser Gln Asn Gly Val
2915 2920 2925
Leu Leu Gly Ile Ser Thr Ala Lys Val Asp Ala Ile Gly Leu Glu
2930 2935 2940
Leu Val Asp Gly Lys Val Leu Phe His Val Asn Asn Gly Ala Gly
2945 2950 2955
Arg Ile Thr Ala Ala Tyr Glu Pro Lys Thr Ala Thr Val Leu Cys
2960 2965 2970
Asp Gly Lys Trp His Thr Leu Gln Ala Asn Lys Ser Lys His Arg
2975 2980 2985
Ile Thr Leu Ile Val Asp Gly Asn Ala Val Gly Ala Glu Ser Pro
2990 2995 3000
His Thr Gln Ser Thr Ser Val Asp Thr Asn Asn Pro Ile Tyr Val
3005 3010 3015
Gly Gly Tyr Pro Ala Gly Val Lys Gln Lys Cys Leu Arg Ser Gln
3020 3025 3030
Thr Ser Phe Arg Gly Cys Leu Arg Lys Leu Ala Leu Ile Lys Ser
3035 3040 3045
Pro Gln Val Gln Ser Phe Asp Phe Ser Arg Ala Phe Glu Leu His
3050 3055 3060
Gly Val Phe Leu His Ser Cys Pro Gly Thr Glu Ser
3065 3070 3075
<210> 105
<211> 158
<212> ПРТ
<213> Homo sapiens
<400> 105
Met Gly Lys Ile Ser Ser Leu Pro Thr Gln Leu Phe Lys Cys Cys Phe
1 5 10 15
Cys Asp Phe Leu Lys Val Lys Met His Thr Met Ser Ser Ser His Leu
20 25 30
Phe Tyr Leu Ala Leu Cys Leu Leu Thr Phe Thr Ser Ser Ala Thr Ala
35 40 45
Gly Pro Glu Thr Leu Cys Gly Ala Glu Leu Val Asp Ala Leu Gln Phe
50 55 60
Val Cys Gly Asp Arg Gly Phe Tyr Phe Asn Lys Pro Thr Gly Tyr Gly
65 70 75 80
Ser Ser Ser Arg Arg Ala Pro Gln Thr Gly Ile Val Asp Glu Cys Cys
85 90 95
Phe Arg Ser Cys Asp Leu Arg Arg Leu Glu Met Tyr Cys Ala Pro Leu
100 105 110
Lys Pro Ala Lys Ser Ala Arg Ser Val Arg Ala Gln Arg His Thr Asp
115 120 125
Met Pro Lys Thr Gln Lys Tyr Gln Pro Pro Ser Thr Asn Lys Asn Thr
130 135 140
Lys Ser Gln Arg Arg Lys Gly Ser Thr Phe Glu Glu Arg Lys
145 150 155
<210> 106
<211> 155
<212> ПРТ
<213> Homo sapiens
<400> 106
Met Ala Glu Gly Glu Ile Thr Thr Phe Thr Ala Leu Thr Glu Lys Phe
1 5 10 15
Asn Leu Pro Pro Gly Asn Tyr Lys Lys Pro Lys Leu Leu Tyr Cys Ser
20 25 30
Asn Gly Gly His Phe Leu Arg Ile Leu Pro Asp Gly Thr Val Asp Gly
35 40 45
Thr Arg Asp Arg Ser Asp Gln His Ile Gln Leu Gln Leu Ser Ala Glu
50 55 60
Ser Val Gly Glu Val Tyr Ile Lys Ser Thr Glu Thr Gly Gln Tyr Leu
65 70 75 80
Ala Met Asp Thr Asp Gly Leu Leu Tyr Gly Ser Gln Thr Pro Asn Glu
85 90 95
Glu Cys Leu Phe Leu Glu Arg Leu Glu Glu Asn His Tyr Asn Thr Tyr
100 105 110
Ile Ser Lys Lys His Ala Glu Lys Asn Trp Phe Val Gly Leu Lys Lys
115 120 125
Asn Gly Ser Cys Lys Arg Gly Pro Arg Thr His Tyr Gly Gln Lys Ala
130 135 140
Ile Leu Phe Leu Pro Leu Pro Val Ser Ser Asp
145 150 155
<210> 107
<211> 288
<212> ПРТ
<213> Homo sapiens
<400> 107
Met Val Gly Val Gly Gly Gly Asp Val Glu Asp Val Thr Pro Arg Pro
1 5 10 15
Gly Gly Cys Gln Ile Ser Gly Arg Gly Ala Arg Gly Cys Asn Gly Ile
20 25 30
Pro Gly Ala Ala Ala Trp Glu Ala Ala Leu Pro Arg Arg Arg Pro Arg
35 40 45
Arg His Pro Ser Val Asn Pro Arg Ser Arg Ala Ala Gly Ser Pro Arg
50 55 60
Thr Arg Gly Arg Arg Thr Glu Glu Arg Pro Ser Gly Ser Arg Leu Gly
65 70 75 80
Asp Arg Gly Arg Gly Arg Ala Leu Pro Gly Gly Arg Leu Gly Gly Arg
85 90 95
Gly Arg Gly Arg Ala Pro Glu Arg Val Gly Gly Arg Gly Arg Gly Arg
100 105 110
Gly Thr Ala Ala Pro Arg Ala Ala Pro Ala Ala Arg Gly Ser Arg Pro
115 120 125
Gly Pro Ala Gly Thr Met Ala Ala Gly Ser Ile Thr Thr Leu Pro Ala
130 135 140
Leu Pro Glu Asp Gly Gly Ser Gly Ala Phe Pro Pro Gly His Phe Lys
145 150 155 160
Asp Pro Lys Arg Leu Tyr Cys Lys Asn Gly Gly Phe Phe Leu Arg Ile
165 170 175
His Pro Asp Gly Arg Val Asp Gly Val Arg Glu Lys Ser Asp Pro His
180 185 190
Ile Lys Leu Gln Leu Gln Ala Glu Glu Arg Gly Val Val Ser Ile Lys
195 200 205
Gly Val Cys Ala Asn Arg Tyr Leu Ala Met Lys Glu Asp Gly Arg Leu
210 215 220
Leu Ala Ser Lys Cys Val Thr Asp Glu Cys Phe Phe Phe Glu Arg Leu
225 230 235 240
Glu Ser Asn Asn Tyr Asn Thr Tyr Arg Ser Arg Lys Tyr Thr Ser Trp
245 250 255
Tyr Val Ala Leu Lys Arg Thr Gly Gln Tyr Lys Leu Gly Ser Lys Thr
260 265 270
Gly Pro Gly Gln Lys Ala Ile Leu Phe Leu Pro Met Ser Ala Lys Ser
275 280 285
<210> 108
<211> 390
<212> ПРТ
<213> Homo sapiens
<400> 108
Met Pro Pro Ser Gly Leu Arg Leu Leu Pro Leu Leu Leu Pro Leu Leu
1 5 10 15
Trp Leu Leu Val Leu Thr Pro Gly Arg Pro Ala Ala Gly Leu Ser Thr
20 25 30
Cys Lys Thr Ile Asp Met Glu Leu Val Lys Arg Lys Arg Ile Glu Ala
35 40 45
Ile Arg Gly Gln Ile Leu Ser Lys Leu Arg Leu Ala Ser Pro Pro Ser
50 55 60
Gln Gly Glu Val Pro Pro Gly Pro Leu Pro Glu Ala Val Leu Ala Leu
65 70 75 80
Tyr Asn Ser Thr Arg Asp Arg Val Ala Gly Glu Ser Ala Glu Pro Glu
85 90 95
Pro Glu Pro Glu Ala Asp Tyr Tyr Ala Lys Glu Val Thr Arg Val Leu
100 105 110
Met Val Glu Thr His Asn Glu Ile Tyr Asp Lys Phe Lys Gln Ser Thr
115 120 125
His Ser Ile Tyr Met Phe Phe Asn Thr Ser Glu Leu Arg Glu Ala Val
130 135 140
Pro Glu Pro Val Leu Leu Ser Arg Ala Glu Leu Arg Leu Leu Arg Leu
145 150 155 160
Lys Leu Lys Val Glu Gln His Val Glu Leu Tyr Gln Lys Tyr Ser Asn
165 170 175
Asn Ser Trp Arg Tyr Leu Ser Asn Arg Leu Leu Ala Pro Ser Asp Ser
180 185 190
Pro Glu Trp Leu Ser Phe Asp Val Thr Gly Val Val Arg Gln Trp Leu
195 200 205
Ser Arg Gly Gly Glu Ile Glu Gly Phe Arg Leu Ser Ala His Cys Ser
210 215 220
Cys Asp Ser Arg Asp Asn Thr Leu Gln Val Asp Ile Asn Gly Phe Thr
225 230 235 240
Thr Gly Arg Arg Gly Asp Leu Ala Thr Ile His Gly Met Asn Arg Pro
245 250 255
Phe Leu Leu Leu Met Ala Thr Pro Leu Glu Arg Ala Gln His Leu Gln
260 265 270
Ser Ser Arg His Arg Arg Ala Leu Asp Thr Asn Tyr Cys Phe Ser Ser
275 280 285
Thr Glu Lys Asn Cys Cys Val Arg Gln Leu Tyr Ile Asp Phe Arg Lys
290 295 300
Asp Leu Gly Trp Lys Trp Ile His Glu Pro Lys Gly Tyr His Ala Asn
305 310 315 320
Phe Cys Leu Gly Pro Cys Pro Tyr Ile Trp Ser Leu Asp Thr Gln Tyr
325 330 335
Ser Lys Val Leu Ala Leu Tyr Asn Gln His Asn Pro Gly Ala Ser Ala
340 345 350
Ala Pro Cys Cys Val Pro Gln Ala Leu Glu Pro Leu Pro Ile Val Tyr
355 360 365
Tyr Val Gly Arg Lys Pro Lys Val Glu Gln Leu Ser Asn Met Ile Val
370 375 380
Arg Ser Cys Lys Cys Ser
385 390
<210> 109
<211> 442
<212> ПРТ
<213> Homo sapiens
<400> 109
Met His Tyr Cys Val Leu Ser Ala Phe Leu Ile Leu His Leu Val Thr
1 5 10 15
Val Ala Leu Ser Leu Ser Thr Cys Ser Thr Leu Asp Met Asp Gln Phe
20 25 30
Met Arg Lys Arg Ile Glu Ala Ile Arg Gly Gln Ile Leu Ser Lys Leu
35 40 45
Lys Leu Thr Ser Pro Pro Glu Asp Tyr Pro Glu Pro Glu Glu Val Pro
50 55 60
Pro Glu Val Ile Ser Ile Tyr Asn Ser Thr Arg Asp Leu Leu Gln Glu
65 70 75 80
Lys Ala Ser Arg Arg Ala Ala Ala Cys Glu Arg Glu Arg Ser Asp Glu
85 90 95
Glu Tyr Tyr Ala Lys Glu Val Tyr Lys Ile Asp Met Pro Pro Phe Phe
100 105 110
Pro Ser Glu Thr Val Cys Pro Val Val Thr Thr Pro Ser Gly Ser Val
115 120 125
Gly Ser Leu Cys Ser Arg Gln Ser Gln Val Leu Cys Gly Tyr Leu Asp
130 135 140
Ala Ile Pro Pro Thr Phe Tyr Arg Pro Tyr Phe Arg Ile Val Arg Phe
145 150 155 160
Asp Val Ser Ala Met Glu Lys Asn Ala Ser Asn Leu Val Lys Ala Glu
165 170 175
Phe Arg Val Phe Arg Leu Gln Asn Pro Lys Ala Arg Val Pro Glu Gln
180 185 190
Arg Ile Glu Leu Tyr Gln Ile Leu Lys Ser Lys Asp Leu Thr Ser Pro
195 200 205
Thr Gln Arg Tyr Ile Asp Ser Lys Val Val Lys Thr Arg Ala Glu Gly
210 215 220
Glu Trp Leu Ser Phe Asp Val Thr Asp Ala Val His Glu Trp Leu His
225 230 235 240
His Lys Asp Arg Asn Leu Gly Phe Lys Ile Ser Leu His Cys Pro Cys
245 250 255
Cys Thr Phe Val Pro Ser Asn Asn Tyr Ile Ile Pro Asn Lys Ser Glu
260 265 270
Glu Leu Glu Ala Arg Phe Ala Gly Ile Asp Gly Thr Ser Thr Tyr Thr
275 280 285
Ser Gly Asp Gln Lys Thr Ile Lys Ser Thr Arg Lys Lys Asn Ser Gly
290 295 300
Lys Thr Pro His Leu Leu Leu Met Leu Leu Pro Ser Tyr Arg Leu Glu
305 310 315 320
Ser Gln Gln Thr Asn Arg Arg Lys Lys Arg Ala Leu Asp Ala Ala Tyr
325 330 335
Cys Phe Arg Asn Val Gln Asp Asn Cys Cys Leu Arg Pro Leu Tyr Ile
340 345 350
Asp Phe Lys Arg Asp Leu Gly Trp Lys Trp Ile His Glu Pro Lys Gly
355 360 365
Tyr Asn Ala Asn Phe Cys Ala Gly Ala Cys Pro Tyr Leu Trp Ser Ser
370 375 380
Asp Thr Gln His Ser Arg Val Leu Ser Leu Tyr Asn Thr Ile Asn Pro
385 390 395 400
Glu Ala Ser Ala Ser Pro Cys Cys Val Ser Gln Asp Leu Glu Pro Leu
405 410 415
Thr Ile Leu Tyr Tyr Ile Gly Lys Thr Pro Lys Ile Glu Gln Leu Ser
420 425 430
Asn Met Ile Val Lys Ser Cys Lys Cys Ser
435 440
<210> 110
<211> 414
<212> ПРТ
<213> Homo sapiens
<400> 110
Met His Tyr Cys Val Leu Ser Ala Phe Leu Ile Leu His Leu Val Thr
1 5 10 15
Val Ala Leu Ser Leu Ser Thr Cys Ser Thr Leu Asp Met Asp Gln Phe
20 25 30
Met Arg Lys Arg Ile Glu Ala Ile Arg Gly Gln Ile Leu Ser Lys Leu
35 40 45
Lys Leu Thr Ser Pro Pro Glu Asp Tyr Pro Glu Pro Glu Glu Val Pro
50 55 60
Pro Glu Val Ile Ser Ile Tyr Asn Ser Thr Arg Asp Leu Leu Gln Glu
65 70 75 80
Lys Ala Ser Arg Arg Ala Ala Ala Cys Glu Arg Glu Arg Ser Asp Glu
85 90 95
Glu Tyr Tyr Ala Lys Glu Val Tyr Lys Ile Asp Met Pro Pro Phe Phe
100 105 110
Pro Ser Glu Asn Ala Ile Pro Pro Thr Phe Tyr Arg Pro Tyr Phe Arg
115 120 125
Ile Val Arg Phe Asp Val Ser Ala Met Glu Lys Asn Ala Ser Asn Leu
130 135 140
Val Lys Ala Glu Phe Arg Val Phe Arg Leu Gln Asn Pro Lys Ala Arg
145 150 155 160
Val Pro Glu Gln Arg Ile Glu Leu Tyr Gln Ile Leu Lys Ser Lys Asp
165 170 175
Leu Thr Ser Pro Thr Gln Arg Tyr Ile Asp Ser Lys Val Val Lys Thr
180 185 190
Arg Ala Glu Gly Glu Trp Leu Ser Phe Asp Val Thr Asp Ala Val His
195 200 205
Glu Trp Leu His His Lys Asp Arg Asn Leu Gly Phe Lys Ile Ser Leu
210 215 220
His Cys Pro Cys Cys Thr Phe Val Pro Ser Asn Asn Tyr Ile Ile Pro
225 230 235 240
Asn Lys Ser Glu Glu Leu Glu Ala Arg Phe Ala Gly Ile Asp Gly Thr
245 250 255
Ser Thr Tyr Thr Ser Gly Asp Gln Lys Thr Ile Lys Ser Thr Arg Lys
260 265 270
Lys Asn Ser Gly Lys Thr Pro His Leu Leu Leu Met Leu Leu Pro Ser
275 280 285
Tyr Arg Leu Glu Ser Gln Gln Thr Asn Arg Arg Lys Lys Arg Ala Leu
290 295 300
Asp Ala Ala Tyr Cys Phe Arg Asn Val Gln Asp Asn Cys Cys Leu Arg
305 310 315 320
Pro Leu Tyr Ile Asp Phe Lys Arg Asp Leu Gly Trp Lys Trp Ile His
325 330 335
Glu Pro Lys Gly Tyr Asn Ala Asn Phe Cys Ala Gly Ala Cys Pro Tyr
340 345 350
Leu Trp Ser Ser Asp Thr Gln His Ser Arg Val Leu Ser Leu Tyr Asn
355 360 365
Thr Ile Asn Pro Glu Ala Ser Ala Ser Pro Cys Cys Val Ser Gln Asp
370 375 380
Leu Glu Pro Leu Thr Ile Leu Tyr Tyr Ile Gly Lys Thr Pro Lys Ile
385 390 395 400
Glu Gln Leu Ser Asn Met Ile Val Lys Ser Cys Lys Cys Ser
405 410
<210> 111
<211> 377
<212> ПРТ
<213> Homo sapiens
<400> 111
Met Cys Asp Glu Asp Glu Thr Thr Ala Leu Val Cys Asp Asn Gly Ser
1 5 10 15
Gly Leu Val Lys Ala Gly Phe Ala Gly Asp Asp Ala Pro Arg Ala Val
20 25 30
Phe Pro Ser Ile Val Gly Arg Pro Arg His Gln Gly Val Met Val Gly
35 40 45
Met Gly Gln Lys Asp Ser Tyr Val Gly Asp Glu Ala Gln Ser Lys Arg
50 55 60
Gly Ile Leu Thr Leu Lys Tyr Pro Ile Glu His Gly Ile Ile Thr Asn
65 70 75 80
Trp Asp Asp Met Glu Lys Ile Trp His His Thr Phe Tyr Asn Glu Leu
85 90 95
Arg Val Ala Pro Glu Glu His Pro Thr Leu Leu Thr Glu Ala Pro Leu
100 105 110
Asn Pro Lys Ala Asn Arg Glu Lys Met Thr Gln Ile Met Phe Glu Thr
115 120 125
Phe Asn Val Pro Ala Met Tyr Val Ala Ile Gln Ala Val Leu Ser Leu
130 135 140
Tyr Ala Ser Gly Arg Thr Thr Gly Ile Val Leu Asp Ser Gly Asp Gly
145 150 155 160
Val Thr His Asn Val Pro Ile Tyr Glu Gly Tyr Ala Leu Pro His Ala
165 170 175
Ile Met Arg Leu Asp Leu Ala Gly Arg Asp Leu Thr Asp Tyr Leu Met
180 185 190
Lys Ile Leu Thr Glu Arg Gly Tyr Ser Phe Val Thr Thr Ala Glu Arg
195 200 205
Glu Ile Val Arg Asp Ile Lys Glu Lys Leu Cys Tyr Val Ala Leu Asp
210 215 220
Phe Glu Asn Glu Met Ala Thr Ala Ala Ser Ser Ser Ser Leu Glu Lys
225 230 235 240
Ser Tyr Glu Leu Pro Asp Gly Gln Val Ile Thr Ile Gly Asn Glu Arg
245 250 255
Phe Arg Cys Pro Glu Thr Leu Phe Gln Pro Ser Phe Ile Gly Met Glu
260 265 270
Ser Ala Gly Ile His Glu Thr Thr Tyr Asn Ser Ile Met Lys Cys Asp
275 280 285
Ile Asp Ile Arg Lys Asp Leu Tyr Ala Asn Asn Val Met Ser Gly Gly
290 295 300
Thr Thr Met Tyr Pro Gly Ile Ala Asp Arg Met Gln Lys Glu Ile Thr
305 310 315 320
Ala Leu Ala Pro Ser Thr Met Lys Ile Lys Ile Ile Ala Pro Pro Glu
325 330 335
Arg Lys Tyr Ser Val Trp Ile Gly Gly Ser Ile Leu Ala Ser Leu Ser
340 345 350
Thr Phe Gln Gln Met Trp Ile Thr Lys Gln Glu Tyr Asp Glu Ala Gly
355 360 365
Pro Ser Ile Val His Arg Lys Cys Phe
370 375
<210> 112
<211> 377
<212> ПРТ
<213> Homo sapiens
<400> 112
Met Cys Glu Glu Glu Asp Ser Thr Ala Leu Val Cys Asp Asn Gly Ser
1 5 10 15
Gly Leu Cys Lys Ala Gly Phe Ala Gly Asp Asp Ala Pro Arg Ala Val
20 25 30
Phe Pro Ser Ile Val Gly Arg Pro Arg His Gln Gly Val Met Val Gly
35 40 45
Met Gly Gln Lys Asp Ser Tyr Val Gly Asp Glu Ala Gln Ser Lys Arg
50 55 60
Gly Ile Leu Thr Leu Lys Tyr Pro Ile Glu His Gly Ile Ile Thr Asn
65 70 75 80
Trp Asp Asp Met Glu Lys Ile Trp His His Ser Phe Tyr Asn Glu Leu
85 90 95
Arg Val Ala Pro Glu Glu His Pro Thr Leu Leu Thr Glu Ala Pro Leu
100 105 110
Asn Pro Lys Ala Asn Arg Glu Lys Met Thr Gln Ile Met Phe Glu Thr
115 120 125
Phe Asn Val Pro Ala Met Tyr Val Ala Ile Gln Ala Val Leu Ser Leu
130 135 140
Tyr Ala Ser Gly Arg Thr Thr Gly Ile Val Leu Asp Ser Gly Asp Gly
145 150 155 160
Val Thr His Asn Val Pro Ile Tyr Glu Gly Tyr Ala Leu Pro His Ala
165 170 175
Ile Met Arg Leu Asp Leu Ala Gly Arg Asp Leu Thr Asp Tyr Leu Met
180 185 190
Lys Ile Leu Thr Glu Arg Gly Tyr Ser Phe Val Thr Thr Ala Glu Arg
195 200 205
Glu Ile Val Arg Asp Ile Lys Glu Lys Leu Cys Tyr Val Ala Leu Asp
210 215 220
Phe Glu Asn Glu Met Ala Thr Ala Ala Ser Ser Ser Ser Leu Glu Lys
225 230 235 240
Ser Tyr Glu Leu Pro Asp Gly Gln Val Ile Thr Ile Gly Asn Glu Arg
245 250 255
Phe Arg Cys Pro Glu Thr Leu Phe Gln Pro Ser Phe Ile Gly Met Glu
260 265 270
Ser Ala Gly Ile His Glu Thr Thr Tyr Asn Ser Ile Met Lys Cys Asp
275 280 285
Ile Asp Ile Arg Lys Asp Leu Tyr Ala Asn Asn Val Leu Ser Gly Gly
290 295 300
Thr Thr Met Tyr Pro Gly Ile Ala Asp Arg Met Gln Lys Glu Ile Thr
305 310 315 320
Ala Leu Ala Pro Ser Thr Met Lys Ile Lys Ile Ile Ala Pro Pro Glu
325 330 335
Arg Lys Tyr Ser Val Trp Ile Gly Gly Ser Ile Leu Ala Ser Leu Ser
340 345 350
Thr Phe Gln Gln Met Trp Ile Ser Lys Gln Glu Tyr Asp Glu Ala Gly
355 360 365
Pro Ser Ile Val His Arg Lys Cys Phe
370 375
<210> 113
<211> 375
<212> ПРТ
<213> Homo sapiens
<400> 113
Met Asp Asp Asp Ile Ala Ala Leu Val Val Asp Asn Gly Ser Gly Met
1 5 10 15
Cys Lys Ala Gly Phe Ala Gly Asp Asp Ala Pro Arg Ala Val Phe Pro
20 25 30
Ser Ile Val Gly Arg Pro Arg His Gln Gly Val Met Val Gly Met Gly
35 40 45
Gln Lys Asp Ser Tyr Val Gly Asp Glu Ala Gln Ser Lys Arg Gly Ile
50 55 60
Leu Thr Leu Lys Tyr Pro Ile Glu His Gly Ile Val Thr Asn Trp Asp
65 70 75 80
Asp Met Glu Lys Ile Trp His His Thr Phe Tyr Asn Glu Leu Arg Val
85 90 95
Ala Pro Glu Glu His Pro Val Leu Leu Thr Glu Ala Pro Leu Asn Pro
100 105 110
Lys Ala Asn Arg Glu Lys Met Thr Gln Ile Met Phe Glu Thr Phe Asn
115 120 125
Thr Pro Ala Met Tyr Val Ala Ile Gln Ala Val Leu Ser Leu Tyr Ala
130 135 140
Ser Gly Arg Thr Thr Gly Ile Val Met Asp Ser Gly Asp Gly Val Thr
145 150 155 160
His Thr Val Pro Ile Tyr Glu Gly Tyr Ala Leu Pro His Ala Ile Leu
165 170 175
Arg Leu Asp Leu Ala Gly Arg Asp Leu Thr Asp Tyr Leu Met Lys Ile
180 185 190
Leu Thr Glu Arg Gly Tyr Ser Phe Thr Thr Thr Ala Glu Arg Glu Ile
195 200 205
Val Arg Asp Ile Lys Glu Lys Leu Cys Tyr Val Ala Leu Asp Phe Glu
210 215 220
Gln Glu Met Ala Thr Ala Ala Ser Ser Ser Ser Leu Glu Lys Ser Tyr
225 230 235 240
Glu Leu Pro Asp Gly Gln Val Ile Thr Ile Gly Asn Glu Arg Phe Arg
245 250 255
Cys Pro Glu Ala Leu Phe Gln Pro Ser Phe Leu Gly Met Glu Ser Cys
260 265 270
Gly Ile His Glu Thr Thr Phe Asn Ser Ile Met Lys Cys Asp Val Asp
275 280 285
Ile Arg Lys Asp Leu Tyr Ala Asn Thr Val Leu Ser Gly Gly Thr Thr
290 295 300
Met Tyr Pro Gly Ile Ala Asp Arg Met Gln Lys Glu Ile Thr Ala Leu
305 310 315 320
Ala Pro Ser Thr Met Lys Ile Lys Ile Ile Ala Pro Pro Glu Arg Lys
325 330 335
Tyr Ser Val Trp Ile Gly Gly Ser Ile Leu Ala Ser Leu Ser Thr Phe
340 345 350
Gln Gln Met Trp Ile Ser Lys Gln Glu Tyr Asp Glu Ser Gly Pro Ser
355 360 365
Ile Val His Arg Lys Cys Phe
370 375
<210> 114
<211> 377
<212> ПРТ
<213> Homo sapiens
<400> 114
Met Cys Asp Asp Glu Glu Thr Thr Ala Leu Val Cys Asp Asn Gly Ser
1 5 10 15
Gly Leu Val Lys Ala Gly Phe Ala Gly Asp Asp Ala Pro Arg Ala Val
20 25 30
Phe Pro Ser Ile Val Gly Arg Pro Arg His Gln Gly Val Met Val Gly
35 40 45
Met Gly Gln Lys Asp Ser Tyr Val Gly Asp Glu Ala Gln Ser Lys Arg
50 55 60
Gly Ile Leu Thr Leu Lys Tyr Pro Ile Glu His Gly Ile Ile Thr Asn
65 70 75 80
Trp Asp Asp Met Glu Lys Ile Trp His His Thr Phe Tyr Asn Glu Leu
85 90 95
Arg Val Ala Pro Glu Glu His Pro Thr Leu Leu Thr Glu Ala Pro Leu
100 105 110
Asn Pro Lys Ala Asn Arg Glu Lys Met Thr Gln Ile Met Phe Glu Thr
115 120 125
Phe Asn Val Pro Ala Met Tyr Val Ala Ile Gln Ala Val Leu Ser Leu
130 135 140
Tyr Ala Ser Gly Arg Thr Thr Gly Ile Val Leu Asp Ser Gly Asp Gly
145 150 155 160
Val Thr His Asn Val Pro Ile Tyr Glu Gly Tyr Ala Leu Pro His Ala
165 170 175
Ile Met Arg Leu Asp Leu Ala Gly Arg Asp Leu Thr Asp Tyr Leu Met
180 185 190
Lys Ile Leu Thr Glu Arg Gly Tyr Ser Phe Val Thr Thr Ala Glu Arg
195 200 205
Glu Ile Val Arg Asp Ile Lys Glu Lys Leu Cys Tyr Val Ala Leu Asp
210 215 220
Phe Glu Asn Glu Met Ala Thr Ala Ala Ser Ser Ser Ser Leu Glu Lys
225 230 235 240
Ser Tyr Glu Leu Pro Asp Gly Gln Val Ile Thr Ile Gly Asn Glu Arg
245 250 255
Phe Arg Cys Pro Glu Thr Leu Phe Gln Pro Ser Phe Ile Gly Met Glu
260 265 270
Ser Ala Gly Ile His Glu Thr Thr Tyr Asn Ser Ile Met Lys Cys Asp
275 280 285
Ile Asp Ile Arg Lys Asp Leu Tyr Ala Asn Asn Val Leu Ser Gly Gly
290 295 300
Thr Thr Met Tyr Pro Gly Ile Ala Asp Arg Met Gln Lys Glu Ile Thr
305 310 315 320
Ala Leu Ala Pro Ser Thr Met Lys Ile Lys Ile Ile Ala Pro Pro Glu
325 330 335
Arg Lys Tyr Ser Val Trp Ile Gly Gly Ser Ile Leu Ala Ser Leu Ser
340 345 350
Thr Phe Gln Gln Met Trp Ile Ser Lys Gln Glu Tyr Asp Glu Ala Gly
355 360 365
Pro Ser Ile Val His Arg Lys Cys Phe
370 375
<210> 115
<211> 375
<212> ПРТ
<213> Homo sapiens
<400> 115
Met Glu Glu Glu Ile Ala Ala Leu Val Ile Asp Asn Gly Ser Gly Met
1 5 10 15
Cys Lys Ala Gly Phe Ala Gly Asp Asp Ala Pro Arg Ala Val Phe Pro
20 25 30
Ser Ile Val Gly Arg Pro Arg His Gln Gly Val Met Val Gly Met Gly
35 40 45
Gln Lys Asp Ser Tyr Val Gly Asp Glu Ala Gln Ser Lys Arg Gly Ile
50 55 60
Leu Thr Leu Lys Tyr Pro Ile Glu His Gly Ile Val Thr Asn Trp Asp
65 70 75 80
Asp Met Glu Lys Ile Trp His His Thr Phe Tyr Asn Glu Leu Arg Val
85 90 95
Ala Pro Glu Glu His Pro Val Leu Leu Thr Glu Ala Pro Leu Asn Pro
100 105 110
Lys Ala Asn Arg Glu Lys Met Thr Gln Ile Met Phe Glu Thr Phe Asn
115 120 125
Thr Pro Ala Met Tyr Val Ala Ile Gln Ala Val Leu Ser Leu Tyr Ala
130 135 140
Ser Gly Arg Thr Thr Gly Ile Val Met Asp Ser Gly Asp Gly Val Thr
145 150 155 160
His Thr Val Pro Ile Tyr Glu Gly Tyr Ala Leu Pro His Ala Ile Leu
165 170 175
Arg Leu Asp Leu Ala Gly Arg Asp Leu Thr Asp Tyr Leu Met Lys Ile
180 185 190
Leu Thr Glu Arg Gly Tyr Ser Phe Thr Thr Thr Ala Glu Arg Glu Ile
195 200 205
Val Arg Asp Ile Lys Glu Lys Leu Cys Tyr Val Ala Leu Asp Phe Glu
210 215 220
Gln Glu Met Ala Thr Ala Ala Ser Ser Ser Ser Leu Glu Lys Ser Tyr
225 230 235 240
Glu Leu Pro Asp Gly Gln Val Ile Thr Ile Gly Asn Glu Arg Phe Arg
245 250 255
Cys Pro Glu Ala Leu Phe Gln Pro Ser Phe Leu Gly Met Glu Ser Cys
260 265 270
Gly Ile His Glu Thr Thr Phe Asn Ser Ile Met Lys Cys Asp Val Asp
275 280 285
Ile Arg Lys Asp Leu Tyr Ala Asn Thr Val Leu Ser Gly Gly Thr Thr
290 295 300
Met Tyr Pro Gly Ile Ala Asp Arg Met Gln Lys Glu Ile Thr Ala Leu
305 310 315 320
Ala Pro Ser Thr Met Lys Ile Lys Ile Ile Ala Pro Pro Glu Arg Lys
325 330 335
Tyr Ser Val Trp Ile Gly Gly Ser Ile Leu Ala Ser Leu Ser Thr Phe
340 345 350
Gln Gln Met Trp Ile Ser Lys Gln Glu Tyr Asp Glu Ser Gly Pro Ser
355 360 365
Ile Val His Arg Lys Cys Phe
370 375
<210> 116
<211> 376
<212> ПРТ
<213> Homo sapiens
<400> 116
Met Cys Glu Glu Glu Thr Thr Ala Leu Val Cys Asp Asn Gly Ser Gly
1 5 10 15
Leu Cys Lys Ala Gly Phe Ala Gly Asp Asp Ala Pro Arg Ala Val Phe
20 25 30
Pro Ser Ile Val Gly Arg Pro Arg His Gln Gly Val Met Val Gly Met
35 40 45
Gly Gln Lys Asp Ser Tyr Val Gly Asp Glu Ala Gln Ser Lys Arg Gly
50 55 60
Ile Leu Thr Leu Lys Tyr Pro Ile Glu His Gly Ile Ile Thr Asn Trp
65 70 75 80
Asp Asp Met Glu Lys Ile Trp His His Ser Phe Tyr Asn Glu Leu Arg
85 90 95
Val Ala Pro Glu Glu His Pro Thr Leu Leu Thr Glu Ala Pro Leu Asn
100 105 110
Pro Lys Ala Asn Arg Glu Lys Met Thr Gln Ile Met Phe Glu Thr Phe
115 120 125
Asn Val Pro Ala Met Tyr Val Ala Ile Gln Ala Val Leu Ser Leu Tyr
130 135 140
Ala Ser Gly Arg Thr Thr Gly Ile Val Leu Asp Ser Gly Asp Gly Val
145 150 155 160
Thr His Asn Val Pro Ile Tyr Glu Gly Tyr Ala Leu Pro His Ala Ile
165 170 175
Met Arg Leu Asp Leu Ala Gly Arg Asp Leu Thr Asp Tyr Leu Met Lys
180 185 190
Ile Leu Thr Glu Arg Gly Tyr Ser Phe Val Thr Thr Ala Glu Arg Glu
195 200 205
Ile Val Arg Asp Ile Lys Glu Lys Leu Cys Tyr Val Ala Leu Asp Phe
210 215 220
Glu Asn Glu Met Ala Thr Ala Ala Ser Ser Ser Ser Leu Glu Lys Ser
225 230 235 240
Tyr Glu Leu Pro Asp Gly Gln Val Ile Thr Ile Gly Asn Glu Arg Phe
245 250 255
Arg Cys Pro Glu Thr Leu Phe Gln Pro Ser Phe Ile Gly Met Glu Ser
260 265 270
Ala Gly Ile His Glu Thr Thr Tyr Asn Ser Ile Met Lys Cys Asp Ile
275 280 285
Asp Ile Arg Lys Asp Leu Tyr Ala Asn Asn Val Leu Ser Gly Gly Thr
290 295 300
Thr Met Tyr Pro Gly Ile Ala Asp Arg Met Gln Lys Glu Ile Thr Ala
305 310 315 320
Leu Ala Pro Ser Thr Met Lys Ile Lys Ile Ile Ala Pro Pro Glu Arg
325 330 335
Lys Tyr Ser Val Trp Ile Gly Gly Ser Ile Leu Ala Ser Leu Ser Thr
340 345 350
Phe Gln Gln Met Trp Ile Ser Lys Pro Glu Tyr Asp Glu Ala Gly Pro
355 360 365
Ser Ile Val His Arg Lys Cys Phe
370 375
<210> 117
<211> 333
<212> ПРТ
<213> Homo sapiens
<400> 117
Met Cys Glu Glu Glu Thr Thr Ala Leu Val Cys Asp Asn Gly Ser Gly
1 5 10 15
Leu Cys Lys Ala Gly Phe Ala Gly Asp Asp Ala Pro Arg Ala Val Phe
20 25 30
Pro Ser Ile Val Gly Arg Pro Arg His Gln Ile Trp His His Ser Phe
35 40 45
Tyr Asn Glu Leu Arg Val Ala Pro Glu Glu His Pro Thr Leu Leu Thr
50 55 60
Glu Ala Pro Leu Asn Pro Lys Ala Asn Arg Glu Lys Met Thr Gln Ile
65 70 75 80
Met Phe Glu Thr Phe Asn Val Pro Ala Met Tyr Val Ala Ile Gln Ala
85 90 95
Val Leu Ser Leu Tyr Ala Ser Gly Arg Thr Thr Gly Ile Val Leu Asp
100 105 110
Ser Gly Asp Gly Val Thr His Asn Val Pro Ile Tyr Glu Gly Tyr Ala
115 120 125
Leu Pro His Ala Ile Met Arg Leu Asp Leu Ala Gly Arg Asp Leu Thr
130 135 140
Asp Tyr Leu Met Lys Ile Leu Thr Glu Arg Gly Tyr Ser Phe Val Thr
145 150 155 160
Thr Ala Glu Arg Glu Ile Val Arg Asp Ile Lys Glu Lys Leu Cys Tyr
165 170 175
Val Ala Leu Asp Phe Glu Asn Glu Met Ala Thr Ala Ala Ser Ser Ser
180 185 190
Ser Leu Glu Lys Ser Tyr Glu Leu Pro Asp Gly Gln Val Ile Thr Ile
195 200 205
Gly Asn Glu Arg Phe Arg Cys Pro Glu Thr Leu Phe Gln Pro Ser Phe
210 215 220
Ile Gly Met Glu Ser Ala Gly Ile His Glu Thr Thr Tyr Asn Ser Ile
225 230 235 240
Met Lys Cys Asp Ile Asp Ile Arg Lys Asp Leu Tyr Ala Asn Asn Val
245 250 255
Leu Ser Gly Gly Thr Thr Met Tyr Pro Gly Ile Ala Asp Arg Met Gln
260 265 270
Lys Glu Ile Thr Ala Leu Ala Pro Ser Thr Met Lys Ile Lys Ile Ile
275 280 285
Ala Pro Pro Glu Arg Lys Tyr Ser Val Trp Ile Gly Gly Ser Ile Leu
290 295 300
Ala Ser Leu Ser Thr Phe Gln Gln Met Trp Ile Ser Lys Pro Glu Tyr
305 310 315 320
Asp Glu Ala Gly Pro Ser Ile Val His Arg Lys Cys Phe
325 330
<210> 118
<211> 207
<212> ПРТ
<213> Homo sapiens
<400> 118
Met Ala Gly Pro Ala Thr Gln Ser Pro Met Lys Leu Met Ala Leu Gln
1 5 10 15
Leu Leu Leu Trp His Ser Ala Leu Trp Thr Val Gln Glu Ala Thr Pro
20 25 30
Leu Gly Pro Ala Ser Ser Leu Pro Gln Ser Phe Leu Leu Lys Cys Leu
35 40 45
Glu Gln Val Arg Lys Ile Gln Gly Asp Gly Ala Ala Leu Gln Glu Lys
50 55 60
Leu Val Ser Glu Cys Ala Thr Tyr Lys Leu Cys His Pro Glu Glu Leu
65 70 75 80
Val Leu Leu Gly His Ser Leu Gly Ile Pro Trp Ala Pro Leu Ser Ser
85 90 95
Cys Pro Ser Gln Ala Leu Gln Leu Ala Gly Cys Leu Ser Gln Leu His
100 105 110
Ser Gly Leu Phe Leu Tyr Gln Gly Leu Leu Gln Ala Leu Glu Gly Ile
115 120 125
Ser Pro Glu Leu Gly Pro Thr Leu Asp Thr Leu Gln Leu Asp Val Ala
130 135 140
Asp Phe Ala Thr Thr Ile Trp Gln Gln Met Glu Glu Leu Gly Met Ala
145 150 155 160
Pro Ala Leu Gln Pro Thr Gln Gly Ala Met Pro Ala Phe Ala Ser Ala
165 170 175
Phe Gln Arg Arg Ala Gly Gly Val Leu Val Ala Ser His Leu Gln Ser
180 185 190
Phe Leu Glu Val Ser Tyr Arg Val Leu Arg His Leu Ala Gln Pro
195 200 205
<210> 119
<211> 204
<212> ПРТ
<213> Homo sapiens
<400> 119
Met Ala Gly Pro Ala Thr Gln Ser Pro Met Lys Leu Met Ala Leu Gln
1 5 10 15
Leu Leu Leu Trp His Ser Ala Leu Trp Thr Val Gln Glu Ala Thr Pro
20 25 30
Leu Gly Pro Ala Ser Ser Leu Pro Gln Ser Phe Leu Leu Lys Cys Leu
35 40 45
Glu Gln Val Arg Lys Ile Gln Gly Asp Gly Ala Ala Leu Gln Glu Lys
50 55 60
Leu Cys Ala Thr Tyr Lys Leu Cys His Pro Glu Glu Leu Val Leu Leu
65 70 75 80
Gly His Ser Leu Gly Ile Pro Trp Ala Pro Leu Ser Ser Cys Pro Ser
85 90 95
Gln Ala Leu Gln Leu Ala Gly Cys Leu Ser Gln Leu His Ser Gly Leu
100 105 110
Phe Leu Tyr Gln Gly Leu Leu Gln Ala Leu Glu Gly Ile Ser Pro Glu
115 120 125
Leu Gly Pro Thr Leu Asp Thr Leu Gln Leu Asp Val Ala Asp Phe Ala
130 135 140
Thr Thr Ile Trp Gln Gln Met Glu Glu Leu Gly Met Ala Pro Ala Leu
145 150 155 160
Gln Pro Thr Gln Gly Ala Met Pro Ala Phe Ala Ser Ala Phe Gln Arg
165 170 175
Arg Ala Gly Gly Val Leu Val Ala Ser His Leu Gln Ser Phe Leu Glu
180 185 190
Val Ser Tyr Arg Val Leu Arg His Leu Ala Gln Pro
195 200
<210> 120
<211> 171
<212> ПРТ
<213> Homo sapiens
<400> 120
Met Ala Gly Pro Ala Thr Gln Ser Pro Met Lys Leu Met Ala Leu Gln
1 5 10 15
Leu Leu Leu Trp His Ser Ala Leu Trp Thr Val Gln Glu Ala Thr Pro
20 25 30
Leu Gly Pro Ala Ser Ser Leu Pro Gln Ser Phe Leu Leu Lys Cys Leu
35 40 45
Glu Gln Val Arg Lys Ile Gln Gly Asp Gly Ala Ala Leu Gln Glu Lys
50 55 60
Leu Val Ser Glu Ala Gly Cys Leu Ser Gln Leu His Ser Gly Leu Phe
65 70 75 80
Leu Tyr Gln Gly Leu Leu Gln Ala Leu Glu Gly Ile Ser Pro Glu Leu
85 90 95
Gly Pro Thr Leu Asp Thr Leu Gln Leu Asp Val Ala Asp Phe Ala Thr
100 105 110
Thr Ile Trp Gln Gln Met Glu Glu Leu Gly Met Ala Pro Ala Leu Gln
115 120 125
Pro Thr Gln Gly Ala Met Pro Ala Phe Ala Ser Ala Phe Gln Arg Arg
130 135 140
Ala Gly Gly Val Leu Val Ala Ser His Leu Gln Ser Phe Leu Glu Val
145 150 155 160
Ser Tyr Arg Val Leu Arg His Leu Ala Gln Pro
165 170
<210> 121
<211> 168
<212> ПРТ
<213> Homo sapiens
<400> 121
Met Ala Gly Pro Ala Thr Gln Ser Pro Met Lys Leu Met Ala Leu Gln
1 5 10 15
Leu Leu Leu Trp His Ser Ala Leu Trp Thr Val Gln Glu Ala Thr Pro
20 25 30
Leu Gly Pro Ala Ser Ser Leu Pro Gln Ser Phe Leu Leu Lys Cys Leu
35 40 45
Glu Gln Val Arg Lys Ile Gln Gly Asp Gly Ala Ala Leu Gln Glu Lys
50 55 60
Leu Ala Gly Cys Leu Ser Gln Leu His Ser Gly Leu Phe Leu Tyr Gln
65 70 75 80
Gly Leu Leu Gln Ala Leu Glu Gly Ile Ser Pro Glu Leu Gly Pro Thr
85 90 95
Leu Asp Thr Leu Gln Leu Asp Val Ala Asp Phe Ala Thr Thr Ile Trp
100 105 110
Gln Gln Met Glu Glu Leu Gly Met Ala Pro Ala Leu Gln Pro Thr Gln
115 120 125
Gly Ala Met Pro Ala Phe Ala Ser Ala Phe Gln Arg Arg Ala Gly Gly
130 135 140
Val Leu Val Ala Ser His Leu Gln Ser Phe Leu Glu Val Ser Tyr Arg
145 150 155 160
Val Leu Arg His Leu Ala Gln Pro
165
<210> 122
<211> 211
<212> ПРТ
<213> Homo sapiens
<400> 122
Met Arg Thr Leu Ala Cys Leu Leu Leu Leu Gly Cys Gly Tyr Leu Ala
1 5 10 15
His Val Leu Ala Glu Glu Ala Glu Ile Pro Arg Glu Val Ile Glu Arg
20 25 30
Leu Ala Arg Ser Gln Ile His Ser Ile Arg Asp Leu Gln Arg Leu Leu
35 40 45
Glu Ile Asp Ser Val Gly Ser Glu Asp Ser Leu Asp Thr Ser Leu Arg
50 55 60
Ala His Gly Val His Ala Thr Lys His Val Pro Glu Lys Arg Pro Leu
65 70 75 80
Pro Ile Arg Arg Lys Arg Ser Ile Glu Glu Ala Val Pro Ala Val Cys
85 90 95
Lys Thr Arg Thr Val Ile Tyr Glu Ile Pro Arg Ser Gln Val Asp Pro
100 105 110
Thr Ser Ala Asn Phe Leu Ile Trp Pro Pro Cys Val Glu Val Lys Arg
115 120 125
Cys Thr Gly Cys Cys Asn Thr Ser Ser Val Lys Cys Gln Pro Ser Arg
130 135 140
Val His His Arg Ser Val Lys Val Ala Lys Val Glu Tyr Val Arg Lys
145 150 155 160
Lys Pro Lys Leu Lys Glu Val Gln Val Arg Leu Glu Glu His Leu Glu
165 170 175
Cys Ala Cys Ala Thr Thr Ser Leu Asn Pro Asp Tyr Arg Glu Glu Asp
180 185 190
Thr Gly Arg Pro Arg Glu Ser Gly Lys Lys Arg Lys Arg Lys Arg Leu
195 200 205
Lys Pro Thr
210
<210> 123
<211> 196
<212> ПРТ
<213> Homo sapiens
<400> 123
Met Arg Thr Leu Ala Cys Leu Leu Leu Leu Gly Cys Gly Tyr Leu Ala
1 5 10 15
His Val Leu Ala Glu Glu Ala Glu Ile Pro Arg Glu Val Ile Glu Arg
20 25 30
Leu Ala Arg Ser Gln Ile His Ser Ile Arg Asp Leu Gln Arg Leu Leu
35 40 45
Glu Ile Asp Ser Val Gly Ser Glu Asp Ser Leu Asp Thr Ser Leu Arg
50 55 60
Ala His Gly Val His Ala Thr Lys His Val Pro Glu Lys Arg Pro Leu
65 70 75 80
Pro Ile Arg Arg Lys Arg Ser Ile Glu Glu Ala Val Pro Ala Val Cys
85 90 95
Lys Thr Arg Thr Val Ile Tyr Glu Ile Pro Arg Ser Gln Val Asp Pro
100 105 110
Thr Ser Ala Asn Phe Leu Ile Trp Pro Pro Cys Val Glu Val Lys Arg
115 120 125
Cys Thr Gly Cys Cys Asn Thr Ser Ser Val Lys Cys Gln Pro Ser Arg
130 135 140
Val His His Arg Ser Val Lys Val Ala Lys Val Glu Tyr Val Arg Lys
145 150 155 160
Lys Pro Lys Leu Lys Glu Val Gln Val Arg Leu Glu Glu His Leu Glu
165 170 175
Cys Ala Cys Ala Thr Thr Ser Leu Asn Pro Asp Tyr Arg Glu Glu Asp
180 185 190
Thr Asp Val Arg
195
<210> 124
<211> 241
<212> ПРТ
<213> Homo sapiens
<400> 124
Met Asn Arg Cys Trp Ala Leu Phe Leu Ser Leu Cys Cys Tyr Leu Arg
1 5 10 15
Leu Val Ser Ala Glu Gly Asp Pro Ile Pro Glu Glu Leu Tyr Glu Met
20 25 30
Leu Ser Asp His Ser Ile Arg Ser Phe Asp Asp Leu Gln Arg Leu Leu
35 40 45
His Gly Asp Pro Gly Glu Glu Asp Gly Ala Glu Leu Asp Leu Asn Met
50 55 60
Thr Arg Ser His Ser Gly Gly Glu Leu Glu Ser Leu Ala Arg Gly Arg
65 70 75 80
Arg Ser Leu Gly Ser Leu Thr Ile Ala Glu Pro Ala Met Ile Ala Glu
85 90 95
Cys Lys Thr Arg Thr Glu Val Phe Glu Ile Ser Arg Arg Leu Ile Asp
100 105 110
Arg Thr Asn Ala Asn Phe Leu Val Trp Pro Pro Cys Val Glu Val Gln
115 120 125
Arg Cys Ser Gly Cys Cys Asn Asn Arg Asn Val Gln Cys Arg Pro Thr
130 135 140
Gln Val Gln Leu Arg Pro Val Gln Val Arg Lys Ile Glu Ile Val Arg
145 150 155 160
Lys Lys Pro Ile Phe Lys Lys Ala Thr Val Thr Leu Glu Asp His Leu
165 170 175
Ala Cys Lys Cys Glu Thr Val Ala Ala Ala Arg Pro Val Thr Arg Ser
180 185 190
Pro Gly Gly Ser Gln Glu Gln Arg Ala Lys Thr Pro Gln Thr Arg Val
195 200 205
Thr Ile Arg Thr Val Arg Val Arg Arg Pro Pro Lys Gly Lys His Arg
210 215 220
Lys Phe Lys His Thr His Asp Lys Thr Ala Leu Lys Glu Thr Leu Gly
225 230 235 240
Ala
<210> 125
<211> 226
<212> ПРТ
<213> Homo sapiens
<400> 125
Met Phe Ile Met Gly Leu Gly Asp Pro Ile Pro Glu Glu Leu Tyr Glu
1 5 10 15
Met Leu Ser Asp His Ser Ile Arg Ser Phe Asp Asp Leu Gln Arg Leu
20 25 30
Leu His Gly Asp Pro Gly Glu Glu Asp Gly Ala Glu Leu Asp Leu Asn
35 40 45
Met Thr Arg Ser His Ser Gly Gly Glu Leu Glu Ser Leu Ala Arg Gly
50 55 60
Arg Arg Ser Leu Gly Ser Leu Thr Ile Ala Glu Pro Ala Met Ile Ala
65 70 75 80
Glu Cys Lys Thr Arg Thr Glu Val Phe Glu Ile Ser Arg Arg Leu Ile
85 90 95
Asp Arg Thr Asn Ala Asn Phe Leu Val Trp Pro Pro Cys Val Glu Val
100 105 110
Gln Arg Cys Ser Gly Cys Cys Asn Asn Arg Asn Val Gln Cys Arg Pro
115 120 125
Thr Gln Val Gln Leu Arg Pro Val Gln Val Arg Lys Ile Glu Ile Val
130 135 140
Arg Lys Lys Pro Ile Phe Lys Lys Ala Thr Val Thr Leu Glu Asp His
145 150 155 160
Leu Ala Cys Lys Cys Glu Thr Val Ala Ala Ala Arg Pro Val Thr Arg
165 170 175
Ser Pro Gly Gly Ser Gln Glu Gln Arg Ala Lys Thr Pro Gln Thr Arg
180 185 190
Val Thr Ile Arg Thr Val Arg Val Arg Arg Pro Pro Lys Gly Lys His
195 200 205
Arg Lys Phe Lys His Thr His Asp Lys Thr Ala Leu Lys Glu Thr Leu
210 215 220
Gly Ala
225
<210> 126
<211> 345
<212> ПРТ
<213> Homo sapiens
<400> 126
Met Ser Leu Phe Gly Leu Leu Leu Leu Thr Ser Ala Leu Ala Gly Gln
1 5 10 15
Arg Gln Gly Thr Gln Ala Glu Ser Asn Leu Ser Ser Lys Phe Gln Phe
20 25 30
Ser Ser Asn Lys Glu Gln Asn Gly Val Gln Asp Pro Gln His Glu Arg
35 40 45
Ile Ile Thr Val Ser Thr Asn Gly Ser Ile His Ser Pro Arg Phe Pro
50 55 60
His Thr Tyr Pro Arg Asn Thr Val Leu Val Trp Arg Leu Val Ala Val
65 70 75 80
Glu Glu Asn Val Trp Ile Gln Leu Thr Phe Asp Glu Arg Phe Gly Leu
85 90 95
Glu Asp Pro Glu Asp Asp Ile Cys Lys Tyr Asp Phe Val Glu Val Glu
100 105 110
Glu Pro Ser Asp Gly Thr Ile Leu Gly Arg Trp Cys Gly Ser Gly Thr
115 120 125
Val Pro Gly Lys Gln Ile Ser Lys Gly Asn Gln Ile Arg Ile Arg Phe
130 135 140
Val Ser Asp Glu Tyr Phe Pro Ser Glu Pro Gly Phe Cys Ile His Tyr
145 150 155 160
Asn Ile Val Met Pro Gln Phe Thr Glu Ala Val Ser Pro Ser Val Leu
165 170 175
Pro Pro Ser Ala Leu Pro Leu Asp Leu Leu Asn Asn Ala Ile Thr Ala
180 185 190
Phe Ser Thr Leu Glu Asp Leu Ile Arg Tyr Leu Glu Pro Glu Arg Trp
195 200 205
Gln Leu Asp Leu Glu Asp Leu Tyr Arg Pro Thr Trp Gln Leu Leu Gly
210 215 220
Lys Ala Phe Val Phe Gly Arg Lys Ser Arg Val Val Asp Leu Asn Leu
225 230 235 240
Leu Thr Glu Glu Val Arg Leu Tyr Ser Cys Thr Pro Arg Asn Phe Ser
245 250 255
Val Ser Ile Arg Glu Glu Leu Lys Arg Thr Asp Thr Ile Phe Trp Pro
260 265 270
Gly Cys Leu Leu Val Lys Arg Cys Gly Gly Asn Cys Ala Cys Cys Leu
275 280 285
His Asn Cys Asn Glu Cys Gln Cys Val Pro Ser Lys Val Thr Lys Lys
290 295 300
Tyr His Glu Val Leu Gln Leu Arg Pro Lys Thr Gly Val Arg Gly Leu
305 310 315 320
His Lys Ser Leu Thr Asp Val Ala Leu Glu His His Glu Glu Cys Asp
325 330 335
Cys Val Cys Arg Gly Ser Thr Gly Gly
340 345
<210> 127
<211> 370
<212> ПРТ
<213> Homo sapiens
<400> 127
Met His Arg Leu Ile Phe Val Tyr Thr Leu Ile Cys Ala Asn Phe Cys
1 5 10 15
Ser Cys Arg Asp Thr Ser Ala Thr Pro Gln Ser Ala Ser Ile Lys Ala
20 25 30
Leu Arg Asn Ala Asn Leu Arg Arg Asp Glu Ser Asn His Leu Thr Asp
35 40 45
Leu Tyr Arg Arg Asp Glu Thr Ile Gln Val Lys Gly Asn Gly Tyr Val
50 55 60
Gln Ser Pro Arg Phe Pro Asn Ser Tyr Pro Arg Asn Leu Leu Leu Thr
65 70 75 80
Trp Arg Leu His Ser Gln Glu Asn Thr Arg Ile Gln Leu Val Phe Asp
85 90 95
Asn Gln Phe Gly Leu Glu Glu Ala Glu Asn Asp Ile Cys Arg Tyr Asp
100 105 110
Phe Val Glu Val Glu Asp Ile Ser Glu Thr Ser Thr Ile Ile Arg Gly
115 120 125
Arg Trp Cys Gly His Lys Glu Val Pro Pro Arg Ile Lys Ser Arg Thr
130 135 140
Asn Gln Ile Lys Ile Thr Phe Lys Ser Asp Asp Tyr Phe Val Ala Lys
145 150 155 160
Pro Gly Phe Lys Ile Tyr Tyr Ser Leu Leu Glu Asp Phe Gln Pro Ala
165 170 175
Ala Ala Ser Glu Thr Asn Trp Glu Ser Val Thr Ser Ser Ile Ser Gly
180 185 190
Val Ser Tyr Asn Ser Pro Ser Val Thr Asp Pro Thr Leu Ile Ala Asp
195 200 205
Ala Leu Asp Lys Lys Ile Ala Glu Phe Asp Thr Val Glu Asp Leu Leu
210 215 220
Lys Tyr Phe Asn Pro Glu Ser Trp Gln Glu Asp Leu Glu Asn Met Tyr
225 230 235 240
Leu Asp Thr Pro Arg Tyr Arg Gly Arg Ser Tyr His Asp Arg Lys Ser
245 250 255
Lys Val Asp Leu Asp Arg Leu Asn Asp Asp Ala Lys Arg Tyr Ser Cys
260 265 270
Thr Pro Arg Asn Tyr Ser Val Asn Ile Arg Glu Glu Leu Lys Leu Ala
275 280 285
Asn Val Val Phe Phe Pro Arg Cys Leu Leu Val Gln Arg Cys Gly Gly
290 295 300
Asn Cys Gly Cys Gly Thr Val Asn Trp Arg Ser Cys Thr Cys Asn Ser
305 310 315 320
Gly Lys Thr Val Lys Lys Tyr His Glu Val Leu Gln Phe Glu Pro Gly
325 330 335
His Ile Lys Arg Arg Gly Arg Ala Lys Thr Met Ala Leu Val Asp Ile
340 345 350
Gln Leu Asp His His Glu Arg Cys Asp Cys Ile Cys Ser Ser Arg Pro
355 360 365
Pro Arg
370
<210> 128
<211> 364
<212> ПРТ
<213> Homo sapiens
<400> 128
Met His Arg Leu Ile Phe Val Tyr Thr Leu Ile Cys Ala Asn Phe Cys
1 5 10 15
Ser Cys Arg Asp Thr Ser Ala Thr Pro Gln Ser Ala Ser Ile Lys Ala
20 25 30
Leu Arg Asn Ala Asn Leu Arg Arg Asp Asp Leu Tyr Arg Arg Asp Glu
35 40 45
Thr Ile Gln Val Lys Gly Asn Gly Tyr Val Gln Ser Pro Arg Phe Pro
50 55 60
Asn Ser Tyr Pro Arg Asn Leu Leu Leu Thr Trp Arg Leu His Ser Gln
65 70 75 80
Glu Asn Thr Arg Ile Gln Leu Val Phe Asp Asn Gln Phe Gly Leu Glu
85 90 95
Glu Ala Glu Asn Asp Ile Cys Arg Tyr Asp Phe Val Glu Val Glu Asp
100 105 110
Ile Ser Glu Thr Ser Thr Ile Ile Arg Gly Arg Trp Cys Gly His Lys
115 120 125
Glu Val Pro Pro Arg Ile Lys Ser Arg Thr Asn Gln Ile Lys Ile Thr
130 135 140
Phe Lys Ser Asp Asp Tyr Phe Val Ala Lys Pro Gly Phe Lys Ile Tyr
145 150 155 160
Tyr Ser Leu Leu Glu Asp Phe Gln Pro Ala Ala Ala Ser Glu Thr Asn
165 170 175
Trp Glu Ser Val Thr Ser Ser Ile Ser Gly Val Ser Tyr Asn Ser Pro
180 185 190
Ser Val Thr Asp Pro Thr Leu Ile Ala Asp Ala Leu Asp Lys Lys Ile
195 200 205
Ala Glu Phe Asp Thr Val Glu Asp Leu Leu Lys Tyr Phe Asn Pro Glu
210 215 220
Ser Trp Gln Glu Asp Leu Glu Asn Met Tyr Leu Asp Thr Pro Arg Tyr
225 230 235 240
Arg Gly Arg Ser Tyr His Asp Arg Lys Ser Lys Val Asp Leu Asp Arg
245 250 255
Leu Asn Asp Asp Ala Lys Arg Tyr Ser Cys Thr Pro Arg Asn Tyr Ser
260 265 270
Val Asn Ile Arg Glu Glu Leu Lys Leu Ala Asn Val Val Phe Phe Pro
275 280 285
Arg Cys Leu Leu Val Gln Arg Cys Gly Gly Asn Cys Gly Cys Gly Thr
290 295 300
Val Asn Trp Arg Ser Cys Thr Cys Asn Ser Gly Lys Thr Val Lys Lys
305 310 315 320
Tyr His Glu Val Leu Gln Phe Glu Pro Gly His Ile Lys Arg Arg Gly
325 330 335
Arg Ala Lys Thr Met Ala Leu Val Asp Ile Gln Leu Asp His His Glu
340 345 350
Arg Cys Asp Cys Ile Cys Ser Ser Arg Pro Pro Arg
355 360
<210> 129
<211> 469
<212> ПРТ
<213> Homo sapiens
<400> 129
Met His Ser Phe Pro Pro Leu Leu Leu Leu Leu Phe Trp Gly Val Val
1 5 10 15
Ser His Ser Phe Pro Ala Thr Leu Glu Thr Gln Glu Gln Asp Val Asp
20 25 30
Leu Val Gln Lys Tyr Leu Glu Lys Tyr Tyr Asn Leu Lys Asn Asp Gly
35 40 45
Arg Gln Val Glu Lys Arg Arg Asn Ser Gly Pro Val Val Glu Lys Leu
50 55 60
Lys Gln Met Gln Glu Phe Phe Gly Leu Lys Val Thr Gly Lys Pro Asp
65 70 75 80
Ala Glu Thr Leu Lys Val Met Lys Gln Pro Arg Cys Gly Val Pro Asp
85 90 95
Val Ala Gln Phe Val Leu Thr Glu Gly Asn Pro Arg Trp Glu Gln Thr
100 105 110
His Leu Thr Tyr Arg Ile Glu Asn Tyr Thr Pro Asp Leu Pro Arg Ala
115 120 125
Asp Val Asp His Ala Ile Glu Lys Ala Phe Gln Leu Trp Ser Asn Val
130 135 140
Thr Pro Leu Thr Phe Thr Lys Val Ser Glu Gly Gln Ala Asp Ile Met
145 150 155 160
Ile Ser Phe Val Arg Gly Asp His Arg Asp Asn Ser Pro Phe Asp Gly
165 170 175
Pro Gly Gly Asn Leu Ala His Ala Phe Gln Pro Gly Pro Gly Ile Gly
180 185 190
Gly Asp Ala His Phe Asp Glu Asp Glu Arg Trp Thr Asn Asn Phe Arg
195 200 205
Glu Tyr Asn Leu His Arg Val Ala Ala His Glu Leu Gly His Ser Leu
210 215 220
Gly Leu Ser His Ser Thr Asp Ile Gly Ala Leu Met Tyr Pro Ser Tyr
225 230 235 240
Thr Phe Ser Gly Asp Val Gln Leu Ala Gln Asp Asp Ile Asp Gly Ile
245 250 255
Gln Ala Ile Tyr Gly Arg Ser Gln Asn Pro Val Gln Pro Ile Gly Pro
260 265 270
Gln Thr Pro Lys Ala Cys Asp Ser Lys Leu Thr Phe Asp Ala Ile Thr
275 280 285
Thr Ile Arg Gly Glu Val Met Phe Phe Lys Asp Arg Phe Tyr Met Arg
290 295 300
Thr Asn Pro Phe Tyr Pro Glu Val Glu Leu Asn Phe Ile Ser Val Phe
305 310 315 320
Trp Pro Gln Leu Pro Asn Gly Leu Glu Ala Ala Tyr Glu Phe Ala Asp
325 330 335
Arg Asp Glu Val Arg Phe Phe Lys Gly Asn Lys Tyr Trp Ala Val Gln
340 345 350
Gly Gln Asn Val Leu His Gly Tyr Pro Lys Asp Ile Tyr Ser Ser Phe
355 360 365
Gly Phe Pro Arg Thr Val Lys His Ile Asp Ala Ala Leu Ser Glu Glu
370 375 380
Asn Thr Gly Lys Thr Tyr Phe Phe Val Ala Asn Lys Tyr Trp Arg Tyr
385 390 395 400
Asp Glu Tyr Lys Arg Ser Met Asp Pro Gly Tyr Pro Lys Met Ile Ala
405 410 415
His Asp Phe Pro Gly Ile Gly His Lys Val Asp Ala Val Phe Met Lys
420 425 430
Asp Gly Phe Phe Tyr Phe Phe His Gly Thr Arg Gln Tyr Lys Phe Asp
435 440 445
Pro Lys Thr Lys Arg Ile Leu Thr Leu Gln Lys Ala Asn Ser Trp Phe
450 455 460
Asn Cys Arg Lys Asn
465
<210> 130
<211> 403
<212> ПРТ
<213> Homo sapiens
<400> 130
Met Gln Glu Phe Phe Gly Leu Lys Val Thr Gly Lys Pro Asp Ala Glu
1 5 10 15
Thr Leu Lys Val Met Lys Gln Pro Arg Cys Gly Val Pro Asp Val Ala
20 25 30
Gln Phe Val Leu Thr Glu Gly Asn Pro Arg Trp Glu Gln Thr His Leu
35 40 45
Thr Tyr Arg Ile Glu Asn Tyr Thr Pro Asp Leu Pro Arg Ala Asp Val
50 55 60
Asp His Ala Ile Glu Lys Ala Phe Gln Leu Trp Ser Asn Val Thr Pro
65 70 75 80
Leu Thr Phe Thr Lys Val Ser Glu Gly Gln Ala Asp Ile Met Ile Ser
85 90 95
Phe Val Arg Gly Asp His Arg Asp Asn Ser Pro Phe Asp Gly Pro Gly
100 105 110
Gly Asn Leu Ala His Ala Phe Gln Pro Gly Pro Gly Ile Gly Gly Asp
115 120 125
Ala His Phe Asp Glu Asp Glu Arg Trp Thr Asn Asn Phe Arg Glu Tyr
130 135 140
Asn Leu His Arg Val Ala Ala His Glu Leu Gly His Ser Leu Gly Leu
145 150 155 160
Ser His Ser Thr Asp Ile Gly Ala Leu Met Tyr Pro Ser Tyr Thr Phe
165 170 175
Ser Gly Asp Val Gln Leu Ala Gln Asp Asp Ile Asp Gly Ile Gln Ala
180 185 190
Ile Tyr Gly Arg Ser Gln Asn Pro Val Gln Pro Ile Gly Pro Gln Thr
195 200 205
Pro Lys Ala Cys Asp Ser Lys Leu Thr Phe Asp Ala Ile Thr Thr Ile
210 215 220
Arg Gly Glu Val Met Phe Phe Lys Asp Arg Phe Tyr Met Arg Thr Asn
225 230 235 240
Pro Phe Tyr Pro Glu Val Glu Leu Asn Phe Ile Ser Val Phe Trp Pro
245 250 255
Gln Leu Pro Asn Gly Leu Glu Ala Ala Tyr Glu Phe Ala Asp Arg Asp
260 265 270
Glu Val Arg Phe Phe Lys Gly Asn Lys Tyr Trp Ala Val Gln Gly Gln
275 280 285
Asn Val Leu His Gly Tyr Pro Lys Asp Ile Tyr Ser Ser Phe Gly Phe
290 295 300
Pro Arg Thr Val Lys His Ile Asp Ala Ala Leu Ser Glu Glu Asn Thr
305 310 315 320
Gly Lys Thr Tyr Phe Phe Val Ala Asn Lys Tyr Trp Arg Tyr Asp Glu
325 330 335
Tyr Lys Arg Ser Met Asp Pro Gly Tyr Pro Lys Met Ile Ala His Asp
340 345 350
Phe Pro Gly Ile Gly His Lys Val Asp Ala Val Phe Met Lys Asp Gly
355 360 365
Phe Phe Tyr Phe Phe His Gly Thr Arg Gln Tyr Lys Phe Asp Pro Lys
370 375 380
Thr Lys Arg Ile Leu Thr Leu Gln Lys Ala Asn Ser Trp Phe Asn Cys
385 390 395 400
Arg Lys Asn
<210> 131
<211> 467
<212> ПРТ
<213> Homo sapiens
<400> 131
Met Phe Ser Leu Lys Thr Leu Pro Phe Leu Leu Leu Leu His Val Gln
1 5 10 15
Ile Ser Lys Ala Phe Pro Val Ser Ser Lys Glu Lys Asn Thr Lys Thr
20 25 30
Val Gln Asp Tyr Leu Glu Lys Phe Tyr Gln Leu Pro Ser Asn Gln Tyr
35 40 45
Gln Ser Thr Arg Lys Asn Gly Thr Asn Val Ile Val Glu Lys Leu Lys
50 55 60
Glu Met Gln Arg Phe Phe Gly Leu Asn Val Thr Gly Lys Pro Asn Glu
65 70 75 80
Glu Thr Leu Asp Met Met Lys Lys Pro Arg Cys Gly Val Pro Asp Ser
85 90 95
Gly Gly Phe Met Leu Thr Pro Gly Asn Pro Lys Trp Glu Arg Thr Asn
100 105 110
Leu Thr Tyr Arg Ile Arg Asn Tyr Thr Pro Gln Leu Ser Glu Ala Glu
115 120 125
Val Glu Arg Ala Ile Lys Asp Ala Phe Glu Leu Trp Ser Val Ala Ser
130 135 140
Pro Leu Ile Phe Thr Arg Ile Ser Gln Gly Glu Ala Asp Ile Asn Ile
145 150 155 160
Ala Phe Tyr Gln Arg Asp His Gly Asp Asn Ser Pro Phe Asp Gly Pro
165 170 175
Asn Gly Ile Leu Ala His Ala Phe Gln Pro Gly Gln Gly Ile Gly Gly
180 185 190
Asp Ala His Phe Asp Ala Glu Glu Thr Trp Thr Asn Thr Ser Ala Asn
195 200 205
Tyr Asn Leu Phe Leu Val Ala Ala His Glu Phe Gly His Ser Leu Gly
210 215 220
Leu Ala His Ser Ser Asp Pro Gly Ala Leu Met Tyr Pro Asn Tyr Ala
225 230 235 240
Phe Arg Glu Thr Ser Asn Tyr Ser Leu Pro Gln Asp Asp Ile Asp Gly
245 250 255
Ile Gln Ala Ile Tyr Gly Leu Ser Ser Asn Pro Ile Gln Pro Thr Gly
260 265 270
Pro Ser Thr Pro Lys Pro Cys Asp Pro Ser Leu Thr Phe Asp Ala Ile
275 280 285
Thr Thr Leu Arg Gly Glu Ile Leu Phe Phe Lys Asp Arg Tyr Phe Trp
290 295 300
Arg Arg His Pro Gln Leu Gln Arg Val Glu Met Asn Phe Ile Ser Leu
305 310 315 320
Phe Trp Pro Ser Leu Pro Thr Gly Ile Gln Ala Ala Tyr Glu Asp Phe
325 330 335
Asp Arg Asp Leu Ile Phe Leu Phe Lys Gly Asn Gln Tyr Trp Ala Leu
340 345 350
Ser Gly Tyr Asp Ile Leu Gln Gly Tyr Pro Lys Asp Ile Ser Asn Tyr
355 360 365
Gly Phe Pro Ser Ser Val Gln Ala Ile Asp Ala Ala Val Phe Tyr Arg
370 375 380
Ser Lys Thr Tyr Phe Phe Val Asn Asp Gln Phe Trp Arg Tyr Asp Asn
385 390 395 400
Gln Arg Gln Phe Met Glu Pro Gly Tyr Pro Lys Ser Ile Ser Gly Ala
405 410 415
Phe Pro Gly Ile Glu Ser Lys Val Asp Ala Val Phe Gln Gln Glu His
420 425 430
Phe Phe His Val Phe Ser Gly Pro Arg Tyr Tyr Ala Phe Asp Leu Ile
435 440 445
Ala Gln Arg Val Thr Arg Val Ala Arg Gly Asn Lys Trp Leu Asn Cys
450 455 460
Arg Tyr Gly
465
<210> 132
<211> 476
<212> ПРТ
<213> Homo sapiens
<400> 132
Met Met His Leu Ala Phe Leu Val Leu Leu Cys Leu Pro Val Cys Ser
1 5 10 15
Ala Tyr Pro Leu Ser Gly Ala Ala Lys Glu Glu Asp Ser Asn Lys Asp
20 25 30
Leu Ala Gln Gln Tyr Leu Glu Lys Tyr Tyr Asn Leu Glu Lys Asp Val
35 40 45
Lys Gln Phe Arg Arg Lys Asp Ser Asn Leu Ile Val Lys Lys Ile Gln
50 55 60
Gly Met Gln Lys Phe Leu Gly Leu Glu Val Thr Gly Lys Leu Asp Thr
65 70 75 80
Asp Thr Leu Glu Val Met Arg Lys Pro Arg Cys Gly Val Pro Asp Val
85 90 95
Gly His Phe Ser Ser Phe Pro Gly Met Pro Lys Trp Arg Lys Thr His
100 105 110
Leu Thr Tyr Arg Ile Val Asn Tyr Thr Pro Asp Leu Pro Arg Asp Ala
115 120 125
Val Asp Ser Ala Ile Glu Lys Ala Leu Lys Val Trp Glu Glu Val Thr
130 135 140
Pro Leu Thr Phe Ser Arg Leu Tyr Glu Gly Glu Ala Asp Ile Met Ile
145 150 155 160
Ser Phe Ala Val Lys Glu His Gly Asp Phe Tyr Ser Phe Asp Gly Pro
165 170 175
Gly His Ser Leu Ala His Ala Tyr Pro Pro Gly Pro Gly Leu Tyr Gly
180 185 190
Asp Ile His Phe Asp Asp Asp Glu Lys Trp Thr Glu Asp Ala Ser Gly
195 200 205
Thr Asn Leu Phe Leu Val Ala Ala His Glu Leu Gly His Ser Leu Gly
210 215 220
Leu Phe His Ser Ala Asn Thr Glu Ala Leu Met Tyr Pro Leu Tyr Asn
225 230 235 240
Ser Phe Thr Glu Leu Ala Gln Phe Arg Leu Ser Gln Asp Asp Val Asn
245 250 255
Gly Ile Gln Ser Leu Tyr Gly Pro Pro Pro Ala Ser Thr Glu Glu Pro
260 265 270
Leu Val Pro Thr Lys Ser Val Pro Ser Gly Ser Glu Met Pro Ala Lys
275 280 285
Cys Asp Pro Ala Leu Ser Phe Asp Ala Ile Ser Thr Leu Arg Gly Glu
290 295 300
Tyr Leu Phe Phe Lys Asp Arg Tyr Phe Trp Arg Arg Ser His Trp Asn
305 310 315 320
Pro Glu Pro Glu Phe His Leu Ile Ser Ala Phe Trp Pro Ser Leu Pro
325 330 335
Ser Tyr Leu Asp Ala Ala Tyr Glu Val Asn Ser Arg Asp Thr Val Phe
340 345 350
Ile Phe Lys Gly Asn Glu Phe Trp Ala Ile Arg Gly Asn Glu Val Gln
355 360 365
Ala Gly Tyr Pro Arg Gly Ile His Thr Leu Gly Phe Pro Pro Thr Ile
370 375 380
Arg Lys Ile Asp Ala Ala Val Ser Asp Lys Glu Lys Lys Lys Thr Tyr
385 390 395 400
Phe Phe Ala Ala Asp Lys Tyr Trp Arg Phe Asp Glu Asn Ser Gln Ser
405 410 415
Met Glu Gln Gly Phe Pro Arg Leu Ile Ala Asp Asp Phe Pro Gly Val
420 425 430
Glu Pro Lys Val Asp Ala Val Leu Gln Ala Phe Gly Phe Phe Tyr Phe
435 440 445
Phe Ser Gly Ser Ser Gln Phe Glu Phe Asp Pro Asn Ala Arg Met Val
450 455 460
Thr His Ile Leu Lys Ser Asn Ser Trp Leu His Cys
465 470 475
<210> 133
<211> 470
<212> ПРТ
<213> Homo sapiens
<400> 133
Met Lys Phe Leu Leu Ile Leu Leu Leu Gln Ala Thr Ala Ser Gly Ala
1 5 10 15
Leu Pro Leu Asn Ser Ser Thr Ser Leu Glu Lys Asn Asn Val Leu Phe
20 25 30
Gly Glu Arg Tyr Leu Glu Lys Phe Tyr Gly Leu Glu Ile Asn Lys Leu
35 40 45
Pro Val Thr Lys Met Lys Tyr Ser Gly Asn Leu Met Lys Glu Lys Ile
50 55 60
Gln Glu Met Gln His Phe Leu Gly Leu Lys Val Thr Gly Gln Leu Asp
65 70 75 80
Thr Ser Thr Leu Glu Met Met His Ala Pro Arg Cys Gly Val Pro Asp
85 90 95
Val His His Phe Arg Glu Met Pro Gly Gly Pro Val Trp Arg Lys His
100 105 110
Tyr Ile Thr Tyr Arg Ile Asn Asn Tyr Thr Pro Asp Met Asn Arg Glu
115 120 125
Asp Val Asp Tyr Ala Ile Arg Lys Ala Phe Gln Val Trp Ser Asn Val
130 135 140
Thr Pro Leu Lys Phe Ser Lys Ile Asn Thr Gly Met Ala Asp Ile Leu
145 150 155 160
Val Val Phe Ala Arg Gly Ala His Gly Asp Phe His Ala Phe Asp Gly
165 170 175
Lys Gly Gly Ile Leu Ala His Ala Phe Gly Pro Gly Ser Gly Ile Gly
180 185 190
Gly Asp Ala His Phe Asp Glu Asp Glu Phe Trp Thr Thr His Ser Gly
195 200 205
Gly Thr Asn Leu Phe Leu Thr Ala Val His Glu Ile Gly His Ser Leu
210 215 220
Gly Leu Gly His Ser Ser Asp Pro Lys Ala Val Met Phe Pro Thr Tyr
225 230 235 240
Lys Tyr Val Asp Ile Asn Thr Phe Arg Leu Ser Ala Asp Asp Ile Arg
245 250 255
Gly Ile Gln Ser Leu Tyr Gly Asp Pro Lys Glu Asn Gln Arg Leu Pro
260 265 270
Asn Pro Asp Asn Ser Glu Pro Ala Leu Cys Asp Pro Asn Leu Ser Phe
275 280 285
Asp Ala Val Thr Thr Val Gly Asn Lys Ile Phe Phe Phe Lys Asp Arg
290 295 300
Phe Phe Trp Leu Lys Val Ser Glu Arg Pro Lys Thr Ser Val Asn Leu
305 310 315 320
Ile Ser Ser Leu Trp Pro Thr Leu Pro Ser Gly Ile Glu Ala Ala Tyr
325 330 335
Glu Ile Glu Ala Arg Asn Gln Val Phe Leu Phe Lys Asp Asp Lys Tyr
340 345 350
Trp Leu Ile Ser Asn Leu Arg Pro Glu Pro Asn Tyr Pro Lys Ser Ile
355 360 365
His Ser Phe Gly Phe Pro Asn Phe Val Lys Lys Ile Asp Ala Ala Val
370 375 380
Phe Asn Pro Arg Phe Tyr Arg Thr Tyr Phe Phe Val Asp Asn Gln Tyr
385 390 395 400
Trp Arg Tyr Asp Glu Arg Arg Gln Met Met Asp Pro Gly Tyr Pro Lys
405 410 415
Leu Ile Thr Lys Asn Phe Gln Gly Ile Gly Pro Lys Ile Asp Ala Val
420 425 430
Phe Tyr Ser Lys Asn Lys Tyr Tyr Tyr Phe Phe Gln Gly Ser Asn Gln
435 440 445
Phe Glu Tyr Asp Phe Leu Leu Gln Arg Ile Thr Lys Thr Leu Lys Ser
450 455 460
Asn Ser Trp Phe Gly Cys
465 470
<210> 134
<211> 2871
<212> ПРТ
<213> Homo sapiens
<400> 134
Met Arg Arg Gly Arg Leu Leu Glu Ile Ala Leu Gly Phe Thr Val Leu
1 5 10 15
Leu Ala Ser Tyr Thr Ser His Gly Ala Asp Ala Asn Leu Glu Ala Gly
20 25 30
Asn Val Lys Glu Thr Arg Ala Ser Arg Ala Lys Arg Arg Gly Gly Gly
35 40 45
Gly His Asp Ala Leu Lys Gly Pro Asn Val Cys Gly Ser Arg Tyr Asn
50 55 60
Ala Tyr Cys Cys Pro Gly Trp Lys Thr Leu Pro Gly Gly Asn Gln Cys
65 70 75 80
Ile Val Pro Ile Cys Arg His Ser Cys Gly Asp Gly Phe Cys Ser Arg
85 90 95
Pro Asn Met Cys Thr Cys Pro Ser Gly Gln Ile Ala Pro Ser Cys Gly
100 105 110
Ser Arg Ser Ile Gln His Cys Asn Ile Arg Cys Met Asn Gly Gly Ser
115 120 125
Cys Ser Asp Asp His Cys Leu Cys Gln Lys Gly Tyr Ile Gly Thr His
130 135 140
Cys Gly Gln Pro Val Cys Glu Ser Gly Cys Leu Asn Gly Gly Arg Cys
145 150 155 160
Val Ala Pro Asn Arg Cys Ala Cys Thr Tyr Gly Phe Thr Gly Pro Gln
165 170 175
Cys Glu Arg Asp Tyr Arg Thr Gly Pro Cys Phe Thr Val Ile Ser Asn
180 185 190
Gln Met Cys Gln Gly Gln Leu Ser Gly Ile Val Cys Thr Lys Thr Leu
195 200 205
Cys Cys Ala Thr Val Gly Arg Ala Trp Gly His Pro Cys Glu Met Cys
210 215 220
Pro Ala Gln Pro His Pro Cys Arg Arg Gly Phe Ile Pro Asn Ile Arg
225 230 235 240
Thr Gly Ala Cys Gln Asp Val Asp Glu Cys Gln Ala Ile Pro Gly Leu
245 250 255
Cys Gln Gly Gly Asn Cys Ile Asn Thr Val Gly Ser Phe Glu Cys Lys
260 265 270
Cys Pro Ala Gly His Lys Leu Asn Glu Val Ser Gln Lys Cys Glu Asp
275 280 285
Ile Asp Glu Cys Ser Thr Ile Pro Gly Ile Cys Glu Gly Gly Glu Cys
290 295 300
Thr Asn Thr Val Ser Ser Tyr Phe Cys Lys Cys Pro Pro Gly Phe Tyr
305 310 315 320
Thr Ser Pro Asp Gly Thr Arg Cys Ile Asp Val Arg Pro Gly Tyr Cys
325 330 335
Tyr Thr Ala Leu Thr Asn Gly Arg Cys Ser Asn Gln Leu Pro Gln Ser
340 345 350
Ile Thr Lys Met Gln Cys Cys Cys Asp Ala Gly Arg Cys Trp Ser Pro
355 360 365
Gly Val Thr Val Ala Pro Glu Met Cys Pro Ile Arg Ala Thr Glu Asp
370 375 380
Phe Asn Lys Leu Cys Ser Val Pro Met Val Ile Pro Gly Arg Pro Glu
385 390 395 400
Tyr Pro Pro Pro Pro Leu Gly Pro Ile Pro Pro Val Leu Pro Val Pro
405 410 415
Pro Gly Phe Pro Pro Gly Pro Gln Ile Pro Val Pro Arg Pro Pro Val
420 425 430
Glu Tyr Leu Tyr Pro Ser Arg Glu Pro Pro Arg Val Leu Pro Val Asn
435 440 445
Val Thr Asp Tyr Cys Gln Leu Val Arg Tyr Leu Cys Gln Asn Gly Arg
450 455 460
Cys Ile Pro Thr Pro Gly Ser Tyr Arg Cys Glu Cys Asn Lys Gly Phe
465 470 475 480
Gln Leu Asp Leu Arg Gly Glu Cys Ile Asp Val Asp Glu Cys Glu Lys
485 490 495
Asn Pro Cys Ala Gly Gly Glu Cys Ile Asn Asn Gln Gly Ser Tyr Thr
500 505 510
Cys Gln Cys Arg Ala Gly Tyr Gln Ser Thr Leu Thr Arg Thr Glu Cys
515 520 525
Arg Asp Ile Asp Glu Cys Leu Gln Asn Gly Arg Ile Cys Asn Asn Gly
530 535 540
Arg Cys Ile Asn Thr Asp Gly Ser Phe His Cys Val Cys Asn Ala Gly
545 550 555 560
Phe His Val Thr Arg Asp Gly Lys Asn Cys Glu Asp Met Asp Glu Cys
565 570 575
Ser Ile Arg Asn Met Cys Leu Asn Gly Met Cys Ile Asn Glu Asp Gly
580 585 590
Ser Phe Lys Cys Ile Cys Lys Pro Gly Phe Gln Leu Ala Ser Asp Gly
595 600 605
Arg Tyr Cys Lys Asp Ile Asn Glu Cys Glu Thr Pro Gly Ile Cys Met
610 615 620
Asn Gly Arg Cys Val Asn Thr Asp Gly Ser Tyr Arg Cys Glu Cys Phe
625 630 635 640
Pro Gly Leu Ala Val Gly Leu Asp Gly Arg Val Cys Val Asp Thr His
645 650 655
Met Arg Ser Thr Cys Tyr Gly Gly Tyr Lys Arg Gly Gln Cys Ile Lys
660 665 670
Pro Leu Phe Gly Ala Val Thr Lys Ser Glu Cys Cys Cys Ala Ser Thr
675 680 685
Glu Tyr Ala Phe Gly Glu Pro Cys Gln Pro Cys Pro Ala Gln Asn Ser
690 695 700
Ala Glu Tyr Gln Ala Leu Cys Ser Ser Gly Pro Gly Met Thr Ser Ala
705 710 715 720
Gly Ser Asp Ile Asn Glu Cys Ala Leu Asp Pro Asp Ile Cys Pro Asn
725 730 735
Gly Ile Cys Glu Asn Leu Arg Gly Thr Tyr Lys Cys Ile Cys Asn Ser
740 745 750
Gly Tyr Glu Val Asp Ser Thr Gly Lys Asn Cys Val Asp Ile Asn Glu
755 760 765
Cys Val Leu Asn Ser Leu Leu Cys Asp Asn Gly Gln Cys Arg Asn Thr
770 775 780
Pro Gly Ser Phe Val Cys Thr Cys Pro Lys Gly Phe Ile Tyr Lys Pro
785 790 795 800
Asp Leu Lys Thr Cys Glu Asp Ile Asp Glu Cys Glu Ser Ser Pro Cys
805 810 815
Ile Asn Gly Val Cys Lys Asn Ser Pro Gly Ser Phe Ile Cys Glu Cys
820 825 830
Ser Ser Glu Ser Thr Leu Asp Pro Thr Lys Thr Ile Cys Ile Glu Thr
835 840 845
Ile Lys Gly Thr Cys Trp Gln Thr Val Ile Asp Gly Arg Cys Glu Ile
850 855 860
Asn Ile Asn Gly Ala Thr Leu Lys Ser Gln Cys Cys Ser Ser Leu Gly
865 870 875 880
Ala Ala Trp Gly Ser Pro Cys Thr Leu Cys Gln Val Asp Pro Ile Cys
885 890 895
Gly Lys Gly Tyr Ser Arg Ile Lys Gly Thr Gln Cys Glu Asp Ile Asp
900 905 910
Glu Cys Glu Val Phe Pro Gly Val Cys Lys Asn Gly Leu Cys Val Asn
915 920 925
Thr Arg Gly Ser Phe Lys Cys Gln Cys Pro Ser Gly Met Thr Leu Asp
930 935 940
Ala Thr Gly Arg Ile Cys Leu Asp Ile Arg Leu Glu Thr Cys Phe Leu
945 950 955 960
Arg Tyr Glu Asp Glu Glu Cys Thr Leu Pro Ile Ala Gly Arg His Arg
965 970 975
Met Asp Ala Cys Cys Cys Ser Val Gly Ala Ala Trp Gly Thr Glu Glu
980 985 990
Cys Glu Glu Cys Pro Met Arg Asn Thr Pro Glu Tyr Glu Glu Leu Cys
995 1000 1005
Pro Arg Gly Pro Gly Phe Ala Thr Lys Glu Ile Thr Asn Gly Lys
1010 1015 1020
Pro Phe Phe Lys Asp Ile Asn Glu Cys Lys Met Ile Pro Ser Leu
1025 1030 1035
Cys Thr His Gly Lys Cys Arg Asn Thr Ile Gly Ser Phe Lys Cys
1040 1045 1050
Arg Cys Asp Ser Gly Phe Ala Leu Asp Ser Glu Glu Arg Asn Cys
1055 1060 1065
Thr Asp Ile Asp Glu Cys Arg Ile Ser Pro Asp Leu Cys Gly Arg
1070 1075 1080
Gly Gln Cys Val Asn Thr Pro Gly Asp Phe Glu Cys Lys Cys Asp
1085 1090 1095
Glu Gly Tyr Glu Ser Gly Phe Met Met Met Lys Asn Cys Met Asp
1100 1105 1110
Ile Asp Glu Cys Gln Arg Asp Pro Leu Leu Cys Arg Gly Gly Val
1115 1120 1125
Cys His Asn Thr Glu Gly Ser Tyr Arg Cys Glu Cys Pro Pro Gly
1130 1135 1140
His Gln Leu Ser Pro Asn Ile Ser Ala Cys Ile Asp Ile Asn Glu
1145 1150 1155
Cys Glu Leu Ser Ala His Leu Cys Pro Asn Gly Arg Cys Val Asn
1160 1165 1170
Leu Ile Gly Lys Tyr Gln Cys Ala Cys Asn Pro Gly Tyr His Ser
1175 1180 1185
Thr Pro Asp Arg Leu Phe Cys Val Asp Ile Asp Glu Cys Ser Ile
1190 1195 1200
Met Asn Gly Gly Cys Glu Thr Phe Cys Thr Asn Ser Glu Gly Ser
1205 1210 1215
Tyr Glu Cys Ser Cys Gln Pro Gly Phe Ala Leu Met Pro Asp Gln
1220 1225 1230
Arg Ser Cys Thr Asp Ile Asp Glu Cys Glu Asp Asn Pro Asn Ile
1235 1240 1245
Cys Asp Gly Gly Gln Cys Thr Asn Ile Pro Gly Glu Tyr Arg Cys
1250 1255 1260
Leu Cys Tyr Asp Gly Phe Met Ala Ser Glu Asp Met Lys Thr Cys
1265 1270 1275
Val Asp Val Asn Glu Cys Asp Leu Asn Pro Asn Ile Cys Leu Ser
1280 1285 1290
Gly Thr Cys Glu Asn Thr Lys Gly Ser Phe Ile Cys His Cys Asp
1295 1300 1305
Met Gly Tyr Ser Gly Lys Lys Gly Lys Thr Gly Cys Thr Asp Ile
1310 1315 1320
Asn Glu Cys Glu Ile Gly Ala His Asn Cys Gly Lys His Ala Val
1325 1330 1335
Cys Thr Asn Thr Ala Gly Ser Phe Lys Cys Ser Cys Ser Pro Gly
1340 1345 1350
Trp Ile Gly Asp Gly Ile Lys Cys Thr Asp Leu Asp Glu Cys Ser
1355 1360 1365
Asn Gly Thr His Met Cys Ser Gln His Ala Asp Cys Lys Asn Thr
1370 1375 1380
Met Gly Ser Tyr Arg Cys Leu Cys Lys Glu Gly Tyr Thr Gly Asp
1385 1390 1395
Gly Phe Thr Cys Thr Asp Leu Asp Glu Cys Ser Glu Asn Leu Asn
1400 1405 1410
Leu Cys Gly Asn Gly Gln Cys Leu Asn Ala Pro Gly Gly Tyr Arg
1415 1420 1425
Cys Glu Cys Asp Met Gly Phe Val Pro Ser Ala Asp Gly Lys Ala
1430 1435 1440
Cys Glu Asp Ile Asp Glu Cys Ser Leu Pro Asn Ile Cys Val Phe
1445 1450 1455
Gly Thr Cys His Asn Leu Pro Gly Leu Phe Arg Cys Glu Cys Glu
1460 1465 1470
Ile Gly Tyr Glu Leu Asp Arg Ser Gly Gly Asn Cys Thr Asp Val
1475 1480 1485
Asn Glu Cys Leu Asp Pro Thr Thr Cys Ile Ser Gly Asn Cys Val
1490 1495 1500
Asn Thr Pro Gly Ser Tyr Ile Cys Asp Cys Pro Pro Asp Phe Glu
1505 1510 1515
Leu Asn Pro Thr Arg Val Gly Cys Val Asp Thr Arg Ser Gly Asn
1520 1525 1530
Cys Tyr Leu Asp Ile Arg Pro Arg Gly Asp Asn Gly Asp Thr Ala
1535 1540 1545
Cys Ser Asn Glu Ile Gly Val Gly Val Ser Lys Ala Ser Cys Cys
1550 1555 1560
Cys Ser Leu Gly Lys Ala Trp Gly Thr Pro Cys Glu Met Cys Pro
1565 1570 1575
Ala Val Asn Thr Ser Glu Tyr Lys Ile Leu Cys Pro Gly Gly Glu
1580 1585 1590
Gly Phe Arg Pro Asn Pro Ile Thr Val Ile Leu Glu Asp Ile Asp
1595 1600 1605
Glu Cys Gln Glu Leu Pro Gly Leu Cys Gln Gly Gly Lys Cys Ile
1610 1615 1620
Asn Thr Phe Gly Ser Phe Gln Cys Arg Cys Pro Thr Gly Tyr Tyr
1625 1630 1635
Leu Asn Glu Asp Thr Arg Val Cys Asp Asp Val Asn Glu Cys Glu
1640 1645 1650
Thr Pro Gly Ile Cys Gly Pro Gly Thr Cys Tyr Asn Thr Val Gly
1655 1660 1665
Asn Tyr Thr Cys Ile Cys Pro Pro Asp Tyr Met Gln Val Asn Gly
1670 1675 1680
Gly Asn Asn Cys Met Asp Met Arg Arg Ser Leu Cys Tyr Arg Asn
1685 1690 1695
Tyr Tyr Ala Asp Asn Gln Thr Cys Asp Gly Glu Leu Leu Phe Asn
1700 1705 1710
Met Thr Lys Lys Met Cys Cys Cys Ser Tyr Asn Ile Gly Arg Ala
1715 1720 1725
Trp Asn Lys Pro Cys Glu Gln Cys Pro Ile Pro Ser Thr Asp Glu
1730 1735 1740
Phe Ala Thr Leu Cys Gly Ser Gln Arg Pro Gly Phe Val Ile Asp
1745 1750 1755
Ile Tyr Thr Gly Leu Pro Val Asp Ile Asp Glu Cys Arg Glu Ile
1760 1765 1770
Pro Gly Val Cys Glu Asn Gly Val Cys Ile Asn Met Val Gly Ser
1775 1780 1785
Phe Arg Cys Glu Cys Pro Val Gly Phe Phe Tyr Asn Asp Lys Leu
1790 1795 1800
Leu Val Cys Glu Asp Ile Asp Glu Cys Gln Asn Gly Pro Val Cys
1805 1810 1815
Gln Arg Asn Ala Glu Cys Ile Asn Thr Ala Gly Ser Tyr Arg Cys
1820 1825 1830
Asp Cys Lys Pro Gly Tyr Arg Phe Thr Ser Thr Gly Gln Cys Asn
1835 1840 1845
Asp Arg Asn Glu Cys Gln Glu Ile Pro Asn Ile Cys Ser His Gly
1850 1855 1860
Gln Cys Ile Asp Thr Val Gly Ser Phe Tyr Cys Leu Cys His Thr
1865 1870 1875
Gly Phe Lys Thr Asn Asp Asp Gln Thr Met Cys Leu Asp Ile Asn
1880 1885 1890
Glu Cys Glu Arg Asp Ala Cys Gly Asn Gly Thr Cys Arg Asn Thr
1895 1900 1905
Ile Gly Ser Phe Asn Cys Arg Cys Asn His Gly Phe Ile Leu Ser
1910 1915 1920
His Asn Asn Asp Cys Ile Asp Val Asp Glu Cys Ala Ser Gly Asn
1925 1930 1935
Gly Asn Leu Cys Arg Asn Gly Gln Cys Ile Asn Thr Val Gly Ser
1940 1945 1950
Phe Gln Cys Gln Cys Asn Glu Gly Tyr Glu Val Ala Pro Asp Gly
1955 1960 1965
Arg Thr Cys Val Asp Ile Asn Glu Cys Leu Leu Glu Pro Arg Lys
1970 1975 1980
Cys Ala Pro Gly Thr Cys Gln Asn Leu Asp Gly Ser Tyr Arg Cys
1985 1990 1995
Ile Cys Pro Pro Gly Tyr Ser Leu Gln Asn Glu Lys Cys Glu Asp
2000 2005 2010
Ile Asp Glu Cys Val Glu Glu Pro Glu Ile Cys Ala Leu Gly Thr
2015 2020 2025
Cys Ser Asn Thr Glu Gly Ser Phe Lys Cys Leu Cys Pro Glu Gly
2030 2035 2040
Phe Ser Leu Ser Ser Ser Gly Arg Arg Cys Gln Asp Leu Arg Met
2045 2050 2055
Ser Tyr Cys Tyr Ala Lys Phe Glu Gly Gly Lys Cys Ser Ser Pro
2060 2065 2070
Lys Ser Arg Asn His Ser Lys Gln Glu Cys Cys Cys Ala Leu Lys
2075 2080 2085
Gly Glu Gly Trp Gly Asp Pro Cys Glu Leu Cys Pro Thr Glu Pro
2090 2095 2100
Asp Glu Ala Phe Arg Gln Ile Cys Pro Tyr Gly Ser Gly Ile Ile
2105 2110 2115
Val Gly Pro Asp Asp Ser Ala Val Asp Met Asp Glu Cys Lys Glu
2120 2125 2130
Pro Asp Val Cys Lys His Gly Gln Cys Ile Asn Thr Asp Gly Ser
2135 2140 2145
Tyr Arg Cys Glu Cys Pro Phe Gly Tyr Ile Leu Ala Gly Asn Glu
2150 2155 2160
Cys Val Asp Thr Asp Glu Cys Ser Val Gly Asn Pro Cys Gly Asn
2165 2170 2175
Gly Thr Cys Lys Asn Val Ile Gly Gly Phe Glu Cys Thr Cys Glu
2180 2185 2190
Glu Gly Phe Glu Pro Gly Pro Met Met Thr Cys Glu Asp Ile Asn
2195 2200 2205
Glu Cys Ala Gln Asn Pro Leu Leu Cys Ala Phe Arg Cys Val Asn
2210 2215 2220
Thr Tyr Gly Ser Tyr Glu Cys Lys Cys Pro Val Gly Tyr Val Leu
2225 2230 2235
Arg Glu Asp Arg Arg Met Cys Lys Asp Glu Asp Glu Cys Glu Glu
2240 2245 2250
Gly Lys His Asp Cys Thr Glu Lys Gln Met Glu Cys Lys Asn Leu
2255 2260 2265
Ile Gly Thr Tyr Met Cys Ile Cys Gly Pro Gly Tyr Gln Arg Arg
2270 2275 2280
Pro Asp Gly Glu Gly Cys Val Asp Glu Asn Glu Cys Gln Thr Lys
2285 2290 2295
Pro Gly Ile Cys Glu Asn Gly Arg Cys Leu Asn Thr Arg Gly Ser
2300 2305 2310
Tyr Thr Cys Glu Cys Asn Asp Gly Phe Thr Ala Ser Pro Asn Gln
2315 2320 2325
Asp Glu Cys Leu Asp Asn Arg Glu Gly Tyr Cys Phe Thr Glu Val
2330 2335 2340
Leu Gln Asn Met Cys Gln Ile Gly Ser Ser Asn Arg Asn Pro Val
2345 2350 2355
Thr Lys Ser Glu Cys Cys Cys Asp Gly Gly Arg Gly Trp Gly Pro
2360 2365 2370
His Cys Glu Ile Cys Pro Phe Gln Gly Thr Val Ala Phe Lys Lys
2375 2380 2385
Leu Cys Pro His Gly Arg Gly Phe Met Thr Asn Gly Ala Asp Ile
2390 2395 2400
Asp Glu Cys Lys Val Ile His Asp Val Cys Arg Asn Gly Glu Cys
2405 2410 2415
Val Asn Asp Arg Gly Ser Tyr His Cys Ile Cys Lys Thr Gly Tyr
2420 2425 2430
Thr Pro Asp Ile Thr Gly Thr Ser Cys Val Asp Leu Asn Glu Cys
2435 2440 2445
Asn Gln Ala Pro Lys Pro Cys Asn Phe Ile Cys Lys Asn Thr Glu
2450 2455 2460
Gly Ser Tyr Gln Cys Ser Cys Pro Lys Gly Tyr Ile Leu Gln Glu
2465 2470 2475
Asp Gly Arg Ser Cys Lys Asp Leu Asp Glu Cys Ala Thr Lys Gln
2480 2485 2490
His Asn Cys Gln Phe Leu Cys Val Asn Thr Ile Gly Gly Phe Thr
2495 2500 2505
Cys Lys Cys Pro Pro Gly Phe Thr Gln His His Thr Ser Cys Ile
2510 2515 2520
Asp Asn Asn Glu Cys Thr Ser Asp Ile Asn Leu Cys Gly Ser Lys
2525 2530 2535
Gly Ile Cys Gln Asn Thr Pro Gly Ser Phe Thr Cys Glu Cys Gln
2540 2545 2550
Arg Gly Phe Ser Leu Asp Gln Thr Gly Ser Ser Cys Glu Asp Val
2555 2560 2565
Asp Glu Cys Glu Gly Asn His Arg Cys Gln His Gly Cys Gln Asn
2570 2575 2580
Ile Ile Gly Gly Tyr Arg Cys Ser Cys Pro Gln Gly Tyr Leu Gln
2585 2590 2595
His Tyr Gln Trp Asn Gln Cys Val Asp Glu Asn Glu Cys Leu Ser
2600 2605 2610
Ala His Ile Cys Gly Gly Ala Ser Cys His Asn Thr Leu Gly Ser
2615 2620 2625
Tyr Lys Cys Met Cys Pro Ala Gly Phe Gln Tyr Glu Gln Phe Ser
2630 2635 2640
Gly Gly Cys Gln Asp Ile Asn Glu Cys Gly Ser Ala Gln Ala Pro
2645 2650 2655
Cys Ser Tyr Gly Cys Ser Asn Thr Glu Gly Gly Tyr Leu Cys Gly
2660 2665 2670
Cys Pro Pro Gly Tyr Phe Arg Ile Gly Gln Gly His Cys Val Ser
2675 2680 2685
Gly Met Gly Met Gly Arg Gly Asn Pro Glu Pro Pro Val Ser Gly
2690 2695 2700
Glu Met Asp Asp Asn Ser Leu Ser Pro Glu Ala Cys Tyr Glu Cys
2705 2710 2715
Lys Ile Asn Gly Tyr Pro Lys Arg Gly Arg Lys Arg Arg Ser Thr
2720 2725 2730
Asn Glu Thr Asp Ala Ser Asn Ile Glu Asp Gln Ser Glu Thr Glu
2735 2740 2745
Ala Asn Val Ser Leu Ala Ser Trp Asp Val Glu Lys Thr Ala Ile
2750 2755 2760
Phe Ala Phe Asn Ile Ser His Val Ser Asn Lys Val Arg Ile Leu
2765 2770 2775
Glu Leu Leu Pro Ala Leu Thr Thr Leu Thr Asn His Asn Arg Tyr
2780 2785 2790
Leu Ile Glu Ser Gly Asn Glu Asp Gly Phe Phe Lys Ile Asn Gln
2795 2800 2805
Lys Glu Gly Ile Ser Tyr Leu His Phe Thr Lys Lys Lys Pro Val
2810 2815 2820
Ala Gly Thr Tyr Ser Leu Gln Ile Ser Ser Thr Pro Leu Tyr Lys
2825 2830 2835
Lys Lys Glu Leu Asn Gln Leu Glu Asp Lys Tyr Asp Lys Asp Tyr
2840 2845 2850
Leu Ser Gly Glu Leu Gly Asp Asn Leu Lys Met Lys Ile Gln Val
2855 2860 2865
Leu Leu His
2870
<210> 135
<211> 2912
<212> ПРТ
<213> Homo sapiens
<400> 135
Met Gly Arg Arg Arg Arg Leu Cys Leu Gln Leu Tyr Phe Leu Trp Leu
1 5 10 15
Gly Cys Val Val Leu Trp Ala Gln Gly Thr Ala Gly Gln Pro Gln Pro
20 25 30
Pro Pro Pro Lys Pro Pro Arg Pro Gln Pro Pro Pro Gln Gln Val Arg
35 40 45
Ser Ala Thr Ala Gly Ser Glu Gly Gly Phe Leu Ala Pro Glu Tyr Arg
50 55 60
Glu Glu Gly Ala Ala Val Ala Ser Arg Val Arg Arg Arg Gly Gln Gln
65 70 75 80
Asp Val Leu Arg Gly Pro Asn Val Cys Gly Ser Arg Phe His Ser Tyr
85 90 95
Cys Cys Pro Gly Trp Lys Thr Leu Pro Gly Gly Asn Gln Cys Ile Val
100 105 110
Pro Ile Cys Arg Asn Ser Cys Gly Asp Gly Phe Cys Ser Arg Pro Asn
115 120 125
Met Cys Thr Cys Ser Ser Gly Gln Ile Ser Ser Thr Cys Gly Ser Lys
130 135 140
Ser Ile Gln Gln Cys Ser Val Arg Cys Met Asn Gly Gly Thr Cys Ala
145 150 155 160
Asp Asp His Cys Gln Cys Gln Lys Gly Tyr Ile Gly Thr Tyr Cys Gly
165 170 175
Gln Pro Val Cys Glu Asn Gly Cys Gln Asn Gly Gly Arg Cys Ile Gly
180 185 190
Pro Asn Arg Cys Ala Cys Val Tyr Gly Phe Thr Gly Pro Gln Cys Glu
195 200 205
Arg Asp Tyr Arg Thr Gly Pro Cys Phe Thr Gln Val Asn Asn Gln Met
210 215 220
Cys Gln Gly Gln Leu Thr Gly Ile Val Cys Thr Lys Thr Leu Cys Cys
225 230 235 240
Ala Thr Ile Gly Arg Ala Trp Gly His Pro Cys Glu Met Cys Pro Ala
245 250 255
Gln Pro Gln Pro Cys Arg Arg Gly Phe Ile Pro Asn Ile Arg Thr Gly
260 265 270
Ala Cys Gln Asp Val Asp Glu Cys Gln Ala Ile Pro Gly Ile Cys Gln
275 280 285
Gly Gly Asn Cys Ile Asn Thr Val Gly Ser Phe Glu Cys Arg Cys Pro
290 295 300
Ala Gly His Lys Gln Ser Glu Thr Thr Gln Lys Cys Glu Asp Ile Asp
305 310 315 320
Glu Cys Ser Ile Ile Pro Gly Ile Cys Glu Thr Gly Glu Cys Ser Asn
325 330 335
Thr Val Gly Ser Tyr Phe Cys Val Cys Pro Arg Gly Tyr Val Thr Ser
340 345 350
Thr Asp Gly Ser Arg Cys Ile Asp Gln Arg Thr Gly Met Cys Phe Ser
355 360 365
Gly Leu Val Asn Gly Arg Cys Ala Gln Glu Leu Pro Gly Arg Met Thr
370 375 380
Lys Met Gln Cys Cys Cys Glu Pro Gly Arg Cys Trp Gly Ile Gly Thr
385 390 395 400
Ile Pro Glu Ala Cys Pro Val Arg Gly Ser Glu Glu Tyr Arg Arg Leu
405 410 415
Cys Met Asp Gly Leu Pro Met Gly Gly Ile Pro Gly Ser Ala Gly Ser
420 425 430
Arg Pro Gly Gly Thr Gly Gly Asn Gly Phe Ala Pro Ser Gly Asn Gly
435 440 445
Asn Gly Tyr Gly Pro Gly Gly Thr Gly Phe Ile Pro Ile Pro Gly Gly
450 455 460
Asn Gly Phe Ser Pro Gly Val Gly Gly Ala Gly Val Gly Ala Gly Gly
465 470 475 480
Gln Gly Pro Ile Ile Thr Gly Leu Thr Ile Leu Asn Gln Thr Ile Asp
485 490 495
Ile Cys Lys His His Ala Asn Leu Cys Leu Asn Gly Arg Cys Ile Pro
500 505 510
Thr Val Ser Ser Tyr Arg Cys Glu Cys Asn Met Gly Tyr Lys Gln Asp
515 520 525
Ala Asn Gly Asp Cys Ile Asp Val Asp Glu Cys Thr Ser Asn Pro Cys
530 535 540
Thr Asn Gly Asp Cys Val Asn Thr Pro Gly Ser Tyr Tyr Cys Lys Cys
545 550 555 560
His Ala Gly Phe Gln Arg Thr Pro Thr Lys Gln Ala Cys Ile Asp Ile
565 570 575
Asp Glu Cys Ile Gln Asn Gly Val Leu Cys Lys Asn Gly Arg Cys Val
580 585 590
Asn Thr Asp Gly Ser Phe Gln Cys Ile Cys Asn Ala Gly Phe Glu Leu
595 600 605
Thr Thr Asp Gly Lys Asn Cys Val Asp His Asp Glu Cys Thr Thr Thr
610 615 620
Asn Met Cys Leu Asn Gly Met Cys Ile Asn Glu Asp Gly Ser Phe Lys
625 630 635 640
Cys Ile Cys Lys Pro Gly Phe Val Leu Ala Pro Asn Gly Arg Tyr Cys
645 650 655
Thr Asp Val Asp Glu Cys Gln Thr Pro Gly Ile Cys Met Asn Gly His
660 665 670
Cys Ile Asn Ser Glu Gly Ser Phe Arg Cys Asp Cys Pro Pro Gly Leu
675 680 685
Ala Val Gly Met Asp Gly Arg Val Cys Val Asp Thr His Met Arg Ser
690 695 700
Thr Cys Tyr Gly Gly Ile Lys Lys Gly Val Cys Val Arg Pro Phe Pro
705 710 715 720
Gly Ala Val Thr Lys Ser Glu Cys Cys Cys Ala Asn Pro Asp Tyr Gly
725 730 735
Phe Gly Glu Pro Cys Gln Pro Cys Pro Ala Lys Asn Ser Ala Glu Phe
740 745 750
His Gly Leu Cys Ser Ser Gly Val Gly Ile Thr Val Asp Gly Arg Asp
755 760 765
Ile Asn Glu Cys Ala Leu Asp Pro Asp Ile Cys Ala Asn Gly Ile Cys
770 775 780
Glu Asn Leu Arg Gly Ser Tyr Arg Cys Asn Cys Asn Ser Gly Tyr Glu
785 790 795 800
Pro Asp Ala Ser Gly Arg Asn Cys Ile Asp Ile Asp Glu Cys Leu Val
805 810 815
Asn Arg Leu Leu Cys Asp Asn Gly Leu Cys Arg Asn Thr Pro Gly Ser
820 825 830
Tyr Ser Cys Thr Cys Pro Pro Gly Tyr Val Phe Arg Thr Glu Thr Glu
835 840 845
Thr Cys Glu Asp Ile Asn Glu Cys Glu Ser Asn Pro Cys Val Asn Gly
850 855 860
Ala Cys Arg Asn Asn Leu Gly Ser Phe Asn Cys Glu Cys Ser Pro Gly
865 870 875 880
Ser Lys Leu Ser Ser Thr Gly Leu Ile Cys Ile Asp Ser Leu Lys Gly
885 890 895
Thr Cys Trp Leu Asn Ile Gln Asp Ser Arg Cys Glu Val Asn Ile Asn
900 905 910
Gly Ala Thr Leu Lys Ser Glu Cys Cys Ala Thr Leu Gly Ala Ala Trp
915 920 925
Gly Ser Pro Cys Glu Arg Cys Glu Leu Asp Thr Ala Cys Pro Arg Gly
930 935 940
Leu Ala Arg Ile Lys Gly Val Thr Cys Glu Asp Val Asn Glu Cys Glu
945 950 955 960
Val Phe Pro Gly Val Cys Pro Asn Gly Arg Cys Val Asn Ser Lys Gly
965 970 975
Ser Phe His Cys Glu Cys Pro Glu Gly Leu Thr Leu Asp Gly Thr Gly
980 985 990
Arg Val Cys Leu Asp Ile Arg Met Glu Gln Cys Tyr Leu Lys Trp Asp
995 1000 1005
Glu Asp Glu Cys Ile His Pro Val Pro Gly Lys Phe Arg Met Asp
1010 1015 1020
Ala Cys Cys Cys Ala Val Gly Ala Ala Trp Gly Thr Glu Cys Glu
1025 1030 1035
Glu Cys Pro Lys Pro Gly Thr Lys Glu Tyr Glu Thr Leu Cys Pro
1040 1045 1050
Arg Gly Ala Gly Phe Ala Asn Arg Gly Asp Val Leu Thr Gly Arg
1055 1060 1065
Pro Phe Tyr Lys Asp Ile Asn Glu Cys Lys Ala Phe Pro Gly Met
1070 1075 1080
Cys Thr Tyr Gly Lys Cys Arg Asn Thr Ile Gly Ser Phe Lys Cys
1085 1090 1095
Arg Cys Asn Ser Gly Phe Ala Leu Asp Met Glu Glu Arg Asn Cys
1100 1105 1110
Thr Asp Ile Asp Glu Cys Arg Ile Ser Pro Asp Leu Cys Gly Ser
1115 1120 1125
Gly Ile Cys Val Asn Thr Pro Gly Ser Phe Glu Cys Glu Cys Phe
1130 1135 1140
Glu Gly Tyr Glu Ser Gly Phe Met Met Met Lys Asn Cys Met Asp
1145 1150 1155
Ile Asp Glu Cys Glu Arg Asn Pro Leu Leu Cys Arg Gly Gly Thr
1160 1165 1170
Cys Val Asn Thr Glu Gly Ser Phe Gln Cys Asp Cys Pro Leu Gly
1175 1180 1185
His Glu Leu Ser Pro Ser Arg Glu Asp Cys Val Asp Ile Asn Glu
1190 1195 1200
Cys Ser Leu Ser Asp Asn Leu Cys Arg Asn Gly Lys Cys Val Asn
1205 1210 1215
Met Ile Gly Thr Tyr Gln Cys Ser Cys Asn Pro Gly Tyr Gln Ala
1220 1225 1230
Thr Pro Asp Arg Gln Gly Cys Thr Asp Ile Asp Glu Cys Met Ile
1235 1240 1245
Met Asn Gly Gly Cys Asp Thr Gln Cys Thr Asn Ser Glu Gly Ser
1250 1255 1260
Tyr Glu Cys Ser Cys Ser Glu Gly Tyr Ala Leu Met Pro Asp Gly
1265 1270 1275
Arg Ser Cys Ala Asp Ile Asp Glu Cys Glu Asn Asn Pro Asp Ile
1280 1285 1290
Cys Asp Gly Gly Gln Cys Thr Asn Ile Pro Gly Glu Tyr Arg Cys
1295 1300 1305
Leu Cys Tyr Asp Gly Phe Met Ala Ser Met Asp Met Lys Thr Cys
1310 1315 1320
Ile Asp Val Asn Glu Cys Asp Leu Asn Ser Asn Ile Cys Met Phe
1325 1330 1335
Gly Glu Cys Glu Asn Thr Lys Gly Ser Phe Ile Cys His Cys Gln
1340 1345 1350
Leu Gly Tyr Ser Val Lys Lys Gly Thr Thr Gly Cys Thr Asp Val
1355 1360 1365
Asp Glu Cys Glu Ile Gly Ala His Asn Cys Asp Met His Ala Ser
1370 1375 1380
Cys Leu Asn Ile Pro Gly Ser Phe Lys Cys Ser Cys Arg Glu Gly
1385 1390 1395
Trp Ile Gly Asn Gly Ile Lys Cys Ile Asp Leu Asp Glu Cys Ser
1400 1405 1410
Asn Gly Thr His Gln Cys Ser Ile Asn Ala Gln Cys Val Asn Thr
1415 1420 1425
Pro Gly Ser Tyr Arg Cys Ala Cys Ser Glu Gly Phe Thr Gly Asp
1430 1435 1440
Gly Phe Thr Cys Ser Asp Val Asp Glu Cys Ala Glu Asn Ile Asn
1445 1450 1455
Leu Cys Glu Asn Gly Gln Cys Leu Asn Val Pro Gly Ala Tyr Arg
1460 1465 1470
Cys Glu Cys Glu Met Gly Phe Thr Pro Ala Ser Asp Ser Arg Ser
1475 1480 1485
Cys Gln Asp Ile Asp Glu Cys Ser Phe Gln Asn Ile Cys Val Phe
1490 1495 1500
Gly Thr Cys Asn Asn Leu Pro Gly Met Phe His Cys Ile Cys Asp
1505 1510 1515
Asp Gly Tyr Glu Leu Asp Arg Thr Gly Gly Asn Cys Thr Asp Ile
1520 1525 1530
Asp Glu Cys Ala Asp Pro Ile Asn Cys Val Asn Gly Leu Cys Val
1535 1540 1545
Asn Thr Pro Gly Arg Tyr Glu Cys Asn Cys Pro Pro Asp Phe Gln
1550 1555 1560
Leu Asn Pro Thr Gly Val Gly Cys Val Asp Asn Arg Val Gly Asn
1565 1570 1575
Cys Tyr Leu Lys Phe Gly Pro Arg Gly Asp Gly Ser Leu Ser Cys
1580 1585 1590
Asn Thr Glu Ile Gly Val Gly Val Ser Arg Ser Ser Cys Cys Cys
1595 1600 1605
Ser Leu Gly Lys Ala Trp Gly Asn Pro Cys Glu Thr Cys Pro Pro
1610 1615 1620
Val Asn Ser Thr Glu Tyr Tyr Thr Leu Cys Pro Gly Gly Glu Gly
1625 1630 1635
Phe Arg Pro Asn Pro Ile Thr Ile Ile Leu Glu Asp Ile Asp Glu
1640 1645 1650
Cys Gln Glu Leu Pro Gly Leu Cys Gln Gly Gly Asn Cys Ile Asn
1655 1660 1665
Thr Phe Gly Ser Phe Gln Cys Glu Cys Pro Gln Gly Tyr Tyr Leu
1670 1675 1680
Ser Glu Asp Thr Arg Ile Cys Glu Asp Ile Asp Glu Cys Phe Ala
1685 1690 1695
His Pro Gly Val Cys Gly Pro Gly Thr Cys Tyr Asn Thr Leu Gly
1700 1705 1710
Asn Tyr Thr Cys Ile Cys Pro Pro Glu Tyr Met Gln Val Asn Gly
1715 1720 1725
Gly His Asn Cys Met Asp Met Arg Lys Ser Phe Cys Tyr Arg Ser
1730 1735 1740
Tyr Asn Gly Thr Thr Cys Glu Asn Glu Leu Pro Phe Asn Val Thr
1745 1750 1755
Lys Arg Met Cys Cys Cys Thr Tyr Asn Val Gly Lys Ala Trp Asn
1760 1765 1770
Lys Pro Cys Glu Pro Cys Pro Thr Pro Gly Thr Ala Asp Phe Lys
1775 1780 1785
Thr Ile Cys Gly Asn Ile Pro Gly Phe Thr Phe Asp Ile His Thr
1790 1795 1800
Gly Lys Ala Val Asp Ile Asp Glu Cys Lys Glu Ile Pro Gly Ile
1805 1810 1815
Cys Ala Asn Gly Val Cys Ile Asn Gln Ile Gly Ser Phe Arg Cys
1820 1825 1830
Glu Cys Pro Thr Gly Phe Ser Tyr Asn Asp Leu Leu Leu Val Cys
1835 1840 1845
Glu Asp Ile Asp Glu Cys Ser Asn Gly Asp Asn Leu Cys Gln Arg
1850 1855 1860
Asn Ala Asp Cys Ile Asn Ser Pro Gly Ser Tyr Arg Cys Glu Cys
1865 1870 1875
Ala Ala Gly Phe Lys Leu Ser Pro Asn Gly Ala Cys Val Asp Arg
1880 1885 1890
Asn Glu Cys Leu Glu Ile Pro Asn Val Cys Ser His Gly Leu Cys
1895 1900 1905
Val Asp Leu Gln Gly Ser Tyr Gln Cys Ile Cys His Asn Gly Phe
1910 1915 1920
Lys Ala Ser Gln Asp Gln Thr Met Cys Met Asp Val Asp Glu Cys
1925 1930 1935
Glu Arg His Pro Cys Gly Asn Gly Thr Cys Lys Asn Thr Val Gly
1940 1945 1950
Ser Tyr Asn Cys Leu Cys Tyr Pro Gly Phe Glu Leu Thr His Asn
1955 1960 1965
Asn Asp Cys Leu Asp Ile Asp Glu Cys Ser Ser Phe Phe Gly Gln
1970 1975 1980
Val Cys Arg Asn Gly Arg Cys Phe Asn Glu Ile Gly Ser Phe Lys
1985 1990 1995
Cys Leu Cys Asn Glu Gly Tyr Glu Leu Thr Pro Asp Gly Lys Asn
2000 2005 2010
Cys Ile Asp Thr Asn Glu Cys Val Ala Leu Pro Gly Ser Cys Ser
2015 2020 2025
Pro Gly Thr Cys Gln Asn Leu Glu Gly Ser Phe Arg Cys Ile Cys
2030 2035 2040
Pro Pro Gly Tyr Glu Val Lys Ser Glu Asn Cys Ile Asp Ile Asn
2045 2050 2055
Glu Cys Asp Glu Asp Pro Asn Ile Cys Leu Phe Gly Ser Cys Thr
2060 2065 2070
Asn Thr Pro Gly Gly Phe Gln Cys Leu Cys Pro Pro Gly Phe Val
2075 2080 2085
Leu Ser Asp Asn Gly Arg Arg Cys Phe Asp Thr Arg Gln Ser Phe
2090 2095 2100
Cys Phe Thr Asn Phe Glu Asn Gly Lys Cys Ser Val Pro Lys Ala
2105 2110 2115
Phe Asn Thr Thr Lys Ala Lys Cys Cys Cys Ser Lys Met Pro Gly
2120 2125 2130
Glu Gly Trp Gly Asp Pro Cys Glu Leu Cys Pro Lys Asp Asp Glu
2135 2140 2145
Val Ala Phe Gln Asp Leu Cys Pro Tyr Gly His Gly Thr Val Pro
2150 2155 2160
Ser Leu His Asp Thr Arg Glu Asp Val Asn Glu Cys Leu Glu Ser
2165 2170 2175
Pro Gly Ile Cys Ser Asn Gly Gln Cys Ile Asn Thr Asp Gly Ser
2180 2185 2190
Phe Arg Cys Glu Cys Pro Met Gly Tyr Asn Leu Asp Tyr Thr Gly
2195 2200 2205
Val Arg Cys Val Asp Thr Asp Glu Cys Ser Ile Gly Asn Pro Cys
2210 2215 2220
Gly Asn Gly Thr Cys Thr Asn Val Ile Gly Ser Phe Glu Cys Asn
2225 2230 2235
Cys Asn Glu Gly Phe Glu Pro Gly Pro Met Met Asn Cys Glu Asp
2240 2245 2250
Ile Asn Glu Cys Ala Gln Asn Pro Leu Leu Cys Ala Phe Arg Cys
2255 2260 2265
Met Asn Thr Phe Gly Ser Tyr Glu Cys Thr Cys Pro Ile Gly Tyr
2270 2275 2280
Ala Leu Arg Glu Asp Gln Lys Met Cys Lys Asp Leu Asp Glu Cys
2285 2290 2295
Ala Glu Gly Leu His Asp Cys Glu Ser Arg Gly Met Met Cys Lys
2300 2305 2310
Asn Leu Ile Gly Thr Phe Met Cys Ile Cys Pro Pro Gly Met Ala
2315 2320 2325
Arg Arg Pro Asp Gly Glu Gly Cys Val Asp Glu Asn Glu Cys Arg
2330 2335 2340
Thr Lys Pro Gly Ile Cys Glu Asn Gly Arg Cys Val Asn Ile Ile
2345 2350 2355
Gly Ser Tyr Arg Cys Glu Cys Asn Glu Gly Phe Gln Ser Ser Ser
2360 2365 2370
Ser Gly Thr Glu Cys Leu Asp Asn Arg Gln Gly Leu Cys Phe Ala
2375 2380 2385
Glu Val Leu Gln Thr Ile Cys Gln Met Ala Ser Ser Ser Arg Asn
2390 2395 2400
Leu Val Thr Lys Ser Glu Cys Cys Cys Asp Gly Gly Arg Gly Trp
2405 2410 2415
Gly His Gln Cys Glu Leu Cys Pro Leu Pro Gly Thr Ala Gln Tyr
2420 2425 2430
Lys Lys Ile Cys Pro His Gly Pro Gly Tyr Thr Thr Asp Gly Arg
2435 2440 2445
Asp Ile Asp Glu Cys Lys Val Met Pro Asn Leu Cys Thr Asn Gly
2450 2455 2460
Gln Cys Ile Asn Thr Met Gly Ser Phe Arg Cys Phe Cys Lys Val
2465 2470 2475
Gly Tyr Thr Thr Asp Ile Ser Gly Thr Ser Cys Ile Asp Leu Asp
2480 2485 2490
Glu Cys Ser Gln Ser Pro Lys Pro Cys Asn Tyr Ile Cys Lys Asn
2495 2500 2505
Thr Glu Gly Ser Tyr Gln Cys Ser Cys Pro Arg Gly Tyr Val Leu
2510 2515 2520
Gln Glu Asp Gly Lys Thr Cys Lys Asp Leu Asp Glu Cys Gln Thr
2525 2530 2535
Lys Gln His Asn Cys Gln Phe Leu Cys Val Asn Thr Leu Gly Gly
2540 2545 2550
Phe Thr Cys Lys Cys Pro Pro Gly Phe Thr Gln His His Thr Ala
2555 2560 2565
Cys Ile Asp Asn Asn Glu Cys Gly Ser Gln Pro Ser Leu Cys Gly
2570 2575 2580
Ala Lys Gly Ile Cys Gln Asn Thr Pro Gly Ser Phe Ser Cys Glu
2585 2590 2595
Cys Gln Arg Gly Phe Ser Leu Asp Ala Thr Gly Leu Asn Cys Glu
2600 2605 2610
Asp Val Asp Glu Cys Asp Gly Asn His Arg Cys Gln His Gly Cys
2615 2620 2625
Gln Asn Ile Leu Gly Gly Tyr Arg Cys Gly Cys Pro Gln Gly Tyr
2630 2635 2640
Ile Gln His Tyr Gln Trp Asn Gln Cys Val Asp Glu Asn Glu Cys
2645 2650 2655
Ser Asn Pro Asn Ala Cys Gly Ser Ala Ser Cys Tyr Asn Thr Leu
2660 2665 2670
Gly Ser Tyr Lys Cys Ala Cys Pro Ser Gly Phe Ser Phe Asp Gln
2675 2680 2685
Phe Ser Ser Ala Cys His Asp Val Asn Glu Cys Ser Ser Ser Lys
2690 2695 2700
Asn Pro Cys Asn Tyr Gly Cys Ser Asn Thr Glu Gly Gly Tyr Leu
2705 2710 2715
Cys Gly Cys Pro Pro Gly Tyr Tyr Arg Val Gly Gln Gly His Cys
2720 2725 2730
Val Ser Gly Met Gly Phe Asn Lys Gly Gln Tyr Leu Ser Leu Asp
2735 2740 2745
Thr Glu Val Asp Glu Glu Asn Ala Leu Ser Pro Glu Ala Cys Tyr
2750 2755 2760
Glu Cys Lys Ile Asn Gly Tyr Ser Lys Lys Asp Ser Arg Gln Lys
2765 2770 2775
Arg Ser Ile His Glu Pro Asp Pro Thr Ala Val Glu Gln Ile Ser
2780 2785 2790
Leu Glu Ser Val Asp Met Asp Ser Pro Val Asn Met Lys Phe Asn
2795 2800 2805
Leu Ser His Leu Gly Ser Lys Glu His Ile Leu Glu Leu Arg Pro
2810 2815 2820
Ala Ile Gln Pro Leu Asn Asn His Ile Arg Tyr Val Ile Ser Gln
2825 2830 2835
Gly Asn Asp Asp Ser Val Phe Arg Ile His Gln Arg Asn Gly Leu
2840 2845 2850
Ser Tyr Leu His Thr Ala Lys Lys Lys Leu Met Pro Gly Thr Tyr
2855 2860 2865
Thr Leu Glu Ile Thr Ser Ile Pro Leu Tyr Lys Lys Lys Glu Leu
2870 2875 2880
Lys Lys Leu Glu Glu Ser Asn Glu Asp Asp Tyr Leu Leu Gly Glu
2885 2890 2895
Leu Gly Glu Ala Leu Arg Met Arg Leu Gln Ile Gln Leu Tyr
2900 2905 2910
<210> 136
<211> 574
<212> ПРТ
<213> Homo sapiens
<400> 136
Met Ala Leu Ala Arg Gly Ser Arg Gln Leu Gly Ala Leu Val Trp Gly
1 5 10 15
Ala Cys Leu Cys Val Leu Val His Gly Gln Gln Ala Gln Pro Gly Gln
20 25 30
Gly Ser Asp Pro Ala Arg Trp Arg Gln Leu Ile Gln Trp Glu Asn Asn
35 40 45
Gly Gln Val Tyr Ser Leu Leu Asn Ser Gly Ser Glu Tyr Val Pro Ala
50 55 60
Gly Pro Gln Arg Ser Glu Ser Ser Ser Arg Val Leu Leu Ala Gly Ala
65 70 75 80
Pro Gln Ala Gln Gln Arg Arg Ser His Gly Ser Pro Arg Arg Arg Gln
85 90 95
Ala Pro Ser Leu Pro Leu Pro Gly Arg Val Gly Ser Asp Thr Val Arg
100 105 110
Gly Gln Ala Arg His Pro Phe Gly Phe Gly Gln Val Pro Asp Asn Trp
115 120 125
Arg Glu Val Ala Val Gly Asp Ser Thr Gly Met Ala Arg Ala Arg Thr
130 135 140
Ser Val Ser Gln Gln Arg His Gly Gly Ser Ala Ser Ser Val Ser Ala
145 150 155 160
Ser Ala Phe Ala Ser Thr Tyr Arg Gln Gln Pro Ser Tyr Pro Gln Gln
165 170 175
Phe Pro Tyr Pro Gln Ala Pro Phe Val Ser Gln Tyr Glu Asn Tyr Asp
180 185 190
Pro Ala Ser Arg Thr Tyr Asp Gln Gly Phe Val Tyr Tyr Arg Pro Ala
195 200 205
Gly Gly Gly Val Gly Ala Gly Ala Ala Ala Val Ala Ser Ala Gly Val
210 215 220
Ile Tyr Pro Tyr Gln Pro Arg Ala Arg Tyr Glu Glu Tyr Gly Gly Gly
225 230 235 240
Glu Glu Leu Pro Glu Tyr Pro Pro Gln Gly Phe Tyr Pro Ala Pro Glu
245 250 255
Arg Pro Tyr Val Pro Pro Pro Pro Pro Pro Pro Asp Gly Leu Asp Arg
260 265 270
Arg Tyr Ser His Ser Leu Tyr Ser Glu Gly Thr Pro Gly Phe Glu Gln
275 280 285
Ala Tyr Pro Asp Pro Gly Pro Glu Ala Ala Gln Ala His Gly Gly Asp
290 295 300
Pro Arg Leu Gly Trp Tyr Pro Pro Tyr Ala Asn Pro Pro Pro Glu Ala
305 310 315 320
Tyr Gly Pro Pro Arg Ala Leu Glu Pro Pro Tyr Leu Pro Val Arg Ser
325 330 335
Ser Asp Thr Pro Pro Pro Gly Gly Glu Arg Asn Gly Ala Gln Gln Gly
340 345 350
Arg Leu Ser Val Gly Ser Val Tyr Arg Pro Asn Gln Asn Gly Arg Gly
355 360 365
Leu Pro Asp Leu Val Pro Asp Pro Asn Tyr Val Gln Ala Ser Thr Tyr
370 375 380
Val Gln Arg Ala His Leu Tyr Ser Leu Arg Cys Ala Ala Glu Glu Lys
385 390 395 400
Cys Leu Ala Ser Thr Ala Tyr Ala Pro Glu Ala Thr Asp Tyr Asp Val
405 410 415
Arg Val Leu Leu Arg Phe Pro Gln Arg Val Lys Asn Gln Gly Thr Ala
420 425 430
Asp Phe Leu Pro Asn Arg Pro Arg His Thr Trp Glu Trp His Ser Cys
435 440 445
His Gln His Tyr His Ser Met Asp Glu Phe Ser His Tyr Asp Leu Leu
450 455 460
Asp Ala Ala Thr Gly Lys Lys Val Ala Glu Gly His Lys Ala Ser Phe
465 470 475 480
Cys Leu Glu Asp Ser Thr Cys Asp Phe Gly Asn Leu Lys Arg Tyr Ala
485 490 495
Cys Thr Ser His Thr Gln Gly Leu Ser Pro Gly Cys Tyr Asp Thr Tyr
500 505 510
Asn Ala Asp Ile Asp Cys Gln Trp Ile Asp Ile Thr Asp Val Gln Pro
515 520 525
Gly Asn Tyr Ile Leu Lys Val His Val Asn Pro Lys Tyr Ile Val Leu
530 535 540
Glu Ser Asp Phe Thr Asn Asn Val Val Arg Cys Asn Ile His Tyr Thr
545 550 555 560
Gly Arg Tyr Val Ser Ala Thr Asn Cys Lys Ile Val Gln Ser
565 570
<210> 137
<211> 774
<212> ПРТ
<213> Homo sapiens
<400> 137
Met Glu Arg Pro Leu Cys Ser His Leu Cys Ser Cys Leu Ala Met Leu
1 5 10 15
Ala Leu Leu Ser Pro Leu Ser Leu Ala Gln Tyr Asp Ser Trp Pro His
20 25 30
Tyr Pro Glu Tyr Phe Gln Gln Pro Ala Pro Glu Tyr His Gln Pro Gln
35 40 45
Ala Pro Ala Asn Val Ala Lys Ile Gln Leu Arg Leu Ala Gly Gln Lys
50 55 60
Arg Lys His Ser Glu Gly Arg Val Glu Val Tyr Tyr Asp Gly Gln Trp
65 70 75 80
Gly Thr Val Cys Asp Asp Asp Phe Ser Ile His Ala Ala His Val Val
85 90 95
Cys Arg Glu Leu Gly Tyr Val Glu Ala Lys Ser Trp Thr Ala Ser Ser
100 105 110
Ser Tyr Gly Lys Gly Glu Gly Pro Ile Trp Leu Asp Asn Leu His Cys
115 120 125
Thr Gly Asn Glu Ala Thr Leu Ala Ala Cys Thr Ser Asn Gly Trp Gly
130 135 140
Val Thr Asp Cys Lys His Thr Glu Asp Val Gly Val Val Cys Ser Asp
145 150 155 160
Lys Arg Ile Pro Gly Phe Lys Phe Asp Asn Ser Leu Ile Asn Gln Ile
165 170 175
Glu Asn Leu Asn Ile Gln Val Glu Asp Ile Arg Ile Arg Ala Ile Leu
180 185 190
Ser Thr Tyr Arg Lys Arg Thr Pro Val Met Glu Gly Tyr Val Glu Val
195 200 205
Lys Glu Gly Lys Thr Trp Lys Gln Ile Cys Asp Lys His Trp Thr Ala
210 215 220
Lys Asn Ser Arg Val Val Cys Gly Met Phe Gly Phe Pro Gly Glu Arg
225 230 235 240
Thr Tyr Asn Thr Lys Val Tyr Lys Met Phe Ala Ser Arg Arg Lys Gln
245 250 255
Arg Tyr Trp Pro Phe Ser Met Asp Cys Thr Gly Thr Glu Ala His Ile
260 265 270
Ser Ser Cys Lys Leu Gly Pro Gln Val Ser Leu Asp Pro Met Lys Asn
275 280 285
Val Thr Cys Glu Asn Gly Leu Pro Ala Val Val Ser Cys Val Pro Gly
290 295 300
Gln Val Phe Ser Pro Asp Gly Pro Ser Arg Phe Arg Lys Ala Tyr Lys
305 310 315 320
Pro Glu Gln Pro Leu Val Arg Leu Arg Gly Gly Ala Tyr Ile Gly Glu
325 330 335
Gly Arg Val Glu Val Leu Lys Asn Gly Glu Trp Gly Thr Val Cys Asp
340 345 350
Asp Lys Trp Asp Leu Val Ser Ala Ser Val Val Cys Arg Glu Leu Gly
355 360 365
Phe Gly Ser Ala Lys Glu Ala Val Thr Gly Ser Arg Leu Gly Gln Gly
370 375 380
Ile Gly Pro Ile His Leu Asn Glu Ile Gln Cys Thr Gly Asn Glu Lys
385 390 395 400
Ser Ile Ile Asp Cys Lys Phe Asn Ala Glu Ser Gln Gly Cys Asn His
405 410 415
Glu Glu Asp Ala Gly Val Arg Cys Asn Thr Pro Ala Met Gly Leu Gln
420 425 430
Lys Lys Leu Arg Leu Asn Gly Gly Arg Asn Pro Tyr Glu Gly Arg Val
435 440 445
Glu Val Leu Val Glu Arg Asn Gly Ser Leu Val Trp Gly Met Val Cys
450 455 460
Gly Gln Asn Trp Gly Ile Val Glu Ala Met Val Val Cys Arg Gln Leu
465 470 475 480
Gly Leu Gly Phe Ala Ser Asn Ala Phe Gln Glu Thr Trp Tyr Trp His
485 490 495
Gly Asp Val Asn Ser Asn Lys Val Val Met Ser Gly Val Lys Cys Ser
500 505 510
Gly Thr Glu Leu Ser Leu Ala His Cys Arg His Asp Gly Glu Asp Val
515 520 525
Ala Cys Pro Gln Gly Gly Val Gln Tyr Gly Ala Gly Val Ala Cys Ser
530 535 540
Glu Thr Ala Pro Asp Leu Val Leu Asn Ala Glu Met Val Gln Gln Thr
545 550 555 560
Thr Tyr Leu Glu Asp Arg Pro Met Phe Met Leu Gln Cys Ala Met Glu
565 570 575
Glu Asn Cys Leu Ser Ala Ser Ala Ala Gln Thr Asp Pro Thr Thr Gly
580 585 590
Tyr Arg Arg Leu Leu Arg Phe Ser Ser Gln Ile His Asn Asn Gly Gln
595 600 605
Ser Asp Phe Arg Pro Lys Asn Gly Arg His Ala Trp Ile Trp His Asp
610 615 620
Cys His Arg His Tyr His Ser Met Glu Val Phe Thr His Tyr Asp Leu
625 630 635 640
Leu Asn Leu Asn Gly Thr Lys Val Ala Glu Gly His Lys Ala Ser Phe
645 650 655
Cys Leu Glu Asp Thr Glu Cys Glu Gly Asp Ile Gln Lys Asn Tyr Glu
660 665 670
Cys Ala Asn Phe Gly Asp Gln Gly Ile Thr Met Gly Cys Trp Asp Met
675 680 685
Tyr Arg His Asp Ile Asp Cys Gln Trp Val Asp Ile Thr Asp Val Pro
690 695 700
Pro Gly Asp Tyr Leu Phe Gln Val Val Ile Asn Pro Asn Phe Glu Val
705 710 715 720
Ala Glu Ser Asp Tyr Ser Asn Asn Ile Met Lys Cys Arg Ser Arg Tyr
725 730 735
Asp Gly His Arg Ile Trp Met Tyr Asn Cys His Ile Gly Gly Ser Phe
740 745 750
Ser Glu Glu Thr Glu Lys Lys Phe Glu His Phe Ser Gly Leu Leu Asn
755 760 765
Asn Gln Leu Ser Pro Gln
770
<210> 138
<211> 753
<212> ПРТ
<213> Homo sapiens
<400> 138
Met Arg Pro Val Ser Val Trp Gln Trp Ser Pro Trp Gly Leu Leu Leu
1 5 10 15
Cys Leu Leu Cys Ser Ser Cys Leu Gly Ser Pro Ser Pro Ser Thr Gly
20 25 30
Pro Glu Lys Lys Ala Gly Ser Gln Gly Leu Arg Phe Arg Leu Ala Gly
35 40 45
Phe Pro Arg Lys Pro Tyr Glu Gly Arg Val Glu Ile Gln Arg Ala Gly
50 55 60
Glu Trp Gly Thr Ile Cys Asp Asp Asp Phe Thr Leu Gln Ala Ala His
65 70 75 80
Ile Leu Cys Arg Glu Leu Gly Phe Thr Glu Ala Thr Gly Trp Thr His
85 90 95
Ser Ala Lys Tyr Gly Pro Gly Thr Gly Arg Ile Trp Leu Asp Asn Leu
100 105 110
Ser Cys Ser Gly Thr Glu Gln Ser Val Thr Glu Cys Ala Ser Arg Gly
115 120 125
Trp Gly Asn Ser Asp Cys Thr His Asp Glu Asp Ala Gly Val Ile Cys
130 135 140
Lys Asp Gln Arg Leu Pro Gly Phe Ser Asp Ser Asn Val Ile Glu Val
145 150 155 160
Glu His His Leu Gln Val Glu Glu Val Arg Ile Arg Pro Ala Val Gly
165 170 175
Trp Gly Arg Arg Pro Leu Pro Val Thr Glu Gly Leu Val Glu Val Arg
180 185 190
Leu Pro Asp Gly Trp Ser Gln Val Cys Asp Lys Gly Trp Ser Ala His
195 200 205
Asn Ser His Val Val Cys Gly Met Leu Gly Phe Pro Ser Glu Lys Arg
210 215 220
Val Asn Ala Ala Phe Tyr Arg Leu Leu Ala Gln Arg Gln Gln His Ser
225 230 235 240
Phe Gly Leu His Gly Val Ala Cys Val Gly Thr Glu Ala His Leu Ser
245 250 255
Leu Cys Ser Leu Glu Phe Tyr Arg Ala Asn Asp Thr Ala Arg Cys Pro
260 265 270
Gly Gly Gly Pro Ala Val Val Ser Cys Val Pro Gly Pro Val Tyr Ala
275 280 285
Ala Ser Ser Gly Gln Lys Lys Gln Gln Gln Ser Lys Pro Gln Gly Glu
290 295 300
Ala Arg Val Arg Leu Lys Gly Gly Ala His Pro Gly Glu Gly Arg Val
305 310 315 320
Glu Val Leu Lys Ala Ser Thr Trp Gly Thr Val Cys Asp Arg Lys Trp
325 330 335
Asp Leu His Ala Ala Ser Val Val Cys Arg Glu Leu Gly Phe Gly Ser
340 345 350
Ala Arg Glu Ala Leu Ser Gly Ala Arg Met Gly Gln Gly Met Gly Ala
355 360 365
Ile His Leu Ser Glu Val Arg Cys Ser Gly Gln Glu Leu Ser Leu Trp
370 375 380
Lys Cys Pro His Lys Asn Ile Thr Ala Glu Asp Cys Ser His Ser Gln
385 390 395 400
Asp Ala Gly Val Arg Cys Asn Leu Pro Tyr Thr Gly Ala Glu Thr Arg
405 410 415
Ile Arg Leu Ser Gly Gly Arg Ser Gln His Glu Gly Arg Val Glu Val
420 425 430
Gln Ile Gly Gly Pro Gly Pro Leu Arg Trp Gly Leu Ile Cys Gly Asp
435 440 445
Asp Trp Gly Thr Leu Glu Ala Met Val Ala Cys Arg Gln Leu Gly Leu
450 455 460
Gly Tyr Ala Asn His Gly Leu Gln Glu Thr Trp Tyr Trp Asp Ser Gly
465 470 475 480
Asn Ile Thr Glu Val Val Met Ser Gly Val Arg Cys Thr Gly Thr Glu
485 490 495
Leu Ser Leu Asp Gln Cys Ala His His Gly Thr His Ile Thr Cys Lys
500 505 510
Arg Thr Gly Thr Arg Phe Thr Ala Gly Val Ile Cys Ser Glu Thr Ala
515 520 525
Ser Asp Leu Leu Leu His Ser Ala Leu Val Gln Glu Thr Ala Tyr Ile
530 535 540
Glu Asp Arg Pro Leu His Met Leu Tyr Cys Ala Ala Glu Glu Asn Cys
545 550 555 560
Leu Ala Ser Ser Ala Arg Ser Ala Asn Trp Pro Tyr Gly His Arg Arg
565 570 575
Leu Leu Arg Phe Ser Ser Gln Ile His Asn Leu Gly Arg Ala Asp Phe
580 585 590
Arg Pro Lys Ala Gly Arg His Ser Trp Val Trp His Glu Cys His Gly
595 600 605
His Tyr His Ser Met Asp Ile Phe Thr His Tyr Asp Ile Leu Thr Pro
610 615 620
Asn Gly Thr Lys Val Ala Glu Gly His Lys Ala Ser Phe Cys Leu Glu
625 630 635 640
Asp Thr Glu Cys Gln Glu Asp Val Ser Lys Arg Tyr Glu Cys Ala Asn
645 650 655
Phe Gly Glu Gln Gly Ile Thr Val Gly Cys Trp Asp Leu Tyr Arg His
660 665 670
Asp Ile Asp Cys Gln Trp Ile Asp Ile Thr Asp Val Lys Pro Gly Asn
675 680 685
Tyr Ile Leu Gln Val Val Ile Asn Pro Asn Phe Glu Val Ala Glu Ser
690 695 700
Asp Phe Thr Asn Asn Ala Met Lys Cys Asn Cys Lys Tyr Asp Gly His
705 710 715 720
Arg Ile Trp Val His Asn Cys His Ile Gly Asp Ala Phe Ser Glu Glu
725 730 735
Ala Asn Arg Arg Phe Glu Arg Tyr Pro Gly Gln Thr Ser Asn Gln Ile
740 745 750
Ile
<210> 139
<211> 608
<212> ПРТ
<213> Homo sapiens
<400> 139
Met Arg Pro Val Ser Val Trp Gln Trp Ser Pro Trp Gly Leu Leu Leu
1 5 10 15
Cys Leu Leu Cys Ser Ser Cys Leu Gly Ser Pro Ser Pro Ser Thr Gly
20 25 30
Pro Glu Lys Lys Ala Gly Ser Gln Gly Leu Arg Phe Arg Leu Ala Gly
35 40 45
Phe Pro Arg Lys Pro Tyr Glu Gly Arg Val Glu Ile Gln Arg Ala Gly
50 55 60
Glu Trp Gly Thr Ile Cys Asp Asp Asp Phe Thr Leu Gln Ala Ala His
65 70 75 80
Ile Leu Cys Arg Glu Leu Gly Phe Thr Glu Ala Thr Gly Trp Thr His
85 90 95
Ser Ala Lys Tyr Gly Pro Gly Thr Gly Arg Ile Trp Leu Asp Asn Leu
100 105 110
Ser Cys Ser Gly Thr Glu Gln Ser Val Thr Glu Cys Ala Ser Arg Gly
115 120 125
Trp Gly Asn Ser Asp Cys Thr His Asp Glu Asp Ala Gly Val Ile Cys
130 135 140
Lys Asp Gln Arg Leu Pro Gly Phe Ser Asp Ser Asn Val Ile Glu Ala
145 150 155 160
Arg Val Arg Leu Lys Gly Gly Ala His Pro Gly Glu Gly Arg Val Glu
165 170 175
Val Leu Lys Ala Ser Thr Trp Gly Thr Val Cys Asp Arg Lys Trp Asp
180 185 190
Leu His Ala Ala Ser Val Val Cys Arg Glu Leu Gly Phe Gly Ser Ala
195 200 205
Arg Glu Ala Leu Ser Gly Ala Arg Met Gly Gln Gly Met Gly Ala Ile
210 215 220
His Leu Ser Glu Val Arg Cys Ser Gly Gln Glu Leu Ser Leu Trp Lys
225 230 235 240
Cys Pro His Lys Asn Ile Thr Ala Glu Asp Cys Ser His Ser Gln Asp
245 250 255
Ala Gly Val Arg Cys Asn Leu Pro Tyr Thr Gly Ala Glu Thr Arg Ile
260 265 270
Arg Leu Ser Gly Gly Arg Ser Gln His Glu Gly Arg Val Glu Val Gln
275 280 285
Ile Gly Gly Pro Gly Pro Leu Arg Trp Gly Leu Ile Cys Gly Asp Asp
290 295 300
Trp Gly Thr Leu Glu Ala Met Val Ala Cys Arg Gln Leu Gly Leu Gly
305 310 315 320
Tyr Ala Asn His Gly Leu Gln Glu Thr Trp Tyr Trp Asp Ser Gly Asn
325 330 335
Ile Thr Glu Val Val Met Ser Gly Val Arg Cys Thr Gly Thr Glu Leu
340 345 350
Ser Leu Asp Gln Cys Ala His His Gly Thr His Ile Thr Cys Lys Arg
355 360 365
Thr Gly Thr Arg Phe Thr Ala Gly Val Ile Cys Ser Glu Thr Ala Ser
370 375 380
Asp Leu Leu Leu His Ser Ala Leu Val Gln Glu Thr Ala Tyr Ile Glu
385 390 395 400
Asp Arg Pro Leu His Met Leu Tyr Cys Ala Ala Glu Glu Asn Cys Leu
405 410 415
Ala Ser Ser Ala Arg Ser Ala Asn Trp Pro Tyr Gly His Arg Arg Leu
420 425 430
Leu Arg Phe Ser Ser Gln Ile His Asn Leu Gly Arg Ala Asp Phe Arg
435 440 445
Pro Lys Ala Gly Arg His Ser Trp Val Trp His Glu Cys His Gly His
450 455 460
Tyr His Ser Met Asp Ile Phe Thr His Tyr Asp Ile Leu Thr Pro Asn
465 470 475 480
Gly Thr Lys Val Ala Glu Gly His Lys Ala Ser Phe Cys Leu Glu Asp
485 490 495
Thr Glu Cys Gln Glu Asp Val Ser Lys Arg Tyr Glu Cys Ala Asn Phe
500 505 510
Gly Glu Gln Gly Ile Thr Val Gly Cys Trp Asp Leu Tyr Arg His Asp
515 520 525
Ile Asp Cys Gln Trp Ile Asp Ile Thr Asp Val Lys Pro Gly Asn Tyr
530 535 540
Ile Leu Gln Val Val Ile Asn Pro Asn Phe Glu Val Ala Glu Ser Asp
545 550 555 560
Phe Thr Asn Asn Ala Met Lys Cys Asn Cys Lys Tyr Asp Gly His Arg
565 570 575
Ile Trp Val His Asn Cys His Ile Gly Asp Ala Phe Ser Glu Glu Ala
580 585 590
Asn Arg Arg Phe Glu Arg Tyr Pro Gly Gln Thr Ser Asn Gln Ile Ile
595 600 605
<210> 140
<211> 392
<212> ПРТ
<213> Homo sapiens
<400> 140
Met Gly Gln Gly Met Gly Ala Ile His Leu Ser Glu Val Arg Cys Ser
1 5 10 15
Gly Gln Glu Leu Ser Leu Trp Lys Cys Pro His Lys Asn Ile Thr Ala
20 25 30
Glu Asp Cys Ser His Ser Gln Asp Ala Gly Val Arg Cys Asn Leu Pro
35 40 45
Tyr Thr Gly Ala Glu Thr Arg Ile Arg Leu Ser Gly Gly Arg Ser Gln
50 55 60
His Glu Gly Arg Val Glu Val Gln Ile Gly Gly Pro Gly Pro Leu Arg
65 70 75 80
Trp Gly Leu Ile Cys Gly Asp Asp Trp Gly Thr Leu Glu Ala Met Val
85 90 95
Ala Cys Arg Gln Leu Gly Leu Gly Tyr Ala Asn His Gly Leu Gln Glu
100 105 110
Thr Trp Tyr Trp Asp Ser Gly Asn Ile Thr Glu Val Val Met Ser Gly
115 120 125
Val Arg Cys Thr Gly Thr Glu Leu Ser Leu Asp Gln Cys Ala His His
130 135 140
Gly Thr His Ile Thr Cys Lys Arg Thr Gly Thr Arg Phe Thr Ala Gly
145 150 155 160
Val Ile Cys Ser Glu Thr Ala Ser Asp Leu Leu Leu His Ser Ala Leu
165 170 175
Val Gln Glu Thr Ala Tyr Ile Glu Asp Arg Pro Leu His Met Leu Tyr
180 185 190
Cys Ala Ala Glu Glu Asn Cys Leu Ala Ser Ser Ala Arg Ser Ala Asn
195 200 205
Trp Pro Tyr Gly His Arg Arg Leu Leu Arg Phe Ser Ser Gln Ile His
210 215 220
Asn Leu Gly Arg Ala Asp Phe Arg Pro Lys Ala Gly Arg His Ser Trp
225 230 235 240
Val Trp His Glu Cys His Gly His Tyr His Ser Met Asp Ile Phe Thr
245 250 255
His Tyr Asp Ile Leu Thr Pro Asn Gly Thr Lys Val Ala Glu Gly His
260 265 270
Lys Ala Ser Phe Cys Leu Glu Asp Thr Glu Cys Gln Glu Asp Val Ser
275 280 285
Lys Arg Tyr Glu Cys Ala Asn Phe Gly Glu Gln Gly Ile Thr Val Gly
290 295 300
Cys Trp Asp Leu Tyr Arg His Asp Ile Asp Cys Gln Trp Ile Asp Ile
305 310 315 320
Thr Asp Val Lys Pro Gly Asn Tyr Ile Leu Gln Val Val Ile Asn Pro
325 330 335
Asn Phe Glu Val Ala Glu Ser Asp Phe Thr Asn Asn Ala Met Lys Cys
340 345 350
Asn Cys Lys Tyr Asp Gly His Arg Ile Trp Val His Asn Cys His Ile
355 360 365
Gly Asp Ala Phe Ser Glu Glu Ala Asn Arg Arg Phe Glu Arg Tyr Pro
370 375 380
Gly Gln Thr Ser Asn Gln Ile Ile
385 390
<210> 141
<211> 756
<212> ПРТ
<213> Homo sapiens
<400> 141
Met Ala Trp Ser Pro Pro Ala Thr Leu Phe Leu Phe Leu Leu Leu Leu
1 5 10 15
Gly Gln Pro Pro Pro Ser Arg Pro Gln Ser Leu Gly Thr Thr Lys Leu
20 25 30
Arg Leu Val Gly Pro Glu Ser Lys Pro Glu Glu Gly Arg Leu Glu Val
35 40 45
Leu His Gln Gly Gln Trp Gly Thr Val Cys Asp Asp Asn Phe Ala Ile
50 55 60
Gln Glu Ala Thr Val Ala Cys Arg Gln Leu Gly Phe Glu Ala Ala Leu
65 70 75 80
Thr Trp Ala His Ser Ala Lys Tyr Gly Gln Gly Glu Gly Pro Ile Trp
85 90 95
Leu Asp Asn Val Arg Cys Val Gly Thr Glu Ser Ser Leu Asp Gln Cys
100 105 110
Gly Ser Asn Gly Trp Gly Val Ser Asp Cys Ser His Ser Glu Asp Val
115 120 125
Gly Val Ile Cys His Pro Arg Arg His Arg Gly Tyr Leu Ser Glu Thr
130 135 140
Val Ser Asn Ala Leu Gly Pro Gln Gly Arg Arg Leu Glu Glu Val Arg
145 150 155 160
Leu Lys Pro Ile Leu Ala Ser Ala Lys Gln His Ser Pro Val Thr Glu
165 170 175
Gly Ala Val Glu Val Lys Tyr Glu Gly His Trp Arg Gln Val Cys Asp
180 185 190
Gln Gly Trp Thr Met Asn Asn Ser Arg Val Val Cys Gly Met Leu Gly
195 200 205
Phe Pro Ser Glu Val Pro Val Asp Ser His Tyr Tyr Arg Lys Val Trp
210 215 220
Asp Leu Lys Met Arg Asp Pro Lys Ser Arg Leu Lys Ser Leu Thr Asn
225 230 235 240
Lys Asn Ser Phe Trp Ile His Gln Val Thr Cys Leu Gly Thr Glu Pro
245 250 255
His Met Ala Asn Cys Gln Val Gln Val Ala Pro Ala Arg Gly Lys Leu
260 265 270
Arg Pro Ala Cys Pro Gly Gly Met His Ala Val Val Ser Cys Val Ala
275 280 285
Gly Pro His Phe Arg Pro Pro Lys Thr Lys Pro Gln Arg Lys Gly Ser
290 295 300
Trp Ala Glu Glu Pro Arg Val Arg Leu Arg Ser Gly Ala Gln Val Gly
305 310 315 320
Glu Gly Arg Val Glu Val Leu Met Asn Arg Gln Trp Gly Thr Val Cys
325 330 335
Asp His Arg Trp Asn Leu Ile Ser Ala Ser Val Val Cys Arg Gln Leu
340 345 350
Gly Phe Gly Ser Ala Arg Glu Ala Leu Phe Gly Ala Arg Leu Gly Gln
355 360 365
Gly Leu Gly Pro Ile His Leu Ser Glu Val Arg Cys Arg Gly Tyr Glu
370 375 380
Arg Thr Leu Ser Asp Cys Pro Ala Leu Glu Gly Ser Gln Asn Gly Cys
385 390 395 400
Gln His Glu Asn Asp Ala Ala Val Arg Cys Asn Val Pro Asn Met Gly
405 410 415
Phe Gln Asn Gln Val Arg Leu Ala Gly Gly Arg Ile Pro Glu Glu Gly
420 425 430
Leu Leu Glu Val Gln Val Glu Val Asn Gly Val Pro Arg Trp Gly Ser
435 440 445
Val Cys Ser Glu Asn Trp Gly Leu Thr Glu Ala Met Val Ala Cys Arg
450 455 460
Gln Leu Gly Leu Gly Phe Ala Ile His Ala Tyr Lys Glu Thr Trp Phe
465 470 475 480
Trp Ser Gly Thr Pro Arg Ala Gln Glu Val Val Met Ser Gly Val Arg
485 490 495
Cys Ser Gly Thr Glu Leu Ala Leu Gln Gln Cys Gln Arg His Gly Pro
500 505 510
Val His Cys Ser His Gly Gly Gly Arg Phe Leu Ala Gly Val Ser Cys
515 520 525
Met Asp Ser Ala Pro Asp Leu Val Met Asn Ala Gln Leu Val Gln Glu
530 535 540
Thr Ala Tyr Leu Glu Asp Arg Pro Leu Ser Gln Leu Tyr Cys Ala His
545 550 555 560
Glu Glu Asn Cys Leu Ser Lys Ser Ala Asp His Met Asp Trp Pro Tyr
565 570 575
Gly Tyr Arg Arg Leu Leu Arg Phe Ser Thr Gln Ile Tyr Asn Leu Gly
580 585 590
Arg Thr Asp Phe Arg Pro Lys Thr Gly Arg Asp Ser Trp Val Trp His
595 600 605
Gln Cys His Arg His Tyr His Ser Ile Glu Val Phe Thr His Tyr Asp
610 615 620
Leu Leu Thr Leu Asn Gly Ser Lys Val Ala Glu Gly His Lys Ala Ser
625 630 635 640
Phe Cys Leu Glu Asp Thr Asn Cys Pro Thr Gly Leu Gln Arg Arg Tyr
645 650 655
Ala Cys Ala Asn Phe Gly Glu Gln Gly Val Thr Val Gly Cys Trp Asp
660 665 670
Thr Tyr Arg His Asp Ile Asp Cys Gln Trp Val Asp Ile Thr Asp Val
675 680 685
Gly Pro Gly Asn Tyr Ile Phe Gln Val Ile Val Asn Pro His Tyr Glu
690 695 700
Val Ala Glu Ser Asp Phe Ser Asn Asn Met Leu Gln Cys Arg Cys Lys
705 710 715 720
Tyr Asp Gly His Arg Val Trp Leu His Asn Cys His Thr Gly Asn Ser
725 730 735
Tyr Pro Ala Asn Ala Glu Leu Ser Leu Glu Gln Glu Gln Arg Leu Arg
740 745 750
Asn Asn Leu Ile
755
<210> 142
<211> 183
<212> ПРТ
<213> Homo sapiens
<400> 142
Met Arg Ala Ala Tyr Leu Phe Leu Leu Phe Leu Pro Ala Gly Leu Leu
1 5 10 15
Ala Gln Gly Gln Tyr Asp Leu Asp Pro Leu Pro Pro Phe Pro Asp His
20 25 30
Val Gln Tyr Thr His Tyr Ser Asp Gln Ile Asp Asn Pro Asp Tyr Tyr
35 40 45
Asp Tyr Gln Glu Val Thr Pro Arg Pro Ser Glu Glu Gln Phe Gln Phe
50 55 60
Gln Ser Gln Gln Gln Val Gln Gln Glu Val Ile Pro Ala Pro Thr Pro
65 70 75 80
Glu Pro Gly Asn Ala Glu Leu Glu Pro Thr Glu Pro Gly Pro Leu Asp
85 90 95
Cys Arg Glu Glu Gln Tyr Pro Cys Thr Arg Leu Tyr Ser Ile His Arg
100 105 110
Pro Cys Lys Gln Cys Leu Asn Glu Val Cys Phe Tyr Ser Leu Arg Arg
115 120 125
Val Tyr Val Ile Asn Lys Glu Ile Cys Val Arg Thr Val Cys Ala His
130 135 140
Glu Glu Leu Leu Arg Ala Asp Leu Cys Arg Asp Lys Phe Ser Lys Cys
145 150 155 160
Gly Val Met Ala Ser Ser Gly Leu Cys Gln Ser Val Ala Ala Ser Cys
165 170 175
Ala Arg Ser Cys Gly Ser Cys
180
<210> 143
<211> 182
<212> ПРТ
<213> Homo sapiens
<400> 143
Met Arg Ala Ala Tyr Leu Phe Leu Leu Phe Leu Pro Gly Leu Leu Ala
1 5 10 15
Gln Gly Gln Tyr Asp Leu Asp Pro Leu Pro Pro Phe Pro Asp His Val
20 25 30
Gln Tyr Thr His Tyr Ser Asp Gln Ile Asp Asn Pro Asp Tyr Tyr Asp
35 40 45
Tyr Gln Glu Val Thr Pro Arg Pro Ser Glu Glu Gln Phe Gln Phe Gln
50 55 60
Ser Gln Gln Gln Val Gln Gln Glu Val Ile Pro Ala Pro Thr Pro Glu
65 70 75 80
Pro Gly Asn Ala Glu Leu Glu Pro Thr Glu Pro Gly Pro Leu Asp Cys
85 90 95
Arg Glu Glu Gln Tyr Pro Cys Thr Arg Leu Tyr Ser Ile His Arg Pro
100 105 110
Cys Lys Gln Cys Leu Asn Glu Val Cys Phe Tyr Ser Leu Arg Arg Val
115 120 125
Tyr Val Ile Asn Lys Glu Ile Cys Val Arg Thr Val Cys Ala His Glu
130 135 140
Glu Leu Leu Arg Ala Asp Leu Cys Arg Asp Lys Phe Ser Lys Cys Gly
145 150 155 160
Val Met Ala Ser Ser Gly Leu Cys Gln Ser Val Ala Ala Ser Cys Ala
165 170 175
Arg Ser Cys Gly Ser Cys
180
<210> 144
<211> 173
<212> ПРТ
<213> Homo sapiens
<400> 144
Met Ser Leu Leu Gly Pro Lys Val Leu Leu Phe Leu Ala Ala Phe Ile
1 5 10 15
Ile Thr Ser Asp Trp Ile Pro Leu Gly Val Asn Ser Gln Arg Gly Asp
20 25 30
Asp Val Thr Gln Ala Thr Pro Glu Thr Phe Thr Glu Asp Pro Asn Leu
35 40 45
Val Asn Asp Pro Ala Thr Asp Glu Thr Val Leu Ala Val Leu Ala Asp
50 55 60
Ile Ala Pro Ser Thr Asp Asp Leu Ala Ser Leu Ser Glu Lys Asn Thr
65 70 75 80
Thr Ala Glu Cys Trp Asp Glu Lys Phe Thr Cys Thr Arg Leu Tyr Ser
85 90 95
Val His Arg Pro Val Lys Gln Cys Ile His Gln Leu Cys Phe Thr Ser
100 105 110
Leu Arg Arg Met Tyr Ile Val Asn Lys Glu Ile Cys Ser Arg Leu Val
115 120 125
Cys Lys Glu His Glu Ala Met Lys Asp Glu Leu Cys Arg Gln Met Ala
130 135 140
Gly Leu Pro Pro Arg Arg Leu Arg Arg Ser Asn Tyr Phe Arg Leu Pro
145 150 155 160
Pro Cys Glu Asn Val Asp Leu Gln Arg Pro Asn Gly Leu
165 170
<---
Реферат
Настоящее изобретение относится к области биотехнологии, конкретно к редактированию генов, и может быть использовано в медицине. Способ лечения дистрофического буллезного эпидермолиза включает доставку в кератиноциты пациента путем введения в эпидермис синтетической РНК, кодирующей редактирующий ген белок, который нацелен на ген COL7 и вызывает двухцепочечный разрыв в гене COL7, и доставку матрицы для репарации COL7 пациенту, для редактирования гена COL7. Предложен также способ, где в кератиноциты пациента с помощью инъекции в эпидермис доставляют синтетическую РНК, кодирующую редактирующий ген белок, который нацелен на ген COL7, и индуцируют одно- или двухцепочечный разрыв в гене COL7 с целью удаления мутации, которая по меньшей мере частично отвечает за фенотип заболевания. Изобретение обеспечивает улучшения одного или нескольких симптомов дистрофического буллезного эпидермолиза у пациента. 2 н. и 5 з.п. ф-лы, 18 ил., 4 табл., 56 пр.

Комментарии