Способ и устройство для доставки лекарственных средств - RU2477151C2
Код документа: RU2477151C2
Чертежи

























































Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Приоритет этой заявки заявляется по дате подачи предварительной патентной заявки США №60/895,518, поданной 19 марта 2007, предварительной патентной заявки США №60/895,519, поданной 19 марта 2007, предварительной патентной заявки США №60/912,698, поданной 19 апреля 2007, предварительной патентной заявки США №60/940,721, поданной 30 мая 2007, заявки на полезную модель США №11/821,230, поданной 21 июня 2007, предварительной патентной заявки США №61/008,278, поданной 18 декабря 2007, предварительной патентной заявки США №60/956,700, поданной 19 августа 2007, предварительной патентной заявки США №60/970,997, поданной 10 сентября 2007, предварительной патентной заявки США №61/008,325, поданной 18 декабря 2007, предварительной патентной заявки США №61/008,274, поданной 18 декабря 2007, и предварительной патентной заявки США №61/008,277, поданной 18 декабря 2007. Каждое из вышеупомянутых описаний включено в этот документ во всей полноте посредством ссылки.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Область изобретения
Настоящее изобретение относится к системам и способам для доставки лекарственных средств пациенту. В частности, настоящее изобретение относится к системам и способам для подкожной инфузии лекарственных средств или веществ, использующим источники энергии для повышения эффективности введенных лекарственных средств.
Предпосылки изобретения
Диабет является очень тяжелым заболеванием, затрагивающим сегодня миллионы людей. Многие пациенты-диабетики нуждаются в инъекциях инсулина, чтобы поддерживать надлежащие уровни глюкозы в их крови, требующиеся для выживания. Такие инъекции инсулина выполняют с использованием системы доставки лекарственных средств.
Много систем и способов лечения используют системы доставки лекарственных средств, которые используют подкожные инфузии терапевтических жидкостей, лекарственных средств, белков и других соединений. Такие системы и способы доставки, особенно в области доставки инсулина, обычно используют подкожные катетеры и насосы для непрерывной подкожной инфузии инсулина (CSII). В традиционных насосах инсулина насос выполнен с возможностью присоединения к одноразовой тонкой пластмассовой трубке или катетеру, через которую инсулин поступает в ткань. Катетер может быть вставлен чрескожно, обычно на животе пациента, и заменяться каждые два-три дня. Новые типы насосов инсулина, такие как насос OmniPod, изготовляемый корпорацией Insulet, не имеют внешнего катетера, а скорее, катетерное отверстие, которое включено в механизм насоса.
Во многих случаях пациенты нуждаются в круглосуточной доставке инсулина, чтобы поддерживать надлежащие уровни глюкозы в их крови. Инсулин может быть доставлен в соответствии с основной нормой или в болюсных дозировках. Основная норма представляет собой количество инсулина, которое непрерывно доставляется пациенту. Такая непрерывная доставка инсулина поддерживает глюкозу в крови пациента в требуемом диапазоне между приемами пищи и в течение ночи. Болюсная дозировка представляет собой количество инсулина, доставляемого пациенту, согласующееся с дозировкой углеводов, потребленных пациентом, чтобы привести в соответствие увеличенные уровни глюкозы как результат принятой внутрь пищи. Некоторые традиционные механизмы насоса выполнены с возможностью реагирования по команде, или посредством алгоритма, на увеличение уровней глюкозы, доставляя болюсную дозировку инсулина, которая согласуется с подъемом уровня глюкозы и предотвращает большие отклонения уровня глюкозы. Однако много традиционных подкожных систем доставки лекарственных средств неспособны к быстрому соответствию или предотвращению повышения уровня глюкозы в крови. Задержка такого соответствия также верна в случае "быстро действующего" инсулина. Некоторые из причин этой задержки включают задержку на абсорбции инсулина от участка инъекции и время, которое требуется для сложных молекул инсулина, чтобы распасться на мономеры.
Кроме того, поскольку уровень глюкозы в крови повышается незамедлительно после еды, задержка в соответствии инсулина повышающимся уровням вызывает наступление прандиального гипергликомического приступа (т.е. когда уровень глюкозы в крови выше нормального). Также иногда после того, как после еды прошло конкретное количество времени (например, 2-3 часа), уровень глюкозы в крови понижается, при этом концентрации инсулина в крови повышаются, что сопровождается пиком системного эффекта инсулина и приводит к наступлению гипогликомического приступа (то есть когда уровень глюкозы в крови ниже нормального). Как гипергликемический, так и гипогликемический приступы крайне нежелательны. Кроме того, так как локальная перфузия крови в области инфузии инсулина сильно изменяется в зависимости от окружающей температуры и других параметров, это вызывает большие изменения в указанной задержке пика временного профиля действия инсулина. Эти изменения в периоде пика действия инсулина дополнительно увеличивают изменчивость в уровне глюкозы в крови.
Таким образом, желательно предусмотреть систему и способ, которые обеспечивают эффективную и своевременную доставку лекарственных средств пациенту. В частности, желательно обеспечить систему и способ доставки инсулина пациенту, который улучшает эффективность инсулина в крови, чтобы поддерживать нормальные уровни глюкозы в крови и предотвращать или уменьшать гипергликемический и гипогликемический приступы.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Варианты выполнения настоящего изобретения относятся к системам, устройствам и способам для доставки лекарственных средств, веществ и/или химических агентов (вместе "лекарственных средств" или "веществ") пациенту и для улучшения эффективности таких лекарственных средств, когда они доставлены. В некоторых вариантах выполнения настоящего изобретения предусмотрено устройство для улучшения работы основанных на катетере устройств доставки лекарственных средств. Катетер может быть дополнением к насосу или может быть вмонтирован в механизм насоса. В таких вариантах выполнения устройство может быть применено в непосредственной близости к области ткани пациента, в которую доставляется лекарственное средство (например, инсулин), чтобы подвергнуть область ткани действию терапии, такого как тепло, холод, температурный контроль, механические колебания, всасывание, массирование, акустическая стимуляция (например, ультразвук), электромагнитное излучение, электрическое поле, магнитное поле, РЧ излучение, микроволновое излучение, электрическая стимуляция или подобные им, или любой комбинации вышеупомянутых терапий для улучшения фармакокинетического профиля и/или фармакодинамического профиля лекарственного средства. Элемент терапии ткани может стимулировать или ингибировать ткань, вводя вторичные вещества, например, включающие, но не ограниченные лекарственными средствами, медикаментами, химическим агентом, биологически активными бактериями, биологически инертными бактериями или подобным им, или также любой комбинации вышеупомянутых терапий для улучшения фармакокинетического профиля и/или фармакодинамического профиля лекарственного средства.
Такое устройство в соответствии с некоторыми вариантам выполнения настоящего изобретения может также быть частью катетера, который имеет одну секцию, находящуюся в ткани, и другую секцию, которая присоединяется к узлу вне ткани (то есть система чрескожной доставки). Как будет понятно специалисту, свойства (такие как амплитуда, фаза, частота, и т.д.) отдельного источника(ов) возбуждения, комбинация источников стимуляции, взаимное отношение и временной диапазон между различными источниками возбуждения, все это может управляться процессором, чтобы добиться требуемого отклика области ткани, расположенной рядом с катетером. Источники также могут быть отрегулированы в соответствии с химическими/физическими свойствами введенного вещества.
В некоторых вариантах выполнения настоящего изобретения устройство для доставки энергии к области ткани (или области введения) может быть выполнено для контролирования и управления свойствами источников стимуляции (такими как амплитуда, фаза, интенсивность, частота, и т.д.). Основываясь на контроле, информация может быть предоставлена контроллеру ("контроллер", также называемый "терапевтическим узлом"), который использует информацию, чтобы уменьшить изменчивость процесса доставки лекарственных средств. В таких вариантах выполнения устройство может быть выполнено для осуществления контроля за свойствами ткани рядом с элементом катетера (например, таких как температура). Основываясь на таком контроле, информация может быть предоставлена контроллеру, который использует информацию для улучшения фармакокинетического и/или фармакодинамического профиля лекарственных средств в требуемом направлении, а также эффективность и для снижения изменчивости процесса доставки лекарственных средств.
Устройство, предусмотренное в соответствии с некоторыми вариантами выполнения настоящего изобретения, может быть выполнено с возможностью любого из автоматического обнаружения доставки лекарственных средств через катетер устройством доставки, получения сигнала от устройства доставки лекарственных средств, получения сигнала от отдельной кнопки или выключателя для запуска протокола экспонирования области инфузии ткани вышеупомянутым описанным терапиям или стимуляциям ткани. Устройство может тогда быть выполнено с возможностью начала работы, применяя стимуляцию или терапию к ткани. Отклик ткани на стимуляцию усиливает функциональные возможности насоса доставки лекарственных средств путем усиления кинетики молекулярного транспорта между наконечником катетера, размещенным внутри ткани, и различными отделениями области ткани вокруг него, а также в кровеносную систему.
В некоторых вариантах выполнения примененная терапия может уменьшить изменчивость абсорбции лекарственных средств в крови или лимфатической системе, а также ее местные и системные эффекты. Например, нагрев области ткани вблизи области доставки лекарственных средств (то есть области инфузии) до заранее установленной регулируемой температуры во время инфузии и абсорбции в кровь лекарственных средств может привести к повторяемости локальной перфузии крови в этой области, а также к большему количеству однородных и повторяемых процессов абсорбции лекарственных средств. Кроме того, путем уменьшения задержки между доставкой лекарственных средств в ткань и абсорбцией в кровеносную систему изменчивость действия лекарственных средств, вызванное задержкой профиля, может также быть снижена. Температура области, смежной с областью инфузии, может быть отрегулирована в течение большего количества длительных периодов, но за счет либо объема источника энергии, либо веса. Поэтому для минимизации размера источника энергии период нагрева должен быть оптимизирован в отношении периода инфузии лекарственных средств и абсорбции их в кровь.
В некоторых вариантах выполнения терапевтическое устройство или стимуляция ткани может быть запущено вручную пользователем. Пользователь может активировать терапевтическое устройство или устройства до или после активации насоса, чтобы усилить отклик ткани на доставляемое лекарственное средство. В таких вариантах выполнения это может быть сделано путем нажатия кнопки или последовательности кнопок на терапевтическом устройстве ткани. В некоторых вариантах выполнения в случае наличия сообщения между устройством доставки лекарственных средств и терапевтическим устройством терапия может быть запущена вручную путем нажатия кнопки или последовательности кнопок на устройстве доставки лекарственных средств. Например, в случае инсулинового насоса насос может иметь специальную кнопку для запуска "болюсной дозы" по сравнению с другими вариантами болюса, обеспечиваемыми насосом. Режим быстрого болюса инсулина может быть выполнен так, чтобы начать одну из описанных терапий параллельно с применением инфузии болюса инсулина в течение заданного промежутка времени, такого как 30 минут (например). Это улучшает или изменяет (преимущественным образом) фармакокинетику или фармакодинамику инсулина, перфузию крови ткани и/или абсорбцию в крови, что является очень привлекательным в сочетании с пищей, обладающей высоким гликемическим индексом. Применение "быстрого болюса" может быть полезным при потреблении пищи с высоким гликемическим индексом, когда происходят большие и в большом количестве быстрые колебания уровня глюкозы, но также и в большинстве случаев использования болюсов инсулина для защиты при приеме пищи. Применение "быстрого болюса" может быть начато путем нажатия специальной последовательности кнопок или выбора режима болюса с использованием дисплея насоса и кнопки. В некоторых вариантах выполнения пользователь может инициировать терапию или стимуляцию ткани вместе с инфузией болюса инсулина перед едой, чтобы еще больше увеличить эффект от терапии. В некоторых вариантах выполнения терапия или стимуляция ткани могут быть запущены после болюса, чтобы продлить срок службы аккумулятора.
Некоторые варианты выполнения настоящего изобретения также обеспечивают способы для осуществления контроля за параметрами ткани неинвазивно или инвазивно с использованием катетера или же как инвазивно, так и неинвазивно и использовать информацию, чтобы управлять активацией устройства, выполненного в соответствии с настоящим изобретением.
Некоторые варианты выполнения настоящего изобретения также обеспечивают способы для улучшения или изменения фармакокинетического и/или фармакодинамического профиля лекарственных средств, чтобы уменьшить время достижения максимума действия в крови введенного материала путем применения схемы модуляции к насосу. С этой модуляцией инфузионная текучая среда немного втягивается в ткань и вытягивается из ткани во время или после процесса инфузии лекарственных средств. В таких вариантах выполнения этот способ, возможно, не требует дополнения существующего инфузионного насоса любыми другими устройствами, скорее, он может быть предназначен для модуляции лекарственного средства, вытекающего из элемента доставки лекарственных средств или насоса.
В некоторых вариантах выполнения насос доставки лекарственных средств может быть механически или с помощью электроники соединен с катетером вышеупомянутого варианта выполнения устройства. В таких вариантах выполнения катетерный узел содержит по меньшей мере один из следующих источников стимуляции или по меньшей мере одну комбинацию двух таких источников, выбранных из следующего списка: источник тепла (например, терморезистор), всасывающее отверстие, активируемое насосом (например), механический источник вибрации, ультразвуковой источник возбуждения, ультразвуковой преобразователь, источник света, оптическое волокно, массирующий элемент, источник электромагнитного излучения и/или комбинация по меньшей мере двух источников из источников тепла, колебаний, всасывания, ультразвука, света, электромагнитного излучения и массирования.
В некоторых вариантах выполнения предусмотрено устройство для доставки лекарственных средств, которое содержит инфузионный катетер для вставки в ткань, устройство доставки лекарственных средств для инфузии лекарственного средства и, внутри инфузионного катетера, терапевтическое устройство для применения конкретной терапии или стимуляции к области с введенным лекарственным средством для улучшения фармакокинетического, фармакодинамического профиля лекарственного средства и/или увеличения перфузии крови в этой области во время периода доставки лекарственных средств для улучшения абсорбции лекарственного средства в кровеносную систему.
В некоторых вариантах выполнения предусмотрено устройство для доставки лекарственных средств, которое содержит инфузионный катетер для вставления в ткань, устройство доставки лекарственных средств для инфузии лекарственного средства в инфузионный катетер, терапевтическое устройство для применения конкретной терапии или стимуляции к области с введенным лекарственным средством для улучшения, изменения и/или стабилизации фармакокинетики, фармакодинамики лекарственного средства и/или уменьшения изменчивости абсорбции лекарственного средства в кровеносную систему.
В некоторых вариантах выполнения предусмотрено устройство для доставки лекарственных средств, которое содержит инфузионный катетер для вставления в ткань, устройство доставки лекарственных средств для инфузии лекарственного средства в инфузионный катетер, терапевтическое устройство для применения конкретной терапии или стимуляции к области с введенным лекарственным средством для улучшения, изменения и/или стабилизации фармакокинетики, фармакодинамики лекарственного средства и/или уменьшения изменчивости процесса абсорбции лекарственного средства в кровеносную систему, по меньшей мере один датчик, предназначенный для измерения эффекта, создаваемого терапевтическим устройством, и блок управления, предназначенный для управления работой терапевтического устройства, используя информацию, полученную от указанного по меньшей мере одного датчика.
В некоторых вариантах выполнения предусмотрено устройство для доставки лекарственных средств, содержащее инфузионный катетер для вставления в ткань, устройство доставки лекарственных средств для инфузии лекарственного средства в инфузионный катетер, датчик для обнаружения инфузии лекарственного средства через катетер либо непосредственно, либо косвенно, терапевтическое устройство для применения конкретной терапии к области с введенным лекарственным средством для улучшения, изменения и/или стабилизации фармакокинетики, фармакодинамики лекарственного средства и/или уменьшения изменчивости процесса абсорбции лекарственного средства в кровеносную систему, и блок управления, предназначенный для запуска терапевтического профиля с помощью терапевтического устройства после обнаружения инфузии лекарственных средств с помощью датчика.
В некоторых вариантах выполнения предусмотрено устройство для доставки лекарственных средств, содержащее инфузионный катетер для вставления в ткань, устройство доставки лекарственных средств для инфузии лекарственного средства в инфузионный катетер, кожух для устройства доставки лекарственных средств, датчик, вмонтированный в кожух, для определения рабочего состояния устройства инфузии при введении устройством болюса лекарственного средства, терапевтический элемент для применения конкретной терапии к области с введенным лекарственным средством для улучшения, изменения и/или стабилизации фармакокинетики, фармакодинамики лекарственного средства, узел электронного управления, соединенный с терапевтическим элементом для запуска терапевтического профиля с помощью терапевтического элемента, когда устройство доставки лекарственных средств начинает инфузию лекарственного средства. В некоторых таких вариантах выполнения указанный узел встроена в кожух.
В некоторых вариантах выполнения предусмотрено устройство для доставки лекарственных средств, содержащее устройство доставки лекарственных средств, инфузионный катетер для вставления в ткань. Инфузионный катетер представляет собой часть набора для инфузии, содержащего: инфузионный катетер, трубку с соединителями или без них, которая соединяет инфузионный катетер с устройством доставки лекарственных средств, терапевтический элемент для применения конкретной терапии к области с введенным лекарственным средством для улучшения, изменения и/или стабилизации фармакокинетики, фармакодинамики лекарственного средства, клейкий элемент, который используется для прочного прикрепления терапевтического элемента и/или инфузионного катетера к месту на ткани, канал сообщения между устройством доставки лекарственных средств и терапевтическим элементом, блок управления (то есть контроллер/терапевтический узел), который запускает терапевтический профиль с помощью терапевтического элемента, когда устройство доставки лекарственных средств начинает инфузию лекарственного средства. Элементы устройства могут быть всеми или частью, содержащимися в том же самом кожухе.
В некоторых вариантах выполнения предусмотрено устройство для доставки лекарственных средств, содержащее устройство доставки лекарственных средств и инфузионный катетер для вставления в ткань. Инфузионный катетер представляет собой часть набора для инфузии, содержащего: инфузионный катетер, трубку с соединителями или без них, которая соединяет инфузионный катетер с устройством доставки лекарственных средств, терапевтический элемент для применения конкретной терапии к области с введенным лекарственным средством для улучшения, изменения и/или стабилизации фармакокинетики, фармакодинамики лекарственного средства, клейкий элемент, который используется для прочного прикрепления терапевтического элемента и/или инфузионного катетера к месту на ткани, кожух для устройства доставки лекарственных средств, измерительную катушку или другой датчик, вмонтированный в кожух, для определения рабочего состояния устройства инфузии при введении устройством болюсной дозировки, и блок управления, который запускает терапевтический профиль с помощью терапевтического элемента, когда устройство доставки лекарственных средств начинает инфузию лекарственного средства. Узел вмонтирован в кожух.
В некоторых вариантах выполнения предусмотрено устройство для доставки лекарственных средств, содержащее инфузионный катетер для вставления в ткань. Инфузионный катетер представляет собой часть набора для инфузии, содержащего: инфузионный катетер, трубку с соединителями или без них, которая соединяет инфузионный катетер с устройством доставки лекарственных средств, терапевтический элемент для применения конкретной терапии к области с введенным лекарственным средством для улучшения, изменения и/или стабилизации фармакокинетики, фармакодинамики лекарственного средства, клейкий элемент, который используется для прочного прикрепления терапевтического элемента и/или инфузионного катетера к месту на ткани, кожух для устройства доставки лекарственных средств, и блок управления, который запускает терапевтический профиль с помощью терапевтического элемента, когда устройство доставки лекарственных средств начинает инфузию лекарственного средства.
В некоторых таких вариантах выполнения клейкий элемент, терапевтический элемент и набор для инфузии выполнены одноразовыми, тогда как все другие компоненты выполнены с возможностью повторного использования. В некоторых вариантах выполнения клейкий элемент, терапевтический элемент, набор для инфузии и блок управления выполнены одноразовыми, тогда как все другие компоненты выполнены с возможностью повторного использования. В некоторых вариантах выполнения все компоненты, включая устройство инфузии и источник питания (аккумуляторы) выполнены одноразовыми. Вышеупомянутые элементы устройства в настоящем изобретении, такие как устройство доставки лекарственных средств, инфузионный катетер, терапевтическое устройство и другие могут быть выполнены как отдельные элементы или элементы, содержащие все или часть их в одном кожухе.
Некоторые варианты выполнения настоящего изобретения предусматривают устройство для повышения эффективности устройств доставки лекарственных средств, путем доставки лекарственного средства (например, инсулина) в сочетании с применением терапии электромагнитным излучением, например, из источника электромагнитного излучения. В некоторых вариантах выполнения устройство доставки лекарственных средств содержит основанное на катетере устройство доставки лекарственных средств. Разнообразные выполнения катетера и устройства доставки лекарственных средств охвачены настоящей заявкой. Например, и без ограничения, катетер может содержать внешний по отношению к насосу элемент или элемент, частично или полностью вмонтированный в механизм насоса. Описанное здесь устройство может быть частью катетера, который имеет одну секцию, вставленную в ткань, и другую секцию, которая присоединена к узлу снаружи ткани.
Терапия электромагнитным излучением в некоторых вариантах выполнения применяется к области ткани, к которой доставлено лекарственное средство, чтобы подвергнуть ее действию электромагнитного излучения и/или эффекту, вызванному электромагнитным излучением, для улучшения фармакокинетики или фармакодинамики лекарственного средства. Этот эффект может включать, например акустическую стимуляцию через применение электромагнитного излучения, стимуляцию, основанную на свете и т.п.
Свойства источника излучения или же комбинация источника излучения и другого источника стимуляции, как описано по меньшей мере в предварительных заявках на патент США №60/912,698, №60/895,519, №60/956,700, №61/008,325, №61/008,277, №60/940,721 и №61/008,278, описания которых включены в этот документ во всей полноте посредством ссылки, как будто бы полностью были здесь описаны, могут управляться контроллером, чтобы достигнуть требуемого отклика области ткани, расположенной рядом с катетером. Такая регулировка химических/физических свойств введенного вещества может также быть выполнена. Кроме того, одна или большее количество регулировок может быть выполнено согласно свойствам каждого источника стимуляции (такие как диапазон, фаза, частота и т.п.), так же как и относительный показатель и временной диапазон между различными источниками стимуляции.
Настоящее описание также обеспечивает в некоторых вариантах выполнения способ осуществления контроля за свойствами стимуляции или свойствами стимулируемой области ткани, причем такой контроль выполняют с помощью монитора, который обеспечивает данные и/или обратную связь вышеупомянутому контроллеру. Контроллер использует информацию, чтобы уменьшить изменчивость процесса доставки лекарственных средств, например улучшить фармакокинетический и/или фармакодинамический профиль лекарственных средств, так же как и повысить эффективность и уменьшить изменчивость процесса доставки лекарственных средств.
В некоторых вариантах выполнения контроль может быть осуществлен, контролируя свойства ткани рядом с элементом катетера (включая, но не ограничиваясь перфузией крови в ткани, температурой, концентрацией одного или большего количества компонентов крови), и/или контролируя результирующий эффект от стимулирования ткани, например контролируя излучение, обратно отраженное от ткани.
В некоторых вариантах выполнения доставку лекарственных средств выполняют через устройство доставки, которое может быть любым типом устройства доставки, известным в области техники. В некоторых вариантах выполнения устройство получает информацию относительно доставки лекарственных средств. Такая информация может быть предоставлена через автоматическое обнаружение доставки лекарственных средств через катетер устройством доставки и/или путем получения отдельного сигнала от устройства доставки лекарственных средств или от отдельной кнопки или выключателя. Независимо от того, как выполняют обнаружение, обнаружение доставки лекарственных средств используется для запуска протокола экспонирования области инфузии ткани вышеупомянутым описанным терапиям облучением или стимуляциям ткани.
При указанном обнаружении источник электромагнитного излучения применяет электромагнитное излучение к ткани, которую нужно лечить. Отклик ткани на стимуляцию усиливает функциональные возможности насоса доставки лекарственных средств путем, например, и не ограничиваясь одним предположением увеличения кинетики молекулярного транспорта от наконечника катетера, размещенного внутри ткани, в различные замкнутые области ткани вокруг этого наконечника, и в кровеносную систему. В некоторых вариантах выполнения примененное электромагнитное излучение уменьшает изменчивость абсорбции лекарственных средств в кровеносной системе и эффект этой изменчивости.
Настоящее описание также описывает в некоторых вариантах выполнения устройство для доставки лекарственных средств, содержащее инфузионный катетер, вставленный в ткань, устройство доставки лекарственных средств, которое вводит лекарственное средство в инфузионный катетер, терапевтическое устройство, которое прикладывает излучение к области с введенным лекарственным средством для улучшения фиксации фармакокинетики или фармакодинамики лекарственного средства, чтобы уменьшить изменчивость процесса абсорбции лекарственных средств в кровеносную систему, по меньшей мере один датчик для измерения эффекта от терапевтического устройства и блок управления для управления работой терапевтического устройства, используя информацию от указанного по меньшей мере одного датчика.
Настоящее описание также описывает в некоторых вариантах выполнения устройство для доставки лекарственных средств, содержащее инфузионный катетер, вставленный в ткань, устройство доставки лекарственных средств, которое вводит лекарственное средство в инфузионный катетер, датчик, который обнаруживает инфузию лекарственных средств через катетер либо непосредственно, либо косвенно, терапевтическое устройство, которое прикладывает излучение к области с введенным лекарственным средством для улучшения фармакокинетики или фармакодинамики лекарственного средства или уменьшения неустойчивости процесса абсорбции лекарственных средств в кровеносную систему, и блок управления, который запускает терапевтический профиль с терапевтического устройства после обнаружения инфузии лекарственных средств датчиком. В соответствии с некоторыми вариантами выполнения датчик встроен в кожух устройства доставки лекарственных средств, чтобы измерять работу устройства инфузии, когда болюс лекарственных средств доставляется устройством.
Некоторые из вариантов выполнения содержат источник электромагнитного излучения для доставки электромагнитного излучения, как описано выше.
Устройство может также содержать канал передачи данных между устройством доставки лекарственных средств и терапевтическим элементом и блок управления, который запускает профиль терапии ткани излучением с терапевтического элемента, когда устройство доставки лекарственных средств начинает инфузию лекарственных средств.
Устройство может также содержать кожух устройства доставки лекарственных средств, измерительную катушку или другой датчик, вмонтированный в кожух, для определения рабочего состояния устройства инфузии, когда болюс лекарственных средств доставляется устройством, и блок управления, который запускает терапевтический профиль с помощью терапевтического элемента, когда устройство доставки лекарственных средств начинает инфузию лекарственного средства. Блок управления в некоторых вариантах выполнения встроен в кожух.
Клейкий элемент, терапевтический элемент и набор для инфузии могут быть выполнены одноразовыми, тогда как по меньшей мере один или большее количество других компонентов выполнены с возможностью повторного использования. В некоторых вариантах выполнения большее количество других компонентов повторно используемо. В некоторых вариантах выполнения все компоненты выполнены с возможностью повторного использования. Блок управления может быть выполнен одноразовым, тогда как все другие компоненты выполнены с возможностью повторного использования. Устройство инфузии и источник питания (аккумулятор) могут быть выполнены одноразовыми.
Как используется в спецификации настоящей заявки, термин "лекарственное средство" определен так, чтобы включать любое фармацевтически активное соединение, включая, но не ограничиваясь соединениями, которые лечат болезни, травмы, нежелательные симптомы и улучшают или поддерживают здоровье. Термины "область, предназначенная для лечения", или "области, предназначенные для лечения", или "участок, предназначенный для лечения", как здесь используются, определены так, чтобы включать кровеносную систему человеческого тела, области человеческого тела, которые можно достичь кровеносной системой, включая, но не ограничиваясь мышцами, мозгом, печенью, почками, и т.д., и областями ткани тела, расположенными вблизи места нахождения введенного лекарственного средства.
Настоящая заявка направлена на доставку лекарственных средств (посредством неограничивающего примера представляет собой инсулин), предназначенных для лечения любого хронического или острого заболевания, например диабета, гипоксии, анемии, заболеваний, связанных с холестерином, инсульта, заболеваний сердца или тому подобного.
В некоторых вариантах выполнения настоящего изобретения лекарственное средство вводится шприцем или механическим насосом или другим устройством раздачи лекарственных средств, которое связано с отверстием инъекции, объединенным с элементом терапии ткани, когда лекарственное средство должно быть введено и отсоединено от указанного отверстия инъекции. В некоторых вариантах выполнения отверстие инъекции включает катетер, вставленный в ткань, крепежный элемент, прикрепленный к коже, и соединитель для соединения шприца или другого устройства раздачи лекарственных средств.
Некоторые варианты выполнения настоящего изобретения обеспечивают терапии, как описано ранее, ткани вблизи участка инъекции лекарственных средств, введенных традиционными инжекторами, такими как шприц и игла.
Некоторые варианты выполнения настоящего изобретения обеспечивают автоматический контроль измеренного уровня в теле пользователя, управляя количеством введенного лекарственного средства, которое влияет на измеренный уровень в теле пользователя. Например, было предпринято много попыток создать "искусственную поджелудочную железу", чтобы управлять уровнем глюкозы в крови, начиная с разработок непрерывного мониторинга глюкозы. В этом случае любая задержка, такая как задержка абсорбции инсулина и времени действия, любая изменчивость в этой задержке и любая изменчивость в остаточном уровне инсулина в теле вызывает ошибку в управляющем алгоритме, что приведет к недостаточному регулированию уровня глюкозы. Таким образом, применяя терапию ткани к участку доставки инсулина, как описано способами и устройствами в настоящем изобретении, может быть достигнута повышенная точность и надежность управляющего алгоритма, который использует показания датчика уровня глюкозы.
Некоторые варианты выполнения настоящего изобретения предусматривают имплантируемое устройство доставки лекарственных средств для автоматического и непосредственного введения лекарственного средства в предназначенный для лечения участок, причем лекарственное средство может быть введено в имплантированное пространство из внешнего источника лекарственных средств. Имплантируемое устройство доставки лекарственных средств содержит контроллер, элемент терапии ткани, элемент доставки и резервуар для хранения лекарственных средств. Имплантируемое устройство может также содержать внешний (не имплантированный) пользовательский интерфейс, который предоставляет пользователю базу данных, форму дозировки, выбор времени дозировки и триггер дозировки. Пользовательский интерфейс может общаться с контроллером, использующим протоколы передачи данных, например, включая, но не ограничиваясь беспроводным, мобильным, оптическим, РЧ, ИК или им подобным. Имплантируемое устройство доставки лекарственных средств может также содержать датчик, который может быть имплантирован вместе с имплантированным устройством.
Резервуар для хранения лекарственных средств в соответствии с некоторыми вариантами выполнения представляет собой внутренний контейнер или участок хранения, который сохраняет лекарственное средство в годной к употреблению форме, пока не требуется его доставка. Резервуар дозировки лекарственного средства может содержать достаточные количества лекарственного средства, чтобы служить в течение длительного периода времени, требуя, например, пополнения каждые 3 месяца или около того. Резервуар для хранения лекарственных средств может получать лекарственное средство от внешнего источника непосредственной инъекцией в резервуар. Резервуар для хранения лекарственных средств может получать лекарственное средство от внешнего источника через элемент получения лекарственных средств, например, включая катетер, так что запас лекарственных средств может быть пополнен, когда это необходимо. Резервуар для хранения лекарственных средств может быть подразделен на большее количество резервуаров хранения, например, для различных лекарственных средств.
В некоторых вариантах выполнения контроллер управляет уровнем лекарственных средств, доставляемых к предназначенному для лечения участку. Имплантированный датчик может быть присоединен к контроллеру для дальнейшего управления дозировкой лекарственных средств и временем доставки. Датчик может указывать контроллеру на уровень измеряемой величины. Например, измеряемая величина может быть показателем уровня глюкозы, уровня холестерина или тому подобного, по меньшей мере частично основанного на том, какой необходимый протокол терапии определяет контроллер, например, включая, но не ограничиваясь, дозировкой лекарственных средств, которая должна быть доставлена, выбором времени доставки лекарственных средств или тому подобным.
Датчик может в соответствии с некоторыми вариантами выполнения представлять собой внешний датчик относительно элемента доставки лекарственных средств и использоваться снаружи для измерения измеряемой величины, например уровня глюкозы в крови. Внешний датчик соединен с процессором, например, включая, но не ограничиваясь, мобильным телефоном, КПК или тому подобным устройством, которое может общаться с контроллером имплантированного устройства доставки лекарственных средств. Данные от датчика передаются имплантированному контроллеру, использующему по меньшей мере один протокол передачи данных, например, включая, но не ограничиваясь, мобильным, беспроводным, ИК, оптическим, РЧ или им подобным протоколам передачи данных. Например, данные датчика представляют собой измеряемую величину, которая может быть показателем уровня глюкозы, уровня холестерина или подобным показателем. Основываясь на переданных данных от датчика, контроллер определяет необходимый протокол терапии, например, включая, но не ограничиваясь, дозировку лекарственных средств, выбор времени и терапию ткани, как это требуется в соответствии с измеренными данными.
В некоторых вариантах выполнения контроллер активирует или деактивирует элемент терапии ткани, чтобы вызвать требуемый стимулирующий или ингибирующий эффект, который может свести к максимуму или к минимуму доставку лекарственных средств к предназначенному для лечения участку. Когда резервуар для хранения лекарственных средств требует пополнения, контроллер может обмениваться данными с внешним устройством, например, включая активацию СИД, по электронной почте, SMS или тому подобным способом, используя различные протоколы передачи данных, например, включая, но не ограничиваясь, беспроводным, телеграфом, оптическим, мобильным, РЧ, ИК или им подобным протоколом передачи данных.
В соответствии с некоторыми вариантами выполнения лекарственное средство доставляется предназначенному для лечения участку с использованием элемента доставки, например, включая, но не ограничиваясь, катетером, проницаемой мембраной, выборочно проницаемой мембраной, большим количеством катетеров, трансплантированной тканью, кровеносным сосудом, или подобным им. Датчик или элемент терапии ткани могут быть включены в элемент доставки.
Элемент терапии ткани может использоваться в соответствии с некоторыми вариантами выполнения, чтобы стимулировать или ингибировать ткань и участок доставки, для управления усвоением инсулина в теле, чтобы снизить пиковое повышение и падение уровней глюкозы в крови, чтобы предотвратить инсулиновое голодание (прандиальную гипергликемию) в начале пика и гипогликемию в конце пика. Контроллер и элемент терапии ткани работают вместе, чтобы регулировать колебания уровней глюкозы в крови. Элемент терапии ткани может использовать различные способы и устройства, как описано в настоящем изобретении, чтобы стимулировать или ингибировать ткань, приводя к увеличенной перфузии крови, которая улучшает абсорбцию инсулина, или также уменьшая абсорбцию инсулина, когда это необходимо.
Некоторые варианты выполнения настоящего изобретения предусматривают устройство доставки лекарственных средств для непосредственного введения лекарственных средств к предназначенному для лечения участку, имеющему имплантированную (внутреннюю) часть и неимплантированную (внешнюю) часть. Различные компоненты могут быть имплантированы, например, включая, но не ограничиваясь, в датчик, контроллер, элемент доставки, производство лекарственных средств, пользовательский интерфейс, элемент терапии ткани или резервуар для хранения лекарственных средств. В некоторых вариантах выполнения элемент терапии ткани не имплантирован, а является внешним и применяет терапию ткани к коже выше имплантированного устройства доставки лекарственных средств. Внешние компоненты могут обмениваться данными с внутренними компонентами, используя протоколы, включая, но не ограничиваясь, беспроводным, телеграфом, мобильным, оптическим, ИК, РЧ или им подобным.
Имплантированный вариант выполнения способен к производству лекарственных средств, например, включая, но не ограничиваясь инсулином. Производство инсулина может быть достигнуто в активном процессе, например, включая, но не ограничиваясь активностью бета-клеток, генетически трансформированных клеток, тканей или подобных живых культур или клеток, способных к производству инсулина, по требованию. Триггером для производства и управления правильной дозировкой инсулина является уровень глюкозы, который может, например, распознаваться непосредственно самими бета-клетками. Способы стимуляции или терапии ткани или кожи могут также быть использованы для терапии или стимулирования области ткани, в которой инсулин введен клетками производства инсулина.
В некоторых вариантах выполнения клетки производства инсулина могут быть закрыты или инкапсулированы, чтобы препятствовать нападению иммунной системой на имплантированные клетки. В некоторых вариантах выполнения клетки производства инсулина могут быть расположены в имплантированном экране или кожухе с дополнительными компонентами. В некоторых вариантах выполнения, как в случае имплантированных бета-клеток или других клеток производства лекарственных средств, элемент терапии ткани может быть использован для управления состояниями ткани, которые могут улучшить производство имплантированных клеток. Например, путем улучшения локальной перфузии клетка увеличивает усвояемость кислорода, глюкозы и других необходимых структурных элементов. Путем улучшения локальной перфузии также и бета-клетки или другие элементы распознавания глюкозы могут реагировать без нежелательных задержек на быстрые изменения уровня глюкозы, так как задержка транспорта глюкозы для кровеносной системы в резервуар ISF (межклеточной жидкости) и на датчик уменьшается, когда локальная перфузия крови увеличивается.
Элемент терапии ткани в соответствии с некоторыми вариантами выполнения используется для стимулирования ткани на участке доставки для улучшения усвояемости инсулина в теле. В некоторых вариантах выполнения контроллер терапии ткани и элемент терапии ткани работают вместе, чтобы уменьшить задержки в абсорбции лекарственных средств и изменчивости через управление посредством обратной связи, которая может вовлекать датчик, используемый в системе доставки лекарственных средств, выполненной в соответствии с настоящим изобретением. Элемент терапии ткани может использовать различные способы и устройства, как описано в настоящем изобретении, чтобы стимулировать или ингибировать ткань, что может привести к увеличенной перфузии крови, которая улучшает абсорбцию инсулина, или может также уменьшать абсорбцию инсулина, когда это необходимо.
Некоторые варианты выполнения настоящего изобретения предусматривают имплантируемое устройство доставки лекарственных средств для автоматического и непосредственного введения лекарственного средства в предназначенный для лечения участок. Имплантированное устройство доставки лекарственных средств содержит элемент терапии ткани, а также контроллер, элемент доставки и внутренний резервуар производства лекарственных средств. Имплантированное устройство может также включать датчик для уровня лекарственных средств. Имплантированное устройство дополнительно содержит внешнее, неимплантированное, устройство пользовательского интерфейса, которое предоставляет пользователю интерфейс, управляющий имплантированным устройством доставки. Пользовательский интерфейс содержит функции, связанные с формой дозировки, выбором времени дозировки и триггером дозировки, при этом гораздо больше функций предусмотрено в отношении базы данных. Пользовательский интерфейс может, например, быть выполнен в форме КПК, персонального компьютера, мобильного телефона или подобного им устройства.
Контроллер в соответствии с некоторыми вариантами выполнения может начать производство глюкозы и выбор дозировки, основываясь на измеренных уровнях глюкозы. Пользовательский интерфейс может позволить пользователю определять выбор времени производства глюкозы, дозировки и время доставки. Контроллер и датчик работают совместно, чтобы измерять и управлять уровнем доставки лекарственных средств, включая, но не ограничиваясь, например, инсулином. Такие совместные функциональные возможности сводят любую ошибку до минимума. Используемый датчик содержит непрерывный монитор глюкозы, который обеспечивает непрерывное чтение уровня глюкозы в крови. Контроллер может управлять выходом элемента терапии ткани, основываясь на измеренных данных, создавая, таким образом, петлю обратной связи, которая может стабилизировать абсорбцию инсулина в кровеносную систему.
В некоторых вариантах выполнения лекарственное средство доставляется предназначенному для лечения участку, используя элемент доставки, включая, но не ограничиваясь, например, одним или большим количеством катетеров, проницаемой мембраной, выборочно проницаемой мембраной, большим количеством катетеров, трансплантированной тканью, кровеносным сосудом, или подобным им. Датчик или элемент терапии ткани могут быть включены в элемент доставки.
В некоторых вариантах выполнения, включая также варианты выполнения настоящего изобретения имплантированных устройств доставки лекарственных средств, элемент терапии ткани используется для улучшения, изменения и/или стабилизация фармакокинетического и/или фармакодинамического профиля лекарственных средств, доставляемых к предназначенному для лечения участку с использованием элемента доставки, включая, но не ограничиваясь, например, катетером, для лекарственного средства, которое должно абсорбироваться в кровеносную или лимфатическую систему. Устройства, описанные в некоторых из вариантов выполнения настоящего изобретения, применяют дополнительную терапию или стимуляцию к месту вблизи участка доставки лекарственных средств. Элемент терапии ткани может быть имплантирован или размещен снаружи, чтобы стимулировать требуемую область.
В некоторых из вариантов выполнения настоящего изобретения, включая также варианты выполнения с имплантированными устройствами доставки лекарственных средств, доставка лекарственных средств может осуществляться с использованием по меньшей мере одного или большего количества катетеров, или проницаемой мембраны, или выборочно проницаемой мембраны, или подобным им средствам. По меньшей мере один или большее количество катетеров могут далее вмещать датчик, элемент терапии ткани или другой компонент устройства доставки лекарственных средств, выполненного в соответствии с настоящим изобретением.
В некоторых из вариантов выполнения настоящего изобретения, включая также варианты выполнения с имплантированными устройствами доставки лекарственных средств, может быть добавлен датчик, предназначенный для управления доставкой лекарственных средств. В любом из этих вариантов выполнения датчик может быть любым датчиком уровня техники, способным контролировать и измерять измеряемую величину, включая, но не ограничиваясь, например, глюкозой, холестерином, гормоном, белком, мочой, углеводом или им подобным. Датчик используется совместно с контроллером для осуществления регулировки протокола доставки лекарственных средств в качестве отклика на измеренные уровни измеряемой величины. Вариант выполнения настоящего изобретения использует непрерывный мониторинг уровня глюкозы, чтобы управлять уровнями инсулина в ткани. Некоторые варианты выполнения настоящего изобретения получены путем автоматического управления скоростью инфузии инсулина, используя непрерывный датчик глюкозы и управляющий алгоритм, эффективно создавая "искусственную поджелудочную железу". Это обеспечивает замкнутый цикл управления уровнями глюкозы и инсулина, которые тщательно отслеживаются и управляются, чтобы регулировать уровень глюкозы и снизить гипергликемический или гипогликемический приступы.
В любом из вариантов выполнения настоящего изобретения любой имплантированный компонент может быть выполнен из биологически совместимых компонентов. Материал, включая различные компоненты устройства доставки лекарственных средств, инертен и не реагирует с участком имплантации.
В некоторых из вариантов выполнения настоящего изобретения имплантированная часть устройства имплантирована подкожно. Имплантация может быть выполнена в минимально агрессивной хирургической процедуре, такой как артроскопическая операция с местной анестезией. Имплантация может быть выполнена путем подкожной инъекции устройства доставки лекарственных средств.
В некоторых из вариантов выполнения настоящего изобретения пользовательский интерфейс позволяет пользователю оперировать и обмениваться данными с имплантированным устройством. Пользовательский интерфейс может быть соединен с внешним датчиком. Пользовательский интерфейс может иметь интегрированный датчик, включая, но не ограничиваясь, например, прибором для контроля уровня содержания глюкозы, прибором для контроля уровня содержания холестерина или подобным им прибором.
Обмен данными между пользовательским интерфейсом и имплантированным устройством может быть осуществлен посредством одного или большего количества различных протоколов передачи данных, включая, но не ограничиваясь беспроводным, телеграфным, мобильным, оптическим, ИК (инфракрасным), РЧ (радиочастотным), звуковым или тому подобным. Пользовательский интерфейс может иметь форму персонального компьютера, КПК, сотового телефона или коммуникатора, мобильного телефона или коммуникатора или тому подобного. Интерфейс предоставляет пользователю один или большее количество вариантов управления имплантированным устройством доставки лекарственных средств в отношении элемента терапии ткани, формы дозировки, выбора времени дозировки и триггера дозировки или тому подобного, путем предоставления доступа к базе данных, разрешая пользователю управлять параметрами доставки лекарственных средств.
Некоторые варианта выполнения настоящего изобретения предусматривают устройство доставки лекарственных средств, которое в состоянии лучше управлять циклом абсорбции лекарственных средств, сводя к минимуму чрезвычайные ситуации. Это осуществляют в соответствии с некоторыми вариантами выполнения путем лучшего контроля доставки лекарственных средств и/или путем улучшения абсорбции лекарственных средств тканью. Конкретно, некоторые варианты выполнения обеспечивают выполнение описанного выше путем применения управляемой терапии к месту вблизи участка инфузии лекарственных средств.
Введение элемента терапии ткани в устройство доставки лекарственных средств было описано в различных заявках изобретателями настоящей заявки. Однако способ, в соответствии с которым выполняют терапию ткани, может значительно меняться. Кроме того, тип используемой терапии ткани может включать по меньшей мере один или большее количество ноцицептивных аксональных рефлексов, тепло, холод, неустойчивые изменения температуры, ультразвук, оптику, массирование, физическую стимуляцию, вибрацию, всасывание, ИК, волны микронного диапазона, РЧ, оптику, инфузию одного или большего количества дополнительных веществ или тому подобное. Эти терапии могут быть применены к внешней поверхности кожи, во внутренней ткани или подкожной ткани, чтобы вызвать нужный эффект.
Протокол терапии ткани может быть осуществлен на предназначенном для лечения участке или поблизости. Один протокол терапии ткани может осуществлять нагрев до температуры приблизительно 39,5 градусов С, который прикладывается короткими импульсами длительностью 2-60 секунд каждые несколько минут, вызывая вазодилатацию, что улучшает фармакокинетику и/или фармакодинамику лекарственного средства в области ткани, куда было введено лекарственное средство. Однако конкретные параметры протокола терапии, связанные с типом ткани, пороговыми уровнями, временами импульса, временем между соседними импульсами, уровнями тепла, мощностью нагрева, временем, необходимым для возрастания и спада температуры, и т.д, являются переменными и управляемыми. Некоторые варианты выполнения, как системы, так и способы настоящего изобретения, предусматривают систему и/или способ, которые настроены в соответствии с требованиями заказчика и имеют конкретный пользовательский протокол терапии.
Тепло (и процесс нагрева) может быть применен к месту вблизи области ткани, куда было введено лекарственное средство. В некоторых случаях, когда дело касается инфузии некоторых типов инсулина и/или других белков в ткань, нагрев до температуры выше некоторого предельного уровня, как, например, 37 градусов С, осуществляется только вблизи области ткани, куда было введено лекарственное средство, а не непосредственно в область ткани, куда было введено лекарственное средство. Это ограничение области и/или объема нагрева обеспечивает предотвращение нагрева лекарственных средств выше предельной температуры, которая может вызвать денатурацию или модификацию самого лекарственного средства. Нагрев места вблизи области ткани, куда было введено лекарственное средство, приводит к вазодилатационному ответу также и в области ткани, куда было введено лекарственное средство, как был показано В.Мэджерлом и др., Журнал Физиологии, 497/3, стр.837-848 (1996), где описано, что нагревание кожи может вызвать вазодилатацию в человеке на расстоянии даже 30 мм из-за активации ноцицептивных аксональных рефлексов. Тепло может быть приложено в соответствии с многими способами и устройствами, описанным здесь и/или в заявках, включенных в этот документ посредством ссылки, включая, но не ограничиваясь одним или несколькими из непосредственного нагрева тепловой энергией, которая может быть произведена электрически, используя, например, резистор, или химически, используя, например, экзотермическую реакцию, и/или путем применения других форм энергии, включая, но не ограничиваясь ультразвуком, оптическим излучением, электромагнитным излучением, волнами в микрометровом диапазоне, РЧ (радиочастотной) энергией и т.д.
Нейрональный ответ человека на стимуляцию теплом включает несколько механизмов, такие как ноцицептивный аксональный рефлекс, который вызывает вазодилатацию, среди прочих эффектов. Тепловой нейрональный ответ может широко варьироваться среди людей. Поэтому в некоторых вариантах выполнения системы и способе согласно настоящему изобретению применяют специализированную откалиброванную индивидуализированную терапию ткани, которая может быть отрегулирована в одном или большем количестве аспектов конкретному человеку, чтобы обеспечить его оптимальной доставкой лекарственных средств через применение оптимизированной терапии ткани.
Протокол стимуляции теплом нервной системы может быть откалиброван для конкретного пациента, чтобы оптимизировать протокол стимуляции согласно его собственному порогу ноцицептивного аксонального рефлекса. Например, в статье В.Марджерл и др. раскрыто, что вазодилатация, вызывающая температуру после 64 секунд нагревания, может находиться в диапазоне между 37 и 43 градусами С для различных пациентов, поэтому индивидуализированное управление нагреванием ткани может улучшить эффективность, точность и/или воспроизводимость системы доставки лекарственных средств с необходимым управлением элемента терапии ткани. Калибровка может быть выполнена в отношении конкретного участка, предназначенного для лечения ткани. В этой статье также было показано, что в некоторых случаях короткие периоды нагревания могут также вызывать вазодилатацию сроком на несколько минут. Поэтому возможно управлять фармакокинетическими и/или фармакодинамическими свойствами лекарственных средств, доставляемых в область ткани, путем применения тепла, вызывающего вазодилатацию, что, в конечном счете, приводит к улучшенной усвояемости лекарственных средств. Однако тепло может также быть создать проблемы, заключающиеся в том, что оно может повлиять или даже ухудшить функцию самого лекарственного средства. Таким образом, нагревание в течение коротких интервалов времени с паузой в одну или несколько минут между этими интервалами может не так сильно нагреть ткань и предотвратить нагревание самого введенного лекарственного средства, в случаях если нагрев лекарственного средства является нежелательным эффектом или же может уменьшить потребление энергии системой.
Способ выполнения калибровки терапевтического устройства заключается в том, что вначале постепенно осуществляют стимуляцию ткани, когда терапевтическое устройство используют в первый раз, при этом измеряют эффект терапии на ткань, такой как вазодилатация, используя конкретный датчик, включая (но не ограничиваясь), например, датчиком лазерной доплер-флоуметрии (ЛДФ), который связан с узлом процессора, который управляет терапевтическим устройством. Узел контроллера определяет, какой уровень терапии ткани использовать, чтобы оптимизировать эффект от терапии, не вызывая отрицательных эффектов. Например, в случае когда используемая терапия ткани применяет нагрев, который имеет желательный эффект увеличения вазодилатации, элемент терапии ткани может постепенно нагревать ткань до заранее заданного безопасного предела и измерять локальную вазодилатацию ткани. Уровень перфузии крови и вазодилатации может быть измерен датчиком лазерной доплер-флоуметрии (ЛДФ) или другими датчиками, используемыми или известными в области техники. Другим выбором для измерения перфузии крови является оптический датчик, используемый для измерения абсорбции ткани и/или рассеяния от ткани, например, в диапазоне длины волны от приблизительно 700 нм до приблизительно 1000 нм, которая соответствует концентрации гемоглобина в исследуемой области ткани. Терапевтический узел может использовать информацию от датчика, чтобы определить пороговую температуру, которая вызывает нейрональный ответ, который вызывает требуемый уровень вазодилатации.
Процесс калибровки может быть осуществлен человеком, чтобы определить пределы вазодилатации нейронального ответа, а также уровня дискомфорта, который человек в состоянии вынести. Процесс также определяет температурный порог, который является безопасным. Например, различные параметры могут включать (но не быть ограничены) выбором времени импульса, выбором времени и продолжительности между импульсами, уровнями тепла, температуры или типом тока. Эти параметры могут быть изменены, чтобы персонализировать протокол терапии в соответствии с пользователем.
Другой способ выполнения калибровки терапевтического устройства может также вначале постепенно осуществлять стимуляцию ткани. Например, когда терапевтическое устройство в первый раз используется на человеке, постепенно применяют стимуляцию ткани, а затем измеряют эффект терапии на ткань, посредством, например, вазодилатации, используя конкретный датчик, как описано выше, пока не будет достигнут необходимый уровень индуцированной вазодилатации или пока не будет достигнута максимальная безопасная температура. Узел обработки данных использует эту информацию в качестве исходных данных для индивидуально отрегулированного уровня терапии, чтобы определить будущие уровни терапии ткани для этого конкретного пациента.
В некоторых вариантах выполнения контроллер может иметь доступ к различным протоколам терапии и статистическим данным (которые могут быть локально сохранены в памяти, связанной с контроллером), которые относятся к различным ситуациям, измеренным по меньшей мере одним или большим количеством датчиков. Контроллер может также использовать обучающие алгоритмы, включая (но не ограничиваясь), например, методами искусственного интеллекта, чтобы регулировать или адаптировать протоколы терапии, чтобы те были более конкретными или подходящими под конкретные нужды доставки лекарственных средств пользователю.
В некоторых вариантах выполнения автоматизированный процесс калибровки может повторяться периодически, например каждые 6-12 часов, чтобы компенсировать изменения, которые могли бы повлиять на температурный порог нейронального теплового ответа, такого как ответ, связанный с аксональным рефлексом человека. Любой из параметров, включая, но не ограничиваясь одним или несколькими из: выбора времени импульса, выбора времени и продолжительности между импульсами, уровней тепла, температуры, или типа тока (например) может быть соответствующим образом отрегулирован.
В некоторых вариантах выполнения процесс калибровки повторяют всякий раз (или незадолго до этого), когда активируют доставку лекарственных средств или элемент терапии ткани. Например, процесс калибровки может быть повторен во время болюсной инфузии инсулина, чтобы гарантировать соответствующий индуцированный ответ вазодилатации.
В некоторых вариантах выполнения ситуативно вызванная калибровка может быть использована для предотвращения или уменьшения вероятности возникновения постепенно появляющихся изменений в нейрональном ответе, таком как аксональный рефлекс, а из-за изменений факторов, которые влияют на нейрональный ответ, включая, но не ограничиваясь, например, уровнями оксида азота и/или норадреналина в предназначенном для лечения участке ткани.
В некоторых вариантах выполнения, когда терапия ткани, такая как нагревание, применена к подвергаемой терапии области, параметр терапии, например температура, может быть плавно отрегулирована контроллером устройства, измеряя при этом требуемые параметры ткани, такие как вазодилатация, с использованием, например, лазерной доплер-флоуметрии (ЛДФ), чтобы создать петлю калибровки обратной связи. Как только вазодилатация достигает намеченной величины, количество или скорость терапии ткани стабилизируют, чтобы поддерживать этот уровень дилатации в течение периода времени.
В некоторых вариантах выполнения процесс калибровки повторяют также во время терапии или стимуляции ткани. В этом случае терапию, такую как нагревание, после активации, как описано ранее, регулируют, чтобы поддерживать требуемый параметр(ы) ткани, такой как уровень вазодилатации, стабилизированным на предназначенном для лечения уровне, в особенности во время всей терапии. Стабилизация требуемого параметра ткани, такого как уровень вазодилатации, стабилизирует также абсорбцию лекарственных средств в кровь и улучшает взаимосогласованность и повторяемость фармакокинетики и фармакодинамики. Управляя уровнем терапии ткани в соответствии с требуемым параметром(и) ткани, таким как, например, уровень вазодилатации, можно также уменьшить потребление энергии терапевтическим устройством в соответствии с некоторыми вариантами выполнения.
Например, в случае нагревания, поскольку короткий период нагревания до определенной температуре выше пороговой температуры инициирует ответ, связанный с аксональным рефлексом, и вазодилатацию, то, возможно, нет необходимости поддерживать температуру высокой в течение длительного промежутка времени из-за эффекта задержки аксонального рефлекса. Снижение температуры также уменьшает потребление энергии.
В некоторых вариантах выполнения процессы калибровки повторяют также во время терапии. В этом случае запускают терапию, такую как введение лекарства. Затем выполняют калибровку стимулирующего эффекта в отношении эффекта введения лекарства так, чтобы уровень лекарственного средства (например) мог быть использован и использовался для калибровки необходимой величины стимуляции.
В некоторых вариантах выполнения нейрональный ответ, который вызывает вазодилатацию, стимулируют, применяя механическую силу к месту вблизи области введения лекарственного средства, включая, но не ограничиваясь одним или несколькими из: давления, массирования, вибрации, всасывания и/или другим известным из области техники способом механической стимуляции. Эти терапии или стимуляции ткани, как известно, также стимулируют ноцицептивный аксональный рефлекс. Среди преимуществ механической стимуляции модно отметить, что механическая стимуляция не повреждает лекарственное средство, тогда как, например, нагрев выше 37 градусов С может повредить инсулин. Калибровка приложенной механической силы может быть выполнена путем использования одной из процедур, описанных выше.
В некоторых вариантах выполнения нейрональный ответ, который вызывает вазодилатацию, может дополнительно стимулироваться инфузией одного или большего количества дополнительных веществ, которые могут включать любое известное периферийное сосудорасширяющее средство, такое как толазин, нафтидрофурил или сулоктидил, в место вблизи области введения лекарственных средств. В некоторых вариантах выполнения дополнительное вещество вводят в место вблизи области измеряемой ткани, модифицируют фармакокинетику лекарственного средства и/или локальную перфузию крови с созданием или без создания химической или другой реакции между лекарственным средством и указанным одним или большим количеством веществ. Этот эффект может быть совокупным или синергическим в отношении вышеупомянутых описанных форм стимуляции. Например, нитропруссид, который вызывает вазодилатацию, может улучшить перфузию крови в области ткани, в которую введено лекарственное средство. Другим примером является капсаицин, который стимулирует нейрональный ответ через рецептор VRI и создает аналогичный ответ на тепловую стимуляцию. Калибровка уровня примененного дополнительного или большего количества веществ может быть выполнена с использованием одной из процедур, описанных выше. В некоторых вариантах выполнения нейрональный ответ, который вызывает вазодилатацию, может дополнительно стимулироваться путем приложения электрического тока (который, как известно, увеличивает кровоток в ткани) к месту вблизи области введения лекарственных средств. Калибровка уровня приложенного электрического тока может быть выполнена с использованием одной из процедур, описанных выше.
В некоторых вариантах выполнения нейрональный ответ, который вызывает вазодилатацию, может стимулироваться через комбинацию вышеупомянутых предложенных типов стимуляции. Например, комбинируя низкотемпературный нагрев (например, ниже 37 градусов С и механическую стимуляцию, может быть достигнут лучший нейрональный ответ без повреждения молекулы лекарственного средства из-за чрезмерно высокой температуры. Другой неограничивающий пример включает объединение низкотемпературного нагрева (например, ниже 37 градусов С) и инфузию дополнительного вещества для получения нейронального ответа без повреждения молекулы лекарственного средства из-за чрезмерной высокой температуры. Другой неограничивающий пример включает объединение применения низкой величины тепловой стимуляции (например, ниже 37 градусов С) и приложения электрического тока, чтобы увеличить перфузию крови в ткани более эффективно, без повреждения молекулы лекарственного средства из-за чрезмерной высокой температуры.
В некоторых вариантах выполнения вызванный нейрональный ответ, такой как ноцицептивный аксональный рефлекс, может также вызвать расширение капиллярных пор и увеличение проницаемости капиллярной стенки. Этот эффект является также существенным для увеличения абсорбции указанного лекарственного средства через капиллярную стенку.
В любом из вариантов выполнения настоящего изобретения элемент терапии ткани может использоваться, чтобы осуществлять терапию области ткани, в которую введен инсулин во время основной или болюсной доставки инсулина. Один возможный эффект терапии ткани улучшает эффективность абсорбции инсулина в кровь и/или лимфатические системы, уменьшая, тем самым, количество инсулина, необходимое для создания требуемого метаболического эффекта. Без ограничения одним предположением, могут быть снижены нежелательные отрицательные эффекты избыточного количества инсулина, такие как набор лишнего веса.
Другой эффект терапии ткани в соответствии с некоторыми вариантами выполнения улучшает и уменьшает количество и время, которое инсулин остается в области инфузии ткани, так как он быстрее абсорбируется в кровь и/или лимфатические системы. Не ограничиваясь одним предположением, могут быть уменьшены нежелательные локальные отрицательные эффекты избыточного количества инсулина, такие как липогипертрофия или локальное раздражение. Кроме того, другая возможная выгода от использования элемента терапии ткани, выполненного в соответствии с настоящим изобретением, состоит в индуцированном увеличении локальной перфузии крови, что уменьшает локальные эффекты воспаления, видимые в текущих наборах для инфузии. Другая возможная выгода от терапии предназначенной для лечения области ткани состоит в снижении краткосрочных и долгосрочных локальных эффектов от инсулина на участке инфузии инсулина, поэтому элемент терапии ткани может (и будет) увеличивать продолжительность использования того же самого участка доставки и может повысить срок службы набора для инфузии.
В некоторых вариантах выполнения настоящего изобретения протокол стимуляции может быть задан контроллером в зависимости от используемого режима доставки лекарственного средства. Например, способы стимуляции ткани могут быть активированы для протокола доставки лекарственных средств избирательных или заранее запрограммированных болюсов в течение коротких промежутков времени, чтобы обеспечить резкое увеличение в абсорбции инсулина. В некоторых вариантах выполнения способы терапии ткани и/или кожи могут формировать часть всех или некоторых из элементов комплекса запрограммированных болюсов, включая, но не ограничиваясь, схемами болюсного введения по типу "двойной волны", "квадратной волны" и другими типами болюсного введения. Стимуляция может быть активирована для начальной фазы стандартного протокола болюса, конкретно для запрограммированных компонентов болюсного введения по типу "двойной волны" или с представляющими интерес интервалами болюсного введения по типу "квадратной волны". Стимуляция может также быть активирована в соответствии с заранее заданным рабочим циклом, независимым от типа болюса. Кроме того, периодическая активация может быть синхронизирована с индивидуальной болюсной доставкой компонентов при введении базального уровня инсулина.
Если иначе не определено, все используемые здесь технические и научные термины имеют то же самое значение, которое традиционно известно специалистам в этой области техники, к которой принадлежит это изобретение. Приведенные здесь материалы, способы и примеры являются исключительно иллюстративными и не предназначены быть ограничивающими.
Хотя все предшествующее было описано в отношении доставки лекарственных средств в виде инсулина для лечения диабета, этот пример не является ограничивающим настоящее изобретение. С помощью устройства доставки лекарственных средств, выполненного в соответствии с настоящим изобретением, можно лечить любое хроническое или острое заболевание, включая, но не ограничиваясь, например, гипоксией, анемией, заболеваниями, связанными с холестерином, инсультом, заболеваниями сердца или тому подобным.
Применение способа и системы, выполненных в соответствии с настоящим изобретением, включает выполнение или завершение определенных выбранных заданий или этапов вручную, автоматически или в их комбинации. Кроме того, согласно фактическому оборудованию и приборам предпочтительных вариантов выполнения способа и системы настоящего изобретения несколько выбранных этапов могут быть осуществлены аппаратными средствами или программным обеспечением на любой операционной системе любого программируемого оборудования или их комбинации. Например, рассматривая аппаратные средства, выбранные этапы изобретения могут быть осуществлены в виде чипа или электронной платы. Рассматривая программное обеспечение, выбранные этапы изобретения могут быть осуществлены как большее количество инструкций программного обеспечения, выполняемых компьютером с любой подходящей операционной системой. В любом случае выбранные этапы способа и системы изобретения могут быть описаны, как выполняемые процессором, таким как вычислительная платформа для выполнения большого количества инструкций.
Хотя настоящее изобретение описано относительно "узла обработки данных", или "компьютера", или "компьютерной сети", нужно отметить, что любое устройство, имеющее процессор и/или способность выполнять одну или большее количество инструкций, может быть описано как компьютер, включая, но не ограничиваясь ПК (персональным компьютером), сервером, миникомпьютером, мобильным телефоном, смартфоном, КПК (помощник анкетных данных), пейджером. Любые два или большее количество таких устройств, находящихся в состоянии обмена данными друг с другом, и/или любой компьютер, находящийся в состоянии обмена данными с любым другим компьютером, могут содержать "компьютерную сеть".
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 изображает иллюстративный катетер для доставки лекарственных средств, объединенный с нагревательным элементом, прикрепленным к коже вокруг катетера, в соответствии с некоторыми вариантами выполнения настоящего изобретения.
Фиг.2 изображает иллюстративный катетер для доставки лекарственных средств, объединенный с нагревательным элементом, включенным в трубу катетера, в соответствии с некоторыми вариантами выполнения настоящего изобретения.
Фиг.3 изображает иллюстративный катетер для доставки лекарственных средств, объединенный с электрическими проводами, включенными в трубу катетера, в соответствии с некоторыми вариантами выполнения настоящего изобретения.
Фиг.4 изображает иллюстративный катетер для доставки лекарственных средств, объединенный с электрическими проводами, прикрепленными к трубе катетера, в соответствии с некоторыми вариантами выполнения настоящего изобретения.
Фиг.5 изображает иллюстративный соединитель между катетером для доставки лекарственных средств и насосом доставки лекарственных средств, причем соединитель соединяет трубу для доставки лекарственных средств, а также электрические провода, в соответствии с некоторыми вариантами выполнения настоящего изобретения.
Фиг.6 изображает иллюстративное устройство для терапии области ткани, объединенное с инфузионным катетером, выполненным из одноразовой части и части многократного использования, в соответствии с некоторыми вариантами выполнения настоящего изобретения.
Фиг.7 изображает иллюстративное устройство для терапии области ткани, объединенное с инфузионным катетером, выполненным из одноразовой части и части многократного использования, в соответствии с некоторыми вариантами выполнения настоящего изобретения.
Фиг.8 изображает иллюстративное устройство для терапии области ткани, объединенное с инфузионным катетером, выполненным из одноразовой части и части многократного использования, в соответствии с некоторыми вариантами выполнения настоящего изобретения.
Фиг.9 изображает иллюстративное устройство для терапии области ткани, объединенное с инфузионным катетером, выполненным из одноразовой части и части многократного использования, в соответствии с некоторыми вариантами выполнения настоящего изобретения.
Фиг.10 изображает иллюстративное устройство для терапии области ткани, объединенное с инфузионным катетером и насосом доставки лекарственных средств, в соответствии с некоторыми вариантами выполнения настоящего изобретения.
Фиг.11 изображает иллюстративный катетер для доставки лекарственных средств, объединенный с механическим вибрирующим элементом, прикрепленным к коже вокруг катетера, в соответствии с некоторыми вариантами выполнения настоящего изобретения.
Фиг.12 изображает иллюстративный катетер для доставки лекарственных средств, объединенный с механическим вибрирующим элементом, прикрепленным к коже вокруг катетера, в соответствии с некоторыми вариантами выполнения настоящего изобретения.
Фиг.13 изображает иллюстративный катетер для доставки лекарственных средств, объединенный с массирующим элементом, который массирует кожу вокруг катетера, используя воздушную подушку, управляемую насосом доставки лекарственных средств, в соответствии с некоторыми вариантами выполнения настоящего изобретения.
Фиг.14 изображает иллюстративный катетер для доставки лекарственных средств, объединенный с элементом всасывания, который влияет на кожу вокруг катетера, в соответствии с некоторыми вариантами выполнения настоящего изобретения.
Фиг.15 изображает иллюстративный катетер для доставки лекарственных средств с дополнительным накачивающим элементом, который перемещает инфузионная текучая среда в катетер и из него, в соответствии с некоторыми вариантами выполнения настоящего изобретения.
Фиг.16 изображает иллюстративный катетер для доставки лекарственных средств с дополнительным накачивающим элементом, который перемещает инфузионная текучая среда в катетер и из него, в соответствии с некоторыми вариантами выполнения настоящего изобретения.
Фиг.17 изображает иллюстративный катетер для доставки лекарственных средств с акустическим возбуждением кожи близко к катетеру, в соответствии с некоторыми вариантами выполнения настоящего изобретения.
Фиг.18 изображает иллюстративный катетер для доставки лекарственных средств, объединенный с оптическим источником излучения, освещающим кожу близко к катетеру, в соответствии с некоторыми вариантами выполнения настоящего изобретения.
Фиг.19 изображает иллюстративный катетер для доставки лекарственных средств, объединенный с оптическим источником излучения, освещающим кожу близко к катетеру, в соответствии с некоторыми вариантами выполнения настоящего изобретения.
Фиг.20 изображает иллюстративный катетер с двойным люменом для доставки лекарственных средств, в соответствии с некоторыми вариантами выполнения настоящего изобретения.
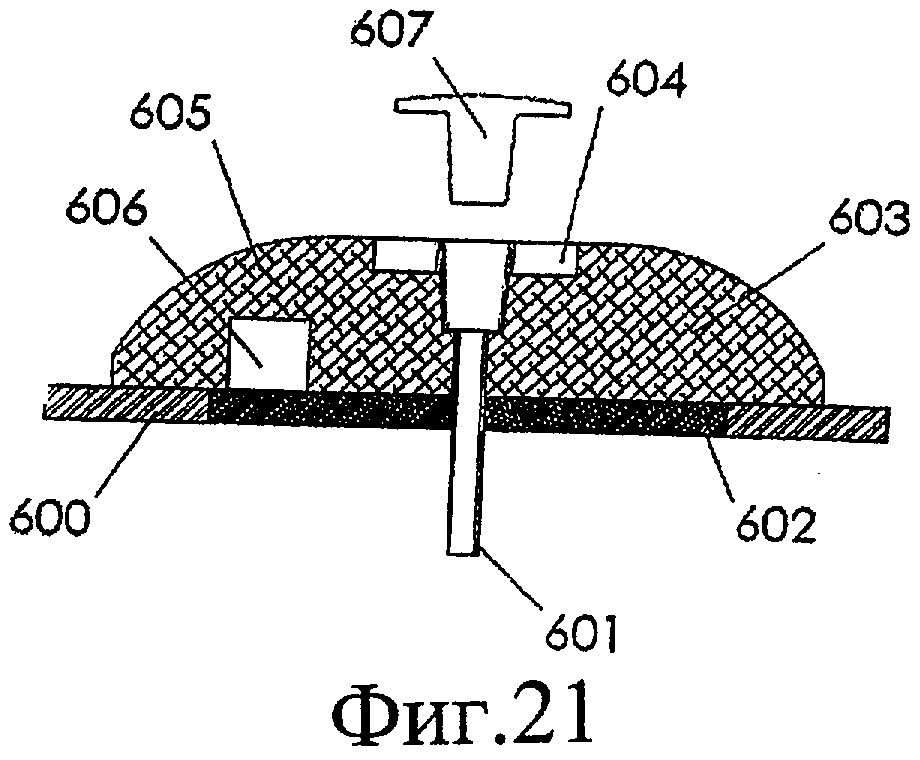
Фиг.21 изображает иллюстративный катетер для доставки лекарственных средств, объединенный с отверстием для вставки шприца, в соответствии с некоторыми вариантами выполнения настоящего изобретения.
Фиг.22 изображает иллюстративное устройство для возбуждения кожи и области ткани под ней, в которое вводится лекарственное средство, в соответствии с некоторыми вариантами выполнения настоящего изобретения.
Фиг.23 изображает иллюстративное устройство для улучшения фармакодинамики инсулина, в соответствии с некоторыми вариантами выполнения настоящего изобретения.
Фиг.24 изображает инфузионный катетер для доставки инсулина с U-образным нагревателем, в соответствии с некоторыми вариантами выполнения настоящего изобретения.
Фиг.25 изображает инфузионный катетер для доставки инсулина с круглым тонким нагревателем, в соответствии с некоторыми вариантами выполнения настоящего изобретения.
Фиг.26а изображает пример графика эффекта инсулина с терапией и без нее, в соответствии с некоторыми вариантами выполнения настоящего изобретения.
Фиг.26b изображает пример графика фармакокинетики инсулина с терапией и без нее, в соответствии с некоторыми вариантами выполнения настоящего изобретения.
Фиг.27 схематично описывает катетер для доставки лекарственных средств, объединенный с излучающим элементом, прикрепленным к коже вокруг катетера.
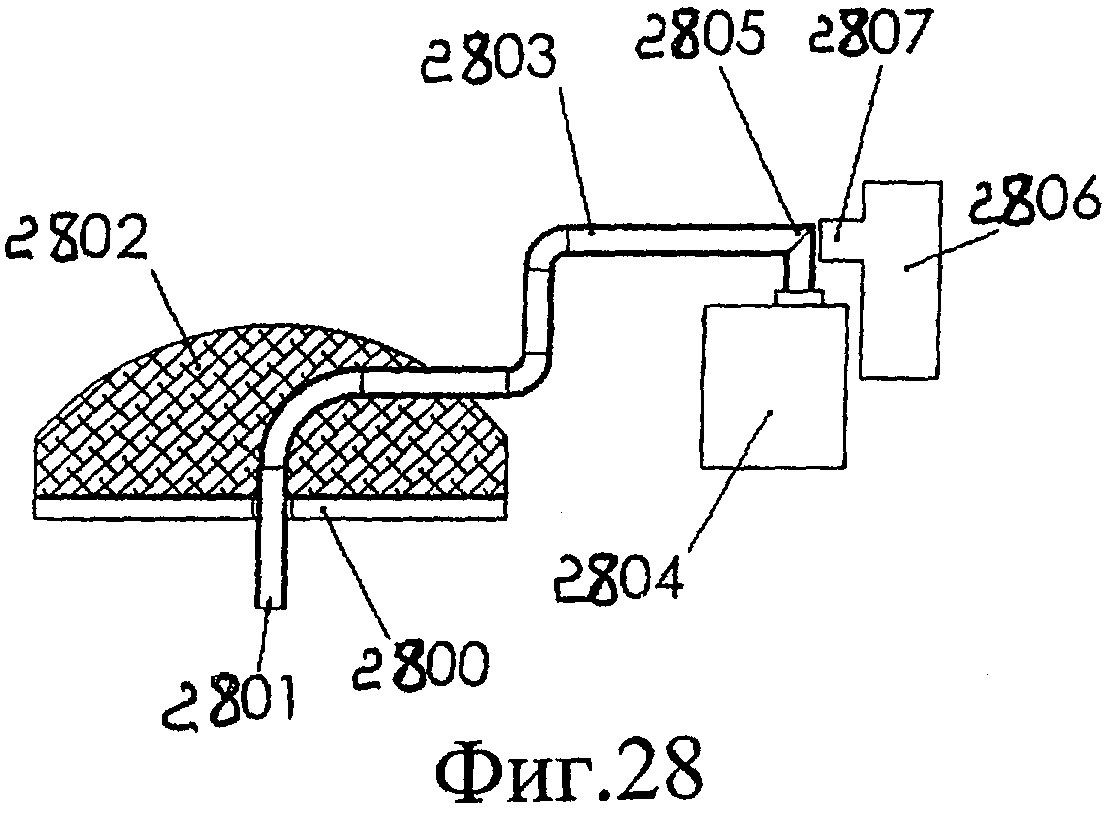
Фиг.28 схематично описывает катетер для доставки лекарственных средств, объединенный с источником излучения, который направляет свет через трубу катетера.
Фиг.29 схематично описывает устройство доставки лекарственных средств, объединенное с источником излучения, который направляет свет через трубу катетера.
Фиг.30 схематично описывает устройство доставки лекарственных средств, объединенное с источником излучения, который направляет свет через трубу катетера.
Фиг.31 схематично описывает устройство доставки лекарственных средств, объединенное с источником излучения, который направляет свет через трубу катетера.
Фиг.32 схематично описывает катетер для доставки лекарственных средств, объединенный с источником излучения, который направляет свет через трубу катетера.
Фиг.33 схематично описывает катетер для доставки лекарственных средств, объединенный с источником излучения, который направляет свет через трубу катетера.
Фиг.34 схематично описывает катетер для доставки лекарственных средств, объединенный с источником излучения, который направляет свет через трубу катетера.
Фиг.35 схематично описывает катетер для доставки лекарственных средств, объединенный с источником излучения, который направляет свет через трубу катетера.
Фиг.36 схематично описывает катетер для доставки лекарственных средств, объединенный с источником излучения, который направляет свет через трубу катетера.
Фиг.37 схематично описывает катетер для доставки лекарственных средств, объединенный с источником излучения, который направляет свет через трубу катетера и с оптическим датчиком.
Фиг.38 изображает иллюстративное имплантированное устройство доставки лекарственных средств, объединенное с нагревательным элементом, в соответствии с некоторыми вариантами выполнения настоящего изобретения.
Фиг.39 изображает иллюстративное имплантированное устройство доставки лекарственных средств, объединенное с нагревательным элементом, прикрепленным к коже выше области инфузии лекарственных средств, в соответствии с некоторыми вариантами выполнения настоящего изобретения.
Фиг.40А-D представляют собой схематические блок-схемы вариантов выполнения имплантированного устройства доставки лекарственных средств в соответствии с настоящим изобретением.
Фиг-41A-D представляют собой схематические диаграммы иллюстративного варианта выполнения имплантированного устройства доставки лекарственных средств, изображенного на Фиг.40А-D, в соответствии с настоящим изобретением.
Фиг.42 представляет собой блок-схему другого иллюстративного способа в соответствии с настоящим изобретением.
Фиг.43А представляет собой схематическую блок-схему иллюстративного варианта выполнения имплантированного устройства доставки лекарственных средств в соответствии с настоящим изобретением.
Фиг.43В представляет собой схематическую диаграмму иллюстративного варианта выполнения имплантированного устройства доставки лекарственных средств в соответствии с настоящим изобретением.
Фиг.44А-С представляют собой различные схематические диаграммы иллюстративных вариантов выполнения имплантированного устройства доставки лекарственных средств в соответствии с настоящим изобретением.
Фиг.45 представляет собой схематическую блок-схему устройства доставки лекарственных средств, используемого со способом терапии настоящего изобретения.
Фиг.46 представляет собой блок-схему процесса калибровки терапии в соответствии с настоящим изобретением.
Фиг.47 представляет собой блок-схему процесса калибровки терапии в соответствии с настоящим изобретением.
Фиг.48 изображает иллюстративное устройство доставки лекарственных средств, в котором первое устройство или первая часть представляет собой постоянный катетер инфузионного насоса, вставленного в ткань или кровеносный сосуд, в соответствии с некоторыми вариантами выполнения настоящего изобретения.
Фиг.49 изображает иллюстративное устройство доставки лекарственных средств, в котором прикрепление к коже содержит источник питания, источник возбуждения, клейкий элемент к коже и согласующий слой между источником возбуждения и кожей, в соответствии с некоторыми вариантами выполнения настоящего изобретения.
Фиг.50 представляет собой блок-схему, изображающую иллюстративный способ управления температурой нагревания, обеспечиваемой терапевтическим элементом, чтобы предотвратить деградацию температурочувствительного лекарственного средства.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Способ и система доставки лекарственных средств
Настоящее изобретение относится к устройствам для улучшения, модифицирования и/или стабилизации фармакокинетического и/или фармакодинамического профиля лекарственного средства, введенного в ткань катетером и абсорбированного в кровь или лимфатическую систему. Устройства, описанные в некоторых из вариантов выполнения настоящего изобретения, применяют дополнительную терапию или стимуляцию к области вблизи участка доставки лекарственных средств. Терапия может быть одной или комбинацией следующих способов терапии ткани: нагревание, температура модификации, массирование, механическая вибрация, акустическая вибрация, ультразвук, всасывание, инфузия дополнительного вещества или химического агента, приложение слабого электрического поля, приложение слабого магнитного поля, излучение света, инфракрасное излучение (ИК), микроволновое (MB) излучение, и т.д. В некоторых вариантах выполнения устройство содержит катетер для вставления внутрь ткани, чтобы ввести вещество в область инфузии ткани. Область инфузии ткани (т.е. область инфузии) может представлять собой один из слоев кожи или подкожной ткани или более глубокие элементы ткани в пределах любого органа или внутреннего органа.
Катетер может также содержать прикрепляющую механическая часть, которая прикрепляется к коже, фиксирует катетер в его местоположении и препятствует случайному вытаскиванию катетера. Проксимальный конец катетера может быть соединен с устройством доставки лекарственных средств, которое управляет профилем инфузии лекарственных средств. В некоторых вариантах выполнения устройство доставки лекарственных средств также управляет дополнительной терапией, примененной к области инфузии ткани. В этих вариантах выполнения имеется канал передачи данных между устройством доставки лекарственных средств и терапевтическим устройством. Передача данных может быть либо проводной либо беспроводной. Части терапевтического устройства могут быть расположены в устройстве доставки лекарственных средств или за его пределами. В некоторых вариантах выполнения устройство доставки лекарственных средств представляет собой насос доставки лекарственных средств, такой как инсулиновый насос.
В некоторых вариантах выполнения настоящее изобретение представляет собой устройство, управляемое насосом, которое вводит лекарственное средство в область ткани и которое применяет дополнительную терапию к области вблизи участка доставки лекарственных средств. В некоторых вариантах выполнения электронный узел обработки данных насоса работает, основываясь на заранее заданном протоколе или алгоритме, любых дополнительных входах и/или профиле инфузии лекарственных средств примененной терапии. В некоторых вариантах выполнения электронный узел обработки данных насоса обменивается данными с терапевтическим узлом терапевтического устройства, который работает, основываясь на заранее заданном протоколе или алгоритме и в соответствии с профилем инфузии лекарственных средств примененной терапии. В некоторых вариантах выполнения устройство регулярно запрашивает статус насоса, используя встроенную возможность насоса к передачи данных. Основываясь на полученных данных, устройство работает в соответствии с заранее заданным протоколом или алгоритмом примененной терапии.
В некоторых вариантах выполнения устройства как не управляются насосом, так и не выполняют никакого обмена данными с насосом доставки лекарственных средств. Вместо этого устройства обнаруживают профиль доставки лекарственных средств через катетер и применяют терапию в соответствии с заранее заданным протоколом или алгоритмом. В таких вариантах выполнения терапевтическое устройство содержит датчик, который может обнаруживать поток инфузии лекарственных средств в катетере и передавать информацию узлу обработки данных устройства, который работает, основываясь на заранее заданном протоколе или алгоритме и на профиле инфузии примененной терапии. Поток лекарственных средств может быть обнаружен любыми обычными датчиками, такими как оптический датчик, который обнаруживает поток лекарственных средств в прозрачном катетере, лазерном доплеровском датчике, ультразвуковом доплеровском датчике, датчике давления, датчике проводимости, датчике индуктивности, который может измерять изменения в скорости потока инфузионной текучей среды при индуцированном магнитном поле. В некоторых вариантах выполнения датчик потока лекарственных средств обнаруживает не только наличие потока инфузии лекарственных средств, но также и скорость инфузии и использует эту информацию в алгоритме терапии. В некоторых вариантах выполнения датчик инфузии лекарственных средств обнаруживает электромагнитную или акустическую эмиссию двигателя насоса доставки лекарственных средств или электроники. В некоторых вариантах выполнения устройство измеряет некоторые дополнительные параметры ткани и также использует эту информацию в алгоритме терапии.
В некоторых вариантах выполнения терапия ткани управляет температурой области ткани, в которую доставляется лекарственное средство. В некоторых вариантах выполнения температурный контроль может быть предназначен для установления профиля повышения температуры с известной скоростью, стабилизации температуры в течение известного промежутка времени и окончания профиля, возвращаясь к естественной температуре ткани. Этот профиль может быть вызван нагревателем, который нагревает область ткани с введенным лекарственным средством. Также возможны и другие температурные профили для терапии или возбуждения области ткани с введенным лекарственным средством. Например, профиль охлаждения для уменьшения перфузии крови или вызывания конкретного фармакокинетического и/или фармакодинамического профиля для лекарственных средств или нагрева в течение коротких промежутков времени, чтобы еще больше улучшить фармакокинетику или фармакодинамику лекарственного средства. В некоторых вариантах выполнения температурный профиль может быть применен к большей области, чем область ткани с введенным лекарственным средством. Такое выполнение может улучшить перфузию крови также около области ткани с введенным лекарственным средством путем дальнейшего увеличения скорости абсорбции лекарственных средств в кровоток, увеличивая доступный абсорбционный объем. В некоторых вариантах выполнения температурный профиль может быть применен к области, меньшей, чем область ткани с введенным лекарственным средством, чтобы увеличить срок службы аккумулятора.
Устройство для нагревания области ткани, в которую доставляется лекарственное средство в соответствии с некоторыми вариантами выполнения настоящего изобретения, проиллюстрировано на Фиг.1. В этом варианте выполнения инфузионный катетер объединен с нагревательным элементом, прикрепленным к коже вокруг катетера. Терапевтическое устройство представляет собой плоскую круглую конструкцию 7 с отверстием в ее центре для трубки 5 катетера, чтобы та могла быть вставлена в подкожную ткань. Другой конец катетера соединен с насосом доставки лекарственных средств. В проиллюстрированных вариантах выполнения терапевтическое устройство содержит нагревательный элемент 2, который может содержать печатную плату, имеющую расположенные на ней нагревательные элементы (например, резисторы) (как должно быть понятно специалистам, также могут быть использованы и другие типы нагревательных элементов). В некоторых вариантах выполнения печатная плата содержит температурный датчик 3. В некоторых вариантах выполнения может быть предусмотрен охлаждающий элемент, в случае когда требуется использовать более жесткие температурные профили.
Нагревательный элемент может содержать контроллер, который управляет нагревательным элементом (например, включая/выключая или увеличивая/уменьшая подачу мощности), чтобы стабилизировать температуру кожи до требуемой температуры в соответствии с алгоритмом. В некоторых вариантах выполнения температура может быть между 32 и 40 градусами С, чтобы, с одной стороны, не раздражать кожу и, с другой стороны, иметь достаточный эффект на ткань. Алгоритмы стабилизации температуры хорошо известны в области техники и могут быть выполнены относительно простыми узлами контроллеров/обработки данных или специализированными ИС. Повреждение кожи или ткани зависит от приложенной температуры и времени экспонирования тепла, так что в течение короткого промежутка времени в несколько минут могут использоваться даже более высокие температуры до 42 градусов С.
В некоторых случаях могут требоваться более низкие температуры нагрева. Например, инсулин Novolog (аспарт) может быть подвержен действию максимальной предельной температуры в 37 градусов С (документ FDA NDA №20-986/S-024, " Инъекция инсулина NovoLog aspart (rDNA)", 26.07.2004). В таком варианте выполнения температура кожи может быть немного выше, до тех пор пока непосредственная близость участка инфузии инсулина ниже 37 градусов С. Для этого случая имеется преимущество в конфигурации нагрева в соответствии с настоящим изобретением, как показано на Фиг.1, так как устройство нагревает ткань а не инсулин, таким образом, минимальные изменения в температуре влияют на сам введенный инсулин, тогда как максимальная стимуляция теплом применена к ткани, чтобы увеличить локальную перфузию крови. Также, как показано на Фиг.1, нагревательный элемент 2 не находится в контакте с катетером 5 инфузии инсулина. Поэтому настоящее изобретение предусматривает также тепловую изоляцию 7 между катетером 5 инсулина и нагревательным элементом 2, такую, что инсулин не перегревается и минимально подвержен действию высоких температур.
В некоторых вариантах выполнения в трубке 5 катетера расположен дополнительный или альтернативный температурный датчик 4. Этот температурный датчик обеспечивает лучший контроль температуры области ткани с введенным лекарственным средством. Конкретно, во-первых, достижение предельной температуры инсулина в ткани можно избежать даже при том, что более высокие температуры могут быть использованы на коже, чтобы добиться оптимальной стимуляции перфузии крови в этой области. Кроме того, путем осуществления регулирования температуры в области ткани с введенным лекарственным средством до фиксированной оптимальной температуры может быть достигнута лучшая стабилизация химических процессов, фармакокинетики, абсорбции в кровеносную систему и/или фармакодинамики лекарственных средств. Локальные изменения температуры в области с введенным лекарственным средством, вызванные изменениями окружающей температуры, а также и другие факторы вызывают изменения в скорости абсорбции лекарственных средств в кровь и вызывает большую изменчивость в фармакокинетике и фармакодинамике лекарственных средств. Как упомянуто ранее, в случае доставки инсулина важно уменьшить изменчивость временного профиля абсорбции инсулина в кровь, при этом более жесткий контроль локальной температуры может выгодно улучшить регулирование уровня глюкозы для пациентов-диабетиков.
В некоторых вариантах выполнения нагревательный элемент 2 и один или два из температурных датчиков 3 и 4 соединены с насосом доставки лекарственных средств посредством кабеля 6. В этом варианте выполнения насос доставки лекарственных средств может содержать источник питания и контроллер процесса терапии.
В некоторых вариантах выполнения элемент 7, покрывающий нагревательный элемент 2, является термоизолированным. Конкретно, элемент 7 уменьшает диссипацию тепла в окружающую среду в случае нагревания ткани. Как упомянуто ранее, элемент 7 может также теплоизолировать лекарственное средство в катетере 5 от экспонирования его увеличенной температурой нагревателя(ей). В случае охлаждения области ткани с введенным лекарственным средством элемент 7 уменьшает теплопередачу от окружающей среды к охлажденной области ткани. В случае изменяющейся окружающей среды и температуры окружающей среды это может также ослабить тепловую стабилизацию области инфузии ткани.
В некоторых вариантах выполнения нагревающее устройство, как показано на Фиг.1, прикреплено к ткани с клейким слоем (лентой) 1. Клейкий слой может также покрыть нагревательный элемент. В некоторых вариантах выполнения клейкий слой может быть теплопроводящим клейким слоем или тонким клейким слоем. Клейкий слой может быть покрыт многослойной структурой (не показана на Фиг.1), которая может быть очищена пользователем перед вставкой катетера и прикреплением нагревающего устройства. Как правило, для вставления катетера устройство снабжено стерильной иглой в катетере (не показана на чертеже), которую вытаскивают после вставки катетера к нужной области ткани.
В некоторых вариантах выполнения нагревающее устройство, показанное на Фиг.1, содержит клейкий теплопроводящий слой, находящийся в контакте с кожей, слой электрической изоляции с температурными датчиками, нагревающий слой, теплоизолирующий слой и клейкий слой для прикрепления нагревающего устройства 2 к дополнительной тепловой изоляции 7, если это необходимо. Все слои могут быть изготовлены с использованием технологии печати и способов массового производства.
Другое устройство для нагревания области ткани, в которую доставляется лекарственное средство, проиллюстрировано на Фиг.2. В этом варианте выполнения инфузионный катетер содержит нагревательный элемент 52 в дистальной части 50, которая расположена близко к области инфузии ткани. Нагревательный элемент может быть изготовлен из проводящего провода с достаточно высоким сопротивлением и хорошей прочностью и износостойкости. Например, с этой целью обычно используются вольфрамовые провода или напыление тонкой медной полосы. Нагревательный элемент 52 может быть включен в трубку катетера во время изготовления трубки, используя способы, известные в области техники. Например, это может быть выполнено путем обертывания проволочной катушки на тонкостенной трубке, а затем покрывая ее вторым полимерным слоем. Другая сторона нагревающей проволочной катушки 51 также направлена вверх в трубке. В некоторых вариантах выполнения нагревающий провод может иметь другие формы, такие как одна петля или зигзаг или что-либо еще, что может быть эффективно изготовлено, чтобы обеспечить необходимую высокую температуру для области инфузии ткани. Преимущество нагревания в ткани состоит в нагревании меньшего объема ткани вокруг области инфузии лекарственных средств и, следовательно, требует меньшей электрической мощности. Кроме того, нагреваемый объем, обычно в подкожной ткани, лучше изолирован от температуры кожи, которая может меняться в зависимости от окружающей температуры. Однако в этом случае температура катетера может быть ограничена температурой, которая не будет изменять свойства введенного лекарственного средства в случае лекарственных средств, которые более чувствительны к повышению температуры, чем инсулин. В конструкции наружного нагрева, показанной на Фиг.1, пространственное температурное распределение может быть таким, что температура кожи и области ткани вокруг нее, но не близко к наконечнику катетера находятся при более высокой температуре, не нанося вреда температурочувствительным лекарственных средствам. В конструкции наружного нагрева экспонирование лекарственного средства более высокими температурами может быть больше ограничено, хотя высокая температура все еще влияет на часть области ткани с введенным лекарственным средством или области ткани вокруг области ткани с введенным лекарственным средством.
В некоторых вариантах выполнения температурный датчик 53 также расположен в трубке катетера. Этот датчик контролирует температуру области инфузии ткани. Этот температурный датчик обеспечивает лучшее управление температурой области инфузии ткани. Посредством лучшей стабилизации химического распада лекарственных средств и процессов растворения или фармакокинетики или кинетики абсорбции в кровеносную систему может быть получен улучшенный и больше воспроизводимый фармакодинамический профиль. В этом устройстве контроллер может находиться либо в терапевтическом устройстве, либо в насосе доставки лекарственных средств и управляет током нагрева, чтобы стабилизировать температуру области инфузии ткани до требуемой температуры и продолжительности в соответствии с алгоритмом.
В некоторых вариантах выполнения элемент 56 устройства, который поддерживает прикрепление катетера к телу, является теплоизолированным, чтобы еще больше уменьшить требования к мощности нагревательного элемента и, таким образом, вес аккумулятора. Нагревающее устройство, как показано на Фиг.2, прикреплен к ткани клейким слоем 55. Клейкий слой может быть покрытым многослойной структурой (не показана на Фиг.2), которая счищается пользователем перед вставлением катетера и прикреплением нагревающего устройства. В некоторых вариантах выполнения для улучшения алгоритма температурной стабилизации другой температурный датчик 54 может находиться в контакте с кожей. В некоторых вариантах выполнения в сочетании с нагревательным элементом катетера используется только температура кожи. В некоторых вариантах выполнения могут использоваться нагревательные элементы, предусмотренные внутри и снаружи ткани.
Другая сторона катетера соединена с насосом доставки лекарственных средств. В некоторых вариантах выполнения в этой конструкции, так же как и в других конструкциях, подробно описанных в этом изобретении, все провода, которые соединяют терапевтическое устройство и насос доставки лекарственных средств, могут быть включены в трубку катетера, соединенную с насосом, как показано в поперечном сечении трубки на Фиг.3. В некоторых вариантах выполнения провода прикреплены к наружной стороне трубки, как показано в поперечном сечении, проиллюстрированном на Фиг.4. Включение или прикрепление проводов к трубке обеспечивают большее удобство для пользователя (например, чтобы носить их и манипулировать ими) устройства.
Провода, показанные на Фиг.3 и 4, предпочтительно соединены с насосом доставки лекарственных средств. В некоторых вариантах выполнения для соединения одноразового катетера и терапевтического устройства к насосу доставки лекарственных средств могут быть использованы два соединителя. Первый соединитель соединяет трубку катетера с насосом, как в настоящее время принято, например, во многих настоящих коммерческих инсулиновых насосах. Второй соединитель может использоваться для соединения проводов, используемых терапевтическим устройством для передачи данных между узлом насоса и узлом терапевтического устройства или источником питания или соединительными датчиками, используемыми для измерения параметров ткани и/или параметров инфузии для узла насоса. Соединитель проводов может быть одним из известных соединителей, используемых для соединения электрических проводов. В случае использования двух отдельных соединителей для электрических проводов и трубки инфузии провода могут также быть отделены от трубки.
В некоторых вариантах выполнения, как показано на Фиг.5, соединитель 102 трубки и электрические соединители 103-106 проводов могут быть объединены в одном кожухе 101. Выбор одного кожуха соединителя является более удобным для обращения пользователем, т.е. чтобы собрать и разобрать катетер и терапевтическое устройство от узла насоса. Кожух соединителя может также включать известный зажим или запирающий механизм предшествующего уровня техники, который делает возможным отсоединение соединителя только тогда, когда запирающий механизм нажат или открыт. Такой запирающий механизм может также снизить вероятность утечки инфузионной текучей среды из соединителя.
На Фиг.5 четыре провода используются для управления терапевтическим устройством посредством узла насоса и для соединения датчика, который измеряет уровень терапии или эффект, чтобы стабилизировать эффект терапии на требуемом уровне. В других случаях терапий, датчиков и конструкций устройства через соединитель может быть соединено различное число проводов.
В некоторых вариантах выполнения аналогичный соединитель может также использоваться на стороне терапевтического устройства. Эти варианты выполнения могут быть более удобными для пользователя в случае, когда инфузионный катетер и насос доставки лекарственных средств используются в течение более продолжительного промежутка времени, чем 2-3 дня. В течение некоторого времени насос доставки лекарственных средств может быть отделен от тела пользователя, оставляя минимальный вес и длину трубки в контакте с телом пользователя. Эти варианты выполнения могут быть полезными и более удобными для того, чтобы принимать душ. В этом случае трубка и провода могут содержать либо соединитель на обоих концах, соединитель только на конце терапевтического устройства или соединитель только на конце устройства насоса доставки лекарственных средств. В случае наличия соединителя на стороне терапевтического устройства другой альтернативой является наличие одноразовой трубки, соединяющей терапевтическое устройство и насос доставки лекарственных средств, причем к насосу доставки лекарственных средств присоединен электрический кабель многократного использования, который содержит соединитель для соединения с терапевтическим устройством. В некоторых вариантах выполнения трубка и провода могут быть выполнены одноразовыми, например, как с катетером или устройством его прикрепления, поскольку разработаны трубка и катетер общего набора для инфузии инсулина.
В некоторых вариантах выполнения терапевтическое устройство может быть изготовлено из двух частей, одна выполнена одноразовой, а одна является частью многократного использования, как показано на Фиг.6. Одноразовая часть содержит катетер 150, который вставлен в ткань, и механизм вставления (не показан на чертеже). В некоторых вариантах выполнения терапевтическое устройство может также содержать часть 151 прикрепления к коже и механизм 152 адаптера для соединения этих двух частей. В некоторых вариантах выполнения терапевтическое устройство может содержать все или одну часть терапевтического элемента, такого как нагревательный элемент (в случае терапии теплом) или другие элементы для других терапий ткани или способов возбуждения настоящего изобретения. В некоторых вариантах выполнения терапевтическое устройство может содержать один или большее количество датчиков.
Часть 155 многократного использования может содержать весь или часть терапевтического элемента. Она может содержать узел обработки данных, один или большее количество датчиков и источник питания. Источник питания может быть аккумулятором, выполненным с возможностью перезарядки. Как показано на Фиг.6, две части прикреплены с помощью механического фиксирующего механизма 153 и четырьмя штырями 154 для электрических соединений. В случае выполненного с возможностью перезарядки аккумулятора пользователь может иметь два чередующихся узла 155 многократного использования, причем один прикреплен к терапевтическому устройству, а другой остается под зарядкой. Когда аккумулятор в терапевтическом устройстве разряжен, поврежден или пользователь проинструктирован (основываясь на конкретном режиме работы аккумулятора), пользователь переключает между двумя узлами многократного использования. Узел зарядного устройства имеет то же самое механическое и электрическое соединение, что и одноразовая часть 152, которая легко вмещается в узел 155 многократного использования.
В некоторых вариантах выполнения часть многократного использования обменивается данными через канал передачи данных с насосом доставки лекарственных средств, используя проводную, беспроводную, кабельную или любую другую связь. В некоторых вариантах выполнения терапевтическое устройство не осуществляет никакой передачи данных с насосом доставки лекарственных средств. Например, только трубка катетера, которая не показана на Фиг.6, может быть соединена с насосом доставки лекарственных средств.
Следовательно, для аналогичных целей в случае инсулинового насоса это устройство может быть использовано со многими из непрерывных подкожных инфузионных инсулиновых насосов, существующих на рынке или в стадии разработки. Терапевтическое устройство само идентифицирует инфузию болюса инсулина и начинает, соответственно, протокол терапии. Начало инфузии инсулина может быть идентифицировано, как описано ранее, датчиком в терапевтическом устройстве, таким как оптический датчик на прозрачной трубке, лазерный доплеровский датчик, ультразвуковой доплеровский датчик, датчик давления, соединенный с трубкой или датчик проводимости в трубке, под действием приложенного магнитного поля, или температурный датчик инфузионной текучей среды в трубке. В качестве альтернативы терапевтическое устройство может идентифицировать электромагнитную эмиссию или акустическую эмиссию двигателя насоса, чтобы обнаружить период болюса. Датчики, которые нуждаются в контакте с инфузионной текучей средой, такой как датчик проводимости, расположены в одноразовой части 152. Другие датчики могут быть расположены как в одноразовой части, так и в части многократного использования с соответствующей известной в уровне техники механической конструкцией, которая позволяют им измерять необходимый параметр или параметры инфузионной текучей среды.
В некоторых вариантах выполнения отдельный узел, который присоединен к инсулиновому насосу, обнаруживает доставку болюса инсулина и передает информацию к терапевтическому узлу, чтобы начать терапию, с помощью либо проводной, либо беспроводной связи. Отдельный узел может измерять электромагнитную или акустическую эмиссию двигателя насоса или считывать показания кнопок насоса, когда они нажаты, или считывать показания дисплея насоса или другие индикаторы насоса или иметь дополнительную кнопку, расположенную на насосе для ручной работы устройства терапии ткани. В некоторых вариантах выполнения узел многократного использования может иметь по меньшей мере один пользовательский вход (например, кнопку) для пользователя, чтобы использовать (например, нажать), когда пользователь желает запустить терапию.
В некоторых вариантах выполнения часть многократного использования или одноразовая часть соединены электрическим кабелем с третьим узлом, который может содержать источник питания, блок управления или другие электронные части устройства. В некоторых вариантах выполнения одноразовое терапевтическое устройство с одной частью электрически связано с третьим узлом.
Альтернативный вариант выполнения настоящего изобретения проиллюстрирован на Фиг.7, в котором часть многократного использования имеет форму тонкого диска 160, вставленного между одноразовой частью 163 и кожей. Тонкий диск 160 может быть нагревателем с температурным датчиком, используемым для помощи в стабилизации температуры кожи вокруг области вставления катетера. В некоторых вариантах выполнения температурный датчик может быть частью термостата, который автоматически регулирует температуру нагрева, соединяя и разъединяя линии электропитания элемента нагревателя, или другими саморегулирующимися нагревателями, такими как терморезисторы с положительным температурным коэффициентом (позисторы), и или путем увеличения или уменьшения мощности, подаваемой нагревателю.
В некоторых вариантах выполнения тонкий нагреватель может быть изготовлен с помощью печатной технологии. В некоторых вариантах выполнения тонкий нагреватель может иметь толщину от 0,1 до 0,5 мм. В некоторых вариантах выполнения может использоваться более толстый нагреватель с толщиной от 0,5 до 2 мм. Кроме того, тонкий диск может быть более гибким и оказаться более удобным для пользователя. Перед вставлением в ткань диск 160 многократного использования может быть приклеен или прикреплен к одноразовой части 163 так, чтобы терапевтический элемент устройства многократного использования был приклеен к коже выше области ткани с введенным лекарственным средством. В некоторых вариантах выполнения специальное механическое зажимное приспособление используется для прикрепления диска 160 многократного использования к одноразовой части 163. В некоторых вариантах выполнения вставка, такая как вставка, используемая для наборов для инфузии инсулина, используется для введения обоих узлов в ткань. Тонкий диск 160 нагревателя и элемент фиксации катетера 163 могут быть выполнены одноразовыми. В некоторых вариантах выполнения тонкий диск 160 нагревателя может точно подходить нескольким традиционным элементам фиксации катетера, включая традиционные наборы для инфузии инсулина.
Диск терапии многократного использования соединен с насосом доставки лекарственных средств или с третьим узлом, используя кабель 162. Диск терапии многократного использования может выполнить разные терапии или стимуляции, отмеченные в настоящей заявке, такие как нагревание, массирование, вибрирование, акустическое возбуждение, оптическое излучение, РЧ излучение, MB излучение, применение электрического поля и т.д. В некоторых вариантах выполнения одноразовая часть 163 может быть более широкой, чем часть 160 многократного использования, так чтобы оправы одноразовой части использовались для прикрепления или фиксации терапевтического устройства к коже.
На Фиг.8 изображен альтернативный вариант выполнения, в котором одноразовая часть 173 содержит только трубку 172 катетера, механизм ввода и элемент 170 приклеивания к коже. Перед вставлением катетера в ткань одноразовая часть 173 может быть прикреплена к части 177 многократного использования таким образом, чтобы элементы 174 и 175 терапии части многократного использования вошли в контакт с кожей, когда терапевтическое устройство присоединено к коже пользователя. В некоторых вариантах выполнения одноразовая часть 173 может быть прикреплена к части 177 многократного использования с техникой с помощью фиксирующего механизма 176. Часть 177 многократного использования может быть беспроводным образом соединена с насосом доставки лекарственных средств или с третьим узлом. В качестве альтернативы, она может быть и не соединена с насосом доставки лекарственных средств и, таким образом, может включать источник питания, как описано выше. Терапевтическая часть многократного использования может выполнять терапии, описанные выше.
На Фиг.9 изображен другой вариант выполнения, в котором одноразовая часть 752 содержит трубку 751 катетера, механизм ввода, элемент 750 приклеивания к коже, контейнер с лекарственным средством и пассивные части насоса лекарственных средств. В этом варианте выполнения часть многократного использования содержит узел обработки данных, двигатель насоса и может содержать некоторые из датчиков, как описано и изображено на Фиг.6. Источник питания может быть расположен либо в части многократного использования, либо в одноразовой части. В случае использования выполненного с возможностью перезарядки аккумулятора последний может быть расположен в части многократного использования, как описано в связи с Фиг.6. В некоторых вариантах выполнения одноразовый аккумулятор расположен в одноразовом узле. До вставления катетера в ткань одноразовая часть 752 может быть присоединена к части 753 многократного использования таким образом, чтобы схематические штыри 754 электрического соединения точно соответствовали штырям электрического соединения одноразовой части и таким образом, чтобы рабочий механизм 757 механического насоса в части многократного использования точно соответствовал пассивным частям насоса лекарственных средств в одноразовом узле. Механизм насоса может быть одним из многих известных в области техники насосов. Например, в случае перистальтического насоса рабочий механизм 757 механического насоса в части многократного использования может быть частью колеса давления перистальтического насоса, который сжимает трубку в одноразовой части.
В качестве альтернативы, рабочий механизм 757 механического насоса в части многократного использования может представлять собой зубчатое колесо, которое вращает соответствующее цевочное колесо насоса в одноразовой части или перемещает линейный ползунок так, что одноразовый узел содержит только дешевые части. В некоторых вариантах выполнения в узел многократного использования могут быть включены некоторые из более дорогих частей насоса доставки лекарственных средств. В некоторых вариантах выполнения одноразовая часть 752 прикреплена к части 753 многократного использования с помощью фиксирующего механизма 756. Часть 753 многократного использования может быть беспроводным или проводным образом соединена с насосом доставки лекарственных средств или с третьим узлом или может и не быть соединена с ними, и содержать источник питания, как описано выше. Терапевтическая часть многократного использования может выполнять терапии, описанные выше.
Фиг.10 изображает вариант выполнения настоящего изобретения, в котором имеется только один одноразовый узел 702, содержащий насос доставки лекарственных средств, терапевтическое устройство, трубку 701 катетера, механизм ввода, элемент 700 прикрепления к коже и источник питания. Насос указанного одного узла и терапевтическое устройство могут выполнить вышеупомянутые описанные терапии. В некоторых вариантах выполнения в случае указанного одного узла с терапией теплом, которая может быть осуществлена либо непосредственным нагреванием, либо опосредованным нагреванием, таким как побочный продукт излучения, резервуар с лекарственным средством теплоизолирован от нагревательного элемента или от нагретых областей. Это полезно в случае доставки инсулина из-за чувствительности инсулина к высоким температурам. В некоторых вариантах выполнения резервуар с лекарственным средством имеет также температурный датчик, предназначенный для проверки того, что температура лекарственного средства не превышает предельную температуру. Та же самая термоизоляция резервуара с лекарственным средством может использоваться в вариантах выполнения, описанных выше в отношении Фиг.6-9.
Устройства, схематично показанные на Фиг.6-10, являются примерами различных комбинаций одноразовых узлов и узлов многократного использования, которые обеспечивают доставку инсулина с терапией или стимуляцией области ткани с введенным лекарственным средством. Как будет понятно специалистам в этой области техники, также возможны и другие варианты выполнения, меняющиеся от полностью одноразовых узлов до узлов полностью многократного использования (кроме катетера, который обычно бывает одноразовым), тогда как каждый из элементов устройства может быть выполнен расположенным в одноразовых узлах или узлах многократного использования в соответствии с областью его применения и стоимостью изготовления.
В некоторых вариантах выполнения третий узел может быть прикреплен снаружи к устройству доставки лекарственных средств для повышения комфорта пользователя. В таком случае электрические провода могут быть присоединены к трубке катетера на большей части длины катетера и отделены только около устройства доставки лекарственных средств, так чтобы катетер лекарственных средств был соединен с устройством доставки лекарственных средств, а провода были соединены с третьим узлом. Третий узел может также содержать источник питания и контроллер. Когда доставка лекарственных средств начинается (например, доставка болюса лекарственных средств), третий узел может определить, что устройство доставки лекарственных средств начало работу либо активно путем непосредственного обмена данными между этими двумя узлами, либо пассивно путем измерения некоторых сигналов, индуцированных устройством доставки лекарственных средств, когда работает, как описано выше, как, например, используя электромагнитную эмиссию устройства доставки лекарственных средств. В некоторых вариантах выполнения третий узел может быть расположена в сумке, мешочке, футляре или адаптере пояса, содержащем насос доставки лекарственных средств, как, например, устройства, используемые для переноса инсулиновых насосов. В таком случае трубка соединена с инсулиновым насосом, а провода соединены с переносным устройством. Переносное устройство может также содержать выключатель для ручного запуска терапии, или индикаторы для указания на то, что терапия применяется, или индикаторы, указывающие на адекватное или низкое питание от аккумулятора, или индикаторы, указывающие на то, что в терапии существует проблема, как, например, произошло отсоединение проводов и т.п. Выключатель или индикаторы или их часть могут быть расположены также на узле многократного использования, или на одноразовом узле, или на насосе доставки лекарственных средств.
В некоторых вариантах выполнения устройства, выполненные в соответствии с настоящим изобретением, могут осуществлять РЧ или ИК обмен данными малой дальности с узлом обработки данных и управления, таким как карманный портативный компьютер ("КПК"), с личным мобильным телефоном или связанным с конкретным применением устройством обработки данных, которое поддерживает управление терапией с помощью лекарственного средства. В случае доставки инсулина устройство обработки данных может получать данные об уровне глюкозы либо вручную от датчика глюкозы, путем передачи данных, или считывая с индикаторных полосок глюкозы. Устройство обработки данных может получать информацию о ранее потребленных углеводах и другой пище или напитках. Устройство обработки данных может также сохранять статистику пациента и соответствующие параметры, такие как вес, индекс массы тела (ВМ1), резистентность к инсулину и т.п.
Устройство обработки данных может также вычислять оптимальное необходимое количество инсулина и оптимальный профиль терапии или возбуждения ткани. Эта информация может быть послана беспроводным образом насосу доставки лекарственных средств и терапевтическому устройству для оптимальной доставки лекарственных средств. Терапевтическое устройство может передавать параметры ткани, измеренные расположенными на нем датчиками, узлу обработки данных (который может также быть блоком управления или содержать этот блок; "узел обработки данных и управления") в качестве дополнительной информации для вычисления терапии или истории для будущей статистики и анализа данных. В некоторых вариантах выполнения узел обработки данных и управления может только рекомендовать пользователю оптимальную дозировку лекарственных средств, оптимальную терапию и/или профиль возбуждения, который будет применен к области инфузии ткани, а пациент должен санкционировать терапию, прежде чем она начнется. В некоторых вариантах выполнения узел обработки данных и управления могут рекомендовать пользователю только оптимальную дозировку лекарственных средств, а пациент должен санкционировать дозировку прежде, чем начнется ее введение, и также выбрать лучшую терапию или возбуждение, которое будет применено к области инфузии ткани. В некоторых вариантах выполнения узел обработки данных и управления может быть частью насоса доставки лекарственных средств. В некоторых вариантах выполнения узел обработки данных и управления может содержать выключатель для ручного запуска терапии, индикаторы для указания на то, что терапия применяется, или индикаторы, указывающие на адекватное или низкое питание от аккумулятора, или индикаторы, определяющие, что в терапии существует проблема, как, например, произошло отсоединение проводов и т.п.
В некоторых вариантах выполнения терапия или стимуляция ткани могут включать (либо в одиночку, либо в комбинации с другой стимуляцией) вибрирование области ткани, в которую доставляется лекарственное средство. Два примера таких терапевтических устройств изображены на Фиг.11-12. Вибрирующее терапевтическое устройство с открытым покрытием, показанное на Фиг.11, содержит электродвигатель 202, который вращает диск 201 с асимметричной нагрузкой. Вращение этого диска приводит к вибрации терапевтического устройства в режиме круговых колебаний. Путем приклеивания терапевтического устройства к коже с помощью клейкого слоя терапевтическое устройство вибрирует ткань под терапевтическим устройством и наконечником катетера. Эта вибрация может выполняться на частоте приблизительно от 1 до 50 Гц, которая обычно используется для массирования ткани, типично имеет от 60 до 300 оборотов в минуту. Как будет понятно специалистам в этой области техники, могут использоваться также и другие частоты или скорости вращения. В некоторых вариантах выполнения ось двигателя может быть расположена горизонтально с вращающимся диском вертикально к поверхности кожи. В этом случае колебания, в дополнение к горизонтальным, также являются вертикальными к поверхности кожи.
Вибрирующее терапевтическое устройство с открытым покрытием, как показано на Фиг.12, содержит электромагнит 251, который тянет ферромагнитный сердечник с помощью двух грузов, расположенных с его обоих концов. Пружина возвращает сердечник к его начальному положению после того, как электромагнит выключают. Таким образом, путем приложения периодического сигнала к электромагниту сердечник с его грузами будет вибрировать на частоте периодического сигнала и вызывать колебания ткани под ним. Чтобы повысить эффективность вибрации, сердечник, масса грузов и сила пружины могут быть рассчитаны, чтобы иметь частоту механического резонанса на требуемой частоте для массирования инфузионной ткани.
Когда к электромагниту приложена частота резонанса, создаются колебания с большей амплитудой. Путем приклеивания терапевтического устройства к коже клейким слоем терапевтическое устройство вибрирует ткань под терапевтическим устройством и наконечником катетера. В некоторых вариантах выполнения ось вибрации может быть выполнена так, чтобы вибрировать в другие направления, как, например, вертикально или перпендикулярно поверхности кожи. В некоторых вариантах выполнения устройство вибрации может вибрировать главным образом наконечник катетера либо горизонтально, либо вертикально, используя механизмы вибрации, которые вызывают возбуждение ткани около наконечника катетера.
Альтернативный вариант выполнения массирования ткани проиллюстрирован на Фиг.13. Это вариант выполнения может массировать с более низкой частотой и большей амплитудой по сравнению с "вибрирующими" вариантами выполнения. Терапевтическое устройство (которое в этом варианте выполнения может быть выполнено одноразовым) содержит наконечник 351 катетера для вставления в ткань (как и прежде), расположенный в середине камеры 354 с жесткой стенкой везде, кроме стороны кожи, где эта камера содержит гибкую мембрану 350. Гибкая мембрана приклеивается к коже, как и прежде, клейким слоем как часть процесса вставления катетера, описанного ранее, чтобы зафиксировать катетер в этом положении. Камера 354 может быть соединена дополнительной трубкой 353 с насосом 352 доставки лекарственных средств. Массирование ткани создается накачкой воздуха в камеру 354 и из нее через трубку 353 и через дополнительный насос, расположенный в узле насоса доставки лекарственных средств, в соответствии с протоколом терапии или массирования. В этом случае управление протоколом терапии обеспечивается узлом насоса доставки лекарственных средств, при этом одноразовый узел может быть относительно простым и дешевым. Когда воздух выкачивается из камеры 354, гибкая мембрана 350 изгибается в камеру, оттягивая за собой приклеенную к ней ткань. Когда воздух накачивается в камеру, гибкая мембрана изгибается наружу и давит на ткань. Этот процесс периодически повторяется в соответствии с типичной частотой приблизительно от 0,01 до 10 Гц. Возможны также и другие частоты. В некоторых вариантах выполнения камера заполнена несжимаемой текучей средой, такой как вода, и соответствующий насос вынуждает текучую среду протекать в камеру и из нее.
В альтернативном варианте выполнения гибкая мембрана может иметь твердую поверхность, которая содержит большое количество отверстий, а гибкая мембрана покрывает отверстия для улучшения прилипания к коже и для пространственного модулирования массирования кожи. В еще одном альтернативном варианте выполнения на наружной поверхности гибкой мембраны могут быть выполнены маленькие детали (наплывы), выступающие наружу из поверхности для улучшения массирующего эффекта ткани. В некоторых вариантах выполнения трубка 353 может быть соединена с третьим узлом, который управляет и применяет терапию массирования, как описано ранее.
Другой вариант выполнения терапевтического устройства представляет собой устройство всасывания, которое обеспечивает аспирацию ткани вокруг инфузионного катетера, как показано на Фиг.14. Всасывание области ткани, как известно, улучшает перфузии крови в этой области ткани. Терапевтическое устройство (одноразовое) содержит наконечник 401 катетера для вставления в ткань (как и прежде), расположенный в середине камеры 404 с жесткой стенкой всюду, кроме стороны кожи, где имеется отверстие. Стенки камеры приклеены к коже круглым клейким слоем 400, который герметизирует ободок камеры к коже. Клейкий слой прикреплен к коже во время процесса вставления катетера, чтобы зафиксировать катетер на месте. Камера 404 соединена дополнительной трубой 403 к насосу 402 доставки лекарственных средств. Аспирация кожи осуществляется откачкой воздуха из камеры 404 через трубку 403 через дополнительный насос, предусмотренный в узле насоса доставки лекарственных средств. В этом случае управление протоколом терапии обеспечивается узлом насоса доставки лекарственных средств, при этом одноразовый узел может быть относительно простым и дешевым. Всасывание выполняют в соответствии с заранее заданным протоколом терапии, например всасывание длительностью в 1 минуту может быть применено после инъекции болюса инсулина для улучшения абсорбции инсулина в кровеносную систему. В другом примере применяют вакуум в камере 404 в течение 30 секунд, а затем снимают вакуум в течение дополнительных 30 секунд. Этот процесс может быть повторен несколько раз, чтобы увеличить перфузии крови в области ткани под терапевтическим устройством. В некоторых вариантах выполнения отверстие в камере со стороны ткани может быть выполнено на жесткой поверхности и включать несколько отверстий для увеличения площади прилипания к коже и для пространственной модуляции всасывания кожи. В некоторых вариантах выполнения трубка 403 может быть соединена с третьим узлом, который управляет и применяет терапию всасывания, как описано ранее.
В некоторых вариантах выполнения, чтобы изменить фармакокинетический и/или фармакодинамический профиль доставляемых лекарственных средств, создают небольшую модуляцию процесса инфузии через инфузионный катетер. Другими словами, инфузионная текучая среда немного втягивается и вытягивается из ткани во время или после процесса инфузии лекарственных средств. Это действие вызывает усиленный поток межклеточной жидкости (ISF) вокруг наконечника катетера из-за меняющихся индуцированных полей давления. Увеличенный поток ISF увеличивает расстояние диффузии лекарственных средств и уменьшает постоянную времени абсорбции лекарственных средств в кровеносную систему. Модуляция потока может быть осуществлена насосом доставки лекарственных средств путем изменения на обратное направления насоса в течение коротких промежутков времени небольших количеств перекаченных текучих сред. Кроме того, насос доставки лекарственных средств может продолжать слегка перемещать инфузионную текучую среду в катетер и обратно и после окончания инфузии болюса лекарственных средств.
На Фиг.15-16 проиллюстрированы два иллюстративных варианта выполнения способов, чтобы применить вышеупомянутую терапию ткани как совокупный компонент к существующим насосам доставки лекарственных средств без изменения на обратное направления насоса доставки лекарственных средств. Эти варианты выполнения включают модуляцию потока инфузионной текучей среды в трубке инфузионного катетера двумя различными способами. На Фиг.15 предусмотрено колесо 503, имеющее ось вращения, смещенную от центра колеса. Таким образом, когда ось вращается, одна сторона колеса оказывает давление на проксимальную сторону трубки 501 катетера и толкает инфузионную текучую среду вперед. Другая сторона колеса 503 высвобождает трубку 501 катетера и втягивает инфузионную текучую среду немного назад. На Фиг.16 модуляцию текучей среды осуществляют поршнем 553, соединенным с трубкой 551 катетера, который перемещается вверх и вниз, чтобы вызвать поток инфузионной текучей среды в трубку 551 катетера и из нее. В некоторых вариантах выполнения следует использовать надлежащую процедуру и средства удаления воздуха, когда катетер соединен с насосом 552 доставки лекарственных средств и перед его вставлением (). В обоих вариантах выполнения механизм модуляции может быть присоединен к предусмотренному насосу доставки лекарственных средств в одноразовой части или в третьем узле, соединенным с трубкой инфузии.
В некоторых вариантах выполнения терапевтическое устройство ткани может содержать элемент акустической стимуляции, чтобы стимулировать место вблизи области ткани, в которую доставляется лекарственное средство, как проиллюстрировано на Фиг.17. В этих вариантах выполнения инфузионный катетер объединен с элементом 2 акустической стимуляции, прикрепленным к коже вокруг катетера. Терапевтическое устройство может иметь плоскую круглую конструкцию 5 с отверстием в центре для трубки 3 катетера, который входит в подкожную ткань. Другая сторона катетера может быть соединена с насосом доставки лекарственных средств. Элемент акустической стимуляции может быть изготовлен из пьезоэлектрических материалов, таких как керамика на основе титаната и цирконата свинца и ПВДФ. Акустическая стимуляция может включать низкие или высокие акустические частоты или более высокие частоты в ультразвуковой области.
Устройство акустической стимуляции прикрепляют к ткани клейким слоем. Клейкий слой может быть нанесен либо на внешней кольцевой области 1 или также покрыть элемент акустической стимуляции звукопроводящим клейким слоем, таким как клейкий гидрогель. Элемент акустической стимуляции может также быть покрыт звукопроводящим слоем, таким как акустический гидрогель или жидкость. Клейкий слой может быть покрыт многослойной структурой (не показана на Фиг.17), которая может быть счищена пользователем перед вставлением катетера и прикреплением элемента акустической стимуляции. Обычно для вставления катетера устройство снабжено стерильной иглой в катетере (не показана на Фиг.17), которую вытаскивают после вставления катетера. Элемент акустической стимуляции может быть соединен либо с насосом доставки лекарственных средств с использованием кабеля 4, либо с третьим узлом или электроникой, размещенной как часть терапевтического устройства акустической стимуляции, как описано ранее.
В некоторых вариантах выполнения устройство терапии ткани для стимуляции области ткани может использовать оптическое излучение, как проиллюстрировано на Фиг.18. В этих вариантах выполнения инфузионный катетер объединен с элементом 301 оптического излучения, прикрепленным к коже вокруг катетера. Терапевтическое устройство может иметь плоскую круглую конструкцию 302 с отверстием в центре для трубки 303 катетера, который входит в подкожную ткань. Другой конец катетера 303 соединен с насосом доставки лекарственных средств. Элемент оптического излучения может быть изготовлен из известных в уровне техники источников света, таких как СИД, лазерные диоды, лампы, и т.п. Оптическое излучение может быть в видимой или NIR или MIR областях. Источник света может испускать импульсный свет или свет с непрерывной волной, причем источник импульсного света может также испускать импульсы, который годятся для генерации фотоакустических или термоакустических сигналов на катетере и/или в области ткани близко к катетеру. Устройство оптического излучения прикреплено к ткани с помощью клейкого слоя.
Клейкий слой может быть предусмотрен на наружной кольцевой области 301 или покрывать элемент оптического излучения оптически прозрачным для соответствующей оптической длины волны клейким слоем. Клейкий слой покрыт многослойной структурой (не показана на Фиг.18), которая счищается пользователем перед вставлением катетера и прикреплением устройства оптического излучения. Обычно для вставления катетера устройство снабжено стерильной иглой в катетере (не показана на чертеже), которую вытаскивают после вставления катетера. В некоторых вариантах выполнения в устройстве доставки лекарственных средств может быть расположен источник света, причем свет доставляется к оптическому терапевтическому устройству оптического излучения с помощью оптического волокна или нескольких волокон. Источник оптического излучения может быть соединен либо с насосом доставки лекарственных средств с использованием кабеля, либо с третьим узлом или с электроникой, размещенной как часть терапевтического устройства оптического излучения, как описано ранее.
В альтернативном варианте выполнения устройство стимуляции ткани оптическим излучением, как проиллюстрировано на Фиг.19, покрывает наконечник катетера оптически поглощающим покрытием 801, которое поглощает длину волны или некоторые из длин волны оптического излучения. Терапевтическое устройство может быть выполнено аналогично терапевтическому устройству оптического излучения, описанному ранее. В этом варианте выполнения терапевтическое устройство может иметь плоскую круглую конструкцию 800 с отверстием в центре для трубки 801 катетера, который входит в подкожную ткань. Другой конец катетера 802 соединен с насосом доставки лекарственных средств. Терапевтическое устройство может также содержать элементы оптического излучения, схематично изображенные номерами позиций 803 и 804. Элементы оптического излучения могут быть изготовлены из известных в уровне техники источников света, таких как СИД, лазерные диоды, лампы, и т.п. Источник света может испускать импульсный свет или свет с непрерывной волной, причем источник импульсного света может также испускать импульсы, который годятся для генерации фотоакустических или термоакустических сигналов на наконечнике 801 катетера.
Длина волны оптического излучения может лежать либо в видимой области, либо в ближней инфракрасной области (NIR). В некоторых вариантах выполнения использование диапазона длин волны от 700 до 1000 нм обеспечивает относительно низкое поглощение оптического излучения в ткани. Следовательно, гораздо большая часть испущенного излучения может быть рассеяна в ткани и поглощена в наконечнике катетера. Оптическое излучение, поглощенное в наконечнике катетера, может вызвать локальный импульс облучения вокруг наконечника катетера и эффективно нагревает область инфузии ткани, как описано выше в отношении Фиг.2. Использование более коротких длин волн в видимой области, но также и в диапазоне от 700 до 1000 нм может увеличить долю излучения, которое поглощается гемоглобином и, следовательно, может нагреть больше крови или области, насыщенные гемоглобином, в области ткани, подверженной этому излучению. Использование более длинных длин волн в NIR, средней инфракрасной области (MIR) или дальней инфракрасной области (FIR) может увеличить долю излучения, которое поглощается водой в ткани и, следовательно, может нагреть больше воды или области, насыщенные водой, в области ткани, подверженной этому излучению. Кроме того, в случае использования световых импульсов для создания фотоакустического возбуждения, часть возбуждения, индуцированного в наконечнике катетера, областях с гемоглобином или областях с водой, может быть определена в соответствии с распределением поглощения излучения и фотоакустическим коэффициентом каждой области. Полученный фотоакустический сигнал может быть измерен с помощью акустического датчика, расположенного в конструкции 800 прикрепления кожи и может быть использован для осуществления контроля за энергией, поглощенной в каждой из этих областей или в наконечнике 801 катетера.
В некоторых вариантах выполнения некоторые из длин волны вышеупомянутых диапазонов могут быть использованы для лучшего управления представляющей интерес областью нагрева или стимуляции. В некоторых вариантах выполнения по меньшей мере одна из длин волны поглощается покрытием наконечника катетера, а по меньшей мере одна длина волны не поглощается покрытием для лучшего управления областью нагрева или стимуляции. Алгоритм управления стимуляцией ткани может получать информацию от датчиков температуры ткани (раскрытых ранее), акустического датчика, оптического датчика, профиля доставки лекарственных средств и дополнительных параметров лекарственных средств или ткани. Алгоритм может управлять длинами волны, чтобы регулировать абсорбцию лекарственных средств в кровеносную систему.
В некоторых вариантах выполнения устройство, аналогичное проиллюстрированному на Фиг.2 и 18, может облучать область ткани с введенным лекарственным средством снаружи или внутри соответственно радиочастотным (РЧ) излучением или микроволновым (MB) излучением. В другом варианте выполнения к области ткани с введенным лекарственным средством может быть приложено электрическое поле, используя, например, два электрода, аналогичные элементам 301, изображенным на Фиг.18, чтобы приложить поле к коже или с использованием электродов, расположенных на наружной стороне наконечника катетера, вставленного в ткань. Кроме того, то же самое устройство может быть использовано для приложения полей высокой или низкой частоты и даже постоянного поля. Для улучшения электрического контакта клейкий слой может быть проводящим гидрогелем или другим известным в области техники материалом для прикрепления электродов.
В некоторых вариантах выполнения дополнительное вещество может быть введено в место вблизи области ткани с введенным лекарственным средством так, что это дополнительное вещество изменяет фармакокинетический и/или фармакодинамический профиль лекарственного средства с созданием или без создания химической или другой реакции между этими двумя веществами. Конкретно, дополнительное лекарственное средство может как влиять на область ткани с введенным лекарственным средством, так и улучшать фармакокинетические и/или фармакодинамические профили лекарственного средства. Этот эффект происходит не обязательно из-за химической реакции между лекарственным средством и дополнительным веществом. В некоторых вариантах выполнения дополнительное вещество улучшает локальную перфузию крови около области с введенным лекарственным средством и, соответственно, уменьшает постоянную времени абсорбции лекарственного средства в кровеносную систему. Этот эффект может быть совокупным или синергическим в отношении вышеупомянутых описанных форм стимуляции. Например, нитропруссид, который вызывает вазодилатацию, может улучшить перфузию крови в ткани с введенным лекарственным средством и улучшить абсорбцию лекарственного средства в кровеносную систему.
Дополнительное вещество может быть введено в область с введенным лекарственным средством либо через тот же самый катетер, либо через дополнительный катетер, который может быть прикреплен или отделен от катетера введения лекарственных средств. В некоторых вариантах выполнения катетер может быть катетером с двойным люменом, с двумя отверстиями в той же самой области ткани или в двух отдельных областях ткани, как показано на Фиг.20. Отверстия 866 и 862 двух люменов соответственно 865 и 864 могут располагаться на различных глубинах в ткани. В проиллюстрированном варианте выполнения катетер с двойным люменом зафиксирован на коже с помощью круглого элемента 863 и клейкого слоя 860. В некоторых вариантах выполнения катетер может содержать дополнительный терапевтический элемент, как описано выше, такой, что комбинация дополнительного вещества и терапии обеспечивает требуемую стимуляцию ткани или терапию. В варианте выполнения катетера с одним люменом дополнительное вещество может быть либо смешано с лекарственным средством, а затем доставлено, накачано, введено или инжектировано вместе с ним в трубку катетера. В качестве альтернативы, дополнительное лекарственное средство может поступить из другого контейнера с отдельным насосом или устройством доставки лекарственных средств и смешиваться в трубке катетера в соответствии со скоростью потока лекарственного средства и дополнительного вещества, используя алгоритм инфузии этих двух веществ. В некоторых вариантах выполнения эти два контейнера могут быть либо расположены в одном и том же кожухе, прикреплены друг к другу или отделены друг от друга. Точно также в случае трубки с двумя люменами один люмен может быть соединен с устройством доставки лекарственных средств, а второй люмен может быть связан с устройством доставки дополнительного вещества. В некоторых вариантах выполнения комбинация вышеупомянутых способов терапии и/или устройств может быть размещена в одном устройстве для улучшения его работы и повышения эффективности.
В некоторых вариантах выполнения катетер может быть введен под углом проникновения в 90 градусов. Как должно быть понятно, возможны и другие углы. Меньшие углы могут улучшить прикрепление катетера, но вставление катетера под такими углами может вызывать большее раздражение у пациента.
В некоторых вариантах выполнения к конструкции терапевтического устройства может быть добавлен датчик. В качестве альтернативы, он может быть добавлен к общим наборам для инфузии, таким, как наборы для инфузии инсулина, и может использоваться для помощи в обнаружении того, что элемент прикрепления катетера приподнялся или начал отслаиваться от кожи. Датчик может быть предусмотрен в элементе прикрепления катетера так, что он находится в непосредственном контакте с кожей, опосредованном контакте через клейкий слой или другие слои, прикрепленные к коже. Датчик может измерять давление или проводимость кожи, импеданс и/или обратно отраженный от кожи оптический или акустический сигнал. Изменение уровня контакта между датчиком и кожей индуцирует электронный сигнал либо на терапевтическом устройстве, либо на устройстве доставки лекарственных средств. Затем устройство может либо сообщить пользователю, что необходимо поправить прикрепление элемента прикрепления к коже, либо повторно вставить катетер в ткань, в случае если он отделился, либо сделать паузу, либо прекратить доставку лекарственных средств или терапию, пока положение катетера не исправлено.
В некоторых вариантах выполнения терапевтическое устройство может быть зафиксировано на пациенте с использованием ремня или пояса, который удерживает терапевтическое устройство на месте. Ремень может быть помещен вокруг любой части тела пациента в зависимости от местоположения области с введенным лекарственным средством и удобства для пациента. Используя такой ремень, можно снизить вероятность вытаскивания катетера в более жестких ситуациях, таких как бег трусцой. Например, ремень может быть помещен вокруг живота, ноги, бедра, руки и т.д. В некоторых вариантах выполнения ремень может содержать резервуар, карман или адаптер для размещения в нем устройства доставки лекарственных средств. В вариантах выполнения, использующих третий узел, который поддерживает терапевтическое устройство, третий узел может быть присоединен к ремню или даже быть вмонтирован в ремень. Третий узел может быть вмонтирован в ремень или пояс, и может быть соединен с катетером одноразового узла электрическими проводами, используя соединитель в конце проводов. В некоторых вариантах выполнения насос доставки лекарственных средств может быть присоединен к ремню и соединен с катетером одноразового узла с помощью трубки для доставки лекарственных средств. В некоторых вариантах выполнения одноразовый узел может быть прикреплен к ремню, чтобы еще больше снизить вероятность вытаскивания катетера в более жестких ситуациях.
Источник питания может быть тонким аккумулятором, таким как аккумулятор, изготовляемый фирмой Power Paper Ltd. Электроника может быть расположена на гибкой печатной схеме, известной в этой области техники, чтобы обеспечивать необходимую гибкость для удобства пациента.
Как должно быть понятно специалистам в этой области техники, вышеупомянутые способы и устройства для стимуляции ткани не ограничены насосами доставки лекарственных средств и могут быть использованы с ручной доставкой лекарственных средств, как, например, подсоединяя шприц (вместо насоса) к проксимальной части катетера. В этих вариантах выполнения проксимальная часть катетера может заканчиваться соединителем или отверстием, в которые плотно посажен наконечник шприца. Соответственно, дистальная часть катетера вставляется в ткань, как и прежде. В некоторых вариантах выполнения проксимальная часть трубки катетера является короткой, как будто она включена в терапевтическое устройство, как показано на Фиг.21. В этом случае аппаратные средства терапии, которые содержат терапевтический элемент 602, процессор 606, источник питания и вышеупомянутые элементы для терапии или стимуляции ткани, расположены в одноразовом узле 603 катетера, который содержит клейкий слой 600 для прикрепления кожи и дистального наконечника 601 катетера. Устройство шприца может быть либо традиционным шприцем, автоматическим шприцем или другими автоматизированными подкожными устройствами доставки лекарственных средств, которые могут обеспечить известный объем лекарственных средств и могут быть связаны с отверстием катетера для доставки лекарственных средств.
В некоторых вариантах выполнения катетерный узел с отверстием шприца может быть разделен на одноразовую часть и часть многократного использования. В некоторых вариантах выполнения отверстие шприца имеет заглушку 607, которая закрывает отверстие шприца, если шприц не используется. В этом случае в системе отсутствует какой бы то ни был узел доставки лекарственных средств, а терапевтическое устройство может обнаружить инфузию лекарственных средств и, соответственно, начать терапию. Инфузия лекарственных средств может быть обнаружена, используя вышеупомянутые способы, такие как определение потока, определение давления, определение проводимости или определение температуры. В некоторых вариантах выполнения механический датчик 604 давления, показанный на Фиг.20, может автоматически определить вставление шприца в отверстие, вручную через выключатель на терапевтическом устройстве или беспроводным способом с помощью дистанционного управления. Датчик определения инъекции может быть также оптическим или датчиком в близкой ИК области, который определяет однозначный ИК переданный сигнал от узла шприца, или же однозначное оптическое изображение или сигнал. Датчик инъекции может также получить некоторую информацию от устройства инъекции путем либо ИК обмена данными, либо оптическим считывателем, таким как считыватель штрихового кода. Информация может включать тип лекарственных средств и дозировку. В некоторых вариантах выполнения терапевтическое устройство содержит узел 606 обработки данных, который может получать эту информацию и соответственно подгонять алгоритм терапии, как описано ранее. То же самое терапевтическое устройство с отверстием шприца может быть использовано для нескольких инъекций в соответствии с каждым профилем терапии и продолжительностью, емкостью аккумулятора и другими параметрами.
В некоторых вариантах выполнения способы терапии или стимуляции ткани или кожи могут быть использованы для терапии или возбуждения области ткани, в которую введено лекарственное средство. В этом случае, как показано на Фиг.22, устройство 652 стимуляции прикреплено к коже и имеет круглое отверстие для непосредственной доставки лекарственных средств шприцем и иглой. Этот выбор может соответствовать устройствам инъекции без иглы, таким как безыгольные шприцы или технологии перфорации ткани или, в качестве альтернативы, устройства инъекции микроиглами. Кроме того, инъекционный шприц может иметь много форм для инъекции лекарственных средств в дополнение к стандартному шприцу, как, например, автоматические шприцы и т.д. Преимущество устройства состоит в том, что его присоединяют к ткани до инъекции лекарственных средств. Устройство стимулирует инжектированную область ткани после окончания процесса доставки лекарственных средств, чтобы улучшить абсорбцию лекарственных средств в кровеносную систему. Профиль стимуляции и продолжительность вычисляют в соответствии с алгоритмом, который подходит лекарственному средству и, возможно, пациенту, как описано ранее.
Обнаружение инъекции может быть выполнено автоматически датчиком 653 инъекции, вручную через выключатель на терапевтическом устройстве или беспроводным способом с помощью дистанционного управления. Датчик обнаружения инъекции может быть оптическим датчиком или датчиком в близкой ИК области. Датчик инъекции может получать информацию от от устройства инъекции путем либо ИК обмена данными, либо оптическим считывателем, таким как считыватель штрихового кода. Информация может включать тип лекарственных средств и дозировку. В некоторых вариантах выполнения терапевтическое устройство содержит контроллер или узел 654 обработки данных, который может получать эту информацию и соответственно подгонять алгоритм терапии. Терапевтический элемент 651, как показано на Фиг.22, размещен вокруг области инъекции и клейкой части 650, которая прикрепляет устройство к коже вокруг нее. В некоторых вариантах выполнения возможны другие формы, такие как многие из тех форм, что были описаны ранее.
То же самое терапевтическое устройство может быть использовано для нескольких инъекций в соответствии с каждым профилем терапии и длительности, емкости аккумулятора и другим параметрам. Перед инъекцией кожа, находящаяся в отверстии устройства, может быть очищена очищающей жидкостью или губкой, такой как губка, пропитанная спиртом, через отверстие устройства, чтобы предотвратить инфекции. В некоторых вариантах выполнения терапевтическое устройство может иметь U-образную форму, чтобы облегчить очистку кожи, или же другие формы.
В некоторых вариантах выполнения для инъекции лекарственных средств устройство терапии ткани или кожи прикреплено к коже после инъекции лекарственных средств. В некоторых вариантах выполнения указанное устройство терапии ткани или кожи является одноразовым с одноразовым источником питания. В некоторых вариантах выполнения указанное устройство терапии ткани или кожи является устройством многократного использования и использует выполненный с возможностью перезарядки источник питания. В некоторых вариантах выполнения указанное устройство терапии ткани или кожи комбинировано из одноразовых элементов и элементов многократного использования. В некоторых вариантах выполнения указанное устройство терапии ткани или кожи активируется и начинает терапию ткани автоматически, когда прикладывается к коже.
Следующий пример демонстрирует устройство, которое улучшает функциональные возможности существующих основанных на насосе систем доставки инсулина. Такая система, показанная на Фиг.23, содержит инсулиновый насос 40 и набор 44 инфузии, который доставляет накаченный инсулин в ткань. Набор для инфузии содержит трубку 44 и катетер 47, который вставлен в подкожную ткань. Устройство имеет два элемента: i) плоский нагреватель 46, который прикреплен к коже вокруг места вставления катетера, и ii) узел 41 контроллера, который расположен в кожухе узла инсулинового насоса. Узел контроллера имеет выключатель/кнопку 48 для ручной работы и два индикатора 49 для сообщения "терапия включена" и для статуса аккумулятора. Эти два элемента соединены проводами 43.
Контроллер контролирует работу инсулинового насоса, используя электронный измерительный элемент, и также управляет работой нагревательного элемента. Контроллер контролирует электромагнитную эмиссию от насоса. Во время болюсного режима насос испускает четко выраженные группы электромагнитных импульсов с постоянной частотой, изображенные как стрелки 42. Например, во время болюсной дозировки модель 722 инсулинового насоса от Minimed испускает конкретный набор электромагнитных импульсов для каждой 0,1 единицы введенного инсулина с частотой 0,1 единиц в секунду. Подсчет этих электромагнитных импульсов позволяет определить количество введенного инсулина в болюсе, начать работу нагревательного элемента и отрегулировать его параметры, такие как соответственно продолжительность и температура нагрева. Температура нагревателя управляется контроллером, использующим температурный датчик 45, расположенный на нагревательном элементе. В этом примере температура нагревательного элемента не превышала 39 градусов С, чтобы избежать повреждения введенного инсулина.
В некоторых вариантах выполнения нагревающим устройством можно управлять вручную. В этом случае контроллер управляет работой терапевтического элемента. Как только пользователь вводит болюс инсулина, используя инсулиновый насос, он также активирует выключатель/кнопку 48, расположенную на контроллере, чтобы запустить работу нагревательного элемента в течение заранее заданного промежутка времени. Температура нагревателя управляется контроллером, использующим температурный датчик, расположенный внутри терапевтического элемента (нагревательного элемента). В этом примере температура нагревательного элемента не превышает 39 градусов С, чтобы избежать повреждения введенного инсулина.
Плоский нагревательный элемент, используемый в этом примере, имеет несколько слоев. Верхний слой представляет собой слой полиэтилена, который герметизирует элемент. Ниже этого слоя имеется протравленная печатная схема, ниже которой имеется медный слой для распределения тепла и механической прочности. Ниже этого слоя расположен другой герметизирующий слой полиэтилена, ниже которого имеется клейкая лента от 3M(R), которая является биологически совместимой. Толщина нагревателя меньше чем 0,2 мм, а его диаметр равен 3 см. Тонкие электрические провода длиной 60 см с маленькими соединителями, расположенными в обоих концах, соединяют нагреватель с узлом контроллера. Мощность, используемая для нагревания, может быть равна 2 Вт. Нагревание включалось и выключалось контроллером для стабилизации температуры кожи на уровне 39 градусов С. Продолжительность нагрева было установлена в 30 минут, после которых температурное регулирование было остановлено.
В целом, прикрепление и работа системы доставки инсулина с нагревателем весьма аналогична работе системы доставки инсулина без нагревателя. Описанное устройство содержит контейнер, в который помещен инсулиновый насос. Контейнер также содержит электронную цепь и аккумуляторы для обеспечения работы контроллера и нагревателя. Соответственно, пациент сначала соединяет трубку набора для инфузии с инсулиновым насосом. Затем пациент подсоединяет соединитель электрических проводов с электрическим соединителем на нагревателе. Затем пациент прикрепляет нагреватель к центру элемента прикрепления катетера, используя клейкую ленту элемента прикрепления катетера. Инсулиновый катетер затем вставляют в подкожную ткань либо вручную, либо с использованием пружины вставки катетера. Механизм ввода катетера тот же самый, что и обычно, используя тот же самый модуль вставления и выполняя те же самые этапы. Нагреватель может быть присоединен к элементу прикрепления катетера перед вставлением последнего. Пациент может соединить трубку набора для инфузии с катетером. Пациент соединяет провода, приходящие от нагревателя, к нужному соединителю на контроллере. Работа по введению болюса либо автоматическая, либо ручная, как описано ранее.
Другая конструкция нагревателя показана на Фиг.24. В этом случае нагреватель 34 имеет U-образную форму и прикреплен к коже вокруг набора 30 для инфузии инсулина. Преимущества этой конструкции состоят в том, что нагреватель может быть независимым узлом, который подходит для многих коммерческих наборов для инфузии, а также в том, что между инсулином и нагревателем имеется тепловая изоляция. U-образный нагреватель может быть тонким или более толстым и может быть изготовлен разными способами, известными в области техники. U-образный нагреватель, показанный на Фиг.24, изготовлен из теплопроводящего металла и имеет резистор 31 для нагревания и температурный датчик 32 для управления температурой.
Другая конструкция нагревателя показана на Фиг.25. В этом случае нагреватель 37 имеет круглую форму и прикреплен к набору для инфузии инсулина вокруг катетера до вставления его в тело, как описано выше. Форма прорезей 39 обеспечивает прикрепление нагревателя к набору для инфузии до удаления покрытия катетера, хотя диаметр покрытия катетера может быть больше, чем центральное отверстие. Важно удалить покрытие катетера или крышку как последнюю операцию перед вставлением катетера в ткань из-за проблем стерильности и безопасности. Однако с прорезями 39 в нагревателе обеспечивается использование нагревателя с оптимизированным центральным диаметром отверстия без ограничений, накладываемых на покрытие катетера. Это важно, с одной стороны, для оптимального нагревания области ткани с введенным лекарственным средством и, с другой стороны, чтобы поддерживать термоизоляцию между инсулином в катетере и нагревателем. Нагреватель может быть независимым узлом, который подходит многим из коммерческих наборов для инфузии. Нагреватель также содержит температурный датчик для управления температурой. Толщина этого нагревателя может быть около 0,2 мм.
Чтобы продемонстрировать улучшение фармакодинамики инсулина в устройстве, описанном в этом примере, был проведен эугликомический гиперинсулинемический клэмп-тест, используя следующий протокол. Инсулинозависящий доброволец-диабетик, прошедший терапию инсулиновым насосом, прибыл после ночного голодания до принятия утреннего болюса с помощью насоса. Объект находился в положении лежа на спине. Уровень глюкозы в крови объекта был стабилизирован на уровне 100 мг/дл. Болюс инсулина был выдан, используя инсулиновый насос субъекта (0,15 Ед/кг). Насос был закрыт с конца введения болюса. Капельное внутривенное вливание 20%-ной декстрозы было отрегулировано, чтобы поддерживать уровень глюкозы в крови приблизительно на уровне 100 мг/дл. Частый забор крови (каждые 5-10 минут) использовался для регулирования скорости инфузии глюкозы (GIR), как это требуется для жесткого контроля гликемического уровня глюкозы.
Вышеупомянутая описанная процедура была выполнена с тем же самым субъектом при тех же самых условиях с использованием и без использования нагревающего устройства. Типичный результат показан на Фиг.26а. Эти два графика показывают GIR в миллиграммах глюкозы в минуту на один кг веса субъекта от времени. Непрерывная линия показывает GIR без терапии нагрева, тогда как штриховая линия показывает GIR на том же самом субъекте с нагреванием. Видно, что время достижения максимума значительно сократилось с 75 минут без нагрева 21 до 50 минут с нагреванием 20. GIR также уменьшается, что является признаком очистки систем циркуляции от инсулина и прекращения его системных эффектов, которое было намного быстрее с нагреванием 22, чем без нагревания 23. Оба эти параметры важны для лучшего контроля уровня глюкозы, так как задержка пикового действия может вызвать повышение уровня глюкозы незамедлительно после приемов пищи, а остаточный уровень инсулина в ткани и в крови может вызвать позднюю гипогликемию и создать ошибку в оценке эффекта следующего болюса инсулина. Эти два параметра (задержка в пике действия инсулина и остаточный уровень инсулина), которые важны для жесткого контроля уровня глюкозы, также очень важны для автоматического управления частотой подкожной инфузии инсулина, используя непрерывный датчик глюкозы и управляющий алгоритм. Предпринималось много попыток создать такую "искусственную поджелудочную железу", начиная с разработок непрерывных мониторов глюкозы. В этом случае любая задержка, такая как текущие задержки абсорбции инсулина и времени действия, любая изменчивость в этой задержке и любая изменчивость в остаточном уровне инсулина в теле вызывает ошибку в управляющем алгоритме, что приводит к менее жесткому регулированию уровня глюкозы. Таким образом, другим использованием способов и устройств в соответствии с настоящим изобретением является объединение их с датчиком глюкозы, устройством доставки инсулина и управляющим алгоритмом, чтобы обеспечить лучшую точность и надежность системы управления уровнем глюкозы с замкнутым контуром.
Тот же самый протокол и протокол теста проводились на переносимость еды, в котором диабетические пациенты принимали жидкую еду и использовали ту же самую болюсную дозировку инсулина (0,15 Ед/кг), используя свой инсулиновый насос, снова с нагревом и без нагрева области инфузии с использованием того же самого устройства. Концентрация инсулина в крови была измерена на образцах крови, используя комплект иммунологического обследования инсулина DRG. Результаты фармакокинетики или профиль концентрации инсулина в крови после инфузии болюса от обоих экспериментов показаны на Фиг.26b. Графики представляют собой усредненное от 11 субъектов, которые имели болюс инсулина 0,15 Ед/кг с использованием и без использования нагревающего устройства. График четко показывает, что концентрация инсулина в крови для того же самого количества введенного инсулина значительно выше в первые 2 часа, когда используют указанное нагревающее устройство. Площадь под кривой, ограниченная 1 часом, показывает улучшение в количестве абсорбированного инсулина в кровь больше чем на 30%. Это улучшение в фармакокинетики инсулина приводит к улучшению фармакодинамики инсулина, как показано на Фиг.26а, уменьшая время до начала действия, уменьшая время достижения максимума действия и других эффектов описанных ранее.
Медицинские и/или косметические устройства для доставки лекарственных средств
Некоторые варианты выполнения настоящего изобретения относятся к способу и устройству для улучшения выполняемой функции имплантируемых устройств или устройств, выполненных с возможностью размещения на коже. Комбинация источников излучения, и/или тепла, и/или механических колебаний, и/или всасывания применена к ткани автоматически путем прикрепления устройства, выполненного с соответствии с настоящим изобретением, рядом с имплантируемым устройством, чрескожным катетером или устройством, помещенным на кожу, служащим либо как датчик, катетер, либо как модуль, который скрыт в ткани (первое устройство). Устройство, выполненное с соответствии с настоящим изобретением, может также быть частью катетера, который имеет одну часть, расположенную в ткани, и другую часть, соединенную с узлом снаружи ткани. Свойства отдельного источника возбуждения, или комбинации источников стимуляции, так же как и свойства каждого источника возбуждения (такие как амплитуда, фаза, частота), так же как относительное отношение и временные параметры между различными источниками возбуждения могут автоматически управляться процессором, чтобы добиться требуемого отклика от ткани рядом с устройством. Активация первого устройства автоматически приводит к запуску устройства, выполненного в соответствии с настоящим изобретением, или же устройство, выполненное в соответствии с настоящим изобретением, определяет работу первого устройства и начинает работу, прикладывая стимуляцию к ткани, или же устройством, выполненным в соответствии с настоящим изобретением, управляют в заранее заданное время в течение заранее заданного промежутка времени. Отклик ткани на стимуляцию увеличивает функциональные возможности первого устройства. Это усиление может быть вызвано, но не ограничивается изменением кинетики молекулярного транспорта между первым устройством и тканью. Либо отклик ткани на стимуляцию увеличивает кинетику молекулярного транспорта между наконечником катетера, размещенным в ткани, и тканью вокруг него.
Устройство стимуляции или обнаружения стимуляции будет упоминаться как второе устройство. Первое устройство и второе устройство могут быть размещены либо внутри ткани, либо на коже, или же второе устройство может быть размещено снаружи ткани, тогда как первое устройство внутри ткани. Первое устройство может быть механически или с помощью электроники, либо механически и с помощью электроники соединено со вторым устройством, или же второе устройство может быть размещено на поверхности ткани выше первого устройства, или же второе устройство может быть частью первого устройства.
Второе устройство содержит по меньшей мере один из следующих источников стимуляции или по меньшей мере одну комбинацию из двух следующих источников стимуляции: по меньшей мере одного источника тепла (такого как высокотемпературный резистор), или по меньшей мере одного отверстия всасывания, активизированного насосом, или по меньшей мере одного источника механической вибрации или по меньшей мере одного ультразвукового передатчика, или по меньшей мере одного ультразвукового преобразователя, или по меньшей мере одного электрического электрода, или по меньшей мере одного источника света или лазерного источника излучения, или по меньшей мере одного оптического волокна, или по меньшей мере одного электромагнита или постоянного магнита, или комбинацию более двух источников, выбранных из источников тепла, колебаний, всасывания, ультразвука, света, электронного электрода, магнита. Источник света может испускать импульсный свет или непрерывный свет, а импульсный источник света может также испускать импульсы, который годятся для генерации фотоакустических или термоакустических сигналов на первом устройстве и/или в ткани, окружающей первое устройство.
Комбинация стимуляций, созданных вторым устройством, реагирует с областью ткани, окружающей первое устройство, при этом реакция усиливает функциональные возможности первого устройства. Или же отклик ткани на стимуляцию или комбинацию стимуляций усиливает кинетику молекулярного транспорта между наконечником катетера, размещенным в ткани, и областью ткани вокруг него.
Второе устройство содержит по меньшей мере две части, причем одна часть используется для закрепления второй части на месте относительно ткани. Одна часть может также быть одноразовой, тогда как другая часть, которая содержит электронику, является повторно используемой. Однако специалистам в этой области техники должно быть понятно, что устройство может быть выполнено в виде одной части или в виде больше чем одной части и что электроника, контроллер, источник питания и модули генерации поля могут быть все размещены в одном контейнере или больше чем в одном контейнере. Источник питания может также быть аккумулятором, или устройство может быть присоединено к линии электропередачи.
Некоторые варианты выполнения относятся к чрескожному катетеру, который используется вместе с инсулиновым насосом для подкожной доставки инсулина, эта часть упоминается как "первое устройство". Второе устройство размещено на поверхность ткани выше катетера, при этом стимуляция от второго устройства уменьшает биозагрязнение катетера. Второе устройство может функционировать независимо от первого устройства, или же оно может обмениваться данными (в проводном и/или беспроводном режиме) с первым устройством. Второе устройство может также использовать источник питания первого устройства.
В некоторых вариантах выполнения чрескожный катетер, который является "первым устройством", излучает поле в низкой РЧ области, которое генерируется между проводом и внешним электродом или между электродами на проводе "второго устройства". Эта область изменяет отклик ткани на инородное тело и обеспечивает лучшие функциональные возможности катетера.
В некоторых вариантах выполнения постоянное или имплантируемое устройство, - "первое устройство", имеет конструкцию и состав материалов, которые усиливают механические колебания, вызванные вторым устройством. Такое усиление может быть достигнуто путем выполнения корпуса первого устройства так, чтобы он входил в резонанс с полем излучения, создаваемым вторым устройством, которое может создаваться ультразвуковыми волнами. Материал первого устройства может быть выполнен с возможностью поглощения излучения света и испускания ультразвуковых волн благодаря термоакустическому или фотоакустическому эффекту. Электрод, предусмотренный вдоль первого устройства, может взаимодействовать с приложенным электромагнитным полевым или магнитным полем, сгенерированным вторым устройством.
В некоторых вариантах выполнения чрескожный катетер представляет собой катетер, который используется вместе с инсулиновым насосом, чтобы осуществить подкожную доставку инсулина, - является "первым устройством". Второе устройство, размещенное на поверхности ткани, стимулирует ткань светом, или теплом, или механическими колебаниями, или всасыванием или электрическим током, или ультразвуком, или ВЧ частотами, или комбинацией по меньшей мере двух из тепла, колебаний, всасывания, ультразвука, света, электронного электрода, магнита, ВЧ частоты, которые приводят к реакции в ткани рядом с катетером. Эта реакция стимулирует ткань, уменьшает биозагрязнение и улучшает динамику передачи инсулина в ткань.
В некоторых вариантах выполнения чрескожный катетер представляет собой катетер, который используется вместе с инсулиновым насосом, чтобы осуществить подкожную доставку инсулина, - является "первым устройством". Второе устройство, размещенное на поверхности ткани, освещает ткань светом, который вызывает фотоакустическую или термоакустическую реакцию на чрескожной ткани рядом с катетером. Эта реакция стимулирует ткань, уменьшает биозагрязнение и улучшает динамику передачи инсулина в ткань.
В некоторых вариантах выполнения первое устройство представляет собой клейкую мягкую прокладку, содержащую клейкий слой для прикрепления к коже и сопряженный слой. Сопряженный слой может представлять сжиженный или отвержденный гель. Состав указанного геля может содержать молекулы, отличные от воды. Второе устройство содержит источник питания и источник стимуляции. Источник питания может быть аккумулятором. Аккумулятор может быть выполнен заменимым или вмонтированным в устройство. Источник стимуляции может быть выполнен с возможностью отсоединения от устройства или вмонтированным в него. Аккумулятор поставляет питание источнику стимуляции. Источник стимуляции является комбинацией источника освещения света или лазера и ультразвукового источника. Стимуляция от второго устройства используется для усиления кинетики молекулярного транспорта, присутствующего в геле, к ткани. Первые и вторые устройства могут механически быть заключены в двух контейнерах или в одном контейнере.
Фиг.48 изображает иллюстративное устройство доставки лекарственных средств, причем первое устройство, или первая часть, представляет собой постоянный катетер инфузионного насоса, вставленного в ткань, в соответствии с некоторыми вариантами выполнения настоящего изобретения. Второе устройство, или вторая часть, объединяет ультразвуковой преобразователь с источником света или лазером в одном контейнере. Контейнер также содержит электронные цепи управления, контроллер и источник питания. Контейнер помещен на кожу выше катетера первого устройства с помощью клейкой ленты с механическими средствами крепления, чтобы удерживать контейнер на ленте.
Фиг.49 изображает иллюстративное устройство доставки лекарственных средств, в котором средство крепления к коже содержит источник питания, источник стимуляции, клейкое средство к коже и слой сопряжения между источником стимуляции и кожей в соответствии с некоторыми вариантами выполнения настоящего изобретения. Слой сопряжения может представлять собой сжиженный гель или отвержденный гель. Состав указанного геля может содержать молекулы, отличные от воды. Второе устройство содержит источник питания и источник стимуляции. Источник питания может быть аккумулятором. Аккумулятор может быть выполнен заменимым или вмонтированным в средство крепления. Источник стимуляции может быть выполнен с возможностью отсоединения от устройства или вмонтированным в него. Аккумулятор поставляет питание источнику стимуляции. Аккумулятор может выполнен путем нанесения чернил на полимерный материал - Power Paper Ltd., Petch Tikva, Израиль (www.powerpaper.com). Источник стимуляции является комбинацией источника освещения света или лазера и ультразвукового источника. Ультразвуковая часть источника стимуляции может быть выполнена из тонкослойного пьезоэлектрического материала, нанесенного на слой светоизлучающего полимера, такого как полифенилвинелин (ПФВ). Тонкий слой пьезоэлектрического материала может также быть выполнен из поливинилиденфторида (ПВДФ). Если слой пьезоэлектрического полимера может быть выполнен пропускающим свет, излучаемый слоем светоизлучающего полимера, то слой светоизлучающего полимера может быть размещен сверху слоя пьезоэлектрического материала.
Способ и система для доставки лекарственных средств с помощью облучения ткани
Некоторые варианты выполнения настоящего изобретения относятся к устройствам, способам и приборам для улучшения и стабилизации фармакокинетики и фармакодинамики лекарственных средств, введенных в ткань катетером и абсорбированных в кровеносную систему. Описанные здесь устройство и приборы прикладывают дополнительную терапию или стимуляцию к области ткани, где введено лекарственное средство. Дополнительная терапия включает электромагнитное излучение, которое, как описано здесь дальше, включает облучение светом ткани.
В соответствии с некоторыми вариантами выполнения предусмотрено устройство для улучшения работы основанного на катетере устройства доставки лекарственных средств независимо от того, является ли катетер внешним элементом по отношению к насосу или элементом, вмонтированным в механизм насоса, который также комбинирует терапию электромагнитным излучением, например, от источника электромагнитного излучения. Применение терапии электромагнитным излучением может быть выполнено в некоторых вариантах выполнения по существу одновременно с процессом инфузии лекарственных средств. Описанное здесь устройство также может быть частью катетера, который имеет одну часть, размещенную в ткани, и другую часть, которая соединена с узлом снаружи ткани.
Терапия электромагнитным излучением применена к области ткани, к которой доставляется лекарственное средство, чтобы подвергнуть ее действию электромагнитного излучения и/или эффекту, вызванному электромагнитным излучением, чтобы улучшить фармакокинетику или фармакодинамику лекарственного средства. Эффект может включать, но не ограничен, нагреванием, акустической стимуляцией, основанной на свете стимуляцией и т.п.
Радиационная терапия, раскрытая в настоящем изобретении, области ткани любым типом электромагнитного излучения совместно с инфузией лекарственных средств в тело пациента включает оптическое излучение, чтобы вызвать различные типы эффектов терапии (или стимуляцию).
Например, здесь описано использование оптического излучения для выполнения терапии кожи, чтобы добиться улучшения фармакокинетики и/или некоторого другого фармацевтически зависящего параметра для введения лекарственных средств через систему насоса, например посредством инфузии. Терапия тканей оптическим излучением в соответствии с настоящим изобретением может быть выполнена светом на большом количестве длин волн от инфракрасного до ближнего ультрафиолетового или короче чем ультрафиолетовые длины волн. Кроме того, большее разнообразие инструментов может использоваться для обеспечения такого света, включая, но не ограничиваясь, лазерами, такими как лазерные диоды, включая одноэлементные диоды или линейки или матрицы лазерных диодов, VECSELs (лазеры с поверхностным излучением с вертикальным внешним резонатором) или твердотельные лазеры, оптоволоконные лазеры, другие типы лазеров, СИД, ртутные дуговые лампы, ксеноновые дуговые лампы, другие типы ламп и т.п. Источник света может испускать импульсный свет или свет непрерывной волны или их комбинацию. Если испускается импульсный свет, то в некоторых вариантах выполнения определяется одна или большее количество деталей импульса в соответствии с одним или большим количеством фармацевтических требований введенного лекарственного средства.
Инструменты могут излучать широкополосный спектр свет и/или узкий спектр света. Если инструменты излучают более широкополосный свет, чем требуется, один или большее количество фильтров могут быть использованы для уменьшения ширины полосы спектров света, осуществляющего терапию ткани. Радиационные устройства, используемые для облучения ткани, могут также содержать зеркала, линзы, волоконную оптику и другие подобные компоненты, чтобы сфокусировать свет на конкретной области или областях.
При обстоятельствах, в которых радиационный узел генерирует свет, который должен быть применен к ткани, свет может включать длины волн в диапазоне от приблизительно 300 до приблизительно 3000 нм. Свет может быть широкополосным светом, включая большую часть этих длин волн, В некоторых вариантах выполнения излученный свет включает излучение в ближнем инфракрасном диапазоне длин волн, и/или более коротких длин волн, и/или более длинных длин волн. Например, для света в ближнем инфракрасном диапазоне длины волн включают диапазон длин волн от приблизительно 700 до приблизительно 1000 нм. Для света, имеющего более длинные волны, длины волн лежат в инфракрасной области. Электромагнитное излучение более высокой частоты, такое как электромагнитные волны в диапазоне терагерц (соответствующие длинам волн в диапазоне миллиметра, микрометра или РЧ (радиочастоты) также возможно).
В некоторых вариантах выполнения низкочастотная РЧ энергия применена на уровне (например, уровне мощности), который является неабляционным. Например, радиочастотная энергия в диапазоне от 50 до 2000 кГц может быть выбрана, чтобы быть неабляционным для субъекта. Радиочастотная энергия может быть приложена как большее количество импульсов. В некоторых вариантах выполнения могут использоваться одиночные или составные электроды. Электроды могут осуществлять контакт с кожей и могут, в некоторых выполнениях, проникать через кожу. В некоторых вариантах выполнения катетер используется для доставки лекарственных средств по меньшей мере с одним электродом, внедренным в катетер. Каждый электрод может быть изготовлен из одного или большего количества проводящих металлов, включая, но не ограничиваясь, платиной, иридием, золотом, серебром, нержавеющей сталью, нитинолом или сплавом этих металлов.
В некоторых вариантах выполнения устройство содержит катетер, вставленный в ткань, чтобы ввести вещество в эту область ткани. Область ткани может представлять собой один из слоев кожи или подкожной ткани или более глубоких элементов ткани внутри любого органа или внутренних органов.
Катетер также может содержать прикрепляющую механическая часть или устройство, которое приклеивается к коже и прикрепляет катетер на его место, чтобы препятствовать его случайному вытаскиванию. Проксимальный конец катетера может быть присоединен к устройству доставки лекарственных средств, которое управляет профилем инфузии лекарственных средств. Устройство доставки лекарственных средств управляет также дополнительной терапией (например, облучением), приложенной к области инфузии ткани. Устройство доставки лекарственных средств и терапевтический модуль (например, излучающий узел) могут находиться в состоянии обмена данными с другим устройством, чтобы передавать данные, основываясь на которых могут быть выполнены операции устройства доставки лекарственных средств и излучающего узла. Обмен данными может быть либо проводным, либо беспроводным. Части терапевтического устройства могут быть расположены внутри устройства доставки лекарственных средств или снаружи его. Устройство доставки лекарственных средств может содержать насос доставки лекарственных средств, такой как инсулиновый насос.
Насос может содержать электронный терапевтический узел, определяющий в соответствии, например, с заранее заданным протоколом осуществляемой процедурой, любыми дополнительными входными данными и профилем инфузии лекарственных средств, когда и до какой степени должно быть приложено электромагнитное излучение. Электронный узел обработки данных насоса в некоторых вариантах выполнения может обмениваться данными с узлом обработки данных терапевтического модуля. Узел обработки данных терапевтического модуля определяет в соответствии с заранее заданным протоколом процедуру, а в соответствии с профилем инфузии лекарственных средств, когда и в какой степени должно быть приложено электромагнитное излучение. Электронный узел обработки данных насоса и/или узел обработки данных терапевтического устройства регулярно запрашивает статус насоса, например, используя встроенную способность насоса обмениваться данными. Полученные данные затем используются для определения параметра(ов) терапии электромагнитным излучением.
Датчики, обменивающиеся данными с источником электромагнитного излучения, могут обнаруживать лекарственное средство, доставляемый в тело пациента через катетер. В ответ на обнаруженную доставку лекарственных средств терапевтический модуль применяет терапию (например, излучение) в соответствии с заранее заданным протоколом или процедурой. В некоторых вариантах выполнения терапевтический модуль содержит датчик, который может обнаруживать поток инфузии лекарственных средств в катетере и доставлять информацию узлу обработки данных устройства, который затем определяет параметр(ы) терапии электромагнитного излучения. Поток лекарственных средств может быть обнаружен, например, посредством оптических датчиков, которые обнаруживают поток лекарственных средств через катетер (например, при обстоятельствах, при которых используется прозрачный или полупрозрачный катетер), лазерный доплеровский датчик, ультразвуковой доплеровский датчик, датчик давления, датчик проводимости и/или датчик индуктивности, который может измерять изменения в скорости потока инфузионной текучей среды, под действием индуцированного магнитным полем (к примеру). Датчик потока лекарственных средств может обнаруживать не только наличие потока инфузии лекарственных средств, но также и скорость инфузии и использует информацию, чтобы определить, по меньшей мере частично, процедуру терапии. Датчик инфузии лекарственных средств может обнаруживать электромагнитную или акустическую эмиссию двигателя насоса доставки лекарственных средств или электроники. В некоторых вариантах выполнения устройства обнаруживают дополнительные параметры, имеющие отношение к ткани, и также используют эту информацию, чтобы определять или управлять процедурой терапии (например, вычислять параметры, релевантные процедуре терапии).
Со ссылкой на Фиг.18, источник света может быть расположен в третьем узле (не показан), а излученный свет может быть доставлен оптическим волокном или несколькими волокнами к оптическому излучающему элементу 301. Третий узел может быть прикреплен снаружи к устройству доставки лекарственных средств для повышения удобства пользователя. При этих обстоятельствах волокно или волокна могут быть расположены вблизи трубки 303 катетера, например оптическое волокно(на) может быть присоединено к внешней оболочке, ограничивающей трубку 303 катетера, и проходить вдоль трубки. Оптическое волокно(на) и трубка 303 могут тогда быть отделены вокруг устройства доставки лекарственных средств таким образом, чтобы трубка 303 катетера лекарственных средств могла быть вытянута и соединена с устройством доставки лекарственных средств (не показан), при этом волокно или волокна соединяют с третьим узлом, который содержит по меньшей мере один источник света. Третий узел может также содержать источник питания и контроллер (не показаны). Когда начинается доставка лекарственных средств, например во время доставки болюса лекарственных средств, статус состояния работы доставки лекарственных средств может быть передан третьему узлу либо активно непосредственным обменом данными между устройством доставки лекарственных средств и третьим узлом, либо пассивно посредством сигналов, сгенерированными датчиком, обнаруживающим статус состояния и/или начала операции доставки лекарственных средств, например, электромагнитной эмиссии устройством доставки лекарственных средств.
Элемент 301 оптического излучения может быть расположен в фиксирующем узле катетера, таком как оболочка (не показана), окружающая трубку 303 катетера. Одним эффектом, вызванным электромагнитным излучением, является нагревание области ткани, подвергнутой действию излучения. Приложение электромагнитного излучения может использоваться, чтобы управлять температурой области ткани, в которую доставляется лекарственное средство. Температурный контроль может использоваться для установки профиля возрастания температуры с известной скоростью, сопровождаемой стабилизацией температуры в течение заранее заданного промежутка времени, и заканчивается возвращением к нормальной температуре ткани. Этот профиль может быть применен, например, путем освещения области ткани с введенным лекарственным средством электромагнитным излучением. Температурный профиль может быть применен к большей области, чем области ткани с введенным лекарственным средством, чтобы избежать рассеяние света в ткани. Такое выполнение может улучшить перфузию крови вблизи области ткани с введенным лекарственным средством, увеличивая, таким образом, далее скорость абсорбции лекарственных средств в кровеносную систему через увеличение доступного объема абсорбции. Температурный профиль может быть применен к области, меньшей, чем область ткани с введенным лекарственным средством, обеспечивая, таким образом, сохранение энергии (например, при обстоятельствах, при которых используется аккумулятор с ограниченной емкостью).
Другое иллюстративное устройство для выполнения облучения излучением области ткани, в которую доставляется лекарственное средство, схематично показано на Фиг.27. Как показано, терапевтическое устройство 2710 содержит катетер 2703 инфузии и по меньшей мере один элемент 2702 источника излучения, прикрепленный к коже (не показан) в области вокруг катетера 2703. Терапевтическое устройство 2710 также содержит круглую конструкцию 2705 с отверстием 2711 в его центре для трубки 2703 катетера, который подкожно вставлен в ткань кожи. Другая сторона катетера 2703 соединена с насосом доставки лекарственных средств (не показан). Элемент 2702 источника излучения может содержать один или большее количество источников 2712 света.
Как далее показано, температурный датчик 2706 расположен в контакте с освещенной областью кожи, чтобы регулировать температуру кожи до требуемой температуры в соответствии с процедурой управления температурой или температурным профилем. Регулирование температуры ткани может быть основано на измеренных значениях температуры, измеренных датчиком 2706. Температурный датчик 2706 соединен с узлом 2713 контроллера, расположенным в катетере 2703 или в устройстве доставки лекарственных средств (не показан) и/или в третьем узле (не показан). В некоторых вариантах выполнения температура лежит в диапазоне между 32 и 40 градусами С. Этот диапазон температуры, как было найдено, имеет значительный эффект на ткань, не нанося повреждения или травмы ткани. Профили/процедуры температурной стабилизации могут быть осуществлены с использованием контроллеров и/или ASICs (специализированных интегральных схем). Может быть использована система охлаждения кожи, как описано, например в патенте США №5344418, содержание которого включено в этот документ во всей полноте посредством ссылки. Повреждение кожи или ткани зависит от приложенной температуры и времени экспонирования теплу. Для относительно короткого периода экспонирования, например несколько минут, могут использоваться еще более высокие температуры, например до 42 градусов С. При некоторых обстоятельствах могут требоваться более низкие температуры. Например, инсулин Novolog требует максимальной температуры 37 градусов С в области инфузии инсулина ткани. Однако при этих обстоятельствах температура кожи может быть немного выше, чем эта температура, поскольку область инфузии инсулина ткани может иметь более низкую управляемую температуру.
В качестве дополнения и/или альтернативы, температурный датчик (не показан) расположен в трубке 2703 катетера. Этот температурный датчик обеспечивает более непосредственное управление температурой области ткани с введенным лекарственным средством, обеспечивая, в свою очередь, потенциально лучшую стабилизацию химических процессов лекарственных средств, или фармакокинетику, или абсорбцию в кровеносную систему, или фармакодинамику, которая может быть достигнута. В ситуациях, в которых доставляемое лекарственное средство является инсулином, важно уменьшить изменчивость временного профиля абсорбции инсулина в кровь и более точно регулировать управление температурой.
Указанный по меньшей мере один элемент 2702 источника излучения и один или два из температурных датчиков может быть соединен с насосом доставки лекарственных средств через кабель 2704. При этих обстоятельствах насос доставки лекарственных средств содержит источник питания и контроллер процесса терапии (не показан).
Круглая конструкция 2705, которая покрывает по меньшей мере один элемент 2702 источника излучения, может быть теплоизолирована таким образом, чтобы плоская круглая конструкция 2705 уменьшала диссипацию тепла в окружающую среду при использовании круглой покрывающей конструкции 2705, что также облегчает тепловую регуляцию (например, стабилизацию) области инфузии ткани в ситуациях, в которых окружающая среда и/или окружающая температура претерпевают изменения.
Указанный по меньшей мере один элемент 2702 источника излучения генерирует излучение, чтобы осуществлять терапию области инфузии лекарственных средств ткани, как здесь описано. В некоторых вариантах выполнения ткань является тканью, к которой приложено тепло, созданное в процессе генерации фактического излучения. Например, если излучение включает свет, то преобразование электроэнергии в энергию света осуществляется либо посредством сопротивления источника излучения, либо посредством неизлучающих переходов. При этих обстоятельствах комбинация созданного нагревания и излучения приложена к ткани, чтобы лучше и/или более эффективно создавать требуемый эффект.
В некоторых вариантах выполнения устройство 2710, как показано на Фиг.27, прикреплено к коже с помощью клейкой ленты 2715. Клейкий слой 2701 ленты 2715 может также покрыть по меньшей мере один элемент 2702 источника излучения, например, прозрачным клейким слоем. Клейкая лента 2715 первоначально покрыта многослойной структурой (не показана), которая счищается пользователем перед вставлением катетера 2703 и элемента 2702 источника излучения. В целом, для облегчения вставления катетера устройство снабжено стерильной иглой, расположенной в катетере 2703 (не показана), которую удаляют после вставления катетера 2703 в требуемую область ткани. Клейкий слой ленты 2715 может частично поглощать электромагнитное излучение, чтобы увеличить нагрев наружного слоя кожи, что может быть необходимо для конкретного распределения глубины нагревания для оптимизации профиля нагрева и/или эффективности нагрева.
Со ссылкой на Фиг.28 изображено другое иллюстративное терапевтическое устройство. Терапевтическое устройство содержит трубку 2803 катетера, выполненную с возможностью направления электромагнитного излучения через трубку и для облучения излучением, испущенным с конца 2801 трубки, области ткани с введенным лекарственным средством (не показана) Как показано, свет из указанного по меньшей мере одного источника 2806 излучения попадает в трубку 2803 рядом с устройством 2804 доставки лекарственных средств через устройство 2807 сопряжения света. Источник излучения может быть частью устройства 2804 доставки лекарственных средств. В качестве альтернативы, источник 2806 излучения может быть размещен в отдельном третьем узле, как показано, который присоединен к устройству 2804 доставки лекарственных средств. Чтобы облегчить сопряжение света в трубку 2803, источник 2806 излучения может быть прикреплен к трубке 2803 в месте расположения устройства 2805 сопряжения света и может быть иначе расположен, чтобы быть по существу совмещенным с продольной осью трубки, когда лекарственное средство, вытекающее из устройства 2804 доставки лекарственных средств, входит в трубку 2803 сбоку. Сгенерированный свет, таким образом, направлен по всей длине трубки 2803, пока это не разделится в конце 2801 трубки, расположенном проксимально к области инфузии лекарственных средств. Разделенное излучение впоследствии поглощается областью ткани. Сгенерированный свет направлен через любой изгиб в трубке 2803.
Наконечник 2801 катетера может быть прикреплен к коже, используя устройство 2802 прикрепления катетера с помощью клейкого слоя 2800. В некоторых вариантах выполнения устройство 2802 прикрепления также содержит по меньшей мере один температурный датчик на коже, катетере или в области ткани с введенным лекарственным средством, чтобы облегчить температурное регулирование ткани. Температура области ткани с введенным лекарственным средством может контролироваться неинвазивно через катетер, например путем измерения ИК излучательной способности ткани или осуществляя другие процедуры для оптического неинвазивного температурного контроля.
Со ссылкой на Фиг.29 изображено иллюстративное устройство для сопряжения и направления света через трубку, которая также переносит лекарственное средство. В некоторых вариантах выполнения свет направляется в трубке 2919 доставки лекарственных средств стенками 2916 трубки. Материал стенок трубки 2916 выбран, основываясь на типе направляемого света с учетом обеспечения приемлемой компенсации света для любого рассеяния света, которое может произойти. Лекарственное средство доставляется устройством 2910 доставки лекарственных средств через соединитель 2911 трубки. По меньшей мере один источник света показан схематично прямоугольником 2912. Сгенерированные световые лучи 2914, показанные схематично линиями в виде отраженных лучей, направлены и/или управляются с помощью оптического устройства (например, устройства сопряжения, и т.д.) или волноводом 2913, чтобы обеспечить соответствующую эффективность сопряжения при входе в трубку 2919 лекарственных средств. Различие между коэффициентом преломления лекарственного средства 2918 и стенкой 2916 трубки позволяет световым лучам 2914 распространяться по трубке. Чтобы достигнуть эффективного направления света, основной материал волновода (который при этих обстоятельствах будет содержать материал 2918 лекарственного средства) обязан иметь более высокий коэффициент преломления, чем стенки 2916 (стенки волновода упоминаются как "оболочка"). Например, в некоторых вариантах выполнения вводится лекарственное средство, которое, когда растворено в воде, имеет оптический коэффициент преломления, равный приблизительно 1,33. Если при этих обстоятельствах стенка 2916 трубки будет изготовлена из полимера, имеющего коэффициент преломления, равный приблизительно 1,4-1,5, то направление света не будет эффективным (поскольку стенка волновода имеет коэффициент преломления выше, чем коэффициент преломления среды, составляющей сердцевину). Однако эффективность направления света может быть значительно улучшена, выбирая полимеры, имеющие для стенки 2916 трубки более низкий коэффициент преломления и/или с покрытием внутренней стороны трубки 2915 (т.е. поверхности стенки 2916 трубки) из тонкого слоя светоотражающего покрытия 2920, которое содержит, например, один или большее количество металлов, таких как алюминий, серебро, золото, и т.д. Светоотражающее покрытие может быть покрыто защитным слоем, выполненным из полимера или других биологически совместимых материалов. При этих обстоятельствах свет будет направляться через результирующую покрытую трубу с очень небольшой потерей. Внешние поверхности 2917 стенок 2916 трубки могут также быть покрыты отражающим покрытием.
Длина волны света выбрана такой, чтобы иметь очень низкую скорость поглощения водой. Подходящими световыми волнами являются те, которые имеют длину волны в диапазоне от 300 до 1300 нм. Внутреннее покрытие 2920 может также быть выполнено из полимера, имеющего низкий коэффициент преломления, чтобы достигнуть лучшего направления света.
Со ссылкой на Фиг.30 изображено другое иллюстративное терапевтическое устройство, в котором трубка доставки лекарственных средств также функционирует как волновод, при этом наружная сторона трубки 3029 доставки лекарственных средств может быть покрыта отражающим покрытием 3027. Устройство 3020 доставки лекарственных средств, соединитель 3021 трубки и источник 3022 света могут быть выполнены аналогичными соответствующим компонентам/модулям, показанным на Фиг.29. Оптический формирующий сопрягающий элемент 3023 выполнен с возможностью оптимизации эффективности сопряжения для света (показаны схематично как линии в виде отраженных лучей) 3024. При этих обстоятельствах свет 3024 направляется через раствор 3028 лекарственного средства (представляющего собой центральное ядро волновода) и прозрачную стенку трубки 3026. Отражающее покрытие может также быть покрыто защитным слоем. Такое выполнение волновода может также использоваться без нанесения отражающего покрытия 3027 на наружные поверхности трубки 3026, потому что коэффициент преломления воздуха (1) меньше, чем коэффициент преломления полимерной трубки 3026. Однако любой объект, касающийся трубки, например живот пациента, может вызвать утечку света. В некоторых вариантах выполнения стенка трубки 3026 выполнена из двух слоев с различными коэффициентами преломления таким образом, чтобы наружный слой имел меньший коэффициент преломления и служил оболочкой для оптического волновода. Аналогично конструкции, показанной на Фиг.29, стенки 3026 могут также быть покрыты отражающим покрытием 3025.
Со ссылкой на Фиг.31 изображено другое выполнение волновода. В конструкции, показанной на Фиг.31, свет 3136 показан схематично линиями в виде отраженных лучей на стенке трубки. Устройство 3130 доставки лекарственных средств, трубка 3139 доставки лекарственных средств, соединитель 3131 трубки и источник 3132 излучения могут быть выполнены аналогичными соответствующим компонентам/модулям, описанным в отношении Фиг.29 и 30. Оптический формирующий сопрягающий элемент 3134 установлен в механическом адаптере 3133. Может быть достигнута приемлемая (возможно, оптимальная) эффективность сопряжения света путем выполнения секции волновода в виде круглого кольца, имеющего форму, подобную форме трубки 3139 в поперечном сечении. Чтобы осуществить сопряжение света в круглый кольцевой волновод, могут быть использованы подходящие оптические элементы, такие как линзы, асферичные компоненты, дифракционные оптические элементы, волоконные осветители и/или установленные источники света, имеющие круглую форму. Например, оптический формирующий сопрягающий элемент 3134, например линза, может использоваться для сопряжения света, сгенерированного в источнике 3132 света, в круглый кольцевой волновод. Конструкция, показанная на Фиг.31, может также быть использована без внутреннего покрытия 3135 и/или наружного покрытия 3137 трубки, поскольку коэффициент преломления воздуха (1) меньше, чем коэффициент преломления стенки 3136 полимерной трубки. В некоторых вариантах выполнения коэффициент преломления раствора 3138 лекарственного средства также меньше, чем коэффициент преломления стенки трубки. Однако при этих обстоятельствах любой объект, касающийся трубки, такой как, например, живот пациента, вызывает утечку света.
В некоторых вариантах выполнения отражающее покрытие также покрыто защитным слоем. Стенка 3136 трубки может быть выполнена из двух слоев, имеющих различные коэффициенты преломления, таким образом, чтобы внешний слой и раствор лекарственного средства имели меньшие коэффициенты преломления и служили оболочкой, тогда как внутренний слой стенки действовал как ядро волновода, чтобы направлять свет. Стенка 3136 трубки может быть выполнена из трех слоев с различными коэффициентами преломления таким образом, чтобы внешний слой и внутренний слой имели меньшие коэффициенты преломления и, таким образом, служили оболочкой, тогда как средний слой стенки служил ядром, чтобы направлять свет.
Со ссылкой на Фиг.32 изображено иллюстративное терапевтическое устройство 3266, в котором электромагнитный излучающий элемент расположен внутри устройства прикрепления катетера и облучает ткань через катетер. В этой конструкции катетер 3265 инфузии объединен по меньшей мере с одним оптическим излучающим элементом 3264, который обеспечивает сопряжение света в проксимальную часть 3261 катетера 3265 инфузии. Устройство 3266 прикрепления катетера содержит круглую конструкцию 3263 с отверстием 3267 в его центре, через которое трубка 3261 катетера входит в подкожную ткань. Круглая конструкция 3263 присоединена к ткани с помощью клейкого слоя 3260. Клейкий слой 3260 может изначально быть снабжен многослойной структурой (не показана), которая счищается пользователем перед вставкой катетера и присоединением оптического излучающего элемента 3264. Электромагнитный источник(и) излучения может освещать область инфузии лекарственных средств ткани через кожу. В этой конструкции клейкий слой 3260 может быть расположен либо вокруг освещенной области кожи, либо покрывать освещенную область кожи, при этом быть оптически прозрачным в соответствующей оптической длине(ах) волны. Другая сторона катетера 3265 соединена с устройством доставки лекарственных средств (не показано).
В целом, для вставления катетера устройство может быть снабжено стерильной иглой (не показана), расположенной в катетере, которую удаляют после вставления катетера. Источник питания для оптического излучающего элемента 3264 может быть расположен в узле 3266 катетера. В качестве альтернативы, источник питания для оптического излучающего элемента 3264 может быть расположен в устройстве доставки лекарственных средств и соединен с проводом с оптическим излучающим элементом 3264. В качестве альтернативы в некоторых вариантах выполнения источник питания для оптического излучающего элемента 3264 может быть расположен в третьем узле (не показан), соединенным проводами с оптическим излучающим элементом 3264. В некоторых вариантах выполнения третий узел может быть снаружи прикреплен к устройству доставки лекарственных средств для повышения удобства пользователя.
Со ссылкой на Фиг.33 изображено другое иллюстративное терапевтическое устройство, которое содержит волновод для облучения излучением области инфузии лекарственных средств ткани через конец катетера. В иллюстрированном примере, показанном на Фиг.33, электромагнитное излучение представляет собой свет. Однако для освещения области инфузии лекарственных средств ткани могут быть использованы и другие типы электромагнитного излучения. Как показано, свет от указанного по меньшей мере одного источника 3305 света сопрягается в катетер 3310. Источник 3305 света может быть частью устройства 3304 прикрепления катетера, как показано, или, в качестве альтернативы, может быть выполнен съемным (аналогично показанной конструкции, изображенной, например, на Фиг.6). Чтобы облегчить сопряжение света в катетер 3310, источник 3305 света может быть совмещен с одной и той же продольной осью трубки 3310 катетера, тогда как лекарственное средство входит в трубку 3310 катетера со стороны трубки.
В некоторых вариантах выполнения лекарственное средство передается с устройства доставки лекарственных средств через трубку 3301. Трубка 3301 может содержать соединитель 3315, имеющий одну часть 3302, прикрепленную к трубке, и вторую сопряженную часть 3303, прикрепленную к катетеру 3310. Свет, схематично изображенный линиями в виде отраженных лучей, направляется через катетер 3310, пока он не выходит в конце катетера, контактирующего с тканью, входит в область инфузии лекарственных средств ткани, где он поглощается окружающей тканью этой области.
Как далее показано на Фиг.33, свет направляется в трубке 3310 катетера стенками 3308 трубки. Свет формируется и управляется (например, путем управления направлением света) с использованием сопрягающего оптического компонента 3306, который может включать линзу или некоторый другой тип оптического устройства, или с использованием волновода, чтобы обеспечить подходящую эффективность сопряжения света в трубку 3310 катетера. Свет, управляемый сопрягающим оптическим компонентом 3306, проходит через прозрачную стенку 3320 внутрь трубки 3301 доставки лекарственных средств. Как было объяснено ранее, свет в целом распространяется внутри трубки 3301, поскольку имеется различие между коэффициентами преломления лекарственного средства (действующего как среда основы) и стенки 3308 трубки. Таким образом, характеристики направления света волноводом могут быть улучшены путем выбора полимера для трубки 3310 катетера с более низким коэффициентом преломления, или нанося покрытие на внутреннюю сторону 3307 трубки 3310 катетера из тонкого слоя светоотражающего покрытия, включая покрытие, которое содержит одно или несколько веществ, выбранных из алюминия, серебра или золота. Отражающее покрытие может быть покрыто полимерным защитным слоем или другими биологически совместимыми материалами. При этих обстоятельствах свет будет направляться трубкой с покрытием, что будет приводить лишь к небольшим потерям. Наружная сторона 3309 трубки катетера 3310 обычно не имеет нанесенного на нее покрытия.
В некоторых вариантах выполнения длину волны света (или диапазона) выбирают так, чтобы наблюдалось лишь небольшое поглощение света водой. Например, подходящий диапазон длин волн света включает длины волн в диапазоне от 300 до 1300 нм. Использование света, имеющего длину(ы) волны в этом диапазоне, уменьшает поглощение света раствором, содержащим лекарственное средство (который вообще имеет высокую концентрацию воды), предотвращая, тем самым, нагревание раствора. Эти длины волн могут быть использованы в ситуациях, в которых лекарственное средство не следует нагревать выше максимальной температуры, что касается лекарственных средств, которые содержат, например, белки.
Наконечник 3311 катетера может быть прикреплен к коже с использованием устройства 3304 прикрепления катетера с помощью клейкого слоя 3300 образом, подобным описанному в отношении других чертежей настоящего изобретения. По меньшей мере один температурный датчик (не показан) может быть размещен в одно или большее из следующего: кожу, катетер, или область ткани с введенным лекарственным средством. Указанный по меньшей мере один температурный датчик выполнен с возможностью регулирования (например, стабилизации) температуры ткани. В некоторых вариантах выполнения температура области ткани с введенным лекарственным средством контролируется неинвазивно через катетер 3310, например, измеряя ИК излучательную способность ткани, или другим способом, используя другие оптические неинвазивные способы контроля температуры.
Со ссылкой на Фиг.34, в некоторых вариантах выполнения внешняя сторона 3428 трубки катетера может быть покрыта отражающим покрытием 3429. Трубка 3421, которая доставляет лекарственное средство от устройства доставки лекарственных средств (не показано), присоединена к соединителю 3415, имеющему части 3422 и 3423. Устройство также содержит источник 3425 излучения, аналогичный источнику излучения, изображенному на Фиг.33. Оптический формирующий сопрягающий элемент 3426 используется для эффективного сопряжения света в трубку катетера. Как показано в конструкции на Фиг.34, свет, изображенный схематично линиями 3430 в виде отраженных лучей, направляется как в растворе лекарственного средства, так и в прозрачных стенках трубки 3428 катетера. Отражающее покрытие 3429 может быть дополнительно покрыто защитным слоем. Покрытие может и не быть предусмотрено в изображенной конструкции для внутренних стенок 3427 трубки 3428 катетера.
Волновод, изображенный на Фиг.34, также может использоваться без покрытия внешней стороны трубки 3428 отражающим покрытием, потому что коэффициент преломления воздуха (I) ниже, чем коэффициент преломления трубки 3428 (обычно основанной на полимере). Однако когда свет входит в часть катетера, которая расположена в ткани, свет будет просачиваться из волновода, поскольку коэффициент преломления ткани выше (см. Фиг.36). Часть катетера, в которой свет должен рассеиваться из трубки катетера, может быть частично покрыта отражающим покрытием, как будет описано подробно далее. В некоторых вариантах выполнения стенка 3428 трубки выполнена из двух слоев с различными коэффициентами преломления таким образом, чтобы внешний слой имел меньший коэффициент преломления и, тем самым, служил оболочкой для оптического волновода (не показано). В некоторых вариантах выполнения может быть предусмотрено устройство 3424 прикрепления катетера с клейким слоем 3420.
Со ссылкой на Фиг.35 изображено другое направляющее устройство для осуществления еще одной схемы направления. Как показано, свет, представленный схематично линиями в виде отраженных лучей, направляется в стенке 3548 трубки катетера 3551. Трубка 3541 устройства доставки лекарственных средств содержит соединитель 3515, который имеет, например, части 3542 и 3543 (аналогично конструкции соответствующего соединителя, изображенного на Фиг.33). Терапевтическое устройство также содержит источник 3545 излучения (аналогичный изображенному на Фиг.33). Также включено устройство 3544 прикрепления катетера с клейким слоем 3540. Оптический сопрягающий элемент 3546 может быть выполнен для сопряжения излучения из источника 3545 излучения в круглую кольцевой конструкцию, которая направляет излучение к точке выхода в конце трубки катетера. Такое оптическое формирование и/или управление для нужного сопряжения излучения в круглую кольцеобразную направляющую может быть достигнуто с использованием, например, одного или большего количества оптических элементов, таких как линзы, асферичные компоненты, дифракционные оптические элементы. Кроме того, необходимое оптическое формирование и/или управление могут также быть осуществлены, устанавливая источники света круглой формы или используя волоконные осветители для сопряжения излучения из источника излучения в направляющую. Направляющая схема, изображенная в конструкции, показанной на Фиг.35, может использоваться без нанесения покрытия на трубку 3551.
В качестве альтернативы, внешняя стенка 3549 трубки 3551 катетера, или внутренняя стенка 3547 катетера 3551, или обе стенки могут быть покрыты отражающим покрытием. Отражающее покрытие может быть покрыто защитным слоем. В некоторых вариантах выполнения часть катетера, в которой свет излучается из трубки катетера, частично покрыта отражающим покрытием. В некоторых вариантах выполнения стенка трубки 3548 катетера выполнена из двух слоев с различными коэффициентами преломления таким образом, чтобы внешний слой и раствор 3550 лекарственных средств имели меньшие коэффициенты преломления и, таким образом, служили оболочкой, тогда как внутренний слой стенки 3548 служил сердцевиной волновода и направлял свет. Второй внешний слой может покрывать только часть катетера, в которой свет должен направляться, и концы в части катетера, в которой свет выходит из трубки катетера. В некоторых вариантах выполнения стенка 3548 трубки выполнена из трех слоев с различными коэффициентами преломления таким образом, чтобы внешний слой и внутренний слой имели меньшие коэффициенты преломления и служили оболочкой, тогда как средний слой стенки 3548 служил сердцевиной, чтобы направлять свет. Третий внешний слой может покрывать только часть катетера, в которой свет должен направляться, и концы в части катетера, в которой свет выходит из трубки 3551 катетера (не показано). В некоторых вариантах выполнения коэффициент отражения по меньшей мере одного из отражающих слоев уменьшен согласно конкретному профилю в части катетера, в которой свет выходит из трубки 3551 катетера, чтобы приобрести необходимый профиль освещения области инфузии лекарственных средств.
Любая из вышеупомянутых конструкций для сопряжения или отделения света от конца катетера может использоваться со всеми различными местами расположения источника света, как здесь описано. Со ссылкой на Фиг.36 изображено другое иллюстративное терапевтическое устройство, в котором свет может направляться в трубке катетера 3670 таким образом, чтобы излучение (например, свет), представленный схематично линиями в виде отраженных лучей, распространялось в текучую среду 3669, содержащую лекарственное средство, и/или в стенках 3667 трубки, и/или в специальных слоях или конструкциях или волноводах внутри трубки 3670, или в стенке 3667 трубки, или в любой их комбинации. Свет может направляться, пока он не достигнет конца катетера, где он излучается наружу через то же самое отверстие, из которого лекарственное средство доставляется и вводится в тело пациента. Как показано, свет сильно рассеивается в ткани и освещает область, имеющую приблизительно сферическую форму (не показано), центр которой лежит, например, от 0,5 до 1 мм ниже наконечника катетера (не показан). В некоторых вариантах выполнения свет излучается изнутри катетера 3670, через, например, источник 3665 излучения.
Как и в некоторых других выполнениях устройства, описанного здесь в отношении других чертежей, устройство, показанное на Фиг.36, может содержать, например, устройство 3664 прикрепления катетера с клейким слоем 3660. Кроме того, лекарственное средство доставляется через трубку 3661 доставки лекарственных средств из устройства доставки лекарственных средств (не показано), которое содержит соединитель 3680 с частями 3662 и 3663 (аналогичными частям, показанным на Фиг.33).
В некоторых вариантах выполнения используется освещенная область большего размера, например, чтобы уменьшить интенсивность света, или количество люменов на единицу площади, например, для соображений безопасности. Поэтому в некоторых вариантах выполнения свет может излучаться через большую часть трубки 3670 катетера. В некоторых вариантах выполнения сфокусированное направление света в части трубки 3670 внутри ткани уменьшено из-за, например, контакта стенки 3667 катетера с тканью или вследствие того, что слои волновода и/или конструкции изменились, чтобы заставить свет просачиваться из волновода в смежную ткань. Как было объяснено ранее, изменение конструкции и/или материала слоев волновода могут использоваться для управления профилем освещения излучением в области инфузии лекарственных средств ткани.
В дополнение к изменению свойств слоев и/или конструкций, к концу трубки катетера могут быть добавлены дополнительные преломляющие или дифракционные элементы, чтобы лучше управлять пространственным и угловым распределением света, испущенного из конца катетера. Например, внутренняя сторона 3666 из катетера 3670 и/или внешняя сторона поверхности катетера могут быть выполнены неровными или диффузивными, чтобы рассеивать испущенный свет 3668. Неровность поверхности стенки 3667 трубки катетера может быть увеличена, например, путем нанесения рельефа на внутренние или внешние стороны. Такое нанесение рельефа может быть осуществлено во время производственного процесса по изготовлению трубки катетера или в конце производственного процесса, например, вдавливая шаблонную цилиндрическую форму в трубку или на трубку 3670, с некоторым нагреванием, которое смягчает полимер трубки. В некоторых вариантах выполнения угловое и пространственное распределение света может быть сформировано путем нанесения рельефа дифракционного оптического элемента на внутренние или внешние стороны. Рельеф дифракционного оптического элемента, такой как дифракционная решетка, может быть использован для сопряжения света в оптические волноводы или из них. Весь свет или часть света могут быть испущены из конца трубки 3670 катетера.
Устройство может обеспечивать освещение ткани как изнутри катетера, так и через кожу посредством комбинации описанных здесь способов, структур и конструкций.
Устройства, описанные здесь (в соответствии с некоторыми вариантами выполнения), могут обмениваться данными в коротковолновом РЧ или в ИК диапазоне с блоком управления и обработки данных, таким как карманный персональный компьютер (КПК), персональный компьютер, мобильный телефон и/или специализированное устройство, которое поддерживает управление терапией лекарственного средства. Например, если лекарственное средство представляет собой инсулин, то блок обработки данных может считывать показания уровня глюкозы из датчика глюкозы либо вручную, либо автоматически, либо считывая измерения глюкозы с индикаторной полоски. Устройство может также получать информацию о потребленных углеводах и других компонентах пищи и/или напитков. Устройство может также сохранять статистику пациентов и соответствующие параметры, такие как вес, индекс массы тела, сопротивляемость инсулину и т.д.
Устройство обработки данных может также вычислять оптимальное необходимое количество инсулина и оптимальный профиль облучения ткани. Эта информация может быть послана беспроводным образом в насос доставки лекарственных средств и/или излучающему устройству (для того, чтобы обеспечить электромагнитное излучение) для оптимальной доставки лекарственных средств. Излучающее устройство может передать параметры ткани, измеренные датчиками, расположенными на ней, в блок управления и обработки данных как дополнительную информацию для определения одного или большего количества терапевтических параметров и/или для будущей статистики и анализа данных. Блок управления и обработки данных может рекомендовать оптимальную дозировку лекарственных средств и оптимальный профиль облучения области инфузии ткани, которые пациент (или другой пользователь) санкционирует перед началом терапии. Блок управления и обработки данных может рекомендовать оптимальную дозировку лекарственных средств. В некоторых вариантах выполнения блок управления и обработки данных управления может быть частью насоса доставки лекарственных средств.
Со ссылкой на Фиг.37 изображено другое иллюстративное терапевтическое устройство с оптическими датчиками. Терапевтическое устройство содержит, например, два датчика 3785 и 3786. Могут быть использованы меньшее количество датчиков или дополнительные датчики различных типов. Как далее показано, устройство, изображенное на Фиг.37, содержит конструкцию одноразового насоса доставки лекарственных средств. В изображенной конструкции насос 3782 доставки лекарственных средств и по меньшей мере один источник 3783 света расположены в одном кожухе 3781, прикрепленном к коже клейким слоем 3780.
Источник света 3783 генерирует свет для освещения ткани. Свет передается ткани через катетер 3790 (свет показан схематично линией 3784 в виде отраженных лучей). Два оптических датчика 3785 и 3786 измеряют свет, проходящий через катетер 3790. Свет также отражается отражающим покрытием для внутренней стороны 3787 из стенок 3788 трубки, хотя некоторая часть света может также рассеиваться к внешней стороне 3789 стенок 3788 трубки.
Свет выходит из наконечника 3791 катетера в ткань (не показана). Затем свет рассеивается в ткань и от ткани и достигает оптических датчиков 3785 и 3786 через окна в клейком слое 3780 или, если клейкий слой прозрачен, через клейкий слой. Измерения, выполняемые оптическими датчиками 3785 и 3786, используются для определения количества поглощенного света (основываясь на том, что начальная мощность источника света известна). Если длины волн сильно поглощаются гемоглобином, как, например, в диапазоне от 600 до 1000 нм, оптические датчики 3785 и 3786 могут предоставить информацию, связанную с концентрацией гемоглобина в смежной области ткани, которая может, таким образом, дать информацию о локальной перфузии крови. Информация о перфузии крови может использоваться для осуществления контроля за уровнем излучения, распределения или длины волны.
Уровень поглощенного света может также быть оценен, измеряя свет, который обратно рассеялся в оптический волновод, сформированный трубкой 3790 катетера, направляется волноводом, а затем сопрягается из волновода, используя то же самое устройство оптического сопряжения, описанное ранее, или с использованием дополнительного устройства оптического сопряжения, в оптический датчик, используемый для измерения обратно рассеянного света (не показано).
Вышеупомянутые описанные способы, устройство и прибор для облучения ткани не ограничены насосами доставки лекарственных средств, но могут также использоваться с ручной доставкой лекарственных средств, как, например, подсоединяя шприц вместо насоса к проксимальной части катетера. При таких обстоятельствах проксимальная часть катетера может оканчиваться соединителем или отверстием, которые соответствуют наконечнику шприца. Дистальная часть катетера вставлена в ткань, как ранее описано в отношении иллюстративных конструкций доставки лекарственных средств.
Хотя катетер в вышеупомянутых вариантах выполнения был вставлен с 90-градусным углом проникновения, может быть выбран любой подходящий угол для проникновения катетера. Меньшие углы проникновения для катетера могут, с одной стороны, улучшить прикрепление, но могут также быть более болезненными при вставлении.
Следует отметить, что всякий раз, когда локальные эффекты облучения или освещения ткани описаны в области инфузии лекарственных средств, эффекты излучения или освещения могут также быть применены к большему объему ткани вблизи объема инфузии лекарственных средств или же к меньшему объему ткани, в зависимости от конкретной терапии.
Нужно отметить, что всякий раз, когда в этом документе используется слово «или», также возможен выбор указанных двух или большего количества детальных вариантов. Следует понимать, что конкретные особенности, как здесь описано, которые для ясности описаны в отношении отдельных вариантов выполнения, могут также быть осуществлены в комбинации в одном варианте выполнения. Наоборот, различные особенности, которые для краткости описаны в контексте одного варианта выполнения, могут также быть осуществлены отдельно или в любой подходящей подкомбинации.
Системы и способы стимулируемой доставки лекарственных средств
В некоторых вариантах выполнения настоящее изобретение относится к устройствами для улучшения, изменения и/или стабилизации фармакокинетического и/или фармакодинамического профиля лекарственного средства, введенного в ткань катетером и абсорбированного в кровеносную или лимфатическую систему. Устройства, описанные в некоторых из вариантов выполнения настоящего изобретения, применяют дополнительную терапию или стимуляцию к области вблизи участка доставки лекарственных средств. Терапия может быть одним способом или комбинацией способов терапии ткани, описанных в заявке на патент США №11/812,230, такими как: нагревание, изменение температуры, массирование, механическая вибрация, акустическая вибрация, ультразвук, всасывание, инфузия дополнительного вещества или химического агента, применение слабого электрического поля, применение слабого магнитного поля, облучение светом, облучение радиочастотными («РЧ») волнами, облучение волнами в микронном диапазоне («MB») и т.д. В некоторых вариантах выполнения устройство имеет катетер для вставления внутрь ткани, чтобы ввести вещество в область инфузии ткани. Область инфузии ткани (т.е. область инфузии) может быть одним из слоев кожи или подкожной ткани или более глубокими элементами ткани внутри любого органа или внутренних органов.
Во многих случаях пациенты нуждаются в круглосуточной доставке инсулина, чтобы поддерживать надлежащие уровни глюкозы в их крови. Инсулин может доставляться на основном уровне или в болюсных дозировках. Основной уровень представляет собой инсулин, который непрерывно доставляется пациенту, хотя на практике все же доставляется в маленьких периодических болюсах. Такая непрерывная доставка инсулина поддерживает уровень глюкозы в крови пациента в требуемом диапазоне между приемами пищи и в течение ночи. Во многих случаях основной уровень инсулина доставляется инсулиновыми насосами короткими импульсами инфузии каждые 1-5 минут. В некоторых вариантах выполнения способы стимуляции или терапии ткани или кожи могут использоваться для терапии или стимуляции области ткани, в которую введен инсулин во время основной доставки инсулина. Один возможный эффект терапии ткани, такой как регулирование до известной температуры участка вблизи области инфузии ткани, улучшает стабильность абсорбции инсулина в кровеносную систему и, следовательно, улучшает стабильность фармакокинетики и фармакодинамики основного инсулина. Другой возможный эффект такой терапии представляет собой повышение эффективности абсорбции инсулина и, следовательно, уменьшение количества введенного инсулина, необходимого для достижения требуемого метаболического эффекта.
Кроме того, пациент-диабетик должен вводить болюсные дозировки инсулина для соответствия их углеводам, потребляемым во время приемов пищи. Когда пациент потребляет пищу, его уровень глюкозы растет, при этом болюсные дозировки инсулина, как предполагается, соответствуют росту уровня глюкозы и предотвращают большие экскурсии глюкозы. Однако многие традиционные системы подкожной доставки лекарственных средств не способны к быстрому соответствию или предотвращению роста глюкозы в крови, что известно как постпрандиальная гипергликемия. Задержка такого соответствия также верна в случае «быстродействующих» аналогов инсулина. Некоторые из причин для этой задержки включают задержку на абсорбцию инсулина от участка инъекции и время, которое требуется для сложных молекул инсулина, чтобы распасться на мономеры.
В области техники известно, что имеются некоторые отрицательные эффекты от введения большого количества инсулина, который, кроме того, что регулирует абсорбцию глюкозы, имеет несколько дополнительных гормональных эффектов, таких как, например, является фактором роста. В некоторых случаях избыточное количество инсулина опосредованно вызывает нежелательное увеличение веса пациентов-диабетиков, в особенности тех, у которых имеется тенденция заболевания гипогликемией. В некоторых случаях избыточное количество инсулина в месте инфузии вызывает нежелательную локальную липогипертрофию.
В некоторых вариантах выполнения способы терапии или стимуляции ткани или кожи могут использоваться для выполнения терапии или стимуляции области ткани, в которую был введен инсулин во время основной или болюсной доставки инсулина. Одним возможным эффектом терапии ткани является улучшение эффективности абсорбции инсулина в кровеносную или лимфатическую систему и, следовательно, уменьшение количества инсулина, необходимого для создания требуемого метаболического эффекта. Следовательно, нежелательные отрицательные эффекты избыточного уровня инсулина, такие как набор лишнего веса, могут быть уменьшены. Другим возможным эффектом терапии ткани является улучшение и уменьшение количества и продолжительности действия инсулина в области инфузии ткани, поскольку он абсорбируется быстрее в кровеносную или лимфатическую систему. Следовательно, нежелательные локальные отрицательные эффекты избыточного уровня инсулина, такие как липогипертрофия или местное раздражение, могут быть уменьшены. Другим возможным эффектом терапии участка вблизи области инфузии ткани является улучшение локальной перфузии крови, что уменьшает локальные воспалительные эффекты набора для инфузии или пункции инсулина. Другой возможный эффект сокращения краткосрочных и долгосрочных локальных эффектов инсулина в области инфузии инсулином ткани состоит в том, чтобы увеличивать продолжительность использования набора для инфузии в том же самом месте.
В некоторых вариантах выполнения способы терапии ткани или кожи могут быть активированы на избирательных или заранее запрограммированных болюсах в течение коротких периодов, чтобы обеспечить повышение абсорбции инсулина. В некоторых вариантах выполнения способы терапии ткани или кожи могут быть частью всех или некоторых из элементов комплекса запрограммированных болюсов, включая, но не ограничиваясь схемами болюсного введения по типу "двойной волны", "квадратной волны" и другими типами болюсного введения. Стимуляция может быть активирована для начальной фазы стандартного болюса, конкретно для заранее заданных компонентов болюсного введения по типу "двойной волны" или с нужными интервалами болюсного введения по типу "квадратной волны". В других вариантах выполнения стимуляция может быть активирована заранее заданным периодом включения независимо от типа болюса. В других вариантах выполнения периодическая активация может быть синхронизирована с отдельными компонентами основного болюса.
В некоторых вариантах выполнения способы терапии или стимуляции ткани или кожи могут использоваться для выполнения терапии или стимуляции области ткани, в которую было введено лекарственное средство с помощью имплантированного устройства доставки лекарственного средства или вещества. В некоторых вариантах выполнения способы терапии или стимуляции ткани или кожи могут использоваться для выполнения терапии или стимуляции области ткани, в которую был введен инсулин с помощью имплантированного устройства доставки инсулина. В некоторых вариантах выполнения имплантированное устройство доставки инсулина представляет собой имплантированный инсулиновый насос. В некоторых вариантах выполнения имплантированное устройство доставки инсулина представляет собой имплантированные бета-клетки, которые могут производить инсулин. В случае имплантированных бета-клеток указанная терапия ткани может также поддерживать имплантированные клетки, например, улучшая локальную перфузию и повышая в клетках доставку кислорода глюкозы и других необходимых компонентов. Путем улучшения локальной перфузии также бета-клетки или другой элемент измерения глюкозы может реагировать без нежелательных задержек на быстрые изменения в уровне глюкозы.
В некоторых вариантах выполнения имплантированного устройства доставки лекарственных средств терапия ткани может быть применена имплантированным устройством. Пример проиллюстрирован на Фиг.38. Имплантированное устройство 3805 доставки лекарственных средств имплантировано в область 3802 ткани под кожей 3801. Имплантированное устройство доставки лекарственных средств имеет катетер 3803, схематично изображенный, для инфузии лекарственных средств в ткань. В некоторых вариантах выполнения инфузия лекарственных средств в ткань может быть выполнена с использованием других средств вместо катетера, таких как несколько катетеров или большое отверстие с мембраной на стороне устройства доставки лекарственных средств для введения лекарственного средства в больший объем ткани, и улучшая абсорбцию лекарственных средств в кровеносную систему или лимфатическую систему. Имплантированное устройство доставки лекарственных средств содержит терапевтический элемент, схематично показанный номером позиции 3804, для применения терапии к участку вблизи области с введенным лекарственным средством. Терапия может быть одним или комбинацией средств терапии ткани, таких как: нагревание, изменение температуры, массирование, механическая вибрация, акустическая вибрация, ультразвук, всасывание, инфузия дополнительного вещества или химического агента, применение слабого электрического поля, применение слабого магнитного поля, облучение светом, радиочастотное (РЧ) облучение, микроволновое облучение (MB), и т.д.
В некоторых вариантах выполнения имплантированного устройства доставки лекарственных средств терапия ткани может быть применена терапевтическим устройством, прикрепленным к коже. Пример проиллюстрирован на Фиг.39. Имплантированное 3915 устройство доставки лекарственных средств имплантировано в область 3913 ткани под кожей 3912. Имплантированное устройство доставки лекарственных средств имеет катетер 3914, схематично показанный, для инфузии лекарственных средств в ткань. В некоторых вариантах выполнения инфузия лекарственных средств в ткань может быть выполнена с использованием других средств вместо катетера, таких как несколько катетеров, или большое отверстие с мембраной на стороне устройства доставки лекарственных средств для введения лекарственного средства в больший объем ткани и улучшая абсорбцию лекарственных средств в кровеносную систему или лимфатическую систему. Терапевтическое устройство, схематично показанное номером позиции 3911, присоединено к коже выше области инфузии лекарственных средств для применения терапии к участку вблизи области с введенным лекарственным средством. Терапия может быть одним или комбинацией средств терапии ткани, таких как: нагревание, изменение температуры, массирование, механическая вибрация, акустическая вибрация, ультразвук, всасывание, инфузия дополнительного вещества или химического агента, применение слабого электрического поля, применение слабого магнитного поля, облучение светом, радиочастотное (РЧ) облучение, микроволновое облучение (MB), и т.д. Терапевтическое устройство 3911 может быть прикреплено к коже многими способами, как описано в заявке на патент США №11/812,230, как, например, клейкий слой.
В некоторых вариантах выполнения регулирования уровня глюкозы достигают автоматическим управлением скоростью инфузии инсулина, используя непрерывный датчик глюкозы и управляющий алгоритм. Имелось много попыток создать такую «искусственную поджелудочную железу», начиная с разработок непрерывных мониторов глюкозы. В этом случае любая задержка, такая как текущие задержки абсорбции инсулина и времени действия, любая изменчивость в этой задержке и любая изменчивость в остаточном уровне инсулина в теле вызывает ошибку в управляющем алгоритме, что приведет к менее четкому регулированию уровня глюкозы. Таким образом, путем стимуляции или применения терапии к участку вблизи области инфузии ткани, объединяя это с входом от имплантированных или других типов датчика глюкозы и управляющим алгоритмом, можно обеспечить лучшую точность и надежность систем управления уровня глюкозы с замкнутой обратной связью.
В некоторых вариантах выполнения ткань около датчика глюкозы подвергается терапии или стимулируется вышеупомянутыми описанными терапиями для улучшения транспорта глюкозы из кровеносной системы в межклеточную жидкость и в датчик глюкозы, как описано в американской предварительной заявке №60/948,472.
В некоторых вариантах выполнения комбинацию вышеупомянутой терапии или терапий применяют вблизи области ткани с введенным инсулином, при этом ту же самую или отличающуюся терапию или комбинацию терапий применяют вблизи области ткани, в которой уровень глюкозы измеряют датчиком глюкозы. Поэтому как задержка транспорта глюкозы к межклеточной жидкости (ISF) и к датчику, так и задержка в фармакокинетики и фармакодинамики инсулина уменьшается, обеспечивая достижение более четкого регулирования уровня глюкозы, замыкая обратную связь между этими двумя устройствами.
В некоторых вариантах выполнения ту же самую терапию или комбинацию терапий применяют вблизи области ткани с введенным инсулином и вблизи области ткани, в которой уровень глюкозы измеряют датчиком глюкозы.
В некоторых вариантах выполнения область ткани, в которой уровень глюкозы измеряют датчиком глюкозы, находится около области ткани с введенным инсулином, и терапию или комбинацию терапий применяют вблизи той области ткани с помощью одного терапевтического элемента.
В некоторых вариантах выполнения, описанных выше, устройство доставки инсулина и датчик глюкозы являются имплантированными. В других вариантах выполнения оба эти устройства представляют собой часть того же самого чрескожного катетера или часть устройства, у которого есть больше чем один катетер (один для инфузии и один в качестве датчика), которые и вставлены одним вставлением, и расположены поблизости друг к другу.
В некоторых вариантах выполнения для автоматического регулирования уровня глюкозы, описанного выше, терапевтический узел или алгоритм включает автоматический алгоритм обнаружения приема пищи, который идентифицирует быстрый подъем уровня глюкозы на непрерывном сигнале уровня глюкозы. Терапевтический узел вводит болюс инсулина, используя устройство доставки инсулина, и в случае обнаружения приема пищи и автоматического обнаружения применяет вышеупомянутую описанную терапию или терапии. В других вариантах выполнения индикация потребления пищи может быть задана вручную пациентом через инфузионный насос.
В некоторых вариантах выполнения для полуавтоматического регулирования уровня глюкозы, которое вовлекает санкционирование человеком для введения болюса инсулина, узел обработки данных или алгоритм содержит алгоритм автоматического обнаружения принятия пищи, который идентифицирует быстрый подъем уровня глюкозы на непрерывном сигнале уровня глюкозы. Узел обработки данных информирует пациента, который вводит болюс инсулина, используя устройство доставки инсулина, и применяет вышеупомянутую описанную терапию или терапии, чтобы сократить время действия инсулина и уменьшить постпрандиальный сдвиг уровня глюкозы.
В некоторых вариантах выполнения терапия может быть запрограммирована, чтобы уменьшить температуру для уменьшения абсорбции ранее введенного инсулина, который находится все еще в подкожном пространстве. Это может быть предостерегающим и защитным элементом системы с замкнутой связью.
В некоторых вариантах выполнения терапия может быть выполнена около области ткани с введенным лекарственным средством и, тем не менее, вызывать требуемый эффект для области ткани с введенным лекарственным средством. Например, в случае нагревания В.Мэджерл и др. [В.Мэджерл и др., Журнал Физиологии, 497/3, стр.837-848 (1996)] показали, что нагревание кожи может вызвать вазодилатацию в человеке даже на расстоянии в 30 мм из-за активации ноцицептивного аксонального рефлекса. Они также показали, что в некоторых случаях краткосрочное нагревание может также вызвать вазодилатацию сроком на несколько минут. Поэтому в некоторых вариантах выполнения терапия, такая как нагревание до температуры 39,5 градусов С, приложенная в течение коротких периодов от 2 до 60 секунд каждые несколько минут, вызывает вазодилатацию, которая улучшает фармакокинетику и/или фармакодинамику лекарственного средства в области ткани с введенным лекарственным средством.
В некоторых вариантах выполнения терапия может быть откалибрована для каждого пациента, чтобы оптимизировать порог активации ноцицептивного аксонального рефлекса конкретного пациента. Например, В.Марджерл и др. показывают, что температура, вызывающая вазодилатацию, после 64 секунд нагревания может колебаться между 37 и 43 градусами С для различных объектов. Калибровка может также быть выполнена локально для конкретного участка инфузии. Способ калибровки терапевтического устройства заключается в начале применения терапии ткани постепенно при первом запуске терапевтического устройства и измерении эффекта терапии на ткань, такого как вазодилатация, используя конкретный датчик, соединенный с процессорным узлом, который управляет терапевтическим устройством. Затем узел обработки данных решает, какой уровень терапии ткани применить, чтобы, с одной стороны, оптимизировать эффект терапии, а с другой стороны, не вызвать отрицательных эффектов. Например, в случае если терапией ткани является нагревание, а требуемый эффект - вазодилатация, то терапевтическое устройство может постепенно нагревать ткань до безопасного верхнего предела и измерять локальную вазодилатацию ткани. Вазодилатация может быть измерена с помощью лазерной доплеровской флоуметрии (ЛДФ). Другой близкий параметр, который может быть измерен, является перфузией крови в ткани, которая может быть измерена с помощью ЛДФ или одним из известных в уровне техники измерением существенных линий поглощения оптической абсорбции гемоглобина в ткани, таких как полоса от 700 до 1000 нм. Впоследствии терапевтический узел использует ту информацию, чтобы решить, какая температура является наилучшей максимальной температурой профиля температурного нагрева, до которой должен быть нагрет конкретный участок в конкретном объекте.
В некоторых вариантах выполнения процесс калибровки повторяют время от времени, например, каждые 6-12 часов, чтобы компенсировать те изменения, которые могут повлиять на температурный порог ответа аксонального рефлекса на локальное нагревание.
В некоторых вариантах выполнения эти процессы калибровки повторяют каждый раз, когда терапевтическое устройство находится в работе, как, например, во время болюса инсулина, чтобы компенсировать более быстрые изменения, которые могли бы повлиять на температурный порог ответа аксонального рефлекса на локальное нагревание, такие как оксид азота, норадреналин и другие вещества [Белинда и др., Журнал Физиологии 572/3, стр.821-820 (1996)]. В этом случае, когда терапию, такую как нагревание, начинают, параметр терапии, такой как температура, постепенно повышают, измеряя требуемый параметр ткани, такой как вазодилатация, используя ЛДФ. Когда происходит вазодилатация, уровень терапии, такой как температура, стабилизируют на том уровне или немного выше него.
В некоторых вариантах выполнения процесс калибровки повторяют также во время терапии. В этом случае терапию, такую как нагревание, после того как ее начинают, как описано в предыдущем абзаце, регулируют так, чтобы поддерживать требуемый параметр ткани, такой как уровень вазодилатации, стабилизированным на заданном уровне во время всей терапии. Стабилизация требуемого параметра ткани, такого как уровень вазодилатации, стабилизирует также абсорбцию лекарственных средств в кровь и улучшает воспроизводимость фармакокинетики и фармакодинамики лекарственных средств. Управление уровнем терапии в соответствии с требуемым параметром ткани, таким как уровень вазодилатации, можно также уменьшить энергопотребление терапевтического устройства. Например, в случае нагревания, поскольку краткосрочное нагревание до определенной температуре выше пороговой температуры вызывает ответ аксонального рефлекса и вазодилатацию, нет никакой необходимости в поддержании высокой температуры в течение длительного периода времени, и благодаря этому потребление энергии может быть уменьшено.
Системы и способы доставки лекарственных средств с использованием имплантированного нейронного стимулятора
Со ссылкой на чертежи на Фиг.40А-С для обозначения тех же самых функционирующим элементам использованы аналогичные номера позиций. Фиг.40А представляет собой схематическую блок-схему устройства 4000 доставки лекарственных средств, выполненного в соответствии с настоящим изобретением, для управляемой доставки лекарственных средств к предназначенный для лечения ткани. Устройство 4000 доставки лекарственных средств содержит пользовательский интерфейс 4002, модуль 4004 обмена данными, контроллер 4006, модуль 4008 доставки лекарственных средств, резервуар 4010 с лекарственным средством, элемент 4014 терапии ткани, внешний источник 4016 лекарственного средства и датчик 4016. Устройство 4000 имплантировано в тело и обеспечивает улучшенную управляемую систему доставки лекарственных средств. Участок имплантирования может меняться и выбираться в зависимости от предназначенной для лечения ткани и доставляемого лекарственного средства. Например, устройство 4000 может быть имплантировано подкожно или около пищеварительного тракта для системы доставки инсулина. Однако если устройство 4000 содержит лекарственное средство для сердечно-сосудистой системы, устройство 4000 может, например, быть имплантировано в подкожную полость около сердечно-сосудистой системы.
Датчик 4016 может и не быть имплантированным и представлять собой независимое внешнее устройство, как известно и принято в области техники, которое используется для контролирования измеряемой величины относительно доставляемого лекарственного средства, например, включая, но не ограничиваясь датчиком глюкозы, который отображает уровни глюкозы во время теста. Для измерения большого количества параметров, относящихся к доставляемому лекарственному средству, может быть использован по меньшей мере один или большее количество датчиков. Измерения, выполненные датчиком 4016, передаются контроллеру 4006 через пользовательский интерфейс 4002 и модуль 4004 обмена данными (например). Контроллер 4006 отображает действие, которое должно быть предпринято в отношении измеренных результатов; предпринятое действие может быть отсутствием действия. Пользовательский интерфейс 4002 может передать инструкции и протоколы контроллеру 4006, используя модуль 4004 обмена данными. Контроллер 4006 может содержать различные протоколы терапии и статистические данные относительно различных ситуаций, измеренных по меньшей мере одним или большим количеством датчиков 4016. Контроллер 4006 может использовать обучающиеся алгоритмы, например, включая, но не ограничиваясь искусственным интеллектом, чтобы регулировать или адаптировать протоколы терапии, чтобы те были более конкретными или подходящими под конкретные нужды доставки лекарственных средств и предпочтениям в еде пациента, использующего устройство 4000.
Контроллер 4006 управляет и осуществляет наблюдение за работой модуля 4008 доставки лекарственных средств и элемента 4014 терапии ткани в отношении параметров, измеряемых по меньшей мере одним или большим количеством датчиков 4016. Модуль 4008 доставки лекарственных средств может содержать по меньшей мере один или большее количество катетеров, которые используются для доставки лекарственного средства к предназначенному для лечения участку. Доставка лекарственных средств может быть выполнена с помощью избирательной мембраны, которая обеспечивает надежную доставку лекарственного средства к предназначенной для лечения ткани на площади поверхности большего размера.
Доставка лекарственных средств к предназначенный для лечения ткани выполняется посредством контроллера 4006, который использует резервуар 4010 для хранения лекарственного средства для доставки лекарственного средства через модуль 4008 доставки лекарственных средств. Резервуар 4010 хранения лекарственного средства содержит достаточные количества лекарственного средства, чтобы хватало в течение длительного периода времени, например нескольких месяцев. Когда количества лекарственного средства исчерпаны и должны быть пополнены, контроллер 4006 может обмениваться данными через модуль 4004 обмена данными с пользовательским интерфейсом 4002 относительно необходимости в пополнении лекарственного средства. Запас лекарственных средств может быть пополнен из внешнего источника 4012, который непосредственно связан с имплантированным контейнером 4010 хранения лекарственного средства. Связь между хранением 4010 лекарственных средств и источником 4012 лекарственных средств может, например, быть установлена посредством механизма, включающего, но не ограниченного одним или большим количеством катетеров многократного использования, инъекцией или тому подобным.
Элемент терапии ткани 4014 используется для стимулирования или ингибирования предназначенного для лечения участка ткани, чтобы увеличить абсорбцию лекарственных средств путем большего увеличения вазодилатации или используя механизм для улучшения усвояемости лекарственных средств, которая является определенной для доставляемого лекарственного средства и самого предназначенного для лечения участка. Элемент 4014 терапии ткани может использоваться непосредственно на лекарственном средстве, обеспечивая дополнительное управление, при котором свойства лекарственного средства изменяются, чтобы увеличить или уменьшить его относительную активность. Элемент 4014 терапии ткани может быть стимулирован такими способами, включая, но не ограничиваясь одним или большим из: изменения температуры, оптического излучения, ИК излучения, РЧ излучения, микроволнового излучения, ультразвука, массирования, или тому подобным. Элемент 4014 терапии ткани может стабилизировать предназначенный для лечения участок ткани, чтобы уменьшить изменчивость абсорбции лекарственных средств в кровеносную систему.
Контроллер 4006 может содержать базу данных (не показана), которая содержит различные протоколы терапии, которые являются конкретными для одного или большего количества различных метаболических параметров, измеряемых датчиком 4016. Изменения, обновления к базе данных и/или протоколы терапии в контроллере 4006 могут быть введены из внешних ресурсов через модуль 4004 обмена данными. Модуль 4004 обмена данными может быть в состоянии как посылать, так и получать обновления к внешнему пользовательскому интерфейсу 4002 или аналогичному источнику и от него, например, включая, но не ограничиваясь КПК, компьютером, сервером, мобильным телефоном или тому подобным. Обмен данными с модулем 4004 обмена данными может быть осуществлена посредством протоколов передачи данных, например, включая, но не ограничиваясь мобильным, беспроводным, оптическим, ИК (инфракрасным), РЧ (радиочастотным) или аналогичными протоколами передачи данных; причем используемые протоколы передачи данных могут быть зашифрованы.
Фиг.40В представляет собой вариант выполнения устройства доставки лекарственных средств в соответствии с настоящим изобретением, которое функционирует аналогично устройству, изображенному на Фиг.40А, однако элемент 4034 терапии ткани не имплантирован, а используется на наружной поверхности кожи. Терапевтический элемент 4034 может быть приклеен к коже и работать снаружи.
Элемент терапии ткани 4034 используется для стимулирования или ингибирования предназначенного для лечения участка ткани, чтобы увеличить абсорбцию лекарственных средств путем большего увеличения вазодилатации или используя механизм для улучшения усвояемости лекарственных средств, которая является определенной для доставляемого лекарственного средства и самого предназначенного для лечения участка. Элемент терапии ткани 4034 может работать в различных режимах, включая, но не ограничиваясь одним или большим из: изменения температуры, оптического излучения, ИК излучения, РЧ излучения, микроволнового излучения, ультразвука, массирования или тому подобным. Элемент 4034 терапии ткани может стабилизировать предназначенный для лечения участок ткани, чтобы уменьшить изменчивость абсорбции лекарственных средств в кровеносную систему.
На Фиг.40С изображен другой вариант выполнения системы доставки лекарственных средств в соответствии с настоящим изобретением, в котором используется большее количество элементов терапии ткани, причем по меньшей мере один или большее количество элементов содержат один или большее количество имплантированных элементов 4014 терапии ткани и указанный по меньшей мере один или большее количество элементов включают один или большее количество внешних элементов 4034 терапии ткани. Комбинация имплантированных и неимплантированных элементов 4014 и 4034 терапии обеспечивает дополнительное управление непосредственно или опосредованно приложенной терапией к предназначенному для лечения участку ткани.
На Фиг.40D изображен другой вариант выполнения системы доставки лекарственных средств, показанной в соответствии с Фиг.40А, в которой датчик не используется. Система 4000 доставки лекарственных средств доставляет соответствующее лекарственное средство предназначенному для лечения участку ткани независимо от измеренной информации; а точнее система 4000 доставки работает в соответствии с данными, полученными от пользовательского интерфейса 4002 и/или от работы контроллера 4006. В этом варианте выполнения модуль 4008 доставки лекарственных средств работает, основываясь на расписании или протоколе, обеспеченных контроллером 4006 и/или опосредованно от пользовательского интерфейса 4002, как описано на Фиг.40А-С. Аналогично, ни один из имплантированного элемента 4014 терапии ткани или внешнего терапевтического элемента 4034 ткани (показан как стимулятор 4034) не работает, основываясь на измеренной информации; скорее обе функции, в соответствии с одним или большим количеством протоколов, полученным либо от пользовательского интерфейса 4002, либо от контроллера 4006.
Фиг.41А является описанием варианта выполнения настоящего изобретения в соответствии с Фиг.40А, где элемент 4112 терапии ткани имплантирован и расположен внутри по отношению к коже 4111. Элемент 4112 терапии ткани используется для терапии слоя ткани для улучшения фармакокинетических и/или фармакодинамических свойств предназначенной для лечения ткани. В некоторых вариантах выполнения резервуар 4108 для хранения лекарственных средств обеспечивает лекарственное средство, которое должно быть доставлено к модулю 4106 доставки, и оттуда к элементу 4120 доставки. В некоторых вариантах выполнения, например, для терапии ткани, которая вовлекает непосредственное или опосредованное нагревание и температурочувствительные лекарственные средства, такие как инсулин, причем некоторые типы инсулина предпочтительно хранятся при температуре меньше чем 37 градусов С, а резервуар 4108 для хранения лекарственных средств теплоизолирован, чтобы поддерживать лекарственное средство при надлежащей температуре во время терапии ткани. Лекарственное средство может быть доставлено в резервуар 4108 для хранения непосредственной инъекцией через мембрану 4104. Протоколы стимуляции ткани и протоколы доставки лекарственных средств могут быть переданы контроллеру (не показан) через пользовательский интерфейс 4116.
Фиг.41В описывает вариант выполнения настоящего изобретения, выполненного в соответствии с Фиг.40B, в котором элемент 4102 терапии ткани расположен снаружи относительно кожи 4111, а не имплантирован. Элемент 4102 терапии ткани может быть присоединен к коже посредством клейкого слоя и/или полосы (не показаны). Элемент 4102 терапии ткани используется для выполнения терапии слоя ткани для улучшения фармакокинетических и/или фармакодинамических свойств предназначенной для лечения ткани. Резервуар 4108 для хранения лекарственных средств может обеспечивать лекарственное средство, который должно быть доставлено к модулю 4106 доставки, а оттуда к элементу 4120 доставки. В некоторых вариантах выполнения, например, для терапии ткани, которая вовлекает непосредственное или опосредованное нагревание и температурочувствительные лекарственные средства, такие как инсулин, как отмечено выше, резервуар 4108 для хранения лекарственных средств является теплоизолированным, чтобы поддерживать лекарственное средство при надлежащей температуре во время терапии ткани. Лекарственное средство может быть доставлено в резервуар 4108 для хранения непосредственной инъекцией через мембрану 4104.
Фиг.41С является описанием варианта выполнения настоящего изобретения, в котором лекарственное средство производят снаружи и вводят в имплантированную часть через катетер 4114 передачи лекарственных средств. Элемент 4102 терапии ткани может быть расположен снаружи по отношению к коже 4111. Элемент 4102 терапии ткани может быть присоединен к коже посредством клейкого слоя (не показан). Элемент 4102 терапии ткани используется для стимулирования или ингибирования слоя ткани для улучшения фармакокинетических и/или фармакодинамических свойств предназначенной для лечения ткани. В некоторых вариантах выполнения, как отмечено выше, для терапии ткани, которая вовлекает непосредственное или опосредованное нагревание и температурочувствительные лекарственные средства, такие как инсулин, резервуар 4108 для хранения лекарственных средств теплоизолирован, чтобы поддерживать лекарственное средство при надлежащей температуре во время терапии ткани. Катетер 4114 может использоваться для заполнения резервуара 4108 для хранения лекарственных средств в имплантированном слое 4113, как только это пополнение станет необходимым, как определяет контроллер (не показан). Может быть предусмотрена регистрация уровней лекарственного средства внутри резервуара 4108 с помощью контроллера (не показан) в виде визуальной реплики 4116, например, включая, но не ограничиваясь, пользовательским интерфейсом или СИД. Лекарственное средство доставляется через элемент 4120 доставки, как показано.
Фиг.41D представляет собой описание варианта выполнения настоящего изобретения, выполненного в соответствии с Фиг.40D и 40С, где может быть предусмотрено большее количество элементов терапии ткани, внешний элемент 4102, расположенный снаружи по отношению к коже 4111, и имплантированный элемент 4112, расположенный в имплантированном слое 4113. Элемент 4102 терапии ткани может быть присоединен к коже 4111 посредством клейкого слоя (не показан). Элементы 4102 и 4112 терапии ткани используются для выполнения терапии слоя ткани для улучшения фармакокинетических и/или фармакодинамических свойств предназначенной для лечения ткани. В некоторых вариантах выполнения, например, как отмечено выше, для терапии ткани, которая вовлекает непосредственное или опосредованное нагревание и температурочувствительные лекарственные средства, такие как инсулин, резервуар 4108 для хранения лекарственных средств является теплоизолированным, чтобы поддерживать лекарственное средство при надлежащей температуре во время выполнения терапии ткани. Резервуар 4108 для хранения лекарственных средств может обеспечить лекарственное средство, которое должно быть доставляется модулю 4106 доставки, а оттуда элементу 4120 доставки, который может быть мембраной, способной к доставке лекарственного средства по большей площади поверхности. Лекарственное средство может быть доставлено в резервуар 4108 для хранения непосредственной инъекцией через принимающую мембрану 4104.
На Фиг.42 изображена блок-схема устройства доставки лекарственных средств с замкнутой обратной связью и внутренний резервуар для лекарственных средств. Резервуар для лекарственных средств может быть пополнен, используя внешний источник лекарственных средств, если это необходимо. На стадии 4200 устройство имплантируют в пациента (объект) на выбранном предназначенном для лечения участке ткани. На стадии 4202 по меньшей мере один или большее количество датчиков обнаруживают клеточные и/или биологические параметры, например, включая, но не ограничиваясь, уровнями глюкозы. На стадии 4204 контроллер решает, какое действие должно быть предпринято, основываясь на данных датчика, полученных на стадии 4202. На стадии 4210 контроллер может активировать элемент терапии ткани, чтобы начать процедуру стимулирования или ингибирования, используя любой из его режимов, например, включая, но не ограничиваясь, теплом, холодом, изменением температуры, ультразвуком, оптикой, массированием, физической стимуляцией, вибрацией, всасыванием, ИК, волнами в микронном диапазоне, РЧ, или тому подобным. Этот этап может также включать отсутствие действия. В некоторых вариантах выполнения стимуляция оптимизируется в соответствии с присущим пользователю порогом активации ноцицептивного аксонального рефлекса.
На этапе 4208 контроллер может указать наружному индикатору, что доставка лекарственных средств исчерпана и что требуется пополнение лекарственных средств. Это указание может быть осуществлено через пользовательский интерфейс, СИД или тому подобное. На этапе 4206 определяют форму дозировки лекарственных средств, а на этапе 4212 определяют, чтобы указанная дозировка была доставлена к предназначенному для лечения участку ткани. Этапы 4202, 4210 и 4212 находятся в петле обратной связи, которая может непрерывно управлять процессом доставки лекарственных средств или по меньшей мере может быть выполнена с большим количеством повторений, чтобы перестраховаться, чтобы требуемые или соответствующие уровни лекарственных средств поддерживались на предназначенном для лечения участке.
На Фиг.43А изображена блок-схема устройства 4300 доставки лекарственных средств, выполненного в соответствии с настоящим изобретением, для управляемой доставки лекарственных средств к предназначенный для лечения ткани. Устройство 4300 доставки лекарственных средств содержит элемент терапии ткани или элемент 4302 терапии ткани (показанный как стимулятор 4302), контроллер 4304, датчик 4306, модуль 4308 производства лекарственных средств, модуль 4305 доставки лекарственных средств и модуль 4307 обмена данными. Устройство 4300 имплантировано внутри тела и обеспечивает систему доставки лекарственных средств в виде замкнутой обратной связи. Место имплантации может варьироваться и выбираться в зависимости от предназначенной для лечения ткани и доставляемого лекарственного средства. Например, устройство 4300 может быть имплантировано подкожно или около пищеварительного тракта для системы доставки лекарственных средств инсулина. Однако если устройство 4300 содержит лекарственное средство для сердечно-сосудистой системы, оно может, например, быть имплантировано в подкожную полость около сердечно-сосудистой системы.
Датчик 4306 непрерывно или по меньшей мере неоднократно и/или периодически контролирует измеряемую величину в отношении доставляемого лекарственного средства, например, включая, но не ограничиваясь непрерывным датчиком уровня глюкозы, который отображает уровни глюкозы в любой данный момент времени. По меньшей мере один или большее количество датчиков могут использоваться совместно, чтобы измерять большее количество параметров, касающихся доставляемого лекарственного средства. Измерения, выполняемые датчиком 4306, передаются контроллеру 4304, который описывает действие, которое должно быть предпринято в отношении измеренных результатов; причем действие, которое должно быть предпринято, может быть отсутствием действия. Контроллер 4304 может содержать различные протоколы терапии и статистические данные относительно различных ситуаций, определенных по меньшей мере одним или большим количеством датчиков 4306. Контроллер 4304 может также использовать обучающиеся алгоритмы, например, включая, но не ограничиваясь искусственным интеллектом для регулирования или адаптации протоколов терапии, чтобы те были более конкретными или подходящими под конкретные нужды доставки лекарственных средств и предпочтениям в еде пациента, использующего устройство 4300.
Контроллер 4304 управляет и осуществляет наблюдение за работой модуля 4308 производства лекарственных средств, модуля 4305 доставки лекарственных средств и элемента 4302 терапии ткани в отношении метаболических параметров, измеряемых по меньшей мере одним или большим количеством датчиков 4306. Модуль 4305 доставки лекарственных средств может содержать по меньшей мере один или большее количество катетеров, которые используются для доставки лекарственного средства к предназначенному для лечения участку. Доставка лекарственных средств может быть выполнена с помощью избирательной мембраны, которая обеспечивает надежную доставку лекарственного средства к предназначенной для лечения ткани.
Элемент 4302 терапии ткани используется для стимулирования или ингибирования предназначенного для лечения участка ткани, чтобы увеличить абсорбцию лекарственных средств, больше за счет увеличения вазодилатации или используя средства для улучшения усвояемости лекарственного средства, которая является конкретной для доставляемого лекарственного средства и самого предназначенного для лечения участка. Элемент 4302 терапии ткани может использоваться на самом лекарственном средстве, обеспечивая дополнительный контроль, когда свойства лекарственного средства изменяются, чтобы увеличить или уменьшить его относительную активность. Элемент 4302 терапии ткани стимулирует в режимах, включая, но не ограничиваясь изменением температуры, оптическим, ИК излучением, РЧ излучением, микроволновым излучением, ультразвуком, массированием или тому подобным. Элемент терапии ткани или элемент 4302 терапии ткани стабилизирует предназначенный для лечения участок ткани, чтобы уменьшить изменчивость абсорбции лекарственных средств в кровеносную систему.
Модуль 4308 производства лекарственных средств содержит клетки, которые могут производить лекарственное средство, например, включая, но не ограничиваясь инсулином, который должен быть доставлен в предназначенный для лечения участок. Модуль 4308 производства лекарственных средств содержит по меньшей мере одну или большее количество бета-клеток, других клетки, культуры ткани и/или бактериальную культуру, способную к производству инсулина. Производство лекарственного средства модулем 4308 управляется контроллером 4304.
Контроллер 4304 содержит базу данных (не показана), которая содержит различные протоколы терапии, конкретные для различных метаболических параметров, измеряемых устройством доставки 4300. Изменения, обновления к базе данных и/или протоколам терапии внутри контроллера 4304, могут быть введены из внешних ресурсов через модуль 4307 обмена данными. Модуль 4307 обмена данными в состоянии и сообщить статус устройства 4300, и получить обновления из внешнего источника, например, включая, но не ограничиваясь КПК, компьютером, сервером, мобильным телефоном или тому подобным. Обмен данными устанавливается протоколами передачи данных например включая, но не ограничиваясь, мобильным, беспроводным, оптическим, ИК, РЧ или подобными протоколами передачи данных; причем используемые протоколы передачи данных могут быть зашифрованы.
Например, когда непрерывные чтения глюкозы от датчика 4306 как обработанные контроллером 4304 указывают на то, что уровень сахара в крови повышается с увеличенной скоростью, контроллер 4304 тогда указывает модулю 4308 производства лекарственного средства начать или увеличить производство инсулина с требуемой скоростью. Точно так же контроллер 4304 использует элемент 4302 терапии ткани, чтобы начать стимуляцию предназначенной для лечения ткани, тогда как модуль 4305 доставки лекарственных средств используется для доставки лекарственного средства к предназначенному для лечения участку с соответствующей скоростью, чтобы максимизировать абсорбцию ткани своевременным и зависящим от дозировки образом. Контроллер 4304 может осуществлять различные протоколы доставки лекарственных средств, основанных на новых протоколах, полученных из внешнего источника через модуль 4307 обмена данными. Поскольку датчик 4306 продолжает контролировать различные метаболические параметры, изменения осуществляются в петле обратной связи способом, который лучшие всего удовлетворяет метаболическим потребностям пациента.
На Фиг.43В изображена схематическая блок-схема варианта выполнения имплантированного устройства 4300 доставки лекарственных средств в соответствии с настоящим изобретением, как изображено на Фиг.43А, и имеющего внешний пользовательский интерфейс 4301. Пользовательский интерфейс 4301 обменивается данными с устройством 4300 доставки лекарственных средств, используя протокол передачи данных, например, включая, но не ограничиваясь мобильным телефоном, беспроводным, оптическим, ИК, РЧ или тому подобным протоколом передачи данных. Пользовательский интерфейс 4301 передает контроллеру 4304 данные, касающиеся любого из компонентов устройства 4300. Например, пользовательский интерфейс 4301 может инициировать производство инсулина или доставку (или производство или доставку другого лекарственного средства) через соответственно модуль 4308 производства лекарственных средств и/или модуль 4305 доставки лекарственных средств посредством обмена данными с контроллером 4304. Точно так же пользовательский интерфейс 4301 может задать конкретный протокол стимуляции, который должен быть выполнен при использовании элемента 4302 терапии ткани.
Фиг.44А-С являются вариантами выполнения устройства 4300, изображенного на Фиг.43А-С. Фиг.44А изображает устройство 4400, которое имплантировано подкожно под слоем 4401 кожи, поэтому имплантированный слой 4413расположен ниже слоя 4401 кожи, тогда как наружный слой 4411 расположен снаружи слоя 4401 кожи. Имплантирование может быть осуществлено подкожной инъекцией, артроскопической операцией или операцией, выполненной с местной анестезией или подобным путем. Устройство 4400 содержит катетер 4410, который доставляет лекарственное средство предназначенному для лечения участку.
Доставка лекарственных средств и фармакокинетические и фармакодинамические свойства дифференцированно управляются элементом 4412 терапии ткани, который больше стимулирует ткань посредством одного или большего количества способов терапии, например, включая, но не ограничиваясь, теплом, температурным контролем, микромассированием или физической или вибрационной стимуляцией, ультразвуком, РЧ, ИК, оптическим излучением или любой их комбинацией или тому подобным. Элемент 4412 терапии ткани может непосредственно стимулировать лекарственное средство, чтобы управлять его свойствами; например инсулин может поддерживаться при постоянной температуре, чтобы гарантировать, что он находится в активной и жизнеспособной форме, тогда как окружающая ткань стимулируется теплом. Контроллер 4414, датчик 4416 и модуль 4418 производства лекарственных средств включены в устройство 4400 и функционируют, как изображено на Фиг.43А и 43В.
Система 4400 доставки лекарственных средств с замкнутой обратной связью использует по меньшей мере один или большее количество датчиков 4416, чтобы определить метаболические параметры; причем контроллер 4414 использует параметры датчика, чтобы определить соответствующее действие, которое необходимо предпринять. Например, контроллер 4414 может инициировать процесс производства лекарственных средств с помощью модуля 4418 производства лекарственных средств. Как только лекарственное средство произведено и готово к доставке, контроллер 4414 активирует элемент 4412 терапии ткани, чтобы подготовить предназначенную для лечения ткань к доставке лекарственных средств, что и осуществляется через катетер 4410. Катетер 4410 доставки лекарственных средств может иметь различные формы, как изображено на Фиг.44В-С. Поскольку лекарственное средство абсорбируется предназначенным для лечения участком, это вызывает изменения в метаболических параметрах, которые измеряются по меньшей мере одним или большим количеством датчиков 4416, из которых один показан только с целью объяснения и без намерения быть ограничивающим. Изменение в данных затем сообщается контроллеру 4414, чтобы выполнить поправку в протоколе терапии и, таким образом, дифференцированно управлять различными компонентами, например, включая модуль 4418 производства лекарственных средств и/или элемент 4412 терапии ткани.
Фиг.44В изображает выполнение имплантированного модуля доставки, как ранее описано. Устройство 4409 доставки содержит большее количество катетеров 4417, 4418, 4419 и 4420, которые вводят лекарственное средство на большой площади в пределах предназначенного для лечения участка. Катетеры 4417-4420 могут дополнительно содержать по меньшей мере один или большее количество датчиков 4426 или элемент 4422 терапии ткани, который измеряет и стимулирует предназначенный для лечения участок ткани.
Фиг.44С изображает выполнение имплантированного модуля доставки, как ранее описано. Способ доставки осуществляют с использованием избирательно проницаемого элемента 4430, который доставляет лекарственное средство предназначенной для лечения ткани через большую площадь поверхности, дополнительно улучшая, тем самым, абсорбцию лекарственных средств в кровеносную систему.
Нейронная стимуляция ткани во время доставки лекарственных средств
Со ссылкой на чертежи Фиг.45 представляет собой схематическую блок-схему устройства 4500 доставки лекарственных средств, которое может быть использовано со способом нейронной стимуляции в соответствии с настоящим изобретением для осуществления управляемой доставки лекарственных средств к предназначенной для лечения ткани, которое содержит управляемую нейронную стимуляцию ткани. Устройство 4500 доставки лекарственных средств содержит контроллер 4502, базу данных 4504, элемент 4508 терапии ткани и датчики 4506. Большее количество других компонентов, таких как элемент 4518 терапии ткани и датчик 4516, могут и не быть связаны с устройством 4500 доставки лекарственных средств. Устройство 4500 доставки лекарственных средств может быть размещено в различных местах, включая, но не ограничиваясь, чрескожно, подкожно, с помощью имплантации или снаружи. Размещение устройства 4500 доставки лекарственных средств зависит от терапии и лекарственного средства, которое должно быть доставлено.
В некоторых вариантах выполнения протокол терапии нейронной стимуляции хранится в базе данных 4504, к которой может иметь доступ контроллер 4502, для того чтобы определить протокол терапии нейронной стимуляции, который должен быть использован. Контроллер 4502 используется для активации элемента 4508 терапии ткани, чтобы начать терапию на участке доставки ткани. Датчик 4506, который может, например, быть использован для лазерной доплеровской флоуметрии (ЛДФ), используется для измерения эффективности терапии, вызванной элементом 4508 терапии ткани. Датчик 4506, элемент 4508 терапии ткани и контроллер 4502 функционально объединены, чтобы вызывать требуемый эффект, основываясь более на протоколе терапии нейронной стимуляции, сохраненном в базе данных 4504.
Дополнительные датчики 4516 и элемент 4518 терапии ткани могут быть размещены на расстоянии от устройства 4500. Объединение датчика 4516 и терапевтического элемента 4518 обеспечивает в некоторых вариантах выполнения дополнительное управление протоколом терапии. Помимо этого, датчик 4516 и терапевтический элемент 4518 могут быть размещены на участках ткани, отличающихся от участков, где размещены датчик 4506 и элемент 4508, обеспечивая, тем самым, возможность устройству 4500 и контроллеру 4502 измерять, управлять и калибровать нейронную стимуляцию, основываясь на данных, полученных от большей площади.
Тип дополнительного терапевтического элемента 4518 может отличаться от типа элемента 4508, позволяя, таким образом, использовать с устройством 4500 большое количество различных типов элементов терапии. Например, элемент 4508 может использоваться для введения электрического тока, тогда как элемент 4518 может использоваться для приложения тепла. В качестве другого неограничивающего примера элемент 4508 может использоваться для приложения тепла, тогда как элемент 4518 может использоваться для приложения холода. Оптимально использование большого количества элементов терапии (как неограничивающий пример двух элементов 4508 и 4518) может обеспечить увеличенную индивидуализацию протокола терапии аксонального рефлекса на большей площади.
Датчики 4516 и 4506 могут использоваться для измерения различных измеряемых величин, чтобы обеспечить лучшую управляемость устройством 4500. Например, датчиком 4516 может быть датчик лазерной доплеровской флоуметрии (ЛДФ), измеряющий вазодилатацию, тогда как датчик 4506 может быть тепловым датчиком, измеряющим температуру ткани.
Фиг.46 представляет собой блок-схему, которая изображает процессы калибровки в соответствии с некоторыми вариантами выполнения или способами настоящего изобретения. На этапе 4600 устройство калибруют для пользователя, причем участок терапии ткани, тип лекарственных средств сообщают устройству доставки, чтобы инициировать правильный протокол терапии. Кроме того, персональные данные, такие как уровень комфорта, могут быть установлены пользователем. Пределы и параметры, определенные на этапе 4600, устанавливают на этапе 4602 и включают в устройство доставки. На этапе 4604 начальную терапию выполняют с помощью контроллера 4502, изображенного на Фиг.45, и по меньшей мере одного или большего количества датчиков, которые могут, например, быть датчиками лазерной доплеровской флоуметрии (ЛДФ), чтобы контролировать выполнение процесса терапии по мере его продвижения. На этапе 4606 параметры, например, включая, но не ограничиваясь, выбором времени импульса, выбором времени и продолжительности периода между импульсами, уровней тепла, температуры или типа тока и т.п., измеряют и могут изменить, чтобы вызвать эффекты относительно истекшего времени, и где эффекты терапии, такие как уровни вазодилатации или пороговые уровни, являются относительными от ожидаемых уровней.
На этапе 4608 терапия может быть изменена в соответствии с обучающимся алгоритмом (например), известным в области техники, например включая, но не ограничиваясь ПИД (пропорционально-интегрально-дифференциальным) контроллером, механизмами искусственного интеллекта или тому подобным, чтобы регулировать или адаптировать протоколы терапии, чтобы те были более конкретными или подходящими под конкретные нужды доставки лекарственных средств пользователю.
На этапе 4610 осуществляется проверка измененной в соответствии с обучающимся алгоритмом терапии, используя управление с обратной связью, которая может быть повторена с более ранним этапом 4602, который может включать положительную обратную связь 4612 для конкретных параметров или отрицательную обратную связь 4614 для других параметров. Положительное и отрицательное управления используются для перезагрузки и изменения старых протоколов и могут использоваться для регулировки новых параметров или протоколов терапии для будущего использования на этапе 4602. Различные протоколы терапии для различных ситуаций могут быть сохранены в базе данных 4504, показанной на Фиг.45.
Протокол калибровки, изображенный выше, может быть осуществлен один раз для конкретного пользователя, используя лишь этапы 4600-4604, тогда как когда терапию осуществляют один раз в день, в каждом случае доставки лекарственных средств, или в динамическом процессе по мере необходимости могут быть использованы все этапы.
Фиг.47 представляет собой блок-схему, изображающую протокол терапии нейронной стимуляции и взаимодействие датчика и терапевтического элемента для управления различными параметрами и может включать (но не ограничиваясь) одним или большим из: выбором времени импульса, выбором времени и продолжительности периода между импульсами, уровней тепла, температуры или типа тока, мощности нагрева, времени для увеличения или уменьшения температуры, которая может быть управляемым образом изменена, чтобы персонифицировать протокол терапии для пользователя. Контроллер 4502, изображенный на Фиг.45, инициирует работу по меньшей мере одного терапевтического элемента, показанного на Фиг.45, для запуска терапии на этапе 4700.
Осуществленная терапия ткани, являющаяся аксональным рефлексом, в соответствии с известными протоколами может быть сохранена в базе данных 4504, как описано на Фиг.45. Температура ткани постепенно увеличивается к верхнему пределу, основываясь больше на уровне комфорта пользователя, и может быть в соответствии с одним или большим количеством зависящих от ткани предельных температур равна, например для кожи, 43 градусам С в соответствии с требованиями безопасности, которые известны в области техники. Повышение температуры происходит в течение заранее заданного промежутка времени, например 64 секунды, чтобы вызвать повышение температуры от 37 градусов С до 43 градусов С. В качестве альтернативы, может быть осуществлен тепловой импульс, чтобы вызвать полное увеличение температуры нейронной стимуляции; причем терапия может быть выполнена в соответствии с отношением 2 к 5-ти, т.е. 2 секунды увеличения температуры и 5 секунд периода покоя, или же, как известно и принято в области техники. Протокол терапии для инициации аксонального рефлекса с помощью индукционного нагрева может также зависеть от местоположения терапевтического элемента, который может быть имплантированным или наружным, а также расположен на стимулируемой ткани.
В некоторых вариантах выполнения, поскольку тепло и другие терапии вводятся на этапе 4700, датчик записывает изменения в температуре и контролируют вазодилатацию и может на этапе 4702 включать скорость изменения температуры и/или дилатацию. Когда датчик записывает изменения в вазодилатации и температуре, контроллер 4502, изображенный на Фиг.45, более непрерывно может определить, был ли на этапе 4704 достигнут порог вазодилатации.
На этапе 4706, если порог был достигнут, контроллер выполняет любую функцию(и), необходимые для ограничения или уменьшения активности терапевтического элемента, регулирующего терапию. Если порог не был достигнут и вазодилатация не достигла требуемого уровня, чтобы вызвать улучшение в фармакокинетических и фармакодинамических свойствах лекарственных средств, то контроллер 4502, изображенный на Фиг.45, на этапе 4700 может увеличить активность элементов терапии в диапазоне пределов, известных и принятых в области техники, чтобы вызвать необходимый уровень тепла и вазодилатации.
Фиг.50 представляет собой блок-схему, изображающую способ для управления температурой нагревания, обеспечиваемого терапевтическим элементом, чтобы предотвратить деградацию температурочувствительного лекарственного средства, в соответствии с некоторыми вариантами выполнения настоящего изобретения. Как показано на этапе 5000, для введения пациенту обеспечивается лекарственное средство, которое чувствительно к деградации выше предельной температуры. На этапе 5001 обеспечивается терапевтический элемент, который имеет управляемое нагревание посредством управляемого нагревательного элемента. На этапе 5002 терапевтический элемент размещают в температурообменном контакте с тканью, которая должна быть нагрета, так что тепло от терапевтического элемента передается ткани, которая должна быть нагрета.
На этапе 5003 управляют максимальной температурой, обеспечиваемой терапевтическим элементом, так что температура, которой подвержено лекарственное средство (т.е. среда, окружающая лекарственное средство), не превышает предельную температуру, которую может выдержать лекарственное средство до того, как произойдет деградация. Максимальная температура может быть откалибрована для каждого лекарственного средства и/или класса лекарственных средств. Например, для некоторых типов инсулина предельная температура равна приблизительно 37 градусам С.
Такой контроль может быть обеспечен посредством микропроцессора или другого процессора для того, чтобы управлять температурой, созданной нагревательным элементом. Для измерения температуры в нагреваемой ткани может также быть предусмотрен датчик, чтобы определять температуру, испытываемую лекарственным средством.
В некоторых вариантах выполнения терапевтический элемент содержит один или большее количество материалов, способных к созданию экзотермической реакции, в которых количество таких материалов и/или их отношение вычисляется так, чтобы температура реакции не превышала максимальной температуры, установленной для терапевтического элемента в соответствии с требуемой предельной температурой лекарственного средства. Экзотермическая реакция может быть создающей тепло реакцией окисления, например, используя смесь железного порошка, активированного угля, соли и воды. Как должно быть понятно специалистам, могут быть использованы другие смеси и/или материалы.
Хотя изобретение было описано в отношении ограниченного числа вариантов выполнения, должно быть понятно, что может быть выполнено большое количество изменений, модификаций и других применений изобретения. Любой из и все патенты, заявки на патент, статьи и другие опубликованные и неопубликованные документы, упомянутые где-либо в настоящем описании, включены в этот документ во всей полноте посредством ссылки. Нужно отметить, что всякий раз, когда описан локальный эффект терапии на области с введенным лекарственным средством, эффект терапии может быть также и на большем объеме вблизи объема инфузии лекарственного средства или на меньшем объеме в зависимости от конкретной терапии.
Хотя здесь были подробно раскрыты конкретные варианты выполнения, это было сделано посредством примера и только в целях иллюстрации и не предназначено для ограничения изобретения. В частности, изобретателями предусмотрено, что могут быть выполнены различные замены, изменения и модификации не отступая от сущности и объема раскрытых вариантов выполнения. Другие аспекты, преимущества и модификации также находятся в рамках раскрытых и заявленных вариантов выполнения, так же как и другие раскрытые здесь изобретения. Представленная после описания формула изобретения является просто типичной для некоторых из вариантов выполнения изобретений, раскрытых в этом документе. Однако также предусмотрены и другие незаявленные варианты выполнения, которые здесь описаны. Изобретатели сохраняют за собой право заявить такие варианты выполнения и изобретения в более поздних формулах изобретения и/или более поздних заявках, требуя общего приоритета.
Реферат
Изобретение относится к медицинской технике, а именно к устройствам для доставки лекарственных средств пациенту, в частности к устройствам для подкожной инфузии лекарственных средств или веществ, использующим источники энергии для повышения эффективности введения лекарственных средств. Устройство для доставки терапевтического вещества в тело пациента содержит инфузионный катетер, элемент прикрепления катетера, кожух, терапевтический элемент и контроллер. Инфузионный катетер выполнен с возможностью вставления в телесную ткань, расположенную на участке вставки на теле пациента, и с возможностью доставки терапевтического вещества в тело пациента в области инфузии. Область инфузии включает объем ткани тела, окружающий участок вставки. Элемент прикрепления катетера выполнен с возможностью прикрепления к коже пациента и с возможностью прикрепления инфузионного катетера к коже. Кожух содержит устройство доставки вещества, предназначенное для введения терапевтического вещества в инфузионный катетер для доставки терапевтического вещества в область инфузии, и датчик, встроенный в кожух и выполненный с возможностью обнаружения инфузии терапевтического вещества. Терапевтический элемент выполнен с возможностью применения терапии вблизи области инфузии для изменения фармакокинетического и/или фармакодинамического профиля терапевтического вещества. Контроллер выполнен с возможностью обмена данными с терапевтическим элементом и с возможностью начала применения терапии с помощью терапевтического элемента при обнаружении начала инфузии терапевтического вещества. Изобретение обеспечивает эффекти�
Формула
инфузионный катетер, выполненный с возможностью вставления в телесную ткань, расположенную на участке вставки на теле пациента, и с возможностью доставки терапевтического вещества в тело пациента в области инфузии, причем область инфузии включает объем ткани тела, окружающий участок вставки;
элемент прикрепления катетера, выполненный с возможностью прикрепления к коже пациента и с возможностью прикрепления инфузионного катетера к коже;
кожух, содержащий устройство доставки вещества, предназначенное для введения терапевтического вещества в инфузионный катетер для доставки терапевтического вещества в область инфузии, и датчик, встроенный в кожух и выполненный с возможностью обнаружения инфузии терапевтического вещества;
терапевтический элемент, выполненный с возможностью применения терапии вблизи области инфузии для изменения фармакокинетического и/или фармакодинамического профиля терапевтического вещества; и
контроллер, выполненный с возможностью обмена данными с терапевтическим элементом и с возможностью начала применения терапии с помощью терапевтического элемента при обнаружении начала инфузии терапевтического вещества.

Комментарии