Композиция, включающая комплексную (и)рнк и свободную ирнк для осуществления или повышения иммуностимулирующего ответа у млекопитающих, и ее применения - RU2545756C2
Код документа: RU2545756C2
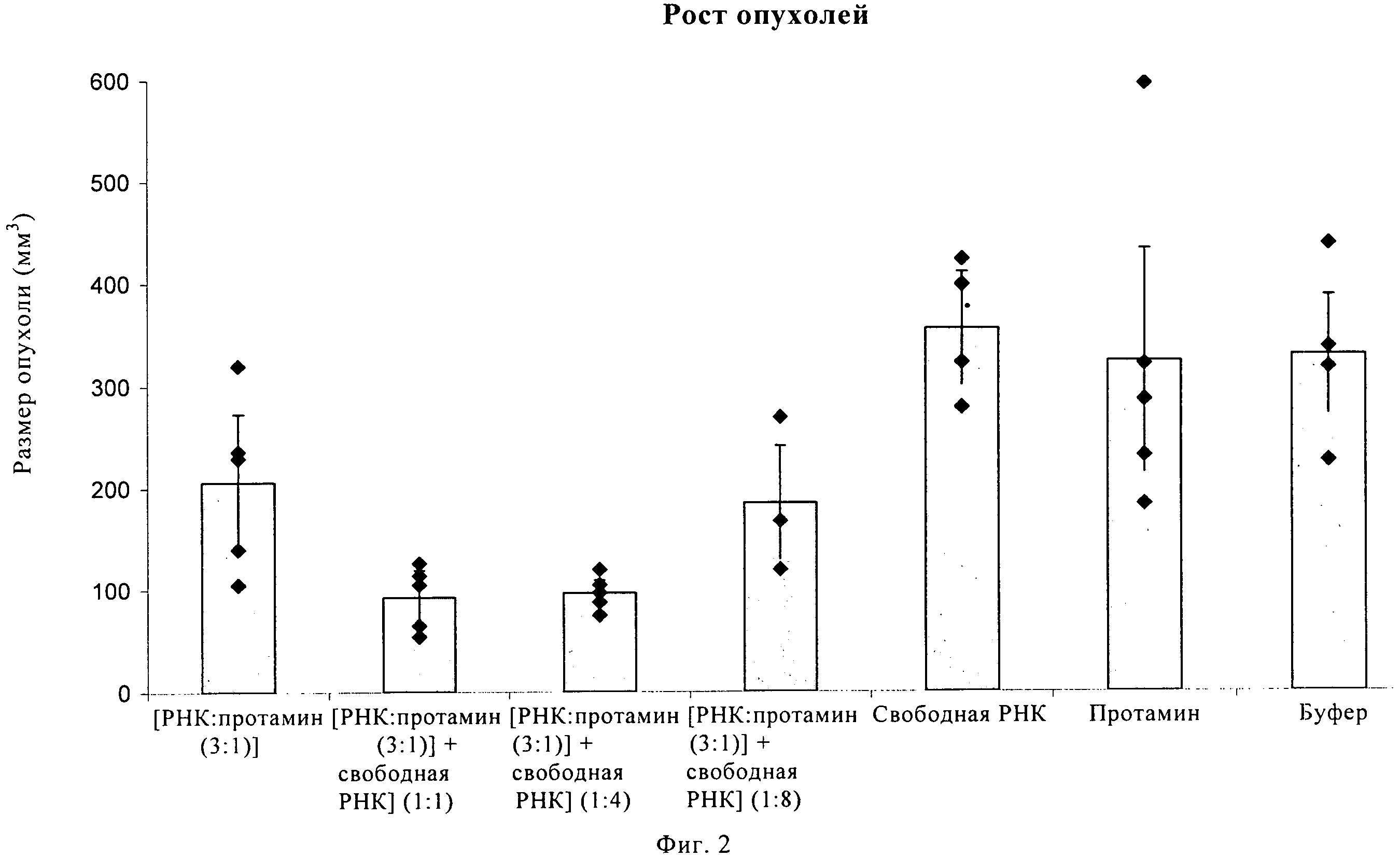
Чертежи






































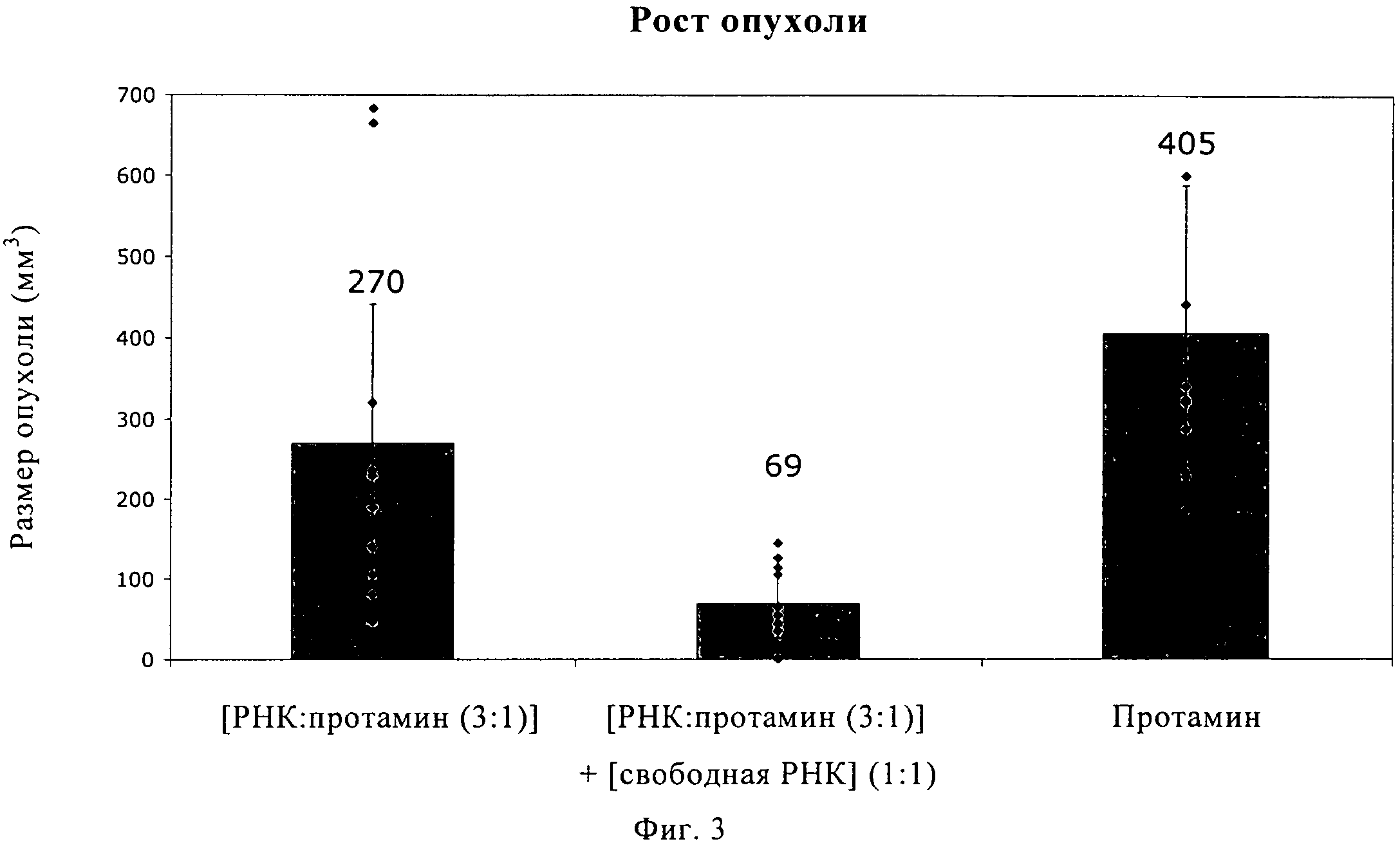
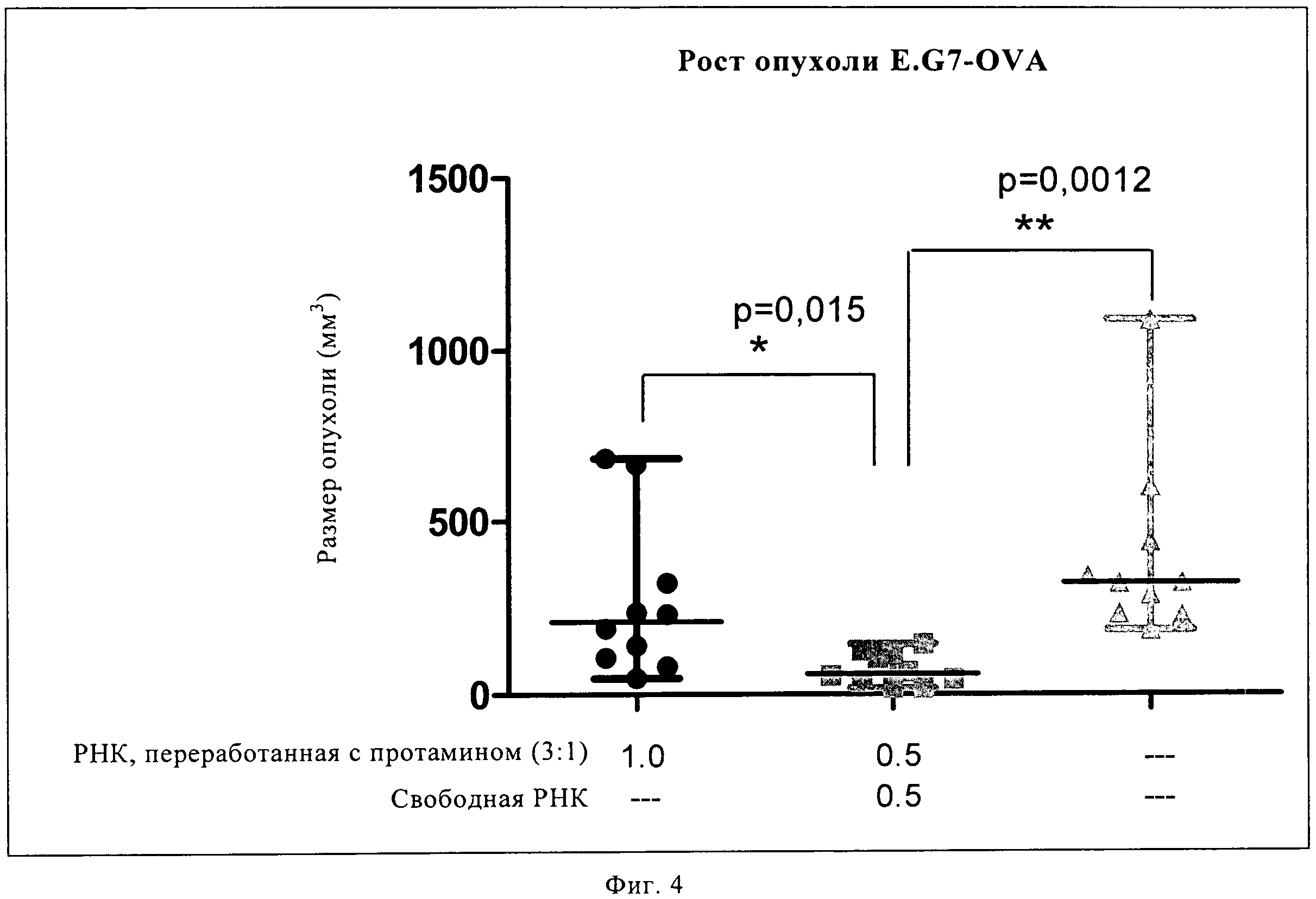
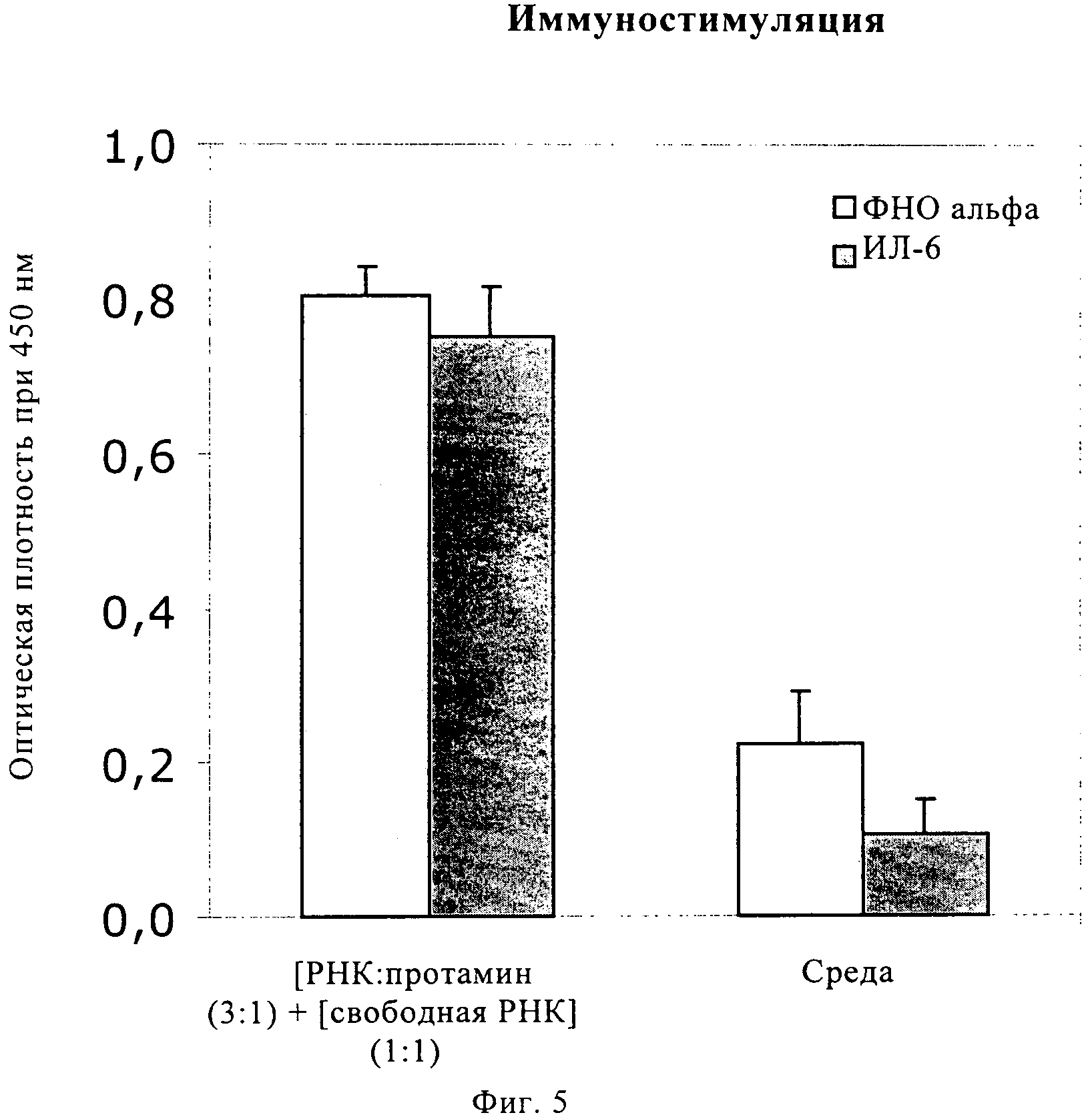
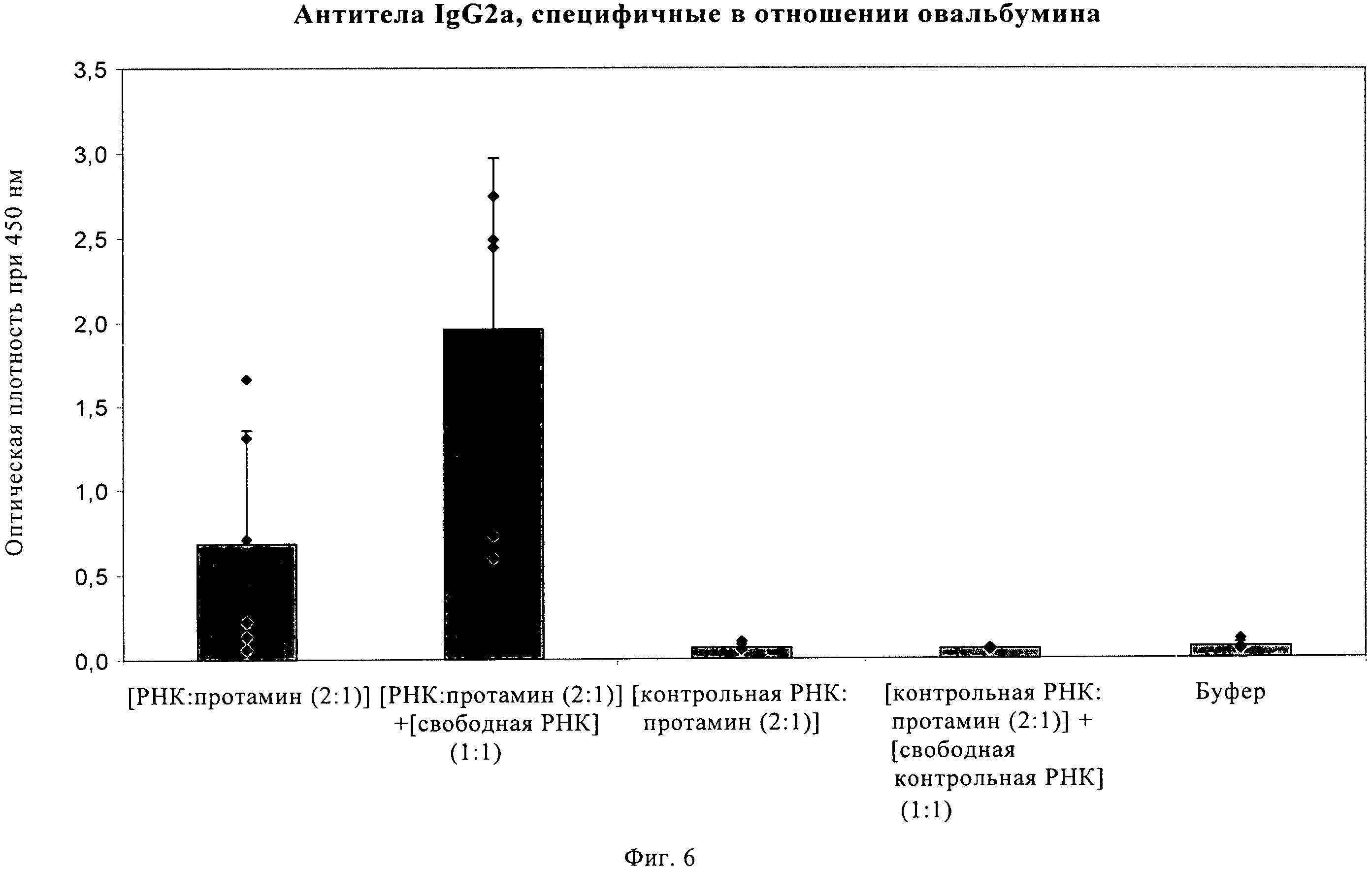



Описание
Настоящее изобретение относится к иммуностимулирующей композиции, включающей а) адъювантный компонент, содержащий или состоящий из, по меньшей мере, одной (и)РНК, объединенной с катионным или поликатионным соединением, и б) по меньшей мере одной свободной иРНК, кодирующей по меньшей мере один белок терапевтического действия, антиген, аллерген и/или антитело, причем иммуностимулирующая композиция способна вызвать или усилить врожденный и необязательно адаптивный иммунный ответ у млекопитающих. Патентоспособная иммуностимулирующая композиция по настоящему изобретению может быть фармацевтической композицией или вакциной. Кроме того, настоящее изобретение относится к способу получения патентоспособной иммуностимулирующей композиции. Настоящее изобретение также относится к применению патентоспособной иммуностимулирующей композиции или ее компонентов (для получения фармацевтической композиции или вакцины) для лечения различных заболеваний. Кроме того, настоящее изобретение относится к наборам, содержащим патентоспособную иммуностимулирующую композицию, ее компоненты и/или фармацевтическую композицию или вакцину.
Индукция и/или усиление иммунных ответов врожденной и/или адаптивной иммунной системы играет важную роль в лечении и предупреждении многих заболеваний. Для этой цели иммунная система обычно модулируется, например, введением иммуностимулирующего агента или адъюванта. Однако иммунная система позвоночных, например, человека, очень сложна и тонко регулируема. Она состоит из многих типов белков, клеток, органов и тканей, которые взаимодействуют, находясь в сложно организованной и динамичной сети. Иммунная система обычно предохраняет организмы от инфекции при помощи многоуровневой защиты с возрастающей специфичностью. Один уровень защиты представляет физические или химические барьеры и позволяет заранее уничтожать, по меньшей мере, некоторые патогены и антигены. Добавочный уровень защиты представляет врожденную и адаптивную иммунную систему.
Врожденная иммунная система, представляющая часть иммунной системы, является доминантной системой защиты хозяина у большинства организмов и создает гуморальные и химические барьеры, включающие, например, воспаление, систему комплемента и клеточные барьеры. Врожденная иммунная система обычно основывается на небольшом количестве рецепторов, называемых рецепторами распознавания структур. Они распознают консервативные молекулярные структуры, которые отличают чужеродные организмы, например, вирусы, бактерии и паразиты, от клеток их хозяев. Такие ассоциированные с патогеном молекулярные структуры включают вирусные нуклеиновые кислоты, компоненты бактериальных или грибковых клеточных стенок, белки жгутиковых и другие структуры.
Первым подробно изученным семейством рецепторов распознавания структур является семейство Толл-подобных рецепторов (Toll-like receptor - TLR). TLR-рецепторы - это трансмембранные белки, распознающие лиганды внеклеточных элементов окружающей среды или лиганды полостей эндосом. Путем связывания лигандов они передают сигнал через цитоплазматические адаптивные белки, что ведет к индукции защитного ответа в организме хозяина и влечет за собой продуцирование антимикробных пептидов-предшественников воспалительных хемокинов и цитокинов, антивирусных цитокинов и т.д. (см., например, Meylan E., Tschopp J. и. др., J. Nature 442 (7098), 2006, с.39-44). В настоящее время было идентифицировано по меньшей мере 10 представителей семейства Толл-подобных рецепторов. (TLR 1-10) у человека и 13 (TLR 1-13) у мышей. К таким Толл-подобным рецепторам у человека относится рецептор TLR1-TLR2 (известный лиганд: триациллипопептид), рецептор TLR1-TLR6 (известный лиганд: диациллипопептид), TLR2 (известный лиганд: пептидогликан), TLR3 (известный лиганд: двуспиральная РНК), TLR4 (известный лиганд: липополисахарид (липополисахарид - LPS) у грамотрицательных бактерий), TLR5 (известный лиганд: бактериальный флагеллин (флагеллины)), TLR7/8 (известные лиганды: имидазохинолины, аналоги гуанозина и одноцепочечная РНК), TLR9 (известные лиганды: CpG (цитозин-фосфат-гуанин)сайты ДНК бактерий, вирусов и простейших, малярийный пигмент хемозоин (продукт расщепления гемоглобина) и TLR10. После распознавания микробных патогенов указанные TLR-рецепторы обычно индуцируют внутриклеточные сигнальные метаболические пути, которые вызывают индукцию воспалительных цитокинов (например, ФНО-альфа, ИЛ-6, ИЛ-1-бета и ИЛ-12), интерферон 1 типа (ИФН-бета и множественный ИФН-альфа) и хемокинез (Kawai Т., Akira S., J. Cell Death Differ 13(5), 2006, cc.816-825).
Будучи частью более сложного иммунного ответа у позвоночных, иммунная система со временем адаптируется к распознаванию определенных патогенов или антигенов более эффективно. Этот адаптационный процесс создает иммунологическую память и обеспечивает даже более эффективную защиту при будущих столкновениях с этими патогенами. Этот процесс адаптивного или приобретенного иммунитета лежит в основе стратегии вакцинации. По сравнению с врожденной иммунной системой, которая была описана выше, адаптивная иммунная система является антигенспецифичной и требует распознавания специфических «своих» или «чужих» антигенов в процессе, названном презентацией антигена. Более того, в отличие от клеток врожденной иммунной системы, которые распознают и отвечают на антигены универсально, адаптивная иммунная система обеспечивает длительный или защитный иммунитет хозяину и таким образом осуществляет более специализированный ответ на специфические патогены, патоген-инфицированные клетки или антигены. Способность устанавливать такие специализированные ответы поддерживается в теле так называемыми «клетками памяти». В случае проникновения/инфицирования антигеном или патогеном организма более одного раза эти специфические клетки памяти используются для его быстрого уничтожения. Адаптивная иммунная система таким образом обеспечивает и более сильный иммунный ответ, и иммунологическую память, причем различные иммунные ответы возможны в отношении специфических заболеваний. Например, в случае инфекций каждый патоген «запоминается» в виде отдельного специфического антигена, а в случае раковых заболеваний опухолевые антигены или собственные антигены могут распознаваться и нейтрализоваться адаптивной иммунной системой.
Главными компонентами адаптивной иммунной системы позвоночных преимущественно являются лимфоциты на клеточном уровне и антитела на молекулярном уровне. Лимфоциты в качестве клеточных компонентов адаптивной иммунной системы включают В-лимфоциты и Т-лимфоциты, которые образуются из кроветворных стволовых клеток костного мозга. В-лимфоциты вовлечены в гуморальный ответ, а Т-лимфоциты вовлечены в иммунный ответ, опосредованный клетками. И В-лимфоциты, и Т-лимфоциты несут рецепторные молекулы, которые распознают специфические мишени. Т-лимфоциты распознают «чужие» клетки-мишени, например патогенные структуры-мишени, только после переработки антигенов (например, мелких фрагментов патогена) и их представления в комбинации со «своим» рецептором, называемым молекулой главного комплекса гистосовместимости (ГКГ). И наоборот, антигенспецифическим рецептором В-лимфоцитов является молекула антитела на поверхности В-лимфоцита, и В-лимфоциты распознают патогены тогда, когда антитела на их поверхности связываются со специфическим чужеродным антигеном. Этот комплекс антиген/антитело захватывается В-лимфоцитом и подвергается протеолизу до пептидов. В-лимфоциты затем перемещают эти антигенные пептиды на поверхность своих ГКГ молекул II класса. Эта комбинация ГКГ и антигена привлекает соответствующий Т-хелпер, который выделяет лимфокины и активирует В-лимфоцит. Поскольку затем активированный В-лимфоцит начинает делиться, производные от него клетки секретируют миллионы копий антител, распознающих данный антиген. Эти антитела циркулируют в плазме крови и лимфе, связывая патогены или опухолевые клетки, экспрессирующие антиген, и помечают их для разрушения путем активации комплемента или для поглощения и разрушения фагоцитами. Будучи компонентами клеточной адаптивной иммунной системы, цитотоксические Т-лимфоциты (CD8+) могут также формировать CTL-ответ. Цитотоксические Т-лимфоциты (CD8+) могут распознавать пептиды эндогенных патогенов и собственные антигены, связанные с молекулами ГКГ I типа. Т-лимфоциты (CD8+) исполняют свою функцию уничтожения путем высвобождения цитотоксических белков в клетке.
Таким образом, оба базовых механизма иммунной системы - врожденный и адаптивный, могут формировать мишени для лечения и предотвращать многие заболевания. Соответствующие методы, известные в данной области, либо утилизируют адъюванты для индукции ответа врожденного иммунитета, либо используют антигены, патогены или иммуногены, чтобы вызвать ответную реакцию адаптивной иммунной системы, или, в редких случаях, запускают оба процесса.
В частности, адаптивный иммунный ответ может вызываться путем введения чужеродного антигена клеток или организма-хозяина, согласно описанному выше, либо в форме пептидных или белковых антигенов, либо антиген может кодироваться нуклеиновой кислотой, например, кДНК или информационной РНК. Чтобы вызвать эффективный адаптивный иммунный ответ, дополнительная неспецифическая стимуляция врожденной иммунной системы может быть полезна, например, когда проводится неспецифическая стимуляция параллельно антигенспецифичному сигналу. Параллельный неспецифический стимул переводит иммунную систему в активированное состояние, которое улучшает адаптивный иммунный ответ. Соединения, способные обеспечить такой неспецифический иммунный ответ принято обозначать термином «адъюванты». В предыдущих работах большое число различных соединений было предложено в качестве адъювантов, например, адъювант Фрейнда, оксиды металлов, (в частности, гидроксид алюминия), неорганические хелаты или их соли, различные парафиноподобные масла, синтетические смолы, альгинаты, мукоиды, полисахариды, казеинаты, а также соединения, выделенные из крови и/или из коагулятов крови, например, производных фибрина, и т.д. Такие адъюванты обычно могут применяться в комбинациях с другими соединениями, например, белками, пептидами, молекулами ДНК или РНК, или другими соединениями терапевтического действия в зависимости от желаемого результата.
Однако молекулы свободной информационной РНК (иРНК), кДНК или нуклеиновых кислот в целом, которые могут кодировать специфический антиген или какой-либо другой белок терапевтического действия, пригодный для специфической терапии, обычно не проявляют в достаточной степени иммуностимулирующих свойств или вообще не проявляют их. Тем не менее, такие иммуностимулирующие свойства могут проявляться у молекул иРНК, кДНК или нуклеиновых кислот, когда они связаны с пептидом или белком, например, протамином, или белком, связывающим нуклеиновую кислоту. В этом контексте молекулы иРНК или нуклеиновой кислоты и молекулы пептида или белка могут быть переработаны таким образом, что формируется комплекс между молекулой иРНК или молекулой нуклеиновой кислоты и пептидом или белком, причем различные комплексы могут формироваться между молекулой иРНК или нуклеиновой кислоты и пептидом или белком. Достаточно сильные (адъювантные) комплексы могут образовываться из-за того, что нуклеиновая кислота, обычно отрицательно заряженная при нейтральной величине рН, связывается с катионным или поликатионным пептидом или белком.
Однако при применении молекул иРНК или нуклеиновой кислоты в методах вакцинации, трансляция иРНК или нуклеиновой кислоты in vivo остается самым важным и существенным фактором для индуцирования адаптивного иммунного ответа или для экспрессии закодированного белка в целом, например, в случае белка или пептида терапевтического действия. Соответственно, молекулы комплексной иРНК или нуклеиновой кислоты могут высвобождаться из комплекса с (катионным) пептидом или белком с последующей трансфекцией комплекса в клетки для обеспечения эффективной трансляции иРНК. К сожалению, в большинстве случаев этого не происходит. Чаще комплексы иРНК или нуклеиновой кислоты с катионными или поликатионными соединениями могут даже препятствовать трансляции нуклеиновой кислоты или по меньшей мере значительно снижают уровень трансляции in vivo из-за сильного связывания поликатионного соединения с молекулой иРНК, кДНК или молекулой нуклеиновой кислоты. Соответственно, трудно получить композицию с хорошим иммуностимулирующим свойством, связанным с врожденной иммунной системой, воспринимающей такие соединения, и убедиться в параллельной эффективной трансляции молекул иРНК, кДНК или нуклеиновой кислоты при использовании такого состава.
Одним из возможных решений проблемы, описанной выше, может являться введение адъюванта и иРНК в отдельных составах. Это, однако, делает введение намного более сложным. Также является предпочтительным, чтобы адъювант и иРНК, кодирующая антиген, попадали бы в одну и ту же клетку для достижения оптимального иммунного ответа. Более того, адъювант успешно поддерживает индукцию адаптивного иммунного ответа, если он индуцирует врожденный иммунный ответ в той же клетке, в которой антиген экспрессируется кодирующей иРНК.
Другой возможностью обойти описанную выше проблему может быть работа с очищенной иРНК, кДНК или нуклеиновой кислотой. Такой подход, хотя и успешный для цели эффективной трансляции иРНК, кДНК или нуклеиновой кислоты in vivo, недостаточен для активации врожденной иммунной системы, запускаемой адъювантом, согласно описанному выше.
Таким образом, все указанные подходы фактически неудовлетворительны и не ведут к параллельному ответу врожденной иммунной системы с хорошей трансляцией введенной иРНК, кДНК или нуклеиновой кислоты. Соответственно, в данной области сохраняется потребность в получении эффективной иммуностимулирующей композиции или метода, позволяющих вызвать врожденный и необязательно адаптивный иммунные ответы, в которых введение не ослабляется неэффективной трансляцией иРНК в результате образования комплекса с партнером по комплексу, который придает иммуностимулирующие свойства иРНК. Другими словами, объектом настоящего изобретения является разработка способа и иммуностимулирующей композиции, которые позволяют запускать или усиливать врожденный и желательно адаптивный иммуностимулирующий ответ у млекопитающих, тем самым, обеспечивая эффективное адъювантное (иммуностимулирующее) свойство и эффективную трансляцию вводимой иРНК.
Эта задача решается в настоящем изобретении, сущность которого изложена в формуле настоящего изобретения. В частности, объектом настоящего изобретения является иммуностимулирующее соединение, состоящее из а) адъювантного компонента, содержащего или состоящего по меньшей мере из одной (и)РНК, связанной с катионным или поликатионным соединением, и б) по меньшей мере одной свободной иРНК, кодирующей по меньшей мере один белок терапевтического действия, антиген, аллерген и/или антитело, в которых иммуностимулирующая композиция способна вызвать или усилить врожденный и необязательно адаптивный иммунный ответ у млекопитающих.
В контексте настоящего изобретения млекопитающее может быть выбрано из каких-либо млекопитающих, предпочтительно выбранных из группы, включающей коз, крупный рогатый скот, свиней, собак, ослов, обезьян, человекообразных обезьян, грызунов, например, мышей, хомяков, кроликов, и особенно человека, однако ими перечень не ограничивается.
Главное преимущество патентоспособной иммуностимулирующей композиции по настоящему изобретению заключается в том, что она может эффективно индуцировать врожденный и необязательно адаптивный иммунный ответ у млекопитающих, при котором трансляция по меньшей мере одной свободной иРНК, кодирующей по меньшей мере один белок терапевтического действия, не нарушается адъювантным компонентом, а именно, комплексом по меньшей мере одной (и)РНК с катионным или поликатионным соединением. Это происходит именно потому, что при формировании адъювантного компонента для комплексообразования используется катионное или поликатионное соединение, что обычно приводит к образованию прочного комплекса между РНК и катионным соединением, которое трудно высвобождает РНК из комплекса. Соответственно, свободная иРНК больше не нарушается катионным соединением, даже если совместное введение адъювантного компонента и свободной иРНК в одном составе ведет к значительно улучшенной трансфекции и экспрессии свободной иРНК in vivo. В данном изобретении представлено неожиданное решение проблемы, заключающееся в том, что оба свойства иммуностимулирующей композиции, т.е. эффективная стимуляция иммунитета и эффективная трансляция РНК, могут сочетаться в одном составе, если этот состав приготовлен на двух разных стадиях. Это решение даже более доказательное, поскольку позволяет смешивать адъювантный компонент с любой свободной иРНК без потери свободной иРНК из-за образования комплекса с катионным соединением адъювантного компонента. Раствор даже может храниться в течение продолжительного периода времени без установления реакции равновесия между комплексной РНК и свободной иРНК. Иначе говоря, отсутствует диссоциация сформированного адъювантного компонента, в результате которой могло бы произойти связывание свободной иРНК катионным соединением адъювантного компонента и высвобождение связанной РНК из комплекса.
В качестве первого компонента иммуностимулирующая композиция по настоящему изобретению содержит так называемый «адъювантный компонент», содержащий или состоящий из по меньшей мере одной (и)РНК, связанной с катионным или поликатионным соединением.
Так называемый, «адъювантный компонент» получают согласно первой стадии путем формирования комплекса по меньшей мере одной (и)РНК адъювантного компонента с катионным или поликатионным соединением в специальном соотношении для формирования стабильного комплекса. В этом контексте важно, чтобы не было ни катионного, ни поликатионного соединения, либо лишь ничтожно малые их количества оставались в адъювантном компоненте после образования комплекса с иРНК. Соответственно, соотношение (и)РНК и катионного или поликатионного соединения в адъювантном компоненте обычно выбирают в таком диапазоне, чтобы иРНК полностью связалась при формировании комплекса, и ни катионного, ни поликатионного компонента, либо лишь ничтожно малые их количества оставались в композиции. Предпочтительное соотношение адъювантного компонента, то есть соотношение (и)РНК и катионного или поликатионного соединения по массе, выбирают из диапазона примерно от 6:1 до 0,25:1, более предпочтительно от примерно 5:1 до 0,5:1, еще более предпочтительно от примерно 4:1 до 1:1 или от примерно 3:1 до 1:1, и самым предпочтительным является соотношение примерно от 3:1 до 2:1.
Более того, соотношение (и)РНК и катионного или поликатионного соединения в адъювантном компоненте также может быть вычислено на основе соотношения азота к фосфату (N/P) всего комплекса РНК. Например, 1 мкг РНК обычно содержит примерно 3 нмоль фосфатных остатков, при условии, что РНК демонстрирует статистическое распределение оснований. Кроме того, 1 мкг пептида обычно содержит примерно х нмоль остатков азота, в зависимости от молекулярной массы и числа основных аминокислот. При примерном подсчете для (Arg)9 (молекулярная масса 1424 г/моль, 9 атомов азота), 1 мкг (Arg)9 содержит примерно 700 пмолей (Arg)9 и таким образом, 700×9=6300 пмолей основных аминокислот = 6,3 нмоля атомов азота. Для соотношения масс PHK/(Arg)9 примерно 1:1, может быть рассчитано соотношение N/P, примерно равное двум. При расчете на примере протамина (молекулярная масса примерно 4250 г/моль, 21 атом азота, в случае применения протамина из лосося) при соотношении масс примерно 2:1 для 2 мкг РНК, рассчитывают для РНК 6 нмолей фосфата; 1 мкг протамина содержит примерно 235 пмолей молекул протамина и таким образом 235×21=4935 пмолей основных атомов азота = 4,9 нмолям атомов азота. Для соотношения масс РНК/протамин примерно 2:1 соотношение N/P может быть рассчитано примерно равным 0,81. Для соотношения масс РНК/протамин примерно 8:1 соотношение N/P может быть рассчитано примерно равным 0,2. В контексте настоящего изобретения предпочтительным является соотношение N/P в диапазоне примерно 0,1-10, предпочтительно в диапазоне примерно 0,3-4 и наиболее предпочтительно в диапазоне примерно 0,5-2 или 0,7-2, принимая во внимание соотношение РНК к пептиду в комплексе, и наиболее предпочтительно в диапазоне примерно 0,7-1,5.
В контексте настоящего изобретения катионное или поликатионное соединение преимущественно выбирают из какого-либо катионного или поликатионного соединения, применимого для образования комплексов и таким образом способного стабилизировать нуклеиновую кислоту, по меньшей мере, одну (и)РНК, например, путем ассоциации по меньшей мере одной иРНК с катионным или поликатионным соединением. Такое катионное или поликатионное соединение в чистом виде не должно проявлять какие-либо адъювантные свойства, поскольку адъювантные свойства, в частности способность индуцировать врожденный иммунный ответ, преимущественно возникает при образовании комплекса по меньшей мере одной (и)РНК с катионным или поликатионным соединением. При образовании комплекса по меньшей мере между одной (и)РНК с катионным или поликатионным соединением формируется адъювантный компонент.Особенно предпочтительно, если катионные или поликатионные пептиды или белки в качестве компонента Р2 могут быть выбраны из протамина, нуклеолина, спермина или спермидина, поли-L-лизина (PLL), основных полипептидов, полиаргинина, пептидов, проникающих в клетки (cell penetrating peptides - СРР), химерных СРР, например, транспортана, или пептидов MPG, ВИЧ-связывающих пептидов, Tat, ВИЧ-1 Tat (ВИЧ), Tat-производных пептидов, олигоаргининов, представителей семейства пенетратина, например, пенетратина, пептидов, производных от белка антеннапедия (в частности из Drosophila antennapedia), pAntp, pIsl и т.д., антимикробных производных СРР-пептидов, например, буфорина-2, Вас715-24, SynB, SynB(1), pVEC, hCT-производных пептидов, SAP, MAP, KALA, PpTG20, обогащенных пролином пептидов, L-олигомеров, обогащенных аргинином пептидов, кальцитониновых пептидов, FGF, лактоферрина, поли-L-лизина, полиаргинина, гистонов, пептидов, являющихся производными или аналогами VP22, HSV, VP22 (Herpes simplex), MAP, KALA или протеин-трансдуцирующих доменов (PTD, РрТ620), обогащенных пролином пептидов, обогащенных аргинином пептидов, обогащенных лизином пептидов, Рер-1, кальцитонинового пептида (пептидов) и т.д. Кроме того, предпочтительные катионные или поликатионные белки или пептиды могут быть выбраны из следующих белков или пептидов, имеющих следующую общую формулу: (Arg)l;(Lys)m;(His)n;(Orn)o;(Xaa)x, где l+m+n+o+x=8-15, и l, m, n или о независимо друг от друга могут быть любыми числами, выбранными из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15, при условии, что общее содержание Arg, Lys, His и Orn составляет по меньшей мере 50% от всех аминокислот в олигопептиде; и Хаа может быть любой аминокислотой, выбранной из естественных (естественного происхождения) или синтезированных аминокислот, за исключением Arg, Lys, His или Orn; и х может быть каким-либо числом из 0, 1, 2, 3, 4, 5, 6, 7 или 8, при условии, что общее содержание Хаа не превышает 50% от всех аминокислот в олигопептиде. Более предпочтительными олигоаргининами в данном контексте являются, например, Arg7, Arg8, Arg9, Arg7, H3R9, R9H3, H3R9H3, YSSR9SSY, (RKH)4, Y(RKH)2R и т.д. К дополнительным предпочтительным катионным или поликатионным соединениям, которые могут применяться для образования комплекса по меньшей мере с одной указанной выше иРНК адъювантного компонента, могут относиться катионные полисахариды, например, хитозан, полибрен, катионные полимеры, например, полиэтиленимин (ПЭИ), катионные липиды, например, ДОТМА: [1-(2,3-сиолейлокси)пропил)]-N,N,N-триметиламмоний хлорид, DMRIE, ди-С14-амидин, DOTIM, SAINT, DC-Chol, BGTC, СТАР, DOPC, DODAP, ДОФЭ: диолеилфосфатидилэтаноламин, DOSPA, DODAB, DOIC, DMEPC, ДОГС: диоктадециламидоглицилспермин, DIMRI: димиристооксипропилдиметилгидроксиэтиламмоний бромид, ДОТАП: диолеолокси-3-(триметиламмонио)пропан, DC-6-14: O,O-дитетрадеканоил-N-(α-триметиламмониоацетил)диэтаноламин хлорид, CLIP1: рац-[(2,3-диоктадецилоксипропил)(2-гидроксиэтил)]диметиламмоний хлорид, CLIP6: рац-[2(2,3-дигексадецилоксипропилоксиметилокси)этил]триметиламмоний, CLIP9: рац-[2(2,3-дигексадецилоксипропилоксисукцинилокси)этил]-триметиламмоний, олигофектамин, или катионные или поликатионные полимеры, например, модифицированные полиаминокислоты, например, β-аминокислотные полимеры или инвертированные полиамиды и т.д., модифицированные полиэтилены, например, ПВП (поли(N-этил-4-винилпиридиний бромид)) и т.д., модифицированные акрилаты, например, пДМАЭМА (поли(диметиламиноэтилметилакрилат)) и т.д., модифицированные амидоамины, например, пАМАМ (поли(амидоамин)) и т.д., модифицированный полибетааминный эфир (ПБАЭ), например, модифицированные по диаминному концу сополимеры 1,4 бутандиолдиакрилата и 5-амино-1-пентанола и т.д., дендримеры, например, полипропиламинные дендримеры или основанные на пАМАМ дендримеры и т.д., полиимин (полиимины), например, ПЭИ: поли(этиленимин), поли(пропиленимин) и т.д., полиаллиламин, например, полимеры, основанные на каркасе молекулы сахара, например, полимеры на основе циклодекстрина, полимеры на основе декстрана, хитозан и т.д., полимеры, основанные на каркасе молекулы силана, например, сополимеры PMOXA-PDMS и т.д., блок-полимеры, состоящие из комбинации одного или более катионных блоков (например, выбранный катионный полимер, упомянутый выше) и из одного или более гидрофильных или гидрофобных блоков(например, полиэтиленгликоль) и т.д. Ассоциирование или образование комплекса с модифицированной (и)РНК иммуностимулирующей композиции по настоящему изобретению с катионными или поликатионными соединениями предпочтительно обеспечивает адъювантные свойства (и)РНК и придает стабилизирующий эффект (и)РНК адъювантного компонента путем комплексообразования. Метод стабилизации модифицированной иРНК в общем описывается в ЕР-А-1083232, описание которого включается в настоящее изобретение в виде ссылки. В качестве катионных или поликатионных соединений особенно предпочтительными являются соединения, выбранные из группы, состоящей из протамина, нуклеолина, спермина, спермидина, олигоаргининов, описанных выше, например, Arg7, Arg8, Arg9, Arg7, H3R9, R9H3, H3R9H3, YSSR9SSY, (RKH)4, Y(RKH)2R и. т.д.
В контексте настоящего изобретения, по меньшей мере, одной (и)РНК «адъювантного компонента» иммуностимулирующей композиции по настоящему изобретению может быть какая-либо РНК, предпочтительно, но ими перечень не ограничивается, короткий олигонуклеотид РНК, кодирующая РНК, иммуностимулирующая РНК, миРНК, антисмысловая РНК или РНК-переключатель, рибозимы или аптамеры. Далее, по меньшей мере одна (и)РНК адъювантного компонента может быть одно- или двухцепочечной РНК (которая также может рассматриваться как РНК (молекула) из-за нековалентной ассоциации двух одноцепочечных РНК (молекул)) или частично двухцепочечная или частично одноцепочечная РНК, которые по меньшей мере частично аутокомплементарны (обе из них являются частично двухцепочечными или частично одноцепочечными молекулами РНК и обычно формируются из удлиненной или укороченной одноцепочечной молекулы РНК или из двух одноцепочечных молекул РНК, которые примерно одинаковы по длине, и одна молекула одноцепочечной РНК частично комплементарна другой молекуле одноцепочечной РНК, таким образом, они обе формируют двухцепочечную молекулу РНК в данной области, т.е. частично двухцепочечную или частично одноцепочечную РНК). Предпочтительно, чтобы по меньшей мере одна (и)РНК адъювантного компонента могла быть одноцепочечной РНК. Кроме того, по меньшей мере одна (и)РНК адъювантного компонента может быть кольцевой или линейной РНК, предпочтительнее линейной РНК. Более предпочтительно, чтобы по меньшей мере одна (и)РНК адъювантного компонента могла быть (линейной) одноцепочечной РНК. По меньшей мере одна (и)РНК адъювантного компонента может быть рибосомальной РНК (рРНК), транспортной РНК (тРНК), информационной РНК (иРНК) или вирусной РНК (вРНК), более предпочтительна иРНК. Настоящее изобретение позволяет всем этим типам РНК быть частью «адъювантного компонента» патентоспособной композиции по настоящему изобретению, либо отдельно, либо в комбинации. В контексте настоящего изобретения иРНК обычно является РНК, состоящей из нескольких структурных элементов, например, необязательной области 5'-UTR, расположенного выше по цепи сайта связывания рибосомы, последующей кодирующей области, необязательной области 3'-UTR, за которой может следовать концевая последовательность поли-А-хвоста (и/или поли-С-хвоста). Молекула иРНК может быть моно-, ди-, или даже полицистронной РНК, т.е. РНК, которая несет кодирующие последовательности для одного, двух или более белков или пептидов. Такие кодирующие последовательности в ди- или даже полицистронной иРНК могут быть разделены по меньшей мере одной последовательностью IRES, например, согласно описанию настоящего изобретения.
Предпочтительно по меньшей мере одна (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции по настоящему изобретению включает в длину примерно от 5 до примерно 20000, или от 100 до примерно 20000 нуклеотидов, предпочтительно примерно от 250 до примерно 20000 нуклеотидов, и более предпочтительна длина примерно от 500 до примерно 10000, еще более предпочтительна длина примерно от 500 до примерно 5000, и самой предпочтительной является длина примерно от 100 до 10000 нуклеотидов или длина примерно от 100 до 5000 нуклеотидов.
Согласно первому варианту осуществления настоящего изобретения по меньшей мере одна (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению может быть коротким олигонуклеотидом РНК. Короткие РНК-олигонуклеотиды в контексте настоящего изобретения могут включать какой-либо тип РНК из числа описанных выше. Предпочтительно короткие олигонуклеотиды РНК могут быть одно- или двухцепочечными олигонуклеотидами РНК, более предпочтительно одноцепочечным нуклеотидом РНК. Более предпочтительно короткий олигонуклеотид РНК может быть линейным одноцепочечным олигонуклеотидом РНК. Также предпочтительно, чтобы короткие олигонуклеотиды РНК, используемые в настоящем изобретении, могли иметь длину, определенную выше, в общем для молекул РНК, предпочтительно от 5 до 100, от 5 до 50 или от 5 до 30, еще более предпочтительно длину от 20 до 100, от 20 до 80, или от 20 до 60 нуклеотидов.
Согласно второму варианту осуществления настоящего изобретения по меньшей мере одна (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению может быть иммуностимулирующей РНК, т.е. РНК, полученной из иммуностимулирующей РНК, которая индуцирует или повышает врожденный иммунный ответ. Предпочтительно по меньшей мере одна (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению может быть одноцепочечной, двухцепочечной или частично двухцепочечной или частично одноцепочечной РНК, более предпочтительно одноцепочечной РНК и/или кольцевой или линейной РНК, более предпочтительно линейной РНК. Более предпочтительно по меньшей мере одна (и)РНК адъювантного компонента могла бы быть (линейной) одноцепочечной РНК. Еще более предпочтительно, чтобы по меньшей мере одна (и)РНК адъюванного компонента была ((линейной) одноцепочечной) информационной РНК (иРНК). По меньшей мере одна (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению может быть также коротким олигонуклеотидом РНК, описанным выше. По меньшей мере одна (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению может быть также выбрана из какого-либо класса молекул РНК, обнаруженных в природе или синтезированных, способных индуцировать врожденный иммунный ответ. В этом контексте предпочтительно, чтобы адъювантный компонент иммуностимулирующей композиции по настоящему изобретению обычно вызывал врожденный иммунный ответ, а свободная иРНК иммуностимулирующей композиции по настоящему изобретению могла бы вызывать адаптивный иммунный ответ, особенно, если свободная иРНК кодирует антиген или аллерген, согласно описанному в настоящем изобретении, или какую-либо другую молекулу, способную вызывать адаптивный иммунный ответ. В частности, те классы молекул РНК, которые могут индуцировать врожденный иммунный ответ, могут быть выбраны из лигандов Толл-подобных рецепторов (TLR). По меньшей мере одна иммуностимулирующая РНК адъювантного компонента патентоспособной иммуностимулирующей композиции по настоящему изобретению может содержать какую-либо последовательность РНК, обладающую иммуностимулирующим свойством, включая, но ими не ограничиваясь, последовательности РНК, представляющие и/или кодирующие лиганды рецепторов TLR, предпочтительно выбранные из представителей семейства TLR1-TLR10 человека или из представителей семейства TLR1-TLR13 мыши, более предпочтительно из TLR7 и TLR8, лигандов для внутриклеточных рецепторов РНК (например, RIG-1 или MDA-5 и т.д.) (см., например, Meylan E., Tschopp J., J. Mol. Cell. 22, 2006, cc.561-569) или каких-либо других иммуностимулирующих последовательностей РНК.
Обычно иммуностимулирующая РНК, используемая в качестве по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, может иметь длину, определенную выше для молекул РНК в общем для РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению. Предпочтительно длина РНК может быть от 1000 до 5000, от 500 до 5000, от 5 до 5000 или от 5 до 1000, от 5 до 500, от 5 до 250, от 5 до 100, от 5 до 50 или от 5 до 30 нуклеотидов.
Такие иммуностимулирующие последовательности могут содержать, например, нуклеиновую кислоту, соответствующую формуле (I):
GlXmGn,
где:
G означает гуанозин, урацил или аналог гуанозина или урацила;
Х означает гуанозин, урацил, аденозин, тимидин, цитозин или аналог выше упомянутых нуклеотидов;
l означает целое число от 1 до 40,
где: если l=1, то G означает гуанозин или его аналог,
если l>1, то по меньшей мере 50% нуклеотидов означают гуанозин или его аналог;
m означает целое число не меньше 3;
где: если m=3, то Х означает урацил или его аналог,
если m>3, по меньшей мере 3 последующих урацила или аналоги имеют место;
n означает целое число от 1 до 40,
где: если n=1, то G означает гуанозин или его аналог,
если n>1, по меньшей мере 50%нуклеотидов означают гуанозин или его аналог.
Такие иммуностимулирующие последовательности могут также содержать, например, нуклеиновую кислоту формулы (II):
ClXmCn,
где:
С означает цитозин, урацил или аналог цитозина или урацила;
Х означает гуанозин, урацил, аденозин, тимидин, цитозин или аналог выше упомянутых нуклеотидов;
l означает целое число от 1 до 40,
где: если l=1, С означает цитозин или его аналог,
если l>1, по меньшей мере 50% нуклеотидов означают цитозин или его аналог;
m означает целое число, не меньше 3;
где: если m=3, то Х означает урацил или его аналог,
если m>3, по меньшей мере 3 последующих урацила или его аналога имеют место;
n означает целое число от 1 до 40,
где: если n=1, то С означает цитозин или его аналог,
если n>1, по меньшей мере 50% нуклеотидов означают цитозин или его аналог.
Нуклеиновые кислоты формулы (I) или (II), которые могут быть применены по меньшей мере для одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, обычно являются сравнительно короткими молекулами нуклеиновой кислоты и обычно имеют длину приблизительно от 5 до 100 (но также могут быть длиннее 100 нуклеотидов для особых вариантов осуществления настоящего изобретения, например, до 200 нуклеотидов), от 5 до 90 или от 5 до 80 нуклеотидов, предпочтительно длина составляет примерно от 5 до 70, более предпочтительной примерно от 8 до 60, и, более предпочтительно, примерно от 15 до 60 нуклеотидов, более предпочтительно примерно от 20 до 60, наиболее предпочтительная от 30 до 60 нуклеотидов. Если нуклеиновая кислота по настоящему изобретению имеет максимальную длину, например, 100 нуклеотидов, m обычно составляет ≤98. Число нуклеотидов G в нуклеиновой кислоте формулы (I) определяется 1 или n. l и n, независимо друг от друга, означают целые числа от 1 до 40, где, если 1 или n=1, то G означает гуанозин или его аналог, и если 1 или n>1, то по меньшей мере 50% нуклеотидов означают гуанозин или его аналог. Например, если 1 или n=4, то G1 или Gn могут быть, например, GUGU, GGUU, UGUG, UUGG, GUUG, GGGU, GGUG, GUGG, UGGG или GGGG и т.д; если l или n=5, то Gl или Gn могут быть, например, GGGUU, GGUGU, GUGGU, UGGGU, UGGUG, UGUGG, UUGGG, GUGUG, GGGGU, GGGUG, GGUGG, GUGGG, UGGGG, или GGGGG и т.д., но эти примеры не являются ограничительными. Нуклеотид, прилегающий к Xm в нуклеиновой кислоте формулы (I) по настоящему изобретению, предпочтительно не является урацилом. Сходным образом, число нуклеотидов С в нуклеиновой кислоте формулы (II) по настоящему изобретению выражают в виде 1 или п.Независимо друг от друга l и n являются целыми числами от 1 до 40, где, если 1 или n=1, то С обозначает цитозин или его аналог, и если 1 или n>1, то меньшей мере 50% нуклеотидов означают цитозин или его аналог. Например, если 1 или n=4, то Cl или Cn могут быть, например, CUCU, CCUU, UCUC, UUCC, CUUC, CCCU, CCUC, CUCC, UCCC или СССС и т.д; если 1 или n=5, то Cl или Cn могут быть, например, CCCUU, CCUCU, CUCCU, UCCCU, UCCUC, UCUCC, UUCCC, CUCUC, CCCCU, CCCUC, CCUCC, CUCCC, UCCCC или ССССС и т.д., но эти примеры не являются ограничительными. Нуклеотид, прилегающий к Xm в нуклеиновой кислоте формулы (II) настоящего изобретения предпочтительно не является урацилом. Предпочтительно, для формулы (I), если l или n>1, по меньшей мере 60%, 70%, 80%, 90% или даже 100% нуклеотодов являются гуанозином или его аналогами, согласно указанному выше. Оставшиеся до 100% нуклеотиды, (если гуанозин составляет меньше 100% нуклеотидов) в примыкающих последовательностях G1 и/или Gn являются урацилом или его аналогом, согласно указанному выше в настоящем изобретении. Также предпочтительно, чтобы l и n независимо друг от друга являлись целыми числами от 2 до 30, более предпочтительно от 2 до 20 и еще более предпочтительно от 2 до 15. Нижняя граница l или n может варьироваться в случае необходимости, и составляет по меньшей мере 1, предпочтительно по меньшей мере 2, предпочтительнее по меньшей мере 3, 4, 5, 6, 7, 8, 9 или 10. Это определение соответствует формуле (II).
Согласно особенно предпочтительному варианту осуществления настоящего изобретения нуклеиновая кислота, соответствующая любой из приведенных выше формул (I) или (II), которая может быть использована в качестве по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, может быть выбрана из последовательности, содержащей или состоящей из следующих последовательностей:
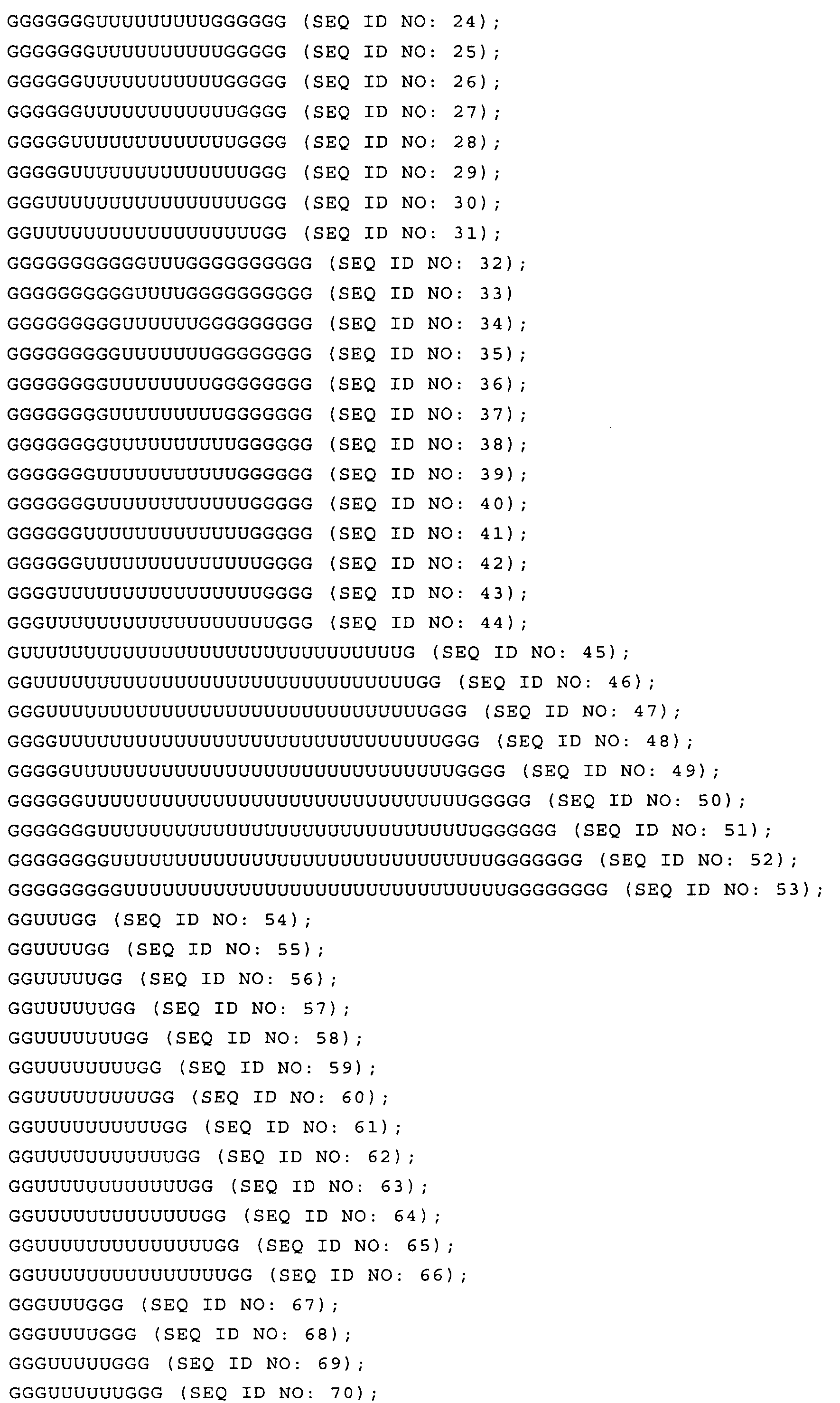

или
или из последовательности, имеющей, по меньшей мере, 60%, 70%, 80%, 90%, или даже 95% последовательной идентичности с какой-либо из этих последовательностей.
В данном контексте понятие «идентичность» в настоящем изобретении означает, что последовательности сравниваются с эталонной последовательностью и процент идентичности определяется таким сравнением. Например, чтобы определить процент идентичности двух последовательностей нуклеиновой кислоты, последовательности сначала можно разместить относительно друг друга (выравнивание), чтобы осуществить последовательное сравнение последовательностей. Так, например, гэпы могут быть вставлены в последовательность первой нуклеиновой кислоты и нуклеотиды могут сравниваться с соответствующей позицией в последовательности второй нуклеиновой кислоты. Если положение в последовательности первой нуклеиновой кислоты занято таким же нуклеотидом, что и в том же положении второй последовательности, тогда эти две последовательности идентичны в данном положении. Процентная идентичность двух последовательностей является функцией числа идентичных позиций, общих для данных последовательностей. Если, например, специфическая последовательная идентичность предполагается для конкретной нуклеиновой кислоты в сравнении с эталонной нуклеиновой кислотой, имеющей определенную длину, то данная процентная идентичность определяется по отношению к эталонной нуклеиновой кислоте. Следовательно, начиная, например, с последовательности нуклеиновой кислоты, которая имеет 50% последовательной идентичности с последовательностью эталонной нуклеиновой кислоты длиной 100 нуклеотидов, такая последовательность нуклеиновой кислоты может быть представлена последовательностью длиной 50 нуклеотидов, которая полностью идентична с секцией последовательности эталонной нуклеиновой кислоты, имеющей длину 50 нуклеотидов. Однако такая последовательность также может представлять последовательность нуклеиновой кислоты длиной 100 нуклеотидов с 50% идентичностью, в этом случае говорят о нуклеиновых кислотах, идентичных на 50% с последовательностью эталонной нуклеиновой кислоты по всей ее длине. В другом варианте такая последовательность нуклеиновой кислоты может быть длиной 200 нуклеотидов, и в секции длиной 100 нуклеотидов может быть полностью идентичной последовательности эталонной нуклеиновой кислоты длиной 100 нуклеотидов. Другие последовательности нуклеиновой кислоты естественным образом в полной мере соответствуют этому критерию.
Определение процентной идентичности двух последовательностей может проводиться посредством математического алгоритма. Предпочтительный, но не единственный пример математического алгоритма, который может быть применен для сравнения двух последовательностей, является алгоритмом Karlin и др. (PNAS USA 90, 1993, cc.5873-5877). Такой алгоритм интегрирован в NBLAST - программу, с помощью которой последовательности, имеющие желаемую идентичность с последовательностями настоящего изобретения, могут быть идентифицированы. Для получения выравнивания при наличии разрывов, согласно описанному выше, может быть применена программа Gapped BLAST, описанная Altschul и др. в J. Nucleic Acids Res 25, 1997, cc.3389-3402. При использовании программ BLAST и Gapped BLAST могут применяться значения параметров по умолчанию конкретной программы (например, NBLAST). Последовательности могут быть выровнены дополнительно, используя версию 9 программы GAP (global alignment program) фирмы Genetic Computing Group, применяя по умолчанию (BLOSUM62) матрицу (величины от -4 до +11) с открытым пенальти гэпом -12 (для первого нуля гэпа) и протяженным пенальти гэпом -4 (для каждого дополнительного последующего нуля в гэпе). После выравнивания процентную идентичность рассчитывают выражением числа соответствий в виде процента нуклеиновых кислот в заявленной последовательности. Описываемые методы для определения процентной идентичности двух последовательностей нуклеиновых кислот также могут применяться соответственно к аминокислотным последовательностям, при использовании соответствующих программ.
Указанные иммуностимулирующие последовательности дополнительно могут также включать, например, молекулу нуклеиновой кислоты, соответствующую формуле (III):
(NuGlXmGnNv)a,
где:
G обозначает гуанозин (гуанин), уридин (урацил) или аналог гуанозина (гуанина) или уридина (урацила), предпочтительно гуанозин (гуанин) или его аналог;
Х обозначает гуанозин (гуанин), уридин (урацил), аденозин (аденин), тимидин (тимин), цитидин (цитозин), или аналог этих нуклеотидов (нуклеозидов), предпочтительно уридин (урацил) или его аналог;
N обозначает последовательность нуклеиновой кислоты длиной от 4 до 50, предпочтительно примерно от 4 до 40, предпочтительнее примерно от 4 до 30 или от 4 до 20 нуклеотидов, причем каждая N независимо выбрана из гуанозина (гуанина), уридина (урацила), аденозина (аденина), тимидина(тимина), цитидина (цитозина) или аналога этих нуклеотидов (нуклеозидов);
а обозначает целое число от 1 до 20, предпочтительно от 1 до 15, наиболее предпочтительно от 1 до 10;
l обозначает целое число от 1 до 40,
где если l=1, G обозначает гуанозин (гуанин) или его аналог,
если l>1, то по меньшей мере 50% этих нуклеотидов (нуклеозидов) являются гуанозином (гуанином) или его аналогом;
m обозначает целое число не меньше 3;
где если m=3, Х обозначает уридин (урацил) или его аналог, и
если m>3, имеется по меньшей мере 3 последующих уридина (урацила) или аналога урилина (урацила);
n обозначает целое число от 1 до 40,
где если n=1, G обозначает гуанозин (гуанин) или его аналог,
если n>1, по меньшей мере 50% этих нуклеотидов (нуклеозидов) являются гуанозином (гуанином) или его аналогом;
u, v могут независимо друг от друга обозначать целые числа от 0 до 50,
предпочтительно где если u=0, v≥1, или
если v=0, u≥1;
где иммуностимулирующая последовательность формулы (III) имеет длину, составляющую по меньшей мере 50 нуклеотидов, предпочтительно по меньшей мере 100 нуклеотидов, предпочтительнее по меньшей мере 150 нуклеотидов, еще более предпочтительно по меньшей мере 200 нуклеотидов и наиболее предпочтительно длиной является длина по меньшей мере 250 нуклеотидов.
Структура (NuGlXmGnNv)a формулы (III) согласно настоящему изобретению содержит элемент ClXmCn в качестве центральной структуры, предпочтительно подобной описанной выше, и дополнительные краевые элементы Nu и/или Nv, причем весь элемент NuGlXmGnNv может повторяться, т.е. по меньшей мере, один раз, и определяется целым числом а. В настоящем изобретении неожиданно было установлено, что молекула формулы (III), т.е. имеющая структуру (NuGlXmGnNv)a, установленную выше, вызывает повышение врожденного иммунного ответа у пациента, что выявляется по повышению уровня ИФН-альфа, при сравнивании с воздействием одной только центральной структуры GlXmGn. Кроме того, молекула, содержащая указанную выше центральную структуру GlXmGn, может быть амплифицирована в клетках бактерий со значительно большим выходом, когда она имеет краевые повторяющиеся элементы Nu и/или Nv, указанные в формуле (III). Такая структура молекулы особенно удачна при получении молекул со структурой (NuGlXmGnNv)a формулы (III), согласно описанному выше, путем применения методов транскрипции in vitro вместо методов твердофазного синтеза, известных в данной области, которые обычно ограничены определенным размером нуклеиновых кислот.
Центральная структура в формуле (III) определяется более точно следующим образом:
G в молекуле нуклеиновой кислоты формулы (III) (и формул (I) и (II)) является нуклеотидом или дезоксинуклеотидом, или содержит нуклеозид, причем нуклеотид (нуклеозид) обозначает гуанозин (гуанин) или уридин (урацил) или их аналог, предпочтительнее обозначает гуанозин (гуанин) или его аналог. В этой связи нуклеотидные (нуклеозидные) аналоги гуанозина (гуанина) или уридина (урацила) определяют в качестве неприродных вариантов природных нуклеотидов (нуклеозидов) гуанозина (гуанина) и уридина (урацила). Соответственно, аналоги гуанозина (гуанина) или уридина (урацила) обычно представляют химически измененные нуклеотиды (нуклеозиды) с ненативными функциональными группами или компонентами, которые предпочтительно добавлены, модифицированы или делегированы от природных нуклеотидов гуанозина (гуанина) или уридина (урацила) или они замещают природные функциональные группы или компоненты естественных нуклеотидов гуанозина (гуанина) или уридина (урацила). Соответственно, каждая функциональная группа или компонент природных нуклеотидов гуанозина (гуанина) или уридина (урацила) может быть модифицирована или делегирована от них, а именно, основной компонент, сахар (рибоза), какая-либо природная боковая функциональная группа и/или фосфатный компонент, формирующий олигонуклеотидный каркас молекулы. Фосфатные части могут быть замещены, например, фосфорамидатами, фосфоротиоатами, пептидными нуклеотидами, метилфосфонатами и т.д., однако природные фосфодиэфирные каркасы молекул все-таки предпочтительней в контексте настоящего изобретения. Дополнительно компонент сахара (рибозы) выбран из дезоксирибозы, в частности нуклеиновой кислотой является РНК, согласно описанному выше, в которой компонент сахара (рибозы) выбран из дезоксирибозы.
Таким образом, аналоги гуанозина(гуанина) или уридина(урацила) включают, но ими не ограничиваются, какой-либо природный или неприродный гуанозин (гуанин) или уридин (урацил), видоизмененный химическим путем, например, ацетилированием, метилированием, присоединением гидроксильных групп и т.д., включая, например, 1-метилгуанозин (гуанин), 2-метилгуанозин(гуанин), 2,2-диметилгуанозин (гуанин), 7-метилгуанозин (гуанин), дигидроуридин (урацил), 4-тио-уридин (урацил), 5-карбоксиметиламинометил-2-тиоуридин (урацил), 5-(карбоксигидроксилметил)-уридин (урацил), 5-фторуридин (урацил), 5-бромуридин (урацил), 5-карбоксиметиламинометилуридин (урацил), 5-метил-2-тиоуридин (урацил), метиловый эфир N-уридин (урацил)-5-оксиуксусной кислоты, 5'-метиламинометилуридин (урацил), 5-метокси-уридин (урацил), метиловый эфир уридин (урацил)-5-оксиуксусной кислоты, уридин (урацил)-5-оксиуксусной кислоты (v). Получение таких аналогов известно специалистам в данной области, например, из патентов US 4373071, US 4401796, US 4415732, US 4458066, US 4500707, US 4668777, US 4973679, US 5047524, US 5132418, US 5153319, US 5262530 и 5700642, сущность которых включена в настоящее изобретение в виде ссылок. В случае описанных выше аналогов, особенное предпочтение отдается тем аналогам, которые повышают иммуногенность молекулы нуклеиновой кислоты формулы (III) (и формул (I) и (II)) и/или не препятствуют вводимой дополнительной модификации. По меньшей мере один гуанозин (гуанин) или уридин (урацил) или их аналог могут иметь место в центральной структуре элементов Gl и/или Gn, необязательно по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% 90% или даже 100% нуклеотидов в элементах центральной структуры Gl и/или Gn представлены гуанозином (гуанином) или уридином (урацилом) природного происхождения и/или их аналогами, и/или проявляют свойства их аналогов, описанных в настоящем изобретении. Предпочтительно элемент центральной структуры Gl и/или Gn содержит по меньшей мере один аналог природного происхождения гуанозина (гуанина) или уридина (урацила) и/или полностью природного происхождения уридин (урацил). Наиболее предпочтительно, если все нуклеотиды (нуклеозиды) таких элементов центральной структуры Gl и/или Gn являются аналогами, которые могут быть (в наиболее предпочтительном варианте) идентичными аналогами для того же типа нуклеотидов (нуклеозидов) (например, все нуклеотиды гуанозина (гуанина) предусмотрены в виде 1-метилгуанозина (гуанина)), или они могут отличаться (например, по меньшей мере два различных аналога гуанозина замещают нуклеотиды гуанозина природного происхождения).
Число нуклеотидов (нуклеозидов) в элементе G (Gl и/или Gn) центральной структуры в молекуле нуклеиновой кислоты формулы (III) (и формул (I) и (II)) определяется величинами l и n. Величины l и n, независимо друг от друга каждая обозначают целые числа от 1 до 100, от 1 до 90, от 1 до 80, от 1 до 70, от 1 до 60, предпочтительно от 1 до 50, более предпочтительно от 1 до 40 и еще более предпочтительно от 1 до 30, причем нижняя граница этих диапазонов может быть равной 1, но в другом варианте также может составлять 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30 или даже более. Предпочтительно, для каждого целого числа, если l и/или n=1, G является гуанозином (гуанином) или его аналогом и если 1 или n>1, тогда по меньшей мере 50%, предпочтительнее по меньшей мере 50%, 60%, 70%, 80%, 90% или даже 100% нуклеотидов (нуклеозидов) в элементе G (Gl и/или Gn) центральной структуры являются гуанозином (гуанином) или его аналогом. Например, без каких-либо ограничений, если l или n=4, то Gl и/или Gn могут представлять, например, GUGU, GGUU, UGUG. UUGG, GUUG, GGGU, GGUG, GUGG, UGGG или GGGG и т.д; если l или n=5, то Gl и/или Gn могут представлять, например, GGGUU, GGUGU. GUGGU, UGGGU, UGGUG, UGUGG, UUGGG, GUGUG, GGGGU, GGGUG, GGUGG, GUGGG, UGGGG или GGGGG и т.д. Нуклеотидом (нуклеозидом) элементов Gl и/или Gn центральной структуры, непосредственно примыкающим к Хщ в молекуле нуклеиновой кислоты формулы (III) (и формул (I) и (II)), предпочтительно является не уридин (урацил) или не его аналог. Более предпочтительными нуклеотидами (нуклеозидами) элементов Gl и/или Gn центральной структуры, непосредственно примыкающими к Xm в молекуле нуклеиновой кислоты формулы (III), являются по меньшей мере один гуанозин (гуанин) или его аналог, более предпочтительной является протяженность, представленная, по меньшей мере, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или даже 20 или более гуанозинами (гуанинами) или их аналогами. Кроме этого, нуклеотидом элементов g) и/или Gn центральной структуры, непосредственно примыкающим к N, например, Nu, и/или Nv (или Nw1, или Nw2, согласно описанному ниже) в молекуле нуклеиновой кислоты формулы (III) (и формул (I) и (II)), предпочтительно является не уридином (урацилом) или не его аналогом. Более предпочтительными нуклеотидами (нуклеозидами) элементов Gl и/или Gn центральной структуры, непосредственно примыкающими к N, например, Nu, и/или Nv (или Nw1, или Nw2, согласно описанному ниже) в молекуле нуклеиновой кислоты формулы (III) (и формул (I) и (II)), являются по меньшей мере один гуанозин (гуанин) или его аналог, более предпочтительной является протяженность, представленная, по меньшей мере, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или даже 20 или более гуанозинами (гуанинами) или их аналогами.
Также предпочтительно для формулы (III) (и формулы (I) и (II)), если l или n>1, то по меньшей мере 60%, 70%, 80%, 90% или даже 100% нуклеотидов (нуклеозидов) элементов Gl и/или Gn центральной структуры являются гуанозином (гуанином) или его аналогом, согласно описанному выше. Остальными (до 100%) нуклеотидами (нуклеозидами) в элементах Gl и/или Gn центральной структуры (если гуанозин (гуанин) составляет меньше 100% этих нуклеотидов (нуклеозидов)), могут быть уридин (урацил) или их аналоги, согласно описанному в настоящем изобретении выше.
X, в частности, Xm, в молекуле нуклеиновой кислоты формулы (III) (и формул (I) и (II)), также является элементом центральной структуры и представляет нуклеотид или дезоксинуклеотид или представляет нуклеозид, причем нуклеотид (нуклеозид) обычно выбирают из гуанозина (гуанина), уридина (урацила), аденозина (аденина), тимидина (тимина), цитидина (цитозина) или их аналогов, предпочтительно уридина (урацила) или его аналога. В этой связи нуклеотидные (нуклеозидные) аналоги определяют в виде ненативных вариантов природных нуклеотидов (нуклеозидов). Соответственно аналоги являются химически модифицированными нуклеотидами (нуклеозидами) с ненативными функциональными группами, которые предпочтительно добавлены или отщеплены от естественных нуклеотидов (нуклеозидов) или которые замещают естественные функциональные группы нуклеотидов (нуклеозидов). Соответственно, каждый компонент природных нуклеотидов может быть модифицирован, а именно, основной компонент, сахар (рибоза или дезоксирибоза) и/или фосфатный компонент, формирующий олигонуклеотидный каркас молекулы. Фосфатные части молекулы могут быть замещены, например, фосфорамидами, фосфоротиоатами, пептидными нуклеотидами, метилфосфонатами и т.д., в которых однако, природный фосфодиэфирный каркас молекулы все-таки предпочтителен. Предпочтительно, чтобы по меньшей мере 10%, предпочтительнее по меньшей мере 20%, более предпочтительно по меньшей мере 30%, еще более предпочтительно по меньшей мере 50%, еще более предпочтительно по меньшей мере 70% и еще более предпочтительно по меньшей мере 90% от всех «X» нуклеотидов могли проявлять свойства аналогов, описанных в настоящем изобретении, если иммуностимулирующая последовательность вообще содержит хотя бы один аналог. Аналоги, замещающие специфический тип нуклеотидов в элементе «Xm» центральной структуры, могут быть идентичными, например, все нуклеотиды цитидина (цитозина), находящиеся в элементе «Xm» центральной структуры, представлены специфическим аналогом цитидина (цитозина), например, 2-тиоцитидином (цитозином), или они могут отличаться от специфических нуклеотидов (нуклеозидов), например, по меньшей мере два различных аналога цитидина (цитозина) содержатся в элементе «Xm» центральной структуры.
Аналоги гуанозина (гуанина), уридина (урацила), аденозина (аденина), тимидина (тимина), цитидина (цитозина) включают без ограничений какие-либо природные или неприродные нуклеотиды гуанозин (гуанин), уридин (урацил), аденозин (аденин), тимидин (тимин), цитидин (цитозин), которые были изменены химически, например, ацетилированием, метилированием, присоединением гидроксильных групп и т.д., к ним относятся, например, 1-метил-аденозин (аденин), 2-метил-аденозин (аденин), 2-метилтио-N6-изопентиладенозин (аденин), N6-метиладенозин (аденин), N6-изопентиладенозин (аденин), 2-тиоцитидин (цитозин), 3-метилцитидин (цитозин), 4-ацетилцитидин (цитозин), 2,6-диаминопурин, 1-метилгуанозин (гуанин), 2-метилгуанозин (гуанин), 2,2-диметилгуанозин (гуанин), 7-метилгуанозин (гуанин), инозин, 1-метилинозин, дигидроуридин (урацил), 4-тиоуридин (урацил), 5-карбоксиметиламинометил-2-тиоуридин (урацил), 5-(карбоксигидроксилметил)уридин (урацил), 5-фторуридин (урацил), 5-бромуридин (урацил), 5-карбоксиметиламинометилуридин (урацил), 5-метил-2-тиоуридин (урацил), метиловый эфир N-уридин (урацил)-5-оксиуксусной кислоты, 5-метиламинометилуридин (урацил), 5-метоксиаминометил-2-тиоуридин (урацил), 5'-метоксикарбонилметилуридин (урацил), 5-метоксиуридин (урацил), метиловый эфир уридин (урацил)-5-оксиуксусной кислоты, уридин (урацил)-5-оксиуксусная кислота (v), квеозин, бета-D-маннозил-квеозин, вибутоксозин и инозин. Получение таких аналогов известно специалистам в данной области, например, из патентов US 4373071, US 4401796, US 4415732, US 4458066, US 4500707, US 4668777, US 4973679, US 5047524, US 5132418, US 5153319, US 5262530 и US 5700642. В случае описанных выше аналогов, особенное предпочтение отдается тем аналогам нуклеотидов (нуклеозидов), которые повышают иммуногенность молекулы нуклеиновой кислоты формулы (III) (и формул (I) и (II)) и/или не препятствуют вводимой модификации.
Число элементов Х в центральной структуре молекулы нуклеиновой кислоты формулы (III) (и формул (I) и (II)) определяется по m. Показатель m обозначает целое число, по меньшей мере 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, от 20 до 30, от 30 до 40, от 40 до 50, от 50 до 60, от 60 до 70, от 70 до 80, от 80 до 90, от 90 до 100, от 100 до 150, от 150 до 200 или даже больше, где если m=3, X является уридином (урацилом) или его аналогом, и если m>3, то по меньшей мере 3 или больше непосредственно расположенных последующих уридинов (урацилов) или их аналогов в элементе Х формулы (III) (и формул (I) и (II)). Такая последовательность по меньшей мере из 3 или большего числа непосредственно расположенных последовательных уридинов (урацилов) называется в настоящем изобретении «монотонной последовательностью уридина (урацила)». Монотонная последовательность уридина (урацила) обычно имеет длину по меньшей мере из 3, 4, 5, 6, 7, 8, 9 или 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, от 20 до 30, от 30 до 40, от 40 до 50, от 50 до 60, от 60 до 70, от 70 до 80, от 80 до 90, от 90 до 100, от 100 до 150, от 150 до 200 уридинов (урацилов) или необязательно аналогов уридина (урацила), согласно описанному выше. Такая монотонная последовательность уридина (урацила) встречается по меньшей мере однократно в элементе Х центральной структуры молекулы нуклеиновой кислоты формулы (III) (и формул (I) и (II)). Таким образом возможно, например, для 1, 2, 3, 4, 5 или более монотонных последовательностей уридина (урацила), имеющих длину по меньшей мере 3 или больше уридинов (урацилов) или их аналогов, что монотонные последовательности уридина (урацила) могут быть прерваны в элементе Х центральной структуры по меньшей мере одним гуанозином (гуанином), аденозином (аденином), тимидином (тимином), цитидином (цитозином) или их аналогами, предпочтительно 2, 3, 4, 5 или большим числом. Например, если m=3, то Xm является UUU. Если m=4, то Xm может быть, например, без каких-либо ограничений, UUUA, UUUG, UUUC, UUUU, AUUU, GUUU или CUUU и т.д. Если n=10, то Xm может быть, например, без каких-либо ограничений, UUUAAUUUUC, UUUUGUUUUA, UUUGUUUGUU, UUGUUUUGUU, UUUUUUUUUU и т.д. Нуклеотиды Xm, примыкающие к Gl или Gn в молекуле нуклеиновой кислоты формулы (III), предпочтительно содержат уридин (урацил) или его аналоги. Если m>3, обычно по меньшей мере 50%, предпочтительно по меньшей мере 60%, 70%, 80%, 90% или даже 100%, нуклеотидов в Xm являются уридином (урацилом) или его аналогом, согласно указанному выше. Оставшиеся от 100% нуклеотиды Xm (если в последовательности Xm содержится меньше 100% уридина (урацила)) являются тогда гуанозином (гуанином), уридином (урацилом), аденозином (аденином), тимидином (тимином), цитидином (цитозином) или их аналогом, согласно указанному выше.
Иммуностимулирующая последовательность формулы (III), представленной выше, также содержит краевой элемент N. Краевой элемент N обычно представляет последовательность нуклеиновой кислоты длиной от 4 до 50, предпочтительно примерно от 4 до 40, более предпочтительно примерно от 4 до 30 нуклеотидов (нуклеозидов), еще более предпочтительно примерно от 4 до 20 нуклеотидов (нуклеозидов), причем нижней границей этих диапазонов также может быть величина 5, 6, 7, 8, 9, 10 или более. Предпочтительно, чтобы нуклеотиды (нуклеозиды) в каждом элементе N были независимо выбраны из гуанозина (гуанина), уридина (урацила), аденозина (аденина), тимидина (тимина), цитидина (цитозина) и/или их аналогов. Другими словами, краевой элемент N в молекуле нуклеиновой кислоты формулы (III) по настоящему изобретению может быть последовательностью, которая может состоять из любой (произвольной) последовательности, доступной в данной области, каждый элемент N независимо выбирают из гуанозина (гуанина), уридина (урацила), аденозина (аденина), тимидина (тимина), цитидина (цитозина) и/или аналогов этих нуклеотидов, или из гомополимеров этих нуклеотидов (нуклеозидов), в каждом случае обеспечивая, чтобы такая последовательность имела бы длину примерно от 4 до 50, предпочтительно примерно от 4 до 40, более предпочтительно примерно от 4 до 30 нуклеотидов (нуклеозидов) и еще более предпочтительно примерно от 4 до 30 или от 4 до 20 нуклеотидов (нуклеозидов), согласно описанному выше.
В одном из вариантов осуществления настоящего изобретения элемент N может быть последовательностью нуклеиновой кислоты, соответствующей данному выше определению, причем такая последовательность обычно содержит не более 2 идентичных нуклеотидов (нуклеозидов), согласно описанному выше, в соседних положениях, т.е. последовательность обычно не содержит протяженностей, представленных более чем двумя идентичными нуклеотидами (нуклеозидами), выбранными из аденозина (аденина), цитидина (цитозина), уридина (урацила) и/или из гуанозина (гуанина) и/или их аналогов (т.е. протяженность «аа», «cc», «uu», «gg» и/или их аналогов), предпочтительнее, чтобы не было таких протяженностей, т.е. не было бы идентичных нуклеотидов (нуклеозидов), указанных выше, в соседних положениях. Дополнительно или в другом варианте N может быть последовательностью нуклеиновой кислоты, соответствующей приведенному выше определению, причем последовательность обычно содержит аденозин (аденин) или его аналог предпочтительно в количестве примерно от 0 до 50%, от 5 до 45% или от 10 до 40%, более предпочтительно примерно от 15 до 35%, еще более предпочтительно примерно от 20 до 30% и наиболее предпочтительно примерно 25%; содержание уридина (урацила) или его аналога предпочтительно примерно от 0 до 50%, от 5 до 45% или от 10 до 40%, более предпочтительно примерно от 15 до 35%, еще более предпочтительно примерно от 20 до 30%, и наиболее предпочтительно примерно 25%; содержание цитидина (цитозина) или его аналога предпочтительно примерно от 0 до 50%, от 5 до 45%, или от 10 до 40%, предпочтительнее примерно от 15 до 35%, еще более предпочтительно примерно от 20 до 30%, и наиболее предпочтительно примерно 25%; содержание гуанозина (гуанина) или его аналога предпочтительно примерно от 0 до 50%, от 5 до 45%, или от 10 до 40%, более предпочтительно примерно от 15 до 35%, еще более предпочтительно от 20 до 30%, и наиболее предпочтительно примерно 25%. Наиболее предпочтительно элемент N может быть последовательностью нуклеиновой кислоты, соответствующей указанному выше определению, причем последовательность обычно содержит аденозин (аденин), гуанозин (гуанин), цитидин (цитозин) и уридин (урацил), в количестве примерно по 25%. Примеры таких последовательностей элемента N включают, например, agcu, ague, augc, acgu, gcua, gcau, gacu, guca, cuag, caug, cagu, cgau, uagc, uacg, ucga, ucag, agcugcua, gcaucaug, caguucga и др.
Число краевых элементов N в молекуле нуклеиновой кислоты формулы (III), т.е. их повторяемость, определяется целыми числами u и/или v. Таким образом, N в молекуле нуклеиновой кислоты формулы (III) может встречаться в виде (повторяющегося) краевого элемента Nu и/или Nv, где u и/или v могут быть, независимо друг от друга, целыми числами от 0 или 1 до 100, предпочтительней от 0 или 1 до 50, еще более предпочтительно от 0 или 1 до 40, и наиболее предпочтительно от 0 или 1 до 30, например, от 0 или 1 до 5, 10, 20, 25 или 30; или от 5 до 10, от 10 до 15, от 15 до 20, от 20 до 25 или от 25 до 30. Предпочтительнее, если по меньшей мере один (повторяющийся) краевой элемент Nu и/или Nv может быть представлен в формуле (III), т.е. или u или v не равно 0, более предпочтительно, если представлены оба (повторяющихся) краевых элемента Nu и/или Nv еще более предпочтительно согласно определению, данному выше.
В добавление к вышесказанному, комбинация элементов центральной структуры и краевых элементов с образованием элемента NuGlXmGnNv может встречаться в виде повторяющихся элементов согласно иммуностимулирующей последовательности формулы (III), (NuGlXmGnNv)a, представленной выше, в которой число повторов комбинированного элемента формулы (III), (NuGlXmGnNv)a, определяется целым числом а. Предпочтительно, чтобы а являлось целым числом примерно от 1 до 100, от 1 до 50, от 1 до 20, предпочтительнее целым числом примерно от 1 до 15, наиболее предпочтительным является целое число 1 до 10. В данном контексте повторяющиеся элементы NuGlXmGnNv могут быть одинаковыми или отличаться друг от друга.
Согласно особенно предпочтительному варианту осуществления настоящего изобретения, иммуностимулирующая последовательность формулы (III) (NuGlXmGnNv)a, описанная выше, содержит элемент центральной структуры GlXmGn, предпочтительно выбранный по меньшей мере из одной из следующих последовательностей SEQ ID NOs:1-80 согласно описанному выше.
Более того, иммуностимулирующие последовательности, описанные в настоящем изобретении, могут также содержать, например, молекулу нуклеиновой кислоты, соответствующую формуле (IIIa)
(NuGlXmGnNv)a
где:
С обозначает цитидин (цитозин), уридин (урацил) или аналог цитидина (питозина), уридина (урацила), предпочтительно цитидин (цитозин), или его аналог;
Х обозначает гуанозин (гуанин), уридин (урацил), аденозин (аденин), тимидин (тимин), цитидин (цитозин) или аналог выше упомянутых нуклеотидов (нуклеозидов), предпочтительно уридин (урацил) или его аналог;
N (каждый элемент) обозначает последовательность нуклеиновой кислоты, имеющей независимую от другой последовательности длину примерно от 4 до 50, предпочтительно примерно от 4 до 40, предпочтительнее примерно от 4 до 30 или от 4 до 20 нуклеотидов, причем в каждый N независимо выбран из гуанозина (гуанина), уридина (урацила), аденозина (аденина), тимидина (тимина), цитидина (цитозина) или аналога этих нуклеотидов (нуклеозидов);
а обозначает целое число от 1 до 20, предпочтительно от 1 до 15, наиболее предпочтительно от 1 до 10;
l обозначает целое число от 1 до 40,
где если l=1, С обозначает цитидин (цитозин) или его аналог,
если l>1, то по меньшей мере 50% этих нуклеотидов (нуклеозидов) являются цитидином (цитозином) или его аналогом;
m обозначает целое число не меньше 3;
где если m=3, то Х обозначает уридин (урацил) или его аналог,
если m>3, то имеются по меньшей мере 3 последующих уридина (урацила) или аналога уридина (урацила);
n обозначает целое число от 1 до 40,
где если n=1, то С обозначает цитидин (цитозин) или его аналог,
если n>1, то по меньшей мере 50% этих нуклеотидов (нуклеозидов) являются цитидином (цитозином) или его аналогом;
u, v могут обозначать независимо друг от друга целые числа от 0 до 50,
предпочтительно в случае, если u=0, v≥1 или
если v=0, u≥1;
где молекула нуклеиновой кислоты формулы (IIIa) имеет длину, составляющую, по меньшей мере, 50 нуклеотидов, предпочтительно, по меньшей мере, 100 нуклеотидов, предпочтительнее, по меньшей мере, 150 нуклеотидов, даже более предпочтительно, по меньшей мере, 200 нуклеотидов и самой предпочтительной длиной является длина по меньшей мере 250 нуклеотидов.
Для формулы (IIIa) любое из указанных выше определений для элементов N (т.е. Nu и Nv) и Х (Xm), особенно для центральной структуры, согласно приведенному выше определению, так и для целых чисел а, 1, m, n, u и v, сходно применяется к соответствующим элементам формулы (IIIa), где в формуле (IIIa) центральная структура обозначается ClXmCn. Определение краевых элементов Nu и Nv идентично определению, приведенному выше для Nu и Nv.
Точнее элемент С в молекуле нуклеиновой кислоты формулы (IIIa) является нуклеотидом, или дезоксинуклеотидом, или содержит нуклеозид, причем нуклеотид (нуклеозид) обозначает цитидин (цитозин) или уридин (урацил) или их аналог. В этой связи нуклеотидные аналоги цитидина (цитозина) или уридина (урацила) определяют в качестве неприродных вариантов природных нуклеотидов цитидина (цитозина) или уридина (урацила). Соответственно, аналоги цитидина (цитозина) или уридина (урацила) представляют химически измененные нуклеотиды (нуклеозиды) с неприродными функциональными группами, которые предпочтительно добавлены или делегированы от природных нуклеотидов (нуклеозидов) цитидина (цитозина) или уридина (урацила) или они замещают природные функциональные группы нуклеотидов (нуклеозидов) цитидина (цитозина) или уридина (урацила). Соответственно, каждый компонент природных нуклеотидов цитидина (цитозина) или уридина (урацила) может быть модифицирован, а именно, основной компонент, сахар (рибоза) и/или фосфатный компонент, формирующий олигонуклеотидный каркас молекулы. Фосфатные части могут быть замещены, например, фосфорамидатами, фосфоротиоатами, пептидными нуклеотидами, метилфосфонатами и т.д., но природные фосфодиэфирные каркасы молекул все-таки предпочтительней.
Таким образом, аналоги цитидина (цитозина) или уридина (урацила) включают, но ими не ограничиваются, какой-либо природный или неприродный цитидин (цитозин) или уридин (урацил), видоизмененный химическим путем, например, ацетилированием, метилированием, присоединением гидроксильных групп и т.д., включая, например, 2-тиоцитидин (цитозин), 3-метилцитидин (цитозин), 4-ацетилцитидин (цитозин), дигидроуридин (урацил), 4-тиоуридин (урацил), 5-карбоксиметиламинометил-2-тиоуридин (урацил), 5-(карбоксигидроксилметил)-уридин (урацил), 5-фторуридин (урацил), 5-бромуридин (урацил), 5-карбоксиметиламинометилуридин (урацил), 5-метил-2-тиоуридин (урацил), метиловый эфир N-уридин (урацил)-5-оксиуксусной кислоты, 5-метиламинометилуридин (урацил), 5-метоксиаминометил-2-тиоуридин (урацил), 5'-метоксикарбонилметилуридин (урацил), 5-метокси-уридин (урацил), метиловый эфир уридин (урацил)-5-оксиуксусной кислоты, уридин (урацил)-5-оксиуксусная кислота (v). Получение таких аналогов известно специалистам в данной области, например, из патентов US 4373071, US 4401796, US 4415732, US 4458066, US 4500707, US 4668777, US 4973679, US 5047524, US 5132418, US 5153319, US 5262530 и 5700642, сущность которых включена в настоящее изобретение в виде ссылок. В случае описанных выше аналогов нуклеотидов (нуклеозидов), предпочтение отдается тем аналогам, которые повышают иммуногенность молекулы нуклеиновой кислоты формулы (IIIa) и/или не препятствуют вводимой дополнительной модификации. По меньшей мере один цитидин (цитозин), или уридин (урацил), или их аналог могут находиться в центральной структуре элементов Cl и/или Cn, необязательно по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% 90% или даже 100% нуклеотидов (нуклеозидов) в элементах центральной структуры Cl и/или Cn представлены цитидином (цитозином) или уридином (урацилом) природного происхождения, и/или их аналогами, и/или проявляют свойства их аналогов, описанных в настоящем изобретении. Элемент центральной структуры Cl и/или Cn предпочтительно содержит по меньшей мере один аналог природного происхождения цитидина (цитозина) и/или полностью природного происхождения уридин (урацил). Наиболее предпочтительно, чтобы все нуклеотиды (нуклеозиды) таких элементов центральной структуры Cl и/или Cn, являлись бы аналогами, которые могут быть (в наиболее предпочтительном варианте) идентичными аналогами для того же типа нуклеотидов (нуклеозидов) (например, все нуклеотиды цитидина (цитозина) предусмотрены в виде 2-тиоцитидина (цитозина)) или они могут отличаться (например, по меньшей мере два различных аналога цитидина (цитозина) замещают нуклеотиды цитидина (цитозина) природного происхождения).
Число нуклеотидов (нуклеозидов) в элементе С (Cl и/или Cn) центральной структуры в молекуле нуклеиновой кислоты формулы (IIIa) определяется величинами l и n. Величины l и n независимо друг от друга каждая обозначает целые числа от 1 до 90, от 1 до 80, от 1 до 70, от 1 до 60, предпочтительно от 1 до 50, более предпочтительно от 1 до 40 и еще более предпочтительно от 1 до 30, причем нижняя граница этих диапазонов может быть равной 1, но в другом варианте также может составлять 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30 или даже более. Предпочтительно, для каждого целого числа, если 1 и/или n=1, то С является цитидином (цитозином) или его аналогом, и если 1 или n>1, то по меньшей мере 50%, 60%, 70%, 80%, 90% или даже 100% нуклеотидов (нуклеозидов) в элементе С (Cl и/или Cn) центральной структуры являются цитидином (цитозином) или его аналогом. Например, без каких-либо ограничений, если l или n=4, то Cl и/или Cn могут представлять, например, CUCU, CCUU, UCUC, UUCC, CUUC, CCCU, CCUC, CUCC, UCCC или СССС, и т.д.; если 1 или n=5, то Cl и/или Cn могут представлять, например, CCCUU, CCUCU, CUCCU, UCCCU, UCCUC, UCUCC, UUCCC, CUCUC, CCCCU, CCCUC, CCUCC, CUCCC, UCCCC или ССССС и т.д. Нуклеотидом (нуклеозидом) элементов Cl и/или Cn центральной структуры, непосредственно примыкающим к Xm в молекуле нуклеиновой кислоты формулы (IIIa), предпочтительно является не уридин (урацил) или не его аналог. Более предпочтительными нуклеотидами (нуклеозидами) элементов Cl и/или Cn центральной структуры, непосредственно примыкающими к Xm в молекуле нуклеиновой кислоты формулы (IIIa), является, по меньшей мере, один цитидин (цитозин) или его аналог, более предпочтительной является протяженность, представленная, по меньшей мере, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или даже 20 или более цитидинами (цитозинами) или их аналогами. Кроме этого, нуклеотидом (нуклеозидом) элементов Cl и/или Cn центральной структуры, непосредственно примыкающими к N, например, Nu, и/или Nv (или Nw1 или Nw2 согласно описанному ниже), в молекуле нуклеиновой кислоты формулы (IIIa) предпочтительно является не уридин (урацил) или не его аналог. Более предпочтительными нуклеотидами (нуклеозидами) элементов Cl и/или Cn центральной структуры, непосредственно примыкающими к N, например, Nu, и/или Nv (или Nw1 или Nw2 согласно описанному ниже) в молекуле нуклеиновой кислоты формулы (IIIa), являются по меньшей мере один цитидин (нитозин) или его аналог, более предпочтительной является протяженность, представленная, по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или даже 20 или более цитидинами (цитозинами) или их аналогами. Также предпочтительно для формулы (IIIa), если 1 или n>1, то по меньшей мере 60%, 70%, 80%, 90% или даже 100% нуклеотидов элементов Cl и/или Cn центральной структуры являются цитидином (цитозином) или его аналогом, согласно описанному выше. Остальными (до 100%) нуклеотидами (нуклеозидами) в элементах Cl и/или Cn центральной структуры (если цитидин (цитозин) составляет меньше 100% этих нуклеотидов (нуклеозидов)), может быть уридин (урацил) или его аналоги, согласно описанному в настоящем изобретении выше.
X, в частности, Хщ, в виде дополнительного элемента центральной структуры в иммуностимулирующей последовательности согласно формуле (IIIa), предпочтительно определяют равно определению в приведенной выше формуле (III). Число элементов Х в центральной структуре молекулы нуклеиновой кислоты формулы (IIIa) определяют показателем m. Показатель m обозначает целое число, по меньшей мере равное 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19. 20, от 20 до 30, от 30 до 40, от 40 до 50, от 50 до 60, от 60 до 70, от 70 до 80, от 80 до 90, от 90 до 100, от 100 до 150, от 150 до 200, или даже больше, где если m=3, то Х является уридином (урацилом) или его аналогом, и если m>3, то по меньшей мере 3 или больше непосредственно расположенных последующих уридинов (урацилов) или их аналогов в элементе Х формулы (IIIa). Такая последовательность по меньшей мере из 3 или большего числа непосредственно расположенных последовательных уридинов (урацилов) называется в настоящем изобретении «монотонной последовательностью уридина (урацила)». Монотонная последовательность уридина (урацила) обычно имеет длину по меньшей мере из 3, 4, 5, 6, 7, 8, 9 или 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, от 20 до 30, от 30 до 40, от 40 до 50, от 50 до 60, от 60 до 70, от 70 до 80, от 80 до 90, от 90 до 100, от 100 до 150, от 150 до 200 уридинов (урацилов) или необязательно аналогов уридина (урацила), согласно описанному выше. Такая монотонная последовательность уридина (урацила) встречается по меньшей мере однократно в элементе Х центральной структуры молекулы нуклеиновой кислоты формулы (IIIa). Таким образом возможно, например, для 1, 2, 3, 4, 5 или более монотонных последовательностей уридина (урацила), имеющих длину по меньшей мере 3 или больше уридинов (урацилов) или их аналогов, что монотонные последовательности уридина (урацила) могут быть прерваны в элементе Х центральной структуры по меньшей мере одним гуанозином (гуанином), аденозином (аденином), тимидином (тимином), цитидином (цитозином) или их аналогами, предпочтительно 2, 3, 4, 5 или большим числом. Например, если m=3, то Xm является UUU. Если m=4, то Xm может быть, например, без каких-либо ограничений, UUUA, UUUG, UUUC, UUUU, AUUU. GUUU или CUUU и т.д. Если n=10. то Xm может быть, например, без каких-либо ограничений, UUUAAUUUUC, UUUUGUUUUA, UUUGUUUGUU, UUGUUUUGUU, UUUUUUUUUU, и т.д. Нуклеотиды (нуклеозиды) Xm, примыкающие к Cl или Cn в молекуле нуклеиновой кислоты формулы (IIIa) предпочтительно содержат уридин (урацил) или его аналоги. Если m>3, то обычно по меньшей мере 50%, предпочтительно по меньшей мере 60%, 70%, 80%, 90% или даже 100% нуклеотидов в Xm являются уридином (урацилом) или его аналогом, согласно указанному выше. Оставшиеся от 100% нуклеотиды (нуклеозиды) Xm (если в последовательности Xm содержится меньше 100% уридина (урацила)) могут быть тогда гуанозином (гуанином), уридином (урацилом), аденозином (аденином), тимидином (тимином), цитидином (цитозином) или их аналогами, согласно данному выше определению.
Иммуностимулирующая последовательность формулы (IIIa), представленной выше, также содержит краевой элемент N, в частности, Nu и/или Nv, причем краевой элемент N, в частности Nu и/или Nv, подобно целым числам x и y определяют согласно указанному выше.
Элемент NuClXmCnNv может в виде повторяющегося элемента по иммуностимулирующей последовательности формулы (IIIa) (NuClXmCnNv)a, согласно определенному выше, где число повторений этого элемента формулы (IIIa) (NuClXmCnNv)a определяют целым числом а. Предпочтительно, чтобы показатель а обозначал целое число примерно от 1 до 100, от 1 до 50, от 1 до 20, предпочтительнее целое число примерно от 1 до 15, самым предпочтительным является целое число примерно от 1 до 10. В данном контексте повторяющиеся элементы NuClXmCnNv могут быть одинаковыми или отличаться друг от друга.
Согласно особенно предпочтительному варианту осуществления настоящего изобретения иммуностимулирующая последовательность формулы (IIIa) (NuClXmCnNv)a, указанная выше, содержит элемент центральной структуры ClXmCn,, предпочтительно выбранный по меньшей мере из одной из следующих последовательностей SEQ ID NOs:81-83, указанных выше.
Иммуностимулирующая последовательность формулы (III) (или (IIIa)), в частности, каждый отдельный повторяющийся ее элемент NuClXmCnNv (или NuClXmCnNv), может быть одноцепочечным, двухцепочечным или частично двухцепочечными и т.д., согласно общему определению для формулы (III).
Если иммуностимулирующая последовательность формулы (III) (или (IIIa)) представлена одноцепочечной молекулой нуклеиновой кислоты, то такая последовательность обычно является одноцепочечной на протяжении всей ее длины.
Также, если иммуностимулирующая последовательность формулы (III) (или (IIIa)) представлена двухцепочечной молекулой нуклеиновой кислоты, то такая последовательность обычно является двухцепочечной на протяжении всей ее длины.
Если иммуностимулирующая последовательность формулы (III) (или (IIIa)) представлена частично двухцепочечной молекулой нуклеиновой кислоты, то такая последовательность нуклеиновой кислоты в молекуле предпочтительно выбирается по меньшей мере из одной из выше определенных последовательностей SEQ ID NO:1-83. Даже более предпочтительно, чтобы центральная структура GlXmGn (или ClXmCn) формулы (III) (или (IIIa)) могла быть двухцепочечной в такой области центральной структуры, в которой имеет место протяженность уридинов (урацилов), наиболее предпочтительна протяженность, полностью представленная уридином (урацилом), или протяженность, состоящая по меньшей мере из 60%, 70%, 80%, 90%, 95%, 98% или 99% этих нуклеотидов.
В другом варианте или дополнительно если иммуностимулирующая последовательность формулы (III) (или (IIIa)) представлена частично двухцепочечной молекулой нуклеиновой кислоты, то другие части (отличные от центральной структуры GlXmGn) такой иммуностимулирующей последовательности формулы (III) или (IIIa) согласно приведенному выше определению могут быть двухцепочечными. Например, если последовательность нуклеиновой кислоты в молекуле нуклеиновой кислоты формулы (III) или (IIIa) может быть двухцепочечной в области, находящейся снаружи от центральной структуры GlXmGn (или ClXmCn), например, в краевых элементах Nu и/или Nv, и одноцепочечной в области указанной центральной структуры, центральной структуры GlXmGn (или ClXmCn), предпочтительно выбранной по меньшей мере одной из выше определенных последовательностей SEQ ID NOs:1-83. Например, по меньшей мере один из краевых элементов Nu и/или Nv, может быть двухцепочечным, а остальные элементы формулы (III) или (IIIa), например, центральная структура GlXmGn и/или другие элементы, могут оставаться одноцепочечными.
В другом варианте или дополнительно иммуностимулирующая последовательность формулы (III) может быть выбрана из смеси, состоящей из молекул одноцепочечных нуклеиновых кислот формулы (III) или (IIIa) и молекул (частично) двухцепочечных нуклеиновых кислот формулы (III) или (IIIa), предпочтительно в соотношении примерно от 1:10 до 10:1, более предпочтительно соотношение от 1:3 до 3:1.
Согласно особенно предпочтительному варианту осуществления настоящего изобретения иммуностимулирующая последовательность формулы (III) может быть выбрана, например, из какой-либо из следующих последовательностей:
из последовательности SEO ID NO:84:

или из последовательности SEQ ID NO:85:
или из последовательности SEQ ID NO:114 (R820: (N100)2)
или из последовательности SEQ ID NO:115 (R719: (N100)5)
или из последовательности SEQ ID NO:116 (R720: (N100)10)
или из последовательности SEQ ID NO:117 (R821: (N40U20N40)2)
или из последовательности SEQ ID NO:118 (Seq. R722: (N40U20N40)5)
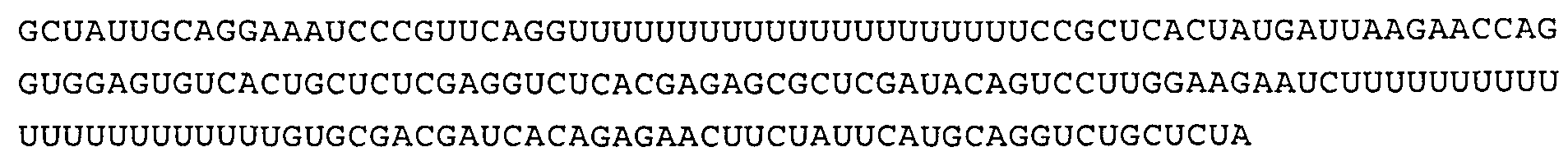
или из последовательности SEQ ID NO:119 (R723: (N40U20N40)10):
Согласно другому особенно предпочтительному варианту осуществления настоящего изобретения иммуностимулирующая последовательность формулы (IIIa) может быть выбрана например, из любой из следующих последовательностей:
или

Согласно одному из предпочтительных вариантов осуществления настоящего изобретения иммуностимулирующая последовательность формулы (III) (или (IIIa)), указанная выше, может быть модифицирована поли(Х) последовательностью (модифицирующим элементом). Такие иммуностимулирующие последовательности могут содержать, например, молекулу нуклеиновой кислоты формулы (IV):
поли(IV)s (NuGlXmGnNv)a поли(IV)t,
где молекула нуклеиновой кислоты формулы (IV) также имеет длину, по меньшей мере составляющую 50 нуклеотидов, предпочтительно, по меньшей мере 100 нуклеотидов, предпочтительнее, по меньшей мере 150 нуклеотидов, даже более предпочтительно, по меньшей мере 200 нуклеотидов и наиболее предпочтительная длина составляет по меньшей мере 250 нуклеотидов.
В иммуностимулирующей последовательности формулы (IV) элементы G, Х и N, а именно, центральная структура GlXmOn, и элементы Nu и Nv, а также целые числа а, l, m, n, u и v определяются тем же образом, что и в приведенной выше формуле (III). В контексте настоящего изобретения модифицирующий элемент поли(IV), а именно, поли(IV)s и/или поли(IV)t иммуностимулирующей последовательности формулы (IV), обычно представляет собой одноцепочечную, двухцепочечную или частично двухцепочечную последовательность нуклеиновой кислоты, например, последовательность ДНК или РНК, согласно приведенному выше общему определению. Предпочтительно модифицирующий элемент поли(IV), а именно, поли(IV)s и/или поли(IV)t представляет собой гомополимерную протяженность нуклеиновых кислот, в которой величина Х может обозначать любой нуклеотид или дезоксинуклеотид или Х может содержать нуклеозид, согласно указанному выше для величины Х иммуностимулирующей последовательности формулы (III) или (IIIa). Предпочтительно Х может быть выбран независимо для каждого модифицирующего элемента поли(IV), а именно, поли(IV)s и/или поли(IV)t, из нуклеотида или дезоксинуклеотида, или Х может содержать нуклеозид. Данный нуклеотид (нуклеозид) выбирают из гуанозина (гуанина), уридина (урацила), аденозина (аденина), тимидина (тимина), цитидина (цитозина), инозина или аналога этих нуклеотидов, например, из одноцепочечной протяженности цитидинов (цитозинов) (поли(С)), гуанозинов (гуанинов) (поли(О)), аденозинов (аденинов) (поли(А)), уридинов (урацилов) (поли(U)), инозинов (поли(III)) и т.д., или из гомополимерной двухцепочечной протяженности инозинов и цитидинов (цитозинов) (поли(III:С)), аденозина (аденина) и уридинов (урацилов) (поли(А:U)) и т д., где гомополимерная последовательность, а именно, поли(III:С) и/или поли(А:U), может быть спарена с последовательностью (NuGlXmGnNv)a молекулы нуклеиновой кислоты формулы (IV) через любые цепи, например, через последовательности поли-С, поли-I, поли-А или поли-U. Длина модифицирующего элемента поли(IV), а именно поли(IV)s и/или поли(IV)t иммуностимулирующей последовательности формулы (IV) определяется целыми числами s и/или t, где s и/или t, могут быть независимо друг от друга целыми числами примерно от 5 до 100, предпочтительно примерно от 5 до 70, предпочтительней примерно от 5 до 50, даже более предпочтительно примерно от 5 до 30 и предпочтительнее всего примерно от 5 до 20.
Согласно особенно предпочтительному варианту осуществления настоящего изобретения молекула нуклеиновой кислоты формулы (IV), описанная выше, может в частности содержать, например, молекулу нуклеиновой кислоты формулы (IVa),
поли(Х) (NuGlXmGnNv)a,
или молекулу нуклеиновой кислоты формулы (IVб),
поли(Х) (NuGlXmGnNv)a поли(Х),
причем какая-либо из этих молекул нуклеиновых кислот по формулам (IVa) или (IVб) также имеет длину, составляющую по меньшей мере 50 нуклеотидов, предпочтительно длину, составляющую по меньшей мере 100 нуклеотидов, более предпочтительно длину, составляющую по меньшей мере 150 нуклеотидов, еще более предпочтительно длину, составляющую по меньшей мере 200 нуклеотидов, самой предпочтительной является длина, составляющая по меньшей мере 250 нуклеотидов. Сходным образом все другие определения применяются в виде, предложенном выше для формул (IV) или (III). Также формулы (IV), (IVa) и (IVб) могут быть определены исходя из формулы (IIIб), т.е. вводя центральную структуру ClXmCn.
Более предпочтительно, если модифицирующий элемент поли(Х) в иммуностимулирующей последовательности по формулам (IV), (IVa) и/или (IVб) может быть выбран из поли(IV), согласно указанному выше, более предпочтительно из поли(I:С) и/или из элемента поли(А:U). Эти модифицирующие элементы поли(Х), а именно, поли(I:С) и/или поли(А:U), могут быть соединены с последовательностью формулы (IV), (IVa) и/или (IVб) через какую-либо из его цепей, например, через последовательности поли-С, поли-G, поли-I, поли-А или поли-U.
Подобно указанному выше для формулы (III) или (IIIa), иммуностимулирующая последовательность по формулам (IV), (IVa) и/или (IVб) может представлять собой одноцепочечную, двухцепочечную, или частично двухцепочечную молекулу нуклеиновой кислоты согласно указанному выше.
Если иммуностимулирующая последовательность по формулам (IV), (IVa) и/или (IVб) представлена одноцепочечной молекулой нуклеиновой кислоты, то такая последовательность обычно является одноцепочечной на протяжении всей ее длины.
Кроме того, если иммуностимулирующая последовательность по формулам (IV), (IVa) и/или (IVб) представлена двухцепочечной молекулой нуклеиновой кислоты, то такая последовательность обычно является двухцепочечной на протяжении всей ее длины.
Если иммуностимулирующая последовательность по формулам (IV), (IVa) и/или (IVб) представлена частично двухцепочечной молекулой нуклеиновой кислоты, то такая последовательность нуклеиновой кислоты в молекуле нуклеиновой кислоты по формулам (IV), (IVa) и/или (IVб) может быть одноцепочечной в области, находящейся снаружи от центральной структуры GlXmGn, и двухцепочечной в области указанной центральной структуры. Центральную структуру GlXmGn предпочтительно выбирают по меньшей мере из одной из указанных выше последовательностей SEQ ID NO:1-80 или SEQ ID NO:81-83. Даже более предпочтительно, чтобы центральная структура GlXmGn (или ClXmCn) формулы (III) (или (IIIa)) могла быть двухцепочечной в такой области центральной структуры, в которой имеет место протяженность уридинов (урацилов), наиболее предпочтительна протяженность, полностью представленная уридином (урацилом), или протяженность, состоящая из них по меньшей мере на 60%, 70%, 80%, 90%, 95%, 98% или 99%.
В другом варианте или дополнительно иммуностимулирующая последовательность по формулам (IV), (IVa) и/или (IVб) представлена частично двухцепочечной молекулой нуклеиновой кислоты, а другие части (отличные от центральной структуры GlXmGn) такой иммуностимулирующей последовательности по формулам (IV), (IVa) и/или (IVб) согласно указанному выше, могут быть двухцепочечными. Например, последовательность нуклеиновой кислоты в молекуле нуклеиновой кислоты по формулах (IV), (IVa) и/или (IVб) может быть двухцепочечной в области, находящейся снаружи от центральной структуры GlXmGn, например, в краевых элементах Nu и/или Nv, и/или в модифицирующем элементе поли(Х), например, поли(X)s и/или поли(Х)t(например, в последовательности поли(I:С) или поли(А:U)), и, например, одноцепочечной в области указанной центральной структуры, центральной структуры GlXmGn, предпочтительно выбираемой по меньшей мере из одной из указанных выше последовательностей SEQ ID NO:1-83. Например, по меньшей мере один из краевых элементов Nu и/или Nv и/или по меньшей мере один из модифицирующих элементов поли(IV), например, поли(IV)s и/или поли(IV)t может быть двухцепочечным, в то время как остальные элементы в формулах (IV), (IVa) и/или (IVб), например, центральная структура GlXmGn и/или другие элементы, могут оставаться одноцепочечными.
В другом варианте или дополнительно смесь молекул одноцепочечных нуклеиновых кислот по формулам (IV), (IVa) и/или (IVб) и (частично) двухцепочечных нуклеиновых кислот по формулам (IV), (IVa) и/или (IVб) предпочтительно в соотношении примерно от 1:10 до 10:1, более предпочтительно соотношение от 1:3 до 3:1.
В особенно предпочтительном варианте осуществления настоящего изобретения, иммуностимулирующая последовательность по формулам (IV), (IVa) и/или (IVб) может быть выбрана, например, из любой из следующих последовательностей:


Иммуностимулирующая последовательность формулы (III) (или (IIIa)), согласно указанному выше, также может быть модифицирована вставкой стволовой части или стволовой петли, например, позволяющей получить молекулу нуклеиновой кислоты формулы (Va),
(Nu ствол 1 GlXmGn ствол 2 Nv)a,
или молекулу нуклеиновой кислоты формулы (Vб),
(NuGlXmGnNv)a ствол 1 Nw1 ствол 2 Nw2,
где молекула нуклеиновой кислоты формулы (Va) и/или (Vб) имеет длину, составляющую по меньшей мере 100 нуклеотидов, более предпочтительна длину, составляющую, по меньшей мере, 150 нуклеотидов, еще более предпочтительно длину, составляющую по меньшей мере 200 нуклеотидов, наиболее предпочтительно длину, составляющую по меньшей мере 250 нуклеотидов. Кроме того, указанные формулы (Va) и (Vб) могут быть определены исходя из формулы (IIIб), т.е. путем введения центральной структуры ClXmCn.
В частности, иммуностимулирующие последовательности формулы (Va) и/или (Vб) представляют собой варианты формулы (III), указанные выше. В нуклеиновой кислоте по какой-либо из формул (Va) и/или (Vб), к краевым элементам N, т.е. Nu и/или Nv, окаймляющим центральную структуру GlXmGn, дополнительно присоединяют по меньшей мере, одне структуре, представляющая собой ствол или стволовую петлю, предпочтительно содержащую одиночные элементы стволовой петли ствол 1 и ствол 2. В иммуностимулирующих последовательностях по любой из формул (Va) и/или (Vб) согласно данному выше определению, элементы G, Х и N, а именно, центральная структура GlXmGn, и целые числа а, l, m, n, u и v определяются согласно описанному выше. Более предпочтительным значением для целого числа а является а=1. Необязательно u и/или v могут быть равными 0. Кроме этого, элементы Nw1 и Nw2, прилегающие к элементам стволовых петель ствол 1 и ствол 2, представляют дополнительные краевые элементы, которые определяют согласно описанному выше для краевых элементов Nu и/или Nv. В частности, краевой элемент N в общем определяют согласно описанному выше для N в формуле (III), а целые числа w1 и w2 выбирают независимо друг от друга и выражают согласно описанному выше в формуле (III) для целых чисел и и/или v.
В данном контексте структура ствола или стволовой петли представляет собой внутримолекулярное спаривание оснований, которое может быть в одноцепочечной ДНК, или, в большинстве случаев, в РНК. Такая структура также известна под названием «шпильки» или «шпилечной петли». Она образуется, когда две области одной и той же молекулы, например, элементы стволовой петли ствол 1 и ствол 2, обычно элементы палиндромных последовательностей в последовательностях нуклеиновых кислот, формируют друг с другом пары оснований, что ведет к образованию двойной спирали, которая заканчивается в неспаренной петле. Неспаренная петля, таким образом, обычно представляет собой область нуклеиновой кислоты, которая не проявляет или почти не проявляет идентичности или гомологичности с последовательностью любого из элементов ствола1 или ствола2 и поэтому не способна образовать пары оснований ни с одним из этих шпилечных элементов. В результате образуется структура, напоминающая леденец на палочке, которая является ключевым строительным блоком для вторичных структур многих РНК. Таким образом, формирование структуры «стебель-петля» зависит от стабильности получившихся спиральных и петлевых областей, причем первой предпосылкой обычно является наличие последовательности, которая может сворачиваться, формируя спаренную двойную спираль. Стабильность спаренных шпилечных элементов определяется длиной, числом содержащихся несовпадений или выпуклостей, которые в них содержатся, (небольшое число несовпадений обычно допускается, особенно в длинной спирали), и композицией оснований в спаренной области. Например, образование пар между гуанозином (гуанином) и цитидином (цитозином) может быть более предпочтительным в таких последовательностях, поскольку они имеют три водородные связи и являются более стабильными по сравнению с парами аденозин (аденин)-уридин (урацил), которые имеют только две водородные связи. В молекуле РНК пары гуанозин (гуанин)-уридин (урацил), образованные двумя водородными связями, могут, таким образом, быть приемлемыми. Стабильность петли также оказывает влияние на формирование шпилечной структуры. «Петли» (т.е. только петля, не содержащая стволовые элементы ствол 1 и ствол 2), которые имеют длину меньше, чем три основания, являются с пространственной точки зрения менее предпочтительными. Однако, стволы, т.е. структуры, которые не демонстрируют (выраженных) петлей, а имеют только неспаренную область между элементами ствол 1 и ствол 2, также могут быть включены. В контексте настоящего изобретения оптимальная длина петли стремится к длине, составляющей примерно от 4 до 100 оснований, более предпочтительно от 4 до 50, или даже от 4 до 30, или даже от 4 до 20 оснований.
Следовательно, в контексте иммуностимулирующей последовательности по любой из формул (Va) и/или (Vб), шпилечные элементы ствол 1 и ствол 2 обычно представляют собой части одной стволовой или шпилечной структуры, причем такая стволовая или шпилечная структура может формироваться шпилечными элементами ствол 1 и ствол 2, а петля может формироваться последовательностью, расположенной между этими шпилечными элементами. Ствол и шпилька могут иметь форму спирали в области спаренных оснований. Каждый шпилечный элемент ствол 1 и ствол 2 предпочтительно является нуклеиновой кислотой, описанной выше, причем предпочтительнее РНК, наиболее предпочтительно одноцепочечной РНК, причем любые из нуклеотидов (нуклеозидов) или аналогов, согласно описанному выше для элемента Х центральной структуры, могут быть использованы в качестве нуклеотидов (нуклеозидов) для элементов ствол 1 и/или ствол 2. Кроме того, шпилечный элемент ствол 1 представляет собой палиндромную последовательность шпилечного элемента ствол 2. Следовательно, обе эти последовательности предпочтительно способны образовывать друг с другом пары оснований и таким образом формировать основу для ствола или шпильки.
Следовательно, шпилечные элементы ствол 1 или ствол 2 могут быть выбраны попарно из какой-либо последовательности нуклеиновой кислоты при условии, что шпилечные элементы ствол 1 или ствол 2 являются палиндромными по отношению друг к другу, т.е. при условии, что одна последовательность тождественна другой (комплементарной) последовательности при считывании в обратном направлении или проявляет идентичность или гомологичность этой последовательности, по меньшей мере, на 90%, предпочтительнее, по меньшей мере, на 95%, и наиболее предпочтительно, по меньшей мере на 99% при считывании второй последовательности в обратном направлении. Каждая из таких палиндромных последовательностей ствол 1 и ствол 2 может быть представлена последовательностью нуклеиновой кислоты, имеющей длину примерно от 5 до 50, предпочтительнее, примерно от 5 до 40 и наиболее предпочтительно примерно от 5 до 30 нуклеиновых кислот, выбранных из аденозина (аденина), гуанозина (гуанина), цитидина (цитозина), уридина (урацила), тимидина (тимина) или их аналогов, согласно описанному в настоящем изобретении.
К примерам последовательностей для шпилечных элементов ствол 1 или ствол 2 могут относиться, например:
а) для ствол 1:
UAGCGAAGCUCUUGGACCUA (SEQ ID NO:95)
для ствол 2:
UAGGUCCAAGAGCUUCGCUA (SEQ ID NO:96)
б) для ствол 1:
UAGGUCCAAGAGCUUCGCUA (SEQ ID NO:96)
для ствол 2:
UAGCGAAGCUCUUGGACCUA (SEQ ID NO:95)
в) для ствол 1:
GCCGCGGGCCG (SEQ ID NO:97)
для ствол 2:
CGGCCCGCGGC (SEQ ID NO:98)
г) для ствол 1:
CGGCCCGCGGC (SEQ ID NO:98)
для ствол 2:
GCCGCGGGCCG (SEQ ID NO:97)
д) для ствол 1:
GACACGGUGC (SEQ ID NO:99)
для ствол 2:
GCACCGUGCA (SEQ ID NO:100)
е) для ствол 1:
GCACCGUGCA (SEQ ID NO:100)
для ствол 2:
GACACGGUGC (SEQ ID NO:99)
ж) для ствол 1:
ACCUAGGU (SEQ ID NO:101)
для ствол 2:
ACCUAGGU (SEQ ID NO:101)
з) для ствол 1:
UGGAUCCA (SEQ ID NO:102)
для ствол 2:
UGGAUCCA (SEQ ID NO:102)
для ствол 1:
CCUGC (SEQ ID NO:103)
для ствол 2:
GCAGG (SEQIDNO:104)
и) для ствол 1:
GCAGG (SEQ ID NO:105)
для ствол 2:
CCUGC (SEQ ID NO:106)
и др.
В другом первом варианте осуществления настоящего изобретения центральная структура GlXmGn может быть расположена в шпилечной структуре, т.е. центральная структура GlXmGn может быть расположена между шпилечными элементами ствол 1 и ствол 2, тем самым предпочтительно формируя петлю. Такая молекула нуклеиновой кислоты похожа на формулу (Va), имеющую состав (Nu ствол 1 GlXmGn ствол 2 Nv)a, согласно описанному выше. Если и и/или v=0 и а=1, формула (Va) может отражать определенную молекулу нуклеиновой кислоты «ствол 1 GlXmGn ствол 2», которая также охватывается настоящим изобретением.
В еще одном другом варианте осуществления настоящего изобретения центральная структура GlXmGn может быть расположена вне шпилечной структуры, причем подобные шпилечные элементы ствол 1 и ствол 2 могут быть отделены друг от друга последовательностью, предпочтительно краевым элементом N, например, Nw1 или Nw2, который в таком случае может формировать петлевую структуру на основе спаривания шпилечных элементов ствол 1 и ствол 2. Дополнительно шпилечные элементы 1 и/или 1, присоединенные к центральной структуре GlXmGn, могут быть отделены от центральной структуры GlXmGn дополнительным краевым элементом, например, Nw1 или Nw2. В настоящем изобретении такая нуклеиновая кислота отображается формулой (Vб) с композицией (NuGlXmGnNv)a ствол 1 Nw1 ствол 2 Nw2, описанной.
Иммуностимулирующая последовательность формулы (Va) и/или (Vб) может быть одноцепочечной или частично двухцепочечной. Если иммуностимулирующая последовательность формулы (Va) и/или (Vб) является молекулой одноцепочечной нуклеиновой кислоты, последовательность которой обычно одноцепочечная по всей ее протяженности. Если иммуностимулирующая последовательность формулы (Va) и/или (Vб) представлена частично двухцепочечной молекулой, молекула нуклеиновой кислоты формулы (Va) и/или (Vб) предпочтительно может быть одноцепочечной в области шпилечных элементов ствол 1 и ствол 2 и в областях петель, сформированных или центральной структурой GlXmGn, или каким-либо другим элементом, например, Nw1 или Nw2. Элементы, расположенные вне шпилечных элементов ствол 1 и ствол 2 и в областях петель, сформированных или центральной структурой GlXmGn, или каким-либо другим элементом, например, Nw1 или Nw2, затем могут быть независимо друг от друга одно- или двухцепочечными. В другом варианте или дополнительно смесь одноцепочечных или частично двухцепочечных молекул нуклеиновой кислоты формул (Va) или (Vб) и (частично) молекулой двухцепочечной нуклеиновой кислоты по формуле (Va) или (Vб), предпочтительно в соотношении примерно от 1:10 до 10:1, более предпочтительно в соотношении от 1:3 до 3:1.
В соответствии с в высокой степени предпочтительным вариантом осуществления настоящего изобретения иммуностимулирующая последовательность формулы (Va) и/или (Vб), соответственно, может быть выбрана, например, из какой-либо из следующих последовательностей:
(ствол 1 и ствол 2 подчеркнуты, центральная структура GlXmGn выделена жирным шрифтом).
Иммуностимулирующая последовательность формул (I), (II), (III), (IIIa), (IV), (IVa), (IVб), (Va) и/или (Vб), указанных выше, обычно представляет нуклеиновую кислоту, которая может быть в форме какой-либо ДНК или РНК, предпочтительно, но ими не ограничивается, кольцевой или линейной ДНК или РНК, одно- или двухцепочечной ДНК или РНК (которые также могут рассматриваться в качестве ДНК или РНК из-за нековалентной ассоциации с двумя одноцепочечными ДНК или РНК) или частично двухцепочечной ДНК или РНК (которые обычно формируются более длинными и по меньшей мере одной более короткой молекулой ДНК или РНК, или по меньшей мере двумя молекулами одноцепочечной ДНК или РНК примерно равной длины, причем одна или несколько молекул одноцепочечных ДНК или РНК частично комплементарны одной или нескольким другим молекулам одноцепочечных ДНК или РНК и таким образом формируют двухцепочечную РНК в этой области), например, (частично) одноцепочечную ДНК или РНК, смешанную с областями (частично) двухцепочечной ДНК или РНК. Предпочтительно молекула нуклеиновой кислоты формулы (I), (II), (III), (IIIa), (IV), (IVa), (IVб), (Va) и/или (Vб), описанная выше, может быть в форме одно- или двухцепочечной ДНК или РНК, более предпочтительно частично двухцепочечной ДНК или РНК. Также предпочтительно, если иммуностимулирующая последовательность формулы (I), (II), (III), (IIIa), (IV), (IVa), (IVб), (Va) и/или (Vб), описанная выше, имеется в форме смеси одноцепочечной и двухцепочечной ДНК или РНК.
Особенно предпочтительно, если иммуностимулирующая последовательность формул (I), (II), (III), (IIIa), (IV), (IVa), (IVб), (Va) и/или (Vб), указанных выше, является частично двухцепочечной молекулой нуклеиновой кислоты, поскольку такая (частично двухцепочечная) иммуностимулирующая последовательность формул (I), (II), (III), (IIIa), (IV), (IVa), (IVб), (Va) и/или (Vб), указанных выше), может положительно стимулировать врожденный иммунный ответ пациента, подвергаемого лечению путем адресации к рецепторам патогенассоциированных молекулярных структур (pathogen associated molecular pattern - PAMP) для отноцепочечной РНК (TLR-7 и TLR-8), а также РАМР-рецепторам для двухцепочечной РНК (TLR-3, RIG-I и MDA-5). Рецепторы TLR-3, TLR-7 и TLR-8 локализованы в эндосоме и активируются с помощью РНК, поглощенной эндосомой. Напротив, RIG-I и MDA-5 являются цитоплазматическими рецепторами, которые активируются под действием РНК, которая непосредственно поступила в цитоплазму или которая была высвобождена эндосомами (эндосомальное выделение). Таким образом, какая-либо частично двухцепочечная иммуностимулирующая последовательность формул (I), (II), (III), (IIIa), (IV), (IVa), (IVб), (Va) и/или (Vб), указанных выше, способна активировать разные сигнальные каскады иммуностимуляции и таким образом приводит к врожденному иммунному ответу или существенно повышает такой ответ.
Молекулы нуклеиновой кислоты одной из формул (I), (II), (III), (IIIa), (IV), (IVa), (IVб), (Va) и/или (Vб), указанных выше, могут быть получены, используя какие-либо методы, известные в данной области, включая методы синтеза, например, твердофазного синтеза, а также методы in vitro, например, реакции транскрипции in vitro. Предпочтительно, транскрипцию in vitro используют для получения иммуностимулирующих последовательностей, В настоящем изобретении неожиданно было установлено, что молекулы нуклеиновой кислоты формул (I), (II), (III), (IIIa), (IV), (IVa), (IVб), (Va) и/или (Vб), указанных выше, показывают даже лучшую стимуляцию врожденной иммунной системы, если получены транскрипцией in vitro из-за имеющегося у них 5'-фосфата, при сравнении с молекулами нуклеиновой кислоты любой из формул (I), (II), (III), (IIIa), (IV), (IVa), (IVб), (Va) и/или (Vб), полученных путем синтеза. Такая стимуляция врожденной иммунной системы способствует активации рецептора RIG-I, но с ней не связана. Таким образом, молекулы нуклеиновой кислоты формул (I), (II), (III), (IIIa), (IV), (IVa), (IVб), (Va) и/или (Vб), указанные выше, особенно предпочтительны, если получены реакцией транскрипции in vitro.
Кроме того, (классы) молекул РНК, которые могут применяться для по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, могут включать какую-либо другую РНК, способную индуцировать иммунный ответ. Такая иммуностимулирующая РНК может включать рибосомальную РНК (рРНК), транспортную РНК (тРНК), информационную РНК (иРНК) и вирусную РНК (вРНК), однако ими перечень не ограничивается.
По третьему варианту осуществления настоящего изобретения по меньшей мере одна (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению может быть малой интерферирующей рибонуклеиновой кислотой (миРНК). Особенно миРНК представляет интерес в связи с феноменом интерференции РНК. Внимание было обращено на явление интерференции РНК в ходе иммунологического исследования. В последние годы был открыт основанный на РНК защитный механизм, который имеется и в царстве грибов, и в царстве растений, и в царстве животных, и действует в качестве «иммунной системы генома». Эта система первоначально описана у разных несвязанных между собой видов, сначала у С. elegans, раньше, чем появилась возможность идентифицировать лежащие в основе механизмы процессов в качестве идентичных: РНК-опосредованная устойчивость к вирусам у растений, посттрансляционный генный сайленсинг (posttranscriptional gene silencing - PTGS) у растений и интерференция РНК у эукариотов, таким образом, основаны на общем процессе. Метод in vitro интерференции РНК (РНКи) основан на двухцепочечных молекулах РНК (дцРНК), которые запускают специфичную в отношении последовательности супрессию генной экспрессии (Zamore, Nat. Struct. Biol. 9, 2001, cc.746-750; Sharp, Genes Dev. 5, 2001, cc.485-490; Hannon, Nature 41, 2002, cc.244-251). При трансфекции клеток млекопитающих длинной дцРНК активирование протеинкиназы R и РНКазы L вызывает близкие к неспецифическим эффекты, например, ответ в виде интерферона (Stark и др., Annu. Rev. Biochem. 67, 1998, cc.227-264; He, Katze, Viral Immunol. 15, 2002, cc.95-119). Ранее молекулы дцРНК также использовали т vivo (McCaffrey и др., Nature 418, 2002, cc.38-39; Xia и др., Nature Biotech. 20, 2002, cc.1006-1010; Brummelkamp и др., Cancer Cell 2, 2002, cc.243-247). Таким образом, миРНК, используемая по меньшей мере в качестве одного (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, может быть иммуностимулирующей РНК и обычно включает одно- или двухцепочечную, предпочтительно двухцепочечную, последовательность РНК примерно с 8-30 нуклеотидами, предпочтительно 17-25 нуклеотидами, еще более предпочтительно 20-25 и наиболее предпочтительно с 21-23 нуклеотидами. В принципе все отрезки, длиной 17-29, предпочтительно 1,9-25, наиболее предпочтительно 21-23 пар оснований, содержащиеся в кодирующей области последовательности РНК, согласно указанному выше, могут служить в качестве последовательности-мишени для таких миРНК. В равной степени молекулы миРНК также могут быть направлены против нуклеотидных последовательностей белков, особенно регулирующих белков, которые отрицательно регулируют индукцию иммунного ответа (врожденного или приобретенного), которые локализованы за пределами кодирующей области, в частности в 5'-некодирующей области РНК, например, таким образом, против некодирующих областей РНК, обладающей регуляторной функцией. Последовательность-мишень миРНК, используемая в качестве по меньшей мере одной (и)РНК адъювантного компонента композиции по настоящему изобретению, может таким образом лежать в транслируемой и/или нетранслируемой области нуклеотидной последовательности белка, подобного описанному выше, и/или в области контрольных элементов. Последовательность-мишень миРНК, подобная описанной выше, также может лежать в перекрывающейся области нетранслируемой или транслируемой последовательности; в частности, последовательность-мишень может включать по меньшей мере один нуклеотид вверх по цепи от стартового триплета кодируемой области РНК.
По четвертому варианту осуществления настоящего изобретения по меньшей мере одна (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению может быть антисмысловой РНК. В контексте настоящего изобретения антисмысловая РНК предпочтительно является (одноцепочечной) молекулой РНК, транскрибирующей скорее кодирующую, чем комплементарную цепь ДНК, при этом (предпочтительно) (целая) последовательность антисмысловой иРНК комплементарна смысловой (информационной) РНК. Антисмысловая РНК, описанная в настоящем изобретении, обычно формирует дуплекс между молекулами смысловой и антисмысловой РНК и таким образом может блокировать транскрипцию кодирующей цепи. Антисмысловая РНК, используемая в качестве по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, может быть направлена против нуклеотидных последовательностей, например, (природной) иРНК или геномной последовательности, кодирующей белок или пептид, которая может быть выбрана из последовательностей какого-либо белка или пептида, применимых для этой цели. Предпочтительно антисмысловая РНК, используемая в настоящем изобретении в качестве по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, представляет отрезок длиной, указанной выше и являющейся обычной для молекул РНК, более предпочтительно длиной 1000-5000, 500-5000, 5-5000 или 5-1000, 5-500, 5-250, 5-100, 5-50 или 5-30 нуклеотидов.
По пятому варианту осуществления настоящего изобретения по меньшей мере одна (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению может быть кодирующей РНК. Такой кодирующей РНК может быть какая-либо РНК, согласно описанному выше. Предпочтительно такая кодирующая РНК может быть одно- или двухцепочечной РНК, более предпочтительно одноцепочечной РНК, и/или кольцевой или линейной РНК, более предпочтительно линейной РНК. Еще более предпочтительно кодирующая РНК может быть (линейной) одноцепочечной РНК. Наиболее предпочтительно кодирующая РНК может быть ((линейной) одноцепочечной) информационной РНК (иРНК). Кодирующая РНК, используемая в качестве по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, может дополнительно кодировать белок или пептид, который может быть выбран, но ими не ограничивается, например, из пептидов или белков терапевтического действия, из антигенов, например, опухолевых антигенов, патогенных антигенов (например, выбранных из патогенных белков, описанных выше, или из животных антигенов, вирусных антигенов, антигенов простейших, бактериальных антигенов, аллергических антигенов), аутоиммунных антигенов или дополнительных антигенов, из аллергенов, из антител, из иммуностимулирующих белков или пептидов, из антиген-специфичных рецепторов Т-клеток или от какого-либо другого пептида или белка, пригодного для специфического (терапевтического) применения, причем кодирующая РНК, используемая в качестве по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, может быть перенесена в клетку, ткань или организм, и белок позднее может быть экспрессирован в таких клетках, тканях или организмах.
а) Белки терапевтического действия
В контексте настоящего изобретения белки терапевтического действия, кодируемые по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, могут быть выбраны из каких-либо природных рекомбинантных или выделенных белков, известных специалистам в данной области. Белки терапевтического действия могут включать белки, способные стимулировать или ингибировать сигнальную транскрипцию в клетке, например, цитокины, антитела и др., но ими перечень не ограничивается. Белки терапевтического действия могут, таким образом, включать цитокины I класса семейства цитокинов, имеющих 4 позиционно консервативных остатков цистеина (СССС) и содержащих мотив консервативной последовательности Trp-Ser-X-Trp-Ser (WSXWS), где Х означает неконсервативную аминокислоту. Цитокины I класса семейства цитокинов включают подсемейство GM-CSF, например, ИЛ-3, ИЛ-5, GM-CSF, ИЛ-6-подсемейство, например, ИЛ-6, ИЛ-11, ИЛ-12 или ИЛ-2-подсемейство, например, ИЛ-2, ИЛ-4, ИЛ-7, ИЛ-9, ИЛ-15 и др., или цитокины ИЛ-1альфа, ИЛ-1бета, ИЛ-10 и др. Белки терапевтического действия могут также включать цитокины II класса семейства цитокинов, которые также включают 4 позиционно консервативных остатков цистеина (СССС), но не консервативную последовательность мотива Trp-Ser-X-Trp-Ser (WSXWS). Цитокины II класса семейства цитокинов включают, например, ИФН-альфа, ИФН-бета, ИФН-гамма и др. Белки терапевтического действия могут дополнительно включать цитокины семейства факторов некроза опухоли, например, ФНО-альфа, ФНО-бета и др. или цитокины семейства хемокинов, которые включают 7 трансмембранных спиралей и взаимодействуют с G-белком, например, ИЛ-8, MIP-1, RANTES, CCR5, CXR4 и др., или специфичные в отношении цитокинов рецепторы, например, ФНО-RI, ФНО-RII, CD40, OX40 (CD134), Fas.
Белки терапевтического действия, кодируемые по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции, также могут быть выбраны из каких-либо следующих белков: 0ATL3, 0FC3, 0РА3, 0PD2, 4-1BBL, 5Т4, хемокина с шестью цистеинами (6Ckine), 707-AP, 9D7, А2М, АА, AAAS, ААСТ, AASS, АВАТ, АВСА1, АВСА4, АВСВ1, АВСВ11, АВСВ2, АВСВ4, АВСВ7, АВСС2, АВСС6, АВСС8, ABCD1, ABCD3, ABCG5, ABCG8, ABL1, АВО, ABR ACAA1, АСАСА, ACADL, ACADM, ACADS, ACADVL, АСАТ1, ACCPN, АСЕ, ACHE, АСНМ3, АСНМ1, ACLS, ACPI, ACTA1, АСТС, ACTN4, ACVRL1, AD2, ADA, ADAMTS13, ADAMTS2, ADFN, ADH1B, ADH1C, ADLDH3A2, ADRB2, ADRB3, ADSL, AEZ, AFA, AFD1, AFP, AGA, AGL, AGMX2, AGPS, AGS1, AGT, AGTR1, AGXT, AH02, AHCY, AHDS, AHHR, AHSG, AIC, AIED, AIH2, AIH3, AIM-2, AIPL1, AIRE, AK1, ALAD, ALAS2, ALB, HPG1, ALDH2, ALDH3A2, ALDH4A1, ALDH5A1, ALDH1A1, ALDOA, ALDOB, ALMS1, ALPL, ALPP, ALS2, ALX4, AMACR, AMBP, AMCD, AMCD1, AMCN, AMELX, AMELY, AMGL, АМН, AMHR2, AMPD3, AMPD1, AMT, ANC, ANCR, ANK1, ANOP1, AOM, AP0A4, AP0C2, АР0С3, АР3В1, APC, аРКС, АРОА2, APOA1, АРОВ, АРОС3, APOC2, APOE, APOH, APP, APRT, APS1, AQP2, AR, ARAF1, ARG1, ARHGEF12, ARMET, ARSA, ARSB, ARSC2, ARSE, ART-4, ARTCl/m, ARTS, ARVD1, ARX, AS, ASAH, ASAT, ASD1, ASL, ASMD, ASMT, ASNS, ASPA, ASS, ASSP2, ASSP5, ASSP6, AT3, ATD, ATHS, ATM, ATP2A1, ATP2A2, ATP2C1, ATP6B1, ATP7A, ATP7B, ATP8B1, ATPSK2, ATRX, ATXN1, ATXN2, ATXN3, AUTS1, AVMD, AVP, AVPR2, AVSD1, AXIN1, AXIN2, AZF2, B2M, B4GALT7, B7H4, BAGE, BAGE-1, BAX, BBS2, BBS3, BBS4, BCA225, BCAA, BCH, BCHE, BCKDHA, BCKDHB, BCL10, BCL2, BCL3, BCL5, BCL6, BCPM, BCR, BCR/ABL, BDC, BDE, BDMF, BDMR, BEST1, бета-катенина/m, BF, BFHD, BFIC, BFLS, BFSP2, BGLAP, BGN, BHD, BHR1, BING-4, BIRC5, BJS, BLM, BLMH, BLNK, BMPR2, BPGM, BRAF, BRCA1, BRCA1/m, BRCA2, BRCA2/m, BRCD2, BRCD1, BRDT, BSCL, BSCL2, BTAA, BTD, ВТК, BUB1, BWS, BZX, C0L2A1, C0L6A1, C1NH, C1QA, C1QB, C1QG, C1S, C2, С3, С4А, C4B, C5, C6, C7, C7orf2, C8A, C8B, C9, CA125, CA15-3/CA 27-29, CA195, CA19-9, CA72-4, CA2, CA242, CA50, CABYR, CACD, CACNA2D1, CACNA1A, CACNA1F, CACNA1S, CACNB2, CACNB4, CAGE, CA1, CALB3, CALCA, CALCR, CALM, CALR. CAM43, CAMEL, CAP-1, CAPN3, CARD15, CASP-5/m, CASP-8, CASP-8/m, CASR, CAT, CATM, CAV3, CB1, CBBM, CBS, CCA1, CCAL2, CCAL1, CCAT, CCL-1, CCL-11, CCL-12, CCL-13, CCL-14, CCL-15, CCL-16, CCL-17, CCL-18, CCL-19, CCL-2, CCL-20, CCL-21, CCL-22, CCL-23, CCL-24, CCL-25, CCL-27, CCL-3, CCL-4, CCL-5, CCL-7, CCL-8, CCM1, CCNB1, CCND1, CCO, CCR2, CCR5, CCT, CCV, CCZS, CD1, CD19, CD20, CD22, CD25, CD27, CD27L, cD3, CD30, CD30, CD30L, CD33, CD36, CD3E, CD3G, CD3Z, CD4, CD40, CD40L, CD44, CD44v, CD44v6, CD52, CD55, CD56, CD59, CD80, CD86, CDAN1, CDAN2, CDAN3, CDC27, CDC27/m, CDC2L1, CDH1, CDK4, CDK4/m, CDKN1C, CDKN2A, CDKN2A/m, CDKN1A, CDKN1C, CDL1, CDPD1, CDR1, CEA, CEACAM1, CEACAM5, CECR, CECR9, СЕРА, CETP, CFNS, CFTR, CGF1, CHAC, CHED2, CHED1, CHEK2, CHM, CHML, CHR39C, CHPHK4, CHPHK1, CHRNB1, CHRNE, CHS, CHS1, CHST6, CHX10, CIAS1, CIDX, CKN1, CLA2, CLA3, CLA1, CLCA2, CLCN1, CLCN5, CLCNKB, CLDN16, CLP, CLN2, CLN3, CLN4, CLN5, CLN6, CLN8, C1QA, C1QB, C1QG, C1R, CLS, CMCWTD, CMDJ, CMD1A, CMD1B, CMH2, МН3, СМН6, CMKBR2, CMKBR5, CML28, CML66, CMM, CMT2B, CMT2D, CMT4A, CMT1A, CMTX2, CMTX3, C-MYC, CNA1, CND, CNGA3, CNGA1, CNGB3, CNSN, CNTF, COA-l/m, COCH, COD2, COD1, COH1, COL10A, COL2A2, COL11A2, COL17A1, COL1A1, COL1A2, COL2A1, COL3A1, COL4A3, COL4A4, COL4A5, COL4A6, COL5A1, COL5A2, COL6A1, COL6A2, COL6A3, COL7A1, COL8A2, COL9A2, COL9A3, COL11A1, COL1A2, COL23A1, COL1A1, COLQ, COMP, COMT, CORDS, CORD1, COX10, COX-2, CP, CPB2, CPO, CPP, CPS1, CPT2, CPT1A, CPX, CRAT, CRB1, CRBM, CREBBP, CRH, CRHBP, CRS, CRV, CRX, CRYAB, CRYBA1, CRYBB2, CRYGA, CRYGC, CRYGD, CSA, CSE, CSF1R, CSF2RA, CSF2RB, CSF3R, CSF1R, CST3, CSTB, CT, CT7, CT-9/BRD6, CTAA1, CTACK, CTEN, CTH, CTHM, CTLA4, CTM, CTNNB1, CTNS, CTPA, CTSB, CTSC, CTSK, CTSL, CTS1, CUBN, CVD1, CX3CL1, CXCL1, CXCL10, CXCL11, CXCL12, CXCL13, CXCL16, CXCL2, CXCL3, CXCL4, CXCL5, CXCL6, CXCL7, CXCL8, CXCL9, CYB5, CYBA, CYBB, CYBB5,, CYFRA21-1, CYLD, CYLD1, CYMD, CYP11B1, CYP11B2, CYP17, CYP17A1, CYP19, CYP19A1, CYP1A2, CYP1B1, CYP21A2, CYP27A1, CYP27B1, CYP2A6, CYP2C, CYP2C19, CYP2C9, CYP2D, CYP2D6, CYP2D7P1, CYP3A4, CYP7B1, CYPB1, CYP11B1, CYP1A1, CYP1B1, CYRAA, D40, DAD1, DAM, DAM-10/MAGE-B1, DAM-6/MAGE-B2, DAX1, DAZ, DBA, DBH, DBI, DBT, DCC, DC-CK1, DCK, DCR, DCX, DDB1, DDB2, DDIT3, DDU, DECR1, DEK-CAN, DEM, DES, DF, DFN2, DFN4, DFN6, DFNA4, DFNA5, DFNB5, DGCR, DHCR7, DHFR, DHOF, DHS, DIA1, DIAPH2, DIAPH1, DIH1, DIO1, DISCI, DKC1, DLAT, DLD, DLLS, DLX3, DMBT1, DMD, DM1, DMPK, DMWD, DNAI1, DNASE1, DNMT3B, DPEP1, DPYD, DPYS, DRD2, DRD4, DRPLA, DSCR1, DSG1, DSP, DSPP, DSS, DTDP2, DTR, DURS1, DWS, DYS, DYSF, DYT2, DYT3, DYT4, DYT2, DYT1, DYX1, EBAF, EBM, EBNA, EBP, EBR3, EBS1, ECA1, ECB2, ECE1, ECGF1, ЕСТ, ED2, ED4, EDA, EDAR, ECA1, EDN3, EDNRB, EEC1, EEF1A1L14, EEGV1, EFEMP1, EFTUD2/m, EGFR, EGFR/Her1, EGI, EGR2, EIF2AK3, eIF4G, EKV, ElIS, ELA2, ELF2, ELF2M, ELK1, ELN, ELONG, EMD, EML1, EMMPRIN, EMX2, ENA-78, ENAM, END3, ENG, ENO1, ENPP1, ENUR2, ENUR1, EOS, EP300, EPB41, EPB42, EPCAM, EPD, EphA1, EphA2, EphA3, эфринА2, эфринА3, EPHX1, EPM2A, EPO, EPOR, EPX, ERBB2, ERCC2 ERCC3, ERCC4, ERCC5, ERCC6, ERVR, ESR1, ETFA, ETFB, ETFDH, ETM1, ETV6-AML1, ETV1, EVC, EVR2, EVR1, EWSR1, EXT2, ЕХТ3, ЕХТ1, EYA1, EYCL2, EYCL3, EYCL1, EZH2, F10, F11, F12, F13A1, F13B, F2, F5, F5F8D, F7, F8, F8C, F9, FABP2, FACL6, FAH, FANCA, FANCB, FANCC, FANCD2, FANCF, FasL, FBN2, FBN1, FBP1, FCG3RA, FCGR2A, FCGR2B, FCGR3A, FCHL, FCMD, FCP1, FDPSL5, FECH, FEO, FEOM1, FES, FGA, FGB, FGD1, FGF2, FGF23, FGF5, FGFR2, FGFR3, FGFR1, FGG, FGS1, FH, FIC1, FIH, F2, FKBP6, FLNA, FLT4, FMO3, FMO4, FMR2, FMR1, FN, FNl/m, FOXC1, FOXE1, FOXL2, FOXO1A, FPDMM, FPF, Fra-1, FRAXF, FRDA, FSHB, FSHMD1A, FSHR, FTH1, FTHL17, FTL, FTZF1, FUCA1, FUT2, FUT6, FUT1, FY, G250, G250/CAIX, G6PC, G6PD, G6PT1, G6PT2, GAA, GABRA3, GAGE-1, GAGE-2, GAGE-3, GAGE-4, GAGE-5, GAGE-6, GAGE-7b, GAGE-8, GALC, GALE, GALK1, GALNS, GALT, GAMT, GAN, GAST, GASTRIN17, GATA3, GATA, GBA, GBE, GC, GCDH, GCGR, GCH1, GCK, GCP-2, GCS1, G-CSF, GCSH, GCSL, GCY, GDEP, GDF5, GDI1, GDNF, GDXY, GFAP, GFND, GGCX, GGT1, GH2, GH1, GHR, GHRHR, GHS, GIF, GINGF, GIP, GJA3, GJA8, GJB2, GJB3, GJB6, GJB1, GK, GLA, GLB, GLB1, GLC3B, GLC1B, GLC1C, GLDC, GLI3, GLP1, GLRA1, GLUD1, GM1 (fuc-GM1), GM2A, GM-CSF, GMPR, GNAI2, GNAS, GNAT1, GNB3, GNE, GNPTA, GNRH, GNRH1, GNRHR, GNS, GnT-V, gp100, GP1BA, GP1BB, GP9, GPC3, GPD2, GPDS1, GPI, GP1BA, GPN1LW, GPNMB/m, GPSC, GPX1, GRHPR, GRK1, GROα, GROβ, GROγ, GRPR, GSE, GSM1, GSN, GSR, GSS, GTD, GTS, GUCA1A, GUCY2D, GULOP, GUSB, GUSM, GUST, GYPA, GYPC, GYS1, GYS2, H0KPP2, H0MG2, HADHA, HADHB, HAGE, HAGH, HAL, HAST-2, HB1, HBA2, HBA1, HBB, HBBP1, HBD, HBE1, HBG2, HBG1, HBHR, HBP1, HBQ1, HBZ, HBZP, HCA, HCC-1, HCC-4, HCF2, HCG, HCL2, HCL1, HCR, HCVS, HD, HPN, HER2, HER2/NEU, HER3, HERV-K-MEL, HESX1, HEXA, HEXB, HF1, HFE, HF1, HGD, HHC2, HHC3, HHG, HK1HLA-A, HLA-A*0201-R170I, HLA-A11/m, HLA-A2/m, HLA-DPB1 HLA-DRA, HLCS, HLXB9, HMBS, HMGA2, HMGCL, HMI, HMN2, HMOX1, HMS1 HMW-MAA, HND, HNE, HNF4A, HOAC, HOMEOBOX NKX 3.1, HOM-TES-14/SCP-1, HOM-TES-85, HOXA1 HOXD13, HP, HPC1, HPD, HPE2, HPE1, HPFH, HPFH2, HPRT1, HPS1, HPT, HPV-E6, HPV-E7, HR, HRAS, HRD, HRG, HRPT2, HRPT1, HRX, HSD11B2, HSD17B3, HSD17B4, HSD3B2, HSD3B3, HSN1, HSP70-2M, HSPG2, HST-2, HTC2, HTC1, hTERT, HTN3, HTR2C, HVBS6, HVBS1, HVEC, HV1S, HYAL1, HYR, I-309, IAB, IBGC1, IBM2, ICAM1, ICAM3, iCE, ICHQ, ICR5, ICR1, ICS1, IDDM2, IDDM1, IDS, IDUA, IF, ИФНа/b, IFNGR1, IGAD1, IGER, IGF-1R, IGF2R, IGF1, IGH, IGHC, IGHG2, IGHG1, IGHM, IGHR, IGKC, IHG1, IHH, IKBKG, ИЛ1, ИЛ-1 RA, ИЛ10, ИЛ-11, ИЛ12, ИЛ12РВ1, ИЛ13, ИЛ-13Rα2, ИЛ-15, ИЛ-16, ИЛ-17, ИЛ18, ИЛ-1a, ИЛ-1α, ИЛ-1b, ИЛ-1β, ИЛ1RАРL1, ИЛ2, ИЛ24, ИЛ-2R, ИЛ2RА, ИЛ2RG, ИЛ3, ИЛ3РА, ИЛ4, ИЛ4R, ИЛ4R, ИЛ-5, ИЛ6, ИЛ-7, ИЛ7R, ИЛ-8, ИЛ-9, незрелого рецептора ламинина, IMMP2L, INDX, INFGR1, INFGR2, INFα, ИФН, INFγ, INS, INSR, INVS, IP-10, IP2, IPF1, IP1, IRF6, IRS1, ISCW, ITGA2, ITGA2B, ITGA6, ITGA7, ITGB2, ITGB3, ITGB4, ITIH1, ITM2B, IV, IVD, JAG1, JAK3, JBS, JBTS1, JMS, JPD, KAL1, KAL2, KALI, KLK2, KLK4, KCNA1, KCNE2, KCNE1, KCNH2, KCNJ1, KCNJ2, KCNJ1, KCNQ2, KCNQ3, KCNQ4, KCNQ1, KCS, KERA, KFM, KFS, KFSD, KHK, ki-67, KIAA0020, KIAA0205, KIAA0205/m, KIF1B, KIT, KK-LC-1, KLK3, KLKB1, KM-HN-1, KMS, KNG, KNO, K-RAS/m, KRAS2, KREV1, KRT1, KRT10, KRT12, KRT13, KRT14, KRT14L1, KRT14L2, KRT14L3, KRT16, KRT16L1, KRT16L2, KRT17, KRT18, KRT2A, KRT3, KRT4, KRT5, KRT6A, KRT6B, KRT9, KRTHB1, KRTHB6, KRT1, KSA, KSS, KWE, KYNU, L0H19CR1, L1CAM, LAGE, LAGE-1, LALL, LAMA2, LAMA3, LAMB3, LAMB1, LAMC2, LAMP2, LAP, LCA5, LCAT, LCCS, LCCS 1, LCFS2, LCS1, LCT, LDHA, LDHB, LDHC, LDLR, LDLR/FUT, LEP, LEWISY, LGCR, LGGF-PBP, LGI1, LGMD2H, LGMD1A, LGMD1B, LHB, LHCGR, LHON, LHRH, LHX3, LIF, LIG1, LIMM, LIMP2, LIPA, LIPA, LIPB, LIPC, LIVIN, L1CAM, LMAN1, LMNA, LMX1B, LOLR, LOR, LOX, LPA, LPL, LPP, LQT4, LRP5, LRS 1, LSFC, LT-β, LTBP2, LTC4S, LYL1, XCL1, LYZ, M344, MA50, MAA, MADH4, MAFD2, MAFD1, MAGE, MAGE-A1, MAGE-A10, MAGE-A12, MAGE-A2, MAGE-A3, MAGE-A4, MAGE-A6, MAGE-A9, MAGEB1, MAGE-B10, MAGE-B16, MAGE-B17, MAGE-B2, MAGE-B3, MAGE-B4, MAGE-B5, MAGE-B6, MAGE-C1, MAGE-C2, MAGE-C3, MAGE-D1, MAGE-D2, MAGE-D4, MAGE-E1, MAGE-E2, MAGE-F1, MAGE-H1, MAGEL2, MGB1, MGB2, MAN2A1, MAN2B1, MANBA, MANBB, MAOA, MAOB, MAPK8IP1, МАРТ, MART-1, MART-2, MART2/m, MAT1A, MBL2, MBP, MBS1, MC1R, MC2R, MC4R, MCC, MCCC2, MCCC1, MCDR1, MCF2, MCKD, MCL1, MC1R, MCOLN1, MCOP, MCOR, MCP-1, MCP-2, MCP-3, MCP-4, MCPH2, MCPH1, MCS, M-CSF, MDB, MDCR, MDM2, MDRV, MDS1, ME1, ME1/m, ME2, ME20, ME3, MEAX, MEB, MEC CCL-28, MECP2, MEFV, MELANA, MELAS, MEN1 MSLN, MET, MF4, MG50, MG50/PXDN, MGAT2, MGAT5, MGC1 MGCR, MGCT, MGI, MGP, MHC2TA, MHS2, MHS4, MIC2, MIC5, MIDI, MIF, MIP, MIP-5/HCC-2, MITF, MJD, MKI67, MKKS, MKS1, MLH1, MLL, MLLT2, MLLT3, MLLT7, MLLT1, MLS, MLYCD, MMA1a, MMP 11, MMVP1, MN/CA IX-антигена, MNG1, MN1, MOC31, MOCS2, MOCS1, MOG, MORC, MOS, MOV18, MPD1, MPE, MPFD, MPI, MPIF-1, MPL, MPO, MPS3C, MPZ, MRE11A, MROS, MRP1, MRP2, MRP3, MRSD, MRX14, MRX2, MRX20, MRX3, MRX40, MRXA, MRX1, MS, MS4A2, MSD, MSH2, MSH3, MSH6, MSS, MSSE, MSX2, MSX1, MTATP6, МТС03, MTCO1, MTCYB, MTHFR, MTM1, MTMR2, MTND2, MTND4, MTND5, MTND6, MTND1, MTP, MTR, MTRNR2, MTRNR1, MTRR, MTTE, MTTG, MTTI, MTTK, MTTL2, MTTL1, MTTN, MTTP, MTTS1, MUC1, MUC2, MUC4, MUC5AC, MUM-1, MUM-1/m, MUM-2, MUM-2/m, MUM-3, MUM-3/m, MUT, мутантного p21 ras, MUTYH, MVK, MX2, MXI1, MY05A, MYB, MYBPC3, MYC, MYCL2, MYH6, MYH7, MYL2, MYL3, MYMY, MY015A, MY01G, MY05A, MY07A, MYOC, миозина/m, MYP2, MYP1, NA88-A, N-ацетилглюкозаминилтрансферазы-V, NAGA, NAGLU, NAMSD, NAPB, NAT2, NAT, NBIA1, NBS1, NCAM, NCF2, NCF1, NDN, NDP, NDUFS4, NDUFS7, NDUFS8, NDUFV1, NDUFV2, NEB, NEFH, NEM1, Neo-PAP, neo-PAP/m, NEU1, NEUROD1, NF2, NF1, NFYC/m, NGEP, NHS, NKS1, NKX2E, NM, NME1, NMP22, NMTC, NODAL, NOG, NOS3, NOTCH3, NOTCH1, NP, NPC2, NPC1, NPHL2, NPHP1, NPHS2, NPHS1, NPM/ALK, NPPA, NQO1, NR2E3, NR3C1, NR3C2, NRAS, NRAS/m, NRL, NROB1, NRTN, NSE, NSX, NTRK1, NUMA1, NXF2, NY-CO1, NY-ESO1, NY-ESO-B, NY-LU-12, ALDOA, NYS2, NYS4, NY-SAR-35, NYS1, NYX, ОА3, ОА1, OAP, OASD, OAT, OCA1, OCA2, OCD1, OCRL, OCRL1, OCT, ODDD, ODT1, OFC1, OFD1, OGDH, OGT, OGT/m, OPA2, OPA1, OPD1, OPEM, OPG, OPN, OPN1LW, OPN1MW, OPN1SW, OPPG, OPTB1, TTD, ORM1, ORP1, OS-9, OS-9/m, OSM LIF, OTC, OTOF, OTSC1, OXCT1, OYTES1, P15, P190 MINOR BCR-ABL, P2RY12, P3, P16, P40, P4HB, P-501, P53, P53/m, P97, PABPN1, PAFAH1B1, PAFAH1P1, PAGE-4, PAGE-5, РАН, PAI-1, PAI-2, PAK3, PAP, PAPPA, PARK2, PART-1, PATE, PAX2, PAX3, PAX6, PAX7, PAX8, PAX9, PBCA, PBCRA1, PBT, PBX1, PBXP1, PC, PCBD, PCCA, PCCB, PCK2, PCK1, PCLD, PCOS1, PCSK1, PDB1, PDCN, PDE6A, PDE6B, PDEF, PDGFB, PDGFR, PDGFRL, PDHA1, PDR, PDX1, PECAM1, PEE1, PE01, PEPD, PEX10, PEX12, PEX13, РЕХ3, РЕХ5, PEX6, PEX7, PEX1, PF4, PFBI, PFC, PFKFB1, PFKM, PGAM2, PGD, PGK1, PGK1P1, PGL2, PGR, PGS, PHA2A, PHB, PHEX, PHGDH, PHKA2, PHKA1, PHKB, PHKG2, PHP, PHYH, PI, PI3, PIGA, PIM1-KINASE, PIN1, PIP5K1B, PITX2, PITX3, PKD2, PKD3, PKD1, PKDTS, PKHD1, PKLR, PKP1, PKU1, PLA2G2A, PLA2G7, PLAT, PLEC1, PLG, PLI, PLOD, PLP1, PMEL17, PML, PML/RARα, PMM2, PMP22, PMS2, PMS1, PNKD, PNLIP, POF1, POLA, POLH, POMC, PON2, PON1, PORC, POTE, POU1F1, POU3F4, POU4F3, POU1F1, PPAC, PPARG, PPCD, PPGB, PPH1, PPKB, PPMX, PPOX, PPP1R3A, PPP2R2B, PPT1, PRAME, PRB, PRB3, PRCA1, PRCC, PRD, PRDX5/m, PRF1, PRG4, PRKAR1A, PRKCA, PRKDC, PRKWNK4, PRNP, PROC, PRODH, PROM1, PROP1, PROS1, PRST, PRP8, PRPF31, PRPF8, PRPH2, PRPS2, PRPS1, PRS, PRSS7, PRSS1, PRTN3, PRX, PSA, PSAP, PSCA, PSEN2, PSEN1, PSG1, PSGR, PSM, PSMA, PSORS1, PTC, PTCH, PTCH1, PTCH2, PTEN, PTGS1, PTH, PTHR1, PTLAH, PTOS1, PTPN12, PTPNI1, PTPRK, PTPRK/m, PTS, PUJO, PVR, PVRL1, PWCR, PXE, PXMP3, PXR1, PYGL, PYGM, QDPR, RAB27A, RAD54B, RAD54L, RAG2, RAGE, RAGE-1, RAG1, RAP1, RARA, RASA1, RBAF600/m, RB1, RBP4, RBP4, RBS, RCA1, RCAS1, RCCP2, RCD1, RCV1, RDH5, RDPA, RDS, RECQL2, RECQL3, RECQL4, REG1A, REHOBE, REN, RENBP, RENS1, RET, RFX5, RFXANK, RFXAP, RGR, RHAG, RHAMM/CD168, RHD, RHO, Rip-1, RLBP1, RLN2, RLN1, RLS, RMD1, RMRP, ROM1, ROR2, RP, RP1, RP14, RP17, RP2, RP6, RP9, RPD1, RPE65, RPGR, RPGRIP1, RP1, RP10, RPS19, RPS2, RPS4X, RPS4Y, RPS6KA3, RRAS2, RS1, RSN, RSS, RU1, RU2, RUNX2,RUNX1, RWS, RYR1, S-100, SAA1, SACS, SAG, SAGE, SALL1, SARDH, SART1, SART2, SART3, SAS, SAX1, SCA2, SCA4, SCA5, SCA7, SCA8, SCA1, SCC, SCCD, SCF, SCLC1, SCN1A, SCN1B, SCN4A, SCN5A, SCNN1A, SCNN1B, SCNN1G, SC02, SCP1, SCZD2, SCZD3, SCZD4, SCZD6, SCZD1, SDF-1α/β, SDHA, SDHD, SDYS, SEDL, SERPENA7, SERPINA3, SERPINA6, SERPINA1, SERPINC1, SERPIND1, SERPINE1, SERPINF2, SERPING1, SERPINI1, SFTPA1, SFTPB, SFTPC, SFTPD, SGCA, SGCB, SGCD, SGCE, SGM1, SGSH, SGY-1, SH2D1A, SHBG, SHFM2, SHFM3, SHFM1, SHH, SHOX, SI, SIAL, SIALYL LEWISX, SIASD, S11, SIM1, SIRT2/m, SIX3, SJS1, SKP2, SLC10A2, SLC12A1, SLC12A3, SLC17A5, SLC19A2, SLC22A1L, SLC22A5, SLC25A13, SLC25A15, SLC25A20, SLC25A4, SLC25A5, SLC25A6, SLC26A2, SLC26A3, SLC26A4, SLC2A1, SLC2A2, SLC2A4, SLC3A1, SLC4A1, SLC4A4, SLC5A1, SLC5A5, SLC6A2, SLC6A3, SLC6A4,SLC7A7, SLC7A9, SLC11A1, SLOS, SMA, SMAD1, SMAL, SMARCB1, SMAX2, SMCR, SMCY, SM1, SMN2, SMN1, SMPD1, SNCA, SNRPN, SOD2, SOD3, SOD1, SOS1, SOST, SOX9, SOX10, Sp17, SPANXC, SPG23, SPG3A, SPG4, SPG5A, SPG5B, SPG6, SPG7, SPINK1, SPINK5, SPPK, SPPM, SPSMA, SPTA1, SPTB, SPTLC1, SRC, SRD5A2, SRPX, SRS, SRY, βhCG, SSTR2, SSX1, SSX2 (HOM-MEL-40/SSX2), SSX4, ST8, STAMP-1, STAR, STARP1, STATH, STEAP, STK2, STK11, STn/KLH, STO, STOM, STS, SUOX, SURF1, сурвивина-2В, SYCP1, SYM1, SYN1, SYNS1, SYP, SYT/SSX, SYT-SSX-1, SYT-SSX-2, TA-90, TAAL6, TACSTD1, TACSTD2, TAG72, TAF7L, TAF1, TAGE, TAG-72, TALI, ТАМ, TAP2, TAP1, TAPVR1, TARC, TARP, TAT, TAZ, TBP, TBX22, ТВХ3, ТВХ5, TBXA2R, TBXAS1, TCAP, TCF2, TCF1, TCIRG1, TCL2, TCL4, TCL1A, TCN2, TCOF1, TCR, TCRA, TDD, TDFA, TDRD1, TECK, ТЕСТА, ТЕК, TEL/AML1, TELAB1, TEX15, TF, TFAP2B, TFE3, TFR2, TG, TGFA, TGF-β, TGFBI, TGFB1, TGFBR2, TGFBRE, TGFβ, TGFβRII, TGIF, TGM-4, TGM1, TH, THAS, THBD, THC, THC2, THM, THPO, THRA, THRB, TIMM8A, TIMP2, TIMP3, TIMP1, TITF1, TKCR, TKT, TLP, TLR1, TLR10, TLR2, TLR3, TLR4, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLX1, TM4SF1, TM4SF2, ТМС1, TMD, TMIP, TNDM, ФНО, TNFRSF11A, TNFRSF1A, TNFRSF6, TNFSF5, TNFSF6, ФНОα, ФНОβ, TNNI3, TNNT2, TOC, TOP2A, TOP1, TP53, TP63, ТРА, TPBG, TPI, TPI/m, TPI1, ТРМ3, ТРМ1, TPMT, TPO, TPS, TPTA, TRA, TRAG3, TRAPPC2, TRC8, TREH, TRG, TRH, TRIM32, TRIM37, TRP1, TRP2, TRP-2/6b, TRP-2/INT2, Trp-p8, TRPS1, TS, TSC2, TSC3, TSC1, TSG101, TSHB, TSHR, TSP-180, TST, TTGA2B, TTN, TTPA, TTR, TU M2-PK, TULP1, TWIST, TYH, TYR, TYROBP, TYROBP, TYRP1, TVS, UBE2A, UBE3A, UBE1, UCHL1, UFS, UGT1A, ULR, UMPK, UMPS, UOX, UPA, UQCRC1, URO5, UROD, UPK1B, UROS, USH2A, USH3A, USH1A, USH1C, USP9Y, UV24, VBCH, VCF, VDI, VDR, VEGF, VEGFR-2, VEGFR-1, VEGFR-2/FLK-1, VHL, VIM, VMD2, VMD1, VMGLOM, VNEZ, VNF, VP, VRNI, VWF, VWS, WAS, WBS2, WFS2, WFS1, WHCR, WHN, WISP3, WMS, WRN, WS2A, WS2B, WSN, WSS, WT2, WT3, WT1, WTS, WWS, XAGE, XDH, XIC, XIST, XK, XM, XPA, XPC, XRCC9, XS, ZAP70, ZFHX1B, ZFX, ZFY, ZIC2, ZIC3, ZNF145, ZNF261, ZNF35, ZNF41, ZNF6, ZNF198, ZWS1.
Белки терапевтического действия могут дополнительно быть выбраны из апоптических факторов или белков, связанных с апоптозом, включая AIF, Apaf например, Apaf-1, Apaf-2, Apaf-3 или АРО-2 (L), APO-3 (L), апопаин, Bad, Bak, Вах, Bcl-2, bci-xl, Bcl-xs, bik, CAD, калпаин, каспазу, например, каспазу-1, каспазу-2, каспазу-3, каспазу-4, каспазу-5, каспазу-6, каспазу-7, каспазу-8, каспазу-9, каспазу-10, каспазу-11, ced-3, ced-9, c-Jun, c-Myc, crm А, цитохром С, CdR1, DcR1, DD, DED, DISC, DNA-PKCS, DR3, DR4, DR5, FADD/MORT-1, FAK, Fas (Fas-лиганд CD95/fas (рецептор)), FLICE/MACH, FLIP, фодрин, fos, G-актин, Gas-2, гелзолин, гранзим А/В, ICAD, ICE, JNK, ламин А/В, MAP, MCL-1, Mdm-2, MEKK-1, MORT-1, NEDD, NF-каппаВ, NuMa, p53, PAK-2, PARP, перфорин, PITSLRE, РКСдельта, pRb, презенилин, prICE, RAIDD, Ras, RIP, сфингомиелиназу, тимидинкиназу от вируса herpes simplex, TRADD, TRAF2, TRAIL-R1, TRAIL-R2, TRAIL-R3, трансглутаминазу и т.д.
Белок терапевтического действия, который может кодироваться по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, также может быть адъювантным белком. В этом контексте адъювантным белком предпочтительно считают какой-либо белок, который может индуцировать врожденный иммунный ответ, указанный в настоящем изобретении выше. Предпочтительно такой врожденный иммунный ответ включает активирование рецептора, распознающего структуру, например, рецептора, выбранного из семейства Толл-подобных рецепторов (TLR), включая например, Толл-подобный рецептор, выбранный из рецепторов человека от TLR1 до TLR10 или из Толл-подобных рецепторов мыши от TLR1 до TLR13. Предпочтительно врожденный иммунный ответ стимулируют у млекопитающих согласно описанному выше. Более предпочтительно адъювантный белок выбирают из адъювантных белков человека или из патогенных адъювантных белков, в частности из патогенных адъювантных белков, в частности из бактериальных адъювантных белков. Кроме того, также могут быть использованы иРНК, кодирующие белки человека, участвующие в адъювантных проявлениях.
Адъювантные белки человека, которые могут кодироваться по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, обычно включают какой-либо белок человека, который может вызвать врожденный иммунный ответ (у млекопитающих), например, в виде реакции связывания экзогенного лиганда TLR с TLR. Более предпочтительно адъювантные белки человека, кодируемые по меньшей мере одной модифицированной (и)РНК иммуностимулирующей композиции по настоящему изобретению, выбраны из группы, состоящей из цитокинов, которые индуцируют или повышают врожденный иммунный ответ, включая ИЛ-2, ИЛ-12, ИЛ-15, ИЛ-18, ИЛ-21CCL21, GM-CSF и ФНО-альфа, но ими перечень не ограничивается; цитокинов, которые высвобождаются из макрофагов, включая ИЛ-1, ИЛ-6, ИЛ-8, ИЛ-12 и ФНО-альфа; из компонентов системы комплемента, включающих C1q, MBL, C1r, C1s, C2b, Bb, D, MASP-1, MASP-2, C4b, C3b, C5a, C3a, C4a, C5b, C6, C7, C8, C9, CR1, CR2, CR3, CR4, C1qR, C1INH, C4bp, MCP, DAF, H, I, P и CD59; из белков, которые являются компонентами сигнальной сети рецепторов распознавания структур, включая TLR и ИЛ-1R1, поскольку компоненты являются лигандами рецепторов распознавания структур, включая ИЛ-1 альфа, ИЛ-1 бета, бета-дефензин, белки теплового шока, например, HSP10, HSP60, HSP65, HSP70, HSP75 и HSP90, gp96, фибриноген, TypIII повтор внешнего домена А фибронектина; рецепторов, включая ИЛ-IRI, TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, TLR11; трансдукторов сигнала, включая компоненты сигнальной системы малых ГТФаз (RhoA, Ras, Rac1, Cdc42 и др.), компонентов сигнальной системы PIP (PI3K, Src-киназы и др.), компонентов MyD88-зависимой сигнальной системы (MyD88, IRAK1, IRAK2 и др.), компонентов MyD88-независимой сигнальной системы (TICAM1, TICAM2 и др.); активированных факторов транскрипции, включая, например, NF-кВ, c-Fos, c-Jun, c-Myc; и индуцированных генов-мишеней, включая, например, ИЛ-1 альфа, ИЛ-1 бета, бета-дефензин, ИЛ-6, ИФН гамма, ИФН альфа и ИФН бета; из совместно стимулируемых молекул, включая CD28 или CD40-лиганд или PD1; белковых доменов, включая LAMP; белков поверхности клеток; или адъювантных белков человека, включая CD80, CD81, CD86, trif, flt-3 лиганда, тимопентина, Gp96 или фибронектина и др., или какого-либо специфического гомолога какого-либо из указанных выше адъювантных белков человека.
Патогенные адъювантные белки, которые могут кодироваться по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, обычно включают какой-либо патогенный (адъювантный) белок, который может индуцировать врожденный иммунный ответ (у млекопитающего), более предпочтительно выбранный из патогенных (адъювантных) белков, производных от бактерий, простейших, вирусов или грибов, животных и др., и еще более предпочтительно из патогенных адъювантных белков, выбранных из группы, состоящей, но ими не ограниченной, из бактериальных белков, белков простейших (например, подобного профилину белка Toxoplasma gondii), вирусных белков или гибных белков, белков животных и др.
В этом контексте бактериальные (адъювантные) белки, которые могут кодироваться по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, могут включать какой-либо бактериальный белок, который может индуцировать врожденный иммунный ответ (предпочтительно у млекопитающих) или проявляет свойства адъюванта. Более предпочтительно такие бактериальные (адъювантные) белки выбирают из группы, состоящей из белков теплового шока или шаперонов, включая Hsp60, Hsp70, Hsp90, Hsp100; OmpA (Outer membrane - внешний мембранный белок) из грамотрицательных бактерий; бактериальных поринов, включая OmpF; бактериальных токсинов, включая токсин коклюша (pertussis toxin - PT) из Bordetella pertussis, токсина аденилатциклаз СуаА и СуаС из Bordetella pertussis, PT-9K/129G мутанта токсина коклюша, токсина столбняка, холерного токсина (cholera toxin - СТ), В-субъединицы холерного токсина, СТК.63 мутанта холерного токсина, мутанта СТЕ112К от СТ, термолабильного энтеротоксина Escherichia coli (heat-labile enterotoxin - LT), B-субъединицы термолабильного энтеротоксина (LTB) Escherichia coli, термолабильных мутантных энтеротоксинов с пониженной токсичностью, включая LTK63, LTR72; растворимого в феноле модулина; нейтрофил-активирующего белка (HP-NAP) из Helicobacter pylori; поверхностно-активного белка D; белка-липопротеина А внешней мембраны из Borrelia burgdorferi, Ag38 (антиген массой 38 кДа) из Mycobacterium tuberculosis; белков из бактериальных фимбрий; энтеротоксина СТ из Vibrio cholerae, пилина из пилей грамотрицательных бактерий и поверхностно-активного белка А; и др. или какого-либо видового гомолога какого-либо указанного выше бактериального (адъювантного) белка.
Бактериальные (адъювантные) белки, которые могут кодироваться по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, могут быть выбраны из бактериальных адъювантных белков, еще более предпочтительно могут быть выбраны из группы, состоящей из бактериальных флагеллинов, но ими перечень не ограничивается, включая флагеллины от организмов, включая Agrobacterium, Aquifex, Azospirillum, Bacillus, Bartonella, Bordetella, Borrelia, Burkholderia, Campylobacter, Caulobacte, Clostridium, Escherichia, Helicobacter, Lachnospiraceae, Legionella, Listeria, Proteus, Pseudomonas, Rhizobium, Rhodobacter, Roseburia, Salmonella, Serpulina, Serratia, Shigella, Treponema, Vibrio, Wolinella, Yersinia, более предпочтительно флагеллины от видов, но ими перечень не ограничивается, Agrobacterium tumefaciens, Aquifex pyrophilus, Azospirillum brasilense, Bacillus subtilis. Bacillus thuringiensis, Bartonella bacilliformis, Bordetella bronchiseptica, Borrelia burgdorferi, Burkholderia cepacia, Campylobacter jejuni, Caulobacter crescentus, Clostridium botulinum штамм Bennett клон 1, Escherichia coli, Helicobacter pylori, Lachnospiraceae bacterium, Legionella pneumophila, Listeria monocytogenes, Proteus mirabilis, Pseudomonas aeroguinosa, Hceeoomonas syringae, Rhizobium meliloti, Rhodobacter sphaeroides, Roseburia cecicola, Roseburis hominis, Salmonella typhimurium. Salmonella bongori, Salmonella typhi, Salmonella enteritidis, Serpulina hyodysenteriae, Serratia marcescens, Shigella boydii, Treponema phagedenis. Vibrio alginolyticus. Vibrio cholerae. Vibrio parahaemolyticus, Wolinella succinogenes и Yersinia enterocolitica, но ими перечень не ограничивается.
Бактериальные флагеллины, которые могут кодироваться по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, еще более предпочтительно включают последовательность, выбранную из группы, включающей какую-либо из следующих последовательностей, обозначенных соответствующими номерами в каталоге:
Белки простейших, которые могут также кодироваться по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, могут быть выбраны в виде какого-либо белка простейших, проявляющего адъювантный характер, более предпочтительно из группы, состоящей, но ими не ограничивающейся, из Тс52 из Trypanosoma cruzi, PFTG из Trypanosoma gondii, белков теплового шока простейших, LeIF из Leishmania spp., белка типа профилина из Toxoplasma gondii и др.
Вирусные белки, которые могут кодироваться по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, могут быть выбраны из какого-либо вирусного белка, проявляющего адъювантные свойства, более предпочтительно из группы, состоящей из гибридного гликопротеина (F-белка) респираторно-синцитиального вируса, белка оболочки вируса ММТ, белка вируса лейкоза мышей, белка гемагглютинина вируса кори дикого типа и др., но ими перечень не ограничивается.
Грибные белки, которые могут кодироваться по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, может быть выбран из какого-либо грибного белка, проявляющего адъювантные свойства, более предпочтительно из группы, состоящей из грибных иммуномодулирующих белков (fungal immunomodulatory protein - FIP; LZ-8) и др., но ими перечень не ограничивается.
В итоге патогенные адъювантные белки, которые могут кодироваться по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, могут быть выбраны из каких-либо патогенных белков, проявляющих адъювантное свойство, более предпочтительно из группы, состоящей из гемоцианина моллюска блюдечка (Keyhole limpet hemocyanin - KLH), OspA и др.
б) Антигены
По меньшей мере одна (и)РНК адъювантного компонента иммуностимулирующей композиции в другом варианте может кодировать антиген. В настоящем изобретении понятие «антиген» относится к веществу, которое распознается иммунной системой и может индуцировать специфический в отношении антигена иммунный ответ, например, путем формирования антител в качестве части адаптивного иммунного ответа или антиген-специфических Т-клеток. В этом контексте первая стадия адаптивного иммунного ответа представляет активирование не подвергшихся какому-либо воздействию антиген-специфических Т-клеток антиген-презентирующими клетками. Это происходит в лимфоидной ткани и в органах, сквозь которые не подвергшиеся какому-либо воздействию Т-клетки постоянно проходят. К клеткам трех типов, способных выступать в качества антиген-презентирующих клеток, относятся дендровидные клетки, макрофаги и В-клетки. Клетки каждого из этих типов имеют отличную функция в индукции иммунного ответа. Тканевые дендровидные клетки захватывают антигены путем фагоцитоза и макропиноцитоза и стимулируются инфекцией к миграции в локальную лимфоидную ткань, где они дифференцируют в зрелые дендровидные клетки. Макрофаги поглощают корпускулярные антигены, например, бактерии, и индуцируются инфекционными агентами к экспрессии молекул II класса главного комплекса гистосовместимости (ГКГ). Уникальная способность В-клеток связывать и интернализировать растворимые пептидные антигены через их рецепторы может быть важна для индукции Т-клеток. Путем представления антигена на молекулах ГКГ происходит активирование Т-клеток, которые индуцируют их пролиферацию и дифференциацию в вооруженные эффекторные Т-клетки. Наиболее важная функция эффекторных Т-клеток заключается в уничтожении инфицированных клеток цитотоксическими Т-клетками CD8 и активирование макрофагов клетками ТН1, которые вместе создают опосредованный клетками иммунитет, и активирование В-клеток клетками обоих типов, ТН2 и ТН1, для получения разных классов антител, таким образом стимулируя гуморальный иммунный ответ. Т-клетки распознают антиген с помощью рецепторов Т-клеток, которые не распознают и не связывают антиген непосредственно, но вместо этого распознают короткие пептидные фрагменты, например, патогенных белковых антигенов, которые связываются с молекулами ГКГ на поверхности других клеток.
Т-клетки относятся к двум большим классам с разными эффекторными функциями. Два класса различаются экспрессией белков CD4 и CD8 на поверхности клеток. Эти два типа Т-клеток отличаются по классу молекул ГКГ, которые они распознают. Существует два класса молекул ГКГ класса I и класса II, которые отличаются по структуре и экспрессии по тканям организма. CD4 Т-клетки связываются с молекулами класса II ГКГ и CD8 Т-клетки связываются с молекулами класса I ГКГ. Класс I ГКГ и класс II ГКГ отличаются по распределению среди клеток, что отражает разные эффекторные функции Т-клеток, которые их распознают. Молекулы I класса ГКГ презентируют пептиды от патогенов, обычно вирусов, на CD8 Т-клетках, которые дифференцируют в цитотоксические Т-клетки, специализирующиеся на уничтожении каких-либо клеток, которые они специфически распознают. Почти все клетки экспрессируют молекулы I класса ГКГ, хотя уровень конститутивной экспрессии варьирует от одного типа клеток к другому. Однако не только патогенные пептиды от вирусов презентированы молекулами I класса ГКГ, ими также презентируются аутоантигены, например, опухолевые антигены. Молекулы I класса связывают пептиды от белков, разрушенных в цитозоле и транспортированных в эндоплазматическую сеть. Таким образом, молекулы I класса ГКГ на поверхности клеток, инфицированных вирусами или другими цитозольными патогенными, представляют пептиды от этих патогенов. CD8 Т-клетки, которые распознают комплексы класс I ГКГ:пептид, специализируются на уничтожении каких-либо клеток, проявляющих чужеродные пептиды и таким образом освобождают организм от инфицированных вирусами и другими цитозольными патогенами клеток. Основная функция CD4 Т-клеток (CD4 хэлперные Т-клетки), которые распознают молекулы II класса ГКГ, заключается в активировании других эффекторных клеток иммунной системы. Таким образом, молекулы II класса ГКГ в норме обнаруживаются на В-лимфоцитах, дендрических клетках и макрофагах-клетках, которые участвуют в иммунном ответе, но не на других тканевых клетках. Макрофаги, например, активируются для уничтожения патогенов внутри везикул, которые они несут, а В-клетки для секреции иммуноглобулинов против чужеродных молекул. Молекулы II класса ГКГ предохранены от связывания с пептидами в эндоплазматической сети, и таким образом молекулы II класса ГКГ связывают пептиды от белков, которые разрушаются в эндосомах. Они могут захватывать пептиды от патогенов, которые проникли в везикулярную систему макрофагов, или от антигенов, интернализированных незрелыми дендровидными клетками, или иммуноглобулиновые рецепторы В-клеток. Патогены, которые накапливаются в большом количестве внутри макрофагов и в везикулах дендровидных клеток, проявляют тенденцию к стимуляции дифференциации клеток ТН1, а внеклеточные антигены проявляют тенденцию к стимуляции выработки клеток ТН2. Клетки ТН1 активируют бактерицидные свойства макрофагов и индуцируют В-клетки к выработке антител IgG, которые весьма эффективны в опсонизации внеклеточных патогенов для разрушения фагоцитными клетками, а клетки ТН2 инициируют гуморальный ответ путем активирования не подвергшиеся воздействию В-клетки к секреции IgM и индуцируют выработку слабо опсонизированных антител, например, IgG1 и IgG3 (мыши), IgG2 и IgG4 (человека), а также и IgA, и IgE (мыши и человека).
В контексте настоящего изобретения антигены, кодируемые по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению обычно включают какой-либо антиген, соответствующий указанному выше определению, более предпочтительно белковые и пептидные антигены, например, опухолевые антигены, аллергические антигены, аутоиммунные аутоантигены, патогенные антигены и др. В соответствии с настоящим изобретением антигены, кодируемые по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, могут быть антигенами, выработанными вне клетки, наиболее часто антигенами, непроизводными от самого организма-хозяина (например, человека) (т.е. антигены не являются аутоантигенами), но предпочтительнее производными от клеток-хозяев вне организма-хозяина, например, вирусными антигенами, бактериальными антигенами, грибными антигенами, протозойными антигенами, антигенами животных (предпочтительно выбранными от животных или организмов, описанных в настоящем изобретении), аллергическими антигенами и др. Аллергические антигены обычно являются антигенами, которые вызывают аллергию у людей и могут быть производными или от человека, или от других источников. Антигены, кодируемые по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, кроме того могут быть антигенами, выработанными внутри клеток, ткани или организма, например, путем секреции белков, в результате разрушения белков и др. Такие антигены включают антигены, производные от самого организма-хозяина (например, человека), например, опухолевые антиген или аутоантигены, например, аутоиммунные антигены и т.д., а также антигены, не являющиеся аутоиммунными, подобные описанным выше, которые первоначально сформировались в качестве производных от клеток-хозяев вне организма хозяина, но которые фрагментированы или разрушены внутри организма, ткани или клетки, например, за счет (протеазного) разрушения, метаболизма и др. Патогенные антигены в частности включают, например, антигены вируса гриппа, включая гемагглютинин (ГА), нейроамидазу (NA), матриксный белок 1 (M1), белок ионного канала М2 (М2), нуклеопротеин (NP) и др.; или например, антигены респираторно-синцитиального вируса (respiratory syncytial virus - RSV), включая F-протеин, G-протеин и др.
Антигены, подобные кодируемым по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, могут кроме того включать фрагменты таких антигенов, подобных указанным выше, особенно белковых или пептидных антигенов. Фрагменты таких антигенов в данном контексте настоящего изобретения могут включать фрагменты, предпочтительно длиной примерно от 6 до примерно 20 или даже более аминокислот, например, фрагменты, подобные процессированным и презентированным молекулами первого класса ГКГ, предпочтительно длиной примерно от 8 до примерно 10 аминокислот, например, 8, 9 или 10 (или даже 11 или 12 аминокислот), или фрагменты, подобные процессированным и презентированным молекулами второго класса ГКГ, предпочтительно длиной примерно 13 или более аминокислот, например, 13, 14, 15, 16, 17, 18, 19, 20 или даже более аминокислот, причем эти фрагменты могут быть выбраны из какой-либо части аминокислотной последовательности. Такие фрагменты обычно распознаются Т-клетками в форме комплекса, состоящего из пептидного фрагмента и молекулы ГКГ, т.е. фрагменты обычно не распознаются в их исходной форме.
Фрагменты антигенов, подобные описанным выше, в контексте настоящего изобретения также могут включать эпитопы таких антигенов. Эпитопами (которые также называют «антигенными детерминантами») обычно являются фрагменты, локализованные на внешней поверхности белка (не подвергшегося какому-либо воздействию), или пептидные антигены, подобные описанным выше, предпочтительно имеющие 5-15 аминокислот, более предпочтительно имеющие 5-12 аминокислот, еще более предпочтительно имеющие 6-9 аминокислот, которые могут распознаваться антителами, т.е. в их исходной форме.
Один класс антигенов, которые кодируются, по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, включает опухолевые антигены. «Опухолевые антигены» предпочтительно локализованы на поверхности (опухолевых) клеток). Опухолевые антигены также могут быть выбраны из белков, которые сверхэкспрессируются в опухолевых клетках в отличие от нормальных клеток. Кроме того, к опухолевым антигенам также относятся антигены, экспрессированные в клетках, которые сами по себе (или не сами по себе) не являются переродившимися, но ассоциированы с предполагаемой опухолью. Антигены, которые связаны с сосудами, снабжающими кровью опухоль, или с формированием (переформированием) этих сосудов, особенно те антигены, которые ассоциированы с неоваскуляризацией, например, факторы роста, например, VEGF, bFGF и др., также относятся к этому понятию. Антигены, связанные с опухолью, кроме того, включают антигены из клеток или тканей, обычно погруженных в опухоль. Кроме того, некоторые вещества (обычно белки или пептиды) экспрессируются у пациентов (о которых заведомо известно или неизвестно наличие ракового заболевания) и содержатся в повышенной концентрации в тканевых жидкостях указанных пациентов. Эти вещества также называются «опухолевыми антигенами», однако они не являются антигенами в строгом значении этого термина, т.е. веществами, индуцирующими иммунный ответ. Класс опухолевых антигенов может быть дополнительно поделен на опухоль-специфичные антигены (tumor-specific antigens - TSA) и опухоль-ассоциированные антигены (tumor-associated-antigens - ТАА). TSA могут быть презентированы только опухолевыми клетками и никогда не презентируются нормальными «здоровыми» клетками. Они обычно возникают от специфической для опухоли мутации. Антигены ТАА, которые больше распространены, обычно присутствуют и на опухолевых, и на здоровых клетках. Эти антигены распознаются и антиген-презентирующие клетки могут разрушаться цитотоксическими Т-клетками. Дополнительно опухолевые антигены могут быть на поверхности опухоли в форме, например, мутантного рецептора. В этом случае они могут распознаваться антителами.
Примеры опухолевых антигенов, кодируемых по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, показаны ниже в табл.1 и 2. Эти таблицы показывают специфические (белковые) антигены (т.е. «опухолевые антигены»), связанные с раковыми заболеваниями. В настоящем изобретении понятия «раковые заболевания» и «опухолевые заболевания» используют в качестве синонимов.
В предпочтительном варианте осуществления настоящего изобретения опухолевые антигены, кодируемые по меньшей мере одной (и)РНК адъювантного компонента разработанной в настоящем изобретении иммуностимулирующей композиции, выбраны из группы, состоящей из 5Т4, 707-АР, 9D7, AFP, AlbZIP HPG1, альфа-5-бета-1-интегрина, альфа-5-бета-6-интегрина, альфа-актинина-4/m, альфа-метилацил-коэнзим А рацемазы, ART-4, ARTC1/m, B7H4, BAGE-1, BCL-2, bcr/abl, бета-катенина/m, BING-4, BRCA1/m, BRCA2/m, CA 15-3/CA 27-29, CA 19-9, CA72-4, CA125, калретикулина, CAMEL, CASP-8/m, катепсина В, катепсина L, CD19, CD20, CD22, CD25, CDE30, CD33, CD4, CD52, CD55, CD56, CD80, CDC27/m, CDK4/m, CDKN2A/m, CEA, CLCA2, CML28, CML66, COA-1/m, коастозин-подобного белка, коллагена XXIII, COX-2, CT-9/BRD6, Cten, циклина B1, циклина D1, cyp-B, CYPB1, DAM-10, DAM-6, DEK-CAN, EFTUD2/m, EGFR, ELF2/m, EMMPRIN, EpCam, EphA2, EphA3, ErbB3, ETV6-AML1, EZH2, FGF-5, FN, Frau-1, G250, GAGE-1, GAGE-2, GAGE-3, GAGE-4, GAGE-5, GAGE-6, GAGE7b, GAGE-8, GDEP, GnT-V, gp100, GPC3, GPNMB/m, HAGE, HAST-2, гепсин, Her2/neu, HERV-K-MEL, HLA-A*0201-R17I, HLA-A11/m, HLA-A2/m, HNE, гомеобокса NKX 3.1, HOM-TES-14/SCP-1, HOM-TES-85, HPV-E6, HPV-E7, HSP70-2M, HST-2, hTERT, iCE, IGF-1R, ИЛ-13Ra2, ИЛ-2R, ИЛ-5, незрелого ламининового рецептора, калликреина-2, калликреина-4, Ki67, KIAA0205, KIAA0205/m, KK-LC-1, K-Ras/m, LAGE-A1, LDLR-FUT, MAGE-A1, MAGE-A2, MAGE-A3, MAGE-A4, MAGE-A6, MAGE-A9, MAGE-A10, MAGE-A12, MAGE-B1, MAGE-B2, MAGE-B3, MAGE-B4, MAGE-B5, MAGE-B6, MAGE-B10, MAGE-B16, MAGE-B17, MAGE-C1, MAGE-C2, MAGE-C3, MAGE-D1, MAGE-D2, MAGE-D4, MAGE-E1, MAGE-E2, MAGE-F1, MAGE-H1, MAGEL2, маммаглобина А, MART-1/мелан-А, MART-2, MART-2/m, матриксного белка 22, MC1R, M-CSF, ME1/m, мезотелина, MG50/PXDN, ММР11, MN/CA IX-антигена, MRP-3, MUC-1, MUC-2, MUM-l/m, MUM-2/m, MUM-3/m, миозина класса I/m, NA88-A, N-ацетилглюкозаминилтрансферазы-V, Neo-PAP, Neo-PAP/m, NFYC/m, NGEP, NMP22, NPM/ALK, N-Ras/m, NSE, NY-ESO-1, NY-ESO-B, OA1, OFA-iLRP, OGT, OGT/m, OS-9, OS-9/m, остеокальцина, остеопонтина, p15, p190 minor bcr-abl, p53, p53/m, PAGE-4, PAI-1, PAI-2, PART-1, PATE, PDEF, Pim-1-киназы, Pin-1, Pm1/РАRальфа, РОТЕ, PRAME, PRDX5/m, простеин, протеиназы-3, PSA, PSCA, PSGR, PSM, PSMA, PTPRK/m, RAGE-1, RBAF600/m, RHAMM/CD168, RU1, RU2, S-100, SAGE, SART-1, SART-2, SART-3, SCC, SIRT2/m, Sp17, SSX-1, SSX-2/HOM-MEL-40, SSX-4, STAMP-1, STEAP, сурвивина, сурвивина-2В, SYT-SSX-1, SYT-SSX-2, TA-90, TAG-72, TARP, TEL-AML1, ТСFбета, ТGFбетаRII, TGM-4, TPI/m, TRAG-3, TRG, TRP-1, TRP-2/6b, TRP/INT2, TRP-p8, тирозиназы, UPA, VEGF, VEGFR-2/FLK-1 и WT1.
В особенно предпочтительном варианте осуществления настоящего изобретения опухолевые антигены, которые кодируются по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, выбраны из группы, включающей MAGE-A1 (например, MAGE-A1, соответствующий номеру М77481), MAGE-A2, MAGE-АЗ, MAGE-A6 (например, MAGE-A6, соответствующий номеру NM_005363), MAGE-C1, MAGE-C2, мелан-А (например, мелан-А, соответствующий номеру NM_005511), GP100 (например, GP100, соответствующий номеру М77348), тирозиназу (например, тирозиназа, соответствующая номеру NM_000372), сурвивин (например, сурвивин, соответствующий номеру AF077350), СЕА (например, СЕА, соответствующий номеру NM_004363), Her-2/neu (например, Her-2/neu, соответствующий номеру M11730), WT1 (например, WT1, соответствующий номеру NM_000378), PRAME (например, PRAME, соответствующий номеру NM_006115), EGFRI (рецептор 1 эпидермального фактора роста) (например, EGFRI (рецептор 1 эпидермального фактора роста), соответствующий номеру AF288738), MUC1, муцин-1 (например, муцин-1, соответствующий номеру NM_002456), SEC61G (например, SEC61G, соответствующий номеру NM_014302), hTERT (например, hTERT, соответствующий номеру NM_198253), 5Т4 (например, 5Т4, соответствующий номеру NM_006670), NY-Eso-1 (например, NY-Eso1, соответствующий номеру NM_001327), TRP-2 (например, TRP-2, соответствующий номеру NM_001922), STEAP, PCA, PSA, PSMA и др.
В еще одном из предпочтительных вариантов осуществления настоящего изобретения опухолевые антигены, кодируемые по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, могут формировать смесь антигенов, например, в действующей (иммуностимулирующей) композиции или в наборе частей (в котором предпочтительно каждый антиген содержится в отдельной части набора), предпочтительно для индукции (адаптивного) иммунного ответа для лечения рака простаты, предпочтительно неоадъювант- и/или гормон-невосприимчивых форм рака простаты и близких заболеваний или расстройств. Для этого по меньшей мере одна (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению предпочтительно представляет по меньшей мере одну РНК, более предпочтительно по меньшей мере одну иРНК, которая может кодировать по меньшей мере один, предпочтительно два, три или даже четыре (предпочтительно разных) антигена из следующих групп антигенов:
PSA (Prostate-Specific Antigen - простатический специфический антиген) = KLK3 (калликреин-3),
PSMA (Prostate-Specific Membrane Antigen - простатический специфический мембранный антиген),
PSCA (Prostate Stem Cell Antigen - антиген стволовых клеток простаты),
STEAP (шестой трансмембранный эпителиальный антиген простаты).
В другом предпочтительном варианте осуществления настоящего изобретения опухолевые антигены, кодируемые по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, могут формировать смесь антигенов, например, в действующей (иммуностимулирующей) композиции или в наборе частей (в котором предпочтительно каждый антиген содержится в одной части набора), предпочтительно для индукции (адаптивного) иммунного ответа для лечения немелкоклеточного рака легких (НМРЛ), предпочтительно выбранного из трех подтипов плоскоклеточного рака легких: аденокарциномы, крупноклеточного рака легких или связанных с ними расстройств. Для этой цели по меньшей мере одна (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению предпочтительно является по меньшей мере одной иРНК, которая может кодировать по меньшей мере один, предпочтительно два, три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать или двенадцать (предпочтительно разных) антигенов из следующих групп антигенов:
hTERT,
pWT1,
MAGE-A2,
5Т4,
MAGE-A3,
MUC1,
Her-2/neu,
NY-ESO-1,
pCEA,
сурвивин,
MAGE-C1 и/или
MAGE-C2,
причем возможна какая-либо комбинация этих антигенов.
В одном из предпочтительных вариантов осуществления настоящего изобретения опухолевые антигены, кодируемые по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, могут формировать смесь антигенов, например, в действующей (иммуностимулирующей) композиции или наборе частей (в котором предпочтительно каждый антиген содержится в отдельной части набора), предпочтительно для индукции (адаптивного) иммунного ответа для лечения немелкоклеточного рака легких (НМРЛ), предпочтительно выбранного из трех основных подтипов плоскоклеточного рака легких: аденокарциномы, крупноклеточного рака легких или связанных с ними расстройств. Для этого по меньшей мере одна (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению предпочтительно представляет по меньшей мере одну РНК, более предпочтительно по меньшей мере одну иРНК, которая может кодировать по меньшей мере два (предпочтительно разных) антигена:
а) причем по меньшей мере один, предпочтительно по меньшей мере два, три, четыре, пять или даже шесть из них, по меньшей мере два антигена выбраны из:
5Т4
NY-ESO-1,
MAGE-A2,
MAGE-A3,
MAGE-C1 и/или
MAGE-C2, и
б) причем дополнительный антиген (антигены) выбран (выбраны) по меньшей мере из одного антигена, описанного в настоящем изобретении, предпочтительно в какой-либо указанной в настоящем изобретении комбинации, группы или подгруппы антигенов, например, дополнительный антиген (антигены) выбран (выбраны), например, из:
hTERT,
WT1,
MAGE-A2,
5Т4,
MAGE-A3,
MUC1,
Her-2/neu,
NY-ESO-1,
СЕА,
сурвивина,
MAGE-C1 и/или
MAGE-C2.
В указанных выше вариантах осуществления настоящего изобретения каждый из описанных выше белков, например, белков терапевтического действия, антител, антигенов и др., описанных в настоящем изобретении, может быть кодирован одной (моноцистронной) РНК, предпочтительно одной (моноцистронной) иРНК. Иначе говоря, по меньшей мере одна (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению может включать по меньшей мере две (моноцистронных) РНК, предпочтительно иРНК, причем каждая из которых по меньшей мере двух (моноцистонных) РНК, предпочтительно иРНК, может кодировать, например, только один (предпочтительно отличный) белок, например, антиген, предпочтительно выбранный из одной из указанных выше комбинаций антигенов.
В другом предпочтительном варианте осуществления настоящего изобретения по меньшей мере одна (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению может включать (по меньшей мере) одну двух- или даже полицистронную РНК, предпочтительно иРНК, т.е. (по меньшей мере) одну РНК, которая несет, например, две или даже более кодирующих последовательностей по меньшей мере двух (предпочтительно отличных) белков, например антигенов, предпочтительно выбранных из одной из указанных выше комбинаций антигенов. Такие кодирующие последовательности, например, по меньшей мере двух (предпочтительно разных) белков, например, антигенов, (по меньшей мере) одной двух- или даже полицистронной РНК могут быть разделены по меньшей мере одной последовательностью IRES (internal ribosomal entry site - внутренний сайт посадки рибосомы), согласно описанному выше. Таким образом, понятие «кодирующая по меньшей мере два (предпочтительно разных) белка» может означать, но этим не ограничивается, что (по меньшей мере) одна (двух- или даже полицистронная) РНК, предпочтительно иРНК, может кодировать, например, по меньшей мере два, три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать или двенадцать или более (предпочтительно разных) белков, например, антигенов указанных выше групп (группы) антигенов, или их фрагментов или вариантов, белков терапевтического действия, антител, адъювантных белков и др. Более предпочтительно, но ими перечень не ограничивается, (по меньшей мере) одна (двух- или даже полицистронная) РНК, предпочтительно иРНК, может кодировать, например, по меньшей мере, два, три, четыре, пять или шесть или более (предпочтительно разных) белков, например, антигенов-представителей указанных выше подгрупп (подгруппы) антигенов, или их фрагментов или вариантов в рамках указанных выше определений. В этом контексте так называемая последовательность IRES (internal ribosomal entry site - внутренний сайт посадки рибосомы), определение которой приводится в настоящем определении, может функционировать в качестве единственного сайта связывания рибосомы, но она может также служить для обеспечения двух- или даже полицистронной РНК, описанной в настоящем изобретении, которая кодирует несколько белков, которые транслируют рибосомами независимо друг от друга. К примерам последовательностей IRES, которые могут использоваться в настоящем изобретении, относятся те последовательности, которые происходят от пикорнавирусов (например, FMDV), пестивирусов (CFFV), полиовирусов (PV), вирусов энцефаломиокардита (ECMV), вирусов ящура (FMDV), вирусов гепатита С (HCV), вируса классической чумы свиней (classical swine fever viruses - CSFV), вируса лейкоза мышей (MLV), вируса иммунодефицита обезьян (SIV) или вируса паралича сверчка (cricket paralysis viruses - иСrРV).
В еще одном предпочтительном варианте осуществления настоящего изобретения по меньшей мере одна (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению может включать смесь по меньшей мере одной моноцистронной РНК, предпочтительно иРНК, описанной в настоящем изобретении, и по меньшей мере одной двух- или даже полицистронной РНК, предпочтительно иРНК, согласно описанному в настоящем изобретении. По меньшей мере одна моноцистронная РНК и/или по меньшей мере одна двух- или даже полицистронная РНК предпочтительно кодируют разные белки, например, антигены, или их фрагменты, или их варианты, антигены предпочтительно выбирают из одной из указанных выше групп или подгрупп антигенов, более предпочтительно в одной из указанных выше комбинаций. Однако меньшей мере одна моноцистронная РНК и по меньшей мере одна двух- или даже полицистронная РНК также может предпочтительно кодировать (частично) идентичные белки, описанные в настоящем изобретении, например, антигены, выбранные из одной из указанных выше групп или подгрупп антигенов, предпочтительно в одной из указанных выше комбинаций, при условии, что по меньшей мере одна (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению в целом предусматривает по меньшей мере два (предпочтительно разных) белка, например, антигена, согласно описанному в настоящем изобретении. Такой вариант осуществления настоящего изобретения может быть благоприятным, например, для ступенчатого, например, зависящего от времени, введения одной или нескольких, по меньшей мере одной, (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, например, в качестве фармацевтической композиции, пациенту, нуждающемуся в этом. Компоненты такой фармацевтической композиции по настоящему изобретению, особенно разных объединенных РНК, кодирующих по меньшей мере два (предпочтительно разных) белка, могут быть, например, содержащимися (в виде разных частей) в наборе частей композиций или могут быть, например, введенными раздельно в качестве компонентов разных фармацевтических композиций по настоящему изобретению.
Еще один класс антигенов, которые кодируются по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, включает аллергические антигены. Такие аллергические антигены могут быть выбраны из антигенов, производных от разных источников, например, от животных, растений, грибов, бактерий и др. В этом контексте к аллергенам относятся, например, травы, пыльца, плесени, лекарственные средства или многочисленные индуцирующие фактора внешней среды и т.д. Аллергические антигены обычно принадлежат к разным классам соединений, например, нуклеиновым кислотам и их фрагментам, белкам или пептидам и их фрагментам, углеводам, полисахаридам, сахарам, липидам, фосфолипидам и т.д. Особый интерес в контексте настоящего изобретения имеют антигены, которые кодируются по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, т.е. белковые и пептидные антигены и их фрагменты или эпитопы, или нуклеиновые кислоты и их фрагменты, особенно нуклеиновые кислоты и их фрагменты, кодирующие такие белковые или пептидные антигены и их фрагменты или эпитопы.
Особенно предпочтительны антигены, производные от животных, кодируемые по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, к которым относятся антигены, но ими перечень не ограничивается, производные от насекомых, клещей (например, домашних пылевых клещей), комаров, пчел (например, медоносных пчел, шмелей), тараканов, иксодовых клещей, моли (например, шелкопряда), мошек, клопов, блох, ос, гусениц, плодовых мушек, мигрирующей саранчи, прямокрылых насекомых, тлей муравьев-соолдатов, от ракообразных, например, мелких ракообразных, крабов, криля, лобстеров, креветок, речных раков, крупных креветок, от птиц, например, уток, гусей, чаек, индюков, страусов, кур, от рыб, например, угрей, сельдей, карпов, морских карасей, трески, палтуса, сома, белуги, лосося, камбалы, скумбрии, каракатицы, окуня, от моллюсков, например, гребешка, осьминога, галиотиса, улиток, брюхоногих моллюсков, кальмара, двустворчатого моллюска, мидий, от пауков, от млекопитающих, например, коров, кроликов, овец, львов, ягуаров, леопардов, крыс, свиней, буйволов, собак, лемуров, хомяков, морских свинок, ланей, лошадей, кошек, мышей, оцелотов, сервалов, от членистоногих, например, пауков или чешуйниц, от червей, например, нематод, от видов трихинелл или круглых червей, от амфибий, например, от лягушек, или от морских горбылей и т.д.
К антигенам, производным от растений, которые кодируются по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, могут относиться, но ими перечень не ограничивается, антигены, производные от фруктов, например, от киви, ананасов, джекфрутов, папай, лимонов, апельсинов, мандаринов, дынь, хурмы, земляники, личи, яблок, вишнеплодных яблок, манго, маракуй, слив, абрикосов, нектарин, персиков, пассифлор, малины, винограда, от овощей, например, чеснока, лука, лука-порея, соевых бобов, сельдерея, цветной капусты, репы, красного перца, турецкого гороха, фенхеля, цукини, огурцов, моркови, ямса, бобов, гороха, оливок, помидоров, картофеля, чечевицы, салата-латука, авокадо, петрушки, хрена, черимои, свеклы, тыквы, шпината, от некоторых видов, например, горчицы, кориандра, шафрана, перца, аниса, от некоторых культур, например, овса, гречки, ячменя, риса, пшеницы, кукурузы, рапса, кунжута, от орехов, например, кешью, грецкого ореха, калифорнийского ореха, фисташек, миндаля, фундука, арахиса, бразильского ореха, пекана, каштана, от деревьев, например, ольхи, граба, кедра, березы, лещины, бука, ясеня, бирючины, дуба, чинары, кипариса, пальмы, от цветов, например, амброзии, гвоздики, форзиции, подсолнечника, люпина, ромашки, лилий, пассифлоры, от трав, например, пырея, полевицы, костра, бермудской травы, душистого колоска, плевела, или от других растений, например, снотворного мака, постенницы, подорожника ланцетовидного, табака, аспарагуса, полыни, кресс-салат и др.
Антигены, производные от грибов, которые кодируются по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, могут включать антигены, производные, например, от Alternia sp., Aspergillus sp., Beauveria sp., Candida sp., Cladosporium sp., Endothia sp., Curcularia sp., Embellisia sp., Epicoccum sp., Fusarium sp., Malassezia sp., Penicillum sp., Pleospora sp., Saccharomyces sp.и др., но ими перечень не ограничивается.
Антигены, производные от бактерий, которые кодируются по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, могут включать антигены, производные, например, от Bacillus tetani, Staphylococcus aureus, Streptomyces griseus, и др., но ими перечень не ограничивается.
в) Антитела
В другом варианте осуществления настоящего изобретения по меньшей мере одна (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению может кодировать антитело. По настоящему изобретению такое антитело может быть выбрано из каких-либо антител, например, каких-либо рекомбинантно полученных или природных антител, известных в данной области, в частности антител, пригодных для терапии, диагностики или научных целей, или антител, которые идентифицированы в связи со специфическими раковыми заболеваниями. В настоящем изобретении понятие «антитело» используют в широком смысле, а конкретно в связи со специфическимими моноклональными и поликлональными антителами (включая агонистов, антагонистов, блокирующих или нейтрализующих антител) и видами антител с полиэпитопной специфичностью. По настоящему изобретению понятие «антитело» обычно включает какие-либо антитела, известные в данной области (например, антитела IgM, IgD, IgG, IgA и IgE), например, природные антитела, антитела, получаемые иммунизацией организма-хозяина, антитела, выделенные и идентифицированные из природных антител или антител, полученных иммунизацией в организме-хозяина, рекомбинантно получаемые биомолекулярными методами антитела, известными в данной области, а также химерные антитела, антитела человека, гуманизированные антитела, биспецифические антитела, внутриклеточные антитела, т.е. антитела, экспрессированные в клетках и необязательно локализованные в специфических компартментах клеток, и фрагменты и варианты указанных выше антител. В общем, антитела состоят из легкой цепи и тяжелой цепи, которые обе имеют вариабельные и константные домены. Легкая цепь состоит из N-концевого вариабельного домена, VL, и С-концевого константного домена, CL. Напротив, тяжелая цепь антитела IgG, например, включает N-концевой вариабельный домен, VH, и три константных домена, CH1, CH2 и CH3. Одноцепочечные антитела могут кодироваться РНК, в том числе модифицированной (и)РНК по настоящему изобретению, предпочтительно одноцепочечной РНК, более предпочтительно иРНК.
По первому отличному варианту осуществления настоящего изобретения по меньшей мере одна (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению может кодировать поликлональное антитело. В этом контексте понятие «поликлональное антитело» обычно означает смеси антител, направленных на специфические антигены, или иммуногены, или эпитопы белка, которые были выработаны путем иммунизации организма-хозяина, например, млекопитающего, например, козы, крупного рогатого скота, свиньи, собаки, кошки, осла, обезьяны, человекообразной обезьяны, грызуна, например, мыши, хомяка и кролика. Поликлональные антитела обычно неидентичные и, таким образом, обычно распознают разные эпитопы или области одного и того же антигена. Таким образом, в данном случае обычно используют смесь (композицию) разных РНК в качестве по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, каждая РНК кодирующая специфическое (моноклональное) антитело, направлена на специфические антигены, или иммуногены, или эпитопы белка.
В другом варианте осуществления настоящего изобретения по меньшей мере одна (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению может кодировать моноклональное антитело. В контексте настоящего изобретения понятие «моноклональное антитело» обычно относится к антителу, полученному из популяции в существенной степени гомогенных антител, т.е. к индивидуальным антителам, представляющим популяцию, идентичным за исключением возможных природных мутаций, которые могут быть в минимальном количестве. Моноклональные антитела высоко специфичны и направлены на один антигенный сайт.Кроме того, в отличие от препаратов традиционных (поликлональных) антител, которые обычно включают разные антитела, направленные на разные детерминанты (эпитопы), каждое моноклональное антитело направлено на один детерминант антигена. Например, моноклональные антитела, описанные выше, могут быть получены методом гибридом, впервые описанным Kohler и Milstein, Nature, 256, 1975, с.495, или могут быть получены методами рекомбинации ДНК, например, описанные в US 4816567. «Моноклональные антитела» также могут быть выделены из библиотек фагов, полученных методами, которые описаны в работе McCafferty и др., Nature, 348, 1990, cc.552-554, например, по Kohler и Milstein исследуемый иммуноген (антиген) вводят инъекцией в организм хозяина, например, мыши, и В-клетки лимфоцитов, выработанных в ответ на иммуноген, собирают после некоторого времени. В-клетки комбинируют с клетками миеломы, полученными от мыши и интродуцированными в среду, которая допускает гибридизацию В-клеток с клетками миеломы, формируя гибридомы. Такие гибридные клетки (гибридомы) затем помещают в отдельные лунки планшетов для микротитрований и выращивают для получения моноклональных антител. Моноклональные антитела исследуют чтобы установить, которые из них пригодны для определения требуемого антигена. После отбора моноклональные антитела могут выращиваться в культурах клеток или путем инъекции гибридом мышам. Однако в соответствии с задачами настоящего изобретения пептидные последовательности таких моноклональных антител подвергают секвенированию, и последовательности РНК, кодирующие эти моноклональные антитела, могут быть получены в качестве по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению может быть получена методами, известными в данной области.
Для лечения людей моноклональные или поликлональные антитела, не являющиеся антителами человека, например, антитела мыши, также могут кодироваться по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению. Однако такие антитела обычно имеют ограниченное применение, поскольку они обычно индуцируют иммунный ответ путем выработки антител человека, направленных на указанные антитела человека, в организме человека. Таким образом, определенное антитело, не являющееся антителом человека, может быть введено человеку только один раз. Для решения этой проблемы химерные, гуманизированные антитела, не являющиеся антителами человека, и антитела человека также рассматриваются в качестве кодируемых по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению. «Химерные» антитела, которые могут кодироваться по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, предпочтительно являются антителами, у которых константные домены, описанные выше, замещены последовательностями антител от других организмов, предпочтительно последовательностей человека. «Гуманизированными» антителами (не являющимися антителами человека), которые также могут кодироваться по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, являются антитела, у которых константные и вариабельные домены (за исключением гипервариабельных доменов), описанные выше у антител, замещены последовательностями человека. В другом варианте по меньшей мере одна (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению может кодировать антитела человека, т.е. антитела, имеющие только последовательности человека. Такие антитела человека могут быть выделены из тканей человека или из иммунизированных организмов-хозяев, не являющихся людьми, которые являются трансгенными по генному локусу IgG человека, и последовательности РНК могут быть получены методами, известными в данной области. Кроме того, антитела человека могут быть получены с помощью метода фагового дисплея.
Кроме того, по меньшей мере одна (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению может кодировать биспецифические антитела. Понятие «биспецифические антитела» в контексте настоящего изобретения предпочтительно означает антитела, которые действуют в качестве адаптера между эффектором и соответствующей мишенью двумя разными Fa/b-доменами, например, для целей рекрутинга эффекторных молекул, например, токсинов, лекарственных агентов, цитокинов и др., нацеливаясь на эффекторные клетки, например, CTL, клетки NK, макрофаги, гранулоциты и др. (см. обзор Kontermann R.E., Acta Pharmacol. Sin, 26(1), 2005, cc.1-9). Биспецифические антитела, описанные в настоящем изобретении, в целом скомпонованы для распознавания двух разных Fa/b-доменов, например, двух разных антигенов, иммуногенов, эпитопов, лекарственных агентов, клеток (или рецепторов на клетках) или других молекул (или структур), согласно описанному выше. При этом биспецифичность означает, что антигенсвязывающие области антител специфичны в отношении двух разных эпитопов. Таким образом, разные антигены, иммуногены или эпитопы и др. могут быть собраны близко друг к другу, что необязательно допускает прямое взаимодействие двух компонентов. Например, разные клетки, например, эффекторные клетки и клетки-мишени, могут быть соединены через биспецифическое антитело. К настоящему изобретению относятся, но ими не ограничиваются, антитела или их фрагменты, которые с одной стороны связывают растворимый антиген, согласно описанному в настоящем изобретении, и с другой стороны антиген или рецептор на поверхности раковых клеток.
По настоящему изобретению по меньшей мере одна (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению также может кодировать внутриклеточные антитела, причем эти внутриклеточные антитела могут быть антителами, подробно описанными выше. Поскольку такие антитела являются внутриклеточно экспрессируемыми антителами, т.е. антителами, которые кодируются нуклеиновыми кислотами, локализованными в специфических областях клетки и также экспрессируемыми в них, такие антитела могут называться внутриклеточными антителами.
Антитела, которые кодируются по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, могут предпочтительно включать антитела полной длины, т.е. антитела, состоящие из полных длинной и короткой цепей. Однако производные антител, например, фрагменты антител, варианты или аддукты также могут кодироваться по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению.
По меньшей мере одна (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению также может кодировать фрагменты антител, выбранных из фрагментов Fab, Fab', F(ab')2, Fc, Facb, pFc', Fd и Fv указанных выше антител (полной длины). В целом фрагменты антител известны в данной области. Например, фрагмент Fab («антиген-связывающий фрагмент») состоит из одного константного и одного вариабельного домена каждой тяжелой и легкой цепи. Два вариабельных домена связывают эпитоп на специфических антигенах. Две цепи соединены через дисульфидную связь. Фрагмент scFv («single chain variable fragment-одноцепочечный вариабельный фрагмент"), обычно состоит, например, из вариабельных доменов легких и тяжелых цепей. Эти домены связаны искусственной связью, обычно полипептидной связью, например, пептидом, состоящим из 15-25 остатков глицина, пролина и/или серина.
В качестве второго компонента иммуностимулирующая композиция по настоящему изобретению включает по меньшей мере одну свободную иРНК, кодирующую по меньшей мере один белок или пептид терапевтического действия, подобный описанным выше в настоящем изобретении, по меньшей мере один антиген, подобный описанным выше в настоящем изобретении, например, опухолевые антигены, патогенные антигены (например, выбранные из патогенных белков, подобных описанным выше, или из животных антигенов, вирусных антигенов, антигенов простейших, бактериальных антигенов, аллергических антигенов), аутоиммунные антигены или дополнительные антигены, по меньшей мере один аллерген, подобный описанным выше, по меньшей мере одно антитело, подобное описанным выше, по меньшей мере один антиген-специфичный рецептор Т-клеток, подобный описанным выше, или по меньшей мере один другой белок или пептид, пригодный для специфического (терапевтического) применения, подобный описанным выше в настоящем изобретении. Этот второй компонент добавляют (на второй стадии получения иммуностимулирующей композиции по настоящему изобретению) к полученному выше «адъювантному компоненту» для формирования иммуностимулирующей композиции по настоящему изобретению. Перед добавлением по меньшей мере одна свободная иРНК не объединена в комплекс и предпочтительно может не претерпевать какой-либо выявляемой или существенной реакции комплексообразования при добавлении адъювантного компонента. Это объясняется сильным связыванием катионного или поликатионного соединения с описанной выше по меньшей мере одной (и)РНК в адъювантном компоненте. Иначе говоря, если по меньшей мере одну свободную иРНК, кодирующую белок терапевтического действия, добавляют к «адъювантному компоненту», предпочтительно отсутствует или практически отсутствует свободное катионное или поликатионное соединение, которое может формировать комплекс по меньшей мере с одной свободной иРНК. Таким образом, возможна эффективная трансляция in vivo по меньшей мере одной свободной иРНК композиции по настоящему изобретению.
По меньшей мере одна свободная иРНК, которая является вторым компонентом иммуностимулирующей композиции по настоящему изобретению является информационной РНК, кодирующей по меньшей мере один белок или пептид терапевтического действия, описанный в настоящем изобретении, по меньшей мере, один антиген, описанный в настоящем изобретении, например, опухолевый антиген, патогенные антигены (например, выбранные из патогенных белков, согласно описанному выше, или из антигенов животных, вирусных антигенов, антигенов простейших, антигенов бактерий, аллергических антигенов), аутоиммунные антигены или другие антигены, по меньшей мере один аллерген, описанный в настоящем изобретении, по меньшей мере одно антитело, описанное в настоящем изобретении, по меньшей мере один антиген-специфичный Т-клеточный рецептор, описанный в настоящем изобретении, или по меньшей мере один другой белок или пептид, пригодный для специфического (терапевтического) применения, описанного в настоящем изобретении. В этом контексте иРНК, в целом подобные описанным выше, для адъювантного компонента в качестве РНК, которая состоит из нескольких структурных элементов, например, необязательной области 5'-UTR, расположенным выше по цепи сайтом связывания рибосомы с последующей кодирующей областью, необязательной области 3'-UTR, которая может сопровождаться хвостом поли-А (и/или хвостом поли-С). По меньшей мере одна свободная иРНК может быть в виде моно-, ди- или даже полицистроной РНК, т.е. РНК, которая несет кодирующие последовательности одного, двух или более белков. Такие кодирующие последовательности в ди- или даже полицистронной иРНК могут быть разделены по меньшей мере одной последовательностью IRES, например, описанной в настоящем изобретении.
По меньшей мере одна свободная иРНК, представленная в качестве второго компонента иммуностимулирующей композиции по настоящему изобретению, может кодировать по меньшей мере один белок терапевтического действия. В контексте настоящего изобретения такой белок терапевтического действия предпочтительно может быть каким-либо белком или пептидом, применимым для терапевтической цели, более предпочтительно может быть выбран из какого-либо рекомбинантного или выделенного белка, известного специалистам в данной области из предшествующих исследований, и еще более предпочтительно может быть выбран из какого-либо белка терапевтического действия, подобного описанным выше, для адъювантного компонента иммуностимулирующей композиции по настоящему изобретению. Такие белки терапевтического действия, подобные описанным выше, включают, но ими не ограничиваются, например, белки, способные стимулировать или ингибировать сигнальную трансдукцию в клетках, например, цитокины, антитела и др., факторы апоптоза или связанные с апоптозом белки, адъювантные белки, например, выбранные из адъювантных белков человека или из патогенных адъювантных белков, в частности из бактериальных адъювантных белков, и др.
По меньшей мере, одна свободная иРНК, представленная в качестве второго компонента иммуностимулирующей композиции по настоящему изобретению, может дополнительно кодировать по меньшей мере одно антитело или фрагмент антитела. В этом контексте по меньшей мере одна свободная иРНК, представленная в качестве второго компонента иммуностимулирующей композиции по настоящему изобретению, может кодировать какое-либо антитело или фрагмент антитела, подобное описанным выше, для адъювантного компонента иммуностимулирующей композиции по настоящему изобретению.
В итоге, по меньшей мере одна свободная иРНК, предусмотренная в качестве второго компонента иммуностимулирующей композиции по настоящему изобретению, также может кодировать по меньшей мере один антиген, подобный описанным выше. В этом контексте, (опухолевый) антиген или в целом понятие «антиген» является подобным описанным выше для адъювантного компонента иммуностимулирующей композиции по настоящему изобретению и обычно означает вещество, которое распознается иммунной системой и способно индуцировать специфичный в отношении антигена иммунный ответ, например, путем формирования антител в качестве части адаптивного иммунного ответа. В предпочтительном варианте осуществления настоящего изобретения по меньшей мере одна свободная иРНК, предусмотренная в качестве второго компонента иммуностимулирующей композиции по настоящему изобретению, может кодировать какой-либо антиген, подобный описанным выше для адъювантного компонента иммуностимулирующей композиции по настоящему изобретению. В более предпочтительном варианте осуществления настоящего изобретения такие антигены могут быть выбраны из опухолевых антигенов, подобных описанным выше для адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, например, опухоль-специфичные антигены (tumor-specific antigens - TSA) и опухоль-ассоциированные антигены (tumor-associated-antigens - ТАА), подобные описанным выше и др.
По меньшей мере одна свободная иРНК, которая предусмотрена в качестве второго компонента иммуностимулирующей композиции по настоящему изобретению, может быть идентичной или отличной по меньшей мере в отношении одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению, в зависимости от определенных потребностей терапии. Еще более предпочтительно, если по меньшей мере одна свободная иРНК, которая предусмотрена в качестве второго компонента иммуностимулирующей композиции по настоящему изобретению, идентична по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению.
Соотношение первого компонента (т.е. адъювантного компонента, включающего или состоящего по меньшей мере из одной (и)РНК, объединенной в комплекс с катионным или поликатионным соединением) и второго компонента (т.е. по меньшей мере одной свободной иРНК) может быть выбрано в иммуностимулирующей композиции по настоящему изобретению исходя из определенных потребностей конкретной терапии, например, противораковой терапии и др. Обычно соотношение адъювантного компонента и по меньшей мере одной свободной иРНК (адъювантный компонент: свободная иРНК) иммуностимулирующей композиции по настоящему изобретению выбирают таким образом, что существенная стимуляция врожденной иммунной системы индуцируется адъювантным компонентом. Параллельно соотношение выбрано таким образом, что существенное количество по меньшей мере одной свободной иРНК может быть предусмотрено in vivo, приводящее к существенной трансляции и концентрации экспрессируемого белка in vivo, например, по меньшей мере одного антитела, антигена и/или белка терапевтического действия и др., подобных описанным выше. Предпочтительно соотношение адъювантного компонента к свободной иРНК в иммуностимулирующей композиции по настоящему изобретению выбрана из диапазона примерно от 5:1 (по массе) к примерно 1:10 (по массе), более предпочтительно из диапазона примерно от 4:1 (по массе) до примерно 1:8 (по массе), еще более предпочтительно из диапазона примерно от 3:1 (по массе) до примерно 1:5 (по массе) или 1:3 (по массе), и наиболее предпочтительно соотношение адъювантного компонента к свободной иРНК в иммуностимулирующей композиции по настоящему изобретению выбрано из соотношения примерно 1:1 (по массе).
Дополнительно или в другом варианте соотношение первого компонента (т.е. адъювантного компонента, включающего или состоящего по меньшей мере из одной (и)РНК, объединенной с катионным или поликатионным соединением) и второго компонента (т.е. по меньшей мере одной свободной иРНК) может быть вычислено на основе соотношения азота/фосфора (соотношение N/P) целого комплекса РНК. В контексте настоящего изобретения соотношение N/P предпочтительно находится в диапазоне примерно 0,1-10, предпочтительно в диапазоне примерно 0,3-4 и наиболее предпочтительно в диапазоне примерно 0,5-2 или 0,7-2 относительно соотношения РНК:пептида в комплексе, и наиболее предпочтительно в диапазоне примерно 0,7-1,5.
Дополнительно или в другом варианте соотношение первого компонента (т.е. адъювантного компонента, включающего или состоящего по меньшей мере из одной (и)РНК, объединенной с катионным или поликатионным соединением) и второго компонента (т.е. по меньшей мере одной свободной иРНК) также может быть выбрано в настоящей иммуностимулирующей композиции по настоящему изобретению на основе мольного соотношения обеих РНК друг к другу, т.е. (и)РНК адъювантного компонента, объединенной с катионным или поликатионным соединением) и по меньшей мере одной свободной иРНК второго компонента. Обычно мольное соотношение (и)РНК адъювантного компонента по меньшей мере к одной свободной иРНК второго компонента может быть выбрано таким образом, что мольное соотношение удовлетворяет приведенным выше определениям (масс./масс.) и/или N/P. Более предпочтительно мольное соотношение (и)РНК адъювантного компонента по меньшей мере к одной свободной иРНК второго компонента может быть выбрано, например, из мольного соотношения примерно 0,001:1, 0,01:1, 0,1:1, 0,2:1, 0,3:1, 0,4:1, 0,5:1, 0,6:1, 0,7:1, 0,8:1, 0,9:1, 1:1, 1:0,9, 1:0,8, 1:0,7, 1:0,6, 1:0,5, 1:0,4, 1:0,3, 1:0,2, 1:0,1, 1:0,01, 1:0,001 и др., или из какого-либо диапазона, сформированного какими-либо двумя из указанных выше величин, например, из диапазона, выбранного примерно из диапазона от 0,001:1 до 1:0,001, включая диапазон примерно от 0,01:1 до 1:0,001, от 0,1:1 до 1:0,001, от 0,2:1 до 1:0,001, от 0,3:1 до 1:0,001, от 0,4:1 до 1:0,001, от 0,5:1 до 1:0,001, от 0,6:1 до 1:0,001, от 0,7:1 до 1:0,001, от 0,8:1 до 1:0,001, от 0,9:1 до 1:0,001, от 1:1 до 1:0,001, от 1:0,9 до 1:0,001, от 1:0,8 до 1:0,001, от 1:0,7 до 1:0,001, от 1:0.6 до 1:0,001, от 1:0,5 до 1:0,001, от 1:0,4 до 1:0,001, от 1:0,3 до 1:0,001, от 1:0,2 до 1:0,001, от 1:0,1 до 1:0,001, от 1:0,01 до 1:0,001, или в диапазоне примерно от 0,01:1 до 1:0,01, от 0,1:1 до 1:0,01, от 0,2:1 до 1:0.01, от 0,3:1 до 1:0,01, от 0,4:1 до 1:0,01, от 0,5:1 до 1:0,01, от 0,6:1 до 1:0,01, от 0,7:1 до 1:0,01, от 0,8:1 до 1:0,01, от 0,9:1 до 1:0,01, от 1:1 до 1:0,01, от 1:0,9 до 1:0,01, от 1:0,8 до 1:0,01, от 1:0,7 до 1:0,01, от 1:0,6 до 1:0,01, от 1:0,5 до 1:0,01, от 1:0,4 до 1:0,01, от 1:0,3 до 1:0,01, от 1:0,2 до 1:0,01, от 1:0,1 до 1:0,01, от 1:0,01 до 1:0,01, или включая диапазон примерно от 0,001:1 до 1:0,01, от 0,001:1 до 1:0,1, от 0,001:1 до 1:0,2, от 0,001:1 до 1:0,3, от 0,001:1 до 1:0,4, от 0,001:1 до 1:0,5, от 0,001:1 до 1:0,6, от 0,001:1 до 1:0.7, от 0,001:1 до 1:0,8, от 0,001:1 до 1:0,9, от 0,001:1 до 1:1, от 0,001 до 0,9:1, от 0,001 до 0,8:1, от 0,001 до 0,7:1, от 0,001 до 0,6:1, от 0,001 до 0,5:1, от 0,001 до 0,4:1, от 0,001 до 0,3:1, от 0,001 до 0,2:1, от 0,001 до 0,1:1, или диапазон примерно от 0,01:1 до 1:0,01, от 0,01:1 до 1:0,1, от 0,01:1 до 1:0,2, от 0,01:1 до 1:0,3, от 0,01:1 до 1:0,4, от 0,01:1 до 1:0,5, от 0,01:1 до 1:0,6, от 0,01:1 до 1:0,7, от 0,01:1 до 1:0,8, от 0,01:1 до 1:0,9, от 0,01:1 до 1:1. от 0,001 до 0,9:1, от 0,001 до 0,8:1, от 0,001 до 0,7:1, от 0,001 до 0,6:1, от 0,001 до 0,5:1, от 0,001 до 0,4:1, от 0,001 до 0,3:1, от 0,001 до 0,2:1, от 0,001 до 0,1:1 и др.
Еще более предпочтительно может быть выбрано мольное соотношение (и)РНК адъювантного компонента по меньшей мере к одной свободной иРНК второго компонента, например, из диапазона примерно от 0,01:1 до 1:0,01. Наиболее предпочтительно мольное соотношение (и)РНК адъювантного компонента по меньшей мере к одной свободной иРНК второго компонента может быть выбрано, например, из мольного соотношения примерно 1:1. Может быть применено какое-либо из указанных выше определений, касающихся соотношения (масс./масс.) и/или N/P.
По настоящему изобретению по меньшей мере одна (и)РНК адъювантного компонента и/или по меньшей мере одна свободная иРНК иммуностимулирующей композиции по настоящему изобретению, согласно указанному выше, кодирующая белок, например, белок терапевтического действия, антитело и/или антиген, также может кодировать фрагменты и/или варианты указанных выше белков, причем фрагменты и/или варианты могут быть идентичны одному из указанных выше белков по меньшей мере на 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 85%, предпочтительно по меньшей мере на 90%, более предпочтительно по меньшей мере на 95% и наиболее предпочтительно по меньшей мере на 99% по всей длине (кодирующих) последовательностей нуклеиновой кислоты, кодирующих эти белки. В контексте настоящего изобретения фрагментом такого белка обозначают его усеченный вариант, т.е. аминокислотную последовательность, которая является усеченной по N-концу, С-концу и/или внутри цепи по сравнению с аминокислотной последовательностью исходного (нативного) белка. Особенно предпочтительны фрагменты, включающие антигенный эпитоп. В этом контексте фрагменты и эпитопы предпочтительно подобны специфическим фрагментам и эпитопам, описанным выше для антигенов.
В контексте настоящего изобретения понятие «вариант» относится к белку, указанному выше, например, белку терапевтического действия, адъювантному белку, антигену или антителу, описанным выше (или последовательности его кодирующей иРНК или (и)РНК), причем нуклеиновая кислота по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению или нуклеиновые кислоты по меньшей мере одной свободной иРНК иммуностимулирующей композиции по настоящему изобретению, кодирующие, например, белок терапевтического действия, антитело и/или антиген, и др., заменены. Таким образом, вырабатывается белок терапевтического действия, адъювантный белок, антиген или антитело с аминокислотной последовательностью, отличающееся от исходной последовательности по одной или большему числу мутаций, например, одна или более аминокислот замещены, инсертированы и/или делегированы. Предпочтительно фрагменты и/или варианты имеют ту же биологическую функцию или специфическое действие, сопоставимое с функцией или действием нативных белков полной длины, например, белков терапевтического действия, антигенов или антител. К такой «биологической функции» относятся, например, способность специфического связывания (например, определенных антигенов), каталитическое действие таких белков, например, белков терапевтического действия и др. В этом контексте понятие «биологическая функция» антител, согласно описанному в настоящем изобретении, также включает нейтрализацию антигенов, активацию комплемента или опсонизацию. Таким образом, антитела обычно распознают или нативные эпитопы на поверхности клеток, или свободные антигены. Антитела, согласно описанному выше, могут взаимодействовать с презентированными клеточными антигенами и инициировать разные защитные механизмы. С одной стороны, антитело может инициировать сигнальные механизмы в клетке-мишени, что приводит к саморазрушению клеток (апоптозу). С другой стороны, антитело может так пометить клетки, что другие компоненты или эффекторные клетки иммунной системы организма могут распознать и атаковать их. Механизмами атаки называются антитело-зависимая комплемент-опосредованная цитотоксичность (antibody-dependent complement-mediated cytotoxicity - CMC) и антитело-зависимая клеточная цитотоксичность (antibody-dependent cellular cytotoxicity - ADCC). ADCC участвует в распознавании антитела иммунными клетками, которые соединяют отмеченные антителом клетки или за счет прямого воздействия, или через рекрутмент клеток других типов, что приводит к гибели клеток-мишеней. CMC означает процесс, в котором активируется каскад разных белков комплемента, обычно если несколько антител расположено в тесной близи друг к другу, или приводя к лизису клеток, или привлекая другие иммунные клетки к этой области для функции эффекторных клеток. При нейтрализации антигена антитело может связывать антиген и нейтрализовать его. Такая реакция нейтрализации в свою очередь приводит в основном к блокированию антитела. Таким образом, антитело может связать только один антиген или, в случае биспецифического антитела, два антигена. В частности фрагменты антитела scFv применимы для реакций нейтрализации, поскольку они не содержат функциональных возможностей константного домена антитела. При активации комплемента комплексная система белков комплемента может быть активирована через связывание антитела, которое независимо от части Fc антитела. Конечные продукты каскада комплемента приводят к лизису клеток и созданию воспалительной среды. При опсонизации патогены или другие неклеточные частицы становятся доступными для фагоцитов через связывание константного домена антитела. В другом варианте клетки, распознанные в качестве чужеродных, могут лизироваться через антитело-зависимую клеточную цитотоксичность (ADCC). В частности клетки NK могут проявить литические функции путем активирования рецепторов Fc.
Для определения процента идентичности двух последовательностей, особенно по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению и/или по меньшей мере одной свободной иРНК иммуностимулирующей композиции по настоящему изобретению, последовательности могу быть выровнены для последующего сравнения друг с другом. Таким образом, в качестве примера гэпы могут быть инсертированы в последовательность первой последовательности (например, (и)РНК или иРНК) и компонент в соответствующем положении второй последовательности (например, (и)РНК или иРНК) могут быть сопоставлены. Если положение в первой последовательности (например, (и)РНК или иРНК) занято тем же компонентом, что и в случае положения во второй последовательности (например, (и)РНК или иРНК), две последовательности идентичны по этому положению. Процент идентичности двух последовательностей (и)РНК (или иРНК) является функцией числа идентичных позиций, поделенных на общее число позиций. Тот же подход применим к последовательностям ДНК или кодируемым аминокислотным последовательностям.
Процент, отражающий идентичность двух последовательностей, например, по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению и/или по меньшей мере одной свободной иРНК иммуностимулирующей композиции по настоящему изобретению, или их кодируемых аминокислотных последовательностей, может быть определен, используя математический алгоритм. Предпочтительным, но не ограничительным, примером математического алгоритма, который может применяться, является алгоритм Karlin и др., PNAS USA, 90, 1993, cc.5873-5877, или Altschul и др., Nucleic Acids Res, 25, 1997, cc.3389-3402. Такой алгоритм интегрирован в программу BLAST или NBLAST. Последовательности, которые идентичны последовательностям по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению или по меньшей мере одной свободной иРНК иммуностимулирующей композиции по настоящему изобретению (или к их кодирующим областям) на определенном протяжении может быть идентифицирована с помощью указанных программ.
Последовательности РНК, соответствующие по меньшей мере одной (и)РНК адъювантного компонента или по меньшей мере одной свободной иРНК иммуностимулирующей композиции по настоящему изобретению, кодирующей аминокислотные последовательности, которые имеют (а) консервативное замещение (замещения), относительно физиологической, т.е. нативной немодифицированной последовательности, в частности относятся к понятию «варианты». Замещения, в которых кодируемые аминокислоты, которые происходят от того же класса, заменены на другие аминокислоты из того же класса, называются консервативными замещениями. В частности, имеются кодируемые аминокислоты, представляющие алифатические боковые цепи, положительно или отрицательно заряженные боковые цепи, ароматические группы в боковых цепях или кодируемые аминокислоты, боковые цепи которых могут войти в водородные мостики, например, боковые цепи, которые имеют гидроксильную функцию. Это означает, что, например, аминокислота с полярной боковой цепью замещена другой аминокислотой, имеющей также полярную боковую цепь или, например, аминокислота, отличающаяся гидрофобной боковой цепью, замещена другой аминокислотой, имеющей также гидрофобную боковую цепь (например, серии (треонин) треонином (серином) или лейцин (изолейцин) изолейцином (лейцином)). Инсерции и замещения возможны, в частности, по тем положениям в последовательности, которые не вызывают модификации трехмерной структуры или не влияют на область связывания или на каталитический домен. Модификации трехмерной структуры путем инсерции (инсерций) или делеции (делеций) могут быть легко определены, например, используя спектр циркулярного дихроизма (circular dichroism - CD) (см. Urry в кн.: «Modern Physical Methods in Biochemistry», 1985, под ред. Neuberger и др., изд-во Elsevier, Амстердам).
Такие последовательности РНК, соответствующие по меньшей мере одной (и)РНК адъювантного компонента по настоящему изобретению или по меньшей мере одной свободной иРНК иммуностимулирующей композиции по настоящему изобретению, кодирующей аминокислотные последовательности, описанные выше, могут быть в виде моно-, ди- или даже полицистронной РНК, т.е. РНК, которая несет кодирующие последовательности одного, двух или более белков, описанных выше, например, белков терапевтического действия, адъювантных белков, (белковых) антигенов или антител, описанных выше. Если последовательность РНК, соответствующая по меньшей мере одной (и)РНК адъювантного компонента и/или по меньшей мере одной свободной иРНК иммуностимулирующей композиции по настоящему изобретению в рамках указанного выше определения, кодирует по меньшей мере один белок, согласно описанному выше, например, два, три или более белков терапевтического действия, адъювантных белков, антигенов или антител, согласно описанному выше, каждый из этих белков может быть выбран из того же или (предпочтительно) другого белка, описанного выше. В некоторых случаях каждый белок, кодируемый последовательностью РНК, соответствующей по меньшей мере одной (и)РНК адъювантного компонента иммуностимулирующей композиции по настоящему изобретению и/или по меньшей мере одной свободной иРНК иммуностимулирующей композиции по настоящему изобретению, может быть выбран независимо.
В другом предпочтительном варианте осуществления настоящего изобретения патентоспособная иммуностимулирующая композиция по настоящему изобретению может включать в качестве по меньшей мере одной свободной иРНК или в качестве по меньшей мере одной (и)РНК адъювантного компонента по меньшей мере одну би- или даже полицистронную последовательность РНК согласно описанному выше. Каждая кодирующая последовательность в таких би- или даже полицистронных последовательностях РНК согласно описанному выше могут быть разделены по меньшей мере одной последовательностью IRES (internal ribosomal entry site - внутренний сайт посадки рибосомы). В этом контексте последовательность IRES может функционировать в качестве единственного сайта связывания рибосомы, но она может также служить в качестве би- или даже полицистронной последовательности РНК, согласно описанному выше, которая кодирует несколько белков, которые транслируются на рибосомах независимо друг от друга. Примерами последовательностей IRES, которые могут применяться в настоящем изобретении, являются последовательности, которые могут применяться по настоящему изобретению, являются последовательности пикорнавирусов (например FMDV), пестивирусов (CFFV), полиовирусов (PV), вирусов энцефаломиокардита (ECMV), вирусов ящура (FMDV), вирусов гепатита С (HCV), вируса классической чумы свиней (classical swine fever viruses - CSFV), вируса лейкоза мышей (MLV), вируса иммунодефицита обезьян (SIV) или вируса паралича сверчка (cricket paralysis viruses - иСrРV).
В особенно предпочтительном варианте осуществления настоящего изобретения иммуностимулирующая композиция по настоящему изобретению также может включать, в качестве по меньшей мере одной (и)РНК адъювантного компонента и/или по меньшей мере одной свободной иРНК, смесь разных последовательностей РНК, причем смесь включает, например, по меньшей мере одну моноцистронную иРНК, кодирующую белок, согласно описанному выше, и/или по меньшей мере одну би- или даже полицистронную иРНК, кодирующую ту же или другие белки, согласно описанному выше, например, белок терапевтического действия, адъювантный белок, антиген и/или антитело согласно описанному выше.
В другом варианте осуществления настоящего изобретения по меньшей мере одна (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции и/или по меньшей мере одна свободная иРНК патентоспособной иммуностимулирующей композиции может быть предусмотрена в качестве «стабилизированной РНК», предпочтительно стабилизированной иРНК, которую называют РНК, которая в существенной степени устойчива к разрушению in vivo разными способами (например, под действием экзо- или эндонуклеаз). Известно, что нестабильность и (быстрое) разрушение иРНК или РНК in vivo в общем может представлять серьезную проблему при применении композиций, основанных на РНК. Такая нестабильность РНК обычно происходит из-за ферментов, разрушающих РНК, («РНКазы» - рибонуклеазы), причем загрязнение такими рибонуклеазами иногда может полностью разрушить в растворе РНК. Поэтому естественное разрушение РНК в цитоплазме клеток очень тонко регулируется и загрязнения рибонуклеазами обычно могут быть ликвидированы специальной обработкой перед применением указанных композиций, в частности с помощью диэтилпикокарбоната (ДЭПК). В этой связи в предшествующем уровне техники известен ряд механизмов естественного разрушения, которые также могут применяться. Например, концевая структура обычно имеет принципиальное значение для иРНК in vivo. Примером является наличие с 5'-конца природных иРНК так называемых «кэп-структуры» (модифицированного нуклеотида гуанозина), а с 3'-конца обычно находится последовательности, содержащей до 200 нуклеотидов аденозина (так называемый поли-А хвост).
В особенно предпочтительном варианте осуществления настоящего изобретения по меньшей мере одна (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции и/или по меньшей мере одной свободной иРНК патентоспособной иммуностимулирующей композиции, особенно в случае иРНК, может быть стабилизирована против разрушения рибонуклеазами путем добавления так называемой «5'-кэп» структуры. В этой связи особенно предпочтительны в качестве 5'-кэп-структур m7G(5')ppp (5'(A,G(5')ppp(5')A или G(5')ppp(5')G. Однако такая модификация внедряется только в том случае, если модификация, особенно согласно описанному в настоящем изобретении, не была уже интродуцирована с 5'-конца по меньшей мере одной (и)РНК и/или иРНК согласно описанному выше, или если модификация не интерферирует с иммуногенными свойствами по меньшей мере одной (и)РНК и/или иРНК согласно описанному выше.
В другом особенно предпочтительном варианте осуществления настоящего изобретения по меньшей мере одна (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции и/или по меньшей мере одна свободная иРНК патентоспособной иммуностимулирующей композиции может содержать, особенно если РНК в форме иРНК, поли-А хвост с 3'-конца обычно примерно из 10-200 нуклеотидов аденозина, предпочтительно примерно из 10-100 нуклеотидов аденозина, более предпочтительно примерно из 20-100 нуклеотидов аденозина или еще более предпочтительно примерно из 40-80 нуклеотидов аденозина.
В другом особенно предпочтительном варианте осуществления настоящего изобретения по меньшей мере одна (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции и/или по меньшей мере одна свободная иРНК патентоспособной иммуностимулирующей композиции может содержать, особенно если РНК в форме иРНК, поли-А хвост с 3'-конца обычно примерно из 10-200 нуклеотидов цитозина, предпочтительно примерно из 10-100 нуклеотидов цитозина, более предпочтительно примерно из 20-70 нуклеотидов цитозина, еще более предпочтительно примерно из 20-60 нуклеотидов цитозина, или еще более предпочтительно примерно из 10-40 нуклеотидов цитозина.
В другом предпочтительном варианте осуществления настоящего изобретения по меньшей мере одна (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции и/или по меньшей мере одна свободная иРНК патентоспособной иммуностимулирующей композиции также может быть GC-модифицированной или в другой форме. Некоторые модификации РНК могут быть, в зависимости от типа РНК, более соответствующие РНК в целом, или, например, в случае последовательностей GC-модифицированной (и)РНК или иРНК, в большей степени применимы для кодирующей РНК, предпочтительно (и)РНК и/или иРНК, согласно описанному выше. Такие дополнительные модификации, согласно описанному в настоящем изобретении, предпочтительно приводят к стабилизированной (и)РНК и/или иРНК, согласно описанному выше.
В одном из вариантов осуществления настоящего изобретения такая стабилизированная РНК может быть получена путем модификации содержания G/C кодирующей области последовательностей РНК, указанных в настоящем изобретении, например, последовательности РНК, соответствующей по меньшей мере одной (и)РНК адъювантного компонента и/или по меньшей мере одной свободной иРНК патентоспособной иммуностимулирующей композиции.
В более предпочтительном варианте осуществления настоящего изобретения содержание G/C в кодирующей области по меньшей мере одной (и)РНК адъювантного компонента и/или по меньшей мере одной свободной иРНК патентоспособной иммуностимулирующей композиции изменено, предпочтительно повышено, по сравнению с содержанием G/C в кодирующей области соответствующей немодифицированной РНК (в нижеследующей «нативной РНК»). В этом контексте кодируемая аминокислотная последовательность такой РНК с повышенным содержанием G/C, соответствующая по меньшей мере одной (и)РНК адъювантного компонента или по меньшей мере одной свободной иРНК патентоспособной иммуностимулирующей композиции, предпочтительно не изменена по сравнению с соответствующей нативной РНК. Такое изменение GC-последовательности может в дальнейшем обозначаться GC-стабилизацией.
Такая G/C-стабилизация по меньшей мере одной (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции и/или по меньшей мере одной свободной иРНК патентоспособной иммуностимулирующей композиции основана на том обстоятельстве, что последовательность какой-либо транслируемой области РНК важна для эффективной трансляции такой РНК. Таким образом, важна последовательность разных нуклеотидов. В частности, последовательности с повышенным содержанием G (гуанозина)УС (цитозина) стабильнее последовательностей с повышенным содержанием А (аденозина)/и (урацила). Следовательно, по настоящему изобретению кодоны по меньшей мере одной (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции или по меньшей мере одной свободной иРНК патентоспособной иммуностимулирующей композиции варьируют по сравнению с их нативной последовательностью РНК, хотя сохраняется транслируемая аминокислотная последовательность, при этом они включают повышенное содержание нуклеотидов G/C. В связи с тем, что несколько кодонов кодируют одну и ту же аминокислотную последовательность (так называемый вырожденный генетический код), могут быть установлены наиболее благоприятные кодоны для стабильности (так называемое применение альтернативных кодонов).
В зависимости от аминокислот, кодируемых по меньшей мере одной (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции и/или по меньшей мере одной свободной иРНК патентоспособной иммуностимулирующей композиции, существуют различные возможности для G/C-модификации последовательности РНК относительно ее нативной последовательности. В случае аминокислот, кодируемых кодонами, которые содержат только нуклеотиды G или С, не требуется G/C-модификация кодона. Таким образом, кодоны аминокислоты Pro (CCC или CCG), Arg (CGC или CGG), Ala (GCC или GCG) и Gly (GGC или GGG) не требуют G/C-модификацию, поскольку не содержат А или U.
Напротив, кодоны, содержащие нуклеотиды А и/или U, могут быть G/C-модифицированными путем замещения других кодонов, которые кодируют те же аминокислоты, но не содержат А и/или U. Примерами являются: кодоны Pro могут быть G/C-модифицированными из CCU или ССА в CCC или CCG; кодоны Arg могут быть G/C-модифицированными из CGU, или CGA, или AGA, или AGG в CGC или CGG; кодоны Ala могут быть G/C-модифицированными из GCU или GCA в GCC или GCG; кодоны Gly могут быть G/C-модифицированными из GGU или GGA в GGC или GGG.
В других случаях хотя нуклеотиды А или U не могут быть элиминированы из кодонов, тем не менее можно снизить содержание А и U, используя кодоны, которые содержат в меньшее число нуклеотидов А и/или U. Примерами являются:
кодон Phe может быть G/C-модифицирован из UUU в UUC;
кодоны Leu могут быть G/C-модифицированы из UUA, UUG, CUU или CUA в CUC или CUG;
кодоны Ser могут быть G/C-модифицированы из UCU, или UCA, или AGU в UCC, UCG или AGC;
кодон Tyr может быть G/C-модифицирован из UAU в UAC;
кодон Cys может быть G/C-модифицирован из UGU в UGC;
кодон His может быть G/C-модифицирован из CAU в САС;
кодон Gln может быть G/C-модифицирован из САА в CAG;
кодоны Ile могут быть G/C-модифицированы из AUU или AUA в AUC;
кодоны Thr могут быть G/C-модифицированы из ACU или АСА в АСС или ACG;
кодон Asn может быть G/C-модифицирован из AAU в ААС;
кодон Lys может быть G/C-модифицирован из ААА в AAG;
кодоны Val могут быть G/C-модифицированы из GUU или GUA в GUC или GUG;
кодон Asp может быть G/C-модифицирован из GAU в GAC;
кодон Glu может быть G/C-модифицирован из GAA в GAG;
стоп-кодон UAA может быть G/C-модифицирован в UAG или UGA.
В случае кодонов для Met (AUG) и Trp (UGG), с другой стороны, нет возможности для модификации последовательности.
Перечисленные выше замещения могут применяться или индивидуально, или во всех возможных комбинациях для повышения содержания G/C по меньшей мере в одной (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции и/или по меньшей мере в одной свободной иРНК патентоспособной иммуностимулирующей композиции по сравнению с соответствующей нативной РНК (т.е. без модификации последовательности). Таким образом, например, все кодоны Thr в нативной последовательности могут быть G/C-модифицированными в АСС (или ACG). Предпочтительно, однако, использовать, например, комбинации указанных выше возможностей по замещению:
замещение всех кодонов, кодирующих Thr в немодифицированной последовательности (нативной РНК), на АСС (или ACG) и
замещение всех кодонов, изначально кодирующих Ser, на UCC (или UCG или AGC);
замещение всех кодонов, изначально кодирующих Ile, на AUC, и
замещение всех кодонов, изначально кодирующих Lys, на AAG, и
замещение всех кодонов, изначально кодирующих Tyr, на UAC;
замещение всех кодонов, изначально кодирующих Val, на GUC (или GUG), и
замещение всех кодонов, изначально кодирующих Glu, на GAG, и
замещение всех кодонов, изначально кодирующих Ala, на GCC (или GCG), и
замещение всех кодонов, изначально кодирующих Arg, на CGC (или CGG);
замещение всех кодонов, изначально кодирующих Val, на GUC (или GUG), и
замещение всех кодонов, изначально кодирующих Glu, на GAG, и
замещение всех кодонов, изначально кодирующих Ala, на GCC (или GCG), и
замещение всех кодонов, изначально кодирующих Gly, на GGC (или GGG) и
замещение всех кодонов, изначально кодирующих Asn, на ААС;
замещение всех кодонов, изначально кодирующих Val, на GUC (или GUG), и
замещение всех кодонов, изначально кодирующих Phe, на UUC, и
замещение всех кодонов, изначально кодирующих Cys, на UGC, и
замещение всех кодонов, изначально кодирующих Leu, на CUG (или CUC), и
замещение всех кодонов, изначально кодирующих Gln, на CAG, и
замещение всех кодонов, изначально кодирующих Pro, на ССС (или CCG); и т.д.
Предпочтительно содержание G/C в кодирующей области последовательности РНК, соответствующей по меньшей мере одной (и)РНК адъювантного компонента и/или по меньшей мере одной свободной иРНК патентоспособной иммуностимулирующей композиции, повышено по меньшей мере на 7%, более предпочтительно по меньшей мере на 15%, особенно предпочтительно по меньшей мере на 20%, по сравнению с содержанием G/C в кодирующей области нативной РНК, кодирующей белок. В одном из вариантов осуществления настоящего изобретения по меньшей мере 60%, более предпочтительно по меньшей мере 70%, еще более предпочтительно по меньшей мере 80% и наиболее предпочтительно по меньшей мере 90%, 95% или даже 100% замещаемых кодонов в области, кодирующей белок или целую последовательность нативной последовательности РНК, замещено, за счет чего повышается GC/содержание в указанной последовательности.
В таком контексте особенно предпочтительно повысить содержание G/C в нативной РНК по меньшей мере одной (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции и/или по меньшей мере одной свободной иРНК патентоспособной иммуностимулирующей композиции, максимально возможным образом(т.е. 100% замещаемых кодонов в нативной РНК), в частности в области, кодирующей белок.
Настоящее изобретение также предусматривает предпочтительную модификацию по меньшей мере одной (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции и/или по меньшей мере одной свободной иРНК патентоспособной иммуностимулирующей композиции, исходя из того обстоятельства, что эффективность трансляции также определяется разной частотой присутствия в клетке тРНК. Таким образом, так называемые «редкие кодоны» содержатся в повышенном количестве в последовательности нативной РНК, соответствующая G/C-стабилизированная или нативная последовательность РНК может транслироваться в существенно меньшей степени, чем в случае, когда имеются кодоны, кодирующие относительно «часто встречающиеся» тРНК.
В настоящем изобретении область по меньшей мере одной (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции и/или по меньшей мере одной свободной иРНК патентоспособной иммуностимулирующей композиции, кодирующей белок, предпочтительно GC-стабилизирована по сравнению с соответствующей областью соответствующей нативной РНК таким образом, что по меньшей мере один кодон нативной последовательности, который кодирует относительно редко встречаемую в клетке тРНК, замещен на кодон, который кодирует тРНК, которая относительно часть встречается в клетке и несет ту же аминокислоту, что и относительно редкая тРНК. За счет такой модификации последовательности нативной РНК являются GC-стабилизированными таким образом, что кодоны, для которых частота встречаемости тРНК доступна, инсертированы. Иначе говоря, в настоящем изобретении с помощью такой модификации все кодоны нативной последовательности, кодирующей тРНК, которая относительно редка в клетке, в каждом случае заменены на кодоны, которые кодируют тРНК, которые относительно часто встречаются в клетке и которые, в каждом случае, несут ту же аминокислоту, что и редко встречаемая тРНК.
Каждая тРНК, относительно часто встречающаяся в клетке, и, напротив, относительно редко встречающаяся в клетке, известна социалистам в данной области; см., например, Akashi, Curr. Opin. Genet. Dev. 11 (6), 2001, cc.660-666. Кодоны, которые используют для тРНК определенной аминокислоты и которые встречаются наиболее часто, например, кодон Gly, используют тРНК, встречающуюся наиболее часто в клетках (человека), и являются особенно предпочтительными.
В настоящем изобретении особенно предпочтительно связывать последующее содержание G/C, которое повышено, в частности максимизировано, в последовательности GC-стабилизированной РНК по меньшей мере одной (и)РНК адъювантного компонента и/или по меньшей мере одной свободной иРНК патентоспособной иммуностимулирующей композиции, с «частыми» кодонами без модификации аминокислотной последовательности белка, кодируемого кодирующей областью нативной РНК. Такой предпочтительный вариант осуществления настоящего изобретения позволяет предоставить особенно эффективно транслированную и GC-стабилизированную последовательность РНК по меньшей мере одной (и)РНК патентоспособной иммуностимулирующей композиции адъювантного компонента и/или по меньшей мере одной свободной иРНК патентоспособной иммуностимулирующей композиции.
Определение необходимости (и/или возможности) ОС-модификации по меньшей мере одной (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции и/или по меньшей мере одной свободной иРНК патентоспособной иммуностимулирующей композиции, согласно описанному выше (повышенное содержание G/C; замена молекул тРНК), может быть выполнено, используя компьютерную программу, разъясняемую в патентной заявке WO 02/098443, сущность которой полностью включена в настоящее изобретение. Используя компьютерную программу, нуклеотидная последовательность какой-либо кодирующей РНК, согласно описанному выше, может быть GC-стабилизированной с помощью генетического кода или его вырожденной природы таким образом, что приводит к максимальному содержанию G/C. В комбинации с применением кодонов, кодирующих молекулы тРНК, присутствующие в клетках столь часто, насколько это возможно, аминокислотная последовательность, кодируемая GC-стабилизированной последовательностью РНК по меньшей мере одной (и)РНК адъювантного компонента и/или по меньшей мере одной свободной иРНК патентоспособной иммуностимулирующей композиции предпочтительно дополнительно не модифицирована по сравнению с их нативной последовательностью РНК. В другом варианте также можно модифицировать только содержание G/C или только применение кодона по сравнению с исходной последовательностью. Исходный код в Visual Basic 6.0 (среда разработки использует: Microsoft Visual Studio Enterprise 6.0 с пакетом обновления Servicepack 3) также описан в WO 02/098443.
В другом варианте осуществления настоящего изобретения по меньшей мере одна (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции и/или по меньшей мере одна свободная иРНК патентоспособной иммуностимулирующей композиции, могут быть представлены в виде стабилизированной РНК, которая в значительной степени устойчива к разрушению in vivo (например, под действием экзо- или эндонуклеаз), путем модификации фосфатного каркаса такой (таких) последовательностей РНК согласно описанному в настоящем изобретении. Нуклеотиды, которые могут предпочтительно применяться в этой связи, содержат фосфортиоат-модифицированный фосфатный каркас молекулы, предпочтительно по меньшей мере один из фосфатных кислородов, содержащихся в фосфатном каркасе молекулы, замещен на атом серы. Стабилизированная последовательность РНК, согласно описанному в настоящем изобретении, может дополнительно включать, например: неионные аналоги фосфатов, например, алкил и арил фосфонаты, в которых заряженный кислород в фосфонате замещен алкильной или арильной группой, или фосфодиэфирами и алкилфосфотриэфирами, у которых заряженный остаток кислорода содержится в алкилированной форме. Точнее фосфонатные части молекулы предпочтительно могут быть замещены, например, фосфорамидатами, фосфортиоатами, пептидными нуклеотидами, метилфосфонатами и т.д.
В другом варианте осуществления настоящего изобретения последовательность РНК, согласно описанному в настоящем изобретении, предпочтительно по меньшей мере одна (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции и/или по меньшей мере одна свободная иРНК патентоспособной иммуностимулирующей композиции, также может быть модифицирована (и предпочтительно стабилизирована) путем внедрения модифицированных нуклеотидов, содержащих модификации рибозы или оснований, в последовательность РНК. Обычно последовательность РНК согласно описанному в настоящем изобретении, предпочтительно по меньшей мере одна (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции и/или по меньшей мере одна свободная иРНК патентоспособной иммуностимулирующей композиции, может содержать какой-либо неизмененный (равный природному) нуклеотид, например, гуанозин, урацил, аденозин, тимидин и/или цитозин, или их аналог. В связи с этим аналогии нуклеотидов определяют в качестве измененных вариантов природных нуклеотидов. Соответственно аналоги являются химическими производными нуклеотидов с неприродными функциональными группами, которые предпочтительно добавлены к природному нуклеотиду или делегированы из природного нуклеотида или которые замещают природные функциональные группы нуклеотида. Соответственно каждый компонент природного нуклеотида может быть модифицирован, а именно основной компонент, компонент сахара (рибозы) и/или фосфатный компонент, формирующий каркас последовательности РНК, модифицируется. К аналогам гуанозина, урацила, аденозина и цитозина относятся, но ими не ограничиваются, какие-либо природные или неприродные гуанозин, урацил, аденозин, тимидин или цитозин, которые были изменены химически, например, ацетилированием, метилированием, гидроксилированием и т.д., включая 1-метил-аденозин, 1-метил-гуанозин, 1-метил-инозин, 2,2-диметил-гуанозин, 2,6-диаминопурин, 2'-амино-2'-дезоксиаденозин, 2'-амино-2'-дезоксицитидин, 2'-амино-2'-дезоксигуанозин, 2'-амино-2'-дезоксиуридин, 2-амино-6-хлорпуринрибозид, 2-аминопурин-рибозид, 2'-арааденозин, 2'-арацитидин, 2'-арауридин, 2'-азидо-2'-дезоксиаденозин, 2'-азидо-2'-дезоксицитидин, 2'-азидо-2'-дезоксигуанозин, 2'-азидо-2'-дезоксиуридин, 2-хлораденозин, 2'-фтор-2'-дезоксиаденозин, 2'-фтор-2'-дезоксицитидин, 2'-фтор-2'-дезоксигуанозин, 2'-фтор-2'-дезоксиуридин, 2'-фтортимидин, 2-метил-аденозин, 2-метил-гуанозин, 2-метил-тио-К6-изопененил-аденозин, 2'-O-метил-2-аминоаденозин, 2'-O-метил-2'-дезоксиаденозин, 2'-O-метил-2'-дезоксицитидин, 2'-O-метил-2'-дезоксигуанозин, 2'-O-метил-2'-дезоксиуридин, 2'-O-метил-5-метилуридин, 2'-O-метилинозин, 2'-O-метилпсевдоуридин, 2-тиоцитидин, 2-тиоцитозин, 3-метил-цитозин, 4-ацетил-цитозин, 4-тиоуридин, 5-(карбоксигидроксиметил)-урацил, 5,6-дигидроуридин, 5-аминоаллилцитидин, 5-аминоаллил-дезокси-уридин, 5-бромуридин, 5-карбоксиметиламинометил-2-тио-урацил, 5-карбоксиметиламинометил-урацил, 5-хло-ара-цитозин, 5-фтор-уридин, 5-йодуридин, 5-метоксикарбонилметилуридин, 5-метокси-уридин, 5-метил-2-тио-уридин, 6-азацитидин, 6-арауридин, 6-хлор-7-деаза-гуанозин, 6-хлорпуринрибозид, 6-меркаптогуанозин, 6-метил-меркаптопурин-рибозид, 7-деаза-2'-дезокси-гуанозин, 7-деаза-аденозин, 7-метил-гуанозин, 8-азааденозин, 8-бром-аденозин, 8-бром-гуанозин, 8-меркапто-гуанозин, 8-оксогуанозин, бензимидазол-рибозид, бета-О-маннозил-квеозин, дигидроурацил, инозин, N1-метиладенозин, N6-([6-аминогексил]карбамоилметил)-аденозин, N6-изопентенил-аденозин, N6-метил-аденозин, N7-метил-ксантозин, метиловый эфир N-урацил-5-оксиуксусной кислоты, пуромицин, квеозин, урацил-5-оксиуксусная кислота, метиловый эфир N-урацил-5-оксиуксусной кислоты, вубутоксозин, ксантозин и ксило-аденозин. Получение таких аналогов известно специалистам в данной области, например, из патентов US 4373071, US 4401796, US 4415732, US 4458066, US 4500707, US 4668777, US 4973679, US 5047524, US 5132418, US 5153319, US 5262530 и 5700642. В случае аналога, описанного выше, особое предпочтение отдают тем аналогам по настоящему изобретению, которые повышают иммуногенность последовательности РНК согласно описанному в настоящем изобретении, предпочтительно по меньшей мере одной (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции и/или по меньшей мере одной свободной иРНК патентоспособной иммуностимулирующей композиции, и/или не интерферируют с дополнительной модификацией РНК, которая была интродуцирована.
Последовательность РНК патентоспособной иммуностимулирующей композиции согласно описанному в настоящем изобретении, предпочтительно по меньшей мере одна (и)РНК адъювантного компонента и/или по меньшей мере одна свободная иРНК патентоспособной иммуностимулирующей композиции, могут содержать модификации каркаса молекулы. Модификация каркаса молекулы в связи с настоящим изобретением является модификацией, при которой такие фосфаты каркаса молекул нуклеотидов, содержащихся в РНК, химически модифицированы. Такие модификации каркаса молекулы обычно включают, но ими никак не ограничиваются, модификации из группы, состоящей из метилфосфонатов, фосфорамидатов и фосфоротиоатов (например, цитидин-5'-O-(1-тиофосфата)).
Последовательность РНК патентоспособной иммуностимулирующей композиции, согласно описанному в настоящем изобретении, предпочтительно по меньшей мере одна (и)РНК адъювантного компонента и/или по меньшей мере одна свободная иРНК патентоспособной иммуностимулирующей композиции, могу дополнительно или в другом варианте также включать модификации Сахаров. Модификация сахара по настоящему изобретению является химической модификацией сахара нуклеотидов и обычно включает, но ими не ограничивается, модификации сахара, выбранные из группы, состоящей из 2'-дезокси-2'-фтор-олигорибонуклеотида (2'-фтор-2'-дезоксицитидин-5'-трифосфата, 2'-фтор-2'-дезоксиуридин-5'-трифосфата), 2'-дезокси-2'-деаминолигорибонуклеотида (2'-амино-2'-дезоксицитидин-5'-трифосфата, 2'-амино-2'-дезоксиуридин-5'-трифосфата), 2'-O-алкилолигорибонуклеотида, 2'-дезокси-2'-С-алкилолигорибонуклеотида (2'-O-метилцитидин-5'-трифосфата, 2'-метилуридин-5'-трифосфата), 2'-С-алкилолигорибонуклеотида и его изомеров (2'-арацитидин-5'- трифосфата, 2'-арауридин-5'-трифосфата), или азидотрифосфата (2'-азидо-2'-дезоксицитидин-5'-трифосфата, 2'-азидо-2'-дезоксиуридин-5'-трифосфата).
Последовательность РНК патентоспособной иммуностимулирующей композиции, согласно описанному в настоящем изобретении, предпочтительно по меньшей мере одна (и)РНК адъювантного компонента и/или по меньшей мере одна свободная иРНК патентоспособной иммуностимулирующей композиции, могут дополнительно или в другом варианте также содержать по меньшей мере одну модификацию основания, которая предпочтительно применима для повышения экспрессии белка, кодируемого последовательностью РНК, предпочтительно по меньшей мере одной (и)РНК адъювантного компонента, что существенно по сравнению с неизмененной, т.е. природной (= нативной) последовательностью РНК. Важным в этом случае является повышение экспрессии белка по сравнению с экспрессией нативной последовательности РНК по меньшей мере на 20%, предпочтительно по меньшей мере на 30%, 40%, 50% или 60%, более предпочтительно по меньшей мере на 70%, 80%, 90% или даже 100% и наиболее предпочтительно по меньшей мере на 150%, 200% или даже 300%. В связи с настоящим изобретением нуклеотид, имеющий модификацию основания, предпочтительно выбран из группы модифицированных по основанию нуклеотидов, включающей 2-амино-6-хлорпуринрибозид-5'-трифосфат, 2-аминоаденозин-5'-трифосфат, 2-тиоцитидин-5'-трифосфат, 2-тиоуридин-5'-трифосфат, 4-тиоуридин-5'-трифосфат, 5-аминоаллилцитидин-5'-трифосфат, 5-аминоаллилуридин-5'-трифосфат, 5-бромцитидин-5'-трифосфат, 5-бромуридин-5'-трифосфат, 5-йодоцитидин-5'-трифосфат, 5-йодоуридин-5'-трифосфат, 5-метилцитидин-5'-трифосфат, 5-метилуридин-5'-трифосфат, 6-азацитидин-5'-трифосфат, 6-азауридин-5'-трифосфат, 6-хлорпуринрибозид-5'-трифосфат, 7-дезазааденозин-5'-трифосфат, 7-дезазагуанозин-5'-трифосфат, 8-азааденозин-5'-трифосфат, 8-азидоаденозин-5'-трифосфат, бензимидазол-рибозид-5'-трифосфат, N1-метиладенозин-5'-трифосфат, N1-метилгуанозин-5'-трифосфат, N6-метиладенозин-5'-трифосфат, O-6-метилгуанозин-5'-трифосфат, псевдоуридин-5'-трифосфат, или пуромицин-5'-трифосфат, ксантозин-5'-трифосфат. Особое предпочтение получают нуклеотиды, имеющие модификации оснований, предпочтительно выбранных из группы модифицированных по основанию нуклеотидов, состоящих из 5-метилцитидин-5'-трифосфата, 7-деазагуанозин-5'-трифосфата, 5-бромцитидин-5'-трифосфата и псевдоуридин-5'-трифосфата.
В одном из вариантов осуществления настоящего изобретения последовательность РНК согласно описанному в настоящем изобретении, предпочтительно по меньшей мере одна (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции и/или по меньшей мере одна свободная иРНК патентоспособной иммуностимулирующей композиции включает от 0,1% до 100% (модифицированных) нуклеотидов, выбранных из (модифицированных) нуклеотидов, согласно описанному выше, что касается немодифицированной, т.е. нативной, последовательности РНК, причем предпочтительно от 0,1% до 100% каждого нативного немодифицированного нуклеотида АТР, GTP, СТР, UTP (и/или ТТР) последовательности РНК согласно описанному в настоящем изобретении, предпочтительно по меньшей мере одна (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции и/или по меньшей мере одна свободная иРНК патентоспособной иммуностимулирующей композиции, или ее соответствующая ДНК-матрица, может быть модифицирована, используя соответствующие модифицированные нуклеотиды согласно описанному выше, более предпочтительно между 0,1% и 20%, между 10% и 30%, между 20% и 40%, между 30% и 50%, между 40% и 60%, между 50% и 70%, между 60% и 80%, между 70% и 90%, или между 80% и 100% или по меньшей мере 10%, более предпочтительно по меньшей мере 30%, более предпочтительно по меньшей мере 40%, более предпочтительно по меньшей мере 60%, более предпочтительно по меньшей мере 70%, более предпочтительно по меньшей мере 80% и более предпочтительно по меньшей мере 90% и наиболее предпочтительно 100% каждого нативного немодифицированного нуклеотида АТР, GTP СТР, UTP (и/или ТТР) немодифицированной РНК.
В другом предпочтительном варианте осуществления настоящего изобретения содержание A/U в среде сайта связывания рибосомы последовательности РНК (необязательно уже GC-стабилизированной) согласно описанному в настоящем изобретении, предпочтительно по меньшей мере одна (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции и/или по меньшей мере одна свободная иРНК патентоспособной иммуностимулирующей композиции, повышено по сравнению с содержанием A/U в среде сайта связывания рибосомы этой определенной последовательности нативной РНК. Эта модификация (повышенное содержание A/U вокруг сайта связывания рибосомы) повышает эффективность связывания рибосомы с последовательностью РНК. Эффективное связывание рибосом с сайтом связывания рибосом (последовательность по классификации Kozak: GCCGCCACCAUGG (SEQ ID NO:122), триплет AUG формирует стартовый кодон) в свою очередь обладает способностью по эффективной трансляции последовательности РНК согласно описанному в настоящем изобретении.
В еще одном из вариантов осуществления настоящего изобретения последовательность РНК согласно описанному в настоящем изобретении, предпочтительно по меньшей мере одна (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции и/или по меньшей мере одна свободная иРНК патентоспособной иммуностимулирующей композиции, может быть дополнительно модифицирована в том, что касается потенциально дестабилизирующих элементов последовательности. В частности, кодирующая область и/или 5'- и/или 3'-нетранслируемой области последовательности РНК, согласно описанному в настоящем изобретении, может быть дополнительно модифицирована по сравнению с соответствующей последовательностью нативной РНК таким образом, что она не содержит элементы дестабилизирующей последовательности, кодируемая аминокислотная последовательность РНК, согласно описанному в настоящем изобретении, предпочтительно не модифицирована по сравнению с соответствующей нативной РНК. Известно, например, что в последовательностях эукариотических РНК имеются элементы дестабилизирующей последовательности (ЭДП), с которыми связываются сигнальные белки и регулируют ферментативное разрушение РНК in vivo. Для дальнейшей стабилизации последовательности РНК, согласно описанному в настоящем изобретении, необязательно в области, которая кодирует белок, соответственно может присутствовать одна или несколько таких дополнительных модификаций по сравнению с соответствующей областью нативной РНК, причем в ней практически не содержатся элементы дестабилизирующей последовательности. По настоящему изобретению последовательности ЭДП, содержащиеся в нетранслируемых областях (3'- и/или 5'-UTR), также могут элиминировать из последовательности РНК, согласно описанному в настоящем изобретении, предпочтительно из по меньшей мере одной (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции и/или из по меньшей мере одной свободной иРНК патентоспособной иммуностимулирующей композиции, с помощью таких дополнительных модификаций.
Такими дестабилизирующими последовательностями являются, например, AU-обогащенные последовательности (AU-rich sequences - AURES), которые присутствуют в 3'-UTR частях многочисленных нестабильных РНК (Caput и др., Proc. Natl. Acad. Sci. USA 83, 1986, cc.1670-1674). Поэтому последовательность РНК, согласно описанному в настоящем изобретении, предпочтительно по меньшей мере одна (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции и/или по меньшей мере одна свободная иРНК патентоспособной иммуностимулирующей композиции, предпочтительно (дополнительно) модифицирована по сравнению с нативной РНК таким образом, что модифицированная РНК не содержит таких дестабилизирующих последовательностей. Это также применимо к тем мотивам последовательностей, которые распознаются возможными эндонуклеазами, например, последовательность GAACAAG, которая содержится в 3'-UTR сегменте гена, который кодирует рецептор трансферина (Binder и др., EMBO J. 13, 1994, cc.1969-1980). Эти мотивы последовательностей согласно настоящему изобретению предпочтительно также удалены из последовательности РНК, согласно описанному в настоящем изобретении, предпочтительно по меньшей мере одной (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции и/или по меньшей мере одной свободной иРНК патентоспособной иммуностимулирующей композиции.
Кроме того, предпочтительно в настоящем изобретении, если последовательность РНК, согласно описанному в настоящем изобретении, предпочтительно по меньшей мере одна (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции и/или по меньшей мере одна свободная иРНК патентоспособной иммуностимулирующей композиции, содержит в дополнительной модифицированной формы по меньшей мере один сайт IRES, согласно описанному выше, и/или по меньшей мере одну 5'- и/или 3'-стабилизированную последовательность, например, для повышения связывания рибосомы или для осуществления экспрессии разных кодируемых белков, например, антител, белков терапевтического действия или антигенов, согласно описанному выше, локализованных по меньшей мере в одной (би- или даже полицистронной) РНК, согласно описанному выше.
По настоящему изобретению последовательность РНК, согласно описанному в настоящем изобретении, предпочтительно по меньшей мере одна (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции и/или по меньшей мере одна свободная иРНК патентоспособной иммуностимулирующей композиции, кроме того предпочтительно может иметь по меньшей мере одну 5'- и/или 3'-стабилизирующую последовательность. Такие стабилизирующие последовательности в 5'- и/или 3'-нетранслируемых областях обладают свойством повышения периода полураспада РНК, согласно описанному в настоящем изобретении, в цитозоле. Такие стабилизирующие последовательности могут иметь 100% гомологию последовательности к природным последовательностям, которые имеются у вирусов, бактерий и эукариот, но также могут быть частично или полностью синтетическими. Нетранслируемые последовательности (untranslated sequences - UTR) гена β-глобина, например, из Homo sapiens или Xenopus laevis, могут быть указаны в качестве примера стабилизирующих последовательностей, которые могут применяться в настоящем изобретении для дополнительно стабилизированной последовательности РНК, согласно описанному в настоящем изобретении, предпочтительно дополнительно стабилизированной по меньшей мере одной (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции и/или дополнительно стабилизированной по меньшей мере одной свободной иРНК патентоспособной иммуностимулирующей композиции. Другой пример стабилизирующей последовательности имеет общую формулу (C/U)CCANxCCC(U/A)PyxUC(C/U)CC (SEQ ID NO:123) и содержится в области 3'UTR высоко стабильной РНК, которая кодирует α-глобин, α(I)-коллаген, 15-липоксигеназу или тирозингидроксилазу (сравните с публикацией Holcik и др., Proc. Natl. Acad. Sci. USA 94, 1997, cc.2410-2414). Безусловно, такие стабилизирующие последовательности используют индивидуально или в комбинации с другими последовательностями, а также в комбинации с другими стабилизирующими последовательностями, известными специалистам в данной области. Поэтому последовательность РНК согласно описанному в настоящем изобретении, предпочтительно по меньшей мере одна (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции и/или по меньшей мере одна свободная иРНК патентоспособной иммуностимулирующей композиции, предпочтительно содержится в качестве глобин-UTR-стабилизированной РНК.
Какая-либо из указанных выше модификаций может применяться в отношении последовательности РНК, согласно описанному в настоящем изобретении, предпочтительно по меньшей мере одной (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции и/или по меньшей мере одной свободной иРНК патентоспособной иммуностимулирующей композиции, и дополнительно в отношении какой-либо РНК, используемой в контексте настоящего изобретения, и может при необходимости комбинироваться друг с другом в какой-либо комбинации при условии, что эти комбинации модификаций не интерферируют друг с другом в соответствующей модифицированной РНК. Специалист в данной области соответственно может сделать свой выбор.
По настоящему изобретению последовательность РНК, предпочтительно по меньшей мере одна (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции и/или по меньшей мере одна свободная иРНК патентоспособной иммуностимулирующей композиции, может быть получена, используя какую-либо последовательность природной или синтетической ДНК или РНК, используемой в настоящей области в качестве матрицы, т.е. какую-либо соответствующую (дезокси)рибонуклеиновую кислоту. Такие природные или синтетические последовательности ДНК или РНК могут быть получены из какого-либо синтетического или природного источника, доступного специалисту, например, могут быть получены из белковой или пептидной библиотеки или могут быть транскрибированы из библиотеки нуклеиновых кислот, например, из библиотеки кДНК, или могут быть получены из какой-либо живой или мертвой ткани, из образца, полученного, например, от человека, животного или бактерии. В другом варианте последовательность РНК, описанная в настоящем изобретении, предпочтительно по меньшей мере одной (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции и/или по меньшей мере одной свободной иРНК патентоспособной иммуностимулирующей композиции, может быть получена синтетически методами, известными специалистам в данной области, например, твердофазным синтезом или каким-либо другим соответствующим методом получения последовательностей нуклеиновой кислоты, в частности последовательностей РНК. Кроме того, замещения, вставки или элиминации нуклеотидов или оснований в таких последовательностях предпочтительно выполняют, используя матрицу ДНК для получения РНК по описанию настоящего изобретения или методами известного сайт-направленного мутагенеза или с применением стратегии олигонуклеотидного лигирования (см., например, кн.: Maniatis и др. «Molecular Cloning: A Laboratory Manual», 2001, 3-е изд., изд-во Cold Spring Harbor Laboratory Press, Cold Spring Harbor, Нью-Йорк). Модификация (модификации) последовательности РНК, описанные в настоящем изобретении, предпочтительно по меньшей мере одна (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции и/или по меньшей мере одна свободная иРНК патентоспособной иммуностимулирующей композиции, также может быть интродуцирована в РНК с помощью дополнительных методов, известных специалистам в данной области. Соответствующими методами являются, например, методы синтеза, использующие (автоматические или полуавтоматические) устройства синтеза олигонуклеотидов, биохимические методы, например, методы транскрипции in vitro и др. В связи с этим предпочтительно могут применяться в случае (относительно коротких) последовательностей, длина которых обычно не превышает 50-100 нуклеотидов, методы синтеза, использующие (автоматические или полуавтоматические) устройства синтеза олигонуклеотидов, а также методы транскрипции in vitro. В случае (относительно длинных) последовательностей, например, последовательностей длиной более 50-100 нуклеотидов, биохимические методы являются предпочтительно применимыми, например, методы транскрипции in vitro. Однако еще более длинные модифицированные по основаниям молекулы РНК могут быть синтезированы путем ковалентного соединения различных синтетических фрагментов.
Выше указано, что патентоспособная иммуностимулирующая композиция включает а) адъювантный компонент и б) по меньшей мере одну свободную иРНК. В другом варианте осуществления настоящего изобретения патентоспособная иммуностимулирующая композиция может включать дополнительный адъювант, т.е. адъювант, который содержится в патентоспособной иммуностимулирующей композиции дополнительно к адъювантному компоненту, описанному выше. В этом контексте адъювант может означать какое-либо соединение, которое применимо для поддержки введения и необязательно высвобождения патентоспособной иммуностимулирующей композиции по настоящему изобретению. Кроме того, такой адъювант может инициировать или повысить иммунный ответ врожденной иммунной системы, т.е. неспецифический иммунный ответ, но эти функции не являются ограничительными. Иначе говоря, при введении патентоспособная иммуностимулирующая композиция обычно индуцирует врожденный иммунный ответ из-за адъювантного компонента, включающего или состоящего по меньшей мере из одной (и)РНК, объединенной в комплекс с катионным или поликатионным соединением, указанным выше. Однако такой врожденный иммунный ответ может быть повышен добавлением адъюванта, осуществляемым следующим образом. Такой дополнительный адъювант может быть выбран из каких-либо адъювантов, известных специалистам в данной области и применимых в данном случае, поддерживая индукцию врожденного иммунного ответа у млекопитающих, исключая катионные и поликатионные соединения, описанные выше, для предупреждения комплексообразования по меньшей мере одной свободной иРНК. Предпочтительно адъювант может быть выбран из группы, представителями которой перечень не ограничивается, включающей хитозан, TDM, MDP, мурамиловый дипептид, плюроник, раствор квасцов, алюминий гидроксид, ADJUMER™ (полифосфазен); гель фосфата алюминия; глюказы из водорослей; альгаммулин; гель алюминия гидроксида (квасцы); гель алюминия гидроксида, в высокой степени адсорбирующий белок; гель алюминия гидроксида низкой вязкости; AF или SPT (эмульсия сквалана (5%), Tween 80 (0,2%), плюроник L121 (1,25%), фосфатно-солевой буфер, рН 7,4); продукт AVRIDINE™ (пропандиамин); BAY R1005™ ((N-(2-дезокси-2-L-лейциламино-b-D-глюкозопиранозил)-N-октадецил-додеканоил-амид гидроацетат); продукт CALCITRIOL (1-альфа,25-дигидрокси-витамин D3); гель кальция фосфата; наночастицы кальция фосфата (calcium phosphate nanoparticles - САРТМ); голотоксин холеры, гибридный белок холерного токсина-А1-белка-А-D-фрагмента, субъединица В холерного токсина; CRL 1005 (блок-сополимер Р1205); цитокин-содержащие липосомы; диметилдиоктадециламмоний бромид (dimehyldioctadecylammoniumcholine - DDA); дегидроэпиандростерон (dehydroepiandrosterone - DHEA); димиристоилфосфатидилхолин (dimyristoylphosphatidylcholine - DMPC); димиристоилфосфатидилглицерин (dimyristoylphosphatidylglycerol - DMPG); комплекс натриевой соли дезоксихолевой кислоты с квасцами (deoxicholic acid sodium salt - DOC); полный адъювант Фройнда; неполный адъювант Фройнда; гамма инулин; адъювант Gerbu (смесь: i) N-ацетилглюкозаминил-(Р1-4)-N-ацетилмурамил-L-аланил-D-глутамина (N-ацетилглюкозаминил-(Р1-4)-N-ацетилмурамил-L-alanyl-D-glutamine - GMDP), ii) диметилдиоктадециламмоний хлорида (dimethyldioctadecylammonium chloride - DDA), iii) комплекса соли цинка-L-пролина (ZnPro-8); GM-CSF); GMDP (N-ацетилглюкозаминил-(b1-4)-N-ацетилмурамил-L-alanyl-D-изоглютамин); имиквимод (1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-4-амин); продукт ImmTher™ (N-ацетилглюкозаминил-N-ацетилмурамил-L-Ala-D-изоGlu-L-Ala-глицерин дипальмитат); иммунолиписомы, полученные из везикул дегидратации-регидратации (immunoliposomes prepared from dehydration-rehydration vesicles - DRY); интерферон гамма; интерлейкин-1бета; интерлейкин-2; интерлейкин-7; интерлейкин-12; продукт ISCOMS™; продукт ISCOPREP 7.0.3.™; липосомы; продукт LOXORIBINE™ (7-аллил-8-оксогуанозин); оральный адъювант LT (лабильный энтеротоксин-протоксин E. coli); микросферы и микрочастицы какой-либо композиции; продукт MF59™; (эмульсия сквалена-воды); продукт MONTANIDE ISA 51™ (очищенный неполный адъювант Фройнда); продукт MONTANIDE ISA 720™ (адъювант в виде метаболизируемого масла); продукт MPL (3-Q-десацил-4'-монофосфорильный липид А); МТР-РЕ ((N-ацетил-L-аланил-D-изоглютаминил-L-аланин-2-(1,2-дипальмитоил-sn-глицеро-3-(гидроксифосфорилокси))-этиламид, однонатриевая соль) и липосомы МТР-РЕ; продукт MURAMETIDE™ (Nac-Mur-L-Ala-D-Gln-OCH3); продукт MURAPALMITINE™ и продукт D-MURAPALMITINE™ (Nac-Mur-L-Thr-D-изоGIn-sn-глицеролдипальмитоил); нейраминидаза-галактоксидаза (NAGO - neuraminidase-galactose oxidase); наносферы или наночастицы какой-либо композиции; неионные поверхностно активные везикулы (NISV - non-ionic surfactant vesicles); продукт PLEURAN™ (β-глюкан); PLGA, PGA и PLA (гомо- и сополимеры молочной кислоты и гликолевой кислоты; микросферы/наносферы); продукт PLURONIC L121™; PMMA (полиметил метакрилат); продукт PODDS™ (протеинированные микросферы); производные полиэтиленкарбамата; поли-rA: поли-rU (комплекс полиадениловая кислота-полиуридиловая кислота); полисорбат 80 (Tween 80); белковые кохлеаты cochleates (фирма Avanti Polar Lipids, Inc., Alabaster, Алабама); продукт STIMULON™ (QS-21); Quil-A (Quil-A saponin); S-28463 (4-амино-otec-диметил-2-этоксиметил-1Н-имидазо[4,5-с]хинолин-1-этанол); SAF-1™ (адъювантный состав фирмы Syntex - Syntex adjuvant formulation); протеолипосомы Sendai и Sendai-содержащие липидные матрицы; Span-85 (сорбитан триолеат); Specol (эмульсия Marcol 52, Span 85 и Tween 85); сквален или продукт Robane® (2,6,10,15,19,23-гексаметилтетракозан и 2,6,10,15,19,23-гексаметил-2,6,10,14,18,22-тетракозагексан); стеарилтирозин (октадецилтирозин гидрохлорид); продукт Theramid® (N-ацетилглюкозаминил-N-ацетилмурамил-L-Ala-D-isoGlu-L-Ala-дипальмитоксипропиламид); теронил-MDP (продукт Termurtide™ или [thr 1]-MDP; N-ацетилмурамил-L-треонил-D-изоглютамин); частицы Ty (Ty-VLP или вирусоподобные частицы); липосомы Walter-Reed (липосомы, содержащие липид А, адсорбированный на алюминии гидроксиде), и липопептиды, включая Pam3Cys, в частности соли алюминия, например, Adju-phos, Alhydrogel, Rehydragel; эмульсии, включая CFA, SAF, IFA, MF59, Provax, TiterMax, Montanide, Vaxfectin; сополимеры, включая Optivax (CRL1005), L121, Poloaxmer4010) и др.; липосомы, включая Stealth, кохлеаты, включая BIORAL; адъюванты растительного происхождения, включая QS21, Quil A, Iscomatrix, ISCOM; адъюванты, пригодные для совместной стимуляции, включая томатин, биополтимеры, включая PLG, РММ, инулин; адъюванты микробного происхождения, включая ромуртид, DETOX, MPL, CWS, маннозу, последовательности CpG нуклеиновой кислоты, CpG7909, лиганды рецепторов человека TLR 1-10, лиганды рецепторов мыши TLR 1-13, ISS-1018, IC31, имидазолхинолины, Ampligen, Ribi529, IMOxine, IRIVs, VLPs, холерный токсин, термолабильный токсин, Pam3Cys, флагеллин, якорь GPI, LNFPIII/Lewis X, антимикробные пептиды, UC-1V150, гибридный белок RSV, cdiGMP; и адъюванты, применимые в качестве антагонистов, включая нейропептид CGRP. Соответствующие адъюванты, кроме того, могут быть выбраны из липидных модифицированных нуклеиновых кислот или из каких-либо иммуностимулирующих последовательностей формулы (I), (II), (III), (IIIa), (IV), (IVa), (IVб), (Va) и/или (Vб), согласно описанному выше.
В другом варианте осуществления настоящего изобретения также предусмотрены фармацевтические композиции, представляющие патентоспособные иммуностимулирующие композиции согласно описанному выше и необязательно фармацевтически приемлемый носитель и/или растворитель.
В качестве первого ингредиента патентоспособные фармацевтические композиции включает патентоспособные иммуностимулирующие композиции, согласно описанному выше, т.е. а) адъювантный компонент, включающий или состоящий по меньшей мере из одной (и)РНК, объединенной в комплекс с катионным или поликатионным соединением, и б) по меньшей мере одну свободную иРНК, кодирующую по меньшей мере один белок терапевтического действия, антиген и/или антитело, причем иммуностимулирующие композиции способны индуцировать или повысить врожденный и необязательно адаптивный иммунный ответ у млекопитающих. Соответственно, патентоспособная фармацевтическая композиция обычно поддерживает врожденный и необязательно адаптивный иммунный ответ иммунной системы пациента, подвергнутого лечению.
Кроме того, патентоспособная фармацевтическая композиция может включать фармацевтически приемлемый носитель и/или растворитель. В контексте настоящего изобретения фармацевтически приемлемый носитель обычно включает жидкую или нежидкую основу патентоспособной фармацевтической композиции. Если патентоспособная фармацевтическая композиция предусмотрена в жидкой форме, носителем обычно может быть апирогенная вода; изотонические или буферные (водные) растворы, например, фосфатов, цитратов и др. буферные растворы. Особенно для инъекций патентоспособной фармацевтической композиции могут применять воду или предпочтительно буфер, более предпочтительно водный буфер, содержащий натриевую соль, предпочтительно по меньшей мере 50 мМ натриевую соль, кальциевую соль, предпочтительно по меньшей мере 0,01 мМ кальциевую соль, и необязательно калиевую соль, предпочтительно по меньшей мере 3 мМ калиевую соль. В предпочтительном варианте осуществления настоящего изобретения соли натрия, кальция и необязательно калия могут присутствовать в форме галогенидов, например, хлоридов, иодидов или бромидов, в форме их гидроксидов, карбонатов, гидрокарбонатов или сульфатов и др. К примерам натриевых солей относятся, например, NaCl, NaI, NaBr, Na2CO3, NaHCO3, Na2SO4, к примерам необязательных калиевых солей относятся, например, KCl, KI, KBr, К2СО3, КНСО3, K2SO4, и к примерам кальциевых солей относятся, например, CaCl2, CaI2, CaBr2, СаСО3, CaSO4, Ca(OH)2, однако указанными солями перечень не ограничивается. Кроме того, органические анионы указанных выше катионов могут содержаться в буфере. В более предпочтительном варианте осуществления настоящего изобретения буфер для инъекций, согласно описанному выше, может содержать соли, выбранные из натрия хлорида (NaCl), кальция хлорида (CaCl2) и необязательно калия хлорида (KCl), причем к хлоридам могут быть добавлены другие анионы. CaCl2 также может быть замещен другой солью, например, KCl. Обычно соли в инъекционном буфере содержатся в концентрации по меньшей мере 50 мМ натрия хлорида (NaCl), по меньшей мере 3 мМ калия хлорида (KCl) и по меньшей мере 0,01 мМ кальция хлорида (CaCl2). Инъекционный буфер может быть гипертоническим, изотоническим или гипотоническим относительно специфической референсной среды, т.е. буфер может иметь повышенную, идентичную или пониженную концентрацию солей относительно специфической референсной среды, причем предпочтительно такие концентрации указанных выше солей могут применяться, которые не приводят к разрушению клеток из-за осмоса или других эффектов, связанных с концентрацией. Референсные среды, например, жидкости для методов «in vivo», например, кровь, лимфа, цитозоли или другие жидкости тела, или, например, жидкости, которые могут применяться в качестве референсных сред в методах ((in vitro», например, распространенные буферы или жидкости. Такие распространенные буферы или жидкости известны специалистам. Раствор Рингера или раствор лактата Рингера особенно предпочтительны в качестве жидкой основы.
Однако, один или более совместимых твердых или жидких наполнителей, или разбавителей, или инкапсулируемых соединений также можно применять для патентоспособной фармацевтической композиции, которая применима для введения пациенту, подвергаемому лечению. Понятие «совместимый», используемое в настоящем изобретении, означает, что эти компоненты патентоспособной фармацевтической композиции могут быть перемешаны с последовательностью РНК согласно описанному в настоящем изобретении, предпочтительно по меньшей мере с одной (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции, объединенной в комплекс с катионным или поликатионным соединением, и по меньшей мере с одной свободной иРНК патентоспособной иммуностимулирующей композиции таким образом, что отсутствуют взаимодействия, которые могут существенно снизить фармацевтическую эффективность патентоспособной фармацевтической композиции в обычных условиях применения. Фармацевтически приемлемые носители, наполнители и разбавители, безусловно, должны иметь существенную высокую чистоту и существенно низкую токсичность, что делает их применимыми для введения субъекту, подвергаемому лечению. Примерами соединений, которые могут применяться в качестве фармацевтически приемлемых носителей, наполнителей или компонентов, являются сахара, например, лактоза, глюкоза и сахароза; крахмалы, например, кукурузный крахмал или картофельный крахмал; целлюлоза и ее производные, например, натриевая соль карбоксиметилцеллюлозы, этилцеллюлоза, ацетат целлюлозы; порошковый трагакант; солод; желатин; жир; твердые агенты скольжения, например, стеариновая кислота, магний стеарат; кальций сульфат; растительные масла, например, арахисовое масло, хлопковое масло, кунжутное масло, оливковое масло, кукурузное масло и масло какао; многоатомные спирты, например, полипропиленгликоль, глицерин, сорбит, манит и полиэтиленгликоль; альгиновая кислота.
Патентоспособные фармацевтические композиции могут вводиться перорально, парентерально, путем ингаляции, местно, ректально, назально, буккально, вагинально или имплантацией резервуара. В контексте настоящего изобретения понятие «парентерально» включает подкожные, внутривенные, внутримышечные, внутрисуставные, надчревные, внутриоболочечные, внутрипеченочные, внутрираневые, внутричерепные, чрескожные, внутрикожные, внутрилегочные, внутрибрюшинные, внутрисердечные, внутриартериальные и подъязычные инъекции или инфузии.
Предпочтительно патентоспособные фармацевтические композиции могут вводиться парентеральной инъекцией, более предпочтительно подкожной, внутривенной, внутримышечной, внутрисуставной, надчревной, внутриоболочечной, внутрипеченочной,внутрираневой, внутричерепной, чрескожной, внутрикожной, внутрилегочной, внутрибрюшинной, внутрисердечной, внутриартериальной и подъязычной инъекцией или инфузией. Стерильные инъекционные формы патентоспособных фармацевтических композиций могут быть водными или масляными суспензиями. Такие суспензии могут быть переработаны методами, известными в данной области, используя соответствующие диспергирующие или увлажняющие агенты. Стерильный инъекционный препарат также может быть стерильным инъекционным раствором или суспензией в нетоксичном пригодным для парентерального применения разбавителе или растворителе, например, раствор в 1,3-буиандиоле. Среди приемлемых растворителей находятся вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла обычно используют в качестве среды для растворения или суспендирования. Для этой цели может быть использовано какое-либо обычное нелетучее масло, включая синтетические моно- или диглицериды. Жирные кислоты, например, олеиновая кислота и ее глицеридные производные, применимы для получения инъекционных форм, поскольку они являются природными фармацевтически приемлемыми маслами, например, оливковым маслом или касторовым маслом, особенно в их полиоксиэтилированных версиях. Эти растворы или суспензии также могут содержать длинноцепочечный спиртовой растворитель или диспергирующий агент, например, карбоксиметилцеллюлозу или сходные диспергирующие агенты, которые обычно используют в составе фармацевтически приемлемых дозированных форм, включая эмульсии и суспензии. Другие обычно используемые поверхностно активные вещества, например, твины, спаны и другие эмульгирующие агенты или усилители биодоступности, которые обычно используют при получении фармацевтически приемлемых твердых, жидких или иных форм, также могут применяться для состава патентоспособных фармацевтических композиций.
Патентоспособные фармацевтические композиции, описанные выше, также могут быть введены перорально в какой-либо приемлемой для перорального введения дозированной форме, включая, но ими не ограничиваясь, капсулы, таблетки, водные суспензии или растворы. В случае таблеток для перорального применения в качестве носителей обычно используют лактозу и картофельный крахмал. Также обычно добавляют смазывающие агенты, например, магний стеарат. Для перорального введения в форме капсул применимые разбавители включают лактозу и высушенных крахмал. Если водные суспензии требуются для перорального введения, действующие ингредиенты, т.е. по меньшей мере одна (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции и/или по меньшей мере одна свободная иРНК патентоспособной иммуностимулирующей композиции, формирующие часть патентоспособных фармацевтических композиций, согласно описанному выше, комбинируют с эмульгирующими и суспендирующими агентами. По желанию могут быть добавлены также подсластители, ароматизаторы или красители.
Патентоспособные фармацевтические композиции также могут вводиться местно, особенно если мишень для обработки включает области и органы, легко доступные при местном применении, например, при болезни кожи или какой-либо другой доступной эпителиальной ткани. Соответствующие местные составы легко приготовить для каждой из таких областей или органов. Для местных применений патентоспособные фармацевтические композиции могут быть переработаны в соответствующую мазь, содержащую патентоспособную иммуностимулирующую композицию, особенно ее компоненты, согласно описанному выше, суспендированные или растворенные в одном или нескольких носителях. Носителями для местного применения могут быть, но ими перечень не ограничивается, минеральное масло, жидкий вазелин, белый вазелин, пропиленгликоль, полиоксиэтилен, полиоксипропилен, эмульгирующий воск и вода. В другом варианте патентоспособные фармацевтические композиции могут быть переработаны в соответствующем лосьоне или мази. В этом контексте настоящего изобретения соответствующим носителями являются, но ими не ограничиваются, минеральное масло, сорбит моностеарат, полисорбат 60, воск цетиловых эфиров, цетаариловый спирт, 2-октилдодеканол, бензиловый спирт и вода.
Патентоспособные фармацевтические композиции обычно включают «безопасное и эффективное количество» компонентов патентоспособных фармацевтических композиций, особенно по меньшей мере одной (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции, объединенной в комплекс с катионным или поликатионным соединением, и/или по меньшей мере одной свободной иРНК патентоспособной иммуностимулирующей композиции. В контексте настоящего изобретения «безопасное и эффективное количество» означает количество по меньшей мере одной (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции, объединенной в комплекс с катионным или поликатионным соединением, и/или по меньшей мере одной свободной иРНК патентоспособной иммуностимулирующей композиции, которое достаточно для существенной индукции положительной модификации заболевания или расстройства, согласно описанному в настоящем изобретении. В то же время, однако, «безопасное и эффективное количество» оказывается достаточно малым, чтобы избежать тяжелых побочных эффектов, иначе говоря, это количество допускает разумную взаимосвязь между преимуществом и риском. Определение таких пределов обычно лежит в области добросовестной медицинской оценки. «Безопасное и эффективное количество» компонентов патентоспособных фармацевтических композиций, особенно по меньшей мере одной (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции, объединенной в комплекс с катионным или поликатионным соединением, и/или по меньшей мере одной свободной иРНК патентоспособной иммуностимулирующей композиции, в настоящем изобретении может кроме того варьировать в связи с определенным состоянием, подвергаемым лечению, а также в связи с возрастом и физическим состоянием пациента, подвергаемого лечению, массой тела, общим состоянием здоровья, полом, питанием, временем введения, скоростью экскреции, комбинацией лекарственных средств, действием специфических (и)РНК или иРНК, согласно указанному в настоящем изобретении применению, тяжестью состояния, длительностью лечения, природой сопутствующей терапии, используемыми определенными фармацевтически приемлемыми носителями и сходными факторами, в рамках знаний и опыта лечащего врача. Патентоспособные фармацевтические композиции могут применяться для людей, а также для ветеринарных целей, предпочтительно для медицинских целей, обычно в виде фармацевтических композиций или вакцин.
В одном из вариантов осуществления настоящего изобретения патентоспособные фармацевтические композиции могут быть предусмотрены в виде вакцины. Такая патентоспособная вакцина обычно составлена в качестве патентоспособной фармацевтической композиции и предпочтительно поддерживает по меньшей мере врожденный иммунный ответ пациента, подвергаемого лечению. Кроме того, патентоспособная вакцина может индуцировать адаптивный иммунный ответ, предпочтительно, если (по меньшей мере одна (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции, объединенной с катионным или поликатионным соединением, и/или предпочтительно) по меньшей мере одна свободная иРНК патентоспособной иммуностимулирующей композиции кодирует какой-либо из указанных выше антигенов (или антител), которые индуцируют адаптивный иммунный ответ.
Патентоспособная вакцина также может включать фармацевтически приемлемый носитель, адъювант и/или растворитель, согласно описанному выше, для патентоспособной фармацевтических композиции. В определенном контексте патентоспособной вакцины выбор фармацевтически приемлемого носителя в принципе определяется методом введения вакцины. Патентоспособная вакцина может вводиться, например, системно или местно. Способы системного введения в целом включают, например, чрескожный, пероральный способы введения, включая подкожные, внутримышечные, внутрикожные и внутрибрюшинные инъекции и/или интраназальные способы введения. Способы местного введения в целом включают, например, местное введение, а также внурикожные, чрескожные, подкожные или внутримышечные инъекции или внутрираневые, внутрилегочные, внутрисердечные и подъязычные инъекции. Более предпочтительно вакцины могут вводиться внутрикожно, подкожно или внутримышечно. Патентоспособные вакцины таким образом предпочтительно перерабатывают в жидкую (или иногда в твердую) форму. Соответствующее количество вводимой вакцины может быть определено в обычных экспериментах на животных моделях. К таким моделям относятся, но ими не ограничиваются, модельные кролики, овцы, мыши, крысы, собаки и приматы (за исключением людей). К предпочтительным единичным дозированным формам для инъекций относятся стерильные водные растворы, физиологический раствор или их смеси. Величина рН таких растворов должна быть доведена примерно до 7,4. Соответствующие носители для инъекций включают гидрогели, устройства для контролируемого или отсроченного высвобождения, полимасляную кислоту и коллагеновые матрицы. К соответствующим фармацевтическим носителям для местного применения относятся те носители, которые применимы для использования в лосьонах, мазях, гелях и др. Если патентоспособную вакцину вводят перорально, предпочтительными единичными дозированными формами являются таблетки, капсулы и др. формы. Фармацевтически приемлемыми носителями для получения единичных дозированных форм, которые могут применяться для перорального введения, известны в предшествующем уровне техники. Их выбор может зависеть от вторичных рассматриваемых обстоятельств, например, от вкуса, стоимости и сохранности, которые не являются принципиально важными для целей настоящего изобретения и могут быть получены без труда специалистами в данной области.
Патентоспособная вакцина может дополнительно содержать одно или несколько вспомогательных веществ для дальнейшего повышения ее иммуногенности. Синергетическое действие по меньшей мере одной (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции, объединенной с катионным или поликатионным соединением, и/или по меньшей мере одной свободной иРНК патентоспособной иммуностимулирующей композиции, согласно описанному выше, и вспомогательного вещества, которое могут необязательно содержаться в патентоспособной вакцине, согласно описанному выше, предпочтительно достигается таким образом. В зависимости от разных типов вспомогательных веществ, могут рассматриваться различные механизмы. Например, соединения, которые допускают созревание дендровидных клеток (ДК), например, липополисахариды, ФНО-альфа или лиганд CD40, формируют первый класс соответствующих вспомогательных веществ. В целом можно использовать в качестве вспомогательного вещества какой-либо агент, который влияет на иммунную систему по типу «сигнала опасности» (LPS, GP96 и др.), или цитокин, например, GM-CFS, которые позволяют иммунный ответ, выработанный адъювантом, стимулирующим иммунную систему по настоящему изобретению, повысить и/или оказать на него иное направленное воздействие. Особенно предпочтительными вспомогательными веществами являются цитокины, например, монокины, лимфокины, интерлейкины или хемокины, которые дополнительно индуцируют врожденный иммунный ответ, например, ИЛ-1, ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-7, ИЛ-8, ИЛ-9, ИЛ-10, ИЛ-12, ИЛ-13, ИЛ-14, ИЛ-15, ИЛ-16, ИЛ-17, ИЛ-18, ИЛ-19, ИЛ-20, ИЛ-21, ИЛ-22, ИЛ-23, ИЛ-24, ИЛ-25, ИЛ-26, ИЛ-27, ИЛ-28, ИЛ-29, ИЛ-30, ИЛ-31, ИЛ-32, ИЛ-33, INF-альфа, ИФН-бета, INF-гамма, GM-CSF, G-CSF, M-CSF, LT-бета или ФНО-альфа, факторы роста, например, факторы роста человека (hGH).
Другими добавками, которые могут быть включены в патентоспособную вакцину, являются эмульгаторы, например, Tween®; увлажняющие агенты, например, натрий лаурилсульфат; красители; вкусовые агенты, фармацевтические носители; агенты для формирования таблеток; стабилизаторы; антиоксиданты; консерванты.
Патентоспособная вакцина также может дополнительно содержать какое-либо соединение, о котором известно, что оно является иммуностимулирующим благодаря присущему ему связывающему сродству (в качестве лиганда) в отношении Толл-подобных рецепторов человека TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, или благодаря присущему ему связывающему сродству (в качестве лиганда) в отношении Толл-подобных рецепторов мыши TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, TLR11, TLR12 или TLR13.
В данном контексте другим классом соединений, которые могут быть добавлены к патентоспособной вакцине, могут быть нуклеиновые кислоты CpG, в частности CpG-PHK или CpG-DNA. CpG-PHK или CpG-ДНК могут быть одноцепочечной CpG-ДНК (ss CpG-DNA), двухцепочечной CpG-DNA (dsDNA), одноцепочечной CpG-PHK (ss CpG-PHK) или двухцепочечной CpG-PHK (ds CpG-РНК). Нуклеиновая кислота CpG предпочтительно содержится в форме CpG-РНК, более предпочтительно в форме одноцепочечной CpG-PHK (ss CpG-PHK). Нуклеиновая кислота CpG предпочтительно содержит по меньшей мере одну или более последовательностей (митогенных) динуклеотидов цитозин/гуанин (мотив (мотивы) CpG). В первом предпочтительном варианте по меньшей мере один мотив CpG, содержащийся в этих последовательностях, а именно С (цитозин) и G (гуанин) мотива CpG, является неметилированным. Все другие цитозины или гуанины, необязательно содержащиеся в этих последовательностях, могут быть или метилированными или неметилированными. В другом предпочтительном варианте, однако, С (цитозин) и G (гуанин) мотив CpG также могут быть в неметилированной форме.
В другом предпочтительном варианте осуществления настоящего изобретения патентоспособная иммуностимулирующая композиция, предпочтительно компоненты патентоспособной иммуностимулирующей композиции, т.е. по меньшей мере одна (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции, объединенная в комплекс с катионным или поликатионным соединением, вместе по меньшей мере с одной свободной иРНК патентоспособной иммуностимулирующей композиции, может применяться для получения фармацевтической композиции или вакцины, которые предпочтительно все соответствуют описанному в настоящем изобретении, для профилактики, лечения и/или облегчения какого-либо из заболеваний и расстройств согласно описанному в настоящем изобретении.
Соответственно, патентоспособные иммуностимулирующие композиции, патентоспособные фармацевтические композиции или патентоспособные вакцины, или по меньшей мере одна (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции, объединенная в комплекс с катионным или поликатионным соединением, вместе по меньшей мере с одной свободной иРНК патентоспособной иммуностимулирующей композиции, могут применяться (препарат или лекарственное средство) для профилактики, лечения и/или облегчения, например, ракового или опухолевого заболевания, предпочтительно выбранного из меланомы, злокачественной меланомы, рака толстой кишки, лимфомы, саркомы, бластомы, рака почки, опухолей кишечника, глиомы, рака простаты, рака мочевого пузыря, опухолей прямой кишки, рака желудка, рака пищевода, рака поджелудочной железы, рака печени, рака груди, рака матки, рака шейки матки, острого миелобластного лейкоза (acute myeloid leukaemia - AML), острого лимфоидного лейкоза (acute lymphoid leukaemia - ALL), хронического миелобластного лейкоза (chronic myeloid leukaemia - CML), хронического лимфолейкоза (chronic lymphocytic leukaemia - CLL), гепатомы, различных индуцированных вирусами опухолей, например, карциномы, индуцированной вирусом папилломы (например, рака шейки матки), аденокарцином, опухолей, индуцированных вирусом герпеса (например, лимфомы Беркитта, В-клеточной лимфомы, индуцированной вирусом EBV), опухолей, индуцированных вирусом гепатита В (гепатоклеточных карцином), HTLV-1- и HTLV-2-индуцированных лимфом, невриномы слухового нерва, карциномы легкого (= рака легкого = бронхиальной карциномы), мелкоклеточного рака легких, рака глотки, анальной карциномы, глиобластомы, рака прямой кишки, астроцитомы, опухолей мозга, ретинобластомы, базалиомы, метастазов мозга, медуллобластомы, рака влагалища, рака поджелудочной железы, рака семенников, синдрома Ходжкина, менингиомы, болезни Шнеебергских рудокопов, опухоли гипофиза, грибовидного микоза, карциноидов, невриномы, шиловидной клеточной карциномы, лимфомы Беркитта, рака гортани, рака почки, тимомы, карциному тела матки, рака костей, неходжкинской лимфомы, рака уретры, синдрома неизвестного первичного рака (CUP - carcinoma unknown primary), опухоли головы/шеи, олигодендроглиомы, рака вульвы, рака кишечника, рака толстой кишки, рака пищевода, бородавок, опухолей тонкого кишечника, краниофагингиомы, рака яичника, опухолей половых органов, рака поджелудочной железы, рака эндометрия, метастаз печени, рака мужского полового члена, рака языка, рака желчного пузыря, лейкоза, плазмоцитомы, рака век, рака простаты (= опухолей простаты) и др.
Кроме того, патентоспособная иммуностимулирующая композиция, патентоспособная фармацевтическая композиция или патентоспособная вакцина, или по меньшей мере одна (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции, объединенная в комплекс с катионным или поликатионным соединением, вместе по меньшей мере с одной свободной иРНК патентоспособной иммуностимулирующей композиции, могут применяться для (получения лекарственного средства для) профилактики, лечения и/или облегчения, например, инфекционных заболеваний, предпочтительно (вирусных, бактериальных или протозойных) инфекционных заболеваний. Такие инфекционные заболевания, предпочтительно (вирусные, бактериальные или протозойные) инфекционные заболевания, обычно выбраны из гриппа, малярии, тяжелого острого респираторного синдрома (ТОРС), желтой лихорадки, СПИДа, лаймского боррелиоза, лейшманиоза, сибирской язвы, менингита, вирусных инфекционных заболеваний, например, СПИДа, инфекции Condyloma acuminata, полых бородавок, лихорадки денге, трехдневной лихорадки, вирусной лихорадки эбола, простуды, раннего летнего менингоэнцефалита (РЛМЭ), гриппа, опоясывающего лишая, гепатита, вируса герпеса I типа, герпеса симплекса II типа, инфекции Herpes zoster, гриппа, японского энцефалита, лихорадки Ласса, марбургской вирусной, кори, ящура, мононуклеоза, свинки, норволкской вирусной инфекции, железистой лихорадки Пфейффера, оспы, полиомиелита (детской хромоты), псевдокрупозной инфекционной эритемы (пятой болезни), бешенства, бородавок, лихорадки Западного Нила, ветрянки, цитомегаловирусной инфекции (cytomegalic virus - CMV), бактериальных инфекционных заболеваний, например, воспаления простаты, сибирской язвы, аппендицита, боррелиоза, ботулизма, инфекции Camphylobacter, инфекции Chlamydia trachomatis (воспаления уретры, конъюнктивита), холеры, дифтерии, венерической гранулемы, эпиглоттита, сыпного тифа, газовой гангрены, гонореи, туляремии, инфекции Heliobacter pylori, коклюша, пахового пораденита, остеомиелита, болезни легионеров, проказы, листериоза, пневмонии, менингита, бактериального менингита, сибирской язвы, отита среднего уха, инфекции Mycoplasma hominis, сепсиса новорожденных (хориоамнионита), влажной гангрены, паратифа, чумы, синдрома Ройтера, пятнистой лихорадки Скалистых Гор, инфекции Salmonella paratyphus, инфекции Salmonella typhus, скарлатины, сифилиса, столбняка, гонореи, цуцугамуши, туберкулеза, тифа, вагинита (кольпита), мягкого шанкра, и инфекционных заболеваний, вызываемых паразитами, простейшими или грибами, например, амебиоза, бульгарциоза, болезни Чагаса, эхинококкоза (Echinococcus), инвазии широким лентецом, отравления рыбой (сигуатеры), инвазии эхинококка, эпидермофитии стопы, инвазии собачьего цепня, кандидоза, дрожжевые микозы, чесотки, кожного лейшманиоза, лямблиоза, педикулеза, малярии, охноцеркоза, грибковых заболеваний, инвазии бычьим цепнем, шистосомоза, инвазии свиным цепнем, токсоплазмоза, трихомониаза, трипаносомоза (сонной болезни), висцерального лейшманиоза, пеленочного дерматита или инвазии карликового цепня.
Кроме того, патентоспособная иммуностимулирующая композиция, патентоспособная фармацевтическая композиция или патентоспособная вакцина, или по меньшей мере одна (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции, объединенная в комплекс с катионным или поликатионным соединением, вместе по меньшей мере с одной свободной иРНК патентоспособной иммуностимулирующей композиции, могут применяться для (получения лекарственного средства для) профилактики, лечения и/или облегчения, например, аутоиммунных заболеваний. Аутоиммунные заболевания могут быть условно поделены на системные и специфичные по органам или локализованные аутоиммунные заболевания, в зависимости от клинико-патологической картины каждого заболевания. Аутоиммунные заболевания могут быть поделены на категории системных синдромов, включая системную красную волчанку, синдром Шегрена, склеродерму, ревматоидный артрит и полимиозит, и локальных синдромов, которые могут быть эндокринными (диабет первого типа (сахарный диабет первого типа), тироидит Хашимото, болезнь Аддисона и др.), кожными (вульгарная пузырчатка), гематологическими (аутоиммунная гемолитическая анемия), нейрональными (рассеянный склероз), или практически любыми синдромами, затрагивающими определенную массу ткани организма. Аутоиммунные заболевания, подвергаемые лечению, могут быть выбраны из группы, состоящей из аутоиммунных заболеваний первого типа, или аутоиммунных заболеваний второго типа, или аутоиммунных заболеваний третьего типа, или аутоиммунных заболеваний четвертого типа, например, рассеянного склероза, ревматоидного артрита, диабета, диабета первого типа (сахарного диабета первого типа), хронического полиартрита, базедовой болезни, аутоиммунных форм хронического гепатита, язвенного колита, аллергий первого типа, аллергий второго типа, аллергий третьего типа, аллергий четвертого типа, фибромиалгии, облесения, болезни Бехтерева, болезни Крона, астенического бульбарного паралича, нейродермита, ревматической полимиалгии, прогрессирующего системного склероза, синдрома Ройтера, ревматического артрита, псориаза, васкулита и др. или диабета второго типа.
Хотя причина индукции иммунной системой иммунной реакции против аутоантигенов до сих пор не объяснена, установлено несколько обстоятельств, связанных с этиологией. Соответственно, аутореакция может быть из-за обходного пути Т-клеток. Нормальная иммунная система требует активирования В-клеток Т-клетками перед выработкой больших количеств антител. Такой рекрутмент Т-клеток может быть обойден в редких случаях, например, при инфицировании организмами, вырабатывающими супер-антигены, которые могут инициировать поликлональное активирование В-клеток, или даже Т-клеток, путем прямого связывания с В-субъединицей рецепторов Т-клеток неспецифическим образом. Другое объяснение рассматривает аутоиммунное заболевание с точки зрения молекулярной мимикрии. Экзогенный антиген может иметь структурное сходство с определенными антигенами хозяина; таким образом, какое-либо антитело, выработанное против этого антигена (которое проявляет мимикрию в отношении собственных антигенов) теоретически также может связываться с антигенами хозяина и увеличивать иммунный ответ. Наиболее удивительную форму молекулярной мимикрии наблюдают в группе А бета-гемолитических стрептококков, которые имеют антигены, близкие антигенам миокардита человека и отвечающие за проявление признаков болезни сердца при ревматической атаке.
Кроме того, патентоспособная иммуностимулирующая композиция, патентоспособная фармацевтическая композиция или патентоспособная вакцина, или по меньшей мере одна (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции, объединенная в комплекс с катионным или поликатионным соединением, вместе по меньшей мере с одной свободной иРНК патентоспособной иммуностимулирующей композиции, могут применяться для (получения лекарственного средства для) профилактики, лечения и/или облегчения аллергий или аллергических заболеваний, т.е. заболеваний, связанных с аллергией. Аллергия - состояние, которое обычно включает нарушенную, приобретенную иммунологическую гиперчувствительность к определенным чужеродным антигенам или аллергенам, например, аллергическим антигенам, согласно описанному выше. Такие аллергические антигены или аллергены могут быть выбраны из аллергических антигенов, согласно описанному выше, антигенов, производных от разных источников, например, от животных, растений, грибов, бактерий и др. В этом контексте к аллергенам относятся, например, травы, пыльца, плесени, лекарства или многочисленные индуцирующие факторы внешней среды и др. Обычно аллергия приводит к местному или системному ответу в виде воспаления на указанные антигены или аллергены и вызывает иммунитет в организме в отношении таких аллергенов. Не приводя теоретических объяснений, полагают, что некоторые механизмы разных заболеваний вовлечены а развитие аллергии. По схеме классификации Р.Gell и R.Coombs понятие «аллергия» ограничивается первым типом гиперчувствительности, которая вызывается классическим механизмом IgE. Геперчувствительность первого типа отличается избыточной активацией тучных клеток и базофилов под действием IgE, вызывая системный воспалительный ответ, который может вызвать слабые симптомы, например, сопливый нос, а также угрожающий жизни анафилактический шок и смерть. К известным типам аллергии относятся, но ими не ограничиваются, аллергическая астма (приводящая к разбуханию носовой слизи), аллергический конъюнктивит (приводящий к покраснению и зуду конъюнктивы), анафилаксия, ангиодэма, атопический дерматит (экзема), крапивница, эозинофилия, респираторные проявления, аллергия на укусы насекомых, кожная аллергия (приводящая к различным сыпям, например, к экземе, крапивнице и (контактному) дерматиту), пищевая аллергия, аллергия на лекарства и др. Кроме того, патентоспособная иммуностимулирующая композиция, патентоспособная фармацевтическая композиция или патентоспособная вакцина, или по меньшей мере одна (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции, объединенная в комплекс с катионным или поликатионным соединением, вместе по меньшей мере с одной свободной иРНК патентоспособной иммуностимулирующей композиции, могут применяться для лечения таких аллергических расстройств или заболеваний, предпочтительно путем десенсибилизации иммунной реакции, которая индуцирует специфический иммунный ответ. Такая десенсибилизация может осуществляться путем введения эффективного количества аллергена или аллергенного антигена, кодируемого РНК патентоспособной иммуностимулирующей композиции, предпочтительно по меньшей мере одной свободной иРНК, для индукции слабой иммунной реакции. Количество аллергена или аллергического антигена затем может быть повышено шаг за шагом при последующих введениях до тех пор, пока иммунная система подвергаемого обработке пациента не выработает устойчивости к специфическому количеству аллергена или аллергического антигена.
В связи с вышесказанным настоящее изобретение также относится к применению патентоспособной иммуностимулирующей композиции, патентоспособной фармацевтической композиции или патентоспособной вакцины, или по меньшей мере одной (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции, объединенной в комплекс с катионным или поликатионным соединением, вместе по меньшей мере с одной свободной иРНК патентоспособной иммуностимулирующей композиции, для профилактики, лечения и/или облегчения заболеваний или расстройств, указанных в настоящем изобретении. Настоящее изобретение также включает применение патентоспособной иммуностимулирующей композиции, патентоспособной фармацевтической композиции или патентоспособной вакцины, или по меньшей мере одной (и)РНК адъювантного компонента патентоспособной иммуностимулирующей композиции, объединенной в комплекс с катионным или поликатионным соединением, вместе по меньшей мере с одной свободной иРНК патентоспособной иммуностимулирующей композиции для инокуляции или применения этих компонентов в качестве инокулята. По одному из особенно предпочтительных вариантов осуществления настоящего изобретения такой способ профилактики, лечения и/или облегчения указанных выше заболеваний или расстройств, или способ инокуляции для предупреждения указанных выше заболеваний, обычно включает введение описанных фармацевтических композиций пациенту, нуждающемуся в этом (например, больному каким-либо из указанных выше заболеваний или с проявлением симптомов таких заболеваний), в частности человеку, предпочтительно в «безопасном и эффективном количестве» в одном из указанных выше составов, согласно описанному выше для патентоспособных фармацевтических композиций. Способ введения также может быть описанным выше для патентоспособных фармацевтических композиций или вакцин.
Настоящее изобретение также относится к способу транскрипции in vitro для получения по меньшей мере одной (и)РНК, объединенной в комплекс с катионным или поликатионным соединением, или по меньшей мере одной свободной иРНК, соответственно, кодирующей по меньшей мере один белок терапевтического действия, антиген и/или антитело, согласно описанному выше, включающий следующие стадии:
а) получения/представления (дезокси)рибонуклеиновой кислоты в качестве матрицы для патентоспособной по меньшей мере одной (и)РНК, объединенной в комплекс с катионным или поликатионным соединением, или по меньшей мере одной свободной иРНК, соответственно, кодирующей по меньшей мере один белок терапевтического действия, антиген и/или антитело, которые обе описаны выше;
б) добавления (дезокси)рибонуклеиновой кислоты в среду для транскрипции in vitro, включающую РНК-полимеразу, соответствующий буфер, смесь нуклеотидов, смесь нуклеотидов, необязательно включающую один или более нуклеотидов с химически модифицированными нуклеозидами, согласно описанному выше, в качестве замещения (частичного или полного) одного или более природных нуклеозидов A, G, U и/или С, и необязательно один или более природных нуклеозидов А, G, U и/или С, если не все природные нуклеозиды А, G, U и/или С подвергаются замещению, и необязательно ингибитор рибонуклеазы;
в) инкубации (дезокси)рибонуклеиновой кислоты в среде для транскрипции in vitro и транскрипции in vitro (дезокси)рибонуклеиновой кислоты; и
г) необязательно очистки и удаления невстроившихся нуклеотидов из среды для транскрипции in vitro.
(Дезокси)рибонуклеиновая кислота, описанная на стадии а) патентоспособного способа транскрипции in vitro, может быть какой-либо нуклеиновой кислотой, согласно описанному выше, которая может использоваться в качестве матрицы для получения по меньшей мере одной (и)РНК, объединенной в комплекс с катионным или поликатионным соединением, и/или по меньшей мере одной свободной иРНК, соответственно, кодирующей по меньшей мере один белок терапевтического действия, антиген и/или антитело. Для этой цели обычно используют последовательности ДНК, например, геномной ДНК или ее фрагментов, или плазмиды, или последовательности РНК (соответствующие ей), например, последовательности иРНК, предпочтительно в линеаризированной форме. Реакция транскрипции in vitro обычно может проводиться, используя вектор с сайтом связывания РНК-полимеразы. Для этой цели могут применяться какие-либо векторы, известные в данной области, например, коммерчески доступные векторы (см. выше). Предпочтение отдается, например, тем векторам, которые имеют сайт связывания SP6, или Т7, или Т3 выше по цепи и/или ниже по цепи от сайта клонирования. Соответственно используемые последовательности (дезокси)рибонуклеиновой кислоты могут быть транскрибированы позднее, что требуется, в зависимости от выбранной РНК-полимеразы. Последовательность (дезокси)рибонуклеиновой кислоты, используемую для транскрипции in vitro и кодирующую белок, например, согласно описанному выше, белок терапевтического действия, антиген или антитело, обычно клонируют в векторе, например, через сайт множественного клонирования используемого вектора. Перед транскрипцией плазмиду обычно расщепляют ферментами рестрикции по сайту, по которому будущий 3'-конец по меньшей мере одной (и)РНК адъювантного компонента, согласно описанному выше, или по меньшей мере одной свободной иРНК, согласно описанному выше, локализован, используя соответствующий фермент рестрикции, и фрагмент очищают. Это предупреждает по меньшей мере одну (и)РНК адъювантного компонента, согласно описанному выше, или по меньшей мере одну свободную иРНК, согласно описанному выше, от контакта векторных последовательностей, и может быть получена определенная длина.
В другом варианте также можно получить (дезокси)рибонуклеиновую кислоту в качестве матрицы для транскрипции с помощью полимеразной цепной реакции (ПЦР). Для этого один из праймеров, используемых для ПЦР, обычно содержит последовательность сайта связывания РНК-полимеразы. Также предпочтительно для 5'-конца праймера, чтобы длина составляла примерно 10-50 нуклеотидов, более предпочтительно 15-30 нуклеотидов и наиболее предпочтительно примерно 20 нуклеотидов.
Перед реакцией транскрипции in vitro (дезокси)рибонуклеиновую кислоту, например, специфическую ДНК или РНК матрицу, обычно очищают и освобождают от рибонклеазы, чтобы убедиться в высоком выходе. Очистку можно выполнить каким-либо методом, известным в данной области, например, с помощью градиента цезия хлорида или методом ионообмена.
По стадии б) патентоспособного способа транскрипции in vitro (дезокси)рибонуклеиновую кислоту добавляют в среду для транскрипции in vitro. Соответствующая среда для транскрипции in vitro во-первых содержит (дезокси)рибонуклеиновую кислоту, полученную на стадии а), например, примерно от 0,1 до примерно 10 мкг, предпочтительно примерно от 1 до примерно 5 мкг, более предпочтительно примерно 2,5 мкг и наиболее предпочтительно примерно 1 мкг, такой нуклеиновой кислоты. Соответствующая среда для транскрипции in vitro дополнительно необязательно содержит восстанавливающий агент, например DTT, более предпочтительно примерно от 1 до примерно 20 мкл примерно 50 мМ DTT, еще более предпочтительно примерно 5 мкл примерно 50 мМ DTT. Среда для транскрипции in vitro дополнительно содержит нуклеотиды (AMP, GMP, UMP и/или СМР), например, смесь нуклеотидов. В случае настоящего изобретения нуклеотиды предпочтительно включают химически модифицированные нуклеозиды, подобные описанным выше. Такие (химически модифицированные) нуклеотиды могут быть замещением одного или более природных нуклеотидов AMP, GMP, UMP и/или СМР, и необязательно одного или более природных нуклеотидов AMP, GMP, UMP и/или СМР, если не все из природных нуклеотидов AMP, GMP, UMP и/или СМР замещены. Нуклеотиды AMP, GMP, UMP и/или СМР обычно содержатся в смеси нуклеотидов в концентрации обычно примерно от 0,1 до 10 мМ на нуклеотид, предпочтительно от 0,1 до 1 нМ на нуклеотид, предпочтительно примерно 4 мМ в целом. (Химически) модифицированные нуклеотиды, подобные описанным выше (примерно 1 мМ на нуклеотид, предпочтительно примерно 4 мМ в целом), обычно добавляют в таком количестве, что нативный нуклеотид замещается полностью (модифицированным) нуклеотидом (нуклеотидами), включая химически модифицированный нуклеозид, согласно описанному выше. Однако также можно использовать смеси одного или более модифицированных нуклеотидов, согласно описанному выше, и одного или более природных нуклеотидов, вместо определенного нуклеотида, т.е. один или более химически модифицированных нуклеотидов, согласно описанному выше, может содержаться в качестве замещения одного или более природных нуклеотидов AMP, GMP, UMP и/или СМР, и необязательно дополнительно одного или более природных нуклеотидов AMP, GMP, UMP и/или СМР, если не все природные нуклеотиды AMP, GMP, UMP и/или СМР замещены. Путем избирательного добавления требуемого основания в среду для транскрипции in vitro содержание, которое подразумевает наличие и количество, требуемой нуклеотидной модификации в транскрибируемой патентоспособной по меньшей мере одной (и)РНК, образующей комплекс с катионным или поликатионным соединением, или по меньшей мере одной свободной иРНК, кодирующей по меньшей мере один белок терапевтического действия, антиген и/или антитело, могут контролироваться. Соответствующая среда для транскрипции in vitro также содержит РНК-полимеразу, например Т7-РНК-полимеразу (например, набор Т7-Opti иРНК, CureVac, Tubingen, Германия), Т3-РНК-полимеразу или SP6, обычно примерно от 10 до 500 Ед, предпочтительно примерно от 25 до 250 Ед, более предпочтительно примерно от 50 до 150 Ед, и наиболее предпочтительно примерно 100 Ед РНК-полимеразы. Среда для транскрипции in vitro также предпочтительно содержится без рибонуклеаз, чтобы избежать разрушения транскрибируемой (и)РНК. Поэтому соответствующая среда для транскрипции in vitro необязательно содержит дополнительно ингибитор рибонуклеазы.
На стадии в) патентоспособного способа транскрипции in vitro (дезокси)рибонуклеиновую кислоту со стадии б) инкубируют и транскрибируют в среде для транскрипции in vitro, обычно примерно на протяжении 30-120 мин, предпочтительно примерно на протяжении 40-90 мин и наиболее предпочтительно примерно 60 мин примерно при 30-45°С, предпочтительно при 37-42°С. Температура инкубирования зависит от применяемой РНК-полимеразы, например, в случае Т7 РНК-полимеразы температура составляет примерно 37°С. Нуклеиновая кислота, полученная путем транскрипции, представляет предпочтительно по меньшей мере одну (и)РНК, объединенную в комплекс с катионным или поликатионным соединением, или по меньшей мере одну свободную иРНК, кодирующую по меньшей мере один белок терапевтического действия, антиген и/или антитело, соответственно, обе нуклеиновые кислоты соответствуют описанным в настоящем изобретении.
После инкубации на стадии в) указанного способа необязательно проводят очистку реакционной смеси на стадии г) способа транскрипции in vitro no настоящему изобретению. Для этого могут применять какой-либо метод, известный в данной области, например, хроматографическую очистку, например, аффинную хроматографию, гель-фильтрацию и др. для очистки невстроившихся, т.е. избыточных, нуклеотидов, которые могут быть удалены из среды для транскрипции in vitro. Какие-либо соответствующие методы, известные в предшествующем уровне техники, например, методы хроматографической очистки, могут применяться для этой цели. С помощью такой очистки может быть получена чистая транскрибированная РНК последовательности РНК, согласно описанному в настоящем изобретении, например, по меньшей мере одна (и)РНК, образующая комплекс с катионным или поликатионным соединением, или по меньшей мере одна свободная иРНК, кодирующей по меньшей мере один белок терапевтического действия, антиген и/или антитело, соответственно. Например, после транскрипции реакционная смесь, содержащая транскрибированную РНК, обычно может быть расщеплена дезоксирибонуклеазой для удаления матрицы ДНК, все еще содержащейся в реакционной смеси. Транскрибированная РНК позднее может быть осаждена с помощью LiCl. Очистка транскрибированной РНК затем может проводиться с помощью ВЭЖХ обратной фазы с ионной парой (ion-pair reversed phase - (IP RP)-HPLC). Способ позволяет в частности эффективно разделить более длинные и более короткие фрагменты друг от друга. Предпочтительно в данном контексте проводить очистку способом очистки РНК в препаративном масштабе, который отличается от способа очистки РНК, описанного в настоящем изобретении, особенно по меньшей мере одну (и)РНК, объединенную в комплекс с катионным или поликатионным соединением, или по меньшей мере одну свободную иРНК, кодирующая по меньшей мере один белок терапевтического действия, антиген и/или антитело, соответственно, очищают методом ВЭЖХ, используя пористую обратную фазу в качестве стационарной фазы (PURE Messenger). Например, для очистки на стадии г) патентоспособного способа транскрипции in vitro, обратная фаза может применяться в качестве стационарной фазы очистки ВЭЖХ. При хроматографировании с обратной фазой неполярное соединение обычно служит стационарной фазой, а полярный растворитель, например, водные смеси, которые обычно используют в форме буферов, с ацетонитриллом и/или метанолом, выступают в качестве подвижной фазы для элюции. Предпочтительно пористая обратная фаза имеет размер частиц 8,0±2 мкм, предпочтительно ±1 мкм, более предпочтительно +/-0,5 мкм. Материал обратной фазы может быть в форме гранул. Очистка может проводиться особенно благоприятным образом с пористым материалом обратной фазы с таким размером частиц, необязательно в форме гранул, что приводит к особенно хорошим результатам. Применяемая обратная фаза предпочтительно пористая, поскольку с непористыми стационарными обратными фазами, например, описанными Asarani А. и Hecker K.H., давление слишком высокое и колонка забивается, поэтому препаративная очистка РНК, согласно описанному в настоящем изобретении, в частности по меньшей мере одна (и)РНК, объединенная в комплекс с катионным или поликатионным соединением, или по меньшей мере одна свободная иРНК, кодирующая по меньшей мере один белок терапевтического действия, антиген и/или антитело, соответственно, возможна, если вообще возможна, лишь с большим трудом. Обратная фаза предпочтительно имеет размер частиц от 200 Å до 5000 Å, в частности размер пор от 300 Å до 4000 Å. Особенно предпочтительные размеры пор для обратных фаз составляют 200-400 Å, 800-1200 Å и 3500-4500 Å. При использовании обратной фазы с указанным размером пор достигаются особенно хорошие результаты по очистке РНК, согласно описанному в настоящем изобретении, на стадии г) способа. Материалом для обратной фазы предпочтительно является полистирол-дивинилбензол и неалкилированные полистирол-дивинилбензолы. Стационарные фазы с полистирол-дивинилбензолом известны. Для очистки на стадии г) способа могут применяться полистирол-дивинилбензолы, известные в данной области, уже применяемые в методах ВЭЖХ и коммерчески доступные. Неалкилированный пористый полистирол-дивинилбензол, который особенно имеет размер частиц 8,0±0,5 мкм и размер пор 250-300 Å, 900-1100 Å или 3500-4500 Å, особо предпочтителен для очистки на стадии г) способа. Преимущества, описанные выше, могут быть достигнуты особенно предпочтительным способом с таким материалом для обратной фазы. Очистку методом ВЭЖХ можно проводить методом ионной пары, при котором ион с положительным зарядом добавляют к мобильной фазе в качестве противоиона для отрицательно заряженной РНК. Ионную пару, обладающую липофильным свойством, которое падает под действием неполярной стационарной фазы системы обратной фазы, формируют таким образом. В частицах точные условия для ионной пары должны действовать эмпирически для каждого конкретного случая разделения. Размер противоиона, его концентрация и рН раствора существенно влияют на результаты разделения. В предпочтительном способе алкиламмонийные соли, например, триэтиламмоний ацетат и/или тетраалкиламмонийные соединения, например, тетрабутиламмоний, добавляют к мобильной фазе. Предпочтительно добавляют 0,1 М триметиламмония ацетата и рН доводят примерно до 7. Выбор мобильной фазы зависит от природы требуемого разделения. Это означает, что мобильная фаза, найденная для определенного разделения, например, может быть известна, например, из предшествующего уровня техники, не может быть с легкостью и успешно использована для другого случая разделения. Идеальные условия элюции, в частности применение мобильной фазы, должны быть определены для каждого случая разделения с помощью эмпирических экспериментов. Смесь водного растворителя и органического растворителя может применяться в качестве мобильной фазы для элюции РНК согласно описанному в настоящем изобретении, особенно по меньшей мере одной (и)РНК, объединенной в комплекс с катионным или поликатионным соединением, или по меньшей мере одной свободной иРНК, кодирующей по меньшей мере один белок терапевтического действия, антиген и/или антитело, соответственно, методом ВЭЖХ. В этом контексте предпочтительно, если используют буфер, имеющий в частности рН около 7, например 6,5-7,5, например 7,0, в качестве водного растворителя; предпочтительно используют буфер триэтиламмоний ацетата, особенно предпочтительно буфер триэтиламмоний ацетата 0,1 М, который, согласно описанному выше, также действует в качестве противоиона для РНК согласно описанному в настоящем изобретении в методе ионной пары. Органическим растворителем, используемым в подвижной фазе, может быть ацетонитрил, метанол или их смесь, особенно предпочтителен ацетонитрил. Очистку РНК согласно описанному в настоящем изобретении в способе на стадии г), используя метод ВЭЖХ согласно описанию, особенно очистку по меньшей мере одной (и)РНК, объединенной в комплекс с катионным или поликатионным соединением, или по меньшей мере одной свободная иРНК, кодирующей по меньшей мере один белок терапевтического действия, антиген и/или антитело, соответственно, проводят особенно благоприятным способом с указанными органическими растворителями. Подвижная фаза особенно предпочтительно представляет смесь 0,1 М триэтиламмония ацетата, рН 7, и ацетонитрила. Она представляется особенно предпочтительной, если мобильная фаза содержит 5,0-20,0 об.% органического растворителя, основанного на подвижной фазе, и остаток дополняется до 100 об.% водным растворителем. Это особенно благоприятно для способа по настоящему изобретению, если подвижная фаза содержит 9,5-14,5 об.% органического растворителя, основанного на мобильной фазе, и остаток до 100 об.% составляет водный растворитель. Элюцию РНК согласно описанному в настоящем изобретении, особенно по меньшей мере одной (и)РНК, объединенной в комплекс с катионным или поликатионным соединением, или по меньшей мере одной свободная иРНК, кодирующей по меньшей мере один белок терапевтического действия, антиген и/или антитело, соответственно, в последствии может быть выполнена изократически или путем разделения в градиенте. В случае изократического разделения элюцию РНК, согласно описанному в настоящем изобретении, выполняют с помощью одного элюирующего агента или смеси нескольких элюирующих агентов, которые остаются постоянными, что возможно для подробно описанных выше растворителей, применяемых в качестве элюирующего агента.
В настоящем изобретении также предусматривают способ трансфекции и необязательно введения патентоспособной иммуностимулирующей композиции или ее компонентов, согласно описанному выше, патентоспособной фармацевтической композиции или патентоспособной вакцины, согласно описанному выше, включающий следующие стадии:
(а) взятие клеток крови, профессиональных антиген-презентирующих клеток (antigen presenting cells - АРС), особенно дендровидных клеток (ДК), и
(б) трансфекции клеток крови, профессиональных антиген-презентирующих клеток (antigen presenting cells - АРС), особенно дендровидных клеток (ДК), in vitro патентоспособной иммуностимулирующей композицией или ее компонентами, патентоспособной фармацевтической композицией или патентоспособной вакциной.
В контексте настоящего изобретения понятие «клетки крови» предпочтительно означает смесь, обогащенную до состояния в значительной степени чистой популяции эритроцитов, гранулоцитов, мононуклеарных клеток периферической крови (МКПК) и/или тромбоцитов из цельной крови, сыворотки крови или другого источника, например, из селезенки или лимфатических узлов, в которой содержится лишь малая доля профессиональных АРС. Предпочтительно клетки крови в настоящем изобретении обычно отличаются тем, что они содержат малую долю хорошо дифференцированных профессиональных антиген-презентирующих клеток (АРС), особенно дендровидных клеток (ДК). Клетки крови, используемые в соответствии с настоящим изобретением, могут предпочтительно быть свежевыделенными клетками крови, т.е. между забором клеток крови (обычно пункцией) и трансфекцией проходит короткий период, например, менее 12 ч, предпочтительно менее 6 ч, особенно предпочтительно менее 2 ч, и наиболее предпочтительно менее 1 ч. Однако клетки крови, используемые по настоящему изобретению, также могут быть клетками крови, полученными пункцией крови перед ее использованием, например, перед операцией или лечением согласно описанному в настоящем изобретении, и которые затем хранят до применения.
Клетки крови отбирают у животных или у больных людей стандартными методами. Цельная кровь может быть легко получена пункцией соответствующего сосуда. Сыворотку получают известным методом путем коагуляции плотных составляющих крови. МКПК можно указать в качестве примера обогащенной неполной популяции клеток крови. Их обычно выделяют способом, впервые описанным Bøyum (Nature 204, 1964, cc.793-794; Scan. J. Lab. Clin. Invest. Suppl. 1967, с.97). Для этого обычно забирают кровь от индивидуума и вносят, например, в раствор с плотностью 1,077 г/мл (25°С), обычно содержащий Ficoll и натрий диатризоат, для центрифугирования в градиенте плотности. При осторожном центрифугировании при комнатной температуре МКПК собирают на разделе сред Ficoll/кровь, причем эритроциты и сохранившиеся лейкоциты осаждены. Раздел сред с МКПК удаляют и промывают обычным образом соответствующим буфером, например, стерильным ФСБ. МКПК предпочтительно подвергают краткой изотонической обработке водным раствором, например, аммония хлорида. В итоге МКПК промывают еще раз или несколько раз буфером, например, ФСБ (стерильным). Полученные клетки затем могут необязательно храниться в соответствующих условиях, обычно при -70°С, до их применения.
В предпочтительном варианте осуществления настоящего изобретения клетки крови непосредственно перед трансфекцией являются свежими клетками крови, т.е. между забором клеток крови (обычно пункцией) на стадии (а) и трансфекцией по стадии (б), проходит, например, менее 12 ч, предпочтительно менее 6 ч, особенно предпочтительно менее 2 ч, и наиболее предпочтительно менее 1 ч.
В контексте настоящего изобретения дендровидные клетки (ДК), используемые в указанном выше патентоспособном способе трансфекции и необязательно введения, обычно являются сильными антиген-презентирующими клетками (АРС), которые обычно обладают способностью стимулировать неизмененные Т-клетки. Они представляют систему лейкоцитов, широко распространенную во всех тканях, особенно в тех тканях, которые соприкасаются с внешней средой. ДК обеспечивают потомство гетерогенных гематопоэтических клеток, в котором подгруппы из разных тканей проявляют разную морфологию, фенотип и функцию. Способность стимулировать пролиферацию не подвергнутых каким-либо изменениям Т-клеток разделяется между такими разными подгруппами ДК. Высказано предположение, что так называемые производные миелоидные и лимфоидные подгруппы ДК выполняют специфическую стимулирующую или толерогенную функцию, соответственно. ДК являются производными от клеток-предшественниц костного мозга и циркулируют в крови в качестве незрелых предшественников перед миграцией в периферические ткани. В разных тканях ДК дифференцируют и становятся действующими в плане потребления и процессинга антигенов и их последующей презентации на поверхности клеток, связанных с молекулами главного комплекса гистосовместимости (ГКГ). При соответствующей стимуляции ДК претерпевают дальнейшее созревание и миграцию во вторичные лимфоидные ткани, где они презентируют антигены Т-клеткам и индуцируют иммунный ответ. ДК приобретают повышенный научный и клинический интерес из-за их ключевой роли в противораковом ответе организма хозяина и возможного применения в качестве биологических адъювантов в противоопухолевых вакцинах, а также их вовлечения в иммунобиологию толерантности и аутоиммунности. Дендровидные клетки (ДК), однако, также могут использоваться в контексте настоящего изобретения, если иммунный ответ не требуется или не предусматривается, или если он понижен. Такие дендровидные клетки, согласно описанному выше, могут быть выделены из разных тканей, о чем было указано выше, или из крови, особенно из образцов крови, согласно описанному выше.
Предпочтительно клетки крови, профессиональные антиген-презентирующие клетки (АРС), особенно дендровидные клетки (ДК), применяемые для патентоспособного способа трансфекции и необязательно введения фармацевтической композиции или вакцины по настоящему изобретению, происходят от конкретного пациента, которого предполагают лечить фармацевтической композицией по настоящему изобретению (аутогенные клетки). Соответственно, фармацевтические композиции или вакцина по настоящему изобретению предпочтительно содержит аутогенные клетки крови, профессиональные антиген-презентирующие клетки (АРС), особенно дендровидные клетки (ДК).
Трансфекция клеток крови, профессиональных антиген-презентирующих клеток (АРС), особенно дендровидных клеток (ДК), также проводят обычными методами, например, электропорацией или химическими методами, особенно липофекцией, предпочтительно только введением патентоспособной композиции без дополнительных реагентов для трансфекции.
РНК, согласно описанному в настоящем изобретении, особенно по меньшей мере одна (и)РНК, объединенная в комплекс с катионным или поликатионным соединением, и по меньшей мере одна свободная иРНК, кодирующая по меньшей мере один белок терапевтического действия, антиген и/или антитело, соответственно, используемую для трансфекции in vitro по стадии (б), получают методами, известными специалистам в данной области, особенно химическим синтезом или особенно предпочтительно методами молекулярной биологии, которые были указаны выше.
Согласно описанному выше может быть потребность в трансфекции клеток крови, профессиональных антиген-презентирующих клеток (АРС), особенно дендровидных клеток (ДК), используемых для патентоспособного способа трансфекции и необязательно введения, РНК согласно описанному в настоящем изобретении, особенно патентоспособной иммуностимулирующей композиции или ее компонентов, или патентоспособной фармацевтических композиции или вакцины. Кроме того, введение таких трансфецированных клеток пациенту, в живые ткани и/или организмы in vivo, особенно ретрансплантация в организм хозяина в случае аутогенных клеток, может быть задумано и выполнено в качестве необязательной стадии в) указанного выше способа. В этом контексте организм (или живое существо) обычно означает млекопитающее, выбранное из группы, включающей людей, животных, включая, например, свиней, коз, крупный рогатый скот, свиней, собак, кошек, ослов, обезьян, человекообразных обезьян или грызунов, включая мышей, хомяков и кроликов, но ими перечень не ограничивается. Кроме того, живые ткани, указанные выше, предпочтительно происходят от таких организмов. Введение трансфецированных клеток в такие живые ткани и/или организмы может происходить через какой-либо соответствующий способ введения, например, системный, и включают, например, внутри- или чрескожные, пероральные, парентеральные введения, включая подкожные, внутримышечные или внутривенные инъекции, местные и/или внутриназальные пути, согласно описанному выше.
В другом варианте осуществления настоящего изобретения также предусмотрен способ получения патентоспособной иммуностимулирующей композиции, включающий следующие стадии:
а) получения «адъювантного компонента», включающего или состоящего по меньшей мере из одной (и)РНК, согласно описанному выше, объединенной в комплекс с катионным или поликатионным соединением, согласно описанному выше, предпочтительно перемешиванием по меньшей мере одной (и)РНК согласно описанному выше, в специфическом соотношении с катионным или поликатионным соединением, согласно описанному выше, и
б) получения патентоспособной иммуностимулирующей композиции добавлением в специфическом соотношении, согласно описанному выше, по меньшей мере одной свободной иРНК согласно описанному выше к адъювантному компоненту, полученному на стадии а), в которой по меньшей мере одна свободная иРНК, согласно описанному выше, кодирует по меньшей мере один белок терапевтического действия, антиген и/или антитело согласно описанному выше.
Так называемый «адъювантный компонент» получают на стадии а) патентоспособного способа получения путем формирования комплекса по меньшей мере одной (и)РНК адъювантного компонента с катионным или поликатионным соединением, предпочтительно в специфическом соотношении для формирования стабильного комплекса. Согласно описанному выше, важно, что отсутствует свободное катионное или поликатионное соединение или лишь незначительное малое количество сохраняется в адъювантном компоненте после комплексообразования (и)РНК. Соответственно соотношение (и)РНК и катионного или поликатионного соединения в адъювантном компоненте обычно выбирают таким образом, что (и)РНК полностью формирует комплекс и в композиции не остается свободного катионного или поликатионного соединения или остается лишь незначительно малое количество. Предпочтительно соотношение адъювантного компонента, т.е. соотношение (и)РНК к катионному или поликатионному соединению, выбрано из диапазона примерно от 6:1 (по массе) до примерно 0,25:1 (по массе), более предпочтительно примерно от 5:1 (по массе) до примерно 0,5:1 (по массе), еще более предпочтительно примерно от 4:1 (по массе) до примерно 1:1 (по массе) или примерно от 3:1 (по массе) до примерно 1:1 (по массе), и наиболее предпочтительно соотношение примерно от 3:1 (по массе) до примерно 2:1 (по массе).
Дополнительно или в другом варианте соотношение первого компонента (т.е. адъювантного компонента, включающего или состоящего по меньшей мере из одной (и)РНК, объединенной в комплекс с катионным или поликатионным соединением) и второго компонента (т.е. по меньшей мере одной свободной иРНК) может быть рассчитано на основании соотношения азота/фосфата (соотношения N/P) в целом комплексе РНК. В контексте настоящего изобретения соотношение N/P предпочтительно находится в диапазоне примерно 0,1-10, предпочтительно в диапазоне примерно 0,3-4 и наиболее предпочтительно в диапазоне примерно 0,5-2 или 0,7-2 относительно соотношения РНК:пептида в комплексе, и наиболее предпочтительно в диапазоне примерно 0,7-1,5.
Дополнительно или в другом варианте соотношение первого компонента (т.е. адъювантного компонента, включающего или состоящего по меньшей мере из одной (и)РНК, объединенной в комплекс с катионным или поликатионным соединением) и второго компонента (т.е. по меньшей мере одной свободной иРНК) также может быть выбрано для патентоспособной иммуностимулирующей композиции на основании мольного соотношения обеих РНК между собой, т.е. (и)РНК адъювантного компонента, объединенной в комплекс с катионным или поликатионным соединением) и по меньшей мере одной свободной иРНК второго компонента. Обычно мольное соотношение (и)РНК адъювантного компонента по меньшей мере к одной свободной иРНК второго компонента может быть выбрано таким, что мольное соотношение удовлетворяет вышесказанному (по массе) и/или N/P-определениям. Более предпочтительно мольное соотношение (и)РНК адъювантного компонента к по меньшей мере одной свободной иРНК второго компонента может быть выбрано, например, из мольного соотношения, согласно описанному выше, например, мольного соотношения примерно 0,001:1, 0,01:1, 0,1:1, 0,2:1, 0,3:1, 0,4:1, 0,5:1, 0,6:1, 0,7:1, 0,8:1, 0,9:1, 1:1, 1:0,9, 1:0,8, 1:0,7, 1:0,6, 1:0,5, 1:0,4, 1:0,3, 1:0,2, 1:0,1, 1:0,01, 1:0,001 и др. или из какого-либо диапазона, сформированного какими-либо двумя из указанных выше величин, например, из диапазона, выбранного примерно от 0,001:1 до 1:0,001, от 0,01:1 до 1:0,001, от 0,1:1 до 1:0,001, от 1:1 до 1:0,001, от 0,001:1 до 1:0,01, от 0,001:1 до 1:0,1, от 0,001:1 до 1:1, от 0,01:1 до 1:0,01, от 0,1:1 до 1:0,1, 1:1 и др.
Еще более предпочтительно мольное соотношение (и)РНК адъювантного компонента по меньшей мере к одной свободной иРНК второго компонента может быть выбран, например, из диапазона примерно от 0,01:1 до 1:0,01. Наиболее предпочтительно мольное соотношение (и)РНК адъювантного компонента по меньшей мере к одной свободной иРНК второго компонента может быть выбрано, например, из мольного соотношения примерно 1:1. В таком конкретном варианте осуществления настоящего изобретения может быть применено какое-либо из указанных выше соотношений (по массе) и/или N/P.
В контексте настоящего изобретения катионное или поликатионное соединение предпочтительно выбирают из катионных или поликатионных соединений, согласно описанному выше, применимых для формирования комплекса и в результате стабилизации нуклеиновой кислоты, особенно (и)РНК, например, путем ассоциации нуклеиновой кислоты с катионным или поликатионным соединением. Ассоциация или комплексообразование модифицированной (и)РНК патентоспособной иммуностимулирующей композиции с катионными или поликатионными соединениями, согласно описанному выше, предпочтительно обеспечивают адъювантные свойства (и)РНК и подтверждают стабилизирующий эффект у (и)РНК адъювантного компонента за счет образования комплекса. Процесс стабилизации модифицированной (и)РНК в целом описан в патентной заявке ЕР-А-1083232, сущность которой включена в настоящее изобретение в виде ссылки, но также может осуществляться с помощью какой-либо соответствующей процедуры, известной в данной области.
По стадии б) патентоспособного способа получения, описанного выше, патентоспособную иммуностимулирующую композицию получают добавлением в определенном соотношении по меньшей мере одной свободной иРНК, согласно описанному выше, к адъювантному компоненту, полученному на стадии а), причем по меньшей мере одна свободная иРНК, согласно описанному выше, кодирует по меньшей мере один белок терапевтического действия, антиген и/или антитело, согласно описанному выше. Согласно описанному выше, соотношение адъювантного компонента (включающего по меньшей мере одну (и)РНК, объединенную в комплекс с катионным или поликатионным соединением) и второго компонента (по меньшей мере одной свободной иРНК) в патентоспособной иммуностимулирующей композиции может быть выбрано исходя из специфических потребностей при определенной терапии, например, противораковой или противоопухолевой терапии, генной терапии, антиаллергической терапии (десенсибилизирующей), профилактике или терапевтической вакцинации и др. Обычно соотношение адъювантного компонента и второго компонента патентоспособной иммуностимулирующей композиции выбирают таким образом, что существенная стимуляция врожденной иммунной системы индуцируется адъювантным компонентом. Параллельно соотношение выбирают таким образом, что существенное количество по меньшей мере одной свободной иРНК может быть предоставлено in vivo, приводя к эффективной трансляции экспрессируемого белка in vivo. Предпочтительно соотношение адъювантного компонента к свободной иРНК в патентоспособной иммуностимулирующей композиции выбрано из диапазона, согласно описанному выше, например, примерно от 5:1 (по массе) до примерно 1:10 (по массе), более предпочтительно из диапазона примерно от 4:1 (по массе) до примерно 1:8 (по массе), еще более предпочтительно из диапазона примерно от 3:1 (по массе) до примерно 1:5 (по массе) или 1:3 (по массе), и наиболее предпочтительно соотношение адъювантного компонента к свободной иРНК в патентоспособной иммуностимулирующей композиции выбрано из соотношения примерно 1:1 (по массе).
Необязательно другие компоненты, согласно описанному выше, могут быть добавлены к патентоспособной иммуностимулирующей композиции, на одной или на нескольких дополнительных стадиях.
В итоговом варианте осуществления настоящего изобретения также предусматриваются наборы, особенно наборы частей, включающие в качестве компонентов отдельно или в комбинации, патентоспособную иммуностимулирующую композицию или ее компоненты, т.е. по меньшей мере одну (и)РНК, объединенную в комплекс с катионным или поликатионным соединением, и по меньшей мере одну свободную иРНК, кодирующую по меньшей мере один белок терапевтического действия, антиген и/или антитело, соответственно, и/или патентоспособную фармацевтическую композицию или вакцину, и необязательно технические инструкции с информацией по введению и дозированию таких компонентов. Такие наборы, предпочтительно наборы частей, могут быть использованы, например, для какого-либо указанного выше назначения или применения.
Фигуры
Приводимые примеры иллюстрируют настоящее изобретение, но никоим образом не ограничивают его.
Фиг.1. Результаты экспрессии люциферазы после внутрикожной инъекции иРНК, кодирующей люциферазу in vivo, причем композицию, включающую 10 мкг свободной иРНК, кодирующей люциферазу (Рр Luc), с комбинацией или без комбинации с LacZ-иРНК (wt LacZ), объединенную в комплекс с протамином (2:1 и 1:1), получают и вводят внутрикожной инъекцией в ушную раковину. Из фигуры следует, что комплексы LacZ-иРНК:протамин, переработанные в соотношении 1:1 или 2:1, соответственно, не оказывают отрицательного воздействия на экспрессию люциферазы, т.е. в растворе нет свободного протамина или его содержится незначительное количество, которое не влияет отрицательно на трансляцию. Соответственно формирование комплекса между протамином и ppLuc иРНК возможно, что указывает на стабильность уже сформированных комплексов LacZ-иРНК:протамин.
Фиг.2. Результаты реакции вакцинации на модели E.G7-OVA для терапевтических целей. Для этого эксперимента 300000 опухолевых клеток E.G7-OVA имплантируют мышам линии С57 BL/6 и мышей вакцинируют 8 раз в течение 2 недель патентоспособной иммуностимулирующей композицией, включающей 20 мкг GC-обогащенной иРНК, кодирующей овальбумин Callus gallus. В первом эксперименте используют любую из двух РНК, которая полностью объединена в комплекс с протамином в соотношении 3:1 или РНК, причем комплексная РНК смешана со свободной РНК в соотношении 1:1, 1:4 и 1:8 (по массе). Из фиг.2 следует, что свободная РНК, а также отдельно протамин, не проявляют какого-либо воздействия на рост опухоли по сравнению с контролем (буфером; раствор лактата Рингера). Неожиданно было установлено, что вакцинация протамином в комплексе с РНК в соотношении 3:1 (РНК:протамин) существенно снижает рост опухоли. Доказано, что дополнительно свободная РНК еще больше повышает ответ опухоли, причем соотношение более 1:8 (комплексная РНК: свободная РНК), например 1: 4 или даже 1:1, особенно эффективно.
Фиг.3. Результаты реакции вакцинации на модели E.G7-OVA для терапевтических целей, близких к эксперименту на фиг.2. Для такого второго эксперимента используют любую из двух РНК, полностью объединенную в комплекс с протамином в соотношении 3:1, или РНК по улучшенному протоколу, причем комплексную РНК смешивают со свободной РНК в соотношении РНК:протамин 3:1 + свободная РНК (1:1)). На фиг.3 показано, что комбинация комплексной РНК и свободной РНК, особенно в описанных соотношениях, приводит к улучшенной противоопухолевой защите.
Фиг.4. Статистический (математический) анализ эксперимента по фиг.3. Фиг.4 в частности показывает существенное различие между группами. Статистический (математический) анализ проводят с помощью программного обеспечения GraphPad Prism и величины р определяют, используя тест Манна-Уитнея. Анализ подчеркивает результаты, показанные на фиг.3.
Фиг.5. Результаты выявления иммуностимулирующих свойств и стимуляции чМКПК с иРНК (CAP-GgOva(GC)-muag-A70-C30). Для этого эксперимента 2×105 чМКПК высевают в 200 мкл среды на лунку в 96-луночные планшеты, и 50 мкл патентоспособной композиции, включающей 10 мкг иРНК, кодирующей овальбумин Callus gallus, добавляют для стимуляции высвобождения цитокина в течение ночи при 37°С. Секреция цитокинов (ФНОальфа и ИЛ-6) клетками чМКПК под воздействием композиций, включающих комплексную и свободную РНК, показывает существенное повышение иммуностимулирующих свойств при использовании метода обнаружения ELISA.
Фиг.6. Результаты индукции гуморального иммунного ответа in vivo, причем мышей С57 BL/6 вакцинируют 8 раз по 16 мкг GC-обогащенной иРНК (CAP-GgOva(GC)-muag-A70-C30), кодирующей овальбумин Callus gallus, или «нерелевантной» контрольной РНК (pB-Luc РНК). Из фиг.6 следует, что комбинация комплексной РНК со свободной РНК, особенно в соотношении (1:1), приводит к повышенному гуморальному иммунному ответу по сравнению с вакцинацией только комплексной РНК.
Фиг.7. Последовательность иРНК, соответствующая последовательности SEQ ID NO:120, длиной 1365 нуклеоидов, обозначается «CAP-GgOva(GC)-muag-А70-С30». Последовательность иРНК CAP-GgOva(GC)-muag-A70-C30 содержит следующие элементы последовательности:
GC-оптимизированная последовательность для лучшего применения кодонов и для стабилизации
muag (мутантная область альфа-глобин-3'-UTR)
70 × аденозинов с 3'-конца (поли-А-хвост),
30 × цитозинов с 3'-конца (поли-С-хвост).
Открытая рамка считывания (ORF) выделена курсивом, область muag (мутантная область альфа-глобин-3'-UTR) отмечена пунктиром, поли-А-хвост подчеркнут одинарной линией, а поли-С-хвост подчеркнут двойной линией.
Фиг.8. Последовательность иРНК, соответствующая SEQ ID NO:121, имеющая длину 1816 нуклеотидов и обозначаемая «T7TS-Ppluc(wt)-A70». Кодирующая последовательность в целой последовательности иРНК выделена курсивом, поли-А-хвост подчеркнут одной линией.
Фиг.9. Статистический анализ экспрессии люциферазы в мышах линии Balb/c. Статистический анализ проводят с помощью программного обеспечения GraphPad Prism и величины р определяют, используя тест Манна-Уитнея. Результаты на фиг.9 показывают, что РНК, объединенная в комплекс по настоящему изобретению (2:1 (50%) + свободная (50%)) проявляет ту же экспрессию при сравнении со свободной РНК и РНК, объединенной в комплекс в соотношении 4:1 с протамином. Можно видеть, что различия между релевантными группами несущественно. Таким образом, иммунная стимуляция может быть эффективно обеспечена с патентоспособной комплексной РНК, причем уровень экспрессии поддерживается по сравнению со свободной РНК и РНК, объединенной в комплекс в соотношении 4:1 с протамином (см. также фиг.10).
Фиг.10. Статистический анализ индукции ИЛ-12 в мышах Balb/c. Статистический анализ проводят с помощью программного обеспечения GraphPad Prism и величины р определяют, используя тест Манна-Уитнея. Результаты показывают, что разница между патентоспособной комплексной РНК (2:1 (50% + свободная (50%)) и группой 4:1 (100%), которая включает то же количество РНК и протамин, является существенной. Таким образом, иммунная стимуляция может быть эффективно обеспечена патентоспособной комплексной РНК, причем уровень экспрессии поддерживается по сравнению со свободной РНК и РНК в комплексе с протамином в соотношении 4:1 (см. также фиг.9).
Фиг.11. Индукция IgG2a-специфических антител против антигенного гемагглютинина вируса гриппа (ГА). Для этого мышей вакцинируют 2 раза с помощью 20 мкг GC-обогащенной иРНК, кодирующей гемагглютинин (ГА), в свободной форме или переработанный с протамином гидрохлоридом (протамин Val) или протамином сульфатом (протамин Leo), согласно указанному. Из фиг.11 следует, что комбинация комплексной РНК со свободной РНК приводит к повышенному гуморальному иммунному ответу по сравнению с вакцинацией полностью комплексной РНК. По сравнению со свободной формой РНК, комплексная РНК приводит к повышенным титрам антитела IgG2a, индикатора Th1-индуцированного ответа. Комплексообразование РНК с протамином гидрохлоридом (протамин Valeant) имеет более сильное воздействие по сравнению с протамином сульфатом.
Фиг.12. Индукция IgG2a-специфических антител против антигена ГА вируса гриппа на протяжении 15 недель после иммунизации. Для этого мышей вакцинируют 2 раза с помощью 20 мкг GC-обогащенной иРНК, кодирующей гемагглютинин (ГА), в свободной форме или переработанный с протамином (РНК:протамин 2:1 + свободная РНК (1:1) (по массе)), и IgG2a антитела измеряют в указанные временные точки. Сыворотку, полученную в разные сроки после иммунизации, анализируют методом ELISA. Титры гемагглютинин-специфичных антител подтипа IgG2a нанесены для групп, обработанных буфером (80% RiLa), иРНК ГА в свободной форме или комплексной.
Фиг.13. Индукция антител против антигена ГА вируса гриппа, показанная методом HAI. Для этого мышей вакцинируют 2 раза с помощью 20 мкг GC-обогащенной иРНК, кодирующей гемагглютинин (ГА), в свободной форме или переработанный с протамином (РНК:протамин 2:1 + свободная РНК (1:1) (по массе)) и исследование HAI проводят в указанные временные точки.
Фиг.14. Последовательность иРНК, кодирующая патогенный антигенный гемагглютинин (ГА) вируса гриппа.
Примеры
Приводимые ниже примеры дополнительно иллюстрируют настоящее изобретение. Они не предназначены для ограничения сущности настоящего изобретения.
Пример 1. Получение конструкции иРНК, кодирующей люциферазу Рр (Photinus pvralis)
Для последующих экспериментов последовательность ДНК, кодирующую люциферазу Рр (Photinus pyralis) и соответствующую иРНК, кодирующую последовательности люциферазы Рр, используемые в настоящем изобретении, получают и используют для последующих экспериментов по трансфекции и вакцинации. Таким образом, последовательность ДНК, соответствующую иРНК, кодирующей нативную люциферазу Рр, модифицируют с помощью поли-А-метки (А70), в результате чего получают последовательность SEQ ID NO:121 (см. фиг.8). Итоговая конструкция имеет длину 1816 нуклеотидов и обозначается «T7TS-Ppluc(wt)-A70».
Пример 2. Получение конструкции иРНК, кодирующей овальбумин Gallus gallus
Для последующих экспериментов дополнительная последовательность ДНК, кодирующую овальбумин Gallus gallus и соответствующие последовательности иРНК, получают и используют для последующих экспериментов по трансфекции и вакцинации. Таким образом, последовательность ДНК, соответствующую иРНК, кодирующей нативный овальбумин Gallus gallus, оптимизируют по GC для лучшего использования кодонов и стабилизации. Затем последовательность ДНК, соответствующую кодирующей последовательности иРНК овальбумина Gallus gallus, переносят на РНК-активную конструкцию, модифицированную поли-А-меткой и поли-С-меткой (А70-С30). Итоговая конструкция имеет длину 1365 нуклеотидов и обозначается «CAP-GgOva(GC)-muag-A70-C30». Она содержит следующие элементы последовательности:
GC-оптимизированную последовательность для лучшего использования кодонов и стабилизации
muag (мутантный альфа-глобин-3'-UTR),
70 × аденозин с 3'-конца (поли-А-хвост),
30 × цитозин с 3'- конца (поли-С-хвост).
Соответствующая последовательность иРНК показана на фиг.7 (см. SEQ ID NO:120).
Пример 3. Эксперименты по транскрипции in vitro
Рекомбинантную плазмидную ДНК линеаризируют и затем транскрибируют in vitro, используя Т7 РНК-полимеразу. Затем матрицу ДНК разрушают расщеплением ДНКазой I. РНК выделяют осаждением в LiCl и затем очищают методом экстракции ВЭЖХ (PUREMessenger®, фирма CureVac GmbH, Тюбинген, Германия).
Пример 4. Разработка патентоспособной композиции
Объединяют иРНК, используемую в приводящихся ниже примерах, с протамином путем добавления протамина к иРНК в указанных соотношениях (1:1-1:4) (по массе). После инкубирования в течение 10 мин добавляют свободную РНК.
Пример 5. Экспрессия in vivo люциферазы после внутрикожной инъекции иРНК, кодирующей люциферазу
В этом эксперименте исследуют влияние композиций, включающих легко получаемые комплексы иРНК:протамин и/или свободную иРНК, на трансляцию. Для этого композицию, включающую 10 мкг свободной иРНК, кодирующей люциферазу (Рр Luc), с комбинацией или без комбинации LacZ-иРНК, объединенной с протамином (2:1 и 1:1), получают и вводят внутрикожно инъекцией в ушную раковину.
Получают иРНК, кодирующую люциферазу Рр, согласно описанному выше. Вводимую комбинацию, не содержащую дополнительной комплексной РНК, lacZ-иРНК:протамин в концентрации 2:1 или lacZ-иРНК:протамин в концентрации 1:1. В качестве контроля вводят композицию, не содержащую иРНК, кодирующую люциферазу Рр (Photinus pyralis). Протамин используют в качестве контроля. Для получения таких композиций lacZ-иРНК перерабатывают на первой стадии с протамином в разных количествах и соотношениях (2:1 и 1:1 (по массе)) и добавляют в качестве первого компонента. Затем через 10 мин к композиции добавляют свободную иРНК, кодирующую Рр Luc.
Через 24 ч ушную раковину удаляют и замораживают в жидком азоте. Для гомогенизации образцы помещают в гомогенизатор TissueLyser на 3 мин при 30 s-1. Затем 800 мкл лизирующего буфера (25 мМ Tris-HCl pH (7,5-7,8); 2 мМ EDTA; 10 мас.% глицерина; 1 мас.% Triton-X-100; 2 мМ DTT; 1 мМ PMSF) добавляют и образцы опять помещают в TissueLyser на 6 мин при 30 s-1. Образцы центрифугируют в течение 10 мин при 13500 об/мин и 4°С. Супернатант удаляют и хранят при -80°С до измерения люциферазы. Супернатанты перемешивают люцифериновым буфером (25 мМ глицилглицин, 15 мМ MgSO4, 5 мМ АТР, 62,5 мкмМ люциферина) и люминесценцию измеряют с помощью измерителя люминесценции (прибор Lumat LB 9507, фирма Berthold Technologies, Bad Wildbad, Германия).
В результате (см. фиг.1) комплексы LacZ-иРНК:протамин, которые переработаны в соотношении 1:1 или 2:1, соответственно, не оказывают отрицательного воздействия на экспрессию люциферазы, т.е. в растворе отсутствует свободный протамин или имеется его небольшое количество, которое не оказывает отрицательного воздействия на трансляцию. Соответственно формирование комплексов между протамином и ppLuc иРНК невозможно, что подтверждает стабильность уже сформированных комплексов LacZ-иРНК:протамин.
Пример 6. Вакцинация на модели E.G7-OVA для терапевтических целей
Общий метод:
300000 опухолевых клеток E.G7-OVA имплантируют мышам С57 BL/6. В последующие три недели мышей вакцинируют 8 раз в течение трех недель патентоспособной композицией, включающей 20 мкг GC-обогащенной иРНК, кодирующей овальбумин Callus gallus. Размер опухолей определяют через 18 суток после имплантации опухолевых клеток.
А) Первый эксперимент
300000 опухолевых клеток E.G7-OVA имплантируют мышам линии С57 BL/6. В последующие две недели мышей вакцинируют 8 раз, каждый раз вводят 20 мкг GC-обогащенной иРНК, кодирующей овальбумин Gallus gallus. Для этого эксперимента используют или РНК, которая полностью объединена в комплекс с протамином в соотношении 3:1, или РНК, причем объединенная в комплекс РНК смешана со свободной РНК в соотношении масс 1:1, 1:4 и 1:8.
Результаты представлены на фиг.2. Из фиг.2 следует, что свободная РНК и отдельно свободный протамин не проявляют какой-либо небольшой эффект в отношении роста опухоли по сравнению с контролем в виде буфера (раствора лактата Рингера). Неожиданно было обнаружено, что вакцинация протамином, объединенным в комплекс с РНК в соотношении 3:1 (РНК:протамин) существенно снижает рост опухоли. Добавление свободной РНК повышает ответ опухоли дополнительно, причем доказано, что соотношение, превышающее 1:8 (комплексная РНК:свободная РНК), например, 1: 4 или даже 1:1, особенно предпочтительны.
Б) Второй эксперимент
300000 опухолевых клеток E.G7-OVA имплантируют мышам линии С57 BL/6. В последующие три недели мышей вакцинируют 8 раз, каждый раз вводят 20 мкг GC-обогащенной иРНК, кодирующей овальбумин Callus gallus. Для этого эксперимента используют или РНК, которая полностью объединена в комплекс с протамином в соотношении 3:1, или РНК по усовершенствованному протоколу, причем объединенная в комплекс РНК смешана со свободной РНК в соотношении РНК:протамин = 3:1 + свободная РНК (1:1).
Результаты этого эксперимента представлены на фиг.3. Из фиг.3 следует, что комбинация комплексной РНК и свободной РНК, особенно в указанных соотношениях, приводит к улучшенной противоопухолевой защите.
Статистический (математический анализ) проводят с помощью программного обеспечения GraphPad Prism. Величину р определяют, используя тест Манна-Уитнея (см. фиг.4).
Пример 7. Выявление иммуностимулирующих свойств и стимуляция чМКПК с помощью иРНК
Для этого эксперимента выделяют центрифугированием чМКПК в фиколе (20 мин при 2000 об/мин) и затем промывают два раза в ФСБ. Мононуклеарные клетки периферической крови человека (чМКПК) затем ресуспендируют в ФСТ, 10% ДМСО, до плотности 5×107/мл. Аликвоты объемом 1 мл замораживают и хранят при -80°С.
Перед проведением эксперимента чМКПК оттаивают путем ресуспендирования в ФСБ, затем дважды промывают в ФСБ. Затем чМКПК суспендируют в X-Vivo 15, 1% глутамине, 1% пенициллина/стрептомицина при плотности 1×106/мл. После засева чМКПК в количестве 2×105 в лунку 96-луночного планшета добавляют по 50 мкл патентоспособной композиции, включающей 8 мкг иРНК, кодирующей овальбумин Gallus gallus, для стимуляции высвобождения цитокина в течение ночи при 37°С.
Затем МКПК человека инкубируют в течение 20 ч с РНК, кодирующей овальбумин Gallus gallus (OVA), объединенной в комплекс с протамином (3:1) плюс 50% свободной РНК (комплекс переработан следующим образом: РНК:протамин = 3:1 + свободная РНК (1:1) (по массе)). Секрецию цитокинов (ФНОальфа и ИЛ6) измеряют и обнаруживают в супернатанте, используя стандартный метод ELISA.
Для количественной оценки ФНОальфа и ИЛ6 (ELISA) планшеты Maxisorb покрывают захватывающим антителом (1 мкг/мл) и выдерживают в течение ночи (4°С), после чего блокируют 1% БСА в течение 1 ч при комнатной температуре. После трех промываний 0,05% Tween, 50 мкл (ФНОα) или 50 мкл (ИЛ-6) супернатанта чМКПК добавляют блокирующий буфер в количестве 15-100 мкл и вносят в лунки. Связывание проводят дополнительно в течение 2 ч при комнатной температуре. Затем планшет промывают и добавляют 100 мкл пероксидазы хрена, конъюгированной со стрептавидином. После инкубирования в течение 30 мин и промывания добавляют колориметрический субстрат (ТМВ, фирма Perbio Science). Оптическую плотность измеряют при 450 нм, используя ридер планшетов Tecan ELISA. Все инкубирования проводят при комнатной температуре, промывка включает по меньшей мере 3 стадии с применением ФСБ/Tween20 (0,05 мас.%).
Добавляют по 100 мкл/лунку смеси стрептавидина/пероксидазы хрена (при разведении 1/1000) и биотинилированное выявляющего антитела (0,5 мкг/мл). Инкубируют в течение 1 ч при комнатной температуре с последующими промывками с помощью 0,05% Tween. В итоге добавляют по 100 мкл/лунку субстрата Amplex Red HRP (50 мкМ), 0,014% Н2О2. Флуоресценцию измеряют в ридере для планшетов Spectramax Gemini (поглощение при 540 нм, эманация при 590 нм, отсечение при 590 нм).
Результаты представлены на фиг.5. Из фиг.5 следует, что композиции, включающие комплексную и свободную РНК, проявляют иммуностимулирующее свойство, которое проявляется в виде существенной секреции ФНОальфа и ИЛ-6 в чМКПК.
Пример 8. Индукция гуморального иммунного ответа
Мышей линии С57 BL/6 вакцинируют 8 раз, причем каждый раз 16 мкг GC-обогащенной иРНК, кодирующей овальбумин Gallus gallus, или «посторонней» контрольной РНК (pB-Luc РНК). Таким образом, РНК или полностью перерабатывают с протамином в соотношении 2:1 или это соотношение соответствует усовершенствованному протоколу и составляет РНК:протамин = 2:1 + свободная РНК (1:1) (по массе). Через 2 недели после последней вакцинации образцы крови собирают и определяют экспрессию антител, специфичных в отношении овальбумина.
Для выявления антигенспецифичных антител планшеты MaxiSorb (фирма Nalgene Nunc International) покрывают антигеном (овальбумин, гибридный белок). После блокирования с помощью 1×ФСБ, 0,05% Tween и 1% БСА, планшеты инкубируют с сывороткой мышей в течение 4 ч при комнатной температуре. Затем добавляют биотин-связанное вторичное антитело. После промывки планшет инкубируют с пероксидазой хрена, и ферментативную активность определяют путем измерения конверсии субстрата (2,2'-азино-бис(3-этил-бензтиазолин-6-сульфокислоты) (оптическая плотность при 450 нм). Оптическую плотность определяют при 450 нм, используя ридер для планшетов Tecan ELISA.
Результаты представлены на фиг.6. Из фиг.6 следует, что комбинация комплексной РНК со свободной РНК приводит к повышенному гуморальному иммунному ответу по сравнению с вакцинацией полностью комплексной РНК.
Пример 9. Статистический анализ экспрессии люциферазы у мышей линии Balb/c
В этом эксперименте исследуют влияние разных составов с протамином на трансляцию люциферазы. Мышам, по 2 в группе, в 4 разных места вводят внутрикожной инъекцией:
(1) композицию, включающую 50% объединенной с протамином (2:1) Luc-РНК в комбинации с 50% свободной РНК,
(2) композицию, включающую комплексную Luc-PHK с протамином в соотношении 4:1,
(3) 100% свободную Luc-PHK, или
(4) лактатный буфер Рингера в качестве контроля.
Каждый образец включает 10 мкг иРНК, кодирующей люциферазу (Luc-PHK, т.е. указанную выше конструкцию «T7TS-Ppluc(wt)-A70», соответствующую последовательности SEQ ID NO:121) в 50 мкл лактатного буфера Рингера. Первая и вторая группы также включают равное количество протамина, но они по разному составлены. Иммуностимулирующую композицию группы (1) получают по описанию настоящего изобретения.
Результаты показаны на фиг.9. Фиг.9 представляет статистический анализ экспрессии люциферазы у мышей линии Balb/c. Статистический анализ проводят с программным обеспечением GraphPad Prism и величины р определяют, используя тест Манна-Уитнея. Результаты на фиг.9 показывают, что комплексная РНК по настоящему изобретению (2:1 (50%) + свободная (50%), группа (1)) проявляет ту же экспрессию при сравнении с голой РНК и РНК, объединенной в комплекс в соотношении 4:1 с протамином (группы (2) и (3)). Можно видеть, что различия между значимыми группами несущественны. Таким образом, иммунная стимуляция может успешно обеспечиваться с помощью патентоспособной иммуностимулирующей композиции, причем уровень экспрессии поддерживается сопоставимым с уровнем экспрессии голой РНК и РНК, которая объединена в комплекс в соотношении 4:1 с протамином (см. также фиг.10).
Пример 10. Статистический анализ индукции ИЛ-2 у мышей линии Balb/c
Для этого эксперимента 40 мкг иРНК, кодирующей люциферазу (Luc-PHK, т.е. описанную выше конструкцию «T7TS-Ppluc(wt)-A70», соответствующую последовательности SEQ ID NO:121) в следующих композициях:
(1) 2:1 (50%) + свободная (50%) включает 20 мкг Luc-PHK, объединенной в комплекс с протамином (2:1) (по массе), и 20 мкг свободного Luc-PHK (т.е. патентоспособная иммуностимулирующая композиция),
(2) 4:1 (100%) включает 40 мкг Luc-PHK, объединенной в комплекс с протамином (4:1) (по массе),
(3) 40 мкг свободной Luc-PHK,
(4) 10 мкг протамина, и
(5) 800 мкл RiLa (все образцы растворяют в лактатном буфере Рингера до конечного объема 800 мкл) и вводят внутривенной инъекцией в хвостовую вену мышам линии Balb/c (по 4 мыши в группах). Через 4 ч берут кровь из задней глазной вены и сыворотку используют для анализа цитокина (ИЛ-12) методом ELISA. Метод ELISA выполняют по описанию, приведенному в примере 7.
Результаты представлены на фиг 10. Фиг.10 показывает статистический анализ индукции ИЛ-12 у мышей линии Balb/c по описанию, приведенному в примере 10. Статистический анализ проводят с программным обеспечением GraphPad Prism и величины р определяют, используя тест Манна-Уитнея. Результаты показывают, что различие между патентоспособной иммуностимулирующей композицией (2:1 (50%) + свободная (50%)) и группой 4:1 (100%), которая включает то же количество РНК и протамина, является значительной. Таким образом, иммунная стимуляция может успешно обеспечиваться с помощью патентоспособной иммуностимулирующей композиции, причем уровень экспрессии поддерживается сопоставимым с уровнем экспрессии голой РНК и РНК, которая объединена в комплекс в соотношении 4:1 с протамином (см. также фиг.9).
Пример 11. Индукция гуморального иммунного ответа против вирусного антигена
Вакцинация
Мышей линии BALB/c вакцинируют дважды с помощью 20 мкг GC-обогащенной иРНК, кодирующей гемагглютинин вируса Influenza A/Puerto Rico/8/34 (PR8), или с помощью буфера для инъекции (80% лактат Ригера). Таким образом, РНК или полностью перерабатывают с протамином в соотношении 2:1 или это соотношение по настоящему изобретению составляет РНК:протамин 2:1 + свободная РНК (1:1) (по массе). Для составов тестируют два разных протамина - протамин гидрохлорид (протамин Valeant) и протамин сульфат (протамин LEO).
Обнаружение специфических антител
В разное время после последней вакцинации образцы крови собирают и определяют экспрессию гемагглютинин-специфических антител методом ELISA (фиг.11 и 12) или методом подавления гемагглютинина (hemagglutination inhibition assay - HAI) (фиг.13).
Определение антиген-специфичных антител методом ELISA
Для определения антигенспецифичных антител методом ELISA планшеты MaxiSorb (фирма Nalgene Nunc International) покрывают антигеном (инактивированным PR8). После блокирования в 1×ФСБ, 0,05% Tween и 1% БСА планшеты инкубируют с сывороткой мышей в течение 4 ч при комнатной температуре. Затем добавляют соединенное с биотином вторичное антитело. После промывки планшет инкубируют с пероксидазой хрена и действие фермента определяют путем измерения конверсии субстрата (2,2'-азино-бис(3-этилбензтиазолин-6-сульфоновой кислоты) (оптическая плотность 405 нм). Оптическую плотность измеряют при 405 нм, используя ридер для планшетов Tecan ELISA. Результаты анализа сыворотки, полученной через 2 недели после иммунизации, показаны на фиг.11. Из фиг.11 следует, что комбинация комплексной РНК со свободной РНК приводит к повышенному гуморальному иммунному ответу по сравнению с вакцинацией только комплексной РНК. По сравнению с чистой РНК комплексная РНК приводит к повышенному титру антител IgG2a, индикатора Th1-индуцированного ответа. Образование комплекса РНК с протамином гидрохлоридом (протамин Valeant) обладает более сильным эффектом по сравнению с образование комплекса РНК с протамином сульфатом.
На фиг.12 сыворотку, полученную в разные сроки после иммунизации, исследуют методом ELISA. Титры гемагглютинин-специфичных антител подтипа IgG2a наносят для групп, обработанных буфером (80% RiLa), свободной или комплексной иРНК ГА. Комплексообразование проводят с протамином Valeant по усовершенствованному протоколу РНК:протамин 2:1 + свободная РНК (1:1) (по массе).
Выявление антиген-специфических антител методом HAI:
Сыворотку иммунизированных мышей также анализируют методом HAI. С помощью метода HAI выявляют антитела, которые нейтрализуют вирус путем блокирования взаимодействия вирусного гемагглютинина и сиаловой кислоты на клетке-хозяине.
Сыворотку инактивируют при 56°С в течение 10 мин для разрушения комплемента и HAI ингибиторов. Сыворотку дополнительно инкубируют с каолином в течение 20 мин и предварительно адсорбируют на эритроцитах цыпленка в течение 30 мин для удаления неспецифических факторов, которые влияют на гемагглютинацию. Предварительно обработанные образцы сыворотки вносят в 96-луночный планшет с U-образными лунками в серийных разведениях с повторами. 25 мкл, содержащих 4 гемагглютинированные единицы инактивированного PR8 в ФСБ и 50 мкл of 0,5% эритроцитов цыпленка, затем добавляют и инкубируют при комнатной температуре в течение 45 мин. Конечные титры HAI определяют в виде реципрокной наибольшего разведения сыворотки, при котором полностью подавляется гемагглютинация эритроцитов. Титры сыворотки в разное время после иммунизации наносят для групп, обработанных буфером (80% RiLa), свободной или комплексной иРНК ГА. Комплексообразование проводят с протамином Valeant по усовершенствованному протоколу РНК:протамин 2:1 + свободная РНК (1:1) (по массе). Титр 40 рассматривают в качестве защитного титра в случае вирусной инфекции. Мыши, иммунизированные комплексной РНК ГА, показывают устойчивый титр HAI, составляющий более 40, а чистая иРНК ГА приводит к титрам в среднем ниже защитного титра 40.
Реферат
Группа изобретений относится к иммуностимулирующей композиции, включающей а) адъювантный компонент, содержащий или состоящий по меньшей мере из одной (и)РНК, объединенной с поликатионным пептидом или белком, и б) по меньшей мере одну свободную иРНК, кодирующую по меньшей мере один антиген, причем иммуностимулирующая композиция способна индуцировать или усиливать врожденный и необязательно адаптивный иммунный ответ у млекопитающего. Мольное соотношение (и)РНК адъювантного компонента а) к по меньшей мере к одной свободной иРНК второго компонента б) иммуностимулирующей композиции находится в пределах от примерно 0,001:1 до примерно 1:0,001. Иммуностимулирующая композиция по настоящему изобретению может являться как фармацевтической композицией, так и вакциной. Группа изобретений также относится к способу получения иммуностимулирующей композиции и ее применению для лечения различных заболеваний. Группа изобретений эффективна в индукции и усилении иммунного ответа у млекопитающего, а также в профилактике и лечении заболеваний и расстройств, выбранных из группы опухолевых, аутоиммунных, инфекционных и аллергических заболеваний. 7 н. и 15 з.п. ф-лы, 2 табл., 14 ил., 11 пр.
Формула
а) в качестве первого компонента адъювантный компонент, включающий или состоящий по меньшей мере из одной (и)РНК, объединенной с поликатионным пептидом или белком, и
б) в качестве второго компонента одну свободную иРНК, кодирующую по меньшей мере один антиген,
причем иммуностимулирующая композиция способна индуцировать или усиливать врожденный и необязательно адаптивный иммунный ответ у млекопитающего и, в которой мольное соотношение (и)РНК адъювантного компонента а) к по меньшей мере к одной свободной иРНК второго компонента б) находится в пределах от примерно 0,001:1 до примерно 1:0,001.
или из олигоаргининов, включающих Arg7, Arg8, Arg9, Arg7, H3R9, R9H3, H3R9H3, YSSR9SSY, (RKH)4, Y(RKH)2R,
или поликатионных полимеров, включая модифицированные полиаминокислоты, включая β-аминокислотные полимеры или инвертированные полиамиды, модифицированные полиэтилены, включая ПВП (поли(N-этил-4-винилпиридиний бромид), модифицированные акрилаты, включая пДМАЭМА (поли(диметиламиноэтилметилакрилат)), модифицированные амидоамины, включая пАМАМ (поли(амидоамин)), модифицированный полибетааминновый эфир (ПБАЭ), включая модифицированные по диаминному концу сополимеры 1,4 бутандиолдиакрилата и 5-амино-1-пентанола, дендримеры, включая полипропиламинные дендримеры или основанные на пАМАМ дендримеры, полиимин (полиимины), включая ПЭИ: поли(этиленимин), поли(пропиленимин), полиаллиламин, полимеры, основанные на каркасе молекулы сахара, включая полимеры на основе циклодекстрина, полимеры на основе декстрана, хитозана, полимеры, основанные на каркасе молекулы силана, включая сополимеры РМОХА-PDMS, блок-полимеры, состоящие из комбинации одного или более катионных блоков (выбранного катионного полимера, указанного выше) и из одного или более гидрофильных или гидрофобных блоков (включая полиэтиленгликоль).
а) по меньшей мере один, два, три или четыре (разных) антигена из следующей группы антигенов:
PSA (Prostate-Specific Antigen - простатический специфический антиген) = KLK3 (калликреин-3),
PSMA (Prostate-Specific Membrane Antigen - простатический специфический мембранный антиген),
PSCA (Prostate Stem Cell Antigen - антиген стволовых клеток простаты),
STEAP (шестой трансмембранный эпителиальный антиген простаты),
или
б) по меньшей мере один, два, три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать или двенадцать (разных) антигенов из следующих групп антигенов:
hTERT,
WT1,
MAGE-A2,
5Т4,
MAGE-А3,
MUC1,
Her-2/neu,
NY-ESO-1,
СЕА,
сурвивин,
MAGE-C1 и/или
MAGE-C2,
причем возможна любая комбинация этих антигенов.
причем иммуностимулирующая композиция способна индуцировать или усиливать врожденный и необязательно адаптивный иммунный ответ у млекопитающего, и эта иммуностимулирующая композиция получена способом, включающим следующие этапы:
а) получения адъювантного компонента, включающего или состоящего по меньшей мере из одной (и)РНК, объединенной в комплекс с поликатионным пептидом или белком, путем смешивания в по меньшей мере одной (и)РНК и поликатионного пептида или белка,
б) получения иммуностимулирующей композиции путем добавления в определенном соотношении по меньшей мере одной свободной иРНК к адъювантному компоненту, полученному на этапе а) так, что мольное соотношение (и)РНК адъювантного компонента по меньшей мере к одной свободной иРНК второго компонента б) находится в пределах от примерно 0,001:1 до примерно 1:0,001.
а) получения адъювантного компонента, включающего или состоящего по меньшей мере из одной (и)РНК, объединенной в комплекс с поликатионным пептидом или белком, путем смешивания в определенном соотношении по меньшей мере одной (и)РНК и поликатионного пептида или белка, описанного в одном из пп.1-14; и
б) получения иммуностимулирующей композиции путем добавления в определенном соотношении по меньшей мере одной свободной иРНК, описанной в одном из пп.1-13, к адъювантному компоненту, полученному на стадии а), причем по меньшей мере одна свободная иРНК кодирует по меньшей мере один белок терапевтического действия, антиген и/или антитело по одному из пп.1-13.
а) в качестве первого компонента адъювантный компонент, включающий или состоящий по меньшей мере из одной (и)РНК, объединенный с поликатионным пептидом или белком, и
б) в качестве второго компонента по меньшей мере одну свободную иРНК, кодирующую по меньшей мере один антиген, причем иммуностимулирующая композиция способна индуцировать или усиливать врожденный и необязательно адаптивный иммунный ответ у млекопитающего, использование включает введение композиции пациенту, который нуждается в этом, в безопасном и эффективном количестве.

Комментарии