Лечение мерцательной аритмии предсердий с использованием высокочастотной электростимуляции и абляции почечных нервов - RU2608619C2
Код документа: RU2608619C2
Чертежи
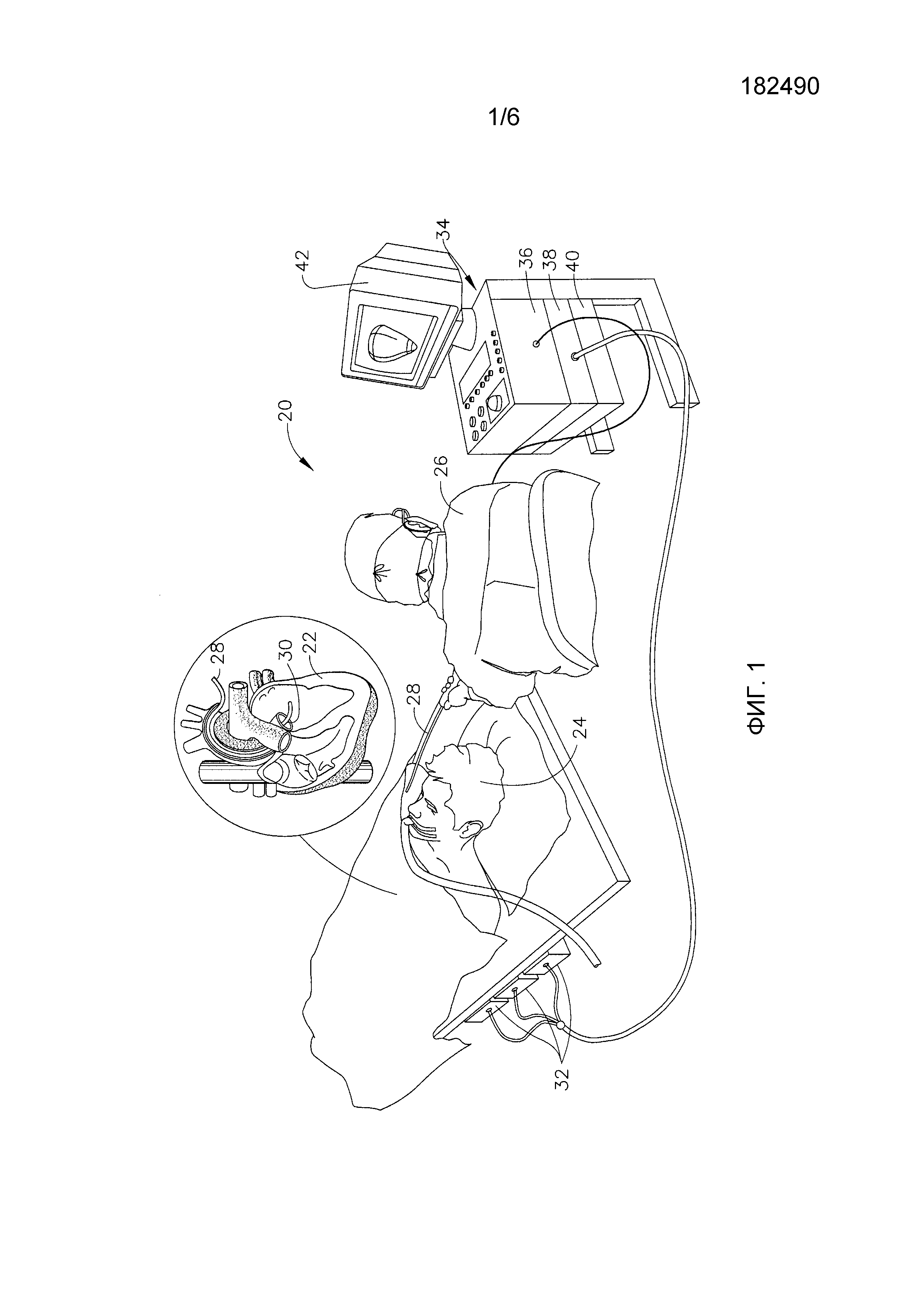




Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу использования абляционных катетеров для лечения сердечных аритмий, в том числе мерцательной аритмии предсердий, с помощью денервации почечного нерва как отдельно, так и в сочетании с абляцией сердечной ткани. В частности, в рамках способа используется высокочастотная электростимуляция, позволяющая определить местоположение почечного нерва для его абляции, и способ может включать абляцию сердечной ткани для достижения электрической изоляции легочной вены в сердце для лечения устойчивых к лекарственной терапии случаев мерцательной аритмии предсердий.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Аритмии сердца, в частности мерцательная аритмия предсердий, являются наиболее распространенными и опасными заболеваниями, особенно среди людей старшего возраста. У пациентов с нормальным синусовым ритмом сердце, состоящее из тканей предсердий, желудочков и проводящей системы и возбуждаемое электрическими импульсами, бьется синхронно и ритмично. У пациентов с аритмией сердца патологические участки сердечной ткани выпадают из синхронного ритма биения, характерного для нормально проводящей ткани, как у пациентов с нормальным синусовым ритмом. Вместо этого патологические участки сердечной ткани искажают электрический импульс, передаваемый прилегающей ткани, тем самым сбивая сердечный цикл на асинхронный ритм. Нарушения проводимости, как известно, могут возникать в различных участках сердца, например в области синусно-предсердного (СП) узла, вдоль проводящих путей атриовентрикулярного (АВ) узла и пучка Гиса, или в сердечной мышечной ткани, из которой состоят стенки нижних и верхних камер сердца.
Сердечные аритмии, в том числе предсердные аритмии, могут быть мелковолнового возвратного типа, который характеризуется множеством асинхронных петель электрических импульсов, рассредоточенных вокруг предсердия и зачастую являющихся спонтанно распространяющимися. Помимо аритмий мелковолнового возвратного типа различают фокальные сердечные аритмии, при которых изолированный участок ткани в предсердии периодически быстро приходит в возбуждение. Желудочковая тахикардия (ЖТ) - тахикардия или учащенный сердечный ритм, возникающий в одном из желудочков сердца. Такая аритмия потенциально опасна для жизни, так как может привести к фибрилляции желудочков и мгновенной смерти.
Один из типов аритмии, мерцательная аритмия предсердий, возникает, когда нормальные электрические импульсы, генерируемые синусно-предсердным узлом, зашумляются дезорганизованными электрическими импульсами, возникающими в предсердных и легочных венах, в результате чего беспорядочные импульсы проводятся к желудочкам. Возникает беспорядочное сердцебиение, которое может продолжаться от нескольких минут до нескольких недель или даже лет. Мерцательная аритмия предсердий (МАП) часто представляет собой хроническое заболевание, приводящее к небольшому увеличению риска летального исхода, часто в результате инфаркта. Риск увеличивается с возрастом. МАП в той или иной степени встречается приблизительно у 8% людей в возрасте более 80 лет. Мерцательная аритмия предсердий часто проходит бессимптомно и сама по себе в целом не представляет угрозы для жизни, однако может вызывать учащенное сердцебиение, слабость, головокружение, боли в груди и застойную сердечную недостаточность. Риск инфаркта при МАП возрастает, поскольку кровь может накапливаться и образовывать сгустки в плохо сокращающихся предсердиях и в ушке левого предсердия. Первым подходом к лечению МАП является медикаментозная терапия, которая либо замедляет частоту сердечных сокращений, либо возвращает сердечный ритм к нормальным показателям. Кроме того, пациентам с МАП часто даются антикоагулянты для защиты от инфаркта. Применение антикоагулянтов создает опасность внутренних кровотечений. Для некоторых пациентов медикаментозная терапия оказывается недостаточной, и предсердная аритмия является устойчивой к лекарствам, т.е. неизлечимой обычными фармакологическими средствами. Для прекращения МАП и возврата к нормальному сердечному ритму может применяться электроимпульсная терапия синхронизированными электрическими разрядами. Как вариант, у пациентов с МАП может применяться катетерная абляция. Однако такая абляция не всегда оказывается успешной. Следовательно, существует потребность в альтернативном способе лечения таких пациентов. Одним из вариантов является хирургическая абляция, однако этот вариант связан с традиционными рисками хирургического вмешательства.
Диагностика и лечение аритмий сердца включает картирование электрических свойств ткани сердца, в особенности эндокарда и объема сердца, и селективную абляцию ткани сердца путем воздействия энергией. Абляция может остановить или изменить распространение нежелательных электрических сигналов из одной части сердца в другую. В процессе абляции образуются непроводящие поврежденные участки, что приводит к разрушению нежелательных путей прохождения электрического сигнала. Известны различные способы подачи энергии для создания поврежденных участков. В рамках этих способов для создания блоков проводимости вдоль сердечной стенки используется микроволновая, лазерная и чаще всего - радиочастотная энергия. В ходе операции, проводимой в два этапа (картирование с последующей абляцией), электрическая активность в точках внутри сердца, как правило, фиксируется и измеряется путем введения и продвижения в полости сердца катетера, содержащего один или более электрических датчиков (или электродов), и получения данных во множестве точек. Полученные данные затем используются для определения целевых областей эндокарда, в которых затем выполняется абляция.
Электродные катетеры широко применяются в медицинской практике в течение многих лет. Они используются для стимуляции и картирования электрической активности сердца, а также для абляции участков нарушенной электрической активности. На практике электродный катетер вводят в главную вену или артерию, например в бедренную артерию, и затем направляют в соответствующую камеру сердца. Стандартная процедура абляции включает введение в камеру сердца катетера с точечным электродом на дистальном конце. Также предусмотрен контрольный электрод, который, как правило, фиксируется на коже пациента или при помощи второго катетера, размещаемого в полости сердца или рядом с ним. Радиочастотный (РЧ) ток подается к точечному электроду абляционного катетера и проходит через окружающую среду, а именно через кровь и ткань, по направлению к контрольному электроду. Распределение тока зависит от площади поверхности электрода, контактирующей с тканью и кровью, так как кровь обладает большей проводимостью, чем ткань. Нагревание ткани обусловлено ее электрическим удельным сопротивлением. Ткань нагревается в достаточной степени, чтобы вызвать разрушение клеток ткани сердца, в результате чего в ней формируется поврежденный участок, который не проводит электрический ток. В ходе этого процесса нагревание электрода также происходит в результате проведения возбуждения от нагретой ткани к электроду. Если температура электрода повышается значительно, предположительно, выше 60 градусов Цельсия, на поверхности электрода может образовываться тонкое прозрачное покрытие из дегидратированного белка крови. В случае если температура продолжает повышаться, этот дегидратированный слой крови постепенно утолщается, что приводит к коагуляции крови на поверхности электрода. В силу того, что дегидратированный биологический материал обладает более высоким электрическим сопротивлением, чем ткань, сопротивление проникновению электрической энергии в ткань тоже возрастает. Если сопротивление значительно возрастает, происходит повышение сопротивления, в этом случае необходимо извлечь катетер из полости организма и очистить точечный электрод.
В патенте США № 6292695 описывается способ борьбы с мерцательной аритмией, тахикардией или сердечной аритмией при помощи электрофизиологического катетера, в наконечник которого встроен по меньшей мере один стимулирующий электрод, и этому электроду придается устойчивое положение в выбранном месте внутри сосуда. Электрод подключают к стимулирующему устройству, и стимуляцию осуществляют в направлении, поперечном относительно стенки сосуда - через сосуд к симпатическому или парасимпатическому нерву, иннервирующему сердце, и интенсивность стимуляции выбирается достаточной для деполяризации нерва и оказания воздействия на работу сердца.
Использование стимуляции почечного нерва при лечении сердечных аритмий описано в патентной публикации США за № 2007/1029671, авторы Demaris et al. Demaris предлагает использовать нейромодуляцию для осуществления необратимого электрошокового открытия клеточных пор, электрошокового слияния клеток, деструкции, некроза и/или индукции апоптоза, изменения экспрессии генов, ослабления или блокады потенциала действия, изменения выделения цитокинов и других состояний в нервных волокнах-мишенях. В некоторых вариантах осуществления такая нейромодуляция достигается путем применения нейромодуляторных агентов, тепловой энергии или высокоинтенсивного фокусированного ультразвука.
В патентной публикации США № 2010/0222851, авторы Deem et al., предлагается осуществлять мониторинг нейромодуляции почечных нервов с целью определения денервации или модуляции активности этих нервов. Ожидается, что стимуляция таких нервов до нейромодуляции будет снижать кровяное давление, а стимуляция после нейромодуляции не будет снижать кровяное давление в той же мере при использовании тех же параметров и расположений, которые использовались до нейромодуляции.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу лечения пациентов, в частности к лечению сердечных аритмий, например, с использованием абляции почечных нервов отдельно или в сочетании с абляцией сердечной ткани.
Настоящий способ лечения пациентов включает следующие этапы: вставление абляционного катетера с установленным на нем электродом в почечную артерию пациента, причем почечная артерия имеет стенку, образующую просвет, стимуляцию участка стенки просвета почечной артерии, отслеживание давления крови у пациента, поиск такого места на стенке артерии, стимуляция которого вызывает снижение давления крови у пациента, что позволит определить нахождение вблизи такого места почечного нерва, и абляцию почечного нерва вблизи выявленного места.
После проведения абляции проводят повторную стимуляцию выявленного места, чтобы определить, приводит ли стимуляция к снижению давления крови. При обнаружении снижения давления может потребоваться повторная абляция в выявленном месте. Абляционный катетер может представлять собой катетер, способный разрушать ткань при помощи энергии радиочастотного излучения, ультразвука, микроволновой энергии или криогенного охлаждения. Абляционный катетер может содержать орошаемый электрод для уменьшения повреждения структур стенки почечной артерии, отличных от клеток почечного нерва, например слоя эндотелия. Орошаемый электрод может иметь множество отверстий, через которые может поступать охлаждающая жидкость, или он может охлаждаться жидкостью, циркулирующей по замкнутой системе. Охлаждающая жидкость может представлять собой солевой раствор, предпочтительно охлажденный по существу до температуры ниже температуры тела пациента, более предпочтительно, до температуры приблизительно 20 градусов Цельсия.
Этап стимуляции участка стенки просвета почечной артерии включает использование высокочастотных импульсов, предпочтительно с частотой более приблизительно 20 кГц, что должно привести к стимуляции почечного нерва и, следовательно, к изменению кровяного давления пациента. Абляционный катетер может быть перемещен вдоль стенки почечной артерии в другое место, где этапы стимуляции, мониторинга, идентификации и абляции можно повторить. Операцию можно повторять до тех пор, пока не будет сочтено, что все почечные нервы были разрушены.
Способ по пункту 1, где лечение применяется при сердечной аритмии. При лечении сердечной аритмии способ предпочтительно включает этапы вставления абляционного катетера в сердце пациента и абляцию сердечной ткани абляционным катетером для коррекции аритмии. Если сердечная аритмия представляет собой мерцательную аритмию предсердий, то этап абляции сердечной ткани приводит к изоляции одной или более легочных вен.
Абляционный катетер, используемый при данном способе, может содержать датчик местоположения, например магнитный датчик местоположения, способный дать информацию о местонахождении кончика абляционного катетера.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Эти и другие особенности и преимущества настоящего изобретения будут более понятными на примере следующего подробного описания в сочетании с сопроводительными чертежами.
На фиг.1 представлен схематичный рисунок системы для катетеризации сердца.
На фиг.2 представлено схематичное изображение, иллюстрирующее анатомию почки.
На фиг.3 представлено схематичное изображение поперечного сечения участка стенки почечной артерии.
На фиг.4 представлен вид сбоку одного варианта осуществления катетера, составляющего предмет настоящего изобретения.
На фиг.5 представлен вид в перспективе дистальной части катетера, изображенного на фиг. 4.
На фиг.6 представлена блок-схема способа почечной денервации в соответствии с настоящим изобретением.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
На фиг. 1 представлен схематичный рисунок системы 20 для почечной и/или сердечной катетеризации в соответствии с одним вариантом осуществления настоящего изобретения. Систему 20 можно создать, например, на основе системы CARTO™, производимой Biosense Webster Inc. (Даймонд Бар, Калифорния, США). Данная система содержит инвазивный зонд, имеющий форму катетера 28, и панель управления 34. В варианте осуществления, описанном ниже в настоящем документе, предполагается, что катетер 28 используется для разрушения ткани эндокарда способом, известным специалисту в данной области. В качестве альтернативы катетер можно использовать mutatis mutandis и при других терапевтических и/или диагностических процедурах на сердце или других органах тела.
Оператор 26, например кардиолог, вводит катетер 28 через сосудистую систему пациента 24 таким образом, что дистальный конец 30 катетера оказывается в почечной артерии или в камере сердца пациента 22. Оператор продвигает катетер таким образом, чтобы дистальный наконечник катетера коснулся ткани эндокарда в заданной точке или точках. Проксимальным концом катетер 28, как правило, присоединен с помощью подходящего устройства к панели управления 34. Панель содержит радиочастотный (РЧ) генератор 40, который подает радиочастотные электрические волны через катетер для абляции ткани сердца в точках, которых касается дистальный наконечник, как описано далее в настоящем документе. Как вариант, катетер и система могут быть выполнены с возможностью проведения абляции иными способами, известными в данной области, например криоабляции, ультразвуковой абляции или абляции при помощи микроволновой энергии.
Панель управления 34 посредством системы позиционирования с использованием магнитного поля определяет координаты положения дистального конца 30 внутри сердца 22. Для этой цели возбуждающий контур 38 панели управления 34 приводит в действие генераторы поля 32, которые создают магнитные поля внутри тела пациента 24. Как правило, генераторы поля представляют собой катушки, размещенные ниже туловища пациента в строго определенных местах, находящихся вне тела пациента. Эти катушки генерируют магнитные поля, охватывающие заданный объем, распространяющийся на сердце 22. Датчик магнитного поля, вмонтированный в дистальный конец 30 катетера 28 (показан на фиг. 2), под действием магнитного поля генерирует электрические сигналы. Процессор 36 обрабатывает эти сигналы и определяет координаты положения (как правило, места и ориентации) дистального конца. Данный способ определения положения реализован в упомянутой выше системе CARTO и детально описан в патентах США №№ 5391199, 6690963, 6484118, 6239724, 6618612 и 6332089, в патентной публикации PCT WO 96/05768 и в опубликованных заявках на патент США №№ 2002/0065455 A1, 2003/0120150 A1 и 2004/0068178 A1, описания которых полностью включены в настоящий документ путем ссылки.
Процессор 36, как правило, содержит компьютер общего назначения со средствами предварительной обработки и интерфейсами, подходящими для приема сигналов с катетера 28 и контроля других компонентов панели управления 34. Для осуществления описанных в настоящем документе функций процессор может быть снабжен специальным программным обеспечением. Программу можно загрузить в панель управления 34 в электронном виде по сети или с носителей, например, оптических, магнитных или электронных устройств памяти. В другом варианте осуществления изобретения некоторые или все функции процессора 36 осуществляются специализированными или программируемыми компонентами цифровых аппаратных средств. С учетом сигналов, получаемых от катетера и других компонентов системы 20, процессор 36 управляет дисплеем 42, позволяя оператору 26 визуально контролировать положение дистального конца 30 катетера в теле пациента, а также получать информацию о состоянии и инструкции, относящиеся к производимой процедуре.
Кроме того или в качестве альтернативы, система 20 может содержать автоматический механизм передвижения и управления катетером 28 внутри тела пациента 24. Такие механизмы, как правило, способны контролировать как продольное перемещение катетера (вперед/назад), так и поперечное перемещение дистального конца катетера (отклонение вбок/поворот). Некоторые механизмы такого типа используют для данной цели, например, постоянные магнитные поля. В таких вариантах осуществления процессор 36 генерирует управляющий входной сигнал, управляющий движением катетера с помощью сигналов с датчика магнитного поля в катетере. По этим сигналам можно определить местонахождение дистального конца катетера и давление на дистальный конец (пояснение ниже).
На фиг. 2 представлено схематичное изображение почечной и мочевыделительной системы человека, включающей левую и правую почки K, получающие насыщенную кислородом кровь по почечным артериям RA, в которые, в свою очередь, кровь попадает из брюшной аорты AA. Несмотря на относительно небольшой размер почек, на них подается приблизительно 20% насыщенной кислородом крови, выходящей из сердца. Каждая почечная артерия разветвляется на сегментарные артерии, которые дальше разветвляются на долевые артерии, проникающие в почечную капсулу и проходящие сквозь почечные столбы между почечными пирамидами. Моча выводится через почки K по мочеточникам U в мочевой пузырь B мочевыделительной системы.
После использования почками оксигенированной крови она отводится обратно к сердцу по почечным венам RV и нижней полой вене IVC. Взаимодействие почек и центральной нервной системы осуществляется через почечное сплетение, волокна которого проходят вдоль почечных артерий и достигают обеих почек. Почечные нервы проходят вдоль и вокруг почечных артерий RA, как правило, внутри адвентициальной оболочки стенки артерии, приблизительно в 3 мм под слоем эндотелия. На фиг. 3 показаны слои типичной артерии, в том числе почечной артерии, включающие эндотелиальный слой E, слой клеток гладкой мускулатуры SMC и адвентициальную оболочку A. Почечный нерв RN расположен, главным образом, внутри адвентициальной оболочки.
На фиг. 3 и 4 показан вариант осуществления катетера 28 с усовершенствованным орошающим протоком через кончик абляционного электрода 17, который может применяться в настоящем способе. Более подробно данный катетер описывается в заявке на патент США № 12/770582, поданной 29 апреля 2010 года, которая включена в настоящий документ в силу ссылки. Точечный электрод выполнен с возможностью продвижения жидкости к точечному электроду и ее дисперсии в этой зоне для более полного охвата зоны и растекания во всех направлениях по внешней поверхности точечного электрода. Следовательно, катетер может работать при более низкой скорости протока жидкости, в результате чего жидкость меньше попадает в организм пациента, и при этом охлаждение является более совершенным, чем в охлаждаемых электродах предыдущих моделей. Более того, при высокой скорости выхода жидкости из точечного электрода создается эффект "струи", который позволяет создать пограничный слой жидкости вокруг точечного электрода, что снижает вероятность образования рубца и/или тромба в ходе абляции. Жидкость, например физиологический раствор или гепаринизированный физиологический раствор, доставляют к месту абляции через точечный электрод для охлаждения ткани, снижения коагуляции и (или) упрощения формирования более глубоких поврежденных участков. Необходимо понимать, что таким же образом могут доставляться любые другие жидкости, в том числе диагностические или лекарственные жидкости, такие как нейроингибиторы и нейростимуляторы.
Катетер 28 имеет продолговатый корпус катетера 12 с проксимальным и дистальным концами, промежуточной изгибаемой секцией 14 на дистальном конце корпуса катетера 12 и дистальной секцией 15 с орошаемым точечным электродом 17 для картирования и абляции. Катетер также включает рукоятку управления 16, исходящую от проксимального конца корпуса катетера 12 и предназначенную для управления (одно- или двунаправленным) изгибом промежуточной секции 14.
Корпус катетера 12 содержит продолговатую трубчатую конструкцию с одним осевым или центральным просветом 18. Корпус катетера 12 является гибким, т.е. поддающимся изгибу, но по существу несжимаемым по всей соей длине. Корпус катетера 12 может иметь любую подходящую конструкцию и может быть изготовлен из любого подходящего материала. Предпочтительная в настоящий момент конструкция включает наружную стенку, изготовленную из полиуретана или пебакса. Наружная стенка включает встроенную плетеную сетку из нержавеющей стали или т.п. для повышения жесткости на скручивание корпуса катетера 12, так чтобы при вращении рукоятки управления 16 промежуточная секция 14 катетера 28 поворачивалась соответствующим образом.
Внешний диаметр корпуса катетера 12 не имеет особого значения, но предпочтительно не должен превышать приблизительно 3,008 мм (8 французских пунктов), а более предпочтительно - 2,632 мм (7 французских пунктов). Аналогичным образом толщина наружной стенки 20 не имеет особого значения, однако она должна быть достаточно тонкой, чтобы центральный просвет 18 мог вместить вытяжные элементы (например, вытяжные проволоки), токопроводящие проводники и другие необходимые провода, кабели и трубки. При необходимости внутренняя поверхность наружной стенки может быть укреплена упрочняющей трубкой для повышения жесткости на скручивание
Компоненты, протянутые между рукояткой управления 16 и изгибаемой секцией 14, проходят через центральный просвет 18 корпуса катетера 12. К этим компонентам относятся: токопроводящие проводники для точечного электрода 17 и кольцевых электродов 22 на дистальной секции 15, оросительная трубка для доставки жидкости к дистальной секции 15, кабель для датчика определения положения, размещенного в дистальной секции, вытяжная(ые) проволока(и) для изгибания промежуточной секции 14 и пара проводов термопары для измерения температуры на дистальном наконечнике 15.
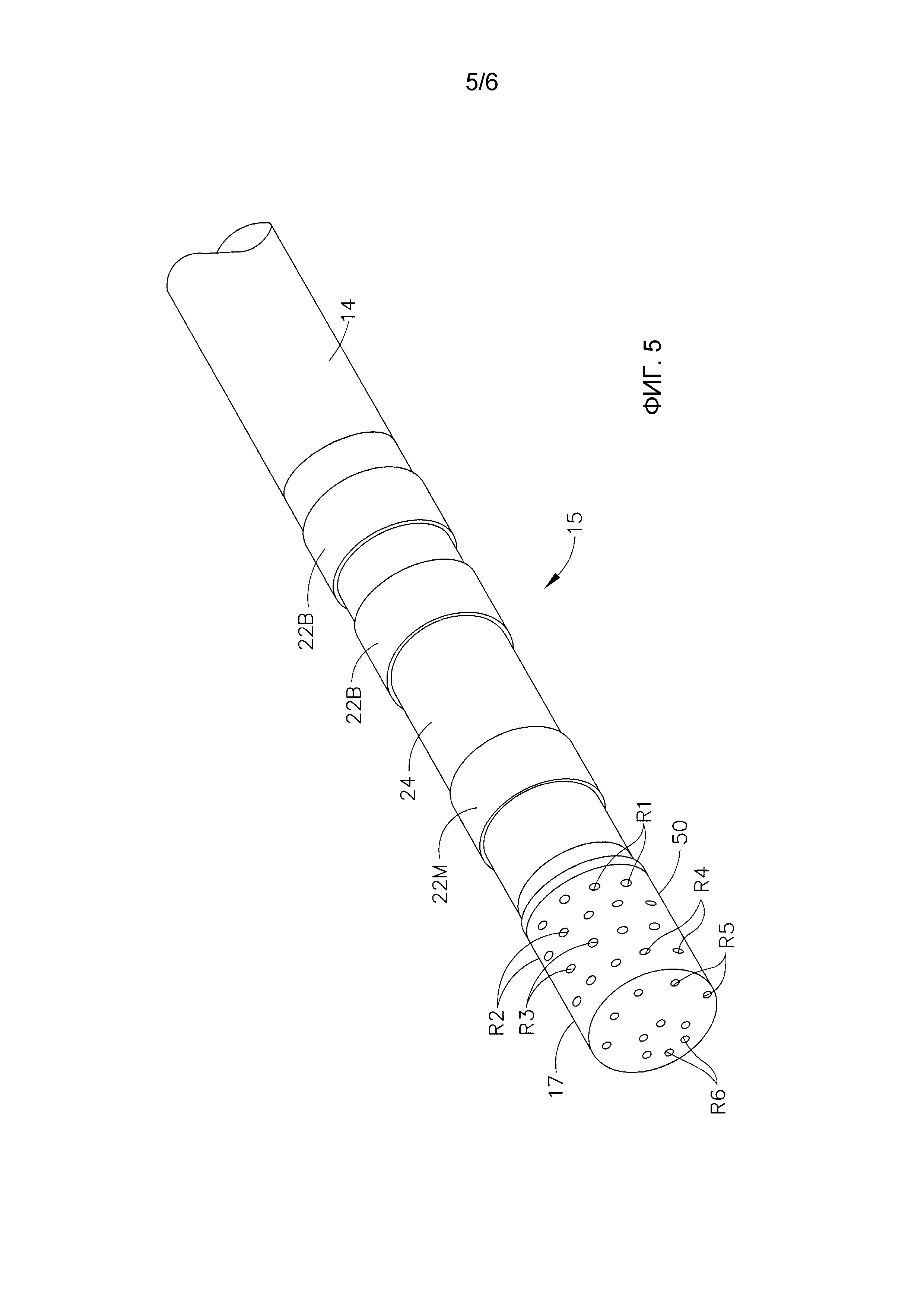
Дистальный конец промежуточной секции 14 содержит дистальный наконечник 15, который включает точечный электрод 17 и относительно короткий участок соединительной трубки или оболочки 24, расположенный между точечным электродом 17 и промежуточной секцией 14. Как изображено на фиг. 4, в представленном варианте осуществления соединительная трубка 24 имеет одиночный просвет, который вмещает токопроводящий проводник точечного электрода и кольцевых электродов 30, кабель датчика 33, провода термопары 41 и 42, вытяжные проволоки 32 и оросительную трубку 38 на входе точечного электрода 17. Одиночный просвет соединительной трубки 24 позволяет переориентировать эти компоненты в зависимости от расположения соответствующих просветов в промежуточной секции 14 и их расположения в точечном электроде 17. В описанном варианте осуществления трубка 24 представляет собой защитную трубку, а именно трубку из полиэфирэфиркетона (ПЭЭК), длина которой находится в диапазоне от 6 мм до 12 мм, а более предпочтительно составляет приблизительно 11 мм. Следует отметить, что отдельные компоненты, включая токопроводящие проводники точечного и кольцевых электродов 30, не показаны для ясности и лучшего обзора других компонентов и структуры точечного электрода.
Оболочка 50 выполнена из биосовместимого металла, в том числе из биосовместимого металлического сплава. Подходящим биосовместимым металлическим сплавом является сплав, принадлежащий к группе, в состав которой входят: нержавеющие стали, сплавы благородных металлов и (или) их комбинации. В одном из вариантов осуществления оболочка выполнена из сплава, содержащего приблизительно 80% вес. палладия и приблизительно 20% вес. платины. В альтернативном варианте осуществления оболочка выполнена из сплава, содержащего приблизительно 90% вес. платины и приблизительно 10% вес. иридия. Оболочка может быть изготовлена методом глубокой вытяжки, который позволяет получить достаточно тонкую, но прочную стенку оболочки, подходящую для выполнения манипуляций, транспортировки в полости тела пациента и контакта с тканью в процессе картирования и абляции. В описанном варианте осуществления стенка оболочки имеет преимущественно равномерную толщину, находящуюся в диапазоне от приблизительно 0,076 мм (0,003 дюйма) до 0,254 мм (0.010 дюйма), предпочтительно - от приблизительно 0,076 мм (0,003 дюйма) до 0,102 мм (0,004 дюйма), более предпочтительно, составляющую приблизительно 0,089 мм (0,0035 дюйма). Хотя метод глубокой вытяжки хорошо подходит для изготовления оболочки с достаточно тонкой стенкой, необходимо понимать, что также могут использоваться и другие методы, например высверливание и (или) отливка (формование).
В описанном варианте осуществления количество отверстий равно 56. Они расположены по периметру в шесть рядов, где пять рядов Р1-Р5 имеют по 10 отверстий в каждом ряду, а дистальный ряд Р6 имеет шесть отверстий. Отверстия в рядах Р1-Р5 преимущественно расположены на одинаковом расстоянии друг от друга, при этом отверстия в соседних рядах расположены со смещением относительно друг друга так, что каждое отверстие равноудалено от четырех или шести соседних отверстий. Наиболее дистальный ряд Р5, содержащий десять отверстий, расположен на закругленной дистальной части оболочки. Ряд (или круг) Р6 расположен на плоском или почти плоском дистальном конце 53 оболочки. Шесть отверстий, составляющих ряд Р6, образуют равные углы в круге.
Кольцевые электроды 22, установленные на соединительной трубке 24, могут быть изготовлены из любого подходящего твердого электропроводного материала, такого как платина или золото, предпочтительной является комбинация платины и иридия. Кольцевые электроды могут быть зафиксированы на соединительной трубке 24 при помощи клея или аналогичного материала. В другом варианте осуществления кольцевые электроды могут быть сформированы посредством покрытия трубки 24 электропроводным материалом, таким как платина, золото и (или) иридий. Покрытие может быть нанесено способом напыления, ионно-лучевого осаждения или эквивалентными способами. По желанию количество кольцевых электродов на трубке 24 может варьироваться. Кольца могут быть одно- или двухполюсными. В представленном варианте осуществления присутствует дистальный однополюсный кольцевой электрод и пара проксимальных двухполярных кольцевых электродов. Каждый кольцевой электрод подсоединен к соответствующему токопроводящему проводнику. Точечный электрод 17 электрически соединен с источником энергии для абляции при помощи токопроводящего проводника. Кольцевые электроды 21 электрически соединены с соответствующей системой картирования и контроля при помощи токопроводящих проводников.
Точечный электрод, составляющий предмет настоящего изобретения, может работать со скоростью приблизительно 8 мл/мин или меньше при мощности потребления ниже 30 Вт и со скоростью приблизительно 17 мл при мощности потребления в пределах от 30 до 50 Вт. Это позволяет достичь существенного снижения жидкостной нагрузки на пациента в течение пяти- или шестичасовой операции. Более того, в тех вариантах, где предусмотрено регулирование скорости потока с помощью программируемого насоса, скорость потока и потребляемая мощность могут быть еще ниже.
На фиг. 5 представлена блок-схема, изображающая ход процедуры двойной абляции в соответствии с настоящим изобретением. На этапе 100 врач вводит абляционный катетер в почечную артерию пациента. Это можно сделать путем надреза в почечной артерии и проведения абляционного катетера в почечную артерию или путем использования другого известного способа. Место применения рч-энергии для абляции определяют на этапе 110 путем высокочастотной стимуляции, предпочтительно, с частотой более 20 кГц. При помощи высокочастотной стимуляции можно определить, находится ли почечный нерв вблизи абляционного катетера. Высокочастотная стимуляция почечного нерва приведет к падению кровяного давления пациента, поэтому на этапе 120 производится мониторинг кровяного давления. На этапе 130, если наблюдается падение кровяного давления в ответ на высокочастотную стимуляцию, то на этапе 140 можно приступать у абляции ткани. Для абляции почечного нерва используется абляционный катетер. Например, при использовании орошаемого рч-катетера, описанного выше, далее можно применить воздействие рч-волнами на данный участок внутренней поверхности почечной артерии, что приведет к абляции почечного нерва. Охлаждающая жидкость из орошаемого абляционного катетера защитит клетки эндотелия и гладкой мускулатуры от чрезмерного повреждения и предотвратит стеноз почечной артерии. Охлаждающая жидкость должна быть достаточно холодной, чтобы уменьшить повреждение эндотелия, предпочтительно, ее температура должна быть ниже температуры тела пациента, более предпочтительно, ниже приблизительно 20 градусов Цельсия. Вместо рч-волн в абляционном катетере может использоваться ультразвук, микроволновое излучение или хладагент, что известно специалистам в данной области.
Для подтверждения успешного проведения абляции на этапе 150 проводят повторную высокочастотную стимуляцию и проверяют, снизилась ли вагальная реакция, т.е. уменьшилось ли падение кровяного давления у пациента при стимуляции той же области такими же стимулами, что и до абляции. В результате мониторинга на этапе 150 и определения наличия реакции на этапе 170 можно удостовериться в абляции почечного нерва вблизи данного участка (этап 180), или, если кровяное давление реагирует на стимуляцию, абляцию можно повторить (этап 140). Как только абляция подтверждается ослаблением вагальной реакции на этапе 130 или 170, абляционный катетер можно переместить (этап 190) и определить, имеется ли в другой точке почечной артерии почечный нерв, который необходимо подвергнуть абляции для получения желаемого результата.
Высокочастотную стимуляцию проводят при помощи генератора производства Grass Technologies при частоте, большей или равной 20 кГц.
Для специфической терапии сердечной аритмии следующим этапом процесса является ввод абляционного катетера в бедренную или плечевую артерию пациента и направление катетера в камеру сердца для абляции сердечной ткани. В случае мерцательной аритмии предсердий абляцию выполняют для изоляции одной или более легочных вен. Абляционный катетер вводят через надрез в плечевой артерии пациента и перемещают в желудочек сердца, например, в соответствии с указаниями, приведенными в патентной публикации США № 2007/003826, автор Y.Schwartz, озаглавленной “Стандартизация катетеризационного лечения мерцательной аритмии предсердий”. Сочетание денервации почечного нерва и изоляции легочной вены позволяет уменьшить рецидивы мерцательной аритмии предсердий и снизить количество повторно проводимых процедур.
Предшествующее описание изложено со ссылкой на предпочтительные на данный момент варианты осуществления изобретения. Специалистам в области техники и технологии, к которой принадлежит настоящее изобретение, будет понятно, что описанная конструкция допускает модификации и изменения, не нарушающие принципы и сущность настоящего изобретения и не выходящие за рамки его объема.
Соответственно, вышеприведенное описание не следует рассматривать как относящееся исключительно к конкретным структурам, описанным и проиллюстрированным прилагаемыми чертежами, но его следует рассматривать в соответствии и в качестве дополнения к приведенным ниже пунктам формулы изобретения, которые должны четко и во всей полноте описать сферу данного изобретения.
Реферат
Изобретение относится к медицине, а именно к медицинской технике. Система включает абляционный катетер с электродом, генератор, средство для мониторинга кровяного давления пациента, средство для проведения абляции почечного нерва электродом. При этом частота генерируемых высокочастотных импульсов для стимуляции участка стенки просвета почечной артерии более чем 20 кГц. Система позволяет повысить эффективность лечения аритмии и снизить травматичность за счет точной абляции почечного нерва. 13 з.п. ф-лы, 6 ил.

Комментарии