Комплект принадлежностей для фиксации протеза или его части и/или заполнения костных дефектов и способ фиксации протеза или его части с использованием указанного комплекта - RU2458655C2
Код документа: RU2458655C2
Чертежи






























Описание
Настоящее изобретение относится к средствам фиксации протеза или его части и (или) заполнения костных дефектов.
При фиксации протезных конструкций, например при эндопротезировании тазобедренного сустава, часть имеющейся кости удаляется с целью создания фиксирующей поверхности, например, путем сверления и (или) развертывания отверстия в остающейся части кости. Затем протез крепится к указанной поверхности, обеспечивая стабильную конфигурацию и замещение сустава.
Известны и традиционно применяются различные средства и способы фиксации указанного протеза к указанной поверхности. В настоящее время эти способы можно условно подразделить на протезирование с цементированием и без него. При использовании цементирования протез крепится к фиксирующей поверхности при помощи слоя костного цемента, основой которого является полиметилметакрилат. Указанный цемент сцепляется как с протезом, так и с фиксирующей поверхностью. В способах без цементирования можно использовать различные средства, такие как зажимы, винты и т.п., способные механически закреплять протез на кости и (или) внутри нее. Другой подход предполагает наращивание костной или какой-либо другой ткани на протезе и (или) внутри него. С этой целью часть протеза снабжается стимулятором роста костной ткани и покрытием, обеспечивающим сцепление с костью. В первое время после фиксации человеку или животному, прошедшему протезирование, разрешаются только весьма ограниченные нагрузки на сустав.
Известно также применение костных чипсов, применяемых в качестве слоя между фиксирующей поверхностью и частью протеза, обеспечивающих наращивание костной или другой ткани в указанном слое костных чипсов. Указанный способ описывается, например, в патенте США №5047035. В данном способе, обычно применяющемся в эндопротезировании, слой костных чипсов, полученных от пациента или банка доноров, наносят на отверстие в бедренной кости, после чего в указанное отверстие вводят уплотняющий инструмент с целью уплотнения указанного слоя на стенках указанного отверстия. Затем в отверстие в указанном слое, образовавшееся в результате удаления указанного инструмента после уплотнения, вводят слой цемента. После этого внутри указанного слоя костного цемента располагают ножку протеза, обеспечивая фиксацию указанного протеза.
Проблемой ревизионной хирургии в соответствии с вышеуказанным способом является потеря костного вещества. Восстановление костного вещества является одним из ключевых факторов в вопросе стабильности имплантантов, таких как протезы, особенно в ревизионной хирургии. В этом смысле представляется перспективным импакционная костная пластика (BIG) с применением костных чипсов для исправления дефектов кости, как это описывалось выше, поскольку при этом восстанавливается первоначальное костное вещество. В импакционной костной пластике применяются только человеческие костные аллотрансплантаты и некоторые аутотрансплантаты. Для этой цели могут рассматриваться и ксенотрансплантаты, но в настоящее время по разным причинам их применение весьма ограничено. Одной из проблем данной технологии является дефицит костного аллотрансплантата в результате возросшего и продолжающего возрастать количества артропластических операций. Кроме того, применение аллотрансплантатов и ксенотрансплантатов потенциально опасно вследствие возможного переноса инфекции или отторжения реципиентом. Наконец, препятствием для использования данного метода могут являться религиозные и прочие убеждения.
В WO 00/13615 описывается применение подушечки, наполненной порцией смеси пористых гранул совместимого с тканью материала и измельченного совместимого с тканью биологического материала, такого как костная мука; к данной смеси добавляется еще один совместимый с тканью компонент, позволяющий моделировать или формовать смесь внутри подушечки. Подушечку подвергают вибрации с целью обеспечения достаточного уплотнения смеси перед применением. В живом организме обеспечивается наращивание костной и другой ткани в указанную подушечку и указанную смесь с целью обеспечения желаемой фиксации. При этом следует избегать нагрузки на протез непосредственно после его имплантации. Применение таких подушечек представляет определенную сложность, особенно в относительно узких и глубоких полостях, как при фиксации бедренного компонента. Кроме того, здесь также необходим костный аллотрансплантат, аутотрансплантат и (или) ксенотрансплантат.
Поэтому целью настоящего изобретения является обеспечение альтернативных средств и способа фиксации протеза или его части и (или) заполнения костных дефектов.
Еще одной целью настоящего изобретения является преодоление по крайней мере одного из недостатков, характерных по крайней мере для одного из описанных выше способов.
Кроме того, целью настоящего изобретения является обеспечение набора принадлежностей для фиксации протеза, особенно, но не исключительно, в ревизионной хирургии.
Наконец, целью настоящего изобретения является создание способа фиксации протеза или его части и (или) заполнения костных дефектов.
Сущность настоящего изобретения заключается в следующем.
Предлагается комплект принадлежностей для фиксации протеза или его части и/или заполнения костных дефектов, содержащий: протез или часть протеза, имеющие, по крайней мере, одну контактную поверхность; металлические гранулы, обладающие внутренней пористостью; костный цемент, при этом указанные гранулы выполнены на основе титана, причем указанные гранулы предпочтительно обладают остеопроводимостью, и предпочтительно имеют покрытие из группы остеопроводящих или остеоиндуктивных покрытий, или покрытий, содержащих биокерамику, биостекло или остеопроводящие или остеоиндуктивные молекулы или жидкости или клетки.
В предложенном комплекте принадлежностей количество гранул достаточно для покрытия, по крайней мере, одной контактной поверхности слоем гранул, имеющим среднюю толщину, равную, по крайней мере, однократному среднему размеру гранул, предпочтительно - от однократного до 10-кратного среднего размера гранул, наиболее предпочтительно - от однократного до 3-кратного размера.
В предложенном комплекте принадлежностей количество цемента достаточно для покрытия гранул в слое гранул, покрывающем, по крайней мере, одну указанную контактную поверхность на глубину, по крайней мере, 2 мм, предпочтительно 2 мм плюс глубина проникновения в слой гранул на среднем расстоянии 2-Х мм, где значение «X» равно диаметру гранулы, соответствующему верхнему пределу размеров указанных гранул.
В предложенном комплекте принадлежностей указанного количества цемента достаточно для заполнения пор указанных гранул и пространства между указанными гранулами в среднем по крайней мере до одной трети указанного слоя гранул.
Предложенный комплект принадлежностей содержит, кроме того, решетчатый материал для покрытия, по крайней мере, части внешней поверхности, образованной слоем указанных гранул на, по крайней мере, одной указанной контактной поверхности.
В предложенном комплекте принадлежностей указанный материал решетки позволяет удерживать указанные гранулы указанной решеткой.
Предложенный комплект принадлежностей содержит, кроме того, средства для уплотнения указанных гранул в отверстии в кости.
В предложенном комплекте принадлежностей указанные средства для уплотнения содержат контактную часть, имеющую конфигурацию, аналогичную, а предпочтительно почти идентичную части указанного протеза, особенно ту, по крайней мере, одну указанную контактную поверхность, которая вводится в указанное отверстие.
Предложенный комплект принадлежностей содержит, кроме того, средства для введения указанных гранул в отверстие в кости.
В предложенном комплекте принадлежностей, по крайней мере, 50% от объема указанных гранул имеют средний размер от 1 до 10 мм, более точно от 2,5 до 7 мм.
В предложенном комплекте принадлежностей практически все указанные гранулы могут иметь средний размер от 1 до 10 мм, более точно от 2,5 до 7 мм.
В предложенном комплекте принадлежностей указанные гранулы имеют среднюю пористость 40-90%.
В предложенном комплекте принадлежностей указанные гранулы имеют шероховатость поверхности, достаточную для сцепления указанных гранул друг с другом, предпочтительно шероховатость поверхности выше 5,5 Ra, более предпочтительно - выше 6 Ra, а наиболее предпочтительно - выше 6,3 Ra.
В предложенном комплекте принадлежностей указанные гранулы получены методом рафинирования титана в процессе восстановления тетрахлорида титана (TiCl4).
В предложенном комплекте принадлежностей указанные гранулы имеют покрытие, предпочтительно остеопроводящее покрытие, особенно покрытие, содержащее фосфат кальция или биоактивное стекло.
В предложенном комплекте принадлежностей указанное покрытие может иметь среднюю толщину от 0,5 до 100 мкм, особенно покрытие, содержащее фосфат кальция.
В предложенном комплекте принадлежностей указанные гранулы состоят, по крайней мере, частично, из титана.
В предложенном комплекте принадлежностей указанный костный цемент выбран из группы акрилатов, таких как полиметилметакрилат (РММА).
Титановые гранулы для использования в комплекте принадлежностей имеют пористость от 40 до 90% и диаметр от 1 до 10 мм, указанные гранулы предпочтительно обладают остеопроводимостью, указанные гранулы предпочтительно имеют покрытие из группы остеопроводящих или остеоиндуктивных покрытий или покрытий, содержащих биокерамику, биостекло или остеопроводящие или остеоиндуктивные молекулы или жидкости, или клетки.
Способ покрытия титановых гранул, используемых в комплекте принадлежностей для фиксации протеза или его части и/или заполнения костных дефектов, включает, по крайней мере, одну из следующих операций:
- биомиметическое покрытие, покрытие в сверхнасыщенном растворе;
- покрытие плазменным напылением;
- или электрохимическое осаждение, предпочтительно с использованием ванны соляного раствора, или электроструйное напыление.
Способ фиксации протеза или его части в организме или вне организма, в кости или в искусственной кости включает следующие стадии:
- подготовка отверстия в кости к приему, по крайней мере, одной контактной поверхности протеза;
- заполнение указанного отверстия и (или) обнаруженного костного дефекта, по крайней мере, частично металлическими гранулами, выполненными на основе титана, обладающими внутренней пористостью, и остеопроводимостью, и предпочтительно имеющими покрытие из группы остеопроводящих или остеоиндуктивных покрытий, или покрытий, содержащих биокерамику, биостекло или остеопроводящие или остеоиндуктивные молекулы, или жидкости, или клетки таким образом, чтобы, по крайней мере часть, а предпочтительно - практически вся внутренняя стенка указанного отверстия была покрыта слоем указанных гранул;
- введение уплотняющего инструмента в указанные гранулы в апертуру в указанном слое и уплотнение указанного слоя гранул на указанной внутренней стенке таким образом, чтобы после извлечения указанного уплотняющего инструмента из указанной апертуры данная апертура имела форму и размеры, по крайней мере, одной контактной поверхности указанного протеза;
- введение костного цемента и по крайней мере одной указанной контактной поверхности протеза в указанную апертуру таким образом, чтобы костный цемент вдавливался в слой указанных гранул, внутрь и между указанными гранулами; так, чтобы когда указанная, по крайней мере, одна контактная поверхность находится в необходимом для фиксации положении, пространство между указанной, по крайней мере, одной контактной поверхностью и внутренней стенкой было бы заполнено указанным слоем гранул, а костный цемент был бы вдавлен в указанный слой.
В предложенном способе указанный цемент вдавливается внутрь указанных гранул и между ними на среднюю глубину, не превышающую две трети от средней толщины указанного слоя, со стороны, по крайней мере, одной контактной поверхности протеза.
В предложенном способе указанный цемент может вдавливаться внутрь указанных гранул и между ними на среднюю глубину, не превышающую одного сантиметра со стороны, по крайней мере, одной контактной поверхности, предпочтительно менее чем на 7,5 мм.
В предложенном способе гранулы перед введением в указанное отверстие могут смачиваться жидкостью, особенно жидкостью, содержащей воду или состоящей из нее.
В процессе уплотнения гранул, по крайней мере, часть, а предпочтительно более 50% указанной жидкости вытесняется из указанных гранул и пространства между ними.
В предложенном способе в указанное отверстие помещают решетку перед или после введения, по крайней мере, части указанных гранул.
В предложенном способе перед подготовкой указанного отверстия для приема, по крайней мере, одной указанной контактной поверхности протеза, из указанной кости удаляют протез, оставляя указанное отверстие, после чего внутреннюю стенку указанного отверстия очищают перед введением указанных гранул.
В предложенном способе уплотнение осуществляется при помощи комплексных уплотняющих инструментов.
В предложенном способе гранулы уплотняются на указанной внутренней стенке, по крайней мере, на 25%.
В предложенном способе пустоты и (или) отверстия в указанной внутренней стенке заполняются гранулами до или в процессе формирования указанного слоя гранул.
В приготовлении комплекта принадлежностей для фиксации протеза в кости применяют металл на основе титана, пористые гранулы и костный цемент.
В приготовлении комплекта принадлежностей для заполнения костных дефектов применяют металл на основе титана и пористые гранулы.
Комплект принадлежностей для фиксации протеза или его части и/или заполнения костных дефектов содержит пористые металлические гранулы, выполненные на основе титана, костный цемент и уплотняющий инструмент для приготовления элементов для заполнения костных дефектов и (или) фиксации протеза или его части в кости.
В предложенном комплекте принадлежностей для фиксации протеза или его части и/или заполнения костных дефектов указанные гранулы могут быть смочены жидкостью, особенно жидкостью, содержащей воду или состоящей из нее.
В предложенных комплектах принадлежностей для фиксации протеза или его части и/или заполнения костных дефектов указанный уплотняющий инструмент имеет продольное направление и снабжен поверхностью импакционного воздействия на продольном конце с целью воздействия на указанный уплотняющий инструмент в указанном продольном направлении, и по крайней мере, слегка сужающейся частью, предпочтительно оконечной частью, сужающейся в направлении, противоположном указанной поверхности импакционного воздействия.
Первой особенностью настоящего изобретения является то, что предлагается комплект принадлежностей, включающий протез или его часть, которые имеют по крайней мере одну контактную поверхность, металлические гранулы, обладающие внутренней пористостью, и костный цемент. Предпочтительно, указанный комплект принадлежностей также содержит уплотняющие средства для уплотнения слоя указанных гранул в естественной или искусственной полости человека или животного, природной или искусственной кости, в организме или вне организма, при этом остается отверстие для указанного протеза или его части, а слой костного цемента проходит между указанной контактной поверхностью и указанным слоем гранул.
Второй особенностью изобретения является то, что предлагается комплект принадлежностей, содержащий пористые гранулы на основе титана, причем по крайней мере 50% от объема указанных гранул имеют размер от 1 до 10 мм, как правило, от 2,5 мм до 7 мм. Предпочтительно почти все гранулы имеют средний размер в указанных пределах. Еще одна особенность заключается в том, что гранулы обладают средней пористостью от 40% до 90%.
Дальнейшая особенность настоящего изобретения состоит в том, что на указанные гранулы наносится покрытие, предпочтительно покрытие, содержащее фосфат кальция. Указанное покрытие может иметь среднюю толщину от 0,5 микрон до 100 микрон.
Кроме того, особенностью настоящего изобретения является то, что указанные гранулы смачивают жидкостью, предпочтительно перед введением в отверстие в кости.
Указанная жидкость может состоять, например, из 0,9% физиологического раствора или жидкостей организма, таких как кровь, сыворотка или костный мозг.
При различных дефектах или в различных частях тела человека или животного могут использоваться гранулы разных размеров. Например, в реконструкции бедренной кости можно использовать гранулы меньшего размера, чем при реконструкции вертлужной впадины.
Ниже следует подробное описание изобретения со ссылками на прилагаемые фигуры, где:
фиг.1 является схематическим изображением в продольном разрезе бедренной кости с отверстием, из которого удален бедренный компонент эндопротеза тазобедренного сустава;
фиг.2 является схематическим изображением бедренной кости фиг.1, на котором указанное отверстие расширено за счет удаления, например, предыдущего цементного слоя и (или) кости, например, развертыванием.
фиг.3 является схематическим изображением бедренной кости фиг.2 с установленным проволочным проводником;
фиг.4 является схематическим изображением бедренной кости фиг.3, на котором большая часть дистальной области отверстия частично заполнена пористыми металлическими гранулами;
фиг.5 является схематическим изображением бедренной кости фиг.4, на котором поверх проволочного проводника размещен уплотняющий инструмент, который надавливает на гранулы;
фиг.6 является схематическим изображением бедренной кости фиг.5, на котором на внутренней стенке указанного отверстия сформирован слой гранул, при этом костный цемент подается в указанное отверстие в основном дистально;
фиг.7 является схематическим изображением бедренной кости фиг.6, на котором бедренный компонент вводится в указанный костный цемент, тем самым вдавливая этот цемент между указанным слоем гранул и контактной поверхностью указанного бедренного компонента и в указанный слой гранул;
на фиг.8 показана бедренная кость, в которой костный дефект замещен гранулами и решеткой;
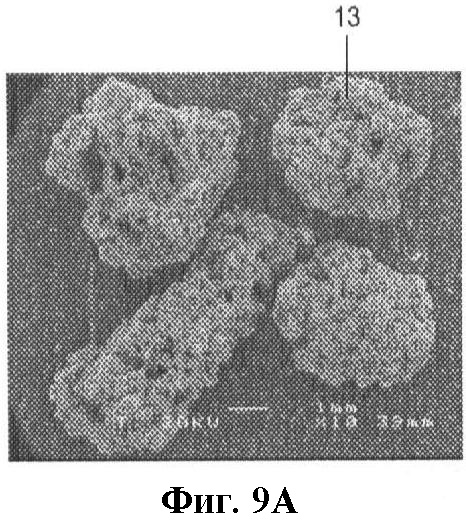
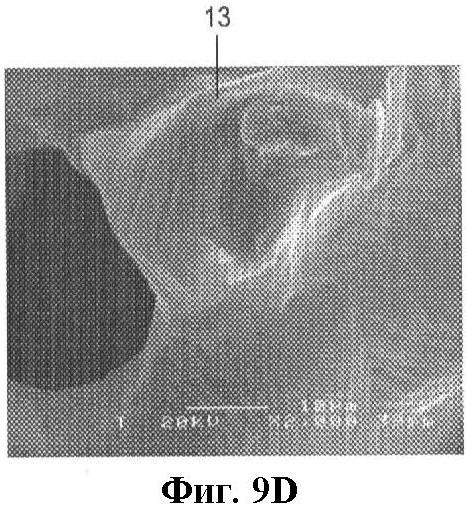
на фиг.9A-D показано микроскопическое изображение гранул в соответствии с настоящим изобретением, увеличенное соответственно в 10, 50, 500 и 2000 раз;
на фиг.10А-В представлены гранулы в соответствии с настоящим изобретением до и после импакции согласно изобретению;
на фиг.10C-F показаны керамические частицы (СеР) и чипсы губчатой кости человека (ВоР) до и после импакции согласно настоящему изобретению, представленные для сравнения;
на фиг.11 представлено испытательное оборудование, использованное для испытания гранул вне организма в соответствии с настоящим изобретением, и сравнительные частицы; и
на фиг.12 показана кривая напряжения уплотненных гранул и частиц, изображенных на фиг.10В, D и F.
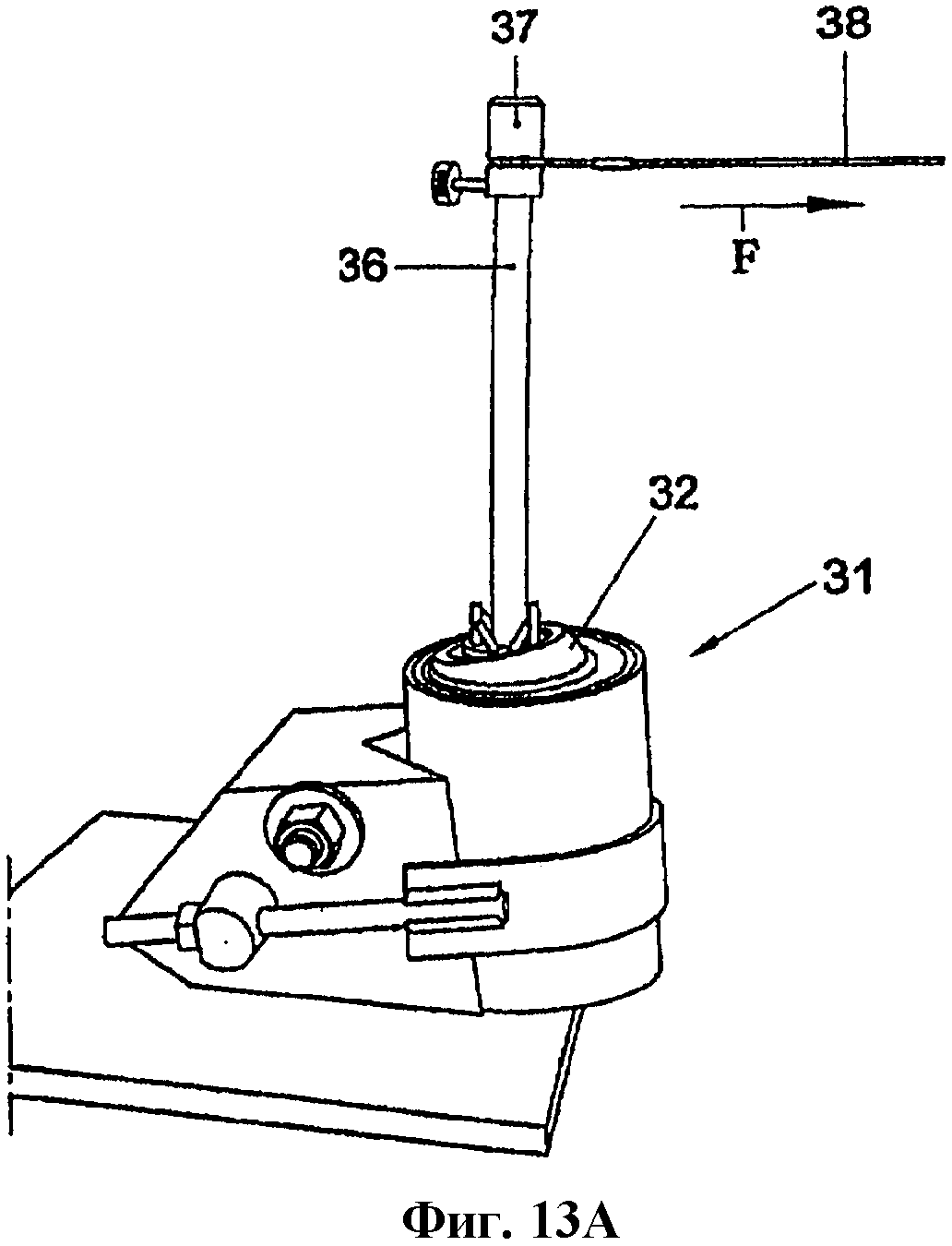
На фиг.13А и В представлено схематическое изображение вертлужного компонента в испытательном устройстве, действующем по принципу рычага, и фиксации указанного компонента в указанном устройстве;
фиг.13С - схематическое изображение вертлужного компонента в поперечном разрезе;
фиг.14 - изображение вертлужного компонента под нагрузкой в виде шарового сочленения;
на фиг.14А и В представлены диаграммы дисплазии и поворотного движения для каждой группы и диаграмма момента силы под воздействием рычага (Нм) для вертлужных компонентов в испытательном оборудовании в соответствии с фиг.13 при использовании различных материалов;
фиг.14С - диаграмма проникновения цемента;
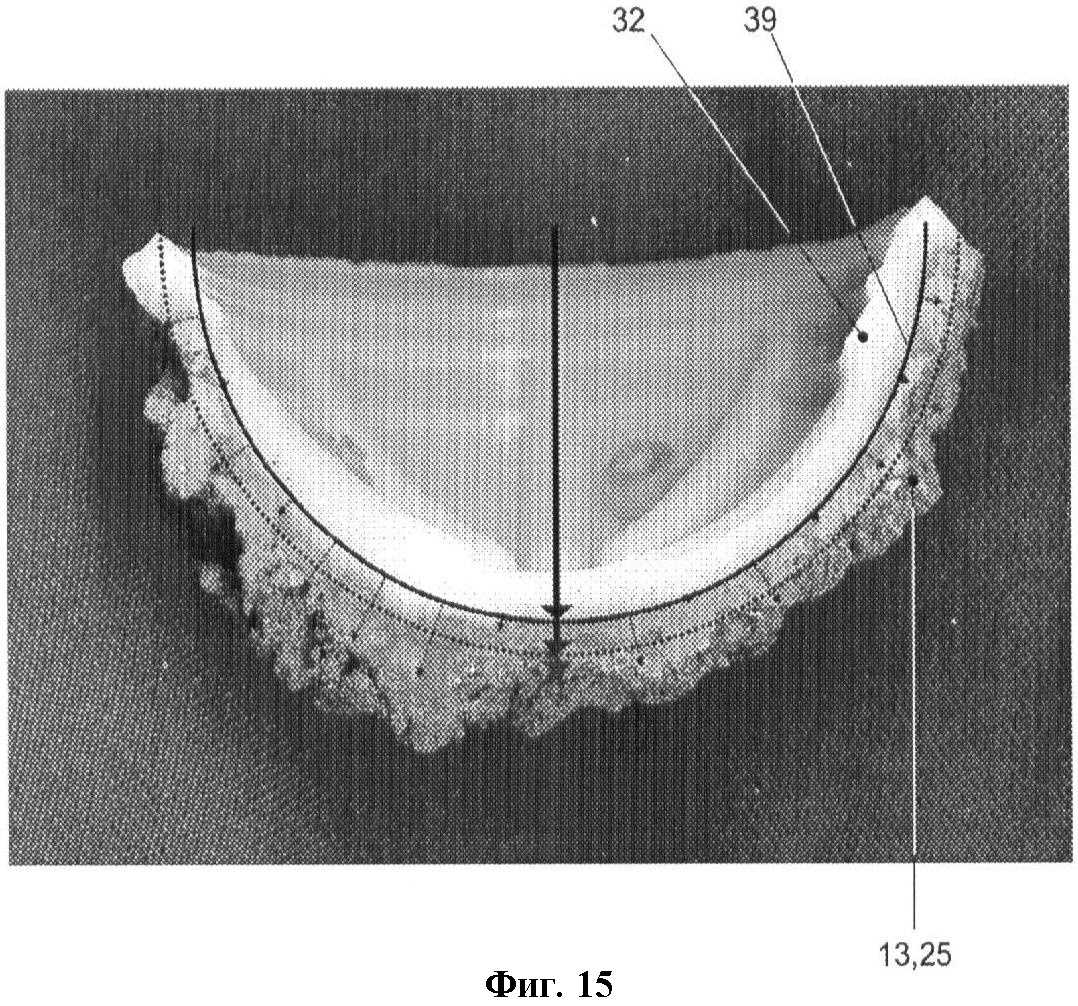
фиг.15 - снимок вертлужного компонента в поперечном разрезе, демонстрирующий среднюю степень проникновения цемента;
фиг.16 - схематическое изображение в поперечном сечении камеры костной проводимости, используемой для оценки врастания кости;
фиг.17 - поперечное сечение трансплантатного цилиндра из гранул Ti после импакции;
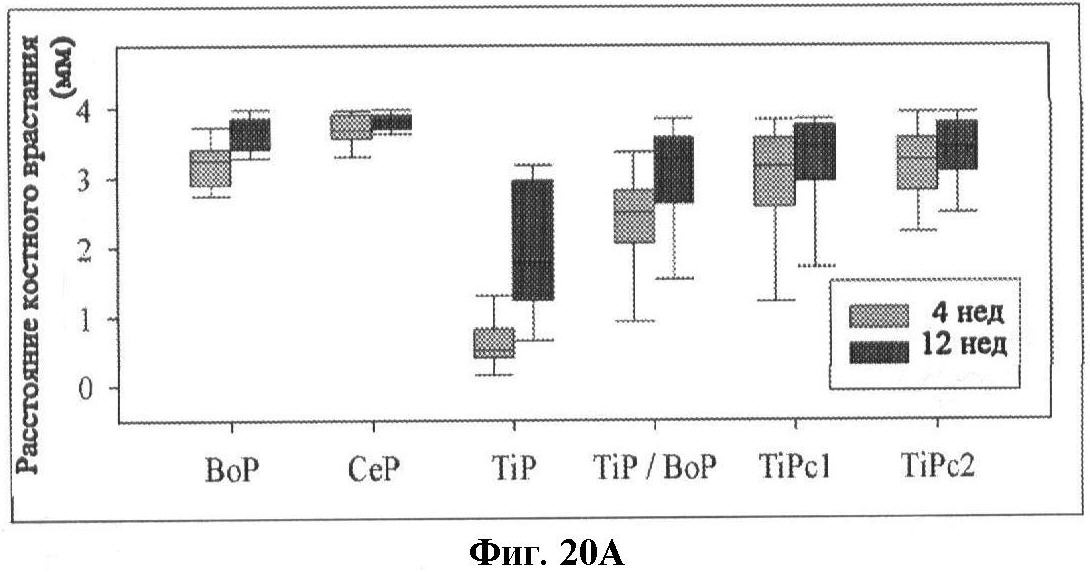
фиг.18 - диаграмма врастания кости, в мм, для различных групп трансплантата;
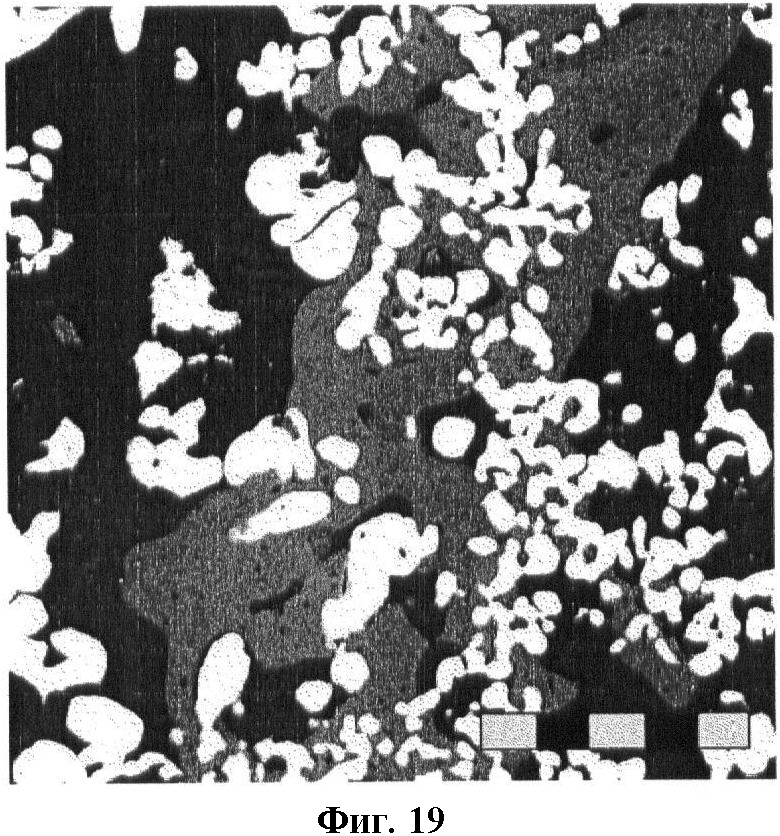
фиг.19 - снимок пористой массы частиц Ti, фиброзной ткани и лакун остеоцитов и минерализованного костного матрикса, демонстрирующий непосредственный контакт кости с титаном;
на фиг.20 представлен снимок замещенного дефекта в поперечном разрезе, демонстрирующий врастание костной ткани в замещающую пористую массу, и диаграмма глубины врастания для различных трансплантатов, применяемых для замещения указанных дефектов;
фиг.21 - типичный профиль имплантата;
на фиг.22 представлены имплантаты, установленные козам 3, 4, 5, 7, 8, 9, 10, 11. Здесь следует отметить различную толщину цемента. Интеграция TiP слоя в исходную кость неизменно дает положительные результаты. Граница раздела между TiP слоем и цементом везде отсутствует или является очень тонкой (менее 100 микрон);
на фиг.23 представлена в большем увеличении реконструкция в случае козы 12;
на фиг.24 более детально и с большей степенью увеличения представлено врастание кости и границы раздела между TiP и цементом;
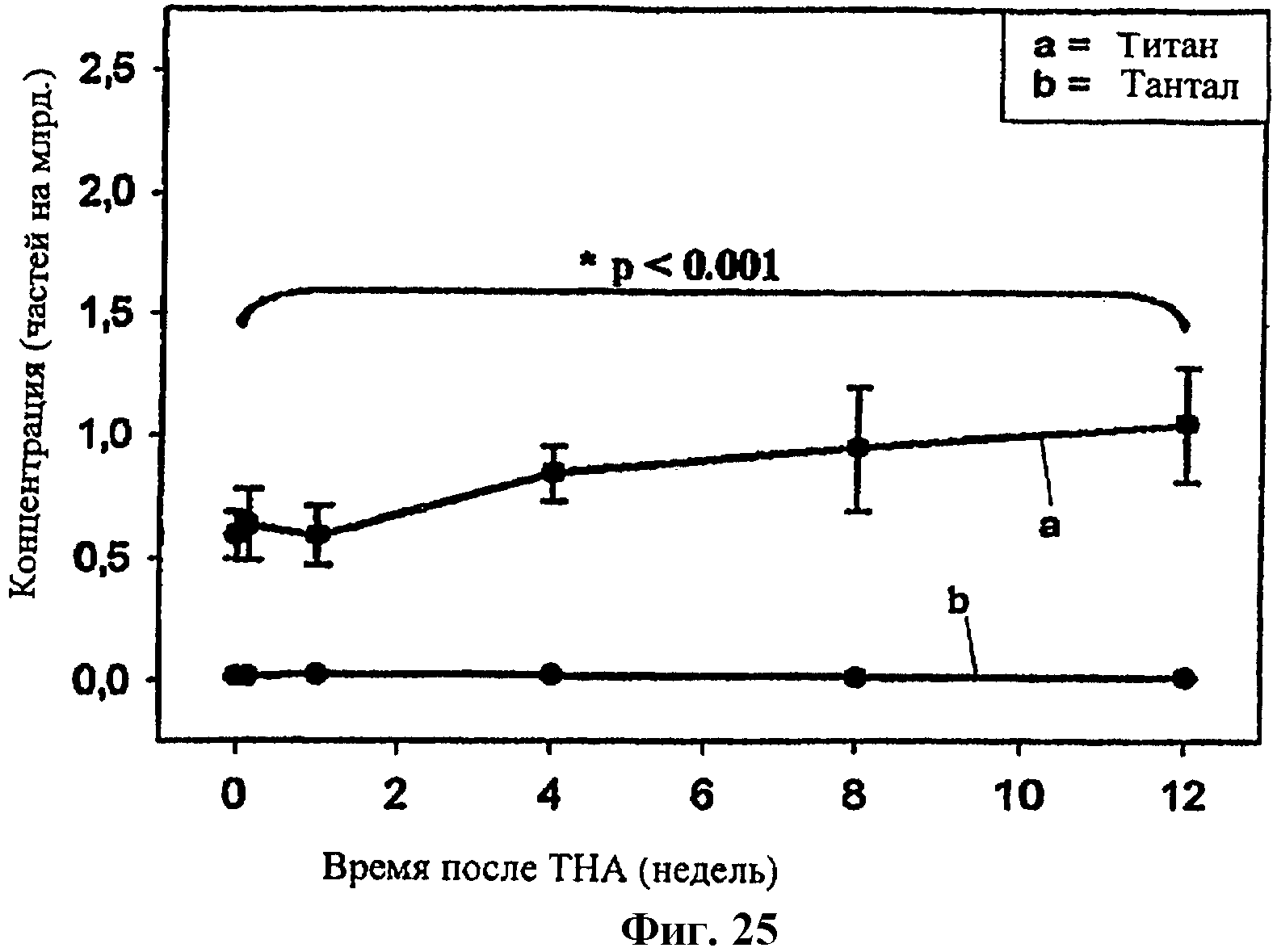
на фиг.25 показаны уровни Ti во время эксперимента.
Настоящее изобретение подробно описывается ниже на примерах применительно к эндопротезированию тазобедренного сустава, особенно тотальному ревизионному эндопротезированию, или, по крайней мере, ревизионному протезированию вертлужного или бедренного элемента. Те же или аналогичные способы и материалы также могут применяться для фиксации других протезов и замещении костных дефектов. Данное изобретение не ограничивается представленным здесь способом осуществления. Возможны и другие варианты осуществления изобретения и их сочетания, предусмотренные объемом изобретения.
В данном описании реципиентом является организм человека или животного или какая-либо его часть, природная или искусственная, на которой фиксируется протез и (или) в которой осуществляется замещение костного дефекта. Материал трансплантата представляет собой, по крайней мере, частично твердый материал, применяемый для заполнения пустот и фиксации протеза или его частей, включающий аутотрансплантаты, аллотрансплантаты и (или) ксенотрансплантаты. Импакция предполагает как минимум применение силы воздействия, например, ударного воздействия, но не ограничивается этим. Костный цемент представляет собой, но не ограничивается этим, жидкость или пасту, которая обладает способностью сцепления с различными замещающими материалами, применяемыми для вертлужной или бедренной части, которые могут быть костными или другими тканями реципиента, и (или) металлом, керамикой и (или) пластмассами, применяемыми для протеза или его частей.
В способе или комплекте приспособлений в соответствии с настоящим изобретением могут использоваться имеющие пористую структуру гранулы, особенно на основе титана, такого как чистый титан или титановый сплав. Степень пористости предпочтительно такова, что по всей грануле проходят открытые каналы или лабиринты. Гранулы можно получить посредством химической реакции титана и тетрахлорида титана (TiCl4) в процессе рафинирования. Химическую реакцию TiCl4 можно вызвать при помощи, например, магния или натрия. Применение натрия предпочтительнее, в том смысле, что пористость гранул может иметь механические преимущества.
Указанные гранулы могут быть высокой чистоты, с содержанием до 99% титана или более. В одном из вариантов осуществления чистота достигает 99,8% или более, в другом из вариантов - 99,9% или более.
Данные гранулы могут иметь покрытие, такое как остеопроводимое или любое остеоиндуктивное покрытие, например, содержащее фосфат кальция или биоактивное стекло, или покрытий, содержащих биокерамику, или остеопроводящие или остеоиндуктивные молекулы или жидкости, или клетки.
Покрытие гранул может быть осуществлено посредством, по крайней мере, одной из следующих операций: биомиметическое покрытие, покрытие в сверхнасыщенном растворе; покрытие плазменным напылением; покрытие посредством электрохимическое осаждения, предпочтительно с использованием ванны соляного раствора, покрытие посредством электроструйного напыления.
Данное покрытие может частично или полностью состоять из элементов, оказывающих воздействие на костный рост, или же дополнительно включать лекарственные или другие вещества, подобные химиотерапевтическим, в зависимости от цели применения гранул. Гранулы являются неразложимыми и биологически совместимыми. Гранулы могут иметь относительно шероховатую поверхность и относительно большой размер по сравнению с гранулами, описанными в WO 00/13615. В преимущественном способе осуществления гранулы сцепляются друг с другом благодаря их поверхностной структуре и шероховатости.
Перед применением указанные гранулы могут быть смочены жидкостью, заполняющей по крайней мере часть пор внутри гранул и пространство между ними и обеспечивающей сцепление гранул. Уплотнение гранул можно осуществлять и вне отверстия в кости, но предпочтительно их уплотняют, обеспечивая их сцепление друг с другом, внутри отверстия в кости, в котором должна осуществляться фиксация протеза и (или), которое образует и (или) содержит костный дефект. Указанная жидкость может оказывать влияние на пористость, увеличивая пористость уплотненных гранул. Данная жидкость может иметь влияние и на степень уплотнения, снижая ее. Данная жидкость может обеспечивать лучшее сцепление гранул друг с другом по сравнению с сухими гранулами, особенно до их уплотнения. Данная жидкость также может давать эффект, когда гранулы в смоченном состоянии хуже сцепляются с тканями организма человека или животного, особенно такими как плоть, мышцы и сухожилия, в области отверстия для фиксации протеза или его части, вследствие чего такие гранулы могут быть удалены легче, чем сухие. Данная жидкость способна ограничивать проникновение цемента внутрь гранул и между ними.
Уплотнение гранул в соответствии с настоящим изобретением может осуществляться путем воздействия на них ударной силой, например, когда они свободно засыпаются в контейнер, такой как пресс-форма, или же, в предпочтительном способе осуществления, в отверстие в кости, в которой предполагается фиксация протеза или его части. Было установлено, что гранулы пористого металла, такого как титан или титановый сплав, импактируются намного лучше, чем ВоР или СеР, при сравнении импакционной деформации после стандартной импакции. Более того, после импакции гранулы подвергались компрессионному воздействию, сравнимому с компрессионным воздействием в искусственном тазобедренном суставе (2,5 МПа). После компрессии у TiP обнаружена меньшая степень деформации, чем у СеР и ВоР. После компрессионной стадии гранулы находились в стадии релаксации. Проводя сравнение с деформацией, вызванной компрессионным воздействием, в период релаксации гранулы TiP восстанавливали форму полнее, чем гранулы ВоР и СеР, уплотненные с той же ударной силой. После импакции у металлических гранул наблюдалась только ограниченная дальнейшая пластическая деформация в организме, в результате чего обеспечивалась достаточно стабильная фиксация. Перед импакцией гранулы можно подвергать вибрации с целью увеличения их плотности.
Гранулы, применяемые в настоящем изобретении, способны демонстрировать под нагрузкой в организме и после импакции ограниченную дальнейшую пластическую деформацию. Их пористость способна усилить фиксацию и прочность слоя трансплантата за счет врастания ткани реципиента. Пористые металлические гранулы, подвергнутые импакции в соответствии с настоящим изобретением, могут обладать механической гибкостью, превышающей механическую гибкость керамических частиц, подвергнутых такой же импакции. Внутренняя пористость высокопористых металлических гранул может превышать 75%, предпочтительно - 80%, и в соответствии с настоящим изобретением они могут иметь взаимосвязанные поры. Полученный в результате импакции в соответствии с настоящим изобретением материал отличается стабильностью и его можно сравнить с «печеньем», по крайней мере, когда его получают вне человеческого или животного организма. Такой материал отличается межгранульной пористостью, т.е. имеет поры между гранулами, и внутренней пористостью, т.е. содержит поры внутри указанных гранул. Гранулы, применяемые в настоящем изобретении, предпочтительно изготовлены из титана или титанового сплава или содержат титан или титановый сплав, известные своей биологической совместимостью и позволяющие осуществлять непосредственный контакт имплантата с костью, при этом прочность их фиксации с тканью реципиента выше, чем у нержавеющей стали.
Эксперименты
Были проведены эксперименты в организме и вне организма с использованием пористых титановых частиц (TiP) в соответствии с настоящим изобретением. В качестве сравнительных материалов были выбраны керамические частицы (СеР, BoneSave®, Stryker Howmedica Osteonics, Лимерик, Ирландия) и полученные по частям частицы губчатой кости человека ВоР, показанные на фиг.9 и 10.
Применяемые пористые титановые частицы получали методом рафинирования посредством восстановления тетрахлорида титана (TiCl4) при помощи Na. Этот процесс обеспечивает получение кристаллической микротекстуры (фиг.9D). Применяемые гранулы имели диаметр в пределах 3,0-5,0 мм (они проходили сквозь сито с ячейкой 5 мм, но задерживались ситом с ячейкой 3 мм). По снимку в поперечном разрезе (SEM, сканирующий электронный микроскоп Jeol 6310) было установлено, что пористость по поверхности сечения занимает около 83%, а титановый компонент составляет приблизительно 17%. Поры являются взаимосвязанными.
BoneSave® - это представленная на рынке биокерамика, состоящая из 80% TCP и 20% НА, пористость которой не взаимосвязана и составляет 50%. СеР, использованные в данном исследовании, имели диаметр от 2,0 мм до 4,0 мм.
Чипсы губчатой кости (ВоР) получали по частям посредством откусывания губчатой кости от пяти свежезамороженных (-80°С) головок бедра человека при помощи кусачек. Использовались крупные костные чипсы (около 7×10 мм, эллипсоидной формы) в соответствии с рекомендацией Bolder и др. и Dunlop и др. Костные трансплантаты не промывали перед испытаниями и адаптировали к температуре 30°С. TiP и СеР смачивали водой в течение 30 минут перед импакцией. Все частицы испытывались при комнатной температуре.
Образцы 107 ВоР содержали 4,0 г частиц, образцы 107 TiP и СеР содержали соответственно 3,0 г и 4,0 г сухих частиц. Частицы подвергали импакции в цилиндрической латунной испытательной камере 100 диаметром 20,5 мм. Для стандартной импакции трансплантата использовался специально сконструированный импактор 101, показанный на фиг.11. Диаметр импактора 101 был лишь немного меньше диаметра испытательной камеры. С целью свободного удаления жира и жидкости из трансплантатов и испытательной камеры 100 во время импакции в боковой поверхности импактора 101 были выполнены три выпускных канала 102 диаметром 2,0 мм. Импакция всех образцов осуществлялась тридцатикратным опусканием груза весом 420 г на импактор с высоты 35 см. В результате степень импакции была аналогична той, которой подвергается вертлужная впадина в процессе операции, проводимой опытным хирургом-ортопедом (BWS). Высоту до импакции и после замеряли измерительным прибором (с разрешением 0,05 мм). С целью определения подверженности материалов импакции рассчитали деформацию при импакции. Высоту образца до импакции обозначили как hизнач, высоту непосредственно после импакции и в начале приложения нагрузки - как h0. Деформацию при импакции рассчитывали как:
εимпак = [ln(hизнач/h0)]
Непосредственно после импакции полученный слой трансплантата подвергали нагрузке в той же испытательной камере 100 в процессе проведения компрессионного теста с ограниченным поперечным расширением (ССТ). Чтобы сделать выводы о желаемой сцепляемости частиц с целью получения адекватных реконструктивных характеристик, импакции подвергли несколько дополнительных образцов 107. Эти образцы 107 не проходили механического тестирования и были удалены из испытательной камеры 100 для макроскопического анализа сразу же после импакции. Эти образцы 107 в форме «печенья» показаны на фиг.10.
Тест ССТ применялся ранее для измерения зависимых от времени механических свойств костных трансплантатов, различных биокерамических частиц и смесей костных трансплантатов и биокерамических частиц после ручной импакции (Verdonschot N, van Hal СТ, Schreurs BW, Buma P, Huiskes R, Slooff TJ. «Зависимые от времени механические свойства HA/TCP частиц относительно полученных частями костных трансплантатов с целью применения в импакционной трансплантации». Журн. Biomed Mater Res. 2001; 58(5):599-604). В этом исследовании тест ССТ применялся для измерения деформации и жесткости слоя трансплантата при подвергании его нагрузке и вязкоупругих свойств слоя трансплантата на стадии последующего снятия нагрузки (релаксация). После импакции на верхнюю часть испытательной камеры 100 поместили рамку с жестким пористым фильтром 105 на поверхности образца, чтобы обеспечить свободное выделение жидкости в процессе приложения нагрузки. Поверх фильтра 105 поместили распределитель нагрузки 106 для обеспечения равномерного распределения прилагаемой нагрузки по всей поверхности образца 107. Образец 107 подвергали циклической нагрузке (0,1-2,5 МПа (20-840 Н)) с частотой 1 Гц в течение 900 с, одновременно замеряя деформацию и жесткость образца транплантата 107. Прилагаемая нагрузка соответствовала уровням напряжения, характерным для области вокруг цементированных имплантатов, и прикладывалась при помощи сервогидравлического устройства MTS (MTS® Systems Corporation, Миннесота, США). Во время испытаний измеряли высоту образца 107 при помощи экстензометра 108, установленного между образцом 107 и нагрузочным стержнем 109. Используя тензодатчик 109, помещенный под испытательную камеру 100 (фиг.11 и 12), регистрировали прилагаемую нагрузку.
Деформация в зависимости от нагрузки представляет собой деформацию материалов, подвергнутых динамической нагрузке. Костные трансплантаты продемонстрировали характеристики ползучести: высота образца 107 уменьшается на стадии приложения нагрузки. Во время каждого цикла приложения нагрузки фиксировали высоту образцов при минимальном напряжении (высота hмин.напр. при 0,1 МПа) и при максимальном напряжении (высота hмакс.напр. при 2,5 МПа).
Деформацию в зависимости от нагрузки рассчитывали как
εдеформ = [ln(hмин.напр./h0)]
Деформацию в зависимости от нагрузки определяли для каждого цикла нагрузки и проводили сравнительный статистический анализ величин, полученных в конце каждой фазы нагрузки. После 900 с нагрузки образец 107 находился в стадии релаксации (нагрузка 0 Н) в течение 900 с для измерения его вязкоэластичных свойств.
Циклический эластичный модуль характеризует жесткость материала. Эластичный модуль рассчитывался с учетом изменения напряжения в пределах одного цикла нагрузки (циклическое напряжение) и соответствующей деформации в пределах того же цикла нагрузки (циклическая деформация). Циклическое напряжение, σцикл, рассчитывалось как разница между минимальным напряжением (0,1 МПа) и максимальным напряжением (2,5 МПа) и оставалось постоянным для каждого цикла приложения нагрузки (2,4 МПа).
Циклическая деформация, εцикл., рассчитывалась как
εцикл. = [hмин.напр. - hмакс.напр.]/[hмин.напр.]
Циклический эластичный модуль, Е, рассчитывался как соотношение циклического напряжения и циклической деформации:
E=[σцикл./εцикл.]
Поскольку циклическое напряжение было постоянным, жесткость была обратно пропорциональна циклической деформации. Жесткость определяли на протяжении всего периода нагрузки и проводили сравнительный статистический анализ величин, полученных в конце каждой фазы нагрузки.
Увлажненные TiP и СеР засыпали в испытательную камеру. Водяная пленка способствовала хорошему слипанию не подвергнутых импакции TiP и СеР. После стандартной импакции применяемого количества трансплантата получали образцы трансплантата с сопоставимой начальной высотой (в пределах 14,5-16,9 мм, таблица 1 (мм)). TiP и СеР оказались более импактируемыми, чем ВоР (фиг.10, таблица 2). В таблицах 1 и 2 в скобках указано стандартное отклонение. Через боковые каналы импактора из TiP выделилось значительное количество воды. Из образцов СеР выделилось меньшее количество жидкости, по виду напоминающей молоко и содержащей мельчайшие керамические гранулы, что в живом организме может представлять опасность для реципиента. В процессе импакции ВоР выделили большое количество жира.
После импакции TiP образовали плотный цилиндр, который хорошо сохранял форму. Хорошее сцепление подвергнутых импакции TiP позволило получить однородные макропористые «печенья» 107, отличающиеся высокой когезией и стойкостью к разрушению. Подвергнутые импакции образцы ВоР имели меньшую когезию по сравнению с TiP, но слипались между собой после извлечения из испытательной камеры.
Подвергнутые импакции образцы СеР после извлечения из испытательной камеры имели тенденцию к дезинтеграции и достаточно легко распадались.
Механические испытания: нагружение и релаксация
«Печенья» 107 TiP продемонстрировали почти полное отсутствие деформации в процессе физиологической нагрузки. В конце фазы приложения нагрузки деформация образцов TiP составила 0,009±0,001 (таблица 2). Деформация СеР вдвое превышала деформацию TiP (нагрузочная деформация 0,017±0,002). По сравнению с этими синтетическими трансплантатами нагрузочная деформация ВоР оказалась значительно выше, составляя 0,29±0,05. Это значительно больше, чем в других группах (р<0,001).
После установочной фазы, включавшей примерно пятьдесят циклов приложения нагрузки, жесткость оставалась почти неизменной на протяжении последующего периода приложения нагрузки во всех группах. Была выявлена четкая и существенная разница между тремя группами испытываемых материалов (таблица 2). Образцы «печенья» TiP 107 имели среднюю жесткость (209±20 МПа), что в два раза выше, чем у образцов ВоР (80±18 МПа, р<0,001). Образцы «печенья» СеР были в 4 раза жестче образцов ВоР (334±47 МПа, р<0,001) и, следовательно, жестче, чем TiP (р<0,001).
После снятия нагрузки у образцов TiP 107 (фиг.10 В) не наблюдалось какой-либо остаточной деформации: деформация релаксации была равна деформации нагрузки (0,009±0,001). Образцы «печенья» СеР 107 (фиг.10D) компенсировали только 50% деформации нагрузки в фазе релаксации (деформация нагрузки и деформация релаксации составляют соответственно 0,017±0,002 и 0,009±0,002). Хотя образцы ВоР 107 (фиг.10F) продемонстрировали значительную деформацию релаксации - 0,10±0,02, все же она составила только одну треть деформации нагрузки (0,29±0,05). Жир, который выделился в процессе циклической нагрузки, был частично поглощен повторно костным трансплантатом в процессе релаксации. Вязкоэластичные свойства образцов ВоР 107 в процессе нагрузки и последующей релаксации весьма очевидны и показаны на фиг.12.
В сответствии с настоящим изобретением в качестве материала трансплантата предлагаются пористые титановые частицы, которые поддаются импакции и способны адаптироваться к геометрической форме дефекта, с целью применения в импакционной костной пластике. Как и фосфат кальция, пористый титан в сыпучем виде является материалом, обладающим костной проводимостью. Он обеспечивает надежную фиксацию кости после имплантации, которую можно дополнительно улучшить путем придания шероховатости или нанесением биокерамического покрытия, например, фосфата кальция.
Прессуемость высокопористой титановой матрицы гранул 13 оказалась весьма впечатляющей, несмотря на то, что использовался чистый металл. Не подвергнутые импакции TiP способны заметно деформироваться при сильном сжатии их двумя пальцами. В процессе импакции TiP деформировались даже больше, чем ВоР, образуя прочно сцепленный слой трансплантата. Сочетание хороших импакционных свойств и прочное сцепление могут быть важными факторами с точки зрения применения в импакционной костной пластике: гранулы 13 легко слипаются уже после слабой импакции и легко поддаются дальнейшей импакции. Пористость титановых «печений» оставалась на высоком уровне 70-75%, что также является положительной характеристикой, поскольку между частицами имеется достаточное пространство для врастания ткани. Пористые титановые частицы достаточно эластичны, имеют более округлые края, чем СеР частицы после уплотнения, и могут постепенно спрессовываться. Это позволяет предотвратить возникновение высокого контактного напряжения, которое наблюдается в случае применения СеР в импакционной костной пластике.
Слой подвергнутых импакции TiP в соответствии с настоящим изобретением отличается высокой устойчивостью как к компрессионному, так и к сдвиговому напряжению и демонстрирует только небольшую пластическую деформацию после реконструкции и под нагрузкой в организме. Это обеспечивает отличную первоначальную стабильность, что в ортопедической хирургии является необходимым предварительным условием для тканевого и особенно костного наращивания. В процессе проведения компрессионного теста с ограниченным поперечным расширением измерялось сопротивление компрессионному напряжению. Подвергнутые импакции TiP продемонстрировали высокое сопротивление силе сжатия. TiP отличаются удивительным сочетанием таких характеристик, как способность к импакции и стабильность после импакции. Деформация TiP под нагрузкой была очень невелика и полностью обратима в процессе последующей релаксации. В противоположность синтетическим материалам TiP и СеР, у ВоР обнаружена значительная дисплазия под нагрузкой несмотря на удовлетворительную импакцию: на стадии нагрузки подвергнутые импакции образцы ВоР теряли около 25-30% своей начальной высоты, и только одна треть этой деформации компенсировалась на стадии упругого восстановления. Наблюдения за подвергнутыми импакции образцами показали, что реконструктивный слой, полученный из прочно сцепленных, почти цельных TiP, подвергнутых импакции, обладает большей прочностью к сдвигу, чем аналогичный реконструктивный слой из ВоР или любой смеси ВоР и СеР.
Считается, что пластическая деформация создает угрозу для жизненности слоя трансплантата. Однако некоторая эластичная деформация, допустимая в гранулах в рамках настоящего изобретения, оказывается благоприятной для врастания или внедрения ткани. Ограниченные осевые микродвижения под нагрузкой стимулируют внедрение и оссификацию костных трансплантатов. Высокая жесткость материала трансплантата, такого как СеР, препятствует этим микродвижениям и может помешать костной дифференциации врастающей ткани, оказывая сопротивление напряжению. Жесткость подвергнутых импакции TiP частиц почти такая же, как у 50/50 весовой смеси костного трансплантата и BoneSave® (217±14 МПа). Реконструкции вертлужной впадины, осуществленные при помощи аналогичной смеси трансплантата и BoneSave® (50/50 по объему), демонстрировали хорошее внедрение трансплантата. TiP являются приемлемой альтернативой такой смеси и обладают лучшей эластичностью и способностью к импакции.
Чтобы оценить врастание кости после имплантации, в коленной кости козы высверлили отверстия, которые заполнили подвергнутыми импакции TiP с покрытием из СаР (трикальцийфосфат/гидроксиапатит) со средней толщиной от 1 до 100 микрон и подвергнутыми импакции TiP без такого покрытия, соответственно. Врастание кости оценивали через 4 недели и через 12 недель. Результаты показаны ниже в таблице 3.
Результаты испытаний, проведенных вне организма, и визуальные наблюдения, опирающиеся на знания специалиста в данной области, показывают, что по своим свойствам TiP превосходят ВоР и СеР по различным позициям и что TiP исключительно пригодны для фиксации протеза в теле человека или животного и замещения костных дефектов.
На фиг.1 показана бедренная кость 1 в продольном разрезе со спиленной головкой бедра. В способе осуществления, представленном на фиг.1, удален предыдущий протез или по крайней мере его бедренная часть с целью проведения ревизионной хирургии. Настоящее изобретение может относиться к тотальной тазобедренной артропластике (ТНА) или другому эндопротезированию, первичному или ревизионному. На фиг.1 показано удлиненное отверстие 3, проходящее от плоскости спила 4 вдоль вертикальной оси 5 бедренной кости 1. Слой костного цемента 6 проходит по внутренней поверхности указанного отверстия 3, которое закрыто на дистальном конце 7 тампоном 8. Слой костного цемента 6 представляет собой остаток костного цемента, применявшегося для уже удаленного бедренного компонента предыдущего протеза. Если настоящее изобретение применяется для первичного протезирования, отверстие 3 высверливают и/или развертывают одним из известных способов. Слой костного цемента 6 частично примыкает к трубчатой кости 9 или губчатой кости 10.
На фиг.2 цемент удален при помощи соответствующих инструментов, таких как дрель или развертка.
На фиг.3 проволочный проводник 11 введен в тампон 8, указанный проволочный проводник 11 проходит более или менее параллельно вертикальной оси 5 бедренной кости от указанного тампона 8 к проксимальному концу 12 за пределами указанного отверстия.
На фиг.4 показаны гранулы 13, помещенные в отверстие 3 и прилегающие к его внутренней стенке или поверхности 14 и тампону 8, что препятствует их проникновению в губчатую кость, костный мозг или другие части организма реципиента. Тип гранул 13, которые являются пористыми, с взаимосвязанными порами, и в данном способе осуществления получены методом рафинирования титана реакцией восстановления тетрахлорида титана (TiCl4), будет подробно описан ниже. Гранулы 13 предпочтительно смочены жидкостью перед введением их в указанное отверстие 3, так что по крайней мере часть указанной жидкости сцепляется с их относительно шероховатой внешней поверхностью, а их поры по крайней мере частично заполнены указанной жидкостью. Данная жидкость, например, физиологический раствор, обеспечивает преимущество, заключающееся в том, что гранулы имеют тенденцию к слипанию друг с другом, при этом предотвращается их сцепление с тканью реципиента перед импакцией, как будет описано ниже. На фиг.4А приведено увеличенное изображение части гранул, помещенных между внутренней поверхностью 14 отверстия 3 и внешней поверхностью 15 уплотняющего инструмента 16, показанного на фиг.5.
На фиг.5 уплотняющий инструмент 16 проведен поверх проволочного проводника 11 и имеет внешнюю форму 17, максимально соответствующую форме бедренного компонента 2, который необходимо зафиксировать в бедренной кости 1. Такой способ проведения известен, например, из патента США 5047035. В поперечном сечении, перпендикулярном вертикальной оси 18 указанного уплотняющего инструмента 16, площадь поверхности каждого поперечного сечения немного больше площади поверхности соответствующего поперечного сечения бедренного компонента, который необходимо ввести; таким образом, когда контуры указанных поперечных сечений накладываются друг на друга, как это схематически показано на фиг.5А для одного из уровней, контур уплотняющего инструмента выходит за пределы контура бедренного компонента 3 и несколько отделен от него.
Под воздействием уплотняющего инструмента 16 гранулы 13 вытесняются в наружном направлении, т.е. в направлении внутренней поверхности 14 отверстия 3, и вдавливаются друг в друга. Усилие, необходимое для воздействия уплотняющего инструмента на гранулы, можно обеспечить ударной силой, например, ударяя молотком по проксимальному концу 20 уплотняющего инструмента 16. Прилагаемое усилие должно представлять собой ударную или мгновенную силу, а не постоянную или плавно увеличивающуюся или уменьшающуюся силу давления. Под указанным воздействием и благодаря своей шероховатой поверхности и механической гибкости, гранулы 13 прочно сцепляются друг с другом. Если гранулы 13 были смочены жидкостью, например водой, они имеют сравнительно высокую внутреннюю пористость по сравнению с внутренней пористостью идентичных гранул, не смоченных жидкостью перед импакцией. Эта разница может быть в пределах, например, 8-12%. Указанная жидкость по крайней мере частично выталкивается из гранул или слоя гранул указанным воздействием и (или) вытекает из гранул и поглощается реципиентом.
Гранулы имеют шероховатость поверхности, достаточную для сцепления друг с другом. Предпочтительно, шероховатость поверхности превышает 5,5 Ra, более предпочтительно - 6 Ra. Очень хорошие результаты можно получить, если шероховатость поверхности гранул превышает 6,3 Ra.
В предпочтительном способе на большей части, желательно на всей поверхности, указанной внутренней стенки 14 отверстия 3 формируют слой 21 взаимосвязанных гранул 13, имеющий толщину Т, в среднем составляющую от одного до десяти средних размеров гранул, как показано на фиг.6. Подобный слой 21 можно сформировать поэтапно, выполнив ряд последовательных процедур частичного заполнения пространства между внутренней стенкой 13 и уплотняющим инструментом с последующей импакцией и повторяя указанные процедуры до получения сформированного слоя 21. Средний размер применяемых гранул составляет, например, от 1 до 10 мм, по крайней мере для 50% от их общего объема. Они могут иметь средний размер от 2,5 до 7 мм, более предпочтительно - от 2,5 до 5 мм. Все гранулы могут иметь размер, соответствующий одному из указанных пределов. Размер гранул определяют посредством просеивания. Например, гранулы с размером в пределах от 3 до 5 мм проходят сквозь сито с ячейкой 5 мм, но задерживаются ситом с ячейкой 3 мм. Гранулы 13 могут иметь покрытие, например, биосовместимое и способствующее врастанию в ткани реципиента. Гранулы могут иметь покрытие, содержащее фосфат кальция или состоящее из него. Толщина слоя покрытия на гранулах может составлять от 0,5 до 100 микрон.
После формирования слоя 21 из гранул 13, имеющего относительно стабильную форму, можно удалить уплотняющий инструмент 16 и проволочный проводник 11, оставив полость 22 над тампоном 8, в которой можно располагать ножку 23 бедренного компонента протеза. Вследствие разницы в размерах соответствующих поперечных сечений уплотняющего инструмента 16 и ножки 23 бедренного компонента 2 эндопротеза, указанную ножку 23 можно расположить в указанной полости 22 так, чтобы образовалось небольшое расстояние D между внутренней поверхностью, образованной слоем гранул 13, и внешней поверхностью ножки 23, которая является контактной поверхностью 24 бедренного компонента 2. Как показано на фиг.6, определенное количество костного цемента заливается, закачивается или вводится иным способом в указанную полость 22; это количество должно быть достаточным, чтобы полностью покрыть всю контактную поверхность, проходящую внутрь указанной полости, образуя слой, который толще, чем указанное расстояние D между гранулами 13 и контактной поверхностью 24. Перед введением в него ножки цемент может быть выдержан под давлением. Когда ножку 23 с усилием вводят в полость 22, как показано на фиг.7, костный цемент 25 вдавливается в контактную поверхность 24, а также частично в поры между гранулами 13, заполняя межпоровое пространство. Небольшое количество костного цемента может также попадать в поры гранул 13. На фиг.7А в увеличенном масштабе показана часть внутренней поверхности 14 и ножки 23 со слоем гранул 13 между ними. Как видно из рисунка, толщина Dg слоя 22 гранул 13 меньше ширины W зазора 26 между внутренней стенкой 14 и ножкой 23; оставшаяся часть указанного зазора 26, имеющая ширину Dc, заполнена слоем 27 костного цемента 25, который проходит на расстояние Dp в указанный слой гранул 22. Расстояние Dc предпочтительно составляет от 1 до 4 средних диаметров гранул, причем средняя толщина цементного слоя предпочтительно составляет по крайней мере приблизительно 2 мм с целью предотвращения механического повреждения, а цемент проникает в слой гранул предпочтительно на расстояние, равное в среднем 2-х мм, где «х» соответствует диаметру наибольшей из гранул, применяемых в данной конкретной реконструкции. Предпочтительно, толщина цементного слоя примерно постоянна на всей контактной поверхности протеза, представляющей собой внешнюю поверхность фиксируемой части протеза, такой как бедренная ножка или внешняя поверхность вертлужного компонента, но она может и варьироваться.
В способе и фиксации протеза в соответствии с настоящим изобретением начальная фиксация протеза достигается главным образом или, по крайней мере, в большой степени посредством гранул, являющихся взаимосвязанными и прижатыми к внутренней стенке 13 отверстия 3 в бедренной кости реципиента или другой поверхности, и костного цемента 25, сцепляющегося с гранулами 13 и контактной поверхностью 24 протеза.
Гранулы, имеющие сравнительно шероховатую поверхность, сцепляются также и механически, когда их прижимают друг к другу. Обнаружено, что слой 22 гранул 13 обладает высокой устойчивостью к компрессионному и, вероятно, сдвиговому напряжению, при этом он допускает небольшую пластическую деформацию только после (реконструктивной) хирургии, под нагрузкой в организме. Это обеспечивает высокую стабильность без риска продолжительной деформации слоя 22 и, как результат, высокую стабильность фиксации протеза и снижение риска растрескивания. Предположительно, ограниченная пластическая деформация способствует врастанию костной и другой ткани реципиента. Возможно, это является и результатом микродвижений под нагрузкой, способных стимулировать оссификацию костных трансплантатов, при этом гранулы допускают перенос нагрузки на врастающую ткань благодаря своей гибкости.
Для проведения хирургического эндопротезирования или операции заполнения в соответствии с настоящим изобретением можно использовать комплект принадлежностей, содержащий по крайней мере эндопротез и (или) решетку, пористые гранулы с взаимосвязанными порами и костный цемент, а также импакционный инструмент для импакции и уплотнения слоя указанных гранул. Гранулы могут иметь покрытие или могут быть увлажнены. Импакционный инструмент, который можно также назвать уплотняющим инструментом, может содержать по крайней мере ножку 23, состоящую из элементов, пригодных к применению по отдельности или в сочетании друг с другом. Ножка предпочтительно слегка сужается в направлении дистального конца и в процессе использования обращена в сторону, противоположную импакционной, с целью выталкивания гранул в наружном направлении. Набор может также содержать тампон с проволочным проводником. Могут быть также предложены различные уплотняющие инструменты для последовательного применения, причем каждый следующий уплотняющий инструмент имеет несколько большее поперечное сечение, чем уплотняющий инструмент, применявшийся на предыдущей стадии. В предпочтительном варианте набор также содержит достаточное количество гранул для покрытия контактной поверхности протеза или его части полноценным слоем гранул толщиной по крайней мере в одну гранулу, а предпочтительно - три гранулы. Кроме того, желательно, чтобы количество костного цемента в наборе было достаточным для покрытия указанного слоя гранул полноценным слоем костного цемента, толщина которого сравнима с толщиной слоя гранул.
Количеств костного цемента в комплекте должно быть достаточно для покрытия гранул в слое гранул, покрывающем, по крайней мере, одну указанную контактную поверхность на глубину, по крайней мере, 2 мм, предпочтительно 2 мм, плюс глубина проникновения в слой гранул на среднем расстоянии 2-Х мм, где значение «X» равно диаметру гранулы, соответствующему верхнему пределу размеров указанных гранул.
Количество костного цемента в комплекте должно быть достаточно для заполнения пор гранул и пространства между гранулами в среднем, по крайней мере, до одной трети указанного слоя гранул.
Комплект принадлежностей содержит решетчатый материал для покрытия, по крайней мере, части внешней поверхности, образованной слоем гранул на, по крайней мере, одной контактной поверхности, при этом материал решетки позволяет удерживать гранулы решеткой.
Комплект принадлежностей содержит средства для уплотнения указанных гранул в отверстии в кости, при этом указанные средства содержат контактную часть, имеющую конфигурацию, аналогичную, а предпочтительно почти идентичную части протеза, особенно ту, по крайней мере, одну контактную поверхность, которая вводится в отверстие в кости.
Комплект принадлежностей содержит средства для введения гранул в отверстие в кости.
Перед установкой ножки бедренного компонента костный цемент может в большой степени или даже полностью заполнять объем отверстия, в которое необходимо поместить указанную ножку. После установки ножки цемент спрессовывается внутри указанного отверстия, а избыточное количество цемента выдавливается на проксимальном конце. В случае с вертлужным компонентом все отверстие вертлужной впадины может быть заполнено цементом, а избыточный цемент вытесняется при установке эндопротезной чашки. Избыточный цемент легко удаляется. В примере, не ограничивающем применение настоящего изобретения, при тотальной артропластике тазобедренного сустава (бедренный и вертлужный компоненты) во взрослом человеческом организме необходимое количество TiP (сухой вес) составляет около 75 г с пористостью 85-90%.
Гранулы 13 имеют предпочтительно шероховатую поверхность, при которой свободно засыпанные в контейнер гранулы сцепляются или слипаются друг с другом главным образом поверхностными частицами соседних взаимосвязывающихся гранул. Гранулы из керамического материала имеют тенденцию к повреждению в процессе импакции, что приводит к нестабильности и свободному перемещению мелких керамических частиц и инородных осколков, которые попадают даже в ткани реципиента, что представляет собой опасность для здоровья. Обнаружено, что пористые металлические гранулы в соответствии с настоящим изобретением обеспечивают более стабильную фиксацию, чем ВоР при аналогичном применении.
На практике в живом организме тотальная артропластика тазобедренного сустава в соответствии со способом осуществления настоящего изобретения производилась на трех козах, как описывается ниже на примерах со ссылкой на фиг.1-7, с заменой как бедренного, так и вертлужного компонента (тотальная артропластика тазобедренного сустава; ТНА). Вес козы составлял около 65 кг, и применялось 5-10 г TiP (сухой вес) для фиксации вертлужного компонента. Сразу же после операции козу помещали в подвесную койку на десять дней. По прошествии десяти дней после операции протез позволялось нагружать. Через две недели измеренный уровень титана в крови составлял менее 10 ррв («частей на миллиард»), а затем снижался до величины менее 7 ррв, что сопоставимо с концентрацией в человеческом организме, содержащем нормально функционирующий обычный титановый протез. TiР обеспечили стабильную реконструкцию непосредственно после операции, и эта стабильность поддерживалась в течение трех месяцев послеоперационного периода. Через три месяца коза подвергалась эвтаназии, и протез проходил визуальные исследования. Гистология не показала никаких признаков раздражения, воспаления или реакции на инородное тело вследствие использования TiP, что свидетельствует о биосовместимости. Протез был очень хорошо зафиксирован за счет врастания как фиброзной, так и костной ткани. На всей поверхности слоя 22 гранул 13 наблюдалось врастание ткани и (или) кости там, где был непосредственный контакт между металлом гранул 13 и костью, вращиваемой в слой 22. В нескольких точках между костью и гранулами не было контакта, но граница раздела формировалась указанной фиброзной тканью.
На фиг.8 показано заполнение костного дефекта 28 с применением частиц 13, которые подвергаются импакции перед и (или) в процессе их помещения в указанный дефект 28, например, полость 29, образовавшуюся во время удаления старого костного цемента или возникшую в результате костной резорбции, удаления опухоли или вследствие иных причин. Гранулы 13 или образованный ими образец 107 могут быть помещены в указанный дефект 28 при помощи решетки 30, которая блокирует полость 29, но не препятствует прорастанию кости и (или) ткани сквозь решетку в гранулы и (или) проникновению костного цемента по крайней мере в межпоровое пространство слоя 22 гранул 13. Таким образом, заполняются сравнительно большие полости 29, и относительно легко и быстро достигается устойчивая фиксация наполнителя.
Эксперименты с вертлужным компонентом
На фиг.13А схематически показано испытательное устройство 31, в которое помещен вертлужный компонент 32. Использовалась синтетическая модель вертлужного компонента (Sawbones®). На фиг.13В и 13С показан указанный вертлужный компонент, выполненный, например, из пластика и представляющий собой полиэтиленовую полусферическую чашку, зафиксированную в полой полусферической камере 33 испытательного устройства 31, представляющего вертлужную впадину и имеющую радиус приблизительно 30 мм, со слоем титановых гранул 13 и костного цемента 6. Гранулы 13 засыпаны во влажном состоянии и подвергнуты импакции в указанной камере 33 при помощи полу сферического уплотняющего инструмента 34 и молотка; таким образом получена полость 34 с радиусом приблизительно 22,5 мм. Толщина слоя гранул 13 составляла от 4 до 10 мм. Объем гранул после импакции соответствовал примерно 55% их объема до импакции. Чашка 35 диаметром 42 мм цементировалась в указанной полости 34.
Использовались четыре группы материалов трансплантата, каждая в восьми испытательных устройствах 31 такого типа, т.е. потребовалось 32 испытательных устройства.
Реконструкции осуществлялись с применением донорской кости (I), донорской кости, смешанной с Ti гранулами (II), Ti гранул диаметром от 3 до 5 мм (III) и Ti гранул диаметром от 4 до 7 мм (IV). Все они использовались в одном и том же испытательном устройстве, с применением одинакового цемента, и имели одинаковые размеры. Когда применялась донорская кость, использовались инструменты Stryker. При реконструкциях группы I применялось 47,5 г донорской кости, группы II - 30 г титана и 15 г донорской кости, групп III и IV - 37,5 г Ti гранул.
По прошествии как минимум 48 часов после цементирования реконструкцию подвергали нагрузке и измеряли дисплазию чашки 32 относительно камеры 33 (вертлужная впадина) в результате нагрузки. Нагрузку переносили на чашку 32 при помощи сферического шарнира 35, как показано на фиг.14, точно прилегающего к указанной чашке (диаметром 28 мм), подвергая его 900 циклам нагрузки от 2 до 3000 Н с частотой 1 Гц посредством сервогидравлического устройства MTS 35A (MTS® Systems Corporation, Миннесота, США). Измерялось положение до и после указанных циклов при статической нагрузке 3000 Н и затем результаты сравнивали. Дисплазию и поворот измеряли в направлениях X, Y, Z и обозначали как «диспл» = дисплазия, «пов» = поворот:
Дисплазия: [(дисплХ)2+(дисплY)2+(дисплZ)2]0,5
Поворот: [(повХ)2+(повY)2+(повZ)2]0,5
На фиг.14А приведены две диаграммы. Верхняя диаграмма показывает дисплазию, нижняя - поворотное движение для каждой из групп I(В), II(ТВ), III(Т3-5) и IV(T4-7). В результате видно, что Ti демонстрирует меньшую степень дисплазии и поворотного движения, хотя требуется меньшее количество граммов, причем чем меньше гранулы, тем меньше степень дисплазии и поворота. Линия погрешности показывает стандартное отклонение внутри каждой группы; минимальное отклонение наблюдается в группе III с наименьшими гранулами.
После замеров дисплазии и поворотного движения сферу удалили и в чашке 32 винтами закрепили стержень 36, как показано на фиг.13В. У свободного конца 37 указанного стержня 36 зафиксировали провод 38, практически перпендикулярный указанному стержню 36 в направлении своей длины в начальном положении, как показано на фиг.13А. Провод 38 оттягивали с постоянной скоростью, непрерывно замеряя необходимую для этого силу F на траектории длиной 10 см. Определяли максимальную силу Fмакс на указанной траектории и умножали на расстояние между точкой соединения провода 38 со стержнем 36 и точкой поворота чашки 32, составлявшее приблизительно 14 см. Эту величину определяли как момент вытеснения (LOM). В данном тесте каждая из конструкций с использованием групп I и II не прошла испытаний, в том смысле, что чашка 32 была вытеснена из вертлужной впадины. В группе III испытания не прошли три конструкции, в группе IV - только две. На фиг.14В показан LOM для каждой группы; линия погрешности показывает стандартное отклонение. Результаты групп с Ti гранулами явно превосходят результаты групп I и II с костными трансплантатами.
В следующем тесте измерялось проникновение костного цемента в слой гранул 13. Тесты, проведенные в организме, показали, что проникновение цемента следует ограничить небольшой глубиной, чтобы позволить костным и другим тканям врастать в указанный слой гранул. Глубину проникновения замеряли, распилив чашку со слоем гранул пополам в среднем сечении, как показано на фиг.15. На внешнюю поверхность чашки 32 помещали полуокружность 39, которую затем делили на 49 сегментов с углом 1,8 градуса. В каждом из сегментов измерялось расстояние от указанной полуокружности 39 до крайней точки цементного слоя 25 в радиальном направлении. На фиг.14С показана средняя глубина проникновения цемента для каждой группы I-IV (левая колонка: сумма всех глубин проникновения, поделенная на 49) и средняя вариантность проникновения (правая колонка); линия погрешности показывает стандартное отклонение. Глубина проникновения в слоях Ti частиц выглядит предпочтительнее по сравнению со слоями костного трансплантата.
Эксперименты с вращиванием кости в ВСС.
На фиг.16 схематически изображена камера для исследования костной проводимости (ВСС; Aspenberg), содержащая два полуцилиндра из чистого титана 41, 42, скрепленных между собой шестиугольным колпачком 43 при помощи винтов. Эти два полуцилиндра 41, 42 вместе образуют заостренный наконечник 44 и внешнюю винтовую резьбу 45 для ввинчивания наконечника 44 ВСС сначала в кость В опытной кости, например, животного. В области указанного наконечника выполнено два отверстия 46, радиально противоположных друг другу и позволяющих ткани врастать в указанную камеру 40 из окружающей среды, как указывают стрелки 47. В проводимых экспериментах ВСС имплантировали в проксимальную большеберцовую кость коз. Отверстия врастания 46 располагали на уровне эндоста, регулируя колпачок 43, находящийся за пределами большеберцовой кости 48.
Материалы и методы
Имплантировали шесть групп ВСС: пять групп, заполненных материалами трансплантата, и одну незаполненную контрольную группу (Е). Пять различных материалов трансплантата включали четыре группы пористых титановых частиц (TiP, Hereford Metal Powder Company Ltd, Хирфорд, Великобритания) и одну группу подвергнутых импакции полученных по частям костных частиц аллотрансплантата (ВоР) (таблицы 4 и 5).

Запас губчатого аллотрансплантата был получен из свежезамороженных (-40°С) грудинных костей пяти коз посредством откусывания при помощи кусачек чипсов размером 1×2×2 мм после отрицательного бактериологического анализа.
TiP представляли собой преимущественно сферические частицы технически чистого титана диаметром 1,0-1,4 мм и имели поры размером от 10 до 150 мкм. Для определения объемной концентрации титана в отдельных частицах посредством определения пористости поперечного сечения использовался анализ изображений, полученных при помощи электронного микроскопа рассеяного сканирования (BEI, Jeol 6310, Jeol, Токио, Япония) и интерактивного компьютерного контроля (AnalySIS®, Soft Imaging System GmbH, Мюнстер, Германия). TiP очищали методом ультразвуковой очистки с использованием 10% Extran® МА01 (Merck KGaA., Дармштадт, Германия), 1 М HNO3, ацетона и спирта. Между этими стадиями TiP промывали под напором и очищали ультразвуковым методом с использованием деминерализованной воды.
Покрытие TIP, состоявшее из диоксида кремния с содержанием фосфата кальция (НА:ТСР 60:40), обеспечивала компания DOT (BONITmatrix®, DOT GmbH, Росток, Германия). Физико-химический анализ TiP и TiP с покрытием осуществлялся путем рентгеновской дифракции (XRD, с тонкопленочным рентгеновским дифрактометром Philips, использующим Cu Кα-радиацию (PW3710, 30 кВ, 40 мА)) и при помощи сканирующего электронного микроскопа (SEM, Jeol 6310, Jeol, Токио, Япония), который был оснащен рентгеновским детектором рассеивания энергии (EDS). TiP демонстрировали гладкую кристаллическую поверхность до нанесения покрытия. После нанесения покрытия TiP были покрыты плотными керамическими гранулами со средним диаметром 5 мм. Покрытие увеличило вес TiP на 3,5%. Метод XRD продемонстрировал, что покрытие BONITmatrix® содержит двухфазный фосфат кальция (HA/TCP 60:40). EDS обнаружил присутствие кальция, фосфата, кремния (покрытие) и титана (TiP) и соотношение кальция к фосфату 1,4-1,5 и кальция к кремнию 1,3-1,4 (фиг.4). TiP с покрытием подвергли рентгеновской стерилизации. TiP без покрытия стерилизовали в автоклаве.
Осуществили стандартную импакцию аллотрансплантатов и титановых гранул посредством тридцатикратного сбрасывания груза весом 9,8 г с высоты 33 см вдоль скользящей резьбы (⌀2 мм, 9,8 г), который выполнял функцию импактора, копируя импакцию в ручном режиме. Пять образцов из каждой группы трансплантатов, включая пять не подвергнутых импакции образцов ВоР, не имплантировали, а использовали для количественного анализа степени импакции: образцы ВоР приготавливали в жестких пластиковых трубках с внутренним диаметром 2,0 мм, не имплантированные образцы TiP приготавливали в ВСС. Площадь поперечного сечения минерализованного костного матрикса определяли по не лишенным известкового вещества центральным продольным слоям (20 мкм, микротом Leica SP1600, Leica Instruments GmbH, Нусслох, Германия) посредством световой микроскопии (окрашивание по методу Голднера). Площадь поперечного сечения титана определяли посредством BEI по продольно нарезанным образцам после полировки влажной поверхности (шлифовальная сетка №200, 400, 800, 1200, 2400). Объемная концентрация кости и объемная концентрация титана рассчитывались методом анализа изображений интерактивного компьютерного контроля, при котором площадь минерализованного костного матрикса и площадь титана делили, соответственно, на общую площадь цилиндра трансплантата. После импакции образцы хранили замороженными (-40°С) в стерильных условиях и оттаивали перед иплантацией. Среднее расстояние между имплантированными камерами составляло 14 мм (12-19 мм).
После получения одобрения от Комитета по этике экспериментов над животными были прооперированы двенадцать голландских молочных коз (Capra Hircus Sanus) со средним весом 47 кг (38-59 кг). Животные по меньшей мере за неделю до операции были размещены вместе в комнате с климатическим контролем (мягкое покрытие, 18-22°С, влажность 60%) и обеспечены свежим сеном, концентратом, жвачкой и водой. Средствами анестезии, применявшимися к козам, служили пентобарбитал (1200 мг) и изофлуран. Для обеспечения двустороннего доступа к медиальному метафизу большеберцовой кости делали продольный разрез. После локальной резекции надкостницы (дерматомом ⌀6,0 мм, Stiefel Laboratorium GmbH, Оффенбах-на-Майне, Германия) сверлильно-резьбонарезной направляющий блок фиксировался константановой проволокой. Для стандартизации расстояния между дефектом и переднемедиальной верхней суставной поверхностью большеберцовой кости использовался измерительный прибор. Шесть ВСС завинчивали в нужное положение в каждой большеберцовой кости, пока колпачок не обеспечивал прочный контакт с кортикальным слоем. Чтобы закрыть поверхностные бинты и кожу, применялся 2,0 мононитяной кетгут. После процедуры имплантации животные получали подкожно ампициллин (Albipen LA, Intervet International BV, Боксмеер, Нидерланды), (15 мг/кг/48 часов) три раза. Обезболивание включало флуниксин (75 мг/24 часа) три раза и бупренорфин (0,3 мг/12 часов) два раза.
Чтобы проследить зависимость костной аппозиции от времени, в течение трех дней подряд вводились флуорохромы - по прошествии четырех недель (тетрациклин), восьми недель (кальцеин зеленый) и двенадцати недель (ализарин) после операции. Коз умертвили передозировкой пентобарбитала (2,4 г) через день после введения последних доз ализарина. ВСС с окружающим кортикальным слоем поместили в 4-процентный буферный формалин. Через три дня содержимое закрепили дополнительно. Было снято несколько последовательных шлифов толщиной 40 мкм параллельно продольной оси камеры, из которых три среза использовались для гистологического анализа: один центральный и два периферийных (300 мкм от центра образца).
Одним из сотрудников была осуществлена субъктивная классификация длинноволновой флуоресценции по возрастающей шкале 0-3; 0: отсутствие флуоресценции, 1: незначительная флуоресценция, несколько узких полос, 2: четкая флуоресценция, промежуточные полосы наложения, 3: значительная флуоресценция с широкими полосами наложения. Количественная оценка максимального расстояния врастания кости осуществлялась другим сотрудником путем анализа изображений при помощи светового микроскопа (LD, метод окрашивания Голднера) и интерактивного компьютерного контроля. Максимальное расстояние врастание кости определялось как самое большое расстояние между основанием костной камеры и новой костью в цилиндре имплантата, измеренное параллельно вертикальной оси шлифа.
Осуществлялся однофакторный анализ отклонений у коз с учетом положения имплантата и группы трансплантата, с целью проанализировать различия между группами в флуорохромных показателях и различия между группами в расстояниях врастания кости. Соответствие отклонений норме и их однородность оценивали по критерию Колмогорова-Смирнова и при помощи теста Левина. После этого проводили t-тесты (Тьюки), чтобы определить различия между группами. Статистический анализ осуществляли при помощи пакета программ обработки статистических данных 9.0 (SPSS Inc., Чикаго, США).
Объемная концентрация титана отдельных TiP составила 26±4%. Цилиндры трансплантата не подвергнутых импакции TiP (11-14 отдельных частиц) продемонстрировали чуть более низкую объемную концентрацию титана. Подвергнутые импакции образцы состояли из 25-30 частиц и продемонстрировали увеличение объемной концентрации титана. Частицы титана были несколько меньше костных частиц. В ВСС можно было подвергнуть импакции 15-18 костных чипсов, в результате чего были получены цилиндры трансплантата с объемной концентрацией кости 61±9%. Цилиндры трансплантата, подвергнутого импакции, как с TIP, так и с ВоР, отличались большой плотностью. Продольные разрезы подвергнутых импакции TiP цилиндров показали, что только очень небольшие поры (10-50 мкм) видны в центре TiP трансплантата. Несколько более крупные поры (50-75 мкм) и просветы между TiP и внутренней поверхностью ВСС можно обнаружить в периферийной области (фиг.17).
Все имплантации прошли без осложнений. Одна из коз умерла спустя пять дней после операции от сепсиса, вызванного клостридиальной кишечной инфекцией. Еще у одной из коз наблюдалась раневая поверхностная инфекция, которую удалось вылечить без осложнений. Последующая аутопсия с применением рентгена через двенадцать недель после имплантации показала кортикальное утолщение и не изменившееся положение имплантата без каких-либо признаков повреждений или остеолиза, соответствующее хорошей фиксации, а также никаких признаков инфекции, судя по анализу ВСС.
Шесть цилиндров трансплантата были повреждены на стадии подготовки к гистологии и поэтому не доступны для гистологического анализа (В: два образца, Е: четыре образца).
Флуоресцентные показатели были самыми высокими в группах В и Е на протяжении всего периода имплантации. После четырех недель лишь небольшая костная аппозиция наблюдалась во всех группах трансплантата (без какого-либо различия тетрациклинового показателя). Основная флюорохромная активность наблюдалась четыре недели спустя с существенно более высокими кальцеиновыми показателями в группах В и Е по сравнению с группами Те (р<0,05), Ti и Tci (p<0,001). В конце имплантационного периода флюорохромная активность снижалась. Показатель ализарина был значительно выше в группах В и Е по сравнению с группами Т (р<0,05), Ti и Tci (р<0,01). Основное костное врастание происходило, вероятно, через восемь недель после имплантации. В период между восемью и двенадцатью неделями прослеживалось четкое увеличение костной аппозиции по сравнению с уже наблюдавшимся после восьми недель костным количеством, но меньшее увеличение расстояние врастания кости.
В группах Е и В небольшое утолщение фиброзной ткани предшествовало проникающей кости, создавая область фиброзной трансформации в цилиндрах трансплантата подвергнутых импакции костных чипсов. Фиброзная ткань проникала в весь цилиндр TiP до колпачка костной камеры во всех образцах. Фронт врастания кости достаточно быстро и легко определялся в незаполненных ВСС и подвергнутых импакции ВоР. Однако врастание кости в TiP, по-видимому, происходило главным образом на периферии цилиндров трансплантата, с некоторыми следами костного образования в более близкой к центру области цилиндра, особенно в цилиндрах трансплантата с подвергнутыми импакции TiP.
Для исследования было выбрано максимальное расстояние костного врастания в отличие от данных среднего расстояния костного врастания, рассмотренных выше в исследованиях костных камер. Исследование максимального расстояния костного врастания по прошествии двенадцати недель показало значительное отклонение внутри групп и было меньше в TiP, чем в подвергнутых импакции ВоР или незаполненных ВСС. Максимальное расстояние костного врастания было самым высоким в группах Е и В: 3,6±2,0 мм, соответственно 2,0±1,0 мм, р<0.001 (таблица 2). Врастание кости было значительно ниже во всех четырех группах TiP по сравнению с группами В (р<0,05) и Е (р<0,001). У подвергнутых импакции TiP наблюдалась тенденция к меньшим расстояниям врастания, в группах как с покрытием, так и без него (р=0,2). Характеристики TiP с покрытием не выглядели лучше, чем характеристики TiP без покрытия (р=0,3). BEI/EDS не показали никаких признаков остатков покрытия Bonitmatrix®. TiP с покрытием и без покрытия продемонстрировали сравнимое распределение по поверхности сопряжения с точки зрения присутствия/отсутствия непосредственного контакта между костью и титаном (фиг.11).
В соответствии с экспериментами по проникновению костных трансплантатов в организме, в ВСС врастанию кости предшествует врастание фиброзной ткани, что, помимо улучшения характеристик прочности на растяжение, почти удваивает сопротивление сжатию подвергнутых импакции трансплантатов по прошествии четырех недель после имплантации. Хотя фиброзной защиты может быть достаточно для долгосрочной стабилизации реконструкции, проведенной из нерассасывающихся материалов, врастание новой кости представляется предпочтительным.
Небольшое количество костного врастания в не подвергнутых импакции TiP представляется любопытным в данном исследовании, поскольку известно, что титан обладает костной проводимостью; поэтому ожидалось, что TiP не только не уменьшит, а даже улучшит остеопроводимость ВСС.
Возможны несколько вариантов объяснения весьма небольшого расстояния костного врастания в TiP. Порозность отдельных TiP почти равна порозности не подвергнутых импакции цилиндров трансплантата TiP. Это свидетельствует о том, что во время введения TiP вручную в ВСС происходила их деформация.
TiP более эффективно скапливались в центральной части цилиндра трансплантата и менее эффективно на периферии, где частицы находились в контакте с окружающей их плоской внутренней поверхностью ВСС. Хотя врастание кости в TiP цилиндрах отмечалось даже в очень мелких порах размером 50 микрон, в поддержку гипотезы окклюзии за счет импакции свидетельствует характер врастания кости, происходившего главным образом на периферии TiP цилиндров трансплантата, особенно в подвергнутых импакции образцах. Отклонения и диапазон расстояний врастания в TiP цилиндрах может указывать на то, что в присутствии пор TiP могли бы продемонстрировать свой остеопроводящий потенциал.
Как показали реконструкции в организме, процесс импакции позволяет получить достаточно пористые слои трансплантата, обеспечивающие проникновение костного цемента, а отдельные костные чипсы и их макропоры часто все еще можно распознать.
Несколько более крупные частицы, у которых все еще наблюдались макропоры, также были полностью уплотнены в применявшейся процедуре импакции. Поэтому применявшаяся деформация могла превышать клинически применяемую импакцию. Избыточная импакция ставит под угрозу не только костное врастание в ВоР, но и остеопроводимость TiP.
Добавление СаР покрытия, по-видимому, в некоторой степени компенсировало неблагоприятный эффект импакции на врастание кости.
Врастание кости в Ti частицы
В таблице 6 показаны шесть групп трансплантатов, которые применялись для замещения аналогичных дефектов мыщелкового пространства большеберцовой кости у коз (цилиндрические дефекты). Данные дефекты имели диаметр 8 мм и высоту 10 мм, т.е. объем 0,5 мл. Все трансплантаты подвергли импакции в соответствии с приведенным выше описанием. Частицы Ti без покрытия имели плотность 0,5 г/мл (плотность А). Массу на дефект увеличивали в случае использования частиц с покрытием, чтобы поддерживать одинаковую плотность Ti во всех дефектах. Покрытие TiPcl было образовано фосфатом кальция (трикальцийфосфат и гидроксиапатит). Оно составляло примерно 7% весовых от общей массы. Покрытие TiPc2 состояло из фосфата кальция (углеродный апатит) и составляло примерно 11% весовых от общей массы.
В каждой группе были замещены 12 дефектов мыщелкового пространства большеберцовой кости указанных коз, после чего, по истечении 4 и 12 недель, определялось расстояние врастания поперечным распилом кости (перпендикулярно направлению длины), при этом поперечное сечение замещенных дефектов было практически округлым. Каждую окружность поделили на четыре четверти, и в каждой четверти определяли врастание как радиальное расстояние, после чего вычислили среднее для этих четырех четвертей врастание. На фиг.20 показано поперечное сечение с обозначенной окружностью 50, указывающей внешнюю периферию дефекта, и четыре сектора 51, в каждом из которых стрелка 52 указывает расстояние врастания. Титан в дефектах обозначен черным цветом, кость - серым. На фиг.20А представлена диаграмма, на которой показано среднее врастание по истечении 4 и 12 недель для групп трансплантатов таблицы 3. Здесь четко видно, что для этих образцов и дефектов расстояние врастания является наименьшим у TiP без покрытия после 4 недель, но сравнимо с указанным расстоянием TiP трансплантатов с покрытием после 12 недель и несколько меньше, чем у ВоР и СеР.
Испытания на козах
Была проведена реконструкция несущего нагрузку дефекта (сегментарного и полостного) с применением проволочной решетки и TiP в вертлужной впадине 10 коз.
У одной из коз эксперимент прошел неудачно вследствие повреждения большеберцовой кости, не связанного с реконструкцией вертлужной впадины. Еще у одной козы был обнаружен вывих чашки, но слой TiP остался неповрежденным. У одной из коз чашка была подвижной при размещении, но слой TiP снова оказался неповрежденным.
Макроскопически цемент проник в слой TiP. По истечении 15 недель флуорохромные метки показали, что в слое TiP всех коз имело место обильное формирование новой кости. У некоторых коз формирование новой кости обнаружено до поверхности сопряжения с цементным слоем. В большинстве областей мягкая ткань на поверхности сопряжения отсутствовала или же присутствовал тонкий слой мягкой ткани между слоем TiP и цементным слоем. Уровни Ti в крови были низкими на протяжении всего последующего периода. В плотных областях не наблюдалось накопления остатков Ti ни у одной из коз.
Крупные дефекты в вертлужной впадине коз можно реконструировать при помощи подвергнутых импакции TiP. Мягкая ткань на поверхности сопряжения тоньше, чем в аналогичных предыдущих экспериментах по той же модели, в которых тот же самый дефект реконструировался при помощи МСВ или смеси МСВ со слоем ТСР/НА.
В настоящем исследовании мы реконструировали тот же дефект при помощи подвергнутых импакции титановых частиц (TiP). Основными поставленными вопросами были: степень костного врастания в слой TiP, природа поверхности сопряжения между слоем TiP и цементным слоем, потенциальная генерация малых Ti частиц при реконструкции и уровни Ti в крови.
Материалы и методы
Экспериментальная модель с использованием животных.
Эксперименты проводились на 10 взрослых голландских молочных козах (самках) (Capra Hircus Sana). Все животные имели полностью сформировавшийся скелет и весили от 50 кг до 60 кг (в среднем - 55 кг). Срок наблюдения составил 15 недель.
Материалы
Титановые частицы (пористость 75-85%, диаметр 2,8-4 мм) были предоставлены фирмой Fondel Finance BV (Роттердам, Нидерланды). Все TiP частицы были очищены в соответствии с протоколами клинических исследований Cam Implants BV (Лейден, Нидерланды). Все TiP имели покрытие в виде слоя фосфата кальция по методу, ранее опубликованному Kukubo (Yan WQ, Nakamura T, Kawanabe К, Nishigochi S, Oka M, Kokubo Т. «Титан с покрытием из слоя апатита для применения в качестве костных связующих имплантатов». «Биоматериалы» 1997; 18:1185-1190). Покрытие наносилось Biomaterialen, Radbout University, Неймеген).
Хирургическая операция
До операции внутримышечно вводился антибиотик (байтрил 0,2 мл/кг, Division Animal Health, Мейдрехт, Нидерланды). Дооперационное обезболивание включало внутримышечное введение бупренорфина гидрохлорида (темгезик 5 мкг/кг; Renckitt Benkiser Healthcare, Халл, Великобритания) и нестероидного противовоспалительного препарата, флуксин меглумина (финадин 1 мг/кг; Schering-Plough Animal Health, Брюссель, Бельгия). В процессе операции обезболивание осуществлялось дополнительно внутривенным введением натрийпентабарбитала (нембутал 30 мг/кг, Ceva Sante Animale, Мааслуис, Нидерланды). Во время операции животные лежали на левом боку; применялась изофлурановая анестезия (2,5% изофлурана в кислородной/нитрокислородной смеси). Сторону, на которой осуществлялся надрез, выбрили и тщательно обработали бетадином. После этого выполнили С-образный надрез, чтобы получить доступ к правому тазобедренному суставу спереди. Ягодичные мышцы частично отсоединили от большеберцовой кости и оттянули. Суставную капсулу вскрыли при помощи Т-образного надреза, после чего сместили головку бедра. Далее, произвели остеотомию шейки бедра. Вертлужную впадину рассверлили до диаметра 32 мм с помощью высокоскоростной электродрели, верхнебоковой край удалили, чтобы симулировать сегментарный дефект, часто наблюдаемый в ревизионной артропластике ТБС. Полученный в результате сегментарный дефект типа 3 по шкале AAOS (Американская ассоциация хирургов-ортопедов) реконструировали при помощи металлической решетки (металлическая решетка X-Change, Stryker Orthopedics, Ньюбери, Великобритания), которая закреплялась на внешней стороне кости таза посредством четырех винтов АО (диаметром 3,5 мм, длиной от 10 мм до 20 мм; Synthes, Швейцария). В плотных костных областях вертлужной впадины проделали небольшие трепанационные отверстия (2 мм), чтобы облегчить васкуляризацию костного трансплантата. После предварительных испытаний чашки дефект реконструировали при помощи ПР. Для каждой реконструкции использовали от 5 до 11 г TiP. Для проведения импакции использовали несколько импакторов полусферической формы, размеры которых варьировались от 26 мм до 32 мм, сопоставимых с «Набором для ревизии вертлужной впадины X-change®» (Stryker Orthopedics, Ньюбери, Великобритания). Внутренний диаметр реконструируемого дефекта составлял 32 мм. Далее костный цемент (хирургический Simplex-P, Stryker Orthopedics, Ньюбери, Великобритания) вводился в дефект через 4 минуты после смешивания порошка с мономером и затем прессовался в течение двух минут. Сделанная на заказ полиэтиленовая чашка Exeter (внутренний диаметр 22,2 мм, внешний диаметр 29 мм) вводилась через 6 минут после смешивания. После этого открывали и зондировали диафиз бедренной кости. Бедренный канал промывали и осуществляли ретроградное заполнение костным цементом в течение 3,5 минут после смешивания компонентов костного цемента. Спустя 5 минут после смешивания костного цемента вводили полированную конусную ножку V 40 Exeter в форме двойного клина (Stryker, Benoist Girard, Франция). После схватывания цемента тазобедренный сустав возвращали в нормальное положение. Мягкие ткани закрывали послойно и проводили рентгеновский контроль области тазобедренного сустава. После операции животных помещали в подвесную койку примерно на 10-14 дней. Им вводили антибиотики группы ампициллина (албипен LA 15 мг/кг; Intervet, Боксмеер, Нидерланды) в течение последующих 48 часов, а также внутримышечно финадин (4 дня) и темгезик (2 дня) для обезболивания. Позднее коз вывозили на ферму с достаточным открытым пространством для прогулок. Каждой козе подкожно вводили раствор зеленого кальцеина (25 мг/кг) за 8 и за 1 день до усыпления с целью гистологической оценки костного образования при размещении.
Козы получали флюорохромы на протяжении всего срока наблюдения (тетрациклин, зеленый кальцеин и оранжевый ксиленол) и были усыплены спустя 15 недель после операции передозировкой барбитурата (нембутал 60 мг/кг). Были сделаны стандартные рентгеновские снимки со стороны имплантата для того, чтобы проверить положение имплантата и исключить повреждения и смещения. Большеберцовая кость и реконструированная вертлужная впадина были извлечены, очищены от всех мягких тканей и помещены в 4%-ный буферный раствор формальдегида при 4°С по крайней мере на 10 дней.
Гистология
После того как были сделаны рентгеновские снимки извлеченных компонентов тазобедренного сустава, реконструированные дефекты вертлужной впадины были препарированы на несколько частей. Все части были обезвожены и помещены без декальцифицирования в полиметилметакрилат (РММА), затем поочередно рассечены при помощи микротома Leica SP1600 (Гейдельберг, Германия) на секции примерно 50 микрон толщиной. Секции были исследованы в неокрашенном состоянии. После количественного анализа костного врастания они были окрашены НЕ (гематоксилин и эозин) или оставлены неокрашенными для визуального исследования кальцеиновой флуоресценции. Все секции обследовались при обычном и флуоресцентном свете.
В одной секции каждого образца толщина сопряжения измерялась в пяти позициях на равном расстоянии друг от друга. Для определения позиции измерений к вертлужной впадине провели касательную линию. От центра чашки провели пять линий под равным углом (30 градусов) и измерения осуществляли на их пересечении с поверхностью сопряжения с мягкими тканями. Все значения усреднили для каждой козы.
Клинические наблюдения и осложнения
У одной из коз произошел перелом большеберцовой кости, явившийся, вероятно, осложнением после операции и не связанный непосредственно с реконструктивной хирургией. В первые две недели после нахождения в подвесных койках все козы хромали, но впоследствии движения всех животных при ходьбе восстановились практически до нормального уровня. Одна из чашек была полностью подвижной, а еще одна - слегка подвижной.
Гистологический анализ
Основан на утолщенных секциях (фиг.21-23). Во всех образцах слой TiP был интегрирован в кость реципиента (фиг.24). Кость была тесно связана с наружным слоем TiP (фиг.22). Во всех образцах обнаружено значительное врастание новой кости в более крупные пустоты между отдельными TiP гранулами (фиг.23).
Образование фиброзной ткани.
В большинстве образцов новая кость достигала поверхности сопряжения TiP с цементом (фиг.23). Сопряжение TiP с цементом было достаточно плотным, и в большинстве случаев наблюдалось непосредственное соединение TiP слоя и цемента (фиг.23). В некоторых позициях была обнаружена сравнительно тонкая поверхность сопряжения с фиброзной тканью - менее 100 микрон (фиг.23). Это значительно меньше, чем ожидалось, и меньше, чем при использовании костного трансплантата.
Уровни Ti в крови.
До операции уровни ионов TiP составляли примерно 0,6 ррв («частей на миллиард»). На протяжении периода наблюдения этот уровень медленно возрастал приблизительно до 1,0 ррв, что является удивительно низким показателем.
В предыдущих публикациях на эту тему, где испытания проводились с использованием смеси TCP/HA MCB, основным осложнением было повреждение стенки вертлужной впадины. Повреждение медиальной стенки связано с особенностями животного, на котором проводились эксперименты, т.е. козы. После использования развертки диаметром 32 мм для имитации воспроизводимого полостного дефекта, особенно у некоторых коз с меньшими размерами костей, медиальная стенка становится довольно тонкой. Во время процедуры импакции с применением ТСР/НА в некоторых случаях тонкая медиальная стенка повреждается. В данной серии никакой перфорации медиальной стенки не наблюдалось. Это может быть связано с подверженностью TiP импакции, что способно обеспечить более равномерное распределение нагрузки на медиальную стенку кости.
Вторым важным наблюдением, полученным в процессе аналогичных предыдущих экспериментов, было то, что на всех трех стадиях образовывалась поверхность сопряжения значительной толщины между введенным костным трансплантатом и цементным слоем (Arts JJ, Gardeniers JW, Welten ML, Verdonschot N, Schreurs BW, Buma P. «Отсутствие негативных эффектов при импакционной костной пластике с использованием костных и керамических смесей». Clin Orthop 2005; 438:239 - 247; Buma P, Arts JJ, Gardeniers JW, Verdonschot N, Schreurs BW. «Отсутствие влияния костного морфогенетического протеина - 7 (ОР - 1) на введение подвергнутых импакции костных трансплантатов в практических экспериментах с вертлужной впадиной». Журн. Biomed Mater Res В Appl Biomater 2007; Schimmel JW, Buma P, Versleyen D, Huiskes R, Slooff TJ. «Реконструкция вертлужной впадины посредством подвергнутых импакции полученных по частям губчатых аллотрансплантатов в артропластике тазобедренного сустава с цементированием: гистологический и биомеханический анализ экспериментов на козах». Журн. «Артропластика» 1998; 13:438-448). В данном исследовании, напротив, фиброзная ткань либо не обнаружена, либо присутствует в виде очень тонкого слоя между слоем TiP и цементом. Вероятно, поверхность сопряжения мягкой ткани формируется в процессе десорбции МСВ. Потенциально это приводит к ослаблению реконструкции, осуществляемой с применением слоя трансплантата и цемента. В случае с использованием TiP слоя целостность TiP и цементного слоя усиливается за счет врастания кости. Не происходит никакого ослабления реконструкции, что может служить объяснением получения весьма благоприятных результатов, относящихся к структуре поверхности сопряжения.
Наконец, уровни Ti были ниже, чем в клинических сериях с использованием бесцементных титановых имплантатов (фиг.25).
В заключение следует отметить, что описанные эксперименты на животных прошли успешно. Врастание кости наблюдалось во всех реконструкциях. Даже у коз с вывихом или подвижностью чашки слой TiP не был поврежден.
Настоящее изобретение ни в коем случае не ограничивается представленным описанием способов его осуществления. Возможно множество вариантов его воплощения в пределах, определяемых формулой изобретения. Следует особо отметить, что способ или комплект принадлежностей в соответствии с настоящим изобретением может применяться и в других частях тела человека или животного, например при различном протезировании. TiP можно смешивать, например, с ВоР и (или) СеР, но предпочтительно использовать только TiP. Протез, если он имеет практическое применение, может быть любой желаемой формы и любых размеров. Эти возможные альтернативные варианты также входят в объем данного изобретения, определяемый его формулой.
Реферат
Группа изобретений относится к медицине. Комплект по первому варианту содержит протез или часть протеза, имеющие, по крайней мере, одну контактную поверхность; металлические гранулы, обладающие внутренней пористостью; костный цемент. Указанные гранулы выполнены на основе титана. Указанные гранулы предпочтительно обладают остеопроводимостью и предпочтительно имеют покрытие из группы остеопроводящих или остеоиндуктивных покрытий или покрытий, содержащих биокерамику, биостекло или остеопроводящие, или остеоиндуктивные молекулы, или жидкости, или клетки. Титановые гранулы для использования в упомянутом комплекте принадлежностей имеют пористость от 40 до 90% и диаметр от 1 до 10 мм. Указанные гранулы предпочтительно обладают остеопроводимостью. Указанные гранулы предпочтительно имеют покрытие из группы остеопроводящих или остеоиндуктивных покрытий или покрытий, содержащих биокерамику, биостекло или остеопроводящие, или остеоиндуктивные молекулы, или жидкости, или клетки. Способ фиксации протеза или его части в организме или вне организма, в кости или в искусственной кости содержит следующие стадии: подготовка отверстия в кости к приему, по крайней мере, одной контактной поверхности протеза; заполнение указанного отверстия и (или) обнаруженного костного дефекта, по крайней мере, частично металлическими гранулами, выполненными на основе титана, обладающими внутренней пористостью, и остеопроводимостью, и предпочтительно имеющими покрытие из группы остеопроводящих или остеоиндуктивных покрытий, или покрытий, содержащих биокерамику, биостекло или остеопроводящие или остеоиндуктивные молекулы, или жидко
Формула
- протез или часть протеза, имеющие, по крайней мере, одну контактную поверхность;
- металлические гранулы, обладающие внутренней пористостью;
- костный цемент,
при этом указанные гранулы выполнены на основе титана, причем указанные гранулы предпочтительно обладают остеопроводимостью, и предпочтительно имеют покрытие из группы остеопроводящих или остеоиндуктивных покрытий, или покрытий, содержащих биокерамику, биостекло или остеопроводящие или остеоиндуктивные молекулы или жидкости или клетки.
- подготовка отверстия в кости к приему, по крайней мере, одной контактной поверхности протеза;
- заполнение указанного отверстия и (или) обнаруженного костного дефекта, по крайней мере, частично металлическими гранулами, выполненными на основе титана, обладающими внутренней пористостью, и остеопроводимостью, и предпочтительно имеющими покрытие из группы остеопроводящих или остеоиндуктивных покрытий, или покрытий, содержащих биокерамику, биостекло или остеопроводящие или остеоиндуктивные молекулы, или жидкости, или клетки таким образом, чтобы, по крайней мере, часть, а предпочтительно практически вся внутренняя стенка указанного отверстия была покрыта слоем указанных гранул;
- введение уплотняющего инструмента в указанные гранулы в апертуру в указанном слое и уплотнение указанного слоя гранул на указанной внутренней стенке таким образом, чтобы после извлечения указанного уплотняющего инструмента из указанной апертуры данная апертура имела форму и размеры, по крайней мере, одной контактной поверхности указанного протеза;
- введение костного цемента и, по крайней мере, одной указанной контактной поверхности протеза в указанную апертуру таким образом, чтобы костный цемент вдавливался в слой указанных гранул, внутрь и между указанными гранулами так, чтобы когда указанная, по крайней мере, одна контактная поверхность находится в необходимом для фиксации положении, пространство между указанной, по крайней мере, одной контактной поверхностью и внутренней стенкой было бы заполнено указанным слоем гранул, а костный цемент был бы вдавлен в указанный слой.
- биомиметическое покрытие, покрытие в сверхнасыщенном растворе;
- покрытие плазменным напылением; или
- электрохимическое осаждение, предпочтительно с использованием ванны соляного раствора, или электроструйное напыление.

Комментарии