Способ определения типа биологической ткани - RU2676647C1
Код документа: RU2676647C1
Чертежи
Описание
Изобретение относится к медицине, а именно к медицинской технике, и предназначено для определения типа биологической ткани на основе метода лазерной флюоресцентной спектроскопии (ЛФС).
Известен способ и устройства для флюоресцентной неинвазивной медицинской диагностики злокачественных новообразований в тканях (RU 2012243 С1 15.01.1994, US 5647368 15.07.1997 и др.). Известен способ и устройство для биофотометрического контроля состояния пораженных биологических тканей (SU 1545346 А1 18.06.1984; SU 1481938 А1 19.11.1985). Известен способ оптической диагностики физиологического и патофизиологического состояния биологических тканей (RU 2234242 С2 20.08.2004).
Базовая методика диагностики для указанных выше способов и устройств заключается в подведении лазерного излучения к обследуемому участку биоткани и регистрации отраженного флюоресцентного излучения от биоткани с последующим анализом амплитуды и спектрального состава зарегистрированного излучения. Сравнение полученных данных с данными от эталонного отражателя или от заведомо здоровых тканей позволяет делать прогноз относительно состояния ткани в терминах "норма-патология".
Не менее актуальной на сегодняшний день является проблема мониторинга типа биоткани. Это очень важно при проведении хирургических вмешательств, особенно для корректирующих операций по трансплантации стволовых клеток, а также в робото-ассистированной хирургии. Стандартные методы определения типа тканей инвазивны для исследуемых образцов и требуют затрат большого количества времени, реактивов, а также специалиста с хорошими познаниями в гистологии. Поэтому хирурги на практике контролируют тип тканей на глаз, полагаясь только на свой опыт. Это рождает множество неопределенностей в прогнозе постоперационного восстановления тканей и результативности операций, связанных с трансплантациями стволовых клеток.
В живых тканях существует множество хромофоров (пигментов) и флюоресцирующих веществ (флюорофоров), различающихся по физиологической концентрации в разных типах тканей, а также отклоняющихся по концентрации от нормы при развитии патологических процессов в тканях. Это, например, коллаген, эластин, кератин, пигменты дыхательной цепи, порфирины и липофусцин. Оптические свойства отдельных слоев и типов тканей сильно зависят от процентного содержания в них данных хромофоров, флюорофоров и других оптически "активных" веществ, имеющих характерные полосы спектрального поглощения, рассеяния и люминесценции (например, меланина, гемоглобина, биллирубина, флавинов, воды и т.п.) (Рогаткин Д.А., Физические основы лазерной клинической флюоресцентной спектроскопии in vivo. Лекция. // Медицинская физика, №4, 2014. - с. 78-96). Таким образом, возможно существование некой «нормы спектра оптических показателей» для каждого типа тканей, а также отклонение этих показателей при патологических изменениях.
Наиболее близким прототипом для данного заявляемого способа является способ определения типа биологической ткани, описанный в зарубежном патенте US 6768918 В2 от 27.07.2004. Данный способ включает в себя проведение лазерной флюоресцентной спектроскопии при возбуждении флюоресценции лазерным излучением ультрафиолетового спектра и регистрацию вышедшего из ткани излучения флюоресценции с использованием дискриминантного анализа для обработки полученных данных. На исследуемый участок биологической ткани воздействуют оптическим излучением в ультрафиолетовом диапазоне длин волн и регистрируют вышедшее из ткани излучение флюоресценции на трех выбранных длинах волн, одна из которых является изобестической точкой (например, 431 нм). Интенсивности зарегистрированных сигналов нормируются на интенсивность сигнала на длине волны 431 нм. Далее при помощи дискриминантного анализа вычисляется показатель, на основе которого делается заключение о том, является ли обследуемая ткань здоровой или больной. На основании этого принимается решение о том, производить или нет резекцию данной ткани.
Но, тем не менее, представленный способ обладает следующими недостатками:
- обработка спектров флюоресценции в данном способе осуществляется на трех длинах волн, а не в диапазоне длин волн, что существенно снижает точность и информативность данного способа диагностики функционального состояния и типа ткани;
- данный способ позволяет классифицировать с высокой точностью (около 85%) такие ткани как здоровая кишка, опухолевые и неопухолевые полипы толстой кишки, но не позволяет дифференцировать другие типы ткани, в том числе здоровые, между собой, такие как кожа, соединительная ткань, жировая ткань, нервная ткань, мышечная ткань, костная и т.д.
Таким образом, существует потребность в способе определения типа биологической ткани, лишенном вышеуказанных недостатков.
Техническим результатом предлагаемого способа является повышение точности, достоверности и медицинской информативности диагностических процедур, которые будут обеспечиваться применением на практике данного способа, а также расширение функциональных возможностей диагностических процедур и обеспечение возможности использования заявляемых способа и устройства в различных областях медицины, таких как, например, регенеративная медицина и робото-ассистированная хирургия.
Для достижения указанного технического результата в предлагаемом способе определения типа биологической ткани, включающем в себя проведение лазерной флюоресцентной спектроскопии при возбуждении флюоресценции лазерным излучением ультрафиолетового спектра и регистрацию вышедшего из ткани излучения флюоресценции с использованием дискриминантного анализа для обработки полученных данных, предлагается осуществлять возбуждение флюоресценции на длине волны 365 нм, при этом запись спектров аутофлюоресценции производят в виде массива данных, состоящего из n значений интенсивности флюоресценции {I1, I2…Ii…In} для последовательности длин волн {λ1, λ2…λi…λn} в диапазоне от 420 до 720 нм, i=n, для всего массива интенсивностей флюоресценции формируют массив коэффициентов флюоресцентной контрастности {K1, K2…Ki…Kn}, где
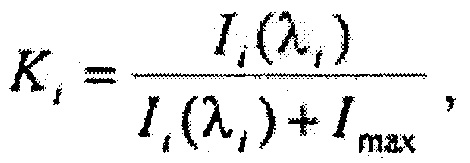
где Imax - максимальная интенсивность обратно рассеянного сигнала на исходной длине волны освещающего ткань лазерного излучения, при помощи метода главных компонент формируют 1-мерный массив главных компонент {PC1, РС2…PCi*…PC1}, который определяется как
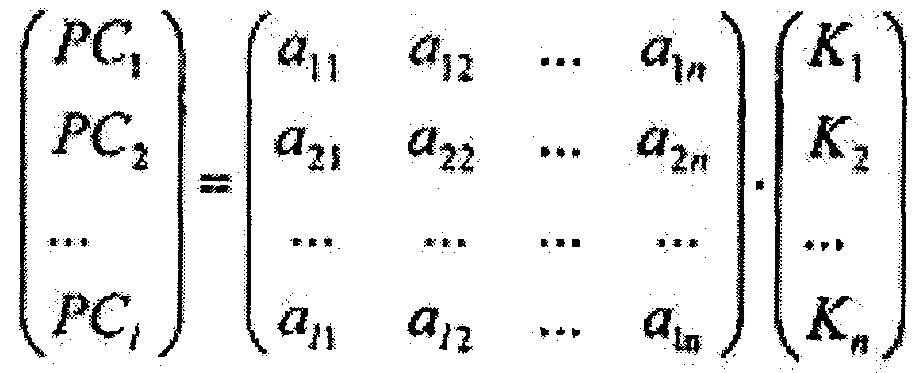
где А={ai*j}1×n, где i*=1,2…1, j=1,2…n, - матрица коэффициентов метода главных компонент, далее на основе линейного дискриминантного анализа Фишера вычисляют массив дискриминантных функций {f1, f2…fi**…fm} размером m, где m - количество классифицируемых типов ткани, определяющийся как
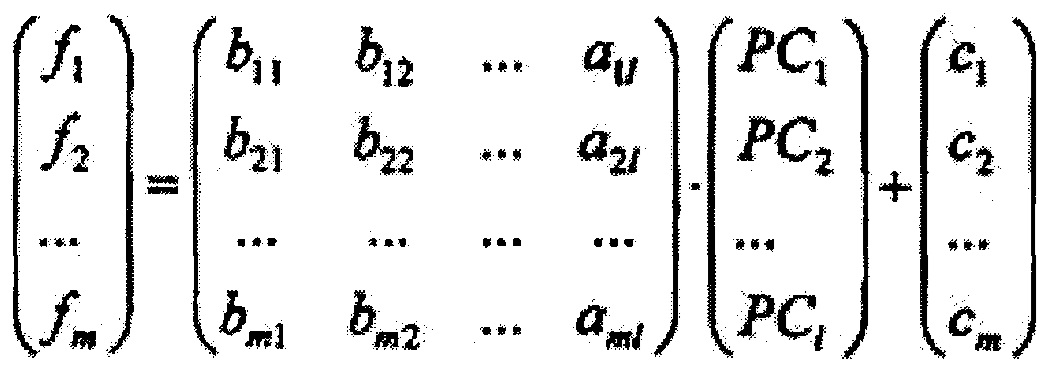
где В={bi**j*}m×1, где i**=1,2…m, j*=1,2…1 - матрица коэффициентов линейного дискриминантного анализа Фишера, {c1, c2…cm} - массив постоянных коэффициентов линейного дискриминантного анализа Фишера, далее вычисляют массив вероятностей принадлежности обследуемого участка ткани к тому или иному классу типов ткани {P1, P2…Pi**…Pm} по формуле
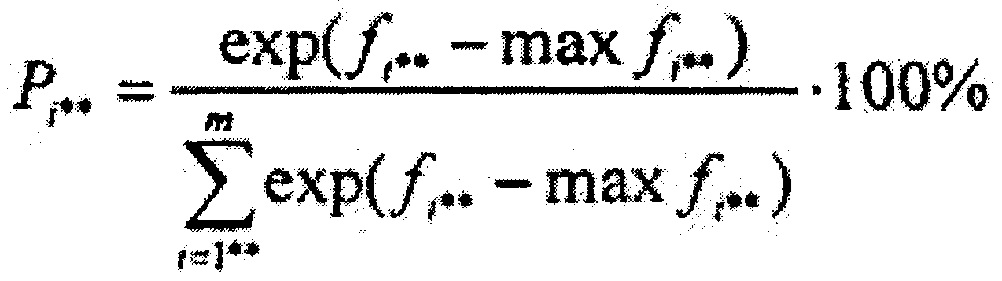
где Pi** - вероятность принадлежности обследуемого участка ткани к классу i**, maxfi** - максимальное значение дискриминантной функции в массиве {f1, f2…fi**…fm}, далее находят максимальное значение вероятности из массива (P1, P2…Pi**…Pm} и на его основе делают заключение о типе ткани, к которому принадлежит исследуемый участок.
…
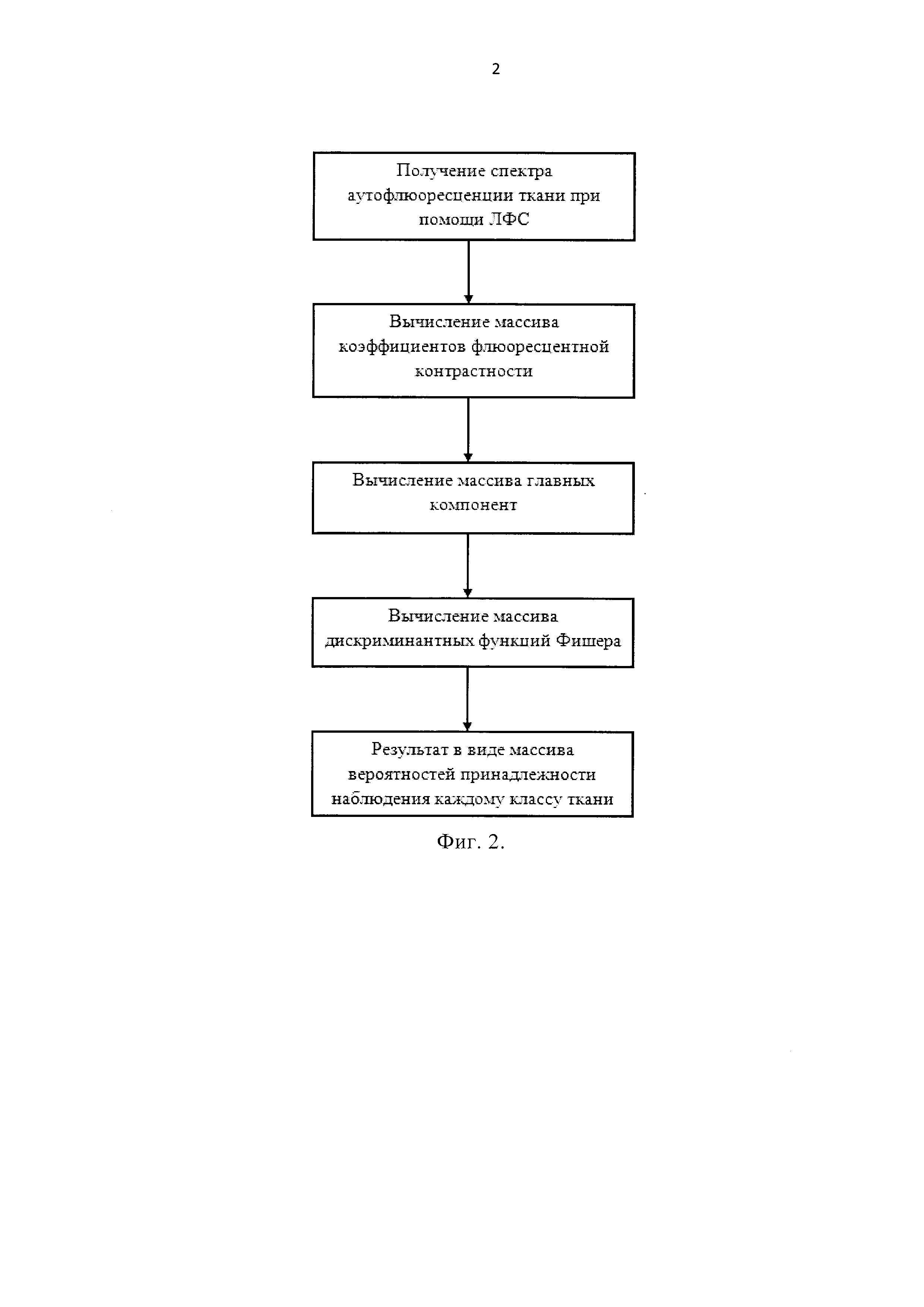
Предлагаемый алгоритм обработки спектров флюоресценции различных типов тканей может быть наглядно проиллюстрирован в виде блок-схемы (см. Фиг. 2).
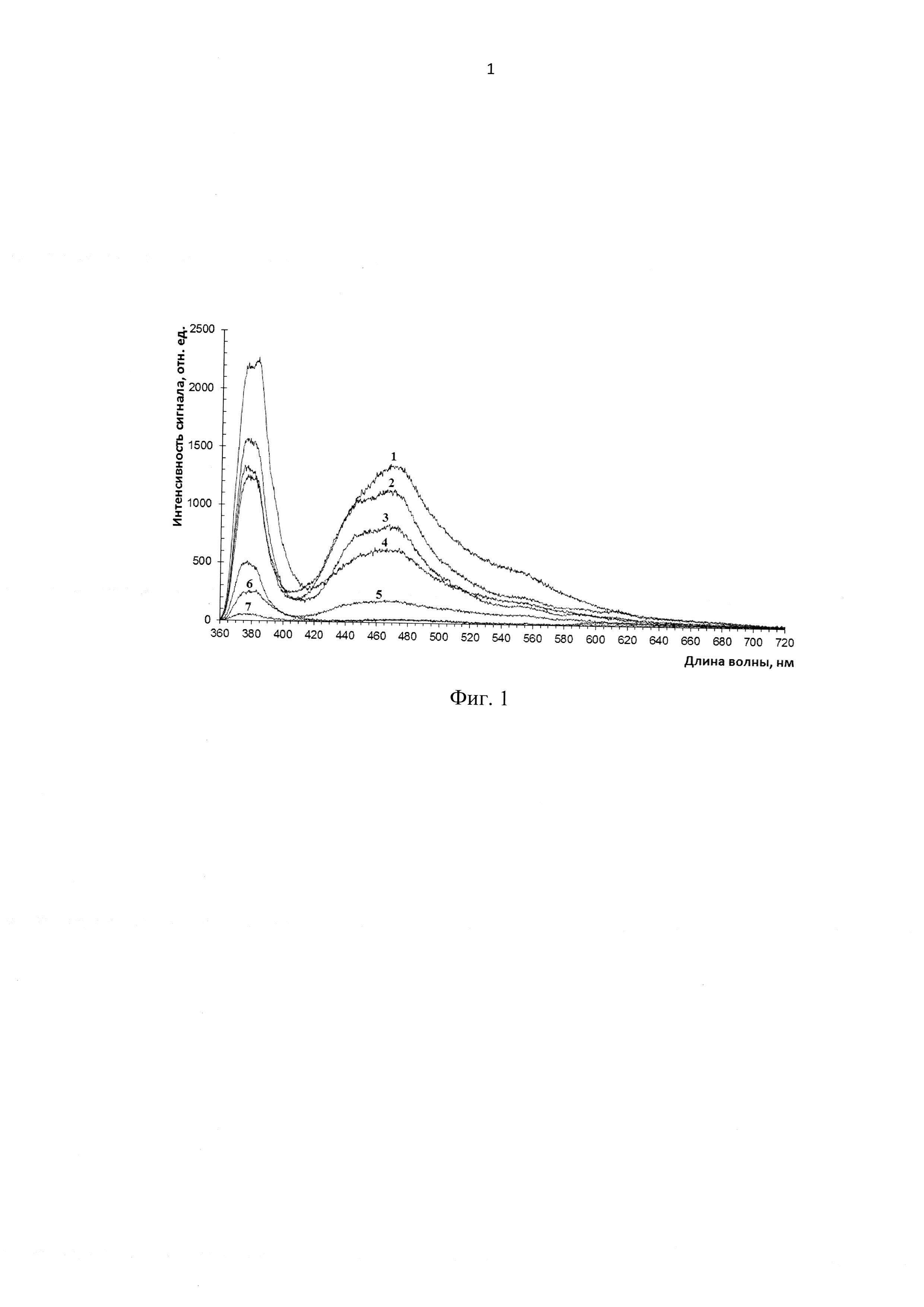
На Фиг. 1 изображены спектры флюоресценции различных типов тканей при возбуждении лазером длиной волны 365 нм. Цифрами обозначены следующие ткани: 1 - кожа, 2 - кость, 3 - надкостница, 4 - жировая ткань, 5 - соединительная ткань, 6 - мышечная ткань, 7 - костный мозг.
На Фиг. 2 представлен алгоритм классификации различных типов тканей по зарегистрированным спектрам флюоресценции на длине волны зондирующего лазерного источника 365 нм.
В предварительном исследовании нами были получены данные флюоресценции образцов разных типов тканей животных. Для этого был произведен забор тканей от экспериментальной беспородной свиньи. Иссеченные ткани для исследования поступали в течение суток после забоя животного. Линейные размеры экспериментальных кусочков тканей составляли около 1 см. Предварительно их промывали физраствором, помещали на фторопластовую подложку, перпендикулярно вплотную (без силового нажима) прикладывали оптоволоконный зонд, - и регистрировали спектры флюоресценции при возбуждении лазером длиной волны 365 нм. Полученные спектры флюоресценции представлены на Фиг. 1. где цифрами обозначены следующие ткани: 1 - кожа, 2 - кость, 3 - надкостница, 4 - жировая ткань, 5 - соединительная ткань, 6 - мышечная ткань, 7 - костный мозг.
Как видно из приведенного сопоставления полученных спектров флюоресценции разных типов тканей (см. Фиг. 1), их интенсивности сильно варьируют по амплитуде. Несмотря на нелинейный (по длинам волн) вклад этих факторов в поглощение излучения, нормировка на интенсивность регистрируемого обратно отраженного сигнала лазера, приводит сигналы тканей к взаимосопоставимому виду. Поэтому в предлагаемом способе определения биологической ткани сравнение спектров флюоресценции осуществляется при помощи соответствующих коэффициентов флюоресцентной контрастности K1, К2…Ki…Kn.
Таким образом, осуществление предлагаемого способа определения типа биологической ткани может быть проиллюстрировано для этого массива классов тканей в данной последовательности {кожа, костный мозг, надкостница, кость, мышца, жир, соединительная ткань} на следующих примерах.
Пример 1 - кожа.
Результаты исследования методом ЛФС представлены массивом интенсивностей флюоресценции {I1, I2…Ii…I133}, где i=1…n, n=133 в диапазоне от 420 до 720 нм с шагом 2,26 нм, подлежащим обработке на компьютере по предлагаемому способу. Получили массив коэффициентов флюоресцентной контрастности, состоящий из 133 значении {K1, К2…К133} по формуле K1,2,…,133 = I1,2,…,133(λ1,2,…,133)/(I1,2,…,133(λ1,2,…,133) + Imax), где Imax - максимальная интенсивность обратно рассеянного сигнала на исходной длине волны освещающего ткань лазерного излучения. При помощи метода главных компонент получены 4 главные компоненты (1=4) по формуле: {РС1, РС2, РС3, РС4}=А*{К1, K2…K133}={2.098, 0.744, -1.234, -1.146}, где А={ai*j}1×n, - матрица коэффициентов метода главных компонент, 1 - количество главных компонент, i*=1,2…1, 1=4, j=1,2…n. При помощи линейного дискриминантного анализа Фишера был вычислен массив дискриминантных функций размером m=7: {f1, f2…f7}=B*{2.098, 0.744, -1.234, -1.146}+{с1, с2…с7}={29.909, -41.344, -18.798, -37.772, -29.234, -5.867, -4.259} размером m, где m=7 - количество классифицируемых типов ткани {кожа, костный мозг, надкостница, кость, мышца, жир, соединительная ткань}, где В - матрица коэффициентов линейного дискриминантного анализа Фишера, {c1, с2…c7} - массив постоянных коэффициентов линейного дискриминантного анализа Фишера. И наконец, был вычислен массив вероятностей принадлежности обследуемого участка ткани к выше обозначенным семи классам ткани по формуле:
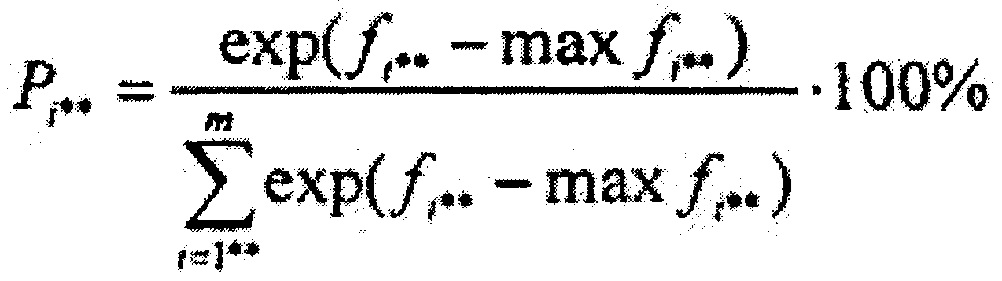
Пример 2 - мышца.
Результаты исследования методом ЛФС представлены массивом интенсивностей флюоресценции {I1, I2…Ii…I133}, где i=1…133, в диапазоне от 420 до 720 нм с шагом 2,26 нм, подлежащим обработке на компьютере по предлагаемому способу. Получили массив коэффициентов флюоресцентной контрастности, состоящий из 133 значений {K1, К2…К133} по формуле K1,2,…,133 = I1,2,…,133(λ1,2,…,133)/(I1,2,…,133(λ1,2,…,133) + Imax), где Imax - максимальная интенсивность обратно рассеянного сигнала на исходной длине волны освещающего ткань лазерного излучения. При помощи метода главных компонент получены 4 главные компоненты по формуле: {РС1, РС2, РС3, РС4}=А*{К1, K2…K133}={-1.140, -0.128, -0.898, -0.151}, где А={ai*j}1×n, - матрица коэффициентов метода главных компонент, 1 - количество главных компонент, i*=1,2…1, 1=4, j=1,2…n. При помощи линейного дискриминантного анализа Фишера был вычислен массив дискриминантных функций размером m=7: {f1, f2…f7}=B*{-1.140, -0.128, -0.898, -0.151}+{с1, с2…с7}={-40.220, -6.718, -19.544, -66.206, 13.080, 4.595, 7.901} размером m, где m=7 - количество классифицируемых типов ткани {кожа, костный мозг, надкостница, кость, мышца, жир, соединительная ткань}, где В - матрица коэффициентов линейного дискриминантного анализа Фишера, {c1, c2…c7} - массив постоянных коэффициентов линейного дискриминантного анализа Фишера. И, наконец, был вычислен массив вероятностей принадлежности обследуемого участка ткани к выше обозначенным семи классам ткани по формуле:
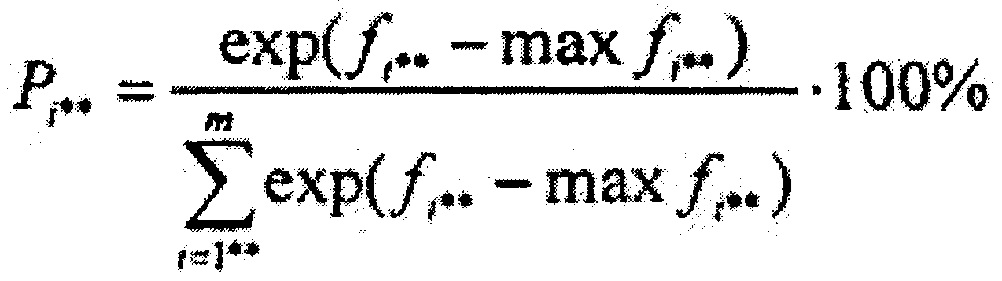
Пример 3 - соединительная ткань.
Результаты исследования методом ЛФС представлены массивом интенсивностей флюоресценции {I1, I2…Ii…I133}, где i=1…133, в диапазоне от 420 до 720 нм с шагом 2,26 нм, подлежащим обработке на компьютере по предлагаемому способу. Получили массив коэффициентов флюоресцентной контрастности, состоящий из 133 значений {K1, К2…К133} по формуле K1,2,…,133 = I1,2,…,133(λ1,2,…,133)/(I1,2,…,133(λ1,2,…,133) + Imax), где Imax - максимальная интенсивность обратно рассеянного сигнала на исходной длине волны освещающего ткань лазерного излучения. При помощи метода главных компонент получены 4 главные компоненты по формуле: {РС1, РС2, РС3, РС4}=А*{К1, K2…K133}={0.429, -0.061, -0.870, -0.493}, где А={ai*j}1×n, - матрица коэффициентов метода главных компонент, 1=4 - количество главных компонент, i*=1,2…1, j=1,2…n. При помощи линейного дискриминантного анализа Фишера был вычислен массив дискриминантных функций размером m=7: (f1, f2…f7}=B*{-1.140, -0.128, -0.898, -0.151}+{с1, с2…с7}={-7.621, -24.575, -17.228, -49.650, -9.856, -0.303, 1.348} размером m, где m=7 - количество классифицируемых типов ткани {кожа, костный мозг, надкостница, кость, мышца, жир, соединительная ткань}, где В - матрица коэффициентов линейного дискриминантного анализа Фишера, {c1, c2…c7} - массив постоянных коэффициентов линейного дискриминантного анализа Фишера. И, наконец, был вычислен массив вероятностей принадлежности обследуемого участка ткани к выше обозначенным семи классам ткани по формуле:
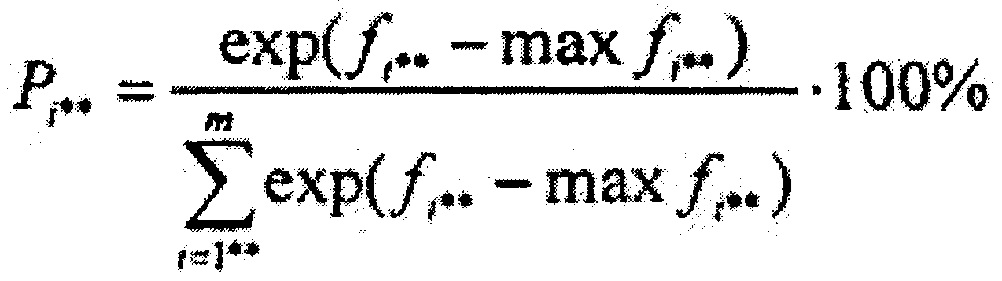
На основании вышеизложенного можно сделать вывод, что предложенный способ определения типа биологической ткани позволяет:
- распознавать различные типы биологических тканей,
- перейти на качественно новый уровень интерпретации, анализа и обработки данных ЛФС, когда в результате собранной информации по спектрам флюоресценции различных типов тканей оцениваются их различия в широком диапазоне длин волн, что существенно повышает точность и достоверность диагностики.
Таким образом, задачами, которые решаются предлагаемым способом, являются:
- повышение точности, достоверности и медицинской информативности диагностических процедур, которые будут обеспечиваться применением на практике данного способа;
- расширение функциональных возможностей диагностических процедур и обеспечение возможности использования заявляемых способа и устройства в различных областях медицины, таких как, например, регенеративная медицина и робото-ассистированная хирургия.
Реферат
Изобретение относится к медицине, а именно к медицинской технике, и предназначено для определения типа биологической ткани на основе метода лазерной флюоресцентной спектроскопии. Способ включает в себя проведение лазерной флюоресцентной спектроскопии при возбуждении флюоресценции лазерным излучением ультрафиолетового спектра и регистрацию вышедшего из ткани излучения флюоресценции с использованием дискриминантного анализа для обработки полученных данных. Возбуждение флюоресценции осуществляют на длине волны 365 нм. Запись спектров аутофлюоресценции производят в виде массива данных, состоящего из n значений интенсивности флюоресценции {I, I…I…I} для последовательности длин волн {λ, λ…λ…λ} в диапазоне от 420 до 720 нм. Для всего массива интенсивностей флюоресценции формируют массив коэффициентов флюоресцентной контрастности {K, K…K…K}, гдегде I- максимальная интенсивность обратно рассеянного сигнала на исходной длине волны освещающего ткань лазерного излучения. При помощи метода главных компонент формируют 1-мерный массив главных компонент {PC, PC…PC…PC}, который определяют как, где {a}- матрица коэффициентов метода главных компонент, где i*=1,2.…1, j=1,2.…n. Далее на основе линейного дискриминантного анализа Фишера вычисляют массив дискриминантных функций {f, f…f} размером m, где m - количество классифицируемых типов ткани - кожа, костный мозг, надкостница, кость, мышца, жир, соединительная ткань,определяющийся как, где {b}- матрица коэффициентов линейного дискриминантного анализа Фишера, где i**=1,2…m, j*=1,2…1, {c, c…c} - массив постоянных коэффициентов линейного дискриминантного анализа Фишера. Далее вычисляют массив вероятностей принадлежности обследуемого участка ткани к тому или иному классу типов ткани {P, P…P} размером m, где каждая из вероятностей относится к соответствующей классификации типа биологической ткани, по формуле, где P- вероятность принадлежности обследуемого участка ткани к классу i**, maxf- максимальное значение дискриминантной функции в массиве {f, f…f}. Далее находят максимальное значение вероятности из массива {P, P…P} и на его основе делают заключение о типе ткани, к которому принадлежит исследуемый участок. Изобретение обеспечивает повышение точности, достоверности и медицинской информативности диагностических процедур, а также расширение функциональных возможностей диагностических процедур. 2 ил., 3 пр.
Формула

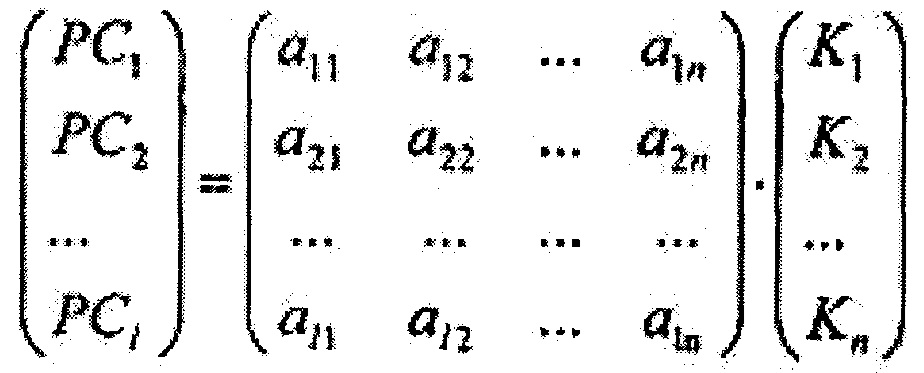
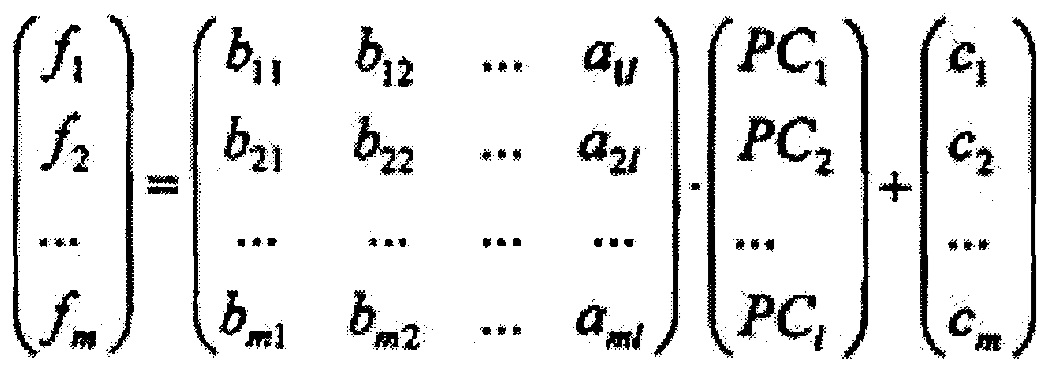
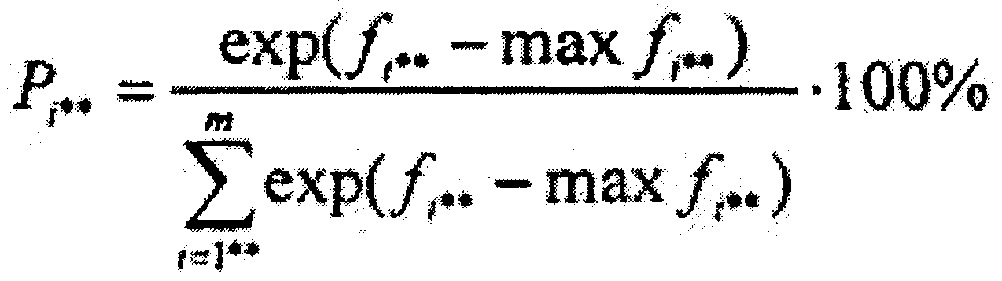

Комментарии