Применение n-ацетил-5-метокситриптамина или его аналогов для активации механизма имплантации эмбриона, а также соответствующие композиции и культуральные среды - RU2657601C2
Код документа: RU2657601C2
Чертежи



Описание
Настоящее изобретение относится к применению N-ацетил-5-метокситриптамина (мелатонина) и/или его аналога в области медицины или ветеринарии при вспомогательной репродукции, для активации/стимуляции механизма имплантации эмбриона, и в частности, для профилактики неудачи имплантации эмбриона в матку, путем местного применения эффективного количества у самки млекопитающего, нуждающейся в таком лечении; и к соответствующим композициям, культуральным средам и медицинским устройствам.
Имплантация человеческого эмбриона в матку является сложным механизмом, в котором участвует как эмбрион, так и эндометриальный эпителий. Фазы апоптоза, адгезии и инвазии вовлекают множество молекул, которые играют уникальную роль в указанном процессе; молекулярный диалог между оплодотворенной яйцеклеткой и эндометрием включает взаимодействия между клетками, и между клетками и биохимическими факторами.
Эти механизмы, если они экспрессируются или ингибируются надлежащим образом, позволяют определить восприимчивое или невосприимчивое состояние эндометрия к эмбриону.
Состояние восприимчивости или невосприимчивости эндометрия, хотя и является общепринятой концепцией, клинически трудно определимо: гистологически нормальное состояние эндометрия не обязательно означает функционально нормальное состояние; с другой стороны, временная и пространственная экспрессия конкретных структур эндометрия, а именно пиноподов, является выраженным показателем восприимчивого состояния как такового.
Имплантация является сложной последовательностью сигналов, которые являются ключевыми для начала беременности; предполагается, что большое число молекулярных медиаторов под влиянием сигналов яичников вовлекается во взаимодействие эмбриона и эндометрия. Эти медиаторы включают широкий диапазон молекул, таких как гормоны, цитокины, факторы роста, липиды, молекулы адгезии и тому подобное (1).
Неудачный исход имплантации в медицинских технологиях вспомогательной репродукции (MAR) все еще остается нерешенной проблемой, и считается одной из главных причин бесплодия у здоровых женщин. Считается, что процент имплантации в методиках MAR составляет примерно 25%, неадекватная восприимчивость матки считается причиной примерно двух третей всех неудач имплантации (ответственность за неудачи в одной трети случаев лежит, как считается, на эмбрионе) (2).
Эндометрий восприимчив к инвазии бластоцисты в ограниченном диапазоне времени, определяемом как «окно имплантации». «Диалог» для синхронизации между «овуляцией - первыми фазами роста эмбриона - клеточными модификациями эндометриального эпителия для имплантации» поддерживается сериями гормональных и биохимических мессенджеров.
Во время «окна имплантации» эндометриальный эпителий экспрессирует, при гормональном и биохимическом контроле, некоторые структуры, именуемые пиноподами, способные обеспечивать адгезию и инвазию бластоцисты.
Окно имплантации может быть охарактеризовано, в соответствии с исследованиями с помощью электронной микроскопии (3), по максимальной экспрессивности пиноподов.
Образование пиноподов считается специфическим маркером восприимчивости эндометрия, оно отмечается спустя примерно одну неделю после овуляции, но полная экспрессия варьирует у разных пациенток, и как кажется, сохраняется только в течение одних суток (4).
Экспрессия пиноподов прямо пропорциональна повышению уровня прогестерона в плазме (5).
Концепция восприимчивости эндометрия или «окна имплантации», связанной с экспрессией пиноподов, единогласно принятая в научном сообществе, в течение нескольких десятилетий является предметом исследований для тех, кто сталкивается с проблемами, связанными с искусственным оплодотворением.
Таким образом, прогестерон, гормон начала беременности, является главным медиатором, с ним связано множество других медиаторов, которые могут способствовать реализации имплантации.
Из вышесказанного ясно, что проблема достижения беременности посредством технологий вспомогательной репродукции в основном обусловлена недостаточными знаниями, относящимися к феномену имплантации.
Таким образом, также с учетом многочисленных законодательных ограничений в области искусственного оплодотворения, становится ясной необходимость оптимизации фазы имплантации.
Авторы настоящего изобретения установили, что одним из медиаторов, способных играть ключевую роль вместе с прогестероном в экспрессии пиноподов с наибольшим положительным влиянием на имплантацию эмбриона, является N-ацетил-5-метокситриптамин (мелатонин).
Мелатонин продуцируется шишковидной, нейроэндокринной железой, контролируемой светом; отсутствие света стимулирует его синтез и секрецию.
Применение мелатонина не вызывает побочных эффектов или проблем передозировки, а также в литературе не сообщалось о противопоказаниях (6).
Также известно множество преимуществ, связанных с применением мелатонина в различных процессах, которые оказывают положительное влияние на имплантацию. В связи с этим, также существует обратно пропорциональная взаимосвязь между риском карциномы эндометрия и сывороточными уровнями мелатонина с установленным защитным действием.
Некоторыми авторами (7) было показано, что мелатонин ингибирует пролиферацию атипичных клеток эндометрия, обозначаемых как клетки Исикавы, ответственных за карциному эндометрия. С помощью экспериментов с радиолигандами и антагонистами мелатонина, такими как люзиндол, результаты группы исследователей показали, что ингибирующий эффект вызывается мелатонином посредством МТ2 рецепторов, присутствующих на мембранах пролиферирующих клеток Исикавы.
Другим определяющим аспектом является менопаузальный период, во время которого снижается продукция мелатонина, и действительно, в такой период повышается риск карциномы эндометрия.
Например, исследования in vitro и in vivo (6, 8) показали сильный антиоксидантный эффект мелатонина, где указанный эффект был выше эффекта маннитола, глутатиона и витамина Е при защите от окислительного повреждения, вызванного токсичными гидроксильными радикалами и другими продуктами клеточного катаболизма, возникающими при различных вариантах дегенеративного или пролиферативного метаболизма и при окислении липидов.
Мелатонин (9-10) обладает к тому же важными антиэстрогенными свойствами и стимулирует продукцию прогестерона, который оказывает влияние, противоположное эффекту эстрогенов как таковых (высокие уровни эстрогенов связаны с худшим результатом в технологиях вспомогательной репродукции) (11).
В связи с этим указано, что суперовуляция посредством гонадотропинов, индуцированная в циклах MAR, определяет гиперэстрогенизацию с повышением гиперплазии эндометрия, являясь важным фактором риска карциномы эндометрия, как упоминалось выше.
Некоторые авторы (12) утверждают, что существует синергизм между хорионическим гонадотропином человека (ХГЧ) и мелатонином: действительно, уровень мелатонина увеличивается, среди прочего, путем повышения продукции прогестерона (как in vivo, так и in vitro), спустя 6-7 суток после овуляторного пика ХГЧ.
В связи с этим, особо отмечалось, что после овуляции пик уровня мелатонина прекрасно совпадает с эндометриальным окном имплантации и с формированием бластоцисты (стадией роста эмбриона, при которой происходит встраивание в матку). Положительная корреляция между мелатонином и прогестероном и отрицательная корреляция между мелатонином и эстрадиолом может быть увеличена посредством ХГЧ: действительно, при отсутствии последнего мелатонин оказывает очень слабое влияние на продукцию прогестерона.
Объектом настоящего изобретения является N-ацетил-5-метокситриптамин или его аналог для применения в области медицины или ветеринарии во вспомогательной репродукции для предотвращения неудачи имплантации в матку путем местного применения эффективного количества у самки млекопитающего, нуждающейся в таком лечении.
Предпочтительно, указанный аналог N-ацетил-5-метокситриптамина выбран из агомелатина, 6-гидроксимелатонина, серотонина, 5-гидрокситриптофана, или их производных.
В предпочтительном варианте осуществления настоящего изобретения самкой млекопитающего является женщина, страдающая бесплодием или у которой было множество выкидышей.
В соответствии с другим предпочтительным вариантом осуществления, местное применение N-ацетил-5-метокситриптамина или его аналога, предпочтительно N-ацетил-5-метокситриптамина, осуществляют путем орошения эндометрия, или промывания матки, или промывания эндометрия.
В соответствии с другим предпочтительным вариантом осуществления, указанное местное применение осуществляют в виде единственного применения во время извлечения яйцеклеток.
Предпочтительно, указанное активное действующее вещество присутствует в диапазоне концентрации от 4×10-9 г/мл до 25×10-9 г/мл, еще более предпочтительно, большей или равной 10×10-9 г/мл.
В альтернативном варианте осуществления возможно параллельное применение системного лечения на основе N-ацетил-5-метокситриптамина, ХГЧ или прогестерона, или их комбинации, со дня извлечения яйцеклеток.
В альтернативных вариантах осуществления настоящего изобретения методики вспомогательной репродукции выбраны из группы, состоящей из основных методик или методик 1 уровня, простых и не слишком инвазивных, таких как запланированное сношение или искусственное внутриматочное оплодотворение; и методик II или III уровня, которые являются более сложными и инвазивными, выбранных из оплодотворения in vitro (IVF), оплодотворения in vitro с пересадкой эмбриона (FIVET), интрацитоплазматической инъекции сперматозоида (ICSI), интрацитоплазматической инъекции морфологически отобранного сперматозоида (IMSI), и методик Tese-Tesa (аспирации-экстракции сперматозоидов из ткани яичка).
Искусственное оплодотворение остается в основном методикой внутриматочного оплодотворения (IUI), которая является медицинской методикой вспомогательной репродукции, где семенную жидкость вводят в полость матки. Можно предположить, что во всех случаях несовместимости между слизистой оболочкой шейки матки и семенной жидкостью, она позволяет выходить за длину шейки матки и вводит сперматозоиды непосредственно в матку. Кроме того, она используется в случае необъяснимого бесплодия, мужского бесплодия легкой или средней степени, в случаях неоднократных неудач стимуляции беременности со стимуляцией овуляции и целенаправленным сношением, и в случаях сексуальных расстройств, не позволяющих завершить половой акт.
Оплодотворение in vitro с пересадкой эмбриона (FIVET) является методикой MAR, при которой извлекают половые клетки человека, помещают в культуру, и после оплодотворения и получения одного или нескольких эмбрионов их переносят в матку. Эта методика предлагается в случаях:
- приобретенной или врожденной патологии маточных труб;
- мужского бесплодия средней степени;
- эндометриоза III или IV уровня;
- бесплодия неустановленной этиологии;
- криосохраненной спермы, в зависимости от качества спермы, после оттаивания;
- безуспешности терапевтической процедуры из методик I уровня.
После стимуляции яичников проводят извлечение яйцеклеток (PICK-UP) посредством трансвагинальной операции, под эхографическим контролем, при местной анестезии и/или глубокой седации, осуществляют приготовление спермы и выбирают яйцеклетки для оплодотворения. Затем готовят экстракорпоральную культуру гамет, и после проверки осуществленного оплодотворения выполняют перенос в матку определенного количества эмбрионов.
При микроинъекции сперматозоида в цитоплазму яйцеклетки (ICSI) используются различные этапы FIVET. В этом случае оплодотворение также является экстракорпоральным, но осуществляется путем инъекции единственного сперматозоида в цитоплазму яйцеклетки. Затем, после оплодотворения, эмбрион переносят в матку.
Эта методика предлагается в случаях:
- мужского бесплодия тяжелой степени;
- окклюзионной и секреторной азооспермии (тестикулярных сперматозоидов или придатков яичка);
- нарушенной или сниженной фертилизации в предыдущих циклах оплодотворения in vitro (IVF);
- оттаявших яйцеклеток;
- снижения числа яйцеклеток;
- криосохраненной спермы, в зависимости от качества спермы, после оттаивания.
Также эту методику можно проводить при спонтанном цикле или при индукции роста множества фолликулов и после стимуляции яичников для получения большего числа фолликулов, и для получения, таким образом, большего числа яйцеклеток; извлечение яйцеклеток (PICK-UP) проводят путем трансвагинальной операции. Одновременно с PICK-UP осуществляют подготовку спермы. В случае азооспермии для извлечения сперматозоидов используют методики: чрескожной аспирации сперматозоидов из яичка (TESA), экстракции сперматозоидов из яичка (TESE), микрохирургической аспирации сперматозоидов из придатков яичка (MESA), чрескожной аспирации сперматозоидов из придатков яичка (PESA).
Затем проводят подготовку яйцеклетки и оплодотворение яйцеклетки посредством методики микроинъекции отдельных сперматозоидов в цитоплазму. После подтверждения оплодотворения в каждой яйцеклетке, эмбрионы переносят в матку.
Другим объектом настоящего изобретения является композиция, пригодная для местного применения, включающая N-ацетил-5-метокситриптамин или его аналог, или их комбинацию, в качестве активного ингредиента, в эффективном количестве у самки млекопитающего, нуждающейся в таком лечении, вместе с одним или несколькими физиологически пригодными носителями или адъювантами для применения в области медицины или ветеринарии при вспомогательной репродукции для предотвращения неудачи имплантации в матку.
Предпочтительно, активный ингредиент присутствует в композиции в диапазоне концентрации от 4×10-9 г/мл до 25×10-9 г/мл, предпочтительно равной или больше 10×10-9 г/л.
В соответствии с предпочтительным вариантом осуществления, активный ингредиент в вышеупомянутой композиции готовят для орошения/промывания эндометрия/матки в культуральной среде для культивирования клеток в итоговой концентрации в диапазоне от 4×10-9 г/мл до 25×10-9 г/мл, предпочтительно равной или большей 10×10-9 г/л.
Таким образом, культуральная среда для культивирования бластоцисты может предпочтительно включать следующие компоненты:
- источник D-глюкозы;
- антибиотик, предпочтительно гентамицин;
- сывороточный альбумин человека;
- незаменимые и заменимые аминокислоты, предпочтительно L-таурин;
- буферные соли, предпочтительно выбранные из:
- солей кальция: лактата кальция, пантотената кальция;
- солей натрия: хлорида натрия, бикарбоната натрия и пирувата натрия;
- солей калия: хлорида калия, фосфата калия;
- солей магния: хлорида магния, сульфата магния
и их смесей;
- воду;
и имеет рН от 7,5 до 7,8.
В соответствии с предпочтительным вариантом осуществления, указанной культуральной средой может быть культуральная среда Sydney IVF ® для культивирования бластоцисты.
В соответствии с альтернативным вариантом осуществления настоящего изобретения, активный ингредиент из вышеупомянутой композиции приготовлен для орошения эндометрия, промывания эндометрия или промывания матки в физиологическом растворе в итоговой концентрации в диапазоне от 4×10-9 г/мл до 25×10-9 г/мл, предпочтительно большей или равной 10×10-9 г/л.
У женщин процедуру промывания полости матки обычно применяют с основной задачей для установки неинвазивного пренатального диагноза, инновационной по сравнению с инвазивными традиционными способами амниоцентеза и отбора ворсинок хориона ((13), (14)). В последние годы такую методику применяли для оценки состояния полости матки перед переносом эмбриона в циклах вспомогательной репродукции. Применение этой процедуры заключается во введении в матку буферного раствора с целью сбора секретируемых жидкостей матки и оценки их органических и неорганических биологических компонентов. Ее целью является идентификация возможных маркеров, прогностических для успеха имплантации ((15), (16), (17), (18)).
Еще более предпочтительно, указанная композиция, пригодная для местного применения посредством промывания матки, включает незаменимые и заменимые аминокислоты, и буферные соли. Предпочтительно, указанные буферные соли являются солями кальция, натрия, калия и магния, и их смесями. Применение буферных солей и аминокислот обеспечивают для получения рецептуры с рН от 7 до 8 (предпочтительно, 7,5-7,8), для воспроизведения микроокружения, пригодного для эмбриона (и подобного культуральной среде, в которой растет эмбрион перед переносом в матку).
В соответствии с альтернативным вариантом осуществления, композиции согласно настоящему изобретению могут быть приготовлены в виде геля, пригодного для внутриматочного введения, в частности, для применения in situ в полости матки, предпочтительно, с медицинским устройством, являющимся внутриматочным устройством «Т-формы». Также могут быть предложены гелевые рецептуры для контролируемого высвобождения для мукозального применения.
С учетом того, что методика промывания матки, описанная выше, как установлено, является неинвазивной практикой и обеспечивает восстановление физиологических условий в матке посредством механического извлечения секретов, что может изменять условия имплантации, другим объектом настоящего изобретения является медицинское устройство для промывания матки, включающее стерильный контейнер, предварительно заполненный или предназначенный для заполнения композицией, указанной выше.
В частности, устройство согласно настоящему изобретению может быть заполнено к моменту применения стерильным раствором, пригодным для промывания матки или эндометрия, с добавлением активного ингредиента мелатонина или его аналога, в соответствии настоящим изобретением, уже сформированным, или оно может быть заполнено таким стерильным раствором, дополненным активным ингредиентом непосредственно в момент применения.
В соответствии с предпочтительным вариантом осуществления стерильный контейнер является одноразовым. Более предпочтительно, стерильный контейнер (предпочтительно, одноразовый стерильный контейнер) предварительно заполнен физиологическим раствором с добавлением мелатонина (в диапазоне концентраций от 4×10-9 г/мл до 25×10-9 г/мл, предпочтительно большей или равной 10×10-9 г/л), буферных солей и аминокислот, с получением рецептуры с рН от 7 до 8, предпочтительно 7,5-7,8.
Промывание матки проводят с применением катетера после забора с помощью эхографического проводника. Последующий перенос или имплантацию эмбриона осуществляют в среднем спустя трое суток после промывания (2-5 суток).
Таким образом, в соответствии с предпочтительными вариантами осуществления, медицинское устройство согласно настоящему изобретению может дополнительно включать стерильный гибкий катетер, предпочтительно с единственным концевым отверстием.
Стерильность компонентов медицинского устройства достигается предпочтительно посредством стерильного заполнения или итоговой стерилизации, такой как тепловая обработка или обработка гамма-облучением.
Кроме того, медицинское устройство может сопровождаться инструкциями по применению в различных методиках MAR.
Задачей медицинского устройства является удаление окислительных веществ и возможных секретируемых продуктов в ответ на стимуляцию, предшествующую методикам MAR, и таким образом, восстановление физиологического состава эндометриального экссудата. Задачей является устранение таких окислительных веществ и секретируемых продуктов, снижающих процент имплантации у пациентов, подвергающихся MAR. Как предполагалось выше, применение буферных солей и аминокислот обеспечивается для установки рН 7-8, предпочтительно от 7,5 до 7,8, для воспроизведения микроокружения, пригодного для эмбриона. Добавление мелатонина, в дополнение к эффектам, показанным в настоящем изобретении, обеспечивает очень сильный антиоксидантный эффект и защитное действие в отношении клеток эндометрия, против окислительного повреждения, обусловленного токсичными радикалами и другими продуктами катаболизма.
Предпочтительно, указанный одноразовый стерильный контейнер выбран из шприца, дозатора, картриджа для самоинъекции/шприца-ручки.
В соответствии с особо предпочтительными вариантами осуществления изобретения, шприц является шприцем люэровского типа объемом 3 мл, изготовленным из поликарбоната или боросиликатного стекла. Когда используется шприц люэровского типа, внутриматочный катетер, по возможности связанный с медицинским устройством согласно настоящему изобретению, обеспечивается с розеточным соединителем люэровского типа для сцепления со шприцем.
В качестве альтернативы, если применяется система самоинъекции или шприц-ручка (инсулинового типа), можно применять стеклянный картридж 3 мл из боросиликатного стекла.
Также предпочтительно, чтобы указанный одноразовый стерильный контейнер был предварительно заполнен объемом 1,5 мл промывающего раствора, содержащего:
- 10×10-9 г/мл (10 нг/мл) мелатонина,
- незаменимые и заменимые аминокислоты,
- соли кальция,
- соли калия,
- соли магния,
с рН 7,5-7,8, и осмолярностью 280-290 мОсм/кг.
Целью настоящего изобретения также является предоставление медицинского устройства, описанного выше, для использования с целью единственного применения для промывания эндометрия к моменту извлечения яйцеклетки в протоколах медицинской вспомогательной репродукции.
Настоящее изобретение также относится к культуральной среде для культивирования клеток in vitro или in vivo, включающей следующие компоненты:
- источник D-глюкозы;
- антибиотик, предпочтительно гентамицин;
- сывороточный альбумин человека;
- незаменимые и заменимые аминокислоты, предпочтительно L-таурин;
- соли кальция: лактат кальция, пантотенат кальция;
- соли натрия: хлорид натрия, бикарбонат натрия и пируват натрия;
- соли калия: хлорид калия, фосфат калия;
- соли магния: хлорид магния, сульфат магния;
- воду;
характеризующейся тем, что она дополнительно содержит N-ацетил-5-метокситриптамин или его аналог, или их комбинацию, где указанный активный ингредиент присутствует в диапазоне концентрации от 4×10-9 г/мл до 25×10-9 г/мл, предпочтительно, большей или равной 10×10-9 г/л.
Другой целью настоящего изобретения является предоставление культуральной среды для культивирования клеток для увеличения пиноподов и достижения модели изучения in vitro.
Такую культуральную среду для культивирования клеток можно также применять для эмбриональных культур путем получения, например, культуральной среды, используемой для переноса эмбриона в матку, когда указанную среду вводят в матку.
Особо предпочтительные аспекты применения в соответствии с настоящим изобретением связаны с предполагаемым способом местного применения, не нарушающим цикл лечения MAR, где такой способ является менее инвазивным, чем биопсия эндометрия, уже применяющаяся у женщины, подвергающейся циклу MAR (13).
Наконец, благодаря свойствам ингибирования синтеза простагландинов (14), что типично для мелатонина, это промывание снижает сокращение матки и дополнительно стимулирует имплантацию.
Настоящее изобретение далее описано с целью иллюстрации, но не для ограничения, в соответствии с двумя предпочтительными вариантами осуществления, с конкретной ссылкой на прилагаемые фигуры, на которых:
- Фигура 1 иллюстрирует эндометрий перед лечением посредством композиции согласно настоящему изобретению, следовательно, при отсутствии пиноподов;
- Фигура 2 иллюстрирует эндометрий спустя 1-2 суток после лечения композицией согласно настоящему изобретению: начинает проявляться образование пиноподов;
- Фигура 3 иллюстрирует эндометрий спустя 3-4 суток после лечения композицией согласно настоящему изобретению: отмечается максимальный рост пиноподов;
Фигура 4 иллюстрирует эндометрий спустя 5-6 суток после лечения композицией согласно настоящему изобретению: начинается разрушение пиноподов, которые становятся нерегулярными (клеточный апоптоз);
- Фигура 5 демонстрирует результаты анализа FACS (определения интенсивности флюоресценции) антиоксидантной активности мелатонина, агомелатина и 6-гидроксимелатонина (170 нМ соответствует 40×10-9 г/мл), проводимого при концентрациях Н2О2 20 мкМ и 200 мкМ;
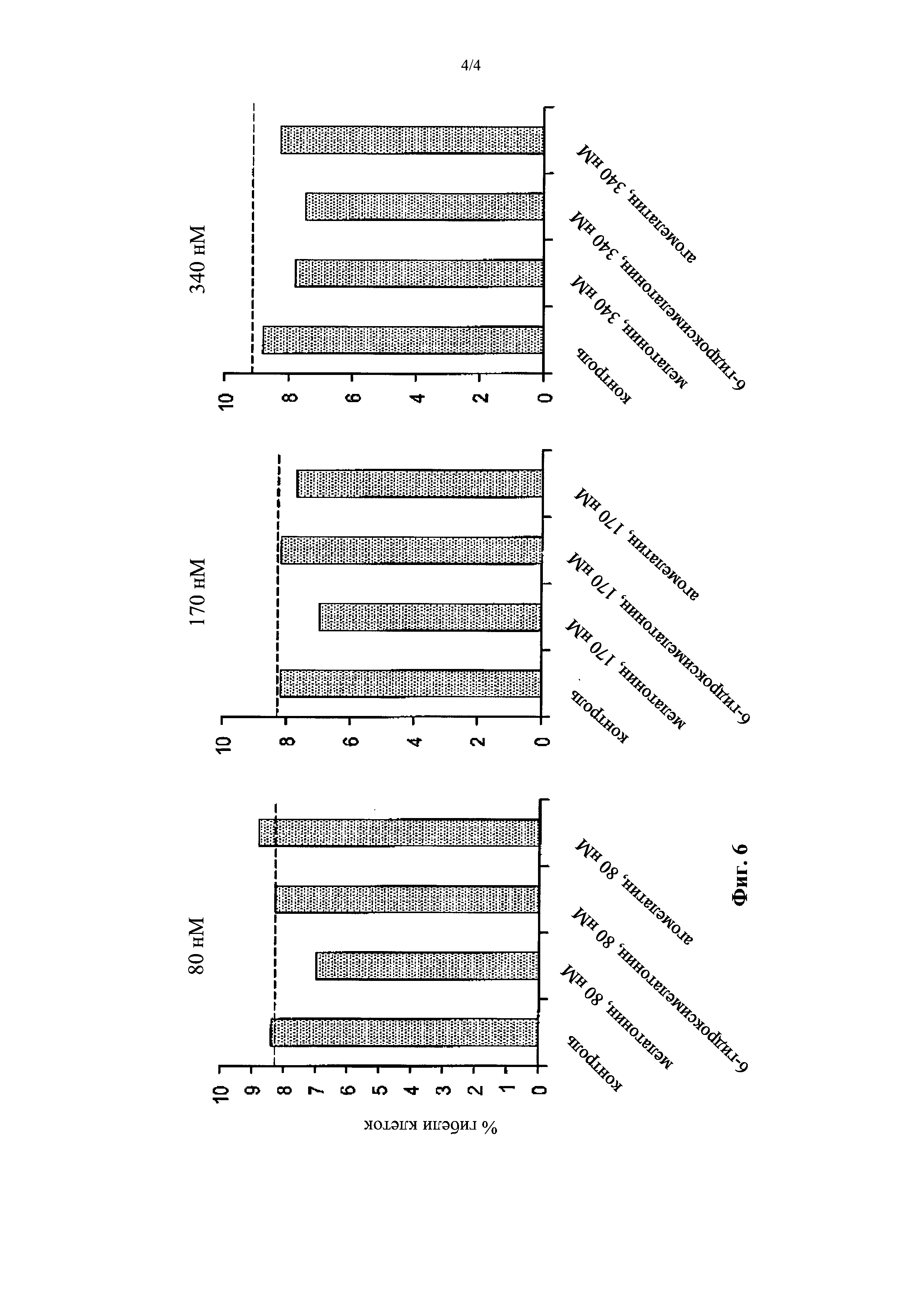
- Фигура 6 демонстрирует результаты анализа апоптоза (% клеточной гибели), проводимого при различных концентрациях (80 нМ, 170 нМ, 340 нМ; соответствующих 18×10-9 г/мл, 40×10-9 г/мл, 80×10-9 г/мл) мелатонина, агомелатина и 6-гидроксимелатонина.
Для примера, но не с целью ограничения настоящего изобретения, далее приведены результаты сравнительных исследований, проведенных (in vitro и in vivo) авторами настоящего изобретения для оценки процентного повышения имплантации эмбриона человека в методиках MAR посредством применения мелатонина в различных растворах.
Пример 1. Исследования in vivo
Материалы и методы
Растворы мелатонина, использованные для промывания эндометрия
Мелатонин (или N-ацетил-5-метокситриптамин; CAS №73-31-4) был получен от Farmalabor в виде продукта в форме порошка со степенью чистоты ≥99%.
Проводили два клинических испытания с применением мелатонина (концентрация 10×10-9 г/мл) посредством промывания эндометрия в:
1) культуральной среде Sydney IVF® для культивирования бластоцисты (клиническое испытание 1), поставляемой Cook Ireland Ltd (№ по каталогу G20722 и G20929). Указанную культуральную среду обычно применяют для улучшения расщепления, дифференцировки и экспансии бластоцисты in vitro. Среда содержит D-глюкозу, все 20 незаменимых L-аминокислот, L-таурин, гентамицин, сывороточный альбумин человека, лактат кальция, пантотенат кальция; хлорид натрия, бикарбонат натрия и пируват натрия; хлорид калия, фосфат калия; хлорид магния, сульфат магния; очищенную воду. Дополнительные характеристики указанной культуральной среды:
- рН: 7,5-7,8 (применение бикарбонатного буферного раствора)
- Осмолярность: 280-290 мОсм/кг
- Эндотоксины: <0,4 ЭЕд/мл
- МЕА: ≥80%.
2) физиологический раствор (Клиническое испытание 2).
Статистический анализ
Был проведен статистический анализ (IMPRUN.TXT) линейной регрессии с большим числом переменных.
Статистические методы:
Роль числа имплантированных эмбрионов, их качества и процесса промывания с раствором, содержащим мелатонин, в повышении вероятности беременности, подсчитывали посредством безусловной логистической регрессии с поправкой на возраст матери.
Отношение между вероятностью беременности, связанной с каждой процедурой (числом эмбрионов, их качеством и применением процесса промывания солевым раствором или средой для бластоцисты, содержащей мелатонин), и вероятностью беременности с низшей категорией числа эмбрионов, с качеством ниже оптимального для имплантированных эмбрионов, или при отсутствии процесса промывания определяли как отношение шансов (ОШ), и подсчитывали посредством безусловной логистической регрессии с поправкой на возраст матери.
При логистической регрессии отношение шансов ОШ соответствует антилогарифму на натуральном основании коэффициента регрессии β, связанного с каждой независимой переменной в регрессионной модели.
Таким образом, рассчитанное значение выражает преимущество, полученное в каждой процедуре, независимо от других условий.
Двухсторонний доверительный интервал при 95% (ДИ 95%) ОШ рассчитывали по формуле Вальда (eβ±(zα/2×seβ)).
Контроль стерильности (культуральная среда)
Для выполнения контроля стерильности культуральной среды с добавлением мелатонина использовали устройство ВАСТ/ALERT 3D-60 (BIOMERIEUX). Флаконы с культурой Bact/ALERT применяли в системах детекции микроорганизмов в количественных процедурах для извлечения и детекции факультативных анаэробных и аэробных бактерий в крови и других жидкостях, обычно стерильных, в качестве среды для бластоцисты, используемой в настоящих экспериментах.
Систему Bact/ALERT для детекции микроорганизмов использовали, чтобы определить, присутствуют ли микроорганизмы в образцах крови или других жидкостей, обычно стерильных, в качестве среды для бластоцисты, используемой в настоящем изобретении, с ожидаемой бактериемией. Система Bact/ALERT и флаконы для культивирования обеспечивают систему детекции микроорганизмов и культуральную среду с экологическими и питательными условиями, пригодными для микроорганизмов, обычно присутствующих при инфекциях крови и других жидкостей, стерильных в нормальных условиях.
Инокулированные флаконы (с минимальным количеством исследуемого образца 5 мл, максимальным - 10 мл) инкубировали в устройстве, где их подвергали постоянному контролю для выявления возможного роста микроорганизмов во флаконах Bact/ALERT.
Система Bact/ALERT для детекции микроорганизмов использует колориметрический датчик и отраженный свет для контроля наличия и продукции диоксида углерода (СО2), растворенного в культуральной среде.
Микроорганизмы, вероятно присутствующие в образце, метаболизируют субстраты в культуральной среде, вырабатывая углекислый газ. Продукция СО2, определяемая ростом микроорганизмов, индуцирует изменение цвета газопроницаемого датчика с зелено-синего на желтый.
Более светлый цвет указывает на повышение единиц контролируемого отражения системы.
Отражение флакона контролировалось и визуализировалось устройством каждые 10 минут.
Культуральные флаконы классифицировались как положительные или отрицательные контрольным программным обеспечением системы детекции микроорганизмов Bact/ALERT спустя 6 суток инкубации.
Не было необходимости в каком-либо вмешательстве до момента, когда устройство Bact/ALERT сообщало, что флакон с культурой является положительным или отрицательным.
Перед проведением тестов культур для орошения эндометрия выполняли анализ стерильности на 2-4-6 сутки, и когда устанавливали, что культура является отрицательной, ее вводили в матку.
Критерии включения
Критерии ограничения для включения, используемые при выборе популяции пациенток, участвующих в исследованиях:
1) возраст от ≥20 до <44 лет;
2) индекс массы тела (ИМТ) от ≥20 до ≤28 кг/м2;
3) Базальный уровень фолликулостимулирующего гормона ≤19 Ед/л
4) Факторы бесплодия мужчин и женщин
Пациентки
Пациентки, участвующие в двух клинических испытаниях, после получения информированного согласия, были подвергнуты вспомогательной репродукции.
В первом рандомизированном многоцентровом клиническом исследовании на двух группах (группе сравнения и опытной группе) участвовало примерно 430 пациенток на группу.
Пациенток, подвергающихся искусственному оплодотворению, произвольно распределяли в день, когда извлекали яйцеклетки, на три группы:
Группа А: 430 пациенток для процедуры орошения эндометрия с 1,5 мл физиологического раствора (контроль).
Группа В: 436 пациенток для процедуры орошения эндометрия с 1,5 мл раствора культуральной среды с добавлением мелатонина в итоговой концентрации 10×10-9 г/мл.
Группа С: пациентки, не подвергавшиеся орошению эндометрия.
Исследование проводили с участием пациенток в нескольких частных центрах, специализирующихся на MAR, таких как Центр BRA, Promea Center в Торино и Каглиари, Genera Center из Перуджи, и поликлинический общественный центр в Бари. В эти центры отправляли культуральную среду с добавлением мелатонина после проведения тестов стерильности в соответствии с протоколом лечения.
После подготовки in vivo для искусственного оплодотворения путем орошения эндометрия с известной концентрацией мелатонина (итоговая концентрация 10×10-9 г/мл) ко времени извлечения яйцеклеток, пациенток подвергали связанной ультразвуковой визуализации диаметра жидкого слоя, образующегося на дне матки.
Второе клиническое испытание с одним перспективным центром включало 64 пациентки в группе сравнения и 92 пациентки в опытной группе.
В указанном исследовании мелатонин применяли в стерильном физиологическом растворе, посредством промывания эндометрия в полости матки пациенток, после извлечения яйцеклеток.
Промывание эндометрия
Вкратце, лечение заключалось в промывании эндометрия в полости матки без каких-либо клеток в совместной культуре, с применением физиологического раствора или культуральной среды с добавлением мелатонина в итоговой концентрации 10×10-9 г/мл (предшествующие исследования проводили с одной третью и половиной от итоговой концентрации, затем сохраняли с получением одних и тех же результатов - данные не показаны).
После извлечения яйцеклеток (время, соответствующее овуляции после применения ХГЧ в протоколе MAR) после установления контролируемого вагинального гемостаза, соединяли стерильный шприц на 2,5 мл с однополостным внутриматочным катетером с апикальным отверстием, и заполняли культуральной средой (средой для бластоцисты) или физиологическим раствором, модифицированными добавлением мелатонина до объема 1,5 мл.
В случае физиологического раствора катетер предварительно заполняли физиологическим раствором с добавлением мелатонина.
Катетер вводили в полость матки с теми же самыми этапами, которые оператор выполняет при обычном переносе эмбриона (ПЭ).
Затем медленно вводили солевой раствор с добавлением мелатонина или модифицированной среды, и в конце орошения измеряли толщину внутриполостного жидкого слоя путем трансабдоминальной эхографии (промывание и эхография должны быть одновременными, жидкий слой формируется толщиной примерно 10 мм, а затем быстро исчезает).
Результаты
Клиническое испытание 1
В многоцентровом исследовании in vivo участвовали 863 пациентки, подвергавшиеся искусственному оплодотворению и орошению эндометрия (эхографическому анализу жидкого слоя) с мелатонином, и спустя 3-4 дня после этого, подвергавшиеся переносу эмбриона.
Для последних рассчитывали ДИ (доверительный интервал) посредством статистического анализа (IMPRUN.TXT) линейной регрессии с несколькими переменными с 95%.
Одновариантный анализ показал, что имплантация 3 эмбрионов обеспечивала существенное повышение, примерно в 3 раза (ОШ=2,8; ДИ 95% 1,7-4,4), вероятности беременности.
При этом имплантация двух эмбрионов была недостаточной для повышения вероятности беременности (ОШ=1,0; ДИ 95% 1,7-4,4).
С другой стороны, оптимальное качество имплантированных эмбрионов также казалось важным фактором повышения вероятности беременности (ОШ=2,9; ДИ 95% 1,8-4,7). В одновариантном анализе один и тот же уровень значимости, как кажется, был связан с применением процедуры орошения (ОШ=2,2; ДИ 95% 1,6-2,9).
Многовариантный анализ проводили для контроля независимого эффекта каждой переменной, следовательно, независимо от эффекта других используемых процедур и от возраста матери. В этом случае применение процедуры промывания в два раза повышало вероятность успеха беременности (ОШ=2,2; ДИ 95% 1,6-3,0).
Подобное улучшение, как кажется, было связано с имплантацией трех эмбрионов, по сравнению с имплантацией одного эмбриона (ОШ=2,1; ДИ 95% 1,2-3,7), и с применением эмбрионов оптимального качества (ОШ=1,9; ДИ 95% 1,1-3,3).
Применение всех трех процедур, как сообщалось выше, как кажется, является наилучшим выбором в процедурах искусственного оплодотворения.
В заключение, исследования in vivo показали, что орошение или промывание с мелатонином клеток эндометрия обеспечивает повышение в два раза числа беременностей, по сравнению с двумя другими группами, в которых не было существенных различий.
Клиническое испытание 2
В одноцентровом исследовании участвовали 64 пациентки в группе сравнения и 92 пациентки в опытной группе.
Пациенток подвергали процедурам вспомогательной репродукции и промыванию эндометрия (с эхографическим анализом жидкого слоя) с мелатонином в стерильном солевом растворе, и спустя 3-4 дня подвергали переносу эмбриона.
Первичной конечной точкой исследования является уровень клинических беременностей (сердцебиение плода), обусловленных переносом эмбриона (ПЭ); вторичной конечной точкой является уровень сохраняющихся беременностей и выкидышей.
Уровень клинических беременностей был равен 37% в опытной группе и 17,2% в группе сравнения, в то время как уровень сохраняющихся беременностей составил 32,6% в опытной группе и 14,1% в группе сравнения.
Результаты показаны в следующей Таблице 1
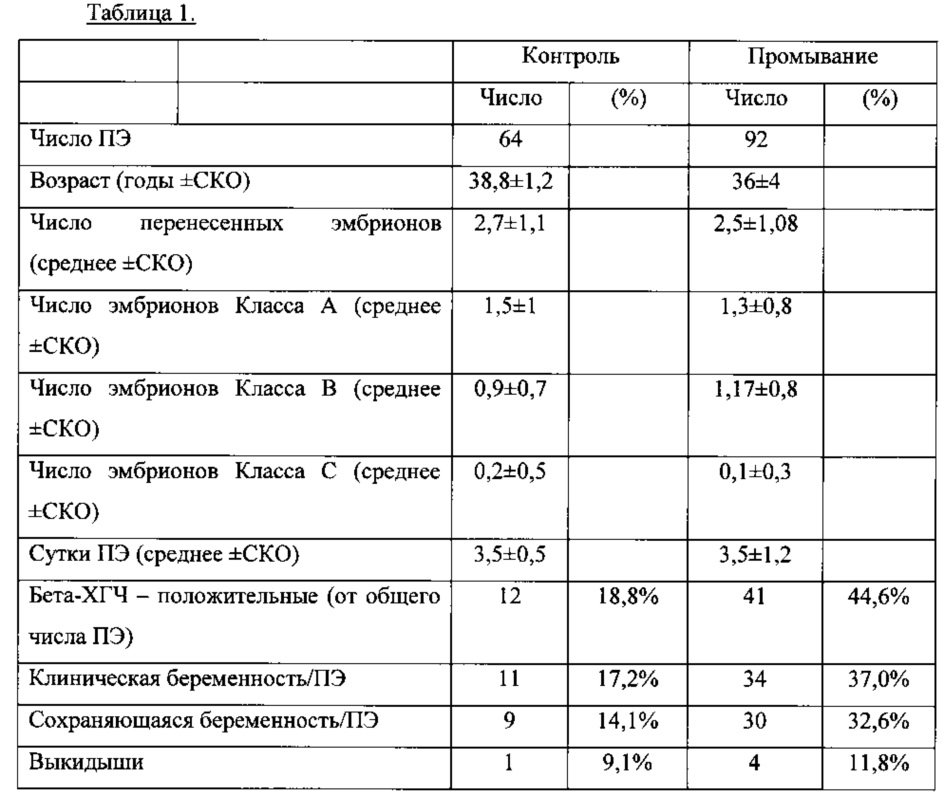
Промывание эндометрия проводили с различными растворами, содержащими мелатонин, обеспечивая удвоение уровня клинических беременностей и сохраняющихся беременностей, в отличие от группы сравнения в популяции бесплодных женщин.
Указанные данные, как оказалось, подтверждают, что удаление эндометриального экссудата с применением физиологического раствора с мелатонином позволяет создать физиологическую среду эндометрия и повысить успех имплантации.
Это позволяет получить эффективные и инновационные средства повышения уровня имплантации в технологиях вспомогательной репродукции (ART).
Пример 2. Исследование in vitro.
Материалы и методы
Использовали тот же самый мелатонин и культуральной среду, что и в исследовании in vivo.
Электронная микроскопия (СЭМ)
Использовали микроскоп с автоэлектронной эмиссией с высоким разрешением, модель FE HITACHI S 4000, работающий при 15-20 кВт.
Подготовка образцов
Вскоре после отбора у пациентки, небольшие образцы ткани эндометрия размером около 1 мм помещали в фиксирующий раствор, состоящий из 1% параформальдегида и 0,5% глутаральдегида в 0,1 М какодилатном буферном растворе с рН 7,2 в течение 3 часов.
После этой фиксации образцы промывали ФБР в течение 20 минут 3 раза (в целом 1 час), а затем проводили последующую фиксацию в растворе 2% тетраоксида осмия и 2,5% ферроцианида калия.
Препарат хранили в темноте в течение 3 часов, а затем осторожно промывали при вращении в ФБР, меняя раствор 4 раза каждые 20 минут.
Затем проводили дегидратацию образцов тканей в ацетоне в возрастающей концентрации с 3 заменами каждый час для каждого возрастания 50%-70%-80%-90%-95% и 2 заменами чистым ацетоном.
На этом этапе проводили сушку до критической точки жидким СО2 в соответствующем устройстве высокого давления, замещающего 10% ацетон на жидкий СО2, затем медленно доводили температуру до критической точки, и СО2 испарялся. В этой точке образцы ткани были превосходно высушены, и их можно было поместить на держатели электронного микроскопа.
Образцы фиксировали посредством специального электропроводного двустороннего адгезивного средства, и для их размещения использовали две очень тонких иглы, и подготовленный препарат анализировали с помощью сканирующего электронного микроскопа (СЭМ).
Биологические образцы
При получении информированного согласия в культуру помещали фрагменты эндометрия, извлеченные у пациенток, подвергнутых диагностической гистероскопии.
Для каждой пациентки исследовали две части: одну часть ткани помещали в культуру с помощью обычной среды для бластоцисты, не содержащей мелатонина, другую часть помещали в культуру с обычной средой для бластоцисты с добавлением мелатонина.
Культура ткани
Культивирование in vitro эндометрия (извлеченного посредством гистероскопии у пациенток, подвергнутых предварительному контролю перед искусственным оплодотворением) с мелатонином проводили в течение 3-6 суток, и анализировали пиноподы посредством электронной микроскопии (СЭМ).
Результаты
Исследования in vitro показали, что совместная культура 3-5 суток эмбриональной ткани в тест-пробирке с постоянным добавлением мелатонина включает несомненное повышение пиноподов (по результатам электронной микроскопии (СЭМ)), независимо от возраста пациентки и фазы менструального цикла в спонтанных циклах или при манипуляции посредством фармакологической стимуляции суперовуляции, по сравнению с контрольной культурой. Такие пиноподы являются структурами, которые определяются как наиболее важный маркер имплантации, которая для каждой женщины (с вариабельностью 5 суток, т.е. у женщин может быть короткий менструальный цикл 26 суток или может быть менструальный цикл 33 суток) составляет 48 часов. Фактически, две трети успеха беременности зависит от правильного момента имплантации, другая треть - от качества эмбриона.
Исследование под электронным микроскопом СЭМ показало, что добавление мелатонина ведет к полной морфологической экспрессии пиноподов, как показано на Фигурах 1-4.
Это демонстрирует важность пиноподов во время периода имплантации, и повышение их экспрессии, индуцированное в культуре с помощью сред с добавлением мелатонина.
Пример 3. Исследование влияния мелатонина и его аналогов на окисление и апоптоз экспериментальной клеточной линии НЕС-1-А.
Исследованные соединения
Аналогами мелатонина, использованными для сравнения с мелатонином (М5250), являются агомелатин (А1362) и 6-гидроксимелатонин (Н0627), все получены от Sigma Aldrich. Их использовали в различных концентрациях (т.е. 40 нМ, 80 нМ, 170 нМ и 340 нМ, что соответствовало 9,4×10-9 г/мл, 18×10-9 г/мл, 40×10-9 г/мл и 80×10-9 г/мл).
Клеточная линия
Клетки НЕС-1-А получали от АТСС и культивировали в соответствии с инструкциями поставщика. НЕС-1-А является стабилизированной эпителиальной клеточной линией, выделенной Н. Kuramoto из клеток аденокарциномы пациентки (21), обеспечивающей ценную модель для изучения клеток эндометрия in vitro (22).
Анализ антиоксидантной активности
Клеточную линию НЕС-1-А культивировали со 170 нМ (40 нг/мл) мелатонина, 6-гидроксимелатонина и агомелатина с двумя различными концентрациями Н2О2 (20 и 200 мкг/мл). Активные формы кислорода (АФК) измеряли посредством FACS, как описано Italiano и др.. (23), в двух независимых повторах.
Результаты
Мелатонин и два его аналога проявляли один и тот же антиоксидантный эффект на модели клеточной линии in vitro при концентрации Н2О2 20 мкг/мл.
Когда концентрацию Н2О2 повышали до 200 мкг/мл, мелатонин и агомелатин продолжали защищать клеточную линию от окисления, в то время как 6-гидроксимелатонин не проявлял эффекта. Однако при повышении дозы 6-гидроксимелатонина до 340 нМ достигался антиоксидантный эффект этого аналога (данные не показаны).
Результаты представлены на графике на Фигуре 5.
Эти результаты согласуются с данными, опубликованными Duan et al. (24), об антиоксидантном эффекте мелатонина на разных клеточных моделях, и показали, что мелатонин и его исследованные аналоги обладают схожим эффектом при использовании 20 мкг/мл Н2О2 на клеточной линии эндометрия.
Анализ апоптоза
Апоптоз (% клеточной гибели) клеток эндометрия является физиологическим явлением, как правило, наблюдаемым на уровне 10-20% при культивировании клеток.
Чтобы определить, индуцирует ли мелатонин и его аналоги клеточную гибель в этом специфическом экспериментальном контексте, клеточную линию НЕС-1-А обрабатывали 340 нМ (80 нг/мл), 170 нМ (40 нг/мл) и 80 нМ (18,8 нг/мл) мелатонина, 6-гидроксимелатонина и агомелатина, соответственно, в течение 24 часов.
Уровень апоптоза оценивали путем окрашивания пропидиум йодидом и анализа FACS. Процент суб-G1 событий показан для одного из двух выполненных экспериментов.
Результаты
Во всех анализируемых концентрациях мелатонин проявлял защитный эффект против апоптоза. Агомелатин обладал защитным эффектом при 170 и 340 нМ, в то время как 6-гидроксимелатонин не оказывал защитного эффекта против апоптоза до концентрации 170 нМ. Результаты показаны на Фигуре 6.
Библиография
1. Simon С, Martin JC, Pellicer A. Clin Obst & Gynaecol, 2000 14; (5) 127: 815-826.
2. Lédée-Bataille N, Laprée-Delage G, Taupin JL, Dubanchet S, Frydman R, Chaouat G. Hum Reprod, 2002 Jan 17; (1): 213-218.
3. Nardo LG, Sabatini L, Rai R, Nardo F. Eur J Obstet Gynecol Reprod Biol, 2002 Mar 10; 101 (2): 104-8.
4. Nikas G, Makrigiannakis A. Ann N Y Acad Sci, 2003 Nov; 997: 120-3.
5. Stavreus-Evers A, Mandelin E, Koistinen R, Aghajanova L, Hovatta O, Seppälä M. Fertil Steril, 2006 Jun; 85 (6): 1803-11. Erratum in: Fertil Steril. 2006 Aug; 86 (2): 498.
6. Brzezinski A.N Engl J Med, 1997 Jan 16; 336 (3): 186-95.
7. Kobayashi Y, Itoh MT, Kondo H, Okuma Y, Sato S, Kanishi Y, Hamada N, Kiguchi K, Ishizuka B.J Pineal Res, 2003 Sep; 35 (2): 71-4.
8. Aydogan S, Yerer MB, Goktas A. Melatonin and nitric oxide. J Endocrinol Invest, 2006 Mar; 29 (3): 281-7.
9. Sandyk R, Anastasiadis PG, Anninos PA, Tsagas N. Int J Neurosci, 1992 Feb; 62 (3-4): 243-50.
10. Sandyk R, Anastasiadis PG, Anninos PA, Tsagas N. Int J Neurosci, 1992 Jan; 62 (1-2): 89-96.
11. Simón C, Garcia Velasco JJ, Valbuena D, Peinado JA, Moreno C, Remohí J, Pellicer A. Fertil Steril, 1998 Aug; 70 (2): 234-9.
12. Tang PL, Chan TY, Tang GW, Pang SF. Gynecol Obstet Invest., 1998; 45(4):247-52.
13. Cioni et al., Prenat Diagn. 2005; 25/3(198-202).
14. Bussani С. и др., Mol Diagn Ther. 2007.
15. Florio и др., Fertil Steril. 2010.
16. Hannan NJ др. Reprod Sci. 2012; 19:1125-32.
17. Giulini S. и др. Arch Gynecol Obstet. 2012; 285:1479-1482.
18. Berlanga S. и др., Placenta 2011; 32 Suppl. 3:S271-5.
19. Ubaldi F, Bourgain C, Tournaye H, Smitz J, Steirteghem A, Devroey P. Fertil Steril, Mar 1997 67, 3: 521-526.
20. Schaeffer HJ, Sirotkin AV. Adv Exp Med Biol. 1995; 395:547-548.
21. Kuramoto H, и др. Am. J. Obstet. Gynecol. 114: 1012-1019, 1972.
22. Mo В. и др, 2006) Mo В, Vendrov AE, Palomino WA, DuPont BR, Apparao KB, Lessey BA. Biol Reprod. 2006; 75(3):387-94.
23. Italiano D., Lena AM, Melino G, Candi E. Cell Cycle. 2012; 11(24):4589-96.
24. Duan W., и др. PLoS One. 2013; 8(3) Epub 6 Marzo 2013.
Реферат
Группа изобретений относится к медицине, а именно к акушерству, и может быть использована при вспомогательной репродукции для профилактики неудачного исхода имплантации в матку самки млекопитающего. Для этого местно вводят композицию, содержащую эффективное количество N-ацетил-5-метокситриптамина (мелатонина) и/или его аналога, выбранного из агомелатина, 6-гидроксимелатонина, серотонина, 5-гидрокситриптофана. Также предложена композиция для местного применения для профилактики неудачного исхода имплантации в матку и медицинское устройство для промывания матки. Группа изобретений обеспечивает повышение вероятности имплантации эмбриона за счет ингибирования мелатонином синтеза простагландинов и снижения сокращения матки.3 н. и 20 з.п. ф-лы, 1 табл., 3 пр.

Комментарии