Кавитационный зародыш для доставки лекарственного средства и способ доставки лекарственного средства, использующий его - RU2704823C2
Код документа: RU2704823C2
Чертежи















Описание
Область техники, к которой относится настоящее изобретение
Настоящее изобретение относится к технологии доставки лекарственного средства и, более конкретно, к кавитационным зародышам для доставки лекарственных средств через эпидермис человека или животных и к способу, использующему их.
Предшествующий уровень техники настоящего изобретения
Способы доставки лекарственных средств могут включать способ, использующий пероральное введение и инъекцию, и способ, использующий проникание через кожу.
Хотя пероральное введение является типичным способом доставки лекарственных средств в организм через рот, сложно доставить лекарственные средства непосредственно к конкретному органу в организме, поскольку на лекарственные средства может действовать пищеварительная система организма, через которую они прошли.
Кроме того, хотя способ с использованием инъекции имеет относительное преимущество, заключающееся в быстрой абсорбции лекарственных средств, существует проблема, состоящая в том, что способ увеличивает страх или боль у человека, которому делают инъекцию, например, пациента.
При этом в отличие от способов, указанных выше, способ, использующий проникание через кожу, предпочтителен в том отношении, что (i) пациент не чувствует страха или боли в процессе доставки лекарственных средств, (ii) возможно непрерывное введение лекарственных средств, и (iii) при помощи способа относительно легко доставлять лекарственные средства к конкретному внутреннему органу пациента.
Однако, согласно существующему способу, использующему проникание через кожу, есть проблема, поскольку эффект доставки лекарственных средств блокируется роговым слоем, образующимся на коже.
Краткое раскрытие настоящего изобретения
Целью настоящего изобретения является решение проблем, указанных выше.
Дугой целью настоящего изобретения является обеспечение кавитационных зародышей, которые можно перемещать в положение, близкое к эпидермису, при помощи силы тяжести или электрического поля.
Еще одной целью настоящего изобретения является обеспечение способа доставки лекарственных средств при помощи кавитационных зародышей путем создания кавитации вблизи эпидермиса посредством ультразвуковых волн, чтобы максимизировать эффект доставки лекарственных средств.
Согласно аспекту настоящего изобретения обеспечивается кавитационный зародыш, чтобы вызвать кавитацию для создания полости около эпидермиса живого организма, содержащий: оболочку, которая образует его наружную поверхность для сохранения его внешней формы в жидкости; и ядро, которое находится внутри оболочки и которое определяет плавучесть кавитационного зародыша в жидкости, причем кавитационный зародыш вызывает кавитацию под воздействием ультразвуковых волн, излучаемых в жидкость.
При этом кавитационный зародыш может вызывать кавитацию под воздействием ультразвуковых волн, излучаемых в жидкость.
При этом ядро может представлять собой инертный сжиженный газ, который тяжелее жидкости, в которую добавляют кавитационный зародыш.
При этом инертный сжиженный газ может испаряться ультразвуковыми волнами.
При этом инертный сжиженный газ может представлять собой по меньшей мере один газ, выбранный из группы, состоящей из перфторпентана, перфторгексана, перфторметилциклогексана и перфтороктана.
При этом инертный сжиженный газ может содержать газы на основе перфторуглерода или может состоять из смесей, содержащих газы на основе перфторуглерода.
При этом ядро может представлять собой газ, который легче жидкости, в которую добавляют кавитационный зародыш.
При этом газ может представлять собой перфторбутан.
При этом оболочка может состоять по меньшей мере из одного вещества, выбранного из группы, состоящей из белков, фосфолипидов с гидрофильными и гидрофобными свойствами, липоида и липида только с гидрофобными свойствами.
При этом оболочка может иметь электрический заряд для реакции на электромагнитное поле.
При этом оболочка может состоять по меньшей мере из одного из следующих веществ: DMPA-Na (1,2-димиристоил-sn-глицеро-3-фосфат), DPPA-Na (1,2-дипальмитоил-sn-глицеро-3-фосфат), DOPA-Na (1,2-диолеоил-sn-глицеро-3-фосфат), DMPG-Na (1,2-димиристоил-sn-глицеро-3-фосфоглицерин), DPPG-Na (1,2-дипальмитоил-sn-глицеро-3-фосфоглицерин), DOPG-Na (1,2-диолеоил-sn-глицеро-3-фосфоглицерин), DMPS-Na (1,2-димиристоил-sn-глицеро-3-фосфосерин), DPPS-Na (1,2-дипальмитоил-sn-глицеро-3-фосфосерин), DOPS-Na (1,2-диолеоил-sn-глицеро-3-фосфосерин), DOPE-глутарил-(Na)2 (1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин), тетрамиристоилкардиолипин-(Na)2, DSPE-mPEG-2000-Na (1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин), DSPE-mPEG-5000-Na, DSPE-малеинимида PEG-2000-Na и DOTAP-Cl (1,2-диолеоил-3-триметиламмония пропан).
При этом оболочка может содержать DPPC (1,2-дипальмитоил-sn-глицеро-3-фосфохолин) и DPPA (1,2-дипальмитоил-sn-глицеро-3-фосфат) в заранее определенном отношении.
При этом жидкость может представлять собой лекарственные средства, доставляемые к эпидермису посредством кавитации, вызванной кавитационным зародышем.
Согласно другому аспекту настоящего изобретения обеспечивается способ доставки лекарственных средств к эпидермису живого организма при помощи кавитационных зародышей, предусматривающий стадии: (а) подачи к эпидермису смеси, содержащей кавитационные зародыши, смешанные с жидкостью, содержащей лекарственные средства; (b) регулирования электромагнитного поля, прикладываемого к смеси, чтобы таким образом определить положения кавитационных зародышей в смеси; и (с) облучения ультразвуковыми волнами смеси при помощи ультразвукового излучателя, чтобы вызвать кавитацию кавитационных зародышей.
Согласно еще одному аспекту настоящего изобретения обеспечивается смесь с кавитационными зародышами, чтобы вызвать кавитацию для создания полости около эпидермиса живого организма, содержащая: жидкость и кавитационные зародыши, смешанные с жидкостью, причем каждый из кавитационных зародышей содержит оболочку, которая образует его наружную поверхность для поддержания его внешней формы в смеси, и ядро, которое находится в оболочке для определения плавучести смеси.
Краткое описание фигур
Вышеуказанные объекты и технические признаки настоящего изобретения станут очевидными из следующего описания предпочтительных вариантов осуществления, показанных вместе с приложенными фигурами, причем подобные номера позиций относятся к подобным элементам на всех видах, на которых:
фиг. 1 представляет собой изображение, показывающее структуру рогового слоя;
фиг. 2А представляет собой типичное изображение, показывающее технологию доставки лекарственного средства при помощи ультразвука для доставки лекарственных средств к эпидермису;
фиг. 2В представляет собой типичное изображение, показывающее как образуется канал для доставки лекарственного средства;
фиг. 3 представляет собой типичное изображение, показывающее ультразвуковые контрастные вещества;
фиг. 4А представляет собой типичное изображение, показывающее вид сверху кавитационных зародышей, ядра которых содержат инертный сжиженный газ, который тяжелее окружающей жидкости, согласно одному типичному варианту осуществления настоящего изобретения;
фиг. 4В представляет собой типичное изображение, показывающее вид сбоку кавитационных зародышей, ядра которых содержат инертный сжиженный газ, который тяжелее окружающей жидкости, согласно одному типичному варианту осуществления настоящего изобретения;
фиг. 5А представляет собой типичное изображение, показывающее вид сверху кавитационных зародышей, ядра которых содержат перфторбутан, согласно одному типичному варианту осуществления настоящего изобретения;
фиг. 5В представляет собой типичное изображение, показывающее вид сбоку кавитационных зародышей, ядра которых содержат перфторбутан, согласно одному типичному варианту осуществления настоящего изобретения;
фиг. 6 представляет собой типичное изображение таблицы, показывающей вещество, которое может образовывать оболочку каждого из кавитационных зародышей, согласно одному типичному варианту осуществления настоящего изобретения;
фиг. 7 представляет собой типичное изображение, показывающее экспериментальное оборудование для подтверждения эффекта доставки к эпидермису при помощи кавитационных зародышей согласно типичному варианту осуществления настоящего изобретения;
фиг. 8 представляет собой типичное изображение, показывающее тяжелые кавитационные зародыши, расположенные вблизи эпидермиса, согласно одному типичному варианту осуществления настоящего изобретения;
фиг. 9 представляет собой график, поясняющий улучшенный эффект доставки лекарственных средств в случае, когда используют тяжелые кавитационные зародыши, согласно одному типичному варианту осуществления настоящего изобретения;
фиг. 10A представляет собой типичное изображение, показывающее вид сверху кавитационных зародышей, каждый из которых имеет оболочку с электрическим зарядом для реакции на электромагнитное поле, согласно одному типичному варианту осуществления настоящего изобретения;
фиг. 10В представляет собой типичное изображение, показывающее ситуацию, в которой электромагнитное поле прикладывают к кавитационным зародышам, каждый из которых имеет оболочку с электрическим зарядом для реакции на электромагнитное поле, согласно одному типичному варианту осуществления настоящего изобретения;
фиг. 11 представляет собой график, поясняющий улучшенные эффекты доставки лекарственных средств при помощи кавитационных зародышей, каждый из которых имеет оболочку с электрическим зарядом для реакции на электромагнитное поле, согласно одному типичному варианту осуществления настоящего изобретения;
фиг. 12 представляет собой блок-схему, показывающую способ доставки лекарственных средств к эпидермису при помощи кавитационных зародышей согласно одному типичному варианту осуществления настоящего изобретения.
Подробное раскрытие предпочтительных вариантов осуществления
Чтобы цели, технические решения и преимущества настоящего изобретения стали ясными, ссылка сделана на приложенные фигуры, которые показывают в качестве иллюстрации более подробные типичные варианты осуществления, в которых изобретение может быть осуществлено на практике. Эти варианты осуществления описаны достаточно подробно для облегчения специалистам в данной области осуществления настоящего изобретения на практике.
Следует понимать, что различные варианты осуществления настоящего изобретения, хотя и разные, не обязательно являются взаимоисключающими. Например, конкретный признак, структура или характеристика, описанные в настоящем документе в связи с одним вариантом осуществления, может использоваться с другими вариантами осуществления без отклонения от сущности и объема настоящего изобретения. Кроме того, следует понимать, что положение или размещение отдельных элементов в каждом раскрытом варианте осуществления можно изменять без отклонения от сущности и объема настоящего изобретения. Следующее подробное описание, таким образом, не следует рассматривать в ограничивающем смысле, и объем настоящего изобретения определен только приложенной формулой изобретения, интерпретируемой надлежащим образом, вместе с полным диапазоном эквивалентов, на которые она имеет право. На фигурах подобные номера позиций относятся к одному и тому же или аналогичному функциональному элементу на всех видах.
Далее предпочтительные варианты осуществления настоящего изобретения будут описаны более подробно со ссылкой на приложенные фигуры, так что специалисты в данной области смогут легко реализовать настоящее изобретение.
Фиг. 1 представляет собой изображение, показывающее структуру рогового слоя. Ссылаясь на фиг. 1, структуру рогового слоя можно объяснить как «модель из кирпичей и раствора». Как можно увидеть на этой структуре рогового слоя, он имеет структуру, состоящую из ороговевшей клеточной оболочки и пр., и роговой слой выступает в качестве важных барьеров для защиты тела человека от инородных веществ, а также для защиты от потерь влаги.
Для справки, толщина рогового слоя изменяется в зависимости от его расположения, но обычно роговой слой имеет толщину приблизительно 100 мкм. Таким образом, сложно доставлять лекарственные средства в организм из-за такой защиты из рогового слоя. Существует множество путей для преодоления такого действия барьеров кожи. «Сонофорез» можно использовать как один из них.
Фиг. 2А представляет собой типичное изображение, показывающее технологию доставки лекарственных средств при помощи ультразвука для доставки лекарственных средств к эпидермису, а фиг. 2В представляет собой типичное изображение, показывающее как образуется канал доставки для лекарственного средства.
Ссылаясь на фиг. 2А, ключевой механизм сонофореза, в котором используются ультразвуковые волны, состоит в том, что пузырьки, образованные на эпидермисе, или зародыши, способные вырасти в пузырьки, вибрируют нелинейно или асимметрично схлопываются, при этом сразу образуется канал доставки для лекарственных средств. Номер позиции 21 на фиг. 2А обозначает поток жидкости, образующийся, когда газ колеблется около кожи, а номер позиции 22 обозначает поток жидкости, который вырос в значительной степени. Номер позиции 23 обозначает поток жидкости, который увеличивается, а номер позиции 24 обозначает напряжение сдвига, создаваемое около кожи из-за потока жидкости. Поток жидкости может вызывать напряжение сдвига около кожи, и в результате он может снижать роль рогового слоя в качестве барьера.
Ссылаясь на фиг. 2В, процесс доставки лекарственных средств можно подтвердить. Номер позиции 25 на фиг. 2В показывает ультразвуковые волны около пузырьков, а номер позиции 26 показывает схлопывание пузырьков вблизи эпидермиса из-за ультразвуковых волн. Номер позиции 27 обозначает канал доставки для лекарственных средств, образованный из-за схловывания пузырьков вблизи эпидермиса. В связи с этим, если пузырьки схлопываются вблизи эпидермиса, сильная струя может возникать из-за асимметричных условий границы, при этом образуя канал доставки для лекарственных средств.
Ультразвуковые контрастные вещества, которые состоят из микропузырьков, можно использовать в качестве кавитационных зародышей, описанных выше. Ультразвуковые контрастные вещества в принципе представляют собой микропузырьки, которые делают кровеносные сосуды или ткани ясно видимыми на ультразвуковых снимках. Такие ультразвуковые контрастные вещества можно использовать в качестве вещества для доставки лекарственных средств.
Фиг. 3 представляет собой типичное изображение, показывающее ультразвуковые контрастные вещества.
Ссылаясь на фиг. 3, ультразвуковые контрастные вещества представляют сбой пузырьки, каждый из которых имеет оболочку, содержащую в себе газ. При этом оболочка играет роль стабилизатора пузырьков.
В общем, ультразвуковые контрастные вещества используют, чтобы сделать кровеносные сосуды или ткани более ясно видимыми. Таким образом, ультразвуковые контрастные вещества должны свободно течь в кровеносных сосудах. Из-за этого свойства, оно не прилипает к стенкам кровеносных сосудов. Кроме того, ультразвуковые контрастные вещества диффундируют, а затем равномерно распределяются в текущей крови. Ультразвуковые контрастные вещества в жидкости, которая не течет, могут иметь меньший размер и, таким образом, плавучесть может быть ниже, но их плавучесть все еще может работать. Таким образом, они могут всплывать в верхнем слое в зависимости от типа их оболочек.
Следовательно, существующие ультразвуковые контрастные вещества сложно размещать вблизи эпидермиса, включая стенки кровеносных сосудов. Таким образом, есть ограничение при доставке лекарственных средств посредством схлопывания пузырьков вблизи эпидермиса, как описано выше со ссылкой на фиг. 2В.
Кавитационные зародыши, которые вызывают кавитацию, способную образовать полость около эпидермиса живого организма, содержат оболочку, которая образует наружную поверхность каждого из кавитационных зародышей для поддержания внешнего контура каждого из кавитационных зародышей в жидкости, в которую добавляют кавитационные зародыши, и ядро, которое находится внутри каждой оболочки. Ядро определяет плавучесть каждого из кавитационных зародышей в жидкости.
При этом оболочка и ядро могут состоять из материалов, которые биосовместимы или не имеют материалистических побочных эффектов в организме.
Эпидермис согласно настоящему изобретению может в общем включать кожу человека, шкуру животного, но не ограничен ими, и следует понимать, что он может включать стенки кровеносных сосудов человека или животного, внутренние стенки кишечника и пр. и подобное.
При этом кавитационные зародыши могут вызывать кавитацию из-за ультразвуковых волн, излучаемых в жидкость. В отношении подробностей касательно кавитации можно сослаться на фиг. 2А и 2В, описанные выше.
Кроме того, жидкость может быть одним из лекарственных средств, которые следует доставить к эпидермису при помощи кавитации, вызванной одним из кавитационных зародышей. Например, феруловую кислоту можно доставлять к эпидермису. Конечно, необходимые и различные виды лекарственных средств можно использовать для доставки в организм через эпидермис.
При этом, поскольку ядро служит для определения плавучести каждого из кавитационных зародышей, плавучесть изменяется в зависимости от вещества ядра, и плавучесть может определять располагается ли большая часть кавитационных зародышей на эпидермисе или нет.
Таким образом, ядро для определения плавучести будет описано более подробно ниже.
Фиг. 4А представляет собой типичное изображение, показывающее вид сверху кавитационных зародышей, ядра которых содержат инертный сжиженный газ, который тяжелее окружающей жидкости, согласно одному типичному варианту осуществления настоящего изобретения.
Фиг. 4В представляет собой типичное изображение, показывающее вид сбоку кавитационных зародышей, ядра которых содержат инертный сжиженный газ, который тяжелее окружающей жидкости, согласно одному типичному варианту осуществления настоящего изобретения.
Ссылаясь на фиг. 4А и 4В, ядро может быть инертным сжиженным газом, который тяжелее жидкости, в которую добавляют кавитационные зародыши. Такие тяжелые кавитационные зародыши 40 смешивают с жидкостью 41 в чаше 42 для наблюдения за изменениями. При этом используемая жидкость 41 представляет собой водную жидкость, но не ограничена ею. Как показано на фиг. 4А, кавитационные зародыши 40 могут опускаться в жидкости 41 из-за того факта, что используют сжиженный газ, который тяжелее окружающей жидкости 41. Как показано на фиг. 4В, вид сбоку кавитационных зародышей 40 показывает, что они явно утонули. В результате можно тщательно регулировать положение кавитационных зародышей 40 на эпидермисе. Также размер каждого кавитационного зародыша 40 можно регулировать для размещения соответствующих кавитационных зародышей 40 более точно на эпидермисе.
При этом инертный сжиженный газ может испаряться при воздействии ультразвуковых волн. Аналогично, кавитацию можно легко вызывать путем испарения при воздействии ультразвуковых волн.
Инертный сжиженный газ может содержать газ на основе перфторуглерода или смесь, содержащую такой газ на основе перфторуглерода.
Например, инертный сжиженный газ может быть по меньшей мере одним, выбранным из группы, состоящей из перфторпентана (температура кипения которого вблизи 30°С, а плотность около 1,63 г/мл), перфторгексана (температура кипения которого вблизи 56°С, а плотность около 1,68 г/мл), перфторметилциклогексана (температура кипения которого вблизи 76°С, плотность около 1,788 г/мл) и перфтороктана (температура кипения которого вблизи 103°С, плотность около 1,76 г/мл). Это предпочтительный пример, и специалистам в области техники, к которой относится настоящее изобретение, очевидно, что можно использовать эквивалентно или частично модифицированные инертные сжиженные газы.
Газы, указанные выше, легко испаряются ультразвуковыми волнами, и, таким образом, газы можно использовать в качестве кавитационных зародышей, подходящих для доставки лекарственных средств.
При этом в случае, когда жидкость и эпидермис находятся в направлении, отличном от направления силы тяжести, если кавитационные зародыши, добавленные в жидкость, тяжелее, чем окружающая жидкость, кавитационные зародыши могут быть дальше от эпидермиса. В таком случае, наоборот, кавитационные зародыши должны быть легче, чем жидкость около эпидермиса. Таким образом, в таком случае ядро может быть газом, который легче, чем жидкость, в которую добавлены кавитационные зародыши.
Фиг. 5А представляет собой типичное изображение, показывающее вид сверху кавитационных зародышей, ядра которых содержат перфторбутан, согласно одному типичному варианту осуществления настоящего изобретения.
Фиг. 5В представляет собой типичное изображение, показывающее вид сбоку кавитационных зародышей, ядра которых содержат перфторбутан, согласно одному типичному варианту осуществления настоящего изобретения.
Перфторбутан представляет собой газ, который легче, чем жидкость, в которую добавлены кавитационные зародыши.
Ссылаясь на фиг. 5А и 5В, перфторбутан используют в качестве ядра каждого из кавитационных зародышей 50, так что кавитационные зародыши 50 могут быть легче окружающей жидкости 41, и плавучесть может иметь на них большее влияние. Легкие кавитационные зародыши 50 смешивают с окружающей жидкостью 41 в чаше 42 для наблюдения за изменениями. При этом окружающая жидкость 41 представляет собой водную жидкость, но не ограничена ею.
Как показано на фиг. 5А, кавитационные зародыши 50 равномерно распределяются в окружающей жидкости 41, как можно видеть на виде сверху фигуры. Как показано на фиг. 5В, кавитационные зародыши 50 равномерно распределяются в окружающей жидкости 41, как можно также видеть на виде сбоку фигуры. Таким образом, кавитационные зародыши 50 могут располагаться вблизи эпидермиса путем компенсации влияния силы тяжести. Как описано выше, размер каждого из кавитационных зародышей 50 можно регулировать для точного регулирования расстояния от эпидермиса.
Однако, как описано выше, в случае, когда кавитационные зародыши используют только как более тяжелые или более легкие, чем окружающая жидкость, может быть сложно применять кавитационные зародыши в различных направлениях, поскольку кавитационные зародыши могут перемещаться только в направлении силы тяжести или в противоположном ей направлении. Например, в случае, когда лекарственные средства следует доставлять на лицо сидящего человека, может быть необходимо помещать кавитационные зародыши на эпидермис с дополнительной силой, отличной от силы тяжести.
Следовательно, оболочка каждого из кавитационных зародышей может иметь электрический заряд для реакции на электромагнитное поле. Далее материалы, которые образуют оболочку каждого из кавитационных зародышей и которые могут реагировать на электрическое поле, будут указаны более подробно.
Фиг. 6 представляет собой типичное изображение таблицы, показывающей вещество, которое может образовывать оболочку каждого из кавитационных зародышей, согласно одному типичному варианту осуществления настоящего изобретения.
Со ссылкой на фиг. 6, материалы, образующие оболочку каждого из кавитационных зародышей, описаны следующим образом.
Во-первых, оболочка каждого из кавитационных зародышей может быть по меньшей мере одним веществом, выбранным из группы, состоящей из белков, фосфолипидов с гидрофильными и гидрофобными свойствами, липоида и липидов только с гидрофобными свойствами.
Фосфолипиды включают, например,
DLPC (1,2-дилауроил-sn-глицеро-3-фосфохолин),
DMPC (1,2-димиристоил-sn-глицеро-3-фосфохолин),
DPPC (1,2-дипальмитоил-sn-глицеро-3-фосфохолин),
DSPC (1,2-дистеароил-sn-глицеро-3-фосфохолин),
DOPC (1,2-диолеоил-sn-глицеро-3-фосфохолин),
DMPE (1,2-димиристоил-sn-глицеро-3-фосфоэтаноламин),
DPPE (1,2-дипальмитоил-sn-глицеро-3-фосфоэтаноламин),
DOPE (1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин),
DMPA-Na (1,2-димиристоил-sn-глицеро-3-фосфат),
DPPA-Na (1,2-дипальмитоил-sn-глицеро-3-фосфат),
DOPA-Na (1,2-диолеоил-sn-глицеро-3-фосфат),
DMPG-Na (1,2-димиристоил-sn-глицеро-3-фосфоглицерин),
DPPG-Na (1,2-дипальмитоил-sn-глицеро-3-фосфоглицерин),
DOPG-Na (1,2-диолеоил-sn-глицеро-3-фосфоглицерин),
DMPS-Na (1,2-димиристоил-sn-глицеро-3-фосфосерин)
DРРS-№(1,2-дипальмитоил-sn-глицеро-3-фосфосерин),
DOPS-Na (1,2-диолеоил-sn-глицеро-3-фосфосерин),
DОРЕ-глутарил-(Na)2 (1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин),
тетрамиристоилкардиолипин-(Na)2,
DSPE-mPEG-2000-Na,
(1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин),
DSPE-mPEG-5000-Na,
DSPE-малеинимид PEG-2000-Na и
DOTAP-C1 (1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин).
Ссылаясь на фиг. 6, полный заряд различных фосфолипидов может обычно равняться нулю в большинстве обычных нейтральных растворов, например, растворов с рН 7,4. Однако на фиг. 6 показано, что часть материалов, указанных в таблице, имеют полный заряд, который не равен нулю с растворами с рН 7,4.
Таким образом, оболочка может состоять по меньшей мере из одного из таких заряженных фосфолипидов.
Например, оболочка может состоять по меньшей мере из одного из следующего:
DMPA-Na (1,2-димиристоил-sn-глицеро-3-фосфат),
DPPA-Na (1,2-дипальмитоил-8П-глицеро-3-фосфат),
DOPA-Na (1,2-диолеоил-sn-глицеро-3-фосфат),
DMPG-Na (1,2-димиристоил-sn-глицеро-3-фосфоглицерин),
DPPG-Na (1,2-дипальмитоил-sn-глицеро-3-фосфоглицерин),
DOPG-Na (1,2-диолеоил-sn-глицеро-3-фосфоглицерин),
DMPS-Na (1,2-димиристоил-sn-глицеро-3-фосфосерина),
DPPS-Na (1,2-дипальмитоил-sn-глицеро-3-фосфосерин),
DOPS-Na (1,2-диолеоил-sn-глицеро-3-фосфосерин),
DОРЕ-глутарил-(Na)2 (1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин),
тетрамиристоилкардиолипин-(Na)2,
DSPE-mPEG-2000-Na (1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин),
DSPE-mPEG-5000-Na,
DSPE-малеинимид PEG-2000-Na и
DOTAP-C1 (1,2-диолеоил-3-триметиламмония пропан).
Однако, в зависимости от цели, кавитационные зародыши, имеющие оболочку, чувствительную к электромагнитному полю, можно получать при помощи вышеописанных веществ, смешанных в некотором отношении, или только при помощи одного вещества, выбранного из них. Специалистам в данной области очевидно, что вещества, указанные выше, являются иллюстративными и примерными.
Например, оболочка может быть образована объединением DPPC (нейтрального фосфолипида) и DPPA (отрицательного полярного фосфолипида) в определенном отношении. Более конкретно, DPPC и DPPA можно разбавлять в отношении 10:1. В этом случае дзета-потенциал приблизительно -28 мВ может быть измерен, и, таким образом, кавитационные зародыши, имеющие такое вещество в качестве оболочек их наружных поверхностей, могут прилипать к эпидермису или наоборот в зависимости от влияния электрического поля.
Кроме того, в случае, когда силы Ван-дер-Ваальса или магнитные поля дополнительно используют, чистые липиды или различные соединения в виде наночастиц можно использовать для получения оболочки для каждого из кавитационных зародышей.
Фиг. 7 представляет собой типичное изображение, показывающее экспериментальное оборудование для подтверждения эффекта доставки к эпидермису при помощи кавитационных зародышей согласно типичному варианту осуществления настоящего изобретения.
Ссылаясь на фиг. 7, в экспериментальном оборудовании можно использовать свиную шкуру 100, которая подобна коже человека, и оно может включать магнитную мешалку 300, используемую с целью взбивания, и диффузионную ячейку 200. При этом диффузионная ячейка 200 показывает верхнюю и нижнюю части элемента, где зафиксирована свиная шкура 100. Кроме того, экспериментальное оборудование, показанное на фиг. 7, должно оцениваться как пример для пояснения кавитационных зародышей.
При этом свиную шкуру 100 готовят при помощи микротома для получения толщины приблизительно 2 мм. Для постоянства образцов используют только образцы со значениями сопротивления на обоих концах свиной шкуры 100 от 800 до 900 Ом. Свиную шкуру 100 закрепляют в диффузионной ячейке 200 при помощи фиксирующего устройства. Однако не обязательно использовать только такую свиную шкуру 100, скорее, это только один типичный вариант осуществления.
Во-первых, оболочка каждого из кавитационных зародышей, которые используют в этом эксперименте, образуется при помощи DPPC, который является нейтральным фосфолипидом, а в его ядре используют перфторгексан для создания сжиженной перфторгексановой липосомы, которая тяжелее, чем раствор, который следует смешивать с кавитационными зародышами. Для справки, размер каждого из кавитационных зародышей можно регулировать до 1 мкм (микрометра) или менее при помощи фильтра.
Раствор, содержащий кавитационные зародыши, можно готовить и получать разбавлением раствора феруловой кислоты 10000 частей на миллион до 0,100 об. %. Раствор феруловой кислоты содержит эти кавитационные зародыши, которые следует доставить к эпидермису.
Фиг. 8 представляет собой типичное изображение, показывающее тяжелые кавитационные зародыши, расположенные вблизи эпидермиса согласно одному типичному варианту осуществления настоящего изобретения. А фиг. 9 представляет собой график, поясняющий улучшенный эффект доставки лекарственных средств в случае, когда используют тяжелые кавитационные зародыши согласно одному типичному варианту осуществления настоящего изобретения.
Ссылаясь на фиг. 8, в экспериментальном оборудовании, показанном на фиг. 7, описанной выше, если раствор 120 феруловой кислоты помещают в диффузионную ячейку 200, из-за того факта, что кавитационные зародыши 105 тяжелее в растворе 120 феруловой кислоты, можно тщательно размещать кавитационные зародыши 105 на свиной шкуре 100.
В общих чертах, ультразвуковые волны 2 Вт/см2 прикладывают к раствору 120 феруловой кислоты в течение 20 минут. Количество доставленной феруловой кислоты отбирают каждые 10 минут, и его можно количественно рассчитать высокоэффективной жидкостной хроматографией (HPLC). При этом время и интенсивность приложения ультразвуковых волн может определять посредством различных способов специалист в области техники, к которой относится настоящее изобретение, и они не ограничены экспериментальным примером в данном документе.
Ссылаясь на фиг. 9, количества доставленной феруловой кислоты согласно обычному способу облучения ультразвуковыми волнами (УЗ) или согласно другому обычному способу облучения ультразвуковыми волнами с контрастными веществами (УКВ) в 10 раз выше, чем при простой диффузии.
Наоборот, количества доставленной феруловой кислоты согласно настоящему изобретению, в котором ультразвуковые волны облучают кавитационные зародыши, больше в 10000 раз по сравнению с результатами простой диффузии.
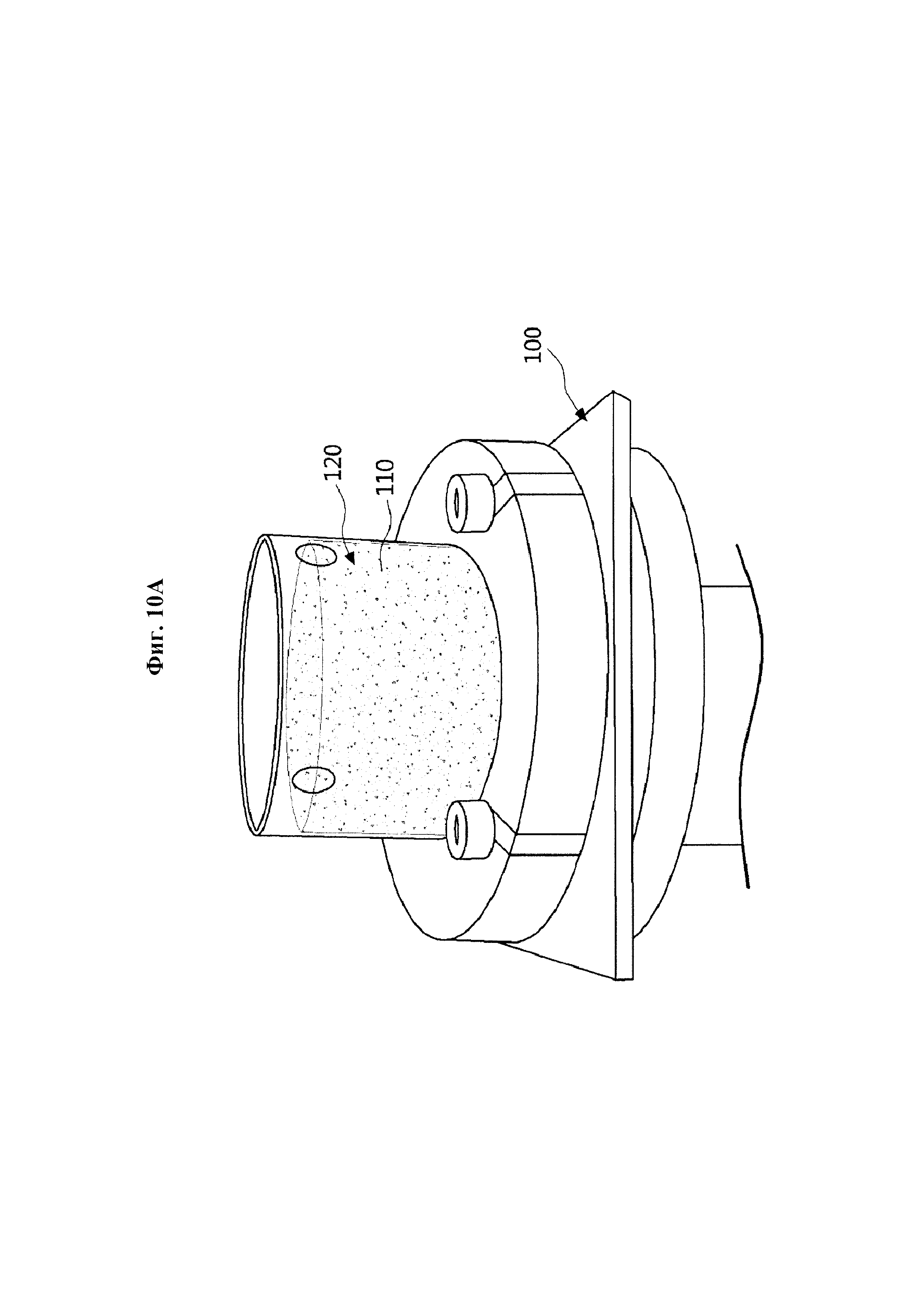
Фиг. 10A представляет собой типичное изображение, показывающее вид сверху кавитационных зародышей, каждый из которых имеет оболочку с электрическим зарядом для реакции на электромагнитное поле согласно одному типичному варианту осуществления настоящего изобретения.
Фиг. 10В представляет собой типичное изображение, показывающее ситуацию, при которой электромагнитное поле прикладывают к кавитационным зародышам, каждый из которых имеет оболочку с электрическим зарядом для реакции на электромагнитное поле согласно одному типичному варианту осуществления настоящего изобретения.
Фиг. 11 представляет собой график, поясняющий повышенные эффекты доставки лекарственных средств при помощи кавитационных зародышей, каждый из которых имеет оболочку с электрическим зарядом для реакции на электромагнитное поле согласно одному типичному варианту осуществления настоящего изобретения.
Ссылаясь на фиг. 10А, свиную шкуру 100, используемую в вариантах осуществления, описанных со ссылкой на фиг. 8 и 9, также используют в типичном варианте осуществления, описанном также и на фиг. 10А-11, и свиную шкуру 100 готовят, чтобы она имела толщину приблизительно 2 мм. Для постоянства образцов для тестов используют только образцы со значениями сопротивления от 800 до 900 Ом на обоих концах образца.
Кроме того, получают каждую оболочку с электрическим зарядом для реакции на электромагнитное поле путем смешивания двух фосфолипидов, DPPC и DPPA, в отношении 10:1, и каждое ядро внутри оболочки может быть заполнено перфторбутаном для получения каждого кавитационного зародыша 110.
Множество кавитационных зародышей 110 можно смешивать с раствором 120 феруловой кислоты в отношении 0,1%.
В случае, когда смешанный раствор 120 феруловой кислоты помещают в диффузионную ячейку 200, кавитационные зародыши 110 широко распространяются и распределяются, как можно увидеть на фиг. 10А. Причиной для этого может быть плавучесть, которая больше силы тяжести, поскольку ядро каждого из кавитационных зародышей заполнено перфторбутаном.
При этом, если электроды помещают и электрическое поле в 15В прикладывают для обеспечения электрического поля, можно вызвать интенсивное размещение кавитационных зародышей 110 на свиной шкуре 100, как показано на фиг. 10В.
Приблизительно ультразвуковые волны 2 Вт/см2 прикладывают на 20 минут как и в типичных вариантах осуществления, описанных выше, таким же образом, и количество доставленной феруловой кислоты отбирают каждые 10 минут, и его можно количественно измерять высокоэффективной жидкостной хроматографией (HPLC).
Ссылаясь на фиг. 11, количества доставленной феруловой кислоты согласно способу облучения ультразвуковыми волнами или согласно способу облучения ультразвуковыми волнами после добавления контрастных веществ увеличиваются в 10 раз по сравнению с количествами при простой диффузии.
Однако, в случае использования кавитационных зародышей с оболочкой с электрическим зарядом, на который действует электромагнитное поле, количества доставляемой феруловой кислоты могут повышаться приблизительно в 800 раз по сравнению с простой диффузией.
Кроме того, результаты эксперимента, описанного выше, могут также улучшаться путем регулирования интенсивности электрического поля.
Фиг. 12 представляет собой блок-схему, показывающую способ доставки лекарственных средств к эпидермису при помощи кавитационных зародышей согласно одному типичному варианту осуществления настоящего изобретения.
Ссылаясь на фиг. 12, способ доставки лекарственных средств к эпидермису живого организма при помощи кавитационных зародышей может предусматривать стадию подачи к эпидермису смеси, содержащей кавитационные зародыши, смешанные с жидкостью, содержащей лекарственные средства (S120), стадию регулирования электромагнитного поля, прикладываемого к смеси для определения при этом положений кавитационных зародышей в смеси (S121), и стадии облучения ультразвуковыми волнами смеси при помощи ультразвукового излучателя, чтобы вызвать кавитацию кавитационных зародышей (S122).
При этом ультразвуковой излучатель может представлять собой различные устройства, которые легкодоступны специалисту в области техники, к которой относится настоящее изобретение.
При этом каждый из кавитационных зародышей может содержать ядро, которое определяет его плавучесть в смеси.
При этом каждый из кавитационных зародышей может содержать оболочку, которая образует его наружную поверхность для поддержания его контура в смеси, и оболочка может быть заряжена для реакции на электромагнитное поле.
Смесь с кавитационными зародышами, которая вызывает кавитацию для создания полости около эпидермиса живого организма, содержит жидкость и кавитационные зародыши, смешанные с жидкостью, и каждый из кавитационных зародышей содержит оболочку, которая образует его наружную поверхность для поддержания его внешней формы в смеси, и ядро, которое находится в оболочке для определения плавучести каждого из кавитационных зародышей в смеси.
При этом жидкость может быть водным раствором, которым феруловую кислоту разбавляют в заранее определенном отношении.
При этом жидкость может представлять собой по меньшей мере одно коммерчески или фармацевтически приемлемое лекарственное средство, выбранное из группы, состоящей из средств для осветления тона кожи, средств для удаления волос, средств для восстановления волос, филлеров для кожи, коллагенов, анальгетиков, местных анестетиков, терапевтических диэлектриков и средств для лечения рака.
При этом оболочка с электрическим зарядом может реагировать на электромагнитное поле.
Настоящее изобретение после интенсивного размещения кавитационных зародышей, способных вызывать кавитацию в идеальных положениях вблизи эпидермиса, может повышать эффективность доставки лекарственного средства к эпидермису путем кавитации посредством приложения подходящих величин ультразвука.
Кроме того, настоящее изобретение можно применять не только к средствам ухода за кожей, таким как средства для осветления тона кожи, средства для удаления волос, средства для восстановления волос, филлеры для кожи, анальгетики для кожи, местные анестетики, средства от генетических заболеваний, таких как псориаз, средства для лечения кожных заболеваний, таких как рак кожи, и пр., но и также к различным способам доставки лекарственных средств.
Настоящее изобретение имеет эффект улучшения эффективности доставки лекарственного средства вследствие кавитации, вызванной ультразвуковыми волнами в идеальных положениях вблизи эпидермиса.
Кроме того, настоящее изобретение может иметь эффект не только обеспечения применений средств ухода за кожей, таких как средства для осветления тона кожи, средства для удаления волос, средства для восстановления волос, филлеры для кожи, анальгетики для кожи, местные анестетики, средства для генетических заболеваний, таких как псориаз, средства для лечения кожных заболеваний, таких как рак кожи и подобные, но также обеспечивать применения, связанные с доставкой различных лекарственных средств.
Варианты осуществления настоящего изобретения, объясненные выше, можно выполнять в виде выполняемой программной команды посредством разнообразных компьютерных средств, записанных на читаемых компьютером носителях. Читаемые компьютером носители могут включать отдельно или в комбинации программные команды, массивы данных и структуры данных. Программные команды, записанные на носителях, могут быть компонентами, специально разработанными для настоящего изобретения, или могут быть использованы специалистом в соответствующей области. Читаемые компьютером носители включают магнитные носители, такие как жесткий диск, дискета и магнитная лента, оптические носители, такие как CD-ROM и DVD, магнитооптические носители, такие как гибкий магнитооптический диск, и аппаратные устройства, такие как ROM, RAM, и флэш-память, специально разработанная для хранения и выполнения программ. Программные команды включают не только машинные коды, полученные компилятором, но также коды высокого уровня, которые могут использоваться интерпретирующей программой и пр., которая выполняется компьютерным устройством. Вышеуказанное аппаратное устройство может работать более как программный модуль для выполнения технических признаков настоящего изобретения, и они могут делать то же самое в противном случае.
Как видно из вышеуказанного, настоящее изобретение было конкретно описано по таким вопросам, как конкретные компоненты, ограниченные варианты осуществления и фигуры. Хотя настоящее изобретение было показано и описано в отношении предпочтительных вариантов осуществления, однако специалисты в данной области техники могут оценить, что различные изменения и модификации можно сделать без отклонения от сущности и объема настоящего изобретения, определенного в следующей формуле изобретения.
Следовательно, настоящее изобретение не должно ограничиваться объясненными предпочтительными или типичными вариантами осуществления, и следующая патентная формула, а также все, включая равные или эквивалентные патентной формуле варианты, относится к категории настоящего изобретения.
Реферат
Изобретение относится к технологии доставки лекарственного средства. Описан кавитационный зародыш, чтобы вызвать кавитацию для создания полости около эпидермиса живого организма, содержащий: оболочку, которая образует его наружную поверхность для поддержания его внешней формы в жидкости; и ядро, которое находится внутри оболочки и которое определяет плавучесть кавитационного зародыша в жидкости, причем кавитационный зародыш вызывает кавитацию под воздействием ультразвуковых волн, излучаемых в жидкость, причем ядро содержит газ на основе перфторуглерода, причем жидкость представляет собой водный раствор, содержащий лекарственное вещество, а оболочка образована объединением (i) по меньшей мере одного нейтрального фосфолипида, выбранного из первой группы, включающей DLPC (1,2-дилауроил-sn-глицеро-3-фосфохолин), DMPC (1,2-димиристоил-sn-глицеро-3-фосфохолин), DPPC (1,2-дипальмитоил-sn-глицеро-3-фосфохолин), DSPC (1,2-дистеароил-sn-глицеро-3-фосфохолин), DOPC (1,2-диолеоил-sn-глицеро-3-фосфохолин), DMPE (1,2-димиристоил-sn-глицеро-3-фосфоэтаноламин), DPPE (1,2-дипальмитоил-sn-глицеро-3-фосфоэтаноламин), DOPE (1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин), и (ii) по меньшей мере одного отрицательного полярного фосфолипида, выбранного из второй группы, включающей DMPA-Na (1,2-димиристоил-sn-глицеро-3-фосфат), DPPA-Na (1,2-дипальмитоил-sn-глицеро-3-фосфат), DOPA-Na (1,2-диолеоил-sn-глицеро-3-фосфат), DMPG-Na (1,2-димиристоил-sn-глицеро-3-фосфоглицерин), DPPG-Na (1,2-дипальмитоил-sn-глицеро-3-фосфоглицерин), DOPG-Na (1,2-диолеоил-sn-глицеро-3-фосфоглицерин), DMPS-Na (1,2-димиристоил-sn-глицеро-3-фосфосерин), DPPS-Na (1,2-дипальмитоил-sn-глицеро-3-фосфосерин), DOPS-Na (1,2-диолеоил-sn-глицеро-3-фосфосерин), DOPE-глутарил-(Na)(1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин), тетрамиристоилкардиолипин-(Na), DSPE-mPEG-2000-Na (1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин), DSPE-mPEG-5000-Na, DSPE-малеинимид PEG-2000-Na и DOTAP-Cl (1,2-диолеоил-3-триметиламмония пропан). Технический результат – обеспечение кавитационных зародышей, которые можно перемещать в положение, близкое к эпидермису, при помощи силы тяжести или электрического поля, максимизирование эффекта доставки лекарственных средств. 3 н. и 16 з.п. ф-лы, 12 ил.

Комментарии