Композитная матрица микроигл, содержащая на поверхности наноструктуры - RU2570280C2
Код документа: RU2570280C2
Чертежи















Описание
Перекрестная ссылка на родственные заявки
Для данной заявки испрашивается приоритет по предшествующей предварительной заявке на патент США, серийный номер 61/328,723, зарегистрированной 28 апреля 2010 г., предварительной заявке на патент США, серийный номер 61/411,071, зарегистрированной 8 ноября 2010 г., и предварительной заявке на патент США, серийный номер 61/435,939, зарегистрированной 25 января 2011 г., содержание которых полностью включено в настоящий документ в качестве ссылки.
Уровень техники
Основные способы доставки лекарственных средств включают пероральный способ введения и инъекции, но эти способы сталкиваются с трудностями. Например, инъекции болезненны, и оба способа имеют тенденцию доставки пиковых количеств препаратов, а не предпочтительной неизменной доставки. Кроме того, успешное долгосрочное использование и перорального способа введения, и доставки путем инъекций требуют от пациента постоянного соответствия временным требованиям способа доставки.
Разработаны вещества для трансдермальной доставки с целью обеспечить безболезненный путь доставки активных препаратов за удовлетворительный период времени с незначительным или без нарушения распорядка дня пациента. К сожалению, естественные характеристики дермы, такие как наложение рогоцитов рогового слоя, плотные контакты зернистого слоя и клетки Лангерганса шиповатого слоя, которые могут вызывать иммунный ответ и/или реакцию на инородное тело, представляют собой барьеры для успешной трансдермальной доставки активного препарата.
Устройства, содержащие микроиглы, которые могут облегчать трансдермальную доставку активных препаратов, обладают улучшенной трансдермальной доставкой. Трансдермальное устройство с микроиглами содержит матрицу игл, которые могут проникать по меньшей мере через роговой слой кожи и достигать нижележащих слоев кожи. В некоторых устройствах микроиглы предназначены для проникновения на глубину, на которой не стимулируются нервные окончания, и устанавливается ответ на боль. Примеры устройств с микроиглами предложены в патенте США №6,334,856, Allen, et al, и патенте США №7,226,439, Prausnitz, et al., которые включены в настоящий документ в качестве ссылки.
К сожалению, даже с введением микроигл в трансдермальные устройства, в настоящее время они остаются ограниченными доставкой препаратов с низкой молекулярной массой, которые обладают умеренной липофильностью и не имеют заряда. Даже при успешном пересечении естественной границы дермы проблемы все еще остаются в отношении поддержания уровня активности доставляемых препаратов и устранения реакции на инородное тело и иммунного ответа.
Обнаружено, что нанотопография поверхности, примыкающей к клетке, влияет на характеристики адгезии между ними, а также на поведение клетки, включая морфологию, подвижность, структуру клеточного скелета, пролиферацию и дифференциацию (см., например, публикацию Hart, et al., European Cells and Materials, Vol. 10, Suppl. 2, 2005; Lim. et al. J R Soc Interface, March 22, 2005, 2(2), 97-108; Yim. et al. Biomaterials, September, 2005, 26(26), 5405-5413). В продолжение этого первоначального исследования изучали нанотопографию поддерживающих подложек для использования в разработке тканевой инженерии (см., например, заявку на патент США, №№. 2008/0026464, Borenstein, et al. и 2008/0311 172, Schapira, et al.).
Что необходимо в этой области, - это устройства улучшенной доставки лекарственных средств. Например, были бы полезны устройства, которые обеспечивают эффективную доставку активных препаратов, при этом снижая потенциальный иммунный ответ и реакцию на инородное тело, как устройства доставки, так и доставляемых препаратов.
Сущность изобретения
По одному варианту осуществления предлагается композитная матрица микроигл. Матрица может содержать сборку микроигл, которая включает опору с первой поверхностью и второй поверхностью, в которой множество микроигл продолжаются наружу из первой поверхности. Матрица также может содержать пленку, наложенную на микроиглы сборки, чтобы она по меньшей мере частично соответствовала форме микроигл. Пленка может обладать первой поверхностью и второй поверхностью. Первая поверхность пленки может быть приклеена к сборке микроигл, и вторая поверхность пленки может содержать множество наноструктур на ней, наноструктуры образуют заранее определенный узор.
Также предлагается способ создания композитной матрицы микроигл. Способ может включать наложение пленки поверх сборки микроигл и сцепление пленки со сборкой микроигл, что пленка по меньшей мере частично соответствовала по форме микроиглам матрицы и была приклеена к сборке микроигл.
Краткое описание чертежей
Полное и всесторонне описание сущности изобретения, включая его предпочтительный режим, предназначенное для специалистов в этой области, изложено более подробно далее в описании со ссылкой на приложенные чертежи, на которых:
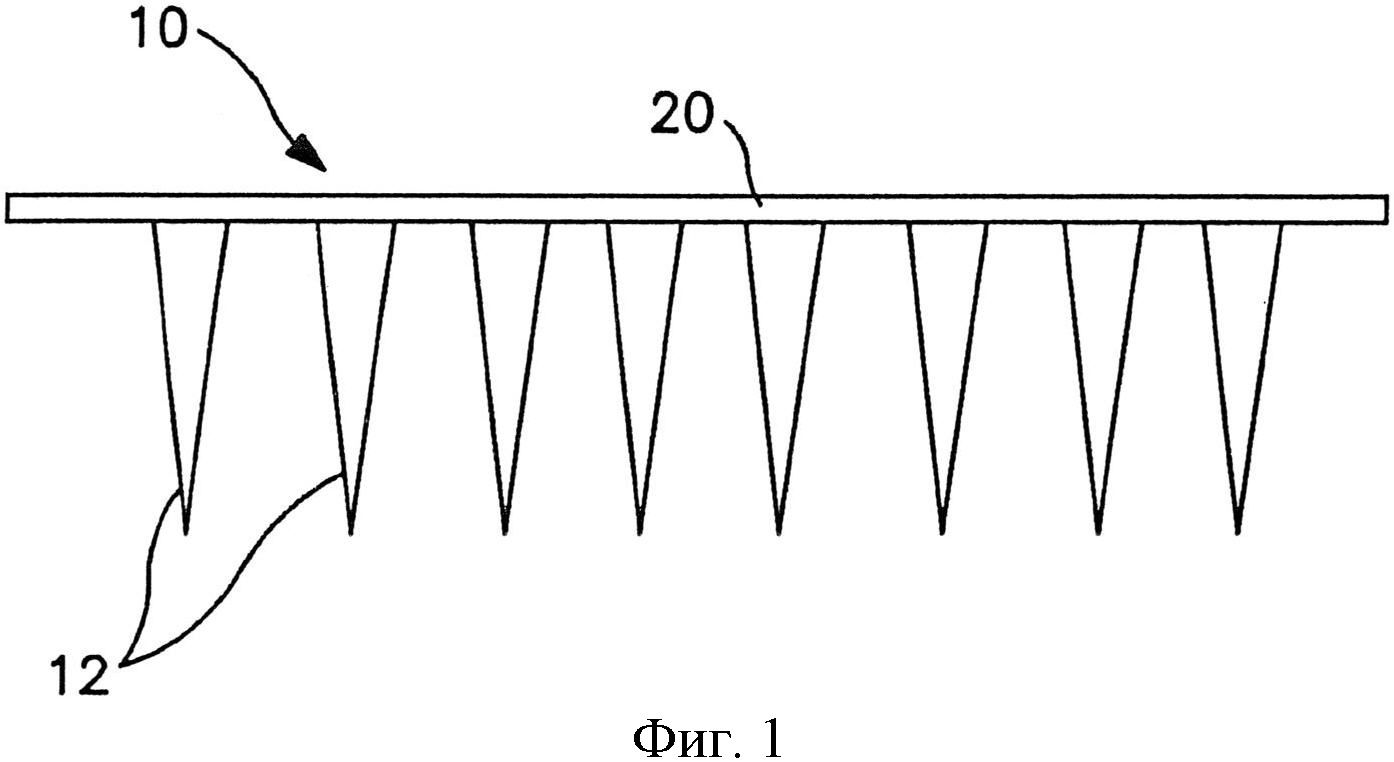
На фиг.1 схематично показан один вариант осуществления матрицы микроигл.
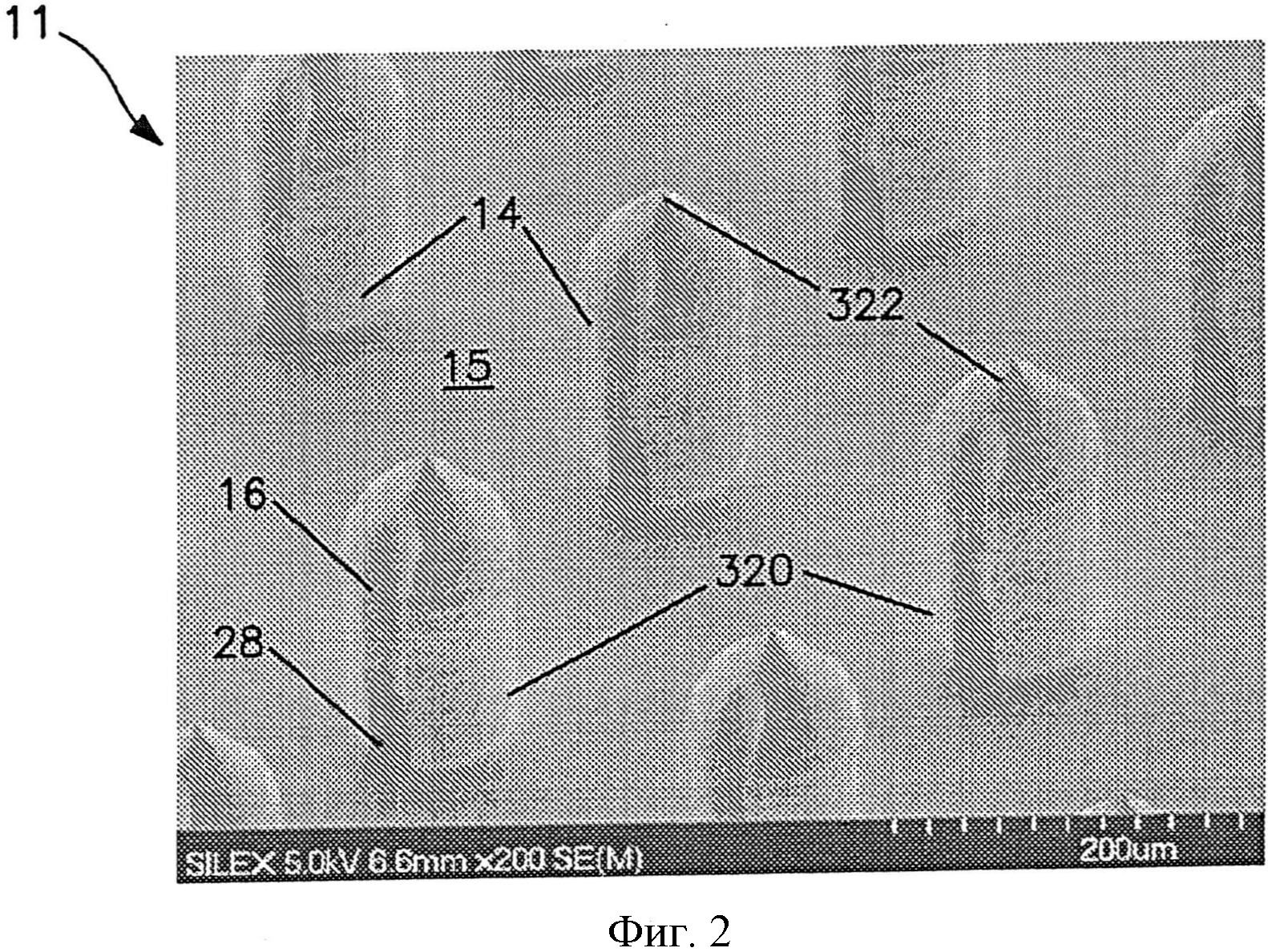
На фиг.2 показано изображение сканирующего электронного микроскопа (SEM) другого варианта осуществления матрица микроигл.
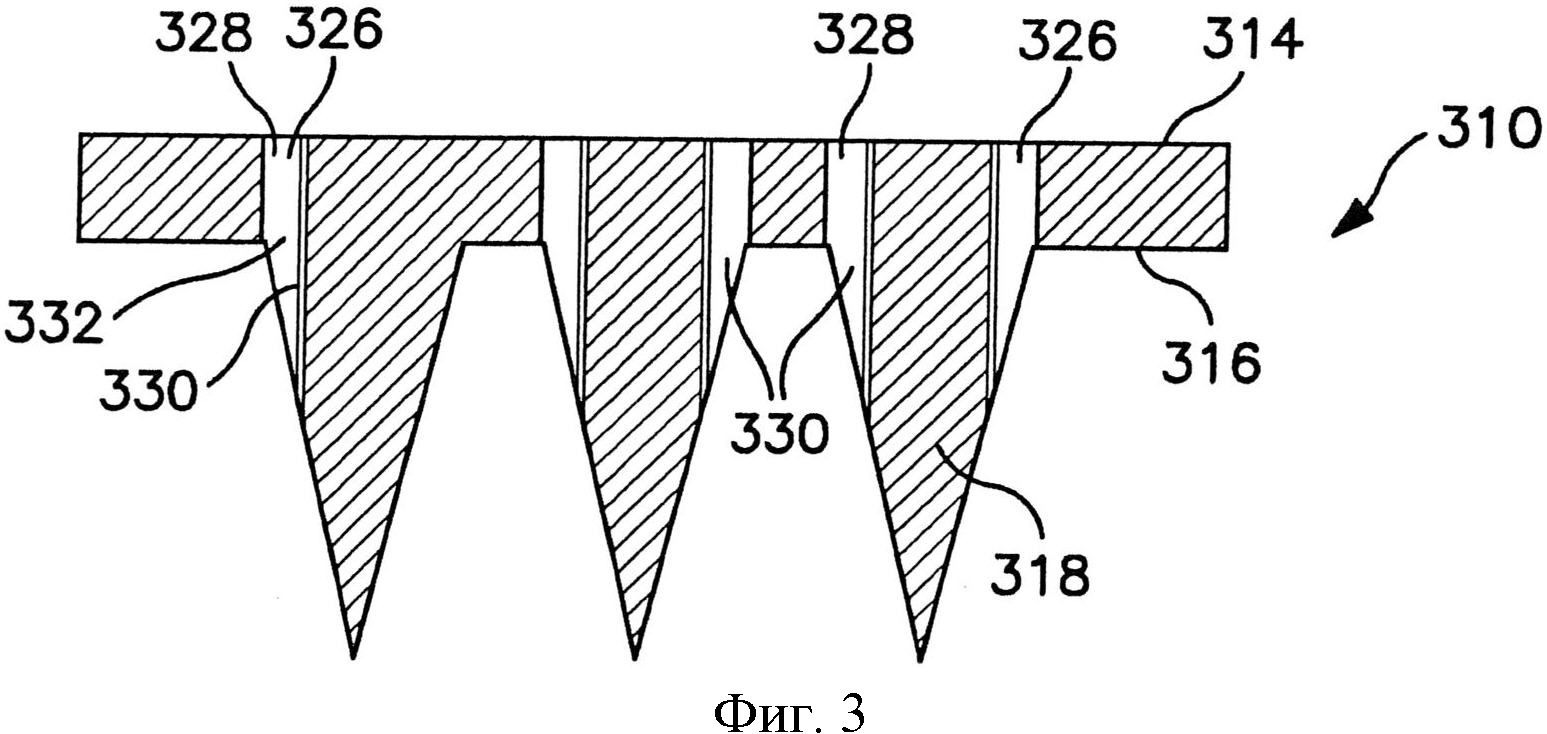
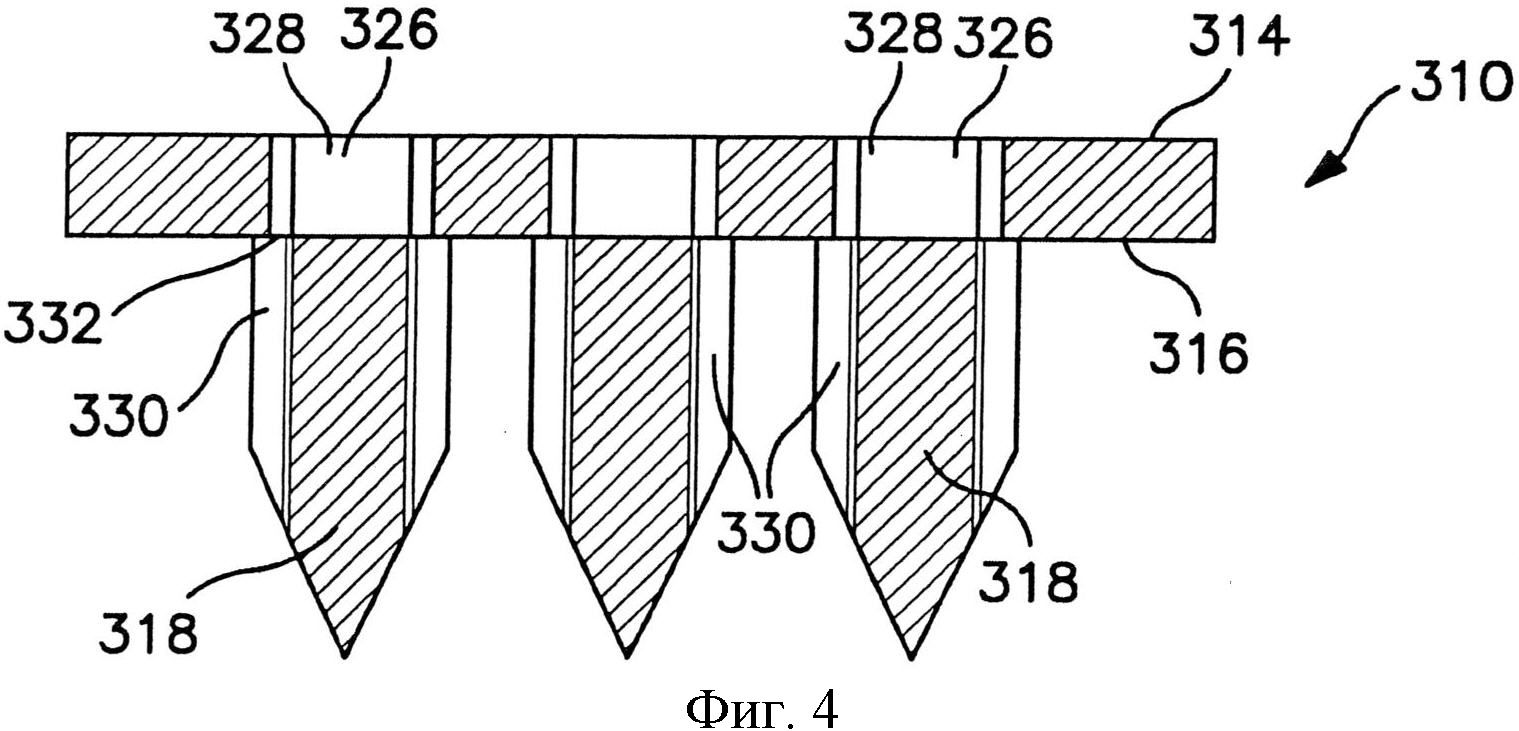
На фиг.3 и 4 показаны частичные виды в сечении матрицы микроигл, которые могут быть сформированы по одному варианту осуществления настоящего изобретения;
На фиг.5А и 5B показаны противоположные стороны пленки с наноузором, которая может быть наложена на матрица микроигл.
На фиг.6 показан один вариант осуществления сложного узора, который может быть сформирован на поверхности пленки.
На фиг.7 показан узор, включающий несколько повторений сложного узора по фиг.6.
На фиг.8A-8D показаны примеры сложной фрактальной и фракталоподобной нанотопографий.
На фиг.9 показан другой сложный узор, который может быть сформирован на поверхности пленки.
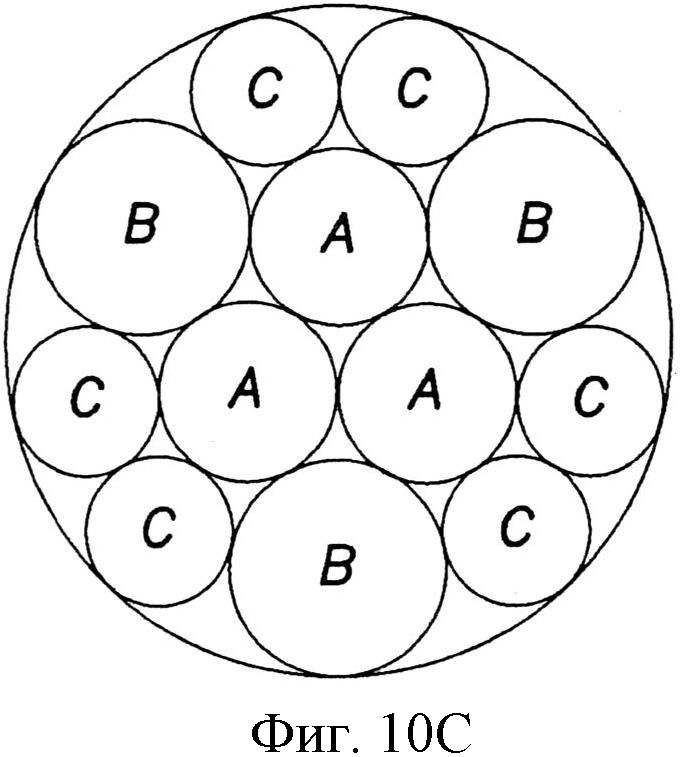
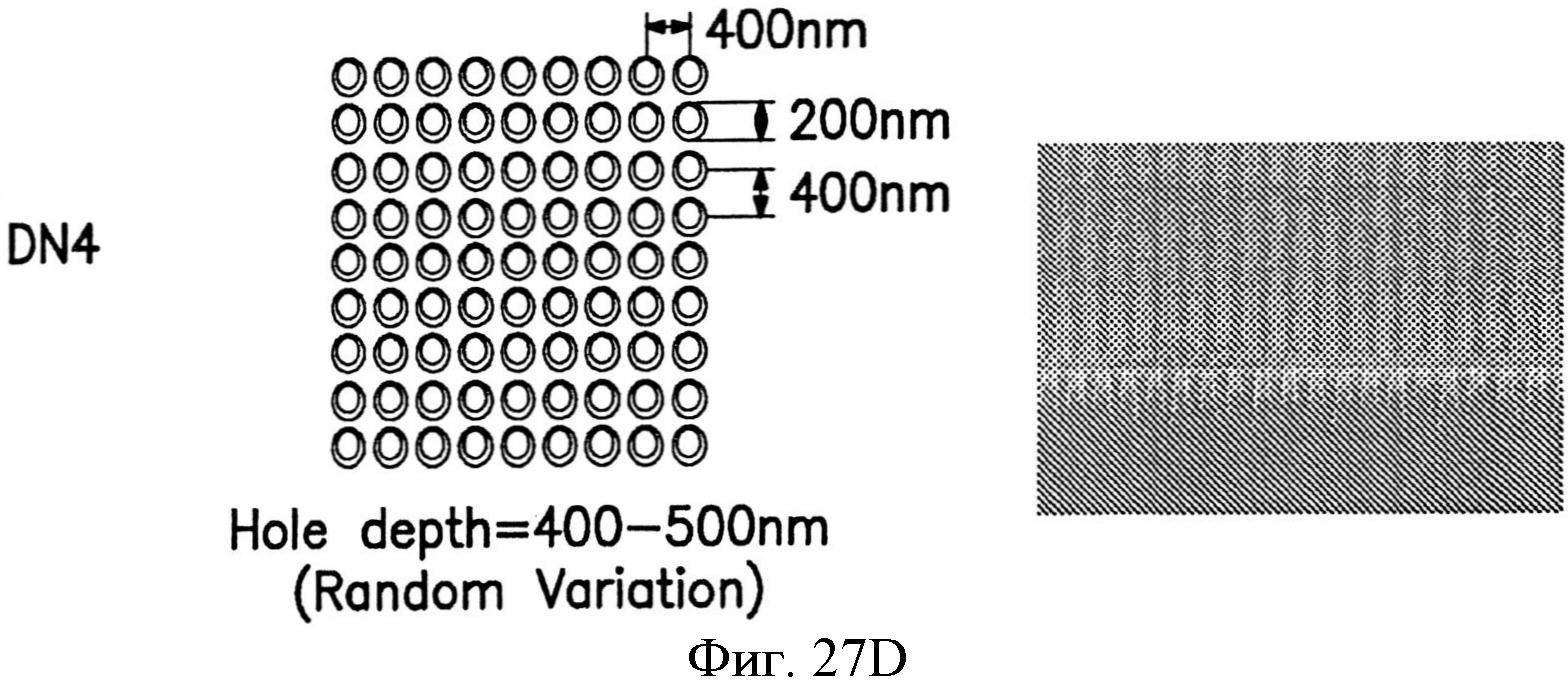
На фиг.10А-10С показаны примеры плотности упаковки, которые могут быть использованы для структур наноразмера, описанных в настоящем документе и содержащих узор с квадратной упаковкой (фиг.10А), узор с гексагональной упаковкой (фиг.10С) и узор с круговой упаковкой (фиг.10С).
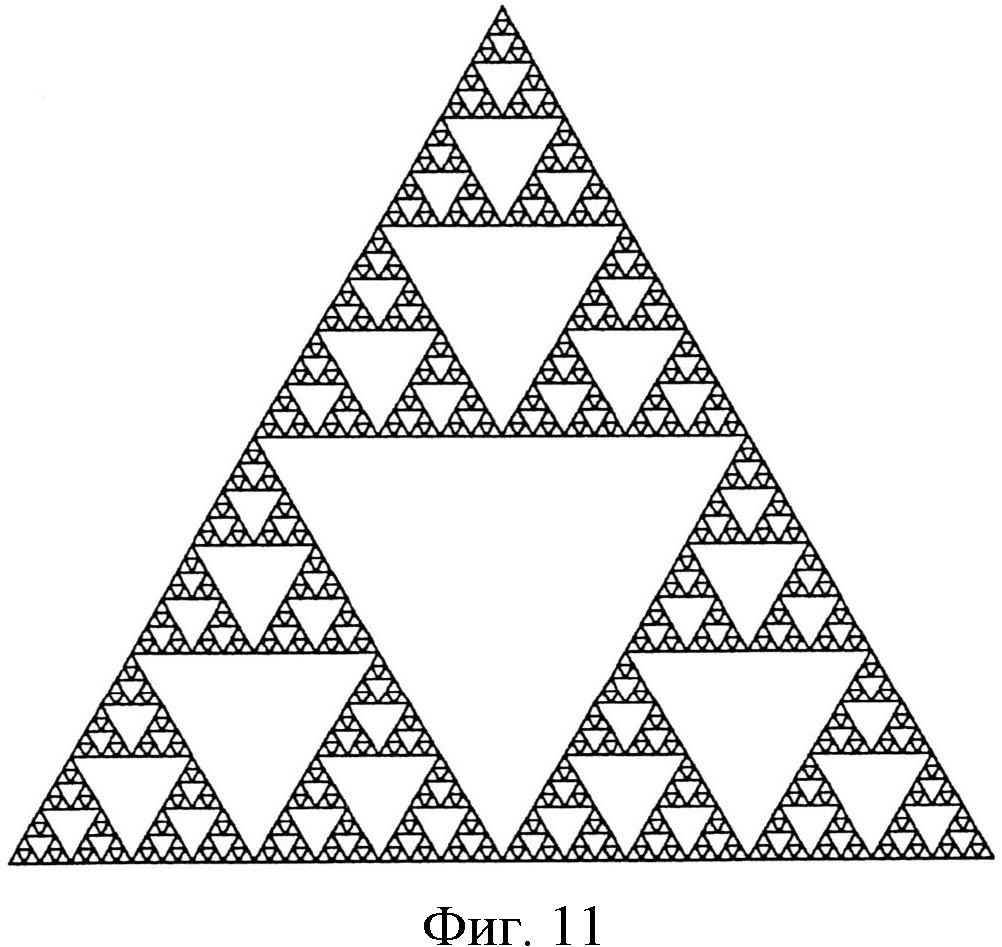
На фиг.11 показан фрактальный узор, также известной как треугольник Серпинского.
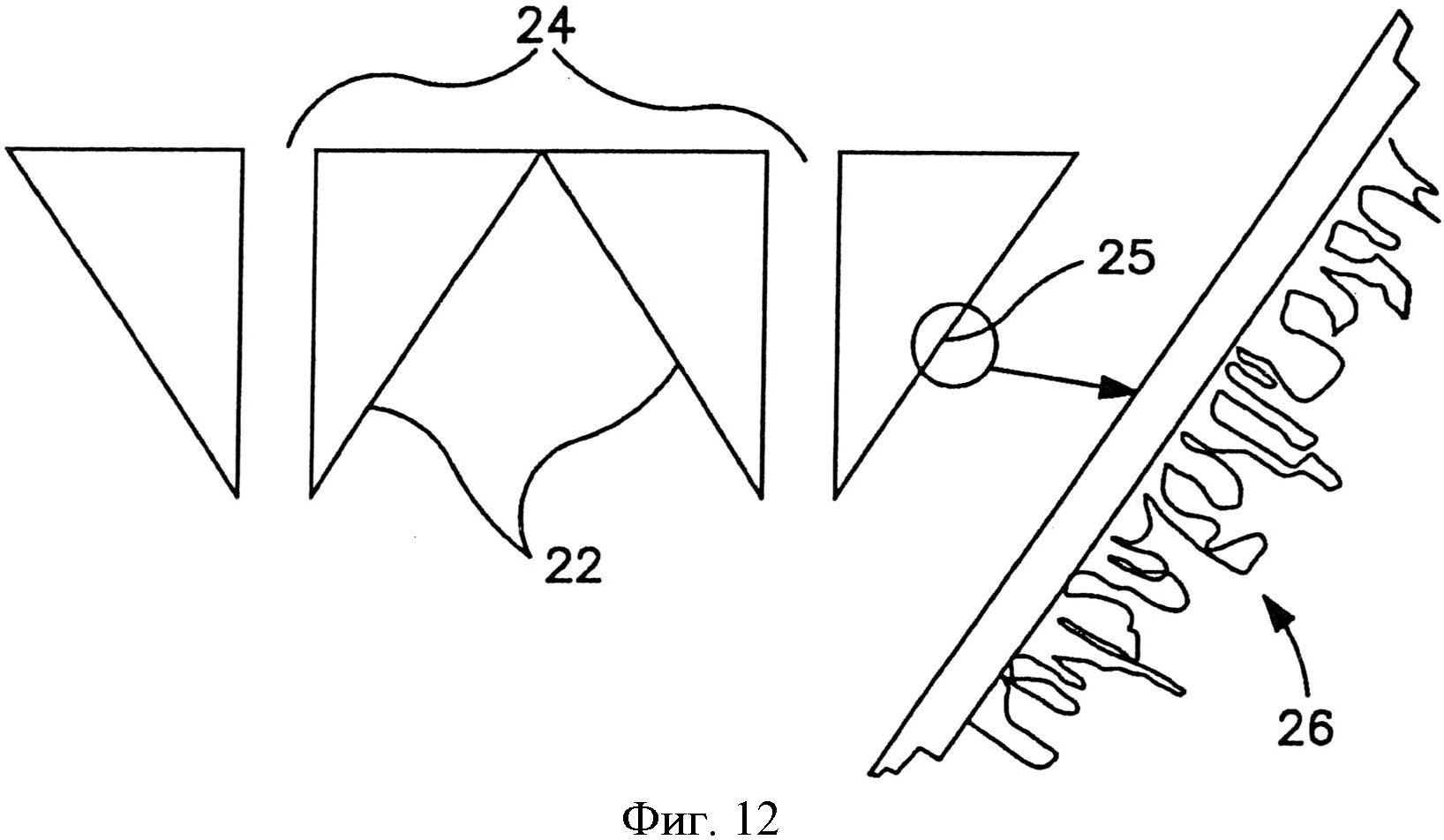
На фиг.12 схематично показан один вариант осуществления микроиглы, включая пленка на поверхности, образующую нанотопографию, которая может взаимодействовать с внеклеточной матрицей (ЕСМ).
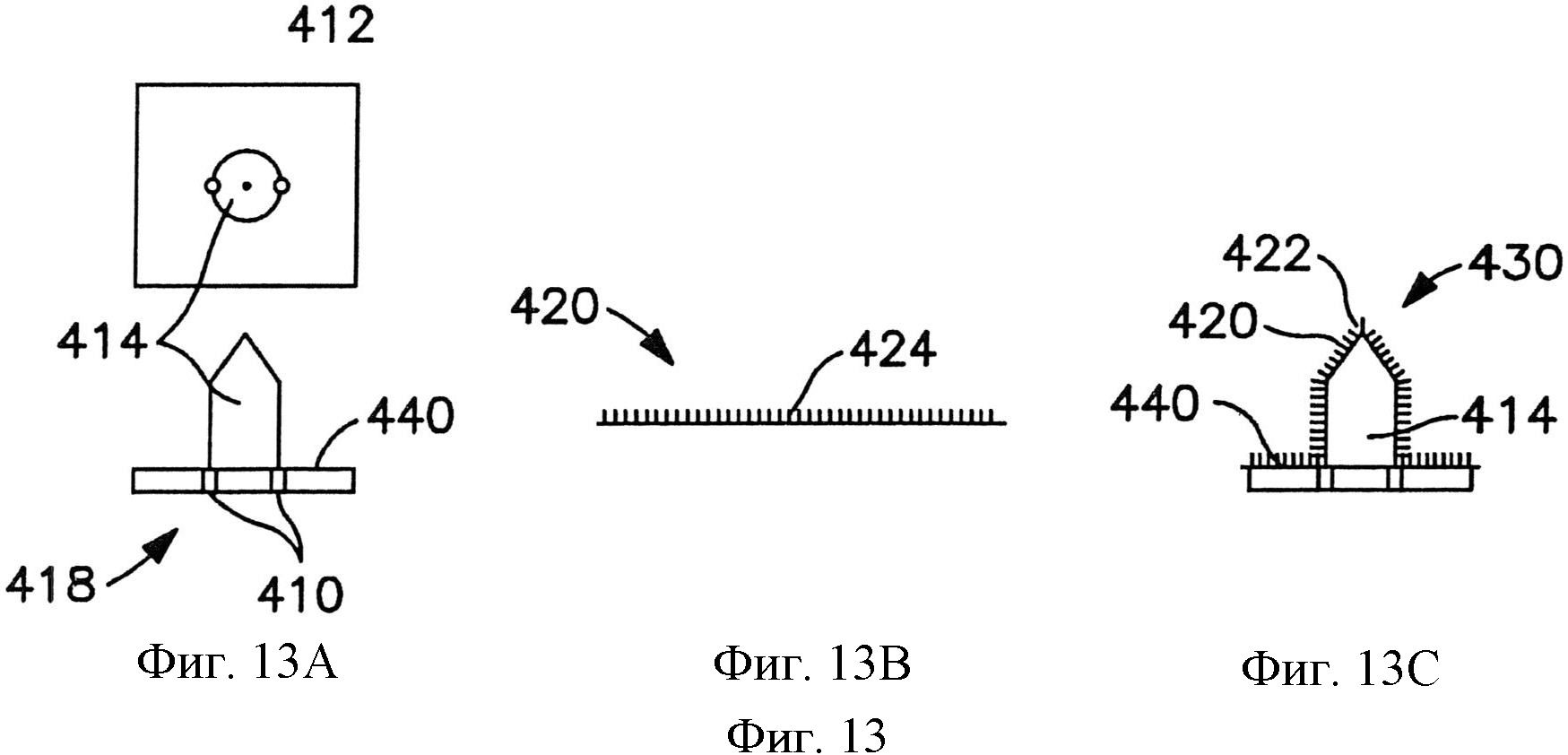
На фиг.13 схематично показан способ наложения пленки с наноузором поверх матрица микроигл для формирования композитная матрица микроигл.
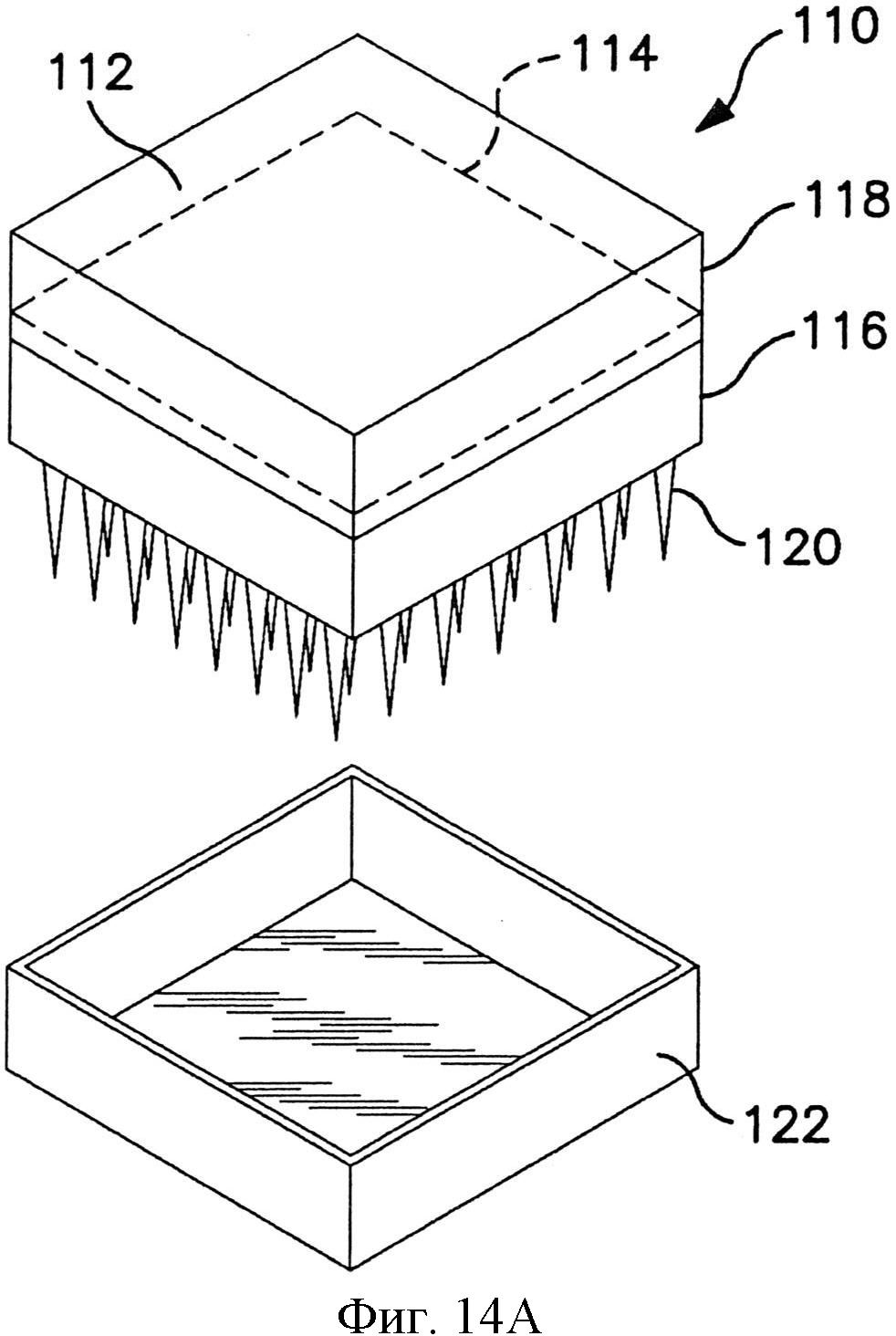
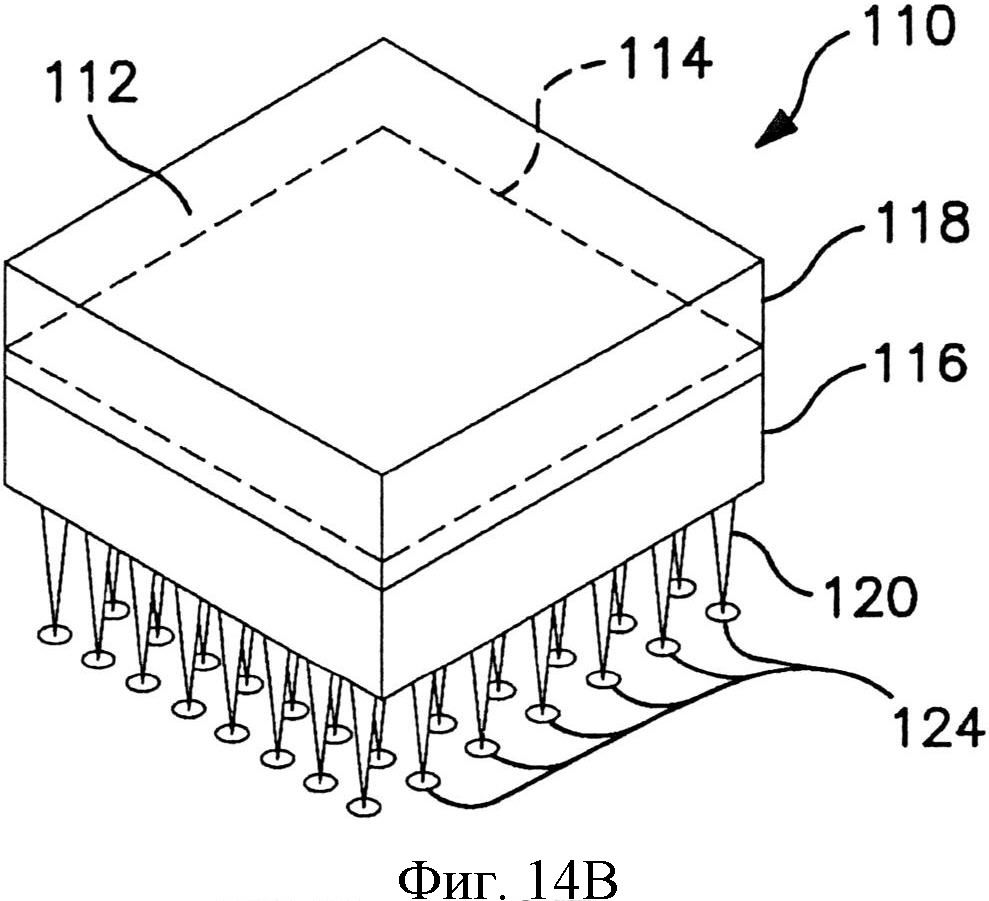
На фиг.14А и 14В схематично показан один вариант осуществления устройства доставки лекарственного средства в разобранном виде (фиг.14А) и в сборе (фиг.14С).
На фиг.15 показан вид в перспективе одного варианта осуществления трансдермального пластыря перед доставкой лекарственного соединения.
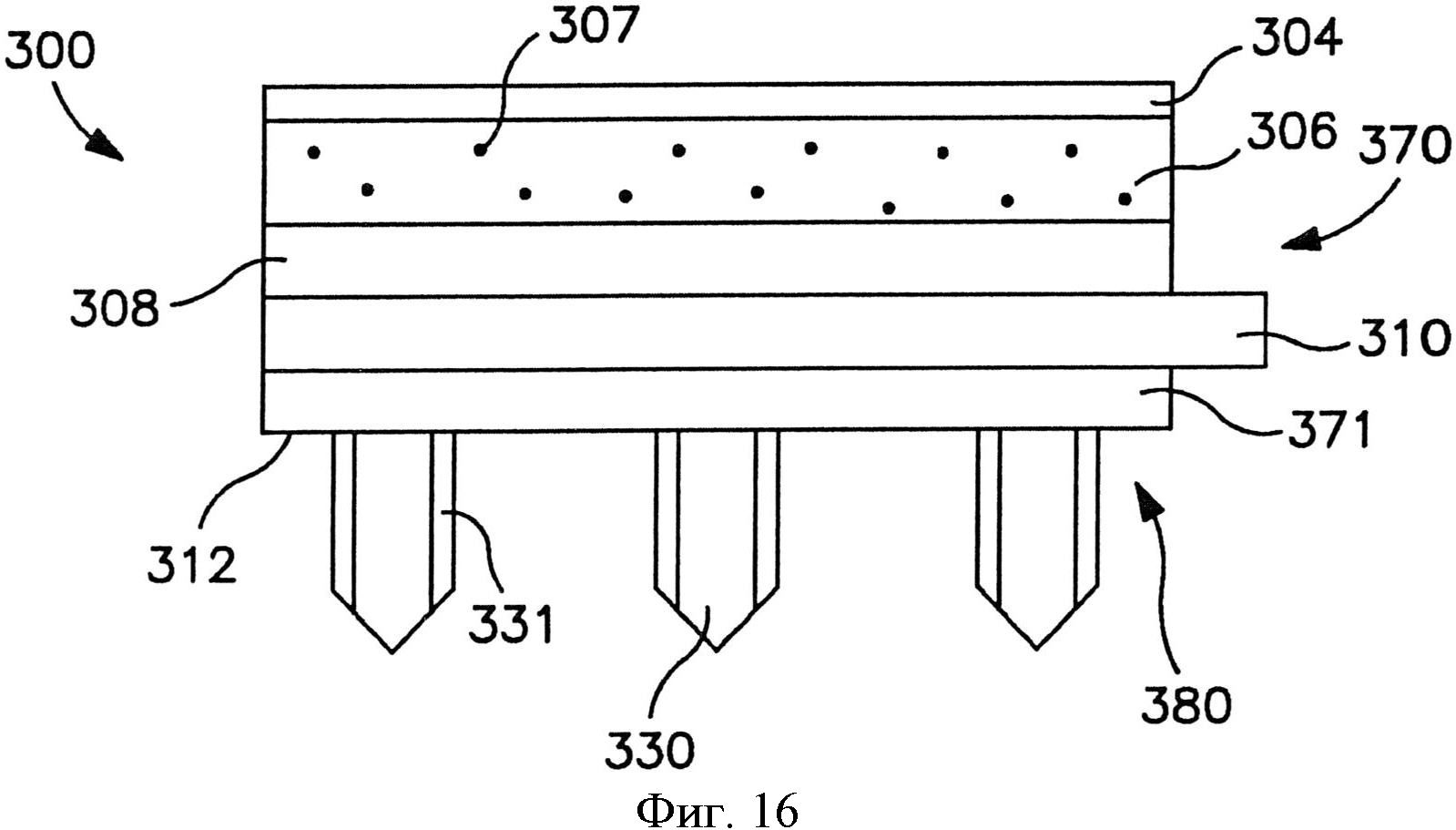
На фиг.16 показан вид спереди пластыря по фиг.15.
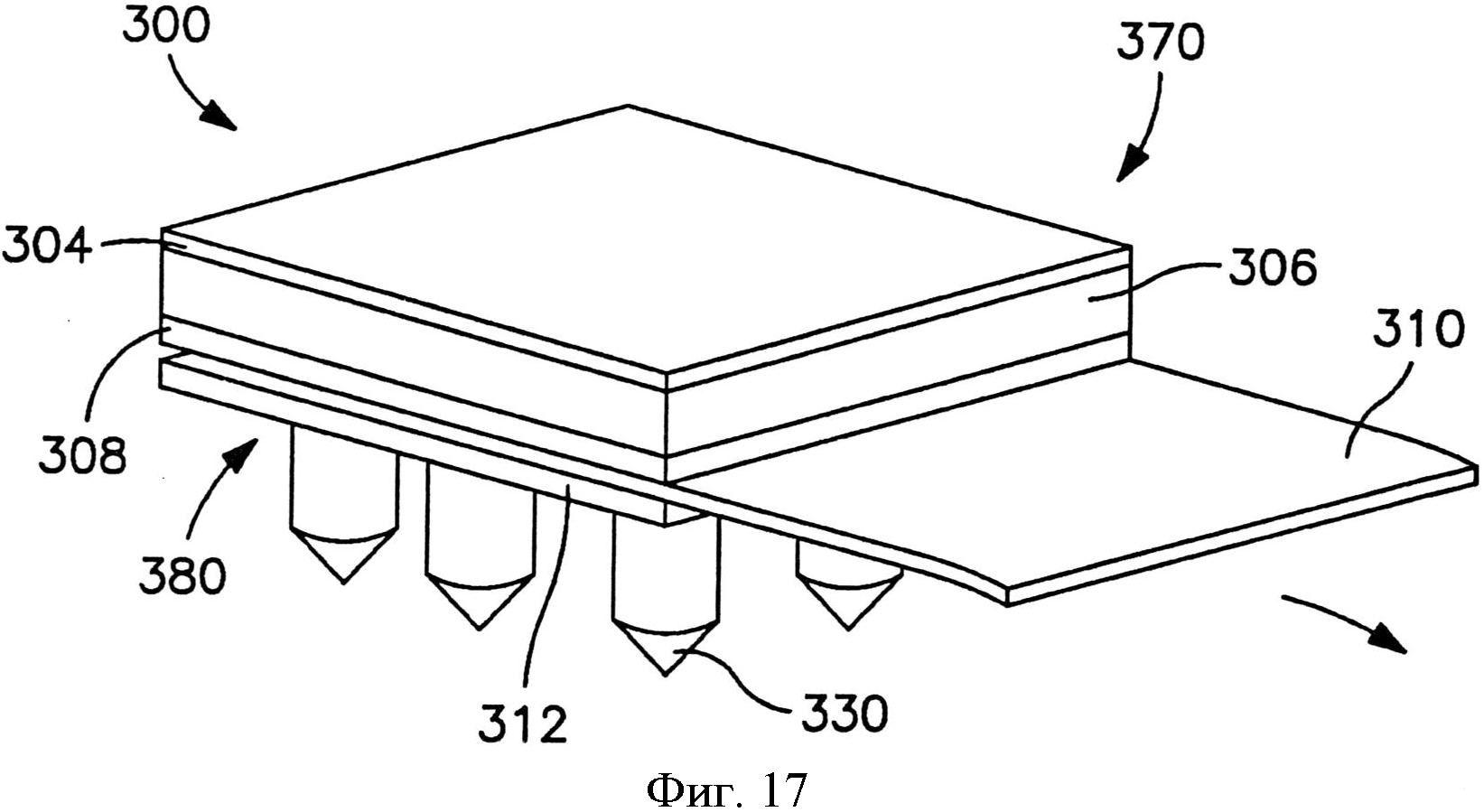
На фиг.17 показан вид в перспективе пластыря по фиг.15, в котором отсоединяемый элемент частично удален с пластыря.
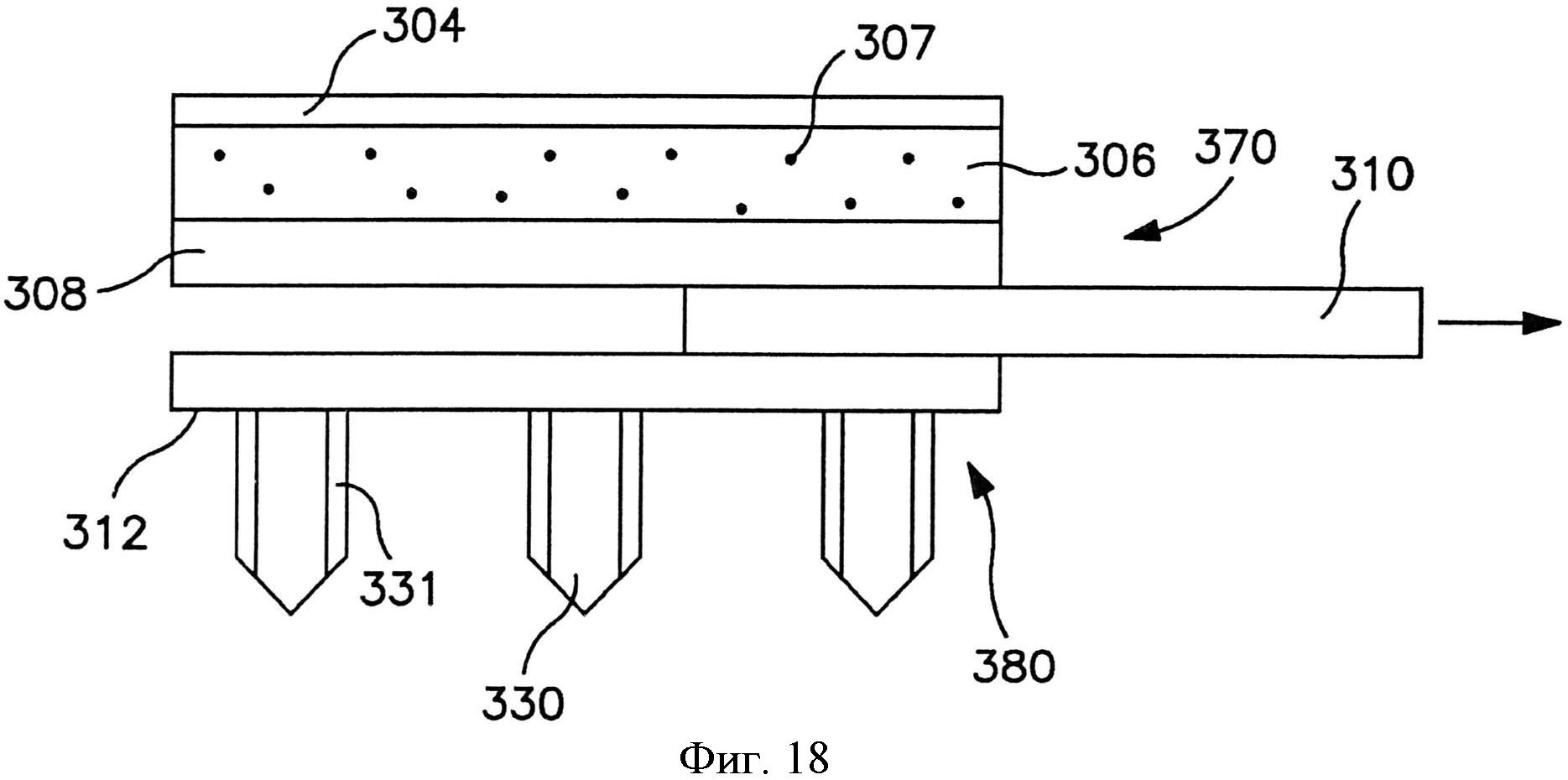
На фиг.18 показан вид спереди пластыря по фиг.15.
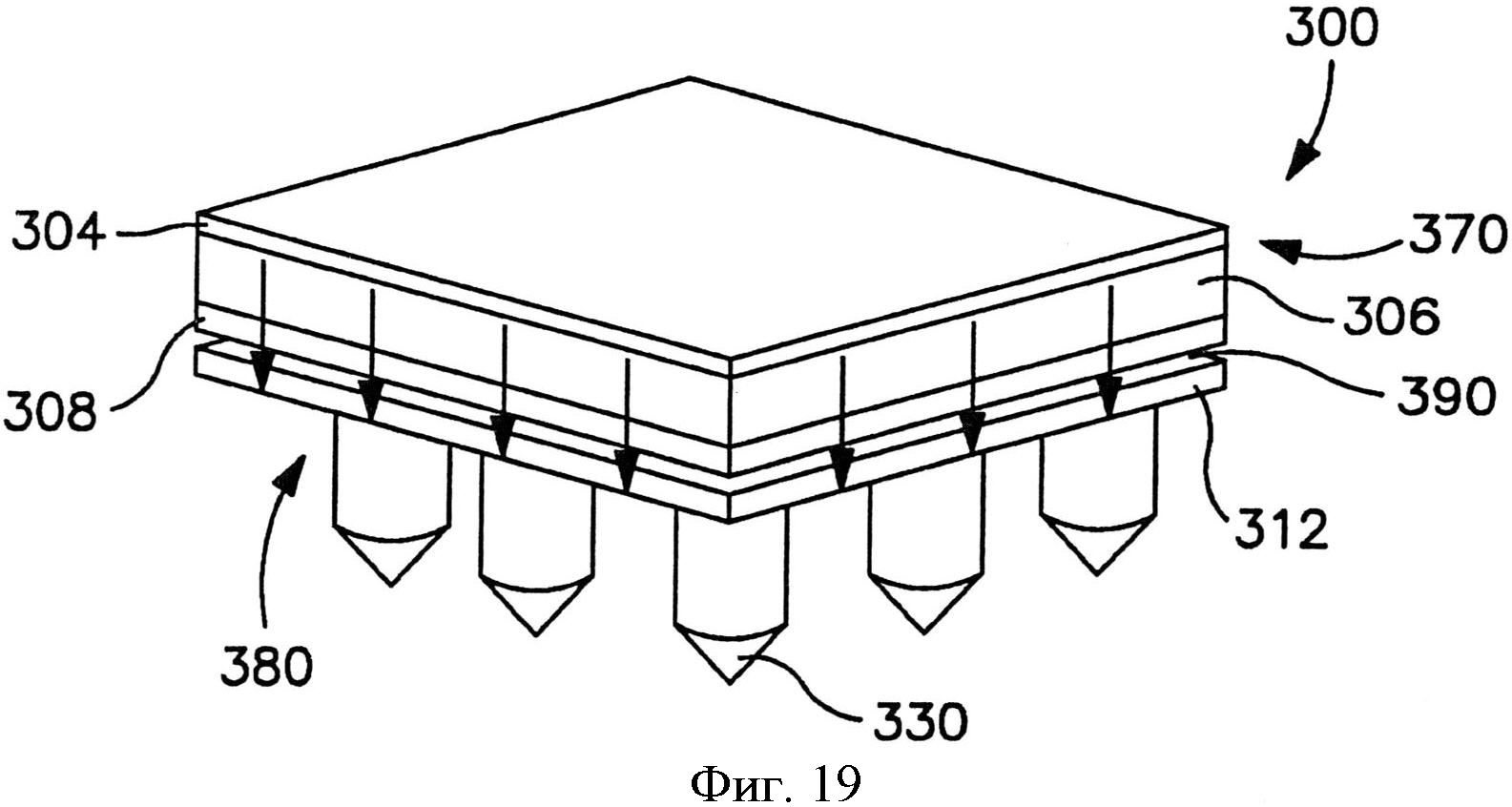
На фиг.19 показан вид в перспективе трансдермального пластыря по фиг.15 после удаления отсоединяемого элемента и во время использования.
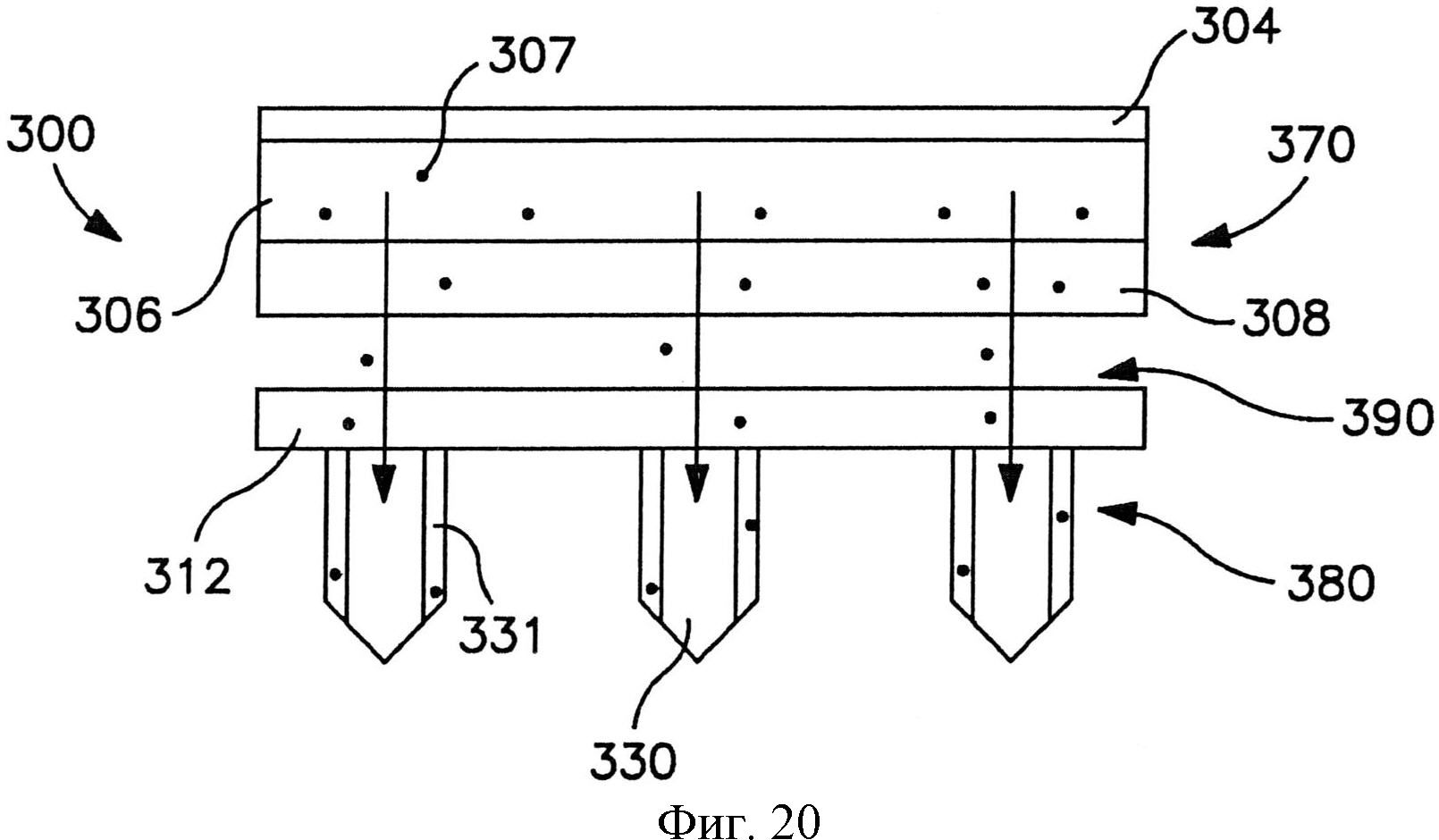
На фиг.20 показан вид спереди пластыря по фиг.9.
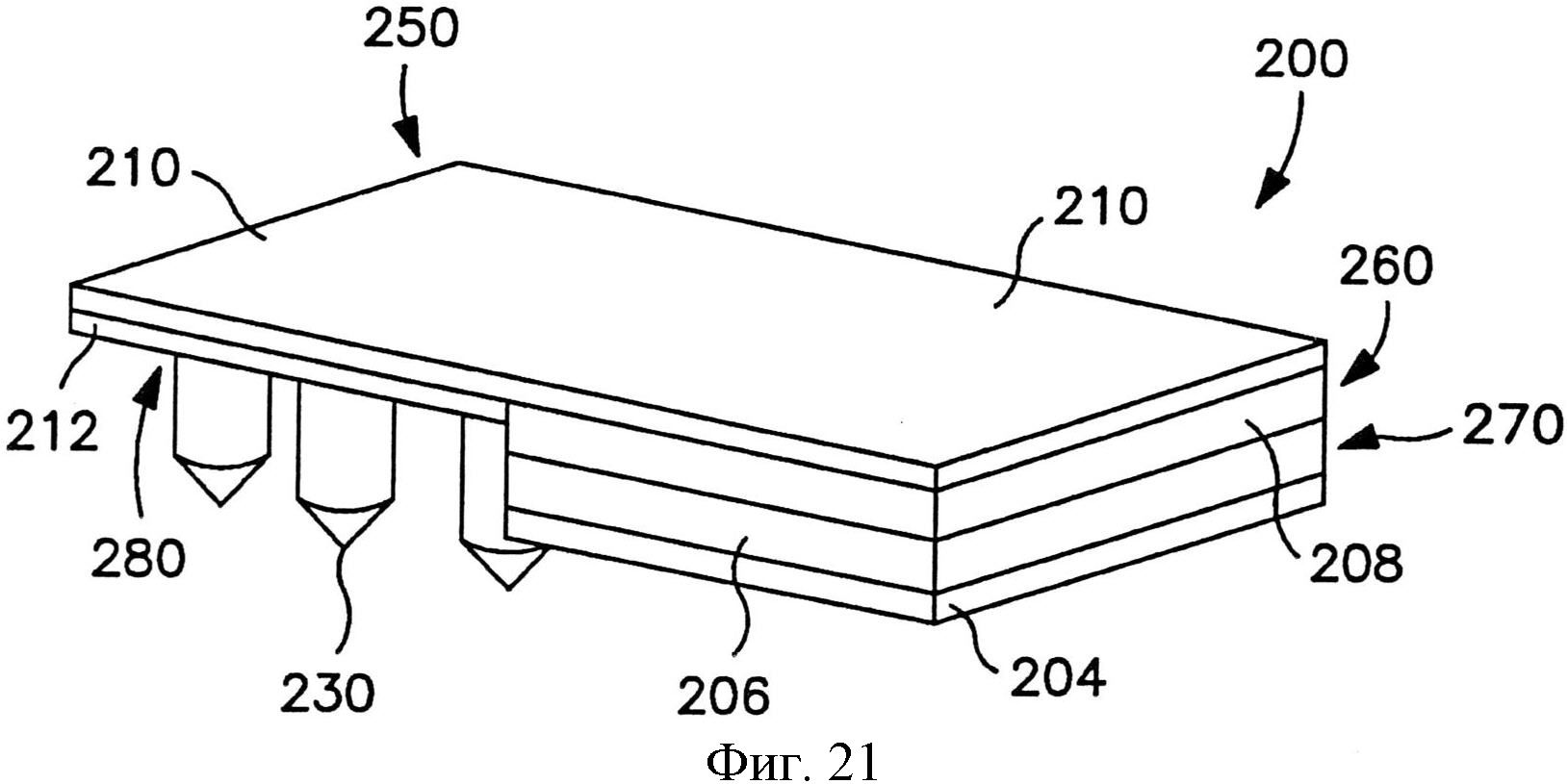
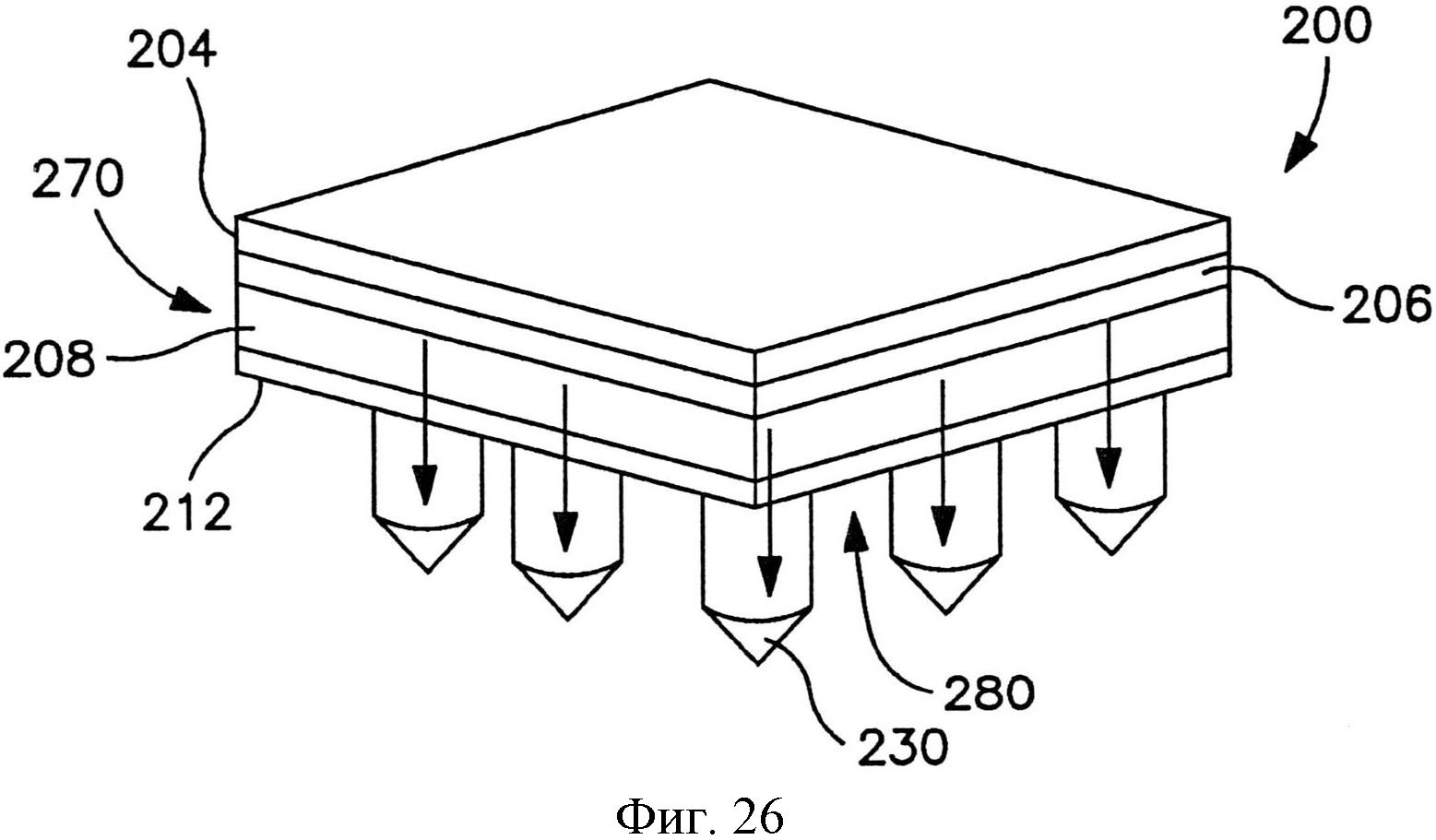
На фиг.21 показан вид в перспективе другого варианта осуществления трансдермального пластыря перед доставкой лекарственного соединения.
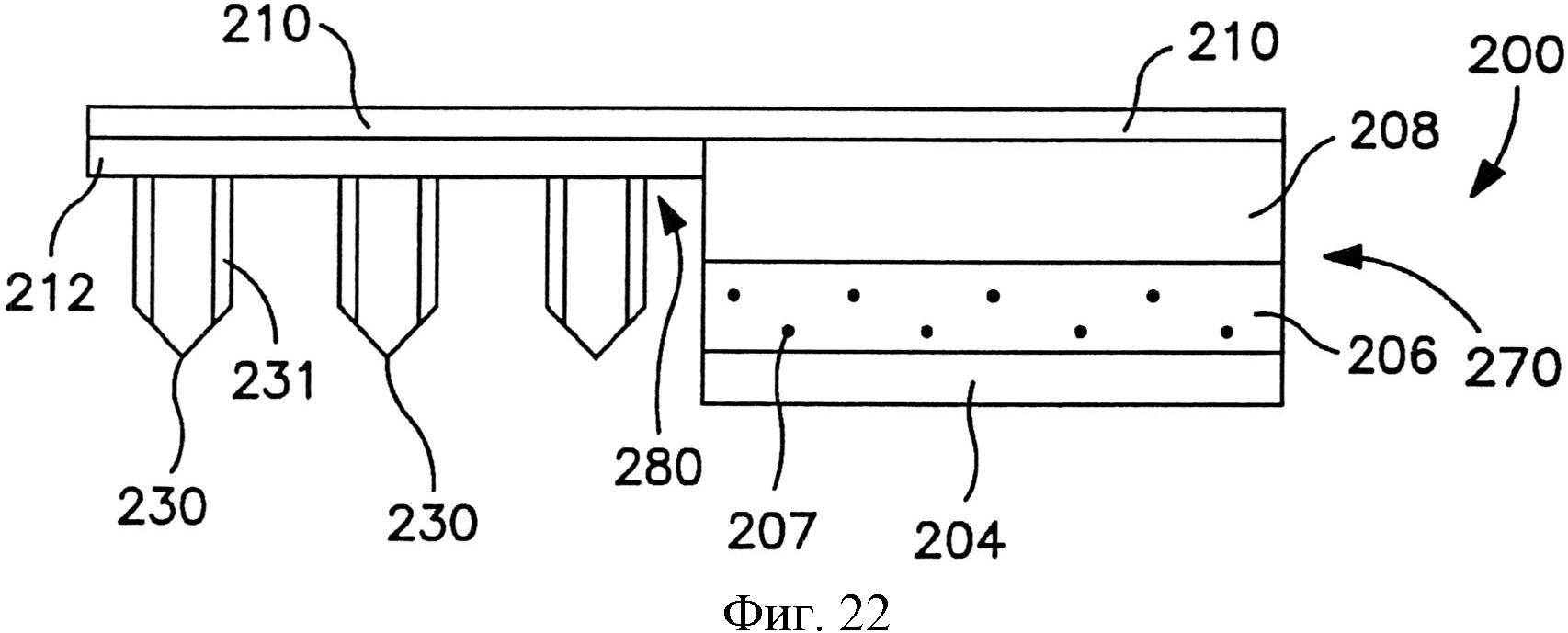
На фиг.22 показан вид спереди пластыря по фиг.21.
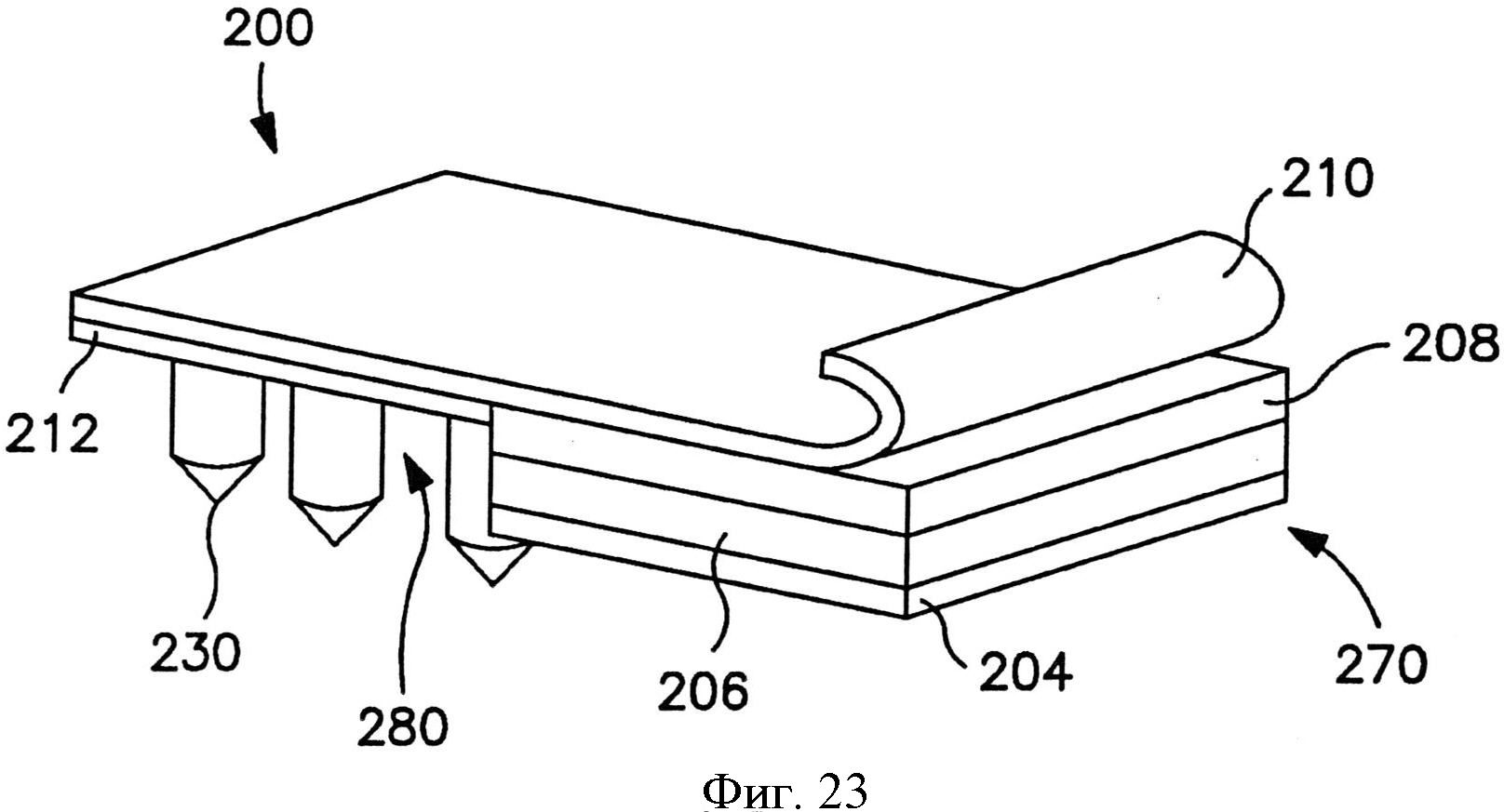
На фиг.23 показан вид в перспективе пластыря по фиг.21, в котором отсоединяемый элемент частично отодран от пластыря.
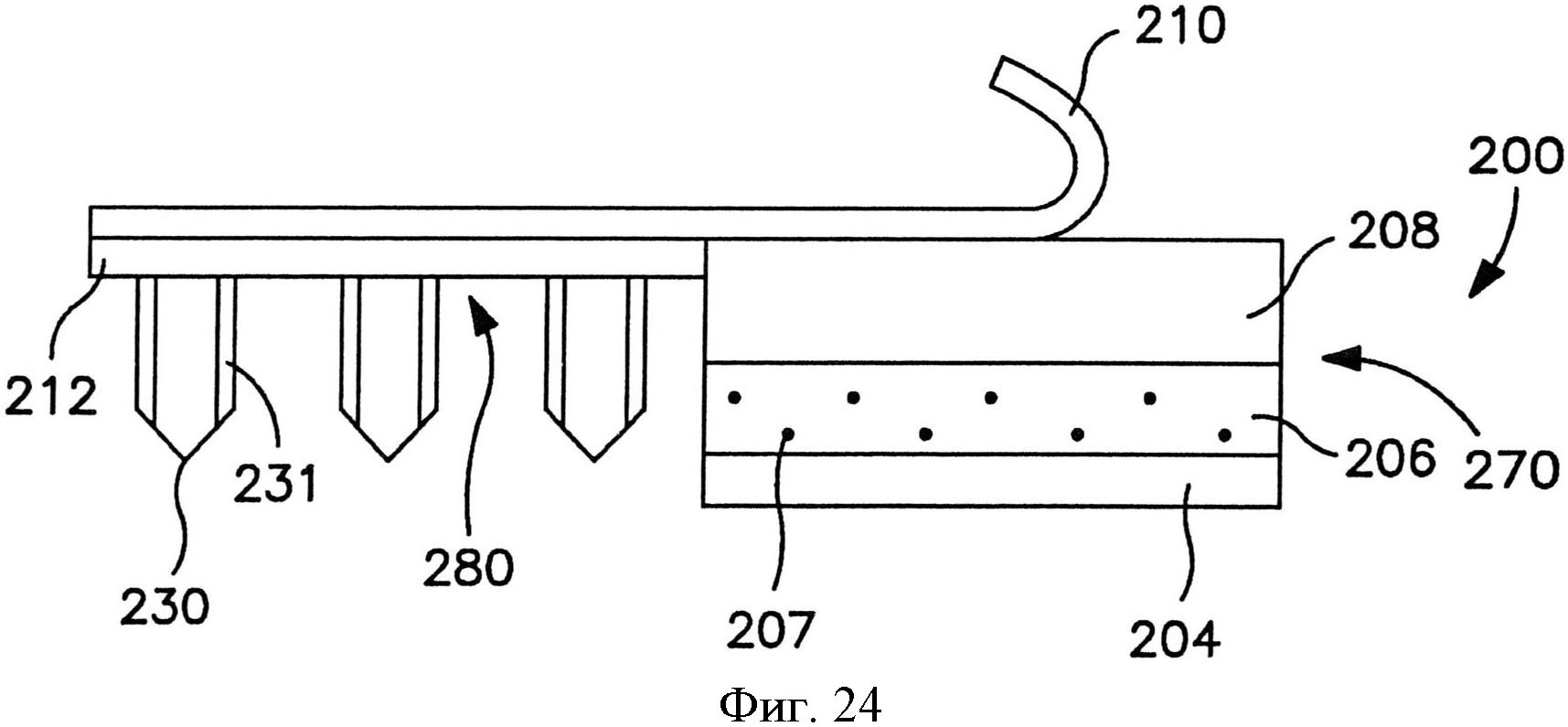
На фиг.24 показан вид спереди пластыря по фиг.23.
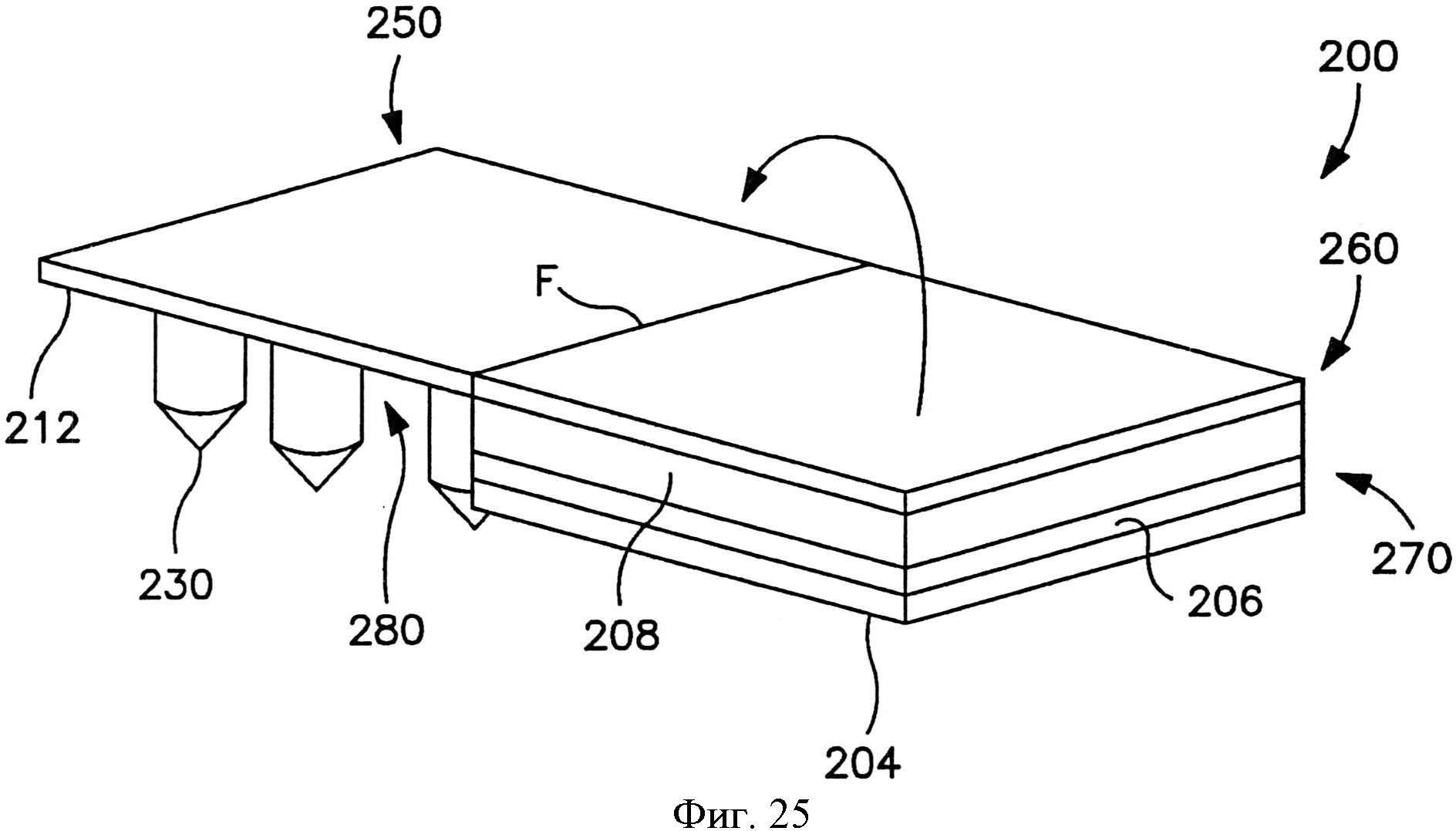
На фиг.25 показан вид в перспективе пластыря по фиг.21, в котором отсоединяемый элемент полностью отодран от пластыря.
На фиг.26 показан вид в перспективе трансдермального пластыря по фиг.21 после удаления отсоединяемого элемента и во время использования.
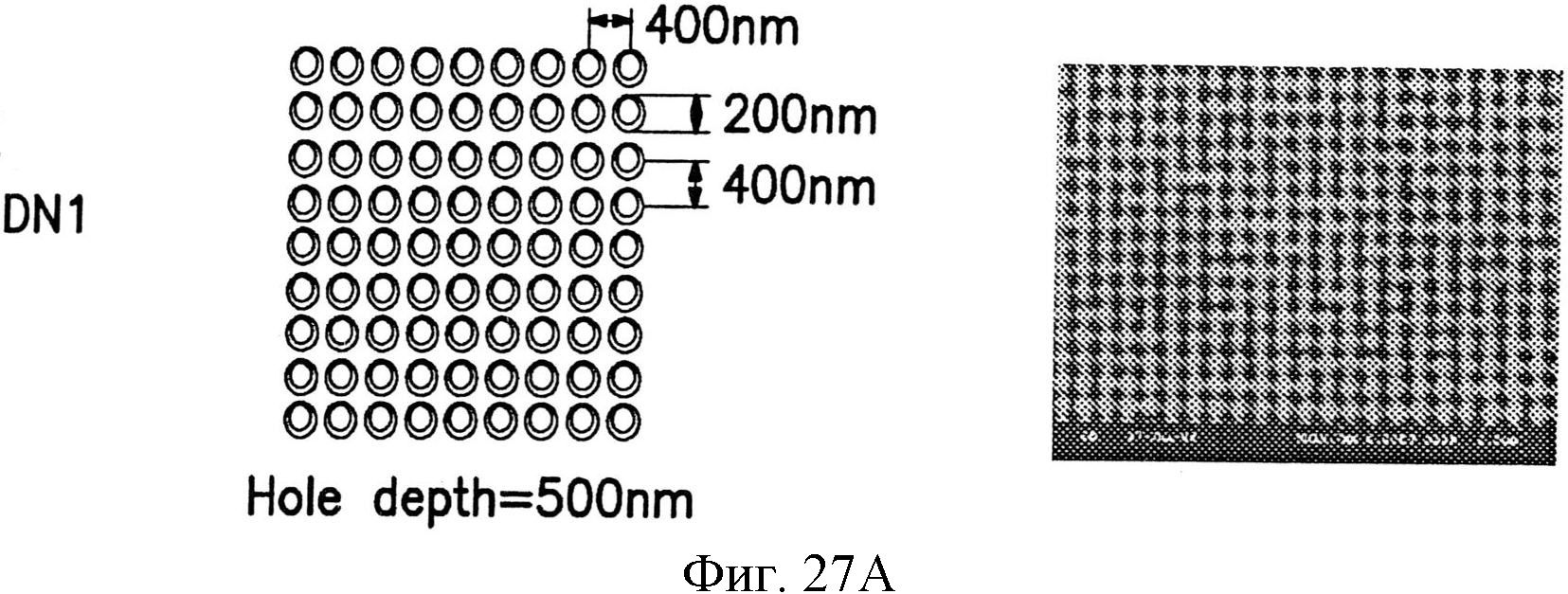
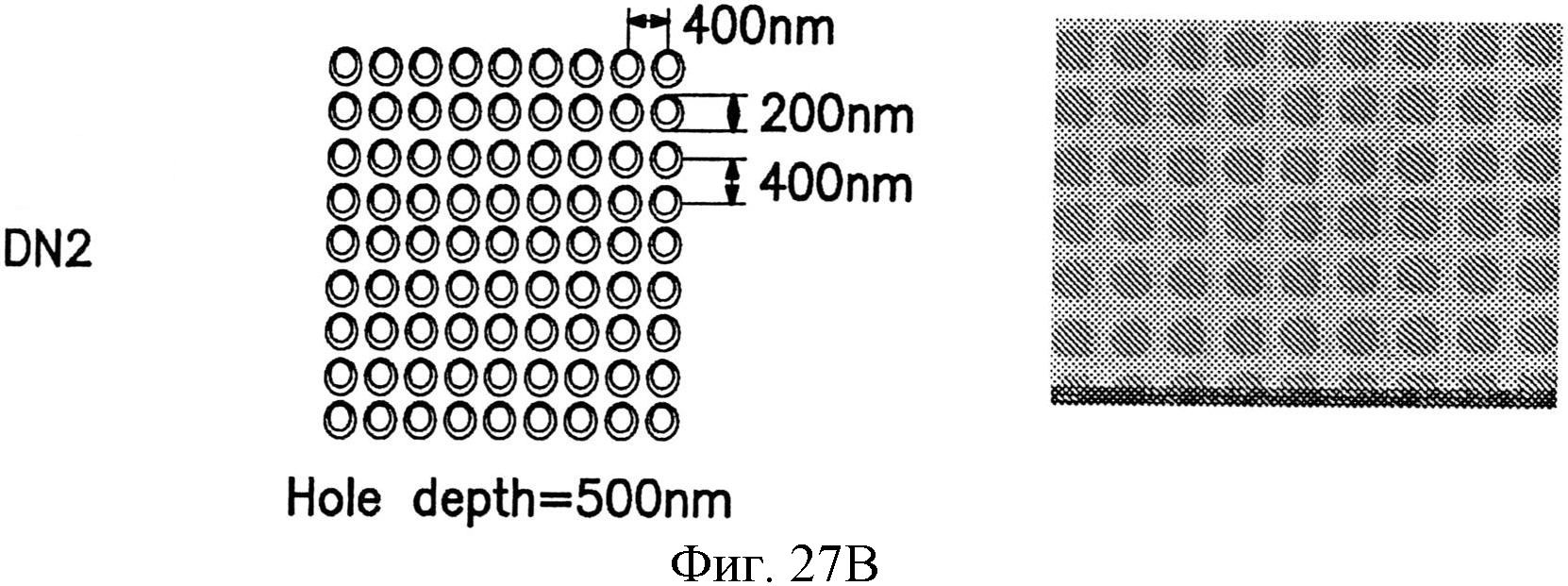
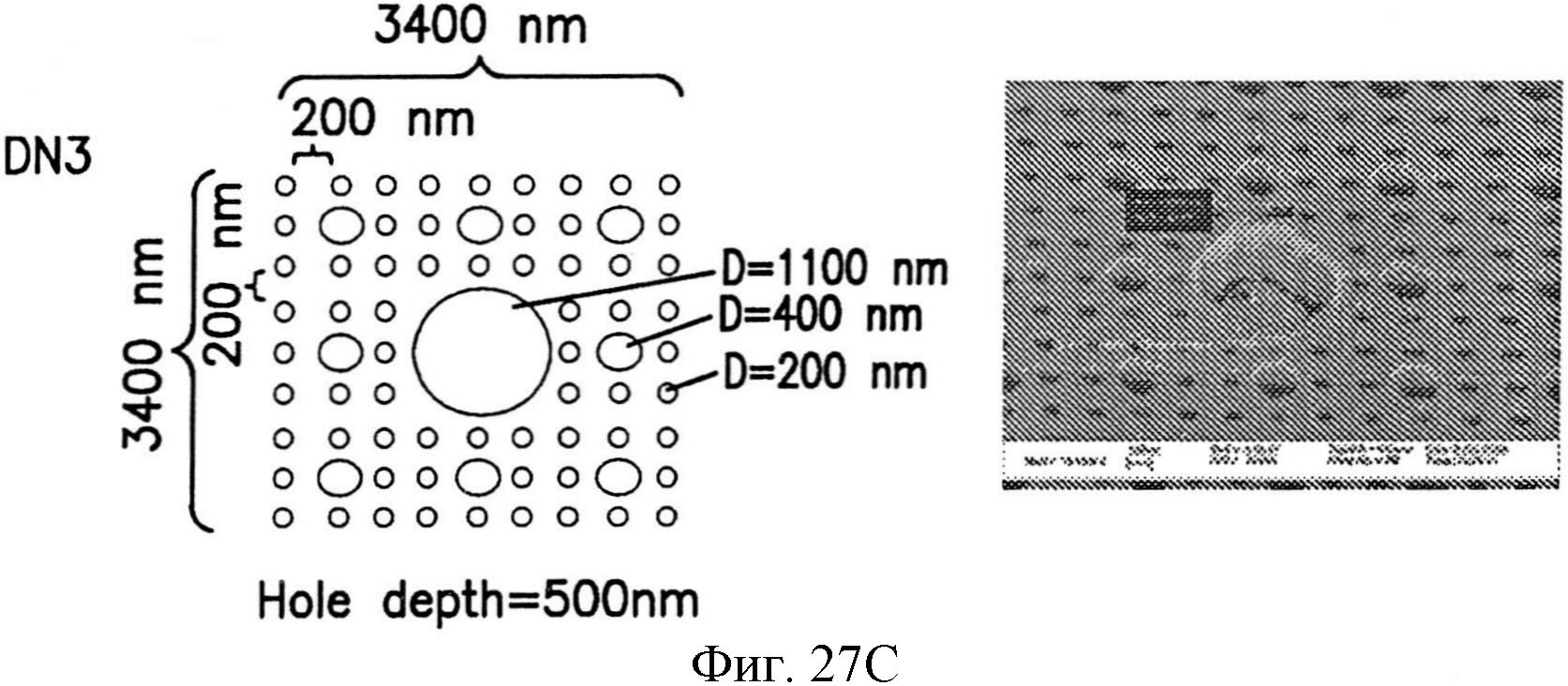
На фиг.27А-27Е показаны несколько узоров нанотопографии, описанных в настоящем документе.
На фиг.28 показано изображение сканирующего электронного микроскопа пленки, содержащей поверхность с наноузором.
На фиг.29А и 29В показаны два изображения сканирующего электронного микроскопа пленки, содержащей поверхность с другим наноузором.
На фиг.30 показано изображение сканирующего электронного микроскопа пленки, содержащей поверхность с другим наноузором.
На фиг.31 показано изображение сканирующего электронного микроскопа пленки, содержащей поверхность с другим наноузором.
На фиг.32 показано изображение сканирующего электронного микроскопа пленки, содержащей поверхность с другим наноузором.
На фиг.33 показано изображение сканирующего электронного микроскопа пленки, содержащей поверхность с другим наноузором.
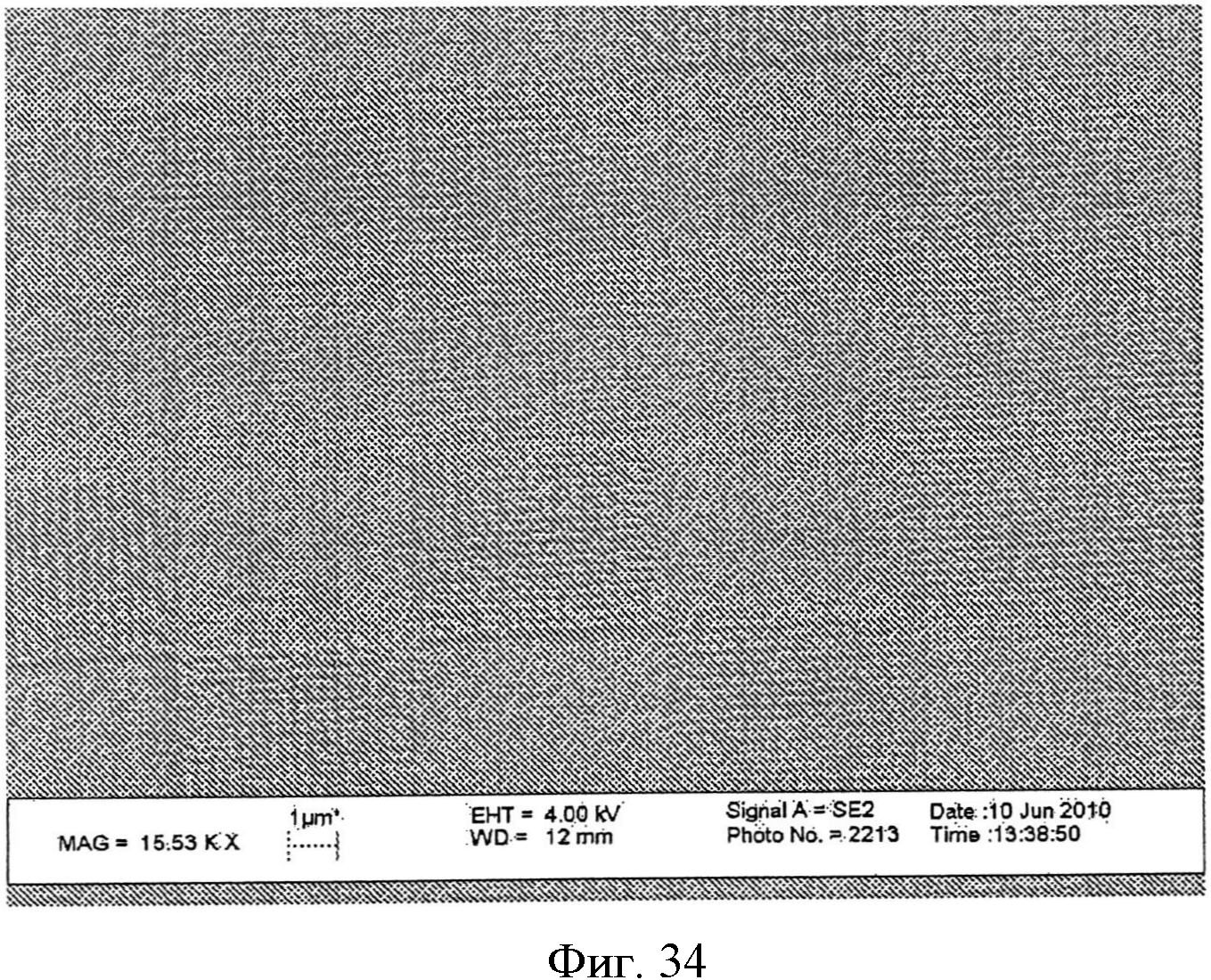
На фиг.34 показано изображение сканирующего электронного микроскопа пленки, содержащей поверхность с другим наноузором.
На фиг.35 показано изображение сканирующего электронного микроскопа пленки, содержащей поверхность с другим наноузором.
На фиг.36 показано изображение сканирующего электронного микроскопа пленки, содержащей поверхность с другим наноузором.
На фиг.37 показан матрица микроигл, содержащий пленку, наложенную на микроиглы, на пленке образован узор из наноструктур.
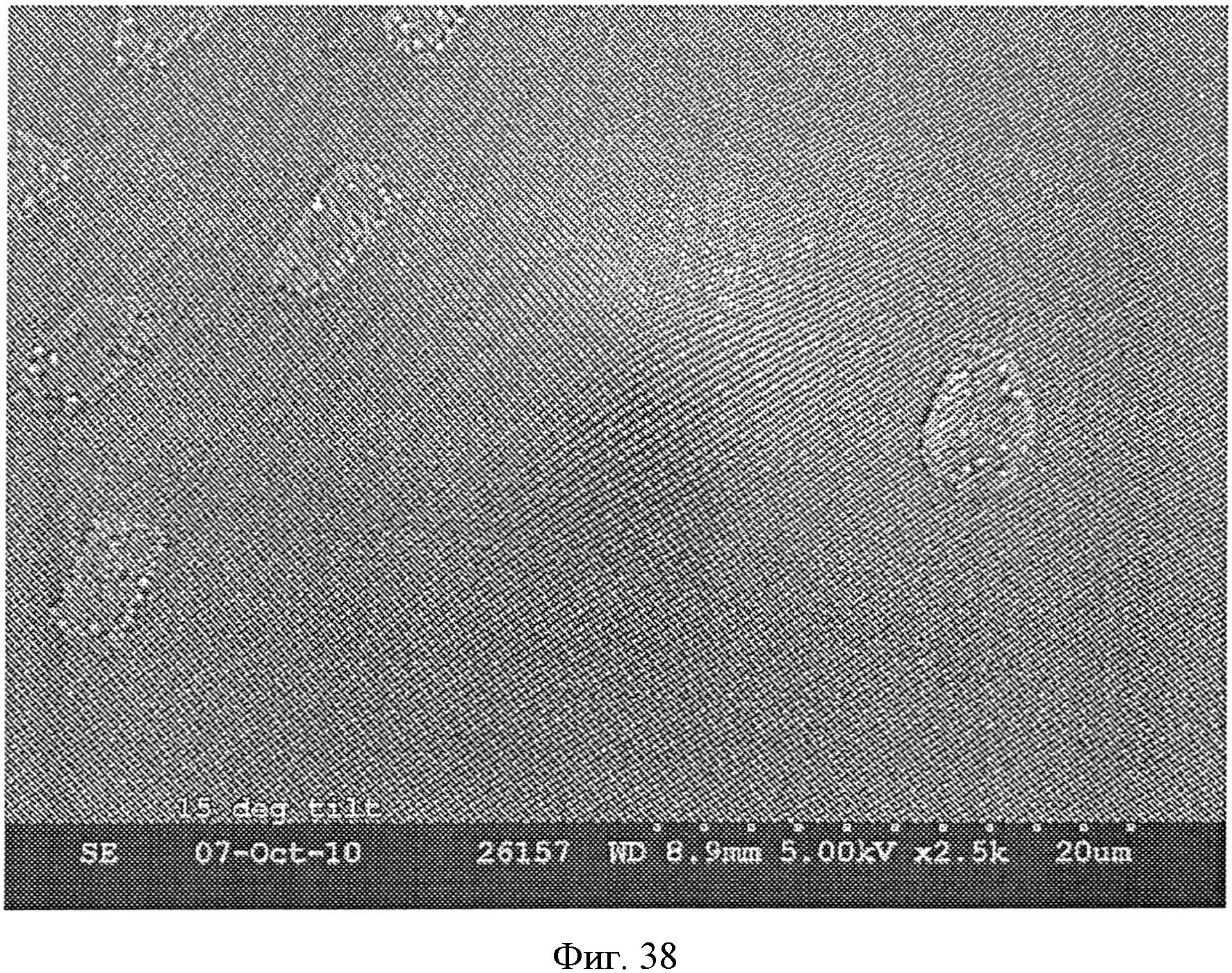
На фиг.38 показан одна матрица микроигла по фиг.37.
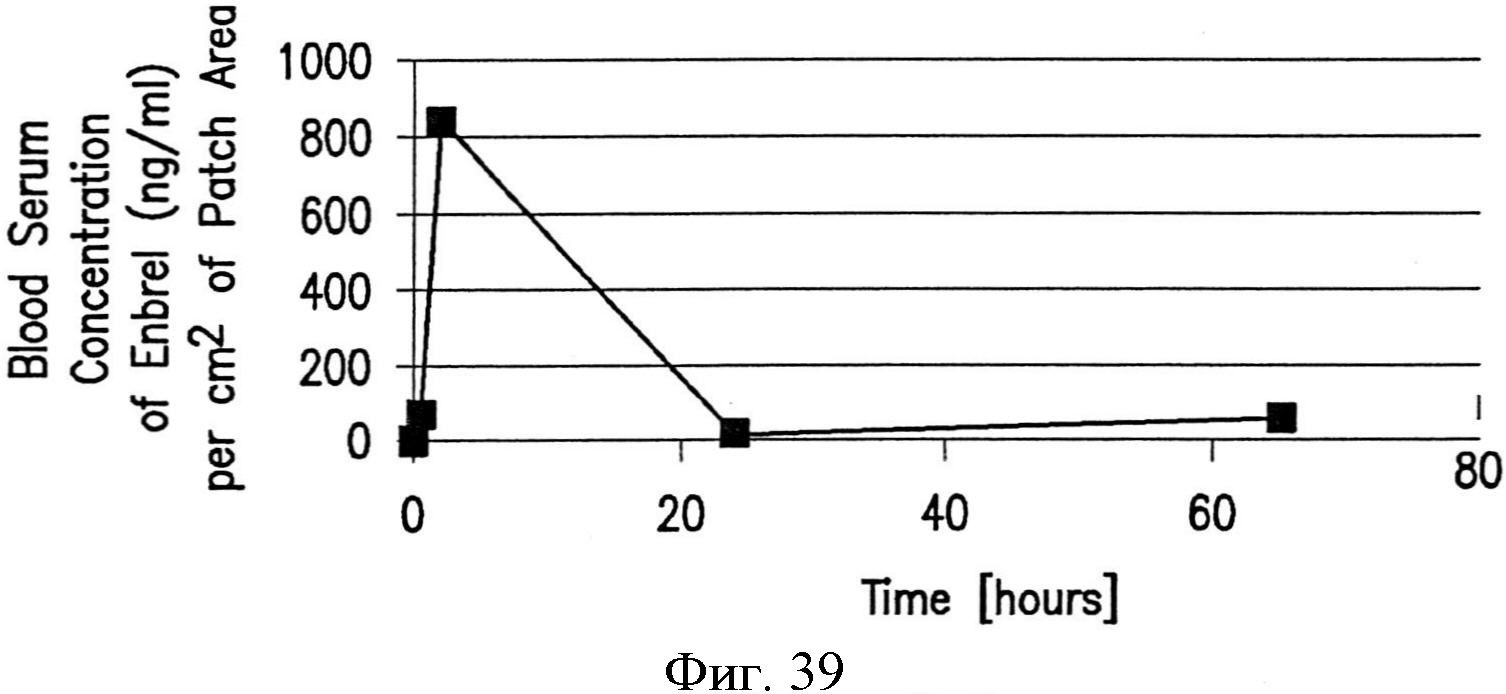
На фиг.39 графически показан профиль фармакокинетики белкового терапевтического препарата, доставляемого устройством, как показано на фиг.37.
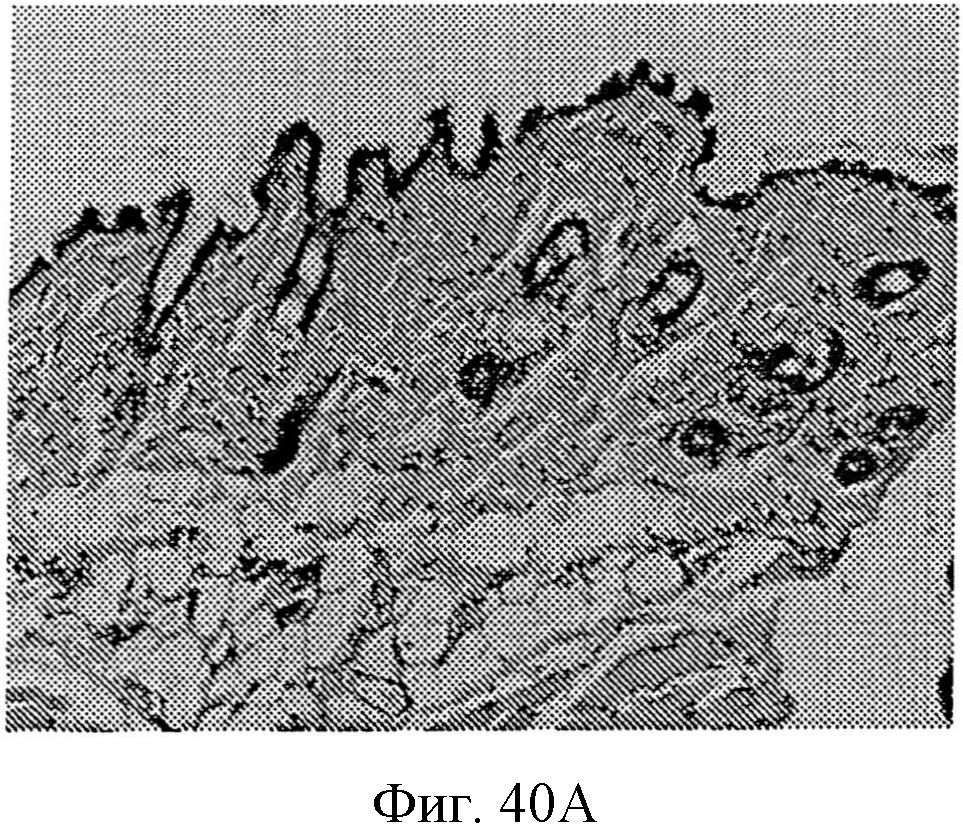
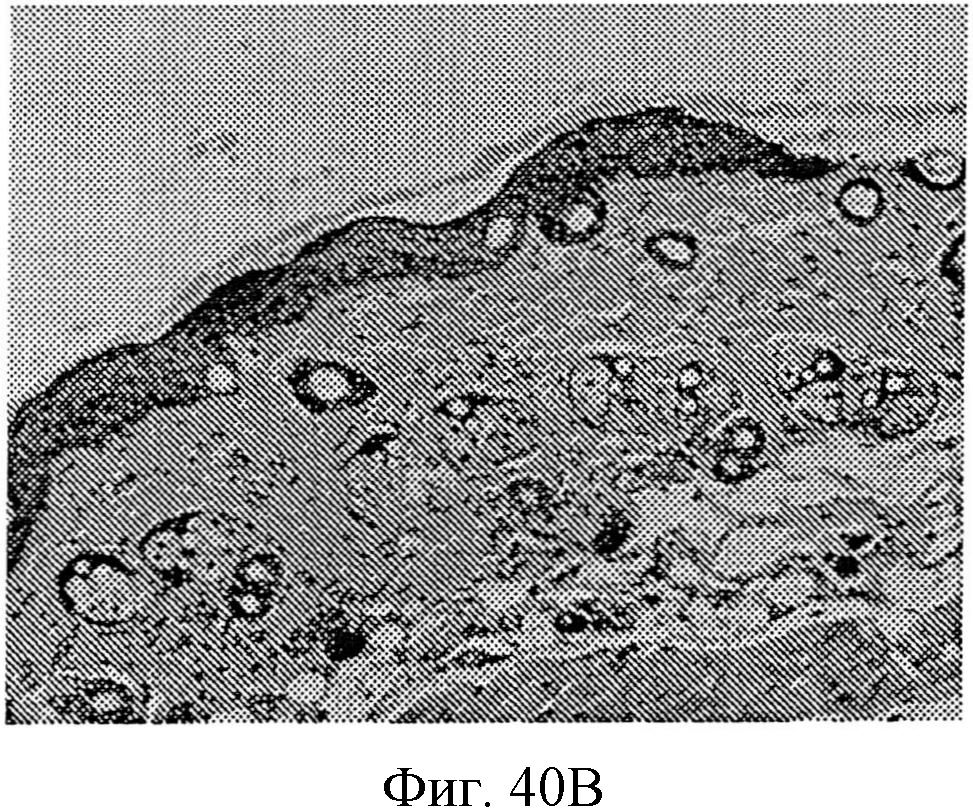
На фиг.40А и 40В показаны изображения в сечении кожи с последующей трансдермальной доставкой белкового лекарственного препарата через кожу. На фиг.40А показан вид в сечении кожи, находящейся в контакте с трансдермальным устройство с образованной на нем нанотопографией, и на фиг.40В показан вид в сечении кожи, находящейся в контакте с трансдермальным устройством, не содержащим сформированного на нем узора нанотопографии.
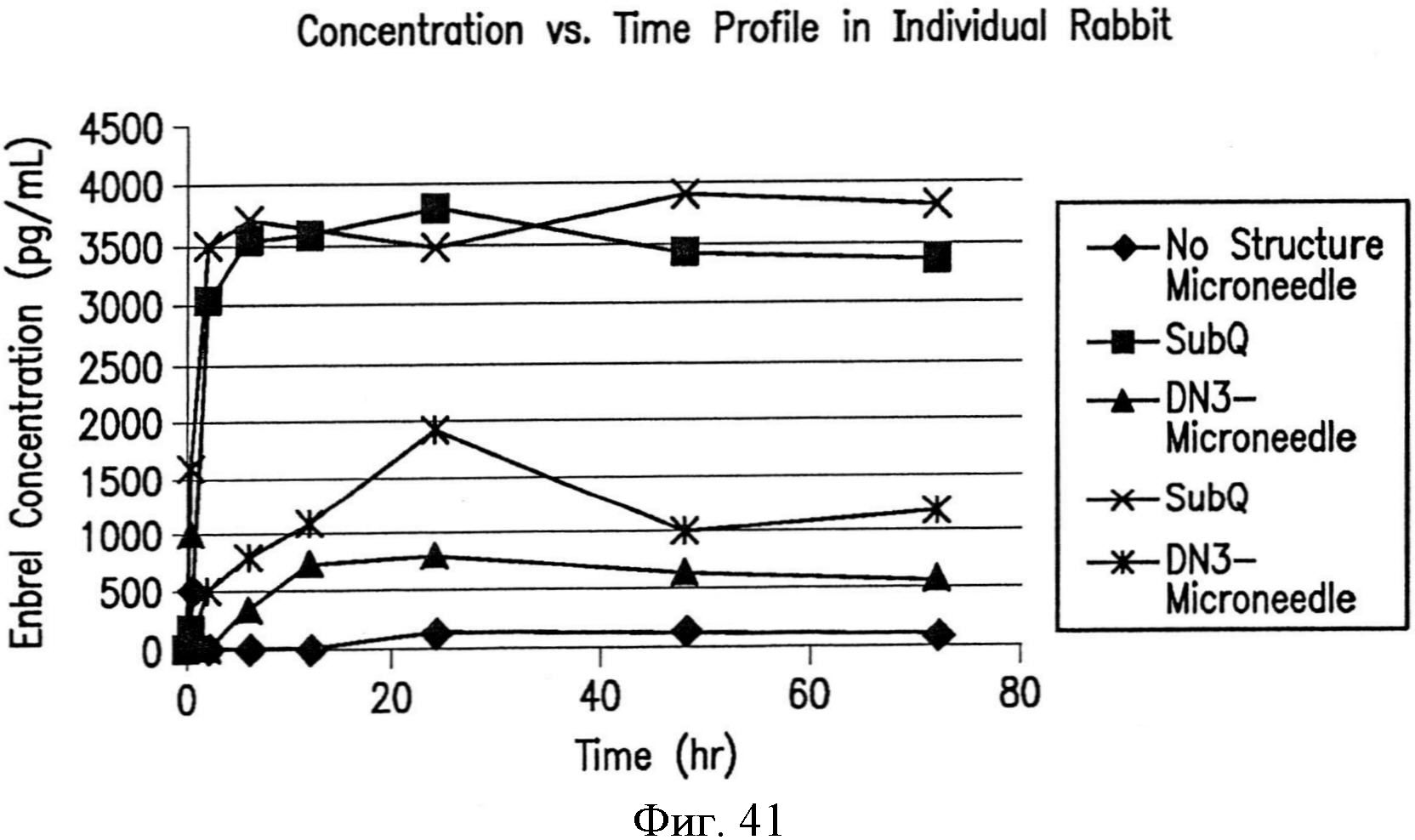
На фиг.41 графически показана концентрация в сыворотке крови белкового лекарственного препарата, доставляемого устройством, описанным в настоящем документе.
Подробное описание репрезентативных вариантов осуществления
Далее подробно описаны различные варианты осуществления, раскрывающие сущность изобретения, один или более примеров которого пояснены далее. Каждый пример подразумевает пояснение, а не ограничение. Действительно, для специалистов в этой области очевидно, что различные модификации и изменения могут быть внесены в настоящее описание без отступления от объема и сущности настоящего изобретения. Например, особенности, показанные или описанные, как часть одного варианта осуществления, могут быть использованы в другом варианте осуществления, чтобы получить еще один вариант осуществления. Таким образом, подразумевается, что настоящее изобретение охватывает такие модификации и изменения, как входящие в объем заявленной формулы изобретения и ее эквивалентов.
В основном в настоящем документе описана матрица микроигл. Матрица микроигл представляет собой композитную структуру, которая включает сборку микроигл и пленку, наложенную на поверхность сборки и контактирующую с микроиглами. Пленка образует множество изготовленных структур на поверхности. По меньшей мере участок структур изготовлен в масштабе нанометров. Используемый в настоящем документе термин "изготовленный" в основном относится к структуре, которая специально разработана, создана или сконструирована для существования на поверхности и не выровнена с особенностью поверхности, которая является просто случайным результатом способа формирования. Таким образом, на поверхности микроигл существует заранее определенный узор из наноструктур.
Также предлагается способ формирования композитных матриц. Способ формирования может включать наложение или укладку слоя пленки поверх сборки микроигл, чтобы пленка по меньшей мере частично соответствовала форме микроигл, и структуры наноразмера пленки были обращены от микроигл, т.е., структуры открыты на поверхности композитной матрицы микроигл. Пленка сцеплена со сборкой микроигл и приклеена к сборке микроигл достаточно прочно, чтобы пленка не отслаивалась от сборки микроигл во время использования.
Матрица микроигл, содержащий сборку микроигл и наложенную на него пленку, которая содержит множество структур наноразмера, может быть использована при доставке лекарственного средства. Например, матрица микроигл может быть сконструирован для размещения с сообщением по потоку текучей среды со сборкой доставки лекарственного средства. Сборка доставки лекарственного средства может содержать лекарственное соединение, сообщающееся по потоку текучей среды со сборкой микроигл во время использования. В одном предпочтительном варианте осуществления сборка микроигл может представлять собой компонент трансдермального пластыря для доставки лекарственного средства.
Предпочтительно структуры наноразмера, расположенные на поверхности сборки микроигл, могут обеспечивать эффективную доставку активных препаратов, включая активные препараты с большой молекулярной массой, при этом снижая иммунный ответ и реакцию на инородное тело и устройства доставки лекарственного средства, и препаратов, доставляемых устройством.
Различные аспекты настоящего изобретения описаны далее более детально.
I. Сборка микроигл
Сборка микроигл содержит множество микроигл, которые выступают наружу из опоры. Как показано, например, на фиг.1, в одном конкретном варианте осуществления сборка 10 микроигл содержит множество микроигл 12, которые продолжаются от опоры 20. Опора 20 может быть сконструирована из жесткого или гибкого листа металла, керамики, пластмассы или другого материала. Опора 20 может обладать разной толщиной в соответствии с назначением устройства, например, примерно 1000 микрометров или меньше, в некоторых вариантах осуществления от примерно 1 до примерно 500 микрометров, и в некоторых вариантах осуществления от примерно 10 до примерно 200 микрометров.
На фиг.2 показан другой вариант осуществления сборки 11 микроигл, причем каждая микроигла 14 сообщается по потоку текучей среды с отверстием 28, которое может быть сформировано в опоре 15. Отверстие 28 продолжается через опору 15. Микроиглы 14 продолжаются от поверхности опоры 15.
Следует понимать, что число микроигл, показанных на чертежах, предназначено только для целей иллюстрации. Фактическое число микроигл, используемых для сборки микроигл, может, например, составлять в диапазоне от примерно 500 до примерно 10000, в некоторых вариантах осуществления от примерно 2000 до примерно 8000, и в некоторых вариантах осуществления от примерно 4000 до примерно 6000.
При необходимости размер и форма микроигл также могут быть различны. Например, микроиглы 14 по фиг.2 содержат цилиндрический участок, на котором расположен конический участок с кончиком. Однако в альтернативных вариантах осуществления микроиглы 14 могут обладать общей пирамидальной формой или общей конической формой. Независимо от этого микроигла 14 обычно имеет основание 320 и кончик 322. Как показано на фиг.2, основание 320 представляет собой участок микроиглы 318, который ближе к поверхности опоры 15. Кончик 322 микроиглы 14 представляет собой точку микроиглы, которая дальше всего от основания 320. Хотя кончик 322 может быть сформирован разным образом, он обычно имеет радиус меньше или равный примерно 1 микрометру. Микроиглы 14 обычно обладают длиной, достаточной для проникновения через роговой слой и прохождения в эпидермис, но не проникают через эпидермис и в дерму при применениях, в которых нужно минимизировать боль. В некоторых вариантах осуществления микроиглы обладают длиной (от их кончика 322 до их основания 320) от примерно 1 микрометра до примерно 1 миллиметра в длину, например, примерно 500 микрометров или меньше, или от примерно 10 до примерно 500 микрометров, или от примерно 30 до примерно 200 микрометров.
Размер отдельных игл может быть оптимизирован в зависимости от нужной глубины конусности, требований к прочности иглы во избежание поломки в ткани конкретного типа и т.д. Например, размер в сечении трансдермальной микроиглы может составлять от примерно 10 нанометров (нм) до 1 миллиметра (мм), или от примерно 1 микрометра (мкм) до примерно 200 микрометров, или от примерно 10 до примерно 100 микрометров. Наружный диаметр может составлять от примерно 10 до примерно 100 микрометров, и внутренний диаметр полой иглы может составлять от примерно 3 до примерно 80 микрометров. Кончик обычно имеет радиус меньше или равный примерно 1 микрометру.
Микроиглы 14 могут быть скомпонованы на подложке в виде разнообразных узоров, и такие узоры могут быть предназначены для конкретного использования. Например, микроиглы 14 могут быть расположены с промежутком равномерным образом, например, в прямоугольной или квадратной сетке или концентрическими кругами. Размер промежутка может зависеть от большого числа факторов, включая высоту и ширину микроигл 14, характеристики пленки, которая будет наложена на поверхность микроигл 14, а также объема и типа вещества, которое предполагается доставлять через микроиглы 14. Хотя применимо разнообразное расположение микроигл, особенно предпочтительно расположение микроигл 14 с промежутком между микроиглы, соответствующим их длине, т.е. примерно 50 микрометров или больше, в некоторых вариантах осуществления примерно 100 до примерно 800 микрометров, и в некоторых вариантах осуществления от примерно 200 до примерно 600 микрометров.
Микроиглы 14 могут быть сформированы из различных веществ, например, полимеров, керамики и металлов. Хотя для изготовления микроигл могут быть использованы многочисленные способы, подходящей системой для изготовления является технология MEMS (Микро- электромеханические системы) и способы микроизготовления. MEMS позволяет формировать микромеханические и другие элементы, такие как полупроводники на одной кремниевой подложке, используя способы микроизготовления, такие как травление, микромеханическая обработка или другие способы. Опора 15 может быть изготовлена из кремния, микроиглы впоследствии формируются по способу микротравления. Также для формирования микроигл 14 и опоры 15 могут быть использованы способы микролитьевого прессования.
В одном варианте осуществления микроиглы 14 могут образовывать по меньшей мере один канал 16, который сообщается по потоку текучей среды по меньшей мере с участком отверстия 28 опоры 15. Размеры канала 16, если он имеется, в частности, могут быть выбраны, чтобы инициировать течение в капилляре лекарственного соединения. Течение в капилляре в основном возникает, когда силы смачивания текучей среды со стенками канала больше, чем силы сцепления между молекулами жидкости. В частности, внутрикапиллярное давление обратно пропорционально размерам в сечении канала 16 и прямо пропорционально поверхностному натяжению жидкости, умноженному на косинус краевого угла контакта текучей среды с материалом, образующим канал. Таким образом, чтобы облегчить течение в капилляре в пластыре, размер в сечении (например, ширина, диаметр и т.д.) канала 16 можно задавать по выбору, причем меньшие размеры приводят к более высокому внутрикапиллярному давлению. Например, в некоторых вариантах осуществления размер в сечении канала обычно составляет в диапазоне от примерно 1 до примерно 100 микрометров, в некоторых вариантах осуществления от примерно 5 до примерно 50 микрометров, и в некоторых вариантах осуществления от примерно 10 до примерно 30 микрометров. Этот размер может быть постоянным, или он может меняться в зависимости от длины канала 16. Длина канала также может меняться для соответствия разным объемам, скорости потока и времени задержки для лекарственного соединения. Например, длина канала может составлять от примерно 10 до примерно 800 микрометров, в некоторых вариантах осуществления от примерно 50 до примерно 500 микрометров, и в некоторых вариантах осуществления от примерно 100 до примерно 300 микрометров. Площадь сечения канала также может быть различна. Например, площадь сечения может составлять от примерно 50 до примерно 1000 квадратных микрометров, в некоторых вариантах осуществления от примерно 100 до примерно 500 квадратных микрометров, и в некоторых вариантах осуществления от примерно 150 до примерно 350 квадратных микрометров. Кроме того, соотношение размеров (длина/размер в сечении) канала могут составлять в диапазоне от примерно 1 до примерно 50, в некоторых вариантах осуществления от примерно 5 до примерно 40, и в некоторых вариантах осуществления от примерно 10 до примерно 20. В случаях, когда размер в сечении (например, ширина, диаметр и т.д.) и/или длина меняется в зависимости от длины, отношение размеров может быть определено по средним размерам.
Как показано на фиг.3-4, микроиглы 318 содержат по меньшей мере один канал 330. Канал может быть расположен в различных положениях, например, внутри микроиглы, на поверхности и т.д. Например, в варианте осуществления по фиг.3-4, канал 330 расположен на поверхности микроиглы 318. В сечении канал может иметь любую подходящую форму. Например, канал 16, показанный на фиг.2, по существу имеет подковообразную форму. Канал может быть изогнутым или обладать любой другой подходящей формой для доставки через него вещества, например, V-образным или С-образным. Независимо от этого и как показано на фиг.3-4, проход 326 может быть сформирован каналом 330 и отверстием 328, которые встречаются на стыке 332, который в основном расположен в плоскости поверхности 316. Каждая микроигла 318 может подавать или выделять лекарственные соединения через кожу посредством прохода 326, как показано на фиг.3-4. Проход 326 позволяет соединению протекать из первой поверхности 314 через отверстие 328, стык 332 и выходить в канал 330. Позволяя соединению протекать через опору и непосредственно в канал 330, можно обеспечить более точное управление местом доставки и объемом доставляемого вещества.
В некоторых вариантах осуществления и как показано на фиг.3, отверстие 328 совмещено с одиночным каналом 330 посредством стыка 332. Альтернативно и как показано на фиг.4, одиночное отверстие 328 может обеспечивать подачу в два или более отдельных каналов 330.
Канал 330 может продолжаться от стыка 332 у основания 320 микроиглы до кончика 322. В других вариантах осуществления канал 330 может продолжаться не по всей длине микроиглы 318 до кончика 322, как показано на фиг.3-4. Каждая микроигла 318 может содержать более одного канала 330, как в варианте осуществления по фиг.4. При необходимости альтернативные варианты осуществления могут содержать большее число каналов. Канал 330 может быть по разному расположен на внешней поверхности 324, образуя по существу линейный путь от основания 320 к кончику 322 или образуя извилистый или обходной путь вдоль внешней поверхности 324. В микроигле, в которой присутствуют два или более каналов, каналы 330 могут быть расположены с разным промежутком вокруг микроиглы 318 симметричным или асимметричным образом.
II. Пленка с наноузором
На сборку микроигл может быть наложена или уложена в виде слоя пленка, на которой образовано множество структур на поверхности. На фиг.5А и 5B схематично показаны стороны с узором (фиг.5А) и без узора (фиг.5B) одного варианта осуществления пленки 500, образующей первую сторону 501 и вторую сторону 502. Множество структур 505 сформировано на первой стороне 501 пленки 500. В одном варианте осуществления пленка 500 может обладать толщиной от первой стороны 501 до второй стороны 502 более примерно 2 микрометров. Например, пленка 500 может обладать толщиной от примерно 1 микрометра до примерно 1 миллиметра. В одном варианте осуществления пленка 500 может обладать толщиной от примерно 5 до примерно 200 микрометров, или от примерно 5 до примерно 100 микрометров.
Пленка 500 может содержать множество идентичных структур, сформированных на первой поверхности 501, или может содержать структуры, сформированные разного размера, формы и их комбинации в произвольном или упорядоченном узоре. Заранее определенный узор из структур может содержать смесь структур разной длины, диаметра, формы в сечении и/или с разными промежутками между структурами. Например, структуры могут быть расположены с промежутком равномерным образом, например, в прямоугольной или квадратной сетке или концентрическими кругами.
На пленке может быть сформирована сложная нанотопография, которая может образовывать фрактальную или фракталоподобную геометрию. Используемый в настоящем документе термин "фрактал" в основном относится к геометрической или физической структуре или узору с фрагментированной формой в любом масштабе измерений от максимального до минимального, так что некоторые математические или физические свойства этой структуры обладают свойствами, как если бы размеры этой структуры были больше, чем ее пространственные размеры. Интересующие математические или физические свойства могут включать, например, периметр кривой или скорость потока в пористой среде. Геометрическая форма фрактала может быть разделена на части, каждая из которых образует самоподобие. Кроме того, фрактал имеет рекурсивное определение и обладает тонкими структурами произвольно малого масштаба.
Используемый в настоящем документе термин "фракталоподобный" в основном относится к геометрической или физической структуре с одной или более, но не всеми, из характеристик фрактала. Например, фракталоподобная структура может включать геометрическую форму, которая содержит самоподобные части, но может не содержать тонких структур при произвольно малом масштабе. В другом примере фракталоподобная геометрическая форма или физическая структура может не уменьшаться (или увеличиваться) в масштабе равномерно между итерациями масштабирования, как фрактал, хотя она может увеличиваться или уменьшаться между рекурсивными итерациями геометрической формы узора. Фракталоподобный узор может быть проще, чем фрактал. Например, он может быть регулярным и относительно просто описанным на традиционном языке эвклидовой геометрии, в то время как фрактал не может.
Пленка 500 может содержать структуры одной и той же общей формы (например, столбики), и могут быть образованы столбики разного масштаба (например, столбики наномасштаба, а также столбики микромасштаба). В альтернативном варианте пленка может содержать на поверхности структуры, которые меняются и по масштабу размеров, и по форме, или которые меняются только по форме, хотя они образованы в одном и том же масштабе наноразмеров. Структуры могут быть различны по размеру и/или форме и могут образовывать сложную нанотопографию.
По меньшей мере участок структур может представлять собой наноструктуры, сформированные в масштабе наноразмеров, например, составляющие размер в сечении меньше примерно 500 нанометров, например, меньше примерно 400 нанометров, меньше примерно 250 нанометров или меньше примерно 100 нанометров. Размер в сечении в основном может быть больше примерно 5 нанометров, например, больше примерно 10 нанометров или больше примерно 20 нанометров. Например, наноструктуры могут обладать размером в сечении от примерно 5 до примерно 500 нанометров, от примерно 20 до примерно 400 нанометров или от примерно 100 до примерно 300 нанометров. В случаях, когда размер наноструктуры в сечении меняется в зависимости от высоты наноструктуры, размер в сечении можно определить, как среднее от основания до кончика наноструктуры, или как максимальный размер структуры в сечении, например, размер в сечении у основания конусообразной наноструктуры.
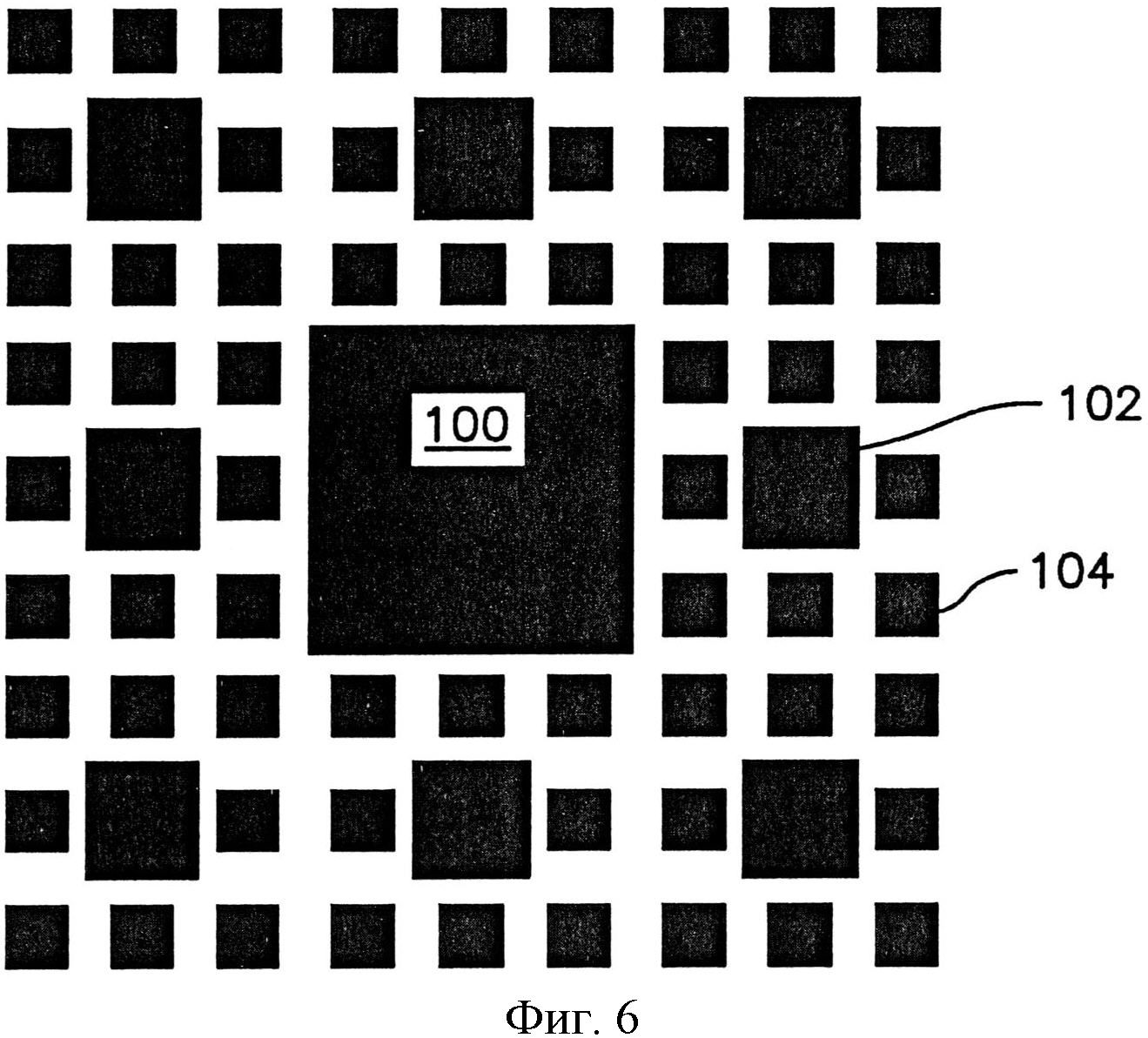
На фиг.4 показан один вариант осуществления сложной нанотопографии, которая может быть образована на поверхности. Этот конкретный узор включает большой центральный столбик 100 и окружающие столбики 102, 104 меньшего размера, предусмотренные на регулярном узоре. Как можно видеть, этот узор включает итерацию столбиков, каждый из которых имеет одну и ту же общую форму, но разных в отношении размера по горизонтали. Этот конкретный сложный узор представляет собой пример фракталоподобного узора, который не включает идентичного изменения по масштабу между последовательными рекурсивными итерациями. Например, в то время как столбики 102 являются первыми наноструктурами, которые определяют размер по горизонтали, который составляет примерно одну треть от этого размера большого столбика 100, который представляет собой микроструктуру, столбики 104 являются второй наноструктурой, которая определяет размер по горизонтали, который составляет примерно половину от этого размера столбиков 102.
Узор, который включает структуры разного размера, может включать большие структуры с размером в сечении, сформированным большего масштаба, например, микроструктуры с размером в сечении больше примерно 500 нанометров, в сочетании с меньшими наноструктурами. В одном варианте осуществления микроструктуры сложной нанотопографии могут обладать размером в сечении от примерно 500 нанометров до примерно 10 микрометров, от примерно 600 нанометров до примерно 1,5 микрометров, или от примерно 650 нанометров до примерно 1,2 микрометров. Например, сложная нанотопография по фиг.8 включает столбики 100 микроразмера с размером в сечении примерно 1,2 микрометра.
Когда узор включает одну или больше микроструктур большего размера, например, с размером в сечении больше примерно 500 нанометров, определенным либо как средний, либо как максимальный размер в сечении этой структуры, сложная нанотопография также может включать наноструктуры, например, первые наноструктуры, вторые наноструктуры другого размера и/или формы и т.д. Например, столбики 102 сложной нанотопографии по фиг.6, обладающие размером в сечении примерно 400 нанометров, и столбики 104, обладающие размером в сечении примерно 200 нанометров.
Нанотопография может быть сформирована из любого числа различных элементов. Например, узор из элементов может включать два различных элемента, три различных элемента, пример которого показан на фиг.6, четыре различных элемента или больше. Относительные пропорции повторяемости каждого из различных элементов также могут меняться. В одном варианте осуществления самые малые элементы узора представлены в большем количестве, чем более крупные элементы. Например, в узоре по фиг.6, имеется восемь столбиков 104 для каждого столбика 102, и имеется восемь столбиков 102 для центрального большого столбика 100. По мере возрастания элементов по размеру в основном может быть меньшая повторяемость элемента в нанотопографии. Например, первый элемент, который составляет примерно 0,5, например, от примерно 0,3 до примерно 0,7 в размере в сечении относительно второго, больший элемент может присутствовать в топографии чаще примерно в пять раз или больше, чем второй элемент. Первый элемент, который составляет приблизительно 0,25 или от примерно 0,15 до примерно 0,3 в размере в сечении относительно второго, большего элемента, может присутствовать в топографии чаще примерно в 10 раз или больше, чем второй элемент.
Промежуток между отдельными элементами также может быть различен. Например, промежуток между центрами отдельных структур может составлять от примерно 50 нанометров до примерно 1 микрометра, например, от примерно 100 до примерно 500 нанометров. Например, промежуток от центра до центра между структурами может быть в масштабе наноразмеров. Например, при рассмотрении промежутка между структурами наноразмера промежуток от центра до центра структур может составлять меньше примерно 500 нанометров. Это не является требованием топографии, однако и отдельные структуры могут быть разнесены дальше. Промежуток от центра до центра структур может быть различен в зависимости от размера структур. Например, отношение среднего размеров в сечении двух соседних структур к промежутку от центра до центра между этими двумя структурами может составлять от примерно 1:1 (например, касание) до примерно 1:4, от примерно 1:1,5 до примерно 1:3,5 или от примерно 1:2 до примерно 1:3. Например, промежуток от центра до центра может составлять приблизительно удвоенное среднее размеров в сечении двух соседних структур. В одном варианте осуществления две соседние структуры с размером в сечении приблизительно 200 нанометров каждая могут обладать промежутком от центра до центра примерно 400 нанометров. Таким образом, отношение среднего диаметров к промежутку от центра до центра в этом случае составляет 1:2.
Промежуток между структурами может быть одним и тем же, т.е., они расположены с равными промежутками, или может быть различным для структур в узоре. Например, самые малые структуры в узоре могут быть разнесены на первое расстояние, и промежуток между этими самыми малыми структурами и большей структурой узора или между двумя большими структурами узора может быть одним и тем же или другим относительно этого первого расстояния.
Например, в узоре по фиг.6, самые малые структуры 104 расположены с промежутком от центра до центра примерно 200 нанометров. Расстояние между большими столбиками 102 и каждым из окружающих столбиков 104 меньше примерно 100 нанометров. Расстояние между самым большим столбиком 100 и каждым из окружающих столбиков 104 также меньше промежутка от центра до центра между самыми малыми столбиками 104 и составляет примерно 100 нанометров. Безусловно, это не является требованием, и все структуры могут быть расположены с равными промежутками друг от друга или с любым вариантом расстояний. В одном варианте осуществления различные структуры могут находиться в контакте друг с другом, например, одна над другой, как дополнительно описано далее, или примыкать одна к другой и соприкасаться одна с другой.
Все структуры топографии могут быть сформированы одной и той же высоты, в основном от примерно 10 нанометров до примерно 1 микрометра, но это не является требованием, и отдельные структуры узора могут быть разными по размеру в одном, двух или трех измерениях. В одном варианте осуществления некоторые или все структуры топографии могут обладать высотой меньше примерно 20 микрометров, меньше примерно 10 микрометров или меньше примерно 1 микрометра, например, меньше примерно 750 нанометров, меньше примерно 680 нанометров или меньше примерно 500 нанометров. Например, структуры могут обладать высотой от примерно 50 нанометров до примерно 20 микрометров или от примерно 100 до примерно 700 нанометров. Например, наноструктуры или микроструктуры могут обладать высотой от примерно 20 до примерно 500 нм, от примерно 30 до примерно 300 нм, или от примерно 100 до примерно 200 нм, хотя следует понимать, что структуры могут быть наноразмера в сечении и могут обладать высотой, измеряемой в масштабе микроразмеров, например, больше примерно 500 нм. Структуры микроразмера могут обладать высотой, аналогичной или отличающейся от структур в масштабе наноразмеров одного и того же узора. Например, в другом варианте осуществления структуры микроразмера могут обладать высотой от примерно 500 нанометров до примерно 20 микрометров, или от примерно 1 до примерно 10 микрометров. Структуры микроразмера также могут обладать размером в сечении в микромасштабе больше примерно 500 нм и могут обладать высотой в масштабе наноразмеров меньше примерно 500 нм.
Отношение сторон структур (отношение высоты структуры к размеру в сечении этой структуры) может составлять от примерно 0,15 до примерно 30, от примерно 0,2 до примерно 0,5, от примерно 0,5 до примерно 3,5 или от примерно 1 до примерно 2,5. Например, наноструктуры могут обладать отношением сторон, попадающим в пределы любого из этих диапазонов.
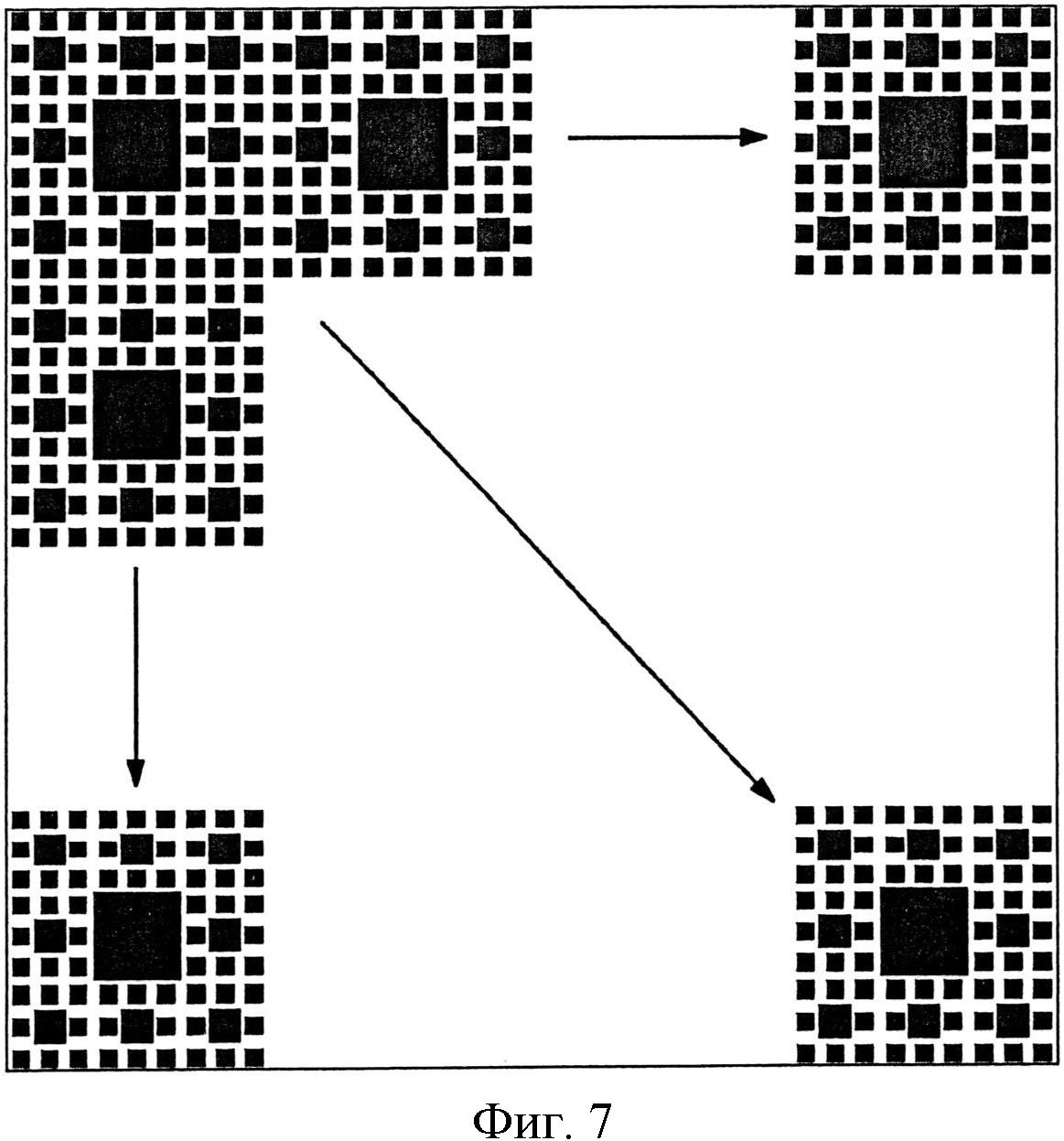
Поверхность пленки может содержать один образец узора, как показано на фиг.6, или может содержать повторение одного и того же или разных узоров. Например, на фиг.7 показан узор поверхности, включающий узор по фиг.6 в нескольких итерациях на поверхности.
На фиг.8А и 8B показаны с возрастающим увеличением изображения другого примера сложной нанотопографии. Нанотопография по фиг.8А и 8B включает матрица напоминающих волокно столбиков 70, расположенных на подложке. На удаленном кончике каждого отдельного столбика он расщепляется на несколько меньших волокон 60. На удаленном кончике каждого из этих меньших волокон 60 каждое волокно также расщепляется на несколько нитей (не видны на фиг.8А и 8B). Структуры, сформированные на поверхности, обладающей отношением сторон больше примерно 1, могут быть гибкими, как структуры, показанные на фиг.8А и 8Б, или могут быть жесткими.
На фиг.8C и 8D показан другой пример сложной нанотопографии. В этом варианте осуществления на подложке сформировано множество столбиков 72, каждый из которых содержит кольцевое полое сквозное отверстие 71 через него. На удаленном кончике каждого полого столбика сформировано множество меньших столбиков 62. Как можно видеть, столбики по фиг.8C и 8D сохраняют свою жесткость и вертикальную ориентацию. Кроме того, и в противоположность предыдущим узорам, меньшие столбики 62 в этом варианте осуществления отличаются по форме от больших столбиков 72. В частности, меньшие столбики являются не полыми, а сплошными. Таким образом, нанотопография, содержащая структуры, сформированные разного масштаба, необязательно содержит все структуры, сформированные одной формы, и структуры могут отличаться и по размеру, и по форме от структур другого масштаба.
На фиг.9 показан другой узор, содержащий структуры наноразмера, которые могут быть сформированы на поверхности пленки. Как можно видеть, в этом варианте осуществления структуры с конкретным узором могут быть сформированы одного и того же общего размера, но с ориентацией и формой, отличающимися друг от друга.
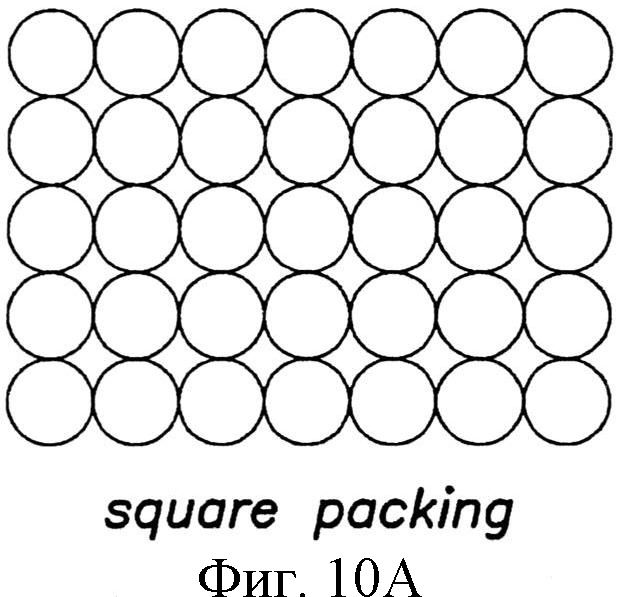
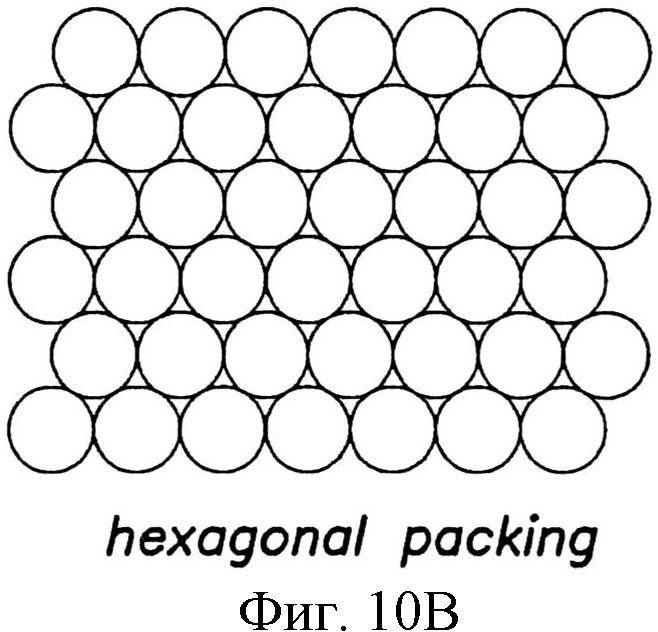
Узор из отдельных структур может быть скомпонован так, чтобы это влияло на плотность упаковки. Например, упаковка в квадрате (фиг.10А), гексагональная упаковка (фиг.10В), или некоторое их изменение может быть использовано для узора из структур на пленке. При создании узору, в котором структуры разного размера по площади сечения А, В и С примыкают друг к другу на подложке, можно использовать упаковку в круге, как показано на фиг.10В. Безусловно, изменение плотности упаковки и определение соответствующего изменения характеристик поверхности зависят от навыка специалиста в этой области.
Формирование нанотопографии на поверхности пленки может увеличивать площадь поверхности пленки без соответствующего увеличения объема. В основном отношение площади поверхности к объему пленки может составлять больше примерно 10000 см-1, больше примерно 150000 см-1 или больше примерно 750000 см-1. Определение отношения площади поверхности к объему может быть выполнено в соответствии с любым стандартным способом, известным в этой области. Например, удельная площадь поверхности может быть получена физическим методом газовой адсорбции (метод В.Е.Т.) с азотом в качестве адсорбирующего газа, широко известным в этой области и описанным в публикации Brunauer, Emmet, и Teller (J.Amer. Chem. Soc, vol. 60, Feb., 1938, pp.309-319), включенной в настоящий документ в качестве ссылки. Площадь поверхности BET может составлять менее примерно 5 м2/г, в одном варианте осуществления например, от примерно 0,1 до примерно 4,5 м2/г или от примерно 0,5 до примерно 3,5 м2/г. Значения площади поверхности и объема также могут быть оценены по геометрии пресс-формы, используемой для формирования поверхности, в соответствии со стандартными геометрическими расчетами. Например, объем может быть оценен по расчетному объему для каждого элемента узора и общему числу элементов узора на заданной площади, например, на поверхности одной микроиглы.
Нанотопография пленки может быть охарактеризована путем определения фрактального размера узора из структур на пленке. В одном варианте осуществления нанотопография поверхности устройства может обнаруживать размер фрактала больше примерно 1, например, от примерно 1,2 до примерно 5, от примерно 1,5 до примерно 3 или от примерно 1,5 до примерно 2,5.
Размер фрактала представляет собой статистическую величину, которая дает указание того, насколько плотно фрактал, по-видимому, заполняет пространство по мере того, как последовательные итерации становятся все меньшего и меньшего масштаба. Размер фрактала двухмерной структуры можно представить, как:
где N(e) - число самоподобных структур, необходимое для охвата всего объекта, когда объект уменьшается на 1/е в каждом пространственном направлении.
Например, при рассмотрении 2-мерного фрактала, известного как треугольник Серпинского, показанного на фиг 11, в котором срединные точки трех сторон равностороннего треугольника соединены, и полученный внутренний треугольник удален, размер фрактала рассчитывается следующим образом:
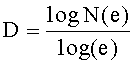
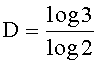
D≈1,585
Таким образом, фрактал треугольника Серпинского обнаруживает увеличение длины линий относительно исходного двухмерного равностороннего треугольника. Кроме того, этого увеличения длины линий не происходит при соответствующем увеличении площади.
Фрактальный размер узора, показанного на фиг.6, равен приблизительно 1,84. В одном варианте осуществления нанотопография поверхности устройства может обнаруживать размер фрактала больше примерно 1, например, от примерно 1,2 до примерно 5, от примерно 1,5 до примерно 3 или от примерно 1,5 до примерно 2,5.
Поверхность пленки может быть охарактеризована измерением шероховатости поверхности. Способами определения шероховатости поверхности в основном являются способы, известные в этой области. Например, обработка в атомно-силовом микроскопе в контактном или бесконтактном режиме может быть использована в соответствии со стандартной практикой для определения шероховатости поверхности материала. Шероховатость поверхности, которая может быть использована, чтобы охарактеризовать микроиглу, может включать среднюю шероховатость (RA), среднеквадратичную шероховатость, асимметрию и/или коэффициент эксцесса. В основном, средняя шероховатость поверхности (т.е., арифметическое среднее высоты поверхности представляет собой параметр шероховатости, как указано в стандарте ISO 25178 серии) для поверхности, образованной изготовленной на ней нанотопографией, может составлять меньше примерно 200 нанометров, меньше примерно 190 нанометров, меньше примерно 100 нанометров или меньше примерно 50 нанометров. Например, средняя шероховатость поверхности может составлять от примерно 10 до примерно 200 нанометров или от примерно 50 до примерно 190 нанометров.
Пленка может быть охарактеризована модулем упругости поверхности с наноузором, например, изменением модуля упругости при добавлении нанотопографии на поверхности. В основном, добавление множества структур, образующих нанотопографию на поверхности, может снижать модуль упругости материала, поскольку добавление структур наноразмера на поверхности может привести к снижению непрерывности поверхности и соответствующему изменению площади поверхности. По сравнению с аналогичной поверхностью, образованной в соответствии с тем же самым способом и из тех же самых материалов, но для некоторого узора нанотопографии на поверхности, пленка, содержащая нанотопографию на поверхности, может обнаруживать снижение модуля упругости от примерно 35% до примерно 99%, например, от примерно 50% до примерно 99% или от примерно 75% до примерно 80%. Например, эффективный модуль сжатия поверхности с наноузором может составлять менее примерно 50 МПа, или меньше примерно 20 МПа. В одном варианте осуществления эффективный модуль сжатия может составлять от примерно 0,2 до примерно 50 МПа, от примерно 5 до примерно 35 МПа, или от примерно 10 до примерно 20 МПа. Эффективный модуль сдвига может составлять менее примерно 320 МПа или менее примерно 220 МПа. Например, в одном варианте осуществления эффективный модуль сдвига может составлять от примерно 4 до примерно 320 МПа, или от примерно 50 до примерно 250 МПа.
Пленка, содержащая нанотопографию на поверхности, также может обнаруживать увеличение поверхностной энергии по сравнению с аналогичной пленкой, которая не обладает поверхностью, образующей на ней узор нанотопографии. Например, пленка, содержащая сформированную на ней нанотопографию, может обнаруживать увеличение поверхностной энергии по сравнению с аналогичной пленкой из тех же самых материалов и сформированной в соответствии с теми же самыми способами, но без включения узора нанотопографии на поверхности. Например, для воды краевой угол смачивания поверхности, содержащей нанотопографию, может составлять больше примерно 80°, больше примерно 90°, больше примерно 100° или больше примерно 110°. Например, в одном варианте осуществления для воды краевой угол смачивания поверхности может составлять от примерно 80° до примерно 150°, от примерно 90° до примерно 130° или от примерно 100° до примерно 120°.
Пленка, содержащая множество наноструктур на поверхности, может быть сформирована по любому известному способу. Пленка с наноструктурами может быть сформирована по одноэтапному способу или способу с несколькими этапами. Например, сначала может быть сформирована пленка, а затем узор из наноструктур может быть изготовлен литьевым прессованием или создан на поверхности пленки. В другом варианте осуществления может быть осуществлен одноэтапный способ, в котором пленка сформирована со структурами на ее поверхности.
В одном варианте осуществления может быть сформирована отливная форма, образующая множество наноструктур на поверхности, а затем пленка может быть получена прессованием по отливной форме. Узор из структур может быть сформирован на отливной форме по любому способу наноизготовления, включая, без ограничения, наноимпринтинг, литографскую печать, рельефное прессование и т.д.
Способы литографской печати, включая фотолитографскую печать, электронно-лучевую литографскую печать, рентгеновскую литографскую печать и т.д. можно использовать для определения первичного узора и формирования эталонной формы. Технологии самосборки, включая способы расслоения полимера и блок-сополимера, разделенных на фазы, и коллоидной литографской печати также могут быть использованы для формирования нанотопографии на поверхности отливной формы.
Как известно, могут быть использованы комбинации способов. Например, подложки с коллоидным узором можно подвергнуть реактивному ионному травлению (RIE, также известному, как сухое травление), чтобы улучшить характеристики изготовленной наноструктуры, такие как диаметр, профиль, высота, шаг и т.д. наностолбиков. Мокрое травление также может быть использовано для получения альтернативных профилей для изготовленных наноструктур, первоначально сформированных различными способами, например, способами расслоения полимеров.
Диаметром, формой и шагом между структурами можно управлять путем выбора соответствующих материалов и способов. Например, травление металлов, первоначально испаряемых на подложки с узором из коллоида, с последующей взрывной литографией коллоида в основном приводит к созданию столбиков призматической формы. Затем процесс травления можно использовать для завершения создания нужных структур. Упорядоченные несферические полимерные наноструктуры также могут быть изготовлены посредством способов спекания с регулируемым нагревом, при которых образуются разнообразные упорядоченные треугольные нанометрические особенности в промежутках в коллоиде с последующим растворением полимерных наночастиц. Эти и другие подходящие способы формования в основном известны в этой области (см., например, публикацию Wood, J R Soc Interface, 2007 February 22; 4(12):1-17, включенную в настоящий документ в качестве ссылки).
Другие способы, которые могут быть использованы при формировании отливной формы, включают использование ультра-высокопрецизионных способов лазерной обработки, примеры которых указаны Hunt, et al. (патент США №6,995,336) и Guo, et al. (патент США №7,374,864), которые оба включены в настоящий документ в качестве ссылки.
Структуры также могут быть сформированы способами добавления химических веществ. Например, напыление пленок, металлизация напылением, химическое осаждение из паровой фазы (CVD), эптаксия (паровой фазы, жидкой фазы и молекулярного пучка), электроосаждение, и т.д. может быть использовано для построения наноструктур на отливной форме.
Могут быть использованы способы самосборки монослоя, известные в этой области, чтобы сформировать узор из наноструктур. Например, способность блок-сополимеров самоорганизовываться может быть использована для формирования узора из монослоя на поверхности. Узор затем может быть использован в качестве шаблона для роста нужных структур, например, коллоидов, в соответствии с узором молослоя.
Например, сеть двухмерных, перекрестно-сшитых полимеров может быть получена из монослоев с двумя или более реактивными участками. Такие перекрестно-сшитые монослои изготовлены с использованием самособирающегося монослоя (SAM) (например, система золото/алифатический радикал) или способы монослоев Ленгмюра-Блоджетта (LB) (Ahmed et al., Thin Solid Films 187:141-153 (1990)), известные в этой области. Монослой может быть перекрестно-сшитым, что может привести к формированию более структурно прочного монослоя.
Мономеры, используемые для формирования монослоя с узором, могут включать все структурные функциональные группы, необходимые для влияния на нужный способ полимеризации и/или способ формирования монослоя, а также для влияния на такие свойства, как общая растворимость, способы диссоциации и литографские способы. Мономер может содержать по меньшей мере одну или более, часто по меньшей мере две реактивные функциональные группы.
Молекула, используемая для формирования органического монослоя, может содержать любые из различных органических функциональных групп, перемежающихся с цепочками метиленовых групп. Например, молекула может представлять собой углеродную структуру с длинными цепями, содержащую цепочки метилена для облегчения упаковки. Упаковка между метиленовыми группами может обеспечить ослабление возникающих сил Ван-дер-Ваальса, повысить стабильность создаваемого молослоя и нейтрализовать потери энтропии, связанные с формированием упорядоченной фазы. Кроме того, различные концевые фрагменты, например, фрагменты с водородной связью, могут присутствовать на одном конце молекул, чтобы обеспечивать рост структур на сформированном монослое, при этом полимеризуемые химические фрагменты могут быть помещены в середину цепи или на противоположных концах. Для формирования этого ансамбля может быть использован любой подходящий химический анализ для распознавания молекул. Например, структуры могут быть соединены на монослое на основе электростатического взаимодействия, Ван-дер-Ваальсового взаимодействия, хелатирования металлов, координационного связывания (т.е., взаимодействий кислоты по Льюису/основания), ионного связывания, ковалентного связывания или водородного связывания.
При использовании системы на основе SAM, для формирования шаблона может быть использована дополнительная молекула. Эта дополнительная молекула может обладать соответствующими функциональными группами на конце, чтобы сформировать SAM. Например, на поверхности золота может быть включена тиольная группа на конце. Для воздействия на получение реплики имеется широкое разнообразие органических молекул. Топографически полимеризуемые фрагменты, такие как диены и диацетилены, особенно предпочтительны в качестве компонентов полимеризации. Они могут быть вставлены в промежутки метиленовых линкеров разной длины.
Для монослоя LB (Ленгмюра-Блоджетта), нужна только одна молекула мономера, поскольку фрагмент для молекулярного распознавания также может служить в качестве полярной функциональной группы для целей формирования монослоя LB. Литографскую печать можно выполнить на монослое LB, перенесенном на подложку, или непосредственно в ванночке. Например, монослой LB мономеров диацетилена может быть смоделирован путем воздействия УФ-излучения через маску или путем нанесения узора электронным пучком.
Формирование монослоя можно облегчить за счет использования молекул, которые претерпели топохимическую полимеризацию в фазе монослоя. Когда скомпонованная пленка подвергнута воздействию катализатора полимеризации, пленка может расти в условиях in situ, и перейти из динамического молекулярного соединения в более прочное полимеризованное соединение для использования в качестве отливной формы.
Способы, используемые для создания узора из монослоя, включают, но не ограничиваются этим, фотолитографскую печать, способы электронно-лучевой обработки, способы фокусировки ионного пучка и мягкую литографию. Различные схемы защиты, такие как фоторезист, могут быть использованы для систем на основе SAM. Аналогично, узоры из блок-сополимера могут быть сформированы на золоте и выборочно протравлены для формирования узоров. Для двухкомпонентной системы нанесение узора также может быть достигнуто легко доступными способами.
Способы мягкой литографской печати могут быть использованы для создания узора, в котором для создания узора могут быть использованы ультрафиолетовое излучение и маска. Например, монослой основания без узора можно использовать в качестве платформы для сборки монослоя реактивного мономера под действием пучка УФ/частиц. На монослой мономера затем может быть нанесен узор посредством УФ фотолитографской печати, электронно-лучевой литографской печати или литографской печати ионным пучком, даже хотя основной SAM не имеет узора.
Рост структур на монослое с узором может достигаться посредством различных механизмов роста, таких как соответствующее химическое восстановление солей металлов и использование центров или зародышей кристаллизации. При использовании элементов распознавания на монослое, рост неорганических соединений можно ускорить катализатором в этом месте раздела фаз различными способами. Например, могут быть сформированы неорганические соединения в форме коллоидов, обладающие формой органического монослоя с узором. Например, структуры из карбоната кальция или кремния могут составлять узоры за счет различных карбонильных функциональных групп, таких как карбоновые кислоты и амиды. Управляя условиями роста кристаллов, можно контролировать толщину и морфологию кристаллов во время роста минеральных соединений. Также для создания узора пригоден диоксид титана.
Способы создания узора путем нанесения покрытий химическим путем можно использовать для синтеза металлов с помощью существующих органических функциональных групп. В частности, путем образования хелатных соединений атомов металлов с карбонильными фрагментами узора из органического вещества, осаждение металлов способом химического восстановления можно катализировать на узоре, формируя металлические коллоиды с узором. Например, Cu, Au, Ni, Ag, Pd, Pt и многие другие металлы, фотоформа которых изготавливается путем нанесения покрытий химическим путем, могут быть использованы для формирования металлических структур в форме органического монослоя. Управляя условиями нанесения покрытий химическим путем, можно контролировать толщину металлических структур с электролитическим покрытием.
Другие способы выращивания типа "вверх дном", известные в этой области, могут быть использованы для формирования отливной формы, например, способ, предложенный в патенте США №7,189,435 Tuominen, et al., который включен в настоящий документ в качестве ссылки. В этом способе проводящая или полупроводниковая подложка (например, такой металл, как золото) может контактировать с пленкой блок-сополимера (например, блок-сополимер метилметакрилата и стирола), когда один компонент сополимера образует наноскопические цилиндры в матрице другого компонента. Проводящий слой затем может быть помещен поверх сополимера, чтобы сформировать композитную структуру. При вертикальной ориентации композитной структуры часть первого компонента может быть удалена, например, посредством воздействия УФ-излучения, электронным пучком или деструкцией под действием озона или подобным для формирования наноскопических пор в этой области второго компонента.
В другом варианте осуществления, предложенном в патенте США №6,926,953, Nealey, et al., включенном в настоящий документ в качестве ссылки, структуры сополимеров могут быть сформированы путем воздействия на подложку с репродуцированным слоем на ней, например, самособранного монослоя алкилсилоксана или оксидецилтрихлорсилоксана, двумя или более пучками выбранной длины волны для формирования интерференционного узора на репродуцированном слое, чтобы изменить смачиваемость репродуцируемого слоя в соответствии с интерференционными узорами. Слой выбранного блок-сополимера, например, сополимера полистирола и поли(метилметакрилата) затем может быть осажден на внешний репродуцируемый слой и отожжен для разделения компонентов сополимера в соответствии с шаблоном смачиваемости и для получения реплики узора репродуцируемого слоя в слое сополимера. Таким образом, могут быть сформированы полосы или выделенные области разделенных компонентов с повторяющимся размером в диапазоне 100 нанометров или меньше.
Отливная форма может быть использована для формирования нужных структур на гибкой пленке. Отливная форма может представлять собой позитивную или негативную отливную форму, в зависимости от способа прессования, используемого для формирования пленки из отливной формы. Например, отливная форма может представлять собой негативную отливную форму, образующую негативные отпечатки наноструктур для формирования на пленке, и пленка может быть сформована или прессована по негативной отливной форме посредством приложения тепла и/или давления. В другом варианте осуществления позитивная отливная форма может быть использована для формирования негативной отливной формы, например, посредством способа электропрессования, и негативная отливная форма затем может быть использована в способе формования пленки. Способ электропрессования включает размещение позитивной отливной формы в бак для электропрессования, в котором металл осаждается вокруг особенностей отливной формы. Это может быть любой подходящий металл. Металл осаждается с нужной толщиной, при которой тыльная сторона позитивной отливной формы отделяется от электропрессованного металла, создавая компоненты негативной формы. Этот тип пресс-формы обычно называется матрицей для гальваностереотипа. После формования матрица для гальваностереотипа затем может быть использована в разрезанном виде для прессования поверхности пленки.
В одном варианте осуществления узор из отливной формы может быть перенесен на пленку с использованием способа и устройства, предложенных в патенте США №7,754,131, Olsson, et al., который включен в настоящий документ в качестве ссылки. Например, отливная форма может быть расположена в соединении с выровненной пленкой без узора. Затем отливную форму прижимают к пленке при достаточном нагревании и давлении, чтобы перенести на эту пленку узор. Предпочтительные значения давления и температуры могут зависеть от материала, который образует пленку. Например, пленка может быть нагрета до температуры до примерно 500°С перед прессованием. В альтернативном варианте могут быть использованы другие способы и устройство формирования узора из наноструктур на пленке, известные в этой области, например, предложенные в патентах США №№6,923,930, 7,022,465, 7,041,228, 7,137,336, 7,195,734, 7,252,492, 7,670,127, 7,670,452, 7,687,007, 7,704,425, 7,717,693, 7,855,046 и 7,862,849, которые включены в настоящий документ в качестве ссылки.
Пленка в основном может представлять собой биосовместимую полимерную пленку, сформированную из термопластичного или термоотверждаемого полимера. Например, пленка может содержать гомополимеры и/или сополимеры полиолефина (например, полипропилен, полиэтилен), полистирол, поликарбонат, полиметакрилат (например, полиметилметакрилат) и т.д. В одном варианте осуществления пленка может содержать биологически разлагаемые полимеры, известные в этой области, включая, без ограничения, гомополимеры и сополимеры полилактидов (например, сополимеры полимолочной кислоты- ко-колигликолевой кислоты PLA-co-PGA), полигидроксиалканаты и подобные.
III. Формирование композитной матрицы
Пленка, сформированная с множеством структур наноразмера по меньшей мере на одной стороне, может быть наложена на сборку микроигл для формирования композитной матрицы микроигл. На фиг.12 схематично показаны кончики двух репрезентативных микроигл 22, которые содержат пленку 26, образующую изготовленные наноструктуры на поверхности микроигл 22. В этом конкретном варианте осуществления микроиглы 22 образуют центральный канал 24, который может быть использован для доставки препарата через микроиглы 22. На поверхность 25 микроиглы 22 наложена в виде слоя пленка 26, которая образует на ней узор из наноструктур. В этом конкретном варианте осуществления нанотопография пленки 26 образует произвольный узор на поверхности.
На фиг.13А-13В схематично показан способ формирования композитной матрицы микроигл. Сборка 418 микроигл включает микроиглу 414, сформированную на поверхности. На фиг.13А, можно видеть и вид сбоку и вид сверху микроиглы 414. Микроигла 414 содержит каналы 412 и отверстия 410, совмещенные с каналами 412. На фиг.13В показана пленка 420, содержащая множество наноструктур 424, сформированных на первой стороне пленки 420. Как показано на фиг.13С, композитная матрица 430 микроигл включает пленку 420, наложенную на поверхность микроиглы 414.
Пленка 420 наложена поверх и сцеплена с микроиглой 414, так что она соответствует по форме по меньшей мере участку микроиглы. В одном варианте осуществления это может быть выполнено путем приложения давления к пленке 420, необязательно в соединении с нагревом, чтобы пленка приняла форму микроиглы, а также чтобы приклеить пленку к поверхности микроиглы. Например, микроигла с наложенной пленкой может удерживаться в нагретой вакуумной камере (например, при уровне вакуума примерно 3 дюйма водяного столба) при повышенной температуре ниже точки размягчения полимерного материала, который формирует пленку 420 (например, от примерно 100°C до примерно 130°C) в течение некоторого периода времени (например, от примерно 15 минут до примерно одного часа), чтобы пленка по меньшей мере частично приняла форму поверхности микроиглы, при этом сохраняя поверхность пленки с наноузором. Таким образом, при таком применении пленка 420 опускается для сцепления с поверхностью микроиглы 414. Предпочтительное давление и температура для любой конкретной системы могут зависеть от конкретных используемых материалов, например, полимерного материала пленки, а также размера и материалов микроигл из сборки микроигл.
В другом варианте осуществления пленка 420 может быть сцеплена с поверхностью микроиглы 414 посредством приложения давления к верхней части пленки 420, необязательно с применением нагрева. Например, пленка 420 может быть наложена на поверхность сборки микроигл, и может быть приложена сила к поверхности пленки, чтобы притянуть пленку 420 к сборке и, таким образом, сцепить и по меньшей мере частично придать пленке 420 форму поверхности микроигл сборки. В одном варианте осуществления негативный отпечаток поверхности сборки микроигл может быть прижат к пленке 420, чтобы сцепить пленку 420 со сборкой 418 микроигл. В одном варианте осуществления прижимающее устройство может контактировать с пленкой в некоторых местах пленки, например, там, где пленка 420 соприкасается с поверхностью 440 сборки микроигл, т.е. между отдельными микроиглами, и/или в местах, где пленка 420 наложена на каналы 412, и может не соприкасаться с пленкой 420 в местах, где пленка 420 наложена на микроиглы 414, чтобы не допустить повреждения наноструктур 424 за счет чрезмерной силы, приложенной к наноструктурам 424 во время сцепления.
В одном варианте осуществления прижимное устройство может прикладывать непосредственное давление к пленке 420 в тех местах, где пленка 420 наложена на каналы 412. Это служит для сцепления пленки 420 со сборкой 418 микроигл, а также может создавать перфорации в пленке 420 на каналах 412, что может способствовать потоку препарата через композитное устройство с микроиглами.
В варианте осуществления по фиг.13 пленка 420 является непрерывной поверх кончика 422 микроиглы 414. Во время использования давление может быть приложено к устройству, например, при приложении трансдермального пластыря к поверхности кожи пользователя, и во время приложения перфорации могут образовываться в пленке 420 на или около кончика 422 микроиглы. В другом варианте осуществления давление может быть приложено к кончику 422 микроиглы перед использованием, например, во время сцепления пленки 420 с матрицей 418 микроигл, или во время формирования устройства доставки лекарственного средства, которое содержит композитную матрицу 430 микроигл, который может формировать перфорации в пленке 420, наложенной в виде слоя поверх сборки 418 микроигл. Перфорации в пленке 420 у кончика 422 микроиглы и/или у каналов 412 обеспечивают путь для препарата, доставляемого из устройства доставки лекарственного средства на участок доставки. В другом варианте осуществления пленка может быть сформирована пористой для препарата(ов), доставляемых композитной матрицей, и препараты могут диффундировать через пленку за счет пористости, например, на выходе из каналов микроигл.
Поверхности композитной матрицы могут быть приданы функциональные особенности для улучшенного взаимодействия с тканями или отдельными клетками во время использования. Например, одна или более биомолекул, таких как полинуклеотиды, полипептиды, все белки, полисахариды и т.п., могут быть связаны со структурированной поверхностью перед использованием. В некоторых вариантах осуществления поверхность, содержащая структуры наноразмера, уже обладает подходящей реактивностью, чтобы можно было спонтанно присоединить нужные функциональные группы к поверхности без необходимости предварительной обработки поверхности. Однако в других вариантах осуществления предварительная обработка структурированной поверхности может быть выполнена перед присоединением нужных соединений. Например, реактивность структурированной поверхности может быть повышена путем добавления или аминных, карбоновых, гидроксильных, альдегидных, тиольных или сложноэфирных групп на поверхности. В одном репрезентативном варианте осуществления поверхность микроигл, содержащая узор из сформированных на ней наноструктур, может быть аминирована посредством контакта с амин-содержащим соединением, таким как 3-аминопропилтриэтоксисилан, чтобы увеличить количество аминных функциональных групп на поверхности и связать одну или более биомолекул с поверхностью посредством добавленных аминных функциональных групп. Придание функциональных особенностей поверхности пленки может быть выполнена до формирования структур на поверхности. Кроме того, придание функциональных особенностей поверхности пленки может происходить до наложения пленки на поверхность сборки микроигл или после ее наложения, в зависимости от необходимости.
Вещества, которые может быть предпочтительно связать с поверхностью композитной матрицы микроигл могут включать белки ЕСМ, такие как ламинины, тропоэластин или эластин, тропоколлаген или коллаген, фибронектин и подобные. Короткие фрагменты полипептидов могут быть связаны с поверхностью устройства с узором, например, последовательность RGD (аргинил-глицил-аспартил), которая является частью последовательности распознавания связи интегрина с многими белками ЕСМ. Таким образом, повышение функциональных возможностей наноструктурированной поверхности с RGD может способствовать взаимодействию устройства с белками ЕСМ и, кроме того, ограничивать реакцию на инородное тело устройства во время использования.
IV. Репрезентативные способы использования
Композитная матрица микроигл может быть использован для взаимодействия с тканью, например, при доставке биоактивного препарата в клетку. Например, матрица микроигл может быть компонентом трансдермального пластыря, используемого для доставки препарата в ткань или к одному или более типам клеток ткани, для структурной поддержки ткани, для удаления участка или компонента ткани и т.д. В одном варианте осуществления матрица микроигл может быть использован для транспорта вещества через один или несколько слоев кожи.
Во время использования нанотопография матрица может взаимодействовать с окружающими биологическими компонентами и регулировать или моделировать (т.е. менять) внутриклеточную и/или межклеточную сигнальную трансдукцию, связанную с взаимодействиями между клетками, эндоцитозом, воспалительной реакцией и т.д. Например, посредством взаимодействия между нанотопографией на поверхности микроигл и окружающими биологическими материалами или структурами устройство может регулировать и/или модулировать трансмембранный потенциал, мембранные белки и/или межклеточные контакты (например, плотные контакты, щелевые контакты и/или десмосомы). Матрица микроигл может быть использован для трансдермальной доставки препаратов или удаления веществ через такие биологические барьеры, как кожа, гематоэнцефалический барьер, ткани слизистой оболочки, кровеносные и лимфатические сосуды и т.д., не вызывая реакцию на инородное тело или иммунный ответ.
Структуры нанотопографии могут имитировать и/или взаимодействовать с одним или более белками ЕСМ, такими как коллаген, ламинин, фибронектин и т.д. Клетки в локальной области, окружающей микроиглы, могут поддерживать противовоспалительную микросреду, поскольку поверхность микроигл может лучше имитировать локальное окружение либо напрямую, либо опосредованно, например, благодаря адсорбции белков на поверхности. Таким образом, вещества могут доставляться путем использования устройства без развития реакции на инородное тело или иммунного ответа.
В одном варианте осуществления нанотопография матрицы может взаимодействовать с одним или более компонентами контактирующей эпителиальной ткани для увеличения пористости ткани за счет механизмов параклеточного и/или трансклеточного транспорта. Эпителиальная ткань, которую можно сделать более пористой путем использования матрицы микроигл, может содержать и простой, и слоистый эпителий, включающий и ороговевший эпителий, и промежуточный эпителий. Эпителиальная ткань, о которой идет речь в настоящем документе, может содержать любые типы клеток эпителиального слоя, включая, без ограничения, кератиноциты, спущенные клетки, клетки, имеющие форму цилиндров, кубов и псевдомногослойные клетки.
Взаимодействие нанотопографии устройства с компонентами клеточной сети или слоем эпидермиса может модулировать (т.е., менять) в ней структуру межклеточных контактов. Внутриклеточное соединение может представлять собой по меньшей мере одно соединение, выбранное из группы, состоящей из плотных контактов, щелевых контактов и десмосом. Например, взаимодействие между биологическими компонентами и структурами нанотопографии может модулировать белки клеточной сети, чтобы индуцировать открытие плотных контактов зернистого слоя, тем самым, обеспечивая улучшенную доставку активного препарата через эпидермис, и в одном конкретном варианте осуществления, активного препарата с высокой молекулярной массой. Плотные контакты обнаружены в зернистом слое, и размыкание плотных контактов может обеспечивать параклеточный путь для улучшенной доставки активных препаратов, особенно активных препаратов с большой молекулярной массой и/или препаратов, которые обнаруживают низкую липофильность, чем ранее наблюдали при трансдермальной доставке.
Благодаря улучшенному взаимодействию с окружающими биологическими компонентами, устройства могут облегчать улучшенное поступление доставляемого препарата. Например, фармакокинетический (РК) профиль (т.е., профиль всасывания через эпителиальные мембраны) белкового терапевтического средства может быть улучшен посредством использования устройства, содержащего узор с нанотопографией. Например, белковое терапевтическое средство с молекулярной массой более 100 кДа, например, от примерно 100 до примерно 200 кДа или до примерно 150 кДа, может быть доставлено трансдермально посредством пластыря, содержащего композитную матрицу микроигл. В одном варианте осуществления пластырь может быть использован для доставки однократной дозы белкового терапевтического средства, например, от примерно 200 до примерно 500 мкл или до примерно 250 мкл. После присоединения трансдермального пластыря к коже у пациента можно обнаруживать профиль РК., который отражает быстрый рост концентрации в сыворотке крови от примерно 500 до примерно 1000 нанограмм терапевтического средства на миллилитр на квадратный сантиметр площади пластыря, например, от примерно 750 до примерно 850 нанограмм терапевтического средства на миллилитр на квадратный сантиметр площади пластыря, в пределах от примерно 1 до примерно 4 часов приема. Этот быстрый первоначальный рост уровня в сыворотке крови, который отражает быстрое поступление терапевтического средства через дермальный барьер, может сопровождаться менее быстрым спадом концентрации в сыворотке крови за период более от примерно 20 до примерно 30 часов, например, более примерно 24 часов, до пренебрежимо малой концентрации терапевтического средства в сыворотке крови. Более того, быстрое поступление доставляемого терапевтического средства может сопровождаться незначительным воспалением, или его может не быть вообще. В частности, помимо способствования улучшенной доставке препарата через трансдермальный барьер, устройства также могут ограничивать реакцию на инородное тело и другие нежелательные реакции, такие как воспаление. Использование известных ранее устройств, таких как трансдермальные пластыри без нанотопографии, образованной на поверхности, контактирующей с кожей, часто приводит к локальным областям воспаления и раздражения.
V. Устройства
Устройства могут быть присоединены к препарату для доставки посредством матрицы микроигл. Например, трансдермальный пластырь с микроиглами может быть использован для доставки веществ ниже рогового слоя в средний слой, stratum spinosum, или ростковый слой, stratum germinativum, или даже глубже в дерму. В основном, препарат может транспортироваться через роговой слой вместе с микроиглой, например, внутри микроиглы или на поверхности микроиглы, или на поверхности пленки, которая покрывает микроиглу.
Устройство может включать емкость, например, сосуд, пористую матрицу и т.д., которые позволяют хранить препарат и обеспечивать препарат для доставки. Устройство может содержать емкость внутри самого устройства. Например, устройство может содержать полость или множество пор, которые могут переносить один или более препаратов для доставки. Препарат может выбрасываться из устройства посредством разрушения участка или всего устройства или посредством диффузии препарата из устройства.
На фиг.14А и 14В репрезентативно представлено устройство с емкостью. Устройство 110 содержит емкость 112, образованную непроницаемым защитным слоем 114 и матрицей 116 микроигл. Защитный слой и матрица 116 микроигл соединены вместе около наружной части устройства, как указано выноской 118. Непроницаемый защитный слой 114 может быть присоединен адгезивом, термосваркой или подобным. Устройство 110 также содержит множество микроигл 120. Покровная пленка 122 может быть удалена перед использованием устройства, чтобы обнажить микроиглы 120.
Состав, содержащий один или более препаратов, может удерживаться внутри емкости 112. Материалы, пригодные для использования в качестве непроницаемого защитного слоя 114, могут включать такие материалы, как сложные полиэфиры, полиэтилен, полипропилен и другие синтетические полимеры. Материал в основном может уплотняться теплом или иным способом относительно защитного слоя, чтобы обеспечить барьер для поперечного потока содержимого емкости.
Емкость 112, образованная пространством или зазором между непроницаемым защитным слоем 114 и основанием матрицаа микроигл, обеспечивает структуру для хранения, в которой удерживается суспензия назначаемых препаратов. Емкость может быть сформирована из разнообразных материалов, которые совместимы с содержащимся в них препаратом. Например, емкость может быть сформирована из натуральных и синтетических полимеров, металлов, керамики, полупроводников и их композитов.
В одном варианте осуществления емкость может быть присоединена к подложке, на которой расположены микроиглы. В другом варианте осуществления емкость может быть отделена и разъемно присоединяться к матрице микроигл или сможет сообщаться с матрицей микроигл по потоку текучей среды, например, посредством соответствующих трубок, насадок Люэра и т.д.
Устройство может содержать одну или несколько емкостей для хранения доставляемых препаратов. Например, устройство может содержать одну емкость, в которой хранится состав, содержащий один или несколько препаратов, или устройство может содержать несколько емкостей, в каждой из которых хранится один или более препаратов для доставки во все или на участок матрицы микроигл. В случае нескольких емкостей, в каждой могут храниться разные вещества, которые могут быть скомбинированы для доставки. Например, первая емкость может содержать препарат, например, лекарственное средство, а вторая емкость может содержать наполнитель, например, физиологический раствор. Различные препараты могут смешиваться перед доставкой. Смешивание может быть начато любыми способами, включая, например, механическое разрушение (т.е. прокалывание, разрушение или разрыв), изменение пористости или электрохимическое разрушение стенок или мембран, разделяющих камеры. Несколько емкостей могут содержать различные активные препараты для доставки, которые можно доставлять вместе с другими или по очереди.
В одном варианте осуществления емкость может сообщаться по потоку текучей среды с одной или более микроиглами трансдермального устройства, и микроиглы могут образовывать структуру (например, центральный или боковой канал) для обеспечения транспорта доставляемых препаратов под барьерный слой.
В альтернативных вариантах осуществления устройство может содержать сборку микроигл и сборку емкости, чтобы предотвратить поток между ними до использования. Например, устройство может содержать отсоединяемый элемент, расположенный с примыканием и к емкости, и к матрице микроигл. Отсоединяемый элемент может быть отделен от устройства перед использованием, так что во время использования емкость и матрица микроигл сообщаются по потоку текучей среды друг с другом. Разделение может быть осуществлено посредством частичного или полного отсоединения отсоединяемого элемента. Например, как показано на фиг. 15-20, в одном варианте осуществления показан отсоединяемый элемент, который сконструирован для отсоединения от трансдермального пластыря для инициации потока лекарственного соединения. Более конкретно, на фиг. 15-16 показан трансдермальный пластырь 300, который содержит сборку 370 доставки лекарственного средства и сборки 380 микроигл. Сборка 370 доставки лекарственного средства содержит емкость 306, расположенную с примыканием к мембране 308, управляющей скоростью доставки.
Мембрана, управляющая скоростью доставки, может способствовать замедлению скорости потока лекарственного соединения при его выпускании. В частности, жидкостные лекарственные соединения, проходящие из емкости с лекарственным средством в сборку микроигл через микрофлюидальные каналы, могут испытывать перепад давлений, который приводит к снижению скорости потока. Если этот перепад слишком большой, может быть создано некоторое обратное давление, которое может препятствовать потоку соединения и, возможно, преодолевать внутрикапиллярное давление текучей среды через микрофлюидальные каналы. Таким образом, использование мембраны, управляющей скоростью доставки, может повысить этот перепад давлений и обеспечить введение лекарственного соединения в микроиглу при более контролируемой скорости потока. Конкретные материалы, толщина и т.д. мембраны, управляющей скоростью доставки, могут быть различны в зависимости от многих факторов, таких как вязкость лекарственного соединения, необходимое время доставки и т.д.
Мембрана, управляющая скоростью доставки, может быть изготовлена из проницаемых, полупроницаемых или микропористых материалов, известных в этой области, чтобы управлять расходом лекарственных соединений, и обладающих проницаемостью относительно усилителя проницаемости ниже, чем у емкости с лекарственным средством. Например, материал, используемый для формирования мембраны, управляющей скоростью доставки, может обладать средним размером пор от примерно 50 нанометров до примерно 5 микрометров, в некоторых вариантах осуществления от примерно 100 нанометров до примерно 2 микрометров, и в некоторых вариантах осуществления от примерно 300 нанометров до примерно 1 микрометра (например, примерно 600 нанометров). Подходящие материалы мембраны включают, например, волокнистые материалы (например, тканые или нетканые), пленки с отверстиями, пеноматериалы, губки и т.д., которые сформированы из полимеров, таких как полиэтилен, полипропилен, поливинилацетат, сополимеры этилен н-бутилацетата и этилен винилацетата. Такие материалы мембраны также указаны более детально в патентах США №№ 3,797,494, 4,031,894, 4,201,21 1, 4,379,454, 4,436,741, 4,588,580, 4,615,699, 4,661,105, 4,681,584, 4,698,062, 4,725,272, 4,832,953, 4,908,027, 5,004,610, 5,310,559, 5,342,623, 5,344,656, 5,364,630 и 6,375,978, которые включены в настоящий документ во всей полноте в качестве ссылки для всех соответствующих целей. Особенно пригодным материалом для мембраны является материал, предлагаемый компанией Lohmann Therapie-Systeme.
Как показано на фиг. 15-16, хотя это необязательно, сборка 370 также содержит адгезивный слой 304, расположенный с примыканием к емкости 306. Аналогично, сборка 380 микроигл содержит опору 312, из которой выступает множество микроигл 330 с каналами 331, как указано выше. Слои сборки 370 доставки лекарственного средства и/или сборки 380 микроигл могут быть соединены вместе, если это необходимо, с помощью любых известных способов присоединения, таких как адгезивное присоединение, термосварка, ультразвуковая сварка и т.д.
Несмотря на используемую конкретную конструкцию, пластырь 300 также содержит отсоединяемый элемент 310, который расположен между сборкой доставки лекарственного средства и сборкой 380 микроигл. Хотя отсоединяемый элемент 310 необязательно может быть присоединен к примыкающей опоре 312 и/или мембране 308, управляющей потоком, обычно предпочтительно, чтобы он был только слабо присоединен, если присоединен вообще, чтобы отсоединяемый элемент 310 можно было легко снять с пластыря 300. Если это необходимо, отсоединяемый элемент 310 также может содержать участок 371 язычка (фиг.15-16), который продолжается по меньшей мере частично за периметр пластыря 300, чтобы облегчить пользователю возможность захватить этот элемент и потянуть его в нужном направлении. В ее "неактивном "состоянии, как показано на фиг.15-16, сборка 370 доставки лекарственного средства пластыря 300 надежно удерживает лекарственное соединение 307, чтобы оно не вытекало до некоторой значимой степени в микроиглы 330. Пластырь может быть "активирован" простым приложением силы к отсоединяемому элементу, чтобы отсоединить его от пластыря.
Как показано на фиг.17-18, в одном варианте осуществления предложен пластырь 300, для активации которого отсоединяемый элемент 310 тянут в продольном направлении. Может быть удален весь отсоединяемый элемент 310, как показано на фиг.19-20, или он может быть просто частично отсоединен, как показано на фиг.17-18. Однако в любом случае уплотнение, сформированное ранее между отсоединяемым элементом 310 и отверстием (не показано) опоры 312, будет разрушено. Таким образом, лекарственное соединение 107 может начать вытекать из сборки 170 доставки лекарственного средства в каналы 131 микроигл 130 через опору 1 12. Примеры того, как лекарственное соединение 307 вытекает из емкости 306 в каналы 331, показаны на фиг.19-20. В частности, поток лекарственного соединения 307 инициируется пассивно и не требует каких-либо активных механизмов вытеснения (например, насосов).
В вариантах осуществления, показанных на фиг.15-20, отсоединение отсоединяемого элемента сразу же инициирует поток лекарственного соединения в микроиглы, поскольку сборка доставки лекарственного средства уже расположена с сообщением по потоку текучей среды со сборкой микроигл. Однако в некоторых вариантах осуществления может быть предпочтительно предусмотреть для пользователя большую степень управления выбором времени выпускания лекарственного соединения. Это можно осуществить путем использования компоновки пластыря, в котором сборка микроигл первоначально не сообщается по потоку текучей среды со сборкой доставки лекарственного средства. Когда нужно использовать пластырь, пользователь может физически привести две отдельные сборки в состояние сообщения по потоку текучей среды. Отсоединяемый элемент может быть отделен либо до, либо после такого физического приведения в состояние сообщения.
На фиг.21-26, например, показан один конкретный вариант осуществления пластыря 200. На фиг.21-22 показан пластырь 200 до использования, и показана первая секция 250, сформированная сборкой 280 микроигл, и вторая секция 260, сформированная сборкой 270 доставки лекарственного средства. Сборка 270 доставки лекарственного средства содержит емкость 206, расположенную с примыканием к мембране 208, управляющей потоком, как указано выше. Хотя это необязательно, сборка 270 также содержит слой 204 адгезива, который расположен с примыканием к емкости 206. Аналогично, сборка 280 микроигл содержит опору 212, из которой выступает множество микроигл 230 с каналами 231, как указано выше.
В этом варианте осуществления опора 212 и мембрана 208, управляющая скоростью доставки, исходно расположены горизонтально с примыканием друг к другу, и отсоединяемый элемент 210 выступает поверх опоры 212 и мембраны 208, управляющей скоростью доставки. В этом конкретном варианте осуществления в основном предпочтительно, чтобы отсоединяемый элемент 210 был съемно присоединен к опоре 212 и мембране 208, управляющая скоростью доставки, адгезивом (например, адгезивом, эффективным при кратковременном прижатии). В "неактивном "состоянии, как показано на фиг.21-22, сборка 270 доставки лекарственного средства пластыря 200 надежно удерживает лекарственное соединение 207, так что оно не вытекает до какой-либо значительной степени в микроиглы 230. Когда нужно "активировать" пластырь, отсоединяемый элемент 210 можно отодрать и удалить, как показано на фиг.23-24, чтобы разрушить ранее сформированное уплотнение между отсоединяемым элементом 210 и отверстием (не показано) опоры 212. Поэтому, вторая секция 260 может быть согнута по линии сгиба "F", как показано направлением стрелки на фиг. 25, чтобы элемент 208 управления скоростью доставки был расположен вертикально с примыканием к опоре 212 и с сообщением по потоку текучей среды с ней. В альтернативном варианте первая секция 250 может быть согнута. Тем не менее, сгибание секций 250 и/или 260 инициирует поток лекарственного соединения 207 от сборки 270 доставки лекарственного средства в каналы 231 микроигл 230 через опору 212 (см. фиг. 26).
Устройство может доставлять препарат с такой скоростью, чтобы это было полезно в лечебных целях. С этой целью трансдермальное устройство может содержать корпус с микроэлектроникой и другими микроструктурами для управления скоростью доставки либо по заранее заданному графику, либо посредством активного взаимодействия с пациентом, медицинским работником или биодатчиком. Устройство может содержать вещество на поверхности с заранее заданной скоростью разложения, чтобы управлять выпусканием препарата, содержащегося внутри устройства. Скоростью доставки можно управлять путем регулирования разнообразных факторов, включая характеристики доставляемого состава (например, вязкость, электрический заряд и/или химический состав); размеры каждого устройства (например, наружный диаметр и объем каждого из отверстий); число микроигл на трансдермальном пластыре; число отдельных устройств в матрице носителя; применения внешней силы (например, градиента концентрации, градиента напряжения, градиента давления); использования клапана; и т.д.
Транспортировкой препаратов через устройство можно управлять или контролировать с помощью, например, различных комбинаций клапанов, насосов, датчиков, приводов и микропроцессоров. Эти компоненты могут быть изготовлены с использованием стандартных способов изготовления или микрообработки. Приводы, которые могут быть удобны с устройством, могут включать микронасосы, микроклапаны и локализаторы. Например, микропроцессор может быть запрограммирован для управления насосом или клапаном, тем самым, он управляет скоростью доставки.
Поток препарата через устройство может возникать вследствие диффузии или капиллярного действия или может быть вызван с использованием обычных механических насосов или немеханических движущих сил, таких как электроосмос или электрофорез или конвекция. Например, при электроосмосе электроды расположены на биологической поверхности (например, поверхности кожи), микроигле и/или подложке, примыкающей к микроигле, чтобы создать конвекционный поток, который переносит противоположно заряженные виды ионов и/или нейтральные молекулы к или на участок доставки.
Потоком препарата можно управлять путем выбора материала, образующего поверхность микроигл. Например, одна или более больших канавок, примыкающих к поверхности микроигл устройства, могут быть использованы для направления прохождения лекарственного средства, особенно в жидком состоянии. В альтернативном варианте физические свойства поверхности устройства можно регулировать либо, чтобы способствовать, либо, чтобы подавлять транспорт вещества вдоль поверхности, например, управляя гидрофильностью или гидрофобностью.
Поток препарата можно регулировать с помощью клапанов или затворов, известных в этой области. Клапаны могут многократно открываться и закрываться, или они могут быть одноразовыми клапанами. Например, в устройстве между емкостью и поверхностью с узором может быть установлен разрушаемый барьер или односторонний затвор. При готовности к использованию барьер разрушается, или затвор открывается, обеспечивая поток через него к поверхности микроигл. Другие клапаны или затворы, используемые в устройстве, могут быть активированы термически, электрохимически, механически или с помощью магнита для выборочной инициации, модуляции или останова потока молекул через устройство. В одном варианте осуществления потоком управляют путем использования ограничивающей поток мембраны в качестве "клапана".
В основном, любая система управления доставкой препаратов, включающая емкости, системы управления потоком, сенсорные системы и т.д., известные в этой области, может быть внедрена в устройство. Например, в патентах США №№ 7,250,037, 7,315,758, 7,429,258, 7,582,069 и 7,611,481 предлагается емкость и системы управления, которые могут быть внедрены в устройства.
Препараты, которые могут доставляться устройством, могут быть предназначены для локальной области около устройства или могут быть предназначены для более широкого распространения. Например, в одном варианте осуществления устройство может доставлять препараты для контроля боли или воспаления в локальной области вокруг сустава, например, при лечении остеоартрита или ревматоидного артрита.
Нанотопография устройства может улучшать доставку препаратов, при этом минимизируя реакцию на инородное тело и иммунный ответ. Это может оказаться особенно выгодным, когда речь идет о доставке олигонуклеотидов и других терапевтических средств в оболочку ядра. В прошлом доставка веществ (например, плазмидов, киРНК, интерферирующих РНК и т.д.), в оболочку ядра считалась проблематичной, поскольку даже при достижении эндоцитоза правильная эндосомальная доставка в оболочку ядра считалась трудной, главным образом, благодаря реакции на инородное тело и иммунному ответу. В цитоплазме доставляемое вещество часто перерабатывается поздними эндосомами или разрушается в липосоме. Путем использования предложенных устройств взаимодействия микроиглы с ЕСМ may prevent реакция на инородное тело внутри клетки после эндоцитоза и будет способствовать доставке веществ в ядро.
Доставка белковых терапевтических средств также считалась проблематичной. Например, доставка препаратов с высокой молекулярной массой, таких как белковые терапевтические средства, представляется трудной для путей трансдермальной доставки из-за естественных барьеров кожи. Присутствие нанотопографии на микроигле может благоприятно влиять на термодинамику ЕМС и повышать эффективность доставки и поступления белковых терапевтических средств. Используемый в настоящем документе термин "белковые терапевтические средства" в основном относится к любому биологически активному белковоподобному соединению, включая, без ограничения, натуральные, синтетические и рекомбинантные соединения, слитые белки, химерные организмы и т.д., а также соединения, включающие 20 стандартных аминокислот и/или синтетических аминокислот. Например, присутствие устройства в или около зернистого слоя может раскрыть плотные контакты и обеспечить параклеточный транспорт препаратов с высокой молекулярной массой. В одном варианте осуществления устройство может использоваться при трансдермальной доставке препаратов с высокой молекулярной массой (например, препаратов, образующих молекулярную массу больше примерно 400 Да, больше примерно 10 кДа, больше примерно 20 кДа, или больше примерно 100 кДа, например, примерно 150 кДа). Кроме того, изменение отношения площади поверхности к объему устройства может быть использовано для изменения адсорбции белков на поверхности устройства, которое, в свою очередь, может менять доставку и клеточное поступление веществ. Таким образом, доставка конкретного вещества может быть оптимизирована посредством оптимизации отношения площади поверхности к объему устройства.
Даже при рассмотрении доставки препаратов с малой молекулярной массой, устройство может обеспечивать повышенную эффективность и улучшенное поступление благодаря взаимодействию устройства с компонентами соединительной ткани дермы и соответствующее снижение реакции на инородное тело и повышение локализованного химического потенциала в этой области.
Безусловно, устройства не ограничены целевой доставкой препаратов. Системная доставка препаратов также охватывается настоящим документом, как и удаление препарата у пациента через устройство.
Нет конкретного ограничения на препараты, которые можно доставлять с помощью этого устройства. Препараты могут включать белковоподобные препараты, такие как инсулин, иммуноглобулины (например, иммуноглобулин G, иммуноглобулин М, иммуноглобулин А, иммуноглобулин Е), TNF-α, противовирусные лекарственные средства и т.д.; полинуклеотидные препараты, включая плазмиды, киРНК, интерферирующие РНК, нуклеозидные противораковые лекарственные средства, вакцины и т.д.; и препараты с небольшими молекулами, такие как алкалоиды, гликозиды, фенолы и т.д. Препараты могут включать противоинфекционные препараты, гормоны, лекарственные средства, которые регулируют сердечную деятельность или кровоснабжение, снимают боли и т.д. Другими веществами, которые можно доставлять по настоящему изобретению, являются препараты, полезные при предотвращении, диагностике, смягчении, терапии или лечении заболевания. Не ограничивающий перечень препаратов включает препараты для антиангиогенеза, антидепрессанты, антидиабетические препараты, антигистаминные препараты, противовоспалительные препараты, буторфанол, тиреокальцитонин и аналоги, ингибиторы циклооксигеназы-2, дерматологические препараты, агонисты и антагонисты дофамина, энкефалины и другие опиоидные пептиды, эпидермальные стимуляторы роста, эритропоэтин и аналоги, фолликулостимулирующий гормон, глюкагон, гормон роста и аналоги (включая гормон высвобождения гормона роста), антагонисты гормона роста, гепарин, гирудин и гирудин аналоги таки как гирулог, Суппрессоры иммуноглобулина Е и другие белковые ингибиторы, иммуносуппрессорные препараты, инсулин, инсулинотропин и аналоги, интерфероны, интерлейкины, лютеинизирующий гормон, гормон высвобождения лютеинизирующего гормона и аналоги, моноклональные или поликлональные антитела, препараты против укачивания, мышечные релаксанты, наркотические анальгетики, никотин, нестероидные противовоспалительные препараты, олигосахариды, паратиреоидный гормон и аналоги, антагонисты паратиреоидного гормона, антагонисты простагландина, простагландины, скополамин, седативные средства, агонисты и антагонисты серотонина, препараты при гиперфункции половых желез, тканевые активаторы плазминогена, транквилизаторы, вакцины с и без носителей/адъювантов, вазодилататоры, важные диагностические средства, такие как такие как туберкулин и другие сверхчувствительные препараты, например, предложенные в патенте СП Т А №6,569,143, озаглавленном "Method of Intradermally Injecting Substances" (Способ внутридермального введения веществ), все содержание которого включено в настоящий документ в качестве ссылки. Составы вакцин могут включать антиген или составы антигенов, позволяющие вызвать иммунный ответ против патогена человека или других вирусных патогенов.
В одном предпочтительном варианте осуществления устройство может быть использовано при лечении хронического заболевания, такого как ревматоидный артрит, для доставки потока препарата пациенту. Лекарственные средства при ревматоидном артрите, которые можно доставлять посредством описанных устройств, могут включать соединения для подавления симптомов, такие как анальгетики и противовоспалительные лекарственные средства, включая и стероидные, и нестероидные противовоспалительные лекарственные средства (NSAID), а также модифицирующие течение заболевания противоревматические средства (DMARDs).
Устройство может содержать и доставлять соединения для подавления симптомов, такие как анальгетики и противовоспалительные лекарственные средства, а также DMARD соединения, включая биологические DMARDs. Без ограничения какой-либо конкретной теорией, понятно, что структуры наномасштаба, изготовленные на поверхности устройства, улучшают доставку соединений через дермальный барьер. За счет использования устройства лекарственные средства при ревматоидном артрите можно доставлять при установленной концентрации в течение установленного времени. Устройство позволяет предотвратить первоначальный всплеск концентрации, обычный, когда используются известные ранее способы доставки лекарственных средств при ревматоидном артрите, включая пероральный способ введения и инъекции.
Настоящее изобретение можно лучше понять с учетом приведенных далее примеров.
Пример 1
Несколько различных пресс-форм подготовлены с помощью фотоспособов литографской печати, аналогичных использованным при разработке и изготовлении электрических схем. Отдельные этапы способа в основном известны в этой области и уже описаны.
Первоначально кремниевые подложки подготовлены путем чистки ацетоном, метанолом и изопропиловым спиртом, а затем покрыты слоем 258 нанометров (нм) диоксида кремния в соответствии со способом химического осаждения из паровой фазы.
Затем на каждой подложке сформирован узор по способу электронно-лучевой литографской печати, известному в этой области, с использованием системы JEOL JBX-9300FS EBL. Условия обработки следующие:
Ток электронного пучка=11 нА
Ускоряющее напряжение=100 кВ
Шаг съемки=14 нм
Доза=260 мкКи/см2
Резист=ZEP520A, толщиной ~330 нм
Проявитель=н-амилацетат
Проявление=2 мин погружение с последующим ополаскиванием в течение 30 с изопропиловым спиртом.
Затем выполняют травление диоксида кремния улучшенным травителем диоксида кремния STS (АОЕ). Время травления составляет 50 секунд с использованием 55 стандартных кубических сантиметров в минуту (см3) Не, 22 см3CF4, 20 см3 C4F8 при 4 мТорр, катушки 400 Вт, мощности при реактивном ионном травлении (RIE) 200 Вт и смещении постоянного тока 404-411 В.
Затем выполняют травление кремния травителем диоксида кремния STS (SOE). Время травления составляет 2 минуты с использованием 20 см3 Cl2 и 5 см3 Ar при 5 мТорр, катушки 600 Вт, мощности при реактивном ионном травлении (RIE) 500 Вт и смещении постоянного тока 96-102 В. Глубина травления кремния составляет 500 нанометров.
Буферный травитель оксида (ВОЕ) используют для удаление оставшегося оксида, что включает три минуты погружения в ВОЕ с последующим ополаскиванием деионизированной водой.
Наноимпринтер Obducat NIL-Eitre®6 используется для формирования наноузоров на различных полимерных подложках. В качестве охладителя используется дополнительная вода. УФ-блок используется с одной импульсной лампой с длиной волны от 200 до 1000 нанометров при мощности 1,8 Вт/см2. Используется УФ-фильтр 250-400 нанометров. Область воздействия составляет 6 дюймов с максимальной температурой 200°C и давлением 80 бар. Наноимпринтер включает полупроводниковый разделительный блок и извлечение из пресс-формы с автоматическим управлением.
Чтобы легче извлечь пленки с наноимпринтом из пресс-форм, пресс-формы обрабатывают тридека-(1,1,2,2-тетрагидро)-октилтрихлорсиланом (F13-TCS). Чтобы обработать пресс-форму, кремниевую пресс-форму сначала очищают, промывая ацетоном, метанолом и изопропиловым спиртом, и высушивают в атмосфере азота. Чашку Петри кладут на горячую пластинку в атмосфере азота и добавляют в чашку Петри 1-5 мл F13-TSC. Кремниевую пресс-форму кладут в чашку Петри и накрывают на 10-15 минут, чтобы дать парам F13-TSC испариться из кремниевой пресс-формы до удаления пресс-формы.
Пять разных полимеров, указанных в Табл. 1, использовали для формирования различных узоров с нанотопографией.
Сформировано несколько разных узоров нанотопографии, схематичное представление которых показано на фиг.27А-27Д. Узор с нанотопографией, показанный на фиг.27Д, представляет собой поверхность плоской подложки, приобретенной в компании NTT Advanced Technology of Tokyo, Япония. Узоры были обозначены DN1 (фиг.27А), DN2 (фиг.27В), DN3 (фиг.27С), DN4 (фиг.27D) и NTTAT2 (фиг.27Е). Изображения SEM пресс-форм показаны на фиг.27А, 27В и 27С, и изображения пленок показаны на фиг.27D и 27Е. На фиг.11 показана пленка с наноузором, сформированная путем использования пресс-формы по фиг.27А (DN1). На этой конкретной пленке особенности полимера нанесены путем изменения температуры, как указано выше. Шероховатость поверхности узора на фиг.27Е составляет 34 нанометра.
Узор, показанный на фиг.10С и 10D, также сформирован по этому способу импринтинга. Как показано, этот узор включает столбики 72 и столбики 62. Большие столбики 72 сформированы с диаметром 3,5 микрометра (мкм) и высотой 30 мкм при расстоянии от центра до центра 6,8 мкм. Столбики 62 составляют 500 нанометров в высоту и 200 нанометров в диаметре, и расстояние от центра до центра составляет 250 нанометров.
Условия способа импринтинга, используемого для пленок полипропилена, приведены в Табл. 2.
Пример 2
Пленки формируют, как указано в Примере 1, включая различные узоры, либо из полистирола (PS), либо из полипропилена (РР). Лежащая внизу подложка различна по высоте. Используются узоры DN2, DN3, или DN4, сформированные с использованием способов, указанных в Примере 1. Пресс-формы узоров различаются по глубине отверстий и промежутку для формирования особенностей разного размера с заданными узорами. Образец №8 (обозначенный ВВ1) формируется путем использования микропористой поликарбонатной пленки 0,6 мкм в качестве пресс-формы. Полипропиленовую пленку толщиной 25 мкм кладут поверх фильтра, а затем нагревают до расплавления, чтобы полипропилен мог протекать в поры фильтра. Затем пресс-форму охлаждают, и поликарбонатную пресс-форму растворяют с помощью растворителя метиленхлорида.
Изображения SEM сформированных пленок показаны на фиг.28-36, и характеристики сформированных пленок сведены в Табл. 3.
Чтобы охарактеризовать пленку, для каждого образца используется АРМ.
Характеристики включают формирование изображений сканирующего электронного микроскопа (SEM), определение шероховатости поверхности, определение максимальной измеренной высоты особенности и определение размера фрактала.
Исследование с помощью атомно-силовой микроскопии (AFM) состоит из серии 16 проб кремния и кантилевера компании µMasch. Кантилевер обладает резонансной частотой 170 кГц, константой пружины 40 Н/м, длиной 230±5 мкм, шириной 40±3 мкм и толщиной 7,0±0,5 мкм. Наконечник датчика представляет собой кремниевый датчик, легированный фосфором n-типа, с типичным радиусом наконечника датчика 10 нанометров, полным углом конуса наконечника 40°, общей высотой наконечника 20-25 мкм и объемным удельным сопротивлением 0,01-0,05 Ом-см.
Значения шероховатости поверхности, приведенные в Табл. 3, представляют собой среднее арифметическое высоты параметра шероховатости области поверхности (Sa), как определено в стандарте ISO 25178 серии.
Фрактальный размер рассчитывается для разных углов посредством анализа спектра Фурье амплитуд; для разных углов выделяется профиль Фурье амплитуд, и рассчитывается логарифм координат частоты и амплитуды. Фрактальный размер, D, затем рассчитывается для каждого направления, как
D=(6+s)/2,
где s - отрицательный уклон двойных логарифмических кривых. Приведенный фрактальный размер представляет собой среднее по всем направлениям.
Фрактальный размер также может быть оценен по 2D спектру Фурье путем применения двойной логарифмической функции. Если поверхность представляет собой фрактал, двойная логарифмическая кривая должна быть линейной с отрицательным уклоном (см., например. Fractal Surfaces, John С.Russ, Springer-Veriag New York, LLC, July, 2008).
Пример 3
Сформирован матрица микроигл, содержащих наложенную пленку, образующую поверхность с наноузором. Исходно матрица микроигл сформирован на кремниевой пластине посредством способа фотолитографской печати. Каждая игла имеет два расположенных друг напротив друга боковых канала, совмещенных с одним сквозным отверстием в основании иглы.
Микроиглы сформированы в соответствии с типичным способом микрообработки на пластине на основе кремния. Пластины расположены слоями с резистом и/или слоями оксида с последующим выборочным травлением (травление оксида, Глубокое реактивно-ионное травление (DRIE), травление по ISO), отделением резиста, отделением оксида и способами литографской печати (например, литографская печать по ISO, литографская печать с контактными отверстиями, литографская печать с зазором) в соответствии со стандартными способами формирование матрицаа микроигл.
После формирования матрицы микроигл 5 мкм полипропиленовую пленку со сформированным на ней узором DN2, описанным в Примере 1, характеристики которой указаны для образца 2 в Табл. 3, накладывают на матрица микроигл. Структура пластина/пленка удерживается в нагретой вакуумной камере (вакуум на уровне 3 дюймов водяного столба) при повышенной температуре (130°С) в течение одного часа для аккуратного наложения пленки на поверхности микроигл, сохраняя при этом поверхность пленки с наноузором.
На фиг.37 показана пленка поверх матрицы микроигл, и на фиг.38 показан укрупненный вид одной иглы из матрицы, содержащей наложенную поверх кончика иглы пленку с наноузором.
Пример 4
Сформированы трансдермальные пластыри, содержащие матрицы микроигл, сформированные, как описано в Примере 3. Пластыри сформированы либо с узором DN2, либо с узором DN3 на матрице микроигл.
Пленки, образующие узоры, которые наложены на микроиглы, описаны в Табл. 4. Пленка 1 эквивалентна образцу №2 Табл. 3 и пленка 2 эквивалентна образцу №9 Табл. 3.
Также формируют пластыри контроля, которые не имеют сформированного на пленке узора, который впоследствии накладывают на матрицу микроигл. Трансдермальные и чрескожные составы этанерцепта (энбрел - Enbrel®) подготавливают в соответствии с указаниями поставщика лекарственного средства. Состав чрескожной дозы (для положительного контроля) подготавливают для обеспечения чрескожной дозы лекарственного средства 4 мг/кг. Концентрация Enbrel® для трансдермальной доставки отрегулирована, чтобы предполагаемая дозировка 200 мг/кг достигалась в течение периода 24 часов.
Всего в исследовании используется популяция 10 мышей BALB/C (назначения №1-№10), 8 с трансдермальной дозой Enbrel® (группа 1) и 2 с чрескожной дозой Enbrel® (группа 2), как указано в Табл. 5 внизу. Трансдермальные пластыри накладывают на побритые области кожи, и отверстия образуются около кончиков микроигл при наложении пластыря на кожу.
Используемые трансдермальные пластыри включают и образующие нанотопографию на поверхности (DN2 и DN3 узоры, как указано выше), а также пластыри без узора с нанотопографией.
Образцы цельной крови отбирают в моменты времени, указанные в Табл. 5. Приблизительно от 100 до 200 мкл крови отбирают посредством кровотечения нижнечелюстного канала, а затем центрифугируют на скорости приблизительно 1300 оборотов/мин в течение 10 минут в охлаждаемой центрифуге (установленной на 4°С). Полученную сыворотку аспирируют и переносят в течение 30 минут отбора/центрифугирования в соответствующим образом помеченные пробирки. Пробирки замораживают и хранят в темноте при температуре ≤-70°С, пока выполняется анализ уровней Enbrel® с использованием комплекта ELISA sTNF-рецептора человека (компании R&D Systems, № по каталогу DRT200). Временной промежуток между двумя отборами крови у одного и того же объекта составляет 24 часа, чтобы предотвратить ненужный стресс объекта.
На фиг.39 графически показан средний РК профиль трансдермальных пластырей, который образует на нем нанотопографию. Среднее результатов для всех пластырей, содержащих нанотопографию, используется для представления общего эффекта введенной нанотопографии в соединении с трансдермальным пластырем с микроиглами. Как можно видеть, уровень сыворотки крови быстро вырастает до более 800 нг/мл/см2 площади пластыря в первые два часа после его присоединения. Затем уровень сыворотки крови постепенно падает до пренебрежимо малого уровня в течение 24 часов присоединения. Данные, использованные для фиг.39, приведены в Табл.6.
На фиг.40А и 40В показаны изображения электронного микроскопа для кожи в сечении, которая удерживается в контакте с пластырями. Изображения получают после удаления пластырей (72 часа после присоединения). Образец на фиг.40А контакт с пластырем, включая нанотопографию на поверхности. В частности, узор DN2, как указано выше, сформирован на поверхности пластыря. Образец на фиг.40В удерживается в контакте с трансдермальным пластырем, на котором нет узора с нанотопографией на поверхности. Как можно видеть, образец на фиг.40В обнаруживает признаки воспаления и высокую плотность присутствия макрофагов.
Пример 5
Сформированы трансдермальные пластыри, содержащие матрицы микроигл, сформированные, как описано в Примере 3. Пластыри сформированы либо с узором DN2, либо с узором DN3 на матрице микроигл, как указано в 4 Примера 4. Пластыри контроля также сформированы без узора на пленке, впоследствии накладываемой на матрица микроигл. Трансдермальные и чрескожные составы этанерцепта (Enbrel®) подготавливают в соответствии с указаниями поставщика лекарственного средства.
Испытуемые объекты (кролики) получают дозу Enbrel® трансдермально, либо чрескожно (SubQ). Результаты показаны графически на фиг.41, на котором концентрация сыворотки крови в пг/мл показана в зависимости от времени. Данные по фиг.41 приведены в Табл.7.
Хотя сущность изобретения подробно описана в отношении его конкретных вариантов осуществления, очевидно, что специалисты в этой области, поняв вышеизложенное, могут легко представить варианты, изменения и эквиваленты этих вариантов осуществления. Соответственно, следует оценить объем настоящего описания, как объем приложенной формулы изобретения и ее эквивалентов.
Реферат
Группа изобретений относится к медицинской технике, а именно к устройствам для трансдермальной доставки лекарственных веществ. Трансдермальный пластырь содержит композитную матрицу микроигл. Матрица микроигл в свою очередь содержит сборку микроигл, которая включает множество микроигл; и пленку, наложенную на микроиглы сборки микроигл. Пленка обладает первой поверхностью и второй поверхностью, пленка, по меньшей мере, частично повторяет форму микроигл, причем первая поверхность пленки приклеена к сборке микроигл, вторая поверхность пленки содержит множество сформированных на ней наноструктур, причем наноструктуры расположены с промежутком и скомпонованы в заранее определенный узор. Способ формирования вышеуказанной композитной матрицы микроигл включает наложение ранее упомянутой пленки поверх ранее упомянутой сборки микроигл и сцепление пленки со сборкой микроигл, чтобы пленка по меньшей мере частично повторяла форму матрицы микроигл и была приклеена к сборке микроигл. Изобретения обеспечивают эффективную доставку активных препаратов, включая активные препараты с большой молекулярной массой, при этом снижая иммунный ответ и реакцию на инородное тело. 3 н. и 17 з.п. ф-лы, 41 ил., 7 табл., 5 прим.
Формула
сборку микроигл, которая включает множество микроигл; и
пленку, наложенную на микроиглы сборки микроигл, где пленка обладает первой поверхностью и второй поверхностью, пленка по меньшей мере частично повторяет форму микроигл, причем первая поверхность пленки приклеена к сборке микроигл, вторая поверхность пленки содержит множество сформированных на ней наноструктур, причем наноструктуры расположены с промежутком и скомпонованы в заранее определенный узор.

Комментарии