Способы лечения дегенеративных состояний костей - RU2668372C1
Код документа: RU2668372C1
Чертежи










Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к способам лечения пациентов, страдающих от дегенерацией костей, например остеопении и остеопороза. В частности, изобретение предусматривает способы лечения пациентов, страдающих дегенерацией костей путем замещения хотя бы части дегенерированного костного материала.
УРОВЕНЬ ТЕХНИКИ
Минеральная плотность костей (BMD) является общепринятым термином, характеризующим количество кальцинированной ткани, приходящееся на квадратный сантиметр кости. Понятно, что данный термин не характеризует степень истинную плотность (в виде соотношения массы на объем материала), но скорее используется для передачи информации о твердости кости и восприимчивости кости к перелому. Как правило, BMD рассчитывается с помощью таких способов, как двухэнергетическая рентгеновская абсорбциометрия (или DEXA-сканирование), ультразвук и количественная компьютерная томография (QCT). Из вышеупомянутых способов DEXA-сканирование часто рассматривается как наиболее надежный способ оценки BMD. Например, ультразвуковое исследование имеет ограничения при оценке пяточной кости и непригодно для прямом выявлении участков, наиболее часто подверженных переломам вследствие остеопороза, таких как тазобедренный сустав и позвоночник. QCT, как правило, используют для обследования позвоночника; ее следует проводить в соответствии со строгими правилами в лабораториях для обеспечения приемлемой степени воспроизводимости. Другие испытательные способы оценки BMD включают однофотонную абсорбциометрию (SPA), двухфотонную абсорбциометрию (DPA), цифровую рентгенографию (DXR) и одноэнергетическую рентгеновскую абсорбциометрию (SEXA).
BMD является крайне важной физической характеристикой, поскольку она может является индикатором восприимчивости к переломам. У большинства взрослого населения BMD достигает пика в возрасте около 30-35 и имеет тенденцию к медленному снижению после этого возраста. Снижение BMD возникает вследствие уменьшения образования новых костных клеток, так что резорбция существующих костных клеток организмом превосходит степень образования новых костных клеток. Фиг. 1 (доступная по ссылке http://courses.washington.edu/bonephys/opbmd.html) иллюстрирует типичное снижение BMD (показано в мг/см2) у взрослых и демонстрирует вариативность снижения в зависимости от расы и пола. Менопауза у женщин является крайне значимым событием в связи с BMD, поскольку снижение BMD значительно ускоряется в течение периода времени после менопаузы. Таким образом, женщины с наступившей менопаузой, как правило, получают содействие в проведении регулярной оценки BMD для оценки необходимости проведения лечения и типа лечения. Национальная Организация Остеопороза (США) рекомендует проведение тестирования BMD для следующих категорий: все женщины в возрасте от 65 лет и старше вне зависимости от факторов риска; более молодые женщины с наступившей менопаузой с одним или более факторами риска; женщины с наступившей менопаузой с переломами (для подтверждения диагноза и определения степени серьезности заболевания); женщины с дефицитом эстрогена с клинически определенным риском возникновения остеопороза; пациенты с вертебральными расстройствами; пациенты, проходящие или планирующие пройти долговременный курс лечения глюкокортикоидами (стероидами); пациенты с первичным гиперпаратиреозом; пациенты, проходящие мониторинг в целях определения ответа или эффективности примененной лекарственной терапии, направленной на лечение остеопороза; пациенты с длительными пищевыми расстройствами.
Сниженная BMD, как правило, рассматривается в отношении остеопении и остеопороза, а существование данных состояний определяется в зависимости от количества баллов пациента, рассчитанных при проведении тестирования в целях определения BMD, в частности Т-балла, полученного при проведении DEXA-сканирования. Т-балл, полученный на основе проведенного DEXA-сканирования, является нормализованной величиной, демонстрирующий отношение BIVID пациента к среднему показателю взрослых людей с пиковыми значениями BMD. Нормализованное значение выражается в рамках стандартных отклонений от среднего значения. Таким образом значение Т-балла 0 является индикатором отсутствия отличия значения BMD по сравнению со средним взрослым, отрицательное значение Т-балла является индикатором значения BMD ниже среднего, а положительное значение Т-балла является индикатором того, что значение BMD находится выше среднего. Т-балл является нормализованной величиной в связи с тем, что среднее значение обладает вариативностью в связи с зависимостью от расы и пола. Т-балл различных костей одного человека также может иметь различные значения. В целом, кость с Т-баллом, значение которого больше - 1, рассматривается в качестве входящей в нормальный диапазон (хотя отрицательное значение балла все же является индикатором того, что значение BMD лежит ниже нормализованного среднего значения). Состояние остеопении, как правило, рассматривается в качестве присущего кости со значениями Т-балла от -1 до -2,5. Состояние остеопороза, как правило, рассматривается в качестве присущего кости со значениями Т-балла менее -2,5.
BMD может коррелировать со степенью прочности кости и, таким образом, может является показателем риска возникновения перелома. В целом, считается, что риск возникновения перелома увеличивается с каждым стандартным отклонением ниже нормальных значений. У пожилых людей перелом костей (в частности переломы тазобедренного сустава или позвоночника) могут коррелировать с увеличенными показателями смертности. Таким образом, увеличение BMD может являться целью медицинского вмешательства у пациентов, страдающих остеопенией и/или остеопорозом, поскольку BMD может коррелировать с возрастающим риском возникновения перелома. Несмотря на то, что были испробованы различные виды вмешательств, в данной области все еще сохраняется потребность в способах лечения, способных эффективно увеличивать BMD.
Лечение и профилактика разрушения костей (то есть снижения BMD) может принимать различные формы. Предотвращение, как правило, начинается в детстве с помощью физических упражнений и правильного питания, которое включает достаточные количества кальция и витамина D, поскольку была доказана необходимость совмещения физических упражнений и питания для максимизации развития BMD. Это является важным, поскольку было доказано замедление снижения BMD с возрастом при более высоком уровне BMD в пиковом возрасте.
При наличии состояний остеопении и остеопороза доступно большое количество различных способов лечения. Лечение женщин после наступления менопаузы может замедлить наступление и/или развитие дегенерации костей. Таким же образом, селективные модуляторы эстрогеновых рецепторов (SERM), такие как ралоксифен, могут использоваться для симулирования высоких уровней эстрогена в организме и, таким образом, замедлять убыль костной ткани. Может быть назначен кальцитонин, являющийся материалом, естественно вырабатываемым клетками щитовидной железы. Кальцитонин действует непосредственно на остеокласты (через кальцитониновые рецепторы на поверхности клеток), осуществляя модификацию остеокластов и, таким образом, останавливает резорбцию костей. Бисфосфонаты, такие как этидронат (DIDRONEL®), памидронат (AREDIA®), алендронат (FOSAMAX®), ризедронат (ACTONEI,), золедронат (ZOMETA® или RECLAST) и ибандронат (BONIVA®) могут увеличивать прочность костей путем увеличения плотности минерализации и снижения резорбции костей. Все бисфосфонаты связаны с пирофосфатом, являющимся побочным продуктом клеточного метаболизма и естественным циркулирующим в крови и моче ингибитором минерализации. Несмотря на то, что пирофосфаты не могут проникать в кости (в связи с тем, что выстилающие клетки уничтожают пирофосфат с помощью щелочной фосфатазы), бисфосфонаты могут проникать в кости (и прикрепляться очень крепко) в связи с химическим замещением в соединениях. Несмотря на то, что такие лекарства могут обладать некоторой пользой, недавние исследования показали, что долговременное использование бифосфонатов может увеличить риск спонтанных переломов подвертела и диафиза бедренной кости (то есть атипичных переломов). Деносумаб (PROLIA®) является другим фармацевтическим препаратом, недавно допущенным Управлением по контролю качества пищевых продуктов и лекарственных средств (США) для проведения инъекций дважды в год у пациентов, страдающих остеопорозом с высоким риском возникновения переломов, или у пациентов, не переносящих другие виды лечения. Деносумаб является полностью человеческим моноклональным антителом, которое связывает RANK-лиганд и воздействует на естественный процесс костного метаболизма организма. Несмотря на то, что долговременные эффекты от использования данного антитела еще не известны, врачи были предупреждены о необходимости проведения мониторинга пациентов с неблагоприятными реакциями, такими как остеонекроз челюсти, атипичные переломы и задержка в сращивании переломов. Далее, поскольку данное антитело вносит изменения в иммунную систему организма, было получено доказательство того, что использование данного антитела может увеличить риск возникновения серьезной инфекции у пациента. Еще один препарат, терипаратид (FORTE0®), является рекомбинантным паратиреоидным гормоном (rPTH), который обладает парадоксальным воздействием, заключающимся в увеличении костной массы путем изменения паттерна выработки в сторону естественного, паратиреоидного гормона организма (РТН), и, таким образом, изменяет скелетальный эффект оценки постоянного уровня РТН, что может приводить к увеличению ломкости костей, потери кальция и остеопорозу. С помощью активации различных путей костного метаболизма rPTH увеличивает количество активных остеобластов, снижает степень естественно запрограммированной смерти остеобластных клеткок и отбирает контурные клетки для действия в качестве остеобластных клеток. Данный препарат, по-видимому, оказывает широкое воздействие на формирующие кости остеобластные клетки и максимально стимулирует их чрезмерную активность. Исследования на крысах, направленные на изучение безопасности применения, показали вероятное увеличение риска возникновения остеосаркомы, связанной с использованием rPTH. Таким образом, в данной области сохраняется потребность в способах лечения, которые не требуют долговременного использования препаратов с вероятностью эффектов, которые, являясь непредусмотренными, могут еще и являться вредоносными.
Нефармацевтические способы лечения, как правило, используются только после возникновения перелома. Например, переломы (в частности, позвоночные) могут лечиться с помощью немедленной фиксации, при этом полиметилметакрилатный цемент (как правило, называемый «костным цементом») или похожий нерассасывающийся материал вводится в перелом для перманентного усиления и «фиксации» кости на месте. Несмотря на то, что такие способы лечения могут быть направлены на лечение существующего перелома, неестественные физические свойства (то есть жесткость, модуль упругости кости и так далее) кости после проведения лечения, как считается, увеличивают вероятность перелома смежной кости, в частности, в том случае, если смежная кость подвергнута остеопорозу в продвинутой стадии. Сверх того, результатом данного способа лечения не является образование естественной кости в переломе, но, скорее, функционирование в качестве подвергающихся резорбции заменителей кости.
Несмотря на наличие фармацевтических и хирургических способов лечения дегенерации костей и переломов, в данной области остается потребность в дополнительных способах лечения, способных увеличить BMD в ключевых участках в целях снижения риска возникновения переломов и сопутствующих рисков для здоровья, включая смерть. В частности, окажется полезным и наличие средств для лечения, нацеленных на определенные участки скелета с высоким риском возникновения переломов за счет, в частности, формирования нового, здорового (то есть нормального) костного материала. К данным способам лечения не будут применяться текущие ограничения, существующие в данной области.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение обеспечивает улучшение костной структуры у пациентов, находящихся в состоянии, характеризующемся дегенерацией костной ткани, таком как остеопения или остеопороз. В частности, данное изобретение позволяет осуществлять селективное замещение дегенеративного костного материала в локализированных участках костей материалом для регенерации костей, который ресорбируется организмом в течение времени и замещается вновь сформированным костным материалом. Благоприятно, что вновь сформированный костный материал является костным материалом, который естественен по отношению к пациенту в смысле, что он не является костным трансплантатом (например кадаверной костью) или нерастворимым костным заменителем (например, костным цементом). Более того, вновь сформированный костный материал не является дегенеративным по своей природе, а является здоровым костным материалом в смысле того, что костный материал (который может включать непосредственно окружающие части кости) обладает характеристиками, такими как BMD и сопротивление на сжатие, которые делают вновь сформированный костный материал, в некоторых вариантах осуществления данного изобретения, по существу аналогичным костному материалу у среднего, здорового 30-летнего человека (то есть при возрасте, в котором BMD, как правило, находится на пике). В других вариантах осуществления данного изобретения вновь сформированная кость может характеризоваться как улучшенная по сравнению с костью, находящейся под воздействием остеопении или остеопороза. Такое улучшение, кроме того, может характеризоваться по определенной шкале, такой как связь с Т-баллом, полученном на основе проведенного DEXA-сканирования.
В определенных вариантах осуществления, данное изобретение, таким образом, может быть направлено на способ лечения пациента, страдающего дегенерацией костей. В частности, способ может включать формирование






В определенных вариантах осуществления данного изобретения дегенеративное состояние кости, в частности, может быть выбрано из группы, включающей остеопению и остеопороз. В то время, как пациент, проходящий лечение, может страдать любым заболеванием, вызывающим дегенерацию костей, термины остеопения и остеопороз могут рассматриваться для, в целом, описания пациентов, страдающих любым заболеванием, вызывающим снижение BMD, в рамках которого значение Т-балла, подсчитанного при проведении DEXA-сканирования, ниже определенного уровня. Например, поскольку наличие остеопении технически определяется в тех случаях, когда значение Т-балла сканируемого участка кости меньше -1,0, и поскольку наличие остеопороза технически определяется в тех случаях, когда значение Т-балла сканируемого участка кости меньше -2,5, данные клинические термины (и настоящие способы их лечения) могут рассматриваться в качестве применимых при лечении дегенерации костей вне зависимости от первичного состояния, вызывающего потерю костей (будь то потеря потеря костей в связи со старением или побочный эффект определенного первичного заболевания или медицинского лечения (например, лечение стероидами).
В определенных вариантах осуществления данного изобретения материал для регенерации костей, используемый в соответствии с данным изобретением, может включать остеоиндуктивный материал, остеокондуктивный материал, остеогенный материал, материал, способствующий образованию костной ткани, или остеофильный материал. Предпочтительно материал для регенерации костей включает сульфат кальция. В следующих вариантах осуществления данного изобретения материал для регенерации костей может включать фосфат кальция. В других вариантах осуществления данного изобретения материал для регенерации костей может включать гранулы трикальцийфосфата. В определенных вариантах осуществления данного изобретения материал для регенерации костей может включать комбинацию всех трех типов материалов. В некоторых вариантах осуществления данного изобретения материал для регенерации костей может включать материал, обладающий трехфазным профилем резорбции in vivo.
Материал для регенерации костей может быть охарактеризованным как материал, который вызывает формирование нового, недегенеративного костного материала в образовавшейся

В определенных вариантах осуществления данного изобретения материал для регенерации костей может характеризоваться обеспечивающим осуществление ремоделирования локализованного участка кости в течение времени, которое, по существу, идентично времени для нормальной кости. В частности, возникновение костного метаболизма может быть выявлено в локализованном участке кости (после проведения имплантации материала для регенерации костей внутри

В дальнейших вариантах осуществления данного изобретения материал для регенерации костей может характеризоваться в качестве стимулирующего образование нового костного материала с, по сути, нормальной степенью BMD в участке кости, смежном с образовавшейся пустотой. Это может быть охарактеризовано как градиентный эффект, который описывается далее здесь.
Кость, подвергнутая образованию

В дальнейших вариантах осуществления, данное изобретение, в частности, может быть охарактеризовано как обеспечивающее способ увеличения BMD в локализованном участке кости. Данный способ может включать формирование






В других дальнейших вариантах осуществления, данное изобретение может характеризоваться как обеспечивающее способ создания желаемого профиля BMD в локализованном участке кости. Как описано здесь далее, способы данного изобретения неожиданно не только увеличивают качество кости в локализованном участке кости, подвергнутой лечению, но также могут улучшать определенный профиль BMD, при этом BMD в локализованном участке значительно увеличивается с последующим постепенным возвратом нормальной, по сути, степени плотности. Способ данного изобретения может включать образование





В других дальнейших вариантах осуществления настоящее изобретение может быть охарактеризовано как предусматривающее способы обеспечения степени костного метаболизма в локализованном участке дегенеративной кости, по сути идентичной степени костного метаболизма нормальной кости. Согласно вышеизложенному, способы данного изобретения неожиданно могут применяться для полного восстановления качества кости в локализованном участке кости, подвергающейся лечению. Другими словами, кость, находящаяся в дегенеративном состоянии, заменяется материалом для регенерации костей, а образованный новый естественный костный материал является не дегенерированным, а, по сути, нормальным костным материалом. Таким образом, кость в локализованном участке может быть охарактеризована как подвергнутая костному ремоделированию с переходом от дегенеративного костного материала к нормальному костному материалу. Как более полно описано ниже, ремоделирование костей не относится к естественному процессу, спонтанно осуществляющемуся в организме, но относится к манипулятивному восстановлению качества костей путем осуществления способов данного изобретения. В частности, данный способ может включать образование




В других дальнейших вариантах осуществления, данное изобретение может быть охарактеризовано как предусматривающее способы восстановления высоты позвонков или коррекции ангулярной деформации в позвонке, подвергнутом перелому (в частности, в позвонке, пораженном остеопенией или остеопорозом) с помощью стимулирования роста нового костного материала, который, по сути, идентичен нормальной кости. Данный способ может включать формирование



В других дальнейших вариантах осуществления настоящее изобретение может быть охарактеризовано как предусматривающее способы улучшения качества кости в локализованном участке кости. Как описано здесь, качество кости может быть охарактеризовано относительно измеряемых характеристик, таких как BMD, сопротивление на сжатие и сопротивление к переломам. Таким образом, способы улучшения качества кости могут быть подтверждены улучшением одной или нескольких из этих характеристик (а также с помощью других измеряемых характеристик, которые могут является полезными для определения качества костей). В некоторых вариантах осуществления данного изобретения данный способ может включать замену объема дегенерированного костного материала из локализованного участка кости, обладающего значением Т-балла менее 1,0 вновь образованным, естественным костным материалом, так что тот же локализованный участок кости обладает значением Т-балла более -1,0 (предпочтительно от -0,5 до 0 и более). В дальнейших предпочтительных вариантах осуществления данного изобретения Т-балл локализованного участка кости после проведения процедуры по данному изобретению может превосходить значение Т-балла дегенерированной кости на 1,0 единицу и более. В определенных вариантах осуществления данного изобретения замещение дегенерированного костного материала может включать образование



В других аспектах данное изобретение может предусматривать различные материалы для применения в способах лечения дегенерированного костного материала. Такие материалы, в частности, могут применяться в комбинации, например, в виде набора, для обеспечения легкости выполнения различных способов данного изобретения. Таким образом, данное изобретение может быть охарактеризовано как предусматривающее набор для применения при замещении дегенерированного костного материала в локализованном участке кости материалом для регенерации костей, который стимулирует образование нового костного материала, который, по сути, идентичен нормальной кости.
В некоторых вариантах осуществления данного изобретения набор в соответствии с данным изобретением может включать одно или несколько канюлированных сверл, направляющую проволоку, рабочую канюлю, санирующий зонд, количество материала для регенерации костей, подходящее для заполнения




КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Здесь приводятся ссылки на различные представленные графические изображения относящиеся к описанному в целом изобретению, при этом:
Фиг. 1 является графиком, иллюстрирующим типичное снижение BMD (мг/см2) всего тазобедренного сустава в зависимости от возраста, пола и национальности;
Фиг. 2а является снимком нормальной кости, сделанным сканирующим электронным микроскопом;
Фиг. 2b является снимком подверженной остеопорозу кости, сделанным сканирующим электронным микроскопом;
Фиг. 3a-3i являются радиографическими изображениями, иллюстрирующими инъецирование материала для регенерации костей в

Фиг. 4 является детальным рентгеновским снимком проксимальной части бедренной кости, иллюстрирующим варианты осуществления данного изобретения, при этом могут быть образованы заполненные

Фиг. 5а-5с являются иллюстрациями, демонстрирующими выбранные этапы хирургической процедуры по замещению дегенерированного костного материала в дистальном отделе лучевой кости пациента в соответствии с одним вариантом осуществления данного изобретения;
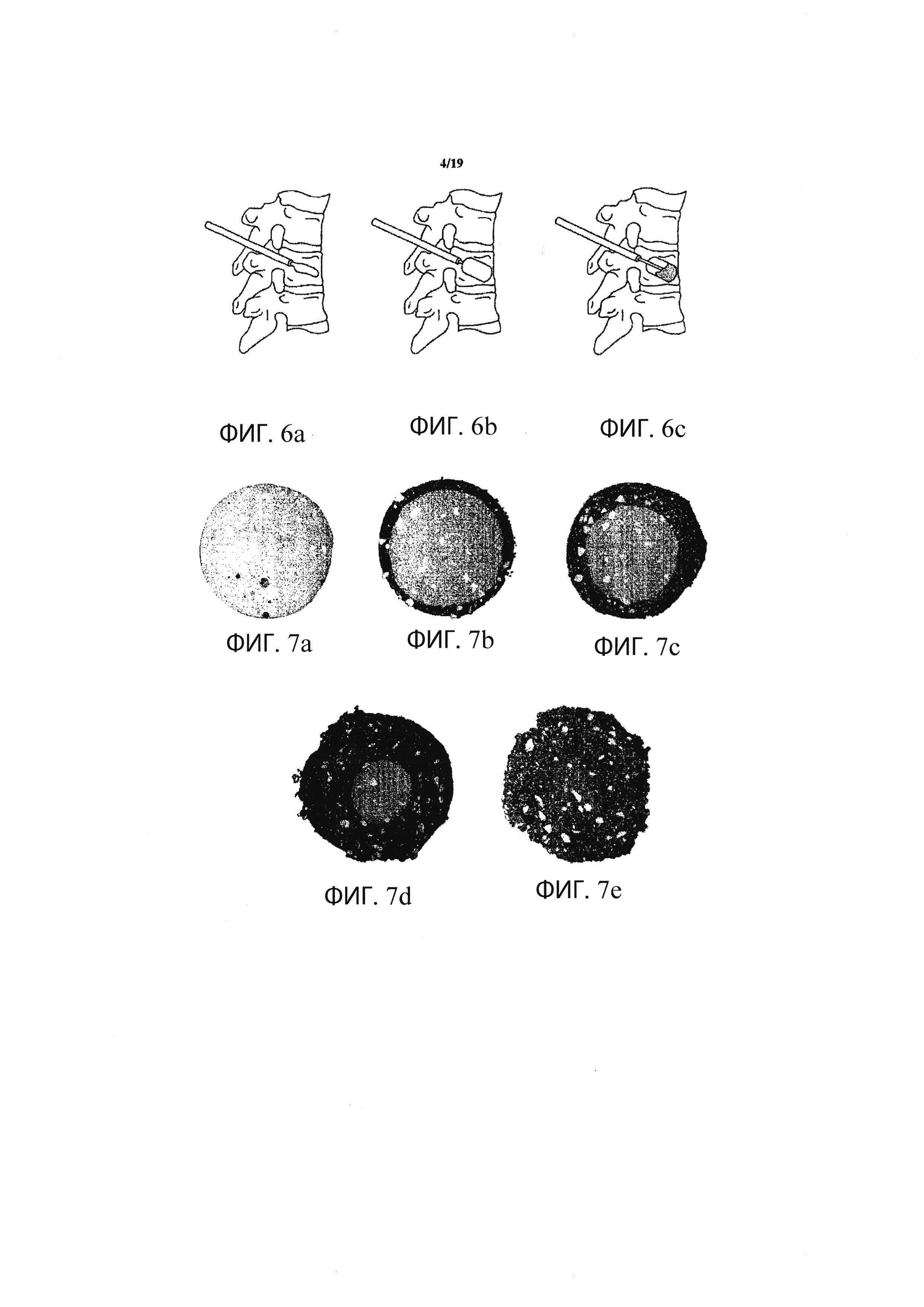
Фиг. 6а-6с иллюстрируют выбранные этапы хирургической процедуры по замещению дегенерированного костного материала в позвонке пациента в соответствии с одним вариантом осуществления данного изобретения;
Фиг. 7а-7е являются изображениями, полученными с помощью сканирующей электронной микроскопии, демонстрирующими изменения с течением времени в материале для регенерации костей, использованном в качестве имлантата в соответствии с одним вариантом осуществления данного изобретения, при этом такие изменения обеспечивают контролируемый рост нового костного материала;
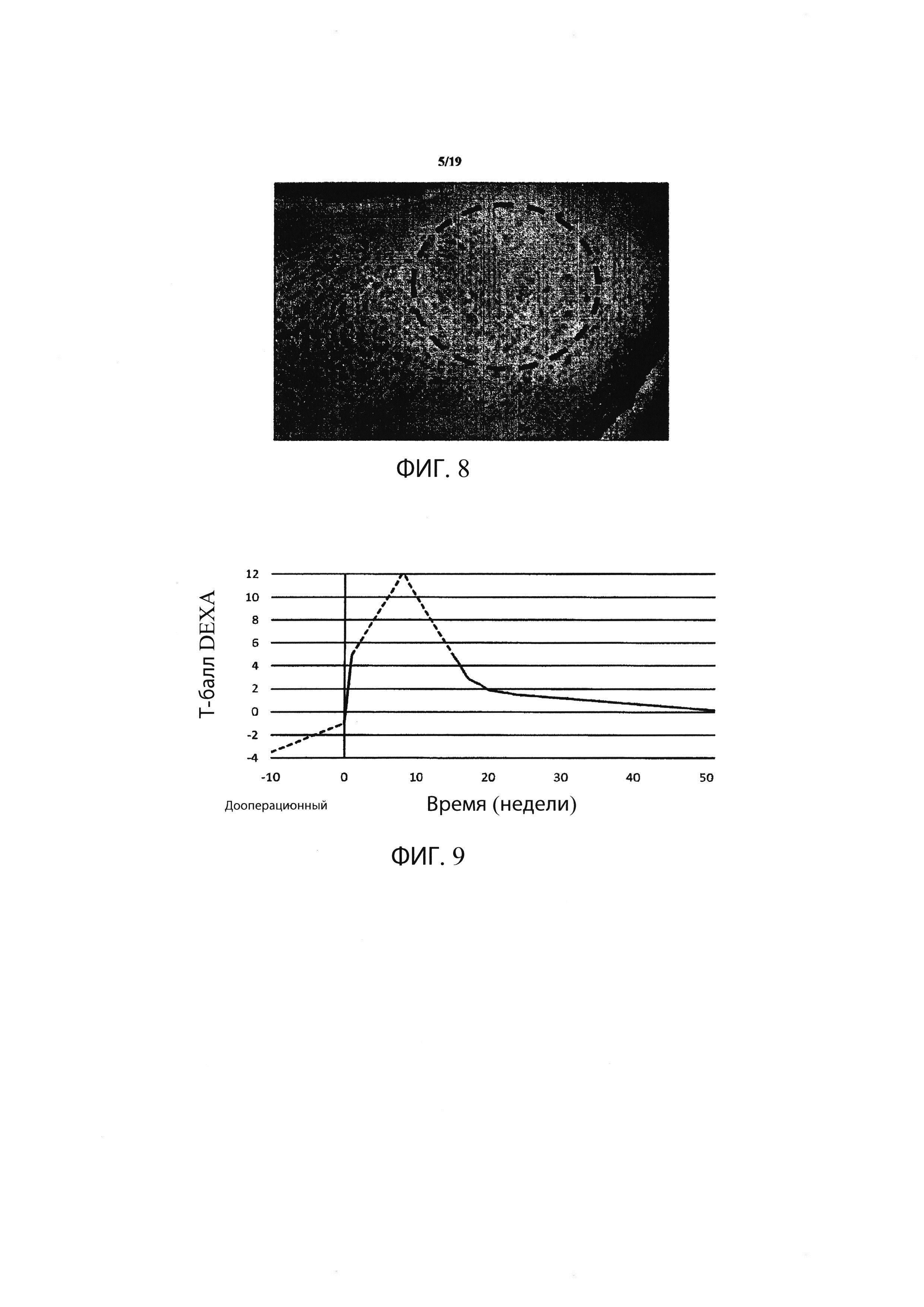
Фиг. 8 демонстрирует 13-недельный макроскопический образец в прокисмальном отделе плечевой кости собаки после введения трансплантата из материала для регенерации костей в соответствии с настоящим изобретением и демонстрирует образование плотной губчатой кости даже за пределами границ первоначального повреждения;
Фиг. 9 является графическим представлением примерного профиля BMD, который может быть выявлен в локализованном участке кости в соответствии с одним вариантом осуществления данного изобретения;
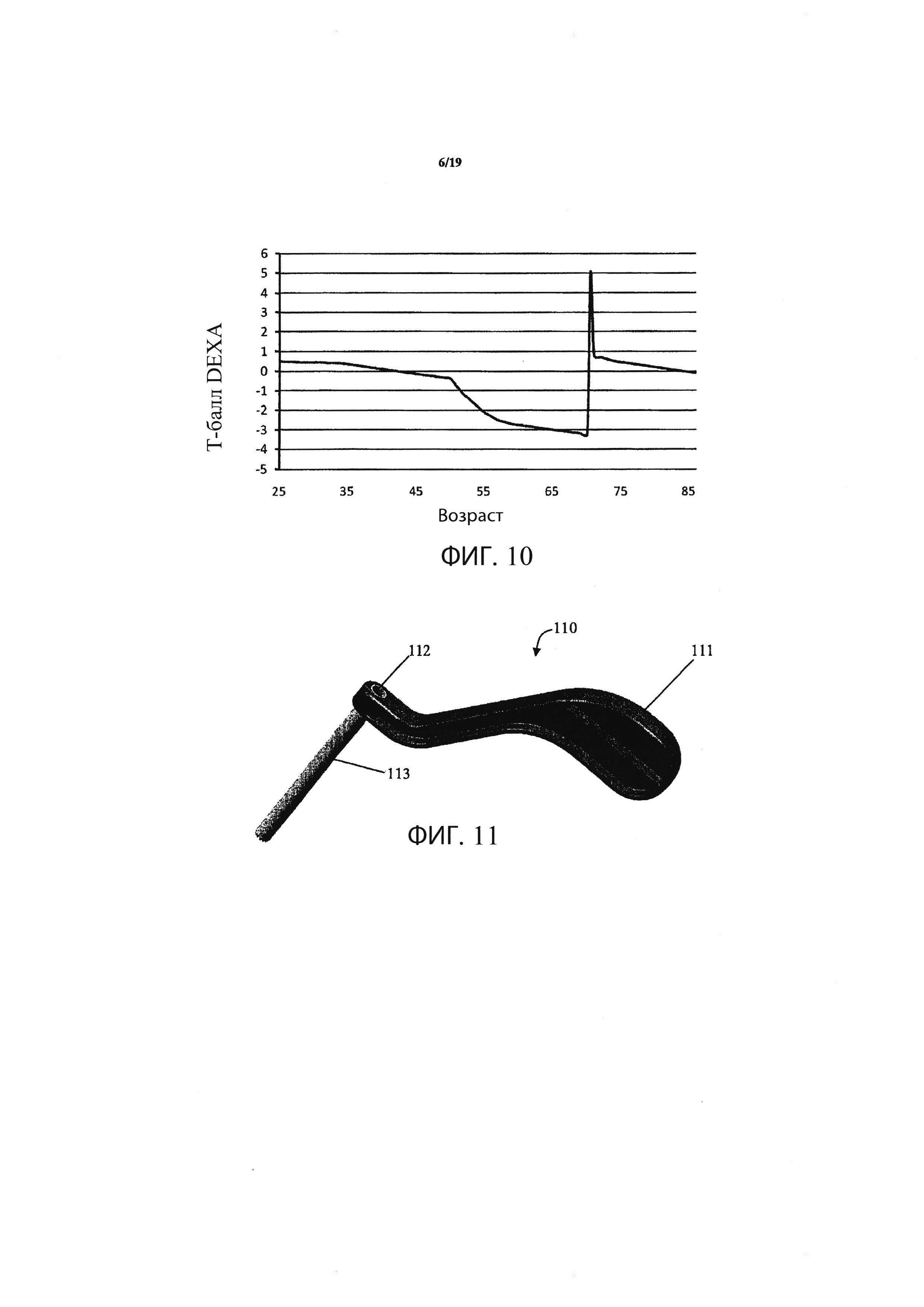
Фиг. 10 является графиком, демонстрирующим ремоделирование кости в локализованном участке кости, демонстрирующим изменение BMD от остеопорозной модели к модели, по сути, идентичной нормальной кости;
Фиг. 11 иллюстрирует инструмент для защиты тканей, который может использоваться при осуществлении способа в соответствии с вариантом осуществления данного изобретения;
Фиг. 12 иллюстрирует канюлированный обтуратор, который может использоваться при осуществлении способа в соответствии с вариантом осуществления данного изобретения;
Фиг. 13 иллюстрирует направляющую проволоку, которая может использоваться при осуществлении способа в соответствии с вариантом осуществления данного изобретения;
Фиг. 14 является увеличенным изображение головки сверла, которое может использоваться при осуществлении способа в соответствии с вариантом осуществления данного изобретения;
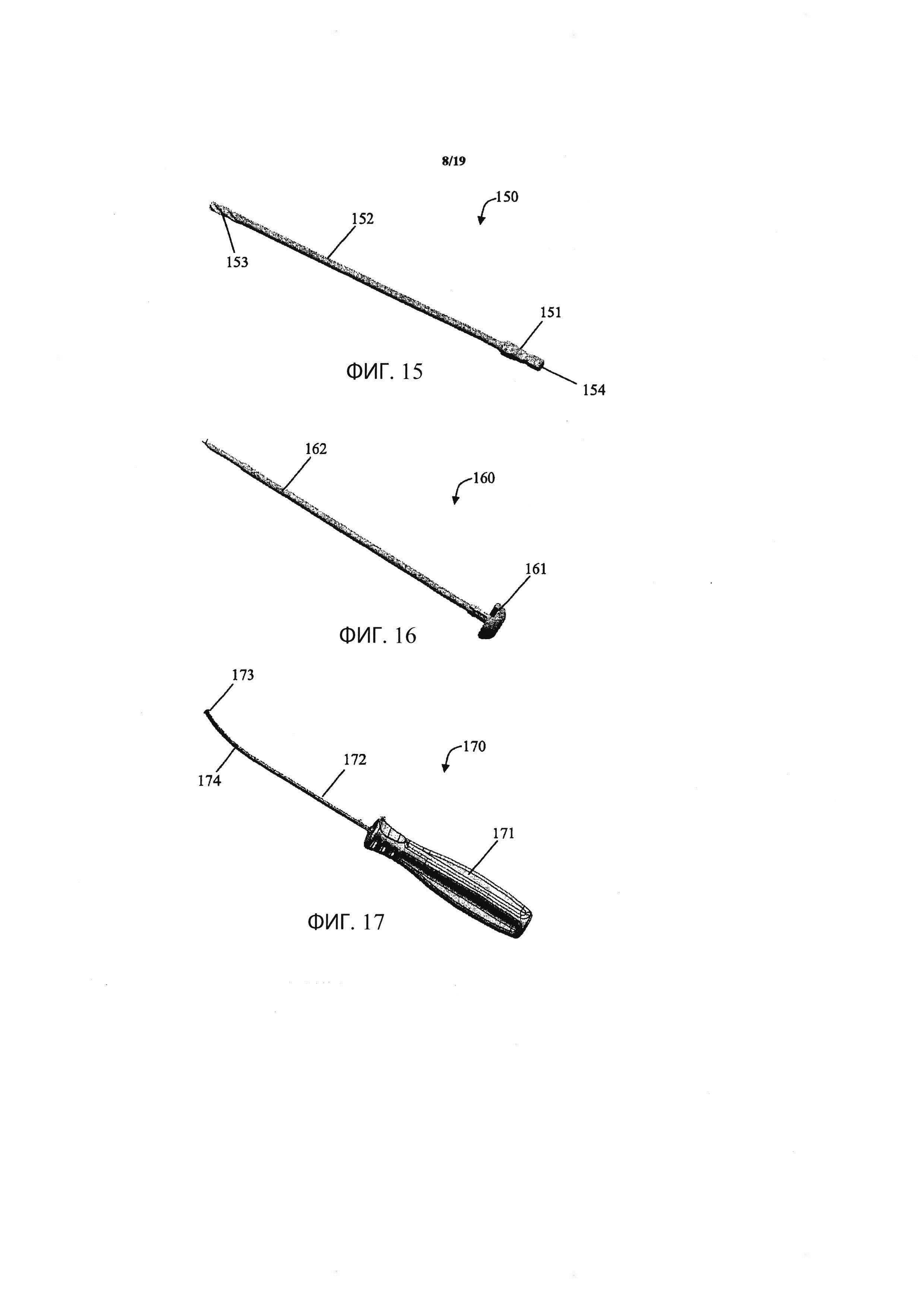
Фиг. 15 иллюстрирует рабочую канюлю, которая может использоваться при осуществлении способа в соответствии с вариантом осуществления данного изобретения;
Фиг. 16 иллюстрирует обтуратор рабочей канюли, который может использоваться при осуществлении способа в соответствии с вариантом осуществления данного изобретения;
Фиг. 17 иллюстрирует санирующий зонд, который может использоваться при осуществлении способа в соответствии с вариантом осуществления данного изобретения;
Фиг. 18 иллюстрирует отсасывающее/ирригирующее устройство, которое может использоваться при осуществлении способа в соответствии с вариантом осуществления данного изобретения;
Фиг. 19 иллюстрирует 180' рабочую канюлю, которая может использоваться при осуществлении способа в соответствии с вариантом осуществления данного изобретения;
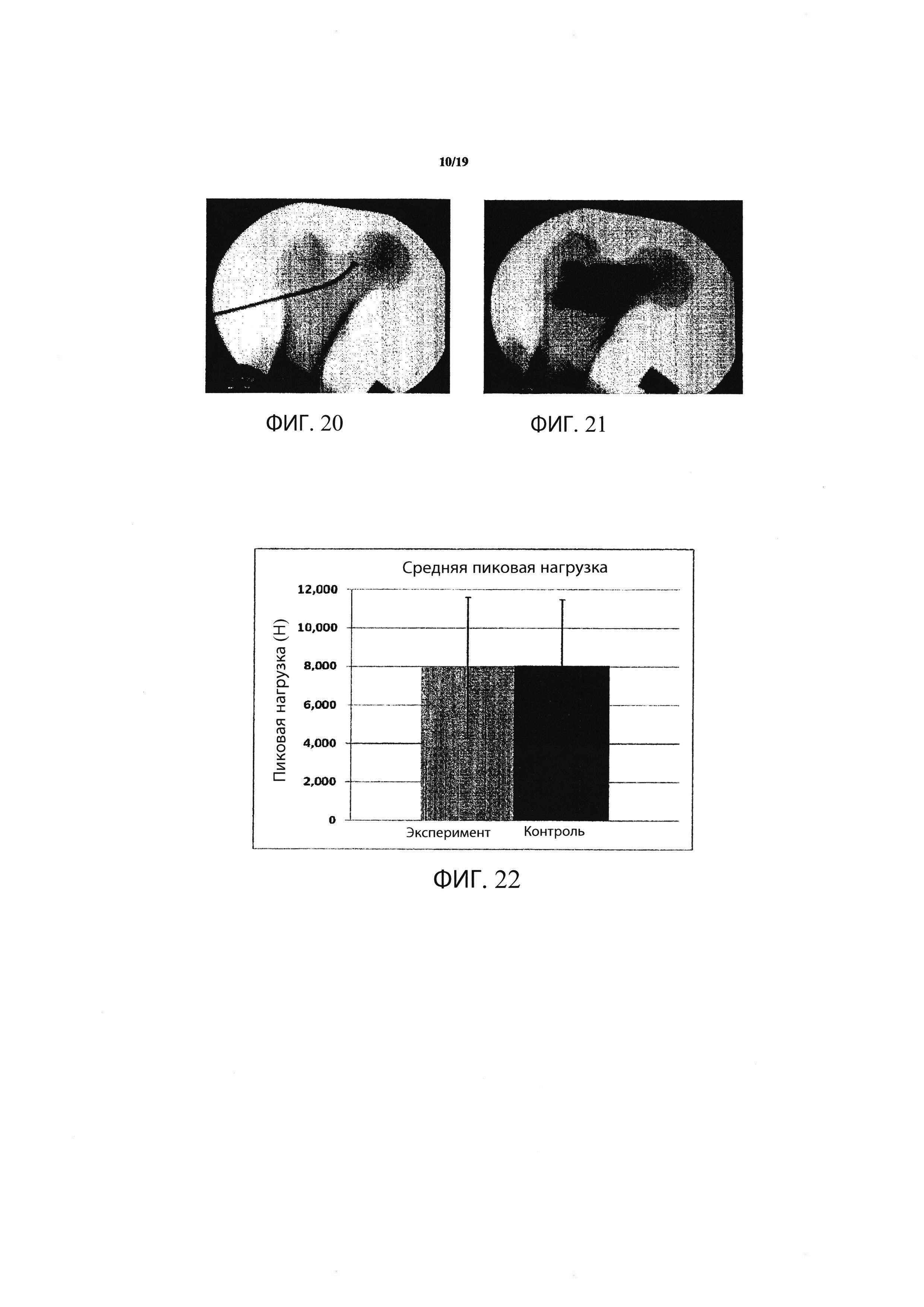
Фиг. 20 является рентгеновским снимком, демонстрирующим введение санирующего зонда, используемого при создании

Фиг. 21 является рентгеновским снимком, демонстрирующим трансплантатный материал, заполняющий образованную

Фиг. 22 является графиком, демонстрирующим среднюю пиковую нагрузку, наблюдаемую среди пар кадаверных бедренных костей, исследованных на сопротивление переломам после образования

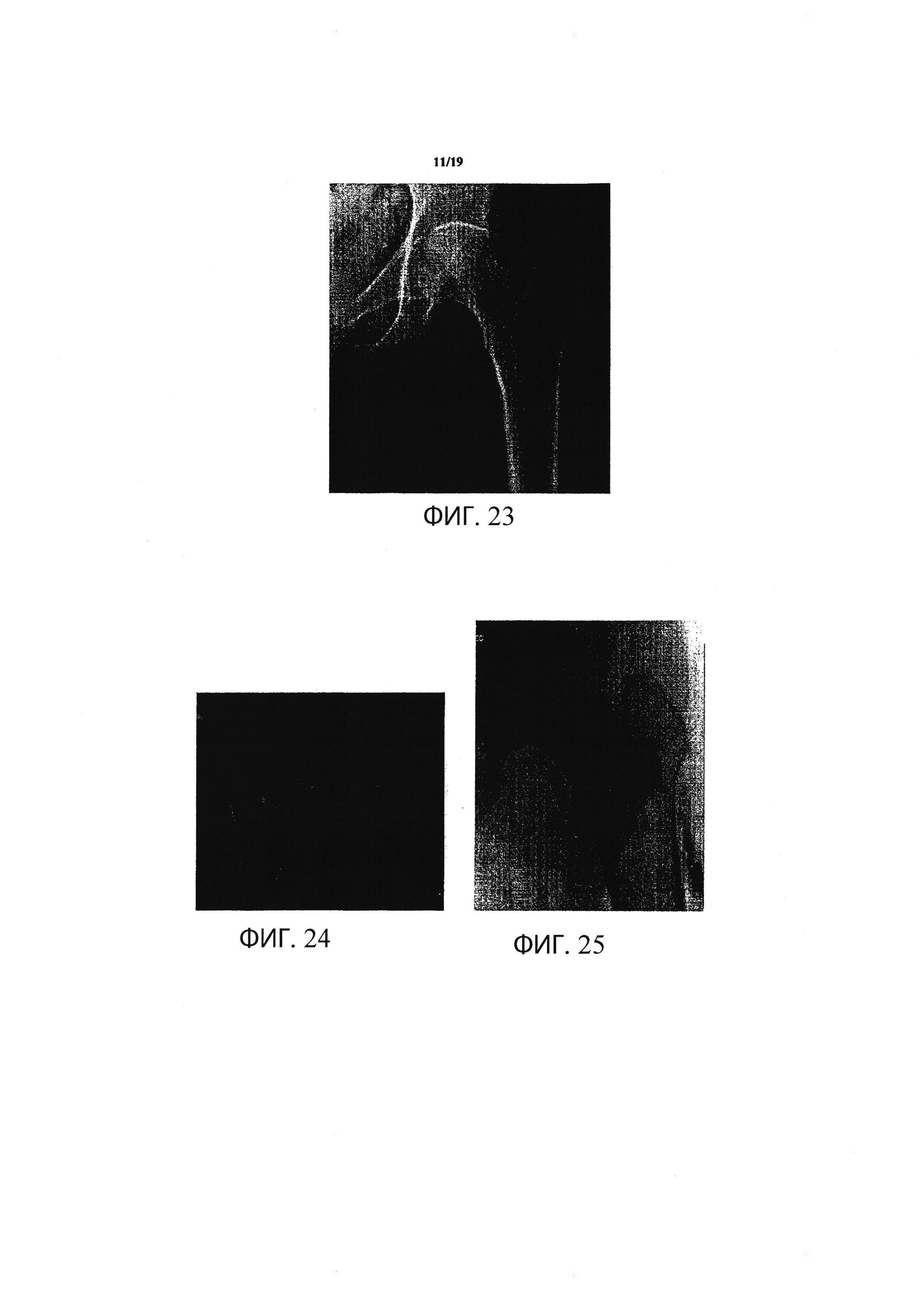
Фиг. 23 является рентгеновским снимком проксимальной части бедренной кости до проведения инъецирования материала для регенерации костей в способе в соответствии с одним вариантом осуществления изобретения;
Фиг. 24 является изображением того же участка проксимальной части бедренной кости, показанного на Фиг. 23, до проведения инъецирования материала для регенерации костей, полученным с помощью компьютерной томографии;
Фиг. 25 является рентгеновским снимком проксимальной части бедренной кости, изображенной на Фиг. 23, во время проведения операции в течение процесса инъецирования материала для регенерации костей в соответствии с данным изобретением;
Фиг. 26 является рентгеновским снимком левой бедренной кости, изображенной на Фиг. 23, спустя 6 недель после лечения, осуществленного по способу в соответствии с одним вариантом осуществления данного изобретения;
Фиг. 27 является изображением левой бедренной кости, изображенной на Фиг. 23, спустя 12 недель после лечения, осуществленного по способу в соответствии с одним вариантом осуществления данного изобретения, полученным с помощью компьютерной томографии;
Фиг. 28 является изображением подвергнутой лечению левой бедренной кости, изображенной на Фиг. 23 спустя 24 недели после лечения, полученным с помощью компьютерной томографии;
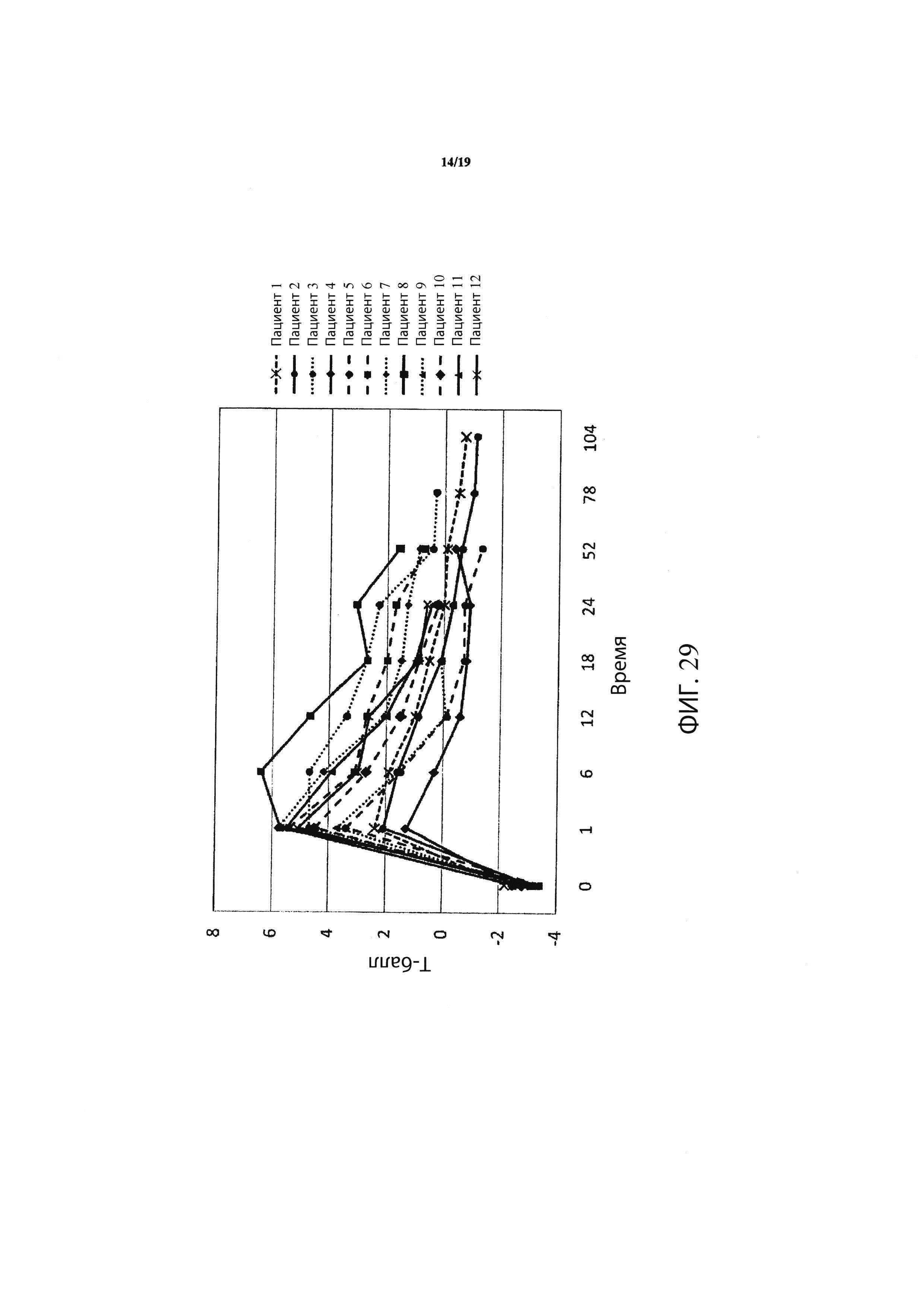
Фиг. 29 является графиком, включающим данные по курсу продолжительностью до двух лет, демонстрирующим средние значения Т-балла шейки бедра подвергнутого лечению тазобедренного сустава пациентов, прошедших лечение в соответствии с определенными вариантами осуществления данного изобретения;
Фиг. 30 является графиком, включающим данные по курсу продолжительностью до двух лет, демонстрирующим средние значения Т-балла всего тазобедренного сустава в тазобедренном суставе пациентов, прошедших лечение в соответствии с определенными вариантами осуществления данного изобретения;
Фиг. 31 является графиком, включающим данные по курсу продолжительностью до двух лет, демонстрирующим средние значения Т-балла участка треугольника Варда в подвергнутом лечению тазобедренном суставе пациентов, прошедших лечение в соответствии с определенными вариантами осуществления данного изобретения;
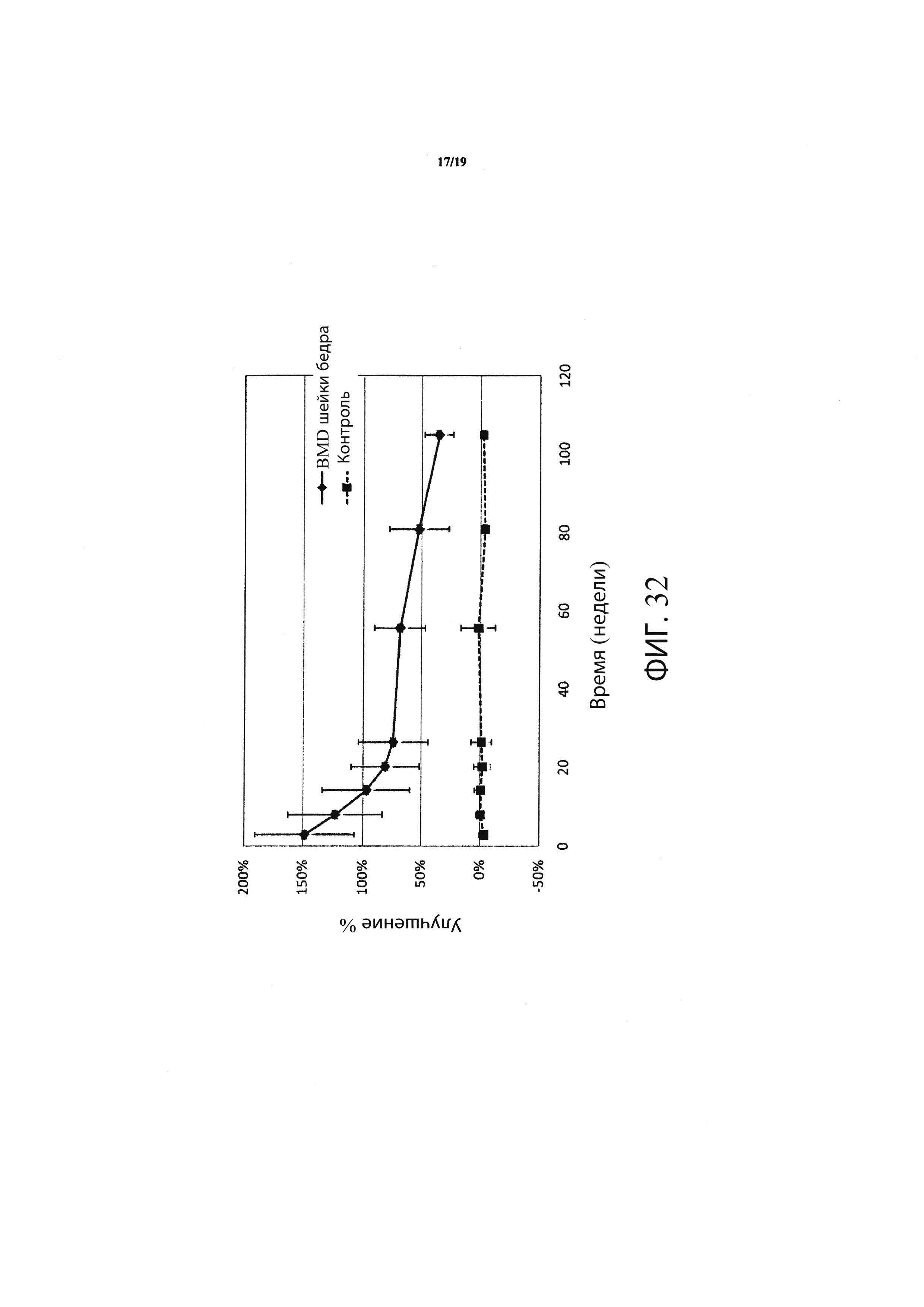
Фиг. 32 является графиком, включающим данные по курсу продолжительностью до двух лет, демонстрирующим среднее процентное увеличение минеральной плотности костей (BMD) шейки бедра в подвергшемся лечению бедре пациентов, прошедших лечение в соответствии с определенными вариантами осуществления настоящего изобретения по сравнению со значениями BMD шейки бедра не подвергнутого лечению контралатерального тазобедренного сустава у тех же пациентов;
Фиг. 33 является графиком, включающим данные по курсу продолжительностью до двух лет, демонстрирующим среднее процентное увеличение минеральной плотности костей (BMD) всего тазобедренного сустава в подвергнутом лечению тазобедренном суставе пациентов, прошедших лечение в соответствии с определенными вариантами осуществления настоящего изобретения по сравнению со значениями BMD всего тазобедренного сустава не подвергнутого лечению контралатерального тазобедренного сустава тех же пациентов; а
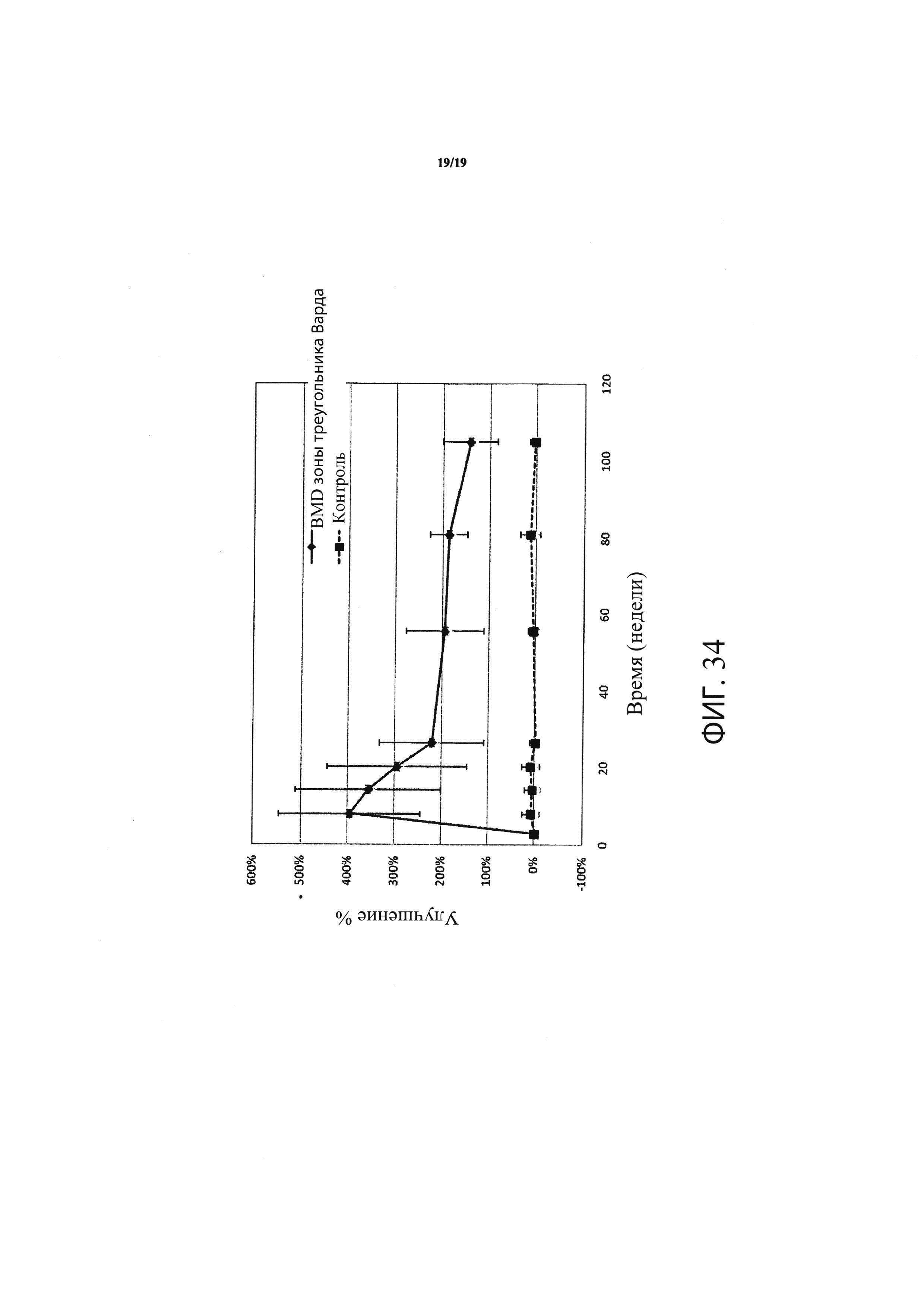
Фиг. 34 является графиком, включающим данные по курсу продолжительностью до двух лет, демонстрирующим среднее процентное увеличение минеральной плотности костей (BMD) зоны треугольника Варда в подвергнутом лечению тазобедренном суставе пациентов, прошедших лечение в соответствии с определенными вариантами осуществления настоящего изобретения по сравнению с BMD всего тазобедренного сустава не подвергнутого лечению контралатерального тазобедренного сустава у тех же пациентов.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение будет описано более полно здесь и далее путем раскрытия различных вариантов его осуществления. Эти варианты осуществления данного изобретения приведены для того, чтобы данное описание было всесторонним и полным, а также с целью полной передачи рамок изобретения для специалистов в данной области. Данное изобретение может быть осуществлено в виде многих различных форм и не должно рассматриваться как ограниченное вариантами осуществления, описанными далее здесь; скорее, данные варианты осуществления приведены для того, чтобы это описание удовлетворяло применимым правовым требованиям. Как указано в данном описании и прилагаемой формуле изобретения, единственное число существительных также подразумевает их множественное число, если контекст явно не указывает иное.
Настоящее изобретение является результатом установления возможности использования различных материалов для регенерации костей при проведении лечения, связанного с замещением дегенеративного костного материала. В частности, было обнаружено, что при замещении дегенеративного костного материала определенными материалами для регенерации костей, в локализованном участке кости вырабатывается новый костный материал при одновременном ресорбировании материалов для регенерации костей. Неожиданно было обнаружено, что даже в том случае, когда существующая кость находится в продвинутой стадии дегенерации (например, при остеопорозе), способность организма формировать новый, здоровый костный материал, который, по сути, является идентичным нормальным костям, сохраняется.
Термины «нормальная кость» или «нормальный костный материал», как они используются здесь, предназначены для обозначения кости или костного материала, обладающего характеристиками здоровой кости человека (предпочтительно того же пола и расы, как и пациент, проходящий лечений) в возрасте, когда BMD, как правило, находится на пике (то есть в возрасте около 30-35 лет). Другими словами, в соответствии с одним вариантом осуществления данного изобретения, было обнаружено, что при лечении страдающих остеопорозом белых пожилых женщин в соответствии с настоящим изобретением, возможно формирование новых костей, которые не подвержены остеопорозу, но, по сути, идентичны (то есть в отношении BMD и/или сопротивления на сжатие) костям средней белой женщины в возрасте 30-35 лет. Конечно, данные результаты могут быть продемонстрированы у обоих полов и среди всех рас. Таким образом, настоящее изобретение обеспечивает возможность локального изменения качества костей. В частности, является возможным, в соответствии с данным изобретением, улучшение качества костей в локализованном участке от дегенеративного состояния до менее дегенеративного состояния, предпочтительно от дегенеративного состояния до, по сути, нормального состояния. Другими словами, является возможным улучшение качества костей в локализованном участке так, что костный материал обладает плотностью, которая, по сути, идентична BMD человека той же расы и пола при среднем возрасте, в котором наблюдается пик BMD (то есть около 30-35 лет). Такие локализованные участки могут включать вновь сформированную кость, а также окружающие части кости, которые не были замещены в соответствии с данным изобретением.
Как описано выше, существуют многие способы в данной области, используемые для оценки BMD, при этом любой подходящий способ, который может использоваться для определения значения BMD в репрезентативной форме для определения нормальных и дегенеративных состояний, может использоваться для настоящего изобретения. Для легкости понимания эффективность способов данного изобретения изложена в настоящем описании в связи с Т-баллом, определяемым с помощью двухэнергетической рентгеновской абсорбциометрии (DEXA). Она является широко используемым способом оценки BMD. Более того, поскольку обычные состояния костной дегенерации могут, в целом, быть описаны с помощью Т-балла пациента, результаты DEXA обеспечивают наглядный способ определения результатов настоящего изобретения в связи с увеличением BMD. Аппараты для DEXA-сканирования, как правило, позволяют определять BMD в единицах г/см2. Из-за различий, связанных с производителями оборудования, однако, варианты определения BMD в единицах г/см2 не стандартизированы. В целях стандартизации Т-балл может быть переведен в BMD в мг/см2 в соответствии со следующим уравнением:
Т-балл=(BMD - базовый BMD) SD
где базовый BMD и стандартное отклонение (SD) относятся к среднему пациенту в возрасти 30-35, когда BMD находится на своем пике, и где BMD и SD используются в единицах мг/см2. Полученное значение Т-балла обеспечивает последовательную, воспроизводимую оценку BMD, которое может использоваться для получения подтверждения изменений BMD. В США Т-балл, как правило, подсчитывается с использованием базы той же расы и пола. Согласно стандартам Всемирной организации здравоохранения (ВОЗ), Т-балл вычисляется с использованием значений белых женщин в качестве базы. Для простоты описания, Т-баллы, описанные здесь, были получены с помощью проведения DEXA-сканирования с использованием измерителя плотности костей Hologic Delphi™ (производства Hologic, Inc., Danbury CT). Другим способом характеристики данных, полученных в результате проведения сканирования, является Z-балл, являющийся количеством стандартных отклонений от средних величин людей того же возраста, пола и национальности, что и испытуемый пациент. Данное изобретение также включает, тем не менее, дальнейшие способы оценки увеличения качества костей - например, BMD, сопротивления на сжатие или сопротивление к переломам - то есть такие, которые могут быть определены с помощью одного или нескольких альтернативных исследовательских способов - например, ультразвука, QCT, SPA, DPA, DXR или SEXA.
В определенных вариантах осуществления данного изобретения, полезность данного изобретения может быть охарактеризована на основе относительного улучшения BMD после применения одного или нескольких способов данного изобретения. Под «относительным улучшением» подразумевается увеличение качественного показателя костей (например, BMD, сопротивления на сжатие или сопротивления к переломам) по сравнению с состоянием локализованного участка кости до проведения лечения в соответствии с данным изобретением. Эта особенность характеристики данного изобретения может не зависеть от достижения стандарта, предназначенного для описания нормальных состояний костей у молодых, здоровых взрослых людей. Например, относительное улучшение, в частности, может включать улучшение качества костей отдельного пациента и влияние на качество жизни. Например, пациент с крайне низкой BMD проксимальной части бедренной кости (например, при значении Т-балла -3) может иметь значительно улучшенное качество жизни благодаря увеличению значения Т-балла на, вероятно, 1,5 единицы. Конечное значение Т-балла, составляющее -1,5, все еще будет говорить о наличии остеопенического состояния, но относительное улучшение качества кости в участке проксимальной части бедренной кости может являться достаточно значительным, являясь индикатором эффективности лечения вне зависимости от достижения заданной, нормальной степени BMD. В некоторых вариантах осуществления данного изобретения, тем не менее, эффективное лечение может быть значительно связано со возможностью достижения нормальной BMD в локализованном участке кости, подвергающейся лечению.
В некоторых вариантах осуществления данного изобретения способы настоящего изобретения могут быть описаны относительно увеличения BMD, что подтверждается увеличением Т-балла (либо определенного костного материала, подвергающегося замещению и образующегося нового костного материала или локализованного участка кости в целом), что может быть воспроизведено специалистом в данной области с помощью способов, которые уже описаны здесь. Таким образом, полезность данного изобретения может быть описана относительно увеличенного значения Т-балла, что может быть связано с уменьшенной степенью дегенеративного состояния (то есть относительным улучшением BMD) или таким изменением BMD, что кость характеризуется как нормальная (то есть не подверженная дегенерации) или лучше. В некоторых вариантах осуществления данного изобретения Т-балл может быть увеличен на, по меньшей мере, 0,25 единицы, на, по меньшей мере, 0,5 единицы, на, по меньшей мере, 0,75 единицы, на, по меньшей мере, 1,0 единицу, на, по меньшей мере, 1,25 единицы, на, по меньшей мере, 1,5 единицы, на, по меньшей мере, 1,75 единицы, на, по меньшей мере, 2,0 единицы, на, по меньшей мере, 2,25 единицы, на, по меньшей мере, 2,5 единицы, на, по меньшей мере, 2,75 единицы, на, по меньшей мере, 3,0 единицы. В других вариантах осуществления данного изобретения BMD может быть увеличена таким образом, что Т-балл находится на, по меньшей мере, минимальном уровне. Например, BMD может быть увеличена таким образом, что Т-балл равен, по меньшей мере, -1, по меньшей мере, -0,75, по меньшей мере, -0,5, по меньшей мере, -0,25, по меньшей мере, 0, по меньшей мере, 0,.25, по меньшей мере, 0,5, по меньшей мере, 0,75, по меньшей мере, 1,0, по меньшей мере, 1,25, по меньшей мере, 1,5, по меньшей мере, 1,75, по меньшей мере, 2,0, по меньшей мере, 2,5, по меньшей мере, 3,0, по меньшей мере, 4,0 или, по меньшей мере, 5,0. В других вариантах осуществления данного изобретения Т-балл может иметь значение более -1, что может свидетельствовать о падении BMD в рамках приемлемого нормального диапазона. В другом варианте осуществления данного изобретения Т-балл может быть равен от около -1,0 до около 2,0, от около -1,0 до около 1,0, от около -1,0 до около 0,5, от около -1,0 до около 0, от около -0,5 до около 2,0, от около -0,5 до около 1,5, от около -0,5 до около 1,0, от около -0,5 до около 0,5, от около 0 до около 2,0, от около 0 до около 1,5, от около 0 до около 1,0. Более того, дегенерированный костный материал в соответствии с данным изобретением может быть описан как кость, обладающая значением Т-балла менее -1,0, менее -1,5, менее -2,0, менее -2,5 или менее -3,0. Важность вышеприведенных значений является даже более существенной, как это следует из дальнейшего описания данного изобретения, приведенного ниже.
Данное изобретение, как описано здесь, может использоваться в отношении фактически любой кости в организме пациента в случаях, когда увеличение BMD является желательным. В определенных вариантах осуществления данного изобретения способы замещения предназначены для использования только в локализованных участках костей. Другими словами, не предполагается замена или образование костей в своем полном виде; замещению подлежат лишь отдельные части или локализованные секции или участки конкретной кости. Способы предпочтительно предназначены для использования в локализованных участках костей, поскольку данные способы предусматривают использование естественной способности тела ресорбировать материалы для регенерации костей, которые используются и замещаются вновь сформированными костями. В определенных вариантах осуществления данного изобретения было обнаружено, что такая костная регенерация может проходить благодаря разрастанию костного материала из окружающего костного материала. Для ясности, является понятным, что, в определенных вариантах осуществления данного изобретения слова «кость» и «костный материал» могут применяться независимым образом. В частности «кость» может относится к общей, целостной анатомической структуре (например, бедренной кости или позвонку), в то время как «костный материал» может относится ко множеству костных клеток и кальцинированных экстраклеточных матриксов, которые присутствуют (или вырабатываются) внутри и вокруг отдельного, локализованного участка большей костной структуры. Таким образом, при удалении костного материала остальная кость остается. Более того, при образовании

В некоторых вариантах осуществления данного изобретения способы данного изобретения, в частности, могут применяться по отношению к костям, которые, в частности, подвержены риску возникновения перелома у пациента, страдающего дегенеративным заболеванием костей. Данное дегенеративное заболевание костей может относиться к любому состоянию, характеризующемуся снижением BMD. В определенных вариантах осуществления данного изобретения состояние дегенерации костей может относится к остеопении или остеопорозу. Поскольку эти состояния могут быть описаны в отношении к значению Т-балла, находящегося в определенном диапазоне, данные термины могут быть использованы здесь для описания дегенерации костей в целом, вне зависимости от того, является ли причиной дегенерации естественная резорбция костных клеток, не вырабатываемых в достаточных количествах, или вызвана другим заболеванием, ведущим к дегенерации костей в качестве симптома или побочного эффекта.
В определенных вариантах способы данного изобретения могут применяться по отношению к кости, связанной с тазобедренным суставом. Это, в частности, может охватывать костные структуры, рассматриваемые, в целом, как бедренная кость, тазовая кость или тазовая кость (то есть седалищная кость, подвздошная кость и лобковая кость), а также как проксимальная часть бедренной кости и подвертельная часть бедренной кости (хотя бедренная кость, в целом, охватывается данным изобретением). Частями бедренной кости, представляющими, в частности, интерес в соответствии с данным изобретением, являются головка, шейка, большой вертел бедренной кости, малый вертел бедренной кости, а также участок, называемый «зоной Варда" (или «треугольником Варда»). Данные участки кости, в частности, подвержены переломам, связанным с падением у пожилых людей или атипичным переломам.
Другие кости, которые могут подвергаться лечению в соответствии с настоящим изобретением, включают позвонки и другие крупные кости, связанные с ногами и руками, такие как лучевая кость, локтевая кость, плечевая кость, большая берцовая кость и малоберцовая кость. Помимо костей бедра, это относится к позвонкам, дистальному отделу лучевой кости и сегментам определенных костей, которые могут быть подвержены атипичным переломам.
Данное изобретение предусматривает использование определенных материалов для регенерации костей. Данный термин может включать различные материалы, которые могут быть полезны для регенерации костей или костного материала, определенные материалы, которые также могут быть помещены в


В некоторых вариантах осуществления данного изобретения материал для регенерации костей может являться материалом, являющимся остеокондуктивным или остеоиндуктивным материалом. «Остеоиндуктивными» называются материалы, которые приводят к митогенезу дифференцированных периваскулярных мезинхимных клеток, способствующих образованию остеопрогениторных клеток (то есть клеток, способных формировать новую кость или костный материал). «Остеокондуктивными» называют материалы, которые проникают в кровеносные сосуды и способствуют формированию новой кости или костного материала в заданной пассивной матричной структуре. Известно, что различные соединения, минералы, белки и им подобные обладают остеоиндуктивными, остеокондуктивными, остеогенными свойствами, способствуют образованию костной ткани. Соответственно, данные материалы могут использоваться в соответствии с настоящим изобретением.
В частности, далее следуют неограничивающие примеры материалов, которые могут использоваться благодаря своим остеоиндуктивным или остеокондуктивным свойствам в соответствии с настоящим изобретением: деминерализованный костный матрикс (DBM), костные морфогенетические белки (BMP), трансформирующие факторы роста (TGF), фибробластные факторы роста (FGF), инсулиноподобные факторы роста (IGF), факторы роста тромбоцитов (PDGF), эпидермальные факторы роста (EGF), факторы роста васкулярного эндотелия (VEGF), неорганический костный минерал (АВМ), фактор роста васкулярного эндотелия (VPF), молекулы клеточной адгезии (САМ), алюминат кальция, гидроксиапатит, коралловый гидроксиапатит, оксид алюминия, двуокись циркония, алюмосиликаты, фосфат кальция, трикальцийфосфат, брушит (кальция гидроортофосфат дигидрат), тетракальцийфосфат, октакальцийфосфат, сульфат кальция, фумарат полипропилена, пиролитический углерод, биоактивное стекло, пористый титан, пористый никель-титановый сплав, пористый тантал, подложки из спеченного сплава кобальта и хрома, керамика, коллаген, аутологичная кость, аллогенная кость, экзогенная кость, коралловый мох и их производные или комбинации, или другие биологически продуцируемые композитные минералы, содержащие кальций или гидроксиапатитные структурные элементы. Вышеупомянутые материалы могут использоваться в качестве материала для регенерации костей или в качестве добавки в определенную композицию материала для регенерации костей.
В определенных вариантах осуществления изобретения материал для регенерации костей, используемый в настоящем изобретении, в частности, может являться материалом, включающим сульфат кальция и может включать дополнительные ингредиенты, если это необходимо. Сульфат кальция, в частности, может являться полугидратом сульфата а-кальция, полугидратом сульфата 3-кальция, дигидратом сульфата кальция или их смесью. В некоторых вариантах осуществления данного изобретения, в частности, в тех случаях, когда сульфат кальция используется в комбинации с другими материалами, композиция сульфата кальция может быть использована в виде водного раствора или суспензии, которая может включать воду и, необязательно, одну или несколько добавок, выбранных из группы, состоящей из неорганических солей и поверхностно-активных агентов, таких как хлорид натрия, хлорид калия, сульфат натрия, сульфат калия, ЭДТА, сульфат аммония, ацетат аммония и ацетат натрия. Сульфат кальция далее может включать дополнительные компоненты, включая любые остеоиндуктивные и остеокондуктивные материалы, описанные здесь, а также катализаторы, используемые для катализа реакции получения дигидрата сульфата кальция из полугидрата сульфата кальция, пластификаторы или биологически активные агенты.
В некоторых вариантах осуществления данного изобретения материал для регенерации костей, в частности, включает фосфат кальция. В частности, данный материал может включать сульфат кальция и фосфат кальция. Фосфат кальция может быть в форме биокерамического материала, описанного как материал, обладающей определенной геометрией или формой, такой как кубики, гранулы, клинья блоки или диски различных размеров. Неограничивающие примеры фосфата кальция могут использоваться в соответствии с данным изобретением, они включают гидроксиапатит, трикальцийфосфат (например α-трикальцийфосфат, β-трикальцийфосфат), тетракальцийфосфат, безводный дикальцийфосфат, монокальцийфосфата моногидрат, кальция гидроортофосфат дигидрат, гептакальцийфосфат, октакальцийфосфат, пирофосфат кальция, оксиапатит, метафосфат кальция, углерод-апатит, карбонизированный гидроксиапатит и их комбинации или смеси в определенных вариантах осуществления данного изобретения, при этом фосфат кальция является α-трикальцийфосфатом, β-трикальцийфосфатом или их смесью. В некоторых вариантах осуществления данного изобретения может использоваться фосфат кальция в двух или более формах, что может приводить к образованию брушита, такого как трикальцийфосфат и кальцийфосфата моногидрат.
В определенных предпочтительных вариантах осуществления данного изобретения материал для регенерации костей, используемый в настоящем изобретении, может включать сульфат кальция, фосфат кальция и порошкообразный материал, такой как гранулы трикальцийфосфата или другой порошкообразный остеоиндуктивный или остеокондуктивный материал, такой как деминерализованный костный матрикс (DBM). Определенными примерами материалов, которые, в частности, могут быть использованы в соответствии с данным изобретением, являются материалы, коммерчески доступные под торговыми названиями PRO-DENSE® и PRO-STIM® (Wright Medical Technology, Inc., Arlington, Tenn.). Несмотря на то, что данные материалы, в частности, могут использоваться для выполнения данного изобретения, другие материалы, которые полезны для применения в костях, могут быть использованы в определенных вариантах осуществления данного изобретения. Несмотря на то, что связанность теорией является нежелательной, считается, что материалы, обладающие свойствами, способствующими регенерации костей, могут обеспечивать лучшие результаты в различных вариантах осуществления данного изобретения, в частности, материалы, обладающие мультифазным профилем, что противоречит описанному здесь. Примеры следующих материалов, которые могут использоваться в определенных вариантах осуществления данного изобретения, включают известные под торговыми OSTEOSET®, MIIG®X3, CELLPLEX®, ALLOMATRIX®, ALLOMATRIX® RCS, IGNITE, ACTIFUSE°, CEM-OSTETIC®, GENEX®, PROOSTEON® 500R, BONEPLAST®, CERAMENT®, α-BSM®, CONDUIT® TCP, γ-BSM®, β-BSM®, EQUIVABONE®, CARRIGEN®, MASTERGRAFT®, NOVABONE®, PERIOGLAS®, Chondromimetic, VITOSS®, PLEXUR® Bone Void Filler, BONESOURCE BVF, HYDROSET®, NORIAN® SRS® Fast Set Putty, NORIAN® CRS® Fast Set Putty, ALLOFUSE®, INTERGRO® DBM Putty, OPTEFORM®, OPTEFIL®, OPTECURE®, ACCELL® 100, ACCELL® CONNEXUS®, ACCELL EV03®, OPTIUM DBM®, PROGENIX® DBM Putty, OSTEOFIC DBM, DBX®, GRAFTON®, GRAFTON PLUS®, PUROS® Demineralized Bone Matrix, INFUSE® Bone Graft, OP-1®, OSTEOCEL®, TRINITY™ Matrix и TRINITY REVOLUTION™. Различные варианты осуществления материалов для регенерации костей, которые могут использоваться в соответствии с данным изобретением, описаны в патентах US 6,652,887; US 7,211,266; US 7,250,550; US 7,371,408; US 7,371,409; US 7,371,410; US 7,507,257; US 7,658,768 и заявке на патент США 2007/0059281, описание которых приводится здесь во всей их полноте для ссылки.
В некоторых вариантах осуществления данного изобретения материал для регенерации костей может быть в виде порошковой композиции, которая затвердевает или применяется при смешивании с водным раствором. Данные композиции могут включать одну или несколько форм сульфата кальция и одну или несколько форм фосфата кальция. Предпочтительно данная композиция может включать хотя бы одну форму сульфата кальция и, по меньшей мере, две формы фосфата кальция. В частности, данная композиция может включать полугидрат сульфата кальция в виде порошка (здесь и далее «CSH») и брушитобразующую смесь фосфата кальция, включающую моногидрат монокальцийфосфата в виде порошка (здесь и далее «МСРМ») и Р-трикальцийфосфат в виде порошка (здесь и далее «β-ТСР»).
Данная порошковая композиция может использоваться для образования материала для регенерации костей, включающего дигидрат сульфата кальция (здесь и далее «CSD»), который является продуктом реакции между CSH и водой. CSD может придавать существенную механическую твердость материалу для регенерации костей, стимулировать рост костей и обеспечивает относительно быструю степень резорбции in vivo, так что в материале для регенерации костей быстро создается пористая структура при проведении имплантации. Таким образом CSD может быть быстро замещен растущей костной тканью на участке имплантации.
Данные два компонента на основе фосфата кальция могут реагировать, образуя брушит при смешивании с водным раствором. Присутствие брушита в материале для регенерации костей может замедлить степень резорбции материала для регенерации костей по сравнению с композицией, содержащей только CSD. Таким образом, использование данного двухфазного материала для регенерации костей может обеспечивать двойную степень резорбции благодаря CSD и брушиту.
Кроме того, в целях замедления резорбции, использование данной порошковой композиции в качестве материала для регенерации костей в настоящем изобретении может обеспечивать высокий уровень механической прочности, удобство применения и приемлемое время осуществления. Кроме того, данный материал для регенерации костей, в частности, полезен для формирования высококачественных костей при использовании в соответствии с данным изобретением.
В некоторых вариантах осуществления данного изобретения порошок CSH может обладать бимодальным распределением частиц - распределением частиц, характеризующимся двумя пиками на диаграмме размера частиц относительно процентного содержания частиц каждого размера, хотя и другие распределения частиц предусматриваются данным изобретением. Например, бимодальное распределение частиц порошка CSH может быть охарактеризовано наличием от около 30 до около 60 процентов содержания частиц, обладающих размером от около 1,0 до около 3,.0 микрон и от около 40 до около 70 процентов содержания частиц, обладающих размером от около 20 до около 30 микрон от всего объема порошка CSH. В другом варианте осуществления данного изобретения бимодальное распределение частиц характерно для от около 40 до около 60 процентов содержания частиц, обладающих размером от около 1,0 до около 2,0 микрон и от около 40 до около 60 процентов содержания частиц, обладающих размером от около 20 до около 25 микрон. Средний размер частиц порошка CSH составляет, предпочтительно, от около 5 до около 20 микрон, более предпочтительно, от около 8 до около 15 микрон, и, более предпочтительно, от около 10 до около 15 микрон.
Порошковая композиция, используемая в составе материала для регенерации костей, используемого в соответствии с данным изобретением, включает порошок CSH в количестве, по крайней мере, 50 вес.% от всего веса порошковой композиции. В других вариантах осуществления данного изобретения материал для регенерации костей, используемый в соответствии с данным изобретением, может включать порошок CSH в количестве, по крайней мере, 60 вес.%, по крайней мере, 65 вес.%, по крайней мере, 70 вес.%, по крайней мере, 75 вес.%, по крайней мере, 80 вес.%, по крайней мере, 85 вес.%, по крайней мере, 90 вес.%. В других вариантах осуществления данного изобретения порошок CSH может присутствовать в количестве от около 50 вес.% до около 99 вес.%, от около 60 вес.% до около 98 вес.%, от около 65 вес.% до около 95 вес.%, от около 70 вес.% до около 95 вес.%, от около 70 вес.% до около 90 вес.%.
CSH является, предпочтительно, полугидратом сульфата α-кальция, который обладает более высокой механической прочностью по сравнению с β-формой при использовании для получения CSD. Присутствие CSD в материале для регенерации костей, используемом в данном изобретении, может обеспечить быструю регенерацию костного материала. Порошок CSH может быть приготовлен с помощью способа, описанного в патенте US 2,616,789, который приводится здесь в своей полноте для ссылки. Порошок CSH может включать другие компоненты, такие как катализатор, способный ускорять конверсию CSH в дигидратную форму, обеспечивая, таким образом, более быстрое получение материала для регенерации костей, изготавливаемого на его основе. Примерные катализаторы включают кристаллы дигидрата сульфата кальция (производимый US Gypsum), в частности, CSD, покрытый сахарозой (производимый VWR Scientific Products). Процесс стабилизации кристаллов дигидрата с помощью их покрытия сахарозой описан в патенте US 3,573,947, приводимый здесь в своей полноте для ссылки. Другие неограничивающие примеры катализаторов, которые могут использоваться, включают сульфаты щелочных металлов и сульфиды (например сульфат калия, сульфат натрия и сульфид кальция, включая их гидраты). Катализатор может присутствовать в количества до 1,0 вес.% от общего веса порошковой композиции. В некоторых вариантах осуществления данного изобретения порошковая композиция включает от около 0,001 до около 0,5 вес.% катализатора, в целом от около 0,01 до около 0,3 вес.%. Могут использоваться смеси двух и более катализаторов.
Часть фосфата кальция, входящего в состав порошковой композиции, используемой в материале для регенерации костей в соответствии с данным изобретением, может включать порошок МСРМ (Са(H2PO4)2Н2О) и порошок β-ТСР (Са3(PO4)2). Как явствует из уровня техники, основным продуктом реакции МСРМ, β-ТСР и воды является брушит, также известный как дигидрат гидроортофосфата кальция (CaHPO4.2H2O) (DCPD). Образующие брушит порошки могут также принимать участие в других реакциях, результатом которых является образование определенных фосфатов кальция с большей термодинамической стабильностью по сравнению с DCPD, таких как гидроксиапатит, октакальций фосфат и им подобные. Определенное количество порошка β-ТСР также может оставаться непрореагировавшим. Порошок β-ТСР может обладать средним размером частиц менее около 20 микрон. Как правило, порошок β-ТСР обладает средним размером частиц от около 10 микрон до около 20 микрон. Часть порошка β-ТСР, входящего в состав порошковой композиции, может обладать бимодальным распределением размера частиц, характеризующимся наличием от около 30 до около 70 процентов частиц в объеме, обладающих размером от около 2,0 до около 6,0 микрон, и от около 30 до около 70 процентов частиц в объеме, обладающих размером от около 40 до около 70 микрон от всего объема порошка фосфата β-трикальция. В одном варианте осуществления данного изобретения порошок β-ТСР обладает бимодальным распределением размера частиц, характеризующимся наличием от около 50 до около 65 процентов частиц в объеме, обладающих размером от около 4,0 до около 5,5 микрон, и от около 35 до около 50 процентов частиц в объеме, обладающих размером от около 60 до около 70 микрон от всего объема порошка β-трикальций фосфат.
Упоминание МСРМ предназначено для описания монокальций фосфата (МСР), являющимся, по сути, безводной формой МСРМ, образующей то же количество ионов кальция и фосфорной кислоты в растворе. Тем не менее, в том случае, если МСР используется в качестве замены МСРМ, количество воды, необходимое для образования материала для регенерации костей, может быть увеличено с учетом отсутствия молекулы воды в МСР (если является желательным получение того же продукта растворения, что и в случае использования МСРМ).
Присутствие брушита может замедлить резорбцию материала для регенерации костей in vivo по сравнению с сульфатом кальция. В свою очередь, более медленная резорбция может позволить материалу для регенерации костей обеспечить поддержку структуры в течение более длительных периодов времени.
Материал для регенерации костей, как описано выше, может быть, в частности, полезен согласно изобретению, благодаря способности становиться высокопористым матриксом из фосфата кальция, при введении in vivo в связи с относительно быстрой скоростью резорбции сульфата кальция в смеси. Оставшийся пористый матрикс из фосфата кальция обеспечивает замечательный каркас для роста кости в течение естественного процесса заживления.
Количество порошка МСРМ и порошка β-ТСР, присутствующее в порошковой композиции, может различаться и зависит, прежде всего, от желаемого количества брушита в замещающем цементе костного трансплантата. Композиция фосфата кальция, образующая брушит (то есть объединенное количество порошков МСРМ и β-ТСР), может присутствовать в концентрации от около 3 до около 30 вес.% от всего веса порошковой композиции. В других вариантах осуществления данного изобретения композиция фосфата кальция, образующая брушит, может присутствовать в концентрации от около 5 до около 25 вес.%, от около 10 до около 20 вес.%, от около 12 до около 18 вес.% или около 15 вес.%. Относительные количества МСРМ и β-ТСР могут быть выбраны в зависимости от их эквимолярного, стехиометрического соотношения в реакции образования брушита. В одном варианте осуществления данного изобретения порошок МСРМ может присутствовать в концентрации от около 3 до около 7 вес.%, в зависимости от всего веса порошковой композиции, а β-ТСР может присутствовать в количестве от около 3,72 до около 8,67 вес.%.
Порошковая композиция также может включать гранулы, частицы или порошкообразное содержимое, если иное не описано. В определенных вариантах осуществления данного изобретения данная композиция может включать множество гранул β-ТСР, обладающих большим средним размером частиц, чем средний размер частиц порошка β-ТСР. Гранулы β-ТСР, как правило, обладают средним размером частиц от около 75 до около 1,000 микрон, от около 100 до около 400 микрон или от около 180 до около 240 микрон. Данные гранулы далее служат для снижения степени резорбции замещающего цемента костного трансплантата и принимают участие в образовании каркаса. Гранулы β-ТСР могут присутствовать при концентрации до 20 вес.% от всего веса порошковой композиции. В других вариантах осуществления данного изобретения гранулы β-ТСР могут присутствовать при концентрации до 15 вес.% или до 12 вес.% от всего веса композиции. Данные гранулы, в частности, полезны для обеспечения третьей фазы (как более полно описано здесь в связи с трехфазными материалами), которая обладает более медленной резорбцией по сравнению с остальными материалами, используемыми в составе композиции для регенерации костей (например, по сравнению с фазой сульфата кальция и фазой брушита, описанными выше).
Водный компонент, который смешивают с порошковой композицией для образования материала для регенерации тканей, используемого в соответствии с данным изобретением, может быть выбран для обеспечения необходимой консистенции композиции, степени ее затвердевания или времени, необходимого для ее использования. Как правило, водный раствор используют в количестве, необходимым для достижения отношения массы жидкости к массе порошка (L/P), по крайней мере, 0,2, по крайней мере, 0,21 или, по крайней мере, 0,23. Предпочтительный диапазон соотношения L/P составляет от около 0,2 до около 0,3, или от около 0,2 до около 0,25. Примеры подходящих водных компонентов включают воду (например, стерильную воду) и ее растворы. Необязательно, материал для регенерации костей в соответствии с данным изобретением может включать одну или несколько добавок, выбранных из группы, состоящей из хлорида натрий, хлорида калия, сульфата натрия, сульфата калия, ЭДТА, сульфата аммония, ацетата аммония и ацетата натрия. В предпочтительном варианте осуществления данного изобретения водным раствором, предназначенным для смешивания, является солевой раствор или фосфатный солевой буферный раствор. Примерным водным раствором является 0.9% солевой раствор NaCl, поставляемый компанией Baxter International (Deerfleld, Ill.) и другие. Водный раствор может включать одно или несколько органических или неорганический соединений, содержащих карбоновую кислоту (здесь и далее карбоновые кислоты или соединения карбоновой кислоты), которые могут или не могут содержать гидроксильную группу, связанную с альфа-углеродом, необязательно оттитрованных до достижения нейтрального рН с помощью подходящего основания (например, нейтрализованы до достижения значения рН от около 6,5 до около 7,5 с помощью основания щелочного металла, такого как гидроксид натрия или гидроксид калия), которые могут изменять необходимое количество воды, текучесть и/или вязкость материала для регенерации костей при осуществлении смешивания. Примерные карбоновые кислоты включают гликолевую кислоту и молочную кислоту. Предпочтительные карбоновые кислоты имеют единственную карбоксильную группу, от 1 до 10 атомов углерода (например, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 атомов углерода, включая карбонильный углерод) и 0-5 гидроксильных групп (например, 0, 1, 2, 3, 4 или 5), связанных с углеродной цепочкой. В одном варианте изобретения раствором для смешивания является 0,6М раствор гликолевой кислоты, нейтрализованный до рН 7,0 с помощью NaOH. Указание карбоновой кислоты означает здесь свободную кислоту и ее соли. Карбоновая кислота может быть нейтрализована до рН от около 6,5 до около 7,5 в растворе с помощью, например, основания щелочного металла, и затем выделена в виде кристаллического порошка путем выпаривания растворителя (например, воды). Кристаллический порошок является, как правило, выделенным в виде соли, такой как форма соли щелочного металла (например, солями лития, натрия или калия). Примерные сухие кристаллические порошки карбоновой кислоты в форме соли включают гликолят натрия, гликолят калия, лактат натрия и лактат калия. Порошкообразная соль карбоновой кислоты может быть добавлена в любой другой порошкообразный компонент, формируя совместно материал для регенерации костей, такой как CSH или другой компонент, являющийся фосфатом кальция. Тем не менее, в определенных вариантах осуществления данного изобретения порошкообразная карбоновая кислота хранится в отдельном контейнере, так что она может быть восстановлена с помощью водного раствора перед смешиванием с раствором, содержащим основные порошкообразные компоненты данной композиции.
Материал для регенерации костей, используемый в соответствии с данным изобретением, может включать одну или несколько добавок, которые могут быть выбраны из любых отдельных материалов, описанных здесь. Данные добавки могут быть в порошковой, жидкой или твердой форме и могут быть смешаны или являться частью материала для регенерации костей. Примерные добавки, подходящие для использовании в данном изобретении включают катализаторы (такие как частицы покрытого сахарозой дигидрата сульфата кальция), пластинки губчатого вещества кости, соли (например, хлоридные, хлористый калий, сульфат натрия, сульфат калия, ЭДТА, сульфат аммония, ацетат аммония и ацетат натрия), пластификаторы могут изменять консистенцию и время, необходимое для применения композиции (например, глицерин и другие высокомолекулярные спирты, виниловый спирт, стеариновая кислота, гиалуроновая кислота, производные целлюлозы и ее смеси, включая алкилцеллюлозы, такие как метилгидроксипропилцеллюлоза, метилцеллюлоза, этилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, карбоксиметилцеллюлоза, ацетобутират целлюлозы и их смеси или соли) и любой «биологически активный агент» (то есть любой агент, препарат, соединение, композиция или смесь, обладающие некоторым фармакологическим эффектом, который может быть продемонстрирован in vivo или in vitro), в частности, любой агент, рассматриваемый в качестве антиостеопенического или антиостеопорозного агента. Определенные фармакологические агенты могут включать препараты для лечения остеопороза, такие как бисфосфонаты, ингибиторы RANKL, ингибиторы протонного насоса, гормональные препараты и SERM, терипаратиды и rPTH. Другие примеры биологически активных агентов включают (но без ограничения) пептиды, белки, энзимы, низкомолекулярные лекарственные средства, красители, липиды, нуклеозиды, олигонуклеотиды, полинуклеотиды, нуклеиновые кислоты, клетки, вирусы, липосомы, микрочастицы и мицеллы. То есть включают агенты, обеспечивающие наличие локализованного или системного эффекта у пациента. Другие примеры биологически активных агентов включают антибиотики, химиотерапевтические препараты, пестициды (например, противогрибковые препараты и антипаразитические агенты), антивирусные препараты, противовоспалительные препараты и анальгетики. Примеры антибиотиков включают ципрофлоксацин, тетрациклин, окситетрациклин, хлортетрациклин, цефалоспорин, аминогликозиды (например, тобрамицин, канамицин, неомицин, эритромицин, ванкомицин, гентамицин и стрептомицин), бацитрацин, рифампицин, N-диметилрифампицин, хлоромицетин и их производные. Примеры химиотерапевтических препаратов включают цисплатин, 5-фторурацил (5-FU), таксол и/или таксотер, ифосфамид, метотрексат и гидрохлорид доксорубицина. Примерны анальгетиков включают гидрохлорид лидокаина, бипивакаин и нестероидные противовоспалительные препараты, такие как трометамин кеторолака. Примерны антивирусных препаратов включают ганцикловир, зидовудин, амантадин, видарабин, рибаравин, трифлуридин, ацикловир, дидеоксиуридин, антитела к компонентам вирусов или генных продуктов, цитокины и интерлейкины. Примерным антипаразитическим агентов является пентамидин. Примерны противовоспалительных агентов включают альфа-1-антитрипсин и альфа-1-антихимотрипсин. Используемые противогрибковые препараты включают дифлюкан, кетоконазол, нистатин, гризеофульвин, микостатин, миконазол и их производные, как описано в патенте US 3,717,655, приведенный здесь в своей полноте для ссылки; бисдигуаниды, такие как хлоргексидин и, в частности, соединения четвертичного аммония, такие как бромид домифена, хлорид домифен, фторид домифена, хлорид бензалкония, хлорид цетилпиридиния, хлорид деквалиния и цис-изомер 1-(3-хлораллил)-3,5,7-триаза-1-азониаадамантан хлорида (коммерчески поставляемого компанией Dow Chemical Company под торговым названием Dowicil 200) и его аналоги, как описано в патенте US 3,228,828, приведенный здесь в своей полноте для ссылки; бромистый цетилтриметиламмоний, а также хлорид бензетония и хлорид метилбензетония, как описано в патентах US 2,170,111, US 2,115,250 и US 2,229,024, приведенных здесь в своей полноте для ссылки; карбанилиды и салициланилиды, такие как 3,4,4-трихлоркарбанилид и 3,4,5-трибромсалициланилид; гидроксидифенилы, такие как дихлорфен, тетрахлорфен, гексахлорфен и 2,4,4'-трихлор-2'-гидроксидифениловый спирт; металлоорганические и галогеновые антисептики, такие как цинк пиритион, сульфадиазон серебра, урацил серебра, йод и иодофоры, полученные из неионных поверхностно-активных веществ, как описано в патентах US 2,710,277 и US 2,977,315, приведенных здесь в своей полноте для ссылки, и из поливинилпирролидона, такого как описанный в патентах US 2,706,701, US 2,826,532 и 2,900,305, приведенных здесь в своей полноте для ссылки. Пригодные факторы роста включают любой клеточный продукт, который модулирует рост и дифференциацию других клеток, в частности, прогениторных клеток соединительной ткани. Факторы роста, которые могут быть использованы в соответствии с настоящим изобретением, включают (но не ограничиваются): фибробластные факторы роста (например FGF-1, FGF-2, FGF-4), факторы роста тромбоцитов (PDGF), включая PDGF-AB, PDGF-BB и PDGF-AA, костные морфогенетические белки (BMP), такие как любой от ВМР-1 до BMP-18, остеогенные белки (например, ОР-1, ОР-2 или ОР-3), трансформирующие факторы роста а или трансформирующие факторы роста β (например β1, β2 или β3), минерализирующие белки LIM (LMP), остеоид-индуцирующий фактор (OIF), ангиогенином(ы), эндотелины, факторы роста дифференциации (GDF), ADMP-1, эндотелины, факторы роста гепатоцитов и факторы роста кератиноцитов, остеогенин (костный морфогенный белок-3), гепарин-связывающие факторы роста (HBGF), такие как HBGF-1 и HBGF-2, семейство белков hedgehog, включая белки indian hedgehog, sonic hedgehog и desert hedgehog, интерлейкины (IL), включая IL от -1 до -6, колоние-стимулирующие факторы (CSF), включая CSF-1, G-CSF, G-CSF и GM-CSF, эпителиальные факторы роста (EGF) и инсулиноподобные факторы роста (например IGF-I и IGF-II), деминерализованный костный матрикс (DBM), цитокины, остеопонтин и остеонектин, включая любые изоформы вышеуказанных белков. Также биологически активным агентом может являться антитело.
Подходящие антитела включают, например, STRO-1, SH-2, SH-3, SH-4, SB-10, SB-20 и антитела к щелочной фосфатазе. Данные антитела описаны у Haynesworth et al., Bone (1992), 13: 69-80; Bruder, S. et al., Trans Ortho Res Soc (1996), 21:574; Haynesworth, S. E., et al., Bone (1992), 13:69-80; Stewart, K., et al, J Bone Miner Res (1996), ll(Suppl.):S142; Flenuning 3 E, et al., in "Embryonic Human Skin. Developmental Dynamics," 212: 119-132, (1998) и Bruder S P, et al., Bone (1997), 21(3): 225-235, приводимые здесь в своей полноте для ссылки. Другие примеры биологически активных агентов включают аспират костного мозга, тромбоцитарный концентрат, кровь, аллотрансплантатные кости, пластинки губчатого вещества кости, пластинки минералов синтетического или естественного происхождения, таких как фосфат кальция или карбонат кальция, мезенхимные стволовые клетки и куски, кусочки и/или кубики сульфата кальция. Добавки, в частности, фармакологические добавки, более точно, антиостеопорозные добавки, которые добавляются в материал для регенерации костей или помещаются внутрь

Материал для регенерации костей, применяемый в способах настоящего изобретения, может быть получен с помощью многих способов, в зависимости от конкретной природы композиции. В некоторых вариантах осуществления данного изобретения материал для регенерации костей может быть в порошкообразной форме и может быть помещенным в образованную


В определенных вариантах осуществления данного изобретения природа материала для регенерации костей может быть охарактеризована с учетом диапазонов усилия инъекции, при которой материал может быть инъецирован. В некоторых вариантах осуществления данного изобретения материал может обладать усилием инъецирования до 1,200 Н, до 1,000 Н, до 800 Н, до 600 Н, до 500 Н, до 400 Н. В других вариантах осуществления данного изобретения диапазон усилия инъецирования может составлять от около 1 Н до около 1,200 Н, от около 2 Н до около 1,000 Н, от около 3 Н до около 800 Н, от около 4 Н до около 700 Н,, от около 5 Н до около 660 Н, от около 10 Н до около 660 Н, от около 10 Н до около 330 Н.
В некоторых вариантах осуществления данного изобретения материалом для регенерации костей, используемым в соответствии с данным изобретением, может являться материал, время применения которого, в целом, в соответствии с испытанием сроков схватывания цемента иглой Вика, проведение которого описано ниже, составляет от около 3 до около 25 минут, более предпочтительно от около 10 до около 20 минут. Материал для регенерации костей, предпочтительно, достигнет твердости, равной и большей твердости кости, спустя от около 30 до около 60 минут. Использование материала может производится в различных средах, включая воздух, воду, in vivo, и при любом другом количестве in vitro состояний.
Затвердевший материал для регенерации костей, используемый в соответствии с данным изобретением, предпочтительно подвергается комплексному растворению с самопроизвольным формированием пористого каркаса, обладающего определенными жесткими механическими свойствами, в частности, характеризуемыми показателями диаметральной силы растяжения и сопротивления на сжатие. Например, данный материал может обладать величиной диаметральной силы растяжения, по меньшей мере, 4 МПа после отверждения в течение одного часа в воздушной среде комнатной температуры после приведения материала в готовое к доставке состояние, более предпочтительно, величиной диаметральной силы растяжения, по меньшей мере 5 МПа, более предпочтительно, по меньшей мере, 6 Мпа. Далее, материал для регенерации костей может обладать диаметральной силой растяжения, по меньшей мере, 8 МПа после отверждения в течение 24 часов в воздушной среде при комнатной температуре с последующей подготовкой материала к доставке, более предпочтительно диаметральной силой растяжения, равной, по крайней мере, 9 МПа после отверждения в течение 24 часов, и, наиболее предпочтительно, по меньшей мере, 10 МПа.
Материал для регенерации костей, используемый в настоящем изобретении, также обладает высоким уровнем сопротивления на сжатие, таким как сопротивление на сжатие, равное, по меньшей мере, 15 МПа после отверждения в течение одного часа в воздушной среде при комнатной температуре после подготовки материала к доставке, более предпочтительно сопротивление на сжатие, равное, по меньшей мере, 40 МПа. Далее, предпочтительные варианты материала для регенерации костей могут обладать сопротивлением на сжатие, по меньшей мере, 50 МПа после отверждения в течение 24 часов в воздушной среде при комнатной температуре после подготовки материала к доставке, более предпочтительно сопротивлением на сжатие, равным, по меньшей мере, 80 МПа.
В некоторых вариантах данного изобретения твердость отвержденного материала для регенерации костей может быть увеличина с помощью добавления различных материалов. Несмотря на то, что данное изобретение охватывает любые материалы, рассматриваемые в данной области в качестве способных увеличивать предел прочности при растяжении и/или сопротивление на сжатие, особо полезными могут являться варианты приготовления, включающие использование одного или нескольких волокнистых материалов. Таким образом, данное изобретение, в частности, охватывает волокнистые композиции материала для регенерации костей.
Волокнистые композиции, используемые в данном изобретении, в частности, могут включать биоразлагаемые полимерные волокна. Такие волокна не только могут обеспечивать увеличение свойств материала для регенерации костей, связанных с твердостью, но также могут обеспечивать непрерывную доставку одного или нескольких биологически активных агентов, Описанных выше (например, факторов роста, антибиотиков и так далее), поскольку активный агент может быть смешан с полимером перед образованием волокна, при этом активный агент будет постепенно выделяться in vivo при разложении волокон. В других вариантах осуществления данного изобретения также могут использоваться волокна, не являющиеся биоразлагаемыми, хотя инертная природа любых волокон, не являющихся биоразлагаемыми, является более предпочтительной. Не ограничивающие примеры материалов, известных своим применением в качестве волокон для увеличения твердости материала для регенерации костей, включают полимолочную кислоту (PLLA), полиэтилентерефталат (PET) (например, хирургические нити MERSILENE®), полиэтилен, полиэстер (например FIBERWIRE®) полиглекапрон (например, MONOCRYL®), полигликолевую кислоту и полипропилен. Конечно, специалист в данной области, используя данное описание, способен определить и другие материалы, которые могут быть представлены в виде волокон или увеличивать твердость материала для регенерации костей, используемого в соответствии с настоящим изобретением, иным образом.
Волокна, используемые для увеличения твердости материала для регенерации костей, могут обладать различным размером. Предпочтительно, волокна, используемые в различных вариантах осуществления данного изобретения, могут обладать средним диаметром от около 1 мкм до около 100 мкм, от около 2 мкм до около 75 мкм, от около 3 мкм до около 50 мкм, от около 4 мкм до около 40 мкм или от около 5 мкм до около 25 мкм. Данные волокна далее, предпочтительно, обладают средней длиной от около 100 мкм до около 1,000 мкм, от около 150 мкм до около 900 мкм, от около 200 мкм до около 800 мкм, от около 250 мкм до около 750 мкм.
Волокна, используемые для увеличения твердости материала для регенерации костей также могут включаться в различных концентрациях. В частности, данные волокна могут составлять от около 0,1% до около 10%, от около 0,25% до около 9%, от около 0,5% до около 8%, от около 0,75% до около 7%, от около 1% до около 6%, от около 1,5% до около 5% веса материала для регенерации костей.
Предпочтительно, волокна добавляются в такой концентрации, при которой обеспечивается заметное увеличение твердости материала для регенерации костей по сравнению с материалом без каких-либо волокнистых добавок.
В частности, волокна могут быть добавлены в количестве, предназначенном для увеличения предела прочности на растяжение материала для регенерации костей на, по меньшей мере, 5%, по меньшей мере, 10%, по меньшей мере, 15%, по меньшей мере, 20% или, по меньшей мере, 25%. Таким же образом, добавление волокнистого компонента может увеличить сопротивление на сжатие на, по меньшей мере, 10%, по меньшей мере, 15%, по меньшей мере, 20%, по меньшей мере, 25% или, по меньшей мере, на 30%.
В некоторых вариантах данного изобретения добавление волокнистого компонента может повлиять на вязкость материала для регенерации костей, что может снизить инъецируемость материала. Для преодоления данного увеличения вязкости возможно осуществлять инъецирование материала с помощью шприца с конической насадкой. Данная конфигурация насадки может снизить величину усилия, необходимого для инъецирования более вязкой пасты с помощью иглы.
При приготовлении данные волокна могут быть добавлены в сухую смесь материалов, используемых в материале для регенерации костей. Объединенные материалы могут быть увлажнены для образования пасты. Далее, может являться полезным включение дополнительных этапов обработки для улучшения размешивания волокон в материале для регенерации костей и снижения присутствия нерастворенных частей волокна. Например, данные волокна могут подвергаться ультразвуковому перемешиванию в течение определенного периода времени (например, в течение 30-60 минут), при этом данное смешивание может выполняться при нахождении волокон в жидкой среде, в которой полимер, из которого состоят волокна, является нерастворимым (например, в изопропиловом спирте). Обработанные ультразвуком волокна затем могут быть добавлены в сухие компоненты, входящие в состав материала для регенерации костей, и смешаны (например, путем размешивания с помощью вращения). Данную комбинацию затем фильтруют и высушивают в вакууме. Объединенные материалы могут быть затем увлажнены для образования предназначенного для применения пастообразного материала.
Способы настоящего изобретения в целом включают замещение определенного объема дегенерированного костного материала (необязательно, в участке, обладающем определенной формой) материалом для регенерации костей, который вызывает образование нового костного материала, обладающего большей плотностью (или другой характеристикой, связанной с качеством костей, как описано здесь), который заменяет дегенерированный костный материал. Термин «дегенеративный костный материал» или «дегенерированный костный материал» может означать костный материал, клинически определяемый в качестве подверженного остеопении или остеопорозу. Данные термины, в частности, могут означать кость со значением Т-балла менее -1, менее -1,5, менее -2, менее -2,5 или менее -3. Данный дегенерированный костный материал, как правило, находится в кости, которая, в целом, также определяется в качестве подверженной остеопении или остеопорозу.
Способы данного изобретения в целом могут быть описаны как способы улучшения качества кости в локализованном участке кости. В частности, качество кости может быть напрямую связано с BMD, но также может относиться к общей твердости кости (включая сопротивление на сжатие) и способности кости сопротивляться переломам вокруг и непосредственно в локализованном участке кости. Данная способность увеличивать качество кости в части возникает вследствие установления того факта, что качество локализованных участков кости может достигать качества более здоровой кости - то есть качества, присущего нормальной кости, или качества кости аналогичного пациента, достигаемого в состояниях, при которых определяется достижение BMD своего пика. Неожиданно было обнаружено, что дегенеративный костный материал в локализованном участке кости, например, у пациента, страдающего остеопорозом, может быть замещен с помощью материала для регенерации костей, который вызывает регенерацию нового костного материала в локализованном участке. В частности, неожиданным является то, что вновь образованный костный материал не обладает остеопорозными качествами. Это является неожиданным, поскольку ожидалось, что любой новый костный материал, формирующийся у пациента, страдающего остеопорозом, будет обладать сниженным качеством (то есть будет являться остеопорозным и обладать низкой плотностью). Настоящее изобретение, тем не менее, показало, что после проведения имплантации материала для регенерации костей в остепеническую или остеопорозную кость, данный материал ресорбируется в предсказуемой степени и не подвергается негативному влиянию системного заболевания. Последующее поколение плотного, нового костного материала в локализованном участке кости улучшает качество кости и BMD при измерении Т-балла с помощью DEXA. В частности, величины Т-баллов показывают, что вновь образованный костный материал, по сути, аналогичен нормальной кости, находясь в которой он демонстрирует плотность, которая, по крайней мере, находится на том же уровне, который ожидается у пациентов с BMD, находящейся на своем пике (например, величина Т-балла, лежащая в диапазоне от -1 до 1) и не находится в остеопеническом или остеопорозном состоянии. В других вариантах осуществления данного изобретения вновь сформированный костный материал может обладать сопротивлением на сжатие, которое, по сути, аналогично (или превосходит) сопротивление на сжатие нормальной кости. Данные характеристики могут относиться ко вновь сформированному костному материалу, в частности, в локализованном участке кости в целом (то есть ко вновь сформированному костному материалу и существующему костному материалу в непосредственно окружающем его участке).
В некоторых вариантах способы данного изобретения могут включать активные этапы формирования







В некоторых вариантах осуществления данного изобретения данные способы могут включать сверление или создание каналов с помощью других способов (например, с помощью прокалывания канюлированной или цельной иглой, зондом или чем-то им подобным) во внутренней части локализованного участка кости. В некоторых вариантах осуществления данного изобретения канал, формируемый данным образом, может обеспечивать создание





На Фиг. 2а и Фиг. 2b показаны микрофотографии сканирующего электронного микроскопа нормальной кости и кости, подверженной остеопорозу, соответственно. Как видно на данных снимках, нормальная кость обладает крепко связанными между собой пластинками костного материала. Большая часть этого материала теряется при остеопорозе, а оставшаяся кость обладает более слабой стержнеподобной структурой, при этом у некоторых стержней полностью утеряна связь между собой. Кости, характеризующиеся подобной разобщенной внутренней структурой, могут обладать костной массой, но не вносят свой вклад в твердость костей. В некоторых вариантах осуществления данного изобретения




В связи с потерей BMD дегенерированный костный материал, который разбивают на части для формирования








Данные способы далее могут включать, по меньшей мере, частичное заполнение сформированной



Форма





В определенных вариантах осуществления данного изобретения, в частности, при лечении пациентов, в частности, с продвинутыми стадиями дегенерации костей, по меньшей мере, некоторая степень лечения может быть осуществлена без создания




Могут быть использованы любые способы, подходящие для использования в целях заполнения сформированной








В некоторых вариантах осуществления материал для регенерации костей может быть введен в созданную



В некоторых вариантах осуществления данное изобретение, в частности, может обеспечить способ лечения пациента, страдающего от состояния, связанного с дегенерацией костей. В частности, данный пациент может страдать и/или иметь диагноз остеопения или остеопороз. С другой стороны, данный пациент, может страдать от любого другого состояния, обладающего способностью вызывать дегенерацию костей, в частности, потерю BMD и/или твердости костей.
Данное изобретение, в частности, полезно тем, что образование


В другом варианте осуществления данного изобретения вновь сформированный костный материал может обладать BMD, которая значительно превосходит BMD до проведения лечения (как это демонстрирует увеличение Т-балла), так что пациент рассматривается в качестве обладающего значительным относительным увеличением BMD. Вновь сформированная кость также может обладать сопротивлением на сжатие, которое, по сути, идентично или превосходит ее степень, присущую нормальной кости.
Способы изобретения, в частности, обладают пользой, заключающейся в том, что подвергаемый лечению локализованный участок кости может быть эффективно ремоделирован в течение времени до достижения, по сути, состояния, идентичного нормальной кости (то есть обладающего нормальной BMD и/или нормальным сопротивлением на сжатие и/или нормальным сопротивлением к переломам). Более того, в некоторых вариантах осуществления данного изобретения влияние материала для регенерации костей в плане стимулирования роста новой, естественной кости может, по сути, продолжаться вне границ сформированной




Как было отмечено, способы данного изобретения могут быть осуществлены по отношению к различным костям в теле млекопитающего. В конкретном полезном варианте осуществления данного изобретения способы изобретения могут быть осуществлены по отношению к кости, находящейся в зоне бедра пациента. Например, далее приводится примерный способ лечения пациента, страдающего дегенеративным костным заболеванием с помощью замены костного материала в локализованном участке бедренной кости пациента, в частности, проксимальной бедренной кости. Хирургический метод включает использование латерального подхода, аналогичного стандартной ядерной декомпрессии или установке бедренного винта. Одним из отличий данного способа является придание формы повреждению или

Для осуществления данного способа пациент может принять положение лежа навзничь, находясь на рентгенопрозрачном столе. Рентгенологическая поддержка может быть обеспечена с помощью C-arm оборудования и присутствия рентгенолога, обеспечивающего рентгенную навигацию в течение времени проведения процедуры. Как указано выше, может использоваться латеральный подход к проксимальной части бедренной кости. В других вариантах осуществления данного изобретения также может использоваться подход к большому вертелу бедренной кости. Малый дистальный надрез может быть осуществлен в зоне большого вертела бедренной кости, при этом направляющая проволока может быть введена в проксимальную часть бедренной кости при рентгеноскопическом обзоре, осуществляемом в переднезадней (АР) и латеральной проекции. Канюлированное сверло диаметром 5,3 мм может быть введено с помощью направляющей проволоки, достигая при этом головки бедра; при этом может быть сформирован канал, достигающий (и, возможно, выходящий за пределы) зоны образования






Разнообразные вариации вышеупомянутой процедуры могут использоваться в рамках области, охватываемой данным изобретением. Например, Фиг. 4 является увеличенным рентгеновским снимком проксимальной части бедренной кости, изображающим целевую зону, предназначенную для заполнения, любая часть которой может быть заполнена с проведением или без проведения первичной санации данной зоны. Данная фигура также иллюстрирует приблизительное месторасположение и размер исходного канала, который может быть образован при использовании латерального подхода. В частности, Фиг. 4 иллюстрирует расширяющийся в стороны канал, проходящий через проксимальную часть бедренной кости и достигающий головку бедра; штриховка приведена для иллюстрации примерной зоны в проксимальная части бедренной кости, любая часть которой может являться целью в качестве кандидата для удаления костного материала и заполнения материалом для регенерации костей. Далее, в качестве неограничивающих примеров может быть сформирована одна или несколько «стоек» в проксимальной части бедренной кости в качестве ответвлений исходного канала и затем быть заполнены материалом для регенерации костей. Далее, одна или несколько стоек могут обладать одной или несколькими частями, являющимися заметно увеличенными в целях увеличения количества материала для регенерации костей, который помещается внутрь определенного участка кости. Далее, более общий, больший участок проксимальной части бедренной кости может быть обработан и заполнен. Далее, аналогичные варианты данного изобретения также могут быть представлены в свете настоящего описания.
Другая хирургическая методика, которая может быть использована в соответствии с настоящим изобретением, описана ниже применительно к угрожающему атипичному перелому бедра. Данные переломы наиболее часто происходят в проксимальной трети диафиза бедренной кости, но они также могут происходить в любом месте диафиза бедренной кости, от дистального до малого вертела бедренной кости, проксимального надмыщелкового расширения, дистального метафиза бедренной кости.
Данный перелом является атипичным вследствие того, что он обычно возникает не в результате травмы или минимальной травмы, эквивалентной падению с высоты роста или менее значительной высоты. Данный перелом может являться полным, распространяющимся по всему диафизу бедренной кости, часто с образованием срединного шипа, или неполным, соответствующим поперечной рентгенопрозрачной линии в латеральном кортексе.
Далее, в частности, описывается методика введения материала для регенерации костей в тело бедренной кости пациента, в частности, пациента с угрозой возникновения атипичного перелома, например, пациентов, страдающих остеопенией или остеопорозом, путем создания

Далее создают повреждение и подготавливают его к инъекции материала для регенерации тканей. В частности, при удержании рифленого протектора тканей на месте, канюлированное центрирующее направляющее извлекают, при этом вставляют канюлированное сверло диаметром 5,3 мм и продвигают его через вертел. Данное сверло затем извлекают, оставляя на месте направляющую спицу и вводят гибкий ример. Данный ример продвигают вдоль направляющей проволоки и далее через вертел, при этом направляющую спицу извлекают. Данный ример затем продвигают в зону, которой угражает возникновение перелома, и извлекают. Рабочую канюлю со троакаром затем вставляют через рифленый протектор тканей и помещают ее внутри кортекса (то есть, добиваясь плотного прилегания). Рифленый протектор тканей и троакар затем удаляют. Инъекционная канюля может быть размещена с помощью рабочей канюли и продвинута в зону перелома бедренной кости, при этом данная канюля может быть использована с отсасыванием в целях удаления любых образованных частиц в бедренной кости. Затем инъецируют материал для регенерации костей, предпочтительно при проведении мониторинга (например, с помощью рентгеноскопии). Время, необходимое для инъецирования, как правило, занимает около 2-4 минут для достижения оптимального заполнения. Инъекционную и рабочую канюлю затем удаляют. Мягкие ткани затем могут быть подвергнуты ирригированию, а кожу закрывают с помощью подходящих для этого средств (например, с помощью наложения швов).
Другое описание хирургической методики, которая может быть использована в соответствии с настоящим изобретением, описана ниже в отношении дистального отдела лучевой кости. Далее приводится, в частности, описание методики ввода материала для регенерации костей в дистальный отдел лучевой кости у пациентов, страдающих остеопенией или остеопорозом, с помощью создания



Другое описание хирургической методики, которая может быть использована в соответствии с настоящим изобретением, дано ниже в отношении позвонков. Следующая методика включает использование надуваемого тампона (или надувного баллонообразного тампона), такого как производимые компанией Kyphon, Inc (теперь являющейся подразделением компании Medtronic, Inc.). Таким образом, как далее описано здесь, некоторые способы в соответствии с настоящим изобретением могут являться усовершенствованиями кифопластической методики. В других вариантах осуществления, теме не менее, методики замены дегенеративных костей в позвонках могут, по сути, являться аналогичными по своей природе методикам, описанным выше в отношении проксимальной части бедренной кости и дистального отдела лучевой кости. Известное различие между известными методиками лечения переломов позвонков заключается в том, что способы настоящего изобретения могут осуществляться по отношению к позвонку до возникновения компрессионного перелома позвонка (или любого другого типа перелома).
В примерных хирургических методиках замены дегенеративной кости в позвонке пациент может быть расположен на рентгенопрозрачном столе в положении лежа. Рентгенологическая поддержка может быть обеспечена с помощью оборудования C-arm и присутствия рентгенолога, обеспечивающего рентгенную навигацию в течение времени проведения процедуры. После фиксирования позвонка, подвергаемого лечению, и связанных с ним ножек в рентгенологическом аппарате в прямой проекции может быть осуществлен малый кожный надрез (около 1 см) на передней или поясничной стороне, в которую вводят иглу для костной биопсии размером 11/13 гаудж через заднюю часть ножек под наклоном спереди медиально в нижней части. Подход в данном примерном способе является двусторонним. Непосредственно при подтверждении достижения иглой необходимого положения вводят проволоку Киршнера. Наконечник сверла продвигают в стенку в нескольких миллиметрах от переднего края кортекса для формирования внутрипозвонкового канала в кости для последующего прохода надувного баллонообразного тампона.
Далее, при осуществлении рентгеноскопического контроля в латеральной проекции, зонд осторожно проталкивают вперед и помещают в передних двух третях позвонка. Он может обладать длиной от 15 до 20 мм, при максимальном объеме, соответственно, от 4 до 6 мл. Непосредственно при подтверждении достижения баллонообразными тампонами необходимого положения в позвонках, недоразвитых с одной стороны, с помощью двух рентгеноконтрастных меток, расположенных в крайних точках (проксимальных и дистальных), данные тампоны обрабатывают жидкостью, содержащей 60% рентгеноконтрастного вещества, достигая подъема вышележащих позвонковых концевых пластинок и создания внутренней полости с помощью компрессии окружающей губчатой кости. Надувание прекращают, когда образуется свободное пространство, при контакте с кортикальной соматической поверхностью или при достижении максимального давления (220 пси), или при достижении расширения баллонообразного тампона. Хирургически созданная

Материал для регенерации костей может быть приготовлен как необходимо. Материал для регенерации костей затем загружают в отдельные канюли и двигают вперед через рабочую канюлю до обеспечения сообщения с передней третью




Несмотря на то, что способы изобретения могут быть охарактеризованы в рамках лечения пациента, страдающего дегенеративным заболеванием костей (таким как остеопения или остеопороз), данное изобретение далее может быть охарактеризовано в связи со способностью, в частности, изменять локализованные участки кости таким путем, как улучшение BMD, улучшение качества костей, увеличение прочности костей, улучшение естественной структуры костей и им подобным. Данное изобретение также может быть охарактеризовано в отношении способности обеспечивать ремоделировать локализованных участков костей, включая получение значительно большей плотности в локализованном участке кости, которая постепенно снижается, достигая нормального уровня BMD.
В определенных вариантах осуществления данное изобретение может быть охарактеризовано в качестве предусматривающего различные способы улучшения качества костей в локализованном участке кости. Качество костей может быть охарактеризовано, в частности, на основе BMD, которая может быть оценена на основе величины Т-балла, полученного с помощью проведения DEXA. Качество костей также может относиться, в большей степени, в целом, к общей структуре костного материала на основе степени образования костного каркаса. Далее, качество костей может, в частности, относиться к твердости костей - то есть к сопротивлению на сжатие.
Специфичная механическая твердость костей в отношении естественного костного материала или костного материала, регенерированного в хирургически образованных повреждениях (включая данные повреждения у пациентов, страдающих остеопенией или остеопорозом) в настоящее время не может быть непосредственно измерена у живых субъектов в связи с тем, что данное тестирование в настоящее время требует удаления значительных сегментов костей. Таким образом, прямое изменение механической твердости кости может осуществляться исключительно с помощью посмертных исследований, осуществляемых в клинических условиях. Тем не менее, исследования говорят об ожидающемся значительном увеличении твердости наряду с сопутствующим увеличениями BMD, как описано здесь. Далее ожидается дальнейшее улучшение свойств костей, таких как объем костей, трабекулярная толщина, трабекулярное количество, разделение трабекул, результаты измерений взаимосвязности и толщины кортикальной стенки. Подтверждающее доказательство данного увеличения механической твердости приводится в приложенных Примерах в отношении исследования на собаках, в котором сопротивление на сжатие и количество кальцинированной кости были напрямую измерены у эксплантированных образцов регенерированной кости после 13 и 26 недель после кавитирующей и заполняющей процедур согласно настоящему изобретению. После 13 недель сегменты кости, включая регенерированный костный материал, показывали значительное увеличение количества кальцинированной кости в размере 172% по сравнению с нормальной костью, забранной из того же анатомического участка при измерении с помощью количественной гистологии. Сопутствующее увеличение сопротивления на сжатие кости, содержащей регенерированный костный материал, по сравнению с сопротивлением на сжатие естественной кости составляло 283%. Спустя 26 недель после проведения операции вновь сформированный костный материал обеспечивал осуществление ремоделирования, приводящее к постепенному возврату к архитектуре нормальной кости и ее свойствам. Увеличение содержания кальцинированной кости в размере 24%, установленное с помощью проведенного гистологического анализа (также по сравнению с естественной костью), соответствовало сопротивлению на сжатие, которое было на 59% выше нормальных значений. Также необходимо отметить, что было отмечено увеличение плотности при проведении радиографии, что соответствует количественным результатам, полученным с помощью проведенной гистологии.
Клиническое доказательство увеличения BMD у человеческих субъектов приводится в приложенных Примерах и рассматривается как поддерживающее заключение о том, что увеличение BMD действительно может коррелировать с увеличением механической прочности костей, в частности, сопротивления на сжатие. Кратко говоря, было выполнено исследование с использованием 12 пациентов (людей), каждый из которых считался страдающим остеопорозом в рамках определения Всемирной Организации Здравоохранения (ВОЗ). Одно бедро каждого пациента было подвергнуто лечению в соответствии с настоящим изобретением, в то время как противоположное бедро не подвергалось лечению в целях сравнения. BMD измеряли в обоих бедрах с помощью DEXA до проведения лечения (для использования в качестве контроля) и через предопределенные интервалы, включающие 6, 12 и 24 недели. Средняя BMD шейки бедра увеличилась на 120%, 96% и 74% соответственно, на каждом интервале по сравнению с контролем. Средняя BMD зоны Варда увеличилась на 350%, 286%) и 189% соответственно, на каждом интервале по сравнению с контролем. Состояние двух пациентов далее оценивали через 24 месяца после окончания исследования. Данные два пациента обладали средним увеличением BMD в размере 15% (в участке шейки бедра) 133% (в зоне Варда) в конце исследования. Процентные значения на данном уровня говорят о том, что трансплантатный материал был ресорбирован и замещен новым костным материалом, как это наблюдалось в исследовании на собаках. В не подвергнутых лечению зонах заметных изменений при проведении оценки BMD по сравнению с контролем не было.
На сегодняшний день не существует известных исследований, подтверждающих, что увеличение BMD и увеличение прочности в подвергнутой остеопорозу кости человека могут в точности коррелировать с теми же значениями, получаемыми при измерении у здоровых собак. Тем не менее, значительное увеличение обоих свойств в исследовании на собаках, а также увеличение BMD, измеряемой при проведении клинических исследований, являются сильным доказательством связанности увеличения прочности костей в отношении человеческих костей, подвергнутых остеопорозу, подвергающихся лечению в соответствии описанными способами.
Качество костей также может быть связано со способностью костей сопротивляться возникновению перелома. Таким образом, варианты осуществления данного изобретения, которые могут быть охарактеризованы как относящиеся к увеличению качества костей, могут, в частности, охватывать улучшение структуры костей таким образом, что подвергающийся лечению участок кости обладает сниженным риском возникновения перелома по сравнению с риском пререлома до осуществления лечения (например, в том случае, если пациент страдает остеопеническим или остеопорозным заболеванием).
Низкий уровень BMD является одним из наиболее значимых факторов риска образования переломов, вызванных хрупкостью. Кроме того, ухудшение архитектуры губчатой кости является фактором, вносящим вклад в хрупкость костей. Таким образом, в то время как остеопороз традиционно определяли в качестве заболевания, характеризующегося недостатком твердости костей, далее он должен быть определен как заболевание, связянное с низкой плотностью костей и ухудшением качества костей. Несмотря на то, что измерение BMD является мощным клиническим инструментом и «золотым стандартом» определения костной массы, качество костей также в значительной степени определяется костным метаболизмом и микроархитектурой. В тех случаях, когда данные свойства костей ухудшаются (например, при истончении трабекул и потере связанности), существует связанное с этим увеличение хрупкости костей и риска возникновения переломов.
Различные неинвазивные способы могут применяться для исследования микроархитектуры, включая (без ограничения): периферическую количественную компьютерную томографию (pQCT) в высоком разрешении, ультрабыструю компьютерную томографию (uCT) и функциональную магнитно-резонансную томографию (fMRI). Изображения, полученные с помощью данных методов, могут использоваться для различения кортикальных костей и губчатой кости, а также визуализации мелких деталей трабекулярной микроархитектуры, изучаемой до этого исключительно с помощью проведения инвазивной биопсии. Результаты, полученные с помощью компьютерной томографии (и также MTI) могут являться компьютерно-смоделированными с помощью анализа методом конечных элементов (FEA) для оценки жесткости костей. Каждый из этих способов может применяться для оценки архитектуры кости. Данные исследования архитектуры включают измерение костного объема, трабекулярной толщины, трабекулярного количества, разделения трабекул, измерения взаимосвязанности и толщины кортикальной стенки.
В связи с развитием технологии также развивается и степень детализации результатов, получаемых с помощью компьютерного программного обеспечения. pQCT и FEA могут использоваться совместно для определения точки начала будущего перелома и его потенциала при определенной нагрузке. Данный анализ также известен как биомеханическая компьютерная томография (ВСТ). При использовании наряду с традиционными методами исследований, такими как всестороннее испытание на животных, изучение остеопороза на животных или трупное биомеханическое исследование, ВСТ может использоваться для определения будущего потенциала возникновения перелома у пациента - включая риск возникновения перелома в результате падения - и обеспечивать получение информации, необходимой для оценки степени улучшения качества костей у живого пациента без необходимости осуществления инвазивной биопсии. В связи с количественным характером оценки ВСТ может ограничивать критерии включения/исключения для любого исследования, поскольку она фокусируется на качестве костей пациента. Также продолжительность любого исследования может быть потенциально снижена, поскольку требуются только определенные подмножества пациентов, находящихся «под угрозой» по сравнению с пациентами, «рассматриваемыми в качестве находящихся под угрозой». Кроме того, ВСТ может снижать потребность в конечной точке, такой как перелом бедра в целом, что имеет высокую связь со смертностью, для определения положительного эффекта проведенного лечения.
Таким образом, в определенных вариантах осуществления данного изобретения подтверждение улучшения качества костей в соответствии с данным изобретением может быть получено с помощью применения ВСТ-анализа к имплантированному костному матриксу, как описано выше, наряду с другими признанными научными исследованиями качества костей. Объединенные результаты могут быть использованы для анализа изменения плотности костей и качества костей в течение времени, и, таким образом, демонстрировать общее снижение риска возникновения переломов после проведения лечения в соответствии с данным изобретением по сравнению с состоянием естественной кости до проведения лечения (то есть в то время, когда данная кость находится в остеопеническом или остепорозном состоянии). Используя данные методы, появляется, таким образом, возможность, оценить риск возникновения перелома до и после проведения лечения в соответствии с данным изобретением, и, на основе данных оценки, продемонстрировать способность данного изобретения снижать восприимчивость к переломам или повышать сопротивляемость к переломам. Например, вероятность возникновения перелома может быть измерена аналогично оценке Т-балла BMD таким образом, что балл, равный около 0, соответствует риску возникновения перелома, аналогичному риску у среднего здорового человека в возрасте около 30 лет (возможно даже с учетом данных о поле, расе и/или национальности, если подтверждение говорит о том, что данные факторы должны приниматься во внимание). Отрицательный балл может соответствовать степени риска возникновения перелома, являющейся большей, чем у среднего здорового человека с возможным увеличением риска при получении более отрицательных значений (например, величина балла, равная -2, соответствует более значительному риску образования перелома, чем величина балла, равная -1). Положительное значение балла может соответствовать тому, что риск возникновения перелома менее, чем у среднего здорового взрослого человека с возможным снижением риска при получении более положительных значений (например, величина балла, равная 2, соответствует менее значительному риску образования перелома, чем величина балла, равная 1).
В определенных вариантах осуществления данного изобретения способ улучшения качества костей в локализованном участке кости может включать замещение объема дегенерированной кости с Т-баллом, равным менее -1,0, вновь образованным естественным костным материалом с Т-баллом, равным более -1,0. Предпочтительно, Т-балл кости с вновь образованным естественным костным материалом равен, по меньшей мере, -0,5, по меньшей мере, 0,5, по меньшей мере, 1,0. В определенных вариантах осуществления данного изобретения Т-балл кости, подвергающейся лечению, может превосходить Т-балл дегенерированной кости на, по меньшей мере, 0,5 единиц, на, по меньшей мере, 1,0 единиц, на, по меньшей мере, 1,5 единиц, на, по меньшей мере, 2,0 единиц, на, по меньшей мере, 2,5 единиц, на, по меньшей мере, 3,0 единиц. В вариантах осуществления данного изобретения, в которых Т-балл подвергающейся лечению кости превосходит Т-балл дегенерированной кости на, по меньшей мере, определенную величину, может являться необязательным превышение значения Т-балла определенного минимума, поскольку увеличение BMD, подтвержденное увеличением Т-балла, отражает достаточно значительное улучшение качества кости для использования у пациента (например, при трансформации кости в локализованном участке с переходом от серьезной степени остеопороза к средней степени остеопороза или от остеопорозного к остеопеническому состоянию).
В способе улучшения качества костей этап замещения может включать образование



В некоторых вариантах осуществления данного изобретения возможность замены дегенеративного костного материала костным материалом улучшенного качества, в частности, может возникать вследствие полезных качества материала для регенерации костей, который используется для заполнения образованной

В определенных вариантах осуществления данного изобретения материал для регенерации костей может включать сульфат кальция в качестве компонента первой фазы, который быстро ресорбируется, как правило, путем простого растворения, брушит (CaPO4) в качестве компонента второй фазы, который подвергается остеобластной резорбции (а также простому растворению) и трикальцийфосфат в качестве компонента третьей фазы, который подвергается, в основном, остеобластной резорбции. Любой материал, обладающий данным трехфазным профилем резорбции, может использоваться в соответствии с данным изобретением. Изменения, происходящие с течением времени в материале для регенерации костей, обладающим данным типом структуры, который позволяет осуществлять контролируемый рост нового костного материала, приведены на Фиг. 7а - 7е. Указанные фигуры иллюстрируют растворение трансплантата в ускоренной in vitro модели, являющееся приблизительно в шесть раз более быстрым, чем растворение, наблюдаемое in vivo в модели с собаками. Более детальное описание профиля резорбции материала для регенерации костей в отношении Фиг. 7а - 7е приведено в Примерах ниже.
Хотя все фазы мультифазного материала могут обнаруживать некоторую степень резорбции вскоре после размещения трансплантата, мультифазный ресорбирующийся материал может быть описан как материал, первую фазу которого составляет резорбция первого материала (например, материала, состоящего из сульфата кальция) до окончания большей части первой фазы, вторую фазу которого составляет резорбция второго материала (например, брушита), а любые дальнейшие фазы которого могут быть описаны как период времени, в течение которого ресорбируются оставшиеся части материала(ов) трансплантата (например, гранулированный TCP). Определенные периоды времени, необходимые для завершения резорбции каждой фазы, могут зависеть от определенных используемых материалов и размера повреждения.
Ангиогенез является ключевым ранним событием, происходящим в течение первой фазы резорбции, поскольку, в связи с тем, что материал, состоящий из сульфата кальция, ресорбируется, начинается пористая вторая фаза, способствующая васкулярной инфильтрации. Пористая вторая фаза также может образовывать связи со свободными белками, такими как VEGF и ВМР-2 в месте имплантации/образования повреждения. Резорбция второй фазы затем может высвобождать связанные белки, способные привлекать клетки к поверхности имплантата. Факторы роста в зоне имплантации могут стимулировать пролиферацию и дифференциацию мезенхимных стволовых клеток. Соответственно, дифференцированные остеобласты выстилают остеоид, который затем осуществляет минерализацию для превращения в новую грубоволокнистую кость. Принципы Закона Вольфа затем могут позволить запустить процесс ремоделирования вновь образованного костного материала. Это, далее, является полезным для пациента в отношении того, что укрепление участков, таких как бедро, склонных к возникновению переломов, может обеспечивать уверенность у пациента, приводящую к большему количеству движений и упражнений, что, в свою очередь, может оказывать положительное влияние на общее качество костей и общее здоровье.
В других вариантах осуществления данное изобретение предусматривает способы увеличения BMD в локализованном участке кости. Данный способ может включать образование






Увеличение BMD может быть обнаружено с помощью сравнения результатов оценки BMD в локализованном участке кости до удаления дегенерированного нативного костного материала и после образования нового костного материала внутри образованной








Кроме способности вызвать образование новых естественных костей, обладающих нормальной плотностью, данное изобретение позволяет поддерживать улучшение BMD в течение продолжительного периода времени. Как описано выше, было неожиданным обнаружить, в соответствии с данным изобретением, что вновь сформированный костный материал у пациента с остеопорозом не обладает остеопорозным качеством, но, по сути, обладает качеством, ожидаемым у пациента того же пола и расы в возрасте достижения BMD своего пика. Таким образом, было обнаружено, что способы данного изобретения полезны для полного восстановления качества костей в локализованном участке, подвергающемся лечению, до достижения пикового состояния (или нормального состояния). Более того, на данное восстановление в локализованном участке кости, как представляется, не влияет общий остеопорозный статус пациента. Другими словами, улучшенная BMD не является временным явлением, таким что вновь образованный костный материал быстро дегенерирует до достижения им остеопорозного состояния, связанного с общим статусом пациента. С другой стороны, вновь образованный костный материал, как представляется, обладает всеми характеристиками, связанными с восстановлением в плане того, что вновь образованный костный материал обнаруживает естественное снижение BMD, как это продемонстрировано на Фиг. 1. Например, как это видно на Фиг. 1, бедро белой женщины в возрасте 70 лет, подверженной типичному снижению BMD, может обладать BMD около 775 мг/см2. После лечения в соответствии с настоящим изобретением локализованный участок бедренной кости может быть восстановлен до достижения нормального уровня BMD - например, около 950 мг/см2 (или типичной BMD в возрасте 30 лет). Спустя 10 лет дополнительного типичного снижения BMD тот же пациент, как ожидается, обладает средней BMD около 700 мг/см2 (то есть типичным снижением BMD, происходящим в возрасте между 70 и 80 годами). Тем не менее, ожидается, что костный материал в локализованном участке бедра, подвергающийся лечению в соответствии с данным изобретением, будет обладать BMD около 930 мг/см2 (то есть типичным снижением BMD, происходящим в возрасте между 30 и 40 годами). Конечно, является очевидным, что вышеупомянутое является лишь примерной характеристикой, основанной на средних значениях, и что ожидается, что непосредственные значения у пациентов могут варьироваться. Таким образом, подтверждается, что способы данного изобретения не являются временным решением, но способны обеспечивать долговременные увеличения BMD, поскольку костный материал, образованный с помощью способов данного изобретения, обладает эффектом восстановления до достижения пикового состояния и затем сохраняется в течение типичного, естественного снижения плотности, сопутствующего старению (то есть не снижается в ускоренном темпе до достижения системного остеопорозного состояния у пациента).
В свете данной характеристики изобретения, определенные варианты осуществления данного изобретения могут подразумевать поддержание увеличенной BMD в течение определенного периода времени. Например, увеличение BMD в локализованном участке кости может поддерживаться в течение времени, равного, по меньшей мере, 6 месяцев, по меньшей мере 1 году, по меньшей мере, 18 месяцев, по меньшей мере, 2 годам, по меньшей мере, 3 годам, по меньшей мере, 4 годам, по меньшей мере, 5 годам или даже дольше. Измерение времени может осуществляться от момента формирования нового костного материала в образованной

Данные способы увеличения BMD, кроме того, обладают преимуществом, заключающимся в том, что увеличение BMD в локализованном участке кости может осуществляться вне пределов

















В других вариантах осуществления данного изобретения способы изобретения могут быть охарактеризованы по отношению к определенному профилю BMD, выявленному в локализованном участке кости. Как указано выше, было обнаружено, что способы данного изобретения не только обеспечивают восстановление вновь образованного костного материала вплоть до достижения нормальной плотности, но также способны вызвать значительное увеличение плотности в локализованном участке кости до достижения по сути нормальной плотности. Это может быть охарактеризовано как ремоделирование кости в локализованном участке в соответствии с определенным профилем плотности.
В некоторых вариантах осуществления, данные способы создания определенного профиля BMD в локализованных участках кости могут включать образование








Одновременно с образованием нового костного материала в


Важным является то, что вновь сформированный костный материал в образованной

Что касается определенного профиля BMD, последующие оценки BMD, осуществляемые в течение времени, такие как последующая DEXA, могут обеспечить получение замедленного профиля BMD в локализованном участке кости, возникающего в результате имплантации материала для регенерации костей. Профиль BMD, полученный в соответствии с настоящим изобретением, является, в частности, неожиданным в связи с тем, что использование материала для регенерации костей в хирургически созданной


имплантации материала для регенерации костей. Фиг. 9 иллюстрирует профиль, при этом локальная BMD кости, подвергающейся лечению в соответствии с данным изобретением, такова, что кость рассматривается в качестве остеопенической или остеопорозной (то есть обладающей значением Т-балла менее -1 или менее -2,5). Прерывистая линия, показанная перед значением времени 0 означает, что непосредственная BMD, которая определяется Т-баллом, может обладать любым значением ниже установленного предела (например, менее -1, менее около -2,5 и так далее). При замещении (при нулевом значении времени) дегенерированной кости в локализованном участке материалом для регенерации костей BMD в локализованном участке начинает быстро увеличиваться, достигая максимальной плотности. Как показано на связанном с этим графике на Фиг. 9, максимальная плотность, соответствующая значениям Т-балла более около 5, достигается в течение времени от около 1 недели до около 13 недель. Непрерывная линия на Фиг. 9 иллюстрирует данное быстрое увеличение BMD, а пунктирная линия со значениями Т-балла более 5 показывает, что максимальный Т-балл может достигать значений более 5 и, как правило, в течение времени, ограниченного пунктирной линией. В определенных вариантах осуществления данного изобретения максимальное достигаемое значение Т-балла в соответствии с определенным профилем BMD равно, по меньшей мере, 2,0, по меньшей мере, 3,0, по меньшей мере, 4,0, по меньшей мере, 5,0, по меньшей мере, 6,0, по меньшей мере, 7,0, по меньшей мере, 8,0, по меньшей мере, 9,0 или, по меньшей мере. 10,0. Время достижения максимальной плотности (то есть максимального значения Т-балла) после проведения имплантации может лежать в диапазоне от около 1 недели до около 6 недель, от около 1 недели до около 10 недель, от около 1 недели до около 13 недель, от около 1 недели до около 18 недель, от около 2 недель до около 10 недель, от около 2 недель до около 13 недель, от около 2 недель до около 18 недель, от около 3 недель до около 10 недель, от около 3 недель до около 13 недель, от около 3 недель до около 18 недель, от около 4 недель до около 10 недель, от около 4 недель до около 13 недель, от около 4 недель до около 18 недель, от около 6 недель до около 10 недель, от около 6 недель до около 13 недель, от около 6 недель до около 18 недель. После достижения максимальной плотности, плотность локализованного участка кости начинает снижаться в течение времени до около 6 месяцев, до около 9 месяцев, до около 13 месяцев, до около 18 месяцев, до около 24 месяцев, от около 6 недель до около 24 месяцев, от около 13 недель до около 18 месяцев или от около 18 недель до около 12 месяцев. Соответственно, BMD локализованного участка кости стабилизируется в рамках, по сути, нормального диапазона от около -1,0 до около 7,0, от около -1,0 до около 0,1, от около -1,0 до около 0,5, от около -1,0 до около 0, от около -0,5 до около 2,0, от около -0,5 до около 1,5, от около -0,5 до около 1,0, от около -0,5 до около 0,5, от около 0 до около 2,0, от около 0 до около 1,5, от около 0 до около 1,0.Учитывая вышеприведенные значения, другие графики, аналогичные графику на Фиг. 9, могут быть подготовлены для получения репрезентативных профилей BMD, охватываемых данным изобретением, отличающихся только максимально достигаемым значением BMD и/или времени достижения максимального значения BMD и/или времени после достижения максимального значения BMD вплоть до снижения значения BMD до, по сути, нормального диапазона. Конкретные варианты профилей BMD, достигнутые у подопытных субъектов, описаны в Примерах, приведенных ниже.
В других вариантах осуществления данного изобретения, BMD может по существу быть поддерживаемым таким образом, что определенный профиль BMD может быть достигнут в течение более длительного периода времени. Другими словами, BMD, соответствующая величине Т-балла от около -1,0 до около 2,0, от около -1,0 до около 1,0, от около -1,0 до около 0,5, от около -1,0 до около 0, от около -0,5 до около 2,0, от около -0,5 до около 1,5, от около -0,5 до около 1,0, от около -0,5 до около 0,5, от около 0 до около 2,0, от около 0 до около 1,5 или от около 0 до около 1,0 может поддерживаться в течение одного дополнительного года или более (то есть профиль BMD в локализованном участке кости может быть таким, что BMD, определенное с помощью значения Т-балла, находящегося в определенных границах, может быть достигнуто и поддерживаемо в течение, по меньшей мере, 1 года, по меньшей мере, 2 лет, по меньшей мере, 3 лет, по меньшей мере, 4 лет, по меньшей мере, 5 лет или даже более).
В других способах настоящее изобретение может быть охарактеризовано в отношении эффекта, описанного выше, касающегося ремоделирования локализованного участка дегенеративной кости до, по сути, идентичного нормальной кости. В определенных вариантах осуществления данное изобретение, в частности, может быть направлено на способы ремоделирования локализованного участка дегенеративной кости, включающие следующие этапы: образование



В определенных вариантах осуществления данного изобретения костный материал в локализованном участке, подвергающемся лечению в соответствии с данным изобретением (то есть до образования

До настоящего изобретения данный эффект не являлся ожидаемым. Остеопороз (то есть значительное снижение BMD), как правило, рассматривается в качестве системного состояния. Несмотря на то, что непосредственное значение Т-балла может варьироваться от одного участка до другого у того же пациента, в целом, в тех случаях, когда имеет место остеопороз, данное состояние сохраняется в организме (например, при значении Т-балла дистального отдела лучевой кости -2,8 по сравнению со значением Т-балл бедра -3). Как описано выше, было обнаружено в соответствии с настоящим изобретением, что, несмотря на то, что остеопороз прогрессирует системно, является возможным локальное восстановление качества костей организма. Другими словами, локализованный участок кости может быть ремоделирован с переходом от остеопорозного к нормальному состоянию. Это является неожиданным, так как остеопороз, как считается, возникает в результате сниженной способности организма образовывать новые костные клетки, так что скорость резорбции костных клеток превосходит скорость образования новых клеток. Можно представить, что образованная кость, растущая в месте повреждения будет попросту являться продолжением окружающей кости - то есть кость низкого качества породит кость низкого качества. Настоящее изобретение демонстрирует, что верно противоположное. С помощью систематического удаления определенных объемов костного материала в локализованных участках кости и замещения данного материала материалом для регенерации костей, как описано здесь, общий процесс приводит в движение регенеративный процесс, при этом инфлюкс новых костных клеток вызывает образование нового естественного костного материала, который не является продолжением дегенеративной кости в окружающем участке, но является костным материалом по сути идентичным нормальной кости нормальной плотности.
Данное ремоделирование графически проиллюстрировано на Фиг. 10, на которой оценивается снижение BMD в локализованном участке кости белой женщины. Как видно здесь, BMD в локализованном участке снижается от нормального диапазона в возрасте около 30, при этом степень снижения увеличивается около времени наступления менопаузы и затем выравнивается, достигая менее резкой степени снижения. Точка на графике, соответствующая возрасту 70 лет, соответствует времени проведения процедуры в соответствии с настоящим изобретением. BMD в локализованном участке значительно увеличивается и восстанавливается до нормального уровня (то есть примерно на уровне плотности в возрасте 30 лет). Начиная с этого времени, BMD нового костного материала в локализованном участке продолжает естественным образом снижаться в связи со старением. Таким образом, локализованный участок кости был эффективно ремоделирован от остепорозного состояния до нормального состояния.
Конкретные значения, отмеченные на Фиг. 10, являются репрезентативными с учетом того, что непосредственные значения Т-балла могут отличаться от пациента к пациенту. Общий эффект ремоделирования, тем не менее, ожидается стойким от пациента к пациенту. Другими словами, несмотря на то, что конкретные значения BMD могут быть несколько большими или меньшими тех, которые приведены на фигуре, ремоделирование будет являться стойким в следующих отношениях: кость будет обладать плотностью, снижающейся до достижения точки, соответствующей остеопеническому или остеопорозному состоянию; после имплантации материала для регенерации костей в соответствии со способами данного изобретения будет значительное увеличение BMD, превосходящей, по сути, нормальный диапазон значений; BMD снизится до, по сути, нормального диапазона; BMD будет снижаться в степени, в целом, характерной для здорового костного материала. Важным является то, что при повторном достижении степени нормального снижения после имплантации, данное снижение начинается с точки, в которой BMD, как правило, присуще нормальному здоровому человеку в возрасте пика BMD. Таким образом, несмотря на то, что BMD продолжает снижаться, ее основа была изменена до нормального уровня плотности, а не уровня, характерного для остеопении или остепороза. Это, в частности, важно в тех случаях, когда процедуры данного изобретения выполняют у женщин с уже произошедшей менопаузой, у которых быстрое снижение BMD, связанное с менопаузой, не будет способно затронуть вновь образованные, плотные кости. В зависимости от возраста пациента-женщины во время проведения лечения и на протяжении жизни человека восстановление природы кости в локализованном участке может эффективно изменять структуру в локализованном участке, так что локализованный участок кости никогда не достигнет остеопенического или остеопорозного состояния снова в течение всей жизни пациента после проведения лечения. Данная способность ремоделировать остеопенический и остеопорозный костный материал с достижением по сути структуры, аналогичной структуре нормального костного материала, далее иллюстрируется в Примерах, приведенных ниже.
Наряду с ремоделированием участка дегенеративной кости, определяемого образованной пустотой, данное изобретение также может приводить к ремоделированию дегенеративного костного материала по сути вблизи от образованной







Также, как уже описано выше, локализованный участок дегенерированной кости, подвергающейся ремоделированию для достижения практически идентичного нормальной кости состояния, предпочтительно поддерживает характеристики ремоделированного состояния в течение длительного периода времени. Например, ремоделированный локализованный участок кости может оставаться по сути идентичным нормальной кости в течение, по меньшей мере, 1 года, по меньшей мере, 2 лет, по меньшей мере, 3 лет, по меньшей мере, 4 лет, по меньшей мере, 5 лет или даже дольше.
Данное изобретение может использоваться наряду с существующими хирургическими процедурами, такими как кифопластика или вертебропластика. В отличие от данных существующих процедур используемые способы в соответствии с данным изобретением будут выполняться у пациентов, которые в настоящее время не страдают переломом позвонка или другими ослабляющими позвонки состояниями. Скорее настоящие способы могут быть охарактеризованы, как выполняемые для профилактики (то есть в целях предотвращения будущего перелома дегенерированной кости). В частности, что касается позвонков, хирургический способ может выполняться в отношении позвонка, не являющегося сломанным, однако используемый хирургический способ может быть аналогичен хирургическому способу, используемому в традиционной кифопластике. В данных вариантах осуществления изобретения способы данного изобретения могут быть здесь описаны иначе и быть, в частности, выполнены в отношении одного или нескольких позвонков у пациента.
В других вариантах осуществления данное изобретение может быть выполнено в отношении позвонка, уже являющегося сломанным. Вместо выполнения традиционной кифопластики, которая, как правило, включает заполнения сломанного участка цементным материалом, таким как полиметилметакрилат (РММА), настоящее изобретение может обеспечивать расширение или увеличение перелома, если это необходимо, для образования


Таким образом, в определенных вариантах осуществления данное изобретение может быть описано как обеспечивающее способ восстановления высоты тела позвонка или корректировки угловой деформации у сломанного позвонка (в частности, сломанного, остеопенического или остеопорозного позвонка) путем стимулирования роста нового костного материала, который, по сути, идентичен нормальной кости. В частности, данный способ может включать образование




Несмотря на то, что установлено, что настоящее изобретение обеспечивает определенные преимущества по сравнению с другими известными способами и материалами для лечения остеопороза и/или остеопении, настоящее изобретение не должно обязательно выполняться с исключением остальных видов лечения. В частности, настоящие способы замещения дегенерированного костного материала вновь образованным костным материалом, являющимся нативным для пациента и, по сути, нормальным в отношении качества кости, могут быть использованы в сочетании с фармацевтическим лечением, известным из уровня техники в качестве полезного для лечения остеопороза и/или остеопении. Например, лечение пациентов в соответствии с данным изобретением может проводиться в то время, когда пациент одновременно получает фармацевтическое лечение, включая гормональную терапию (например, эстроген, SERM, кальцитонин и рекомбинанты, такие как rPTH), бифосфонаты и антитела (например, деносумаб). Данные виды фармацевтического лечения могут проводиться до, одновременно или после лечения в соответствии с настоящим изобретением. В частности, проведение данных видов лечения может быть приостановлено на определенный период времени до выполнения способов данного изобретения. Таким же образом, данные виды лечения могут быть начаты в течение определенного периода времени после выполнения способа данного изобретения.
В другом аспекте настоящее изобретение также предусматривает материал, который может быть использован в способах для замещения дегенерированной кости, как описано здесь. В частности, различные материалы могут быть собраны в форме набора. Таким образом, способы изобретения или определенные этапы этих способов могут выполняться с использованием инструментов из набора, включающего различные компоненты. Примерные материалы, которые могут быть предусмотрены в наборе в соответствии с данным изобретением, описаны ниже.
Набор в соответствии с данным изобретением, предпочтительно, должен включать инструмент для сверления, который включает сверло и/или долото для сверления, такое как канюлированное долото для сверления. Например, может быть включено канюлированное OD сверло диаметром 5,3 мм. Набор также может включать одну или несколько направляющих проволок, шприцов, инструментов для доставки материала для регенерации костей в


Любые материалы, полезные для осуществления санации кости, могут быть включены в набор в соответствии с данным изобретением. Например, в добавление к кюреткам, рашпилям, трефинам и им подобным, возможно использовать расширяющееся устройство для создания свободного пространства (с помощью расширения с применением баллона, мелкоячеистой ткани, сетки, гибкой проволоки, гибких и/или перфорированных трубок, расширяемой метелки, вращающейся проволоки, расширяющегося лезвия, нерасширяющегося гибкого лезвия или других аналогичных устройств). Все вышеприведенное может иметь ручной или механический привод. Они могут быть ограничены (например, в виде лезвия, просунутого в отверстие трубки) или неограничены (например, в виде лезвия, деформированного через отверстие в трубке).
Определенные примеры инструментов, которые могут быть полезны при выполнении вариантов осуществления настоящего изобретения и, таким образом, могут быть включены в набор в соответствии с данным изобретением, приведены на Фиг. 11-19. На Фиг. 11 изображен протектор тканей, который используется для обеспечения безопасного прохождения для других инструментов (например, инструмента для сверления) с внешней стороны тела внутрь путем защиты окружающих мягких тканей от повреждения. Протектор тканей НО включает рукоятку 111 и удлиненный корпус 112 с открытым каналом 113, находящемся в нем. На Фиг. 12 изображен канюлированный обтуратор, который может быть использован для отцентрированного размещения направляющей проволоки (и может быть проведен через внутреннюю часть протектора тканей). Обтуратор 120 включает расширенную головку 121, удлиненный корпус 122 и открытый канал 123, находящийся в нем. На фиг.13 изображена секция режущей головки направляющей проволоки, которая обеспечивает врезание внутрь кости с одновременным сохранением расположения in vivo. Направляющая проволока 130 включает корпус 131 (показана часть) и режущую головку 132, являющуюся достаточной для врезания в кость без образования значительного просверленного канала.
На Фиг. 14 изображено сверло, которое используется для создания канала или туннеля определенной формы (например, с диаметром 5,3 мм) в кости. Сверло 140 включает корпус 141 и режущую головку 142. На Фиг. 15 изображена гибкая рабочая канюля. Функция рабочей канюли заключается в обеспечении безопасного прохода дальнейших рабрасчих инструментов (например, санационных инструментов и игл шприцов) во внутреннюю часть кости с одновременной защитой окружающих тканей. Изображенная канюля 150 включает головку 151, обладающую подходящим размером для прикрепления других устройств, корпусом 152, режущей головкой 153, и открытым каналом 154, расположенном в ней. На Фиг. 16 изображен обтуратор, который может быть использован с канюлей, обтуратор 160 включает увеличенную головку 161 и вытянутый корпус 16 и может включать центральный канал (не показан). На Фиг. 17 изображен санирующий зонд, который вставляют в кость для расчистки дегенерированного костного материала и образования


Набор в соответствии с данным изобретением может включать одну или несколько комбинаций изображенных инструментов, или другие инструменты, которые могут быть полезны при выполнении способа в соответствии с данным изобретением. В определенных вариантах осуществления данного изобретения набор включает все инструменты и материал для регенерации костей, необходимые для выполнения остеосупплементарной процедуры. Он может включать инструменты, необходимые для создания кожного надреза, создания



В некоторых вариантах осуществления данного изобретения набор может содержать только минимальное количество компонентов, необходимых для осуществления изобретения. Например набор может минимально содержать санирующий зонд (например, зонд особой изогнутой формы, такой как изогнутой на угол в описанных здесь диапазонах) и/или сверл для образования входного канала определенного размера и/или материалы для регенерации костей. В других вариантах осуществления данного изобретения канюлированный обтуратор также может включаться. В других вариантах осуществления данного изобретения может включаться рабочая канюля. В других вариантах осуществления данного изобретения может включаться отсасывающее/ирригирующее устройство. В других вариантах осуществления данного изобретения может включаться протектор тканей. В других вариантах осуществления данного изобретения направляющая проволока также может включаться. В других вариантах осуществления данного изобретения может включаться аппарат для смешивания. В другом варианте осуществления данного изобретения могут включаться шприц и игла для доставки. Другие инструменты также могут включаться в набор в соответствии с настоящим изобретением, как понятно специалисту в данной области с учетом настоящего описания.
В добавление к любому из описанных выше компонентов, набор в соответствии с данным изобретением может включать набор инструкций об использовании компонентов набора для лечения пациента, находящегося в состоянии, связанном с дегенерацией костей. Например, набор инструкций может включать инструкции, связанные с использованием скальпеля для обеспечения доступа к подвергающейся лечению кости, связанные с использованием протектора тканей в месте надреза для защиты окружающей ткани, связанные с использованием направляющей проволоки или направляющей спицы для образования первоначальной точки входа в кость, использованием сверла для образования канала во внутренней части кости, использованием санационного инструмента для расчистки дегенерированного костного материала, использованием отсасывающего инструмента для удаления вычищенного костного материала, смешиванием материала для регенерации костей (если необходимо), использованием шприца для инъецирования материала для регенерации костей в образованную

ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Настоящее изобретение описывается следующими примерами, которые приведены для иллюстрации настоящего изобретения и обеспечения полноты описания и которые не должны рассматриваться в качестве ограничивающих его.
ПРИМЕР 1
Резорбционные характеристики трехфазного материала для регенерации костей
Усовершенствованная (ускоренная) модель, иллюстрирующая резорбционные характеристики трехфазного материала для регенерации костей была воспроизведена с помощью заранее подготовленных и взвешенных кубиков материала для регенерации костей размером 4,8 мм × 3,2 мм, коммерчески доступного под торговым названием PRO-DENSE®. Данное испытание было предназначено для иллюстрации изменений в материале для регенерации костей в течение времени для осуществления контролируемого роста нового костного материала. Ускоренная in vitro модель является приблизительно в шесть раз более быстрой, чем резорбция, наблюдаемая in vivo в модели с собаками, при этом степень резорбции in vitro модели является еще менее продолжительной по сравнению с человеческими моделями.
Для начала оценки кубики были погружены в дистиллированную воду. Для ежедневного испытания кубики извлекали из воды, высушивали и взвешивали для оценки оставшейся процентной массы. Кубики помещали в свежие аликвоты дистиллированной воды после проведения измерений. Для микроскопического анализа кубики были выложены, выровнены и проанализированы с помощью сканирующего электронного микроскопа (SEM) при 35-кратном увеличении.
Первоначальное состояние материала для регенерации костей показано на Фиг. 7а. На Фиг. 7b показаны кубики спустя 4 дня in vitro (которые, как ожидается, они являются соответствующими состоянию спустя около 24 дней in vivo). Присутствует первоначальное появление раствора сульфата кальция на поверхности кубика, достигающего внешнего слоя тонких кристаллов брушита и крупных гранул TCP (белого цвета на снимках SEM). Брушит формирует диффузионный барьер, который замедляет скорость растворения CaSO4. Спустя 8 дней in vitro (приблизительно 48 дней in vivo) наблюдается процесс растворения, как это видно на Фиг. 7 с, при этом видно, что кристаллы брушита на внешней стороне кубиков (те, которые были затронуты в первую очередь) стали менее плотными, что говорит о том, что брушит также подвергается растворению. На Фиг. 7d изображен кубик спустя 12 дней in vitro (приблизительно 72 дня in vivo), при этом видно, что относительно плотный участок брушита, окружающий незатронутую часть кубика, движется по направлению внутрь при продолжении растворения. Наконец, на Фиг. 7е изображен законченный раствор сульфата кальция с образованием TCP гранулами равномерно распределенного каркаса после того, как была растворена большая часть CaSO4 и брушита. Является вероятным, что некоторая часть брушита остается присоединенной к TCP и удерживает гранулы вместе.
ПРИМЕР 2
Сравнительная резистентность в отношении переломов остеопорозной кости до и после образования

Для оценки воздействия на чувствительность к переломам непосредственно после проведения процедуры в соответствии с данным изобретением выполняли исследования на трупах с использованием десяти совпадающих пар остеопенических и остеопорозных проксимальных бедренных костей. Выполняли первоначальную DEXA шейки бедра и зоны Варда, а Т-баллы всех испытуемых костей были менее или равны -2,0, что говорило об остеопеническом или остеопорозном состоянии костного материала во время проведения исследования. Совпадающими парами были левые и правые бедренные кости того же трупа. В каждом тесте создавали повреждение в одной бедренной кости и заполняли его трансплантируемым материалом PRO-DENSE®. Рентгеновские снимки на Фиг. 20 и Фиг. 21 изображают соответственно введение санирующего зонда, используемого при создании


Результаты тестов показали отсутствие значительного различия в пиковой нагрузке между проксимальной бедренной костью, подвергнутой лечению в соответствии с данным изобретением, и контрольной (неповрежденной) бедренной костью. Средняя пиковая нагрузка, наблюдаемая среди десяти пар совпадающих трупных бедренных костей, показана на графике на Фиг. 22. Как видно из него, все проксимальные бедренные кости были сломаны при пиковой нагрузке около 8,000 Н. Таким образом, данные тесты говорят об отсутствии клинического риска, связанного с сокращенной прочностью проксимальной бедренной кости, подвергнутой процедуре в соответствии с настоящим изобретением при образовании

ПРИМЕР 3
Исследование на собаках In Vivo с использованием материала для регенерации костей в большой продольной модели проксимального отдела плечевой кости предельного размера
Исследование выполняли для оценки 13 и 16-недельных результатов in vivo материалов для регенерации костей в продольной модели проксимального отдела плечевой кости собак предельного размера. Биологический ответ, конкретно образование новой кости, дегенерация имплантата и биосовместимость были качественно оценены с помощью рентгеновских снимков и гистологических снимков.
В данном исследовании 16 собак со сформированным скелетом получали двусторонние продольные цилиндрические повреждения (13 мм OD × 50 мм) в проксимальной плечевой кости. Все субъекты получали заместительные кубики костного имплантата OSTEOSET® из сульфата кальция (Wiight Medical Technology, Inc., Arlington Tenn.) для одного или двух повреждений. Противоположные повреждения лечили либо с помощью инъекции болюса текучего имплантационного материала PRO-DENSE® или кубиков материала PRO-DENSE®, каждый из которых является коммерчески доступным. Половина каждой экспериментальной группы прошла оценку после 13 недель, а другая половина - после 26 недель. Дополнительные 10 плечевых костей были получены от пяти не прошедших операцию собак в целях получения сравнительных данных в отношении нормальной кости, взятой из того же места. Все образцы были протестированы на предмет сопротивления на сжатие и гистоморфологии.
Ограниченный черепной подход к большому бугорку левой и правой плечевой кости выполняли у каждого субъекта с помощью надреза и сокращения ключичноплечевой мышцы. Использовали сверление и рассверловку для создания повреждения, размер которого указан выше, в каждом тестовом участке. Образованные повреждения затем заполняли одним из тестовых материалов, альтернативными материалами между левой и правой сторонами для произвольности места повреждения для каждого используемого материала. Кубики затем плотно набивали в каждое повреждение с помощью хирургических щипцов. Инъецируемый болюс готовили с помощью комбинирования жидких и порошкообразных компонентов в вакуумном аппарате для смешивания костного цемента (Summit Medical; Gloucestershire, UK). После смешивания в течение 30 секунд при 20-23 Hg вакууме материал был помещен в шприц объемом 20 см3, а болюс (объемом приблизительно 6 см3) был доставлен в место повреждения с помощью канальной иглы Джамшиди 11 Гаудж объемом 6 см3 с использованием методики заполнения материалом. Раны затем закрыли.
Выполняли биомеханическое тестирование для определения предельной силы сжатия и модуля упругости вновь образованной кости с помощью образцов для механического тестирования, полученных из тестовых участков субъектов. Тестирование выполняли на сервогидравлической механической испытательной системе Instron Model 8874, оборудованной 1 кН - динамометрическим элементом производства компании Dynacell и испытательным программным обеспечением производства компании Bluehill Materials (система, динамометрический элемент и программное обеспечение производства Instron Corp., Canton, MA). Компрессионный пресс (Wyoming Test Fixtures, Inc., Laramie, Wyoming, серийный номер. WTF-SP-9), совместимый с ASTM D695, модифицировали таким образом, что округлый наконечник был удален, а нагрузочный стержень ввинчивался в привод испытательной рамы. Выполняли также тестирование для оценки количества нового костного материала, образующегося в каждом тестовом образце. Непосредственно перед проведением тестирования были определены длина и диаметр при половине длины каждого образца (+/- 0,01 мм).
Образцы подвергли испытаниям свободным ненаправленным давлением при 0.5 мм/мин до явного разрушения образцов при существенном падении кривой нагрузки или достижения разрушения 30% образцов. Предельное сопротивление на сжатие и модуль упругости образцов были вычислены с помощью полученных кривых нагрузки с использованием ПО. В девяти механических образцах, полученных от пяти дополнительных собак, были образованы

Диаграммы нагрузка/деформация были получены для каждого образца с использованием испытательного ПО Bluehill Materials, при этом предельные силы сжатия были определены в качестве усилия, при котором диаграммы нагрузка/деформация имели нулевой наклон. Предельное сопротивление на сжатие (МПа) и модуль эластичности, Е (МПа) образцов показаны ниже в Таблице 1. Включены образцы, в которых материал OSTEOSET® был использован в двух отдельных тестах и средние значения, полученные в каждом тесте (I и II). Значение нормальной кости включены для сравнения. Таблица 2 таким же образом показывает возникновения перелома в материале новой и остаточной кости спустя 13 и 26 недель. Данные средние значения были определены с помощью стандартной методики подсчета точек.
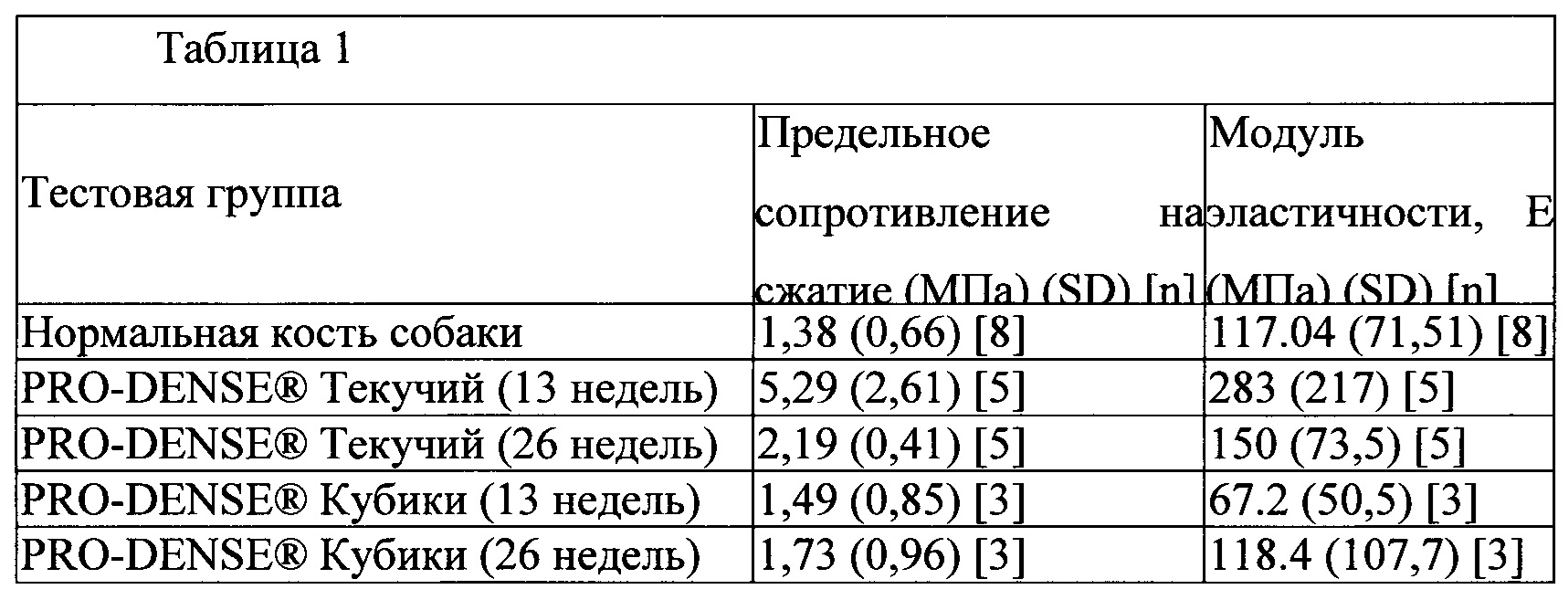


Как видно из приведенных выше данных, текучий материал PRO-DENSE® обладал воздействием на образование и минерализацию костей спустя 13 недель, превосходящим воздействие, видимое у нормальной кости (5.29 МПа против 1.38 МПа). Данное явление снижалось в точке после 26 недель, где средние значения сопротивления на сжатие и модуля эластичности более близко сопадали с этими же показателями нормальной кости. Данное явление ремоделирования с возвратом к плотности нормальной кости совпадает со значениями плотности в Таблице 2, где участок перелома кости в 13-недельных тестах текучего материала PRO-DENSE® был значительно выше, чем плотность нормальной кости, однако значения в отношении текучего материала PRO-DENSE® были более близкими к плотности нормальной кости спустя 26 недель. Данные открытия соответствовали высоким уровням радиоплотности, наблюдаемым на 13-недельных рентгеновских снимках образцов, подвергнутых лечению с использованием текучего материала PRO-DENSE®. Образцы, подвергнутые лечению материалом PRO-DENSE® в форме кубиков, не демонстрировали того же уровня образования костей, наблюдаемого у повреждений, подвергнутых лечению текучим материалом. Важно отметить, тем не менее, что материал в кубиках все же приводил к образование костей со свойствами, по сути, аналогичными и превосходящими свойства, наблюдаемые у образцов нормальной кости в точках, соответствующих 13 и 26 неделям.
Средние значения механических свойств повреждений, подвергнутых лечению кубиками OSTEOSET®, были ниже, чем те же значения нормальной кости; тем не менее, данные различия не были определены как статистически значимые. Следует также отметить, что относительно высокая степень стандартных отклонений, как следует из приведенного выше, является очень частой при проведении данного вида механического тестирования.
ПРИМЕР 4
Формирование нового плотного костного материала в образованной

Для оценки формирования новой кости у пациента, страдающего остеопорозом подвергали лечению левую бедренную кость 80-летней женщины в соответствии с настоящим изобретением. В частности, была образована

Приведенная ниже таблица включает величины Т-балла и Z-балла левой бедренной кости до проведения процедуры Данная таблица далее включает те же значения правой бедренной кости (не подвергавшейся лечению) для использования в целях сравнения.

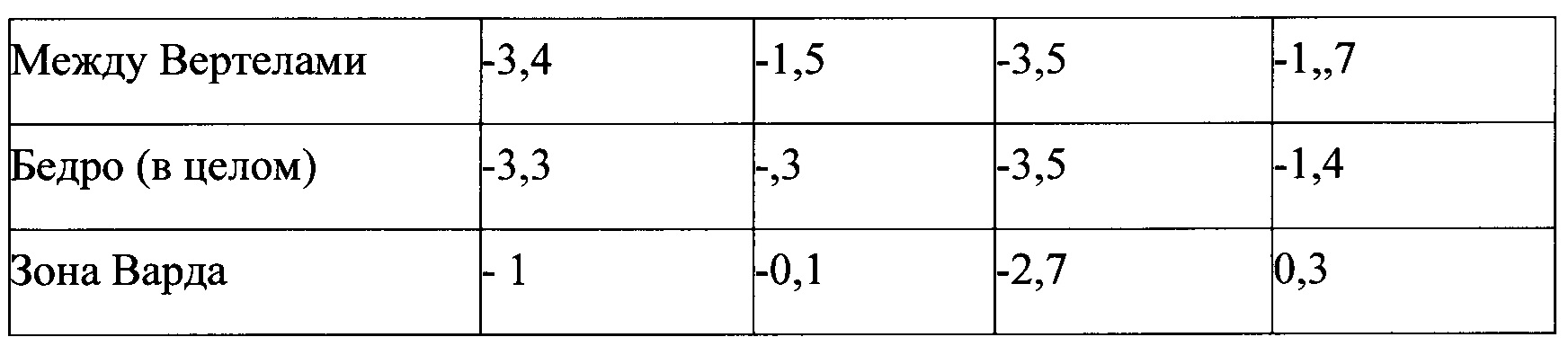
После проведения операции данного пациента оценивали с множественными интервалами времени для определения изменений плотности в локализованном участке кости, подвергнутой лечению в соответствии с данным изобретением, и изменений с течением времени по сравнению с контролем. В Таблице 4 ниже приведены тестовые значения спустя одну неделю после лечения. Как видно, подвергнутая лечению бедренная кость уже обнаруживает значительные улучшения в плотности, в то время как контрольная бедренная кость обладает характерными для остеопороза значениями, схожими со значениями до проведения лечения.

На Фиг. 26 приведен рентгеновский снимок подвергнутой лечению левой бедренной кости спустя 6 недель после лечения. Как видно, трансплантат начинает ресорбироваться организмом с одновременным ремоделированием кости в локализованном участке. В Таблице 5 приведены тестовые значения, полученные на основе DEXA, спустя 6 недель после лечения.

На Фиг. 27 приведено изображение подвергнутой лечению левой бедренной кости спустя 12 недель после лечения, полученное с помощью компьютерной томографии. Присутствие трансплантатного материала (массы светлого цвета) является подтверждением о говорит о дальнейшем осуществлении резорбции. В Таблице 6 приведены полученные с помощью DEXA значения спустя 12 недель после лечения, а в Таблице 7 приведены полученные с помощью DEXA значения спустя 18 недель после лечения.

ПРИМЕР 5
Увеличение BMD в локализованных участках остеопорозной кости после образования


На Фиг. 28 приведено изображение подвергнутой лечению левой бедренной кости спустя 24 недели после лечения, полученное с помощью компьютерной томографии. Присутствие трансплантационного материала (масса, окрашенная светлым цветом) значительно снижено с одновременным продолжением резорбции трансплантационного материала и замены плотным костным материалом. В Таблице 8 придены значения, полученные с помощью DEXA, спустя 24 недели после лечения, а в Таблице 9 приведены значения, полученные с помощью DEXA, спустя 12 месяцев после лечения.

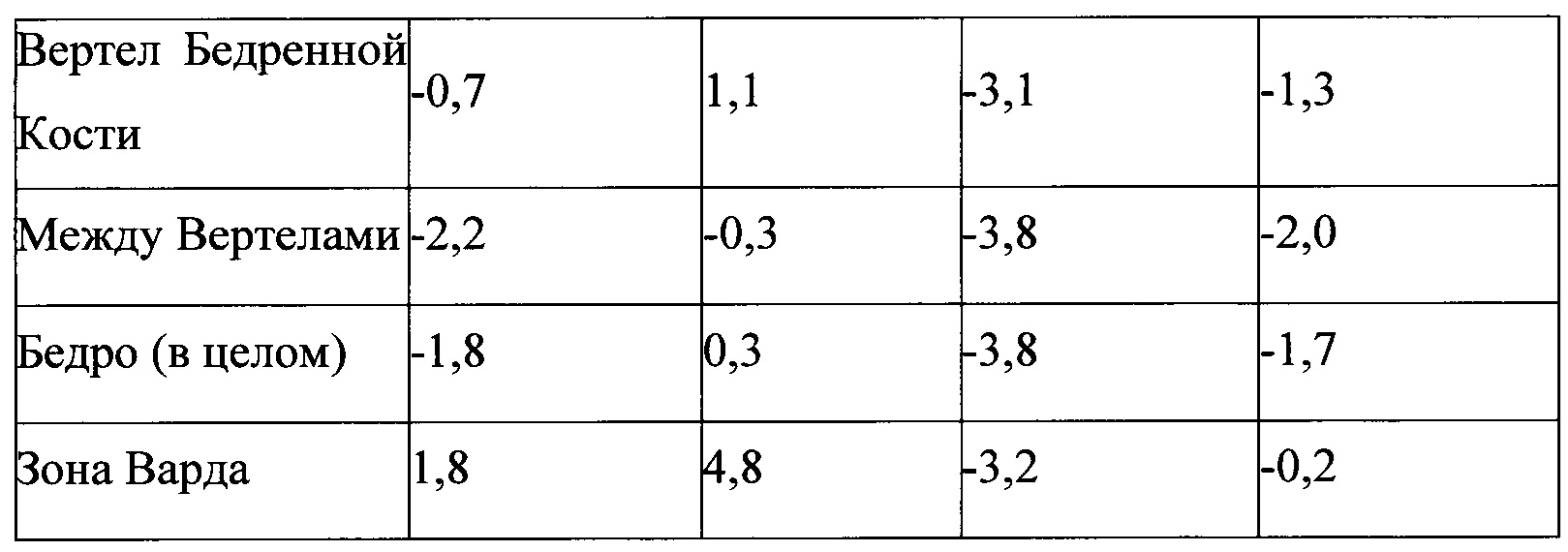

Испытание выполняли на 12 пациентах-людях, каждый из которых был признан страдающим остеопорозом согласно определению Всемирной Организации Здравоохранения (ВОЗ). У каждого пациента одна бедренная кость была подвергнута лечению в соответствии с настоящим изобретением, при этом противоположная сторона оставалась не подвергнутой лечению в целях сравнения.
Сначала для получения базовой линии измеряли BMD обоих бедер с помощью DEXA. Далее, в испытуемом участке одного бедра каждого пациента образовывали


В каждом последующем обследовании (а также при измерении базовой линии) фиксировали величины Т-балла шейки бедра и всего бедра каждого пациента, полученные с помощью DEXA. Как видно на Фиг. 29, величины Т-балла шейки бедра всех пациентов составляли менее -2 относительно базовой линии; тем не менее, каждый пациент демонстрировал значительное увеличение величины Т-балла на отметке, соответствующей одной неделе (в диапазоне от около 1 до почти 6). После данного первоначального увеличения Т-балл каждого пациента постепенно возвращался в нормальный диапазон, характерный для здоровой кости (по сравнению со средним человеком в возрасте 30 лет). В течение всего лишь 12 недель несколько пациентов обнаруживали снижение Т-балла, достигающего или находящегося чуть ниже нуля. Даже у пациентов, обследованных спустя 104 недели, Т-балл продолжал сохраняться на практически нормальном уровне (хотя и ниже нуля). Аналогичные тенденции были обнаружены относительно Т-баллов бедра в целом, как видно на Фиг. 30. Несмотря на то, что быстрое увеличение Т-балла не являлось таким же значительным, как в случае шейки бедра, первоначальное увеличение являлось приблизительно пропорциональным (то есть у каждого пациента наблюдалось увеличение от около 3 пунктов и более спустя одну неделю после прохождения процедуры). Т-баллы всего бедра так же снижались в течение времени исследования; тем не менее, итоговый балл каждого пациента отражает ремоделирование вплоть до значительно улучшенного состояния по сравнению с баллом базовой линии. Даже большие улучшения были обнаружены в зоне Варда бедер, подвергнутых лечению. Как видно на Фиг. 31, в течение одной недели Т-баллы большинства пациентов возрастали, достигая диапазона от 5 до 17. Методики данного изобретения в данном участке бедра прошедших лечение пациентов таким же образом приводили к ремоделированию кости вплоть до достижения нормального качества (то есть значений Т-балла более нуля у этих пациентов).
Эффективное, значительное увеличение качества костей в подвергнутом лечению участке после прохождения процедуры замещения в соответствии с данным изобретением далее приведено на Фиг. 32, иллюстрирующей среднее улучшение BMD шейки бедра у пациентов с различными интервалами времени. Наряду с Т-баллами (значения которых демонстрируют абсолютное изменение качества костей от остеопорозной до нормальной кости), сравнительные средение изменения, показанные на Фиг. 32 подтверждают, что процедуры данного изобретения обеспечивают ремоделирование базовой костной структуры участка, подвергающегося лечению, с помощью удаления кости с низкой BMD и обеспечения роста новой кости, обладающей значительно более высокой BMD. Как видно на Фиг. 32, в течение одной недели после прохождения процедуры данного изобретения BMD возросла по сравнению с контролем (являющимся средней BMD противоположного, не подвергнутого лечению бедра каждого пациента) приблизительно на 150%. Соответственно, в течение времени до около 24 недель связанное с этим увеличение BMD шейки бедра демонстрирует относительно быстрое ремоделирование в сторону BMD нормальной кости (BMD на 120% большего, чем контроль спустя 6 недель, на 96% большего, чем контроль спустя 12 недель и на 74% большего, чем контроль спустя 24 недели). Начиная от этой точки, BMD медленно снижалась более плавно. В оценке, проведенной спустя два года, два пациента, остававшиеся в данном исследовании, все еще демонстрировали среднее увеличение BMD шейки бедра на 35%) по сравнению с контролем.
Аналогичные результаты приведены на Фиг. 33, которая демонстрирует среднее улучшение BMD в целом среди группы пациентов с различными интервалами. Как видно здесь, в течение одной недели после прохождения процедуры данного изобретения BMD была увеличено по сравнению с контролем (являющимся средней BMD противоположного, не подвергнутого лечению бедра каждого пациента) приблизительно на 68%. Соответственно, в течение времени до около 24 недель связанное с этим увеличение BMD бедра в целом демонстрирует относительно быстрое ремоделирование в сторону BMD нормальной кости (BMD на 54% большего, чем контроль спустя 6 недель, на 45% большего, чем контроль спустя 12 недель и на 36% большего, чем контроль спустя 24 недели). Начиная от этой точки, BMD медленно снижалась более плавно. В оценке, проведенной спустя два года, два пациента, остававшиеся в данном исследовании, все еще демонстрировали среднее увеличение BMD бедра в целом на 18% по сравнению с контролем. В связи с данным увеличением BMD в течение периода проведения исследования, ожидается, что подвергнутый лечению участок кости будет обладать увеличенным сопротивлением на сжатие (как подтверждено в исследовании на собаках, описанном выше) и будет обладать большим сопротивлением к переломам в связи с увеличенной BMD и сопротивлением на сжатие. Значительных изменений в измерениях BMD не подвергнутых лечению сторон относительно базовой линии не наблюдалось (несмотря на то, что Фиг. 33 говорит о постепенном снижении BMD бедра в целом на не подвергнутых лечению сторонах после 20 недель).
Таким же образом, наблюдались даже большие результаты в отношении увеличения BMD зоны Варда, как показано на Фиг. 34. В течение одной недели после лечения в соответствии с данным изобретением средняя BMD возросла на 400%. Постепенно снижение наблюдалось с течением времени - на 355% большее BMD спустя 6 недель, на 295% большее BMD спустя 12 недель и на 220% большее BMD спустя 24 недели. Спустя от 52 недель после лечения до 104 недель после лечения BMD подвергнуты лечению бедер в зоне Варда была на от около 140% до около 200% большей, чем BMD контрольного бедра.
Многие модификации и другие варианты осуществления данного изобретения будут явными для специалиста в области, к которой принадлежит данное изобретение, на основе приведенного выше описания и связанных с ним фигур. Таким образом, должно являться очевидным, что данное изобретение не ограничивается описанным и что модификации и другие варианты осуществления данного изобретения включаются в область, охватываемую приложенной Формулой Изобретения. Несмотря на использование здесь определенных терминов, данные термины используются только в общем и описательном смыслах, но не в ограничивающих целях.
Реферат
Изобретение относится к медицине. Описан способ лечения пациента с дегенеративными костями. Способ включает образование пустоты в локализованном участке дегенеративной кости и заполнениематериалом для регенерации костей, что приводит к образованию нового здорового естественного костного материала. Способ пригоден для улучшения качества кости в локализованном участке дегенеративной кости, такой как остеопенической или остеопорозной кости, путем улучшения минеральной плотности костей (BMD) вплоть до достижения по сути аналогичной BMD среднего здорового человека в возрасте пика BMD. 9 з.п. ф-лы, 34 ил., 9 табл., 3 пр.
Формула


Комментарии