Способ восстановления никеля путем осаждения - RU2236475C2
Код документа: RU2236475C2
Описание
Настоящее изобретение относится к гидрометаллургическому процессу получения никеля, а именно к способу осаждения никеля из водного раствора никельсодержащего соединения в виде металлического порошка при использовании водорода. Водный раствор, содержащий соединение никеля, нейтрализуют сначала с помощью соединения щелочного или щелочно-земельного металла с тем, чтобы выделить никель из раствора в виде гидроокиси никеля или соли, полученной в щелочной реакции, после чего непрерывно проводят восстановление в присутствии катализатора в форме ионов в атмосферных условиях или близких к ним.
Предшествующий уровень техники
Согласно известному уровню техники, гидрометаллургический процесс получения никелевого порошка обычно осуществляют с помощью водородосодержащего газа. Наиболее часто используют способ, который заключается в восстановлении, проводимом из раствора сульфата аммония, в котором никель растворен в виде комплекса аммиаката. Подобные виды способов описали Шерит Гордон Майнес и Амакс. В этих способах к раствору сульфата никеля добавляют нейтрализующий реагент, аммиак, после чего в раствор вводят водород и осуществляют процесс восстановления.
Этот восстановительный процесс описывается следующим уравнением реакции:
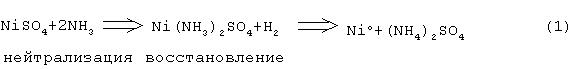
Вышеуказанный процесс восстановления представляет собой гетерогенную реакцию, для начала которой необходим катализатор. В качестве катализатора используют много веществ, но широкое применение находит сульфат железа FeSO4, который осаждает гидроксид железа Fe(OH)2 при добавлении сульфата железа к щелочному раствору. Предполагается, что гидрат окиси железа образует активные центры кристаллизации, на которых начинается восстановление никеля. Когда процесс восстановления развивается далее, сам никелевый порошок начинает действовать как катализатор, активизирующий восстановление, и реакция далее проходит автокаталитически.
Аммиак является хорошим нейтрализующим реагентом, потому что аммиак и сульфат аммония, который он образует, являются водорастворимыми веществами. Сульфат аммония может также быть извлечен путем испарения и кристаллизации и используется в качестве удобрения или подобного сырья. Однако это не всегда выгодно. Для этих случаев найдены другие нейтрализующие вещества, более дешевые, чем аммиак, и упоминание о них можно найти в соответствующей литературе. Одной из альтернатив, представляющей особый интерес, является конечно известь, которая представляет собой один из самых дешевых нейтрализующих реагентов и предполагает возможность извлечения сульфата из такого раствора в виде гипса. Свои преимущества имеет также окись магния.
В патенте GB 1231572 описан способ, согласно которому в качестве нейтрализующего реагента используют вещество, отличное от аммиака. Описанный способ не нашел применения в промышленном производстве, и причина этого несомненно заключается в необходимости использования особой технологии, определяемой сложными условиями осуществления способа. При осуществлении указанного способа происходят следующие реакции:
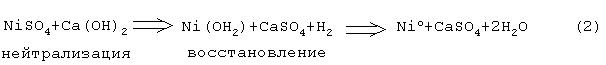
В публикации У. Кунда и др. в Трудах международной конференции по порошковой металлургии, Нью-Йорк, 1965 (редактор Х.Х. Хаузнер, Пергамон, 1966) на сс.15-49 отмечено, что при температуре 175°С и давлении водорода 350psi (приблизительно 25 бар) восстановление гидроксида никеля не происходит даже в присутствии катализатора. В публикации Р. Дэрри, Р.Дж. Виттемор, Международный Симпозиум по гидрометаллургии, 1973, Чикаго, на с.42 отмечено, что для таких условий осуществления восстановления затравочные кристаллы не являются необходимыми, а на с. 54 данной публикации отмечено, что при температуре 170°С было возможным только слабое восстановление из пульпы даже в том случае, если извести использовали меньше стехиометрического количества, но при температуре 200° С восстановление протекало быстро до тех пор, пока не было излишка извести. В описанных опытах парциальное давление водорода составляло 15-40 бар.
Раскрытие сущности изобретения
В предлагаемом согласно данному изобретению способе водные растворы никеля сначала обрабатываются известным способом так, чтобы соединение никеля, например сульфат никеля в водном растворе, нейтрализовалось соединением щелочного или щелочно-земельного металла с целью осаждения никеля. В результате образуется осадок никеля, которым является или гидроксид никеля или соли никеля (полученной по щелочной реакции), при этом согласно настоящему изобретению восстановление никеля из пульпы с указанным осадком возможно в условиях намного более легких, чем описанные выше, и даже при непрерывном проведении процесса. В вышеупомянутых публикациях утверждается, что пульпа с гидроксидом является автокаталитической, хотя для этого требуются высокие давления и температуры. Однако заявителем обнаружено, что применение внешнего катализатора позволяет проводить процесс восстановления в значительно более легких условиях, чем описанные выше, то есть при атмосферных условиях или близких к ним. Неожиданно было также обнаружено, что основным фактором является не только непосредственно сам катализатор, но и то, каким образом этот катализатор вводится при осуществлении процесса. Существенная особенность настоящего изобретения заключается в том, что на стадии восстановления никеля из пульпы катализатор находится в растворе по меньшей мере частично в ионной форме, а также в том, что катализатор предпочтительно вводится в осадок никеля в то же самое время, что и восстанавливающий реагент, по крайней мере, на ранних стадиях процесса восстановления. Существенные признаки данного изобретения будут очевидны из приложенной формулы изобретения.
Было обнаружено, что, например, двухвалентное железо в растворе (в ионной форме) является сильным катализатором процесса восстановления из пульпы, содержащей гидроксид никеля, причем до такой степени сильным, что восстановление протекает быстро при температурах даже менее 100°С и при атмосферном давлении. Проведенные опыты доказали, что восстановление начинается при низкой температуре порядка 60°С и является уже существенным при 80°С и давлении водорода 0.5 бар. Восстановление проводят предпочтительно при температуре 80-130°С и парциальном давлении водорода 0.5-6 бар. Естественно, что предлагаемый способ может быть осуществлен также и при более высоких температурах и парциальном давлении водорода, но в этом случае утрачиваются особые преимущества настоящего изобретения - возможность его проведения в атмосферных условиях или при небольшом избыточном давлении.
В качестве катализатора, кроме двухвалентного железа, можно также использовать по меньшей мере частично растворенный двухвалентный хром Сr2+. Предлагаемый в соответствии с данным изобретением способ, кроме того, легко приспособить для проведения непрерывного процесса, который может обеспечить значительно более низкие капиталовложения и себестоимость получения продукта.
При осуществлении способа согласно данному изобретению для выделения никеля в виде гидроокиси никеля или соли никеля (полученной по щелочной реакции) в раствор сульфата никеля добавляют нейтрализующий реагент, например СаО, Са(ОН)2, NaOH, MgO или другое подходящее соединение щелочного или щелочно-земельного металла, причем в количестве немного меньшем стехиометрического, а именно 70-98% от стехиометрического, предпочтительно же - 95-98%. В качестве катализатора в случае необходимости можно также использовать аммиак. Как отмечено выше, преимущество извести - его умеренная стоимость и возможность извлечения сульфата в виде гипса.
В пульпу с гидроксидом никеля добавляют небольшое количество FeSO4, находящегося в водном растворе, с тем, чтобы в растворе находилось по меньшей мере некоторое количество железа в виде ионов. Водород, действующий как восстанавливающий газ, добавляют непосредственно в раствор так, чтобы процесс восстановления начинался незамедлительно. Водородсодержащий газ добавляют до тех пор, пока не восстановится весь никель. Однако настоящее изобретение не ограничено указанным порядком и условиями проведения технологического процесса, поскольку могут быть использованы и другие процедуры при условии, что используемая процедура проведения процесса обеспечивает наличие ионов железа (или ионов хрома), действующих в растворе как катализатор при подаче в него водородосодержащего газа. Описанный выше способ осуществляется по приведенной выше реакции (2).
Важная роль катализатора в предлагаемом способе и метод, посредством которого контролируется его существование, а именно в виде ионов двухвалентного железа Fe2+, раскрыты далее с помощью следующих примеров.
Пример 1.
В раствор сульфата никеля, содержащий 30 г/л Ni, добавляли 34 г/л Са(ОН)2. Пульпа была непосредственно загружена в автоклав и нагрета до 120°С. Водород подавали под мешалки и в течение 2 часов поддерживали величину парциального давления водорода равную 5 бар. После этого полученный осадок, как было проверено и установлено, представлял собой зеленый гидроксид никеля, и, следовательно, восстановление не произошло.
Пример 2.
Были повторены те же операции, что и в предыдущем примере, за исключением того, что перед загрузкой пульпы в автоклав в нее добавили раствор, содержащий 0.5 г/л FeSO4. Первая проба была взята через 10 минут после начала процесса восстановления. Эта проба представляла собой совсем черный восстановленный никель. Следующая проба, взятая через 20 минут, была серого цвета. На этой стадии величина рН пульпы упала до 4.3 по сравнению с начальной величиной, равной 7.6. Полученные вышеприведенные результаты свидетельствовали о том, что в пробе не содержалось какого-либо количества гидроксида никеля и процесс восстановления завершился.
Пример 3.
Была повторена та же процедура, что и в примере 2, но в этом случае пульпу с введенным в нее катализатором (Fe) выдерживали в течение 2 часов. Первая проба была взята через 2 часа после начала процесса восстановления (т.е. после начала подачи водородосодержащего газа в пульпу). Исследование пробы показало, что процесс восстановления только что начался, но металлический никель от пробы отделить не смогли, поскольку последняя оказалась полностью не магнитной. Это свидетельствует о том, что по крайней мере в определенных условиях для реализации процесса восстановления одного присутствия железа недостаточно.
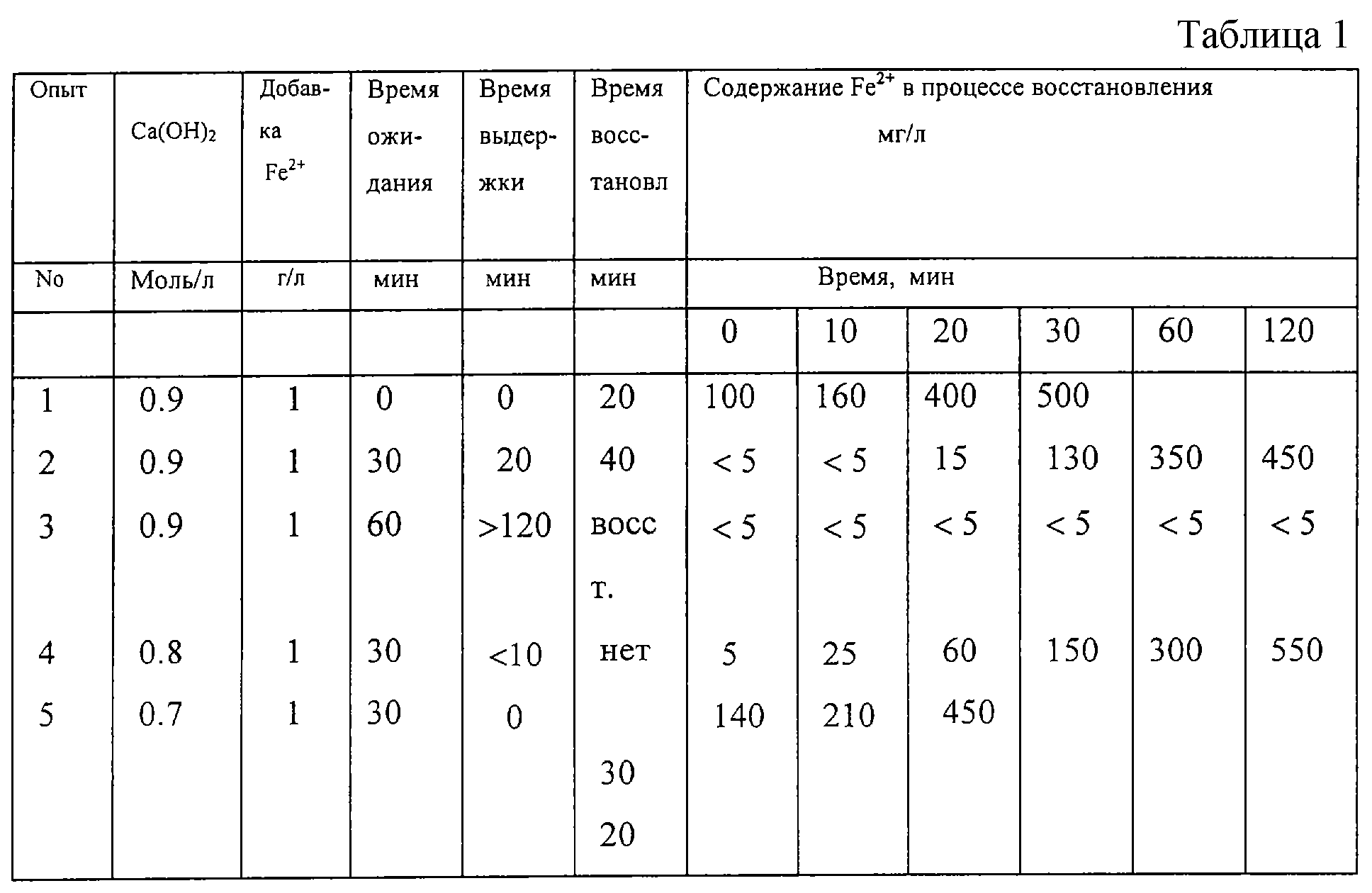
Пример 4.
Был проведен ряд опытов с целью установления влияния железа. Во всех этих опытах раствор никеля содержал 58.7% г/л никеля, т.е. 1 моль/л. В опытах изменяли содержание Са(ОН)2 и добавки железа, изменяли также способ добавления железа и время между его добавлением и началом процесса восстановления (подачей водорода). Результаты представлены в таблице 1, где под "временем ожидания" подразумевается интервал времени между добавлением железа и началом подачи водорода, а "время выдерживания" означает промежуток времени между началом подачи водорода и началом реакционных процессов в резервуаре.
Единственным значительным фактором, который, как представлялось, оказывал в этих опытах заметное влияние на восстановление никеля, было содержание ионов железа в растворе. Если содержание двухвалентного железа было менее чем 5 мг/л, восстановление не происходило, и это приводило к увеличению продолжительности времени выдержки, как видно по результатам опытов 2 и 3. Когда содержание Fe2+ превышало 5 мг/л, скорость начинавшегося процесса восстановления не так сильно зависела от концентрации ионов железа. Опыты 1-3 показали, кроме того, что железо может осаждаться до процесса восстановления при выдерживании пульпы и может также осаждаться по мере кристаллизации осадка никеля. Следовательно, после добавления катализатора важно начинать восстановительный процесс как можно быстрее.
Проведенные опыты также показали, что каталитически-восстановительное воздействие железа не является результатом действия твердой гидроокиси железа как кристалла затравки для образования частиц никеля, а, скорее всего, ключевую роль в восстановлении играют ионы железа в растворе. Кроме того, опыты показали, что, чем меньше содержание добавляемого нейтрализующего реагента, тем легче было удерживать железо в растворе и тем меньше была длительность технологического процесса. Это свидетельствует о том, что указанный процесс лучше проводить непрерывно. Если только часть нейтрализующего реагента добавлять в первый реактор, в который, кроме того, добавляют и катализатор, то вероятность осаждения катализатора будет меньшей. Остальную часть нейтрализующего реагента в этом случае можно было бы добавить в следующие последовательно установленные реакторы, где удерживание катализатора в растворе будет более легким.
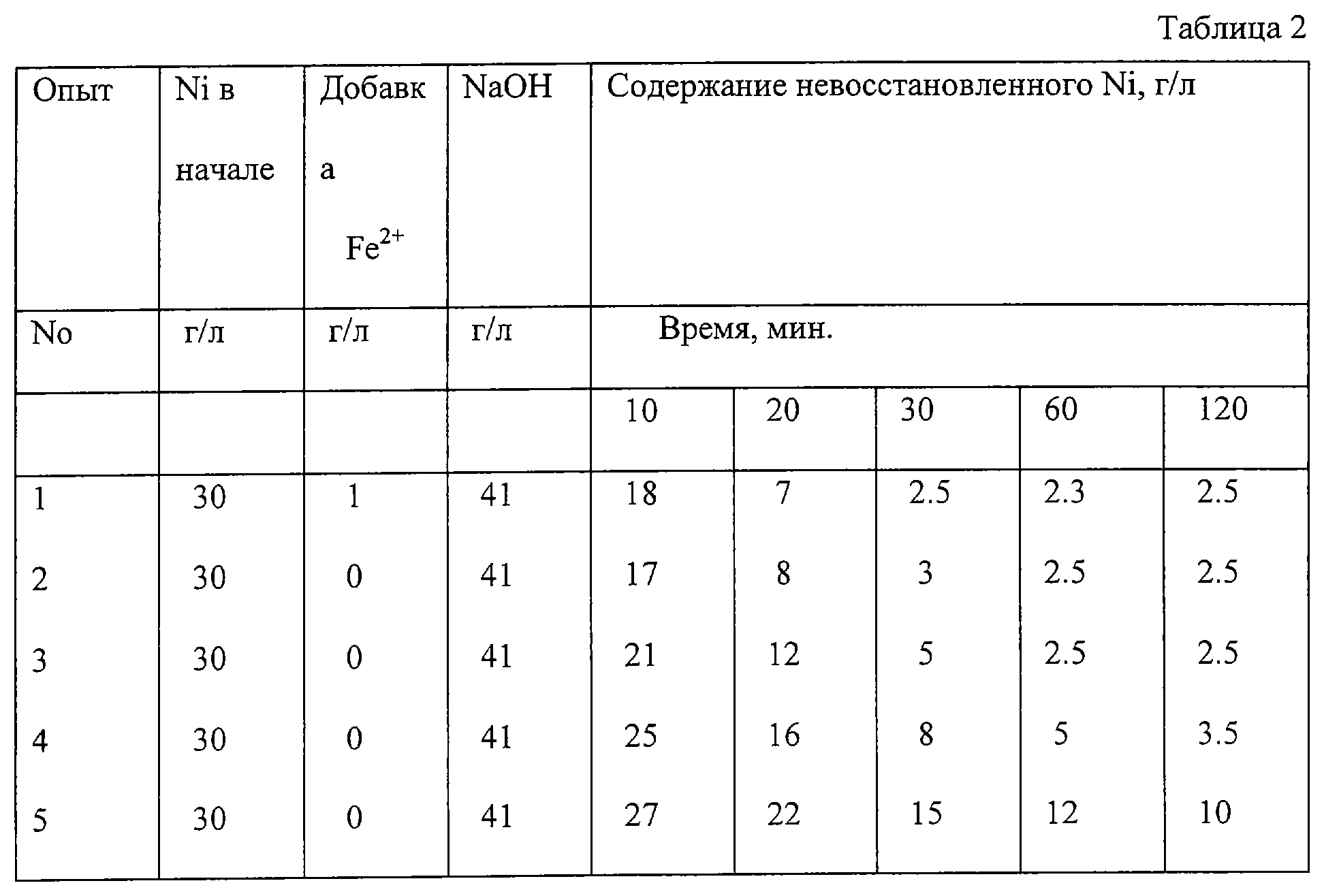
Пример 5.
Была проведена серия из пяти следовавших один за другим опытов. В качестве нейтрализующего реагента был использован NaOH при мольном отношении, равном 0.9 моля NaOH на моль никеля. В каждом из опытов полученный никель отделяли и брали для использования в следующем опыте. Катализатор (железо) добавляли только в первом опыте. Контролировали ход процесса восстановления путем добавления кислоты в пробу пульпы, пока величина рН не стабилизировалась на уровне 2.0 (при такой величине рН остаточная гидроокись никеля растворяется), и определяли содержание никеля в полученном таким образом растворе. По полученным данным можно было рассчитать содержание восстановленного никеля и исходное содержание никеля в опыте. Результаты проведенных опытов приведены в таблице 2.
Проведенная серия описанных выше опытов показала, что добавление железа в каждую загружаемую дозу не является необходимым, и показала также, что сам никелевый порошок через определенное время после осаждения действует в качестве центров кристаллизации.
Пример 6.
Проводилось непрерывное восстановление в автоклаве емкостью 50 л, разделенном на 6 секций. Пульпу, содержащую известковое молоко и раствор NiSO4, загружали в два перемешивающих реакционных аппарата емкостью 2 л, соединенных последовательно, для осаждения Ni(OH)2, после чего пульпа выливалась в резервуар для исходной реакционной смеси. Время нахождения в этом резервуаре составляло 5-15 мин в зависимости от скорости перекачивания пульпы.
Контролировали ход процесса восстановления путем титрования проб пульпы при рН, равном 2, и определяли содержание растворенного никеля. Количество восстановленного никеля было получено как разность между количеством никеля, поступающего в реактор с исходной смесью, и количеством восстановленного (?) никеля. Можно было отслеживать влияние времени нахождения пульпы в реакторе путем отбора проб из различных секций реактора. В качестве катализатора использовали сульфат железа FeSO4, который сначала добавляли в первый реактор перемешивания, но в этом случае, когда процесс восстановления начинался, содержание двухвалентного Fe2+ в автоклаве было ниже 5 мг/л, и восстановление не происходило. Когда раствор FeSO4 подавали непосредственно в первую секцию автоклава, процесс восстановления начинал проходить незамедлительно. Температура поддерживалась равной 85-120°С, а парциальное давление водорода - в интервале 1-5 бар. Результаты опытов представлены в таблице 3.
Содержание двухвалентного железа изменялось в различные периоды времени опытов от 30 до 500 мг/л. Когда были перерывы и подачу железа прекращали, процесс восстановления на короткое время также приостанавливался. Единственное очевидное влияние содержания железа, выявленное при анализе полученных данных, позволило заключить, что для восстановления предпочтительно должно быть по меньшей мере 5 мг/л железа. Содержание подаваемого Fe2+ составляло около 1% от содержания никеля за исключением периода времени 5, когда оно составляло 0.5%. Большую часть времени, включающую периоды 1, 2, 3, и 4, подача Ca(OH)2 составляла только 75% от теоретической, но в период времени 5 она составляла 95%. Эти результаты показали, что восстановление протекало затем с той же скоростью, что и при боле низкой степени нейтрализации, другими словами, степень восстановления была почти одинаковой при обеих указанных величинах подачи извести. Полученные результаты показывают также, что основное восстановление происходит в первой секции, т.е. за время нахождения в ней, составляющее примерно 10 мин.
Представленные в приведенных примерах результаты показывают, что настоящее изобретение может быть осуществлено различными путями, и в рамках данного описания представить все варианты выполнения, охватываемые объемом настоящего изобретения, невозможно.

Реферат
Изобретение относится к способу осаждения никеля из водного раствора никельсодержащего соединения в виде металлического порошка водородом. Водный раствор, содержащий соединение никеля, нейтрализуют сначала с помощью соединения щелочного или щелочно-земельного металла с тем, чтобы выделить никель из раствора в виде гидроокиси никеля или соли, полученной в щелочной реакции, после чего непрерывно проводят восстановление в присутствии катализатора в форме ионов в атмосферных условиях или близких к ним, предпочтительно в непрерывном процессе. 15 з.п. ф-лы, 3 табл.

Комментарии