Получение титановых сплавов посредством восстановления тетрахлорида титана - RU2734225C1
Код документа: RU2734225C1
Чертежи
Описание
Информация о приоритете
По данной заявке испрашивается приоритет от 21 октября 2016 по дате подачи предварительной патентной заявки США №62/411205, которая включена в данный документ посредством ссылки.
Область техники
Настоящее изобретение относится в общем к способам получения титановых сплавов посредством восстановления тетрахлорида титана (TiCl4) в реакционных средах на основе AlCl3. Более конкретно, титановые сплавы получают посредством восстановления Ti4+ в TiCl4 до более низкой валентности титана (например, Ti3+ и Ti2+), после чего следует реакция диспропорционирования Ti2+. Возможно также образование других легирующих элементов из соли в сплав в способе восстановления и/или диспропорционирования.
Уровень техники
Титановые сплавы, которые содержат алюминий, такие как сплавы на основе титана и алюминия (Ti-Al) и сплавы, основанные на интерметаллических соединениях титана и алюминия (Ti-Al), являются очень ценными материалами. Однако, их получение может быть трудным и дорогим, особенно в порошковой форме, и существуют определенные сплавы, недоступные с помощью традиционных способов плавки. Эта стоимость получения ограничивает широкое применение этих материалов, даже несмотря на то, что они обладают весьма желательными свойствами для применения в аэрокосмической, автомобильной и других промышленностях.
Известны реакторы и способы образования сплавов на основе титана и алюминия и интерметаллических соединений. Например, в WO 2007/109847 показывают ступенчатый способ получения сплавов на основе титана и алюминия и интерметаллических соединений посредством двухстадийного способа восстановления, основанного на восстановлении тетрахлорида титана алюминием. В WO 2009/129570 описан реактор, приспособленный для решения одной из проблем, связанных с реакторами и способами, описанными в WO 2007/109847, когда их используют при условиях, которые должны требоваться для образования сплавов на основе титана и алюминия с низким содержанием алюминия.
Однако, обсуждение химических процессов, которые в действительности происходят в способах, описанных в WO 2007/109847 и WO 2009/129570, не предоставляет полного понимания действительных реакций, происходящих при образовании металлического сплава из металлогалоидных предшественников.
С учетом этих исследований существует необходимость в лучшем понимании химических процессов для получения титаноалюминиевых сплавов посредством восстановления тетрахлорида титана TiCl4, а также в улучшенных технологиях обработки для таких реакций.
Приведенные выше ссылки на уровень техники не означают, что такой уровень техники образует часть общего знания специалиста.
Краткое описание изобретения
Аспекты и преимущества изобретения изложены частично в последующем описании, или они могут быть очевидны из описания, или их можно изучить посредством практического применения изобретения.
В общем, предоставляется способ получения титанового сплава, такого как титаноалюминиевый сплав. В одном из воплощений способ включает добавление TiCl4 к входящей смеси при температуре первой реакции, так что по меньшей мере часть Ti4+ в TiCl4 восстанавливается до Ti3+ с образованием продукта первой реакции. Входящая смесь может содержать алюминий и, возможно, AlCl3, и/или, возможно, один или более галогенид легирующего элемента. После того, как добавление TiCl4 останавливают, продукт первой реакции можно нагреть при условиях сушки для завершения восстановления Ti4+ или для удаления по существу всего любого остающегося TiCl4 с образованием первой промежуточной смеси, которая является раствором соли на основе AlCl3, который содержит Ti3+. Первую промежуточную смесь можно затем нагреть до температуры второй реакции, так что по меньшей мере часть Ti3+ восстанавливается до второй промежуточной смеси, которая является раствором соли на основе AlCl3, который содержит Ti2+. Вторую промежуточную смесь затем дополнительно нагревают до температуры третьей реакции, так что Ti2+ образует титановый сплав посредством реакции диспропорционирования.
В одном из воплощений способ получения титанового сплава может включать восстановление TiCl4 алюминием, AlCl3 и по меньшей мере одним хлоридом металла при температуре ниже 180°C с образованием первого промежуточного продукта, содержащего Ti3+, и восстановление первого промежуточного продукта при температуре ниже 900°C с образованием титаноалюминиевого сплава.
В одном из воплощений способ получения содержащего титан материала может включать смешивание частиц Al, частиц AlCl3 и, возможно, частиц по меньшей мере одного другого хлорида легирующего элемента с образованием входящей смеси, добавление TiCl4 к входящей смеси, восстановление Ti4+ в TiCl4 в присутствии входящей смеси при температуре первой реакции (например, ниже примерно 180°C) с образованием первой промежуточной смеси, содержащей Ti3+.
Эти и другие признаки, аспекты и преимущества настоящего изобретения станут лучше понятны со ссылкой на последующее описание и приложенную формулу изобретения. На сопутствующих чертежах, которые включены в это техническое описание и составляют его часть, показаны воплощения изобретения и, вместе с описанием, они служат для объяснения принципов изобретения.
Краткое описание чертежей
Полное и полезное описание настоящего изобретения, включая его наилучший способ, предназначенное специалисту, изложено в техническом описании, в котором ссылаются на приложенные чертежи, на которых:
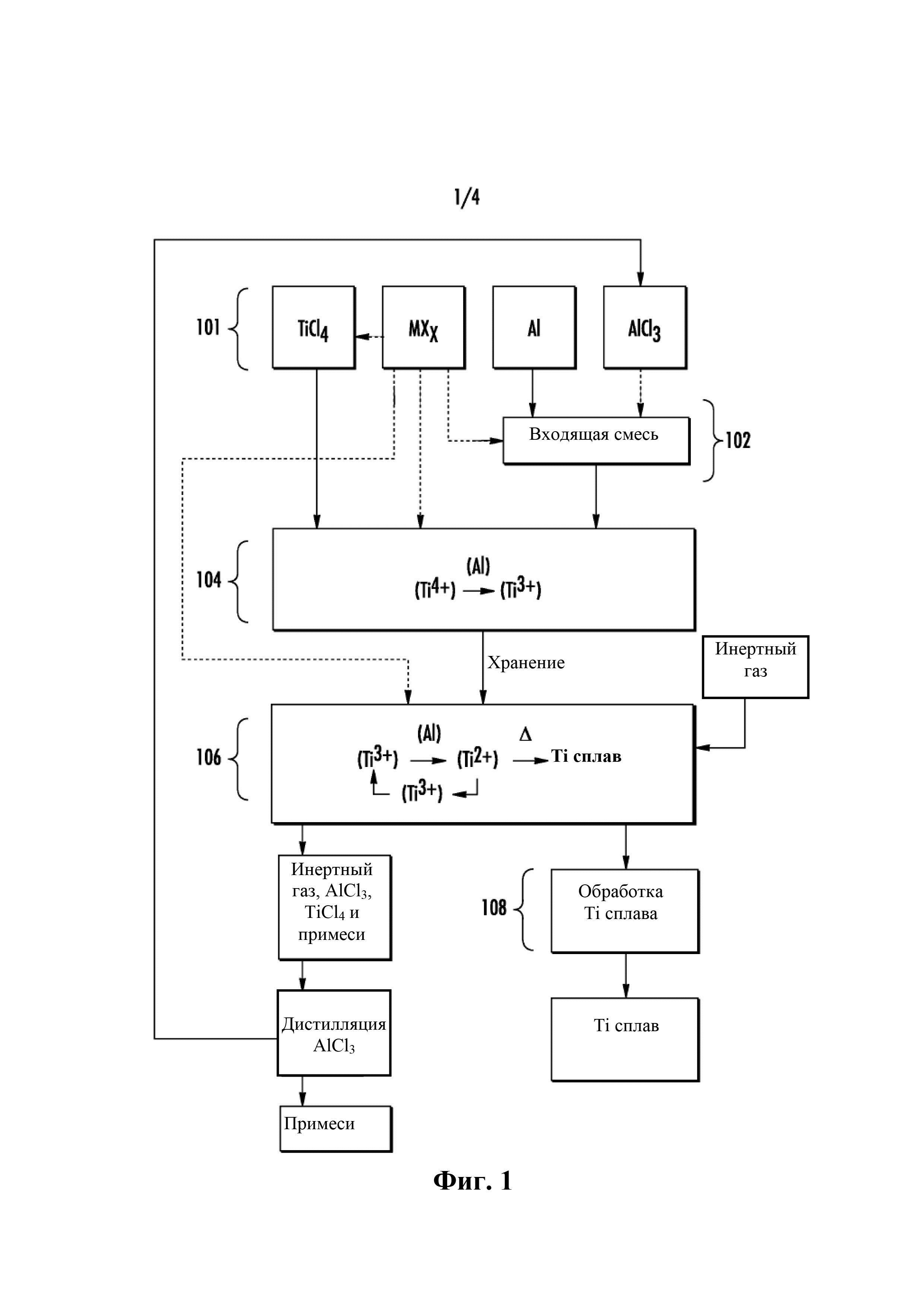
на Фиг. 1 показана диаграмма примерного способа согласно одному из воплощений настоящего изобретения,
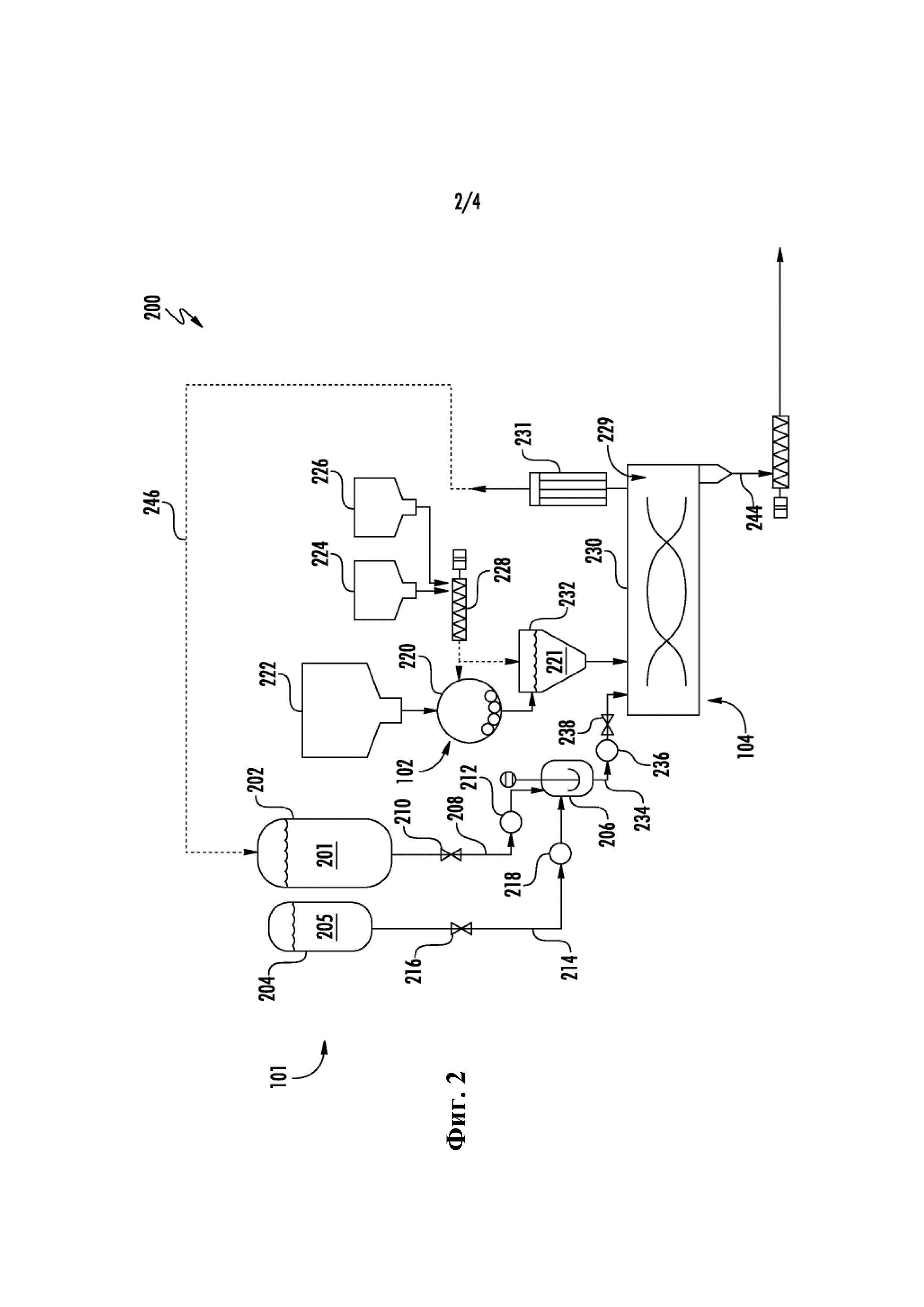
на Фиг. 2 показана схема одного примерного воплощения реакции стадии 1 примерного способа Фиг. 1,
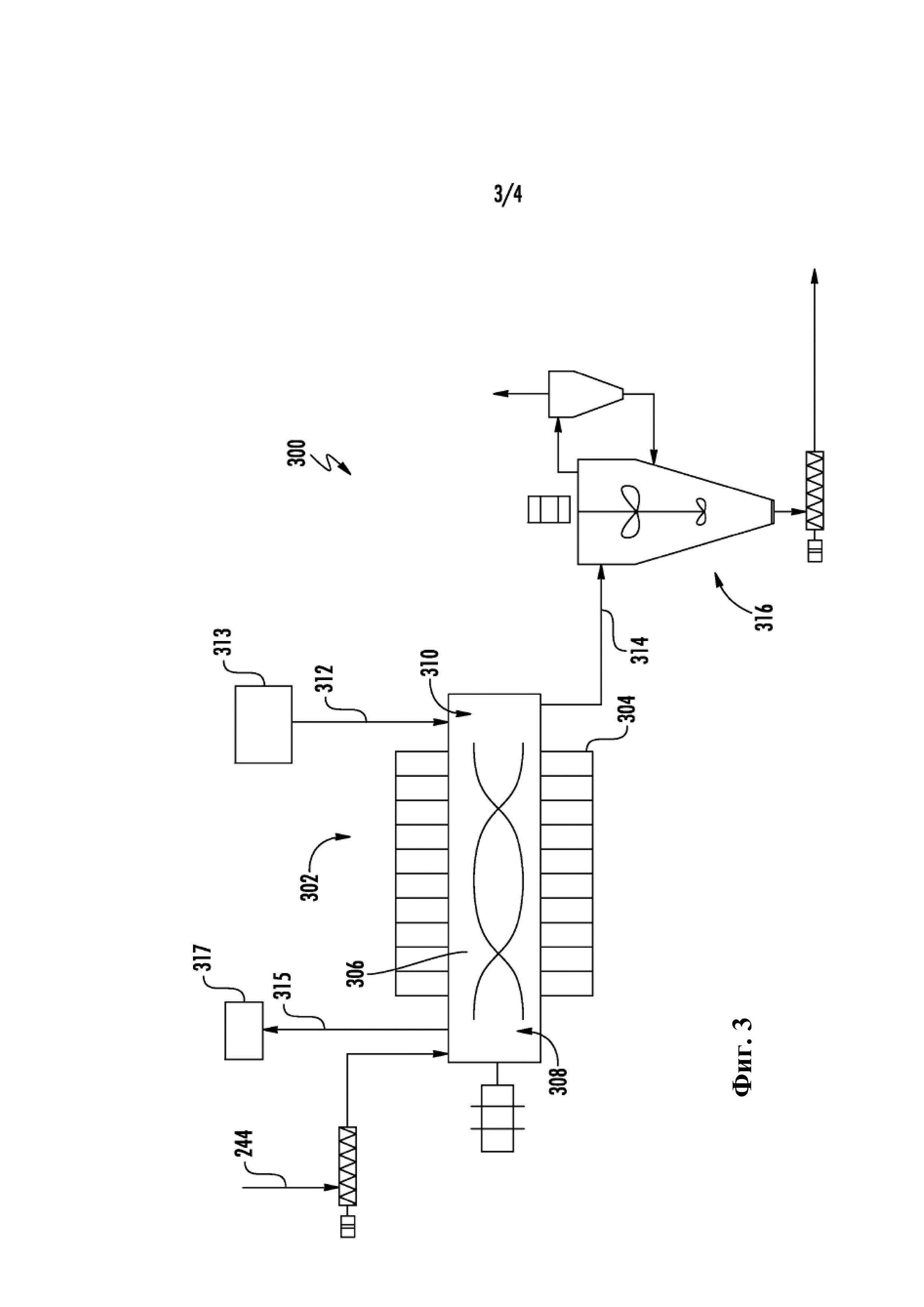
на Фиг. 3 показана схема одного примерного воплощения реакций стадии 2 примерного способа и дополнительной обработки получающегося титанового сплава примерно способа Фиг. 1, и
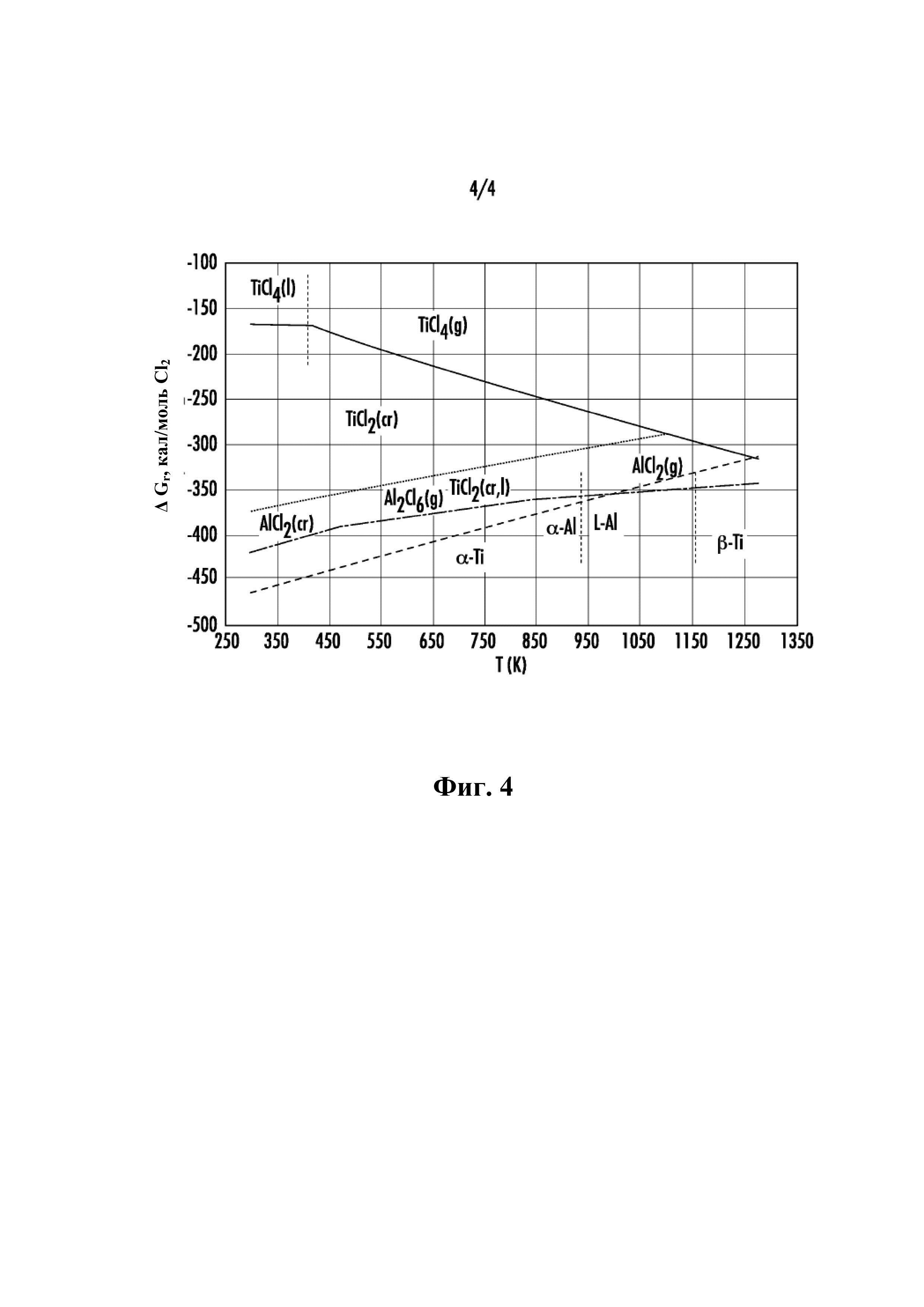
на Фиг. 4 показана диаграмма устойчивости равновесия (энергия Гиббса на моль Cl2 в зависимости от абсолютной температуры) для перекрывания систем Ti-Cl и Al-Cl для того, чтобы показать восстановительный потенциал металлического Al. Учитывают только чистые элементы (Ti, Al and Cl2) и чистые соединения солей (TiCl4, TiCl3, TiCl2 и AlCl3), потому что отсутствуют установленные термодинамические данные для фаз солевых растворов (TiCl4(AlCl3)x, TiCl3(AlCl3)x, TiCl2(AlCl3)x).
Повторное использование номеров позиций в данном техническом описании и на чертежах предназначено для представления одинаковых или аналогичных признаков или элементов настоящего изобретения.
Подробное описание изобретения
Теперь подробно разобраны воплощения изобретения, один или более примеров которых показаны на чертежах. Каждый пример предоставлен в целях объяснения изобретения, а не ограничения изобретения. Фактически, специалистам понятно, что в настоящем изобретении можно выполнить различные модификации и изменения, не отклоняясь от объема или сущности изобретения. Например, признаки, показанные или описанные как часть одного воплощения можно использовать с другим воплощением с получением еще одного дополнительного воплощения. Таким образом, это подразумевает, что настоящее изобретение покрывает такие модификации и изменения, которые попадают в область защиты приложенной формулы изобретения и ее эквивалентов.
Используемые в данном документе термины «первый», «второй» и «третий» можно использовать взаимозаменяемо для того, чтобы отличать один компонент от другого, и они не предназначены для обозначения положения или важности отдельных компонентов.
Химические элементы обсуждают в настоящем изобретении, используя их обычные химические сокращенные обозначения, такие как обычно можно найти в Периодической таблице элементов. Например, водород представлен своим обычным химическим сокращенным обозначением Н, гелий представлен своим обычным химическим сокращенным обозначением Не и т.д.
Используемый в данном документе термин «титановый сплава» или подобный термин необходимо понимать как охватывающий любой сплав на основе титана или любой сплав на основе титанового интерметаллического соединения и, возможно, других дополнительных легирующих элементов, помимо Ti и Al. Аналогично, термин «сплав титана и алюминия» или подобный термин необходимо понимать как охватывающий сплав на основе титана и алюминия или сплав на основе интерметаллических соединений титана и алюминия и, возможно, других дополнительных легирующих элементов, помимо Ti и Al.
Используемый в данном документе термин «хлориды алюминия» необходимо понимать как относящийся к соединениям хлоридов алюминия или смеси таких соединений хлоридов алюминия, включая AlCl3 (твердый, жидкий или в паровой фазе) или любым другим соединениям или ионным соединениям Al - Cl (например, AlCl, AlCl2, (AlCl4)-, Al2Cl6 and (Al2Cl7)-). Использование AlClx относится к термину «хлориды алюминия», и его необходимо понимать как выражение, относящееся к таким соединениям хлоридов алюминия или смеси таких соединений хлоридов алюминия, независимо от стехиометрического отношения.
Используемый в данном документе термин «хлорид титана» необходимо понимать как относящийся к трихлориду титана (TiCl3) и/или дихлориду титана (TiCl2) или другим сочетаниям титана и хлора, но не к TiCl4, который в данном документе называют тетрахлоридом титана. В некоторых разделах технического описания может быть использован более общий термин «TiClx», который необходимо понимать как относящийся к соединениям хлорида титана и охватывающий тетрахлорид титана (TiCl4), трихлорид титана (TiCl3), дихлорид титана (TiCl2) и/или другие сочетаниям титана и хлора в твердой, жидкой или паровой формах. Так как также существуют различные фазы раствора и комплексы хлорида титана, в данном документе называют конкретную степень окисления иона Ti (например, Ti2+, Ti3+ и Ti4+) в общей фазе (то есть смеси солей), а не конкретные химические соединения.
Используемый в данном документе термин «галогенид легирующего элемента» относится к иону легирующего элемента, соединенного с галогенидом (например, хлоридом, фторидом, бромидом, иодидом или астатидом). Легирующий элемент может быть любым элементом, который должен быть включен в конечный титановый сплав, таким как металлы или другие элементы. «Галогенид легирующего элемента» можно представить как MXx, где М является ионом легирующего элемента и X является галогенидом (то есть ионом галогена), независимо от стехиометрического отношения (представленного как х). Например, хлорид легирующего элемента можно представить как MClx.
В общем, раскрыты способы получения титановых сплавов (например, титаноалюминиевых сплавов) посредством восстановления TiCl4, который содержит ион титана (Ti4+). Более конкретно, титановые сплавы образуют посредством восстановления Ti4+ в TiCl4 до более низкой валентности титана (например, Ti3+ и Ti2+), после чего следует реакция диспропорционирования Ti2+ с образованием титанового сплава. Следует отметить, что валентность титана (например, Ti4+, Ti3+ и/или Ti2+) может присутствовать в реакции и/или промежуточных материалах в виде комплекса с другими соединениями в смеси (например, хлором, другими элементами и/или другими соединениями, такими как хлороалюминаты, металлгалоалюминаты и т.п.) и необязательно может присутствовать в чистой форме TiCl4, TiCl3 и TiCl2, соответственно. Например, металлогалоидные алюминаты могут быть образованы в виде комплекса MXx с AlCl3 в этих промежуточных соединениях, таких как описаны ниже. В общем, AlCl3 обеспечивает реакционные среды, представляющие собой реакционноспособные соединения (например, Ti4+, Ti3+, Ti2+, Al, Al+, Al2+, Al3+, также другие ионы легирующих элементов) для всех реакций. Не желая связывать себя какой-либо конкретной теорией, авторы полагают, что присутствие солевых растворов на стадии 1 и стадии 2 реакций обеспечивает восстановление Ti4+ до Ti3+ и восстановление Ti3+ до Ti2+, происходящее в конденсированном состоянии (например, твердом и жидком), например, при температуре примерно 700°C или менее (например, примерно 300°C или менее).
На Фиг. 1 показана общая блок-схема одного примерного способа 100, в котором восстанавливают TiCl4 до титанового сплава. Способ 100 в общем показан в последовательных стадиях: предшественники 101 реакции (включая образование входящей смеси 102), реакция 104 стадии 1, реакции 106 стадии 2 и последующая обработка 108.
1. Предшественники реакции
Предшественники реакции для реакции 104 стадии 1 в способе 100 Фиг. 1 включают, как минимум, TiCl4 и входящую смесь, которая содержит алюминий (Al), либо сам по себе, либо с дополнительными хлоридными компонентами. В одном из воплощений предшественники реакции включают входящую смесь в виде твердого материала при условиях окружающей среды (например, примерно 25°C и 100 кПа (1 атм.)) и TiCl4 в жидкой форме. На различных стадиях способа 100 в предшественники реакции можно включить дополнительные материалы (например, AlCl3 и/или другие галогениды легирующих элементов), такие как включены во входящую смесь, с TiCl4, и/или в виде отдельной загрузки, входящей в реакции стадии 1 и/или стадии 2. То есть, один или более хлорид легирующего элемента можно при необходимости ввести в материалы реакции стадии 1 (например, во входящую смесь, если они твердые, в TiCl4, если они жидкие или растворимые твердые материалы, и/или непосредственно независимо в сосуд реакции стадии 1), растворенные в другом компоненте входящих материалов, и/или их можно при необходимости ввести в материалы реакции стадии 2. В некоторых воплощениях, в особенности, когда галогенид легирующего элемента добавляют в жидкий TiCl4 (например, растворимый в нем), жидкий TiCl4 можно фильтровать, чтобы удалить любые частицы в жидком потоке. Такой фильтр может, в конкретных воплощениях, очищать жидкий поток путем удаления кислородных соединений из жидкости, так как растворимость кислорода и окисленные вещества чрезвычайно малы. Собственно, фильтрация жидкого TiCl4 (с растворенным или без растворенного в нем любого галогенида легирующего элемента) может настроить химический состав жидкости и удалить из него кислородные вещества.
Например, предшественники реакции могут включать некоторые или все элементы сплава для достижения требуемого химического состава титанового сплава. В одном из воплощений галогенид легирующего элемента (MXx) может быть хлоридом легирующего элемента (MClx). Особенно подходящие легирующие элементы (М) включают, но не ограничены перечисленным, ванадий, хром, ниобий, железо, иттрий, бор, марганец, молибден, олово, цирконий, кремний, углерод, никель, медь, вольфрам, бериллий, цинк, германий, литий, магний, скандий, свинец, галлий, эрбий, церий, тантал, осмий, рений, сурьму, уран, иридий и их сочетания.
Как показано на Фиг. 1 номером 102, входящую смесь образуют из алюминия (Al), возможно хлорида алюминия (например, AlCl3), и возможно одного или более хлорида легирующего элемента. Не желая связывать себя какой-либо конкретной теорией, авторы полагают, что AlCl3 полезен в качестве компонента входящей смеси, но он необязательно требуется, если присутствует хлорид легирующего элемента, который растворим в TiCl4 или смешивается с ним при условиях реакции стадии 1 с образованием in situ AlClx из хлорида легирующего элемента и алюминия. В одном из воплощений AlCl3 включен в качестве материала во входящую смесь. Однако, в другом воплощении входящая смесь может по существу не содержать AlCl3. Используемый здесь термин «по существу не содержит» означает присутствие не более чем незначительного следового количества и включает «полностью не содержит» (например, «по существу не содержит» может составлять от 0 атомн. % до 0,2 атомн. %). Если AlCl3 не присутствует во входящей смеси, тогда присутствуют Al и другие хлориды металлов, и их используют для образования AlCl3, так что реакция стадии 1 может продолжаться.
Если он находится в твердом состоянии при условиях окружающей среды, один или более хлоридов легирующих элементов (MClx) можно при необходимости включить во входящую смесь для образования входящей смеси. Особенно подходящие хлориды легирующего элемента в твердом состоянии, включаемые с алюминием и, возможно, AlCl3, включают, но не ограничены перечисленным, VCl3, CrCl2, CrCl3, NbCl5, FeCl2, FeCl3, YCl3, BCl3, MnCl2, MoCl3, MoCl5, SnCl2, ZrCl4, NiCl2, CuCl, CuCl2, WCl4, WCl6, BeCl2, ZnCl2, LiCl, MgCl2, ScCl3, PbCl2, Ga2Cl4, GaCl3, ErCl3, CeCl3 и их смеси. Один или более из этих хлоридов легирующих элементов также можно включить на других стадиях способа, включая, но не ограничиваясь перечисленным, тетрахлорид титана и/или после стадии 1.
В одном из воплощений входящая смесь находится в форме частиц (то есть, в порошковой форме). Например, входящую смесь образуют путем помола смеси алюминия (Al), возможно хлорида алюминия (например, AlCl3) и возможно одного или более галогенид легирующего элемента (например, хлорид легирующего элемента). Материал входящей смеси можно объединить в виде твердых материалов и смолоть вместе с образованием частиц, имеющих смешанный состав. В одном из воплощений смесь частиц алюминия, возможно частиц хлорида алюминия, и возможно частиц одного или более хлорид легирующего элемента смешивают и вместе изменяют их размеры (например, мелют) с образованием множества частиц входящей смеси. Например, частицы алюминия могут быть частицами алюминия, которые имеют сердцевину из чистого алюминия со слоем оксида алюминия, образованном на поверхности частиц. Альтернативно, частицы алюминия могут содержать алюминиевую сердцевину и по меньшей мере один другой легирующий элемент или лигатуру из алюминия и легирующего элемента. Частицы алюминия могут иметь подходящую морфологию, включая подобную хлопьям форму, по существу сферическую форму и т.п.
Так как в частицах алюминия в общем образуется слой оксида алюминия на поверхности частиц, процесс помола выполняют в атмосфере, которая по существу не содержит кислорода для подавления образования любых дополнительных оксидов алюминия во входящей смеси. Например, способ помола можно выполнять в инертной атмосфере, такой как аргоновая атмосфера при давлении от примерно 93,3 кПа до примерно 506,5 кПа (от примерно 700 Торр до примерно 3800 Торр). Не желая связывать себя какой-либо конкретной теорией, авторы полагают, что при реакции между AlCl3 и поверхностным Al2O3 в течение измельчения Al(тв) AlCl3 превращает Al2O3 в AlOCl (например, посредством Al2O3+AlCl3 → 3AlOCl). Поверхностный слой Al2O3 защищает лежащий под ним Al(тв), и в таком случае превращение этого поверхностного слоя Al2O3 в AlOCl в течение помола позволяет Al растворяться и диффундировать в соль в виде Al+ от Al2+. Не желая связывать себя какой-либо конкретной теорией, авторы полагают, что парциальное давление кислорода ниже требуемого для стабилизации Al2O3 (то есть, в инертной атмосфере) позволяет в этих реакциях превращать Al2O3, который в других случаях очень устойчив в кислороде. Собственно, получающиеся частицы являются «активированным» Al порошком.
Кроме того, уменьшение размера частиц позволяет увеличивать площадь поверхности для расширения доступности площади поверхности алюминия в последующих реакциях восстановления. Частицы могут иметь любую подходящую морфологию, включая подобную хлопьям форму, по существу сферическую форму и т.п. В конкретных воплощениях частицы входящей смеси имеют минимальный размер частиц в среднем от примерно 0,5 мкм до примерно 25 мкм (например, от примерно 1 мкм до примерно 20 мкм), который вычислен путем усреднения минимального размера частиц. Например, в одном из воплощений хлопьевидная частица может представлять собой плоскую частицу, имеющую размеры в плоскости х - у и толщину в z-направлении с минимальным размером в среднем от примерно 0,5 мкм до примерно 25 мкм (например, от примерно 1 мкм до примерно 20 мкм), при этом в х- и у-направлениях размеры имеют большие средние размеры. В одном из воплощений помол выполняют при температуре измельчения примерно 40°C или менее для подавления агломерации частиц Al.
Помол можно осуществить, используя способ высокой интенсивности или способ низкой интенсивности для получения частиц входящей смеси, например, используя способы помола в шаровой мельнице, способы дробления или другие способы уменьшения размера.
2. Реакция стадии 1 (восстановление Ti4+ до Ti3+)
Как указано, предшественники реакции включают, как минимум, TiCl4 в жидкой или паровой форме и входящую смесь в порошковой форме, которая содержит алюминий (Al) и может содержать дополнительные материалы (например, AlCl3 и/или другие хлориды легирующих элементов). TiCl4 может быть чистой жидкостью TiCl4 или жидкостью, смешанной с другими легирующими хлоридами. В некоторых воплощениях смеси TiCl4 и других легирующих хлоридов можно нагреть для того, чтобы обеспечить получение раствора ненасыщенным, что могло бы привести к осаждению компонентов из раствора. Пример смешанных жидких предшественников включает смесь TiCl4 и VCl4 для образования содержащего ванадий титанового сплава. Различные хлориды металлов (то есть, AlCl3, VCl4, VCl3, MClx, и т.п.) можно растворить в TiCl4(l), что можно представить как (TiCl4)x(AlCl3)у(MClx)z, где М является любым подходящим металлом, обсуждавшимся в данном документе, и х, у и z являются мольными долями конкретных компонентов солевого раствора. Такой солевой раствор можно в общем определить в краткой форме как [Ti4+:соль], где скобки [] представляют материал в виде фазы раствора, содержащей Ti4+ в качестве основного вещества растворителя, и «соли», представляющей все второстепенные соединения или легирующие элементы.
Эти предшественники реакции добавляют вместе для восстановления Ti4+ до Ti3+ в реакции 104 стадии 1. Для реакции стадии 1 предшественники реакции нагревают до температуры первой реакции, которая является достаточной высокой, чтобы вызвать химическое восстановление, но достаточно низкой для подавления образования жидкого TiCl4. Например, реакцию стадии 1 можно выполнять с предшественниками реакции, нагретыми до температуры первой реакции, которая составляет примерно 180°C или менее (например, от примерно 100°C до примерно 165°C, такой как от примерно 140°C до примерно 160°C). В одном из воплощений входящую смесь нагревают до температуры первой реакции до добавления TiCl4 во входящую смесь. Альтернативно или дополнительно, TiCl4 можно добавлять во входящую смесь одновременно с нагревом входящей смеси до температуры первой реакции.
Не желая связывать себя какой-либо конкретной теорией, авторы полагают, что алюминий (например, в форме металлического алюминия или соли алюминия, такой как AlCl3 и/или AlClx), присутствующий во входящей смеси, восстанавливает Ti4+ в TiCl4 до Ti3+ путем алюминотермического способа при температуре первой реакции, в котором AlCl3 служит в качестве реакционной среды в форме солевого раствора AlCl3. Кроме того, полагают, что Ti4+ и Al растворяются в AlCl3 и в TiCl3(AlCl3)x, образованном из продуктов реакции входящей смеси, так что Ti4+ и Al могут реагировать. Также полагают, что Al растворяется в соли в виде Al+ или Al2+ и эти соединения Al диффундируют в Ti4+ и реагируют с образованием нового продукта реакции TiCl3(AlCl3)x. Наконец, полагают, что Al(тв) растворяется в солевом растворе через поверхностный слой AlCl3 или AlOCl на Al(тв). Например, не желая связывать себя какой-либо конкретной теорией, авторы полагают, что Ti4+ в TiCl4 восстанавливается до Ti3+ в форме комплекса TiCl3, с хлоридом(ами) металла, такого как TiCl3(AlCl3)x с х больше 0, например от больше 0 до 10 (например, х от 1 до 5), который либо является непрерывным твердым раствором TiCl3 и AlCl3, либо двумя растворами богатого TiCl3 TiCl3(AlCl3)x и богатого AlCl3 AlCl3(TiCl3)x, где оба раствора имеют одинаковые кристаллические структуры. Таким образом, полагают, что по существу все образованные соединения Ti3+ находятся в форме таких комплексов хлорида металла, вместо чистого TiCl3.
Собственно, получающийся продукт реакции представляет собой солевой раствор на основе AlCl3, который содержит соединения Ti3+. Аналогично обсуждавшемуся выше [Ti4+:соль], различные хлориды металлов (то есть, AlCl3, VCl4, VCl3, MClx и т.п.) растворяются в TiCl3 (твердом или жидком), что можно представить с помощью (TiCl3)x(AlCl3)у(MClx)z, где М является любым подходящим металлом и х, у и z представляют мольные доли солевого раствора. TiCl3(AlCl3)x является разновидностью большей фазы раствора, даже если все хлориды легирующих элементов, MClx, растворяются в этой фазе раствора. Кроме того, Ti4+ также растворяются в этой фазе раствора, которую можно описать как богатую Cl сторону фазового поля. По мере того, как TiCl4 добавляют в реакционную смесь, в некотором месте может быть больше TiCl4/TiCl3 чем AlCl3, что делает соль богатой TiCl3. Такой солевой раствор можно в краткой форме определить как [Ti3+:соль], со скобками [], представляющими материал в виде фазы раствора, содержащей Ti3+ в качестве основного соединения раствора, и «соли» представляющей все второстепенные соединения или легирующие элементы.
Эту реакцию можно выполнять по мере того, как TiCl4 добавляют регулируемым образом во входящую смесь при температуре первой реакции. Например, TiCl4 можно добавлять непрерывно или полунепрерывно. В одном воплощении избыток Al включают в реакцию для обеспечения по существу полного восстановления Ti4+ до Ti3+ и для последующих восстановлений. Как таковой TiCl4 можно добавлять для получения требуемого отношения Ti/Al с получением требуемой солевой композиции.
В течение реакции входная смесь может оставаться по существу твердой при условиях первой реакции (например, температуре первой реакции и давлении первой реакции). В конкретных воплощениях реакцию стадии 1 выполняют в скребковом реакторе (plow reactor), ленточном смесителе или другом реакторе для жидкости/твердого вещества/пара. Например, реакцию восстановления Ti4+ можно выполнять в устройстве для дефлегмации потока в течение фазы реакции и/или для дистилляции после фазы реакции любого непрореагировавшего пара TiCl4 для продолжающегося восстановления и/или для предотвращения потери TiCl4(г) в течение реакции.
Реакцию стадии 1 можно выполнять в инертной атмосфере (например, содержащей аргон). Собственно, в течение реакции восстановления можно избежать поглощения кислорода (O2), водяного пара (H2O), азота (N2), оксидов углерода (например, СО, CO2 и т.п.) и/или углеводородов (например, СН4 и т.п.) алюминием и/или другими соединениями. В конкретных воплощениях инертная атмосфера имеет давление от 100 кПа (1 атм.) (например, примерно 760 Торр) до 500 кПа (5 атм.) (например, примерно 3800 Торр), например, от примерно 100 кПа (760 Торр) до примерно 200 кПа (1500 Торр). Хотя в некоторых воплощениях можно использовать давления менее примерно 100 кПа (760 Торр), это нежелательно в большинстве воплощений из-за возможного поступления кислорода, воды, оксида углерода и/или азота при таких низких давлениях. Например, инертная атмосфера имеет давление от 92 кПа (0,92 атм.) (например, примерно 700 Торр) до примерно 500 кПа (5 атм.) (например, примерно 3800 Торр), такое как от примерно 0,92 кПа до примерно 200 кПа (от примерно 700 Торр до примерно 1500 Торр).
После реакции стадии 1 восстановления Ti4+ до Ti3+ продукт первой реакции можно высушить при условиях сушки для удаления по существу всего любого остающегося непрореагировавшего TiCl4 (в силу кинетических ограничений) с образованием промежуточной смеси. Например, продукт первой реакции можно высушить путем нагрева и/или в вакуумных условиях. В одном из воплощений любой захваченный TiCl4 удаляют из продукта первой реакции путем нагрева до температуры, которая выше температуры кипения TiCl4 (например, примерно 136°C), но ниже температуры, при которой Ti3+ дополнительно восстанавливается (например, выше примерно 180°C), такой как температура сушки от примерно 160°C до примерно 180°C (например, от примерно 160°C до примерно 170°C).
Однако, следует отметить, что Al способен восстанавливать Ti4+ до Ti3+ и Ti3+ до Ti2+ при всех температурах, включая температуры ниже 20°C. Определенные выше температуры обусловлены кинетическими ограничениями и/или переносом в твердом состоянии в продуктах реакции. Также, не желая связывать себя какой-либо конкретной теорией, авторы полагают, что восстановление Ti3+ до Ti2+ не может происходить, когда Ti4+ присутствует в продуктах реакции стадии 1 из-за правила фаз Гиббса и фазовых равновесий системы Ti-Al-Cl-O. То есть, окисление Al может приводить в действие обе стадии реакции при одинаковой температуре, однако аспект последовательности этих реакций обусловлен настоящим убеждением, что Ti4+ до Ti2+ не могут существовать одновременно в одинаковом положении изолированной системы. Таким образом, реакции выполняют последовательно, так что по существу весь Ti4+ восстанавливается до Ti3+ до образования Ti2+ в системе. Таким образом, способ восстановления выполняют с помощью описанных в настоящий момент способов последовательным образом.
После сушки первой реакционной смеси и перед нагревом промежуточной смеси до температуры второй реакции для реакции стадии 2, описанной ниже, промежуточную смесь, содержащую [Ti3+:соль] можно хранить, например, в инертной атмосфере до дополнительной реакции. В одном из воплощений промежуточную смесь, содержащую комплексы Ti3+, можно охладить для хранения до температуры ниже примерно 100°C, такой как ниже примерно 50°C или ниже примерно 25°C.
Что касается Фиг. 2, она представляет собой технологическую схему 200 одного примерного воплощения предшественников 101 реакции (включая образование входящей смеси 102) и реакции 104 стадии 1 примерного способа 100 Фиг. 1. В показанном воплощении первый бак 202 для хранения жидкости и возможный второй бак 204 для хранения жидкости находится в гидравлическом соединении со смесителем 206 жидкости, так чтобы подавать жидкие предшественники реакции в него через подающий трубопровод 208. В общем, первый бак 202 для хранения жидкости содержит жидкость 201 TiCl4 в виде чистого жидкого TiCl4 или жидкости, смешанной с другими хлоридами легирующих элементов. Клапан 210 и насос 212 регулируют поток жидкости 201 из бака 202 для хранения жидкости в смеситель 206 жидкости. Аналогично, второй бак 204 для хранения жидкости находится в гидравлическом соединении со смесителем 206 жидкости, так чтобы подавать жидкие предшественники реакции в него через подающий трубопровод 214. Второй бак 204 для хранения жидкости содержит в одном воплощении жидкость 205 по меньшей мере одного хлорида легирующего элемента. Клапан 216 и насос 218 регулируют поток жидкости 205 из бака 204 для хранения жидкости в смеситель 206 жидкости.
Также, как показано на Фиг. 2, твердые предшественники реакции подают в шаровую мельницу 220 из устройства 222 хранения Al, возможного устройства 224 хранения хлорида алюминия (например, AlCl3) и, возможно, устройства 226 хранения одного или более хлорида легирующего элемента. Хотя устройство показано как шаровая мельница 220, любое подходящее устройство уменьшения размеров (например, измельчающее устройство) можно использовать согласно тому способу. Как показано, устройство 224 хранения хлорида алюминия и устройство 226 хранения одного или более хлорида легирующего элемента поставляют через возможный смеситель 228 в мельницу 220. Из мельницы 220 входящую смесь 221 предоставляют в устройство 230 реакции стадии 1 через загрузочный бункер 232. Кроме того, смешанную жидкость из смесителя 206 жидкости добавляют в устройство 230 реакции стадии 1 регулируемым образом через подающую трубу 234 с потоком смешанной жидкости, регулируемым насосом 236 и клапаном 238. В некоторых случаях, устройство 224 хранения хлорида алюминия и устройство 226 хранения одного или более хлорида легирующего элемента могут поставлять через возможный смеситель 228 непосредственно в загрузочный бункер 232.
В устройстве 230 реакции стадии 1 Ti4+ восстанавливается до Ti3+ при описанных выше условиях с образованием продукта первой реакции. Продукт первой реакции можно высушить в конце устройства 230 реакции стадии 1, например, в зоне 229 сушки, обладающей условиями сушки, такими как обсуждалось выше, для удаления по существу всего любого остающегося TiCl4 посредством конденсатора 231 с образованием промежуточной смеси (содержащей Ti3+, например, в форме комплекса TiCl3 с хлоридом(ами) металла(ов), такого как TiCl3(AlCl3)x), поставляемой в трубопровод 244 продуктов для дополнительного восстановления титана. Как показано, любой остающийся TiCl4 или жидкую смесь можно испарить и, при необходимости, рециркулировать (например, посредством способа дистилляции, не показан) в трубопровод 246 контура рециркуляции. В альтернативных воплощениях устройство уменьшения размеров можно объединить с устройством 230 реакции стадии 1. В одном воплощении условия устройства 230 реакции стадии 1 в течение реакции удерживают жидкость в реакторе или конденсируют пар для возвращения в реактор стадии 1. Затем, в течение сушки конденсатор нагревают до температуры выше температуры кипения жидкой смеси для того, чтобы обеспечить сушку.
Промежуточную смесь (содержащую Ti3+, например, в форме комплекса TiCl3 с другими материалами) можно хранить после сушки перед дальнейшими способами восстановления. В одном из воплощений промежуточную смесь хранят в инертной атмосфере для подавления образования и препятствования образованию любых оксидов алюминия, других оксидных комплексов или оксихлоридных комплексов в промежуточной смеси.
3. Реакции стадии 2 (Ti3+ до Ti2+ и Ti2+ до Ti сплава)
В реакциях 106 стадии 2 в способе 100 Ti3+ и любые галогениды легирующих элементов MXx промежуточной смеси восстанавливают до Ti2+ и М субгалоидов путем нагрева до температуры второй реакции и реакции с Al, присутствующим в виде твердого Al или в виде соединений Al, растворенных в комплексе, и затем Ti2+ восстанавливают до Ti сплава посредством эндотермической реакции при температуре третьей реакции, которая больше температуры второй реакции. Металлические субгалоиды также восстанавливают посредством восстановления Al с образованием основного легирующего металла М при температурах в интервале стадии 2 способа. В одном воплощении эти реакции можно выполнять последовательно при различных температурах на одной стадии реакции или в виде отдельных стадий в виде двухстадийного или более способа (например, на стадиях по мере повышения температуры).
Не желая связывать себя какой-либо конкретной теорией, авторы полагают, что алюминий (например, в форме металлического алюминия или соли алюминия, такой как AlCl3 и/или AlClx), присутствующий в промежуточной смеси, восстанавливает Ti3+ в комплексы TiCl3 с хлоридом(ами) металла(ов), такие как TiCl3(AlCl3)х, до Ti2+ при температуре второй реакции. Например, не желая связывать себя какой-либо конкретной теорией, авторы полагают, что при реакции может образовываться Ti2+ в TiCl2, образующем комплекс с хлоридом(ами) металла(ов), с образованием солевых растворов на основе комплексов титана и хлорида алюминия, таких как TiAlCl5, Ti(AlCl4)2 или их смеси с возможными дополнительными легирующими элементами или галогенидами или хлороалюминатами.
Не желая связывать себя какой-либо конкретной теорией, авторы полагают, что существуют три возможные формы TiCl2: (1) по существу чистый TiCl2, который растворяет только небольшое количество любого материала, (2) TiAlCl5(тв), который также не растворяет большое количество других материалов и возможно стабилен только до примерно 200°C, и (3) {Ti(AlCl4)2}n, который вероятно является неорганическим полимерным материалом, существующим в виде жидкости или газа, стеклообразным материалом и мелким порошком (длинноцепочечные молекулы). То есть, {Ti(AlCl4)2}n имеет большой композиционный интервал (например, n может составлять от 2 до примерно 500, например, от 2 до примерно 100, например, от 2 до примерно 50, например, от 2 до примерно 10) и растворяет все хлориды легирующих элементов. В одном конкретном воплощении газообразный {Ti(AlCl4)2}n способствует удалению непрореагировавшей соли из частиц титанового сплава (например, при низкой температуре на последней стадии реакции). В результате продукт реакции, содержащий Ti2+, является фазой на основе комплекса TiCl2 и AlCl3 (например, Ti(AlCl4)2 и т.п.). Такой комплекс может быть солевым раствором, кратко определенным как [Ti2+:соль], со скобками [], представляющими материал в виде фазы раствора, содержащей AlCl3 в качестве основного соединения растворителя, Ti2+ и «соли», представляющей все второстепенные соединения или легирующие элементы.
Восстановление Ti3+ до Ti2+ можно выполнять при температуре второй реакции от примерно 180°C или выше (например, от примерно 180°C до примерно 900°C, такой как от примерно 180°C до примерно 500°C или от примерно 180°C до примерно 300°C). Не желая связывать себя какой-либо конкретной теорией, авторы полагают, что по меньшей мере часть Ti2+ находится в форме комплекса TiCl2 с хлоридом(ами) металла(ов).
Не желая связывать себя какой-либо конкретной теорией, авторы полагают, что в этом способе AlCl3 химически связан в TiCl3(AlCl3)х, TiAlCl5 и {Ti(AlCl4)2}n. В силу его значительной химической активности (например, <1), AlCl3 не испаряется, как можно было ожидать для чистого AlCl3, и не существует никакого значительного испарения AlCl3 до тех пор, пока температуры реакции не достигнут или превысят примерно 600°C. Таким образом, AlCl3 предоставляет среду реактора для обеспечения протекания реакции и AlCl3 предоставляет химическую среду, которая стабилизирует ион Ti2+ и обеспечивает превращение Ti3+ в Ti2+ при температурах реакции менее примерно 250°C (например, от примерно 180°C до примерно 250°C).
После того, как Ti3+ в комплекса TiCl3 с хлоридом(ами) металла(ов) (например, в форме TiCl3-(AlCl3)x и/или TiAlCl6 (г)), восстанавливается до Ti2+ (например, в форме комплекса TiCl2 с хлоридом(ами) металла(ов)), Ti2+ можно превратить в Ti сплав посредством реакции диспропорционирования. В одном воплощении TiAlCl6 (г) может присутствовать для способствования удалению побочных продуктов Ti3+ из образования Ti сплава и/или рециркулирования Ti3+ в реакционной камере. Например, Ti2+ можно превратить Ti сплав посредством реакции диспропорционирования при температуре третьей реакции 250°C или выше (например, от примерно 250°C до примерно 1000°C, такой как от примерно 500°C до примерно 1000°C). Хотя в некоторых воплощениях температура третьей реакции может достигать примерно 1000°C, в других воплощениях температура третьей реакции имеет верхний предел температуры примерно 900°C. Например, Ti2+ можно восстановить до Ti сплава посредством реакции диспропорционирования при температуре третьей реакции от примерно 300°C до примерно 900°C (например, от примерно 300°C до примерно 900°C, такой как от примерно 500°C до примерно 900°C). Не желая связывать себя какой-либо конкретной теорией, авторы полагают, что сохранение третьей температуры реакции ниже примерно 900°C обеспечивает, что любые кислородные загрязнения, присутствующие в реакционной камере остаются стабильно летучими веществами, которые могут улетучиваться, так чтобы ограничивать кислород в получающемся продукте титанового сплава. С другой стороны, при температуре реакции выше 900°C кислородные загрязнения более не находятся в форме летучих соединений, делая более трудным уменьшение остаточного кислорода. Любые другие летучие вещества, такие как оксихлориды, хлориды и/или содержащие углерод оксиды, можно удалить с помощью термической дистилляции.
В общем, эту реакцию образования титанового сплава можно разделить на стадию образования сплава посредством реакции диспропорционирования (например, при температуре реакции диспропорционирования от примерно 250°C до примерно 650°C) и стадию дистилляции (например, при температуре дистилляции от примерно 650°C до примерно 1000°C).
Например, образование титанового сплава можно разделить на два способа: образования зародышей и роста частиц (который также можно назвать укрупнением частиц). В течение образования зародышей первый титановый сплав образуется из [Ti2+:соль] при более низких температурах (например, от примерно 250°C до примерно 400°C). Локальная композиция соли (активности компонентов), поверхностная энергия и кинетика диспропорционирования определяют получающуюся композицию титанового сплава. Затем, происходит рост частиц, когда титановый сплав продолжает расти из [Ti2+:соль] при более высоких температурах (например, от примерно 400°C до примерно 700°C) в конденсированном состоянии и при температурах выше 700°C (например, от примерно 700°C до примерно 1000°C) в реакции газа и твердого вещества. Эти реакции при более высокой температуре (например, более примерно 700°C) также можно описать как способ дистилляции, в котором Cl удаляют из продукта титанового сплава, что происходит одновременно с ростом частиц титанового сплава. Оба эти способа основаны на реакции диспропорционирования, однако в них можно получать титановые сплавы с различными составами. Также следует отметить, что существует реакция диспропорционирования как для Ti, так и для Al в способе реакции: Ti2+=1/3[Ti]+2/3Ti3+ и Al+=2/3[Al]+1/3Al3+. Конструкцию оборудования для этого способа можно выполнить для независимого регулирования времени пребывания при каждой температуре (например, в тепловой зоне), что может способствовать регулированию способа.
В одном из воплощений промежуточную смесь, содержащую Ti2+, поддерживают при температуре третьей реакции до тех пор, пока по существу весь Ti2+ не прореагирует до титанового сплава. В реакции любой Ti3+, образованный в течение реакции диспропорционирования, можно внутренне рециркулировать на восстановление до Ti2+ путем теплового алюминиевого восстановления и на дальнейшее реагирование в реакции диспропорционирования. Кроме того, Ti4+ (например, в форме TiCl4) можно образовать с помощью параллельной реакции диспропорционирования Ti, который можно откачать из системы реакции в виде газового побочного продукта для продолжающейся реакции (например, восстановления обратно до Ti3+, затем до Ti2+) или в виде отбираемого побочного продукта (например, выполняемого посредством противотока инертного газа).
Реакции стадии 2 (например, Ti3+ до Ti2+ и/или Ti2+ до Ti сплава) можно выполнять в инертной атмосфере, например, содержащей аргон и/или по существу не содержащей кислород, азот, влагу, углеводороды и другие примеси. В конкретных воплощениях инертная атмосфера имеет давление от примерно 100 кПа (1 атм.) (например, примерно 760 Торр) до примерно 500 кПа (5 атм.) (например, примерно 3800 Торр), такое как от примерно 100 кПа (760 Торр) до примерно 200 кПа (1500 Торр). Как показано на Фиг. 1, инертный газ можно вводить в виде противотока для регулирования реакционной атмосферы и для вывода комплексов хлоридов титана и AlClx прочь из титанового сплава и обратно в обратный поток зоны реакции Т3+ до Ti2+ и/или Ti2+ до Ti сплава. Дополнительно или альтернативно, любой TiCl4, полученный в течение реакции, можно вывести из реактора в виде отбираемого побочного продукта. Таким образом, реакцию можно выполнять эффективно без каких-либо значительных потерь Ti материалов.
Например, Ti образуется в сплаве на основе Ti-Al из Ti2+ в солевом растворе (сконденсированном и парообразном) путем диспропорционирования и образования Ti3+ в солевом растворе (сконденсированном и парообразном), как описано выше (Ti2+=1/3[Ti]+2/3Ti3+). Аналогичные соответствующие реакции диспропорционирования происходят одновременно для Al+/Al/Al3+ и других легирующих элементов, растворенных в солевых растворах, и при образовании сплавов на основе Ti-Al. Таким образом, продукты из чистого титана не образуются в течение этих реакций диспропорционирования. Не желая связывать себя какой-либо конкретной теорией или конкретной последовательностью реакций, авторы полагают, что образование сплава Ti-Al происходит посредством эндотермической реакции, которая включает подвод тепла для приведения в действие реакции по направлению к продуктам сплава Ti-Al.
Сплав Ti-Al, образованный путем указанных выше реакций, может находиться в форме сплава Ti-Al, смешанного с другими металлическими материалами. Легирующие элементы также могут быть включены в хлороалюминаты титана, потребленные и образованные в указанной выше реакции диспропорционирования. Посредством регулирования системы можно получить мелкие, однородно сплавленные частицы требуемой композиции посредством регулирования по меньшей мере температуры, потока тепла, давления, расхода газа, отношения Al/AlCl3 и размера частиц/состояния агрегации смеси Ti2+/Al/AlCl3, поступающей в реакцию стадии 2.
В качестве продукта реакций стадии 2 образуется титановый сплав, который содержит элементы из предшественников реакции и любые дополнительные легирующие элементы, добавленные в течение реакции стадии 1 и/или реакций стадии 2. Например, Ti-6Al-4V (в масс. %), интерметаллический Ti-4822 (48Al, 2Cr и 2Nb в атомн. %) можно образовать в качестве титанового сплава. В одном воплощении титановый сплав находится в форме порошка титанового сплава, такого как порошок сплава алюминида титана (например, Ti-6Al-4V, Ti-4822 и т.п.).
Что касается Фиг. 3, на ней представлена технологическая схема 300 одного примерного воплощения реакции 106 стадии 2 и последующей обработки 108 примерного способа Фиг. 1. В показанном воплощении промежуточную смесь подают через трубопровод 224 в устройство 302 реакции стадии 2 после прохождения через возможный смеситель 306. В устройстве 302 реакции стадии 2 Ti3+ промежуточной смеси восстанавливают до Ti2+ путем нагрева до температуры второй реакции и затем Ti2+ восстанавливают до Ti сплава посредством реакции диспропорционирования при температуре третьей реакции, которая больше температуры второй реакции, как описано более подробно выше. Показанное в качестве примера устройство 302 реакции стадии 2 является одностадийным реактором, который содержит устройство 304 зоны нагрева, окружающей реакционную камеру 306. Устройство 304 зоны нагрева обеспечивает изменяемую, повышающуюся температуру внутри реакционной камеры 306 по мере того, как промежуточная смесь течет через реакционную камеру. Например, устройство 304 зоны нагрева может иметь температуру первой реакции по направлению ко входу реакционной камеры 306 (например, первую зону 308) и температуру второй реакции на выходе реакционной камеры 306 (например, вторую зону 310). Устройство также может иметь градиент температуры реакции между 2 или более зонами. Этот способ сконструирован для обеспечения однородного смешивания и непрерывного потока через температурный градиент.
Паровые продукты реакции, такие как AlCl3, Al2Cl6, TiCl4, TiAlCl6, AlOCl, TiOCl(AlOCl)x и т.п. можно удалять из реакционной камеры 306, используя противоток инертного газа. Например, инертный газ можно подавать во вторую зону 310 реакционной камеры 306 через подающую трубу 312 из подачи 313 инертного газа. Инертный газ может затем течь против продвижения твердых материалов через реакционную камеру 306 для вывода газовых комплексов хлорида титана из титанового сплава, образующегося во второй зоне 310, и обратно в реакцию при более низкой температуре восстановления Ti3+ до Ti2+, происходящую в первой зоне 308.
Дополнительно или альтернативно, газовые комплексы хлорида титана, полученные в течение реакции, можно выводить обратно в реакционную камеру 306, в которой они конденсируются при более низкой температуре, и таким образом регулируют стехиометрию титана в реагирующих солях. Любой остающийся AlClx и любой TiCl4, образованный в течение диспропорционирования, удаляют из реактора 306 с помощью вентиляционного трубопровода 315, который может быть нагретым трубопроводом для предотвращения конденсации и засорения, и собирают в конденсаторе/сублиматоре 317 (например, одноступенчатом конденсаторе или многоступенчатом конденсаторе) для повторного захвата. Таким образом, реакцию можно выполнять эффективно без каких-либо значительных потерь Ti материалов.
Использование инертного газа с низким содержанием примесей (например, аргонового газа с низким содержанием примесей, такого как газообразный аргон высокой чистоты) в качестве технологического газа является предпочтительным для минимизации образования в способе оксихлоридных фаз, таких как TiOClx и AlOClx, и для окончательного подавления образования TiO, TiO2, Al2O3 и/или TiO2-Al2O3 смесей. Также можно использовать другие инертные газы, такие как гелий или другие благородные газы, которые должны быть инертными для способа реакции.
Контролирование способа можно использовать для определения завершения реакции путем измерения баланса, температуры, давления, химического состава технологического газа, химического состава продукта на выходе и химического состава побочных продуктов.
Титановый сплав можно собирать посредством 314, предоставленного в устройстве 316 последующей обработки, такого как описано ниже. Стадию последующей обработки можно выполнять в отдельном устройстве или можно выполнять в том же устройстве, которое используют для способа стадии 2, или соединенном с ним устройстве.
4. Последующая обработка титанового сплава
После образования титановый сплава можно обработать 108. Например, порошок титанового сплава можно обработать для укрупнения, спекания, непосредственного упрочения, технологии послойного синтеза, объемного плавления или сфероидизации. Например, титановый сплав можно подвергнуть высокотемпературной обработке для очистки титанового сплава путем удаления остаточных хлоридов и/или обеспечения диффузии для уменьшения градиентов состава, например, при температуре обработки примерно 800°C или выше (например, от примерно 800°C до примерно 1000°C).
В одном из воплощений высокотемпературная обработка также продолжает реакции диспропорционирования с получением титанового сплава из любого остаточного Ti2+.
Примеры
Описанный здесь способ можно объяснить в самом общем виде и простейших терминах путем обзора наложенных диаграмм устойчивости (энергия Гиббса на моль Cl2 в зависимости от абсолютной температуры) для систем Ti-Cl и Al-Cl, как показано на Фиг. 4.
Хотя не учитывают сплав или солевые растворы, это показывает максимальную доступную химическую энергию в системе Ti-Al-Cl. При температурах ниже 1000К (730°C) Ti4+ в виде TiCl4(ж, г) можно восстановить до Ti3+ в виде TiCl3(тв) и затем до Ti2+ в виде TiCl2(тв) путем окисления металлического Al до Al3+ (в форме AlCl3(тв), Al2Cl6(г) и/или AlCl3(г)), однако Ti2 нельзя восстановить до металлического Ti путем окисления металлического Al. В этом способе металлический титан, сплавленный с Al[Ti], можно образовать в температурном интервале от 523 до 923K (от 250 до 650°C) посредством диспропорционирования Ti2+ (Ti2+=1/3[Ti]+2/3Ti3+) в солевом растворе [Ti2+:соль] с получением частиц [Ti] и Ti3+ в виде солевого раствора [Ti3+:соль] или пара. Движимое Al восстановление Ti4+ и Ti3+ является экзотермическим способом и его выполняют в реакторе стадии один, S1, и реакторе низкотемпературной части стадии два, S2, при температурах ниже 523K или 250°C, при этом диспропорционирование Ti2+ является эндотермическим способом и его выполняют при промежуточных температурах в реакторе S2.
Восстановление Ti4+, Ti3+ (и других легирующих элементов, Мх+), окисление Al и последующие диспропорционирование означает, что этот способ является по своей сути электрохимическим способом. Описанный здесь способ не основан на электродах или внешних электрических цепях, в результате ожидают нейтральности заряда посредством зон взаимодействия. Это означает, что частицы сплава могут однородно образовываться из [Ti2+:соль] при условии локального потока тепла и если композиция поддерживает эндотермическую реакцию диспропорционирования. Это является значительным преимуществом этого способа по сравнению с электрохимическим осаждением и родственными способами.
Кроме того, не желая связывать себя какой-либо конкретной теорией, авторы полагают, что металлический Al и другие легирующие элементы М осаждаются из соли одновременно с Ti2+ посредством соответствующих реакций диспропорционирования (то есть, для Al: Al+=2/3[Al]+1/3Al3+ [9] и для М: Мх+=1/(х+1)[М]+х/(х+1)М(х+1)+) и подача ионов в низком состоянии окисления из соли в фронт роста частиц сплава не затруднена. Далее, низкотемпературная природа этого способа означает, что кристаллическая структура и фазовые границы, обычно наблюдаемые с обычными технологическими маршрутами (то есть, отверждение и термомеханическая работа), необязательно образуются или даже ожидаются.
Имея в виду общий/высокий уровень признаков этого способа описывают подробности способа. В конкретных воплощениях следующие способы можно выполнять, убедившись, что исходные реагенты (TiCl4, AlCl3 и галогениды легирующих элементов, MXx) эффективно не содержат Н2О и О, так как все металлогалоиды сильно реагируют с Н2О и после введения кислорода может быть трудным удалить его из некоторых солей. Кроме того, полагают, что кислородное загрязнение в соли стабилизирует Ti3+ против Ti2+, что затрудняет образование Ti2+ и таким образом влияет на композицию образующегося сплава.
Пример 1
Реакцию химического восстановления Ti4+, изначально в форме TiCl4(ж), до Ti3+ в виде TiCl3(AlCl3)х выполняли в реакторе стадии 1 и оценивали в инертных средах. Входящую смесь, содержавшую 201,8 г Al хлопьев, 100,5 г AlCl3, 34,3 г NbCl5 и 20,1 г CrCl3, загружали в атмосфере аргона высокой чистоты в герметичную шаровую мельницу и перемалывали в течение 16 часов при близкой к комнатной температуре (шаровые мельницы предоставляют сырье для каждого цикла стадии 1). Перемолотый материал просеивали через сито с ячейками 150 мкм, и 594, 1 г, номинально от двух мельниц, загружали в скребковый смесительный реактор в атмосфере аргона высокой частоты. Реактор поддерживают при давлении 120 кПа изб. (1,2 бар изб.) с низким потоком (менее 1 л/мин) аргона высокой чистоты, протекающего через реактор. Реактор и загрузку предварительно нагревали до 130°C и стабилизировали перед введением 1164 г TiCl4(ж) со скоростью 6,5±2,0 г/мин, при этом непрерывно перемешивая. В течение времени закачивания TiCl4(ж) он сначала испаряется, но со временем образуется TiCl4(ж), по мере того, как стенку реактора поддерживают при примерно 130°C, при этом объем свободно текущей в способе загрузки, {соль + Al}, может достигать температур вплоть до 145°C. После добавления всего TiCl4(ж) температуру стенки реактора поддерживают при 130°C в течение номинально такого же времени, что и для закачивания TiCl4, в течение которого конденсированный TiCl4(ж) абсорбировался во входящей смеси и получающейся в реакции соли, продолжая реагировать и восстанавливаясь. После того, как большая часть конденсированного TiCl4(ж) восстанавливалась (на что указывает уменьшение объемного изменения температуры и температуры газа выше смешанной загрузки), температуру стенки реактора повышали до 160°C и поддерживали при этой температуре. Это обеспечивает то, что весь конденсированный TiCl4(ж) на стенке реактора способен восстановиться или его можно удалить. Промежуточный материал охлаждали и удаляли из реактора. Для характерных образцов, взятых из продукта описанного способа, определяли характеристики, обеспечивая соответствующие меры предосторожности останавливали реакцию с воздухом, используя методы рентгеновской дифракции, индуктивно-связанной плазмы, Cl титрования и электронной микроскопии и анализ энергодисперсионной спектроскопии для оценки формы хлоридов металлов. Результаты этого определения характеристик подтверждали получение остаточных непрореагировавших частиц Al с соответствующей формой и размером, наблюдавшимися в перемолотом продукте, загруженном в реакцию, а также в количестве, соответствующем восстановлению добавленного TiCl4. Микроструктура, наблюдавшаяся с помощью сканирующей электронной микроскопии, показывает, что частицы Al были окружены постепенно изменяющимся слоем солевого продукта, при этом соль в контакте с Al поверхностью богата AlCl3, и обычно наблюдается выделение О на этой поверхности раздела в виде оксихлоридного слоя "AlOCl". Дополнительная форма поверхности Al частиц, фаза TiCl3(AlCl3)x, существовала и представляла объемную часть продукта этой реакции. Это солевой продукт имел плохие механические свойства и Al частицы сердцевины легко отделялись, и он мог существовать отдельно от Al частиц. Рентгеновский дифракционный анализ показал, что солевая фаза TiCl3(AlCl3)x существует в виде α фазы, с плотно упакованной гексагональной структурой. Кристаллическая структура соответствовала AlCl3(TiCl3)x, и это было доказательством непрерывного твердого раствора. Измеренная композиция объемного образца согласовалась с рентгеновской дифракцией и наблюдаемой микроструктурой.
Остальную часть материала подавали в HED реактор вращающейся печи с противотоком Ar газа с 5 зонами с температурами зон от примерно 250°C до примерно 300°C, от примерно 300°C до примерно 650°C и от примерно 650°C до примерно 1000°C. После реакции во вращающейся печи при максимальной температуре 800°C материал образца собирали и анализировали с помощью рентгеновской дифракции, индукционно-связанной плазмы, Cl титрования и электронной микроскопии и анализа энергодисперсионной спектроскопии, которые показали образование порошка металлического сплава гамма алюминида титана с размером частиц <150 мкм и с композицией 32.0±1,0 масс. % Al, 61,4±1,7 масс. t% Ti, 2,6±0,1 масс. % Cr, 4,5±0,1 масс. % Nb, а также с небольшим количеством остаточного хлора (0,6 масс. %).
Пример 2
Реакцию химического восстановления выполняли и оценивали в инертной среде. Входящая смесь содержала 250 г Al хлопьев, 62,5 г AlCl3, 42,75 г NbCl5 и 25,0 г CrCl3 и ее перемалывали при комнатной температуре в течение 16 часов. Перемолотый материал просеивали через сито с ячейками 150 мкм и 714 грамм (номинальный продукт из двух мельниц) загружали в скребковый реактор-смеситель. Реактор предварительно нагревали до 130°C и закачивали TiCl4 со скоростью 6,5 г/мин при перемешивании. После добавления 1541 г TiCl4, температуру реактора повышали до 160°C и поддерживали ее для сушки/удаления избытка TiCl4. Промежуточный материал охлаждали и удаляли из реактора. Материал из 3 похожих стадий одного способа подавали в HED реактор вращающейся печи с противотоком газообразного Ar с 5 зонами с температурами зон, установленными на 250°C. Продукт {Al+TiCl3(AlCl3)х} из указанной выше реакции стадии 1 подавали во вращающуюся печь с постоянной скоростью 1,0±0,2 кг/ч, проводя через нагретую зону в интервале скоростей, регулируемых скоростью вращения рабочей трубы (при 6 об/мин время пребывания составляет примерно 13 минут, при 4 об/мин время пребывания составляет примерно 20 минут, при 2 об/мин время пребывания составляет примерно 40 минут). Образцы из способа собирали на всем протяжении цикла и определяли их характеристики, используя рентгеновскую дифракцию, индуктивно-связанную плазму, Cl титрование и электронную микроскопию и энергодисперсионную спектроскопию. Результаты показали, что начальный материал {Al+TiCl3(AlCl3)х} быстро реагировал во вращающейся печи. Частицы Al оставались в спектре рентгеновской дифракции и их также явно видно в микроструктуре, однако их количество уменьшалось. Это соответствовало продолжающемуся окислению с восстановлением Ti3+ до Ti2+. Характеристические пики рентгеновской дифракции для α-TiCl3(AlCl3)х исчезали, оставляя только пики для исходного Al и сплава. Объемная композиция образца, микроструктура и количество собранного конденсированного пара AlCl3 подтверждают, что объем отобранного образца представляет собой соль, и эта соль не имеет определенной кристаллической структуры (то есть, является аморфным, стеклянным или полимерным материалом), что показывает, что Al легко восстанавливает Ti3+ в виде TiCl3(AlCl3)х до Ti2+ в виде Ti(AlCl4)2 при температурах ниже 250°C без значительного испарения AlCl3. Из литературе известно, что фаза Ti(AlCl4)2 не является кристаллической.
Помимо низкотемпературного восстановления Ti3+ этот результат недвусмысленно показывает, что титановый сплав начинает образовываться при температурах всего лишь 250°C из солевой фазы (посредством одновременной реакции диспропорционирования). Описанные здесь условия реакции не оптимизированы и образовывался широкий диапазон сплавов: α-[Ti], α2-Ti3Al, γ-TiAl, TiAl2, TiAl3, также содержащих Nb и Cr. Эти частицы сплава совместно существуют с солью и частицами непрореагировавшего Al. Полагают, что широкий диапазон фаз сплава обусловлен широким диапазоном солевых композиций/неоднородностью. Этот экспериментальный цикл проводили для того, чтобы доказать легкость восстановления Ti3+ до Ti2+ и доказательства того, что титановый сплав образуется посредством одновременного способа диспропорционирования.
В этом описании используются примеры для описания изобретения, включая наилучший режим, а также для того, чтобы обеспечить возможность любому специалисту реализовать изобретение на практике, включая изготовление и использование любых устройств или систем и выполнение любых включенных способов. Область защиты изобретения определяется формулой изобретения, и она может включать другие возможные воплощения. Такие другие воплощения находятся в области защиты формулы изобретения, если они включают структурные элементы, которые не отличаются от буквальных формулировок формулы изобретения, или если они включают эквивалентные структурные элементы с несущественными отличиями от буквальных формулировок формулы изобретения.
Реферат
Группа изобретений относится к способам получения титановых сплавов. Титановый сплав получают путем добавления TiClк входящей смеси при температуре первой реакции. Часть Tiв TiClвосстанавливается до Tiс образованием продукта первой реакции. Входящая смесь содержит алюминий и, возможно, AlClи/или, возможно, по меньшей мере один галогенид легирующего элемента. После остановки добавления TiClнагревают продукт первой реакции при условиях сушки для завершения восстановления Tiили для удаления остающегося TiClс образованием первой промежуточной смеси. Первая промежуточная смесь является раствором соли на основе AlCl, который содержит Ti, причем Tiв первой промежуточной смеси находится в форме TiCl(AlCl), где х больше чем 0-10. Нагревают первую промежуточную смесь до температуры второй реакции. Часть Tiвосстанавливается до второй промежуточной смеси, которая является раствором соли на основе AlCl, который содержит Ti. Дополнительно нагревают вторую промежуточную смесь до температуры третьей реакции, причем Tiобразует титановый сплав посредством реакции диспропорционирования. Изобретения позволяют получить материалы титановых сплавов посредством улучшенных технологий обработки реакции восстановления тетрахлорида титана в реакционных средах на основе AlCl. 3 н. и 28 з.п. ф-лы, 2 пр., 4 ил.

Комментарии