Получение титановых сплавов посредством восстановления тетрагалогенида титана - RU2714979C1
Код документа: RU2714979C1
Чертежи


Описание
Информация о приоритете
Данная патентная заявка испрашивает приоритет на основании Предварительной Патентной заявки США серийный №62/411,224, зарегистрированной 21 октября 2017 г., которая включена в данное патентное описание посредством ссылки.
Область техники
Данное изобретение в целом относится к способам получения титановых сплавов путем восстановления тетрахлорида титана (TiCl4) в реакционной среде на основе AlCl3. Более конкретно, титановые сплавы получают путем восстановления содержащегося в TiCl4 Ti4+ до более низкой формы валентности титана (например, Ti3+ и Ti2+) с последующей реакцией диспропорционирования Ti2+ и других легирующих элементов. Другие легирующие элементы также могут быть получены из соли в сплав в процессе восстановления и/или диспропорционирования.
Предпосылки создания изобретения
Титановые сплавы, которые включают алюминий, например, сплавы на основе титана-алюминия (Ti-Al) и сплавы на основе интерметаллических соединений титана и алюминия (Ti-Al), являются очень ценными материалами. Однако их получение может быть трудным и дорогим, особенно в порошкообразной форме, и имеются сплавы, которые невозможно получить традиционными способами плавки. Эти затраты на получение ограничивают широкое использование этих материалов, даже если они обладают весьма желательными свойствами для применения в аэрокосмической, автомобильной и других отраслях промышленности.
Реакторы и способы формирования сплавов на основе титана-алюминия и их интерметаллических соединений уже описаны. Например, WO 2007/109847 излагает стадийный способ получения сплавов на основе титана-алюминия и их интерметаллических соединений посредством двухстадийного процесса восстановления, основанного на восстановлении тетрахлорида титана алюминием. WO 2009/129570 раскрывает реактор, предназначенный для решения одной из проблем, связанной с реакторами и способами, раскрытыми в WO 2007/109847, когда их используют в условиях, которые могли бы потребоваться для формирования сплавов на основе титана-алюминия с низким содержанием алюминия.
Однако обсуждение химических процессов, которые фактически происходят в способах, описанных в WO 2007/109847 и WO 2009/129570, не дают полного понимания фактических реакций, протекающих при формировании металлического сплава из предшественников галогенидов металлов.
Принимая о внимание эти концепции, существует необходимость в лучшем понимании химических процессов, протекающих при получении титан-алюминиевых сплавов путем восстановления тетрахлорида титана TiCl4, а также в создании усовершенствованных технологий для проведения таких реакций.
Вышеприведенные ссылки на существующий уровень техники не позволяют предположить, что для специалиста этот уровень техники формирует часть общедоступных сведений.
Краткое описание изобретения
Аспекты и преимущества данного изобретения отчасти будут изложены в последующем описании, или они могут быть очевидны из этого описания, или могут быть усвоены при осуществлении данного изобретения.
В целом, предложены способы получения титанового сплава, например, сплавов Ti-Al. Одно из воплощений способа включает нагревание исходной смеси до заданной температуры предварительного нагрева; при этом исходная смесь включает алюминий, возможно, AlCl3, и, возможно, один или более хлоридов легирующих элементов; введение в исходную смесь TiCl4 при первой температуре реакции, чтобы восстановить по существу весь содержащийся в TiCl4 Ti4+ до Ti3+; затем нагревание до второй температуры реакции, чтобы восстановить по существу весь Ti3 до Ti2+, с образованием промежуточной смеси (то есть соли Ti2+); и введение промежуточной смеси в реакционную камеру при температуре проведения реакции диспропорционирования с получением из Ti2+ титанового сплава посредством реакции диспропорционирования (наряду с проведением реакций диспропорционирования других возможных легирующих элементов).
Эти и другие признаки, аспекты и преимущества данного изобретения станут более понятными со ссылкой на последующее описание и прилагаемую формулу изобретения. Сопровождающие чертежи, которые включены в текст данного описания и составляют его часть, иллюстрируют воплощения данного изобретения и, совместно с описанием, служат для разъяснения принципов данного изобретения.
Краткое описание чертежей
Предназначенное для специалиста полное и достаточное для воспроизведения раскрытие данного изобретения, включая наилучший режим его осуществления, изложено в патентном описании, которое ссылается на прилагаемые чертежи, в которых:
Фиг. 1 изображает схему одного из примеров воплощения реакций стадии 1 одного из приведенных в качестве примера способов;
Фиг. 2 изображает схему одного из примеров воплощения реакции стадии 2 и последующей переработки полученного материала титанового сплава для одного из приведенных в качестве примера способов;
Фиг. 3 изображает блок-схему одного из примеров воплощения способа формирования материала титанового сплава; и
Фиг. 4 изображает диаграммы устойчивости (зависимость энергии Гиббса на моль Cl2 от абсолютной температуры (Т)) для систем Ti-Cl и Al-Cl, наложенных друг на друга, чтобы показать восстановительный потенциал металлического Al [1,2,3]. Рассматривают только чистые элементы (Ti, Al и Cl2) и чистые соединения солей (TiCl4, TiCl3, TiCl2 и AlCl3), поскольку отсутствуют доступные термодинамические данные для фаз солевых растворов (TiCl4(AlCl3)x, TiCl3(AlCl3)x, TiCl2(AlCl3)x).
Предполагается, что повторное использование численных сносок в данном патентном описании и в чертежах представляет такие же или аналогичные признаки или элементы данного изобретения.
Подробное описание изобретения
Теперь обратимся к подробным описаниям воплощений данного изобретения, один или более примеров которого проиллюстрированы на чертежах. Каждый пример приведен посредством разъяснения данного изобретения, а не ограничения данного изобретения. Фактически, специалистам будет понятно, что можно осуществить различные модификации и вариации данного изобретения, не выходя за рамки объема или сущности данного изобретения. Например, отличительные особенности, проиллюстрированные или описанные как часть одного примера воплощения, можно использовать с другим примером воплощения, получая дополнительный пример воплощения. Таким образом, полагают, что данное изобретение охватывает такие модификации и вариации, как входящие в объем прилагаемой формулы изобретения и ее эквивалентов.
Как используют в тексте данного описания, термины «первый», «второй» и «третий» можно применять взаимозаменяемо, чтобы отличить один компонент от другого; и не предполагается, что они обозначают местоположение или значимость отдельных компонентов.
В данном патентном описании химические элементы обсуждают с использованием их обычных химических обозначений, которые обычно применяют в Периодической таблице элементов. Например, водород обозначают его обычной химической аббревиатурой Н, гелий обозначают его обычной химической аббревиатурой Не и так далее.
Как используют в тексте данного описания, термин «титановый сплав» или т.п.следует понимать как охватывающий сплавы на основе титана, или сплавы на основе интерметаллического соединения титана и, возможно, других дополнительных легирующих элементов, в дополнение к Ti и Al. Подобным образом, термин «сплав титан-алюминий» или т.п. следует понимать, как охватывающий сплавы на основе титана-алюминия, или сплава на основе интерметаллических соединений титана-алюминия и, возможно, других дополнительных легирующих элементов, в дополнение к Ti и Al. Следует отметить, что обозначение [Ti] относится к титану, присутствующему в виде титанового сплава (например, в сплаве с другим элементом, таким как алюминий).
Как используется в тексте данного описания, термин «хлориды алюминия» следует понимать как относящийся к хлоридным соединениям алюминия или к смеси таких хлоридных соединений алюминия, включая AlCl3 (твердый, жидкий или парообразный) или любые другие соединения или ионы Al-Cl (например, AlCl, AlCl2, (AlCl4)-, Al2Cl6 и (Al2Cl7)-). Применение обозначения AlClx относится к термину «хлориды алюминия», и следует понимать, что он относится к таким хлоридным соединениям алюминия, или к смеси таких хлоридных соединений алюминия, независимо от их стехиометрического отношения.
Следует понимать, что термин «хлорид титана», как его используют в тексте данного описания, относится к трихлориду титана (TiCl3) и/или дихлориду титана (TiCl2), или к другим сочетаниям титана и хлора, но не к TiCl4, который здесь называют тетрахлоридом титана. Можно использовать более общий термин "TiClx", который относится к хлоридным соединениям титана и включает тетрахлорид титана, трихлорид титана, дихлорид титана и/или другие комбинации титана и хлора в твердой, жидкой или парообразной форме. Поскольку также существуют различные фазы растворов и комплексные соединения хлорида титана, здесь ссылаются на конкретное состояние окисления иона Ti (например, Ti2+, Ti3+ и Ti4) в общей фазе (то есть в смеси солей), а не на какие-либо конкретные химические соединения.
Как используют в тексте данного описания, термин «галогениды легирующих элементов» относится к иону компонента сплава в соединении с галогенидом (например, хлоридом, фторидом, бромидом, иодидом или астатидом). Легирующий элемент может представлять собой любой элемент, который мог бы быть включен в материал конечного титанового сплава, такой как металлы или другие элементы. «Галогенид легирующего элемента» может быть представлен формулой MXx, где М является ионом компонента сплава, а X является галогенидом (то есть ионом галогена), независимо от стехиометрического отношения (представленного показателем х). Например, хлорид компонента сплава может быть представлен формулой MClx.
Способы производства титановых сплавов (например, сплавов титан-алюминий) обычно представляют собой восстановление TiCl4, который включает четырехвалентный положительный ион титана (Ti4+). Конкретнее, материалы титановых сплавов образуются посредством восстановления Ti4+ в TiCl4 до более низкой формы валентности титана (например, Ti3+ и Ti2+), с последующей реакцией диспропорционирования Ti2+ с образованием титанового сплава. Следует отметить, что данная форма валентности титана (например, Ti4+, Ti3+ и/или Ti2+) может присутствовать в участвующих в реакции и/или в промежуточных материалах в виде комплекса с другими молекулами, находящимися в смеси (например, с хлором, другими элементами и/или другими соединениями, например, хлор алюминатами, галогеналюминатами металла и т.д.) и, соответственно, TiCl4, TiCl3 и TiCl2 не обязательно могут присутствовать в чистой форме. Например, в этих промежуточных продуктах галогеналюминаты металла могут быть образованы за счет комплексообразования MXx с AlCl3, как описано ниже.
Обычно AlCl3 обеспечивает реакционные среды, которые содержат реакционноспособные частицы (например, Ti4+, Ti3+, Ti2+, Al, Al+, Al2+, Al3+, а также ионы легирующих элементов) для всех реакций. К тому же, содержание AlCl3 в солевом растворе позволяет получать Ti2+ при относительно низких температурах (например, около 250°С или ниже). AlCl3 включают в соль основы, так как Al (например, в форме Al+, Al+) выполняет роль восстанавливающего агента. Например, в условиях присутствия AlCl3 роль реакционных сред могут играть дополнительные галогениды металлов, например, NaCl-AlCl3, KCl-AlCl3 и NaCl-KCl-AlCl3 (чтобы назвать некоторые из них). Не желая ограничиваться теорией, полагают, что использование NaCl-KCl-AlCl3 может обеспечить дополнительные степени свободы по составу, чтобы можно было регулировать Ti2+/Ti3+ и Al+/Al3+ в [Ti2+ : соль] для осуществления контроля состава Ti сплава.
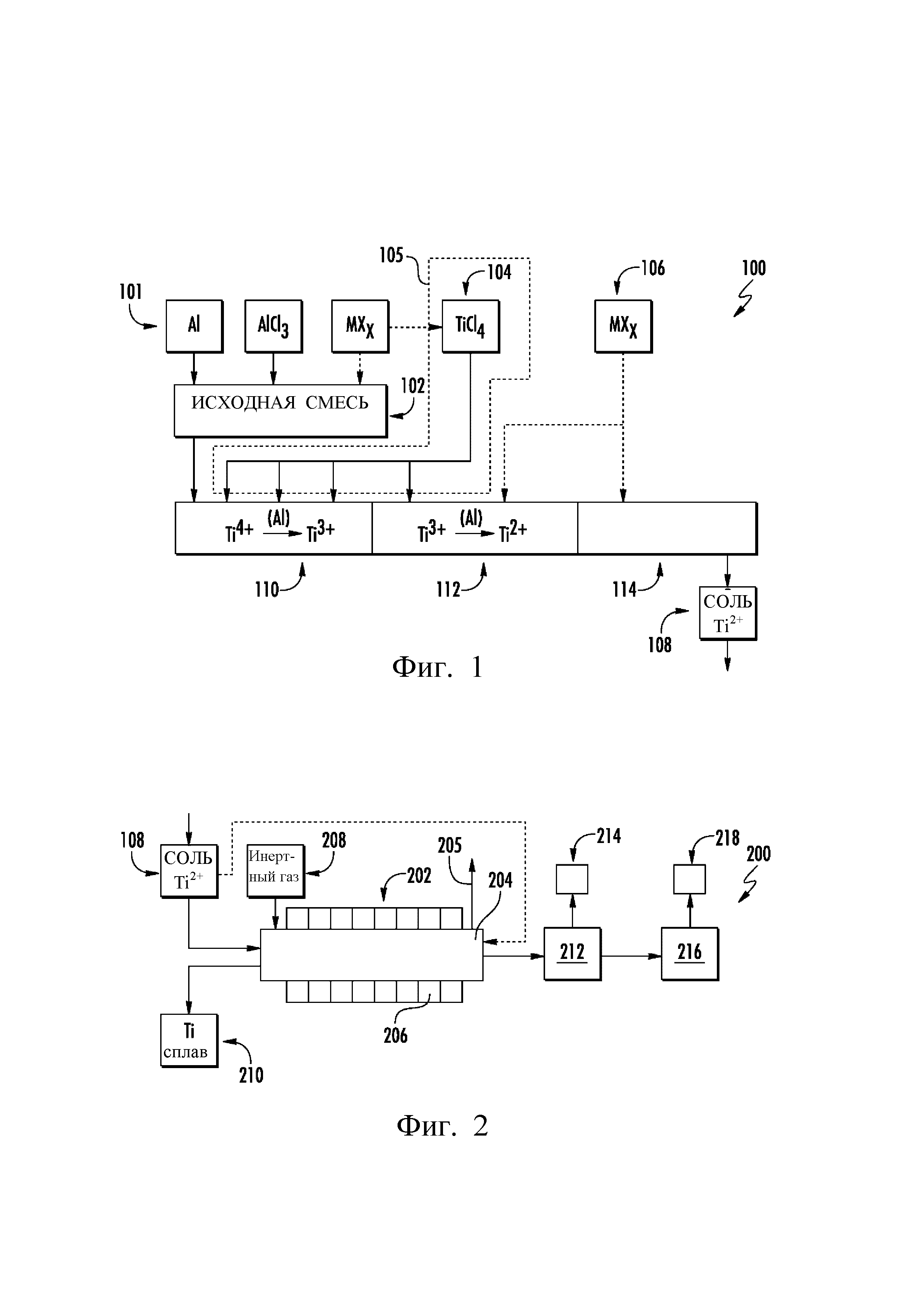
Фиг. 1 изображает общую блок-схему приведенного в качестве примера способа 100 проведения реакций стадии I, в форме непрерывных реакций стадии I, на которой TiCl4 восстанавливают до промежуточного материала, содержащего Ti2+ (то есть раствора соли Ti2+). Способ 100 изображен схематично в виде последовательных зон: добавление твердых реакционных предшественников в 101 (включая формирование исходной смеси в 102); добавление жидких реакционных предшественников в 104, в одном или более местоположений, и, возможно, введение дополнительных реакционных компонентов в 106, чтобы получить соль Ti2+ в 108. Способ 100 включает прохождение исходной смеси через последовательные зоны (например, зону 1 в 110, зону 2 в 112 и зону 3 в 114), при введении в нее дополнительных материалов.
I. Реакционные предшественники
Твердые реакционные предшественники 101 для реакций стадии I в способе 100 Фиг. 1 включают, как минимум, исходную смесь, которая включает алюминий (Al), или сам по себе, или с дополнительными хлоридными компонентами (например, MXx), добавленными в первой зоне 110, а также жидкий TiCl4 104, добавленный в одном или более местоположений, через зону 105 нагрева, по первой зоне 110 и/или по второй зоне 112. В одном из воплощений реакционные предшественники включают исходную смесь, которую подают в виде твердого материала в первую зону 110, где начинают нагревание до температуры предварительного нагрева (например, до температуры примерно от 100°С до 160°С, как более подробно разъяснено ниже); и в первой зоне 110 и/или во второй зоне 112 в исходную смесь добавляют TiCl4 в жидкой форме. Например, жидкий TiCl4 можно добавить, когда первая температура реакции составляет примерно от 110°С до 200°С (например, примерно от 125°С до 180°С; например, примерно от 130°С до 175°С). В конкретных примерах воплощения к TiCl4 (жидк.) можно добавить MXx. В таком воплощении систему ввода TiCl4 можно нагревать, чтобы способствовать поддержанию растворимости легирующих элементов (MXx) в TiCl4 (жидк.).
В реакционные предшественники могут быть включены дополнительные материалы (например, AlCl3 и/или хлориды других легирующих элементов), на различных стадиях процесса 100; например, их можно вводить в исходную смесь, в TiCl4 (например, растворять в нем и/или смешивать с ним), и/или вводить отдельным потоком во вторую зону 112 и/или в третью зону 114. То есть один или более хлоридов 106 легирующих элементов можно вводить в реакционные материалы стадии 1 (например, в исходную смесь, в TiCl4, (если он представляют собой жидкость), и/или непосредственно и независимо в реакционную емкость стадии 1, например, в третью зону 114). В некоторых воплощениях, особенно если галогенид легирующего элемента добавляют к жидкому TiCl4 (например, если галогенид легирующего элемента растворим в нем), жидкий TiCl4 можно профильтровать, чтобы удалить любые содержащиеся в жидком потоке частицы. Такой фильтр может, в конкретных воплощениях, очищать жидкий поток, удаляя кислород из жидкости, так как растворимость кислорода и содержащих кислород соединений является чрезвычайно низкой. Фильтрация жидкого TiCl4 как таковая (при наличии растворенных в нем галогенидов легирующих элементов или в отсутствии их), может регулировать химический состав жидкости и удалять из нее содержащие кислород соединения.
Например, реакционные предшественники могут включать часть или все компоненты сплава, необходимые для получения желаемого химического состава титанового сплава. Как указано, хлорид легирующего элемента представлен формулой MClx, где М - ион компонента сплава, включающий металлы и другие элементы, которые могут входить в конечный материал сплава. Отмечено, что М может быть основным или второстепенным легирующим элементом, включая Ti. В частности, подходящие ионы легирующих элементов могут состоять из титана, ванадия, хрома, ниобия, железа, иттрия, бора, марганца, молибдена, олова, циркония, кремния, углерода, никеля, меди, вольфрама, бериллия, цинка, германия, лития, магния, скандия, свинца, галлия, эрбия, церия, тантала, осмия, рения, сурьмы, урана, иридия и их комбинаций, совместно с другими материалами/элементами. Такой гибкости можно достичь благодаря использованию KCl-NaCl-AlCl3 в качестве реакционной среды, что ставит природу сплава, который может быть получен, в зависимость только от диапазона растворимости М в реакционной среде расплавленных солей.
Как показано на Фиг. 1 под номером 102, исходную смесь формируют из алюминия (Al), возможно, хлорида алюминия (например, AlCl3) и, возможно, одного или более хлоридов легирующих элементов. Обычно Al является восстанавливающим компонентом, который превращает Ti4+ в Ti2+ в реакциях стадии I. Не желая ограничиваться какой-либо конкретной теорией, в настоящее время полагают, что AlCl3 полезен в качестве компонента исходной смеси, но не является обязательным, если имеется хлорид компонента сплава, который растворим в TiCl4 или смешивается с ним в реакционных условиях стадии 1, с образованием in situ AlClx из хлорида легирующего элемента и алюминия. В одном из воплощений AlCl3 включают в качестве материала исходной смеси. В этом воплощении TiCl4 растворяется в конденсированной соли на основе AlCl3, присутствующей в начале реакции стадии 1, а также в продуктах реакции, которые образуются в ходе реакции стадии 1. В одном из воплощений реакционный процесс стадии 1 включает добавление TiCl4 с расходом, достаточным для того, чтобы всегда присутствовал избыток продукта реакции AlCl3 или TiCl3(AlCl3)х, для обеспечения поглощения TiCl4 и растворения его в AlCl3 и TiCl3(AlCl3)х.
Однако в другом воплощении исходная смесь может по существу не содержать AlCl3. Как используют в тексте данного описания, термин «по существу не содержит» означает, что присутствует не более чем незначительное следовое количество; и этот термин охватывает понятие «полностью отсутствует» (например, «по существу не содержит» может означать от 0% ат. до 0,2% ат.). Если AlCl3 отсутствует в исходной смеси, то хлориды Al и других металлов присутствуют, и их используют для образования AlCl3, так что реакция стадии 1 может протекать.
В твердом состоянии и в условиях окружающей среды в исходную смесь можно включить один или более хлоридов легирующих элементов (MClx), для получения исходной смеси. Особенно пригодные для введения вместе с алюминием и, возможно, AlCl3, хлориды легирующих элементов включают, не ограничиваясь этим, VCl3, CrCl2, FeCl2, FeCl3, YCl3, BCl3, MnCl2, MoCl3, MoCl5, SnCl2, ZrCl4, NiCl2, CuCl, CuCl2, WCl4, WCl6, BeCl2, ZnCl2, LiCl, MgCl2, ScCl3, PbCl2, Ga2Cl4, GaCl3, ErCl3, CeCl3 и их смеси.
В одном из воплощений исходная смесь находится в форме совокупности частиц (то есть в порошкообразной форме). Например, исходную смесь формируют, размалывая смесь алюминия (Al), возможно, хлорида алюминия (например, AlCl3) и, возможно, одного или более хлоридов легирующих элементов. Материал исходной смеси можно объединить в виде твердых материалов и размолоть совместно, с получением совокупности частиц, имеющих смешанный состав. В одном из примеров воплощения смесь частиц алюминия, возможно, частиц хлорида алюминия и, возможно, частиц одного или более хлоридов легирующих элементов смешивают и размалывают совместно, с получением совокупности частиц исходной смеси. Например, алюминиевые частицы могут представлять собой частицы, имеющие сердцевину из чистого алюминия со слоем оксида алюминия, образованным на поверхности этих частиц. В альтернативном случае алюминиевые частицы могут включать сердцевину из алюминия и по меньшей мере одного другого компонента сплава. Алюминиевые частицы могут обладать любой подходящей морфологией, включая хлопьеобразную форму, по существу сферическую форму и т.д.
Так как алюминиевые частицы обычно образуют слой оксида алюминия на поверхности частиц, процесс размола проводят в атмосфере, которая по существу не содержит кислорода, чтобы воспрепятствовать образованию любых дополнительных оксидов алюминия в исходной смеси. Например, процесс размола можно проводить в инертной атмосфере, такой как атмосфера аргона, имеющей давление примерно от 93,3 КПа (700 мм Hg) до 506,54 КПа (3800 мм Hg). Не желая ограничиваться какой-либо конкретной теорией, полагают, что в ходе размола Al (тв.) (происходит) реакция между AlCl3 и поверхностным Al2O3, (при которой) AlCl3 превращает Al2O3 в AlOCl (например, посредством реакции Al2O3+AlCl3→3AlOCl). Поверхностный слой Al2O3 защищает нижележащий Al (тв.), а затем превращение этого поверхностного слоя Al2O3 в AlOCl в ходе размола позволяет Al растворяться и диффундировать в соль, в виде Al+ (или) Al2+. Полученные частицы, как таковые, представляют собой порошок «активированного» Al.
Кроме того, уменьшение размера частиц позволяет увеличить площадь поверхности частиц, повышая доступность площади поверхности алюминия в последующих реакциях восстановления. Совокупность частиц может обладать любой подходящей морфологией, включая хлопьеобразную форму, по существу сферическую форму и т.д. В конкретных примерах воплощения совокупность частиц исходной смеси имеет максимальный средний размер по меньшей мере в одном направлении примерно от 0,5 мкм до 25 мкм (например, примерно от 1 мкм до 20 мкм). Например, в одном из воплощений хлопья могут представлять собой плоские частицы, имеющие размеры в плоскости х-у и толщину в направлении z, с максимальным средним размером примерно от 0,5 мкм до 25 мкм (например, примерно от 1 мкм до 20 мкм), в то время как средние размеры в направлениях х и у будут больше. В одном из воплощений размол проводят при температуре размола примерно не выше 40°С и в течение времени, не превышающего критическое, чтобы замедлить агломерацию частиц Al (например, примерно 10 часов или менее).
Для того, чтобы получить совокупность частиц исходной смеси, размол можно проводить с использованием высокоинтенсивного процесса или низкоинтенсивного процесса, или с помощью любого другого устройства для уменьшения размеров, например, используя шаровую мельницу.
Однако размол и/или смешивание компонентов исходной смеси можно проводить в соответствии с одним из воплощений, в котором перед добавлением TiCl4 исходную смесь смешивают в жидкой форме (например, расплавленную, растворенную в каком-либо растворе и т.д.).
II. Реакции стадии 1 (восстановление Ti4+ до Ti3+ и Ti3+ до Ti2)
В первой зоне 110 твердые реакционные предшественники (например, исходную смесь 102) нагревают в инертной среде. В одном конкретном воплощении первая зона 110 находится в инертных условиях (например, в инертной атмосфере с общим давлением примерно от 50,5 КПа (0,5 атм) до 505 КПа (5 атм)), так, чтобы любой пар, присутствующий в первой зоне 110 (и в последующих второй и третьей зонах 112, 114), выделялся из реакционных продуктов стадии 1 и вводимых реакционных материалов, таких как TiCl4. Внутри реакционной камеры можно использовать, а можно и не использовать, проточный инертный газ. В одном из примеров воплощения перед добавлением TiCl4 исходную смесь нагревают. Например, в одном из конкретных воплощений реакционные предшественники нагревают в первой реакционной зоне до температуры предварительного нагрева, которая составляет примерно не более 160°С (например, примерно от 100°С до 140°С, примерно от 120°С до 135°С).
Затем, в первой зоне 110 и/или во второй зоне 112„ к нагретой исходной смеси, которая включает алюминий (Al), и может включать дополнительные материалы (например, AlCl3 и/или другие хлориды легирующих элементов), добавляют TiCl4. TiCl4 может представлять собой чистый жидкий TiCl4 или жидкий TiCl4, смешанный с хлоридами других легирующих элементов. В некоторых воплощениях смеси TiCl4 и другого хлорида (хлоридов) легирующих элементов можно нагреть, чтобы гарантировать, что полученный раствор не является насыщенным, что могло бы привести к выпадению компонентов в осадок из раствора. Один из примеров смешанных жидких предшественников включает смесь TiCl4 и VCl4, для получения содержащего ванадий титанового сплава. В TiCl4 (жидк.) можно растворить различные хлориды металлов (то есть AlCl3, VCl4, VCl3, MClx и т.д.); результат можно представить формулой (TiCl4)x(AlCl3)y(MClx)z, где М является любым подходящим металлом, как обсуждалось в тексте данного описания, а х, у и z представляют собой мольные доли конкретных компонентов солевого раствора. Такой солевой раствор можно в общем виде кратко обозначить как [Ti4+ : соль], при этом скобки [] представляют материал фазы раствора, имеющей Ti4+ в качестве основных компонентов растворителя, а «соль» представляет все второстепенные частицы или легирующие элементы.
То есть TiCl4 добавляют к нагретой исходной смеси для восстановления Ti4+ до Ti3+ (в первой зоне 110 и/или в начале второй зоны 112) и для восстановления Ti3+ до Ti2+ (во второй зоне 112). В реакциях стадии 1 в процессе 100 Ti4+ восстанавливают до Ti3+ алюмотермическим методом в первой зоне 110 и/или во второй зоне 112, при первой температуре реакции, а затем Ti3+ дополнительно восстанавливают до Ti2+, алюмотермическим методом, при второй температуре реакции, во второй зоне 112; при этом вторая температура реакции больше, чем первая температура реакции. В показанных примерах воплощения эти реакции проводят последовательно, при различных температурах, в одном реакторе, как отдельные стадии многостадийного процесса.
Не желая ограничиваться какой-либо конкретной теорией, полагают, что алюминий (например, в форме металлического алюминия или соли алюминия, такой как AlCl3 и/или AlClx), присутствующий в исходной смеси, восстанавливает Ti4+ в TiCl4 до Ti3+ посредством алюмотермического процесса при первой температуре реакции, при этом AlCl3 служит реакционной средой в форме раствора соли AlCl3. Не желая ограничиваться какой-либо конкретной теорией, полагают, что Ti4+ и Al растворяются в AlCl3 и в TiCl3(AlCl3)x, образованном из продуктов реакции исходной смеси, так что Ti4+ и Al могут прореагировать. Полагают также, что Al растворяется в соли в виде Al+ или Al2+, и что эти частицы Al диффундируют к Ti4+ и реагируют с образованием нового продукта реакции - TiCl3(AlCl3)х. Наконец, полагают, что Al растворяется в солевом растворе через слой AlCl3 или AlOCl, который защищает поверхность Al. Например, не желая ограничиваться какой-либо конкретной теорией, полагают, что Ti4+ в TiCl4 восстанавливается до Ti3+ в форме TiCl3, образующего комплекс с хлоридом (хлоридами) металлов, например, TiCl3(AlCl3)х, где х равно от 0 до 10 (например, х равно от 1 до 5), который является или непрерывным рядом твердых растворов от TiCl3 до AlCl3, или двумя растворами - обогащенным по TiCl3 TiCl3(AlCl3)х и обогащенным по AlCl3 TiCl3(AlCl3)х, где оба раствора обладают сходными кристаллическими структурами. Таким образом, полагают, что по существу все полученные частицы Ti3+ находятся в форме такого металло-хлоридного комплекса, а не в виде чистого TiCl3.
Как таковой полученный продукт реакции представляет собой солевой раствор на основе AlCl3, который включает частицы Ti3+. Подобно обсуждаемой выше [Ti4+ соли], различные хлориды металлов (то есть AlCl3, VCl4. VCl3, MClx и т.д.) растворяются в TiCl3 (твердом или жидком), что можно представить формулой (TiCl3)х(AlCl3)2(MClx)z, где М является любым подходящим металлом, ах, у и z представляют мольные доли в солевом растворе. TiCl3(AlCl3)x представляет собой разновидность более крупной фазы раствора, даже если все хлориды легирующих элементов, MClx, растворяются в этой фазе раствора. Кроме того, Ti4+ также растворяется в этих фазах раствора, что можно описать как обогащенную Cl область фазового поля на диаграмме состояния. Такой солевой раствор можно в общем кратко определить как [Ti3+ : соль], где скобки [] обозначают данный материал как фазу раствора, имеющую Ti3+ в качестве основных компонентов растворителя, а «соль» представляет все второстепенные частицы или компоненты сплава.
Например, восстановление Ti4+ до Ti3+ можно осуществить при первой температуре реакции примерно от 110°С до 200°С (например, примерно от 125°С до 180°С, например, примерно от 130°С до 175°С).
Эту реакцию можно осуществить по мере добавления TiCl4 к исходной смеси в виде твердого вещества и/или жидкости (например, при впрыскивании и/или барботаже), контролируемым образом, в нагретую исходную смесь, при первой температуре реакции, в пределах первой зоны 110. Например, TiCl4 можно добавлять непрерывно, или полунепрерывным образом. В показанном примере воплощения процесс стадии 1 представляет собой непрерывный реакционный процесс. Например, весь добавленный TiCl4 восстанавливают до соли Ti2+ в промежуточной смеси, так как механизм удаления в замкнутом реакционном процессе отсутствует (например, не имеется потока инертного газа для уноса избытка TiCl4); и движущей силой этого процесса является окисление Al, где стехиометрическое количество Al было окислено с получением [Ti2+ соли]. В исходную смесь можно добавить TiCl4 как таковой, в количестве, равном стехиометрическому количеству, необходимому для образования желаемого количества Ti3+ в промежуточной смеси. Избыток Al может присутствовать в первой зоне и/или во второй зоне, но также весь Al (тв.) должен быть потреблен к концу третьей зоны и в 108 (например, Al растворяется в [Ti2+ соли]).
В одном из воплощений восстановление TiCl4 проводят путем нагревания до температуры, которая превышает температуру кипения TiCl4 (то есть примерно 136°С), но ниже температуры, при которой Ti3+ восстанавливается далее (то есть примерно превышающей 180°С); например, до температуры примерно от 160°С до 180°С (например, примерно от 160°С до 180°С).
Однако отмечено, что А1 способен восстанавливать Ti4+ до Ti3+ и Ti3+ до Ti2+ при всех температурах, включая температуры ниже 20°С. Указанные выше температуры являются результатом кинетических ограничений и/или твердофазного переноса продуктов реакции. Также, не желая ограничиваться какой-либо конкретной теорией, полагают, что восстановление Ti3+ до Ti2+ не может происходить в то время как в продуктах реакции стадии 1 существует Ti4+ из-за правила фаз Гиббса и фазовых равновесий в системе Ti-Al-Cl-O. То есть окисление Al может, при одной и той же температуре, вызывать обе стадии восстановления, но последовательный аспект этих реакций вытекает из представленного предположения, что Ti4+ и Ti2+ не могут одновременно существовать в изолированной системе. Соответственно, реакции протекают последовательно таким образом, что по существу весь Ti4+ восстанавливается до Ti3+ до начала образования Ti2+ в системе. Таким образом, процесс восстановления проводят описанными здесь методами, последовательным образом.
Затем Ti3+ можно дополнительно восстановить до Ti2+ посредством алюмотермического восстановления во второй зоне 112, при второй температуре реакции. Например, восстановление Ti3+ до Ti2+ можно осуществить при второй температуре реакции примерно 180°С или выше (например, примерно от 180°С до 500°С; например, примерно от 180°С до 300°С). Не желая ограничиваться какой-либо конкретной теорией, полагают, что данная реакция может образовать соль Ti2+, например, в форме комплексного соединения TiCl2 с хлоридом (хлоридами) металлов, например, TiAlCl5 Ti(AlCl4)2 или их смесей. Например, не желая ограничиваться какой-либо конкретной теорией, полагают, что в этом процессе AlCl3 химически связывается в TiCl3(AlCl3)х, TiAlCl5 и {Ti(AlCl4)2}n. Из-за значительной химической активности этих соединений (например <1), AlCl3 не испаряется, как можно было бы предположить для чистого AlCl3, и значительного испарения AlCl3 не происходит до тех пор, пока реакционная температура не достигнет, или не превысит, значения примерно 600°С. Таким образом, AlCl3 обеспечивает в реакторе среду, которая позволяет реакции протекать, и AlCl3 обеспечивает химическое окружение, которое стабилизирует ион Ti2+ и позволяет Ti3+ превращаться в Ti2+ при температурах реакции, меньших чем примерно 250°С (например, примерно от 180°С до 250°С).
Не желая ограничиваться какой-либо конкретной теорией, обычно полагают, что имеется три возможных формы Ti2+ : (1) по существу чистый TiCl2, который растворяет лишь небольшое количество чего-либо; (2) TiAlCl5(тв.), который также не растворяет большого количества чего-либо еще и, возможно, стабилен только примерно до 200°С; и (3) {Ti(AlCl4)2}n, который, вероятно, является неорганическим полимерным материалом, существующим в виде жидкого, стеклообразного материала и мелкого порошка (молекулы с длинной цепью). То-есть {Ti(AlCl4)2}n имеет широкий диапазон (например, n может равняться от 2 примерно до 500; например, от 2 примерно до 100; например, от 2 примерно до 50; например, от 2 примерно до 10), что указывает на число повторяющихся блоков Ti(AlCl4)2; и растворяет все хлориды легирующих элементов. В результате продукт реакции, включающий Ti2+, представляет собой фазу на основе комплекса, находящегося между TiCl2 и AlCl3 (например, Ti(AlCl4)2 и т.д.). Такой комплекс может быть солевым раствором, который кратко можно обозначить [Ti2+: соль], где скобки [] представляют такой материал, как фазу раствора, имеющую AlCl3 в качестве основного химического соединения или растворителя; a Ti2+ и «соль» представляют второстепенные химические соединения или легирующие элементы.
В еще одном воплощении реакции, протекающие в пределах первой зоны 110 и второй зоны 112, могут протекать одновременно при температурах реакции, связанных со второй температурой реакции (например, примерно от 180°С до 500°С, например, примерно от 180°С до 300°С), путем добавления TiCl4 в исходную смесь при второй температуре реакции. В этот момент реакционного процесса можно добавить часть или весь TiCl4 (например, при температуре примерно от 180°С до 500°С, например, примерно от 180°С до 300°С).
В ходе этих реакций исходная смесь может оставаться по существу твердой в пределах первой зоны 110. В пределах второй зоны 112 и третьей зоны 114 продукт реакции может быть или твердым, или жидким; или одновременно и твердым, и жидким. Например, третья температура реакции может составлять около 200°С или выше (например, примерно от 200°С до 500°С, например, примерно от 250°С до 350°С), чтобы обеспечить полное восстановление всего Ti3+ до Ti2+, одновременно гомогенизируя полученную соль Ti2+. В конкретных воплощениях реакции проводят в реакторе со скребковой мешалкой, в ленточном смесителе или в различных других реакторах типа жидкость/твердое вещество/пар.
В некоторых воплощениях реакции стадии 1 можно проводить в инертной атмосфере (например, содержащей аргон). В ходе реакции восстановления можно избежать захвата кислорода (О2), паров воды (Н2О), азота (N2), оксидов углерода (например, СО, СО2 и т.д.) и/или углеводородов (например, СН4 и т.д.) алюминием и/или другими соединениями. В конкретных воплощениях инертная атмосфера имеет давление 1 атмосферу (например, примерно 101,3 КПа (760 мм Hg)) и примерно 5 атмосфер (например, примерно 506,54 КПа (3800 мм Hg)), например, примерно от 101,3 КПа (760 мм Hg) до 199,95 КПа (1500 мм Hg). Хотя в некоторых воплощениях можно использовать давления меньше чем примерно 101,3 КПа (760 мм Hg), в большинстве примеров воплощения это нежелательно из-за возможного притока кислорода, воды, оксида углерода и/или азота при таких более низких давлениях. Например, инертная атмосфера имеет давление 0,92 атмосферы (например, около 93,3 КПа (700 мм Hg) и около 5 атмосфер (например, около 506,54 КПа (3800 мм Hg), например, примерно от 93,3 КПа до 199,95 КПа (от 700 мм Hg до 1500 мм Hg). С другой стороны, реакции стадии 1 можно проводить в равновесии с паровой фазой, которая образуется из продуктов реакции внутри реактора (то есть без добавления инертного газа).
По завершении реакций стадии 1 промежуточная смесь покидает реакционные условия третьей зоны 114 в виде твердого вещества или жидкости и поступает в емкость 108 для хранения. Эта емкость для хранения может находиться при температуре около 200°С или выше (например, примерно от 200°С до 500°С, например, примерно от 250°С до 350°С) и при давлении 1 атмосфера (например, около 101,3 КПа (760 мм Hg)) и примерно 5 атмосфер (например, примерно 506,54 КПа (3800 мм Hg)). В качестве альтернативы промежуточную смесь можно охладить до температуры примерно ниже 100°С, например, примерно ниже 50°С. Например, твердую промежуточную смесь можно хранить при комнатной температуре.
В одном воплощении в промежуточной смеси, которая хранится в 108, отсутствует избыток Al. При хранении можно определить состав промежуточной смеси соли Ti2+ и откорректировать его, чтобы придать ей конкретный состав, необходимый для получения желаемого сплава Ti-Al. Таким образом, состав можно откорректировать желаемым образом путем добавления дополнительных легирующих элементов. Подобным образом, состав можно определить и откорректировать в третьей зоне 114.
Следует отметить, что промежуточная смесь будет содержать Al, растворенный в соли Ti2+, но не будет содержать частиц металлического Al.
III. Реакция стадии 2 (реакция диспропорционирования Ti2+ до Ti)
Ti2+ в составе соли Ti2+ (например, в форме TiCl2, образующего комплекс с Al и/или металлами) можно восстановить до сплава Ti посредством реакции диспропорционирования в реакциях 200 стадии 2, как показано на Фиг. 2; при этом соль Ti2+ добавляют в реакционную камеру 204 с обоих концов (например, одновременно добавляют с обоих концов). Например, Ti2+ можно восстановить до сплава Ti посредством эндотермической реакции диспропорционирования при температуре реакции диспропорционирования примерно 250°С или выше, например примерно 300°С или выше (например примерно от 300°С до 1000°С, например примерно от 500°С до 1000°С). Хотя в некоторых воплощениях третья температура реакции может доходить примерно до 1000°С, в других воплощениях третья температура реакции имеет верхний предел по температуре примерно 900°С. Например, Ti2+ может восстанавливаться до сплава Ti посредством реакции диспропорционирования при третьей температуре реакции примерно от 300°С до 900°С (например примерно от 300°С до 900°С, например примерно от 500°С до 900°С).
Обычно образование сплава Ti можно разделить на два процесса: зародышеобразование и рост частиц (который также можно назвать укрупнением частиц). В ходе зародышеобразования первый сплав Ti образуется из [Ti2+ : соли] при более низких температурах (например, примерно от 250°С до 400°С). Конечный состав сплава Ti определяется локальным составом соли (активностями компонентов), поверхностной энергией и кинетикой диспропорционирования. Затем происходит рост частиц, где сплав Ti продолжает расти из [Т12+ : соли] в сконденсированном состоянии при более высоких температурах (например, примерно от 400°С до 700°С), а при температурах выше 700°С (например, примерно от 700°С до 1000°С) в реакции типа газ-твердое вещество. Эти реакции, протекающие при более высоких температурах (например выше чем примерно 700°С) можно также описать как процесс дистилляции, где Cl удаляют из продукта - сплава Ti, что происходит одновременно с ростом частиц сплава Ti. Оба эти процесса основаны на реакции диспропорционирования, но могут образовывать сплавы Ti различных составов. Отмечено также, что реакция диспропорционирования происходит как для Ti, так и для Al, по следующим реакциям: Ti2+=1/3[Ti]+2/3Ti3+ и Al+=2/3[Al]+1/3Al3+.
Не желая ограничиваться какой-либо конкретной теорией, полагают, что поддержание третьей температуры реакции примерно ниже 900°С обеспечивает то, что любой кислород остается в виде стабильных соединений в паровой фазе и ограничивает загрязнение кислородом конечного продукта - сплава Ti. С другой стороны, при температурах реакции выше 900°С, содержащие кислород загрязняющие вещества более не находятся в форме летучих соединений, что в большей степени затрудняет восстановление остаточного кислорода. Любые другие летучие соединения, такие как оксихлориды или хлориды, и/или содержащий оксиды углерод, можно удалить термической перегонкой.
В одном из воплощений соль Ti2+, содержащую Ti2+, поддерживают при температуре реакции диспропорционирования до тех пор, пока по существу весь Ti2+ не прореагирует до материала титанового сплава. В этой реакции любой Ti3+, образованный в ходе реакций диспропорционирования, удаляют из реакционной камеры и собирают с целью переработки извне. Соответственно, Ti3+ удаляют из реактора посредством конденсаторов и/или десублиматоров, или в форме аэрозоля, в 204, то есть собирают в системе фильтров (где конденсатор, десублиматор и/или фильтр совместно обозначены 212, 216) в вентиляционной системе, и собирают в виде TiC13(AlCl3)х, который можно переработать вне устройства 200, изображенного на Фиг. 2. Подобным образом, любой Ti4+ (например, в форме TiCl4), который может быть получен в ходе другой реакции диспропорционирования, можно откачать из реакционной системы в виде газообразного побочного продукта для сбора и переработки извне.
В одном из воплощений реакцию стадии 2 (например, превращение Ti2+ в Ti сплав) можно осуществить в инертной атмосфере, например содержащей аргон. В конкретных воплощениях инертная атмосфера имеет давление 1 атмосфера (например, около 101,3 КПа (760 мм Hg)) и примерно 5 атмосфер (например, около 506,54 КПа (3800 мм Hg)); например, примерно от 101,3 КПа до 199,95 КПа (от 760 мм Hg до 1500 мм Hg).
Предпочтительным является применение в качестве технологического газа инертного газа с низким содержанием примесей (например, газообразного аргона с низким содержанием примесей; например, газообразного аргона высокой чистоты), чтобы минимизировать образование в этом процессе оксихлоридных фаз, таких как TiOClx и AlOClx, и существенно замедлить образование TiO, TiO2, Al2O3 и/или смесей TiO2-Al2O3. Также можно использовать другие инертные газы, такие как гелий или другие благородные газы, которые были бы инертными по отношению к реакционному процессу.
Например, Ti образуется в сплаве на основе Ti-Al из Ti2+ в солевом растворе (сконденсированного и парообразного) путем диспропорционирования и образования Ti3+ (сконденсированного и парообразного) в солевом растворе, как описано выше (Ti2+=1/3[Ti]+2/3Ti3+). В ходе реакции стадии 2 может образоваться пересыщенный пар [Ti2+ : соль], что приводит к росту частиц Ti сплава из пересыщенного пара. В некоторых примерах воплощения для того, чтобы способствовать непрерывному росту частиц из пара, с целью непосредственного нагревания поверхности частиц Ti сплава можно использовать сфокусированный энергетический луч.
Подобные соответствующие реакции диспропорционирования протекают одновременно для Al+/Al/Al3+ и других легирующих элементов, растворенных в солевых растворах и входящих в состав сплавов на основе Ti-Al. Таким образом, в ходе этих реакций диспропорционирования не образуются продукты из чистого Ti. Не желая ограничиваться какой-либо конкретной теорией или конкретной реакционной последовательностью, полагают, что образование сплава Ti-Al происходит посредством эндотермической реакции, которая включает повод тепла для смещения реакции в направлении продуктов Ti-Al сплава.
Сплав Ti-Al, полученный в вышеприведенных реакциях, может находиться в форме сплава Ti-Al, смешанного с другими металлическими материалами. Контролируя данную систему, можно получить мелкие, однородно легированные частицы желаемого состава, регулируя по меньшей мере температуру, давление, расход газа, отношение Al/AlCl3 и размер частиц/степень агрегации смеси Ti2+/Al/AlCl3, поступающей из 108 на реакцию стадии 2. Данный способ разработан таким образом, чтобы можно было иметь однородное смешивание и непрерывный поток через реакционную зону.
В качестве продукта реакций стадии 2 образуется титановый сплав, который включает элементы из реакционных предшественников и любых дополнительных легирующих элементов, добавленных в ходе реакции стадии 1 и/или реакций стадии 2.
Например, в качестве титанового сплава могут образоваться Ti-6Al-4V (в массовых процентах), интерметаллическое соединение Ti-4822 (48Al, 2Cr и 2Nb в атомных процентах). В одном из примеров воплощения титановый сплав находится в форме порошка титанового сплава, например, порошка сплава алюминида титана (например, Ti-6Al-4V, Ti-4822 и т.д.).
На Фиг. 2 показана в общем технологическая схема 200 одного из примеров воплощения реакции стадии 2. В качестве исходного материала служит промежуточный материал 108 - соль Ti2+ (образованный в ходе реакций стадии 1 приведенного в качестве примера процесса 100 Фиг. 1). В показанном воплощении промежуточный материал 108 - соль Ti2+ добавляют в нагретый реактор 202 (например, во вращающуюся печь), который включает реакционную камеру 204 и нагревательные элементы 206. Нагревательные элементы 206 могут нагревать промежуточный материал 108 - соль Ti2+ внутри реакционной камеры 204 до третьей температуры реакции, для проведения реакции диспропорционирования. В одном воплощении нагревательные элементы 206 могут нагревать отдельные зоны внутри реакционной камеры, чтобы изменять температуру внутри реакционной камеры по различным зонам. Ti сплав 210 можно собрать в емкость для сплава или в другой сборник. В одном из воплощений Ti сплав 210 находится в форме порошка.
Как показано на Фиг. 2, инертный газ 208 можно вводить в виде потока для регулирования реакционной атмосферы и переноса газообразных и аэрозольных хлоридов титана, хлоридов алюминия и их комплексов (например, TiAlCl6, AlCl3, Al2Cl6, TiCl3, TiOClx и/или пара AlOClx) из титанового сплава. Например, любые продукты Ti3+ и Ti4+ (например, TiCl4), полученные в ходе реакции, могут быть вынесены из реактора в виде отобранных побочных продуктов, которые можно рециркулировать на дополнительное восстановление. Таким образом, можно эффективно проводить реакцию без сколько-нибудь значительных отходов содержащих Ti материалов.
В примере воплощения Фиг. 2 инертный газ (например, аргон) может протекать через реакционную камеру 204, и из реакционной камеры 204 по вентиляционному каналу 205 в первую сублимационную камеру 212, где содержащие Ti3+ вещества (например, TiCl3-AlClx) повторно улавливают в первую емкость 214 для хранения. Например, первая сублимационная камера 212 может представлять собой конденсатор AlCl3 с температурой примерно от комнатной (например, около 20°С) до 100°С. В таком примере воплощения TiCl3 может образовывать туман в камере 204, при этом камера 212 представляет собой конденсатор A1Cl3, так что емкость 214 собирает AlCl3 (тв.), а камера 216 представляет собой систему фильтров, для сбора TiCl3 (тв.). Альтернативно, первая сублимационная камера 212 имеет, в одном из воплощений, температуру примерно от 200°С до 500°С и находится под таким же давлением, как и реакторы, чтобы выполнять функции конденсатора в диапазоне температур примерно от 200°С до 500°С. В этом воплощении TiCl3 не образует тумана в камере 204; в этом случае конденсатор 212 имеет температуру примерно от 200°С до 500°С для сбора TiCl3 (тв.), так что емкость 214 собирает TiCl3 (тв.), в то время как конденсатор 216 представляет собой конденсатор AlCl3, работающий при температуре примерно от комнатной (например, около 20°С) до 100°С; и AlCl3 (тв.) собирают в емкость 218. TiCl3 и AlCl3 рециркулируют как таковые.
Извлеченные таким образом Ti3+ заместители можно рециркулировать и снова ввести в реакции стадии 1 (например, с исходными материалами в первой зоне 110, показанными на Фиг. 1). Например, MXx в 101 может представлять собой TiCl3(AlCl3)x из 214, в дополнение к другим легирующим добавкам, так как в материале из 214 обычно присутствует небольшое количество AlCl3.
Затем, в воплощении Фиг. 2, инертный газ (например, аргон) может протекать через первую сублимационную камеру 212 и из нее, во вторую сублимационную камеру 216, где AlCl3 повторно улавливают во вторую емкость 218 для хранения. Инертный газ можно сбрасывать в атмосферу или очищать в скруббере, по желанию. В одном из воплощений первая сублимационная камера 212 имеет температуру примерно от 50°С до 150°С и находится под таким же давлением, как реактор. AlCl3 можно очистить/рециркулировать и снова ввести в реакции стадии 1 (например, вместе с исходными материалами в первой зоне 110, показанной на Фиг. 1).
Для определения окончания реакции можно применять мониторинг без остановки технологического процесса, путем измерения материального баланса, температуры, давления, химического состава технологического газа, химического состава продукта на выходе и химического состава побочных продуктов.
IV. Последующая переработка титанового сплава
После формирования титановый сплав можно переработать. Например, порошок титанового сплава можно переработать с целью укрупнения частиц, спекания, прямой консолидации, послойного наращивания, сплавления или сфероидизации.
Например, титановый сплав можно подвергнуть высокотемпературной обработке для очистки Ti сплава путем удаления остаточных хлоридов и/или создавая условия для диффузии, чтобы снизить градиент по составу; например, при температуре обработки примерно 800°С или выше (например, примерно от 800°С до 1000°С).
В одном из воплощений при высокотемпературной обработке также продолжаются реакции диспропорционирования с получением Ti сплава из остаточного Ti2+.
V. Примерные схемы процесса
Обращаясь к Фиг. 3, приведенная для примера технологическая схема 300 в целом изображает твердые исходные материалы 302, которые включают Al и AlCl3, подаваемые в устройство 304 для уменьшения размера частиц (изображенное в виде шаровой мельницы), с инертной атмосферой. В одном воплощении процесс активации поверхности Al и уменьшения размера частиц является непрерывным. Как установлено, уменьшение размера частиц позволяет увеличить площадь поверхности частиц, чтобы расширить доступность алюминия в последующих реакциях восстановления. Из устройства 304 для уменьшения размера частиц исходный материал 302 проходит через питатель 306 для твердых веществ и в реактор 308, где его нагревают в первой зоне 110, как описано выше (например, при первой температуре реакции примерно от 100°С до 160°С).
Затем исходный материал 302 последовательно проходит в реакторе 308 через первую зону 110, вторую зону 112 и третью зону 114. Устройство 310 для нагревания зон окружает реакционную камеру 309, чтобы независимо контролировать температуру внутри соответствующих зон 110, 112, 114. В конкретных примерах воплощения температура в первой зоне 110 составляет в диапазоне примерно от 100°С до 160°С, для введения TiCl4 с целью начала восстановления Ti4+ до Ti3+; температура во второй зоне 112 составляет в диапазоне примерно от 160°С до 250°С, чтобы восстановление Ti4+ до Ti3+ продолжалось до завершения процесса восстановления Ti3+ до Ti2+, а Al эффективно поглощался в конце второй зоны 112; и температура в третьей зоне составляет примерно от 200°С до 300°С, для гомогенизации и добавления дополнительных реакционноспособных легирующих элементов.
После того, как исходную смесь нагревают в первой зоне 112, как обсуждалось выше, из емкости 312 в реакционную камеру 309 подают TiCl4 в жидкой и/или парообразной фазе (например, в пределах зоны 313 нагревания) в различных пунктах первой зоны 112 и в начале второй зоны 112. TiCl4 добавляют к исходной смеси для восстановления Ti4+ до Ti3+ при второй температуре реакции примерно от 110°С до 200°С (например, примерно от 125°С до 180°С, например, примерно от 130°С до 175°С).
Затем Ti3+ дополнительно восстанавливают до Ti2+ при третьей температуре реакции (которая выше, чем вторая температура реакции), в третьей зоне 114, где в третью зону 114 можно ввести один или более хлоридов 106 легирующих элементов посредством питателя 314 для твердых веществ. Например, один или более хлоридов 106 легирующих элементов могут включать часть или все компоненты сплава, необходимые для достижения желаемого химического состава титанового сплава. Хлорид легирующего элемента представлен формулой MClx, где М является легирующим элементом, который включает металлы и другие элементы, которые могут быть включены в конечный сплав, при любой комбинации основных и второстепенных элементов. Особенно подходящие легирующие элементы включают, не ограничиваясь этим, алюминий, титан, ванадий, хром, ниобий, железо, иттрий, бор, марганец, молибден, олово, цирконий, кремний, углерод, никель, медь, вольфрам, бериллий, цинк, германий, литий, магний, скандий, свинец, галлий, эрбий, церий, тантал, осмий, рений, сурьму, уран, иридий и их комбинации. В конкретных воплощениях, например, CrCl2 и/или NbCl5 могут быть добавлены после того, как весь Al израсходован в процессе реакции, чтобы предотвратить их восстановление.
Например, восстановление Ti3+ до Ti2+ можно осуществить при третьей температуре реакции примерно 180°С или выше (например, примерно от 180°С до 500°С, например, примерно от 180°С до 300°С).
В показанном воплощении продукт реакции (то есть промежуточный продукт соль Ti2) подают из реакционной камеры 309 в емкость 316 для хранения, например, в форме комплекса TiCl2 с хлоридом (хлоридами) металлов, такого как TiAlCl5, Ti(AlCl4)2, или их смеси. Внутри емкости 316 для хранения промежуточный продукт - соль Ti2+ может оставаться в конденсированном состоянии и в инертной атмосфере. В конкретных воплощениях можно определить и отрегулировать состав промежуточного продукта - соли Ti2+, находящейся в емкости 316 для хранения, чтобы контролировать состав полученного Ti сплава. Не желая ограничиваться какой-либо конкретной теорией, полагают, что состав промежуточного продукта - соли Ti2+ в емкости 316 для хранения непосредственно связан с полученным Ti сплавом.
В одном из конкретных воплощений емкость 316 для хранения содержит датчики 317 для измерения состава находящейся в ней [Т12+ : соли]. Датчики 317 могут быть соединены с управляющим блоком 319 обратной связи, который связан с подающими устройствами и/или с реакционными зонами стадии 1, для регулирования состава [Ti2+ : соли], подаваемой в 316.
Из емкости 316 для хранения промежуточный продукт - соль Ti2+ подают во вращающуюся печь 320, или другую вращающуюся реакционную камеру, имеющую реакционную камеру 322 и устройство 324 для нагревания зон, где соль Ti2+ восстанавливают до Ti сплава посредством реакции диспропорционирования. Устройство 324 для нагревания зон служит для нагревания соли Ti2+ в ходе реакции диспропорционирования при температуре реакции диспропорционирования, как обсуждали выше (например, примерно от 300°С до 1000°С, например, примерно от 500°С до 900°С). Не желая ограничиваться какой-либо конкретной теорией, полагают, что температурная зона, в которой [Ti2+ : соль] добавляют в печь 320, непосредственно связана с составом образованного Ti сплава. Например, чтобы получить γ-TiAl, [Ti2+ : соль] можно добавлять с холодного конца и пропускать по возрастающему температурному профилю, например, с возможным использованием подпора и/или винтовой поверхности для того, чтобы регулировать время пребывания в различных зонах. В альтернативном случае, для образования α-[Ti], [Ti2+ : соль] можно добавлять с горячего конца, например, с применением вращающейся спирали для регулирования времени пребывания в горячей зоне (укрупнение частиц).
Продукт - Ti сплав можно собирать в емкости 326 для порошка сплава, в то время как другие продукты реакции можно отбирать в виде побочных продуктов в сублимационные камеры 327, 329, где содержащие Ti3+ соединения (например, TiCl3-AlClx) повторно улавливают в первой емкости 328 для хранения, а AlCl3 повторно улавливают во второй емкости 330 для хранения. AlCl3 можно дополнительно переработать (например, перегнать в перегонной камере 332 и сублимировать в сублимационной камере 334), чтобы его можно было рециркулировать и снова ввести в исходную смесь 302.
Данное описание использует примеры для раскрытия данного изобретения, включая наилучший режим его осуществления, а также чтобы дать возможность любому специалисту осуществить данное изобретение на практике, включая изготовление и применение любых устройств или систем и осуществление любых включенных способов.
Патентоспособный объем данного изобретения определен формулой изобретения и может включать другие примеры, с которыми могут встретиться специалисты. Предполагают, что такие другие примеры находятся в пределах объема формулы изобретения, если они включают структурные элементы, которые не отличаются от буквально изложенного в формуле изобретения, или если они включают эквивалентные структурные элементы с несущественными отличиями от буквально изложенного в формуле изобретения.
Реферат
Изобретение относится к получению титанового сплава Ti-Al. Исходную смесь, содержащую алюминий, возможно, AlClи, возможно, один или более галогенидов легирующего элемента, нагревают до температуры предварительного нагрева, затем вводят в исходную смесь TiClпри первой температуре реакции для восстановления по существу всего Tiв TiClдо Ti, затем производят нагрев до второй температуры реакции для восстановления по существу всего Tiдо Tiс получением промежуточной смеси, которая содержит соль Ti, и вводят промежуточную смесь в реакционную камеру при температуре реакции диспропорционирования с получением из Tiтитанового сплава посредством реакции диспропорционирования. Обеспечивается получение титан-алюминиевого сплава путем восстановления тетрахлорида титана. 19 з.п. ф-лы, 4 ил.

Комментарии