Гиалуроновая кислота и ее применение в лечении венозной недостаточности и варикозного расширения вен - RU2674478C2
Код документа: RU2674478C2
Чертежи





Описание
Область техники
Настоящее изобретение относится к области медицины, в частности к области заболеваний вен, таких как венозная недостаточность, варикозное расширение вен, эктазии или аневризмы у людей и животных. Изобретение также относится к области фармацевтических средств и медицинских устройств для лечения этих заболеваний.
Уровень техники
Кровеносные сосуды у людей и животных подразделяют на артериальные и венозные, в зависимости от того, течет ли кровь по ним от сердца (артериальные) или к сердцу (венозные).
Вследствие недостатка активности венозный застой крови появляется у все большего числа людей. Если человек не меняет свои привычки, застой крови переходит в недостаточность в течение нескольких лет. Недостаточность означает, происходит ослабление клапанов вен, что приводит к обратному току крови. В порочном круге недостаточность дополнительно усиливает застой венозной крови, и болезнь со временем прогрессирует. Варикозные вены - это поверхностные вены, которые подвергаются нагрузке кровью в течение многих лет, что обуславливает их большие диаметры и извилистую форму. Ослабленные вены встречаются у 21-25% людей в возрасте 35 лет и старше, а сосудистая сетка - у 50% людей (Uldis Maurins, Barbara Н. Hoffmann, Christian Losch, Karl-Heinz Jockel, Eberhard Rabe, FelicitasPannier: Distribution and prevalence of reflux in the superficial and deep venous system in the general population - results from the Bonn Vein Study, Germany. Journal of Vascular Surgery, Vol 48, Issue 3, Sept. 2008, 680-687).
Помимо косметических проблем, венозная недостаточность и варикозное расширение вен приводят к значительным осложнениям вследствие застоя крови и недостаточного кровообращения в пораженных конечностях. Осложнения включают боль, тяжесть, неспособность ходить или стоять в течение многих часов, кожное воспаление, повреждение кожи, предрасположенность к увяданию кожи или кожные язвы, особенно в области лодыжки, обычно называемые венозными язвами, тяжелые кровотечения от незначительной травмы, свертывание крови в пораженных венах (тромбофлебит, тромбоз, эмболические осложнения). В более чем 100 случаях сообщается даже о развитии рака или саркомы в застарелых венозных язвах. Согласно опубликованным данным, степень злокачественного превращения составляет от 0,4% до 1% (Goldman М. Sclerotherapy, Treatmentof Varicose and Telangiectatic Leg Veins. Hardcover Text, 2nd Ed, 1995).
Широко используемой средством лечения расширенных вен является хирургическое удаление целевой структуры, например, варикозных вен. Однако, как и любое хирургическое лечение, оно может сопровождаться несколькими довольно серьезными побочными эффектами, такими как повреждение прилегающих артерий, нервов или лимфатических сосудов, образование ран и шрамов, раневых инфекций или непереносимость пациентом наркотических лекарственных средств.
Как альтернатива хирургическому удалению были разработаны различные способы склерозирующей терапии.
Цель склерозирующей терапии - перманентное смыкание обработанной вены или сегмента вены. Такой эффект может быть достигнут за счет эндоваскулярной термообработки (например, лазером, радиочастотой, паром) или инъекции химических веществ (жидкости, пены). Вследствие использования катетеров и зондов, применение термообработки ограничивается линейными сосудами, тогда как химические вещества могут достигать и изогнутых сегментов.
Действие всех этих методов заключается в денатурации функциональных белков в глубочайшем слое ткани (эндотелиальный слой клеток). Действие может достигать даже мышечного слоя вены. Указанный процесс денатурации вызывает сокращение ткани, что приводит к окклюзии целевой структуры. Только те части стенки сосуда, в которые в достаточной степени проникает склеротический агент как ожидается, могут быть закрыты перманентно, поскольку неповрежденный эндотелий восстанавливается, что приводит к обратному патологическому току крови.
Все процедуры склерозирующей терапии в той или иной степени связаны с локальным спазмом вены, вследствие воздействия на мышечный слой. Спазм в целом не длится дольше минуты сверх времени действия методики, хотя было бы желательно поддерживать его для нормализации диаметра сосуда. Реальное начальное сокращение может быть достигнуто только в том случае, если действие достигает глубокого мышечного слоя. С другой стороны, с увеличением воздействия на мышечный слой увеличивается опасность перфорации, а также боль в процессе лечения и после него.
Известные жидкие склерозирующие лекарственные средства представляют собой например, спирты со свойствами детергента, такие как полидоканол или тетрадецилсульфат натрия. Жидкое склерозирующее лекарственное средство вводят в сосуды. Вследствие его высокой текучести жидкое склерозирующее лекарственное средство течет с кровотоком и быстро смешивается с кровью, что вскоре приводит к неэффективному разбавлению. Белковые связи дополнительно ограничивают действие этих жидких компонентов.
Для преодоления некоторых недостатков жидких склерозирующих лекарственных был разработан способ получения пенного склерозирующего лекарственного средства путем смешивания жидкого склерозирующего лекарственного средства с газом. Полученное пенное склерозирующее лекарственное средство вводят в целевую структуру, например, варикозную вену. Для вспенивания склерозирующее лекарственное средство (например, тетрадецилсульфат натрия или полидоканол) смешивают со стерильным воздухом или физиологическим газом (диоксидом углерода) в шприце или с применением механических насосов.
Вспенивание увеличивает площадь поверхности лекарственного средства. Благодаря большим густоте и вязкости пенное склерозирующее лекарственное средство более эффективно вызывает склероз, чем жидкое склерозирующее лекарственное средство (уплотнение стенки сосуда и прекращение тока крови; Yamaki Т, Nozaki М, Iwasaka S (2004). "Comparative study of duplex-guided foam sclerotherapy andduplex-guided liquid sclerotherapy for the treatment of superficial venous insufficiency", DermatolSurg 30 (5): 718-22), поскольку оно не смешивается с кровью в сосуде и фактически вытесняет ее. Однако пенные склерозирующие лекарственные средства, известные в технике, все же быстро распадаются в сосудах. Из-за этого склерозирующее лекарственное средство вымывается из целевой структуры. Следовательно, пенные склерозирующие лекарственные средства, известные в технике, недостаточно пригодны для лечения больших целевых структур, поскольку они только вызывают болезненные воспалительные реакции, но не обеспечивают устойчивую окклюзию целевых К заявке №2014124987 структур. Кроме того, известные пенные склерозирующие лекарственные средства имеют значительно более низкую плотность, чем кровь. Это приводит к плаванию пены склерозирующего лекарственного средства в крови в сосудах. Из-за этого склерозирующее лекарственное средство часто не достигает всех участков сосуда в целевой структуре.
После лечения больного сосуда описанным выше образом расширение сосуда или аневризма могут сохранять большой объем. Давление на соседние нервы, сосуды или органы может сохраниться, несмотря на окклюзию больного сосуда. Чем больше диаметр больной вены, тем выше риск рецидива.
В случае облитерации увеличенных сосудов, в частности, обработки пенным склерозирующим лекарственным средством, было бы полезно располагать веществом, которое может применяться посредством инъекции вокруг расширенного или аневризматического сосуда для ограничения его диаметра. Действие большинства веществ, таких как солевые растворы, слишком кратковременно. Также было бы полезно иметь вещество для компрессии расширенных вен (или клапанных зон вены) на период от нескольких дней до нескольких недель, пока релаксация не восстановит функцию вены.
Соответственно, в настоящем изобретении эти проблемы решаются путем обеспечения водного раствора, содержащего от 0,1% до 3% гиалуроновой кислоты, и инъекционного набор для параваскулярного ввередния.
WO 2011/037912 относится к улучшению восстановления ткани. В нем гликозаминогликан применяется для активации тромбоцитов, то есть восстановления ткани.
Определения
Следующие определения даны для специальных терминов, которые применяются ниже.
В настоящем тексте гиалуроновая кислота применяется в том же значении, что и гиалуронан, и гиалуронат. В настоящем тексте этот термин относится к анионному несульфатированному гликозаминогликану.
Гиалуронан встречается во многих тканях тела, таких как кожа, хрящ и стекловидное тело. Первый биомедицинский препарат гиалуронана, Healon, был разработан в 1970-е и 1980-е гг.компанией Pharmacia, и одобрен для применения в глазной хирургии (а именно, в трансплантации роговицы, хирургии катаракты, хирургии глаукомы и хирургии восстановления отслоения сетчатки).
Нативный гиалуронан имеет относительно короткий период полураспада, и различные технологии производства фактически создавались с целью удлинить цепь и стабилизировать молекулу для ее применения в медицинских приложениях.
Использовались такие методики, как введение поперечных связей в белок, введение 10 молекул, захватывающих свободные радикалы, таких как сорбит, и минимальная стабилизация цепей ГК химическими веществами, например, стабилизация гиалуроновой кислоты неживотного происхождения (NASHA).
Управление по контролю качества пищевых и лекарственных веществ США (FDA) быстро одобрило Healon как хирургическое средство в 1980 г., и Healon был успешно выпущен на рынок.
Гиалуронан также применяют в лечении остеоартрита колена. Такое лечение, названное вискосапплементарной терапией, применяют в форме курса инъекций в коленный сустав, и считается, что оно повышает вязкость синовиальной жидкости и обеспечивает смазывание сустава, амортизацию сустава, а также оказывает болеутоляющее действие. Также предполагалось, что данный гиалуронан оказывает положительное биохимическое действие на клетки хряща.
Гиалуронан может также применяться после операции для стимуляции заживления ткани, особенно после хирургии катаракты. Данные модели заживления ран предлагают более крупные полимеры гиалуроновой кислоты, образующиеся на ранних стадиях заживления, для физического создания места для лейкоцитов, которые служат медиаторами иммунной реакции.
В 2007 г. ЕМА (Европейское агентство лекарственных средств) зарегистрировало Hylan GF-20 как средство для лечения боли при остаоартрите лодыжки и плеча.
В ветеринарии гиалуронан применяется в форме внутривенных инъекций от 10 мг (собакам) до 40 мг (лошадям) для лечения артрита. В медицине не установлены объемы внутривенных инъекций, хотя публикаций о каком-либо неблагоприятном эффекте не было. Гиалуронан применяется во многих препаратах для перорального приема, но эффективность в лечении артроза или артрита не была доказана.
Гиалуронан также применяется в анти-адгезивных препаратах, таких как Hyalobarrier, широко используемый в хирургии тазовой и брюшной областей для предотвращения послеоперационных адгезий.
Гиалуронан является распространенным ингредиентом средств для ухода за кожей.
В 2003 г. FDA одобрило гиалуронан для наполнения дефектов мягкой ткани, таких как лицевые морщины. Restylane является распространенной торговой маркой препарата. Инъекции гиалуронана временно сглаживают складки посредством добавления объема под кожей, эффект обычно длится до шести месяцев.
Juvederm является впрыскиваемым наполнителем на основе бактериальной гиалуроновой кислоты, подобным Restylane, но немного отличающимся с точки зрения эффекта и продолжительности действия. Он применяется для увеличения губ, уменьшения складок и морщин и удаления шрамов. Эффекты лечения препаратом Juvederm также являются временными, стоимость аналогична Restylane.
Например, Restylane вводят под морщины и линии старения на лице, такие как носогубные складки (линии от носа до рта), губоподбородочные складки (углы грустного рта), " гусиные лапки" и морщины лба (межбровные складки). Он также может применяться для наполнения связанных со старением лицевых впадин и "орбитальных впадин" (под глазами и вокруг них), а также для обеспечения объема щек и формирования контура подбородка, лба и носа. Restylane может также применяться для восстановления кожи за счет увеличения эластичных структур кожи, без цели добавления объема, например на лице, руках и декольте.
Продолжительность зависит от таких факторов, как тип кожи индивидуума, образ жизни и возраст. После базовой терапии обычно рекомендуют дополнительные процедуры примерно каждые 6-12 месяцев в зависимости от индивидуума и терапии.
Лечение губ длится примерно 6 месяцев. Действие некоторых типов Juvederm длятся 12 месяцев.
Подробное описание изобретения
Изобретение относится к вводимому путем инъекций водному вязкому раствору, например в форме жидкости, геля или гидрогеля. Вязкий раствор предпочтительно имеет период полураспада в соединительной ткани человека более 1 недели. Специалисту понятно, что период полураспада будет зависеть от того, применяется ли раствор в независимой терапии или в качестве сопутствующей терапии. Соответственно, в некоторых случаях период полураспада предпочтительно больше 1 месяца, более предпочтительно больше 3 месяцев, наиболее предпочтительно больше 6 месяцев или даже 12 месяцев. В других случаях период полураспада составляет от 1 недели до 3 лет, предпочтительно от 1 до 12 недель, более предпочтительно от 4 до 6 недель.
Термин "вязкий" здесь обозначает раствор, который может быть легко введен через описанный здесь катетер в ткань, но все же имеет определенную плотность, за счет которой композиция сохраняется в ткани в течение долгого времени. Предпочтительные значения вязкости □. лежат в диапазоне от 10 до 5000 мПа*с, предпочтительно от 20 до 5000 мПа*с, более предпочтительно от 30 до 2000 мПа*с.В другом аспекте вязкость лежит в диапазоне от 20 до 1000 мПа*с, от 50 до 2000 мПа*с или от 50 до 1000 мПа*с. Так как вязкость зависит от температуры, пригодность для инъекций должна быть дана при рабочей температуре, например, между 20°С и 40°С.
Плотность раствора предпочтительно близка к плотности обрабатываемой ткани. В большинстве случаев ткань будет жировой. Соответственно, предпочтительно, чтобы значение плотности находилось между 0,7 и 1,2 кг/л, более предпочтительно между 0,0 и 1,1 кг/л, наиболее предпочтительно между 0,9 и 1,0 кг/л или примерно 0,94 кг/л.
Гель представляет собой твердый желеподобный материал, который может иметь свойства от мягкого и рыхлого до твердого и плотного. Гели определяют как существенно разбавленную поперечно-связанную систему, которая в стационарном состоянии не проявляет текучести. По массе гели являются по большей части жидкими, однако ведут себя как твердые вещества за счет трехмерной поперечно-сшитой сети в жидкости. Именно поперечные сшивки в жидкости придают гелю его структуру (жесткость) и способствуют липкости (клейкости).
Гидрогель представляет собой сеть полимерных цепей, которые являются гидрофильными, иногда имеет форму коллоидного геля, в котором вода играет роль дисперсионной среды. Гидрогели являются высоко абсорбирующими (могут содержать более 99,9% воды) природными или синтетическими полимерами. Гидрогели также обладают степенью гибкости, очень близкой к природной ткани, вследствие значительного содержания воды в них.
Раствор предпочтительно включает одно или более из следующих соединений: полимолочную кислоту, альгинат, гиалуроновую кислоту, в частности гиалуроновую кислоту, описанную здесь, и жировую ткань (телесный жир). Полимолочная кислота, например, применяется в косметической терапии морщин и демонстрирует более длительное пребывание в коже человека, чем поперечно-сшитая гиалуроновая кислота. Жировую ткань для настоящей цели измельчают и фильтруют или обрабатывают другим подобным способом чтобы ее можно было ввести через тонкую канюлю (размеры катетера см. ниже).
В одном варианте реализации изобретение относится к водному раствору, содержащему от 0,1% до 3% гиалуроновой кислоты, предпочтительно от 0,25% до 2% гиалуроновой кислотой, еще более предпочтительно от 0,5 до 1% гиалуроновой кислоты, предпочтительно поперечно сшитой 1,4-бутандиолдиглицидиловым эфиром (BDDE). Процент здесь характеризует концентрацию по массе, то есть, например, грамм на литр.
Известны различные методы достижения некоторого периода действия (срока службы), определенного выше, или изменения периода действия. Например, раствор может быть объединен с 2-(диэтиламино)-этилдекстраном (также известным как Sephadex DEAE А25), гипромеллозой (гидроксипропилметилцеллюлоза, НРМС). В альтернативном варианте соединение(-я) в растворе могут быть поперечно-сшитыми. Таким образом, получаемый раствор в предпочтительном случае является биосовместимым и не вызывает длительных раздражений или воспалений. Специалисту понятно, что период полураспада такого раствора больше, чем у раствора без указанных модификаций, потому что в этом случае досутп разрушающих ферментов, таких как гиалуронидазы, к участкам расщепления молекул затруднен. Сопоставимые стабильные свойства имеют так называемые гипер-изогнутые стабилизированные гиалуроновые кислоты.
В одном из вариантов реализации раствор дополнительно содержит ингибирующие агенты. Ингибирующие агенты здесь обозначают агенты, способные ингибировать разрушение одного или большего числа соединений в вязком растворе. Например, агенты, имеющие структуру подобную полисахаридам, ингибируют разрушение гиалуроновой кислоты, например, гепарин, пектины растительного происхождения и альгиновые кислоты, каждый из которых проявляет гелеподобные свойства в растворе. Пектин растительного происхождения может представлять собой яблочный пектин. В некоторых случаях способность проникать в ткань слишком слаба. В этом случае более эффективны сапонины, такие как глицирризиновая кислота и глицирретиновая кислота (агликон), каждая из которых содержится в экстракте лакрицы, и аэсцин (из экстракта семени конского каштана). Это относится также к флавонидам.
В дополнение к ингибирующему веществу или вместо него, раствор может также включать одно или более эндогенных веществ. В одном из вариантов реализации указанное вещество способно образовывать поперечные связи с соединением в растворе. Например, смесь гиалуроновой кислоты и эндогенного вещества образует поперечные связи. Такое эндогенное вещество в предпочтительном варианте является веществом, приводящим к образованию сгустка фибрина. В качестве такого вещества могут использоваться искусственные гематомы из аутологичной крови. Однако предпочтительно применять аутологичную кровь или фракции аутологичной крови (тромбоциты, факторы свертывания крови и/или подобное). В некоторых случаях удобно применять кровь без эритроцитов, во избежание обесцвечивания. В частности, в целях обеспечения долговременных венозных структур (лечение недостаточности клапана) это является экономически целесообразным решением.
Среди способов лечения венозной недостаточности, варикозного расширения вен и других заболеваний, связанных с расширением вен, в настоящее время предпочтительны нехирургические, основанные на применении катетера окклюзионные способы, такие как радиочастотный, способы с применением лазера, пара, пенного склерозанта или клея. За исключением клея, ни один из этих способов не способен сразу закупорить целевой сосуд с необходимым уменьшением диаметра. Клей запечатывает сосуд контактом от стенки до стенки, но во всех других способах требуемое уменьшение просвета займет от нескольких недель до месяцев. Кровь повторно проникнет в целевую вену, несмотря на внешнее сжатие, обеспечиваемое бандажами, чулками или локально наложенными давящими повязками. Чем больше крови содержится в сосуде, тем дольше продолжается процесс всасывания, и тем выше риск, что всасывание будет сопровождаться с воспалением и болью.
Вместе со способами термической окклюзии обычно применяют тумесцентную анестезию. Тумесценция означает растворение локальных соединений ткани. Способ был разработан для липосакции и осуществляется путем распределения большого количества солевого раствора с местным анастетиком и необязательными добавками, такими как бикарбонат, эпинефрин или кортикоидами, вводимого в жировую ткань инъекцией вручную или с применением насосов. Цель способа заключается в отделении липоцитов друг от друга и от соединительной ткани для обеспечения последующего процесса вакуумирования (Klein, J. (2000). Tumescent Technique: Tumescent Anesthesia & Microcanullar Liposuction. St. Louis, Missouri: Mosby, Inc, 2000).
Применение тумесцентной анестезии во внутривенных способах означает введение больших количеств раствора (США: 400-600 мл для сегмента вены длиной 40 см) в соединительную ткань, прилегающую к целевой вене. Это помогает уменьшить просвет вены во время лечения, что способствует более однородному распределению энергии, но эффект исчезает в течение нескольких часов. Растворов HAES или других крупных молекул было не достаточно, так как эффект исчезал в течение нескольких дней. Если применять сжатие вены жидкостью или гелем, они должны находиться строго вокруг целевого сосуда, а не распределяться по обширной области, проникая во все виды окружающих тканей. На практике из-за больших количеств жидкостей, сама тумесцентная анестезия часто является болезненной для пациента.
Желаемое сжатие достигается за счет вещества (раствора), который пригоден для введения путем инъекции как жидкость, но не проникает в соединительную ткань. Это означает, что существует баланс между легкостью введения (низкое усилие) и способностью проникать в соединительную ткань, которая приводит к снижению периода действия раствора. В предпочтительном случае раствор можно ввести с усилием менее 50 Н. В отдельном варианте реализации указанное усилие составляет от 7,5 до 15 Н (нормальное усилие) в другом варианте реализации от 15 до 50 Н (высокое усилие). Оказывается, это хорошо видно при ультразвуковой визуализации с различимым сигналом. Период полураспада гиалуроновой кислоты при концентрации согласно настоящему изобретению составляет 2-8 недель для каждой процедуры. После 8 недель не остается пальпируемых или видимых остатков.
Автор изобретения неожиданно обнаружил, что специальный водный раствор гиалуронана может весьма эффективно применяться в лечении венозные заболевания. Соответственно, далее изобретение описано подробно для гиалуроновой кислоты. Однако настоящее открытие применимо в целом к любым растворам, описанным здесь.
Авторы изобретения обнаружили, что в отличие от тумесцентной анестезии, раствор гиалуронана не проникает в соединительную ткань по механизму диффузии. У пациентов раствор гиалуронана располагался точно вокруг целевой вены, и очень небольшие количества, примерно 1-2 мл на сантиметр (40-80 мл для сегмента вены длиной 40 см), позволяли достичь достаточного сжатия вены. Это также верно для вязкого раствора, описанного здесь.
Применение раствора согласно изобретению влазерной терапии (длина волны: 810 нм, энергия: 100 Дж/см) недостаточности подкожных вен (диаметр 6,2-10,8 мм; 8 случаев) позволяло снизить время обратного развития от состояния перед лечением до целевого диаметра 25% может быть снижено от 33 - 98 дней с применением тумесцентной анестезии.
В другом продолжающемся предварительном исследовании две аневризмы вен размером 18 и 25 мм были нормализованы по диаметру до 6 и 7,5 мм с применением 3 мл раствора или композиции согласно изобретению, и этот уменьшенный диаметр сохранялся в течение всего 90-дневого периода времени наблюдения.
Для применения в окклюзионной терапии вен предпочтительно, чтобы раствор гиалуронана имел период полужизни в месте инъекции от 2 до 8 недель. Следовательно, другой способ описания гиалуроновой кислоты в водном растворе - по значению периода его полужизни (также см. выше).
Изобретение может также применяться для воздействия на форму расширенных и ослабленных участков клапанов за счет уменьшения диаметра. Действие можно контролировать непосредственно путем допплеровской ультразвуковой визуализации с цветовым кодом. Если больной клапан вены восстановлен в том смысле, что остановлен обратный ток крови и установлен прямой ток, то ранее пораженная вена может ослабнуть и сжаться из-за снижения нагрузки кровью. Поэтому нормальная функция вены может быть восстановлена путем модулирования формы пораженных зон клапанов. Этот принцип опробован в хирургическом методе, называемым экстралюминальной вальвулопластикой, посредством имплантации околовенозной манжеты (В. Geier, I. Voigt, L. Barbera, В. Marpe, М. Stiicker, S. El Gammal, A. Mumme: Extraluminal Valvuloplasty in Insufficiency of V. saphena magna; Phlebologie 2004, Vol. 33:5; 145-185).
Раствор или композиция для описанного выше лечения обладает множеством преимуществ: раствор - неиммуногенный, биосовместимый, неживотного происхождения, очень хорошо связывает воду и очень хорошо всасывается в организме.
Гиалуронан (также называемый гиалуроновой кислотой или гиалуронатом) представляет собой анионный несульфатированный гликозаминогликан, широко распространенный в соединительной, эпителиальной и нервной тканях. Это единственный несульфатированный гликозаминогликан, образующий в плазматической мембране комплекс Гольджи, он может быть очень крупным, его молекулярная масса может достигать миллионов.
Гиалуронан представляет собой полимер дисахаридов, состоящих, в свою очередь, из остатков D-глюкуроновой кислоты и D-N-ацетилглюкозамина, соединенных перемежающимися 0-1,4 и 0-1,3 гликозидными связями; см. Фиг. 1. Гиалуронан может содержать до 25 000 дисахаридных повторов в цепи. Размер полимеров гиалуронана в организме может составлять от 5000 до 20 000 000 Да. Средняя молекулярная масса в синовиальной жидкости человека составляет 3-4 миллиона Да., а у гиалуронана, выделенного из человеческой пуповины, 3 140 000 Да.
Предпочтительно, чтобы гиалуроновая кислота имела массу от 1 миллиона до 8 миллионов Да, более предпочтительно от 2 до 6 млн. Да, более предпочтительно от 3 до 5 млн. Да, наиболее предпочтительно - приблизительно 4 миллиона Да (+/-20%).
Гиалуронан получают посредством бактериальной ферментации с дальнейшей фильтрацией и дополнительной термической обработкой. Дополнительно может быть проведено удаление возможно присутствующих эндотоксинов. Термическая стерилизация может сократить длину молекулярных цепей.
Гиалуронан энергетически стабилен, что частично обусловлено стереохимией составляющих его дисахаридов. Объемные группы на каждой молекуле сахара находятся в стерически предпочтительных положениях, тогда как водородные группы меньшего размера занимают менее удобные аксиальные положения.
Один из предпочтительных растворов получают посредством поперечного сшивания гиалуроновой кислоты (НА) 1,4-бутандиолдиглицидиловым эфиром (BDDE). Такой раствор проходит все тесты биосовместимости. BDDE является сенсибилизатором, а также было обнаружено, что он является мутагеном для дрозофил (Foureman et al, Environ Mol Mutagen 1994; 23(1):51-63). Для выяснения вопроса о потенциале канцерогенности остаточного BDDE (2 ppm), присутствующего в устройстве, можно обратиться к исследованию BDDE на животных, проведенному компанией CIBA-GEIGY на животных. Исследователи, проводившее указанное исследование на животных, не сочли, что его результаты позволяют сделать вывод о том, что BDDE является системным канцерогеном. Поэтому на сегодняшний день BDDE считается наименее токсичным поперечно-связывающим реагентом.
В некоторых вариантах реализации раствор может дополнительно содержать местный анастетик. Это может быть скандикаин, мепивакаин, кокаин, прокаин, бензокаин (Ethoform), лидокаин, мепивакаин, бупивакаин, ропивакаин, этидокаин, прилокаин и тетракаин, а также другие. Для предотвращения периваскулярных воспалений могут применяться кортикоиды. Дополнительные вещества могут быть добавлены для задержки или ускорения всасывания НА или соединений в композиции.
Интенсивность сигнала вещества может быть различной, от равной сигналу воды до более высокой, чем интенсивность сигнала тканей человека, чего достигают добавлением небольших количеств газа (диоксида углерода, кислорода, воздуха или их смеси), например, 1-10 об. -%, и подготовкой вводимой смеси. В отличие от подобных воде жидкостей, пузырьки газа в гиалуронане будут стабильны в течение от нескольких минут до часов вследствие того, что по вязкости он близок к гелю.
Обычно желаемый ультразвуковой сигнал равен сигналу воды, поскольку это обеспечивает лучшее представление о вене и эндолюминальных инструментах, но при некоторых показаниях (например, аневризма) может быть предпочтительным применение ультразвукового паттерна, сильно отличающегося от воды для облегчения различения аневризмы и сжимающего вещества.
Предпочтительное значение рН раствора 7,2±0,1.
Раствор может дополнительно включать СО2, О2, воздух или их смеси, в количествах 1-10%.
Изобретение также относится к предложенному раствору для применения в качестве лекарственного средства.
В предпочтительном варианте раствор применяют для лечения дилатационных заболеваний или эктазирующих заболеваний вен. Соответственно, изобретение также относится к способу лечения пациента с заболеванием вен. В предпочтительном варианте заболевание вен характеризуется расширенными венами.
Заболевание вен в предпочтительном варианте выбрано из группы, включающей венозную недостаточность, расширение вен, варикозное расширение вен, эктазий или аневризм.
Объем раствора, например, раствора гиалуронана, для одного пациента может составлять от 3 мл (например, при малых аневризмах) до 200 мл (например, при длинных эктазированных венах).
Изобретение также относится к набору, включающему раствор согласно приведенным выше признаками и одно из следующего: полую иглу, катетер и/или трубку. В предпочтительном варианте катетер представляет собой систему катетеров, описанную ниже.
Система катетеров здесь представляет собой медицинское устройство, которое может быть введено в тело для лечения заболеваний, в частности заболеваний вен. Система катетеров согласно изобретению включает иглу для пункции сосудов с двойным или тройным резом кончика, которые подходят для легкой пункции кожи, и внешнюю канюлю. Внешнюю канюлю наиболее уместно называть катетером, хотя катетеры обычно изготавливают из резины. Материал известных катетеров был бы в большинстве случаев слишком непрочным для изготовления данной системы катетеров. Соответственно, описанная здесь система катетеров и катетер (внешняя канюля) отличаются от известных описанными здесь характеристиками. Катетеры или трубки, близкие к необходимому типу, известны в биопсии, где они служат внешней частью (неразрезающим элементом). Иглы для тумесцентной анестезии в липосакции представляют собой либо острые канюли, либо подобные трубкам инструменты со множеством боковых отверстий для быстрой инфильтрации ткани.
Система катетеров согласно изобретению значительно отличается от всех существующих систем коаксиальных катетеров или игл, поскольку до сих пор не существовало конструкции для целей настоящего изобретения, то есть для безопасного применения вязких растворов вокруг сосудистых структур.
Прямые коаксиальные системы для внутрисосудистого применения широко распространены и применяются для введений, переливаний или взятия образцов крови. Они состоят из полой иглы с острым кончиком, проникающей через слои ткани, и второй внешней трубки из пластикового материала, которая остается в сосуде после удаления внутренней иглы. Такие пластиковые трубки слишком мягки и склонны к образованию петель чтобы применять их в качестве управляемой тупоконечной канюли для распределения гелей или жидкостей снаружи сосудов.
Системы коаксиальных трубок, обычно используемые для биопсии, содержат твердый внутренний элемент, который замещает материал ткани и позволяет аспирировать образец при помощи внешней трубки. Цель состоит в срезании и сборе образцов ткани. Существует несколько систем коаксиальных игл для биопсии, состоящих из двух острых полых структур. Не существует системы для биопсии, содержащей одну тупоконечную и одну острую трубки без отверстий.
Существуют коаксиальные системы для поясничной анестезии, но они не являются прямыми и не подходят для данной анатомии. Кроме того, они жесткие, что препятствует проникновение в оказывающее сопротивление соединительную ткань околопоясничной области.
Канюли для липосакции выполняют из металла с минимальной гибкостью, но это инструменты только с одной трубкой, обычно с закрытым закругленным кончиком и боковым отверстием около кончика для сбора липоцитов.
Наконец, существует несколько конструкций, называемых "безопасная канюля", состоящих из канюли с острым кончиком для прокалывания, и устройства для закрытия этот острого кончика при извлечении канюли во избежание повреждений. Другие конструкции позволяют вводить полые иглы в катетер и извлекать их из него, эндоскоп или другие инструменты. Однако это не относится к очень гибким коаксиальным инъекционным трубкам.
В отличие от вышеописанного катетера, включающего две коаксиальные прямые трубки (канюли), открытые с обеих сторон: одну трубку с острым концом, т.е. иглу, и вторую трубку с тупым концом, т.е. внешнюю часть; здесь также обозначена внешняя канюля (неразрезающий элемент). Обе трубки являются гибкими и/или эластичными. Трубки составлены на расстоянии, обеспечивающем легкое перемещение, но предпочтительно не совершать вручную существенных манипуляций, направляя кончик движением рукояти. Система обеих трубок предназначены для их продвижения в положения снаружи больных сосудов, для распределения вязких композиций вокруг сосудистых структур, для их модулирования формы или уменьшения их диаметра на период продолжительностью от нескольких недель до месяцев (см. выше).
Иглы размещают в канюле с тупым концом. Соответственно, наружный диаметр иглы меньше внутреннего диаметра внешней канюли. Игла может быть дополнена прозрачной камерой для аспирации, чтобы контролировать случайное размещение внутри сосуда или гематому после сосудистых повреждений.
В предпочтительном варианте соединяющий элемент позволяет размещать иглу в положении для инъекции для безопасного внесосудистого распределения вязких композиций и/или движения иглы в положение прокола для проникновения через кожу и слои соединительной ткани, пока не будет достигнуто целевое положение. В предпочтительном варианте канюли могут быть зафиксированы в заданных положениях относительно друг друга в одном или в обоих из указанных положений.
Положение прокола для этого кончика иглы определяется как от 2 до 8 мм перед внешней канюлей. Положение инъекции характеризуется тем, что кончика иглы располагается во внешней канюле. Например, игла может быть извлечена на несколько мм таким образом, чтобы она располагалась и фиксировалась на 4-6 мм до отверстия внешней канюли.
Здесь «острый» обозначает, что канюля способна проникать в кожу и соединительную ткань, например, при приложении усилия менее 5, предпочтительно менее 3 или даже менее 1,5 Н. Тупоконечный (с тупым концом) означает, что канюля не может проникать в кожу или соединительную ткань, например, при усилии, меньшем 3, предпочтительно, меньшем 4 или меньшем 5 Н. Для специалиста понятно, что приведенные выше значения зависят от наружного диаметра канюли и, таким образом, относятся к канюлям с наружным диаметром примерно от 0,8 до 1,2 мм. Более конкретно, для канюль с наружным диаметром 0,8 мм и 1,2 мм, значения для острой канюли могут быть меньше примерно 1,5 Н и меньше примерно 2,0 Н соответственно. Значения для тупоконечной канюли могут быть меньше примерно 3 Н и меньше примерно 4 Н соответственно.
Игла и/или внешняя канюля являются гибкими и эластичными, благодаря чему катетер может как проникать в кожу под углом от 10 до 90 градусов, предпочтительно от 20 до 45 градусов относительно поверхности кожи, так и направляться параллельно сосуду, который в большинстве случаев параллелен поверхности кожи. В некоторых вариантах реализации это может означать, что коаксиальные трубки гнутся под углом от 5 до 90 градусов, предпочтительно от 5 до 50 градусов, более предпочтительно от 5 до 30 градусов или более чем 10 градусов при приложении сгибающей силы менее 1 Н. В других вариантах реализации канюля гнется от 10 до 40 мм, предпочтительно от 10 до 30 мм или от 15 до 25 мм (измерение на кончике) при воздействии на кончик с силой 0,2 Н. Определение может относиться к игле и/или внешней канюле и/или к системе катетера, т.е. когда собраны обе канюли.
"Эластичная" означает, что трубка возвращается к исходной прямой форме при воздействии на кончик канюли длиной 100 мм с силой 0,2 Н (20 г). Эти свойства редко достигаются в некоторых малых инъекционных иглах, но ни в одной из существующих систем коаксиальных игл.
Для легкого и безболезненного введения и установки системы катетера предпочтителен как можно меньший максимальный наружный диаметр (OD), не превышающий 3,0 мм, предпочтительно 2,0 мм, более предпочтительно 1,5 мм. Однако для легкого распределения вязких жидкостей или гелей предпочтительно, чтобы внутренний диаметр (ID) составлял по меньшей мере 0,3, предпочтительно 0,5 мм.
В отдельном варианте реализации система катетера имеет следующие размеры. Полная длина катетера составляет от 60 до 250 мм, предпочтительно от 80 до 180 мм, более предпочтительно от 100 до 140 мм. Игла имеет наружный диаметр (OD) от 0,6 до 0,9 мм, предпочтительно от 0,7 до 0,8 мм. Ее внутренний диаметр (ID) составляет от 0,45 до 0,8 мм, предпочтительно от 0,6 до 0,7 мм. Диаметр стенки иглы (WD) составляет от 0,05 до 0,15 мм, предпочтительно от 0,75 до 0,125 мм, более предпочтительно от 0,8 до 1,0 мм. Наружный диаметр внешней канюли (OD) составляет от 0,7 до 1,2 мм, предпочтительно 0,9 мм. Внутренний диаметр внешней канюли (ID) составляет от 0,6 до 0,9 мм, предпочтительно 0,8 мм. Диаметр стенки внешней канюли (WD) составляет от 0,05 до 0,15 мм, предпочтительно от 0,075 до 0,125 мм, еще более предпочтительно от 0,08 до 0,1 мм.
В другом отдельном варианте реализации катетер согласно изобретению включает трубкоподобную конструкцию, наружный диаметр которой составляет предпочтительно от 0,9 до 1,2 мм, и внутренний диаметр от 0,8 до 1,1 мм. Она является гибкой (незначительно).
Специалисту понятно, что по меньшей мере некоторые из указанных выше размеров зависят от материала канюль. В частности это верно для диаметра стенки. В любом случае внутренний диаметр внешней канюли меньше, чем наружный диаметр иглы, благодаря чему эти канюли могут быть вставлены друг в друга (см. выше). Диаметр стенки означает толщину стенки трубки.
Также предпочтительно, чтобы радиальное расстояние между канюлями составляло меньше 20% от ID второй трубки, предпочтительно меньше 15% и более предпочтительно, меньше 10%, что позволяет без значительных манипуляций осуществить любое перемещение задней части к кончику.
Канюли системы катетера могут быть выполнены из металла, пластика, углеродистого волокна и других принятых в медицине материалов при условии, что эти материалы имеют описанные здесь свойства. Предпочтительным материалом является металл, такой как нержавеющая сталь.
В одном из вариантов реализации трубка выполнена из металла. В другом варианте реализации она выполнена из пластикового материала. Зона кончика может быть сужающейся, что облегчает введение. Края могут быть закруглены для обеспечения атравматического продвижения. В одном из вариантов реализации она включает разъем (соединение) типа Люэр-лок.
Полая игла может быть эластичной и сгибаемой. Она может включать прозрачный павильон для ранней индикации крови из возможного прокола сосуда. Диаметр игл меньше диаметра внешней канюли с расстоянием, обеспечивающим легкое удаление иглы (от 0,05 до 0,10 мм). Внутренний диаметр определяет усилие, необходимое для инъекции, поэтому он не должен составлять меньше 0,25 мм. Инъекция легко выполняется в использованием канюли с внутренним диаметром 0,4-0,8 мм. Игла может включать соединение Люэр-лок или другой соединитель для шприца с гиалуронананои. Игла и внешняя канюля соединены временным соединением для обеспечения фиксации кончика иглы в соответствующем положении снаружи катетера во время пункции кожи и введения в целевой участок. Соединение может быть обеспечено нитью, крючками, выступами, пробками, магнитами и клейкими материалами или иными средствами.
Набор системы катетера включает канюли для сосудистой пункции с кончиком с двойным или тройным резом, причем катетер включает
(i) внешнюю часть (нережущий элемент), трубкоподобную конструкцию, обладающую некоторой гибкостью, выполненную из металла или пластического материала, с наружным диаметром предпочтительно от 0,9 до 1,2 мм и внутренним диаметром 0,8-1,1 мм,
(a) зона кончика которой может необязательно быть суживающейся для облегчения введения,
(b) края которой могут быть необязательно закругленными для обеспечения атравматического продвижения и
(c) и которая необязательно содержит соединитель Люэр-лок. (И) эластичную и гибкую полую иглу,
(a) с необязательно прозрачным павильоном, причем
(b) диаметр иглы меньше диаметра катетера, и при этом
(c) игла и катетер соединены временным соединением для обеспечения фиксации кончика иглы в соответствующем положении снаружи катетера во время пункции кожи и введения в целевой участок.
Сначала система применяют в соединенном виде с кончиком канюли впереди для проникновения в оказывающие сопротивление структуры (кожа, фасция) до достижения целевого положения в периваскулярной области. Внесосудистое положение и подтверждение отсутствия повреждения сосуда проверяются аспирацией: в павильоне не должна появляться кровь, в противном случае положение необходимо изменить. После установки канюлю удаляют. Вводят гиалуронан или другой раствор (см. выше) и передвигают катетер для соответствующего размещения гиалуронана. Передвижения катетера можно выполнять без риска случайного прокалывания целевой вены или других значимых сосудов или повреждения нервов, благодаря тупому кончику.
Изобретение также относится к шприцу, предварительно заполненному раствором согласно изобретению. Набор может также включать такой шприц.
Примеры
Пример 1
15 мл водного раствора, включающего 0,5% гиалуроновой кислоты, смешали с 2 мл 2%-ого раствора скандикаина и ввели, как показано на фигурах. После 2 недель сжатие гиалуронаном все еще действовало (Фиг. 14-15), в то время как противоположная сторона, обработанная аналогичным образом солевым раствором, была совершенно не сжата.
Пример 2: Уменьшение диаметров вен после склерозирующей терапии
Проводили склерозирующую терапию вен. Впоследствии в ткань, окружающую обработанную вену, вводили водный раствор, включающий 1% гиалуроновой кислоты (не поперечно-связанной) согласно изобретению (с 1% IntraShape). Диаметр обработанной вены определяли в трех временных точках и рассчитывали его уменьшение в процентах. Результаты сравнивали с результатами, полученными без применения раствора или композиции согласно изобретению (без IntraShape).
20 пациентов, целевая вена с диаметром от 6 до 22 мм и длиной сегмента для обработки от 23 до 45 см.

Пример 3
Проводили терапию двух групп пациентов как описано в примере 2 и дальнейшее обследование на предмет возникновения гематомы после околовенозной тумесценции.
20 пациентов на группу, большая подкожная вена ноги (GSV), диаметр от 8,2 до 22,1 мм.

Пример 4
Канюли с предпочтительной гибкостью были установлены следующим образом. Первая (острая) канюля, вторая (тупоконечная) канюля и катетер (обе канюля в сборке) соответственно сдавливались напротив шкал. После сгибания регистрировали смещение кончика относительно его касательной и массы (см. фигуру 15). Рассчитали соответствующую силу. Результаты показаны ниже и проиллюстрированы на фигуре 16.
Гибкость первой канюли (OD 0,8 мм; WD 0,125 мм; длина 100 мм):
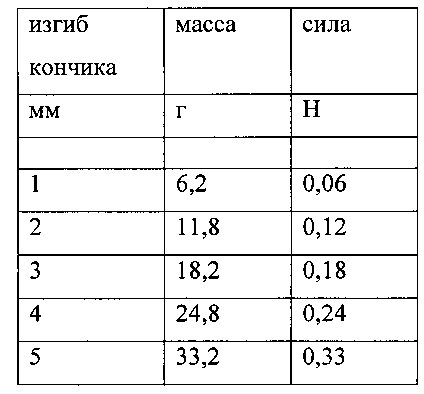
Гибкость второй канюли (OD: 0,95 мм, WD 0,125 мм; длина 100 мм):
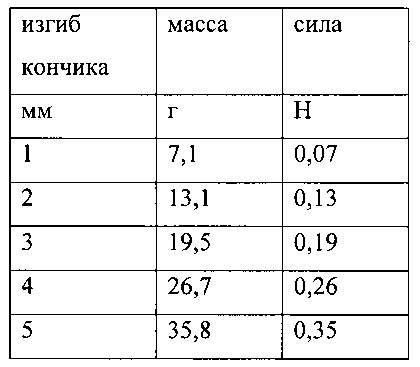
Гибкость обеих канюль:

Подписи к фигурам Фиг. 1:
На Фиг. 1 показан гиалуронан. Фиг. 2:
На Фиг. 2 показана вена с аневризмой. Фиг. 3:
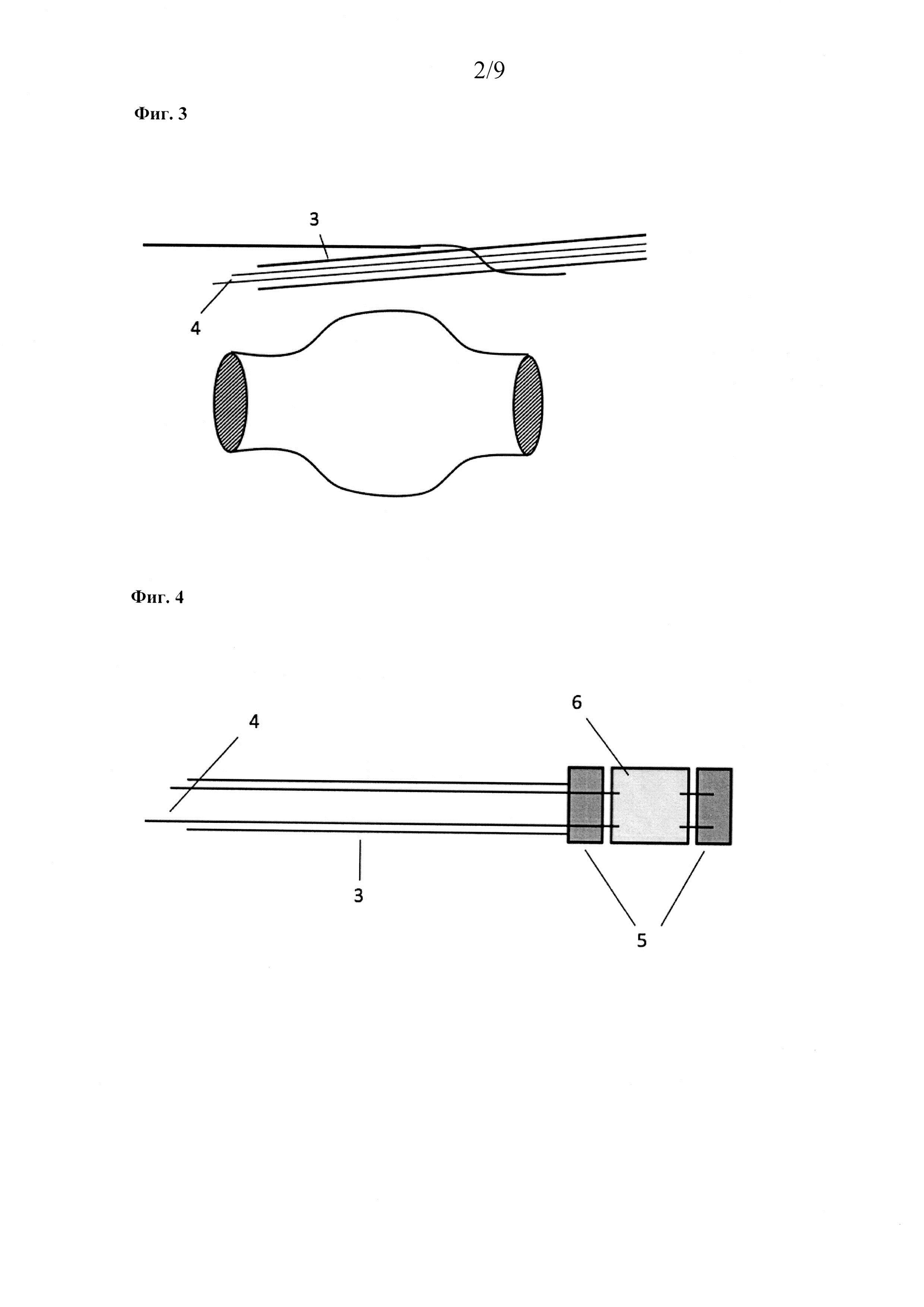
После проникновения в кожу систему катетера продвигают коаксиально. Фиг. 4:
Система катетера содержит полую иглу с кончиком с двойным или тройным резом (4) и прозрачный пластиковый павильон (6). Система может содержать соединитель Люэр-лок.
Вверху: положение прокалывания; внизу: положение инъекции (безопасное положение).
Как описано выше, диаметр может варьировать. Фиг. 5:
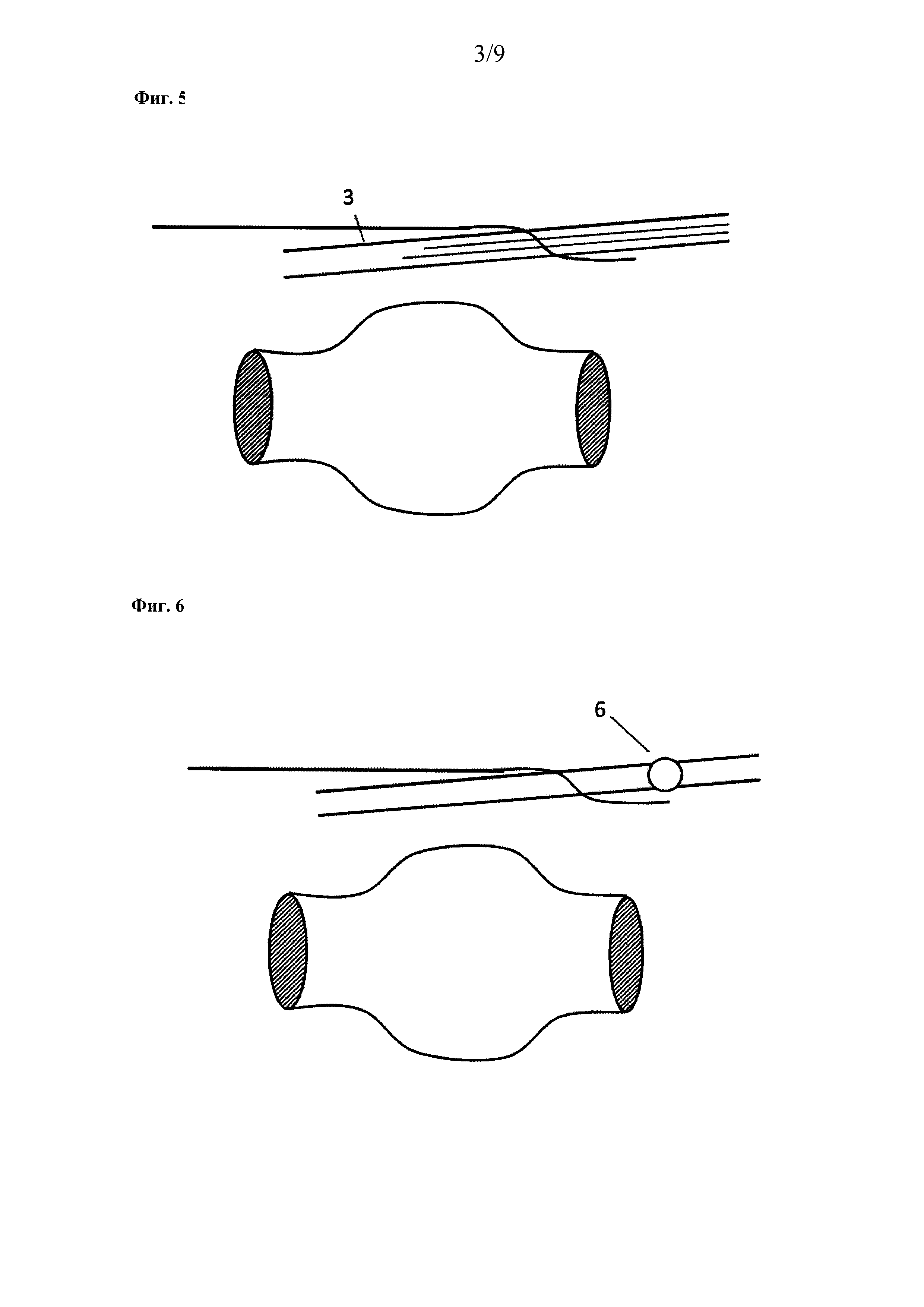
После прокалывания инструмент продвигают, не повреждая сосуд. Фиг. 6:
Втягивание и удаление иглы.
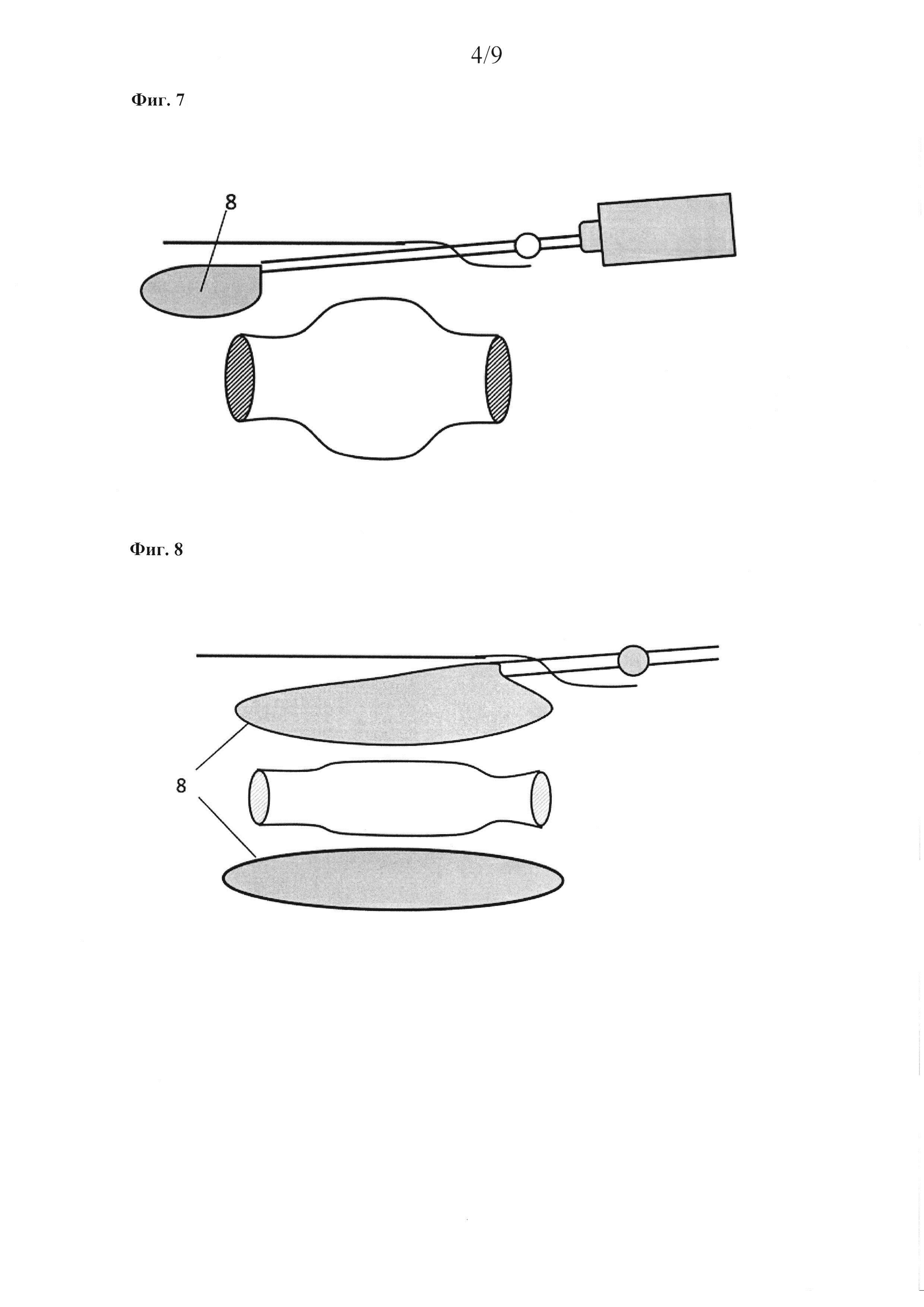
Фиг. 7:
Внесосудистое положение подтверждается отсутствием крови в павильоне или аспирацией шприцем.
Фиг. 8:
Рядом с сосудом вводят водный раствор, включающий от 0,1% до 3% гиалуроновой кислоты.
Фиг. 9:
На фиг.9 показаны типичные ультразвуковые изображения в поперечном сечении.
Фиг. 10:
На фиг.10 показана вена, готовая к эндоваскулярной терапии.
Фиг. 11:
На фиг.11 показана вена до и после обработки раствором согласно изобретению. Ультразвук, вид в поперечном сечении.
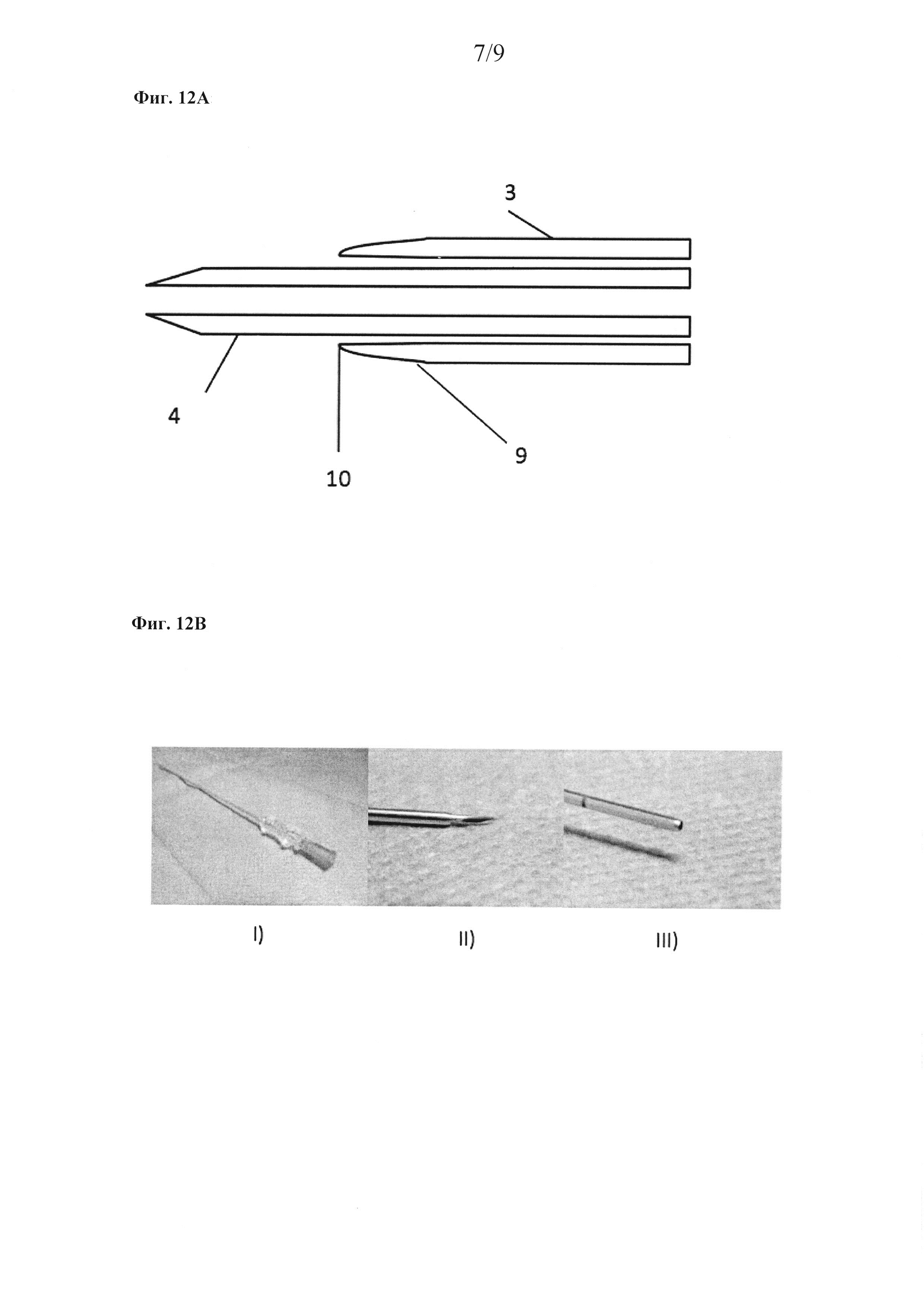
Фиг. 12
На фиг.12 детали системы катетера. А) показана схема, В) прототип (i) соединенная система, (ii) внутренняя трубка с режущим кончиком, зафиксированная снаружи, (iii) внешняя трубка с гладким кончиком и (снова ii) внешней трубкой (положение прокалывания) и (снова iii) втянутая внутренняя трубка.
Фиг. 13
Это ультразвуковое изображение показывает паховую область (сафено-феморальное соустье) с гиалуронаном около вены, сжимающим целевую вену в ходе лазерной облитерации. Исходный диаметр вены составлял 8,8 мм, в данный момент сжат до 2,5 мм.
Фиг. 14
Это ультразвуковое изображение показывает ту же область с гиалуронаном, действие которого продолжается после 2 недель. Целевая вена закрыта. Ее диаметр сжат до примерно 2,7 мм (в среднем).
Фиг. 15
Экспериментальная установка для определения предпочтительной гибкости.
Фиг. 16
Результат определения гибкости.
Реферат
Группа изобретений относится к области медицины, а именно к применению в лечении заболеваний вен, характеризующихся расширенными венами, вязкого водного раствора для инъекций, который инъецируют в периваскулярное пространство, при этом он виден при ультразвуковой визуализации, причем указанный раствор содержит от 0,1% до 3% гиалуроновой кислоты с молекулярной массой от 1 миллиона до 8 миллионов Да и характеризуется периодом полужизни в соединительной ткани человека более 1 недели; а также к набору для параваскулярного или периваскулярного введения, включающему катетер и вязкий водный раствор для инъекций, содержащий от 0,1% до 3% гиалуроновой кислоты с молекулярной массой от 1 миллиона до 8 миллионов Да. Группа изобретений обеспечивает создание эффективного средства для лечения заболевания вен. 2 н. и 4 з. п. ф-лы, 17 ил., 5 табл., 4 пр.
Формула
Документы, цитированные в отчёте о поиске
Состав для лечения хронических венозных недостаточностей, содержащий водный экстракт листьев красного винограда и противовоспалительное средство

Комментарии