Биорассасывающиеся полимерные композиции, способы их обработки и изготовленные из них медицинские устройства - RU2583007C2
Код документа: RU2583007C2
Чертежи


Описание
Область применения изобретения
Настоящее изобретение относится к области биорассасывающихся полимеров и, в частности, к биорассасывающимся полимерным смесям, которые можно использовать для получения медицинских устройств.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Биорассасывающиеся полимеры и изготовленные из таких полимеров медицинские устройства хорошо известны специалистам в данной обрасти. Стандартные биорассасывающиеся полимеры включают полимолочную кислоту, поли(п-диоксанон), полигликолевую кислоту, сополимеры лактида, гликолида, п-диоксанона, триметиленкарбоната, ε-капролактона в различных комбинациях и т.п. Химическую структуру биорассасывающихся полимеров выбирают таким образом, чтобы обеспечить их разложение in vivo с сопутствующим метаболизмом или расщеплением иного типа, например, путем гидролиза, и выведение из тела пациента. Преимущества использования имплантируемых медицинских устройств, изготовленных из биорассасывающихся полимеров, включают, например, устранение потребности в дополнительных хирургических вмешательствах для удаления имплантата после выполнения им своей функции. В идеале при необходимости обеспечения «временного присутствия» имплантата может быть обеспечена поддержка ткани до ее заживления.
Иногда в качестве биорассасывающихся полимеров, используемых для получения медицинских устройств, применяли полимерные смеси биорассасывающихся полимеров и сополимеров, созданные для придания конкретных характеристик и свойств производимым медицинским устройствам, включая скорость биорассасывания, сохранение прочности на разрыв, стабильность размеров и т.п.
Существует множество стандартных способов, используемых при получении медицинских устройств из биорассасывающихся полимеров и полимерных смесей. Способы включают литье под давлением, формование окунанием в раствор, экструзию, механическую обработку, резку, а также различные комбинации и эквиваленты. Особенно полезный и широко распространенный способ получения таких устройств представляет собой горячее формование с использованием стандартных способов литья под давлением. Специалистам в данной области известно, что способы получения, такие как горячее литье под давлением, могут приводить к получению литых изделий с низкими свойствами, особенно, например, с неприемлемой стабильностью размеров, механическими свойствами и сохранением механических свойств со временем после имплантации устройства. Существует ряд причин пониженной стабильности размеров. Они включают наличие остаточных напряжений, созданных в процессе получения. Другая причина заключается в слишком низкой температуре стеклования по меньшей мере одного полимерного компонента, особенно если полимерный компонент плохо кристаллизуется после литья.
Следовательно, в данной области существует потребность в разработке новых биорассасывающихся полимерных смесей, которые можно использовать в способах горячего литья под давлением и других стандартных способах для получения биорассасывающихся медицинских устройств с улучшенным сохранением прочности на разрыв, отличной биорассасываемостью, улучшенными механическими свойствами, такими как жесткость и прочность, удобством получения и улучшенной стабильностью размеров.
Известно, что при использовании способов горячего литья под давлением технологические условия и элементы конструкции, снижающие напряжение сдвига при заполнении полости, как правило, помогают уменьшить индуцируемые течением остаточные напряжения. Аналогичным образом данные условия, помогающие повысить эффективность заполнения формы и однородность ее охлаждения, как правило, также приводят к уменьшению индуцируемых нагревом остаточных напряжений. Часто оказывается очень сложным, если не почти невозможным, полностью устранить остаточное напряжение в изделиях, полученных литьем под давлением. Используемые для этого подходы включают: (1) попытку кристаллизовать изделие еще во время его нахождения в форме для повышения механической жесткости для сопротивления искажениям; и (2) использование смол с высокой температурой стеклования (Tg).
Последний случай относится к ситуации, при которой подвижность полимерной цепи достигается только при значительно более высоких температурах, защищая тем самым изделие при умеренных температурах таким образом, чтобы изделие могло выдержать стерилизацию окисью этилена, перевозку и хранение. Материалы, обладающие высокими температурами стеклования, не всегда могут обладать и другими необходимыми характеристиками, такими как рассасываемость. Считается, что остаточные напряжения являются основной причиной усадки и коробления изделий. Коробление или искажение изделий может происходить при их извлечении из формы во время технологического цикла литья под давлением или в результате воздействия высоких температур в процессе нормального хранения или перевозки продукта.
Ранее в данной области предпринимались попытки решения проблемы недостаточной стабильности размеров медицинских устройств, образованных способом горячего формования из расплава смесей биорассасывающихся полимеров. В патенте США № 4646741, автор Smith, описана смесь из расплава лактид/гликолидного сополимера и поли(п-диоксанона), используемая для изготовления хирургических зажимов и двухэлементных скоб. Описанные в патенте Smith смеси из расплава позволяют получить литые изделия, обладающие стабильностью размеров. В патенте Smith требуется, чтобы количество поли(п-диоксанона) в смеси было больше 25% вес., и не рекомендуется использовать меньшие количества. Описанные в патенте Smith полимерные смеси имеют недостатки, связанные с их использованием для получения медицинских устройств, включая: ограниченную жесткость или модуль Юнга, более короткий период сохранения механических свойств после имплантации, большую чувствительность к влаге, ограничивающую доступное время открытого хранения во время получения, и, хотя это трудно характеризовать количественно, более сложный процесс горячего формования.
Как указано выше, считается, что остаточные напряжения являются основной причиной усадки и коробления изделий. Известно, что индуцируемые течением остаточные напряжения могут оказывать влияние на свойства полимерного медицинского изделия, изготавливаемого горячим формованием. Свободные от напряжения длинноцепочечные полимерные молекулы склонны принимать равновесную конформацию статистического клубка при температурах выше температуры плавления (т.е. в расплавленном состоянии). В процессе термообработки (например, литья под давлением) молекулы ориентируются в направлении потока по мере вытягивания полимера под воздействием сдвиговых напряжений. Отверждение расплава обычно происходит до полной релаксации полимерных молекул в равновесное состояние, что приводит к замораживанию частичной молекулярной ориентации в отформованном изделии. Данный тип замороженного, напряженного состояния часто называют остаточным напряжением, индуцированным течением. Растянутая молекулярная структура приводит к анизотропной неоднородной усадке и механическим свойствам в направлении, параллельном и перпендикулярном направлению течения.
Охлаждение также может привести к остаточным напряжениям. Например, вариация скорости охлаждения от стенки формы к ее центру могут приводить к появлению термоиндуцированного остаточного напряжения. Более того, несбалансированность скоростей охлаждения двух поверхностей может приводить к асимметричному термоиндуцированному остаточному напряжению. Такое несбалансированное охлаждение приводит к асимметричному распределению сжимающего усилия по изделию, что вызывает появление изгибающего механического момента, стремящегося покоробить изделие. Следовательно, для изделий с неоднородной толщиной или плохо охлаждаемыми областями возможно несбалансированное охлаждение и, таким образом, появление остаточных термических напряжений. Для умеренно сложных изделий распределение термоиндуцированного остаточного напряжения дополнительно усложняется из-за неоднородной толщины стенок, охлаждения формы и накладываемых ею ограничений.
Следует отметить, что общепринятый стандартный способ стерилизации представляет собой обработку газообразной окисью этилена в цикле процесса стерилизации. Рассасывающиеся полимерные устройства часто стерилизуют обработкой газообразной окисью этилена (ОЭ). Окись этилена может выступать в роли пластификатора лактид-гликолидных сополимеров и может немного понизить Tg; это может привести к «усадке» и/или «короблению» изделия, изготовленного литьем под давлением, особенно при обработке при температурах выше Tg. Данная проблема создает дополнительные сложности при обработке и использовании изделий при использовании лактид-гликолидных полимерных материалов для изготовления рассасываемых медицинских устройств. Следует отметить, что процесс стерилизации окисью этилена предполагает воздействие на изделие не только газообразной окисью этилена, но и повышенными температурами. Обычно это требует обработки при немного повышенных температурах. Поскольку окись этилена может выступать в качестве пластификатора для синтетических рассасывающихся полиэфиров, проблемы усадки и коробления и общей нестабильности размеров в его присутствии часто еще больше усугубляются.
Существует ряд технологических способов, стандартно используемых для снижения или полного устранения напряжений сдвига в ходе обработки. Технологические условия и элементы конструкции, позволяющие снизить напряжение сдвига при заполнении полости, помогают уменьшить индуцируемые течением остаточные напряжения. Полимерные изделия часто проходят термообработку (термический отжиг) для изменения их качественных характеристик. Целью термообработки является морфологическое созревание структуры, например, кристаллизация и/или релаксация напряжений. При успешном проведении термообработки полученное изделие может показывать лучшую стабильность размеров и может показывать большую механическую прочность.
Изделия, изготовленные литьем под давлением и извлеченные из машины для литья под давлением без искажений размеров или формы, могут быть плавно или резко охлаждены до комнатной температуры и могут иметь правильные размеры. Однако обычно в них все равно остаются напряжения, которые могут привести к искажению размеров или формы изделий при любом размораживании подвижности полимерных цепей. Как описано выше, это может произойти при повышении температуры или под воздействием пластификатора, такого как газообразная окись этилена. Для устранения данной потенциальной причины искажений формы или размеров изделий существует ряд стратегий; они включают (термический) отжиг.
Если изделие может быть пространственно ограничено, термический отжиг можно использовать с двумя целями: одна заключается в попытке снизить степень ориентации молекул в полимерных цепях, что также известно как снижение напряжений; а другая состоит в повышении степени кристалличности изделия для повышения механической жесткости для сопротивления искажениям.
Для некоторых легко кристаллизующихся полимеров может оказаться возможной кристаллизация изделия еще до извлечения его из формы, однако такая ситуация не является стандартной. В данном случае полость формы для литья не только выполняет функцию образования формы изделия, она также может сохранять форму изделия в процессе кристаллизации. Для более сложных в кристаллизации полимеров продолжительность цикла такой обработки становится недопустимо большой, и способ литья под давлением становится практически нецелесообразным. Таким образом, необходимо извлекать изделие из формы до завершения процесса развития морфологии полимера.
Изделия, изготовленные литьем под давлением из полукристаллических полимеров, часто можно отжечь с использованием термообработки для повышения степени кристалличности и завершения процесса развития морфологии полимера. Часто изделия требуют физического ограничения для того, чтобы предотвратить искажения, для таких целей и проводится обработка. После кристаллизации изделие имеет повышенную механическую жесткость для сопротивления искажениям в условиях, которые обычно приводят к искажениям. Часто создание подходящих физических ограничений оказывается сложным, поскольку это часто требует значительных трудозатрат и экономически обременительно.
Предпочтительно проводить отжиг извлеченного из формы изделия без необходимости физических ограничений; однако в процессе отжига часто происходит искажение изделия, что делает его непригодным для многих приложений.
В отрасли известна практика отжига изделий для снижения зафиксированных при литье напряжений с использованием термической релаксации. Необходимые для снятия напряжений продолжительность и температура обработки могут варьироваться, но часто отжиг должен проводиться при температуре ниже Tg во избежание серьезных искажений. Однако даже при этом условии результаты обработки могут существенно различаться. Еще сложнее снизить уровни напряжений, не вызывая искажений, в смолах с большей молекулярной массой. Снижение зафиксированных при литье напряжений с использованием термической релаксации в высокотекучих полиэфирах с низкой молекулярной массой значительно легче выполнить, чем в полиэфирах с большей молекулярной массой.
Что касается молекулярной массы полимерной смеси, большая молекулярная масса обычно приводит к более высоким уровням напряжений и требует более продолжительного периода времени/более высоких температур обработки для релаксации напряжений. При этом большая молекулярная масса часто необходима для достижения высоких механических свойств и биологических характеристик. Данная ситуация часто создает трудности для производителя медицинских устройств.
В идеале для обеспечения более высокой степени кристалличности для повышения механической жесткости с целью улучшения сопротивляемости искажениям или для снижения степени молекулярной ориентации для ослабления непосредственных причин возникновения искажений изделия следует термически обрабатывать (отжигать) при температуре, не приводящей к искажениям изделия. К сожалению, в связи с природой обычно используемых синтетических рассасывающихся полиэфиров данную обработку часто требуется проводить при температурах выше их температуры стеклования, где избежать искажений практически невозможно.
Например, ниже описаны устройства из полилактидного гомополимера или сополимера лактида и гликолида. При нагреве до или выше точки стеклования находящиеся в напряженном состоянии полимерные цепи в данных изделиях, изготовленных литьем под давлением, будут стремиться срелаксировать и вернуться в естественное состояние («статистические трехмерные клубки»). Внешне это проявится как коробление, усадка или общее искажение размеров изделия. Из-за данной потенциальной деформации при получении литых изделий на основе полилактида в промышленности существует общепринятая практика отказа от отжига при обработке. Такие отформованные изделия из полилактида имеют очень низкую степень кристалличности (если не являются аморфными или лишены кристалличности) и будут склонны к деформации при температурах, равных или превышающих соответствующие температуры стеклования. Благоприятной представляется возможность проведения отжига таких изделий для повышения степени кристалличности, чтобы придать им большую жесткость для сохранения стабильности размеров в условиях, обычно сопровождающих стерилизацию окисью этилена, транспортировку и хранение.
Существуют медицинские сферы применения, требующие от медицинского устройства значительной прочности на сжатие, как, например, в случае имплантируемой скобы или фиксатора. Очевидно, что для получения устройства, соответствующего таким требованиям, с меньшей площадью сечения полимер, из которого оно образовано, должен обладать высокой собственной жесткостью, чтобы фиксатор мог надлежащим образом выполнять свои функции в предполагаемой сфере применения.
Для достижения более высокой жесткости в смеси из расплава лактид/гликолидного сополимера и поли(п-диоксанона) необходимо свести к минимуму количество поли(п-диоксанона). В отличие от рекомендаций, изложенных в патенте Smith, было обнаружено, что можно получить высокую стабильность размеров для изделий, отлитых из смеси сополимера с высоким содержанием лактида и поли(п-диоксанона), в которой содержание поли(п-диоксанона) составляет менее 25% вес. Добавление поли(п-диоксанона) даже в данных малых количествах повышает способность к достижению стабильности размеров в готовом изделии.
Хотя такие полимерные смеси уже известны, в данной области существует постоянная потребность в создании новых полимерных рассасывающихся материалов, обеспечивающих медицинскому устройству улучшенные характеристики, включая жесткость, сохранение прочности в условиях in vivo (in situ), стабильность размеров, рассасываемость in vivo и удобство получения наряду с потребностью в создании новых медицинских устройств, изготовленных из таких полимерных материалов, а также новых способов получения медицинских устройств из таких полимерных материалов.
ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение представляет новые биорассасывающиеся полимерные смеси, которые можно использовать в производственных процессах для получения новых рассасывающихся медицинских устройств и компонентов медицинских устройств с помощью способов формования из расплава, таких как литье под давлением, и других способов, причем устройства или компоненты обладают улучшенными механическими свойствами (такими как высокая жесткость и прочность на сжатие), отличной способностью сохранения прочности на разрыв, приемлемыми скоростями биорассасывания и высокой стабильностью размеров.
В соответствии с описанным выше настоящее изобретение раскрывает новую композицию на основе биорассасывающейся полимерной смеси. Полимерная смесь содержит первый биорассасывающийся полимер и второй биорассасывающийся полимер. Первый полимер содержит от приблизительно 76% вес. до приблизительно 92% вес. полимера с высоким содержанием лактида, содержащего от приблизительно 100 мольных процентов до приблизительно 70 мольных процентов полимеризованного лактида и от приблизительно 0 мольных процентов до приблизительно 30 мольных процентов полимеризованного гликолида. Второй полимер представляет собой поли(п-диоксанон). Максимальная весовая доля поли(п-диоксанона) в смеси составляет приблизительно 24% вес., а минимальная весовая доля поли(п-диоксанона) в смеси зависит от молярного количества полимеризованного лактида в полимере с высоким содержанием лактида и рассчитывается по следующему выражению:
Весовая доля поли(п-диоксанона)=(215,6212/мольная доля полимеризованного лактида)2,7027.
Полимерная смесь обеспечивает стабильность размеров полученного из нее изделия.
Другим аспектом настоящего изобретения является термически обработанная композиция на основе биорассасывающейся полимерной смеси. Полимерная смесь содержит первый биорассасывающийся полимер и второй биорассасывающийся полимер. Первый полимер содержит от приблизительно 76% вес. до приблизительно 92% вес. полимера с высоким содержанием лактида, содержащего от приблизительно 100 мольных процентов до приблизительно 70 мольных процентов полимеризованного лактида и от приблизительно 0 мольных процентов до приблизительно 30 мольных процентов полимеризованного гликолида. Второй полимер представляет собой поли(п-диоксанон). Максимальная весовая доля поли(п-диоксанона) в смеси составляет приблизительно 24% вес., а минимальная весовая доля поли(п-диоксанона) в смеси зависит от молярного количества полимеризованного лактида в полимере с высоким содержанием лактида и рассчитывается по следующему выражению:
Весовая доля поли(п-диоксанона) = (215,6212/мольная доля полимеризованного лактида)2,7027.
Термически обработанная полимерная смесь обеспечивает стабильность размеров полученного из нее изделия.
Еще одним аспектом настоящего изобретения является новое биорассасывающееся медицинское устройство. Медицинское устройство имеет структуру. Медицинское устройство содержит биорассасывающуюся полимерную смесь, состоящую из первого биорассасывающегося полимера и второго биорассасывающегося полимера. Первый полимер содержит от приблизительно 76% вес. до приблизительно 92% вес. полимера с высоким содержанием лактида, содержащего от приблизительно 100 мольных процентов до приблизительно 70 мольных процентов полимеризованного лактида и от приблизительно 0 мольных процентов до приблизительно 30 мольных процентов полимеризованного гликолида. Второй полимер представляет собой поли(п-диоксанон). Максимальная весовая доля поли(п-диоксанона) в смеси составляет приблизительно 24% вес., а минимальная весовая доля поли(п-диоксанона) в смеси зависит от молярного количества полимеризованного лактида в полимере с высоким содержанием лактида и рассчитывается по следующему выражению:
Весовая доля поли(п-диоксанона) = (215,6212/мольная доля полимеризованного лактида)2,7027.
Полимерная смесь обеспечивает стабильность размеров медицинского устройства.
Еще одним аспектом настоящего изобретения является способ получения медицинского устройства. Способ включает стадии обработки биорассасывающейся полимерной смеси. Полимерная смесь содержит первый биорассасывающийся полимер и второй биорассасывающийся полимер. Первый полимер содержит от приблизительно 76% вес. до приблизительно 92% вес. полимера с высоким содержанием лактида, содержащего от приблизительно 100 мольных процентов до приблизительно 70 мольных процентов полимеризованного лактида и от приблизительно 0 мольных процентов до приблизительно 30 мольных процентов полимеризованного гликолида. Второй полимер представляет собой поли(п-диоксанон). Максимальная весовая доля поли(п-диоксанона) в смеси составляет приблизительно 24% вес., а минимальная весовая доля поли(п-диоксанона) в смеси зависит от молярного количества полимеризованного лактида в полимере с высоким содержанием лактида и рассчитывается по следующему выражению:
Весовая доля поли(п-диоксанона) = (215,6212/мольная доля полимеризованного лактида)2,7027.
Из полимерной смеси образуется биорассасывающееся медицинское устройство. Полимерная смесь обеспечивает стабильность размеров полученного медицинского устройства.
Дополнительные аспекты настоящего изобретения включают описанные выше медицинское устройство и способ, причем полимерная смесь проходит термическую обработку.
Данные и другие аспекты и преимущества настоящего изобретения станут более понятными после изучения следующего описания и прилагаемых чертежей.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На ФИГ. 1 представлено полученное при помощи сканирующей электронной микроскопии (СЭМ) изображение собранных поли(п-диоксаноновых) структур изделий, изготовленных литьем под давлением из полимерной смеси, содержащей 20% вес. поли(п-диоксанона) и 80% вес. сополимера лактида и гликолида, причем сополимер лактида и гликолида содержит 85 мольных процентов полимеризованного лактида и 15 мольных процентов полимеризованного гликолида.
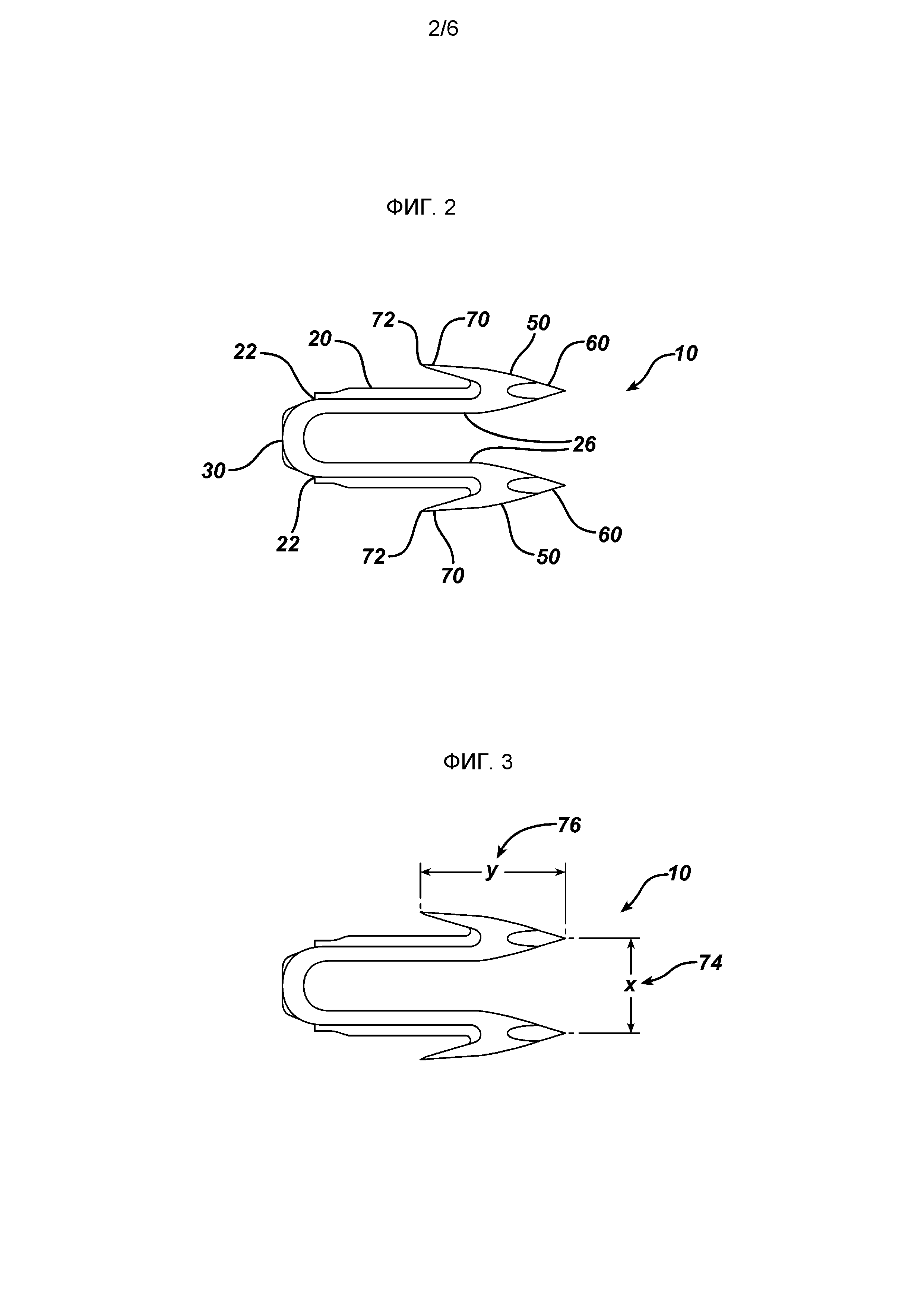
На ФИГ. 2 представлено изображение имплантируемой скобы или фиксатора, иллюстрирующее настоящее изобретение, и показано устройство с малой площадью сечения.
На ФИГ. 3 представлено изображение устройства, показанного на ФИГ. 2, с указанием критических размеров указанного устройства.
На ФИГ. 4 представлен график, показывающий влияние изменения композиции материала литого медицинского изделия на сохранение прочности на разрыв (BSR) по результатам тестирования in vitro.
На ФИГ. 5 представлен график зависимости мольной доли полимеризованного лактида в лактид/гликолидном сополимерном компоненте от весовой доли поли(п-диоксанона); ограниченная кривыми область содержит новые полимерные композиции, составляющие предмет настоящего изобретения.
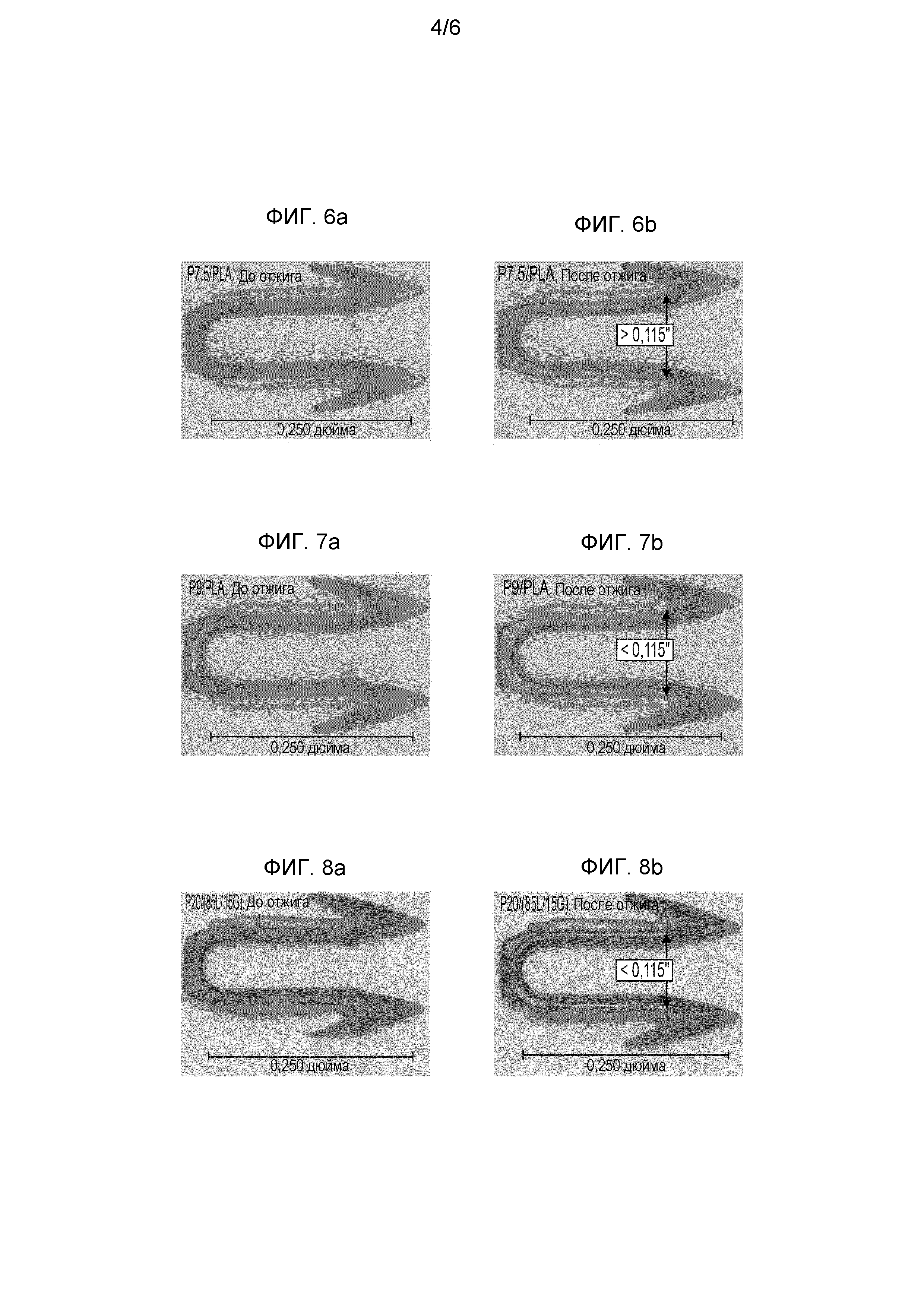
На ФИГ. 6a представлена фотография отлитого под давлением фиксатора, представленного в ПРИМЕРЕ 8C (т.е. до отжига), изготовленного из полимерной композиции, представленной в ПРИМЕРЕ 6C, из которой изготовлены отлитые под давлением фиксаторы с неприемлемым короблением после отжига.
На ФИГ. 6b представлена фотография отлитого под давлением фиксатора, представленного в ПРИМЕРЕ 9C (аналогично фиксатору, показанному на ФИГ. 6a, но после отжига), изготовленного из полимерной композиции, представленной в ПРИМЕРЕ 6C, из которой изготовлены отлитые под давлением фиксаторы с неприемлемым короблением после отжига.
На ФИГ. 7a представлена фотография отлитого под давлением фиксатора, представленного в ПРИМЕРЕ 8D (т.е. до отжига), изготовленного из полимерной композиции, представленной в ПРИМЕРЕ 6D, из которой изготовлены отлитые под давлением фиксаторы с повышенной стабильностью размеров и приемлемой степенью коробления после отжига.
На ФИГ. 7b представлена фотография отлитого под давлением фиксатора, представленного в ПРИМЕРЕ 9D (аналогично фиксатору, показанному на ФИГ. 7a, но после отжига), изготовленного из полимерной композиции, представленной в ПРИМЕРЕ 6D, из которой изготовлены отлитые под давлением фиксаторы с повышенной стабильностью размеров и приемлемой степенью коробления после отжига.
На ФИГ. 8a представлена фотография отлитого под давлением фиксатора, представленного в ПРИМЕРЕ 8N (т.е. до отжига), изготовленного из полимерной композиции, представленной в ПРИМЕРЕ 6N, из которой изготовлены отлитые под давлением фиксаторы с повышенной стабильностью размеров и приемлемой степенью коробления после отжига.
На ФИГ. 8b представлена фотография отлитого под давлением фиксатора, представленного в ПРИМЕРЕ 9N (аналогично фиксатору, показанному на ФИГ. 8a, но после отжига), изготовленного из полимерной композиции, представленной в ПРИМЕРЕ 6N, из которого изготовлены отлитые под давлением изделия с повышенной стабильностью размеров и приемлемой степенью коробления после отжига.
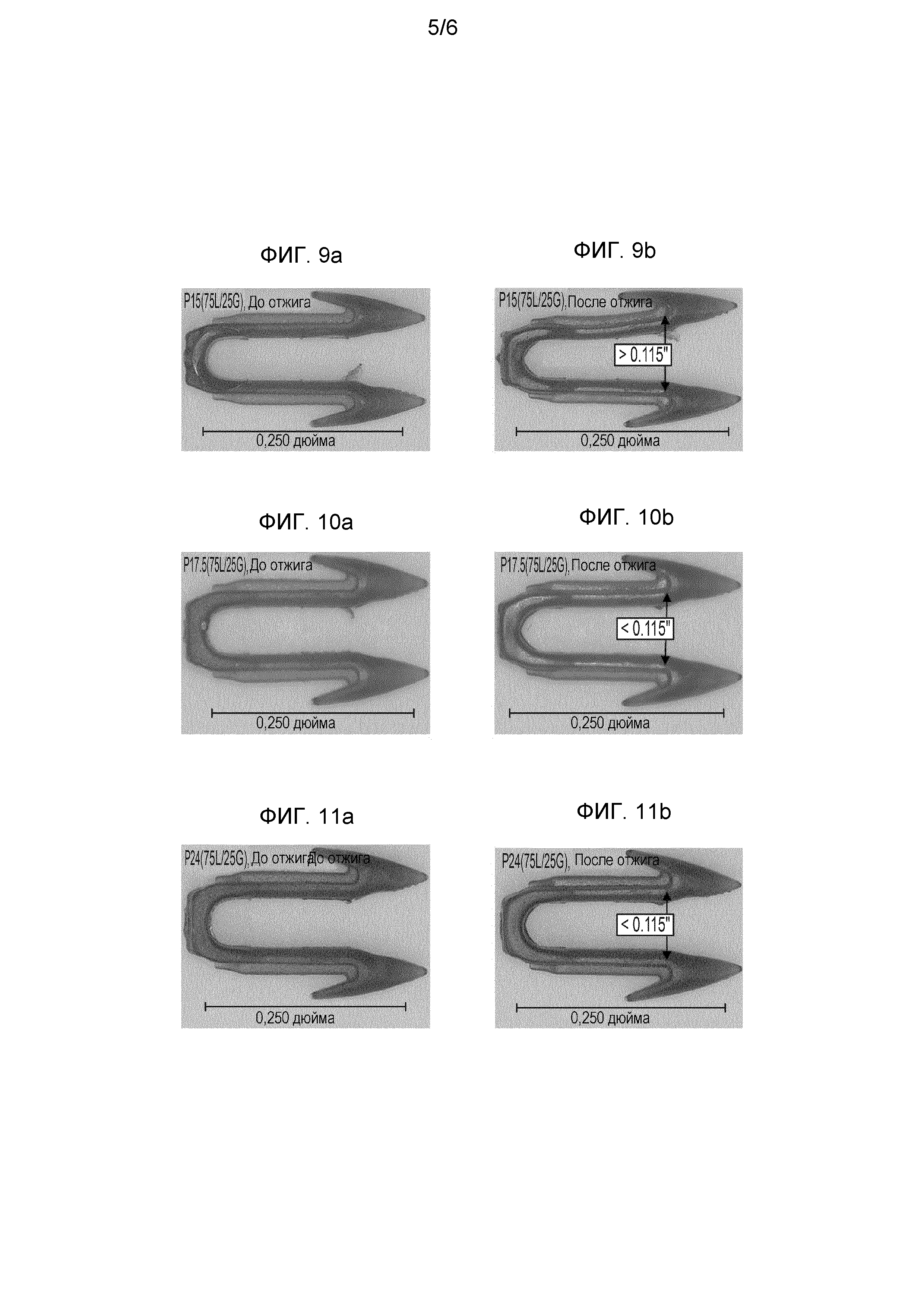
На ФИГ. 9a представлена фотография отлитого под давлением фиксатора, представленного в ПРИМЕРЕ 8S (т.е. до отжига), изготовленного из полимерной композиции, представленной в ПРИМЕРЕ 6S, из которой изготовлены отлитые под давлением фиксаторы с неприемлемым короблением после отжига.
На ФИГ. 9b представлена фотография отлитого под давлением фиксатора, представленного в ПРИМЕРЕ 9S (аналогично фиксатору, показанному на ФИГ. 9a, но после отжига), изготовленного из полимерной композиции, представленной в ПРИМЕРЕ 6S, из которой изготовлены отлитые под давлением фиксаторы с неприемлемым короблением после отжига.
На ФИГ. 10a представлена фотография отлитого под давлением фиксатора, представленного в ПРИМЕРЕ 8T (т.е. до отжига), изготовленного из полимерной композиции, представленной в ПРИМЕРЕ 6T, из которой изготовлены отлитые под давлением фиксаторы с повышенной стабильностью размеров и приемлемой степенью коробления после отжига.
На ФИГ. 10b представлена фотография отлитого под давлением фиксатора, представленного в ПРИМЕРЕ 9T (аналогично фиксатору, показанному на ФИГ. 10a, но после отжига), изготовленного из полимерной композиции, представленной в ПРИМЕРЕ 6T, из которой изготовлены отлитые под давлением фиксаторы с повышенной стабильностью размеров и приемлемой степенью коробления после отжига.
На ФИГ. 11a представлена фотография отлитого под давлением фиксатора, представленного в ПРИМЕРЕ 8X (т.е. до отжига), изготовленного из полимерной композиции, представленной в ПРИМЕРЕ 6X, из которой изготовлены отлитые под давлением фиксаторы с повышенной стабильностью размеров и приемлемой степенью коробления после отжига.
На ФИГ. 11b представлена фотография отлитого под давлением фиксатора, представленного в ПРИМЕРЕ 9X (аналогично фиксатору, показанному на ФИГ. 11a, но после отжига), изготовленного из полимерной композиции, представленной в ПРИМЕРЕ 6X, из которой изготовлены отлитые под давлением фиксаторы с повышенной стабильностью размеров и приемлемой степенью коробления после отжига.
На ФИГ. 12 представлено изображение изделия в форме гантели для проведения испытания.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Новые полимерные смеси, составляющие предмет настоящего изобретения, изготовлены из биорассасывающихся полиэфирных полимеров и сополимеров. Один из компонентов смеси предпочтительно представляет собой либо поли(L(-)-лактид), либо лактид/гликолидный сополимер с высоким содержанием лактида. Другой компонент смеси представляет собой биорассасывающийся полимер поли(п-диоксанон).
Поли(L(-)-лактид) или лактид/гликолидный сополимер с высоким содержанием лактида производят стандартным образом. Предпочтительным является следующий способ получения: лактоновые мономеры вместе со спиртовым инициатором, подходящим катализатором и красителем (при необходимости) загружают в реактор с перемешиванием. После продувки для удаления кислорода реагенты нагревают в атмосфере азота при перемешивании для проведения полимеризации с раскрытием цикла. По истечении подходящего периода времени образованную смолу выгружают и нарезают на фрагменты соответствующего размера. Частицы смолы обрабатывают для удаления остатков летучих веществ с последующим хранением в вакууме. Мольные доли полимеризованного лактида и полимеризованного гликолида в полимере с высоким содержанием лактида, который можно использовать в новых смесях, составляющих предмет настоящего изобретения, могут варьироваться для получения необходимых характеристик. Как правило, мольная доля полимеризованного лактида в полимере с высоким содержанием лактида составляет от приблизительно 70 процентов до приблизительно 100 процентов, чаще - от приблизительно 80 процентов до приблизительно 90 процентов, а предпочтительно - от приблизительно 83 процентов до приблизительно 87 процентов. Когда доля полимеризованного лактида в полимере с высоким содержанием лактида составляет 100 процентов, полимер представляет собой полилактид; для некоторых сфер хирургического применения предпочтительным является поли(L(-)-лактид). Как правило, мольная доля полимеризованного гликолида в полимере с высоким содержанием лактида составляет от приблизительно 0 процентов до приблизительно 30 процентов, чаще - от приблизительно 10 процентов до приблизительно 20 процентов, а предпочтительно - от приблизительно 13 процентов до приблизительно 17 процентов.
Поли(L(-)-лактидный) гомополимер или лактид/гликолидный сополимер с высоким содержанием лактида характеризуют с использованием химического анализа. Данные характеристики включают, без ограничений, характеристическую вязкость в диапазоне от приблизительно 0,80 до приблизительно 2,25 дл/г по результатам измерения в гексафторизопропаноле при температуре 25°C и концентрации 0,1 г/дл. По результатам анализа с использованием гель-проникающей хроматографии средневесовая молекулярная масса полимеров находится в диапазоне приблизительно от 35 000 до 120 000 Дальтон. Следует понимать, что можно применять, а для определенных приложений и желательны к применению, смолы с большей молекулярной массой при условии, что оборудование, используемое для приготовления смеси и для образования медицинского устройства, способно работать с расплавами с вязкостью, характерной для данных высоких молекулярных масс. Например, в некоторых приложениях для получения медицинских устройств с определенными характеристиками, например, такими как большая прочность, может потребоваться применение смолы с характеристической вязкостью 2,5 дл/г. По результатам анализа с использованием дифференциальной сканирующей калориметрии температура стеклования полимеров находится в диапазоне от 20 до 65°C, а фазовый переход плавления происходит при температурах от приблизительно 120 до 180°C. Анализ с использованием ядерного магнитного резонанса подтвердил, что сополимерная смола представляет собой статистический сополимер L(-)-лактида и гликолида. Рентгеноструктурный анализ показал степень кристалличности приблизительно от 20 до 45 процентов.
Следует понимать, что компонент смеси, представляющий собой полилактидный гомополимер или лактид/гликолидный сополимер с высоким содержанием лактида, может быть основан на лактидном мономере в LL-конфигурации, т.е. L(-)-лактиде. Однако можно использовать и другие стереохимические изомеры, при условии что полимерный компонент на основе лактида в готовом устройстве показывает достаточную степень кристалличности для обеспечения стабильности размеров. Таким образом, вместо поли(L(-)-лактида) можно использовать гомополимер поли(D(+)-лактид) на основе DD-конфигурации мономера. Лактид/гликолидный сополимерный компонент может быть полностью основан на DD-изомере или может содержать смеси DD-изомера и LL-изомера при условии удовлетворения требований к степени кристалличности в готовом устройстве. Также в небольших количествах можно использовать мезо-лактид, DL-изомер, однако также при условии удовлетворения требований к степени кристалличности готового устройства.
Поли(п-диоксаноновый) полимер, который можно использовать в новых полимерных смесях, составляющих предмет настоящего изобретения, производят стандартным способом. Предпочтительным является следующий способ получения такого полимера: лактоновый мономер вместе со спиртовым инициатором, подходящим катализатором и красителем (при необходимости) загружают в реактор с перемешиванием. Краситель должен быть разрешен к клиническому использованию; данные красители включают D&C Violet № 2 и D&C Blue № 6. После продувки для удаления кислорода реагенты нагревают в атмосфере азота с перемешиванием для проведения полимеризации с раскрытием цикла. По истечении подходящего времени образованную смолу выгружают в соответствующие емкости и дополнительно проводят полимеризацию в условиях, известных как «твердофазная» полимеризация. Альтернативный способ может включать полимеризацию в расплаве. По завершении данного реакционного периода полимерную смолу нарезают на фрагменты соответствующего размера. Частицы смолы обрабатывают для удаления остатков летучих веществ, удаляя непрореагировавший мономер, с последующим хранением в вакууме. Полидиоксаноновые полимеры, которые можно использовать в смесях, составляющих предмет настоящего изобретения, имеют характеристическую вязкость по меньшей мере приблизительно 0,80 дл/г при измерении при температуре 25°C и концентрации 0,1 г/дл. Полидиоксаноновые полимеры, особенно предпочтительные для использования в смесях, составляющих предмет настоящего изобретения, имеют следующие характеристики: данные характеристики должны включать, без ограничений, характеристическую вязкость в диапазоне от приблизительно 0,80 до приблизительно 2,30 дл/г по результатам измерения в гексафторизопропаноле при температуре 25°C и концентрации 0,1 г/дл. По результатам анализа с использованием гель-проникающей хроматографии средневесовая молекулярная масса полимеров находится в диапазоне приблизительно от 35 000 до 120 000 Дальтон. Следует понимать, что можно применять, а для определенных приложений и желательны к применению, смолы с большей молекулярной массой при условии, что оборудование, используемое для приготовления смеси и для образования медицинского устройства, способно работать с расплавами с вязкостью, характерной для данных высоких молекулярных масс. Например, в некоторых приложениях для получения медицинских устройств с определенными характеристиками, например, такими как большая прочность, может потребоваться применение смолы с характеристической вязкостью 2,5 дл/г. По результатам анализа с использованием дифференциальной сканирующей калориметрии температура стеклования полимеров находится в диапазоне от -15 до -8°C, а фазовый переход плавления происходит при температуре от приблизительно 100 до 107°C. Анализ с использованием ядерного магнитного резонанса подтвердил, что смола представляет собой гомополимер поли(п-диоксанона), в композицию которой входит приблизительно 98 процентов полимеризованного п-диоксанона и приблизительно от 0 до 2 процентов мономера п-диоксанона при измерении по мольным количествам. Рентгеноструктурный анализ, как правило, показывал степень кристалличности приблизительно от 25 до 40 процентов, хотя наблюдались и степени кристалличности 55 процентов и выше.
Новые полимерные смеси, составляющие предмет настоящего изобретения, имеющие повышенную стабильность размеров, как правило, содержат первый биорассасывающийся полимер и второй биорассасывающийся полимер, причем первый полимер содержит от приблизительно 76% вес. до приблизительно 92% вес. полимера с высоким содержанием лактида, содержащего от приблизительно 100 мольных процентов до приблизительно 70 мольных процентов полимеризованного лактида и от приблизительно 0 мольных процентов до приблизительно 30 мольных процентов полимеризованного гликолида, а второй полимер содержит поли(п-диоксанон), причем максимальная весовая доля поли(п-диоксанона) в смеси составляет приблизительно 24% вес., а минимальная весовая доля поли(п-диоксанона) в смеси зависит от мольного количества полимеризованного лактида в полимере с высоким содержанием лактида и рассчитывается согласно выражению:
Весовая доля поли(п-диоксанона) = (215,6212/мольная доля полимеризованного лактида)2,7027.
Иными словами, новые полимерные смеси, составляющие предмет настоящего изобретения, как правило, представляют собой смесь лактид/гликолидного сополимера с высоким содержанием лактида или полилактидного гомополимера и поли(п-диоксанона). Например, лактид/гликолидный сополимер может представлять собой поли(L(-)-лактид и гликолид), имеющий композицию из 85 мольных процентов полимеризованного лактида и 15 мольных процентов полимеризованного гликолида. Максимальная весовая доля поли(п-диоксанона) в смеси составляет приблизительно 24% вес., а минимальную весовую долю поли(п-диоксанона) в смеси можно рассчитать в зависимости от молярного количества полимеризованного лактида в лактид/гликолидном сополимере, используя приведенное выше уравнение. Таким образом, в случае лактид/гликолидного сополимера с соотношением 85/15 (на основе мольных количеств):
Минимальная весовая доля поли(п-диоксанона) = (215,6212/мольная доля полимеризованного лактида)2,7027 = (215,6212/85)2,7027 = 12,4 весовая доля поли(п-диоксанона).
Таким образом, для новых полимерных смесей, составляющих предмет настоящего изобретения, с использованием лактид/гликолидного сополимера с соотношением 85/15 (на основе мольных количеств) весовая доля поли(п-диоксанона) будет находиться в диапазоне от приблизительно 12,4 до приблизительно 24% вес.
Новые полимерные смеси, составляющие предмет настоящего изобретения, будут чаще содержать от приблизительно 76% вес. до приблизительно 84% вес. полимера с высоким содержанием лактида и от приблизительно 16% вес. до приблизительно 24% вес. поли(п-диоксанона), причем полимер с высоким содержанием лактида содержит от приблизительно 80 мольных процентов до приблизительно 90 мольных процентов полимеризованного лактида и от приблизительно 10 мольных процентов до приблизительно 20 мольных процентов полимеризованного гликолида.
Новые полимерные смеси, составляющие предмет настоящего изобретения, будут предпочтительно содержать от приблизительно 78% вес. до приблизительно 82% вес. полимера с высоким содержанием лактида и от приблизительно 18% вес. до приблизительно 22% вес. поли(п-диоксанона), причем полимер с высоким содержанием лактида содержит от приблизительно 83 мольных процентов до приблизительно 87 мольных процентов полимеризованного лактида и от приблизительно 13 мольных процентов до приблизительно 17 мольных процентов полимеризованного гликолида.
По результатам рентгеноструктурного анализа смеси, составляющие предмет настоящего изобретения, имели степень кристалличности по меньшей мере приблизительно 15 процентов, как правило, более приблизительно 25 процентов, а более предпочтительно - более приблизительно 35 процентов.
Новые полимерные смеси, составляющие предмет настоящего изобретения, могут производиться из индивидуальных компонентов рядом стандартных способов с использованием стандартного технологического оборудования. Примеры технологических способов включают химические реакции типа полимеризации с раскрытием цикла и поликонденсации, способы удаления летучих веществ и сушки смолы, способы сухого смешивания в сушильном барабане, смешивания в растворе, экструзионного смешивания в расплаве, литья под давлением, термического отжига и стерилизации окисью этилена. Альтернативой сухому смешиванию с последующим смешиванием смеси в расплаве могут включать использование двух или более питателей, предпочтительно весовых питателей непрерывного действия, которые подают смешиваемые компоненты в экструдер; причем экструдер может быть одношнекового или двухшнекового типа. В альтернативном варианте осуществления для подачи расплавов компонентов смеси можно использовать множество экструдеров, как, например, в процессе совместной экструзии.
Смеси, составляющие предмет настоящего изобретения, можно изготовить с использованием термических способов обработки. Примеры способов термической обработки для получения полимерных смесей, составляющих предмет настоящего изобретения, включают смешивание в расплаве в экструдере, которое может включать двухшнековое смешивание или одношнековую экструзию, совместную экструзию, двухшнековое смешивание с одновременным вакуумным удалением летучих веществ на экструдере с выходным отверстием, вакуумную барабанную сушку с термическим удалением летучих веществ, удаление мономера экстракцией растворителем при повышенной температуре и отжиг смолы.
Как полимерные компоненты, так и смеси, составляющие предмет настоящего изобретения, могут разделяться на частицы стандартными способами, такими как комкование, гранулирование и измельчение.
Дополнительный вариант осуществления настоящего изобретения представляет собой подачу частиц компонентов смеси соответствующего размера непосредственно в питатель машины для литья под давлением. Специалисту в данной области будет понятна возможность применения данного способа с другими технологическими способами, такими как, без ограничений, пленочная или волоконная экструзия. Преимуществом ограничения тепловой истории компонентов полимерной смеси является избежание возможности преждевременной деструкции полимера. Дополнительные способы термической обработки могут включать способ, выбранный из группы, состоящей из литья под давлением, прямого прессования, раздувного формования, экструзии с раздувом, термоформования, пленочной экструзии, волоконной экструзии, листовой экструзии, профильной экструзии, экструзии нетканого материала аэродинамическим способом из расплава, совместной экструзии, экструзии труб, вспенивания, центробежного формования, каландрования и экструзии. Как указано выше, частицы компонентов смеси соответствующего размера могут смешиваться в расплаве с использованием данных способов термической обработки.
Не стремясь предложить научное объяснение, авторы считают, что способ формирования устройства, такой как литье под давлением, может оказывать большое влияние на развитие морфологии готового изделия. Таким образом, полученная смешиванием в растворе смола может иметь морфологию с очень малым коэффициентом пропорциональности для неосновной фазы, поли(п-диоксанона). Высокий коэффициент пропорциональности неосновной фазы может быть индуцирован лишь в процессе формирования устройства с большими сдвиговыми усилиями (например, литья под давлением).
Другие примеры производственного технологического оборудования включают химические реакторы емкостью от 7,6 л (два галлона) до 283,9 л (семьдесят пять галлонов), встраиваемые сушители для удаления летучих веществ объемом от одного кубического фута до двадцати кубических футов, одношнековые и двухшнековые экструдеры диаметром от приблизительно 2,54 см (один дюйм) до приблизительно 7,6 см (три дюйма) и системы для литья под давлением емкостью от приблизительно 6350,3 кг до приблизительно 36287,4 кг (от приблизительно семи до приблизительно 40 тонн). Предпочтительный способ и необходимое для него оборудование при получении полимерных смесей, составляющих предмет настоящего изобретения, описаны в ПРИМЕРАХ 1-6.
При необходимости полимерные смеси, составляющие предмет настоящего изобретения, могут содержать другие стандартные компоненты и вещества. Другие компоненты, добавки или вещества вводят для придания полимерным смесям и медицинским устройствам, составляющим предмет настоящего изобретения, дополнительных качеств, включая бактерицидные характеристики, контролируемое высвобождение лекарственного средства, рентгеноконтрастность и остеоинтеграцию.
Другие такие компоненты вводят в количестве, достаточном для эффективного получения необходимых свойств или характеристик. Как правило, количество других вспомогательных веществ будет составлять от приблизительно 0,1% вес. до приблизительно 20% вес., чаще - от приблизительно 1% вес. до приблизительно 10% вес., а предпочтительно - от приблизительно 2% вес. до приблизительно 5% вес.
Примеры бактерицидных веществ включают полихлорфеноксифенолы, такие как 5-хлор-2-(2,4-дихлорфенокси)фенол (также известный как Триклозан).
Примеры рентгеноконтрастных веществ включают сульфат бария, тогда как примеры остеоинтегрирующих веществ включают трикальцийфосфат.
Разнообразие терапевтических веществ, которые можно использовать в полимерных смесях, составляющих предмет настоящего изобретения, огромно. В целом, терапевтические вещества, которые можно вводить через фармацевтические композиции, составляющие предмет настоящего изобретения, включают, без ограничений, противоинфекционные средства, такие как антибиотики и противовирусные вещества; обезболивающие средства и их комбинации; анорексические вещества; противоглистные средства; противоревматические средства; противоастматические средства; блокаторы образования спаек; противосудорожные средства; антидепрессанты; антидиуретические средства; противодиарейные средства; антигистаминные средства; противовоспалительные средства; противомигренозные средства; контрацептивные средства; противорвотные средства; противоопухолевые средства; противопаркинсонические средства; противозудные средства; нейролептические средства; жаропонижающие средства, спазмолитические средства; антихолинергические средства; симпатомиметические средства; ксантиновые производные; сердечнососудистые средства, включая блокаторы кальциевых каналов и бета-блокаторы, такие как пиндолол и антиаритмические средства; противогипертонические средства; мочегонные средства; сосудорасширяющие средства, включая общие коронарные, периферические и церебральные сосудорасширяющие средства; стимуляторы центральной нервной системы; средства от кашля и простуды, включая противозастойные средства; гормоны, такие как эстрадиол и другие стероиды, включая кортикостероиды; снотворные средства; иммунодепрессанты; мышечные релаксанты; парасимпатолитические средства; психостимуляторы; седативные средства; транквилизаторы; натуральные или созданные методами генной инженерии белки, полисахариды, гликопротеины или липопротеины; олигонуклеотиды, антитела, антигены, холинергические средства, химиотерапевтические средства, гемостатические средства, тромболитические вещества, радиоактивные вещества и цитостатические средства. Терапевтически эффективные дозировки можно определить способами in vitro или in vivo. Для каждой конкретной добавки можно провести независимые определения для подбора оптимальной необходимой дозировки. Определение эффективных уровней дозировки для достижения необходимых результатов находится в компетенции специалистов в данной области. Скорость высвобождения добавок также может варьироваться в пределах знаний специалиста в данной области для определения благоприятного профиля высвобождения средства в зависимости от терапевтических условий, на которые он направлен.
Подходящие стекла или керамики включают, без ограничений, фосфаты, такие как гидроксиапатиты, замещенные апатиты, тетракальцийфосфат, альфа- и бета-трикальцийфосфат, октакальцийфосфат, брушит, монетит, метафосфаты, пирофосфаты, фосфатные стекла, карбонаты, сульфаты и оксиды кальция и магния, а также их комбинации.
Подходящие полимеры, которые могут входить в композиции полимерных смесей, составляющих предмет настоящего изобретения, включают подходящие биосовместимые, биорассасывающиеся полимеры, которые могут представлять собой натуральные или синтетические полимеры. Подходящие синтетические биосовместимые, биорассасывающиеся полимеры включают полимеры, выбранные из группы, состоящей из алифатических полиэфиров, поли(аминокислот), сополимеров простых и сложных эфиров, полиалкиленоксалатов, полиамидов, поликарбонатов, полученных функционализацией тирозина, поли(иминокарбонатов), полиортоэфиров, полиоксаэфиров, полиамидоэфиров, полиоксаэфиров, содержащих аминогруппы, поли(ангидридов), полифосфазенов, полидигликолятов, а также их комбинаций. Следует понимать, что возможность введения в композицию дополнительных подходящих полимеров зависит от возможности получения стабильности размеров у готового устройства.
Для целей настоящего изобретения указанные выше необязательные алифатические полиэфиры включают, без ограничений, гомополимеры и сополимеры лактида (который включает молочную кислоту, D-, L- и мезо-лактид), гликолида (включая гликолевую кислоту), эпсилон-капролактона, п-диоксанона (1,4-диоксан-2-он), триметиленкарбоната (1,3-диоксан-2-он), алкилпроизводные триметиленкарбоната, а также их смеси.
Подходящие натуральные полимеры включают, без ограничений, коллаген, эластин, гиалуроновую кислоту, ламинин, желатин, кератин, сульфат хондроитина и децеллюляризованную ткань.
Хотя это не является предпочтительным, медицинские устройства, составляющие предмет настоящего изобретения, могут также содержать нерассасывающиеся полимеры в дополнение к смесям рассасывающихся полимеров, составляющих предмет настоящего изобретения. Примеры таких устройств могут включать, без ограничений, сетки, нити и скобы, в которых выгодно используются свойства как рассасывающихся, так и нерассасывающихся полимеров.
Подходящие нерассасывающиеся полимеры включают, без ограничений, акриловые полимеры; полиамидимидные полимеры (ПАИ); полиарилэфиркетоны (ПЭЭК); поликарбонаты; термопластичные полиолефины, такие как полиэтилен (ПЭ), полипропилен (ПП), полиметилпентен (ПМП) и полибутен-1 (ПБ-1);
полиолефиновые эластомеры (ПОЭ), такие как полиизобутилен (ПИБ), этилен-пропиленовый каучук (ЭПК); полибутилентерефталат (ПБТ); полиэтилентерефталаты (ПЭТ); полиамиды (ПА), такие как нейлон 6 и нейлон 66; поливинилиденфторид (ПВДФ); сополимер поливинилиденфторида и гексафторпропилена (ПВДФ/ГФП); полиметилметакрилат (ПММА), а также их комбинации и эквиваленты.
Биорассасывающиеся медицинские устройства, составляющие предмет настоящего изобретения, изготавливаемые из полимерных смесей, составляющих предмет настоящего изобретения, включают, без ограничений, стандартные медицинские устройства, особенно имплантируемые медицинские устройства, включая скобы, фиксаторы, зажимы, нити, устройства фиксации ткани, устройства фиксации сетки, устройства для анастомоза, фиксаторы нити и костные фиксаторы, винты для тканей и костей, фиксирующие пластины, протезы, поддерживающие конструкции, устройства для пластики ткани, устройства для сшивания ткани, заплатки, подложки, сетки, каркасы для восстановления ткани, устройства доставки лекарственных средств и стенты.
Пример медицинского устройства, которое может быть отлито из полимерных смесей, составляющих предмет настоящего изобретения, представляет собой фиксатор ткани 10, показанный на ФИГ. 2. На ФИГ. 2 представлено изображение имплантируемой скобы или фиксатора, иллюстрирующее настоящее изобретение, и показано устройство с малой площадью сечения. Материал для изготовления данного устройства должен обладать высокой собственной жесткостью, чтобы фиксатор мог надлежащим образом выполнять свои функции в предполагаемом приложении.
Как показано на фигуре, фиксатор 10 имеет два элемента ножек 20, соединенных элементом соединительной перекладины 30 у проксимальных концов 22. Как показано на фигуре, дистальные концы 26 имеют элементы зазубрин 50, проходящие от них дистально. Элементы зазубрин 50 имеют дистальные прокалывающие ткань острия 60 и проксимальные зазубрины 70 с остриями 72. Как показано на ФИГ. 3, элементы зазубрин 50 имеют длину 74, показанную как размер Y. Острия 60 находятся на расстоянии 76 друг от друга, показанном как размер X.
Подходящие фиксаторы, которые можно изготовить из полимерных смесей, составляющих предмет настоящего изобретения, также раскрыты и описаны в принадлежащих одному и тому же правообладателю заявках на патенты США № 12/464,143; 12/464,151; 12/464,165 и 12/464,177, которые включены в настоящий документ путем ссылки.
Способность изделий, изготовленных литьем под давлением, достигать некоторой степени кристалличности до отжига позволяет изделиям выдержать цикл отжига для дополнительной кристаллизации поли(лактидной и гликолидной) фазы смеси без излишнего коробления или усадки, т.е. сохраняя стабильность размеров.
Преимуществом изделий, изготовленных литьем под давлением из смесей, составляющих предмет настоящего изобретения, является благоприятная возможность проведения с ними цикла отжига для стимулирования созревания морфологии полимера. Часто это приводит к повышению степени кристалличности материала изделия. Данный процесс помогает обеспечить приемлемую стабильность размеров изделия в случае воздействия на него умеренно повышенных температур, особенно под действием окиси этилена во время стерилизации. Не стремясь предложить научное объяснение, авторы считают, что во многих технологических условиях непосредственно после окончания литья под давлением изделия являются практически полностью аморфными, но при хранении при комнатной температуре поли(п-диоксаноновая) фаза смеси начинает кристаллизоваться. Полимерные материалы будут кристаллизоваться только при хранении при температурах больше их температуры стеклования. Температура стеклования поли(п-диоксанона) составляет приблизительно минус 10°C, что позволяет поли(п-диоксанону) начать кристаллизоваться в условиях хранения при комнатной температуре. В некоторых технологических условиях, как правило, при большем периоде времени выдержки изделия в форме может кристаллизоваться поли(п-диоксаноновый) компонент. В результате по существу благодаря данной фазе извлеченные из формы изделия обладают небольшой степенью кристалличности.
Способность поли(п-диоксаноновой) фазы смеси достигать некоторой степени кристалличности до проведения отжига позволяет поли(лактидной и гликолидной) фазе кристаллизоваться без избыточного искажения отлитого изделия. Причина заключается в повышении сопротивляемости изделия искажениям при повышенных температурах благодаря формированию в нем организованной полукристаллической молекулярной структуры. Например, при отжиге аморфного изделия из 100% сополимера лактида и гликолида изделие с большой вероятностью покоробится в процессе отжига при наличии в нем даже умеренных уровней напряжения. Диспергированный в объеме смеси полукристаллический поли(п-диоксанон) поддерживает стабильность размеров изделия под воздействием повышенных температур, необходимых для кристаллизации поли(лактидной и гликолидной) фазы смеси. Конечный результат представляет собой полукристаллическое изделие со стабильными размерами, изготовленное методом литья под давлением.
Медицинские устройства, составляющие предмет настоящего изобретения, допускают термический отжиг при температуре по меньшей мере 45 градусов Цельсия в течение по меньшей мере одной минуты. Более предпочтительно медицинские устройства, составляющие предмет настоящего изобретения, термически отжигают при температуре приблизительно 60 градусов Цельсия в течение приблизительно 8 часов с последующим отжигом при температуре приблизительно 70 градусов Цельсия в течение приблизительно 4 часов, с последующим отжигом при температуре приблизительно 80 градусов Цельсия в течение приблизительно 4 часов.
Согласно результатам рентгеноструктурных измерений медицинское устройство, составляющее предмет настоящего изобретения, имеет степень кристалличности по меньшей мере приблизительно 15 процентов, как правило, более приблизительно 25 процентов, а более предпочтительно - более приблизительно 35 процентов.
Для дополнительной защиты изделия от коробления в процессе отжига изделие также можно механически ограничить с использованием оснастки для отжига. Гипотетически изделие можно отжигать в полностью зафиксированном, или ограниченном, состоянии. Это потребует эквивалента отжига в форме для литья. Конечно, такой вариант часто является экономически неприемлемым. Однако фиксация ограниченного числа измерений в процессе отжига может оказаться экономически возможной. Изделия, представленные в ПРИМЕРЕ 8, отжигали с использованием оснастки для отжига, которая предохраняла изделия от искажений в горизонтальной плоскости изделия. Хотя данная оснастка для отжига предназначена для защиты изделия от искажений при повышенных температурах во время отжига, она не защитит изделия с нестабильными размерами от коробления.
По мере снижения уровня лактида в поли(лактидной и гликолидной) части смеси кристаллизация поли(лактидной и гликолидной) фазы становится более сложной. В смесях с использованием поли(лактидного и гликолидного) сополимера с меньшим содержанием полимеризованного лактида для сохранения стабильности размеров отлитого изделия может потребоваться увеличение весовой доли поли(п-диоксанона). Такие сополимеры включают сополимер лактида и гликолида с соотношением 70/30.
Как указано выше, чем выше степень ориентации молекул, или напряжения, в образованном медицинском устройстве, тем сильнее будет склонность к усадке или короблению изделия; усадка и коробление обычно считаются нежелательными явлениями.
При формировании устройств с использованием технологических способов, индуцирующих по меньшей мере умеренную степень ориентации молекул, или напряжения, желательно поддерживать стабильность размеров изделия. Один такой технологический способ, обычно приводящий к по меньшей мере умеренному уровню напряжения, представляет собой литье под давлением. Иными словами, продавливание потока расплавленного полимера через узкий канал и затем в полость обычно сопровождается высокими скоростями сдвига и высокими уровнями напряжения. В такой ситуации молекулярные цепи стремятся ориентироваться в направлении течения, подготавливая тем самым систему к последующей усадке или короблению при воздействии температур, слегка превышающих температуру стеклования, в частности, в процессе обработки газообразной окисью этилена в ходе стерилизации.
Подтверждением наличия больших усилий сдвига в процессе получения изделия является наличие высокого уровня остаточных напряжений в изделии, которые можно измерить различными способами. Один такой способ состоит в наблюдении изделия через скрещенные поляризованные пленки. Другие способы оценки уровня остаточных напряжений используют способы сканирующей электронной микроскопии (СЭМ). Фазовая архитектура смесей по существу несмешивающихся полимеров, лактид/гликолидных сополимеров и поли(п-диоксанона), дает дополнительные подтверждения уровня напряжений, создаваемых в смеси в процессе обработки. В ситуациях высоких напряжений сдвига неосновная фаза, как правило, по своей природе имеет несферическую форму. Неосновная фаза обычно искажается с образованием структур от удлиненных эллипсоидов с отношением L/D более приблизительно 3 до змеевидных структур с отношением L/D 50 и выше. Медицинские устройства, составляющие предмет настоящего изобретения, как правило, имеют коэффициент пропорциональности неосновной фазы более приблизительно 3, чаще - более приблизительно 5, а предпочтительно - более приблизительно 20. В зависимости от поля сдвига можно представить себе возникновение некруговых сечений, больше напоминающих ленты. Когда неосновная фаза имеет по своей природе по существу сферическую форму, можно сделать вывод, что: (1) уровень воздействовавших на полимерный расплав сдвиговых усилий был относительно невелик или (2) используемые технологические условия позволили полимерному расплаву срелаксировать таким образом, чтобы последующие удлиненные домены изменили свою форму на структуры со значительно меньшим отношением L/D. В любом случае ожидаемый уровень остаточных напряжений будет невысоким. Только сферическая морфология неосновной фазы тогда может быть свидетельством низких остаточных напряжений.
Способы выявления фазовой архитектуры в смесях несмешивающихся полимеров включают фазоконтрастную микроскопию (микроскопию в поляризованном свете); атомно-силовую микроскопию (АСМ); электронную микроскопию, включая сканирующую электронную микроскопию, сканирующую туннельную микроскопию и просвечивающую электронную микроскопию (РЭМ, СТМ, ПЭМ). Другие потенциально полезные способы включают цифровую оптическую микроскопию высокого разрешения.
Для приготовления образцов можно использовать криогенное раскалывание или технику микротомирования, включая криогенное микротомирование. Для ряда систем полезным способом приготовления образцов оказывается травление растворителем.
Как известно специалисту в данной области, при анализе морфологии неосновной фазы важно понимать, что измерения для образца необходимо проводить под различными углами. В частности, для изделий с удлиненными структурными элементами, которые могут присутствовать в изделии, составляющем предмет настоящего изобретения, анализ при наблюдении только за сечением может привести к неверному заключению о том, что неосновная фаза по своей природе имеет сферическую форму. Только при анализе в продольном направлении можно будет установить, что на самом деле неосновная фаза по своей природе имеет удлиненную форму с высоким коэффициентом пропорциональности.
Медицинские устройства, составляющие предмет настоящего изобретения, имеют характеристическую вязкость по меньшей мере приблизительно 0,8 дл/г по результатам измерения в гексафторизопропаноле при температуре 25 градусов Цельсия и концентрации 0,1 г/дл. Кроме того, характеристическая вязкость полимера с высоким содержанием лактида составляет по меньшей мере приблизительно 0,8 дл/г, а характеристическая вязкость поли(п-диоксанона) составляет по меньшей мере приблизительно 0,8 дл/г, оба значения получены по результатам измерения в гексафторизопропаноле при температуре 25 градусов Цельсия и концентрации 0,1 г/дл.
Медицинские устройства, составляющие предмет настоящего изобретения, будут сохранять стабильность размеров при погружении в воду при повышенной температуре. Предпочтительно они будут сохранять стабильность размеров при погружении в воду при температуре 49 градусов Цельсия. Наиболее предпочтительно они будут сохранять стабильность размеров при погружении в воду при температуре 70 градусов Цельсия.
В предпочтительном варианте осуществления настоящего изобретения (ПРИМЕР 7) изделие, изготовленное литьем под давлением, можно наблюдать в хирургическом поле, поскольку в композицию полимерной смеси введен фиолетовый краситель. Данный краситель, D&C Violet No. 2, вводят в смесь как часть поли(п-диоксанонового) гомополимера, что составляет от приблизительно 7 до приблизительно 24% вес. смеси. В альтернативном варианте осуществления краситель можно вводить в смесь как часть лактидного полимера. В еще одном варианте осуществления краситель можно добавлять в момент смешивания полимерных компонентов, например, в процессе смешивания в расплаве или сухого смешивания. Специалисту в данной области будет понятно, что, помимо способов, описанных выше, красители можно вводить в полимерные композиции, составляющие предмет настоящего изобретения, рядом стандартных способов. Красители могут включать D&C Violet No. 2 и D&C Blue No. 6, в количестве в диапазоне от приблизительно 0,01% вес. до приблизительно 0,3% вес. от смеси полимера или медицинского устройства. Для тех хирургических сфер применения, где окрашивание не требуется или нежелательно, в смеси используют неокрашенный поли(п-диоксаноновый) гомополимер, так чтобы хирургическое изделие было бесцветным.
Следующие примеры иллюстрируют принципы и способы реализации настоящего изобретения, хотя не ограничиваются ими.
ПРИМЕР 1
Синтез поли(L(-)-лактида)
В подходящий реактор из нержавеющей стали емкостью 56,8 л (15 галлонов) с масляной рубашкой и возможностью перемешивания добавляли 25,0 кг L(-)-лактида, 58,77 г додеканола и 4,38 мл 0,33M раствора октоата олова в толуоле. Реактор закрывали и запускали цикл продувки при перемешивании со скоростью вращения 12 об/мин в направлении вверх. Реактор откачивали до давления менее 26,7 Па (200 мТорр) с последующим напуском газообразного азота. Цикл повторяли несколько раз для получения сухой атмосферы.
В конце последнего напуска азота давление устанавливали на уровне, слегка превышающем уровень атмосферного давления. Сосуд нагревали со скоростью 180°C в час до температуры масла приблизительно 130°C. Сосуд выдерживали при температуре 130°C до полного расплавления мономера; температура массы достигала 110°C. В данный момент направление перемешивания изменяли на вращение вниз. Когда температура массы достигала 120°C, скорость перемешивания уменьшали до 7,5 об/мин и нагревали сосуд до температуры масла приблизительно 180°C со скоростью нагрева приблизительно 60°C в час. После достижения температуры расплавленной массы 178°C температуру масла поддерживали на уровне приблизительно 180°C в течение дополнительных 3 часов.
В конце реакционного периода скорость перемешивания уменьшали до 5 об/мин, температуру масла поднимали до 190°C и выгружали полимер из сосуда в подходящие емкости для последующего отжига. Емкости помещали в азотную печь для отжига с температурой 80°C приблизительно на 16 часов; на данной стадии в печи поддерживали постоянный поток азота для снижения вызванной влагой деструкции.
По окончании цикла отжига емкости с полимером извлекали из печи и оставляли охлаждаться до комнатной температуры. Кристаллизовавшийся полимер извлекали из емкостей и помещали в холодильник минимум на 24 часа при температуре приблизительно -20°C. Полимер извлекали из холодильника и переносили в гранулятор производства компании Cumberland с сортирующим ситом для измельчения полимерных гранул до размера приблизительно 0,48 см (3/16 дюйма). Затем гранулированный полимер просеивали для удаления мелкой фракции и взвешивали. Вес нетто гранулированного полимера составил 18,08 кг, затем его помещали в сушильный барабан емкостью 85,0 л (3 куб. фута) производства компании Patterson-Kelley.
Сушильный барабан закрывали и откачивали до давления менее 26,7 Па (200 мТорр). После снижения давления до менее 26,7 Па (200 мТорр) включали вращение барабана со скоростью 5-10 об/мин без подогрева на 10 часов. По истечении 10 часов температуру масла поддерживали на уровне 120°C со скоростью нагрева 120°C в час. Температуру масла поддерживали на уровне приблизительно 120°C в течение 32 часов. В конце данного периода нагрева массу оставляли охлаждаться в течение 4 часов при продолжающемся вращении и откачке. Полимер выгружали из барабана, напустив в сосуд азот, открывая выпускной клапан и позволяя гранулам полимера высыпаться в предназначенные для них сосуды для долговременного хранения.
Сосуды для долговременного хранения были герметичны и имели клапаны для откачки, позволяя хранить смолу в вакууме. Смолу охарактеризовали. Она показала характеристическую вязкость 1,84 дл/г по результатам измерения в гексафторизопропаноле при температуре 25°C и концентрации 0,10 г/дл. По результатам анализа с использованием гель-проникающей хроматографии средневесовая молекулярная масса полимера составила приблизительно 121 000 Дальтон. По результатам анализа с использованием дифференциальной сканирующей калориметрии температура стеклования полимера составила 65°C, а фазовый переход плавления происходил при температуре 182°C. Анализ с использованием ядерного магнитного резонанса подтвердил, что смола представляла собой поли(L(-)-лактид) с остаточным содержанием мономера менее 1,0 процента. Рентгеноструктурный анализ показал степень кристалличности приблизительно 64 процента.
ПРИМЕР 2
Синтез сополимера L(-)-лактида и гликолида с соотношением 85/15
В подходящий реактор из нержавеющей стали емкостью 56,8 л (15 галлонов) с масляной рубашкой и возможностью перемешивания добавляли 43,778 кг L(-)-лактида и 6,222 кг гликолида, 121,07 г додеканола и 9,02 мл 0,33M раствора октоата олова в толуоле. Реактор закрывали и запускали цикл продувки при перемешивании со скоростью вращения 12 об/мин в направлении вверх. Реактор откачивали до давления менее 26,7 Па (200 мТорр) с последующим напуском газообразного азота. Цикл повторяли несколько раз для получения сухой атмосферы.
В конце последнего напуска азота давление устанавливали на уровне, слегка превышающем уровень атмосферного давления. Сосуд нагревали со скоростью 180°C в час до температуры масла приблизительно 130°C. Сосуд выдерживали при температуре 130°C до полного расплавления мономера; температура массы достигала 110°C. В данный момент направление перемешивания изменяли на вращение вниз. Когда температура массы достигала 120°C, скорость перемешивания уменьшали до 7,5 об/мин и нагревали сосуд до температуры масла приблизительно 185°C со скоростью нагрева приблизительно 60°C в час, пока температура расплавленной массы не достигала 180°C. Температуру масла поддерживали на уровне приблизительно 185°C в течение 2,5 часов.
В конце реакционного периода скорость перемешивания уменьшали до 5 об/мин, температуру масла поднимали до 190°C и выгружали полимер из сосуда в подходящие емкости для последующего отжига. Емкости помещали в азотную печь для отжига с температурой 105°C приблизительно на 6 часов; на данной стадии в печи поддерживали постоянный поток азота для снижения вызванной влагой деструкции.
По окончании цикла отжига емкости с полимером извлекали из печи и оставляли охлаждаться до комнатной температуры. Кристаллизовавшийся полимер извлекали из емкостей и помещали в холодильник минимум на 24 часа при температуре приблизительно -20°C. Полимер извлекали из холодильника и переносили в гранулятор производства компании Cumberland с сортирующим ситом для измельчения полимерных гранул до размера приблизительно 0,48 см (3/16 дюйма). Затем гранулированный полимер просеивали для удаления мелкой фракции и после этого взвешивали. Вес нетто гранулированного полимера составил 39,46 кг, полимер помещали в сушильный барабан емкостью 85,0 л (3 куб. фута) производства компании Patterson-Kelley.
Сушильный барабан закрывали и откачивали до давления менее 26,7 Па (200 мТорр). После снижения давления до менее 26,7 Па (200 мТорр) включали вращение барабана со скоростью 8-15 об/мин и сушили массу в вакууме в течение 10 часов. По истечении 10-часовой вакуумной сушки температуру масла поддерживали на уровне 120°C в течение 32 часов. В конце данного периода нагрева массу оставляли охлаждаться в течение по меньшей мере 4 часов при продолжающемся вращении и глубоком вакууме. Полимер выгружали из барабана, напустив в сосуд азот, открывая шибер и позволяя гранулам полимера высыпаться в предназначенные для них сосуды для долговременного хранения.
Сосуды для долговременного хранения были герметичны и имели клапаны для откачки, позволяя хранить смолу в вакууме. Смолу охарактеризовали. Она показала характеристическую вязкость 1,64 дл/г по результатам измерения в гексафторизопропаноле при температуре 25°C и концентрации 0,10 г/дл. По результатам анализа с использованием гель-проникающей хроматографии средневесовая молекулярная масса полимера составила приблизительно 96 200 Дальтон. По результатам анализа с использованием дифференциальной сканирующей калориметрии температура стеклования полимера составила 56°C, а фазовый переход плавления происходил при температуре 154°C. Анализ с использованием ядерного магнитного резонанса подтвердил, что смола представляла собой статистический сополимер полимеризованного L(-)-лактида и гликолида с содержанием 83,1 процента полимеризованного L(-)-лактида, 15,2 процента полимеризованного гликолида, 1,6 процента мономера лактида и 0,1 процента мономера гликолида при измерении по мольным количествам. Общее остаточное содержание мономера составило приблизительно 1,7 процента. Рентгеноструктурный анализ показал степень кристалличности приблизительно 48 процентов.
ПРИМЕР 3
Синтез сополимера L(-)-лактида и гликолида с соотношением 75/25
В подходящий реактор из нержавеющей стали емкостью 56,8 л (15 галлонов) с масляной рубашкой и возможностью перемешивания добавляли 19,709 кг L(-)-лактида и 5,291 кг гликолида, 61,77 г додеканола и 4,60 мл 0,33M раствора октоата олова в толуоле. Реактор закрывали и запускали цикл продувки при перемешивании со скоростью вращения 12 об/мин в направлении вверх. Реактор откачивали до давления менее 26,7 Па (200 мТорр) с последующим напуском газообразного азота. Цикл повторяли несколько раз для получения сухой атмосферы.
В конце последнего напуска азота давление устанавливали на уровне, слегка превышающем уровень атмосферного давления. Сосуд нагревали со скоростью 180°C в час до температуры масла приблизительно 130°C. Сосуд выдерживали при температуре 130°C до полного расплавления мономера; температура массы достигала 110°C. В данный момент направление перемешивания изменяли на вращение вниз. Когда температура массы достигала 120°C, скорость перемешивания уменьшали до 7,5 об/мин и нагревали сосуд до температуры масла приблизительно 185°C со скоростью нагрева приблизительно 60°C в час. После того как температура расплавленной массы достигала 180°C, температуру масла поддерживали на уровне 185°C в течение 2,5 часов.
В конце реакционного периода скорость перемешивания уменьшали до 5 об/мин, температуру масла поднимали до 190°C и выгружали полимер из сосуда в подходящие емкости для последующего отжига. Емкости помещали в азотную печь для отжига с температурой 105°C приблизительно на 6 часов; на данной стадии в печи поддерживали постоянный поток азота для снижения вызванной влагой деструкции.
По окончании цикла отжига емкости с полимером извлекали из печи и оставляли охлаждаться до комнатной температуры. Кристаллизовавшийся полимер извлекали из емкостей и помещали в холодильник минимум на 24 часа при температуре приблизительно -20°C. Полимер извлекали из холодильника и переносили в гранулятор производства компании Cumberland с сортирующим ситом для измельчения полимерных гранул до размера приблизительно 0,48 см (3/16 дюйма). Затем гранулированный полимер просеивали для удаления мелкой фракции и после этого взвешивали. Вес нетто гранулированного полимера составил 17,89 кг, полимер помещали в сушильный барабан емкостью 85,0 л (3 куб. фута) производства компании Patterson-Kelley.
Сушильный барабан закрывали и откачивали до давления менее 26,7 Па (200 мТорр). После снижения давления до менее 26,7 Па (200 мТорр) включали вращение барабана со скоростью 5-15 об/мин и сушили полимер в вакууме в течение 16 часов без нагрева. Затем температуру сушки доводили до 60-65°C со скоростью нагрева 100°C в час. Температуру масла выдерживали на уровне 60-65°C в течение приблизительно 9 часов. В конце данного периода нагрева массу оставляли охлаждаться в течение по меньшей мере 4 часов при продолжающемся вращении и глубоком вакууме. Полимер выгружали из барабана, напустив в сосуд азот, открывая шибер и позволяя гранулам полимера высыпаться в предназначенные для них сосуды для долговременного хранения.
Сосуды для долговременного хранения были герметичны и имели клапаны для откачки, позволяя хранить смолу в вакууме. Смолу охарактеризовали. Она показала характеристическую вязкость 1,56 дл/г по результатам измерения в гексафторизопропаноле при температуре 25°C и концентрации 0,10 г/дл. По результатам анализа с использованием гельпроникающей хроматографии средневесовая молекулярная масса полимера составила приблизительно 102 000 Дальтон. По результатам анализа с использованием дифференциальной сканирующей калориметрии температура стеклования полимера составила 48°C, а фазовый переход плавления происходил при температуре 132°C. Анализ с использованием ядерного магнитного резонанса подтвердил, что смола представляла собой статистический сополимер полимеризованного L(-)-лактида и гликолида с содержанием 70,1 процента полимеризованного L(-)-лактида, 25,2 процента полимеризованного гликолида, 4,5 процента лактида и 0,2 процента гликолида при измерении по мольным количествам. Общее остаточное содержание мономера составило менее 5 процентов. Рентгеноструктурный анализ показал степень кристалличности приблизительно 26 процентов.
ПРИМЕР 4
Синтез поли(п-диоксанона)
В подходящий реактор из нержавеющей стали емкостью 246,1 л (65 галлонов) с масляной рубашкой и возможностью перемешивания добавили 164,211 кг мономера п-диоксанона (PDO), 509 грамма додеканола, 164 грамма красителя D&C Violet No. 2 и 100 г 0,33M раствора октоата олова в толуоле. Реактор закрывали и запускали цикл продувки при перемешивании со скоростью вращения 12 об/мин в направлении вверх. Реактор откачивали до давления менее 66,7 Па (500 мТорр) с последующим напуском газообразного азота. Цикл повторяли несколько раз для получения сухой атмосферы.
В конце последнего напуска азота давление устанавливали на уровне, слегка превышающем уровень атмосферного давления. Сосуд нагревали со скоростью 180°C в час до температуры масла приблизительно 100°C. Сосуд выдерживали при температуре 100°C до тех пор, пока температура массы не достигала 50°C, и в данный момент направление перемешивания изменяли на вращение вниз. Когда температура смеси достигала 90°C, температуру масла устанавливали на 95°C. Поддерживая данные условия, из сосуда отбирали образцы и измеряли их вязкость по Брукфильду. Когда вязкость полимерной массы достигала по меньшей мере 110 сантипуаз, массу считали готовой к выгрузке. Скорость вращения уменьшали до 5 об/мин и к выпускному порту сосуда присоединяли предварительно подогретый фильтр. Полимер выгружали из сосуда в подходящие емкости при продувке азотом, закрывали и переносили в азотную полимеризационную печь с установленной температурой 80°C. Проводили твердофазную полимеризацию в течение приблизительно 96 часов; на данной стадии в печи поддерживали постоянный поток азота для снижения вызванной влагой деструкции.
По окончании цикла твердофазной полимеризации емкости с полимером извлекали из печи и оставляли охлаждаться до комнатной температуры. Кристаллизовавшийся полимер извлекали из емкостей и помещали в холодильник минимум на 24 часа при температуре приблизительно -20°C. Полимер извлекали из холодильника и измельчали в грануляторе производства компании Cumberland с сортирующим ситом до получения полимерных гранул размером приблизительно 0,48 см (3/16 дюйма). Затем гранулы просеивали для удаления любой мелкой фракции и помещали в сушильный барабан емкостью 566,3 л (20 куб. футов) производства компании Patterson-Kelley.
Барабан закрывали и откачивали до давления менее 2 мм рт. ст. После снижения давления до менее 2 мм рт. ст. включали вращение барабана со скоростью 6 об/мин и сушили смесь без подогрева в течение 10 часов. По истечении 10 часов сушки температуру масла поддерживали на уровне 95°C со скоростью нагрева 120°C в час. Температуру масла выдерживали на уровне 95°C в течение 32 часов. В конце данного периода нагрева массу оставляли охлаждаться в течение по меньшей мере 4 часов при продолжающемся вращении и откачке. Полимер выгружали из барабана, напустив в сосуд азот, открывая выпускной клапан и позволяя гранулам полимера высыпаться в предназначенные для них сосуды для долговременного хранения. Сосуды для долговременного хранения были герметичны и имели клапаны для откачки, позволяя хранить смолу в вакууме.
Смолу охарактеризовали. Она показала характеристическую вязкость 1,99 дл/г по результатам измерения в гексафторизопропаноле при температуре 25°C и концентрации 0,10 г/дл. По результатам анализа с использованием гельпроникающей хроматографии средневесовая молекулярная масса полимера составила приблизительно 85 000 Дальтон. По результатам анализа с использованием дифференциальной сканирующей калориметрии температура стеклования полимера составила приблизительно -15°C, а фазовый переход плавления происходил при температуре приблизительно 105°C. Анализ с использованием ядерного магнитного резонанса подтвердил, что смола представляла собой гомополимер поли(п-диоксанона) с остаточным содержанием мономера менее 2 процентов. Рентгеноструктурный анализ показал степень кристалличности приблизительно 40 процентов. Для получения полимеров с другой целевой молекулярной массой количество инициатора (додеканола) может быть скорректировано для получения необходимого значения. Кроме того, если сфера хирургического применения не требует изделия с окраской, из стадий технологического процесса можно опустить добавление красителя, что приведет к получению неокрашенного, или «натурального», полимера.
ПРИМЕР 5
Сухое смешивание
После получения лактид/гликолидного и поли(п-диоксанонового) полимеров описанными выше способами соответствующие количества данных компонентов в измельченной (размолотой) форме смешивали в сухую смесь. Данные сухие смеси получают исходя из весовых количеств в зависимости от конкретного применения и хирургических потребностей. В настоящем примере приготовили сухую смесь поли(п-диоксанона) в количестве 20% вес. и лактид/гликолидного сополимера в количестве 80% вес.
В чистый сушильный барабан емкостью 85,0 л (3 куб. фута) производства компании Patterson-Kelley взвешивали и добавляли 36,0 кг гранул лактид/гликолидного сополимера с мольным соотношением компонентов 85/15, представленного в ПРИМЕРЕ 2. В тот же сушильный барабан емкостью 85,0 л (3 куб. фута) взвешивали и добавляли 9,0 кг гранул поли(п-диоксанонового) полимера, представленного в ПРИМЕРЕ 4. Барабан закрывали и емкость откачивали до давления менее 26,7 Па (200 мТорр). Включали вращение со скоростью 7,5 об/мин и продолжали перемешивание в течение минимум одного часа. Затем сухую смесь выгружали в переносные вакуумируемые емкости для хранения, которые хранили под вакуумом до готовности к использованию на следующей стадии.
Для цели настоящего изобретения аналогичным образом можно получать смеси данного типа с другими композициями. Другие композиции, обладающие признаками изобретения, перечислены в таблице I. Кроме того, для сравнения также приготовили несколько смесей из предшествующего уровня техники, более конкретно, смеси из патента Smith. Три изготовленные смеси содержали 30% вес. поли(п-диоксанона) и 70% вес. лактид/гликолидного сополимера при 80, 85 и 90 мольных процентах полимеризованного L(-)-лактида соответственно. Как описано выше, для некоторых ответственных ситуаций данные смеси, содержащие более приблизительно 24% вес. поли(п-диоксанона), оказываются слишком мягкими.
ПРИМЕР 6
Смешивание в расплаве
После получения сухих смесей и их кондиционирования в вакууме в течение по меньшей мере трех суток можно начинать стадию смешивания в расплаве. На двухшнековый экструдер ZSK-30 устанавливали шнеки, выполненные с возможностью смешивания в расплаве с использованием двух портов для вакуумирования с целью удаления остаточного мономера. В конструкции шнека существует несколько различных типов элементов, включая транспортирующие, сжимающие, перемешивающие и уплотняющие элементы. На экструдер устанавливали фильеру с тремя отверстиями, а рядом с выходным отверстием экструдера устанавливали бак с охлаждаемой водой, температура которой могла составлять от 4,4 до 21,1°C (от 40 до 70°F). На конце бака с водой размещали стренговый гранулятор и классификатор гранул. Горячие зоны экструдера нагревали до температуры от 160 до 180°C и устанавливали температуру вакуумных охлаждаемых ловушек -20°C. Подготовленные гранулы сухой смеси извлекали из вакуумированных емкостей и под потоком азота помещали в двухшнековый питающий бункер. Скорость вращения шнеков экструдера устанавливали 175-225 об/мин и включали питатель, обеспечивая подачу сухой смеси в экструдер.
После заполнения смесью полимерного расплава всего экструдера до получения стабильной подачи включали откачку через два порта для вакуумирования. Выходящие из экструдера нити полимерной смеси пропускали через бак с водой и подавали на стренговый гранулятор. Гранулятор нарезал нити на гранулы соответствующего размера; было обнаружено, что достаточно приготовить гранулы диаметром 1 мм и длиной приблизительно 3 мм. Затем гранулы подавали в классификатор. Классификатор отделял гранулы большего или меньшего размера от гранул необходимого размера, вес которых обычно составлял приблизительно 10-15 мг на гранулу. Данный процесс продолжали до тех пор, пока вся сухая полимерная смесь не проходила через процесс смешивания в расплаве на экструдере и не превратилась в по существу однородные гранулы. В процессе экструзии отбирали образцы полимера и определяли такие его характеристики, как характеристическая вязкость, молекулярная масса и композиция. По окончании процесса смешивания в расплаве гранулированный полимер помещали в полиэтиленовые мешки, взвешивали и хранили в холодильнике при температуре ниже -20°C до проведения процедуры удаления летучего остаточного мономера.
Смесь полимеров в расплаве помещали в сушильный барабан емкостью 85,0 л (3 куб. фута) производства компании Patterson-Kelley с возможностью откачки сосуда. Сушильный барабан закрывали и откачивали до давления менее 26,7 Па (200 мТорр). Когда давление опускалось ниже 26,7 Па (200 мТорр), включали вращение барабана со скоростью 10 об/мин без подогрева на 6 часов. По истечении 6 часов температуру масла поддерживали на уровне 120°C со скоростью нагрева 85°C в час. Температуру масла выдерживали на уровне 85°C в течение 12 часов. В конце данного периода нагрева массу оставляли охлаждаться в течение по меньшей мере 4 часов при продолжающемся вращении и откачке. Гранулы смешанного в расплаве полимера выгружали из барабана, напустив в сосуд азот, открывая выпускной клапан и позволяя гранулам полимера высыпаться в предназначенные для них сосуды для долговременного хранения. Сосуды для долговременного хранения были герметичны и имели клапаны для откачки, позволяя хранить смолу в вакууме. Смолу охарактеризовали.
Следуя описанному выше способу, проводили смешивание в расплаве сухой смеси, представленной в ПРИМЕРЕ 5. Полученная смесь из расплава показала характеристическую вязкость 1,70 дл/г по результатам измерения в гексафторизопропаноле при температуре 25°C и концентрации 0,10 г/дл. По результатам анализа с использованием гельпроникающей хроматографии средневесовая молекулярная масса полимера составила приблизительно 88 000 Дальтон. По результатам анализа с использованием дифференциальной сканирующей калориметрии температура стеклования полимера составила приблизительно от -15°C до 55°C, а фазовый переход плавления происходил при температуре приблизительно от 105 до 150°C. Анализ с использованием ядерного магнитного резонанса подтвердил, что смола представляла собой смесь поли(п-диоксанона) и лактид/гликолидного сополимера с мольным соотношением компонентов 85/15, содержащую приблизительно 64 процента полимеризованного лактида, 24 процента поли(п-диоксанона) и 11 процентов полимеризованного гликолида при измерении по мольным количествам. Общее остаточное содержание мономера составило менее 2 процентов. Рентгеноструктурный анализ показал степень кристалличности приблизительно 40 процентов.
Как указано выше в ПРИМЕРЕ 5, указанным выше способом получили смеси с различными композициями, содержащие поли(п-диоксанон), полилактидные гомополимеры и лактид/гликолидные сополимеры с высоким содержанием лактида. Для целей настоящего изобретения с использованием данных способов приготовили полимеры и смеси из расплава, перечисленные ниже в таблице I. Из полимера, представленного в ПРИМЕРЕ 1, и смесей из расплава, представленных в ПРИМЕРЕ 6, литьем под давлением изготовили хирургические изделия, описанные в ПРИМЕРЕ 7, для которых проанализировали физические, биологические и химические характеристики.
ПРИМЕР 7
Описание изделия для тестирования
Выбранное для оценки изделие представляло собой лапароскопическое устройство для герниопластики размером 5 мм; оно имело форму скобы или стяжки с ножками и средствами фиксации ткани на концах ножек. Устройство показано на ФИГ. 2. Устройство имело сложную форму и было стерилизовано с использованием стандартных способов стерилизации окисью этилена после проведения процесса отжига. Устройство использовали для закрепления простетической сетки на мягкой ткани как в лапароскопических, так и в открытых процедурах.
ПРИМЕР 8
Литье под давлением
Способ литья под давлением хорошо известен в полимерной промышленности. Он разработан с возможностью изготовления изделий различных форм и размеров путем плавления полимера, его перемешивания и последующего впрыскивания расплавленной смолы в литьевую форму подходящей геометрии. После отверждения смолы изделие по существу извлекают из формы и продолжают технологический процесс.
Для целей настоящего изобретения использовали стандартную машину для литья под давлением емкостью 27215,5 кг (30 тонн) с электрическим управлением. Полимер, представленный в ПРИМЕРЕ 1, и полимерные смеси, представленные в ПРИМЕРЕ 6, обрабатывали следующим общим образом. Полимер и полимерные смеси подавали под током азота самотеком из питателя в подогреваемый цилиндр. В цилиндре полимер перемещали вперед плунжером шнекового типа в подогреваемую камеру. При продвижении шнека вперед расплавленный полимер и полимерные смеси продавливались через упирающееся в форму сопло, позволяя полимеру и полимерным смесям попасть в специально сконструированную полость пресс-формы через систему литника и распределительного канала. В полости пресс-формы происходило образование смеси в изделие, которое затем оставляли охлаждаться в течение периода времени при заданной температуре. Затем его извлекали, или выталкивали, из формы и отделяли от литника и распределительного канала. Цикл литья под давлением состоял из целой последовательности отдельных операций. Цикл начинали с закрытия формы с последующим впрыскиванием полимера и полимерных смесей в полость пресс-формы. После заполнения полости давление продолжали поддерживать для компенсации усадки материала. Затем шнек-плунжер проворачивали, подавая следующую «порцию» в переднюю часть шнека. После приготовления следующей «порции» шнек отводили назад. Изделие охлаждали в форме до достаточной температуры, открывали форму и извлекали из нее изделие. Продолжительность операций закрытия формы и выталкивания из формы составляла от долей секунды до нескольких секунд. Продолжительность охлаждения выбирали исходя из ряда факторов, включая размер изделия и композицию материала.
ПРИМЕР 9
Отжиг отлитого изделия
После отливки под давлением изделия, представленные в ПРИМЕРЕ 8, подвергали отжигу для доведения морфологии полимера до окончательного состояния. Как указано выше, это часто приводит к повышению степени кристалличности материала изделия. Изделия, представленные в ПРИМЕРЕ 8, отжигали с использованием оснастки для отжига, которая предохраняла изделия от искажений в горизонтальной плоскости изделия. Хотя данная оснастка для отжига предназначена для защиты изделия от искажений при повышенных температурах во время отжига, она не защитит изделия с нестабильными размерами от коробления.
Цикл отжига, использованный для обработки изделий, представленных в ПРИМЕРЕ 8, состоял из трех стадий: 60°C в течение 8 часов, 70°C в течение 4 часов и затем 80°C в течение 4 часов. Целью стадии с температурой отжига 60°C являлась дополнительная кристаллизация поли(п-диоксаноновой) фазы в смеси до достижения температур кристаллизации поли(лактидной и гликолидной) фазы. На стадии с температурой отжига 70°C начинается кристаллизация поли(лактидной и гликолидной) фазы до достижения последней стадии цикла. Наконец, на стадии с температурой отжига 80°C происходит дополнительная кристаллизация поли(лактидной и гликолидной) фазы.
Следует отметить, что для заданного устройства и заданной композиции можно подобрать такие условия отжига, которые позволят оптимизировать определенные ключевые рабочие характеристики устройства. Данные благоприятные условия отжига могут быть подобраны путем экспериментирования, изменения температуры и продолжительности отжига и измерения эффекта обработки.
ПРИМЕР 10
Аналитическая характеризация отлитых изделий
В целом, отлитые изделия характеризовали по химическому составу с использованием ядерного магнитного резонанса (ЯМР); по молекулярной массе с использованием измерения характеристической вязкости в гексафторизопропаноле при концентрации 0,1 г/дл и температуре 25°C и/или с использованием гельпроникающей хроматографии (ГПХ); по морфологии с использованием рентгеноструктурных измерений, дифференциальной сканирующей калориметрии (ДСК) и химического травления. Изделия анализировали до отжига, после отжига, а также часто после стерилизации окисью этилена.
Степени кристалличности выбранного множества изделий, изготовленных литьем под давлением и отжигом, указаны ниже в таблице.
ПРИМЕР 11
Тестирование in vitro; механические свойства
Проверяли механические свойства выбранных множеств изделий, изготовленных литьем под давлением и отжигом, которые представлены в ПРИМЕРЕ 9, с использованием разрывной машины INSTRON модели 5544 с соответствующей тензодатчиком. Изделия закрепляли в оснастке, выполненной с возможностью захвата ножек с зазубринами на одном конце и головки на другом конце. Измеренные усилия разрушения фиксировали как «прочность на разрыв на 0 сутки».
ПРИМЕР 12
Тестирование in vitro; тестирование на сохранение прочности на разрыв (BSR)
Выбранные множества изделий, изготовленных литьем под давлением и отжигом, которые представлены в ПРИМЕРЕ 9, помещали в емкости, заполненные подходящим количеством фосфатно-буферного раствора с pH 7,27. Затем емкости инкубировали при температуре 37°C, периодически извлекая представительную выборку изделий, как правило, десяти, для испытания их механических свойств. Механические свойства инкубированных изделий тестировали с использованием разрывной машины INSTRON способом, аналогичным описанному в ПРИМЕРЕ 11. Измеренные усилия разрушения фиксировали как «прочность на разрыв». Затем рассчитывали отношение «прочности на разрыв» к «прочности на разрыв на 0 сутки» и фиксировали результат как «сохранение прочности на разрыв» для каждого периода времени. Результаты тестирования графически представлены на ФИГ. 4. На ФИГ. 4 представлен график, показывающий влияние изменения композиции материала литого медицинского изделия на сохранение прочности на разрыв (BSR) по результатам тестирования in vitro.
ПРИМЕР 13
Проникающая способность
Изделия для тестирования, представленные в ПРИМЕРЕ 9N, тестировали на их способность проникать в ткани тела и фиксировать хирургическую сетку. С помощью разрывной машины INSTRON измеряли усилие, необходимое для фиксации доступной в продаже хирургической сетки к брюшку свиньи. Для тестирования проникающей способности использовали специально изготовленные верхнюю и нижнюю оснастки. Верхняя оснастка представляла собой вилку-толкатель для проталкивания фиксатора через сетку, тогда как нижняя оснастка представляла собой прижим для удержания брюшка свиньи на месте.
Было обнаружено, что изделия для тестирования, представленные в ПРИМЕРЕ 9N, функционируют должным образом. Другими словами, они показали достаточные остроту наконечников, стабильность размеров и имели адекватную жесткость и прочность на сжатие. В зависимости от функционального назначения изделия, такого как ортопедические приложения, указанную жесткость можно повысить путем снижения доли поли(п-диоксанона). Аналогичным образом жесткость можно понизить путем увеличения доли поли(п-диоксанона), как например, для приложений по фиксации мягких тканей.
ПРИМЕР 14
Прочность крепления
Способность удерживать хирургическую сетку на ткани тела является важной функцией фиксатора, особенно в критический период заживления раны. К закрепленной на ткани сетке прикладывали механические усилия для определения усилия, необходимого для отделения сетки от ткани; данное усилие называется «прочность крепления». Более конкретно, хирургическую сетку закрепляли на брюшке свиньи путем вставки трех изделий, представленных в ПРИМЕРЕ 9N, вдоль одной стороны сетки. Затем сетку захватывали между двумя прижимами, присоединенными к динамометру, и тянули в направлении сдвига (параллельно плоскости ткани) до отделения сетки от ткани. Предельное усилие фиксировали как «прочность крепления». Изделия, представленные в ПРИМЕРЕ 9N, создавали значения усилия крепления приблизительно от 10 до 11 фунтов. В зависимости от медицинского приложения требования к прочности крепления могут различаться, и композиция используемого изделия может быть подобрана для удовлетворения таких требований.
Получили данные по прочности крепления для изделий, изготовленных из смесей с различными средневесовыми молекулярными массами при композиции полимера 20% вес. поли(п-диоксанона)/80% вес. сополимера L(-)-лактида и гликолида с соотношением 85/15. Данные представлены ниже в таблице III.
ПРИМЕР 15
Стабильность размеров
Неотожженные изделия, представленные в ПРИМЕРЕ 8N, подвергали рентгеноструктурному анализу и, в целом, получили степень кристалличности приблизительно от 11 до 12 процентов. По результатам рентгеноструктурного анализа кристалличность в основном обусловлена поли(п-диоксаноновой) фазой. После отжига отлитые изделия имели повышенную стабильность размеров. Изделия, представленные в ПРИМЕРЕ 9, показывали более высокие степени кристалличности по сравнению с их аналогами, представленными в ПРИМЕРЕ 8. Отожженные изделия, представленные в ПРИМЕРЕ 9N, также подвергали рентгеноструктурному анализу, и они показали более высокие степени кристалличности приблизительно от 38 до 41 процентов.
Отлитые изделия, представленные в ПРИМЕРЕ 9, проверяли на стабильность размеров. Размеры отлитых изделий измеряли до проведения отжига и после проведения отжига; кроме того, изделия фотографировали. Хотя точного совпадения размеров не ожидали, очевидно, что имеются недопустимые уровни искажений. В некоторых случаях избыточные искажения приводят к снижению функциональности изделий.
Изделия для тестирования, представленные в ПРИМЕРЕ 9, имеют сложную форму и ряд критических размеров. Например, слишком сильное искажение ножек отлитого изделия приведет к снижению способности устройства прокалывать и удерживать ткань. Аналогичным образом значительная усадка зазубрин отлитого изделия приведет к снижению функциональности изделия из-за снижения способности удерживать ткань. У каждой конструкции будут свои критические размеры. Авторы считают, что конструкция, представленная в ПРИМЕРЕ 7, является представительным примером устройства с высокими требованиями к стабильности размеров; такое мнение основано и на геометрической сложности изделия. Кроме того, малые размеры изделия приводят к повышению степени ориентации молекул в процессе литья под давлением, что в свою очередь приводит к повышенной склонности к искажениям извлеченного изделия при повышенных температурах, которые могут воздействовать на изделие во время отжига, и/или стерилизации, и/или хранения.
Изделия оценивали и характеризовали по принципу «годен/не годен». Отлитые изделия отбраковывали при наличии значительного коробления, изделие считали годным при отсутствии признаков избыточного искажения. Аналогичным образом при обнаружении избыточного искажения изделие считали негодным. В принципе все изделия, изготовленные литьем под давлением, после литья имеют некоторый уровень остаточного напряжения, поэтому изделия с допустимыми уровнями искажений считали прошедшими тест на стабильность размеров.
Для изделий, представленных в ПРИМЕРЕ 9, критическим размером является расстояние между наконечниками ножек, см. ФИГ. 3. На ФИГ. 3 представлено изображение устройства, показанного на ФИГ. 2, с указанием критических размеров указанного устройства. Изменение данных размеров из-за недостаточной стабильности размеров изделия может привести к снижению качественных характеристик устройства или сделать его полностью непригодным к использованию. Расстояние между наконечниками ножек менее 0,29 см (0,115 дюйма) для изделий, представленных в ПРИМЕРЕ 9, считали допустимыми, тогда как расстояние между наконечниками, равное или превышающее 0,29 см (0,115 дюйма), считали недопустимым и обозначали такую ситуацию как «причина отбраковки один» или «fm1». Аналогичным образом длину элементов зазубрин для изделий, представленных в ПРИМЕРЕ 9, также считали критическим размером. Длину зазубрины меньше или равную 0,35 см (0,136 дюйма) считали недопустимой и такую ситуацию обозначали как «причина отбраковки 2» или «fm2».
Делали фотографии и определяли размеры с использованием цифрового микроскопа модели VHX-600 компании Keyence при увеличении 20X. Результаты тестирования приведены в таблице IV.
На ФИГ. 6a представлена фотография отлитого под давлением фиксатора, представленного в ПРИМЕРЕ 8C (т.е. до отжига), изготовленного из полимерной композиции, представленной в ПРИМЕРЕ 6C, из которой изготовлены отлитые под давлением фиксаторы с неприемлемым короблением после отжига. На ФИГ. 6b представлена фотография отлитого под давлением фиксатора, представленного в ПРИМЕРЕ 9C (аналогично фиксатору, показанному на ФИГ. 6a, но после отжига), изготовленного из полимерной композиции, представленной в ПРИМЕРЕ 6C, из которой изготовлены отлитые под давлением фиксаторы с неприемлемым короблением после отжига.
На ФИГ. 7a представлена фотография отлитого под давлением фиксатора, представленного в ПРИМЕРЕ 8D (т.е. до отжига), изготовленного из полимерной композиции, представленной в ПРИМЕРЕ 6D, из которой изготовлены отлитые под давлением фиксаторы с повышенной стабильностью размеров и приемлемой степенью коробления после отжига. На ФИГ. 7b представлена фотография отлитого под давлением фиксатора, представленного в ПРИМЕРЕ 9D (аналогично фиксатору, показанному на ФИГ. 7a, но после отжига), изготовленного из полимерной композиции, представленной в ПРИМЕРЕ 6D, из которой изготовлены отлитые под давлением фиксаторы с повышенной стабильностью размеров и приемлемой степенью коробления после отжига.
На ФИГ. 8a представлена фотография отлитого под давлением фиксатора, представленного в ПРИМЕРЕ 8N (т.е. до отжига), изготовленного из полимерной композиции, представленной в ПРИМЕРЕ 6N, из которой изготовлены отлитые под давлением фиксаторы с повышенной стабильностью размеров и приемлемой степенью коробления после отжига. На ФИГ. 8b представлена фотография отлитого под давлением фиксатора, представленного в ПРИМЕРЕ 9N (аналогично фиксатору, показанному на ФИГ. 8a, но после отжига), изготовленного из полимерной композиции, представленной в ПРИМЕРЕ 6N, из которого изготовлены отлитые под давлением изделия с повышенной стабильностью размеров и приемлемой степенью коробления после отжига.
На ФИГ. 9a представлена фотография отлитого под давлением фиксатора, представленного в ПРИМЕРЕ 8S (т.е. до отжига), изготовленного из полимерной композиции, представленной в ПРИМЕРЕ 6S, из которой изготовлены отлитые под давлением фиксаторы с неприемлемым короблением после отжига. На ФИГ. 9b представлена фотография отлитого под давлением фиксатора, представленного в ПРИМЕРЕ 9S (аналогично фиксатору, показанному на ФИГ. 9a, но после отжига), изготовленного из полимерной композиции, представленной в ПРИМЕРЕ 6S, из которой изготовлены отлитые под давлением фиксаторы с неприемлемым короблением после отжига.
На ФИГ. 10a представлена фотография отлитого под давлением фиксатора, представленного в ПРИМЕРЕ 8T (т.е. до отжига), изготовленного из полимерной композиции, представленной в ПРИМЕРЕ 6T, из которой изготовлены отлитые под давлением фиксаторы с повышенной стабильностью размеров и приемлемой степенью коробления после отжига. На ФИГ. 10b представлена фотография отлитого под давлением фиксатора, представленного в ПРИМЕРЕ 9T (аналогично фиксатору, показанному на ФИГ. 10a, но после отжига), изготовленного из полимерной композиции, представленной в ПРИМЕРЕ 6T, из которой изготовлены отлитые под давлением фиксаторы с повышенной стабильностью размеров и приемлемой степенью коробления после отжига.
На ФИГ. 11a представлена фотография отлитого под давлением фиксатора, представленного в ПРИМЕРЕ 8X (т.е. до отжига), изготовленного из полимерной композиции, представленной в ПРИМЕРЕ 6X, из которой изготовлены отлитые под давлением фиксаторы с повышенной стабильностью размеров и приемлемой степенью коробления после отжига. На ФИГ. 11b представлена фотография отлитого под давлением фиксатора, представленного в ПРИМЕРЕ 9X (аналогично фиксатору, показанному на ФИГ. 11a, но после отжига), изготовленного из полимерной композиции, представленной в ПРИМЕРЕ 6X, из которой изготовлены отлитые под давлением фиксаторы с повышенной стабильностью размеров и приемлемой степенью коробления после отжига.
ПРИМЕР 16
Профиль рассасываемости
Изделия, составляющие предмет настоящего изобретения, рассасываются в ткани тела. В целом, чем выше количество гликолида в поли(лактидном и гликолидном) сополимере с высоким содержанием лактида, тем быстрее будет рассасываться изделие. Кроме того, чем выше количество поли(п-диоксанона) в полимерной смеси, тем быстрее будет рассасываться изделие.
Отлитые под давлением и отожженные изделия, которые по существу аналогичны по конструкции изделиям, показанным на ФИГ. 2, изготовленные из смесей сополимера лактида и гликолида с высоким содержанием лактида и поли(п-диоксанона), тестировали на время гидролиза при pH 7,27 и температуре 70°C. Результаты данного теста по ускоренному гидролизу представлены в таблице V.
ПРИМЕР 17
Определение морфологии смеси
Определяли морфологию неосновного компонента изделий, изготовленных литьем под давлением из полимерной смеси, содержащей 20% вес. поли(п-диоксанона) и 80% вес. сополимера лактида и гликолида, причем сополимер лактида и гликолида содержит 85 мольных процентов полимеризованного лактида и 15 мольных процентов полимеризованного гликолида. Микрофотографии получали следующим образом: отлитое под давлением устройство разрезали на 8 малых фрагментов для доступа ко всем внутренним структурам; малые фрагменты замачивали на ночь в хлороформе (5 мл) для растворения поли(лактидного и гликолидного) компонента смеси. Затем раствор хлороформа встряхивали для разрушения спутанной волокнистой структуры; затем раствор пропускали через полипропиленовый фильтр с размером пор 0,3 мкм; затем фильтр промывали хлороформом для удаления любых возможных остатков осевшего на фильтре лактид/гликолидного сополимера; затем оставшиеся на поверхности фильтра структуры поли(п-диоксанона) изучали с использованием СЭМ.
На ФИГ. 1 представлено полученное при помощи СЭМ изображение собранных поли(п-диоксаноновых) структур изделий, изготовленных литьем под давлением из полимерной смеси, содержащей 20% вес. поли(п-диоксанона) и 80% вес. сополимера лактида и гликолида, причем сополимер лактида и гликолида содержит 85 мольных процентов полимеризованного лактида и 15 мольных процентов полимеризованного гликолида. Коэффициент пропорциональности поли(п-диоксаноновой) фазы существенно превышает единицу, указывая на наличие высокого уровня напряжения сдвига в процессе получения, что, как правило, приводит к высокому уровню остаточных напряжений, приводящих к повышенной склонности к последующей усадке и короблению.
ПРИМЕР 18
Пригодность смеси, обладающей признаками изобретения, для медицинских устройств
Следует понимать, что смесь, составляющую предмет настоящего изобретения, можно использовать для получения медицинских устройств с использованием различных способов обработки расплава. Как показано в некоторых примерах, описанных выше, один из таких применимых способов представляет собой литье под давлением. Следует также понимать, что смеси, обладающие признаками изобретения, можно использовать для изготовления изделий различных конструкций.
Одно такое изготовленное устройство имело форму гантели длиной 0,89 см (0,35 дюйма) с по существу дисковидными концевыми частями диаметром 0,51 см (0,20 дюйма) и толщиной 0,13 см (0,05 дюйма). Соединяющий два диска элемент имел по существу круговое сечение диаметром 0,157 см (0,062 дюйма). На ФИГ. 12 представлен чертеж такого устройства в форме гантели. Данную конструкцию изготовили литьем под давлением с использованием лактид/гликолидного сополимера с соотношением 90/10 в качестве контроля и из полимерной смеси, составляющей предмет настоящего изобретения, в частности, полученной смешением в расплаве смеси 20% вес. поли(п-диоксанона) и 80% вес. лактид/гликолидного сополимера с соотношением 90/10. Изготовленные таким образом изделия обработали термическим отжигом без физических ограничений при температурах 60, 70 и 80°C в течение 8, 4 и 4 часов соответственно. После такого отжига устройства, отлитые из лактид/гликолидного сополимера с соотношением 90/10, показали значительную усадку и коробление. Устройства, отлитые из смеси, обладающей признаками изобретения, после отжига по существу не содержали следов усадки и коробления.
Ожидается, что смеси, составляющие предмет настоящего изобретения, также можно будет использовать для получения путем литья под давлением очень широкого спектра устройств, включая, без ограничений, скобы, штифты, винты, пластины, зажимы, фиксаторы, каркасы для восстановления ткани и устройства для закрытия ран. Кроме того, также ожидается, что для формирования применимых устройств с использованием смесей, обладающих признаками изобретения, также можно использовать другие способы обработки. Такие способы включают, без ограничений, волоконную экструзию, профильную экструзию, пленочную экструзию, экструзию труб и раздувное формование. Специалист в данной области может, например, использовать резку или штамповку в необходимой геометрии для получения устройств из листового материала, образованного способами экструзии. Специалист в данной области без труда выберет соответствующий способ формирования.
ПРИМЕР 19
Смешивание в расплаве в процессе получения медицинского устройства
Как указано выше, альтернативный способ получения смеси из расплава, составляющей предмет настоящего изобретения, заключался в добавлении компонентов смеси соответствующего размера непосредственно в питатель машины для литья под давлением. Смешивание в расплаве происходит внутри цилиндра машины для литья под давлением и позволяет получить изделия приемлемого качества, как описано в ПРИМЕРЕ 7.
ПРИМЕР 20
Расчет минимальной весовой доли поли(п-диоксанона) в смеси, составляющей предмет настоящего изобретения
Как указано выше, минимальное количество поли(п-диоксанона) в смеси зависело от мольного количества полимеризованного лактида, присутствующего в полимере на основе лактида, присутствующего в полимерной смеси, и было рассчитано с использованием приведенного ниже уравнения:
Весовая доля поли(п-диоксанона) = (215,6212/мольная доля полимеризованного лактида)2,7027.
Например, по результатам расчетов при композиции сополимера лактида и гликолида с соотношением 82/8 (на основе мольных количеств) минимальная весовая доля поли(п-диоксанона) в смеси составила 10 процентов, а максимальное количество - приблизительно 24 процента. Аналогичным образом по результатам расчетов при композиции сополимера лактида и гликолида с соотношением 86/14 (на основе мольных количеств) минимальная весовая доля поли(п-диоксанона) в смеси составила 12 процентов, а его максимальное количество - приблизительно 24 процента. В таблице VI представлены диапазоны количества поли(п-диоксанона) в смеси, составляющей предмет настоящего изобретения, выраженные как его минимальная и максимальная весовые доли.
На ФИГ. 5 представлен график зависимости мольной доли лактида в лактид/гликолидном сополимерном компоненте от весовой доли поли(п-диоксанона); ограниченная кривыми область показывает новые полимерные композиции, составляющие предмет настоящего изобретения.
Хотя настоящее изобретение было показано и описано применительно к его подробным вариантам осуществления, специалистам в данной области будет понятно, что возможны различные изменения в форме и деталях без отступления от сущности и объема заявляемого изобретения.
Реферат
Изобретение относится к биорассасывающимся полимерным смесям, которые могут использоваться для получения медицинских устройств. В изобретении раскрыты новые биорассасывающиеся полимерные смеси. Смеси содержат первый компонент, который представляет собой полилактидные полимеры или сополимер лактида и гликолида, и второй компонент, который представляет собой поли(п-диоксаноновый) полимер. Новые полимерные смеси обеспечивают изготовление медицинских устройств, имеющих стабильность размеров. Также раскрыты новые биорассасывающиеся медицинские устройства, изготовленные из данных новых полимерных смесей, а также новые способы получения медицинских устройств. 4 н. и 106 з.п. ф-лы,12 ил.,6 табл, 20 пр.
Формула
первый биорассасывающийся полимер и второй биорассасывающийся полимер,
причем первый полимер содержит от приблизительно 76% вес. до приблизительно 92% вес. полимера с высоким содержанием лактида, содержащего от приблизительно 100 мольных процентов до приблизительно 70 мольных процентов полимеризованного лактида и от приблизительно 0 мольных процентов до приблизительно 30 мольных процентов полимеризованного гликолида, а второй полимер представляет собой поли(п-диоксанон),
причем максимальная весовая доля поли(п-диоксанона) в смеси составляет приблизительно 24% вес., а минимальная весовая доля поли(п-диоксанона) в смеси зависит от молярного количества полимеризованного лактида в полимере с высоким содержанием лактида и рассчитывается согласно выражению:
Весовая доля поли(п-диоксанона) = (215,6212/мольная доля полимеризованного лактида)2,7027,
и причем полимерная смесь обеспечивает стабильность размеров полученного изделия.
первый биорассасывающийся полимер и второй биорассасывающийся полимер,
причем первый полимер содержит от приблизительно 76% вес. до приблизительно 92% вес. полимера с высоким содержанием лактида, содержащего от приблизительно 100 мольных процентов до приблизительно 70 мольных процентов полимеризованного лактида и от приблизительно 0 мольных процентов до приблизительно 30 мольных процентов полимеризованного гликолида, а второй полимер представляет собой поли(п-диоксанон),
причем максимальная весовая доля поли(п-диоксанона) в смеси составляет приблизительно 24% вес., а минимальная весовая доля поли (п-диоксанона) в смеси зависит от молярного количества полимеризованного лактида в полимере с высоким содержанием лактида и рассчитывается согласно выражению:
Весовая доля поли(п-диоксанона) = (215,6212/мольная доля полимеризованного лактида)2,7027,
и причем полимерная смесь обеспечивает стабильность размеров полученного изделия.
медицинское изделие, выполненное из смеси первого биорассасывающегося полимера и второго биорассасывающегося полимера,
причем первый полимер содержит от приблизительно 76% вес. до приблизительно 92% вес. полимера с высоким содержанием лактида, содержащего от приблизительно 100 мольных процентов до приблизительно 70 мольных процентов полимеризованного лактида и от приблизительно 0 мольных процентов до приблизительно 30 мольных процентов полимеризованного гликолида, а второй полимер представляет собой поли(п-диоксанон),
причем максимальная весовая доля поли(п-диоксанона) в смеси составляет приблизительно 24% вес., а минимальная весовая доля поли(п-диоксанона) в смеси зависит от молярного количества полимеризованного лактида в полимере с высоким содержанием лактида и рассчитывается согласно выражению:
Весовая доля поли(п-диоксанона) = (215,6212/мольная доля полимеризованного лактида)2,7027,
и причем полимерная смесь обеспечивает стабильность размеров полученного изделия.
термической обработки смеси первого биорассасывающегося полимера и второго биорассасывающегося полимера, причем первый полимер содержит от приблизительно 76% вес. до приблизительно 92% вес. полимера с высоким содержанием лактида, содержащего от приблизительно 100 мольных процентов до приблизительно 70 мольных процентов полимеризованного лактида и от приблизительно 0 мольных процентов до приблизительно 30 мольных процентов полимеризованного гликолида, а второй полимер представляет собой поли(п-диоксанон),
причем максимальная весовая доля поли(п-диоксанона) в смеси составляет приблизительно 24% вес., а минимальная весовая доля поли (п-диоксанона) в смеси зависит от молярного количества полимеризованного лактида в полимере с высоким содержанием лактида и рассчитывается согласно выражению:
Весовая доля поли(п-диоксанона) = (215,6212/мольная доля полимеризованного лактида)2,7027,
и формируют биорассасывающееся медицинское изделие из смеси, причем полимерная смесь обеспечивает стабильность размеров полученного изделия.

Комментарии