Фторуретаны в качестве добавки в фотополимерной композиции - RU2570662C9
Код документа: RU2570662C9
Чертежи
Описание
Настоящее изобретение касается композиции фотополимера, включающей в себя полимеры матрикса, записывающие мономеры и фотоинициаторы, применение композиции фотополимера для изготовления оптических элементов, в особенности для изготовления голографических элементов и изображений, способа экспозиции голографических сред из композиции фотополимера, а также специальных фторуретанов.
В международной заявке на патент WO 2008/125229 А1 описаны фотополимерные композиции указанного в начале вида. Они включают в себя полимеры матрикса на основе полиуретанов, записывающие мономеры на акриловой основе, а также фотоинициаторы. В затвердевшем состоянии записывающие мономеры и фотоинициаторы отлагаются в полиуретановом матриксе в распределенном по объему состоянии. Из публикации WO также известно добавление к фотополимерной композиции дибутилфталата - классического пластификатора технических пластмасс.
Для применения фотополимерных рецептур в описанных ниже областях решающую роль играет созданная в фотополимере посредством голографической экспозиции (топографического освещения) модуляция коэффициента преломления Δn. При голографической экспозиции интерференционное поле объектного и опорного лучей света (в простейшем случае - двух плоских волн) отображается в решетке коэффициента преломления путем местной фотополимеризации, например, сильно преломляющих акрилатов, в точках высокой интенсивности в интерференционном поле. Решетка коэффициента преломления в фотополимере (голограмма) содержит всю информацию объектного светового луча. Впоследствии, освещая голограмму только опорным световым лучом, можно реконструировать сигнал. Силу реконструированного таким образом сигнала относительно силы падающего опорного света называют дифракционной эффективностью, в дальнейшем ДЭ (DE, Diffraction Efficiency). В простейшем случае голограммы, которая образуется из наложения двух плоских волн, ДЭ получают как частное интенсивности света, дифрагированного при реконструкции, деленного на суммарную интенсивность падающего опорного света и дифрагированного света. Чем выше ДЭ, тем эффективнее голограмма с точки зрения количества опорного света, необходимого, чтобы придать сигналу видимость с фиксированной яркостью. Сильно преломляющие акрилаты в состоянии создавать решетку коэффициентов преломления с высокой амплитудой между участками с минимальным коэффициентом преломления и участками с самым высоким коэффициентом преломления и дают таким образом возможность создавать в фотополимерных композициях голограммы с высокой ДЭ и высоким Δn. При этом необходимо учитывать, что ДЭ зависит от произведения Δn и толщины слоя полимера d. Чем выше произведение, тем больше возможная ДЭ (для отражательных голограмм). Величина угла, в котором голограмма становится видна (реконструируется), например, при монохроматическом освещении, зависит только от толщины слоя d. При освещении голограммы, например, белым светом, ширина спектрального диапазона, способного участвовать в реконструкции голограммы, также зависит только от толщины слоя d. При этом справедливо, что чем меньше d, тем шире конкретные диапазоны приемлемости. Поэтому, когда желательно изготавливать яркие (светлые) и хорошо видимые голограммы, необходимо стремиться к высокому Δn·d и малой толщине d, причем так, чтобы ДЭ была по возможности высокой. То есть чем выше становится Δn, тем большей степени свободы удается достичь для создания ярких голограмм путем изменения d и без потери ДЭ. Поэтому оптимизации Δn при оптимизации рецептур фотополимеров придают огромное значение (Р.Hariharan, Optical Holography, 2nd Edition, Cambridge University Press, 1996.).
Задача настоящего изобретения состояла в том, чтобы представить фотополимерную композицию, которая в сравнении с известными композициями дает возможность изготавливать голограммы с высокой яркостью.
В фотополимерной композиции согласно изобретению эту задачу решают посредством того, что композиция содержит в качестве пластификаторов фторуретаны. Так, было обнаружено, что добавление фторуретанов к известным фотополимерным композициям повышает значения Δn у изготовленных из этих композиций голограмм. В результате это означает, что голограммы, изготовленные из композиции согласно изобретению, обладают более высокой яркостью, чем известные голограммы.
Фторуретаны предпочтительно представляют собой соединения, имеющие структурный элемент общей формулы (I)

и замещены по меньшей мере одним атомом фтора. Кроме того, предпочтительно, если фторуретаны имеют общую формулу (II)
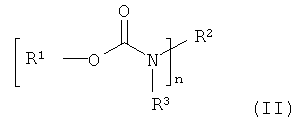
в которой n≥1 и n≤8, a R1, R2, R3 представляют собой водород и/или независимо друг от друга линейные, разветвленные, циклические или гетероциклические, незамещенные или же при необходимости замещенные гетероатомами органические остатки, причем по меньшей мере один из остатков R1, R2, R3 замещен по меньшей мере одним атомом фтора. При этом особо предпочтительно, чтобы R1 представлял собой органический остаток по меньшей мере с одним атомом фтора.
В соответствии с еще одной формой исполнения R1 может включать в себя 1-20 групп CF2 и/или одну или несколько групп CF3, особо предпочтительно 1-15 групп CF2 и/или одну или несколько групп CF3, особенно предпочтительно 1-10 групп CF2 и/или одну или несколько групп CF3, наиболее предпочтительно 1-8 групп CF2 и/или одну или несколько групп CF3, R2 может включать в себя алкильный остаток с 1-20 атомами углерода, предпочтительно алкильный остаток с 1-15 атомами углерода, особо предпочтительно алкильный остаток с 1-10 атомами углерода или водород, и/или R3 может включать в себя алкильный остаток с 1-20 атомами углерода, предпочтительно алкильный остаток с 1-15 атомами углерода, особо предпочтительно алкильный остаток с 1-10 атомами углерода или водород.
Особо предпочтительно, если фторуретаны несут уретдионовые, изоциануратные, биуретовые, аллофанатовые, полимочевинные, оксадиазадионовые и/или иминооксадиазиндионовые структурные элементы или смеси этих структурных элементов.
Коэффициент преломления фторуретанов может составлять ≤1,4600, предпочтительно ≤1,4500, особо предпочтительно ≤1,4400 и особенно предпочтительно ≤1,4300.
Содержание фтора во фторуретанах может составлять 10-80 масс.% фтора, предпочтительно 12,5-75 масс.% фтора, особо предпочтительно 15-70 масс.% фтора и особенно предпочтительно 17,5-65 масс.% фтора.
Фторуретаны формулы (III) получают реакцией изоцианатов формулы R[NCO]n со фторированными спиртами в стехиометрическом соотношении с образованием уретана.
Предпочтительные изоцианаты формулы R[NCO]n - это метилизоцианат, этилизоцианат, изомерные пропилизоцианаты, изомерные бутилизоцианаты, изомерные пентилизоцианаты, изомерные гексилизоцианаты, изомерные гептилизоцианаты, изомерные октилизоцианаты, изомерные нонилизоцианаты, изомерные децилизоцианаты, стеарилизоцианат, циклопропилизоцианат, циклобутилизоцианат, циклопентилизоцианат, циклогексилизоцианат, циклогептилизоцианат, 2-метилпентан-1,5-диизоцианат (MPDI), додекаметилене-диизоцианат, 1,8-диизоцианато-4-(изоцианатометил)октан (TIN), 6-диизоцианатогексан (HDI, Desmodur Н), 1-изоцианато-3,3,5-триметил-5-изоцианатометил-циклогексан (IPDI, Desmodur I), 2,4,4-триметилгексан-1,6-диизоцианат (TMDI), дициклогексилметан-диизоцианат (Desmodur W), гексагидротолуилендиизоцианат (H6TDI), бис(4-изоцианатоциклогексил)-метан (H12-MDI), 1,3-бис-(изоцианатометил)-циклогексан, Desmodur LD, Desmodur N 100, Desmodur N3200, Desmodur N3300, Desmodur N3350, Desmodur N3368, Desmodur N3375, Desmodur N3390, Desmodur N3400, Desmodur N3600, Desmodur N3790, Desmodur N3800, Desmodur N3900, Desmodur N50, Desmodur N75, Desmodur NZ1, Desmodur PL340, Desmodur PL350, Desmodur PM76, Desmodur BL3175, Desmodur BL3272, Desmodur BL3370, Desmodur BL3475, Desmodur BL4265, Desmodur BL5375, Desmodur BLXP2677, Desmodur DA-L, Desmodur DN, Desmodur E 305, Desmodur E3265, Desmodur E3370, Baymicron OXA, Desmodur VP LS 2078/2, Desmodur VP LS 2114/1, Desmodur VP LS 2257, Desmodur VP LS 2352/1, Desmodur VP LS 2371, Desmodur VP LS 2376/1, Desmodur XP 2406, Desmodur XP 2489, Desmodur XP 2565, Desmodur XP 2580, Desmodur XP 2599, Desmodur XP 2617, Desmodur XP 2626, Desmodur XP 2675, Desmodur XP 2679, Desmodur XP 2714, Desmodur XP 2730, Desmodur XP 2731, Desmodur XP 2742, Desmodur XP 2748, Desmodur Z 4470 или их смеси.
Особо предпочтительные изоцианаты формулы R[NCO]n - это изомерные пропилизоцианаты, изомерные бутилизоцианаты, изомерные пентилизоцианаты, изомерные гексилизоцианаты, изомерные гептилизоцианаты, изомерные октилизоцианаты, изомерные нонилизоцианаты, изомерные децилизоцианаты, стеарилизоцианат, 1,8-диизоцианато-4-(изоцианатометил)октан (TIN), 6-диизоцианатогексан (HDI, Desmodur Н), 1-изоцианато-3,3,5-триметил-5-изоцианатометил-циклогексан (IPDI, Desmodur I), 2,4,4-триметилгексане-1,6-диизоцианат (TMDI), дициклогексилметан-диизоцианат (Desmodur W), гексагидротолуилендиизоцианат (H6TDI), 1,3-бис-(изоцианатометил)-циклогексан, Desmodur LD, Desmodur N3400, Desmodur N3600, Baymicron OXA или их смеси.
Наиболее предпочтительные изоцианаты формулы R[NCO]n - это изо-пропилизоцианат, н-бутилизоцианат, н-гексилизоцианат, н-октилизоцианат, н-децилизоцианат, циклогексилизоцианат, стеарилизоцианат, 1,8-диизоцианато-4-(изоцианатометил)октан (TIN), 6-диизоцианатогексан (HDI, Desmodur Н), 1-изоцианато-3,3,5-триметил-5-изоцианатометил-циклогексан (IPDI, Desmodur I), 2,4,4-триметилгексан-1,6-диизоцианат (TMDI), дициклогексилметан-диизоцианат (Desmodur W), гексагидротолуилендиизоцианат (H6TDI), 1,3-бис-(изоцианатометил)-циклогексан, Desmodur LD, Desmodur N3400, Desmodur N3600, Desmodur N3900, Baymicron OXA или их смеси.
При этом имеется широкий выбор фторированных спиртов; предпочтительно применять первичные или вторичные, монофункциональные, дифункциональные или три функциональные спирты с содержанием фтора от 30% до 82%, особо предпочтительно с содержанием фтора от 40% до 80%, а особенно предпочтительно - с содержанием фтора от 49% до 75%.
Реакция изоцианатов со спиртами приведенного выше в каждом случае вида для синтеза фторуретанов представляет собой уретанизацию. Реакцию можно осуществлять с помощью катализаторов, известных для ускорения реакций присоединения изоцианатов, как, например, третичных аминов, соединений олова, цинка, железа или висмута, в частности, триэтиламина, 1,4-диазабицикл-[2,2,2]-октана, октоата висмута, октоата цинка или дилаурата дибутилолова, которые можно помещать в реакционную смесь вначале или добавлять позднее. Содержание изоцианатных групп (М = 42 г/моль) или свободных мономеров изоцианатных остатков во фторуретанах может составлять менее 0,5 масс.%, предпочтительно менее 0,2 масс.%, особо предпочтительно менее 0,1 масс.%. Кроме того, во фторуретанах могут содержаться не прошедшие преобразование гидроксифункциональные соединения в количестве ниже 1 масс.%, предпочтительно ниже 0,5 масс.% и особо предпочтительно ниже 0,2 масс.%. Содержание фтора во фторуретанах может составлять 10-80 масс.% фтора, предпочтительно 12,5-75 масс.% фтора, особо предпочтительно 15-70 масс.% фтора и особо предпочтительно 17,5-65 масс.% фтора.
Коэффициент преломления фторуретанов 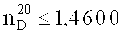
По окончании реакции не обладающие реакционной активностью растворители можно при нормальном или сниженном давлении удалить из смеси, а конечную точку установить путем определения содержания твердых веществ. Содержание твердых веществ обычно находится в пределах от 99,999 до 95,0 масс.%, предпочтительно от 99,998-98,0 масс.%, относительно фторуретана.
Полимеры матрикса могут, в частности, представлять собой полиуретаны. Полиуретаны предпочтительно получают реакцией изоцианатного компонента а) со способным реагировать с изоцианатом компонентом b).
Изоцианатный компонент а) включает в себя предпочтительно полиизоцианаты. В качестве полиизоцианатов можно использовать все известные специалисту как таковые соединения или их смеси, которые в среднем содержат по две или более функциональные группы NCO на молекулу. Они могут иметь ароматическую, аралифатическую, алифатическую или циклоалифатическую основу. В небольших количествах можно также применять моноизоцианаты и/или содержащие ненасыщенные группы полиизоцианаты.
Применять можно, например, бутилендиизоцианат, гексаметилендиизоцианат (HDI), изофорондиизоцианат (IPDI), 1,8-диизоцианато-4-(изоцианатометил)-октан, 2,2,4- и/или 2,4,4-триметилгексаметилендиизоцианат, изомерные бис-(4,4′-изоцианатоциклогексил)метаны и их смеси с произвольным содержанием изомеров, изоцианатометил-1,8-октандиизоцианат, 1,4-циклогексилендиизоцианат, изомерные циклогександиметилендиизоцианаты, 1,4-фенилендиизоцианат, 2,4- и/или 2,6-толуилендиизоцианат, 1,5-нафтилендиизоцианат, 2,4′- или 4,4′-дифенилметандиизоцианат и/или трифенилметан-4,4′,4″-триизоцианат.
Равным же образом возможно применение производных мономерных диизоцианатов или триизоцианатов с уретановыми, мочевинными, карбодиимидными, ацилмочевинными, изоциануратовыми, аллофанатовыми, биуретовыми, оксадиазинтрионовыми, уретдионовыми и/или иминооксадиазиндионовыми структурами.
Предпочтительно применение полиизоцианатов на основе алифатических и/или циклоалифатических диизоцианатов или триизоцианатов.
Особо предпочтительно, чтобы полиизоцианаты компонента а) представляли собой димеризованные или олигомеризованные алифатические и/или циклоалифатические диизоцианаты или триизоцианаты.
Наиболее предпочтительны изоцианураты, уретдионы и/или иминооксадиазиндионы на основе HDI, 1,8-диизоцианато-4-(изоцианатометил)-октана или их смесей.
Точно также в качестве компонента а) можно применять NCO-функциональные преполимеры с уретановыми, аллофанатовыми, биуретовыми и/или амидными группами. Преполимеры компонента а) получают способом, хорошо известным специалисту как таковой, путем реакции мономеров, олигомеров или полиизоцианатов а1) со способными реагировать с изоцианатами соединениями а2) в надлежащем стехиометрическом соотношении, причем в качестве опции возможно применение катализаторов и растворителей.
В качестве полиизоцианатов а1) можно применять все известные специалисту алифатические, циклоалифатические, ароматические или аралифатические диизоцианаты и триизоцианаты, причем не имеет значения, получены ли они фосгенированием или бесфосгенным способом. Кроме того, можно также применять хорошо известные специалисту как таковые более высокомолекулярные продукты переработки мономерных диизоцианатов или триизоцианатов с уретановыми, мочевинными, карбодиимидными, ацилмочевинными, изоциануратовыми, аллофанатовыми, биуретовыми, оксадиазинтрионовыми, уретдионовыми и/или иминооксадиазиндионовыми структурами, в каждом случае по отдельности или в произвольных смесях друг с другом.
Примеры надлежащих мономерных диизоцианатов или триизоцианатов, которые можно применять как компонент а1), это бутилендиизоцианат, гексаметилендиизоцианат (HDI), изофорондиизоцианат (IPDI), триметил-гексаметилен-диизоцианат (TMDI), 1,8-диизоцианато-4-(изоцианатометил)-октан, изоцианатометил-1,8-октандиизоцианат (TIN), 2,4- и/или 2,6-толуен-диизоцианат. В качестве способных реагировать с изоцианатами соединений а2) для формирования преполимеров предпочтительно применяют соединения с функциональной группой ОН. Они аналогичны ОН-функциональным соединениям для компонента b), описание которых приведено ниже.
Для изготовления преполимера можно также применять амины. Можно использовать, например, этилендиамин, диэтилентриамин, триэтилентетрамин, пропилендиамин, диаминоциклогексан, диаминобензол, диаминобисфенил, дифукциональные полиамины, как, например, Jeffamine®, полимеры с аминным окончанием со среднечисловой молярной массой до 10000 г/моль или любые их смеси друг с другом.
Для изготовления преполимеров с биуретовыми группами проводят реакцию избытка изоцианата с амином, при которой образуется биуретовая группа. В этом случае в качестве аминов для реакции с упомянутыми диизоцианатами, триизоцианатами и полиизоцианатами можно применять все олигомерные или полимерные, первичные или вторичные амины вышеуказанного вида.
Предпочтительные полимеры - это уретаны, аллофанаты или биуреты из алифатических соединений с изоцианатной функциональной группой и олигомерных или полимерных соединений, способных реагировать с изоцианатами, со среднечисленной молярной массой в 200-10000 г/моль, особо предпочтительны уретаны, аллофанаты или биуреты из алифатических соединений с изоцианатной функциональной группой и олигомерных или полимерных полиолов или полиаминов со среднечисленной молярной массой 500-8500 г/моль, а крайне предпочтительны аллофанаты из HDI или TMDI и дифункциональные простые полиэфирполиолы со среднечисленными значениями молярной массы 1000-8200 г/моль.
Предпочтительно, чтобы остаточное содержание свободного мономерного изоцианата в вышеописанных преполимерах составляло менее 1 масс.%, особо предпочтительно менее 0,5 масс.%, крайне предпочтительно менее 0,2 масс.%. Само собой разумеется, что изоцианатный компонент может, кроме описанных преполимеров, содержать доли других изоцианатных компонентов. Для этого можно использовать ароматические, аралифатические и циклоалифатические диизоцианаты, триизоцианаты или полиизоцианаты. можно также использовать смеси таких ди-, три- или полиизоцианатов. Примеры надлежащих ди-, три- или полиизоцианатов - это бутилендиизоцианат, гексаметилендиизоцианат (HDI), изофорондиизоцианат (IPDI), 1,8-диизоцианато-4-(изоцианатометил)-октан, 2,2,4- и/или 2,4,4-триметилгексаметилендиизоцианат (TMDI), изомерные бис-(4,4′-изоцианатоциклогексил)метаны и их смеси с произвольным содержанием изомеров, изоцианатометил-1,8-октандиизоцианат, 1,4-циклогексилендиизоцианат, изомерные циклогександиметилендиизоцианаты, 1,4-фенилендиизоцианат, 2,4- и/или 2,6-толуилендиизоцианат, 1,5-нафтилендиизоцианат, 2,4′- или 4,4′-дифенилметандиизоцианат, трифенилметан-4,4′,4″-триизоцианат или их производные с уретановыми, мочевинными, карбодиимидными, ацилмочевинными, изоциануратовыми, аллофанатными, биуретовыми, оксадиазинтрионовыми, уретдионовыми и/или иминооксадиазиндионовыми структурами и смеси. Предпочтительны полиизоцианаты на основе олигомеризованных и/или дериватизированных диизоцианатов, которые надлежащим способом освобождены от избыточного диизоцианата, в особенности на основе гексаметилендиизоцианата. Особо предпочтительны олигомерные изоцианураты, уретдионы и/или иминооксадиазиндионы HDI, а также их смеси.
При необходимости изоцианатный компонент а) может также в определенных долях содержать изоцианаты, которые частично прошли реакцию со способными реагировать с изоцианатом этилен-ненасыщенными соединениями. При этом в качестве изоцианат-реактивных этилен-ненасыщенных соединений предпочтительны α,β-ненасыщенные производные карбоновых кислот такие, как акрилаты, метакрилаты, малеинаты, фумараты, малеимиды, акриламиды, а также соединения, содержащие простые винилэфирные, пропенилэфирные и дициклопентадиениловые единицы, содержащие по меньшей мере одну способную реагировать с изоцианатами группу, особо предпочтительно, чтобы это были акрилаты и метакрилаты меньшей мере с одной способной реагировать с изоцианатами группой. В качестве гидроксифункциональных акрилатов или метакрилатов можно применять, например, такие соединения как 2-гидрокси-этил(мет)акрилат, полиэтиленоксид-моно(мет)акрилаты, полипропиленоксид-моно(мет)акрилаты, полиалкиленоксид-моно(мет)акрилаты, поли(ε-капролактон)моно(мет)акрилаты, как, например. Tone® M100 (Dow, США), 2-гидроксипропил(мет)акрилат, 4-гидроксибутил(мет)акрилат, 3-гидрокси-2,2-диметилпропил(мет)акрилат, гидроксифункциональные моно-, ди- или тетра(мет)акрилаты многоатомных спиртов, как, например, триметилолпропана, глицерина, пентаэритрита, дипентаэритрита, этоксилированного, пропоксилированного или алкоксилированного триметилолпропана, глицерина, пентаэритрита, дипентаэритрита или их технические смеси. Кроме того, пригодны к применению изоцианат-реактивные олигомерные или полимерные соединения, содержащие ненасыщенные акрилатные и/или метакрилатные группы, в чистом виде или в сочетании с вышеуказанными мономерными соединениями. Доля изоцианатов, которые частично или полностью прошли реакцию с изоцианат-реактивными этилен-ненасыщенными соединениями, составляет в изоцианатном компоненте а) 0-99%, предпочтительно 0-50%, особо предпочтительно 0-25% и наиболее предпочтительно 0-15%.
При необходимости изоцианатный компонент а) может также исключительно в определенных долях содержать изоцианаты, которые полностью или частично прошли реакцию с блокирующими средствами, известными специалисту из технологии нанесения покрытий. В качестве примера блокирующих агентов следует упомянуть: спирты, лактамы, оксимы, сложные малоновые эфиры, алкилацетоацетаты, триазолы, фенолы, имидазолы, пиразолы, а также амины, как, например, бутаноноксим, диизопропиламин, 1,2,4-триазол, диметил-1,2,4-триазол, имидазол, диэтиловый эфир малоновой кислоты, ацетоуксусный эфир, ацетоноксим, Acetessigester, Acetonoxim, 3,5-диметилпиразол, ε-капролактам, н-трет.-бутил-бензиламин, циклопентанонкарбоксиэтиловый эфир или произвольные смеси этих блокирующих агентов.
В качестве компонента b) можно, в принципе применять все полифункциональные соединения, способные реагировать с изоцианатами, которые в среднем содержат по меньшей мере 1,5 изоцианат-реактивные группы на молекулу.
В рамках настоящего изобретения группы, способные реагировать с изоцианатами (изоцианат-реактивные группы), - это предпочтительно гидроксигруппы, аминогруппы или тиогруппы, особо предпочтительны гидроксисоединения.
Надлежащие полифункциональные изоцианат-реактивные соединения - это, например, сложные полиэфирполиолы, простые полиэфирполиолы, поликарбонатполиолы, поли(мет)акрилатполиолы и/или полиуретанполиолы. В качестве сложных полиэфирполиолов применимы, например, линейные сложные полиэфирдиолы или разветвленные сложные полиэфирполиолы, которые можно известным образом получать из алифатических, циклоалифатических или ароматических дикарбоновых либо же поликарбоновых кислот или их ангидридов с многоатомными спиртами, имеющими показатель функциональности по ОН≥2.
Примеры таких дикарбоновых либо же поликарбоновых кислот либо же ангидридов - это янтарная, глутаровая, адипиновая, пимелиновая, пробковая, азелаиновая, себациновая, нонандикарбоновая, декандикарбоновая, терефталевая, изофталевая, ортофталевая, тетрагидрофталевая, гексагидрофталевая или тримеллитовая кислоты, а также ангидриды ортофталевой, тримеллитовой или янтарной кислоты или же любые их смеси друг с другом. Примеры таких подходящих спиртов - это этандиол, диэтиленгликоль, триэтиленгликоль, тетраэтиленгликоль, 1,2-пропандиол, дипропиленгликоль, трипропиленгликоль, тетрапропиленгликоль, 1,3-пропандиол, бутандиол-1,4, бутандиол-1,3, бутандиол-2,3, пентандиол-1,5, гександиол-1,6, 2,2-диметил-1,3-пропандиол, 1,4-дигидроксициклогексан, 1,4-диметилолциклогексан, октандиол-1,8, декандиол-1,10, додекандиол-1,12, триметилолпропан или же любые их смеси друг с другом.
Сложные полиэфирполиолы могут также иметь в основе натуральное сырье, например, касторовое масло. Равным же образом возможно, чтобы сложные полиэфирполиолы имели в основе гомополимеризаты или смесовые полимеризаты лактонов, которые предпочтительно можно получить отложением лактонов или смесей лактонов, как, например, бутиролактона, ε-капролактона и/или метил-ε-капролактона на гидроксифункциональные соединения, например, многоатомные спирты с ОН-функциональностью ≥2, например, описанного выше вида.
Среднечисленные значения молярной массы таких сложных полиэфирполиолов предпочтительно составляют 400-4000 г/моль, особо предпочтительно 500-2000 г/моль. Функциональность их по ОН-группам предпочтительно составляет от 1,5 до 3,5, особо предпочтительно от 1,8 до 3,0. Надлежащие поликарбонатполиолы получают известным как таковой способом путем реакции органических карбонатов или фосгена с диолами или смесями диолов.
Надлежащие органические карбонаты - это диметилкарбонат, диэтилкарбонат и дифенилкарбонат.
Надлежащие диолы либо же смеси включают в себя упомянутые в разделе, касающемся сложных эфиров, многоатомные спирты с функциональностью по ОН-группам ≥2, предпочтительно 1,4-бутандиол, 1,6-гександиол и/или 3-метилпентандиол, либо же в поликарбонатполиолы можно также преобразовать сложные полиэфирполиолы.
Среднечисленные значения молярной массы таких поликарбонатполиолов предпочтительно составляют 400-4000 г/моль, особо предпочтительно 500-2000 г/моль. Функциональность этих полиолов по OH-группам предпочтительно составляет от 1,8 до 3,2, особо предпочтительно от 1,9 до 3,0.
Надлежащие простые полиэфирполиолы - это продукты полиприсоединения циклических простых эфиров к молекулам-стартерам с функциональными группами OH- или NH-, при необходимости имеющие блоковое строение.
Надлежащие простые циклические эфиры - это, например, стиролоксиды, этиленоксид, пропиленоксид, тетрагидрофуран, бутиленоксид, эпихлоргидрин, а также их произвольные смеси.
В качестве стартеров можно применять упомянутые как таковые применительно к сложным полиэфирполиолам многоатомные спирты с функциональностью по ОН-группам ≥2, а также первичные или вторичные амины и аминоспирты.
Предпочтительные простые полиэфирполиолы - это таковые упомянутого вида, исключительно основанные на пропиленоксиде, или статистические или блоковые сополимеры на основании пропиленоксида с другими 1-алкиленоксидами, причем доля 1-алкиленоксидов составляет не более 80 масс.%. Кроме того предпочтительны поли(триметиленоксиды), а также смеси полиолов, упомянутых в качестве предпочтительных. Особо предпочтительны гомополимеры пропиленоксида, а также статистические или блоковые сополимеры, имеющие оксиэтиленовые оксипропиленовые и/или оксибутиленовые единицы, причем доля оксипропиленовых единиц относительно общего количества всех оксиэтиленовых, оксипропиленовых и оксибутиленовых единицы составляет по меньшей мере 20 масс.%, предпочтительно по меньшей мере 45 масс.%. При этом понятия «оксипропиленовый» и «оксибутиленовый» охватывают все соответствующие линейные и разветвленные изомеры С3 и С4. Среднечисленные значения молярной массы таких простых полиэфирполиолов предпочтительно составляют 250-10000 г/моль, особо предпочтительно 500-8500 г/моль и наиболее предпочтительно - от 600 до 4500 г/моль. Функциональность по ОН-группам предпочтительно составляет от 1,5 до 4,0, особо предпочтительно от 1,8 до 3,1.
Кроме того, в качестве составных частей компонента b) как многофункциональные соединения, способные реагировать с изоцианатами, можно применять также и низкомолекулярные, то есть имеющие молекулярную массу менее 500 г/моль, короткоцепочечные, то есть содержащие от 2 до 20 атомов углерода, алифатические, аралифатические или циклоалифатические дифункциональные, трифункциональные или полифункциональные спирты.
Это могут, например, быть этиленгликоль, диэтиленгликоль, триэтиленгликоль, тетраэтиленгликоль, дипропиленгликоль, трипропиленгликоль, 1,2-пропандиол, 1,3-пропандиол, 1,4-бутандиол, неопентилгликоль, 2-этил-2-бутилпропандиол, триметилпентандиол, изомерные по положению диэтилоктандиолы, 1,3-бутилен-гликоль, циклогександиол, 1,4-циклогександиметанол, 1,6-гександиол, 1,2- и 1,4-циклогександиол, гидрированный бисфенол А (2,2-бис(4-гидроксицикло-гексил)пропан), 2,2-диметил-3-гидроксипропионовая кислота (2,2-диметил-3-гидроксипропиловый эфир). Примеры надлежащих триолов - это триметилолэтан, триметилолпропан или глицерин. Надлежащие более высокофункциональные спирты - это дитриметилолпропан, пентаэритрит, дипентаэритрит или сорбит.
В качестве компонента с) применяют один или несколько фотоинициаторов. Обычно это активируемые актиничным излучением инициаторы, запускающие полимеризацию соответствующих пригодных к полимеризации групп. Фотоинициаторы - это известные сами по себе и представленные в торговле соединения, причем различают унимолекулярные (тип I) и бимолекулярные (тип II) инициаторы. Кроме того, эти инициаторы в зависимости от их химической природы применяют для радикальной, для анионной (или), для катионной (или смешанной) форм вышеупомянутой полимеризации.
Системы типа I для радикальной фотополимеризации - это, например, ароматические кетоновые соединения, например, бензофеноны в сочетании с третичными аминами, алкилбензофеноны, 4,4′-бис(диметиламино)бензофенон (кетон Михлера), антрон и галогенированные бензофеноны или смеси указанных типов. Кроме того, пригодны к использованию инициаторы типа II, как то: бензоин и его производные, бензилкетали, ацилфосфиноксиды, например, 2,4,6-триметил-бензоил-дифенилфосфиноксид, бисациклофосфиноксиды, эфиры фенилглиоксиловой кислоты, камфорный хинон, альфа-аминоалкилфеноны, альфа-, альфа-диалкоксиацетофеноны, 1-[4-(фенилтио)фенил]октан-1,2-дион-2-(O-бензоилоксим), различным образом замещенные гексарилбисимидазолы (HABI) с надлежащими соинициаторами, как, например, меркалтобензоксазол, а также альфа-гидроксиалкилфеноны. Также в качестве фотоинициатора можно применять описанные в европейской заявке ЕР-А 0223587 системы фотоинициаторов, состоящие из смеси арилбората аммония и одного или несколкьих красителей. В качестве арилбората аммония можно применять, например, тетрабутиламмония трифенилгексилборат, тетрабутиламмония трифенилбутилборат, тетрабутиламмония тринафтилбутилборат, тетраметиламмония трифенилбензилборат, тетра(н-гексил)аммония (втор.-бутил)трифенилборат, 1-метил-3-октилимидазолиума дипентилдифенилборат, тетрабутиламмония трис-(4-трет.-бутил)-фенилбутилборат, тетрабутиламмония трис-(3-фторфенил)-гексилборат и тетрабутиламмония трис-(3-хлор-4-метилфенил)-гексилборат. В качестве красителей можно применять, например, новый метиленовый синий, тионин, основной желтый, пинацинол хлорид, родамин 6G, галлоцианин, этиловый фиолетовый, Виктория синий R, целестиновый синий, хинальдиновый красный, кристаллический фиолетовый, бриллиантовый зеленый, астразон оранжевый G, дарроу красный, пиронин Y, основной красный 29, пирилий I, сафранин О, цианин и метиленовый синий, азур A (Cunningham et al., RadTech′98 North America UV/EB Conference Proceedings, Chicago, Apr. 19-22, 1998).
Применяемые для анионной полимеризации фотоинициаторы, как правило, относятся к системам типа I и являются производными комплексов переходных металлов первого ряда. Здесь следует назвать соли хрома, например, транс-Cr(NH3)2(NCS)4- (Kutal et al, Macromolecules 1991, 24, 6872) или соединения ферроценила (Yamaguchi et al. Macromolecules 2000, 33, 1152). Еще одна возможность анионной полимеризации состоит в применении красителей, таких как кристаллического фиолетового лейконитрила или малахитового зеленого лейконитрила, которые способны полимеризовывать цианоакрилаты путем фотолитического распада (Neckers et al. Macromolecules 2000, 33, 7761). При этом, однако, в полимер встраивается хромофор, так что получающиеся в итоге полимеры оказываются окрашены.
Фотоинициаторы, применяемые для катионной полимеризации, по существу относятся к трем классам: арилдиазониевые соли, ониевые соли (в частности, йодониевые, сульфониевые и селенониевые соли), а также металлоорганические соединения. Фенилдиазониевые соли под облучением способны как в присутствии, так и в отсутствие донора водорода создавать катион, который инициирует полимеризацию. Эффективность всей системы в совокупности определяется природой применяемого противоиона к соединению диазония. В данном случае предпочтительны менее реактивные, но очень дорогие SbF6-, AsF6- или PF6-. Для применения в покрытиях для тонких пленок эти соединения, как правило, годятся плохо, поскольку из-за высвобождающегося после экспозиции азота ухудшается качество поверхности (pinholes, «булавочные уколы») (Li et al., Polymeric Materials Science and Engineering, 2001, 84, 139). Ониевые соли, в особенности сульфониевые и йодониевые соли, очень широко распространены и в различных формах представлены в торговле. Фотохимия этих соединений подробно изучена. После возбуждения соли йодония сначала распадаются по гомолитическому механизму и создают таким образом радикал и радикальный анион, который стабилизируется посредством Н-абстракции и высвобождает фотон, а затем запускает катионную полимеризацию (Dektar et al. J. Org. Chem. 1990, 55, 639; J. Org. Chem., 1991, 56. 1838). Этот механизм позволяет применять соли йодония и для радикальной фотополимеризации. При этом выбор противоиона опять же имеет большое значение, и снова предпочтительны 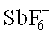

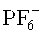
Может также оказаться выгодно применять и смеси этих соединений. В зависимости от источника излучения, применяемого для отверждения, необходимо известным специалисту образом подбирать тип и концентрацию фотоинициатора. Более подробная информация приведена, например, в книге P.K.T.Oldring (Ed.), Chemistry & Technology of UV & ЕВ Formulations For Coatings, Inks & Paints, Vol.3, 1991, SITA Technology, London, стр.61-328.
Предпочтительные фотоинициаторы с) - это смеси тетрабутиламмония трифенилгексилбората, тетрабутиламмония трифенилбутилбората, тетрабутиламмония тринафтилбутилбората, тетрабутиламмония трис-(4-трет.-бутил)-фенилбутилбората, тетрабутиламмония трис-(3-фторфенил)-гексилбората и тетрабутиламмония трис-(3-хлор-4-метилфенил)-гексилбората с такими красителями как астразон оранжевый G, метиленовый синий, новый метиленовый синий, азур А, пирилий I, сафранин О, цианин, галлоцианин, бриллиантовый зеленый, кристаллический фиолетовый, этиловый фиолетовый и тионин.
Обладающие высоким коэффициентом преломления акрилаты в качестве компонента d), придающего контраст, позволяют добиться очень хороших результатов в фотополимерных композициях, как это описано в патенте США US 6,780,546.
Поэтому согласно изобретению предпочтительно, чтобы в фотополимерной композиции пишущими мономерами были акрилаты, особо предпочтительно - таковые с коэффициентом преломления 

Другим предметом настоящего изобретения являются среды для регистрации визуальных голограмм, получаемые с применением фторуретанов формулы (I), применение таких сред в качестве оптических элементов, изображений или для отображения или проекции изображений, а также способ записи голограммы, при котором применяют такие среды.
Фотополимерная композиция согласно изобретению может содержать 15-79 масс.%, предпочтительно 30-60 масс.%, полимера матрикса, 5-50, предпочтительно 10-40 масс.%, пишущего мономера, 1-10, предпочтительно 1-3 масс.%, фотоинициатора и 5-50 масс.%, предпочтительно 10-40 масс.%, фторуретанов и 0-10 масс.% прочих добавок, причем сумма компонентов составляет 100 масс.%.
Еще один аспект изобретения касается способа изготовления фотополимерной композиции согласно изобретению, при реализации которого в фотополимерной композиции смешивают полимеры матрикса, пишущие мономеры, фотоинициаторы и фторуретаны как пластификаторы.
Третий аспект изобретения касается фотополимерной композиции, получаемой по этому способу.
Четвертый аспект изобретения касается фольги, пленки, слоя, многослойной конструкции или фасонного изделия из фотополимерной композиции.
Типичные значения Δn слоев, многослойных структур и фасонных изделий из фотополимерных рецептур согласно изобретению, измеренные методом, описанным в разделе "Измерение топографических показателей ДЭ и Δn голографических сред методом интерференции двух лучей в отражательном расположении", составляют Δn>0.0120, предпочтительно >0.0130, особо предпочтительно >0,0140, крайне предпочтительно >0.0150.
Пятый аспект настоящего изобретения касается применения фотополимерной композиции для изготовления оптических элементов, в особенности для изготовления голографических элементов и изображений.
Равным образом предметом изобретения является способ экспозиции голографических сред из фотополимерной композиции согласно изобретению, при реализации которого посредством электромагнитного излучения вызывают избирательную полимеризацию пишущих мономеров с разрешением по месту.
Такие голографические среды после топографической экспозиции пригодны для изготовления голографических оптических элементов, которые обладают функцией, например, оптической линзы, зеркала, отклоняющего зеркала, фильтра, рассеивающего диска, дифракционного элемента, световода, устройств, изменяющих направление оси светового пучка (фар), проекционного диска и/или маски. Кроме того, с их применением можно изготавливать голографические картины и изображения, как, например, для портретов людей, биометрических изображениях в документах, касающихся безопасности, или же вообще изображений или структур изображений для рекламы, меток безопасности, защиты товарных знаков (от подделок), обозначения товарных знаков, этикеток, элементов дизайна, украшений, иллюстраций, коллекционных открыток, картин и т.п., а также картин, которые могут отображать цифровые данные, в т.ч. в сочетании с продуктами, представленными ранее. Определенные фторуретаны известны на нынешнем техническом уровне. Так, заявка США US 2003/105263 А1 содержит описание фторуретанов, которые получают преобразованием полиизоцианата, содержащего биурет, изоцианурат, уретдион, полимочевину, с фторированным спиртом. Из международной заявки WO 03/023519 А известен фторуретан, который получают реакцией полиизоцианата, содержащего биурет, со фторированным спиртом. Еще один аспект изобретения касается фторуретана, получаемого реакцией полиизоцианата, содержащего иминооксадиазиндион или оксадиазиндион, который имеет по меньшей мере одну свободную изоцианатную группу, со спиртом, причем полиизоцианат и/или спирт замещены по меньшей мере одним атомом фтора. Наконец, предметом изобретения является также фторуретан общей формулы (III)

в которой m≥1 и m≤8 и R4, R5, R6 представляют собой водород и/или независимо друг от друга линейные, разветвленные, циклические или гетероциклические незамещенные или при необходимости замещенные гетероатомами органические остатки и иминооксадиазиндионовые и/или оксадиазиндионовые структурные элементы, причем в то же время по меньшей мере один из остатков R4, R5, R6 замещен по меньшей мере одним атомом фтора.
Примеры:
В дальнейшем приведено более подробное пояснение изобретения на основании примеров.
Если не указано иное, все данные в процентах представляют собой проценты по массе.
Методы измерения:
Приведенные значения NCO (содержание изоцианата) определяли согласно DIN EN ISO 11909.
В зависимости от свойств соединения в данном примере измерение коэффициента преломления проводили одним из трех следующих методов:
Измерение коэффициента преломления n при длине волны 405 нм (метод А):
Коэффициент преломления n образцов в зависимости от длины волны получали из спектров пропускания и отражения. Для этого пленки образцов толщиной около 100-300 нм наносили центробежным методом из разбавленного раствора в бутилацетате на предметное кварцевое стекло. Спектр пропускания и отражения этой слоистой структуры регистрировали спектрометром производства фирмы STEAG ETA-Optik, изделием CD-Measurement System ETA-RT, а затем приводили изменения n по спектру и толщину слоя в соответствие с зарегистрированными спектрами пропускания и отражения. Это осуществляют с помощью собственного программного обеспечения спектрометра, и для этого дополнительно необходимы данные n субстрата из кварцевого стекла, которые определяют предварительно в измерении холостой пробы.
Измерение коэффициента преломления 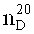
Образец соединения-примера вводили в рефрактометр Аббе и измеряли 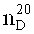
Измерение коэффициента преломления 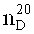
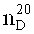
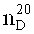
Измерение голографических показателей ДЭ и Δn голографических сред методом интерференции двух лучей в отражательном расположении
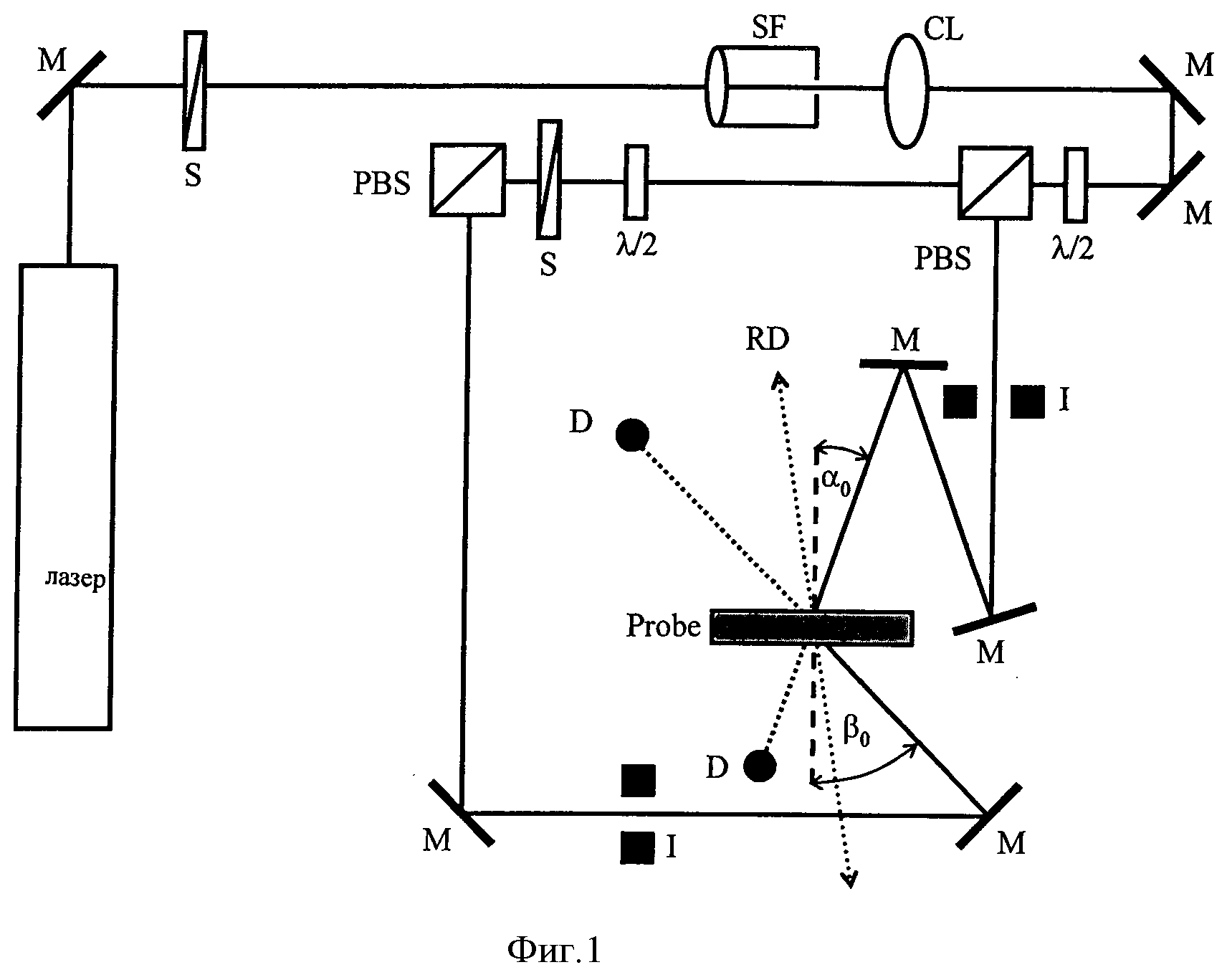
На следующем этапе изготовленные среды с помощью измерительной установки, соответствующей фигуре 1, проверили на предмет голографических характеристик следующим образом:
Луч гелиево-неонового лазера (длина волны испускания 633 нм) с помощью объемного фильтра (SF) в совокупности с коллиматорной линзой (CL) преобразовали в параллельный гомогенный луч. Итоговые сечения объектного и опорного лучей задавали с помощью ирисовых диафрагм (I). Диаметр отверстия ирисовой диафрагмы составляет 0,4 см. Поляризационные делители луча (PBS) делят лазерный луч на два когерентных луча одинаковой поляризации. С помощью пластинок λ/2 мощность опорного луча установили на 0,5 мВт, а мощность объектного луча на 0,65 мВт. Значения мощности определяли полупроводниковыми детекторами (D) в отсутствие образца. Угол падения (α0) опорного луча составляет -21,8°, угол падения (β0) объектного луча составляет 41,8°. Углы измеряли между нормалью к образцу и направлением луча. Поэтому соответственно фигуре 1 угол α0 имеет отрицательный знак, а угол β0 положительный. В месте расположения образца (среды) интерференционное поле из двух накладывающихся друг на друга лучей создавало решетку из светлых и темных линий, располагающихся перпендикулярно к биссектрисе двух лучей, падающих на образец (отражательная голограмма). Расстояние между линиями Λ, также называемое периодом решетки, составляет в среде ~225 нм (коэффициент преломления среды принят равным примерно 1,504).
На фигуре 1 представлены геометрические очертания прибора Holographic Media Testers (НМТ) при λ=633 нм (гелиево-неоновый лазер): М - зеркало, S - затвор, SF - объемный фильтр, CL - коллиматорная линза, λ/2 - пластина λ/2, PBS - чувствительный к поляризации делитель луча, D - детектор, I - ирисовая диафрагма, α0=-21,8°, β0=41,8° - углы падения когерентных лучей, измеренные вне образца (среды). RD - референтное направление вращающегося столика.
С помощью экспериментальной установки, представленной на фигуре 1, измеряли дифракционную эффективность (ДЭ) сред.
Голограммы в среду записывали следующим образом:
Обе шторки (S) открывали на длительность выдержки t.
Затем среду оставляли на 5 минут при закрытых шторках (S) для диффузии еще не полимеризовавшихся пишущих мономеров.
Затем проводили считывание записанных голограмм следующим образом.
Шторка объектного луча оставалась закрыта. Открывали шторку опорного луча.
Ирисовую диафрагму опорного луча закрывали до диаметра менее 1 мм. Таким образом добивались того, чтобы для всех углов вращения (Ω) среды луч всегда полностью находился в пределах записанной ранее голограммы. Затем вращающийся столик под управлением компьютера проходил диапазон углов от Ωmin до Ωmax угловыми шагами по 0,05°. Ω измеряют от перпендикуляра к образцу до референтного направления вращающегося столика. Референтное направление вращающегося столика получается тогда, когда при записи голограммы углы падения опорного и объектного луча равны по модулю, то есть α0=-31,8°, а β0=31,8°. В этом случае Ωrecording=0° (записи). Соответственно, для α0=-21,8° и β0=41,8° Ωrecording составляет 10°. В общем случае для интерференционного поля при записи („recording") голограммы справедливо выражение:
α0=θ0+Ωrecording.
θ0 - половина угла в лабораторной системе вне среды, и при записи голограммы действует соотношение:
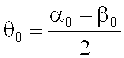
Соответственно, в данном случае θ0=-31,8°. В каждой занятой позиции по углу поворота Ω, измеряли мощности проходящего луча (нулевой порядок) с помощью соответствующего детектора D и мощности дифрагированного луча первого порядка с помощью детектора D. В позиции каждого угла вращения Ω дифракционную эффективность определяли как частное:
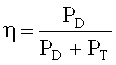
PD - мощность на детекторе дифрагированного луча, а PT - мощность на детекторе проходящего луча.
С помощью описанного выше метода регистрировали кривую Брэгга (она описывает коэффициент полезного действия дифракции η в зависимости от угла поворота Ω) записанной голограммы и сохраняли ее в компьютере.
Дополнительно записывали интенсивность пропускания (нулевой порядок) в зависимости от угла поворота Ω, и сохраняли ее в компьютере.
Максимальную дифракционную эффективность (DE=ηmax) голограммы, то есть пиковое значение, определяли при значении Ωreconstruction. Чтобы определить это максимальное значение, в некоторых случаях приходилось изменять положение детектора дифрагированного луча.
Контраст коэффициентов преломления Δn и толщину слоя полимера d затем определяли с помощью теории связанных волн (Coupled Wave Theory, см. Н.Kogelnik, The Bell System Technical Journal, Volume 48, November 1969, Number 9 стр.2909-2947) по измеренной кривой Брэгга и изменениям интенсивности пропускания соответственно углу. При этом необходимо учитывать, что из-за уменьшения толщины, обусловленной фотополимеризацией, расстояние между линиями голограммы Λ′ и ориентация линий (slant) может отличаться от расстояния между линиями интерференционного узора Λ и их ориентации. Соответственно, угол Λ0′ либо же соответствующий угол поворота столика Ωreconstruction, при котором получена максимальная дифракционная эффективность, будет отличаться от α либо же от соответствующего Ωrecording. Из-за этого изменяется критерий Брэгга. В процессе вычислений (оценки) это изменение учитывают. Ниже приведено описание процесса оценки:
Все геометрические величины, относящиеся к записанной голограмме, а не к интерференционному узору, обозначены как значения со штрихом.
По Когельнику для кривой Брэгга η(Ω) отражательной голограммы выполняются соотношения:

где:
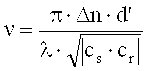

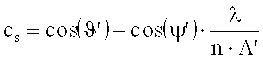
cr=cos(ϑ′)

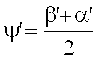
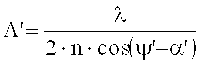
При считывании голограммы (воспроизведении, "reconstruction"), как аналогичным образом приведено выше, справедливо:


В критерии Брэгга дефазировка ("Dephasing") DP=0. И, соответственно:
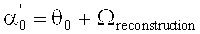

Неизвестный угол β′ можно определить из сравнения критерия Брэгга интерференционного поля при записи голограммы и критерия Брэгга при считывании голограммы, при условии того предположения, что имеет место только уменьшение толщины. В этом случае:
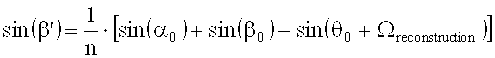
ν - толщина решетки, ξ - параметр рассогласования (Detuning Parameter), a ψ′ ориентация (Slant) решетки коэффициентов преломления, которая записана, α′ и β′ соответствуют углам α0 и β0 интерференционного поля при записи голограммы, но измерены в среде и действительны для решетки голограммы (после уменьшения толщины), n - усредненный коэффициент преломления фотополимера, и его задали равным 1,504. λ - это длина волны света лазера в вакууме.
Тогда максимальна дифракционная эффективность (DE=ηmax) для ξ=0 получается равной:
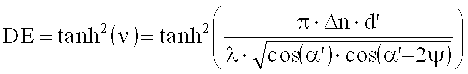
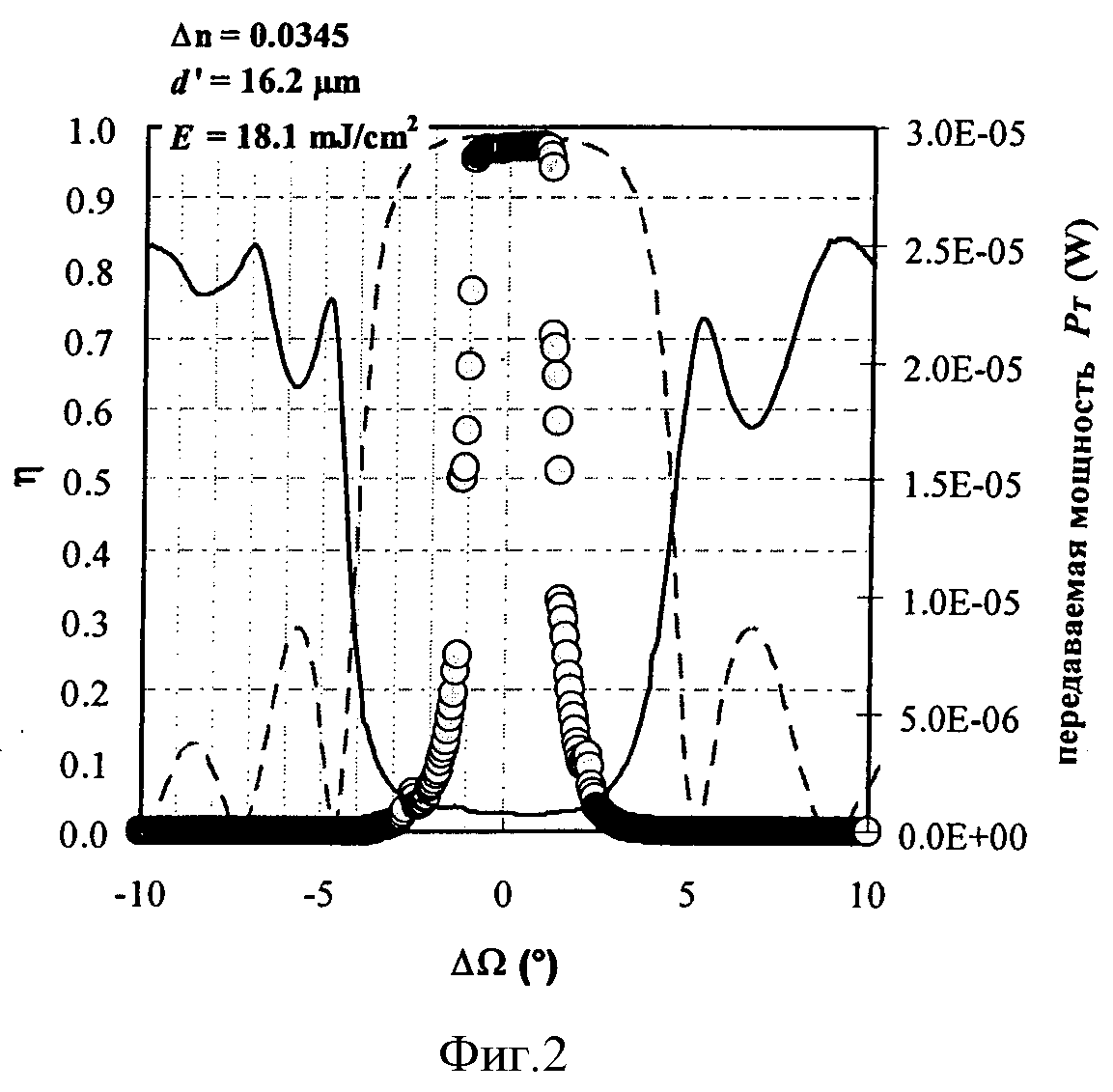
На фигуре 2 сплошной линией показан результат измерения мощности пропускания 2 PT (правая ось ординат) в зависимости от углового рассогласования ΔΩ, результат измерения дифракционной эффективности η (левая ось ординат) представлен сплошными кругами в зависимости от углового рассогласования ΔΩ (настолько, насколько это позволял конечный размер детектора) а аппроксимация по теории Когельника показана штриховой линией (левая ось ординат).
Результаты измерения дифракционной эффективности, теоретическая кривая Брэгга и интенсивность пропускания, как показано на фигуре 2, представляют в зависимости от центрированного угла поворота 
Поскольку ДЭ известна, форма теоретической кривой Брэгга по Когельнику определяется только толщиной d′ слоя фотополимера. Δn корректируют посредством ДЭ для данной толщины d′ таким образом, чтобы результаты измерения и теории ДЭ всегда соответствовали друг другу. d′ аппроксимируют до тех пор, пока угловые положения первых боковых минимумов теоретической кривой Брэгга не будут соответствовать угловым положениям первых боковых максимумов интенсивности пропущенного света, кроме того, полная ширина при половинной высоте (FWHM) будут соответствовать друг другу у теоретической кривой Брэгга и интенсивности пропущенного света.
Поскольку детектор дифрагированного света способен охватить лишь конечный диапазон углов направления, в котором поворачивается отражательная голограмма при реконструкции путем сканирования по Ω, кривую Брэгга широких голограмм (малое d′) при сканировании по Ω, регистрируют не полностью, но только ее центральный участок, при надлежащем расположении детектора. Поэтому для аппроксимации толщины слоя d′ дополнительно используют комплементарную кривой Брэгга форму кривой интенсивности пропущенного света.
На фигуре 2 изображены кривая Брэгга η в соответствии с теорией связанных волн (штрихованная линия), результаты измерения коэффициента полезного действия дифракции (сплошные круги) и мощность пропущенного света (сплошная черная линия) в зависимости от углового рассогласования ΔΩ.
Для одной композиции эту процедуру измерений иногда повторяют много раз с различными выдержками t в различных средах, чтобы определить, при какой средней дозе энергии падающего лазерного луча при записи голограммы ДЭ приобретает значение насыщения. Среднюю энергетическую дозу Е получают следующим образом из мощностей частных лучей, соответствующих углам α0 и β0 (опорный луч, Pr=0,50 мВт и объектный луч, Ps=0,63 мВт), длительности выдержки t и диаметра ирисовой диафрагмы (0,4 см):
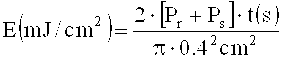
Мощности частных лучей подобрали так, чтобы в среде при используемых углах α0 и β0 получалась одинаковая плотность мощности.
Использованные вещества:
Fluorlink Е 10/Н - это изготавливаемая Solvay Solexis реактивная добавка на основе фторированного спирта со средней молярной массой 750 г/моль.
CGI-909 (тетрабутиламмония-трис(3-хлор-4-метилфенил)(гексил)борат, [1147315-11-4]) - это изготовленный фирмой CIBA Inc., Базель (Швейцария) экспериментальный продукт.
1,8-диизоцианато-4-(изоцианатометил)октан (TIN) изготавливали так, как описано в европейской заявке ЕР749958.
Использованные фторированные спирты и монофункциональные изоцианаты приобретали в торговле химикатами, использованные полиизоцианаты (Desmodur Н (HDI), Desmodur I (IPDI), Desmodur W, Desmodur LD, Desmodur N3400, Desmodur N3600, Desmodur N3900, Baymicron OXA) - это торговые продукты фирмы Bayer MaterialScience AG, Леверкузен (Германия).
2,4,4-триметилгексан-1,6-диизоцианат, Vestanat TMDI - это продукция фирмы Evonik Degussa GmbH, Марль (Германия).
Получение 2,2,2-трифторэтил-(6-изоцианатогексил)карбамата В круглодонную колбу емкостью 1 л поместили 684 г гексаметилендиизоцианата (HDI) при 80°C и добавили 0,002 г дихлорида изофталевой кислоты. По каплям медленно добавляли 54,4 г трифторэтанола и продолжали перемешивать, пока значение NCO не составило 43,2 масс.%. Смесь разделили путем дистилляции в тонкослойном испарителе и получили 47 г (=47% от теоретического выхода) титульного соединения с содержанием NCO в 22,7 масс.%.
Синтез 2,2,3,3,4,4,5,5-октафторпентил-(6-изоцианатогексил)карбамата В круглодонную колбу емкостью 1 л поместили 399 г гексаметилендиизоцианата (HDI) при 80°C и добавили 0,002 г дихлорида изофталевой кислоты. По каплям медленно добавляли 73,4 г 2,2,3,3,4,4,5,5-октафторопентанола и продолжали перемешивать, пока значение NCO не составило 39,4 масс.%. Смесь разделили путем дистилляции в тонкослойном испарителе и получили 40 г (=40% от теоретического выхода) титульного соединения с содержанием NCO в 12,4 масс.%.
Пример 1: бис(2,2,2-трифторэтил)гексан-1,6-диилбискарбамат
В круглодонную колбу емкостью 500 мл поместили 0,07 г Desmorapid Z и 64,4 г 6-диизоцианатогексана (HDI) и нагрели до 60°C. Затем по каплям добавили 81,5 г трифторэтанола и продолжали выдерживать смесь при 60°C, пока содержание изоцианата не упало ниже 0,1%. Затем смесь охладили. Получили продукт в виде бесцветного твердого вещества.
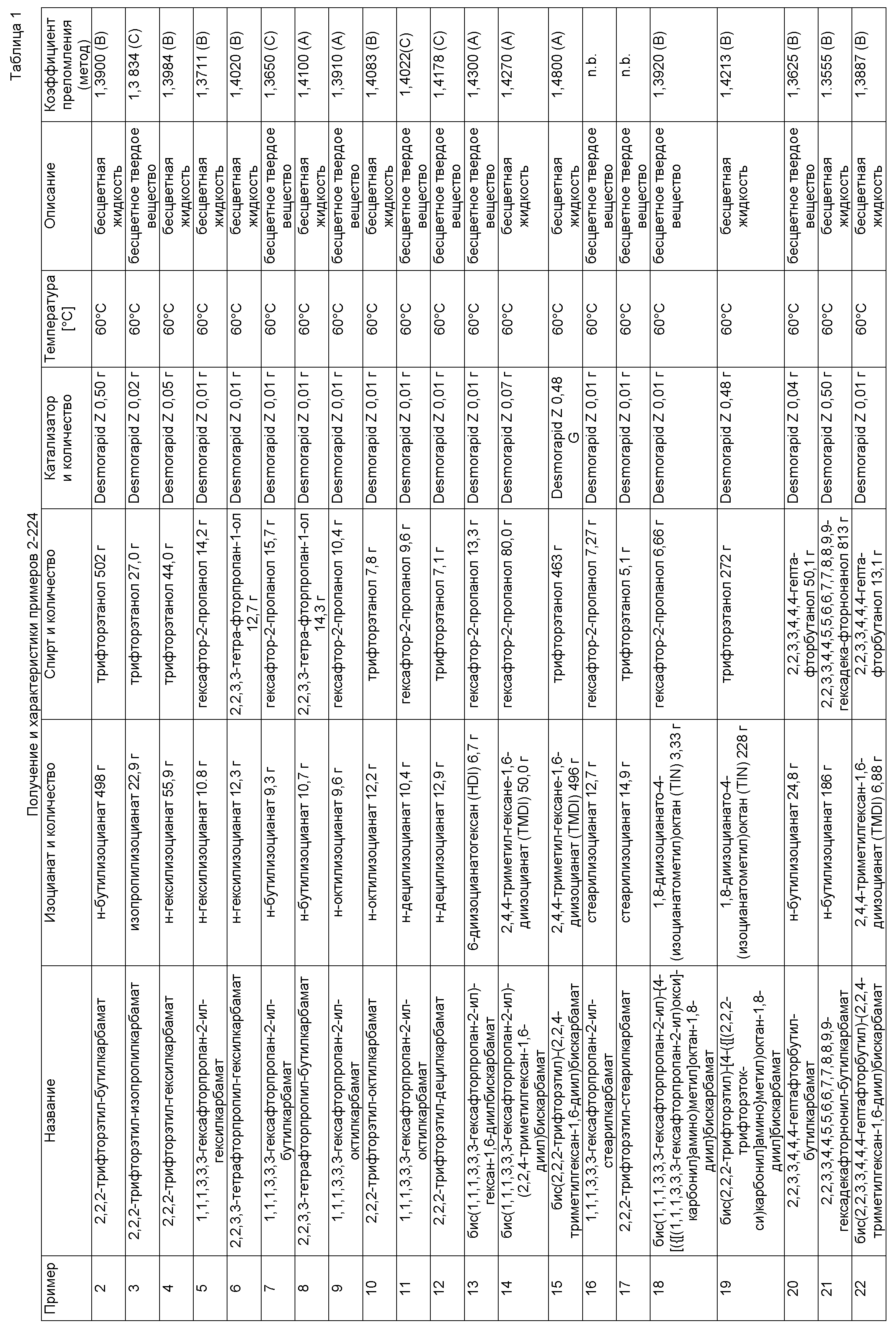
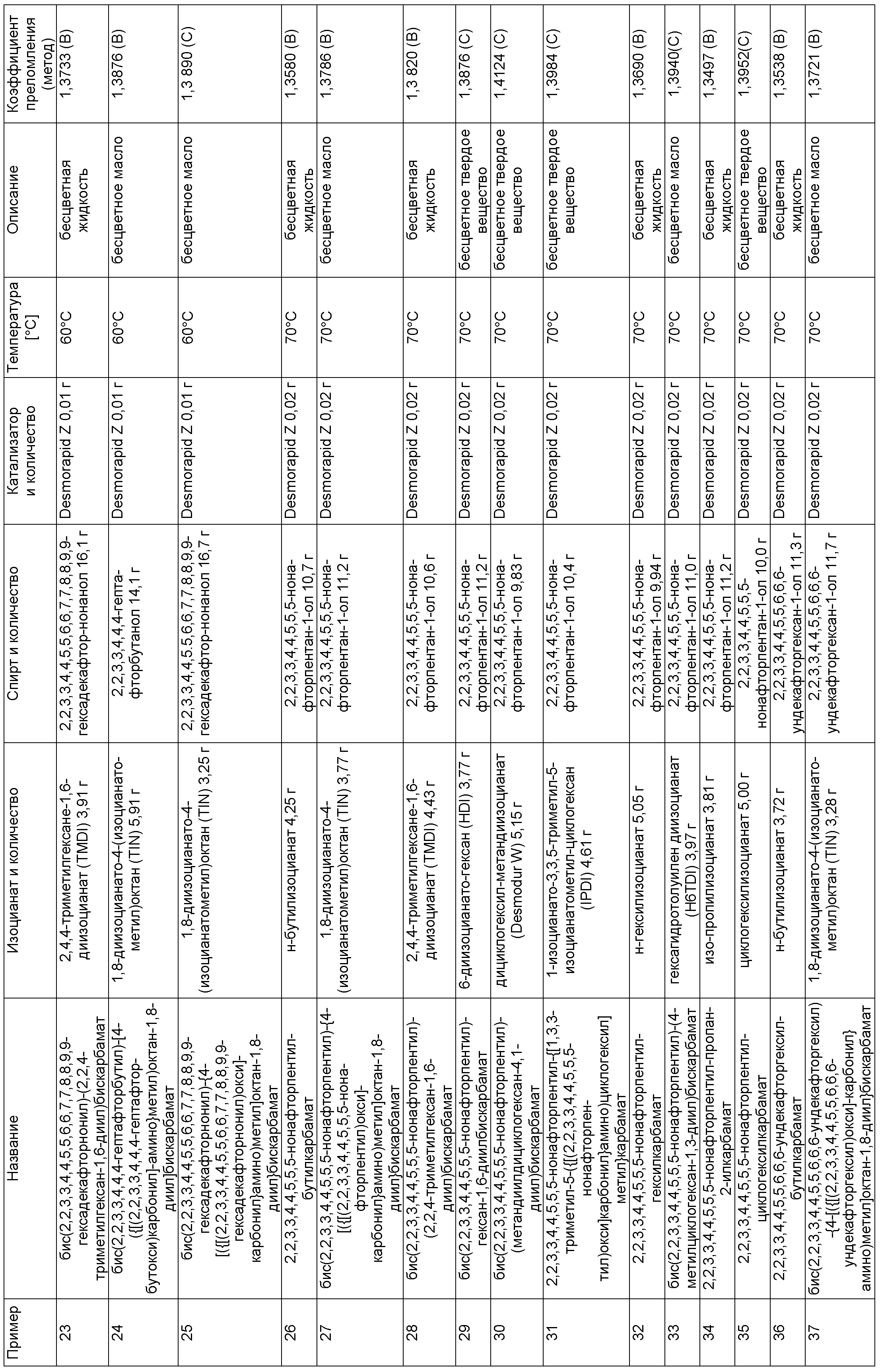
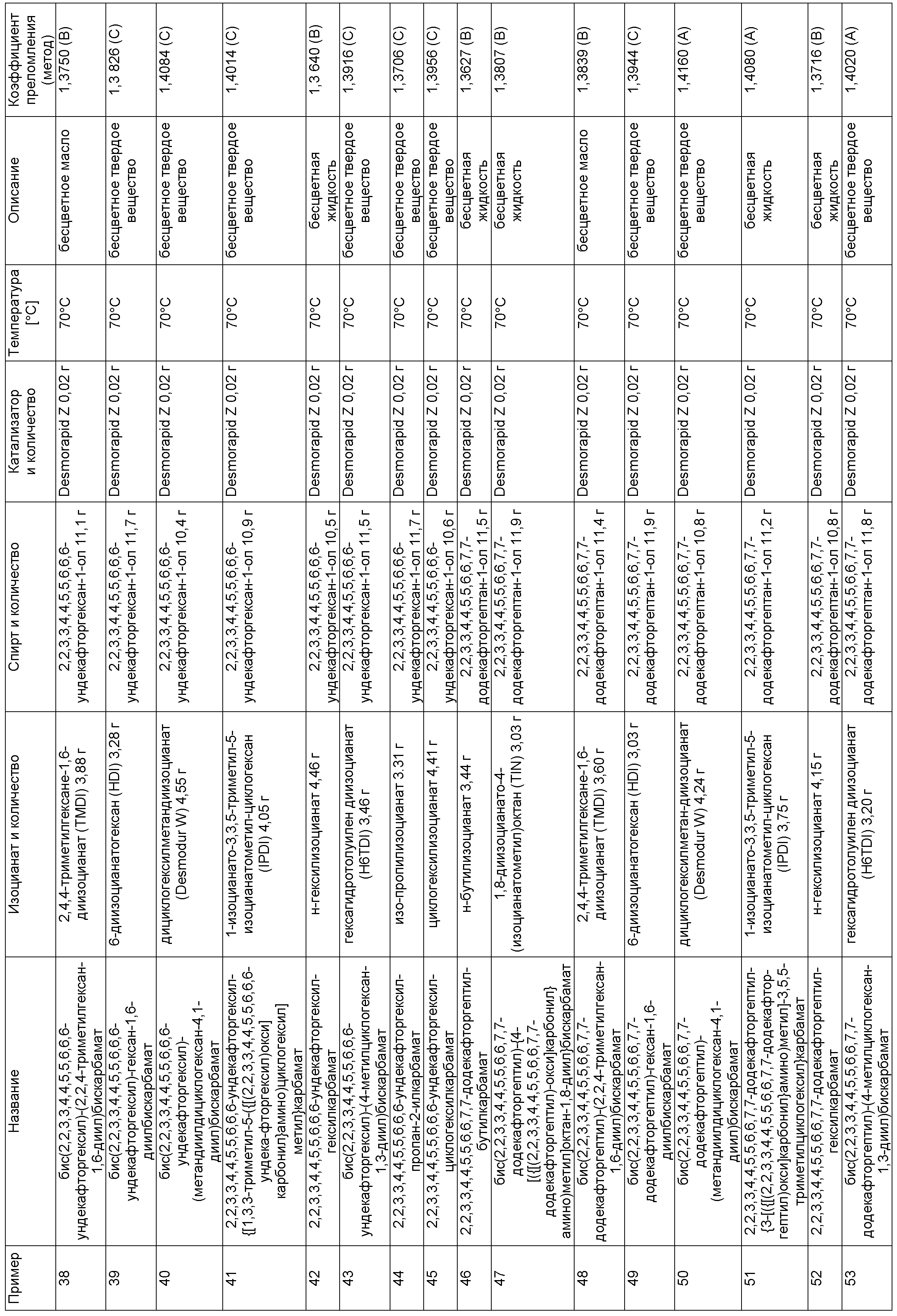
Примеры, описанные в таблице 1 ниже, изготовили описанным в примере 1 способом в указанных составах.
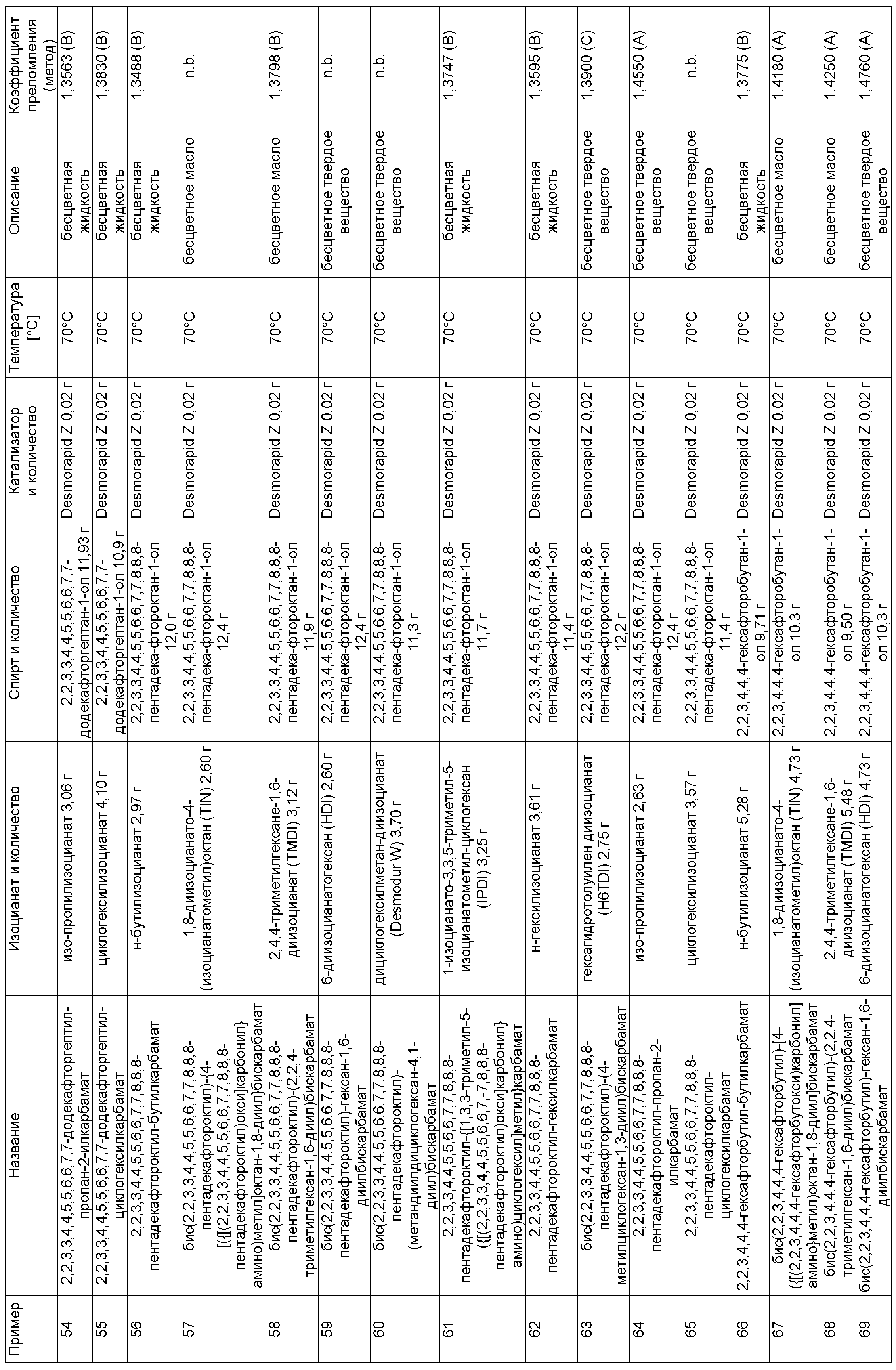


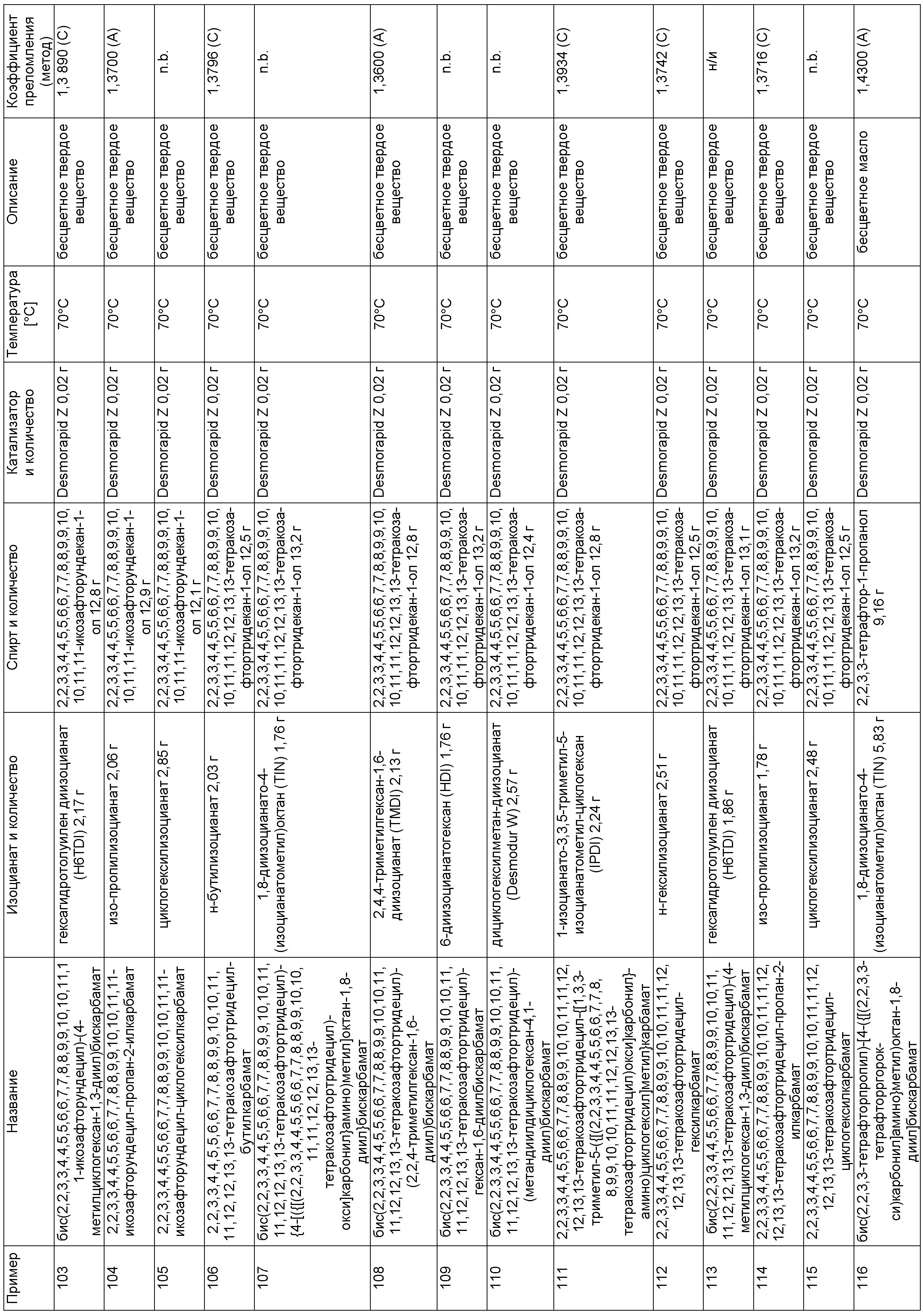
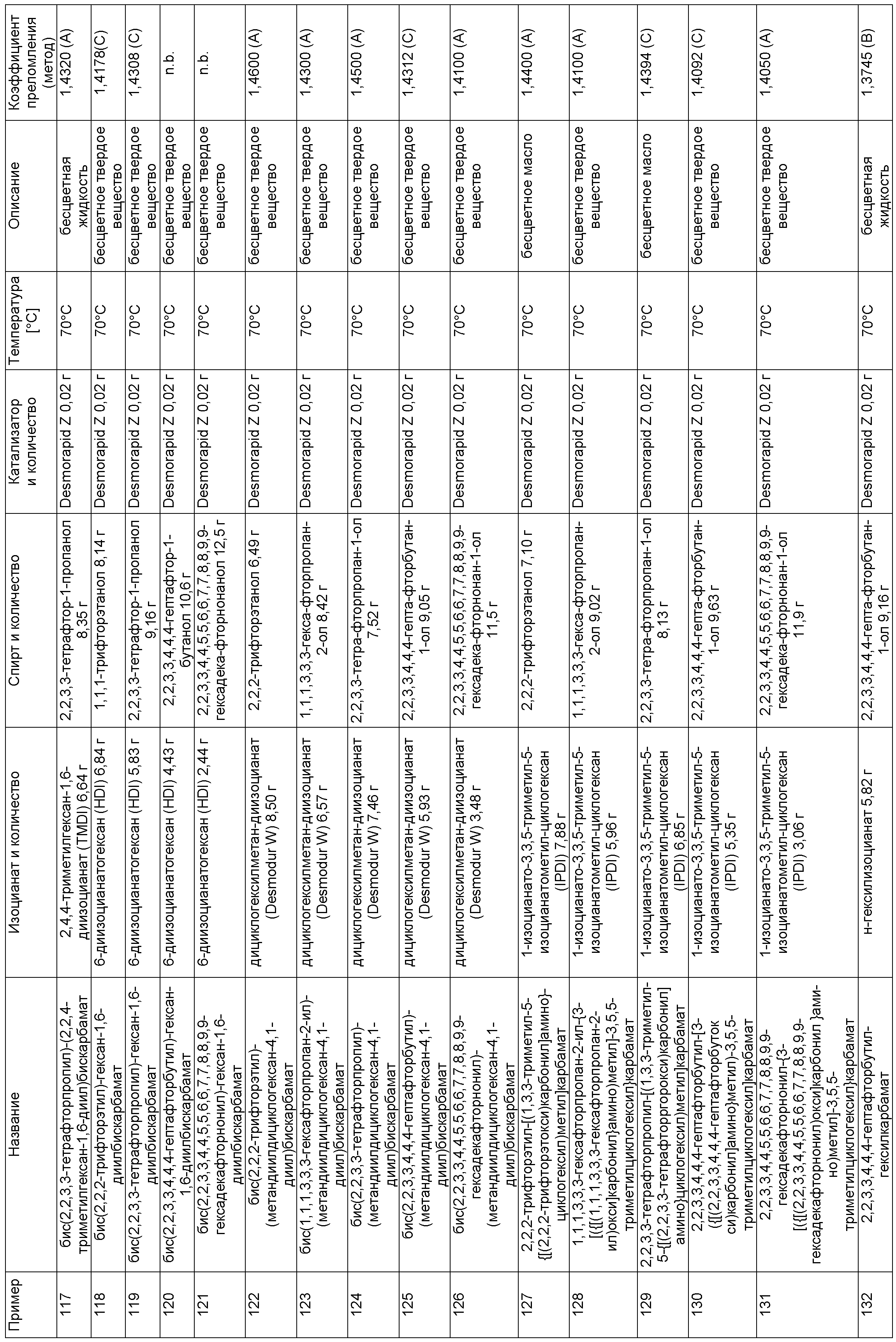
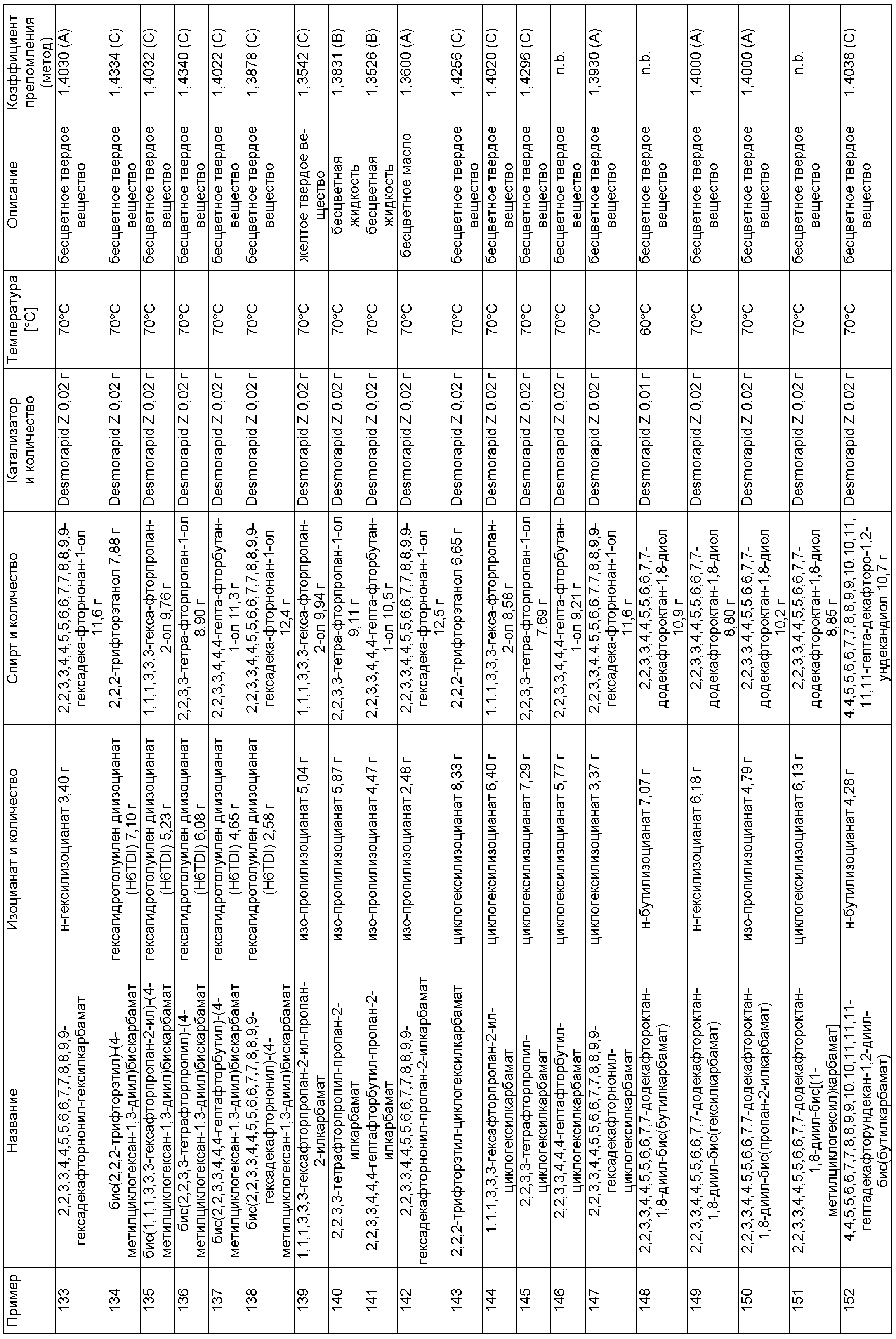

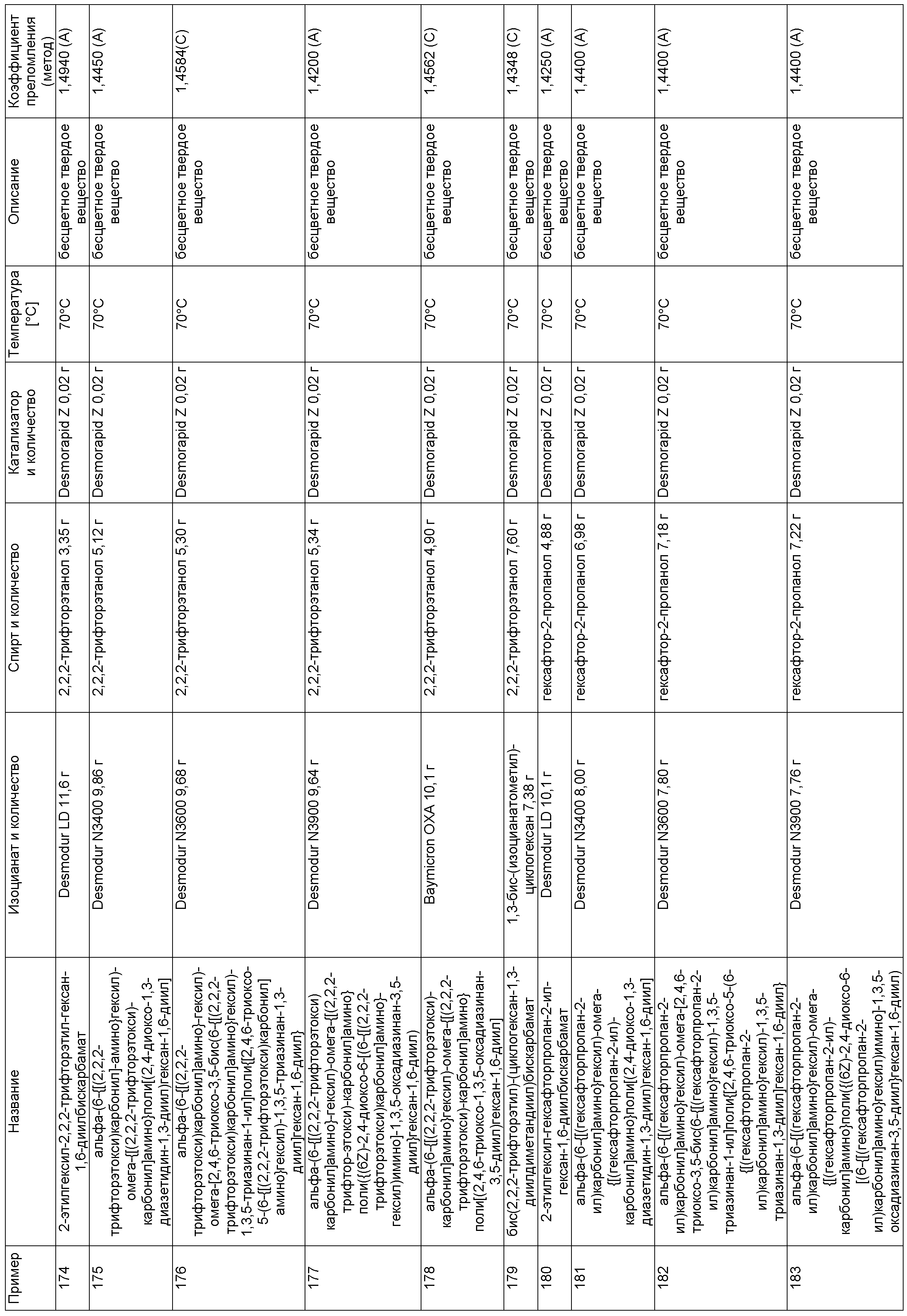




Пример 225: 9,9,10,10,11,11,12,12,13,13,14,14,29,29,30,30,31,31,32,32,33,33,34,34-тетракозафтор-20,20,22-триметил-6,17,26-триоксо-7,16,27-триокса-5,18,25-триазапентатриаконтан-35-ил-бутилкарбамат
В круглодонную колбу емкостью 250 мл поместили 2,2,3,3,4,4,5,5,6,6,7,7-додекафтор-1,8-октандиол, добавили 0,05 г дилаурата дибутилолова (Desmorapid Z, Bayer MaterialScience AG, Леверкузен, Германия) и нагрели до 60°C. По порциям добавили 18,7 г н-бутилизоцианата и в течение 3 ч перемешивали при 60°C. Затем по каплям добавили 19,9 г 2,4,4-триметилгексан-1,6-диизоцианата (TMDI) и продолжали выдерживать смесь при 60°C, пока содержание изоцианата не упало ниже 0,1%. Затем смесь охладили и получили продукт в виде бесцветного масла, коэффициент преломления, определенный по методу В, составил 
Пример 226: 23-(8,8,9,9,10,10,11,11,12,12,13,13-додекафтор-5,16-диоксо-6,15-диокса-4,17-диазагеникоз-1-ил)-9,9,10,10,11,11,12,12,13,13,14,14,29,29,30,30,31,31,32,32,33,33,34,34-тетракозафтор-6,17,26-триоксо-7,16,27-триокса-5,18,25-триазапентатриаконтан-35-ил-бутилкарбамат
В круглодонную колбу емкостью 100 мл поместили 2,2,3,3,4,4,5,5,6,6,7,7-додекафтор-1,8-октандиол, добавили 0,01 г дилаурата дибутилолова (Desmorapid Z, Bayer MaterialScience AG, Леверкузен, Германия) и нагрели до 60°C. По порциям добавили 3,63 г н-бутилизоцианата и в течение 3 ч перемешивали при 60°C. Затем по каплям добавили 3,08 г 1,8-диизоцианато-4-(изоцианатометил)октана (TIN) и продолжали выдерживать смесь при 60°C, пока содержание изоцианата не упало ниже 0,1%. Затем смесь охладили и получили продукт в виде бесцветного масла, коэффициент преломления, определенный по методу А, составил n=1,4200.
Изготовление сред
Для проверки оптических свойств изготовили среды, как это описано ниже, и провели с ними оптические измерения:
Изготовление полиольного компонента.
В колбу емкостью 1 л поместили 0,18 г октоата олова, 374,8 г ε-капролактона и 374,8 г дифункционального политетрагидрофуран-полиэфирполиола (эквивалентно по массе 500 г/моль ОН), нагрели до 120 и выдерживали при этой температуре до тех пор, пока содержание твердых веществ (доля нелетучих компонентов) не составила 99,5 масс.% или более. Затем смесь охладили и получили продукт в виде восковидного твердого вещества.
Изготовление уретанакрилата 1: фосфоротиоилтрис(оксибензол-4,1-диилкарбамоилоксиэтан-2,1-диил)трисакрилат.
В круглодонную колбу емкостью 500 мл поместили 0,1 г 2,6-ди-трет.-бутил-4-метилфенола, 0,05 г дилаурата дибутилолова(Desmorapid Z, Bayer MaterialScience AG, Леверкузен, Германия), а также 213,07 г 27%-ного раствора трис(пара-изоцианатофенил)тиофосфата в этилацетате (Desmodur® RFE, продукт Bayer MaterialScience AG, Леверкузен, Германия) и нагрели до 60°C. Затем по каплям добавили 42,37 г 2-гидроксиэтилакрилата и продолжали выдерживать смесь при 60, пока содержание изоцианата не упало ниже 0,1%. После этого провели охлаждение, а этилацетат полностью удалили в вакууме. Получили продукт в виде частично кристаллического твердого вещества.
Изготовление уретанакрилата 2: 2-({[3-(метилсульфанил)фенил]карбамоил}окси)пропилпроп-2-еноат.
В круглодонную колбу емкостью 250 мл поместили 0,05 г 2,6-ди-трет.-бутил-4-метилфенола, 0,02 г Desmorapid Z, 26,8 г 3-(метилтио)фенилизоцианат в 50 г этилацетата и нагрели до 60°C. Затем по каплям добавили 21,1 г 2-гидроксипопилакрилата и продолжали выдерживать смесь при 60, пока содержание изоцианата не упало ниже 0,1%. Затем дистилляцией при 5 мбар удалили этилацетат и провели охлаждение. Получили продукт в виде светло-желтой жидкости.
Среда 1:
3,82 г изготовленного так, как описано выше, полиольного компонента смешали с 2,50 г фосфоротиоилтрис(оксибензол-4,1-диилкарбамоилоксиэтан-2,1-диил)трисакрилата (уретанакрилат 1), 2,50 г 2,2,2-трифторэтил-гексилкарбамата (пример 4), 0,10 г CGI 909 (экспериментальный продукт фирмы Ciba Inc, Базель, Швейцария), 0,01 г нового метиленового синего и 0.35 г н-этилпирролидона при 60°C, так, что получили прозрачный раствор. Затем провели охлаждение до 30°C, добавили 0,71 г Desmodur® N3900 (торговый продукт Bayer MaterialScience AG, Леверкузен (Германия), полиизоцианат на основе гександиизоцианата, доля иминооксадиазиндиона не менее 30%, содержание NCO 23,5%) и снова перемешали. В конце добавили 0,006 г Fomrez UL 28 (катализатор уретанизации, торговый продукт фирмы Momentive Performance Chemicals, Уилтон, Коннектикут, США) и снова провели кратковременное перемешивание. Полученную жидкую массу затем поместили на стеклянную пластинку и накрыли там второй стеклянной пластинкой, которую распоркой удерживали на расстоянии в 20 мкм. Этот образец оставили при комнатной температуре на 12 часов, он затвердел.
Среды 2-13 изготовили из приведенных в таблице 1 примеров аналогичным образом. При этом в таблице 2 в каждом случае указано, соединение из какого примера и в каком количестве содержалось в фотополимерной рецептуре. Сводка значений Δn, полученных для изготовленных фотополимерных рецептур, также приведена в таблице 2.
Среда 14:
3,40 г изготовленного так, как описано выше, полиольного компонента смешали с 2,00 г фосфоротиоилтрис(оксибензол-4,1-диилкарбамоилоксиэтан-2,1-диил)трисакрилата (уретанакрилат 1), 2,00 г 2,2,2-трифторэтил-гексилкарбамата (пример 4), 0,10 г CGI 909 (экспериментальный продукт фирмы Ciba Inc, Базель, Швейцария), 0,01 г нового метиленового синего и 0.35 г н-этилпирролидона при 60°C, так, что получили прозрачный раствор. Затем провели охлаждение до 30°C, добавили 0,64 г N3900 (торговый продукт Bayer MaterialScience AG, Леверкузен (Германия), полиизоцианат на основе гександиизоцианата, доля иминооксадиазиндиона не менее 30%, содержание NCO 23,5%) и снова перемешали. В конце добавили 0,006 г Fomrez UL 28 (катализатор уретанизации, торговый продукт фирмы Momentive Performance Chemicals, Уилтон, Коннектикут, США) и снова провели кратковременное перемешивание. Полученную жидкую массу затем поместили на стеклянную пластинку и накрыли там второй стеклянной пластинкой, которую распоркой удерживали на расстоянии в 20 мкм. Этот образец оставили при комнатной температуре на 12 часов, он затвердел.
Среды 14-70 изготовили из приведенных в таблице 1 примеров аналогичным образом. При этом в таблице 3 в каждом случае указано, соединение из какого примера и в каком количестве содержалось в фотополимерной рецептуре. Сводка значений Δn, полученных для изготовленных фотополимерных рецептур, также приведена в таблице 3.
Контрольная среда I:
8,89 г изготовленного так, как описано выше, полиольного компонента смешали с 3,75 г фосфоротиоилтрис(оксибензол-4,1-диилкарбамоилоксиэтан-2,1-диил)трисакрилата (уретанакрилат 1), 0,15 г CGI 909 (экспериментальный продукт фирмы Ciba Inc, Базель, Швейцария), 0,015 г нового метиленового синего и 0.53 г н-этилпирролидона при 60°C, так, что получили прозрачный раствор. Затем провели охлаждение до 30°C, добавили 1647 г Desmodur® N3900 (торговый продукт Bayer MaterialScience AG, Леверкузен (Германия), полиизоцианат на основе гександиизоцианата, доля иминооксадиазиндиона не менее 30%, содержание NCO 23,5%) и снова перемешали. В конце добавили 0,009 г Fomrez UL 28 (катализатор уретанизации, торговый продукт фирмы Momentive Performance Chemicals, Уилтон, Коннектикут, США) и снова провели кратковременное перемешивание. Полученную жидкую массу затем поместили на стеклянную пластинку и накрыли там второй стеклянной пластинкой, которую распоркой удерживали на расстоянии в 20 мкм. Этот образец оставили при комнатной температуре на 12 часов, он затвердел.
Контрольная среда II:
3,82 г изготовленного так, как описано выше, полиольного компонента смешали с 2,50 г фосфоротиоилтрис(оксибензол-4,1-диилкарбамоилоксиэтан-2,1-диил)трисакрилата (уретанакрилат 1), 2,50 г пропиленкарбоната (контрольный пример II), 0,10 г CGI 909 (экспериментальный продукт фирмы Ciba Inc, Базель, Швейцария), 0,01 г нового метиленового синего и 0,35 г н-этилпирролидона при 60°C, так, что получили прозрачный раствор. Затем провели охлаждение до 30°C, добавили 0,702 г Desmodur® N3900 (торговый продукт Bayer MaterialScience AG, Леверкузен (Германия), полиизоцианат на основе гександиизоцианата, доля иминооксадиазиндиона не менее 30%, содержание NCO 23,5%) и снова перемешали. В конце добавили 0,022 г Fomrez. UL 28 (катализатор уретанизации, торговый продукт фирмы Momentive Performance Chemicals, Уилтон, Коннектикут, США) и снова провели кратковременное перемешивание. Полученную жидкую массу затем поместили на стеклянную пластинку и накрыли там второй стеклянной пластинкой, которую распоркой удерживали на расстоянии в 20 мкм. Этот образец оставили при комнатной температуре на 12 часов, он затвердел.
Контрольные среды III-V изготовили из приведенных в таблице 2 контрольных примеров аналогичным образом.
Контрольная среда VI:
4,66 г изготовленного так, как описано выше, полиольного компонента смешали с 2,00 г фосфоротиоилтрис(оксибензол-4,1-диилкарбамоилоксиэтан-2,1-диил)трисакрилата (уретанакрилат 1), 2,00 г 2,2,2-трифторэтил-гексилкарбамата (пример 4), 0,10 г CGI 909 (экспериментальный продукт фирмы Ciba Inc, Базель, Швейцария), 0,01 г нового метиленового синего и 0.35 г н-этилпирролидона при 60°C, так, что получили прозрачный раствор. Затем провели охлаждение до 30°C, добавили 0,87 г Desmodur® N3900 (торговый продукт Bayer Material Science AG, Леверкузен (Германия), полиизоцианат на основе гександиизоцианата, доля иминооксадиазиндиона не менее 30%, содержание NCO 23,5%) и снова перемешали. В конце добавили 0,006 г Fomrez UL 28 (катализатор уретанизации, торговый продукт фирмы Momentive Performance Chemicals, Уилтон, Коннектикут, США) и снова провели кратковременное перемешивание. Полученную жидкую массу затем поместили на стеклянную пластинку и накрыли там второй стеклянной пластинкой, которую распоркой удерживали на расстоянии в 20 мкм. Этот образец оставили при комнатной температуре на 12 часов, он затвердел.
Полученные значения топографического показателя Δn для топографических сред демонстрируют, что примененные в контрольных средах коммерческие добавки для применения в топографических средах менее пригодны к применению, а уретаны согласно изобретению в средах 1-13, напротив, очень хорошо годятся для изготовления топографических сред в силу высоких значений Δn.
Указанные значения Δn получены при дозах 4-32 мДж/см2.
Полученные значения топографического показателя Δn для топографических сред демонстрируют, что уретаны согласно изобретению в средах 14-70 очень хорошо годятся для изготовления топографических сред в силу высоких значений Δn.
Реферат
Изобретение касается фотополимерной композиции для получения оптических элементов, включающая в себя полимеры матрикса, пишущие мономеры и фотоинициаторы, причем полимеры матрикса представляют собой полиуретаны и пишущие мономеры представляют собой акрилаты, в качестве пластификаторов она содержит фторуретаны, причем фторуретаны имеют общую формулу (II)в которой n≥1 и n≤8, R, R, Rпредставляют собой водород и/или независимо друг от друга линейные, разветвленные, циклические или гетероциклические, незамещенные или при необходимости замещенные гетероатомами органические остатки, причем по меньшей мере один из остатков R, R, Rзамещен по меньшей мере одним атомом фтора и фторуретаны имеют коэффициент преломления. Также изобретение относится к применению композиции фотополимера для изготовления для получения топографических элементов и изображений, способ экспозиции топографических сред из композиции фотополимера, а также к фторуретанам общей формулы (III)в которой m≥1 и m≤8, R, R, Rпредставляют собой водород и/или независимо друг от друга линейные, разветвленные, циклические или гетероциклические незамещенные или при необходимости замещенные гетероатомами органические остатки и иминооксадиазиндионовые и/или оксадиазиндионовые структурные элементы, причем одновременно по меньшей мере два из остатков R, R, Rзамещены по меньшей мере одним атомом фтора. Технический результат - изготовление голограммы с высокой яркостью. 5 н. и 6 з.п. ф-лы, 2 ил., 3 табл.
Формула
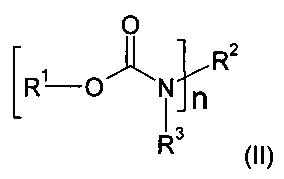
в которой n≥1 и n≤8, R1, R2, R3 представляют собой водород и/или независимо друг от друга линейные, разветвленные, циклические или гетероциклические, незамещенные или при необходимости замещенные гетероатомами органические остатки, причем по меньшей мере один из остатков R1, R2, R3 замещен по меньшей мере одним атомом фтора и фторуретаны имеют коэффициент преломления


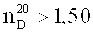
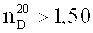
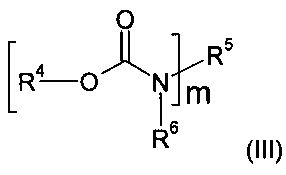
в которой m≥1 и m≤8, R4, R5, R6 представляют собой водород и/или независимо друг от друга линейные, разветвленные, циклические или гетероциклические незамещенные или при необходимости замещенные гетероатомами органические остатки и иминооксадиазиндионовые и/или оксадиазиндионовые структурные элементы, причем одновременно по меньшей мере два из остатков R4, R5, R6 замещены по меньшей мере одним атомом фтора.
Документы, цитированные в отчёте о поиске
Устройство и способ получения флексографических печатных форм для печатания газет путем нанесения цифровых оптических изображений

Комментарии