Ультразвуковая оценка сердечной синхронности и жизнеспособности - RU2508055C2
Код документа: RU2508055C2
Чертежи












Описание
Настоящее изобретение относится к медицинским диагностическим ультразвуковым системам и, в частности, к ультразвуковым системам, которые выполняют оценку синхронности и жизнеспособности работы сердца.
Существует много ультразвуковых способов оценить и измерить функцию сердечной камеры.
Движения стенки желудочка, указывающие на инфаркт миокарда, и фракция выброса являются базовыми средствами диагностики для эхокардиографов.
Эти средства диагностики требуют, чтобы сердечная камера была определена и прослежена на ряде изображений на протяжении сердечного цикла, так что могут быть сделаны измерения изображенного миокарда и сердечной камеры. Методики изображения сердечной стенки на ультразвуковом изображении включают, к примеру, автоматическое отслеживание границ внутренних поверхностей кровяных тканей и формирование изображений тканей путем обработки доплеровских сигналов движения сердечной стенки, чтобы измерить скорость сокращения сердечной мышцы, среди прочих. Способность изображать и отслеживать движение миокарда важна для диагностирования синхронности электростимуляции сердца, а также для оценки неподвижных областей сердца, которые могут быть вызваны такими состояниями, как ишемия, гибернация или потеря сознания. Сердцу дается команда сокращаться посредством электрохимических сигналов, передаваемых натриевыми и калиевыми каналами в клетках мышцы миокарда. Эти сигналы, рассредоточенные, как они есть, по всей сердечной мышце, должны давать клеткам сердечной мышцы команду сокращаться в одинаковый момент времени. Когда это происходит, сердце сокращается из расслабленного полного объема до сокращенного минимального объема, таким образом, прокачивая максимальный объем крови с каждым ударом сердца. Это признак здорового сердца. Однако, когда сигналы, которые стимулируют это сокращение, вызывают сокращение различных областей сердца в разные промежутки времени, неравномерное сокращение будет прокачивать меньше, чем максимальный объем крови, вызывая сниженную эффективность и со временем изнашивая сердце. Желательно иметь возможность диагностировать такое состояние, чтобы при необходимости могла быть выполнена нужная схема лечения, как правило, имплантация сердечного ритмоводителя с отведениями, помещенного для вызова синхронных сокращений. Эта диагностика и ее терапия указываются ссылкой, как сердечная ресинхронизирующая терапия или СРТ (CRT).
Состояние болезни, которое может влиять на электромеханическое преобразование сердца, есть блокада левой ножки пучка Гиса. Блокада левой ножки пучка Гиса имеет место, когда передача сердечного электрического импульса задерживается или не передается по быстро проводящим волокнам главной левой ножки пучка Гиса или в обоих левом переднем и заднем пучках. Это может послужить причиной медленной деполяризации левого желудочка через межклеточную проводимость, распространяясь от правого желудочка к левому желудочку. Это состояние приводит к потере синхронности сокращения камеры и последующему неэффективному выбросу объема крови из камеры. Соответственно, желательно уметь эффективно и точно идентифицировать и измерять признаки и результаты такой потери синхронности.
В соответствии с принципами настоящего изобретения, движение или смещение миокарда отслеживается и измеряется в течение некоторых или всех систолических и/или диастолических фаз сердечного цикла. Предпочтительная мера - дистанционное измерение, известное как растяжение. Измерение проводится в различных областях миокарда, и строится семейство кривых для мер смещения различных областей. Последовательные вклады различных областей в сердечное сокращение во время сердечного цикла измеряются графически, численно, или вместе в сердечной оценке, указываемой изобретателями как "задействование". Было обнаружено, что степень оцененного задействования коррелирует с состояниями блокады левой ножки пучка Гиса и дилатационной кардиомиопатии.
НА ЧЕРТЕЖАХ:
Фиг.1 иллюстрирует ультразвуковую систему в форме блок-схемы, сконструированную в соответствии с принципами настоящего изобретения.
Фиг.2 более подробно иллюстрирует участок процессора QLab ультразвуковой системы Фиг.1.
Фиг.3a-3c иллюстрируют три методики для измерения смещения или растяжения на ультразвуковом изображении миокарда.
Фиг.4 - схематический чертеж сегментированной стенки миокарда левого желудочка.
Фиг.5a и 5b иллюстрируют построение кривой задействования в соответствии с принципами настоящего изобретения.
Фиг.6 иллюстрирует отображение ввода числовых данных для параметров анализа задействования.
Фиг.7 иллюстрирует параметрическое изображение задействования.
Фиг.8a-8d иллюстрируют последовательность параметрических изображений, показывающих динамическое выполнение критерия задействования в соответствии с принципами настоящего изобретения.
Сначала со ссылкой на Фиг.1, в форме блок-схемы показана ультразвуковая диагностическая система формирования изображения, сконструированная в соответствии с принципами настоящего изобретения. Ультразвуковой зонд 112 включает в себя матрицу 114 ультразвуковых преобразователей, которые передают и принимают ультразвуковые импульсы.
Матрица может быть одномерной линейной или криволинейной матрицей для формирования двухмерного изображения, или может быть двухмерной матрицей элементов преобразователя для управления электронным лучом в трех измерениях.
Трехмерные наборы данных и изображения, описанные ниже, предпочтительно получаются, используя зонд с двухмерной матрицей. Они также могут быть получены с помощью механически перемещаемого зонда с одномерной матрицей. Ультразвуковые преобразователи в матрице 114 передают ультразвуковую энергию и принимают эхо-сигнал, вернувшийся в ответ на эту передачу. Схема 20 управления частотой передачи управляет передачей ультразвуковой энергии на требуемой частоте или полосе частот через переключатель 22 передачи/приема ("П/П (T/R)"), соединенный с ультразвуковыми преобразователями в матрице 114. Промежутки времени, в которые матрица преобразователя активируется для передачи сигналов, могут быть синхронизированы с внутренними системными часами (не показано), или могут быть синхронизированы с телесной функцией, такой как сердечный цикл, для которого устройством 26 ЭКГ обеспечивается форма сигнала сердечного цикла. Когда сердечное сокращение находится в требуемой фазе своего цикла, как определено формой сигнала, обеспеченного устройством 26 ЭКГ, на зонд поступает команда получить ультразвуковое изображение. Частота и ширина полосы ультразвуковой энергии, сгенерированной схемой 20 управления частотой передачи, управляется сигналом ftr управления, сформированным центральным контроллером 28.
Эхо-сигналы от переданной ультразвуковой энергии принимаются преобразователями в матрице 114, которые формируют эхо-сигналы, которые связываются через переключатель 22 П/П и оцифровываются аналогово-цифровыми ("А/Ц") преобразователями 30, когда система использует цифровой формирователь луча. Также могут быть использованы аналоговые формирователи луча. А/Ц преобразователи 30 производят выборку полученных эхо-сигналов на частоте выборки, управляемой сигналом fs, сформированным центральным контроллером 28. Требуемая частота выборки, предписанная теорией выборок, по меньшей мере, в два раза выше самой высокой частоты полученной полосы пропускания, и может быть порядка, по меньшей мере, 30-40 МГц. Также желательны частоты выборки выше, чем минимальное требование.
Выборки эхо-сигналов от отдельных преобразователей в матрице 114 откладываются и суммируются формирователем 32 луча для формирования когерентных эхо-сигналов. Для формирования трехмерных изображений с помощью двухмерной матрицы, является предпочтительным разделить формирователь луча между микроформирователем луча, расположенном на зонде, и главным формирователем луча в центральном блоке системы, как описано в патенте США 6013032 (Savord) и патенте США 6375617 (Fraser). Цифровые когерентные эхо-сигналы затем фильтруются цифровым фильтром 34. В этом варианте осуществления частотой передачи и частотой приема управляют отдельно, так что формирователь 32 луча может свободно принимать полосу частот, которая отлична от переданной полосы, например гармоническую полосу частот. Цифровой фильтр 34 полосы пропускания фильтрует сигналы, и может также сдвигать полосу частот к более низкому или узкополосному частотному диапазону. Цифровой фильтр может быть, например, типа фильтра раскрытого в патенте США № 5833613. Отфильтрованные эхо-сигналы от ткани передаются от цифрового фильтра 34 на процессор 36 режима В для традиционной обработки в режиме В.
Отфильтрованные эхо-сигналы контрастного вещества, например микропузырьков, связываются с процессором 38 контрастных сигналов. Контрастные вещества часто используются для более ясного изображения внутрисердечной стенки относительно контрастного вещества в пуле крови сердечной камеры, или для выполнения исследования кровотока микроциркуляторной части миокарда, как описано, например, в патенте США 6692438. Процессор 38 контрастных сигналов предпочтительно разделяет эхо-сигналы, вернувшиеся от гармонических контрастных веществ методом импульсной инверсии, в котором эхо-сигналы, являющиеся результатом передачи множества импульсов в расположение изображения, комбинируются, чтобы аннулировать основные составляющие сигнала и усилить гармонические компоненты. Предпочтительный метод импульсной инверсии описан в патенте США 6186950, например.
Отфильтрованные эхо-сигналы от цифрового фильтра 34 также связаны с доплеровским процессором 40 для традиционной доплеровской обработки для создания доплеровских сигналов скорости и энергии. Выходные сигналы от этих процессоров могут быть отображены как плоские изображения, и также связаны с процессором 42 трехмерных изображений для визуализации трехмерных изображений, которые хранятся в памяти 44 трехмерных изображений. Трехмерная визуализация может быть выполнена, как описано в патенте США 5720291 и патентах США 5474073 и 5485842, все из которых включены в настоящее описание посредством ссылки.
Сигналы от процессора 38 контрастных сигналов, процессора 36 режима В и доплеровского процессора 40, и трехмерные изображения из памяти 44 трехмерных изображений связаны с памятью 48 Cineloop®, которая хранит данные изображения для каждого из многочисленных ультразвуковых изображений. Данные изображения предпочтительно хранятся в памяти 48 Cineloop в виде наборов, где каждый набор данных изображения соответствует изображению, полученному в соответствующий промежуток времени. Данные изображения в наборе данных могут быть использованы для отображения параметрического изображения, показывающего тканевую перфузию в соответствующий промежуток времени во время удара сердца. Наборы данных изображения, хранящиеся в памяти 48 Cineloop, могут также храниться в постоянном запоминающем устройстве, таком как дисковый накопитель или цифровое записывающее устройство, для дальнейшего анализа. В этом варианте осуществления изображения также связаны с процессором 50 QLAB, в котором изображения анализируются для характеристик задействования, как описано ниже. Процессор QLAB также производит дискретные измерения различных аспектов анатомии на изображении и изображает контуры ткани и границы автоматическим вычерчиванием границ, как описано в патенте США публикации № US20050075567 и публикации PCT № 2005/054898. Это может быть сделано полностью автоматическими средствами, как описано в патенте США 6491636, или содействующим автоматическим определением границы, как описано в вышеуказанной публикации патента США № US20050075567. Данные и изображения, произведенные процессором QLAB, отображаются на дисплее 52.
Фиг.2 - подробная блок-схема участка процессора 50 QLab, показанного на Фиг.1, функционирующего в соответствии с настоящим изобретением. Процессор QLab принимает изображения от процессора 440 изображений, как, например, те, которые предшествуют сохраненным в памяти 48 Cineloop, показанной на Фиг.1. Процессор 440 изображений производит данные сканирования строк изображения, которое хранится в памяти 140 данных изображения. Первое, исходное точечное изображение последовательности изображений сердца анализируется обнаружением границы сердечной камеры на изображении процессором 144 ABD, как описано в публикации PCT № 2007/138522. Когда определена граница на этом первом изображении, ее расположение отслеживается через последовательные изображения устройством 142 отслеживания спеклов, которое следит за повторяющимися спекл-структурами на или около границы изображенной ткани. Изначально определенная граница и границы последующих изображений изображаются или отслеживаются графическим процессором 148. Ультразвуковые изображения последовательности конвертируются в требуемый формат отображения (например, секторный, линейный, трехмерный и так далее) преобразователем 450 развертки, который отображает графически произведенные границы над определенными положениями границ на ультразвуковых снимках. Изображения со своими наложениями графической границы хранятся в памяти 460 Cineloop, вместе с характеристиками задействования, произведенными метрическим процессором 120 задействования, который обрабатывает изображения сердца, как обсуждено подробно ниже. Изображения и информация задействования затем отправляются на дисплей 52.
Специфические точки на идентифицированных границах последовательных изображений отслеживаются устройством 142 отслеживания спеклов, которое отслеживает исходные анатомические положения точек с помощью спекл-структуры, произведенной местной тканью на расположениях изображений точек. Устройство 142 отслеживания спеклов идентифицирует области пикселей вокруг опорных точек в прилегающем миокарде. Спекл-структуры этих пикселей сохраняются и сравниваются со спекл-структурами в тех же областях последующих изображений и спекл-структурами подобранными согласованием блоков, как описано в патенте США 6442289 (Olsson et al.). Трудность и точность подбора определяется установлением максимальной взаимосвязи для подбора. Расположения опорных точек на изображениях, таким образом, отслеживаются от изображения к изображению, следя за спекл-структурами вокруг точек. Когда устройство 142 отслеживания спеклов размещает опорные точки на новом изображении, расположения опорных точек связываются с графическим процессором 148, граница перерисовывается, используя вновь идентифицированные расположения точек и графическое наложение, произведенное для нового изображения. Новое изображение и его графическое наложение развертываются и отображаются на дисплее 52. Процессор 144 ABD может использовать такую же методику, чтобы идентифицировать или отследить границу эпикарда миокарда на изображении. Дополнительные детали идентификации границ эндо- и эпикарда могут быть найдены в вышеупомянутой публикации PCT № 2007/138522.
Вместо отслеживания спекл-структуры ткани миокарда, окружающей, нижележащей или прилегающей к опорным точкам, можно заметить, что расположения опорных точек могут быть отслежены средствами, отличными от отслеживания спеклов, а именно, отслеживанием характеристик изображения, которые по размеру больше длины волны. К примеру, можно отследить движение специфических анатомических элементов, как например углов плоскости левого митрального клапана. В качестве другого примера, может быть отслежена структура ткани. Также будет принято во внимание, что целевые характеристики могут быть отслежены как в виде данных изображения до развертки, так и после развертки.
В качестве завершающего этапа, пользователь может захотеть вручную настроить идентифицированные точки границ или линий развертки, так что они точно будут очерчивать границу нижележащего миокарда.
На каждой идентифицированной границе миокарда в примере на Фиг.3a расположено некоторое количество малых контрольных точек 14, 16, как показано на этом чертеже.
Количество и размещение этих малых контрольных точек есть выбор системного проектирования или может быть переменным, настраиваемым пользователем. Используя управление на интерфейсе пользователя или панель 150 управления, пользователь может указывать на или около этих контрольных точек и нажимать и передвигать точки для более точного изображения того, что, по мнению пользователя, является контуром миокарда на изображении. Этот процесс растягивания или перетаскивания границы известен как "упругая привязка", и описан более полно в вышеуказанном патенте 6491636, с конкретной ссылкой на Фиг.9 того патента. В качестве альтернативы настройке упругой привязки, в более сложном варианте осуществления, аппроксимированные границы могут быть автоматически подстроены к границам изображения обработкой изображения, которая использует информацию об интенсивности пикселей на и вокруг аппроксимированных границ ткани. Когда этот процесс закончен, контрольные точки или вычерчивание границ может точно изобразить контур миокарда на изображении.
Фиг.3a иллюстрирует изображение сердца в виде короткой оси, произведенное ультразвуковой системой, сконструированной в соответствии с принципами настоящего изобретения. Камера 10 сердца, окруженная миокардом 12, показана в центре изображения короткой оси. Границы эндокарда и эпикарда определены, используя методики, описанные выше или методики, описанные в патенте США 5797396 (Geiser et al.), к примеру. Количество контрольных точек определено на границах как эндо-, так и эпикарда. Каждая пара контрольных точек 14, 16 эндо- и эпикарда в этом примере содержит две точки, расположенные на отдельном радиусе вида короткой оси. Каждая пара контрольных точек связана графически нарисованной линией 18 хорды, произведенной графическим процессором 148, которая соединяет точки. Можно увидеть, что все радиальные линии хорд приблизительно направлены к центру камеры 10 сердца. По мере того как миокард будет сокращаться с каждым ударом сердца во время систолы, миокард будет двигаться по направлению линий хорд к центру камеры сердца. Соответственно, когда миокард расслабляется во время диастолы, миокард будет двигаться обратно в противоположном направлении. Когда контрольные точки 14, 16 продолжают двигаться с границами миокарда, расстояния между контрольными точками 14, 16, а именно, длины линий 18 хорд, будут укорачиваться и удлиняться с сокращениями сердца.
В этом примере не отображены графики чертежей границ; отображены только контрольные точки 14, 16 эндо- и эпикарда и их соединяющие хорды 18. В этом примере контрольные точки для семи линий расположены вокруг миокарда, и нарисованы семь линий хорд, хотя в данном варианте осуществления большее или меньшее количество хорд может быть использовано или определено пользователем посредством интерфейса 150 пользователя.
По мере того как последовательность изображений будет двигаться от кадра к кадру через сердечный цикл, границы эндо- и эпикарда будут изменяться по отношению друг к другу от изображения к изображению, так как сердечная мышца сокращается во время систолы, затем расслабляется во время диастолы. Один способ измерить это движение или смещение ткани с помощью ультразвука - измерение, известное как лагранжева деформация (относительное изменение в длине относительно первоначальной длины) или скорость растяжения, как описано в патенте США 6537221 (Criton et al.) Растяжение - мера деформации в ткани и индикатор механического воздействия на мышечную ткань. Растяжение обычно описывают как безразмерный параметр или процентное отношение, с изменением в длине в качестве числителя, и первоначальной длиной в качестве знаменателя параметра. Таким образом, изменения в длинах 18 хорд на Фиг.3a от их исходных длин, по мере того как сердце сокращается или расслабляется, могут быть использованы, чтобы вычислить меру растяжения для каждой линии 18 хорды и соответствующей пары контрольных точек 14, 16 границы. Так как линии 18 хорды на Фиг.3a находятся приблизительно на радиальных линиях от центра камеры сердца, эти измерения Фиг.3a указаны ссылкой как радиальное растяжение.
Фиг.3b иллюстрирует измерение продольного растяжения, сделанное вдоль стенки сердечной камеры. На этом ультразвуковом изображении, на продольном перекрестном виде левого желудочка с чертежом 15 границы эндокарда, контрольные точки 14, 14' расположены вокруг границы эндокарда сердечной камеры. Линии 18 хорд соединяют контрольные точки 14, 14', расположенные вдоль сердечной камеры. По мере того, как сокращается миокард, контрольные точки 14, 14' приближаются друг к другу и линии 18 хорд между ними сокращаются. Соответственно, когда миокард расслабляется, соседние контрольные точки раздвигаются дальше в стороны и линии 18 хорд удлиняются. Эти длины или изменения длин, могут, таким образом, быть использованы, чтобы произвести измерение растяжения для каждой линии хорды.
Фиг.3c иллюстрирует другой способ произвести измерение растяжения, известный как периферическое растяжение. Видно, что процессор 144 ABD нарисовал чертеж 15 эндокарда, который изображен вдоль периферии сердечной стенки в этом виде короткой оси сердечной камеры. Некоторое количество контрольных точек 14, 14' расположены вдоль чертежа 15 границы. По мере того, как сердечная мышца сокращается, периферийное расстояние между этими контрольными точками, как например соседними точками 14, 14', будет сокращаться. Когда сердечная мышца будет расслабляться, расстояние между этими точками будет снова увеличиваться. Эти смещения могут быть использованы, чтобы произвести измерение периферического растяжения в точках вокруг границы эндокарда.
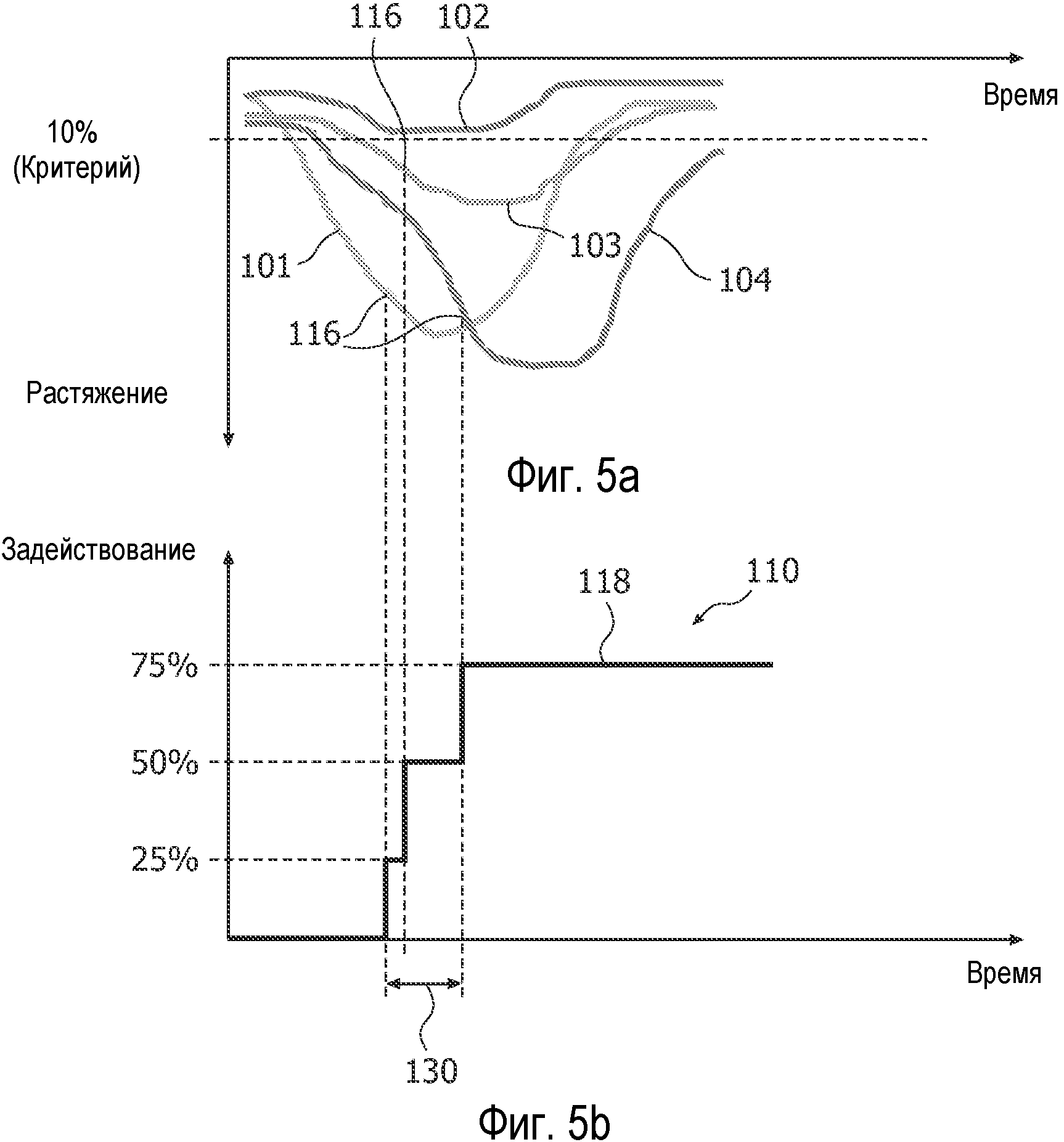
В соответствии с принципами настоящего изобретения, измерения растяжения движения или смещения миокарда используются для вычисления характеристики, которую в настоящем изобретении называют "задействование". Характеристика имеет такое название, потому что она указывает на задействование или участие разных областей сердца в смещении или движении сердца. Задействование может быть понято со ссылкой на Фиг.4, 5a и 5b. Фиг.4 - схематический чертеж левого желудочка (LV) с апексом камеры вверху и плоскостью левого митрального клапана внизу. В этом примере, миокард левого желудочка сегментирован на четыре области, идентифицированные как 1, 2, 3 и 4. Измерения растяжения делаются на протяжении всего сердечного цикла для каждого из этих сегментов миокарда и графически показаны на Фиг.5a, как кривые 101, 102, 103 и 104 растяжения, соответственно. Каждая кривая достигает своего наименьшего растяжения, когда соответствующий ей сегмент передвинулся на максимальное расстояние во время сокращения миокарда; кривая возвращается к вершине графика, когда сердце снова расслабляется. Можно видеть, что четыре кривые двигаются не в унисон в этом примере. А именно, четыре сегмента не синхронизированы в своем движении. Также можно видеть, что различные сегменты имеют разные максимумы растяжения. А именно, смещения четырех сегментов во время сокращения разные. Обе эти характеристики обозначаются измерением задействования настоящего изобретения.
Фиг.5b иллюстрирует кривую задействования, построенную в соответствии с настоящим изобретением. В этом примере пользователь сначала определяет критерий задействования, который является пороговым значением растяжения, которого должен достичь сегмент, чтобы эффективно участвовать в сердечном сокращении, или быть задействованным для него. В данном случае пользователь определяет 10% критерий задействования, указанный горизонтальной пунктирной линией на Фиг.5a. Видно, что кривая 102 сегмента 2 миокарда не достигает этого порогового критерия. Смещение сегмента недостаточно, чтобы сегмент 2 был задействован для этого критерия. Все три другие кривые пересекают этот критерий, и все три задействованы для эффективного сокращения сердца в этом примере.
Пользователь также настраивает уровень контрольных точек задействования, который является процентным отношением максимального растяжения сегмента сердечной стенки. Контрольная точка может быть настроена на 100% от полного смещения сегмента, или на часть максимального измерения растяжения. В этом примере уровень контрольной точки настроен на 85% от максимального растяжения. Если эти параметры определены, процессор 50 QLab может построить кривую 110 задействования, как показано на Фиг.5b. Видно, что кривая 110 имеет нулевой исходный уровень до сокращения сердца и конечный плоский уровень 118, когда все задействованные сегменты достигли контрольной точки. Ступени на кривой 110 показывают, когда сегменты 1, 3, и 4, представленные кривыми 101, 103, и 104, достигли своих контрольных точек. На Фиг.5a уровни контрольных точек указаны с помощью 116, и вниз от этих контрольных точек опущены вертикальные пунктирные линии. Горизонтальные пунктирные линии на Фиг.5b показывают уровни ступеней задействования 25%, 50% и 75%, три ступени трех сегментов сердечной стенки, которые задействованы выше 10% критерия. Время, которое ушло на возрастание прямой 110 от ее исходного уровня 116 до ее конечного плоского уровня 118, является промежутком времени, указанным стрелкой 130. Вертикальные пунктирные линии между Фиг.5a и 5b отмечают соответствующие моменты времени, в которые кривые 101-104 растяжения достигают своих 85% уровней контрольных точек, которые пунктирные линии переносят ниже к кривой задействования. Таким образом, промежуток 130 времени возрастания кривой задействования является мерой синхронности электрической согласованности во времени сердца.
Если бы все кривые 101-104 сегментов достигли своего уровня контрольной точки одновременно, случай для идеально здорового сердца, кривая 110 задействования не имела бы множества ступеней, но являлась бы одной ступенью от исходного уровня базовой линии до конечного уровня 118, так как сегменты двигались бы абсолютно синхронно.
Характеристика длительности, указанная стрелкой 130, будет в этом случае нулевой. Таким образом, большая длительность указывает на недостаточную синхронность. Кривая 110 задействования здорового сердца будет также иметь количество ступеней равное количеству кривых сегмента. А именно, все сегменты сердца будут задействованы в сокращении. Когда сегмент не задействован и находится ниже критерия задействования, 10% в этом примере, указывается вероятность инфаркта сегмента стенки. Таким образом, кривая задействования чувствительна к степени ткани, которая в конечном счете будет задействована, индикатора ишемии, и чувствительна к тому, как быстро будет задействована ткань в конечном счете, что является индикатором синхронности. По этой причине задействование может одновременно указывать на жизнеспособность и синхронность. Это важно, потому что электрическая стимуляция нежизнеспособной ткани является одной из причин, по которой процедура СРТ не действует. В то время как предшествующий пример разделил миокард только на четыре сегмента, будет принято во внимание, что альтернативно может быть использовано большее или меньшее количество сегментов, включая расчет растяжения для каждого пикселя. Большое количество сегментов будет производить множество ступеней в кривой задействования, показывая последовательное задействование каждой точки миокарда в общем движении и эффективности сердца. Посредством цветового кодирования точек в миокарде, могут быть приняты во внимание кривые растяжения и ступени кривой задействования, моменты времени максимального участия каждой точки миокарда в движении сердца.
Фиг.6 иллюстрирует блок дисплея для ввода данных, посредством которого пользователь может настраивать параметры кривой задействования, критерий и уровень контрольной точки. В этом примере пользователь настроил критерий задействования растяжения на 10% и контрольную точку задействования растяжения на 85% от максимума. Окружности ниже этих точек ввода могут быть настроены, чтобы указывать на использование радиальных, продольных или периферических измерений растяжения для анализа задействования.
В качестве альтернативы или дополнения к графическому представлению анализа задействования, как показано на Фиг.5b, может быть использован анатомический параметрический дисплей для указания задействования, как показано на Фиг.7. В этом примере круглая параметрическая лента 200 отображения наложена поверх миокарда, показанного на ультразвуковом изображении. Указатель на ЭКГ формы 210 волны внизу дисплея показывает точку в сердечном цикле, в которой было получено изображение. Точки на параметрической ленте 200 отображения окрашены для указания задействования низлежащих точек сердечной мышцы. В то время как последовательное задействование вдоль кривой растяжения может быть указано продолжительным спектром цветов или затенений, как показано цветовой полосой 212 справа от изображения сердца, в этом примере использованы только темный и светлый цвета, чтобы указать превысила ли или не превысила низлежащая точка миокарда либо критерий задействования, либо контрольную точку задействования. Темное затенение указывает, что низлежащий миокард был задействован этой фазой сердечного цикла, а светлое затенение указывает, что лежащий снизу миокард еще не был задействован. Темная область 202 в нижней половине параметрической ленты отображения в этом примере указывает, что область миокарда в нижней стенке изначально была задействована, тогда как область миокарда в передней стенке сердца, лежащая под областью 204 светлой ленты отображения, еще должна быть задействована к моменту этой фазы сердечного цикла.
Фиг.8a-8d показывают последовательность изображений сердца, полученных во время сердечного цикла, которая показывает последовательное задействование областей миокарда во время цикла. Темные области параметрической ленты 200 отображения на Фиг.8a показывают, что исходное движение сердечного сокращения происходит в верхней левой (нижне-перегородочной) области сердца в этом примере. Фиг.8b показывает, что левая сторона (перегородочная часть) миокарда теперь фактически полностью задействована этой фазой сердечного цикла, с некоторым движением, начинающимся с правой (боковой) стороны сердца. В момент времени сердечного цикла Фиг.8c, весь эндокард и почти вся правая сторона сердца теперь участвуют в сокращении, а в момент времени Фиг.8d изображенное задействование явно очевидно вокруг полной периферии сердечной камеры. Последовательность изображений Фиг.8a-8d дает практикующему врачу хорошее понимание синхронности сердечного сокращения и промежутков времени участия различных областей сердца в сокращении.
Реферат
Изобретение относится к медицинской технике, а именно к ультразвуковым диагностическим системам формирования изображений. Устройство содержит зонд, выполненный с возможностью передачи ультразвуковых волн в сердце и приема ответных эхо-сигналов, процессор изображений, реагирующий на эхо-сигналы, выполненный с возможностью производить последовательность изображений миокарда в течение, по меньшей мере, части сердечного цикла, анализатор движения миокарда, реагирующий на последовательность изображений, который определяет движение множества сегментов миокарда, процессор задействования, реагирующий на движение сегментов, который производит индикатор совокупного участия множества сегментов в процентном отношении от полного смещения миокарда во время сердечного цикла и относительных промежутков времени участия сегментов в движении миокарда относительно процентного отношения от полного смещения во время сердечного цикла, и дисплей, соединенный с процессором задействования, который отображает индикатор. Использование изобретения позволяет повысить эффективность и точность идентификации потери синхронности при движении миокарда. 14 з.п. ф-лы, 8 ил.
Формула
зонд, выполненный с возможностью передачи ультразвуковых волн в сердце и приема ответных эхосигналов;
процессор изображений, реагирующий на эхосигналы, выполненный с возможностью производить последовательность изображений миокарда в течение, по меньшей мере, части сердечного цикла;
анализатор движения миокарда, реагирующий на последовательность изображений, который определяет движение множества сегментов миокарда;
процессор задействования, реагирующий на движение сегментов, который производит индикатор совокупного участия множества сегментов в процентном отношении от полного смещения миокарда во время сердечного цикла и относительных промежутков времени участия сегментов в движении миокарда относительно процентного отношения от полного смещения во время сердечного цикла; и
дисплей, соединенный с процессором задействования, который отображает индикатор.
Документы, цитированные в отчёте о поиске
Ультразвуковая томография объектов посредством сканирования во множественных плоскостях

Комментарии