Ультразвуковое планирование и наведение имплантируемых медицинских устройств - RU2542378C2
Код документа: RU2542378C2
Чертежи









Описание
Настоящее изобретение относится к медицинским диагностическим ультразвуковым системам и, в частности, к ультразвуковым системам, которые выполняют размещение медицинских устройств, например, протезов сердечных клапанов, с наведением по трехмерным изображениям.
Для имплантации имплантируемых медицинских устройств, например, искусственных клапанов сердца, выполняют две важные операции. Первая составляет стадию планирования, на которой врач устанавливает размеры или физическую конфигурацию имплантируемого устройства, которое будет должным образом входить в анатомическое место имплантации. Например, клапан сердца не может быть больше, чем кровеносный сосуд или место в органе, в который(ое) клапан сердца требуется имплантировать. Вторая операция является фактической имплантацией устройства в процессе хирургической операции, во время которой имплантируемое устройство должным образом размещают в месте имплантации. Например, во многих случаях, устройство следует расположить симметрично, с полным совмещением со стенкой сосуда или кольцом перед наложением на него шва или иного прикрепления к телу. В прошлом, обе упомянутые операции часто выполняли во время самой хирургической операции. После того, как врач получал хирургическим путем доступ к месту имплантации, врач использовал, по меньшей мере, один примерочный имплантат (в последующем, сайзер), который производитель обеспечивал вместе с имплантируемым устройством. Сайзеры обычно изготавливали в форме нейлоновых или пластиковых колец, щупов или других форм, которые имеют, по меньшей мере, один критический размер, который согласуется с размерами имплантируемого устройства. Производители клапанов сердца, например, компании Medtronic, Edwards Lifesciences и St. Jude Medical, обеспечивают сайзеры со своими клапанами сердца. Поскольку аортальный клапан сердца должен иметь такой же размер, как и внутренний диаметр корня аорты, и должен держаться на кольце аортального клапана тела, сайзер будет представлять собой кольцеобразный шаблон с размерами и формой клапана сердца. Кольцеобразный шаблон прикреплен к небольшой ручке, которой врач пользуется для фиксации кольцеобразного шаблона к корню аорты и клапану пациента. Затем врач может определить, точно ли подходит клапан сердца с размерами сайзера для пациента. Если нет, то врач будет пробовать другой сайзер, пока не будет найден сайзер с размерами шаблона, которые должным образом соответствуют анатомии пациента. Затем врач имплантирует клапан сердца надлежащего размера.
Приведенная процедура планирования выполняется во время, которое является наиболее критичным для пациента и хирурга, во время самой хирургической операции. Желательно располагать возможностью определения размеров под имплантат до начала хирургического вмешательства. Если определение размеров можно выполнять как предоперационную процедуру, то данное определение можно тщательно выполнять без опасений, сопутствующих хирургической операции. Имплантат с правильно установленными размерами можно было бы получить заранее, чтобы он был готов к операции, и в хирургическом наборе присутствовал только имплантат с правильными размерами. Кроме того, если процедура имплантации является не операцией на открытом сердце, а минимально инвазивной процедурой, сердце и сосуды не вскрываются хирургически и не доступны для определения размеров. В таком случае желательно располагать возможностью определения размеров имплантируемого устройства без физического доступа к месту имплантации.
В соответствии с принципами настоящего изобретения, ультразвуковая система содержит электронные данные изображения сайзера имплантируемого устройства, т.е. виртуальный сайзер. Получают ультразвуковое изображение места в теле, в которое следует имплантировать устройство, с использованием 2-мерной или 3-мерной ультразвуковой визуализации. Масштаб изображения виртуального сайзера согласуют с масштабом анатомии в ультразвуковом изображении, чтобы как анатомия, так и виртуальный сайзер имели единый масштаб. Затем, виртуальным сайзером манипулируют относительно ультразвукового изображения, чтобы определить, подходит ли виртуальный сайзер к анатомии в ультразвуковом изображении, с выдачей показаний надлежащего размера для хирургической операции. Ультразвуковое изображение может быть статическим изображением, записанной в памяти кинопетлей изображений или динамическими изображениями. Врач может, например, выбрать изображение конкретной фазы сердца из последовательности (кинопетли) изображений сердца, чтобы выполнить определение размера по размерам сердца во время диастолы или систолы, по требованию. Когда получены трехмерные изображения сердца, можно манипулировать трехмерным изображением виртуального сайзера в трех измерениях, как действовал бы врач при определении размеров во время хирургической операции, что позволяет оценить размеры, ориентацию имплантата и возможные закупоривания других сосудов. Определение размеров можно выполнять по реальному анатомическому ультразвуковому изображению места имплантации или по модели анатомии, полученной из данных ультразвукового изображения.
В одном аспекте изобретения заявлена ультразвуковая система для планирования хирургической операции с имплантируемым устройством, содержащая: источник масштабируемых анатомических ультразвуковых изображений места в теле, в котором следует расположить имплантируемое устройство; источник, по меньшей мере, одного масштабируемого изображения сайзера, формирующего виртуальный сайзер, который указывает размер имплантируемого устройства; блок масштабирования, выполненный с возможностью поддержки отображения анатомического ультразвукового изображения и виртуального сайзера в едином масштабе; дисплей, выполненный с возможностью отображения единообразно масштабированных анатомического ультразвукового изображения и виртуального сайзера; и орган пользовательского управления, выполненный с возможностью применения пользователем для манипулирования позиционированием виртуального сайзера на дисплее относительно анатомии единообразно масштабированного анатомического ультразвукового изображения.
В дополнительных аспектах раскрыто, что ультразвуковые изображения являются трехмерными ультразвуковыми изображениями; орган пользовательского управления функционально предназначен для осуществления подгонки виртуального сайзера в анатомии ультразвукового изображения, и причем система отображения выполнена с возможностью отображения блока выделения наложения подгонки, который выделяет подгонку виртуального сайзера в анатомии; система дополнительно содержит формирователь изображений, учитывающий анатомическое ультразвуковое изображение, для создания масштабированной графической модели анатомии анатомического ультразвукового изображения, при этом единообразно масштабированное анатомическое ультразвуковое изображение дополнительно содержит масштабированную графическую модель анатомии; единообразно масштабированное ультразвуковое изображение и виртуальный сайзер являются трехмерными изображениями; предусмотрен наклон и поворот трехмерного ультразвукового изображения и изображения виртуального сайзера совместно в ответ на сигнал пользовательского управления; формирователь изображений дополнительно выполнен с возможностью разметки анатомической границы анатомического ультразвукового изображения; источник масштабируемых изображений сайзера дополнительно содержит источник виртуальных сайзеров для имплантируемых устройств разных размеров; орган пользовательского управления дополнительно выполнен с возможностью изменения пользователем относительного коэффициента непрозрачности или прозрачности анатомии представленной в ультразвуковом изображении; виртуальный сайзер дополнительно содержит масштабированное изображение имплантируемого устройства.
В другом аспекте изобретения заявлен способ установления размеров имплантируемого устройства, которое подходит к анатомии тела, при этом способ содержит этапы, на которых: отображают масштабированное ультразвуковое изображение анатомии тела, в которой следует разместить имплантируемое устройство; отображают единообразно масштабированное изображение виртуального сайзера, который показывает размер имплантируемого устройства с масштабированным ультразвуковым изображением анатомии; и манипулируют виртуальным сайзером относительно анатомии ультразвукового изображения, чтобы установить, подогнан ли виртуальный сайзер надлежащим образом к анатомии в ультразвуковом изображении.
В дополнительных аспектах раскрыто, что этап отображения дополнительно содержит отображение множества виртуальных сайзеров для имплантируемых устройств разных размеров; и при этом этап манипуляции дополнительно содержит манипуляцию множеством виртуальных сайзеров относительно анатомии ультразвукового изображения; что этап отображения дополнительно содержит отображение масштабированного трехмерного ультразвукового изображения анатомии тела; что этап манипуляции дополнительно содержит совместные поворот или наклон виртуального сайзера и анатомии; что единообразно масштабированный виртуальный сайзер дополнительно содержит единообразно масштабированное изображение имплантируемого устройства.
На чертежах:
Фигура 1 - изображение ультразвуковой системы, смонтированной на тележке.
Фигура 2 - блок-схема некоторых из подсистем ультразвуковой системы, представленной на фигуре 1.
Фигура 3 - блок-схема 3-мерного формирования пучка в ультразвуковой системе в соответствии с настоящим изобретением.
Фигуры 4а, 4b и 5 - автоматическое выделение границ применительно к анатомической границе в ультразвуковом изображении.
Фигура 6 - 3-мерное изображение сайзера и его аннулопластического кольца с соответственно подогнанными размерами.
Фигуры 7а-7с - изображения, поясняющие манипуляцию 2-мерным изображением сайзера относительно модели анатомической структуры тела.
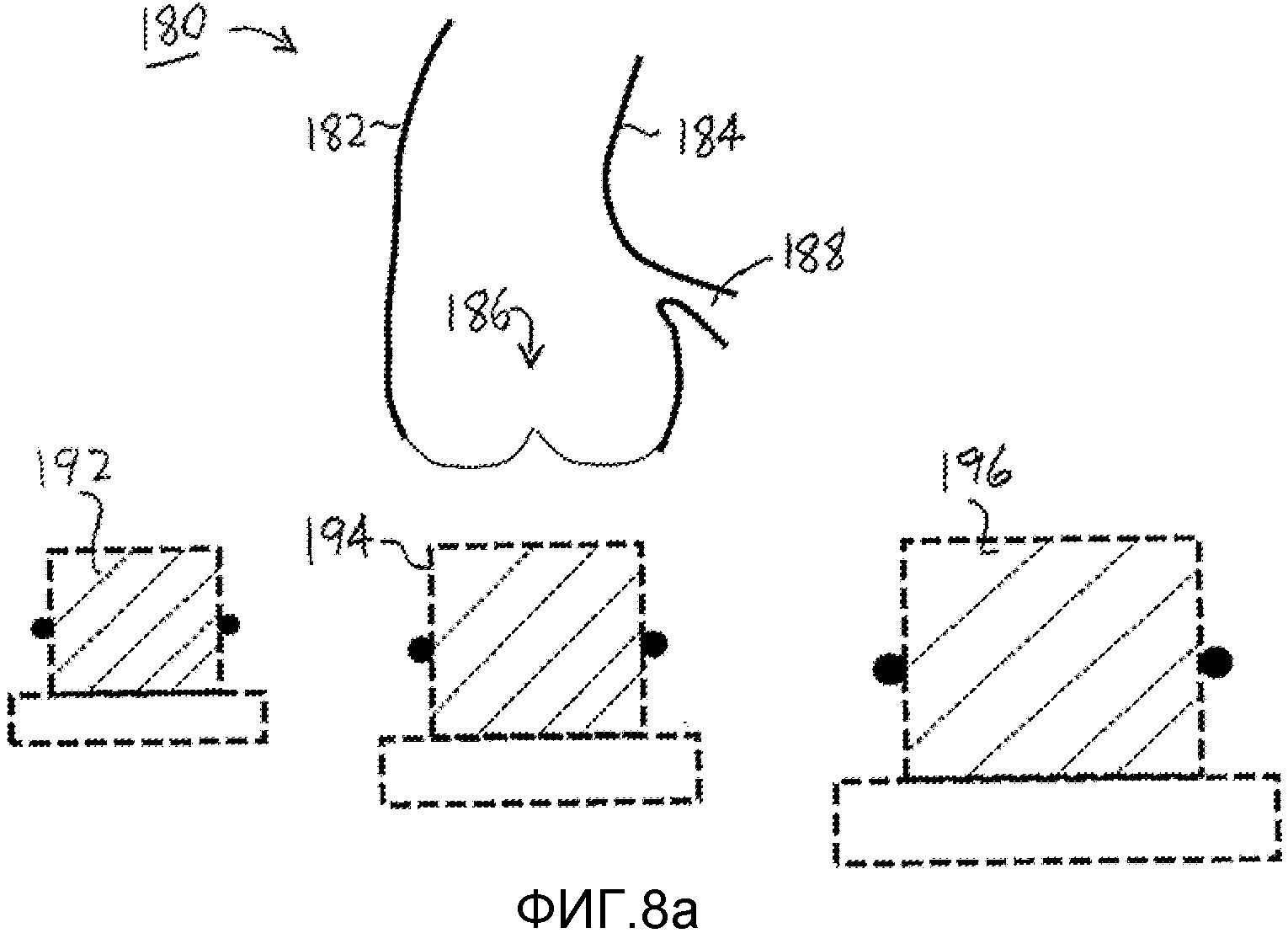
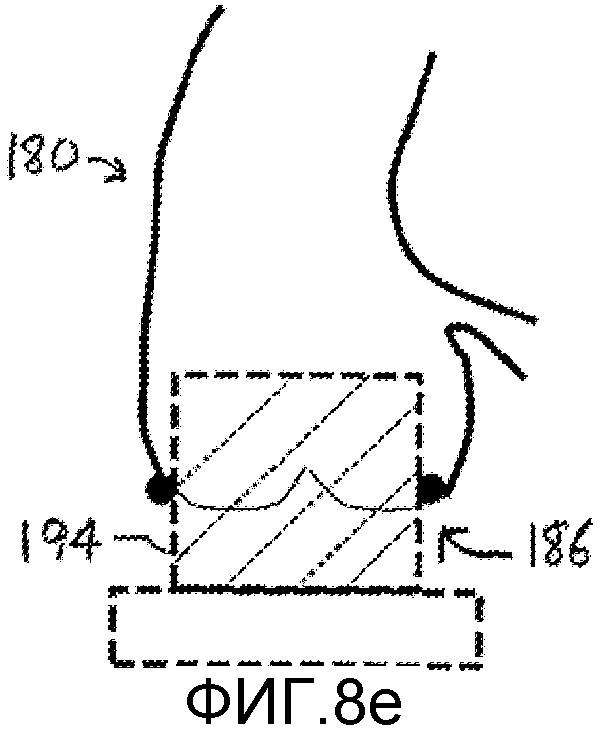
Фигуры 8а-8е - изображения, поясняющие определение размера и предоперационное планирование размещения аортального клапана для имплантации.
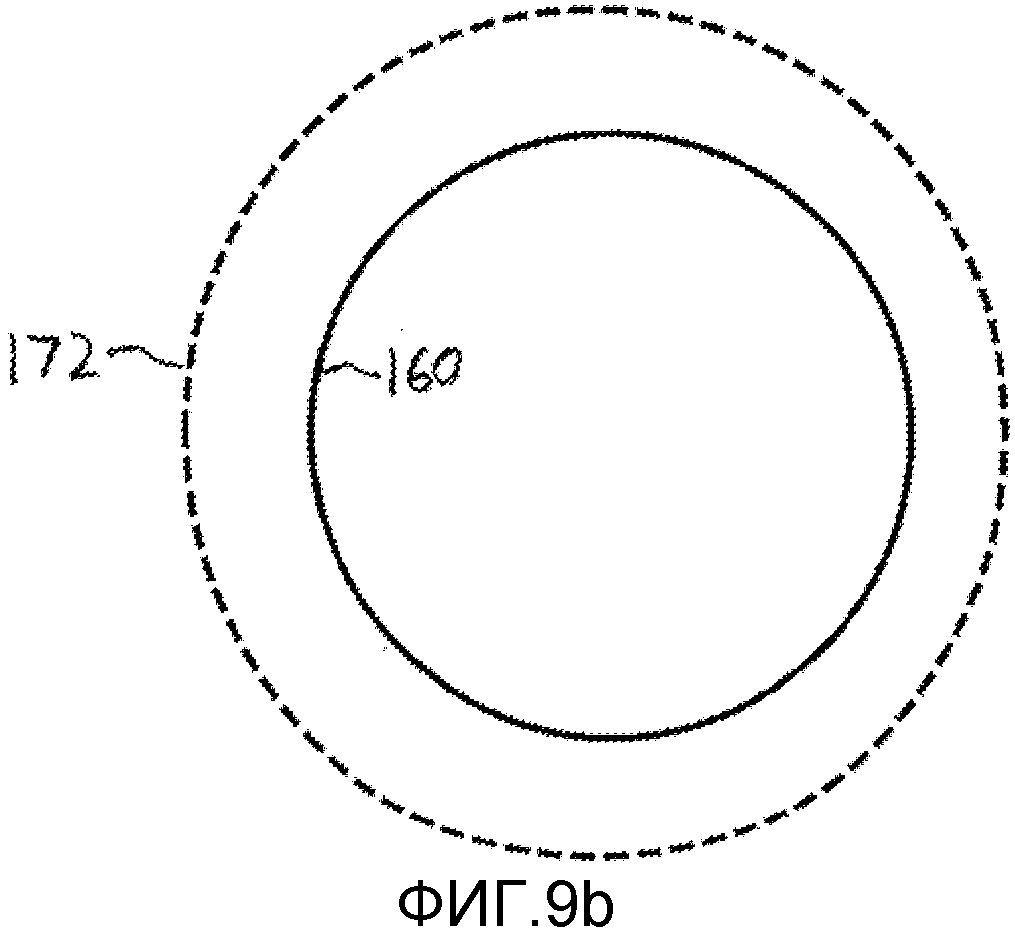
Фигуры 9a-9b - изображения, поясняющие определение размера по 2-мерному слою мультипланарной реконструкции (MPR) набора данных 3-мерного изображения.
Фигуры 10a-10c - изображения, поясняющие определение размера с помощью 3-мерного сайзера, манипулируемого с использованием 3-мерного изображения.
Фигура 11 - изображение, поясняющее использование 3-мерного ультразвукового изображения для наведения в процедуре имплантации.
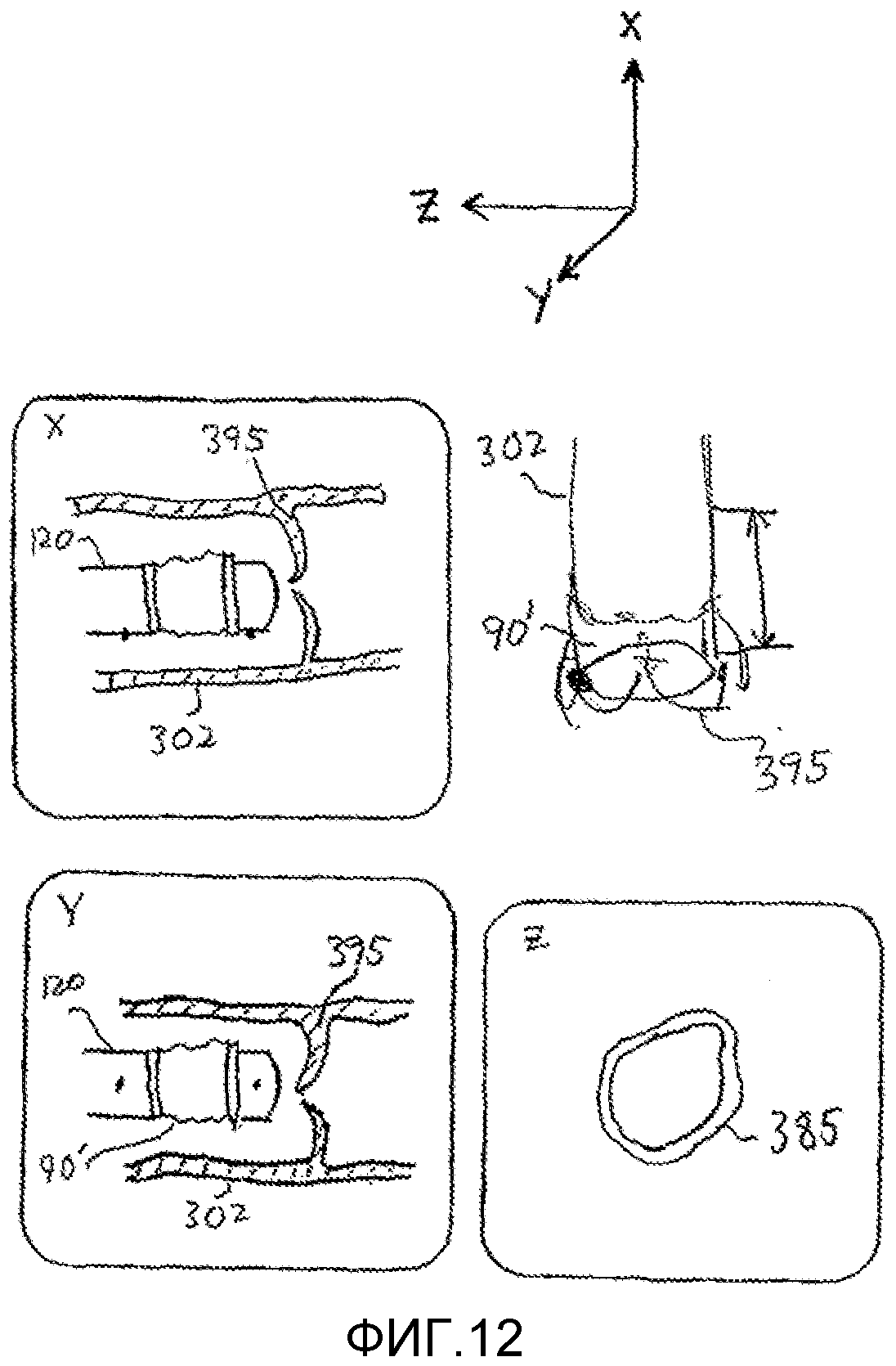
Фигура 12 - изображение, поясняющее использование 3-мерной ультразвуковой визуализации и с мультипланарной реконструкцией (MPR) для наведения в процедуре имплантации.
В первую очередь, на фигуре 1 показана ультразвуковая система, выполненная в соответствии с принципами настоящего изобретения. Ультразвуковая система содержит базовую стойку или шасси 60, вмещающую большую часть электронных схем системы. Шасси 60 собрано на колесном ходу для удобства перемещения. На шасси 60 установлен графический дисплей 62. Разные видеозонды можно вставлять в три соединителя 64 на шасси. В одном исполнении настоящего изобретения применен матричный зонд TEE (чреспищеводной эхокардиографии), который выполняет 3-мерную визуализацию с помощью двумерного решетчатого преобразователя на конце гастроскопа, располагаемого внутри пищевода или желудка. Подходящий матричный зонд TEE (чреспищеводной эхокардиографии) описан в патенте США 6572547 (Miller и др.). Шасси 60 содержит панель управления с клавиатурой и органами управления, обозначенными, в общем, позицией 66, посредством которых специалист по ультразвуковой эхографии управляет ультразвуковой системой и вводит информацию о пациенте или типе исследования, которое проводят. С задней стороны панели 66 управления находится сенсорный дисплей 68, на котором представляются программируемые функциональные клавиши для специальной функции управления. Специалист по ультразвуковой эхографии выбирает функциональную клавишу на сенсорном дисплее 18 простым прикасанием к изображению функциональной клавиши на дисплее. Внизу сенсорного дисплея находится ряд кнопок, функции которых изменяются в соответствии с обозначениями функциональных клавиш на сенсорном экране, непосредственно над каждой кнопкой.
Блок-схема основных элементов ультразвуковой системы в соответствии с настоящим изобретением представлена на фигуре 2. Ультразвуковой передатчик 10 связан, через переключатель 12 передачи/приема (T/R-переключатель), с решеткой 14 преобразователей зонда. Решетка 14 преобразователей является двумерной решеткой (матричной решеткой) преобразовательных элементов для выполнения трехмерного сканирования. Решетка 14 преобразователей посылает ультразвуковую энергию в визуализируемую объемную область и принимает отраженную ультразвуковую энергию или эхо-сигналы от различных структур и органов внутри области. Передатчик 10 содержит передающий преобразователь пучка, который управляет временным распределением задержек, согласно которому синхронизируются сигналы, подаваемые в элементы решетки преобразователей, чтобы посылать пучки с требуемым направлением поворота и фокусировкой. При соответствующей задержке импульсов, подаваемых в каждый преобразовательный элемент передатчиком 10, передатчик 10 посылает сфокусированный ультразвуковой пучок вдоль требуемой сканирующей линии в режиме передачи. Решетка 14 преобразователей связана, через переключатель 12 передачи/приема (T/R-переключатель), с ультразвуковым приемником 16. Ультразвуковая энергия, отраженная от точек в объемной области, принимается преобразовательным элементом в отличающиеся моменты времени. Преобразовательные элементы преобразуют принятую ультразвуковую энергию в принятые электрические сигналы, которые усиливаются приемником 16 и подаются в приемный преобразователь 20 пучка. Сигналы из каждого преобразовательного элемента отдельно задерживаются и, затем, суммируются преобразователем 20 пучка для обеспечения направленно сформированного сигнала, который представляет уровень отраженной ультразвуковой энергии вдоль точек на данной сканирующей линии в режиме приема. Как известно в данной области техники, задержки, вносимые в принимаемые сигналы, можно изменять во время приема ультразвуковой энергии для выполнения динамической фокусировки. Процесс повторяется для нескольких сканирующих линий, направляемых через объемную область, для обеспечения сигналов для формирования, по меньшей мере, одного изображения объемной области, как поясняется ниже. Так как решетка преобразователей является двумерной, то сканирующие линии в режиме приема можно отклонять по азимуту и углу наклона для формирования трехмерной диаграммы сканирования. Направленно сформированные сигналы могут быть подвергнуты обработке сигналов, например, фильтрации, обработке доплеровских сигналов и обработке и буферизации изображений посредством формирователя 30 изображений, который создает изображения разных сегментов объема или частичных объемов максимальной объемной области. Данные изображений выводятся из формирователя 30 изображений в систему 28 отображения, которая создает трехмерное изображение области интереса из данных изображения, для представления на графическом дисплее 62. Система отображения может также строить, по меньшей мере, одну плоскость 2-мерного изображения области по данным трехмерного изображения, в процессе, известном как мультипланарная реконструкция (MPR). Как поясняется ниже, в одном исполнении настоящего изобретения используют несколько разных 2-мерных изображений, например, три взаимно ортогональных плоскости изображения. Формирователь 30 изображений содержит скан-конвертор, который преобразует сигналы секторного сканирования из формирователя 20 пучка в обычные сигналы видеотерминала с растровой разверткой. Формирователь 30 изображений содержит также блок объемного рендеринга для создания трехмерных изображений отображаемой анатомии в объемной области. Системный контроллер 32 обеспечивает общее управление системой по данным пользовательского ввода из пользовательских органов 66 управления и данным из внутренней памяти. Системный контроллер 32 выполняет функции синхронизации во времени и управления и, обычно, содержит микропроцессор и соответствующую память. Системный контроллер реагирует на сигналы, получаемые из панели 66 управления и сенсорного дисплея 68 при ручном или речевом управлении пользователем системы.
Устройство 34 ЭКГ (электрокардиографии) содержит электроды ЭКГ, присоединяемые к пациенту. Устройство 34 ЭКГ подает сигналы ЭКГ в системный контроллер 32 для отображения во время исследования сердца. Сигналы ЭКГ могут применяться также во время некоторых исследований для синхронизации визуализации с сердечным циклом пациента.
На фигуре 3 приведена более подробная блок-схема ультразвуковой системы во время работы с матричной решеткой для 3-мерной визуализации. Элементы двумерной решетки 14 преобразователей, показанной на фигуре 1, разделены на M передающих составляющих решеток 30A, соединенных с M внутригрупповыми передающими процессорами, и N приемных составляющих решеток 30B, соединенных с N внутригрупповыми приемными процессорами. В частности, передающие составляющие решетки 311, 312, …, 31M соединены, соответственно, с внутригрупповыми передающими процессорами 381, 382, …, 38M, которые, в свою очередь, соединены с каналами 411, 412, … 41M передающего формирователя 40 пучка. Приемные составляющие решетки 421 422, …, 42N соединены, соответственно, с внутригрупповыми приемными процессорами 441, 442, …, 44N, которые, в свою очередь, соединены с каналами 481, 482, …, 48N обработки приемного формирователя 20 пучка. Каждый внутригрупповой передающий процессор 38i содержит, по меньшей мере, один генератор цифровых сигналов, который обеспечивает передаваемые сигналы, и, по меньшей мере, один формирователь напряжения усиливает передаваемые импульсы для возбуждения подсоединенных преобразовательных элементов. В альтернативном варианте, каждый внутригрупповой передающий процессор 38i содержит программируемую линию задержки, получающую сигнал из обычного передающего формирователя пучка. Например, передаваемые выходные сигналы из передатчика 10 могут подключаться к внутригрупповым передающим процессорам вместо преобразовательных элементов. Каждый внутригрупповой приемный процессор 44i может содержать суммирующую линию задержки или несколько программируемых элементов задержки, соединенных с суммирующим элементом (суммирующим соединением). Каждый внутригрупповой приемный процессор 44i задерживает сигналы отдельных преобразователей, суммирует задержанные сигналы и обеспечивает суммарный сигнал в один канал 48i приемного формирователя 20 пучка. В альтернативном варианте, один внутригрупповой приемный процессор обеспечивает суммарный сигнал в несколько каналов 48i обработки параллельного приемного формирователя пучка. Параллельный приемный формирователь пучка выполнен с возможностью синтеза нескольких пучков в режиме приема одновременно (многоканальность). Каждый внутригрупповой приемный процессор 44i может также содержать несколько суммирующих линий задержки (или групп программируемых элементов задержки, при этом, каждая группа соединена с суммирующим соединением) для получения сигналов из нескольких точек одновременно. Системный контроллер 32 содержит микропроцессор и соответствующую память и выполнен с возможностью управления работой ультразвуковой системы. Системный контроллер 32 обеспечивает команды задержки в каналы передающего формирователя пучка по шине 53, а также обеспечивает команды задержки во внутригрупповые передающие процессоры по шине 54. Данные задержек наклоняют и фокусируют формируемые пучки в режиме передачи вдоль сканирующих линий в режиме передачи, с клиновидной диаграммой направленности в режиме передачи, ромбической диаграммой направленности в режиме передачи или другими диаграммами направленностями, включая трехмерные диаграммы направленности в режиме передачи. Системный контроллер 32 обеспечивает также команды задержки в каналы формирователя пучка в режиме передачи по шине 55 и команды задержки во внутригрупповые приемные процессоры по шине 56. Применяемые относительные задержки управляют наклоном и фокусировкой синтезированных пучков в режиме приема. Каждый канал 48i приемного формирователя 20 пучка содержит усилитель с переменным коэффициентом усиления, который управляет коэффициентом усиления в зависимости от глубины принимаемого сигнала, и элемент задержки, который задерживает акустические данные для обеспечения наклона и динамической фокусировки синтезированного пучка. Суммирующий элемент 50 принимает выходные сигналы из каналов 481, 482, …, 48N формирователя пучка и суммирует выходные сигналы для обеспечения суммарного сигнала формирователя пучка в формирователь 30 изображений. Сигналы формирователя пучка представляют ультразвуковой пучок в режиме приема, синтезированный вдоль сканирующей линии в режиме приема. Формирователь 30 изображений строит изображение зондируемой области посредством множества двукратно проходящих пучков, синтезированных по секторной диаграмме направленности, ромбической диаграмме направленности или другим диаграммам направленности, включая трехмерные диаграммы направленности. Приемные и передающие формирователи пучка могут быть аналоговыми или цифровыми формирователями пучка, которые описаны, например, в патентах США №№ 4140 022 (Maslak); 5469851 (Hancock); или 5345426 (Lipschutz), которые включены в настоящее описание посредством ссылки.
Системный контроллер управляет синхронизацией по времени преобразовательных элементов посредством использования «грубых» значений задержек в каналах 41i передающего формирователя пучка и «точных» значений задержек во внутригрупповых передающих процессорах 38i. Существует несколько способов формирования передаваемых импульсов для преобразовательных элементов. Генератор импульсов в передатчике 10 может обеспечивать сигналы задержек импульсов в сдвиговый регистр, который обеспечивает несколько значений задержек в передающие составляющие решетки 30A. Передающие составляющие решетки обеспечивают импульсы высокого напряжения для возбуждения передающих преобразовательных элементов. В альтернативном варианте, генератор импульсов может обеспечивать сигналы задержек импульсов в линию задержки, соединенную с передающими составляющими решетками. Линия задержки обеспечивает значения задержек в передающие составляющие решетки, которые обеспечивают импульсы высокого напряжения для возбуждения передающих преобразовательных элементов. В других вариантах осуществления, передатчик может обеспечивать сформированные аналоговые сигналы в передающие составляющие решетки 30A. Дополнительные сведения, касающиеся передающих и приемных схем, представленных на фигуре 3, можно найти в патенте США 6126602 (Savord и др.).
На фигуре 4a показано 2-мерное ультразвуковое изображение 18 сердца. Приведенное ультразвуковое изображение показано с обращением черно-белого контраста нормального представления ультразвукового изображения для ясности пояснения. В приведенном примере, решетка 14 преобразователей находится напротив верхушки сердца в верхней части изображения. Септальная стенка 22 сердца показана продолжающейся через центр изображения. Рамка 24 обозначает местоположение, в котором митральный клапан пересекает септальную стенку сердца. Упомянутая точка пересечения 26 может быть указана вручную врачом, просматривающим изображение, как показано на фигуре 4b. На фигуре 4b, рамка 34 вычерчена для указания местоположения, в котором митральный клапан пересекает другую сторону сердца на изображении. Представленную точку пересечения можно аналогичным образом указать вручную. Существуют также автоматические и полуавтоматические методы для автоматического оконтуривания признаков сердца в ультразвуковом изображении, например, плоскости митрального клапана и эндо- и эпикардиальных границ миокарда. Автоматический метод описан, например, в патенте США 6491636 (Chenal и др.), и полуавтоматический метод описан, например, в патентной публикации США 2005/0075567 (Skyba и др.). Упомянутые методы можно использовать в системе 28 отображения в одном исполнении настоящего изобретения. На фигуре 5 представлено ультразвуковое изображение, с которым использован автоматический метод Ченэла с соавторами (Chenal и др.) для разметки границы левого желудочка и проведения линии через плоскость митрального клапана.
Однако линии, указывающей плоскость митрального клапана на двумерном изображении, или двух точек пересечения митрального клапана с его кольцом не достаточны для точной подгонки или расположения искусственного митрального клапана. Причина в том, что показана только одна плоскость через клапан. Даже двухпроекционная визуализация, когда получают две ортогональных плоскости через митральный клапан, будет указывать только четыре точки кольца митрального клапана. Кольцо митрального клапана нельзя рассматривать находящимся в одной плоскости или точно представляемым четырьмя точками, так как кольцо может быть волнообразным и изогнутым по высоте. Трехмерное ультразвуковое изображение, в котором может быть собран полный набор трехмерных данных о митральном клапане и его кольце, будет полностью и точно изображать кольцо. Таким образом, набор данных 3-мерного ультразвукового изображения можно использовать в соответствии с настоящим изобретением для создания трехмерного изображения места имплантации, графической модели, например, скелетной модели места имплантации или, по меньшей мере, одного выбранного двумерного изображения мультипланарной реконструкции (MPR), которые можно использовать для оценки подгонки протеза, например, клапана сердца, перед процедурой замены клапана.
На фигуре 6 представлено изображение сайзера 70 кольца митрального клапана. Сайзер 70 имеет ручку 72 и измерительный шаблон 74 на конце ручки. Под сайзером находится аннулопластическое кольцо митрального клапана. Шаблон 74 имеет размеры и форму, необходимые для соответствующего определения размеров и формы искусственного митрального клапана и кольца. Во время хирургической операции, хирург будет располагать множеством сайзеров 70 с разными размерами для подгонки к анатомии пациента. Посредством пробной подстановки разных сайзеров для сравнения с кольцом митрального клапана пациента, хирург может измерить правильный размер митрального клапана и кольца для замены митрального клапана пациента.
Желательной возможностью является получение упомянутой размерной информации до хирургической операции, чтобы процедуру определения размеров можно было выполнять заранее, и надлежащий митральный клапан или кольцо можно было подготовить перед хирургической операцией. В соответствии с настоящим изобретением, набор цифровых данных шаблона 74 сайзера сохраняют в файле 52 данных автоматизированного проектирования (CAD) изображения сайзера и используют для отображения виртуального сайзера, которым можно манипулировать вместе с созданным ультразвуком изображением кольца митрального клапана, чтобы определять размеры перед процедурой. Сайзеры, обычно, изготавливают с использованием процедуры автоматизированного проектирования (CAD), которая создает набор цифровых данных размера и формы шаблона сайзера. Обычно, цифровые данные будут задавать двух- или трехмерное изображение сайзера, которое можно использовать для отображения виртуального сайзера. Упомянутым изображением шаблона сайзера в файле CAD манипулируют относительно созданного ультразвуком изображения анатомии пациента. Последнее может быть реальным ультразвуковым изображением или моделью, созданной по данным ультразвукового изображения и/или данным размеченных границ, например, скелетной моделью, описанной в патенте США 6106466 (Sheehan et al.). На фигуре 7а изображен шаблон 74′ виртуального сайзера митрального клапана, созданный из данных CAD сайзера митрального клапана, которые были перенесены в ультразвуковую систему и сохранены в файле 52 данных изображения сайзера. Виртуальный сайзер окружен скелетной моделью кольца митрального клапана. Скелетная модель создана по набору 3-мерных данных сердца, которое содержало митральный клапан, и, затем, кольцо митрального клапана оконтурено посредством выделения границ, как пояснялось выше. Затем, врач манипулирует органом пользовательского управления на панели управления системы, например, трекболом и джойстиком, для перемещения виртуального сайзера 74′ до совмещения с моделью 80 кольца митрального клапана. Однако прежде, чем упомянутая операция выполняется, два изображения следует преобразовать, при необходимости, в единый масштаб. Как показано на фигуре 5, ультразвуковые изображения обычным образом оконтурены с сантиметровым шагом, как показано с использованием сантиметровой шкалы с правой стороны от изображения сердца. Следовательно, один из наборов данных (данные сайзера или данные изображения) можно привести к масштабу другого изображения таким образом, что как один сантиметр кольца митрального клапана, так и один сантиметр виртуального сайзера изображаются в едином масштабе. В исполнении, представленном на фигуре 2, приведение к упомянутому единому масштабу выполняется блоком 51 масштабирования сайзера, который, с учетом масштаба ультразвукового изображения из формирователя 30 изображений и данных изображения сайзера, соответственно изменяет масштаб изображения сайзера. После этого, когда масштабы выверены упомянутым образом, врач может точно оценить подгонку виртуального сайзера и кольца. Если конкретный сайзер имеет неправильный размер, как показано на фигуре 7a, где виртуальный сайзер слишком мал, врач может использовать данные CAD и изображение из файла 52 для виртуального сайзера следующего размера и оценить подгонку более крупного сайзера. В альтернативном варианте, набор данных исходного сайзера можно изменить в масштабе до набора данных виртуального сайзера отличающегося размера. Разные виртуальные сайзеры используют до тех пор, пока врач не найдет такой, который подходит к размеру кольца митрального клапана, то есть, врач определяет надлежащий митральный клапан и кольцо, подлежащие использованию для хирургической операции.
В соответствии с дополнительным аспектом настоящего изобретения, ультразвуковая система указывает не совмещение по размеру и форме. На фигуре 7b, виртуальный сайзер 74' слишком мал, из-за чего остается пространство 82 между виртуальным сайзером 74' и кольцом 80 митрального клапана. Система 28 отображения ультразвуковой системы выделяет данное пространство 82 посредством его заполнения отличающимся, например, желтым, цветом. При отображении, пиксели внутри скелетной модели 80, которые не служат для отображения виртуального сайзера 74', заполняются цветом. Когда виртуальный сайзер полностью заполнит кольцо, между виртуальным сайзером 74' и кольцом 80 не появится никаких желтых пикселей.
Аналогично, если виртуальный сайзер 74' слишком велик, то он будет налагаться на кольцо 80, как показано в позиции 84 на фигуре 7c. Упомянутая зона наложения, в которой пиксели двух объектов стремятся занять одни и те же пиксели на дисплейном экране, выделяется красным. Таким образом, красный цвет сообщает врачу, что между анатомией и виртуальным сайзером существует взаимное наложение, и следует применить виртуальный сайзер меньшего размера или другой формы. Одновременно, если требуется, пространства 82 между виртуальным сайзером 74' и кольцом 80 могут быть заполнены другим (например, желтым) цветом. Когда на дисплее изображения не заметно никаких цветов, то обеспечена точная подгонка.
В нижней части ультразвукового изображения на фигуре 5 представлена кривая ЭКГ, формируемая устройством 34 ЭКГ и показываемая вместе с изображением. Треугольный значок с продолжающейся вверх вершиной указывает фазу сердечного цикла, в которой получено ультразвуковое изображение, представленное на фигуре 5. Поскольку сердце постоянно сокращается и, следовательно, постоянно изменяет свою форму и, в некоторой степени, размеры, врач может использовать информацию ЭКГ для получения ультразвукового изображения в фазе сердечного цикла, которая наиболее подходит для определения размера имплантата.
На фигурах 8a-8e поясняется процесс определения размера. На фигуре 8a показано (2-мерное) изображение 180 сечения аорты на дисплее ультразвукового изображения. Представленное изображение показывает стенки 182 и 184 сосуда с противоположных сторон аорты, коронарную артерию 188 и аортальный клапан 186. В данной процедуре, аортальный клапан требуется заменить имплантированным клапаном. Под аортой и аортальным клапаном, на экране дисплея показаны три соответственно масштабированных виртуальных сайзера для аортального клапана, сайзер 192 небольшого размера, средний сайзер 194 и крупный сайзер 196 для замены клапанов с тремя разными размерами.
На фигуре 8b, врач щелкнул мышью на виртуальном сайзере 192 небольшого размера и переместил его в аорту 180 к местоположению аортального клапана 186, который планируется заменить. Как видно на дисплее, клапан данного размера слишком мал и не обеспечит удовлетворительную замену аортального клапана 186.
На фигуре 8c показана попытка поместить другой виртуальный сайзер 198 в аорте 180 и аортальном клапане 186 на экране дисплея. Как можно видеть, данный виртуальный сайзер имеет нужный диаметр для подгонки к кольцу аортального клапана 186. Однако данный конкретный клапан для замены имеет слишком большую длину, поскольку видно, что он закупоривает коронарную артерию 188.
На фигуре 8d показано, как врач манипулирует виртуальным сайзером 194 среднего размера для перемещения к аорте 180 и аортальному клапану 186 на экране дисплея. На фигуре 8e изображен экран дисплея после того, как врач переместил виртуальный сайзер 194 в требуемое место в аорте и клапане. Как можно видеть, сайзер точно входит в кольцо клапана и не блокирует коронарную артерию. Представленное определение размеров указывает, что, для данной процедуры замены клапана следует использовать сменный клапан, соответствующий виртуальному сайзеру 194, и выполняется на предварительной стадии планирования, до хирургического вмешательства.
Когда для получения ультразвуковых изображений применяют матрично-решеточный зонд, можно получить набор трехмерных данных объема, который содержит операционное поле. В таком случае можно формировать планарные слои изображения по любой плоскости объема методом мультипланарной (MPR) реконструкции изображений. Таким образом можно выбирать 2-мерное изображение анатомии, с которой следует соединять имплантируемое устройство. Если анатомия является не планарной и волнообразной, то можно составить и совместно отобразить несколько пространственно последовательных слоев мультипланарной реконструкции (MPR) в виде изображения толстого слоя, как поясняется в международной публикации патентной заявки WO 2008/126015 (Thiele et al.). Одно подобное изображение MPR или реконструированная анатомическая модель 160 представлено(а) на фигурах 9a и 9b. На фигуре 9a виртуальный сайзер 170 подогнан к анатомии на изображении MPR или модели 160 и, как показано, подходит надлежащим образом. На фигуре 9b показано, что другой виртуальный сайзер 172 является слишком большим для анатомического отверстия 160.
На фигурах 7a-7c показано определение размера, выполняемое с 2-мерными изображениями, однако, данное определение можно также выполнять в трех измерениях, что часто предпочтительнее. На фигурах 10a-10c поясняется применение трехмерных изображений для определения размеров. На фигуре 10a представлен дисплей, на котором масштабированное 3-мерное графическое изображение виртуального сайзера 190, которое, в данном примере, является графическим представлением самого имплантируемого устройства, приближается к аналогично масштабированному 3-мерному изображению или модели аорты 180' и аортальному клапану 186. На фигуре 10b показан результат после того, как врач выполнил манипуляцию виртуальным сайзером 190 для сдвига в местоположение его размещения в аортальном клапане. Для полной оценки подгонки виртуального сайзера в сосуде, врачом настраивается коэффициент непрозрачности сосуда и/или виртуального сайзера. В примере на фигуре 10b, врач, например, настроил коэффициент непрозрачности сосуда таким образом, чтобы сосуд был частично прозрачным, и подгонку виртуального сайзера 190 внутри сосуда 180' можно было оценить без затруднений. Сосуд 180' с виртуальным сайзером 190 внутри можно наклонять и поворачивать посредством манипулирования динамическим параллаксом обоих, чтобы врач мог наблюдать вставленный сайзер/устройство с разных ракурсов. Врач может изменять относительную прозрачность сосуда и виртуального сайзера/устройства, пока врач не проверит тщательно подгонку устройства в сосуде и не убедится, что устройство данного размера подходит для данного пациента.
На дисплее, приведенном на фигуре 10c, показано совмещение трехмерного ультразвукового изображения кровеносного сосуда 92 с единообразно масштабированным изображением стента или баллонного устройства 90 в качестве виртуального сайзера. При наличии 3-мерного изображения как анатомии, так и имплантируемого устройства, врач может манипулировать изображением устройства и пробовать устройства разных размеров и форм, пока не устанавливается подгонка устройства к анатомии. Врач может проверить подгонку посредством поворота или вращения изображения анатомии и устройства, чтобы просмотреть подгонку со всех сторон и под всеми углами. Описанную процедуру можно аналогичным образом поддерживать посредством окрашивания пространств и областей наложения выделяющимися оттенками или цветами.
Следует понимать, что многие анатомические области в теле имеют динамические характеристики, которые требуется учитывать, как в случае сердца. Кольцо митрального клапана не статично, а перемещается и изменяет форму, когда сердце сокращается. При ультразвуковой визуализации в реальном времени, последовательность изображений можно останавливать в конкретных фазах сердца для оценки подгонки сайзера или устройства в сердце в упомянутые конкретные моменты времени сердечного цикла. Врач может пожелать убедиться, например, удовлетворительно ли работает конкретное ангиопластическое кольцо как в конце диастолы, так и в пике систолы. Полученную методом CAD модель имплантируемого устройства можно совмещать с изображениями или моделями сердца в упомянутые конкретные фазы сердца, чтобы дать врачу возможность убедиться, что выбранное устройство удовлетворительно работает во время полного сердечного цикла. Изображение виртуального сайзера можно также деформировать или изгибать, чтобы лучше оценивать подгонку имплантируемого устройства к не планарному анатомическому месту имплантации.
В ультразвуковой системе можно установить библиотеку файлов, полученных методом CAD изображений разных устройств, чтобы пользователь мог выбрать файл для использования в ходе данной процедуры. В альтернативном варианте, файлы полученных методом CAD изображений устройств, подлежащих использованию в ходе настоящей процедуры, можно загружать, приводить к масштабу ультразвукового изображения (или наоборот) и использовать для определения надлежащей подгонки устройства до хирургического вмешательства.
На фигуре 11 показано применение 3-мерной ультразвуковой визуализации для наведения в процедуре реальной имплантации. В ходе данной процедуры, матричный TEE (чреспищеводный эхокардиографический) зонд 150, описанный в патенте Миллера с соавторами (Miller et al.), введен в пищевод 380 пациента, как показано стрелками 152. Как показывают стрелки, TEE (чреспищеводный эхокардиографический) зонд можно вводить в пищевод, отводить обратно после использования и поворачивать для надлежащего наблюдения во время нахождения в пищеводе. Из пищевода или желудка, матричная решетка 14 преобразователей может наблюдать сердце, объемная область которого, наблюдаемая зондом, указана стрелкой V. В одном варианте данной процедуры катетер 120 с имплантируемым устройством 90' на данном катетере вводят через разрез в брюшном отделе и через миокард в верхушке 320 сердца. В данном примере имплантируемое устройство 90' является искусственным аортальным клапаном, и, поэтому, катетер 120 проводят через камеры сердца в путь оттока и аорту 302. После того, как катетер прошел через аортальный клапан 395, и протез 90' совмещен с клапаном 395, протез 90' развертывают, закрепляют в заданном месте, и катетер 120 отводят.
Теоретически, было бы желательно четко наблюдать все упомянутые действия в 3-мерном ультразвуковом изображении. Однако катетер 120 и устройство 90', обычно, являются мощными рассеивателями ультразвука, и их местоположение на изображении, обычно, окружено сильными местными помехами, так что часто невозможно четко различить их точное положение на ультразвуковом изображении. В соответствии с дополнительным аспектом настоящего изобретения, упомянутое затруднение можно преодолеть с помощью хирургической навигационной системы, например, системы, описанной в патенте США 6785571 (Glossop). В патенте Глоссопа (Glossop) предлагается формирователь поля, который создает комплексное электромагнитное поле сквозь тело пациента. Небольшие датчики, например, магнитно-чувствительные катушки, формируют сигналы, которые реагируют на изменения положения и ориентации датчиков в комплексном поле. Упомянутая реакция позволяет отслеживать ориентацию и положение в поле внутри пациента. В другом исполнении, отслеживание может выполняться ультразвуковыми датчиками, как описано в патенте США 5158088 (Nelson et al.). В примере на фигуре 11, датчик 50 расположен на TEE (чреспищеводном эхокардиографическом) зонде для отслеживания его положения, и датчики 130 расположены на катетере 120 перед устройством 90' и позади. Данное расположение позволяет вводить данные местоположения катетера из датчиков в ультразвуковое изображение. Местоположение аортального клапана 395 можно находить на изображении перед введением катетера 120 и отмечать на изображении. Катетер 120 вводят в аорту до тех пор, пока датчики 130 не оказываются с каждой стороны от данной отметки. После этого, устройство 90' можно развернуть, где требуется, даже если артефакты создают местные помехи на ультразвуковом изображении и загораживают место имплантации.
На фигуре 11 показана также процедура, выполняемая внутрисердечным эхокардиографическим (ICE) катетером 140, который наблюдает место имплантации из другого кровеносного сосуда. Как в случае с матричным TEE (чреспищеводным эхокардиографическим) зондом, внутрисердечный эхокардиографический (ICE) катетер 140 содержит датчик 130 для сопоставления координат катетера 120 с имплантатом и устройство 90' в поле 3-мерного изображения внутрисердечного эхокардиографического (ICE) катетера.
На фигуре 12 показано, в верхнем правом квадранте чертежа, 3-мерное ультразвуковое изображение аорты 302 и аортального клапана 395. Данное изображение может быть анатомическим ультразвуковым изображением или моделью анатомии, например, скелетной моделью. При выборе точки в данном 3-мерном ультразвуковом изображении, можно создать изображения в трех плоскостях, которые ортогонально пересекают точку, методом мультипланарной реконструкции (MPR), как показано на фигурах 9-14 патента Миллера с соавторами (Miller et al.). В приведенном примере, точка пересечения расположена в аортальном клапане 395, и три плоскости мультипланарной реконструкции (MPR) находятся в плоскостях X, Y и Z, показанных над 3-мерным изображением. Таким образом, три ортогональных плоскости будут показывать три вида катетера 120 и устройства 90', когда они приближаются к операционному полю. В данном случае, виды в плоскостях X и Y отражают ортогональные сечения аорты 302 и аортального клапана 395 по мере того, как катетер 120 приближается к клапану. Плоскость Z в данном примере проходит через кольцо 385 аортального клапана и будет показывать катетер, когда он проходит через клапан. В предпочтительном варианте, описанное наведение выполняется с реальными 3-мерными ультразвуковыми анатомическими изображениями. Однако, если проблема местных помех является слишком серьезной, то 3-мерное изображение 302 можно строить как модель аорты и аортального клапана перед введением катетера. Затем датчики наведения (показанные в виде небольших точек в данных изображениях) будут отслеживать положение катетера 120 по мере того, как он приближается к аортальному клапану 395, и пиктограмма или другое представление катетера (например, модель, полученная по 3-мерным данным CAD устройства) может перемещаться к клапану в модели 302 по мере того, как приближается катетер 120, с наведением по информации отслеживания из позиционно-чувствительных датчиков.
На фигуре 10c показано другое полезное применение трехмерной ультразвуковой визуализации при наведении имплантируемого устройства, при котором исследуются положение и ориентация устройства 90 перед его развертыванием. Некоторые имплантаты, например, клапаны и стенты, нуждаются в высокоточной ориентации в надлежащем положении перед развертыванием, так как их положение невозможно отрегулировать после развертывания. Например, устройство не может быть искривленным или наклоненным в кровеносном сосуде; устройство должно равномерно совмещаться с просветом сосуда перед развертыванием. На фигуре 10c показано устройство 90, которое искривлено и наклонено в сосуде 92. Данное несовмещение можно наблюдать со всех сторон и под всеми углами в 3-мерном ультразвуковом изображении, при поддержке регулировкой относительной прозрачности изображения 92 сосуда и устройства, и совмещение исправляют перед развертыванием устройства 90. При необходимости, процесс совмещения может поддерживаться позиционно-чувствительными датчиками 130 на устройстве, как пояснялось выше. В предпочтительном варианте, ультразвуковое изображение является динамическим 3-мерным изображением, но, если проблема местных помех слишком серьезна, то, до введения устройства, можно получать или создавать статическое изображение или анатомическую модель, и, затем, можно выполнять наводку совмещения посредством определения датчиками положения и ориентации устройства относительно анатомии или модели, как предложено в патенте Глоссопа (Glossop).
Реферат
Изобретение относится к медицинским ультразвуковым диагностическим системам, а именно к ультразвуковым системам для размещения медицинских устройств с наведением по трехмерным изображениям. Ультразвуковая система для планирования хирургической операции с имплантируемым устройством содержит источник масштабируемых анатомических ультразвуковых изображений места в теле, в котором следует расположить имплантируемое устройство, источник масштабируемого изображения сайзера, формирующего виртуальный сайзер, который указывает размер имплантируемого устройства, блок масштабирования, выполненный с возможностью поддержки отображения анатомического ультразвукового изображения и виртуального сайзера в едином масштабе, дисплей и орган пользовательского управления, выполненный с возможностью применения пользователем для манипулирования позиционированием виртуального сайзера на дисплее относительно анатомической структуры в единообразно масштабированном анатомическом ультразвуковом изображении. Причем орган пользовательского управления выполнен с возможностью проверки подгонки виртуального сайзера к анатомической структуре, согласно выделениям, показывающим области наложения между виртуальным сайзером и анатомической структурой. При работе ультразвуковой системы осуществляется способ установления размеров имплантируемого устройства, которое подходит к анатомической структуре тела. Использование изобретения позволяет определить размеры имплантируемого устройства без физического доступа к месту имплантации. 2 н. и 12 з.п. ф-лы, 12 ил.
Формула
источник масштабируемых анатомических ультразвуковых изображений места в теле, в котором следует расположить имплантируемое устройство;
источник, по меньшей мере, одного масштабируемого изображения сайзера, формирующего виртуальный сайзер, который указывает размер имплантируемого устройства;
блок масштабирования, выполненный с возможностью поддержки отображения анатомического ультразвукового изображения и виртуального сайзера в едином масштабе;
дисплей, выполненный с возможностью отображения единообразно масштабированных анатомического ультразвукового изображения и виртуального сайзера; и
орган пользовательского управления, выполненный с возможностью применения пользователем для манипулирования позиционированием виртуального сайзера на дисплее относительно анатомической структуры в единообразно масштабированном анатомическом ультразвуковом изображении, причем орган пользовательского управления выполнен с возможностью проверки подгонки виртуального сайзера к анатомической структуре, согласно выделениям, показывающим области наложения между виртуальным сайзером и анатомической структурой.
при этом единообразно масштабированное анатомическое ультразвуковое изображение дополнительно содержит масштабированную графическую модель анатомической структуры.
отображают масштабированное ультразвуковое изображение анатомической структуры тела, в которой следует разместить имплантируемое устройство;
отображают единообразно масштабированное изображение виртуального сайзера, который показывает размер имплантируемого устройства с масштабированным ультразвуковым изображением анатомической структуры; и
манипулируют виртуальным сайзером относительно анатомической структуры в ультразвуковом изображении, чтобы установить, подогнан ли виртуальный сайзер надлежащим образом к анатомической структуре в ультразвуковом изображении, используя выделения, которые показывают области наложения между виртуальным сайзером и анатомической структурой.
при этом этап манипуляции дополнительно содержит манипуляцию множеством виртуальных сайзеров относительно анатомической структуры ультразвукового изображения.

Комментарии