Количественная оценка и отображение утолщения стенки камеры сердца - RU2448649C2
Код документа: RU2448649C2
Чертежи


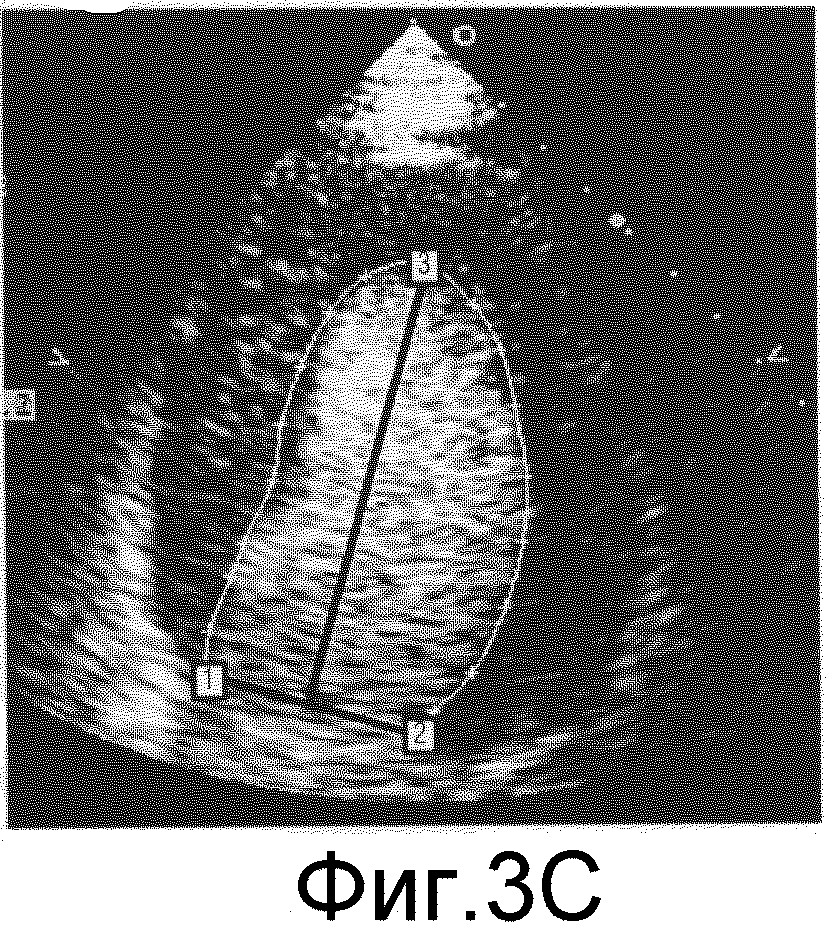

Описание
По данной заявке испрашивается приоритет предварительных заявок на патент США № 60/803148 и 60/823114, поданных 25 мая 2006 г. и 22 августа 2006 г., соответственно.
Изобретение относится к медицинским ультразвуковым диагностическим системам, в частности к ультразвуковым системам, которые выполняют количественные измерения эхокардиографических изображений.
Существует множество ультразвуковых методов для количественной оценки функции камеры сердца. Основными диагностическими средствами для эхокардиографистов являются движение стенки желудочка, свидетельствующее об инфаркте миокарда, и фракция выброса. Эти диагностические средства требуют обозначения границ и отслеживания камеры сердца на ряде изображений на протяжении сердечного цикла, чтобы можно было выполнить измерения оконтуренных миокарда и камеры сердца. Методы обвода контуров стенки сердца на ультразвуковом изображении включают в себя, например, автоматическое отслеживание контуров границ раздела кровь-ткань и тканевую доплеровскую визуализацию движения сердечной стенки, позволяющую, помимо прочего, количественно оценить скорость сокращения. Возможность оконтуривания и отслеживания движения миокарда также важна для диагностики синхронии электрической стимуляции сердца или так называемой электромеханической трансдукции. Сердце получает команду на сокращение от электрохимических сигналов, передаваемых по натриевым и калиевым каналам в мышечные клетки миокарда. Эти сигналы, распространенные по всей сердечной мышце, должны дать команду мышечным клеткам сердца сократиться в один и тот же момент времени. Когда это происходит, сердце сокращается, переходя из состояния расслабленного полного объема в состояние сокращенного минимального объема, при этом с каждым биением сердца прокачивается максимальный объем крови. Это характерно для здорового сердца. Однако если сигналы, стимулирующие это сокращение, вызывают сокращение различных областей сердца в разное время, такое беспорядочное сокращение будет прокачивать объем крови меньше максимального, что снижает эффективность и изнашивает сердце со временем. Желательно иметь возможность диагностировать такое состояние, чтобы можно было при необходимости осуществить необходимый курс лечения, обычно имплантацию водителя ритма с проводниками, обеспечивающего вынужденные синхронные сокращения. Эти диагностика и курс лечения известны как кардиоресинхронизационная терапия или КРТ.
На электромеханическую трансдукцию сердца может влиять такая патология, как блокада левой ветви пучка. Блокада левой ветви пучка возникает, когда передача сердечного электрического импульса по быстро проводящим волокнам главной ветви левого пучка или в обоих пучках (левом переднем и заднем) задерживается или не происходит совсем. Это может приводить к медленной деполяризации левого желудочка через межклеточное распространение передачи от правого желудочка к левому желудочку. Такое состояние приводит к потере синхронии сокращения камеры и последующему неэффективному выбросу объема крови из камеры. Поэтому желательно иметь возможность эффективно и точно идентифицировать и количественно оценить показатели и эффекты такого состояния, как утолщение сердечной стенки. До настоящего времени утолщения стенки оцениваются специалистами посредством субъективных измерений.
Идентификация утолщения требует обвода контуров эндокарда и эпикарда. В настоящее время не существует надежных методов выделения эпикардиальных контуров посредством обычного выделения градиентов изображения. Кроме того, хотя утолщение стенки теоретически можно оценить тканевыми доплеровскими методами, доплеровский эффект имеет ограничения по ориентации акустического луча, при этом определенные скорости изменяются пропорционально отношению между направлением движения и направлением ультразвуковых лучей. Например, если миокард движется под прямыми углами к акустической линии (направлению луча), то движение не будет детектироваться. Доплеровские методы также позволяют измерять утолщение только косвенным путем. Они измеряют скорости, которые затем необходимо интегрировать, ввести шум и потенциальную погрешность, чтобы определить смещения, а значит и утолщение. Следовательно, существует потребность в прямой идентификации и количественной оценке утолщения стенки миокарда.
В соответствии с принципами настоящего изобретения зона интереса (ЗИ) на ультразвуковом изображении сердца обозначается точками на эндокарде и эпикарде для кадра в какой-то точке сердечного цикла. Затем эти точки прослеживаются по спекл-структурам/текстуре в течение сердечного цикла. Расстояние между соответствующими отслеживаемыми эндо- и эпикардиальными точками вычисляется для каждого кадра, что дает прямые показатели длины и деформации Лагранжа или других относительных изменений длины по сравнению с исходным значением. Оба показателя являются прямыми измерениями утолщения стенки и отображаются на графиках как функция времени. Предложенный способ не ограничен методами определения градиента (на границе раздела кровь-ткань), не подвержен угловым отклонениям движения ткани относительно характеристики ультразвукового луча доплеровских измерений и обеспечивает прямую оценку смещений, а значит и утолщения.
На чертежах:
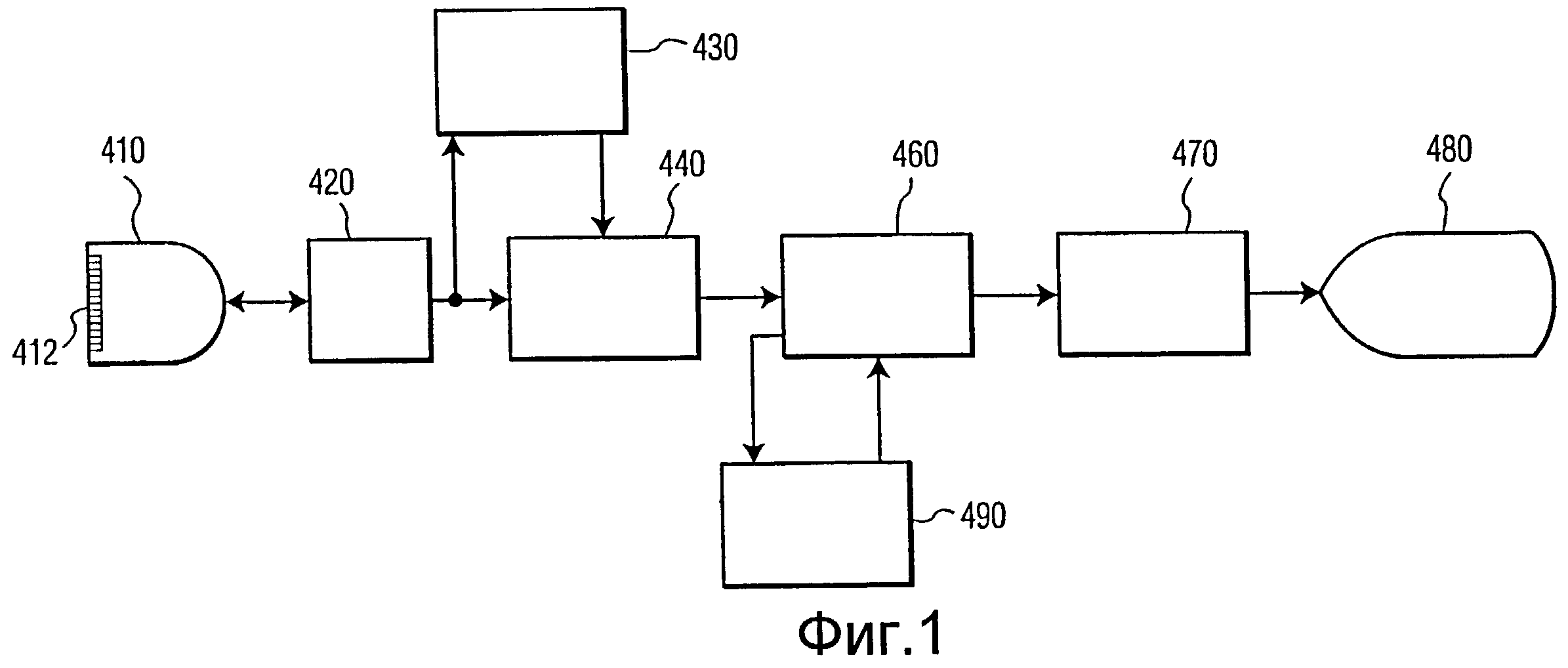
фиг.1 иллюстрирует в виде блок-схемы ультразвуковую систему с процессором для автоматического определения контуров в соответствии с настоящим изобретением;
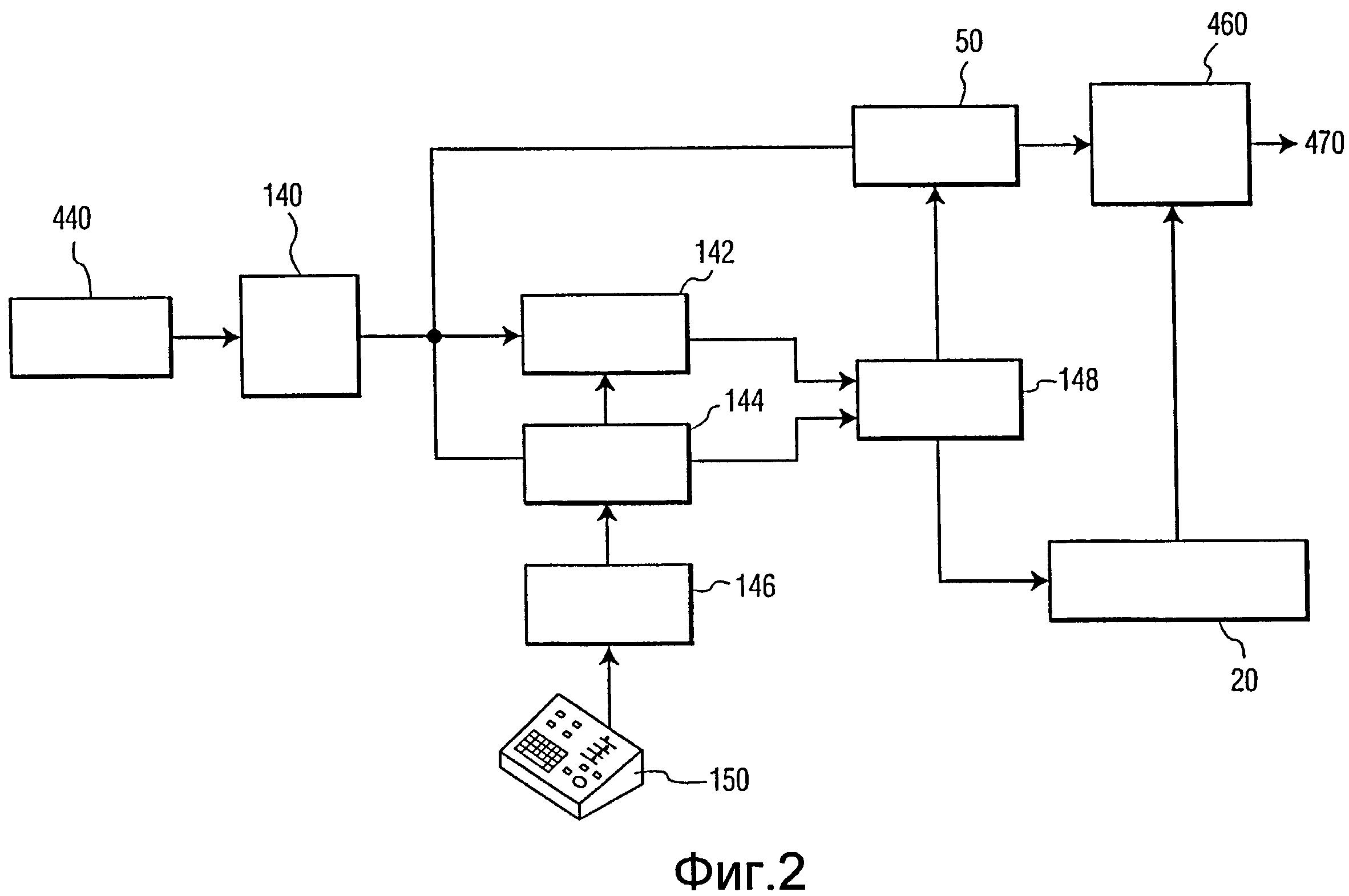
фиг.2 иллюстрирует более детально часть ультразвуковой системы по фиг.1;
фиг.3а-3с иллюстрируют метод обнаружения эндокардиального контура левого желудочка на ультразвуковом изображении;
фиг.4 иллюстрирует расширение способа по фиг.3а-3с для обнаружения эпикардиального контура левого желудочка на ультразвуковом изображении;
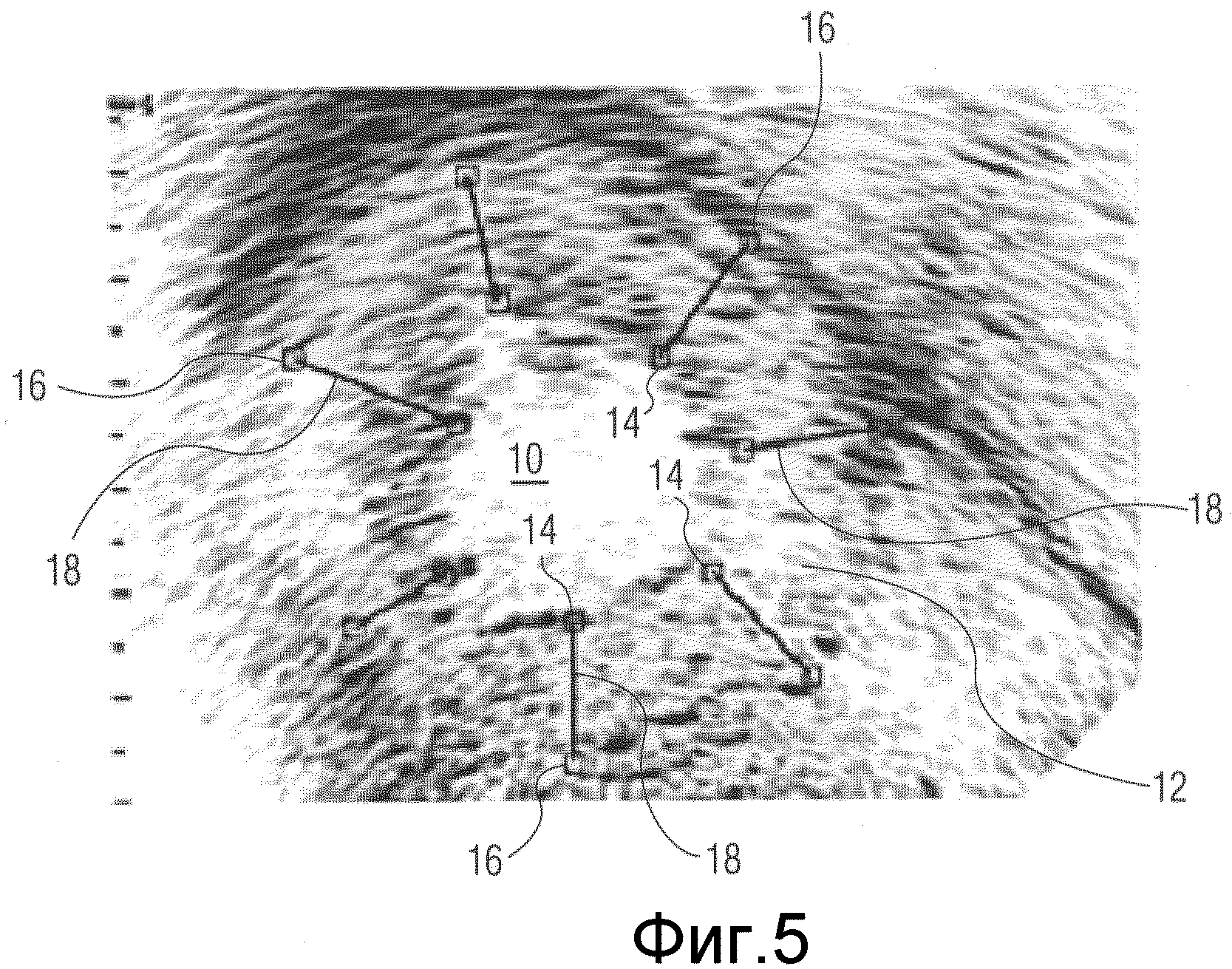
фиг.5 иллюстрирует ультразвуковое изображение с графикой, используемой для измерения утолщения стенки в соответствии с принципами настоящего изобретения;
фиг.6 иллюстрирует график измерений утолщения стенки в течение сердечного цикла в соответствии с другим вариантом настоящего изобретения.
Сначала обратимся к фиг.1, на которой в виде блок-схемы изображена диагностическая ультразвуковая система формирования изображения, выполненная в соответствии с принципами настоящего изобретения. Зонд или сканирующая головка 410, которая содержит одномерную (1Д) или двухмерную (2Д) матрицу 412 датчиков, передает ультразвуковые волны и принимает ультразвуковые эхо-сигналы. Эти передача и прием выполняются под управлением формирователя луча 420, который обрабатывает принятые эхо-сигналы, формируя когерентные лучи эхо-сигналов от сканируемой анатомии. Эта эхо-информация подвергается доплеровской обработке доплеровским процессором 430, если требуется представить доплеровскую информацию, и обработанная доплеровская информация передается в процессор 440 изображений, который формирует двухмерные или трехмерные доплеровские изображения. Для получения двухмерных изображений структуры ткани эхо-сигналы подвергаются обработке с формированием изображения посредством определения амплитуды и преобразования скана в изображение требуемого для отображения формата. Эти изображения проходят через кинопамять (Cineloop®) 460, из которой они могут передаваться прямо в видеопроцессор 470 для отображения на устройстве 480 отображения. Кинопамять может также записывать последовательность последних полученных в реальном времени изображений для их сохранения и последующего просмотра и диагностики. Последовательность записанных изображений, именуемая "кинопетлей" изображения, может охватывать один или несколько сердечных циклов. Эти изображения можно также передать в процессор 490 автоматического определения контуров (АОК), который оперирует двух- или трехмерными изображениями для обозначения анатомических контуров и границ на изображениях, как будет описано ниже. Обозначенные контуры графически накладываются на изображения, которые передаются в видеопроцессор 470 для отображения. Система может обозначать и отображать контуры на кинопетлях изображений, сохраненных в кинопамяти 460, или отображать контуры, очерченные на изображениях, получаемых в реальном времени по время сканирования пациента.
На фиг.2 представлена подробная блок-схема части ультразвуковой системы между процессором 440 изображений и видеопроцессором 470 на фиг.1. Процессор 440 изображений формирует данные полос сканирования изображения, которое хранится в памяти 140 данных изображения. Первое изображение со стартовой точкой из последовательности изображений сердца анализируется устройством 144 для оконтуривания толщины стенки миокарда или процессором АОК 144 для определения контура камеры сердца, как будет описано более подробно ниже. После обозначения этого контура на первом изображении его положение отслеживается на последующих изображениях устройством 142 отслеживания спеклов. Первоначально обозначенный контур и контур на последующих изображениях вычерчиваются графическим процессором 148. Ультразвуковые изображения этой последовательности преобразуются в требуемый формат отображения (например, секторальный, линейный, трехмерный и т.д.) с помощью сканирующего преобразователя 50, который отображает графически построенные контуры в определенных положениях контуров на ультразвуковых изображениях. Изображения с наложенными графическими контурами сохраняются в кинопамяти 460. Затем эти изображения передаются в видеопроцессор 470 для отображения.
Конкретные точки на идентифицированных контурах последовательных изображений отслеживаются устройством 142 отслеживания спеклов, которое отслеживает стартовые анатомические положения точек по спекл-паттерну, образованному локальной тканью в положениях точек на изображении. Устройство 142 отслеживания спеклов идентифицирует области пикселей вокруг опорных точек в соседнем миокарде. Спекл-паттерны этих пикселей сохраняются и сравниваются со спекл-паттернами в тех же самых областях последовательных изображений и спекл-паттернах, согласованных посредством согласования блоков, как описано в патенте США № 6443289 (Olsson et al.). Сложность и точность этого согласования определяется путем установления максимальной корреляции для согласования. При этом положения опорных точек на изображениях отслеживаются от изображения к изображению посредством следования за спекл-паттернами вокруг точек. Когда устройство 142 отслеживания спеклов находит положения опорных точек на новом изображении, эти положения опорных точек передаются в графический процессор 148, очертания контура корректируются с использованием новых идентифицированных положений точек и создается графическое наложение для нового изображения. Новое изображение и его графическое наложение подвергаются сканирующему преобразованию и отображаются на дисплее 480.
Отслеживание спеклов является более предпочтительным, чем выделение градиентов изображения на контуре миокарда, по той причине, что оно менее чувствительно к шуму, присутствующему на изображении. Кроме того отсутствует четкий градиент для эпикардиального контура, который в отличие от эндокардиального контура не ограничен соседним пулом крови. Шум изображения также может вызывать выпадения в очерченном контуре, в результате чего оценки контура могут оказаться не на границе ткани, а глубже в миокарде. Было обнаружено, что достаточно хорошо обозначенный спекл-паттерн отслеживается с достаточной точностью от кадра к кадру в присутствии шума. Однако было также обнаружено, что спекл-паттерн изменяется со временем. Эту тенденцию можно компенсировать путем посева положения спекл-паттерна на множестве участков на сохраненных изображениях сердечного цикла, а затем отслеживать с опережением и отставанием во времени от двух обозначенных контуров, чтобы обеспечить совмещение плавающего спекл-паттерна. Посев выполняется путем очерчивания двух контуров, например, в начале и конце сердечного цикла, с помощью автоматического или полуавтоматического методов определения контура, описанных ниже, или вручную, путем ручного обозначения контура. После того как был обозначен эндокардиальный контур, его можно равномерно расширить наружу во всех направлениях, а затем вручную скорректировать по эпикардиальному контуру, видимому на изображении. Этот метод сближения хорошо зарекомендовал себя на последовательностях 80-300 кадров, содержащих 30-100 кадров в одном сердечном цикле.
Вместо отслеживания спекл-паттерна ткани миокарда, окружающей опорные точки, лежащей ниже или рядом с ними, можно отслеживать положения опорных точек и другими методами кроме отслеживания спеклов, например, посредством отслеживания характеристик изображения, имеющих размер больше длины волны. Например, можно отслеживать движение конкретных анатомических признаков. В качестве другого примера можно упомянуть отслеживание текстуры ткани. Понятно также, что можно отслеживать целевые характеристики в данных изображения, преобразованных перед или после сканирования.
На фиг.3а, 3b и 3с показаны изображения повышенной контрастности, полученные по длинной оси левого желудочка (ЛЖ), на которых трассируется контур ЛЖ. Пользователь указывает первый ориентир на изображении с помощью указательного устройства, такого как мышь или трекбол, обычно расположенного на пульте управления 150 ультразвуковой системы, или клавиатуры рабочей станции, которая манипулирует курсором на изображении. В примере на фиг.3а первым указанным ориентиром является медиальное (септальное) митральное кольцо (ММК). Когда пользователь щелкает по ММК на изображении, появляется графический маркер в виде белой контрольной точки, обозначенной цифрой "1" на чертеже. Затем пользователь указывает второй ориентир, в данном примере латеральное митральное кольцо (ЛМК), которое маркируется второй белой контрольной точкой, обозначенной цифрой "2" на фиг.3b. Затем процессор АОК автоматически соединяет две контрольные точки линией, которая в случае вида по длинной оси левого желудочка показывает плоскость митрального клапана. Далее пользователь перемещает указатель на вершину эндокарда, которая является самой верхней точкой в полости левого желудочка. Когда пользователь перемещает указатель на этот третий ориентир на изображении, за курсором динамически следует шаблонная форма эндокардиальной полости левого желудочка, разрываясь и вытягиваясь, когда указатель ищет вершину камеры ЛЖ. Этот шаблон, показанный белой линий на фиг.3с, зафиксирован первой и второй контрольными точками 1 и 2 и проходит через третью контрольную точку 3, расположенную на вершине, когда пользователь щелкает указателем по этой вершине. После позиционирования шаблон эндокардиальной полости обеспечивает приблизительную трассировку эндокарда, как показано на фиг.3с. В варианте на фиг.3с черная линия, которая делит левый желудочек, следует за указателем, когда он достигает и указывает вершину. Эта черная линия фиксируется между центром линии, показывающей плоскость митрального клапана, и вершиной левого желудочка, по существу показывая центральную линию между центром митрального клапана и вершиной полости. В коммерческих применениях процессор АОК 144 входит в состав ультразвуковых систем или автономной рабочей станции компании Philips Medical Systems of Andover, Ma, в пакете анализа изображений "QLAB". Это свойство пакета QLAB более полно описано в заявке на патент США №2005/0075567 (Skyba et al.). Автоматическая обработка контура может быть полностью автоматизирована с помощью других средств, например, как описано в патенте США № 6491636 (Chenal et al.).
Согласно следующему аспекту настоящего изобретения процессор АОК 144 также может трассировать эпикардиальный контур миокарда, как показано на фиг.4. Трассировку эпикардиального контура можно осуществлять в непрерывном процессе, начинающемся с этапов идентификации эндокарда, показанных на фиг.3а, 3b и 3с. После обозначения контура эндокарда пользователь перемещает курсор на вершину эпикарда, самую верхнюю точку на внешней поверхности миокарда. Затем пользователь щелкает по вершине эпикарда и позиционирует четвертую контрольную точку, показанную цифрой "4". При этом автоматически появляется вторая трассировка, которая приблизительно очерчивает эпикардиальный контур, как показано на фиг.4. Эта вторая трассировка, показанная внешним белым контуром на фиг.4, также зафиксирована первой и второй контрольными точками и проходит через позиционированную четвертую контрольную точку на эпикардиальной вершине. Эти две трассировки являются приблизительным очертанием контура миокарда.
На последнем этапе пользователь может пожелать скорректировать трассировки, показанные на фиг.4, чтобы они точно очертили контур миокарда. Вокруг каждой трассировки расположен ряд маленьких контрольных точек, показанных на чертеже знаком "+". Их количество и расстояние между ними зависят от конструкции выбранной системы или могут быть изменяемыми, с возможностью их установки пользователем. С помощью органа управления на пользовательском интерфейсе или пульте 150 управления пользователь может указать на эти контрольные точки или вблизи них, щелкнуть и перетащить очертание, чтобы точнее очертить границу миокарда на изображении. Этот процесс растягивания или буксировки контура известен как метод "резиновой нити" и раскрыт более подробно в упомянутом выше патенте США № 6491636, конкретно, на фиг.9 этого патента. В качестве альтернативы корректировке методом резиновой нити в более сложном варианте можно автоматически корректировать приблизительные контуры по контурам изображения с помощью обработки изображения, в которой используется информация об интенсивности пикселей на аппроксимированных контурах ткани или вблизи них. После завершения контур может точно очертить границу миокарда, замкнув пиксели изображения миокарда на изображении.
На фиг.5 показано изображение сердца по короткой оси, полученное с помощью ультразвуковой системы, построенной в соответствии с принципами настоящего изобретения. В центре изображения по короткой оси показана камера 10 сердца, окруженная миокардом 12. Эндокардиальный и эпикардиальный контуры обозначены с помощью методов, описанных выше, или методов, описанных, например, в патенте США № 5797396 (Geiser et al.). На эндокардиальном и эпикардиальном контурах обозначено несколько опорных точек. Каждая пара опорных эндокардиальных и эпикардиальных точек 14, 16 в этом примере содержит две точки, расположенные на отдельном радиусе изображения по короткой оси. Каждая пара опорных точек соединена графически прочерченной линией хорды 18, созданной графическим процессором 148, которая соединяет эти точки и ортогональна к контурам на стартовом изображении. В этом примере графика трассировки контура не отображается, а отображаются только опорные эндокардиальная и эпикардиальная точки 14, 16 и их соединительные хорды 18. В этом примере вокруг миокарда расположены опорные точки для семи линий и прочерчено семь линий хорд, хотя в конкретной реализации может использоваться или задаваться пользователем через пользовательский интерфейс 150 большее или меньшее количество хорд. По мере изменения пользователем положений опорных точек соответственно обновляются их значения в файле 146 данных опорных точек. Линии хорд могут быть непрерывными между связанными опорными точками или могут быть сегментированы между точками для более подробного анализа изменений сегментов линии.
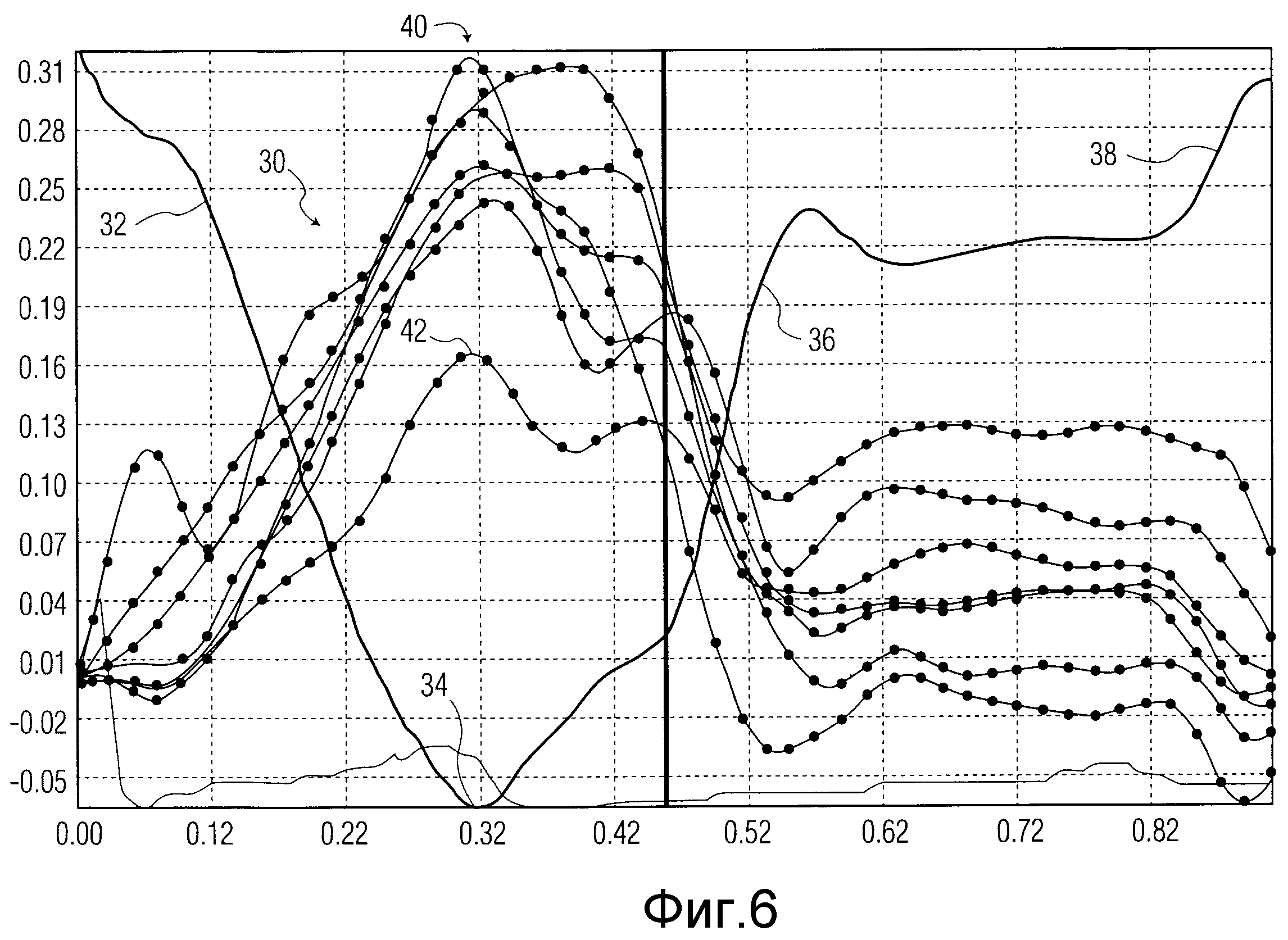
При перемещении последовательности изображений от кадра к кадру в течение сердечного цикла эндокардиальный и эпикардиальный контуры будут изменяться от изображения к изображению по мере того, как сердечная мышца сокращается во время систолы и затем расслабляется во время диастолы. Опорные точки 14, 16 продолжают отслеживать те же самые положения на соответствующих контурах благодаря отслеживанию спеклов их положений. Когда сердечная мышца сокращается, выталкивая кровь из камеры, эндокард должен относительно равномерно двигаться к центру камеры и длины хорд 18 должны увеличиваться, при этом увеличивается толщина от эндокарда до эпикарда. Это позволяет сравнивать изменение длины хорд толщины стенки, как показано в виде семи соответствующих трансмуральных кривых утолщения стенки 30 на фиг.6, сформированных вычислителем 20 кривой утолщения стенки. В этом примере кривые 30 утолщения стенки наносятся на графике против кривой 32-38 акустической количественной оценки, которая показывает изменение объема камеры сердца. Кривая акустической количественной оценки (AQ) может быть построена, как описано в патенте США № 5195521 (Melton Jr. et al.). В начальной части 32 кривой AQ сердечная камера выбрасывает кровь, пока не будет достигнута точка 34 минимального объема камеры. В это время толщина стенки сердца должна увеличиваться, пока не будет достигнута точка максимальной толщины 40. В данном примере все кривые утолщения стенки достигают максимума приблизительно в одно и то же время 40, что характерно для здорового сердца. При заболевании сердца, например, при инфаркте, хорда в положении инфаркта может не достигать своей максимальной толщины одновременно со здоровыми участками или достигает меньшей максимальной толщины, так как соседние здоровые участки растягивают инфарктный участок, как показано кривой 42 утолщения стенки.
От точки 34 максимального сокращения сердечная мышца ЛЖ начинает расслабляться во время части 36 кривой AQ по мере того, как сердце снова заполняется кровью из легких, и толщина стенки будет уменьшаться, как показано уменьшающимися кривыми 30 в течение этого времени. Расслабленное сердце будет иметь плато во время последней части диастолы до тех пор, пока не произойдет последний атриальный толчок 38 при сокращении левого предсердия.
Опорные точки хорд не должны обязательно располагаться точно на эпикардиальном и эндокардиальном контурах. ЗИ может быть обозначена выбранным пользователем количеством опорных точек 14, расположенных на одинаковом расстоянии внутрь миокарда от эндокардиального контура (ЗИ эндокарда). Соответствующие точки обозначают другое выбранное пользователем расстояние внутрь миокарда (ЗИ эпикарда). Точки ЗИ можно уточнять вручную, если требуется, чтобы эндокардиальные и эпикардиальные точки соответствовали воспринимаемым областям ткани. Расположение точки на некотором расстоянии в ткань, а не точно на контуре, лучше гарантирует их попадание в спекл-паттерн, пригодный для отслеживания в последовательных кадрах сердечного цикла. ЗИ должны быть основаны на обозначении всего для одного кадра в начале сердечного цикла, а затем их обозначение корректируется с помощью обновлений в результате отслеживания.
Альтернативно или дополнительно к отслеживанию изменения длины хорды, как показано на фиг.6, можно вычислить деформацию Лагранжа (относительное изменение длины относительно исходной длины) с помощью вычислителя 20 кривой утолщения стенки и отобразить ее графически. Деформация представляет собой меру изменения формы ткани и является показателем механических эффектов мышечной ткани. См. например, патент США № 6537221 (Criton et al.). Согласно еще одному аспекту настоящего изобретения можно отображать и анализировать накопленную деформацию от эндокарда эпикарду. Вычисления длины и деформации для каждой эндокардиальной и эпикардиальной пары опорных точек 14, 16 в ЗИ отображаются на графиках относительно времени с отображением для сравнения эталонных графиков площади желудочка, фракции выброса или ЭКГ, как показано на графике фиг.6. В других вариантах изменения длины и деформации можно отобразить на параметрическом изображении в цветовом или графическом представлении над изображением ткани на фиг.5, что позволит врачу легко идентифицировать аномальные изменения относительно их положений в ткани миокарда.
Реферат
Изобретение относится к медицинской технике. Система содержит зонд, передающий ультразвуковые волны в сердце и принимающий в ответ эхо-сигналы, процессор изображений, формирующий в ответ на эхо-сигналы последовательность кадров изображений миокарда в течение по меньшей мере части сердечного цикла, устройство для оконтуривания толщины стенки миокарда, которое оконтуривает расстояние между эндокардом и эпикардом в миокарде в каждом из кадров изображений последовательности, посредством использования устройства отслеживания изображения, которое отслеживает оконтуренное расстояние от кадра к кадру в течение указанной части указанного сердечного цикла, и анализатор толщины стенки, формирующий в ответ на оконтуренные расстояния графическую кривую утолщения стенки непрерывного изменения толщины стенки миокарда в течение указанной части указанного сердечного цикла. Применение системы позволит отслеживать изменение толщины стенки в сердечном цикле как изменение расстояния между эндокардом и эпикардом. 13 з.п.ф-лы, 6 ил.

Комментарии