Фильтр пульсации стенок сосудов для ультразвукового анализа митральной регургитации - RU2605417C2
Код документа: RU2605417C2
Чертежи




Описание
По данной заявке испрашивается приоритет предварительной патентной заявки США №61/426669, поданной 23 декабря 2010 г.
Настоящее изобретение относится к медицинским ультразвуковым диагностическим системам и, в частности, к фильтрам пульсаций стенок сосудов, используемым ультразвуковыми системами диагностической визуализации для анализа регургитирующего тока из митрального клапана.
Регургитирующий ток является серьезным медицинским состоянием, которое требует анализа и соответствующего лечения. Непосредственно до сокращения левого желудочка для накачивания крови в организм митральный клапан должен полностью закрыться, чтобы сокращение вытолкнуло весь поток крови в аорту. Если клапан не закрывается полностью, часть крови в левом желудочке будет вытолкнута обратно в левое предсердие через отверстие в не перекрытом полностью клапане. Такой обратный ток крови, обычно небольшой кратковременный выброс тока крови, выбрасываемого сильной струей через не полностью закрытые листки клапана, снижает выход крови из сердца и, следовательно, эффективность каждого сердечного сокращения. В результате, сердце должно перекачивать кровь быстрее с целью обеспечения организма необходимым питающим током крови. Сердце работает с повышенной нагрузкой вследствие его неэффективности, что приводит к сердечной недостаточности.
Врачи-клиницисты использовали ультразвуковую визуализацию в течение многих лет с целью попытки обнаружения регургитирующего тока крови. Ультразвуковое обнаружение регургитации клапана первоначально выполнялось путем поиска упомянутого выше выброса крови на ультразвуковом изображении левой стороны сердца. В течение последних двадцати лет наблюдению выброса способствовала двумерная (2D) цветовая допплеровская визуализация кровотока, в которой высокая скорость и турбулентность небольшого выброса крови обнаруживается путем внимательного поиска данных аномальных локальных скоростей потока вблизи имеющего утечку клапана сердца. Но получение плоскости изображения, на котором выброс является наиболее преобладающим, вместе с движением сердца и клапана и турбулентностью тока крови вблизи митрального клапана, а также кратковременное появление выброса, представляет сложности в данном субъективном подходе. В последние годы в случаях, когда место выброса может наблюдаться с помощью ультразвука, врачи-клиницисты использовали методику, называемую PISA, сокращение для "площади формирующейся струи митральной регургитации", с тем, чтобы попытаться количественно определить регургитирующий ток крови. В данном способе подозреваемый клапан и область внутри LV камеры сердца, а также вблизи клапана, визуализируются посредством цветовой допплеровской визуализации кровотока. Во время появления выброса область сходимости потока (FCR) формируется в ближней области, поскольку скорости тока крови в этой области мгновенно увеличиваются в направлении отверстия регургитации. Данный профиль тока приводит к искажению информации на цветовом изображении тока, поскольку скорости тока кратковременно превышают диапазон скоростей, используемый для цветового изображения. Цветовое изображение получают в этот момент и «замораживают» на экране. Затем выполняется измерение скорости v на первой линии искажения FCR и выполняется измерение расстояния r от линии искажения до предполагаемого центра отверстия клапана. Эти два измерения затем используются для вычисления скорости потока через отверстие с использованием выражения Qt=2пr2v.
Несколько сложностей возникает при проведении данной процедуры. Одна заключается в том, что наибольшая точность получается, когда выброс захватывается на цветовом изображении в самом его пике. Продолжительность выброса в течение сердечного цикла может составлять всего лишь 300-450 миллисекунд, однако обычная частота кадров цветовой визуализации тока крови может находиться в диапазоне 10-20 кадров в секунду. Таким образом, вероятно, что момент времени получения кадров цветового изображения тока крови не будет совпадать с моментом, когда выброс будет находиться в своем пике. Врач-клиницист может повторить последовательность получения цветового изображения тока крови для дополнительных сердечных циклов, или может согласиться на неточности, получаемые при проведении измерений не в самом пике выброса.
Другая проблема заключается в том, что центр отверстия клапана нелегко определить на цветовом изображении тока крови. Ткань клапана вызывает сильные отражения ультразвука и быстро двигается в процессе сканирования и может выглядеть как громоздкая, расплывчатая или нечеткая масса на изображении. Таким образом, возможно, что точность измерения r будет подставлена под сомнение вследствие невозможности оценки точного положения отверстия.
Еще одна, третья проблема заключается в том, что базовая методика PISA представляет собой однократное одномерное измерение. Выполняется только измерение скорости, и только один радиус r для отверстия используется при вычислении. В данном способе предполагается, что остальной ток крови в FCR ведет себя так же, как и при однократном измерении. Очевидно, что любая неточность при выполнении единственного измерения приведет к неточному результату.
Расширение базовой методики PISA, в котором производится попытка исправления данных неточностей, состоит в выполнении множества измерений скорости вокруг дуги, очерчивающей внешнюю границу FCR на двумерном изображении. Измеряется расстояние r от каждой точки измерения скорости до отверстия, и множество измерений используется для вычисления скорости потока Qt. Хотя множество измерений может предотвратить зависимость от одного неточного измерения, возникает другая проблема. Методика единственного измерения (1D) обычно выполняется путем нацеливания центрального луча ультразвукового зонда через верх сердца и непосредственно через предполагаемое отверстие регургитации и выполнения измерения скорости v и расстояния r вдоль линии луча. При таком выравнивании линии луча с этим вектором регургитирующего потока измеренная скорость будет точной и не будет зависеть от ненулевого допплеровского угла. Как хорошо известно, на ультразвуковые допплеровские измерения скорости влияет угол между направлением потока и направлением ультразвукового луча. Ток непосредственно на одной линии с направлением луча будет измерен точно, тогда как ток под ненулевым углом к направлению луча будет сокращен на косинус угла. Ток, ортогональный (90°) направлению луча, не приведет к наличию допплеровского отклика. Следовательно, допплеровская скорость, измеренная посредством ультразвука, должна быть скорректирована как функция угла между вектором потока и направлением луча с целью выдачи более точного измерения скорости. В случае методики 2D PISA, дополнительные измерения скорости вдоль дуги FCR будут неточными вследствие изменения углов между их векторами потока и направлением луча в каждой точке, в которой выполняется измерение скорости. Таким образом, принимая во внимание, что множество измерений может компенсировать ошибку, сделанную в одном измерении скорости, совокупность измерений будет занижать скорость тока вследствие изменения допплеровских углов в каждой точке измерения.
Еще одна проблема, характерная для методики PISA, заключается в неточности определения точного местоположения отверстия регургитации в клапане. Как упоминалось выше, искажение на цветовом изображении тока крови преобладает вблизи утечки из клапана вследствие скачкообразного увеличения скорости тока крови в направлении отверстия и через отверстие. Цветовое изображение тока крови, таким образом, зашумляется всплеском искажающих цветов на допплеровском изображении вблизи отверстия. Кроме того, плоскость митрального клапана находится в движении во время сокращения сердца. Поскольку точность методики PISA зависит от знания местоположения отверстия при измерении расстояния r, данные препятствия точному определению местоположения отверстия могут привести к неточному измерению r и, следовательно, к неточному вычислению скорости потока. Эксперименты продемонстрировали, что ошибка на один миллиметр в определении положения отверстия может привести к значительной ошибке при вычислении скорости потока через утечку. Кроме того, известно, что многие регургитирующие клапаны имеют не одно маленькое отверстие утечки, а утечку вдоль щели нечеткого закрытия клапана. Предположение, что утечка вызывается единственным маленьким отверстием в клапане, таким образом, может быть необоснованным.
Соответственно, желательно предоставить способ и устройство для количественной оценки скорости потока и объемного расхода митрального клапана, который преодолевает указанные выше ограничения методики PISA. Целью настоящего изобретения является точная идентификация конкретного положения отверстия регургитации клапана. Еще одной целью настоящего изобретения является выполнение ряда измерений, на которые не оказывает влияния допплеровский угол в каждом месте измерения. Также целью настоящего изобретения является способность идентифицировать и количественно оценить регургитацию митрального клапана не только через утечку вследствие единственного маленького отверстия, но также вследствие щели вдоль места закрытия клапана.
В соответствии с принципами настоящего изобретения, описаны система и способ ультразвуковой диагностической визуализации для количественной оценки регургитирующего тока крови. Дуговидная (двумерная) или полусферическая (трехмерная) область тока крови очерчивается вблизи предполагаемого места утечки из митрального клапана на ультразвуковом изображении регургитирующего клапана. Внутренняя граница области находится непосредственно или точно за пределами области искажения, смежной с отверстием утечки, и внешняя граница области находится вовне и является концентрической с внутренней границей. Делаются исходные предположения в отношении регургитирующего тока, включая местоположение отверстия регургитации. Данные предположения используются для расчета модели поля скорости для регургитирующего потока. Параметры модели настраиваются в соответствии с физическими параметрами ультразвука и/или настройками ультразвуковой системы для определения ожидаемых векторов скорости, которые будут наблюдаться ультразвуковой системой, VOBS, в очерченной области. Измерения скорости выполняются ультразвуковой системой в пределах очерченной области, и измеренные скорости сравниваются с ожидаемыми скоростями. Рассчитываются различия между измеренными и ожидаемыми значениями, и путем приближения нелинейной кривой выполняются настройки одного или более значений модели. Процесс итеративно повторяется до тех пор, пока ожидаемые и измеренные значения не сойдутся приемлемым образом. Итеративно настроенные параметры модели могут быть использованы для получения количественного измерения скорости потока или положения отверстия утечки в клапане.
В соответствии с еще одним аспектом настоящего изобретения, исходно предполагаемое положение отверстия регургитации на ультразвуковом изображении автоматически обновляется посредством упомянутого выше процесса с целью указания фактического положения отверстия на изображении. Таким образом, врачу-клиницисту демонстрируется точное положение отверстия регургитации, несмотря на наличие помех на изображении вблизи митрального клапана.
В соответствии с еще одним аспектом настоящего изобретения, приведенная выше методика повторяется во множестве пространственных положений около митрального клапана. Совокупный регургитирующий поток, измеренный в пространственных положениях, дает измерение регургитирующего потока вследствие регургитирующей утечки, которая представляет собой щель в закрытии митрального клапана, а не единичное маленькое отверстие утечки.
В соответствии с еще одним аспектом настоящего изобретения, описывается несколько характеристик фильтра пульсаций стенок сосудов, которые являются предпочтительными для реализации измерения регургитирующего потока в соответствии с настоящим изобретением, включая фильтр пульсаций стенок сосудов с характеристикой, имеющей пик в промежуточных скоростях потока, которые часто обнаруживаются в области потока вблизи отверстия регургитации.
НА ЧЕРТЕЖАХ
Фиг. 1 иллюстрирует в форме блок-схемы ультразвуковую систему диагностической визуализации, сконструированную в соответствии с принципами настоящего изобретения.
Фиг. 2 представляет собой блок-схему, иллюстрирующую функционирование процессора количественной оценки потока по фиг. 1.
Фиг. 3 иллюстрирует ультразвуковое допплеровское изображение регургитирующего выброса.
Фиг. 4 иллюстрирует ультразвуковое изображение с исходно предполагаемым положением отверстия и автоматически указанным положением отверстия в соответствии с настоящим изобретением.
Фиг. 5 иллюстрирует методику для количественной оценки регургитирующего потока через щель вдоль клапана в соответствии с настоящим изобретением.
Фиг. 6 иллюстрирует характеристику отклика фильтра пульсаций стенок сосудов, подходящую для использования в ультразвуковой системе настоящего изобретения.
На фиг. 1 ультразвуковая система диагностической визуализации, сконструированная в соответствии с принципами настоящего изобретения, показана в форме блок-схемы. На фиг. 1 матрица 10′ преобразователей представлена в ультразвуковом зонде 10 для передачи ультразвуковых волн и приема отраженной информации. Матрица 10′ преобразователей, предпочтительно, представляет собой двумерный массив преобразовательных элементов, способных осуществлять сканирование в трех измерениях, например, в направлении высоты и азимута около местоположения митрального клапана, для 3D-визуализации. Матрица преобразователей соединена с микроустройством 12 формирования луча в зонде, которое управляет передачей и приемом сигналов элементами матрицы. Микроустройства формирования луча способны, по меньшей мере частично, осуществлять формирование луча для сигналов, принятых группами, или «гнездами» преобразовательных элементов, как описано в патентах США 5997479 (Savord et al.), 6013032 (Savord) и 6623432 (Powers et al.). Микроустройство формирования луча соединено посредством кабеля зонда с переключателем 16 передачи/приема (T/R), который переключается между передачей и приемом и защищает основной формирователь 20 луча от высокоэнергетических сигналов передачи. Передача ультразвуковых лучей от матрицы 10 преобразователей под управлением микроустройства формирования луча 12 направляется контроллером 18 передачи, соединенным с переключателем T/R и формирователем 20 луча, который принимает сигнал пользовательской операции с пользовательского интерфейса или панели 38 управления. Одной из функций, управляемых контроллером передачи, является направление, в котором следуют лучи. Лучи могут следовать прямо из (ортогонально) матрицы преобразователей, или под различными углами с целью получения поля обзора большей ширины.
Сигналы частично сформированных лучей, выдаваемые микроустройством 12 формирования луча, передаются на основной формирователь 20 луча, где сигналы частично сформированных лучей из отдельных патчей элементов объединяются в сигнал полностью сформированного луча. Например, основной формирователь 20 луча может иметь 128 каналов, каждый из которых принимает сигнал частично сформированного луча от патча из 12 преобразовательных элементов. Таким образом сигналы, принятые более чем 1500 преобразовательными элементами двумерной матрицы, могут внести эффективный вклад в одиночный сигнал сформированного луча.
Сигналы сформированного луча передаются на процессор 22 сигналов. Процессор 22 сигналов может обрабатывать принятые отраженные сигналы различным образом, таким как полосовая фильтрация, прореживание, разделение I и Q компонентов и выделение гармонических сигналов, который осуществляет разделение линейных и нелинейных сигналов, с тем, чтобы обеспечить осуществление идентификации нелинейных отраженных сигналов, возвращенных из ткани и микропузырьков. Процессор сигналов также может выполнять дополнительное улучшение сигналов, такое как понижение уровня спеклов, соединение сигналов и удаление шума.
Обработанные сигналы передаются на процессор 26 В-режима и допплеровский процессор 28. Процессор 26 В-режима применяет амплитудное детектирование для визуализации структур в организме, таких как ткань стенки сердца, митральный клапан и клетки крови. Изображения В-режима структуры организма могут быть сформированы в гармоническом режиме или основном режиме, или в комбинации обоих, как описано в патенте США 6283919 (Roundhill et al.) и патенте США 6458083 (Jago et al.). Допплеровский процессор 28 обрабатывает различающиеся по времени сигналы из ткани и кровотока с целью обнаружения движения веществ, таких как поток клеток крови, в поле визуализации. Допплеровский процессор обычно содержит фильтр пульсаций стенок сосудов с параметрами, которые могут быть установлены для пропускания и/или отклонения отраженных сигналов, возвращенных от выбранных типов веществ в организме. Например, фильтр пульсаций стенок сосудов может быть настроен таким образом, чтобы он имел характеристику полосы пропускания, которая пропускает сигнал сравнительно низкой амплитуды от веществ с более высокой скоростью, но отклоняет сравнительно сильные сигналы от веществ с более низкой или нулевой скоростью. Данная характеристика полосы пропускания будет пропускать сигналы от текущей крови, при этом отклоняя сигналы от соседних неподвижных или медленно движущихся объектов, таких как стенка сердца. Обратная характеристика будет пропускать сигналы от движущейся ткани сердца, при этом исключая сигналы тока крови для того, что называется допплеровской визуализацией ткани, обнаружением и изображением движения ткани. Допплеровский процессор принимает и обрабатывает последовательность дискретных по времени отраженных сигналов от различных точек в поле изображения, при этом последовательность отраженных сигналов от конкретной точки называется ансамблем. Ансамбль отраженных сигналов, принятых быстро и последовательно за относительно короткий интервал, может быть использован для оценки частоты допплеровского смещения текущей крови, при этом соответствие допплеровской частоты скорости показывает скорость тока крови. Ансамбль отраженных сигналов, принятых за более длинный период времени, используется для оценки скорости медленнее текущей крови или медленнее движущейся ткани. Для оценки митральной регургитации быстро происходящего выброса обычно используются короткие длины ансамблей (меньше образцов), чтобы могла быть реализована высокая частота кадров получения. Допплеровское смещение Δf может быть оценено с помощью формулы вида Δf=2υf0cosθ/c, где f0 - частота передачи, с - скорость распространения ультразвука, v - скорость и θ - угол между направлением луча и направлением тока крови.
Структурные сигналы и сигналы движения, выдаваемые процессорами В-режима и допплеровскими процессорами, передаются преобразователю 32 сканирования и устройству 44 многоплоскостного переформатирования. Преобразователь 32 сканирования организует отраженные сигналы в пространственной взаимосвязи, из которой они были приняты, в желаемый формат изображения. Например, преобразователь сканирования может организовывать отраженный сигнал в двумерный (2D) веерообразный формат или пирамидальное трехмерное (3D) изображение. Преобразователь сканирования может накладывать на структурное изображение В-режима цвета, соответствующие движению в точках в поле изображения, соответствующему их оцененным по допплеровскому смещению скоростям, с целью выдачи цветного допплеровского изображения, которое отображает движение ткани и ток крови в поле изображения. Устройство 44 многоплоскостного переформатирования будет преобразовывать отраженные сигналы, которые приняты из точек в общей плоскости в объемной области организма, в ультразвуковое изображение этой плоскости, как описано в патенте США 6443896 (Detmer). Объемный визуализатор 42 преобразует отраженные сигналы множества данных 3D в проецированное 3D изображение, соответствующее наблюдению из заданной контрольной точки, описанному в патенте США 6530885 (Entrekin et al). 2D- или 3D-изображения передаются с преобразователя 32 сканирования, устройства 44 многоплоскостного переформатирования и объемного визуализатора 42 на процессор 30 изображений с целью дальнейшего улучшения, буферизации и временного хранения для отображения на графическом дисплее 40.
В соответствии с принципами настоящего изобретения, значения скорости тока крови, выдаваемые допплеровским процессором 28, передаются процессору 34 количественной оценки потока. Процессор количественной оценки потока функционирует, как описано ниже, для выдачи измерения скорости потока через отверстие регургитации, объемного потока через отверстие и пространственного положения отверстия. Процессор количественной оценки потока может получать входные данные от пользовательской панели 38 управления, такие как исходная оценка положения отверстия, как описано ниже.
Выходные данные от процессора количественной оценки потока передаются на графический процессор 36 для воспроизведения выходных данных от процессора в виде изображения на дисплее 40. Графический процессор 36 также может генерировать графические слои для отображения вместе с ультразвуковыми изображениями. Такие графические слои могут содержать стандартную идентификационную информацию, такую как имя пациента, дату и время изображения, параметры визуализации и т.п. Для этих целей графический процессор принимает входные данные от пользовательского интерфейса 38, например набранное имя пациента. Пользовательский интерфейс также соединен с контроллером 18 передачи для управления генерацией ультразвуковых сигналов в матрице 10′ преобразователей и, следовательно, изображениями, выдаваемыми матрицей преобразователей и ультразвуковой системой. Пользовательский интерфейс также соединен с устройством 44 многоплоскостного переформатирования для выбора и управления отображением множества многоплоскостных переформатированных (MPR) изображений, которые могут быть использованы для количественной оценки регургитирующего потока на MPR-изображениях в соответствии с настоящим изобретением, как описано ниже.
Фиг. 2 описывает функционирование процессора количественной оценки потока по фиг. 1. Процессор основывается на математической модели поля скорости потока в точках измерения в пределах зоны включения, как описано ниже. В варианте осуществления с 2D-изображением зона включения, предпочтительно, представляет собой криволинейную полосу, очерчиваемую двумя дугами с центром в местоположении отверстия регургитации {х0, у0, z0}. В варианте осуществления с 3D-изображением криволинейная полоса имеет форму полусферической оболочки, что обсуждается в связи с фигурой 3 ниже. В предпочтительном варианте осуществления модель представляет собой векторную модель скорости для поля скорости потока в форме

Или

где
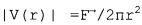


В блоке 50 на фиг. 2 скорость потока для каждой точки зоны включения моделируется таким образом. Изначально модель может начинаться с предполагаемых или оцененных значений для неизвестных параметров, включая поток

Модель поля скорости потока аппроксимирует векторы скорости, которые были бы точными, если были бы известны истинные физиологические векторы скорости. Векторы скорости, аппроксимированные моделью, показаны на выходе блока 50 как ~VTRUE. Далее в блоке 52 налагаются некоторые ограничения и настройки для ~VTRUE вследствие практических факторов, таких как физические параметры ультразвука и параметры функционирования используемой ультразвуковой системы. Модель поля скорости потока затем настраивается или масштабируется с целью принятия в расчет данных практических факторов при рассмотрении фактических значений скорости, которые наблюдались бы ультразвуковой системой. Одним из практических факторов, для которых может быть сделана настройка, является допплеровский угол. Как упоминалось выше, допплеровские измерения, выполняемые ультразвуковой системой, являются точными, только когда направление потока совпадает с направлением ультразвукового луча, и допплеровский угол равен нулю. Для всех остальных углов между направлением луча и направлением потока оценка скорости является заниженной. В представленной выше формуле допплеровского смещения допплеровский угол взвешивается в результате множителем cosθ, где θ представляет собой допплеровский угол. Другим практическим фактором ультразвуковой системы является систематическая ошибка фильтра пульсаций стенок сосудов. Допплеровский фильтр пульсаций стенок сосудов будет обычно демонстрировать нелинейную характеристику, которая, для обнаружения тока крови, будет иметь нулевой отклик на DC (движение отсутствует) и возрастать до максимальной чувствительности при выбранной высокой частоте ±f. Альтернативно, фильтр пульсаций стенок сосудов может демонстрировать максимальную чувствительность при частоте, меньшей, чем определяется пределом Найквиста для частоты дискретизации ансамбля, как обсуждается ниже. Объем выборки в организме, при котором измеряется допплеровское смещение, не будет представлять собой одну точку в организме, но будет иметь конечный размер, что в результате приведет к возврату допплеровских сигналов, показывающих диапазон скоростей. Неоднородный отклик фильтра пульсаций стенок сосудов может вызывать большой разброс скоростей с большим усилением в различных местах характеристики отклика, например, более высокие скорости выделяются больше, чем более низкие скорости. Такой неоднородный отклик может создать смещение в воспринимаемом центре разброса скоростей, называемое систематической ошибкой (смещением) фильтра пульсаций стенок сосудов. Влияние систематической ошибки фильтра пульсаций стенок сосудов также может приниматься во внимание путем настройки модели. Другим связанным фактором, который может приниматься в расчет, является спектральный разброс, эффект допплеровского спектрального расширения, возникающий вследствие различных траекторий и углов из объема выборки для каждого принимающего элемента активной апертуры матрицы преобразователей. См. патент США 5606972 (Routh). Еще одним фактором, который может приниматься в расчет, являются эффекты искажения, неточного представления допплеровских частот и скоростей, когда движение тока крови имеет скорость, превышающую значение, при котором может происходить однозначное обнаружение в соответствии с пределом Найквиста частоты дискретизации ансамбля отраженных сигналов. В блоке 52 факторы, такие как эти, принимаются в расчет настройкой скалярного произведения модели поля скорости потока, которые для ранее описанных моделей могут иметь форму

где

Компаратор 54 сравнивает ожидаемые значения скорости из модели поля скорости потока, VOBS, с фактическими измерениями скорости из точек (объемов выборки) в поле, VMEAS, выдаваемых допплеровским процессором 28. В блоке 56 разности между ожидаемыми и полученными значениями возводятся в квадрат с целью получения параметра ошибки для каждой точки. Параметры ошибки интегрируются по всей зоне включения, которая может быть одномерной (например, 1D-прямая), двумерной (например, ограниченная 2D-дугообразной кривой область) или трехмерной (например, 3D-полусферической оболочкой) зоной включения для получения среднеквадратичной формы параметра ошибки для полной зоны. Затем параметр ошибки используется для настройки параметров модели поля, таких как r и скорость потока, с целью снижения впоследствии измеренного параметра ошибки. Предпочтительной методикой настройки является использование приближения нелинейной кривой для модификации модели с целью снижения ошибки. Одной из таких методик приближений нелинейной кривой, которая может быть использована, является алгоритм Левенберга-Марквардта, который улучшает координаты положения отверстия регургитации и потока

Цикл на фиг. 2 итеративно повторяется с целью уменьшения параметра ошибки. С каждым прохождением через цикл точнее настроенная модель поля настраивается и сравнивается с ультразвуковыми измерениями скорости из области принятия, и параметр ошибки итерационно снижается. Когда параметр ошибки будет снижен до приемлемого низкого значения, модель будет демонстрировать желаемые фактические измерения местоположения отверстия и тока крови через отверстие. Данные параметры, а также другие, при необходимости, выдаются как выходные данные процессором 34 количественной оценки потока и представляются пользователю на дисплее.
Фиг. 3 представляет собой схематичное 2D-ультразвуковое изображение, иллюстрирующее практическое применение настоящего изобретения для измерения регургитации митрального клапана. Прямая 100 показывает плоскость митрального клапана, в которой имеется регургитирующая утечка через отверстие О. При сжатии левого желудочка происходит выброс 102 крови назад в правое предсердие. В методике PISA данный выброс будет исследован допплеровским лучом 110, проходящим через отверстие О. В патенте США 6719697 (Li) представлено улучшение методики PISA, в котором цветное отображение М-режима выдается для сердечного цикла из положения допплеровского луча 110. Процессор цветного допплеровского отображения настроен для ограничений отображения, показанных цветной полосой 120 на правой стороне изображения, проходя от центрального контрольного нулевого значения скорости (В = черный) до максимальных скоростей +V и -V в противоположных направлениях. Диапазон цветов (Y = желтый; DR-темно-красный; и т.д.) отображается в соответствии с данным диапазоном скоростей. Искажение имеет место, когда измеряемая скорость превышает пределы Найквиста +V и -V. Непосредственно прилегает к отверстию область сходимости потока (FCR) 104. За пределами области сходимости потока находится область принятия 112 (S), используемая в реализации настоящего изобретения.
Как методики PISA, так и настоящее изобретение основаны на предположении, что регургитирующий поток в левом желудочке является сходящимся и проходит в направлении местоположения отверстия О. Это показано векторами потока

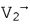
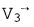
Цветное допплеровское изображение FCR 104 будет хаотичным и ошибочным. Это объясняется тем, что пространственная ориентация клеток крови и скорости тока крови изменяются в данной области очень быстро при изменении направления тока крови и мгновенного ускорения в направлении отверстия О во время систолического сжатия. Образцы ансамбля, полученные в течение данного интервала, часто не имеют корреляции друг с другом, что разрушает корреляцию внутри ансамбля, на которую полагаются обычные процессоры допплеровских оценок. В результате, даже хотя поток в пределах FCR может в целом быть ламинарным, цветовое отображение тока крови может показывать высокую турбулентность и искажение потока. Внутренняя граница 108 зоны принятия S, предпочтительно, установлена за пределами области 104 сходимости потока во избежание использования ошибочных оценок скорости из FCR. Один из подходов к установке границы 108 состоит в ее установке на границу разрыва скорости или за ее пределы. Это может быть сделано визуально в отношении цветового отображения тока крови или автоматически в отношении порога разрыва скорости.
Внешняя граница 106 зоны принятия может быть установлена в отношении измеряемых скоростей. Хотя скорости регургитирующего потока являются сравнительно высокими вблизи отверстия, они становятся все более низкими при увеличении расстояний от отверстия. Внешняя граница 106 может быть установлена на расстоянии от отверстия О, при котором низкие допплеровские скорости все еще могут быть надежно измерены. Это может быть определено в отношении процента предела Найквиста или в отношении низкой скорости потока, такой как 5 мм/с. Внешняя граница 106 может быть, таким образом, установлена на расстоянии, при котором приемлемая чувствительность для низких потоков все еще может быть реализована допплеровским процессором.
Зона принятия 112 в примере по фиг. 3 предусматривается как двумерная дугообразная область S, имеющая центр вращения в отверстии О. Настоящее изобретение может быть использовано в одном, двух или трех измерениях. Одномерная реализация и модель могут рассматривать только отрезок оси луча 110, который, например, находится между дугами 108 и 106. Двумерная реализация может представлять собой реализацию, которая производит выборку в зоне принятия, являющейся плоской, такой как зона принятия 112 на фиг. 3. В трехмерной реализации будет рассматриваться дугообразная зона принятия, такая как 112, но в полной полусфере с центром в отверстии. Для двухмерной и трехмерной реализаций ожидается большая точность. Предпочтительной реализацией будет использование зонда 3D-визуализации с двумерным матричным датчиком, как показано на фиг. 1, при этом получение данных и моделирование выполняется в полусферической или полу-полусферической объемной оболочке вокруг отверстия. Более высокая частота кадров может быть реализована при двумерной визуализации, и в этом случае кадр MPR, проходящий через отверстие и выброс, может быть выбран из объема, просканированного 3D-зондом, посредством использования устройства 44 многоплоскостного переформатирования. Желаемая плоскость может повторно сканироваться с более высокой частотой кадров получения данных, при этом измерения скорости и вычисления потока выполняются в двумерной зоне принятия, показанной на 2D MPR-изображении.
Хотя могут иметься зоны принятия, из которых поток сходится в круговом порядке в направлении отверстия, как показано на фиг. 3, в некоторых случаях может быть обнаружено присутствие некруговых порядков. Другими словами, векторы потока, указывающие в направлении отверстия, могут быть расположены в порядке, отличном от дуги или чистого круга. Вместо круговой формы на фиг. 3, зона принятия может иметь параболическую или сплюснутую круглую форму. В трехмерных реализациях зона принятия может представлять собой параболоидную или сплющенную сфероидную оболочку. Форма зоны принятия, то есть область или объем, в котором измеряются скорости для сравнения с моделью, могут динамически изменяться во время итеративных проходов в цикле обработки по фиг. 2, в результате чего процесс будет настраиваться и сходиться к зоне принятия с измененной формой по отношению к форме, использованной в исходной модели.
Как упоминалось ранее, врачу-клиницисту часто сложно точно указать местоположение маленького отверстия регургитации на ультразвуковом изображении. Когда сердце не сжимается, отверстие не присутствует, и когда оно присутствует, его положение искажается артефактами изображения получающейся в результате турбулентности, такой как имеющая место вблизи области сходимости потока. В соответствии с еще одним аспектом настоящего изобретения, реализация настоящего изобретения может автоматически показывать положение отверстия утечки на ультразвуковом изображении. Фиг. 4 иллюстрирует ультразвуковое изображение, на котором элементы, ранее описанные в связи с фиг. 3, имеют те же самые цифровые обозначения. Данное изображение также содержит небольшой блок 130, который был помещен на изображение врачом-клиницистом в начале диагностики для указания предполагаемого положения отверстия регургитации. Элемент управления панели 38 управления, такой как шаровой манипулятор, используется врачом-клиницистом для помещения иконки 130 в месте изображения, в котором, как считает врач-клиницист, находится отверстие. Координаты указанной иконки 130 отверстия используются для инициализации обработки процессором количественной оценки потока, показанным на фиг. 2, в результате чего координаты используются как исходные координаты отверстия в математической модели в блоке 50. Процессор 34 итеративно корректирует смоделированные значения векторов скорости потока в направлении местоположения отверстия в ответ на получение измеренных значений скорости VMEAS. Было обнаружено, что вертикальное помещение местоположения отверстия имеет наибольшее влияние на сходимость моделируемых векторов скорости с измеренными значениями скорости. Когда сердце сжимается во время систолы, движение сжатия вызывает вертикальное перемещение митрального клапана на изображении Ж в направлении центра левого желудочка. Таким образом, естественное движение сжатия сердца может быть источником наибольшей ошибки в оценке регургитирующего потока. Процессор 34 итеративно корректирует положение отверстия с целью снижения ошибки несовпадения между измеренными и оцененными значениями скорости в поле скорости потока (зона принятия S) между границами 106 и 108. Когда процессор количественной оценки потока осуществляет итерации по сходимости к истинным координатам отверстия, определенные в итоге координаты используются процессором 34 количественной оценки потока и графическим процессором 36 для автоматического перемещения иконки 130 отверстия в рассчитанные координаты на изображении. Альтернативно, графический процессор будет помещать еще одну (вычисленную) иконку 132 отверстия на отображение в истинном координатном положении, определенном посредством итеративной настройки модели. Как упоминалось ранее, неправильное помещение отверстия всего на 1 мм может значительно повлиять на расчеты скорости потока через отверстие и объемного потока, при этом объемный поток является интегралом скорости потока по времени, в течение которого сердце сжимается (около 1/3 сердечного цикла). Объем потока будет иметь максимум приблизительно в середине систолического интервала. На фигуре 4 видно, что система поместила иконку 132 вычисленного отверстия в его истинное положение в поле изображения, которое отличается от первоначальной оценки положения отверстия врачом-клиницистом. В случае, когда ультразвуковое исследование выполняется с использованием 2D-визуализации, координаты отверстия обычно будут иметь форму декартовых координат (х, у, z). В случае, когда используется 3D-визуализация, обычно будет использоваться сферическая система координат (r, θ, φ). Кроме того, как иллюстрирует ультразвуковое изображение на фиг. 4, зона принятия S графически очерчивается на отображенном ультразвуковом изображении, и любая модификация формы зоны принятия, как обсуждалось выше, включается в отображенную форму и графическое очерчивание зоны принятия на дисплее.
Как упоминалось выше, отверстие регургитации не всегда присутствует как единственное маленькое отверстие утечки в закрытом клапане. Утечки могут проходить через щелевые отверстия или множество маленьких утечек. Фиг. 5 представляет собой иллюстрацию применения реализации настоящего изобретения для оценки скорости потока и объемного потока через щели и множественные утечки в закрытом клапане. Как проиллюстрировано на фиг. 5, процесс по настоящему изобретению выполняется для ряда положений отверстия, выстроенных вдоль имеющего утечку митрального клапана 100′. Данные дискретные положения маленького отверстия могут быть использованы для моделирования сложных щелеподобных отверстий или множества отверстий в закрытом клапане. На фиг. 5 показан пример трех таких определений, каждое - со своей зоной принятия, показанной внешними границами зоны 106, 106′ и 106″ и векторами потока (показаны маленькими стрелками), направленными со сходимостью в другом положении отверстия вдоль клапана 100′. Поле вектора скорости, ассоциированное с каждым маленьким отверстием, объединяется векторно с другими отверстиями, в результате чего задается единственная комбинированная зона принятия вдоль одного объединенного векторного поля скорости. Для множества отверстий объединенное векторное поле скорости теперь аппроксимирует истинные физиологические векторы скорости (~Vtrue, выход блока 50 на фиг. 2). Обработка объединенного векторного поля скорости определяет скорость потока или объемный поток всех маленьких отверстий, соответствующих целой щели вдоль закрытия митрального клапана. Хотя на фиг. 5 приведен пример векторного поля скорости, сгенерированного по трем маленьким отверстиям, для адекватного моделирования щели может быть использовано произвольное число отверстий. Зоны принятия, используемые для каждого измерения, могут объединяться, как показано на фиг. 5, поскольку поток, который определяется для объединенных отверстий, представляет собой векторный поток, направленный к уникальному отверстию или положению вдоль щели. В трехмерной реализации линия измерений не ограничивается прямой на плоскости, но может следовать нелинейной траектории закрытия листков митрального клапана.
Фиг. 6 иллюстрирует характеристики отклика двух допплеровских фильтров пульсаций стенок сосудов, которые могут быть использованы в реализации настоящего изобретения. Координаты абсциссы графика на фиг. 6 приведены в единицах пределов Найквиста для выборочных данных фильтра пульсаций стенок сосудов, при этом пределы +1 и -1 представляют собой нормализованные пределы Найквиста для фильтра, соответствующие скоростям тока крови. Нулевое (DC, или отсутствие тока) состояние находится в центре. Координаты по оси ординат показывают относительную амплитудную характеристику параметров фильтра. Кривая 140 отклика представляет собой типичную кривую отклика фильтра пульсаций стенок сосудов для измерения тока крови и может быть использована в реализации настоящего изобретения. Данная характеристика имеет нулевой отклик в центре, что приводит к отсутствию реакции на неподвижные объекты, такие как неподвижные стенки сосудов. Видно, что отклик постепенно увеличивается при прохождении кривой от нуля, при этом максимальным является отклик при пределах Найквиста для потоков с наибольшей скоростью, обнаруживаемых без искажения при выбранном интервале дискретизации. В результате, данная характеристика отклика является более чувствительной к току при наивысших скоростях потока.
Кривая 150 отклика представляет собой кривую, которая часто является предпочтительной для фильтра пульсаций стенок сосудов в реализации настоящего изобретения. Видно, что отклик данной кривой 150 имеет максимум при относительно высокой, но промежуточной частоте дискретизации, прямо над ±0,5 Найквиста, предпочтительно, в диапазоне от 1/2 до 2/3 Найквиста, и снижается до нулевого отклика при пределах Найквиста. Данная характеристика фильтра спроектирована таким образом, чтобы она была более чувствительной к более низким скоростям потока, которые можно ожидать вокруг внешней границы 106 зоны принятия S. Полезно сдвинуть низкую чувствительность в сторону низкой скорости потока, которая имеет место при коротких ансамблях, обычно используемых для цветовой визуализации тока крови для регургитирующего потока. Это можно увидеть как более высокий отклик кривой 150 для низких скоростей около центра графика. Хотя видно, что кривая 150 падает до нуля при пределах Найквиста, такая потеря чувствительности к высокой скорости обычно является приемлемой, если взамен можно получить более высокую чувствительность для потоков с низкой скоростью.
Реферат
Изобретение относится к медицинской технике, а именно к ультразвуковым диагностическим системам. Диагностическая ультразвуковая система для измерения регургитирующего потока содержит ультразвуковой зонд, процессор изображений, фильтр пульсаций стенок сосудов, чувствительный к принятым отраженным сигналам, имеющий характеристику отклика, простирающуюся от нуля до пределов Найквиста, составляющих ±1, при этом характеристика отклика имеет только один максимум в диапазоне от 1/2 до 2/3 Найквиста, причем характеристика отклика постепенно увеличивается от нуля до максимума, система также содержит допплеровский процессор, процессор количественной оценки потока и устройство отображения. Изобретение позволяет повысить точность измерения. 9 з.п. ф-лы, 6 ил.
Формула
ультразвуковой зонд, имеющий матрицу преобразователей для передачи ультразвуковой энергии и приема отраженных ультразвуковых сигналов из местоположения регургитирующего потока в организме;
процессор изображений, чувствительный к принятым отраженным сигналам, для выдачи ультразвукового изображения местоположения регургитирующего потока;
фильтр пульсаций стенок сосудов, чувствительный к принятым отраженным сигналам, имеющий характеристику отклика, простирающуюся от нуля до пределов Найквиста, составляющих ±1, при этом характеристика отклика имеет только один максимум в диапазоне от 1/2 до 2/3 Найквиста, причем характеристика отклика постепенно увеличивается от нуля до максимума;
допплеровский процессор, чувствительный к принятым отраженным сигналам, проходящим через фильтр пульсаций стенок сосудов, для выдачи допплеровских ультразвуковых измерений скорости тока крови вблизи местоположения регургитирующего потока;
процессор количественной оценки потока, сконфигурированный для выдачи измерения поля скорости потока вблизи местоположения регургитирующего потока; и
устройство отображения, соединенное с процессором изображений и процессором количественной оценки потока, для отображения ультразвукового изображения местоположения регургитирующего потока и результата измерения потока, полученного из измерения с процессора количественной оценки потока.
при этом характеристика фильтра пульсаций стенок сосудов приспособлена для демонстрации высокой чувствительности к скоростям потока в поле скорости потока.

Комментарии