Формирование трехмерного изображения сердца плода посредством физиологически стробированного получения данных, не связанного с экг - RU2539006C2
Код документа: RU2539006C2
Чертежи


Описание
Настоящее изобретение относится к медицинским диагностическим ультразвуковым системам, в частности к ультразвуковым системам получения наборов данных трехмерного (3D) изображения сердца плода.
Ультразвук хорошо подходит для формирования изображения плода, поскольку формирование изображения происходит неинвазивным способом, без подвергания матери и плода воздействию ионизирующего излучения. Задача многих исследований плода состоит в том, чтобы оценить развитие анатомии плода и определить, развивается ли плод нормальным образом. Поскольку за последние годы качество ультразвукового изображения улучшилось, стало возможным для оценки развития визуализировать больше анатомических областей с большими подробностями. Следовательно, ультразвуковые исследования плода стали более полными, с повышенными требованиями к представлению анатомической структуры, которая должна обследоваться. Одной из областей анатомической структуры, которая тщательно исследуется, является развивающееся сердце плода. В последние годы пути оттока сердца стали центром повышенного внимания. Кардиальные пути оттока сердца плода, однако, с трудом поддаются формированию изображения. Одной из причин этого является небольшой размер этой анатомии плода. Другая причина состоит в том, что желательно видеть не просто анатомическую структуру, но также и динамику характеристик потока через пути оттока в полном цикле сердцебиения плода. Дополнительная причина состоит в том, что пути оттока подвергаются значительному развитию по мере роста плода и, следовательно, в зависимости от возраста плода могут происходить изменения внешнего вида и сложности. Пути оттока могут, таким образом, быть трудны для идентификации на ультразвуковом изображении и еще более трудным может быть получение кадра изображения в соответствующей ориентации для адекватного диагноза.
Некоторые из этих потребностей отошли в прошлое благодаря использованию с недавних пор трехмерного ультразвука для формирования изображения сердца плода. С помощью технологии формирования трехмерного изображения может быть получено полное изображение сердца плода и последовательность наборов данных трехмерного изображения может быть получена для воспроизведения и диагностики в последующее время. Когда в наборах данных получены данные всего сердца плода, данные изображения после их получения могут быть исследованы во время диагностики, чтобы определить местоположение путей оттока сердца. Из трехмерных данных при мультипланарной реконструкции (MPR) могут быть извлечены различные переменные плоскости двумерного изображения, так чтобы можно было исследовать плоскость изображения с желаемой ориентацией. Формирование трехмерных изображений направлено, таким образом, на многие задачи статических изображений, решение которых проблематично при двумерных изображениях плода. Недавно проблема анализа динамики во времени кровотока плода была решена способом, получившим название "пространственно-временная корреляция изображения" или STIC. При STIC осуществляется свиппирование сердца плода с помощью ультразвука и многочисленные кадры изображения получают в течение последовательности циклов сердцебиения. Когда сканирование проводится вручную с двумерным ультразвуковым зондом, такое получение изображения может занимать десять или более секунд. Такой же сбор данных может быть выполнен с помощью механического трехмерного зонда, который механически свиппирует плоскость изображения, проходящую через область сердца плода, но трехмерные механические зонды часто имеют ухудшенную фокусировку по высоте, которая приводит к неточностям при реконструкции изображения MPR в направлении по высоте. После того, как получение данных закончено и кадры изображения сохранены, кадры изображения желаемой анатомической структуры, создаваемой при реконструкции MPR, если необходимо, повторно собираются в последовательность изображений в соответствии с их фазовой последовательностью в цикле сердцебиения плода. Эта задача становится трудной из-за того факта, что для этого повторного упорядочивания сигнал электрокардиограммы (ЭКГ) сердцебиения плода недоступен. ЭКГ плода не может быть получена во время формирования изображения, так как электроды ЭКГ не могут быть присоединены к плоду, и электрические импульсы плода подавляются собственными сигналами ЭКГ матери. Следовательно, из изображений сердца плода необходимо извлечь синтетический сигнал синхронизации цикла сердцебиения плода. Это выполняется путем определения события переключений, основываясь на перемещении ткани плода в сердце или вблизи сердца, как описано в патенте США 7261695 (Brekke и др.). Синтетические сигналы переключения цикла сердца затем используются для повторного упорядочивания изображений, полученных из многочисленных сердцебиений, в одну последовательность цикла сердцебиения, в которой кадры имеют порядок, соответствующий фазам сердцебиения.
Способ STIC, однако, не лишен сложностей. Одной из них является надежность алгоритма повторной сборки. Так как типичное получение данных создает слишком много изображений, чтобы проводить изменение порядка вручную, были разработаны алгоритмы, позволяющие проводить изменение порядка кадров автоматически. Эти алгоритмы зависят от качества данных изображения, которое может быть ниже требуемого. Были приложены усилия, чтобы улучшить эту ситуацию, используя рекомендуемое манипулирование зондом для получения оптимального набора данных, но оно зависит от способа и использование при этом анатомической статистики может сделать его зависимым от индивидуального пациента. Но большей проблемой является все же то, что плод часто движется и может не оставаться неподвижным в течение всех десяти или более секунд, необходимых для получения данных. Когда плод движется, данные ориентации желаемого изображения относительно зонда будут меняться и плод может полностью выйти из поля зрения, приводя в результате к отсутствию возможности получения желаемой анатомической структуры из полученного набора данных. Кроме того, движение плода во время получения данных ограничивает точность производного синтетического цикла сердцебиения плода, что вносит артефакты в реконструированные трехмерные данные. Соответственно, желательно преодолеть эти трудности при формировании изображения сердца плода в целом, и те трудности, которые представляются способом STIC, в частности. В соответствии с принципами настоящего изобретения, описывается диагностическая ультразвуковая система, которая собирает наборы трехмерных данных сердца плода, стробированные в цикле сердцебиения плода посредством физиологически получаемого сигнала стробирования. Сердце плода отображается посредством формирования одномерного, двумерного или трехмерного изображения и собираются сигналы, отраженные от цели, демонстрирующей соответствующее движение. Для формирования изображения сердца плода целью может быть, например, сердечная мышца плода или кровоток в каротидной артерии плода. Сигналы движения обрабатываются, чтобы создать сигнал стробирования, синхронизированный с циклом сердцебиения плода, который используется для стробирования получения данных трехмерного изображения. Трехмерные наборы данных затем получают с временным отношением с фазой сердечного сокращения плода, используя этот физиологически полученный сигнал стробирования. Стробирование получения данных в трехмерном пространстве достигается намного легче с помощью двумерного матричного преобразователя, содержащего в себе микроформирователь луча, поскольку в этом случае плоскости формирования изображения могут создаваться электронно в любой последовательности или с любой ориентацией. Используя такой матричный преобразователь, последовательность цикла сердцебиения может обычно быть получена меньше, чем за одну секунду, и несколько последовательностей могут быть получены всего через несколько секунд. Так как полученные данные изображения уже синфазны с циклом сердцебиения плода, нет необходимости повторно упорядочивать данные изображения, и так как получение данных занимает всего несколько секунд, движение плода становится меньшей проблемой. Еще одно преимущество этого подхода, по сравнению с STIC, состоит в том, что пользователю могут быть предоставлены реконструированные изображения, которые показывают качество получения данных, так чтобы пользователь мог решить, присутствуют ли какие-либо артефакты движения, прежде чем завершить сбор информации. Если плод действительно движется во время короткого периода получения данных, положение зонда может быть изменено и выполняется другое получение трехмерных данных. Успешно полученные трехмерные данные могут после этого быть тщательно проанализированы во время диагностики, проводимой после получения данных.
На чертежах:
Фиг.1 - блок-схема диагностической системы формирования ультразвуковых изображений, соответствующая принципам настоящего изобретения.
Фиг.2 - изображение в М-режиме движения сердечной мышцы.
Фиг.3 - форма сигнала стробирования сердца, созданного из движения сердца.
Фиг.4 - объемная область, сканированная двумерным матричным преобразователем.
Фиг.5 - деление объемной области, показанной на фиг.4, на три субобласти.
Фиг.6a, 6b, и 6c - плоскости изображения трех субобластей, показанных на фиг.5.
Фиг.7a, 7b и 7c - сканирование трех объемных субобластей сердца матричным преобразователем.
Фиг.8a, 8b и 8c - три субобъема данных изображения, полученные последовательностью сканирования, показанной на фиг.7.
Фиг.9 - способ получения набора трехмерных данных сердца плода, используя физиологически полученный сигнал стробирования цикла сердцебиения.
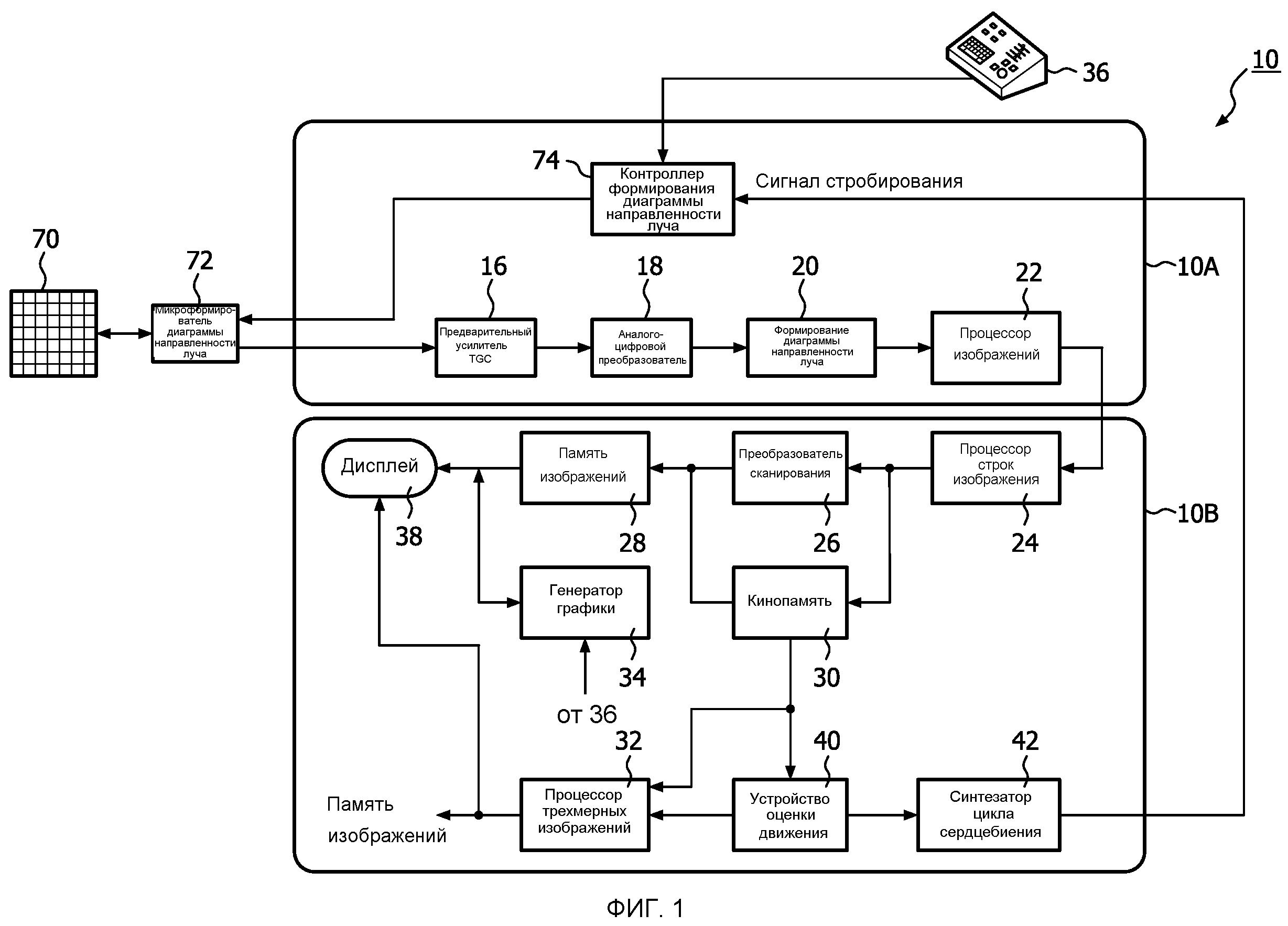
Обращаясь сначала к фиг.1, ультразвуковая система 10, выполненная в соответствии с принципами настоящего изобретения, показана в форме блок-схемы. Ультразвуковая система образована двумя субсистемами, внешняя субсистема 10А получения данных и субсистема 10B отображения. Ультразвуковой зонд подключается к субсистеме получения данных, которая содержит двумерный матричный преобразователь 70 и микроформирователь 72 луча. Микроформирователь содержит электрическую схему, управляющую сигналами, подаваемыми на группы элементов ("пэтчи") матричного преобразователя 70, и осуществляет обработку отраженных сигналов, принимаемых элементами каждой группы. Микроформирование луча в зонде предпочтительно сокращает количество проводников в кабеле между зондом и ультразвуковой системой и описывается в патенте США 5997479 (Savord и др.) и в патенте США 6436048 (Pesque).
Зонд соединяется с субсистемой 10A получения данных ультразвуковой системы. Субсистема получения данных содержит контроллер 74 формирователя диаграммы направленности, который реагирует на средство 36 управления пользователя и обеспечивает подачу управляющих сигналов на микроформирователь 72 луча, подавая команды на зонд в отношении синхронизации, частоты, направления и фокусировки лучей передачи. Контроллер формирования диаграммы направленности также управляет формированием диаграммы направленности для отраженных сигналов, принимаемых субсистемой получения данных, ее средством управления аналого-цифровыми (A/D) преобразователями 18 и формирователем 20 диаграммы направленности. Отраженные сигналы, принятые зондом, усиливаются предварительным усилителем и схемой 16 TGC (управления усилением во времени) в субсистеме получения данных и затем оцифровываются A/D преобразователями 18. Оцифрованные отраженные сигналы затем формируются в полностью управляемые и фокусируемые лучи формирователем 20 диаграммы направленности. Отраженные сигналы затем обрабатываются процессором 22 изображений, который выполняет цифровую фильтрацию, обнаружение в В-режиме и в М-режиме и допплеровскую обработку, и может также выполнить другую обработку сигнала, такую как разделение на гармоники, снижение спекла и другую требуемую обработку сигналов изображения.
Отраженные сигналы, созданные субсистемой 10A получения данных, подаются на субсистему 10B отображения, которая обрабатывает отраженные сигналы для отображения в желаемом формате изображения. Отраженные сигналы обрабатываются процессором 24 строк изображения, который способен осуществлять выборку отраженных сигналов, сращивать сегменты лучей в полные сигналы строк и усреднять сигналы строк для улучшения отношения сигнал/шум или послесвечения потока. Строки изображения для двумерного изображения являются сканированием, преобразованным в требуемый формат изображения преобразователем 26 стандарта развертки, который выполняет преобразование R-тета, известное в технике. Изображение затем сохраняется в памяти 28 изображений, из которой оно может отображаться на дисплее 38. Изображение в памяти также складывается с графикой, отображаемой вместе с изображением, которая создается генератором 34 графики, чувствительным к работе средства 36 управления пользователя.
Индивидуальные изображения или последовательности изображений могут сохраняться в кинопамяти 30 во время получения последовательностей или динамических изображений.
Для формирования объемных изображений в реальном времени субсистема 10B отображения также содержит процессор 32 предоставления трехмерного изображения, который принимает строки изображения от процессора 24 строк изображения для предоставления трехмерных изображений в реальном времени. Трехмерные изображения могут отображаться как динамичные (в реальном времени) трехмерные изображения на дисплее 38 или передаваться в память 28 изображений для хранения наборов трехмерных данных для анализа и диагностики в последующее время.
В соответствии с принципами настоящего изобретения устройство 40 оценки движения принимает дискретные во времени отраженные сигналы от обозначенного места отображаемой анатомической структуры и обрабатывает отраженные сигналы, чтобы создать сигнал, представляющий движение в обозначенном месте. Местом в анатомической структуре, от которого принимаются дискретные во времени отраженные сигналы, может быть место в изображении по умолчанию, такое как центр изображения, или это может быть место, обозначенное пользователем посредством манипулирования средством управления из средств 36 управления, управляемых пользователем. Например, пользователь может манипулировать ручкой управления, шаровым указателем или другим средством управления из средств управления, управляемых пользователем, чтобы определить местоположение объема выборки в каротидной артерии плода. Оценка движения может затем быть выполнена из выборок движущейся ткани или крови плода. Процессором изображений может выполняться часть этой обработки, такая как допплеровская обработка сигналов, отраженных от местоположения объема выборки. Скорость движения потока или ткани, полученная процессором изображений, может затем быть передана, например, непосредственно на устройство оценки движения. Если объем выборки расположен на ткани, такой как сердечная мышца плода, сигналы, отраженные от сердца плода, могут быть обработаны для определения движения посредством допплеровской обработки. Другой способ обнаружения движения состоит в слежении за движением спекла в данном месте расположения ткани в изображении. Еще один способ обнаружения движения состоит в сравнении изменений местоположения ткани по последовательным изображениям посредством совмещения блоков MSAD, как описано в патенте США 6299579 (Peterson и др.). Еще одним другим способом обнаружения движения является использование М-режима с М-линией, проходящей через сердце плода. Это показано на фиг.2, где показано изображение 60 в М-режиме, созданное М-линией, расположенной путем помещения курсора М-линии на ультразвуковое изображение так, чтобы она проходила через левый желудочек (LV) сердца плода. При размещении таким образом М-линия пройдет через миокардиальную стенку 12 на одной стороне сердца плода, через камеру LV и через миокардиальную ткань 14 на другой стороне сердца. Ультразвуковой луч проходит вдоль этого направления М-линии через LV периодически и принятая А-линия от каждой передачи показывается на дисплее, используя прокрутку вдоль ранее принятых А-линий. Результатом является изображения в М-режиме, как показано на фиг.2, где противоположные стороны сердца разделены больше всего, когда сердце плода расслабляется в конечной точке диастолы цикла сердцебиения, как указано стрелкой 52'. Противоположные стенки сердца находятся в непосредственной близости в фазе пика систолы цикла сердцебиения, как указано стрелкой 54'. На фиг.2 показана эта циклическая структура перемещения сердечной стенки по мере того, как сердце плода сжимается и расширяется при каждом сердцебиении плода. Следя за изменяющимся положением (движением) сердечной стенки 12 или 14, может быть создан сигнал, синфазный с сердечным циклом.
Хотя место для обнаружения движения может быть обозначено в двумерном или трехмерном изображении, предпочтительно использовать двумерное изображение из-за его более высокой частоты кадров и поэтому более высокой частоты выборки. М-линия для обозначения места, используя М-режим, как показано на фиг.2, может обеспечить еще более высокую частоту выборки. Местоположение объема выборки, М-линии, или другого курсора, который выбирается средством 36 управления пользователя, передается на генератор 34 графики, так чтобы это место могло непрерывно обновляться и отображаться в ультразвуковом изображении, которое видит пользователь, когда устанавливает положение курсора. В варианте осуществления настоящего изобретения необходимо, чтобы оцениваемое движение было связано с движением бьющегося сердца плода. Таким образом, движущаяся сердечная мышца плода и кровоток в каротидной артерии плода снабжают превосходные источники отраженных сигналов обнаружения движения, связанного с сердцебиением плода.
Сигналы, представляющие обнаруженное движение, связываются с синтезатором цикла сердцебиения, который создает сигналы, представляющие цикл сердцебиения плода. Сигналы цикла сердцебиения плода могут быть непрерывной последовательностью сигналов, приближающихся по форме к сигналу 62 такому, как показан на фиг.3, где показана форма сигнала сердцебиения, созданного из объема выборки посредством обработки при тонкой визуализации движения, как описано в патенте США 5718229 (Pesque и др.), при которой следующие один за другим сигналы, отраженные от местоположения объема выборки, выделяются (вычитаются), чтобы обнаружить изменения сигнала, указывающие на движение. Форма волны может сглаживаться, если желательно, чтобы приобрести более периодически повторяющуюся, совместимую форму. Периодические сигналы могут использоваться для указания моментов стробирования при последующих фазах цикла сердцебиения. Альтернативно, сигналы сердцебиения могут создаваться только в требуемые моменты стробирования, когда изображение сердца плода должно быть получено в заданной фазе цикла сердцебиения. Например, если требуется последовательность изображений, полученных в конце диастолы, сигнал стробирования должен создаваться только в этот момент в каждом цикле сердцебиения. В примере, показанном на фиг.2, это должно быть тем временем в каждом цикле сердцебиения, когда пространство между сердечными стенками было самым большим, как показано стрелкой 52'. Сигналы цикла сердцебиения подаются на контроллер 74 формирования диаграммы направленности, где они используются для стробирования получения данных изображений сердца плода в требуемые моменты во время цикла сердцебиения плода. Так как последовательность изображений может теперь стробироваться для получения данных в известных фазах цикла сердцебиения, нет необходимости пытаться ретроспективно оценивать моменты времени для получения данных, как это делается в STIC, и нет никакой необходимости повторно упорядочивать изображения, так как они получены и, таким образом, уже располагаются в порядке фаз цикла сердцебиения.
Время и способ, используемые для получения наборов трехмерных данных сердцебиения плода, зависят от протяженности анатомической структуры, которая должна сканироваться. Если объемная область, для которой должны быть собраны наборы трехмерных данных, является относительно малой, может быть возможным получение наборов трехмерных данных при одиночном объемном свиппировании. Это означает, что последовательность изображений для воспроизведения в качестве динамичных изображений полного цикла сердцебиения может быть получена в одиночном цикле сердцебиения. Так как частота сердечного ритма плода обычно намного выше, чем у детей или у взрослых, это означает, что необходимые наборы трехмерных данных полного цикла сердцебиения могут быть получены меньше, чем за полсекунды.
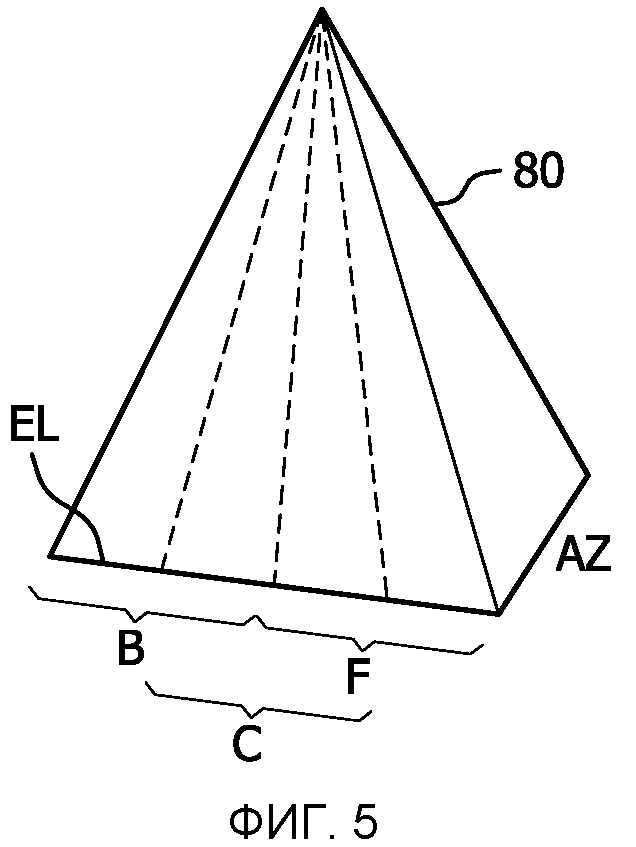
Когда объемная область является большой, объем может быть сканирован с помощью последовательно собираемых данных по субобъемам, которые затем объединяются для воспроизведения в качестве динамичного изображения полного объема, как описано в патенте США 5993390 (Savord и др.). Наборы трехмерных данных для каждого субобъема собираются для полного цикла сердцебиения. Субобъемы затем пространственно выравниваются и воспроизводятся синхронно с фазой сердца. Фазовый синхронизм получения и воспроизведения данных может, таким образом, полагаться на физиологически полученный сигнал стробирования фазы сердцебиения, соответствующий настоящему изобретению. Этот способ с сегментированным полным объемом поясняется на фиг.4-8. На фиг.4 показана полная объемная область 80, которая сканируется посредством операции, выполняемой фазированной матрицей преобразователя 70 ультразвуковой системы 10, показанной на фиг.1. В этом примере полный объем имеет форму прямоугольной пирамиды. Высота пирамиды от вершины до основания определяет глубину отображаемой области, которая выбирается в соответствии с такими факторами, как частота и глубина проникновения лучей. Наклон боковых граней пирамиды определяется степенью управления, прикладываемого к лучам, которые, в свою очередь, помимо прочих соображений, выбираются с учетом задержек, доступных для управления лучом и чувствительности преобразователя к управлению лучом во внеосевом направлении (наклона под острым углом).
Полная объемная область, такая как объемная область 80, может иметь достаточный размер, чтобы охватить все сердце плода для трехмерного изображения. Однако время, требующееся для сканирования полностью всей объемной области 80, чтобы визуализировать все сердце, может быть слишком большим для получения удовлетворительного изображения в реальном времени, или может занять слишком много времени, так что появляются артефакты движения, или то и другое. Чтобы преодолеть эти ограничения, вся объемная область 80 делится на субобъемы B (задний), C (центральный) и F (передний), как показано на фиг.5. Хотя объемная область 80 может стягивать в направлении азимута (AZ) угол 60°, например, субобъемы будут стягивать меньшие углы. В примере, показанном на фиг.5, каждый из субобъемов стягивает угол 30°. Это означает, что для одной и той же плотности и глубины луча каждый субобъем может быть сканирован за половину времени сканирования всей объемной области 80. Это приведет в результате к удвоению частоты кадров отображения в реальном времени. Субобъемы могут быть сделаны непрерывными или накладывающимися. Например, если угол полной объемной области был 90°, могут использоваться три непрерывных субобъема по 30° каждый. Альтернативно, для полной объемной области с углом 60°, три субобъема по 20° могут использоваться для еще более высокой частоты кадров. В примере, показанном на фиг.5, субобъемы B и F непрерывны в центре полной объемной области 80 и субобъем C центрируется в центре области 80, обеспечивая 50-процентное перекрытие непрерывных субобъемов. Если бы плоскость была получена для каждого из субобъемов B, C, и F посредством прямого сканирования или реконструкции MPR, то плоскости должны были бы иметь формы, показанные на фиг.6a, 6b и 6c.
Субобъемы B, C и F сканируются по полному циклу сердцебиения, в одном непрерывном интервале или более мелкими, перемещающимися во времени интервалами, как показано на фиг.7a, 7b и 7c. На фиг.7a показан субобъем B, сканируемый матричным преобразователем 70, который в этом примере собирает наборы трехмерных данных левого предсердия и части левого желудочка. На фиг.7b показан сканируемый субобъем C, который в этом примере собирает наборы трехмерных данных остальной части LV, большей части левого предсердия и аорты. На фиг.7c показан сканируемый субобъем F, который собирает наборы трехмерных данных правой части LV, аорты и правого желудочка. Таким образом, эти три субобъема собирают наборы трехмерных данных фактически всего сердца и по полному циклу сердцебиения. На фиг.8a, 8b и 8c показаны трехмерные изображения каждого субобъема. Когда эти три субобъема сливаются вместе при пространственном выравнивании и воспроизводятся с фазовым синхронизмом, все сердце плода можно видеть в последовательности динамичного трехмерного изображения полного цикла сердцебиения. Воспроизведение может быть остановлено, чтобы тщательно исследовать сердце в трехмерном изображении в любой точке цикла сердцебиения, и выбранные плоскости, проходящие через объем, могут быть реконструированы посредством MPR, а для анализа сердца плода выбираются двумерные представления.
Независимо от того, сколько получается субобъемов, или от количества перекрытий, другое преимущество получения данных по субобъемам со стробированием по времени состоит в том, что пользователю может быть предоставлен полный объем данных, которые обновляются в псевдореальном времени подобно концепциям, описанным в патентах США 5993390 (Savord и др.) и 5099847 (Powers и др.). Это может быть достигнуто созданием полного объема, как только был собран один полный набор для субобъемов, и последующим циклическим проходом через последовательность субобъемов, обновляя полный объем каждый раз, когда собираются данные для нового субобъема. Таким образом, полное объемное изображение представляется пользователю с более высокой скоростью субобъемов, позволяя, таким образом, пользователю либо оценивать сердце плода динамически (в псевдореальном времени), либо, альтернативно, динамически определять, когда было получено полное объемное изображение с хорошим качеством, и сохранить его для последующего просмотра.
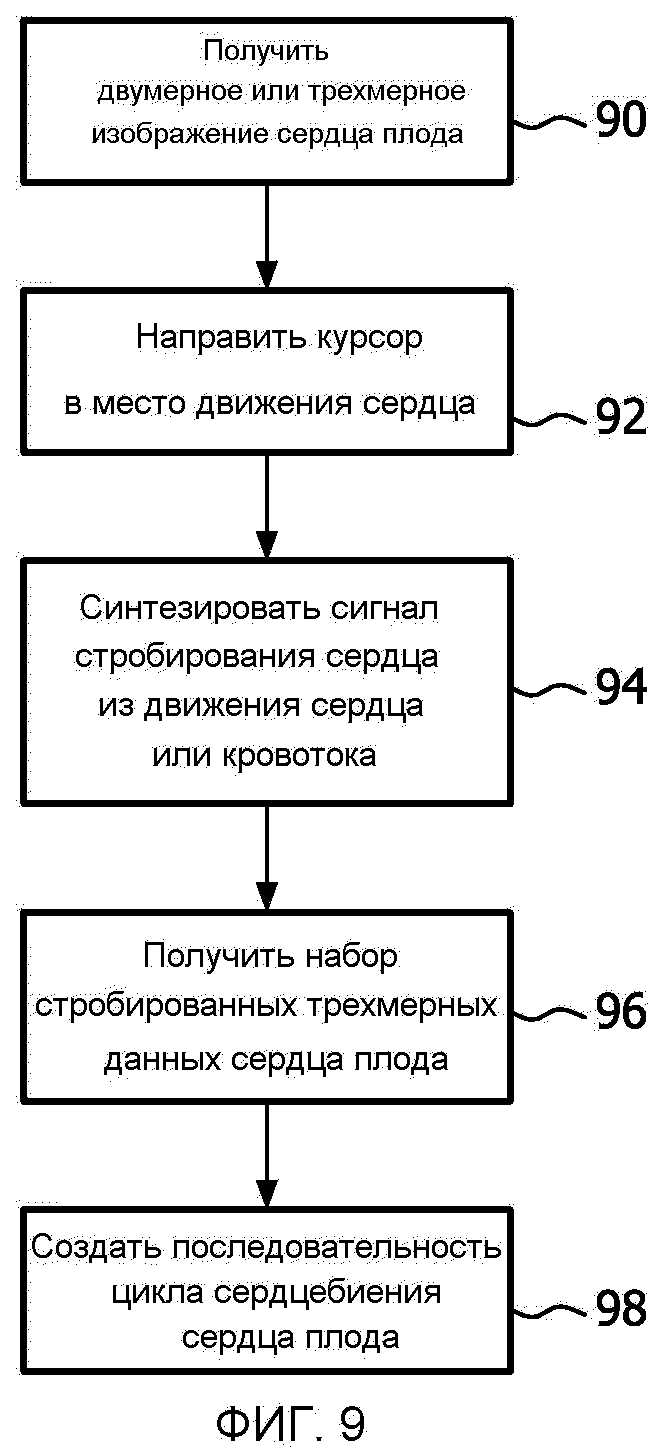
На фиг.9 показана процедура получения наборов трехмерных данных для динамичной последовательности трехмерного изображения сердца плода. На этапе 90 сердце плода отображается в режиме реального времени. Получение двумерных или трехмерных изображений для указания места оценки его движения не делается автоматически. Если желательно тщательно исследовать путь оттока для плода, например, путь оттока может заметно быть виден в области изображения. На этапе 92 клинический врач перемещает курсор по ультразвуковому изображению к месту, в котором должно оцениваться движение сердца. При этом размещение объема выборки может производиться на движущейся ткани сердца, в кровотоке каротидной артерии плода или посредством расположения М-линии так, чтобы она, например, пересекала миокард сердца плода. На этапе 94 устройство оценки движения и синтезатор цикла сердца синтезируют сигнал стробирования сердца из указанного движения сердца или кровотока. На этапе 96 сигнал стробирования сердца используется, чтобы собрать один или более наборов трехмерных стробированных данных для сердца или для интересующей области в сердце такой, как пути оттока. Это может делаться автоматически, как только сигнал стробирования сердца стабилизировался, или это может быть сделано по команде клиническим врачом. Например, если плод движется, клинический врач может изменять положение зонда до тех пор, пока желаемая анатомическая структура сердца плода не окажется в центре изображения. Когда клинический врач поместил целевую анатомическую структуру в области изображения, как требуется, она нажимает кнопку на пульте 36 управления, чтобы дать системе команду получить данные. Когда сигнал стробирования сердца достаточно устойчив, ультразвуковая система затем должна собрать необходимые наборы трехмерных стробированных данных для диагноза. Меньше, чем через две секунды обычно можно получить полный набор данных для сердца в трех субобъемах, как показано на фиг.5-8. Таким образом, если плод остается неподвижным в течение всего двух секунд, наборы трехмерных данных диагностического качества для сердца плода могут быть успешно получены. На этапе 98 динамичная последовательность трехмерного изображения сердца плода создается из одиночного полученного набора трехмерных данных или объединяя наборы трехмерных данных, полученных по субобъемам.
Должно быть очевидным, что настоящее изобретение будет применимо для других типов обследований в дополнение к кардиологическим обследованиям плода. Например, рентгенологическое отделение может не иметь оборудования для ЭКГ при стробируемом исследовании сосудов. Способы, соответствующие настоящему изобретению, могут затем использоваться для получения сигналов стробирования при получении данных для обследования сосудов.
Реферат
Изобретение относится к медицине. Ультразвуковая диагностическая система формирования изображения для анализа сердца плода содержит зонд для формирования трехмерного изображения, средство управления пользователя, устройство оценки движения, реагирующее на сигналы, отраженные от обозначенного места, контроллер зонда, реагирующий на сигнал стробирования, и дисплей, реагирующий на наборы трехмерных данных для создания трехмерного изображения сердца. Зонд выполнен с возможностью получения наборов данных изображения сердца и отраженных сигналов в М-режиме от выборочно устанавливаемой М-линии. Средство управления пользователя выполнено с возможностью установки положения курсора М-линии, обозначающего место движения в анатомической структуре на ультразвуковом изображении, которое представляет цикл сердцебиения. Устройство оценки движения выполнено с возможностью обработки отраженных от М-линии сигналов для создания сигнала стробирования относительно цикла сердцебиения. Контроллер зонда выполнен с возможностью предписания зонду получать наборы трехмерных данных в заданных фазах цикла сердцебиения, как определено сигналом стробирования, для формирования трехмерных изображений. При этом формируют изображение сердца плода с использованием двумерных или трехмерных ультразвуковых изображений. Направляют курсор М-линии в место движения сердца. Получают одномерные отраженные сигналы в М-режиме от места движения сердца. Синтезируют стробированный сигнал получения данных из информации об отраженных сигналах при движении сердца. Получают наборы стробированных трехмерных данных о сердце, используя �
Формула
зонд для формирования трехмерного изображения, выполненный с возможностью получения наборов данных изображения сердца плода и отраженных сигналов в М-режиме от выборочно устанавливаемой М-линии;
средство управления пользователя, выполненное с возможностью манипулирования для установки положения курсора М-линии, обозначающего место движения в анатомической структуре на ультразвуковом изображении, которое представляет цикл сердцебиения плода;
устройство оценки движения, реагирующее на сигналы, отраженные от обозначенного места, выполненное с возможностью обработки отраженных от М-линии сигналов для создания сигнала стробирования относительно цикла сердцебиения плода;
контроллер зонда, реагирующий на сигнал стробирования, выполненный с возможностью предписания зонду получать наборы трехмерных данных в одной или более заданных фазах цикла сердцебиения плода, как определено сигналом стробирования, для формирования трехмерных изображений; и
дисплей, реагирующий на наборы трехмерных данных для создания трехмерного изображения сердца плода.
которая дополнительно содержит процессор субобъемов, выполненный с возможностью обновления объема трехмерного изображения с помощью вновь полученных наборов трехмерных данных субобъема.
- формируют изображение сердца плода, используя формирование двумерных или трехмерных ультразвуковых изображений,
- направляют курсор М-линии в место движения сердца;
- получают одномерные отраженные сигналы в М-режиме от места движения сердца,
- синтезируют стробированный сигнал получения данных из информации об отраженных сигналах при движении сердца;
- получают наборы стробированных трехмерных данных о сердце плода, используя синтезированный стробированный сигнал получения данных; и
- формируют последовательность динамических трехмерных изображений сердца плода из наборов трехмерных данных.
зонд для формирования трехмерных изображений, выполненный с возможностью получения наборов трехмерных данных изображения движущейся анатомической структуры;
средство управления пользователя, выполненное с возможностью манипулирования для установки положения курсора М-линии, обозначающего место движения в ультразвуковом изображении анатомической структуры;
устройство оценки движения, реагирующее на сигналы, отраженные от обозначенного места М-линии, выполненное с возможностью обработки отраженных сигналов для создания сигнала стробирования относительно движения анатомической структуры,
контроллер зонда, реагирующий на сигнал стробирования, выполненный с возможностью предписания зонду получать наборы стробированных трехмерных данных в одной или более заданных фазах сигнала стробирования для формирования трехмерных изображений; и
дисплей, реагирующий на наборы трехмерных данных для создания последовательности динамических трехмерных изображений движущейся анатомической структуры.

Комментарии