Управляющее устройство для управления введением пропофола для пациента - RU2713972C1
Код документа: RU2713972C1
Чертежи



Описание
Изобретение относится к управляющему устройству для управления введением пропофола для пациента, согласно ограничительной части пункта 1 формулы изобретения, и к способу управления введением пропофола для пациента, согласно ограничительной части пункта 4 формулы изобретения.
В способе такого вида устанавливается целевая величина биспектрального показателя (BIS), который должен достигаться по меньшей мере приблизительно внутри пациента. Затем контроллер вычисляет рекомендуемую скорость инфузии пропофола на основе целевой величины BIS и, возможно, дополнительно на основе измеренного уровня пропофола пациента для введения пропофола пациенту. При этом контроллер содержит модельный блок для вычисления скорости инфузии так, что при использовании модельного блока для определения чувствительности пациента к пропофолу с помощью математической модели с учетом величины биспектрального показателя (BIS) и, возможно, измеренного уровня пропофола в качестве входных переменных, может быть определена рекомендуемая скорость инфузии для введения пропофола пациенту с целью достижения целевой величины BIS.
Такой способ и соответствующее управляющее устройство для выполнения такого способа можно использовать, в частности, для обеспечения персональной для пациента анестезии в соответствии с медицинской необходимостью, при этом указанный способ и указанное управляющее устройство для выполнения такого способа имеют целью предотвращение излишней или недостаточной инфузии средств анестезии и предотвращение возможных побочных явлений. Указанный способ и указанное управляющее устройство дополнительно подходят для учета в реальном времени метаболизма пациента. Используемый в указанном способе и в соответствующем управляющем устройстве контроллер позволяет предотвращать чрезмерную дозу, в частности, когда используется система с большой задержкой для введения анестетика, такого как пропофол, для пациента.
В последние годы пропофол является наиболее подходящим и широко используемым внутривенным анестетиком. Пропофол обеспечивает много преимуществ в качестве тотального внутривенного анестетика относительно фармакокинетического профиля, однако анестезиологи все еще имеют трудности при использовании внутривенных агентов для поддержания анестезии по сравнению со стандартными анестетиками, вводимыми с помощью калиброванных испарителей. Предлагались различные варианты для подходящих скоростей инфузии пропофола для поддержки удовлетворительной анестезии. Наряду со схемой инфузии вручную, разработана управляемая компьютером схема инфузии пропофола для достижения постоянного уровня в крови в течение всей операции. Однако такая схема имеет принципиальный недостаток невозможности изменения концентрации пропофола в крови в ответ на изменение хирургических и анестезиологических требований. Затем необходимо вводить летучие агенты для сохранения адекватной анестезии.
Фармакокинетика пропофола подвержена влиянию многих факторов. В публикации Thomas W. Schnider et al., ʺThe influence of method of administration and covariates on the pharmacokinetics in adult volunteersʺ, Anesthesiology, 1998, 88(5), стр. 1170-82 показано, что способ введения (таблетки или инфузия) влияет на фармакокинетику пропофола.
В публикации M. White and G.N.C. Kenny ʺIntravenous propofol anaesthesia using a computerized infusion systemʺ, Anaesthesia, 1990, том 45, стр. 204-209 предлагается управляемое компьютером устройство для инфузии пропофола, которое позволяет изменять концентрацию пропофола в крови в ответ на изменение хирургических или анестезиологических требований. Характеристики этого устройства оценивались посредством сравнения прогнозируемой концентрации пропофола в крови, выбранной анестезиологом для создания удовлетворительного уровня анестезии, с величинами, измеренными в пробах крови. Однако эта система имеет тот недостаток, что невозможно измерять концентрацию внутривенного анестетика в крови в реальном времени.
В последнее время стали коммерчески доступными основанные на фармакокинетике, управляемые компьютером системы, такие как, например, система Diprifusor (SatraZeneca Pharmaceuticals, UK), которые были разработаны для достижения и поддержания целевой концентрации пропофола в крови, имеющие приемлемую степень точности.
ʺTarget Controlled Infusionʺ TCI (прицельно управляемая инфузия) обозначает поддерживаемую компьютером систему инфузии, которая вычисляет концентрацию вещества в конкретной ткани тела на основе математических моделей и которая, после установки анестезиологом целевой концентрации, регулирует скорость инфузии до достижения целевой концентрации. Система TCI инфузии состоит из инфузионной системы (системы из насоса и шприца) и компьютера или микропроцессора. С помощью монитора или интерфейса человек-машина можно задавать параметры, такие как возраст пациента, вес, пол, тип анестетика и желаемая фармакокинетическая модель, а также вводимая концентрация вещества в крови пациента. Микропроцессор вычисляет скорости инфузии и управляет насосом шприца и монитором на основе этих данных. Звуковые и визуальные сигналы информируют анестезиолога о проблемах инфузии (таких как разъединение, закрывание, окончание инфузии и т.д.). Дополнительно к этому, монитор отображает как графически, так и в числовом виде, текущий ход инфузии, выполненный объем инфузии и ожидаемую кривую зависимости концентрации от времени в завершение инфузии. В принципе, все действующие короткое время внутривенные анестетики с известной фармакокинетикой и фармакодинамикой пригодны для управления TCI.
На основе эмпирически определяемой популяционно-фармакокинетической модели и использования известного набора фармакокинетических и специальных для пациента фармакодинамических параметров медикамента (например, пропофола), а также с помощью специфических для пациента данных, насос TCI вычисляет концентрацию в зависимости от времени в плазме пациента или в области действия (мозг). Взаимодействия с дополнительно используемыми анестетиками также требуют регулирования дозы пропофола. Основное проблемой в управлении введением анестетика через систему TCI является правильный выбор индивидуальной целевой величины для соответствующей глубины анестезии, поскольку специфичная для пациента фармакокинетика и фармакодинамика могут отличаться о лежащей в основе популяционной фармакокинетической модели. Точность вычисления концентрации зависит также сильно от выбора математической модели. Во многих системах TCI используются математические модели для применения пропофола, разработанные Маршем и др. и Шнайдером и др. Оценка модели Марша для пропофола показывает отклонения между -7% и +30%, в одном случае 84%, между вычисленным и реально измеренным пропофолом в крови. Таким образом, желательно использовать фармакокинетические модели, в которых учитывается большее количество индивидуальных переменных и которые обеспечивают более точное вычисление концентрации вещества и тем самым согласованную с пациентом анестезию.
В связи с разработкой и увеличивающимся использованием этих систем с управляемой целевой инфузией (TCI), несколько исследовательских групп изучали корреляцию концентрации пропофола с динамическими эффектами.
В публикации A.R. Absolom et al. ʺPharmacokinetic models for propofol - defining and illuminating the devil in detailʺ, British Journal of Anaesthesia, 2009, 103(1), стр. 26-37, обсуждаются фармакокинетические модели для пропофола. Прежние системы TCI предназначались для достижения заданной целевой концентрации в плазме пациента. Было установлено, что имеется гистерезис в соотношении между концентрацией в плазме и клиническим эффектом, вызванный задержкой в достижении равновесия концентрации в плазме и концентрацией в местах действия внутри центральной нервной системы, называемых местами действия. Скорость достижения равновесия плазмы и места действия зависит от факторов, которые определяют скорость доставки лекарственного средства к месту действия (таких как производительность сердца и церебральный поток крови), и фармакологических свойств, которые определяют скорость переноса лечебного средства через кровяной барьер мозга (растворимость липидов, степень ионизации и т.д.). Ход во времени достижения равновесия между плазмой и местом действия может быть описан математически с помощью постоянной скорости первого порядка, обычно называемой keO. Это понятие используется для описания скорости исключения лекарственного средства из места действия в теле, но место действия рассматривается как имеющее пренебрежительно малый объем, так что нет необходимости в разделении постоянных, описывающих постоянные скорости движения в отделение действия и из него (keO определяет пропорциональное изменение в каждую единицу времени градиента концентрациимежду плазмой и местом действия). При нацеливании на место действия, система TCI манипулирует концентрацией в плазме для достижения концентрации в месте действия как можно быстрее. Когда целевая концентрация в месте действия увеличивается, то система TCI кратковременно повышает концентрацию в плазме до оптимального уровня над целевой концентрацией в месте действия. Если целевая концентрация в месте действия уменьшается, то система останавливает инфузию, позволяя падать концентрации в плазме, создавая тем самым градиент концентрации из места действия, пока оцениваемая концентрация в месте действия не упадет до новой целевой величины. При нацеливании на место действия, величина превышения концентрации в плазме, оцениваемая системой, зависит критически от keO, а также от оцениваемой скорости уменьшения концентрации в плазме. Оцениваемая скорость уменьшения концентрации в плазме также оказывает влияние на превышение. Естественно, что конечная скорость уменьшения, вызванная перераспределением, зависит от градиентов концентрации между отделениями.
Поскольку точность оценки самой концентрации в плазме и степени требуемого превышения зависит от точности нескольких параметров и предположений, то имеется множество возможных источников ошибок. Ошибки модели, приводящие к существенно высокой концентрации в крови, могут переноситься молодыми, находящимися в хорошей форме пациентами, но у престарелых пациентов они могут приводить к значительной сердечно-сосудистой нестабильности.
В публикации M.G. Irwin et al. ʺPropofol effective concentration 50 and its relationship to bispectral indexʺ, Anaesthesia, 2002, том 57, стр. 242-8, анализируется, как коммерчески доступная система TCI обеспечивает анестезию в клинической практике и как стандартные конечные точки, определяющие анестезию и потерю сознания, соотносятся с биспектральным показателем (BIS) и прогнозируемой концентрацией пропофола в крови и в месте действия. Действительно, как показывает М.Г. Ирвин и др. в своей публикации, имеется соотношение между эффективной концентрацией 50 пропофола (ЕС50) и биспектральным показателем (BIS). Это было затем подтверждено в публикации M. Iannuzzi et al. ʺRelationship between bispectral index, electroencephalographic state entropy and effect-site EC50 for propofol at different clinical endpointsʺ, Br J Anaesth, 2005, 94, стр. 613-16, в которой указаны концентрации пропофола в месте действия и величины BIS при потере вербального контакта (LVC) и при потере сознания (LOC).
Дополнительные последние исследования показали результаты, достигнутые с различными совокупностями пациентов, которые подтверждают результаты Ирвина и др. и Яннуцци и др. Эти результаты сведены в публикацию T.A. Lim ʺRelationship between bispectral index and effect-site EC50 for propofolʺ, Br J Anaesth, 2006, 267-268.
На основе доступной информации в уровне техники, можно коррелировать концентрацию в месте действия и биспектральный показатель (BIS) пропофола в заданных точках, например, при потере сознания, или в точках анестезии, т.е. нет больше необходимости в корреляции концентрации пропофола в месте действия с нервной реакцией.
Однако опубликованные фармакокинетические модели основаны на небольшом количестве пациентов, используемых в исследованиях и не пригодны для учета в реальном времени метаболизма.
Имеется потребность в надежном способе управления введением пропофола пациенту, который обеспечивает возможность быстрого, надежного поддержания уровня пропофола у пациента на желаемой целевой величине или вокруг нее, с целью, в частности, исключения опасности недостаточной или чрезмерной дозы анестетика у пациента.
Задачей данного изобретения является создание управляющего устройства и способа для управления введением пропофола пациенту, которые обеспечивают возможность надежного, вычислительно эффективного поддерживания желаемого целевого уровня пропофола.
Эта задача решена с помощью управляющего устройства, содержащего признаки пункта 1, и способа, содержащего признаки пункта 4 формулы изобретения.
В соответствии с этим,
- определяется чувствительность пациента к пропофолу с помощью математической модели с учетом биспектрального показателя (BIS) и, возможно, измеренного уровня пропофола в крови, и
- на основе предварительно заданной целевой величины BIS и, если доступен, измеренного уровня пропофола, вычисляется с помощью компьютера рекомендуемая скорость инфузии введенного пропофола для пациента.
Предпочтительно, контроллер при вычислении рекомендованной скорости инфузии на основе целевой величины BIS дополнительно учитывает также измеренный уровень пропофола пациента. При этом измеренный уровень пропофола пациента может учитываться непосредственно в качестве параметра при вычислении рекомендуемой скорости инфузии, или измеренный уровень пропофола может учитываться опосредованно через математическую модель при определении чувствительности к пропофолу. Поэтому чувствительность к пропофолу определяется с использованием математической модели с учетом в качестве параметров биспектрального показателя (BIS) и, если доступен, измеренного уровня пропофола в крови пациента.
В соответствии с этим, управляющее устройство, согласно изобретению, содержит монитор глубины анестезии, предпочтительно монитор биспектрального показателя (BIS), и, возможно, датчик лекарственного средства для измерения уровня пропофола.
Данное изобретение основывается на идее использования математической модели для определения величины специфичной, зависимой от ситуации чувствительности пациента к пропофолу. Модель учитывает биспектральный показатель (BIS) и, возможно, фактически измеренный уровень пропофола у пациента. Кроме того, например, введение других веществ, таких как анальгетики, подобные Alfentanil® или Remifentanil®. Модель приводит фактическую скорость инфузии и биспектральный показатель (BIS) во взаимосвязь друг с другом, при этом взаимосвязь определяется количественно с помощью чувствительности к пропофолу.
Биспектральный показатель (BIS) относится к безразмерному числу между 0 (глубокая анестезия) и 100 (пробуждение). Публикации показывают, что BIS тесно коррелирует с различными количествами успокоительных средств и концентрации анестетиков в крови. Типичная корреляция числа BIS и состояний анестезии показана в таблице.
Модель предпочтительно является так называемой фармакокинетической-фармакодинамической (PK-PD) моделью, учитывающей специфичные параметры пациента, такие как рост, вес, возраст, пол, индекс массы тела (BMI) и/или другие параметры пациента для моделирования фармакодинамики и фармакокинетики пропофола в пациенте.
Модель PK-PD для пропофола известна в уровне техники как так называемая «3+1 PK-PD модель», как будет пояснено ниже со ссылками на фиг. 2. Модель основана на так называемой модели Шнайдера или так называемой модели Марша.
Заявителями было неожиданным образом установлено, что надежность управляющего устройства или способа для управления введением пропофола для пациента может быть улучшена, когда существующая «3+1 PK-PD модель» расширена на два других отделения, отделение Х удаления и датчика S BIS. Отделение Х является отделением удаления, которое моделирует задержку действия концентрации пропофола на биспектральный показатель (BIS). В частности, физиологическая задержка, а также вычислительная задержка, возможно вызванная обработкой сигналов в модели BIS, моделируется в отделении Х. Отделение S представляет сам датчик BIS. Модель, согласно изобретению, поясняется ниже со ссылками на фиг. 3.
Расширенная 3+1 PK-PD модель, согласно изобретению, имеет несколько преимуществ. Модель, согласно изобретению, оценивает чувствительность пациента к пропофолу и настраивает параметры модели в соответствии с глубиной анестезии и, если доступно, измеренным уровнем лекарственных средств. В другом варианте выполнения в расширенной 3+1 PK-PD модели используется адаптивный способ управления, согласно изобретению. Адаптивный способ управления, согласно изобретению, предвведен для нацеливания на уровень BIS, а не на концентрацию пропофола. Данное изобретение особенно пригодно для использования в хирургических блоках и в блоках интенсивной терапии.
Соответственно, расширенная 3+1 PK-PD модель, согласно изобретению, основана на центральном отделении А, содержащем концентрацию Ср пропофола в крови, отделение CRD быстрого равновесия, отделение CSD медленного равновесия и отделение Е действия, содержащее концентрацию Се отделения действия пропофола. Отделения расширенной 3+1 PK-PD модели могут быть вычислены, как указано в уравнениях 1-10.
Отделение S может быть вычислено в соответствии с уравнением 1:

Где
sp представляет чувствительность к пропофолу пациента;
αM представляет параметр насыщения скорости действия анестетика, такого как пропофол (т.е. насыщение рецепторов пропофола);
kbo представляет скорость уменьшения биспектрального показателя BIS;
OF представляет смещение, которое может оставаться, когда больше нет анестетика, такого как пропофол, в теле пациента;
Х представляет отделение удаления; и
S представляет датчик BIS.
Отделение X может быть вычислено в соответствии с уравнением 2:

Где
s1 и s2 представляют постоянные параметры скорости переноса между отделением удаления и параметрами действия;
Ce представляет концентрацию отделения действия; и
X представляет отделение удаления.
Отделение CRD быстрого равновесия может быть вычислено в соответствии с уравнением 3:

Где
k12 постоянная исключения, указывающая распределения пропофола из центрального отделения А в направлении отделения CRD быстрого равновесия,
k21 постоянная исключения, указывающая распределения пропофола из отделения CRD быстрого равновесия в направлении центрального отделения А,
CRD представляет отделение быстрого равновесия, и
Cp представляет концентрацию в крови.
Отделение CSD медленного равновесия может быть вычислено в соответствии с уравнением 4:

Где
k13 постоянная исключения, указывающая распределения пропофола из центрального отделения А в направлении отделения CSD медленного равновесия,
k31 постоянная исключения, указывающая распределения пропофола из отделения CSD медленного равновесия в направлении центрального отделения А,
CSD представляет отделение медленного равновесия, и
Cp представляет концентрацию в крови.
Концентрация Ce отделения действия пропофола может быть вычислено в соответствии с уравнением 5:

Где
ke0 определяет скорость уменьшения действия пропофола;
k1e указывает «виртуальную» постоянную скорости переноса из центрального отделения А и отделения E действия;
CE представляет концентрацию отделения действия.
Концентрация CP в крови пропофола может быть вычислена в соответствии с уравнением 6:
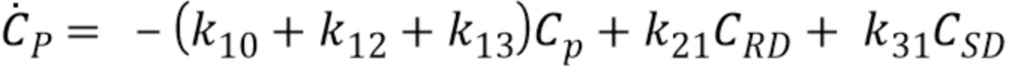
Где
k10 представляет постоянную исключения введенного лекарственного средства, такого как пропофол, из тела,
k12 постоянная исключения, указывающая распределение пропофола из центрального отделения А в направлении отделения CRD быстрого равновесия,
k21 постоянная исключения, указывающая распределение пропофола из отделения CRD быстрого равновесия в направлении центрального отделения А,
k13 постоянная исключения, указывающая распределения пропофола из центрального отделения А в направлении отделения CSD медленного равновесия,
k31 постоянная исключения, указывающая распределения пропофола из отделения CSD медленного равновесия в направлении центрального отделения А,
CRD представляет отделение быстрого равновесия, и
CSD представляет отделение медленного равновесия, и
Cp представляет концентрацию в крови.
В соответствии с этим, параметры keo и k1e можно оперативно настраивать во время анестезии, в частности, данное изобретение предлагает способ, в котором параметры keo и k1e можно оперативно настраивать в соответствии с величиной BIS в точках EC50 и ЕС95 во время анестезии. Возможность оперативной настройки означает, что keo и k1e можно регулировать, чтобы иметь во время потери сознания концентрацию Се отделения действия, равную величине Се50, указанной в уравнении 7:
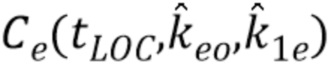

где
Ce представляет концентрацию отделения действия;
tLOC представляет момент времени потери сознания;
keo определяет скорость уменьшения действия пропофола;
k1e указывает «виртуальную» постоянную скорости переноса из центрального отделения А и отделения E действия; и
Ce50 представляет концентрацию отделения действия в точке ЕС50 в соответствии с уравнением 8:
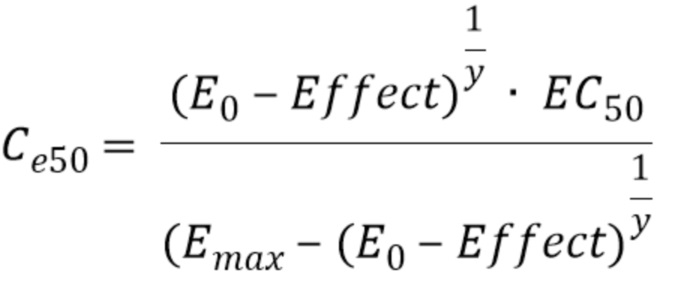
где Effect представляет зависимость концентрации-действия между EC50 и показателем BIS, при этом уравнение 8 выведено из уравнения 9:

при этом применимо уравнение 10:
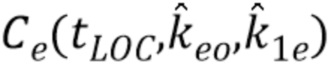

где в уравнениях 8-10:
E0 представляет первоначальную величину BIS действия в момент времени 0;
Emax представляет максимальную величину BIS действия;
y представляет коэффициент Хилла;
EC50 задает, сколько необходимо вводить пропофола для получения действия в 50% популяции пациентов;
tLOC представляет момент времени потери сознания;
keo определяет пропорциональное изменение в каждую единицу времени градиента концентрации между плазмой и местом действия;
k1e указывает постоянную исключения перераспределения пропофола из отделения E действия в центральное отделение А; и
Ce50 представляет концентрацию отделения действия в точке ЕС50.
Концентрация EC50 сдвигается при инфузии пропофола в комбинации с другими веществами, такими как анальгетики, подобные алфентанилу или ремифентанилу. В соответствии с этим, управляющее устройство и способ, согласно изобретению, могут учитывать взаимодействие пропофола с другими лекарственными средствами, такими как анальгетики, подобные Alfentanil® и Reminfentanil®. Это достигается с помощью повторной калибровки расширенной 3+1 PK/PD модели, согласно изобретению, после введения по меньшей мере одного анальгетика.
Другое преимущество данного изобретения состоит в том, что отделения расширенной 3+1 PK/PD модели повторно оцениваются в реальном времени. Это осуществляется предпочтительно с использованием наблюдателя Люнбергера. Наблюдатель Люнбергера относится к наблюдателям состояния, который обеспечивает оценку внутреннего состояния данной реальной системы посредством измерений входа и выхода реальной системы. Наблюдатели состояния, такие как наблюдатель Люнбергера, известны специалистам в данной области техники.
Контроллер, используемый в управляющем устройстве и в способе, согласно изобретению, может быть контроллером на основе модели, предпочтительно контроллером на основе расширенной 3+1 PK/PD модели, поясненной выше. Это имеет то преимущество, что можно учитывать данные BIS для достижения целевой величины BIS вместо достижения целевой величины концентрации пропофола. Использование указанного контроллера на основе модели поддерживает управление введением пропофола пациенту в реальном времени.
Если доступна система измерения концентрации лекарственного средства (датчик лекарственного средства), то отделения модели повторно оцениваются в реальном времени с использованием наблюдателя Люнбергера. Контроллер все еще является контроллером на основе модели для обеспечения включения/выключения датчика в различные моменты хирургической операции, когда требуется повышенная точность.
Кроме того, задача изобретения решена с помощью способа управления введением пропофола пациенту, в котором:
- устанавливается целевая величина BIS, и
- контроллер вычисляет рекомендуемую скорость инфузии для введения пропофола пациенту на основе целевой величины BIS и, возможно, измеренного уровня пропофола пациента.
При этом способ дополнительно содержит
- определение чувствительности к пропофолу пациента с помощью математической модели, учитывающей биспектральный показатель (BIS) и, возможно, измеренный уровень пропофола, и
- настройку параметров математической модели в соответствии с глубиной анестезии и/или уровня анестетика в теле пациента.
Преимущества и предпочтительные варианты выполнения, указанные выше относительно управляющего устройства, в равной мере относятся также к способу, согласно изобретению, так что делается ссылка на указанное выше.
Ниже приводится более подробное описание лежащей в основе изобретения идеи на основании вариантов выполнения со ссылками на прилагаемые чертежи, на которых изображено:
фиг. 1 - соотношение между эффективной концентрацией 50 пропофола (ЕС50) и биспектральным показателем (BIS);
фиг. 2 - блок-схема 3+1 PK/PD модели, согласно уровню техники;
фиг. 3 - блок-схема расширенной 3+1 PK/PD модели, согласно изобретению;
фиг. 4 - блок-схема управляющего устройства; и
фиг. 5 - зависимость концентрации от времени при различной активности контроллера.
На фиг. 1 показана взаимосвязь между эффективной концентрацией 50 пропофола (ЕС50) и биспектральным показателем (BIS). Фиг. 1 была показана в публикации T.A. Lim ʺRelationship between bispectral index and effect-site EC50 for propofolʺ, Br J Anaesth, 2006, 267-268 и демонстрирует подтвержденные результаты на различных составах пациентов. Эта информация обеспечивает путь соотнесения концентрации в месте действия и биспектрального показателя (BIS) в различных точках, таких как точка потери сознания (LOC) или точка анестезии.
Показанная на фиг. 1 зависимость между эффективной концентрацией 50 пропофола (ЕС50) и биспектральным показателем (BIS) выведен из уравнения Хилла:

при этом ЕС50=4,14 мкг/мл для пропофола, Emax=E0=100 и y=2.
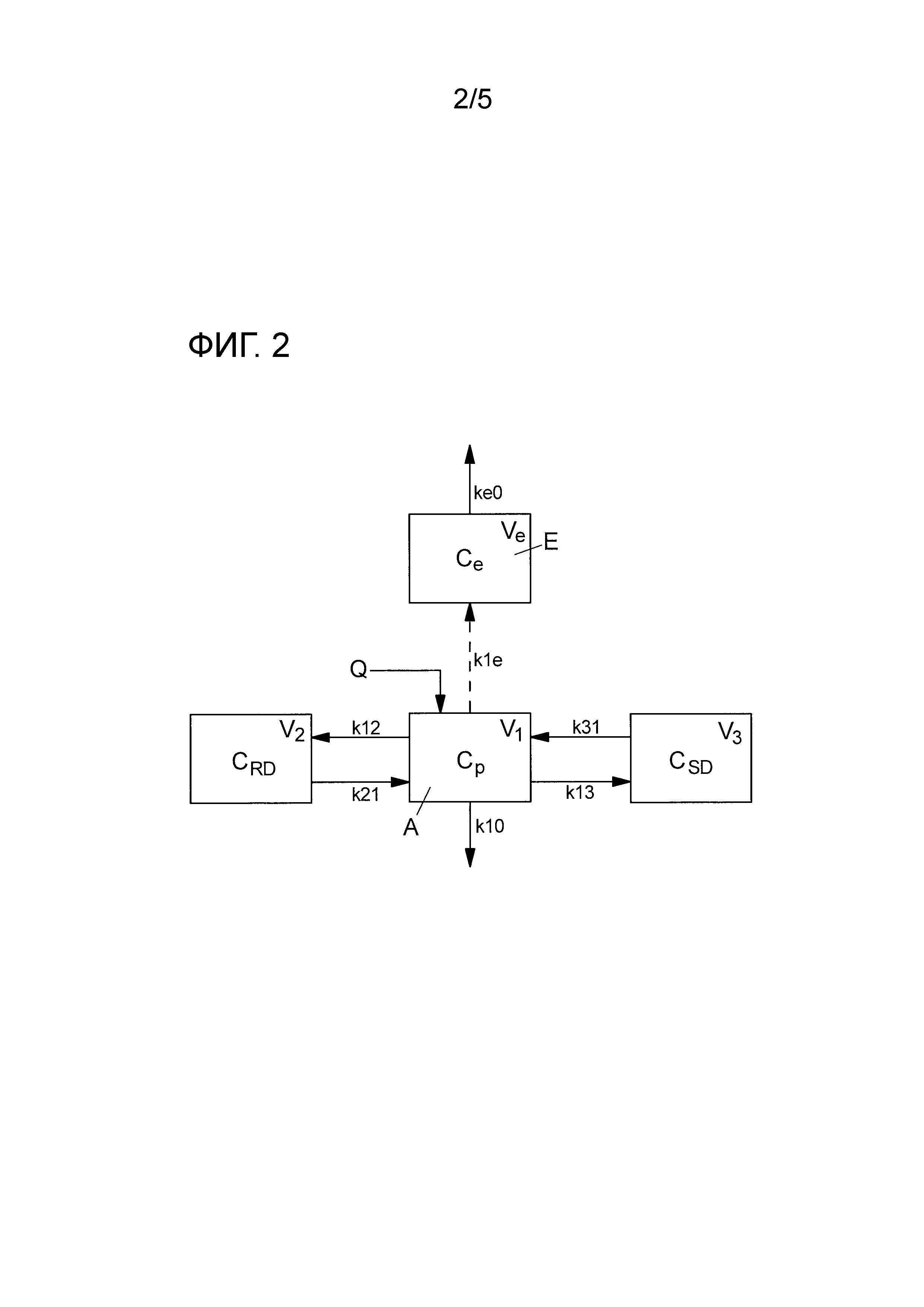
На фиг. 2 показана блок-схема 3+1 PK/PD модели, согласно уровню техники. Указанная 3+1 PK/PD модель содержит центральное отделение А, содержащее концентрацию Ср пропофола в крови, отделение CRD быстрого равновесия, отделение CSD медленного равновесия, отделение Е действия, содержащее концентрацию Ce отделения действия пропофола,
где
Q представляет введенное лекарственное средство,
keo определяет пропорциональное изменение в каждую единицу времени градиента концентрации между плазмой и местом действия;
k1e указывает постоянную исключения перераспределения пропофола из отделения E действия в центральное отделение А;
k12 постоянная исключения, указывающая распределение объема V1 в направлении объема V2,
k21 постоянная исключения, указывающая распределение объема V2 в направлении объема V1,
k13 постоянная исключения, указывающая распределение объема V1 в направлении объема V3,
k31 постоянная исключения, указывающая распределение объема V3 в направлении объема V1,
k10 представляет постоянную исключения введенного лекарственного средства, такого как пропофол, из тела.
На фиг. 2 показана так называемая модель Шнайдера, которую можно представить следующим образом: после внутривенной инъекции, лечебное средство Q быстро распределяется в циркуляции (называемой центральным отделением А) и быстро достигает хорошо проницаемых тканей. Затем происходят зависящее от тканей перераспределение в различных других отделениях, таких как мышцы или жирные ткани и наоборот из центрального отделения А. В то же время тело исключает введенное вещество из центрального отделения с определенной скоростью исключения. Для фармакокинетической характеристики липофильных анестетиков была создана состоящая из 3 отделений модель, которая содержит центральное отделение А (сердце, легкие, почки, мозг), отделение CRD быстрого равновесия (мышцы, внутренние органы) и отделение CSD медленного равновесия (жир, кости, так называемое «глубокое» отделение). Кривая зависимости концентрации от времени лекарственного средства характеризуется объемом распределения конкретного отделения и очисткой (объем плазмы, из которого исключается лечебное средство в единицу времени), при этом V1 обозначает объем центрального отделения, V2 - объем хорошо проницаемой ткани CRD, и V3 - объем плохо проницаемого отделения CSD. Очистка вещества из различных отделений может быть описана постоянными исключения и включает по определению описание направление распределения. Например, постоянная k12 исключения описывает распределение объема V1 в направлении объема V2, при этом k21 описывает распределение в противоположном направлении. Введенное вещество исключается с помощью этой модели из тела с постоянной k10 исключения. После достижения равновесия (стабильного состояния) между отдельными отделениями, скорость исключения определяет количество вещества, подлежащего подаче для сохранения равновесия. Внутривенно введенный анестетик сначала распределяется внутри центрального отделения А. Отсюда распределение происходит в направлении отделения Е действия и в периферийные отделения. Вещество исключается из центрального отделения А с постоянной k10.
Для поддержки клинического действия (так называемой фармакодинамики) лекарственного средства в месте действия, используются кривые доза-реакция. Эти обычно сигмоидальные кривые описывают связь между концентрацией лекарственного средства и частным клиническим действием. При знании этой взаимосвязи между дозой и реакцией можно вычислять предполагаемую концентрацию лекарственного средства в месте действия, отделение Е действия. Задержка между максимальной концентрацией в плазме и максимальным клиническим действием называется гистерезисом.
На фиг. 3 показана блок-схема расширенной 3+1 ЗЛ/PD модели, согласно данному изобретению, которая дополнительно содержит отделение Х удаления и датчик S биспектрального показателя BIS,
при этом
s1 и s2 представляют постоянные параметры скорости переноса между отделением Х удаления и отделением Е действия,
Sp представляет коэффициент скорости переноса между отделением Х удаления и монитором S глубины анестезии, и
kb0 представляет скорость уменьшения показателя BIS.
Клинически, Sp можно рассматривать в качестве чувствительности к пропофолу. Большая величина Sp приводит к короткой задержке системы и к высокой скорости реагирования системы.
Отделение Х удаления указывает задержку между концентрацией пропофола в отделении места действия и ее фактическим воздействием на величину BIS.
Отделение S представляет зависимый от пациента датчик BIS, т.е. текущую величину BIS, отображаемую на мониторе.
На фиг. 4 показана блок-схема управляющего устройства для управления введением пропофола пациенту, содержащего интерфейс 1 человек-машина, насос 2 инфузии, который содержит контроллер 3 для вычисления скорости инфузии введенного пропофола для пациента, монитор 6 глубины анестезии, такой как монитор биспектрального показателя BIS, и, возможно, датчик 7 лекарственного средства, который содержит дополнительно, согласно изобретению, блок 2 установки цели для установки целевой величины BIS, и модельный блок 4 для определения чувствительности к пропофолу пациента с помощью математической модели, учитывающей биспектральный показатель BIS и, возможно, измеренный уровень пропофола. Управляющее устройство может дополнительно содержать по меньшей мере один исполнительный механизм. Исполнительные механизмы в смысле данного изобретения являются любыми механическими частями насоса инфузии, включая, например, электродвигатель или другие механические части между приводимым в действие моделью контроллером и шприцем инъекции.
Обычно, при использовании управляющего устройства, согласно изобретению, оператор сначала включает монитор 6 глубины анестезии, такой как монитор BIS. Оператор обычно является анестезиологом или его медсестрой. Затем выбирается модель для целевой управляемой инфузии (TCI) для пропофола и устанавливается в управляющее устройство.
Модели TCI для пропофола известны из уровня техники. Введенные в последнее время системы управляемой инфузии с открытым целеуказанием могут быть запрограммированы с помощью фармакокинетической модели, и позволяют выполнять целеуказание для плазмы или для места действия. При указании цели места действия, целью является достижение заданной пользователем целевой концентрации в месте действия возможно быстрее посредством манипулирования концентрацией в плазме вокруг цели. Современные системы предварительно программированы с помощью фармакокинетических моделей Марша (B. Marsh et al. ʺPharmacokinetic model driven infusion of propofol in childrenʺ Br J Anaesth, 1991$ 67, стр. 41-48) и Шнайдера (Thomas W. Schnider et al., ʺThe influence of method of administration and covariates on the pharmacokinetics in adult volunteersʺ, Anesthesiology, 1998, 88(5), стр. 1170-82). Модель Марша является адаптированной моделью Гептса, в которой постоянные скорости фиксированы, в то время как объемы отделений и очистка пропорционально взвешены. Модель Шнайдера была разработана во время изучения комбинированного фармакокинетического-фармакодинамического моделирования. Она имеет фиксированные величины для определенных параметров, таких как k13 и k31, регулирует другие, такие как k12 и k21, для возраста, и регулирует k10 в соответствии с полным весом, массой тела без жира (LBM) и ростом. В режиме целевой плазмы модель Шнайдера начинает с малых первоначальных доз при запуске системы или с увеличения целевой концентрации по сравнению с моделью Марша. Таким образом, модель Шнайдера должна всегда использоваться в режиме целеуказания для места действия, в котором вводятся большие первоначальные дозы, хотя и меньшие, чем в модели Марша.
После выбора подходящей модели TCI оператор 8 затем должен ввести параметры пациента, такие как, например, возраст, пол, полный вес, масса тела без жира (LBM) и рост. После синхронизации модели/BIS для настройки параметра сброса модели, оператор 8 должен ввести целевую величину BIS. Затем можно выбирать, работает ли управляющее устройство в ступенчатом режиме или нет, при этом ступенчатый режим оказался наилучшим на практике для увеличения чувствительности пациента к пропофолу. Ступенчатый режим означает, что желаемая целевая величина BIS достигается не прямым линейным образом, а ступенчатым образом. В противоположность этому, если не выбран ступенчатый режим, то должно быть установлено время для достижения целевой величины BIS, представляющее активность контроллера. На следующей стадии запускается протокол. В точке LOC потери сознания оператор обычно нажимает клавишу LOC в системе (насосе или машине инфузии). Это подает сигнал обратной связи в протокол, что достигнута величина ЕС50 и приводит к повторной калибровке модели в соответствии с параметрами пациента и фактической величиной BIS. Для дальнейшего повышения точности врач, возможно, информирует систему о достижении величины EC95. Существует несколько технологий для простого определения этой величины во время хирургической операции, например, посредством определения непосредственно перед началом операции.
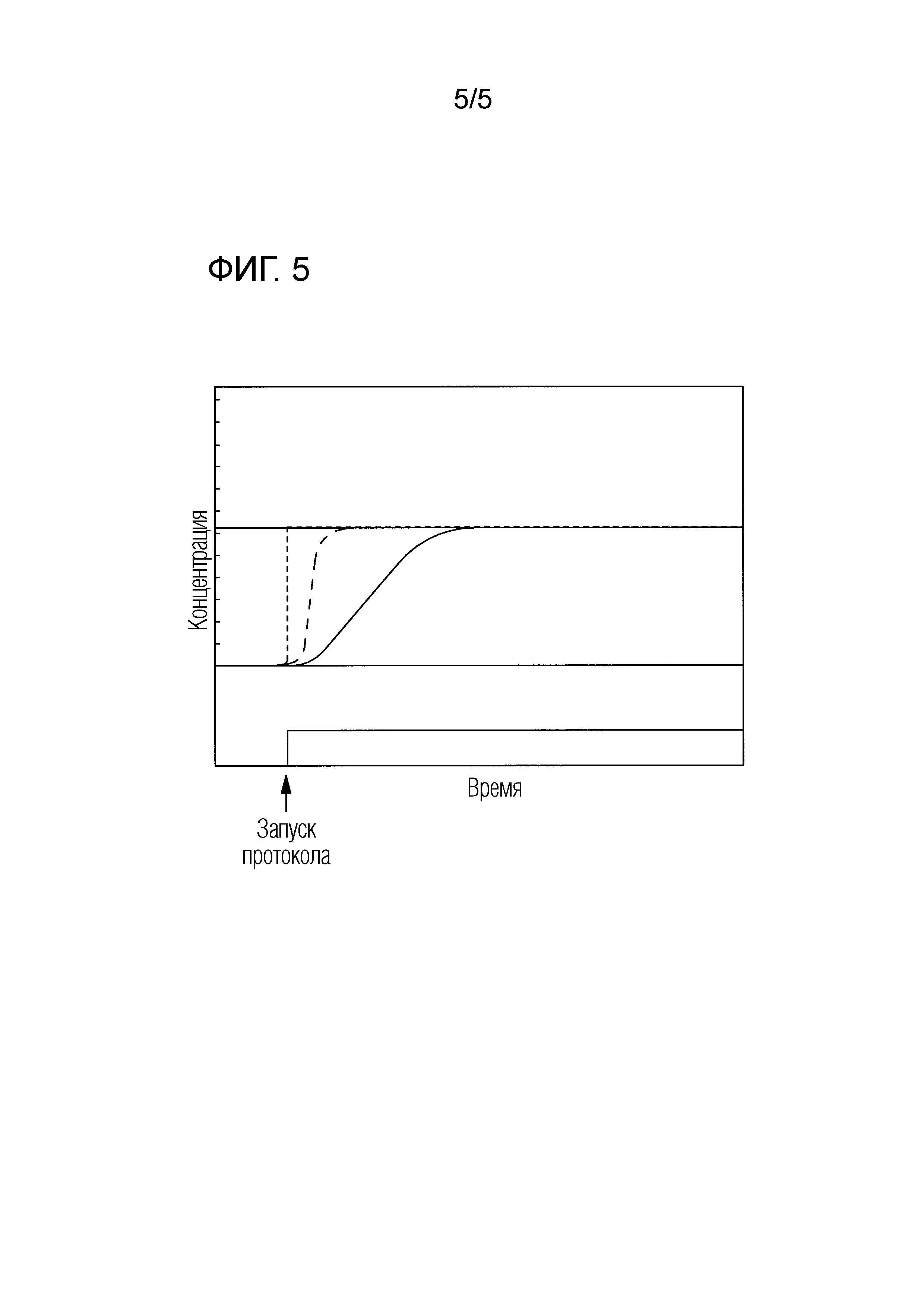
На фиг. 5 показан график зависимости концентрации от времени, иллюстрирующий различную активность контроллера. Как указывалось выше применительно к фиг. 4, оператор устанавливает целевую величину BIS для насоса инфузии, и контроллер использует PK/PD модель для вычисления правильной скорости инфузии для ведения пациенту для достижения целевой величины BIS. Контроллер, согласно изобретению, (возможно, в комбинации с контроллером PID с предиктором Смита) способен предотвращать чрезмерную дозу пропофола при использовании системы с большой задержкой. Контроллер может прогнозировать различные будущие сценарии с использованием генерирования и отслеживания траектории для достижения желаемой целевой величины BIS. Эта технология дополнительно позволяет оператору выбирать время достижения цели, т.е. выбирать активность контроллера. На фиг. 5 показаны в качестве примера различные траектории активности контроллера. Пунктирная линия, полупунктирная линия и сплошная линия представляют, соответственно, высокую, среднюю и низкую активность контроллера.
В соответствии с этим, изобретение предлагает дополнительно способ использования управляющего устройства, согласно изобретению, содержащий стадии:
а) включения монитора 6 глубины анестезии,
b) выбора модели TCI и ввода параметров пациента,
с) ожидания синхронизации модели TIC с BIS,
d) установки целевой величины BIS (5),
е) выбора ступенчатого режима или нет;
f) запуска протокола,
g) в точке потери сознания, нажатия на клавишу LOC на устройстве инфузии, таком как насос инфузии или машина инфузии,
h) возможно, информирования управляющего устройства о EC95; и
i) также возможно, выбора времени достижения цели (активности контроллера).
Идея изобретения не ограничивается указанными выше вариантами выполнения.
В частности, указанная выше система может быть выполнена в принципе в виде системы с обратной связью, которая не требует взаимодействия с оператором. Для этого скорость инфузии может автоматически передаваться с помощью контроллера в насос инфузии для введения пропофола пациенту, и может выполняться автоматическое измерение уровня пропофола, например, периодически в заданные интервалы времени для обеспечения обратной связи для управляющего устройства.
Перечень позиций
1 Интерфейс человек-машина
2 Насос инфузии
3 Контроллер
4 Модельный блок
5 Целевая величина BIS
6 Монитор BIS
7 Датчик лекарственного средства
8 Оператор
9 Исполнительный механизм
10 Пациент
А Центральное отделение
Е Отделение действия
Q Скорость инфузии лекарственного средства.
Реферат
Изобретение относится к медицине, а именно к управляющему устройству для управления введением пропофола для пациента. Предложены управляющее устройство для реализации способа, устройство содержит интерфейс человек-машина, насос инфузии, который содержит контроллер для вычисления рекомендуемой скорости инфузии для введения пропофола пациенту, монитор глубины анестезии. Предусмотрены также: блок целевой установки для установки целевой величины биспектрального показателя (BIS), модельный блок для определения чувствительности пациента к пропофолу с помощью PK/PD модели учитывающей (BIS). Причем оценка чувствительности пациента к анестетику основана на PK/PD модели, которая содержит 3+1 PK/PD модель, отделение Х удаления и отделение S датчика BIS. Причем 3+1 PK/PD модель основана на центральном отделении А, содержащем концентрацию Ср пропофола в крови, отделение CRD быстрого равновесия, отделение CSD медленного равновесия, отделение Е действия, содержащее концентрацию Се отделения действия пропофола. Изобретение обеспечивает повышение эффективности управления введением пропофола для пациента. 2 н. и 22 з.п. ф-лы, 1 табл., 5 ил.
Формула











Комментарии