Применение контрастных агентов в форме частиц в диагностической визуализации для изучения физиологических параметров - RU2207808C2
Код документа: RU2207808C2
Чертежи

































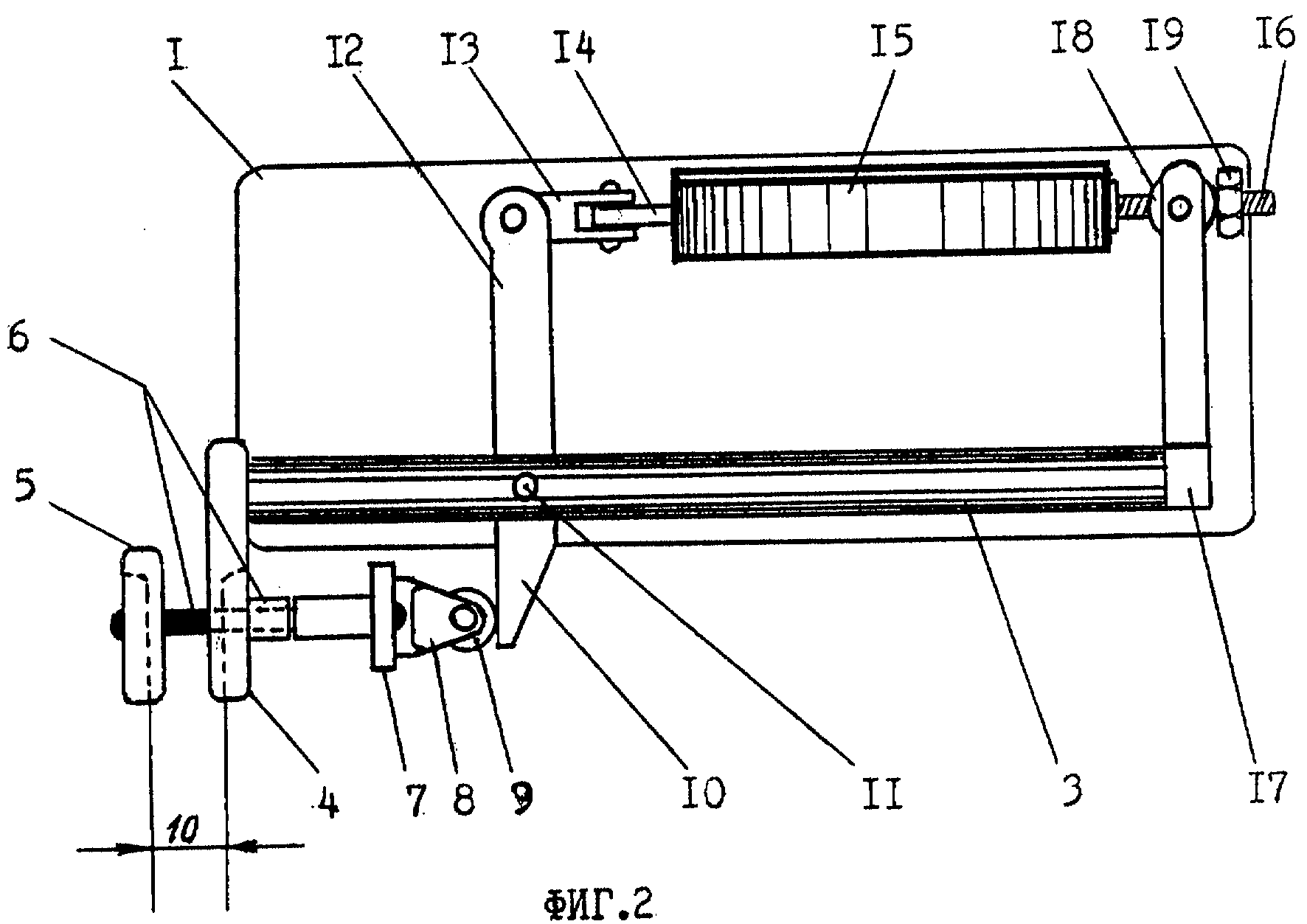


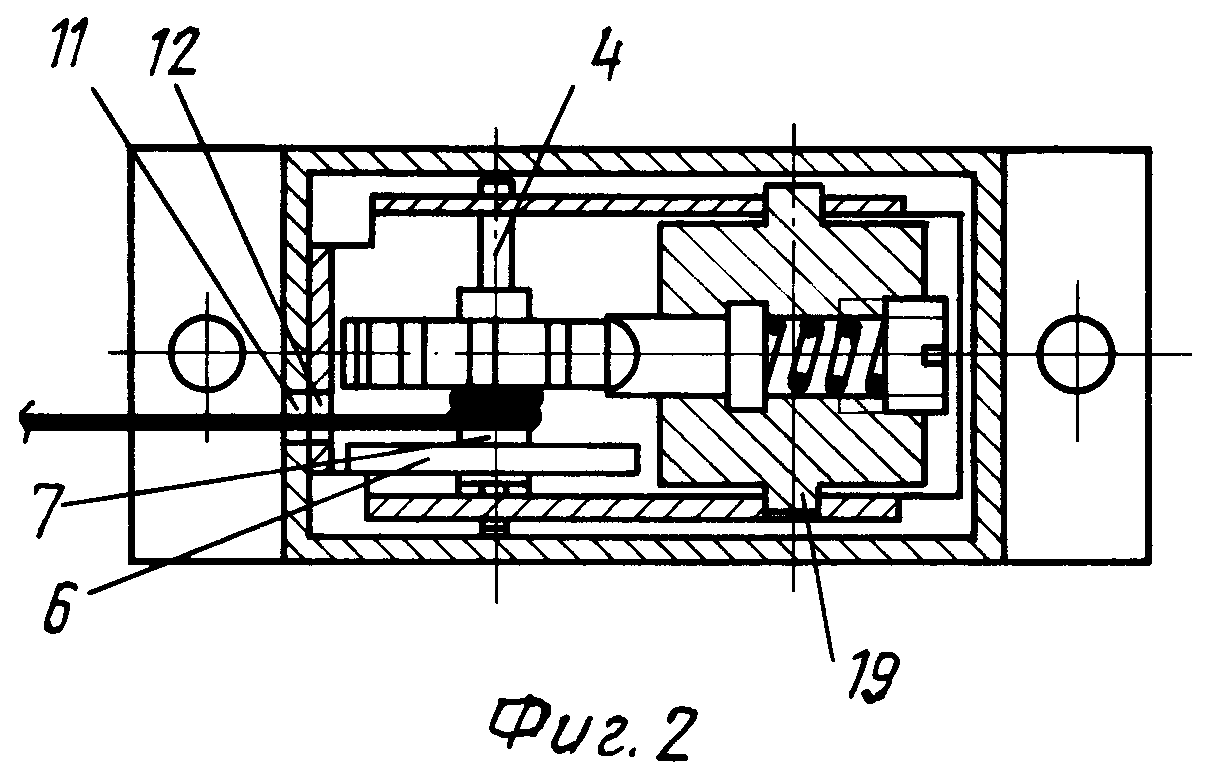










Описание
Изобретение относится к применению контрастных агентов в форме частиц в процедурах диагностической визуализации для изучения физиологических параметров субъекта при обследовании.
Давно известно, что в процедурах диагностической визуализации, например рентгеновской визуализации, визуализации методом ядерно-магнитного резонанса (magnetic resonance imaging, MRI), ультразвуковой, световой и ядерной визуализации, применяют контрастные агенты для облегчения визуализации конкретных органов или тканей или для идентификации пораженных участков или участков с нарушенной функцией, то есть для генерирования морфологических изображений.
Настоящее изобретение относится к применению парентерально вводимых контрастных агентов в форме частиц для количественного или качественного изучения физиологических параметров в организме человека или животного, не являющегося человеком (например, млекопитающего, птицы или рептилии, но предпочтительно млекопитающего).
Такие параметры включают в себя, например, рН, температуру, давление, парциальное давление кислорода, парциальное давление диоксида углерода, напряжение/концентрацию ионов, присутствие или концентрацию других метаболитов или ферментов организма и свойства клеточных поверхностей, например присутствие или отсутствие различных рецепторов на клеточной поверхности. Эти параметры могут указывать на нормальное или ненормальное функционирование организма в целом или конкретной локализованной области, например органа, который может быть или не быть пораженным опухолью, инфицированным или неправильно функционирующим еще как-либо. Подобным же образом вариации таких параметров могут происходить в ответ на лекарства или другие виды терапии, применяемые к организму, например гипертермическое лечение. В результате этого количественное, полуколичественное или даже качественное определение таких параметров можно применять для оценки необходимости в конкретном лечении или для отслеживания успешности конкретного лечения.
Особенно важными в качестве индикаторов ненормальности или нарушения функции являются рН и температура.
Для того, чтобы исследовать физиологические параметры, например диагностировать заболевание, можно использовать несколько способов in vivo, представляющих собой как визуализирующие методики, так и невизуализирующие методики. Типичные невизуализирующие методики включают в себя простые измерения давления крови, электрокардиографию или электроэнцефалографию для детектирования электрических токов в сердечной мышце и головном мозге соответственно и другие простые тесты, выполняемые в кабинетах врачей или больницах. В настоящее время также применяют множество различных визуализирующих методик. К числу наиболее часто применяемых способов относятся методики, основанные на рентгеновском излучении, MRI, ультразвуковые исследования и диагностические методы, основанные на использовании радиоактивных материалов (например, сцинтиграфия, эмиссионная позитронная томография (positron emission tomography, PET) и однофотонная эмиссионная компьютерная томография (single-photon emission computer tomography, SPECT). К числу других диагностических способов визуализации относятся методы световой визуализации, визуализация методом ядерно-магнитного резонанса по Оверхаузеру (Overhauser magnetic resonance imaging, OMRI), кислородная визуализация (oxygen imaging, OХI), которая основана на OMRI, визуализация с помощью магнитного источника (magnetic source imaging, MSI), томография приложенного потенциала (applied potential tomography, APT) и способы визуализации, основанные на применении микроволн.
Изображения, получаемые при использовании рентгеновских методик, отражают различные плотности структур/органов/тканей в организме пациента. В настоящее время для улучшения контрастности изображения при обследованиях мягких тканей применяют контрастные агенты. К числу примеров таких контрастных агентов относятся газ (эффект отрицательного контраста относительно ткани), суспензии сульфата бария и иодированные агенты, в том числе ионные мономерные агенты, неионные мономеры, ионные димеры и неионные димеры. Типичными примерами имеющихся в продаже рентгеноконтрастных агентов являются Omnipaque® и Visipaque®.
MRI представляет собой способ визуализации, в общем основанный на взаимодействиях между радиоволнами и водными протонами тканей организма в магнитном поле. Показатель контрастности или интенсивность сигнала зависит от нескольких факторов, которые включают в себя протонную плотность и времена спин-решеточной (T1) и спин-спиновой (Т2) релаксации водных протонов. К числу типичных имеющихся в продаже MRI контрастных агентов относятся Omniscan®, Magnevist® и ProHance®.
Еще одним ценным методом диагностической визуализации является ультразвук, поскольку он не предусматривает применения ионизирующего излучения. При ультразвуковых обследованиях пациента обычно подвергают действию звуковых волн с частотой 1-10 мГц. Эти звуковые волны (или ультразвуковые волны) проникают через ткань или отражаются от нее. Прошедшие или отраженные звуковые волны регистрируются "микрофоном" и образуют основу для формирования ультразвукового изображения. Ультразвуковая визуализация является предпочтительным способом для проверок на беременность и регулирования рождаемости, а также для диагностики заболеваний сердечно-сосудистой системы и печени.
Хотя ультразвуковые контрастные агенты и получили одобрение, они еще не нашли широкого применения. Главная причина этого состоит в слабой эффективности агентов "первого поколения". Разрабатываемые в настоящее время ультразвуковые контрастные агенты основаны на инкапсулированном газе, потому что отражение звука от границы раздела между газом и жидкостью чрезвычайно эффективно.
Типичные ультразвуковые контрастные агенты представляют собой газ, инкапсулированный в сахарной матрице, в каркасе из денатурированного альбумина или частично денатурированного альбумина, в полимерах и в поверхностно-активных веществах, в том числе фосфолипидах. Типичный ультразвуковой контрастный агент, имеющий высокую контрастную эффективность, состоит из пузырька фторированного газа (например, SF6 или полностью фторированного углеводорода, такого как перфторпропан или перфторбутан), покрытого одно- или многослойной фосфолипидной мембраной. Размер частиц обычно составляет около 4 мкм при очень небольшом числе частиц больше 10 мкм в диаметре. Основными показаниями для такого типичного продукта в будущем может быть визуализация сердца (исследования перфузии сердца) и печени.
Методы радиологической медицинской визуализации основаны на введении радиоактивных изотопов с последующим детектированием этих изотопов, например с применением гамма-камеры или эмиссионной позитронной томографии (positron emission tomography, PET). Наиболее часто применяемым обследованием является детектирование в гамма-камере технеция-99 в форме хелата, например фосфонатного хелата технеция, при сцинтиграфии костей.
Световую визуализацию осуществляют, применяя контрастные агенты, которые поглощают и/или испускают свет (обычно в ближней инфракрасной области).
Способы MSI можно осуществлять без контрастных агентов, однако контрастные агенты на основе магнитных материалов значительно улучшают эту методику.
Способы на основе APT также можно осуществлять без применения контрастных агентов (например, авторадиограммы таллия), однако опять же контрастные агенты на основе физиологически приемлемых ионов или другие агенты, влияющие на проводимость, улучшают диагностическую полезность APT.
Все эти различные методы дополняют друг друга в том, что касается диагностики, основанной на морфологии/анатомии.
Однако имеется большая заинтересованность в измерении и количественном определении различных физиологических параметров (смотри, например, J. Magn. Reson. Imaging 1997, 7, 82-90, где приведен обзор по физиологическим измерениям с помощью контрастно-усиленной MR-визуализации).
В научной литературе описаны разные способы измерений физиологически важных параметров: рН тканей измеряли с использованием отражательной спектроскопии в ближней инфракрасной области (J. Clin. Monit. 1996, 12, 387-95), рН внутри опухолей измеряли с использованием19F-магнитно-резонансной спектроскопии (Invest. Radiol., 1996, 31, 680-689); в качестве19 F-индикаторов рН для магнитно-резонансной спектроскопии было предложено применять конъюгаты полимеров 6-фторпиридоксаля (Bioconiug. Chem. 1996, 7, 536-540); микроскопию со спектральной визуализацией применяли для одновременного измерения внутриклеточного рН и Са2+ в инсулинсекретирующих клетках (Am. J. Physiol. 1996, 270, 1438-46); визуализацию по соотношению флуоресценций применяли для измерения интерстициального рН в твердых опухолях (Вr. J. Cancer 1996, 74, 1206-15); фторированный зонд рН для19F-магнитно-резонансной спектроскопии применяли для измерения рН in vivo после гипертермического лечения опухолей у мышей (Ada Radiol. 1996, 3, 5363-4); протонный ЯМР применяли для анализа внутриклеточного свободного магния и рН в эритроцитах (J. Soc. Gynecol. Investiq. 196, 3, 66-70); внутриклеточный рН оценивали в развивающихся эмбрионах грызунов с использованием методик компьютерной визуализации (Teratology, 1995, 52, 160-8); бискарбоксиэтилкарбоксифлуоресцеин оценивали как флуоресцентный индикатор рН in vivo (J. Photochem. Photobiol. В. 1995, 227, 302-8); влияние модификации тока крови на внутри- и внеклеточный рН в опухолях мышей измеряли с помощью31Р-магнитно-резонансной спектроскопии (Вr. J. Cancer, 1995, 72, 905-11); внутриклеточный Са2+, рН, и митохондриальную функцию в культурах ткани роговицы кролика изучали с помощью флуоресцентной визуализации с цифровым отсчетом (In Vitro Cell Biol. Anim. 1995, 31, 499-507); флюорофор с двойной эмиссией оценивали для флуоресцентной спектроскопии рН in vivo (J. Photochem. Photobiol. В. 1995, 28, 19-23); спектроскопию ядерного магнитного резонанса применяли для исследования истечения лактата и внутриклеточного рН во время гипоксии в коре головного мозга крыс (Neurosci. Lett. 1994, 178, 111-114);31Р-ЯМР-спектроскопию применяли для визуализации фосфоэнергетического состояния и внутриклеточного рН в икроножных мышцах человека после упражнений (Magn. Reson. Imaging 1994, 12, 1121-6); многоядерную ЯМР-спектроскопию применяли для исследований регуляции внутриклеточного рН в нейрональных и глиальных опухолевых клетках (NMR Biomed. 1994, 7, 157-166), 5, 6-карбоксифлуоресцеин применяли в качестве рН чувствительного флуоресцентного зонда для измерений рН in vivo (Photochem. Photobiol. 1994, 60, 274-9); фторированный рН-зонд применяли для неинвазивных измерений рН in vivo (Invest. Radiol. 1994, 29, 220-2); микроскопию с визуализацией по соотношению флуоресценций применяли для неинвазивного измерения профилей интерстициального рН в нормальной и неопластической ткани (Cancer Res. 1994, 54, 5670-4); 6-фторпиридоксол применяли в качестве зонда для клеточного рН, используя19F-ЯМР-спектроскопию (FEBS Lett., 1994, 349, 234-8); в икроножных мышцах крыс во время ишемии/реперфузии картировали лактат и рН, определяемые визуализацией на основе химического сдвига протонного и фосфорного магнитного резонанса in vivo (Invest. Radiol. 1994, 29, 217-23); спектроскопию на основе ядерного магнитного резонанса применяли для измерения рН in vivo и ex vivo (Eur. J. Lab. Med. 1996, 4, 143-156); семинафтофлуоресцеин-кальцеин тестировали в качестве флуоресцентного зонда для определения внутриклеточного рН посредством одновременной визуализации с двойной эмиссией и лазерной сканирующей конфокальной микроскопией (J. Cell Physiol. 1995, 164. 9-16); амфолитные красители были предложены для спектроскопического определения рН при электрофокусировке (J. Chromatogr. A. 1995, 695, 113-122); EPR (электронный парамагнитный резонанс) спектроскопию применяли для прямого и непрерывного определения величин рН в непрозрачных системах вода-в-масле (Eur. J. Pharm. Sci. 1995, 3, 21-6); внутриклеточный Са2+ и рН одновременно визуализировали в клетках клубочкового эпителия (Am. J. Physiol. Cell Physiol. 1993, 46, 216-230); фторированные макромолекулярные зонды проходили оценку для неинвазивного определения рН магнитно-резонансной спектроскопией (Bioorg. Med. Chem. Lett. 1993, 2, 187-192); в живых тканях картировали рН применением визуализации химического сдвига31Р-ЯМР in vivo (Magn. Res. Med. 1993, 29, 249-251); флуоресцентную спектроскопию применяли для измерения зависимой от температуры агрегации чувствительных к рН липосом из фосфатидилэтаноламина, олеиновой кислоты и холестерина (Anal. Biochem. 1992, 207, 109-113);13С-ЯМР-спектроскопию применяли для определения внутриклеточного рН (Am. J. Physiol. Cell Physiol. 1993, 264, c.775-760); визуализацию химического сдвига31Р-ЯМР применяли для картирования рН в живой ткани (Magn. Reson. Med. 1993, 29, 249-251); флуоресцентный зонд и31Р-ЯМР-спектроскопию сравнивали для измерения внутриклеточного рН в акне, вызываемых пропионовокислой бактерией (Can. J. Microbiol. 1993, 39, 180-6); панорамную визуализацию рН головного мозга и CBF (cerebral blood flow, мозговой кровоток) выполняли во время вызванного пенициллином и метразолом эпилептического статуса (Epilepsy Res. 1992, 13, 49-58); спектроскопию на основе ядерного магнитного резонанса применяли для исследования энергетического метаболизма, внутриклеточного рН и концентрации свободного Мg в головном мозге трансгенных мышей (J. Neurochem. 1992, 58, 831-6); зависимость поглощения 5-фторурацила от рН наблюдали с помощью спектроскопии на основе31Р- и19F-ядерного магнитного резонанса in vivo (Cancer Res., 1991, 51, 570-3); спектроскопию на основе31Р-магнитного резонанса применяли для изучения рН опухоли и реакции на химиотерапию при не-ходжкинской лимфоме (Вr. J. Radiol. 1991, 64, 923-8);31Р-магнитно-резонансную спектроскопию и микроэлектроды применяли для оценки зависимой от дозы температурной реакции рН и энергетического метаболизма опухоли (Radiat. Res. 1991, 127, 177-183); внутриклеточный рН в печени изучали19F-ЯМР-спектроскопией in vivo (Magn. Reson. Med. 1991, 19, 386-392); связь между внутрикостным давлением в позвонках, рН, рO2, рСO2 и неоднородностью сигнала магнитной визуализации оценивали у пациентов с болями в спине (Spine 1991, 16, 239-242); влияние гипоксии на метаболиты фосфора и внутриклеточный рН в головном мозге плода крысы исследовали31Р-ЯМР-спектроскопией (J. Phvsiol. 1990, 430, 98Р); рН головного мозга при травме головы оценивали с использованием направляемой по изображению31Р-магнитно-резонансной спектроскопии (Ann. Neurol. 1990, 28, 661-7); получали меченные селеном третичные амины и оценивали их в качестве агентов для визуализации рН головного мозга (Nucl. Med. Biol. Int. J. Radiat. Apl. Instrum. Part В. 1990, 17, 601-607);1H-,31Р- и13С-ЯМР-спектроскопию применяли для изучения церебрального энергетического метаболизма и внутриклеточного рН во время тяжелой гипоксии и восстановления в коре головного мозга морской свинки in vitro (J. Radiat. Appl. Instrum. Part В. 1990, 26, 356-369); сообщалось о разработке чувствительного к рН контрастного агента для1H-ЯМР визуализации (Magn. Reson. Med. 1987, 5, 302-5), а также имеются другие ссылки на исследования рН с помощью31Р-ЯМР, смотри, например, Biomed. Res. (Japan) 1989, 10, Suppl. 3, 587-597, J. Cereb. Blood Flow Metab. 1990, 10, 221-6, Br. J. Radiol. 1990, 63, 120-4. Pediatr. Res. 1989, 25, 440-4, Radiology 1989, 170, 873-8, Cereb. Blood Flow Metab. 1988, 8, 816-821, J. Neuro. Chem. 1988, U51U, 1501-9 и Am. Heart J. 1988, 116, 701-8. WO/41241 от Nihon Schering обсуждает MRI методики, которые используют полимеры, для отслеживания рН.
Одним из важных физиологических параметров, представляющим огромный медицинский интерес, всегда была температура: температуру измеряли посредством спектроскопии на основе электронного парамагнитного резонанса (J. Biomed. Eng. 1996, 118, 193-200), в качестве температурочувствительного зонда для MR-спектроскопии применяли хелат иттербия (Magn. Res. Med. 1996, 35, 648-651), оценивали методики быстрой визуализации в MRI для визуализации температуры (J. Magn. Reson. В. 1996, 112, 86-90),31Р- и1H-магнитно-резонансную спектроскопию применяли для исследования связи между температурой головного мозга и скоростью утилизации энергии in vivo (Pediatr. Res. 1995, 38, 919-925), локальную температуру головного мозга оценивали in vivo с помощью1H-ЯМР-спектроскопии (J. Neurochem. 1995, 38, 1224-30), магнитный резонанс применяли для того, чтобы следить за температурными изменениями во время интерстициального микроволнового нагревания (Med. Phys. 1997, 24, 269-277), температурную зависимость коэффициента диффузии в ткани головного мозга собаки измеряли in vivo с использованием магнитно-резонансной эхопланарной визуализации (Int. J. Hyperthermia 1995, 11, 73-86), зависимую от температуры допплеровскую ультразвуковую визуализацию цветового потока проводили на экспериментальных опухолях у кроликов (Ultrasound Med. Biol. 1993, 19, 221-9), для измерения температуры предлагали электрическую импедансную томографию (Trans ASME J. Biochem. Eng. 1996, 118, 193-200), измерение температуры проводили in vivo с использованием температурочувствительного лантанидного комплекса и1 H-магнитно-резонансной спектроскопии (Magn. Res. Med., 1996, 35, 364-9), проводили визуализацию температуры тела компьютерной импедансной томографией (СТ, computerized tomography) (Med. Imag. Tech. (Japan) 1995, 13, 696-702), проводили температурную визуализацию в организме человека с использованием микроволн (Med. Imag. Techn. (Japan) 1995, 13, 691-5), одновременно определяли парциальное давление кислорода и температуру in vivo с использованием19F-ЯМР-спектроскопии перфторированного углеводорода (Маg. Res. Med. 1993, 29, 296-302), измерение рН в нормальной и опухолевой ткани in vivo проводили локализованной спектроскопией с использованием флуоресцентного маркера (Optical Eng. 1993, 32, 239-243), предлагали микроволновую визуализацию температуры (IEEE Trans. Med. Imag. (USA) 1992, 4, 457-69), неинвазивное картирование температуры во время гипертермии проводили магнитно-резонансной визуализацией молекулярной диффузии (Proceedings of the Annual International Conference of the IEEE 1988, 342-343). Имеются другие сообщения о неинвазивных и минимально инвазивных способах раннего выявления болезненных состояний с помощью MRI, позитронной эмиссионной томографии, электороэнцефалографической (EEG, electroencephalography) визуализации, магнитноэнцефалографической (MEG, magnetoencephalography) визуализации, SPECT, электрической импедансной томографии, электрокардиографической (ECG, elecrocardiography) визуализации и томографии на основе оптической диффузии, смотри, например, Proceedings of the SPIE - The International Society for Optical Engineering (USA) 1887 (1993).
Также имеются сообщения о следующих, преимущественно основанных на MRI, методиках в измерении температуры и изменений температуры: Med. Phys. 1997, 24(2), 269-277, Int. J. Hyperthermia 1995, 11(5), 409-424, Int. J. Hyperthermia 1992, 8(2), 253-262, Int. J. Hyperthermia (1994), 10(3), 389-394, Radiologe 1998, 38, 200-209, Med. Phys. 1997, 24(12), 1899-1906, JMRI 1998, 8, 128-135, JMRI 1998, 8, 160-164, JMRI 1998, 8, 165-174, MRM 1995, 34, 359-367, MRM 1995, 33, 729-731, MRM 1995, 33, 74-81, Radiology 1998, 208, 789-794, JMRI 1996, 7, 226-229, JMRI 1997, 8, 188-196, JMRI 1998, 8, 197-202, JMRI 1998, 8, 31-39, JMRI 1998, 8, 121-127, JMRI 1998, 8, 493-502, Int. J. Radiation Oncology Biol. Phvs. 1998, 40(4), 815-822, Int. J. Hyperthermia 1998, 14(5), 479-493, Radiology 1995, 196, 725-733, Advances in Radiation Therapy 1998, Eds. Mittal, Purdy and Ang, Kluver Academic Publishers, Chapter 10, p. 213-245.
Опубликовано несколько патентов и заявок на патенты, имеющих отношение к физиологической визуализации: применение макроциклических комплексов металлов в качестве температурных зондов для определения температуры тела с использованием спектроскопических методов со сниженными фоновыми сигналами (WO 94/27977); новые фторсодержащие макроциклические комплексы металлов из производных тетраазадодекана, применимые для измерения температуры тканей на основании величин химического сдвига ЯМР и в качестве контрастных агентов для рентгеновского или ЯМР-диагностирования (WO 94/27978); определение и визуализация изменения температуры в человеческом организме с использованием коэффициентов диффузии, полученных с помощью ЯМР, для определения абсолютной температуры отдельных точек тела и температурных различий (WO 90/02321); термографическая визуализация с использованием парамагнитного материала, зависимого от температуры, в аппарате для ESR (electron spin resonance, электронный парамагнитный резонанс) усиленной магнитно-резонансной визуализации (WO 90/02343); фторзамещенные производные бензола, применимые в качестве агентов для ЯМР-диагностики in vivo, например для тканеспецифичных рН, температуры, окислительно-восстановительных потенциалов и так далее (ЕР-А-368429); магнитно-резонансная импульсная нагревательная система для селективного нагревания области субъекта, каковая система использует импульсное тепло от фокусируемого ультразвукового оборудования для того, чтобы разрушать опухолевую ткань, и MRI для получения изображений быстрого сканирования для отслеживания ткани и температуры последовательностью чувствительных к диффузии импульсов (US-A-5247935); магнитно-резонансная импульсная нагревательная система для селективного нагревания ткани - хирургическую операцию выполняют с применением локализованного нагревания ткани, направляемого и отслеживаемого температурочувствительной магнитно-резонансной визуализацией, причем ткань организма нагревают с использованием системы магнитно-резонансной визуализации, имеющей источник и зонд, содержащий спираль для магнитной визуализации и источник радиочастоты для визуализации нагревания (US-A-5323778); аппарат для гипертермического лечения рака, включающий в себя комбинированный гипертермический и MRI зонд, чтобы одновременно нагревать злокачественный участок и отслеживать температуру, с фильтром для выделения сигналов (WO/07132), и способ измерения температуры с применением томографических методик магнитно-резонансной визуализации, чтобы измерять температуру участка косвенно на основании изменения интенсивности магнитно-резонансного сигнала (US-A-5207222).
Настоящее изобретение, однако, основано на понимании того, что можно получить такие контрастные агенты в форме частиц, у которых матричный или мембранный материал для частиц реагирует на определенный физиологический параметр, что приводит к изменению контрастной эффективности этого контрастного агента, которая может быть скоррелирована с этим физиологическим параметром.
Таким образом, в одном аспекте это изобретение предлагает способ визуализации организма живого человека или животного, не являющегося человеком, при котором в указанный организм парентерально вводят материал в форме частиц, содержащий матричный или мембранный материал и по меньшей мере один генерирующий контраст компонент, причем матричный или мембранный материал реагирует на заранее выбранный физиологический параметр, посредством чего меняется контрастная эффективность указанного компонента в ответ на изменение в величине указанного параметра; генерируют данные изображения по меньшей мере части указанного организма, в которой присутствует указанный компонент, и генерируют из них сигнал, являющийся показателем величины или изменения указанного параметра в указанной части указанного организма.
В еще одном аспекте это изобретение предлагает вводимую парентерально контрастную среду для визуализации физиологического параметра, которая содержит материал в форме частиц, частицы которого содержат матричный или мембранный материал и по меньшей мере один генерирующий контраст компонент, причем указанный матричный или мембранный материал реагирует на указанный физиологический параметр, вызывая изменение контрастной эффективности указанного генерирующего контраст компонента в ответ на указанный параметр. В особенно предпочтительном воплощении этот матричный или мембранный материал представляет собой липид или смесь липидов со значением Тc между 35 и 80oС, предпочтительно между 37 и 45oС, более предпочтительно между 38 и 43oС (Тc определяют как температуру перехода гель - жидкокристаллическая фаза). В еще одном предпочтительном воплощении этот матричный или мембранный материал представляет собой пептиды или один или более чем один полимер.
В еще одном аспекте это изобретение предлагает применение генерирующего контраст компонента для изготовления контрастной среды в форме частиц для использования в способе диагностики, при котором генерируют сигнал, являющийся показателем значения указанного физиологического параметра, причем частицы указанной контрастной среды содержат матричный или мембранный материал и по меньшей мере один генерирующий контраст компонент, причем указанный матричный или мембранный материал реагирует на указанный физиологический параметр, вызывая изменение контрастной эффективности указанного генерирующего контраст компонента в ответ на указанный параметр.
В способе по этому изобретению генерируемые данные изображения можно при желании представлять в виде двухмерного или имеющего большую мерность пространственного изображения, либо их можно представлять в виде временного изображения, опять же двухмерного или имеющего большую мерность. Однако в предельном случае эти данные просто могут давать одну или более чем одну величину изображения, например численные величины, которые прямо или косвенно могут быть использованы для получения количественной или качественной информации (сигнала), являющейся показателем величины исследуемого параметра. Данные изображения можно при желании представлять в визуализированной форме или же они могут быть просто совокупностью точек, представляющих данные, которые собирают и обрабатывают для получения сигнала без действительной генерации видимого изображения. Сигнал, являющийся показателем значения исследуемого параметра, можно подобным же путем генерировать в форме видимого изображения, например карты значений параметра в организме или графика, показывающего изменение значения этого параметра во времени, или он может просто представлять собой рассчитанное численное значение этого параметра или указание того, что этот параметр находится выше или ниже конкретной пороговой величины. Однако желательно, чтобы этот сигнал давал количественное или по меньшей мере полуколичественное значение этого параметра, например, в интересующей области или во множестве интересующих областей в организме, например, давая пространственную и/или временную карту этого параметра по меньшей мере в части организма.
Данные, относящиеся к физиологическому параметру, могут, но не обязательно, содержать также и информацию, относящуюся к анатомии этого животного организма, и, таким образом, следующий аспект этого изобретения относится к комбинации традиционной анатомической визуализации с физиологической визуализацией для получения двух изображений, причем одно содержит информацию о физиологическом параметре, а другое содержит анатомическую информацию. Эти два изображения могут быть объединены с получением одного изображения с анатомической и физиологической информацией.
Таким образом, согласно дальнейшему аспекту предложен способ визуализации живого организма человека или животного, не
являющегося человеком, при котором
в
указанный организм парентерально вводят по
меньшей мере один генерирующий контраст компонент, контрастная эффективность которого реагирует на значение
заранее выбранного физиологического параметра;
генерируют данные изображения по меньшей мере части указанного организма, в котором присутствует указанный компонент;
генерируют из них
сигнал, являющийся показателем значения или
изменения указанного параметра в указанной части указанного организма, а также генерируют анатомическое изображение той же части животного организма.
Дополнительное использование анатомической информации может помогать в интерпретации физиологических данных. Изображение, генерируемое в ответ на физиологический параметр, "физиологическое изображение", можно формировать с применением любых описанных здесь способов визуализации или контрастных сред. Это физиологическое изображение можно комбинировать с обычным изображением, которое получают с применением контрастного агента или без такового. Подходящие контрастные агенты для использования с традиционной анатомической визуализацией хорошо известны в данной области для всех типов методик визуализации, MRI, рентгеновской, ультразвуковой, световой и ядерной визуализации и так далее, и здесь обсуждается много подходящих контрастных агентов для анатомической визуализации.
Методики визуализации, применяемые для получения физиологических данных, могут быть такими же, что и методики визуализации, применяемые для получения анатомического изображения, или отличными от них. В предпочтительном воплощении эта методика визуализации является такой же, причем особенно подходящей является MRI.
Можно применять два отдельных контрастных агента, один для физиологической визуализации и один для традиционной визуализации. Можно инъецировать эти два агента последовательно и сканировать организм последовательно в соответствии с надлежащими методиками визуализации, эти два сгенерированных изображения потом можно скомбинировать. В альтернативном воплощении можно применять единственный многофункциональный контрастный агент, который способен давать как физиологическую, так и анатомическую информацию. Можно применять многофункциональный MRI контрастный агент, причем одна из его функций реагирует на физиологический параметр, тогда как вторая функция дает анатомическую информацию. При этом, хотя применяют один контрастный агент, можно сканировать организм дважды и комбинировать два получающихся изображения.
В дальнейшем альтернативном воплощении можно применять многофункциональный контрастный агент, в котором компоненты этого агента функционируют как контрастные агенты для разных методик визуализации. Так, этот контрастный агент может содержать микропузырьки для обеспечения контраста при ультразвуковой визуализации и парамагнитные комплексы для MRI, причем один из этих компонентов реагирует на физиологический параметр. Опять же можно комбинировать изображения, получаемые сканированием в соответствии с этими двумя методиками визуализации. Согласно еще одному примеру MRI с гиперполяризованными веществами способна давать хорошую физиологическую информацию, относящуюся, например, к рН, температуре или давлению, но при этом дает мало или не дает вообще никакой анатомической информации. Таким образом, MR гиперполяризованное изображение преимущественно комбинируют с анатомическим изображением, например, наложением этих изображений. Эти два изображения можно генерировать по-отдельности или одновременно.
Комбинацию физиологической и анатомической визуализации можно применять, чтобы исследовать все части организма человека или животного, не являющегося человеком, и любой из обсужденных здесь физиологических параметров, в частности рН и температуру. Если этим физиологическим параметром является температура, то изменения значения этого параметра, то есть температурные изменения, могут быть вызваны внутренними или внешними причинами. Внутренние причины включают в себя рак, сердечно-сосудистое заболевание и воспаление, тогда как внешние причины включают в себя лечение гипертермией (внешнее нагревание). Таким образом, физиологический контрастный агент может быть контрастным агентом для гипертермии.
Методикой визуализации, применяемой в способе по этому изобретению, может быть любая методика, которую можно применять в сочетании с контрастными агентами, например рентген (например, компьютерное томографическое сканирование), MRI, MRS, MR-микроскопия, ESR-визуализация, ESR-спектроскопия, мессбауэровская визуализация (

Физиологическим параметром, изучаемым с применением способа по этому изобретению, может быть любой физиологический параметр, способный влиять на матричный или мембранный материал контрастного агента, например давление, температура, рН, парциальное давление кислорода, парциальное давление диоксида углерода, ферментативная активность, концентрация метаболитов, тканевая электрическая активность, тканевая диффузия, концентрация ионов, в частности Mg2+, Са2+ и Zn2+, и так далее. Однако предпочтительно выбирать его из параметров крови, например давления, температуры и рН, в частности в сосудистой сети сердца, а не в его камерах. Если измеряют температуру, изменения могут иметь место из-за внутренних факторов, таких как болезнь, или внешних факторов, например гипертермии. Не предусматривается, чтобы этот параметр был одним из тех параметров, которые не воздействуют на мембрану или матрицу, например, скоростью тока или плотностью перфузии.
Ключевая часть настоящего изобретения состоит в том, что частицы контрастного агента должны содержать матричный или мембранный материал, который реагирует на исследуемый физиологический параметр таким образом, что меняет контрастную эффективность контрастного агента. То, как реагирует мембрана или матрица, должно зависеть от конкретной комбинации выбранных метода визуализации, физиологического параметра и материала, генерирующего контраст. Однако в типичных случаях эта реакция может включать в себя изменение проницаемости мембраны или матрицы для одного или более чем одного компонента (например, воды или газов), химическое или физическое разрушение матричного или мембранного материала, генерирование материала, генерирующего контраст, отщепление функциональных групп от материала, генерирующего контраст, посредством чего происходит изменение его способности генерировать контраст, изменение состояния окисления материала, генерирующего контраст, посредством чего происходит изменение его способности генерировать контраст, и так далее. Так, такая реакция может, например, включать в себя высвобождение из контрастного агента в форме частиц растворимых в воде группировок, генерирующих контраст, которые способны поступать во внеклеточную текучую среду вне сосудистой системы. Конкретные примеры контрастных агентов в форме частиц, способных реагировать на физиологический параметр, будут более подробно описаны ниже.
Таким образом, одно из воплощений этого изобретения относится к термочувствительным парамагнитным композициям в форме частиц для температурного MRI-картирования организма человека. Другое воплощение настоящего изобретения относится к применению термочувствительных газовых композиций в форме частиц в качестве основанного на ультразвуке термометра для измерений in vivo.
Еще одно воплощение этого изобретения относится к радиоактивным композициям для температурного картирования в организме человека. Другое воплощение настоящего изобретения относится к термочувствительным композициям в форме частиц, содержащим растворимые в воде рентгеноконтрастные агенты для картирования температуры в организме человека.
Еще один аспект настоящего изобретения относится к композициям в форме частиц, содержащим красители для ближней инфракрасной области для основанного на световой визуализации температурного картирования в этом организме.
Другим аспектом настоящего изобретения является применение одной или более чем одной из термочувствительных композиций в форме частиц для температурного картирования в направляемом визуализацией гипертермическом лечении.
Другое воплощение настоящего изобретения относится к чувствительным к рН композициям в форме частиц для определения рН в организме. Например, активным контрастным агентом (или индикатором, или зондом) может быть парамагнитное, магнитное или фторированное соединение, обнаруживаемое посредством MRI. Активным контрастным агентом (или индикатором, или зондом) может быть газ или вещество, генерирующее газ, для детектирования ультразвуком, им может быть радиоактивное вещество для детектирования сцинтиграфией, SPECT или PET, или им может быть флуоресцентный краситель, краситель ближней инфракрасной области, ультрафиолетовый краситель или другой краситель, который можно обнаруживать in vivo способами световой визуализации или светового детектирования.
Еще одно воплощение этого изобретения относится к композициям в форме частиц в качестве контрастных агентов или индикаторов, или зондов для детектирования концентрации/парциального давления кислорода в ткани in vivo с применением таких методов визуализации, как ультразвук, MRI, оверхаузеровская MRI и ESR.
Другое воплощение настоящего изобретения относится к композициям в форме частиц в качестве контрастных агентов или индикаторов или зондов для детектирования давления, турбулентности, вязкости, ферментативной активности, концентраций ионов, коэффициентов диффузии метаболитов, эластичности и гибкости in vivo.
Другой аспект настоящего изобретения относится к композициям в форме частиц в качестве контрастных агентов или индикаторов или зондов in vivo в комбинации с нацеливающими лигандами, причем указанные нацеливающие лиганды нацеливаются на клетки или рецепторы, выбираемые из группы, которую составляют миокардиальные клетки, эндотелиальные клетки, эпителиальные клетки, опухолевые клетки, клетки головного мозга и рецепторы гликопротеина GPIIb/IIIa, для детектирования изменений в физиологических параметрах и/или количественного/полуколичественного определения физиологических параметров, значимых для диагностики заболевания.
Дополнительными примерами нацеливающих лигандов, которые могут быть использованы, являются следующие.
1. Антитела, которые можно применять в качестве векторов для очень широкого диапазона мишеней и которые обладают полезными свойствами, такими как очень высокая специфичность, высокое сродство (при желании), возможность модифицировать сродство в соответствии с потребностью и так далее. Должны ли быть антитела биоактивными или нет, будет зависеть от конкретной комбинации вектор/мишень. Можно применять как обычные, так и полученные генно-инженерными методами антитела, причем последние позволяют создавать антитела для конкретных потребностей, например, в отношении сродства и специфичности. Во избежание возможных иммунных реакций против векторной молекулы предпочтительным может быть применение человеческих антител.
Дополнительный полезный класс антител включает в себя так называемые биспецифичные антитела, то есть антитела, обладающие специфичностью к двум разным молекулам-мишеням в одной молекуле антитела. Такие антитела могут, например, быть полезными для содействия образованию пузырьковых кластеров, а также их можно применять для различных терапевтических нужд, например для переноса токсичных группировок к мишени. Разные аспекты биспецифичных антител описаны в McGuinness В. Т. et al., Nat. Biotechnol. (1996), 14, 1149-1154; George A. J. et al., in J. immunol. (1994), 152, 1802-1811; Bonardi et al. , in Cancer Res. (1993), 53, 3015-3021; French R. R. et al., in Cancer Res. (1991), 51, 2353-2361.
2. Молекулы клеточной адгезии, их рецепторы, цитокины, факторы роста, пептидные гормоны и их фрагменты. Такие векторные/нацеливающие лиганды зависят от нормальных биологических белок-белковых взаимодействий с рецепторами, представляющими собой молекулы-мишени, и поэтому во многих случаях должны генерировать биологический ответ при связывании с мишенями и, таким образом, быть биоактивными; это может быть относительно неважно в случае векторов, мишенями которых являются протеогликаны.
3. Непептидные агонисты/антагонисты или небиоактивные связующие рецепторов для молекул клеточной адгезии, цитокинов, факторов роста или пептидных гормонов. Эта категория может включать в себя небиоактивные векторы, которые не должны быть ни агонистами, ни антагонистами, но которые могут тем не менее проявлять ценную нацеливающую способность.
4. Олигонуклеотиды и модифицированные олигонуклеотиды, которые связывают ДНК или РНК посредством уотсон-криковских или других типов спаривания оснований. Обычно ДНК присутствует во внеклеточном пространстве только вследствие повреждения клеток, поэтому такие олигонуклеотиды, которые обычно должны быть небиоактивными, можно применять, например, в нацеливании на некротические области, которые связаны со многими различными патологическими состояниями. Олигонуклеотиды можно создавать с возможностью связывания со специфическими ДНК- или РНК-связывающими белками, например с транскрипционными факторами, которые очень часто весьма чрезмерно экспрессированы или активированы в опухолевых клетках или в активированных иммунных или эндотелиальных клетках. Для выбора олигонуклеотидов, которые специфически связываются с возможными молекулами-мишенями (от белков до кофеина) и которые поэтому можно применять в качестве векторов для нацеливания, можно использовать комбинаторные библиотеки.
5. Подобно олигонуклеотидам могут вести себя ДНК-связывающие лекарства, но при этом они, будучи захваченными клетками, могут проявлять биологическую активность и/или токсические эффекты.
6. Различные малые молекулы, в том числе биоактивные соединения, о которых известно, что они связываются с биологическими рецепторами разного рода. Такие векторы или их мишени можно применять, чтобы создавать небиоактивные соединения, связывающиеся с теми же мишенями.
7. Нацеливающие лиганды можно выбирать из комбинаторных библиотек, не обязательно зная точную молекулярную мишень, посредством функциональной селекции (in vivo, ex vivo или in vitro) на молекулы, связывающиеся с областью/структурой, подлежащей визуализации.
8. Белки и пептиды, которые связываются с боковыми цепями гликозаминогликанов, например гепаринсульфата, в том числе гликозаминогликансвязывающие участки более крупных молекул, поскольку связывание с такими боковыми цепями гликозаминогликанов не вызывает биологическую реакцию. Протеогликаны не обнаруживаются на красных кровяных клетках, что элиминирует нежелательную адсорбцию к таким клеткам.
Таким образом, эти контрастные агенты в форме частиц можно применять для количественного/полуколичественного определения физиологического параметра, значимого для диагностики заболевания. Контрастные агенты в форме частиц можно заставить давать измеримую разницу по сигналу либо самим целевым параметром (например, локальной температурой, рН или давлением, или связыванием с конкретными представляющими интерес рецепторами на поверхности клеток), либо химической или биологической реакцией целевого параметра (например, высвобождением ферментов или локальным изменением рН или температуры из-за клеточных реакций). Таким образом, этот агент в форме частиц может реагировать, идентифицировать и/или количественно или полуколичественно определять бактерии, вирусы, антитела, ферменты, лекарства, токсины и так далее.
Еще один аспект настоящего изобретения относится к внутривенным композициям в форме частиц в качестве контрастных агентов или в качестве индикаторов или зондов in vivo с длительным периодом полужизни в сосудах (сниженное поглощение печенью) для детектирования изменений физиологических параметров и/или количественного/полуколичественного определения физиологических параметров, значимых для диагностики заболевания.
Применяемый согласно настоящему изобретению контрастный агент в форме частиц может представлять собой твердый материал, пористый материал, жидкокристаллический материал, гель, пластичный материал, материал, имеющий одну или более чем одну стенку или мембрану, или жидкие частицы, например капельки эмульсии или частицы на основе газа, например микропузырьки. Эти частицы также могут быть термодинамически стабилизированы, например капельки микроэмульсии или мицеллы поверхностно-активного вещества. По химическому составу этот материал в форме частиц может быть простым химическим соединением или смесью одного или нескольких химических соединений. Обычно он содержит две или более чем две химические сущности, из которых по меньшей мере одна является материалом, образующим матрицу или мембрану, и по меньшей мере одна другая является генерирующим контраст компонентом. Эта композиция может состоять только из твердого(ых) материала(ов) или она может представлять собой смесь различных твердых веществ/жидкостей/газов. Частицы обычно имеют средний размер частиц (например, определяемый анализаторами размеров частиц, такими как аппарат на основе лазерного светового рассеивания или счетчики Коултера (Coulter)) в диапазоне от 0,001 до 20 мкм, более предпочтительно от 0,01 до 10 мкм, особенно от 0,05 до 7 мкм. Такие частицы в литературе часто описывают как частицы, коллоиды, эмульсии, капельки, микрокристаллы, нанокристаллы, микрочастицы, наночастицы, везикулы, липосомы, пузырьки, микросферы, микропузырьки, частицы с оболочкой, микрошарики и тому подобное.
Термин "полимер" при использовании здесь относится к любому химическому соединению с числом повторяющихся единиц более десяти. Полимер может быть природным, синтетическим или полусинтетическим. Полусинтетические полимеры являются полимерами, которые получают синтетической модификацией природных полимеров. О соединениях с числом повторяющихся единиц от 2 до 10 здесь обычно говорят как об "олигомерах", и они также могут быть природными, синтетическими или полусинтетическими.
Термин "поверхностно-активное соединение" используют здесь по отношению к любому химическому соединению, имеющему по меньшей мере одну гидрофильную функциональную группу и по меньшей мере одну гидрофобную (липофильную) группу. В многофазной системе поверхностно-активные соединения обычно накапливаются на границе раздела фаз.
Термин "липид" используют здесь по отношению к природным соединениям, синтетическим соединениям и полусинтетическим соединениям, которые являются поверхностно-активными соединениями и имеют структуры, сходные с жирными кислотами, восками, моно-, ди- или триглицеридами, гликолипидами, фосфолипидами, высшими (С10 или более) алифатическими спиртами, терпенами и стероидами.
Термин "газ" используют здесь по отношению к любому соединению или любой смеси соединений с давлением паров, достаточно высоким для того, чтобы находиться, по меньшей мере частично, в газовой фазе при 37oС. Если методом визуализации, который применяют по этому изобретению, является ультразвук, то генерирующий контраст компонент в контрастном агенте предпочтительно состоит из одного или более чем одного инкапсулированного газа и/или одного или более чем одного инкапсулированного газового предшественника. Этот генерирующий контраст компонент способен взаимодействовать с окружением так, что этот контрастный агент дает информацию об одном или более чем одном физиологическом параметре обычно в результате взаимодействия между окружением и инкапсулированным материалом, за чем при необходимости следуют изменения, связанные с газом/газом-предшественником. Однако газообразный генерирующий контраст компонент можно применять и в других методах визуализации, таких как, например, MRI и рентгеновская визуализация.
Типичные примеры типов газов, которые меняют контрастное свойство в зависимости от физиологических параметров в окружающей ткани, включают в себя газы, которые генерируются из предшественника в результате, например, изменений рН, температуры или давления, в частности в результате химической реакции, в результате достижения точки кипения газа или в результате изменения растворимости; газы, которые конкурируют с газами крови за абсорбцию или сайты абсорбции в матричном или мембраном материале; газы, которые меняют свойства (например, теряют гиперполяризацию или меняют другие магнитные свойства) при контакте с текучими средами или компонентами организма, в том числе его растворенными компонентами; молекулы газа, чувствительные к рН; газы, которые меняют свойства/объем под действием окружающего газа (например, парциального давления кислорода), и так далее.
Предпочтительные газы включают в себя водород, кислород, азот, благородные газы (в том числе гиперполяризованные газы), диоксид углерода, фторированные газы (например, гексафторид серы, фторированные углеводороды, полностью фторированные углеводороды и другие фторированные галогенированные органические соединения в газовой фазе) и низкомолекулярные углеводороды. Предпочтительные газы также включают в себя любую фармацевтически приемлемую газовую смесь, как, например, смеси воздуха и воздуха/перфторуглеводорода. Предпочтительно газообразный перфторуглеводород выбирают из перфторметана, перфторэтана, перфторпропанов и перфторбутанов. Можно применять любой фармацевтически приемлемый газовый предшественник. Среди подходящих газовых предшественников есть соединения, которые образуют газ в результате химической реакции (например, соединения, чувствительные к рН, например угольная кислота, аминомалоновая кислота или другие приемлемые чувствительные к рН генерирующие газ вещества). Другими подходящими газовыми предшественниками являются соединения, которые образуют газ в результате действия других физиологических условий, как, например, температуры, кислорода, ферментов или других физиологических параметров/соединений, значимых для ткани организма (в нормальном или болезненном состоянии), или активируемые до состояния, образующего газ, в результате взаимодействия с внешним стимулом (например, фотоактивация, звуковая активация и так далее).
Инкапсулирующий материал может быть любым материалом, таким как, например, липиды, фосфолипиды, поверхностно-активные вещества, белки, олигомеры или полимеры. Такие материалы можно выбирать так, чтобы они растворялись, плавились, распадались, ослаблялись, чтобы у них увеличивалась пористость, или чтобы они как-либо иначе разлагались, меняли фазовое состояние или размер (например, путем агрегации из-за изменения заряда поверхности, например, в ответ на местную концентрацию Са2+ и/или Мg2+) в ответ на физиологический параметр так, чтобы позволить генерирующему контраст компоненту высвободиться в окружающую текучую среду или позволить текучей среде организма или ее компонентам войти в контакт с генерирующим контраст агентом, или повысить местную концентрацию компонента контрастного агента выше предела обнаружения, и так далее. Таким путем эффект генерирования контраста генерирующего контраст компонента можно распространить (например, в пространство внеклеточной текучей среды), включить или увеличить (например, путем генерирования генерирующего контраст компонента, такого как газ, или путем усиления контакта с водой (для положительного (T1-эффект) MR контрастного агента, такого как хелат гадолиния)), или отключить или уменьшить (например, путем нарушения компартментализации, необходимой для негативного (Т2-эффект) MR контрастного агента, такого как хелат диспрозия, или путем гашения радикала, или деполяризацией гиперполяризованного ядра, или растворением газа, растворимого в крови). Более того, генерирующим контраст компонентом можно насыщать пористую твердую матрицу, например цеолит, причем выходы пор затем полностью или частично закрывают, применяя материал, который разрушается, плавится или растворяется, когда соответствующий физиологический параметр (например, рН, температура, концентрация фермента) в окружающей текучей среде организма становится выше или ниже заранее установленного значения.
Применяемый согласно этому изобретению контрастный агент в форме частиц может реагировать на физиологические параметры несколькими разными путями. Согласно одному аспекту контрастный агент в форме частиц может реагировать на физиологический параметр тем, что в области, где соблюдается определенное значение конкретного параметра, он накапливается в сравнении с областями, где оно не соблюдается. Согласно другому аспекту этого изобретения контрастный агент в форме частиц реагирует тем, что он накапливается в областях, где это значение физиологического параметра не соблюдается. Согласно еще одному аспекту изобретения контрастный агент в форме частиц реагирует на заданный параметр тем, что он распадается, причем этот распад представляет собой растворение или химическое разложение. Особенно полезной является реакция на физиологический параметр, состоящая в утечке или иной транспортировке в частицы или из частиц. Противоположная ситуация, при которой реакция на физиологический параметр состоит в том, чтобы предотвратить растворение/утечку путем достижения увеличения стабильности или снижения мембранного транспорта в сравнении с частицами в областях, где пороговое значение заданного параметра не соблюдено, также является предпочтительным аспектом настоящего изобретения. Такой тип реакции полезен, поскольку прошествие времени может вести к снижению контраста посредством элиминации из органа в областях, где пороговое значение этого параметра не соблюдено, тогда как контраст сохраняется в области, представляющей интерес.
Когда композиция в форме частиц реагирует путем распада или транспорта, можно достичь изменений в эффекте контраста, обнажая контрастные агенты, которые в противном случае невидимы/экранированы, изменяя распределение контрастных агентов или, когда контрастный агент сам является частицей (как в случае контрастных агентов для ультразвука), разрушая свойство, придающее контраст. Особенно полезными являются композиции в форме частиц, где эффект контраста достигается взаимодействием с окружающей средой. В этом случае для детектирования физиологических параметров можно применять как транспорт контрастного агента, так и транспорт фактического компонента окружающей среды. Примером являются MRI контрастные агенты, где увеличение степени доступности/транспорта воды к контрастному агенту приводит к измеряемому усилению контраста. В этом случае реакцией на физиологический параметр может быть увеличенная скорость транспорта воды в частицы или из частиц.
Утечка или увеличенная скорость транспорта растворенных веществ в/из частицы может быть достигнута множеством разных способов. Для того, чтобы индуцировать утечку/транспорт, можно использовать все виды фазовых переходов. Например, твердая частица/мембрана может стать пропускающей, когда она плавится, причем этот процесс чувствителен к температуре. Фазовые переходы с участием газовой фазы можно применять, чтобы реагировать на давление как физиологический параметр. Особенно полезным аспектом настоящего изобретения являются частицы, включающие в себя жидкокристаллический материал, как, например, липосомы, ниосомы или другие везикулы. Жидкокристаллические материалы могут претерпевать несколько разных фазовых изменений, которые могут вызывать утечку и/или увеличение скорости транспорта растворенных веществ или даже разрушение частицы. Например, фазовый переход фосфолипидов от геля к жидкокристаллической фазе может увеличить проницаемость липосом и увеличить скорость транспорта или вызвать утечку растворенных веществ при нагревании и, следовательно, температурную чувствительность. Переход от ламеллярной к обратной гексагональной фазе также индуцирует утечку, поскольку для липосом требуются липиды в ламеллярной, гелевой или другой слоистой фазовой структуре. Переход от ламеллярной к обратной гексагональной фазе может быть индуцирован рН, электролитами и изменениями в химическом окружении, такими как нацеливание, ферменты, антитела и так далее. На подходящий для реагирования параметр, чтобы отвечать на него, можно настроиться, выбрав состав мембраны и технологию. Для того, чтобы вызвать утечку, можно применять другие фазовые переходы, такие как переходы от ламеллярной к кубической фазе, от ламеллярной к микроэмульсионной фазе или от ламеллярной к нормальной гексагональной фазе.
Частицы на основе геля или частицы, окружающие гель (например, частицы, полученные коацервацией), могут реагировать на физиологический параметр, например, снижением вязкости геля. Такое снижение вязкости можно, например, получить с помощью температуры, рН или электролитов, таких как Са2+ или Мg2+, и частицы поэтому являются чувствительными к этим параметрам. Такие параметры могут также индуцировать разделение фаз в частицах геля, приводя к утечке жидкости и разделению фаз полимера, который составляет этот гель. Эти механизмы могут, в свою очередь, влиять на такой параметр, как утечка воды и воздействие воды на, например, парамагнитные хелаты, и следовательно, приводить к изменению контраста MRI.
Частицы или мембраны, состоящие из твердого полимера, также могут реагировать на физиологические параметры. Например, температура может изменить температуру перехода полимера из высокоэластического состояния в стеклообразное и, таким образом, индуцировать фазовые переходы в полимерной мембране, которая, в свою очередь, может влиять на такой параметр, как транспорт воды, который влияет на контрастную эффективность контрастного агента.
Частицы, которые по меньшей мере частично состоят из водорастворимых полимеров или стабилизированы водорастворимыми полимерами, например пептидами, могут реагировать на физиологические параметры изменением конформаций пептидов. Например, пептиды могут претерпевать переход от α-спирали к β-слою или наоборот и, следовательно, влиять на параметр, который, в свою очередь, влияет на контраст. Также и переходы к/от α-спирали или β-слоя к неупорядоченному клубку могут влиять на такой параметр, как проницаемость мембран, устойчивость частиц к агрегации/коагуляции или даже слиянию, или растворение или выпадение частиц в осадок, который, в свою очередь, изменяет контрастную эффективность контрастного агента.
В качестве контрастных агентов в случаях, когда методом визуализации является ультразвук, также применимы чувствительные к температуре и давлению эмульсии и текучие среды.
Утечку можно контролировать также компонентами, образующими каналы или другие транспортные пути через мембрану частицы. Эти каналы могут контролировать транспорт молекул в частицу или из частицы и быть весьма селективными, например для ионов. К примеру, белок тубулин, который в отсутствие Са2+ образует микротрубочки, может индуцировать более сильную утечку в присутствии Са2+, чем в отсутствие Са2+, и, следовательно, является чувствительным к Са2+. К числу других белков/ферментов, которые могут контролировать транспорт вещества в везикулу или из везикулы, относятся эритроцитарный переносчик анионов, эритроцитарный переносчик глюкозы, Nа+,K+-ATФаза (Na+/K+-нacoc), Са2+-АТФаза (Са2+ -насос) и бактериородопсин (Н+-насос). Также для того, чтобы в результате реакции на внешние параметры индуцировать/предотвращать утечку, можно применять в качестве компонентов мембран биологические поверхностно-активные вещества, такие как итурины, эсперин, бацилломицины, микосубтилин, сурфактин и подобные им вещества, поскольку эти молекулы могут реагировать на влияния со стороны внешних параметров изменениями во вторичной и третичной структуре, а также свойствами самосборки.
Генерирующий контраст компонент в MR контрастных агентах, применяемый согласно этому изобретению, обычно представляет собой парамагнитное, суперпарамагнитное, ферримагнитное или ферромагнитное соединение и/или соединение, содержащее иные, чем водород, ядра с ненулевым спином, например19F,13С,15N,29Si,31P, и определенные благородные газы, такие как129Хе или3He.
В качестве парамагнитных соединений предпочтительны стабильные свободные радикалы и соединения (особенно хелаты) переходных металлов или металлов группы лантанидов, например соединения марганца, хелаты гадолиния, хелаты иттербия и хелаты диспрозия. Предпочтительными магнитными (например, суперпарамагнитными) соединениями являются Y-Fe2O3, Fе3O4 и другие оксиды железа/металла с высокой магнитной восприимчивостью. Предпочтительными фторированными соединениями являются соединения с относительно короткими временами19F T1 -релаксации. Другими предпочтительными фторированными соединениями по настоящему изобретению являются фторированные рН-зонды, такие как соединения, описанные в ЕР-0447013, Schering A.G., и ZK-150471, описанное Y. Aoki, in Invest. Radiol 1996, 34, 680-689. Примеры эффективных MR контрастных материалов хорошо известны из патентной литературы, смотри, например, патентные публикации от Nycomed, Salutar, Sterling Winthrop, Schering, Squibb, Mallincrodt, Guebert и Вrассо.
В общем, есть два типа генерирующих контраст компонентов, пригодных для MR контрастных агентов для применения по этому изобретению: компоненты, которые изменяют контрастное свойство как результат физиологических параметров в окружающей ткани, и компоненты, которые инертны по отношению к физиологии, но изменяют контрастные свойства как результат взаимодействия между материалом оболочки/инкапсулирующим материалом и физиологией. Типичными примерами являются GdDTPA, GdDTPA-BMA, GdDOTA, GdHPDO3A, РrDО3А-производные и Tm хелаты в термочувствительных липосомах или рН-чувствительных везикулах.
Типичные примеры компонентов, которые меняют контрастное свойство как результат физиологических параметров в окружающей ткани, включают в себя парамагнитные хелаты, которые меняют релаксационные свойства и/или меняют химический сдвиг как результат температуры, парамагнитные хелаты, которые меняют координационное число и через него релаксационные свойства и/или сдвиговые свойства как функцию рН, парамагнитные соединения, например соединения марганца (Мn(2+)/Мn(3+)), соединения европия (Eu(2+), Eu(3+)) и свободные радикалы (радикал, не радикал), которые меняют релаксационные свойства и/или сдвиговые свойства как результат парциального давления/концентрации кислорода или как результат окислительно-восстановительного потенциала в окружающей ткани, парамагнитные и магнитные соединения, которые меняют релаксационные/сдвиговые свойства как результат ферментативной активности (например, при ферментативном отщеплении парамагнитных хелатов от сконъюгированных с ними макромолекул, вызывающем тем самым изменение периода корреляции и/или водную координацию) и парамагнитные хелаты, которые меняют свойства как результат концентрации ионов в ткани, например, из-за изменений водной координации.
Парамагнитные соединения по настоящему изобретению оказывают действие либо на времена релаксации (Т1 или Т2), либо на химический сдвиг. Типичными соединениями, которые изменяют времена релаксации, являются хелаты гадолиния, соединения марганца и суперпарамагнитные оксиды железа. С другой стороны, хелаты европия являются хорошо известными соединениями химического сдвига. Влияние на химический сдвиг связано с температурой. На этом основании макроциклические парамагнитные хелаты, такие как 2-метоксиэтилзамещенный PrDO3A и 1,4,7,10-тетраазациклододекан-1,4,7,10-тетракис(метиленфосфонаттулиевый комплекс), были предложены в качестве температурных зондов (смотри WO 94/27977 (Platzek, Schering) и С. S. Zuo et al. in J. Magn. Res. 133, 53-60 (1998)). Все эти парамагнитные соединения можно применять согласно настоящему изобретению.
Генерирующие контраст компоненты в рентгеноконтрастных агентах для применения по этому изобретению обычно представляют собой газ или
генератор газа, или водорастворимое
соединение, содержащее тяжелые атомы (например, с атомным номером 37 или больше), например хелаты металлов, кластеры металлов, хелаты кластеров металлов и
иодированные соединения. Предпочтительные
генерирующие контраст компоненты включают в себя ионные и неионные иодированные органические ароматические соединения, в частности трииодфенильные
соединения. Наиболее предпочтительны разрешенные к
применению контрастные агенты на основе иода, такие как соли, например натриевые или меглуминовые соли иодамида, иоталамата, диатризоата, иоксаглата
и метризоата, и неионные соединения, такие как
метризамид (смотри DE-A-2031724), иопамидол (смотри ВЕ-А-836355), иогексол (смотри GB-A-1548594), иотролан (смотри ЕР-А-33426), иодецимол (смотри
ЕР-А-49745), иодиксанол (смотри ЕР-А-108638), иоглюкол
(смотри USA-4314055), иоглюкомид (смотри ВЕ-А-846657), иоглунид (смотри DE-A-
2456685), иогуламид (смотри ВЕ-А-882309), иопромид
(смотри DE-A-2909439), иосакол (смотри DE-A-3407473), иосимид
(смотри DE-A-3001292), иотасул (смотри ЕР-А-22056), иоверсол (смотри ЕР-А-83964) и иоксилан (смотри WО 87/00757).
Такие генерирующие контраст компоненты можно вводить в матрицы или оболочки, которые чувствительны к одному или более чем одному физиологическому параметру.
Входящие в состав контрастных агентов для медицинской радиологии генерирующие контраст компоненты для применения согласно этому изобретению могут представлять собой любое радиоактивное соединение такого типа, который используется в диагностической медицинской радиологии, например известные соединения, применимые для сцинтиграфии, SPECT и PET. Типичные соединения включают в себя соединения, содержащие радиоактивный иод; материалы, меченные111индием, и материалы, меченные99mТc (например,99mTcDTPA,99mTcHIDA и99mТс-меченные полифосфонаты) и51 CrEDTA.
Такие генерирующие контраст компоненты можно вводить в матрицы и оболочки, которые чувствительны к одному или более чем одному физиологическому параметру.
Для других методов визуализации, таких как световая визуализация, оверхаузеровская MRI, кислородная визуализация, визуализация магнитных источников и томография приложенного потенциала, контрастные агенты можно получать посредством инкапсуляции генерирующего контраст компонента, например хромофора или флюорофора (предпочтительно имеющего максимум поглощения или испускания в диапазоне от 600 до 1300 нм, особенно от 700 до 1200 нм), стабильного свободного радикала, суперпарамагнитной частицы или ионных (предпочтительно полиионных) разновидностей, соответствующим образом в физиологически чувствительную матрицу или оболочку.
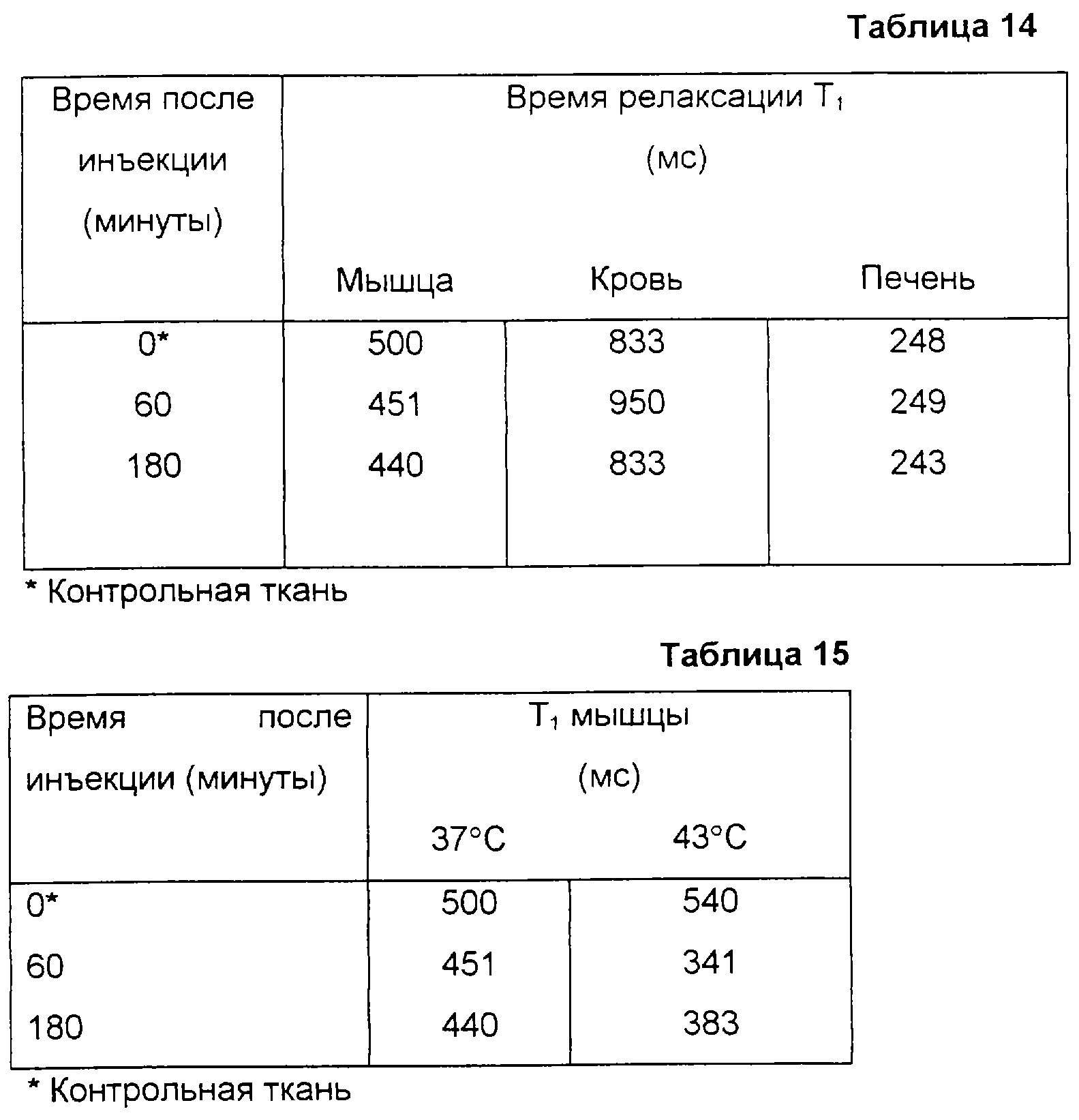
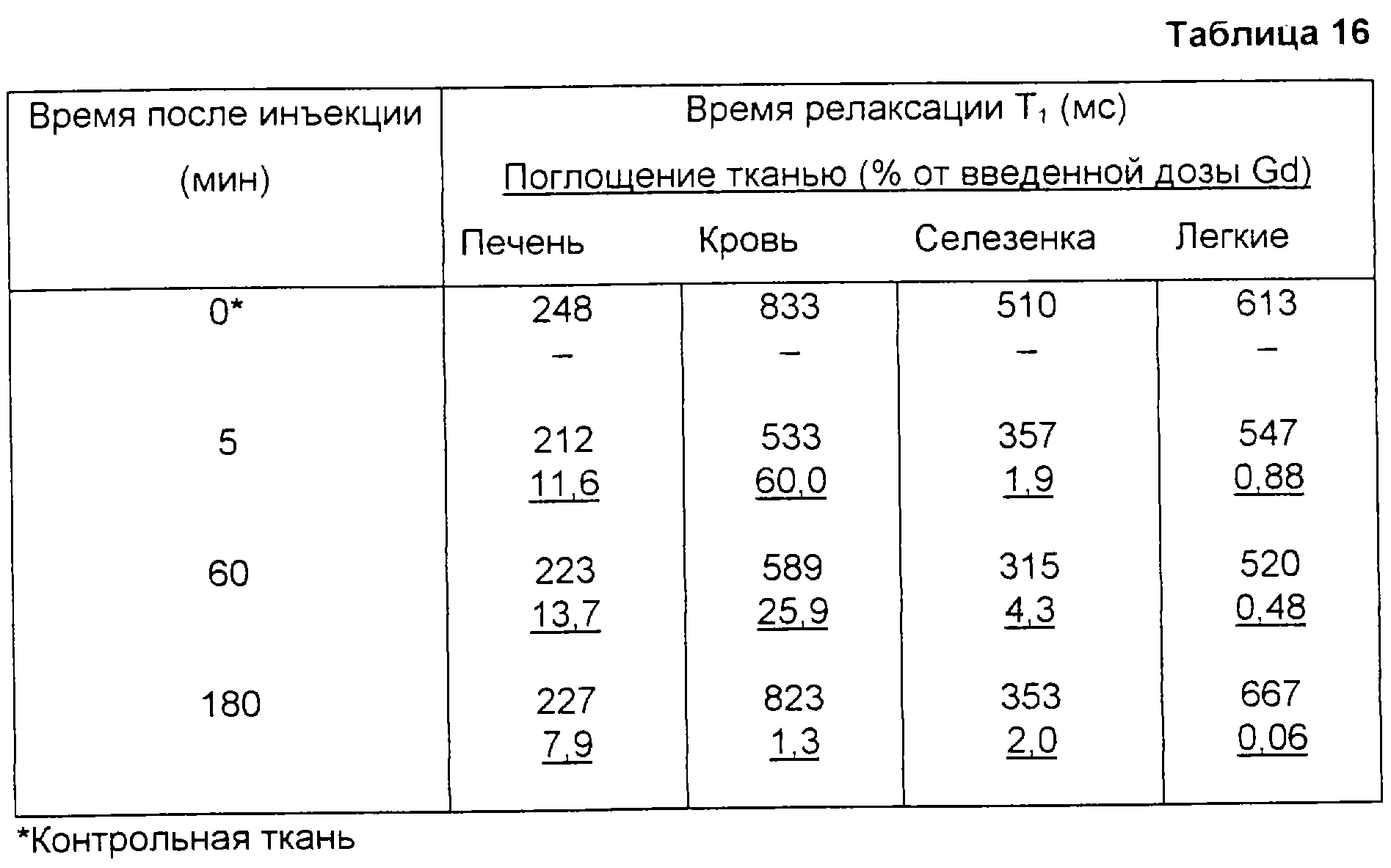
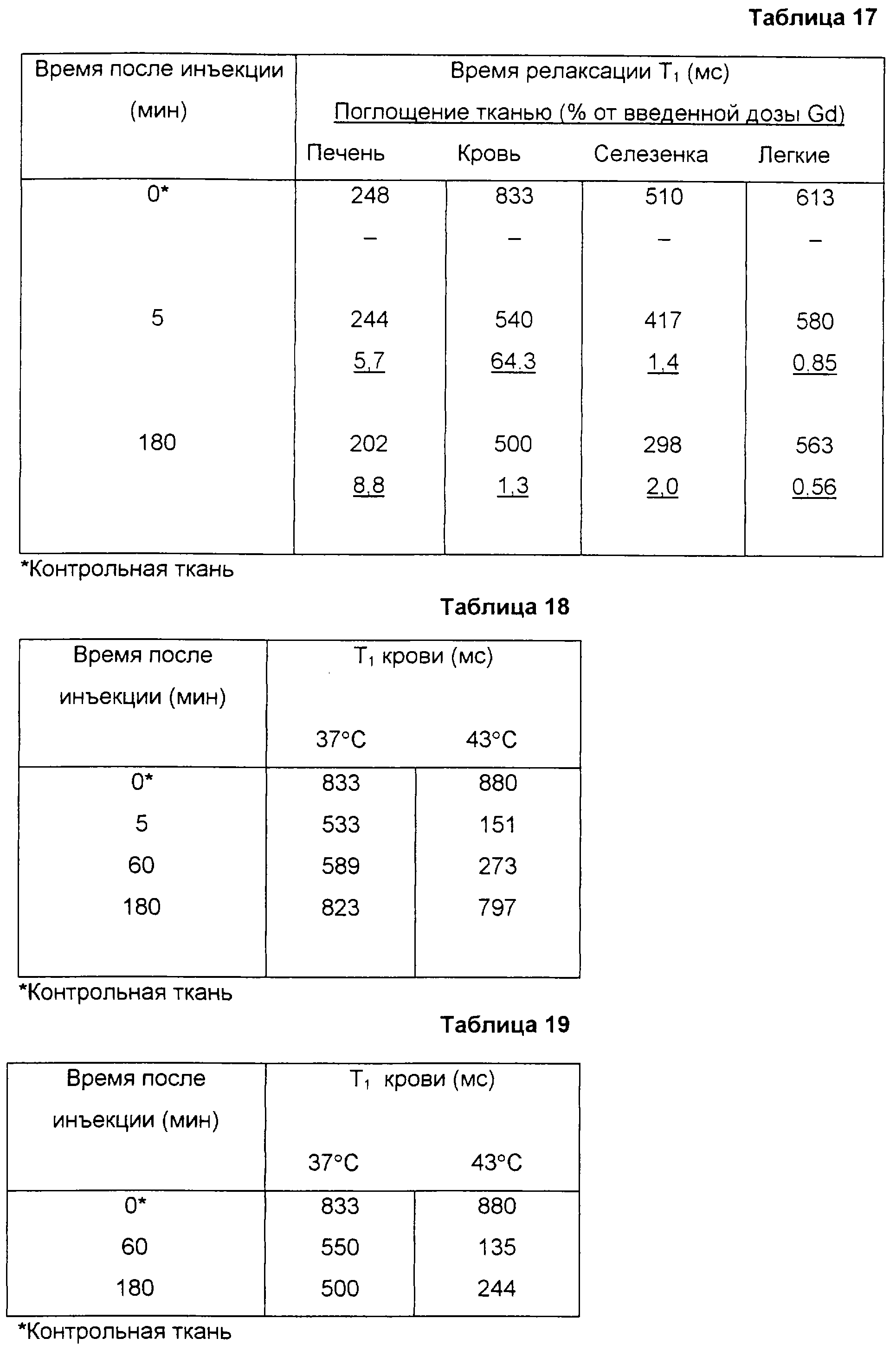
Измерения температуры in vivo всегда представляли большой интерес, потому что температура является важным физиологическим параметром, имеющим отношение к нескольким показаниям, в том числе раку, сердечно-сосудистым болезням и воспалению. Местное отслеживание температуры также должно представлять большую ценность во время гипертермического лечения.
Генерирующие контраст компоненты могут быть высвобождены из матрицы/инкапсулирующего материала в результате повышения температуры и тем самым могут изменить свое контрастное свойство или распределиться в иных тканях, чем в тех, где распределен продукт в форме частиц. Или же, в случае MR активного агента, чувствительного к температуре, изменение контрастной эффективности может произойти из-за увеличения проницаемости матрицы/инкапсулирующего материала и, следовательно, из-за увеличения скорости транспорта воды через матрицу/инкапсулирующий материал, даже если сам агент не покидает матрицу/инкапсулирующий материал.
Типичными примерами чувствительных к температуре материалов в форме частиц являются чувствительные к температуре липосомы, причем они особенно пригодны для применения с MRI. В этих липосомах использован тот факт, что проницаемость мембран заметно повышается при температуре фазового перехода (Тc) их мембранных липидов от геля к жидкокристаллической фазе. Также, возможно в зависимости от свойств мембраны и природы MR активного агента, может происходить утечка этого агента. Липосомы, полученные из специфических фосфолипидов или специфической смеси фосфолипидов, могут быть стабильными до температуры 37oС, но при этом демонстрировать повышенную проницаемость для воды и/или утечки, когда они проходят через область тела, в которой температура повышена, например, до 40-45oС, в результате болезненного процесса или внешнего нагревания.
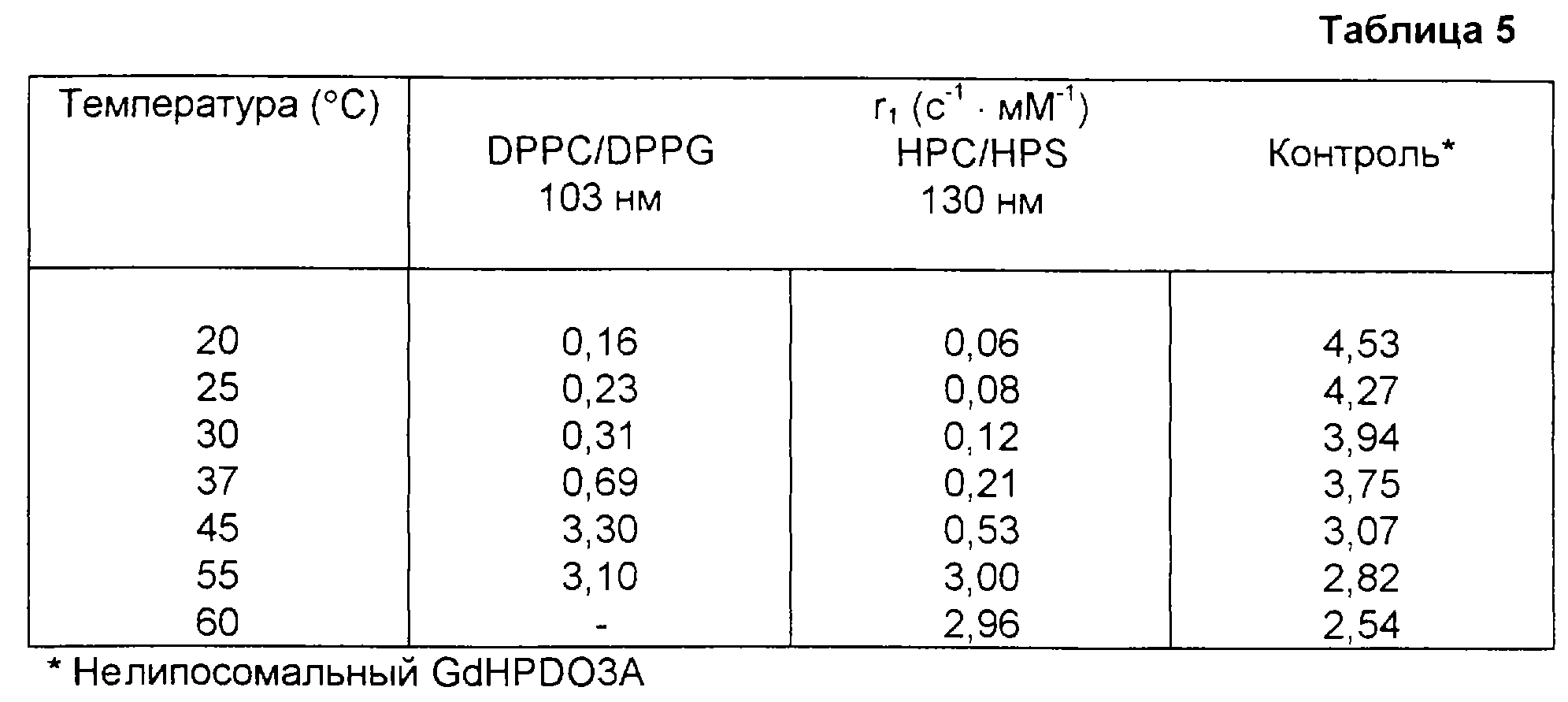
Приведенная табл. 1 показывает температуры перехода разных насыщенных фосфатидилхолинов.
Приведенная табл. 2 показывает фазовый переход разных ненасыщенных фосфатидилхолинов.
Приведенная табл. 3 показывает температуру фазового перехода разных асимметричных фосфатидилхолинов.
Приведенная табл. 4 показывает температуру фазового перехода разных насыщенных симметричных фосфатидилглицеринов (PG) в форме их натриевых солей.
Табл. 1-4 основаны на информации из каталога продуктов Avanti Polar Lipids Inc., USA.
Соответственно фосфолипиды или смеси фосфолипидов можно подбирать так, чтобы получать продукты с правильной Тс для чувствительных к температуре липосом для диагностического применения. Типичными смесями для получения чувствительных к температуре липосом являются смеси дипальмитоилфосфатидилхолина (dipalmitoylphosphatidylcholine, DPPC) и дипальмитоилфосфатидилглицерина (dipalmitoylphosphatidyl glycerol, DPPG) и дистеарилфосфатидилхолина (distearyllphosphatidylcholine, DSPC).
Кроме того, контрастные агенты в форме частиц могут реагировать на температуру, используя свойственную некоторым полимерным системам конформационную чувствительность к температуре. Примером является поли(N-изопропилакриламид), фазы которого разделяются при 37oС. Следовательно, частицы, включающие в себя контрастный агент, должны становится пропускающими в зависимости от температуры (смотри Hoffmann et al. Macromol. Symp. 118, 553-563 (1997)).
Другими примерами чувствительных к температуре матриц/оболочек являются липидные суспензии/эмульсии, содержащие генерирующий контраст компонент или другие препараты в форме частиц или подобные частицам, которые высвобождают генерирующий контраст компонент или меняют свойства как результат изменений температуры.
Если исследуемый параметр такой, что им можно манипулировать, например лечением лекарственными
средствами, внешним подводом тепла и так далее, то его можно применять для
изучения эффективности такого лечения, либо локализация такого лечения может быть использована для того, чтобы вызывать
изменение контрастной эффективности, что, в свою очередь, можно применять для
того, чтобы измерять такие параметры, как перфузия органа. Так, например, внешний подвод тепла к органу, представляющему
интерес, возле него или выше его можно применять для того, чтобы вызывать
высвобождение контрастного агента из частиц, причем этот контрастный агент может диффундировать в этот орган и тем самым
детектировать перфузию крови (или отсутствие перфузии) в этом органе. В этом
контексте можно вводить термочувствительный контрастный агент в сочетании с внешним нагреванием, чтобы следить за
транспортом тепла в частях тела. Транспорт тепла in vivo прямо связан с током крови
через биотепловое уравнение (J. Appl. Physiol, v. 1, (1948), 93-122)

где rt (кг/м3) означает плотность ткани, Ct (Дж/кг•oС) означает удельную теплоемкость ткани, t (с) означает время, Т (oС) означает температуру, Wb (кг/м2•с) означает перфузию крови, cb (Дж/кг•oС) означает удельную теплоемкость крови, Тa (oС) означает артериальную температуру, k (Вт/м•oС) означает теплопроводность ткани, Qp (Вт/м3) означает накопление тепла и Qm (Вт/м3) означает локальную метаболическую величину. Следовательно, термочувствительные композиции в форме частиц могут, после контролируемого локализованного внешнего нагревания, давать критерий перфузии крови в органе.
Температурную
реакцию термочувствительных MR-липосом можно в общем разделить на три разных области:
а) область "низкой релаксивности"; r1=r1низк; Т<Та, где r1низк является константой при температуре (Т);
б) "температурно-активная" область; r1(T)=f(T); Тb <Т<Та и
в) область "высокой релаксивности"; r1=r1выс; Т>Тb, где r1выс является константой при Т (в
идеале r1выс>>r1низк).
Локальную температуру в температурно-активной области липосом можно определять количественно при условии соответствия трем критериям.
1. Вокруг Т существует вполне определенная связь между релаксивностью липосом и температурой, то есть r1(T) = f(T); Та<Т<Тb, где диапазон от Та до Тb является клинически значимым температурным диапазоном. В идеале r1 должна быть линейной функцией Т в диапазоне от Тa до Тb.
2. Температурно-активная область охватывает достаточно большой диапазон температур.
3. Должна быть известна концентрация Gd в ткани [Gd].
Если [Gd] не известна, даже качественная оценка изменений температуры может оказаться затруднительной, поскольку области с разными [Gd] будут иметь разную степень усиления, даже если температуры одинаковы. Более того, будет невозможно сказать, является ли отсутствие усиления после нагревания следствием низкой локальной температуры или отсутствия липосом в этой области.
Однако локальную [Gd] in vivo можно оценить на основании релаксационных эффектов липосом в состоянии "низкой релаксивности" следующим способом.
1. Получают количественные изображения R1 и/или R2/R2* (R1,2 = 1/T1,2) перед введением контраста и после введения контраста, но перед началом гипертермии. Изображения R1 и R2/R2 * можно получать в рутинных процедурах на большинстве современных клинических MR-систем.
2. Измеряют фракционное изменение R1 и/или R2/R2*, Δ R1 = R1после - R1до в области, представляющей интерес.
3. Тогда локальную концентрацию Gd задает соотношение [Gd]=ΔR1/ r1.
4. Если r1 не известно, соотношение концентраций Gd между двумя областями задается соотношением [Gd1]/[Gd2 ]=R11/ΔR12. Или же для получения того же соотношения Gd можно использовать изображения R2 или R2*.
Поэтому абсолютную [Gd] определить, в общем, нельзя, если не известна релаксивность липосом в ткани. Однако ее можно вполне хорошо аппроксимировать для релаксивности r, но не для релаксивности r*, поскольку она зависит от геометрии ткани. Тем не менее [Gd] в одной области относительно [Gd] в другой области можно определить, как описано выше. Информация об относительной [Gd] важна, потому что ее можно использовать для того, чтобы настраивать усиление сигнала в образе так, чтобы он отражал истинные температурные изменения. Чтобы это было возможно, надо допустить существование "сердцевинной области", где температура выше Тc. В клинической ситуации существование такой сердцевинной области, где нагревание наиболее эффективно, является вероятным, причем эта область окружена "областью полумрака", где нагревание менее эффективно, и распределение температур является менее определенным. Теперь, когда известна относительная [Gd] в сердцевине сравнительно с областью полумрака, интенсивность изображения можно настраивать так, чтобы компенсировать любые различия в [Gd] между этими двумя областями.
Возможно оценить [Gd1]/[Gd2] с помощью сильно T1-взвешенной последовательности, в каковом случае изменение интенсивности сигнала почти линейно связано с изменением R1 и, следовательно, [Gd]. Для этого требуется, чтобы в ткани-мишени TR<< T1. Аналогичным образом, чтобы оценивать [Gd1]/[Gd2], можно использовать сильно Т2- или Т2*-взвешенные последовательности.
Таким образом, когда Gd соединение инкапсулировано в липосомах, результирующая релаксивность (r1, r2) мала из-за ограниченного доступа воды к парамагнитному центру. Однако при условии использования очень T1-чувствительной последовательности, все же возможно детектировать изменение в T1 благодаря присутствию липосом перед нагреванием (то есть при температурах намного более низких, чем Тc). Следовательно, при получении количественных R1- или T1 -карт области, представляющей интерес, до и после введения контраста (до гипертермического лечения), изменение R1 или T1 делает возможным определение локальной концентрации Gd [Gd]. Таким образом после нагревания можно учитывать варьирование по [Gd] между областями, поэтому можно различать варьирование усиления контраста из-за различий температуры и варьирование усиления контраста из-за варьирования концентраций.
Продольная скорость релаксации R1 после введения контраста задается соотношением
R1=R*1+[Gd]*r1,
где
R*1 означает скорость релаксации до ведения контраста. Поэтому изменение в R1 из-за контрастного агента описывается выражением
ΔR1
=R1
-R*1=[Gd]*r1.
После гипертермии генерируется новая R1- или T1-карта.
Поэтому можно заключить, что, при возможности детектирования T1-эффекта липосом ниже Тc, можно картировать локальные концентрации Gd и, следовательно, компенсировать различия в усилении контраста после нагревания, происходящие из-за локальных вариаций концентрации Gd. Также для этой цели можно использовать R2- или R2*-эффект липосом.
Измерения рН in vivo всегда представляли большой интерес, потому что рН является важным физиологическим параметром, связанным с несколькими серьезными заболеваниями. Величина рН обычно снижается во время раковых заболеваний, сердечно-сосудистых заболеваний, как, например, инсульта, остеопороза, воспалений и аутоиммунных заболеваний.
Один из типов рН-чувствительной инкапсуляции для диагностических агентов включает в себя применение липосом, чувствительных к рН. Общая стратегия состоит в том, чтобы применять рН-чувствительные группы в мембране липосом. Типичные группы такого рода имеют значения рКа между 4 и 5,5. Фосфолипиды, применимые для получения рН-чувствительных диагностических агентов, включают в себя дигептадеканоилфосфатидилхолин (diheptadecanoylphosphatidylcholine, DHPC) в смеси с DPPC и N-пальмитоилгомоцистеином (N-palmitoylhomocystein, PHC) в разных соотношениях (смотри обзор по липосомам, чувствительным к рН и температуре, в Eur. J. Pharm. Biopharm. 1993, 39, 97-101).
Другой тип рН-чувствительной инкапсуляции генерирующих контраст компонентов включает в себя применение рН-чувствительных поверхностно-активных агентов, как, например, N-додецил-2-имидазола пропионат (N-dodecyl-2-imidazole propionate, DIP), который имеет рКа 6,8 (смотри, например, Pharm. Res. 1993, 13, 404). Это значит, что при рН 7,3-7,4 (физиологическом) DIP находится в неионизированной (поверхностная активность низкая или отсутствует) форме (80%), тогда как, например, при лизосомальном рН (5,2) более 97% будет в заряженной форме.
Другой способ рН-зависимой инкапсуляции генерирующих контраст компонентов включает в себя применение матричных материалов и/или оболочечных материалов, имеющих значения рКа в диапазоне от 4,5 до 7,0, так что этот материал растворим или частично растворим в заряженной форме и нерастворим или частично нерастворим в незаряженной форме. Такими соединениями могут быть физиологически приемлемые низкомолекулярные соединения или физиологически приемлемые полимеры.
Еще один способ рН-чувствительной инкапсуляции включает в себя применение соединений, которые в результате рН расщепляются химически, например полиортоэфиров или полиацеталей/кеталей, которые расщепляются в кислых условиях.
Липосомы, включающие в себя фосфатидилэтаноламины (phosphatidyl ethanolamines, РЕ) в качестве центрального компонента, представляют собой другой пример липосом, которые могут претерпевать фазовый переход и становиться пропускающими, когда рН снижается. рН-чувствительные липосомы можно также получать включением жирных кислот в фосфолипидные мембраны.
В принципе можно применять любую систему заряженных частиц, у которой заряд зависит от рН и влияет на упаковку мембранного материала.
Доступ к кислороду имеет критическое значение для всех типов клеток, и диагностические агенты для определения концентрации/парциального давления кислорода в тканях должны иметь огромную важность в диагностике таких заболеваний, как рак, сердечно-сосудистые заболевания, аутоиммунные заболевания и некоторые заболевания центральной нервной системы.
Одним из типов чувствительного к кислороду или чувствительного к окислению-восстановлению материала для инкапсуляции/оболочки является материал с разными свойствами растворимости/диффузии в зависимости от уровня кислорода или статуса окисления-восстановления; например, соединения, содержащие нитрогруппу, которая in vivo восстанавливается в аминогруппу, что улучшает растворение этого материала в восстановительном/низкокислородном окружении.
Для нескольких заболеваний важно определять концентрации физиологически важных ионов в ткани.
Типы материалов для инкапсуляции, чувствительных к концентрациям ионов, которые можно применять в этой связи, включают в себя фосфолипиды, поверхностно-активные вещества и другие материалы, образующие хелаты с ионами. Например, отрицательно заряженные липосомы связывают Са2+, и их мембрана изменяет свои диффузионные свойства и становиться более плотной.
Примером композиций в форме частиц, чувствительных к Са2+/Мg2+, являются липосомы, обогащенные димерным фосфолипидом кардиолипином. Мембрана, содержащая кардиолипин, может претерпевать переход от ламеллярной к обратной гексагональной фазе при добавлении двухвалентных катионов, поскольку эти ионы связываются с дифосфатидильной группой кардиолипина.
Чувствительность к Са2+ или Мg2+ можно получить, применяя частицы, стабилизированные зарядом, например твердые частицы, жидкие частицы, такие как капельки эмульсии, газообразные частицы, такие как дисперсии микропузырьков или липосом. Таким образом, Са2+ или Мg2+ могут вызывать агрегацию или коагуляцию среди этих частиц и посредством этого изменять контрастный эффект. Также чувствительность к Ca2+ или Мg2+ можно получить, применяя стабилизирующие группировки для частиц, которые подвержены химическому или физическому влиянию со стороны Ca2+ или Мg2+, например применяя поверхностно-активные вещества, которые при действии Са2+ или Мg2+ на них образуют нерастворимые в воде вещества и, таким образом, выпадают в осадок.
Некоторые частицы или стабилизирующие мембраны, окружающие частицы, могут при действии Са2+ или Мg2+ на них также отвечать фазовым переходом. Примером являются частицы на жидкокристаллической основе, например липосомы, которые при добавлении Са2+ или Мg2+ могут реагировать переходом от ламеллярной к обратной гексагональной фазе. Также гелевые частицы при действии Са2+ или Мg2+ на них могут легко реагировать на Ca2+ или Мg2+ значительным снижением вязкости или даже фазовым разделением полимера, который образует основу геля. Это снижение вязкости или разделение фаз может индуцировать изменение контрастного эффекта.
Типы чувствительного к ферментам инкапсулирующего материала включают в себя матрицы и оболочки, которые разлагаются ферментами, например простые эфиры низкомолекулярных соединений или полиэфиры, такие как полиуксусная кислота, и другие.
Различные метаболиты также могут изменять свойства материалов оболочки.
Частицы можно сделать чувствительными, например, к антителам, основываясь на усиленной утечке из-за фазового перехода, индуцированного химическим связыванием между молекулами мембраны и антителом. Например, липосомы, включающие в себя N-(динитрофениламино-ε -капроил)фосфатидилэтаноламин (N-(dinitrophenylamino-ε-caproyl)phosphatidyl ethanolamine, DNP-cap-PE) при связывании с анти-DNP становятся пропускающими из-за перехода от ламеллярной к обратной гексагональной фазе. Другой пример включает в себя липосомы, в состав которых входит человеческий гликофорин А в мембранах из диолеилфосфатидилэтаноламина. Эти липосомы становятся пропускающими при добавлении к ним иммобилизованных антител.
Дальнейшим аспектом настоящего изобретения является применение одного из описанных выше диагностических агентов в форме частиц вместе с другим соединением, которое имеет возможность изменять физиологический параметр, представляющий интерес, или вместе с применением внешнего источника энергии изменять параметр, представляющий интерес.
Так, одним из примеров является введение термочувствительных диагностических агентов в сочетании с внешним нагреванием и слежение за эффектом нагревания в частях организма.
Другим примером является введение соединений, которые изменяют рН, в связи с рН-чувствительным диагностическим агентом в форме частиц, чтобы следить за рН-профилем в области, представляющий интерес.
Еще один пример состоит в том, чтобы исследуемый субъект после введения чувствительного к кислороду диагностического агента вдыхал кислород для того, чтобы следить за поглощением кислорода в ткани.
Для получения хорошего терапевтического результата очень важна ранняя диагностика. В большинстве болезненных процессов изменения в физиологических параметрах происходят прежде изменений в морфологии. Все существующие контрастные агенты диагностируют морфологию. Новые типы контрастного агента по этому изобретению способны детектировать заболевания на очень ранней стадии в болезненном процессе и тем самым улучшать терапевтический исход для пациента.
В случаях, когда диагностический агент в форме частиц или его компонент несет суммарный заряд, его удобно использовать в форме соли с физиологически приемлемым противоионом, например катионом аммония, замещенного аммония, щелочного металла или щелочноземельного металла, или анионом, происходящим из неорганической или органической кислоты. В этом отношении особенно предпочтительны меглуминовые соли.
Диагностические агенты по настоящему изобретению можно изготавливать в виде препаратов в общепринятых фармацевтических или ветеринарных формах для парентерального введения, например суспензий, дисперсий и так далее, например, в водном носителе, таком как вода для инъекций.
Такие композиции могут дополнительно содержать фармацевтически приемлемые разбавители и эксципиенты и вспомогательные средства, например стабилизаторы, антиоксиданты, агенты для корректировки осмоляльности, буферы, агенты для корректировки рН и так далее.
В случаях, когда агент изготовлен в виде препарата в готовой к применению форме для парентерального введения, среда-носитель предпочтительно является изотонической или несколько гипертонической.
В случаях, когда агент в форме частиц, включает в себя хелат или соль разновидности иным образом токсичного металла, например иона тяжелого металла, может быть желательно включать в этот препарат небольшой избыток хелатирующего агента, например, как описано Schering в DE-A-3640708, или, более предпочтительно, небольшой избыток кальциевой соли такого хелатирующего агента.
Дозировка диагностических агентов по этому изобретению будет зависеть от метода визуализации, от генерирующего контраст компонента и от способа, которым происходит усиление контраста (включение или выключение контраста, распространение контраста из сосудистого пространства и тому подобное).
Однако в общем дозировка составляет от 1/10 до десятикратной дозировки, обычно применяемой для выбранного генерирующего контраст компонента или аналогичного компонента в том же методе визуализации. Также можно применять даже еще более низкие дозы.
При том, что настоящее изобретение особенно пригодно для способов, включающих в себя парентеральное введение материала в форме частиц, например, в сосудистую систему или прямо в ткань мышцы или органа, особенно предпочтительно внутривенное введение, также применимо введение непарентеральным путем, например трансдемальное, назальное, сублингвальное, или введение в открывающуюся во внешнюю среду полость тела, например желудочно-кишечный тракт, мочевой пузырь, матку или влагалище.
Настоящее изобретение охватывает такое ведение.
Описания всех упомянутых здесь документов включены сюда посредством ссылки.
Настоящее изобретение проиллюстрировано далее следующими неограничивающими примерами.
Пример 1
Получение чувствительных к температуре парамагнитных липосом
Липосомы, содержащие GdHPDOSA (ProHance, Bracco Spa, Милан, Италия) и GdDTPA-BMA (Omniscan, Nycomed Amersham
Imaging, Осло, Норвегия), получали способом, представляющим собой гидратацию тонкой
пленки. Применяли две разные смеси насыщенных фосфолипидов, причем одна состояла из гидрированного фосфатидилхолина
(НРС) (Lipoid Gmbh, Людвигшафен, Германия) и гидрированного фосфатидилсерина натрия
(HPS) (NOF Corporation, Агамасаки, Япония), другая была составлена из DPPC и DPPG-натрия (Sygena Ltd., Сиесталь,
Швейцария). Эти смеси фосфолипидов содержали 5 мас.% или 10 мас.% отрицательного
заряженных компонентов, представляющих собой HPS и DPPG. Растворяли эти смеси фосфолипидов в смеси хлороформа и
метанола и упаривали этот органический раствор досуха под пониженным давлением.
DPPC/DPPG-липосомы получали гидратацией липидной пленки предварительно
нагретым (55oС) водным раствором
(рН 7,4) 250 мМ GdDTPA-BMA или 250 мМ GdHPDO3A. HPC/HPS-липосомы получали
аналогично, но при температуре гидратации липидов, равной 70oС. DPPC/DPPG- и HPC/HPS-липосомам давали набухать в
течение 2 часов при 55 и 70oС соответственно. Суммарная
концентрация липидов была 50 мг/мл. Подвергали липосомы трем циклам замораживания/оттаивания в жидком азоте. Липосомы разных
размеров получали последовательной экструзией (Lipex Extruder®, Lipex Biomembranes Inc. , Ванкувер, Канада) через поликарбонатные фильтры с разными диаметрами пор. Температура
экструзии составляла 55 и 70oС для DPPC/DPPG- и HPC/HPS-липосом
соответственно. Незахваченный хелат металла удаляли гель-фильтрацией или диализом против изоосмотического и изопротонного
раствора глюкозы.
Физико-химические свойства
Средний
гидродинамический диаметр липосом варьировал от 103 до 276 нм при измерении фотонно-корреляционной спектроскопией
(ZetaSister IV, Malvern Instruments Ltd. , Малверн, Англия); зета-потенциал был
отрицательным, порядка -25 мВ, соглсно результатам лазерной допплеровской велосиметрии при 25oС (ZetaSister
IV, Malvern Instruments Ltd., Малаерн, Англия). Средняя температура фазового
перехода от геля к жидкокристаллической фазе (Тс) препаратов HPC/HPS и DPPC/DPPG составляла 50 и 42oС
соответственно при определении дифференциальной сканирующей калориметрией (DSC4, Perkin
Elmer Inc., Норуолк, Коннектикут).
Температурный ответ MR контрастной эффективности in
vitro
Фиг. 1 прилагаемых графических материалов и приведенная ниже табл. 5 показывают
температурную чувствительность T1 релаксивности (r1) in vitro для
инкапсулированных в липосомах GdDTPA-BMA и GdHPDO3A соответственно (0,47 Тл). Фиг.2 прилагаемых графических
материалов показывает температурный ответ интенсивности MR сигнала in vitro для
инкапсулированного в липосомах GdDTPA-BMA.
Фиг.3 прилагаемых графических материалов показывает серию T1-w (T1-взвешенных) GRE изображений до и после нагревания гелевого фантома, содержащего включения инкапсулированного в липосомы GdDTPA-BMA.
Пример 2
GdDTPA-BMA, инкапсулированный в DSPC/DPPC/DPPG-липосомах
Получали
DSPC/DPPC/DPPG-липосомы (массовое соотношение 28,5/66,5/5) способом, представляющем собой гидратацию тонкой пленки.
Растворяли фосфолипиды (500 мг) в смеси хлороформа и метанола и упаривали этот
органический раствор досуха под пониженным давлением. Формировали липосомы гидратацией липидной пленки предварительно
нагретым (57oС) водным раствором (рН ≈7) 250 мМ GdDTPA-BMA (10
мл). Подвергали липосомы трем циклам замораживания/оттаивания в жидком азоте и давали им набухать в течение полутора
часов при 65oС. Дисперсию липосом подвергали экструзии при 65oС через поликарбонатные фильтры с разными диаметрами пор. Размер липосом (z-среднее) после экструзии составлял 167
нм. Незахваченный GdDTPA-BMA удаляли диализом против изоосмотического и
изопротонного раствора глюкозы.
Табл. 6 показывает температурную чувствительность in vitro r1 (0,235 Тл) в 5%-ном растворе глюкозы для инкапсулированного в липосомы GdDTPA-BMA.
Пример 3
GdDTPA-BMA, инкапсулированный в DPPC/DPPG/DPPE-PEG-2000-липосомах
Получали
DPPC/DPPG/DPPE-PEG-2000-липосомы (массовое соотношение 90/5/5),
способом, представляющем собой гидратацию тонкой пленки. Растворяли фосфолипиды (500 мг) в смеси хлороформа и метанола и упаривали этот
органический раствор досуха под пониженным давлением.
Формировали липосомы гидратацией липидной пленки предварительно нагретым (57oС) водным раствором (рН ≈7) 250 мМ GdDTPA-BMA (10
мл). Подвергали липосомы трем циклам
замораживания/оттаивания в жидком азоте и давали им набухать в течение полутора часов при 65oС. Дисперсию липосом подвергали экструзии при 65o
С через поликарбонатные фильтры с
разными диаметрами пор. Размер липосом (z-среднее) после экструзии составлял 132 нм. Незахваченный GdDTPA-BMA удаляли диализом против изоосмотического и изопротонного
раствора глюкозы.
Табл. 7 показывает температурную чувствительность in vitro r1 (0,235 Тл) в 5%-ном растворе глюкозы для инкапсулированного в липосомы GdDTPA-BMA.
Пример 4
GdDTPA-BMA, инкапсулированный в DSPC/DPPC/DPPG-липосомах
Получали DSPC/DPPC/DPPG-липосомы (массовое соотношение 43/52/5), способом, представляющем собой
гидратацию тонкой пленки. Растворяли
фосфолипиды (500 мг) в смеси хлороформа и метанола и упаривали этот органический раствор досуха под пониженным давлением. Формировали липосомы гидратацией липидной
пленки предварительно нагретым
(63oС) водным раствором (рН ≈7) 250 мМ GdDTPA-BMA (10 мл). Подвергали липосомы трем циклам замораживания/оттаивания в жидком азоте и давали набухать в
течение полутора часов при
64oС. Дисперсию липосом подвергали экструзии при 65oС через поликарбонатные фильтры с разными диаметрами пор. Размер липосом (z-среднее) после
экструзии составлял 145 нм.
Незахваченный хелат металла удаляли диализом против изоосмотического и изопротонного раствора глюкозы.
Табл. 8 показывает температурную чувствительность in vitro r1 (0,235 Тл) как в 5%-ном растворе глюкозы, так и в человеческой сыворотке для инкапсулированного в липосомы GdDTPA-BMA.
Пример 5
GdDTPA-BMA,
инкапсулированный в
DPPC/DPPG-липосомах
Получали DPPC/DPPG-липосомы (массовое соотношение 95/5), способом, представляющем собой гидратацию тонкой пленки. Растворяли фосфолипиды (500 мг) в
смеси хлороформа и
метанола и упаривали этот органический раствор досуха под пониженным давлением. Формировали липосомы гидратацией липидной пленки предварительно нагретым (52oС) водным
раствором (рН ≈
7) 250 мМ GdDTPA-BMA (10 мл). Подвергали липосомы трем циклам замораживания/оттаивания в жидком азоте и давали им набухать в течение полутора часов при 55oС. Дисперсию
липосом подвергали
экструзии при 62oС через поликарбонатные фильтры с разными диаметрами пор. Размер липосом (z-среднее) после экструзии составлял 148 нм. Незахваченный хелат металла
удаляли диализом против
изоосмотического и изопротонного раствора глюкозы.
Табл. 9 показывает температурную чувствительность in vitro r1 (0,235 Тл) как в 5%-ном растворе глюкозы, так и в человеческой сыворотке для инкапсулированного в липосомах GdDTPA-BMA.
Пример 6
"Двойной переход" со смесью DSPC/DPPC/DPPG и DPPC/DPPG-липосом, причем оба
вида липосом
содержат GdDTPA-BMA
1,5 мл липосом из примера 4 смешивали с 1,5 мл DPPC/DPPG-липосом, полученных, как в примере 5. Эту смесь разбавляли до 40 мл раствором глюкозы (5%).
Табл. 10 показывает температурную чувствительность in vitro R1 (0,235 Тл) в 5%-ном растворе глюкозы для смеси липосом.
Пример 7
Пузырьки перфторбутана,
стабилизированные с помощью 5 мг/мл DSPC/ DPPC/DPPG
Получали DSPC/DPPC/DPPG-пузырьки (массовое соотношение 28,5/66,6/5) газообразного перфторбутана способом, представляющим собой гидратацию
тонкой пленки. Растворяли фосфолипиды (500 мг) в смеси хлороформа и метанола и упаривали этот органический раствор досуха под пониженным давлением. Липидную пленку гидратировали в течение 1 часа при
60oС после добавления 100 мл 1,5%-ного пропиленгликоля в воде. Готовая дисперсия содержала 5 мг липидов в 1 мл.
По 1 мл этой дисперсии вносили в пять флаконов на 2 мл. Свободное пространство заполняли газообразным перфторбутаном. Встряхивали эти флаконы на CapMixer в течение 45 секунд и оставляли на ночь на вращающемся столике. Содержимое этих пяти флаконов собирали и центрифугировали в течение 5 минут при 2000 об/мин. Жидкость под всплывшим материалом удаляли и заменяли таким же объемом воды. Воссоздавали микропузырьки мягким встряхиванием вручную после заполнения свободного пространства газообразным перфторбутаном. Процедуру промывки повторяли трижды.
Образец пузырьков перфторбутана характеризовали, используя Coulter Multisizer II, снабженный апертурой на 50 мкм и внутренним оборудованием от Nicomed для измерения акустического затухания. Эта дисперсия продемонстрировала размерное распределение объемного среднего диаметра, составляющее около 3 мкм. При использовании акустической методики пузырьки продемонстрировали прекрасный спектр затухания в диапазоне от 3,5 до 8,0 мГц и были проверены на устойчивость к давлению при избыточном давлении 150 мм рт. ст. (19995 Па) в диапазоне температур от 22 до 47oС. Акустические измерения показали, что при избыточном давлении 150 мм рт. ст. (19995 Па) газовые пузырьки разрушались при 47oС, тогда как при 40oС они оставались стабильными. Это показывает, что эти газовые микропузырьки можно применять в ультразвуковой визуализации для картирования физиологического давления in vivo.
Пример 8
Визуализационные исследования на крысах с применением GdDTPA-BMA, инкапсулированного в DPPC/DPPG -липосомах
а)
Внутримышечная инъекция в левое бедро
Инъецировали липосомы внутримышечно в дозировке 0,02 ммоль/кг. Мышцу левого бедра нагревали сфокусированным ультразвуком, тогда как мышца
правого бедра
служила контролем.
Фиг. 4-5 показывают аксиальные T1-w SE-изображения бедра до и после инъекции липосом соответственно. Фиг.6-8 представляют собой T1-w SE-изображения через 2, 5 и 9 минут нагревания соответственно.
В этот момент времени прекращали нагревание, перемещали крысу из MRI-сканера и измерением определяли, что температура мышцы равна 47oС. Фиг.9 показывает последнее изображение через 15 минут после прекращения нагревания. Для целей сравнения был включен шприц с дисперсией липосом (идентичной той, что была инъецирована).
Эти результаты показывают, что после нагревания интенсивность сигнала от мышцы левого бедра значительно увеличивается при сравнении с мышцей правого бедра и шприцем.
б) Внутривенная инъекция
Инъецировали липосомы внутривенно крысе (верхняя позиция) в дозировке 0,10 ммоль/кг. Крыса в нижней позиции служила контролем (без инъекции
и
нагревания).
Фиг. 10 представляет собой аксиальное T1-w SE-изображение печени через 7 минут после инъекции липосом. Через 15 минут после инъекции нагревали печень сфокусированным ультразвуком (фиг. 11). Фиг.12-13 представляют собой T1-w SE-изображения на 16-й и 21-й минуте после инициирования нагревания соответственно. После прекращения нагревания измеренная температура в печени составляла 51oС.
Эти результаты показывают, что после нагревания интенсивность сигнала от печени существенно увеличивается при сравнении с контрольной печенью.
Пример 9
Получение парамагнитных липосом, чувствительных к рН
Получали состоящие из DPPE/PA (4: 1 моль/моль) липосомы, содержащие GdDTPA-BMA,
способом, представляющим собой гидратацию тонкой пленки. Общая концентрация липидов была 25 мг/мл. Вкратце, упаривали раствор липидов в хлороформе/метаноле (10:1) на роторном испарителе досуха и
сушили получившуюся пленку дополнительно под вакуумом в течение ночи. Гидратировали липиды раствором 250 мМ GdDTPA-BMA в 0,05 М буфере Трис-НСl (рН = 8,4) при 75oС. Подвергали липосомы
трем
циклам замораживания/оттаивания в MeOH/CO2 (s). Уменьшали размер липосом последовательной экструзией (Lipex Extruder®, Lipex Biomembranes Inc., Ванкувер, Канада)
через
поликарбонатные фильтры с разными диаметрами пор. Незахваченый хелат металла удаляли диализом против изоосмотического раствора глюкозы (рН = 8,4).
Физико-химические свойства
Средний гидродинамический диаметр липосом был определен фотонно-корреляционной спектроскопией (ZetaSizer IV, Malvern Instruments Ltd., Малверн, Англия) как равный 165 нм. Измеряли времена
релаксации
T1 парамагнитных липосом in vitro (0,235 Тл, Minispec PC-110b, Brucker Gmbh, Рейнстеттен, Германия) в разных изоосмотических буферных растворах (0,05 М цитратно-фосфатный буфер
и 0,05 М
буфер Трис-HCl). Исследовали диапазон рН от 4 до 8,5. Инкубировали забуференные дисперсии липосом при 37oС в течение 15 минут. Табл. 11 показывает чувствительность к рН r1
-релаксивности in vitro для GdDTPA-BMA, инкапсулированного в липосомы.
Пример 10
DvDTPA-BMA, инкапсулированный в DPPC/DPPG-липосомах
Получали
DPPC/DPPG-липосомы
(массовое соотношение 95/5) способом, представляющим собой гидратацию тонкой пленки. Растворяли фосфолипиды (500 мг) в смеси хлороформа и метанола и упаривали этот органический
раствор досуха под
пониженным давлением. Формировали липосомы гидратацией липидной пленки при 50oС водным 250 мМ раствором (рН ≈7) DyDTPA-BMA (спродиамид, Nycomed Imaging AS, Осло,
Норвегия) (10 мл).
Подвергали липосомы трем циклам замораживания/оттаивания и давали им набухать в течение полутора часов при 59oС. Дисперсию липосом подвергали экструзии при 65o
С через
поликарбонатные фильтры с разными диаметрами пор. Размер липосом (z-среднее) после экструзии составлял 153 нм. Незахваченный DyDTPA-BMA удаляли диализом против изоосмотического и
изопротонного
раствора глюкозы. Можно исследовать чувствительность эффекта, представляющего собой MRI контраст, к температуре.
Пример 11
GdDTPA-декстран, инкапсулированный в
DPPC/DPPG-липосомах
Получали DPPC/DPPG-липосомы (массовое соотношение 95/5) способом, представляющим собой гидратацию тонкой пленки. Растворяли фосфолипиды (500 мг) в смеси хлороформа и
метанола и упаривали этот органический раствор досуха под пониженным давлением. Формировали липосомы гидратацией липидной пленки при 48oС водным 50 мМ раствором GdDTPA-дестрана
(молекулярная масса 156 кДа), синтез которого описан Р. Rongved et al., Carbohvdr. Res., 287 (1996), 77-89. Дисперсию липосом обрабатывали ультразвуком при 46oС с использованием
наконечника
соникатора. Размер липосом (z-среднее) после обработки ультразвуком составлял 70 нм. Незахваченный GdDTPA-BMA удаляли гель-фильтрацией или диализом против изоосмотического и изопротонного
раствора
глюкозы. Можно исследовать чувствительность эффекта, представляющего собой MR-контраст, к температуре.
Пример 12
GdDTPA-BMA, инкапсулированный в
дибехеноил-РС-липосомах
Дибехеноил-РС-липосомы (22:0, табл. 1) можно получать способом, представляющим собой гидратацию тонкой пленки. Растворяют фосфолипиды (500 мг) в смеси хлороформа и
метанола и упаривают этот
органический раствор досуха под пониженным давлением. Формируют липосомы гидратацией липидной пленки при 80oС водным раствором (рН ≈7) 250 мМ GdDTPA-BMA
(10 мл). Дисперсию липосом
подвергают трем циклам замораживания/оттаивания и дают ей набухать в течение полутора часов при 80oС. Дисперсию липосом подвергают экструзии при 80oС
через поликарбонатные
фильтры с разными диаметрами пор. Незахваченный GdDTPA-BMA удаляют гель-фильтрацией или диализом против изоосмотического и изопротонного раствора глюкозы. Можно исследовать
чувствительность эффекта,
представляющего собой MR-контраст, к температуре.
Пример 13
Суперпарамагнитные оксиды железа (superparamaqnetic iron oxides. SPIOs),
инкапсулированные в HPC/HPS-липосомы
Получали HPC/HPS-липосомы (массовое соотношение 90/10) модифицированным способом гидратации тонкой пленки. Формировали липосомы добавлением гомогенной
смеси фосфолипидов (700 мг) в 10 мл
предварительно нагретой (55oС) водной дисперсии РЕGилированных SPIOs (6,10 мг железа в 1 мл). Липосомам давали набухать в течение 30 минут при 65oС. Дисперсию липосом подвергали
экструзии при 66oС через поликарбонатные фильтры с разными диаметрами пор. Удаляли незахваченные SPIOs гель-фильтрацией или диализом. Можно
исследовать чувствительность эффекта,
представляющего собой MR-контраст, к температуре.
Пример 14
Сверхмелкие суперпарамагнитные оксиды железа (USPIOs), инкапсулированные в
HPC/HPS-липосомы
Получали
HPC/HPS-липосомы (массовое соотношение 90/10) модифицированным способом гидратации тонкой пленки. Формировали липосомы добавлением гомогенной смеси фосфолипидов
(700 мг) в 10 мл предварительно
нагретой (70oС) водной дисперсии USPIOs (3,63 мг железа в 1 мл). Липосомам давали набухать в течение 90 минут при 70oС. Дисперсию липосом
подвергали экструзии при 70oС
через поликарбонатные фильтры с разными диаметрами пор. Удаляли незахваченные USPIOs гель-фильтрацией или диализом. Можно исследовать чувствительность эффекта,
представляющего собой MR-контраст, к
температуре.
Пример 15
Суперпарамагнитные оксиды железа (SPIOs) или сверхмелкие SPIOs, инкапсулированные в рН-чувствительных
липосомах
SPIOs или USPIOs,
инкапсулированные в рН-чувствительных липосомах, можно получать способом, аналогичным тому, что применяли в примере 9. Незахваченный суперпарамагнитный материал
удаляют гель-фильтрацией или диализом.
Можно исследовать рН-чувствительность эффекта, представляющего собой MR-контраст.
Пример 16
GdDTPA-BMA, инкапсулированный в
DSPC/DMPG/холестериновых липосомах
Получали DSPC/DMPG/холестериновые липосомы (молярное соотношение 49/5/20) модифицированным способом гидратации тонкой пленки. Формировали липосомы
добавлением высушенной вымораживанием смеси
фосфолипидов (60 мг) к предварительно нагретому (59oС) водному раствору (рН ≈ 6,3) 250 мМ GdDTPA-BMA/300 мМ сахарозы/10 мМ фосфата (300
мл). Липосомам давали набухать в течение 30
минут при 59oС. Дисперсию липосом гомогенизировали и подвергали экструзии при высоком давлении через поликарбонатные фильтры с размером пор 400
нм. Удаляли незахваченный GdDTPA-BMA
ультрафильтрацией с раствором 300 мМ сахарозы/10 мМ фосфата. Размер липосом (z-средний) после ультрафильтрации составлял 100 нм. Кроме того, лиофилизировали
липосомы (2 мл на флакон) и восстанавливали
их добавлением 2 мл деионизированной воды. Размер (z-среднее) липосом после восстановления составлял 119 нм.
Табл. 12 суммирует результаты температурной чувствительности in vitro R1 (0,235 Тл) для инкапсулированного в липосомах GdDTPA-BMA в растворе 300 мМ сахарозы/10 мМ фосфата. Также в табл. 12 показано влияние лиофилизации на R1 -температурную чувствительность восстановленных липосом к температуре.
Пример 17
Соединения Gd, имеющиеся в продаже, и соединения Gd, находящиеся на стадии
разработки, инкапсулированные в
липосомах, чувствительных к рН или к температуре
Липосомы, содержащие следующие контрастные агенты: GdBOPTA (Вrассо spa, Италия), GdDTPA (Shering AG, Берлин),
GdDOTA (Guerbet SA,
Олнэй-су-Буа), Gadomer (Shering AG, Берлин), MS-325 и MS-325, связанный с белком (Epix Medical Inc., США), можно получать способом, аналогичным тому, который применяли в примерах
1-5, 9 и 12.
Незахваченное соединение Gd удаляют гель-фильтрацией или диализом. Можно исследовать температурную чувствительность эффекта, представляющего собой MR-контраст.
Пример
18
Температурная зависимость in vitro r1 в крови для GdDTPA-BMA, инкапсулированного в липосомах
Получали DPPC/DPPG/DPPE-PEG-2000 и DPPC/DPPG-липосомы, содержащие
GdDTPA-BMA, способом,
аналогичном тому, который применяли в примерах 3 и 5 соответственно. Tабл. 13 суммирует температурную эволюцию in vitro r1 (0,235 Тл) в крови крыс in vitro для обоих
препаратов.
Пример 19
Опытные исследования биораспределения и релаксометрические исследования липосомального GdDTPA-BMA на самцах крыс
а) Внутримышечная инъекция
Инъецировали
DPPC/DPPC-липосомы, содержащие GdDTPA-BMA (получали их, как в примере 18), внутримышечно (в.м.) крысам Sprague Dawley в дозировках 20 мкмоль/кг.
В табл. 14 представлены времена релаксации Т1 (37oС, 0,235 Тл) иссеченной ткани и крови через один и три часа после внутримышечной инъекции DPPC/DPPG-липосом (n=2х3). Табл. 15 показывает температурный ответ T1 в мышце. Все результаты даны как средние значения.
Несмотря на большие межиндивидуальные различия, эти результаты показывают наличие температурной зависимости T1 мышцы после внутримышечного введения GdTPA-BMA, инкапсулированного в липосомах.
б) Внутривенная инъекция
Инъецировали DPPC/DPPG/DPPE-PEG-2000 и
DPPC/DPPG-липосомы,
содержащие GdDTPA-BMA (получали их, как в примере 18), внутривенно (в.в.) крысам Sprague Dawley в дозировке 100 мкмоль/кг.
В табл. 16 и 17 показаны времена релаксции T1 (37oC, 0,235 Тл) иссеченных тканей и крови через 5 минут (n = 3) и один час (n = 2) и три часа (n = 3) после внутривенной инъекции DPPC/DPPG и DPPC/DPPG/DPPE-PEG-2000-липосом соответственно. Также показано поглощение Gd в ткани, выраженное как процент тканевого поглощения введенной дозы Gd. Табл. 18 и 19 суммируют температурный ответ T1 крови после внутривенной инъекции DPPC/DPPG и DPPC/DPPG/DPPE-PEG-2000-липосом соответственно. Более детальное исследование температурного ответа выполняли в крови, взятой через один час после внутривенного введения (n = 3) DPPC/DPPG-липосом, как показано в табл. 20. Все результаты даны как средние значения.
Эти результаты показывают потенциал как не-РЕGилированнного, так и особенно РЕGилированнного липосомального GdDTPA-BMA как агентов пула крови. Также в крови была продемонстрирована T1- температурная чувствительность липосом.
Пример
20
Исследования
визуализации in vitro с GdTPA-BMA, инкапсулированным в DSPC/DPPC/DPPG-липосомы
Готовили DSPC/DPPC/DPPG-липосомы, содержащие GdTPA-BMA, аналогично примеру 2. Размер
липосом (z-среднее)
составлял 129 нм. MR-визуализацию проводили при 2,0 Тл (Brucker Medspec) на концентрическом сферическом фантоме, в котором внутренняя камера содержала липосомальный GdTPA-BMA,
разбавленный
изотонической средой, состоящей из глюкозы и 6,25% поливинилпирролидона (конц. Gd ≈ 0,8 мМ), тогда как внешний отдел был наполнен физиологическим раствором. Микроволновое
нагревание проводили
при 434 мГц линейной радиочастотной антенной, помещенной во внешнюю камеру. Микроволновым облучением действовали одновременно с получением изображения. Повторяли блоки, состоящие
из 10
диффузионно-взвешенных спиново-эховых одиночных коротких EPI-изображений (diffusion-weighted spin-echo EPI, DW-SE-EPI) с b-фактором от 3 до 864 с/мм, совокупности SE-EPI изображений с
инверсионно-восстановительным получением (inversion-recovery, IR-SE-EPI) и градиентно-эховых T1-взвешенных изображений (gradient echo, T1W-GE), пока температура липосомального
образца не достигала 48oС (через примерно 110 минут). Получали T1W-GE-изображения при следующем значении TE/TR/переворот: 5 мс/30 мс/50. Рассчитывали T1-карты, исходя
из совокупности 13 IR-SE-EPI изображений, промеренных с периодами инверсии, варьирующими от 14,4 мс до 16 с. Для фиксированной представляющей интерес области внутри фантома
получали графики
зависимости 1/T1 (R1) от температуры. Температуру образца измеряли термопарой немедленно после получения каждого блока. Распределение температуры по визуализированному срезу
оценивали, исходя из ADC-карт.
Температурная эволюция измеренной R1 для липосомального GdTPA-ВМА суммирована на фиг. 14. В "области перехода" от 40,4 до 43,7oС
была получена линейная корреляция между R1 и температурой (коэффициент регрессии 0,995). Фиг. 15 показывает отобранные T1W GE изображения фантома (а) до нагревания, (b) во время
нагревания; наблюдали распределение интенсивности сигнала внутри липосомального образца, и (с) после нагревания; гомогенное распределение интенсивности сигнала. Фиг. 16 показывает соответствующие
T1-карты в те же моменты времени, что и для фиг.15. Как видно на фиг.17, путем использования линейной корреляции между R1 и температурой можно из T1-карты в момент
времени (b) вывести соответствующую температурную карту. Эта температурная карта показывает термочувствительность липосомального GdTPA-BMA. (NB: Температурная шкала действительна только для
внутренней
камеры, содержащей липосомы.)
Пример 21
Исследования MR-визуализации in vitro с GdTPA-BMA, инкапсулированным в DPPC/DPPG-липосомы, oпределение концентрации Gd
В
этом
исследовании применяли статичный фантом in vitro, состоящий из двенадцати стеклянных флаконов (диаметр 10 мм), помещенных в прямоугольный пластиковый контейнер. Пластиковый контейнер заполняли
вязкой
изотонической средой, состоящей из глюкозы и 25 мас.% поливинилпирролидона (PVP) с добавлением GdTPA-BMA для получения T1 со значением около 430 мс при 1,5 Тл. Три из этих флаконов
содержали маркерный раствор с известным значением T1 (около 630 мс). Заполняли остальные девять флаконов содержащими GdDTPA-BMA липосомами на основе DPPC/DPPG (получали их, как в примере
18), диспергированными в различных количествах изотонического раствора 10% PVP/глюкоза. Концентрация Gd [Gd] в этих липосомальных образцах находилась в пределах от 0 до 5,2 мМ при определении
индуктивно сопряженной плазменной атомно-эмиссионной спектрофотометрией. Визуализировали фантом на системе Philips NT при комнатной температуре в квадратурно-коленчатой катушке при 1,5 Тл.
Использовали следующую систему визуализации.
1. T1-FFE (эхо искаженного градиента) ТR/TЕ/переворот: 15 мс / 2 мс / 30o.
2. TMIX (количественная T1/T2 последовательность).
3. Двойной ТЕ FFE T2*-картирование) (TE1/TE2: 4 мс/50 мс).
После нагревания фантома повторяли все три последовательности, причем достигали нагревания помещением фантома в теплую (> 60oС) водяную баню. Эффект нагревания исследовали не во времени, а только в конце (то есть, Т >>Тc).
Перед нагреванием получили линейную корреляцию между [Gd] и R1 (ΔR1) (с коррекцией на матрицу) (по измерению в TMIX-последовательности), причем коэффициент регрессии составлял 0,996. Рассчитанная липосомальная r1 составляла 0,11 мМ-1•с-1. Аналогично по кривой зависимости R2 от [Gd] (коэффициент регрессии = 0,997) определяли, что липосомальная r2 составляет 0,55 мМ-1•с-1, причем отношение r2 /r1 было равно 5. После нагревания липосом r1 и r2 составляли 3,23 и 3,75 соответственно, что давало отношение r2/r1 равное 1,16.
Фиг. 18 показывает, перед нагреванием, линейную корреляцию между [Gd] и соотношением интенсивностей сигнала липосомального изображения и поливинипирролидонового геля (SIлип /SIгель) при использовании T1-FFE-последовательности. Фиг.19 показывает график зависимости R1/R1max соотношения от [Gd] /[Gdmax] соотношения; здесь [Cdmax]=5,2 мМ. Эти результаты показывают, что перед нагреванием соотношение R1 точно отражало соотношение [Gd]. Получили сходные результаты и тогда, когда использовали соотношение R2. Из этих наблюдений следует, что T1- (и Т2-) эффект GdDTPA-BMA, инкапсулированного в липосомах, перед нагреванием достаточно значителен для того, чтобы сделать возможной относительную оценку концентрации липосомального Gd.
Пример 22
Исследования MR-визуализации in vitro c GdTPA-BMA,
инкапсулированным в DPPE/PA-липосомы
Получали DPPE/PA-липосомы, содержащие GdTPA-BMA, аналогично примеру 9. Средний гидродинамический диаметр этих липосом по результатам измерения
фотонно-корреляционной спектроскопией (Malvern
PS/MW 4700, Malvern Instruments Ltd., Малверн, Англия) составлял 158 нм. Для этого исследования использовали фантом in vitro, состоящий из тринадцати
стеклянных флаконов (диаметр 11 мм) и помещенный в
круглый стеклянный реактор. Заполняли этот стеклянный реактор агаровым гелем (2% масса/объем) с добавленным к нему GdTPA-BMA, чтобы получить
значение T1 около 900 мс при 1,5 Тл. Заполняли
эти стеклянные флаконы изоосмотическими буферными растворами со значениями рН в диапазоне от 4,8 до 8,2. Этот фантом постоянно поддерживали
при температуре 37oС циркуляцией нагретой воды
через рубашку реактора, осуществляемой циркуляционным водяным насосом. К каждому флакону последовательно с интервалом в 1 минуту добавляли
липосомы. Визуализацию начинали через 25 минут после
добавления липосом к первому флакону. Фантом визуализировали при 1,5 Тл на системе Philips NT. Применяли следующие параметры визуализации:
последовательность: MIX-TSE; TR (мс): 800,0; ТЕ (мс): 12,5;
TI (мс): 500,0; переворот (градусы): 90; толщина среза (мм): 7,0; FoV (частота*фаза, мм): 230,0*230,0. Повторяли циклы сканирования каждую
минуту в течение 20 минут. Фиг.20 показывает фантом через 25
минут после добавления липосом в первый флакон. Интенсивность сигнала увеличивалась при уменьшении рН.
Пример 23
Частицы из полимера, изготовленного из
этилиден-бис-(16-гидроксигексадеканоата) и адипоилхлорида
Получали наполненные воздухом частицы из полимера этилиден-бис-(16-гидроксидеканоата) и
адипоилхлорида, как описано в примере 3f из
WO 96/07434.
Замена газа
Сухой порошок подвергали действию вакуума 20 мм рт. ст. (2666 Па) в течение примерно 15 минут, а затем
вводили газ. Затем встряхиванием на
лабораторном шейкере в течение 12-16 часов повторно диспергировали порошок полимерных частиц, содержащих газообразный перфторбутан, до 10 мг/мл по сухому материалу
в воде MilliQ. Проверка световой
микроскопией показала образование дисперсии частиц нерегулярной формы. Эти частицы легко всплывали, как и можно ожидать для частиц, содержащих газ.
Нагревание полимерных частиц
Нагревали 10 мл дисперсии полимера на водяной бане до 65oС за одну минуту, используя при этом магнитную мешалку. При этой температуре полимер плавился.
Проверка микроскопией показала,
что нерегулярные частицы изменились на сферические гладкие частицы, что указывало на плавление полимерной капсулы.
Характеристика
Акустический эффект суспензии,
приготовленной выше, получали измерением пропускания ультразвука через дисперсию в водной жидкости-носителе импульсно-отражательной методикой с использованием
измерительного широкополосного
преобразователя на 3,5 мГц. В качестве эталона использовали водную жидкость-носитель.
В табл. 21 приведены характеристики содержащих перфторбутан полимерных частиц, обработанных нагреванием дисперсий до 65oC. Табл. 21 содержит наблюдавшееся акустическое ослабление в сравнении с ненагретой дисперсией частиц при той же концентрации, указывающее на то, что тепловая обработка ликвидирует большую часть акустического ослабления.
Содержание газа измеряли измерением плотности до и после разрушения микрокапсул с применением ультразвука высокой энергии. Результаты показывают, что содержание газа сохраняется. Результаты показывают, что при плавлении полимерных капсул наполненные газом микрокапсулы становятся почти невидимыми в ультразвуке, возможно, из-за жесткой полимерной оболочки, которая теперь окружает газовую фазу.
Пример 24
Изучают частицы из приведенного выше примера 23,
акустически характеризуя их in
vitro измерением пропускания ультразвука через дисперсию в водной жидкости-носителе импульсно-отражательной методикой с использованием широкополосного измерительного
преобразователя на 3,5 мГц. В
качестве эталона используют водную жидкость-носитель. Получение акустических характеристик начинают при комнатной температуре, при которой акустическое ослабление низкое,
как показано в табл. 21.
Повышают температуру и получают акустические характеристики при разных интервалах температуры. Когда температура переходит 48,6oС, точку плавления полимера
(смотри пример 23), акустическое
ослабление резко увеличивается, что является показателем контрастного агента, чувствительного к температуре. Сходные эксперименты можно выполнить, используя полимер с
точкой плавления около 37-40oС, и, следовательно, ближе к температуре тела.
Пример 25
Добавляют микронизированный каолин на кончике шпателя к 2 мл
перфтордиметилциклобутана (т. кип. 45o
С) и диспергируют с применением 0,2 мл поверхностно-активного вещества FluoradТМ FC-171. Интенсивным перемешиванием получают молочно-белую
дисперсию.
Помещают 1 мл дисперсии 1,2-дистеароилфосфатидилглицерина (0,5 мг/мл) и дистеароилфосфатидилхолина (4,5 мг/мл) в очищенной воде во флакон на 2 мл, к которому добавляют 100 мкл каолина в дисперсии перфтордиметилциклобутана, описанной выше. Закрывают флаконы и затем встряхивают их в течение 75 секунд, используя Espe Capmix®, с получением каолина в перфтордиметилциклобутане в водной эмульсии.
Монтируют акустический аппарат, в котором акустический эффект суспензии, полученной выше, можно получить измерением пропускания ультразвука через дисперсию в водной жидкости-носителе, используя в импульсно-отражательной методике широкополосный измерительный преобразователь на 3,5 мГц. В качестве эталона можно использовать водную жидкость-носитель. Образец инъецируют в термостатированную ячейку, в которой насосом можно создать избыток или недостаток давления.
Эмульсию переносят в акустическую ячейку и разбавляют водой (50 мл), поддерживая постоянную температуру 37oС. Первое измерение выполняют при атмосферном давлении, оно показывает слабое акустическое ослабление из-за присутствия жидких капелек эмульсии и отсутствия пузырьков газа в ячейке. Затем давление постепенно снижают через интервалы и через каждый интервал выполняют акустическое измерение. Когда давление достигает 580 мм рт. ст. (77314 Па) (то есть на 180 мм рт. ст. ниже атмосферного), акустическое ослабление резко и значительно увеличивается, демонстрируя, что микрокапли теперь вскипают и превращаются в акустически эффективные микропузырьки.
Этот эксперимент показывает, как эмульсию с дисперсной фазой, имеющей точку кипения слегка выше температуры тела, можно использовать для картирования недостаточного давления in vivo, которое должно иметь место ниже места эмболизации кровеносного сосуда.
Пример 26
GdDTPA-BMA, инкапсулированный в липосомы,
чувствительные к Мg2+
Цезиевую соль кардиолипина сердца быка, дипальмитоилфосфатидилхолин (DPPC) и калиевую соль дипальмитоилфосфатидилглицерина (DPPG) добавляют в круглодонную
колбу в молярном соотношении
40/55/5 (всего 500 мг) и растворяют, используя хлороформ. Хлороформ удаляют выпариванием под пониженным давлением, используя роторный испаритель. Формируют липосомы
гидратацией липидной пленки
предварительно нагретым (52oС) водным раствором 250 мМ GdDTPA-ВМА (10 мл). Подвергают липосомы трем циклам замораживания/оттаивания и дают им набухать в течение
полутора часов при 55oС. Дисперсию липосом подвергают экструзии при 62oС через поликарбонатные фильтры с разными диаметрами пор. Незахваченный GdDTPA-BMA удаляют диализом против
изоосмотического и
изопротонного раствора глюкозы.
Разбавляют эту дисперсию липосом в десять раз водой и переносят в трубку для ЯМР. Релаксивность r1 при 0,235 Тл измеряют, используя ЯМР-спектрометр Minispec при 37oС. Релаксивность r1 низка. Затем титруют образец 0,6 М раствором MgCl. Когда отношение Мg2+ к кардиолипину увеличивается, индуцируется переход от ламеллярной к H...-фазе, как описано в F. Reiss-Husson, J. Mol. Biol., 25, 363 (1967). Разрушение липосомальной структуры ведет к контакту между GdDTPA-BMA и водой, индуцирующему значительное увеличение релаксивности r1. Этот эксперимент демонстрирует чувствительный к Mg2+ MRI контрастный агент.
Пример 27
GdDTPA-BMA,
инкапсулированный в липосомы, чувствительные к Са2+
Повторяют такой же эксперимент, какой описан в примере 26, но заменяют раствор МgСl2 на раствор CaCl2.
Наблюдение сходного увеличения релаксивности при достаточно высоких концентрациях Са2+ демонстрирует чувствительный к Mg2+ MRI контрастный агент.
Пример 28
Микропузырьки перфторбутана, стабилизированные фосфатидилсерином, как пример чувствительного к Са2+ контрастного агента для ультразвука
Получение
Гомогенезировали
гидрированный фосфатидилсерин (5 мг/мл в 1%-ном (по массе) растворе пропиленгликоля в очищенной воде) и газообразный перфторбутан ротором-статором Ystral® при 7800
об/мин и примерно
40oС с получением кремово-белой дисперсии микропузырьков. Фракционировали эту дисперсию, чтобы в существенной степени удалить слишком маленькие пузырьки (< 2 мкм),
и доводили объем
дисперсии до желаемой концентрации микропузырьков добавлением водной сахарозы, чтобы концентрация сахарозы была 92 мг/мл. Вносили порции по 2 мл получившейся дисперсии в плоскодонные
флаконы на 10 мл,
специально предназначенные для лиофилизации, и лиофилизировали содержимое с получением белой пористой лепешки. Затем заполняли лиофилизационную камеру перфторбутаном и запечатывали
флаконы. Перед
использованием добавляли во флакон воду и осторожно вручную встряхивали содержимое в течение нескольких секунд с получением дисперсии микропузырьков перфторбутана.
Микроскопическое
исследование
Одну каплю дисперсии микропузырьков помещали на предметное стекло для исследования микроскопией. Образец покрывали покровным стеклом и помещали под микроскоп. К
краю покровного
стекла добавляли капельки раствора хлорида кальция в воде (50 мг/мл), чтобы этот раствор проник в дисперсию микропузырьков. Поведение дисперсии микропузырьков по мере продвижения
фронта раствора
хлорида кальция записывали на видеопленку. Наблюдали образование агрегатов микропузырьков с размерами больше, чем у исходных микропузырьков, что демонстрировало генерирование
микропузырьков, способных
иметь разные ультразвуковые свойства.
Пример 29
TcDTPA, инкапсулированный в DPPC/DPPG-липосомах
TcDTPA получают из пертехнетата натрия и
коммерческого набора,
содержащего SnCl2 и DTPA. TcDTPA инкапсулируют в липосомы так же, как в приведенном выше примере 10. Продукт является чувствительным к температуре контрастным агентом
для сцинтиграфических
исследований.
Пример 30
Крахмальные микросферы, меченные DТРА-гадолинием
Получали крахмальные частицы с DTPA-гадолинием по R. Rongved et al.
Carbohydrate Research
214 (1991), 325-330, субстраты 9-12. Перед введением суспендировали эти частицы в 0,9%-ном растворе NaCI. Этот продукт можно применять, чтобы диагностировать болезни, связанные,
например, с аномальной
ферментативной активностью (α-амилазы и эстеразы).
Пример 31
Липосомы, содержащие иодиксанол
Диагностическую композицию, включающую в
себя, мг/мл:
Иодиксанол (общее количество) - 400
Инкапсулированный иод - 80
Сорбит - 20
Трометамол (ТРИС) - 0,097
ЭДТАNа2Са - 0,1
Гидрированный
фосфатидилхолин - 51,2
Гидрированный фосфатидилсерин - 5,1
Воду для инъекций до 1 мл - (примерно 0,9 мл)
получали растворением фосфолипида в смеси
хлороформ/метанол/вода
(4:1: 0,025 по объему) и выпариванием растворителя (роторное выпаривание). Получали изотонический раствор иодиксанола и сорбита и нагревали до 60-70oС, причем
поддерживали эту температуру в
течение остальной части процесса. При перемешивании добавляли фосфолипидную смесь и формировали липосомы. Чтобы контролировать размер липосом, гомогенизировали этот
препарат (гомогенизатор типа
ротор/статор). Затем подвергали липосомы экструзии через 7 поликарбонатных фильтров по очереди (диаметр пор 1 мкм). Разбавляли продукт изотоническим раствором иодиксанола
и сорбита и добавляли
трометамол и ЭДТА. Продукт вносили в стеклянные флаконы и автоклавировали (121oС, 15 минут). Тc= 49oС.
Пример 32
Содержащие газ микропузырьки
DPPC/PPG/DPPE-PEG с добавлением вектора, имеющего сродство к ангиогенезу
С использованием технологии, описанной в WO 98/18500, можно получать разные продукты.
Эти продукты можно применять в
качестве опухолеспецифичных маркеров для лечения, представляющего собой гипертермию.
Реферат
Изобретение относится к области медицины. В способе визуализации организма живого человека или животного, при котором в указанный организм парентерально вводят материал в форме частиц, содержащий матричный или мембранный материал и по меньшей мере один генерирующий контраст компонент, причем этот матричный или мембранный материал реагирует на заранее выбранный физиологический параметр таким образом, что изменяется контрастная эффективность указанного компонента в ответ на изменение величины указанного параметра, генерируют данные изображения по меньшей мере части указанного организма, в которой присутствует указанный компонент, и из них генерируют сигнал, являющийся показателем величины или изменения указанного параметра в указанной части указанного организма. Изобретение также относится к контрастной среде для визуализации физиологического параметра. Изобретение обеспечивает визуализацию организма с возможностью измерения физиологических параметров организма при обследовании. 3 с. и 23 з.п. ф-лы, 20 ил., 21 табл.

Формула
09.04.1998 по пп.1-14, 16-18, 20, 25 и 26;
31.12.1998 по пп.15, 19 и 21-24.
Документы, цитированные в отчёте о поиске
Макромолекулярное парамагнитное соединение, способ получения макромолекулярного парамагнитного соединения, диагностическое контрастное средство, способ получения диагностического контрастного средства
Рентгенконтрастная композиция, способ визуализации при томографических исследованиях в эксперименте и способ получения рентгенконтрастной композиции

Комментарии