Способ и устройство для контроля состояния автономной нервной системы пациента под наркозом - RU2464930C2
Код документа: RU2464930C2
Чертежи




Описание
Область техники, к которой относится изобретение
Настоящее изобретение в общем относится к медицинской технологии, в особенности к способу и устройству для контроля состояния пациента под наркозом.
Уровень техники
Во время хирургической операции очень важно следить за уровнем сознания и степенью пробуждения пациента. На сегодняшний день имеется мало надежных способов осуществления такого слежения. В области медицинской технологии существует проблема выполнения физических измерений, характеризующих активность автономной нервной системы индивидуума, то есть части нервной системы, не контролируемой волей.
В частности, имеется особая потребность контролировать состояние автономной нервной системы усыпленного неговорящего пациента, то есть пациента, находящегося под наркозом или подключенного к аппарату искусственной вентиляции легких, с целью определения потребности пациента в дополнительных усыпляющих средствах вследствие появления раздражителей пробуждения или в дополнительных обезболивающих средствах вследствие появления болевых раздражителей.
Испытания показали, что проводимость кожи меняется, представляя собой зависящую от времени переменную, которая в дополнение к базовому, медленно меняющемуся значению (так называемый базовый уровень, или средний уровень проводимости за определенный промежуток времени) имеет еще составляющую, включающую спонтанные волны или флуктуации.
Этот базовый уровень и характеристики этих флуктуаций может отслеживать на мониторе квалифицированный оператор (например, хирург или анестезиолог) с тем, чтобы контролировать состояние автономной нервной системы пациента.
Однако для улучшения интерпретируемости, а также удобства и легкости выполнения операции все еще есть потребность в способе и устройстве, которые давали бы один единый показатель, отражающий состояние автономной нервной системы.
В документе WO-03/94726 раскрыты способ и устройство для контроля состояния автономной нервной системы пациента под наркозом. В этом способе измеряется проводимость некоторого участка кожи пациента. Рассчитываются определенные характеристики, включая среднюю величину проводимости кожи за некоторый промежуток времени и количество значений флуктуаций за тот же промежуток времени. На основе этих характеристик формируются два выходных сигнала, отражающих соответственно болевой дискомфорт и степень пробуждения пациента. Сигнал степени пробуждения формируется на основе количества флуктуаций и средней величины проводимости за некоторый промежуток времени.
Раскрытие изобретения
Задача настоящего изобретения заключается в том, чтобы предложить способ и устройство для контроля состояния пациента под наркозом, которые обеспечивают улучшенную интерпретируемость, а также удобство и легкость контроля состояния автономной нервной системы пациента за счет обеспечения единого показателя, отражающего состояние автономной нервной системы.
Другая задача настоящего изобретения заключается в том, чтобы предложить способ и устройство, основанные на измерении изменений проводимости кожи, вызванных аффективным потоотделением.
Еще одна задача настоящего изобретения заключается в том, чтобы предложить способ и устройство, дающие надежные выходные указания.
Еще одна задача настоящего изобретения заключается в том, чтобы предложить способ и устройство, преодолевающие недостатки известных технических решений в данной области.
Еще одна задача настоящего изобретения заключается в том, чтобы предложить способ и устройство, существенно отличающиеся от известных технических решений в данной области.
В соответствии с настоящим изобретением по меньшей мере одна из вышеуказанных задач решается предложением способа и устройства, охарактеризованных в прилагаемой формуле изобретения.
Дальнейшие преимущества и характеристики настоящего изобретения определены в зависимых пунктах формулы изобретения.
Первый аспект изобретения предусматривает способ контроля состояния автономной нервной системы пациента под наркозом, в котором:
снимают, в течение интервала измерений, сигнал проводимости кожи на участке кожи пациента; идентифицируют, в пределах интервала измерений, точки локальных минимумов сигнала проводимости кожи; выбирают интервалы между указанными идентифицированными последовательными точками минимумов в качестве интервалов интегрирования; рассчитывают, для каждого интервала интегрирования, функцию линейного наклона, определяемую сигналом проводимости кожи в начальной и конечной точках интервала интегрирования, а также интеграл от разности значений сигнала проводимости кожи и функции линейного наклона в подмножествах значений интервала интегрирования, где сигнал проводимости кожи выше значений функции линейного наклона; и рассчитывают первый показатель, отражающий состояние автономной нервной системы пациента под наркозом, как сумму указанных интегралов в пределах интервала измерений;
выбирают подмножество значений интервала измерений, начинающееся в первой точке минимума в пределах интервала измерений; выбирают значение проводимости кожи в первой точке минимума в пределах интервала измерений в качестве постоянной величины; рассчитывают интеграл от разности значений сигнала проводимости кожи и этой постоянной величины в относящемся к подмножествам интервала измерений подмножестве, где сигнал проводимости кожи выше этой постоянной величины; и рассчитывают второй показатель, отражающий состояние автономной нервной системы пациента под наркозом, как сумму указанных интегралов в пределах интервала измерений; и
выдают наибольший из двух показателей, первого и второго, как выходной сигнал (Y), отражающий состояние автономной нервной системы пациента под наркозом.
В одном предпочтительном варианте осуществления изобретения конечную точку указанного подмножества интервала измерений выбирают в точке последнего минимума сигнала проводимости кожи в пределах интервала измерений.
В другом варианте осуществления изобретения в качестве конечной точки указанного подмножества значений интервала измерений выбирают последнюю точку интервала измерений.
В соответствии с предпочтительным вариантом осуществления изобретения отображают выходной сигнал (Y) на дисплее.
Интервал измерений находится в диапазоне от 5 до 30 сек, предпочтительно в диапазоне от 10 до 25 сек, наиболее предпочтительно составляет около 15 сек.
В предпочтительном варианте осуществления способа устанавливают сигнал индикации боли, если выходной сигнал (Y) находится в заранее заданном диапазоне (Y1-Y2) значений выходного сигнала. При этом Y1 находится в диапазоне 0,05 мкСм·с - 0,20 мкСм·с, предпочтительно составляет около 0,1 мкСм·с, a Y2 находится в диапазоне 0,5 мкСм·с - 3,0 мкСм·с, наиболее предпочтительно составляет около 2,0 мкСм·с.
В соответствии с изобретением устанавливают сигнал индикации пробуждения, если выходной сигнал (Y) превышает заранее заданное значение выходного сигнала (Y3). При этом Y3 находится в диапазоне 0,5 мкСм·с - 3,0 мкСм·с, предпочтительно составляет около 2,0 мкСм·с.
В одном варианте осуществления способа предварительно оказывает раздражающее болевое воздействие на пациента, например, стандартное повреждающее раздражение.
Второй аспект изобретения предусматривает устройство для контроля состояния автономной нервной системы пациента под наркозом, включающее измерительное оборудование для съема сигнала проводимости кожи, измеренного на участке кожи пациента; и управляющий блок, выполненный с возможностью осуществления способа в соответствии с первым аспектом изобретения.
Краткое описание графических материалов
Принципы настоящего изобретения будут раскрыты ниже на примере осуществления изобретения, проиллюстрированном фигурами.
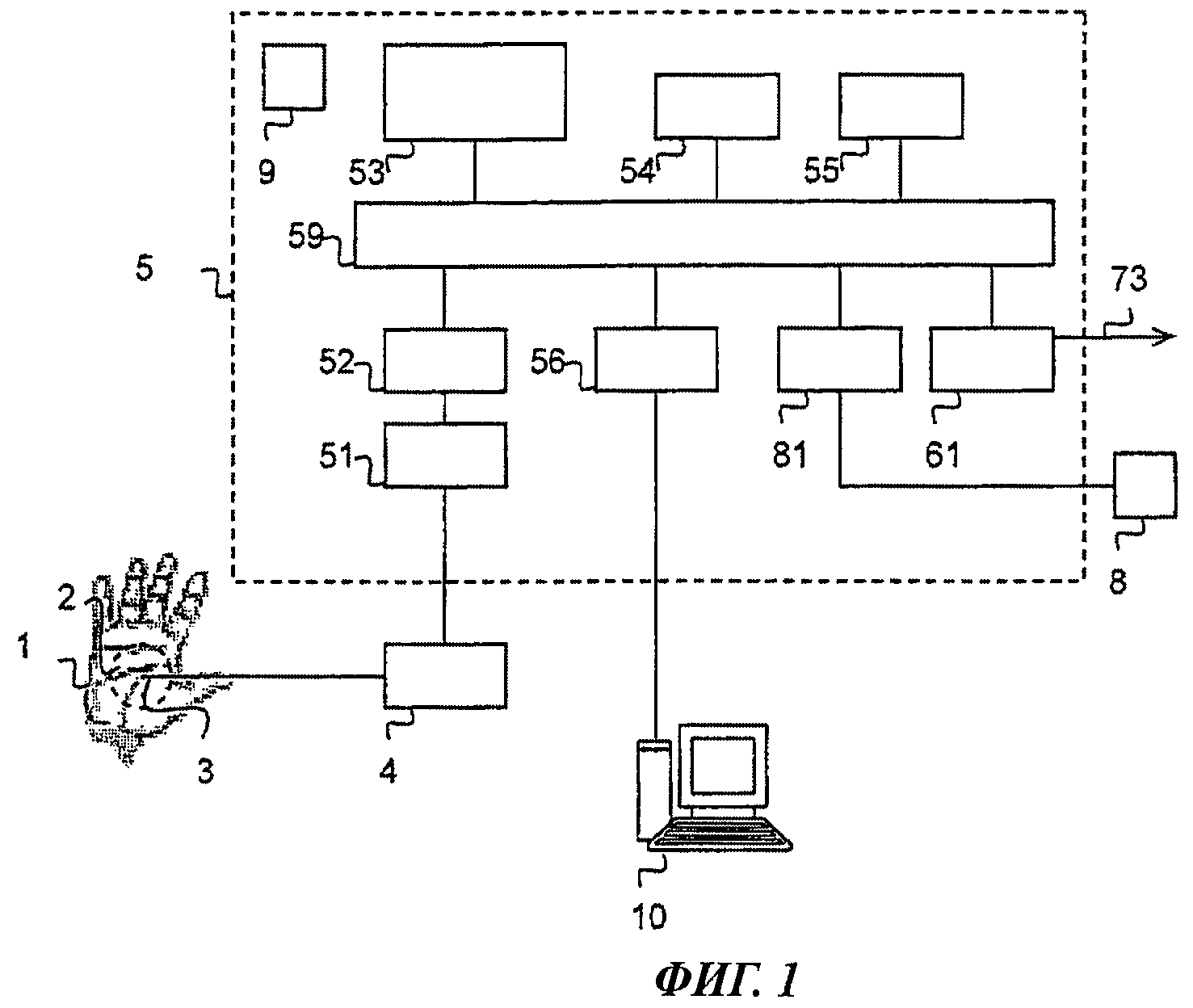
На фиг.1 представлена блок-схема предпочтительного варианта осуществления устройства согласно изобретению.
На фиг.2 представлена блок-схема способа согласно изобретению.
На фиг.3 представлен пример графика измерений проводимости кожи для иллюстрации расчета первого показателя способа согласно изобретению.
На фиг.4 представлен пример графика измерений проводимости кожи для иллюстрации расчета первого показателя способа согласно изобретению.
На фиг.5 представлен пример графика измерений проводимости кожи для иллюстрации расчета второго показателя способа согласно изобретению.
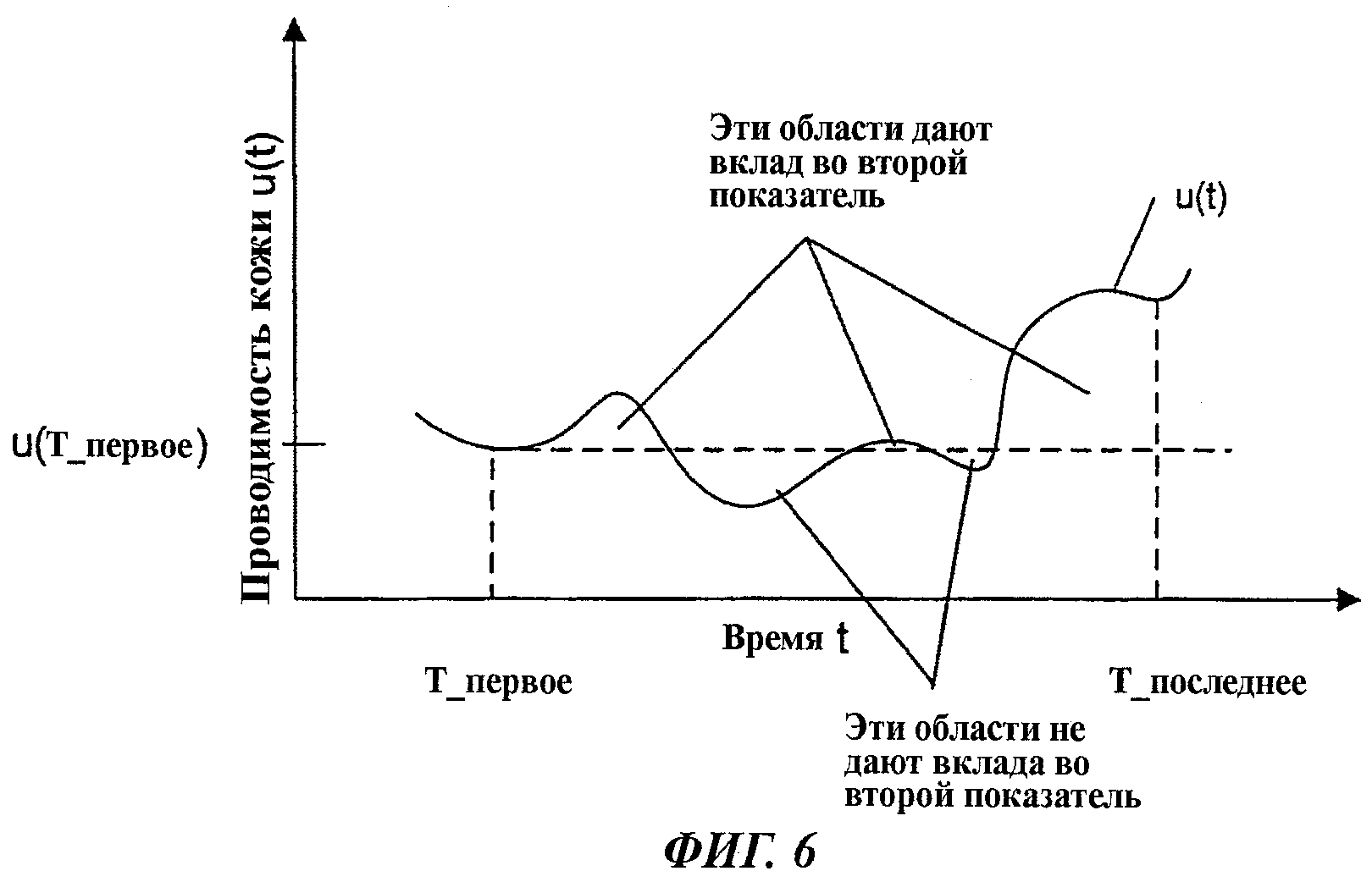
На фиг.6 представлен пример графика измерений проводимости кожи для иллюстрации расчета второго показателя способа согласно изобретению.
Осуществление изобретения
На фиг.1 представлена блок-схема предпочтительного варианта осуществления устройства согласно изобретению.
Существенные конструктивные элементы аппаратной части устройства были описаны ранее в публикации заявителя WO-03/94726, с детальными ссылками на блок-схему, приведенную на фиг.1 указанной публикации, и соответствующим подробным описанием. Содержание этой публикации и, в частности, конструкция аппаратной части устройства включены в настоящий текст посредством ссылки.
В зоне 2 кожного покрова части 1 тела пациента размещены датчики 3 для измерения проводимости кожи. Часть 1 тела - это, предпочтительно, рука или нога, а зона 2 кожного покрова части 1 тела - это предпочтительно ладонь руки или подошва ноги. В альтернативном варианте осуществления частью 1 тела может быть лоб пациента. Датчики 3 включают контактные электроды, из которых по меньшей мере два электрода размещены на коже в зоне 2. В одном из предпочтительных вариантов датчики 3 включают три электрода: сигнальный электрод, измерительный электрод и электрод опорного напряжения, обеспечивающий постоянное приложение напряжения к stratum corneum (поверхностному роговому слою кожи) под измерительным электродом. Измерительный электрод и сигнальный электрод предпочтительно размещены на коже в зоне 2. Электрод опорного напряжения также может быть размещен на коже в зоне 2, но предпочтительно размещается в близлежащей зоне, пригодной по условиям конкретной схемы измерения.
В одном из вариантов осуществления для измерения проводимости кожи используется переменный ток. Используемый переменный ток предпочтительно имеет частоту в диапазоне до 1000 Гц, например 88 Гц. Генератор сигнала, работающий на заданной частоте, подает ток сигнала на сигнальный электрод.
Результирующий ток, протекающий через измерительный электрод, подается на измерительный преобразователь 4, включающий преобразователь тока в напряжение и схему разложения, выделяющую активную проводимость как действительную часть комплексной полной проводимости.
Измерительный преобразователь 4 может также включать схемы усилителя и фильтра. В предпочтительном варианте осуществления измерительный преобразователь включает фильтры низких частот, поставленные как на входе, так и на выходе. Назначение входного фильтра низких частот - ослабление высокочастотных помех, например, помех, создаваемых прочим медицинским оборудованием; кроме того, он выполняет функцию антиэлайсингового фильтра, отсекающего высокочастотные составляющие, чтобы они не попали в последующие цепи дискретизации времени.
Управляющий блок 5 включает блок 51 дискретизации времени для дискретизации времени сигнала измерительного преобразователя. Может дать преимущества выполнение дискретизации времени с частотой дискретизации порядка 20-200 отсчетов в секунду. Далее, управляющий блок включает аналого-цифровой преобразователь 52, преобразующий данные измерений в цифровую форму.
Управляющий блок 5 включает также центральный процессор (ЦП) 53 для обработки оцифрованных данных измерений, устройства хранения информации в виде по меньшей мере одного запоминающего устройства (ЗУ) для хранения данных и программ, например, энергонезависимого ЗУ 54, и оперативную память (ОЗУ) 55. Управляющий блок 5 включает, далее, схему выходного интерфейса 61, через которую выдается выходной сигнал 73. Управляющий блок 5 предпочтительно включает, далее, схему дисплейного интерфейса 81, которая подсоединяется затем к блоку 8 дисплея. Может дать преимущества выполнение, при котором управляющий блок 5 включает также коммуникационный порт 56 для цифровой связи с каким-либо внешним устройством, например, с персональным компьютером 10.
В одном из предпочтительных вариантов осуществления энергонезависимое ЗУ 54 включает постоянную память в виде блока программируемого постоянного ЗУ или, в альтернативном варианте, блока флэш-памяти, содержащего по меньшей мере программный код и постоянные данные, а ОЗУ 55 включает схемы оперативной памяти для сохранения результатов измерений и прочих временных данных.
Управляющий блок 5 включает также задающий генератор (не показан), выдающий тактовые сигналы для управления ЦП 53. ЦП 53 также включает средства отсчета времени (не показаны) для индикации текущего времени, используемого при анализе измерений. Эти средства отсчета времени хорошо известны специалистам и зачастую уже встроены в те схемы микроконтроллеров или процессоров, которые специалист сочтет пригодными для использования в комплексе с настоящим изобретением.
Управляющий блок 5 может быть выполнен на базе микропроцессора с подсоединением входа, выхода, ЗУ и других периферических узлов, или он может быть выполнен в виде микроконтроллера, в который встроены некоторые или все подсоединяемые узлы; в него также могут быть включены блок 51 дискретизации времени и/или аналого-цифровой преобразователь 52. Выбор подходящего исполнения управляющего блока 51 предполагает решения, находящиеся в компетенции специалиста.
В альтернативном варианте осуществления управляющий блок выполнен в виде цифрового процессора сигналов (DSP: digital signal processor - цифровой процессор сигналов).
В соответствии с настоящим изобретением новый, обладающий признаками изобретения способ анализа сигнала проводимости кожи осуществляется управляющим блоком 5. Благодаря наличию программного кода управляющий блок 5 является специализированным устройством для осуществления способа согласно изобретению, например, представленного примером способа, проиллюстрированного на нижеприводимой фиг.2.
Управляющий блок 5 выполнен так, чтобы в нем имелась возможность считывать дискретизированные по времени и квантованные данные измерений проводимости кожи из измерительного преобразователя 4 предпочтительно с помощью выполнимого программного кода, хранящегося в энергонезависимом ЗУ 54 и выполняемого с помощью ЦП 53. Далее, управляющий блок 5 выполнен так, чтобы имелась возможность сохранения результатов измерений в допускающем считывание и запись ОЗУ 55. Далее, управляющий блок 5 выполнен так, чтобы с помощью программного кода анализировать результаты измерений в реальном времени, то есть одновременно или параллельно с выполнением измерений.
В данном контексте выражение «одновременно или параллельно» следует понимать в смысле практической одновременности или параллельности, то есть в связи с временными параметрами, характерными для природы данных измерений. Это значит, что ввод, сохранение и анализ результатов могут проводиться в разнесенные временные интервалы, но в данном случае эти временные интервалы и промежутки между ними столь малы, что отдельные действия представляются происходящими одновременно.
Управляющий блок 5, далее, выполнен так, чтобы имелась возможность идентифицировать флуктуации сигнала проводимости кожи. В частности, управляющий блок 5 выполнен так, чтобы имелась возможность идентифицировать точки минимумов сигнала проводимости кожи.
Управляющий блок 5, далее, выполнен так, чтобы имелась возможность выбрать первую точку локального минимума сигнала проводимости кожи как первую точку локального минимума в интервале измерений. Управляющий блок 5, кроме того, выполнен так, чтобы имелась возможность отыскать последнюю точку локального минимума сигнала проводимости кожи как последнюю точку локального минимума в интервале измерений.
Управляющий блок 5, далее, выполнен так, чтобы имелась возможность рассчитать функцию линейного наклона по определенным точкам графика проводимости кожи, в частности, по двум последовательным точкам минимума.
Управляющий блок 5, далее, выполнен так, чтобы имелась возможность сравнить величину проводимости кожи с соответствующим значением функции линейного наклона в любой точке интервала измерений.
Управляющий блок 5, далее, выполнен так, чтобы имелась возможность вычислить в некотором интервале интегрирования приближенную величину интеграла функции, зависящей от времени.
Прочие функции управляющего блока описаны ниже со ссылкой на способ, проиллюстрированный на фиг.2.
Все вышеупомянутые функции управляющего блока 5 выполняются соответствующими частями компьютерной программы, хранящейся в памяти, предпочтительно в энергонезависимом ЗУ 54.
ЦП 53, ЗУ 54 и 55, аналого-цифровой преобразователь 52, коммуникационный порт 56, схема интерфейса 81 и схема интерфейса 61 - все подсоединены к узлу шины 59. Детали строения архитектуры такой шины для создания прибора на основе микропроцессора считаются хорошо известными специалисту.
Схема интерфейса 61 - это цифровая или аналоговая выходная схема, которая формирует цифровое или аналоговое представление выходного сигнала 73, передаваемого от центрального процессора 53 через шину 59, когда ЦП 53, выполняя программный код, обращается к схеме интерфейса 61.
Выходной сигнал 73 представляет собой расчетную приближенную величину интеграла вышеупомянутого сигнала проводимости кожи в зависимости от времени.
Выходной сигнал 73 отражает состояние автономной нервной системы в качестве одного единого показателя, который квалифицированному оператору, например, хирургу или анестезиологу, удобно считывать и интерпретировать с тем, чтобы контролировать состояние автономной нервной системы пациента.
В одном из предпочтительных вариантов осуществления дисплей 8 включает поле или окно отображения величины выходного сигнала 73 либо в виде цифрового показателя, либо в графическом представлении, либо и в том и в другом. Кроме того, может обеспечить преимущество использования дисплея 8 для графической визуализации сигнала проводимости, например, в виде зависящего от времени графика, а также для индикации частоты и амплитуды замеренных флуктуаций сигнала.
Далее, устройство включает блок 9 источника питания для подачи рабочего питания на различные части устройства. Питание может осуществляться от аккумулятора или от сети.
Может дать преимущество адаптация устройства для выполнения требований, предъявляемых к больничному оборудованию с целью обеспечения безопасности пациента. Такого рода требования безопасности сравнительно просто выполнить, если устройство питается от аккумулятора. Но если устройство работает от сети, подача питания должна удовлетворять специальным требованиям - или предъявляются требования гальванического разделения безопасных для пациента частей устройства (например, работающих от аккумулятора) и частей устройства, представляющих опасность для пациента. Если устройство должно подсоединяться к внешнему оборудованию, работающему от сети и представляющему опасность для пациента, предъявляется требование гальванической развязки соединения устройства, безопасного для пациента, и внешнего оборудования, представляющего опасность для пациента. Может дать преимущество осуществление такой гальванической развязки посредством оптического разделения. Требования к безопасности оборудования, окружающего пациента, и технические решения, обеспечивающие выполнение таких требований в отношении устройств, аналогичных устройству согласно настоящему изобретению, хорошо известны специалистам.
На фиг.2 представлена блок-схема способа согласно изобретению.
Способ предпочтительно выполняется процессором в составе устройства, формирующего выходной сигнал, отражающий состояние автономной нервной системы пациента, находящегося под наркозом, то есть центральным процессором 53 в управляющем блоке 5, изображенным на фиг.1.
Выполнение способа начинается шагом запуска 200.
На вводном шаге 202 на пациента оказывается раздражающее воздействие. Обеспечивает преимущество раздражение, вызывающее болевые ощущения, в частности, стандартное повреждающее раздражение. Для его создания может быть использовано специализированное оборудование, активирующее С-волокна. Большее преимущество обеспечивает оборудование, активирующее ряд нервов, включая С-волокна, например, могут быть использованы тетанические повреждающие раздражения.
Шаг 202 может выполняться вручную оператором. В альтернативном варианте шаг 202 может выполняться управляющим блоком 5; в этом случае прибор болевого раздражения (не показан на фиг.) подсоединен к управляющему блоку 5 в качестве исполнительного механизма и выполнен так, что способен оказать воздействие на пациента.
В альтернативном варианте шаг 202 может быть опущен, то есть способ согласно изобретению может использоваться и без оказания на пациента внешнего воздействия.
Далее, на шаге съема сигнала 210 в течение интервала измерений на некотором участке кожи пациента измеряется сигнал u(t) проводимости.
Далее, на шаге идентификации 212 в течение интервала измерений идентифицируется точка локального минимума сигнала проводимости кожи.
Далее, на шаге выбора 214 в качестве интервалов интегрирования для дальнейших расчетов выбираются интервалы между идентифицированными последовательными точками минимума в интервале измерений.
Далее, на шаге 220 расчета первого показателя рассчитывается первый показатель, отражающий состояние автономной нервной системы пациента под наркозом.
Расчет первого показателя основан на многократных съемах и обработках сигнала u(t) проводимости кожи в интервале от Т1 до Т2, соответствующем интервалу интегрирования.
Для каждого интервала интегрирования [Т1, Т2] определяется функция v(t) линейного наклона - как прямая, идущая от первой к последней точке графика u(t) в интервале интегрирования [Т1, Т2]. Таким образом, эта прямая идет от точки (Т1, и(Т1)) к точке (Т2, u(Т2)). Функция линейного наклона дается выражением

Первый показатель вычисляется как сумма интегралов в пределах интервала измерений.
В пределах каждого интервала интегрирования интегрируемая функция равна нулю в подинтервалах, где u(t)≤v(t), то есть где график проводимости кожи идет ниже линейного наклона или совпадает с ним.
В пределах каждого интервала интегрирования подинтегральное выражение равно u(t)-v(t)dt в подинтервалах, где u(t)>v(t), то есть где график проводимости кожи идет выше линейного наклона.
Отсюда следует, что подинтервалы, где u(t)≤v(t), не дают вклада в интеграл. В подинтервалах, где u(t)>v(t), площадь между графиком проводимости кожи и линейным наклоном будет прибавляться в качестве вклада в интеграл и, таким образом, в первый показатель.
Расчеты интегралов выполняются для каждого интервала интегрирования, и сумма таких интегралов по всему интервалу измерений выдается как первый показатель, отражающий состояние автономной нервной системы пациента под наркозом.
Таким образом, первый показатель может быть вычислен на расчетном шаге 220 по следующей формуле:

где u(t) - это измеренный сигнал проводимости кожи, а Т1 и Т2 - точки соответственно начала и конца каждого интервала интегрирования (first_measure=первый показатель, measurement_interval=интервал измерений).
Т1 и Т2 - это точки локальных минимумов сигнала проводимости кожи. В процессе суммирования по интервалу измерений Т1 и Т2 для каждого добавляемого интегрального члена получают новые, бóльшие значения.
В данном описании термин «интеграл» следует интерпретировать как приближенное значение точного интеграла. Аналогично термин «интегрирование» следует интерпретировать как нахождение приближенного значения точного интеграла. В расчетах шага 220 преимущественно используются численные методы интегрирования, такие, например, как метод прямоугольников, метод трапеций или метод, основанный на правиле Симпсона.
Специалисту понятно, что расчет шага 220 может включать предварительный обсчет любых точек пересечения графиков u(t) проводимости кожи и функции v(t) линейного наклона. Специалисту понятно также, что подинтервалы могут быть определены точками таких пересечений и, возможно, начальной точкой Т1 или конечной точкой Т2. И если в какой-то точке такого подинтервала u(t)≤v(t), то в интегральном расчете всем этим подинтервалом можно пренебречь, так как весь этот подинтервал определенно не даст вклада в первый показатель.
Далее, на шаге 230 расчета второго показателя рассчитывается второй член, отражающий состояние автономной нервной системы пациента под наркозом.
Второй показатель рассчитывается как интеграл по интервалу от T_first (Т_первое) до T_last (Т_последнее), где T_first - это точка первого локального минимума в интервале измерений, а T_last выбирается из группы значений, включающей:
- точку последнего локального минимума в интервале измерений и
- последнюю точку интервала измерений.
В пределах интервала [T_first, T_last] интегрируемая функция равна нулю в подинтервалах, где u(t) ≤ u(T_first), то есть там, где текущее значение проводимости кожи меньше или равно значению проводимости кожи в точке T_first.
В пределах интервала [T_first, T_last] подинтегральное выражение равно (u(t)-u(T_first))dt в подинтервалах, где u(t)>u(T_first), то есть там, где текущее значение проводимости кожи больше значения проводимости кожи в момент T_first.
Отсюда следует, что подинтервалы, в которых текущее значение проводимости кожи меньше или равно значению проводимости кожи в точке T_first, не дают вклада во второй показатель. С другой стороны, в подинтервалах, где текущее значение проводимости кожи больше значения проводимости кожи в точке T_first, разность между текущим значением проводимости кожи и значением в момент T_first будет интегрироваться в зависимости от времени, и результат даст вклад во второй показатель.
Конкретнее, второй показатель рассчитывается на шаге 230 по формуле:

где u(t) - это измеренный сигнал проводимости кожи, T_first - точка первого локального минимума в интервале измерений, а T_last - последняя точка интервала измерений или точка последнего локального минимума в интервале измерений (second_measure=второй показатель).
Специалисту понятно, что расчет шага 230 может включать предварительный обсчет любых точек пересечения графика u(t) проводимости кожи и прямой линии, изображающей постоянную величину u(T_first). Специалисту понятно также, что подинтервалы могут быть определены точками таких пересечений и, возможно, начальной точкой T_first или конечной точкой T_last. И если в какой-то точке такого подинтервала u(t)≤u(T_first), то в интегральном расчете всем этим подинтервалом можно пренебречь, так как весь этот подинтервал определенно не даст вклада во второй показатель.
На первом шаге сравнения 240 сравниваются рассчитанные первый и второй показатели. Если первый показатель больше второго, то первый показатель выдается для шага 242 как выходной сигнал Y, отражающий состояние автономной нервной системы пациента под наркозом. И наоборот, если первый показатель не больше второго, то второй показатель выдается для шага 244 как выходной сигнал Y, отражающий состояние автономной нервной системы пациента под наркозом. То есть, по существу, наибольший из двух показателей, первого и второго, выдается как выходной сигнал Y.
Выходной сигнал Y предпочтительно отображается (это не представлено как отдельный шаг на иллюстрации фиг.2) на дисплее 8.
Этот выходной сигнал, например, выданный на дисплей устройства, осуществляющего способ согласно настоящему изобретению, отражает состояние автономной нервной системы пациента под наркозом в качестве одного единого показателя. Настоящее изобретение обеспечивает высокую степень интерпретируемости, удобства и легкости выполнения операции, при условии, что устройство согласно изобретению обслуживает квалифицированный оператор (например, хирург или анестезиолог).
Способ согласно изобретению может быть далее усовершенствован включением второго шага сравнения 250, на котором определяется, попадает ли выходной сигнал Y в заранее заданный интервал Y1-Y2 значений выходного сигнала.
Предпочтительно, чтобы Y1 находился в диапазоне 0,05 мкСм·с - 0,20 мкСм·с. Более предпочтительно, чтобы Y1 находился в диапазоне 0,08 мкСм·с - 0,12 мкСм·с. Наиболее предпочтительно, чтобы Y1 составлял около 0,1 мкСм·с.
Предпочтительно, чтобы Y2 находился в диапазоне 0,5 мкСм·с - 3,0 мкСм·с. Более предпочтительно, чтобы Y2 находился в диапазоне 0,8 мкСм·с - 2,2 мкСм·с. Наиболее предпочтительно, чтобы Y2 составлял около 2,0 мкСм·с.
Если критериальное суждение второго сравнения истинно, на шаге 252 устанавливается сигнал индикации боли, и процесс предпочтительно повторяется с шага 210 съема сигнала проводимости кожи. В противном случае процесс предпочтительно продолжается переходом к третьему шагу сравнения 260 (см. ниже).
Способ согласно изобретению может быть также далее усовершенствован включением третьего шага сравнения 260, на котором определяется, превышает ли выходной сигнал Y заранее заданное значение выходного сигнала Y3.
Предпочтительно, чтобы Y3 находился в диапазоне 0,5 мкСм·с - 3,0 мкСм·с. Более предпочтительно, чтобы Y3 находился в диапазоне 0,8 мкСм·с - 2,2 мкСм·с. Наиболее предпочтительно, чтобы Y3 составлял около 2,0 мкСм·с.
Если критериальное суждение этого третьего сравнения истинно, на шаге 262 устанавливается сигнал индикации пробуждения, и процесс предпочтительно повторяется с шага 210 съема сигнала проводимости кожи. В противном случае процесс предпочтительно продолжается переходом к шагу проверки окончания 270 (см. ниже).
Весь процесс предпочтительно осуществляется итерационно или повторяется. Для окончания процесса предпочтительно предусматривается шаг проверки окончания 270, на котором выполняется проверка, имеющая целью определить, следует ли окончить процесс. Если да, то процесс завершается шагом 290; в противном случае процесс повторяется с шага 210 съема сигнала проводимости кожи.
На фиг.3 представлен пример графика измерений проводимости кожи для иллюстрации расчета, выполняемого на расчетном шаге 220, то есть на шаге расчета первого показателя способа согласно изобретению.
График фиг.3 представляет часть первого сигнала проводимости кожи, замеренного на пациенте в течение интервала измерений. Длительность интервала измерений может составлять, например, 15 с. В течение этого интервала измерений идентифицируются точки локальных минимумов сигнала проводимости кожи и выбираются интервалы между последовательными точками минимума в качестве интервалов интегрирования.
Один такой интервал интегрирования показан на фиг.3; он начинается в точке локального минимума Т1, а следующая точка локального минимума - Т2.
Для этого интервала интегрирования [Т1, Т2] определяется функция v(t) линейного наклона как прямая, идущая от первой к последней точке графика u(t) в интервале интегрирования [Т1, Т2]. Таким образом, эта прямая идет от точки (Т1, u(Т1)) к точке (Т2, u (Т2)), как было объяснено выше при рассмотрении фиг.2.
В данном примере u(t)>v(t) во всем интервале интегрирования [Т1, Т2]. Таким образом, в соответствии с вышеприведенным объяснением со ссылкой на фиг.2, первый показатель рассчитывается как площадь между графиком u(t) и линией v(t), то есть как интеграл от разности (u(t)-v(t))dt в пределах от Т1 до Т2.
Расчеты интегралов выполняются для каждого интервала интегрирования, и сумма таких интегралов по всему интервалу измерений выдается как первый показатель, отражающий состояние автономной нервной системы пациента под наркозом.
На фиг.4 представлен другой пример графика измерений проводимости кожи - также для иллюстрации расчета, выполняемого на расчетном шаге 220, то есть на шаге расчета первого показателя способа согласно изобретению.
График фиг.4 представляет часть первого сигнала проводимости кожи, замеренного на пациенте в течение интервала измерений. Длительность интервала измерений может составлять, например, 15 с. В течение этого интервала измерений идентифицируются точки локальных минимумов сигнала проводимости кожи и выбираются интервалы между последовательными точками минимума в качестве интервалов интегрирования.
Один такой интервал интегрирования показан на фиг.4; он начинается в точке локального минимума Т1, а следующая точка локального минимума - Т2.
Для этого интервала интегрирования [Т1, Т2] определяется функция v(t) линейного наклона как прямая, идущая от первой к последней точке графика u(t) в интервале интегрирования [Т1, Т2]. Таким образом, эта прямая идет от точки (Т1, u (Т1)) к точке (Т2, u (Т2)), как было объяснено выше при рассмотрении фиг.2.
В данном примере u(t)≤v(t) в первой части интервала [Т1, Т2], то есть график проводимости кожи идет ниже линейного наклона или совпадает с ним. Как было объяснено выше при рассмотрении фиг.2, интегрируемая функция равна нулю в этой части интервала. Таким образом, левая область на фиг.4 не дает вклада в первый показатель.
Как видно далее из фиг.4, во второй части интервала интегрирования [Т1, Т2] график проводимости кожи идет выше линейного наклона, то есть u(t)>v(t). В этой части интервала интегрирования площадь между графиком u(t) и линией v(t), то есть интеграл от разности (u(t)-v(t))dt в пределах от Т1 до Т2, будет давать вклад в первый показатель.
Расчеты интегралов выполняются для каждого интервала интегрирования, и сумма таких интегралов по всему интервалу измерений выдается как первый показатель, отражающий состояние автономной нервной системы пациента под наркозом.
На фиг.5 представлен пример графика измерений проводимости кожи для иллюстрации расчета, выполняемого на расчетном шаге 230, то есть на шаге расчета второго показателя способа согласно изобретению.
График фиг.5 представляет подмножество значений первого сигнала проводимости кожи, замеренного на пациенте в течение интервала измерений. Длительность интервала измерений может составлять, например, 15 с. В течение этого интервала измерений идентифицируется первая точка локального минимума сигнала проводимости кожи и обозначается T_first. Эта точка выбирается в качестве первой точки интервала подмножества [T_first, T_last].
Последней точкой интервала подмножества [T_first, T_last] может быть либо последняя точка интервала измерений, либо точка последнего минимума в интервале измерений. В приводимом примере фиг.5 в качестве T_last выбрана точка последнего минимума.
Как видно из фиг.5, u(t)>u(T_first) во всем интервале подмножества [T_first, T_last]. В соответствии с вышеприведенным описанием со ссылкой на расчет шага 230, проиллюстрированный на фиг.2, это означает, что второй показатель будет рассчитан как интеграл от разности (u(t) - u(T_first)) в пределах от T_first до T_last в зависимости от времени. Другими словами, второй показатель рассчитывается как площадь между графиком u(t) и горизонтальной линией, определяемой постоянным значением u(T_first).
На фиг.6 представлен другой пример графика измерений проводимости кожи - также для иллюстрации расчета, выполняемого на расчетном шаге 230, то есть на шаге расчета второго показателя способа согласно изобретению.
График фиг.6 представляет подмножество значений первого сигнала проводимости кожи, замеренного на пациенте в течение интервала измерений. Длительность интервала измерений может составлять, например, 15 с. В течение этого интервала измерений идентифицируется первая точка локального минимума сигнала проводимости кожи и обозначается T_first. Эта точка выбирается в качестве первой точки интервала подмножества [T_first, T_last].
Последней точкой интервала подмножества [T_first, T_last] может быть либо последняя точка интервала измерений, либо точка последнего минимума в интервале измерений. В приводимом примере фиг.6 в качестве T_last выбрана точка последнего минимума.
Как видно из фиг.6, u(t)>u(T_first) в некоторых частях интервала подмножества [T_first, T_last] (области над горизонтальной пунктирной линией), тогда как в остальных частях интервала подмножества [T_first, T_last] u(t)≤u(T_first) (области под горизонтальной пунктирной линией).
В соответствии с вышеприведенным описанием со ссылкой на расчет шага 230, проиллюстрированный на фиг.2, второй показатель будет рассчитан как интеграл от разности (u(t) - u(T_first))dt в пределах от T_first до T_last в тех подинтервалах, где u(t)>u(T_first). А те подинтервалы, где u(t)≤u(T_first), не добавляют никакого вклада (ноль) во второй показатель.
Другими словами, второй показатель рассчитывается как сумма площадей между графиком u(t) и горизонтальной линией, определяемой постоянным значением u(T_first) в тех подинтервалах, где u(t)>u(T_first).
Специалисту понятно, что выходной сигнал Y, формируемый в соответствии с изобретением, уменьшается по фазе при введении анестезирующего средства.
Вышеприведенное описание и иллюстрации представляют собой конкретный вариант осуществления настоящего изобретения. Специалисту понятно, что существуют альтернативные и эквивалентные варианты осуществления настоящего изобретения, не выходящие за его объем. Например, использование вместо проводимости импеданса кожи, разумеется, даст аналогичные результаты, если будет принята во внимание обратная пропорциональность этих переменных.
Во всем данном описании и формуле изобретения используется термин «пациент», однако следует понимать, что, хотя настоящее изобретение в первую очередь предназначено для контроля состояния человеческих существ, изобретение, как оказалось, применимо и для контроля состояния животных, в частности млекопитающих. Поэтому термин «пациент» следует понимать как обозначение и пациентов-людей, и пациентов-животных.
Сущность изобретения не ограничена вышеприведенными иллюстративными вариантами осуществления. Напротив, объем изобретения определен нижеследующей формулой изобретения.
Реферат
Группа изобретений относится к медицинской технологии, в особенности к способу и устройству для контроля состояния автономной нервной системы пациента под наркозом. Способ реализуется устройством, включающим измерительное оборудование для съема сигнала проводимости кожи и управляющий блок. В соответствии со способом в течение интервала измерений снимают сигнал проводимости кожи, идентифицируют точки локальных минимумов, выбирают интервалы интегрирования, рассчитывают функцию линейного наклона, а также интеграл от разности значений сигнала проводимости кожи и функции линейного наклона в случае, когда сигнал проводимости кожи выше значений функции линейного наклона, рассчитывают первый показатель состояния автономной нервной системы пациента под наркозом. Также выбирают подмножество значений интервала измерений с началом в первой точке минимума, выбирают значение проводимости кожи в указанной точке в качестве постоянной величины, рассчитывают интеграл от разности значений сигнала проводимости кожи и этой постоянной величины в случае, когда сигнал проводимости кожи выше этой постоянной величины, рассчитывают второй показатель состояния автономной нервной системы пациента под наркозом. Наибольший из первого и второго показателей выдают как выходной сигнал, отражающий состояние автономной нервной системы пациента под наркозом. Применение группы изобретений позволит улучшить интерпретируемость результатов измерений, а также повысит удобство и легкость контроля состояния автономной нервной системы пациента под наркозом. 2 н. и 9 з.п. ф-лы, 6 ил.
Формула
снимают, в течение интервала измерений, сигнал проводимости кожи на участке кожи пациента; идентифицируют, в пределах интервала измерений, точки локальных минимумов сигнала проводимости кожи; выбирают интервалы между указанными идентифицированными последовательными точками минимумов в качестве интервалов интегрирования; рассчитывают, для каждого интервала интегрирования, функцию линейного наклона, определяемую сигналом проводимости кожи в начальной и конечной точках интервала интегрирования, а также интеграл от разности значений сигнала проводимости кожи и функции линейного наклона в подмножествах значений интервала интегрирования, где сигнал проводимости кожи выше значений функции линейного наклона; и рассчитывают первый показатель, отражающий состояние автономной нервной системы пациента под наркозом, как сумму указанных интегралов в пределах интервала измерений;
выбирают подмножество значений интервала измерений, начинающееся в первой точке минимума в пределах интервала измерений; выбирают значение проводимости кожи в первой точке минимума в пределах интервала измерений в качестве постоянной величины; рассчитывают интеграл от разности значений сигнала проводимости кожи и этой постоянной величины в относящемся к подмножествам интервала измерений подмножестве, где сигнал проводимости кожи выше этой постоянной величины; и рассчитывают второй показатель, отражающий состояние автономной нервной системы пациента под наркозом, как сумму указанных интегралов в пределах интервала измерений; и выдают наибольший из двух показателей, первого и второго, как выходной сигнал (Y), отражающий состояние автономной нервной системы пациента под наркозом.

Комментарии