Система и способ для автоматического переноса реагента в блок анализа - RU2669767C2
Код документа: RU2669767C2
Чертежи


Описание
Предпосылки к созданию изобретения
Обнаружение большого числа биомаркеров болезней и разработка и внедрение миниатюризированных медицинских систем открыли новые пути для прогнозирования, диагностики и мониторинга лечения болезней в месте ухода за больным. Системы, расположенные в месте ухода за больным, позволяют быстро выдавать результаты испытаний медицинскому персоналу, другим медицинским профессионалам и пациентам. Ранняя диагностика заболевания или протекания заболевания позволяет медицинскому персоналу своевременно начинать или изменять терапию.
Мультиплексное измерение биомаркера позволяет получить дополнительные сведения о состоянии пациента. Например, при мониторинге воздействий лекарственного средства, три или более биомаркеров могут быть измерены в параллель. Типично, используют титрационные микропланшеты и другие аналогичные устройства для проведения объединенных количественных анализов на базе разделения. Титрационный микропланшет (например, титрационный микропланшет с 384 лунками) позволяет проводить большое число количественных анализов в параллель.
В устройстве, расположенном в месте ухода за больным (в РОС устройстве), число проводимых в параллель количественных анализов часто ограничено размером устройства и объемом пробы, подлежащим анализу. Во многих РОС устройствах, число проводимых количественных анализов составляет ориентировочно от 2 до 10. Желательно иметь РОС устройство, которое позволяет проводить объединенные количественные анализы на небольшом объеме пробы.
Недостатком многих РОС устройств для объединенного количественного анализа является высокая стоимость изготовления компонентов устройства. Если устройство является одноразовым, то высокая стоимость компонентов может сделать использование РОС устройства непрактичным. Кроме того, в случае объединенного РОС устройства, которое содержит все необходимые реагенты внутри устройства, если только один из этих реагентов окажется нестабильным, то приходится выбрасывать все устройство, даже если все другие реагенты еще можно использовать.
Когда потребитель заинтересован в изготовлении на заказ РОС устройства со специфическим набором аналитов, тогда изготовители РОС систем для объединенного количественного анализа часто сталкиваются с необходимостью смешения и подгонки (mix-and-match) количественных анализов и реагентов устройства. Объединенный РОС количественный анализ, подходящий для каждого потребителя, может быть очень дорогим, трудным для калибровки и сложным для поддержания контроля качества.
Было доказано, что РОС способы является очень ценными при мониторинге заболевания и терапии (например, системы измерения глюкозы крови в лечении диабета, измерение времени протромбина в антикоагулянтной терапии с использованием зоокумарина). Можно полагать, что за счет измерения множества маркеров можно лучше контролировать комплексные заболевания (такие как рак) и терапии, такие как терапию с использованием множеством лекарств.
Сущность изобретения
Таким образом, с учетом изложенного, остается необходимость в альтернативном построении РОС устройств. Желательная конструкция должна иметь модульные поверхности захвата и инкубационные элементы для количественного анализа. Более того, модульные поверхности захвата и инкубационные элементы для количественного анализа необходимо встраивать в РОС расходные элементы, приспособленные для использования в способах изготовления с оперативной поставкой узлов. Было бы желательно создавать заказное РОС устройство по цене, устраивающей заказчика и изготовителя. Настоящее изобретение позволяет удовлетворить эти потребности, а также обеспечить соответствующие преимущества.
В соответствии с первым аспектом настоящего изобретения, предлагается патрон для автоматического обнаружения аналита в пробе телесной жидкости, который содержит: матрицу адресуемых блоков анализа, сконфигурированную для проведения химической реакции, которая дает различимый сигнал, несущий информацию о наличии или отсутствии аналита; матрицу адресуемых блоков реагентов, в которой обращаются к индивидуальному адресуемому блоку реагента матрицы, соответствующему индивидуальному адресуемому блоку анализа матрицы блоков анализа, и в которой индивидуальные блоки реагентов сконфигурированы для калибровки по опорному сигналу соответствующего индивидуального блока анализа, ранее сборки матриц на (в) патроне. Устройство может дополнительно содержать блок отбора пробы, сконфигурированный для приема пробы телесной жидкости.
В соответствии с другим аспектом настоящего изобретения, предлагается патрон для автоматического обнаружения аналита в пробе телесной жидкости, который содержит: блок отбора пробы, сконфигурированный для приема пробы телесной жидкости; матрицу блоков анализа, сконфигурированную для приема порции пробы от блока отбора пробы и для проведения химической реакции, которая дает различимый сигнал, несущий информацию о наличии аналита в пробе; матрицу блоков реагентов, содержащих реагенты для проведения химической реакции; причем индивидуальный блок анализа матрицы блоков анализа и индивидуальный блок реагента матрицы блоков реагентов сконфигурированы подвижными и имеющими флюидную связь, так что реагенты для проведения химической реакции вводятся в контакт с порцией пробы в блоке анализа.
Индивидуальный блок реагента может быть сконфигурирован для приема подвижного блока анализа. В соответствии с некоторыми вариантами, индивидуальный блок анализа содержит (представляет собой) наконечник для количественного анализа.
В соответствии с некоторыми вариантами, индивидуальный блок анализа сконфигурирован для проведения иммунологического анализа.
Проба телесной жидкости может быть пробой крови. В некоторых случаях, блок отбора пробы сконфигурирован для приема объема пробы телесной жидкости, составляющей ориентировочно 50, 20, 10, 5 или 3 мкл или меньше. В частности, блок отбора пробы сконфигурирован для приема объем пробы телесной жидкости, эквивалентного одной капли крови.
Описанное здесь устройство может иметь блок предварительной обработки, сконфигурированный для отбора порции пробы телесной жидкости для проведения химической реакции, чтобы обнаружить аналит, причем блок предварительной обработки может быть сконфигурирован для отбора плазмы из пробы цельной крови, введенной в блок отбора пробы.
В соответствии с еще одним аспектом настоящего изобретения, предлагается система для автоматического обнаружения аналита в пробе телесной жидкости, которая содержит: устройство, соответствующее описанному здесь выше; узел обнаружения, предназначенный для обнаружения различимого сигнала, несущего информацию о наличии или отсутствии аналита. Система может дополнительно содержать программируемое механическое устройство, сконфигурированное для перемещения индивидуального блока анализа от первого местоположения во второе местоположение. В некоторых случаях, система содержит устройство для переноса флюида. Устройством для переноса флюида может быть пипетка, а также может быть автоматизированное устройство. Система также может содержать узел связи для передачи протокола, основанного на аналите, подлежащем обнаружению. В некоторых случаях, указанная система содержит блок нагрева, сконфигурированный для приема индивидуального блока анализа, а также содержит магнитный блок, например, который может быть использован для выделения эритроцитов из пробы крови.
В соответствии с еще одним аспектом настоящего изобретения, предлагается система для автоматического обнаружения множества аналитов в пробе телесной жидкости, которая содержит: флюидное устройство, который содержит: блок отбора пробы, сконфигурированный с возможностью содержания (хранения) пробы телесной жидкости; матрицу блоков анализа, причем индивидуальный блок анализа указанной матрицы блоков анализа сконфигурирован для проведения химической реакции, которая дает сигнал, несущий информацию об индивидуальном аналите указанного множества подлежащих обнаружению аналитов; матрицу блоков реагентов, причем индивидуальный блок реагента указанной матрицы блоков реагентов содержит реагент; устройство для переноса флюида, которое содержит множество головок, причем индивидуальная головка множества головок сконфигурирована для входа в зацепление с индивидуальным блоком анализа, при этом указанное устройство для переноса флюида содержит программируемое обрабатывающее устройство, сконфигурированное для прямого переноса пробы телесной жидкости от блока отбора пробы и реагента от индивидуального блока реагента в индивидуальный блок анализа. В соответствии с некоторыми вариантами, конфигурация обрабатывающего устройства для прямого переноса флюида позволяет задавать степень разбавления пробы телесной жидкости в матрице блоков анализа, чтобы получить сигналы, несущие информацию о множестве аналитов, подлежащих обнаружению внутри диапазона обнаружения, так что указанное множество аналитов может быть обнаружено с использованием указанной системы.
В некоторых случаях, проба телесной жидкости содержит по меньшей мере два аналита, присутствующие при концентрациях, которые отличаются по меньшей мере на 2, 5, 10, 15, 50 или 100 порядков величины. Степень разбавления пробы телесной жидкости может давать сигналы, несущие информацию по меньшей мере о двух аналитах внутри диапазона обнаружения.
Предложенная система может дополнительно содержать устройство обнаружения, сконфигурированное для обнаружения интенсивностей сигнала в диапазоне обнаружения. Примерным устройством обнаружения является фотоумножитель, диапазон обнаружения которого составляет ориентировочно от 20 до 10 миллионов отсчетов (в секунду).
В соответствии с некоторыми вариантами, индивидуальная головка устройства для переноса флюида сконфигурирована для сцепления с индивидуальным блоком анализа. Индивидуальный блок анализа может обеспечивать место реакции иммунологического анализа. В некоторых случаях, индивидуальный блок анализа представляет собой наконечник пипетки. Устройством для переноса флюида может быть пипетка, такая как пипетка с вытеснением воздухом. Устройство для переноса флюида также может содержать двигатель, подключенный к программируемому обрабатывающему устройству, причем указанный двигатель может перемещать указанное множество головок, на основании протокола от указанного программируемого обрабатывающего устройства.
В соответствии с еще одним аспектом настоящего изобретения, предлагается система для автоматического обнаружения множества аналитов в порции плазмы пробы цельной крови, которая содержит: устройство, сконфигурированное для автоматического приема и обработки пробы цельной крови, чтобы получить порцию плазмы крови, с использованием которой в устройстве генерируют различимый сигнал, несущий информацию о наличии или отсутствии представляющего интерес аналита; и узел обнаружения, предназначенный для обнаружения различимого сигнала, несущего информацию о наличии или отсутствии аналита.
В соответствии с еще одним аспектом настоящего изобретения, предлагается способ обнаружения аналита в пробе телесной жидкости, который включает в себя следующие операции: подача пробы крови в описанное выше устройство; создание условий для реагирования указанной пробы внутри по меньшей мере одного блока анализа; и обнаружение указанного различимого сигнала, генерируемого за счет указанного аналита, собранного в указанной пробе телесной жидкости. Пробой телесной жидкости может быть проба крови, причем указанный способ может предусматривать отбор (извлечение) плазмы из пробы крови.
В соответствии с еще одним аспектом настоящего изобретения, предлагается способ сборки по запросу патрона для автоматического обнаружения аналита в пробе телесной жидкости, причем устройство содержит корпус, а указанный корпус содержит: матрицу адресуемых блоков анализа, в которой индивидуальный блок анализа матрицы сконфигурирован для проведения химической реакции, которая дает различимый сигнал, несущий информацию о наличии или отсутствии аналита; матрицу адресуемых блоков реагентов, в которой обращаются к индивидуальному блоку реагента матрицы, соответствующему индивидуальному блоку анализа матрицы, причем указанный способ включает в себя следующие операции: (i) размещение в корпусе, в соответствии с подлежащим обнаружению аналитом, матрицы адресуемых блоков анализа, причем индивидуальный блок анализа матрицы сконфигурирован для проведения химической реакции, которая позволяет обнаружить представляющий интерес аналит, заказанный указанным конечным пользователем; (ii) размещение в корпусе, в соответствии с подлежащим обнаружению аналитом, матрицы блоков реагентов, причем индивидуальный блок реагента матрицы соответствует индивидуальному блоку анализа; и (iii) закрепление матриц (i) и (ii) внутри корпуса устройства. Способ может предусматривать выбор подлежащего обнаружению аналита. В соответствии с некоторыми вариантами, способ предусматривает герметизацию патрона. В одном варианте, способ предусматривает маркирование патрона удобочитаемой этикеткой, на которой указан подлежащий обнаружению аналит, например, в виде штрихкода или RFDD.
В соответствии с еще одним аспектом настоящего изобретения, предлагается способ автоматического обнаружения множества аналитов в пробе телесной жидкости, который включает в себя следующие операции: введение пробы телесной жидкости во флюидное устройство, причем флюидное устройство содержит: блок отбора пробы, сконфигурированный с возможностью содержания (хранения) пробы телесной жидкости; матрицу блоков анализа, причем индивидуальный блок анализа указанной матрицы блоков анализа сконфигурирован для проведения химической реакции, которая дает сигнал, несущий информацию об индивидуальном аналите указанного множества обнаруживаемых аналитов; матрицу блоков реагентов, причем индивидуальный блок реагента указанной матрицы блоков реагентов содержит реагент; подсоединение индивидуального блока анализа с использованием устройства для переноса флюида; перенос пробы телесной жидкости от блока отбора пробы в индивидуальный блок анализа с использованием устройства для переноса флюида; и перенос реагента от индивидуального блока реагента в индивидуальный блок анализа, чтобы провести реакцию реагента с пробой телесной жидкости и получить сигнал, несущий информацию об индивидуальном аналите множества подлежащих обнаружению аналитов.
В одном варианте, устройство для переноса флюида содержит множество головок, при этом индивидуальная головка множества головок сконфигурирована для входа в зацепление с индивидуальным блоком анализа; причем указанное устройство для переноса флюида содержит программируемое обрабатывающее устройство, сконфигурированное для прямого переноса пробы телесной жидкости от (из) блока отбора пробы и реагента от (из) индивидуального блока реагента в индивидуальный блок анализа. Способ может дополнительно предусматривать подачу команд на программируемое обрабатывающее устройство, причем указанные команды могут управлять операцией переноса пробы телесной жидкости в индивидуальный блок анализа.
В одном варианте, операция переноса пробы телесной жидкости включает в себя изменение степени разбавления пробы телесной жидкости в индивидуальном блоке анализа, чтобы получить сигнал, несущий информацию об индивидуальном аналите множества подлежащих обнаружению аналитов внутри диапазона обнаружения. Проба телесной жидкости может содержать по меньшей мере два индивидуальных аналита, которые присутствуют при концентрациях, отличающихся по меньшей мере на 2, 5, 10, 15, 50 или 100 порядков величины. В некоторых случаях, степень разбавления пробы телесной жидкости позволяет получить сигналы, несущие информацию по меньшей мере о двух индивидуальных аналитах внутри диапазона обнаружения. В одном варианте, диапазон обнаружения составляет ориентировочно от 1000 до 1 миллиона отсчетов в секунду, когда используют фотоумножитель.
В одном варианте, реагент в индивидуальном блоке реагента представляет собой субстрат фермента для иммунологического анализа, а способ может дополнительно предусматривать повтор операции переноса реагента от индивидуального блока реагента, после завершения реакции, для получения сигнала, несущего информацию об индивидуальном аналите множества подлежащих обнаружению аналитов, за счет чего протекает вторая реакция для получения второго сигнала, несущего информацию об индивидуальном аналите. Интенсивность сигнала и вторую интенсивность второго сигнала, несущих информацию об индивидуальном аналите, усредняют, чтобы получить окончательную интенсивность сигнала, несущего информацию об индивидуальном аналите.
В соответствии с еще одним аспектом настоящего изобретения, предлагается способ измерения объема пробы жидкости (биологического флюида), который включает в себя следующие операции: реагирование известного количество контрольного аналита в указанной пробе с реагентом, чтобы получить различимый сигнал, несущий информацию о количестве контрольного аналита; и сравнение указанного различимого сигнала с ожидаемым различимым сигналом, причем ожидаемый сигнал несет информацию о ожидаемом объеме пробы, при этом указанное сравнение позволяет измерять указанный объем указанной пробы. В некоторых случаях, контрольный аналит обычно не присутствует в указанной жидкой пробе в обнаруживаемом количестве. Способ может предусматривать проверку объема указанной жидкой пробы, когда измеренный объем пробы составляет ориентировочно менее 50% ожидаемого объема пробы. В одном варианте, способ дополнительно предусматривает: реагирование с реагентом пробы телесной жидкости, содержащей заданный аналит, чтобы получить различимый сигнал, несущий информацию о заданном аналите; и измерение количества заданного аналита в пробе телесной жидкости с использованием интенсивности указанного различимого сигнала, несущего информацию о заданном аналите, и измерение указанного объема указанной жидкой пробы. Проба жидкости и проба телесной жидкости могут быть одной и той же пробой, причем контрольный аналит не реагирует с заданным аналитом в пробе телесной жидкости. В некоторых случаях, проба жидкости и проба телесной жидкости представляют собой разные пробы. Контрольным аналитом может быть, например, флуоресцеин-меченый (меченый флуоресцеином) альбумин, флуоресцеин-меченый IgG, анти-флуоресцеин, анти-дигоксигенин, дигоксигенин-меченый альбумин, дигоксигенин-меченый IgG, биотинилированные протеины и IgG не человека.
В соответствии с еще одним аспектом настоящего изобретения, предлагается способ отбора плазмы из пробы крови, который включает в себя следующие операции: перемешивание пробы крови в присутствии намагничиваемых частиц в блоке отбора пробы, причем намагничиваемые частицы содержат поверхность захвата антитела для связывания не плазменных порций пробы крови; и наложение магнитного поля поверх зоны сбора плазмы крови, для перемешивания пробы крови, чтобы получить суспензию не плазменных порций пробы крови поверх зоны сбора плазмы крови. В некоторых случаях, блок отбора пробы представляет собой волосную трубку. Объем пробы крови может составлять ориентировочно меньше чем 20 мкл, причем плазму крови отбирают в объеме ориентировочно меньше чем 10 мкл. В некоторых случаях, пробу крови не разбавляют. В некоторых случаях, перемешивание протекает в присутствии антител, несвязанных с твердой поверхностью. Перемешиванием может быть перемешивание за счет действия шприца.
В соответствии с еще одним аспектом настоящего изобретения, предлагается способ использования автоматизированного иммунологического анализа для обнаружения аналита, присутствующего в порции плазмы пробы цельной крови, который включает в себя следующие операции: подача пробы цельной крови в устройство, которое сконфигурировано для автоматического приема и обработки пробы цельной крови, чтобы получить порцию плазмы крови, дающую различимый сигнал, несущий информацию о наличии или отсутствии представляющего интерес аналита; обнаружение указанного сигнала, несущего информацию о наличии или отсутствии аналита в указанной пробе телесной жидкости; и передача результатов операции (b) конечному пользователю. Иммунологическим анализом может быть анализ ELISA. В некоторых случаях, результаты передают при помощи беспроводной связи (радиосвязи).
В соответствии с некоторыми вариантами, описанный здесь выше способ осуществляют в описанной здесь выше системе.
Все публикации и патентные заявки, упомянутые в описании настоящего изобретения, включены в данное описание в качестве ссылки, в том объеме, который соответствует объему каждой индивидуальной публикации или патентной заявки.
Указанные ранее и другие новые характеристики и преимущества изобретения будут более ясны из последующего детального описания, приведенного со ссылкой на сопроводительные чертежи.
Краткое описание чертежей
На фиг.1 показано примерное устройство в соответствии с настоящим изобретением, которое содержит блоки анализа, блок реагентов, а также другие модульные компоненты устройства.
На фиг.2 показано срезанное с двух сторон примерное устройство, показанное на фиг.1, которое содержит полости в корпусе устройства, форма которых позволяет ввести в них блок анализа, блок реагента и наконечник отбора пробы.
На фиг.3А показан примерный блок анализа, который содержит небольшой наконечник или трубку.
На фиг.3В показан примерный наконечник для отбора пробы.
На фиг.4А и 4В показаны два примера блока реагента, который содержит колпачок.
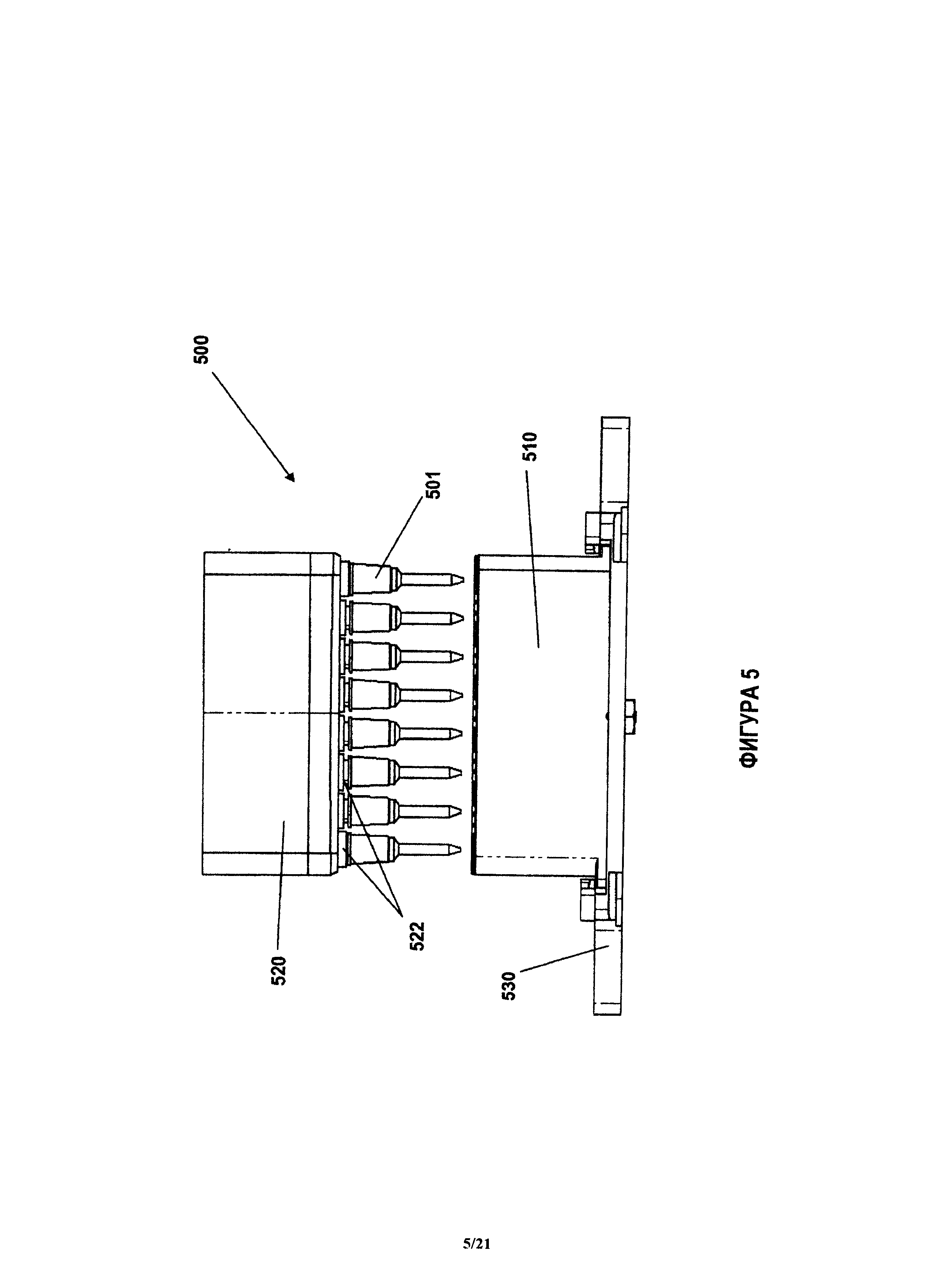
На фиг.5 показан пример системы, которая содержит устройство в соответствии с настоящим изобретением и устройство для переноса флюида.
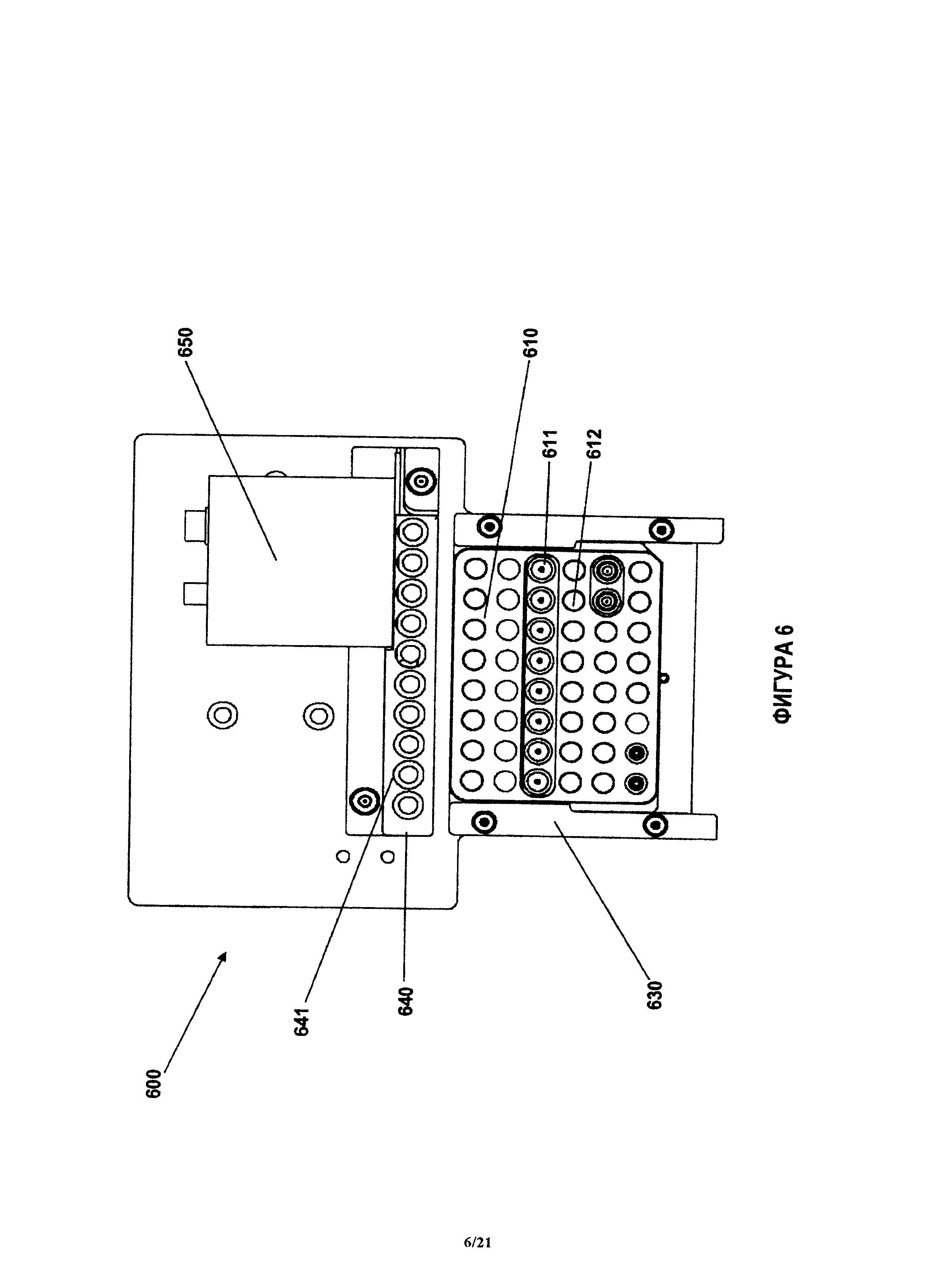
На фиг.6 показана примерная система в соответствии с настоящим изобретением, которая содержит блок нагрева для регулировки температуры и устройство обнаружения.
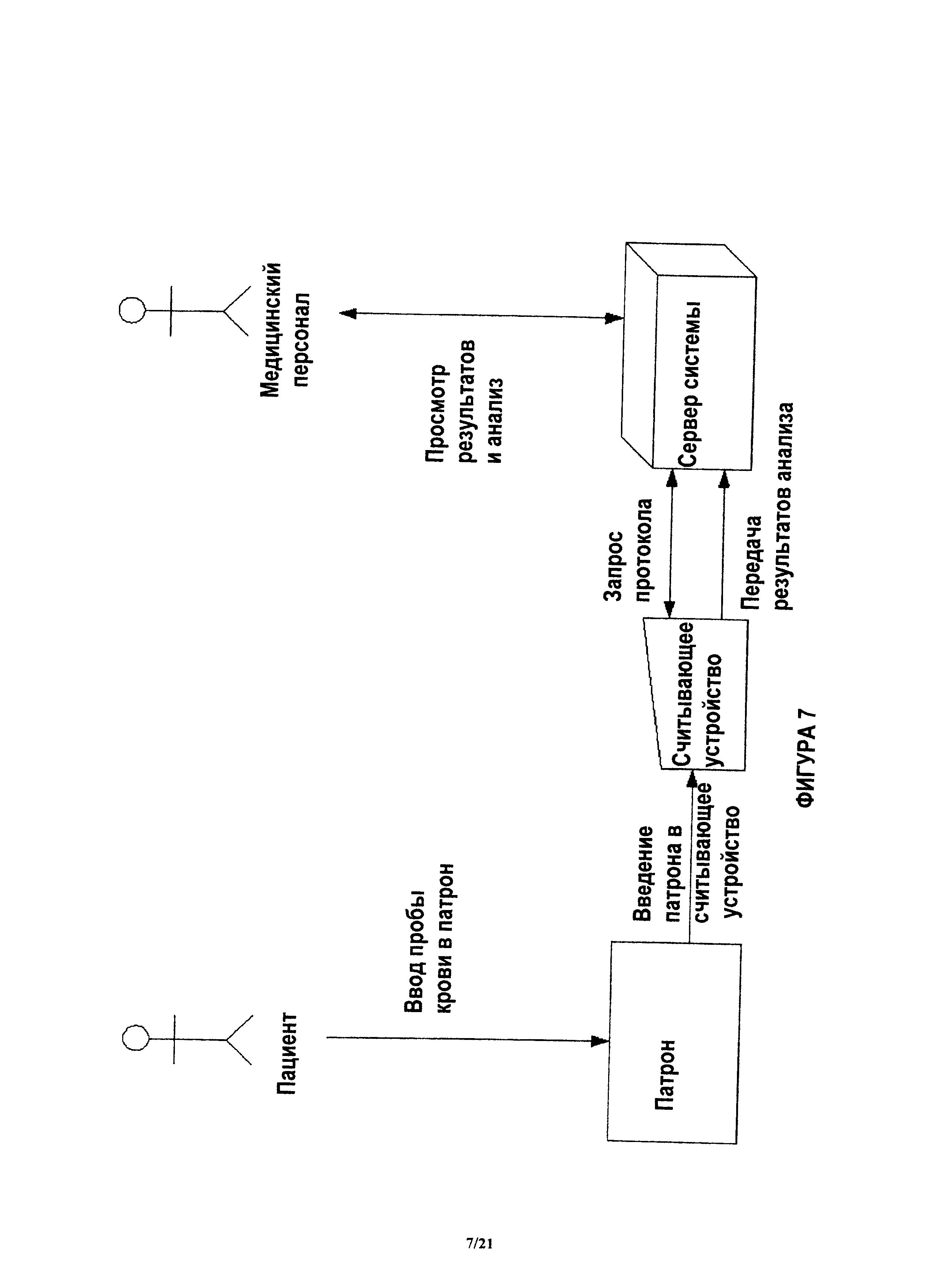
На фиг.7 показана примерная система, в которой пациент вводит кровь в устройство, после чего устройство вставляют в считывающее устройство.
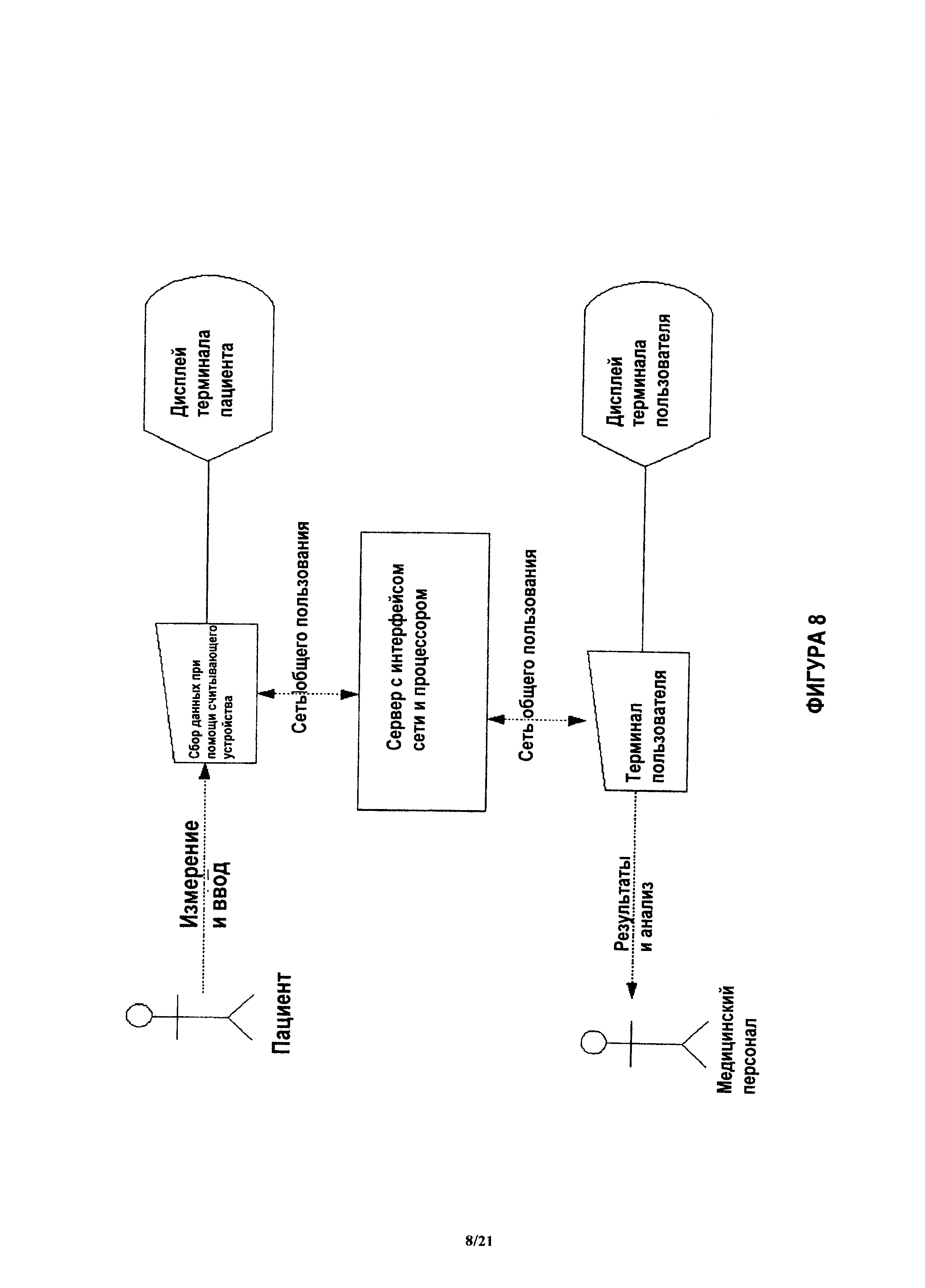
На фиг.8 показана блок-схема системы для оценки медицинского состояния пациента.
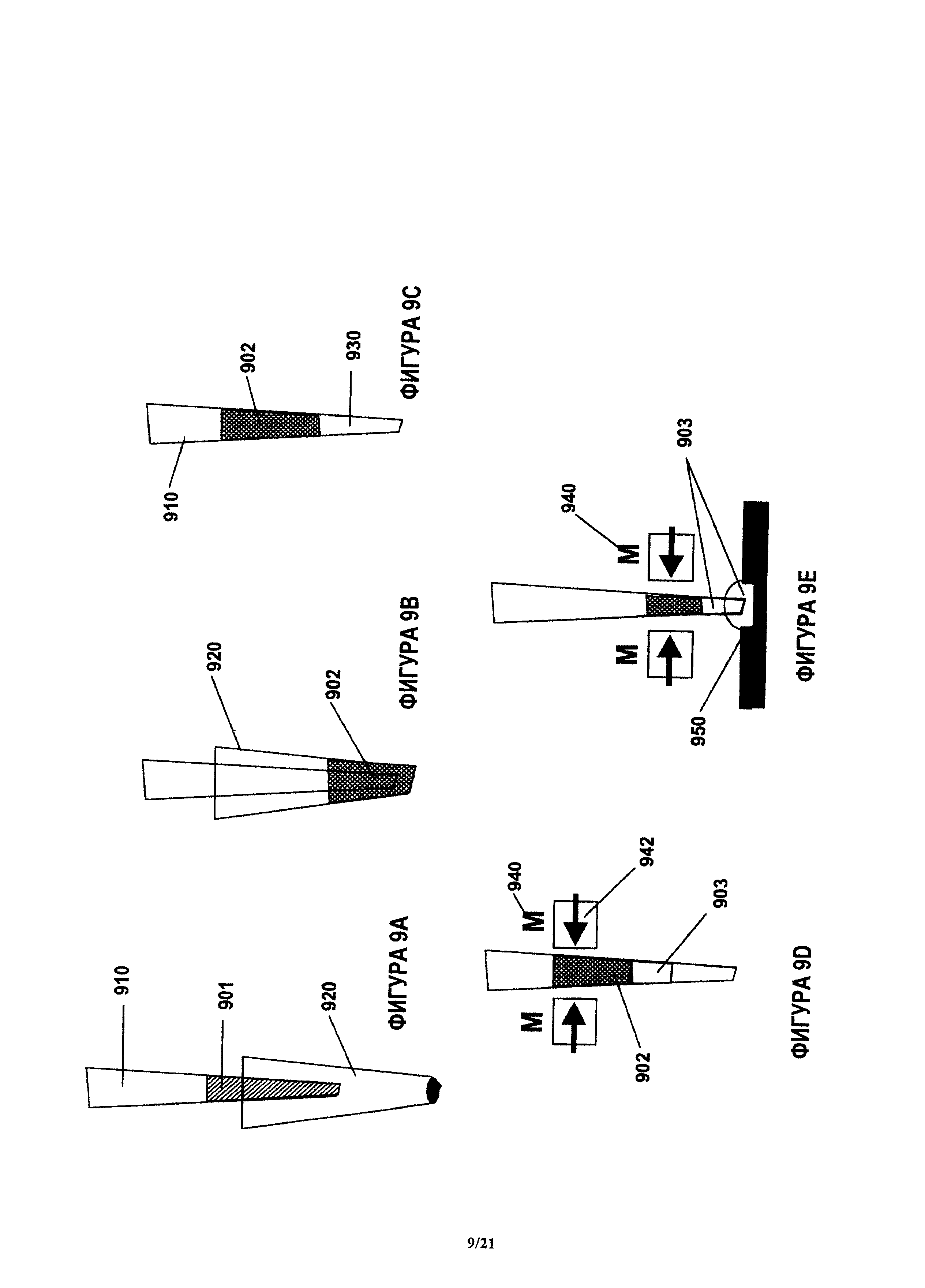
На фиг.9А-9Е показан пример способа разделения плазмы крови, в котором пробу цельной крови всасывают в наконечник для отбора пробы и магнитный реагент перемешивают с пробой и образуют суспензию, после чего прикладывают магнитное поле к смеси пробы цельной крови и магнитного реагента. Затем отделенную от крови плазму распределяют в лунках устройства.
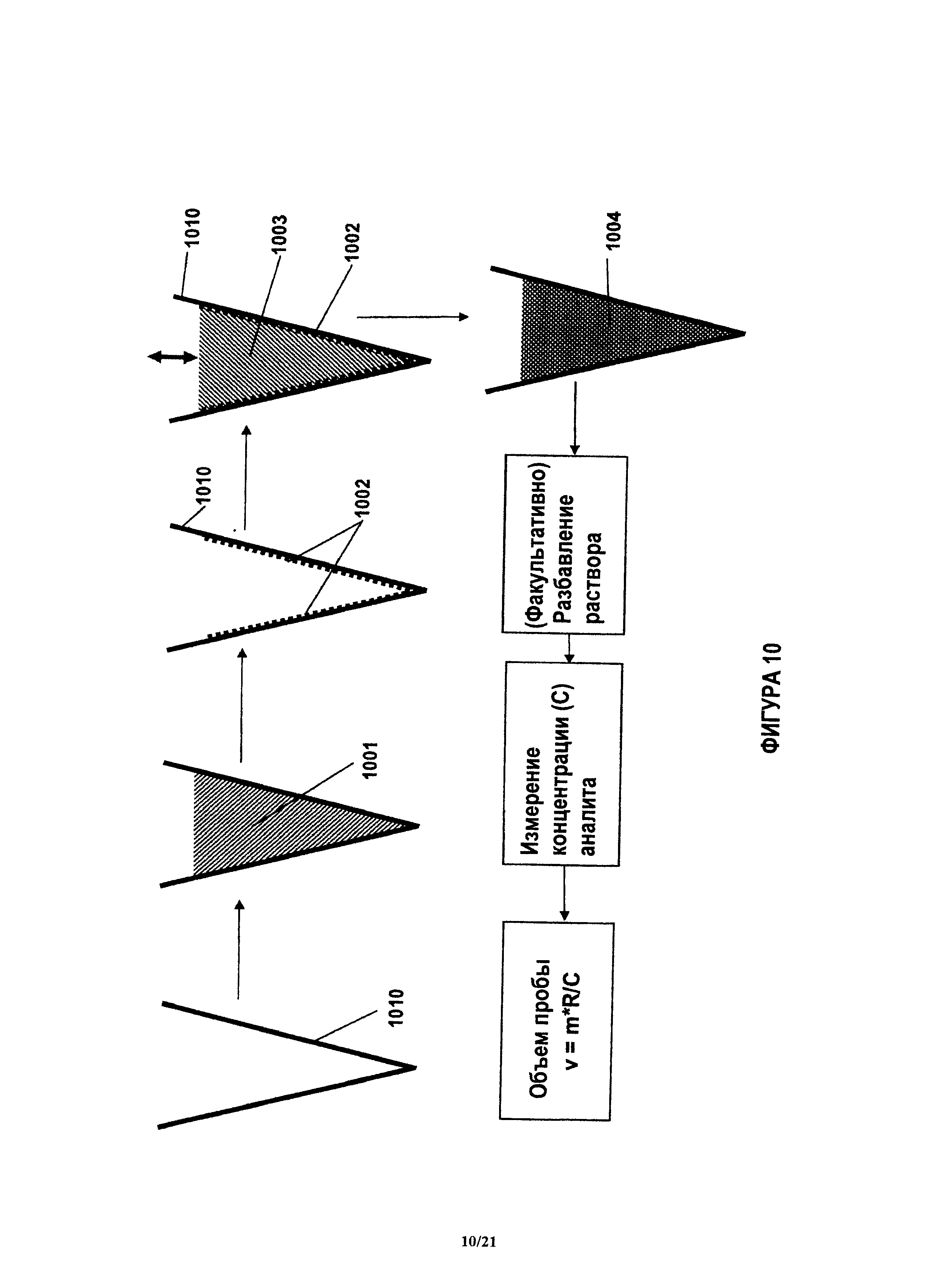
На фиг.10 показан примерный способ проведения контрольного количественного анализа, в котором используют известное количество контрольного аналита.
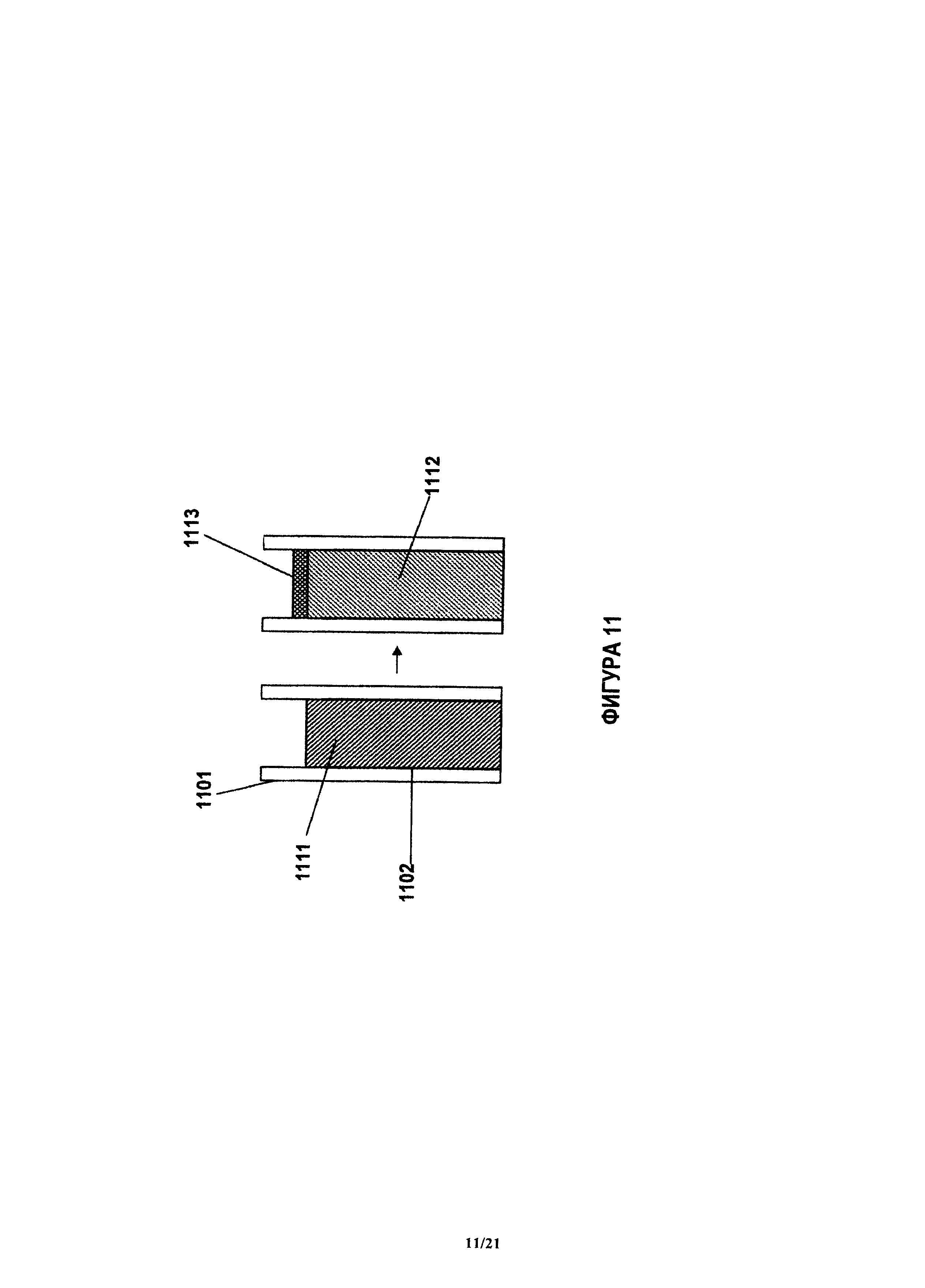
На фиг.11 показана тонкая пленка, например, пленка загрязнения, внутри наконечника, когда выталкивают одну жидкость и всасывают другую жидкость.
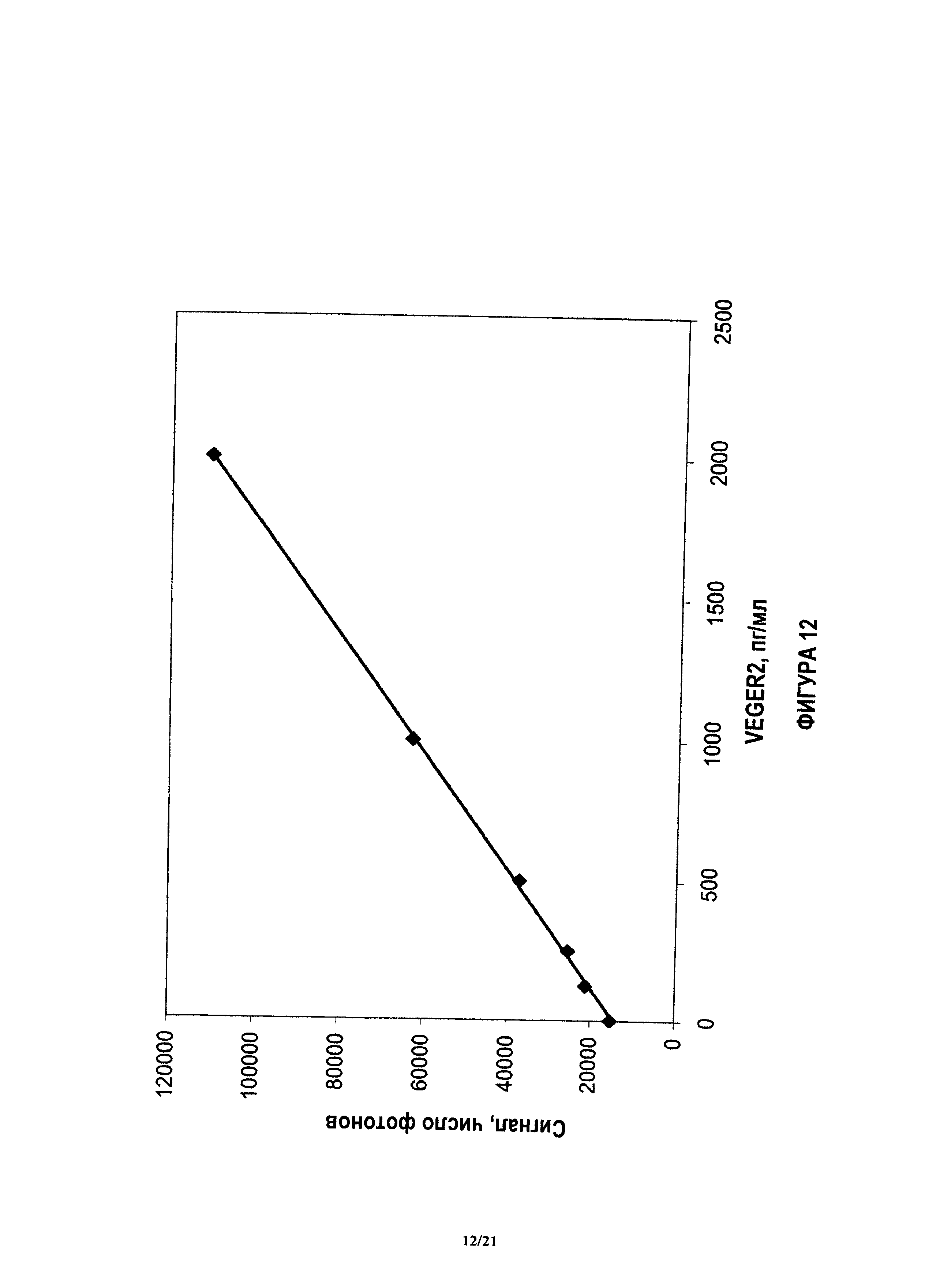
На фиг.12 показана градуировочная кривая, коррелирующая блок анализа и блок реагента для проведения количественного анализа для VEGFR2.
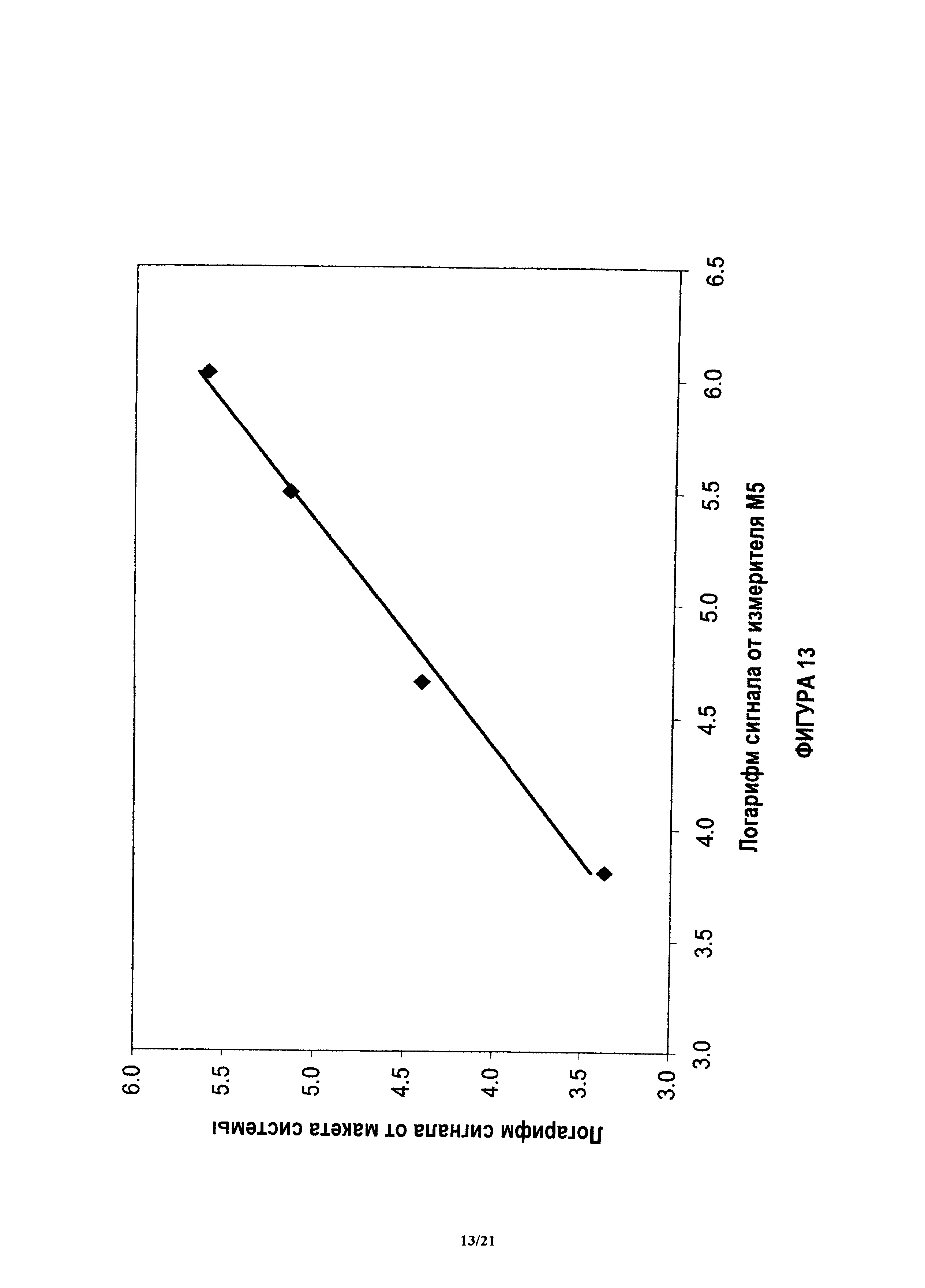
На фиг.13 показана градуировочная кривая, коррелирующая результаты блока анализа и блока реагента для проведения количественного анализа для P1GF в системе, когда измерение проводят с использованием люминометра.
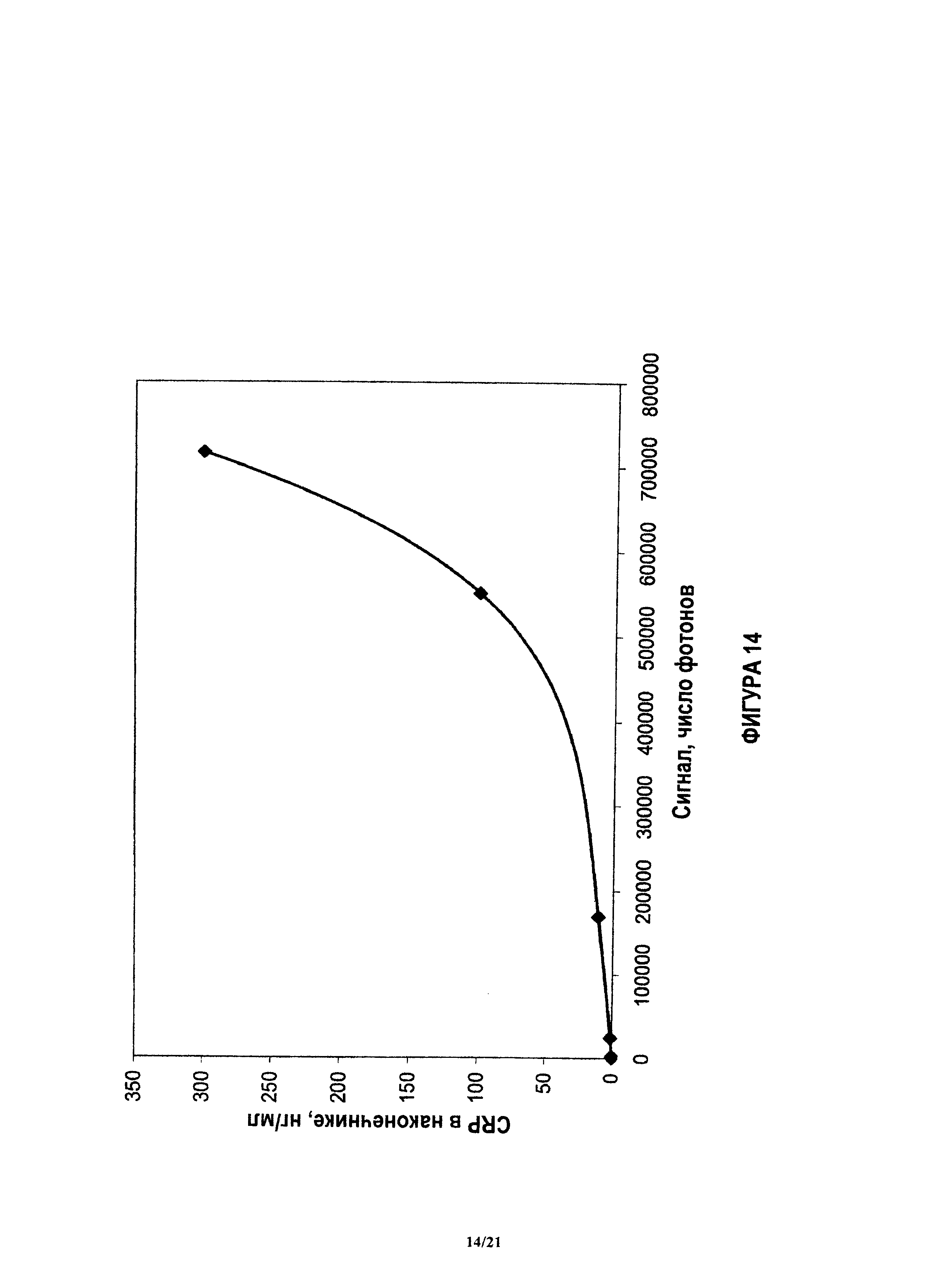
На фиг.14 показана концентрация CRP в функции сигнала количественного анализа (числа фотонов), причем данные подогнаны под пятичленную полиномиальную функцию, чтобы генерировать функцию калибровки.
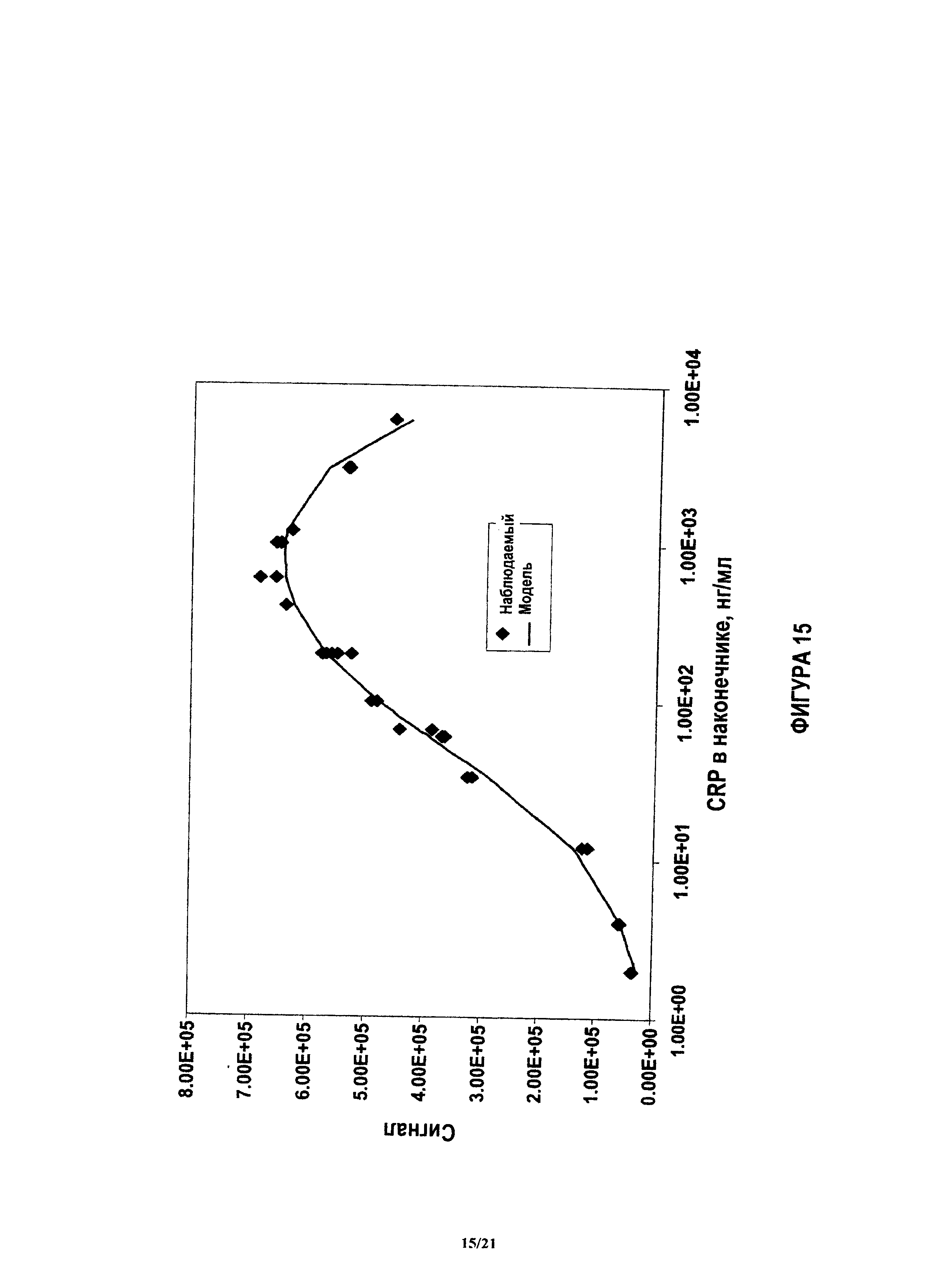
На фиг.15 показано достигнутое соответствие между моделью и величинами описанных здесь параметров Smax, C0.5 и D.
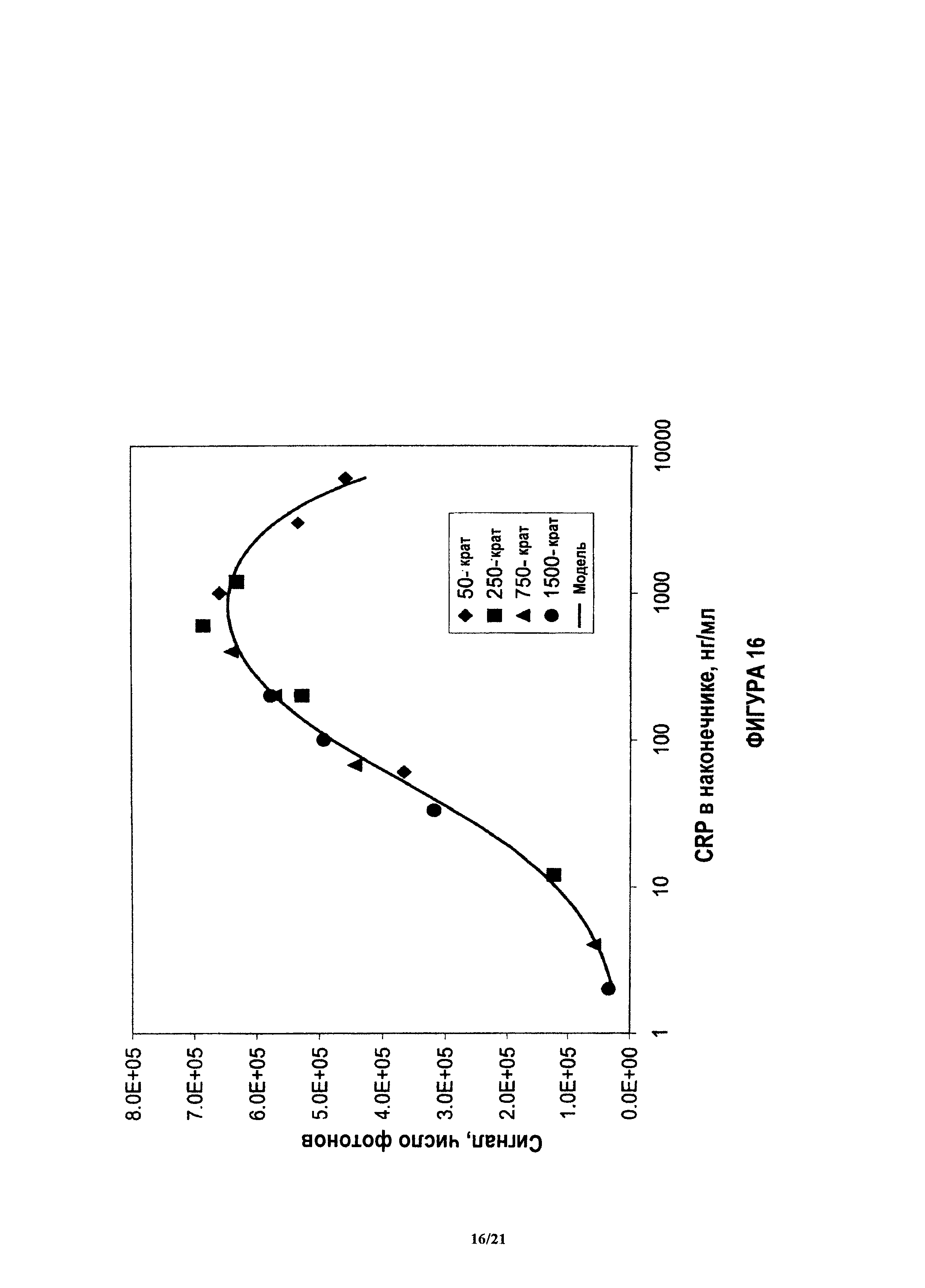
На фиг.16 показаны данные после разбавления, использованного для достижения финальной концентрации в наконечнике для количественного анализа.
На фиг.17 показан нормализованный отклик количественного анализа (В/Вmах) в функции логарифма нормализованной концентрации (С/С0.5), для следующих относительных разбавлений: 1:1 (сплошная линия), 5:1 (штриховая линия) и 25:1 (пунктирная линия).
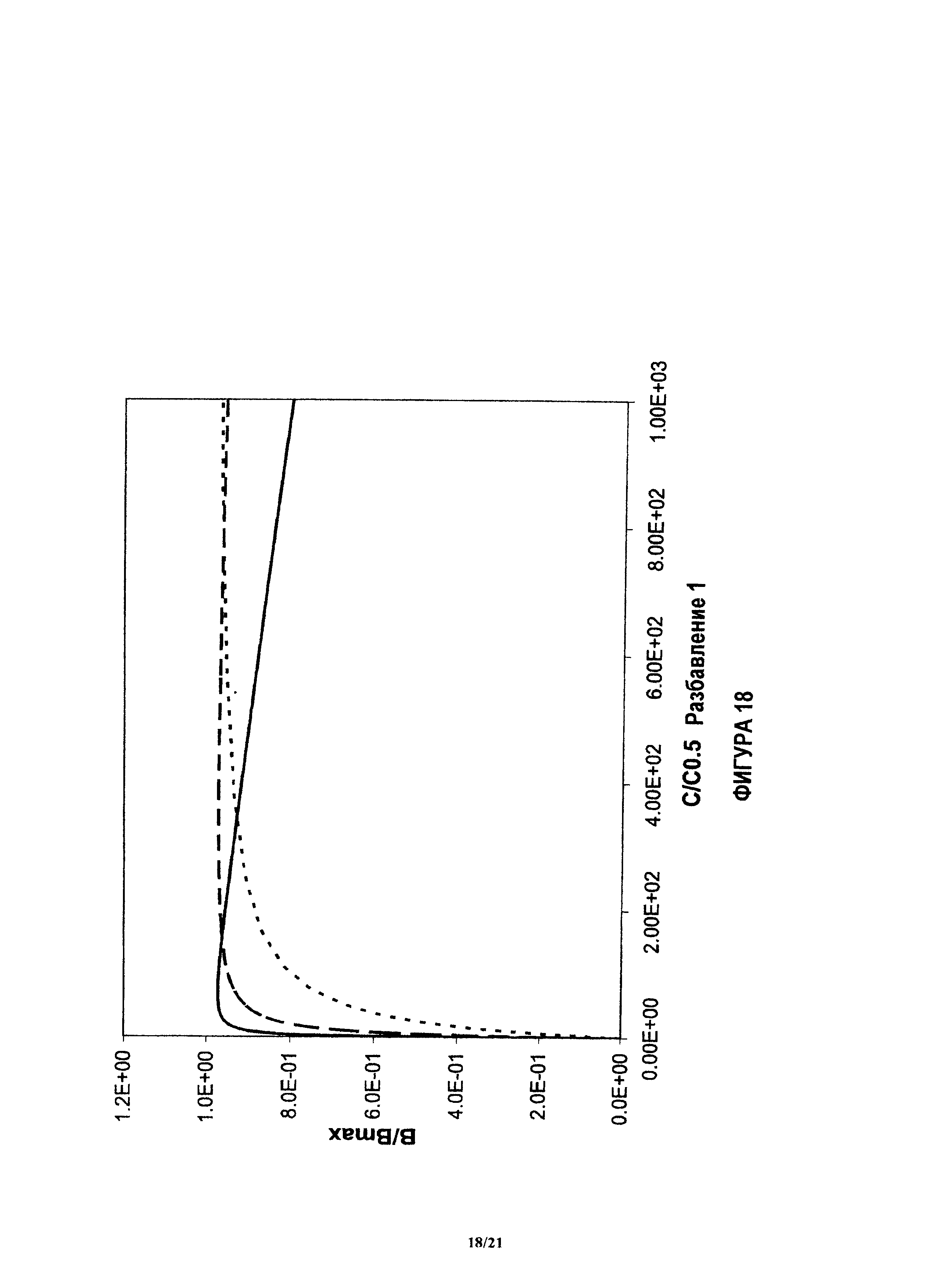
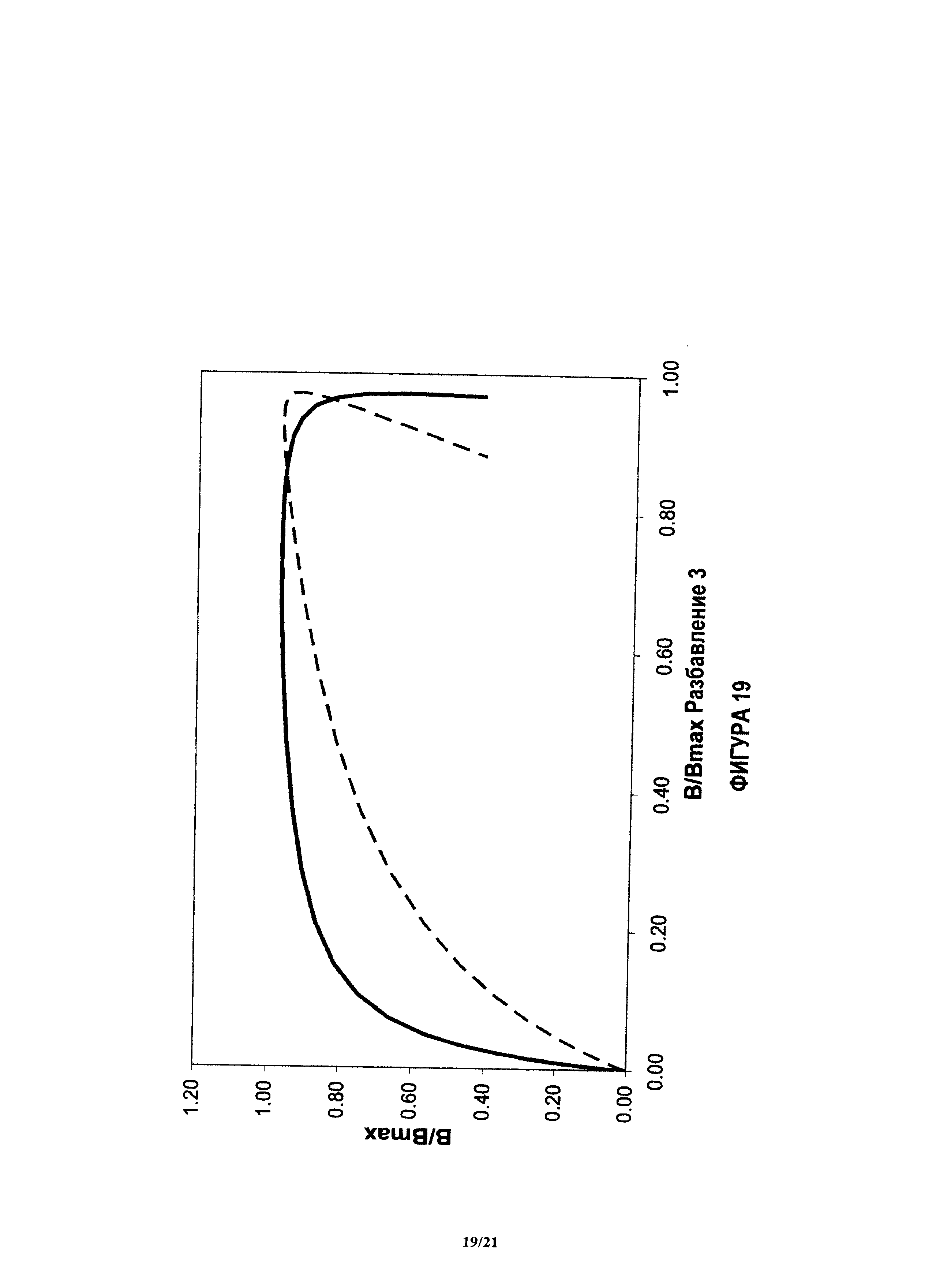
На фиг.18 и 19 показан пример, аналогичный показанному на фиг.17, при других нормализованных концентрациях.
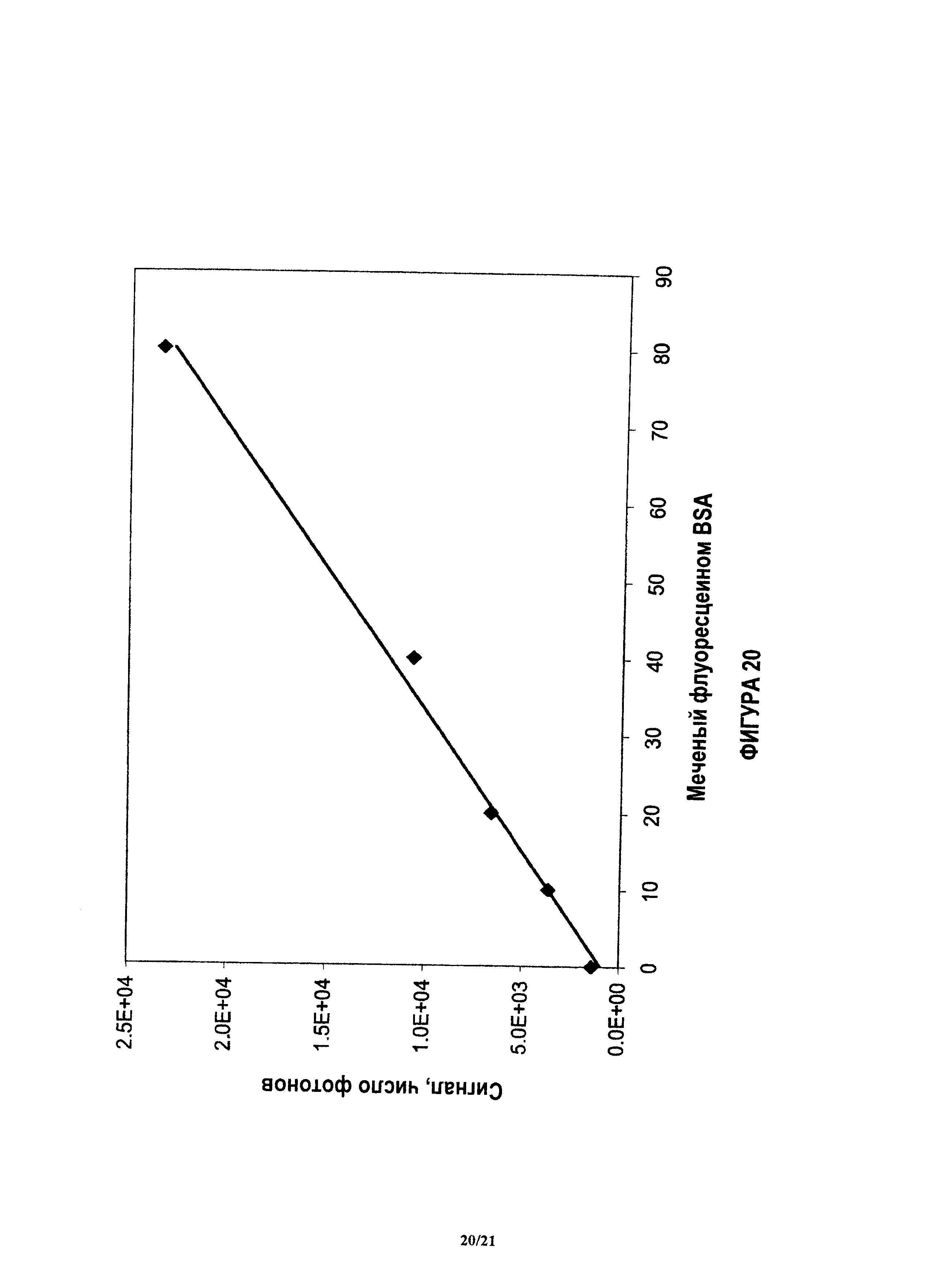
На фиг.20 показан отклик количественного анализа для контрольного аналита, после проведения следующих операций: удаление антитела обнаружения, промывка анализа и добавление субстрата, при считывании с использованием спектролюминометра в течение 0.5 сек.
На фиг.21 показаны результаты анализа, полученные при помощи подсчета фотонов в течение ориентировочно 10 сек в предложенной системе.
Подробное описание изобретения
Описанные здесь варианты и аспекты настоящего изобретения относятся к устройствам, системам и способам автоматического обнаружения аналита в пробе телесной жидкости. Настоящее изобретение позволяет производить обнаружение и/или определение количества аналитов, которые связаны со специфическими биологическими процессами, физиологическими состояниями, расстройствами (нарушениями) или стадиями расстройств, или с воздействиями биологических или лечебных средств. Описанные здесь варианты и примеры настоящего изобретения не предназначены для ограничения объема патентных притязаний настоящего изобретения.
Устройства
В соответствии с первым аспектом настоящего изобретения, предлагается устройство для автоматического обнаружения аналита в пробе телесной жидкости, которое содержит матрицу адресуемых блоков анализа, сконфигурированную для проведения химической реакции, которая дает различимый сигнал, несущий информацию о наличии или отсутствии аналита, и матрицу адресуемых блоков реагентов, в которой обращаются к индивидуальному адресуемому блоку реагента матрицы, соответствующему одному или нескольким адресуемым блокам анализа в указанном устройстве, так что индивидуальные блоки реагентов могут быть откалиброваны по опорному сигналу соответствующего блока (блоков) анализа, ранее сборки матриц на (в) устройстве.
В соответствии с другим аспектом настоящего изобретения, предлагается устройство для автоматического обнаружения аналита в пробе телесной жидкости, которое содержит матрицу блоков анализа, сконфигурированную для проведения химической реакции, которая дает различимый сигнал, несущий информацию о наличии аналита, и матрицу блоков реагентов, содержащих реагенты для проведения химической реакции, причем по меньшей мере один из блоков анализа и по меньшей мере один из блоков реагентов выполнены с возможностью перемещения друг относительно друга внутри устройства, так что реагенты для проведения химической реакции автоматически вводятся в контакт с пробой телесной жидкости в блоке анализа.
В одном варианте устройства в соответствии с настоящим изобретением, обращение к матрице блоков анализа или блоков реагентов производят в соответствии с химической реакцией, проводимой при помощи сконфигурированного блока анализа. В другом варианте, по меньшей мере один из блоков анализа и по меньшей мере один из блоков реагентов выполнены с возможностью перемещения друг относительно друга внутри устройства, так что реагенты для проведения химической реакции автоматически вводятся в контакт с пробой телесной жидкости в блоке анализа.
В одном варианте, устройство в соответствии с настоящим изобретением является автономным и содержит все реагенты, в том числе реагенты в жидкой и твердой фазах, необходимые для проведения множества количественных анализов в параллель. По желанию, устройство может быть сконфигурировано для проведения по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 100, 200, 500, 1000 или больше анализов. По желанию, один или несколько контрольных количественных анализов также могут быть выполнены в устройстве в параллель.
Количественными анализами могут быть количественные иммунологические анализы, которые могут быть проведены в течение короткого промежутка времени. Другой тип количественного анализа, который может быть осуществлен в устройстве в соответствии с настоящим изобретением, включает в себя (но без ограничения) измерения последовательностей (последовательностей нуклеотидов) нуклеиновых кислот и измерения метаболитов, таких как холестерин. В соответствии с некоторыми вариантами, количественный анализ завершают в течение времени не более одного часа, а преимущественно меньше чем за 30, 15, 10 или 5 минут. В соответствии с другими вариантами, количественный анализ проводят в течение времени меньше чем 5 минут. Длительность количественного анализа можно регулировать в зависимости от типа количественного анализа, который следует проводить в устройстве в соответствии с настоящим изобретением. Например, если необходима более высокая чувствительность, количественный анализ может быть проведен в течение времени более одного часа или более одного дня. В некоторых примерах, количественные анализы, которые требуют длительного времени, являются более практичными для проведения в других РОС применениях, таких как в домашних условиях, чем в клинических РОС применениях.
Любые телесные жидкости, в которых предположительно содержится представляющий интерес аналит, могут быть подвергнуты анализу в системе или в устройствах в соответствии с настоящим изобретением. Обычно используемые телесные жидкости включают в себя (но без ограничения) кровь, сыворотку крови, слюну, мочу, гастрические и дигестионные флюиды, слезы, кал, сперму, вагинальную жидкость, интерстициальные жидкости, полученные из опухолевой ткани, и цереброспинальную жидкость.
Телесные жидкости могут быть отобраны у пациента и введены в устройство при помощи различных средств, в том числе (но без ограничения) при помощи трубки, инъекции или пипетки. Использованные здесь термины субъект и пациент являются взаимозаменяемыми, которые используют для обозначения позвоночного животного, а преимущественно млекопитающего, а предпочтительнее, для обозначения человека. Млекопитающие включают в себя (но без ограничения) мышей или крыс, обезьян, человека, скотину, спортивных и домашних животных. В одном варианте, ланцет прокалывает кожу и отбирает пробу с использованием, например, силы тяжести, капиллярного действия, всасывания или вакуума. Ланцет может быть частью устройства или частью системы, или отдельным компонентом. При необходимости, ланцет может быть приведен в действие при помощи различных механических, электрических, электромеханических или любых других известных механизмов приведения в действие, или любой их комбинации. В другом варианте, никакой активный механизм не требуется, так как сам пациент может вводить телесную жидкость в устройство, например, когда вводят пробу слюны. Набранный флюид может быть помещен в блок отбора пробы внутри устройства. В соответствии с еще одним вариантом, устройство содержит по меньшей мере одну микроиглу для прокола кожи.
Объем телесной жидкости, который используют в устройстве, обычно составляет ориентировочно меньше чем 500 мкл, типично ориентировочно от 1 до 100 мкл. По желанию, пробы от 1 до 50 мкл, от 1 до 40 мкл, от 1 до 30 мкл, от 1 до 10 мкл или даже от 1 до 3 мкл могут быть использованы для обнаружения аналита с использованием устройства.
В одном варианте, объем телесной жидкости, использованный для обнаружения аналита в заявленных устройствах или системах, представляет собой одну каплю жидкости. Например, одна капля крови из уколотого пальца может образовать пробу телесной жидкости, анализ которой проводят при помощи описанных здесь устройства, системы или способа.
Проба телесной жидкости может быть отобрана у субъекта и введена в устройство в соответствии с настоящим изобретением так, как это описано далее более подробно.
В одном варианте, матрицы блоков анализа и блоков реагентов сконфигурированы в виде набора компонентов, полученных за счет смешения и подгонки (mix-and-match). Блоки анализа могут иметь по меньшей мере одну поверхность захвата, позволяющую вступать в реакцию с аналитом из пробы телесной жидкости. Блоком анализа может быть трубчатый наконечник с поверхностью захвата внутри наконечника. Далее описаны более подробно примеры наконечников в соответствии с настоящим изобретением. Блок реагента типично хранит жидкие или твердые реагенты, необходимые для проведения количественного анализа, позволяющего обнаружить данный аналит. Каждый индивидуальный блок количественного анализа и блок реагента может быть сконфигурирован для независимого проведения операции количественного анализа. Для сборки устройства, блоки собирают с использованием оперативной поставки узлов, для использования в объединенных патронах.
Могут быть изготовлены отдельные компоненты, как в жидкой, так и в твердой фазе, после чего проверяют их характеристики и направляют на хранение. В одном варианте, сборку устройства проводят по запросу в месте изготовления. Устройство может быть модульным и может содержать такие компоненты, как корпус, который является общим для всех количественных анализов, блоки анализа, такие как наконечники, и блоки реагентов, такие как различные хрупкие или действующие при помощи инструмента (instrument operable) контейнеры, которые капсулируют (содержат) жидкие реагенты. В некоторых случаях, собранное устройство затем подвергают испытаниям для проверки калибровки (зависимости отклика системы от уровней известного аналита). Устройства (блоки) анализа могут быть собраны по запросу из библиотеки предварительно изготовленных и калиброванных элементов. В соответствии с некоторыми вариантами, флюидные проходы внутри устройства могут быть простыми и исключающими любую возможность захвата пузырьков, а также обеспечивающими эффективную промывку избытка меченых реагентов при проведении количественных анализов с избытком реагентов, таких как анализы ELISA.
Корпус для устройства в соответствии с настоящим изобретением может быть изготовлен из полистирола или другого формуемого или подвергаемого механической обработке пластика, и может иметь заданные местоположения для размещения блоков анализа и блоков реагентов. В одном варианте, корпус имеет средство для осушения (blotting) наконечников или блоков анализа, чтобы удалять избыток жидкости. Средством для осушения может быть пористая мембрана, например, из ацетата целлюлозы, или кусок впитывающего материала, такого как фильтровальная бумага.
В соответствии с некоторыми вариантами, по меньшей мере один из компонентов устройства может быть изготовлен из полимерного материала. В качестве не ограничительных примеров полимерных материалов можно привести полистирол, поликарбонат, полипропилен, полидиметоксисилоксаны (PDMS), полиуретан, поливинилхлорид (ПВХ), полисульфон, полиметилметакрилат (РММА), сополимер акрилонитрила, бутадиена и стирола (ABS), и стекло.
Устройство или субкомпоненты устройства могут быть изготовлены при помощи различных способов, в том числе (но без ограничения) при помощи штамповки, литьевого формования, выдавливания (embossing), литья, формования раздувом, механической обработки, сварки, ультразвуковой сварки и термической сварки. В одном варианте, устройство изготавливают при помощи литьевого формования, термической сварки и ультразвуковой сварки. Субкомпоненты устройства могут быть прикреплены друг к другу при помощи термической сварки, ультразвуковой сварки, фрикционной пригонки (пригонки под давлением), при помощи адгезивов или, в случае некоторых подложек, например, из стекла, или из полужестких и нежестких полимерных подложек, за счет естественного сцепления между двумя компонентами.
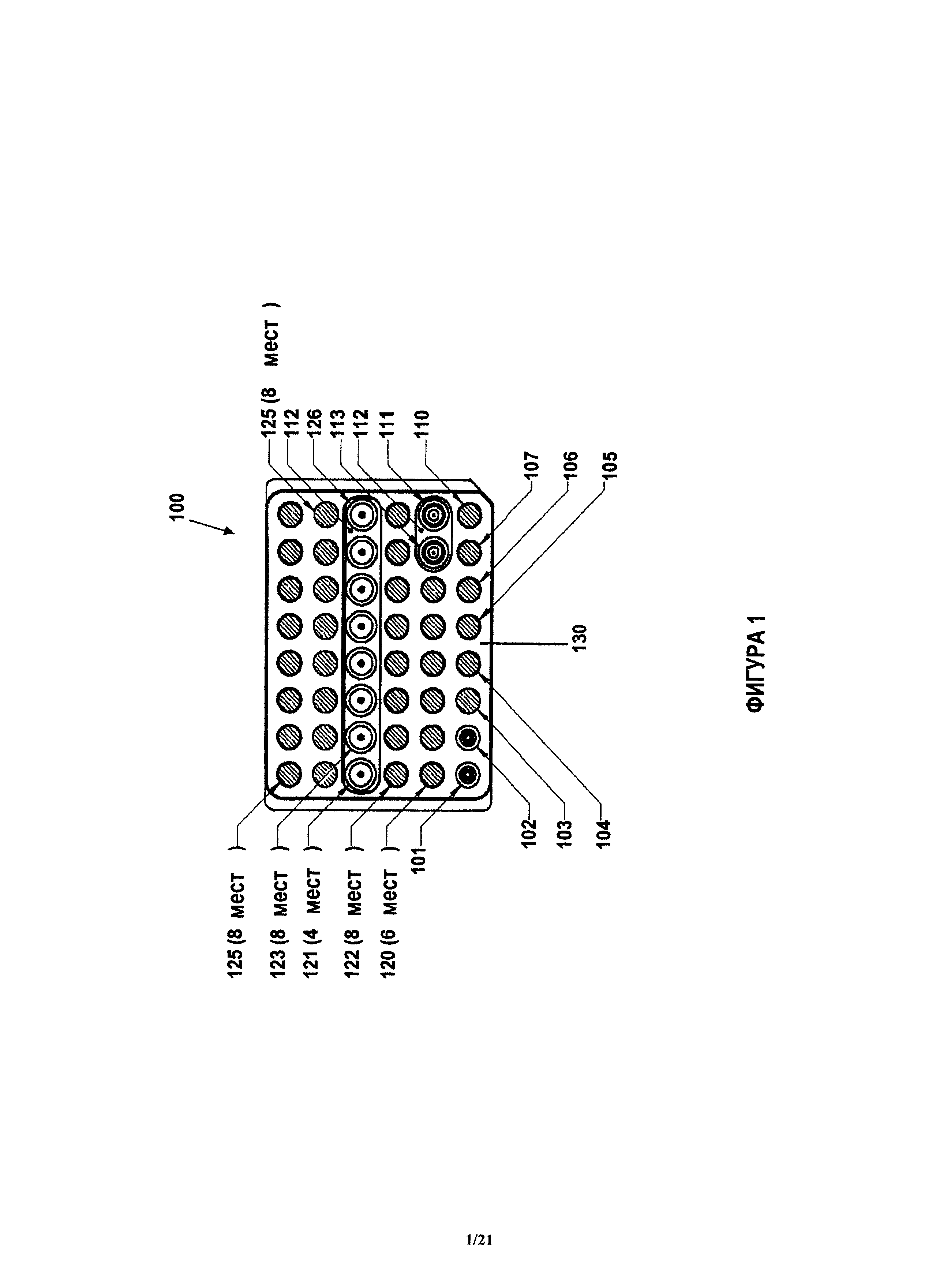
Примерное устройство, такое как описанное здесь, показано на фиг.1. Устройство 100 также иногда называют здесь патроном 100. Устройство 100 содержит корпус 130 с местоположениями для размещения блоков 121 анализа и блоков 103, 122, 124, 125 реагентов. В примерном варианте, показанном на фиг.1, блоки 121 анализа занимают центральный ряд корпуса 130 устройства 100. Блоки 121 анализа при необходимости могут содержать по меньшей мере один блок 126 калибровки. В соответствии с одним из примеров, блоки 121 анализа аналогичны наконечникам пипеток и могут быть названы наконечниками 121 для количественного анализа, а блоки 126 калибровки могут быть названы наконечниками 126 калибровки, однако следует иметь в виду, что блоки 121 анализа могут иметь любую форму и размеры, позволяющие ввести их в описанное здесь устройство 100. Блоки 121 анализа и блоки 126 калибровки представляют собой примерные блоки 121 анализа и описаны далее более подробно. Блоки 121 анализа, показанные на фиг.1, могут иметь поверхность захвата и позволяют, например, проводить химическую реакцию, например, необходимую для осуществления количественных анализов нуклеиновой кислоты и иммунологических анализов. Блоки 121 анализа могут быть собраны в корпусе в соответствии с инструкциями пользователя или в соответствии с количественными анализами, которые пользователь желает провести на пробе.
Как это показано на фиг.1, корпус 100 устройства может иметь блок 110 отбора пробы, сконфигурированный с возможностью содержания пробы. Проба, такая как проба крови, может быть размещена в блоке 110 отбора пробы. Наконечник 111 отбора пробы (например, наконечник пипетки, который соединен с устройством для переноса флюида, как это описано далее более подробно) может занимать другой участок корпуса 130. При проведении количественного анализа, наконечник 111 отбора пробы может распределять пробу в блоки предварительной обработки реагентов или блоки 103, 104, 105, 106, 107 предварительной обработки, или в блоки 121 анализа. Примерные блоки 103, 104, 105, 106, 107 предварительной обработки содержат (но без ограничения): блоки 107 перемешивания, блоки 103, 104 разбавления, и, если проба представляет собой пробу крови, блоки 105, 106 отбора плазмы крови. Блоки 103, 104, 105, 106, 107 предварительной обработки могут быть блоками одного типа или блоками разных типов. Специалисты легко поймут, что другие блоки 103, 104, 105, 106, 107 предварительной обработки, необходимые для проведения химической реакции, также могут быть встроены в устройство 100. Блоки 103, 104, 105, 106, 107 могут содержать различные количества реагентов или разбавителей, необходимые для проведения количественного анализа в данном патроне 100.
Блоки 121 анализа часто могут быть изготовлены отдельно от корпуса 130 и затем вставлены в корпус 130 при помощи способов захвата и установки (pick-and-place). Блоки 121 анализа могут быть плотно вставлены в корпус 130 или могут быть свободно вставлены в корпус 130. В соответствии с некоторыми вариантами, корпус 130 изготовлен так, что он плотно удерживает блоки 103, 122, 124, 125 реагентов и/или блоки 121 анализа на месте, например, во время отгрузки или перемещения патрона. Блоки 103, 122, 124, 125 реагентов, показанные на фиг.1, содержат конъюгированный реагент 122 (например, для использования при иммунологическом анализе), промывочный реагент 125 (например, для промывки указанного конъюгата с поверхностей захвата) и субстрат 124 (например, субстрат фермента). Далее описаны другие варианты устройства 100 и компонентов в соответствии с одним из примеров на фиг.1. Блоки 103, 122, 124, 125 реагентов могут быть изготовлены и заполнены (реагентами) отдельно от корпуса 130 и затем размещены в корпусе 130. За счет этого, патрон 100 может быть выполнен модульным, что повышает гибкость использования патрона 100 для проведения различных количественных анализов. Реагенты в блоке 103, 122, 124, 125 реагента могут быть выбраны в соответствии с проводимым количественным анализом. Далее описаны более подробно примерные реагенты и количественные анализы.
Устройство, такое как показанное на фиг.1, также может иметь другие характеристики, необходимые для проведения химической реакции. Например, если блоки 121 анализа представляют собой описанные здесь наконечники 121 для количественного анализа, тогда устройство может содержать осушающие подушки (touch-off pads) 112 для удаления избытка пробы или реагента с наконечника 121 для количественного анализа или с наконечника 111 отбора пробы после переноса флюида, например, при помощи описанной здесь системы. Корпус 130 также может иметь блоки или области 101, 102 внутри устройства 100 для размещения использованного наконечника или блока, например, чтобы избежать перекрестного загрязнения наконечника 111 отбора пробы или блока 121 анализа. На фиг.1 показано устройство 100, которое содержит наконечник 111 отбора пробы, предназначенный для перемещения пробы между блоками устройства 100. Устройство 100, показанное на фиг.1, также содержит наконечник 113 предварительной обработки, предназначенный для перемещения пробы, которая была предварительно обработана в одном блоке устройства 100, в другие блоки устройства 100, для проведения химической реакции. Например, наконечник 111 отбора пробы может быть использован для отбора пробы крови из блока 110 отбора пробы и для перемещения пробы крови в блоки 103, 104, 105, 106, 107 предварительной обработки, как уже было указано здесь выше. Эритроциты могут быть удалены из пробы крови в блоках 103, 104, 105, 106, 107 предварительной обработки и наконечник 113 предварительной обработки затем может быть использован для сбора плазмы крови из блоков 103, 104, 105, 106, 107 предварительной обработки и переноса плазмы крови в другой блок 103, 104, 105, 106, 107 предварительной обработки (например, в блок разбавления) и/или по меньшей мере в один блок 121 анализа. В одном варианте, наконечник 111 отбора пробы представляет собой блок 110 отбора пробы. В другом варианте, блок 110 отбора пробы аналогичен лунке и может быть сконфигурирован для хранения пробы, полученной пользователем.
Блоки 121 анализа и блоки 103, 122, 124, 125 реагентов, показанные на фиг.1, могут иметь доступный адрес, чтобы указать местоположение блоков на патроне 100. Например, одна колонка патрона 100, как это показано на фиг.1, может содержать блок 121 анализа, предназначенный для проведения количественного анализа, сконфигурированного для обнаружения С-химически активного протеина, а другие колонки могут содержать соответствующие блоки 103, 122, 124, 125 реагентов для проведения количественного анализа в указанной ранее колонке, причем указанные блоки выполнены с возможностью обращения друг к другу. Например, адреса могут быть введены при помощи компьютерной системы и могут храниться в ней, а патрон 100 может иметь соответствующую этикетку, такую как штрихкод. После сканирования штрихкода патрона 100, компьютер может посылать адреса блоков в заявленную здесь систему, чтобы перемещать флюиды и проводить реакцию в соответствии с адресами, введенными в компьютер. Адреса могут быть частью протокола, управляющего работой системы. Адреса могут иметь любую конфигурацию и могут быть изменены, если необходимо изменить протокол проведения количественного анализа или операции использования патрона, что обычно невозможно в известных ранее РОС устройствах. В соответствии с некоторыми вариантами, блоки в корпусе 130 образуют матрицу 6 на 8 блоков, как это показано на фиг.1. Формат расположения блоков может быть любым, например, это могут быть прямоугольные матрицы или случайные схемы расположения. Патрон 100 может иметь любое число блоков, например, ориентировочно от 1 до 500. В соответствии с некоторыми вариантами, патрон 100 имеет 5-100 блоков. В примере, показанном на фиг.1, патрон 100 имеет 48 блоков.
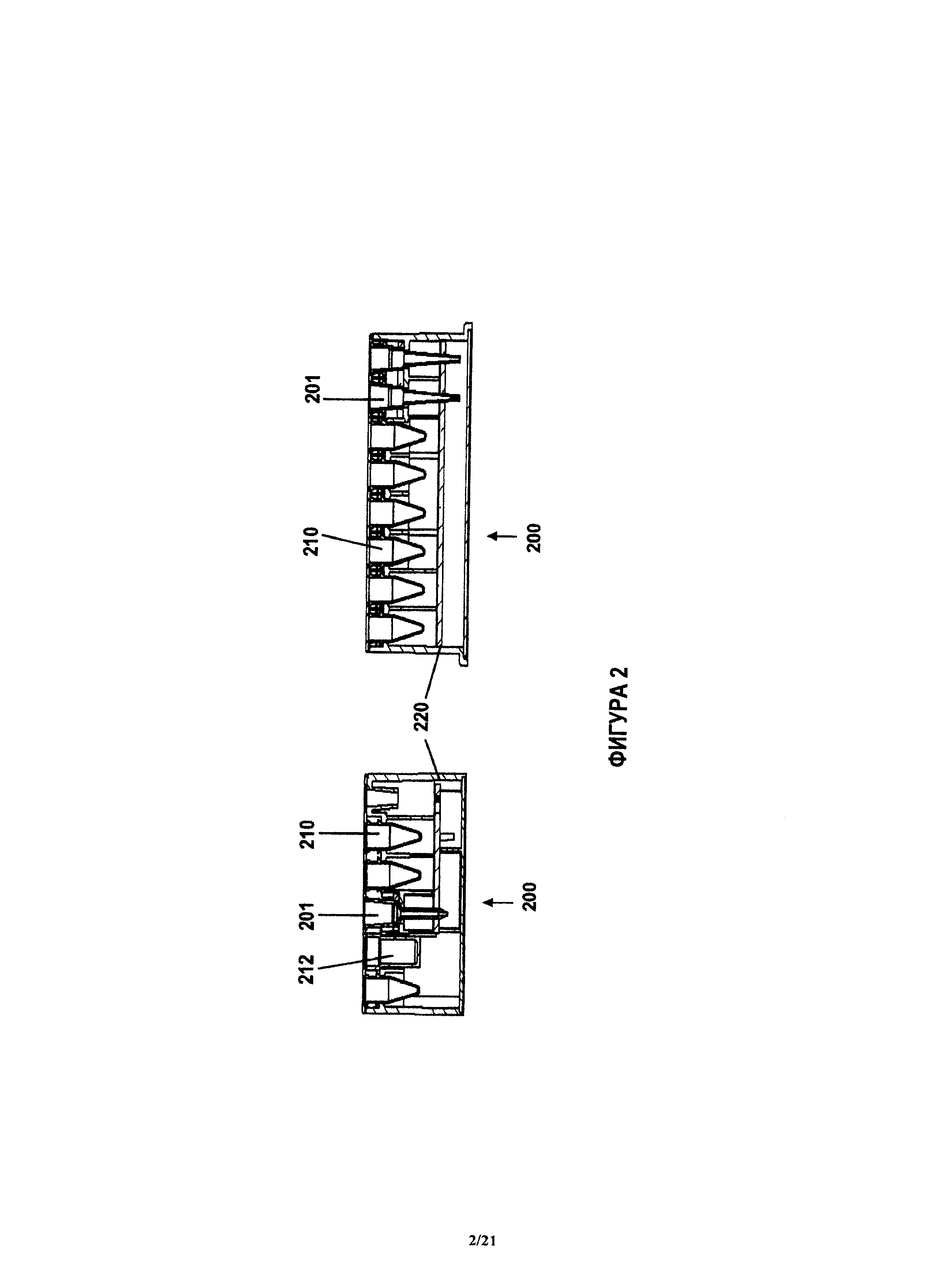
На фиг.2А и 2В показано срезанное с двух сторон примерное устройство, показанное на фиг.1. В корпусе 220 устройства может быть образована полость для размещения блоков 201 анализа (например, наконечников для количественного анализа) в вертикальной ориентации (при горизонтальном корпусе), с бобышками, обращенными вверх в устройстве 200. Как это показано на фиг.2, также может быть образована полость для размещения блока 210, 212 реагента или блока отбора пробы или наконечника 202. Корпус 220 может быть выполнен так, чтобы точно захватывать блоки и прочно их удерживать. Эти характеристики также относятся к механизму для перемещения наконечников, который производи захват и установку (drop-off, сброс) наконечника. В другом варианте, блок отбора пробы содержит сгибаемый или отламываемый элемент, который служит для защиты небольшой сборной трубки при отгрузке и для удержания плунжера внутри капилляра. Также на фиг.2А показаны два примерных варианта заявленных блоков 210, 212 реагентов. Основание корпуса 220 может быть выполнено с возможностью сбора жидких отходов, например, промывочных реагентов после их использования, когда они стекают в основание через отверстие в корпусе 220. Корпус 220 может иметь гигроскопическую прокладку для сбора жидких отходов. Блоки анализа 201 и блоки 202 отбора проб могут быть пропущены через полость корпуса 220 устройства 200 и могут выступать за внутреннюю опорную конструкцию. Блоки 210, 212 реагентов плотно входят в корпус, как это показано на фиг.2, и не выступают за внутреннюю опорную конструкцию. Корпус 220 и зоны, в которых установлены и удерживаются блоки 201 анализа и блоки 210, 212 реагентов, могут иметь различную конфигурацию.
В соответствии с некоторыми вариантами, каждый наконечник служит для проведения единственного количественного анализа и может быть спарен с надлежащим реагентом или может соответствовать надлежащему реагенту, который требуется для проведения заданного количественного анализа. Некоторые наконечники предназначены для контрольных блоков анализа и имеют известные количества аналита на их поверхностях захвата, нанесенные в процессе изготовления наконечников или при проведении количественного анализа. В случае контрольного блока анализа, этот блок сконфигурирован для проведения контрольного количественного анализа, который проводят для сравнения. Контрольный блок анализа может иметь, например, поверхность захвата и аналит в жидком или твердом состоянии.
Во многих случаях, устройство содержит все реагенты и жидкости, которые требуются для проведения количественного анализа. Например, для проведения люминогенного (luminogenic) количественного анализа ELISA, реагенты внутри устройства могут содержать разбавитель пробы, средство обнаружения конъюгата (например, три меченых ферментом антитела), промывочный раствор и субстрат фермента. При необходимости могут быть введены дополнительные реагенты.
В соответствии с некоторыми вариантами, реагенты могут быть введены в устройство для предварительной обработки пробы. В качестве примеров реагентов для предварительной обработки можно привести (но без ограничения) реагенты лизиса лейкоцитов, реагенты для освобождения аналитов от связующих материалов в пробе, ферменты и детергенты. Реагенты для предварительной обработки также могут быть добавлены в разбавитель, который содержится внутри устройства.
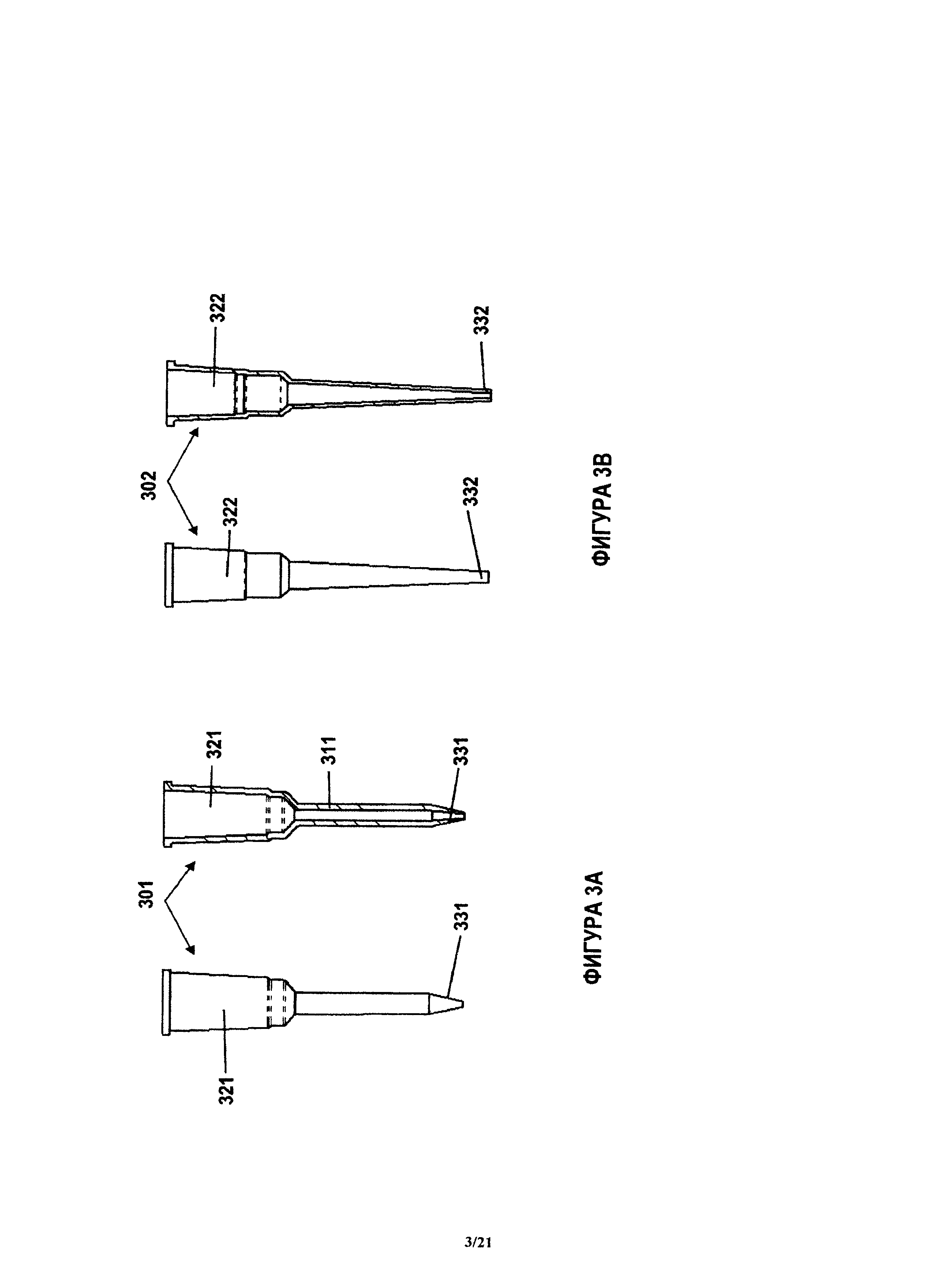
Индивидуальный блок реагента может быть сконфигурирован для приема подвижного блока анализа. В соответствии с некоторыми вариантами, индивидуальный блок анализа представляет собой полый цилиндрический элемент с открытым концом, который содержит поверхность захвата и реакционную кювету. Цилиндрический блок анализа также может быть назван наконечником для количественного анализа. В соответствии с некоторыми вариантами, индивидуальный блок анализа сконфигурирован для проведения иммунологического анализа. Блок 301 анализа, который содержит небольшой наконечник или трубку, показан на фиг.3А. В некоторых случаях, наконечник 301 сконфигурирован так, что он имеет внутреннюю цилиндрическую поверхность 311 захвата и бобышку 321, выполненную с возможностью входа в зацепление с корпусом устройства. В некоторых случаях, бобышка 321 и наконечник 301 сконфигурированы с возможностью входа в зацепление с механизмом перемещения наконечника 301, таким как описанная здесь система или, например, устройство для переноса флюида. Наконечник 301 для количественного анализа, показанный на фиг.3А, может иметь отверстие 331 на нижнем конце. Это отверстие 331 может быть использовано для переноса флюидов или реагентов в блок анализа и от него. В одном варианте, описанный здесь блок 301 анализа аналогичен наконечнику пипетки, однако блок 301 анализа дополнительно содержит поверхность 311 захвата, сконфигурированную для обнаружения аналита в пробе.
Наконечник 301 может быть изготовлен при помощи процесса литьевого формования. В одном варианте, наконечник 301 изготовлен из прозрачного полистирола, который обычно используют в хемилюминесцентных количественных анализах. Как это показано на фиг.3А, примерный наконечник 301 содержит бобышку (показанную как более широкая верхняя часть наконечника 301), которая выполнена с возможностью входа в зацепление с корпусом и может, например, входить в зацепление с коническими элементами устройства для переноса флюида и/или с пипетками, с образованием герметичного уплотнения. Кроме того, как это показано на фиг.3А, примерный наконечник 301 имеет небольшую цилиндрическую часть. Во многих случаях, поверхность захвата находится внутри этой небольшой цилиндрической части. Однако поверхность захвата может также находиться в любом другом месте внутри наконечника 301 или снаружи от наконечника 301. Поверхность наконечника 301 может иметь любую геометрическую форму, в том числе (но без ограничения) трубчатую, кубическую или пирамидальную. В основанных на хемилюминесценции и флуоресценции количественных анализах, наконечник 301 является удобным средством для введения продукта количественного анализа в оптический тракт устройства.
На фиг.3В показан примерный блок 302 отбора пробы, который содержит наконечник 302 отбора пробы. Показанный на фиг.3В наконечник 302 отбора пробы также может быть выполнен отдельно от блока 302 отбора пробы и может быть использован для переноса пробы от блока отбора пробы в другие блоки заявленного устройства. Показанный на фиг.3В наконечник 302 отбора пробы содержит бобышку 322, позволяющую соединять наконечник 302 с корпусом заявленного устройства и с устройством для переноса флюида. Наконечник 302 отбора пробы также имеет отверстие 332, позволяющее вводить флюиды или пробы в наконечник отбора пробы и выводить их из него. В соответствии с некоторыми вариантами, наконечник 302 отбора пробы имеет такую же форму, что и наконечник 301 для количественного анализа. В других вариантах (таких как показанные на фиг.3А и 3В), наконечник 302 отбора пробы имеет другую форму, чем наконечник 301 для количественного анализа.
В одном варианте, одной из функций наконечника является введение в контакт проб и жидких реагентов с поверхностью захвата блока анализа. Перемещение может быть осуществлено при помощи различных средств, в том числе (но без ограничения) при помощи капиллярного действия, всасывания и контролируемого нагнетания насосом. Небольшой размер наконечников позволяет быстро регулировать температуру, необходимую для проведения химической реакции. Теплоперенос и/или поддержание температуры могут быть осуществлены просто за счет помещения наконечника в блок регулировки температуры.
В соответствии с некоторыми вариантами, наконечник может содержать ориентировочно от 1 до 40 мкл флюида. В соответствии с другими вариантами, наконечник может содержать ориентировочно от 5 до 25 мкл флюида. В одном варианте, наконечник содержит 20 мкл флюида. В некоторых случаях, наконечник может содержать 1 мкл флюида или меньше. В соответствии с другими вариантами, наконечник может содержать до 100 мкл флюида.
При необходимости, кончик наконечника может быть осушен за счет контакта с поглощающим материалом (например, встроенным в одноразовый патрон), ранее введения следующего компонента количественного анализа, чтобы избежать загрязнения небольшим количеством пробы и/или реагента. За счет физических сил, любая жидкость, втянутая в данный наконечник, может удерживаться в любом желательном месте, с минимальным риском вытекания жидкости, даже при удержании наконечника в вертикальном положении.
Блок анализа (например, наконечник для количественного анализа) может быть покрыт до его использования реагентами захвата, с использованием таких же средств, что и при проведении количественного анализа (например, при помощи регулируемого капиллярного или механического всасывания).
Поверхность захвата (также называемая здесь местом реакции) может быть образована за счет связывающего антитела или других реагентов захвата, связанных ковалентно или за счет поглощения с блоком анализа. Поверхность затем может быть осушена и может поддерживаться в сухом состоянии, до момента использования в количественном анализе. В одном варианте, имеется место реакции для каждого измеряемого аналита.
В одном варианте, блок анализа может быть перемещен для введения во флюидную связь с блоком реагента и/или с блоком отбора пробы, таким образом, что реагент или проба могут взаимодействовать с местом реакции, где связанные пробы позволяют обнаруживать представляющий интерес аналит в пробе телесной жидкости. Место реакции позволяет затем создать сигнал, несущий информацию о наличии или концентрации представляющего интерес аналита, который затем может быть обнаружен при помощи описанного здесь устройства обнаружения.
В соответствии с некоторыми вариантами, местоположение и конфигурация места реакции являются важными элементами в устройстве для количественного анализа. Большинство, если не все, одноразовые устройства для иммунологического анализа выполнены так, что их поверхность захвата является неотъемлемой частью устройства.
В одном варианте, формованный пластмассовый блок анализа может быть закуплен или может быть изготовлен при помощи литьевого формования, с точными размерами и формой. Например, он может иметь диаметр 0.05-3 мм и длину от 3 до 30 мм. Блоки могут быть покрыты реагентами захвата с использованием способа. аналогичного тому, который используют для покрытия титрационных микропланшетов, но с тем преимуществом, что может быть проведена их обработка навалом, в большом резервуаре, путем введения покрывающих реагентов и обработки с использованием сит, держателей и т.п., чтобы извлекать детали и при необходимости их промывать.
Блок анализа образует жесткую опору, на которой может быть фиксирован реагент. Блок анализа также имеет соответствующие характеристики взаимодействия со светом. Например, блок анализа может быть изготовлен из такого материала, как специальное (functionalized) стекло, Si, Ge, GaAs, GaP, SiO2, SiN4, модифицированный кремний, или любой материал из широкого разнообразия гелей или полимеров, такой как (поли)тетрафторэтилен, (поли)винилидендифторид, полистирол, поликарбонат, полипропилен, РММА, ABS, или их комбинации. В одном варианте, блок анализа содержит полистирол. В соответствии с настоящим изобретением могут быть использованы и другие подходящие материалы. Прозрачное место реакции является предпочтительным. Кроме того, в том случае, когда имеется оптически пропускающее окно, которое позволяет свету доходить до фотоприемника, тогда поверхность преимущественно может быть светонепроницаемой и/или преимущественно рассеивающей свет.
Реагентом, фиксированным на поверхности захвата, может быть любой реагент, полезный для обнаружения представляющего интерес аналита в пробе телесной жидкости. Например, такие реагенты включают в себя (но без ограничения) пробы нуклеиновой кислоты, антитела, рецепторы клеточной мембраны, моноклоновые антитела и антисыворотки, химически активные относительно специфического аналита. Могут быть использованы различные покупные реагенты, такие как содержащие поликлоновые и моноклоновые антитела реагенты, специально разработанные для специфических аналитов.
Специалисты легко поймут, что имеются различные возможности фиксации (иммобилизации) различных реагентов на опоре, где протекает реакция. Иммобилизация может быть ковалентной или не ковалентной, за счет доли линкера, или за счет их привязки к иммобилизованной доле. В качестве не ограничительных примеров связывающих компонентов для прикрепления нуклеиновых кислот или протеиновых молекул, таких как антитела, к твердой опоре, можно привести, среди прочего, связи за счет стрептавидина или авидина/ биотина, карбаматные связи, эфирные, амидные, тиолэфирные связи, связи за счет (N)-функциональной тиомочевины, связи за счет функционального малеимида, аминные, дисульфидные, амидные и гидразоновые связи. Кроме того, доля сиолила может быть прикреплена к нуклеиновой кислоте, для прямого прикрепления к подложке, такой как стекло, с использованием известных способов. Поверхность иммобилизации также может быть получена с использованием фала (tether) роли-L лизина, который обеспечивает связь заряд-заряд с поверхностью.
Блоки анализа могут быть высушены после последней операции встраивания (введения) поверхности захвата. Например, сушка может быть осуществлена за счет пассивной выдержки в сухой атмосфере или за счет использования вакуумного коллектора, и/или за счет пропускания чистого сухого воздуха через коллектор.
Во многих случаях, блок анализа спроектирован так, что могут быть использованы массовые процессы изготовления с высокой производительностью. Например, наконечники могут быть установлены в больших матрицах для массового нанесения покрытия на поверхности захвата в или на наконечниках. В другом примере, наконечники могут быть размещены на ленточном конвейере или карусели для серийной обработки. В еще одном примере, большая матрица наконечников для упрощения обработки может быть соединена с вакуумным коллектором и/или с находящимся под давлением коллектором.
В одном варианте, блок анализа может быть оперативно связан с устройством для переноса флюида. Устройство для переноса флюида может работать с автоматическим управлением, без вмешательства человека. В случае блоков анализа, которые содержат наконечники, контроль установленной высоты одноразового наконечника основан на коническом прикреплении с натягом наконечника к распределителю жидкости. Устройство для переноса флюида может входить в зацепление с наконечником. В некоторых случаях, глубина погружения наконечника в переносимую жидкость должна быть известна, чтобы свести к минимуму контакт с внешней стороной наконечника, который может быть неконтролируемым. Для того, чтобы соединять или сцеплять наконечник с устройством для переноса флюида, в основании конического соединителя может быть отформован твердый упор, который входит в зацепление с соплом распределителя. Воздухонепроницаемое уплотнение может быть образовано за счет уплотнительного кольца, которое расположено на половине высоты конуса или на плоском основании сопла. За счет разделения функции уплотнения наконечника от контролируемой высоты наконечника, можно раздельно производить их регулировку. Модульное заявленное устройство и устройство для переноса флюида позволяют производить множество количественных анализов в параллель.
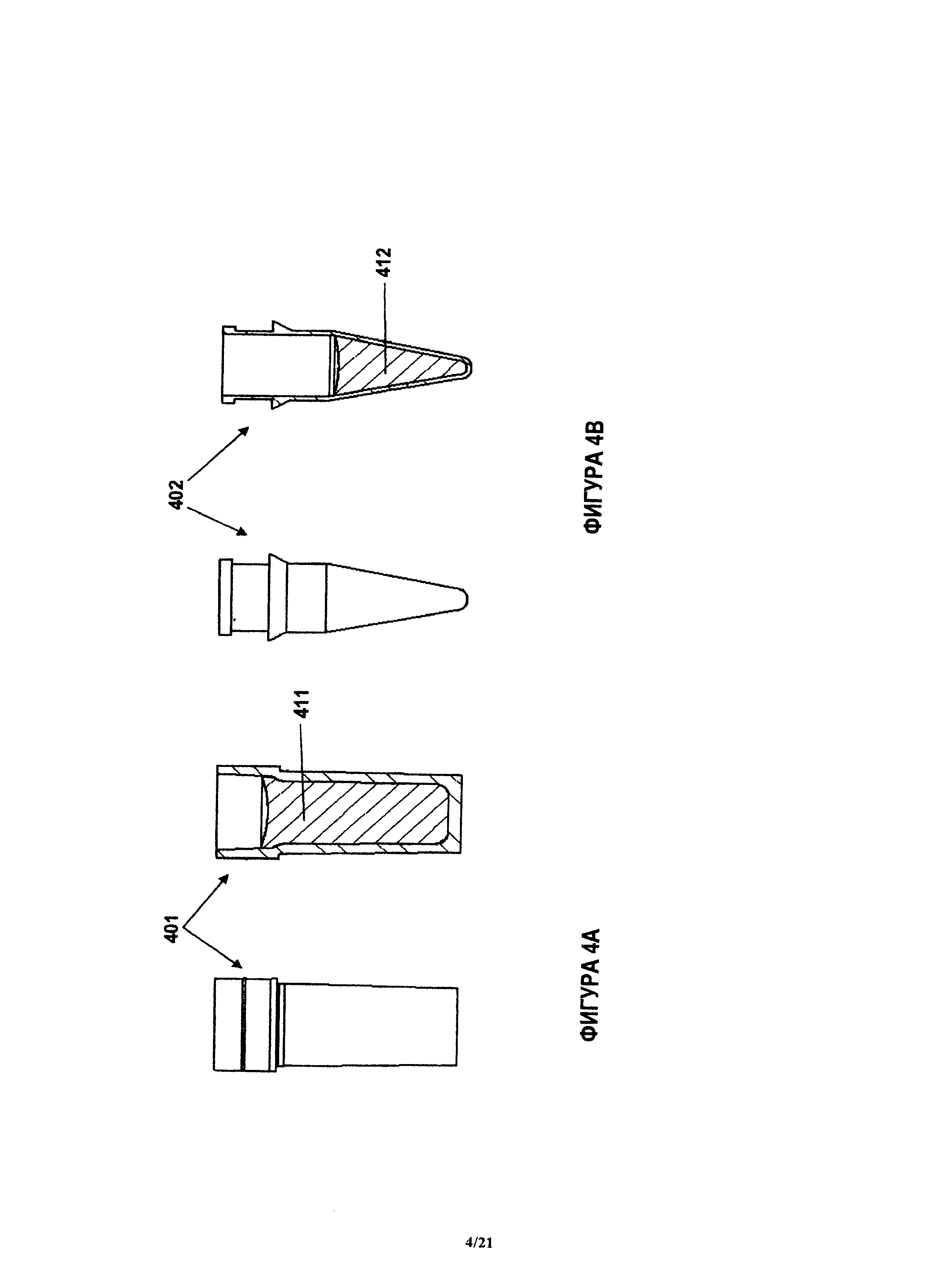
Блоки реагентов устройства могут хранить реагенты, которые требуются для проведения данной химической реакции, чтобы обнаружить данный представляющий интерес аналит. Жидкие реагенты могут разливаться в небольшие капсулы, которые могут быть изготовлены из различных материалов, в том числе (но без ограничения) из пластмасс, таких как полистирол, полиэтилен или полипропилен. В соответствии с некоторыми вариантами, блоки реагентов содержат цилиндрические стаканы. Два примера блока 401, 402 реагента, который содержит стаканы, показаны на фиг.4А и 4В. При необходимости, блоки 401,402 могут плотно входить в полости в корпусе устройства. Блоки 401, 402 могут быть герметизированы на открытой поверхности. чтобы избежать разбрызгивания реагентов 411, 412 внутри устройства. В соответствии с некоторыми вариантами, стакан уплотняют с использованием алюминированного пластика при помощи термической сварки. Блок может иметь любую форму, позволяющую хранить реагент. Например, на фиг.4А показан блок реагента 401 цилиндрической формы, который может хранить жидкий реагент 411. Показанный на фиг.4В блок реагента 402 другой формы также позволяет хранить жидкий реагент 412. Оба примерных блока 401, 402 реагентов при необходимости могут иметь небольшие модификации поблизости от верхней поверхности, позволяющие плотно вводить блоки 401, 402 в корпус устройства, как уже было указано здесь выше.
В соответствии с различными вариантами осуществления настоящего изобретения, блоки реагентов являются модульными. Блок реагента спроектирован так, что могут быть использованы массовые процессы изготовления с высокой производительностью. Например, множество блоков реагентов могут быть заполнены и герметизированы одновременно в массовом процессе. Блоки реагентов могут быть заполнены в соответствии с типом количественного анализа или количественных анализов, проводимых при помощи устройства. Например, если один пользователь желает провести иные количественные анализы, чем другой пользователь, то блоки реагентов могут быть изготовлены в соответствии с предпочтениями каждого пользователя, без необходимости изготовления иного всего устройства. В другом примере, блоки реагентов могут быть размещены на ленточном конвейере или карусели для серийной обработки.
В другом варианте, блоки реагентов введены непосредственно в полости в корпусе устройства. В этом варианте, уплотнение может быть сделано в областях корпуса, окружающих блоки.
Реагенты в соответствии с настоящим изобретением включают в себя (но без ограничения) промывочные буферные растворы, субстраты ферментов, буферные растворы для разведения, конъюгаты, меченые ферментом конъюгаты, усилители ДНК, разбавители пробы, промывочные растворы, реагенты для предварительной обработки пробы, в том числе добавки, такие как детергенты, полимеры, хелатные добавки, связывающие альбумин реагенты, ингибиторы фермента, ферменты, антикоагулянты, агглютинирующие агенты эритроцитов, антитела или другие материалы, необходимые для проведения количественного анализа в устройстве. Меченый ферментом конъюгат может быть поликлоновым антителом или моноклоновым антителом, меченым ферментом, что позволяет создать различимый сигнал за счет реакции с соответствующим субстратом. В качестве примеров таких ферментов можно привести (но без ограничения) щелочную фосфатазу и хреновую пероксидазу. В соответствии с некоторыми вариантами, реагенты представляют собой реагенты для иммунологического анализа. Как правило, реагенты, особенно те, которые являются относительно нестабильными при перемешивании с жидкостью, хранят отдельно в заданной области (например, в блоке реагента) внутри устройства.
В соответствии с некоторыми вариантами, блок реагента содержит ориентировочно от 5 мкл до 1 мл жидкости. В соответствии с некоторыми вариантами, блок реагента может содержать ориентировочно 20-200 мкл жидкости. В соответствии с другим вариантом, блок реагента содержит 100 мкл флюида. В одном варианте, блок реагента содержит около 40 мкл флюида. Объем жидкости в блоке реагента может изменяться в зависимости от типа проводимого количественного анализа или от объема имеющейся пробы телесной жидкости. В одном варианте, объемы реагентов не являются заданными, но должны превышать известный минимум. В соответствии с некоторыми вариантами, реагенты хранят в сухом виде и растворяют перед началом проведения количественного анализа в устройстве.
В одном варианте, блоки реагентов могут быть заполнены с использованием сифона, воронки, пипетки, шприца, иглы, или их комбинации. Блоки реагентов могут быть заполнены с использованием канала заполнения и канала вакуумного отсоса. Блоки реагентов могут быть заполнены индивидуально или в массовом процессе изготовления.
В одном варианте, индивидуальный блок реагента содержит другой реагент в качестве средства изоляции реагентов друг от друга. Блоки реагентов также могут содержать промывочный раствор или субстрат. Кроме того, блоки реагентов могут содержать люминогенный субстрат. В другом варианте, внутри блока реагента содержится множество реагентов.
В некоторых случаях, настройка устройства предусматривает проведение предварительной калибровки блоков анализа и блоков реагентов, ранее сборки одноразовых компонентов данного устройства.
Системы
В соответствии с одним аспектом, система в соответствии с настоящим изобретением содержит устройство, содержащее блоки анализа и блоки реагентов которые содержит реагенты (реагенты как в жидкой, так и твердой фазе). В соответствии с некоторыми вариантами, по меньшей мере все устройство, блок анализа, блок реагента или их комбинации являются одноразовыми. В системе в соответствии с настоящим изобретением, обнаружение аналита с использованием устройства проводят при помощи измерителя. В большинстве случаев, измеритель, устройство и способ позволяют получить автоматизированную систему обнаружения. Автоматизированная система обнаружения может быть автоматизирована на основании заданного протокола или протокола, введенного в систему пользователем.
В соответствии с одним аспектом, система для автоматического обнаружения аналита в пробе телесной жидкости содержит устройство или патрон, а также узел обнаружения или устройство обнаружения, для обнаружения различимого сигнала, несущего информацию о наличии или отсутствии аналита.
В одном варианте, пользователь вводит пробу (например, замеренную или не замеренную пробу крови) в устройство и вставляет устройство в измеритель. Все последующие операции являются автоматическими, программируемыми при помощи измерителя (с жестким монтажом), пользователя, дистанционного пользователя или системы, или модификации измерителя, работающего в соответствии с идентификатором (например, со штрихкодом или RFID в устройстве).
В качестве примеров различных функций, которые можно осуществлять с использованием системы в соответствии с настоящим изобретением, можно привести (но без ограничения) разбавление пробы, удаление частей пробы (например, эритроцитов), проведение реакции пробы в блоке анализа, добавку жидких реагентов в пробу и блок анализа, промывку реагентов из пробы и блока анализа, и хранение жидкостей во время использования и после использования устройства. Реагенты могут быть введены внутри устройство в блок реагента или в блок реагента, который вводят в устройство при сборке.
Автоматизированная система позволяет обнаруживать специфический аналит в биологической пробе (например, в пробе крови) за счет количественного анализа со связанным ферментом иммуносорбентом (за счет анализа ELISA). Система поддается мультиплексированию и особенно хорошо подходит для обнаружения представляющего интерес аналита, присутствующего в небольшом объеме пробы цельной крови (например, 20 мкл или меньше). Система также позволяет обнаруживать аналиты при различных разбавлениях единственной пробы, что позволяет при необходимости проверять различные чувствительности на одном и том же устройстве. Все реагенты, запасы и отходы могут храниться в устройстве системы.
При использовании, пробу от субъекта вводят в собранное устройство, после чего устройство вводят в измеритель. В одном варианте, измеритель может начинать обработку пробы за счет некоторой комбинации удаления эритроцитов (в случае пробы крови), разбавления пробы и перемещения пробы в блок анализа. В варианте с объединенными количественными анализами, используют множество блоков анализа и порции пробы перемещают в индивидуальные блоки анализа последовательно или параллельно. Затем могут быть проведены количественные анализы с использованием контролируемой последовательности инкубации и нанесения реагентов на поверхности захвата.
Примерное устройство для переноса флюида содержит все компоненты, которые необходимы для осуществления количественного анализа и/или считывания результатов количественного анализа. В качестве примера компонентов можно привести (но без ограничения) насосы для всасывания точных объемов флюида из лунок или блоков устройства, по меньшей мере один каскад поступательного перемещения, позволяющий повысить точность перемещения внутри системы, устройство обнаружения аналита в блоке анализа и регулятор температуры, позволяющий регулировать температуру среды для инкубация количественных анализов. В одном варианте в соответствии с настоящим изобретением, измеритель регулирует температуру устройства. В соответствии с другим вариантом, температура лежит в диапазоне около 30-40 градусов Цельсия. В соответствии с некоторыми вариантами, регулировка температуры при помощи системы предусматривает активное охлаждение. В некоторых случаях, диапазон температур составляет ориентировочно 0-100 градусов Цельсия. Например, для количественных анализов нуклеиновой кислоты, температуры могут достигать 100 градусов Цельсия. В одном варианте, диапазон температур составляет ориентировочно 15-50 градусов Цельсия. Блок регулировки температуры системы может содержать термоэлектрическое устройство, такое как устройство Пельтье.
Описанные здесь патроны, устройства и системы обладают многими характеристиками, которые отсутствуют в существующих РОС системах или системах объединенного анализа. Например, во многих РОС патронах используют замкнутую флюидную систему или петлю, что позволяет производить эффективную обработку малых объемов жидкости. Описанные здесь патроны и флюидные устройства обеспечивают свободное движение флюида между блоками патрона. Например, реагент может храниться в блоке (реагента), проба в блоке отбора пробы, разбавитель в блоке разбавителя, а поверхность захвата может находиться в блоке анализа, причем, в одном из состояний патрона, ни один из блоков не имеет флюидной связи с другими блоками. При использовании описанных здесь устройства для переноса флюида или системы, блоки в этом состоянии не имеют флюидной связи друг с другом. Блоки могут быть перемещены друг относительно друга для того, чтобы создать флюидную связь некоторых блоков друг с другом. Например, устройство для переноса флюида может иметь головку, которая входит в зацепление с блоком анализа и вводит блок анализа во флюидную связь с блоком реагента.
Описанные здесь устройства и системы эффективно позволяют обеспечивать высокую производительность и обнаружение в реальном масштабе времени аналитов, присутствующих в телесной жидкости субъекта. Предложенные здесь способы обнаружения могут быть использованы при самых разных обстоятельствах, в том числе для идентификации и определения количества аналитов, которые связаны со специфическими биологическими процессами, физиологическими состояниями, расстройствами (нарушениями) или стадиями расстройств. Как таковые, предложенные здесь системы имеют широкий диапазон использования, например, для лекарственного скрининга, диагностики заболевания, филогенетической классификации, отцовской и судебно-медицинской идентификации, начала и повтора заболевания, индивидуальной реакции на лечение различных групп населения, и для мониторинга терапии. Предложенные здесь устройства и системы также особенно полезны для оценки преклинической и клинической стадии лечения, для улучшения соблюдения режима медицинского лечения пациентом, мониторинга эритроцитов, связанных с назначенным лекарством, для развития индивидуализированной медицины, что позволяет перевести проверку крови из центральной лаборатории в проверку на дому или на базе рецепта, и мониторинга терапевтических средств после получения разрешения на их применение.
Устройства и системы позволяют создать гибкую систему для персонифицированной медицины. При использовании одной и той же системы, устройство может быть заменено вместе с протоколом или командами на программируемое обрабатывающее устройство систем, для осуществления широкого разнообразия количественных анализов. Преложенные здесь системы и устройства могут быть использованы в лаборатории, в виде настольного автоматизированного измерителя небольшого размера.
В соответствии с некоторыми вариантами, пациент может иметь множество устройств, используемых для обнаружения различных аналитов. Пациент может, например, использовать различные флюидные устройства в разные дни недели. В соответствии с некоторыми вариантами, программа на внешнем устройстве, связывающая идентификатор с протоколом, может содержать процесс для сравнения текущего дня с тем днем, когда необходимо использовать флюидное устройство, например, на основании клинического обследования. В другом варианте, пациент имеет различные блоки реагентов и блоки анализа, которые попеременно могут быть введены в корпус устройства. В еще одном варианте, если пациент не нуждается в новом устройстве для каждого дня проверки, система может быть программирована или перепрограммирована за счет загрузки новой команды, например, от внешнего устройства, такого как сервер. Если, например, два дня недели не являются одинаковыми, то внешнее устройство по радиосвязи посылает уведомление пациенту о том, какое выбрать устройство и/или какую выбрать команду для системы. Это только один из примеров, причем в другом случае пациент может получать уведомление о том, что флюидное устройство не было использовано в надлежащее время дня.
Например, патрон, такой как показанный на фиг.1, может содержать множество блоков анализа и блоков реагентов. Блоки анализа могут иметь поверхность захвата в соответствии с подлежащим обнаружению аналитом. Блоки анализа затем могут быть оперативно (in just-in-time fashion) объединены с остальной частью устройства. Во многих известных ранее РОС устройствах, поверхность захвата составляет одно целое с устройством, и если поверхность захвата образована неправильно, то все устройство является плохим. При использовании описанного здесь устройства, можно изготавливать на заказ и контролировать качество поверхности захвата и/или блока анализа индивидуально и независимо от блоков реагентов и корпуса устройства.
Блоки реагентов также оперативно могут быть заполнены различными реагентами. Это обеспечивает гибкость устройства, изготавливаемого на заказ. Кроме того, блоки реагентов могут быть заполнены различными объемами реагентов, что не влияет на стабильность устройства или на химические реакции, протекающие внутри устройства. При соединении с описанной здесь системой, имеющей устройство для переноса флюида, описанные здесь устройства и блоки обеспечивают гибкость при осуществлении способов и протоколов проводимых количественных анализов. Например, партия аналогичных устройств, содержащих одинаковые реагенты, может быть передана пулу пациентов для клинического обследования. После проведения половины клинического обследования, пользователь обнаруживает, что количественный анализ может быть оптимизирован за счет изменения разбавления пробы и количества реагента, вводимого в блок анализа. После этого, количественный анализ может быть изменен или оптимизирован всего только за счет изменения команды, подаваемой в программируемое обрабатывающее устройство, являющееся частью устройства для переноса флюида. Например, партия патронов в пуле пациентов имеет избыток разбавителя в патроне. Тогда новый протокол требует в 4 раза больше разбавителя, чем предыдущий протокол. За счет использования предложенных здесь способов и систем, протокол может быть изменен в центральном сервере и послан на все системы для осуществления способов в устройствах, без необходимости поставки новых устройств пулу пациентов. Другими словами, описанные здесь РОС устройство и система обеспечивают намного большую гибкость стандартной лабораторной практики, когда часто имеются избыточные реагенты и избыточные пробы.
В некоторых случаях, когда блоки патрона являются отдельными, устройства и системы обеспечивают гибкость при конструировании описанных здесь систем. Например, патрон может быть сконфигурирован для проведения 8 количественных анализов с использованием матрицы блоков анализа и матрицы блоков реагентов. За счет характеристик описанного здесь патрона, один и тот же корпус, или корпус такой же конструкции может быть использован для изготовления патрона, позволяющего проводить до 8 количественных анализов, других чем в предыдущем патроне. Такую гибкость трудно получить во многих известных в настоящее время РОС устройствах по причине использования в них замкнутых систем и флюидных каналов, так что эти устройства не могут быть модульными или обеспечивающими легкую сборку.
В настоящее время существует необходимость обнаружения нескольких аналитов, которые присутствуют в диапазоне сильно изменяющихся концентраций, когда, например, один аналит лежит в диапазоне концентраций пг/мл, а другой аналит лежит в диапазоне концентраций мкг/мл. Описанная здесь система позволяет одновременно проводить количественный анализ аналитов, которые присутствуют в одной и той же пробе в диапазоне сильно изменяющихся концентраций. Другим преимуществом, связанным с возможностью проведения количественного анализа аналитов, которые присутствуют в диапазоне сильно изменяющихся концентраций, является возможность связывать отношения концентраций этих аналитов с безопасностью и эффективностью назначения множества лекарственных средств пациенту. Например, неожиданное взаимодействие лекарственных средств друг с другом является обычным случаем неблагоприятных реакций лекарственных средств. Проводимое в реальном масштабе времени, одновременное измерение различных аналитов позволяет избежать потенциально опасных последствий неблагоприятного взаимодействия лекарственных средств друг с другом.
Возможность текущего контроля степени изменения концентрации аналита и/или концентрации PD или РК маркеров в течение периода времени на одном пациенте, или анализ тренда концентрации аналита и/или концентрации PD или РК маркеров, когда концентрациями являются концентрации лекарственных средств или их метаболитов, позволяет предотвратить потенциально опасные ситуации. Например, если глюкоза является представляющим интерес аналитом, то концентрация глюкозы в пробе в данное время и скорость изменения концентрации глюкозы в течение заданного периода времени являются очень полезными, например, в прогнозировании и предупреждении гипогликемических событий. Такой анализ тренда концентрации является очень полезным при выборе режима дозировки лекарственных средств. Что касается множества лекарственных средств и их метаболитов, то часто является желательной возможность анализа тренда и возможность принятия профилактических мер.
Таким образом, данные, полученные за счет использования предложенных флюидных устройств и систем, могут быть использованы для осуществления анализа тренда концентрации аналита у пациента.
Очень часто, проведение 8 количественных анализов в одном и том же патроне может потребовать различных разбавлений или предварительных обработок. Диапазон разбавления может сильно отличаться между количественными анализами. Многие известные РОС устройства часто имеют ограниченный диапазон разбавления и поэтому имеют ограниченное число количественных анализов, которые потенциально могут быть проведены на таком РОС устройстве. Однако описанные здесь система и/или патрон имеют широкий диапазон разбавлений за счет возможности последовательного разбавления пробы. Следовательно, большое число потенциальных количественных анализов могут быть проведены на единственном патроне или на множестве патронов, без необходимости модификации устройства обнаружения или считывающего измерителя для количественных анализов.
В соответствии с одним из примеров, предложенная здесь система сконфигурирована для проведения множества (например, пяти или больше) различных заданных количественных анализов аналита. Для того, чтобы привести ожидаемую концентрацию аналита внутрь диапазона обнаружения за счет иммунологического анализа, обычно используемого в РОС поле, проба должна быть разбавлена, например, в соотношении 3:1, 8:1, 10:1, 100:1 и 2200:1, для проведения каждого из пяти количественных анализов. Так как устройство для переноса флюида позволяет хранить и перемещать флюид внутри устройства, то последовательные разбавления могут быть осуществлены внутри описанной здесь системы, чтобы получить эти пять различных разбавлений и обнаружить все пять различных заданных аналитов. как уже было описано здесь выше, причем протокол для проведения количественных анализов также может быть подстроен, без необходимости в модификации устройства или системы.
В лабораторных условиях, при традиционном использовании пипетки, обычно отбирают большие объемы пробы, чем в случае РОС системы. Например, в лаборатории могут проводить анализ пробы крови, отобранной из руки пациента в объеме нескольких миллилитров. В случае РОС устройства, когда требуется, чтобы процесс был быстрым, легким и минимально инвазвным, используют небольшие пробы (в объеме нескольких микролитров), обычно получаемые из кончика пальца. За счет разности в объемах проб, известные РОС устройства могут терять гибкость в проведении количественного анализа, которую имеют лабораторные устройства. Например, для проведения множества количественных анализов одной пробы, может потребоваться заданный минимальный объем для каждого количественного анализа, чтобы осуществить точное обнаружение аналита, что накладывает некоторые ограничения на РОС устройство.
В другом примере, описанные здесь система и/или устройство для переноса флюида обеспечивают большую гибкость. Например, устройство для переноса флюида может быть автоматизировано для перемещения блока анализа, наконечника для количественного анализа или пустой пипетки из одного блока устройства в отдельный блок устройства, причем эти блоки не имеют флюидной связи друг с другом. В некоторых случаях, это позволяет избежать перекрестного загрязнения блоков устройства. В других случаях, это обеспечивает гибкость для перемещения различных флюидов внутри устройства, которые входят в контакт друг с другом в соответствии с протоколом или командой. Например, при обращении к патрону, который содержит 8 различных реагентов в 8 различных блоках реагентов, с ним может быть введено в зацепление устройство для переноса флюида, в любом порядке или комбинации, в соответствии с протоколом. Таким образом, множество различных последовательностей могут быть использованы при проведении любой химической реакции в устройстве. Без изменения объема реагентов в патроне или типа реагентов в патроне, протокол количественного анализа может быть изменен, без необходимости во втором патроне или во второй системе.
Например, пользователь заказывает патрон со специфическим типом поверхности захвата и специфическими реагентами для проведения количественного анализа, чтобы обнаружить аналит (например, С-химически активный протеин (CRP)) в пробе. Протокол пользователя первоначально планирует проведение 2 операций промывки и 3 операций разбавления. После получения пользователем устройства и системы, пользователь решил, что протокол должен предусматривать 5 операций промывки и только 1 операцию разбавления. Предложенные здесь устройства и системы обладают гибкостью, позволяющей изменять протокол без изменения компоновки устройства или системы. В этом примере, только новый протокол или набор команд необходимо послать в программируемое обрабатывающее устройство системы или в устройство для переноса флюида.
В другом примере, предложенная здесь система сконфигурирована для проведения пяти различных количественных анализов заданного аналита, причем каждый количественный анализ необходимо инкубировать при различной температуре. Во многих известных ранее РОС устройствах, инкубация множества количественных анализов при различных температурах представляет собой трудную задачу, так как множество количественных анализов не являются модульными и поверхности захвата не могут перемещаться относительно устройства нагрева. В описанной здесь системе, в которой индивидуальный блок анализа сконфигурирован для проведения химической реакции, индивидуальны блок анализа может быть установлен в индивидуальный блок нагрева. В соответствии с некоторыми вариантами, система содержит множество блоков нагрева. В некоторых случаях, система содержит по меньшей мере столько же блоков нагрева, сколько и блоков анализа. Следовательно, множество количественных анализов могут быть проведены при множестве температур.
Описанные здесь системы и устройства также позволяют производить контроль качества, который отсутствует во многих известных ранее РОС устройствах. Например, за счет модульности устройства, контроль качества блоков анализа и блоков реагентов может быть проведен раздельно друг от друга и/или отдельно от корпуса и/или отдельно от системы или устройства для переноса флюида. Далее описаны примерные способы и системы контроля качества, применяемые в описанных здесь системах и устройствах.
Описанная здесь система позволяет проводить различные количественные анализы, вне зависимости от аналита, обнаруженного в пробе телесной жидкости. Протокол, который зависит от природы устройства, может быть передан от внешнего устройства, где он хранится в считывающем узле устройства, что позволяет считывающему узлу использовать специфический протокол в устройстве. В соответствии с некоторыми вариантами, устройство имеет идентификатор (ID), который считывается при помощи обнаружителя идентификатора. Обнаружитель идентификатора может иметь связь с узлом связи при помощи контроллера, который передает идентификатор во внешнее устройство. При необходимости, внешнее устройство посылает, на основании идентификатора, протокол, который хранится во внешнем устройстве, в узел связи. Протокол, исполняемый в системе, может содержать команды для контроллера системы на исполнение протокола, в том числе (но без ограничения) для проведения специфического количественного анализа и осуществления способа обнаружения. После проведения количественного анализа системой, возникает сигнал, несущий информацию об аналите в пробе телесной жидкости, который обнаруживает узел обнаружения системы. Обнаруженный сигнал затем через узел связи может быть передан во внешнее устройство для обработки, в том числе (но без ограничения) для вычисления концентрации аналита в пробе.
В соответствии с некоторыми вариантами, идентификатором может быть идентификатор штрихкода с группой черных и белых линий, который считывается при помощи обнаружителя идентификатора, такого как хорошо известное считывающее устройство штрихкода. Могут быть использованы и другие идентификаторы, которые содержат буквенно-цифровые последовательности, последовательности цветов и выпуклостей, и которые могут быть расположены в устройстве и могут считываться при помощи обнаружителя идентификатора. Обнаружителем идентификатора также может быть СИД, излучающий свет, который отражается от идентификатора и измеряется в обнаружителе идентификатора, чтобы определить идентичность устройства. В соответствии с некоторыми вариантами, идентификатор может иметь запоминающее устройство и может передавать информацию на обнаружитель идентификатора. В соответствии с некоторыми вариантами, может быть использована комбинация указанных средств идентификации. В соответствии с некоторыми вариантами, обнаружитель калибруют с использованием источника света, такого как СИД.
В соответствии с одним из примеров, проба телесной жидкости может быть введена в устройство, а устройство может быть вставлено в систему. В соответствии с некоторыми вариантами, устройство частично вставляют вручную, а затем механический переключатель в считывающем узле автоматически устанавливает устройство в заданное положение внутри системы. Однако могут быть использованы и другие известные средства введения устройства или патрона в систему. В соответствии с некоторыми вариантами, устройство вставляют в систему вручную.
В соответствии с некоторыми вариантами, предлагается способ автоматического выбора протокола, исполняемого в системе, который предусматривает использование устройства, которое содержит обнаружитель идентификатора и идентификатор; обнаружение идентификатора; передачу указанного идентификатора во внешнее устройство; и выбор протокола, исполняемого в системе, из множества протоколов в указанном внешнем устройстве, связанных с указанным идентификатором.
В соответствии с первым аспектом настоящего изобретения, предлагается система для автоматического обнаружения множества аналитов в пробе телесной жидкости, которая содержит: флюидное устройство (такое как описанное здесь выше), которое содержит: блок отбора пробы, сконфигурированный с возможностью хранения пробы телесной жидкости; матрицу блоков анализа, причем индивидуальный блок анализа указанной матрицы блоков анализа сконфигурирован для проведения химической реакции, которая дает сигнал, несущий информацию об индивидуальном аналите указанного множества аналитов, подлежащих обнаружению; матрицу блоков реагентов, причем индивидуальный блок реагента указанной матрицы блоков реагентов содержит реагент. Система дополнительно содержит устройство для переноса флюида, которое содержит множество головок, причем индивидуальная головка множества головок сконфигурирована для входа в зацепление с индивидуальным блоком анализа, при этом указанное устройство для переноса флюида содержит программируемое обрабатывающее устройство, сконфигурированное для прямого переноса пробы телесной жидкости из блока отбора пробы и реагента из индивидуального блока реагента в индивидуальный блок анализа. Например, индивидуальный блок анализа содержит реагент и сконфигурирован для проведения химической реакции с этим реагентом.
В некоторых случаях, конфигурация обрабатывающего устройства, направляющего перенос флюида, позволяет изменять степень разбавления пробы телесной жидкости в матрице блоков анализа, чтобы получать сигналы, несущие информацию о множестве подлежащих обнаружению аналитов внутри диапазона обнаружения, так что указанное множество аналитов может быть обнаружено с использованием указанной системы. В соответствии с одним из примеров, проба телесной жидкости содержит по меньшей мере два аналита, присутствующие при концентрациях, которые отличаются по меньшей мере на 2, 5, 10, 15, 50 или 100 порядков величины. В соответствии с одним из примеров, проба телесной жидкости представляет собой одну каплю крови. В одном варианте, концентрации по меньшей мере двух аналитов, присутствующих в пробе, отличаются на 10 порядков величины (например, первый аналит присутствует при концентрации 0.1 пг/мл, а второй аналит присутствует при концентрации 500 мкг/мл. В другом примере, некоторые протеиновые аналиты присутствуют при концентрациях больше чем 100 мг/мл, что позволяет расширить представляющий интерес диапазон ориентировочно на 12 порядков величины.
Степень разбавления пробы телесной жидкости позволяет получать сигналы, несущие информацию по меньшей мере о двух аналитах внутри диапазона обнаружения. Во многих случаях, система дополнительно содержит устройство обнаружения, такое как фотоумножитель (ФЭУ). В случае фотоумножителя, диапазон обнаружения составляет, например, ориентировочно от 10 до 10 миллионов отсчетов в секунду. Каждый отсчет соответствует единичному фотону. В некоторых случаях, ФЭУ не является на 100% эффективным и наблюдаемая скорость подсчета слегка ниже действительного числа фотонов, поступающих на ФЭУ в единицу времени. В некоторых случаях, подсчеты проводят в 10 интервалах ориентировочно по одной секунде и результаты усредняют. В соответствии с некоторыми вариантами, диапазоны для количественных анализов соответствуют 1000-1,000,000 отсчетов в секунду, когда в качестве устройства обнаружения используют ФЭУ. В некоторых случаях, скорость подсчета может быть низкой и может составлять 100 отсчетов в секунду, или может быть высокой и может составлять 10,000,000 отсчетов в секунду. Линейный диапазон отклика ФЭУ (например, диапазон, в котором скорость подсчета прямо пропорциональна числу фотонов в единицу времени) может составлять ориентировочно 1000-3,000,000 отсчетов в секунду. В соответствии с одним из примеров, количественный анализ имеет различимый сигнал, составляющий около 200-1000 отсчетов в секунду на нижнем конце (диапазона), и составляющий около 10,000-2,000,000 отсчетов в секунду на верхнем конце (диапазона). В некоторых случаях для протеиновых биомаркеров, скорость подсчета прямо пропорциональна щелочной фосфотазе, связанной с поверхностью захвата, а также прямо пропорциональна концентрации аналита. Другими примерными устройствами обнаружения могут быть лавинные фотодиоды, лавинные фотодиодные матрицы, ПЗС матрицы и переохлажденные ПЗС матрицы. Многие другие устройства обнаружения имеют цифровой выходной сигнал, который обычно пропорционален числу фотонов, воздействующих на устройство обнаружения. Диапазон обнаружения примерных устройств обнаружения выбирают в соответствии с обнаруживаемым аналитом.
Индивидуальная головка устройства для переноса флюида может быть сконфигурирована с возможностью сцепления с индивидуальным блоком анализа. Устройством для переноса флюида может быть пипетка, такая как пипетка с вытеснением воздухом. Устройство для переноса флюида может быть автоматическим. Например, устройство для переноса флюида может дополнительно содержать двигатель, подключенный к программируемому обрабатывающему устройству, причем указанный двигатель может перемещать множество головок на основании протокола от программируемого процессора. Как уже было описано выше, индивидуальным блоком анализа может быть наконечник пипетки, например, наконечник пипетки с поверхностью захвата или с местом реакции.
Очень часто, в РОС устройстве, таком как описанные здесь системы и устройства, следует учитывать и разумно задавать коэффициент разбавления. Например, в средах, в которых с системой работают не квалифицированные пользователи, необходимо обеспечивать принудительное разбавление пробы.
Как уже было описано здесь выше, устройство для переноса флюида позволяет изменять степень разбавления пробы, чтобы выдавать точные результаты количественного анализа. Например, программируемое устройство для переноса флюида может иметь множество головок для разбавления или последовательного разбавления проб, а также для перемешивания пробы и разбавителя. Устройство для переноса флюида также обеспечивает перемещение флюида в РОС устройствах.
Как уже было описано здесь выше, описанные здесь системы и устройства обладают многими характеристиками гибкости лабораторных устройств в РОС условиях эксплуатации. Например, пробы могут отбираться и подвергаться обработке автоматически в настольных устройстве или системе или имеющих еще меньший размер. Общей характеристикой РОС устройств является достижение различных диапазонов разбавления при проведении множества количественных анализов, причем количественные анализы могут иметь сильно отличающиеся чувствительности или специфичности. Например, в пробе могут быть два аналита, но один аналит имеет высокую концентрацию в пробе, а другой аналит имеет очень низкую концентрацию. Предусмотрено, что описанные здесь системы и устройства позволяют разбавлять пробу до сильно отличающихся уровней, чтобы можно было обнаружить оба аналита.
Например, если аналит имеет высокую концентрацию, проба может быть последовательно разбавлена до соответствующего диапазона обнаружения и нанесена на поверхность захвата для обнаружения. В этой же системе или в этом же устройстве, пробу с аналитом при низкой концентрации разбавлять не следует. Таким образом, может быть расширен диапазон количественного анализа предложенных здесь РОС устройств и систем по сравнению с многими известными ранее РОС устройствами.
Устройство для переноса флюида может быть частью системы, которая представляет собой настольный (стендовый) измеритель. Устройство для переноса флюида может иметь множество головок. Любое число головок, которое необходимо для обнаружения множества аналитов в пробе, может быть предусмотрено в устройстве для переноса флюида в соответствии с настоящим изобретением. В соответствии с одним из примеров, устройство для переноса флюида имеет 8 головок, установленных в линию с промежутком друг от друга. В одном варианте, головки имеют конические сопла, которые при помощи прессовой посадки могут быть введены в зацепление с различными наконечниками, такими как описанные здесь блок анализа или блоки отбора пробы. Наконечники могут быть удалены автоматически при помощи измерителя и после использования могут храниться в корпусе устройства. В одном варианте, наконечники для количественного анализа являются прозрачными и аналогичными кювете, внутри которой проводят количественный анализ, сигнал которого может быть обнаружен с использованием фотоприемника, такого как фотоумножитель.
В соответствии с одним из примеров, программируемый процессор системы может подавать команды на устройство для переноса флюида для переноса жидких проб, за счет всасывания или выталкивания жидкости при соответствующем перемещении поршня в замкнутом воздушном пространстве. Как объем перемещаемого воздуха, так и скорость перемещения точно контролируют, например, при помощи программируемого процессора.
Перемешивание проб (или реагентов) с разбавителями (или другими реагентами) может быть осуществлено за счет всасывания перемешиваемых компонентов в общую трубку и затем за счет многократного всасывания существенной фракции объединенного объема жидкости вверх и вниз в наконечник. Растворение сухих реагентов в трубке может быть осуществлено аналогичным образом. Инкубация жидких проб и реагентов с поверхностью захвата, на которой связан реагент захвата (например, антитело), может быть обеспечена за счет всасывания соответствующей жидкости в наконечник и удержания ее в течение заданного времени. Удаление проб и реагентов в описанном устройстве может быть осуществлено за счет выталкивания жидкости в резервуар или в гигроскопическую прокладку. Затем другой реагент может быть введен в наконечник в соответствии с командой или протоколом от программируемого котроллера.
В соответствии с одним из примеров, показанным на фиг.11, жидкость 1111, которая находилась ранее в наконечнике 1101, при ее выталкивании может оставлять тонкую пленку 1113 внутри наконечника 1101. Поэтому в системе используют действие первой (например, самой верхней) порции следующей жидкости 1112 для смывания предыдущей жидкости 1111 из наконечника 1101. Порция 1113 жидкости, загрязненной предыдущей жидкостью, может находиться в верхней части наконечника 1101, где она не взаимодействует с поверхностью 1102 захвата. Поверхностью 1102 захвата может быть заданная область наконечника 1101, выбранная так, что предыдущая жидкость 1111 не вступает в реакцию с поверхностью 1102 захвата; например, как это показано на фиг.11, поверхность 1102 захвата занимает заданный участок цилиндрической части наконечника 1101, который не доходит до бобышки наконечника. Во многих случаях, время инкубации является коротким (например, составляет 10 минут), а загрязненная зона жидкости является относительно длинной (более 1 мм), так что диффузия активных компонентов загрязненной порции 1113 жидкости не происходит достаточно быстро для того, чтобы вступать в реакцию с поверхностью 1102 захвата во время инкубации. В случае многих имеющих высокую чувствительность количественных анализов, предъявляется требование удаления одного реагента или требование промывки поверхности захвата (например, в случае антитела обнаружения (detector), которое мечено генератором сигналов количественного анализа). В соответствии с одним из примеров, описанное здесь устройство для переноса флюида системы может обеспечивать промывку за счет введения дополнительных циклов удаления и всасывания при переносе флюида, например, с использованием промывочного реагента. В соответствии с одним из примеров, 4 операции промывки достаточны для того, чтобы концентрация несвязанного антитела обнаружения в контакте с поверхностью захвата снижалась больше чем в 10 раз. Любое антитело, которое не специфически связано с поверхностью захвата (что в высшей степени нежелательно), также может быть удалено во время этого процесса промывки.
Расширение диапазона количественного анализа может быть достигнуто за счет разбавления пробы. В РОС системах анализа, в которых используют содержащие разбавитель одноразовые патроны, часто имеется практический предел увеличения разбавления. Например, если из кончика пальца получена небольшая проба крови (например, около 20 мкл), которую необходимо разбавить, а максимальный объем разбавителя, который может быть введен в трубку, составляет 250 мкл, то практический предел разбавления всей пробы ориентировочно является 10-кратным. В соответствии с одним из примеров, система может всасывать и меньший объем пробы (например, около 2 мкл), что позволяет получить ориентировочно 100-кратный максимальный коэффициент разбавления. Для многих количественных анализов такие коэффициенты разбавления являются приемлемыми, однако в случае такого количественного анализа как CRP (описанного здесь в одном из примеров), существует необходимость еще большего разбавления пробы. Основанные на разделении количественные анализы ELISA имеют характерное ограничение способности поверхности захвата связывать аналит (например, ориентировочно несколько сот нг/мл в случае типичного протеинового аналита). Некоторые аналиты присутствуют в крови при концентрациях, составляющих сотни мкг/мл. Даже при 100-кратном разбавлении, концентрация аналита может лежать вне диапазона калибровки. В примерном варианте заявленной системы, заявленного устройства и устройства для переноса флюида, может быть осуществлено множество разбавлений за счет проведения множества переносов разбавителя в индивидуальный блок анализа или в блок отбора пробы. Например, если концентрация аналита в пробе является очень высокой, то проба может быть разбавлена несколько раз, пока концентрация аналита не будет находиться внутри приемлемого диапазона обнаружения. Описанные здесь системы и способы позволяют обеспечивать точное измерение или оценку разбавлений, чтобы рассчитать исходную концентрацию аналита.
В одном варианте, предложенная здесь система позволяет перемещать жидкую пробу и позволяет перемещать блок анализа. Система может содержать блок нагрева и устройство обнаружения. Чтобы перемещать жидкую пробу, система может осуществлять всасывание или действие типа действия шприца или пипетки. В примерном варианте, устройство для переноса флюида, которое перемещает жидкую пробу, представляет собой пипетку и пипеточную головку системы. Число устройств в виде пипеток, которое требуется в системе, зависит от типа подлежащего обнаружению аналита и от числа проводимых количественных анализов. Действия пипеток в системе могут быть автоматическими или осуществляемыми вручную пользователем.
На фиг.5 показан пример описанных здесь устройства 520 для переноса флюида и системы 500. Устройство для переноса флюида системы может перемещать 8 различных или одинаковых объемов жидкости одновременно, с использованием восьми различных головок 522. Например, патрон (или описанное здесь устройство) 510 содержит восемь блоков 501 анализа. Индивидуальные блоки 501 анализа сконфигурированы в соответствии с типом количественного анализа, проводимого внутри блока 501. Индивидуальные блоки 501 анализа могут потребовать определенного объема пробы. Индивидуальная головка 522 может быть использована для распределения надлежащих количеств пробы в индивидуальный блок 501 анализа. В этом примере, каждая головка 522 соответствует адресуемому индивидуальному блоку 501 анализа.
Механизм 520 устройства для переноса флюида также может быть использован для распределения реагентов от блоков реагентов. Различные типы реагентов включают в себя раствор конъюгата, промывочный раствор и раствор субстрата. В автоматизированной системе, платформа 530, показанная на фиг.5, на которой сидит устройство 510, может перемещаться, чтобы перемещать устройство 510 относительно расположения блоков 501 анализа и головок 522, и в соответствии с операциями, необходимыми для проведения количественного анализа. Альтернативно, головки 522 и наконечники 501 или устройство 520 для переноса флюида могут быть перемещены относительно положения устройства 510.
В соответствии с некоторыми вариантами, реагент получают в сухом виде и растворяют его при проведении анализа. Сухими формами могут быть лиофилизированные материалы и нанесенные на поверхность пленки.
Система может иметь держатель для перемещения блоков анализа или наконечников. Держателем может быть вакуумный узел или узел, который может плотно заходить в бобышку наконечника для количественного анализа. Например, средство для перемещения наконечников может перемещаться аналогично перемещению головок устройства для переноса флюида. Устройство также может перемещаться на платформе до положения держателя.
В одном варианте, средство для перемещения наконечников является аналогичным средству для перемещения объема пробы, такому как описанное здесь устройство для переноса флюида. Например, наконечник отбора пробы может плотно заходить в головку пипетки до бобышки на наконечнике. Затем наконечник отбора пробы может быть использован для распределения жидкости по всему устройству и системе. После распределения жидкости, наконечник отбора пробы может быть выброшен, а головка пипетки может быть плотно надета на блок анализа, до бобышки на блоке анализа. Затем наконечник для количественного анализа может быть перемещен от одного блока реагента к другому блоку реагента, и реагенты могут быть распределены в блок анализа за счет действия всасывания или действия пипетки, с использованием головки пипетки. Головка пипетки также может производить перемешивание внутри наконечника отбора пробы, блока анализа или блока реагента, за счет действия всасывания или действия шприца.
Система может иметь блок нагрева, предназначенный для нагрева блока анализа и/или для регулирования температуры количественного анализа. Теплота может быть использована в операции инкубации реакции количественного анализа, чтобы ускорить реакцию и уменьшить время, необходимое для операции инкубации. Система может иметь блок нагрева, сконфигурированный для приема блока анализа в соответствии с настоящим изобретением. Блок нагрева может быть сконфигурирован для приема множества блоков анализа от устройства в соответствии с настоящим изобретением. Например, если 8 количественных анализов желательно провести в устройстве, то блок нагрева может быть сконфигурирован для приема 8 блоков анализа. В соответствии с некоторыми вариантами, блоки анализа могут быть перемещены (введены) в тепловой контакт с блоком нагрева при помощи средства перемещения блоков анализа. Нагревание может быть осуществлено при помощи средств нагрева, известных сами по себе.
Описанная здесь примерная система 600 показана на фиг.6. Система 600 содержит платформу 630 поступательного перемещения, на которую устройство 610 (или патрон в данном примере) устанавливают вручную или автоматически, или за счет комбинации того и другого. Система 600 также содержит блок 640 нагрева, который может быть совмещен с блоками 611 анализа устройства 610. Как это показано на фиг.6, устройство 610 содержит ряды по 8 блоков 611 анализа и множество соответствующих блоков 612 реагентов, причем блок 640 нагрева также содержит область 641, в которой по меньшей мере 8 блоков могут нагреваться одновременно. В каждой из областей 641 нагрева могут быть одинаковые или разные температуры для каждого из индивидуальных блоков 611 анализа, в соответствии с типом проводимого количественного анализа или типом подлежащего обнаружению аналита. Система 600 также содержит устройство обнаружения (такое как фотоумножитель) 650, для обнаружения сигнала от блока 611 анализа, который несет информацию относительно аналита в пробе.
В одном варианте предусмотрен датчик для локализации блока анализа относительно устройства обнаружения при проведении количественного анализа.
В одном варианте, устройство обнаружения представляет собой считывающее устройство, в корпусе которого расположен узел обнаружения, для обнаружения сигнала, созданного за счет по меньшей мере одного количественного анализа в устройстве. Узел обнаружения может быть расположен над устройством или может иметь другую ориентацию относительно устройства, на основании, например, типа проводимого количественного анализа и использованного механизма обнаружения. Узел обнаружения может быть перемещен для создания связи с блоком анализа, или блок анализа может быть перемещен для создания связи с узлом обнаружения.
Во многих случаях в качестве устройства обнаружения используют фотоприемник. В качестве не ограничительных примеров фотоприемников можно привести фотодиод, фотоумножитель (ФЭУ), детектор фотонов, лавинный фотодиод или прибор с. зарядовой связью (ПЗС). В соответствии с некоторыми вариантами, может быть использован pin диод. В соответствии с некоторыми вариантами, pin диод может быть объединен с усилителем для создания устройства обнаружения, имеющего чувствительность, сопоставимую с чувствительностью ФЭУ. Некоторые описанные здесь количественные анализы могут возбуждать люминесценцию. В соответствии с некоторыми вариантами, обнаруживают хемилюминесценцию. В соответствии с некоторыми вариантами, узел обнаружения может иметь множество волоконно-оптических кабелей, пучок которых подключен к ПЗС датчику или к матрице ФЭУ. Жгут оптических волокон может состоять из отдельных волокон, или множество небольших волокон могут быть сплавлены вместе для образования жгута. Такие жгуты имеются в продаже, причем их легко состыковать с ПЗС датчиками.
Устройство обнаружения также может иметь источник света, такой как лампа накаливания или светоизлучающий диод (СИД). Источник света служит для подсветки (места проведения) количественного анализа, чтобы обнаружить результаты. Например, количественный анализ может быть флуоресцентным количественным анализом или поглощательным количественным анализом, что обычно используют в количественных анализах нуклеиновой кислоты. Устройство обнаружения также содержит оптику для ввода излучения от источника света в количественный анализ, такую как линза или волоконная оптика.
В соответствии с некоторьми вариантами, система обнаружения может иметь не оптические датчики для обнаружения специфических параметров субъекта. Такими датчиками могут быть датчики температуры, проводимости, потенциометрические датчики и амперометрические датчики, которые используют для обнаружения окисленных или восстановленных химических соединений, например, O2, Н2O2 и I2, или же окисленных или восстановленных органических соединений.
Устройство и система после изготовления могут быть отгружены конечному пользователю, совместно или индивидуально. Устройство или система в соответствии с настоящим изобретением могут быть упакованы вместе с инструкцией по эксплуатации. В одном варианте, система в соответствии с настоящим изобретением является общей для всех типов количественных анализов, проводимых в различных устройствах. Так как компоненты устройства могут быть модульными, пользователь нуждается только в одной системе и в различных устройствах или блоках анализа или блоках реагентов для проведения множества количественных анализов в месте ухода за больным. В этом контексте, система может быть повторно использована с множеством устройства, однако могут потребоваться датчики, как в устройстве, так и в системе, чтобы обнаруживать, например, изменения давления или температуры во время отгрузки. Во время отгрузки, изменения давления или температуры могут влиять на характеристики различных компонентов данной системы, однако датчики, установленные в устройстве или системе, позволяют связать эти изменения, например, с внешним устройством, чтобы могли быть сделаны подстройки во время калибровки или во время обработки данных на внешнем устройстве. Например, если температура флюидного устройства изменилась на некоторую величину во время отгрузки, то датчик, расположенный в устройстве, может обнаруживать это изменение и передавать соответствующую информацию в систему, когда пользователь вставляет устройство в систему. Для осуществления этих задач в системе может быть предусмотрено дополнительное устройство обнаружения (датчик), или такое устройство может быть встроено в другой компонент системы. В соответствии с некоторыми вариантами, информация может быть передана с использованием радиосвязи в систему или во внешнее устройство, такое как персональный компьютер или дисплей. Аналогично, установленный в системе датчик может обнаруживать аналогичные изменения. В соответствии с некоторыми вариантами, желательно также иметь датчик в отгрузочной упаковке, вместо датчика в компонентах системы или в дополнение к нему. Например, неблагоприятные условия могут приводить к выходу из строя патрона анализа или системы, однако указанный датчик может исключить повышение температуры выше максимального допустимого уровня или исключить нарушение целостности патрона за счет проникновения влаги.
В одном варианте, система содержит узел связи, который позволяет передавать и принимать информацию от внешнего устройства при помощи беспроводной связи. В такой беспроводной связи могут быть использованы технологии Bluetooth или RTM. Могут быть использованы различные способы связи, такие как кодовый вызов с использованием модема, прямая связь, такая как T1, ISDN, или кабельная линия. В соответствии с некоторыми вариантами, беспроводное соединение устанавливают с использованием таких примерных беспроводных сетей, как сотовая сеть, спутниковая сеть или абонентская сеть, GPRS, или локальная система передачи данных, такая как Ethernet или кольцевая сеть с маркерным доступом внутри локальной сети. В соответствии с некоторыми вариантами, информацию кодируют ранее ее передачи по беспроводной сети. В соответствии с некоторыми вариантами, узел связи может иметь беспроводной инфракрасный компонент связи для передачи и приема информации. Система может иметь встроенные графические карты для облегчения индикации информации.
В некоторых вариантах, узел связи может иметь запоминающее устройство (ЗУ), например, локализованное ЗУ с произвольной выборкой, в котором может храниться собранная информация. Запоминающее устройство может потребоваться, если информацию не передают в заданный момент времени, например, по причине временного отсутствия связи. Информация может быть объединена с идентификатором устройства в запоминающем устройстве. В соответствии с некоторыми вариантами, узел связи может повторно передавать запомненную информацию по истечении некоторого промежутка времени.
В некоторых вариантах, внешнее устройство имеет связь с узлом связи внутри считывающего устройства. Внешнее устройство может иметь беспроводную связь или физическую связь с системой, но также может иметь связь с третьей стороной, в том числе (но без ограничения) с пациентом, медицинским персоналом, клиницистами, лабораторным персоналом, или с другими лицами в сфере здравоохранения.
Примерные способ и система показаны на фиг.7. В соответствии с примером, показанным на фиг.7, пациент вводит пробу крови в описанное здесь устройство и затем вставляет устройство в считывающее устройство, причем считывающее устройство может быть настольной системой, которая позволяет считывать аналит в пробе крови. Считывающее устройство может быть выполнено в виде описанной здесь системы. Считывающее устройство может быть настольной системой, которая позволяет считывать множество описанных здесь различных устройств. Считывающее устройство или система способны проводить химическую реакцию и обнаруживать или считывать результаты химической реакции. В соответствии с примером, показанным на фиг.7, считывающее устройство автоматизировано в соответствии с протоколом, посланным от внешнего устройства (например, от сервера, который содержит интерфейс пользователя). Считывающее устройство также может посылать результаты химической реакции в сервер и интерфейс пользователя. В примерной системе, пользователь (например, медицинский работник, такой как врач или исследователь) может видеть результаты анализа и может принимать или развивать протокол, использованный для автоматизации системы. Результаты также могут храниться локально (в считывающем устройстве) или в сервере системы. В сервере также могут храниться записи пациента, регистрационный журнал пациента и база данных пациентов.
На фиг.8 показана блок-схема системы для оценки медицинского состояния пациента. Пациент вводит персональные данные и/или результаты измерений от описанных здесь устройства, считывающего устройства и/или системы в базу данных, которая имеется в описанном сервере. Система может быть сконфигурирована для индикации персональных данных на дисплее терминала пациента. В соответствии с некоторыми вариантами, дисплей терминала пациента является интерактивным и пациент может изменять введенные данные. Эта же база данных или другие базы данных содержат данные от других пациентов с аналогичным медицинским состоянием. Данные от других пациентов могут быть данными о протекании процесса, полученными от общественных или частных учреждений. Данные от других пациентов могут быть внутренними данными клинического обследования.
На фиг.8 также показан поток данных от считывающее устройство и поступающих в него данных, который содержит данные пациента, передаваемые в сервер, подключенный по сети общего пользования. Сервер может управлять данными или просто передавать данные на терминал пользователя. Данные пациента также могут быть введены в сервер отдельно, а именно, могут быть введены данные относительно медицинского состояния, которые хранятся в базе данных. На фиг.8 также показан дисплей терминала пользователя и поток информации для медицинского персонала или пользователя. Например, с использованием системы, показанной на фиг.8, пациент дома может вводить пробу телесной жидкости в описанный здесь патрон в соответствии с настоящим изобретением и вставлять его в описанные здесь систему или считывающее устройство. Пациент может видеть данные, полученные от системы, на дисплее терминала пациента, и/или может изменять данные или вводить новые данные. Затем данные от пациента проходит по сети общего пользования, такой как Интернет, например, в кодированном виде, и поступают в сервер, который содержит интерфейс сети и процессор, причем сервер расположен в вычислительном центре или в клиническом испытательном центре. Сервер может использовать данные медицинского состояния для обработки и понимания полученных от пользователя данных, а затем может посылать результаты по сети общего пользования на терминал пользователя. Терминал пользователя может находиться в медицинском кабинете или в лаборатории, и может иметь дисплей для индикации результатов анализа и обработки данных пациента медицинским персоналом. В этом примере, медицинский персонал может получать результаты и анализы пробы от пациента, полученные за счет испытания, которое пациент провел в другом месте, например, у себя дома. Могут быть использованы и другие варианты и примеры описанных здесь систем и компонентов систем.
В соответствии с некоторыми вариантами, внешним устройством может быть компьютерная система, сервер или другое электронное устройство, позволяющее хранить информацию или производить обработку информации. В соответствии с некоторыми вариантами, внешнее устройство содержит одну или несколько компьютерных систем, один или несколько серверов или одно или несколько других электронных устройств, позволяющих хранить информацию или производить обработку информации. В соответствии с некоторыми вариантами, внешнее устройство может иметь базу данных с информацией относительно пациента, например, (но без ограничения) с медицинскими записями или историей болезни пациента, с записями клинических испытаний или с записями преклинических испытаний. Внешнее устройство может хранить протоколы, исполняемые в системы, которые могут быть переданы в узел связи системы, когда он получил идентификатор, указывающий, какое устройство было вставлено в систему. В соответствии с некоторыми вариантами, протокол может зависеть от идентификатора устройства. В соответствии с некоторыми вариантами, внешнее устройство хранит несколько протоколов для каждого устройства. В соответствии с другими вариантами, информация относительно пациента во внешнем устройстве включает в себя несколько протоколов. В некоторых случаях, внешний сервер хранит математические алгоритмы для обработки отсчетов фотонов, принятых от узла связи, и использует, в соответствии с некоторыми вариантами, математические алгоритмы для расчета концентрации аналита в пробе телесной жидкости.
В соответствии с некоторыми вариантами, внешнее устройство может иметь один или несколько покупных серверов, как это хорошо известно специалистам в данной области. Каждый сервер может обеспечивать выравнивание нагрузки, управление задачами, и имеет емкость резервной памяти, которую используют в случае отказа одного или нескольких серверов или других компонентов внешнего устройства, чтобы повысить коэффициент готовности сервера. Сервер также может быть реализован в виде распределенной сети блоков хранения и обработки информации, что само по себе известно, причем обработку данных в соответствии с настоящим изобретением производят на рабочих станциях, таких как компьютеры, за счет чего исключается необходимость использования (отдельного) сервера.
Сервер может иметь базу данных и может подвергать обработке данные системы. База данных может постоянно находиться внутри данного сервера, или может постоянно находиться в другом сервере системы, к которому имеет доступ данный сервер. Так как информация в базе данных может содержать секретную информацию, может быть обеспечена безопасность системы, не позволяющая незарегистрированному пользователю иметь доступ в базу данных.
Одним из преимуществ некоторых описанных здесь характеристик является то, что информация может быть передана от внешнего устройства назад, не только в узел считывающего устройства, но и в другие части системы или в другие внешние устройства, в том числе, например, (но без ограничения) в "карманный" компьютер (PDA) или на сотовый телефон. Некоторые виды связи могут быть осуществлены при помощи сети с беспроволочной связью, как уже было указано здесь выше. В соответствии с некоторыми вариантами, вычисленная концентрация аналита или другая касающаяся пациента информация может быть послана, например, (но без ограничения) медицинскому персоналу или пациенту.
Таким образом, данные, полученные за счет заявленных устройств и систем, могут быть использованы для осуществления анализа тренда концентрации аналита у пациента.
Другим преимуществом настоящего изобретения является то, что результаты количественного анализа могут быть практически немедленно переданы любой третьей стороне, которая может получать выгоду от полученных результатов. Например, после определения концентрации аналита во внешнем устройстве, она может быть передана пациенту или медицинскому персоналу, которые могут предпринять дополнительные действия. Операция передачи информации третьей стороне может быть осуществлена при помощи беспроводной связи, как уже было указано здесь выше, например, за счет передачи данных на мобильное устройство третьей стороны, так что третья сторона может получать результаты количественного анализа фактически в любое время и в любом месте. Таким образом, в сценарии с нехваткой времени, контакт с пациентом может быть осуществлен немедленно, если требуется срочное медицинское действие.
За счет обнаружения устройства на основании идентификатора, связанного с флюидным устройством после его введения в систему, система позволяет загружать специфические для флюидного устройства протоколы от внешнего устройства и исполнять их. В соответствии с некоторыми вариантами, внешнее устройство может хранить множество протоколов, связанных с системой или связанных с конкретным пациентом или группой пациентов. Например, когда идентификатор передают по связи во внешнее устройство, программа во внешнем устройстве может получать идентификатор. После получения идентификатора, программные средства во внешнем устройстве, такие как база данных, могут использовать идентификатор для идентификации протоколов, которые хранятся в базе данных, связанной с идентификатором. Если с идентификатором связан только один протокол, то тогда, например, база данных может выбирать протокол и программные средства во внешнем устройстве и затем может передавать протокол в узел связи системы. Возможность использования протоколов, специфическим образом связанных с устройством, позволяет использовать любой компонент устройства в соответствии с настоящим изобретением в единственной системе, так что фактически любой представляющий интерес аналит может быть обнаружен в единственной системе.
В соответствии с некоторыми вариантами, множество протоколов могут быть связаны с единственным идентификатором. Например, если является предпочтительным обнаружение одного аналита пациента один раз в неделю, а другого аналита у этого же пациента два раза в неделю, то протоколы во внешнем устройстве, связанные с идентификатором, также могут быть связаны с разными днями недели, так что когда идентификатор обнаружен, программа во внешнем устройстве может выбирать соответствующий протокол, который связан с определенным днем недели.
В соответствии с некоторыми вариантами, пациент может иметь множество заявленных устройств, используемых для обнаружения различных аналитов. Пациент, например, может использовать различные устройства в разные дни недели. В соответствии с некоторыми вариантами, программа во внешнем устройстве, связывающая идентификатор с протоколом, может содержать процесс сравнения текущего дня с днем использования устройства, например, на основании клинического обследования. Если, например, два дня недели не являются одинаковыми, то внешнее устройство может с использованием беспроводной связи уведомить пациента, с использованием любого из описанных здесь способов или других известных способов, о том, что неправильное устройство вставлено в систему, а также о том, какое правильное устройство нужно использовать в этот день. Этот пример является только пояснительным и легко может быть распространен, например, на случай, когда уведомляют пациента о том, что устройство не было использовано в нужное время дня.
В системе также может быть использован способ подключения к сети для оценки медицинского состояния пациента. Система передачи информации может иметь или не иметь считывающее устройство для считывания данных пациента. Например, если данные биомаркера получены при помощи микрофлюидного РОС устройства, то тогда показатели, связанные с различными индивидуальными биомаркерами, могут быть считаны при помощи этого устройства или другого отдельного устройства. Другим примером считывающего устройства является система со штрихкодом, позволяющая сканировать данные пациента, которые были введены в электронную медицинскую запись или в карту терапевта. Еще одним примером считывающего устройства является база данных электронной записи пациента, из которой данные пациента могут быть непосредственно получены при помощи сети связи. В настоящее время, эффективность специфических лекарственных средств можно оценить в реальном масштабе времени, что позволяет оправдать расходы на терапию.
Несоблюдение режимов лечения, в том числе заданных за счет клинического обследования, может серьезно понизить эффективность лечения. Поэтому, в соответствии с некоторыми вариантами, заявленная система может быть использована для контроля соблюдения режимов лечения пациентом и уведомления пациента или медицинского персонала о несоблюдении режимов. Например, если пациент, который принимает лекарственное средство, что является частью плана медицинского лечения, производит отбор пробы телесной жидкости для проведения описанного здесь количественного анализа, и при проведении анализа система обнаруживает, например, повышенный уровень концентрации метаболита по сравнению с известным профилем, это может свидетельствовать о (самовольном) приеме множества доз лекарственного средства. Пациент или медицинского персонал могут быть уведомлены о таком несоблюдении режимов лечения при помощи средств беспроводной связи, например, в том числе (но без ограничения) при помощи мобильного устройства, такого как "карманный" компьютер или мобильный телефон. Указанный известный профиль может храниться в описанном здесь внешнем устройстве.
В одном варианте, система может быть использована для идентификации субпопуляций пациентов, для которых терапия является благоприятной или вредной. За счет этого, лекарственные средства с изменяющейся токсичностью, имеющиеся в продаже, будут назначаться только тем пациентам, для которых они не являются вредными.
Способы
Устройства и способы в соответствии с настоящим изобретением обеспечивают эффективное средство обнаружения в реальном масштабе времени аналитов, присутствующих в телесной жидкости пациента. Заявленные способы обнаружения могут быть использованы в самых разных обстоятельствах, в том числе при идентификации и квантификации (количественном определении) аналитов, которые связаны со специфическими биологическими процессами, физиологическими состояниями, расстройствами (нарушениями) или стадиями расстройств, или со стадиями терапии. Как таковые, указанные устройства и способы имеют широкий спектр применения, например, для лекарственного скрининга, диагностики заболевания, филогенетической классификации, отцовской и судебно-медицинской идентификации, начала и повтора заболевания, индивидуальной реакции на лечение различных групп населения, и для мониторинга терапии. Предложенные здесь устройства и системы также особенно полезны для оценки преклинической и клинической стадии терапии, для улучшения соблюдения режима медицинского лечения пациентом, мониторинга эритроцитов, связанных с назначенным лекарством, для развития индивидуализированной медицины, что позволяет перевести проверку крови из центральной лаборатории в проверку на дому пациента. Устройство также может быть использовано на базе рецепта (prescription basis), используемого фармацевтическими компаниями для мониторинга терапевтических средств после получения разрешения на их применение, Таким образом, в соответствии с одним вариантом настоящего изобретения, предлагается способ обнаружения аналита в пробе телесной жидкости, который предусматривает введение (подачу) пробы крови в устройство или систему в соответствии с настоящим изобретением, создание условий для реагирования указанной пробы внутри по меньшей мере одного блока анализа, и обнаружение указанного различимого сигнала, генерируемого за счет указанного аналита в пробе крови.
На фиг.1 показан примерный вариант устройства в соответствии с настоящим изобретением, которое содержит по меньшей мере один блок анализа и по меньшей мере один блок реагента. Блоки анализа (например, выполненные как наконечники отбора пробы и наконечники для калибровки на фиг.1) могут иметь поверхность захвата, а блоки реагентов могут содержать такие средства, как конъюгаты, промывочные растворы и субстраты. Примерное устройство, показанное на фиг.1, также содержит наконечник для сбора пробы цельной крови, наконечник для отбора плазмы крови, лунку для приема крови, лунку для разделение плазмы крови, наконечник для осушения или впитывающую (гигроскопическую) прокладку, лунку для разбавления, лунку для разбавленной плазмы крови или лунку для разбавителя плазмы крови, а также области хранения отработавших наконечников.
В одном варианте, способ предусматривает осуществление количественного анализа со связанным ферментом иммуносорбентом (ELISA). В соответствии с одним из примеров, описанным в этом параграфе, пробу подают в блок отбора пробы описанного здесь устройства. Устройство затем вставляют в систему, причем система обнаруживает тип введенного устройства или патрона. Система затем может устанавливать связь с внешним устройством для приема набора команд или протокола, что позволяет системе осуществлять желательный количественный анализ или количественные анализы патрона (содержимого патрона). Протокол может быть послан в программируемый процессор устройства для переноса флюида системы. В соответствии с одним из примеров, устройство для переноса флюида входит в зацепление с наконечником пробы патрона, отбирает некоторый объем пробы из блока отбора пробы и перемещает его в блок предварительной обработки, где удаляют эритроциты. Затем может быть произведено всасывание пробы плазмы крови в наконечник для плазмы крови или в другой наконечник, для количественного анализа при помощи устройства для переноса флюида, в соответствии с протоколом. В наконечник, содержащий плазму крови, затем может быть введен разбавитель, чтобы разбавить пробу в соответствии с проводимыми количественными анализами. Множество различных разбавлений может быть осуществлено за счет использования последовательных разбавлений пробы. Например, каждый наконечник для количественного анализа или блок анализа может содержать пробу с различным разбавлением. После всасывания пробы в блок анализа при помощи устройства для переноса флюида, блок анализа затем может быть инкубирован пробой, чтобы создать условия для прикрепления любого присутствующего заданного аналита к поверхности захвата. Описанные в этом примере инкубации могут быть проведены при комнатной температуре в течение заданного периода времени, например, в течение 10 минут, или могут быть проведены при нагревании описанного здесь устройства системы. Блок анализа может быть введен в зацепление с блоком реагента, содержащим реагент, соответствующий проводимому количественному анализу в каждом индивидуальном блоке анализа, который имеет поверхность захвата для такого количественного анализа. В этом примере, первым реагентом является раствор для обнаружения при проведении анализа ELISA, например, который содержит антитело, такое как меченое анти-протеином антитело, отличающееся от поверхности захвата. Раствор для обнаружения затем удаляют из блока анализа и всасывают промывочный раствор в блок анализа для удаления любого избытка раствора для обнаружения. Может быть использовано множество операций промывки. Финальным добавляемым реагентом является субстрат фермента, который производит связывание раствора для обнаружения с хемилюминесценцией. Затем субстрат фермента удаляют из блока анализа и результаты анализа считывают при помощи устройства обнаружения системы. В каждой описанной здесь операции могут быть проведены необходимые описанные инкубации. В этом примере, весь процесс после установки патрона в систему является автоматическим и протекает в соответствии с протоколом или набором команд, вводимых в программируемую систему.
Один примерный способ начинают вводом пробы крови в лунку для крови. Проба затем может быть отобрана наконечником для отбора и введена в лунку для отделения плазмы крови. Альтернативно, кровь может быть непосредственно введена в лунку, которая содержит сепаратор крови. Например, отделение плазмы крови может быть осуществлено при помощи различных описанных здесь способов. В этом примере, отделение плазмы крови может быть осуществлено с использованием намагничиваемых шариков и антител, чтобы удалить компоненты крови, которые не являются плазмой крови. Плазма крови затем может быть перенесена при помощи наконечника отбора плазмы крови, чтобы не загрязнять пробу цельной кровью с наконечника отбора крови. В этом примере, наконечник отбора плазмы крови может отбирать заданное количество разбавителя для разбавления пробы плазмы крови. Разбавленную пробу плазмы крови затем распределяют в блоки (наконечники) анализа для связывания с поверхностью захвата. Блоки анализа могут быть инкубированы для создания условий для протекания реакции на поверхности захвата. Блок анализа затем может быть использован для сбора конъюгата для связывания с реакцией в блоке анализа. Конъюгат может иметь составную часть, которая позволяет обнаруживать представляющий интерес аналит при помощи устройства обнаружения, такого как фотоприемник. После добавления конъюгата в блок анализа, реакция может быть инкубирована. В примерном способе использования примерного устройства, показанного на фиг.1, блок реагента, содержащий промывочный раствор для конъюгата, затем вводят в контакт с блоком анализа для удаления любого избытка конъюгата, который может помешать обнаружению аналита. После промывки избытка конъюгата, в блок анализа может быть добавлен субстрат для обнаружения. Кроме того, в соответствии с одним из примеров, показанным на фиг.1, в данном способе может быть использован блок (наконечник) калибровки, который используют во всех описанных в этом параграфе операциях, за исключением отбора и распределения пробы. Обнаружение и измерения с использованием блока калибровки могут быть использованы для калибровки обнаружения и измерений аналита в пробе. Далее описаны другие процессы и способы, аналогичные описанным в этом примере.
Любые телесные жидкости, которые могут содержать представляющий интерес аналит, могут быть использованы для анализа в системе или устройстве в соответствии с настоящим изобретением. Например, во входной лунке или блоке отбора пробы в соответствии с одним из примеров, показанным на фиг.1, можно собирать и хранить любой тип обычно используемых телесных жидкостей, в том числе (но без ограничения) кровь, сыворотку крови, слюну, мочу, гастрические и дигестионные флюиды, слезы, кал, сперму, вагинальную жидкость, интерстициальные жидкости, полученные из опухолевой ткани, и цереброспинальную жидкость. В одном варианте, телесная жидкость представляет собой кровь, которая может быть отобрана из кончика пальца. В одном варианте, проба телесной жидкости представляет собой пробу плазмы крови.
Телесная жидкость может быть отобрана у пациента и распределена в устройстве при помощи различных средств, в том числе (но без ограничения) при помощи трубки, инъекции или пипетки. В одном варианте, ланцет прокалывает кожу и отбирает пробу с использованием, например, силы тяжести, капиллярного действия, всасывания или вакуума. Ланцет может быть частью устройства или частью системы, или отдельным компонентом. При необходимости, ланцет может быть приведен в действие при помощи различных механических, электрических, электромеханических или любых других известных механизмов приведения в действие, или любой их комбинации. В другом варианте, никакой активный механизм не требуется, так как сам пациент может вводить телесную жидкость в устройство, например, когда вводят пробу слюны. Набранный флюид может быть помещен в лунку или блок для сбора пробы устройства. В соответствии с некоторыми вариантами, пользователь приводит в действие ланцет и капиллярную трубку для сбора пробы внутри устройства.
Объем телесной жидкости, используемый в описанном здесь способе или устройстве, обычно составляет ориентировочно меньше чем 500 мкл, и может составлять ориентировочно от 1 до 100 мкл. При необходимости проба от 1 до 50 мкл, от 1 до 40 мкл, от 1 до 30 мкл, от 1 до 10 мкл или даже от 1 до 3 мкл может быть использована для обнаружения аналита с использованием заявленного флюидного устройства. В одном варианте, объем пробы составляет 20 мкл.
В одном варианте, объем телесной жидкости, используемой для обнаружения аналита с использованием заявленных устройств, систем или способов, равен объему одной капли жидкости. Например, одна капля крови из уколотого пальца может образовать пробу телесной жидкости для анализа с использованием устройства, системы или способа в соответствии с настоящим изобретением.
В соответствии с некоторыми вариантами, телесные жидкости используют непосредственно для обнаружения аналитов, присутствующих в телесной жидкости, без дополнительной обработки. Однако при необходимости может быть проведена предварительная обработка телесных жидкостей до проведения анализа в устройстве. Выбор вида предварительной обработки зависит от типа использованной телесной жидкости и/или от природы исследуемого аналита. Например, когда аналит присутствует при низком уровне в пробе телесной жидкости, проба может быть концентрирована при помощи любого обычного средства, чтобы повысить концентрацию аналита. Способы повышения концентрации аналита включают в себя (но без ограничения) сушку, выпаривание, центрифугирование, седиментацию, осаждение и амплификацию. Когда аналитом является нуклеиновая кислота, она может быть экстрагирована с использованием различных литических ферментов или химических растворов, или с использованием полимеров для связывания нуклеиновой кислоты, в соответствии с инструкциями фирм-производителей. Когда аналитом является молекула на поверхности или внутри клетки, экстрагирование может быть осуществлено с использованием различных литических ферментов, в том числе (но без ограничения) антикоагулянтов, таких как этилендиаминтетраацетат или гепарин, денатурированный детергент, такой как SDS, или не денатурированный детергент, такой как Thesit, деоксилат натрия, тритон Х-100 и tween-20.
В одном варианте, пациент отбирает пробу телесной жидкости при помощи шприца. Проба может быть введена в шприц через волосную (капиллярную) трубку. В варианте измерения аналита в пробе крови, пациент прокалывает кончик пальца и касается внешнего края стеклянной капиллярной трубки, так чтобы произвести всасывание крови за счет капиллярного действия и ввести необходимый объем крови в капиллярную трубку. В некоторых случаях, объем пробы известен. В соответствии с некоторыми вариантами, объем пробы лежит в диапазоне ориентировочно 5-20 мкл, или же это может быть другой подходящий диапазон.
В другом варианте, способ и систему используют для получения пробы плазмы крови, главным образом не содержащей эритроцитов. При проведении количественного анализа, аналиты часто содержатся в плазме крови, а эритроциты могут помешать реакции.
При измерении пробы крови, представляющие интерес аналиты часто находятся в сыворотке крови или в плазме крови. Для клинических целей, часто необходимо связать окончательную концентрацию множества испытаний крови с концентрацией сыворотки крови или плазмы крови в разбавленной пробе. Во многих случаях, сыворотка крови или плазма крови представляют собой предпочтительную контрольную среду в лаборатории. Две операции могут потребоваться ранее проведения количественного анализа, а именно, разбавление пробы и удаление эритроцитов. Пробы крови могут иметь существенно отличающиеся объемы, занимаемые эритроцитами (при изменении гематокрита ориентировочно 20-60%). Более того, в устройстве в месте ухода за больным, когда систему анализа использует не квалифицированный персонал, объем полученной пробы может не соответствовать необходимому объему. Если не произвести изменение этого объема, то это может привести к ошибке в измеренных концентрациях аналитов.
В соответствии со связанным, но отдельным вариантом осуществления, в соответствии с настоящим изобретением предлагается способ отбора плазмы крови из пробы крови, который предусматривает перемешивание пробы крови в присутствии намагничиваемых частиц в блоке отбора пробы, причем намагничиваемые частицы содержат поверхность захвата антитела для связывания не плазменных порций пробы крови, и наложение магнитного поля поверх зоны сбора плазмы крови, для перемешивания пробы крови, чтобы получить суспензию не плазменных порций пробы крови поверх зоны сбора плазмы крови, за счет чего отбирают плазму из пробы крови.
Для обработки проб крови, устройство или система в соответствии с настоящим изобретением может иметь магнитный реагент, который связывает эритроциты и позволяет произвести магнитное удаление эритроцитов из плазмы крови. Реагент может иметь лиофилизированную форму или может иметь вид жидкой дисперсии. Реагент, содержащий намагничиваемые частицы (например, размером около 1 мкм) может быть покрыт антителом антигена эритроцита или молекулы адаптера. В соответствии с некоторыми вариантами, реагент также содержит антитела, несвязанные с антигенами поверхности эритроцита, которые могут быть немечеными или мечеными долей адаптера (такой как биотин, дигоксигенин или флуоресцеин). В варианте анализа пробы крови, эритроциты в разбавленной пробе совместно агглютинируют с намагничиваемыми частицами, добавленными за счет фазы раствора антитела. Альтернативно, лектин, который идентифицирует углевод поверхности эритроцита, может быть использован в качестве агента совместной агглютинации. Иногда используют комбинацию агентов совместной агглютинации. Иногда используют также комбинации агентов агглютинации эритроцитов. Альтернативно, устройство в соответствии с настоящим изобретением может иметь фильтр крови, такой как прокладка из стекловолокна, помогающая отделению эритроцитов из пробы крови.
Когда кровь перемешивают с магнитным реагентом, может происходить совместная агглютинация, в которой многие, если не все, эритроциты образуют смешанный агглютинат с намагничиваемыми частицами. Процесс растворения и перемешивания реагента осуществляют за счет многократного всасывания с использованием наконечника в соответствии с настоящим изобретением или наконечника в виде пипетки. После образования намагничиваемой массы, эта масса может быть отделена от плазмы крови за счет использования магнита, который удерживает массу на месте во время выхода плазмы крови из наконечника. В одном варианте, плазма крови выходит из наконечника самотеком в вертикальном направлении, пока магнит удерживает массу на месте. В другом варианте, плазма крови выходит из наконечника за счет приложения вакуума или давления, пока масса удерживается внутри наконечника. Плазма крови может быть введена в лунку, в другой наконечник или в блок анализа в соответствии с настоящим изобретением.
Пример способа отделения плазмы крови в соответствии с настоящим изобретением показан на фиг.9А-9Е. На фиг.9А показано, что пробу 901 цельной крови всасывают в описанный здесь наконечник 910 отбора пробы, например, в объеме около 20 мл. Затем пробу 901 цельной крови вводят в разделительную лунку 920 (например, в лунку, которая содержит намагничиваемые шарики или частицы) примерного устройства. На фиг.9В показан способ суспендирования и перемешивания магнитного реагента в пробе 902 цельной крови в разделительной лунке (например, реагента, содержащего круглые магнитные частицы и свободные связующие молекулы). На фиг.9С показана воздушная пробка 930 объемом 10 мкл, которая может быть использована для исключения потери материала из наконечника 910. Смесь 902 пробы цельной крови и магнитного реагента инкубируют в течение нескольких секунд (например, от 60 до 180 секунд), чтобы провести реакцию агглютинации.
На фиг.9D показано приложение магнитного поля 940 к смеси 902 пробы цельной крови и магнитного реагента. Магнитное поле 940 может быть приложено при помощи магнитного кольца 942, встроенного в систему, или при помощи других известных магнитных средств. Магнитное поле 940 притягивает любые частицы, которые прилипли к магнитному реагенту. За счет этого, плазма 903 крови, которая не прилипает к магнитному реагенту, может быть отделена от не плазменных порций пробы цельной крови.
На фиг.9Е показан способ распределения пробы 903 плазмы крови, полученной за счет описанного разделения за счет магнитного реагента, в лунку или блок 950 описанного устройства. Проба 903 плазмы крови также может быть введена в наконечник или блок анализа, а также в любую другую часть устройства для количественного анализа, что известно специалисты в данной области. На фиг.9Е показано магнитное поле 940, которое перемещается вместе с наконечником 910 при распределении пробы 903 плазмы крови. В этом примере, отбирают от 5 до 8 мкл плазмы крови из 20 мкл пробы цельной крови. С использованием способа отделения плазмы крови в соответствии с настоящим изобретением, от 1 до 99% пробы цельной крови образуют плазму крови, которую можно отделить. В одном варианте, от 25 до 60% объема пробы цельной крови образуют плазму крови, которую можно отделить.
Для завершения описанного способа могут быть использованы другие примерные операции. Для перемещения пробы плазмы крови в другую лунку или другой блок, может быть использован капиллярный наконечник сбора плазмы крови (которым можно управлять при помощи роботизированной системы или любой другой системы в соответствии с настоящим изобретением), позволяющий собирать пробу плазмы крови за счет капиллярного действия и силы всасывания. Другой операцией может быть разбавление пробы плазмы крови разбавителем. Заданный объем разбавленной пробы плазмы крови затем можно отбирать при помощи соответствующего наконечника. После этого, разбавленная проба плазмы крови может быть перемешана и введена в лунку или блок устройства, для распределения в один или множество блоков анализа устройства в соответствии с настоящим изобретением. Проба также может быть распределена в устройство другого типа, такое как титрационный микропланшет, как это хорошо известно специалистам в данной области.
Примерный способ, показанный на фиг.9А-9Е, может быть использован с другими устройствами и системами, которые отличаются от описанных здесь. Например, наконечник для переноса флюида может содержать агглютинированную массу, а плазма крови может находиться в титрационном микропланшете. Другие известные устройства и системы, как это хорошо известно специалистам в данной области, могут быть использованы также для осуществления отделения плазмы крови.
Проба телесной жидкости также может быть разбавлены иным образом, например, с использованием устройства для отбора пробы, позволяющего произвести разбавление. Корпус устройства для отбора пробы может иметь камеру. В этой камере, между двумя подвижными уплотнительными прокладками, может находиться объем разбавителя. В соответствии с предпочтительным вариантом, объем разбавителя является заданным, например, составляет ориентировочно от 50 мкл до 1 мл, а преимущественно ориентировочно от 100 мкл до 500 мкл.
В соответствии с другим аспектом настоящего изобретения, предлагается способ автоматического обнаружения множества аналитов в пробе телесной жидкости, который включает в себя следующие операции: введение пробы телесной жидкости во флюидное устройство, причем флюидное устройство содержит: блок отбора пробы, сконфигурированный для хранения пробы телесной жидкости; матрицу блоков анализа, причем индивидуальный блок анализа указанной матрицы блоков анализа сконфигурирован для проведения химической реакции, которая дает сигнал, несущий информацию об индивидуальном аналите указанного множества обнаруживаемых аналитов; и матрицу блоков реагентов, причем индивидуальный блок реагента указанной матрицы блоков реагентов содержит реагент. Способ также может предусматривать введение в зацепление индивидуального блока анализа с использованием устройства для переноса флюида. Для продолжения процесса, проба телесной жидкости может быть перенесена из блока отбора пробы в индивидуальный блок анализа с использованием устройства для переноса флюида, а реагент из индивидуального блока реагента может быть перенесен в индивидуальный блок анализа, в результате чего происходит реакция реагента с пробой телесной жидкости, дающая сигнал, несущий информацию об индивидуальном аналите множества подлежащих обнаружению аналитов. В соответствии с некоторыми вариантами, устройство для переноса флюида содержит множество головок, причем индивидуальная головка множества головок сконфигурирована для входа в зацепление с индивидуальным блоком анализа; при этом указанное устройство для переноса флюида содержит программируемое обрабатывающее устройство, сконфигурированное для прямого переноса флюида пробы телесной жидкости из блока отбора пробы и реагента из индивидуального блока реагента в индивидуальный блок анализа.
В некоторых случаях, команды, поступающие в программируемое обрабатывающее устройство, задает, например, пользователь, пациент или фирма-изготовитель. Команды могут поступать от внешнего устройства, такого как персональное электронное устройство или сервер. Команда может управлять операцией переноса пробы телесной жидкости в индивидуальный блок анализа. Например, операция переноса пробы телесной жидкости может изменять степень разбавления пробы телесной жидкости в индивидуальном блоке анализа, для того, чтобы получить сигнал, несущий информацию об индивидуальном аналите множества аналитов, подлежащем обнаружению внутри диапазона обнаружения. В некоторых примерах, степень разбавления пробы телесной жидкости позволяет получить сигналы, несущие информацию по меньшей мере о двух индивидуальных аналитах внутри диапазона обнаружения.
Техника распознавания образов может быть использована для определения того, что обнаружение аналита или множества аналитов при помощи описанного здесь способа произведено внутри заданного диапазона или вне него. Например, могут быть отброшены различимые сигналы, если они находятся вне заданного диапазона. Заданный диапазон может быть образован при калибровке флюидного устройства, а также блоков реагентов и блока анализа. Например, диапазон может быть задан при сборке и настройке (just-in-tune fashion) устройства.
В некоторых случаях, если различимый сигнал аналита, обнаруженный при меньшем коэффициенте разбавления или степени разбавления, превышает сигнал при более высоком коэффициенте разбавления, тогда результат, полученный при меньшем коэффициенте разбавления, должен быть отброшен, как недействительный. В большинстве случаев, концентрации аналита в пробах с различными коэффициентами разбавления дают сигналы, которые уменьшаются при повышении степени разбавления. Если этого не происходит, результаты количественного анализа необходимо проверить. Описанные здесь системы, устройства и способы обеспечивают гибкость при проведении контроля качества, которая отсутствует у многих известных ранее РОС устройств. Описанные здесь системы, устройства и способы обладают многими характеристиками, которые необходимы в лабораторных устройствах.
В одном варианте, пробу разбавляют в таком отношении, которое подходит для количественных анализов как с высокой, так и с низкой чувствительностью. Например, коэффициент разбавления пробы разбавителем может лежат в ориентировочном диапазоне 1:10,000-1:1. Устройство позволяет производить разбавление пробы в различных местах или в разных отношениях. Устройство также позволяет производить последовательные разбавления пробы. В соответствии с другими вариантами, последовательное разбавление внутри устройства или системы позволяет разбавлять пробу до отношения 10,000,000,000:1.
В одном из вариантов, содержащая обнаруживаемый аналит проба может быть перемещена из первого местоположения во второе местоположение за счет всасывания или действия шприца или пипетки. Проба может быть втянута в реакционный наконечник за счет капиллярного действия или пониженного атмосферного давления. В соответствии с некоторыми вариантами, пробу перемещают в различные местоположения, в том числе в матрицу блоков анализа устройства в соответствии с настоящим изобретением и в различные лунки в корпусе устройства в соответствии с настоящим изобретением. Процесс перемещения пробы может быть автоматизирован при помощи описанной здесь системы в соответствии с настоящим изобретением.
Блоки анализа и/или содержащие пробу наконечники также могут быть перемещены из первого местоположения во второе местоположение. Процесс перемещения блока анализа или наконечника отбора пробы может быть автоматизирован и может быть осуществлен при помощи заданного пользователем протокола.
В одном варианте, блоки анализа перемещают для отбора реагента из блока реагента в соответствии с настоящим изобретением. Во многих случаях, перемещение блока анализа может быть автоматизировано. Отбор реагента из блока реагента в блок анализа может быть осуществлен за счет всасывания или действия шприца или пипетки.
После ввода пробы в блок анализа, который содержит поверхность захвата, весь блок может быть инкубирован в течение заданного периода времени, чтобы создать условия для реакции между пробой и поверхностью захвата блока анализа. Период времени, необходимый для никубации реакции, часто зависит от типа проводимого количественного анализа. Процесс может быть автоматизирован при помощи системы в соответствии с настоящим изобретением. В одном варианте, время инкубации составляет от 30 секунд до 60 минут. В другом варианте, время инкубации составляет 10 минут.
Блок анализа также может быть инкубирован при повышенной температуре. В одном варианте, блок анализа инкубируют при температуре в диапазоне ориентировочно от 20 до 70 градусов Цельсия. Блок анализа может быть вставлен в блок нагрева, чтобы повысить температуру блока анализа и/или температуру содержимого блока анализа.
В варианте способа в соответствии с настоящим изобретением, конъюгат добавляют в блок анализа после введения пробы в блок анализа. Конъюгат может иметь молекулу для маркирования аналита, захваченного поверхностью захвата в блоке анализа. Далее описаны примеры конъюгатов и поверхностей захвата. Конъюгатом может быть реагент, который находится внутри блока реагента. Конъюгат может быть распределен в блок анализа за счет всасывания или действия шприца или пипетки. После ввода конъюгата в блок анализа, блок анализа может быть инкубирован, чтобы создать условия для реакции конъюгата с аналитом внутри блока анализа. Время инкубации зависит от типа проводимого количественного анализа или от типа подлежащего обнаружению аналита. Температурой инкубации может быть любая температура, необходимая для протекания реакции.
В соответствии с еще одним аспектом настоящего изобретения, предлагается способ калибровки устройства для автоматического обнаружения аналита в пробе телесной жидкости. Устройство может иметь матрицу адресуемых блоков анализа, сконфигурированную для проведения химической реакции, которая дает различимый сигнал, несущий информацию о наличии или отсутствии аналита, и матрицу адресуемых блоков реагентов, в которой обращаются к каждому из блоков реагентов, соответствующему одному или нескольким адресуемым блокам анализа в указанном устройстве, так что индивидуальные блоки реагентов калибруют по опорному сигналу соответствующего блока (блоков) анализа, ранее сборки матриц в устройстве. Устройство калибруют путем калибровки блоков анализа и блоков реагентов ранее их установки в устройство. Устройство затем может быть собрано с использованием калиброванных компонентов, что делает устройство, а также способ и систему, в которых используют устройство, модульными компонентами.
Калибровка может быть проведена с использованием предварительного измерения характеристик реагентов для количественного анализа, таких как конъюгаты, ранее сборки блоков анализа и блока реагента в устройство в соответствии с настоящим изобретением. Информация и алгоритмы калибровки могут храниться в сервере, подключенном при помощи беспроводной связи к системе для количественного анализа. Калибровка может быть произведена заранее или ретроспективно, за счет количественных анализов, проведенных в копиях системы в отдельном местоположении, или за счет использования информации, полученной во время использования системы для количественного анализа.
В одном аспекте, контрольный материал может быть использован в устройстве или системе для измерения или проверки степени разбавления пробы телесной жидкости. Например, количественные анализы на базе твердой фазы, такие как EL1SA, представляют собой количественный анализ, в котором используют реагент в твердой фазе, контроль качества которого затруднен без разрушения его функции. Описанные здесь системы и способы позволяют определять разбавление, полученное в РОС системе, с использованием одноразового устройства с автоматизированным перемешиванием и/или разбавлением.
В одном варианте, способ предусматривает проведение ретроспективного анализа, например, за счет использования сервера в реальном масштабе времени для анализа данных ранее выдачи результатов. Например, количественный анализ и контрольный количественный анализ могут проводиться одновременно. Контрольный количественный анализ позволяет произвести измерение ожидаемого разбавления пробы. В некоторых примерах, контрольный количественный анализ позволяет проверить разбавление пробы и, таким образом, разбавление пробы для количественного анализа или множества количественных анализов, проводимых внутри системы, которую можно считать точной.
Способ измерения объема жидкой пробы может предусматривать: реагирование известного количества контрольного аналита в жидкой пробе с реагентом, чтобы получить различимый сигнал, несущий информацию о контрольном аналите; сравнение интенсивности указанного различимого сигнала с ожидаемой интенсивностью указанного различимого сигнала, причем ожидаемая интенсивность указанного сигнала несет информацию об ожидаемом объеме жидкой пробы, при этом указанное сравнение позволяет произвести измерение указанного объема указанной жидкой пробы. Во многих случаях, контрольный аналит отсутствует в указанной жидкой пробе в обнаруживаемом количестве.
В одном варианте, способ может дополнительно предусматривать проверку объема указанной жидкой пробы, когда результаты измерения объема пробы составляют ориентировочно меньше 50% ожидаемого объема жидкой пробы.
Например, способ, в котором используют описанные здесь устройство или систему, может дополнительно предусматривать: реагирование пробы телесной жидкости, содержащей заданный аналит, с реагентом, чтобы получить различимый сигнал, несущий информацию о заданном аналите; и измерение количества заданного аналита в пробе телесной жидкости с использованием интенсивности указанного различимого сигнала, несущего информацию о заданном аналите, и измерение указанного объема указанной жидкой пробы. Жидкой пробой и пробой телесной жидкости может быть одна и та же проба. В соответствии с некоторыми вариантами, контрольный аналит не реагирует с заданным аналитом в пробе телесной жидкости, так что отсутствует взаимодействие при обнаружении заданного аналита.
В некоторых случаях, проба жидкости и проба телесной жидкости представляют собой различные пробы. Например, контрольной жидкостью является вода, а пробой телесной жидкости является проба крови или, в другом примере, контрольной жидкостью является проба слюны, а пробой телесной жидкости является проба крови.
Контрольным аналитом может быть (но без ограничения) меченый флуоресцеином альбумин, меченый флуоресцеином IgG, анти-флуоресцеин, анти-дигоксигенин, меченый дигоксигенином альбумин, меченый дигоксигенином IgG, биотинилированные протеины, и IgG не человека. Специалистам в данной области известные и другие примерные контрольные аналиты. В одном варианте, контрольный аналит не содержится в пробе телесной жидкости человека.
Описанная здесь РОС система, сконфигурированная для обнаружения множества аналитов внутри пробы, может иметь возможности для разбавления и перемешивания жидкостей. Во многих случаях, автоматизированная система позволяет использовать или пользователь может использовать контрольный количественный анализ для измерения действительно достигнутого разбавления и коэффициента разбавления в системе калибровки. Например, контрольный аналит никогда не может быть обнаружен в представляющей интерес пробе и высушен в блоке реагента. Известное количество высушеного контрольного аналита может быть перемешано с пробой в блоке реагента.
Концентрация аналита может быть измерена для того, чтобы определить объем пробы и любое проведенное разбавление пробы.
В качестве примеров контрольных аналитов для иммунологического анализа можно привести (но без ограничения): меченый флуоресцеином протеин, биотинилироапнный протеин, меченый флуоресцеином, меченый Axlexa™, меченый родамином, меченый красный пигментом Texas Red, иммуноглобулин. Например маркирование может быть обеспечено за счет по меньшей мере двух гаптенов, связанных с каждой молекулой протеина. В соответствии с некоторыми вариантами, 1-20 гаптенов связаны с каждой молекулой протеина. В соответствии с другим вариантом, 4-10 гаптенов связаны с каждой молекулой протеина. Многие протеины имеют большое число свободных аминогрупп, с которыми могут быть связаны гаптены. Во многих случаях, модифицированные гаптенами протеины являются стабильными и растворимыми. Кроме того, такие гаптены как флуоресцеин и красный пигмент Texas Red являются достаточно большими и жесткими и позволяют создавать антитела с высоким сродством (например, гаптен является достаточно большим, чтобы заполнить место связывания антитела). В соответствии с некоторыми вариантами, гаптены могут быть прикреплены к протеинам с использованием реагентов, таких как изотиоцианат флуоресцеина и эфир NHS флуоресцеин карбоновой кислоты, чтобы создать контрольные аналиты, в которых опознаваемой при помощи системы количественного анализа частью является гаптен.
В соответствии с некоторыми вариантами, в способе используют высушенный контрольный аналит. В некоторых примерах, высушенный контрольный аналит избегает разбавления пробы, что позволяет сделать контрольный аналит более стабильным. Композиция высушенного контрольного аналита может быть выбрана так, что он быстро и/или полностью растворяется при воздействии жидкой пробы. В соответствии с некоторыми вариантами, контрольным аналитом может быть аналит с высоким сродством с антителами. В некоторых случаях, контрольным аналитом может быть аналит, который не имеет побочной реакции с любым эндогенным компонентом пробы. Кроме того, аналит является дешевым и/или легким в изготовлении. В соответствии с некоторыми вариантами, контрольный аналит является стабильным в течение срока службы описанных здесь устройства или системы. В качестве примерных носителей, используемых для создания аналитов с ковалентно связанными гептанами, можно привести протеины, такие как (но без ограничения) альбумин, IgG и казеин. В качестве примерных полимерных носителей, используемых для создания новых аналитов с ковалентно связанными гептанами можно привести (но без ограничения) декстран и поливинилпирролидон. В качестве примерных наполнителей, используемых для образования и стабилизации контрольных аналитов можно привести (но без ограничения) сахарозу, соли и буферные растворы (такие как фосфат натрия и трис хлорид).
Описанные здесь контрольный аналит и способ калибровки могут быть использованы различным образом, в том числе в соответствии с описанными здесь примерами. Например, способ позволяет измерять объем пробы. В соответствии с некоторыми вариантами, способ позволяет измерять разбавление или коэффициент разбавления или степень разбавления пробы. В некоторых случаях, способ позволяет измерять концентрацию контрольного аналита в пробе. В описанных здесь системе или устройстве для обнаружения множества аналитов, измерения по данному способу с использованием контрольного аналита могут быть использованы для проверки измерений заданных аналитов. Например, устройство для переноса флюида с множеством головок может быть использовано для распределения жидкости в множество блоков анализа, в том числе и в контрольный блок. В некоторых случаях полагают, что, при распределении жидкости в множество блоков, индивидуальные блоки получают одинаковые количества жидкости. В соответствии с некоторыми вариантами, описанный здесь способ проверки с контрольным аналитом может быть использован для проверки того, что был отобран или использован правильный объем пробы внутри устройства или системы. В другом варианте, указанный способ может быть использован для проверки объема разбавителя, введенного в пробу. Кроме того, могут быть проверены коэффициент разбавления или степень разбавления. В соответствии с еще одним вариантом, способ проверки с контрольным аналитом может быть использован для проверки того, что правильный объем пробы был распределен в множество блоков.
На фиг.10 показан примерный способ описанного здесь контрольного количественного анализа, в котором используют известное количество контрольного аналита. Блок 1010 ранее введения (сборки) в патрон может быть заполнен раствором 1001, который содержит известную массу контрольного аналита 1002. Жидкость из раствора может быть удалена и блок 1010 высушен, чтобы оставить контрольный аналит 1002 в блоке 1010. Блок 1010 затем может быть вставлен в устройство и направлен для использования. Когда блок 1010 используют и вводят в него пробу или разбавитель 1003 в ожидаемом количестве, проба 1003 перемешивается с высушенным контрольным аналитом 1002 внутри блока 1010 для создания контрольного раствора 1004 с ожидаемой концентрацией. Контрольный раствор 1004 при необходимости может быть разбавлен. В одном варианте, контрольный аналит 1002 может быть обнаружен аналогично обнаружению заданного аналита в устройстве. Измеряют концентрацию контрольного аналита в контрольном растворе 1004. Измерение концентрации может быть использовано для расчета объема пробы 1003, добавленной для создания контрольного раствора 1004. Таким образом, пользователь может сравнивать измеренный объем пробы 1003 с ожидаемым объемом пробы 1003.
В соответствии с одним из примеров, эритроциты могут быть удалены из пробы крови. Однако, если некоторая часть эритроцитов осталась или если эритроциты не удаляют из пробы крови, то способ с контрольным аналитом может быть использован для корректировки влияния эритроцитов в пробе крови. Так как гематокрит может существенно изменяться (например, от 20-60% полного объема пробы), то количество аналита в фиксированном или ожидаемом объеме (v) крови может быть функцией гематокрита (Н выражен здесь в виде десятичной дроби). Например, количество аналита с концентрацией С в плазме крови составляет C*v*(1-H). Таким образом, количество пробы с гематокритом 0.3 в 1.4 раза больше, чем количество пробы с гематокритом 0.5. В примерном варианте, неразбавленная кровь может быть распределена в описанном здесь устройстве и эритроциты могут быть удалены. Затем может быть измерена концентрация контрольного аналита во фракции плазмы крови, чтобы оценить объем пробы плазмы крови и определить гематокрит.
В соответствии с некоторыми вариантами, может потребоваться смыть несвязанный конъюгат с места реакции, чтобы исключить неверное обнаружение несвязанных конъюгатов. Ограничивающей операцией многих иммунологических анализов является операция промывки. Компромисс минимального переноса и высокой чувствительности зависит от удаления промывкой несвязанного конъюгата. Операция промывки может быть сильно ограничена в формате титрационного микропланшета из-за трудности удаления промывочной жидкости из лунки (например, при помощи автоматического средства). Блок анализа устройства и системы в соответствии с настоящим изобретением обладает рядом преимуществ в проведении обработки жидкостей. Одним из преимуществ является повышение отношения сигнал - шум количественного анализа.
Удаление конъюгата может быть затруднено, если конъюгаты прилипают к краям блоков анализа устройства и когда, например, нет избытка промывочного раствора.
Промывка конъюгата может быть осуществлена за счет нагнетания промывочного раствора сверху или всасывания промывочного раствора вверх и удаления жидкости аналогично загрузке пробы. Промывка при необходимости может быть повторена несколько раз.
Когда в количественном анализе используют промывочный буферный раствор, устройство может хранить промывочный буферный раствор в блоках реагентов, и блок анализа может быть введен во флюидную связь с промывкой. В одном варианте, промывочный реагент позволяет удалять за счет промывки ориентировочно до 99,99.9 или 99.999% несвязанного реагента из блоков анализа. Как правило, предпочтительной является высокая промывочная способность, позволяющая получить высокую степень снижения нежелательных фоновых сигналов. Эффективность промывки, которую типично определяют как отношение сигнала от данного количественного анализа к полному значению сигнала, полученного за счет количественного анализа без операции промывки, легко может быть определена при помощи стандартных экспериментов. Обычно является предпочтительным увеличение объема промывочного раствора и времени инкубации, но без снижения сигналов от данного количественного анализа. В соответствии с некоторыми вариантами, промывку осуществляют с использованием ориентировочно от 50 мкл до 5000 мкл промывочного буферного раствора, а преимущественно, ориентировочно от 50 мкл до 500 мкл промывочного буферного раствора, в течение времени ориентировочно от 10 до 300 секунд.
Кроме того, предпочтительным является использование нескольких циклов промывки небольшими объемами промывочного раствора, которые разделены промежутками времени, когда промывочный раствор не используют. Эта последовательность позволяет осуществить диффузионную промывку, в которой меченые антитела диффундируют со временем в объем промывочного раствора от защищенных частей блока анализа, таких как их края или поверхности, с которыми эти антитела слабо связаны, после чего они могут быть удалены, когда промывочный раствор удаляют от места реакции.
Во многих случаях, последней операцией является распределение субстрата фермента для обнаружения конъюгата при помощи оптических или электрических средств. Далее описаны примеры субстратов.
Например, реагентом в индивидуальном блоке реагента заявленного устройства может быть субстрат фермента для иммунологического анализа. В другом варианте, операция переноса реагента в виде субстрата от индивидуального блока реагента может быть повторена после реакции в месте захвата. Например, субстрат фермента переносят в место реакции и инкубируют. После измерения полученного сигнала количественного анализа, использованный субстрат может быть удален и заменен свежим субстратом, после чего вновь измеряют сигнал количественного анализа. Сигнал, несущий информацию об индивидуальном подлежащем обнаружению аналите при помощи описанной здесь системы, получают с использованием первого и второго введения субстрата. Второй субстрат обычно является таким же, как первый субстрат. В одном варианте, второй субстрат переносят в место реакции от второго блока реагента заявленного устройства. В другом варианте, второй субстрат переносят в место реакции от того же самого блока реагента, что и первый субстрат. Перенос второго субстрата создает вторую реакцию, позволяющую получить второй сигнал, несущий информацию об индивидуальном аналите. Интенсивность исходного сигнала и вторую интенсивность второго сигнала сравнивают, чтобы вычислить окончательную интенсивность сигнала, несущего информацию об индивидуальном аналите, и оценить правильность проведения количественного анализа.
В одном варианте могут быть использованы интенсивности множества сигналов для контроля качества количественного анализа. Например, если сигналы отличаются на 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100% или больше, то результаты количественного анализа можно игнорировать (отбросить).
В одном варианте, описанный здесь способ предусматривает повторную загрузку пробы и/или конъюгата обнаружения (меченого ферментом антитела) и/или субстрата фермента и пробы, чтобы подтвердить сигнал количественного анализа или провести внутреннюю проверку. Например, можно повторно использовать описанные здесь наконечник для количественного анализа или блок анализа, чтобы проверить функциональную зависимость, и/или чтобы ввести дополнительную пробу или контрольные материалы, чтобы получить второй сигнал.
В некоторых случаях, способ повторной загрузки субстрата в блок фермента может быть осуществлен при помощи описанной здесь системы, которая позволяет автоматически переносить жидкие пробы и реагенты в блоки анализа. В случае некоторых количественных анализов не требуется, чтобы система выдавала результаты немедленно или вовремя, поэтому описанный здесь способ проверки позволяет повысить надежность результатов. Отклик, наблюдаемый после итераций добавки субстрата фермента, может быть использован для проверки исходного отклика или для вычисления восстановления пика.
Проведенные эксперименты показали, что за счет добавления второго субстрата фермента в блок анализа можно поддерживать воспроизводимость результатов. В соответствии с некоторыми вариантами, контрольный способ с использованием блока анализа позволяет провести повторные анализы, которые дают отклик существенно ниже ожидаемого.
При осуществлении любых описанных здесь контрольных способов могут возникать различные ошибки (погрешности). В качестве примеров ошибок количественного анализа можно привести (но без ограничения) погрешности за счет неточного изготовления блока анализа или устройства, за счет неточного всасывания пробы и/или одного или нескольких реагентов, за счет неточной установки блока анализа относительно фотоумножителя при обнаружении, и за счет пропуска блока анализа в устройстве или системе.
В соответствии с некоторыми вариантами настоящего изобретения, предлагается способ получения фармакологических данных, полезных для оценки эффективности и/или токсичности лекарственного средства, на лабораторных животных, с использованием заявленных флюидных устройств или систем.
Когда используют лабораторных животных в преклинической оценке лекарственного средства, часто необходимо умерщвлять животное для отбора количества крови, достаточного для проведения количественного анализа, чтобы обнаружить представляющий интерес аналит. Это вызывает финансовые и этические отрицательные последствия, поэтому предпочтительным является отбор такого количества крови, чтобы лабораторное животное не нужно было умерщвлять. Кроме того, это также позволяет использовать одно и то же животное для испытаний в различные моменты времени, что позволяет произвести более эффективную оценку воздействия лекарства на одно и то же животное. В среднем, например, у мыши отбирают 6-8 мл крови на 100 г веса тела. Преимуществом настоящего изобретения является очень малый объем крови, который требуется для осуществления преклинических испытаний на мышах или других небольших лабораторных животных. В соответствии с некоторыми вариантами, отбирают ориентировочно от 1 мкл до 50 мкл крови. В одном из вариантов, отбирают ориентировочно от 1 мкл до 10 мкл крови. В соответствии с предпочтительными вариантами, отбирают около 5 мкл крови.
Другое преимущество, связанное с тем, что лабораторное животное остается живым, становится очевидным в ходе преклинических исследований. Когда, например, множество мышей используют для контроля уровней аналита в течение времени в телесной жидкости лабораторных животных, тогда в результаты испытания вводится переменный параметр за счет использования множества животных. Если же для контроля уровней аналита в течение времени использовать только одно лабораторное животное, то может быть проведено более точное преклиническое испытание.
В соответствии с некоторыми вариантами настоящего изобретения, предлагается способ автоматического мониторинга соблюдения пациентом режимов лечения с использованием заявленных устройств или систем. Способ включает в себя следующие операции: создание условий для реагирования пробы телесной жидкости с реагентами количественного анализа в устройстве, чтобы получить различимый сигнал, несущий информацию о наличии аналита в указанной пробе; обнаружение указанного сигнала с использованием указанного устройства; сравнение указанного сигнала с известным профилем, связанным с указанным лечением, чтобы определить, что указанный пациент соблюдает или не соблюдает режим лечения; и уведомление пациента об указанном соблюдении или не соблюдении.
В другом варианте, система и способы в соответствии с настоящим изобретением образуют средство обнаружения новых биомаркеров и/или средство для оценки связи трендов таких маркеров с результатами лечения заболеваний.
В другом варианте, система и способы в соответствии с настоящим изобретением позволяют идентифицировать тренды уровней биомаркеров и снабдить пациента информацией о ежедневной регулировке дозы лекарства до оптимального уровня для этого пациента (например, при адаптивном выборе диапазона дозы).
В соответствии с некоторыми вариантами, несоблюдение пациентом режимов лечения связано с приемом неверной дозы лекарственного средства, в том числе (но без ограничения) с приемом множества доз или с полным отсутствием приема дозы, или с не надлежащим перемешиванием лекарственных средств. В соответствии с предпочтительными вариантами, пациенту немедленно сообщают о несоблюдении режимов лечения, после сравнения сигнала с известным профилем.
Пациент или субъект при проведении клинического испытания может забыть отобрать пробу телесной жидкости для описанного здесь анализа. В соответствии с некоторыми вариантами, предлагается способ предупреждения пациента о необходимости отбора пробы телесной жидкости с использованием описанного здесь устройства, который включает в себя следующие операции: использование протокола, исполняемого на указанном устройстве, причем указанный протокол находится во внешнем устройстве, связанном с указанным пациентом, и который содержит время и дату испытания указанной пробы телесной жидкости; и уведомление пациента о необходимости испытания указанной телесной жидкости в указанные дату и время, если указанная проба еще не была испытана. В соответствии с некоторыми вариантами, пациент может быть уведомлен с использованием беспроводной связи, как уже было указано здесь выше. Соблюдение терапевтических режимов может быть улучшено за счет использования подсказок на дисплее и получения ответов от пациентов (например, при помощи сенсорного экрана).
Пациент может быть снабжен устройством, когда ему выписывают лекарства, при помощи любого из известных способов, например, он может получить устройство в аптеке. Аналогично, проходящий клиническое обследование субъект может получить такие устройства при начале клинического обследования. Контактная информация о пациенте или субъекте, в том числе (но без ограничения) номер сотового телефона, адрес электронной почты, адрес текстовых сообщений или адрес другого средства беспроводной связи, в это время может быть введен во внешнее устройство и объединен, например, с базой данных пациента или субъекта. Программное обеспечение на внешнем устройстве может содержать драйвер или другую программу, которая позволяет обнаруживать, что сигнал, генерируемый при помощи устройства обнаружения, еще не получен внешним устройством, например, в заданное время, и тогда внешнее устройство может послать предупреждение пациенту о необходимости взять пробу телесной жидкости.
В одном варианте, систему непосредственно передают потребителю, который использует ее в стиле жизни или при занятиях спортом. Подходящий стиль жизни и данные физических упражнений могут быть введены в систему, так что могут быть проведены измерения параметров, свидетельствующих о растяжении мышц и об анаэробном метаболизме (например, об уровне молочной кислоты). В соответствии с некоторыми вариантами, система может быть достаточно малой, так что она может быть переносной.
В другом варианте, система особенно хорошо подходит для измерения маркеров в крови небольших животных, таких как крысы и мыши, которых обычно используют в преклинических испытаниях. Такие животные имеют небольшой объем крови. Так что системы количественного анализа, требующие очень малых объемов пробы, являются особенно полезными, особенно при проведении длительных испытаний, когда необходимо взять несколько проб у одного животного с малыми промежутками времени друг от друга. Это соображения являются особенно важными, когда необходимо измерять в параллель несколько аналитов.
В одном варианте, система позволяет производить удобную упаковку, в надежном для отгрузки виде, нескольких элементов, которые требуются для проведения множества сложных количественных анализов. Например, элементы для количественного анализа могут быть введены в корпус с защелкиванием.
Количественные анализы
Различные виды количественного анализа могут быть выполнены с использованием флюидного устройства в соответствии с настоящим изобретением, для обнаружения представляющего интерес аналита в пробе. Широкое разнообразие маркеров, используемых в настоящее время, может быть использовано при проведении заявленных количественных анализов. В соответствии с некоторыми вариантами, маркеры обнаруживают при помощи спектроскопических, фотохимических, биохимических, электрохимических, иммунохимических или других химических средств. Например, полезные маркеры нуклеиновой кислоты включают в себя радиоизотопы 32Р, 35S, флуоресцентные красители, реагенты с плотными электронами (electron-dense) и ферменты. В научной и патентной литературе описано широкое многообразие маркеров, подходящих для маркирования биологических компонентов, которые обычно применимы для маркирования биологических компонентов в соответствии с настоящим изобретением. В качестве подходящих маркеров можно привести радионуклеотиды, ферменты, субстраты, кофакторы, ингибиторы, флуоресцентные компоненты, хемилюминесцентные компоненты, биолюминесцентные маркеры или колориметрические маркеры. Реагентами, определяющими специфичность количественного анализа, могут быть, например, моноклоновые антитела, поликлоновые антитела, протеины, пробы нуклеиновой кислоты или другие полимеры, такие как матрицы сродства, углеводы или липиды. Обнаружение может быть проведено с использованием любых известных способов, в том числе с использованием спектрофотометрического или оптического прослеживания радиоактивного, флуоресцентного или люминесцентного маркеров, или с использованием других способов, в которых прослеживают молекулу на основании ее размера, заряда или сродства. Обнаруживаемым параметром может быть любой материал, который имеет обнаруживаемое физическое или химическое свойство. Такие обнаруживаемые маркеры широко используют в областях электрофореза геля, колоночной хроматографии, твердых субстратов, спектроскопических исследований и т.п., причем, как правило, используемые в таких областях маркеры могут быть использованы в соответствии с настоящим изобретением. Таким образом, маркер содержит без ограничения любую композицию, которая может быть обнаружена при помощи спектроскопических, фотохимических, биохимических, иммунохимических, основанных на пробах нуклеиновой кислоты, электрических, оптико-термических или других химических средств.
В соответствии с некоторыми вариантами, маркер может быть связан прямо или косвенно с подлежащей обнаружению молекулой, такой как продукт, субстрат или фермент, в соответствии с хорошо известными способами. Как уже было указано здесь выше, используют широкое разнообразие маркеров, причем выбор маркера зависит от требуемой чувствительности, легкости конъюгации соединения, от требований стабильности, от имеющихся измерительных средств и возможностей удаления отходов. Не радиоактивные маркеры часто прикрепляют при помощи косвенных средств. Как правило, специфический для аналита рецептор связывают с генерирующим сигнал компонентом. Иногда рецептор аналита связывают с молекулой адаптера (такого как биотин или авидин), при этом набор реагентов для количественного анализа содержит связующий компонент (такой как биотинилированный реагент или авидин), который образует связь с адаптером и с аналитом. Аналит связан со специфическим рецептором в месте реакции. Меченый реагент может образовывать комплекс с сандвичевой структурой, в которой аналит находится в центре. Реагент может также образовывать комплекс с аналитом для рецепторов на месте реакции или связывать свободные рецепторы на месте реакции, не занятом аналитом. Маркер сам по себе является обнаруживаемым или может быть связан с сигнальной системой, такой как обнаруживаемый фермент, флуоресцентное соединение, хемилюминесцентное соединение или хемилюминогенный компонент, такой как фермент с люминогенным субстратом. Может быть использовано несколько лигандов и анти-лигандов. Когда лиганд имеет природный анти-лиганд, например, биотин, тироксин, дигоксигенин и кортизол, тогда он может быть использован в сочетании с мечеными анти-лигандами. Альтернативно, любое гаптеновое или антигеновое соединение может быть использовано в комбинации с антителом.
В соответствии с некоторыми вариантами, маркер также может быть конъюгирован непосредственно для соединений, генерирующих сигнал, например, за счет конъюгации с ферментом или флуорофором. Представляющими интерес ферментами, такими как маркеры, в первую очередь являются гидролазы, в особенности фосфатазы, эстеразы и гликозидазы, или оксиредуктазы, в особенности пероксидазы. Флуоресцентные соединения включают в себя флуоресцеин и его производные, родамин и его производные, дансильные группы и умбеллиферон. Хемилюминесцентные соединения включают в себя диокситаны, акридиниум эфиры, луциферин и 2,3-дигидрофталазиндионы, такие как люминол.
Способы обнаружения маркеров хорошо известны специалистам в данной области. Так, например, когда маркер является радиоактивным, средством обнаружения является подсчет вспышек или использование фотопленки в случае авторадиографии. Когда маркер является флуоресцентным, он может быть обнаружен за счет возбуждения флуорохрома светом соответствующей длины волны и за счет обнаружения результирующей флуоресценции, например, при помощи микроскопии, визуального контроля, фотопленки, а также при помощи электронных средств обнаружения, таких как цифровые фотокамеры, устройства с зарядовой связью (ПЗС) или фотоумножители и фотоэлементы, или при помощи других устройств обнаружения. Аналогично, ферментные маркеры могут быть обнаружены за счет использования соответствующих субстратов для фермента и обнаружения соответствующего продукта реакции. Наконец, простые колориметрические маркеры часто могут быть просто обнаружены за счет наблюдения связанного с маркером цвета. Например, конъюгатный золотой часто становится розовым, в то время как различные конъюгатные шарики получают цвет шариков.
В соответствии с некоторыми вариантами, различимый сигнал может быть создан с использованием источников люминесценции. Термин люминесценция обычно используют для обозначения излучения света от вещества, возникающего по любым причинам, кроме повышения его температуры. Как правило, атомы или молекулы излучают фотоны электромагнитной энергии (например, свет), когда они перемещаются из возбужденного состояния в состояние более низкой энергии (обычно в основное квантовое состояние). Если возбуждение создает фотон, то процесс люминесценции называют фотолюминесценцией, Если возбуждение создает электрон, то процесс люминесценции называют электролюминесценцией. Более конкретно, электролюминесценция возникает за счет прямого ввода и удаления электронов, чтобы образовать электронно-дырочную пару, и последующей рекомбинации электронно-дырочной пары с излучением фотона. Люминесценцию, которая возникает за счет химической реакции, обычно называют хемилюминесценцией. Люминесценцию, которую создают живые организмы, называют биолюминесценцией. Если фотолюминесценция является результатом разрешенного спином перехода (например, перехода синглет-синглет или перехода триплет-триплет), то процесс фотолюминесценции может быть назван флуоресценцией. Обычно флуоресцентное излучение пропадает при устранении источника возбуждения, по причине кратковременных возбужденных состояний, которые быстро релаксируют за счет разрешенных спином переходов. Если фотолюминесценция является результатом запрещенного спином перехода (например, перехода триплет-триплет), то процесс фотолюминесценции обычно называют фосфоресценцией. Обычно фосфоресцентное излучение сохраняется длительное время после устранения источника возбуждения, по причине длительных возбужденных состояний, которые могут релаксировать только через такие запрещенные спином переходы. Люминесцентный маркер может иметь любое одно из описанных выше свойств.
Подходящие хемилюминесцентные источники содержат химическое соединение, которое становится электронно возбужденным за счет химической реакции и может затем излучать свет, который служит обнаруживаемым сигналом или донором энергии для флуоресцентного акцептора. Различные семейства химических соединений могут создавать хемилюминесценцию при различных обстоятельствах. Одним из таких семейств химических соединений является 2,3-дигидро-1,4-фталазиндион. Часто используемым соединением является люминол, который представляет собой 5-амино соединение. Другие соединения из указанных семейств включают в себя 5-амино-6,7,8-тримтокси- и диметиламино[са]бенц аналог. Эти соединения могут быть сделаны люминесцентными с использованием щелочного пероксида водорода или гипохлорита кальция и основания. Другим семейством указанных соединений являются 2,4,5-трифенилимидазоли, причем лофин является общепринятым названием для исходного продукта. Хемилюминесцентными аналогами являются пара-диметиламино и -метокси заместители. Хемилюминесценция также может быть получена при помощи оксалатов, а обычно при помощи оксалил активных эфиров, например, р-нитрофенила и пероксида, такого как пероксид водорода, при основных состояниях. Другими также известными полезными Хемилюминесцентными соединениями являются -N-алкил акридиниум эфиры и диоксетаны. Альтернативно, луциферины могут быть использованы в сочетании с луциферазой или луцигенинами, чтобы получить биолюминесценцию.
Использованные здесь термин «аналит» включает в себя (но без ограничения) лекарственные средства, пролекарства, фармацевтические препараты, лекарственные метаболиты, биомаркеры, такие как выраженные протеины и клеточные маркеры, антитела, протеины сыворотки крови, холестерин и другие метаболиты, полисахариды, нуклеиновые кислоты, биологические аналиты, биомаркеры, гены, протеины или гормоны, или любую их комбинацию. Аналитами могут быть комбинации полипептидов, гликопротеинов, полисахаридов, липидов и нуклеиновых кислот.
Особый интерес представляют биомаркеры, связанные со специфическим заболеванием или со специфической стадией заболевания. Такие аналиты включают в себя (но без ограничения) аналиты, связанные с аутоиммунными болезнями, ожирением, с повышенным кровяным давлением, диабетами, неврональными болезнями и/или дегенеративными заболеваниями мышц, с болезнями сердца, эндокринными заболеваниями, метаболическими нарушениями, с воспалением, сердечно-сосудистыми заболеваниями, с сепсисом, с заболеваниями кровеносных сосудов, с различными видами рака, с болезнью Альцгеймера, и с любыми их комбинациями.
Также особый интерес представляют биомаркеры, которые в различных количествах присутствуют в одной или нескольких тканях тела, в том числе в сердце, печени, простате, в легких, почках, в костном мозге, в крови, коже, в мочевом пузыре, в мозгу, в мышцах, нервах и в избранных тканях, пораженных различными заболеваниями, такими как различные виды рака (злокачественного или не метастатического), аутоиммунные заболевания, воспалительные или дегенеративные заболевания.
Также особый интерес представляют аналиты, которые свидетельствуют о микроорганизме, вирусе или хламидии (chlamydiaceae). Примерные микроорганизмы включают в себя (но без ограничения) бактерии, вирусы, грибы и протозоа. Аналиты, которые могут быть обнаружены при помощи заявленного способа, также включают в себя зарождающиеся в крови патогены, выбранные из группы, в которую входят (но без ограничения) Staphylococcus epidermidis, Escherichia coli, стойкий к метициллину Staphylococcus aureus (MSRA), Staphylococcus aureus, Staphylococcus hominis, Enterococcus faecalis, Pscudomonas aeruginosa, Staphylococcus capitis, Staphylococcus wameri, Klebsiella pneumoniae, Haemophilus influenzae, Staphylococcus simulans, Streptococcus pneumoniae и Candida albicans.
Аналиты, которые могут быть обнаружены при помощи заявленного способа, также включают в различные передаваемые половым путем заболевания, выбранные из группы, в которую входят: гонорея (Neisseria gorrhoeae), сифилис (Treponena pallidum), хламидии (Clamyda tracomitis), не гонококковый уретрит (Ureaplasm urealyticum), дрожжевая инфекция (Candida albicans), мягкий шанкр (Haemophilus ducreyi), трихомониаз (Trichomonas vaginalis), генитальный герпес (HSV типа I & II), ВИЧ I, ВИЧ II и гепатит А, В, С, G, а также гепатит, вызванный TTV.
Дополнительные аналиты, которые могут быть обнаружены при помощи заявленных способов, включают в себя различные респираторные патогены, в том числе (но без ограничения) Pseudomonas aeruginosa, стойкий к метициллину Staphlococccus aureus (MSRA), Klebsiella pneumoniae, Haemophilis influenzae, Staphlococcus aureus, Stenotrophomonas maltophilia, Haemophilis parainfluenzae, Escherichia coli, Enterococcus faecalis, Serratia marcescens, Haemophilis parahaemolyticus, Enterococcus cloacae, Candida albicans, Moraxiella catarrhalis. Streptococcus pneumoniae, Citrobacter freundii, Enterococcus faecium, Klebsella oxytoca, Pseudomonas fluorscens, Neiseria meningitidis. Streptococcus pyogenes, Pneumocystis carinii, Klebsella pneumoniae Legionella pneumophila, Mycoplasma pneumoniae и Mycobacterium tuberculosis.
Дополнительные примерные маркеры, которые могут быть обнаружены при помощи заявленных способов, включают в себя: теофиллин, CRP, CKMB, PSA, миоглобин, СА125, прогестерон, ТхВ2, 6-keto-PGF-1-alpha, и теофиллин, эстрадиол, латинизированный гормон, триглицериды, триптазу, липопротеин холестерин низкой плотности, липопротеин холестерин высокой плотности, холестерин и IGFR.
Примерные маркеры печени включают в себя (но без ограничения) LDH, (LD5), (ALT), аргиназу 1 (типа печени), альфа-фетопротеин (AFP), щелочную фосфатазу, аланиновую аминотрансферазу, лактат дигидрогеназу и билирубин.
Примерные маркеры почек включают в себя (но без ограничения) TNFa рецептор, цистатин С, мочевой простагландин D липокалинового типа, синтатазу (LPGDS), рецептор фактора роста гепатоцита, полицистин 2, полицистин 1, фиброцистин, уромодулин, аланин, аминопептазу, N-ацетил-В-D-глюкозаминодазу, альбумин и связывающий ретинол протеин (RBP).
Примерные маркеры сердца включают в себя (но без ограничения) тропонин I (ThI), тропонин Т (TnT), CK, CKMB, миоглобин, связывающий жирную кислоту протеин (FABP), CRP, D-димер, S-100 протеин, BNP, NT-proBNP, PAPP-A, миелопероксидазу (МРО), гликоген фосфорилаза изофермент BB (GPBB), активируемый тромбином ингибитор фибринолизы (TAFI), фибриноген, модифицированный ишемией альбумин (IMA), кардиотропин-1, и MLC-I (легкая цепь - I миозина).
Примерные маркеры поджелудочной железы включают в себя (но без ограничения) амилазу, связанный с панкреатитом протеин (РАР-1) и протеины регенерации (regeneratein) (REG).
Примерные маркеры мышечной ткани включают в себя (но без ограничения) миостатин.
Примерные маркеры крови включают в себя (но без ограничения) эритропоэтин (ЕРО).
Примерные маркеры костей включают в себя (но без ограничения), сшитые N-телопептиды коллагена кости типа I (NTx), карбокситерминальный сшивающий телопептид костного коллагена, лизил-пиридинолин (деоксипиридинолин), пиридинолин, стойкую к тетрату кислую фосфатазу, проколлаген пропетида типа I С, проколлаген пропетида типа I N, остеокальцин (гла-протеин кости), щелочную фосфатазу, катепсин К, СОМР (хрящевой олигометрический матричный протеин), остеокрин остеопротегерин (OPG), RANKL, sRANK, TRAP 5 (TRACP 5), специфический фактор 1 остеобласта (OSF-1, плеиотропин), молекулы адгезии растворимой клетки, sTfR, sCD4, sCD8, sCD44 и специфический фактор 2 остеобласта (OSF-2, периостин).
В соответствии с некоторыми вариантами настоящего изобретения, маркеры являются специфическими для заболевания. Примерные маркеры рака включают в себя (но без ограничения) PSA (полный специфический антиген простаты), креатинин, кислую фосфатазу простаты, PSA комплексы, специфический ген 1 простаты, СА 12-5, карциноэмбриональный антиген (СЕА), альфа фето протеин (AFP), hCG (хорионический гонадотропин человека), ингибин, САА овариан С1824, СА 27.29, СА 15-3, САА грудной клетки С 1924, Неr-2, панкреатический, СА 19-9, карциноэмбриональный антиген, панкреатический САА, нейрон-специфическую энолазу, ангиостатин DcR3 (растворимый приманивающий (decoy) рецептор 3), эндостатин, Ер-САМ (МК-1), свободный иммуноглобулин легкой цепи каппа, свободный иммуноглобулин легкой цепи лямбда, херстатин, хромогранин А, адреномедуллин, интегрин, рецептор фактора роста эпидермы, рецептор фактора роста эпидермы - тирозинкиназу, про-адреномедуллин N-терминал 20 пептид, васкулярный эндотелиальный фактор роста, рецептор васкулярного эндотелиального фактора роста, рецептор фактора роста стволовых клеток, c-kit/KDR, KDR и Midkine.
Примерными состояниями инфекционного заболевания являются (но без ограничения) виремия, бактериемия и сепсис, для обнаружения которых могут быть использованы следующие маркеры: PMN эластаза, комплекс PMN эластаза/ α1-PI, поверхностно-активный протеин D (SP-D), HBVc антиген, HBVs антиген, анти-HBVc, анти-HIV, Т-подавитель антигена клетки, отношение антигенов Т-клетки, Т-помощник антигена клетки, анти-HCV, пирогены, антиген р24, мюрамил-дипептид.
Примерные маркеры диабетов включают в себя (но без ограничения) С-пептид, гемоглобин A1c, гликатный альбумин, конечные продукты углубленного гликозилирования (AGEs), 1,5-ангидроглюцитол, гастрический ингибиторный полипептид, глюкозу, гемоглобин, ANGPTL 3 и 4.
Примерные маркеры воспаления включают в себя (но без ограничения) ревматоидный фактор (RF), антинуклеарное антитело (ANA), С-химически активный протеин (CRP), протеин клетки Клара (утероглобин).
Примерные маркеры аллергии включают в себя (но без ограничения) полный IgE и специфический IgE.
Примерные маркеры аутизма включают в себя (но без ограничения) церулоплазмин, металлотионеин, цинк, медь, В6, В 12, глутатион, щелочную фосфатазу и активатор апо-щелочной фосфатазы.
Примерные маркеры нарушений свертывания крови включают в себя (но без ограничения) b-тромбоглобулин, фактор 4 бляшек и фактор Фон Виллебрандта.
В соответствии с некоторыми вариантами, маркер может быть специфическим для терапии. СОХ ингибиторы включают в себя (но без ограничения) ТхВ2 (Сох-1), 6-keto-PGF-1 -альфа (Сох 2), 11-дегидро-ТхВ-1а (Сох-1).
Другие маркеры в соответствии с настоящим изобретением включают в себя (но без ограничения) лептин, рецептор лептина, а также прокальцитонин. Brain S100 протеин. Substance P и 8-Iso-PGF-2a.
Примерные гериатрические маркеры включают в себя (но без ограничения), нейрон-специфическую энолазу, GFAP и S100B.
Примерные маркеры состояния питания включают в себя (но без ограничения) преальбумин, альбумин, связывающий ретинол протеин (RBP), трансферрин, стимулирующий ацилирование протеин (ASP), адипонектин, связанный с агути протеин (AgRP), аналогичный ангиопоэтину протеин 4 (ANGPTL4, FIAF), С-пептид, AFABP (протеин, связывающий адипоцит жирной кислоты, FABP4), EFABP (протеин, связывающий эпидермическую жирную кислоту, FABP5), глицентин, глюкагон, аналогичный глюкагону пептид-1, аналогичный глюкагону пептид-2, грелин, инсулин, лептин, рецептор лептина, PYY, RELMs, резистин и sTfR (рецептор растворимого трансферрина).
Примерные маркеры липидного обмена веществ включают в себя (но без ограничения) различные апо-липопротеины, Apo-Al, Apo-B, Apo-C-CII, Apo-D, Apo-E.
Примерные маркеры состояния свертывания крови включают в себя (но без ограничения) фактор I: фибриноген, фактор II: протромбин, фактор III: тканевой фактор, фактор IV: кальций, фактор V: проакселерин, фактор VI, фактор VII: проконвертин, фактор VIII: анти-гемолитический фактор, фактор IX: Christmas фактор, фактор X: Stuart-Prower фактор, фактор XI: тромбопластин антецедент плазмы крови, фактор XII: фактор Хагемана, фактор XIII: стабилизирующий фибрин фактор, прекалликреин, кининоген с высоким молекулярным весом, протеин С, протеин S, D-димер, активатор профибринолизина ткани, профибринолизин, а2-антиплазмин, ингибитор 1 активатора профибринолизина (РАН).
Примерные моноклоновые антитела включают в себя антитела для EGFR, ЕгЬВ2, и IGF1R.
Примерные ингибиторы тирозинкиназы включают в себя (но без ограничения) Ab1, Kit, PDGFR, Src, ЕгЬВ2, ErbB4, EGFR, EphB, VEGFR1-4, PDGFRb, FLt3, FGFR, PKC, Met, Tie2, RAF и TrkA.
Примерные ингибиторы серин/ треолин киназ включают в себя (но без ограничения) АКТ, Aurora А/В/В, CDK, CDK (pan), CDK1-2, VEGFR2, PDGFRb, CDK4/6, MEK1-2, mTOR и РКС-бета.
GPCR мишени включают в себя (но без ограничения) рецепторы гистамина, рецепторы серотонина, рецепторы ангиотензина, адренорецепторы, рецепторы мускаринового ацетилхолина, GnRH рецепторы, рецепторы допамина, рецепторы простагландина и ADP рецепторы.
В соответствии с отдельным вариантом осуществления настоящего изобретения предлагается способ мониторинга нескольких фармакологических параметров, полезных для оценки эффективности и/или токсичности лечебного средства. Например, лечебное средство может содержать любые вещества, которые обладают терапевтической эффективностью и/или имеют терапевтический потенциал. Такие вещества включает в себя (но без ограничения) биологические или химические соединения, такие как простые или сложные органические молекулы, пептиды, протеины (например, антитела) или полинуклеотиды (например, антисыворотка (anti-sense)). Может быть синтезировано широкое разнообразие соединений, в том числе, например, полимеры, такие как пептиды и полинуклеотиды, а также синтетические органические соединения на основании различных стержневых структур, которые также могут быть использованы в качестве лечебных средств. Кроме того, различные природные источники, такие как экстракты растений или животных, могут давать соединения для скрининга. Следует иметь в виду, что, несмотря на то, что это не всегда ясно выражено, агент (лечебное средство) может быть использован изолированно или в комбинации с другим агентом, имеющим такую же или другую биологическую активность. Кроме того, предложенные здесь агенты и способы также предназначены для комбинации с другими видами терапии. Следует также иметь в виду, что небольшие молекулы лекарственных средств часто измеряют при помощи масс спектрометрии, которая может быть неточной. Основанные на измерении антител количественные анализы ELISA являются намного более точными.
Физиологические параметры в соответствии с настоящим изобретением включают в себя (но без ограничения) такие параметры, как температура, сердечный ритм/ пульс, кровяное давление и частота дыхания. Фармакодинамические параметры включают в себя концентрации биомаркеров, таких как протеины, нуклеиновые кислоты, клетки и клеточные маркеры. Биомаркеры могут нести информацию о заболеваниях или могут быть результатом действия лекарственных средств. Фармакокинетические параметры (РК параметры) в соответствии с настоящим изобретением включают в себя (но без ограничения) концентрации лекарственных средств и метаболитов лекарственных средств. Идентификация и квантификация РК параметров в реальном масштабе времени из объема пробы является крайне желательной для оценки безопасности и эффективности лекарственных средств. Если концентрации лекарственных средств и их метаболитов находятся вне желательного диапазона и/или если возникают непредвиденные метаболиты за счет непредвиденных реакций с лекарственным средством, то следует предпринять немедленное действие для обеспечения безопасности пациента. Аналогично, если фармакокинетические параметры (PD) выпадают из желательного диапазона во время режима лечения, тогда также следует предпринять немедленное действие.
Возможность мониторинга степени изменения концентрации аналита или PD или РК параметров в течение периода времени на одном и том же объекте, или возможность анализа тренда концентрации, PD или РК параметров, когда они являются концентрациями лекарственных средств и их метаболитов, может помочь предотвращать потенциально опасные ситуации. Например, если глюкоза представляет собой представляющий интерес аналит, то концентрация глюкозы в пробе в данный момент времени, а также скорость изменения концентрации глюкозы в течение заданного периода времени, может быть крайне полезной, например, в прогнозировании и исключении гипогликемических событий. Такой анализ тренда имеет широко распространенные полезные последствия в режиме дозирования лекарственных средств. В случае использования множества лекарственных средств и их метаболитов, способность оценки тренда и возможность принятия превентивных мер часто является весьма желательной.
В соответствии с некоторыми вариантами настоящего изобретения, предлагается коммерческий способ содействия клиницисту в проведении индивидуализированного лечения. Коммерческий способ может включать в себя, после назначения лекарства, мониторинг лекарственной терапии, чтобы произвести оценку трендов биомаркеров в течение времени. Коммерческий способ может предусматривать получение по меньшей мере одного фармакологического параметра от принимающего лекарство пациента, причем указанную операция получения (сбора) осуществляют за счет введения пробы телесной жидкости в реакцию с реагентами, которые содержатся во флюидном устройстве, которое было передано указанному пациенту и которое позволяет получить различимый сигнал, несущий информацию об указанном по меньшей мере одном фармакологическом параметре; и обращение для сравнения, с использованием хранящихся в памяти компьютера медицинских записей указанного пациента, по меньшей мере к одному фармакологическому параметру указанного пациента, чтобы помочь указанному клиницисту в проведении индивидуализированного лечения.
Описанные здесь устройства, системы и способы позволяют производить автоматическую квантификацию фармакологического параметра пациента, а также автоматическое сравнение указанного параметра, например, с медицинскими записями пациента, которые могут содержать историю контролируемого параметра, или с медицинскими записями другой группы пациентов. Мониторинг аналита в реальном масштабе времени за счет подключения внешнего устройства, которое может хранить данные, а также осуществлять любой тип обработки данных или использовать любой алгоритм обработки, позволяет, например, получить устройство, которое помогает в лечении типичного пациента и позволяет, например, сравнивать текущие данные пациента с предыдущими данными пациента. Таким образом, в соответствии с настоящим изобретением предлагается коммерческий способ, который позволяет эффективно осуществлять по меньшей мере часть мониторинга пациента, который в настоящее время осуществляет медицинский персонал.
Пример 1
В этом примере, устройство, способ и систему в соответствии с настоящим изобретением использовали для осуществления количественного анализа для VEGFR2 человека. Этот пример демонстрирует тип количественного анализа, который может быть осуществлен в месте ухода за больным. Поверхность захвата блока анализа может быть покрыта (реагентами) в блоке анализа в соответствии с проводимым количественным анализом, а в этом примере, в соответствии с количественным анализом VEGFR2. Внутренняя поверхность блока анализа (изготовленная из полистирола при помощи литьевого формования в соответствии с примером, показанным на фиг.3А) была открыта для нанесения последовательности покрывающих реагентов за счет всасывания и пневматического удаления. В блоки анализа вводили по 20 мкл каждого покрывающего реагента и инкубировали при комнатной температуре в течение 10 минут. В этом примере использовали покрывающие реагенты в такой последовательности: нетравидин (neutravidin) (20 мкг/мл) в карбонат-бикарбонатном буферном растворе (рН 9), биотинилированное "антитело захвата" (моноклоновое антитело, введенное в VEGFR2 при концентрации 20 мкг/мл) в три раза забуференном (в тройном) солевом растворе (рН 8), и "фиксирующий" реагент, содержащий 3% альбумина коровьей сыворотки крови в три раза забуференном солевом растворе. После нанесения последовательностей покрытий, блоки анализа были высушены при помощи сухого воздуха и хранились высушенными.
Пробы для анализа затем были распределены (введены) в блок анализа в растворе 50 мМ тройного буфера (рН 8), содержащего альбумин коровьей сыворотки крови и изотоническую сахарозу, в течение 20 минут. Блок реагента, который содержит конъюгат, раствор щелочной фосфатазы и меченое коровьим кишечником моноклоновое антитело, предназначенное для VEGFR2 (для связывания ясно выраженного эпитопа с антителом на поверхности захвата) при концентрации 250 нг/мл в стабилизирующем реагенте (фирма Biostab), вводили в контакт с блоком анализа на 10 минут. После создания условий для связывания конъюгата с комплексом аналита, связанным с поверхностью захвата, блок анализа был промыт раствором, содержащимся в блоке реагента (покупным промывочным буферным раствором фирмы Assay Designs). Блок анализа был промыт 5 раз. Затем блок анализа был перемещен для ввода и перемешивания с другим реагентом, содержащимся в другом блоке реагента, а именно, с раствором покупного люминогенного субстрата для щелочной фосфатазы (KPL Phosphaglo), и инкубирован в течение 10 минут. Затем реакцию количественного анализа в блоке анализа обнаруживали с использованием узла обнаружения в соответствии с настоящим изобретением.
На фиг.12 показан отклик количественного анализа VEGFR2 с использованием описанного выше примерного способа. По оси х отложена концентрация (пг/мл) VEGFR2; а по оси у отложена относительная люминесценция (число фотонов). Полученный график был использован для калибровки модульных блока анализа и блоков реагентов.
Пример 2
Количественный анализ для P1GF человека был проведен с использованием блоков анализа и блоки реагентов в соответствии с настоящим изобретением, а результаты были считаны (получены) с использованием покупного измерителя. Параллельно был проведен количественный анализ с использованием тех же самых реагентов с использованием макета описанных здесь ниже одноразовых патронов в макете считывающего устройства. Использованные концентрации аналита составляют соответственно 0,4, 80 и 400 пг/мл. Показанные на фиг.13 результаты измерений были использованы для калибровки блока анализа и блока реагента, необходимых для проведения количественного анализа P1GF человека.
Пример 3
Были использованы намагничиваемые частицы BioMag диаметром 1.3 мкм фирмы Bangs Laboratories, покрытые материалом anti-rabbit IgG. Частицы были диспергированы при концентрации 14 мг/мл в три раза забуференном растворе сахарозы (или, альтернативно, в три раза забуференном солевом растворе), который содержит 3% альбумина коровьей сыворотки крови и эритроциты rabbit anti-human IgG фирмы CedarLane, при концентрации более 1.15 мг/мл. Аликвоты (10 мкл этой дисперсии) были распределены в конические трубки и лиофилизированы (заморожены в жидком N2 и лиофилизированы в течение времени около 24 часов при температуре -70С), ранее введения в паз в корпусе патрона. Антитело кролика (rabbit) связывает как эритроциты, так и покрытые материалом anti-rabbit IgG частицы, и образует совместный агглютинат частиц и эритроцитов.
Лиофилизированные намагничиваемые частицы были повторно суспендированы за счет добавления 20 мкл цельной крови, а затем было проведено их всасывание и распределение по меньшей мере 8 раз (в течение ориентировочно 1.5 мин) в коническую трубку.
Кровь была разделена за счет установки наконечника (в вертикальном положении) в сильное, горизонтально ориентированное магнитное поле. Типично получали 8 мкл главным образом не содержащей эритроцитов плазмы крови без наблюдаемого гемолиза из 20 мкл пробы крови (выход 70%). Выделение аналитов (по сравнению с плазмой крови без магнитного разделения) было близко к 100% для протеина-С, VEGF, P1GF, инсулина, GIP и G1P-1.
Пример 4
Было осуществлено последовательное разбавление пробы для анализа аналита в описанной здесь системе. С-химически активный протеин (CRP) представляет собой маркер острой фазы заболевания. Нормальные уровни содержатся в диапазоне от нг/мл (верхний конец диапазона) до мкг/мл (нижний конец диапазона). В любой острой фазе заболевания, печень человека производит CRP, причем его уровни в крови могут повышаться до сотен мкг/мл. Измерение CRP создает проблемы в известных ранее РОС аналитических системах, по причине необходимости измерения широкого динамического диапазона аналита (уровень которого изменяется более чем в 105 раз).
Описанная здесь система содержит устройство для переноса флюида и патрон или устройство с матрицами блоков анализа и блоков реагентов. Наконечники для количественного анализа, которые имеют моноклоновый анти-CRP, связанный с их внутренней поверхностью, были установлены в патроне вместе с раствором обнаружения антитела (меченый щелочной фосфотазой моноклоновый анти-CRP (имеющий другую специфичность эпитопа, чем на наконечниках), промывочным раствором и субстратом хемилюминогенной щелочной фосфотазы (PhosphaGLOTM) фирмы KPL.
Для проведения количественного анализа CRP, в патроны были введены предварительно разбавленные растворы CRP, которые используют без дальнейшего разбавления. Затем была проведена обработка патронов при помощи системы. Последовательно отбирали CRP раствор (10 мкл) и антитело обнаружения (12 мкл) в наконечники, инкубировали в течение 10 мин при 34°С, а затем выбрасывали. Наконечники промывали за счет всасывания 4 раза 20 мкл промывочного раствора, до того, пока не будет осуществлено всасывание 15 мкл субстрата в наконечники. После выдержки в течение 10 мин при 37°С, измеряли световое излучение при помощи измерителя в течение 5 сек. Откладывали CRP концентрацию в функции сигнала количественного анализа (числа фотонов) и данные подгоняли под 5-членную полиномную функцию, чтобы получить функцию калибровки, как это показано на фиг.14.
Пример 5
Затем были проведены эксперименты с использованием последовательных разбавлений пробы, содержащей аналит с высокой концентрацией, чтобы получить однозначный отклик количественного анализа в описанных здесь системе и устройстве. Растворы CRP (20 мкл) были загружены в патроны и последовательно разбавлены при помощи измерителя (до разбавлений соответственно в 1: 50, 250, 750 и 1500 раз). Разбавленные растворы были обработаны в соответствии с примером 4. Если концентрация разбавленного CRP превышает диапазон калибровки количественного анализа (300 нг/мл), то наблюдается убывающий отклик (как это показано ниже; данные двух измерителей).
Показанный на фиг.15 отклик моделировали с использованием модификации связывающей изотермы Scatchard (S/Smax=C/(C+С0.5). Модификация допускает, что отклик количественного анализа является линейно пропорциональным концентрации антитела обнаружения, как в этом примере (данные не показаны). Любой перенос CRP в разбавленной пробе в следующий реагент (антитело обнаружения) будет быстро реагировать с реагентом, что не позволяет ему образовать связь с антигеном, связанным с антителом твердой фазы. Снижение эффективной концентрации в пропорции переноса CRP может быть учтена при помощи коэффициента (D-C*f)/D.
Следовательно, S=Smax*(C/(C+C0.5))*(D-C*f)/D, в котором S представляет собой сигнал количественного анализа, Smax представляет собой максимальный сигнал (соответствующий нулевому переносу), С представляет собой концентрацию аналита, СО.5 представляет собой концентрацию половины максимального сигнала (без переноса), D представляет концентрацию антитела обнаружения, a f представляет собой фракционный перенос.
Значения, которые используют для подгонки данных, были получены за счет оптимизации каждого из указанных ниже четырех параметров с использованием техники минимизации среднеквадратических расхождений между данными и моделью подгонки. Как это показано на фиг.15, была получена отличная подгонка, при этом значения параметров Smax, С0.5 и D (см. таблицу 2) были близки к значениям, которые можно ожидать при максимальном полученном сигнале, наблюдаемой С0.5 и известной концентрации антитела обнаружения. В этой модели принятая степень переноса составляет 0.034% (децимальное значение 3.83Е-04).
Затем могут быть рассмотрены данные в соответствии с разбавлением, использованным для достижения окончательной концентрации в каждом наконечнике для количественного анализа, причем для каждого уровня разбавления были получены такие же отклики, показывающие, что разбавления являются точными, как это показано на фиг.16.
Описанная здесь модель может быть использована для вычисления откликов при любом заданном разбавлении и для отладки алгоритмов, обеспечивающих нахождение концентрации аналита в любом наконечнике внутри диапазона калибровки. Графические средства отображения данных показаны на фиг.17, причем нормализованный отклик количественного анализа (В/Вmах) отложен в функции логарифма нормализованный концентрации (С/С0.5) для следующих относительных разбавлений: 1:1 (сплошная линия), 5:1 (штриховая линия) и 25:1 (пунктирная линия). На фиг.18 и 19 показан пример, аналогичный показанному на фиг.17, при других нормализованных концентрациях. Простые алгоритмы распознавания образов могут быть использованы для идентификации достоверных данных при высокой концентрации проб. Например, для большинства откликов дозы, сигнал уменьшается при разбавлении. Если сигнал при любом разбавлении будет равным или большим, чем при следующем более высоком разбавлении, то результат анализа при этом разбавлении следует отбросить. В другом примере, концентрации, полученные с использованием функции калибровки, приведенной в примере 4, должны иметь такую же системную погрешность, что и известные разбавления. Если расчетная концентрация для меньшего разбавления меньше чем концентрация для более высоких разбавлений, то результат меньшего разбавления следует отбросить.
Когда отклик дозы количественного анализа приближается к максимуму, увеличивается угол наклона концентрации (ΔC/ΔS) к сигналу. В случае количественных анализов, в которых относительное изменение сигнала (ΔS/S) является главным образом постоянным (например, как в описанной здесь системе), это может приводить к большему изменению результата расчета концентрации при более высоких концентрациях. Предложенное здесь разбавление или последовательное разбавление позволяет получить точность концентрации, достигаемую при иммунологических анализах, но при существенно более высоких уровнях сигнала (например, более чем в 10 раз), чем для сигнала нулевого аналита, но не близко к максимальному сигналу (например, менее 0.3 максимального сигнала). Последовательное разбавление позволяет получить сигнал количественного анализа в этом диапазоне.
За счет осуществления нескольких оценок концентрации аналита при различных разбавлениях, может быть получено среднее (усредненное) значение. Среднее значение также может быть получено за счет проведения параллельных измерений при единственном уровне разбавления. В некоторых случаях, подход с использованием последовательного разбавления, который обеспечивают описанные здесь способы, системы и устройства, позволяет оценивать погрешность за счет нелинейности разбавления, вызванной, например, воздействие матрицы на пробу.
Пример 6
Флуоресцеин представляет собой хорошо известный химикат, причем известны также антитела с высоким сродством, специфические для его молекулы. За счет прикрепления нескольких долей флуоресцеина к такому протеину, как альбумин, создается искусственный аналит, который может быть измерен при помощи анализа ELISA. Приведенный здесь пример, который реализован на титрационном микропланшете, чтобы показать возможность осуществления такого количественного анализа, легко может быть переведен в описанные здесь устройство или систему в соответствии с настоящим изобретением.
Анти-флуоресцеиновое моноклоновое антитело было прикреплено к стенкам лунок титрационного микропланшета с 384 лунками, для создания поверхности захвата. Количественный анализ был осуществлен за счет добавления серий растворов в лунки и инкубирования при комнатной температур в течение 10 мин на каждой стадии, когда это необходимо. Затем в лунки добавляли 30 мкл покупного препарата, с известными концентрациями, меченого флуоресцеином коровьего альбумина (проба), с соотношением около пяти флуоресцеинов на молекулу. После механического удаления пробы, добавляли 30 мкл меченого щелочной фосфатазой анти-флуоресцеина (антитела обнаружения), с концентрацией 100 нг/мл. После удаления антитела обнаружения, лунки промывали три раза с использованием 40 мкл промывочного раствора ("Wash Buffer" Cat # 80-1351 [фирма Assay Designs, Ann Arbor, Michigan]), разбавленного перед использованием в отношении 1:20. Затем добавляли субстрат PhosphaGLO™ (40 мкл) и считывали отклик количественного анализа с использованием спектролюминометра М5 в течение 0.5 сек. Отклик количественного анализа показан на фиг.20.
Меченый флуоресцеином альбумин (5 мкл, при различных концентрациях, вплоть до 80 нг/мл) растворяли в три раза забуференном солевом растворе, который содержит коровий альбумин при концентрации 3 мг/мл (буфер), вводили в полипропиленовые трубки и сушили в течение ночи сухим воздухом. Полное высушивание проверяли путем взвешивания трубок до и после сушки и проверки соответствующей потери в массе, пока не будет достигнут почти постоянный окончательный вес. Аналит покрывали за счет добавки 5 мкл воды, 20 мкл сыворотки крови человека и 180 мкл буфера, после чего производили перемешивание.
Контрольные эксперименты были проведены за счет перемешивания 5 мкл аликвотов раствора аналита с 20 мкл сыворотки крови и 180 мкл буфера.
Выделение аналита измеряли с использованием описанного здесь количественного анализа. Как это описано далее более подробно, получение сигнала количественного анализа (и выделение аналита) является главным образом количественным при всех концентрациях. Может быть желательно иметь хорошее выделение (>90%) с высокой точностью (<2% CV при выделении). В некоторых случаях, отклик дозы количественного анализа может быть сделан линейным в представляющем интерес диапазоне за счет использования низкой концентрации аналита и избытка реагентов. Например, линейный отклик дозы количественного анализа может быть обеспечен за счет наличия существенной способности связывания антигена на поверхности захвата, так что даже при самом высоком уровне аналита только умеренная пропорция (например, <30%) мест (сайтов) будет занята в конце реакции связывания. Как уже было указано здесь выше, для аналитов в диапазоне нг/мл и при количественных анализах с малыми временами инкубации (например, <30 мин), это условие может быть обеспечено при описанном здесь выше покрытии поверхностей захвата. В соответствии с другим примером, используют достаточную концентрацию антитела обнаружения, так что эта концентрация главным образом не обедняется во время инкубации антитела обнаружения (например, <30% реагента будет связано с поверхностью при самых высоких уровнях антигена), причем это условие может быть обеспечено за счет использования концентраций антитела обнаружения, составляющих ориентировочно от 5 до 100 нг/мл. В соответствии с еще одним примером, линейный отклик дозы количественного анализа может быть обеспечен за счет выработки сигнала, который меньше чем линейная характеристика устройства обнаружения (например, ФЭУ с линейной характеристикой до 4 миллионов фотонов в секунду). Описанные здесь системы и способы позволяют работать внутри этого диапазона. В соответствии с еще одним примером, линейный отклик дозы количественного анализа может быть обеспечен за счет выработки достаточно мощного сигнала, чтобы его можно было точно измерить (например, со скоростью подсчета фотонов ориентировочно выше 1,000 фотонов в секунду).
Описанные здесь наконечники для количественного анализа покрывают путем всасывания следующей последовательности реагентов: 20 мкл при концентрации 5 мкг/мл анти-флуоресцеина кролика (Molecular Probes # A6413) в карбонатном буферном растворе рН 9, 20 мкл 3% коровьего альбумина в три раза забуференном солевом растворе рН 8, и 20 мкл при концентрации 2.5 мкг/мл коровьего альбумина, меченого флуоресцеином (Sigma-Aldrich A9771), причем после каждого всасывания проводят инкубацию в течение 10 мин и удаление жидкости. Наконечники затем промывают три раза за счет всасывания коровьего альбумина в три раза забуференном солевом растворе рН 8, с последующей инкубацией 3% коровьего альбумина в три раза забуференном солевом растворе рН 8. После этого наконечники сушат в соответствии с описанным здесь выше. Эти наконечники были использованы для количественного анализа проб, содержащих козий (goat) анти-флуоресцеин, за счет инкубации 20 мкл аликвотов следующих растворов в последовательности: козий анти-флуоресцеин (проба) в три раза забуференном солевом растворе рН 8, содержащий 3% BSA; меченый щелочной фосфатазой rabbit-anti-goat флуоресцеин при концентрации 100 нг/мл в растворителе Stabilzyme™ (имеющийся в продаже), с промывкой четыре раза промывочным раствором Wash Buffer; и PhosphaGLO™ хемидюминогенный субстрат щелочной фосфатазы, с проведением каждой инкубация при комнатной температуре в течение 10 мин. Оценку количественного анализа проводили путем подсчета фотонов, полученных в течение времени около 10 сек, в измерителе с использованием фотоумножителя (люминометр М5 фирмы Molecular Devices), при установке каждого наконечника в изготовленную по заказу рамку, которая стыкуется с платформой титрационного микропланшета. Полученные в этом примере результаты приведены на фиг.21. На фиг.21 показана линейная характеристика, аналогичная показанной на фиг.20.
Пример 7
В этом примере показана предсказуемость отклика иммунологического анализа для CRP с использованием описанных здесь наконечников для количественного анализа, когда проводят начальную добавку реагентов, удаление продукта реакции, промывку наконечников и затем повторное введение некоторых или всех компонентов количественного анализа. При этом используют следующую последовательность операций количественного анализа: инкубация наконечников в макете измерителей при 34°С в течение 10 мин, последовательно: (1) с пробой (CRP 0.3,3, 30, 150 и 300 мкг/мл), разбавленной с использованием измерителя в 500, а затем в 2000 раз; (2) с меченым щелочной фосфатазой rabbit anti-goat IgG ["Dab"] (5 нг/мл), с промывкой три раза; и (3) с PhosphaGLO™, хемилюминогенным субстратом щелочной фосфатазы ["Субстрат"]. Эксперимент был проведен на нескольких измерителях, при считывании скорости появления фотонов в течение 10 сек после операции 3. Окончательные (в наконечнике) CRP концентрации составляли 0.15, 0.6, 1.5, 6, 15, 60, 75, 300 и 600 нг/мл, а уровни свечения составляли от 2,000 до 600,000 отсчетов (фотонов) в течение 0.5 сек. В некоторых экспериментах, после операции (3) количественного анализа, производили удаление продукта реакции и осуществляли различным образом повтор: операций 3 (ромбики и сплошная линия на фиг.22), операций 2+3 (квадраты и штриховая линия) или операций 1+2+3 (треугольники и пунктирная линия). Полученные результаты были представлены на фиг.22 как сигнал повторного количественного анализа в функции сигнала исходного количественного анализа.
Сигналы повторного количественного анализа связаны линейно (являются пропорциональными) с сигналом исходного количественного анализа. Вторая добавка субстрата дает более сильный сигнал по сравнению с исходным сигналом, в то время как повторные количественные анализы, в которых вводили вместе Dab и субстрат, и в которых вводили вместе пробу. Dab и субстрат, дают более слабые сигналы по сравнению с исходным сигналом. В соответствии с одним из примеров использования указанного способа, все операции в последовательности операций количественного анализа могут быть подвергнуты контролю качества, чтобы понять, что они протекают в соответствии с ожидаемыми соотношениями между первой и последующими итерациями операций количественного анализа.
Например, как описано здесь, если операция количественного анализа не протекает надлежащим образом, тогда результат количественного анализа может быть отброшен как неправильный или же результат более поздних итераций количественного анализа может быть использован в качестве надлежащего отклика количественного анализа.
Иммунологический анализ для С-химически активного протеина был проведен в описанной здесь системе. Шесть эквивалентных наконечников для количественного анализа были инкубированы последовательно пробой (200 нг/мл CRP); меченым щелочной фосфатазой rabbit anti-goat IgG, с промывкой; и PhosphaGLO™, хемилюминогенным субстратом щелочной фосфатазы. Инкубации проводили в течение 10 мин при 34°С. Эксперимент был проведен на трех измерителях, при считывании (скорости появления) фотонов в течение 10 сек. В среднем было обнаружено около 40,000 отсчетов (фотонов) в течение времени считывания 0.5 сек. В этом примере, уровень свечения на наконечниках 1 и 2 измерителя 3 дает совсем другие результаты, как это показано в приведенной ниже Таблице 3. Измеритель был затем использован для промывки наконечников и для введения свежего PhosphaGLO™ субстрата (всасывание 2). Полученные результаты были представлены как отношения степени свечения для каждого наконечника к среднему значению для шести наконечников на каждом соответствующем измерителе. После второго всасывания, наконечники 1 и 2 дают результаты, линейно связанные с другими четырьмя наконечниками в измерителе 3, что говорит о том, что была решена проблема, связанная с низким сигналом в наконечниках 1 и 2.
Реферат
Группа изобретений относится к области автоматического анализа. Система для автоматического переноса реагента в блок анализа содержит: патрон, содержащий идентификатор, блок анализа, блок реагента; и измеритель, содержащий устройство для переноса флюида, содержащее программируемое обрабатывающее устройство и множество головок для входа в зацепление с блоком анализа. При этом измеритель сконфигурирован для приема патрона, для считывания идентификатора на патроне и для передачи идентичности идентификатора на внешнее устройство, причем программируемое обрабатывающее устройство сконфигурировано для приема специфического для патрона протокола от внешнего устройства, содержащего команды для прямого переноса реагента из блока реагента в блок анализа, причем патрон имеет избыток разбавителя для компенсации возможных изменений в специфическом для патрона протоколе. Также раскрывается способ автоматического переноса реагента в блок анализа. Группа изобретений обеспечивает возможность проведения комплексных анализов, а также уменьшение стоимости изготовления компонентов устройства. 2 н. и 22 з.п. ф-лы, 21 ил., 3 табл.,7 пр.
Формула
Документы, цитированные в отчёте о поиске
Многоканальное пипетирующее устройство

Комментарии