Системы и способы для оптимизации объемов забора плазмы - RU2752596C1
Код документа: RU2752596C1
Чертежи









Описание
[0001] Настоящее изобретение относится к системам и способам для выполнения плазмафереза и, в частности, к системам и способам плазмафереза, в которых оптимизируется объем продукта исходной или необработанной плазмы, который можно взять от конкретного донора.
[0002] Плазмаферез является процедурой афереза, в ходе которой у донора берут цельную кровь, плазму отделяют от клеточных компонентов крови (красных кровяных телец (эритроцитов) (RBC), тромбоцитов и лейкоцитов) и сохраняют, и некоторые клеточные компоненты крови возвращают донору. Отделение плазмы от клеточных компонентов обычно выполняется в ходе автоматизированной процедуры посредством центрифугирования или мембранной фильтрации.
[0003] В процессе автоматизированного плазмафереза, цельную кровь забирают у донора, смешивают в заданном соотношении с антикоагулянтом («AC») и затем разделяют на антикоагулированную плазму и эритроциты и другие клеточные компоненты. После того, как забирают целевой объем антикоагулированной плазмы (или «продукта плазмы»), определяемый на весах, соответствующих сборному контейнеру для плазмы, забор цельной крови у донора прекращают, и эритроциты и другие клеточные компоненты возвращают донору. Продукт плазмы часто забирают в течение нескольких циклов забора и реинфузии, пока не собран суммарный целевой объем антикоагулированной плазмы. Антикоагулированная плазма применяется для последующей трансфузии или дальнейшей обработки.
[0004] Плазма, которую забирают для использования в качестве исходного материала («исходной плазмы») для дальнейшей обработки, забирается от нескольких доноров и смешивается или объединяется в общий пул с упомянутой целью. Организация FDA выпустила руководство для зарегистрированных центров сбора крови, касающееся объема плазмы, которую можно взять в качестве исходной плазмы в процессе плазмафереза, чтобы повысить единообразие процедур для обработки исходной плазмы и минимизировать возможность ошибки персонала. (Памятка FDA: «Volume Limits-Automated Collection of Source Plasma (11/4/92)»). Памятка FDA отмечала отсутствие единообразия из-за используемых различных типов растворов антикоагулянтов, разных концентраций антикоагулянта и разброса соотношений антикоагулянта к плазме.
[0005] Памятка FDA предложила упрощенную номограмму для объема плазмы, приведенную в таблице на фиг. 1, в которой ограничивается объем (или вес) плазмы, который можно взять от конкретного донора, чтобы гарантировать безопасность и удобство для донора. В частности, номограмма FDA ограничивает объем (или вес) плазмы с учетом веса донора и устанавливает объем антикоагулянта, который можно добавлять в отношении 1:16 антикоагулянта к антикоагулированной крови или 0,06 частей антикоагулянта на 1 часть антикоагулированной крови, чтобы получить максимальный забираемый объем для суммарного количества плазмы вместе с антикоагулянтом для конкретного донора.
[0006] Упрощенная номограмма, приведенная в памятке FDA, была главным способом для определения забираемых объемов продукта плазмы, применяемым в центрах сбора крови. Следовательно, устройства для плазмафереза, применяемые в таких центрах, обычно программируют для сбора заданного объема/веса антикоагулированной плазмы (в предположении известной плотности) в соответствии с максимальным забираемым объемом, разрешенным номограммой FDA, с добавление антикоагулянта в цельную кровь в соотношении 1:16 или 0,06.
[0007] Одно упрощение, сделанное в номограмме FDA, состоит в исключении учета гематокрита донора, при определении забираемого объем продукта плазмы. Однако, относительные доли необработанной плазмы и антикоагулянта в продукте плазмы зависят от гематокрита донорской крови и соотношения, в котором AC смешивается с донорской цельной кровью. Вследствие этого, доноры с более высоким гематокритом подходят к максимальному забираемому объему, предложенному в номограмме FDA, раньше достижения максимального объема (необработанной) плазмы, который можно безопасно взять у донора. Это означает неэффективность для центра сбора плазмы, так как объем необработанной плазмы, который забирается, оказывается меньше максимального возможного количества.
[0008] Кроме того, количество плазмы, которое можно безопасно взять у донора, может зависеть от факторов помимо веса и гематокрита донора, таких как вес донора, пол и возраст, так как такие факторы влияют на суммарный объем крови донора (и объем плазмы).
[0009] Поскольку исходную плазму от нескольких доноров смешивают, то важно максимально увеличить объем плазмы, который можно взять у каждого отдельного донора, так как даже небольшие увеличения объема, забираемого у каждого отдельного донора, при складывании, дают в результате весомое увеличение суммарного объема объединяемой плазмы. Если устройство для плазмафереза выполнено с возможностью более точной настройки на объем необработанной плазмы, то от каждого донора можно взять больше белков плазмы, что повышает общую эффективность центра сбора плазмы. Соответственно, в настоящем изобретении предлагаются системы и способы для оптимизации забираемого объема плазмы, которые совместимы с безопасностью и удобством для донора.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0010] В настоящем изобретении предлагаются способы управления системой для плазмафереза, чтобы забирать объем антикоагулированной плазмы (т.е. продукта плазмы), который гарантирует, что суммарный объем необработанной плазмы в продукте плазмы является максимальным объемом, который можно взять у конкретного донора, с учетом безопасности и удобства для донора, будь это обусловлено индивидуальными физическими характеристиками донора, указано номограммой FDA, или установлено другими методами.
[0011] Согласно первому аспекту изобретения предлагается способ для управления системой для плазмафереза, чтобы забирать объем продукта плазмы, который содержит максимально допустимый объем/вес необработанной плазмы в соответствии с пределами, установленными в номограмме FDA, с учетом веса донора.
[0012] Для забора максимального объема/веса необработанной плазмы, допускаемого номограммой FDA, предлагается модифицированная номограмма, которая использует гематокрит донора, чтобы вычислять целевой объем/вес для продукта плазмы, имеющего максимальный объем необработанной плазмы, допускаемый номограммой FDA. Вычисленный объем/вес необработанной плазмы сравнивается с максимальным объемом/весом для необработанной плазмы, допускаемым номограммой FDA. Если вычисленный объем/вес необработанной плазмы оказывается меньше, чем максимально допустимый объем/вес, то объем/вес продукта плазмы, подлежащий забору, корректируется в сторону увеличения от максимального объема/веса, допускаемого номограммой FDA для продукта плазмы, на величину, равную разности, плюс дополнительное количество антикоагулянта, которое добавляют для обработки дополнительного объема/веса плазмы.
[0013] Таким образом, в случае знания гематокрита донора и соотношения AC прибора, определяется объем дополнительной необработанной плазмы, который можно безопасно взять у донора, на основании пределов, установленных в номограмме FDA, и затем соответственно корректируется суммарный объем/вес продукта плазмы, подлежащий забору, с учетом веса донора, указанного в номограмме FDA.
[0014] Обычно, процедуры плазмафереза включают в себя последовательные циклы чередующихся фаз, из которых в одной у донора берут цельную кровь, и отделяют и собирают плазму, и в другой выделенные эритроциты и любые другие неэритроцитные клеточные компоненты возвращают обратно донору. Гематокрит донора будет изменяться в ходе процедуры плазмафереза, что влияет на количество антикоагулянта в продукте плазмы, забираемом от одного цикла к следующему.
[0015] Следовательно, в первом аспекте изобретения, перед началом последующей фазы извлечения/разделения определяется новое значение гематокрита донора, и целевой объем/вес продукта плазмы для процедуры вычисляется заново перед началом каждой фазы извлечения/разделения, чтобы гарантировать забор максимального количества необработанной плазмы, допускаемого номограммой FDA.
[0016] Согласно второму аспекту предлагается дополнительный способ для забора объема плазмы в ходе процедуры афереза. Этапы способа содержат: определение суммарного объема Vb цельной крови для донора; определение объема необработанной плазмы (VRP), который можно забрать у донора, на основании Vb; определение целевого объема продукта плазмы (VPP), подлежащего забору, при этом VPP равен объему необработанной плазмы (VRP), подлежащему забору, плюс объем антикоагулянта (VAC), который добавляют в VRP в ходе процедуры афереза, так что VPP=VRP×K, где К=(ACR×(1-Hct/100)+1)/(ACR×(1-Hct/100)), с учетом доли антикоагулянта (ACR, определяемой как отношение объема крови донора к объему антикоагулянта для крови донора, не содержащей антикоагулянта), установленной для процедуры, и Hct (гематокрита) донора; забор цельной крови у донора; добавление антикоагулянта в цельную кровь в количестве, соответствующем ACR; отделение продукта плазмы от цельной крови; и перенос продукта плазмы в сборный контейнер, пока объем продукта плазмы в сборном контейнере не достигает VPP. Поскольку процедура плазмафереза содержит несколько фаз извлечения/разделения и возврата, то VPP для процедуры вычисляют заново перед тем, как начинается каждая фаза извлечения/разделения, на основании значения для гематокрита донора, определяемого перед началом каждой фазы забора, и целевой объем для продукта плазмы соответственно корректируется. В качестве альтернативы, VRP можно определять на основании вычисленного значения для суммарного объема плазмы донора, на основании Vb и гематокрита донора.
[0017] В третьем аспекте предлагается способ для определения объема продукта плазмы (VPP), который можно забрать в ходе процедуры афереза, при этом VPP равен объему необработанной плазмы (VRP), который можно взять, с добавлением объема антикоагулянта (VAC), который добавляют в VRP в ходе процедуры афереза. Этапы способа содержат: определение веса (Wkg) и пола (M (мужской) или F (женский)) донора, определение гематокрита (Hct) для донора; определение объема необработанной плазмы (VRP), который можно взять с учетом веса (Wkg) и пола (M или F) донора; определение соотношения К между VPP и VRP, а именно К=VPP/VRP, на основании доли антикоагулянта (ACR) и Hct донора; определение VPP по формуле VPP=VRP×K. При этом, К= ACR×(1-Hct/100)+1)/(ACR×(1-Hct/100)). После определения VPP, забирают цельную кровь у донора; добавляют антикоагулянт в цельную кровь в количестве, соответствующем ACR; отделяют продукт плазмы от цельной крови; и переносят продукт плазмы в сборный контейнер. После того, как у донора взято искомое количество цельной крови, эритроциты возвращают обратно донору. Затем, Hct донора и VPP определяют перед каждой фазой забора.
[0018] В связанном аспекте, этапы забора и разделения повторяют, пока объем продукта плазмы в сборном контейнере не достигает VPP.
[0019] В связанном аспекте, гематокрит донора после первой фазы забора может вычислять методом баланса объема, в предположении, что количество эритроциты донора является одинаковым в начале каждого цикла забора, тогда как суммарный объем крови уменьшается от одного цикла к следующему циклу на объем, равный объему взятой необработанной плазмы. В качестве альтернативы, гематокрит донора в начале каждого цикла забора можно измерять оптическим или другим датчиком.
[0020] В дополнительном аспекте, объем необработанной плазмы, который можно взять у конкретного донора, можно определять любым из нескольких различных методов. Такие методы включают в себя, например, номограмму FDA, учитывающую только вес донора; модифицированную номограмму FDA, дополнительно учитывающую гематокрит донора, и с учетом доли суммарного объема крови или суммарного объема плазмы, вычисленного для конкретного донора. Суммарный объем крови или суммарный объем плазмы можно определять с использованием, например, уравнений Надлера, правила Пяти Гилчера, таблиц, предложенных Международным комитетом по стандартизации в гематологии (ICSH), или любого другого общепринятого способа, использующего рост, вес, пол и возраст донора, с учетом безопасности и удобства донора.
[0021] В четвертом аспекте предлагается автоматизированная система для отделения плазмы от цельной крови, которая содержит многократно используемый аппаратный компонент и одноразовый набор. Одноразовый набор дополнительно содержит i) сепаратор для разделения цельной крови на фракцию плазмы и концентрированную клеточную фракцию, при этом сепаратор содержит впускной порт, содержащий кровопроводящую линию, неразъемно соединенную с ним, для транспортировки цельной крови от донора к сепаратору, выпускной порт для плазмы, неразъемно соединенный со сборным контейнером для плазмы линией плазмы, и выпускной порт для концентрированных клеток, неразъемно соединенный с резервуаром для приема концентрированных клеток перед реинфузией донору; ii) донорскую линию, заканчивающуюся иглой для венепункции, для транспортировки цельной крови от донора в кровопроводящую линию, iii) линию антикоагулянта, неразъемно соединенную с кровопроводящей линией и выполненную с возможностью подсоединения к источнику антикоагулянта, для транспортировки антикоагулянта в донорскую линию, и iv) реинфузионную линию для транспортировки концентрированных клеток из резервуара в донорскую линию.
[0022] Многократно используемый аппаратный компонент дополнительно содержит i) первый перистальтический насос для подачи антикоагулянта с управляемым расходом в кровопроводящую линию в фазе забора, ii) второй насос для подачи антикоагулированной цельной крови в сепаратор в фазе забора и для возврата концентрированных клеточных компонентов в фазе реинфузии, iii) третий насос для подачи концентрированных клеточных компонентов из сепаратора в резервуаре в фазе забора, iv) зажим, связанный с каждой из кровопроводящей линии, линии плазмы и реинфузионной линии, v) весы для взвешивания каждого из сборного контейнера для плазмы, резервуара и источника антикоагулянта, и vi) программируемый контроллер, содержащий сенсорный экран для приема входных данных от оператора, при этом программируемый контроллер выполнен с возможностью приема сигнала из каждых из весов и автоматического управления первым, вторым и третьим насосами и зажимами, чтобы разделять цельную кровь на фракцию плазмы и концентрированную клеточную фракцию в фазе забора и возвращать концентрированные клетки донору на стадии реинфузии. Программируемый контроллер дополнительно выполнен с возможностью определения целевого количества для продукта плазмы, подлежащего накоплению в сборном контейнере для плазмы, в соответствии с любым из способов, описанных в настоящем документе, и прекращения фазы забора по получению сигнала, что количество продукта плазмы в сборном контейнере для плазмы равняется целевому количеству продукта плазмы, определенному контроллером. При определении целевого количества для продукта плазмы, подлежащего забору, контроллер может быть выполнен с возможностью вычисления гематокрита донора перед фазой забора каждого цикла. В качестве альтернативы или дополнительно, контроллер может принимать сигнал из датчика или чего-то подобного, который показывает гематокрит донора. Дополнительно, количество продукта плазмы в сборном контейнере для плазмы может определяться, например, весами, связанными со сборным контейнером для плазмы, или оптическим датчиком, который непосредственно измеряет объем.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0023] Фиг. 1 - таблица, показывающая упрощенную номограмму, представленную в Памятке FDA: «Volume Limits-Automated Collection of Source Plasma (11/4/92)».
[0024] Фиг. 2 - вид в перспективе примерного прибора для плазмафереза, пригодного для применения в системе и способе настоящей заявки.
[0025] Фиг. 3 - вид в перспективе сепаратора с вращающейся мембраной такого типа, который включен в одноразовый набор, с местными вырезами для показа деталей, применимый с системой для плазмафереза, показанной на фиг. 2.
[0026] Фиг. 4 - вид в перспективе передней панели системы для плазмафереза, показанной на фиг. 2, с изображением компонентов одноразового набора, которые смонтированы на передней панели.
[0027] Фиг. 5 - схематическое изображение, представляющее работу системы для плазмафереза в фазе забора.
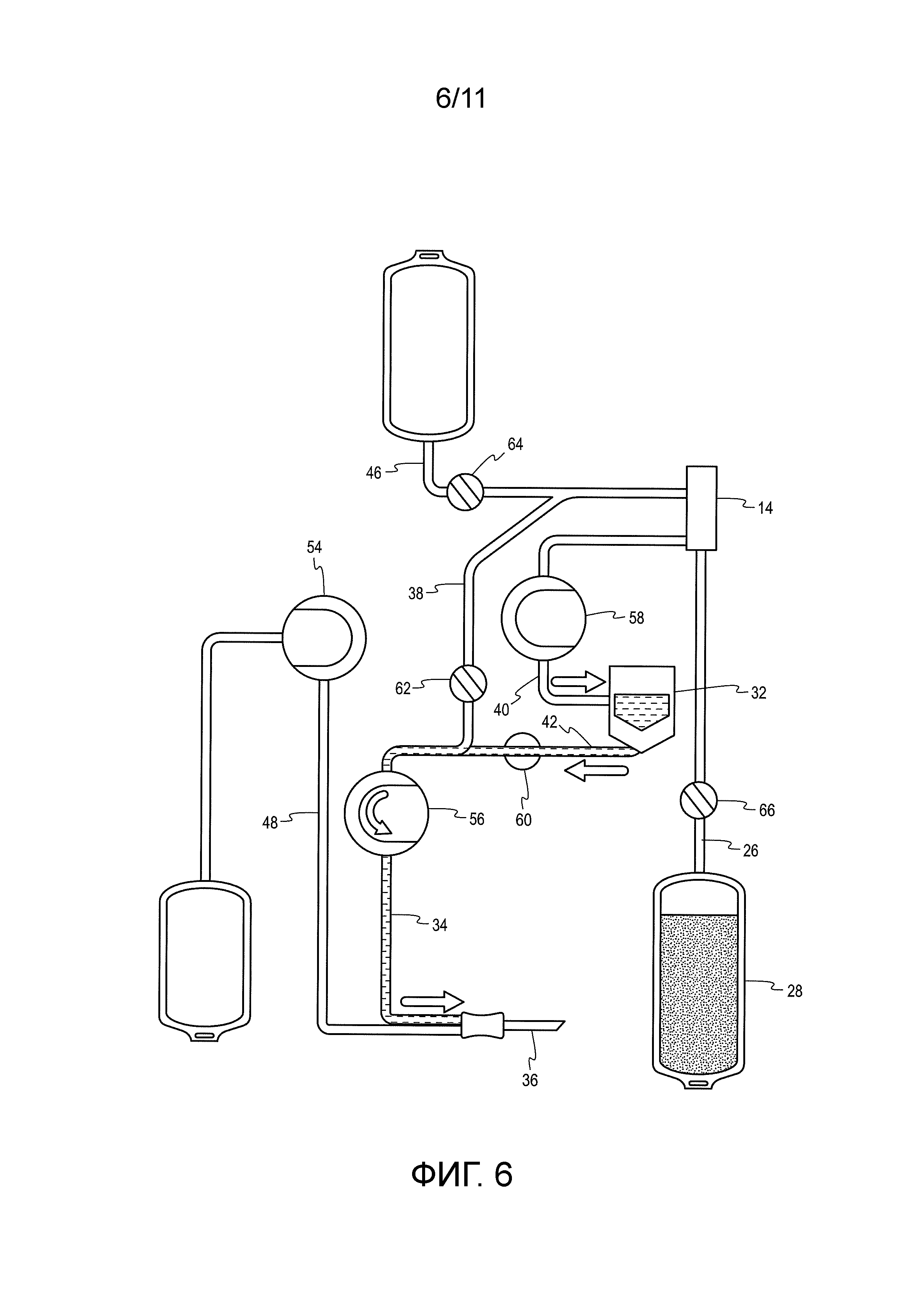
[0028] Фиг. 6 - схематическое изображение, представляющее работу системы для плазмафереза в фазе реинфузии.
[0029] Фиг. 7 - таблица, которая представляет объем необработанной плазмы, вычисленный с учетом гематокрита донора, который находится в пределах объема продукта плазмы, установленного номограммой FDA с использованием соотношения 1:16 антикоагулянта к цельной кровь.
[0030] Фиг. 8 - таблица, которая представляет объем «невостребованной» необработанной плазмы в продукте плазмы, рассчитанный по разности между значениями, представленными на фиг. 7, и максимальным объемом необработанной плазмы, который можно взять на основании номограммы FDA.
[0031] Фиг. 9 - таблица, которая представляет объем продукта плазмы, который может быть взят у донора, с учетом веса и гематокрита донора, что дает, в результате, максимально допустимый объем необработанной плазмы, допускаемый номограммой FDA.
[0032] Фиг. 10 - таблица входных данных для программируемого контроллера для выполнения гипотетической процедуры плазмафереза в соответствии со способом настоящей заявки.
[0033] Фиг. 11a, 11b - таблица, разделенная на две части, показывающая, как гематокрит донора увеличивается на протяжении гипотетической процедуры плазмафереза, учитывающей входные данные из таблицы, показанной на фиг. 10, и приводящей к увеличению суммарного забираемого объема продукта плазмы, необходимого для взятия целевого объема необработанной плазмы.
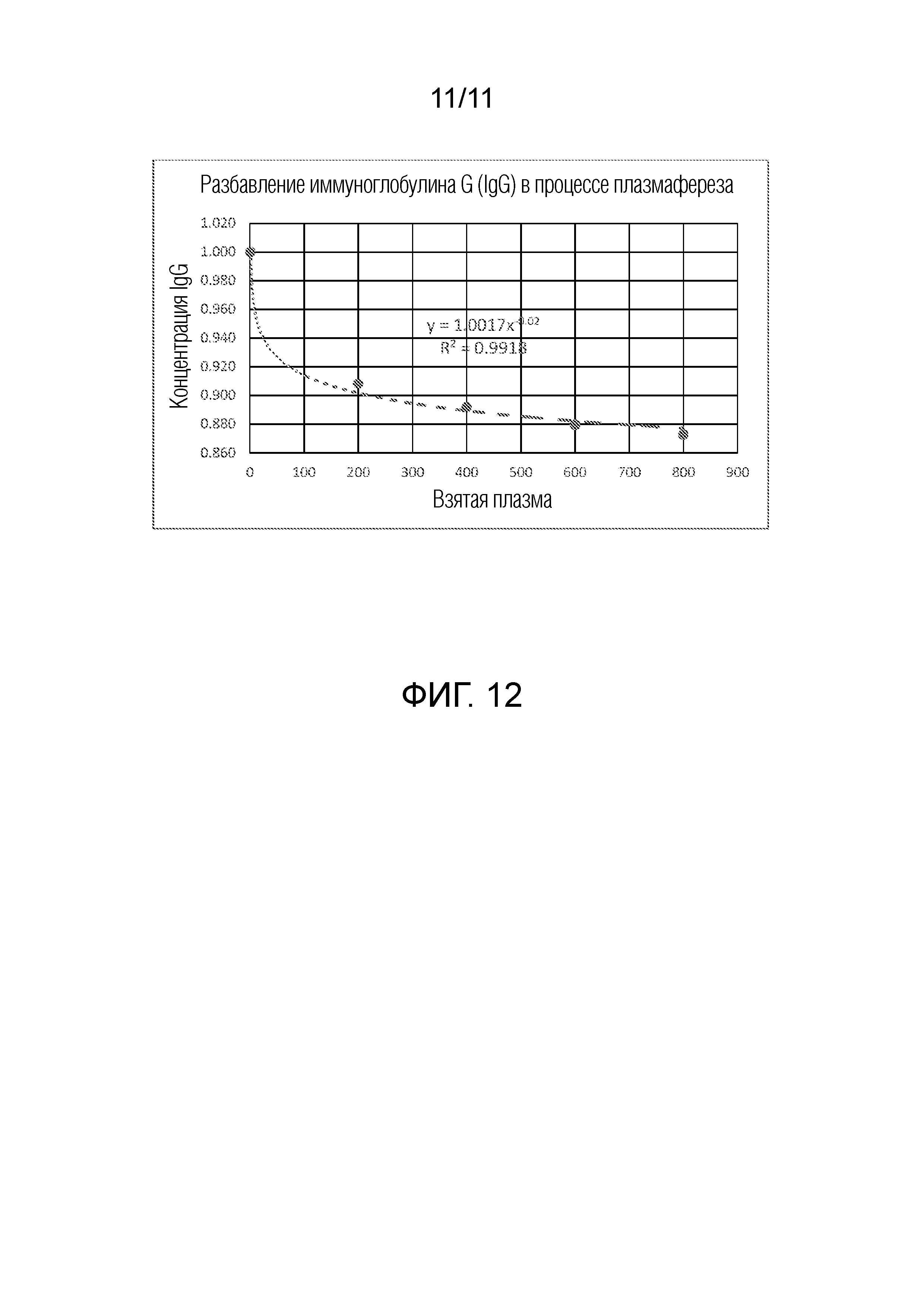
[0034] Фиг. 12 - график, показывающий разбавление иммуноглобулина G (IgG) в процессе плазмафереза.
ПОДРОБНОЕ ОПИСАНИЕ
[0035] Ниже приведено более подробное описание систем и способов в соответствии с настоящим изобретением. Следует понимать, что нижеприведенное описание конкретных устройств и способов предназначено в качестве примера и не исчерпывает все возможные варианты или применения. Таким образом, объем раскрытия не предполагает ограничения и должен пониматься как охватывающий видоизменения или варианты осуществления, которые будут созданы специалистами среднего уровня.
[0036] В контексте настоящей заявки, плазмаферез выполняется в автоматизированной системе, содержащей аппаратный компонент, обозначенный общей позицией 10, и одноразовый набор, обозначенный общей позицией 12, для забора плазмы, подлежащей обработке в качестве исходной плазмы. Как показано на фиг. 2-6 и подробно описано ниже, одноразовый набор 12 состоит из неразъемно соединенных сепаратора, контейнеров и системы трубок для транспортировки крови и растворов в стерильном проходе для текучих сред.
[0037] Сепаратор 14, лучше всего показанный на фиг. 3, содержит вращающийся мембранный фильтр 16, закрепленный к ротору 18 для вращения внутри корпуса 20, чтобы разделять кровь на компоненты. Подробное описание сепаратора с вращающейся мембраной можно найти в патенте США № 5,194,145 выданном Скондорферу, который включен в настоящую заявку путем отсылки. Как можно понять, в другой системе, разделение цельной крови может выполняться центрифугированием. Смотри, например, патент US 5,360,542, изобретателей Уилльямсона с соавторами.
[0038] В процессе плазмафереза, антикоагулированная цельная кровь поступает в сепаратор 14 через впускной порт 22 для цельной крови. Плазма отделяется вращающимся мембранным фильтром и затем выпускается из выпускного порта 24 для плазмы, по линии 26 плазмы и в сборный контейнер 28 для плазмы. Концентрированные клетки перекачиваются из выпускного порта 30 для концентрированных клеток в резервуар 32, где клетки остаются до реинфузии донору.
[0039] Одноразовый набор 12 включает в себя также систему трубных линий для подачи цельной крови из донора в систему во время забора и возвращения концентрированных клеток донору в процессе реинфузии (донорская линия 34, которая заканчивается иглой 36 для венепункции) и для транспортировки антикоагулированной цельной крови в сепаратор (кровопроводящая линия 38), концентрированных клеток в резервуар (линия 40 клеток), концентрированных клеток из резервуара в донорскую линию (реинфузионная линия 42), плазмы в сборный контейнер для плазмы (линия 44 плазмы), физиологического раствора (линия 46 физиологического раствора) и антикоагулянта (линия 48 AC).
[0040] Аппаратный компонент 10 включает в себя программируемый контроллер 50 и сенсорный экран 52 с графическим пользовательским интерфейсом («GUI»), посредством которого оператор управляет процедурой. Например, GUI допускает ввод чего-нибудь из идентификатора (ID) донора, пола донора, высоты донора, веса донора, возраста донора, гематокрита/гемоглобина донора; целевого инфузионного объема физиологического раствора (если выбран протокол для физиологического раствора) и целевого объема плазмы. Сенсорный экран 52 позволяет также оператору собирать информацию о состоянии и справляться с состояниями ошибок.
[0041] Три перистальтических насоса располагаются на передней панели аппаратного компонента 10, включая насос 54 AC, насос 56 крови и насос 58 клеток. Насос 54 AC нагнетает раствор антикоагулянта (AC) с управляемым расходом в кровопроводящую линию 38, когда цельная кровь поступает в набор из донора. Насос 56 крови нагнетает антикоагулированную цельную кровь в сепаратор в фазе забора процедуры и возвращает концентрированные клеточные компоненты и, при желании, замещающую жидкость донору в реинфузионной фазе процедуры. Насос 58 клеток нагнетает концентрированные клеточные компоненты из сепаратора 14 в резервуар в фазе забора.
[0042] Передняя панель включает в себя также четыре зажима, в которые устанавливается одноразовый набор 12, включающий в себя зажим 60 реинфузионной линии, зажим 62 кровопроводящей линии, зажим 64 линии физиологического раствора и зажим 66 линии плазмы. Зажим 60 реинфузионной линии сжимается для блокировки реинфузионной линии (42) в фазе забора (фиг. 5) и разжимается в фазе реинфузии (фиг. 6), чтобы позволить насосу крови выполнять реинфузию концентрированных клеточных компонентов из резервуара 32 донору. Зажим 62 кровопроводящей линии разжимается в фазе забора, чтобы допускать нагнетание антикоагулированной цельной крови в сепаратор 14, и сжимается в фазе реинфузии, чтобы блокировать кровопроводящую линию 38. Зажим 64 линии физиологического раствора сжимается, чтобы блокировать линию 46 физиологического раствора в фазе забора и во время реинфузии отделенных клеточных компонентов. Если физиологический раствор планируется использовать в качестве замещающей жидкости, то зажим 64 линии физиологического раствора разжимается в фазе реинфузии. Зажим 66 линии плазмы разжимается в фазе забора, чтобы допустить протекание плазмы в сборный контейнер 28 для плазмы, и сжимается в фазе реинфузии.
[0043] Аппаратный компонент 10 включает в себя трое весов для контроля текущего взятого объема плазма (весы 68), объема раствора AC (весы 70) и объема концентрированных клеточных компонентов (весы 72). Система включает в себя различные датчики и детекторы, включающие в себя датчик 74 венозного давления, датчик 76 давления в сепараторе, оптические детекторы 78 крови и воздушный детектор 80.
[0044] Донор подключен к системе на протяжении всей процедуры. Как показано, одноразовый набор 12 включает в себя одну иглу 36 для венепункции, через которую цельная кровь забирается у донора в фазе забора (фиг. 5) и концентрированные клетки возвращаются донору на стадии реинфузии (фиг. 6). Как отмечено выше, процедура плазмафереза может содержать множество циклов, каждый из которых содержит фазу забора/разделения, за которой следует фаза возврата или реинфузии. В фазе забора, цельная кровь разделяется на плазму и концентрированные клетки. Одноразовый набор включает в себя сборный контейнер 28 для плазмы для приема отделенной плазма и резервуар 32 для приема концентрированных клеток. В фазе реинфузии выполняется реинфузия концентрированных клеток из резервуара 32 донору через иглу 36 для венепункции. Обычно, плазмаферез, выполняемый с использованием одной иглы 36 для венепункции, включает в себя несколько циклов забора и реинфузии.
[0045] Как также показано на фиг. 5, в фазе забора, раствор антикоагулянта (AC) нагнетается с управляемым расходом и смешивается с цельной кровью, когда она поступает в одноразовый набор 12. Антикоагулированная кровь нагнетается в сепаратор 14, где плазма отделяется от клеточных компонентов и направляется в сборный контейнер 28 для плазмы.
[0046] Клеточные компоненты откачиваются из сепаратора 14 в резервуар 32. Фаза забора прекращается, когда резервуар 32 набирает расчетный объем концентрированных клеток, или если набирается целевой забираемый объем плазмы.
[0047] Затем начинается фаза реинфузии. Как показано на фиг. 6, в фазе реинфузии, насос 56 крови изменяет направление работы и перекачивает концентрированные клетки из резервуара 32 обратно донору через иглу 36 для афереза. Если выбран протокол для физиологического раствора, по которому донору возвращается физиологический раствор в качестве жидкости, замещающей забираемую плазму, то за окончательной фазой реинфузии следует инфузия физиологического раствора.
[0048] Согласно одному аспекту изобретения, автоматизированное устройство для забора плазмы выполнено с возможностью забора объема/веса антикоагулированной плазмы (т.е., продукта плазмы), имеющей максимальный объем/вес необработанной плазмы, допустимый для донора согласно пределам, установленным в номограмме FDA. Чтобы максимально увеличить объем необработанной плазмы, содержащий продукт плазмы, устройство программируют с помощью номограммы, которая учитывает гематокрит донора. При известных гематокрите донора и соотношении AC прибора, суммарный объем/вес продукта плазмы, подлежащий забору, можно определять так, чтобы продукт плазмы включал в себя максимальный объем/вес необработанной фракции плазмы, который можно взять у донора, на основании пределов для суммарного объема/веса необработанной плазмы, установленных в номограмме FDA. Благодаря выполнению вычислений, запрограммированных в контроллере, вероятность операторский ошибки снижается по сравнению с автономным вычислением забираемого объема, который затем вводится в прибор.
[0049] В процессе плазмафереза, когда антикоагулянт смешивается с цельной кровью, когда она забирается у донора, антикоагулянт равномерно распределяется внутри необработанной плазмы в крови. Однако, количество необработанной плазмы в цельной крови зависит от гематокрита (Hct) цельной крови. Установлены нижеследующие зависимости:
Объем RBC (эритроцитов) = Объем цельной крови × Hct/100. [1]
Объем необработанной плазмы=Объем цельной крови × (1-Hct/100). [2]
Когда антикоагулянт смешивается с цельной кровью, он обычно дозируется в соотношении AC (ACR) 16 частей цельной крови на 1 часть AC или 1 часть цельной крови на 0,06 частей AC.
ACR=Объем цельной крови/Объем антикоагулянта (донорская кровь, не содержащая антикоагулянта). [3]
(Это дает результат, немного отличающийся от номограммы FDA, которая, как отмечено выше, стандартизирует объем антикоагулянта, который можно добавлять в соотношении 1:16 антикоагулянта к антикоагулированной крови или 0,06 частей антикоагулянта на 1 часть антикоагулированной крови).
Объем антикоагулированной крови=Объем антикоагулянта+Объем цельной крови. [4]
Совместное решение уравнений дает:
Объем необработанной плазмы=ACR × Объем антикоагулянта × (1-Hct/100). [5]
Поскольку эритроциты возвращаются обратно донору, то:
Объем взятой плазмы=Объем необработанной плазмы+Объем антикоагулянта. [6]
Уравнения [5] и [6] можно объединить для вычисления количества антикоагулянта в данном количестве взятой плазмы:
Объем антикоагулянта=Объем взятой плазмы/(1+ACR×(1-Hct/100)). [7]
Далее:
Объем взятой плазмы=Объем необработанной плазмы × K, где К = (ACR×(1-Hct/100)+1)/(ACR×(1-Hct/100)). [8]
[0050] Ввиду зависимостей, выраженных вышеприведенными уравнениями, объем необработанной плазмы, содержащейся в объеме продукта плазмы, допустимый согласно номограмме FDA, можно определять с учетом гематокрита донора. Результаты таких вычислений приведены на фиг. 7, которая представляет объем необработанной плазмы с учетом гематокрита донора, который содержится в пределах объема продукта плазмы, установленных номограммой FDA.
[0051] Как можно понять из фиг. 7, для доноров с весом 110-149 фунтов (49,9-67,6 кг) (для кого максимальный объем продукта плазмы по номограмме FDA равен 690 мл), если донор имеет гематокрит не ниже 42, то, по номограмме FDA, допускается брать объем необработанной плазмы меньше 625 мл. Ситуация является аналогичной для доноров с весом 150-174 фунтов (69,0-78,9 кг) (для кого максимальный забираемый объем плазмы по номограмме FDA равен 825 мл) и для доноров с весом не меньше 175 фунтов (79,4 кг) (для кого максимальный забираемый объем плазмы по номограмме FDA равен 880 мл), когда гематокрит донора составляет не ниже 40.
[0052] Таблица, приведенная на фиг. 8, представляет объем «невостребованной» необработанной плазмы в продукте плазмы, рассчитанный по разности между значениями, представленными на фиг. 7, и максимальным объемом необработанной плазмы, который можно взять на основании номограммы FDA. Таким образом, как показано в таблице, представленной на фиг. 9, продукт плазмы, забираемый у любого конкретного донора, можно скорректировать по количеству от приведенного в номограмме FDA на количество, соответствующее количеству «невостребованной» необработанной плазмы, приведенному на фиг. 8, плюс количество антикоагулянта, необходимое для обработки дополнительного объема.
[0053] В качестве альтернативы, объем продукта плазмы, подлежащий забору, можно вычислить путем определения сначала веса и гематокрита (Hct) для донора; определения объема необработанной плазмы (VRP), который можно взять с учетом веса донора (Wkg); определения соотношения К между VPP и VRP, а именно K=VPP/VRP, на основании соотношения антикоагулянта (ACR; 1:16 или 0,06:1 по номограмме FDA) и Hct донора; и определения VPP по формуле VPP=VRP×K. При этом, K=(ACR×(1-Hct/100)+1)/(ACR×(1-Hct/100)).
[0054] В качестве дополнительной альтернативы, объем продукта плазмы, который подлежит забору, (VPP) можно вычислить путем определения сначала веса (Wkg) и гематокрита (Hct) донора; определения объема необработанной плазмы (VRP), который можно взять с учетом веса донора (Wkg); определения объема антикоагулянта (VAC), подлежащего добавлению, на основании соотношения антикоагулянта (ACR; 1:16 или 0,06:1 по номограмме FDA) и гематокрита донора, по формуле VAC=VRP×(ACR×(1-Hct/100)); и определения забираемого объема по формуле VPP=VRP+VAC.
[0055] Для определения объема необработанной плазмы, который можно взять с учетом веса донора, можно применить различные способы. Например, вес донора можно умножать на установленную постоянную величину «К1» (например, 10 мл/кг). В качестве альтернативы, вес донора можно разделить на весовые категории, с назначением фиксированного объема для каждой категории (например, в вышеописанной номограмме FDA, в которой диапазоны веса донора разбиты на три категории).
[0056] В качестве альтернативы, объем плазмы донора можно оценивать по суммарному объему крови донора, и объем плазмы, который можно взять с учетом безопасности и удобства для донора, можно вычислить на основании данной оценки. Для оценки суммарного объема крови донора обычно применяют способы, использующие параметры донора. Примеры таких способов включают в себя уравнения Надлера (которые учитывают рост, пол и вес донора), правило Пяти Гилчера (которое учитывает пол, вес и морфологию (ожирение, истощение, нормальный или спортивный организм) или стандарты Международного комитета по стандартизации в гематологии («ICSH») (изложенные в публикации Br. J. Haem. 1995, 89:748-56) (которые учитывают рост, вес, возраст и пол донора). Можно также применять любые другие общепринятые методы для определения суммарного объема крови донора. После того, как определение суммарного объема крови донора выполнено, объем плазмы донора можно оценить умножением суммарного объема крови на постоянную величину «К2», где K2 равна (1-Hct донора).
[0057] Из анализа демографических, исследовательских и лабораторных данных, полученных по Национальной программе проверки здоровья и питания за 2015-2016 гг., в которой выбирались пол, возраст, рост, вес, данные о беремести и гематокрит, представленных в публикации Pearson et al., Interpretation of measured red cell mass and plasma volume in adults: Expert Panel on Radionuclides of the International Council for Standardization in Haematology, British J. Haematology, 89: 748-756 (1995) (из которой получены формулы, рекомендованные ICSH), было установлено, что у доноров, имеющих некоторые характеристики, (а именно женщин с небольшим весом и высокими уровнями гематокрита) можно брать до 36% имеющейся плазмы, при этом оставаясь в рамках действующих правил. Процедуры плазмафереза с такими донорами регулярно выполнялись без нежелательных реакций и, следовательно, полагаются безопасными. Это предполагает, что до 36% имеющейся плазмы донора можно безопасно забирать в ходе процедуры плазмафереза.
[0058] С учетом того, что потенциальную опасность представляют только отрицательные отклонения истинного объема крови донора от прогнозируемого/вычисленного суммарного объема крови, возможно, целесообразна дополнительная корректировка в сторону понижения доступного для забора объема плазмы. С учетом отклонения между вычисленным объемом крови, установленным в вышеупомянутой публикации Pearson et al., и экспериментальными данными по объему крови, представленными в публикации Retzlaff et al., Erythrocyte Volume, Plasma Volume, and Lean Body Mass in Adult Men and Women, J. Haematology, 33, 5:649-667 (1969), существует 95% достоверность того, что прогнозируемый объем крови индивидуума будет отличаться не более, чем на 20,5%. Таким образом, вышеупомянутое установленное значение для доступной для забора необработанной плазмы, составляющее 36% от суммарного объема плазмы донора, можно умножить на масштабный коэффициент 0,795, и поэтому от вычисленного объема необработанной плазмы донора можно брать 28,6%, с учетом безопасности и удобства для донора.
[0059] В качестве альтернативы, в вычисленный объем цельной крови VWB можно внести поправку VC перед вычислением объема доступной для забора плазмы VRP, а именно VRP=0,36(1-Hct)(VWB-VC). Регрессионный анализ данных, представленных в публикации Retzlaff et al., привел, в результате, к VC=523 мл.
[0060] Таким образом, забираемый объем (объем продукта плазмы) определяют, исходя из объема необработанной плазмы, который можно взять у конкретного донора, гематокрита донора и фиксированного соотношения антикоагулянта (ACR). Следовательно, данная методология дает возможность надежнее контролировать объем необработанной плазмы донора, который является переменной величиной, наиболее соответствующей безопасности донора.
[0061] На практике, оператор вводит в контроллер системы забираемый объем продукта плазмы для конкретного донора, исходя из целевого объема необработанной плазмы, который можно взять. Целевой забираемый объем плазмы может быть таким, который показан на фиг. 9 и учитывает вес и гематокрит донора для начальной фазы забора, или получен любым из других вышеизложенных способов. В качестве альтернативы, контроллер выполнен с возможностью вычисления целевого забираемого объема продукта плазмы для начальной фазы забора в соответствии с такими методами, которые описаны выше, после ввода оператором, например, веса и гематокрита донора, и/или любой дополнительной информации, относящейся к конкретному донору, (например, пола, роста и возраста донора), требуемой согласно методам, применяемым для определения суммарного объема крови донора, суммарного объема плазмы и целевого объема доступной для забора плазмы, который можно взять. В дополнительном альтернативном варианте, устройство для забора плазмы может быть объединено с системой организации работы с донорами, посредством которой параметры донора, используемые для скрининга на годность, (такие как вес, гематокрит и т.п.) могут передаваться в электронном формате в прибор, что устраняет возможность ошибки оператора при вводе параметров донора. Система организации работы с донорами может также использовать измерения при скрининге доноров, вместе с зависимостью между объемом необработанной плазмы и забираемым объемом, чтобы автоматически вычислять забираемый объем плазмы, который она будет передавать в контроллер устройства для плазмафереза.
[0062] Как отмечено выше, процедуры плазмафереза выполняются в форме нескольких циклов фаз забора/взятия и фаз возврата/реинфузии. Если фаза возврата/реинфузии не включает в себя реинфузию замещающей жидкости, то гематокрит донора будет повышаться от одного цикла к следующему циклу. Следовательно, если целевой объем для продукта плазмы определяется с учетом только начального гематокрита донора и не учитывает повышающийся гематокрит донора, то объем антикоагулянта в продукте плазмы будет больше (и объем необработанной плазмы меньше), чем объем, спрогнозированный первоначальным вычислением для определения целевого объема продукта плазмы. Таким образом, для обеспечения того, чтобы объем продукта плазмы, который забирается, содержал максимальный объем необработанной плазмы, который определили для забора от конкретного донора, целевой объем для продукта плазмы периодически вычисляется повторно на протяхении всей процедуры плазмафереза, например, перед началом фазы забора каждого цикла, чтобы учитывать изменение гематокрита донора.
[0063] Соответственно, выполняется определение целевого объема для продукта плазмы с учетом начального гематокрита донора. Процедура плазмафереза начинается с первой фазы взятия, пока у донора не забирают заданный объем цельной крови (обычно, около 500 мл). В цельную кровь добавляют антикоагулянт, и антикоагулированную цельную кровь разделяют на продукт плазмы, эритроциты и другие неэритроцитные компоненты крови. В заключение первой фазы забора, эритроциты и неэритроцитные компоненты крови возвращают донору. Текущий объем продукта плазмы, взятый после первой фазы забора, определяют например, например, на весах. Затем, устанавливается текущее значение гематокрита донора, и определяется новый целевой объем продукта плазмы, подлежащий забору, и выполняется второй цикл фаз забора и возврата. Цикл фаз забора и возврата повторяется, пока не забирается целевой объем продукта плазмы для процедуры плазмафереза, вычисляемый перед началом каждой фазы забора. После окончательной фазы забора, контроллер начинает окончательную стадию реинфузии эритроцитов, после которой донора отключают.
[0064] Преимущества выполнения процедуры плазмафереза, содержащей несколько циклов забора/реинфузии, в соответствии с вышеизложенной методологией можно видеть из таблиц на фиг. 10 и 11a, 11b. Фиг. 10 отображает входные данные для гипотетической процедуры плазмафереза для донора, имеющего вес 190 фунтов (86,4 кг) и начальный гематокрит 44. Как видно из фиг. 1, упрощенная номограмма FDA будет ограничивать объем плазмы, подлежащий забору у такого донора, до 800 мл и суммарный забираемый объем продукта плазмы до 880 мл. В настоящем примере, предел по номограмме FDA для объема необработанной плазмы, который можно взять, представлен только с целью иллюстрации. Как изложено выше, можно воспользоваться другими методами для определения количества необработанной плазмы, которое можно безопасно извлечь из донора, и которое будет отличаться от количества, указанного номограммой FDA.
[0065] Число циклов забора и реинфузии в ходе процедуры плазмафереза может варьироваться от трех до двенадцати. В гипотетической процедуре плазмафереза выполняется пять циклов забора и реинфузии, которые выбраны с целью иллюстрации.
[0066] Перед началом первого цикла забора, объем необработанной плазмы, подлежащий забору, и суммарный целевой объем продукта плазмы, подлежащий забору, определяются в соответствии с вышеописанными методами, с учетом начального гематокрита донора. Как указано в первой строке таблицы (начало цикла 1), начальный, подлежащий забору целевой объем для продукта плазмы равен 889 мл, что равно значению, указанному в таблице на фиг. 9 для донора, имеющего вес не менее 175 фунтов (79,4 кг) и гематокрит 44, чтобы взять у донора предельный объем 800 мл по FDA необработанной плазмы.
[0067] В каждой фазе забора, у донора берут 500 мл цельной крови, в которую добавляется антикоагулянт в предварительно заданном отношении (т.е., 1:16), так что в каждом цикле забора 500 мл добавляется 31 мл. Цельная кровь с антикоагулянтом разделяется на фракции плазмы и фракцию эритроцитов.
[0068] В первой фазе возврата (окончание возврата в цикле 1), эритроциты и «неэритроцитные» компоненты крови возвращаются донору, и поэтому в конце первого цикла возврата гематокрит донора повысился до 45,6% по результату вычисления контроллером с учетом уменьшения объема крови на количество взятой необработанной плазмы, тогда как количество эритроцитов в суммарном объеме крови остается таким же, как в начале процедуры. Контроллер может также учитывать объем антикоагулянта, который возвращается в результате реинфузии в каждой фазе возврата вместе с эритроцитами, а также остаточный антикоагулянт в цельной крови донора, забираемой в цикле 2 и последующих циклах, при определении нового значения гематокрита для следующего цикла. Затем повторно вычисляется объем необработанной плазмы и суммарный целевой объем продукта плазмы, подлежащие забору в ходе процедуре, исходя из нового, повышенного гематокрита донора и объема необработанной плазмы. Это дает новый суммарный целевой забираемый объем 891 мл.
[0069] Затем выполняется вторая фаза забора, дающая, в результате, в сумме 430 мл продукта плазмы, содержащего 386 мл необработанной плазмы, забираемой в течение первых двух фаз забора (окончание забора в цикле 2). Эритроциты и «неэритроцитные» компоненты крови снова возвращаются донору, после чего гематокрит донора вычисляется как равный 47,2%.
[0070] Выполняются еще две фазы забора по 500 мл, после каждой из которых следует фаза возврата, в ходе которых новые значения для объема необработанной плазмы и суммарного объема продукта плазмы, подлежащие забору, определяются перед началом каждой фазы забора. С повышением гематокрита донора, пересчитанный целевой забираемый объем для процедуры увеличивается до 893 мл (для третьей фазы забора) и затем до 894 мл (для четвертой фазы забора). Пятый цикл «мини»-забора выполняется, чтобы довести объем взятой необработанной плазмы до 800 мл, допускаемых номограммой FDA для гипотетического донора. Пересчитанный целевой забираемый объем продукта плазмы для пятой фазы забора остается равным 894 мл.
[0071] Таким образом, как показано в вышеприведенном примере, когда целевой забираемый объем для продукта плазмы повторно вычисляют для каждой фазы забора, получают целевой забираемый объем 894 мл для продукта плазмы, который требуется для забора целевого объема 800 мл необработанной плазмы. Напротив, было бы взято 889 мл продукта плазмы, если бы целевой забираемый объем определялся только с учетом начального гематокрита донора, или 880 мл, если бы целевой забираемый объем определялся по упрощенной номограмме FDA. В обоих случаях, был бы взят целевой объем менее 800 мл.
[0072] Как можно понять, чем выше точность, с которой можно определять гематокрит донора, как до, так и в ходе процедуры, тем выше вероятность, что целевой объем забираемого продукта плазмы будет включать в себя максимальный объем необработанной плазмы, который можно брать у конкретного донор. Как описано выше, гематокрит донора в ходе процедуры определяется в предположении, что 100% эритроцитов, которые извлекаются в каждом цикле забора, возвращаются реинфузией в каждом цикле возврата, вместе со 100% неэритроцитных клеточных продуктов и объемом антикоагулянта. Однако, как установлено, в течение процедуры разделения крови, во внутрисосудистое пространство может переместиться интерстициальная жидкость, что приводит к восстановлению половины взятого объема. Смотри публикацию Saito et al., Interstitial fluid shifts to plasma compartment during blood donation, Transfusion 2013; 53(11):2744-50. Перемещенная интерстициальная жидкость является добавлением к эритроцитам, неэритроцитным клеточным продуктам и антикоагулянту, которые возвращаются реинфузией в каждой фазе возврата. Таким образом, учет перемещения интерстициальной жидкость имел бы следствием более точное определение гематокрита и, следовательно, более точное определение целевого объема продукта плазмы, что дало бы, в результате, максимальное количество необработанной плазмы.
[0073] Перемещение интерстициальной жидкости в процессе плазмафереза подтверждено отслеживанием уровня иммуноглобулина G (IgG) донора на протяжении процедуры плазмафереза. Смотри, например, публикацию Burkhardt et al., Immunoglobulin G levels during collection of large volume plasma for fractionation; Transfusion 2017; 56:417-420. Если бы никакая интерстициальная жидкость не перемещалась, то уровень IgG донора оставался бы стабильным на протяжении процедуры плазмафереза. Однако, как выяснилось, уровень IgG level снижался, и величина, на которую снизился уровень IgG, зависит от объема интерстициальной жидкости, который переместился в кровеносную систему.
[0074] На фиг. 12 представлен эмпирически полученный график зависимости концентрации IgG (по Y-оси) от объема взятой плазмы (по X-оси). Показано снижение IgG донора на 9% от исходного значения при нулевом объеме взятой плазмы (в начале процедуры) в интервале забора до 200 мл плазмы, и снижение еще на 4% в интервале забора от 200 мл до 800 мл. Это объяснялось перемещением интерстициальной жидкости, эквивалентным от, приблизительно, 9% от начального суммарного объема крови донора (после забора 200 мл плазмы) до, приблизительно, 13% от начального суммарного объема крови донора (после забора 800 мл плазмы).
[0075] На основании графика на фиг. 12 установлена следующая зависимость между значением концентрации IgG донора и объемом взятой плазмы: у=1,0017x-0,02, где у=концентрация IgG, и x=взятый объем плазмы. Таким образом, процентная доля объема крови донора, которая замещается перемещением интерстициальной жидкости, равна Vb(1-y), где Vb означает начальный объем цельной крови донора. Таким образом, перемещенный объем интерстициальной жидкости можно вычислять по объему взятой плазмы, и данное количество можно суммировать с объемом эритроцитов, неэритроцитных клеточных продуктов и антикоагулянт, возвращаемых реинфузией в каждой фазе возврата, чтобы определять текущий суммарный объем крови, и, следовательно, гематокрита, донора. Как можно понять, контроллер может быть сконфигурирован с возможностью автоматического определения объема интерстициальной жидкости, которая была перемещена, исходя из объема взятой плазмы, и учета перемещенного объема, при определении гематокрита донора перед каждой фазой забора.
[0076] В качестве альтернативы можно применить другие способы, которые непосредственно измеряют гематокрит донора, например, оптический датчик или, если применяется центробежный сепаратор, измерение объема эритроцитов в центрифуге.
[0077] Кроме того, перед началом процедуры плазмафереза, на этапах предварительной обработки, в одноразовый набор обычно добавляют антикоагулянт, например, для первичной заливки одноразового набора, выполнения одного или более подготовительных циклов или для выполнения других допроцедурных этапов. В той мере, насколько антикоагулянт, используемый в упомянутых целях, направляется, в конечном счете, в сборный контейнер для продукта плазмы, его можно учитывать при определении объема, содержащегося в сборном контейнере для плазмы, дает, в результате, целевой объем забираемой необработанной плазмы. Это можно сделать, например, посредством измерения веса «полного» контейнера антикоагулянта и веса контейнера антикоагулянта перед началом первого цикла забора и прибавлением данного объема антикоагулянта к целевому объему продукта плазмы. Контроллер может быть выполнен с возможностью автоматического выполнения этапов, необходимых для учета антикоагулянта, поданного в сборный контейнер для плазмы отдельно от антикоагулированной плазмы.
[0078] Вышеописанные способ и система имеют несколько аспектов. В первом аспекте предлагается способ для забора плазмы, в котором продукт плазмы забирается в течение нескольких фаз забора, между которыми отделенные эритроциты возвращаются реинфузией донору. Способ в соответствии с данным первым аспектом содержит следующие этапы: a) определение объема цельной крови (Vb) и гематокрита (Hct) для донора; b) определение объема необработанной плазмы (VRP), который можно взять у донора; c) определение объема продукта плазмы (VPP), который можно взять, при этом продукт плазмы содержит объем необработанной плазмы, плюс объем антикоагулянта; d) забор цельной крови у донора; e) добавление антикоагулянта во взятую цельную кровь в заданном соотношении (ACR); f) разделение взятой цельной крови на продукт плазмы и второй компонент, содержащий эритроциты; g) накопление продукта плазмы в сборном контейнере для плазмы; h) после того, как у донора взято требуемое количество цельной крови, возвращение эритроцитов донору; и i) определение Hct донора и VPP перед каждой фазой забора.
[0079] Во втором аспекте, этапы d)-i) продолжаются, пока измеренный объем продукта плазмы в сборном контейнере не становится равным VPP.
[0080] В третьем аспекте предлагается способ для забора плазмы, в котором продукт плазмы забирается в течение нескольких фаз забора, между которыми отделенные эритроциты возвращаются реинфузией донору. Способ в соответствии с данным вторым аспектом содержит следующие этапы: a) определение объема цельной крови (Vb) и гематокрита (Hct) для донора; b) определение объема необработанной плазмы (VRP), который можно взять у донора, на основании Vb; c) определение объема антикоагулянта VAC, подлежащего добавлению в VRP, на основании соотношения антикоагулянта (ACR) и Hct донора, по формуле VAC=VRP×(ACR×(1-Hct)); d) определение объема продукта плазмы (VPP), который можно взять, при этом продукт плазмы содержит объем необработанной плазмы (VRP), плюс объем антикоагулянта (VAC); e) забор цельной крови у донора; f) добавление антикоагулянта во взятую цельную кровь в заданном соотношении (ACR); g) разделение взятой цельной крови на продукт плазмы и второй компонент, содержащий эритроциты; h) накопление продукта плазмы в сборном контейнере для плазмы; i) после того, как у донора взято требуемое количество цельной крови, возвращение эритроцитов донору; и j) определение Hct донора и VPP перед каждой фазой забора.
[0081] В четвертом аспекте, этапы d)-j) продолжаются, пока измеренный объем продукта плазмы в сборном контейнере не становится равным VPP.
[0082] В пятом аспекте, Vb определяется на основании одной или более конкретных характеристик донора, включающих в себя вес, рост, пол, возраст и морфологию донора.
[0083] В четвертом аспекте предлагается способ для забора объема продукта плазмы (VPP) в ходе процедуры афереза, в котором продукт плазмы забирается в течение нескольких фаз забора, между которыми отделенные эритроциты возвращаются реинфузией донору. В способе в соответствии с данным четвертым аспектом, VPP равен объему необработанной плазмы (VRP), который можно взять у донора, плюс объем антикоагулянта (VAC), который добавляют в VRP в ходе процедуры афереза. Этапы способа содержат: a) определение веса (Wkg) и пола (M или F) для донора; b) определение гематокрита (Hct) для донора; c) определение объема необработанной плазмы (VRP), который можно взять с учетом веса (Wkg) и пола (M или F) донора; d) определение соотношения К между VPP и VRP, а именно К=VPP/VRP, на основании соотношения антикоагулянта и Hct донора; e) определение VPP по формуле VPP=VRP×K; f) забор цельной крови у донора; g) добавление антикоагулянта во взятую цельную кровь в заданном соотношении (ACR); h) разделение взятой цельной крови на продукт плазмы и второй компонент, содержащий эритроциты; i) накопление продукта плазмы в сборном контейнере для плазмы; j) после того, как у донора взято требуемое количество цельной крови, возвращение эритроцитов донору; и k) определение Hct донора и целевого VPP перед каждой фазой забора.
[0084] В пятом аспекте, этапы c)-k) повторяются, пока измеренный объем продукта плазмы в сборном контейнере не становится равным VPP. Предпочтительно, К=VPP/VRP=(ACR×(1-Hct/100)+1)/(ACR×(1-HCT/100)).
[0085] В пятом аспекте предлагается способ для забора объема продукта плазмы (VPP) в ходе процедуры афереза, в котором продукт плазмы забирается в течение нескольких фаз забора, между которыми отделенные эритроциты возвращаются реинфузией донору. В данном пятом аспекте, VPP равен объему необработанной плазмы (VRP), который можно взять у донора, плюс объем антикоагулянта (VAC), который добавляют в VRP в ходе процедуры афереза. Этапы способа содержат: a) определение веса (Wkg) и пола (M или F) для донора; b) определение гематокрита (Hct) для донора; c) определение объема необработанной плазмы (VRP), который можно взять, с учетом веса донора (Wkg) и пола (M или F) донора; d) определение VAC, подлежащего добавлению в VRP, на основании соотношения антикоагулянта (ACR) и Hct донора, по формуле VAC=VRP×(ACR×(1-Hct)); e) определение VPP по формуле VPP=VRP+VAC; f) забор цельной крови у донора; g) добавление антикоагулянта во взятую цельную кровь в заданном соотношении (ACR); h) разделение взятой цельной крови на продукт плазмы и второй компонент, содержащий эритроциты; i) накопление продукта плазмы в сборном контейнере для плазмы; j) после того, как у донора взято требуемое количество цельной крови, возвращение эритроцитов донору; и k) определение Hct донора и VPP перед каждой фазой забора.
[0086] В шестом аспекте, этапы d)-k) продолжаются, пока измеренный объем продукта плазмы в сборном контейнере не становится равным VPP.
[0087] В седьмом аспекте, VRP определяется посредством установления VRP для каждого из множества диапазонов веса донора и выбора VRP для диапазона веса, который включает в себя вес донора. Диапазоны веса донора могут подразделяться на три категории 110-149 фунтов (49,9-67,6 кг), 150-174 фунтов (69,0-78,9 кг) и не меньше 175 фунтов (79,4 кг).
[0088] В восьмом аспекте, VRP=K1×Wkg.
[0089] В девятом аспекте, VRP не превышает 28,6% от (1-Hct)×(Vb).
[0090] В десятом аспекте, Vb определяется с использованием чего-то одного из уравнений Надлера, правила Пяти Гилчера, стандартов ICSH или любой другой общепринятой методологии.
[0091] В одиннадцатом аспекте, VRP=Wkg×10 мл/кг.
[0092] В двенадцатом аспекте, когда для оценки суммарного объема крови (Vb) для донора используются параметры донора, VRP=K2×Vb.
[0093] В тринадцатом аспекте предлагается автоматизированная система для отделения плазмы от цельной крови, содержащая многократно используемый аппаратный компонент и одноразовый набор. Одноразовый набор дополнительно содержит i) сепаратор для разделения цельной крови на фракцию плазмы и концентрированную клеточную фракцию, при этом сепаратор содержит впускной порт, содержащий кровопроводящую линию, неразъемно соединенную с ним, для транспортировки цельной крови от донора к сепаратору, выпускной порт для плазмы, неразъемно соединенный со сборным контейнером для плазмы линией для плазмы, и выпускной порт для концентрированных клеток, неразъемно соединенный с резервуаром для приема концентрированных клеток перед реинфузией донору; ii) донорскую линию, заканчивающуюся иглой для венепункции, для транспортировки цельной крови от донора в кровопроводящую линию, iii) линию антикоагулянта, неразъемно соединенную с кровопроводящей линией и выполненную с возможностью подсоединения к источнику антикоагулянта, для транспортировки антикоагулянта в донорскую линию, iv) линию физиологического раствора, выполненную с возможностью присоединения к источнику физиологического раствора, для транспортировки физиологического раствора в кровопроводящую линию, и v) реинфузионную линию для транспортировки концентрированных клеток из резервуара в донорскую линию. Многократно используемый аппаратный компонент дополнительно содержит i) первый перистальтический насос для подачи антикоагулянта с управляемым расходом в кровопроводящую линия в фазе забора, ii) второй насос для подачи антикоагулированной цельной крови в сепаратор в фазе забора и для возврата концентрированных клеточных компонентов в фазе реинфузии, iii) третий насос для подачи концентрированных клеточных компонентов из сепаратора в резервуар в фазе забора, iv) зажим, связанный с каждой из кровопроводящей линии, линии плазмы, реинфузионной линии и линии физиологического раствора, v) весы для взвешивания каждого из сборного контейнера для плазмы, резервуара и источника антикоагулянта, и vi) программируемый контроллер, содержащий сенсорный экран для приема входных данных от оператора, причем программируемый контроллер выполнен с возможностью приема сигнала из каждых из весов и автоматического управления первым, вторым и третьим насосами и зажимами, чтобы разделять цельную кровь на фракцию плазмы и концентрированную клеточную фракцию в фазе забора и возвращать концентрированные клетки донору на стадии реинфузии. Программируемый контроллер дополнительно выполнен с возможностью определения веса фракции плазмы, подлежащего накоплению в сборном контейнере для плазмы, в соответствии с любым из аспектов, описанных в настоящей заявке, и прекращения фазы забора по получению сигнала из весов для сборного контейнера для плазмы, эквивалентного весу фракции плазмы, определенному контроллером. При определении целевого количества для продукта плазмы, подлежащего забору, контроллер может быть выполнен с возможностью вычисления гематокрита донора перед фазой забора каждого цикла. В качестве альтернативы или дополнительно, контроллер может принимать сигнал из датчика или чего-то подобного, который показывает гематокрит донора. Кроме того, количество продукта плазмы в сборном контейнере для плазмы может определяться, например, весами, связанными с накоплением плазмы. В одном варианте осуществления, сепаратор содержит сепаратор с вращающейся мембраной.
[0094] Следует понимать, что описанные варианты осуществления служат для иллюстрации некоторых из применений принципов настоящего объекта изобретения. Специалистами в данной области техники могут быть созданы многочисленные модификации, не выходящие за пределы существа и объема заявленного объекта изобретения, в том числе таких сочетаний признаков, которые по-отдельности раскрыты или заявлены в настоящем документе. По этой причине, объем притязаний формулы изобретения не ограничен вышеприведенным описанием, но изложен в нижеследующей формуле изобретения.
Реферат
Изобретение относится к медицинской технике, а именно к системам для плазмафереза и способам для управления системой для плазмафереза, посредством которых оптимизируется объем/вес антикоагулированной плазмы, который забирают. В одном примере предложена номограмма, которая использует гематокрит донора, чтобы вычислять объем/вес необработанной плазмы в продукте плазмы, имеющий максимальный объем, допускаемый номограммой FDA. В ходе процедуры плазмафереза, содержащей несколько фаз забора, за которыми следует цикл реинфузии, в котором концентрированные эритроциты возвращаются донору, объем продукта плазмы, подлежащий забору, вычисляется перед началом каждого цикла забора, чтобы учитывать повышение гематокрита донора, что дает, в результате, больший суммарный объем продукта плазмы, подлежащий забору в ходе процедуры плазмафереза. 4 з.п. ф-лы, 12 ил.

Комментарии