Устройство для измерения и прогнозирования респираторной стабильности пациентов - RU2492808C2
Код документа: RU2492808C2
Чертежи


Описание
Настоящее изобретение относится к области медицинской оценки. Оно находит особое применение в сочетании с прогнозированием респираторной стабильности (или нестабильности) с использованием информации о пациентах и будет описана с конкретной ссылкой на нее. Однако следует понимать, что описанное ниже изобретение также применимо для прогнозирования других медицинских состояний на основании мониторинга и оценки стояния пациентов.
Дыхательная нестабильность, вызванная нарушением газообмена в легких, представляет собой серьезную проблему в отделении интенсивной терапии, поражающую и терапевтических, и хирургических пациентов, и является основной проблемой длительного стационарного лечения и смерти. Она часто связана с искусственной вентиляцией легких, которой подвергаются пациенты. На это указывает низкое отношение PaO2/FiO2 (PF), которое представляет собой отношение парциального давления кислорода в артериальной крови (PaO2) к фракции вдыхаемого кислорода (FiO2). Нарушение газообмена представляет собой один аспект в диагностике острого легочного повреждения (ALI) и острого респираторного дистресс синдрома взрослых (ARDS). ALI может быть связано с отношением PF менее чем 300 и ARDS с отношением PF менее 200. ARDS, например, возникает, когда некардиогенный отек легких (вторичный по отношению к острому повреждению альвеол) ведет к острой дыхательной недостаточности. ARDS характеризуется высокой смертностью на уровне примерно 40-50%.
Искусственная вентиляция легких остается основным способом ведения пациентов по поводу острой дыхательной недостаточности. Аппарат искусственной вентиляции легких подает газ в легкие пациента с использованием положительного давления для обеспечения вспомогательной дыхательной поддержки. Хотя эта респираторная поддержка может спасти жизнь пациента, длительное применение аппарата искусственной вентиляции легких может оказывать повреждающее воздействие. Недавно проведенные исследования свидетельствуют о том, что искусственная вентиляция легких может вызывать, поддерживать или увеличивать риск повреждения легких, приводя к нарушению газообмена. Недостаточность вследствие напряжения, вызванного высоким объемом вентиляции, представляет собой тип повреждения вследствие растяжения, возникающего в результате избыточного растяжения воздушных пространств. Напротив, напряжение в результате действия силы сдвига, вызванное повторным закрытием дыхательных путей во время дыхательного цикла при искусственной вентиляции легких, приводит к повреждению легких низким объемом.
Чем раньше выявляется состояние повреждения у человека, тем скорее может быть предпринято предотвращающее действие, и можно потенциально избежать невосстановимого повреждения. Было разработано несколько способов ослабления повреждения легких, включая введение лекарственных средств и модификацию конструкций аппаратов искусственной вентиляции легких. Однако оказалось трудным определить, когда пациент находится на грани развития нарушения газообмена. Большинство предупреждений в отделениях интенсивной терапии основано на «правилах», в которых используется одна переменная величина, например, частота дыхания. Эти правила подвержены получению множества ложно положительных результатов, т.е., ложных предупреждений, которые становятся назойливыми и имеют тенденцию часто игнорироваться больничным персоналом, или их даже отключают.
Настоящая заявка предоставляет новое и усовершенствованное устройство и способ измерения и прогнозирования респираторной нестабильности пациентов, который преодолевает указанные выше и другие проблемы.
В соответствии с одним аспектом, предоставлено устройство для прогнозирования респираторной нестабильности пациента. Устройство включает в себя запоминающее устройство данных пациента, хранящее данные пациента, и связанный с запоминающим устройством анализатор, который рассчитывает показатель респираторной стабильности пациента. Анализатор применяет, по меньшей мере, одно правило к данным пациента, причем это, по меньшей мере, одно правило основано на множестве параметров, которые в комбинации были идентифицированы как прогнозирующие респираторную нестабильность пациента. На основании применения этих правил, анализатор определяет показатель респираторной стабильности пациента.
В другом аспекте, выполняемый компьютером способ прогнозирования респираторной стабильности пациента заключается в том, что сохраняют данные пациента и рассчитывают показатель респираторной стабильности пациента. Расчет заключается в том, что применяют к данным пациента, по меньшей мере, одно правило, причем это, по меньшей мере, одно правило основано на множестве параметров, которые в комбинации были идентифицированы как прогнозирующие респираторную стабильность пациента, и определяют показатель респираторной стабильности пациента на основании примененных правил.
В другом аспекте, система мониторинга и прогнозирования респираторной стабильности пациента включает в себя запоминающее устройство данных пациента, хранящее данные пациента, и связанный с запоминающим устройством анализатор, который рассчитывает показатель респираторной стабильности пациента. Анализатор применяет набор правил к параметрам данных пациента, причем набор правил был идентифицирован как прогнозирующий респираторную стабильность пациента. На основании применения этих правил, анализатор определяет показатель респираторной стабильности пациента. Каждое правило из набора правил устанавливает порог, по меньшей мере, для одного параметра. Система мониторинга для получения данных пациента, относящихся к респираторной стабильности, направляет данные пациента в запоминающее устройство. Устройство вывода для вывода выходного показателя респираторной стабильности пользователю системы связано с анализатором.
Одно из преимуществ состоит в том, что респираторная нестабильность пациента прогнозируется заранее, до ее возникновения, обеспечивая возможность проведения процедур, облегчающих состояние пациента.
Другое преимущество состоит в том, что прогнозы основываются на параметрах, которые указывают на респираторную нестабильность, таких как нарушение газообмена.
Другое преимущество состоит в том, что изобретение снижает вероятность ложных предупреждений.
Другое преимущество состоит в том, что изобретение обеспечивает возможность начала автоматизированных процедур для смягчения респираторной нестабильности пациента.
Другие преимущества настоящего изобретения станут понятны средним специалистам в данной области по прочтении и осмыслении следующего детального описания.
Изобретение может осуществляться в виде различных компонентов и схем расположения компонентов, и в различных этапах и последовательностях этапов. Чертежи представлены только в целях иллюстрации предпочтительных вариантов осуществления, и их не следует рассматривать как ограничивающие изобретение.
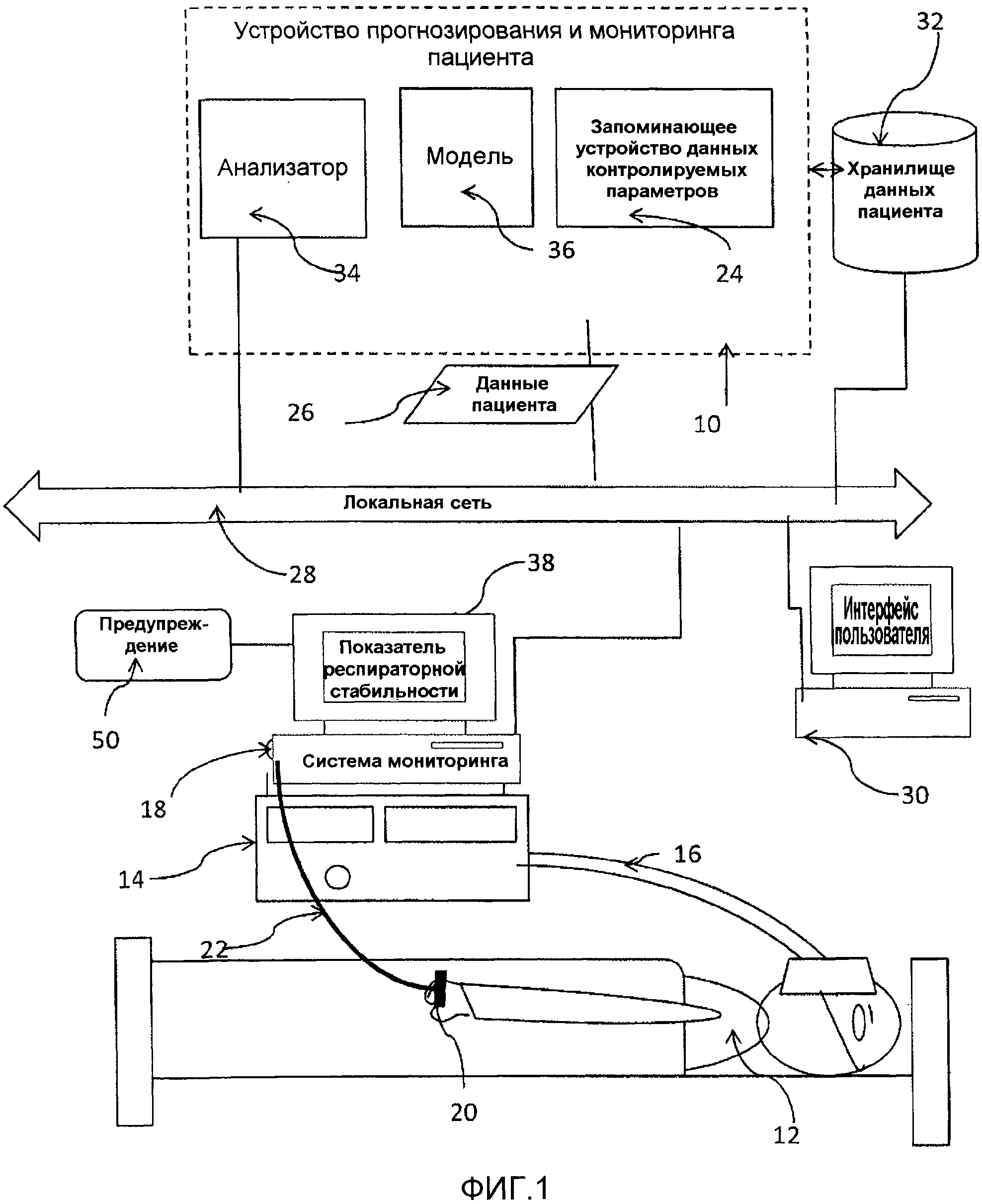
Фиг.1 представляет схематическую функциональную блок-схему варианта осуществления устройства мониторинга и прогнозирования, работающего в условиях стационара, в котором пациент подвергается искусственной вентиляции легких;
Фиг.2 иллюстрирует дисплей жизненно важных показателей, на котором представлен показатель респираторной стабильности; и
Фиг.3 представляет график последовательности операций, иллюстрирующий способ измерения и прогнозирования респираторной стабильности пациента в соответствии с другим вариантом осуществления.
На фиг.1 устройство мониторинга и прогнозирования респираторной стабильности (или нестабильности) пациента включает устройство 10 прогнозирования респираторной стабильности пациента. Устройство 10 предоставляет показатель стабильности дыхательной системы пациента на основании клинических данных пациента. Иллюстративное устройство 10 предоставляет немедленно получаемый, текущий показатель стабильности дыхательной системы пациента, например, вероятности того, что пациент подвергнется нарушению газообмена, и у него возможно разовьется респираторный дистресс синдром (острый/взрослых) (ARDS) или острое повреждение легких (ALI). Этот показатель может использоваться в качестве основы для прогностических предупреждений, которые указывают, у какого пациента вероятно развитие тяжелых респираторных проблем, если не будет предпринято предотвращающее действие. Предупреждение может поступать, когда показатель респираторной стабильности указывает на то, что у пациента скоро разовьется респираторная нестабильность. Следует отметить, что хотя респираторная нестабильность определяется в иллюстративном варианте осуществления как состояние, которое связано с отношением PF менее чем 300 (и, таким образом, считается, что респираторная стабильность связана с отношением PF 300 и более), следует понимать, что порог респираторной нестабильности может определяться с других точек зрения, таких как отношение PF менее чем 320 или отношением PF менее чем 250. Предусматриваются также другие показатели определения респираторной нестабильности, которые аналогичным образом основаны на величинах давления кислорода в артериальной крови или тому подобных параметрах.
В одном варианте осуществления, устройство 10 анализирует клинические данные в течение периода времени для определения вероятности того, что у пациента 12 разовьется респираторная нестабильность. В частности, устройство 10 осуществляет мониторинг набора параметров пациента, выведенных из клинических данных, которые, как было показано, связаны с респираторной нестабильностью. Устройство 10 применяет правила для классификации пациентов на основании величин параметров. Ввиду того, что измерения респираторной стабильности основываются на комбинации множественных признаков (например, насыщении кислородом артериальной крови, частоте сердечных сокращений, среднем давлении в дыхательных путях, давлении плато), часто можно достичь более высокой степени специфичности (т.е., меньшего числа ложных предупреждений) при сохранении полезной степени чувствительности (т.е., обоснованных предупреждений).
Иллюстративное устройство 10 подходит для применения в больницах, других медицинских учреждениях, в домашних условиях, в пансионатах и тому подобных учреждениях для разнообразных видов применения в здравоохранении.
В иллюстративном варианте осуществления, аппарат 14 искусственной вентиляции легких подает газ в легкие пациента под давлением, превышающем атмосферное давление, через трубку 16 подачи воздуха. Газ в целом представляет собой воздух, необязательно обогащенный кислородом. Связанная с аппаратом система 18 мониторинга осуществляет мониторинг параметров пациента, например, путем получения данных пациента, относящихся к респираторной стабильности, по которым могут рассчитываться параметры. Иллюстративные параметры пациента могут включать параметры, выбранные из:
Среднего давления в дыхательных путях (MAWP), например, выраженного в мм рт.ст.,
Давления плато (PP), например, выраженного в мм рт.ст.,
Пикового давления на вдохе (PIP), например, выраженного в мм рт.ст.,
Динамической податливости легких/грудной клетки (Cdyn), например, выраженной в мл/см Н2О,
Статической податливости дыхательной системы (Cstat), например, выраженной в мл/см Н2О,
Частоты дыхания (RR), например, выраженной в циклах дыхания/мин,
Показателя насыщения кислородом, такого как насыщенность периферийным кислородом (SpO2), например, выраженная в % оксигенации, и/или насыщение кислородом артериального кровотока (SaO2),
Частоты сердечных сокращений (HR), например, выраженной в количестве сокращений/мин,
Количества лейкоцитов (WBC) и
Жидкостного нетто-баланса.
В целом, параметры основаны на физиологических данных, полученных у пациента, хотя некоторые параметры могут быть основаны, по меньшей мере, частично, на механических установках, таких как установки аппарата искусственной вентиляции легких. Например, SaO2 представляет собой насыщение артериальной крови кислородом в процентах, т.е., измерение количества кислорода, присоединенного к переносящей гемоглобин клетке в системе кровообращения. Для здоровых пациентов, SaO2 составляет около 96%. SaO2 в целом измеряется пульсовой оксиметрией и затем обозначается как SpO2. Динамическая податливость легких/грудной клетки рассчитывается с использованием наблюдаемого дыхательного объема (Vt в мл), PIP и положительного давления в конце выдоха (PEEP в мм рт.ст.). Статическая податливость дыхательной системы рассчитывается с использованием Vt, PP и PEEP. Количество лейкоцитов (WBC) представляет собой число лейкоцитов (белых клеток крови)/кубический миллиметр крови. Норма составляет от 5000 до 9000. Если количество больше 10000, то у пациента имеется лейкоцитоз; если оно составляет менее чем 5000, то у пациента имеется лейкопения. WBC обычно выражается в виде числа от 1 (1000) до 165 (16000). Жидкостный нетто-баланс представляет собой общее потребление жидкости - общий выход жидкости = 0 в нормальных условиях. Он обычно измеряется в мл/сутки.
В типичных стационарных условиях, MAWP, PP, PIP и Vt представляют собой все измеряемые величины, которые обычно регистрируются приблизительно через каждые 4 часа у пациентов, находящихся на искусственной вентиляции легких. PEEP представляет собой установку аппарата искусственной вентиляции легких, которая выбирается специалистом по респираторной патологии или другим соответствующим лицом, осуществляющим уход за пациентом. Мониторинг RR, SpO2 и HR обычно осуществляется на непрерывной основе. Например, SpO2 может измеряться датчиком 20 SpO2 на кончике пальца, который может быть соединен с системой 18 мониторинга посредством кабеля 22 или беспроводного соединения. Частота сердечных сокращений может измеряться датчиком 20 на кончике пальца, электродами ЭКГ или тому подобными приспособлениями. Частота дыханий может измеряться через аппарат 14 искусственной вентиляции легких.
Следует понимать, что устройство 10 также подходит для применения у пациентов, которые не подвергаются искусственной вентиляции легких.
Устройство 10 включает запоминающее устройство 24 данных контролируемых параметров, которое хранит величины параметров и/или полученные у пациента данные, по которым определяются величины параметров. Полученные данные/величины параметров связаны с определенным пациентом в запоминающем устройстве 24, например, идентификационным номером пациента. Полученные у пациента данные 26 могут передаваться из системы 18 мониторинга в запоминающее устройство 24 автоматически, например, по сети 28, такой как проводная или беспроводная локальная сеть, или глобальная сеть, такая как интернет. Альтернативно, некоторые (например, жидкостный нетто-баланс) или все данные пациента могут вручную вводиться в запоминающее устройство 24 данных или непосредственно, или опосредованно, например, медицинским работником, на основании произведенных измерений, например, с использованием интерфейса 30 пользователя, такого как рабочая станция, или вводиться с устройства хранения данных, такого как оптический диск, жесткий диск, устройство usb, карта памяти или тому подобные. Дополнительно, другие данные пациента (например, лабораторные данные, такие как количество лейкоцитов) могут автоматически вводиться в запоминающее устройство 24 данных через сеть 28. В другом варианте осуществления все полученные у пациента данные хранятся в общем больничном или другом общем учрежденческом хранилище 32 данных пациента, к которому имеет доступ устройство 10, например, через сеть.
Устройство 10 включает в себя анализатор 34, который в течение заданного временного окна обеспечивает показатель стабильности дыхательной системы определенного пациента на основании мониторинга клинических данных пациента, хранящихся в запоминающем устройстве 24 данных. Временное окно может представлять собой, например, следующие 2 часа, 12 часов или 24 часа или период времени, который начинается в будущем, например тот, который начинается через 2, 12 или 24 часа. В частности, анализатор применяет набор правил в отношении данных пациента, которые вместе прогнозируют респираторную нестабильность (например, вероятность того, что последует респираторная нестабильность). Эти правила могут храниться в модели 36. Правила могут использоваться непрерывно (например, для данных мониторинга) или после ручного ввода новых данных или подтвержденных жизненно важных показателей (например, в случае жидкостного нетто-баланса) или после того, как данные становятся доступными (например, количество лейкоцитов по лабораторным тестам).
Иллюстративное устройство 10 может быть осуществлено в вычислительном устройстве, таком как один или более общецелевых компьютеров, специализированный компьютер (компьютеры), программируемый микропроцессор или микрорегулятор и периферические элементы интегральной схемы, ASIC (специализированная интегральная схема) или другая интегральная схема, цифровой процессор сигналов, жестко смонтированная электронная или логическая схема, такая как цепь дискретных элементов, программируемое логическое устройство, такое как PLD (программируемое логическое устройство), PLA (программируемая логическая матрица), FPGA (программируемая полем матрица логических элементов) или PAL (программируемая матричная логика) или тому подобные. Анализатор 34 может быть в форме программного обеспечения, аппаратного обеспечения или их комбинации. В одном варианте осуществления, анализатор 34 включает программное обеспечение в виде инструкций, хранящихся в запоминающем устройстве, которые исполняются соответствующим процессором вычислительного устройства. Запоминающее устройство 24 данных пациента, которое может представлять собой запоминающее устройство, которое хранит анализатор или отдельное запоминающее устройство, может представлять любой тип машиночитаемого носителя информации, такой как RAM (оперативное запоминающее устройство), ROM (постоянно запоминающее устройство), магнитный диск или пленка, оптический диск, флеш-память или голографическое запоминающее устройство. В одном варианте осуществления, запоминающее устройство 24 включает комбинацию оперативного запоминающего устройства и постоянно запоминающего устройства.
Определенный показатель респираторной стабильности может выводиться из устройства 10, например, в хранилище 32 регистрируемых данных пациента или на устройство вывода, такое как экранный монитор 38 жизненно важных показателей, принтер, система предупреждения или тому подобные, через локальную сеть 28. Монитор 38 может быть локальным, расположенным около пациента, например, прикроватным монитором, или может располагаться на станции мониторинга жизненно важных показателей или в центре наблюдения. Действительно, после того как собранные данные направляются в хранилище 32 регистрируемых данных пациента и хранятся в нем, они могут использоваться любым устройством в сети 28, которое имеет соответствующую авторизацию для доступа. Например, как показано на фиг.2, монитор 38 может отображать каждый из набора измеренных параметров 40, 42, 44, 46, а также прогностический показатель 48 (показанный как показатель респираторной стабильности) стабильности/нестабильности дыхательной системы пациента в течение одного или более временных окон, в данном случае, 12 и 24 часов. Необязательно, предупреждение 50, связанное с монитором 38, активируется, если показатель указывает на нестабильность.
На фиг.3 показан иллюстративный способ измерения и прогнозирования респираторной стабильности пациента. Способ начинается с этапа S100.
На этапе S102 совокупность ранее полученных данных пациента собирают и классифицируют в соответствии с тем, была ли у пациента респираторная нестабильность.
На этапе S104 величины параметров выводят из данных пациента.
На этапе S106 идентифицируют правила на основании параметров, чьи величины, извлеченные из данных пациента, могут быть использованы для дифференцирования двух групп. Поэтому набор правил может считаться прогностическим в плане нестабильности (или стабильности) у пациента для новых пациентов, которые еще не находятся в состоянии респираторной нестабильности.
На этапе S108 правила сохраняют в модели 36.
На этапе S110 вводят данные новых пациентов и извлекают величины параметров.
На этапе S112 набор сохраненных правил применяют к извлеченным величинам параметров пациентов. Правила могут быть выбраны на основании выбранного временного окна.
На этапе S114 рассчитывают показатель стабильности пациента на основании результата применения правил и выводят в форме данных.
На этапе S116 для пациента, чей показатель стабильности соответствует или превышает заданный порог, указывающие на нестабильность, медицинский персонал может получать предупреждение с тем, чтобы было обеспечено соответствующее лечение.
Этапы S110-S116 могут повторяться в отношении некоторых пациентов через интервалы, такие как, по меньшей мере, через каждые 4 часа или на полунепрерывной основе, например, каждый раз, когда вводятся данные нового пациента. Способ завершается на этапе S118. Теперь будут представлены дальнейшие детали способа.
Модель 36 может быть построена (S102-S108) путем применения алгоритмов обучения машины к большой совокупности ранее полученных данных пациента, включая данные по случаям, в которых в последующем наблюдалась респираторная нестабильность (в пределах временных окон прогноза, например, 2, 12 или 24 часа), и по случаям, в которых ее не было (т.е., считалось, что состояние пациента стабильное). В одном варианте осуществления, ретроспективные данные пациентов отделения интенсивной терапии используются для разработки двух эталонных наборов данных: набора данных пациентов с нестабильной дыхательной функцией, у которых развились тяжелые респираторные проблемы, и набора данных пациентов, у которых не развились такие проблемы. В другом варианте осуществления, ретроспективные данные пациентов отделения интенсивной терапии анализируются медицинским работником, осуществляющим наблюдение за пациентом, или другим подготовленным персоналом на основании медицинских регистрационных документов для указания, у каких пациентов развились тяжелые респираторные проблемы, а у каких нет.
Из совокупности данных, методики обучения машины идентифицируют, какие параметры в наибольшей степени связаны с началом респираторной нестабильности и правила, на основании этих параметров, которые являются прогностическими в отношении начала респираторной нестабильности. В целом разрабатывается набор из одного или более правил, в котором используется, по меньшей мере, два из параметров в качестве переменных величин. При генерировании правил для параметров могут быть установлены пороги. Как будет понятно, для выполнения правила и классификации пациента как респираторно нестабильного может потребоваться, чтобы величина (величины) параметров для некоторых из порогов были на уровне или ниже порога (например, в случае SpO2), в то время как в других случаях для соблюдения правила может потребоваться, чтобы величина параметра была на уровне или ниже порога (например, в случае MAWP, PP или HR).
Например, один тип правила может включать только первый из параметров и определять относительно проблематичную запрашиваемую пороговую величину для того параметра, по которому выполняется правило, и прогнозируется, что пациент респираторно нестабилен, например, в пределах определенного временного окна. Другой тип правила может включать, по меньшей мере, два параметра (один из которых может быть первым параметром). Для этого типа правил, для выполнения правила, должны соблюдаться пороговые величины для каждого из параметров, например, для того, чтобы пациент считался респираторно нестабильным. В целом, когда один из этих параметров является первым параметром, его порог может быть менее проблематичен, чем для первого типа правила, когда это единственный параметр. Например, может потребоваться, чтобы MAWP было выше 17 при первом типе правила и выше 12,6 при втором типе правила. Предусмотрены также другие правила, при которых для соблюдения правила должен соблюдаться порог связи между параметрами (такой как соотношение между ними).
В одном варианте осуществления, для того, чтобы пациент был определен как респираторно нестабильный (или стабильный) должно выполняться, по меньшей мере, одно из правил. В других вариантах осуществления, должно выполняться более чем одно правило. В некоторых вариантах осуществления, показателем респираторной стабильности пациента может быть непрерывно вариабельный показатель, а не бинарный показатель (стабильный/нестабильный). В этом варианте осуществления, может учитываться одно или более правил. Альтернативно, правилом или правилами может быть взвешенная функция двух или более параметров, где весовые значения разрядов учитывают относительное значение параметров.
Дополнительно или альтернативно, показатель респираторной стабильности пациента может быть основан на двух или более наборах величин параметров, которые получены в различные моменты времени. Например, одно или более правил могут соблюдаться изменением порога одного или более величин параметров в течение заданного периода времени.
Правила могут варьироваться, в зависимости от временного окна прогноза, и, таким образом, модель 36 может иметь различные наборы правил для каждого из множества окон времени. Например, пороги могут быть различными, в зависимости от временного окна. Дополнительно, правила могут варьироваться в зависимости от типа пациента, например, находящегося на искусственной вентиляции легких, в сравнении с не находящимся на искусственной вентиляции легких, или в соответствии с возрастом, полом, медицинским состоянием или другими факторами. Соответственно, каждый из этих факторов может использоваться при составлении различных наборов правил, применимых к этому классу пациентов.
Например, в одном случае внедрения, пациентов, которые все находились на искусственной вентиляции легких, делили на две группы на основании того, были ли пациенты подвержены респираторной нестабильности, на которую указывало низкое (например, <300) отношение PF в течение длительного периода. Методики обучения машины используются для обнаружения правил, которые правильно классифицируют пациентов по двум наборам данных с использованием идентифицированных переменных величин. Было обнаружено, что определенные измеренные параметры имели тенденцию дифференцироваться между этими двумя наборами: среднее давление в дыхательных путях (MAWP в мм рт. ст.), давление плато (PP в мм рт. ст.), пиковое давление на вдохе (PIP в мм рт. ст.), динамическая податливость легких/грудной клетки (Cdyn в мл/см Н2О), статическая податливость дыхательной системы (Cstat), частота дыхания (RR в циклах дыхания/мин), насыщенность периферийным кислородом, по данным измерения пульсовой оксиметрией (SpO2 в % оксигенации) и частота сердечных сокращений (HR в ударах/мин). При применении этих параметров использовались методики обучения машины для разработки алгоритмов классификации пациентов как либо респираторно нестабильных, или стабильных в отношении нарушения газообмена. Ниже приводится пример одного из наборов правил:
MAWP>17→нестабильный
MAWP>12,6 и SpO2<=97 и HR>86,5→естабильный
PP>23,8 и HR>90,5 и SpO2<=97,5→нестабильный
В ином случае→стабильный
В этом примере, имеется три правила для идентификации респираторно нестабильных пациентов и четвертое типовое правило идентификации респираторно стабильных пациентов. Следует отметить, что хотя в этом примере, для алгоритмов обучения машины были предоставлены данные по восьми признакам (параметры, подлежащие использованию), в данном наборе правил используются лишь четыре из них. Было обнаружено, что использование других признаков в списке не так продуктивно для этой группы пациентов. Понятно, что параметры не ограничиваются теми, которые перечислены выше. Например, 2 или 3 из этих параметров могут использоваться отдельно или в комбинации с другими параметрами. Кроме переменных величин, основанных на показателях аппарата искусственной вентиляции легких или данных мониторинга, другие возможные переменные величины могут быть основаны на лабораторных данных (количество лейкоцитов), ручном вводе (жидкостный нетто-баланс), рентгенологической визуализации (для оценки объема) и хирургическом анамнезе. Также, как отмечено ранее, хотя приведенный выше пример алгоритма классификации представлен в форме набора правил, эти правила могут быть трансформированы в один непрерывный показатель (а не бинарное предупреждение) путем трансформации бинарных порогов в непрерывные функции, варьирующиеся от 0 до 1, и комбинирования этих непрерывных функций с использованием стандартных нечетких многозначных логических операторов.
Иллюстративный вариант осуществления подходит для применения в отделении интенсивной терапии для предоставления прогностических предупреждений пациентов с нарушением газообмена. Однако его можно применять другим образом. Предупреждения могут быть разработаны для поднаборов проблем в пределах категории нарушения газообмена, например, ALI и ARDS. В других вариантах осуществления, способы, описанные в настоящей заявке, могут применяться для разработки респираторного компонента общего показателя остроты патологического состояния у пациента. Или этот подход может применяться к использованию данных высокого разрешения или в отделении интенсивной терапии, или вне его.
В одном варианте осуществления, данные, предоставленные системой 18 мониторинга, анализируются для ретроспективного определения, как медицинский персонал реагировал на определенные показатели, и как вмешательства воздействовали на результат лечения пациента. Администратор может оценить, насколько хорошо медицинский персонал справился с респираторной нестабильностью пациента, и соответственно модифицировать правила или временное окно.
Способ, иллюстрируемый на фиг.3, может осуществляться в компьютерном программном продукте, который может выполняться на компьютере. Компьютерный программный продукт может представлять собой реальный машиночитаемый носитель информации, на котором записана программа управления, такой как диск, жесткий диск или может представлять собой передаваемую волну-носитель, в которой программа управления осуществлена в виде сигнала данных. Обычные формы машиночитаемых носителей информации включают, например, дискеты, гибкие диски, жесткие диски, магнитную ленту или любой другой магнитный носитель для хранения информации, CD-ROM, DVD или любой другой оптический носитель информации, RAM, PROM (программируемая постоянная память), EPROM (стираемая программируемая постоянная память), флеш-EPROM или другую микросхему или картридж памяти, передающую среду, такую как акустические или световые волны, такие как волны, генерируемые во время связи посредством радиоволн и инфракрасных волн, и тому подобные, или любой другой носитель информации, с которого компьютер может считывать и использовать.
Иллюстративный способ может осуществляться на одном или более целевых компьютерах, специализированном целевом компьютере (компьютерах), программируемом микропроцессоре или микрорегуляторе и периферических элементах интегральной схемы, ASIC или другой интегрированной схеме, цифровом процессоре сигналов, жестко смонтированной электронной или логической схеме, такой как цепь дискретных элементов, программируемом логическом устройстве, таком как PLD, PLA, FPGA или PAL или тому подобные. В целом любое устройство, способное реализовать машину в конечном состоянии, которая, в свою очередь, способна осуществить блок-схему, показанную на фиг.3, может использоваться для осуществления способа прогнозирования респираторной стабильности.
Изобретение было описано со ссылкой на предпочтительные варианты осуществления. По прочтении и осмыслении предшествующего детального описания, у других специалистов в данной области могут возникнуть идеи о внесении модификаций и изменений. Предполагается, что изобретение следует рассматривать как включающее все такие модификации и изменения, охватываемые объемом прилагаемой формулы изобретения или ее эквивалентов.
Реферат
Группа изобретений относится к медицине. Устройство прогнозирования респираторной стабильности пациента включает в себя запоминающее устройство данных пациента, которое хранит данные пациента, и анализатор, связанный с запоминающим устройством, рассчитывает показатель респираторной стабильности пациента. Анализатор применяет одно или более правил к данным пациента, основанных на множестве параметров, которые в комбинации были идентифицированы как прогнозирующие респираторную нестабильность пациента, таких как среднее давление в дыхательных путях (MAWP), давление плато (PP), насыщение кислородом артериальной крови (SpOили SaO) и частота сердечных сокращений (HR). На основании применения правил, анализатор определяет показатель респираторной стабильности пациента. Группа изобретений позволяет эффективнее ослабить повреждение легких. 3 н. и 12 з.п. ф-лы, 3 ил.
Формула
монитор (18) дыхания, осуществляющий мониторинг параметров пациента (12), который получает дыхательную смесь от аппарата (14) искусственной вентиляции легких, путем получения данных пациента, связанных с респираторной стабильностью, включая, по меньшей мере, среднее давление в дыхательных путях (MAWP) и давление плато (PP);
запоминающее устройство (24) данных пациента, хранящее данные пациента (12);
анализатор (34), связанный с запоминающим устройством, для расчета прогностического показателя начала респираторной нестабильности пациента, при этом анализатор применяет, по меньшей мере, одно правило к данным пациента, причем это, по меньшей мере, одно правило основано на множестве параметров, включая, по меньшей мере, параметры MAWP и PP, мониторинг которых осуществляется монитором дыхания, которые в комбинации были идентифицированы как прогнозирующие начало респираторной нестабильности пациента, и на основании применения, по меньшей мере, одного правила определяет прогностический показатель начала респираторной нестабильности пациента.
показателя насыщения кислородом (SpO2 или SaO2);
частоты сердечных сокращений (HR);
пикового давления на вдохе (PIP);
динамической податливости легких/грудной клетки (Cdyn);
статической податливости дыхательной системы (Cstat);
частоты дыхания (RR);
количества лейкоцитов (WBC) и жидкостного нетто-баланса.
среднего давления в дыхательных путях (MAWP);
давления плато (PP);
насыщенности периферийным кислородом (SpO2) и частоты сердечных сокращений (HR).
MAWP>17 → нестабильный
MAWP>12,6 и SpO2<=97 и HR>86,5 → нестабильный
PP>23,8 и HR>90,5 и SpO2<=97,5 → нестабильный
в ином случае → стабильный
подают газ в легкие пациента (12);
осуществляют мониторинг параметров пациента (12) путем получения данных пациента, связанных с респираторной стабильностью, включая, по меньшей мере, среднее давление в дыхательных путях (MAWP) и давление плато (PP);
сохраняют данные пациента; и
рассчитывают прогностический показатель начала респираторной нестабильности пациента, при этом этап заключается в том, что
применяют, по меньшей мере, одно правило к данным пациента, причем это, по меньшей мере, одно правило основано на множестве параметров, включая, по меньшей мере, параметры MAWP и PP, мониторинг которых осуществляется монитором дыхания, которые в комбинации были идентифицированы как прогнозирующие начало респираторной нестабильности пациента; и
определяют прогностический показатель начала респираторной нестабильности пациента на основании примененного, по меньшей мере, одного правила.
получают совокупность данных пациента, включая, по меньшей мере, параметры MAWP и PP для группы пациентов;
классифицируют пациентов на основе полученной совокупности данных пациента в соответствии с тем, проявляли ли пациенты респираторную нестабильность; и
генерируют правила на основании полученной совокупности и классификаций пациентов.
генерируют первый набор правил, применимых к первому выбираемому временному окну; и генерируют второй набор правил, применимых ко второму выбираемому временному окну.

Комментарии