Способ, устройство и система для автоматического управления подачей вдыхаемого кислорода - RU2728185C2
Код документа: RU2728185C2
Чертежи


















Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[001] Настоящее изобретение относится, в общем, к способу, устройству и системе для автоматического управления подачей вдыхаемого кислорода, например, способу, устройству и системе для автоматического управления концентрацией вдыхаемого кислорода, чтобы поддерживать насыщение кислородом в искомом диапазоне.
УРОВЕНЬ ТЕХНИКИ
[002] Дополнительную оксигенотерапию можно применять с разнообразными целями при оказании помощи как при хронических, так и острых заболеваниях. Например, она имеет ключевое значение в тактике лечения новорожденных с респираторной дисфункцией. Для недоношенных новорожденных, исследования показали, что существует связь между непрерывной гипоксией и ростом смертности. Кроме того, наблюдалось также, что избыточная подача кислорода связана с неблагоприятными результатами, в частности, ретинопатией недоношенных. Следовательно, существует потребность в непрерывной регулировке фракции вдыхаемого кислорода (FiO2), чтобы поддерживать насыщение кислородом (SpO2) в приемлемом искомом диапазоне во избежание экстремальных значений оксигенации. Реакция SpO2 на изменения FiO2 называется «коэффициентом передачи системы», где «система» является пациентом.
[003] В настоящее время, достижение равновесия при подаче кислорода недоношенным новорожденным во многом зависит от медицинского персонала, ухаживающего за лежачими пациентами, который вручную регулирует FiO2, чтобы поддерживать насыщение кислородом SpO2 в искомом диапазоне. К сожалению, такое ручное управление FiO2 является неточным, и младенцы немало времени находятся в условиях при SpO2 за пределами искомых диапазонов.
[004] Автоматическая регулировка FiO2 может обеспечивать большее время нахождения в искомом диапазоне, чем ручное управление, и значительно уменьшает пропорцию времени гипероксии ятрогенного характера и тяжелой гипоксии. Однако, применение автоматизации для подачи кислорода недоношенным новорожденным с легочной дисфункцией сопряжено со значительными проблемами. Первая проблема заключается в эффективности назначения искомого SpO2 и исключение времени эпизодов гипоксии и гипероксии. Вторая проблема автоматического управления подачей кислорода состоит в том, что основные факторы оксигенации новорожденных смешиваются неисчислимым образом и вносят вклад в принципиально разные реакции на изменения FiO2, и, следовательно, автоматизированный контроллер с равномерным и неменяющимся откликом на данное отклонение SpO2 может быть не в состоянии удовлетворить потребности всех индивидов. Третья проблема состоит в том, что коэффициент передачи системы может изменяться с течением времени.
[005] Желательно устранить или смягчить один или более недостатков или ограничений, связанных с известным уровнем техники или, по меньшей мере, предложить полезную альтернативу.
[006] Ссылка в настоящем описании на любую предшествующую публикацию (или полученную из нее информацию) или на любой известный информационный материал, не считаются и не должны считаться подтверждением или допущением, или любой формой предположения, что данная предшествующая публикация (или полученная из нее информация) или известный информационный материал формирует часть общеизвестных знаний в области деятельности, к которой относится настоящее описание.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[007] В соответствии с настоящим изобретением предлагается способ для автоматического управления подачей вдыхаемого кислорода, содержащий следующие этапы:
принимают сигналы, представляющие множество входных значений насыщения кислородом (SpO2) для пациента;
формируют управляющие значения, исходя из входных значений SpO2 и искомого значения SpO2; и
формируют выходные значения концентрации вдыхаемого кислорода (FiO2), исходя из управляющих значений и эталонных значений концентрации вдыхаемого кислорода (rFiO2);
при этом управляющие значения включают в себя:
мгновенные управляющие значения, сформированные, исходя из входных значений SpO2, искомого значения SpO2 и мгновенного коэффициента передачи;
накопленные управляющие значения, сформированные, исходя из входных значений SpO2, искомого значения SpO2 и накопленного коэффициента передачи; и
прогнозные управляющие значения, сформированные, исходя из входных значений SpO2, искомого значения SpO2 и прогнозного коэффициента передачи;
причем мгновенные управляющие значения вычисляют, исходя из значения rFiO2; и
причем к накопленному управляющему значению применяют нелинейное взвешивание компенсации, исходя из предварительно заданной нелинейной зависимости между парциальным давлением кислорода (PaO2) в артериальной крови и SpO2.
[008] В соответствии с другим аспектом настоящего изобретения предлагается устройство для автоматического управления подачей вдыхаемого кислорода, содержащее:
входной блок, принимающий сигналы, представляющие множество входных значений насыщения кислородом (SpO2) для пациента;
память, записывающую принятые входные значения SpO2;
контроллер, вычисляющий выходные значения концентрации вдыхаемого кислорода (FiO2), исходя из входных значений SpO2; и
выходной блок, выводящий вычисленные выходные значения FiO2;
при этом контроллер:
формирует управляющие значения, исходя из входных значений SpO2 и искомого значения SpO2; и
формирует выходные значения концентрации вдыхаемого кислорода (FiO2), исходя из управляющих значений и эталонных значений концентрации вдыхаемого кислорода (rFiO2);
причем управляющие значения включают в себя:
мгновенные управляющие значения, сформированные, исходя из входных значений SpO2, искомого значения SpO2 и мгновенного коэффициента передачи;
накопленные управляющие значения, сформированные, исходя из входных значений SpO2, искомого значения SpO2 и накопленного коэффициента передачи; и
прогнозные управляющие значения, сформированные, исходя из входных значений SpO2, искомого значения SpO2 и прогнозного коэффициента передачи;
причем мгновенные управляющие значения вычисляются, исходя из значения rFiO2; и
причем к накопленному управляющему значению применяется нелинейное взвешивание компенсации, исходя из предварительно заданной нелинейной зависимости между парциальным давлением кислорода (PaO2) в артериальной крови и SpO2.
[009] В соответствии с другим аспектом настоящего изобретения предлагается система для автоматического управления подачей вдыхаемого кислорода, содержащая:
одно или множество устройств контроля насыщения кислородом и одно или множество устройств управления вдыхаемым кислородом;
устройство управления; и
сеть, допускающую взаимодействие между одним или множеством устройств контроля насыщения кислородом и устройством управления и взаимодействие между одним или множеством устройств управления вдыхаемым кислородом и устройством управления,
при этом устройство управления управляет подачей вдыхаемого кислорода посредством:
приема сигналов, представляющих множество входных значений насыщения кислородом (SpO2) для пациента, от каждого из одного или множества устройств контроля насыщения кислородом по сети;
формирования управляющих значений, исходя из входных значений SpO2 и искомого значения SpO2;
формирования выходных значений концентрации вдыхаемого кислорода (FiO2), исходя из управляющих значений и эталонных значений концентрации вдыхаемого кислорода (rFiO2);
передачи вычисленных выходных значений FiO2 в соответствующее устройство управления вдыхаемым кислородом по сети;
причем управляющие значения включают в себя:
мгновенные управляющие значения, сформированные, исходя из входных значений SpO2, искомого значения SpO2 и мгновенного коэффициента передачи;
накопленные управляющие значения, сформированные, исходя из входных значений SpO2, искомого значения SpO2 и накопленного коэффициента передачи; и
прогнозные управляющие значения, сформированные, исходя из входных значений SpO2, искомого значения SpO2 и прогнозного коэффициента передачи;
причем мгновенные управляющие значения вычисляют, исходя из значения rFiO2; и
причем к накопленному управляющему значению применяется нелинейное взвешивание компенсации, исходя из предварительно заданной нелинейной зависимости между парциальным давлением кислорода (PaO2) в артериальной крови и SpO2.
[010] В соответствии с аспектом настоящего изобретения предлагается способ для автоматического управления подачей вдыхаемого кислорода, содержащий следующие этапы:
принимают сигналы, представляющие множество входных значений насыщения кислородом (SpO2) для пациента;
формируют управляющие значения, исходя из входных значений SpO2 и искомого значения SpO2; и
формируют выходные значения концентрации вдыхаемого кислорода (FiO2), исходя из управляющих значений и эталонных значений концентрации вдыхаемого кислорода (rFiO2);
при этом управляющие значения включают в себя:
мгновенные управляющие значения, сформированные, исходя из входных значений SpO2, искомого значения SpO2 и мгновенного коэффициента передачи;
накопленные управляющие значения, сформированные, исходя из входных значений SpO2, искомого значения SpO2 и накопленного коэффициента передачи; и
прогнозные управляющие значения, сформированные, исходя из входных значений SpO2, искомого значения SpO2 и прогнозного коэффициента передачи.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[011] Некоторые варианты осуществления настоящего изобретения описаны в дальнейшем только для примера, со ссылкой на прилагаемые чертежи, на которых:
[012] Фиг. 1 - блок-схема системы подачи вдыхаемого кислорода;
[013] Фиг. 2 - блок-схема компонентов в системе подачи вдыхаемого кислорода;
[014] Фиг. 3 - блок-схема последовательности операций, описывающая процесс формирования ПИД (пропорционального, интегрального и дифференциального) компонентов, т.е. формирования пропорционального компонента, интегрального компонента и дифференциального компонента;
[015] Фиг. 4 - блок-схема последовательности операций, описывающая процесс коррекции Kp, исходя из результата оценки рабочих параметров;
[016] Фиг. 5 - блок-схема последовательности операций, описывающая процесс коррекции значения rFiO2;
[017] Фиг. 6 - блок-схема последовательности операций, описывающая процесс вычисления значения показателя перфузии;
[018] Фиг. 7 - блок-схема последовательности операций, описывающая процесс процедуры иерархической проверки SpO2;
[019] Фиг. 8 - блок-схема последовательности операций, описывающая процесс вычисления выходного значения FiO2, исходя из достоверности SpO2;
[020] Фиг. 9 - блок-схема последовательности операций, описывающая процесс переключения между ручным режимом и режимом автоматического управления;
[021] Фиг. 10 - блок-схема последовательности операций, описывающая процесс управления тревожными сигналами и их сброса;
[022] Фиг. 11 - схема пользовательского интерфейса системного устройства подачи кислорода;
[023] Фиг. 12 - блок-схема последовательности операций, описывающая общий процесс управления способа для автоматического управления подачей вдыхаемого кислорода;
[024] Фиг. 13 - блок-схема последовательности операций, описывающая процесс обработки входных данных;
[025] Фиг. 14 - блок-схема последовательности операций, описывающая процесс считывания входных данных;
[026] Фиг. 15 - блок-схема последовательности операций, описывающая процесс проверки входных данных;
[027] Фиг. 16 - блок-схема последовательности операций, описывающая процесс проверки ограничений по вводу;
[028] Фиг. 17 - блок-схема последовательности операций, описывающая процесс автоматического управления;
[029] Фиг. 18 - блок-схема последовательности операций, описывающая периодический адаптивный процесс;
[030] Фиг. 19 - график зависимости между погрешностью PaO2 и единичной погрешностью SpO2;
[031] Фиг. 20 - блок-схема системы подачи вдыхаемого кислорода, применяемой во втором примерном эксперименте;
[032] Фиг. 21A и 21B - графики двухчасовых записей для одного и того же младенца во время ручного и автоматического управления, записанных в ходе второго примерного эксперимента;
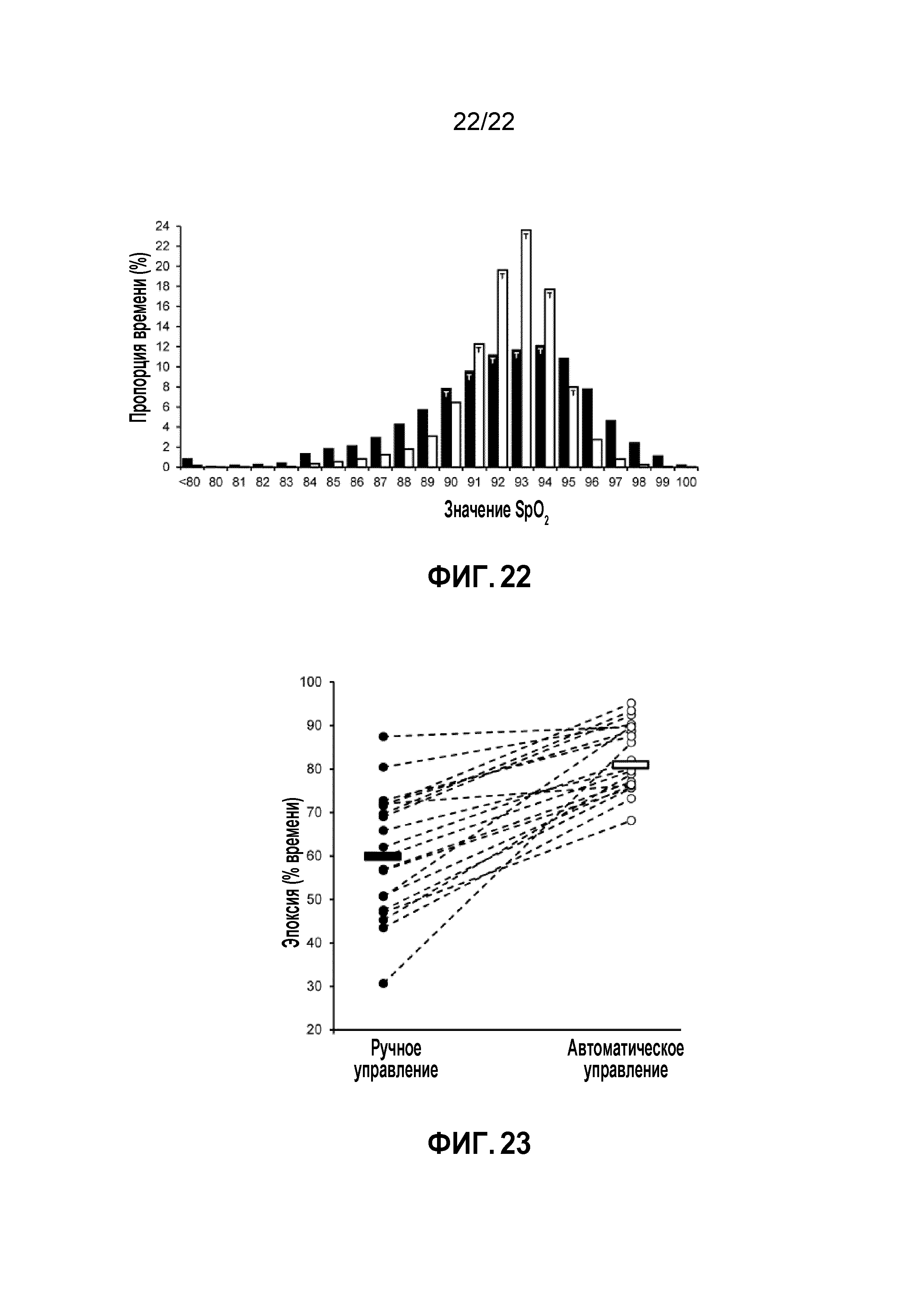
[033] Фиг. 22 - график частотных гистограмм объединенных данных SpO2 в соответствии с результатами второго примерного эксперимента; и
[034] Фиг. 23 - график, сравнивающий наилучший период ручного управления с автоматическим управлением в соответствии с результатами второго примерного эксперимента.
ПОДРОБНОЕ ОПИСАНИЕ
[035] Далее описана система 100 подачи вдыхаемого кислорода, которая выполняет способ автоматического управления подачей вдыхаемого кислорода пациенту (например, младенцу).
[036] Описанная система (и способ) может обеспечивать одно или более преимуществ по сравнению с существующими системами и способами. Во-первых, описанная система может эффективно задавать требуемый диапазон SpO2 и исключать экстремальные значения оксигенации. Во-вторых, описанная система может быстро реагировать на отклонения SpO2, например, обусловленные изменениями отношения V/Q и шунтированием в легких. В-третьих, описанная система может компенсировать нелинейности зависимости PaO2-SpO2 (где PaO2означает парциальное давление кислорода в артериальной крови, например, изменение PaO2 только на 1-2 мм рт. ст. на 1% ступенчатое изменение SpO2 на линейном участке S-образной кривой, но более, чем на 20 мм рт. ст. далее к асимптоте). В-четвертых, описанная система может по-разному реагировать для разных индивидов, чтобы компенсировать переменные реакции SpO2 индивидов на регулировки FiO2, соответствующие разным индивидуальным комбинациям сдвига кривой FiO2-SpO2 (где сдвиг вправо соответствует уменьшению отношения вентиляция-перфузия (V/Q)) и шунтированию (пропорции или фракции крови, накачиваемой в тело без какого-либо добавления в нее кислорода в легких). В-пятых, описанная система может регулировать свой коэффициент передачи, исходя из метрики рабочих параметров.
[037] Как показано на фиг. 1, система 100 включает в себя устройство 10 управления, оксигемометр 20 и устройство 30 респираторной поддержки.
[038] Устройство 10 управления предназначено для автоматического управления подачей вдыхаемого кислорода.
[039] Оксигемометр 20 измеряет насыщение кислородом (SpO2) артериальной крови пациента 40 и передает выходной сигнал, представляющий значения SpO2, в устройство 10 управления. Значение SpO2, представляемое выходным сигналом оксигемометра 20 называется также «входным значением SpO2» с точки зрения устройства 10 управления.
[040] Оксигемометр 20 может иметь аналоговый или цифровой вывод данных.
[041] Исходя из входных значений SpO2 из оксигемометра 20, устройство 10 управления вычисляет выходное значение концентрации вдыхаемого кислорода (FiO2) и выдает сигнал FiO2, представляющий вычисленное выходное значение FiO2.
[042] Выходной сигнал FiO2 из устройства 10 управления передается в устройство 30 респираторной поддержки. Устройство 30 респираторной поддержки является системой, способной реагировать на ввод FiO2, т.е. система респираторной поддержки может принимать и исполнять требуемое значение FiO2. Устройство 30 респираторной поддержки может быть в форме воздушно-кислородного смесителя, механического вентилятора, привода аппарата постоянного положительного давления в воздушных путях (CPAP) или генератора потока для респираторной поддержки через высокопоточные назальные канюли или низкопоточной подачи кислорода.
[043] Устройство 30 респираторной поддержки подает газообразную смесь (содержащую фракцию вдыхаемого кислорода с вычисленным FiO2) в пациента 40. Система 100 подачи вдыхаемого кислорода может дополнительно включать в себя вспомогательную систему 50 контроля пациента и систему 60 контроля дыхательного контура.
[044] Вспомогательная система 50 контроля пациента контролирует пациента 40 и выдает сигналы, представляющие состояние пациента. Вспомогательная система 50 контроля пациента может включать в себя контрольные устройства в форме кардиореспираторного монитора или респираторного монитора.
[045] Система 60 контроля дыхательного контура контролирует выход устройства 30 респираторной поддержки, т.е. фракцию вдыхаемого кислорода, подлежащую подаче в пациента. Данная система выдает сигналы, представляющие результаты контроля. Система 60 контроля дыхательного контура может включать в себя устройства в форме кислородного газоанализатора и, дополнительно, датчик давления.
[046] Выходные данные из вспомогательной системы 50 контроля пациента и системы 60 контроля дыхательного контура передаются в устройство 10 управления. Устройство 10 управления может вычислять выходное значение FiO2, исходя из входного значения SpO2 и сигналов, переданных из вспомогательной системы 50 контроля пациента и системы 60 контроля дыхательного контура.
[047] Как показано на фиг. 2, устройство 10 управления может быть автономным устройством. Устройство 10 управления может включать в себя: a контроллер 11, который вычисляет выходное значение FiO2, исходя из входных значений SpO2; и интерфейс 12 ввода/вывода, который принимает сигналы, представляющие входные значения SpO2 и выдает сигналы, представляющие вычисленные выходные значения FiO2. Интерфейс 12 ввода/вывода может также принимать входные сигналы из вспомогательной системы 50 контроля пациента и/или системы 60 контроля дыхательного контура.
[048] Контроллер 11 имеет форму электронного устройства управления, включающего в себя один или более цифровых микроконтроллеров или микропроцессоров, которые выполняют этапы способа, описанного в настоящей заявке. Контроллер 11 может включать в себя одну или более специализированных интегральных схем и/или вентильных матриц с эксплуатационным программированием, которые выполнены с возможностью выполнения этапов способа.
[049] Устройство 10 управления может дополнительно включать в себя память 13, которая записывает принятые входные значения SpO2. Память 13 может хранить машиночитаемые команды, которые задают этапы способа, описанного в настоящей заявке, и считываются и выполняются контроллером 11 для выполнения одного или более этапов способа.
[050] Устройство 10 управления может также включать в себя дисплей 14 пользовательского интерфейса, который отображает пользовательский интерфейс, представляющий различную информацию для пользователя (например, медицинского работника, ухаживающего за лежачим пациентом) и принимает команды, вводимые пользователем на пользовательском интерфейсе. Принятые данные пользовательского ввода передаются в контроллер 11.
[051] Устройство 10 управления может дополнительно включать в себя устройство 15 сбора данных (DAQ), которое собирает сигналы/данные, передаваемые из других компонентов системы 100.
[052] Оксигемометр 20 может включать в себя пульсовый оксигемометр 21. Пульсовый оксигемометр 21 измеряет SpO2 пациента 40 и посылает выходной сигнал, представляющий значения SpO2, в устройство 10 управления. Пульсовый оксигемометр 21 может дополнительно измерять: (1) показатель перфузии, являющийся мерой пульсации оксигемометрической формы сигнала, при этом низкие значения потенциально соответствуют ложным значениям SpO2; и (2) плетизмографическую форму сигнала SpO2 («Pleth»). Выходной сигнал, представляющий показатель перфузии, и выходной сигнал, представляющий плетизмографическую форму сигнала SpO2, передаются в устройство 10 управления из пульсового оксигемометра 21. Пульсовый оксигемометр 21 может дополнительно измерять частоту сердечных сокращений, выводимую из плетизмографической формы сигнала SpO2 (HRpleth), и передавать ее в устройство 10 управления.
[053] Устройство 30 респираторной поддержки может включать в себя воздушно-кислородный смеситель 31. Сигнал, представляющий вычисленное выходное значение FiO2, может направляться из устройства 10 управления в сервомотор 32 специально установленный на воздушно-кислородном смесителе 31, что обеспечивает возможность автоматического поворота дискового переключателя FiO2 смесителя посредством кольцевого механизма с зубчатой передачей. Сервомотор 32 и зубчатая передача могут обеспечивать достаточные крутящий момент и точность, чтобы допускать подстройки FiO2 (например, минимум±0,5%), которые требуется выполнять точно и многократно. Сервомотор 32 может также иметь слабый удерживающий крутящий момент, так что диск смесителя можно еще поворачивать от руки; такое ручное вмешательство может обнаруживаться датчиком положения и приводить к переключению в ручной режим, в котором больше не осуществляется автоматическое управление FiO2.
[054] В начале автоматического управления FiO2 может проверяться и, при необходимости, изменяться калибровка сервомотора. Калибровка сервомотора может проверяться и/или изменяться периодически, при необходимости, в течение длительного использования.
[055] Устройство 10 управления может подтверждать, что изменения выходного значения FiO2 выполняются сервомотором 32 точно, с использованием сигналов обратной связи из сервомотора 32 о положении дискового переключателя FiO2 (FiO2 сервоуправления).
[056] Как показано на фиг. 2, вспомогательная система 50 контроля пациента может включать в себя респираторный монитор 51 и кардиореспираторный монитор 52. Респираторный монитор 51 контролирует дыхание пациента 40 и выдает сигнал, представляющий частоту дыхания пациента 40. Кардиореспираторный монитор 52 контролирует электрокардиограмму (ЭКГ) пациента 40 и выдает сигнал, представляющий частоту сердечных сокращений пациента 40, полученную в результате контроля электрокардиограммы (HRecg). Выходные сигналы из респираторного монитора 51 и кардиореспираторного монитора 52 передаются в устройство 10 управления.
[057] Система 60 контроля дыхательного контура может включать в себя кислородный газоанализатор 61 и датчик 62 давления. Кислородный газоанализатор 61 контролирует результат работы воздушно-кислородного смесителя 31, т.е. газообразную смесь, подлежащую подаче в пациента 40, и выдает сигнал, представляющий измеренное значение FiO2 в устройство 10 управления. Датчик 62 давления преобразует давление в патрубке вдоха контура CPAP и выдает сигнал, представляющий давление в контуре CPAP в устройство 10 управления.
[058] Подтверждение того, что изменения выходного значения FiO2, передаваемые из устройства 10 управления, точно выполняются автоматизированным воздушно-кислородным смесителем 31, могут также основываться на измерении выходного значения FiO2 из воздушно-кислородного смесителя 31, с использованием кислородного газоанализатора 61. Информация из кислородного газоанализатора 61 (измеренное значение FiO2) может преобразовываться в цифровую форму из аналогового сигнала и может дополнительно смещаться на выбранную задержку времени истечения (которая может составлять 5 секунд или любые другие подходящие значения и может выбираться или определяться во время настройки системы), чтобы компенсировать время на протекание газа и установление равновесного состояния после смесителя.
[059] По данным входным сигналам из оксигемометра 20, вспомогательной системы 50 контроля пациента и системы 60 контроля дыхательного контура, устройство 10 управления вычисляет выходное значение FiO2.
[060] Входные сигналы из оксигемометра 20, вспомогательной системы 50 контроля пациента и системы 60 контроля дыхательного контура, отличающиеся от входных значений SpO2, называются «дополнительными входными сигналами». Как описано выше, дополнительные входные сигналы могут включать в себя измеренные значения FiO2, давление в контуре CPAP, частоту дыхания, показатель перфузии, плетизмографическую форму сигнала, HRpleth и HRecg.
[061] Устройство 10 управления может дополнительно включать в себя блок тревожной сигнализации, управляемый контроллером 11, для включения звукового и/или визуального тревожного сигнала. Например, в случае отклонения либо значения FiO2 сервоуправления, либо измеренного значения FiO2 от выходного значения FiO2 сверх допустимых пределов (1 и 2%, соответственно) может включаться тревожный сигнал. В одном примере, включение тревожного сигнала высокого уровня и переключение в ручной режим могут происходить при отклонении 5 и 10%, соответственно.
[062] Кроме того, в качестве альтернативы, устройство 10 управления может быть и не автономным устройством, установленным или встроенным в другое устройство. Например, устройство 10 управления может быть встроено в оксигемометр 20 или встроено в устройство 30 респираторной поддержки.
[063] Как дополнительно подробно описано в дальнейшем, контроллер 11 может включать в себя основной компонент в форме контроллера с обратной связью, который предназначен для автоматического управления подачей кислорода для недоношенного новорожденного. Контроллер с обратной связью включает в себя механические, цифровые и/или электронные схемы для формирования выходных сигналов управления по входным сигналам управления и внутренних управляющих значений (называемых также «компонентами») в контроллере с обратной связью. Внутренние управляющие значения могут включать в себя суммирование:
(a) промежуточного управляющего значения, которое регулирует выходной сигнал, исходя из текущего значения входного сигнала;
(b) накопленного управляющего значения, которое регулирует выходной сигнал, исходя из предыдущих или прошлых значений входного сигнала; и
(c) прогнозного управляющего значения, которое регулирует выходной сигнал, исходя из прогнозируемых будущих значений входного сигнала.
[064] Способ для автоматического управления подачей вдыхаемого кислорода включает в себя следующие этапы:
(a) принимают сигналы, представляющие множество входных значений насыщения кислородом (SpO2) для пациента;
(b) формируют управляющие значения, исходя из входных значений SpO2 и искомого значения SpO2; и
(c) формируют выходные значения концентрации вдыхаемого кислорода (FiO2), исходя из управляющих значений и эталонных значений концентрации вдыхаемого кислорода (rFiO2).
[065] Управляющее значение может включать в себя мгновенное управляющее значение, связанное со сравнением текущего входного значения SpO2 и искомого значения SpO2. Мгновенное управляющее значение может быть сформировано, исходя из входных значений SpO2, искомого значения SpO2 и мгновенного коэффициента передачи.
[066] Управляющее значение может дополнительно включать в себя накопленное управляющее значение, сформированное на основании накопительной зависимости между входными значениями SpO2 и искомым значением SpO2. Накопительная зависимость между входными значениями SpO2 и искомым значением SpO2 может быть суммированием разностей между входными значениями SpO2 и искомым значением SpO2. Накопленное управляющее значение может быть сформировано, исходя из входных значений SpO2, искомого значения SpO2 и отрегулировано накопленным коэффициентом передачи.
[067] Управляющее значение может дополнительно включать в себя формирование прогнозного управляющего значения, формируемого, исходя из прогностической зависимости между входными значениями SpO2 и искомым значением SpO2. Прогностическая зависимость может быть производной по времени разностей между входными значениями SpO2 и искомым значением SpO2. Прогнозное управляющее значение может быть сформировано, исходя из входных значений SpO2, искомого значения SpO2 и прогнозного коэффициента передачи.
[068] Контроллер с обратной связью формирует управляющее значение, исходя из мгновенного управляющего значения, накопленного управляющего значения и прогнозного управляющего значения, и значения rFiO2 и вычисляет выходное значение FiO2.
[069] В контроллере с обратной связью, погрешность (e) определяется как отклонение обработанного сигнала от заданного значения. Контроллер с обратной связью может быть пропорционально-интегрально-дифференциальным (ПИД) контроллером.
[070] ПИД-контроллер с обратной связью можно улучшить несколькими способами. Степень тяжести легочной дисфункции можно получать периодически автоматической оценкой текущей потребности в кислороде. Средства оптимизации мгновенного управляющего значения могут включать в себя модуляцию на основании степени тяжести легочной дисфункции, подавление погрешностей, при нахождении в искомом диапазоне, и ограничение погрешностей во время гипоксии. Средства оптимизации накопленного управляющего значения могут включать в себя ограничение подынтегральной функции, компенсацию нелинейности зависимости PaO2-SpO2 и сдерживание повышения подынтегральной функции, в воздухе помещения.
[071] Для ПИД-контроллера с обратной связью, значение обрабатываемого выходного сигнала в каждый момент пропорционально погрешности, ее интегралу и ее производной, умноженным на разные коэффициенты в каждом случае, т.е. мгновенный коэффициент передачи, накопленный коэффициент передачи и прогнозный коэффициент передачи (называемые Kp, Ki, Kd, соответственно). Для ПИД-контроллера с обратной связью, мгновенное управляющее значение можно также называть «пропорциональным компонентом»; накопленное управляющее значение можно также называть «интегральным компонентом»; и прогнозное управляющее значение можно также называть «дифференциальным компонентом»; а все три можно называть «ПИД-компонентами».
[072] В способе для автоматического управления подачей вдыхаемого кислорода описанного в настоящей заявке, мгновенное управляющее значение можно формировать посредством умножения значения погрешности, соответствующей разности между текущим входным значением SpO2 и искомым значением SpO2, на мгновенный коэффициент передачи. Значение погрешности может быть погрешностью (e), т.е. сформированной вычислением разности между текущим входным значением SpO2 и искомым значением SpO2. В качестве альтернативы, значение погрешности можно формировать другими подходящими математическими методами, которые сравнивают текущее входное значение SpO2 с искомым значением SpO2.
[073] Для ПИД-контроллера, в качестве погрешности (e) можно использовать численную разницу между входящим значением для SpO2 (в предположении достоверного сигнала) и средней точкой выбранного искомого диапазона (например, для искомого диапазона 91-95%, средняя тока равна 93%).
[074] Кроме того, накопленное управляющее значение можно формировать умножением суммы разностей между входными значениями SpO2 и искомыми значениями SpO2 на накопленный коэффициент передачи. Например, накопленное управляющее значение можно формировать умножением суммы значений погрешностей на накопленный коэффициент передачи для цифровых сигналов или умножением интеграла значений погрешностей на накопленный коэффициент передачи для аналоговых сигналов. В качестве альтернативы, накопленное управляющее значение можно формировать другими подходящими математическими методами, которые дают в результате накопительную зависимость между входными значениями SpO2 и искомым значением SpO2.
[075] Для ПИД-контроллера, интегральная функция (
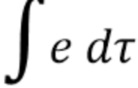
[076] Далее, прогнозное управляющее значение можно формировать умножением разности, деленной на время, между последовательными значениями погрешностей (для цифровых сигналов) или производной (для аналоговых сигналов) значений погрешностей (т.е. разностей между входными значениями SpO2 и искомыми значениями SpO2) на прогнозный коэффициент передачи. В качестве альтернативы, прогнозное управляющее значение можно формировать другими подходящими математическими методами, которые дают, в результате, прогностическую зависимость между входными значениями SpO2 и искомым значением SpO2.
[077] Для ПИД-контроллера, производная (

[078] Например, сумма каждого из ПИД-компонентов может быть представлена как ΔFiO2 (как показано в последующем уравнении 1).
[079] Как описано ранее, выходное значение FiO2 (фракцию FiO2, подлежащую подаче в пациента) можно вычислять, исходя из управляющего значения и эталонного значения концентрации вдыхаемого кислорода (rFiO2).
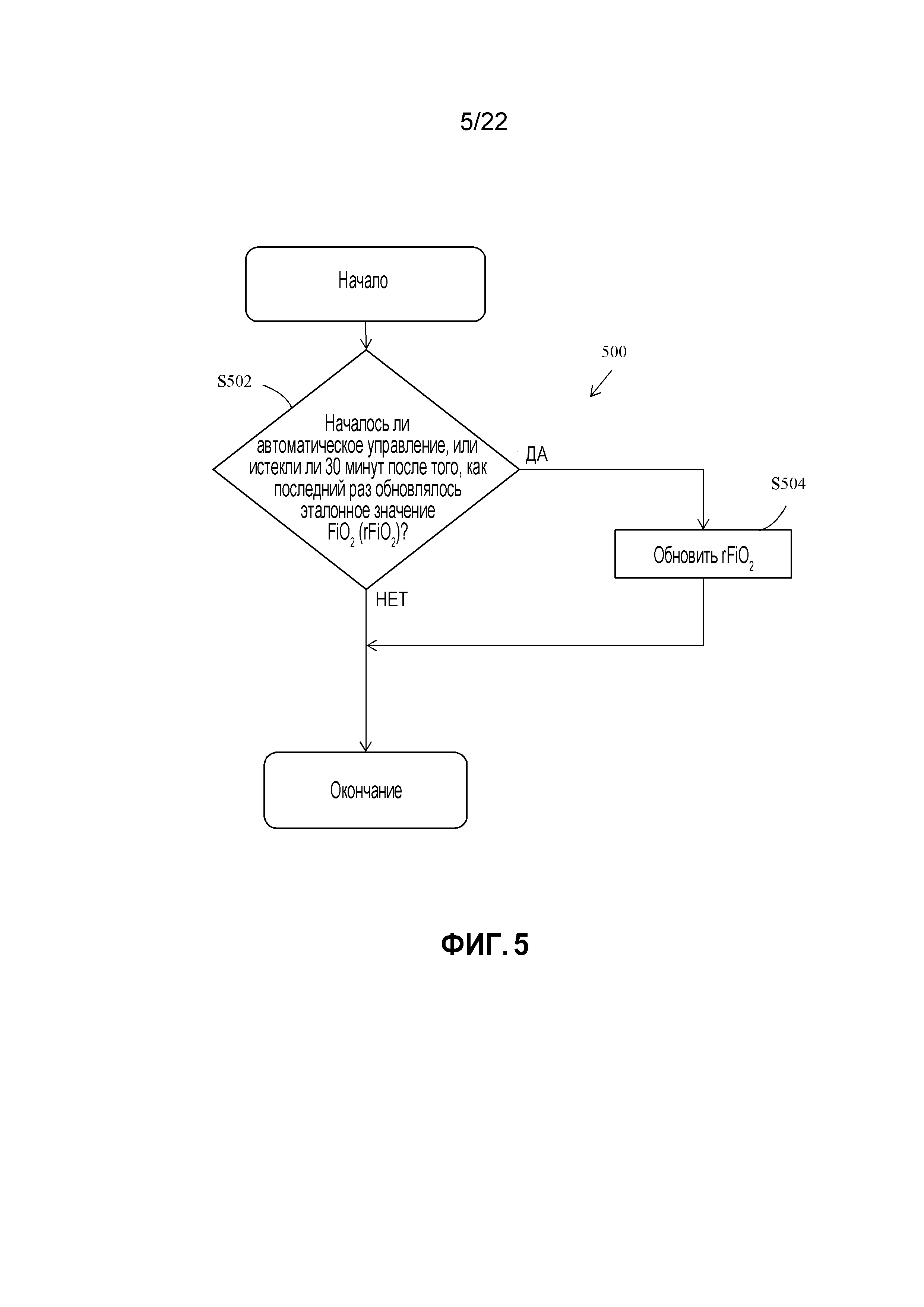
[080] В некоторых вариантах осуществления, выходные значения FiO2 могут быть суммой соответствующего управляющего значения и соответствующего значения rFiO2, т.е. как показано в уравнении 2.
[081] Например, FiO2могут быть суммой ΔFiO2 и rFiO2 (как показано далее в уравнении 2). Кроме того, FiO2 можно округлять до±0,5% и ограничивать до значения от 21 до 100%, т.е. любое значение меньше 21% округляется с повышением до 21%, и любое значение больше 100% округляется с понижением до 100%.
[082] ΔFiO2=Kp×e+Ki×
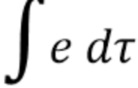

[083] Заданное FiO2=ΔFiO2+rFiO2. (уравнение 2)
[084] Значение rFiO2 может представлять текущее базисное требование по кислороду, которое указывает степень тяжести легочной дисфункции пациента. Данное значение может быть предварительно заданным значением или диапазоном значений, или может быть выбрано пользовательским вводом. Например, значение rFiO2 может быть предварительно задано как число от 21% до 60% или любое другое подходящее число до 100%. Значение rFiO2 может иметь первоначальное значение и многократно корректироваться с течением времени, как дополнительно подробно описано в дальнейшем. Период времени для повторения определения может быть фиксированным (например, любой период от 30 минут до 2 часов) или, в качестве альтернативы, может быть неопределенным. Таким образом, можно обнаруживать и реагировать на постепенные изменения в фундаментальной потребности в кислороде, которая возникает у субъектов с респираторной дисфункцией.
[085] В некоторых вариантах осуществления мгновенный коэффициент передачи имеет первоначальное значение, выбираемое в диапазоне от -2 до -0,2, например, -1.
[086] В некоторых вариантах осуществления накопленный коэффициент передачи имеет первоначальное значение, выбираемое в диапазоне от -0,25 до -0,005, например, -0,0125.
[087] В некоторых вариантах осуществления прогнозный коэффициент передачи имеет первоначальное значение, выбираемое в диапазоне от -2 до -0,25, например, -1.
[088] Каждое из значений Kp, Ki и Kd можно определять, исходя из предварительно заданных эталонных значений или диапазона значений. Например, Kp, Ki и Kd можно определить, исходя из эталонных значений или диапазонов значений, полученных в результате исследований методом моделирования с использованием данных от недоношенных новорожденных. Значения для каждого из коэффициентов могут быть отрицательными, то есть ПИД-компоненты согласованно исправляют погрешность. Примерные диапазоны значений для коэффициентов могут составлять: Kp от -2 до -0,2; Ki от -0,25 до -0,005; Kd от -2 до -0,25, например, Kp=-1, Ki=-0,0125, и Kd=-1. Как дополнительно подробно описано в дальнейшем, постоянное значение для Kp можно корректировать в зависимости от степени тяжести легочной дисфункции и можно дополнительно уточнять в процессе самонастройки в течение автоматического управления, например, уточнять один раз через каждые 30-60 минут (или любой другой подходящий период времени, который достаточен для правильной оценки, например, больше 10 минут или меньше 120 минут).
[089] В некоторых вариантах осуществления мгновенные управляющие значения можно корректировать.
[090] В некоторых вариантах осуществления способ может дополнительно включать в себя этап:
вычисления искомого значения SpO2, исходя из искомого диапазона SpO2;
при этом, когда текущее входное значение SpO2 находится в пределах искомого диапазона SpO2, то к мгновенному коэффициенту передачи применяется коэффициент подавления, и
причем коэффициент подавления формируется, исходя из текущего входного значения SpO2 и средней точки искомого диапазона SpO2.
[091] Коэффициент подавления может равняться дробному множителю, который пропорционален разности между текущим входным значением SpO2 и средней точкой искомого диапазона SpO2.
[092] Кроме того, когда текущее входное значение SpO2 ниже искомого значения SpO2, значение погрешности, соответствующей разности между текущим входным значением SpO2 и искомым значением SpO2 может ограничиваться выбранной максимальной разностью.
[093] Определение пропорционального компонента для ПИД-управления можно корректировать, когда входное значение SpO2 находится в пределах искомого диапазона SpO2.
[094] Система 100 может задавать среднюю точку искомого диапазона, с определением любого отклонения от данного значения в качестве погрешности (e). При установлении, что значения SpO2 в других точках в пределах искомого диапазона являются допустимыми, погрешности, связанные с отклонением от средней точки искомого диапазона, можно уменьшать умножением на дробный множитель Kpfm, пропорциональный расстоянию от средней точки (ослабление в искомом диапазоне). Например, для искомого диапазона с размахом±2 от средней точки (например, 91-95%), при |e|=1, Kp можно умножать на дробный множитель Kpfm, равный 0,25, и при |e|=2, можно умножать на дробный множитель Kpfm, равный 0,5.
[095] Далее, при условии, что относительная погрешность контроля SpO2 при значениях ниже 80%, отрицательная погрешность может ограничиваться, например, на уровне 15%, для определения пропорционального компонента.
[096] В некоторых вариантах осуществления накопленные управляющие значения можно корректировать.
[097] В некоторых вариантах осуществления, к накопленному управляющему значению может применяться нелинейное взвешивание компенсации, с учетом нелинейной, предварительно заданной зависимости между парциальным давлением кислорода (PaO2) в артериальной крови и SpO2.
[098] Кроме того, накопленные управляющие значения можно корректировать, чтобы ограничивать управляющее значение на уровне выбранного максимального управляющего значения.
[099] Интегральный компонент для ПИД-управления можно корректировать.
[100] При понимании того, что интегральный компонент постепенно наращивает FiO2 в случае непрерывной гипоксии, на величину подынтегральной функции можно установить пределы, которые ограничивают максимум ΔFiO2, который может быть выдан из ПИД-контроллера, до значения, установленного пользователем (которое может составлять±30-40%, т.е. от 30 до 40% выше или ниже rFiO2). При гипероксии (т.е. при SpO2 выше искомого диапазона, когда имеет место дополнительная оксигенотерапия), которая может последовать за эпизодом гипоксии в случае «проскока», погрешность при высоких значениях SpO2 может быть и не пропорциональной вероятному отклонению PaO2 от допустимого значения (т.е. имеет место нелинейная зависимость PaO2-SpO2). По данной причине, пока подынтегральная функция остается отрицательной (т.е. проявляющей тенденцию к повышению ΔFiO2), положительные погрешности, пропорциональные соответствующим значениям ΔPaO2, можно умножать на множитель погрешностей. В одном варианте осуществления, к подынтегральному выражению добавляется исправленная погрешность, при каждой итерации, пока подынтегральная функция остается отрицательной. Множители погрешностей могут быть такими, как в таблице 1.
[101] Таблица 1. Множители погрешностей при положительных погрешностях SpO2
[102] Множители погрешностей могут производить действие быстрого повышения отрицательной подынтегральной функции обратно в сторону нуля и, тем самым, смягчения проскока.
[103] Кроме того, в некоторых вариантах осуществления формирование накопленных управляющих значений может включать в себя:
сдерживание увеличения накопленных управляющих значений, когда: (i) текущее выходное значение FiO2 находится на уровне воздуха в помещении, и (ii) текущее входное значение SpO2 выше искомого значения SpO2.
[104] Как только подынтегральная функция оказывается положительной (т.е. проявляющей тенденцию к снижению ΔFiO2), дополнительные положительные погрешности могут добавляться к подынтегральной функции только в то время, когда установленное значение FiO2 остается выше, чем в воздухе помещения (21%). При значении как в воздухе помещения (т.е. FiO2=21%), последующие значения SpO2 выше искомого диапазона могут больше не считаться представляющими непрерывную гипероксию, и к подынтегральной функции могут и не добавляться положительные погрешности, т.е. данные положительные значения погрешностей аннулируются или обнуляются. Это может исключить нарастание положительной подынтегральной функции, что задерживало бы соответствующую реакцию интегрального компонента на следующий эпизод гипоксии.
[105] В некоторых вариантах осуществления прогнозные управляющие значения можно корректировать.
[106] В некоторых вариантах осуществления прогнозные управляющие значения могут аннулироваться, если входные значения SpO2 были выше выбранного порога SpO2 для всего периода определения отрицательного наклона SpO2.
[107] Дифференциальный компонент для ПИД-управления можно корректировать. Например, дифференциальный компонент можно корректировать во время гипероксии.
[108] В некоторых вариантах осуществления отрицательный наклон SpO2 можно приводить к нулевому (т.е. присваивать значение =0), если все самые последние 5 значений SpO2 превышают заданное значение (во время эпизода гипероксии). Тем самым, можно устранить повышающее воздействие дифференциального компонента на ΔFiO2 при гипероксии.
[109] На фиг. 3 изображен процесс 300, выполняемый контроллером 11, для формирования пропорционального компонента, интегрального компонента и дифференциального компонента, включая корректировки, описанные выше в настоящей заявке.
[110] Как показано на фиг. 3, на этапе S302 вычисляется значение погрешности (e) в виде численной разности между входным значением SpO2 и искомым значением SpO2 (например, средней точкой выбранного искомого диапазона), как показано ниже в уравнении 3.
[111] e=SpO2 - искомое-SpO2. (уравнение 3)
[112] Затем, на этапе S304, пропорциональный компонент корректируется с использованием следующих этапов:
(a) Выбрать значение для дробного множителя Kpfm, исходя из значения погрешности:
Если |e|<=1 (т.е. погрешность не больше, чем 25% от искомого диапазона, и, следовательно, входное значение SpO2 находится в пределах искомого диапазона и вблизи искомого значения SpO2), то Kpfm=0,25;
иначе, если |e|<=2 (т.е. погрешность больше, чем 25% от искомого диапазона но не больше, чем 50% от искомого диапазона, и, следовательно, входное значение SpO2 находится в пределах искомого диапазона, однако не вблизи искомого значения SpO2), то Kpfm=0,5;
в ином случае (т.е. погрешность больше, чем 50% от искомого диапазона, и, следовательно, входное значение SpO2 находится за пределами искомого диапазона) Kpfm=1.
(b) Регулируют Kpfm, исходя из давления в контуре CPAP и частоты дыхания:
Если (давление в контуре CPAP =низкое), то Kpfm=2×Kpfm (т.е. снижение давления в контуре приводит к удвоению Kpfm);
иначе, если (дыхательная пауза составляет 5-15 сек), то Kpfm=2×Kpfm в течение 30 секунд (т.е. дыхательная пауза приводит к удвоению Kpfm в течение 30 секунд).
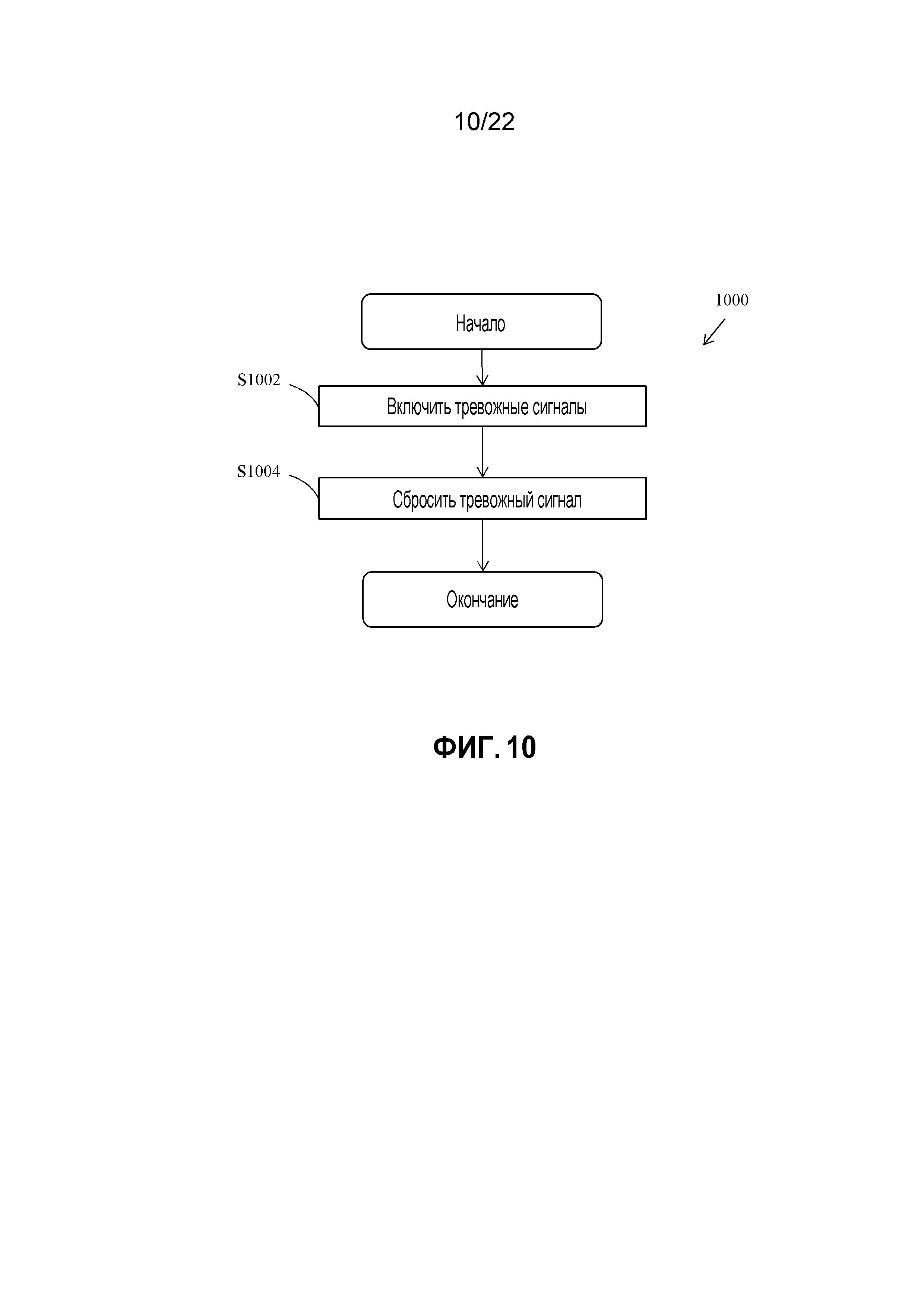
(c) Применить ограничение погрешности пропорционального компонента во время гипоксии:
Если e>-15% (т.е. пациент находится в состоянии гипоксии), то пропорциональная погрешность ep=-15% (т.е. погрешность пропорционального компонента ограничена);
в ином случае ep=e.
(d) Вычислить пропорциональный компонент:
Пропорциональный компонент =P(t)=Kpfm×Kp×ep.
[113] После коррекции пропорционального компонента, логическая схема переходит к этапу S306, чтобы корректировать интегральный компонент с применением следующих этапов:
(a) Определение множителя (Ks) нелинейной компенсации, исходя из нелинейной, предварительно заданной зависимости, которая может быть предварительно задана с использованием известных зависимостей между уровнем кислорода крови и высокими значениями SpO2: (включая значения, описываемые уравнением Северингхауса):
Если предшествующий интегральный компонент I(t-1)<0 (т.е. подынтегральная функция осталась отрицательной), и e>0 (т.е. SpO2 превышает искомый диапазон),
то
если SpO2=92, то Ks=1,2;
иначе, если SpO2=93, то Ks=1,4;
иначе, если SpO2=94, то Ks=1,7;
иначе, если SpO2=95, то Ks=2,2;
иначе, если SpO2=96, то Ks=2,9;
иначе, если SpO2=97, то Ks=4,4;
иначе, если SpO2=98, то Ks=7,9;
иначе, если SpO2=99, то Ks=20,1;
иначе, если SpO2=100, то Ks=50;
в ином случае Ks=1
(т.е. применить множитель нелинейной компенсации к положительным погрешностям, пропорциональным соответствующим значениям ΔPaO2).
(b) Сдерживание повышения подынтегральной функции в воздухе помещения:
Если FiO2=21% (т.е. в воздухе помещения), и e>0, то dI=0 (т.е. дополнительная положительная погрешность не добавляется к подынтегральной функции);
в ином случае dI=Ki×Ks×e.
(c) Определить значение интегрального компонента:
Интегральный компонент =I(t)=I(t-1)+dI.
(d) Ограничение подынтегральной функции:
Если |I(t)|>|максΔFiO2/Ki|, I(t)=(знак)×(максΔFiO2/Ki)
(т.е. значение интегрального компонента ограничивается, исходя из выбранного максΔFiO2).
[114] После коррекции интегрального компонента, корректируют дифференциальный компонент на этапе S308 с применением следующих этапов:
(a) Оценить дифференциальный компонент:
Дифференциальный компонент =D(t)=Kd×de/dt, где de/dt вычисляется методом линейной регрессии в течение 5 секунд.
(b) Обнулить для отрицательного наклона и гипероксии:
Если de/dt<0 и (SpO2(t)>искомое SpO2) и
(SpO2(t-1)>искомое SpO2), (SpO2(t-2)>искомое SpO2), и
(SpO2(t-3)>искомое SpO2), и (SpO2(t-4)>искомое SpO2)
(т.е. все самые последние 5 значений SpO2превышают заданное значение),
то D(t)=0 (т.е. отрицательный наклон SpO2 обнуляется).
[115] Кроме того, управляющее значение может быть дополнительно сформировано, исходя из значения rFiO2.
[116] В некоторых вариантах осуществления мгновенное управляющее значение (пропорциональный компонент) дополнительно определяется, исходя из значения rFiO2.
[117] Мгновенное управляющее значение (пропорциональный компонент) корректируется на корректировочное значение, вычисляемое по значению rFiO2. Корректировочное значение можно определить с использованием монотонной зависимости от rFiO2, т.е. по монотонной функции. Например, Kp можно скорректировать путем изменения предварительно заданного первоначального эталонного значения или его текущего значения на значение, вычисленное по значению rFiO2. Данное корректировочное значение повышает эффективное значение мгновенного управляющего значения для повышения rFiO2, например, с масштабирующим коэффициентом, пропорциональным степени тяжести легочной дисфункции, показываемой текущим значением rFiO2. Например, постоянное значение Kp можно умножать на коэффициент в диапазоне от 0,5 до 1,5 при rFiO2 в соответствующем диапазоне от 21% до 60% (например, при rFiO2 21%, масштабирующий коэффициент может быть 0,5, при rFiO2 40%, масштабирующий коэффициент может быть 1.0, и масштабирующий коэффициент может изменяться линейно от 0,5 до 1,5 пропорционально изменению rFiO2 от 21% до 60%). В качестве альтернативы, масштабирующий коэффициент можно реализовать как эквивалентное корректировочное значение, которое корректирует мгновенное управляющее значение. Адаптация Kp данным способом может компенсировать обратно пропорциональную зависимость между коэффициентом передачи и степенью тяжести легочного заболевания.
[118] Кроме того, способ может дополнительно включать в себя следующие этапы:
прием сигналов, представляющих множество входных значений SpO2 в период времени анализа рабочих параметров;
формирование результата оценки рабочих параметров, исходя из входных значений SpO2, принятых в период времени анализа рабочих параметров; и
формирование управляющего значения, исходя из результата оценки рабочих параметров.
[119] Кроме того, мгновенный коэффициент передачи корректируют по результату оценки рабочих параметров.
[120] В некоторых вариантах осуществления значение Kp может корректироваться многократно в течение автоматического управления подачей вдыхаемого кислорода: анализ рабочих параметров автоматического управления подачей вдыхаемого кислорода может выполняться периодически, исходя из входных значений SpO2, принятых в течение периода времени анализа рабочих параметров, и формирование результата оценки рабочих параметров, и значение Kp можно корректировать, исходя из результата оценки рабочих параметров.
[121] В некоторых вариантах осуществления результат оценки рабочих параметров может формироваться, исходя из, по меньшей мере, чего-то одного из: длительности гипоксии, в течение которой входные значения SpO2 в период времени анализа рабочих параметров находились в диапазоне гипоксии, и длительности гипероксии, в течение которой входные значения SpO2 в период времени анализа рабочих параметров находились в диапазоне гипероксии.
[122] Кроме того, в некоторых вариантах осуществления результат оценки рабочих параметров формируется, исходя из отношения длительности гипероксии к длительности гипоксии.
[123] Кроме того, в некоторых вариантах осуществления способ может дополнительно включать в себя:
определение искомого значения SpO2, исходя из искомого диапазона SpO2;
при этом результат оценки рабочих параметров формируется, исходя из, по меньшей мере, чего-то одного из:
искомой длительности, в течение которой входные значения SpO2 в период времени анализа рабочих параметров находились в искомом диапазоне SpO2, и
длительности эпоксии («eupoxia»), в течение которой входные значения SpO2 в период времени анализа рабочих параметров находились в диапазоне эпоксии, при этом диапазон эпоксии является диапазоном, в котором входные значения SpO2 находились в искомом диапазоне SpO2 или превышают искомый диапазон SpO2 в воздухе помещения.
[124] Период времени анализа рабочих параметров может быть фиксированным периодом времени, например, предварительно заданным или заданным пользователем. Период времени анализа рабочих параметров может составлять 60 минут, так что анализ выполняется по данным SpO2, записанным в течение последних 60 минут перед анализом. В качестве альтернативы, период времени анализа рабочих параметров может быть переменным периодом времени (например, любым периодом времени от 30 минут до 2 часов), основанным на результате анализа или командах, введенных пользователем.
[125] Анализ может выполняться периодически. Например, анализ может выполняться через каждые 30 минут. Анализ может также выполняться непрерывно или выполняться однократно после каждого некоторого интервала, который может быть любым подходящим периодом времени до 2 часов. Частота анализа может также задаваться пользователем.
[126] Анализ может быть основан на реакции на все эпизоды гипоксии во временном окне, начиная с наступления гипоксии (SpO2<85%), и в продолжении некоторого периода (любого выбранного подходящего периода времени от 2 до 10 минут) после устранения эпизода.
[127] Суммарное время гипоксии (SpO2 80-84%) и тяжелой гипоксии (SpO2<80%), а также длительность последующего проскока SpO2 в гипероксию (97-98%) и тяжелую гипероксию (99-100%), при получении кислорода, можно определять количественно, как описано в настоящей заявке со ссылкой на фиг. 4.
[128] Из упомянутых данных можно вывести взвешенный коэффициент работоспособности как отношение времени гипероксии ко времени гипоксии, значение которого <1 и >1 может указывать на недостаточный и избыточный Kp, соответственно. Текущее значение Kp может изменяться на вплоть до±10% каждые 30 мин в результате данного анализа.
[129] Кроме того, возможно вычисление пропорций времени, в течение которого значение SpO2 находилось в искомом диапазоне и в диапазоне эпоксии (SpO2 находилось в искомом диапазоне или превышало искомый диапазон при в воздухе помещения), а также появление гипоксии и гипероксии по кислороду.
[130] В некоторых вариантах осуществления тревожный сигнал может включаться, когда результат оценки рабочих параметров не удовлетворяет некоторым условиям, в том числе, выходной сигнал контроллера существенно ниже минимального требования для пропорции времени эпоксии, которое может регулироваться пользователем, и задается в диапазоне от 50 до 80%.
[131] Фиг. 4 изображает процесс 400, выполняемый контроллером 11, по коррекции Kp, исходя из результата оценки рабочих параметров, как описано выше в настоящей заявке.
[132] Как показано на фиг. 4, на этапе S402, процесс 400 определяет, истекли ли 30 минут с начала автоматического управления или предыдущего анализа рабочих параметров.
[133] Если результатом определения оказывается нет, то процесс 400 заканчивается. Если определяется, что 30 минут истекли, то процесс 400 переходит на этап S404, чтобы выполнять анализ рабочих параметров, исходя из рабочих параметров управления в течение предыдущего 60-минутного временного окна, с применением следующих этапов:
(a) Вычислить пропорцию времени в диапазонах эпоксии, гипоксии и гипероксии:
tтяжелая гипоксия: SpO2<80%.
tгипоксия: 80%<=SpO2<=84%.
tэпоксия: SpO2 в искомом диапазоне или выше при FiO2=21%.
tгипероксия: 97%<=SpO2<99%, при получении кислорода.
tтяжелая гипероксия: SpO2>=99%, при получении кислорода.
(т.е. количественно определить суммарное время гипоксии, тяжелой гипоксии, гипероксии, тяжелой гипероксии и эпоксии).
(b) Вычислить взвешенный коэффициент работоспособности:
Cработоспособности=(tтяжелая гипероксия+tгипероксия)/(tгипоксия+tтяжелая гипоксия)
(т.е. пропорцию времени гипероксии, включая тяжелую гипероксию, к времени гипоксии, включая тяжелую гипоксию, показывающее недостаточный и избыточный Kp).
(c) Вычислить новый Kp:
Если Cработоспособности<=0,7, то Kp=Kp×1,1.
Если 0,7
Если 1,15<=Cработоспособности<1,3, то Kp=Kp×0,95.
Если Cработоспособности>=1,3, то Kp=Kp×0,9.
(т.е. изменить значение Kp, исходя из отношения времени)
(d) Вычислить время эпоксии:
время эпоксии=(tэпоксия×100)/tсуммарное.
(т.е. пропорцию времени, в течение которого SpO2 находилось в диапазоне эпоксии)
Если время эпоксии<целевое время в искомом диапазоне,
тревожный сигнал: «соответствие искомому диапазону»=истина
(т.е. тревожный сигнал включается, если автоматическое управление было ниже минимального требования).
[134] Кроме того, способ автоматического управления подачей вдыхаемого кислорода может дополнительно включать в себя:
(a) формирование результата оценки rFiO2, исходя из входных значений SpO2 и соответствующих выходных значений FiO2 в период времени оценки rFiO2; и
(b) коррекция значения rFiO2, исходя из результата оценки rFiO2.
[135] Значение rFiO2 может иметь первоначальное значение и может корректироваться многократно с течением времени.
[136] В некоторых вариантах осуществления анализ может выполняться периодически. Например, анализ может выполняться однократно каждые 30 минут, что можно назвать временной частотой оценки. Анализ может также выполняться однократно после каждого некоторого интервала, который может быть любым подходящим временем от 30 минут до 2 часов. Анализ зависимости между заданным значением FiO2 и SpO2 в скользящем временном окне («период времени оценки») может выполняться с временной частотой оценки, в предположении, что фиксированное отношение V/Q, вместе с переменным шунтированием, вызывало нарушения оксигенации. Временное окно может составлять 60 минут или любой подходящий период времени (любой выбранный период от 30 минут до 2 часов). Затем может быть выведено значение для отношения V/Q, например, с использованием известных способов и формул для вычисления отношения V/Q, и по данному значению можно корректировать значение rFiO2 для устранения его влияния на оксигенацию. Данное скорректированное значение может стать новым значением rFiO2, которое может быть ограничено с точностью до±10% предыдущего значения. Тем самым можно исключить быстрые изменения rFiO2.
[137] Фиг. 5 изображает процесс 500, выполняемый контроллером 11, по коррекции значения rFiO2.
[138] Как показано на фиг. 5, на этапе S502, процесс 500 определяет, началось ли автоматическое управление, или истекли ли 30 минут после того, как последний раз обновлялось эталонное значение FiO2 (rFiO2).
[139] Если результатом определения является нет, то процесс 500 заканчивается. Если определяется, что автоматическое управление началось, или что 30 минут истекли, то процесс 500 переходит на этап S504, чтобы обновить значение rFiO2, с применением следующих этапов:
(a) Анализ методом скользящего окна
Выполнить анализ FiO2 и SpO2 методом 60-минутного скользящего окна, чтобы получить отношение V/Q и получить rFiO2по отношению V/Q.
(b) Ограничить rFiO2 в пределах±10% от предыдущего значения
Если (rFiO2 - предыдущее rFiO2)/(предыдущее rFiO2)>0,1,
то rFiO2=предыдущее rFiO2+знак(rFiO2 - предыдущее rFiO2)×0,1×предыдущее rFiO2
(т.е. определить новое значение rFiO2, ограниченное в пределах±10% предыдущего значения; тем самым можно исключить быстрые изменения rFiO2).
(c) С начала автоматического управления, применять текущее значение для FiO2 или значение, введенное пользователем в качествен начального значения для rFiO2.
[140] Кроме того, способ автоматического управления подачей вдыхаемого кислорода может дополнительно включать в себя:
(a) формирование результата проверки SpO2, исходя из текущего входного значения SpO2, посредством отнесения текущего входного значения SpO2 к одному из нескольких уровней достоверности в ходе процедуры иерархической проверки; и
(b) определение выходного значения FiO2 на основании результата проверки SpO2.
[141] Можно принять следующие уровни иерархической проверки:
(a) «Уровень I», соответствующий входному значению SpO2, являющемуся «отсутствующим», если входное значение SpO2 удовлетворяет первому условию;
(b) «Уровень II», соответствующий входному значению SpO2, являющемуся «подозрительным», если входное значение SpO2 удовлетворяет второму условию; и
(c) «Уровень III», соответствующий входному значению SpO2, являющемуся «недостоверным», если входное значение SpO2 удовлетворяет третьему условию.
[142] Кроме того, в некоторых вариантах осуществления, способ может дополнительно включать в себя:
прием, по меньшей мере, какого-то одного из:
сигнала, представляющего частоту сердечных сокращений, полученную по плетизмографической форме сигнала SpO2;
сигнала, представляющего частоту сердечных сокращений, полученную в результате электрокардиографического контроля; и
сигнала, представляющего показатель перфузии;
при этом достоверность текущего входного значения SpO2 определяется, исходя из, по меньшей мере, какой-то одной из:
принятой частоты сердечных сокращений, полученной по плетизмографической форме сигнала SpO2;
принятой частоты сердечных сокращений, полученной в результате электрокардиографического контроля; и
принятого показателя перфузии.
[143] Для проверки сигнала SpO2, некоторые или все следующие вспомогательные входные сигналы могут предоставляться как цифровые сигналы:
(a) частота сердечных сокращений, полученная по плетизмографической форме сигнала SpO2 (HRpleth);
(b) частота сердечных сокращений, полученная в результате электрокардиографического контроля (HRecg); и
(c) показатель перфузии, представляющий собой метрику пульсации оксигемометрической формы сигнала, при этом низкие значения потенциально соответствуют ложным значениям SpO2.
[144] В начале автоматического управления и затем каждые 24 часа («период проверки перфузии»), значение показателя перфузии, представляющее оптимальную перфузию, может записываться в то время, когда плетизмографическая форма сигнала является стабильной, и сигнал является мощным. Период проверки перфузии может быть любым подходящим периодом времени, включая любой выбранный период времени от 6 часов до 2 суток.
[145] Фиг. 6 изображает процесс 600, выполняемый контроллером 11, по определению значения показателя перфузии.
[146] Как показано на фиг. 6, на этапе S602, процесс 600 определяет, началось ли автоматическое управление, или истекли ли 24 часа после последней оценки показателя перфузии.
Если результатом определения является нет, то процесс 600 заканчивается. Если определяется, что автоматическое управление началось, или что 24 часа истекли, то 600 переходит на этап S604, чтобы ввести новое оптимальное значение показателя перфузии, например, являющееся 95-м центилем в течение последних 24 часов.
[147] Плетизмографическая форма сигнала, которая может быть записана в течение предыдущих 10 секунд (или любого подходящего периода времени, включая любой выбранный период времени от 5 секунд до 20 секунд) может вводиться также в форме аналогового сигнала, который оцифровывался с помощью аналого-цифрового преобразователя. Цифровые и аналоговые сигналы могут собираться с использованием устройства сбора данных.
[148] Анализ формы сигнала проверяет достоверность значения SpO2 путем анализа плетизмографического сигнала из пульсового оксигемометра, чтобы подтвердить, что форма сигнала соответствует свойствам, ожидаемым от достоверного плетизмографического сигнала. Способы оценки включают в себя, по отдельности или в комбинации, анализ статистических свойств сигнала (например, среднее значение и дисперсию), классические методы обработки сигналов (например, автокорреляцию), логические алгоритмы (включая нечеткую логику) и методы распознавания образов (включая нейронные сети).
[149] Например, один примерный процесс для выполнения анализа плетизмографической формы сигнала SpO2 включает в себя следующие этапы:
(a) периодическое получение достоверной «репрезентативной» плетизмографической кривой от отдельного пациента;
(b) нормирование текущего входного плетизмографического сигнала SpO2 по двум осям таким образом, чтобы как периодичность, так и максимальная и минимальная амплитуды соответствовали «репрезентативной» плетизмографической кривой;
(c) сравнение двух сигналов методом множественной линейной регрессии, при этом среднеквадратическая погрешность дает показание отклонения текущего сигнала от «репрезентативной» плетизмографической формы сигнала SpO2.
[150] В качестве альтернативы, два сигнала можно сравнивать другими способами, например, таким распознаванием образов, как линейный дискриминантный анализ или искусственные нейронные сети. При применении данных способов, предварительно записанную базу данных записей плетизмографических форм сигналов, со значениями SpO2, классифицированными как достоверный или недостоверный, можно использовать для обучения и проверки распознавания образов таким образом, чтобы данный метод можно было применять для классификации контролируемого сигнала SpO2 как достоверного или недостоверного.
[151] С использованием упомянутых дополнительных входных сигналов можно применить следующую процедуру иерархической проверки:
(a) Уровень I: если значение SpO2 является нулевым или нечисловым;
(b) Уровень II: если, после нормирования по двум осям, форма сигнала не соответствует типичной плетизмографической форме сигнала; и
(c) Уровень III: если:
i. показатель перфузии <30% (или любого другого подходящего значения, например, любого значения от 10% до 50%) от оптимального значения, и форма сигнала является «подозрительной», или
ii. абсолютное значение HRecg - HRpleth>30 ударов/мин (или любого другого подходящего значения, например, любого значения от 20 ударов/мин до 50 ударов/мин) и форма сигнала является «подозрительной», или
iii. имеет место резкое снижение SpO2 (например, >15% через 5 секунд, или любого другого подходящего значения, представляющего резкое и глубокое снижение SpO2, при этом снижение должно продолжаться в течение некоторого периода времени, например, 5 секунд, поскольку иногда резкое снижение SpO2 может быть ложным показанием), вместе с чем-нибудь из: «подозрительной» формы сигнала, несоответствия частоты сердечных сокращений или несоответствия показателя перфузии (предполагающих ложную гипоксию).
[152] Фиг. 7 описывает пример процесса (700) иерархической проверки, выполняемого контроллером 11.
[153] Как показано на фиг. 7, сначала на этапе S702 определяется, является ли входное значение SpO2 нулевым или нечисловым. Если да, то признак «уровень 1» устанавливается как истина (S704), и процесс 700 заканчивается.
[154] Если входное значение SpO2 не является нулевым или нечисловым, то признак «уровень 1» устанавливается как ложь (S706), и на этапе S708 выполняется дополнительное определение, чтобы испытать входной сигнал SpO2 на совместимость с плетизмографической формой сигнала. Если определяется, что, после нормирования по обеим осям, форма входного сигнала SpO2 не согласуется с типичной плетизмографической формой сигнала, то признак «уровень 2» устанавливается как истина (S712), т.е. входной сигнал SpO2 является «подозрительным». Если форма сигнала входного сигнала SpO2 согласуется с типичной плетизмографической формой сигнала, то признак «уровень 2» устанавливается как ложь.
[155] Затем, логическая схема переходит на этап S714, чтобы определить, является ли показатель перфузии <30% от оптимального, и устанавливает признак «несоответствие ПИ (показателя перфузии)» как истина, если показатель перфузии <30% от оптимального (S716), или устанавливает признак «несоответствие ПИ» как ложь, если нет (S718).
[156] Далее, на этапе S720 выполняется испытание для определения, является ли абсолютное значение HRecg - HRpleth>30 ударов/мин. Если да, то признак «несоответствие HR (частоты сердечных сокращений» устанавливается как истина (S722); и если нет, то признак «несоответствие HR» устанавливается как ложь (S724).
[157] Кроме того, на этапе S726 определяется, выполняется ли условие «уровня III», т.е. является ли входное значение SpO2 «недостоверным», например, с использованием следующей логической схемы:
(«Несоответствие ПИ» и «уровень 2») или («несоответствие HR» и «уровень 2») или
((SpO2 уменьшилось на >15% через 5 секунд) и («уровень 2» или «несоответствие ПИ» или «несоответствие HR»))
Если результат положителен, то признак «уровень III» устанавливается как истина (S728), т.е. входное значение SpO2 является «недостоверным»; если нет, то признак «уровень III» устанавливается как ложь (S730).
[158] В некоторых вариантах осуществления, когда входное значение SpO2определяется как недостоверное (например, в случае отсутствия или недостоверного сигнала), значение FiO2 может устанавливаться для фиксации текущего значения выходного значения FiO2, т.е. ранее записанного значения FiO2. В случае длительного отсутствия или недействительного сигнала, кроме включения тревог, описанных в дальнейшем, выходное значение FiO2 может изменяться в направлении rFiO2.
[159] Фиг. 8 изображает процесс 800, выполняемый контроллером 11, для определения выходного значения FiO2 на основании достоверности SpO2.
[160] Как показано на фиг. 8, на этапе S802 выполняется тест для принятия решения, является ли входное значение SpO2 «отсутствующим» или «недостоверным». Если определяется, что входное значение SpO2 является «отсутствующим» или «недостоверным», то на этапе S806 выходное значение FiO2 устанавливается таким же, как предыдущее выходное значение FiO2. Если на этапе S802 определяется, что входное значение SpO2 не является «отсутствующим» или «недостоверным», то логическая схема переходит на этап S804, на котором выходное значение FiO2 определяется, исходя из входного значения SpO2, например, с использованием следующих этапов:
(a) Вычислить ΔFiO2: ΔFiO2=P(t)+I(t)+D(t).
(b) Вычислить выходное значение FiO2: FiO2=ΔFiO2+rFiO2.
(c) Если апноэ >15 сек, то изменить выходное значение FiO2 с повышением на 5% на 30 сек после прекращения апноэ.
(d) Округлить «выходное значение FiO2» до±0,5%.
(e) Если FiO2 <21%, то выдать значение FiO2=21%.
Если FiO2 >100%, то выдать значение FiO2=100%.
[161] В некоторых вариантах осуществления тревожный сигнал (например, звуковой и/или визуальный тревожный сигнал) может включаться, когда SpO2 определяется как бывшее недостоверным в течение некоторого периода времени (например, 30 секунд или любого другого подходящего периода времени, который может предотвратить непрерывное пропускание сигнала от ребенка, который имеет низкое SpO2). Например, тревожный сигнал может быть звуковым тревожным сигналом, и громкость тревожного сигнала может повышаться через каждые несколько минут (например, 2 минуты), когда тревожный сигнал включен, вместе с выдачей сообщения об ошибке с целью проверки датчика и соединений оксигемометра.
[162] В некоторых вариантах осуществления тревожный сигнал может прекращаться, и определение выходного значения FiO2, исходя из мгновенного управляющего значения, накопленного управляющего значения, прогнозного управляющего значения и эталонной концентрации вдыхаемого кислорода может возобновляться, как только обнаруживается достоверное SpO2.
[163] Кроме того, способ автоматического управления подачей вдыхаемого кислорода может дополнительно включать в себя:
(a) прием сигнала, представляющего частоту дыхания;
(b) при этом мгновенное управляющее значение формируется дополнительно по частоте дыхания.
[164] В некоторых вариантах осуществления частота дыхания может записываться абдоминальным датчиком, связанным с респираторным монитором, из которого, при каждом обнаруженном спонтанном дыхании, в автоматизированный контроллер может направляться цифровой импульс через аналого-цифровой преобразователь.
[165] Возможна идентификация эпизодов дыхательной паузы (например, прекращения дыхания на 5-15 секунд или прекращения дыхания на любой подходящий период времени, достаточный для прогнозирования вероятного эпизода гипоксии) и апноэ (например, длительнее, чем 15 секунд или длительнее любого подходящего периода времени, достаточного для прогнозирования вероятного эпизода гипоксии).
[166] Значение Kp можно корректировать по данному дополнительному входному сигналу.
[167] Например, дыхательная пауза может приводить к удвоению Kp в течение некоторого периода времени (например, 30 секунд или любого подходящего периода времени) после прекращения дыхания. Благодаря данной регулировке, автоматизированный контроллер более чувствительно реагирует на эпизод гипоксии, если таковой происходит. Если дыхательная пауза продолжается вплоть до очевидного апноэ, то FiO2 также может быть временно увеличено на 2-8% пропорционально базовому значению Kp.
[168] Кроме того, способ автоматического управления подачей вдыхаемого кислорода может дополнительно включать в себя:
(a) прием сигнала, представляющего давление в контуре;
(b) при этом мгновенное управляющее значение формируется дополнительно по давлению в контуре.
[169] Для младенцев с респираторной поддержкой постоянным положительным давлением в воздушных путях (CPAP), давление в патрубке вдоха контура CPAP может измеряться и вводиться в виде цифрового сигнала.
[170] Например, снижение давления в контуре до уровней ниже некоторой процентной части (в том числе, любого значения от 20% до 50%) от постоянного высокого значения может приводить к удвоению Kp и, через 30 секунд, включению тревожного сигнала, представляющего снижение давления в контуре. Полная потеря давления в контуре (<1 см H2O, т.е. когда никакого давления, по существу, не нагнетается) может включать тревожный сигнал высокого уровня, представляющий потерю давления в контуре.
[171] В некоторых вариантах осуществления способ может дополнительно включать в себя:
прием ввода ручного управления в обход автоматики;
определение выходного значения FiO2, исходя из ввода ручного управления в обход автоматики, вместо управляющих значений.
[172] Кроме того, устройство 10 управления может иметь режим автоматического управления и режим ручного управления, и из режима автоматического управления может выполняться переключение в режим ручного управления в обход автоматики, при некоторых введенных пользователем данных (т.е. вводов ручного управления) и последующее обратное переключение в автоматический режим, при необходимости.
[173] Например, пользователь (например, персонал, ухаживающий за лежачими пациентами) может переключать устройство 10 управления в режим ручного управления, чтобы контроллер 11 больше не создавал изменений выходного значения FiO2, и оксигенация была целиком под ручным управлением.
[174] Режим ручного управления может быть выбран посредством ввода ручного управления в обход автоматики на пользовательском интерфейсе, отображаемом на дисплее 14 пользовательского интерфейса. Данный выбор может быть либо в виде временного останова (например, длительностью 30 секунд) функционирования контроллера, вносящего изменения в FiO2, либо в виде постоянной ручной работы до отмены выбора.
[175] Режим ручного управления можно также выбрать поворотом дискового переключателя FiO2 на автоматизированном воздушно-кислородном смесителе, т.е. подачей ввода ручного управления в обход автоматики для запуска останова автоматического управления (например, останова на 30 секунд или любой выбранный подходящий период времени).
[176] При первой итерации после останова, т.е. возврата из режима ручного управления, подынтегральная функция может регулироваться так, чтобы выходное значение FiO2 установилось равным текущему (т.е. выбранному пользователем) значению FiO2 сервоуправления, с возобновлением после этого автоматического управления.
[177] Фиг. 9 изображает процесс 900, выполняемый контроллером 11, по переключению между ручным режимом и режимом автоматического управления.
[178] Как показано на фиг. 9, во-первых, на этапе S902 выполняется тест для определения, был ли вручную переведен ввод FiO2 сервоуправления, т.е. принимался ли ввод ручного управления в обход автоматики. Если да, то на этапе S904 начинается режим ручного управления в обход автоматики. Если ввод FiO2 сервоуправления не переводился вручную, то логическая схема переходит на этап S906, чтобы определить, истекло ли ограниченное время режима ручного управления. Если ограниченное время режима ручного управления истекло, то тогда устройство 10 управления устанавливается на возвращение в режим автоматического управления на этапе S908. Если ограниченное время режима ручного управления не истекло, то процесс 900 заканчивается.
[179] Кроме того, в некотором состоянии во время автоматического управления могут включаться один или более тревожных сигналов.
[180] Например, в устройстве 10 управления могут содержаться тревожные сигналы (например, звуковые и/или визуальные тревожные сигналы), предупреждающие персонал, ухаживающий за лежачими пациентами, о необходимости быстро повысить FiO2, достижении максимального ΔFiO2, отсутствии или недействительном сигнале SpO2 в течение >30 сек и >2 мин, длительном апноэ или потере давления в контуре и неправильном функционировании системы. Данные тревожные сигналы могут добавляться к, объединяться с, или подменять тревожные сигналы, установленные в стандартных прикроватных мониторах в неонатальном отделении интенсивной терапии (NICU).
[181] Фиг. 10 изображает процесс 1000, выполняемый контроллером 11, по управлению тревожными сигналами на основании контроля различных вышеописанных сигналов.
[182] Как показано на фиг. 10, на этапе S1002 выполняется процесс включения тревожных сигналов с применением следующих этапов:
(a) Если тревожный сигнал: «отсутствующий сигнал»=истина, то включить тревожный сигнал отсутствия сигнала.
(b) Если тревожный сигнал: «гипоксия»=истина, то включить тревожный сигнал гипоксии.
(c) Если тревожный сигнал: «снижение давления в контуре»=истина, то включить тревожный сигнал снижения давления в контуре.
(d) Если тревожный сигнал: «потеря давления в контуре»=истина, то включить тревожный сигнал потери давления в контуре.
(e) Если тревожный сигнал: «несоответствие сервоуправления FiO2»=истина, то включить тревожный сигнал несоответствия сервоуправления FiO2.
(f) Если тревожный сигнал: «ошибка FiO2 сервоуправления»=истина, то включить тревожный сигнал ошибки FiO2 сервоуправления.
(g) Если тревожный сигнал: «несоответствие измеренного FiO2»=истина, то включить тревожный сигнал несоответствия измеренного FiO2.
(h) Если тревожный сигнал: «ошибка измеренного FiO2»=истина, то включить тревожный сигнал ошибки измеренного FiO2.
(i) Если тревожный сигнал: «соответствие искомому диапазону»=истина, то включить тревожный сигнал соответствия искомому диапазону.
[183] После этого, процесс 1000 переходит на этап S1004, на котором тревожные сигналы сбрасываются с использованием следующих этапов:
(a) Если тревожный сигнал отсутствия сигнала сбрасывается, то тревожный сигнал («отсутствующий сигнал»)=ложь.
(b) Если тревожный сигнал гипоксии сбрасывается, то тревожный сигнал («гипоксия»)=ложь.
(c) Если тревожный сигнал снижения давления в контуре сбрасывается, то тревожный сигнал («снижение давления в контуре»)=ложь.
(d) Если тревожный сигнал потери давления в контуре сбрасывается, то тревожный сигнал («потеря давления в контуре»)=ложь.
(e) Если тревожный сигнал FiO2 сервоуправления сбрасывается, то тревожный сигнал («несоответствие FiO2 сервоуправления»)=ложь.
(f) Если тревожный сигнал высокого уровня FiO2 сервоуправления сбрасывается, то тревожный сигнал («ошибка FiO2 сервоуправления»)=ложь.
(g) Если тревожный сигнал измеренного FiO2 сбрасывается, то тревожный сигнал («несоответствие измеренного FiO2»)=ложь.
(h) Если тревожный сигнал высокого уровня измеренного FiO2 сбрасывается, то тревожный сигнал («ошибка измеренного FiO2»)=ложь.
(i) Если тревожный сигнал соответствия искомому диапазону сбрасывается, то тревожный сигнал («соответствие искомому диапазону»)=ложь.
[184] После окончания этапа S1004, процесс 1000 заканчивается.
[185] Кроме того, как описано выше, устройство 10 управления может дополнительно включать в себя дисплей 14 пользовательского интерфейса, который отображает пользовательский интерфейс, представляющий различную информацию для пользователя (например, медицинского работника, ухаживающего за лежачим пациентом) и принимающий команды, вводимые пользователем на пользовательском интерфейсе. Принятые введенные пользователем данные передаются затем в контроллер 11.
[186] Один пример пользовательского интерфейса 200, отображаемого на дисплее 14 пользовательского интерфейса, изображен на фиг. 11. Пользовательский интерфейс 200 может включать в себя:
(a) область A01 цифрового отображения SpO2/FiO2, отображающую самое последнее входное значение SpO2 и самое последнее выходное значение FiO2;
(b) область A02 графического отображения SpO2/FiO2, графически отображающая тренд входных значений SpO2 и выходных значений FiO2;
(c) область A03 выбора типа оксигемометра, предназначенная для выбора пользователем типа оксигемометра, используемого для формирования сигнала SpO2;
(d) область A04 установки искомого диапазона SpO2 для отображения и предоставления пользователю возможности изменения искомого диапазона SpO2 в реальном времени;
(e) область A05 установки максимального значения ΔFiO2 для указания и предоставления пользователю возможности изменять ограничение значения ΔFiO2в реальном времени;
(f) кнопка B06 режима ручного управления, нажатием которой устройство 10 управления можно переключать между режимом автоматического управления и режимом ручного управления;
(g) кнопка B07 включения/выключения, нажатием которой можно включать или выключать устройство 10 управления;
(h) область A08 отображения состояния, отображающая рабочее состояние устройства 10 управления, которое может включать в себя отображение визуальной тревожной информации в некоторых условиях;
(i) область A09 отображения эталонных значений FiO2, отображающая самые последние значения для rFiO2;
(j) область A10 отображения времени эпоксии, отображающая пропорцию времени пребывания в состоянии эпоксии;
(k) область A11 указания обратной связи по FiO2, указывающая, согласуется ли FiO2 сервоуправления или измеренное FiO2 с выходным значением FiO2, например, посредством светоиндикатора;
(l) область A12 указания достоверного значения SpO2, указывающая, является входное значение SpO2 достоверным, например, посредством светоиндикатора; и
(m) области A13 и A14 указания дополнительных входных сигналов, указывающие, соответственно, введены ли сигналы, представляющие частоту дыхания и давление в дыхательном контуре в устройство 10 управления, например, посредством светоиндикаторов.
[187] Общий процесс управления с применением способа автоматического управления подачей вдыхаемого кислорода, выполняемого контроллером 11 в соответствии с некоторыми вариантами осуществления, изображен с использованием блок-схемы последовательности операций на фиг. 12.
[188] Как показано на фиг. 12, когда процесс управления начался, входные сигналы для устройства 10 управления обрабатываются на этапе S1202.
[189] Фиг. 13 изображает примерные этапы (1300) обработки входных сигналов на этапе S1202: входные сигналы считываются из входного блока (S1302) и затем проверяются (S1304). После проверки входных сигналов выполняется оценка ручного управления в обход автоматики (S1306).
[190] Примерные этапы считывания входных сигналов на этапе S1302 изображены на фиг. 14. Как показано на фиг. 14, на этапе S1402 принимаются входные сигналы, включающие в себя сигналы, представляющие множество входных значений насыщения кислородом (SpO2) для пациента. Входные сигналы могут включать в себя: SpO2,HRpleth, показатель перфузии, плетизмографическую форму сигнала, HRecg, частоту дыхания, давление в контуре CPAP, FiO2 сервоуправления, измеренное FiO2, максΔFiO2max, искомое значение SpO2, целевое время в искомом диапазоне.
[191] Примерные этапы проверки входных сигналов на этапе S1304 изображены на фиг. 15. Сначала, на этапе S1502 выполняется проверка ограничений по вводу, после чего на этапе S1504 обновляется состояние показателя перфузии. Затем на этапе S1506 выполняется иерархическая проверка SpO2. Кроме того, на этапе S1508 могут включаться тревожные сигналы на основании результата иерархической проверки SpO2 и на основании того, отклоняется ли FiO2 сервоуправления или измеренное FiO2 от заданного FiO2 сверх допустимых пределов (1 и 2%, соответственно).
[192] Включение тревожных сигналов на этапе S1508 может содержать следующие этапы:
(a) Если сигнал SpO2 имеет уровень 1 или уровень 3 в течение >30 сек,
то тревожный сигнал: «отсутствующий сигнал»=истина.
Если сигнал SpO2 имеет уровень 1 или уровень 3 в течение >2 мин,
то увеличить громкость тревожного сигнала: «отсутствующий сигнал» с сообщением об ошибке, чтобы проверить датчик оксигемометра и соединения
(b) Если |(заданное FiO2 - FiO2 сервоуправления)/(заданное FiO2)|>1%,
то тревожный сигнал: «несоответствие сервоуправления FiO2»=истина.
Если |(заданное FiO2 - FiO2 сервоуправления)/(заданное FiO2)|>5%,
то тревожный сигнал: «ошибка FiO2 сервоуправления»=истина, и ManualMode (ручной режим)=истина;
(c) Если |(заданное FiO2 - FiO2 сервоуправления)/(заданное FiO2)|>2%,
то тревожный сигнал: «несоответствие измеренного FiO2»=истина.
Если |(заданное FiO2 - FiO2 сервоуправления)/(заданное FiO2)|>10%,
то тревожный сигнал: «ошибка измеренного FiO2»=истина, и ManualMode (ручной режим)=истина.
[193] Кроме того, фиг. 16 изображает примерные этапы проверки ограничений по вводу на этапе S1502.
[194] Как показано на фиг. 16, сначала, на этапе S1602 устанавливают достоверные ограничения по вводу. Например, достоверные ограничения по вводу для IB(1)-IB(9) можно установить следующим образом:
(IB1) SpO2: 0<=SpO2<=100%
(IB2) HRpleth: 0<=HRpleth<=300 ударов/мин
(IB3) Показатель перфузии: 0<=Показатель перфузии<=10
(IB4) Плетизмографическая форма сигнала: 0<=Плетизмографическая форма сигнала<=5 В
(IB5) HRecg: 0<=HRecg<=300 ударов/мин
(IB6) Частота дыхания: 0<=Частота дыхания<=150/мин
(IB7) Давление в контуре CPAP: 0<=Давление в контуре CPAP<= 20 см H2O
(IB8) FiO2 сервоуправления:21%<=FiO2 сервоуправления<=100%
(IB9) Измеренное FiO2: 21%<=Измеренное FiO2<=100%
[195] Затем, по циклу на этапах S1604, S1608 и S1616 осуществляется определение для решения о том, выходит ли входное значение каждого IB(i) за пределы достоверного ограничения по вводу. Если нет, то цикл переходит к определению следующего IB(i). Если да, то логическая схема переходит на этап S1610, на котором используется последнее достоверное значение для IB(i), вместо текущего IB(i). После этапа S1610 выполняется тест для определения, произошло ли превышение времени ожидания (S1612). Если да, то устанавливается признак ITO(i) превышения времени ожидания ввода (S1614), и логическая схема переходит на этап S1616, чтобы обрабатывать следующее IB(i) или закончить оценку ограничений по вводу.
[196] После того, как все IB(i) проверены, логическая схема переходит на этап S1618 для определения, следует ли включать тревожный сигнал на основании текущего давления в контуре CPAP, например, с применением следующих этапов:
a. Проверить, что давление в контуре находится в пределах диапазона:
если давление в контуре CPAP <50% от постоянного высокого значения,
то давление в контуре CPAP =низкое
(т.е., если давление в контуре ниже 50% от постоянного высокого значения, то такое давление в контуре следует определить как низкое);
если давление в контуре CPAP <1 см H2O,
то давление в контуре CPAP =потеряно.
(т.е., если давление в контуре ниже 1 см H2O от постоянного высокого значения, то такое давление в контуре следует определить как полностью отсутствующее);
b. Включить тревожные сигналы по давлению в контуре CPAP:
если давление в контуре CPAP является низким в течение >30 секунд,
включить тревожный сигнал: «снижение давления в контуре»
(т.е. если давление в контуре было ниже 50% в течение более, чем 30 секунд, включить тревожный сигнал).
[197] Обновление состояния показателя перфузии на этапе S1504 может применять вышеописанный процесс, изображенный на фиг. 6.
[198] Иерархическая проверка SpO2на этапе S1506 может применять вышеописанный процесс, изображенный на фиг. 7.
[199] Оценка ручного управления в обход автоматики на этапе S1306 может применять вышеописанный процесс, изображенный на фиг. 9.
[200] После обработки входных сигналов на этапе S1202 выполняется автоматическое управление (S1204), с вычислением значений FiO2, исходя из входных значений SpO2.
[201] Фиг. 17 изображает примерные этапы автоматического управления на этапе S1204. Как показано на фиг. 17, после того, как начинается автоматическое управление, сначала выполняется периодический адаптивный процесс (S1702).
[202] Примерные этапы периодического адаптивного процесса на этапе S1702 представлены посредством блок-схемы последовательности операций на фиг. 18. Как изображено на фиг. 18, периодический адаптивный процесс может включать в себя обновление опорного значения FiO2 (S1802) и анализ рабочих параметров (S1804), которые могут применять примерный процесс, изображенный на фиг. 5 и фиг. 4 (описанный выше в настоящей заявке), соответственно.
[203] После периодического адаптивного процесса на этапе S1702, формируются ПИД-компоненты на этапе S1704. На этапе S1704 может быть применен примерный вышеописанный процесс, изображенный на фиг. 3.
[204] На этапе S1706 вычисляется выходное значение FiO2, исходя из ПИД-компонентов, значения rFiO2 и достоверности входного значения SpO2. Для вычисления выходного значения FiO2 на этапе S1706 может применяться примерный вышеописанный процесс, изображенный на фиг. 8.
[205] На этапе S1708 определяется, переключено ли устройство в ручной режим. Если обнаружено, что устройство было переключено в ручной режим, то выходное значение FiO2 устанавливается равным значению FiO2, выбранному пользователем (например, персоналом, ухаживающим за лежачими пациентами).
[206] На этапе S1710, процесс управления определяет, требуется ли включить один или множество тревожных сигналов и соответственно управляет тревожным(и) сигналом(ами). На этапе S1710 может быть принят примерный процесс, изображенный на фиг. 10 (описанный ранее).
[207] Как показано на фиг. 12, после этапа S1204, вычисленное значение FiO2устанавливается как выходное значение и передается в выходной блок (S1206), и процесс управления обновляет дисплей, чтобы отразить обновленные данные (S1208), например, отобразить данные, включающие в себя принятое входное значение SpO2и обновленные выходные значения.
[208] После обновления дисплея, процесс управления определяет, обнаружены ли введенные пользователем данные, которые дают команду выйти из режима автоматического управления (S1210). Если нет, то процесс управления снова переходит на этап S1202, чтобы повторить S1202-S1210. Если обнаружены введенные пользователем данные, выдающие команду выйти из режима автоматического управления, то процесс управления заканчивается.
[209] Кроме того, хотя способ автоматического управления подачей вдыхаемого кислорода в некоторых вариантах осуществления, описанных выше в настоящей заявке, выполняется устройством 10 управления, способ можно также реализовать в программном обеспечении; аппаратном обеспечении; микропрограммном обеспечении; некоторой комбинации программного обеспечения, аппаратного обеспечения и/или микропрограммного обеспечения; и/или других механизмах. Например, способ может выполняться компьютером или микрокомпьютером, выполняющим этапы в машиночитаемом коде, например, сформированным с использованием средств кодирования. Программное обеспечение может быть также интегрировано или установлено в устройство управления, оксигемометр или устройство респираторной поддержки. Сигналы, описанные в настоящей заявке, являются электронными сигналами, и сохраняемые значения сохраняются в энергонезависимом запоминающем устройстве с электронной выборкой.
[210] В настоящей заявке описано устройство для автоматического управления подачей вдыхаемого кислорода.
[211] Устройство включает в себя: входной блок, принимающий сигналы, представляющие множество входных значений насыщения кислородом (SpO2) пациента; память, записывающую принятые входные значения SpO2; контроллер, вычисляющий выходные значения концентрации вдыхаемого кислорода (FiO2), исходя из входных значений SpO2; и выходной блок, выводящий вычисленные выходные значения FiO2.
[212] Контроллер формирует управляющие значения, исходя из входных значений SpO2 и искомого значения SpO2; и формирует выходные значения FiO2, исходя из управляющих значений и опорных значений концентрации вдыхаемого кислорода (rFiO2). Как описано ранее, управляющие значения включают в себя: мгновенные управляющие значения, сформированные, исходя из входных значений SpO2, искомого значения SpO2 и мгновенного коэффициента передачи; накопленные управляющие значения, сформированные, исходя из входных значений SpO2, искомого значения SpO2 и накопленного коэффициента передачи; и прогнозные управляющие значения, сформированные, исходя из входных значений SpO2, искомого значения SpO2 и прогнозного коэффициента передачи; при этом мгновенный коэффициент передачи вычисляется, исходя из значения rFiO2; и причем к накопленному управляющему значению применяется нелинейное взвешивание компенсации, исходя из предварительно заданной нелинейной зависимости между парциальным давлением кислорода (PaO2) в артериальной крови и SpO2
[213] Например, устройство может иметь такую конфигурацию, как устройство 10 управления, показанное на фиг. 2.
[214] В настоящей заявке описана система для автоматического управления подачей вдыхаемого кислорода. Система включает в себя: одно или множество устройств контроля насыщения кислородом и одно или множество устройств управления вдыхаемым кислородом; устройство управления; и сеть, допускающую взаимодействие между одним или множеством устройств контроля насыщения кислородом и устройством управления, и взаимодействие между одним или множеством устройств управления вдыхаемым кислородом и устройством управления.
[215] Устройство управления управляет подачей вдыхаемого кислорода посредством: приема сигналов, представляющих множество входных значений насыщения кислородом (SpO2) для пациента, от каждого из одного или множества устройств контроля насыщения кислородом по сети; формирования управляющих значений, исходя из входных значений SpO2 и искомого значения SpO2; формирования выходных значений концентрации вдыхаемого кислорода (FiO2), исходя из управляющих значений и опорных значений концентрации вдыхаемого кислорода (rFiO2); и передачи вычисленных выходных значений FiO2 в соответствующее устройство управления вдыхаемым кислородом по сети. Как описано ранее, управляющие значения включают в себя: мгновенные управляющие значения, сформированные, исходя из входных значений SpO2, искомого значения SpO2 и мгновенного коэффициента передачи; накопленные управляющие значения, сформированные, исходя из входных значений SpO2, искомого значения SpO2 и накопленного коэффициента передачи; и прогнозные управляющие значения, сформированные, исходя из входных значений SpO2, искомого значения SpO2 и прогнозного коэффициента передачи; при этом мгновенный коэффициент передачи вычисляется, исходя из значения rFiO2; и причем к накопленному управляющему значению применяется нелинейное взвешивание компенсации, исходя из предварительно заданной нелинейной зависимости между парциальным давлением кислорода (PaO2) в артериальной крови и SpO2.
[216] Таким образом, устройство управления можно применять в сети с одной или более пар устройств контроля насыщения кислородом и устройств управления вдыхаемым кислородом, подключенным к сети. Данный подход может допускать автоматическое управление в реальном времени работой в удаленных местах и может допускать сбор данных в широких масштабах. Центральное устройство управления может также упростить регулировку или модификацию процесса управления.
ПРИМЕРЫ
[217] Ниже описаны примерные эксперименты, охватывающие способы автоматического управления подачей вдыхаемого кислорода, и соответствующие экспериментальные результаты.
Первый пример
Способ
[218] В первом примере пропорционально-интегрально-дифференциальный (ПИД-) контроллер был усовершенствован посредством (i) компенсации нелинейной зависимости SpO2-PaO2, (ii) адаптации к степени тяжести легочной дисфункции, и (iii) уменьшения погрешностей в пределах искомого диапазона.
[219] Способ управления подачей кислорода осуществили в автономном устройстве, состоящем из платформы обработки информации (носимого персонального компьютера), устройств ввода и вывода, сервоуправляемого воздушно-кислородного смесителя и пользовательского интерфейса, отображаемого на экране компьютера. Управляющие команды записывались в графическом языке программирования (LabVIEW 2010, National Instruments, Austin, USA) и загружались в носимый персональный компьютер как машиночитаемые команды.
[220] Команды обеспечивали пропорционально-интегрально-дифференциальный (ПИД-) контроллер. При ПИД-управлении, погрешность определялась как отклонение обработанного сигнала от заданного значения, и значение обрабатываемого выходного сигнала в каждый момент времени пропорционально погрешности, ее интегралу и производной, при отличающемся коэффициенте умножения в каждом случае (Kp, Ki, Kd). В данном случае, погрешность (e) равнялась численной разности между входящим значением для SpO2 (в предположении достоверного сигнала) и средней точкой выбранного искомого диапазона (например, искомый диапазон 91-95%, средняя точка 93%). Подынтегральная функция (
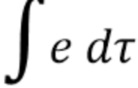

ΔFiO=Kp×e+Ki×
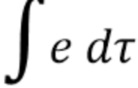

Заданное FiO2=ΔFiO2+rFiO2. (уравнение 5)
[221] Процесс ПИД-управления находился внутри цикла, выполняющего итерацию каждую секунду, позволяющую вносить изменения в FiO2 с 1-секундными интервалами, при необходимости. Диапазоны значений Kp, Ki и Kd получали из широких исследований методом моделирования. Значения Kp, Ki и Kd, использованные в примере, равнялись: Kp -1; Ki -0,0125; Kd -1. Значение Kp можно адаптировать соответственно степени тяжести легочной дисфункции в пределах диапазона от -0,5 до -1 (смотри ниже).
[222] ПИД-контроллер подвергали модификациям для учета некоторых специфических особенностей управляемой системы. Погрешность, связанную со значениями SpO2 в пределах искомого диапазона, уменьшали умножением на дробный множитель, пропорциональный удалению от средней точки искомого диапазона (ослабление в искомом диапазоне). Кроме того, с учетом относительной неточности контроля SpO2 при значениях меньше, чем 80%, отрицательную погрешность ограничивали уровнем 13%. Данные регулировки погрешности применяли для вычисления только пропорционального компонента.
[223] Ряд модификаций внесли также в обработку интегрального компонента. С учетом того, что интегральный компонент постепенно наращивает FiO2 в случае непрерывной гипоксии, его величину ограничивали так, чтобы ограничить максимальное значение ΔFiO2 уровнем на 40% выше rFiO2. При гипероксии (SpO2 выше искомого диапазона, когда подается дополнительный кислород), которая может следовать за эпизодом гипоксии, например, при «проскоке», погрешность при высоких значениях SpO2 не пропорциональна вероятному отклонению PaO2 от допустимого значения (фиг. 19).
[224] Для решения данной проблемы применили компенсацию методом Северингхауса, в соответствии с которым, во время гипероксии, пока интегральный компонент оставался положительным (т.е. проявляющим тенденцию к повышению ΔFiO2), входящие положительные погрешности умножали на множитель погрешности (смотри таблицу 2 ниже). При вычислении интегрального компонента, положительные погрешности SpO2 умножали на множитель погрешности, пока интегральный компонент не сводили к нулю. Значения множителя погрешности получали из уравнения Северингхауса. В воздухе помещения, последовательные значения SpO2, превышающие искомый диапазон, больше не считали непрерывной гипероксией, и интегральный компонент не изменяли.
[225] Таблица 2. Множитель погрешности для положительных погрешностей SpO2
[226] Вычисление дифференциального компонента при гипероксии также корректировали так, чтобы отрицательный наклон SpO2 обнулялся (т.е. становился =0), если все 5 самых последних значений SpO2 превышали заданное значение. Тем самым устраняли повышающее воздействие на ΔFiO2 со стороны дифференциального компонента при гипероксии.
[227] Исследовали адаптивный подход, при котором Kp корректировали соответственно степени тяжести легочной дисфункции посредством умножения на масштабирующий коэффициент, пропорциональный текущему rFiO2. Коррекцию Kp осуществляли умножением постоянного значения Kp на коэффициент в диапазоне от 0,5 до 1,0 для rFiO2 в соответствующем диапазоне от 21% до 40%. Адаптация Kp приведенным способом подтверждает обратно пропорциональную зависимость между коэффициентом передачи и степенью тяжести заболевания легких, которая наблюдалась в данной группе.
[228] Первичный входной сигнал в процесс управления, SpO2, может отбираться из любого оксигемометра, осуществляющего вывод данных в аналоговой или цифровой форме. Для предклинического испытания, SpO2 получали путем моделирования оксигенации у недоношенного новорожденного. Выходной сигнал процесса управления может передаваться в любое устройство, которое может принимать и исполнять искомое значение FiO2, в том числе, воздушно-кислородные смесители и механические вентиляторы. Для предклинического испытания, выходное значение FiO2 передавалось в устройство моделирования оксигенации.
Предклиническое испытание
[229] Исследовали вклад трех совершенствующих признаков. Рабочие параметры всех сочетаний ПИД-управления с a) компенсацией Северингхауса, b) адаптацией Kp и c) ослаблением в искомом диапазоне оценивали с использованием моделирования оксигенации. Запись FiO2 и SpO2 с частотой 1 Гц (длительностью ~24 часов) от каждого из 16 недоношенных новорожденных, получающих терапию постоянным положительным давлением в воздушных путях, преобразовали в серию значений для отношения вентиляция-перфузия (
[230] Для каждой из 16 последовательностей SpO2, сформированных в течение моделирования, вычисляли пропорции времени пребывания в следующих состояниях оксигенации: SpO2 в искомом диапазоне, эпоксия (SpO2 в искомом диапазоне или выше искомого диапазона, в воздухе помещения), SpO2<80%, <85%, ниже и выше искомого диапазона, >96% при подаче кислорода и >98% при подаче кислорода. Частоту длительных эпизодов гипоксии (SpO2<85%) и гипероксии (SpO2>96% при подаче кислорода) идентифицировали, как и частоту проскоков SpO2, определяемых как показания SpO2 выше искомого диапазона в течение, по меньшей мере, 60 сек на протяжении 2 минут после эпизода гипоксии с SpO2<85%. Нестабильность SpO2 оценивали с использованием коэффициента вариации (CV) SpO2 и частоты и средней длительности эпизодов за пределами искомого диапазона. Упомянутые данные обобщали как медианное значение и интерквартильный диапазон (IQR), отличный от проскока SpO2, при этом данные обобщали и выражали в виде единственного значения для каждого процесса управления. Параметры управления оценивали сравнением медианных значений с использованием критерия Фридмана ANOVA с непараметрическими повторяющимися измерениями (с апостериорным критерием Данна). Сравнения ограничивали для упрощения следующими группами: a) ПИД-управление с одним или без одного фактора усовершенствования (компенсации Северингхауса/адаптации Kp/ослабления в искомом диапазоне); b) усовершенствованное ПИД-управление с изъятием или без изъятия одного фактора усовершенствования; c) сравнение ПИД-управления/усовершенствованного ПИД-управления/ПИД-управления с 30-сек блокировкой/ПД-управления. Формировали также сводные данные, относящиеся к назначению искомого SpO2 посредством ручного управления на основании исходных записей, но статистические сравнения не выполнялись, с учетом отличающегося искомого диапазона SpO2 (88-92%).
Результаты
[231] Записи, использованные при моделировании, поступали от 16 недоношенных новорожденных с медианным гестационным возрастом при рождении 30,5 недель (IQR 27,5-31 недель), весом тела при рождении 1320 (910-1860) граммов и послеродовым возрастом 2,0 (0-5,3) дней. Младенцы характеризовались значительной степенью нестабильности SpO2, эпизодами гипоксии (SpO2<80), случающими с частотой 3,1 (1,6-9,9) эпизодов каждые 4 часа. Во время записи, уровень давления CPAP составлял 7,0 (6,5-8,0) см H2O, и базисное значение FiO2 было 0,28 (0,25-0,31), с базисным диапазоном FiO2 от 0,21 до 0,61. После исключения отсутствующих данных SpO2, записи имели длительность 22 (20-26) часа.
[232] При испытании методом моделирования проявилась дополнительная функция разных компонентов ПИД-контроллера. Раздельное добавление адаптации Kp и ослабления в искомом диапазоне в ПИД-контроллер совершенствовало время эпоксии, а добавление компенсации Северингхауса сокращало эпизоды гипероксии (таблицы 3 и 4). В общем, рабочие параметры ПИД-контроллера со всеми 3 средствами оптимизации превосходили другие комбинированные устройства. Без ослабления в искомом диапазоне, время эпоксии обычно становится больше, чем для полностью усовершенствованного ПИД-управления (таблица 3). Эпизоды гипоксии и гипероксии наиболее эффективно устранялись без адаптации Kp (таблица 4). Исключение компенсации Северингхауса из усовершенствованного контроллера минимизировало гипоксию, но предсказуемо приводило к увеличению времени эпизодов гипероксии (таблицы 3 и 4). Усовершенствованный контроллер действовал лучше во всех отношениях, чем контроллер с 30-секундным периодом блокировки после каждого изменения FiO2, и значительно лучше, чем ПД-контроллер (таблицы 3 и 4).
[233] Стабильность записи SpO2 также значительно изменялась при разных сочетаниях совершенствующих признаков (таблица 5). Значения CV для SpO2 в записях отражали, в общем, нестабильность, наблюдаемую в отдельных примерах (например, при исключении адаптации Kp из усовершенствованного контроллера). Коэффициент вариации (CV) SpO2 минимизировали с помощью усовершенствованного контроллера (и нескольких других комбинированных устройств), предлагающих относительную стабильность в данных обстоятельствах. Как ПИД-управление с 30-секундной блокировкой, так и ПД-управление приводили к снижению стабильности, с более длительными эпизодами с отклонением выше и ниже искомого диапазона (таблица 5).
[234] Отдельное добавление каждого совершенствующего признака в ПИД-контроллер доставляло выгоду. Усовершенствованный контроллер обладал более высокими комплексными рабочими параметрами, чем ПИД-контроллер с меньшим числом средств оптимизации, при оптимальном сочетании времени пребывания в искомом диапазоне SpO2 и исключения гипоксии и гипероксии. Данный контроллер действовал лучше, чем контроллер с 30-секундной блокировкой, и заметно лучше, чем ПД-контроллер.
[235] Усовершенствованный ПИД-контроллер мог быстро реагировать на отклонения SpO2, с регулировкой FiO2 до одного раза в секунду, при необходимости. Первоначальную реакцию на эпизод гипоксии или гипероксии обеспечивают, в основном, пропорциональный и дифференциальный компоненты, с дополнительным и более умеренными регулировками FiO2, обусловленными интегральным компонентом, пока не восстанавливались нормальные кислородные условия.
[236] По меньшей мере, во время моделирования, усовершенствованный ПИД-контроллер был очень эффективным при смягчении эпизодов длительной гипоксии и гипероксии. Добавление компенсации Севрингхауса в ПИД-контроллер способствовало решению проблемы эпизодов гипероксии (включая проскок), исключение данной компенсации из усовершенствованного контроллера приводило к их повторному появлению.
[237] В итоге, в ходе вышеописанного предклинического испытания с использованием моделирования оксигенации, усовершенствованный контроллер показал высокую эффективность при назначении искомого диапазона SpO2 и исключении экстремальных значений оксигенации.
[238] Таблица 3. Назначение искомого SpO2
Сравнение пропорции времени (% от суммарного времени) пребывания в пределах предварительно заданных диапазонов SpO2. Медианное значение (интерквартильный диапазон). Статистические сравнения в столбцах (Критерий Фридмана ANOVA с апостериорным критерием Данна):aОтличается от b, P<0,05,cОтличается от d;eОтличается от f;gОтличается от h;iОтличается от j;kОтличается от i. ПИД: пропорционально-интегрально-дифференциальный; Kp: пропорциональный коэффициент; SC: компенсация Северингхауса, TRA: подавление в искомом диапазоне.
[239] Таблица 4. Эпизоды гипоксии и гипероксии и проскок
Сравнение частоты непрерывных эпизодов гипоксии и гипероксии (≥30- и≥60-сек длительность) и проскока. Статистические сравнения в столбцах (Критерий Фридмана ANOVA с апостериорным критерием Данна):aОтличается от b, P<0,05,cОтличается от d;eОтличается от f;gОтличается от h; *данные по эпизодам проскока, объединенные для всех 16 записей. Сокращения являются такими же, как в таблице 3; смотри вышеописанные способы по определению проскока.
[240] Таблица 5. Нестабильность SpO2
Показатели нестабильности SpO2. Медианное значение (интерквартильный диапазон). Статистические сравнения в столбцах (Критерий Фридмана ANOVA с апостериорным критерием Данна):aОтличается от b, P<0,05,cОтличается от d;eОтличается от f;gОтличается от h;iОтличается от j; ПИД: пропорционально-интегрально-дифференциальный; Kp: пропорциональный коэффициент; SC: компенсация Северингхауса, TRA: подавление в искомом диапазоне.
Второй пример
Способ
[241] Во втором примере усовершенствованный ПИД-контроллер, представленный в примере 1, был встроен в устройство управления подачей кислорода и испытан путем клинической оценки.
[242] Как показано на фиг. 20, устройство, включающее в себя способ автоматического управления подачей кислорода, было автономным прибором, состоящим из носимого персонального компьютера, автоматизированного воздушно-кислородного смесителя и устройства ввода/вывода данных (USB-6008, National Instruments, Austin, USA), включающего в себя аналого-цифровой (АЦ) преобразователь. Контроллер принимает цифровые входные сигналы из стандартного кардиореспираторного монитора (Dräger Infinity, Dräger Medical Systems Inc, Notting Hill, Australia), содержащие SpO2 (оксигемометрический датчик Masimo, Masimo Corp, Irvine, California), частоту сердечных сокращений, вычисляемую по электрокардиографическому сигналу (HRecg) и плетизмографической частоте сердечных сокращений (HRpleth). Усреднение SpO2 устанавливалось на коротком промежутке (2-4 сек). Значение FiO2 измерялось датчиком в проксимальной ветви дыхательного контура (Teledyne) и вводилось в устройство через АЦ-преобразователь. Искомое значение FiO2, принятое из контроллера, направлялось в сервомотор (модель HS-322HD, Hitec RCD USA, Poway, USA), специально установленный на воздушно-кислородном смесителе (Bird Ultrablender, Carefusion, Seven Hills, NSW), что допускало автоматический поворот дискового переключателя FiO2 смесителя посредством кольцевого механизма с зубчатой передачей. Сервомотор и зубчатая передача обеспечивали достаточный крутящий момент и точность, чтобы допускать выполнение точных и многократных подстроек FiO2 (минимум±0,5%). Сервомотор имел также низкий удерживающий крутящий момент, чтобы диск смесителя можно было поворачивать еще вручную; и такое ручное вмешательство обнаруживалось датчиком положения и приводило к переключению в ручной режим, в котором управление значением FiO2 больше не было автоматическим (смотри ниже). В начале каждого исследования калибровку сервомотора проверяли и, при необходимости, изменяли.
[243] Способ автоматического управления состоял из процесса ПИД-управления со средствами оптимизации при вычислении пропорционального, интегрального и дифференциального компонентов, чтобы согласовать применение ПИД-управления с автоматическим управлением подачей кислорода в недоношенного новорожденного. Средства оптимизации пропорционального компонента включали в себя модуляцию, исходя из степени тяжести легочной дисфункции, уменьшение погрешностей при нахождении в пределах искомого диапазона и ограничение погрешности во время гипоксии. Интегральный компонент средства оптимизации включал в себя ограничение подынтегральной величины, компенсацию нелинейной зависимости PaO2-SpO2 и сдерживание повышения подынтегральной функции в воздухе помещения.
[244] Процесс ПИД-управления происходил внутри цикла, выполняющего итерацию каждую секунду. Таким образом, способ предназначался для обнаружения и реагирования на быстрые изменения оксигенации, которые являются слишком частыми у недоношенных новорожденных. Диапазоны значений ПИД-коэффициентов получали из широких исследований методом моделирования с использованием данных от недоношенных новорожденных, допускающих несколько сочетаний разных значений для всех коэффициентов, подлежащих исследованию. Значения Kp, Ki и Kd, использованные в примере, составляли: Kp -1; Ki -0,0125; Kd -1. Значение Kp можно адаптировать соответственно степени тяжести легочной дисфункции в пределах диапазона от -0,5 до -1.
[245] Нечисловые значения SpO2 трактовались как отсутствующие, как и значения SpO2, при которых значения HRecg и HRpleth различались на >30 ударов/мин. В случае отсутствующих значений SpO2, значение FiO2 удерживали равным текущему значению. Полная функция контроллера восстанавливалась, как только обнаруживался достоверный сигнал.
[246] Во время автоматического управления, персонал, ухаживающий за лежачими пациентами может переключить устройство управления в обход автоматики посредством ручного поворота дискового переключателя FiO2 смесителя. Сигнал о данном ручном переключении в обход автоматики определяется по обнаружению различия между заданным FiO2 и значением FiO2, определяемого датчиком положения в сервомоторе. После ручного переключения в обход автоматики, автоматическое управление восстанавливается с выбранного пользователем значения FiO2 через 30 секунд после последнего ручного изменения FiO2. Устройство может быть также зафиксировано в режиме ручного управления исследовательской группой или по команде от персонала, ухаживающего за лежачими пациентами, при необходимости.
Клиническое испытание
[247] Исследование проводили в неонатальном и педиатрическом отделении интенсивной терапии больницы Royal Hobart. Отделение обеспечивает уход за ~70 недоношенными новорожденными с гестационным возрастом <32 недель ежегодно и обычно применяет неинвазивную респираторную поддержку во всех возможных случаях для данной группы пациентов, включая поддержку постоянным положительным давлением в воздушных путях (CPAP) и высокопоточными назальными канюлями (HFNC). Искомый диапазон SpO2 для подбора кислородной терапии уточнен до 90-94%, а ранее составлял 88-92%.
[248] Недоношенные новорожденные с гестационным возрастом <37 недель и в возрасте <4 месяцев подходили для исследования, если получали неинвазивную респираторную поддержку (CPAP или HFNC) и получали дополнительный кислород вначале периода исследования. Младенцы с острой нестабильностью или врожденными аномалиями (включая пороки сердца, отличающиеся от персистирующего артериального протока) исключались.
[249] Данное исследование было проспективным интервенционным исследованием 4-часового периода автоматического управления подачей кислорода, который сравнивали с двумя граничащими периодами стандартного ручного управления, составляющими в сумме 8 часов (по 4 часа до и после автоматического управления). Между периодами исследования был 15-минутный интервал для исключения переходящих эффектов. Исследовательский персонал дежурил в течение периода автоматического управления, но не взаимодействовал с клиническим персоналом, ухаживающим за лежачими пациентами, пока клиническая система не давала сбоя. Во время автоматического управления, лица, осуществляющие уход, могли переключать в обход автоматики выход устройства управления на специализированный воздушно-кислородный смеситель, применяемый при исследовании, посредством поворота диска смесителя. Во время записей ручного управления, медицинский персонал, ухаживающий за лежачим пациентом, инструктировали применять его обычный метод назначения искомого SpO2, при стандартном искомом диапазоне SpO2 (90-94%). С учетом предыдущих исследований, ожидалось, что, при ручном управлении, назначения приходились бы предпочтительно на верхний конец упомянутого диапазона. При условии, что автоматизированный контроллер задает среднюю точку диапазона SpO2, во время автоматического управления искомый диапазон устанавливался в пределах 91-95%, с расчетом на то, что гистограммы SpO2 в ручном и автоматическом режимах будут перекрываться, при одинаковом медианном значении SpO2. Для периодов исследования как ручного, так и автоматического режимов, настройки тревожных сигналов по SpO2 были идентичными, с нижним пределом 89% и верхним пределом 96%.
[250] Перед исследованием оксигемометрического датчика, оксигемометрический датчик помещали в послепротоковое положение и не перемещали в течение 3 периодов исследования, пока не было клинической необходимости или постоянно слабого сигнала SpO2. Периоды ухода планировали так, чтобы, по возможности, не попадать в периоды записи данных. Постоянное значение для эталонного FiO2 (rFiO2) с целью автоматического управления выбирали у каждого младенца, исходя из самой последней базисной дополнительной потребности в кислороде.
[251] Релевантные демографические и клинические данные записывали для каждого младенца, включая срок беременности, вес тела при рождении и детали клинического состояния и уровень респираторной поддержки во время исследования. SpO2 и FiO2 записывали с частотой 1 Гц в течение как ручного, так и автоматического управления. Анализ данных записей позволял оценивать нестабильность SpO2 у каждого младенца по коэффициенту вариации SpO2 и количество и среднюю длительность эпизодов выхода за пределы искомого диапазона. Кроме того, определяли пропорцию времени пребывания в каждом из следующих состояний оксигенации: SpO2 в искомом диапазоне, эпокция (SpO2 в искомом диапазоне или выше искомого диапазона в воздухе помещения), SpO2 в диапазоне выдачи тревожного сигнала (89-96%) и SpO2<80%, 80-84%, 85-88%, 97-98% при подаче кислорода и >98% при подаче кислорода. При вычислении упомянутых значений, делителем было рабочее время после исключения данных в периоды отсутствующего сигнала SpO2. Определяли частоту длительных эпизодов гипоксии и гипероксии, а также частоту проскоков SpO2, определяемых как показания SpO2 выше искомого диапазона в течение, по меньшей мере, 60 сек на протяжении 2 минут после эпизода гипоксии с SpO2 <85%. Определяли количество регулировок FiO2 (изменений измеряемого FiO2 на 1% или больше) в течение записей в ручном и автоматическом управлении, а также среднюю концентрацию кислорода (среднее FiO2) в каждом случае.
[252] Данные выражали в виде медианного значения и интерквантильного диапазона (IQR), если не оговаривается иное. Сравнения между периодами автоматического и ручного управления выполняли с использованием теста согласованных пар Уилкоксона. Для данных анализов, данные из обоих периодов ручного управления объединяли, но, дополнительно, для сравнения также использовали период наилучшего ручного управления для каждого младенца (т.е. ручную запись длительности≥2 часов с максимальной пропорцией времени пребывания в состоянии эпоксии). Основным результатом была пропорция времени пребывания в состоянии эпоксии. Назначенный размер выборки для исследования (20 младенцев) основывался, главным образом, на потребности получения первоначальной клинической практики, касающейся работоспособности контроллера и безопасности достаточного числа субъектов. В предыдущем исследовании 45 младенцев авторы настоящей заявки обнаружили, что пропорция времени пребывания в искомом диапазоне, при подаче кислорода, составляла 30±15% (среднее значение±SD (стандартное отклонение)). В предположении подобного стандартного отклонения для разностей между парами автоматических и ручных управляющих значений в настоящем исследовании, выборка из 20 младенцев допускала обнаружение 10% разности времени пребывания в состоянии эпоксии между периодами автоматического и ручного режимов, с 80% статистической мощностью и ошибкой первого рода 0,05.
Результаты
[253] Исследование проводили с мая по декабрь 2015 г. Младенцы, включенные в исследование (n=20) имели медианный гестационный возраст при рождении 27,5 недель (IQR 26-30 недель) и вес тела при рождении 1130 (940-1400) грамм. 15 из 20 младенцев были мальчиками (75%). Младенцев исследовали в послеродовом возрасте 8,0 (1.8-34) дней, скорректированном гестационном возрасте 31 (29-33) постменструальных недель, и весом тела 1400 (1120-1960) г. Для исследованных младенцев, получавших терапию CPAP (n=13), уровень давления в начале записи составлял 6 (5-8) см H2O; для исследованных младенцев, получавших терапию HFNC (n=7), начальный расход составлял 6 (5,5-6,5) л/мин. Отношение числа медсестер к числу пациентов составляло 1:2 во всех случаях.
[254] Данные двух граничащих периодов ручного управления имелись для 18 младенцев, при этом причинами отсутствия записи вторых данных ручного управления (одной в каждом случае) были сбой записи данных и потребность в интубации сразу после автоматического управления. Пропорция отсутствующего сигнала составляла 2,9 (0,5-5,4)%, 1,7 (0,7-3,4)% и 1,5 (0,8-7,1)% в записях первого ручного, автоматического и второго ручного управления, соответственно, что оставляло 3,8 (3,7-4,0), 3,8 (3,7-3,9) и 4,0 (3,8-4,0) часов рабочего времени для анализа.
[255] Фиг. 21A и 21B представляют двухчасовые записи для одного и того же младенца во время ручного и автоматического управления, включая выборочные записи SpO2 (сплошная линия, Y-ось: % насыщения) и FiO2 (штриховая линии, Y-ось: % кислорода) для:
(A) Младенца 5, рожденного в гестационном возрасте 27 недель, исследованного на 40-й день, получающего терапию с высокопоточными назальными канюлями (HFNC) 6 л/мин, с ручным управлением, временем эпоксии 59% (фиг. 21A); и
(B) Младенца 5, с автоматическим управлением, время эпоксии 79%, при автоматическом управлении со значением rFiO2, установленным на 29% в продолжении всего времени, время эпоксии 82% (фиг. 21B).
[256] Фиг. 21A и 21B обнаруживают характерную изменчивость SpO2 во время ручного управления FiO2 (фиг. 21A), которая была менее выраженной во время автоматического управления (фиг. 21B). Примерные данные, представленные на фиг. 21A и 21B демонстрируют быстрые реакции на FiO2, производимые контроллером, и увеличение времени пребывания в искомом диапазоне (показанного серой полосой).
[257] Как показано на фиг. 22 (черные столбики: ручное управление; белые столбики: автоматическое управление, значения T=SpO2 в пределах искомого диапазона, искомый диапазон составляет 90% - 94% для ручного управления, 91% - 95% для автоматического управления), частотные гистограммы объединенных данных SpO2 демонстрирую значительное повышение пропорции времени в пределах искомого диапазона при автоматическом управлении, при этом как гипоксические, так и гипероксические значения представлены меньше, по сравнению с ручным управлением. Назначенный профиль SpO2 во время ручного управления показывал пик кривой на верхнем конце искомого диапазона. Напротив, и как ожидалось, автоматическое управление, ориентировалось на среднюю точку заданного искомого диапазона (т.е. SpO2 93%). При получении дополнительного кислорода, медианное значение SpO2 в объединенных данных составляло 93% как при ручном, так и автоматическом управлении.
[258] Оксигенация была значительно более стабильной во время автоматического управления, с меньшим числом отклонений SpO2 ниже искомого диапазона и ниже 80%, и меньшей длительностью всех эпизодов за пределами искомого диапазона, по сравнению с ручным управлением. Коэффициент вариации SpO2 также значительно отличался (ручное управление: 3,8 (3,2-4,7)%, автоматическое управление: 2,3 (1,8-3,0)%, P <0,0001).
[259] По сравнению с обоими объединенными периодами ручного управления, автоматическое управление имело следствием пребывание в искомом диапазоне и диапазоне эпоксии больше времени на 23% и 25%, соответственно (таблица 6). Время, проведенное в диапазоне выдачи тревожного сигнала (89-96%), также увеличилось. Автоматическое управление заметно сокращало время пребывания при обоих экстремальных значениях оксигенации, практически, исключая гипоксию с SpO2<80% и гипероксию при подаче кислорода с SpO2>98%. Время, проведенное в более мягких диапазонах гипоксии и гипероксии, также сокращалось.
[260] Данные полученные результаты отражались в анализе длительных эпизодов гипоксии и гипероксии ятрогенного характера, которые, и тот и другой, происходили с небольшой частотой во время ручного управления (таблица 7), но заметно реже встречались во время автоматического управления. Эпизоды проскока не отмечались ни в одной из записей автоматического управления.
[261] Как показано на фиг. 23 (отдельные парные значения времени пребывания в эпоксии в наилучшем периоде ручного управления, по сравнению с автоматическим управлением; горизонтальная полоска=медианное значение; эпоксия=SpO2в искомом диапазоне или выше искомого диапазона, с воздухом помещения), при измерении по сравнению с наилучшим из двух периодов ручного управления, сохранялось очевидное преимущество автоматического управления, при этом время пребывания в диапазоне эпоксии составляло 60 (50-72)% и 81 (76-90)% для наилучшего ручного и автоматического управления, соответственно (P<0,001). Кроме того, автоматическое управление соответствовало улучшенному назначению искомого SpO2 при исследовании каждого отдельного пациента, с относительным увеличением времени пребывания в эпоксии от 2,2 до 55% (фиг. 23).
[262] В периоды ручного управления, регулировки FiO2 на, по меньшей мере, 1% выполнялись 2,3 (1,3-3,4) раза в час персоналом, ухаживающим за лежачими пациентами. Во время автоматического управления, сервомотором выполнялись частые минимальные изменения FiO2 0,5% (9,9 изменений/мин, в общем), и изменения измеренного FiO2 на, по меньшей мере, 1% происходили с частотой 64 (49-98) в час. В автоматическом режиме, всего 18 ручных регулировок произведено во время всех 20 записей (0,24 регулировки/час), что показывало уменьшение на 90% от частоты ручных регулировок, наблюдаемых во время ручной регулировки (2,3/час). Максимальное число ручных регулировок для отдельного субъекта во время ручного управления составляло 4 в течение 4-часовой записи (т.е. 1/час). Никаких критических нарушений нормальной работы системы не происходило.
[263] Медианные значения потребности в кислороде (среднее FiO2) составили 27 (25-30)%, 27 (25-30)% и 26 (24-31)% в течение записей для первого ручного, автоматического и второго ручного управлений, соответственно. Потребности в кислороде не различались между записями для режимов автоматического и любого ручного управления (P>0,05, тест согласованных пар Уилкоксона).
[264] В итоге, усовершенствованный ПИД-контроллер показал более высокую эффективность при назначении искомого SpO2, чем обычное ручное управление, с пребыванием на 25% больше времени в искомом диапазоне SpO2. Экстремальные значения оксигенации, в основном, исключались, и практически исключались длительные эпизоды гипоксии и гипероксии. Эффективное управление подачей кислорода достигалось при очень малой доле ручных регулировок вдыхаемого кислорода и воздействии одинаковой концентрацией кислорода.
[265] Таблица 6. Назначение насыщения кислородом (SpO2)
Сравнение пропорции времени (% от всего рабочего времени) в пределах предварительно заданных диапазонов SpO2 во время ручного и автоматического управления. Данные ручного управления из двух граничащих периодов объединены. Медианное значение (интерквартильный диапазон). *Тест согласованных пар Уилкосона.
[266] Таблица 7. Эпизоды гипоксии и гипероксии
Сравнение частоты непрерывных эпизодов гипоксии и гипероксии (30- и 60-сек длительность) между ручным и автоматическим управлением. Данные ручного управления из двух граничащих периодов объединены. Медианное значение (интерквартильный диапазон). *Тест согласованных пар Уилкосона.
[267] Специалистам в данной области техники будут очевидны многочисленные модификации, не выходящие за пределы объема настоящего изобретения, описанного выше со ссылкой на прилагаемые чертежи.
РОДСТВЕННЫЕ ЗАЯВКИ
[268] Первоначально поданное описание следующей родственной заявки целиком включено в настоящую заявку путем отсылки: Предварительная заявка на патент Австралии 2015904621, поданная 10 ноября 2015 г.
Реферат
Группа изобретений относится к медицинской технике, а именно к способу автоматического управления подачей вдыхаемого кислорода, устройству для автоматического управления подачей вдыхаемого кислорода и системе для автоматического управления подачей вдыхаемого кислорода. Способ автоматического управления подачей вдыхаемого кислорода содержит этап, на котором принимают сигналы, представляющие входные значения насыщения кислородом (SpO) для пациента. Способ включает формирование управляющих значений исходя из входных значений SpOи искомого значения SpO. В способе формируют выходные значения концентрации вдыхаемого кислорода (FiO) исходя из управляющих значений и эталонных значений концентрации вдыхаемого кислорода (rFiO). Управляющие значения включают в себя мгновенные управляющие значения, сформированные исходя из входных значений SpO, искомого значения SpOи мгновенного коэффициента передачи. Управляющие значения содержат накопленные управляющие значения, сформированные исходя из входных значений SpO, искомого значения SpOи накопленного коэффициента передачи. Управляющие значение включают в себя прогнозные управляющие значения, сформированные исходя из входных значений SpO, искомого значения SpOи прогнозного коэффициента передачи. Мгновенные управляющие значения вычисляют исходя из значения rFiO. К накопленному управляющему значению применяют нелинейное взвешивание компенсации исходя из предварительно заданной нелинейной зависимости между парциальным давлением кислорода (PaO) в артериальной крови и SpO. Устройство содержит входной блок, принимающий сигналы, представляющие входные значения насыщения кислородом (SpO) для пациента. Устройство имеет память, записывающую принятые входные значения SpO. Устройство включает контроллер, вычисляющий выходные значения концентрации вдыхаемого кислорода (FiO) исходя из входных значений SpO. Устройство содержит выходной блок, выводящий вычисленные выходные значения FiO. Контроллер формирует управляющие значения исходя из входных значений SpOи искомого значения SpOи формирует выходные значения концентрации вдыхаемого кислорода (FiO) исходя из управляющих значений и эталонных значений концентрации вдыхаемого кислорода (rFiO). Система содержит устройство контроля насыщения кислородом и устройство управления вдыхаемым кислородом. Система имеет устройство управления и сеть, допускающую взаимодействие между устройством контроля насыщения кислородом и устройством управления и взаимодействие между устройствами управления вдыхаемым кислородом и устройством управления. Техническим результатом является эффективность назначения искомого SpOи исключение времени эпизодов гипоксии и гипероксии, удовлетворение потребности всех индивидов и сохранение коэффициента передачи системы. 3 н. и 22 з.п. ф-лы, 23 ил., 7 табл.

Комментарии