Неинвазивный способ оценки изменений уровня глюкозы в крови человека и аппарат для осуществления способа - RU2477074C2
Код документа: RU2477074C2
Чертежи








Описание
Область техники, к которой относится изобретение
Изобретение относится к неинвазивному способу оценки изменения уровня ΔG глюкозы в крови человека и к аппарату для осуществления упомянутого способа.
Уровень техники
В настоящее время известны различные способы и устройства для неинвазивной оценки уровня глюкозы в крови, основанные на поглощении и рассеянии лазерного излучения, комбинационном (рамановском) рассеянии (патенты US 7054514, 7454429, 5448992), методах ЯМР (NMR) резонанса (US 7295006), импедансной спектроскопии (патенты US 2002/0155615, RU 2001/115028). Устройства измерения, основанные на таких технологиях, имеют и еще, вероятнее всего, долго будут иметь высокую себестоимость и, следовательно, высокую цену, недоступную для индивидуального потребителя.
Рассматриваются доступные по цене и потому перспективные способы для массового потребления, отличные от способов оценки уровня глюкозы в крови, импеданса или способов кондуктометрии, строго говоря, непрямого характера. Такие способы требуют наличия связи между электрическими параметрами тканей и концентрацией глюкозы в крови. Однако электрические параметры нативных тканей непосредственно зависят не только от содержания в них глюкозы или иных веществ, но и от состояния их гидратации. Несмотря на все такие хорошо известные физиологические механизмы все же отсутствуют качественные и надежные неинвазивные глюкометры, работающие на основе измерения проводимости.
Сущность изобретения
Таким образом, задачей настоящего изобретения является обеспечение надежного способа неинвазивной оценки изменения уровня глюкозы в крови человека, основанной на принципах кондуктометрии. Дополнительной задачей изобретения является обеспечение доступного по цене аппарата для осуществления способа согласно изобретению.
Эти и другие задачи достигаются с помощью способа по пункту 1 формулы изобретения и аппарата по пункту 10 формулы изобретения. Предпочтительные пути осуществления изобретения и предпочтительные варианты реализации аппарата согласно настоящему изобретению определены в зависимых пунктах формулы изобретения.
Для оценки изменения уровня глюкозы в крови человека в настоящем изобретении используется изменение объема интерстициальной жидкости в мускульной ткани вследствие перераспределения жидкости между внеклеточным и внутриклеточным компартментами, вызванного изменениями осмотического давления внеклеточных жидкостей, которое в свою очередь коррелируется с уровнем глюкозы. Внеклеточные жидкости, помимо интерстициальной жидкости, включают кровь и лимфу. Уровень глюкозы во всех таких жидкостях почти одинаковый.
Осмотическое давление биологических жидкостей в биологических компартментах зависит от концентрации веществ, которые отличаются осмотической активностью и плохой проницаемостью для плазматических мембран. Такие вещества накапливаются в одном из компартментов и выравнивают уровень осмотического давления в свою пользу посредством перераспределения воды между компартментами. Такие вещества «тянут на себя воду». Глюкоза является одним из таких веществ в организме человека. Мембраны клеток обладают низкой проницаемостью для глюкозы. Глюкоза задерживается во внеклеточных компартментах и поступает в клетки только с существенной задержкой.
Изменение уровня глюкозы во внеклеточных жидкостях, включая плазму крови, очень динамично. Классическое физиологическое объяснение, почему организм не создает мобильный запас энергии в виде растворенной в крови глюкозы, таково, что растворенная глюкоза существенно повышает осмотическое давление крови. Таким образом, принимая во внимание то, что тканевые жидкости организма взрослого человека содержат около 15 г глюкозы, этого достаточно для энергообеспечения организма всего на несколько десятков минут. Эта же величина с точки зрения осмотического давления составляет 5-6 мМ/л (мМ/л означает миллимоль на литр) из примерно 300, т.е. достигает 2%. Именно с точностью до 2% в нашем организме поддерживается постоянство осмотического давления: при выходе осмолярности плазмы крови за пределы отклонения более или менее 2%, в организме запускаются физиологические механизмы сбережения или выведения воды: вторичная моча образуется либо существенно гипо-, либо гиперосмолярной. С другой стороны, кроме исключительных случаев профузной диареи, рвоты, приема мочегонных препаратов и подобных случаев, мы потребляем более 400 г глюкозы в сутки в виде углеводов - это как минимум 2,5 моля. В итоге, содержащаяся в крови глюкоза «обновляется» 25-30 раз в сутки и ее круговорот очень динамичен.
С другой стороны, в клетке концентрация глюкозы поддерживается на относительно стабильном и низком уровне - 1-1,2 мМ/л. Поступив в клетку, молекула глюкозы фосфорилируется, превращается в глюкозо-6-фосфат, который в свою очередь либо «сгорает» в реакциях гликолиза, либо полимеризуется, образуя высокомолекулярный гликоген.
Фактически, те же законы относятся и к случаю повышения осмолярности внеклеточного компартмента вследствие любого другого, не связанного с глюкозой фактора. Примером такого фактора может служить натрий. Однако чтобы повысить осмолярность плазмы на 2% за счет натрия, нужно съесть примерно 2,5-3 г поваренной соли - половину суточной нормы! В обычных условиях мы не съедаем по несколько граммов столовой соли и не теряем электролиты в тех же количествах за несколько десятков минут. Но обычный прием пищи - всего одно пирожное - как раз и приводит к указанным выше изменениям осмолярности внеклеточного компартмента в самых обычных («штатных»), а не «исключительных» ситуациях. Свободные аминокислоты поступают в кровь и утилизируются из нее так, что их концентрация сохраняется на уровне единиц мМ/л в крови с высоким постоянством, а жирные кислоты образуют коллоидные частицы и тем самым также «скрывают» свое осмотическое давление, почти не присутствуя в крови в виде свободных молекул. Минеральные компоненты внеклеточных жидкостей составляют основную квоту уровня их осмотического давления - более 95% - но они весьма стабильны в своем содержании в живом организме и в ничтожной доле подвержены суточному круговороту. Ряд примеров можно и продолжить, но вывод очевиден: за переменную составляющую суточных колебаний осмотического давления крови и других внеклеточных жидкостей отвечает главным образом глюкоза.
В итоге, в клетках глюкоза поддерживается на относительно постоянном уровне, а вне клеток существенно колеблется. Это приводит к колебаниям объема интерстициального компартмента: глюкоза растет, растет и объем интерстициальных жидкостей, также за счет движения воды из клеток в интерстициальный компартмент, выравнивая осмотическое давление биологической жидкости внутри и снаружи клетки.
Изменение объема интерстициальных жидкостных компартментов обнаруживается, согласно настоящему изобретению, путем неинвазивного измерения проводимости с помощью электродов, находящихся в контакте с кожей человека, покрывающей часть мягкой ткани, включая мышечные волокна.
Измерения проводимости осуществляются, по меньшей мере, с применением переменного тока относительно низкой частоты 1×104 Гц - 5×104 Гц. Благодаря высокоактивному и емкостному сопротивлению клеточных мембран токи такой частоты в основном представляют собой ионные токи, которые распространяются в основном по внеклеточному компартменту, охватывая клетки и другие мембранные структуры. Их размер зависит от электролитического состава внеклеточной жидкости и размера объема или эффективной площади сечения. Обезвоженные, лиофилизированные ткани представляют собой электрические изоляторы и фактически не проводят электрический ток.
Кровяные и лимфатические компоненты внеклеточной жидкости протекают по сосудам. Часть измеренной проводимости, таким образом, обусловлена проводимостью сосудов, которые в основном являются капиллярными сосудами в ткани, представляющей интерес для настоящего изобретения (такой как, в частности, поперечно-полосатые мышцы). Однако объем сосудов в теле человека контролируется различными физиологическими механизмами рефлекторной и гуморальной регуляции, которые поддерживают постоянство объема крови, циркулирующей в сосудах и не коррелируется, в отличие от объема интерстициального компонента, с осмотическим давлением и уровнем глюкозы.
Для оценки негативного влияния проводимости капиллярных сосудов в настоящем изобретении производится измерение проводимости ткани независимо в двух направлениях, а именно параллельно и перпендикулярно мышечным волокнам. Вследствие хаотичной ориентации капиллярных сосудов изменение проводимости, вызванное изменением объема сосудов, должно быть почти одинаковым в обоих направлениях измерения. С другой стороны, проводимость в направлении, параллельном мышечным волокнам, по большому счету, определена объемом интерстициальной жидкости, в отличие от направления, перпендикулярного мышечным волокнам. Изменение объема интерстициального компартмента, таким образом, имеет большее влияние на проводимость в параллельном направлении мышечным волокнам, чем в перпендикулярном направлении.
Используя такие отношения, в настоящем изобретении делается предположение, что изменение объема интерстициального компартмента было подвержено влиянию (изменения осмотического давления и, в свою очередь, изменения уровня глюкозы в интерстициальной жидкости) в заданный период времени Δt, если относительное изменение проводимости, измеренной параллельно направлению мышечных волокон, больше или меньше относительного изменения проводимости, измеренной перпендикулярно мышечным волокнам. Такие изменения не принимаются во внимание, если относительные изменения проводимости, измеренной параллельно и перпендикулярно направлению мышечных волокон, почти одинаковы. В последнем случае относительные изменения проводимости влияют только на изменения объема сосудов.
Если относительное изменение проводимости, измеренной параллельно направлению мышечных волокон, больше, чем относительное изменение проводимости, измеренной перпендикулярно направлению мышечных волокон, то предполагается положительное изменение уровня глюкозы интерстициальной жидкости. Если относительное изменение проводимости, измеренной параллельно направлению мышечных волокон, меньше, чем относительное изменение проводимости, измеренной перпендикулярно направлению мышечных волокон, то предполагается отрицательное изменение уровня глюкозы в интерстициальной жидкости.
Абсолютное значение изменения уровня глюкозы оценено как находящееся в диапазоне 0,15-1,0 мкМ/(л·с).
Описанные выше изменения проводимости могут быть измерены с достаточной точностью в пределах интервала Δt времени измерения не более 15 секунд, в частности в пределах 2-12 секунд.
Существует еще одно негативное влияние на измеренную проводимость контактного сопротивления электродов и поверхности кожи. Такое сопротивление, к сожалению, также зависит от концентрации глюкозы в крови. Повышение уровня глюкозы в крови приводит к повышению контактного сопротивления при повышении сухости поверхности кожи. Снижаются потоотделение и гидратация. В результате измеренная проводимость увеличивается в результате увеличения объема внеклеточной жидкости, но уменьшается в результате повышенного контактного сопротивления.
Чтобы исключить влияние контактного сопротивления, в настоящем изобретении применяется тетраполярная электродная схема с парой внешних и парой внутренних электродов. При подаче тока на одну пару таких электродов (предпочтительно на внешнюю пару) измеряется напряжение между другой парой электродов. Влияние контактного сопротивления исключается благодаря тому факту, что контактные сопротивления обеих пар электродов и поверхности кожи примерно равны и компенсируют друг друга. Тетраполярные электроды, очевидно, применяются при измерениях как параллельно, так и перпендикулярно мышечным волокнам.
Согласно предпочтительному варианту осуществления настоящего изобретения кондуктометрические измерения выполняются дополнительно со вторым переменным током относительно высокой частоты в диапазоне 0,5×106 Гц - 5×106 Гц. Токи такой частоты в основном представляют собой токи смещения, поскольку цитолеммы почти прозрачны для них и размер таких токов зависит от эффективной площади сечения тканевой жидкости, как внутриклеточной, так и внеклеточной. Дополнительные измерения на высокой частоте также проводятся в направлении, параллельном и перпендикулярном мышечным волокнам той же ткани человека и также с использованием тетраполярных электродов.
Измеренные относительные изменения высокочастотной проводимости используются для получения более точной оценки изменения уровня глюкозы. Предполагается, что существует большее отклонение уровня глюкозы (что в целом было обнаружено при измерениях на низкой частоте) в период времени Δt, если относительное изменение проводимости, измеренной в направлении, параллельном мышечным волокнам, больше или меньше относительного изменения проводимости, измеренной перпендикулярно направлению мышечных волокон, также «прослеживаемое» на высокой частоте. В противном случае, то есть когда такая разница не возникает на высокой частоте, изменение уровня глюкозы предполагается меньшим.
Абсолютные значения изменений уровня глюкозы оценены как находящиеся в диапазоне 0,15-0,5 мкМ/(л·с) в случае небольших изменений и в диапазоне 0,3-1,0 мкМ/(л·с) в случае более значительных изменений.
По сравнению с измерениями на низкой частоте измерения на высокой частоте менее чувствительны к изменениям во внеклеточной жидкости в отношении всех тканевых жидкостей. С другой стороны, контакт между электродом и кожей является менее критичным.
В соответствии с другим предпочтительным вариантом осуществления настоящего изобретения температура участка ткани дополнительно измеряется с помощью датчика температуры в контакте с кожей для коррекции измеренных значений проводимости в зависимости от температуры.
В целом удельная проводимость электролитов, таких как биологические жидкости, зависит от температуры: если температура повышается, ионная проводимость увеличивается. Так, рост глюкозы в крови вызывает эмиссию инсулина, основного анаболического гормона. Катаболические реакции временно угнетаются и в результате температура тела понижается. Этот эффект снижает проводимость, что противоречит увеличивающемуся влиянию глюкозы на проводимость вследствие роста объема внеклеточного жидкостного компартмента.
В изобретении учитывается этот эффект путем измерения температуры кожи вблизи участка измерения с помощью датчика температуры и ввода температурного поправочного коэффициента в значения измеренных уровней проводимости. Используются различные температурные поправочные коэффициенты для коррекции значения проводимости на высокой и низкой частотах. Высокочастотная проводимость уменьшается на 1,5-2,5% на °C при снижении температуры, в то время как низкочастотная проводимость уменьшается более чем в два раза по сравнению с высокочастотной проводимостью. Температурный поправочный коэффициент для низкой частоты составляет 4,5-6,5% на °C.
Для надежности результатов измерения окружающая температура не должна быть экстремальной (например, ниже -5°C или выше 25°C) и должна также не слишком быстро изменяться за короткий период времени. В таких случаях, например, для измерения окружающей температуры и для выдачи предупреждающего сигнала может использоваться второй датчик температуры.
Диапазоны частот, пригодные для настоящего изобретения, указаны выше и составляют 1×104 Гц - 5×104 Гц для низкой частоты и 0,5×106 Гц - 5×106 Гц для высокой частоты. Снижение низкой частоты ниже 10 кГц имеет значительные ограничения благодаря поляризации электродов и зависимости импеданса от качества контакта электродов с кожей. Увеличение высокой частоты до 10 МГц и более приведет к индуктивным и емкостным (вследствие реактивной струи) помехам: проводимость зависит от расположения окружающих элементов, их размеров и проводимости.
В помощь для нахождения правильных и/или оптимальных ориентаций тетраполярных электродных устройств в конкретном месте на ткани человека могут использоваться восемь тетраполярных электродных устройств, вместо только двух. Восемь тетраполярных электродных устройств размещают в контакте с кожей упомянутого человека на месте, с ориентацией вдоль восьми осей, образуя радиально-симметричную схему. Значение проводимости упомянутой ткани измеряют каждым из упомянутых восьми тетраполярных электродных устройств для определения оси с минимальной проводимостью и оси с максимальной проводимостью. Тетраполярное электродное устройство, ориентированное вдоль оси с максимальной проводимостью, используется затем для измерения вдоль направления мышечных волокон. Подобным образом, тетраполярное электродное устройство, ориентированное вдоль оси с минимальной проводимостью, используется затем для измерения в направлении, перпендикулярном мышечным волокнам.
Таким образом, не требуется вводить a priori правильные и/или оптимальные ориентации измерений, отражающие анизотропию проводимости ткани - согласно анатомическим (мускульным или сосудистым) ориентирам, они задаются a posteriori - в результате измерений. Таким образом, способ согласно изобретению может корректно применяться даже людьми, не осведомленными об упомянутых анатомических ориентирах на участке ткани, на котором осуществляется данный способ.
Краткое описание чертежей
Варианты осуществления и предпочтительные варианты осуществления настоящего изобретения описаны далее со ссылкой на сопровождающие чертежи, на которых:
Фиг. 1 - блок-схема аппарата согласно настоящему изобретению с двумя датчиками проводимости;
Фиг. 2 - временной график цикла измерения;
Фиг. 3 - схематическое представление одного из двух датчиков проводимости аппарата, показанного на Фиг. 1;
Фиг. 4 - предпочтительное относительное геометрическое расположение электродов двух датчиков проводимости;
Фиг. 5 - предплечье пациента с, по меньшей мере, частью аппарата, показанного на Фиг. 1, закрепленного с помощью манжеты;
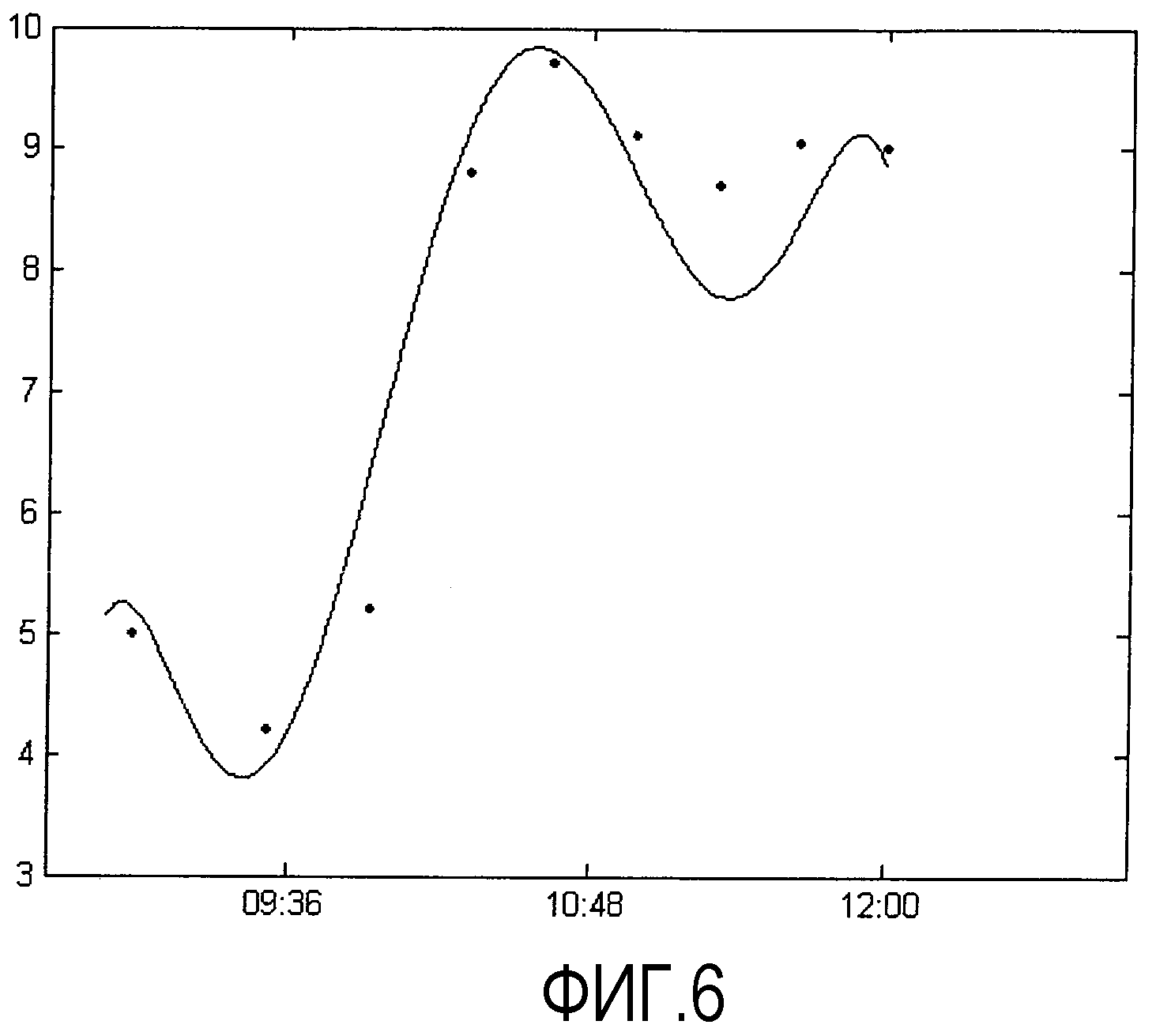
Фиг. 6-8 - временные графики, показывающие изменение уровня глюкозы трех пациентов, полученное в соответствии с настоящим изобретением, в сравнении с данными, полученными с помощью обычной инвазивной системы измерений;
Фиг. 9 - предпочтительное относительное геометрическое расположение электродов в общей сумме восьми датчиков проводимости для использования в предпочтительном варианте осуществления настоящего изобретения.
Описание предпочтительного варианта осуществления изобретения
Устройство, представленное на Фиг. 1, включает: цифровой сигнальный процессор (DSP) 1, оперативную память (RAM) 2, постоянную память (ROM) 3, компьютерный вход-выход (Interface RS232) 4, аналого-цифровой преобразователь (ADC) 5, мультиплексор (MUX) 6, квадратурный детектор 7, двухчастотный генератор 8 колебаний, цифровой потенциометр 9, датчик 10 тока, два переключателя 11a и 11b датчика проводимости, два дифференциальных усилителя 12/1 и 12/2, два датчика 13 и 14 проводимости и два датчика 15 и 16 температуры.
Цифровой сигнальный процессор 1 управляет процессом измерения, принимает результаты измерений от аналого-цифрового преобразователя 5, осуществляет предварительную обработку сигналов и передает их на внешний компьютер или электронный секретарь (PDA) (не показанный и не являющийся составной частью аппарата) через интерфейс 4. Операционная программа процессора хранится в постоянной памяти (ROM) 3.
Аппарат работает следующим образом. Генератор 8 колебаний попеременно формирует напряжение переменного тока с частотой F1 (30 кГц) и F2 (1 МГц). Такие напряжения проходят через цифровой потенциометр 9, датчик 10 тока и устройство 11а переключения, которое попеременно подает напряжения на токоподводящие электроды "IN" (Фиг. 3) датчиков 13 и 14. Генератор 8 колебаний также формирует контрольные сигналы, которые поступают на квадратурный детектор 7 для цели синхронизации.
Цифровой потенциометр 9, управляемый процессором 1, автоматически поддерживает амплитуды напряжения постоянными на токонесущих электродах "IN" (Фиг. 3) датчиков 13 и 14 проводимости, которые соответствуют начальному контактному сопротивлению кожи отдельного человека. Это позволяет расширить динамический диапазон измерений проводимости и повысить точность измерений.
Сигналы от центральных электродов "OUT" (Фиг. 2) датчиков 13 и 14 проводимости усиливаются дифференциальными усилителями 12 и через второй переключатель 11b датчика проводимости поступают на один из входов, обозначенных как U~, квадратурного детектора 7. С датчика 10 тока на второй вход, обозначенный как I~, квадратурного детектора 7 подается напряжение, пропорциональное току, протекающему через токонесущие электроды "IN" (Фиг. 3).
Квадратурный детектор 7 имеет четыре выхода. На выходе, обозначенном как U02, квадратурный детектор 7 выдает сигнал постоянного тока (DC), пропорциональный квадрату сигнала переменного тока (АС) на входе, обозначенном как U~, в момент времени t0. На выходе, обозначенном как Uπ/22, квадратурный детектор 7 выдает DC сигнал, пропорциональный квадрату АС сигнала на входе, обозначенном как U~, в момент времени tπ/2. На выходе, обозначенном как I02, квадратурный детектор 7 выдает DC сигнал, пропорциональный квадрату AC сигнала, на вход, обозначенный как I~, в момент времени t0. На выходе, обозначенном как Iπ/22, квадратурный детектор 7 выдает DC сигнал, пропорциональный квадрату АС сигнала на вход, обозначенный как I~, в момент времени tπ/2.
Такие DC сигналы поступают через мультиплексор (MUX) 6 и аналого-цифровой преобразователь (ADC) 5, в котором они оцифровываются, на цифровой сигнальный процессор (DSP) 1.
Постоянные напряжения от двух датчиков 15 и 16 температуры также подаются через мультиплексор 6 и аналого-цифровой преобразователь 5 в оцифрованной форме на цифровой сигнальный процессор (DSP) 1.
Цифровой сигнальный процессор (DSP) 1 вычисляет средние значения U и I на основании четырех выходных сигналов квадратурного детектора 7 следующим образом:
U = SQRT(U02 + Uπ/22),
I = SQRT(Io2 + Iπ/22),
и вычисляет значения проводимости на основании таких средних значений I и U, как
C = I/U.
Эти значения проводимости далее подвергаются коррекции с помощью значений температуры, полученных от датчиков 15 и 16 температуры.
В зависимости от значений температуры, полученных датчиком 16 температуры, цифровым сигнальным процессором (DSP) 1 может создаваться также предупреждающий сигнал.
Аппарат работает циклически. На Фиг. 2 показан полный цикл и часть следующего цикла.
Цикл начинается с входа U~ квадратурного детектора 7, соединенного с датчиком 13 с помощью второго переключателя 11b датчика проводимости. Двухчастотный генератор 8 колебаний сначала формирует частоту F1, которая подается с помощью первого переключателя 11а датчика проводимости на датчик 13. Далее двухчастотный генератор 8 колебаний формирует частоту F2, которая также подается с помощью первого переключателя 11a датчика проводимости на датчик 13. Затем получают значения температуры от датчиков 15 и 16 температуры соответственно, чем и заканчивается первая половина цикла. Во вторую половину цикла отдельные этапы первой половины цикла повторяются с тем отличием, что частоты F1 и F2 подают с помощью первого переключателя 11a датчика проводимости на датчик 14. К тому же, вход U~ квадратурного детектора 7 также подключен к датчику 14 с помощью второго переключателя 11b датчика проводимости.
Сохранение данных, предварительная обработка ранее собранных данных и передача данных на компьютер осуществляются в соответствии с Фиг. 2.
На примере, показанном на Фиг. 2, полный цикл измерения высокочастотной и низкочастотной проводимости на обоих датчиках занимает 12 секунд. Следует понимать, что этот цикл является только иллюстративным и может быть сокращен и до меньшего количества секунд.
Аппарат может запитываться от перезаряжаемой батареи.
Тетраполярная электродная схема используется в обоих датчиках 13 и 14 проводимости. Относительное расположение электродов "IN" и "OUT" датчика такого типа показано на Фиг. 3. На Фиг. 4 показано предпочтительное взаимно-перпендикулярное расположение тетраполярных электродов обоих датчиков 13 и 14, выполненных на общей планарной основе. Датчик 15 температуры расположен в центре восьми электродов на той же основе. Основа может быть сформирована манжетой, пригодной для закрепления, например, на предплечье пациента.
На Фиг. 5 показано предплечье пациента, на котором закреплена такая манжета 17 с невидимыми электродами датчиков 13 и 14 и невидимым датчиком 15 температуры с ее внутренней стороны в контакте с кожей. На внешней стороне манжеты 17 имеется корпус 18, который предпочтительно вмещает описанные выше электронные компоненты аппарата, соответствующего настоящему изобретению, а также батареи. Описанная выше передача данных на компьютер может осуществляться через кабельное соединение между корпусом и компьютером или даже беспроводным образом.
Следует понимать, что измерения на предплечье представляют собой только пример и что также возможно измерение на любом другом участке тела человека, покрывающем мягкие мышечные ткани.
В частности, в описанном выше варианте осуществления аппарат, соответствующий настоящему изобретению, можно легко переносить без причинения каких-либо неудобств носящему аппарат человеку в течение нескольких часов, включая ночные часы и сон. В связи с этим измерительный цикл непрерывно повторяется.
Начиная с некоторой точки во времени изменение уровня глюкозы в крови может контролироваться и предпочтительно сохраняться для представления на временном графике. На Фиг. 6-8 представлены такие временные графики, показывающие изменения уровня глюкозы у трех пациентов с диабетом 2 степени в течение нескольких часов, каждое из которых получено в соответствии с настоящим изобретением. Ось абсцисс представляет время в часах. Ось ординат представляет концентрацию глюкозы в ммоль/литр.
Необходимо отметить, что настоящее изобретение обеспечивает только изменение уровня глюкозы, но не абсолютные значения. Для получения абсолютных значений необходима калибровка, которую можно провести, например, в начале периода измерения с помощью стандартного инвазивного способа.
На графиках Фиг. 6-8 представлены для сравнения значения глюкозы, полученные с помощью хорошо известной и широко применяемой системы ACCU CHECK®.
На Фиг. 6 показаны результаты глюкозо-толерантного теста, проведенного с пациенткой в возрасте 49 лет. Пациентка приняла 70 г глюкозы, растворенной в 130 мл воды, в момент времени между 09:51 и 09:52.
На Фиг. 7 показано изменение уровня глюкозы в крови пациента в возрасте 81 года после приема пищи в период времени между 10:40 и 10:48.
На Фиг. 8 показано изменение уровня глюкозы в крови пациентки в возрасте 69 лет после приема пищи в период времени между 10:00 и 10:05.
Кривые на Фиг 6-8, которые первоначально выглядели как ступенчатые кривые, были полиномиально сглажены для лучшего представления общей тенденции изменения уровня глюкозы.
Как было описано, на Фиг.4 показано предпочтительное взаимное расположение тетраполярных электродов датчиков 13 и 14 на общей планарной основе. На Фиг.9 изображено расположение тетраполярных электродов в общей сумме восьми датчиков на общей планарной основе в соответствии с еще более предпочтительным вариантом осуществления настоящего изобретения. Четыре электрода каждого из восьми датчиков расположены вдоль восьми осей a-h, образуя радиально-симметричную схему. Датчик 15 температуры также расположен в центре схемы на оси ее вращения, при этом такой центр также является центром всех тетраполярных электродных датчиков. Как показано на Фиг.4 и Фиг.5, основа может быть сформирована манжетой 17, подходящей для закрепления на предплечье пациента.
При расположении, показанном на Фиг.9, могут быть автоматически найдены направления с наибольшим дифференциалом проводимости. Для этого проводятся начальные тестовые измерения последовательно вдоль каждой из осей a-h для определения оси с максимальной проводимостью и оси с минимальной проводимостью. Датчик, который ориентирован вдоль оси с максимальной проводимостью, используется впоследствии в качестве датчика 13, показанного на Фиг.1. Аналогичным образом, датчик, который ориентирован вдоль оси с минимальной проводимостью, используется впоследствии в качестве датчика 14, показанного на Фиг.1.
Список принятых сокращений
1. Цифровой сигнальный процессор (DSP)
2. Оперативная память (RAM)
3. Постоянная память (ROM)
4. Вход-выход компьютера (Interface RS232)
5. Аналого-цифровой преобразователь (ADC)
6. Мультиплексор (MUX)
7. Квадратурный детектор
8. Двухчастотный генератор колебаний
9. Цифровой потенциометр
10. Датчик тока
11а. Первый переключатель датчика проводимости (параллельный и перпендикулярный)
11b. Второй переключатель датчика проводимости (параллельный и перпендикулярный)
12/1. Дифференциальный усилитель
12/2. Дифференциальный усилитель
13. Датчик проводимости (С(1) параллельный)
14. Датчик проводимости (С(2) перпендикулярный)
15. Датчик температуры (Т(1) кожи)
16. Датчик температуры (Т(2) окружающей среды)
17. Манжета
18. Корпус
a-h. Ось ориентации
Реферат
Группа изобретений относится к медицине. Для оценки изменения уровня глюкозы в крови человека в настоящем изобретении используется изменение объема интерстициальных жидкостных компартментов в мышечных тканях, происходящее вследствие движения жидкости между внеклеточными и внутриклеточным компартментами, возникающего из-за изменений осмотического давления внеклеточных жидкостей, в свою очередь коррелирующего с уровнем глюкозы. Изменение объема интерстициальных жидкостных компартментов обнаруживается благодаря неинвазивному кондуктометрическому измерению с использованием электродов, находящихся в контакте с кожей человека, покрывающей часть мягкой ткани, включая мышечные волокна. Для исключения негативного влияния проводимости капиллярных сосудов в группе изобретений осуществляется измерение проводимости ткани независимо в двух направлениях, а именно параллельно и перпендикулярно мышечным волокнам. 2 н. и 9 з.п. ф-лы, 9 ил.
Формула
размещают первое тетраполярное электродное устройство параллельно направлению мышечных волокон в контакте с кожей упомянутого человека, покрывающей часть мягкой ткани, включая мышечные волокна;
размещают второе тетраполярное электродное устройство перпендикулярно направлению мышечных волокон в контакте с кожей упомянутого человека, покрывающей упомянутую часть мягкой ткани;
измеряют в течение интервала Δt времени:
- относительное изменение ΔС||,LF/С||,LF значения С||,LF проводимости упомянутой ткани параллельно направлению мышечных волокон на низкой частоте с помощью первого тетраполярного электродного устройства;
- относительное изменение ΔC||,LF/C⊥,LF значения C⊥,LF проводимости упомянутой ткани перпендикулярно направлению мышечных волокон на низкой частоте с помощью второго тетраполярного электродного устройства;
оценивают ΔG как:
- 0,0, если ΔС||,LF/C||,LF≈ΔC⊥,LF/C⊥,LF,
- +а, если ΔC||,LF/C||,LF>ΔC⊥,LF/C⊥,LF,
- -а, если ΔС||,LF/C||,LF<ΔC⊥,LF/C⊥,LF,
где а находится в диапазоне 0,15-1,0 мкМ/л·с;
низкая частота находится в диапазоне 1·104 Гц - 5·104 Гц; и
≈ означает "равно в пределах диапазона +/-2,5% - +/-7,5%".
измеряют в течение интервала Δt времени:
- относительное изменение ΔC||,HF/С||,HF значения C||,HF проводимости упомянутой ткани параллельно направлению мышечных волокон на высокой частоте с помощью первого тетраполярного электродного устройства;
относительное изменение ΔC⊥,HF/C⊥,HF значения C⊥,HF проводимости упомянутой ткани перпендикулярно направлению мышечных волокон на высокой частоте с помощью второго тетраполярного электродного устройства;
оценивают ΔG как:
+a, если ΔС||,LF/C||,LF>ΔC⊥,LF/C⊥,LF и ΔС||,HF/С||,HF≈ΔC⊥,HF/C⊥,HF,
+b, если ΔС||,LF/C||,LF>ΔC⊥,LF/C⊥,LF и ΔС||,HF/C||,HF>ΔC⊥,HF/C⊥,HF,
-a, если ΔС||,LF/C||,LF<ΔC⊥,LF/C⊥,LF и ΔС||,HF/C||,HF≈ΔC⊥,HF/C⊥,HF,
-b, если ΔC||,LF/C||,LF<ΔC⊥,LF/C⊥,LF и ΔC||,HF/C||,HF<ΔC⊥,HF/C⊥,HF,
где a находится в диапазоне 0,15-0,5 мкМ/л·с;
b находится в диапазоне 0,3-1,0 мкМ/л·с; и
высокая частота находится в диапазоне 0,5·106 Гц - 5·106 Гц.
размещают датчик температуры в контакте с кожей упомянутого человека, покрывающей упомянутую часть мягкой ткани;
измеряют температуру Т кожи; и
корректируют значения проводимости по коэффициенту f,
причем:
- f - это коэффициент уменьшения в случае температурного понижения;
- f находится в диапазоне 4,5-6,5% на °C разности температур от Т0 для измерений на низкой частоте; и
- Т0 - это предварительно измеренная температура кожи упомянутого человека, покрывающей упомянутую часть мягкой ткани.
f находится в диапазоне 1,5-2,5% на °C разности температур от Т0 для измерений на высокой частоте.
размещают первое тетраполярное электродное устройство параллельно направлению мышечных волокон в контакте с кожей упомянутого человека, покрывающей часть мягкой ткани, включая мышечные волокна,
и
размещают второе тетраполярное электродное устройство перпендикулярно направлению мышечных волокон в контакте с кожей упомянутого человека, покрывающей упомянутую часть мягкой ткани,
включают дополнительные этапы, на которых:
размещают восемь тетраполярных электродных устройств вдоль восьми осей, образующих радиально-симметричную схему, в контакте с кожей упомянутого человека, покрывающей упомянутую часть мягкой ткани;
измеряют значение проводимости упомянутой ткани с помощью каждого из упомянутых восьми тетраполярных электродных устройств для определения оси с минимальной проводимостью и оси с максимальной проводимостью;
используют тетраполярное электродное устройство, ориентированное вдоль оси с максимальной проводимостью, в качестве первого тетраполярного электродного устройства;
и
используют тетраполярное электродное устройство, ориентированное вдоль оси с минимальной проводимостью, в качестве второго тетраполярного электродного устройства.
Документы, цитированные в отчёте о поиске
Способ определения концентрации глюкозы в крови человека

Комментарии