Микроволновое томографическое устройство для спектроскопии и способ ее осуществления - RU2238033C2
Код документа: RU2238033C2
Чертежи

















Описание
Область техники
Настоящее изобретение относится к получению микроволнового томографического изображения и, в частности, к получению изображения биологических тканей с тем, чтобы получить их внутреннее структурное изображение, а также функциональное изображение.
Предпосылки создания изобретения
При формировании мигроволнового топографического изображения для получения отображения объекта используется микроволновое излучение, при этом обнаруживается эффект воздействия этого объекта на микроволновый луч после его взаимодействия с данным объектом. В случае применения микроволнового излучения характер взаимодействия определяется диэлектрической проницаемостью диэлектрика и свойствами проводимости тканей отображаемого объекта. Диэлектрическая проницаемость диэлектрика и свойства проводимости объекта выражаются совместно в виде комплексной диэлектрической проницаемости.
Электромагнитные волны как компонент спектра электромагнитного излучения занимают диапазон частот приблизительно от 0,1 гигагерц (ГГц) до 300 ГГц. Это соответствует диапазону длин волн от 300 мм до 1 мм. Микроволновый диапазон, используемый для получения микроволного изображения биологических тканей, находится в пределах приблизительно от 0, 5 до 3 ГГц, но также могут использоваться и другие диапазоны микроволнового спектра. Квантовая энергия фотонов в этом диапазоне электромагнитного спектра представляет собой неионизирующее излучение.
В общем случае получение микроволнового изображения отличается от использования рентгеновских лучей позитронной эмиссии, ультразвука или ядерного магнитного резонанса, потому что микроволновое излучение взаимодействует с объектом, который будет изображен как функция комплексной диэлектрической проницаемости этого объекта. Комплексная диэлектрическая проницаемость состоит из диэлектрической проницаемости диэлектрика и потерь в диэлектрике. Диэлектрическая проницаемость диэлектрика является ее вещественной частью и определяется уравнением:

Соответственно потери в диэлектрике выражаются мнимой частью в виде:

где εo - диэлектрическая проницаемость вакуума, σ - проводимость материала и f - рабочая частота.
Например, вода имеет широкополосную диэлектрическую проницаемость, которая составляет приблизительно 80 на частоте около 1 ГГц и понижается до величины приблизительно 4,5 на частотах выше 100 ГГц. Диэлектрические потери воды увеличиваются от частоты около 1 ГГц до около 25 ГГц. Дополнительным фактором, воздействующим на диэлектрическую проницаемость воды, является температура.
Существуют две основные категории получения микроволнового изображения. Первая категория - получение статического изображения, основанного на формировании изображений с определением абсолютных величин диэлектрической проницаемости для микроволнового излучения после его взаимодействия с объектом. Вторая категория - получение динамического изображения, которое основано на изменениях диэлектрической проницаемости внутри объекта, возникающие во время воздействия микроволнового излучения. Эта вторая форма получения изображения особенно применима для получения изображения биологических тканей при осуществлении контроля за непосредственно происходящими физиологическими изменениями. Однако должно быть ясно, что при получении статического изображения, как и динамического изображения, требуется активное воздействие в процессе получения изображения, что выражается в необходимости производить перемещение микроволнового сканера или сканирование падающим излучением, при котором происходит обнаружение изменений в микроволновом излучении, которые являются следствием их взаимодействия с отображаемым объектом.
Большинство небиологических объектов, которые являются применимыми для получения их изображения с помощью электромагнитных микроволн, представляют собой очень простые структуры в отношении изменения их проводящих и диэлектрические свойств. С другой стороны, биологические ткани показывают широкий диапазон относительных диэлектрических постоянных. Считается, что эти диапазоны определяются, в значительной степени, благодаря взаимодействию микроволнового излучения с зарядами, имеющимися на поверхности мембран клеток, и с фактической структурой мембраны клеток с гидрофобным слоем между гидрофильными слоями, и водой и электролитом как внутри, так и снаружи клеточных структур. Следовательно, взаимодействие биологической ткани проявляется в чрезвычайно сложном виде и даже изменяется в течение времени из-за небольших изменений температуры, вызываемых поглощением микроволновой энергии, используемой для получения микроволнового изображения. Эта поглощаемая энергия преобразуется в тепло, особенно это характерно для воды. Это является довольно важным фактором, потому что, в среднем, биологическая ткань содержит приблизительно 70% воды.
Обычно при получении томографического микроволнового изображения используется набор микроволновых излучателей и приемников, пространственно расположенных в виде антенной решетки вокруг объекта, изображение которого требуется получить. В публикации 1990 года в Трудах ИИЭРА по биомедицинским разработкам, т.37 №3; с.303-12 (IEEE Transactions on Biomedical Engineering, vol.37 no.3, pp.303-12), март, 1990, под названием "Получение изображений в медицине с помощью микроволнового томографического сканера" ("Medical Imaging with a Microwave Tomographic Scanner"), авторов Джофре и др. (Jofre et al.), описано расположение антенной решетки микроволновых излучателей и приемников цилиндрической формы. Эта антенная решетка состояла из 64 волноводных антенн, расположенных в четырех группах по 16 антенн. Каждая волноводная антенна способна функционировать как излучатель или приемник. Объект, изображение которого требуется получить, помещается внутри круга антенной решетки излучателей и погружается в воду, чтобы минимизировать ослабление падающего микроволнового луча во время его взаимодействия с поверхностью объекта. Каждая антенна в группе последовательно включается на излучение, а 16 антенн в группе, расположенной напротив излучающей группы, работают на прием. Эта процедура последовательно повторяется для каждой антенны, пока не будет завершен один круг. Выходной микроволновый сигнал излучался на частоте 2,45 ГГц, образуя коллимационное поле высотой приблизительно 2 см, при удельной мощности на объекте меньше 0,1 милливатта на квадратный сантиметр.
В структуре Джофре и др. используется когерентный фазовый квадратурный детектор для измерения уровня и фазы сигнала приемных антенн. Данные преобразуются в цифровую форму, и компьютер выполняет реконструкцию изображения, основанного на изменениях в микроволновом излучении. Эта реконструкция выполняется алгоритмом, сформулированным, таким образом, чтобы получить аппроксимацию микроволновой дифракции в двух измерениях. Данный алгоритм использует аппроксимацию Борна, в которой принимается, что рассеяние действует так же, как слабое возмущение освещения, и, следовательно, поле внутри органа приблизительно совпадает с падающим полем. Эта проблема аппроксимации остается реальным ограничением в микроволновой томографии.
В публикации в Журнале по методам Неврологии (Journal of Neuroscience Methods), 36; с.239-51, 1991, озаглавленной "Вычисляемая активная микроволновая томография мозга; ответ на вызов", авторов Амиралл и др. (Active Microwave Computed Brain Tomography: The Response to a Challenge", Amirall, et al.), раскрывается применение цилиндрической антенной решетки, описанной в статье Джофре для получения изображения мозга. В этом случае также изображение было восстановлено, используя алгоритм дифракции для цилиндрических конфигураций, с использованием метода быстрого преобразования Фурье и аппроксимации Борна первого порядка. Данные, восстановленные с помощью алгоритма, определяют контрастность в величинах диэлектрической проницаемости сечения органа, как функцию пространственных координат части изображаемого органа, создающего эту контрастность диэлектрической проницаемости. Разрешающая способность теоретически ограничена величинами дифракции до значения, равного половине длины волны микроволнового излучения. Для частоты 2,45 ГГц это означает теоретически минимальное разрешение, равное приблизительно 6 см в воздухе и 7 мм в воде. В результате применяемых алгоритмов реконструкции и ограничений в используемых электронных приборах эти теоретические величины не были достигнуты.
Применение в вышеупомянутом приборе аппроксимаций первого порядка и используемых алгоритмов ограничивает его применение до получения статических изображений малых органов, таких как члены тела. В случае больших органов, таких как голова человека, восстановленное изображение правильно показало бы только внешний контур органа, но не его внутреннюю структуру.
При использовании динамического изображения реконструкция изображения производится на основе разности дифрагирующих полей, зарегистрированных из нескольких наборов данных, снимаемых при проведении облучения органа с изменяющейся контрастностью диэлектрика. Амиралл и др. смогли получить внутреннее изображение больших органов, однако разрешающая способность составляла при этом только приблизительно половину теоретически предсказанной величины.
Сущность изобретения
Настоящее изобретение представляет собой устройство для микроволновой топографической спектроскопии ткани без нарушения ее целостности, содержащее источник питания для подачи микроволнового излучения, множество микроволновых излучателей-приемников, пространственно ориентированных на ткань, согласующую среду, расположенную между излучателями-приемниками, устройство управления, оперативно подключенное между источником питания и множеством микроволновых излучателей-приемников, кодирующее устройство для кодирования микроволнового излучения и устройство вычисления для вычисления томографического спектроскопического изображения ткани с помощью принятых микроволновых сигналов, в соответствии с изобретением устройство управления выполнено с возможностью выборочного управления через подсистему формирования каналов, подачи энергии на множество излучателей-приемников и приема микроволновых сигналов от множества излучателей-приемников так, что многочастотное микроволновое излучение излучается из выбранного множества излучателей-приемников после прохождения его через ткань, а кодирующее устройство в подсистеме формирования каналов выполнено с возможностью кодирования микроволнового излучения, подаваемого на выбранное множество излучателей-приемников, и декодирования принимаемого сигнала из принимающего множества излучателей-приемников.
Кроме того, согласующая среда содержит жидкость, имеющую исходную диэлектрически настраиваемую диэлектрическую проницаемость в диапазоне приблизительно от 50 до 90 на частоте 2,45 ГГц и диэлектрические потери приблизительно от 5 до 25, многочастотное микроволновое излучение предпочтительно производится в диапазоне от приблизительно 0,2 ГГц до приблизительно 5 ГГц и генерируется с использованием импульсного излучения от одного из излучателей, причем при каждом излучении уровень энергии составляет, приблизительно, 1 мВт/см2.
Множество микроволновых излучателей-приемников образует антенную решетку излучателей-приемников, расположенных по кругу.
Кроме того, положение микроволновых излучателей-приемников можно изменять вдоль радиуса этой круговой антенной решетки.
Множество микроволновых излучателей-приемников содержит множество размещенных друг над другом излучателей-приемников, расположенных по кругу. Устройство управления обладает способностью выбирать ряд излучателей-приемников для работы в качестве излучателей и отдельный ряд излучателей-приемников для работы в качестве приемников.
Устройство вычисления содержит компонент формирования входных данных для приема и формирования данных, используемых в компоненте решения прямой задачи, причем компонент решения прямой задачи выполнен с возможностью приема данных из компонента формирования входных данных и для вычисления изображения биологической ткани, основываясь на знании амплитуды и фазы излучаемой микроволновой энергии, делая допущение о том, что в биологической ткани возникнут диэлектрические эффекты, и вычисления ожидаемого значения амплитуды и фазы для переданной микроволновой энергии, компонент решения обратной задачи, который принимает решение из компонента решения прямой задачи, а затем вычисляет изображение биологической ткани, основываясь на известных значениях амплитуды и фазы излученных микроволн и известных принятых значениях амплитуды и фазы из антенных решеток излучателей-приемников, и компонент частотной корреляции.
Компонент решения обратной задачи содержит компонент функционального формирования, выполненный с возможностью суммирования входных сигналов из всех излучателей-приемников, компонент формирования градиента, выполненный с возможностью использования производной компонента функционального формирования для упрощения скорости обработки, компонент вычисления параметра минимизации “тау”, выполненный с возможностью подтверждения точности функции градиента и для обеспечения восстановления изображения наиболее точным образом, и компонент вычисления ε*, выполненный с возможностью вычисления ε* как представление диэлектрического контраста между областями ткани или физиологическими состояниями ткани, где ε*=ε’+ε’’ и где ε’ и ε’’ являются значениями измеренной диэлектрической проницаемости и диэлектрических потерь, a i представляет мнимое число.
Кроме того, кодирующее устройство содержит средство для изменения фазы микроволнового излучения. Кодирующее устройство содержит средство для изменения амплитуды микроволнового излучения.
Кроме того, кодирующее устройство содержит средство для изменения полярности микроволнового излучения. Результат вычисления ε* представляет собой величину, получаемую с помощью вычисления диэлектрических характеристик ε’ и ε’’, получаемых из измеряемого изменения амплитуды и фазы излученной и принятой микроволновой энергии в определенном частотном диапазоне.
Настоящее изобретение включает способ для микроволновой томографической спектроскопии ткани без нарушения ее целостности, содержащий этапы, на которых размещают источник питания микроволнового излучения, размещают множество излучателей-приемников микроволнового излучения, управляют множеством излучателей-приемников микроволнового излучения, помещают согласующую среду между излучающими и принимающими микроволновыми излучателями-приемниками, помещают ткань, которая будет подвергаться облучению, внутри разделяющей среды, кодируют излучаемое микроволновое излучение, принимают микроволновое излучение микроволновыми излучателями-приемниками после взаимодействия его с тканью, и декодируют принятое микроволновое излучение, и измеряют изменение микроволнового излучения после взаимодействия с тканью, в соответствии с изобретеним множеством излучателей-приемников управляют так, чтобы множество выбранных излучателей-приемников через подсистему формирования канала излучало многочастотное микроволновое излучение к множеству излучателей-приемников, принимающих микроволновое излучение, кодируют излучаемое микроволновое излучение среди выбранных излучателей-приемников и декодируют принимаемый сигнал после взаимодействия с тканью с возможностью определения излучившего его излучателя-приемника. Кроме того, многочастотное микроволновое излучение одновременно излучается из множества излучателей.
Этап измерения включает решение обратной задачи для вычисления томографического изображения ткани, основываясь на измеряемом изменении микроволнового излучения, причем это решение обратной задачи содержит этапы, на которых определяют компонент функционального формирования, вычисляют значение производной компонента функционального формирования для создания компонента формирования градиента, используемого для увеличения скорости обработки математических расчетов по восстановлению, вычисляют параметр минимального “тау”, и выполняют вычисление ε*.
Настоящее изобретение также осуществляет способ идентификации дискретных сигналов по отношению к определенным антенным решеткам, содержащий этапы ориентирования ткани, изображение которой будет построено, в согласующей среде в устройстве микроволновой томографической спектроскопии, содержащем источник питания для подачи микроволнового излучения, множество микроволновых излучателей-приемников, устройство управления с кодирующим устройством, кодирования излучаемого микроволнового излучения и декодирования принимаемого сигнала, в соответствии с изобретением кодируют одновременно излучаемое микроволновое излучение от множества выбранных излучателей-приемников, а затем декодируют принимаемый после взаимодействия с тканью сигнал с возможностью определения излучившего его излучателя-приемника.
Этап кодирования содержит изменение фазы микроволнового излучения. Кроме того, этап кодирования содержит изменение амплитуды микроволнового излучения, и этап кодирования содержит изменение полярности микроволнового излучения, а также этап кодирования содержит изменение частоты микроволнового излучения.
Настоящее изобретение также осуществляет способ микроволновой томографической спектроскопии ткани без нарушения ее целостности, содержащий этапы определения области нацеливания на ткани для микроволнового облучения, определения ожидаемых значений диэлектрических параметров ткани определенной области нацеливания на ткани, облучения определенной области посредством микроволнового излучения от множества излучателей-приемников, приема микроволнового излучения от облучаемой области множеством излучателей-приемников и его анализа для получения наблюдаемых значений диэлектрических параметров ткани и сравнения их с ожидаемыми значениями для определения физиологического состояния ткани в определенной области нацеливания, в соответствии с изобретением облучение области нацеливания на ткань проводят многочастотным микроволновым излучением посредством его одновременной передачи из выбранного множества излучателей-приемников, а этапы анализа и сравнения включают этап решения обратной задачи для вычисления томографического изображения ткани, основываясь на измеряемом изменении микроволнового излучения, причем это решение обратной задачи содержит этапы, на которых определяют компонент функционального формирования, вычисляют значение производной компонента функционального формирования для создания компонента формирования градиента, используемого для увеличения скорости математических расчетов по восстановлению, вычисляют параметр минимизации “тау” и выполняют вычисление ε*.
Кроме того, этап обеспечения передачи микроволнового излучения содержит этап многочастотного микроволнового излучения. Этап сравнения содержит сравнение принятого микроволнового излучения в режиме реального времени, что позволяет осуществлять определение в режиме реального времени изменяющегося физиологического состояния.
Определенное физиологическое состояние является физиологическим состоянием, выбранным из списка физиологических состояний, состоящих из температуры, состояния электрического возбуждения, насыщения оксигемоглобином, содержания кислорода в крови, общего уровня гемоглобина и парциального давления газа в крови, причем парциальное давление газа в крови включает РО2, определенная область нацеливания на ткани включает в себя сердечную область пациента для определения местоположения начала сердечной аритмии.
Кроме того, этап обеспечения системы передачи и приема многочастотного микроволнового излучения включает использование подсистем in vivo и in vitro. Используют подсистему катетерной доставки энергии для удаления.
Способ дополнительно включает этап удаления определенных областей ткани с использованием подсистемы катетерного удаления. Кроме того, подсистема катетерного удаления использует для удаления энергию лазера и микроволновую энергию, причем подсистема катетерного удаления использует для удаления энергию высокой частоты. Определенная область нацеливания на ткани включает в себя ткань вблизи грудной клетки пациента.
Краткое описание чертежей
Фигура 1 изображает принципиальную схему устройства для микроволновой топографической спектроскопии согласно изобретению.
Фигура 2 изображает принципиальную схему устройства микроволновой томографической спектроскопии согласно изобретению.
Фигура 3 изображает структурную схему алгоритма для решения обратной задачи.
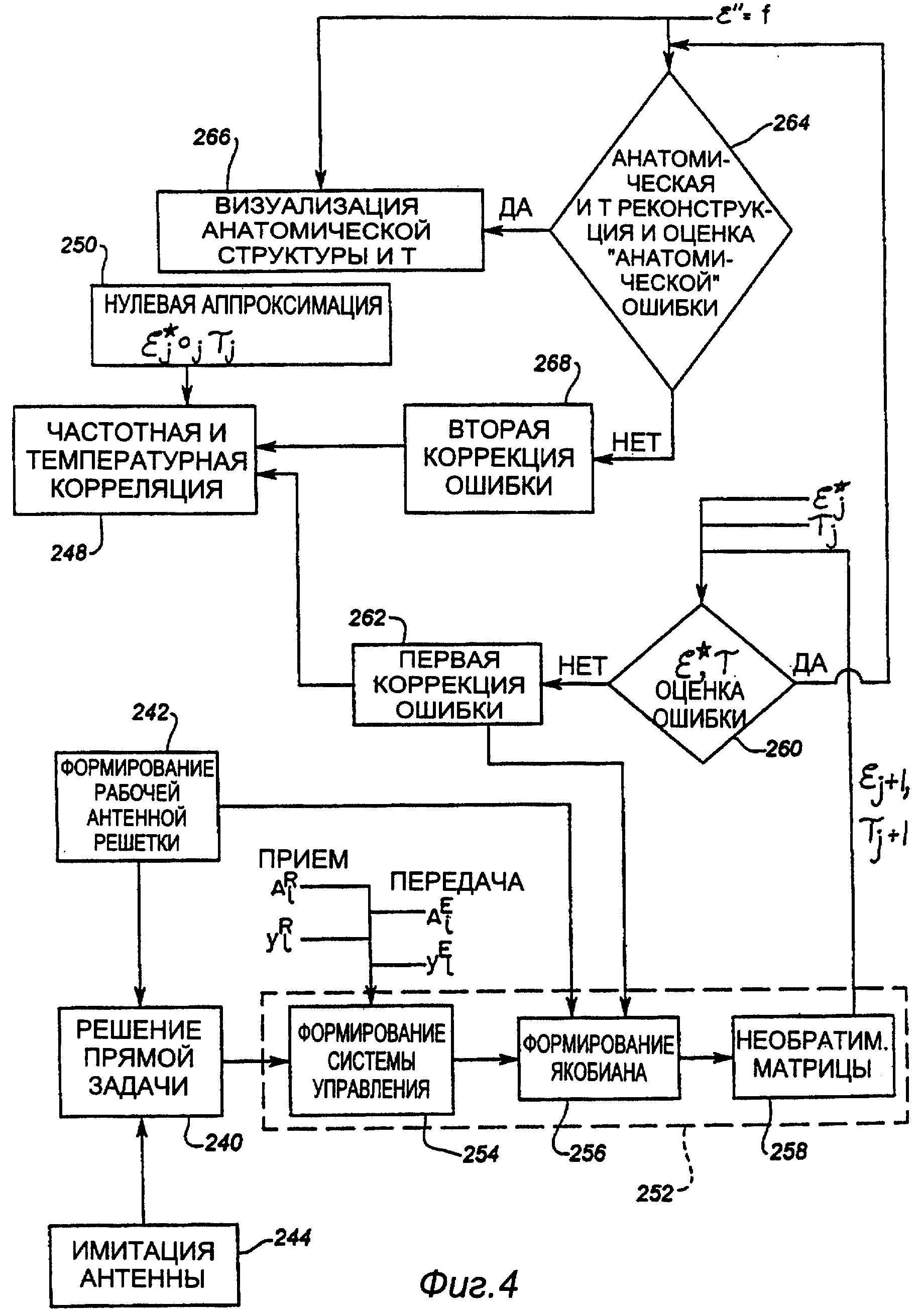
Фигура 4 изображает структурную схему альтернативного алгоритма реконструкции для решения обратной задачи.
Фигура 5 изображает график диэлектрических характеристик сердечной ткани собаки как функции сердечного цикла.
Фигура 6 изображает график диэлектрических характеристик сердечной ткани собаки как функции сердечного цикла.
Фигура 7 изображает график диэлектрических характеристик сердечной ткани собаки как функции смыкания и повторного смачивания.
Фигура 8 изображает график диэлектрических характеристик сердечной ткани собаки как функции смыкания и повторного смачивания.
Фигура 9 изображает график диэлектрических характеристик сердечной ткани собаки как функции смыкания и повторного смачивания.
Фигура 10 изображает график диэлектрических характеристик сердечной ткани собаки как функции смыкания и повторного смачивания.
Фигура 11 изображает график диэлектрических характеристик первого и второго порядка сердечной ткани собаки как функцию времени и частоты микроволнового излучения.
Фигура 12 изображает график диэлектрических характеристик первого и второго порядка сердечной ткани собаки как функцию времени и частоты микроволнового излучения.
Фигура 13 изображает график диэлектрических характеристик первого порядка сердечной ткани собаки по отношению к частоте микроволнового излучения.
Фигура 14 изображает график содержания кислорода в крови по отношению к диэлектрическим характеристикам второго порядка сердечной ткани собаки и частоте микроволнового излучения.
Фигура 15 изображает график содержания кислорода в крови по отношению к коэффициентам корреляции первого порядка диэлектрика и частоте микроволнового излучения.
Фигура 16 изображает график содержания кислорода в крови по отношению к коэффициентам корреляции второго порядка диэлектрика и частоте микроволнового излучения.
Фигура 17 изображает график коэффициентов диэлектрика первого и второго порядка, соотнесенных к общим коэффициентам корреляции гемоглобина и частоте микроволнового излучения.
Фигура 18 изображает график диэлектрических характеристик второго порядка для нормальной и больной ткани левого миокарда желудочка сердца человека, соотнесенный к частоте микроволнового излучения.
Фигура 19 изображает график диэлектрических характеристик первого порядка для нормальной и больной ткани левого миокарда желудочка сердца человека, соотнесенный к частоте микроволнового излучения.
Фигура 20 изображает увеличенный масштаб графика диэлектрических характеристик второго порядка для нормальной и больной ткани левого миокарда желудочка сердца человека, соотнесенный к частоте микроволнового излучения, изображенного на фиг.18.
Фигура 21 изображает структурную схему алгоритма выбора хирургического удаления.
Подробное описание изобретения
Фигуры 1 и 2 изображают принципиальные схемы устройства для топографической спектроскопии 10 согласно изобретению.
Применение настоящего изобретения возможно во многих областях, однако предпочтительно применять его в области медицины, как описано ниже. В частности, варианты осуществления настоящего изобретения, описанного ниже, касаются диагностики без нарушения целостности органа и терапии сердечной аритмии. Данное микроволновое устройство позволяет быстро и с высокой точностью производить обнаружение и локализацию сердечных аритмогенных фокусов, не нарушая целостность органа, а также проводить составление распределения характеристик сердца, не нарушая целостность органа. Устройство 10 выполняет эти процедуры, используя многочастотный режим, технологию кодирования сигнала, улучшенные математические алгоритмы и ранее не использовавшиеся функции корреляции. Эти и другие свойства изобретения будут очевидными из подробного описания, приведенного ниже.
Идентификация происхождения сердечной аритмии производилась ранее с использованием одного из трех основных способов: составления карты распределения характеристик с помощью катетера, составления карты распределения характеристик электрического возбуждения во время операции на сердце или составления карты распределения характеристик по электрическим потенциалам или магнитным полям на поверхности тела. Каждый из этих способов содержит реальный риск и ограничения. Например, составление распределения характеристик с помощью катетера и составление карты распределения характеристик возбуждения во время операции на сердце обязательно являются хирургическими операциями, им присущ ограниченный доступ, и они чувствительны ко времени. Составление карты распределения характеристик на поверхности тела может выполняться без нарушения целостности органа, с низкой степенью риска, но с такой плохой четкостью изображения, из-за которой полученные этим способом данные вообще рассматриваются непригодными для направленной терапии. Составление карты распределения характеристик может выполняться, используя последовательные временные изменения распределения электрического потенциала на поверхности тела или последовательные изменения магнитных полей на поверхности тела.
Настоящее изобретение не требует ввода катетера в тело, не требуется также вводить зонды в сердечную ткань. Однако, используя настоящее изобретение, становится возможным производить достоверную и точную (2-5 мм) трехмерную реконструкцию сердца и последовательности его электрического возбуждения. Использование технологических приемов, перечисленных ниже, для удаления аритмогенных мест производится без нарушения целостности организма и успешно использует различные частоты и направление пучков энергии таким образом, что порог удаления будет возникать только в требуемом месте. Настоящее изобретение предупреждает хирургическое вмешательство, например, с помощью систем для удаления, выполняемого катетерами или хирургическими процедурами при проведении направленной терапии.
Как кратко упомянуто выше, настоящее изобретение использует новые функции корреляции. Эти функции относятся к физическим свойствам ткани и изменениям этих свойств во время возбуждения клетки. В частности, поведение диэлектрических характеристик биологической ткани может быть определено двумя параметрами: диэлектрическая проницаемость и проводимость. Функции параметра включают частоту, температуру и тип ткани. Параметр типа ткани обеспечивает возможность определения анатомической структуры, измеряя переданную через ткань, то есть отраженную и рассеянную, электромагнитную энергию. Для гомогенных объектов диэлектрические характеристики можно легко определить, измеряя амплитуду и фазу переданного электромагнитного излучения. Однако задача усложняется при попытке измерить диэлектрические параметры, используя излучение, передаваемое через негомогенную биологическую ткань, используя простое измерение амплитуды и фазы передаваемой волны. Эта задача известна как "инверсия" или "обратная" задача, и она привлекла определенное внимание к ее решению. Настоящее изобретение включает сильную зависимость характеристик ткани от температуры, и решает "обратную" задачу новыми способами, используя многочастотное поле и конфигурации излучателей-приемников с различным расположением.
Изображенное на фигурах 1 и 2 устройство 10 содержит узел микроволновых излучателей-приемников 14, подходящий для установки на нем множества микроволновых излучателей-приемников 16. Предпочтительная конфигурация расположения излучателей-приемников - в виде круглой антенной решетки. Однако любые другие 3-мерные или 2-мерные конфигурации антенной решетки, подходящие для некоторых частей тела или для всего тела (например, "головы", "сердца", "руки", "ноги", и т.д.), являются применимыми в настоящем изобретении. Каждый излучатель-приемник 16 может радиально перемещаться относительно круговой антенной решетки. Узел 14 может также включать множество излучателей-приемников, размещенных вертикально. Источник питания 19 подает короткие импульсные электромагнитные сигналы энергии на каждый излучатель, которые создают падающую плотность мощности на объекте не более чем приблизительно 10 мВт/см2. Предпочтительно ширина полосы частот этих коротких импульсных сигналов сосредоточена между приблизительно 0,1 ГГц и приблизительно 6 ГГц и более предпочтительно внутри диапазона частот приблизительно от 0,2 ГГц до приблизительно 2,5 ГГц. Источник питания 19 может включать множество источников питания или единственный источник питания, типа генератора. В варианте осуществления, представленном на фигуре 2, источник питания 19 включает диагностический генератор 22 качающейся частоты, блок 24 управления диагностического генератора, генератор 27 удаления и блок 29 управления генератором удаления. Диагностический генератор 22 качающейся частоты вырабатывает многочастотную энергию малой мощности для использования в целях диагностики, в то время как генератор 27 удаления вырабатывает энергию большой мощности для микроволнового удаления обозначенных областей ткани. Выбор одного из вышеупомянутых генераторов выполняется переключателем 33, который соединяет выход одного из генераторов с излучателями 16.
Механизм формирования каналов 35 предназначен для активизации и управления каналами i, i+1, i+n, формируемыми для излучения энергии и ее приема. Эта подсистема содержит переключатель 36 номера канала, амплитудный аттенюатор-детектор манипулирования (АДМ) 39, фазовращатель-детектор 42, амплитудный детектор 45, фазовый детектор 48 и переключатель 53 режима антенны. При диагностировании переключатель 36 номера канала соединяет выход диагностического генератора 22 с входом излучателя (или множества излучателей) в любое определенное время. В режиме удаления или терапии переключатель соединяет все каналы с выходом генератора 27 удаления. Амплитудный аттенюатор-детектор 39 и фазовращатель-детектор 42 располагаются на пути излучения во всех каналах. Амплитудный аттенюатор-детектор 39 ослабляет амплитуду излучаемой энергии и вместе с фазовращателем-детектором 42 детектирует и кодирует выходной сигнал. Амплитудный детектор 45 и фазовый детектор 48 находятся на пути приема всех каналов и в режиме диагностики детектируют и декодируют амплитуду и фазу принимаемого сигнала. Считается, что другие средства кодирования, например, с помощью изменения полярности могут потребовать применение дополнительных кодирующих-декодирующих компонентов. Переключатель 53 режима антенны работает во всех каналах для соединения выхода путей излучения с антенной или путями приема, в пути приемника, с применением той же самой антенны.
Средство 65 вычисления и управления модуля включает центральное процессорное устройство (ЦПУ) 68, подсистему 72 разделительной среды, дисплей 75 и программное обеспечение 77 дисплея, а также запоминающее устройство 82. Подсистема 72 разделительной среды состоит из цифроаналогового преобразователя (преобразователей) (ЦАП) 86, мультиплексора 89, аналого-цифрового преобразователя (АЦП) 92, а также блока 94 управления, который задает синхронизацию времени регулируемых процессов и получает данные, которые будут подвергаться анализу.
Вспомогательная подсистема 102 включает термостатический щит 105 для управления температурой согласующей среды 106. Подходящей согласующей средой, например, может быть жидкость типа титановых и бариевых растворов. Другие подходящие жидкости (или субстраты), типа специально гомогенизированных растворов жиров, также являются применимыми в настоящем изобретении. Эти жидкости имеют исходную регулируемую диэлектрическую проницаемость в диапазоне приблизительно от 50 до 90 при частоте 2,45 ГГц и потерях в диэлектрике приблизительно от 5 до 25 между излучателями-приемниками 16; подсистема 102 также содержит блок 108 терморегулятора для управления термостатическим щитом 105 и блок 111 основного канала управления для управления принимаемым сигналом из Вi каналов управления, когда устройство 10 находится в режиме калибровки. Дополнительные вспомогательные компоненты могут быть добавлены в зависимости от желательных свойств функционирования устройства, например, может быть целесообразно подключить к устройству 10 анализатор электрокардиограмм и/или принтер 119.
В многочастотном томографическом устройстве спектроскопии 10 ткань 135 нацеливания последовательно облучается микроволновым излучением низкой энергии с первого до n-ого излучателя (приемника) 16 при одновременном проведении измерения принимаемых сигналов в (излучателях) приемниках 16, которые на этом конкретном этапе работы не функционируют как излучатели. Для приема сигнала, передаваемого одним излучателем-приемником 16 в каждый момент времени используются несколько излучателей-приемников 16. Устройство 10 последовательно быстро сменяет номер канала и режим работы антенны в соответствии с вышеуказанной конфигурацией. После одного цикла передачи и приема n-ого канала быстрый диагностический генератор 22 качающейся частоты выполняет другой цикл переключаемых измерений n-ого канала. Общее количество измерений в цикле обычно не превышает N×M, где N - количество антенн и М - количество используемых частот диагностики. Считается также, что одновременно проводимые измерения могут быть выполнены с использованием многочастотной конфигурации с кодированием. Выполняя измерения, устройство 10 решает "обратную" задачу в соответствии с полученной информацией и новыми алгоритмами, более полно описанными ниже со ссылками на фигуры 3 и 4. При выполнении измерений физиологических изменений важно понимать время, которое требуется для достижения физиологического события, чтобы произошло, например, сокращение миокарда. Эти интервалы времени определены как временные циклы события в ткани.
Сбор данных в устройстве 10 выполняется в течение временных интервалов, которые являются частью цикла временного цикла события в ткани так, что сбор данных может происходить много раз в течение каждого события в ткани, и эти данные могут сохраняться в запоминающем устройстве 82. Время, затрачиваемое на реконструкцию, достаточно мало, чтобы движение тела было проблемой. Анатомическая структура объекта и температурные профили наблюдаются на дисплее 75, изображение которого можно регулировать, используя программное обеспечение 77 дисплея, и оно может быть напечатано с помощью принтера 119. Аритмогенные зоны сердца опредены как области с конкретными значениями ε’ и ε’’. Пространственные координаты этих зон определяются с помощью программного обеспечения дисплея, ЦПУ, и запоминающего устройства.
Во время циклов измерения устройство 10 периодически осуществляет коррекции температурного контроля согласующей среды 106 с помощью блока 108 термостатического контроля. Устройство 10 также синхронизируется с циклом сердца, ткань которого подвергается исследованию с использованием анализатора 115 электрокардиограмм.
Главной особенностью устройства 10, которая дает возможность обеспечить быстроту и точность вычисления, является использование кодирующего устройства для кодирования микроволновых сигналов, подаваемых на излучатели. Когда приемники принимают соответствующие сигналы после взаимодействия их с тканью, можно определить излучатель или группу излучателей, передавших эти сигналы. Предпочтительной техникой кодирования является фазовая, амплитудная или полярная модуляция; однако в пределах рассмотрения настоящего изобретения находится также применение и частотной модуляции. Частотная модуляция может быть полезна в определенных случаях применения, где требуется одновременное излучение из целого ряда излучателей.
Устройство 10 представляет собой один из вариантов воплощения с использованием этапов нового способа в соответствии с настоящим изобретением, которые позволяют производить микроволновую томографическую спектроскопию ткани без нарушения целостности органа. Настоящий способ содержит этапы: обеспечения источника питания микроволнового излучения; обеспечения набора микроволновых излучателей-приемников; и управления этим набором микроволновых излучателей-приемников таким образом, что этот набор излучателей-приемников может излучать многочастотные микроволновые сигналы, поступающие от источника питания на набор излучателей-приемников, которые принимают микроволновое излучение. Дальнейшие этапы включают; размещение согласующей среды между излучающими и принимающими микроволновыми излучателями-приемниками для обеспечения диэлектрического соответствия, размещение исследуемой ткани, которая будет подвергаться облучению внутри согласующей среды; излучение микроволновой энергии из микроволновых излучателей-приемников; прием микроволнового излучения микроволновыми излучателями-приемниками после его взаимодействия с исследуемой тканью; и измерение изменения в микроволновом излучении после его взаимодействия с исследуемой тканью.
Как описано выше, для вычислений, связанных с решением "обратной" задачи, используются новые алгоритмы. В настоящем изобретении не используются аппроксимации, такие как аппроксимация Борна, описанная выше, для определения параметров диэлектрика или проводимости негомогенных облучаемых объектов ткани. Вернее этап измерения, приведенный выше, включает как старую, так и новую концепции для очистки и обеспечения воспроизводства информации, полученной в этой форме генерации электромагнитного изображения. В частности, как показано на диаграмме, изображенной на фиг.3, этап измерения содержит вычисления, использующие компонент 220 формирования входной информации, компонент 222 решения прямой задачи, компонент 224 решения обратной задачи, компонент 226 многочастотной корреляции, управление формированием компьютерного изображения 236 и томографическое спектроскопическое изображение 238.
Решение прямой задачи является известным способом вычисления, который решает параметры микроволнового распространения от излучателя к приемнику через биологическую среду. Решение обратной задачи позволяет точно рассчитать и сгенерировать полезное томографическое спектроскопическое изображение ткани, основываясь на измеренных изменениях микроволнового излучения. Этапы решения обратной задачи содержат компонент 228 определения функционального формирования, на котором суммируются входные сигналы всех излучателей-приемников; использование компонента 230 формирования градиента как производной компонента функционального формирования для упрощения скорости обработки; вычисление параметра минимизации "тау" для проверки точности функции градиента и для выполнения реконструкции с наилучшей точностью; а также выполнение вычисления 234 Е*. При вычислении 234 Е* использует следующую форму:

где указанные ε’ и ε’’ являются величинами диэлектрической проницаемости и потерь, измеренные в соответствии с настоящим изобретением, которые представляют собой мнимое число. Использование ε* в качестве представления ε’ и ε’’ является удобным математическим инструментом. Следует понимать, что настоящее изобретение может также использовать ε’ и/или ε’’ как измеряемый диэлектрический параметр для генерирования изображения. Причина, по которой используется ε*, состоит в том, что диэлектрический контраст между тканью и/или физиологическими состояниями ткани может быть определен как разность или изменение величин ε’ и/или ε’’. Если ε’ и ε’’ вычисляются вместе как ε*, то будет определено любое изменение параметра диэлектрика величин ε’ и ε’’ при вычислении ε*. Как будет показано ниже, некоторые физиологические изменения параметра диэлектрика лучше всего могут быть оценены с использованием только величины ε’ и ε’’. Важно признать, что везде, где бы не использовалась величина ε*, вместо нее может также использоваться ε’ или ε’’.
Схема процесса, изображенного на фиг.4, представляет собой вариант воплощения настоящего изобретения, который может также использоваться в катетерной системе. Информация поступает на этап 240 решения прямой задачи с этапа 242 формирования рабочей антенной решетки и этапа 244 имитации антенны. Этап 242 формирования рабочей антенной решетки принимает информацию из этапа 248 частотной и температурной корреляции, который берет свои исходные значения с этапа 250 нулевой аппроксимации. На этапе 244 имитации антенны вырабатываются величины для начала процесса вычислений, которые работают как базовая линия, от которой конструируется изображение. Этап 240 решения прямой задачи затем позволяет решить задачу формирования изображения, основываясь на знании величин амплитуды и фазы излучаемой микроволновой энергии, и делая предположение относительно того, каким должно быть воздействие диэлектрика биологической ткани, и вычисляя ожидаемые величины амплитуды и фазы для переданной микроволновой энергии. Это решение с этапа 240 решения прямой задачи затем передается на этап 252 решения обратной задачи, который содержит этап 254 формирования системы уравнения, этап 256 формирования Якобиана и этап 258 необращения матрицы. Этап 252 решения обратной задачи затем вычисляет изображение биологической ткани, основываясь на известных значениях амплитуды и фазы излучаемой микроволновой энергии и известных принятых величинах амплитуды и фазы сигналов, излучаемых антенной решеткой излучателей-приемников. В действительности решение обратной задачи представляет собой генерирование томографического изображения, основываясь на знании амплитуды и фазы излученной микроволновой энергии и амплитуды и фазы переданной и принятой микроволновой энергии для вычисленния диэлектрических характеристик биологической ткани, через которую прошла микроволновая энергия. Эта информация об изображении из этапа 258 формирования необращения матрицы затем проходит через процесс итерационного корректирования ошибок, включающий этап 260 оценки ошибки и этап 262 первой коррекции ошибки. Для каждого значения излучаемой и принимаемой амплитуды и фазы, где i равно 1-n, на этапе 258 необращения матрицы, вместе с оценкой ошибок 260 и первой коррекцией ошибки 262, формируется итерационная петля, которая начинается с ввода первой точки сетки ε*ΔТ в этап 260 оценки ошибки. Для каждого значения i от 1-n генерируются величины ε*j+1, Тj+1, где j - это номер ячейки сетки в системе координат для генерирования двух- или трехмерного изображения и где j равно величинам, начиная с 1- n. После того как каждая величина ε*, T пройдет этап оценки ошибки и первой коррекции ошибки, эти величины затем передаются на этап 264 анатомической и Т-реконструкции и этап оценки анатомической ошибки. В этом месте величины, которые были поданы на этап 264 оценки ошибки, сравниваются с величиной ε’’, и, если появляются ошибки, величина передается на этап 266 визуализации анатомической структуры и Т, который служит для генерирования двумерного или трехмерного изображения биологической ткани, основываясь на диэлектрическом контрасте. Однако, если на этапе оценки ошибки не будет выработан соответствующий отклик, информационная точка передается на этап 268 второй коррекции ошибки, который подстраивает совместно с этапом 262 первой коррекции величины, генерируемые на этапе 248 частотной и температурной корреляции.
На фигуре 5 изображен график, демонстрирующий возможности устройства 10 определять возбуждение сердца по изменению диэлектрических характеристик сердечной ткани. В частности, на фигуре 5 изображено изменение величины ε’ в начале, через некоторый период ΔТ1 процесса электрического возбуждения и в течение переходного периода ΔТ2 восстановления. На фигуре 6 изображены аналогичные возможности определения для устройства 10, но для величин ε’’ параметра диэлектрика. На обеих фигурах 5 и 6, каждая точка представляет среднюю величину для семи измерений.
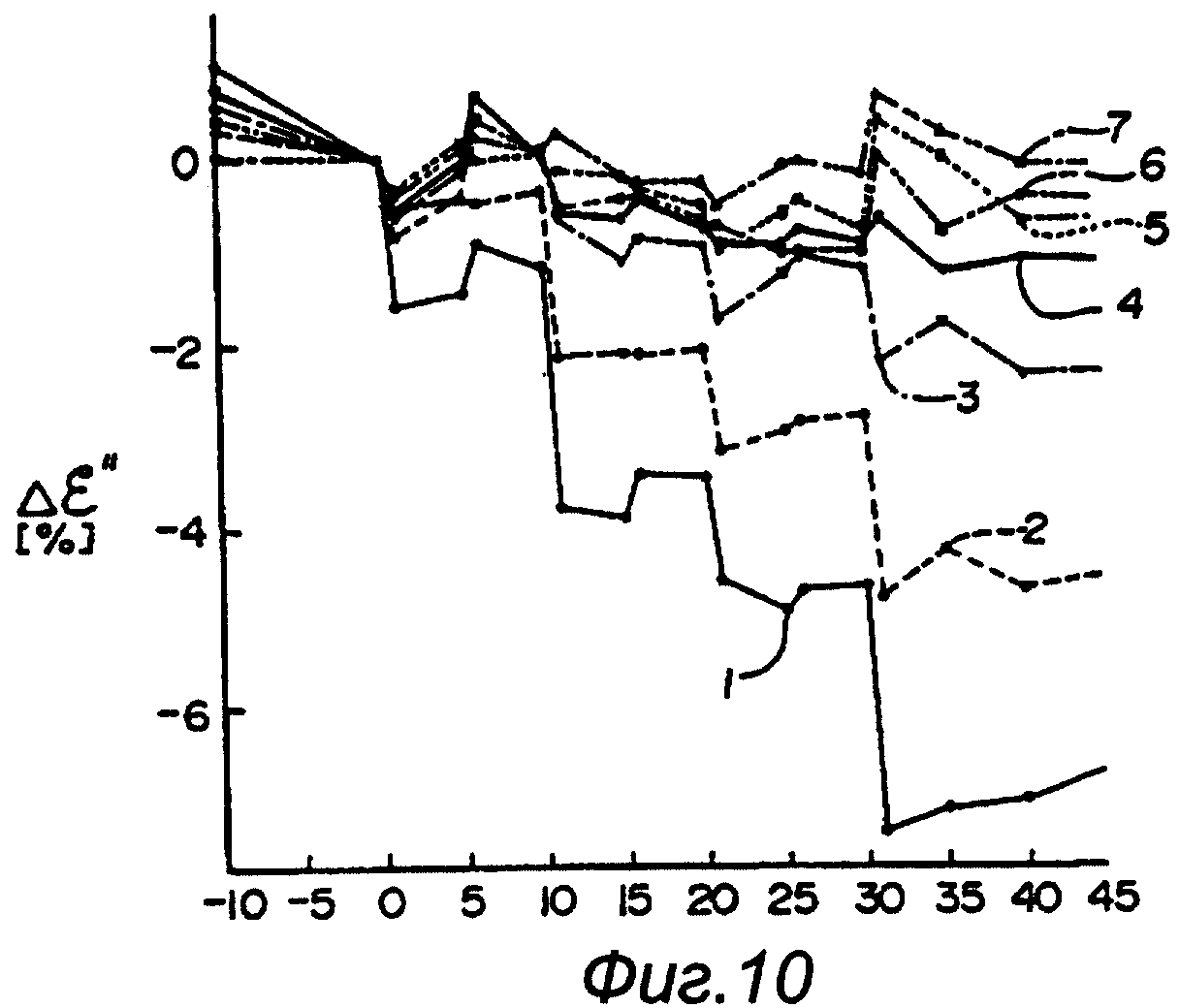
На фигурах 7-10 изображены графики, демонстрирующие процентное изменение избранных диэлектрических характеристик, для многочастотного облучения во время серии коронарных артериальных окклюзий. На фигурах 7 и 8 изображена, в течение длительного времени, серия коротких окклюзий, за которыми следует одна длинная окклюзия. Эти фигуры демонстрируют корреляцию диэлектрических характеристик для ε’ и ε’’ в зависимости от степени ишемии сердца. Такое распределение диэлектрических изменений соответствует известному явлению в ткани, представляющему защитный эффект от условий, предшествующих полной окклюзии. На фигурах 9 и 10 изображена, в течение короткого времени, серия коротких окклюзий, за которыми следует длительная окклюзия. Эти фигуры подтверждают вывод, сделанный выше по отношению к фигурам 7 и 8.
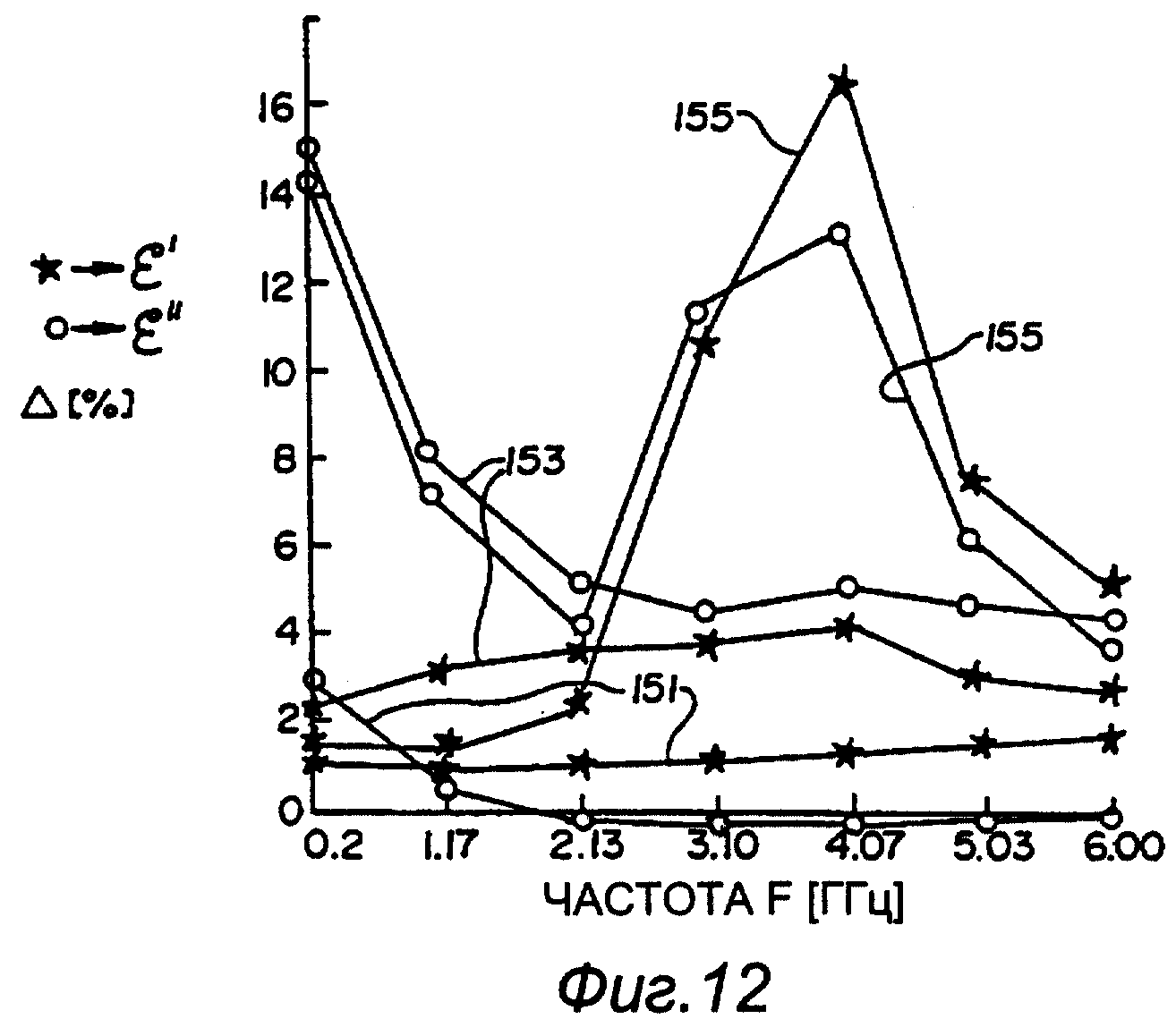
На фигуре 10 представлен еще один пример величин многочастотного спектроскопического анализа ткани. На этой фигуре кривая величин в процентном изменении ε’’ на частоте 4,1 ГГц является относительно плоской и менее пригодной по сравнению с соответствующими величинами на частотах 0,2 ГГц или 1,17 ГГц. Это подчеркивает необходимость в устройстве 10 для определения явления возбуждения ткани и других физиологических событий, например ишемии, с использованием многочастотной технологии, которые, в другом случае, могут остаться необнаруженными или неприемлемыми для анализа с применением одной частоты. Это дополнительно продемонстрировано на графиках ε*(f), изображенных на фигурах 11 и 12, на которых кривые 145, 147, 149, 151, 153 и 155 представляют время после окклюзии (то есть острой ишемии) через 0, 15, 30, 45, 120 и 125 минут соответственно для ε’ (показано кривыми с метками *) и ε’’ (показано кривыми с метками о). Величина Δ ранее была Δε*/ε*. Повторное смачивание возникало через 125 минут и представлено кривой 155. Эти фигуры демонстрируют, что, если анализ ограничен до применения одной частоты, в течение коротких периодов возбуждения ткани получается очень небольшое количество пригодной для использования информации. Однако, если выполняется многочастотный анализ в достаточной степени одновременно, то физиологические явления ткани будут четко выявлены.
На фигурах 13 и 14 изображена корреляция диэлектрических характеристик содержания оксигемоглобина в крови. На фигуре 13 диэлектрическая характеристика представляет собой процент (ε ’(HbО2)-ε’(86,9))/ε’(86,9), а на фигуре 14 диэлектрическая характеристика представляет процент от (ε’’(НbO2)-ε’’(86,9))/ε’’ (86,9). На каждой фигуре кривые частот 161, 163, 165, 167, 169, 171 и 173 соответствуют частотам 0,2 ГГц, 1,14 ГГц, 2,13 ГГц, 3,12 ГГц, 4,01 ГГц, 5,0 ГГц, и 6,0 ГГц соответственно.
Диэлектрическая проницаемость оксигемоглобина (НbO2), парциальное давление кислорода (РО2) и общее содержание гемоглобина (tHb) коррелируют в диапазоне микроволновой частоты 0, 2-6 КГц на фигуре 15. Наивысшая степень корреляции для оксигемоглобина происходит в диапазоне частот между 0,5-2,5 МГц. В этом диапазоне величина диэлектрической проницаемости ε’ наиболее чувствительна к содержанию насыщенности окскгемоглобина крови.
Кривая коэффициента корреляции для ε’’, диэлектрических потерь, изображена на фигуре 16. Коэффициент корреляции для НbО2 наибольший на частоте приблизительно 2 ГГц с коэффициентом корреляции РО2, приблизительно равномерным в диапазоне от 2,5 до 4 ГГц.
Исследования коэффициентов корреляции, изображенных на фигурах 15 и 16, представляют возможности использования настоящего изобретения для разделения процента насыщения оксигемоглобином (HbО2) и РО2. Oбе из этих величин представляют собой важные части информации, необходимой для лечения сердцa. В настоящее время существует средство определения процента насыщения оксигемоглобином в режиме реального времени во время ухода за больным, называемое оксиметром. Однако для получения величины РО2 из пациента следует изъять артериальную кровь специальными шприцами и пропустить ее через машину, способную выполнять непосредственные измерения парциального давления газов в жидкости.
Кривые ε’ и ε’’ общего содержания гемоглобина как исходные величины для вычисления коррелляции изображены на фигуре 17. Как видно, кривая ε’ имеет достаточно плоскую кривую корреляции, которая в достаточной степени не коррелирует, сохраняя величины корреляции меньше чем 0,995 практически нa протяжении всей кривой. Кривая ε’’, однако, показывает увеличение корреляции по отношению к общему содаржанию гемоглобина для микроволнового частотного диапазона от 4 до 5 ГГц. Как отмечено выше, при обсуждении, имеющем отношение к Фигурам 3 и 4, величины корреляции для оксигемоглобина PО2и полного содержания гемоглобина могут быть точно получены из этих кривых корреляции во время сканирования одной частотой в диапазоне от 0,2 до 6 ГГц и вычисления величин диэлектрической проницаемости ε’ и диэлектрических потерь ε’’ для крови. Концентрация насыщения оксигемоглобина была бы затем в наилучшей степени скоррелирована с величинами ε’ на частоте приблизительно 1,5 ГГц, величина РО2 могла бы быть вычислена из величины корреляции диэлектрических потерь в ткани ε’’, вычисляемых на частоте приблизительно 3,5 ГГц и величина tHb может быть вычислена из величины корреляции кривой диэлектрических потерь ε’’, вычисляемой на частоте приблизительно 4,5 ГГц. На каждое сканирование в частотном диапазоне от 0,2 до 6 ГГц может потребоваться не более чем несколько миллисекунд микроволнового облучения, и затем будет производиться вычисление величины. Таким образом, настоящее изобретение позволяет использовать его в виртуальном режиме реального времени для оценки этих параметров при ухаживании за больным.
Настоящее изобретение позволяет производить мониторинг в режиме реального времени процентного насыщения величин НbO2 и РО2 при ухаживании за больным. Настоящее изобретение позволяет производить это без необходимости извлечения крови из пациента и без задержек и затрат, связанных с отправкой крови на лабораторный анализ.
Настоящее изобретение не ограничивается измерением величин НbО2 и РО2. Любые компоненты крови и ткани, обладающие характеристикой диэлектрического контраста, можно подвергать прямому измерению и оценкам в режиме реального времени, не нарушая целостности органа, используя настоящее изобретение. Настоящее изобретение также обладает способностью определять изменения диэлектрических характеристик, которые происходят в ткани, которая становится больной. В качестве примера была восстановлена ослабленная больная аневризмическая часть левого желудочка десятилетнего самца. Во время этого восстановления больная часть была подвергнута резекции из сердца таким образом, что больная часть была полностью удалена. При этом требуется, чтобы края резекции содержали нормальный миокард. Настоящее изобретение использовалось для оценки этой части сердечной ткани, подвергшейся резекции, и оценки результатов изображены на фигурах 18-20.
Характеристика диэлектрических потерь ε’’ нормального миокарда показана на фигуре 18 как кривая 200, измерения которой производились с помощью микроволнового излучения с частотой в диапазоне от 0,2 до 6 ГГц. Во всем частотном диапазоне эта нормальная ткань четко отличается от ненормальной ткани, представленной кривой 202.
На фигуре 19 показана характеристика диэлектрической проницаемости ε’ для тех же образцов ткани. Нормальная ткань имеет одиночную кривую ε’, представленную кривой 204. Ненормальная ткань показана кривой 206. Нормальная ткань миокарда отличается от ненормальной ткани миокарда во всем частотном диапазоне с использованием настоящего изобретения.
На фигуре 20 изображена увеличенная шкала графического представления той же самой информации диэлектрических потерь ε’’, изображенной на фигуре 18. Кривая 208 представляет величину ε’’ для нормальной ткани миокарда, и кривая 210 представляет величины для ненормальной ткани миокарда.
Настоящее изобретение позволяет использовать эту разницу диэлектрических характеристик для генерации изображения. Например, в случае, когда устройство 10, представленное на фигурах 1-4, сканирует грудную клетку пациента, акатомическое изображение органов получается на основе разности диэлектрических характеристик между различными тканями, как показано на фигурах 5-12 и 18-20. Кроме того, настоящее изобретение позволяет определить анатомическое местоположение больной ненормальной ткани внутри нормальной ткани. Эта анатомическая информация используется различными путями. Примером одного важного варианта использования может быть проведение прямой терапии в режиме реального времени. Часто ненормальная ткань миокарда вызывает вредные нарушения ритма. К сожалению, эта ненормальная ткань может быть визуально неотличима от окружающего нормального миокарда. Настоящее изобретение позволяет проводить получение изображения в режиме реального времени ненормальной ткани, основываясь на разности диэлектрических характеристик, таких как показаны на фигурах 18-20. Используя процедуры быстрой реконструкции и сканирования по частотному диапазону в течение периода времени, которые являются малой частью временного цикла события в ткани, клиницист создает карту ненормальной ткани. В зависимости от того, какая частота и диэлектрическая характеристика подвергались оценкам, исследователь может реконструировать диэлектрические свойства для генерации карты функционального возбуждения, используя область ненормальной ткани, или в качестве альтернативы может реконструировать временную карту изменений и коррелирующие с ней временные изменения известных электрических маркеров для аномалий внутри ткани. Клиницист может затем применить терапию прямого удаления для удаления этого фокуса ненормального ритма и оценить адекватность удаления ткани.
Один из вариантов воплощения настоящего изобретения с использованием лазера или источника микроволновой энергии для удаления изображен на фигуре 21. Как описано, способ удаления повреждения, например аритмогенный фокус внутри нормальной ткани миокарда, выполняется начиная с формирования исходных данных на этапе 300 на основе анализа анатомической структуры, полученного из информации, генерируемой с помощью варианта изобретения, изображенного на фигуре 2, и ожидаемого распределения величины температуры. Этап формирования исходных данных использует информацию от микроволнового источника питания как этап 302 аппроксимации или с этапа 304 аппроксимации источника питания лазера для получения исходной информации, которая подается на решение прямой задачи 306 для микроволнового излучения или решение прямой задачи 308 для управления лазером. Этап определения для определения возможности применения источников питания микроволновой энергии или лазера выполняется на этапе 310. Результат этого определения передается на источники и банк данных 312 корреляции повреждений для обеспечения этапа 314 аппроксимации, на который также вводится информация от этапа 316 имитации антенны. Текущее значение ожидаемой температуры вычисляется на этапе 318 и корректируется для нелинейности температуры на этапе 320. Результаты решения прямой задачи для микроволнового излучения или лазера 306, 308 совместно со скорректированным значением текущей температуры с этапа 320 вводятся в решение 322 уравнения биологического тепла для определения результата решения действительной температуры. Распределение температуры с этапа 322 решения биологического уравнения передается на этап 324 локализации повреждения, который передает информацию обратно в банк данных 312 корреляции повреждения для выполнения следующей аппроксимации вплоть до этапа формирования 300 исходных данных для следующего определения этапа 322 решения уравнения биологического тепла. Информация с этапа 322 решения уравнения также подается на этап формирования различных необходимых повреждений текущего повреждения для сравнения текущего размера повреждения с ожидаемым размером необходимого повреждения для определения того, была ли достигнута оптимальная терапия или нет. В случае, если лечение достигло своей цели, решение затем передается на этап 328 оптимальной области. Если текущее повреждение отличается от необходимого повреждения, информация о разности передается обратно на этап 312 банка данных корреляции источников повреждения для повторения этапа 314 аппроксимации и далее через этап 300 формирования исходных данных для выполнения следующего лечения для того, чтобы получить более близкую аппроксимацию необходимого повреждения при лечении. Количество этапов итеративного процесса контролируется переключателем 330 с одновременным выполнением сравнения ожидаемого положения и размеров повреждения на этапе 332 на этапе 0, этап 334. Для количества этапов больше 0 переключатель 330 переключается на положение этапа 336, большего нуля. Весь процесс постоянно подвергается пересмотру оценок величин для гарантирования полной терапии удалением, и эти повторные оценки повреждения производятся в режиме реального времени с помощью генерирования на основе анализа анатомической структуры полученной системы формирования изображения на основе микроволновой томографии.
Настоящее изобретение позволяет, используя микроволновую энергию новым способом, производить быструю оценку биологической функции и анатомической структуры в режиме реального времени с помощью решения обратной задачи для диэлектрических характеристик биологических тканей. Настоящее изобретение позволяет достигать существенного увеличения скорости обработки, а также существенного улучшения разрешающей способности по сравнению с любыми другими системами известного уровня техники. Настоящее изобретение также предоставляет возможность проведения оценки параметров в режиме реального времени для определения концентраций биологических компонентов или физиологических характеристик, основываясь на диэлектрическом контрасте между различными состояниями физиологической активности для биологических компонентов или физиологической реакции.
Реферат
Изобретение относится к медицинской технике, а именно к устройствам и способам получения внутреннего структурного изображения биологических тканей. Устройство для микроволновой томографической спектроскопии ткани включает множество микроволновых излучателей-приемников, пространственно ориентированных на ткань, согласующую среду, устройство управления для выборочного управления через подсистему формирования каналов, кодирующее устройство которой выполнено с возможностью кодирования микроволнового излучения и декодирования принимаемого сигнала от множества излучателей-приемников. При этом при осуществлении способа идентификации дискретных сигналов по отношению к антенным решеткам декодирование проводят с возможностью определения излучившего его излучателя-приемника. При проведении микроволновой томографической спектроскопии множеством излучателей-приемников управляют так, чтобы они через систему формирования канала излучали многочастотное микроволновое излучение. Использование изобретения позволяет производить быструю оценку биологической функции и анатомической структуры в режиме реального времени. 4 н. и 31 з.п.ф-лы, 21 ил.


Комментарии