Мутантные иммуноглобулин-связывающие полипептиды - RU2701695C2
Код документа: RU2701695C2
Чертежи






























Описание
Техническая область изобретения
Настоящее изобретение относится к области аффинной хроматографии и более конкретно к мутантным иммуноглобулин-связывающим доменам белка А, которые являются полезным в аффинной хроматографии иммуноглобулинов. Изобретение также относится к мультимерам мутантных доменов и к разделительным матрицам, содержащим мутантные домены или мультимеры.
Предшествующий уровень техники
Иммуноглобулины представляют собой наиболее распространенные биофармацевтические продукты как в производстве, так и в разработке во всем мире. Высокий коммерческий спрос и, следовательно, значение этого конкретного терапевтического рынка привели к большому вниманию, уделяемому фармацевтическими компаниями к максимальному увеличению продуктивности соответствующих процессов получения mAb с контролем за связанными с этим затратами.
В большинстве случаев аффинную хроматографию используют в качестве одной из ключевых стадий в очистке таких иммуноглобулиновых молекул, например моноклональных или поликлональных антител. Особенно интересным классом аффинных реагентов являются белки, способные специфически связываться с неизменяемыми частями молекулы иммуноглобулина, причем такое взаимодействие не зависит от антигенсвязывающей специфичности антитела. Такие реагенты могут широко использоваться для извлечения иммуноглобулинов с помощью аффинной хроматографии из разных образцов, таких как, но без ограничения ими, препараты сыворотки или плазмы, или исходные материалы, получаемые из клеточных культур. Примером такого белка является стафилококковый белок А, содержащий домены, способные связываться с фрагментами Fc и Fab иммуноглобулинов IgG разных видов. Эти домены обычно обозначаются как Е-, D-, А-, В- и С-домены.
Реагенты на основе стафилококкового белка A (SpA) из-за их высокой аффинности и селективности нашли широкое применение в биотехнологической области, например в аффинной хроматографии для захвата и очистки антител, а также для обнаружения или количественного определения. В настоящее время аффинная среда на основе SpA вероятно является наиболее широко используемой аффинной средой для выделения моноклональных антител и их фрагментов из разных образцов, включая супернатанты промышленных клеточных культур. Соответственно, различные матрицы, содержащие лиганды на основе белка А, имеются в продаже, например в форме нативного белка А (например Protein A SEPHAROSE™, GE Healthcare, Uppsala, Sweden), а также содержащие рекомбинантный белок А (например rProtein A-SEPHAROSE™, GE Healthcare). Более конкретно, генетическая манипуляция, осуществляемая в коммерческом продукте - рекомбинантном белке А, направлена на облегчение его прикрепления к подложке и на повышение продуктивности лиганда.
Эти применения, аналогично другим применениям аффинной хроматографии, требуют тщательного внимания к окончательному удалению загрязнений. Такими загрязнениями могут быть, например, неэлюированные молекулы, адсорбированные на неподвижной фазе или матрице в хроматографическом процессе, такие как нежелательные биомолекулы или микроорганизмы, включая, например, белки, углеводы, липиды, бактерии и вирусы. Удаление таких загрязнений из матрицы обычно осуществляют после первого элюирования целевого продукта для регенерации матрицы перед следующим использованием. Такое удаление обычно включает процедуру, известную как безразборная мойка (CIP), где используются агенты, способные элюировать загрязняющие вещества из неподвижной фазы. Одними из таких часто используемых классов агентов являются щелочные растворы, которые пропускают через указанную неподвижную фазу. В настоящее время наиболее широко используемым чистящим и дезинфицирующим средством является NaOH, и его концентрация может варьироваться от 0,1 вплоть до, например, 1 M в зависимости от степени и характера загрязнения. Эта стратегия связана с воздействием на матрицу растворов, имеющих рН выше 13. Для многих матриц для аффинной хроматографии, содержащих белковые аффинные лиганды, такие щелочные условия являются очень жесткими и в результате приводят к уменьшению емкости вследствие нестабильности лиганда при высоком рН.
Поэтому обширные исследования были сосредоточены на разработке сконструированных белковых лигандов, которые обладают повышенной способностью выдерживать щелочные значения рН. Например, в






Недавние работы показывают, что изменения также могут быть сделаны в белке A (SpA) для получения аналогичных свойств. В публикации патентной заявки US 2005/0143566, которая включена в данный документ посредством ссылки во всей своей полноте, раскрыто, что, когда по меньшей мере один аспарагиновый остаток мутирован в аминокислоту, отличную от глутамина или аспарагиновой кислоты, такая мутация обеспечивает повышенную химическую стабильность при значениях рН вплоть до примерно 13-14 по сравнению с родительским SpA, таким как В-домен SpA или белок Z, синтетическая конструкция, полученная из В-домена SpA (US 5143844, включенный посредством ссылки во всей полноте). Авторы показывают, что, когда такие мутантные белки используются в качестве аффинных лигандов, разделительные среды, как ожидается, могут лучше выдерживать процедуры очистки с использованием щелочных агентов. Дополнительные мутации доменов белка А с целью повышения щелочной стабильности также были опубликованы в WO 2008/039141, JP 2006304633 А, ЕР 1992692 А1, ЕР 2202310 А2, WO 2010/110288, WO 2012/086660, WO 2012/083425, WO 2012/087230 и WO 2014/146350, все из которых включены в данное описание изобретения посредством ссылки во всей их полноте. Однако, имеющиеся в настоящее время мутанты все еще чувствительны к щелочному рН, и концентрация NaOH во время очистки обычно ограничена 0,1 М, что означает, что трудно достичь полной очистки. Более высокие концентрации NaOH, которые улучшили бы очистку, приводят к неприемлемым потерям емкости.
Таким образом, в данной области все еще существует потребность в получении разделительной матрицы, содержащей белковые лиганды, обладающие дополнительно улучшенной стабильностью в процедурах щелочной очистки.
Краткое изложение сущности изобретения
Один аспект изобретения заключается в создании полипептида с улучшенной щелочной стабильностью. Это достигается с помощью полипептида, определенного в п. 1 формулы изобретения.
Одно из преимуществ заключается в том, что щелочная стабильность улучшена по сравнению с родительскими полипептидами с сохранением высокоселективного связывания с иммуноглобулинами и другими Fc-содержащими белками.
Второй аспект изобретения состоит в том, чтобы предложить мультимер с улучшенной щелочной стабильностью, содержащий множество полипептидов. Это достигается с помощью мультимера, определенного в формуле изобретения.
Третий аспект изобретения заключается в предложении нуклеиновой кислоты или вектора, кодирующего полипептид или мультимер с улучшенной щелочной стабильностью. Это достигается с помощью нуклеиновой кислоты или вектора, как определено в формуле изобретения.
Четвертый аспект изобретения заключается в предложении экспрессирующей системы, способной экспрессировать полипептид или мультимер с улучшенной щелочной стабильностью. Это достигается с помощью экспрессирующей системы, как определено в формуле изобретения.
Пятый аспект изобретения заключается в создании разделительной матрицы, способной селективно связывать иммуноглобулины и другие Fc-содержащие белки и демонстрирующей улучшенную щелочную стабильность. Это достигается с помощью разделительной матрицы, как определено в формуле изобретения.
Шестой аспект изобретения заключается в предложении эффективного и экономичного способа выделения иммуноглобулина или другого Fc-содержащего белка. Это достигается с помощью способа, определенного в формуле изобретения.
Другие подходящие воплощения изобретения описаны в зависимых пунктах изобретения.
Определения
Термины "антитело" и "иммуноглобулин" используются здесь взаимозаменяемо и под ними подразумеваются также фрагменты антител, слитые белки, содержащие антитела или фрагменты антител, и конъюгаты, содержащие антитела или фрагменты антител.
Термины "Fc-связывающий полипептид" и "Fc-связывающий белок" означают, соответственно, полипептид или белок, способный связываться с кристаллизуемой частью (Fc) антитела, и включают, например, белок А и белок G, или любой их фрагмент или слитый белок, который сохраняет указанное свойство связывания.
Термин "линкер" в данном документе означает элемент, связывающий две полипептидные единицы, мономеры или домены друг с другом в мультимере.
Термин "спейсер" здесь означает элемент, соединяющий полипептид или полипептидный мультимер с подложкой.
Краткое описание графических материалов
На Фиг. 1 показано выравнивание Fc-связывающих доменов, определенных посредством SEQ ID NO: 1-7 и 51-52.
На Фиг. 2 показаны результаты из примера 2 в отношении щелочной стабильности родительских и мутантных тетрамерных Zvar (SEQ ID NO: 7) полипептидных вариантов, соединенных с биосенсорным чипом SPR.
На Фиг. 3 показаны результаты из примера 4 в отношении щелочной стабильности (0,5 М NaOH) родительских и мутантных тетрамерных Zvar (SEQ ID NO: 7) полипептидных вариантов, соединенных с агарозными шариками.
На Фиг. 4 показаны результаты из примера 4 в отношении стабильности к щелочи (1,0 М NaOH) родительских и мутантных тетрамерных Zvar (SEQ ID NO: 7) полипептидных вариантов, соединенных с агарозными шариками.
Подробное описание воплощений
В одном аспекте настоящего изобретения раскрыт Fc-связывающий полипептид, который содержит или по существу состоит из мутанта Fc-связывающего домена белка A Staphylococcus (SpA), определенного посредством или имеющего по меньшей мере 90%-ную, по меньшей мере 95%-ную или по меньшей мере 98%-ную идентичность с SEQ ID NO: 1 (Е-домен), SEQ ID NO: 2 (D-домен), SEQ ID NO: 3 (А-домен), SEQ ID NO: 22 (вариант A-домена), SEQ ID NO: 4 (В-домен), SEQ ID NO: 5 (С-домен), SEQ ID NO: 6 (белок Z), SEQ ID NO: 7 (Zvar), SEQ ID NO: 51 (Zvar без аминокислот 1-6 линкерного участка) или SEQ ID NO: 52 (С-домен без аминокислот 1-6 линкерного участка), как показано на Фиг. 1, где по меньшей мере остаток аспарагина (или серина в случае SEQ ID NO: 2) в положении*, соответствующем положению 11 в SEQ ID NO: 4-7, мутирован в аминокислоту, выбранную из группы, состоящей из глутаминовой кислоты, лизина, тирозина, треонина, фенилаланина, лейцина, изолейцина, триптофана, метионина, валина, аланина, гистидина и аргинина. Белок Z (SEQ ID NO: 6) представляет собой мутантный В-домен, как описано в US 5143844, тогда как SEQ ID NO: 7 представляет собой другой мутантный вариант белка Z, называемый здесь Zvar, с мутациями N3A, N6D, N23T. SEQ ID NO: 22 представляет собой природный вариант А-домена в белке А из штамма N315 Staphylococcus aureus, имеющий мутацию A46S при использовании обозначения положений как на Фиг. 1. Мутация N11 в этих доменах обеспечивает улучшенную щелочную стабильность по сравнению с родительским доменом/полипептидом без ухудшения иммуноглобулин-связывающих свойств. Следовательно, полипептид также может быть описан как Fc- или иммуноглобулин-связывающий полипептид, или альтернативно как Fc- или иммуноглобулин-связывающая полипептидная единица.
*Во всем данном описании изобретения используется система нумерации положений аминокислотных остатков, показанная на Фиг. 1, и номера положений соответствуют номерам в SEQ ID NO: 4-7.
Альтернативно, в изобретении описан Fc-связывающий полипептид, который содержит последовательность, определенную посредством SEQ ID NO: 53 или имеющую по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98%-ную идентичность SEQ ID NO: 53.
SEQ ID NO: 53
KEX1Q X2AFYEILX3LP NLTEEQRX4X5F IX6X7LKDX8PSX9 SX10X11X12LAEAKX13 X14NDAQAPK
где независимо друг от друга:
X1=A или Q
X2=E, K, Y, T, F, L, W, I, M, V, A, H или R
Х3=Н или K
Х4=А или N
Х5=А или G
X6=Q или Е
X7=S или K
Х8=Е или D
X9=Q или V
X10=K, R или А
Х11=А, Е или N
Х12=I или L
X13=K или R
X14=L или Y.
Мутация N11 (Х2) (например мутация N11E или N11K) может быть единственной мутацией или полипептид также может содержать дополнительные мутации, такие как замещения по меньшей мере в одном из положений, соответствующих положениям 3, 6, 9, 10, 15, 18, 23, 28, 29, 32, 33, 36, 37, 40, 42, 43, 44, 47, 50, 51, 55 и 57 в SEQ ID NO: 4-7. В одном или более из этих положений первоначальный аминокислотный остаток может быть, например, замещен аминокислотой, которая не является аспарагином, пролином или цистеином. Исходный аминокислотный остаток может быть, например, замещен аланином, валином, треонином, серином, лизином, глутаминовой кислотой или аспарагиновой кислотой. Кроме того, один или более аминокислотных остатков могут быть удалены, например из положений 1-6 и/или из положений 56-58.
В некоторых воплощениях аминокислотный остаток в положении, соответствующем положению 9 в SEQ ID NO: 4-7 (Х1) представляет собой аминокислоту, отличную от глутамина, аспарагина, пролина или цистеина, такую как аланин. Комбинация мутаций в положениях 9 и 11 обеспечивает особенно хорошую щелочную стабильность, как показано в примерах. В конкретных воплощениях в SEQ ID NO: 7 аминокислотный остаток в положении 9 представляет собой аланин, и аминокислотный остаток в положении 11 представляет собой лизин или глутаминовую кислоту, такую как лизин. Мутации в положении 9 также обсуждаются в одновременно находящейся на рассмотрении заявке PCT/SE2014/050872, которая включена в данный документ посредством ссылки во всей своей полноте.
В некоторых воплощениях аминокислотный остаток в положении, соответствующем положению 50 в SEQ ID NO: 4-7 (Х13), представляет собой аргинин или глутаминовую кислоту.
В некоторых воплощениях, аминокислотный остаток в положении, соответствующем положении 3 в SEQ ID NO: 4-7, представляет собой аланин, и/или аминокислотный остаток в положении, соответствующем положению 6 в SEQ ID NO: 4-7, представляет собой аспарагиновую кислоту. Один из аминокислотных остатков в положениях 3 и 6 может представлять собой аспарагин и в альтернативном воплощении оба аминокислотных остатка в положениях 3 и 6 могут представлять собой аспарагины.
В некоторых воплощениях аминокислотный остаток в положении, соответствующем положению 43 в SEQ ID NO: 4-7 (Х11), представляет собой аланин или глутаминовую кислоту, например аланин. В конкретных воплощениях аминокислотные остатки в положениях 9 и 11 в SEQ ID NO: 7 представляют собой аланин и лизин/глутаминовую кислоту, соответственно, в то время как аминокислотный остаток в положении 43 представляет собой аланин или глутаминовую кислоту.
В некоторых воплощениях аминокислотный остаток в положении, соответствующем положению 28 в SEQ ID NO: 4-7 (Х5), представляет собой аланин или аспарагин, например аланин.
В некоторых воплощениях аминокислотный остаток в положении, соответствующем положению 40 в SEQ ID NO: 4-7 (X9), выбран из группы, состоящей из аспарагина, аланина, глутаминовой кислоты и валина, или из группы, состоящей из глутаминовой кислоты и валина. В конкретных воплощениях аминокислотные остатки в положениях 9 и 11 в SEQ ID NO: 7 представляют собой аланин и глутаминовую кислоту, соответственно, в то время как аминокислотный остаток в положении 40 представляет собой валин. Возможно, аминокислотный остаток в положении 43 может тогда представлять собой аланин или глутаминовую кислоту.
В некоторых воплощениях аминокислотный остаток в положении, соответствующем положению 42 в SEQ ID NO: 4-7 (Х10), представляет собой аланин, лизин или аргинин.
В некоторых воплощениях аминокислотный остаток в положении, соответствующем положению 18 в SEQ ID NO: 4-7 (Х3), представляет собой лизин или гистидин, например лизин.
В некоторых воплощениях аминокислотный остаток в положении, соответствующем положению 33 в SEQ ID NO: 4-7 (Х7), представляет собой лизин или серии, например лизин.
В некоторых воплощениях аминокислотный остаток в положении, соответствующем положению 37 в SEQ ID NO: 4-7 (Х8), представляет собой глутаминовую кислоту или аспарагиновую кислоту, например глутаминовую кислоту.
В некоторых воплощениях аминокислотный остаток в положении, соответствующем положению 51 в SEQ ID NO: 4-7 (Х14), представляет собой тирозин или лейцин, например тирозин.
В некоторых воплощениях аминокислотный остаток в положении, соответствующем положению 44 в SEQ ID NO: 4-7 (Х12), представляет собой лейцин или изолейцин. В конкретных воплощениях аминокислотные остатки в положениях 9 и 11 в SEQ ID NO: 7 представляют собой аланин и лизин/глутаминовую кислоту, соответственно, в то время как аминокислотный остаток в положении 44 представляет собой изолейцин. Возможно, аминокислотный остаток в положении 43 может представлять собой аланин или глутаминовую кислоту.
В некоторых воплощениях аминокислотные остатки в положениях, соответствующих положениям 1, 2, 3 и 4 или положениям 3, 4, 5 и 6 в SEQ ID NO: 4-7, делетированы. В конкретных вариантах этих воплощений родительский полипептид представляет собой С-домен белка A (SEQ ID NO: 5). Влияние этих делеций на природный С-домен описано в US 9018305 и US 8329860, которые включены в данное описание изобретения посредством ссылок во всей своей полноте.
В некоторых воплощениях мутация в SEQ ID NO: 4-7, например в SEQ ID NO: 7, выбрана из группы, состоящей из: N11K; N11E; N11Y; N11T; N11F; N11L; N11W; N11I; N11M; N11V; N11A; N11H; N11R; N11E, Q32A; N11E, Q32E, Q40E; N11E, Q32E, K50R; Q9A, N11E, N43A; Q9A, N11E, N28A, N43A; Q9A, N11E, Q40V, A42K, N43E, L44I; Q9A, N11E, Q40V, A42K, N43A, L44I; N11K, H18K, S33K, D37E, A42R, N43A, L44I, K50R, L51Y; Q9A, N11E, N28A, Q40V, A42K, N43A, L44I; Q9A, N11K, H18K, S33K, D37E, A42R, N43A, L44I, K50R, L51Y; N11K, H18K, D37E, A42R, N43A, L44I; Q9A, N11K, H18K, D37E, A42R, N43A, L44I; Q9A, N11K, H18K, D37E, A42R, N43A, L44I, K50R; Q9A, N11K, H18K, D37E, A42R; Q9A, N11E, D37E, Q40V, A42K, N43A, L44I и Q9A, N11E, D37E, Q40V, A42R, N43A, L44I. Эти мутации обеспечивают особенно высокую щелочную стабильность. Мутация в SEQ ID NO: 4-7, например в SEQ ID NO: 7, также может быть выбрана из группы, состоящей из N11K; N11Y; N11F; N11L; N11W; N11I; N11M; N11V; N11A; N11H; N11R; Q9A, N11E, N43A; Q9A, N11E, N28A, N43A; Q9A, N11E, Q40V, A42K, N43E, L44I; Q9A, N11E, Q40V, A42K, N43A, L44I; Q9A, N11E, N28A, Q40V, A42K, N43A, L44I; N11K, H18K, S33K, D37E, A42R, N43A, L44I, K50R, L51Y; Q9A, N11K, H18K, S33K, D37E, A42R, N43A, L44I, K50R, L51Y; N11K, H18K, D37E, A42R, N43A, L44I; Q9A, N11K, H18K, D37E, A42R, N43A, L44I и Q9A, N11K, H18K, D37E, A42R, N43A, L44I, K50R.
В некоторых воплощениях полипептид содержит или по существу состоит из последовательности, выбранной из группы, состоящей из: SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49 и SEQ ID NO: 50. Он может, например, содержать или по существу состоять из последовательности, выбранной из группы, состоящей из: SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 16, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28 and SEQ ID NO: 29. Он также может содержать или по существу состоять из последовательности, выбранной из группы, состоящей из: SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 16, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 38, SEQ ID NO: 40; SEQ ID NO: 41; SEQ ID NO: 42; SEQ NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47 and SEQ ID NO: 48. Полипептид может, например, определяться последовательностью, выбранной из вышеприведенных групп или из подмножеств этих групп, но он также может содержать дополнительные аминокислотные остатки на N- и/или С-конце, например лидерную последовательность на N-конце и/или хвостовую последовательность на С-конце.





















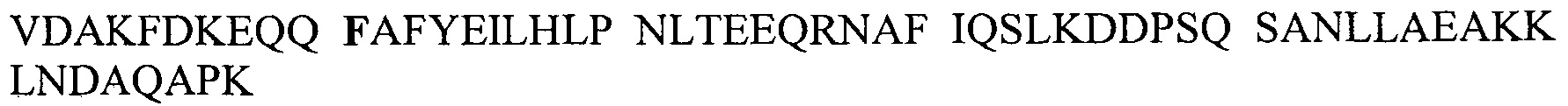










Во втором аспекте настоящего изобретения раскрыт мультимер, содержащий или по существу состоящий из множества полипептидных единиц, как определено в любом воплощении, описанном выше. Мультимер может, например, представлять собой димер, тример, тетрамер, пентамер, гексамер, гептамер, октамер или нонамер. Он может представлять собой гомомультимер, где все единицы в мультимере идентичны, или может представлять собой гетеромультимер, где по меньшей мере одна единица отличается от других. Предпочтительно, все единицы в мультимере являются стабильными в щелочных условиях, например за счет того, что содержат описанные выше мутации. Полипептиды могут быть связаны друг с другом непосредственно пептидными связями между С-концами и N-концами полипептидов. Альтернативно, две или более единиц в мультимере могут быть связаны линкерами, содержащими олигомерные или полимерные компоненты, такие как элементы, содержащие вплоть до 15 или 30 аминокислот, например 1-5, 1-10 или 5-10 аминокислот. Это, в частности, относится к мутациям SEQ ID NO: 51 и 52 и к полипептиду SEQ ID NO: 53, где конкретными примерами линкеров могут быть, например, VDAKFD или ADNKFN, например VDAKFD. Природа такого линкера предпочтительно не должна дестабилизировать пространственную конформацию белковых единиц. Этого можно, например, достичь, избегая присутствия пролина в линкерах. Кроме того, указанный линкер предпочтительно также должен быть достаточно стабильным в щелочных условиях, чтобы не ухудшать свойства мутантных белковых единиц. Для этой цели предпочтительно, чтобы линкеры не содержали аспарагин. Также может быть полезным, чтобы линкеры не содержали глутамин. Мультимер может дополнительно на N-конце содержать множество аминокислотных остатков, например образующихся в процессе клонирования или составляющих остаток отщепляемой сигнальной последовательности. Количество дополнительных аминокислотных остатков может составлять, например, 15 или менее, например 10 или менее, или 5 или менее. В качестве конкретного примера мультимер может содержать AQ-последовательность на N-конце.
В некоторых воплощениях мультимер может содержать или состоять по существу из последовательности, выбранной из группы, состоящей из: SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34 и SEQ ID NO: 35. Эти последовательности приведены ниже и обозначены как Родитель(Мутации)n, где n представляет собой число мономерных единиц в мультимере.












В некоторых воплощениях полипептид и/или мультимер, описанный выше, дополнительно содержит на С-конце или N-конце один или более связывающих элементов, выбранных из группы, состоящей из одного или более остатков цистеина, множества остатков лизина и множества остатков гистидина. Соединительный(е) элемент(ы) также может(гут) быть расположен(ы) в пределах 1-5 аминокислотных остатков, например в пределах 1-3 или 1-2 аминокислотных остатков, от С-конца или N-конца. Соединительный элемент может, например, представлять собой один цистеин на С-конце. Соединительный(е) элемент(ы) может(гут) быть непосредственно связан(ы) с С- или N-концом или он/они может(гут) быть соединен(ы) посредством участка, содержащего вплоть до 15 аминокислот, например 1-5 или 5-10 аминокислот. Этот участок также предпочтительно должен быть достаточно стабильным в щелочных условиях, чтобы не ухудшать свойств мутантного белка. Для этой цели желательно, чтобы участок не содержал аспарагин. Кроме того, желательно, чтобы участок не содержал глутамин. Преимущество наличия С-концевого цистеина заключается в том, что связывание на конце белка может быть достигнуто посредством реакции цистеинового тиола с электрофильной группой на подложке. Это обеспечивает превосходную подвижность связанного белка, что является важным для связывающей способности.
Щелочную стабильность полипептида или мультимера можно оценить, соединяя его с чипом SPR, например с сенсорными чипами Biacore СМ5, как описано в примерах, используя, например, NHS- или малеимидное связывание, и измеряя иммуноглобулин-связывающую способность чипа, обычно с использованием поликлонального человеческого IgG, до и после инкубирования в щелочных растворах при определенной температуре, например 22+/-2°С. Инкубирование можно проводить, например, в 0,5 М NaOH в течение нескольких 10-минутных циклов, например 100, 200 или 300 циклов. IgG-емкость матрицы после 100 10-минутных циклов инкубирования в 0,5 М NaOH при 22+/-2°С может составлять по меньшей мере 55, например по меньшей мере 60, по меньшей мере 80 или по меньшей мере 90% от IgG-емкости перед инкубированием. Альтернативно, остаточную IgG-емкость после 100 циклов для конкретного мутанта, измеренную как указано выше, можно сравнить с остаточной IgG-емкостью для родительского полипептида/мультимера. В этом случае остаточная IgG-емкость для мутанта может составлять по меньшей мере 105%, например по меньшей мере 110%, по меньшей мере 125%, по меньшей мере 150% или по меньшей мере 200% от родительского пол и пептида/мультимера.
В третьем аспекте настоящего изобретения раскрыта нуклеиновая кислота, кодирующая полипептид или мультимер по любому воплощению, описанному выше. Таким образом, изобретение охватывает все формы нуклеиновокислотной последовательности по настоящему изобретению, такие как РНК и ДНК, кодирующие полипептид или мультимер Изобретение включает вектор, такой как плазмида, который в дополнение к кодирующей последовательности содержит нужные сигнальные последовательности для экспрессии полипептида или мультимера по изобретению. В одном воплощении вектор содержит нуклеиновую кислоту, кодирующую мультимер по изобретению, где отдельные нуклеиновые кислоты, кодирующие каждую единицу, могут иметь гомологичные или гетерологичные последовательности ДНК.
В четвертом аспекте настоящего изобретения раскрыта экспрессирующая система, которая содержит нуклеиновую кислоту или вектор, описанные выше. Экспрессирующая система может представлять собой, например, систему на основе грамположительной или грамотрицательной прокариотической клетки-хозяина, например E.coli или Bacillus sp., которая модифицирована так, чтобы экспрессировать полипептид или мультимер по настоящему изобретению. В альтернативном воплощении экспрессирующая система представляет собой систему на основе эукариотической клетки-хозяина, такой как дрожжи, например Pichia pastoris or Saccharomyces cerevisiae, или клеток млекопитающих, например клеток СНО (яичник китайского хомячка).
В пятом аспекте настоящего изобретения раскрыта разделительная матрица, где множество полипептидов или мультимеров согласно любому воплощению, описанному выше, соединено с твердой подложкой. Такую матрицу используют для отделения иммуноглобулинов или других Fc-содержащих белков и, благодаря улучшенной щелочной стабильности полипептидов/мультимеров, эта матрица выдерживает высокощелочные условия во время очистки, что важно для долгосрочного многократного использования в установке для разделения в биопроцессе. Щелочную стабильность матрицы можно оценить путем измерения способности связывать иммуноглобулин, обычно с использованием поликлонального человеческого IgG, до и после инкубирования в щелочных растворах при определенной температуре, например при 22+/-2°С. Инкубирование можно проводить, например, в 0,5 М или 1,0 М NaOH в течение нескольких 15-минутных циклов, например 100, 200 или 300 циклов, что соответствует общему времени инкубирования 25, 50 или 75 ч. IgG-емкость матрицы после 96-100 15-минутных циклов инкубирования или после общего времени инкубирования 24 или 25 часов в 0,5 М NaOH при 22+/-2°C может составлять по меньшей мере 80, например по меньшей мере 85, по меньшей мере 90 или по меньшей мере 95% от IgG-емкости перед инкубированием. Емкость матрицы после общего времени инкубирования 24 часа в 1,0 М NaOH при 22+/-2°С может составлять по меньшей мере 70, например по меньшей мере 80 или по меньшей мере 90% от емкости IgG перед инкубированием.
Как понятно специалисту, экспрессируемый полипептид или мультимер должен быть очищен до необходимой степени перед иммобилизацией на подложку. Такие способы очистки хорошо известны в данной области и иммобилизация белковых лигандов на подложки легко осуществляется с использованием стандартных методов. Подходящие способы и подложки рассмотрены ниже более подробно.
Твердая подложка матрицы согласно изобретению может быть любого подходящего хорошо известного вида. Обычная аффинная разделяющая матрица часто имеет органическую природу и основана на полимерах, которые экспонируют гидрофильную поверхность к используемой водной среде, то есть экспонируют гидрокси (-ОН), карбокси (-СООН), карбоксамидо (-CONH2, возможно в N-замещенных формах), амино (-NH2, возможно в замещенной форме), олиго- или полиэтиленоксигруппы на своих внешних и, если они имеются, также и на внутренних поверхностях. Твердая подложка может, соответственно, быть пористой. Пористость может быть выражена в виде значения Kav или Kd (доля объема пор, доступная для тест-молекулы определенного размера), измеренного с помощью обратной эксклюзионной хроматографии, например в соответствии со способами, описанными в Gel Filtration Principles and Methods, Pharmacia LKB Biotechnology 1991, pp 6-13. По определению, значения и Kd, и Kav всегда лежат в диапазоне 0-1. Значение Kav может преимущественно быть равно 0,6-0,95, например 0,7-0,90 или 0,6-0,8, при измерении с декстраном, имеющим Mw 110 кДа, в качестве тест-молекулы. Преимуществом этого является то, что подложка имеет большую долю пор, способных вмещать как полипептиды/мультимеры по изобретению, так и иммуноглобулины, связывающиеся с полипептидами/мультимерами, и обеспечивать массовый перенос иммуноглобулинов к сайтам связывания и от них.
Полипептиды или мультимеры могут быть присоединены к подложке с помощью обычных методов связывания с использованием, например, тиоловых, амино и/или карбоксильных групп, присутствующих в лиганде. Бисэпоксиды, эпихлоргидрин, CNBr, N-гидроксисукцинимид (NHS) и др. являются хорошо известными связующими реагентами. Между подложкой и полипептидом/мультимером может быть введена молекула, известная как спейсер, которая улучшает доступность полипептида/мультимера и облегчает химическое связывание полипептида/мультимера с подложкой. В зависимости от природы полипептида/мультимера и условий связывания, связывание может представлять собой многоточечное связывание (например с помощью нескольких лизинов) или одноточечное связывание (например с помощью одного цистеина). Альтернативно, полипептид/мультимер может быть присоединен к подложке нековалентной связью, например посредством физической адсорбции или биоспецифической адсорбции.
В некоторых воплощениях матрица содержит 5-25, например 5-20 мг/мл, 5-15 мг/мл, 5-11 мг/мл или 6-11 мг/мл полипептида или мультимера, связанного с подложкой. Количество связанного полипептида/мультимера можно контролировать концентрацией полипептида/мультимера, используемой в процессе связывания, посредством используемых условий активации и связывания и/или посредством пористой структуры используемой подложки. Как правило, абсолютная связывающая способность матрицы возрастает с увеличением количества связанного полипептида/мультимера, по меньшей мере вплоть до точки, когда поры становятся значительно суженными связанным полипептидом/мультимером. Относительная связывающая способность на мг связанного полипептида/мультимера уменьшается при высоких уровнях связывания, что приводит к оптимальному соотношению затрат и результатов в указанных выше диапазонах.
В некоторых воплощениях полипептиды или мультимеры связаны с подложкой посредством тиоэфирных связей. Способы выполнения такого соединения хорошо известны в данной области и легко выполняются специалистом в данной области с использованием стандартных методов и оборудования. Тиоэфирные связи являются гибкими и стабильными и в целом подходят для использования в аффинной хроматографии. В частности, когда тиоэфирная связь осуществляется через концевой или близкий к концу остаток цистеина в полипептиде или мультимере, подвижность связанного полипептида/мультимера увеличивается, что обеспечивает улучшенную связывающую способность и кинетику связывания. В некоторых воплощениях полипептид/мультимер соединен через С-концевой цистеин, представленный на белке, как описано выше. Это обеспечивает эффективное связывание цистеинового тиола с электрофильными группами, например с эпоксидными группами, группами галогенгидрина и т.д. на подложке, что приводит к связыванию посредством тиоэфирного мостика.
В некоторых воплощениях подложка содержит полигидроксиполимер, такой как полисахарид. Примеры полисахаридов включают, например, декстран, крахмал, целлюлозу, пуллулан, агар, агарозу и т.д. Полисахариды по своей природе являются гидрофильными с низкими степенями неспецифических взаимодействий, они обеспечивают высокое содержание реакционно-способных (активируемых) гидроксильных групп, и они, как правило, стабильны по отношению к щелочным очищающим растворам, используемым в биопроцессе.
В некоторых воплощениях подложка содержит агар или агарозу. Подложки, используемые в настоящем изобретении, могут быть легко получены в соответствии со стандартными способами, такими как обратное гелеобразование суспензии (S

В некоторых воплощениях подложка, например полисахаридная или агарозная подложка, сшита, например с помощью гидроксиалкильных простых эфирных сшивок. Сшивающими реагентами, образующими такие сшивки, могут являться, например, эпигалогенгидрины, такие как эпихлоргидрин, диэпоксиды, такие как бутандиолдиглицидиловый эфир, аллилирующие реагенты, такие как аллилгалогениды или аллилглицидиловый эфир. Сшивание является полезным для жесткости подложки и улучшает химическую стабильность. Гидроксиалкильные простые эфирные связи являются устойчивыми к щелочи и не вызывают значительной неспецифической адсорбции.
Альтернативно, твердая подложка основана на синтетических полимерах, таких как поливиниловый спирт, полигидроксиалкилакрилаты, полигидроксиалкилметакрилаты, полиакриламиды, полиметакриламиды и т.д. В случае гидрофобных полимеров, таких как матрицы на основе дивинил- и моновинил-замещенных бензолов, поверхность матрицы часто гидрофилизуют, чтобы экспонировать гидрофильные группы, определенные выше, окружающей водной жидкости. Такие полимеры легко получают в соответствии со стандартными методами, см., например, "Styrene based polymer supports developed by suspension polymerization" (R Arshady: Chimica e

В еще одном воплощении твердая подложка находится в другой форме, такой как поверхность, чип, капилляры или фильтр (например мембрана или матрица с глубинным фильтром).
Что касается формы матрицы по изобретению, то в одном воплощении матрица находится в виде пористого монолита. В альтернативном воплощении, матрица находится в форме сферических гранул или частиц, которые могут быть пористыми или непористыми. Матрицы в форме сферических гранул или частиц могут быть использованы в виде плотного слоя или в суспендированной форме. Суспендированные формы включают формы, известные как неплотные слои и чистые суспензии, в которых частицы или шарики могут свободно перемещаться. В случае монолитов, плотного слоя и неплотного слоя, процедура разделения обычно следует за обычной хроматографией с градиентом концентрации. В случае чистой суспензии используют периодический режим.
В шестом аспекте настоящего изобретения раскрыт способ выделения иммуноглобулина, в котором используется разделительная матрица, описанная выше.
В некоторых воплощениях способ включает стадии:
а) приведения жидкого образца, содержащего иммуноглобулин, в контакт с разделительной матрицей, как описано выше,
б) промывания указанной разделительной матрицы промывной жидкостью,
в) элюирования иммуноглобулина из разделительной матрицы с помощью элюирующей жидкости и
г) очистки разделительной матрицы с помощью очищающей жидкости, которую альтернативно можно назвать жидкостью для безразборной (CIP) очистки, например при времени контакта (инкубирования) по меньшей мере 10 минут.
Способ также может включать, перед стадией (а), стадии создания аффинной разделительной матрицы согласно любому из воплощений, описанных выше, и приготовления раствора, содержащего иммуноглобулин и по меньшей мере одно другое вещество, в качестве жидкого образца и, после стадии (в), извлечения элюата и возможно обработка элюата на дополнительных стадиях разделения, например при помощи анионо- или катионообменной хроматографии, мультимодальной хроматографии и/или хроматографии гидрофобного взаимодействия. Подходящие композиции жидкого образца, промывной жидкости и элюирующей жидкости, а также общие условия проведения разделения хорошо известны в области аффинной хроматографии и, в частности, в области хроматографии на белке А. Жидкий образец, содержащий Fc-содержащий белок и по меньшей мере одно другое вещество, может содержать белки клетки-хозяина (НСР), такие как белки клеток СНО, Е.coli или дрожжей. Содержание белков клеток СНО и Е.coli можно удобно определить с помощью иммуноанализов, направленных на эти белки, например с использованием наборов СНО НСР или Е Coli НСР ELISA от Cygnus Technologies. Белки клеток-хозяев или белки клеток СНО/Е Coli могут быть десорбированы на стадии (б).
Элюирование может быть выполнено с использованием любого подходящего раствора, используемого для элюирования из среды с белком А. Это может быть, например, раствор или буфер, имеющий рН 5 или ниже, такой как рН 2,5-5 или 3-5. В некоторых случаях это также может быть раствор или буфер, имеющий рН 11 или выше, например рН 11-14 или рН 11-13. В некоторых воплощениях элюирующий буфер или градиент элюирующего буфера содержит по меньшей мере одну моно-, ди- или трехфункциональную карбоновую кислоту или соль такой карбоновой кислоты. В некоторых воплощениях элюирующий буфер или градиент элюирующего буфера содержит по меньшей мере один вид аниона, выбранный из группы, состоящей из ацетата, цитрата, глицина, сукцината, фосфата и формиата.
В некоторых воплощениях очищающая жидкость представляет собой щелочь, например имеющую рН 13-14. Такие растворы обеспечивают эффективную очистку матрицы, в частности на верхней границе интервала.
В некоторых воплощениях очищающая жидкость содержит 0,1-2,0 М NaOH или KOH, например 0,5-2,0 или 0,5-1,0 М NaOH или KOH. Они являются эффективными очищающими растворами и, в частности, когда концентрация NaOH или KOH составляет выше 0,1 М или по меньшей мере 0,5 М. Высокая стабильность полипептидов по изобретению позволяет использовать такие сильнощелочные растворы.
Способ может также включать стадию санирования матрицы с помощью санирующей жидкости, которая может, например, содержать пероксид, такой как перекись водорода/, и/или перкислоту, такую как перуксусная кислота или надмуравьиная кислота.
В некоторых воплощениях стадии (а)-(г) повторяют по меньшей мере 10 раз, например по меньшей мере 50 раз, 50-200, 50-300 или 50-500 раз. Это важно для экономичности способа, так как матрица может повторно использоваться много раз.
Стадии (а)-(в) также могут быть повторены по меньшей мере 10 раз, например по меньшей мере 50 раз, 50-200, 50-300 или 50-500 раз, со стадией (г), выполняемой после множества повторов стадии (в), так что стадию (г) выполняют по меньшей мере 10 раз, например по меньшей мере 50 раз. Стадию (г) можно, например, выполнять после каждого второго-двадцатого повтора стадии (в).
Примеры
Мутагенез белка
Сайт-направленный мутагенез выполняли с помощью двухстадийной ПЦР, используя олигонуклеотиды, кодирующие мутации. В качестве матрицы использовали плазмиду, содержащую один из доменов Z, В или С. ПЦР-фрагменты лигировали в экспрессионный вектор Е.coli. Секвенирование ДНК использовали для проверки правильной последовательности встроенных фрагментов.
Для образования мультимеров мутантов использовали сайт АСС I, расположенный в стартовых кодонах (GTA GAC) домена В, С или Z, соответствующих аминокислотам VD. Вектор для мономерного домена расщепляли Асе I и обрабатывали фосфатазой. Были разработаны праймеры с липкими концами Асе I, специфические для каждого варианта, и с каждой матрицы были получены два перекрывающихся продукта ПЦР. Продукты ПЦР очищали и оценивали концентрацию путем сравнения этих продуктов ПЦР на 2% агарозном геле. Равные количества парных продуктов ПЦР гибридизировали (90°С -> 25°С за 45 мин) в буфере для лигирования. Полученный продукт состоит примерно из % фрагментов, которые вероятно лигированы в сайт Асе I (правильные фрагменты ПЦР и/или расщепленный вектор). После лигирования и трансформирования колонии подвергали ПЦР-анализу для идентификации конструкций, содержащих нужный мутант. Положительные клоны подтверждали посредством секвенирования ДНК.
Экспрессия и очистка конструкции
Конструкции экспрессировали в бактериальной периплазме посредством ферментации Е.coli K12 в стандартных средах. После ферментации клетки подвергали термической обработке для высвобождения содержимого периплазмы в среды. Выделенные в среду конструкции извлекали при помощи микрофильтрации на мембране с размером пор 0,2 мкм.
Каждую конструкцию, теперь находящуюся в фильтрате после стадии фильтрации, аффинно очищали. Фильтрат загружали на хроматографическую среду, содержащую иммобилизованный IgG (IgG Sepharose 6FF, GE Healthcare). Загруженный продукт промывали забуференным фосфатным солевым раствором и элюировали путем снижения рН.
Значение рН элюированного пула доводили до нейтрального рН (рН 8) и уменьшали путем добавления дитиотреитола. Образец затем наносили на анионообменник. После стадии промывки конструкцию элюировали в градиенте NaCl для отделения ее от любых загрязнений. Элюированный пул концентрировали ультрафильтрацией до 40-50 мг/мл. Следует отметить, что успешная аффинная очистка конструкции на среде с иммобилизованным IgG указывает на то, что рассматриваемая конструкция имеет высокое сродство к IgG.
Очищенные лиганды анализировали с помощью RPC LC-MS (сочетание жидкостной хроматографии с обращенными фазами и масс-спектрометрии) для определения чистоты и для подтверждения того, что молекулярная масса соответствует ожидаемой (основанной на аминокислотной последовательности).
Пример 1
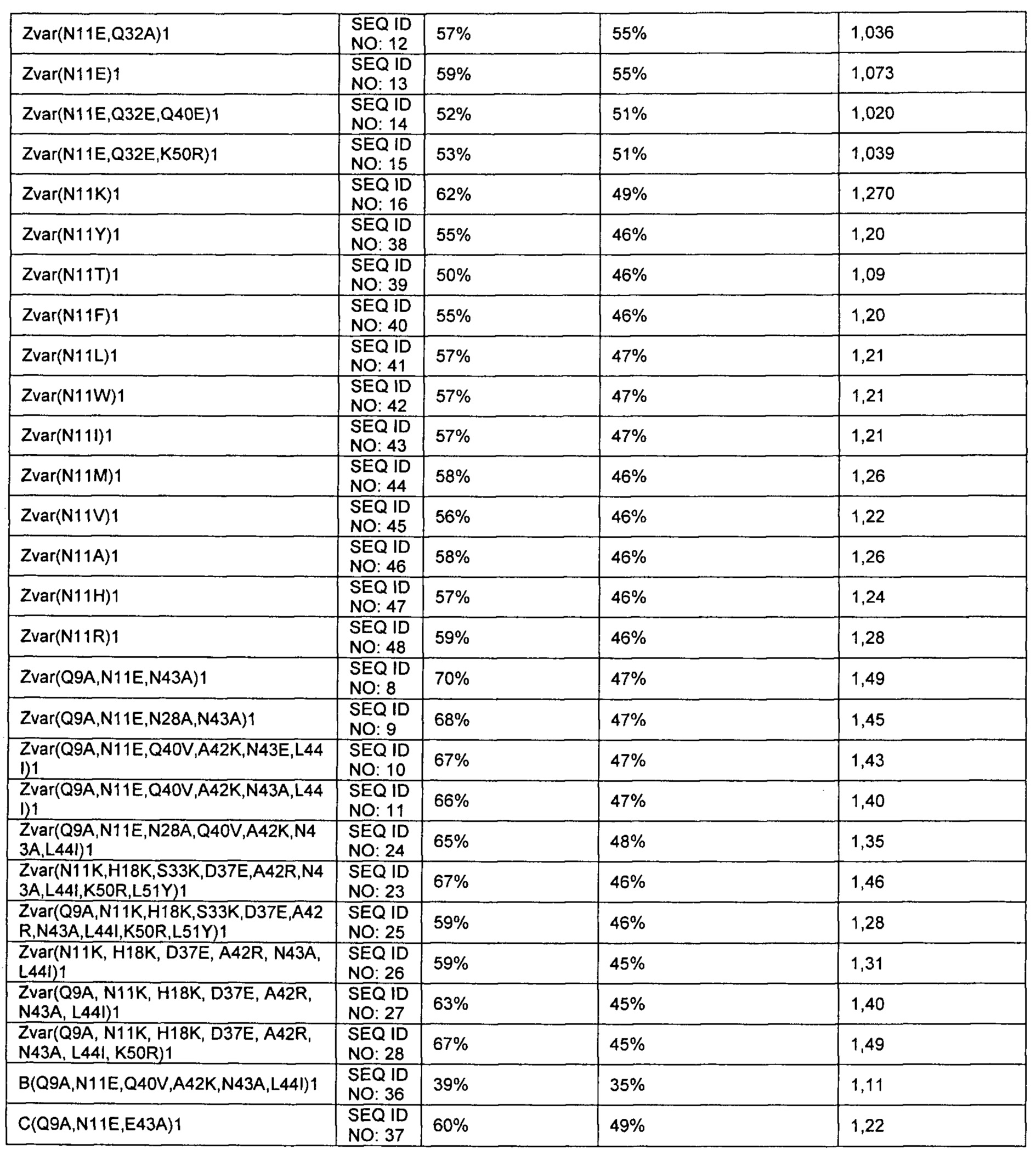
Очищенные мономерные лиганды, перечисленные в таблице 1, дополнительно содержащие лидерную последовательность AQGT на N-конце и цистеин на С-конце, были иммобилизованы на сенсорных чипах Biacore СМ5 (GE Healthcare, Sweden) с использованием набора для аминного связывания GE Healthcare (для карбодиимидного связывания аминов с карбоксиметильными группами на чипе) в количестве, достаточном для получения сигнала, составляющего примерно 200-1500 RU в приборе Biacore для измерения поверхностного плазмонного резонанса (SPR) (GE Healthcare, Sweden). Для определения IgG-связывающей способности иммобилизованной поверхности, 1 мг/мл человеческого поликлонального IgG (Gammanorm) пропускали через чип и отмечали интенсивность сигнала (пропорциональную величине связывания). Затем поверхность подвергали безразборной (CIP) очистке, то есть промывали 500 мМ NaOH в течение 10 минут при комнатной температуре (22±2°С). Это повторяли в течение 96-100 циклов, и стабильность иммобилизованного лиганда в щелочной среде оценивали по остаточной IgG-связывающей способности (величина сигнала) после каждого цикла. Результаты представлены в таблице 1 и показывают, что по меньшей мере лиганды Zvar(N11K)1, Zvar(N11E)1, Zvar(N11Y)1, Zvar(N11T)1, Zvar(N11F)1, Zvar(N11L)1, Zvar(N11W)1, ZN11I)1, Zvar(N11M)1, Zvar(N11V)1, Zvar(N11A)1, Zvar(N11H1), Zvar(N11R)1, Zvar(N11E,Q32A)1, Zvar(N11E,Q32E,Q40E)1 и Zvar(N11E,Q32E,K50R)1, Zvar(Q9A,N11E,N43A)1, Zvar(Q9A,N11E,N28A,N43A)1, Zvar(Q9A,N11E,Q40V,A42K,N43E,L44I)1, Zvar(Q9A,N11E,Q40V,A42K,N43A,L44I)1, Zvar(Q9A,N11E,N28A,Q40V,A42K,N43A,L44I)1, Zvar(N11K,H18K,S33K,D37E,A42R,N43A,L44I,K50R,L51Y)1, Zvar(Q9A,N11K,H18K,S33K,D37E,A42R,N43A,L44I,K50R,L51Y)1, Zvar(N11K,H18K,D37E,A42R,N43A,L44I)1, Zvar(Q9A,N11K,H18K,D37E,A42R,N43A,L44I)1 и Zvar(Q9A,N11K,H18K,D37E,A42R,N43A,L44I,K50R)1 имеют улучшенную щелочную стабильность по сравнению с родительской структурой Zvar1, используемой в качестве эталона для сравнения. Кроме того, лиганды В (Q9A,N11E,Q40V,A42K,N43A,L44I)1 и C(Q9A,N11E,Е43А)1 имеют улучшенную стабильность по сравнению с родительскими доменами В и С, используемыми в качестве эталонов для сравнения.

Пример 2
Очищенные тетрамерные и гексамерные лиганды, перечисленные в таблице 2, были иммобилизованы на сенсорных чипах Biacore СМ5 (GE Healthcare, Sweden) с использованием набора для аминного связывания GE Healthcare (для карбодиимидного связывания аминов с карбоксиметильными группами на чипе) в количестве, достаточном для получения сигнала примерно 200-1500 RU (относительных единиц) на приборе Biacore (GE Healthcare, Sweden). Для определения IgG-связывающей способности иммобилизованной поверхности, 1 мг/мл человеческого поликлонального IgG (Gammanorm) пропускали через чип и отмечали интенсивность сигнала (пропорциональную величине связывания). Затем поверхность подвергали безразборной очистке (CIP), то есть промывали 500 мМ NaOH в течение 10 минут при комнатной температуре (22±2°С). Промывку повторяли в течение 300 циклов и щелочную стабильность иммобилизованного лиганда определяли по остаточной IgG-связывающей способности (величина сигнала) после каждого цикла. Результаты представлены в Таблице 2 и на Фиг. 2 и показывают, что по меньшей мере лиганды Zvar(Q9A,N11E,N43A)4, Zvar(Q9A,N11E,N28A,N43A)4, Zvar(Q9A,N11E,Q40V,A42K,N43E,L44I)4 и Zvar(Q9A,N11E,Q40V,A42K,N43A,L44I)4, Zvar(Q9A,N11E,D37E,Q40V,A42K,N43A,L44I)4 и Zvar(Q9A,N11E,D37E,Q40V,A42R,N43A,L44I)4 имеют улучшенную щелочную стабильность по сравнению с родительской структурой Zvar4, которую использовали в качестве эталона для сравнения. Гексамерный лиганд Zvar(Q9A,N11E,Q40V,A42K,N43A,L44I)6 также обладает улучшенной щелочной стабильностью по сравнению с родительской структурой Zvar6, используемой в качестве эталона для сравнения.

Пример 3
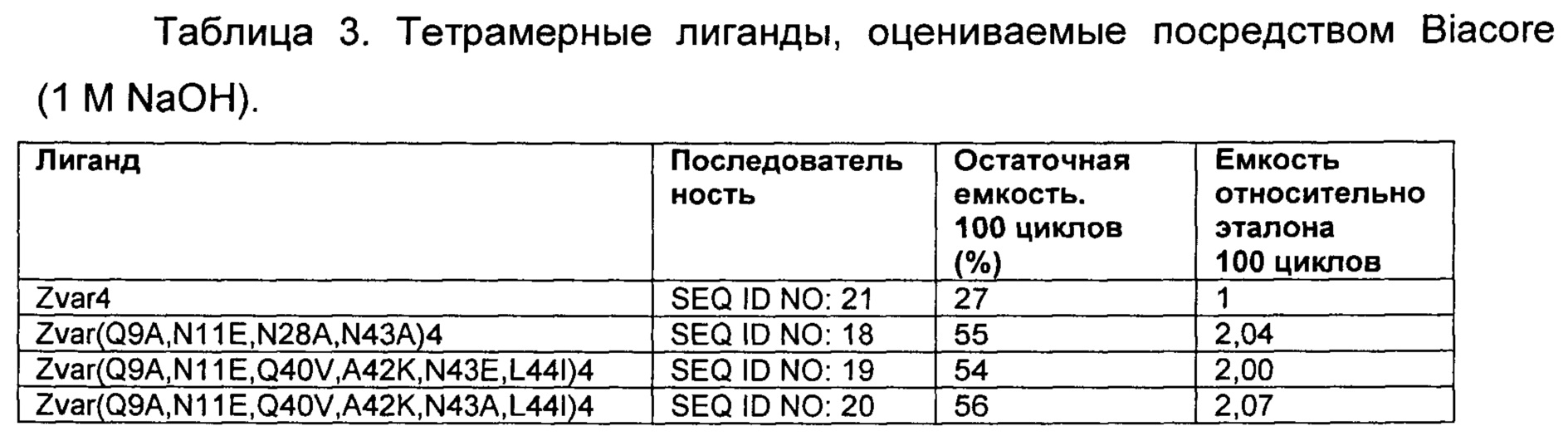
Пример 2 повторяли со 100 циклами CIP для трех лигандов, используя 1 М NaOH вместо 500 мМ, как в примере 2. Результаты представлены в Таблице 3 и показывают, что все три лиганда имеют улучшенную щелочную стабильность также в 1 М NaOH, по сравнению с родительской структурой Zvar4, которую использовали в качестве эталона для сравнения.
Пример 4
Очищенные тетрамерные лиганды из Таблицы 2 (все с дополнительным N-концевым цистеином) были иммобилизованы на сферические гранулы агарозы с использованием описанных ниже методов и проанализированы на их емкость и стабильность. Результаты представлены в Таблице 4 и на Фиг. 3.

Активация
Основной используемой матрицей были жесткие сшитые агарозные гранулы с медианным диаметром 85 мкм (средневзвешенный по объему, d50 В), полученные в соответствии с методами из US 6602990 и с размером пор, соответствующим величине Kav 0,70 для декстрана Mw 110 «Да при обратной эксклюзионной хроматографии, в соответствии со способами, описанными в Gel Filtration Principles and Methods, Pharmacia LKB Biotechnology 1991, pp 6-13.
Смешивали 25 мл (г) высушенной основной матрицы, 10,0 мл дистиллированной воды и 2,02 г NaOH (s) в 100 мл колбе с механическим перемешиванием в течение 10 мин при 25°С. Добавляли 4,0 мл эпихлоргидрина и реакция продолжалась в течение 2 часов. Активированный гель промывали водой в количестве 10 седиментационных объемов геля.
Связывание
К 20 мл раствора лиганда (50 мг/мл) в 50 мл пробирке фирмы Falcon добавляли 169 мг NaHCO3, 21 мг Na2CO3, 175 мг NaCl и 7 мг ЭДТА. Пробирку Falcon помещали на роликовый стол на 5-10 мин, и затем добавляли 77 мг DTE. Восстановление продолжалось в течение более 45 минут. Затем раствор лиганда обессоливали на колонке PD10, заполненной Sephadex G-25. Содержание лиганда в обессоленном растворе определяли путем измерения УФ-поглощения при 276 нм.
Активированный гель промывали 3-5 GV (0,1 М фосфат/1 мМ ЭДТА рН 8,6) и лиганд затем связывали в соответствии со способом, описанным в US 6399750. Все буферы, использованные в экспериментах, дегазировали газообразным азотом в течение по меньшей мере 5-10 мин. Содержание лиганда в гелях можно было контролировать, варьируя количество и концентрацию раствора лиганда.
После иммобилизации гели промывали дистиллированной водой 3×GV. Гели + 1 GV (0,1 М фосфат/1 мМ ЭДТА/10% тиоглицерина, рН 8,6) смешивали и пробирки оставляли на вибростоле при комнатной температуре в течение ночи. Затем гели поочередно промывали 3×GV (0,1 М Трис/0,15 М NaCl, рН 8,6) и 0,5 М НАс, а затем 8-10×GV дистиллированной воды. Образцы геля отправляли в независимую лабораторию для анализа аминокислот, и содержание лиганда (мг/мл геля) рассчитывали из общего содержания аминокислот.
Белок
Gammanorm 165 мг/мл (Octapharma), разведенный до 2 мг/мл в уравновешивающем буфере.
Уравновешивающий буфер
PBS Фосфатный буфер 10 мМ + 0,14 М NaCl + 0,0027 М KCl, рН 7,4 (Medicago)
Адсорбционный буфер
PBS Фосфатный буфер 10 мМ + 0,14 М NaCl + 0,0027 М KCl, рН 7,4 (Medicago)
Элюирующие буферы
100 мМ ацетат рН 2,9
Динамическая связывающая способность
2 мл смолы помещали в колонки TRICORN™ 5/100. Емкость до проскока определяли с помощью системы

Образец загружали на колонку вплоть до достижения УФ-сигнала, составляющего 85% от максимальной абсорбции. Колонку затем промывали уравновешивающим буфером в количестве 5 объемов колонки (CV) при скорости потока 0,5 мл/мин. Белок элюировали 5 CV элюирующего буфера при скорости потока 0,5 мл/мин. Затем колонку очищали 0,5 М NaOH при скорости потока 0,2 мл/мин и снова уравновешивали уравновешивающим буфером.
Для расчета емкости до проскока при значении 10%, использовали представленное ниже уравнение. Это количество IgG, которое наносили на колонку вплоть до достижения концентрации IgG в элюате с колонки, составляющей 10% от концентрации IgG при подаче.
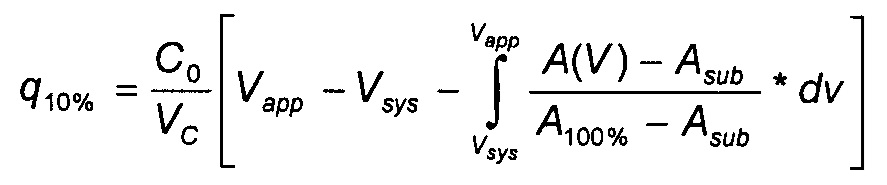
А100% = 100% УФ-сигнал;
Asub = вклад поглощения от несвязывающегося подкласса IgG;
A(V) = поглощение при заданном объеме;
Vc = объем колонки;
Vapp = используемый объем вплоть до 10% проскока;
Vsys = мертвый объем системы;
С0 = концентрация при подаче.
Рассчитывали динамическую связывающую способность (DBC) при 10% проскоке. Динамическую связывающую способность (DBC) рассчитывали для 10 и 80% проскока.
CIP - 0,5 М NaOH.
10%-ный проскок DBC (QM0) определяли как до, так и после повторных воздействий щелочными очищающими растворами. Каждый цикл включал стадию CIP с 0,5 М NaOH, прокачиваемым через колонку со скоростью 0,5/мин в течение 20 мин, после чего колонку оставляли стоять в течение 4 ч. Воздействие происходит при комнатной температуре (22+/-2°С). После этого инкубирования колонку промывали уравновешивающим буфером в течение 20 мин при скорости потока 0,5 мл/мин. В таблице 4 показана остаточная емкость после шести 4-часовых циклов (то есть суммарно 24 ч воздействия 0,5 М NaOH), как в абсолютных числах, так и относительно начальной емкости.
Пример 5
Пример 4 повторяли с тетрамерными лигандами, показанными в таблице 5, но с 1,0 М NaOH, используемым на стадиях CIP вместо 0,5 М. Результаты представлены в Таблице 5 и на Фиг. 4.

В данном письменном описании использованы примеры для раскрытия изобретения, включающие лучший вариант осуществления изобретения, а также для того, чтобы любой специалист в данной области мог осуществить изобретение на практике, в том числе создать и использовать любые устройства или системы и выполнить любые включенные способы. Патентуемый объем изобретения определен формулой изобретения и может включать в себя другие примеры, которые встречаются специалистом в данной области техники. Предполагается, что такие другие варианты входят в объем формулы изобретения, если они имеют структурные элементы, которые не отличаются от буквального языка формулы изобретения, или если они включают эквивалентные структурные элементы с несущественными отличиями от буквального языка формулы изобретения. Все патенты и патентные заявки, упоминаемые в тексте, включены в настоящий документ посредством ссылки во всей своей полноте, как если бы они были включены индивидуально.
Реферат
Изобретение относится к области биотехнологии, конкретно к получению Fc-связывающих полипептидов с улучшенной щелочной стабильностью, содержащих мутант Fc-связывающего домена белка A Staphylococcus (SpA), выбранного из группы, состоящей из SEQ ID NO: 8-20, 23-28 и 30-48. Полученные пептиды используют в составе разделительных матриц для отделения иммуноглобулинов и других Fc-содержащих белков. Изобретение позволяет получать разделительные матрицы, способные выдерживать высокощелочные условия во время очистки. 3 н. и 19 з.п. ф-лы, 4 ил., 5 табл., 5 пр.

Комментарии