Способы очистки аденоассоциированных вирусов - RU2785661C2
Код документа: RU2785661C2
Чертежи





































Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] По этой заявке испрашивается приоритет временной заявки США № 62/611709, поданной 29 декабря 2017 г., раскрытие которой полностью включено в настоящее описание посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[0002] Изобретение относится к материалам и способам очистки аденоассоциированного вируса (AAV).
УРОВЕНЬ ТЕХНИКИ
[0003] Аденоассоциированный вирус (AAV) представляет собой небольшой безоболочечный вирус, который упаковывает линейный одноцепочечный ДНК-геном. AAV принадлежит к семейству Parvoviridae и роду Dependovirus, поскольку продуктивное заражение AAV происходит только в присутствии вируса-помощника, такого как, например, аденовирус или вирус герпеса. Даже в отсутствие вируса-помощника AAV (серотип 2) может достигать латентности путем интеграции в хромосому 19q13.4 генома человека-хозяина. Это единственный ДНК-вирус млекопитающих, о котором известно, что он способен к сайт-специфической интеграции (Daya and Berns, Clinical Microbiology Reviews, pages 583-593 (2008)).
[0004] Для безопасного использования AAV в клинике AAV был генетически модифицирован в нескольких местах в своем геноме. Например, ген Rep, который необходим для репликации вируса, и элемент, необходимый для сайт-специфической интеграции, были удалены из генома AAV во многих вирусных векторах. Такие рекомбинантные AAV (rAAV) существуют во внехромосомном состоянии и имеют очень низкую эффективность интеграции в геномную ДНК. Таким образом, вероятность возникновения случайного мутагенеза в клетке-хозяине с помощью rAAV снижается, если не устраняется полностью. Из-за этих свойств и отсутствия патогенности rAAV показал большой потенциал в качестве вектора для генной терапии во многих аспектах доклинических и клинических применений. В клинике проходят испытания новые серотипы и самокомплементарные вектора. Наряду с этими постоянными разработками векторов, постоянные усилия были сосредоточены на масштабируемых производственных процессах, которые могут эффективно генерировать большие количества титра векторов rAAV с высокой чистотой и эффективностью.
[0005] Хотя усилия по разработке эффективных, крупномасштабных способов очистки продукта AAV, пригодного для введения человеку, были значительными, сохраняется потребность в более совершенных способах очистки AAV. Существуют различные другие белки и материалы из матрицы культуры клеток-хозяев, которые могут быть более эффективно удалены во время очистки AAV. Поэтому необходимы способы очистки AAV, которые включают стадии удаления материала клеток-хозяев из конечного продукта AAV.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0006] Особенностью генерации вектора AAV в клеточной культуре является образование сложного матрикса, который содержит материал из разрушенных клеток. В частности, белки клетки-хозяина, протеасомы, клеточный дебрис и потенциальные вирус-специфические рецепторы часто присутствуют в материале из разрушенных клеток. Раскрыты способы, которые включают стадии удаления материала клетки-хозяина из конечного продукта AAV в условиях, которые приводят к большей чистоте при физиологически пригодном pH.
[0007] В одном аспекте изобретение относится к способу очистки аденоассоциированного вируса (AAV), включающему
(а) загрузку раствора, содержащего AAV, на аффинную смолу, нацеленную на AAV, при условиях проводимости, которые обеспечивают связывание между AAV в растворе и аффинной смолой;
(b) проведение, по меньшей мере, двух стадий промывки; и
(с) элюирование AAV из аффинной смолы.
[0008] В некоторых вариантах осуществления способ дополнительно включает приведение в контакт раствора, содержащего AAV, с анионитом и элюирование раствора, содержащего AAV, из анионита перед загрузкой раствора, содержащего AAV, на аффинную смолу.
[0009] В некоторых вариантах осуществления по меньшей мере одна из стадий промывки включает нанесение на аффинную смолу буфера, содержащего органический растворитель или детергент. В некоторых вариантах осуществления буфер содержит Трис-HCl и соль. В некоторых вариантах осуществления буфер содержит один или более из Гистидина, Гистидин-HCl, Аргинин-HCl, Лизин-HCl, Глицина, Таурина, MES-Na, Бис-Трис и N-ацетил-D, L-триптофана. В некоторых вариантах осуществления соль представляет собой NaCl. В некоторых вариантах осуществления буфер содержит ацетат натрия. В некоторых вариантах осуществления буфер содержит хлорид магния. В некоторых вариантах осуществления буфер содержит Трис-HCl и этиленгликоль. В некоторых вариантах осуществления буфер содержит Аргинин-HCl и одно из сахарозы и глицерина. В некоторых вариантах осуществления буфер содержит Таурин и этиленгликоль. В некоторых вариантах осуществления буфер содержит Аргинин-HCl, Лизин-HCl и Гистидин-HCl. В некоторых вариантах осуществления буфер содержит Трис-HCl и ДМСО.
[0010] В некоторых вариантах осуществления проводят по меньшей мере три стадии промывки. В некоторых вариантах осуществления выполняются три стадии промывки. В некоторых вариантах осуществления три стадии промывки выполняются последовательно.
[0011] В некоторых вариантах осуществления органический растворитель или детергент представляет собой полисорбат 80, этиленгликоль, сорбит, маннит, ксилит, ДМСО, сахарозу или трегалозу. В некоторых вариантах осуществления детергент содержит один или более из тритона X100, полисорбата 80 и три(н-бутил)фосфата (TNBP). В некоторых вариантах осуществления буфер содержит Бис-Трис.
[0012] В некоторых вариантах осуществления первая стадия промывки включает нанесение на аффинную смолу первого буфера, содержащего от приблизительно 50 до приблизительно 2000 мМ ацетата натрия и от приблизительно 0,05 до приблизительно 0,2% полисорбата 80, и первый буфер имеет рН от приблизительно 5,2 до приблизительно 6,8;
вторая стадия промывки включает нанесение на аффинную смолу второго буфера, содержащего от приблизительно 30 до приблизительно 200 мМ Трис-HCl и от приблизительно 75 до приблизительно 500 мМ соли, и второй буфер имеет рН от приблизительно 7,5 до приблизительно 9,2; и
третья стадия промывки включает нанесение на аффинную смолу третьего буфера, содержащего от приблизительно 30 до приблизительно 200 мМ Трис-HCl и от приблизительно 30 до приблизительно 75% об. этиленгликоля, и третий буфер имеет рН от приблизительно 7,3 до приблизительно 8,8.
[0013] В некоторых вариантах осуществления первая стадия промывки включает нанесение на аффинную смолу первого буфера, содержащего от приблизительно 50 до приблизительно 500 мМ натриевой соли 2-(N-морфолино)этансульфоновой кислоты (MES-Na), от приблизительно 3 до приблизительно 30 мМ EDTA и смесь растворитель/детергент, включающую полисорбат 80, ДМСО и три(н-бутил)фосфат (TNBP), и первый буфер имеет рН от приблизительно 5,2 до приблизительно 6,8;
вторая стадия промывки включает нанесение на аффинную смолу второго буфера, содержащего от приблизительно 30 до приблизительно 200 мМ Трис-HCl или Аргинин-HCl и от приблизительно 75 до приблизительно 500 мМ соли, и второй буфер имеет рН от приблизительно 7,5 до приблизительно 9,2; и
третья стадия промывки включает нанесение на аффинную смолу третьего буфера, содержащего от приблизительно 20 до приблизительно 80 мМ Аргинин-HCl и от приблизительно 50 до приблизительно 200 мМ соли, и третий буфер имеет рН от приблизительно 7,3 до приблизительно 8,8.
[0014] В некоторых вариантах осуществления первая стадия промывки включает нанесение на аффинную смолу первого буфера, содержащего от приблизительно 50 до приблизительно 200 мМ таурина и от 0,2 до 1,5% ПЭГ (например, ПЭГ 6000), причем первый буфер имеет рН от приблизительно 5,2 до приблизительно 6,8;
вторая стадия промывки включает нанесение на аффинную смолу второго буфера, содержащего от приблизительно 30 до приблизительно 300 мМ глицина, и второй буфер имеет рН от приблизительно 7,5 до приблизительно 9,2; и
третья стадия промывки включает нанесение на аффинную смолу третьего буфера, содержащего от приблизительно 20 до приблизительно 150 мМ таурина, от приблизительно 30 до приблизительно 75% об. этиленгликоля и от 0,05 до 0,2% октилгликопиранозида, и третий буфер имеет рН от приблизительно 7,3 до приблизительно 8,8.
[0015] В некоторых вариантах осуществления первая стадия промывки включает нанесение на аффинную смолу первого буфера, содержащего от приблизительно 80 до приблизительно 400 мМ Бис-Трис и от приблизительно 10 до приблизительно 20 грамм смеси растворитель/детергент, содержащей примерно Тритон-X100, полисорбат 80 и TNBP в соотношении приблизительно 11:3:3 (по массе), причем первый буфер имеет рН от приблизительно 5,2 до приблизительно 6,8;
вторая стадия промывки включает нанесение на аффинную смолу второго буфера, содержащего от приблизительно 5 до приблизительно 20 ммоль цитрата натрия, и причем второй буфер имеет рН от приблизительно 7,5 до приблизительно 9,2; и
третья стадия промывки включает нанесение на аффинную смолу третьего буфера, содержащего от приблизительно 50 до приблизительно 200 мМ Аргинин-HCl, от приблизительно 50 до приблизительно 200 мМ Лизина HCl, от приблизительно 50 до приблизительно 200 мМ Гистидина-HCl и от приблизительно 1 мМ до приблизительно 4 мМ N-ацетил-D, L-триптофана и от приблизительно 10% до приблизительно 40% (масс./масс.) полисорбата 80 и причем третий буфер имеет рН от приблизительно 7,3 до приблизительно 8,8.
[0016] В некоторых вариантах осуществления первая стадия промывки включает нанесение на аффинную смолу первого буфера, содержащего от приблизительно 50 нМ до приблизительно 200 мМ ацетата натрия и от приблизительно 0,05 до приблизительно 0,2% полисорбата 80, причем первый буфер имеет pH от приблизительно 5,2 до приблизительно 6,8;
вторая стадия промывки включает нанесение на аффинную смолу второго буфера, содержащего от приблизительно 20 нМ до приблизительно 100 мМ Трис-HCl и от приблизительно 50 нМ до приблизительно 200 нМ соли, причем второй буфер имеет рН от приблизительно 7,5 до приблизительно 8,8; и
третья стадия промывки включает нанесение на аффинную смолу третьего буфера, содержащего от приблизительно 20 до 100 мМ Трис-HCl, от приблизительно 40% до приблизительно 60% (масс./масс.) этиленгликоля, и причем третий буфер имеет рН от приблизительно 7,5 до приблизительно 8,8.
[0017] В некоторых вариантах осуществления первая стадия промывки включает нанесение на аффинную смолу первого буфера, содержащего от приблизительно 50 нМ до приблизительно 200 мМ ацетата натрия и от приблизительно 0,05 до приблизительно 0,2% полисорбата 80, причем первый буфер имеет pH от приблизительно 5,2 до приблизительно 6,8;
вторая стадия промывки включает нанесение на аффинную смолу второго буфера, содержащего от приблизительно 20 нМ до приблизительно 100 мМ Трис-HCl и от приблизительно 50 нМ до приблизительно 200 нМ соли, причем второй буфер имеет рН от приблизительно 7,5 до приблизительно 8,8; и
третья стадия промывки включает нанесение на аффинную смолу третьего буфера, содержащего от приблизительно 20 до 100 мМ Трис-HCl, от приблизительно 40% до приблизительно 60% (масс./масс.) этиленгликоля, и третий буфер имеет рН от приблизительно 7,5 до приблизительно 8,8.
[0018] В некоторых вариантах осуществления соль выбрана из NaCl, KCl, MgCl2, CaCl2, цитрата натрия, LiCl, CsCl, ацетата натрия и комбинации одного или более из NaCl, KCl, MgCl2, CaCl2, цитрата натрия, LiCl, CsCl и ацетата натрия. В некоторых вариантах осуществления соль представляет собой NaCl.
[0019] В некоторых вариантах осуществления концентрация соли не превышает 500 мМ. В некоторых вариантах осуществления концентрация соли не превышает 200 мМ. В некоторых вариантах осуществления концентрация соли в третьем буфере не превышает 500 мМ. В некоторых вариантах осуществления концентрация соли в третьем буфере не превышает 200 мМ.
[0020] В некоторых вариантах осуществления способ дополнительно включает четвертую стадию промывки, которая происходит перед первой стадией промывки, и включает нанесение на аффинную смолу четвертого буфера, содержащего от приблизительно 10 до приблизительно 30 мМ Трис-HCl и от приблизительно 75 до приблизительно 250 мМ NaCl, и четвертый буфер имеет рН от приблизительно 6,5 до приблизительно 8,0.
[0021] В некоторых вариантах осуществления первый буфер содержит приблизительно 100 мМ ацетата натрия, приблизительно 0,1% полисорбата 80, и первый буфер имеет рН приблизительно 6,0. В некоторых вариантах осуществления второй буфер содержит приблизительно 50 мМ Трис-HCl и приблизительно 125 мМ NaCl, и второй буфер имеет рН приблизительно 8,5. В некоторых вариантах осуществления третий буфер содержит приблизительно 50 мМ Трис-HCl и приблизительно 50% об. этиленгликоля, и третий буфер имеет рН приблизительно 8,5.
[0022] В некоторых вариантах осуществления первая стадия промывки включает нанесение на аффинную смолу первого буфера, содержащего от приблизительно 50 до приблизительно 200 мМ ацетата натрия и от приблизительно 0,05 до приблизительно 0,2% полисорбата 80, и первый буфер имеет рН от приблизительно 5,5 до приблизительно 6,5;
вторая стадия промывки включает нанесение на аффинную смолу второго буфера, содержащего от приблизительно 10 до приблизительно 70 мМ Трис-HCl и от приблизительно 75 до приблизительно 250 мМ NaCl, и второй буфер имеет рН от приблизительно 8,0 до приблизительно 9,0; и
третья стадия промывки включает нанесение на аффинную смолу третьего буфера, содержащего от приблизительно 10 до приблизительно 70 мМ Трис-HCl и от приблизительно 30 до приблизительно 75% об. этиленгликоля, и третий буфер имеет рН от приблизительно 8,0 до приблизительно 9,0. В некоторых вариантах осуществления способ дополнительно включает четвертую стадию промывки, которая происходит перед первой стадией промывки, и включает нанесение на аффинную смолу четвертого буфера, содержащего от приблизительно 10 до приблизительно 30 мМ Трис-HCl и от приблизительно 75 до приблизительно 250 мМ NaCl, и четвертый буфер имеет рН от приблизительно 6,5 до приблизительно 8,0.
[0023] В некоторых вариантах осуществления первый буфер содержит приблизительно 100 мМ ацетата натрия и приблизительно 0,1% полисорбата 80, и первый буфер имеет рН приблизительно 6,0. В некоторых вариантах осуществления второй буфер содержит приблизительно 50 мМ Трис-HCl и приблизительно 125 мМ NaCl, и второй буфер имеет рН приблизительно 8,5. В некоторых вариантах осуществления третий буфер содержит приблизительно 50 мМ Трис-HCl и приблизительно 50% об. этиленгликоля, и третий буфер имеет рН приблизительно 8,0.
[0024] В некоторых вариантах осуществления кислотный компонент удаляют. В некоторых вариантах осуществления кислотный компонент представляет собой ДНК клетки-хозяина, такую как ДНК HEK293, и причем количество кислотного компонента снижается до значения ниже 250 пг на микрограмм антигена AAV, как измерено с помощью кПЦР. В некоторых вариантах осуществления кислотный компонент представляет собой ДНК клетки-хозяина, такую как ДНК HEK293, и причем количество кислотного компонента снижается до значения ниже 250 пг на микрограмм антигена AAV, как измерено с помощью ИФА.
[0025] В некоторых вариантах осуществления элюирование включает применение непрерывного линейного увеличения проводимости элюирующего буфера путем градиентного элюирования. В некоторых вариантах осуществления элюирование включает применение непрерывного линейного увеличения концентрации органического растворителя путем градиентного элюирования. В некоторых вариантах осуществления элюирование включает приведение в контакт аффинной смолы с элюирующим буфером, содержащим этиленгликоль, соль, такую как NaCl, и буфер, такой как Трис-HCl, причем pH составляет по меньшей мере 7,0. В некоторых вариантах осуществления концентрация соли составляет приблизительно 750 мМ, концентрация буфера составляет приблизительно 50 мМ, и этиленгликоль составляет 50-60% (масс./масс.). В некоторых вариантах осуществления pH составляет приблизительно 8,0. В некоторых вариантах осуществления соль представляет собой NaCl, а буфер представляет собой Трис-HCl.
[0026] В некоторых вариантах осуществления элюирование включает приведение в контакт аффинной смолы с элюирующим буфером, содержащим приблизительно 750 мМ NaCl и 50-60% (масс./масс.) этиленгликоля при рН по меньшей мере 7,0. В некоторых вариантах осуществления элюирующий буфер содержит по меньшей мере приблизительно 55% (масс./масс.) этиленгликоля. В некоторых вариантах осуществления элюирование включает приведение в контакт аффинной смолы с элюирующим буфером, содержащим приблизительно 50 мМ Трис-HCl, от приблизительно 750 мМ до приблизительно 1250 мМ NaCl и приблизительно 60% (масс./масс.) этиленгликоля при рН по меньшей мере 7,8.
[0027] В некоторых вариантах осуществления элюирование включает приведение в контакт аффинной смолы с элюирующим буфером, содержащим приблизительно 2 мМ хлорида магния, приблизительно 50 мМ Аргинин-HCl, от приблизительно 750 мМ до приблизительно 1000 мМ NaCl и по меньшей мере приблизительно 55% (масс./масс.) сахарозы при рН по меньшей мере приблизительно 8,0.
[0028] В некоторых вариантах осуществления элюирование дополнительно включает
(а) приведение в контакт аффинной смолы с пятым буфером, содержащим от приблизительно 20 до приблизительно 100 мМ Аргинин-HCl и от приблизительно 75 до приблизительно 250 мМ NaCl, и пятый буфер имеет рН от приблизительно 7,5 до приблизительно 8,5; и
(b) приведение в контакт аффинной смолы со вторым элюирующим буфером, содержащим от приблизительно 20 до приблизительно 100 мМ Аргинин-HCl, от приблизительно 40 до приблизительно 60% (масс./масс.) глицерина и от приблизительно 500 до 1000 мМ соли, и второй элюирующий буфер имеет рН от приблизительно 7,5 до приблизительно 8,5.
[0029] В некоторых вариантах осуществления стадии выполняются последовательно.
[0030] В некоторых вариантах осуществления элюирование включает приведение в контакт аффинной смолы с элюирующим буфером, содержащим приблизительно 2 мМ хлорида магния, приблизительно 50 мМ Аргинин-HCl, от приблизительно 750 мМ до приблизительно 1000 мМ NaCl и по меньшей мере приблизительно 50% (масс./масс.) глицерина при рН по меньшей мере приблизительно 8,0.
[0031] В некоторых вариантах осуществления элюирование включает приведение в контакт аффинной смолы с элюирующим буфером, содержащим приблизительно 2 мМ хлорида магния, приблизительно 50 мМ таурина, от приблизительно 600 мМ до приблизительно 1000 мМ NaCl, от приблизительно 0,05 до приблизительно 0,2% октилгликопиранозида и приблизительно 60% (масс./масс.) этиленгликоля при рН по меньшей мере приблизительно 7,8. В некоторых вариантах осуществления элюирование дополнительно включает
(а) приведение в контакт аффинной смолы с пятым буфером, содержащим от приблизительно 20 до приблизительно 100 мМ Трис-HCl и от приблизительно 75 до приблизительно 250 мМ NaCl, и пятый буфер имеет рН от приблизительно 8,0 до приблизительно 8,8; и
(b) приведение в контакт аффинной смолы со вторым элюирующим буфером, содержащим приблизительно 1 М сульфата аммония, приблизительно 50 мМ Трис-HCl и приблизительно 50% (об./об.) этиленгликоля при рН по меньшей мере приблизительно 6,8.
[0032] В некоторых вариантах осуществления стадии осуществляют последовательно.
[0033] В некоторых вариантах осуществления элюирование включает приведение в контакт аффинной смолы с элюирующим буфером, содержащим приблизительно 1 М сульфата аммония, приблизительно 50 мМ Трис-HCl и приблизительно 50% (об./об.) этиленгликоля при рН по меньшей мере приблизительно 6,8. В некоторых вариантах осуществления элюирование включает приведение в контакт аффинной смолы с элюирующим буфером, содержащим приблизительно 20% (масс./масс.) сахарозы, приблизительно 10% (масс./масс.) сорбита, приблизительно 5% (масс./масс.) маннита или приблизительно 5% (масс./масс.) сахарозы, приблизительно 15% (масс./масс.) глицерина, приблизительно 50 мМ гистидина и от приблизительно 750 до приблизительно 1000 мМ NaCl при рН по меньшей мере приблизительно 7,8.
[0034] В некоторых вариантах осуществления элюирование дополнительно включает
(а) приведение в контакт аффинной смолы с пятым буфером, содержащим от приблизительно 20 до приблизительно 100 мМ гистидина и от приблизительно 80 до приблизительно 120 мМ NaCl, и пятый буфер имеет рН от приблизительно 8,0 до приблизительно 8,8; и
(b) приведение в контакт аффинной смолы со вторым элюирующим буфером, содержащим от приблизительно 20 до приблизительно 100 мМ гистидина и от приблизительно 600 до приблизительно 900 мМ NaCl, и от приблизительно 5 до 60% (масс./масс.) ДМСО, и пятый буфер имеет рН от приблизительно 6,5 до приблизительно 8,5.
[0035] В некоторых вариантах осуществления стадии осуществляют последовательно. В некоторых вариантах осуществления элюирование включает приведение в контакт аффинной смолы с элюирующим буфером, содержащим приблизительно 100 мМ глицин-HCl, приблизительно 200 мМ NaCl, при рН приблизительно 2,5.
[0036] В некоторых вариантах осуществления элюирующий буфер имеет рН приблизительно 8,0. В некоторых вариантах осуществления элюирующий буфер имеет рН 8,0.
[0037] В некоторых вариантах осуществления элюирование включает постепенное увеличение концентрации противоиона. В некоторых вариантах осуществления элюирование включает постепенное увеличение концентрации органического растворителя. В некоторых вариантах осуществления соль в элюирующем буфере выбрана из одновалентных, двухвалентных или поливалентных анионов, таких как хлорид, ацетат, сульфат и цитрат.
[0038] В некоторых вариантах осуществления первая стадия промывки включает нанесение на аффинную смолу первого буфера, содержащего от приблизительно 50 до приблизительно 200 мМ ацетата натрия, от приблизительно 0,05 до приблизительно 0,2% полисорбата 80, и первый буфер имеет рН от приблизительно 5,2 до приблизительно 6,8;
вторая стадия промывки включает нанесение на аффинную смолу второго буфера, содержащего от приблизительно 25 до приблизительно 100 мМ Трис-HCl и от приблизительно 50 до приблизительно 200 мМ NaCl, и второй буфер имеет рН от приблизительно 7,5 до приблизительно 9,2; и
третья стадия промывки включает нанесение на аффинную смолу третьего буфера, содержащего от приблизительно 20 до приблизительно 100 мМ Трис-HCl и от приблизительно 75 до приблизительно 250 мМ NaCl, и третий буфер имеет рН от приблизительно 7,5 до приблизительно 8,8. В некоторых вариантах осуществления способ дополнительно включает элюирование путем нанесения на аффинную смолу очищенной воды с последующим нанесением на аффинную смолу от приблизительно 20 до приблизительно 50 мМ HCl при рН от приблизительно 1,7 до приблизительно 2,5. В некоторых вариантах осуществления способ дополнительно включает элюирование с применением градиента от 0 до 100% 20-50 мМ хлористоводородной кислоты/800-1200 мМ NaCl в 0,5-2,0 мМ хлористоводородной кислоты.
[0039] В некоторых вариантах осуществления AAV, полученный на стадии элюирования, имеет уровень примесей HC ≤ 99,9%. В некоторых вариантах осуществления AAV, полученный на стадии элюирования, имеет уровень примесей HC ≤ 99,0%.
[0040] В некоторых вариантах осуществления AAV представляет собой AAV8, аффинная смола представляет собой POROS™ CaptureSelect™ AAV8, и элюирующий буфер является кислотным и не содержит этиленгликоль. В некоторых вариантах осуществления AAV представляет собой AAV9, аффинная смола представляет собой POROS™ CaptureSelect™ AAV9, и элюирующий буфер является кислотным и не содержит этиленгликоль.
[0041] В некоторых вариантах осуществления AAV представляет собой AAV8, а аффинная смола представляет собой иммуноаффинную смолу, состоящую из иммобилизованного моноклонального антитела против AAV8 типа ADK8 или ADK8/9, иммобилизованного на хроматографической матрице. В некоторых вариантах осуществления AAV представляет собой AAV9, а аффинная смола представляет собой иммуноаффинную смолу, состоящую из иммобилизованного моноклонального антитела против AAV9 типа ADK9 или ADK8/9, иммобилизованного на хроматографической матрице.
[0042] В некоторых вариантах осуществления способ дополнительно включает приведение в контакт раствора, содержащего AAV, с фильтром, содержащим положительно заряженные группы, эффективные для удаления кислотных заряженных загрязнений из раствора, содержащего AAV.
[0043] В некоторых вариантах осуществления способ дополнительно включает нанофильтрацию фракции AAV для удаления вирусов размером более чем 35 нм.
[0044] В некоторых вариантах осуществления способ дополнительно включает стадию полировки, включающую проведение AEX-хроматографии с колонкой, содержащей гель типа «щупальца».
[0045] В некоторых вариантах осуществления способ дополнительно включает тестирование фракции AAV с помощью AAV-специфического ИФА.
[0046] В некоторых вариантах осуществления AAV-специфический ИФА представляет собой сэндвич-вариант ИФА, специфичный для AAV.
[0047] В другом аспекте предлагается продукт AAV, полученный способом по любому из пп. 1-83.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0048] На фиг. 1 представлен вестерн-блот, показывающий существенно меньшее количество белка теплового шока 70 кДа (HSP70) в соответствии с протприблизительном очистки с несколькими стадиями промывки, описанными в данном документе (полоса 4), в отличие от сравнительного протокола очистки без стадий промывки (полоса 6).
[0049] На фиг. 2 проиллюстрировано окрашивание серебром белковых SDS-PAGE гелей, показывающее белки AAV8 на полосе 2, элюат, содержащий AAV8, из протокола очистки с несколькими стадиями промывки, описанными в данном документе (полоса 4), и сравнительного протокола очистки без стадии промывки (полоса 6).
[0050] На фиг. 3 проиллюстрирован вестерн-блот, показывающий больше AAV8, присутствующего в элюате, приготовленном в соответствии с протоколом очистки с несколькими стадиями промывки, описанными в данном документе (полоса 4), чем в элюате из сравнительного протокола очистки без стадий промывки (полоса 6). Контрольный образец AAV8 находится на полосе 2.
[0051] На фиг.4 проиллюстрировано серебряное окрашивание белковых SDS-PAGE гелей, показывающее белки, присутствующие в различных фракциях от (L) начальной загрузки среды для культивирования клеток из клеток HEK 293, экспрессирующих AAV8, до элюата (E), обогащенного AAV8. Наблюдалась небольшая потеря AAV8 при прохождении через стадии промывки (W1, W2 и W3), и небольшое количество AAV8 элюировалось из колонки во время стриппинга (S).
[0052] На фиг. 5 изображен вестерн-блот против антигенов AAV8. AAV8 экспрессировали в начальной загрузке среды для культивирования клеток из клеток HEK 293, экспрессирующих AAV8 (L). Значительно меньше AAV8 присутствовало в потоке после этой начальной загрузки (FT) и последующих стадий промывки (W1, W2 и W3). AAV8 присутствовал в элюате (E, E2). Опять же, значительно меньше AAV8 элюировалось из колонки во время стриппинга (S).
[0053] На фиг. 6 изображена хроматограмма процедуры разделения согласно Примеру 3.
[0054] На фиг. 7 изображена хроматограмма из процедуры разделения согласно Примеру 11.
[0055] На фиг. 8 проиллюстрировано серебряное окрашивание белковых SDS-PAGE гелей, показывающее белки, присутствующие в различных фракциях с разных стадий промывки и элюатов в соответствии с Примером 11.
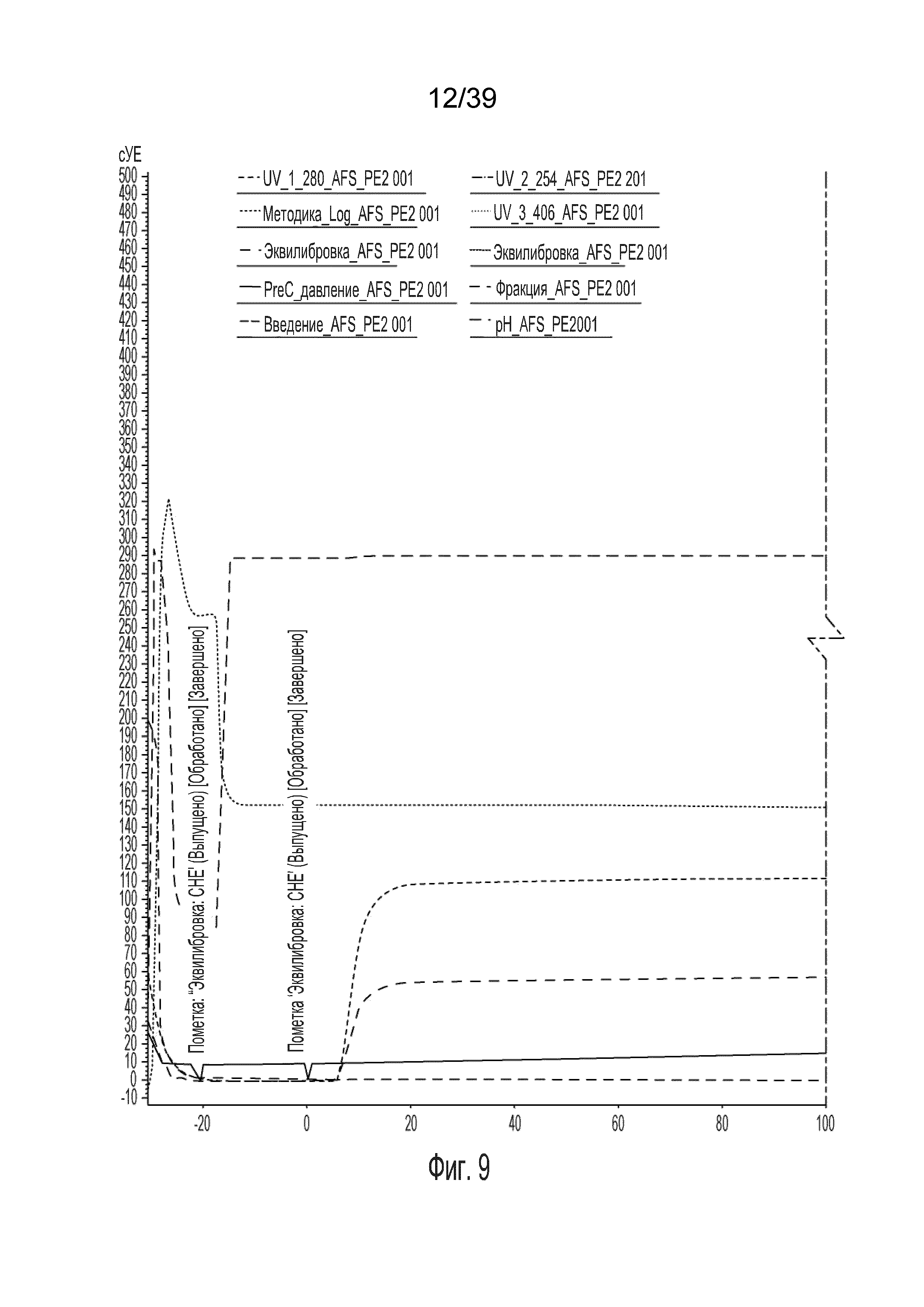
[0056] На фиг. 9 изображена хроматограмма из процедуры разделения согласно Примеру 12.
[0057] На фиг. 10 проиллюстрировано серебряное окрашивание белковых SDS-PAGE гелей, показывающее белки, присутствующие в различных фракциях с разных стадий промывки и элюатов в соответствии с Примером 12.
[0058] На фиг. 11 изображена хроматограмма из процедуры разделения согласно Примеру 13.
[0059] На фиг. 12 проиллюстрировано серебряное окрашивание белковых SDS-PAGE гелей, показывающее белки, присутствующие в различных фракциях с разных стадий промывки и элюатов в соответствии с Примером 13.
[0060] На фиг. 13 изображена хроматограмма из процедуры разделения согласно Примеру 14.
[0061] На фиг. 14 проиллюстрировано окрашивание серебром белковых SDS-PAGE гелей, показывающее белки, присутствующие в различных фракциях, взятых со стадий промывки и элюатов, как описано в Примере 14.
[0062] На фиг. 15 изображен вестерн-блот против антигенов AAV из различных фракций, взятых со стадий промывки и элюатов, как описано в Примере 14.
[0063] На фиг. 16 изображена хроматограмма из процедуры разделения согласно Примеру 15.
[0064] На фиг. 17 изображена хроматограмма из процедуры разделения согласно Примеру 16.
[0065] На фиг. 18 изображен вестерн-блот против антигенов AAV из различных фракций, взятых со стадий промывки и элюатов, как описано в Примере 16.
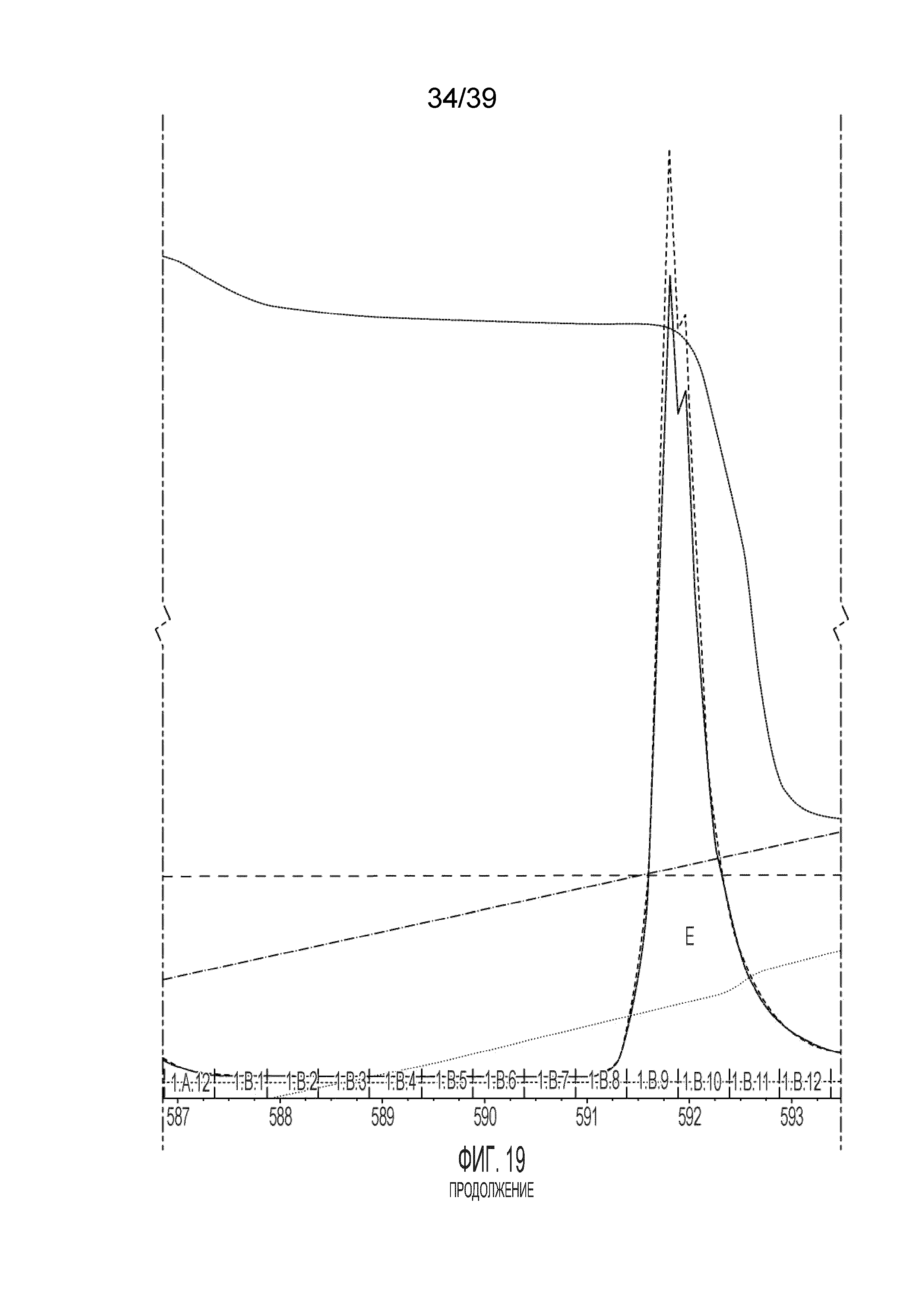
[0066] На фиг. 19 изображена хроматограмма из процедуры разделения согласно Примеру 17.
[0067] На фиг. 20 проиллюстрировано окрашивание серебром белковых SDS-PAGE гелей, показывающее белки, присутствующие в различных фракциях, взятых со стадий промывки и элюатов, как описано в Примере 17.
[0068] На фиг. 21 изображена хроматограмма, иллюстрирующая результаты со скрининга элюирования, описанного в Примере 18.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0069] В данном документе представлены способы получения продукта аденоассоциированного вируса (AAV), способы очистки AAV и способы очистки полных капсидов AAV из концентрированной фракции AAV, содержащей пустые капсиды AAV и полные капсиды AAV.
[0070] Использование терминов в единственном числе и аналогичные ссылки в контексте описания данного изобретения (особенно в контексте следующей формулы изобретения) должны толковаться как для единственного, так и для множественного числа, если иное не указано в данном документе или явно не противоречит контексту. Термины «содержащий», «имеющий», «включающий» и «содержащий» следует истолковывать как неограничивающие термины (то есть означающие «включающий, но не ограничивающийся»), если не указано иное.
[0071] Перечисление диапазонов значений в данном документе просто предназначено для того, чтобы служить кратким способом индивидуальной ссылки на каждое отдельное значение, попадающее в диапазон и каждую конечную точку, если в данном документе не указано иное, и каждое отдельное значение и конечная точка включены в спецификацию, как если бы это было индивидуально изложенный в данном документе.
[0072] Все способы, описанные в данном документе, могут быть выполнены в любом подходящем порядке, если иное не указано в данном документе или иное явно не противоречит контексту. Использование любых и всех примеров или примерных формулировок (например, «таких как»), представленных в данном документе, предназначено просто для лучшего освещения данного документа и не ограничивает объем данного документа, если не заявлено иное. Ни одна формулировка в описании не должна быть истолкована как указывающая на любой не заявленный элемент как существенный для практики данного изобретения.
[0073] Предпочтительные варианты осуществления данного изобретения описаны в данном документе, включая наилучший способ, известный изобретателям для осуществления данного изобретения. Изменения этих предпочтительных вариантов осуществления могут стать очевидными для специалистов в данной области техники после прочтения предшествующего описания. Авторы изобретения ожидают, что квалифицированные специалисты будут использовать такие варианты в зависимости от обстоятельств, и авторы изобретения предполагают, что данное изобретения будет осуществляться на практике иначе, чем конкретно описано в данном документе. Соответственно, данное изобретение включает все модификации и эквиваленты объекта изобретения, перечисленного в прилагаемой формуле изобретения, как это разрешено применимым законодательством. Кроме того, любая комбинация вышеописанных элементов во всех возможных их вариациях охватывается данным изобретением, если иное не указано в данном документе или иное явно не противоречит контексту.
[0074] Особенностью генерации вектора AAV в клеточной культуре является образование сложного матрикса, который содержит материал из разрушенных клеток. В частности, белки клетки-хозяина, протеасомы, клеточный дебрис и потенциальные вирус-специфические рецепторы часто присутствуют в материале из разрушенных клеток. Раскрыты способы, которые включают стадии удаления материала клетки-хозяина из конечного продукта AAV в условиях, которые приводят к большей чистоте при физиологически пригодном pH.
[0075] В одном аспекте предложен способ очистки аденоассоциированного вируса (AAV). Способ включает (а) загрузку раствора, содержащего AAV, на аффинную смолу, нацеленную на AAV, при проводимости, которая позволяет связывание AAV в растворе и аффинной смолой; (b) выполнение по меньшей мере двух стадий промывки; и (с) элюирование AAV из аффинной смолы.
[0076] В некоторых вариантах осуществления AAV, очищенный способами, описанными в данном документе, имеет серотип AAV1, серотип AAV2, серотип AAV3, серотип AAV4, серотип AAV5, серотип AAV6, серотип AAV7, серотип AAV8, серотип AAV9, серотип AAV10, серотип AAV11, серотип AAV12, серотип AAV13, серотип AAAV, серотип BAAV, серотип AAV (VR-195) и серотип AAV (VR-355). В некоторых вариантах AAV модифицируется с помощью способов генной инженерии и/или химически модифицируется.
[0077] В некоторых вариантах осуществления способ дополнительно включает приведение в контакт раствора, содержащего AAV, с анионитом и элюирование раствора, содержащего AAV, из анионита перед загрузкой раствора, содержащего AAV, на аффинную смолу. Анионит может работать в проточном режиме. В некоторых вариантах осуществления по меньшей мере одна из стадий промывки включает нанесение на аффинную смолу буфера, содержащего органический растворитель или детергент. В некоторых вариантах осуществления буфер содержит Трис-HCl и соль, например, NaCl. В некоторых вариантах осуществления буфер содержит ацетат натрия. В некоторых вариантах осуществления буфер содержит хлорид магния. В некоторых вариантах осуществления буфер содержит Трис-HCl и этиленгликоль. В некоторых вариантах осуществления буфер содержит Аргинин-HCl и одно из сахарозы и глицерина. В некоторых вариантах осуществления буфер содержит Таурин и этиленгликоль. В некоторых вариантах осуществления буфер содержит Аргинин-HCl, Лизин-HCl и Гистидин-HCl. В некоторых вариантах осуществления буфер содержит Трис-HCl и ДМСО.
[0078] В некоторых вариантах осуществления буфер содержит Аргинин-HCl, и соль, например, NaCl. В некоторых вариантах осуществления буфер содержит гистидин и соль, например, NaCl. В некоторых вариантах осуществления буфер содержит Трис-HCl и этиленгликоль. В некоторых вариантах осуществления органический растворитель представляет собой этиленгликоль. В некоторых вариантах осуществления органический растворитель представляет собой ДМСО. В некоторых вариантах осуществления соль выбрана из NaCl, KCl, MgCl2, CaCl2, цитрата натрия, LiCl, CsCl, ацетата натрия и комбинации одного или более из NaCl, KCl, MgCl2, CaCl2, цитрата натрия, LiCl, CsCl и ацетат натрия. В некоторых вариантах осуществления концентрация соли не превышает 500 мМ. В некоторых вариантах осуществления концентрация соли не превышает 200 мМ.
[0079] В некоторых вариантах осуществления выполняются по меньшей мере три стадии промывки. В некоторых вариантах осуществления выполняются три стадии промывки. В некоторых вариантах осуществления три стадии промывки выполняются последовательно.
[0080] В некоторых вариантах осуществления органический растворитель или детергент представляет собой полисорбат 80, этиленгликоль, сорбит, маннит, ксилит, ДМСО, сахарозу или трегалозу. В некоторых вариантах осуществления детергент содержит один или более из тритона X100, полисорбата 80 и три(н-бутил)фосфата (TNBP). В некоторых вариантах осуществления буфер содержит Бис-Трис.
[0081] В некоторых вариантах осуществления выполняются по меньшей мере три стадии промывки; первая стадия промывки включает нанесение на аффинную смолу первого буфера, содержащего от приблизительно 50 до приблизительно 2000 мМ ацетата натрия и от приблизительно 0,05 до приблизительно 0,2% полисорбата 80, и при этом первый буфер имеет рН от приблизительно 5,2 до приблизительно 6,8; вторая стадия промывки включает нанесение на аффинную смолу второго буфера, содержащего от приблизительно 30 до приблизительно 200 мМ Трис-HCl и от приблизительно 75 до приблизительно 500 мМ соли, и при этом второй буфер имеет рН от приблизительно 7,5 до приблизительно 9,2; и третья стадия промывки включает нанесение на аффинную смолу третьего буфера, содержащего от приблизительно 30 до приблизительно 200 мМ Трис-HCl и от приблизительно 30 до приблизительно 75% об. этиленгликоля, и при этом третий буфер имеет рН от приблизительно 7,3 до приблизительно 8,8. В некоторых вариантах осуществления соль выбрана из NaCl, KCl, MgCl2, CaCl2, цитрата натрия, LiCl, CsCl, ацетата натрия и комбинации одного или более из NaCl, KCl, MgCl2, CaCl2, цитрата натрия, LiCl, CsCl и ацетата натрия. В некоторых вариантах осуществления соль представляет собой NaCl. В некоторых вариантах осуществления концентрация соли не превышает 500 мМ. В некоторых вариантах осуществления концентрация соли не превышает 200 мМ. В некоторых вариантах осуществления концентрация соли в третьем буфере не превышает 500 мМ. В некоторых вариантах осуществления концентрация соли в третьем буфере не превышает 200 мМ. В некоторых вариантах осуществления способ дополнительно включает четвертую стадию промывки, которая происходит перед первой стадией промывки, и включает нанесение на аффинную смолу четвертого буфера, содержащего от приблизительно 10 до приблизительно 30 мМ Трис-HCl и от приблизительно 75 до приблизительно 250 мМ NaCl, и при этом четвертый буфер имеет рН от приблизительно 6,5 до приблизительно 8,0. В некоторых вариантах осуществления первый буфер содержит приблизительно 100 мМ ацетата натрия, приблизительно 0,1% полисорбата 80, и при этом первый буфер имеет рН приблизительно 6,0. В некоторых вариантах осуществления второй буфер содержит приблизительно 50 мМ Трис-HCl и приблизительно 125 мМ NaCl, и при этом второй буфер имеет рН приблизительно 8,5. В некоторых вариантах осуществления третий буфер содержит приблизительно 50 мМ Трис-HCl и приблизительно 50% об. этиленгликоля, и при этом третий буфер имеет рН приблизительно 8,5.
[0082] В некоторых вариантах осуществления органический растворитель или детергент представляет собой полисорбат 80, этиленгликоль, сорбит, маннит, ксилит, сахарозу или трегалозу.
[0083] В некоторых вариантах осуществления выполняются по меньшей мере три стадии промывки; первая стадия промывки включает нанесение на аффинную смолу первого буфера, содержащего от приблизительно 50 до приблизительно 200 мМ ацетата натрия и от приблизительно 0,05 до приблизительно 0,2% полисорбата 80, и при этом первый буфер имеет рН от приблизительно 5,5 до приблизительно 6,5; вторая стадия промывки включает нанесение на аффинную смолу второго буфера, содержащего от приблизительно 10 до приблизительно 70 мМ Трис-HCl и от приблизительно 75 до приблизительно 250 мМ NaCl, и при этом второй буфер имеет рН от приблизительно 8,0 до приблизительно 9,0; и третья стадия промывки включает нанесение на аффинную смолу третьего буфера, содержащего от приблизительно 10 до приблизительно 70 мМ Трис-HCl и от приблизительно 30 до приблизительно 75% об. этиленгликоля, и при этом третий буфер имеет рН от приблизительно 8,0 до приблизительно 9,0. В некоторых вариантах осуществления способ дополнительно включает четвертую стадию промывки, которая происходит перед первой стадией промывки, и включает нанесение на аффинную смолу четвертого буфера, содержащего от приблизительно 10 до приблизительно 30 мМ Трис-HCl и от приблизительно 75 до приблизительно 250 мМ NaCl, и при этом четвертый буфер имеет рН от приблизительно 6,5 до приблизительно 8,0. В некоторых вариантах осуществления первый буфер содержит приблизительно 100 мМ ацетата натрия и приблизительно 0,1% полисорбата 80, и первый буфер имеет рН приблизительно 6,0. В некоторых вариантах осуществления второй буфер содержит приблизительно 50 мМ Трис-HCl и приблизительно 125 мМ NaCl, и причем второй буфер имеет рН приблизительно 8,5. В некоторых вариантах осуществления третий буфер содержит приблизительно 50 мМ Трис-HCl и приблизительно 50% об. этиленгликоля, и при этом третий буфер имеет рН приблизительно 8,0.
[0084] В еще большем числе вариантов осуществления выполняются по меньшей мере три стадии промывки; первая стадия промывки включает нанесение на аффинную смолу первого буфера, содержащего от приблизительно 50 до приблизительно 500 мМ натриевой соли 2-(N-морфолино)этансульфоновой кислоты (MES-Na), от приблизительно 3 до приблизительно 30 мМ ЭДТА, и смесь растворитель/детергент, включающую полисорбат 80, ДМСО и три(н-бутил)фосфат (TNBP), и причем первый буфер имеет рН от приблизительно 5,2 до приблизительно 6,8; вторая стадия промывки включает нанесение на аффинную смолу второго буфера, содержащего от приблизительно 30 до приблизительно 200 мМ Трис-HCl или Аргинин-HCl и от приблизительно 75 до приблизительно 500 мМ соли, и причем второй буфер имеет рН от приблизительно 7,5 до приблизительно 9,2; и третья стадия промывки включает нанесение на аффинную смолу третьего буфера, содержащего от приблизительно 20 до приблизительно 80 мМ Аргинин-HCl и от приблизительно 50 до приблизительно 60% (масс./масс.) сахарозы, и причем третий буфер имеет рН от приблизительно 7,3 до приблизительно 8,8. В некоторых вариантах осуществления соль выбрана из NaCl, KCl, MgCl2, CaCl2, цитрата натрия, LiCl, CsCl, ацетата натрия и комбинации одного или более из NaCl, KCl, MgCl2, CaCl2, цитрата натрия, LiCl, CsCl и ацетата натрия. В некоторых вариантах осуществления соль представляет собой NaCl. В некоторых вариантах осуществления концентрация соли не превышает 500 мМ. В некоторых вариантах осуществления концентрация соли не превышает 200 мМ. В некоторых вариантах осуществления концентрация соли в третьем буфере не превышает 500 мМ. В некоторых вариантах осуществления концентрация соли в третьем буфере не превышает 200 мМ. В некоторых вариантах осуществления способ дополнительно включает четвертую стадию промывки, которая происходит перед первой стадией промывки, и включает нанесение на аффинную смолу четвертого буфера, содержащего от приблизительно 20 до приблизительно 100 мМ Аргинин-HCl и от приблизительно 75 до приблизительно 250 мМ NaCl, и при этом четвертый буфер имеет рН от приблизительно 7,5 до приблизительно 8,8. В некоторых вариантах осуществления первая стадия элюирования включает нанесение на аффинную смолу первого элюирующего буфера, содержащего от приблизительно 20 до приблизительно 100 мМ Аргинин-HCl и от приблизительно 40 до приблизительно 60% (масс./масс.) сахарозы, и причем первый элюирующий буфер имеет рН от приблизительно 7,5 до приблизительно 8,5. В некоторых вариантах осуществления способ дополнительно включает пятую стадию промывки, которая имеет место после первой стадии элюирования и перед второй стадией элюирования, причем стадия промывки включает нанесение на аффинную смолу пятого буфера, содержащего от приблизительно 20 до приблизительно 100 мМ Аргинин-HCl и от приблизительно 75 до приблизительно 250 мМ NaCl, и причем пятый буфер имеет рН от приблизительно 7,5 до приблизительно 8,5. В некоторых вариантах осуществления вторая стадия элюирования включает нанесение на аффинную смолу второго буфера для элюирования, содержащего от приблизительно 20 до приблизительно 100 мМ Аргинин-HCl, от приблизительно 40 до приблизительно 60% (масс./масс.) глицерина и от приблизительно 500 до 1000 мМ соли (например, NaCl) и причем второй элюирующий буфер имеет рН от приблизительно 7,5 до приблизительно 8,5. Пятая стадия промывки может быть эффективной для минимизации эффектов размывания фронта между первой и второй стадиями элюирования, например, для обеспечения элюирования, запускаемого только самими первым и вторым элюирующими буферами, а не от размывания фронта, который может возникнуть в результате смешивания первого и второго элюирующих буферов. В некоторых вариантах осуществления способ дополнительно включает шестую стадию промывки, которая имеет место после пятой стадии промывки и второй стадией элюирования, причем стадия промывки включает нанесение на аффинную смолу шестого буфера, содержащего от приблизительно 20 до приблизительно 100 мМ Аргинин-HCl и от приблизительно 75 до приблизительно 250 мМ NaCl, и причем пятый буфер имеет рН от приблизительно 7,5 до приблизительно 8,5.
[0085] В некоторых вариантах осуществления первый буфер содержит приблизительно 100 мМ натриевой соли 2-(N-морфолино)этансульфоновой кислоты (MES-Na), приблизительно 10 мМ ЭДТА и приблизительно 11 г/кг смеси растворитель/детергент, содержащей приблизительно 18 грамм полисорбата 80, 3,5 грамм ДМСО и 3,5 грамм три(н-бутил)фосфата (TNBP), и при этом первый буфер имеет рН приблизительно 6,0. В некоторых вариантах осуществления второй буфер содержит приблизительно 50 мМ Аргинин-HCl и приблизительно 100 мМ NaCl, и при этом второй буфер имеет рН приблизительно 8,0. В некоторых вариантах осуществления третий буфер содержит приблизительно 50 мМ Аргинин-HCl и приблизительно 50% (масс./масс.) сахарозы, и при этом третий буфер имеет pH приблизительно 8,5. В некоторых вариантах осуществления четвертый буфер содержит приблизительно 50 мМ Аргинин-HCl и приблизительно 100 мМ NaCl, и при этом четвертый буфер имеет pH приблизительно 8,0. В некоторых вариантах осуществления пятый буфер содержит приблизительно 50 мМ Аргинин-HCl и приблизительно 100 мМ NaCl, и при этом пятый буфер имеет pH приблизительно 8,0. В некоторых вариантах осуществления шестой буфер содержит приблизительно 50 мМ Аргинин-HCl и приблизительно 100 мМ NaCl, и при этом шестой буфер имеет pH приблизительно 8,0.
[0086] В некоторых вариантах осуществления выполняются по меньшей мере три стадии промывки; первая стадия промывки включает нанесение на аффинную смолу первого буфера, содержащего от приблизительно 50 до приблизительно 200 мМ таурина, и от 0,2 до 1,5% ПЭГ (например, ПЭГ 6000), и при этом первый буфер имеет pH от приблизительно 5,2 до приблизительно 6,8; вторая стадия промывки включает нанесение на аффинную смолу второго буфера, содержащего от приблизительно 30 до приблизительно 300 мМ глицина, и при этом второй буфер имеет pH от приблизительно 7,5 до приблизительно 9,2; и третья стадия промывки включает нанесение на аффинную смолу третьего буфера, содержащего от приблизительно 20 до приблизительно 150 мМ таурина, от приблизительно 30 до приблизительно 75% об. этиленгликоля, и от 0,05 до 0,2% октилгликопиранозида, и при этом третий буфер имеет pH от приблизительно 7,3 до приблизительно 8,8. В некоторых вариантах осуществления соль выбрана из NaCl, KCl, MgCl2, CaCl2, цитрата натрия, LiCl, CsCl, ацетата натрия и комбинации одного или более из NaCl, KCl, MgCl2, CaCl2, цитрата натрия, LiCl, CsCl и ацетата натрия. В некоторых вариантах осуществления соль представляет собой NaCl. В некоторых вариантах осуществления концентрация соли не превышает 500 мМ. В некоторых вариантах осуществления концентрация соли не превышает 200 мМ. В некоторых вариантах осуществления способ дополнительно включает четвертую стадию промывки, которая происходит перед первой стадией промывки, и включает нанесение на аффинную смолу четвертого буфера, содержащего от приблизительно 20 до приблизительно 100 мМ Трис-HCl и от приблизительно 75 до приблизительно 250 мМ NaCl, и при этом четвертый буфер имеет рН от приблизительно 7,5 до приблизительно 8,8.
[0087] В некоторых вариантах осуществления первая стадия элюирования включает нанесение на аффинную смолу первого элюирующего буфера, содержащего от приблизительно 30 до приблизительно 70 мМ таурина, от приблизительно 50 до приблизительно 70% об. этиленгликоля, от 0,05 до 0,2% октилгликопиранозида, и от приблизительно 600 до приблизительно 900 мМ NaCl, и при этом первый элюирующий буфер имеет pH от приблизительно 7,5 до приблизительно 8,5. В некоторых вариантах осуществления способ дополнительно включает пятую стадию промывки, которая имеет место после первой стадии элюирования и перед второй стадией элюирования, причем стадия промывки включает нанесение на аффинную смолу пятого буфера, содержащего от приблизительно 20 до приблизительно 100 мМ Трис-HCl и от приблизительно 75 до приблизительно 250 мМ NaCl, и причем пятый буфер имеет рН от приблизительно 7,5 до приблизительно 8,8. Пятая стадия промывки может быть эффективной для минимизации эффектов размывания фронта . В некоторых вариантах осуществления вторая стадия элюирования включает нанесение на аффинную смолу второго элюирующего буфера, содержащего от приблизительно 30 до приблизительно 70 мМ Трис-HCl, от 0,05 до 0,2 M сульфата аммония, и от приблизительно 40 до приблизительно 60% об. этиленгликоля и при этом второй элюирующий буфер имеет pH от приблизительно 6,5 до приблизительно 7,5. Пятая стадия промывки может быть эффективной для минимизации эффектов размывания фронта между первой и второй стадиями элюирования, например, для обеспечения элюирования, запускаемого только самими первым и вторым элюирующими буферами, а не от размывания фронта, который может возникнуть в результате смешивания первого и второго элюирующих буферов.
[0088] В некоторых вариантах осуществления способ дополнительно включает шестую стадию промывки, которая имеет место после пятой стадии промывки и второй стадией элюирования, причем стадия промывки включает нанесение на аффинную смолу шестого буфера, содержащего от приблизительно 20 до приблизительно 100 мМ Трис-HCl и от приблизительно 75 до приблизительно 250 мМ NaCl, и причем пятый буфер имеет рН от приблизительно 7,5 до приблизительно 8,8.
[0089] В некоторых вариантах осуществления первый буфер содержит приблизительно 100 мМ таурина, и приблизительно 0,5% ПЭГ 6000 при этом первый буфер имеет pH приблизительно 6,0. В некоторых вариантах осуществления второй буфер содержит приблизительно 100 мМ глицина, и при этом второй буфер имеет pH от приблизительно 7,5 до приблизительно 9,2. В некоторых вариантах осуществления третий буфер содержит приблизительно 50 мМ таурина, приблизительно 50% (масс./масс.) этиленгликоля, и 0,1% октилгликопиранозида, и при этом третий буфер имеет pH приблизительно 8,5. В некоторых вариантах осуществления четвертый буфер содержит приблизительно 50 мМ Трис-HCl и приблизительно 125 мМ NaCl, и при этом четвертый буфер имеет pH приблизительно 8,5. В некоторых вариантах осуществления пятый буфер содержит приблизительно 50 мМ Трис-HCl и приблизительно 125 мМ NaCl, и при этом пятый буфер имеет pH приблизительно 8,5. В некоторых вариантах осуществления шестой буфер содержит приблизительно 50 мМ Трис-HCl и приблизительно 125 мМ NaCl, и при этом шестой буфер имеет pH приблизительно 8,5.
[0090] В некоторых вариантах осуществления выполняются по меньшей мере три стадии промывки; первая стадия промывки включает нанесение на аффинную смолу первого буфера, содержащего от приблизительно 80 до приблизительно 400 мМ Бис-Трис, и приблизительно 10 до приблизительно 20 грамм смеси растворитель/детергент, содержащей Тритон-X100, полисорбат 80 и TNBP в соотношении приблизительно 11:3:3 (по массе), и при этом первый буфер имеет pH от приблизительно 5,2 до приблизительно 6,8; вторая стадия промывки включает нанесение на аффинную смолу второго буфера, содержащего от приблизительно 5 до приблизительно 20 ммоль цитрата натрия, и при этом второй буфер имеет pH от приблизительно 7,5 до приблизительно 9,2; и третья стадия промывки включает нанесение на аффинную смолу третьего буфера, содержащего от приблизительно 50 до приблизительно 200 мМ Аргинин-HCl, от приблизительно 50 до приблизительно 200 мМ Лизина HCl, от приблизительно 50 до приблизительно 200 мМ Гистидин-HCl, от приблизительно 1 мМ до приблизительно 4 мМ N-ацетил-D, L-триптофана, и приблизительно 10% до приблизительно 40% (масс./масс.) полисорбата 80, и при этом третий буфер имеет pH от приблизительно 7,3 до приблизительно 8,8. В некоторых вариантах осуществления соль выбрана из NaCl, KCl, MgCl2, CaCl2, цитрата натрия, LiCl, CsCl, ацетата натрия и комбинации одного или более из NaCl, KCl, MgCl2, CaCl2, цитрата натрия, LiCl, CsCl и ацетата натрия. В некоторых вариантах осуществления соль представляет собой NaCl. В некоторых вариантах осуществления концентрация соли не превышает 500 мМ. В некоторых вариантах осуществления концентрация соли не превышает 200 мМ. В некоторых вариантах осуществления способ дополнительно включает четвертую стадию промывки, которая происходит перед первой стадией промывки, и включает нанесение на аффинную смолу четвертого буфера, содержащего от приблизительно 20 до приблизительно 100 мМ Гистидина и от приблизительно 75 до приблизительно 250 мМ NaCl, и при этом четвертый буфер имеет рН от приблизительно 7,5 до приблизительно 8,8.
[0091] В некоторых вариантах осуществления первая стадия элюирования включает нанесение на аффинную смолу первого элюирующего буфера, содержащего от приблизительно 15 до 25% сахарозы, от 5% до 15% (масс./масс.) сорбита, от 3% до 7% (масс./масс.) маннита, от 10% до 20% (масс./масс.) глицерина, от 40 до 60 мМ гистидина и от 700 до 900 мМ соли (например, NaCl), и при этом первый элюирующий буфер имеет pH от приблизительно 7,5 до приблизительно 8,5. В некоторых вариантах осуществления способ дополнительно включает пятую стадию промывки, которая имеет место после первой стадии элюирования и перед второй стадией элюирования, причем стадия промывки включает нанесение на аффинную смолу пятого буфера, содержащего от приблизительно 20 до приблизительно 100 мМ Гистидина и от приблизительно 75 до приблизительно 250 мМ NaCl, и причем пятый буфер имеет рН от приблизительно 7,5 до приблизительно 8,8. В некоторых вариантах осуществления вторая стадия элюирования включает нанесение на аффинную смолу второго элюирующего буфера, содержащего от приблизительно 30 до приблизительно 70 мМ Трис-HCl, от приблизительно 700 до приблизительно 900 мМ соли (например, NaCl), и от 40% до 60% (масс./масс.) ДМСО и при этом второй элюирующий буфер имеет pH от приблизительно 7,5 до приблизительно 8,5. Пятая стадия промывки может быть эффективной для минимизации эффектов размывания фронта между первой и второй стадиями элюирования, например, для обеспечения элюирования, запускаемого только самими первым и вторым элюирующими буферами, а не от размывания фронта, который может возникнуть в результате смешивания первого и второго элюирующих буферов. В некоторых вариантах осуществления способ дополнительно включает шестую стадию промывки, которая имеет место после пятой стадии промывки и второй стадией элюирования, причем стадия промывки включает нанесение на аффинную смолу шестого буфера, содержащего от приблизительно 20 до приблизительно 100 мМ Гистидина и от приблизительно 75 до приблизительно 250 мМ NaCl, и причем пятый буфер имеет рН от приблизительно 7,5 до приблизительно 8,8.
[0092] В некоторых вариантах осуществления первый буфер содержит приблизительно 200 мМ Бис-Трис, приблизительно от 16 до приблизительно 17 грамм смеси растворитель/детергент, содержащей приблизительно Тритон-X100, полисорбат 80 и TNBP в соотношении приблизительно 11:3:3 (по массе), при этом первый буфер имеет pH приблизительно 6,0. В некоторых вариантах осуществления второй буфер содержит приблизительно 10 ммоль цитрата натрия, и при этом второй буфер имеет pH приблизительно 8,5. В некоторых вариантах осуществления третий буфер содержит приблизительно 100 мМ Аргинин-HCl, приблизительно 100 мМ Лизин-HCl, приблизительно 100 мМ Гистидин-HCl, приблизительно 2 мМ N-ацетил-D, L-триптофана, и приблизительно 20% (масс./масс.) полисорбата 80, и третий буфер имеет pH приблизительно 8,5. В некоторых вариантах осуществления четвертый буфер содержит приблизительно 50 мМ Гистидина и приблизительно 100 мМ NaCl, и при этом четвертый буфер имеет pH приблизительно 8,5. В некоторых вариантах осуществления пятый буфер содержит приблизительно 50 мМ Гистидина и приблизительно 100 мМ NaCl, и при этом пятый буфер имеет pH приблизительно 8,5. В некоторых вариантах осуществления шестой буфер содержит приблизительно 50 мМ Гистидина и приблизительно 100 мМ NaCl, и при этом шестой буфер имеет pH приблизительно 8,5.
[0093] В некоторых вариантах осуществления выполняются по меньшей мере три стадии промывки; первая стадия промывки включает нанесение на аффинную смолу первого буфера, содержащего от приблизительно 50 нМ до приблизительно 200 мМ Na ацетата и от приблизительно 0,05 до приблизительно 0,2% Полисорбата 80, при этом первый буфер имеет pH приблизительно 5,2 до приблизительно 6,8; вторая стадия промывки включает нанесение на аффинную смолу второго буфера, содержащего от приблизительно 20 нМ до приблизительно 100 мМ Трис-HCl и от приблизительно 50 нМ до приблизительно 200 нМ соли, при этом второй буфер имеет pH от приблизительно 7,5 до приблизительно 8,8; и третья стадия промывки включает нанесение на аффинную смолу третьего буфера, содержащего от приблизительно 20 мМ до 100 мМ Трис-HCl, от приблизительно 40% до приблизительно 60%(масс./масс.) этиленгликоля, и при этом третий буфер имеет pH от приблизительно 7,5 до приблизительно 8,8. В некоторых вариантах осуществления соль выбрана из NaCl, KCl, MgCl2, CaCl2, цитрата натрия, LiCl, CsCl, ацетата натрия и комбинации одного или более из NaCl, KCl, MgCl2, CaCl2, цитрата натрия, LiCl, CsCl и ацетата натрия. В некоторых вариантах осуществления соль представляет собой NaCl. В некоторых вариантах осуществления концентрация соли не превышает 500 мМ. В некоторых вариантах осуществления концентрация соли не превышает 200 мМ. В некоторых вариантах осуществления способ дополнительно включает четвертую стадию промывки, которая происходит перед первой стадией промывки, и включает нанесение на аффинную смолу четвертого буфера, содержащего от приблизительно 10 до приблизительно 50 мМ Трис-HCl и от приблизительно 75 до приблизительно 250 мМ NaCl, и при этом четвертый буфер имеет рН от приблизительно 6,5 до приблизительно 8,0. В некоторых вариантах осуществления способ дополнительно включает пятую стадию промывки, которая происходит после третьей стадии промывки, и включает нанесение на аффинную смолу пятого буфера, содержащего от приблизительно 20 мМ до приблизительно 100 мМ Трис-HCl, от приблизительно 50% до приблизительно 70% (масс./масс.) этиленгликоля, и от приблизительно 500 до приблизительно 900 мМ NaCl, и при этом пятый буфер имеет pH от приблизительно 7,5 до приблизительно 8,5. В некоторых вариантах осуществления способ дополнительно включает шестую стадию промывки, которую выполняют после пятой стадии промывки, и включает нанесение на аффинную смолу шестого буфера, содержащего от приблизительно 10 мМ до приблизительно 50 мМ Трис-HCl и от приблизительно 75 до приблизительно 250 мМ NaCl, и при этом шестой буфер имеет pH от приблизительно 7,0 до приблизительно 8,0.
[0094] В некоторых вариантах осуществления первый буфер содержит приблизительно 100 мМ таурина, и приблизительно 0,5% ПЭГ 6000 при этом первый буфер имеет pH приблизительно 6,0. В некоторых вариантах осуществления второй буфер содержит приблизительно 100 мМ глицина, и при этом второй буфер имеет pH от приблизительно 7,5 до приблизительно 9,2. В некоторых вариантах осуществления третий буфер содержит приблизительно 50 мМ таурина, приблизительно 50% об. этиленгликоля, и от 0,1% октилгликопиранозида, и при этом третий буфер имеет pH приблизительно 8,5. В некоторых вариантах осуществления четвертый буфер содержит приблизительно 20 мМ Трис-HCl и приблизительно 150 мМ NaCl, и при этом четвертый буфер имеет pH приблизительно 7,4. В некоторых вариантах осуществления пятый буфер содержит приблизительно 50 мМ Трис-HCl, 60% (масс./масс.) этиленгликоля, и 750 мМ NaCl, и при этом пятый буфер имеет pH приблизительно 8,0. В некоторых вариантах осуществления шестой буфер содержит приблизительно 20 мМ Трис-HCl и приблизительно 150 мМ NaCl, и при этом шестой буфер имеет pH приблизительно 7,4.
[0095] В некоторых вариантах осуществления выполняются по меньшей мере три стадии промывки; первая стадия промывки включает нанесение на аффинную смолу первого буфера, содержащего от приблизительно 50 нМ до приблизительно 200 мМ Na ацетата и от приблизительно 0,05 до приблизительно 0,2% Полисорбата 80, при этом первый буфер имеет pH приблизительно 5,2 до приблизительно 6,8; вторая стадия промывки включает нанесение на аффинную смолу второго буфера, содержащего от приблизительно 20 нМ до приблизительно 100 мМ Трис-HCl и от приблизительно 50 нМ до приблизительно 200 нМ соли, при этом второй буфер имеет pH от приблизительно 7,5 до приблизительно 8,8; и третья стадия промывки включает нанесение на аффинную смолу третьего буфера, содержащего от приблизительно 20 мМ до 100 мМ Трис-HCl, от приблизительно 40% до приблизительно 60%(масс./масс.) этиленгликоля, и при этом третий буфер имеет pH от приблизительно 7,5 до приблизительно 8,8. В некоторых вариантах осуществления соль выбрана из NaCl, KCl, MgCl2, CaCl2, цитрата натрия, LiCl, CsCl, ацетата натрия и комбинации одного или более из NaCl, KCl, MgCl2, CaCl2, цитрата натрия, LiCl, CsCl и ацетата натрия. В некоторых вариантах осуществления соль представляет собой NaCl. В некоторых вариантах осуществления концентрация соли не превышает 500 мМ. В некоторых вариантах осуществления концентрация соли не превышает 200 мМ. В некоторых вариантах осуществления способ дополнительно включает четвертую стадию промывки, которая происходит перед первой стадией промывки, и включает нанесение на аффинную смолу четвертого буфера, содержащего от приблизительно 10 до приблизительно 50 мМ Трис-HCl и от приблизительно 75 до приблизительно 250 мМ NaCl, и при этом четвертый буфер имеет рН от приблизительно 6,5 до приблизительно 8,0. В некоторых вариантах осуществления способ дополнительно включает пятую стадию промывки, которая происходит после третьей стадии промывки, и включает нанесение на аффинную смолу пятого буфера, содержащего от приблизительно 20 мМ до приблизительно 100 мМ Трис-HCl, от приблизительно 50% до приблизительно 70% (масс./масс.) этиленгликоля, и от приблизительно 500 до приблизительно 900 мМ NaCl, и при этом пятый буфер имеет pH от приблизительно 7,5 до приблизительно 8,5. В некоторых вариантах осуществления способ дополнительно включает шестую стадию промывки, которую выполняют после пятой стадии промывки, и включает нанесение на аффинную смолу шестого буфера, содержащего от приблизительно 10 мМ до приблизительно 50 мМ Трис-HCl и от приблизительно 75 до приблизительно 250 мМ NaCl, и при этом шестой буфер имеет pH от приблизительно 7,0 до приблизительно 8,0.
[0096] В некоторых вариантах осуществления первый буфер содержит приблизительно 100 мМ таурина, и приблизительно 0,5% ПЭГ 6000 при этом первый буфер имеет pH приблизительно 6,0. В некоторых вариантах осуществления второй буфер содержит приблизительно 100 мМ глицина, и при этом второй буфер имеет pH от приблизительно 7,5 до приблизительно 9,2. В некоторых вариантах осуществления третий буфер содержит приблизительно 50 мМ таурина, приблизительно 50% об. этиленгликоля, и от 0,1% октилгликопиранозида, и при этом третий буфер имеет pH приблизительно 8,5. В некоторых вариантах осуществления четвертый буфер содержит приблизительно 20 мМ Трис-HCl и приблизительно 150 мМ NaCl, и при этом четвертый буфер имеет pH приблизительно 7,4. В некоторых вариантах осуществления пятый буфер содержит приблизительно 50 мМ Трис-HCl, 60% (масс./масс.) этиленгликоля, и 750 мМ NaCl, и при этом пятый буфер имеет pH приблизительно 8,0. В некоторых вариантах осуществления шестой буфер содержит приблизительно 20 мМ Трис-HCl и приблизительно 150 мМ NaCl, и при этом шестой буфер имеет pH приблизительно 7,4.
[0097] В некоторых вариантах осуществления выполняются по меньшей мере три стадии промывки; первая стадия промывки включает нанесение на аффинную смолу первого буфера, содержащего от приблизительно 50 до приблизительно 200 мМ ацетата натрия, и от 0,05 до 0,2% Полисорбата 80, и при этом первый буфер имеет pH от приблизительно 5,2 до приблизительно 6,8; вторая стадия промывки включает нанесение на аффинную смолу второго буфера, содержащего от приблизительно 25 до приблизительно 100 мМ Трис-HCl и от приблизительно 50 до 200 мМ соли, и при этом второй буфер имеет pH от приблизительно 7,5 до приблизительно 9,2. В некоторых вариантах осуществления соль выбрана из NaCl, KCl, MgCl2, CaCl2, цитрата натрия, LiCl, CsCl, ацетата натрия и комбинации одного или более из NaCl, KCl, MgCl2, CaCl2, цитрата натрия, LiCl, CsCl и ацетата натрия. В некоторых вариантах осуществления соль представляет собой NaCl. В некоторых вариантах осуществления способ дополнительно включает третью стадию промывки, которая происходит перед первой стадией промывки, и включает нанесение на аффинную смолу третьего буфера, содержащего от приблизительно 20 до приблизительно 100 мМ Трис-HCl и от приблизительно 75 до приблизительно 250 мМ NaCl, и при этом третий буфер имеет рН от приблизительно 7,5 до приблизительно 8,8. В некоторых вариантах осуществления первая стадия элюирования включает нанесение на аффинную смолу очищенную воду, с последующим нанесением от 0,5 до 2 мМ HCl при pH от 3,0 до 3,5, с последующим нанесением буфера, содержащего от приблизительно 25 до приблизительно 100 мМ Трис-HCl, от приблизительно 500 до приблизительно 1000 мМ NaCl, и от приблизительно 25% до приблизительно 75% ДМСО (масс./масс.), и при этом буфер имеет pH от приблизительно 7,5 до приблизительно 8,5. В некоторых вариантах осуществления способ дополнительно включает четвертую стадию промывки, которую выполняют после первой стадии элюирования и перед второй стадией элюирования, причем стадия промывки включает нанесение очищенной воды на аффинную смолу. В некоторых вариантах осуществления вторая стадия элюирования включает нанесение на аффинную смолу от приблизительно 20 до приблизительно 50 мМ HCl при pH от приблизительно 1,7 до приблизительно 2,5.
[0098] В некоторых вариантах осуществления первый буфер содержит приблизительно 100 мМ ацетата натрия, и приблизительно 0,1% Полисорбата 80, при этом первый буфер имеет pH приблизительно 6,0. В некоторых вариантах осуществления второй буфер содержит приблизительно 50 мМ Трис-HCl, приблизительно 125 мМ NaCl, и при этом второй буфер имеет pH приблизительно 8,5. В некоторых вариантах осуществления третий буфер содержит приблизительно 50 мМ Трис-HCl и от приблизительно 125 мМ NaCl, и при этом третий буфер имеет pH приблизительно 8,5. В некоторых вариантах осуществления первая стадия элюирования включает нанесение на аффинную смолу очищенную воду, с последующим нанесением 1 мМ HCl при pH приблизительно 3,2, с последующим нанесением на аффинную смолу буфера, содержащего приблизительно 50 мМ Трис-HCl, приблизительно 750 мМ NaCl, и приблизительно 50% ДМСО (масс./масс.), и при этом буфер имеет pH приблизительно 8,0. В некоторых вариантах осуществления вторая стадия элюирования включает нанесение на аффинную смолу приблизительно 33 мМ HCl при pH приблизительно 2,0.
[0099] В некоторых вариантах осуществления выполняются по меньшей мере три стадии промывки; первая стадия промывки включает нанесение на аффинную смолу первого буфера, содержащего от приблизительно 50 до приблизительно 200 мМ ацетата натрия, и от 0,05 до 0,2% Полисорбата 80, и при этом первый буфер имеет pH от приблизительно 5,2 до приблизительно 6,8; вторая стадия промывки включает нанесение на аффинную смолу второго буфера, содержащего от приблизительно 25 до приблизительно 100 мМ Трис-HCl и от приблизительно 50 до 200 мМ соли, и при этом второй буфер имеет pH от приблизительно 7,5 до приблизительно 9,2. В некоторых вариантах осуществления соль выбрана из NaCl, KCl, MgCl2, CaCl2, цитрата натрия, LiCl, CsCl, ацетата натрия и комбинации одного или более из NaCl, KCl, MgCl2, CaCl2, цитрата натрия, LiCl, CsCl и ацетата натрия. В некоторых вариантах осуществления соль представляет собой NaCl. В некоторых вариантах осуществления способ дополнительно включает третью стадию промывки, которая происходит перед первой стадией промывки, и включает нанесение на аффинную смолу третьего буфера, содержащего от приблизительно 20 до приблизительно 100 мМ Трис-HCl и от приблизительно 75 до приблизительно 250 мМ NaCl, и при этом третий буфер имеет рН от приблизительно 7,5 до приблизительно 8,8. В некоторых вариантах осуществления первая стадия элюирования включает нанесение на аффинную смолу градиента от 0 до 100% 20-50мМ хлористоводородной кислоты/800-1200 мМ NaCl в 0,5-2,0мМ хлористоводородной кислоте. В некоторых вариантах осуществления градиент составляет от 0 до 100% 33 мМ хлористоводородной кислоты/1000 мМ NaCl в 1 мМ соляной кислоте. В определенных вариантах осуществления первой стадии элюирования предшествует промывка очищенной водой.
[00100] В некоторых вариантах осуществления первый буфер содержит приблизительно 100 мМ ацетата натрия, и приблизительно 0,1% Полисорбата 80, при этом первый буфер имеет pH приблизительно 6,0. В некоторых вариантах осуществления второй буфер содержит приблизительно 50 мМ Трис-HCl, приблизительно 125 мМ NaCl, и при этом второй буфер имеет pH приблизительно 8,5. В некоторых вариантах осуществления третий буфер содержит приблизительно 50 мМ Трис-HCl и от приблизительно 125 мМ NaCl, и при этом третий буфер имеет pH приблизительно 8,5. В некоторых вариантах осуществления первая стадия элюирования включает нанесение на аффинную смолу буфера, содержащего от приблизительно 50 мМ Трис-HCl, приблизительно 750 мМ NaCl, и приблизительно 50% ДМСО (масс./масс.), и при этом буфер имеет pH приблизительно 8,0.
[00101] В некоторых вариантах осуществления органический растворитель или детергент представляет собой полисорбат 80, этиленгликоль, сорбит, маннит, ксилит, сахарозу или трегалозу.
[00102] В некоторых вариантах осуществления кислотный компонент удаляется. В некоторых вариантах осуществления кислотный компонент представляет собой ДНК клетки-хозяина, такую как ДНК HEK293, и количество кислотного компонента снижается до значения ниже 250 пг на микрограмм антигена AAV, как измерено с помощью кПЦР. В некоторых вариантах осуществления кислотный компонент представляет собой ДНК клетки-хозяина, такую как ДНК HEK293, и причем количество кислотного компонента снижается до значения ниже 250 пг на микрограмм антигена AAV, как измерено с помощью ИФА.
[00103] В некоторых вариантах осуществления элюирование включает приведение в контакт аффинной смолы с элюирующим буфером, содержащим этиленгликоль, соль, такую как NaCl, и буфер, такой как Трис-HCl, причем pH составляет по меньшей мере 7,0. В некоторых вариантах осуществления концентрация соли составляет приблизительно 750 мМ, концентрация буфера составляет приблизительно 50 мМ, и этиленгликоль составляет 50-60% (масс./масс.). В некоторых вариантах осуществления концентрация этиленгликоля составляет по меньшей мере 55% (масс./масс.). В некоторых вариантах осуществления соль представляет собой NaCl, а буфер представляет собой Трис-HCl. В некоторых вариантах осуществления рН элюирующего буфера составляет приблизительно 8,0. В некоторых вариантах осуществления рН элюирующего буфера составляет 8,0.
[00104] В некоторых вариантах осуществления элюирование включает приведение в контакт аффинной смолы с элюирующим буфером, содержащим сахар, такой как сахароза, соль, и буфер, такой как Аргинин-HCl, при этом pH составляет по меньшей мере 8,0. В некоторых вариантах осуществления концентрация соли составляет приблизительно 800 мМ. В некоторых вариантах осуществления концентрация буфера составляет приблизительно 50 мМ. В некоторых вариантах осуществления сахар представляет собой сахарозу, и элюирующий буфер содержит 50-60% (масс./масс.) сахарозы. В некоторых вариантах осуществления элюирующий буфер содержит 1-3 мМ MgCl2 или приблизительно 2 мМ MgCl2. В некоторых вариантах осуществления соль представляет собой NaCl, а буфер представляет собой Аргинин-HCl. В некоторых вариантах осуществления рН элюирующего буфера составляет приблизительно 8,0. В некоторых вариантах осуществления рН элюирующего буфера составляет 8,0.
[00105] В некоторых вариантах осуществления элюирование включает приведение в контакт аффинной смолы с элюирующим буфером, содержащим этиленгликоль, соль, такую как NaCl, и таурин, причем pH составляет по меньшей мере 7,0. В некоторых вариантах осуществления pH составляет 8,0. В некоторых вариантах осуществления концентрация соли составляет приблизительно 750 мМ. В некоторых вариантах осуществления концентрация буфера составляет приблизительно 50 мМ. В некоторых вариантах осуществления концентрация этиленгликоля составляет 50-70% (масс./масс.). В некоторых вариантах осуществления концентрация этиленгликоля составляет по меньшей мере 55% (масс./масс.). В некоторых вариантах осуществления элюирующий буфер дополнительно содержит 0,05-0,2% октилгликопиранозида. В некоторых вариантах осуществления рН элюирующего буфера составляет приблизительно 8,0. В некоторых вариантах осуществления рН элюирующего буфера составляет 8,0.
[00106] В некоторых вариантах осуществления элюирование включает приведение в контакт аффинной смолы с элюирующим буфером, содержащим (i) смесь сахарозы, сорбита, маннита и глицерина, (ii) соль, такую как NaCl, и (iii) буфер, такой как гистидин, при этом рН составляет не менее 7,8. В некоторых вариантах осуществления концентрация соли составляет приблизительно 800 мМ. В некоторых вариантах осуществления концентрация буфера составляет приблизительно 50 мМ. В некоторых вариантах осуществления концентрация сахарозы составляет приблизительно 20% (масс./масс.). В некоторых вариантах осуществления концентрация сорбита составляет приблизительно 10% (масс./масс.). В некоторых вариантах осуществления концентрация маннита составляет приблизительно 5% (масс./масс.). В некоторых вариантах осуществления концентрация глицерина составляет приблизительно 15% (масс./масс.). В некоторых вариантах осуществления соль представляет собой NaCl, а буфер представляет собой гистидин. В некоторых вариантах осуществления рН элюирующего буфера составляет приблизительно 8,0. В некоторых вариантах осуществления рН элюирующего буфера составляет 8,0.
[00107] В некоторых вариантах осуществления проводится вторая стадия элюирования, которая включает приведение в контакт аффинной смолы с элюирующим буфером, содержащем (i) буфер, (ii) соль, такую как NaCl, и (iii) 50-60% (масс./масс.) этиленгликоля, при этом рН составляет не менее 8,0. В некоторых вариантах осуществления концентрация соли составляет приблизительно 1000 мМ. В некоторых вариантах осуществления концентрация буфера составляет приблизительно 50 мМ. В некоторых вариантах осуществления концентрация этиленгликоля составляет по меньшей мере 60% (масс./масс.). В некоторых вариантах осуществления буфер представляет собой Трис-HCl. В некоторых вариантах осуществления соль представляет собой NaCl, а буфер представляет собой гистидин. В некоторых вариантах осуществления рН элюирующего буфера составляет приблизительно 8,0. В некоторых вариантах осуществления рН элюирующего буфера составляет 8,0.
[00108] В некоторых вариантах осуществления проводится вторая стадия элюирования, которая включает приведение в контакт аффинной смолы с элюирующим буфером, содержащем (i) буфер, (ii) соль, такую как NaCl, и (iii) 50-60% (об./об.) глицерина, при этом рН составляет не менее 8,0. В некоторых вариантах осуществления концентрация соли составляет приблизительно 800 мМ, концентрация буфера составляет приблизительно 50 мМ, а концентрация глицерина составляет 50% (об./об.). В некоторых вариантах осуществления соль представляет собой NaCl, а буфер представляет собой Аргинин-HCl. В некоторых вариантах осуществления рН элюирующего буфера составляет приблизительно 8,0. В некоторых вариантах осуществления рН элюирующего буфера составляет 8,0. В различных вариантах осуществления пятая стадия промывки выполняется после первой стадии элюирования и перед второй стадией элюирования. Пятая стадия включает приведение в контакт аффинной смолы с пятым буфером, содержащим 40-60 мМ Аргинин-HCl и 80-120 мМ NaCl, при pH от 7,5 до 8,5. Пятая стадия промывки может быть эффективной для минимизации эффектов размывания фронта между первой и второй стадиями элюирования, например, для обеспечения элюирования, запускаемого только самими первым и вторым элюирующими буферами, а не от размывания фронта, который может возникнуть в результате смешивания первого и второго элюирующих буферов.
[00109] В некоторых вариантах осуществления проводится вторая стадия элюирования, которая включает приведение в контакт аффинной смолы с элюирующим буфером, содержащем (i) буфер, (ii) соль, такую как (NH4)2SO4), и (iii) 40-60% (об./об.) этиленгликоля, при этом рН составляет не менее 8,0. В некоторых вариантах осуществления концентрация соли составляет приблизительно 1 М, концентрация буфера составляет приблизительно 50 мМ, а концентрация этиленгликоля составляет 50% (об./об.). В некоторых вариантах осуществления соль представляет собой (NH4)2SO4, а буфер представляет собой Трис-HCl. В некоторых вариантах осуществления рН элюирующего буфера составляет приблизительно 7,0. В некоторых вариантах осуществления рН элюирующего буфера составляет 7,0. В различных вариантах осуществления пятая стадия промывки выполняется после первой стадии элюирования и перед второй стадией элюирования. Пятая стадия включает приведение в контакт аффинной смолы с пятым буфером, содержащим 40-60 мМ Таурина, 50-70% (масс./масс.) этиленгликоля, 600-900 мМ NaCl, и 0,05-0,2% Октилгликопиранозида, при pH от 7,5 до 8,5. Пятая стадия промывки может быть эффективной для минимизации эффектов размывания фронта между первой и второй стадиями элюирования, например, для обеспечения элюирования, запускаемого только самими первым и вторым элюирующими буферами, а не от размывания фронта, который может возникнуть в результате смешивания первого и второго элюирующих буферов.
[00110] В некоторых вариантах осуществления проводится вторая стадия элюирования, которая включает приведение в контакт аффинной смолы с элюирующим буфером, содержащем (i) буфер, (ii) соль, такую как NaCl, и (iii) 50-60% (масс./масс.) ДМСО, при этом рН составляет не менее 8,0. В некоторых вариантах осуществления концентрация соли составляет приблизительно 1000 мМ. В некоторых вариантах осуществления концентрация буфера составляет приблизительно 50 мМ. В некоторых вариантах осуществления концентрация ДМСО составляет 50% (масс./масс.). В некоторых вариантах осуществления соль представляет собой NaCl, а буфер представляет собой Трис-HCl. В некоторых вариантах осуществления рН элюирующего буфера составляет приблизительно 8,0. В некоторых вариантах осуществления рН элюирующего буфера составляет 8,0. В различных вариантах осуществления ДМСО-содержащий элюирующий буфер эффективен для элюирования AAV9, но не для AAV8 из смолы Capture Select AAV8. В различных вариантах осуществления ДМСО-содержащий элюирующий буфер эффективен для элюирования AAV8 и AAV9 из смолы Capture Select AAVx. В различных вариантах осуществления ДМСО-содержащий элюирующий буфер эффективен для элюирования одного или более из AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV10, AAV11, AAV12, AAV13, AAAV, BAAV, AAV (VR-195) и AAV (VR-355), но не для AAV8, из смолы Capture Select AAV8. В различных вариантах осуществления ДМСО-содержащий элюирующий буфер эффективен для элюирования любого из AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV10, AAV11, AAV12, AAV13, AAAV, BAAV, AAV (VR-195) и AAV (VR-355) из смолы Capture Select AAVx.
[00111] В различных вариантах осуществления пятая стадия промывки выполняется после первой стадии элюирования и перед второй стадией элюирования. Пятая стадия включает приведение в контакт аффинной смолы с пятым буфером, содержащим 40-60 мМ гистидина и 70-130 мМ NaCl, при рН от 8,0 до 8,8. Пятая стадия промывки может быть эффективной для минимизации эффектов размывания фронта между первой и второй стадиями элюирования, например, для обеспечения элюирования, запускаемого только самими первым и вторым элюирующими буферами, а не от размывания фронта, который может возникнуть в результате смешивания первого и второго элюирующих буферов.
[00112] В некоторых вариантах осуществления элюирование включает непрерывное линейное увеличение проводимости элюирующего буфера путем градиентного элюирования. В некоторых вариантах осуществления элюирование включает непрерывное линейное увеличения концентрации органического растворителя путем градиентного элюирования. В некоторых вариантах осуществления элюирование включает приведение в контакт аффинной смолы с элюирующим буфером, содержащим приблизительно 750 мМ NaCl и 50-60% (масс./масс.) этиленгликоля при рН по меньшей мере 7,0. В некоторых вариантах осуществления концентрация этиленгликоля составляет по меньшей мере 55% (масс./масс.). В некоторых вариантах осуществления элюирующий буфер имеет рН приблизительно 8,0. В некоторых вариантах осуществления элюирующий буфер имеет рН 8,0.
[00113] В некоторых вариантах осуществления элюирование включает постепенное увеличение концентрации противоиона. В некоторых вариантах осуществления элюирование включает постепенное увеличение концентрации органического растворителя. В некоторых вариантах осуществления соль в элюирующем буфере выбрана из одновалентных, двухвалентных или поливалентных анионов, таких как хлорид, ацетат, сульфат и цитрат. В некоторых вариантах осуществления AAV, полученный на стадии элюирования, имеет уровень примесей HC ≤ 99,9%. В некоторых вариантах осуществления AAV, полученный на стадии элюирования, имеет уровень примесей HC ≤ 99,0%.
[00114] В некоторых вариантах осуществления AAV представляет собой AAV8, аффинная смола представляет собой POROS™ CaptureSelect™ AAV8, и элюирующий буфер является кислотным и не содержит этиленгликоль. В некоторых вариантах осуществления AAV представляет собой AAV9, аффинная смола представляет собой POROS™ CaptureSelect™ AAV9, и при этом элюирующий буфер является кислотным и не содержит этиленгликоль. В некоторых вариантах осуществления AAV представляет собой AAV8, а аффинная смола представляет собой иммуноаффинную смолу, состоящую из иммобилизованного моноклонального антитела против AAV8 типа ADK8 или ADK8/9, иммобилизованного на хроматографической матрице. В некоторых вариантах осуществления AAV представляет собой AAV9, а аффинная смола представляет собой иммуноаффинную смолу, состоящую из иммобилизованного моноклонального антитела против AAV9 типа ADK9 или ADK8/9, иммобилизованного на хроматографической матрице.
[00115] В некоторых вариантах осуществления способ дополнительно включает приведение в контакт раствора, содержащего AAV, с фильтром, содержащим положительно заряженные группы, эффективные для удаления кислотных заряженных загрязнений из раствора, содержащего AAV. В некоторых вариантах осуществления способ дополнительно включает нанофильтрацию фракции AAV для удаления вирусов размером более чем 35 нм. В некоторых вариантах осуществления способ дополнительно включает стадию полировки, включающую проведение AEX-хроматографии с колонкой, содержащей гель типа «щупальца». В некоторых вариантах осуществления способ дополнительно включает испытание фракции AAV с помощью AAV-специфичного ИФА, например, специфичного для AAV8 или специфичного для AAV9. Специфичный для AAV ИФА может представляет собой сэндвич-вариант ИФА, специфичный для AAV, например, AAV8 или AAV9.
[00116] В другом аспекте предоставляется продукт AAV, полученный любым способом, описанным в данном документе.
[00117] Частицы AAV, например, частицы AAV8 и AAV9, очищают на стадии аффинности, выполняя множество определенных стадий промывки, например, применяя промывочные буферы к аффинной матрице, связанной с AAV, и элюируя в условиях, близких к нейтральному pH, чтобы сохранить инфекционность указанного вируса. В некоторых вариантах осуществления стадию анионного обмена включают до стадии аффинности. Стадия анионита может проводиться в проточном режиме. В некоторых вариантах осуществления загрязняющие вещества могут быть истощены, что влияет на время цикла аффинной смолы, используемой на стадии аффинности.
[00118] Способы по данному изобретению могут приводить к более высокой чистоте AAV, удалению белков клетки-хозяина, истощению ДНК клетки-хозяина, удалению потенциальных вирусных рецепторов, частичной или полной инактивации вирусов с липидной оболочкой, где AAV связан с лигандом (например, на стадии промывки) и частично для полной инактивации вирусов с липидной оболочкой в жидкой фазе (например, на стадии элюирования). Не желая быть связанными какой-либо теорией, этиленгликоль сам по себе или в сочетании с другой добавкой может инактивировать такие вирусы с липидной оболочкой. Типовые добавки включают неионогенные детергенты, алифатические агенты (например, TnBP) и детергенты (например, полисорбат (например, Твин), Triton X100, TnBP). Например, смесь растворитель-детергент может содержать 1% Triton X100, 0,3% три-N-бутилфосфата и 0,3% Твин 80.
[00119] Инактивация вирусов в оболочке может иметь особое значение при использовании системы трансфекции Baculo. Элюирование в соответствии с различными вариантами осуществления, описанными в данном документе, может предотвращать воздействие низкого pH и сохранять высокую активность AAV. Дальнейшее улучшение можно увидеть при последовательном выполнении стадий промывки и стадий элюирования в соответствии с различными вариантами осуществления и примерами, описанными в данном документе.
[00120] Инактивацию вирусов с липидной оболочкой «на колонке» тестировали в различных аффинных хроматографических опытах в вышеприведенных Примерах 11, 12 и 13, как приведено в Таблице 1 ниже.
Таблица 1: Обработка растворитель/детергент, используемая в Вариантах A, B и C
[00121] Буфер Промывки X, содержащий ДМСО, может быть эффективным для начала элюирования AAV9, но не AAV8, на смоле CaptureSelect AAV8 при pH, близком к нейтральному (например, pH 8,0), что является неожиданным результатом. Содержащий ДМСО буфер Промывки X буфер может быть эффективным для начала элюирования различных AAV, включая, но не ограничиваясь ими, AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11, AAV12, AAV13, AAAV, BAAV, AAV (VR-195) и AAV (VR-355) на смоле CaptureSelect AAVx при pH, близком к нейтральному (например, pH 8,0), результат, который был неожиданным. Не желая быть связанными какой-либо теорией, ожидается, что буфер Промывки X будет обладать активностью промывания колонки и/или инактивации или дезинтеграции вирусов с липидной оболочкой. Не ожидалось, что буфер ПРОМЫВКИ X будет по-разному элюировать AAV9 по сравнению с AAV8.
[00122] Стадия аффинной очистки включает одну или более стадий промывки. Одна или более стадий промывки могут сопровождаться одной или более стадиями элюирования. В определенных вариантах осуществления способы по данному изобретению включают стадию фильтрования, которая происходит перед стадиями аффинной очистки.
[00123] После культивирования клеток-хозяев, например клеток HEK293, для получения частиц AAV (например, AAV8, AAV9 и т.д.) и осветленный супернатант бесклеточной культуры концентрируют и/или фильтруют, вирусные частицы загружают на аффинную матрицу. В определенных вариантах осуществления вирусные частицы загружают в раствор, имеющий рН в диапазоне от приблизительно 7,4 до приблизительно 7,8. В определенных вариантах осуществления вирусные частицы загружают в раствор, имеющий рН в диапазоне от приблизительно 8,3 до приблизительно 8,7. В определенных вариантах осуществления вирусные частицы загружают в раствор, имеющий рН приблизительно 8,5. В некоторых вариантах осуществления pH составляет от 8,3 до 8,7, и раствор содержит NaCl и Трис-HCl. В некоторых вариантах осуществления вирусные частицы загружают в раствор, содержащий приблизительно 20 мМ Трис-HCl и приблизительно 150 мМ NaCl, и имеющий рН приблизительно 8,5.
[00124] По меньшей мере, три различных стадии промывки могут быть выполнены с использованием одного или разных буферов. В определенных вариантах осуществления промывочные буферы различны.
[00125] В некоторых вариантах осуществления на первой стадии промывки используется первый буфер, который может быть буфером на основе ацетата натрия (Na ацетат). В некоторых вариантах осуществления на первой стадии промывки используется первый буфер, содержащий натриевую соль 2- (N-морфолино)этансульфоновой кислоты (MES-Na), ЭДТА, и смесь растворителя/детергента, содержащую полисорбат 80, ДМСО и три (н-бутил)фосфат (TNBP). В некоторых вариантах осуществления на первой стадии промывки используется первый буфер, содержащий от приблизительно 50 до приблизительно 200 мМ таурина и от 0,2 до 1,5% ПЭГ (например, ПЭГ 6000). В некоторых вариантах осуществления на первой стадии промывки используется первый буфер, содержащий Бис-Трис, и смесь растворителя/детергента, содержащую Тритон-X100, полисорбат 80 и TNBP. В некоторых вариантах осуществления на первой стадии промывки используется первый буфер, содержащий ацетат натрия и полисорбат 80.
[00126] В некоторых вариантах осуществления на второй стадии промывки используется второй буфер, который может быть буфером на основе Трис, содержащим хлорид натрия (NaCl), буфер на основе глицина, буфер на основе цитрата натрия или буфер на основе Аргинина-HCl, содержащий NaCl. В некоторых вариантах осуществления третья стадия промывки использует третий буфер, который может быть буфером на основе Трис, содержащим этиленгликоль и/или NaCl, буфер на основе таурина или буфер на основе Аргинина-HCl, содержащий NaCl. Как альтернативный вариант, один или более из сорбита, маннита, ксилита, сахарозы или трегалозы могут быть использованы в сочетании с этиленгликолем или вместо этиленгликоля. В определенных вариантах осуществления необязательная четвертая стадия промывки или стадия повторного уравновешивания выполняется перед тремя стадиями промывки, перечисленными выше. На необязательной четвертой стадии промывки используется четвертый буфер, который может быть буфером на основе Трис, содержащим NaCl.
[00127] В некоторых вариантах осуществления предварительная очистка может быть предпринята для удаления одной или более сложных кислотных белковых структур и ДНК клетки-хозяина перед аффинной очисткой AAV-содержащего раствора из продукции клетки-хозяина. Предварительная очистка может быть проведена путем анионного обмена в проточном режиме. Стадия предварительной очистки может быть проведена перед любым из описанных в данном документе способов аффинной очистки. Предварительная очистка такого AAV-содержащего раствора может удалить одно из следующего: гистоны (например, гистон H2A тип 1, гистон H2B тип 1-B, гистон H4, гистон H1.4), рибосомальные белки 60S (например, рибосомный белок 60S L27, рибосомальный белок 60S L6 и рибосомальный белок 60S, L30) цитоплазматический актин (например, цитоплазматический актин 1), тубулин (например, тубулина бета-2A цепь ), гетерогенный ядерный рибонуклеопротеин C, белок Rep68, ламинин-рецептор HEK293 форма 37 кДа (LamR 37 кДа) и АТФ-зависимый молекулярный шаперон HSC82.
[00128] Стадии промывки могут быть эффективными для удаления сильно связанных загрязнений из AAV и/или основной смолы аффинной матрицы. Например, буфер может содержать один или более из Трис-HCl, ацетата, фосфата, гистидина, имидазола, лизина, аргинина, глицина, таурина, цитрата, HEPES, MES, MES-Na, бората, Бис-Трис, MOPS, бицина, трицина, TAPS, TAPSO, MES, PIPES, TES (2-[[1,3-дигидрокси-2-(гидроксиметил)пропан-2-ил]амино]этансульфоновая кислота), барбитала натрия (Veronal), ADA (N-(2-ацетамидо)иминодиуксусная кислота), ACES (N-(2-ацетамидо)-2-аминоэтансульфоновая кислота), Бис-Трис-пропана, BES (N, N-бис(2-гидроксиэтил)-2-аминоэтансульфоновая кислота), DIPSO (3-(N, N-бис[2-гидроксиэтил]амино)-2-гидроксипропансульфоновая кислота), Trizma, HEPPSO(4-(2-гидроксиэтил)пиперазин-1-(2-гидроксипропансульфоновая кислота)), POPSO (пиперазин-1,4-бис(2-гидроксипропансульфоновой кислоты Дегидрат), TEA, EPPS (4-(2-гидроксиэтил)-1-пиперазинпропансульфоновая кислота), HEPBS (N- (2-гидроксиэтил)пиперазин-N'-(4-бутансульфоновая кислота), AMPD (2-амино-2-метил-1,3-пропандиол), AMPSO (N-(1,1-диметил-2-гидроксиэтил)-3-амино-2-гидроксипропансульфоновая кислота), отдельные аминокислоты или любую комбинацию двух или более аминокислот, которая обеспечивает диапазон pH и скорость истощения HEK-HCP, например, глицин, аргинин, триптофан, производные аминокислот, например, таурин (окисленный цистеин), N-ацетил-триптофан и глицилглицин. В то же время буферы, используемые на стадиях промывки, по существу не элюируют AAV.
[00129] В определенных вариантах осуществления промывочный буфер может дополнительно содержать органический растворитель или детергент. Например, органический растворитель или детергент может представлять собой, помимо прочего, Твин 80, полисорбат 80, Тритон X100, три(н-бутил)фосфат (TNBP), этиленгликоль, сорбит, маннит, ксилит, сахарозу или трегалозу. Например, детергент может представлять собой, но не ограничиваясь этим, неионогенное полиоксиэтиленовое поверхностно-активное вещество (например, Brij 35), 4-нонилфенил-полиэтиленгликоль (Arkopal N100), октилглюкозид, н-додецил-β-D-мальтозид, дигитонин, 6-циклогексилгексил β-D-мальтозид или октилгликопиранозид. Например, этиленгликоль может представлять собой ПЭГ, такой как, но не ограничиваясь этим, ПЭГ 2000, ПЭГ4000, ПЭГ6000 (Макрогол). Например, органическим растворителем может быть, но не ограничиваясь этим, глицерин (1,2,3-пропантриол) и эритрит (мезо-1,2,3,4-бутантетрол).
[00130] Органический растворитель или детергент необязательно должны присутствовать во всех используемых промывочных буферах. Однако органический растворитель или детергент присутствует по меньшей мере в одном из использованных промывочных буферов. В некоторых вариантах осуществления промывочный буфер, например, первый промывочный буфер, содержит и ацетат натрия, и Твин 80. В некоторых вариантах осуществления промывочный буфер содержит одно или более из Твин 80, ДМСО и три(н-бутил)фосфата (TNBP). В некоторых вариантах осуществления промывочный буфер содержит одно или более из Тритон-X100, полисорбата 80 и TNBP. В некоторых вариантах осуществления промывочный буфер, например третий промывочный буфер, содержит трис и этиленгликоль. Не желая быть связанными какой-либо теорией, органические растворители и детергенты в промывочных буферах эффективны для удаления сильно связанных белков-хозяев и вирусных рецепторов, а также инактивируют и/или дезинтегрируют вирусы с липидной оболочкой.
[00131] Первый буфер может содержать от приблизительно 50 до приблизительно 2000 мМ ацетата натрия или от 50 до приблизительно 250 мМ ацетата натрия, и от приблизительно 0,05 до приблизительно 5% полисорбата 80, или Твин 80, или от 0,05 до приблизительно 0,2% полисорбата 80, или Твин 80, с рН от 5,2 до 6,8. В некоторых вариантах осуществления первый буфер может содержать от приблизительно 50 до приблизительно 75 мМ; от приблизительно 75 до приблизительно 100 мМ; от приблизительно 90 до приблизительно 110 мМ; от приблизительно 100 до приблизительно 125 мМ; от приблизительно 125 до приблизительно 150 мМ ацетата натрия; от приблизительно 150 до приблизительно 175 мМ ацетата натрия; от приблизительно 175 до приблизительно 200 мМ ацетата натрия; от приблизительно 200 до приблизительно 250 мМ ацетата натрия; от приблизительно 250 до приблизительно 300 мМ ацетата натрия; от приблизительно 300 до приблизительно 350 мМ ацетата натрия; от приблизительно 350 до приблизительно 400 мМ ацетата натрия; от приблизительно 400 до приблизительно 450 мМ ацетата натрия; от приблизительно 450 до приблизительно 500 мМ ацетата натрия; от приблизительно 500 до приблизительно 550 мМ ацетата натрия; от приблизительно 550 до приблизительно 600 мМ ацетата натрия; от приблизительно 600 до приблизительно 650 мМ ацетата натрия; от приблизительно 650 до приблизительно 700 мМ ацетата натрия; от приблизительно 700 до приблизительно 750 мМ ацетата натрия; от приблизительно 750 до приблизительно 800 мМ ацетата натрия; от приблизительно 800 до приблизительно 850 мМ ацетата натрия; от приблизительно 850 до приблизительно 900 мМ ацетата натрия; от приблизительно 900 до приблизительно 950 мМ ацетата натрия; от приблизительно 950 до приблизительно 1000 мМ ацетата натрия; от приблизительно 1000 до приблизительно 1050 мМ ацетата натрия; от приблизительно 1050 до приблизительно 1100 мМ ацетата натрия; от приблизительно 1100 до приблизительно 1150 мМ ацетата натрия; от приблизительно 1150 до приблизительно 1200 мМ ацетата натрия; от приблизительно 1200 до приблизительно 1250 мМ ацетата натрия; от приблизительно 1250 до приблизительно 1300 мМ ацетата натрия; от приблизительно 1300 до приблизительно 1350 мМ ацетата натрия; от приблизительно 1350 до приблизительно 1400 мМ ацетата натрия; от приблизительно 1400 до приблизительно 1450 мМ ацетата натрия; от приблизительно 1450 до приблизительно 1500 мМ ацетата натрия; от приблизительно 1500 до приблизительно 1550 мМ ацетата натрия; от приблизительно 1550 до приблизительно 1600 мМ ацетата натрия; от приблизительно 1600 до приблизительно 1650 мМ ацетата натрия; от приблизительно 1650 до приблизительно 1700 мМ ацетата натрия; от приблизительно 1700 до приблизительно 1750 мМ ацетата натрия; от приблизительно 1750 до приблизительно 1800 мМ ацетата натрия; от приблизительно 1800 до приблизительно 1850 мМ ацетата натрия; от приблизительно 1850 до приблизительно 1900 мМ ацетата натрия; от приблизительно 1900 до приблизительно 1950 мМ ацетата натрия; или от приблизительно 1950 до приблизительно 2000 мМ ацетата натрия.
[00132] В некоторых вариантах осуществления первый буфер может содержать от приблизительно 50 до приблизительно 500 мМ натриевой соли 2-(N-морфолино)этансульфоновой кислоты (MES-Na), от приблизительно 3 до приблизительно 30 мМ ЭДТА, и смесь растворитель/детергент, содержащую полисорбат 80, ДМСО и три(н-бутил)фосфат (TNBP). В некоторых вариантах осуществления первый буфер может содержать от приблизительно 50 до приблизительно 75 мМ; от приблизительно 75 до приблизительно 100 мМ; от приблизительно 90 до приблизительно 110 мМ; от приблизительно 100 до приблизительно 125 мМ; от приблизительно 125 до приблизительно 150 мМ; от приблизительно 150 до приблизительно 175 мМ; от приблизительно 175 до приблизительно 200 мМ; от приблизительно 200 до приблизительно 250 мМ; от приблизительно 250 до приблизительно 300 мМ; от приблизительно 300 до приблизительно 350 мМ; от приблизительно 350 до приблизительно 400 мМ; от приблизительно 400 до приблизительно 450 мМ; или от приблизительно 450 до приблизительно 500 мМ натриевой соли MES-Na. В некоторых вариантах осуществления первый буфер может содержать приблизительно 50; приблизительно 75; приблизительно 90 мМ; приблизительно 100 мМ; приблизительно 125 мМ; приблизительно 150 мМ; приблизительно 175 мМ; приблизительно 200 мМ; приблизительно 250 мМ; приблизительно 300 мМ; приблизительно 350 мМ; приблизительно 400 мМ; приблизительно 450 мМ; или приблизительно 500 мМ натриевой соли MES-Na.
[00133] В некоторых вариантах осуществления первый буфер может содержать от приблизительно 50 до приблизительно 200 мМ таурина. В некоторых вариантах осуществления первый буфер может содержать от приблизительно 50 до приблизительно 75 мМ; от приблизительно 75 до приблизительно 100 мМ; от приблизительно 90 до приблизительно 110 мМ; от приблизительно 100 до приблизительно 125 мМ; от приблизительно 125 до приблизительно 150 мМ; от приблизительно 150 до приблизительно 175 мМ; от приблизительно 175 до приблизительно 200 мМ таурина. В некоторых вариантах осуществления первый буфер может содержать приблизительно 50; приблизительно 75; приблизительно 90 мМ; приблизительно 100 мМ; приблизительно 125 мМ; приблизительно 150 мМ; приблизительно 175 мМ; приблизительно 200 мМ таурина.
[00134] В некоторых вариантах осуществления первый буфер может содержать от приблизительно 80 до приблизительно 400 мМ Бис-Трис. В некоторых вариантах осуществления первый буфер может содержать от приблизительно 80 до приблизительно 100 мМ; от приблизительно 90 до приблизительно 110 мМ; от приблизительно 100 до приблизительно 125 мМ; от приблизительно 125 до приблизительно 150 мМ; от приблизительно 150 до приблизительно 175 мМ; от приблизительно 175 до приблизительно 200 мМ; от приблизительно 200 до приблизительно 250 мМ; от приблизительно 250 до приблизительно 300 мМ; от приблизительно 300 до приблизительно 350 мМ; от приблизительно 350 до приблизительно 400 мМ Бис-Трис. В некоторых вариантах осуществления первый буфер может содержать приблизительно 50; приблизительно 75; приблизительно 90 мМ; приблизительно 100 мМ; приблизительно 125 мМ; приблизительно 150 мМ; приблизительно 175 мМ; приблизительно 200 мМ; приблизительно 250 мМ; приблизительно 300 мМ; приблизительно 350 мМ; приблизительно 400 мМ Бис-Трис.
[00135] В некоторых вариантах осуществления первый буфер может содержать от приблизительно 50 до приблизительно 200 мМ ацетата натрия. В некоторых вариантах осуществления первый буфер может содержать от приблизительно 50 до приблизительно 80 мМ; от приблизительно 70 до приблизительно 100 мМ; от приблизительно 80 до приблизительно 110 мМ; от приблизительно 90 до приблизительно 120 мМ; от приблизительно 100 до приблизительно 130 мМ; от приблизительно 120 до приблизительно 150 мМ; от приблизительно 140 до приблизительно 170 мМ; от приблизительно 170 до приблизительно 200 мМ ацетата натрия. В некоторых вариантах осуществления первый буфер может содержать приблизительно 60; приблизительно 70 мМ; приблизительно 80 мМ; приблизительно 90 мМ; приблизительно 100 мМ; приблизительно 110 мМ; приблизительно 120 мМ; приблизительно 130 мМ; приблизительно 140 мМ; приблизительно 150 мМ; или приблизительно 160 мМ ацетата натрия.
[00136] В некоторых вариантах осуществления первый буфер может содержать приблизительно 25 мМ ацетата натрия, приблизительно 50 мМ ацетата натрия, приблизительно 75 мМ ацетата натрия, приблизительно 100 мМ ацетата натрия, приблизительно 125 мМ ацетата натрия, приблизительно 150 мМ ацетата натрия, приблизительно 175 мМ ацетата натрия, приблизительно 200 мМ ацетата натрия, приблизительно 225 мМ ацетата натрия, приблизительно 250 мМ ацетата натрия, приблизительно 275 мМ ацетата натрия, приблизительно 300 мМ ацетата натрия, приблизительно 325 мМ ацетата натрия, приблизительно 350 мМ ацетата натрия, приблизительно 375 мМ ацетата натрия, приблизительно 400 мМ ацетата натрия, приблизительно 425 мМ ацетата натрия, приблизительно 450 мМ ацетата натрия, приблизительно 475 мМ ацетата натрия, приблизительно 500 мМ ацетата натрия, приблизительно 525 мМ ацетата натрия, приблизительно 550 мМ ацетата натрия, приблизительно 575 мМ ацетата натрия, приблизительно 600 мМ ацетата натрия, приблизительно 625 мМ ацетата натрия, приблизительно 650 мМ ацетата натрия, приблизительно 675 мМ ацетата натрия, приблизительно 700 мМ ацетата натрия, приблизительно 725 мМ ацетата натрия, приблизительно 750 мМ ацетата натрия, приблизительно 775 мМ ацетата натрия, приблизительно 800 мМ ацетата натрия, приблизительно 825 мМ ацетата натрия, приблизительно 850 мМ ацетата натрия, приблизительно 875 мМ ацетата натрия, приблизительно 900 мМ ацетата натрия, приблизительно 925 мМ ацетата натрия, приблизительно 950 мМ ацетата натрия, приблизительно 975 мМ ацетата натрия, приблизительно 1000 мМ ацетата натрия, приблизительно 1025 мМ ацетата натрия, приблизительно 1050 мМ ацетата натрия, приблизительно 1075 мМ ацетата натрия, приблизительно 1100 мМ ацетата натрия, приблизительно 1125 мМ ацетата натрия, приблизительно 1150 мМ ацетата натрия, приблизительно 1175 мМ ацетата натрия, приблизительно 1200 мМ ацетата натрия, приблизительно 1225 мМ ацетата натрия, приблизительно 1250 мМ ацетата натрия, приблизительно 1275 мМ ацетата натрия, приблизительно 1300 мМ ацетата натрия, приблизительно 1325 мМ ацетата натрия, приблизительно 1350 мМ ацетата натрия, приблизительно 1375 мМ ацетата натрия, приблизительно 1400 мМ ацетата натрия, приблизительно 1425 мМ ацетата натрия, приблизительно 1450 мМ ацетата натрия, приблизительно 1475 мМ ацетата натрия, приблизительно 1500 мМ ацетата натрия, приблизительно 1525 мМ ацетата натрия, приблизительно 1550 мМ ацетата натрия, приблизительно 1575 мМ ацетата натрия, приблизительно 1600 мМ ацетата натрия, приблизительно 1625 мМ ацетата натрия, приблизительно 1650 мМ ацетата натрия, приблизительно 1675 мМ ацетата натрия, приблизительно 1700 мМ ацетата натрия, приблизительно 1725 мМ ацетата натрия, приблизительно 1750 мМ ацетата натрия, приблизительно 1775 мМ ацетата натрия, приблизительно 1800 мМ ацетата натрия, приблизительно 1825 мМ ацетата натрия, приблизительно 1850 мМ ацетата натрия, приблизительно 1875 мМ ацетата натрия, приблизительно 1900 мМ ацетата натрия, приблизительно 1925 мМ ацетата натрия, приблизительно 1950 мМ ацетата натрия, приблизительно 1975 мМ ацетата натрия или приблизительно 2000 мМ ацетата натрия. В некоторых вариантах осуществления первый буфер может содержать приблизительно 100 мМ или 100 мМ ацетата натрия.
[00137] В некоторых вариантах осуществления первый буфер может содержать от приблизительно 0,05 до приблизительно 0,08%; от приблизительно 0,08 до приблизительно 0,11%; от приблизительно 0,11 до приблизительно 0,14%; от приблизительно 0,14 до приблизительно 0,17%; или от приблизительно 0,17 до приблизительно 0,20% полисорбата 80. В некоторых вариантах осуществления первый буфер может содержать приблизительно 0,1% или 0,1% полисорбата 80. В некоторых вариантах осуществления первый буфер может содержать от приблизительно 0,05 до приблизительно 0,08%; от приблизительно 0,08 до приблизительно 0,11%; от приблизительно 0,11 до приблизительно 0,14%; от приблизительно 0,14 до приблизительно 0,17%; или от приблизительно 0,17 до приблизительно 0,20% Твин 80. В некоторых вариантах осуществления первый буфер может содержать приблизительно 0,1% Твин 80. В некоторых вариантах осуществления pH может составлять от приблизительно 5,2 до приблизительно 5,5; от приблизительно 5,5 до приблизительно 5,8; от приблизительно 5,8 до приблизительно 6,1; от приблизительно 6,1 до приблизительно 6,4; или от приблизительно 6,4 до приблизительно 6,8. В некоторых вариантах осуществления первый буфер имеет pH приблизительно 6,0 или 6,0.
[00138] В некоторых вариантах осуществления первый буфер содержит хелатирующий агент, например ЭДТА.
[00139] Второй буфер может содержать от приблизительно 30 до приблизительно 200 мМ Трис-HCl или от 30 до приблизительно 80 мМ Трис-HCl и соль, причем второй буфер имеет рН от приблизительно 7,5 до приблизительно 9,2. В некоторых вариантах осуществления соль представляет собой NaCl, KCl, MgCl2, CaCl2, цитрат натрия, LiCl, CsCl, ацетат натрия и комбинации одного или более из NaCl, KCl, MgCl2, CaCl2, цитрата натрия, LiCl, CsCl и ацетата натрия. В некоторых вариантах осуществления соль представляет собой NaCl. Концентрация соли, например, NaCl, может составлять от приблизительно 75 до приблизительно 500 мМ. В некоторых вариантах концентрация соли, например, концентрация NaCl, составляет от приблизительно 75 до приблизительно 200 мМ. В некоторых вариантах осуществления концентрация соли, например, концентрация NaCl, не превышает 500 мМ. В некоторых вариантах осуществления концентрация соли, например, концентрация NaCl, не превышает 200 мМ. Не желая быть связанными какой-либо теорией, концентрация соли, не превышающая 500 мМ или не превышающая 200 мМ, может предотвратить элюирование AAV на стадии промывки, поскольку проводимость солевого раствора слишком низкая, чтобы вызывать элюирование.
[00140] Второй буфер может содержать от приблизительно 30 до приблизительно 35 мМ; от приблизительно 35 до приблизительно 40 мМ; от приблизительно 40 до приблизительно 45 мМ; от приблизительно 45 до приблизительно 50 мМ; от приблизительно 50 до приблизительно 55 мМ; от приблизительно 55 до приблизительно 60 мМ; от приблизительно 60 до приблизительно 65 мМ; от приблизительно 65 до приблизительно 70 мМ; от приблизительно 70 до приблизительно 75 мМ; или от приблизительно 75 до приблизительно 80 мМ Трис-HCl. В некоторых вариантах осуществления второй буфер может содержать приблизительно 50 мМ или 50 мМ Трис-HCl. В некоторых вариантах осуществления второй буфер может содержать от приблизительно 75 до приблизительно 100 мМ; от приблизительно 100 до приблизительно 125 мМ; от приблизительно 125 до приблизительно 150 мМ; от приблизительно 150 до приблизительно 175 мМ; от приблизительно 175 до приблизительно 200 мМ; от приблизительно 200 до приблизительно 225 мМ; или от приблизительно 225 до приблизительно 250 мМ NaCl. В некоторых вариантах осуществления второй буфер может содержать приблизительно 150 мМ или 150 мМ NaCl. В некоторых вариантах осуществления pH второго буфера может составлять от приблизительно 7,5 до приблизительно 7,7; от приблизительно 7,7 до приблизительно 7,9; от приблизительно 7,9 до приблизительно 8,1; от приблизительно 8,1 до приблизительно 8,3; от приблизительно 8,3 до приблизительно 8,5; от приблизительно 8,5 до приблизительно 8,7; от приблизительно 8,7 до приблизительно 8,9; или приблизительно 8,9 до приблизительно 9,2. В определенных вариантах осуществления pH второго буфера может составлять приблизительно 8,5 или 8,5.
[00141] Второй буфер может содержать от приблизительно 30 до приблизительно 35 мМ; от приблизительно 35 до приблизительно 40 мМ; от приблизительно 40 до приблизительно 45 мМ; от приблизительно 45 до приблизительно 50 мМ; от приблизительно 50 до приблизительно 55 мМ; от приблизительно 55 до приблизительно 60 мМ; от приблизительно 60 до приблизительно 65 мМ; от приблизительно 65 до приблизительно 70 мМ; от приблизительно 70 до приблизительно 75 мМ; или от приблизительно 75 до приблизительно 80 мМ Аргинин-HCl. В некоторых вариантах осуществления второй буфер может содержать приблизительно 50 мМ или 50 мМ Аргинин-HCl. В некоторых вариантах осуществления второй буфер может содержать от приблизительно 75 до приблизительно 100 мМ; от приблизительно 100 до приблизительно 125 мМ; от приблизительно 125 до приблизительно 150 мМ; от приблизительно 150 до приблизительно 175 мМ; от приблизительно 175 до приблизительно 200 мМ; от приблизительно 200 до приблизительно 225 мМ; или от приблизительно 225 до приблизительно 250 мМ NaCl. В некоторых вариантах осуществления второй буфер может содержать приблизительно 150 мМ или 150 мМ NaCl. В некоторых вариантах осуществления pH второго буфера может составлять от приблизительно 7,5 до приблизительно 7,7; от приблизительно 7,7 до приблизительно 7,9; от приблизительно 7,9 до приблизительно 8,1; от приблизительно 8,1 до приблизительно 8,3; от приблизительно 8,3 до приблизительно 8,5; от приблизительно 8,5 до приблизительно 8,7; от приблизительно 8,7 до приблизительно 8,9; или приблизительно 8,9 до приблизительно 9,2. В определенных вариантах осуществления pH второго буфера может составлять приблизительно 8,5 или 8,5.
[00142] Второй буфер может содержать от приблизительно 50 до приблизительно 200 мМ глицина. В некоторых вариантах осуществления второй буфер может содержать от приблизительно 50 до приблизительно 100 мМ; от приблизительно 70 до приблизительно 120 мМ; от приблизительно 100 до приблизительно 150 мМ; от приблизительно 120 до приблизительно 170 мМ; от приблизительно 150 до приблизительно 200 мМ глицина. В некоторых вариантах осуществления pH второго буфера может составлять от приблизительно 7,5 до приблизительно 7,7; от приблизительно 7,7 до приблизительно 7,9; от приблизительно 7,9 до приблизительно 8,1; от приблизительно 8,1 до приблизительно 8,3; от приблизительно 8,3 до приблизительно 8,5; от приблизительно 8,5 до приблизительно 8,7; от приблизительно 8,7 до приблизительно 8,9; или приблизительно 8,9 до приблизительно 9,2. В определенных вариантах осуществления pH второго буфера может составлять приблизительно 8,5 или 8,5.
[00143] Второй буфер может содержать от приблизительно 50 до приблизительно 20 мМ цитрата натрия. В некоторых вариантах осуществления второй буфер может содержать от приблизительно 5 до приблизительно 10 мМ; от приблизительно 7 до приблизительно 12 мМ; от приблизительно 10 до приблизительно 15 мМ; от приблизительно 12 до приблизительно 17 мМ; от приблизительно 15 до приблизительно 20 мМ цитрата натрия. В некоторых вариантах осуществления pH второго буфера может составлять от приблизительно 7,5 до приблизительно 7,7; от приблизительно 7,7 до приблизительно 7,9; от приблизительно 7,9 до приблизительно 8,1; от приблизительно 8,1 до приблизительно 8,3; от приблизительно 8,3 до приблизительно 8,5; от приблизительно 8,5 до приблизительно 8,7; от приблизительно 8,7 до приблизительно 8,9; или приблизительно 8,9 до приблизительно 9,2. В определенных вариантах осуществления pH второго буфера может составлять приблизительно 8,5 или 8,5.
[00144] В некоторых вариантах осуществления второй буфер содержит хелатирующий агент, например ЭДТА.
[00145] Третий буфер может содержать от приблизительно 30 до приблизительно 200 мМ Трис-HCl и от приблизительно 30 до приблизительно 75% об. этиленгликоля, с рН от приблизительно 7,5 до приблизительно 9,2. Третий буфер может содержать от приблизительно 20 до приблизительно 80 мМ Аргинин-HCl и от приблизительно 50 до приблизительно 200 мМ соли, с рН от приблизительно 7,3 до приблизительно 8,8. Третий буфер может содержать приблизительно 50 мМ Трис-HCl и приблизительно 50% об. этиленгликоля, с рН приблизительно 8,5. Третий буфер может содержать от приблизительно 20 до приблизительно 150 мМ таурина, от приблизительно 30 до приблизительно 75% об. этиленгликоля и от 0,05 до 0,2% октилгликопиранозида, с рН от приблизительно 7,3 до приблизительно 8,8. Третий буфер может содержать от приблизительно 50 до приблизительно 200 мМ Аргинин-HCl, от приблизительно 50 до приблизительно 200 мМ Лизина HCl, от приблизительно 50 до приблизительно 200 мМ Гистидин-HCl, и от приблизительно 1мМ до приблизительно 4 мМ N-ацетил-D, L-триптофана, и от приблизительно 10% до приблизительно 40% (масс./масс.) полисорбата 80, с pH от приблизительно 7,3 до приблизительно 8,8. Если в третьем буфере присутствует соль, например, NaCl, в некоторых вариантах осуществления концентрация соли не превышает 500 мМ, а в некоторых вариантах осуществления концентрация соли не превышает 200 мМ. В некоторых вариантах осуществления соль представляет собой NaCl, KCl, MgCl2, CaCl2, цитрат натрия, LiCl, CsCl, ацетат натрия и комбинации одного или более из NaCl, KCl, MgCl2, CaCl2, цитрата натрия, LiCl, CsCl и ацетата натрия. В определенных вариантах осуществления соль представляет собой NaCl. В некоторых вариантах осуществления одно или более из сорбита, маннита, ксилита, сахарозы или трегалозы могут быть использованы в сочетании с этиленгликолем или вместо этиленгликоля.
[00146] Не желая быть связанными теорией, на степень элюирования AAV влияет как количество этиленгликоля, так и проводимость соли в третьем буфере. Количество по меньшей мере 55% (масс./масс.) этиленгликоля в буфере может значительно увеличить количество элюирования по сравнению с 50% (масс./масс.) этиленгликоля. Соответственно, при данной концентрации этиленгликоля повышенная концентрация NaCl может увеличить степень и скорость элюирования. При данной концентрации этиленгликоля замена NaCl на поливалентную соль также может увеличить степень и скорость элюирования.
[00147] Не желая быть связанными теорией, если содержание соли является постоянным, например 750 мМ NaCl, то увеличение количества этиленгликоля может увеличить элюирующую силу буфера. Если содержание этиленгликоля является постоянным, например 55%, то увеличение количества соли может увеличить элюирующую силу буфера. Таким образом, элюирующая сила увеличивается от 40% до 45%, от 50% до 55% до 60% (масс./масс.) этиленгликоля в 750 мМ NaCl.
[00148] Увеличение содержания этиленгликоля в растворе с постоянным содержанием соли может снизить проводимость. Увеличенное количество этиленгликоля может снизить величину растворимости соли в буфере.
[00149] В некоторых вариантах осуществления третий буфер может содержать от приблизительно 30 до приблизительно 35 мМ; от приблизительно 35 до приблизительно 40 мМ; от приблизительно 40 до приблизительно 45 мМ; от приблизительно 45 до приблизительно 50 мМ; от приблизительно 50 до приблизительно 55 мМ; от приблизительно 55 до приблизительно 60 мМ; от приблизительно 60 до приблизительно 65 мМ; от приблизительно 65 до приблизительно 70 мМ; от приблизительно 70 до приблизительно 75 мМ; от приблизительно 75 до приблизительно 80 мМ; от приблизительно 80 до приблизительно 90 мМ; от приблизительно 90 до приблизительно 100 мМ; от приблизительно 100 до приблизительно 110 мМ; от приблизительно 110 до приблизительно 120 мМ; от приблизительно 120 до приблизительно 130 мМ; от приблизительно 130 до приблизительно 140 мМ; от приблизительно 140 до приблизительно 150 мМ; от приблизительно 150 до приблизительно 160 мМ; от приблизительно 160 до приблизительно 170 мМ; от приблизительно 170 до приблизительно 180 мМ; от приблизительно 180 до приблизительно 190 мМ; или от приблизительно 190 до приблизительно 200 мМ Трис-HCl. В некоторых вариантах осуществления третий буфер может содержать от приблизительно 50 мМ или 50 мМ Трис-HCl. В некоторых вариантах осуществления третий буфер может содержать от приблизительно 30 до приблизительно 35% об.; от 35 до приблизительно 40% об.; от приблизительно 40 до приблизительно 45% об.; от приблизительно 45 до приблизительно 50% об.; от приблизительно 48 до приблизительно 52% об.; от приблизительно 50 до приблизительно 55% об.; от приблизительно 55 до приблизительно 60% об.; от приблизительно 60 до приблизительно 65% об.; от приблизительно 65 до приблизительно 70% об.; или от приблизительно 70 до приблизительно 75% об. этиленгликоля. В некоторых вариантах осуществления третий буфер может содержать от приблизительно 50% или 50% этиленгликоля. В некоторых вариантах осуществления pH третьего буфера может составлять от приблизительно 7,5 до приблизительно 7,7; от приблизительно 7,7 до приблизительно 7,9; от приблизительно 7,9 до приблизительно 8,1; от приблизительно 8,1 до приблизительно 8,3; от приблизительно 8,3 до приблизительно 8,5; от приблизительно 8,5 до приблизительно 8,7; от приблизительно 8,7 до приблизительно 8,9; или от приблизительно 8,9 до приблизительно 9,2. В определенных вариантах осуществления pH третьего буфера может составлять приблизительно 8,5 или 8,5.
[00150] В некоторых вариантах осуществления третий буфер содержит хелатирующий агент, например ЭДТА.
[00151] Четвертый буфер может содержать от приблизительно 10 до приблизительно 30 мМ Трис-HCl и от приблизительно 75 до приблизительно 250 мМ NaCl, с рН от приблизительно 6,5 до приблизительно 8,0. В некоторых вариантах осуществления четвертый буфер может содержать от приблизительно 10 до приблизительно 15 мМ; от приблизительно 15 до приблизительно 20 мМ; от приблизительно 20 до приблизительно 25 мМ; или от приблизительно 25 до приблизительно 30 мМ Трис-HCl. В некоторых вариантах осуществления четвертый буфер может содержать приблизительно 20 мМ или 20 мМ Трис-HCl. В некоторых вариантах осуществления четвертый буфер может содержать от приблизительно 75 до приблизительно 100 мМ; от приблизительно 100 до приблизительно 125 мМ; от приблизительно 125 до приблизительно 150 мМ; от приблизительно 150 до приблизительно 175 мМ; от приблизительно 175 до приблизительно 200 мМ; от приблизительно 200 до приблизительно 225 мМ NaCl; или от приблизительно 225 до приблизительно 250 мМ NaCl. В некоторых вариантах осуществления четвертый буфер может содержать приблизительно 150 мМ или 150 мМ NaCl. В некоторых вариантах осуществления четвертый буфер может иметь pH от приблизительно 6,5 до приблизительно 6,9; от приблизительно 6,8 до приблизительно 7,2; от приблизительно 7,1 до приблизительно 7,5; от приблизительно 7,4 до приблизительно 7,9; или от приблизительно 7,6 до приблизительно 8,0. В некоторых вариантах осуществления четвертый буфер может иметь рН приблизительно 7,4 или 7,4.
[00152] Четвертый буфер может содержать от приблизительно 20 до приблизительно 100 мМ Гистидина и от приблизительно 75 до приблизительно 250 мМ NaCl, с pH от приблизительно 7,5 до приблизительно 8,8. В некоторых вариантах осуществления четвертый буфер может содержать от приблизительно 20 до приблизительно 40 мМ; от приблизительно 40 до приблизительно 60 мМ; от приблизительно 60 до приблизительно 75 мМ; или от приблизительно 75 до приблизительно 100 мМ Гистидина. В некоторых вариантах осуществления четвертый буфер может содержать приблизительно 20 мМ или 20 мМ Гистидина. В некоторых вариантах осуществления четвертый буфер может содержать от приблизительно 75 до приблизительно 100 мМ; от приблизительно 100 до приблизительно 125 мМ; от приблизительно 125 до приблизительно 150 мМ; от приблизительно 150 до приблизительно 175 мМ; от приблизительно 175 до приблизительно 200 мМ; от приблизительно 200 до приблизительно 225 мМ NaCl; или от приблизительно 225 до приблизительно 250 мМ NaCl. В некоторых вариантах осуществления четвертый буфер может содержать приблизительно 150 мМ или 150 мМ NaCl. В некоторых вариантах осуществления четвертый буфер может иметь pH от приблизительно 7,5 до приблизительно 7,9; от приблизительно 7,8 до приблизительно 8,2; от приблизительно 8,1 до приблизительно 8,5; от приблизительно 8,4 до приблизительно 8,9; или от приблизительно 8,6 до приблизительно 9,0. В некоторых вариантах осуществления четвертый буфер может иметь рН приблизительно 8,0 или 8,0.
[00153] В некоторых вариантах осуществления четвертый буфер содержит хелатирующий агент, например ЭДТА. В некоторых вариантах осуществления дополнительная промывка может проводиться с буфером, содержащим хелатирующий агент, например, ЭДТА.
[00154] После стадий промывки частицы AAV элюируют, используя элюирующий буфер. Элюирующий буфер может содержать от приблизительно 30 до приблизительно 200 мМ буфера, от приблизительно 30 до приблизительно 75% об. этиленгликоля и от приблизительно 500 мМ до приблизительно 2000 мМ соли, при этом элюирующий буфер имеет рН от приблизительно 7,3 до приблизительно 8,8. В некоторых вариантах осуществления концентрация этиленгликоля составляет по меньшей мере 50% (масс./масс.). В некоторых вариантах осуществления концентрация этиленгликоля составляет по меньшей мере 55% (масс./масс.). В некоторых вариантах осуществления концентрация этиленгликоля составляет по меньшей мере 60% (масс./масс.). В некоторых вариантах осуществления буфер представляет собой Трис-HCl, Глицин, Цитрат, Аргинин, Фосфат-Глицин-HCl, сульфат аммония, хлорид магния, борат, Бис-Трис, MOPS, бицин, трицин, TAPS, TAPSO, MES, PIPES, TES (2-[[1,3-дигидрокси-2-(гидроксиметил)пропан-2-ил]амино]этансульфоновая кислота), барбитал натрия (веронал), ADA (N- (2-ацетамидо)иминодиуксусная кислота), ACES (N-(2)-Ацетамидо)-2-аминоэтансульфоновая кислота), Бис-Трис-пропан, BES (N, N-бис(2-гидроксиэтил)-2-аминоэтансульфокислота), DIPSO (3- (N, N-бис[2-гидроксиэтил]амино)-2-гидроксипропансульфоновая кислота), Trizma, HEPPSO (4-(2-гидроксиэтил)пиперазин-1-(2-гидроксипропансульфоновая кислота)), POPSO (пиперазин-1,4-бис(2-гидроксипропансульфоновая кислота)дегидрат), TEA , EPPS (4-(2-гидроксиэтил)-1-пиперазинпропансульфоновая кислота), HEPBS (N-(2-гидроксиэтил)пиперазин-N'-(4-бутансульфоновая кислота), AMPD (2-амино-2-метил-1,3-пропандиол), AMPSO (N-(1,1-диметил-2-гидроксиэтил)-3-амино-2-гидроксипропансульфоновая кислота), отдельные аминокислоты или любая комбинация двух или более аминокислот для обеспечения pH и элюирования AAV, например, глицина, аргинина, триптофана, производных аминокислот, например, таурина (окисленный цистеин), N-ацетил-триптофана и глицилглицина. В некоторых вариантах осуществления буфер представляет собой Трис-HCl.
[00155] В некоторых вариантах осуществления соль представляет собой NaCl, KCl, CaCl2, CsCl, LiCl, CaCl2, цитрат натрия, LiCl, CsCl или комбинации одного или более из KCl, CaCl2, CsCl, LiCl, CaCl2, цитрата натрия, LiCl и CsCl. В некоторых вариантах осуществления соль представляет собой NaCl. Концентрация соли, например, NaCl, может составлять от приблизительно 500 до приблизительно 2000 мМ. В некоторых вариантах осуществления концентрация соли составляет от приблизительно 500 до приблизительно 900 мМ, приблизительно 750 мМ NaCl или 750 мМ NaCl. В некоторых вариантах осуществления, когда используется градиент концентрации NaCl, целевая концентрация составляет 2000 мМ.
[00156] В некоторых вариантах осуществления один или более из сорбита, маннита, ксилита, сахарозы, трегалозы, глицерина (1,2,3-пропантриола) или эритрита (мезо-1,2,3,4-бутантетрола) могут использоваться в сочетании с этиленгликолем или вместо этиленгликоля. В некоторых вариантах осуществления элюирующий буфер может содержать от приблизительно 30 до приблизительно 35 мМ; от приблизительно 35 до приблизительно 40 мМ; от приблизительно 40 до приблизительно 45 мМ; от приблизительно 45 до приблизительно 50 мМ; от приблизительно 50 до приблизительно 55 мМ; от приблизительно 55 до приблизительно 60 мМ; от приблизительно 60 до приблизительно 65 мМ; от приблизительно 65 до приблизительно 70 мМ; от приблизительно 70 до приблизительно 75 мМ; или от приблизительно 75 до приблизительно 80 мМ Трис-HCl. В некоторых вариантах осуществления элюирующий буфер может содержать приблизительно 50 мМ или 50 мМ Трис-HCl. В некоторых вариантах осуществления элюирующий буфер может содержать от приблизительно 30 до приблизительно 35% об.; от приблизительно 35 до приблизительно 40% об.; от приблизительно 40 до приблизительно 45% об.; от приблизительно 45 до приблизительно 50% об.; от приблизительно 48 до приблизительно 52% об.; от приблизительно 50 до приблизительно 55% об.; от приблизительно 55 до приблизительно 60% об.; от приблизительно 60 до приблизительно 65% об. приблизительно 65 до приблизительно 70% об.; или от приблизительно 70 до приблизительно 75% об. этиленгликоля. В некоторых вариантах осуществления элюирующий буфер может содержать приблизительно 50% или 50% этиленгликоля. В некоторых вариантах осуществления концентрация этиленгликоля составляет по меньшей мере 55% (масс./масс.). В некоторых вариантах осуществления концентрация этиленгликоля составляет по меньшей мере 56% (масс./масс.). В некоторых вариантах осуществления концентрация этиленгликоля составляет по меньшей мере 57% (масс./масс.). В некоторых вариантах осуществления концентрация этиленгликоля составляет по меньшей мере 58% (масс./масс.). В некоторых вариантах осуществления элюирующий буфер может содержать от приблизительно 500 до приблизительно 700 мМ; от приблизительно 550 до приблизительно 750 мМ; от приблизительно 600 до приблизительно 800 мМ; от приблизительно 650 до приблизительно 850 мМ; от приблизительно 700 до приблизительно 900 мМ; от приблизительно 750 до приблизительно 950 мМ; от приблизительно 800 до приблизительно 1000 мМ NaCl; от приблизительно 900 до приблизительно 1100 мМ NaCl; от приблизительно 1000 до приблизительно 1200 мМ NaCl; от приблизительно 1100 до приблизительно 1300 мМ NaCl; от приблизительно 1200 до приблизительно 1400 мМ NaCl; от приблизительно 1300 до приблизительно 1500 мМ NaCl; от приблизительно 1400 до приблизительно 1600 мМ NaCl; от приблизительно 1500 до приблизительно 1700 мМ NaCl; от приблизительно 1600 до приблизительно 1800 мМ NaCl; от приблизительно 1700 до приблизительно 1900 мМ NaCl; от приблизительно 1800 до приблизительно 2000 мМ NaCl. В некоторых вариантах осуществления элюирующий буфер может содержать приблизительно 750 мМ или 750 мМ NaCl. рН может составлять от 7,3 до 7,6. рН может составлять от 7,5 до 7,8. рН может составлять от 7,7 до 8,0. рН может составлять от 7,9 до 8,2. рН может составлять от 8,1 до 8,4. рН может составлять от 8,3 до 8,6. рН может составлять от 8,5 до 8,8.
[00157] В некоторых вариантах осуществления элюирование осуществляют с помощью элюирующего буфера, содержащего органический растворитель. Например, органический растворитель может содержать один или более из полиола (например, этиленгликоль, сорбит, маннит, ксилит), глицерина, сахарозы, трегалозы или комбинации полиолов. Буфер может иметь диапазон рН от 7,5 до 8,5. Не желая быть связанными какой-либо теорией, органический растворитель может инактивировать вирусы в липидной оболочке, которые могут продуцироваться, если, например, продуцирование AAV включает бакуловирусную трансфекцию клеток насекомых Sf9. Аффинный элюат может содержать органический растворитель (например, полиол, такой как этиленгликоль), который можно использовать в регулируемом градиенте плотности на последующей стадии ультрацентрифугирования.
[00158] Любой органический растворитель в промывочных буферах или в элюирующих буферах может быть способен дезинтегрировать или инактивировать вирусы в липидной оболочке. Такая инактивация может происходить посредством комбинации инактивации на колонне и инактивации в жидком состоянии. В некоторых вариантах осуществления органический растворитель в элюирующем буфере и/или промывочном буфере имеет концентрацию от приблизительно 50% (масс./масс.) до приблизительно 80% (масс./масс.), чтобы обеспечить дезинтеграцию или инактивацию вирусов в липидной оболочке. В некоторых вариантах осуществления концентрация составляет приблизительно 50% (масс./масс.). В некоторых вариантах осуществления концентрация составляет приблизительно 55% (масс./масс.). В некоторых вариантах осуществления концентрация этиленгликоля составляет приблизительно 56% (масс./масс.). В некоторых вариантах осуществления концентрация этиленгликоля составляет приблизительно 57% (масс./масс.). В некоторых вариантах осуществления концентрация этиленгликоля составляет приблизительно 58% (масс./масс.). В некоторых вариантах осуществления концентрация этиленгликоля составляет приблизительно 59% (масс./масс.). В некоторых вариантах осуществления концентрация составляет приблизительно 60% (масс./масс.). В некоторых вариантах осуществления концентрация составляет приблизительно 65% (масс./масс.). В некоторых вариантах осуществления концентрация составляет приблизительно 70% (масс./масс.). В некоторых вариантах осуществления концентрация составляет приблизительно 75% (масс./масс.). В некоторых вариантах осуществления органический растворитель в элюирующем буфере и/или промывочном буфере имеет концентрацию от приблизительно 40% (масс./масс.) для обеспечения дезинтеграции или инактивации вирусов в липидной оболочке. В некоторых вариантах осуществления органический растворитель в элюирующем буфере и/или промывочном буфере имеет концентрацию от приблизительно 30% (масс./масс.) для обеспечения дезинтеграции или инактивации вирусов в липидной оболочке. В некоторых вариантах осуществления органический растворитель в элюирующем буфере или промывочном буфере может быть неактивен или разрушать бакуловирус.
[00159] В некоторых вариантах осуществления первый буфер имеет рН от приблизительно 5,8 до приблизительно 6,2 и содержит от приблизительно 90 до приблизительно 110 мМ ацетата натрия и от приблизительно 0,09 до приблизительно 0,11% полисорбата 80/Твин 80, второй буфер имеет рН от приблизительно 8,2 до 8,8 и содержит от приблизительно 45 до приблизительно 55 мМ Трис-HCl, и от приблизительно 110 до приблизительно 135 мМ NaCl, третий буфер имеет рН от приблизительно 8,2 до приблизительно 8,8 и содержит от приблизительно 45 до приблизительно 55 мМ Трис-HCl, и от приблизительно 45 до приблизительно 55% этиленгликоля, необязательный четвертый буфер имеет рН от приблизительно 7,2 до приблизительно 7,6 и содержит от приблизительно 15 до приблизительно 25 мМ Трис-HCl, и от приблизительно 135 до приблизительно 165 мМ NaCl. В некоторых вариантах осуществления элюирующий буфер имеет рН от приблизительно 7,8 до приблизительно 8,2 и содержит от приблизительно 45 до приблизительно 55 мМ Трис-HCl, от приблизительно 45 до приблизительно 55% этиленгликоля и от приблизительно 650 до приблизительно 850 мМ NaCl. Могут быть использованы различные объемы, такие как от приблизительно 2 объемов колонки до приблизительно 15 объемов колонки, от приблизительно 3 объемов колонки до приблизительно 7 объемов колонки, от приблизительно 4 объемов колонки до приблизительно 8 объемов колонки, от приблизительно 5 объемов колонки до приблизительно 10 объемов колонки или от приблизительно 7 объемов колонки до приблизительно 12 объемов колонки. Могут быть использованы приблизительно 5 объемов колонки или 5 объемов колонки каждого из первого, второго, третьего, четвертого и элюирующего буфера. В качестве альтернативы, могут быть использованы приблизительно 10 объемов колонки или 10 объемов колонки каждого из первого, второго, третьего, четвертого и элюирующего буфера. Например, 10 объемов колонки могут быть использованы, когда объем колонки составляет от приблизительно 2 мл до приблизительно 3 мл. Увеличение продолжительности стадий промывки может быть дополнительно предпринято для улучшения чистоты AAV.
[00160] В некоторых вариантах осуществления первый буфер имеет рН от приблизительно 7,2 до приблизительно 7,6 и содержит от приблизительно 15 до приблизительно 25 мМ Трис-HCl и от приблизительно 135 до приблизительно 165 мМ NaCl, второй буфер имеет рН от приблизительно 5,8 до приблизительно 6,2 и содержит от приблизительно 90 до приблизительно 110 мМ ацетата натрия и от приблизительно 0,09 до приблизительно 0,11% полисорбата 80, третий буфер имеет рН от приблизительно 8,2 до приблизительно 8,8 и содержит от приблизительно 45 до приблизительно 55 мМ Трис-HCl и от приблизительно 110 до приблизительно 135 мМ NaCl, четвертый буфер имеет рН от 7,5 до 8,5 и содержит от 45 до 55 мМ Трис-HCl и от 45 до 55% этиленгликоля, а элюирующий буфер имеет рН от 7,8 до 8,2 и содержит от приблизительно 45 до приблизительно 55 мМ Трис-HCl, от приблизительно 45 до приблизительно 55% этиленгликоля и от приблизительно 650 до приблизительно 850 мМ NaCl. Могут быть использованы приблизительно 10 объемов колонки или 10 объемов колонки каждого промывочного буфера.
[00161] В некоторых вариантах осуществления первый буфер имеет рН от приблизительно 7,2 до приблизительно 7,6 и содержит от приблизительно 15 до приблизительно 25 мМ Трис-HCl и от приблизительно 135 до приблизительно 165 мМ NaCl, второй буфер имеет рН от приблизительно 5,8 до приблизительно 6,2 и содержит от приблизительно 90 до приблизительно 110 мМ ацетата натрия, и от приблизительно 0,09 до приблизительно 0,11% полисорбата 80, третий буфер имеет рН от приблизительно 8,2 до приблизительно 8,8 и содержит от приблизительно 45 до приблизительно 55 мМ Трис-HCl, и от приблизительно 110 до приблизительно 135 мМ NaCl, четвертый буфер имеет рН от приблизительно 7,5 до приблизительно 8,5 и содержит от приблизительно 45 до приблизительно 55 мМ Трис-HCl, и от приблизительно 45 до приблизительно 55% этиленгликоля. Элюирование проводят с градиентом, начинающимся с первого элюирующего буфера при рН от приблизительно 7,8 до приблизительно 8,2, и включает от приблизительно 45 до приблизительно 55 мМ Трис-HCl, от приблизительно 45 до приблизительно 55% этиленгликоля и от приблизительно 650 до приблизительно 850 мМ NaCl и заканчивая при втором элюирующем буфере при рН от приблизительно 7,8 до приблизительно 8,2 и содержащем от приблизительно 45 до приблизительно 55 мМ Трис-HCl, от приблизительно 45 до приблизительно 55% этиленгликоля и от приблизительно 1900 до приблизительно 2100 мМ NaCl. Могут быть использованы приблизительно 10 объемов колонки или 10 объемов колонки каждого промывочного буфера. Элюирование может проводиться с 10 объемами колонки градиента.
[00162] В определенных вариантах осуществления раствор, содержащий частицы AAV, подвергается ионообменной хроматографии. В определенных вариантах осуществления ионный обмен представляет собой анионный обмен. В некоторых вариантах осуществления с помощью анионообменной хроматографии можно удалять не только остаточные загрязняющие частицы из клеточной культуры, но также кислотные примеси и вирусные частицы. В некоторых вариантах осуществления с помощью анионообменной хроматографии можно удалять протеазы и/или ДНК клетки-хозяина. В некоторых вариантах осуществления ионообменная хроматография может проводиться с мембранным разделением, например, гибридной мембранно-анионообменной хроматографии. В некоторых вариантах осуществления используют очищающую хроматографию AEX, например, в проточном режиме или в режиме связывания/элюирования. В некоторых вариантах осуществления анионообмен может представлять собой, но не ограничивается ими, Mustang®Q, STREAMLINE Q XL™, POROS 50 PI™, Q SEPHAROSE™, Emphase™ AEX Hybrid Purifier, Nuvia Q, POROS 50 HQ, Capto Q, Capto Q impress, Unosphere Q, Q Ceramic HYPERD® F, TOYOPEARL® Q, TOYOPEARL® Super Q, смолы AEX в смешанном режиме (например, Capto Adhere, Capto Adhere Impress и MEP Hypercell) и любые DEAE, TMAE, третичный или четвертичный амин, или смолы на основе PEI. В некоторых вариантах осуществления анионообмен представляет собой Mustang® Q.
[00163] В некоторых вариантах осуществления ДНК из клеток HEK293 или любой используемой клетки-хозяина не обрабатывают бензоназой и/или ДНКазой. Описанные в данном документе стадии анионного обмена и промывки могут быть эффективными для удаления такой ДНК, так что нет необходимости обрабатывать бензоназой или ДНКазой.
[00164] AAV обычно извлекают из стадии анионного обмена в проточных фракциях (в зависимости от pH).Как альтернативный вариант, AAV можно использовать в способе связывания/элюирования. Для исключения примесей в клетках-хозяевах, которые элюируются при более высокой проводимости (при постоянном pH) или более низком pH (при постоянной проводимости), чем AAV, следует применять либо проточный метод, либо метод связывания/элюирования. При работе в режиме связывания/элюирования, pH и состав буфера эффективны для проведения элюирования продукта, но не кислотных примесей клетки-хозяина. Не желая быть связанными какой-либо теорией, каждая стадия связывания и элюирования может вызывать силы в микроокружении, так что проточный способ в условиях без связывания может вызывать меньшее повреждение или разрушение AAV, чем способ связывания/элюирования.
[00165] В различных вариантах осуществления выход AAV, например, AAV8 и AAV9, после стадий очистки, описанных в данном документе и измеренных с помощью анализа ITR-кПЦР по массе/объему, составляет по меньшей мере на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60% или 65% больше, чем при сравнительной процедуре, при которой не выполняются стадии промывки.
[00166] В различных вариантах осуществления выход AAV, например, AAV8 и AAV9, после стадий очистки, описанных в данном документе и измеренных с помощью анализа ITR-кПЦР по массе/массе, составляет по меньшей мере на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60% или 65% больше чем при сравнительной процедуре, при которой не выполняются стадии промывки.
[00167] В определенных вариантах осуществления способы получения и очистки AAV, описанные в данном документе, уменьшают количество белковых примесей приблизительно на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 99% больше, чем полученное сравнительной процедурой без того же протокола промывки. Неожиданно было обнаружено, что способы получения и очистки AAV, описанные в данном документе, уменьшают количество белковых примесей по меньшей мере на 25%. Неожиданно было обнаружено, что способы получения и очистки AAV, описанные в данном документе, уменьшают количество белковых примесей по меньшей мере на 75%, когда раствор частиц AAV подвергают анионообменной хроматографии перед загрузкой на аффинную матрицу. Например, данные в Таблице 7 Примера 2 показывают, что количество белковых примесей уменьшается с 20 до 14 (без предварительного анионного обмена) и с 20 до 4 (с предварительным анионным обменом).
[00168] В определенных вариантах осуществления способы получения и очистки AAV, описанные в данном документе, обеспечивают чистоту AAV, например, AAV8 и AAV9, которая составляет по меньшей мере 98,0%, 98,1%, 98,2%, 98,3%, 98,4%, 98,5%, 98,6%, 98,7%, 98,8%, 98,9%, 99,0%, 99,1% или 99,2%, при проведении анионообменной и аффинной очистки со стадиями промывки, как предусмотрено в данном документе. В определенных вариантах осуществления способы получения и очистки AAV, описанные в данном документе, обеспечивают чистоту AAV, например, AAV8 и AAV9, которая составляет по меньшей мере 96,0%, 96,1%, 96,2%, 96,3%, 96,4%, 96,5%, 96,6%, 96,7%, 96,8%, 96,9%, 97,0%, 97,1%, 97,2%, 97,3%, 97,4%, 97,5%, 97,6%, 97,7%, 97,8%, 97,9% или 98,0% при проведении аффинной очистки с помощью стадий промывки как предусмотрено в данном документе.
[00169] Преимущественно способы можно масштабировать до больших объемов исходного материала, например, клеточной культуры. В определенных вариантах осуществления способы, представленные в данном документе, представляют собой крупномасштабные способы, способные очищать AAV от объемов по меньшей мере или приблизительно 500 л, по меньшей мере или приблизительно 600 л, по меньшей мере или приблизительно 700 л, по меньшей мере или приблизительно 800 л, по меньшей мере или приблизительно 900 л, или по меньшей мере или приблизительно 1000 л. В некоторых вариантах осуществления способы масштабируются до минимального объема исходного материала (например, клеточной культуры) по меньшей мере или приблизительно 1250 л, по меньшей мере или приблизительно 1500 л, по меньшей мере или приблизительно 2000 л, по меньшей мере или приблизительно 2500 л, по меньшей мере или приблизительно 3000 л, по меньшей мере или приблизительно 4000 л, по меньшей мере или приблизительно 5000 л, по меньшей мере или приблизительно 6000 л, по меньшей мере или приблизительно 7000 л, по меньшей мере или приблизительно 8000 л, по меньшей мере или приблизительно 9000 л, по меньшей мере или приблизительно 10000 л или более. Например, способы выполняются с минимальным объемом приблизительно 1000 л или приблизительно 10000 л или 25000 л или более клеточной культуры, продуцирующей AAV.
[00170] Способы получения и очистки AAV, описанные в данном документе, также являются предпочтительными, поскольку способы приводят к получению AAV с высоким титром. В некоторых вариантах осуществления продукт AAV, содержащий по меньшей мере приблизительно 1010 вирусных частиц (вч), получают из приблизительно 1000 л исходного материала (например, клеточной культуры). В некоторых вариантах осуществления продукт AAV, содержащий по меньшей мере приблизительно 1011 вирусных частиц (вч), получают из приблизительно 1000 л исходного материала (например, клеточной культуры). В некоторых вариантах осуществления продукт AAV, содержащий по меньшей мере приблизительно 1012 вирусных частиц (вч), получают из приблизительно 1000 л исходного материала (например, клеточной культуры). В некоторых вариантах осуществления продукт AAV, содержащий по меньшей мере приблизительно 1013 вирусных частиц (вч), получают из приблизительно 1000 л исходного материала (например, клеточной культуры). В некоторых вариантах осуществления продукт AAV, содержащий по меньшей мере приблизительно 1014 вирусных частиц (вч), получают из приблизительно 1000 л исходного материала (например, клеточной культуры). В некоторых вариантах осуществления продукт AAV, содержащий по меньшей мере приблизительно 1015 вирусных частиц (вч), получают из приблизительно 1000 л исходного материала (например, клеточной культуры). В некоторых вариантах осуществления продукт AAV, содержащий по меньшей мере приблизительно 1016 вирусных частиц (вч), получают из приблизительно 1000 л исходного материала (например, клеточной культуры). В некоторых вариантах осуществления продукт AAV, содержащий по меньшей мере приблизительно 1017 вирусных частиц (вч), получают из приблизительно 1000 л исходного материала (например, клеточной культуры). В некоторых вариантах осуществления продукт AAV, содержащий по меньшей мере приблизительно 2×1016 вирусных частиц (вч), получают из приблизительно 1000 л исходного материала (например, клеточной культуры). В некоторых вариантах осуществления продукт AAV, содержащий по меньшей мере приблизительно 5×1017 вирусных частиц (вч), получают из приблизительно 1000 л исходного материала (например, клеточной культуры).
[00171] Другое преимущество описанных в данном документе способов состоит в том, что с помощью этих способов получают высокочистый продукт AAV. В некоторых вариантах осуществления продукт AAV, полученный способами по данному изобретению, по существу не содержит одного или более загрязняющих веществ: белков клетки-хозяина, нуклеиновых кислот клетки-хозяина (например, свободной ДНК клетки-хозяина и свободной плазмидной ДНК), плазмидной ДНК, пустых вирусных капсидов, белка теплового шока 70 (HSP70), лактатдегидрогеназы (LDH), протеасом, загрязняющих вирусов не AAV (например, вирусы с липидной оболочкой), компонентов культуры клеток-хозяев (например, антибиотики), микоплазмы, пирогенов, бактериальных эндотоксинов, клеточного детрита (например, детрит, состоящий из мембранных липидов, белков и других биологических полимеров) и занесенных агентов. Одна или более, или даже все из следующих примесей могут не обнаруживаться при очистке AAV в соответствии с описанными в данном документе способами получения и очистки AAV: гистон H2A типа 1, гистон H2B типа 1-B, гистон H4, белок теплового шока 70 кДа 1А, пируваткиназа PKM, фактор элонгации 2, АТФ-цитрат-синтаза, гистон H1.4, тяжелая константа гамма-1 иммуноглобулина (иммобилизованный лиганд из метода кислотного элюирования), рибосомальный белок 60S L27, фруктоза-бисфосфат-альдолаза А, когнат белка теплового шока 71 кДа, цитоплазматический актин 1, S-формилглутатионгидролаза, аспарагинсинтетаза (гидролизующийся глутамин), L-лактатдегидрогеназа B-цепь, тубулин-бета-2A-цепь, X-хромосома РНК-связывающий мотивный белок, 60S рибосомный белок L6, цитоплазматический треонин-TRNA лигаза, константа каппа иммуноглобулина, рибосомный белок 60S L30, повторный белок WD 1, аденозилгомоцистеиназа, гетерогенный ядерный рибонуклеопротеин С, белок Rep68, тиметолигопептидаза, D-3-фосфоглицератдегидрогеназа, АТФ-зависимый молекулярный шаперон HSC82. Добавление стадии анионного обмена перед стадиями промывки в соответствии со способами получения и очистки аниона AAV, описанными в данном документе, также может сделать следующее необнаружимым: гистон H1.4, рибосомальный белок 60S L27, цитоплазматический актин 1, цепь бета-2A тубулина, 60S рибосомный белок L6, 60S рибосомный белок L30, гетерогенный ядерный рибонуклеопротеин С, белок Rep68 и АТФ-зависимый молекулярный шаперон HSC82.
[00172] В примерных вариантах осуществления способы по данному изобретению обеспечивают очищенный продукт AAV, в котором удаляется по меньшей мере или приблизительно 50% примеси, обнаруженной в исходном материале (например, клеточной культуре). В примерных вариантах осуществления способы по данному изобретению обеспечивают очищенный продукт AAV, в котором удаляется по меньшей мере или приблизительно 60% примеси, обнаруженной в исходном материале (например, клеточной культуре). В примерных вариантах осуществления способы по данному изобретению обеспечивают очищенный продукт AAV, в котором удаляется по меньшей мере или приблизительно 70% примеси, обнаруженной в исходном материале (например, клеточной культуре). В примерных вариантах осуществления способы по данному изобретению обеспечивают очищенный продукт AAV, в котором удаляется по меньшей мере или приблизительно 80% примеси, обнаруженной в исходном материале (например, клеточной культуре). В примерных вариантах осуществления способы по данному изобретению обеспечивают очищенный продукт AAV, в котором удаляется по меньшей мере или приблизительно 90% примеси, обнаруженной в исходном материале (например, клеточной культуре).
[00173] В определенных вариантах осуществления продукт AAV, полученный с помощью способов по данному изобретению, подходит для введения человеку. В определенных вариантах осуществления AAV представляет собой рекомбинантный AAV (rAAV). В определенных вариантах осуществления продукт AAV, полученный с помощью способов по данному изобретению, является стерильным и/или класса надлежащей производственной практики (GMP). В некоторых вариантах осуществления продукт AAV, полученный с помощью способов по данному изобретению, соответствует требованиям, изложенным в главе 1046 Фармакопеи США или Европейской фармакопее по лекарственным средствам для генной терапии или в соответствии с требованиями Управления по контролю за продуктами и лекарствами США (USFDA) или Европейского агентства по лекарственным средствам (EMA).
[00174] Кроме того, продукт AAV, полученный с помощью способов, описанных в данном документе, является сильнодействующим. Активность продукта AAV, например, продукта AAV8 или AAV9, может быть описана в терминах (1) биоактивности in vivo (например, продуцирования активного белка у мышей), которая дана в единицах (FIX или FVIII) на мл мышиной плазмы; или (2) биоактивности in vitro. Тест на биоактивность in vitro измеряет потенциал векторов AAV инфицировать клетки, например, клетки HepG2, которые экспрессируют и секретируют представляющий интерес белок в среду, и определяет количество с помощью методов ИФА и/или активность фермента. Подходящие способы измерения биоактивности in vivo и in vitro известны в данной области техники и также описаны в данном документе.
[00175] В других вариантах осуществления продукт AAV, полученный способами, описанными в данном документе, демонстрирует превосходную специфическую активность. «Специфическая активность» AAV представлена соотношением кПЦР к мкг AAV8. В примерных вариантах осуществления продукт AAV, полученный с помощью способов, описанных в данном документе, демонстрирует превосходное соотношение векторных геномов на мкг AAV, демонстрируя, что продукт AAV имеет большое количество «полных» вирусных частиц. В определенных вариантах осуществления способы по данному изобретению включают испытание фракции AAV с помощью AAV-специфического ИФА. В определенных вариантах осуществления AAV-специфический ИФА является достаточным для обеспечения репрезентативного считывания активности фракции AAV, потому что большинство капсидов во фракции AAV являются полными капсидами.
[00176] Источник частиц rAAV
[00177] Что касается способов данного раскрытия, AAV может иметь любой серотип AAV. В некоторых вариантах осуществления AAV, очищенный способами, описанными в данном документе, имеет серотип AAV1, серотип AAV2, серотип AAV3, серотип AAV4, серотип AAV5, серотип AAV6, серотип AAV7, серотип AAV8, серотип AAV9, серотип AAV10, серотип AAV11, серотип AAV12, серотип AAV13, серотип AAAV, серотип BAAV, серотип AAV (VR-195) и серотип AAV (VR-355) или химерные векторы AAV. В некоторых вариантах осуществления AAV является диким типом. В некоторых вариантах AAV модифицируется с помощью способов генной инженерии и/или химически модифицируется. В определенных вариантах осуществления AAV содержит модифицированный капсид, например, генетически модифицированный или химически модифицированный капсид AAV. В определенных вариантах осуществления частицы AAV, очищенные описанными в данном документе способами, имеют серотип AAV8.
[00178] Что касается способов по данному изобретению, фракция AAV представляет собой в примерных аспектах концентрированную фракцию AAV. В некоторых вариантах осуществления фракция AAV содержит по меньшей мере 1×1010, 1×1011 или 1×1012 AAV капсид AAV на мл. В некоторых вариантах осуществления фракция AAV содержит по меньшей мере 1×1012 AAV капсид AAV на мл. Капсиды AAV могут включать пустые капсиды AAV и полные капсиды AAV.
[00179] В определенных вариантах осуществления фракция AAV представляет собой фракцию AAV, продуцируемую трансфицированными клетками-хозяевами. В некоторых вариантах осуществления фракция AAV представляет собой супернатант, собранный из культуры клеток, включающей клетки-хозяева, трансфицированные тройной плазмидной системой, где одна плазмида системы содержит интересующий ген или кДНК, одна плазмида кодирует капсидный белок VP1, капсидный белок VP2 и/или капсидный белок VP3. В некоторых вариантах осуществления VP1, VP2 и/или VP3 представляют собой AAV8 VP1, AAV8 VP2 и/или AAV8 VP3. В некоторых вариантах осуществления VP1, VP2 и/или VP3 представляют собой AAV9 VP1, AAV9 VP2 и/или AAV9 VP3. Тройная плазмидная трансфекция с целью получения rAAV известна в данной области техники. См., например, Qu et al., 2015, supra, and Mizukami et al., "A Protocol for AAV vector production and purification." PhD dissertation, Division of Genetic Therapeutics, Center for Molecular Medicine, 1998; и Kotin et al., Hum Mol Genet 20(R1): R2-R6 (2011). В некоторых вариантах осуществления трансфекция может быть осуществлена с использованием неорганических соединений, например, фосфата кальция, или органических соединений, полиэтиленимина (PEI) или нехимических средств, например, электропорирования. В определенных вариантах осуществления клетки-хозяева являются адгезивными клетками. В определенных вариантах осуществления клетки-хозяева представляют собой суспензионные клетки. В определенных вариантах осуществления клетки-хозяева представляют собой клетки HEK293 или клетки Sf9. В определенных вариантах осуществления клеточная культура включает культуральную среду, которая не содержит сыворотку и белок. В определенных вариантах осуществления среда химически определена и не содержит компонентов животного происхождения, например, гидролизатов. В некоторых вариантах осуществления фракция, содержащая частицы rAAV, представляет собой фракцию, содержащую клетки HEK293, трансфицированные тройной плазмидной системой. В некоторых вариантах осуществления фракция, содержащая частицы rAAV, описана в предварительной заявке США № 62/417775 и международной заявке № PCT/US2017/059967.
Дополнительные стадии
[00180] Способы по данному раскрытию включают любую комбинацию стадий, раскрытых в данном документе, и могут необязательно комбинироваться с одной или более дополнительными стадиями. Соответственно, в типовых аспектах способы по данному изобретению дополнительно включают стадии трансфекции клеток-хозяев тройной плазмидной системой, как описано в данном документе. В иллюстративных аспектах способы по данному изобретению включают сбор супернатанта из клеточной культуры, содержащей клетки-хозяева, например, клетки HEK293, трансфицированные тройной плазмидной системой. В иллюстративных аспектах стадия трансфекции и сбора происходит перед стадией ультрацентрифугирования, описанной в данном документе.
[00181] Способы по данному изобретению могут содержать еще другие дополнительные стадии, которые могут дополнительно повысить чистоту AAV и удалить другие нежелательные компоненты, и/или сконцентрировать фракцию и/или подготовить фракцию для последующей стадии. Дополнительные стадии могут происходить до или после стадии ультрацентрифугирования, описанной в данном документе.
[00182] В иллюстративных аспектах способ включает стадию глубинной фильтрации. В иллюстративных аспектах способ включает подвергание фракции супернатанта трансфицированной клеточной культуры HEK293 глубинной фильтрации с использованием фильтра, содержащего целлюлозу и перлиты, и имеющего минимальную проницаемость приблизительно 500 л/м2. В иллюстративных аспектах способ дополнительно включает использование фильтра с минимальным размером пор приблизительно 0,2 мкм. В иллюстративных аспектах глубинная фильтрация сопровождается фильтрацией через фильтр с минимальным размером пор приблизительно 0,2 мкм. В иллюстративных аспектах один или оба из пористого фильтра и фильтра, имеющего минимальный размер пор приблизительно 0,2 мкм, промывают и промывочные фракции собирают. В иллюстративных аспектах промывки объединяют вместе и объединяют с фильтратом, полученным после глубинной фильтрации и фильтрации с помощью фильтра, имеющего минимальный размер пор приблизительно 0,2 мкм.
[00183] В иллюстративных аспектах способы по данному изобретению включают одну или более стадий хроматографирования. В иллюстративных аспектах способы включают стадию отрицательной хроматографии, посредством которой нежелательные компоненты связываются с хроматографической смолой, а желаемый AAV не связывается с хроматографической смолой. В иллюстративных аспектах способы включают стадию хроматографирования с отрицательным анионным обменом (AEX) или стадию хроматографирования AEX в «режиме без связывания». Пример 2 описывает такую стадию. Преимущества «режима без связывания» включают относительную простоту проведения процедуры и проведения последующего анализа.
[00184] Соответственно, в примерных вариантах осуществления способы очистки частиц AAV включают выполнение хроматографирования с отрицательным анионным обменом (AEX) с фракцией, содержащей частицы AAV, путем нанесения фракции на хроматографическую колонку AEX или мембрану в условиях, которые позволяют AAV проходить через AEX хроматографическую колонку или мембрану и сбор частиц AAV. В иллюстративных аспектах фракцию наносят на хроматографическую колонку или мембрану AEX с помощью загрузочного буфера, содержащего от приблизительно 100 мМ до приблизительно 150 мМ соли, например, NaCl, необязательно, причем рН загрузочного буфера составляет от приблизительно 8 до приблизительно 9. В иллюстративных аспектах загрузочный буфер содержит от приблизительно 115 мМ до приблизительно 130 мМ соли, например, NaCl, необязательно, причем загрузочный буфер содержит от приблизительно 120 мМ до приблизительно 125 мМ соли, например, NaCl. В иллюстративных аспектах стадия отрицательной AEX происходит до стадии ультрацентрифугирования, описанной в данном документе.
[00185] В примерных аспектах способы данного раскрытия включают концентрирование фракции AAV с использованием системы ультра/диафильтрования. В примерных аспектах способы данного раскрытия включают в себя еще одну стадию фильтрации в тангенциальном потоке (TFF). В иллюстративных аспектах фракция AAV подвергается ультра-/диафильтрованию. В иллюстративных аспектах фракцию AAV концентрируют в системе ультра/диафильтрования перед стадией, включающей выполнение отрицательной хроматографии AEX, после стадии, включающей выполнение отрицательной хроматографии AEX, или до и после включающей выполнение отрицательной хроматографии AEX. В примерных аспектах стадии TFF происходят перед стадией ультрацентрифугирования, описанной в данном документе.
[00186] В иллюстративных аспектах способы данного раскрытия включают фильтрование фракции, содержащей частицы rAAV, для удаления вирусов большего размера, чем частицы rAAV во фракции.
[00187] В иллюстративных аспектах способы данного раскрытия включают в себя одну или более стадий контроля качества, например стадии для измерения эффективности или специфической активности фракций AAV, полученных после одной или более стадий (например, после каждой стадии) способа. В примерных аспектах способы данного раскрытия включают ИФА, специфичный для AAV. В иллюстративных аспектах ИФА представляет собой сэндвич-ИФА. В иллюстративных аспектах сэндвич-ИФА содержит антитело, специфичное к эпитопу AAV. В иллюстративных аспектах эпитоп AAV представляет собой конформационный эпитоп, присутствующий на собранных капсидах AAV. Как обсуждено в данном документе, ИФА может заменить кПЦР в качестве способа определения эффективности фракции AAV. В иллюстративных аспектах способы данного раскрытия включают тестирование фракции AAV с помощью AAV-специфического ИФА, и способы не включают способ измерения эффективности посредством количественной ПЦР. В иллюстративных аспектах AAV-специфический ИФА является достаточным для обеспечения репрезентативного считывания активности фракции AAV, потому что большинство капсидов во фракции AAV являются полными капсидами.
[00188] В примерных аспектах способы данного раскрытия включают ИФА, специфичный для AAV, после одной или более стадий данного раскрытия. В иллюстративных аспектах способы данного раскрытия включают тестирование фракции AAV, полученной после глубинной фильтрации, с помощью специфичного для AAV ИФА для определения специфической активности AAV в этой фракции. В иллюстративных аспектах способы данного раскрытия включают тестирование фракции AAV, полученной после концентрирования фракции AAV, с использованием системы ультра-/диафильтрования с помощью AAV-специфического ИФА для определения специфической активности AAV в этой фракции. В иллюстративных аспектах способы данного раскрытия включают тестирование фракции AAV, полученной после стадии фильтрования в тангенциальном потоке (TFF), посредством AAV-специфического ИФА для определения специфической активности AAV в этой фракции. В иллюстративных аспектах способы по данному изобретению включают тестирование фракции AAV, полученной после хроматографии с отрицательным анионным обменом (AEX), с помощью AAV-специфического ИФА для определения специфической активности AAV в этой фракции. В иллюстративных аспектах способы данного раскрытия включают в себя тестирование фракции AAV, полученной после стадии полировки, с помощью AAV-специфического ИФА для определения специфической активности AAV в этой фракции.
[00189] Продукт AAV, полученный с помощью способа по данному изобретению, дополнительно представлен в данном документе. В иллюстративных аспектах продукт AAV содержит, по меньшей мере приблизительно 1012 вирусных частиц (вч), полученных из приблизительно 1000 л исходного материала (например, клеточной культуры), или, по меньшей мере, приблизительно 1013 вирусных частиц (вч), полученных из приблизительно 1000 л исходного материала (например, клеточной культуры). В иллюстративных аспектах продукт AAV представляет собой пустой капсид, генерируемый путем трансфекции плазмиды rep-cap и Ad хелперной без трансгена плазмиды. Очищенные пустые плазмиды могут быть использованы для истощения или удаления антител, специфичных к антигенам AAV, из крови пациента.
[00190] В иллюстративных аспектах продукт AAV по данному изобретению является высокочистым, высокоэффективным и пригодным для клинического применения у людей. В иллюстративных аспектах продукт AAV содержит частицы AAV гомогенной популяции и высокой чистоты. В иллюстративных аспектах продукт AAV содержит полноразмерную векторную ДНК. В иллюстративных вариантах осуществления продукт AAV по существу не содержит нежелательных загрязнений, включая, но не ограничиваясь ими, частицы AAV, содержащие усеченную или неполную векторную ДНК, частицы AAV с неполной белковой композицией и олигомеризованными структурами или загрязняющие вирусы, например не AAV вирусы с липидной оболочкой. В иллюстративных вариантах осуществления продукт AAV содержит большое количество кодирующей кДНК представляющего интерес белка. В иллюстративных аспектах продукт AAV по данному изобретению подходит для введения человеку. В иллюстративных аспектах продукт AAV является стерильным и/или имеет чистоту согласно надлежащей производственной практики (GMP). В иллюстративных аспектах продукт AAV соответствует требованиям, изложенным в главе 1046 Фармакопеи США или Европейской фармакопее по лекарственным средствам для генной терапии или в соответствии с требованиями Управления по контролю за продуктами и лекарствами США (USFDA) или Европейского агентства по лекарственным средствам (EMA). В иллюстративных аспектах продукт AAV представляет собой готовый к использованию продукт для непосредственного введения человеку практически без обработки или без обработки.
[00191] Следующие примеры приведены просто для иллюстрации данного изобретения, а не для ограничения его объема.
ПРИМЕР 1
[00192] В следующем примере описан иллюстративный способ трансфекции клеточной линии HEK293 тройной плазмидной системой для получения частиц rAAV, содержащих нуклеиновую кислоту, кодирующую представляющий интерес белок.
[00193] Адгезивные клетки HEK293 выращивали в условиях суспензии в коммерчески доступной культуральной среде, которая химически определена и не содержит компонентов животного происхождения, белка и сыворотки, например, как описано в параграфах [00146] - [00150] PCT/US2017/059967. Клетки трансфицировали тремя плазмидами: (1) хелперная плазмида, которая обеспечивает вспомогательные вирусные функции, важные для продуктивной AAV-инфекции, (2) repcap-плазмида, которая несет всю информацию, касающуюся образования капсида, репликации и упаковки вируса, и (3) плазмида, содержащая представляющий интерес ген (GOI), который упакован в полученную частицу rAAV. Частицы rAAV, содержащие представляющий интерес ген, находятся в клеточной линии HEK293 в течение 3-5 дней после трансфекции.
[00194] Супернатант трансфицированной клеточной культуры HEK293 собирали, например, как описано в параграфах [00151] - [00155], Таблице 1 и Таблице 2 PCT/US2017/059967. Собранный супернатант концентрировали и кондиционировали (диафильтровали), например, как описано в параграфах [00156] - [00160], Таблице 3 и Таблице 4 PCT/US2017/059967. Отрицательную хроматографию проводили на диафильтрованном концентрате, например, как описано в параграфах [00161] - [00165] и в Таблице 5 PCT/US2017/059967.
ПРИМЕР 2
[00195] Продукцию AAV8 разрабатывали в клеточной линии HEK293 после трансфекции тройной плазмидной системой, содержащей кодирующую кДНК представляющего интерес белка и AAV8-. VP1. -VP2 и -VP3. Осветленный супернатант бесклеточной культуры концентрировали и подвергали диафильтрации с помощью кассеты Pall Omega T-Series 100 кДа. Вирусные частицы загружали на мембранный адсорбер (MustangQ; Pall Part Number XT140MSTGQP05) в условиях без связывания, т. е. в растворе, содержащем 125 мМ NaCl и 50 мМ Трис-HCl при рН 8,5. рН-обусловленную ЗАГРУЗКУ получали доведения рН потока, содержащего AAV8, до диапазона рН между 7,4 и 7,8 с помощью 25% HCl.
[00196] Была проведена следующая тестовая процедура. Сначала колонку, содержащую матрицу сродства POROS™ CaptureSelect™ AAV8 (кат. № 195338010; Thermo Fisher) ВД 32 мм, с высотой слоя 59 мм и объемом 47,45 мл, уравновешивали по меньшей мере пятью объемами колонки 20 мМ Трис-HCl и 150 мМ NaCl при рН 7,4. рН-обусловленную ЗАГРУЗКУ наносили на колонку, содержащую матрицу сродства POROS ™ CaptureSelect ™ AAV8 (кат. № 195338010; Thermo Fisher). Затем колонку повторно уравновешивали пятью объемами колонки 20 мМ Трис-HCl и 150 мМ NaCl при рН 7,4 (необязательно, четвертый буфер).
[00197] Затем колонку промывали пятью объемами колонки Промывки 1 (W1): 100 мМ ацетата натрия и 0,1% Твин80 при рН 6,0. Затем колонку промывали пятью объемами колонки Промывки 2 (W2): 50 мМ Трис-HCl и 125 мМ NaCl при рН 8,5. Затем колонку промывают пятью объемами колонки Промывки 3 (W3): 50 мМ Трис-HCl и 50% этиленгликоля при рН 8,5.
[00198] Элюирование осуществляли путем применения пяти объемов колонки следующего буфера для элюирования: 50 мМ Трис-HCl, 50% этиленгликоля и 750 мМ NaCl, при рН 8,0. Пять объемов колонки следующего вторичного буфера для элюирования затем были применены к колонке: 50 мМ Трис-HCl, 50% этиленгликоля и 2000 мМ NaCl.
[00199] Линейная скорость потока для вышеуказанных стадий составляла 60 см/ч.
[00200] Была проведена следующая сравнительная процедура. Колонку, содержащую матрицу сродства POROS ™ CaptureSelect ™ AAV8 (кат.№ 195338010; Thermo Fisher) ВД 10 мм, с высотой слоя 2,5 мм и объемом 1,96 мл, уравновешивали по меньшей мере 10 объемами колонки 20 мМ Трис-HCl и 150 мМ NaCl при рН 7,4. рН-обусловленную ЗАГРУЗКУ наносили на колонку, содержащую матрицу сродства POROS ™ CaptureSelect ™ AAV8 (кат. № 195338010; Thermo Fisher). Затем колонку повторно уравновешивали 10 объемами колонки 20 мМ Трис-HCl и 150 мМ NaCl при рН 7,4.
[00201] Стадия промывки была выполнена с использованием следующего буфера TBS: 20 мМ Трис-HCl/150 мМ NaCl/рН 7,4. Вместо этого проводили элюирование 10 объемами колонки 100 мМ цитрата натрия при рН 3,0.
[00202] Вышеупомянутая тестовая и сравнительная процедура описаны более подробно в Таблице 2, где «CV» указывает количество колоночных объемов раствора, добавленного на стадии.
Таблица 2:
[00203] Следующие анализы были проведены с данными, выраженными в масса/объем в Таблице 3. Плотность буфера для элюирования измеряли на измерителе плотности с колеблющимися U-образными трубками DMA 4500M (Anton Paar).
[00204] ИФА использовали для измерения количества антигена AAV8. ИФА проводили с набором ИФА для титрования AAV-8 ( № PRAAV8; Progen (Гейдельберг, Германия) на системе TECAN Roboter. Вкратце, моноклональное антитело, специфичное к конформационному эпитопу на собранных капсидах AAV8 (ADK8), наносили на полоски для микротитрования и использовали для захвата частиц AAV8 из фракции AAV. Захват частиц AAV8 детектировали в две стадии. На первой стадии биотин-конъюгированное моноклональное антитело, специфичное к антителу ADK8, связывалось с иммунным комплексом (антитела ADK8 и ADK8). Конъюгаты стрептавидинпероксидазы добавляли к иммунным комплексам, связанным с биотин-конъюгированным моноклональным антителом, и конъюгаты стрептавидинпероксидазы реагировали с биотином. Добавляли раствор субстрата пероксидазы, и происходила цветная реакция, которая пропорциональна количеству связанных частиц AAV. Цветная реакция измерялась фотометрически при 450 нм.
[00205] Анализ ITR-кПЦР использовали для определения титра копии генома путем количественного определения инвертированных тандемных повторов, обнаруженных в векторе, кодирующем представляющий интерес ген (например, человеческий фактор VIII или человеческий фактор IX). HEK-HCP представляет собой измерение уровня остаточного белка клетки-хозяина с помощью ИФА. LDH определяли колориметрическим анализом активности.
[00206] ИФА на выявление утечки лиганда AAV8 (иммуно-сорбентный анализ со связанным ферментом) предназначен для обнаружения аффинного лиганда AAV8 в концентрации 1 нг/мл, который может присутствовать в продукте, очищенном с помощью среды сродства POROS ™ CaptureSelect ™ AAV8, которая содержит аффинный лиганд AAV8 в качестве захватывающего агента. ИФА на выявление утечки лиганда AAV8 можно использовать в качестве инструмента, помогающего оптимизировать способ очистки и осуществлять регулярный контроль качества как потоков внутри способа, так и конечного продукта.
[00207] Величина «ИФА на выявление утечки лиганда/ AAV8 - Антиген» отражает соотношение «ИФА с утечкой лиганда» к «антигену AAV8», рассчитанное как нанограммы лиганда на микрограмм AAV8.
[00208] В анализе биопотентности in vitro вирусный вектор AAV8 заражает печеночную клеточную линию-мишень, которая впоследствии секретирует функциональный, измеряемый кодируемый белок в среду. На первой стадии клетки-мишени HepG2 трансдуцируют инфицированием AAV8. Во время инкубации кодированный белок высвобождается в клеточный супернатант. На второй стадии активность кодированного белка в супернатанте клеточной культуры непосредственно измеряется с помощью анализа активности. Измерение образца AAV8 приведено в процентах по отношению к эталонному материалу. Способ позволяет количественно оценить биологическую функцию вектора генной терапии AAV8.
Таблица 3:
[00209] Выход на стадии для ITR-кПЦР для тестовой процедуры составил 105,3%, в то время как для сравнительной процедуры он составил 71,2%. Биопотентность in vitro для тестовой процедуры составляла 0,45, в то время как для сравнительной процедуры - 0,33.
[00210] Анализы также проводились с данными, выраженными в масса/масса в Таблице 4.
Таблица 4:
[00211] Выход на стадии для ITR-кПЦР для тестовой процедуры составил 127,4%, в то время как для сравнительной процедуры он составил 72,4%. Улучшение выхода и чистоты в сочетании с отсутствием необходимости использовать экстремальные условия, которые ухудшают инфекционность и биопотентность AAV8, было неожиданным. Кроме того, было удивительно, что тестовая процедура удаляла большую часть примесей без элюирования продукта из аффинного лиганда, особенно в условиях, когда было существенно большее неспецифическое связывание и комплексы продукта с примесями, которые присутствовали до очистки.
[00212] Анализ SDS-PAGE был проведен, чтобы определить, было ли снижение уровня белка теплового шока 70 кДа (HSP70) при использовании тестовой процедуры со стадиями промывки вместо сравнительной процедуры. Вестерн-блоттинг проводили с использованием Анти-Hsp70 антитела (Abcam, кат. № ab79852) в качестве первичного антитела при разведении 1:2000 в течение двух часов и козий анти-кроличий IgG (H+L) АР конъюгат в качестве вторичного антитела (Sigma, кат. № A8025) в разведении 1:1000 в течение одного часа. Результаты показаны на Фиг 1. При сравнении полосы 4 (тестовая процедура) с полосой 6 (сравнительная процедура) наблюдалось значительное снижение HSP70 при проведении тестовой процедуры. Полоса 2 показывает 20 нг HSP70, а полоса 4 показывает 4 нг HSP70.
[00213] Анализ SDS-PAGE на окрашивание серебром проводили для определения общего уровня присутствующих примесей. Результаты показаны на Фиг. 2. Полоса 2 представляет собой эталон AAV8 и показывает три характерные полосы. Элюат (190 мкг/мл) очищали в соответствии с тестовой процедурой и сравнительной процедурой. Результаты тестовой процедуры показаны на дорожке 4. Результаты сравнительной процедуры показаны на дорожке 6. При сравнительной процедуре заметно больше примесей, чем при тестовой процедуре.
[00214] Вестерн-блоттинг с 12% анти-AAV-антителом проводили для определения уровней и чистоты AAV8, выделенного после очистки, в соответствии с тестовой и сравнительной процедурами. Вестерн-блоттинг проводили с моноклональными антителами к VP1, VP2 и VP3 AAV в качестве первичных антител, с козьим антимышиным ALP антителом (Sigma, кат. № A4656) в качестве вторичного антитела. Результаты показаны на Фиг. 3. Полоса 2 показывает эталон AAV (130 нг, что соответствует 60 мкг/мл) с тремя полосами для каждого из VP1, VP2 и VP3. Полоса 4 показывает элюат в соответствии с тестовой процедурой (190 мкг/мл антигена AAV8), а полоса 6 показывает элюат в соответствии со сравнительной процедурой. По данным вестерн-блоттинга, выход является выше при тестовой процедуре по сравнению со сравнительной процедурой.
[00215] ЖХ-МС проводили (rp-ВЭЖХ-УФ-ЭСИ-МС/ МС) для определения идентичности и количества различных примесей клетки-хозяина. Образцы расщепляли с использованием фермента трипсина. Полученную пептидную смесь разделяли в системе ВЭЖХ, используя колонку с обратной фазой (колонка ZORBAX 300SB-C18, 0,5×150 мм, 3,5 мкм), и затем пептиды анализировали на масс-спектрометре Q-Exactive HF. Данные были проанализированы с использованием программного обеспечения Proteome Discoverer для идентификации белков в образце.
[00216] Agilent HPLC1209 (1200 capHPLC) использовали с ChemStation для систем ЖХ-3D (Rev. B.04.03-SP2 (105)). Метод ВЭЖХ был PEPMAP_CAP_170.M. Элюент A представлял собой 0,1% (об./об.) HCOOH в деионизированной воде, а элюент B представлял собой 0,08% (об./об.) HCOOH в ацетонитриле. Подробная информация о ВЭЖХ представлена в следующей Таблице 5:
Таблица 5:
[00217] Подробная информация о МС приведена в следующей Таблице 6:
Таблица 6:
[00218] Были предприняты три различных способа очистки. Один включал сравнительную процедуру этого примера, другой включал тестовую процедуру этого примера (которая включала анионообменную очистку MustangQ перед аффинной очисткой), а третий проводился в соответствии с тестовой процедурой, но без анионообменной очистки MustangQ. Таблица 7 ниже суммирует общие результаты.
Таблица 7:
[00219] В приведенной выше таблице чистота отражает процентную площадь под кривой (AUC), связанную с капсидами AAV8, относительно общей AUC всех белков.
[00220] В приведенных ниже Таблицах 8-10 для каждого белка приведены значение AUC и количество пептидов, идентифицированных методом ЖХ/МС для сравнительной процедуры (Таблица 8), тестовой процедуры с предварительным анионным обменом (Таблица 9) и тестовой процедуры без предварительного анионного обмена (Таблица 10).
Таблица 8: Сравнительная процедура
Таблица 9: Тестовая процедура с предварительным анионным обменом
Таблица 10: Процедура тестирования без предварительного анионного обмена
[00221] Наименьшее количество белков было обнаружено с помощью тестовой процедуры в сочетании с предварительным анионным обменом. Без анионного обмена чистота снижается, а количество обнаруженных белков увеличивается. Самая низкая чистота и наибольшее количество обнаруженных белков наблюдается при сравнительной процедуре.
ПРИМЕР 3
[00222] Продукцию AAV8 разрабатывали в клеточной линии HEK293 после трансфекции тройной плазмидной системой, содержащей кодирующую кДНК представляющего интерес белка и AAV8-. VP1. -VP2 и -VP3. Осветленный супернатант бесклеточной культуры концентрировали и подвергали диафильтрации с помощью кассеты Pall Omega T-Series 100 кДа. Вирусные частицы были загружены на мембранный адсорбер (MustangQ. номер детали Pall XT140MSTGQP05) в условиях без связывания. Полученный поток, содержащий AAV8, не доводили до рН в диапазоне от 7,4 до 7,8 с помощью 25% HCl. Вместо этого была сформирована ЗАГРУЗКА путем восстановления потока, содержащего AAV-8, в загрузочном буфере, содержащем 125 мМ NaCl и 50 мМ TrisHCl при рН 8,5.
[00223] Помимо преимущества, заключающегося в том, что нет необходимости включать стадию регулирования pH, наличие pH 8,5 обеспечивает улучшенную устойчивость к сродству и предотвращает неспецифическое связывание примесей с продуктом или смолой.
[00224] Образцы с различных стадий промывки и элюирования отбирали в различных точках, чтобы определить, сколько AAV8 присутствовало в образце. Анализы показывают, сколько AAV8 было потеряно в различных стадиях промывки. Была проведена следующая тестовая процедура. Сначала, колонка, содержащая матрицу сродства POROS ™ CaptureSelect ™ AAV8 (кат. № 195338010. Thermo Fisher) ВД 10 мм, с высотой слоя 25 мм и объемом 1,96 мл, уравновешивали по меньшей мере пятью объемами колонки 20 мМ Трис-HCl и 150 мМ NaCl при рН 7,4. ЗАГРУЗКА была применена к колонке, содержащей матрицу сродства POROS ™ CaptureSelect ™ AAV8 (кат. № 195338010. Thermo Fisher). Часть образца, загруженного в колонку, была сохранена и затем проанализирована с помощью ITR кПЦР, ИФА против антигенов AAV и ИФА против антигенов HЕК293 HCP. Затем колонку повторно уравновешивали 10 объемами колонки 20 мМ Трис-HCl и 150 мМ NaCl при рН 7,4. Образец проходящего потока сохраняли и затем анализировали с помощью ITR кПЦР, ИФА против антигенов AAV и ИФА против антигенов HЕК293 HCP.
[00225] Затем колонку промывали 10 объемами колонки Промывка 1 (W1): 100 мМ ацетата натрия и 0,1% Твин80 при рН 6,0. Затем колонку промывали 10 объемами колонки Промывка 2 (W2): 50 мМ Трис-HCl и 125 мМ NaCl при рН 8,5. Затем колонку промывают 10 объемами колонки Промывка 3 (W3): 50 мМ Трис-HCl и 50% этиленгликоля при рН 8,5. Пробу из элюата каждого из W1, W2 и W3 отбирали и анализировали в соответствии с ITR кПЦР, ИФА против антигенов AAV и ИФА против антигенов HЕК293 HCP.
[00226] Элюирование осуществляли путем нанесения 10 объемов колонки следующего буфера для элюирования на колонку: 50 мМ Трис-HCl, 50% этиленгликоль и 750 мМ NaCl, при рН 8,0.
[00227] Вышеуказанная тестовая процедура более подробно описана в Таблице 11.
Таблица 11:
[00228] Отобранные образцы анализировали с помощью каждого из ITR кПЦР, ИФА против антигенов AAV и ИФА против HEK293 НСР, чтобы оценить выход и возможные потери на стадиях. В Таблице 12 показано распределение AAV8, анализируемое с помощью ITR кПЦР, во всех фракциях стадий промывки, элюирования и постэлюирования, перечисленных в Таблице 11.
Таблица 12:
[00229] В приведенной ниже Таблице 13 показано распределение AAV8, проанализированное с помощью ИФА, во всех фракциях стадий промывки, элюирования и постэлюирования, перечисленных в Таблице 11.
Таблица 13:
[00230] В приведенной ниже Таблице 14 показаны результаты анализов для определения количества HEK 293 HCP, присутствующего согласно ИФА, только на стадиях ЗАГРУЗКА и элюат.
Таблица 14:
[00231] Хроматограмма, связанная с данными в Таблицах 12-14, показана на Фиг.6.
[00232] Вышеуказанные образцы также анализировали с помощью SDS-PAGE и 12% окрашивания серебром для выявления общего количества белка. Результаты показаны на Фиг. 4 с меткой для каждой полосы, обозначенной на Фиг. Полосы AAV8 хорошо видны на линиях элюата (E) и 50% -ного разбавления элюата (E2). Очень мало AAV8 наблюдается в полосе промывочного потока через образцы (W1, W2 и W3) и в полосе стриппинг-потока (S) через образцы. Таким образом, способ эффективно удаляет AAV8 без существенных потерь во время промывки или оставления AAV8 на колонке после элюирования.
[00233] Затем образцы анализировали с помощью SDS-PAGE и вестерн-блоттинга против антигенов AAV. Первичные антитела представляют собой моноклональные антитела к VP1, VP2 и VP3 AAV, тогда как вторичные антитела представляют собой козьи антимышиные антитела, связанные с щелочной фосфатазой. Результаты показаны на Фиг. 5 с теми же метками для каждой полосы, что и на Фиг. 4. Потери AAV8 на стадиях промывки и стриппинга минимальны.
ПРИМЕР 4
[00234] Продукцию AAV9 разрабатывали в клеточной линии HEK293 после трансфекции тройной плазмидной системой, содержащей кодирующую кДНК представляющего интерес белка и AAV9-. VP1. -VP2 и -VP3. Осветленный супернатант бесклеточной культуры концентрировали и диафильтровали с помощью кассеты Pall Omega T-Series 100 кДа. Вирусные частицы загружали на мембранный адсорбер (MustangQ; номер детали Pall XT140MSTGQP05) в условиях без связывания, то есть в растворе, содержащем 125 мМ NaCl и 50 мМ Трис-HCl при рН 8,5. ЗАГРУЗКА, обусловленная pH, достигается путем регулирования потока, содержащего AAV9, до диапазона pH от 7,4 до 7,8 с помощью 25% HCl.
[00235] Проводили следующую тестовую процедуру. Сначала колонку, содержащую матрицу сродства POROS™ CaptureSelect™ AAV9 (кат. № A27354; Thermo Fisher) ВД 32мм, с высотой слоя 59 мм и объемом 47,45мл уравновешивали, по меньшей мере, пятью объемами колонки 20 мМ Трис-HCl и 150 мМ NaCl при рН 7,4. рH-кондиционированную ЗАГРУЗКУ наносили на колонку, содержащую матрицу сродства POROS ™ CaptureSelect ™ AAV9 (кат. № A27354; Thermo Fisher). Затем колонку повторно уравновешивали пятью объемами колонки 20 мМ Трис-HCl и 150 мМ NaCl при рН 7,4 (необязательно, четвертый буфер).
[00236] Затем колонку промывали пятью объемами колонки Промывки 1 (W1): 100 мМ ацетат натрия и 0,1% Твин 80 при рН 6,0. Затем колонку промывали пятью объемами колонки Промывки 2 (W2): 50 мМ Трис-HCl и 125 мМ NaCl при рН 8,5. Затем колонку промывали пятью объемами колонки Промывки 3 (W3): 50 мМ Трис-HCl и 50% этиленгликоль при рН 8,5.
[00237] Элюирование осуществляется путем нанесения пяти объемов колонки следующего буфера для элюирования на колонку: 50 мМ Трис-HCl, 50% этиленгликоль и 750 мМ NaCl, при рН 8,0. Пять объемов колонки следующего вторичного буфера для элюирования затем применяли к колонке: 50 мМ Трис-HCl, 50% этиленгликоль и 2000 мМ NaCl.
[00238] Линейная скорость потока для вышеуказанных стадий составляла 60 см/ч.
[00239] Проводили следующую сравнительную процедуру. Колонку, содержащую матрицу сродства POROS™ CaptureSelect™ AAV9 (№ в каталоге A27354; Thermo Fisher), ВД 10 мм, с высотой слоя 2,5 мм и объемом 1,96 мл, уравновешивали по меньшей мере 10 объемами колонки 20 мМ Трис-HCl и 150 мМ NaCl при рН 7,4. рH-кондиционированную ЗАГРУЗКУ наносили на колонку, содержащую матрицу сродства POROS ™ CaptureSelect ™ AAV9 (кат. № A27354; Thermo Fisher). Затем колонку повторно уравновешивали 10 объемами колонки 20 мМ Трис-HCl и 150 мМ NaCl при рН 7,4.
[00240] Стадию промывки выполняли с использованием следующего буфера TBS: 20 мМ Трис-HCl/150 мМ NaCl/рН 7,4. Вместо этого проводили элюирование 10 объемами колонки 100 мМ цитрата натрия при рН 3,0.
[00241] Вышеупомянутая тестовая и сравнительная процедура описаны более подробно в Таблице 15, где «CV» указывает количество колоночных объемов раствора, добавленного на стадии.
Таблица 15:
50% этиленгликоль масс./масс. во всем буфере (масс./масс.)
[00242] Плотность буфера для элюирования измеряли на измерителе плотности с осцилирующей U-образной трубкой DMA 4500M (Anton Paar).
[00243] ИФА использовали для измерения количества антигена AAV9. ИФА проводили с набором для титрования AAV-9 ИФА ( № PRAAV9; Progen (Гейдельберг, Германия) на системе TECAN Roboter. Вкратце, моноклональное антитело, специфичное к конформационному эпитопу на собранных капсидах AAV9 (ADK9), наносят на полоски для микротитрования и используют для захвата частиц AAV9 из фракции AAV. Захваченные частицы AAV9 обнаруживали в две стадии. На первой стадии биотин-конъюгированное моноклональное антитело, специфичное к антителу ADK9, связывается с иммунным комплексом (антитела ADK9 и ADK9). Конъюгаты стрептавидинпероксидазы добавляли к иммунным комплексам, связанным с биотин-конъюгированным моноклональным антителом, и конъюгаты стрептавидинпероксидазы реагировали с биотином Добавляли раствор субстрата пероксидазы, и происходила цветная реакция, отклик в которой пропорционален количеству связанных частиц AAV. Цветная реакция измерялась фотометрически при 450 нм.
[00244] Анализ ITR-кПЦР используется для определения титра копии генома путем количественного определения инвертированных тандемных повторов, обнаруженных в векторе, кодирующем интересующий ген (например, человеческий фактор VIII или человеческий фактор IX). HEK-HCP представляет собой измерение уровня остаточного белка клетки-хозяина с помощью ИФА. LDH определяют колориметрическим анализом активности.
[00245] ИФА на выявление утечки лиганда AAV9 (иммуно-сорбентный анализ со связанным ферментом) может обнаружить 1 нг/мл аффинного лиганда AAV9, который может присутствовать в продукте, очищенном с помощью матрицы сродства POROS ™ CaptureSelect ™ AAV9, которая содержит аффинный лиганд AAV9 в качестве захватывающего агента. ИФА на выявление утечки лиганда AAV9 можно использовать в качестве инструмента, помогающего оптимизировать способ очистки и осуществлять регулярный контроль качества как потоков внутри способа, так и конечного продукта. Величина «ИФА на выявление утечки лиганда/ AAV9 - Антиген» отражает соотношение «ИФА с утечкой лиганда» к «антигену AAV9», рассчитанное как нанограммы лиганда на микрограмм AAV9.
[00246] В анализе биопотентности in vitro вирусный вектор AAV9 заражает печеночную клеточную линию-мишень, которая впоследствии секретирует функциональный, измеряемый кодируемый белок в среду. На первой стадии клетки-мишени HepG2 трансдуцируют инфицированием AAV9. Во время инкубации кодированный белок высвобождается в клеточный супернатант. На второй стадии активность кодированного белка в супернатанте клеточной культуры непосредственно измеряется с помощью анализа активности. Измерение образца AAV9 приведено в процентах по отношению к эталонному материалу. Способ позволяет количественно оценить биологическую функцию вектора генной терапии AAV9.
[00247] Анализ SDS-PAGE проводили для определения того, произошло ли снижение уровня белка теплового шока 70 кДа (HSP70) при использовании тестовой процедуры со стадиями промывки вместо сравнительной процедуры. Вестерн-блоттинг проводили с использованием антитела против Hsp70 (Abcam, кат. № ab79852) в качестве первичного антитела при разведении 1:2000 в течение двух часов и конъюгата козий анти-кроличий IgG (H+L) AP в качестве вторичного антитела (Sigma, кат. № A8025) в разведении 1:1000 в течение одного часа.
[00248] Анализ SDS-PAGE на окрашивание серебром проводили для определения общего уровня присутствующих примесей.
[00249] Вестерн-блот с 12% антител против AAV проводили для определения уровней и чистоты AAV9, выделенного после очистки, в соответствии с тестовой и сравнительной процедурами. Вестерн-блоттинг проводили с моноклональными антителами к VP1, VP2 и VP3 AAV9 в качестве первичных антител, с козьим антимышиным ALP-антителом (Sigma, кат. № A4656) в качестве вторичного антитела.
[00250] ЖХ-МС выполняли (rp-ВЭЖХ-УФ-ЭСИ-МС/МС) для определения идентичности и количества различных примесей клетки-хозяина. Образцы переваривали с использованием фермента трипсина. Полученную смесь пептидов разделяли в системе ВЭЖХ, используя колонку RP (колонка ZORBAX 300SB-C18, 0,5×150 мм, 3,5 мкм), и затем пептиды анализировали на масс-спектрометре Q-Exactive HF. Данные анализировали с использованием программного обеспечения Proteome Discoverer для идентификации белков в образце.
[00251] Agilent HPLC1209 (1200 capHPLC) использовали с ChemStation для систем ЖХ 3D (Rev. B.04.03-SP2 (105)). Метод ВЭЖХ - PEPMAP_CAP_170.M. Элюент А представляет собой 0,1% (об./об.) HCOOH в деионизированной воде, а элюент B представляет собой 0,08% (об./об.) HCOOH в ацетонитриле. Подробная информация о ВЭЖХ представлена в следующей Таблице 16:
Таблица 16:
[00252] Подробная информация о МС приведена в следующей Таблице 17:
Таблица 17:
[00253] Проводили три различных режима очистки. Один включал сравнительную процедуру этого примера, другой включал тестовую процедуру испытания этого примера (которая включает в себя анионообменную очистку MustangQ перед аффинной очисткой), а третий проводили в соответствии с тестовой процедурой, но без анионообменной очистки MustangQ.
ПРИМЕР 5
[00254] Продукцию AAV9 разрабатывали в клеточной линии HEK293 после трансфекции тройной плазмидной системой, содержащей кодирующую кДНК представляющего интерес белка и AAV9-. VP1. -VP2 и -VP3. Осветленный супернатант бесклеточной культуры концентрировали и диафильтровали с помощью кассеты Pall Omega T-Series 100 кДа. Вирусные частицы загружали на мембранный адсорбер (MustangQ. номер детали Pall XT140MSTGQP05) в условиях без связывания. Полученный поток, содержащий AAV9, не доводили до рН в диапазоне от 7,4 до 7,8 с помощью 25% HCl. Вместо этого ЗАГРУЗКА образовали путем восстановления потока, содержащего AAV-8, в загрузочном буфере, содержащем 125 мМ NaCl и 50 мМ Трис-HCl при рН 8,5.
[00255] Помимо преимущества, заключающегося в том, что нет необходимости включать стадию регулирования рН, наличие рН 8,5 может обеспечить улучшенную устойчивость к сродству и предотвращать неспецифическое связывание примесей с продуктом или смолой.
[00256] Образцы с различных стадий промывки и элюирования отбирали в различных точках, чтобы определить, сколько AAV9 присутствует в образце. Анализы показывали, сколько AAV9 теряется на различных стадиях промывки. Проводили следующую тестовую процедуру. Сначала колонку, содержащую матрицу сродства POROS™ CaptureSelect™ AAV9 (кат. № A27354; Thermo Fisher) ВД 10 мм, с высотой слоя 25 мм и объемом 1,96 мл уравновешивали, по меньшей мере, пятью объемами колонки 20 мМ Трис-HCl и 150 мМ NaCl при рН 7,4. ЗАГРУЗКУ наносили на колонку, содержащую матрицу сродства POROS ™ CaptureSelect ™ AAV9 (кат. A27354; Thermo Fisher). Часть образца, загруженного в колонку, сохраняли и затем анализировали с помощью ITR кПЦР, ИФА против антигенов AAV и ИФА против антигенов HЕК293 HCP. Затем колонку повторно уравновешивали 10 объемами колонки 20 мМ Трис-HCl и 150 мМ NaCl при рН 7,4. Образец проходящего потока сохраняли и затем анализировали с помощью ITR кПЦР, ИФА против антигенов AAV и ИФА против антигенов HEK293 HCP.
[00257] Затем колонку промывали 10 объемами колонки Промывки 1 (W1): 100 мМ ацетат натрия и 0,1% Твин 80 при рН 6,0. Затем колонку промывали 10 объемами колонки Промывки 2 (W2): 50 мМ Трис-HCl и 125 мМ NaCl при рН 8,5. Затем колонку промывали 10 объемами колонки Промывки 3 (W3): 50 мМ Трис-HCl и 50% этиленгликоль при рН 8,5. Образец из элюата каждого из W1, W2 и W3 отбирали и анализировали в соответствии с ITR кПЦР, ИФА против антигенов AAV и ИФА против антигенов HEK293 HCP.
[00258] Элюирование осуществляли путем нанесения 10 объемов колонки следующего буфера для элюирования на колонку: 50 мМ Трис-HCl, 50% этиленгликоль и 750 мМ NaCl, при рН 8,0.
[00259] Вышеуказанная тестовая процедура более подробно описана в Таблице 18.
Таблица 18:
[00260] Отобранные образцы анализировали с помощью каждого из ITR кПЦР, ИФА против антигенов AAV и ИФА против HEK293 HCP, чтобы оценить выход и возможные потери на стадиях.
[00261] Вышеприведенные образцы также анализировали с помощью SDS-PAGE и 12% окрашивания серебром для выявления уровня общего белка.
[00262] Затем образцы анализировали с помощью SDS-PAGE и вестерн-блоттинга против антигенов AAV9. Первичные антитела представляли собой моноклональные антитела против VP1, VP2 и VP3 AAV9, тогда как вторичные антитела представляли собой козье антимышиное антитело, связанное с фосфатазой.
ПРИМЕР 6
[00263] Продукцию AAV9 разрабатывали в клеточной линии HEK293 после трансфекции тройной плазмидной системой, содержащей кодирующую кДНК представляющего интерес белка и AAV9-. VP1. -VP2 и -VP3. Осветленный супернатант бесклеточной культуры концентрировали и диафильтровали с помощью кассеты Pall Omega T-Series 100 кДа. Вирусные частицы загружали на мембранный адсорбер (MustangQ; номер детали Pall XT140MSTGQP05) в условиях без связывания, то есть в растворе, содержащем 125 мМ NaCl и 50 мМ Трис-HCl при рН 8,5. ЗАГРУЗКА, обусловленная pH, достигается путем регулирования потока, содержащего AAV9, до диапазона pH от 7,4 до 7,8 с помощью 25% HCl.
[00264] Проводили следующую тестовую процедуру. Сначала колонку, содержащую антиинтактное антитело AAV8/9 (кат.№ 03-651161, American Research Products, Inc., Уолтем, Массачусетс), иммобилизованное на смоле («аффинная смола ADK8/9») ВД 32 мм, высотой слоя 59 мм и объемом 47,45 мл уравновешивали по меньшей мере пятью колоночными объемами 20 мМ Трис-HCl и 150 мМ NaCl при рН 7,4. рН обусловленную ЗАГРУЗКУ наносили на колонку, содержащую аффинную смолу ADK8/9. Затем колонку повторно уравновешивали пятью объемами колонки 20 мМ Трис-HCl и 150 мМ NaCl при рН 7,4 (необязательно, четвертый буфер).
[00265] Затем колонку промывали пятью объемами колонки Промывки 1 (W1): 100 мМ ацетат натрия и 0,1% Твин 80 при рН 6,0. Затем колонку промывали пятью объемами колонки Промывки 2 (W2): 50 мМ Трис-HCl и 125 мМ NaCl при рН 8,5. Затем колонку промывали пятью объемами колонки Промывки 3 (W3): 50 мМ Трис-HCl и 50% этиленгликоль при рН 8,5.
[00266] Элюирование осуществляется путем нанесения пяти объемов колонки следующего буфера для элюирования на колонку: 50 мМ Трис-HCl, 50% этиленгликоль и 750 мМ NaCl, при рН 8,0. Пять объемов колонки следующего вторичного буфера для элюирования затем применяли к колонке: 50 мМ Трис-HCl, 50% этиленгликоль и 2000 мМ NaCl.
[00267] Линейная скорость потока для вышеуказанных стадий составляла 60 см/ч.
[00268] Проводили следующую сравнительную процедуру. Колонку, содержащую аффинную смолу ADK8/9, ВД 10 мм, с высотой слоя 2,5 мм и объемом 1,96 мл, уравновешивали по меньшей мере 10 объемами колонки 20 мМ Трис-HCl и 150 мМ NaCl при рН 7,4. рН обусловленную ЗАГРУЗКУ наносили на колонку, содержащую аффинную смолу ADK8/9. Затем колонку повторно уравновешивали 10 объемами колонки 20 мМ Трис-HCl и 150 мМ NaCl при рН 7,4.
[00269] Стадию промывки выполняли с использованием следующего буфера TBS: 20 мМ Трис-HCl/150 мМ NaCl/рН 7,4. Вместо этого проводили элюирование 10 объемами колонки 100 мМ цитрата натрия при рН 3,0.
[00270] Вышеупомянутая тестовая и сравнительная процедура описаны более подробно в Таблице 1, где «CV» указывает количество колоночных объемов раствора, добавленного на стадии.
[00271] Плотность буфера для элюирования измеряли на измерителе плотности с осцилирующей U-образной трубкой DMA 4500M (Anton Paar).
[00272] ИФА использовали для измерения количества антигена AAV9. ИФА проводили с набором для титрования AAV-9 ИФА ( № PRAAV9; Progen (Гейдельберг, Германия) на системе TECAN Roboter. Вкратце, моноклональное антитело, специфичное для капсидов AAV9 (антитело AAV8/9 («антитело ADK8/9», кат. 03-651161, American Research Products, Inc., Уолтам, Массачусетс) наносили на полоски для микротитрования и использовали для захвата частиц AAV9 из фракции AAV. Захваченные частицы AAV9 обнаруживали в две стадии. На первой стадии биотин-конъюгированное моноклональное антитело, специфичное к антителу ADK8/9, связывается с иммунным комплексом (антитела ADK8/9 и ADK8/9). Конъюгаты стрептавидинпероксидазы добавляли к иммунным комплексам, связанным с биотин-конъюгированным моноклональным антителом, и конъюгаты стрептавидинпероксидазы реагировали с биотином Добавляли раствор субстрата пероксидазы, и происходила цветная реакция, отклик в которой пропорционален количеству связанных частиц AAV. Цветная реакция измерялась фотометрически при 450 нм.
[00273] Анализ ITR-кПЦР используется для определения титра копии генома путем количественного определения инвертированных тандемных повторов, обнаруженных в векторе, кодирующем интересующий ген (например, человеческий фактор VIII или человеческий фактор IX). HEK-HCP представляет собой измерение уровня остаточного белка клетки-хозяина с помощью ИФА. LDH определяют колориметрическим анализом активности.
[00274] ИФА на выявление утечки лиганда AAV8/9 (иммуно-сорбентный анализ со связанным ферментом) может обнаружить аффинный лиганд, который может присутствовать в продукте, очищенном с помощью аффинной смолы ADK8/9.
[00275] В анализе биопотентности in vitro вирусный вектор AAV9 заражает печеночную клеточную линию-мишень, которая впоследствии секретирует функциональный, измеряемый кодируемый белок в среду. На первой стадии клетки-мишени HepG2 трансдуцируют инфицированием AAV9. Во время инкубации кодированный белок высвобождается в клеточный супернатант. На второй стадии активность кодированного белка в супернатанте клеточной культуры непосредственно измеряется анализом активности. Измерение образца AAV9 приведено в процентах по отношению к эталонному материалу. Способ позволяет количественно оценить биологическую функцию вектора генной терапии AAV9.
[00276] Анализ SDS-PAGE проводили для определения того, произошло ли снижение уровня белка теплового шока 70 кДа (HSP70) при использовании тестовой процедуры со стадиями промывки вместо сравнительной процедуры. Вестерн-блоттинг проводили с использованием антитела против Hsp70 (Abcam, кат. № ab79852) в качестве первичного антитела при разведении 1:2000 в течение двух часов и конъюгата козий анти-кроличий IgG (H+L) AP в качестве вторичного антитела (Sigma, кат. № A8025) в разведении 1:1000 в течение одного часа.
[00277] Анализ SDS-PAGE на окрашивание серебром проводили для определения общего уровня присутствующих примесей.
[00278] Вестерн-блот с 12% антител против AAV проводили для определения уровней и чистоты AAV9, выделенного после очистки, в соответствии с тестовой и сравнительной процедурами. Вестерн-блоттинг проводили с моноклональными антителами к VP1, VP2 и VP3 AAV9 в качестве первичных антител, с козьим антимышиным ALP-антителом (Sigma, кат. № A4656) в качестве вторичного антитела.
[00279] ЖХ-МС выполняли (rp-ВЭЖХ-УФ-ЭСИ-МС/МС) для определения идентичности и количества различных примесей клетки-хозяина. Образцы переваривали с использованием фермента трипсина. Полученную смесь пептидов разделяли в системе ВЭЖХ, используя колонку RP (колонка ZORBAX 300SB-C18, 0,5×150 мм, 3,5 мкм), и затем пептиды анализировали на масс-спектрометре Q-Exactive HF. Данные анализировали с использованием программного обеспечения Proteome Discoverer для идентификации белков в образце.
[00280] Agilent HPLC1209 (1200 capHPLC) использовали с ChemStation для систем ЖХ 3D (Rev. B.04.03-SP2 (105)). Метод ВЭЖХ - PEPMAP_CAP_170.M. Элюент А представляет собой 0,1% (об./об.) HCOOH в деионизированной воде, а элюент B представляет собой 0,08% (об./об.) HCOOH в ацетонитриле. Подробная информация о ВЭЖХ представлена в следующей Таблице 19:
Таблица 19:
[00281] Подробная информация о МС приведена в следующей Таблице 20:
Таблица 20:
[00282] Проводили три различных режима очистки. Один включал сравнительную процедуру этого примера, другой включал тестовую процедуру испытания этого примера (которая включает в себя анионообменную очистку MustangQ перед аффинной очисткой), а третий проводили в соответствии с тестовой процедурой, но без анионообменной очистки MustangQ.
ПРИМЕР 7
[00283] Продукцию AAV9 разрабатывали в клеточной линии HEK293 после трансфекции тройной плазмидной системой, содержащей кодирующую кДНК представляющего интерес белка и AAV9-. VP1. -VP2 и -VP3. Осветленный супернатант бесклеточной культуры концентрировали и диафильтровали с помощью кассеты Pall Omega T-Series 100 кДа. Вирусные частицы загружали на мембранный адсорбер (MustangQ. номер детали Pall XT140MSTGQP05) в условиях без связывания. Полученный поток, содержащий AAV9, не доводили до рН в диапазоне от 7,4 до 7,8 с помощью 25% HCl. Вместо этого ЗАГРУЗКА образовалась путем восстановления потока, содержащего AAV9, в загрузочном буфере, содержащем 125 мМ NaCl и 50 мМ Трис-HCl при рН 8,5.
[00284] Помимо преимущества, заключающегося в том, что нет необходимости включать стадию регулирования рН, наличие рН 8,5 может обеспечить улучшенную устойчивость к сродству и предотвращать неспецифическое связывание примесей с продуктом или смолой.
[00285] Образцы с различных стадий промывки и элюирования отбирали в различных точках, чтобы определить, сколько AAV9 присутствует в образце. Анализы показывали, сколько AAV9 теряется на различных стадиях промывки. Проводили следующую тестовую процедуру. Сначала колонку, содержащую аффинную смолу ADK8/9 ВД 10 мм, с высотой слоя 25 мм и объемом 1,96 мл уравновешивали, по меньшей мере, пятью объемами колонки 20 мМ Трис-HCl и 150 мМ NaCl при рН 7,4. ЗАГРУЗКУ наносили на колонку, содержащую аффинную смолу ADK8/9. Часть образца, загруженного в колонку, сохраняли и затем анализировали с помощью ITR кПЦР, ИФА против антигенов AAV и ИФА против антигенов HЕК293 HCP. Затем колонку повторно уравновешивали 10 объемами колонки 20 мМ Трис-HCl и 150 мМ NaCl при рН 7,4. Образец проходящего потока сохраняли и затем анализировали с помощью ITR кПЦР, ИФА против антигенов AAV и ИФА против антигенов HEK293 HCP.
[00286] Затем колонку промывали 10 объемами колонки Промывки 1 (W1): 100 мМ ацетат натрия и 0,1% Твин 80 при рН 6,0. Затем колонку промывали 10 объемами колонки Промывки 2 (W2): 50 мМ Трис-HCl и 125 мМ NaCl при рН 8,5. Затем колонку промывали 10 объемами колонки Промывки 3 (W3): 50 мМ Трис-HCl и 50% этиленгликоль при рН 8,5. Образец из элюата каждого из W1, W2 и W3 отбирали и анализировали в соответствии с ITR кПЦР, ИФА против антигенов AAV и ИФА против антигенов HEK293 HCP.
[00287] Элюирование осуществляли путем нанесения 10 объемов колонки следующего буфера для элюирования на колонку: 50 мМ Трис-HCl, 50% этиленгликоль и 750 мМ NaCl, при рН 8,0.
[00288] Вышеуказанная тестовая процедура более подробно описана в Таблице 21.
Таблица 21:
[00289] Отобранные образцы анализировали с помощью каждого из ITR кПЦР, ИФА против антигенов AAV и ИФА против HEK293 HCP, чтобы оценить выход и возможные потери на стадиях.
[00290] Вышеприведенные образцы также анализировали с помощью SDS-PAGE и 12% окрашивания серебром для выявления уровня общего белка.
[00291] Затем образцы анализировали с помощью SDS-PAGE и вестерн-блоттинга против антигенов AAV9. Первичные антитела представляли собой моноклональные антитела против VP1, VP2 и VP3 AAV9, тогда как вторичные антитела представляли собой козье антимышиное антитело, связанное с фосфатазой.
ПРИМЕР 8
[00292] AAV8 ИФА проводили с набором ИФА для титрования AAV-8 ( № PRAAV8; Progen (Гейдельберг, Германия) на системе TECAN Roboter. Моноклональное антитело, специфичное к конформационному эпитопу на собранных капсидах AAV8 (ADK8), наносили на полоски для микротитрования и использовали для захвата частиц AAV8 из фракции AAV. Захват частиц AAV8 детектировали в две стадии. На первой стадии биотин-конъюгированное моноклональное антитело, специфичное к антителу ADK8, связывалось с иммунным комплексом. Конъюгаты стрептавидинпероксидазы добавляли к иммунным комплексам, связанным с биотин-конъюгированным моноклональным антителом, и конъюгаты стрептавидинпероксидазы реагировали с биотином. Добавляли раствор субстрата пероксидазы, и происходила цветная реакция, которая пропорциональна количеству связанных частиц AAV. Цветную реакцию измеряли фотометрически при 450 нм.
ПРИМЕР 9
[00293] Для анализов ITR-кПЦР, проведенных в примерах, была предпринята следующая процедура. Титр векторного генома (vg) на миллилитр (мл) определяли с использованием кПЦР на основе TaqMan с праймерами и флуоресцентно меченым зондом, детектирующим последовательность в последовательностях ITR векторного генома. Для обнаружения ITR-специфической последовательности в частице AAV образцы подвергались различным обработкам. Образцы обрабатывали ДНКазой I, а затем протеиназой К, так что геном scAAV высвобождался из капсида. Затем проводили расщепление рестрикционным ферментом с целью разрешения Т-образных структур AAV ITR.
[00294] Плазмиду, используемую в качестве эталонного материала, линеаризовали рестриктазой с одним расщеплением и затем очищали от геля агарозы. Поглощение УФ А260 гель-экстрагированной ДНК измеряли трижды на УФ-спектрофотометре, при этом среднее значение концентрации ДНК рассчитывали в мкг на мл.
[00295] Чтобы определить число копий на мл для линеаризованной стандартной плазмиды, молекулярный вес дцДНК рассчитывали в граммах на моль с учетом точной массы для каждого отдельного нуклеотида основной последовательности.
[00296] Титр векторного генома в исследуемом изделии (в векторных геномах на мл) рассчитывали с помощью подбора стандартной кривой плазмиды с линейной регрессией.
ПРИМЕР 10
[00297] Продукцию AAV8 разрабатывали в клеточной линии HEK293 после трансфекции тройной плазмидной системой, содержащей кодирующую кДНК представляющего интерес белка и AAV8-. VP1. -VP2 и -VP3. Осветленный супернатант бесклеточной культуры концентрировали и подвергали диафильтации с помощью кассеты Pall Omega T-Series 300 кДа. Вирусные частицы были загружены на мембранный адсорбер (MustangQ. номер детали Pall XT140MSTGQP05) в условиях без связывания для AAV8. Полученный поток, содержащий AAV8, разбавляли буфером для разведения, содержащим 100 мМ аргинина, 200 мМ NaCl при pH 8,0, для приготовления загрузки для матрицы сродства AAV8. Аргининсодержащую загрузку наносили на колонку, содержащую матрицу сродства POROSTM CaptureSelectTM AAV8 (Thermo Fisher, кат. №. A30793).
[00298] Образцы с различных стадий промывки и элюирования отбирали в различных точках, чтобы определить, сколько AAV8 присутствует в образце. Анализы показывают, сколько AAV8 было потеряно в различных стадиях промывки. Была проведена следующая тестовая процедура. Сначала колонку, содержащую аффинную смолу ADK8/9 ВД 10 мм, с высотой слоя 25 мм и объемом 2,04 мл уравновешивали, по меньшей мере, десятью объемами колонки 20 мМ Трис-HCl и 125 мМ NaCl при рН 8,5. Загрузку наносили на колонку, содержащую аффинную смолу ADK8/9. Часть образца, загруженного в колонку, была сохранена и затем проанализирована с помощью ITR кПЦР, ИФА против антигенов AAV и ИФА против антигенов HЕК293 HCP. Затем колонку повторно уравновешивали (Промывка 1, W1) 10 объемами колонки 50 мМ Трис-HCl и 125 мМ NaCl при рН 8,5. Образец проходящего потока сохраняли и затем анализировали с помощью ITR кПЦР, ИФА против антигенов AAV и ИФА против антигенов HЕК293 HCP.
[00299] Затем колонку промывали 10 объемами колонки Промывка 2 (W2): 100 мМ ацетата натрия и 0,1% Твин80 при рН 6,0. Затем колонку промывали 10 объемами колонки Промывка 3 (W3): 50 мМ Трис-HCl и 125 мМ NaCl при рН 8,5. Затем колонку промывают 10 объемами колонки Промывка 4 (W4): 50 мМ Трис-HCl и 50% этиленгликоля при рН 8,5. Пробу из элюата каждого из W2, W3 и W4 отбирали и анализировали в соответствии с ITR кПЦР, ИФА против антигенов AAV и ИФА против антигенов HЕК293 HCP.
[00300] Элюирование осуществляли путем введения 10 объемов колонки следующего буфера для элюирования на колонку: 50 мМ Трис-HCl, 60% (масс./масс.) этиленгликоль и 750 мМ NaCl, при рН 8,0. Стадию промывки впоследствии не выполняли. Элюирование осуществляли путем введения 10 объемов колонки следующего буфера для элюирования на колонку: 50 мМ Трис-HCl, 60% (масс./масс.) этиленгликоль и 1000 мМ NaCl, при рН 8,0. Затем колонку промывали 20 мМ Трис-HCl при рН 7,4. Затем колонку регенерировали путем нанесения на колонку 10 объемов колонки раствора, содержащего 100 мМ глицина и 200 мМ NaCl, при рН 2,5.
[00301] Вышеуказанная тестовая процедура более подробно описана в Таблице 22.
Таблица 22:
ПРИМЕР 11
[00302] Продукцию AAV8 разрабатывали в клеточной линии HEK293 после трансфекции тройной плазмидной системой, содержащей кодирующую кДНК представляющего интерес белка и AAV8-. VP1. -VP2 и -VP3. Из собранной аликвоты 30 л клетки были разрушены с помощью Megatron MT3000 (Pall) с последующей фильтрацией раствора, содержащего AAV8 через: а) глубинный фильтр PDP8, площадь 0,5м2, b) глубинный фильтр V100, площадь: 0,5м2 и c) Kleenpak Capsule 0,2 мкм, площадь 0,15м2. Осветленный супернатант бесклеточной культуры концентрировали и подвергали диафильтации с помощью кассеты Pall Omega T-Series 300 кДа. Вирусные частицы были загружены на мембранный адсорбер (MustangQ. номер детали Pall XT140MSTGQP05) в условиях без связывания для AAV8. Полученный поток, содержащий AAV8, разбавляли 1:2 буфером для разведения, содержащим 100 мМ аргинина, 200 мМ NaCl при pH 8,0, для приготовления загрузки для матрицы сродства AAV8. Аргининсодержащую загрузку наносили на колонку, содержащую матрицу сродства POROSTM CaptureSelectTM AAV8 (Thermo Fisher, кат. № A30793; ВД 10 мм, высота слоя 26 мм, объем 2,04 мл).
[00303] Образцы с различных стадий промывки и элюирования отбирали в различных точках, чтобы определить, сколько AAV8 присутствует в образце. Анализы показывают, сколько AAV8 было потеряно в различных стадиях промывки. Была проведена следующая тестовая процедура. Сначала колонку, содержащую аффинную смолу ADK8/9 ВД 10 мм, с высотой слоя 25 мм и объемом 2,04 мл уравновешивали по меньшей мере десятью объемами колонки 50 мМ Аргинин-HCl и 100 мМ NaCl при рН 8,0. Загрузку наносили на колонку, содержащую аффинную смолу ADK8/9. Часть образца, загруженного в колонку, была сохранена и затем проанализирована с помощью ITR кПЦР, ИФА против антигенов AAV и ИФА против антигенов HЕК293 HCP. Затем колонку повторно уравновешивали (Промывка 1, W1) 10 объемами колонки 50 мМ Аргинин-HCl и 100 мМ NaCl при рН 8,0. Образец проходящего потока сохраняли и затем анализировали с помощью ITR кПЦР, ИФА против антигенов AAV и ИФА против антигенов HЕК293 HCP.
[00304] Колонку затем промывали 10 объемами колонки Промывки 2 (W2):100 мМ MES-натрия, 10 мМ ЭДТА и 11,2 г/кг S/D II раствора (18,0 г Твин 80, 3,4 г ДМСО и 3,6 г TnBP) при pH 6,0. Затем колонку промывали 10 объемами колонки Промывки 3 (W3): 50 мМ Трис-HCl и 100 мМ NaCl при рН 8,0. Затем колонку промывали 10 объемами колонки Промывки 4 (W4): 50 мМ Трис-HCl и 50% сахарозы при рН 8,5. Пробу из элюата каждого из W2, W3 и W4 отбирали и анализировали в соответствии с ITR кПЦР, ИФА против антигенов AAV и ИФА против антигенов HЕК293 HCP.
[00305] Элюирование осуществляли путем введения 10 объемов колонки следующего буфера для элюирования на колонку: 50 мM Аргинин-HCl, 55% (масс./масс.) сахарозы, 2 мМ MgCl2 и 800 мМ NaCl при рН 8,0. Затем колонку промывали 10 объемами колонки Промывки 5 (W5): 50 мМ Аргинин-HCl и 100 мМ NaCl при рН 8,0. Элюирование осуществляли путем введения 10 объемов колонки следующего буфера для элюирования на колонку: 50 мМ Аргинин-HCl, 50% (об./об.) глицерин и 800 мМ NaCl при рН 8,0. Затем колонку промывали 50 мМ Аргинин-HCl и 100 мМ NaCl при рН 8,0. Затем колонку регенерировали путем нанесения на колонку 10 объемов колонки раствора, содержащего 100 мМ глицина и 200 мМ NaCl, при рН 2,7.
[00306] Вышеуказанная тестовая процедура более подробно описана в Таблице 23. На всех стадиях применялась линейная скорость потока 39 см/ч.
Таблица 23:
[00307] На приведенной выше стадии загрузки было сделано разведение 1:2 в колонке Mustang Q, чтобы скорректировать загрузку до условий, близких к матрице уравновешивающего буфера. Эта стадия была сделана, чтобы исследовать влияние буферных веществ с точки зрения связывания AAV8 с лигандом. Любое новое введенное соединение может иметь потенциальные конкурентные свойства и/или потенциально может вызывать элюирование.
[00308] Отобранные образцы анализировали с помощью каждого из ITR кПЦР, ИФА против антигенов AAV и ИФА против HEK293 НСР, чтобы оценить выход и возможные потери на стадиях. Хроматограмма, связанная с приведенным выше примером, показана на Фиг. 7. В следующей Таблице 24 показаны образцы, взятые на каждой из вышеуказанных стадий, а выход каждого компонента показан в Таблице 25.
Таблица 24:
[00309] Стадия «Промывка 5» уменьшила фронтальные эффекты при элюировании.
Таблица 25:
[00310] Вышеуказанные образцы также анализировали с помощью SDS-PAGE и 12% окрашивания серебром для выявления общего количества белка. Результаты анализа SDS-PAGE показаны на Фиг. 8.
ПРИМЕР 12
[00311] Продукцию AAV8 разрабатывали в клеточной линии HEK293 после трансфекции тройной плазмидной системой, содержащей кодирующую кДНК представляющего интерес белка и AAV8-. VP1. -VP2 и -VP3. Из собранной аликвоты 30 л клетки были разрушены с помощью Megatron MT3000 (Pall) с последующей фильтрацией раствора, содержащего AAV8 через: а) глубинный фильтр PDP8, площадь 0,5м2, b) глубинный фильтр V100, площадь: 0,5м2 и c) Kleenpak Capsule 0,2 мкм, площадь 0,15м2. Осветленный супернатант бесклеточной культуры концентрировали и подвергали диафильтации с помощью кассеты Pall Omega T-Series 300 кДа. Вирусные частицы были загружены на мембранный адсорбер (MustangQ. номер детали Pall XT140MSTGQP05) в условиях без связывания для AAV8. Загрузка была введена на колонку, содержащую матрицу сродства AAV8 POROSTM CaptureSelectTM (Thermo Fisher, кат. № A30793; ВД 10 мм, высота слоя 26 мм, объем 2,04 мл).
[00312] Образцы с различных стадий промывки и элюирования отбирали в различных точках, чтобы определить, сколько AAV8 присутствует в образце. Анализы показывают, сколько AAV8 было потеряно в различных стадиях промывки. Была проведена следующая тестовая процедура. Сначала колонку, содержащую аффинную смолу ADK8/9 ВД 10 мм, с высотой слоя 25 мм и объемом 2,04 мл уравновешивали, по меньшей мере, десятью объемами колонки 50 мМ Трис-HCl и 125 мМ NaCl при рН 8,5. Загрузку наносили на колонку, содержащую аффинную смолу ADK8/9. Часть образца, загруженного в колонку, была сохранена и затем проанализирована с помощью ITR кПЦР, ИФА против антигенов AAV и ИФА против антигенов HЕК293 HCP. Затем колонку повторно уравновешивали (Промывка 1, W1) 10 объемами колонки 50 мМ Трис-HCl и 125 мМ NaCl при рН 8,5. Образец проходящего потока сохраняли и затем анализировали с помощью ITR кПЦР, ИФА против антигенов AAV и ИФА против антигенов HЕК293 HCP.
[00313] Затем колонку промывали 10 объемами колонки Промывки 2 (W2): 100 мМ Таурин, 125 мМ NaCl, при рН 8,5. Затем колонку промывали 10 объемами колонки Промывки 3 (W3): 100 мМ глицин при рН 8,5. Затем колонку промывали 10 объемами колонки Промывки 4 (W4): 50 мМ таурина, 50% (масс./масс.) этиленгликоль, 0,1% октилгликопиранозид, при рН 8,5. Пробу из элюата каждого из W2, W3 и W4 отбирали и анализировали в соответствии с ITR кПЦР, ИФА против антигенов AAV и ИФА против антигенов HЕК293 HCP.
[00314] Элюирование осуществляли путем введения 10 объемов колонки следующего буфера для элюирования на колонку: 50 мМ таурин, 60% (масс./масс.) этиленгликоль, 750 мМ NaCl, 0,1% октилгликопиранозид при рН 8,0. Затем колонку промывали 10 объемами колонки Промывки 5 (W5): 50 мМ Трис-HCl и 125 мМ NaCl при рН 8,5. Элюирование осуществляли путем введения 10 объемов колонки следующего буфера для элюирования на колонку: 1 M (NH4)2SO4, 50 мМ Трис-HCl, 50% (об./об.) этиленгликоля при рН 7,0. Затем колонку промывали 50 мМ Трис-HCl и 125 мМ NaCl при рН 8,5. Затем колонку регенерировали путем нанесения на колонку 10 объемов колонки раствора, содержащего 100 мМ глицина и 200 мМ NaCl, при рН 2,7.
[00315] Вышеуказанная тестовая процедура более подробно описана в Таблице 26. На всех стадиях применялась линейная скорость потока 39 см/ч.
Таблица 26:
[00316] Отобранные образцы анализировали с помощью каждого из ITR кПЦP и ИФА (как описано в Примере 8 выше) против антигенов AAV и ИФА против HEK293 HCP, чтобы оценить выход и могли ли потери происходить на стадиях. Хроматограмма, связанная с приведенным выше примером, показана на Фиг. 9. В следующей Таблице 27 показаны образцы, взятые на каждой из вышеуказанных стадий, а выход каждого компонента показан в Таблице 28.
Таблица 27:
[00317] Стадия «Промывка 5» уменьшила фронтальные эффекты при элюировании.
Таблица 28:
[00318] Вышеуказанные образцы также анализировали с помощью SDS-PAGE и 12% окрашивания серебром для выявления общего количества белка. Результаты анализа SDS-PAGE показаны на Фиг. 10.
ПРИМЕР 13
[00319] Продукцию AAV8 разрабатывали в клеточной линии HEK293 после трансфекции тройной плазмидной системой, содержащей кодирующую кДНК представляющего интерес белка и AAV8-. VP1. -VP2 и -VP3. Из собранной аликвоты 30 л клетки были разрушены с помощью Megatron MT3000 (Pall) с последующей фильтрацией раствора, содержащего AAV8 через: а) глубинный фильтр PDP8, площадь 0,5м2, b) глубинный фильтр V100, площадь: 0,5м2 и c) Kleenpak Capsule 0,2 мкм, площадь 0,15м2. Осветленный супернатант бесклеточной культуры концентрировали и подвергали диафильтации с помощью кассеты Pall Omega T-Series 300 кДа. Вирусные частицы были загружены на мембранный адсорбер (MustangQ. номер детали Pall XT140MSTGQP05) в условиях без связывания для AAV8. Полученный поток, содержащий AAV8, разбавляли 1:2 буфером для разведения [100 мМ гистидин, 200 мМ NaCl, pH 8,5], дополнительно 4 г полисорбата 80 /кг добавляли для приготовления загрузки на аффинную смолу AAV8. Гистидинсодержащую загрузку наносили на колонку, содержащую матрицу сродства POROS™ CaptureSelect™ AAV8 (кат. № A30793, Thermo Fisher; ВД 10 мм, высота слоя 26 мм, объем 2,04 мл).
[00320] Образцы с различных стадий промывки и элюирования отбирали в различных точках, чтобы определить, сколько AAV8 присутствует в образце. Анализы показывают, сколько AAV8 было потеряно в различных стадиях промывки. Была проведена следующая тестовая процедура. Сначала колонку, содержащую аффинную смолу ADK8/9 ВД 10 мм, с высотой слоя 26 мм и объемом 2,04 мл уравновешивали, по меньшей мере, десятью объемами колонки 50 мМ Трис-HCl и 125 мМ NaCl при рН 8,5. Загрузку наносили на колонку, содержащую аффинную смолу ADK8/9. Часть образца, загруженного в колонку, была сохранена и затем проанализирована с помощью ITR кПЦР и ИФА против антигенов AAV (как описано в Примере 9 выше) и ИФА против антигенов HEK293 HCP (как описано в Примере 8 выше). Затем колонку повторно уравновешивали (Промывка 1, W1) 10 объемами колонки 50 мМ гистидина и 100 мМ NaCl при рН 8,5. Образец проходящего потока сохраняли и затем анализировали с помощью ITR кПЦР и ИФА (как описано в Примерах 8 и 9 выше) против антигенов AAV и ИФА против антигенов HEK293 HCP.
[00321] Колонку промывали 10 объемами колонки Промывка 2 (W2): 200 мМ Бис-Трис, 16,6 г раствора S/D (Тритон Х-100; полисорбат 80; TNBP=10,87; 3,31:3,01 (по массе), при рН 6,0. Затем колонку промывали 10 объемами колонки Промывка 3 (W3): 10 мМ цитрат натрия при рН 8,5. Затем колонку промывали 10 объемами колонки Промывка 4 (W4): 100 мМ Аргинин-HCl, 100 мМ Лизин-HCl, 100 мМ гистидин-HCl, 2 мМ N-ацетил-D, L-триптофан, при рН 8,5, с 20% (масс./масс.) полисорбата 80. Пробу из элюата каждой из W2, W3 и W4 отбирали и анализировали в соответствии с ITR кПЦР, ИФА против антигенов AAV и ИФА против антигенов HEK293 HCP (как описано в Примерах 8 и 9 выше).
[00322] Элюирование осуществляли путем введения 10 объемов колонки следующего буфера для элюирования на колонку: 20% (масс./масс.) сахарозы, 10% (масс./масс.) сорбита, 5% (масс./масс.) маннита (сахарозы), 15% (масс./масс.) глицерина, 50 мМ гистидина, 800 мМ NaCl, при рН 8,0. Затем колонку промывали 10 объемами колонки Промывка 5 (W5): 50 мМ Гистидин и 100 мМ NaCl при рН 8,5. Элюирование осуществляли путем введения 10 объемов колонки следующего буфера для элюирования на колонку: 50 мм Трис-HCl, 750 мМ NaCl и 50% (масс./масс.) ДМСО при рН 8,0. Затем колонку промывали 50 мМ гистидина и 100 мМ NaCl при рН 8,5. Затем колонку регенерировали путем нанесения на колонку 10 объемов колонки раствора, содержащего 100 мМ глицина и 200 мМ NaCl, при рН 2,7.
[00323] Вышеуказанная тестовая процедура более подробно описана в Таблице 29. На всех стадиях применялась линейная скорость потока 39 см/ч.
ТАБЛИЦА 29:
[00324] Стадия «Промывка 5» уменьшила фронтальные эффекты при элюировании. На второй стадии элюирования не было обнаружено элюирования AAV8 (элюирование 2). Для AAV8 ДМСО все еще может быть подходящим в качестве промывочного буфера и/или в качестве буфера для потенциальной инактивации или дезинтеграции вирусов в липидной оболочке.
[00325] Отобранные образцы анализировали с помощью каждого из ITR кПЦР, ИФА против антигенов AAV и ИФА против HEK293 HCP (как описано в Примерах 8 и 9 выше), чтобы оценить выход и возможные потери на стадиях. Хроматограмма, связанная с приведенным выше примером, показана на Фиг. 11. В приведенной ниже Таблице 30 показаны образцы, взятые на каждой из вышеуказанных стадий, а выход каждого компонента показан в Таблице 31.
[00326] Неожиданно, что элюирование AAV8 из смолы Capture Select AAV8 происходит в условиях, близких к нейтральным, в присутствии полиолов и определенного количества соли. Производитель смолы предположил, чтобы для элюирования требовались кислотные условия ниже pH 3,5. Также было удивительно, что элюирование может быть инициировано сахарами, сахарными спиртами и/или смесью сахаров и сахарных спиртов. Кроме того, было неожиданным, что ДМСО в качестве полярного растворителя не мог элюировать AAV8 из смолы Capture Select AAV8.
Таблица 30:
[00327] Стадия «Промывка 5» уменьшила фронтальные эффекты при элюировании. На второй стадии элюирования не было обнаружено элюирования AAV8 (элюирование 2).
Таблица 31:
[00328] Вышеуказанные образцы также анализировали с помощью SDS-PAGE и 12% окрашивания серебром для выявления общего количества белка. Результаты анализа SDS-PAGE показаны на Фиг. 12.
ПРИМЕР 14
[00329] Продукцию AAV2 разрабатывали в клеточной линии HEK293 после трансфекции тройной плазмидной системой, содержащей кодирующую кДНК представляющего интерес белка и AAV2-. VP1. -VP2 и -VP3. Образец AAV2 разбавляли 150 мМ NaCl, 20 мМ Трис-HCl, pH 7,4, чтобы обеспечить загрузку. Загрузку нанесли на колонку, содержащую матрицу сродства POROS™ CaptureSelect™ AAVX (Thermo Fisher, кат. № : A36739, Thermo Fisher; ВД 10 мм, высота слоя 25 мм, объем 1,96 мл).
[00330] Образцы с различных стадий промывки и элюирования отбирали в различных точках, чтобы определить, сколько AAV2 присутствует в образце. Анализы показывают, сколько AAV2 было потеряно в различных стадиях промывки. Была проведена следующая тестовая процедура. Сначала колонку, содержащую аффинную смолу ADK8/9 ВД 10 мм, с высотой слоя 25 мм и объемом 1,96 мл уравновешивали, по меньшей мере, десятью объемами колонки 20 мМ Трис-HCl, 150 мМ NaCl при рН 7,4. Загрузку наносили на колонку, содержащую аффинную смолу ADK8/9. Часть образца, загруженного в колонку, была сохранена и затем проанализирована с помощью ITR кПЦР, ИФА против антигенов AAV и ИФА против антигенов HEK293 HCP (как описано в Примерах 8 и 9 выше). Затем колонку повторно уравновешивали (Промывка 1, W1) 10 объемами колонки 20 мМ Трис-HCl, 150 мМ NaCl при рН 7,4. Образец проходящего потока сохраняли и затем анализировали с помощью ITR кПЦР, ИФА против антигенов AAV и ИФА против антигенов HEK293 HCP (как описано в Примерах 8 и 9 выше).
[00331] Затем колонку промывали 10 объемами колонки Промывка 2 (W2): 100 мМ ацетат натрия, 0,1% Полисорбат 80 при pH 6,0. Затем колонку промывали 10 объемами колонки Промывка 3 (W3): 50 мМ Трис-HCl и 125 мМ NaCl при рН 8,5. Затем колонку промывали 10 объемами колонки Промывка 4 (W4): 50 мМ Трис-HCl, 50% (масс./масс.) этиленгликоля при рН 8,5. Затем колонку промывали 10 объемами колонки Промывка 5 (W5): 50 мМ Трис-HCl, 60% (масс./масс.) этиленгликоля+750 мМ NaCl, рН 8,0. Затем колонку промывали 10 объемами колонки Промывка 6 (W6): 20 мМ Трис-HCl и 150 мМ NaCl при рН 7,4. Пробу из элюата каждой из W2, W3 и W4 отбирали и анализировали в соответствии с ITR кПЦР, ИФА против антигенов AAV и ИФА против антигенов HEK293 HCP (как описано в Примерах 8 и 9 выше).
[00332] Элюирование осуществляли путем введения 10 объемов колонки следующего буфера для элюирования на колонку: 100 мМ Глицин-HCl, 200 мМ NaCl, pH 2,5. Затем колонку промывали 10 объемами колонки Промывка 7 (W7): 20 мМ Трис-HCl и 150 мМ NaCl при рН 7,4. Колонку стриппировали 10 объемами колонки 50 мМ фосфорной кислоты при pH 2,0, промывали 10 объемами колонки Промывка 8 (W8): 20 мМ Трис-HCl, 150 мМ NaCl при рН 7,4, а затем стриппировали 10 объемами колонки 50 мМ фосфорной кислоты при рН 2,0.
[00333] Вышеуказанная тестовая процедура более подробно описана в Таблице 32. На всех стадиях применялась линейная скорость потока 39 см/ч.
Таблица 32:
[00334] Отобранные образцы анализировали с помощью каждого из ITR кПЦР, ИФА против антигенов AAV и ИФА против HEK293 HCP (как описано в Примерах 8 и 9 выше), чтобы оценить выход и возможные потери на стадиях. Хроматограмма, связанная с приведенным выше примером, показана на Фиг. 13. В приведенной ниже Таблице 33 показаны образцы, взятые на каждой из вышеуказанных стадий, а выход каждого компонента показан в Таблице 34.
Таблица 33:
Таблица 34:
[00335] Вышеуказанные образцы также анализировали с помощью SDS-PAGE и 12% окрашивания серебром для выявления общего количества белка. Результаты анализа SDS-PAGE показаны на Фиг. 14 (см. полосы 2-11).
[00336] Затем образцы анализировали с помощью SDS-PAGE и вестерн-блоттинга против антигенов AAV. Первичные антитела представляют собой моноклональные антитела к VP1, VP2 и VP3 AAV, тогда как вторичные антитела представляют собой козьи антимышиные антитела, связанные с щелочной фосфатазой. Результаты анализа вестерн-блоттинга показаны на Фиг. 15 (см. полосы 2-11).
ПРИМЕР 15
[00337] Продукцию AAV9 разрабатывали в клеточной линии HEK293 после трансфекции тройной плазмидной системой, содержащей кодирующую кДНК представляющего интерес белка и AAV9-, VP1, -VP2 и -VP3. Образец AAV9 разбавляли 150 мМ NaCl, 20 мМ Трис-HCl, pH 7,4, чтобы обеспечить загрузку. Загрузку нанесли на колонку, содержащую матрицу сродства POROS™ CaptureSelect™ AAVX (Thermo Fisher, кат. № : A36739, Thermo Fisher; ВД 10 мм, высота слоя 25 мм, объем 1,96 мл).
[00338] Образцы с различных стадий промывки и элюирования отбирали в различных точках, чтобы определить, сколько AAV9 присутствует в образце. Анализы показывают, сколько AAV9 было потеряно в различных стадиях промывки. Была проведена следующая тестовая процедура. Сначала колонку, содержащую аффинную смолу ADK8/9 ВД 10 мм, с высотой слоя 25 мм и объемом 1,96 мл уравновешивали, по меньшей мере, десятью объемами колонки 20 мМ Трис-HCl, 150 мМ NaCl при рН 7,4. Загрузку наносили на колонку, содержащую аффинную смолу ADK8/9. Часть образца, загруженного в колонку, была сохранена и затем проанализирована с помощью ITR кПЦР, ИФА против антигенов AAV и ИФА против антигенов HEK293 HCP (как описано в Примерах 8 и 9 выше). Затем колонку повторно уравновешивали (Промывка 1, W1) 10 объемами колонки 20 мМ Трис-HCl, 150 мМ NaCl при рН 7,4. Образец проходящего потока сохраняли и затем анализировали с помощью ITR кПЦР, ИФА против антигенов AAV и ИФА против антигенов HEK293 HCP (как описано в Примерах 8 и 9 выше).
[00339] Затем колонку промывали 10 объемами колонки Промывка 2 (W2): 100 мМ ацетат натрия, 0,1% Полисорбат 80 при pH 6,0. Затем колонку промывали 10 объемами колонки Промывка 3 (W3): 50 мМ Трис-HCl и 125 мМ NaCl при рН 8,5. Затем колонку промывали 10 объемами колонки Промывка 4 (W4): 50 мМ Трис-HCl, 50% (масс./масс.) этиленгликоля при рН 8,5. Затем колонку промывали 10 объемами колонки Промывка 5 (W5): 50 мМ Трис-HCl, 60% (масс./масс.) этиленгликоля+750 мМ NaCl, рН 8,0. Затем колонку промывали 10 объемами колонки Промывка 6 (W6): 20 мМ Трис-HCl и 150 мМ NaCl при рН 7,4. Пробу из элюата каждой из W2, W3 и W4 отбирали и анализировали в соответствии с ITR кПЦР, ИФА против антигенов AAV и ИФА против антигенов HEK293 HCP (как описано в Примерах 8 и 9 выше).
[00340] Элюирование осуществляли путем введения 10 объемов колонки следующего буфера для элюирования на колонку: 100 мМ Глицин HCl, 200 мМ NaCl, pH 2,5. Затем колонку промывали 10 объемами колонки Промывка 7 (W7): 20 мМ Трис-HCl и 150 мМ NaCl при рН 7,4. Колонку стриппировали 10 объемами колонки 50 мМ фосфорной кислоты при pH 2,0, промывали 10 объемами колонки Промывка 8 (W8): 20 мМ Трис-HCl, 150 мМ NaCl при рН 7,4, а затем стриппировали 10 объемами колонки 50 мМ фосфорной кислоты при рН 2,0.
[00341] Вышеуказанная тестовая процедура более подробно описана в Таблице 35. На всех стадиях применялась линейная скорость потока 39 см/ч.
Таблица 35:
[00342] Отобранные образцы анализировали с помощью каждого из ITR кПЦР, ИФА против антигенов AAV и ИФА против HEK293 HCP (как описано в Примерах 8 и 9 выше), чтобы оценить выход и возможные потери на стадиях. Хроматограмма, связанная с приведенным выше примером, показана на Фиг. 16. В приведенной ниже Таблице 36 показаны образцы, взятые на каждой из вышеуказанных стадий, а выход каждого компонента показан в Таблице 37.
Таблица 36:
Таблица 37:
[00343] Вышеуказанные образцы также анализировали с помощью SDS-PAGE и 12% окрашивания серебром для выявления общего количества белка. Результаты анализа SDS-PAGE показаны на Фиг. 14 (см. полосы 12-20).
[00344] Затем образцы анализировали с помощью SDS-PAGE и вестерн-блоттинга против антигенов AAV. Первичные антитела представляют собой моноклональные антитела к VP1, VP2 и VP3 AAV, тогда как вторичные антитела представляют собой козьи антимышиные антитела, связанные с щелочной фосфатазой. Результаты анализа вестерн-блоттинга показаны на Фиг. 15 (см. полосы 12-20).
ПРИМЕР 16
[00345] Этот пример демонстрирует условия элюирования, улучшенные для AAV9, относительно использования кислого глицина или фосфорной кислоты.
[00346] Продукцию AAV9 разрабатывали в клеточной линии HEK293 после трансфекции тройной плазмидной системой, содержащей кодирующую кДНК представляющего интерес белка и AAV9-. VP1. -VP2 и -VP3. Из собранной аликвоты 30 л клетки были разрушены с помощью Megatron MT3000 (Pall) с последующей фильтрацией раствора, содержащего AAV9 через: а) глубинный фильтр PDP8, площадь 0,5м2, b) глубинный фильтр V100, площадь: 0,5м2 и c) Kleenpak Capsule 0,2 мкм, площадь 0,15м2. Осветленный супернатант бесклеточной культуры концентрировали и подвергали диафильтации с помощью кассеты Pall Omega T-Series 300 кДа. Вирусные частицы были загружены на мембранный адсорбер (MustangQ. номер детали Pall XT140MSTGQP05) в условиях без связывания для AAV9. Загрузку наносили на колонку, содержащую матрицу сродства POROS ™ CaptureSelect ™ AAVX (Thermo Fisher, кат. № A36739, Thermo Fisher), ВД 16 мм, высота слоя 50 мм, объем 10,0 мл, после чего следовали стадии с буфером с объемом колонки, как указано.
[00347] Образцы с различных стадий промывки и элюирования отбирали в различных точках, чтобы определить, сколько AAV9 присутствует в образце. Анализы показывают, сколько AAV9 было потеряно в различных стадиях промывки. Была проведена следующая тестовая процедура. Сначала колонку уравновешивали, по меньшей мере, пятью объемами колонки 50 мМ Трис-HCl, 125 мМ NaCl при рН 8,5. Загрузку наносили на колонку, содержащую аффинную смолу. Часть образца, загруженного в колонку, была сохранена и затем проанализирована с помощью ITR кПЦР, ИФА против антигенов AAV и ИФА против антигенов HЕК293 HCP. Затем колонку повторно уравновешивали (Промывка 1, W1) 5 объемами колонки 50 мМ Трис-HCl, 125 мМ NaCl при рН 8,5. Образец проходящего потока сохраняли и затем анализировали с помощью ITR кПЦР, ИФА против антигенов AAV и ИФА против антигенов HЕК293 HCP.
[00348] Затем колонку промывали 5 объемами колонки Промывка 2 (W2): 100 мМ ацетат натрия, 0,1% Полисорбат 80 при pH 6,0. Затем колонку промывали 10 объемами колонки Промывка 3 (W3): 50 мМ Трис-HCl и 125 мМ NaCl при рН 8,5. Пробу из элюата каждой из W2 и W3 отбирали и анализировали в соответствии с ITR rПЦР, ИФА против антигенов AAV и ИФА против антигенов HEK293 HCP.
[00349] Элюирование осуществляли, сначала применяя 20 объемов колонки очищенной воды, затем 20 объемов колонки 1 мМ HCl при pH 3,2, а затем 20 объемов колонки 50 мМ Трис-HCl, 750 мМ NaCl, 50% ДМСО (масс./масс.) при pH 8,0. Колонку промывали 20 объемами очищенной воды, а затем 10 объемами 33 мМ HCl при pH 2,0.
[00350] Вышеуказанная тестовая процедура более подробно описана в Таблице 38. На всех стадиях применялась линейная скорость потока 39 см/ч.
Таблица 38:
[00351] Отобранные образцы анализировали с помощью каждого из ITR кПЦP и ИФА (как описано в Примере 8 выше) против антигенов AAV и ИФА против HEK293 HCP, чтобы оценить выход и могли ли потери происходить на стадиях. Хроматограмма, связанная с приведенным выше примером, показана на Фиг. 17. В приведенной ниже Таблице 39 показаны образцы, взятые на каждой из вышеуказанных стадий, а выход некоторых компонентов показан в Таблице 40.
Таблица 39:
Таблица 40:
[00352] Приведенные выше образцы также анализировали с помощью SDS-PAGE и Вестерн-блоттинга с результатами, показанными на Фиг. 18.
[00353] AAV9 можно элюировать из Capture select AAVx 1 мМ хлористоводородной кислотой, что дает преимущество, заключающееся в том, что в водную систему вводится только очень небольшое количество свободной кислоты. Дальнейшую процедуру элюирования при близком к нейтральному значению рН можно проводить с использованием ДМСО, содержащего водный буферный раствор (750 мМ NaCl, 50 мМ Трис-HCl, 50% масс./масс. диметилсульфоксид). ДМСО может быть полезным, если элюат, содержащий ДМСО, применяют для ультрацентрифугирования с использованием градиента сахарозы. Обе стратегии элюирования потенциально имеют улучшенные свойства для поддержания биопотентности во время элюирования из смолы AAVX для всех подтипов AAV по сравнению с жесткими условиями элюирования при 100 мМ при pH ниже 3 и/или в присутствии больших количеств хлорида натрия или магния.
ПРИМЕР 17
[00354] Этот пример демонстрирует условия элюирования, улучшенные для AAV9, относительно использования кислого глицина или фосфорной кислоты.
[00355] Продукцию AAV9 разрабатывали в клеточной линии HEK293 после трансфекции тройной плазмидной системой, содержащей кодирующую кДНК представляющего интерес белка (FIX-padua, двухцепочечная) и AAV9-. VP1. -VP2 и -VP3. Из собранной аликвоты 30 л клетки были разрушены с помощью Megatron MT3000 (Pall) с последующей фильтрацией раствора, содержащего AAV9 через: а) глубинный фильтр PDP8, площадь 0,5м2, b) глубинный фильтр V100, площадь: 0,5м2 и c) Kleenpak Capsule 0,2 мкм, площадь 0,15м2. Осветленный супернатант бесклеточной культуры концентрировали и подвергали диафильтации с помощью кассеты Pall Omega T-Series 300 кДа. Вирусные частицы были загружены на мембранный адсорбер (MustangQ. номер детали Pall XT140MSTGQP05) в условиях без связывания для AAV9. Загрузку наносили на колонку, содержащую матрицу сродства POROS™ CaptureSelect™ AAVX (Thermo Fisher, кат. № A36739; 10 мм, высота слоя 28 мм, объем 2,2 мл).
[00356] Образцы с различных стадий промывки и элюирования отбирали в различных точках, чтобы определить, сколько AAV9 присутствует в образце. Анализы показывают, сколько AAV9 было потеряно в различных стадиях промывки. Была проведена следующая тестовая процедура. Сначала колонку, содержащую аффинную смолу ВД 10 мм, с высотой слоя 28 мм и объемом 2,2 мл уравновешивали, по меньшей мере, десятью объемами колонки 50 мМ Трис-HCl, 125 мМ NaCl при рН 8,5. Загрузку наносили на колонку, содержащую аффинную смолу. Часть образца, загруженного в колонку, была сохранена и затем проанализирована с помощью ITR кПЦР, ИФА против антигенов AAV и ИФА против антигенов HЕК293 HCP. Затем колонку повторно уравновешивали (Промывка 1, W1) 10 объемами колонки 50 мМ Трис-HCl и 125 мМ NaCl при рН 8,5. Образец проходящего потока сохраняли и затем анализировали с помощью ITR кПЦР, ИФА против антигенов AAV и ИФА против антигенов HЕК293 HCP.
[00357] Затем колонку промывали 10 объемами колонки Промывка 2 (W2): 100 мМ ацетат натрия, 0,1% Полисорбат 80 при pH 6,0. Затем колонку промывали 10 объемами колонки Промывка 3 (W3): 50 мМ Трис-HCl и 125 мМ NaCl при рН 8,5. Затем колонку промывали 30 объемами очищенной воды (Промывка 4 (W4)). Пробу из элюата каждого из W2, W3 и W4 отбирали и анализировали в соответствии с ITR кПЦР, ИФА против антигенов AAV и ИФА против антигенов HЕК293 HCP.
[00358] Элюирование осуществляли, сначала применяя 20 объемов колонки с градиентом от 0 до 100% 33 мМ хлористоводородной кислоты/1000 мМ NaCl в 1 мМ хлористоводородной кислоты.
[00359] Вышеуказанная тестовая процедура более подробно описана в Таблице 41. На всех стадиях применялась линейная скорость потока 39 см/ч.
Таблица 41:
[00360] Отобранные образцы анализировали с помощью каждого из ITR кПЦP и ИФА (как описано в Примере 8 выше) против антигенов AAV и ИФА против HEK293 HCP, чтобы оценить выход и могли ли потери происходить на стадиях. Хроматограмма, связанная с приведенным выше примером, показана на Фиг. 19. Серебряное пятно показано на Фиг. 20.
[00361] Биопотентность элюированного AAV9 составляла 0,51 BPU.
ПРИМЕР 18
[00362] Элюирующие свойства различных типов смол оценивали в отношении разных элюирующих буферов. Готовили буфер для элюирования полиолов, который содержит 50% этиленгликоль (масс./масс.), 50 мМ Трис-HCl, 750-2000 мМ NaCl, рН 8,0. Был приготовлен кислотный элюирующий буфер, который содержит 100 мМ Глицин рН 2,5, 100 мМ цитрат натрия рН 3,0 и 50 мМ фосфорную кислоту рН 2,0. Приготовили MgCl2-содержащий элюирующий буфер, который содержит 2M MgCl2 и 50 мМ Трис-HCl при pH 7,4.
[00363] Были испытаны несколько смол. Результаты показаны в Таблице 42 ниже. В таблице «Да» указывает, что AAV8 может быть элюирован из смолы потенциальным «буфером для элюирования» с количеством, превышающим 10% от нагрузки, в то время как «Нет» указывает, что AAV может быть элюирован из смолы буфером «потенциального элюирования» в количестве менее 1% от загрузки.
Таблица 42:
1 Thermo Fisher Scientific
2Смолу готовили иммобилизированием моноклонального антитела типа ADK8 от Progen AG на CNBr-SepharoseFastFlow афинную смолу при плотности смолы 0,94 мг/мл.
3GE Healthcare
[00364] Различные буферы были протестированы на их способность элюировать AAV8 из вышеуказанной смолы Capture Select AAV8. Результаты показаны в Таблице 43 ниже.
Таблица 43:
[00365] Буферы для элюирования, перечисленные в Таблице 44, также были протестированы, чтобы определить, были ли они удовлетворительными для элюирования AAV из Capture Select® AAV9, доступного от Thermo Fisher Scientific.
Таблица 44.
[00366] Каждый из потенциальных буферов для элюирования, как описано в Таблице 44, применялся последовательно как часть отбора для элюирования, чтобы определить, какие буферы для элюирования можно использовать в программе Capture select AAVx. Отбор начинался с буфера для элюирования с потенциально самой низкой силой элюирования и заканчивается буфером с потенциально самой высокой силой элюирования. Хроматограмма показана на Фиг. 21. Это пример того, какие параметры элюирования могут быть применены к Capture select AAVx.
[00367] Все ссылки, включая публикации, заявки на патенты и патенты, цитированные в данном документе, включены в него посредством ссылки в той же степени, как если бы каждая ссылка была отдельно и конкретно указана для включения в качестве ссылки и была изложена во всей ее полноте в настоящем документе.
Реферат
Изобретение относится к способу очистки аденоассоциированного вируса (AAV). Способ очистки аденоассоциированного вируса (AAV) включает загрузку раствора, содержащего AAV, на аффинную смолу; проведение по меньшей мере двух стадий промывки; и элюирование AAV из аффинной смолы. При этом по меньшей мере одна из стадий промывки включает нанесение на аффинную смолу буфера, содержащего органический растворитель или детергент. Способ дополнительно включает приведение в контакт раствора, содержащего AAV, с анионитом и элюирование раствора, содержащего AAV, из анионита перед загрузкой раствора, содержащего AAV, на аффинную смолу. Осуществление изобретения обеспечивает повышение эффективности очистки AAV. 79 з.п. ф-лы, 21 ил., 44 табл., 18 пр.

Комментарии