Низкомолекулярные производные карбоксамидных галогенированных порфиринов, а именно хлоринов и бактериохлоринов, и их применения - RU2718923C2
Код документа: RU2718923C2
Чертежи
Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящая заявка относится к новым низкомолекулярным карбоксамидным галогенированным производным порфиринов, а именно производным хлорина и бактериохлорина, а также к способу их получения и применению в фотодинамической терапии.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Фотодинамическая терапия (ФДТ) представляет собой клинически одобренное лечение, основанное на введении фотосенсибилизирующей молекулы, ее накоплении в ткани-мишени и последующем освещении светом, избирательно поглощаемым фотосенсибилизатором. Такую избирательность улучшают, применяя фотосенсибилизаторы, которые поглощают свет в фототерапевтическом окне (650-850 нм), где ткани имеют более высокие оптические глубины проникновения (например, δ, равное 2,3 мм при 750 нм) (1). Поглощение света оставляет фотосенсибилизатор в электронно-возбужденном состоянии, которое реагирует с молекулами субстрата переносом электронов с образованием супероксидного аниона и гидроксильных радикалов (реакция типа I) или переносит свою энергию на молекулярный кислород, генерирующий синглетный кислород основного состояния (реакция типа II). Эти фотогенерируемые реактивные формы кислорода (ROS) запускают биологические механизмы, которые делают ФДТ эффективной противораковой процедурой (2).
Парадигмой ФДТ в лечении гиперпролиферативных расстройств является то, что стабильные красители с более сильным поглощением света в фототерапевтическом окне и с высокими квантовыми выходами ROS (ФROS) должны быть лучшими фотосенсибилизаторами. Кроме того, разработка ФДТ-фотосенсибилизаторов, нацеленных на грамотрицательные бактерии, основывалась на необходимости иметь по меньшей мере один положительный заряд, присутствующий в фотосенсибилизаторе (3). Такие фотосенсибилизаторы обычно представляют собой производные порфирина (хлорина или бактериохлорина) с молекулярными массами выше 600 Да. Хотя была достигнута фотодинамическая инактивация бактериальных суспензий на 5-6 порядков с применением микромолярных концентраций фотосенсибилизатора и дозой света приблизительно 10 Дж/см2 (4), перенос в клиническую практику не увенчался успехом. Вероятной причиной неудачного переноса фотодинамической инактивации бактериальных суспензий на клинические условия является несовместимость между большими размерами молекул фотосенсибилизаторов, которые поглощают инфракрасный свет, и небольшим молекулярным размером, необходимым для быстрой диффузии в биопленки и поглощения бактериями. Аналогичные трудности были обнаружены при переносе фотосенсибилизаторов для ФДТ в область местного лечения дерматологических заболеваний. В то время как фотосенсибилизаторы, такие как порфимер натрия (торговое название Photofrin®) и темопорфин (Foscan®), были одобрены к применению при раковых заболеваниях путем внутривенного введения, местное применение не осуществляли в клинической практике (5). Опять же отказ от местного применения фотосенсибилизаторов для получения терапевтических эффектов, вероятно, связан с трудностью преодоления такими фотосенсибилизаторами верхнего слоя кожи, называемого роговым слоем, и достижения своих целей. Роговой слой эпидермиса является основным барьером для чрескожного проникновения экзогенных молекул.
Наилучшее максимальное проникновение (Jmax) лекарственного средства через кожу после местного нанесения сильно ограничено молекулярной массой (MW) лекарственного средства (6),
log Jmax=-3,90-0,0190 MW
Например, лекарственные средства с MW, составляющей 600 или 700 Да, должны иметь Jmax, равное 5×10-16 или 6×10-18 моль/(см2 ч), соответственно. Эти расчеты показывают, что небольшое увеличение молекулярной массы выше 600 Да может привести к резкому снижению трансдермального проникновения фотосенсибилизаторов. С практической точки зрения, фотосенсибилизатор с молекулярной массой 700 Да, вероятно потребует в 100 раз больше времени для того, чтобы достичь терапевтической концентрации в подкожной мишени, по сравнению с фотосенсибилизатором с молекулярной массой 600 Да. Еще одним важным свойством, которым должны обладать лекарственные средства, предназначенные для местного применения, является подходящая растворимость в липидных доменах рогового слоя эпидермиса, чтобы позволить диффузию через этот домен, сохраняя при этом достаточную гидрофильность для обеспечения распределения в жизнеспособных тканях эпидермиса. Лекарственные средства, соответствующие этому показателю, имеют логарифм их коэффициента распределения н-октанол-вода (logPOW) от 1 до 3 (7).
Идеальный фотосенсибилизатор для местного применения при ФДТ и для фотоинактивации бактерий должен иметь молекулярную массу MW менее 700 Да, logPOW от 1 до 3, высокий молярный показатель поглощения ε более 30000 М-1 см-1 от 650 до 850 нм, и квантовый выход ROS ФROS более 0,3. Кроме того, фотостабильность фотосенсибилизатора также имеет решающее значение для успеха ФДТ (8). Фотостабильность фотосенсибилизатора можно сравнить с оборотом химического катализатора: он связан с количеством молей субстрата, которые моль катализатора может преобразовать (то есть количество генерируемых ROS) прежде чем катализатор (то есть фотосенсибилизатор) инактивируется (т.е. подвергнется фоторасщеплению).
Два наиболее широко применяемых фотосенсибилизатора при ФДТ рака представляют собой порфимер натрия (торговое название Photofrin®) и темопорфин (патентованное название Foscan®). Порфимер натрия представляет собой смесь олигомеров, образованных простыми эфирными и сложными эфирными связями до восьми порфириновых единиц, относительно растворимую в водных растворах, с logPOW, приблизительно равным 0. Порфимер натрия не является одиночным молекулярным объектом и не имеет характерной молекулярной массы, но молекулярная масса самого маленького диммера превышает 1000 Да. Темопорфин представляет собой очень липофильный 5,10,15,20-тетра (м-гидроксифенил)хлорин с молекулярной массой 680 Да и logPOW, равным 5,5 при физиологическом рН. Квантовые выходы синглетного кислорода порфимера натрия и темопорфина составляют 0,36 и 0,43, соответственно (8). Их максимальные пики поглощения в красном диапазоне составляют λmax, равное 630 нм, с молярным показателем поглощения ε630, равным 1170 М-1 см-1 для порфимера натрия и λmax, равным 650 нм с ε650, равным 29600 М-1 см-1 для темопорфина. Они относительно фотостабильны, с квантовыми выходами фоторасщепления Фрd, равным 5,5×10-5 и 3,3×10-5 для порфимера натрия и темопорфина, соответственно. Когда порфимер натрия или темопорфин инкубируют с клетками СТ26 (мышиной аденокарциномы толстой кишки) и после промывки освещают лазерным светом длины волны, соответствующей их красным полосам поглощения для достижения дозы света 1 Дж/см2, становится видно, что концентрация порфимера натрия 18 мкМ (оцененная на основе молекулярной массы порфириновой единицы) была необходима для уничтожения 50% клеток в культуре (IC50 равно 18 мкМ), тогда как для темопорфина концентрация, необходимая для достижения той же токсичности для той же самой дозы света, составляла 0,2 мкМ (IC50 равно 0,2 мкМ) (8).
Свойства порфимера натрия недостаточны для прохождения биологических барьеров, а именно из-за его чрезвычайно высокой молекулярной массы, гидрофильности и умеренного поглощения света в фототерапевтическом окне. Темопорфин частично решает вопрос молекулярного веса, но он чрезвычайно липофильный для трансдермальной доставки и поглощает свет только на пределе фототерапевтического окна. Трудность прохождения этих клинически одобренных фотосенсибилизаторов через биологические барьеры, а именно кожный барьер, усугубляется необходимостью относительно больших концентраций этих фотосенсибилизаторов в биологической мишени для достижения фототоксичности, необходимой для ФДТ, чтобы обеспечить хороший терапевтический результат.
В ранних применениях фотосенсибилизаторов для ФДТ не было оценено, что идеальные свойства фотосенсибилизатора для ФДТ могут быть объединены в одну молекулу с идеальными свойствами лекарственных средств для местного применения. Способность быстро диффундировать через биологические барьеры имеет решающее значение для успеха, например, интрадермальной или трансдермальной доставки фотосенсибилизаторов, применяемых местно при лечении дерматологических заболеваний, проникновения фотосенсибилизаторов в биопленки для фотоинактивации бактерий, диффузии фотосенсибилизатора через ногти для лечения грибковых инфекций, таких как онихомикоз. Способность быстро диффундировать через биологические барьеры также имеет решающее значение для быстрого накопления фотосенсибилизатора в его биологической мишени, например, проникновение через внешнюю мембрану эукариотических клеток или мембрану бактериальных клеток. Такая быстрая диффузия сокращает время между введением фотосенсибилизатора и освещением мишени, что является преимуществом во многих применениях фотодинамической терапии и увеличивает фототоксичность по отношению к мишени. Специалисту в данной области техники не следует ожидать, что карбоксамидная группа по меньшей мере в одном мезоположении производных галогенированного порфирина, показанных в формуле (I), в частности бактериохлоринов и хлоринов, может способствовать амфифильности и фотостабильности таких производных бактериохлорина или хлорина без ущерба для образования ROS, и с таким небольшим вкладом в молекулярную массу фотосенсибилизатора, что его диффузия через биологические барьеры не нарушается.
Настоящее изобретение впервые раскрывает фотосенсибилизаторы для ФДТ гиперпролиферативных расстройств и/или для фотоинактивации бактерий или вирусов, или грибов, которые соответствуют всем критериям идеального фотосенсибилизатора и эффективно преодолевают биологические барьеры. Настоящее изобретение также раскрывает способы получения таких фотосенсибилизаторов и, к примеру, иллюстрирует применение этих фотосенсибилизаторов для уничтожения раковых клеток и инактивации бактерий. В дополнительном варианте осуществления настоящего изобретения, описанные здесь фотосенсибилизаторы применяют для тераностики гиперпролиферативных тканей. Тераностика представляет собой способ терапии под визуальным контролем, где одно и то же соединение применяют для визуализации биологической мишени и получения желаемого терапевтического эффекта.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является обеспечение новых карбоксамидных галогенированных производных порфиринов, в частности бактериохлоринов и хлоринов, которые могут быть эффективно применены для уничтожения бактерий, даже если они присутствуют в биопленках, для уничтожения опухолевых клеток даже при местном применении, для уничтожения грибов и для инактивации вирусов. Ввиду недостатков представленных в настоящее время фотосенсибилизаторов ФДТ для обеспечения эффективной трансдермальной доставки или для преодоления биопленок настоящее изобретение раскрывает новые производные порфирина, в частности бактериохлоринов и хлоринов, которые сочетают в себе низкомолекулярные массы с сильным поглощением в фототерапевтическом окне, высокой фотостабильностью, высокими квантовыми выходами фотогенерации ROS, подходящей амфифильностью и биосовместимостью, которые могут быть получены в больших количествах из недорогого сырья.
Другой целью настоящего изобретения является обеспечение лекарственного средства для применения в фотодинамической терапии, где мишень выбирают из группы, состоящей из: сосудистого эндотелия, ткани с новообразованными сосудами, ткани с новообразованными сосудами, присутствующей в глазу, аномальной сосудистой стенки опухоли, солидной опухоли, опухоли кожи, опухоли головы, опухоли шеи, опухоли глаза, опухоли желудочно-кишечного тракта, опухоли печени, опухоли груди, опухоли предстательной железы, опухоли легкого, несолидной опухоли, злокачественных клеток одной из кроветворной ткани и лимфоидной ткани, повреждений сосудистой системы, пораженного костного мозга и пораженных клеток, где заболевание представляет собой одно из аутоиммунного и воспалительного заболевания.
Дополнительной целью настоящего изобретения является обеспечение лекарственного средства для лечения дерматологических заболеваний, таких как псориаз, обыкновенные угри и розацеа; гинекологических заболеваний, таких как дисфункциональное маточное кровотечение; урологических заболеваний, таких как вирус кондиломы; сердечно-сосудистых заболеваний, таких как рестеноз и атеросклеротические бляшки; лечение грибковых инфекций, таких как онихомикоз; фотодинамического разрушения бактерий или вирусов, включая бактерии с множественной лекарственной устойчивостью; удаления волос и косметических процедур; ингибирования иммунных реакций после трансплантации органов или тканей. Удаление поверхностного слоя клеток с применением способов фотодинамической терапии с фотосенсибилизаторами, раскрытыми здесь, стимулирует рост новых клеток в подлежащих слоях кожи с последующим улучшением внешнего вида кожи косметического значения. Другой целью настоящего изобретения является обеспечение лекарственного средства для лечения сердечной аритмии, заключающегося в селективном разрушении клеток, таких как сердечные миоциты, путем локализованной фотодинамической терапии и восстановления физиологического ритма сердца.
Наконец, дополнительно настоящее изобретение обеспечивает способы диагностики гиперпролиферативных тканей с применением новых карбоксамидных производных порфиринов, в частности бактериохлоринов и хлоринов. При условии, что эти соединения предпочтительно накапливаются в таких тканях, дополнительным свойством, необходимым для диагностических целей, является точное обнаружение очень малых количеств таких соединений. Эти соединения имеют очень определенные полосы поглощения в красном и инфракрасном диапазоне, где ткани наиболее проницаемы. Избирательное возбуждение этих соединений приводит к различной флуоресценции на длинах волн, где биологические молекулы не выделяются. Обнаружение флуоресценции может быть сделано с помощью очень чувствительного оборудования, а субнаномолярные количества бактериохлоринов и хлоринов могут быть измерены в биологических средах. Источник облучения для фотодиагностики и фототерапии не ограничен, но лазерный луч является предпочтительным, поскольку интенсивные световые лучи в желаемом диапазоне длин волн могут быть применены избирательно. Необходимо, чтобы световые лучи имели достаточную интенсивность, чтобы заставить соединения излучать флуоресценцию для диагностики и оказывать эффект уничтожения клеток для терапии. Кроме того, при применении фторированных хлоринов или бактериохлоринов, с помощью фтор-МРТ (магнитно-резонансная томография) можно обнаружить накопление этих соединений в небольших областях тела и следить за метаболитами, образующимися при их выведении из организма. Более того, при применении импульсных лазеров для возбуждения, последующие процессы безызлучательного распада выделяют тепло, которое образует фотоакустическую волну, и такие волны могут быть обнаружены с помощью фотоакустической томографии, обеспечивая дополнительную информацию, представляющую интерес для диагностики гиперпролиферативных расстройств.
Другие цели и технические характеристики будут представлены в последующем описании, которое дается только в качестве примера и не ограничивается им.
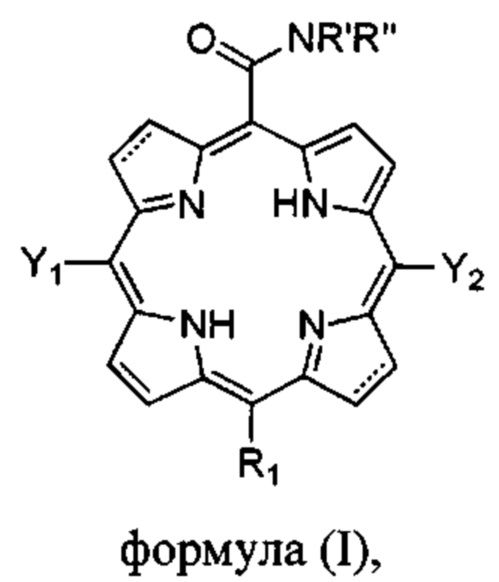
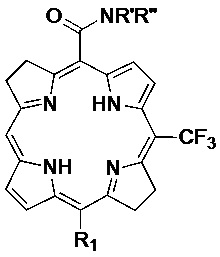
Настоящее изобретение относится к карбоксамидным производным порфиринов, в частности бактериохлорина или хлорина, формулы:
где


Y1, Y2 каждый независимо выбран из водорода, галогенированного алкила или галогенированного циклоалкила с 6 или менее атомами углерода или галогенированного фенила, где галогены независимо выбраны из F, Cl и Br, при условии, что алкил, циклоалкил или фенил по меньшей мере в одном положении галогенирован, и при условии, что по меньшей мере один из Y1, Y2 не является водородом, т.е. по меньшей мере один из Y1, Y2 представляет собой галогенированный алкил или галогенированный циклоалкил с 6 или менее атомами углерода или галогенированный фенил, где галогены независимо выбраны из F, Cl и Br, при условии, что алкил, циклоалкил или фенил по меньшей мере в одном положении галогенирован;
R1 выбран из Н, I, Cl, Br или -CONR'R'';
R' и R'' независимо выбраны из водорода, алкила с 6 или менее атомами углерода, циклопропила, циклобутила, циклопентила, спирта, первичного амина, вторичного амина, третичного амина, положительно заряженного четвертичного амина, карбоновой кислоты, простого эфира или сложного эфира;
или их фармацевтически приемлемым солям.
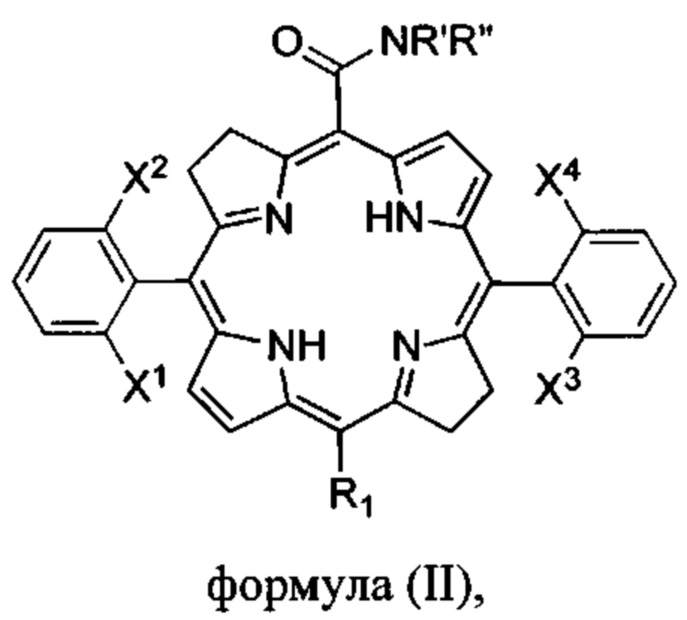
Следовательно, соединения формулы (I) могут представлять собой бактериохлорины формулы
где
X1, X2, X3, X4 каждый независимо выбран из галогена (F, Cl, Br) и атомов водорода, при условии, что по меньшей мере X1 и X3 представляют собой галогены;
R1 выбран из Н, F, Cl, Br или -CONR'R'';
R' и R'' независимо выбраны из водорода, алкила с 6 или менее атомами углерода, циклопропила, циклобутила, циклопентила, спирта, первичного амина, вторичного амина, третичного амина, положительно заряженного четвертичного амина, карбоновой кислоты, простого эфира или сложного эфира;
или их фармацевтически приемлемые соли.
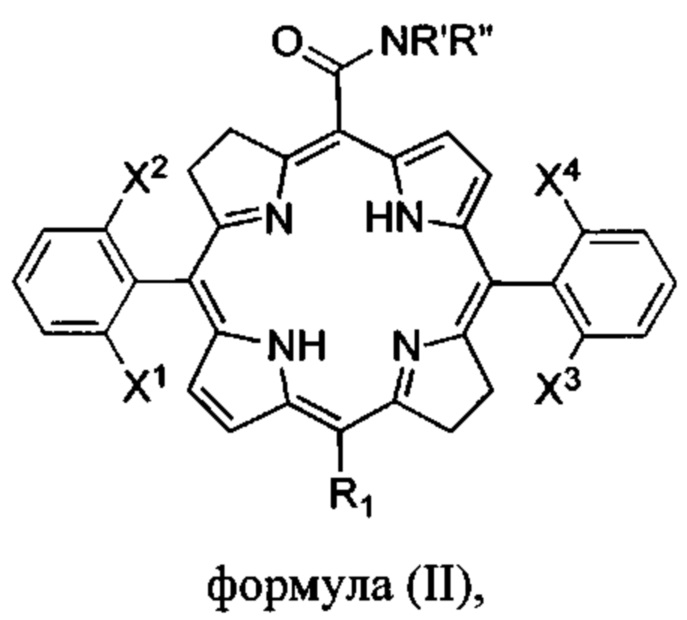
Конкретные предпочтительные соединения по изобретению включают карбоксамидный бактериохлорин формулы (II), где X1, X2, X3, X4 представляют собой атомы фтора, R1 представляет собой водород, R' представляет собой водород и R'' представляет собой метил.
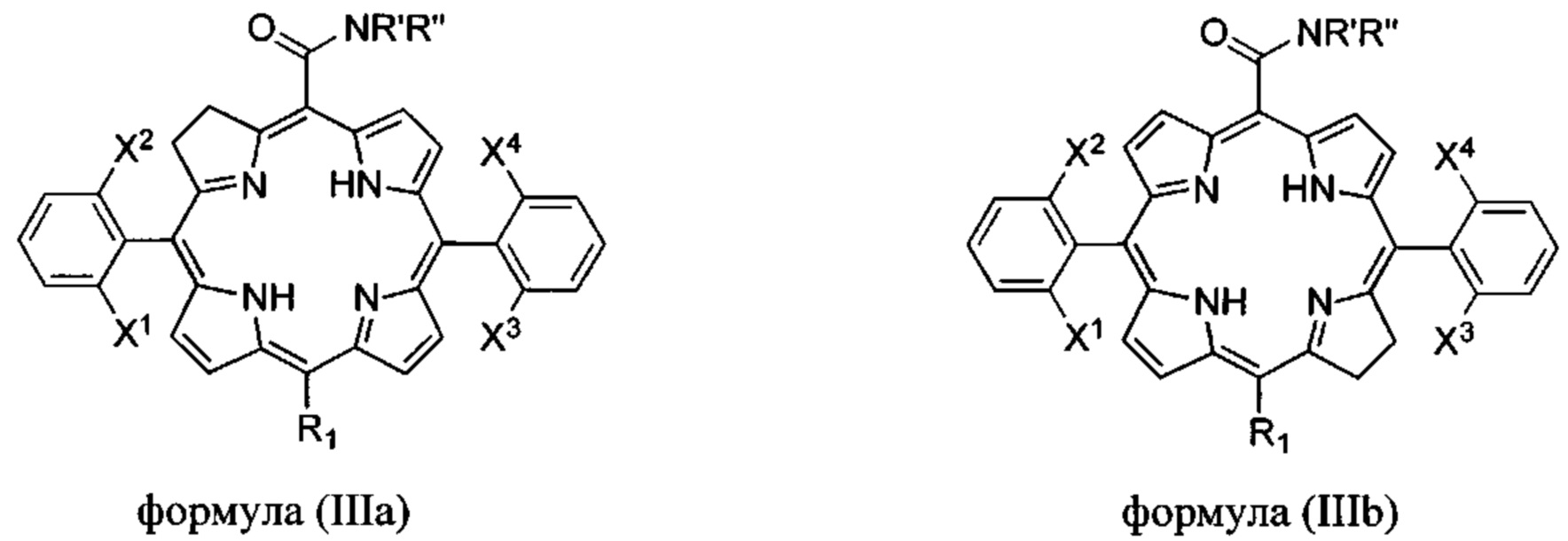
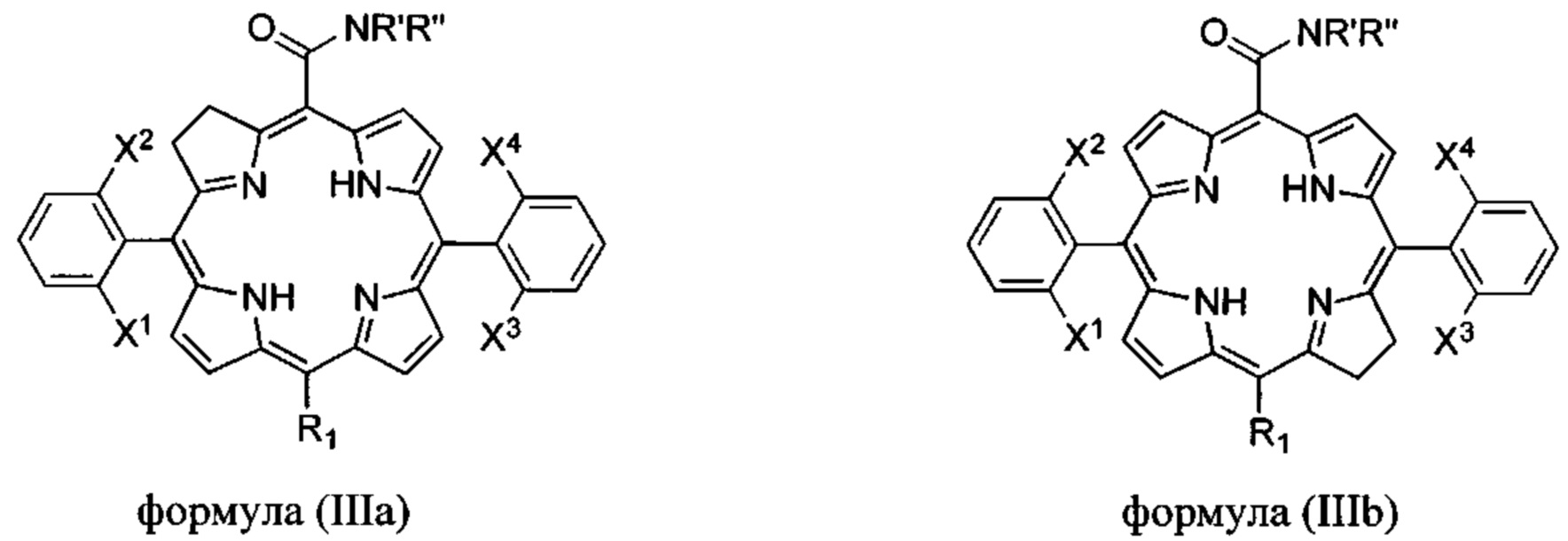
Альтернативно, соединения формулы (I) могут представлять собой хлорины формулы
где:
X1, X2, X3, X4 каждый независимо выбран из галогена (F, Cl, Br) и атомов водорода, при условии, что по меньшей мере X1 и X3 представляют собой галогены;
R1 выбран из Н, F, Cl, Br или -CONR'R'';
R' и R'' независимо выбраны из водорода, алкила с 6 или менее атомами углерода, циклопропила, циклобутила, циклопентила, спирта, первичного амина, вторичного амина, третичного амина, положительно заряженного четвертичного амина, карбоновой кислоты, простого эфира или сложного эфира;
или их фармацевтически приемлемые соли.
Когда X1 отличается от X2 и/или X3 отличается от X4, соединения формулы (II) или (III) имеют атропоизомеры из-за затрудненного вращения вокруг одинарной связи фенил-макроцикл. В таких случаях атропоизомеры можно отличить по числу более тяжелых атомов на каждой стороне плоскости, определенной макроциклом. Формула IV иллюстрирует два атропоизомера производного бактериохлорина, отличающихся наличием обоих атомов фтора на одной и той же стороне плоскости макроцикла (атропоизомер αα) или на разных сторонах плоскости макроцикла (атропоизомер αβ)
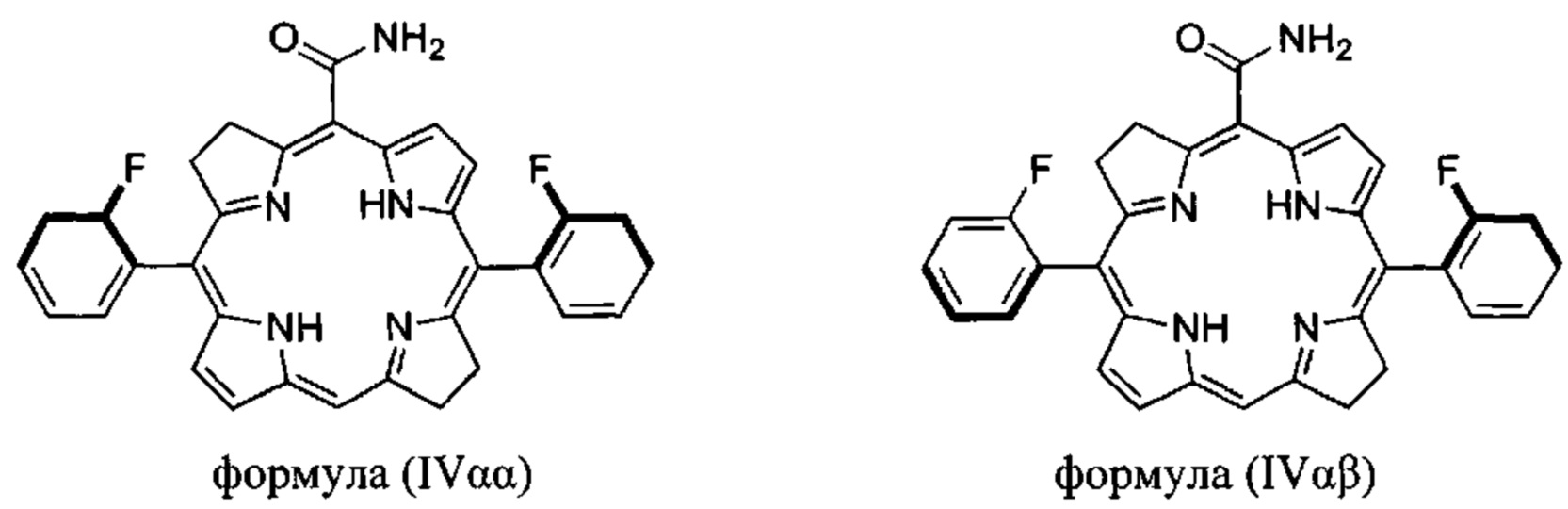
Где жирными линиями показано, что выделенные жирным шрифтом атомы и присоединенные к ним группы стерически ограничены так, чтобы находиться над плоскостью, определяемой кольцом макроцикла.
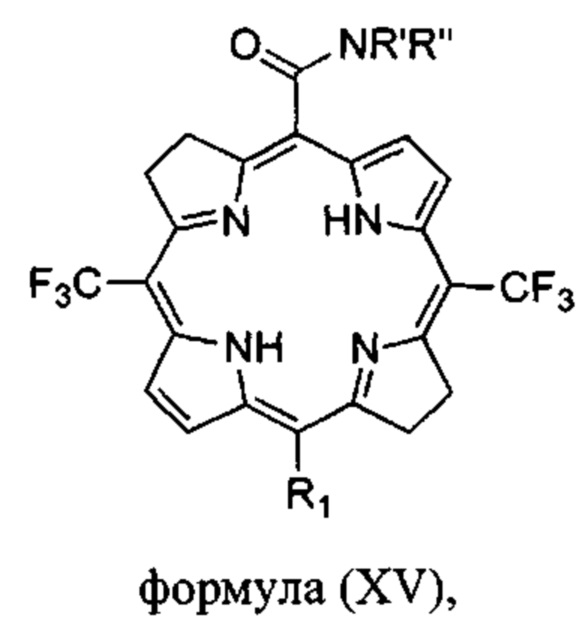
Соединения формулы (I) также могут представлять собой бактериохлорины формулы
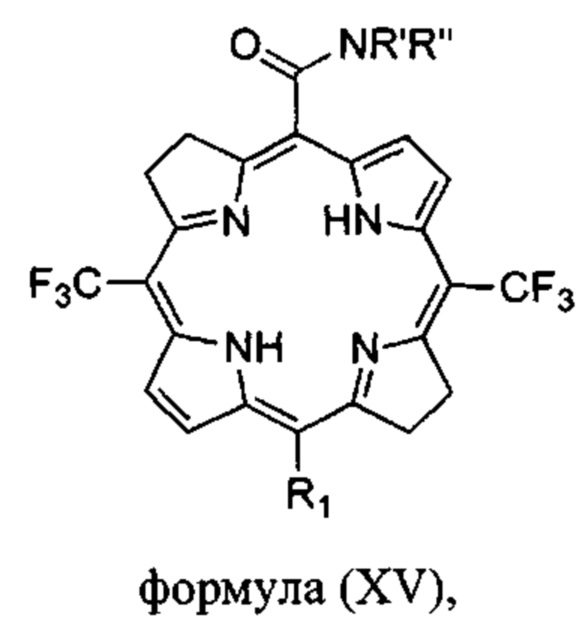
где
R1 выбран из Н, I, Cl, Br или -CONR'R'';
R' и R'' независимо выбраны из водорода, алкила с 6 или менее атомами углерода, циклопропила, циклобутила, циклопентила, спирта, первичного амина, вторичного амина, третичного амина, положительно заряженного четвертичного амина, карбоновой кислоты, простого эфира или сложного эфира;
или их фармацевтически приемлемые соли.
Конкретные предпочтительные соединения по изобретению включают карбоксамидный бактериохлорин формулы (XV), где R1 представляет собой водород, R' представляет собой водород и R'' представляет собой метил.
Изобретение также относится к фармацевтической композиции, содержащей эффективное количество соединения, описанного здесь, и фармацевтически приемлемый носитель.
Фактические уровни дозировки и временная динамика введения активных ингредиентов в фармацевтические композиции по настоящему изобретению могут варьироваться так, чтобы получить количество активного ингредиента, которое эффективно для достижения желаемого терапевтического ответа для конкретного пациента, композиции и способа введения, не будучи токсичным (или неприемлемо токсичным) для пациента.
При применении, по меньшей мере одно соединение по настоящему изобретению вводят в фармацевтически эффективном количестве субъекту, нуждающемуся в этом, в фармацевтическом носителе путем внутривенной, внутримышечной, подкожной, вводимой внутрь пораженных тканей или интрацеребровентрикулярной инъекции, или путем перорального введения или местного применения. В соответствии с настоящим изобретением соединение по изобретению можно вводить отдельно или в сочетании со вторым, другим лекарственным средством. Под "в сочетании с" подразумевается вместе, по существу, одновременно или последовательно.
Под "фармацевтически эффективным количеством", в контексте данного документа, подразумевается количество соединения по изобретению, достаточно высокое, чтобы значительно и положительно изменить состояние, подлежащее лечению, но достаточно низкое, чтобы избежать серьезных побочных эффектов (при разумном соотношении польза/риск), в рамках обоснованного врачебного решения. Фармацевтически эффективное количество соединения по изобретению будет варьировать в зависимости от конкретной цели, которая должна быть достигнута, возраста и физического состояния пациента, подвергаемого лечению, тяжести основного заболевания, продолжительности лечения, характера сопутствующей терапии и применяемого конкретного соединения. Например, терапевтически эффективное количество соединения по изобретению, вводимого ребенку или новорожденному, будет уменьшаться пропорционально в соответствии с обоснованным врачебным решением. Таким образом, эффективное количество соединения по изобретению будет минимальным количеством, которое обеспечит желаемый эффект. Кроме того, при фотодинамической терапии "фармацевтически эффективное количество" фармацевтической композиции или соединения частично зависит от других факторов, таких как доза света и кислород, оба из которых необходимы для достижения терапевтического результата. Таким образом, также будет "эффективное количество" света, также как количество кислорода при лечении субъекта или пациента. Другими важными факторами, которые способствуют определению "фармацевтически эффективного количества" лекарственного средства, света и кислорода, являются интервалы между лекарственным средством и светом (время между введением лекарственного средства и освещением ткани). Интервал между лекарственным средством и светом является важным, потому что, например, введение более высокой дозы лекарственного средства 50 мг/кг и освещение ткани на одну неделю позже при дозе света 500 Дж/см2 может быть столь же безрезультатным или неэффективным, как применение дозы лекарственного средства 0,01 мг/кг и освещения ткани через 10 минут после введения при дозе света 0,1 Дж/см2. Выделение лекарственного средства (метаболизм) организмом между введением лекарственного средства и освещением может снизить эффективность терапии при увеличении интервала между лекарственным средством и светом (удлиняется). Однако увеличение интервала между лекарственным средством и светом может привести к более избирательной терапии и меньшему количеству побочных эффектов. Таким образом, по меньшей мере по этим причинам интервал между лекарственным средством и светом является важным фактором, который следует учитывать при определении "фармацевтически эффективного количества" композиций по настоящему изобретению.
В дополнение к рассмотренным выше факторам, которые влияют на определение "эффективного количества" лекарственного средства, света, кислорода и интервала между лекарственным средством и светом, специалист в данной области техники также учитывает плотность потока частиц света (количество фотонов, подаваемое на единицу площади в единицу времени). Плотность потока частиц важна, потому что подача слишком большого количества фотонов слишком быстро может истощать кислород в ткани и сделать терапию безрезультатной или неэффективной.
Несомненным практическим преимуществом настоящего изобретения является то, что соединение можно вводить удобным способом, таким как внутривенная, внутримышечная, подкожная, пероральная, вводимая внутрь пораженных тканей или интрацеребровентрикулярная инъекция, или местное применение, такое как кремы или гели. В зависимости от способа введения, активные ингредиенты, которые содержат соединение по изобретению, могут потребовать покрытия материалом для защиты соединения от действия ферментов, кислот и других природных условий, которые могут инактивировать соединение. Для того, чтобы ввести соединение по изобретению отличным от парентерального введения путем, соединение может быть покрыто, или введено с материалом для предотвращения инактивации или для улучшения растворения.
Настоящее изобретение также относится к фармацевтической композиции, содержащей, по меньшей мере одно из производных, соответствующих формуле (I), или их фармацевтически приемлемые соли и фармацевтически приемлемый носитель, который временно делает кожу проницаемой, заставляя фармацевтическую композицию преодолевать различные слои кожи.
Другой целью настоящего изобретения является применение соединения, согласно настоящему описанию, для получения лекарственного средства для применения при лечении расстройства или заболевания, согласно настоящему описанию. Другой целью настоящего изобретения является применение соединения, согласно настоящему описанию, для применения при лечении расстройства или заболевания, согласно настоящему описанию.
Раскрытие списка химических групп в любом определении переменной в контексте настоящего документа включает определения этой переменной как любой одной группы или сочетания перечисленных групп. Раскрытие варианта осуществления для переменной в контексте настоящего документа включает этот вариант осуществления в качестве любого одного варианта осуществления или в сочетании с любыми другими вариантами осуществления или их частями. Раскрытие варианта осуществления в контексте настоящего документа включает этот вариант осуществления в качестве любого одного варианта осуществления или в сочетании с любыми другими вариантами осуществления или их частями.
Настоящее изобретение также относится к применению вышеуказанных производных или их фармацевтически приемлемых солей и фармацевтической композиции, содержащей по меньшей мере одно из них для лечения гиперпролиферативных расстройств и/или рака и/или бактериальных и/или вирусных или грибковых инфекций. Кроме того, применение фармацевтической композиции для интрадермального или трансдермального лечения.
Настоящее изобретение также относится к применению фармацевтической композиции, содержащей, по меньшей мере одно из вышеуказанных производных или их фармацевтически приемлемых солей в тераностике гиперпролиферативных расстройств, где по меньшей мере одно из производных, описанных в пунктах формулы изобретения 1-9, связывается с тканью-мишенью, визуализируемой способами получения изображения и, необязательно, посредством освещения указанных производных, вызывает желаемый терапевтический эффект в ткани-мишени. Где способы получения изображения включают магнитно-резонансную томографию (МРТ), воздействие на производные, соответствующие формуле (I), или их фармацевтически приемлемые соли, света достаточной энергии, чтобы вызвать их флуоресценцию, или включают воздействие на производные, соответствующие формуле (I), или их фармацевтически приемлемые соли, светового импульса пикосекундной или наносекундной продолжительности, достаточной энергии, чтобы спровоцировать возбуждение соединением фотоакустической волны.
Примечательно, что молекулярная масса бактериохлоринов или хлоринов формулы (I) составляет от 425 Да до 700 Да, они амфифильные, образуют несколько водородных связей и могут эффективно диффундировать через биологические барьеры, такие как роговой слой эпидермиса или через биопленки. Одна из технических характеристик таких производных заключается в их низкой молекулярной массе и, как следствие, увеличении проникновения через защитные биологические барьеры. Другим техническим преимуществом является сохранение бактериохлорина или хлорина, макроцикла, известного своим сильным поглощением света в фототерапевтическом окне и способностью генерировать ROS в высоких квантовых выходах. Еще одно преимущество заключается в наличии групп заместителей, которые повышают фотостабильность восстановленных производных порфирина и уравновешивают растворимость в липидных доменах с биосовместимостью с биологическими и фармацевтическими носителями. Дополнительная техническая характеристика бактериохлоринов или хлоринов формулы (I) заключается в том, что они значительно флуоресцентны, а именно с квантовыми выходами флуоресценции выше 0,1, что делает возможной их неинвазивную визуализацию в мишени. Данная визуализация представляет собой желаемое свойство, потому что она позволяет визуализировать мишень и выбирать наилучшее время для начала лечения, например, когда соотношение мишени фотосенсибилизатора к окружающей среде является высоким. Применение бактериохлоринов или хлоринов формулы (I) в тераностике возможно также с помощью фтормагнитного резонанса (МРТ), когда они содержат атомы фтора, или с помощью фотоакустической томографии (ФАТ), когда они провоцируют возбуждение фотоакустических волн при импульсном лазерном свете.
В контексте данного документа, значение "защитные биологические барьеры" следует понимать, как барьеры для диффузии молекулярных и надмолекулярных видов в организме, такие как кожа и, в частности роговой слой эпидермиса, барьеры желудочно-кишечного тракта, а также офтальмологические барьеры, барьер ногтевой пластины, наружная мембрана клеток и бактерий, а также биопленки, созданные микроорганизмами. Для специалиста в данной области техники не является очевидным то, что производные карбоксамидных галогенированных порфиринов, в частности бактериохлоринов и хлоринов, могут эффективно преодолевать биологические мембраны и быстро превращаться в очень фототоксичные фотосенсибилизаторы в отношении злокачественных клеток, бактерий или грибов, защищенных указанными биологическими барьерами.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Для более легкого понимания далее представлены прилагаемые графические материалы иллюстративных вариантов осуществления, без намерения ограничить раскрытое в данном описание изобретение.
Фиг. 1: А) Структуры молекул формулы (V), (VI), (VII) и (VIII). В) Структуры молекул формулы (XI), (XII), (XIII) и (XIV).
Фиг. 2: Структуры молекул формулы (IX), (Ха) и (Xb).
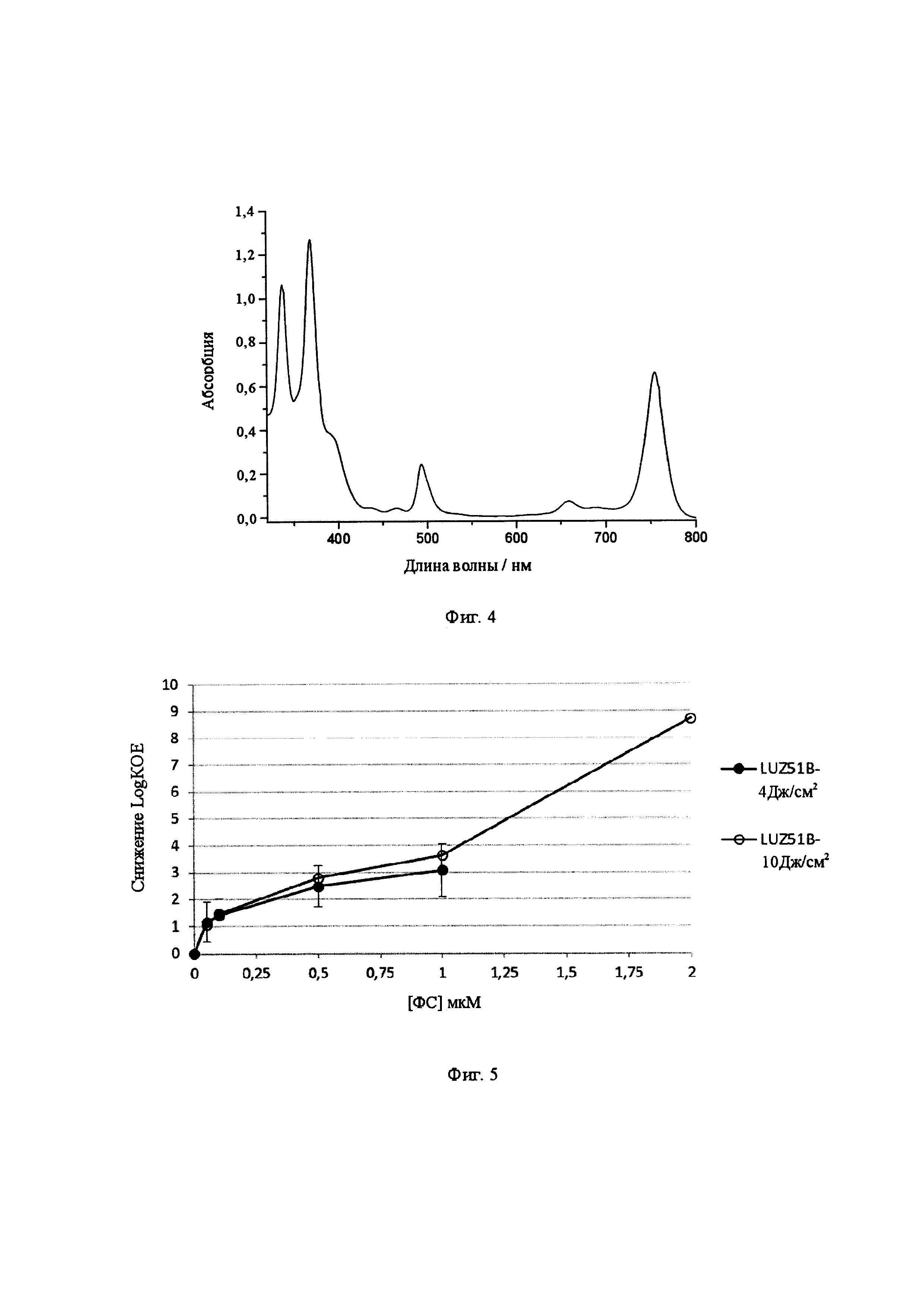
Фиг. 3: Спектры поглощения молекулы формулы (IX) в этаноле и ДМСО.
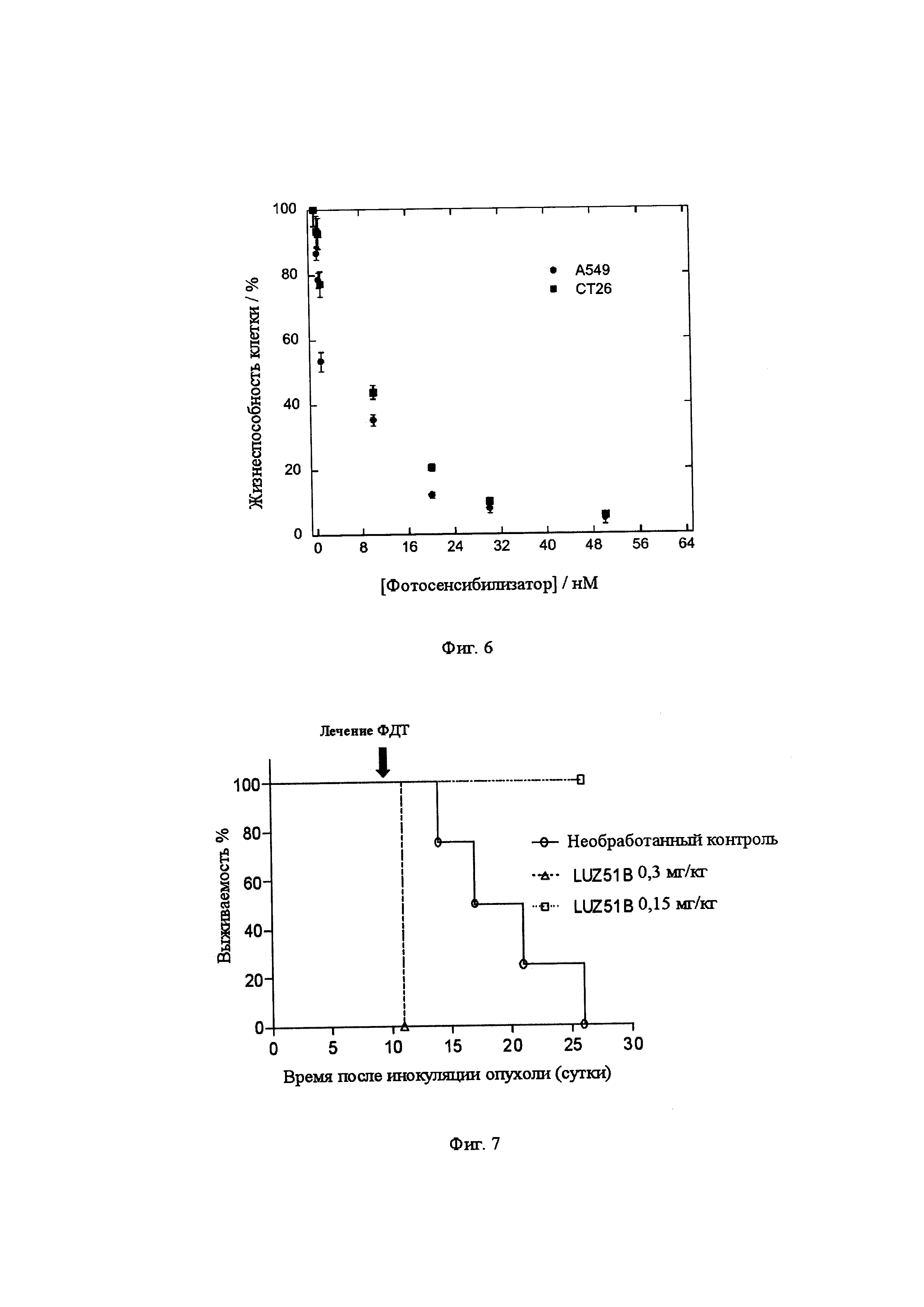
Фиг. 4: Спектры поглощения молекулы формулы (XIV) в дихлорметане.
Фиг. 5: Фототоксичность молекулы формулы (IX) в отношении Propionibacterium acnes после освещения при 4 Дж/см2 или 10 Дж/см2.
Фиг. 6: Фототоксичность молекулы формулы (IX) в отношении линий раковых клеток А549 и СТ26 после облучения (1 Дж/см2).
Фиг. 7. Кривые выживаемости Каплана-Майера для мышей с подкожно имплантированными опухолями СТ26, где сплошная линия представляет собой необработанную контрольную группу, пунктирная линия представляет собой группу, обработанную 0,3 мг/кг молекулы формулы (IX), и точечная пунктирная линия представляет собой группу, обработанную 0,15 мг/кг молекулы формулы (IX).
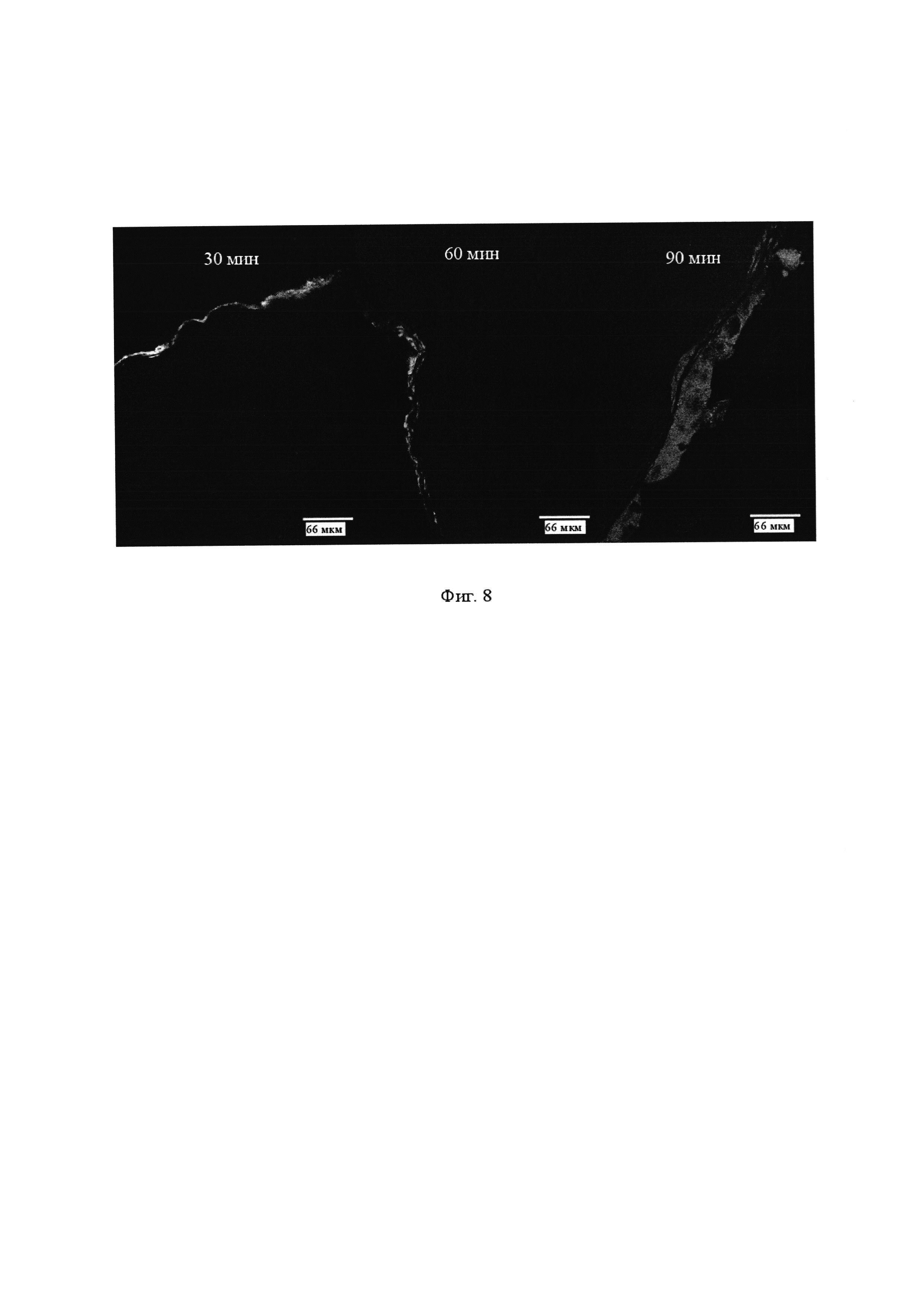
Фиг. 8. Конфокальная микроскопия образцов кожи, вырезанных перпендикулярно поверхности кожи, подвергнутых воздействию композиций для местного применения, содержащих молекулу формулы (IX), при инкубационных периодах 30, 60 и 90 минут, где более светлые области показывают флуоресценцию фотосенсибилизатора в коже.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Со ссылкой на графические материалы, в данном описании более подробно раскрыты дополнительные варианты осуществления, которые, однако, не ограничивают объем настоящей заявки.
А. Предшественники соединений
А.1. Предшественники 5,15-бис-(2,6-дифторфенил)порфирина
5,15-бис-(2,6-Дифторфенил)порфирин (формула V на Фиг. 1) получали с модификацией способа получения 5,15-дифенилпорфиринов (9а). Эквимолярной смеси коммерчески доступного 2,2'-дипиррометана и 2,6-дифторбензальдегида давали возможность взаимодействовать в присутствии трифторуксусной кислоты (ТФУ). После окисления 2,3-дихлор-5,6-дициано-1,4-бензохиноном (ДЦХ), обработки и очистки, соединение V получали с выходом 35% в достаточно большом количестве (приблизительно 5 г). Характеристика соединения V выглядит следующим образом:1Н ЯМР: (400 МГц, (CDCl3) δ м.д.: -3,05 (s, 2Н, -NH); 7,55-7,79 (t, 4Н, Ar-Н); 7,98-8,05 (m, 2Н); 9,03 (d, J=4,4 Гц, 4Н, β-Н); 9,41 (d, J=4,5 Гц, 4Н, β-Н); 10,32 (s, 2Н, мезо-Н); МС (ESI-FIA-TOF времяпролетная масс-спектрометрия с электрораспылительной ионизацией с применением флуоресцентных индикаторов): m/z вычислено для (C32H19F4N4) [М+Н]+ 535,1540, найдено: 535,1536 [М+Н]+.
[5,15-бис-(2,6-дифторфенил)порфиринато]цинка (II) (формула VI) получали путем комплексообразования 5,15-бис(2,6-дифторфенил)порфирина с ацетатом цинка (Zn(OAc)2) в смеси дихлометан : метанол 1:1. Раствор нагревали при магнитном перемешивании до полного расходования исходного материала. Раствор промывали водой, сушили безводным сульфатом натрия, фильтровали и концентрировали ротационным выпариванием; 4,3 г выделенного продукта получали с выходом 99%. ЯМР выделенного продукта выглядит следующим образом:1H ЯМР: (400 МГц, CDCl3) δ м.д.: 7,41-7,45 (t, 4Н, Ar-Н); 7,81-7,86 (m, 2Н, Ar-Н); 9,13 (d, J=4,3 Гц, 4Н, β-Н); 9,50 (d, J=4,5 Гц, 4Н, β-Н); 10,37 (s, 2Н, мезо-Н).
[5-бром-10,20-бис-(2,6-дифторфенил)порфиринато]цинка (II) (формула VII) синтезировали реакцией N-бромсукцинимида (БСИ) (298 мг ± 10 мг), растворенного в дихлорметане (ДХМ) (100±20 мл), добавленного по каплям к смеси 1 г [5,15-бис-(2,6-дифторфенил)порфиринато]цинка (II) в ДХМ (400±50 мл) и пиридина (1,35±0,5 мл) при -6°С. Через 1 ч реакцию завершали, добавляли воду (50±20 мл) и органический слой последовательно промывали раствором 0,1 М соляной кислоты (3 раза) и водой (3 раза). Растворитель выпаривали и очищали колоночной хроматографией на силикагеле (ДХМ/гексан). Получали соединение [5-бром-10,20-бис-(2,6-дифторфенил)порфиринато]цинка (II) с выходом 70±5% (790±40 мг).1Н ЯМР: (400 МГц, CDCl3) δ м.д.: 7,34-7,38 (m, 4Н, Ar-Н); 7,76-7,79 (m, 2Н, Ar-Н); 8,83 (s, 4Н, β-Н); 9,26 (d, J=4,5 Гц, 2Н, β-Н); 9,70 (d, J=4,7 Гц, 2Н, β-Н); 10,13 (s, 1H, мезо-Н).
5-Метиламид-10,20-бис-(2,6-дифторфенил)порфирин (формула VIII) получали с помощью реакции аминокарбонилирования. В автоклавный стальной реактор, содержащий стержень магнитной мешалки, загружали 4,0 г (5,9 ммоль) [5-бром-10,20-бис-(2,6-дифторфенил)порфиринато]цинка (II), 66,0 мг (0,3 ммоль) ацетата палладия (Pd(OAc)2), 155,0 мг (0,6 ммоль) трифенилфосфина, 0,8 мл (5,9 ммоль) триметиламина, 14,6 мл (29,5 ммоль) 2 М раствора метиламина в тетрагидрофуране (ТГФ) и 60,0 мл сухого ТГФ. Реактор закрывали и наполняли 5 бар (0,5 МПа) окиси углерода. Смесь перемешивали при 70°С и реакцию оставляли на 15 часов. Реакционную смесь переносили в кругл о донную колбу и растворитель удаляли в ротационном испарителе. Неочищенный реакционный остаток растворяли в ДХМ и добавляли ТФУ (10 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Обработку проводили жидкостно-жидкостной экстракцией с применением насыщенного раствора бикарбоната натрия и дистиллированной воды. Органический слой сушили безводным сульфатом натрия, фильтровали и в конце растворитель удаляли в ротационном испарителе. После колоночной хроматографии (силикагель, ДХМ : этилацетат, 20:1) получали 2,45 г выделенного продукта с выходом 70%. ЯМР и МС выделенного продукта выглядят следующим образом:1H ЯМР: (400 МГц, (CD3)2СО) δ м.д.: 3,14 (s, 2Н, -NH); 3,56 (d, J=4,2 Гц, 3Н, -СН3); 7,63 (t, J=8,2 Гц, 4Н, Ar-Н); 8,04-8,11 (m, 2Н, Ar-Н); 8,49 (bs, 1Н, -NH); 9,09 (m, 4Н, β-Н); 9,63 (d, 2Н, J=4,5 Гц, β-Н), 9,56 (d, 2Н, J=4,7 Гц, β-Н); 10,60 (s, 1Н, мезо-Н). МС (ESI-FIA-TOF): m/z вычислено для C34H22F4N5O: 592,1760; найдено: 592,1751 [М+Н]+.
А2. Предшественники 5,15-бис-(трифторметил)порфирина
[5,15-бис-(трифторметил)порфиринато]цинка (II) (формула XI на Фиг. 1) получали с применением ранее описанного способа (9b). Характеристика соединения XI выглядит следующим образом:1Н ЯМР: (400 МГц, ТГФ-d8) δ м.д.: 9,67 (d, J=4,0, β-Н); 9,88 (bs, β-Н); 10,57 (s, 2Н, мезо-Н).
[5-Бром-10,20-бис-(трифторметил)порфиринато]цинка (II) (формула XII) получали реакцией N-бромсукцинимида (БСИ), растворенного в дихлорметане, добавленного по каплям к смеси [5,15-бис-(трифторметил)порфиринато]цинка (II) в дихлорметане и пиридина при -6°С. Через 1 ч реакцию завершали. Добавляли воду и органический слой последовательно промывали раствором 0,1 М соляной кислоты (3 раза) и водой (3 раза). Растворитель выпаривали досуха и соединение применяли на следующей стадии реакции.
5-Метиламид-10,20-бис-(трифторметил)порфирин (формула XIII) получали с помощью реакции аминокарбонилирования. В автоклавный стальной реактор, содержащий стержень магнитной мешалки, загружали [5-бром-10,20-бис-(трифторметил)порфиринато]цинк (II), ацетат палладия, трифенилфосфин, триэтиламин, метиламин и сухой ТГФ. Реактор закрывали и наполняли до давления 10 бар (1 МПа) окиси углерода. Смесь перемешивали при 70°С и реакцию оставляли на 15 часов. Реакционную смесь переносили в круглодонную колбу и растворитель удаляли в ротационном испарителе. Неочищенный реакционный остаток растворяли в дихлорметане и добавляли трифторуксусную кислоту. Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 2 часов. Обработку проводили жидкостно-жидкостной экстракцией с применением насыщенного раствора бикарбоната натрия и дистиллированной воды. Органический слой сушили безводным сульфатом натрия, фильтровали и в конце растворитель удаляли в ротационном испарителе. После колоночной хроматографии (силикагель, дихлорметан:гексан) продукт выделяли. Характеристика соединения XIII выглядит следующим образом:1Н ЯМР: (400 МГц, ТГФ-d8) δ м.д.: -2,84 (s, 2Н, -NH); 3,56 (d, J=4,2 Гц, 3Н, -СН3); 8,72 (bs, 1H, -NH); 9,66-9,68 (m, 4Н, β-Н); 9,80 (bs, 4Н, β-Н); 10,62 (s, 1Н, мезо-Н).
В. Материалы и способы
Элементные анализы выполняли на элементном анализаторе Leco TruSpec CHNS.1Н-ЯМР и19F-ЯМР и спектры регистрировали на Bruker Avance 400 МГц. 1Н-назначения выполняли с применением экспериментов 2D COZY и NOESY, данные масс-спектрометрии с высоким разрешением ESI-FIA TOF получали с применением масс-спектрометра Micromass Autospec. ВЭЖХ Shimadzu Prominence оснащена диодно-матричным детектором (модель SPD 20 AV). Разделения наблюдали при 743 нм, 23°С на полупрепаративной колонке Inertsil-Phenyl (250×10 мм, 5 мкм).
Оптическое поглощение: оптическое поглощение в ультрафиолетовой, видимой и ближней инфракрасной областях регистрировали спектрофотометром Agilent Cary5000 UV-Vis-NIR при определении молярного показателя поглощения и спектрометром Shimadzu UV-2100 при обычных измерениях. Спектры поглощения регистрировали на длинах волн от 300 нм до 800 нм.
Флуоресценция: Спектры флуоресценции регистрировали на самодельной установке, состоящей из Horiba-Jobin Fluoromax 4, применяемой для возбуждения образцов, подключенной к держателю образца через оптическое волокно. В держателе образца, перпендикулярном к волокну, передающему возбуждение, оптическое волокно подключено для управления светом к спектрофотометрическому детектору Avantes модели SensLine, поставляемому с AvaSoft 7.7.2. Щель возбуждения устанавливали равной 2 мм, а время интеграции составляло 3 с, со средним количеством 3. Спектры регистрировали от 200 нм до 1100 нм с применением стандартных кювет 1 см оптического пути. Получали квантовые выходы флуоресценции (ФF), сравнивая общую флуоресценцию образцов с эталонным флуориметрическим соединением, имеющим известный ФF.
Время жизни флуоресценции: Время жизни флуоресценции определяли на самодельном оборудовании, состоящем из светодиода, который генерирует световой импульс для возбуждения образца, держателя образца, детектора и оптики. Длина волны возбуждения составляла 373 нм, и излучение регистрировали при 737 нм. Сигнал регистрировали с применением 1024 каналов с временной шкалой 28,5 пс на канал.
Переходное поглощение: триплетно-триплетное переходное поглощение регистрировали на спектрометре лазерного импульсного фотолиза Applied Photophysics LKS.60, с помощью осциллографа Hewlett-Packard Infinium и лазера Nd-YAG Spectra-Physics Quanta-Ray GRC-130 в качестве источника возбуждения. Импульсное возбуждение устанавливали на уровне 355 нм.
Квантовый выход синглетного кислорода: эксперименты проводили при комнатной температуре с применением лазера Nd-YAG Spectra-Physics Quanta-Ray GRC-130. Растворы возбуждали при 355 нм и фосфоресценцию синглетного кислорода регистрировали при 1270 нм в фотоумножителе Hamamatsu R5509-42, охлажденном до 193 K (-80,15°С) в камере с жидким азотом, после выбора длины волны с помощью монохроматора с градуировкой по 600 линиям. Феналенон применяли в качестве эталонного генератора синглетного кислорода. При излучении применяли модель фильтра Ньюпорт 10LWF-1000-B, чтобы избежать рассеяния и флуоресценции.
Фотоакустическая калориметрия: тепловую энергию, высвобождаемую после электронного возбуждения, измеряли фотоакустической калориметрией с временным разрешением с применением фотоакустической ячейки облучения фронтальной стороны и EKSPLA ОРО модели PG-122, накачиваемой EKSPLA Nd:YAG. Обнаружение сигнала осуществляли с применением преобразователя Panametrics 2,25 МГц. Возбуждение составляло 690 нм, а в качестве эталона фотоакустической калориметрии применяли азулен.
Отношение распределения н-октанол:РВ8: для определения равновесных концентраций фотосенсибилизатора в н-октаноле и в фосфатно-солевом буферном растворе (PBS), смешанном в равных объемах, применяли модификацию способа встряхиваемой колбы с применением типичной полосы флуоресценции одного и того же фотосенсибилизатора и калибровочные кривые.
Эксперименты по фотообесцвечиванию проводили в метаноле:РВ8 (3:2) и в органических растворителях. Растворы облучали в кювете с оптическим путем 1 см с применением лазера с непрерывной генерацией, излучающего при 749±3 нм от Omicron Laserage. Общая выходная мощность составляла 212 мВт или 244 мВт. Для каждого соединения поглощение регистрировали в промежутках времени от нескольких минут до нескольких часов облучения.
Фототоксичность по отношению к бактериям оценивали in vitro по отношению к Р. acnes (АТСС® 6919 - Remel, Lenexa, KS, USA) с применением света с соответствующей длиной волны. Бактерии P. acnes культивировали в усиленной клостридиальной среде (Oxoid, Basingstok, UK) в анаэробных условиях при 37°С. Анаэробные условия роста обеспечивали применением анаэростата с саше для генерации анаэробных состояний (Anaerocult A, Merck, Darmstadt, Germany). Суспензию P. acnes разбавляли культуральной средой до оптической плотности 1,3 при 620 нм, что соответствовало приблизительно 1×107 КОЕ/мл (колониеобразующие единицы на миллилитр). Разведенную суспензию центрифугировали при 13000 об/мин в течение 10 минут и повторно суспендировали в PBS. Стоковые растворы исследуемого соединения растворяли в ПЭГ 400:ДМСО (пропиленгликоль 400: диметилсульфоксид) (55:45) и разбавляли до соответствующих концентраций с помощью PBS. Инкубацию исследуемых соединений с P. acnes проводили в черных 96-луночных планшетах DB Falcon с прозрачным плоским дном (Franklin Lakes, NJ, USA) в отсутствие света в течение 30 минут. После инкубационного периода планшеты облучали светодиодным светом от Marubeni (модель L740-66-60-550), максимум излучения при 740 нм с полной шириной на половине высоты равной 25 нм, соответствующий возбуждению бактериохоринов, для общей дозы света 4 или 10 Дж/см2. После облучения содержимое каждой лунки центрифугировали при 13000 об/мин в течение 10 минут и повторно суспендировали в культуральной среде. Планшет с P. acnes инкубировали при 37°С в течение 24 ч в анаэробных условиях. После инкубационного периода оценивали жизнеспособность P. acnes. Бактериальные суспензии в лунках планшета разбавляли культуральной средой и высевали в чашки Петри с усиленным клостридиальным агаром (Oxoid, Basingstok, UK) для дальнейшего подсчета КОЕ. Чашки Петри инкубировали при 37°С в течение по меньшей мере 72 ч в анаэробных условиях.
Фототоксичность по отношению к линиям раковых клеток оценивали in vitro с применением клеточных линий А549 (аденокарцинома легкого человека) и СТ26 (мышиная аденокарцинома толстой кишки). Клетки культивировали в модифицированной Дульбекко среде Игла (ДМЕМ), дополненной 10% термоинактивированной фетальной бычьей сывороткой и 1% пенициллина. Клетки высевали с плотностью 20000/лунку и 15000/лунку соответственно, в 96-луночные планшеты с плоским дном. На следующий день получали разбавленные растворы исследуемого соединения (1 мМ стокового раствора) и добавляли к клеткам для 30-минутной инкубации. Концентрация ПЭГ400:ДМСО (55:45) в среде не превышала 1%. Лунки дважды промывали PBS и облучали после 30-минутной инкубации с применением описанного выше светодиода. Доза света составляла 1 Дж/см2. Среду заменяли свежей после облучения и планшеты инкубировали в течение 24 ч, после чего жизнеспособность клеток оценивали по способу резазурина с применением спектрофотометра для чтения микропланшетов (Synergy НТ Biotek).
Фотодинамическая терапия самок мышей BALB/c, имеющих опухоли, была одобрена Национальным ветеринарным управлением (разрешение DGVA №0420/000/000/2011). Мышей весом 18-20 г (Charles River Laboratories, Барселона, Испания) содержали на стандартной лабораторной диете со свободным доступом к питьевой воде. Модель опухоли была установлена с применением 350000 клеток СТ26 (CRL-2638™, ATCC-LCG Standards, Барселона, Испания) в 0,1 мл PBS и клетки инокулировали подкожно в правое бедро каждой мыши. Источник света, применяемый для ФДТ in vivo, представлял собой изготовленный по заказу полупроводниковый диодный лазер модели LDM750.300.CWA.L.M с контроллером 1201-08Р и лазерной головкой 1201-08D (Omicron, Родгау, Германия), соединенный оптическим волокном с фиксированной рассеивающей линзой, модель FD диаметром 2 мм (Medlight, Экюблан, Швейцария).
Проницаемость кожи оценивали с применением состава для местного применения, содержащего бензиловый спирт (23%), коллифор EL (17%), транскутол (50%) и воду (10%). Добавляемый к этому составу фотосенсибилизатор соответствовал 1,85% массы перед его добавлением, а добавляемый гелеобразователь (Aerosil 200) соответствовал 5% массы перед его добавлением. Фотосенсибилизатор сначала растворяли в транскутоле и подвергали перемешиванию на вихревой мешалке в течение 3 мин и ультразвуку в течение 5 мин. Затем добавляли смесь бензилового спирта и коллифора EL. Сразу же после этого смесь перемешивали в смесителе IKA со скоростью 200 об/мин в течение 5 мин, а воду добавляли по каплям в течение 10 мин. В конце в смесь вводили гелеобразующий агент Aerosil 200 и получали гель микроэмульсии. Исследования проницаемости кожи выполняли на коже свиней с применением образцов, собранных у 5-месячных свиней. Перед исследованием проницаемости удаляли волосы, а также подлежащий жировой слой.
С. Свойства соединений
Поглощающую способность соединений измеряли в нескольких концентрациях в диапазоне мкМ и во всех случаях наблюдали в соответствии с законом Бэра-Ламберта. Кроме того, длина волны максимального поглощения (λmax) в инфракрасном диапазоне не изменялась в изученном диапазоне концентраций. Это свидетельствует о незначительной агрегации между молекулами, которые в основном являются мономерами в этих концентрациях в изученных растворителях. В таблице 1 представлен показатель инфракрасного молярного поглощения (εmax) и максимум длины волны в этаноле типичного производного карбоксамидного галогенированного бактериохлорина формулы (I). В той же таблице также представлены времена жизни триплетных состояний (τT) в воздухе и насыщенных растворах N2, время жизни флуоресценции (τS), квантовые выходы флуоресценции (ФF), образование триплетного состояния (ФT) и генерация синглетного кислорода (ФΔ) в этаноле и квантовый выход фотодеградации (Фрd) в метаноле:РВ8 (3:2). Триплетные распады были явно моноэкспоненциальными, а в воздухонасыщенном этаноле времена жизни триплетных состояний составляли от 200 до 300 наносекунд. Такие значения согласуются с диффузионно-ограниченным переносом энергии из триплетного состояния фотосенсибилизатора на молекулярный кислород через взаимодействие с переносом заряда (8). Интенсивность поглощения исследуемых соединений в исследованиях фотообесцвечивания сопровождалась моноэкспоненциальным уменьшением в зависимости от времени освещения.

Типичные фотофизические, фотохимические и фотобиологические свойства карбоксамидных производных порфиринов, в частности бактериохлоринов или хлоринов, формулы (I) устраняют недостаток, указанный выше в отношении современных фотосенсибилизаторов, используемых в ФДТ. В частности, молекулы формулы (I) могут иметь низкие молекулярные массы и могут обладать высокой способностью проникновения через биологические мембраны. Время инкубации, применяемое для получения фототоксичности, показанное в таблице 1, составляло всего 30 минут, тогда как время инкубации 18 часов применяли для получения значений IC50 для порфимера натрия и темопорфина, рассмотренных выше. Кроме того, величина значения IC50 бактериохлоринов или хлоринов формулы (I) может быть на несколько порядков ниже, чем у порфимера натрия или темопорфина, что означает, что бактериохлорины или хлорины формулы (I) достигают той же фототоксичности, что и клинически одобренные фотосенсибилизаторы при на порядок меньших величинах концентрации. Это позволит таким фотосенсибилизаторам достичь концентрации, необходимой для того, чтобы вызвать терапевтический эффект в течение короткого периода взаимодействия с защитным биологическим барьером. Кроме того, карбоксамидная группа обеспечивает достаточную амфифильность для биосовместимости и пересечения биологических барьеров, а именно приводит к значениям log Pow от 1 до 3. Этот заместитель вместе с атомами галогена в заместителях в мезо-положениях также способствует повышению фотостабильности производных порфирина формулы (I), что сопоставимо с производными клинически одобренных фотосенсибилизаторов.
Сочетание фотостабильности, сильного поглощения в фототерапевтическом окне, высокого выхода ROS и амфифильности дает еще одну выгодную техническую характеристику для производных порфирина формулы (I): очень высокая фототоксичность по отношению к бактериям и раковым клеткам. В таблице 1 представлен пример фотосенсибилизатора по формуле (I), который инкубировали в концентрации 2 мкМ с колониями P. acnes и освещали 10 Дж/см2 света, поглощаемого его красной полосой поглощения, уменьшающий на 9 порядков величину количества бактериальных КОЕ. Не менее впечатляет фототоксичность в отношении раковых клеток. Дозы фотосенсибилизатора, которые уничтожают более 50% популяции раковых клеток in vitro (IC50) при дозе света 1 Дж/см2, составляют менее 10 нМ.
Способность производных порфирина, в частности бактериохлорина или хлорина, формулы (I) пересекать защитные биологические барьеры и быстро диффундировать к своим мишеням, в сочетании с их высокой фототоксичностью при освещении светом в фототерапевтическом окне, делает такие бактериохлорины или хлорины особенно подходящими для противораковых и/или противомикробных и/или противовирусных и/или противогрибковых лекарственных средств для применения человеком или животным, с применением одного или нескольких производных порфирина, описанных в настоящем изобретении, в качестве основного активного агента. Такой тип лекарственного средства, применяемый, в частности, в ФДТ, также может содержать один или более фармацевтически приемлемых эксципиентов. При ФДТ фармацевтическую композицию, содержащую одно или более соединений, описанных в настоящем изобретении, вводят субъекту либо местно, перорально, либо системно, и через некоторое время (интервал между введением лекарственного средства и освещением) ткань-мишень освещают светом, поглощаемым производными порфиринов, предпочтительно бактериохлоринов или хлоринов. Процент фотосенсибилизатора, присутствующего в композиции для местного применения, может варьировать от 0,01% до 15%. Доза света, применяемого для активации фотосенсибилизатора при местном нанесении, также может варьировать, и могут потребоваться дозы от 1 до 100 Дж/см2. Такие дозы света могут быть обеспечены источниками света, которые соответствуют полосе поглощения фотосенсибилизатора в фототерапевтическом окне, при условии, что эти источники света имеют облучение ниже начала тепловых эффектов, близкое к 250 мВт/см2. Альтернативно, дозы света можно назначать в течение длительного периода времени, включая применение солнечного облучения в областях нанесения композиции для местного применения. Системное введение фотосенсибилизаторов, используемых в ФДТ, осуществляют с применением фармацевтически приемлемых носителей для получения доз фотосенсибилизатора от 0,1 до 10 мкмоль/кг массы тела. После интервала между введением лекарственного средства и освещением, который может варьировать от параллельного введения лекарственного средства до 5 суток после введения, дозу света направляют к цели. Реактивные виды кислорода, генерируемые освещаемыми молекулами фотосенсибилизатора, вызывают каскад химических и биологических процессов, которые приводят к гибели клеток и/или бактерий и/или вирусов.
Соединения по настоящему изобретению могут также флуоресцировать с высокими квантовыми выходами и в фототерапевтическом окне. В таблице 1 представлен пример фотосенсибилизатора с ФF равным 0,20. Эта типичная флуоресценция может быть использована для обнаружения присутствия соединения в ткани-мишени и делает возможным применение соединений по настоящему изобретению для диагностики сосудистых или гиперпролиферативных расстройств.
Соединения по настоящему изобретению также теряют энергию за счет безызлучательных процессов с высокими квантовыми выходами. В таблице 1 представлен пример фотосенсибилизатора с ФF, равным 0,20 и ФТ, равным 0,45, который должен иметь внутренний квантовый выход преобразования Фic равный 0,35. Тепловая энергия, потерянная в течение жизни 3,2 нс синглетного состояния, обеспечивает быстрое термоупругое расширение, которое провоцирует возбуждение интенсивной фотоакустической волны. Ультразвуковые преобразователи могут быть применены для обнаружения фотоакустических волн, как описано выше для фотоакустической калориметрии. Альтернативно, их можно обнаружить с помощью фотоакустической томографии и применять при диагностике сосудистых или гиперпролиферативных расстройств.
D. Описание способов получения соединений
Другая цель настоящего изобретения относится к способу получения производных, описанных выше.
Несимметричные 5,15-дизамещенные порфирины получали модификацией способа конденсации-циклизации коммерчески доступного 2,2'-дипиррометана с галогенированными альдегидами с применением ТФУ в качестве катализатора в ДХМ в инертной атмосфере (10), с последующей стадией окисления порфириногена до соответствующего порфирина с помощью ДЦХ в качестве окислителя. Следующие стадии включают металлирование 5,15-дизамещенных порфиринов ацетатом цинка в растворе ДХМ/метанол (1:1) (11), с последующим моно- или дигалогенированием 10 или 10,20-порфириновых положений. Комплекс порфиринат-цинк(II) бромировали БСИ, хлорировали N-хлорсукцинимидом (ХСИ), йодировали бис(трифторацетокси)иодбензолом или 2,6-дихлор-1-фторпиридиний трифлатом (9а). Хотя реакция аминокарбонилирования является стандартным способом получения карбоксамидов из арилгалогенидов или арилтрифлатов и аминов, аминокарбонилирование порфиринов не является обычным (12). Карбоксамидные порфирины получали путем аминокарбонилирования соответствующих галогенированных предшественников, предпочтительно бромированного, с метиламином при низких уровнях давления окиси углерода (1-10 бар) (0,1-1 МПа) и температуре от 50 до 100°С в присутствии основания и с применением катализатора комплекса переходного металла (MLn). Металл может быть выбран из молибдена, хрома, никеля или, предпочтительно палладия. Лиганды в комплексе переходного металла могут быть выбраны из 1,2-бис(дифенилфосфино)этана (DPPE), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (Ксантфос), 1,2-бис(дифенилфосфино)пропана (DPPP), 1,2-бис(дифенилфосфино)бутана (DPPB), 2,2'-бис(дифенилфосфино)-1,1'-бинафтила (BINAP), бис-[2-(дифенилфосфино)фенил]эфира (DPEPhos), 2-ди-трет-бутилфосфино-2',4',6'-триизопропилбифенила (t-BuXpho), три-н-алкилфосфина или, предпочтительно трифенилфосфина (PPh3). Основание может быть неорганическим и выбрано из карбонатов, фосфатов или оснований, содержащих фтор. Основание также может быть органическим и выбрано из аминов, предпочтительно триэтиламина. Растворитель может быть выбран из толуола, диоксана, N-метил-2-пирролидона (NMP), диметилформамида (ДМФ), ДХМ или ТГФ. Также могут быть применены альтернативные источники СО, а именно (М(СО)n), где М представляет собой Мо или Со. Схематически получение предшественников порфирина может быть описано следующим образом
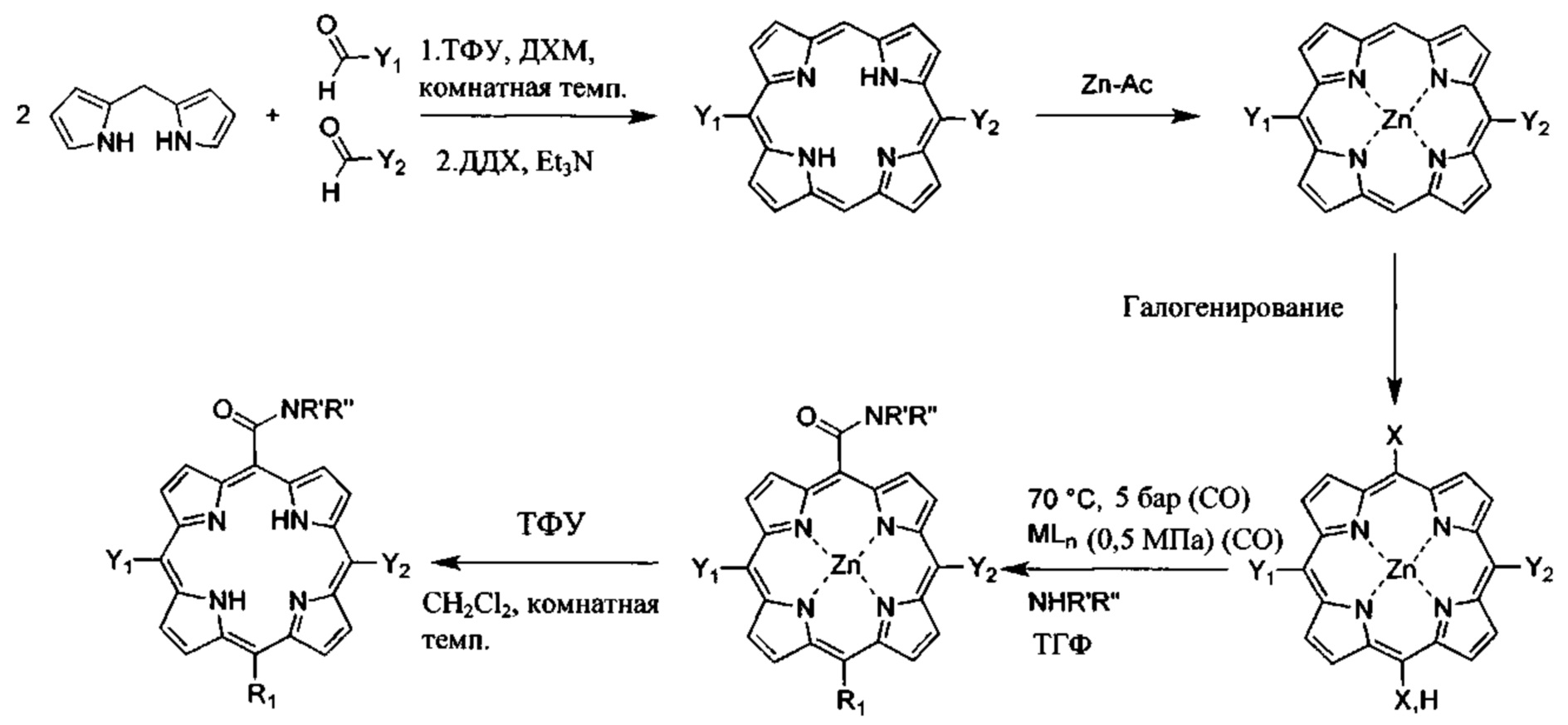
Где:
Y1, Y2 каждый независимо выбран из водорода, галогенированного алкила или галогенированного циклоалкила с 6 или менее атомами углерода или галогенированного фенила, где галогены независимо выбраны из F, Cl и Br, при условии, что алкил, циклоалкил или фенил по меньшей мере в одном положении галогенирован, и при условии, что по меньшей мере один из Y1, Y2 не является водородом;
R1 выбран из Н, F, Cl, Br или -CONR'R'';
R' и R'' независимо выбраны из водорода, алкила с 6 или менее атомами углерода, циклопропила, циклобутила, циклопентила, спирта, первичного амина, вторичного амина, третичного амина, положительно заряженного четвертичного амина, карбоновой кислоты, простого эфира или сложного эфира.
Затем предшественники карбоксамидных галогенированных порфиринов применяют для получения соответствующих восстановленных бактериохлоринов или хлоринов. Восстановление основано на способе восстановления диимида с использованием гидразида в качестве источника водорода, предпочтительно с применением п-толуолсульфонилгидразида (p-TSH), неорганических или затрудненных органических оснований, в растворителях, выбранных из ДМФ, толуола, ксилола, пиридина и пиколина, с применением модифицированного способа, раскрытого в РСТ/ЕР 2005/012212. Восстановление также может проходить в отсутствие растворителей и в отсутствие оснований с применением модифицированного способа, раскрытого в РСТ/РТ 2009/000057. Восстановление карбоксиамидного порфирина до соответствующего бактериохлорина или хлорина может быть описано следующим образом:
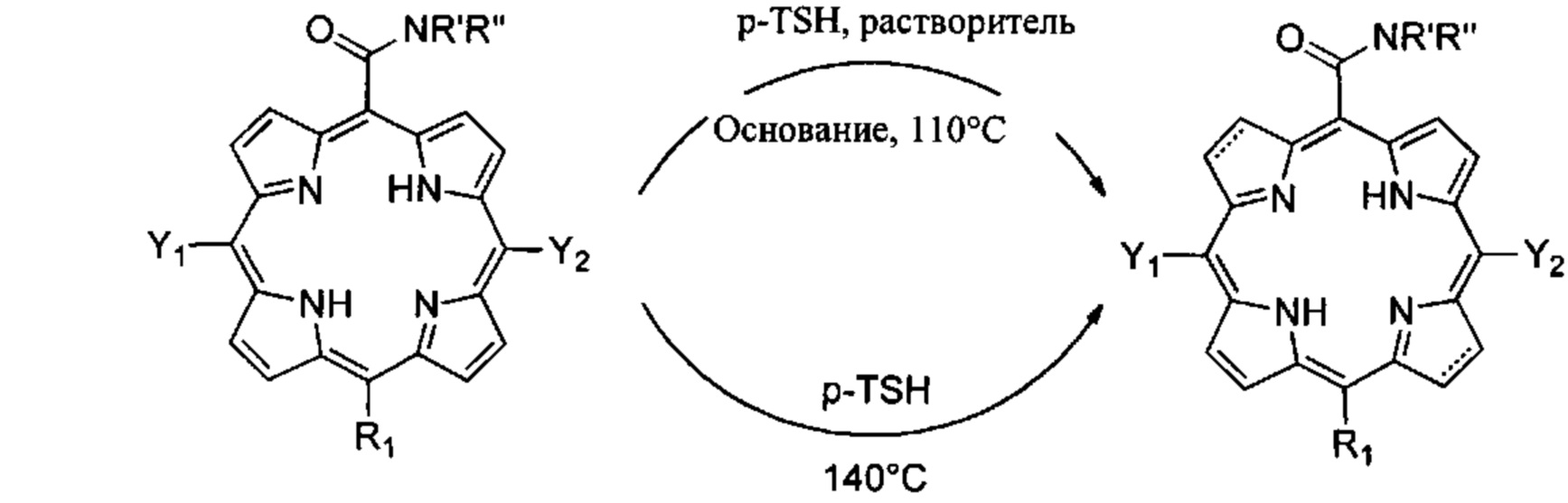
где


ПРИМЕРЫ
Настоящее изобретение далее будет описано более подробно в следующих неограничивающих примерах со ссылкой на следующие графические материалы:
Пример 1. Способ получения 5-метилкарбоксамид-10,20-бис-(2,6-дифторфенил)хлорина
Синтез 5-метилкарбоксамид-10,20-бис-(2,6-дифторфенил)хлорина проводили реакцией п-толуолсульфонилгидразида (504±10 мг) с 5-метилкарбоксамид-10,20-бис-(2,6-дифторфенил)порфирином (VIII) (100±10 мг), карбонатом калия (374±10 мг) и пиридином (15 мл) или, альтернативно без растворителя в инертной атмосфере и при нагревании от 100°С до 150°С в течение 2 ч. После охлаждения до комнатной температуры добавляли ДХМ (приблизительно 50 мл) и органический слой промывали раствором соляной кислоты (0,1 М) (3 раза) и водой (3 раза). Органическую фазу сушили безводным сульфатом натрия, фильтровали и затем концентрировали. Твердое вещество растворяли в этилацетате (20 мл) и добавляли раствор хлоранила (0,6 экв.) в этилацетате (5 мл). Конечный раствор выдерживали при перемешивании при 45°С. Реакцию останавливали при исчезновении ультрафиолетового и видимого пика поглощения бактериохлорина (приблизительно 740 нм). Растворитель выпаривали и неочищенный остаток растворяли в ДХМ (50 мл), а затем промывали насыщенным раствором бикарбоната натрия, дистиллированной водой и затем сушили над безводным сульфатом натрия. Растворитель выпаривали и очищали колоночной хроматографией с силикагелем (ДХМ). 5-метилкарбоксамид-10,20-бис-(2,6-дифторфенил)хлорин, содержащий два изомера (формула Ха и Xb), показанный на Фиг. 2, был получен с выходом 80±5% (80±5 мг). ЯМР и МС выделенного продукта выглядят следующим образом:
Формула Ха:
1Н-ЯМР (400 МГц, (CD3)CO) δ (м.д.): -1,89 (s, 1Н, NH); -1,59 (s, 1H, NH); 3,34 (d, J=4,6 Гц, 3H, CH3); 4,33-4,37 (m, 2H, β-H); 4,76-4,80 (m, 2H, β-H); 7,49-7,55 (m, 4H, Ar-H); 7,89-7,99 (m, 2H, Ar-H); 8,29 (bs, 1H, NH); 8,44 (d, J=4,4 Гц, 1H, β-H); 8,48 (d, J=4,4 Гц, 1H, β-H); 8,82 (d, J=4,2 Гц, 1H, β-H); 8,99 (d, J=4,5 Гц, 1H, β-H); 9,06 (d, J=4,2 Гц, 1H, β-H); 9,25 (s, 1H, мезо-Н); 9,27 (d, J=4,5 Гц, 1H, β-H).
19F ЯМР: (376,5 МГц, (CD3)2CO) δ м.д.: -110,47 (s, 2F, Ar-F); -111,53 (s, 2F, Ar-F).
MC ESI-FIA-TOF: рассчитано для (C34H24F4N5O) [M+H]+: 594,1911, получено [М+Н]+: 594,1911.
Формула Xb:
1Н-ЯМР (400 МГц, (CD3)CO) δ (м.д.): -1,79 (s, 1Н, NH); -1,63 (s, 1Н, NH); 3,37 (d, J=4,6 Гц, 3Н, СН3); 4,33-4,37 (m, 2Н, β-Н); 4,68-4,72 (m, 2Н, β-Н); 7,50-7,56 (m, 4Н, Ar-Н); 7,90-8,04 (m, 3Н, Ar-H + NH); 8,46 (d, J=4,4 Гц, 1Н, β-Н); 8,52 (d, J=4,2 Гц, 1H, β-Н); 8,83 (d, J=4,6 Гц, 1H, β-Н); 8,97 (d, J=4,6 Гц, 1Н, β-Н); 9,05 (d, J=4,3 Гц, 1H, β-Н); 9,37 (d, J=4,4 Гц, 1H, β-Н); 10,05 (s, 1Н, мезо-Н).
19F ЯМР: (376,5 МГц, (CD3)2CO) δ м.д.: -110,47 (s, 2F, Ar-F); -111,52 (s, 2F, Ar-F).
MC ESI-FIA-TOF: рассчитано для (C34H24F4N5O) [М+Н]+: 594,1911, получено [М+Н]+: 594,1912.
Пример 2. Получение 5-метилкарбоксамид-10,20-бис-(2,6-дифторфенил)бактериохлорина
Способ на веществах в твердой фазе: синтез 5-метилкарбоксамид-10,20-бис-(2,6-дифторфенил)бактериохлорина (IX) осуществляли реакцией п-толуолсульфонилгидразида (2,52±0,05 г) с 5-метилкарбоксамид-10,20-бис-(2,6-дифторфенил)порфирином (0,2±0,05 г) при давлении ниже 6×10-1 мбар (6 Па) при нагревании (140±1°С) в течение 60 минут. После охлаждения до комнатной температуры неочищенную реакционную смесь растворяли и очищали хроматографией. 5-метилкарбоксамид-10,20-бис-(2,6-дифторфенил)бактериохлорин получали с выходом 80±5% (160±20 мг).
Способ с растворителем: синтез 5-метилкарбоксамид-10,20-бис-(2,6-дифторфенил)бактериохлорина (IX) осуществляли реакцией п-толуолсульфонилгидразида (12,5±0,05 г) с 5-метилкарбоксамид-10,20-бис(2,6-дифторфенил)порфирином (1±0,05 г), карбонатом калия (4,6±0,05 г), 2-метилпиридином (20 мл) и толуолом (40 мл) в инертной атмосфере и при нагревании (110±2°С) в течение 3 часов. После охлаждения до комнатной температуры добавляли ДХМ (приблизительно 400 мл) и последовательно промывали раствором соляной кислоты (0,1 М) (3 раза), водой (3 раза), гидроксидом натрия (0,05 М) (3 раза) и водой (3 раза). Органическую фазу сушили безводным сульфатом натрия, фильтровали и затем концентрировали. Растворитель выпаривали и очищали хроматографией. 5-метилкарбоксамид-10,20-бис-(2,6-дифторфенил)бактериохлорин получали с выходом 75±5% (750±50 мг).
Спектры поглощения соединения IX в этаноле и ДМСО представлены на Фиг. 3. ЯМР, МС и ЭА выделенного продукта выглядят следующим образом:
1Н-ЯМР (400 МГц, (CD3)CO) δ (м.д.): -1,52 (s, 1Н, NH); -1,56 (s, 1Н, NH); 3,30 (d, J=4,7 Гц, 3Н, СН3); 4,11-4,16 (m, 4Н, β-Н); 4,43-4,45 (m, 2Н, β-Н); 4,53-4,57 (m, 2Н, β-Н); 7,44-7,48 (m, 4Н, Ar-Н); 7,81-7,90 (m, 3Н, Ar-H + NH); 8,14-8,16 (m, 1Н, β-Н); 8,22-8,23 (m, 1Н, β-Н); 8,63-8,65 (m, 1H, β-Н); 8,78-8,80 (m, 1Н, β-Н); 8,94 (s, 1Н, мезо-Н).
19F ЯМР: (376,5 МГц, (CD3)2CO) δ м.д.: -110,70 (s, 2F, Ar-F); -111,76 (s, 2F, Ar-F).
MC ESI-FIA-TOF: рассчитано для (C34H26F4N5O) [М+Н]+: 596,2066, получено [М+Н]+: 596,2057.
Элементный анализ (C34H26F4N5O.1/2(H2O)): вычислено С 67,37, Н 4,33, N 11,58, найдено С 67,37, Н 4,13, N 10,99.
Пример 3. Получение 5-метилкарбоксамид-10,20-бис-(трифторметил)бактериохлорина
Синтез 5-метилкарбоксамид-10,20-бис-(трифторметил)бактериохлорина (формула XIV) проводили с применением условий синтеза и очистки способа с растворителем, описанного в примере 2. Спектр поглощения соединения XIV в дихлорметане представлен на Фиг. 4. Характеристика ЯМР выделенного продукта выглядит следующим образом:
1Н-ЯМР: (400 МГц, CDCl3) δ м.д.: -1,00 (s, 1Н, NH); -1,07 (s, 1H, NH); 3,30 (d, J=4,7 Гц, 3Н, СН3); 4,44-4,48 (m, 2Н, β-Н); 4,52-4,55 (m, 2Н, β-Н); 4,61-4,65 (m, 2Н, β-Н); 8,05 (bs, 1Н, -NH); 8,75-8,76 (m, 1Н, β-Н); 8,84-8,86 (m, 1Н, β-Н); 8,96 (bs, 2Н, β-Н + мезо-Н); 9,03-9,05 (m, 1Н, β-Н).
Пример 4. Фототоксичность in vitro по отношению к Propionibacterium acnes после облучения светом
Настоящий пример описывает оценку фототоксичности in vitro карбоксамидного бактериохлорина формулы IX после облучения светом и его потенциал для применения в ФДТ при лечении обыкновенных угрей. Фототоксичность измеряли в соответствии с описанием в разделе "Материалы и способы". Отношение распределения н-октанол:РВ8 соединения IX составляет POW равный 2,9±0,5. Подходящий состав для такого карбоксамидного бактериохлорина представляет собой ПЭГ400:ДМСО (55:45). Фототоксичность исследуемого соединения пропорциональна ингибированию жизнеспособности P. acnes относительно необработанного контроля и представлена на Фиг. 5 в виде снижения КОЕ в зависимости от концентрации фотосенсибилизатора для доз света 4 и 10 Дж/см2.
Пример 5. Фототоксичность in vitro по отношению к линиям раковых клеток А549 и СТ26 после облучения светом
Настоящий пример описывает оценку фототоксичности in vitro карбоксамидного бактериохлорина формулы IX после облучения светом и его потенциала для применения в ФДТ рака. Применяемая композиция была такой же, как и в примере 4. Инкубация исследуемого соединения с линией клеток А549 или СТ26 в темноте в течение 30 мин не показала признаков токсичности до 40 мкМ. Фототоксичность измеряли в соответствии с описанием в разделе "Материалы и способы". Фототоксичность исследуемого соединения оценивали по процентному отношению выживаемости клеток для различных концентраций исследуемого соединения, инкубированных в течение 30 мин, с последующим промыванием PBS, добавлением культуральной среды и освещением дозой света 1 Дж/см2. На Фиг. 6 показано, что почти все клетки погибают, когда концентрация фотосенсибилизатора достигает 50 нМ.
Пример 6. Противоопухолевая эффективность ФДТ in vivo в отношении СТ 26 подкожных опухолей, вживленных в мышей BALB/c
Настоящий пример описывает ФДТ мышей, несущих подкожные опухоли СТ26, вживленные в правое бедро. Опухоли обрабатывали карбоксамидным бактериохлорином формулы IX с применением сосудистого протокола, когда наибольший диаметр опухоли достигал 5 мм. Протокол лечения заключался во внутривенном введении определенной дозы фотосенсибилизатора формулы IX в композиции, состоящей из Коллифор EL:этанол:NaCl 0,9% (0,6:3:96,4, об./об./об.), с последующим освещением опухоли лазерным светом 749±3 нм через 15 минут. В разделе "Материалы и способы" описана животная модель, лазер и оптическое волокно, применяемые в лечении. Оптическое волокно размещали перпендикулярно поверхности опухоли, чтобы осветить площадь 1,33 см2, сконцентрированные у опухоли, для доставки дозы света 40 Дж/см2 при облучении 130 мВт/см2. Вводимые дозы карбоксамидного бактериохлорина формулы IX рассчитывали с учетом чистоты образца. После ФДТ оценивали реакцию мышей на терапию, пока максимальный диаметр их опухоли не достигал 15 мм. В этой точке (гуманная конечная точка) животных умерщвляли. Результаты эффективности представлены в виде кривых выживаемости Каплана-Мейера на Фиг. 7. Этот пример показывает, что фотосенсибилизаторы, раскрытые в настоящей работе, чрезвычайно фототоксичны. Действительно, доза фотосенсибилизатора 0,3 мг/кг была настолько фототоксичной, что животные умерли от острого ответа на лечение менее чем через 72 часа после ФДТ. Доза фотосенсибилизатора 0,15 мг/кг, применяемая в другой группе лечения, была очень хорошо переносимой. Местный ответ в освещенной области, в дни после ФДТ, представлял собой отек и эритему, связанные с началом острого воспалительного ответа, сопровождающегося разрушением опухоли и образованием некротической корки. Как только некротическая корка отпадала, можно было видеть, что опухоль полностью регрессировала и было достигнуто 100% выздоровление. С другой стороны, опухоли росли непрерывно в контрольной группе (необработанная группа), и все животные должны были быть подвергнуты умерщвлению в течение 27 суток после инокуляции опухоли. Кривая выживаемости группы, обработанной дозой фотосенсибилизатора 0,15 мг/кг, статистически отличается от кривой выживаемости контрольной необработанной группы, которая представляет среднее время выживания 19 суток (логарифмический ранговый критерий, р менее 0,05).
ПРИМЕР 7. Интрадермальное проникновение
Настоящий пример описывает проникновение карбоксамидного бактериохлорина формулы IX в кожу свиньи. Композиция для местного применения и животная модель описаны в разделе "Материалы и способы". Проникновение оценивали, как с точки зрения количества фотосенсибилизатора в коже после установленного времени взаимодействия композиции для местного применения с кожей (время инкубации), так и с точки зрения глубины проникновения в кожу.
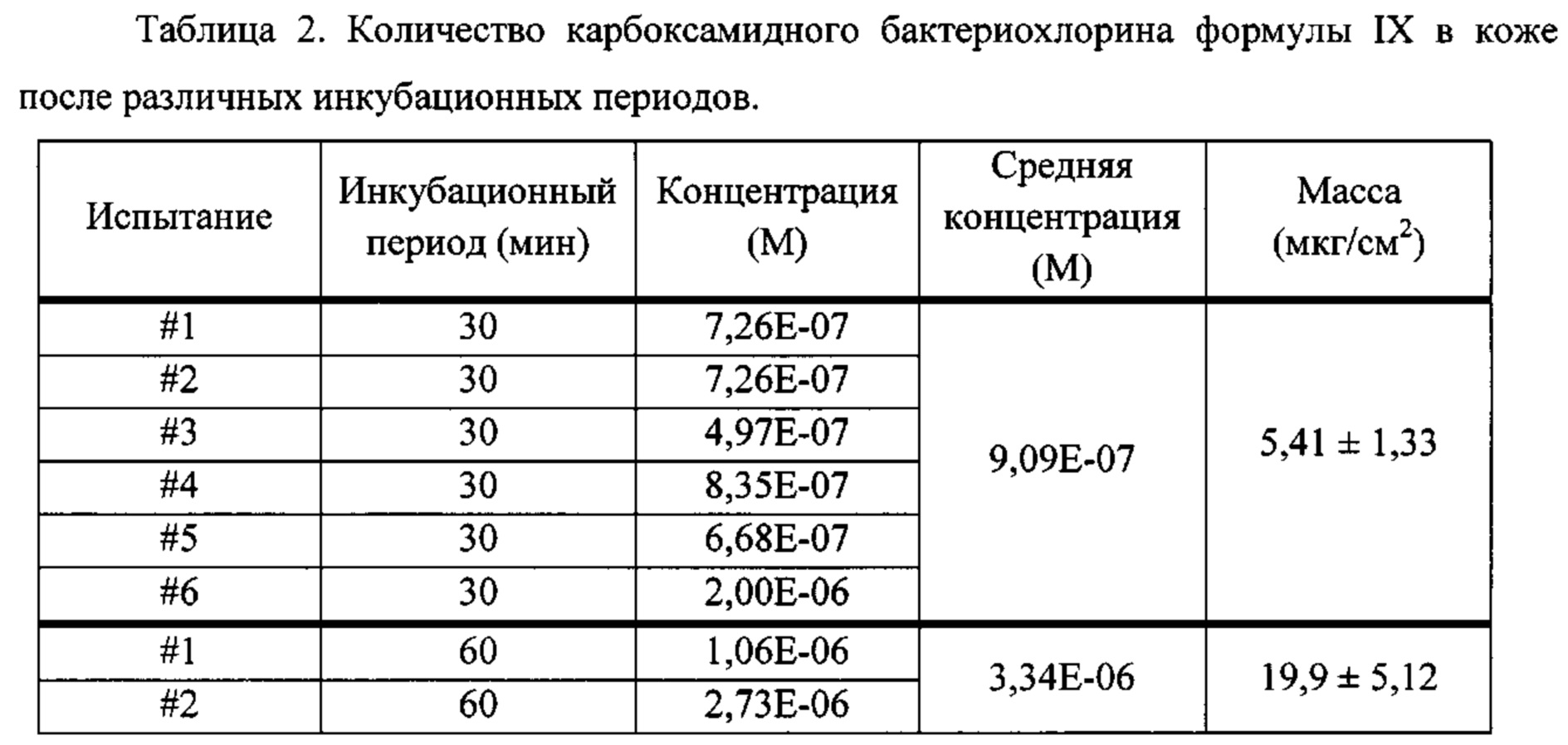
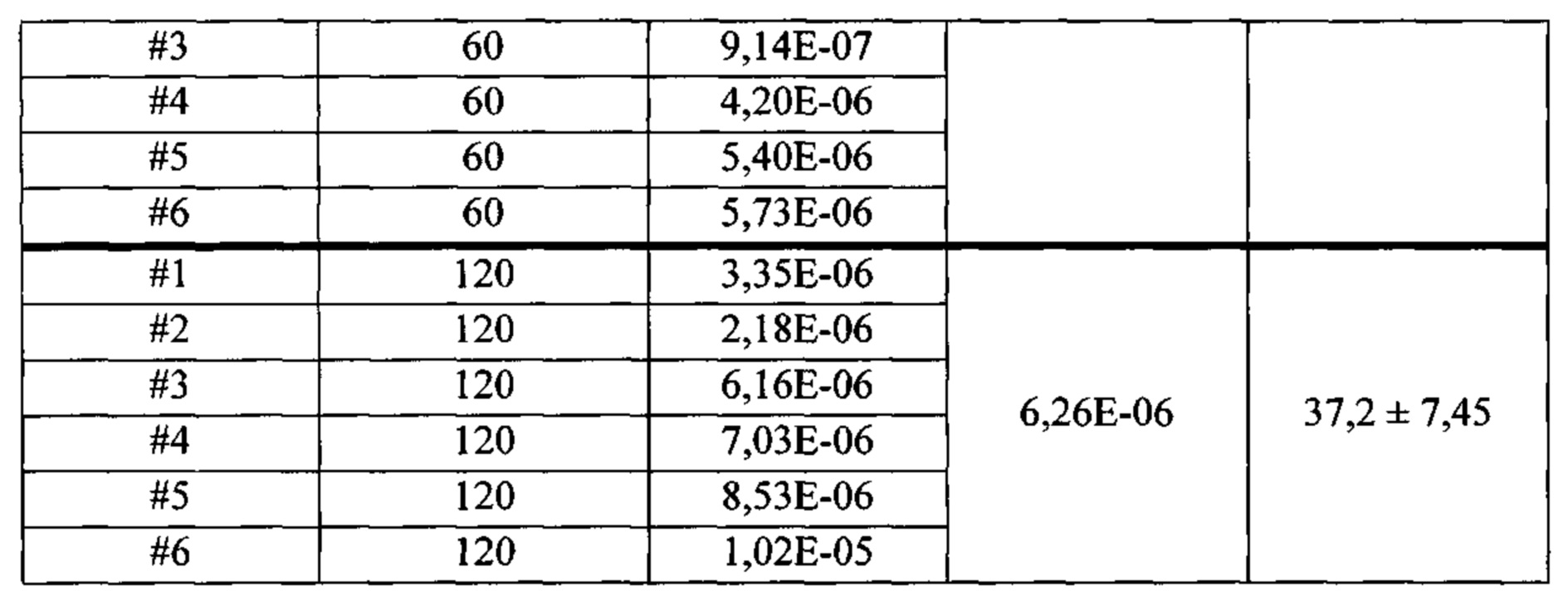
Оценка количества карбоксамидного бактериохлорина формулы IX в коже после различных инкубационных периодов включала следующие стадии: (i) применение 0,30 мл композиции на области кожи 1 см2 карликовой свиньи для получения 6 независимых измерений для инкубационных периодов 30, 60 и 120 минут; (ii) очистка поверхности кожи в конце инкубационных периодов; (iii) разрезание кожи на небольшие кусочки и мацерация в 2 мл дихлорметана с помощью диспергирующего устройства; (iv) экстракция 10 мл дихлорметана в пробирке Falcon в течение шести часов; (v) разбавление в 5 раз этанолом. Исследуемый раствор в объеме 200 мкл добавляли в трех повторах в 96-луночный планшет, и определяли интенсивность флуоресценции с применением считывающего устройства для микропланшетов Synergy НТ Biotek (California, USA), с фильтром возбуждения 508/20 нм и фильтром излучения 760/35 нм, в зависимости от калибровочной кривой. Сигнал контроля, полученного с применением того же способа очистки, вычитали из сигнала образца, а концентрацию фотосенсибилизатора в каждом образце получали с помощью калибровочной кривой. Краткое описание результатов представлено в таблице 2. Проникновение фотосенсибилизатора в коже достигает Jmax, равное 4×10-8 моль/(см2 ч) за 1,5 часа, что представляет собой неожиданно высокий результат для фотосенсибилизатора с MW равным 594 Да. Этот пример показывает, что низкомолекулярные карбоксамидные галогенированные производные хлоринов и бактериохлоринов, раскрытые в настоящей работе, имеют высокую способность к преодолению биологических барьеров.
Оценка глубины проникновения карбоксамидного бактериохлорина формулы IX в кожу после различных инкубационных периодов включала следующие стадии: (i) собирали биопсии тканей, инкубированных с композицией в течение 30, 60 и 120 минут, в замороженном виде на сухом льду; (ii) заключали замороженные ткани на держателе с помощью реагента Tissue-Tek О.С.Т. (Sakura Finetek Europe B.V., Zoeterwoude, Нидерланды) и делали срезы толщиной 25 мкм в криостате; (iii) срезы кожи размещали на предметных стеклах микроскопа и хранили в холодильнике для микроскопии. Конфокальную флуоресценцию бактериохлорина проводили с помощью конфокального микроскопа LSM 510 Meta (Carl Zeiss, Jena, Germany) с объективом для масляной иммерсии ×63 (Plan-Apochromat, 1.4 NA, Carl Zeiss), применяя λex равное 514 нм, λem не менее 650 нм, мощность лазера 5% и усиление 40×. Изображения, иллюстрирующие флуоресценцию фотосенсибилизатора в коже после различных инкубационных периодов, представлены на Фиг. 8. Контрольные эксперименты, выполненные в тех же условиях, но без инкубации композиции с кожей, не показывают какую-либо флуоресценцию, и в условиях, показанных на Фиг. 8 представляют собой полностью черные области. Увеличение времени инкубации приводит к более глубокому проникновению фотосенсибилизатора в кожу, которая может достигать глубины 40 мкм за 90 минут и покрывает большую часть эпидермиса. Этот пример показывает, что низкомолекулярные карбоксамидные галогенированные производные хлоринов и бактериохлоринов, раскрытые в настоящей работе, имеют высокую способность к диффузии в биологические ткани и быстрому достижению своих целей.
Разумеется, настоящие варианты осуществления никоим образом не ограничены вариантами осуществления и примерами, описанными в настоящем документе, и специалист со средними знаниями в данной области техники сможет предсказать множество возможных изменений, не отклоняясь от основной идеи, раскрытой в формуле изобретения.
Список цитируемой литературы
1. А.N. Bashkatov, Е.A. Genina, V.I. Kochubey, V.V. Tuchin, Optical properties of human skin, subcutaneous and mucous tissues in the wavelength range from 400 to 2000 nm. J. Phys. D: Appl. Phys. 38, 2543-2555 (2005).
2. P. Agostinis, K. Berg, K.A. Cengel, Т.H. Foster, A.W. Girotti, S.O. Gollnick, S.M. Hahn, M.R. Hamblin, A. Juzeniene, D. Kessel, M. Korbelik, J. Moan, P. Mroz, D. Nowis, J. Piette, В.C. Wilson, J. Golab, Photodynamic therapy of cancer: An update. CA Cancer J. Clin. 61, 250-281 (2011).
3. M.R. Hamblin, T. Hasan, Photodynamic therapy: a new antimicrobial approach to infectious disease? Photochem. Photobiol. Sci. 3,436-450 (2004).
4. L. Huang, M. Krayer, J.G. Roubil, Y.Y. Huang, D. Holten, J.S. Lindsey, M.R. Hamblin, Stable synthetic mono-substituted cationic bacteriochlorins mediate selective broad-spectrum photoinactivation of drug-resistant pathogens at nanomolar concentrations. J. Photochem. Photobiol. B: Biol. 141, 119-127 (2014).
5. N. Dragicevic-Curic, S. Winter, M. Stupar, J. Milic, D. Krajisnik, B. Gitter, A. Fahr, Temoporfin-loaded liposomal gels: Viscoelastic properties and in vitro skin penetration. Int. J. Pharm. 373, 77-84 (2009).
6. В.M. Magnusson, Y.G. Anissimov, S.E. Cross, M.S. Roberts, Molecular size as the main determinant of solute maximum flux across the skin. J. Invest. Dermatol. 122, 993-999 (2004).
7. H.A. Benson, Transdermal drug delivery: permeation enhancement techniques. Curr. Drug Deliv. 2, 23-33 (2005).
8. L.G. Arnaut, M.M. Pereira, J.M. Dabrowski, E.F. Silva, F.A. Schaberle, A.R. Abreu, L.B. Rocha, M.M. Barsan, K. Urbanska, G. Stochel, С.M. Brett, Photodynamic therapy efficacy enhanced by dynamics: the role of charge transfer and photostability in the selection of photosensitizers. Chem. Eur. J. 20, 5346-5357 (2014).
9a. S.G. Dimagno, V.S.Y. Lin, M.J. Therien, Facile elaboration of porphyrins via metal-mediated cross-coupling. J. Org. Chem. 58, 5983-5993 (1993).
9b. D. Fan, M. Taniguchi, Z. Yao, S. Dhanalekshmi, J.S. Lindsey, 1,9-Bis(N,N-dimethylaminomethyl)dipyrromethanes in the synthesis of porphyrins bearing one or two meso substituents. Tetrahedron 61, 10291-10302 (2005).
10. J.S. Lindsey, I.C. Schreiman, H.C. Hsu, P.C. Kearney, A.M. Marguerettaz, Rothemund and Adler-Longo reactions revisited: Synthesis of tetraphenylporphyrins under equilibrium conditions. J. Org. Chem. 52, 827-836 (1987).
11. A.D. Adler, L. Sklar, F.R. Longo, J.D. Finarelli, M.G. Finarelli, A mechanistic study of the synthesis of meso-tetraphenylporpyrin. J. Heterocycl. Chem 669-678, (1968).
12. M. Ptaszek, D. Lahaye, M. Krayer, C. Muthiah, J.S. Lindsey, De novo synthesis of long-wavelength absorbing chlorin-13,15-dicarboximides. J. Org. Chem. 75, 1659-1673 (2010).
Реферат
Настоящее изобретение относится к карбоксамидным галогенированным производным порфирина, в частности бактериохлорина или хлорина, формулы (I):формула (I)В формуле (I):представляет собой углерод-углеродную одинарную связь или углерод-углеродную двойную связь, при условии, что по меньшей мере однапредставляет собой углерод-углеродную одинарную связь; Y, Yкаждый независимо выбран из водорода или галогенированного алкила, или галогенированного циклоалкила с 6 или менее атомами углерода, или галогенированного фенила, где галогены независимо выбраны из F, Cl и Br, при условии, что по меньшей мере один из Y, Yне является водородом; Rпредставляет собой H'; R' и R'' независимо выбраны из водорода, алкила с 6 или менее атомами углерода, циклопропила, циклобутила или циклопентила. Также предложены фармацевтическая композиция и содержащий ее набор. Предложенные соединения применяются в качестве фотосенсибилизатора для ФДТ гиперпролиферативных расстройств и/или для фотоинактивации бактерий или вирусов, или грибов, соответствуют всем критериям идеального фотосенсибилизатора и эффективно преодолевают биологические барьеры. 3 н. и 21 з.п. ф-лы, 2 табл., 7 пр., 8 ил.
Формула
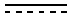
Документы, цитированные в отчёте о поиске
Новые производные порфиринов, в частности хлорины и/или бактериохлорины, и их применение в фотодинамической терапии

Комментарии